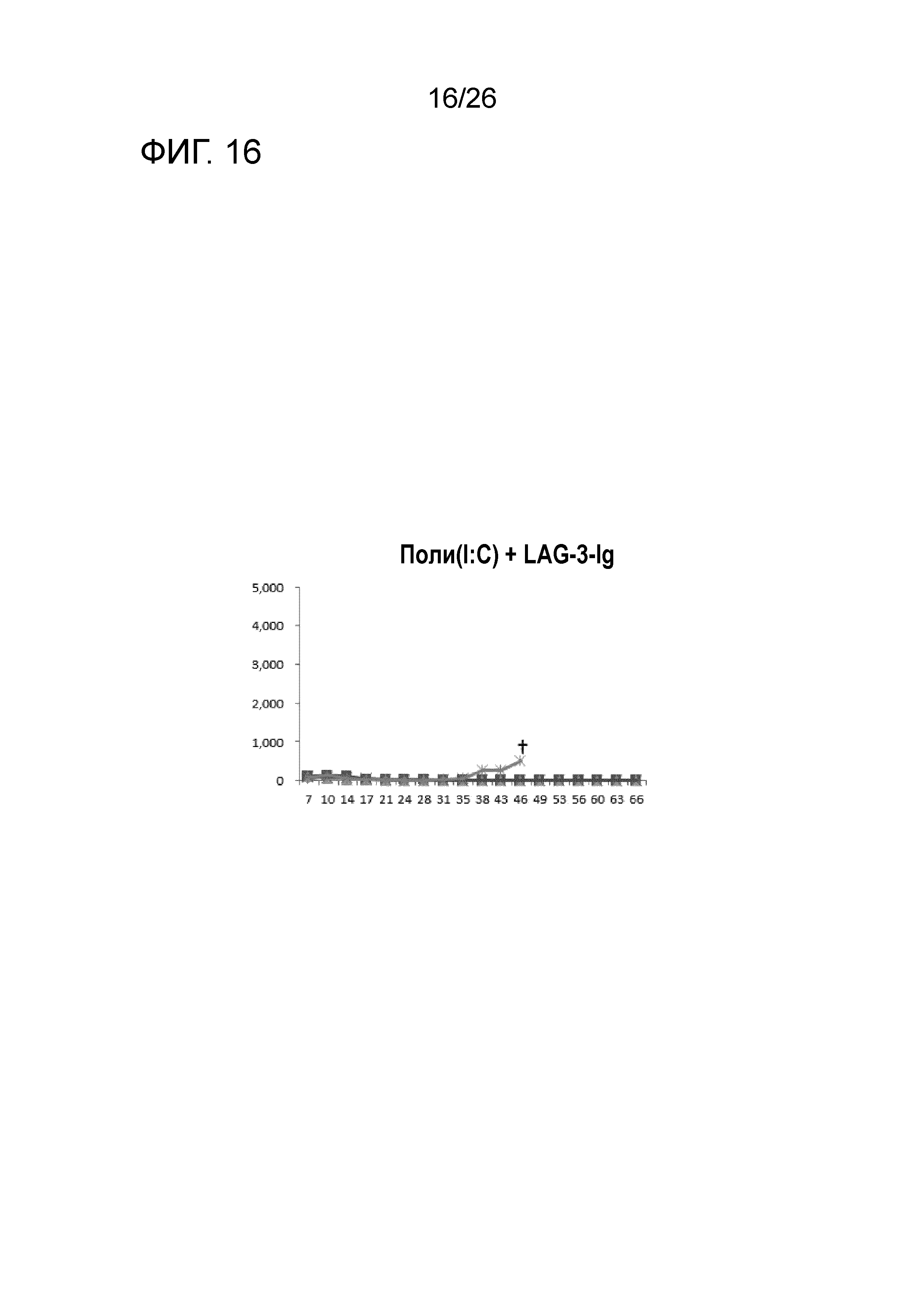Результат интеллектуальной деятельности: ЛЕКАРСТВЕННОЕ СРЕДСТВО
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к лекарственному средству или подобному, содержащему агонист Toll-подобного рецептора и белок LAG-3, его вариант или производное.
Уровень техники
[0002]
В последнее время были разработаны способы иммунотерапии рака, направленные против раковых антигенов, специфически экспрессируемых в раковых клетках. В частности, "противораковая вакцинотерапия" является способом индукции регрессии рака при введении ракового антигена непосредственно больным для индукции иммунного ответа, специфичного к раковому антигену в теле больного. В качестве ракового антигена, вводимого больному, например, используют сам раковый антигенный белок, полученный из ракового антигена пептид, нуклеиновую кислоту, кодирующую их, дендритную клетку, презентирующую раковый антиген, и саму раковую клетку.
[0003]
Для усиления индукции иммунного ответа раковым антигеном, вместе с раковым антигеном вводят адъювант. В качестве адъюванта, например, используют цитокины, стимулирующие различные иммунокомпетентные клетки, а также агонисты Toll-подобного рецептора (TLR).
[0004]
В качестве агониста TLR, служащего адъювантом, может использоваться любой из агонистов TLR1-TLR10 (например, непатентные источники 1 и 2). Например, TLR3, который распознает вирусную двухцепочечную РНК и ускоряет продукцию интерферона I типа, проявляющего сильное противовирусное действие, является молекулой врожденной иммунной системы. Аналог двухцепочечной РНК, поли-I:C (также называемый полиинозиновой:полицитидиловой кислотой), который известен как агонист TLR3, как известно, применяется в качестве адъюванта вакцины (например, патентный источник 1). Кроме того, TLR9, который распознает бактериальную или вирусную неметилированную CpG ДНК и проявляет действие, является молекулой врожденной иммунной системы. CpG ODN (синтетическая нуклеиновая кислота - CpG олигодезоксинуклеотид), служащий в качестве TLR9-лиганда, как известно, обладает адъювантным действием в отношении вакцины.
[0005]
Известно, что LAG-3 также используется в качестве адъюванта для вакцины (например, патентный источник 2). LAG-3 является посттрансляционным продуктом гена активации лимфоцитов 3 и также назвается CD223. LAG-3 связывается с молекулой MHC II класса, обеспечивая негативную регуляцию пролиферации активированных Т-клеток и сохранение гомеостаза Т-клеток, играет важную роль в функции регуляторных Т-клеток (Treg) и, как также известно, учатствует в гомеостатической регуляции плазмоцитоидных дендритных клеток.
Список источников
Патентные источнки
[0006]
Патентный источник 1: национальная публикация международной заявки на патент 2011-506309
Патентный источник 2: национальная публикация международной заявки на патент 2001-510806
Непатентные источнки
[0007]
Непатентный источник 1: OncoImmunology 1: 5, 699-716; August 2012
Непатентный источник 2: OncoImmunology 2: 8, e25238; August 2013
Сущность изобретения
Техническая задача
[0008]
Цель настоящего изобретения заключается в предоставлении лекарственного средства, содержащего новую комбинацию адъювантов.
Решение задачи
[0009]
Авторы настоящего изобретения провели различные исследования с применением различных адъювантов, отдельно или в комбинации. В результате была обнаружена новая комбинация адъювантов, служащих в качестве лекарственного средства, применимого, например, для индукции противоракового иммунитета.
В частности, настоящее изобретение состоит в следующем.
[1]
Лекарственное средство, включающее:
агонист Toll-подобного рецептора и
белок LAG-3, его вариант или производное.
[2]
Лекарственное средство согласно [1] для комбинированного введения:
агониста Toll-подобного рецептора и
белка LAG-3, его варианта или производного.
[3]
Лекарственное средство согласно [1] или [2], где агонист Toll-подобного рецептора является агонистом Toll-подобного рецептора 3 или агонистом Toll-подобного рецептора 9.
[4]
Лекарственное средство согласно любому из [1]-[3], где агонистом Toll-подобного рецептора является поли-I:C или его соль.
[5]
Лекарственное средство согласно любому из [1]-[4], где белок LAG-3, его вариант или производное является слитым белком белка LAG-3 и IgG.
[6]
Лекарственное средство согласно любому из [1]-[5], дополнительно включающее вещество для индукции специфичного иммунного ответа по меньшей мере против одной раковой клетки.
[7]
Лекарственное средство согласно [6] для комбинированного введения:
агониста Toll-подобного рецептора,
белка LAG-3, его варианта или производного, и
вещества для индукции специфичного иммунного ответа по меньшей мере против одной раковой клетки.
[8]
Лекарственное средство согласно [6] или [7], где вещество для индукции специфичного иммунного ответа против раковой клетки является полученным из ракового антигена пептидом.
[9]
Лекарственное средство согласно [8], включающее два или более полученных из ракового антигена пептидов.
[10]
Лекарственное средство согласно любому из [1]-[9] для применения в противораковой вакцинотерапии.
[11]
Лекарственное средство согласно любому из [1]-[10], где лекарственное средство является противоопухолевым средством.
[12]
Адъювант, включающий:
агонист Toll-подобного рецептора и
белок LAG-3, его вариант или производное,
для применения в индукции специфичного иммунного ответа против раковой клетки или для применения в противораковой вакцинотерапии.
[13]
Комбинация, включающая:
агонист Toll-подобного рецептора и
белок LAG-3, его вариант или производное,
для применения в индукции специфичного иммунного ответа против раковой клетки или в противораковой вакцинотерапии.
[14]
Способ лечения или предотвращения заболевания у больного, включающий введение:
агониста Toll-подобного рецептора и
белка LAG-3, его варианта или производного
нуждающемуся в этом больному.
[15]
Способ индукции специфичного иммунного ответа, включающий введение:
агониста Toll-подобного рецептора и
белка LAG-3, его варианта или производного
нуждающемуся в этом больному.
Преимущества изобретения
[0010]
Согласно настоящему изобретению можно получить лекарственное средство, содержащее новую комбинацию адъювантов.
Краткое описание чертежей
[0011]
[Фигура 1] На Фигуре 1 показан схематический протокол эксперимента для сравнения действия адъювантов в противораковой вакцине, в которой применяется полученный из ракового антигена пептид.
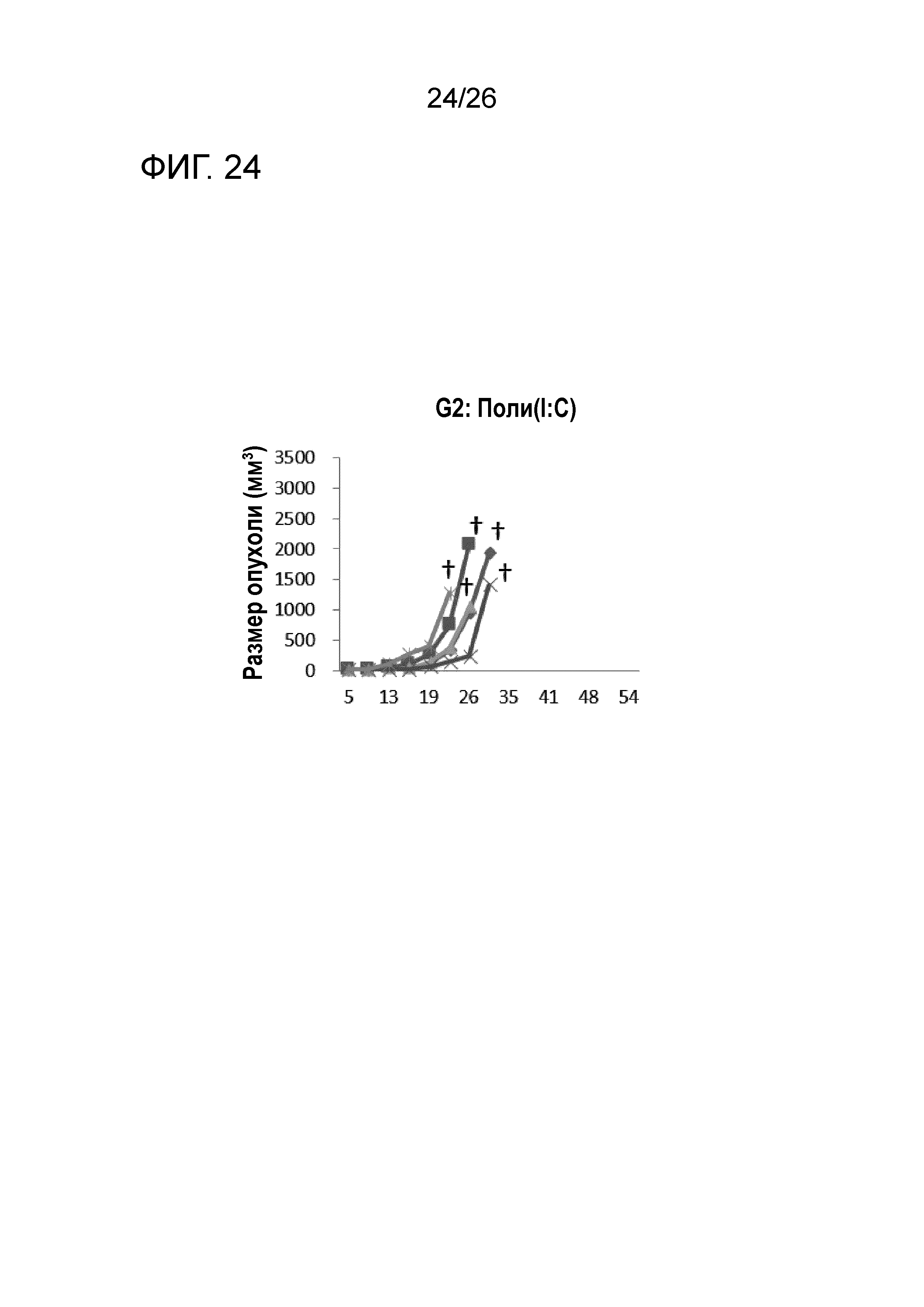
[Фигура 2] Фигура 2 является графиком, на котором показаны изменения размера опухоли в Группе 1, в которой PBS использовали в качестве контроля в эксперименте, показанном на Фигуре 1.
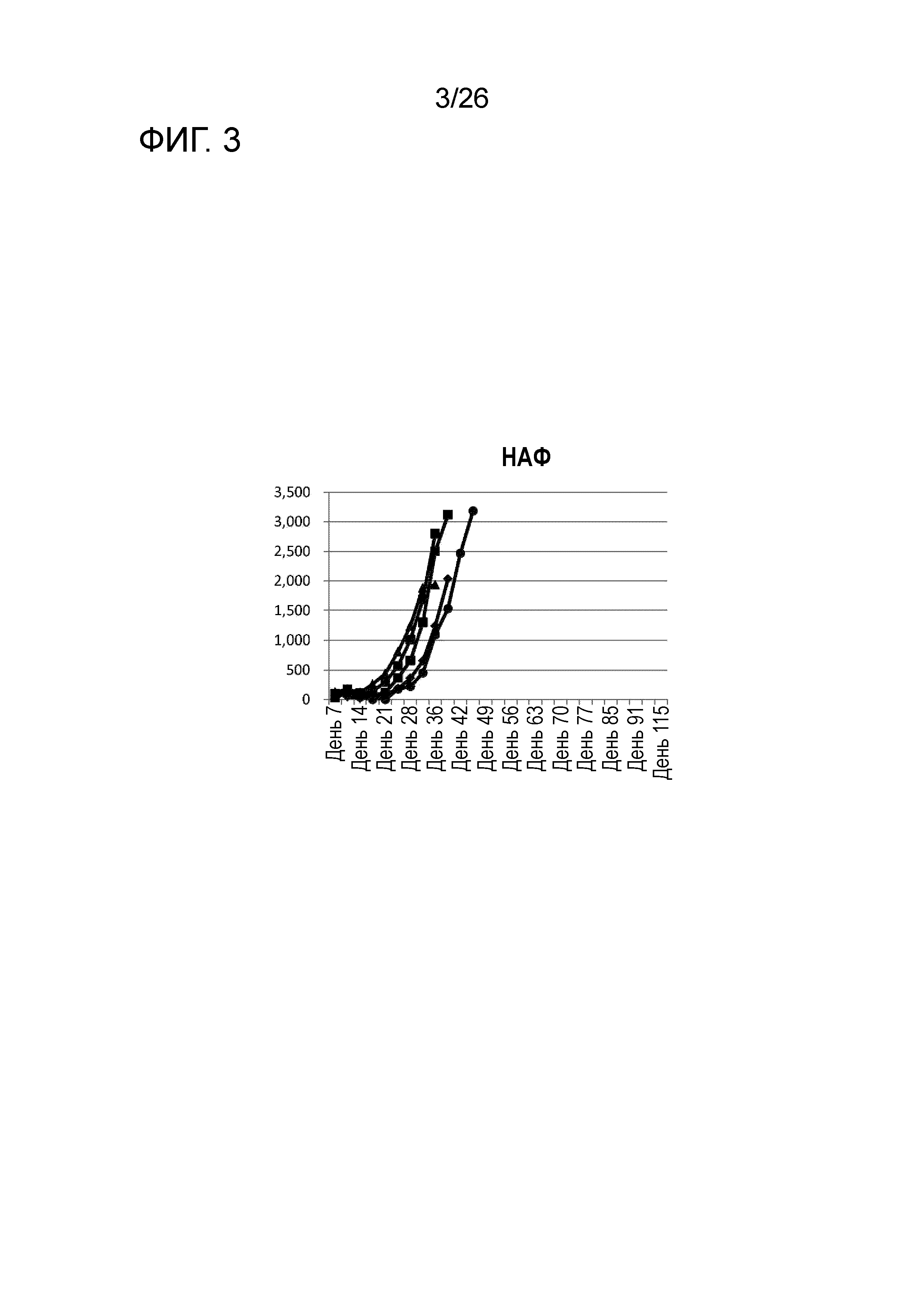
[Фигура 3] Фигура 3 является графиком, на котором показаны изменения размера опухоли в Группе 2, в которой НАФ использовали в качестве адъюванта в эксперименте, показанном на Фигуре 1.
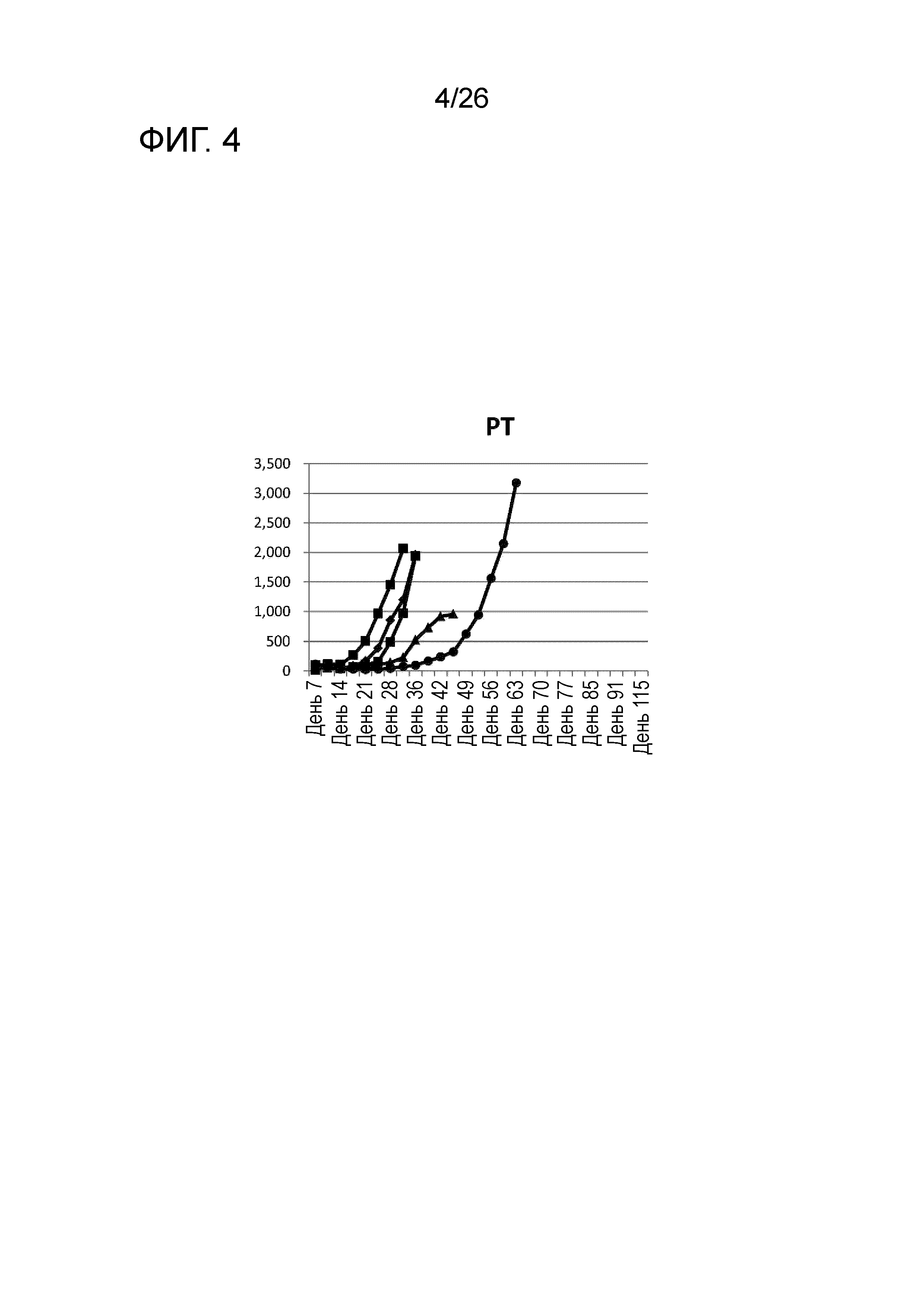
[Фигура 4] Фигура 4 является графиком, на котором показаны изменения размера опухоли в Группе 3, в которой PT использовали в качестве адъюванта в эксперименте, показанном на Фигуре 1.
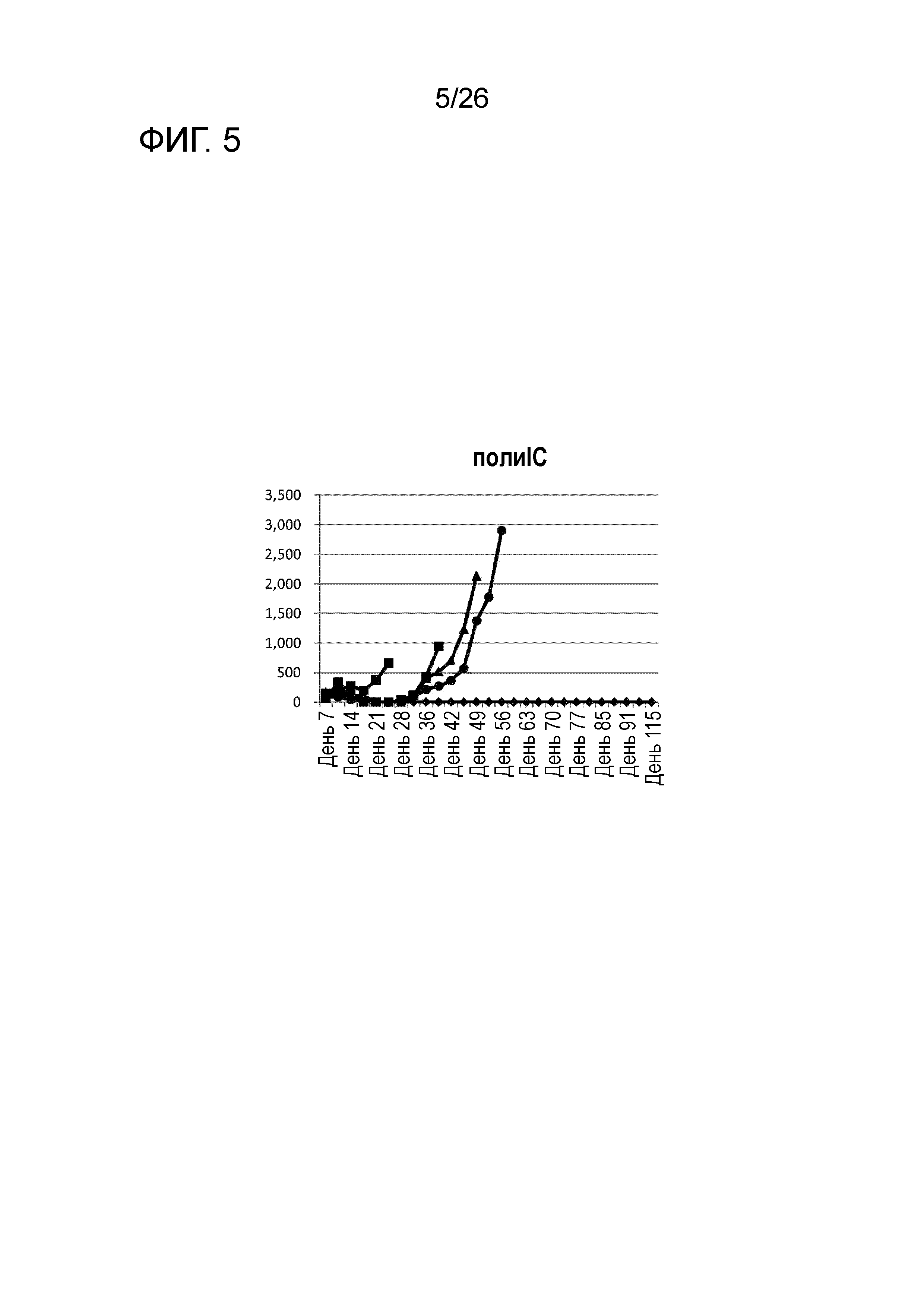
[Фигура 5] Фигура 5 является графиком, на котором показаны изменения размера опухоли в Группе 4, в которой поли-I:C использовали в качестве адъюванта в эксперименте, показанном на Фигуре 1.
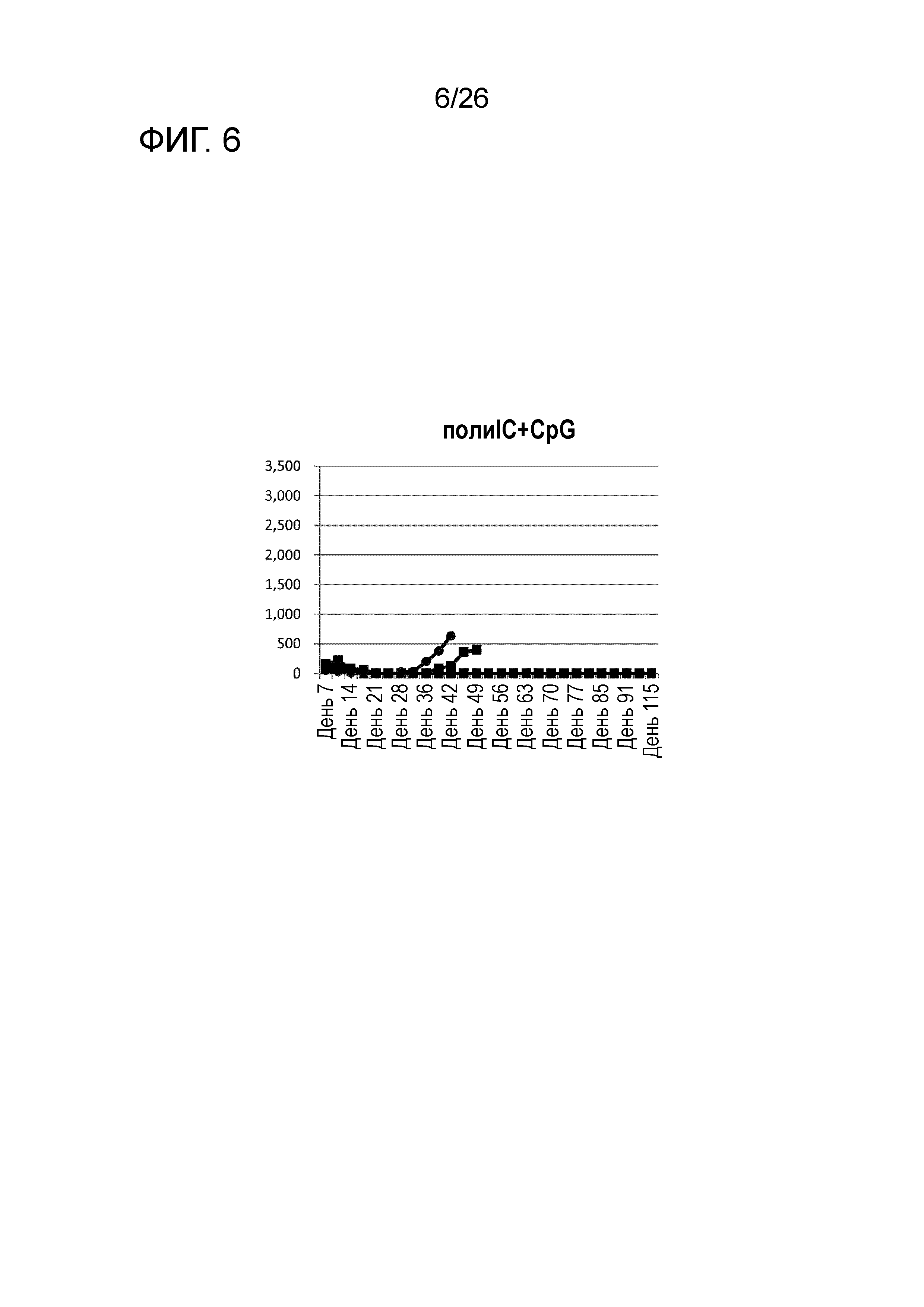
[Фигура 6] Фигура 6 является графиком, на котором показаны изменения размера опухоли в Группе 5, в которой комбинацию поли-I:C и CpG использовали в качестве адъюванта в эксперименте, показанном на Фигуре 1.
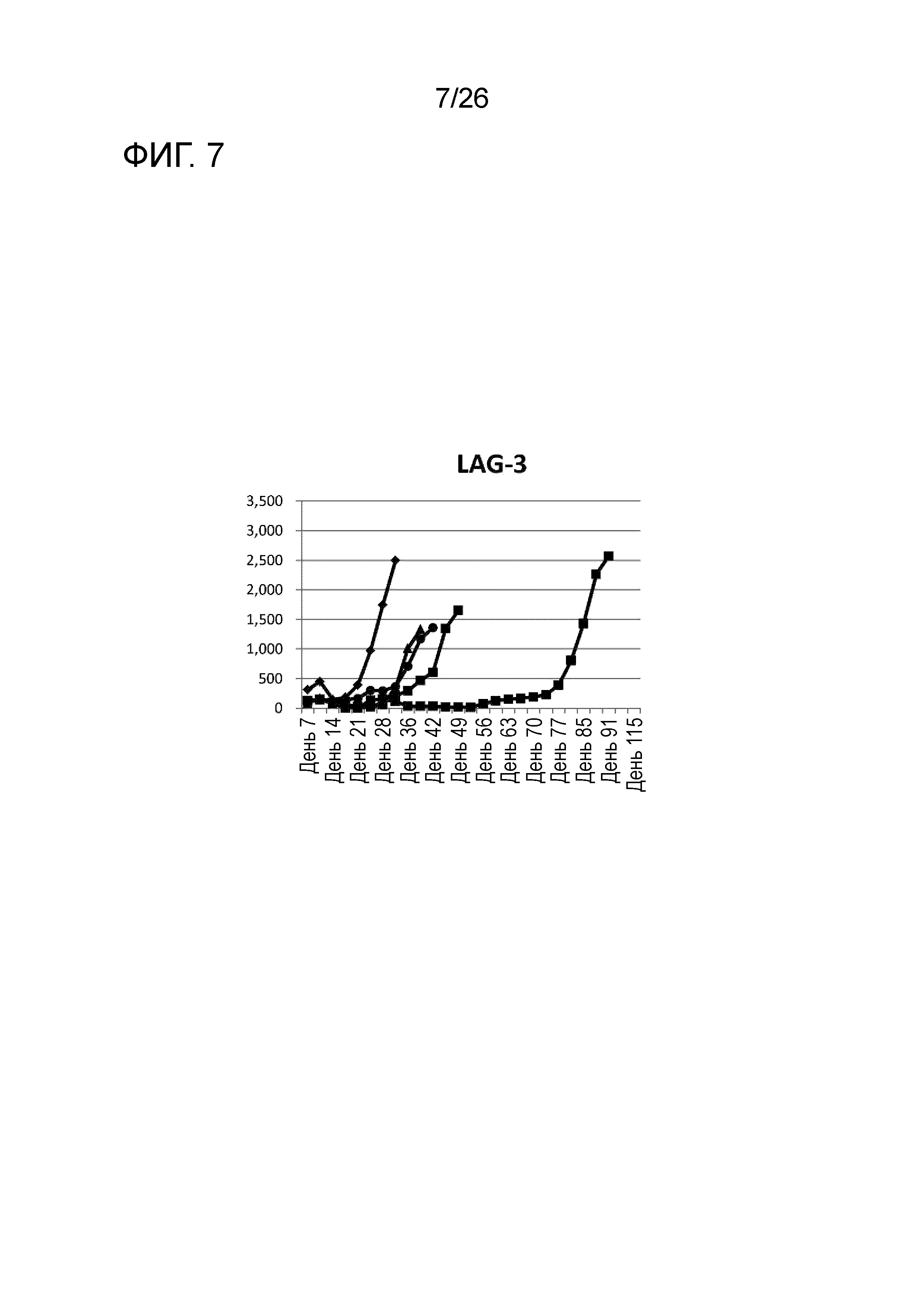
[Фигура 7] Фигура 7 является графиком, на котором показаны изменения размера опухоли в Группе 6, в которой LAG-3 использовали в качестве адъюванта в эксперименте, показанном на Фигуре 1.
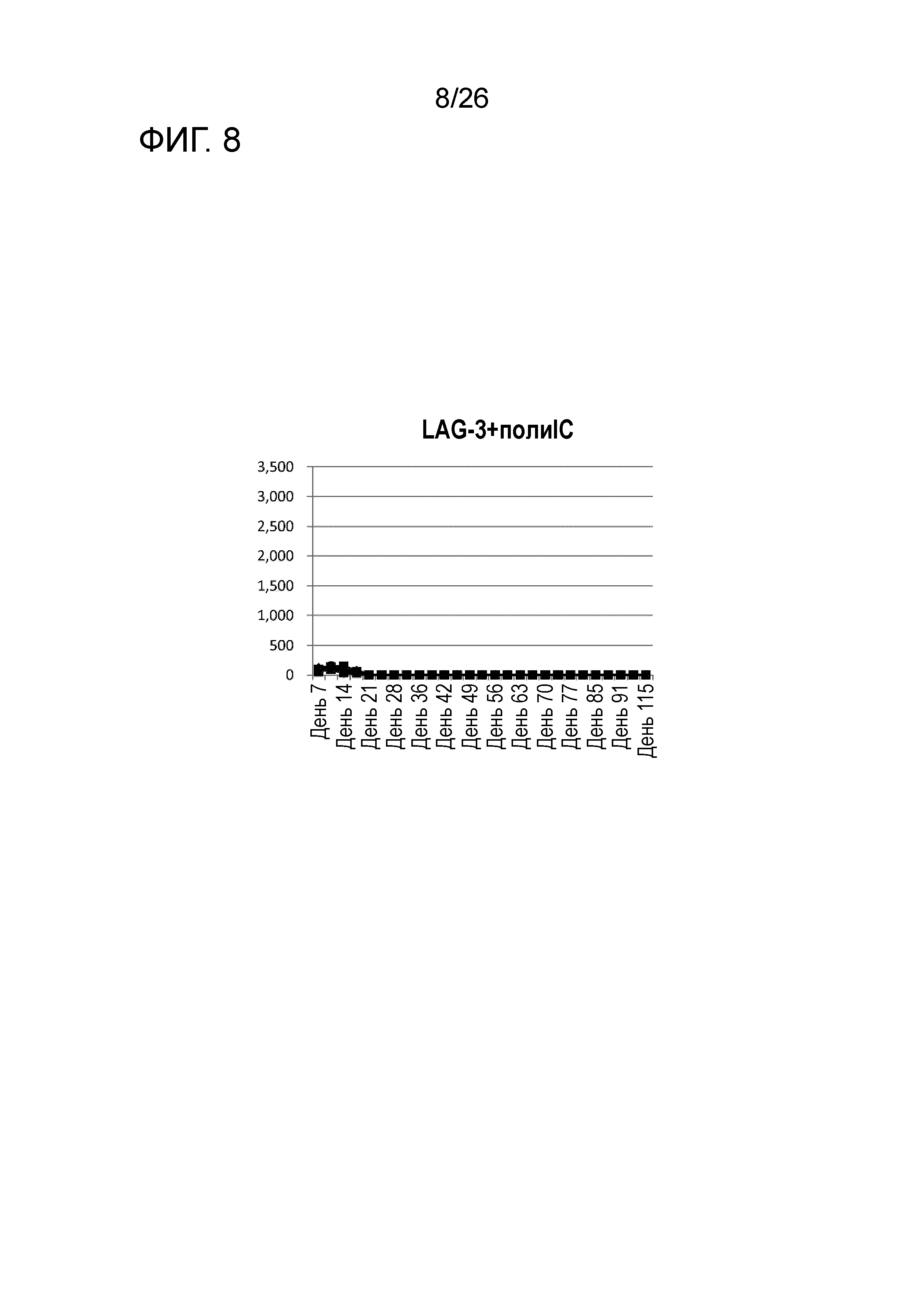
[Фигура 8] Фигура 8 является графиком, на котором показаны изменения размера опухоли в Группе 7, в которой LAG-3 и поли-I:C использовали в качестве адъювантов в эксперименте, показанном на Фигуре 1.
[Фигура 9A] На Фигуре 9A показаны изображения опухолевой ткани, окрашенной гематоксилином-эозином, в таком же эксперименте, как на Фигуре 1.
[Фигура 9B] На Фигуре 9B показаны изображения ядер клеток и иммуноцитов в опухолевой ткани, окрашенной флуоресцентным красителем, в таком же эксперименте, как на Фигуре 1.
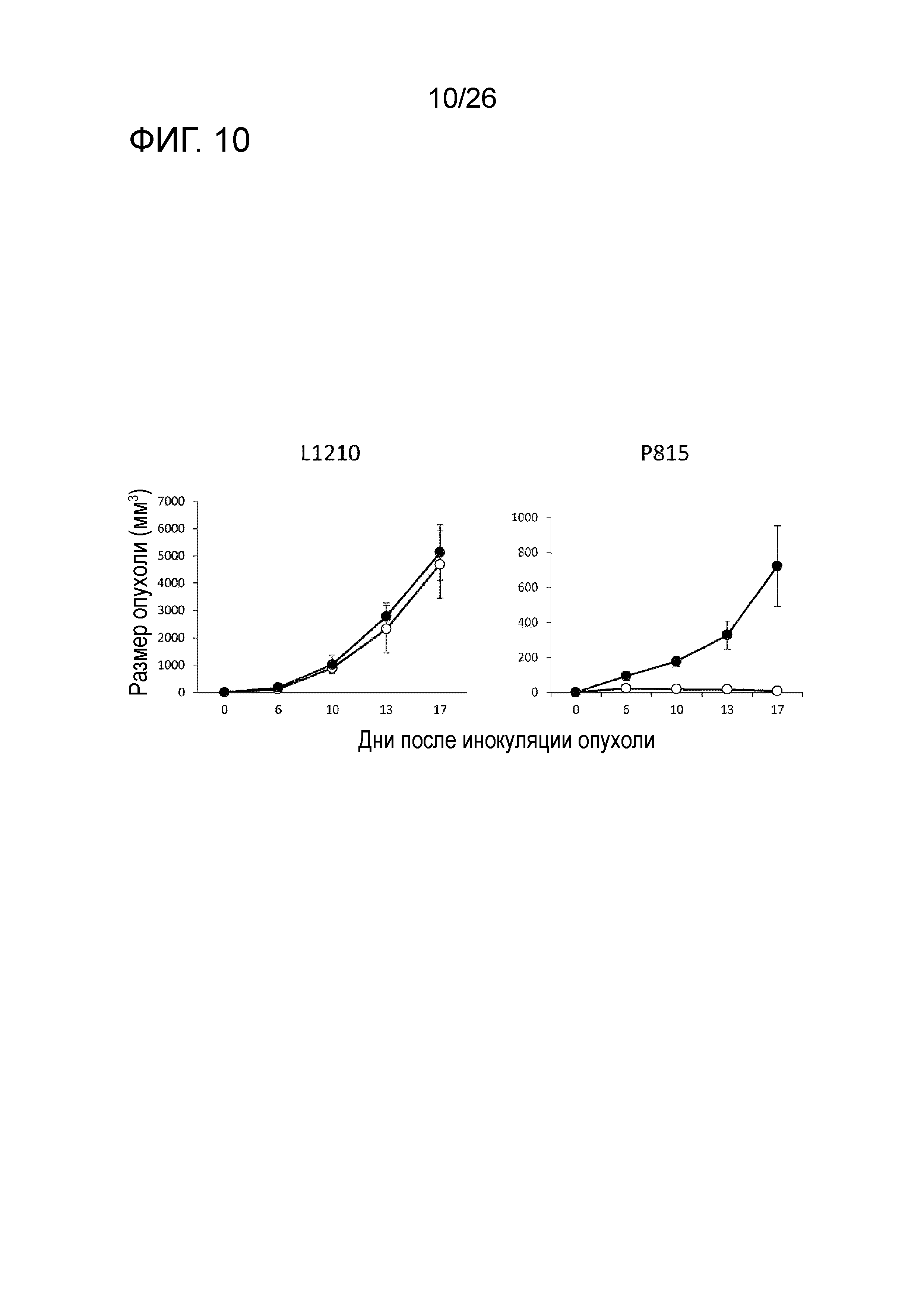
[Фигура 10] Фигура 10 является графиком, на котором показаны результаты измерения (увеличение) размера опухоли после повторного введения опухолевых клеток мыши, у которой увеличение размера опухоли было ранее успешно подавлено противораковой вакциной (в качестве адъювантов использовали LAG-3 и поли-I:C) в таком же эксперименте, как на Фигуре 1.
[Фигура 11A] Фигура 11A является графиком, на котором показаны результаты измерения пролиферативной способности иммуноцитов, которые были получены при заборе лимфатического узла у мыши после введения противораковой вакцины, в таком же эксперименте, как на Фигуре 1, при выделении иммуноцитов из лимфатического узла и совместном культивировании с опухолевыми клетками, предварительно инактивированными радиоактивным облучением.
[Фигура 11B] На Фигуре 11B показаны графики, на которых показаны результаты измерения цитокинов в клеточном супернатанте такой же сокультуры, как в эксперименте, показанном на Фигуре 11A.
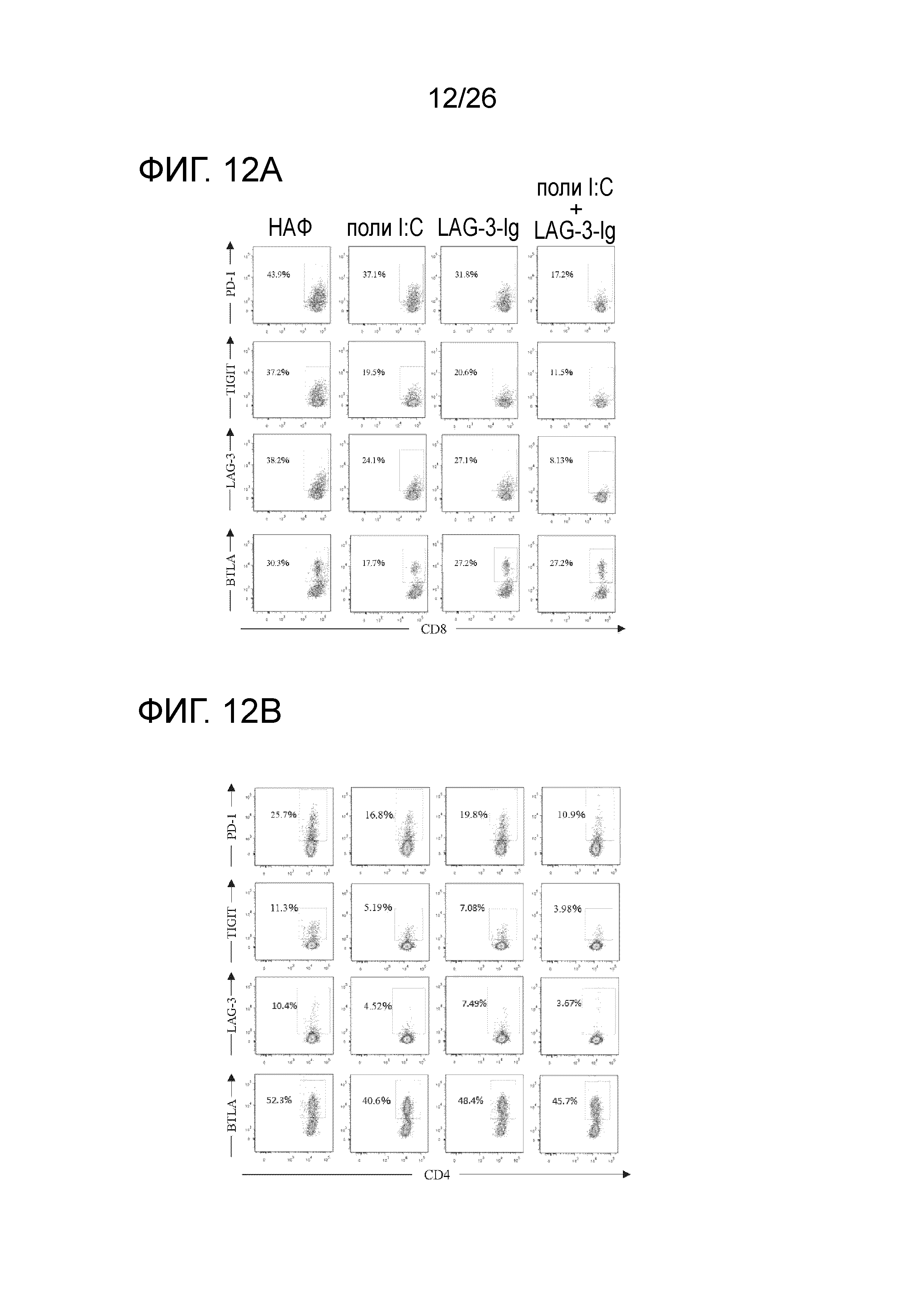
[Фигура 12A] На Фигуре 12A показаны результаты измерения экспрессии молекул маркеров клеточной поверхности, PD-1, BTLA, TIGIT и LAG-3, присутствующих на поверхности CD8-положительных иммуноцитов, которые были получены при заборе лимфатического узла у мыши после введения противораковой вакцины, в таком же эксперименте, как на Фигуре 1, и при выделении иммуноцитов из лимфатического узла.
[Фигура 12B] На Фигуре 12B показаны результаты измерения экспрессии молекул маркеров клеточной поверхности, PD-1, BTLA, TIGIT и LAG-3, присутствующих на поверхности CD4-положительных иммуноцитов, которые были получены при заборе лимфатического узла у мыши после введения противораковой вакцины, в таком же эксперименте, как на Фигуре 1, и при выделении иммуноцитов из лимфатического узла.
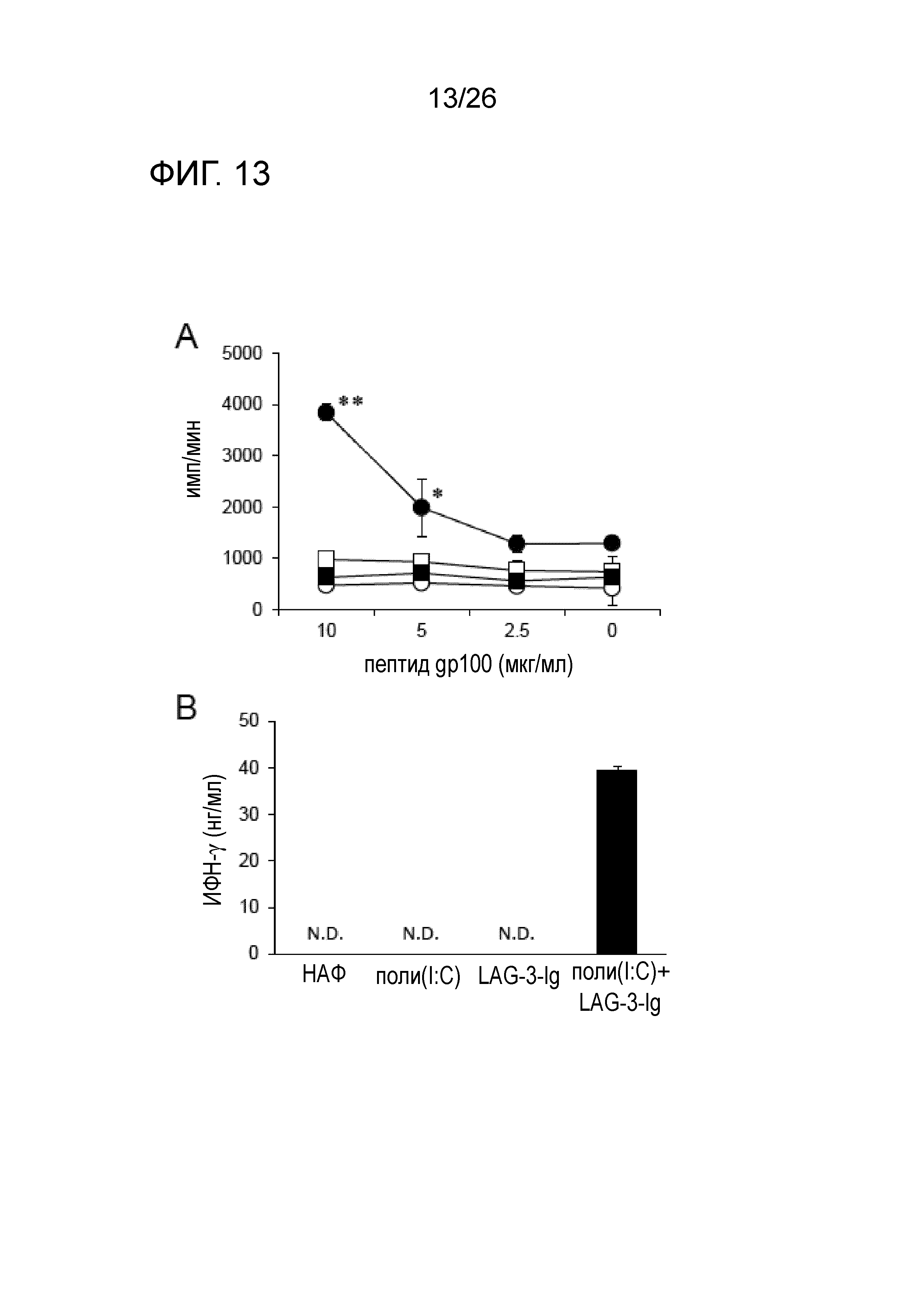
[Фигура 13] Фигура 13A является графиком, на котором показаны результаты измерения пролиферативной способности иммуноцитов, и Фигура 13B является графиком, на котором показаны результаты измерения продукции ИФН-гамма.
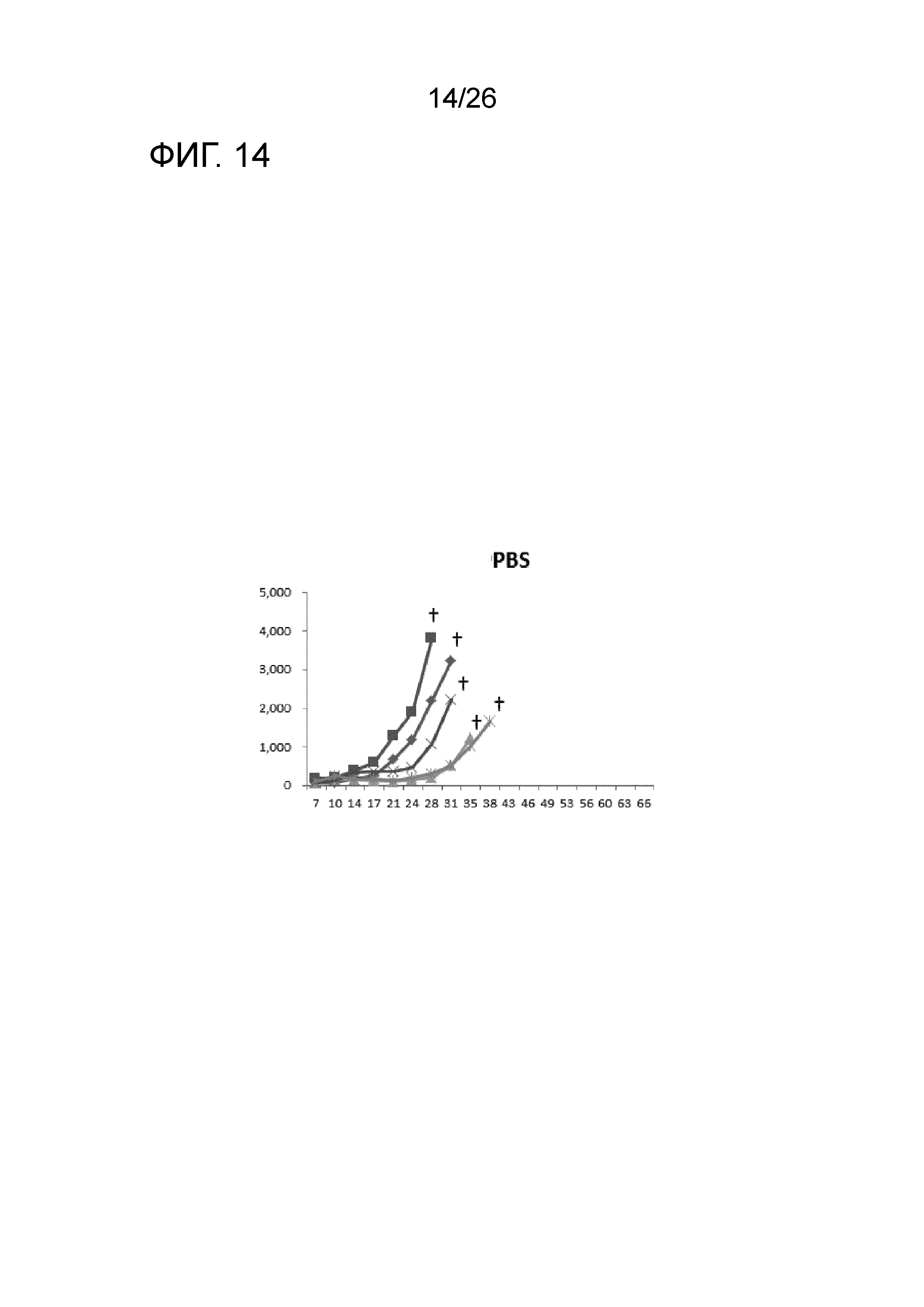
[Фигура 14] Фигура 14 является графиком, на котором показаны изменения размера опухоли в Группе 1, в которой PBS использовали в качестве контроля.
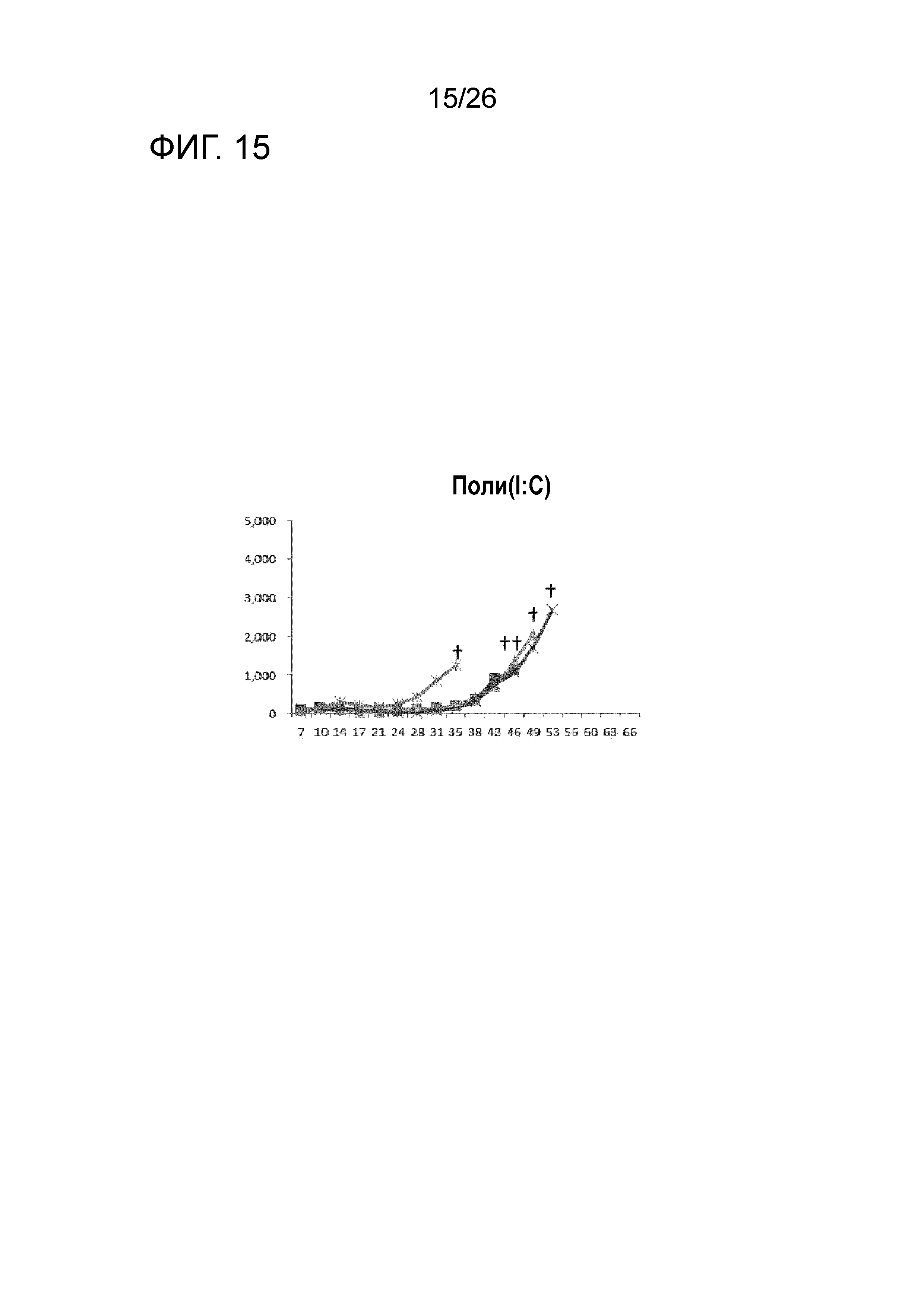
[Фигура 15] Фигура 15 является графиком, на котором показаны изменения размера опухоли в Группе 2, в которой поли-I:C использовали в качестве адъюванта.
[Фигура 16] Фигура 16 является графиком, на котором показаны изменения размера опухоли в Группе 3, в которой LAG-3 и поли-I:C использовали в качестве адъювантов.
[Фигура 17] Фигура 17 является графиком, на котором показаны изменения размера опухоли в Группе 4, в которой использовали только LAG-3 и поли-I:C без использования пептида P1A.
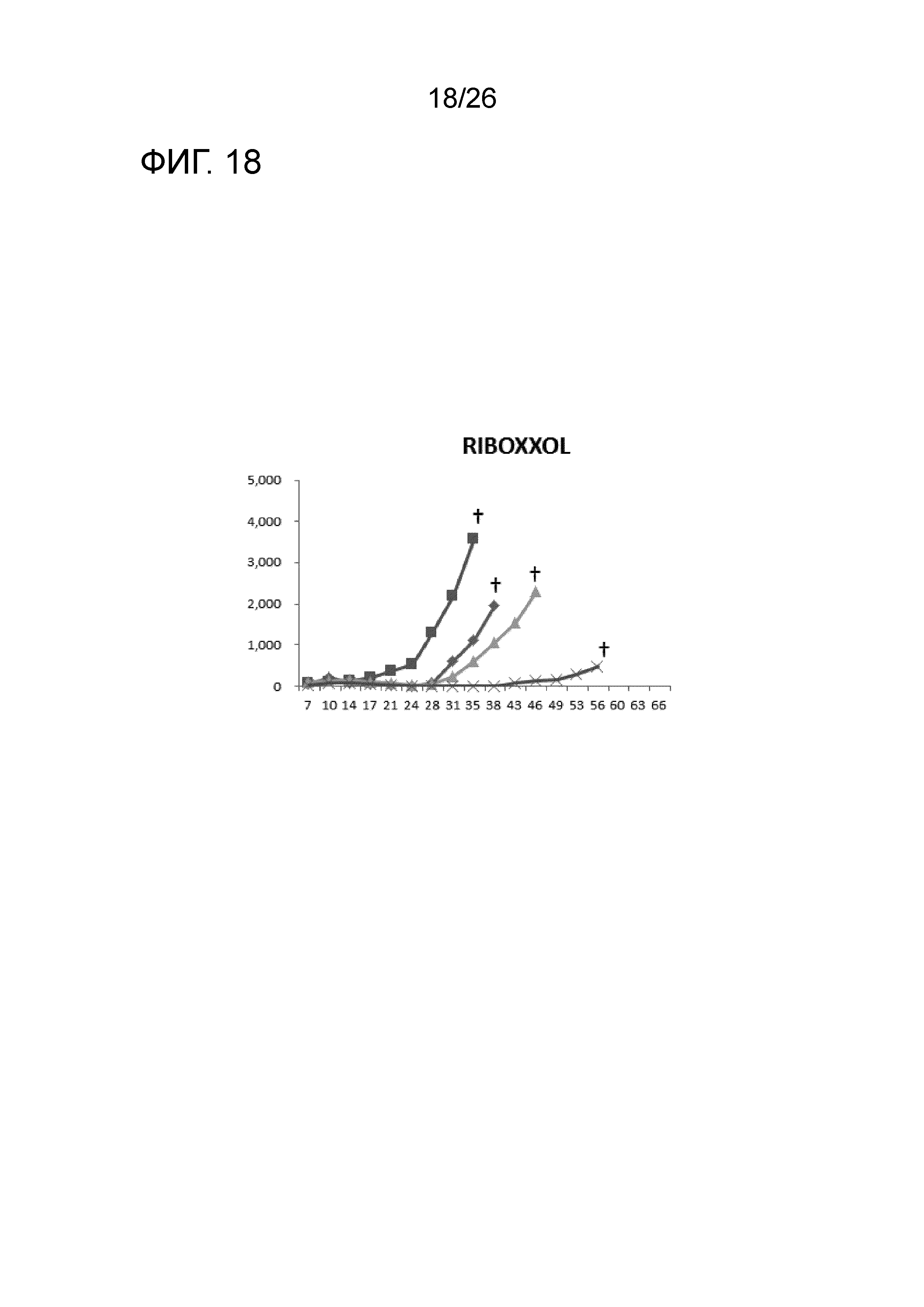
[Фигура 18] Фигура 18 является графиком, на котором показаны изменения размера опухоли в Группе 5, в которой RIBOXXOL использовали в качестве адъюванта.
[Фигура 19] Фигура 19 является графиком, на котором показаны изменения размера опухоли в Группе 6, в которой комбинацию LAG-3 и RIBOXXOL использовали в качестве адъюванта.
[Фигура 20] Фигура 20 является графиком, на котором показаны изменения размера опухоли в Группе 7, в которой комбинацию LAG-3 и MPL использовали в качестве адъюванта.
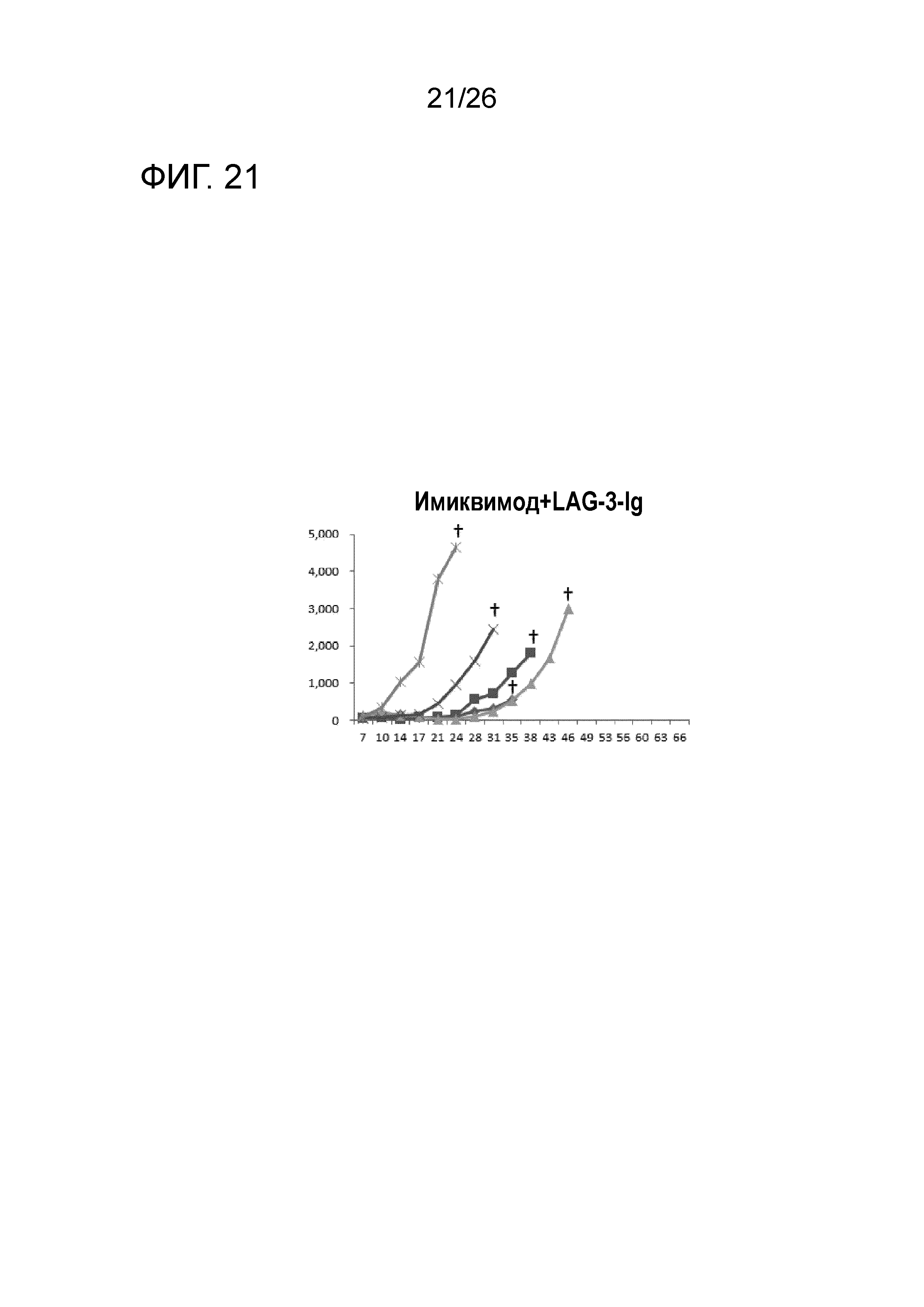
[Фигура 21] Фигура 21 является графиком, на котором показаны изменения размера опухоли в Группе 8, в которой комбинацию LAG-3 и имиквимод использовали в качестве адъюванта.
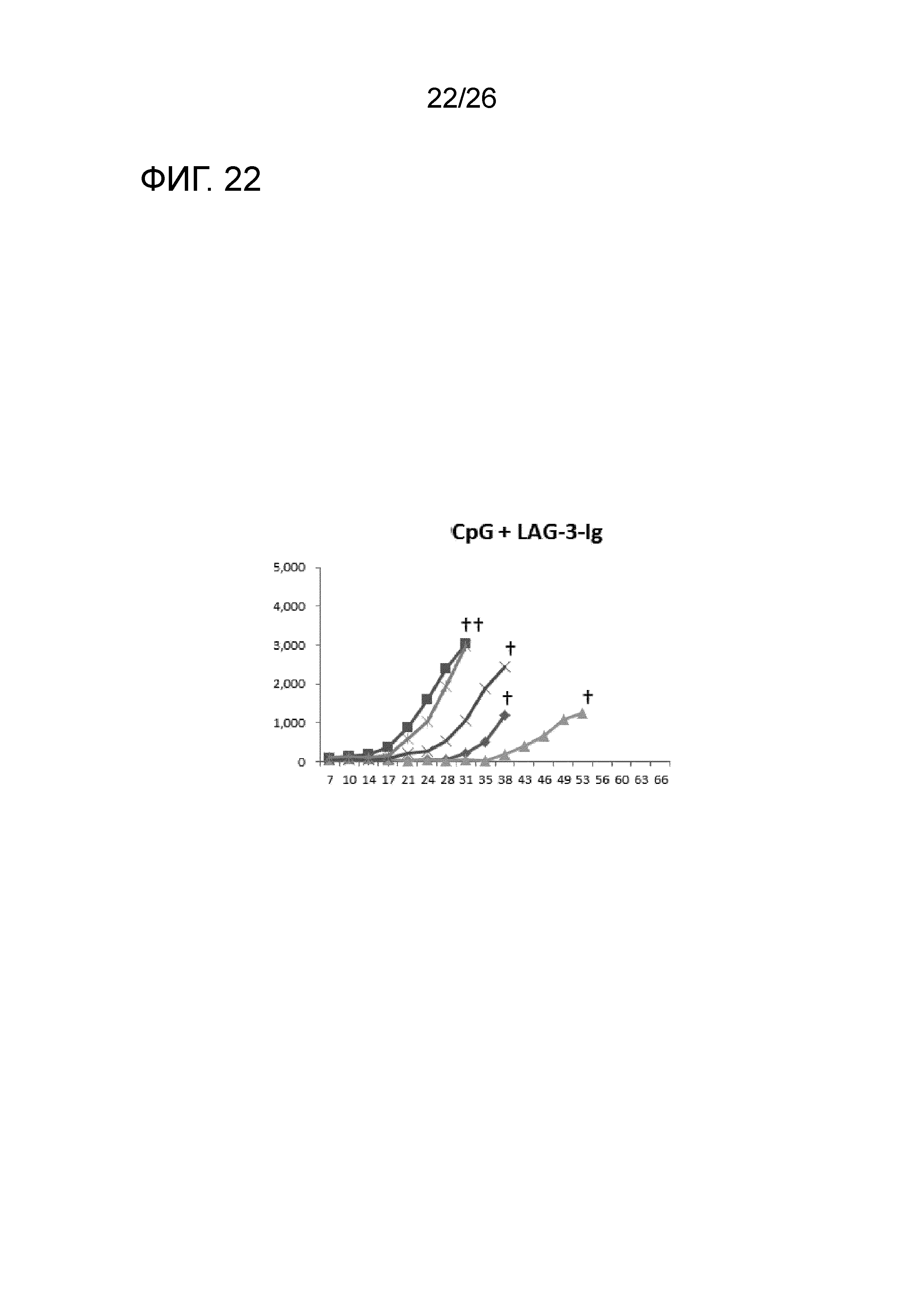
[Фигура 22] Фигура 22 является графиком, на котором показаны изменения размера опухоли в Группе 9, в которой комбинацию LAG-3 и CpG использовали в качестве адъюванта.
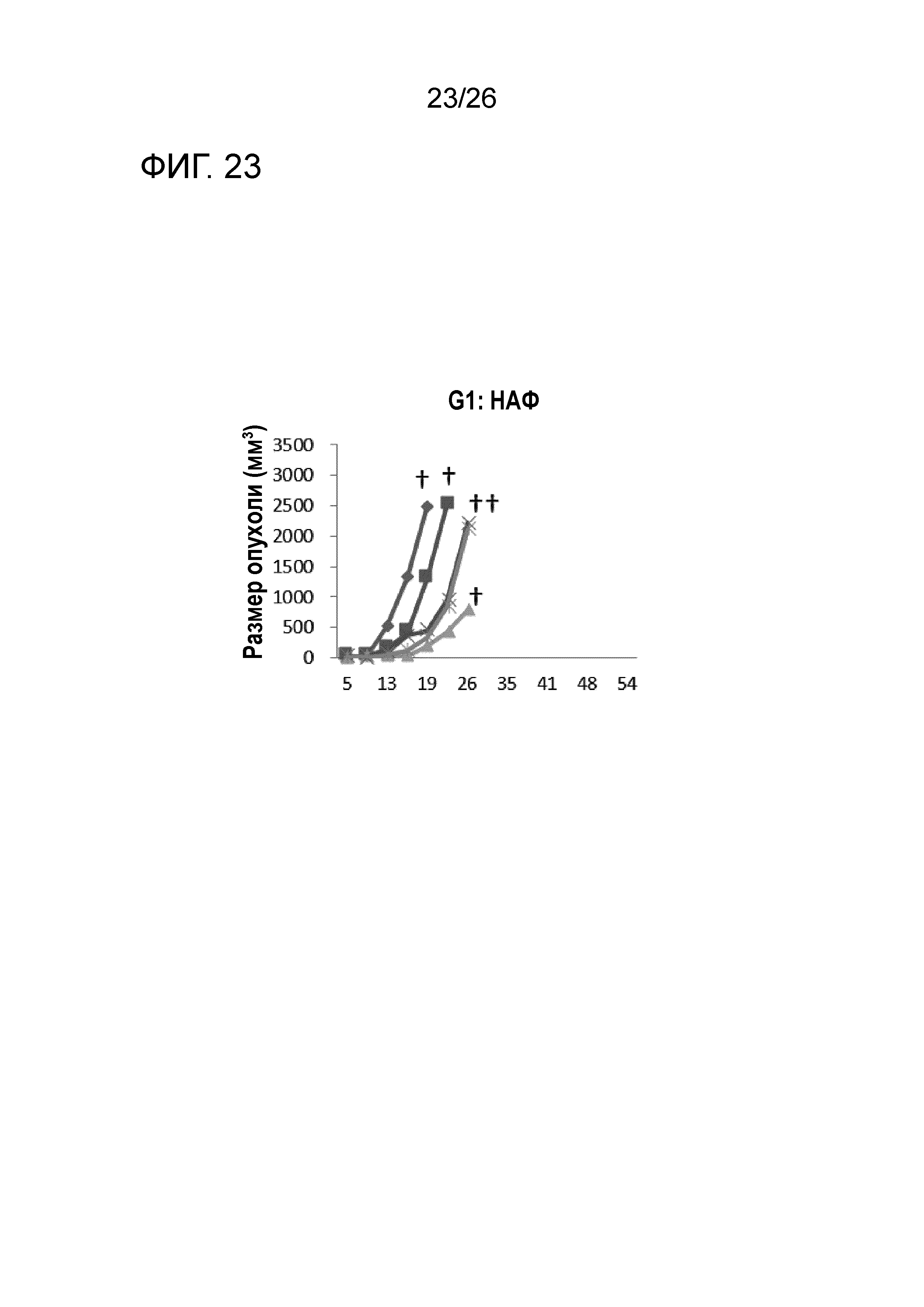
[Фигура 23] Фигура 23 является графиком, на котором показаны изменения размера опухоли в Группе 1, в которой НАФ использовали в качестве адъюванта.
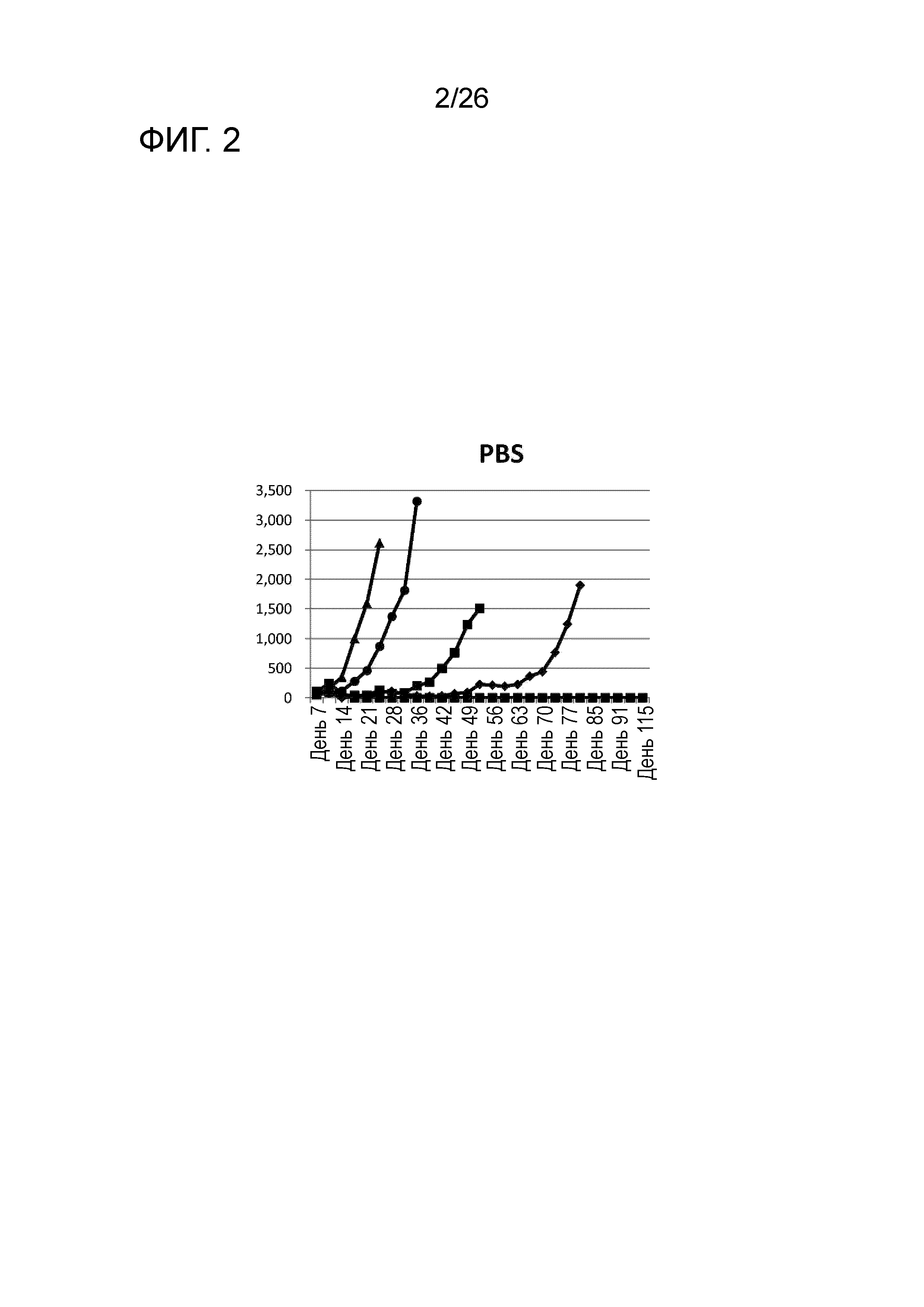
[Фигура 24] Фигура 24 является графиком, на котором показаны изменения размера опухоли в Группе 2, в которой поли-I:C использовали в качестве адъюванта.
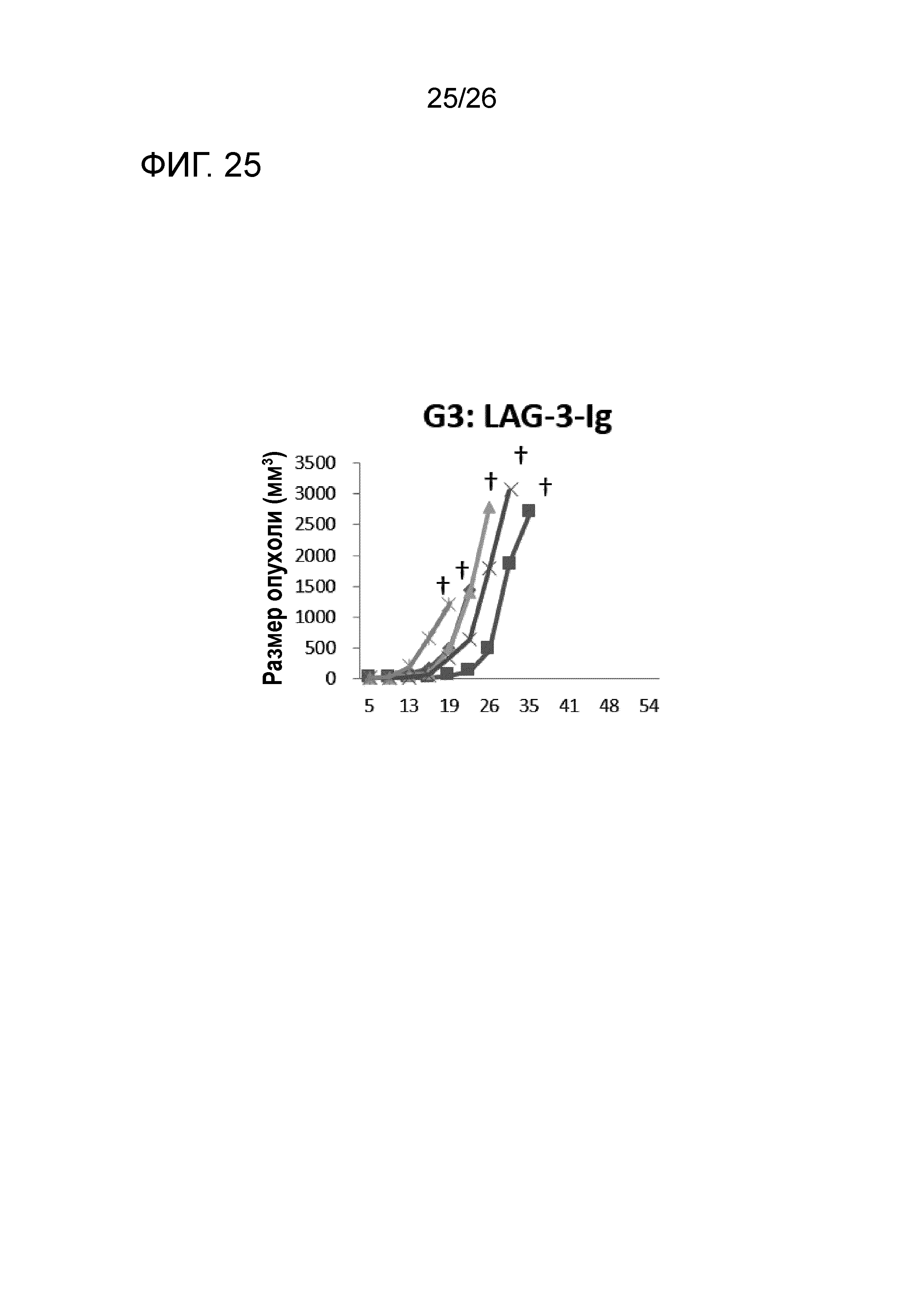
[Фигура 25] Фигура 25 является графиком, на котором показаны изменения размера опухоли в Группе 3, в которой LAG-3 использовали в качестве адъюванта.
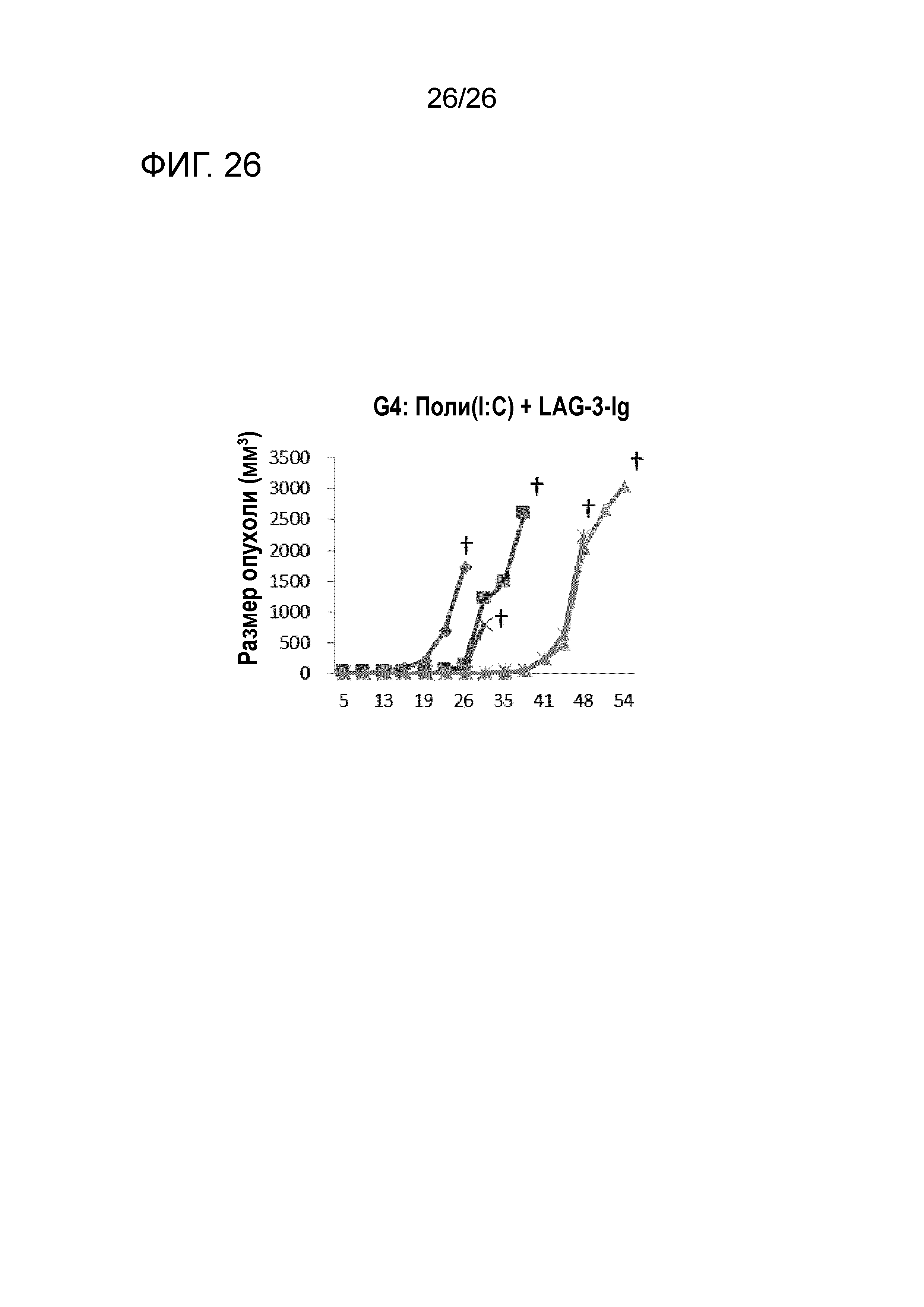
[Фигура 26] Фигура 26 является графиком, на котором показаны изменения размера опухоли в Группе 4, в которой LAG-3 и поли-I:C использовали в качестве адъювантов.
Описание вариантов осуществления
[0012]
Настоящее изобретение будет более подробно описано ниже посредством вариантов осуществления; однако настоящее изобретение не ограничивается вариантами осуществления и может быть изменено и осуществлено различными способами.
[0013]
Лекарственное средство согласно настоящему изобретению включает агонист Toll-подобного рецептора (агонист TLR) и белок LAG-3, его вариант или производное.
[0014]
В настоящем описании "агонист Toll-подобного рецептора (агонист TLR)" относится к молекуле, которая связывается с любым из Toll-подобных рецепторов и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR. В качестве агониста TLR известны агонисты TLP, описанные в Trends in Immunology Vol.30 No.1, 23-32, Immunity 33, October 29, 2010, 492-503, и World Journal of Vaccines, 2011, 1, 33-78. Каждый из указанных TLR рецепторов, известных в уровне техники, может применяться в качестве агониста TLR настоящего изобретения; например, могут применяться агонист TLR3, агонист TLR4, агонист TLR7, агонист TLR8, агонист TLR9 или агонист TLR10. Из них в качестве агониста TLR могут применяться агонист TLR3 или агонист TLR9.
[0015]
В настоящем описании "агонист TLR3" относится к молекуле, которая связывается с TLR3 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR3. TLR3 распознает вирусную двухцепочечную РНК, вызывая активацию врожденной иммунной системы. В качестве агониста TLR3 известен синтетический двухцепочечный полинуклеотид, поли-I:C, имеющий структуру, аналогичную двухцепочечной РНК; однако агонист TLR3 не ограничивается этим. В настоящем изобретении может применяться соль поли-I:C; например, может применяться его натриевая соль. В качестве агониста TLR3 может применяться RIBOXXOL.
[0016]
В настоящем описании "агонист TLR4" относится к молекуле, которая связывается с TLR4 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR4. TLR4 распознает бактериальный липополисахарид (ЛПС), вызывая активацию врожденной иммунной системы. В качестве агониста TLR4 известен MPL; однако агонист TLR4 не ограничивается этим. В настоящем изобретении может применяться соль MPL; например, может применяться его натриевая соль.
[0017]
В настоящем описании "агонист TLR5" относится к молекуле, которая связывается с TLR5 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR5. TLR5 распознает бактериальный флагеллин, вызывая активацию врожденной иммунной системы. В качестве агониста TLR5 известны флагеллины (белки), полученные из различных бактерий, или рекомбинантные белки флагеллины; однако агонист TLR5 не ограничивается этим.
[0018]
В настоящем описании "агонист TLR7" относится к молекуле, которая связывается с TLR7 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR7.
Кроме того, в настоящем описании "агонист TLR8" относится к молекуле, которая связывается с TLR8 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR8.
TLR7 и TLR8 распознают вирусную одноцепочечную РНК, вызывая активацию врожденной иммунной системы. В качестве агониста TLR7/8 известен имиквимод; однако агонист TLR7/8 не ограничивается этим. В настоящем изобретении может применяться соль имиквимода; например, может применяться его натриевая соль.
[0019]
В настоящем описании "агонист TLR9" относится к молекуле, которая связывается с TLR9 и обеспечивает такую же стимуляцию, какую обеспечивает природный лиганд при связывании с TLR9. TLR9 распознает бактериальную и вирусную CpG ДНК, вызывая активацию врожденной иммунной системы. В качестве агониста TLR9 известен CpG ODN; однако агонист TLR9 не ограничивается этим. В настоящем изобретении может применяться соль CpG ODN; например, может применяться его натриевая соль.
[0020]
В настоящем описании "белок LAG-3, его вариант или производное" относятся к белку LAG-3, его функциональному варианту или производному. Белок LAG-3, применяемый в настоящем изобретении, может быть получен из любого животного, например, такой белок может быть получен из того же животного, что и субъект, которому надлежит вводить лекарственное средство согласно настоящему изобретению. В частности, если лекарственное средство согласно настоящему изобретению вводят человеку, может применяться человеческий LAG-3. Человеческий белок LAG-3 является белком, имеющим аминокислотную последовательность, представленную в NCBI под рег. номером P18627.5.
[0021]
Примеры функционального варианта белка LAG-3 включают: (i) вариант LAG-3, состоящий из аминокислотной последовательности, которая является аминокислотной последовательностью LAG-3, имеющей дополнение, замену или делецию одной или нескольких аминокислот и обладающей функцией белка LAG-3, требуемой для проявления действия согласно настоящему изобретению, (ii) вариант LAG-3, имеющий идентичность последовательности с аминокислотной последовательностью LAG-3 по меньшей мере 80% или больше, или 85% или больше, 90% или больше, 95% или больше, 98% или больше или 99% или больше, и обладающий функцией белка LAG-3, требуемой для проявления действия согласно настоящему изобретению, и (iii) неполный полипептид белка LAG-3, его варианта, определенного в (i) выше, или варианта, определенного в (ii) выше, обладающий функцией белка LAG-3, требуемой для проявления действия согласно настоящему изобретению.
В настоящем описании "одна или несколько аминокислот" относятся к 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотам.
[0022]
В настоящем описании "аминокислота" используется в соответствующем наиболее широком смысле и включает природные аминокислоты, а также искусственные варианты и производные аминокислот. В настоящем описании примеры аминокислоты включают L-аминокислоты природных белков; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; природные аминокислоты, не входящие в состав белков, такие как норлейцин, β-аланин и орнитин; и химически синтезируемые соединения, обладающие свойствами аминокислот, известными в уровне техники. Примеры неприродных аминокислот включают α-метиламинокислоту (например, α-метилаланин), D-аминокислоту, гистидин-подобную аминокислоту (например, β-гидрокси-гистидин, гомогистидин, α-фторметил-гистидин и α-метил-гистидин), аминокислоты с дополнительным метиленом в боковой цепи (гомоаминокислоты) и аминокислоты (например, цистеин), в котором карбоксильная функциональная группа в боковой цепи аминокислоты заменена сульфоновой группой.
[0023]
Примеры функционального производного белка LAG-3 включают слитый белок всего или части белка LAG-3 и другого белка или полипептида, а также белок LAG-3 с присоединенной сахарной цепью и/или липидом. В качестве примера функционального производного белка LAG-3 - слитый белок LAG-3 и IgG. Примеры функционального производного белка LAG-3 включают производные, описанные в Journal of Translational Medicine 2014, 12: 97.
[0024]
Лекарственное средство согласно настоящему изобретению может содержать агонист TLR, белок LAG-3, его вариант или производное и вещество для индукции специфичного иммунного ответа против раковой клетки.
[0025]
В настоящем описании "вещество для индукции специфичного иммунного ответа против раковой клетки" конкретно не ограничено при условии, что оно является веществом, способным индуцировать иммунный ответ, необходимый для разрушения раковых клеток in vivo и индукции апоптоза раковых клеток; например, можно указать белок ракового антигена, полученный из ракового антигена пептид, нуклеиновые кислоты, кодирующие их, презентирующую раковый антиген клетку и саму опухолевую клетку.
[0026]
В настоящем описании "белок ракового антигена" является белком, специфически экспрессируемым на раковой клетке и распознаваемым/атакуемым иммунной системой в качестве чужеродного тела. "Белок ракового антигена" может экспрессироваться на раковых клетках всех типов и определенного типа рака. В качестве белка ракового антигена предпочтителен белок, обладающий сильной иммуногенностью и никогда не экспрессирующийся в нормальных клетках. Примеры белка ракового антигена включают, без конкретного ограничения перечисленными, белки, описанные в Clin Cancer Res 2009; 15 (17) 5323. Их определенные примеры включают, без конкретного ограничения перечисленными, WT1, MUC1, LMP2, HPVE6, HPVE7, EGFRv III, HER-2/neu, MAGE-A3, немутантный p53, HSP70, GPC3, MUC1, Casp8, CDAM1, cMyb, EVC1, EVC2, Helios, Fas, NY-ESO-1, PSMA, GD2, CEA, MelanA/MART1, мутантный Ras, gp100, мутантный p53, Протеиназу 3 (PR1), bcr-abl, Тирозиназу, Сурвивин, PSA, hTERT, транслокационные точки разрыва саркомы, EphA2, PAP, ML-IAP, AFP, EpCAM, ERG, NA17, PAX3, ALK, андрогеновый рецептор, Циклин B1, полисиаловую кислоту, MYCN, PhoC, TRP-2, GD3, Фукозил GM1, Мезотелин, PSCA, MAGE A1, sLe, CYP1B1, PLAC1, GM3, BORIS, Tn, GloboH, ETV6-AML, NY-BR-1, RGS5, SART3, STn, карбоангидразу IX, PAX5, OY-TES1, белок спермы 17, LCK, HMWMAA, AKAP-4, SSX2, XAGE1, B7H3, Легумаин, Tie2, Page4, VEGFR2, MAD-CT-1, FAP, PDGFR, MAD-CT-2 и Fos-родственный антиген 1.
[0027]
В настоящем описании "полученный из ракового антигена пептид" относится к пептиду, имеющему часть аминокислотной последовательности белка ракового антигена, или к пептиду, имеющему последовательность, которая является такой же аминокислотной последовательностью, как выше, и содержащей дополнение, замену или делецию 1 или 2 аминокислот, или к пептиду, обладающему идентичностью последовательности с вышеуказанной аминокислотной последовательностью 90% или больше, 95% или больше, 98% или больше или 99% или больше и индуцирующему иммуноциты, которые атакуют раковые клетки. Полученный из ракового антигена пептид может состоять из 8 или более и 11 или менее остатков аминокислот. Такой пептид, если его подкожно вводят больному, включается в антигенпрезентирующие клетки, такие как дендритные клетки и макрофаги, и презентируется на поверхности клеток вместе с молекулами HLA. Клетки-предшественники цитотоксической Т-клетки (CTL), обладающие реактивностью в отношении презентированного пептида, клонально пролиферируют, и зрелые CTL клетки, которые пролиферировали и дифференцировались, мигрируют через ток лимфы в раковую ткань. Зрелые CTL атакуют раковую клетку, на которой экспрессирован пептид, имеющий ту же последовательность, что и введенный пептид, вызывая апоптоз.
[0028]
В настоящем описании "нуклеиновая кислота" кокретно не ограничена при условии, что она является нуклеиновой кислотой, кодирующей белок ракового антигена или полученный из ракового антигена пептид, и включает РНК, ДНК, ПНК, ЛНК или химеры двух или более из них. Такие нуклеиновые кислоты могут быть встроены, например, в вектор, в соответствии с известным методом, и затем введены больным, и могут экспрессировать белок ракового антигена или полученный из ракового антигена пептид in vivo.
[0029]
В настоящем описании "антигенпрезентирующая раковая клетка" относится к антигенпрезентирующей клетке, презентирующей полученный из ракового антигена пептид на своей поверхности посредством связывания с молекулой HLA. В качестве антигенпрезентирующей клетки могут применяться дендритные клетки и макрофаги. Дендритные клетки характеризуются особенно высокой индуцируемостью CTL. Презентирующие антиген дендритные клетки могут быть получены, например, при выделении мононуклеарных клеток из собственной периферической крови больного, дифференцировке мононуклеарных клеток в незрелые дендритные клетки и последующей дифференцировке в зрелые дендритные клетки после добавления белка ракового антигена или полученного из ракового антигена пептида в среду.
[0030]
В качестве противораковой вакцины, разрабатываемой в настоящее время, известны вакцины, в которых применяются дендритные клетки, сенсибилизированные экстрактом опухолевых клеток, дендритные клетки, сенсибилизированные слитым белком ракового антигена/ГМ-КСФ, а также комбинация неинфекционных вирусоподобных частиц полученного из ВПЧ белка L1 и адъюванта. Они включены в "вещество для индукции специфичного иммунного ответа против раковой клетки".
[0031]
Лекарственное средство согласно настоящему изобретению может содержать по меньшей мере два типа "веществ, индуцирующих специфичный иммунный ответ против раковой клетки". Например, лекарственное средство согласно настоящему изобретению может содержать два или более различных полученных из раковых антигенов пептидов.
[0032]
Лекарственное средство согласно настоящему изобретению может применяться в качестве противораковой вакцинотерапии. В данном случае агонист TLR и белок LAG-3, его вариант или производное служат в качестве адъювантов и усиливают индукцию иммунного ответа "веществом для индукции специфичного иммунного ответа против раковой клетки". Как показано в Примерах (описанных ниже), в случае применения агониста TLR и белка LAG-3 в комбинации, может быть получено крайне высокое противоопухолевое действие, даже при низкой дозе, при которой не может быть получено никакое действие, если они применяются отдельно.
В настоящем описании "адъювант" относится к молекуле(ам), которую вводят вместе с веществом для индукции иммунного ответа с целью усиления индукции иммунного ответа.
[0033]
Противораковая вакцинотерапия может применяться для профилактики или лечения рака. В настоящем описании профилактика или лечение рака относятся к инициированию по меньшей мере одного из следующих явлений: уменьшение размера опухоли, задержка или остановка увеличения размера опухоли, ингибирование (задержка или остановка) метастаза рака, ингибирование (задержка или остановка) пролиферации раковых клеток, ингибирование (задержка или остановка) рецидива рака и ослабление одного или более симптомов, связанных с раком.
[0034]
В настоящем описании термин "рак" используется в наиболее широком смысле. Примеры рака включают, без ограничения перечисленными, астроцитому, олигодендроглиому, менингиому, нейрофиброму, глиобластому, эпендимому, неврилеммому, нейрофибросаркому, нейробластому, опухоль гипофиза (например, в случае аденомы гипофиза), медуллобластому, меланому, опухоль головного мозга, рак предстательной железы, рак головы и шеи, рак пищевода, рак почки, почечно-клеточную карциному, рак поджелудочной железы, рак молочной железы, рак легкого, рак толстой кишки, рак толстой и прямой кишки, рак желудка, рак кожи, рак яичника, рак мочевого пузыря, фибросаркому, плоскоклеточную карциному, нейроэктодермальную опухоль, опухоль щитовидной железы, лимфому, лейкоз, множественную миелому, гепатоцеллюлярную карциному, мезотелиому и эпидермоидную карциному.
[0035]
Настоящее изобретение включает адъювант, включающий агонист TLR и белок LAG-3, его вариант или производное для применения в противораковой вакцинотерапии. Агонист TLR является адъювантом, вводимым в комбинации с белком LAG-3, его вариантом или производным; тогда как белок LAG-3, его вариант или производное могут быть адъювантом, вводимым в комбинации с агонистом TLR. Такие адъюванты можно вводить больному вместе с различными "веществами, индуцирующими специфичный иммунный ответ против раковой клетки". Термин "вместе", используемый в настоящем описании, не означает параллельное введение, но означает, что агонист TLR и белок LAG-3, его вариант или производное вводят больному таким образом, что агонист TLR и белок LAG-3, его вариант или производное могут функционировать как адъюванты в соответствии с противораковой вакцинотерапией in vivo (в организме больного) и ex vivo.
В настоящем изобретении может быть предложено лекарственное средство, содержащее агонист TLR, для комбинированного введения с белком LAG-3, его вариантом или производным; или может быть предложено лекарственное средство, содержащее белок LAG-3, его вариант или производное, для комбинированного введения с агонистом TLR.
Кроме того, в настоящем изобретении может быть предложено лекарственное средство, содержащее агонист TLR, для комбинированного введения с веществом для индукции специфичного иммунного ответа против раковой клетки и белком LAG-3, его вариантом или производным. Лекарственное средство, содержащее агонист TLR, может действовать, с белком LAG-3, его вариантом или производным, в качестве адъюванта для усиления индукции иммунного ответа веществом для индукции специфичного иммунного ответа против раковой клетки, предпочтительно полученным из ракового антигена пептидом. В настоящем изобретении может быть предложено лекарственное средство, содержащее белок LAG-3, его вариант или производное, для комбинированного введения с веществом для индукции специфичного иммунного ответа против раковой клетки и агонистом TLR. Лекарственное средство, содержащее белок LAG-3, его вариант или производное, могут действовать, с агонистом TLR, в качестве адъюванта для усиления индукции иммунного ответа веществом для индукции специфичного иммунного ответа против раковой клетки, предпочтительно полученным из ракового антигена пептидом.
[0036]
В лекарственном средстве, содержащем агонист TLR и белок LAG-3, его вариант или производное согласно настоящему изобретению, агонист TLR и белок LAG-3, его вариант или производное могут применяться в качестве действующих веществ лекарственного средства. Лекарственное средство, содержащее агонист TLR и белок LAG-3, его вариант или производное в качестве действующих веществ согласно настоящему изобретению, как показано в Примерах (описанных ниже), может применяться в качестве противоопухолевого средства, обладающего сильным противоопухолевым действием. В настоящем описании "противоопухолевое средство" относится к средству, которое может применяться для предотвращения или лечения рака. Лекарственное средство, служащее в качестве противоопухолевого средства, может содержать агонист TLR и белок LAG-3, его вариант или производное в качестве действующих веществ, и может дополнительно содержать вещество для индукции специфичного иммунного ответа против раковой клетки.
В настоящем изобретении лекарственное средство, служащее в качестве противоопухолевого средства, содержит вещество для индукции специфичного иммунного ответа против раковой клетки, предпочтительно полученный из ракового антигена пептид, в качестве действующего вещества, и может содержать агонист TLR и белок LAG-3, его вариант или производное в качестве адъювантов.
[0037]
Компоненты лекарственного средства согласно настоящему изобретению растворяют в водорастворимом растворителе с получением фармацевтически приемлемых солей, после чего препарат, содержащий компоненты в форме солей, можно вводить больным. Примеры таких фармацевтически приемлемых солей включают физиологически приемлемые водорастворимые соли, такие как натриевую соль, калиевую соль, магниевую соль и кальциевую соль, которые доводят буфером до физиологического pH. Кроме водорастворимых растворителей может использоваться неводный растворитель. Примеры неводного растворителя включают спирты, такие как пропиленгликоль и этанол.
[0038]
Лекарственное средство согласно настоящему изобретению может применяться в качестве фармацевтической композиции, которая имеет любую лекарственную форму, вводимую перорально или парентерально. Лекарственная форма конкретно не ограничена. Примеры лекарственной формы фармацевтической композиции могут включать жидкость (например, для инъекций), дисперсант, суспензию, таблетку, пилюлю, лекарственное средство в форме порошка, суппозиторий, порошок, тонкое зерно, гранулу, капсулу, сироп, назальные капли и ушные капли.
Лекарственное средство согласно настоящему изобретению, в случае его применения в качестве противораковой вакцины, можно вводить перорально или парентерально. В качестве парентерального введения, например, можно применять внутрибрюшинное введение, подкожное введение, внутрикожное введение, внутримышечное введение, внутривенное введение или интраназальное введение.
[0039]
Препарат лекарственного средства согласно настоящему изобретению может быть получен в соответствии со способом, известным в уровне техники. В препарате лекарственного средства согласно настоящему изобретению могут применяться фармацевтически приемлемые носители и добавки (такие как вспомогательное вещество, связующее вещество, дисперсант, разрыхлитель, смазывающее вещество, растворитель, солюбилизатор, краситель, ароматизатор, стабилизатор, эмульгатор, суспендирующее вещество, улучшающее абсорбцию вещество, поверхностно-активное вещество, регулятор pH, консервант и антиоксидант). Примеры носителей и добавок включают фармацевтически приемлемые органические растворители, такие как воду, раствор хлорида нитрия, фосфатный буфер, декстрозу, глицерин и этанол, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, натрий карбоксиметилцеллюлозу, полиакрилат натрия, альгинат натрия, водорастворимый декстран, натрий карбоксиметилкрахмал, пектин, глутаминовую кислоту, аспарагиновую кислоту, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметил-целлюлозу, ксантановую камедь, гуммиарабик, казеин, агар, полиэтиленгликоль, диглицерин, глицерин, пропиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, человеческий сывороточный альбумин, маннит, сорбит, лактозу, глюкозу, кукурузный крахмал, микрокристаллическую целлюлозу, поверхностно-активное вещество, бисульфит натрия, бисульфат натрия, тиосульфат натрия, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенилртути, нитрат фенилртути, метилпарабен, фенилэтиловый спирт, аммиак, дитиотреитол, бета-меркаптоэтанол, карбонат натрия, борат натрия, фосфат натрия, ацетат натрия, бикарбонат натрия, сахарозу, тонкодисперсный сахар, сахарозу, фруктозу, глюкозу, лактозу, восстановленный мальтозный сироп, тонкодисперсный восстановленный мальтозный сироп, фруктозно-глюкозный сироп, фруктозно-глюкозный сахар, мед, эритрит, аспартам, сахарин, сахарин натрия и желатин.
[0040]
В случае, когда лекарственное средство согласно настоящему изобретению содержит пептид, может использоваться улучшающее абсорбцию вещество для улучшения абсорбции плохо абсорбируемого лекарственного средства (плохо абсорбируемого через слизистую лекарственного средства), такого как пептид. Соответствующие примеры включают поверхностно-активные вещества, такие как полиоксиэтилен лауриловый эфир, лаурилсульфат натрия и сапонин; соли желчных кислот, таких как гликохолевая кислота, дезоксихолевая кислота и таурохолевая кислота; хелатообразующие вещества, такие как ЭДТА и соль салицил желчной кислоты; жирные кислоты, такие как капроновую кислоту, каприновую кислоту, лауриновую кислоту, олеиновую кислоту, линолевую кислоту и смешанную мицеллу; производное енамина, N-ацилколлагеновый пептид, N-ациламинокислоту, циклодекстрин, хитозан и донор оксида азота.
В случае, когда лекарственное средство согласно настоящему изобретению содержит пептид, лекарственное средство инкапсулировано, например, в микрокапсулах из полимолочной кислоты/гликолевой кислоты (PLGA), или адсорбировано на тонких частицах пористого гидроксиапатита с получением лекарственного средства с замедленным высвобождением, или лекарственное средство применяется в ионтофорезной трансдермальной системе с импульсным высвобождением, с получением трансдермального абсорбента.
[0041]
Лекарственное средство согласно настоящему изобретению может быть одним препаратом, содержащим агонист TLR и белок LAG-3, его вариант или производное, или может быть комбинацией различных препаратов, т.е. препарата, содержащего агонист TLR, и препарата, содержащего белок LAG-3, его вариант или производное.
Также лекарственное средство согласно настоящему изобретению может быть одним препаратом, содержащим вещество для индукции специфичного иммунного ответа против раковой клетки, агонист TLR и белок LAG-3, его вариант или производное, или может быть комбинацией различных препаратов, т.е. препарата, содержащего вещество для индукции специфичного иммунного ответа против раковой клетки, препарата, содержащего агонист TLR, и препарата, содержащего белок LAG-3, его вариант или производное. В частности, препарат, содержащий два типа компонентов, выбранных из вещества для индукции специфичного иммунного ответа против раковой клетки, агониста TLR и белка LAG-3, его варианта или производного, может применяться в комбинации с препаратом, содержащим другой оставшийся компонент. В случае если представлена комбинация трех типов компонентов, препарат, содержащий любые два типа компонентов, и препарат, содержащей любые два типа компонентов, могут применяться в комбинации.
Лекарственное средство согласно настоящему изобретению может быть представлено в форме набора. В случае набора набор может содержать агонист TLR и белок LAG-3, его вариант или производное, или может содержать вещество для индукции специфичного иммунного ответа против раковой клетки, агонист TLR и белок LAG-3, его вариант или производное.
[0042]
Лекарственное средство согласно настоящему изобретению, если оно применяется в качестве противораковой вакцины, может содержать дополнительные адъюванты. Неограничивающие примеры дополнительных адъювантов включают осаждаемые адъюванты, такие как гидроксид алюминия, гидроксид натрия, фосфат алюминия, фосфат кальция, квасцы и карбоксивиниловый полимер, и масляные адъюванты, такие как полный адъювант Фрейнда, неполный адъювант Фрейнда, вазелиновое масло, ланолин, Montanide ISA763AV и Montanide ISA51.
[0043]
Лекарственное средство согласно настоящему изобретению может применяться в комбинации с другими противоопухолевыми средствами в любом варианте осуществления и может применяться в комбинации с лучевой терапией и хирургическим вмешательством. Примеры другого противоопухолевого средства включают низкомолекулярные соединения, такие как адриамицин, дауномицин, митомицин, цисплатин, винкристин, эпирубицин, метотрексат, 5-фторурацил, аклациномицин, азотистый иприт, циклофосфамид, блеомицин, даунорубицин, доксорубицин, винкристин, винбластин, виндезин, тамоксифен и дексаметазон; и белки, такие как цитокины, активирующие иммунокомпетентные клетки (например, человеческий интерлейкин 2, человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор, человеческий макрофагальный колониестимулирующий фактор и человеческий интерлейкин 12).
[0044]
Настоящее изобретение включает способ лечения рака путем введения лекарственного средства согласно настоящему изобретению в терапевтически эффективной дозе. Терапевтически эффективная доза может быть соответствующим образом определена специалистами в данной области, например, в зависимости от симптомов, возраста, пола, массы тела и различия в чувствительности больного, способа введения, интервала между введениями и типа препарата.
В настоящем изобретении лечить или предотвращать заболевание у больного можно путем введения агониста TLR и белка LAG-3, его варианта или производного нуждающемуся в этом больному. В настоящем изобретении предложен способ индукции специфичного иммунного ответа против раковой клетки посредством введения агониста TLR и белка LAG-3, его варианта или производного нуждающемуся в этом больному.
При лечении или предотвращении заболевания у больного или в способе индукции специфичного иммунного ответа против раковой клетки может быть дополнительно введено вещество для индукции специфичного иммунного ответа против раковой клетки, предпочтительно полученный из ракового антигена пептид.
Лечебное действие вещества для индукции специфичного иммунного ответа против раковой клетки, предпочтительно полученного из ракового антигена пептида, может сильнее проявляться при индукции специфичного иммунного ответа против раковой клетки.
[0045]
Лекарственное средство согласно настоящему изобретению предпочтительно применяется для комбинированного введения.
Применение лекарственного средства согласно настоящему изобретению в комбинированном введении означает, что агонист TLR и белок LAG-3, его вариант или производное могут быть введены больному в любой комбинации, в одно время или в разное время. Если лекарственное средство согласно настоящему изобретению содержит вещество для индукции специфичного иммунного ответа против раковой клетки, вещество для индукции специфичного иммунного ответа против раковой клетки, агонист TLR и белок LAG-3, его вариант или производное могут быть введены в любой комбинации, в одно время или разное время.
При введении компонентов в одно время, компоненты можно вводить в одной лекарственной форме в одно время; в частности, агонист TLR и белок LAG-3, его вариант или производное могут быть смешаны во время введения с получением препарата и введены в одно время.
При введении компонентов в разное время, вводят агонист TLR, и после этого может быть введен белок LAG-3, его вариант или производное; или вводят белок LAG-3, его вариант или производное, и после этого может быть введен агонист TLR.
[0046]
При введении компонентов в одно время, если лекарственное средство согласно настоящему изобретению содержит вещество для индукции специфичного иммунного ответа против раковой клетки, компоненты могут быть введены в одной лекарственной форме в одно время; в частности, вещество для индукции специфичного иммунного ответа против раковой клетки, агонист TLR и белок LAG-3, его вариант или производное могут быть смешаны во время введения с получением препарата и введены в одно время.
При введении компонентов в разное время, вводят вещество для индукции специфичного иммунного ответа против раковой клетки, и после этого агонист TLR и белок LAG-3, его вариант или производное вводят в одно время или в разное время; или агонист TLR и белок LAG-3, его вариант или производное могут быть введены в одно время или в разное время, и после этого может быть введено вещество для индукции специфичного иммунного ответа против раковой клетки. В альтернативе вводят одно из агониста TLR и белка LAG-3, его варианта или производного, и после этого вводят вещество для индукции специфичного иммунного ответа против раковой клетки, а затем может быть введен другой из агониста TLR и белка LAG-3, его варианта или производного. При введении компонентов в разное время, компоненты могут быть введены в зависимости от свойств и интервала между введением доз отдельных компонентов, другими словами, согласно схемам применения отдельных компонентов.
[0047]
Описания всех Патентных источников и Непатентных источников, цитируемых в настоящем описании, полностью включены в настоящую заявку посредством отсылки.
Пример 1
[0048]
Далее настоящее изобретение будет описано на основе Примера; впрочем, настоящее изобретение не ограничивается этим. Настоящее изобретение может быть изменено различными способами специалистами в данной области без отступления от объема настоящего изобретения, при этом такое изменение включено в объем настоящего изобретения.
[0049]
1. Противораковая вакцина
В соответствии с протоколом, показанным на Фигуре 1, сравнивали действие адъювантов в противораковых вакцинах, в которых применяется полученный из ракового антигена пептид.
[0050]
Материалы
В качестве модели рака на мышах применяли мышей DBA/2, которым перевивали клетки P815 (мышиной мастоцитомы, полученной в мышах DBA/2).
В качестве полученного из ракового антигена пептида применяли пептид (в дальнейшем указанный как "пептид P1A"), состоящий из неполной последовательности белка P1A, который является опухолевым антигеном опухоли P815 и, как известно, ограниченно презентирован H-2Ld MHC. Аминокислотная последовательность пептида P1A представлена последовательностью LPYLGWLVF (SEQ ID No: 1).
В качестве P1A CTL использовали Т-клетку, экспрессирующую Т-клеточный рецептор и распознающую пептид P1A. В эксперименте селезенку забирали у P1A-CTL трансгенной мыши, которая имелась у авторов настоящего изобретения, и процент положительных клеток проверяли по TCR Vα 8.3 (маркер TCR, полученный при введении гена). На основе процента положительных клеток определяли и вводили соответствующее количество P1A-CTL клеток.
В качестве адъювантов использовали следующие вещества.
Цельные бактериальные клетки коклюшной палочки (PT) (BioFarma, Bandung, Indonesia)
Поли-I:C (агонист TLR3) (Invivogen, SanDiego, USA)
CpG (агонист TLR9) (Invivogen, SanDiego, USA)
НАФ (неполный адъювант Фрейнда) (Seppic, Paris, France)
LAG-3 (Adipogen, SanDiego, USA)
[0051]
Методы
Опухолевые клетки P815 подкожно вводили мышам DBA/2 в количестве 5×105 клеток на мышь. День введения обозначали как День 0. В День 8 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 9 и День 16 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. Мышей распределяли в 9 групп, каждая из которых состояла из 5 мышей, и использовали следующие адъюванты, соответственно.
Группа 1: PBS (контроль)
Группа 2: НАФ (50 мкл/мышь)
Группа 3: PT (1×108/мышь)
Группа 4: поли-IC (50 мкг/мышь)
Группа 5: поли-IC (50 мкг/мышь)+CPG (10 мкг/мышь)
Группа 6: LAG-3 (1 мкг/мышь)
Группа 7: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
[0052]
Результаты
Изменения размера опухоли (мм3) у всех мышей на День 7 и после показаны на Фигурах 2-8.
Во всех Группах 1-6 размеры опухоли постепенно увеличивались, и мыши главным образом погибали в середине исследования. Число мышей, доживших до Дня 70 без увеличения размера опухоли, составило 0 в Группах 2, 3 и 6, 1 в Группах 1 и 4, и 3 в Группе 5; однако в Группе 7 увеличение размера опухоли не наблюдали ни у одной из 5 мышей, при этом мыши выживали до Дня 115.
[0053]
2. Инфильтрация иммуноцитов в раковую ткань
Мышей для модели рака получали при подкожном введении опухолевых клеток P815 (5×105 клеток на мышь) мышам DBA/2. День введения обозначали как День 0. В День 8 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 9 и День 14 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. Следующие адъюванты использовали в соответствующих группах мышей.
Группа 1: НАФ (50 мкл/мышь)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: LAG-3 (1 мкг/мышь)
Группа 4: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
В День 21 опухолевую ткань забирали и подготавливали препараты срезов опухолевой ткани. После этого изображение ткани исследовали при окрашивании гематоксилином-эозином; в то же время ядра клеток и иммуноциты (CD4 клетки и CD8 клетки) окрашивали флуоресцентным красителем.
При флуоресцентном окрашивании ткани использовали следующие реактивы.
Ядро клетки: препятствующий выгоранию флуоресцентного сигнала реактив ProLongR Gold с DAPI (Invitrogen)
Первичное антитело к CD4 клеткам: крысиный очищенный IgG2b против мышиного CD4. Клон: GK1.5 (eBioscience)
Вторичное антитело к CD4 клеткам: моноклональное мышиное антитело (2B 10A8) против тяжелой цепи IgG2b крысы (Alexa FluorR 647), (abcam)
Первичное антитело к CD8 клеткам: крысиный очищенный IgG2a против мышиного CD8α. Клон: 53-6.7 (eBioscience)
Вторичное антитело к CD8 клеткам: моноклональное мышиное антитело (2А 8F4) против тяжелой цепи IgG2a крысы (Alexa FluorR 488) (abcam)
[0054]
Изображения ткани, окрашенной гематоксилином-эозином, показаны на Фигуре 9A, и изображения ядер клеток и иммуноцитов, окрашенных флуоресцентным красителем, показаны на Фигуре 9B. В случае, когда LAG-3 и поли-IC использовали в комбинации в качестве адъюванта, наблюдали значительную инфильтрацию CD4 клеток и CD8 клеток в опухолевую ткань.
[0055]
3. Сохранение способности к отторжению той же опухоли у мышей после предыдущего отторжения опухоли
Клетки опухоли P815 подкожно вводили мышам DBA/2 в количестве 5×105 клеток на мышь и использовали их в качестве мышей в модели рака. День введения обозначали как День 0. В День 8 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 9 и День 14 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. В качестве адъюванта использовали LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь).
Затем мышам DBA/2, у которых не наблюдали увеличения размера опухоли, даже после введения опухолевых клеток P815, и которых определяли как отторгающих опухоль, и наивным мышам DBA/2, которых не подвергали никакой обработке, повторно подкожно вводили опухолевые клетки P815 (1×106 клеток на мышь) или опухолевые клетки L1210 (1×106 клеток на мышь). Мышам DBA/2, определенным как отторгающим опухоль, опухолевые клетки повторно вводили в День 115 после первого введения опухолевых клеток P815.
На Фигуре 10 (слева) показаны изменения среднего размера опухоли (мм3) у мышей после введения клеток L1210; тогда как на Фигуре 10 (справа) показаны изменения среднего размера опухоли (мм3) у мышей после введения клеток P815. На обеих фигурах незакрашенный круг обозначает мышей DBA/2, определенных как отторгающих опухоль мышей, и закрашенный круг обозначает наивных мышей DBA/2.
У наивных мышей DBA/2 наблюдали увеличение размера опухоли, даже если вводили любые из клеток P815 или клеток L1210. Напротив, у мышей, определенных как отторгающих рост опухолевых клеток P815, наблюдали увеличение размера опухоли при введении другого типа опухолевых клеток, т.е. клеток L1210; однако увеличение размера опухоли при введении клеток P815 не наблюдали. Было подтверждено, что способность отторгать такую же опухоль сохранялась.
[0056]
4. Определение пролиферативной способности иммуноцитов и измерение цитокинов в супернатанте клеток
Опухолевые клетки P815 подкожно вводили мышам DBA/2 в количестве 5×105 клеток на мышь для получения мышей в модели рака. День введения обозначали как День 0. В День 8 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 9 и День 14 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. Следующие адъюванты использовали в соответствующих группах мышей.
Группа 1: НАФ (50 мкл/мышь)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: LAG-3 (1 мкг/мышь)
Группа 4: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
Из лимфатических узлов в подмышечной и паховой области лимфатический узел, расположенный близко к участку локализации опухоли, забирали в День 21 и выделяли иммуноциты. Иммуноциты (1,5×105 клеток) и клетки P815 (4×104 клеток), облученные 100 Гр, совместно культивировали в течение 3 дней.
Пролиферативную способность иммуноцитов определяли при добавлении 3H-тимидина (37 кБк/лунка) к супернатанту культуры и измеряли радиоактивность 3H-тимидина, поглощенного клетками через 4 часа.
Количества цитокинов в супернатанте клеток измеряли при помощи набора Bio-Plex Pro mouse cytokine 23-Plex Immunoassay kit (BIO-RAD).
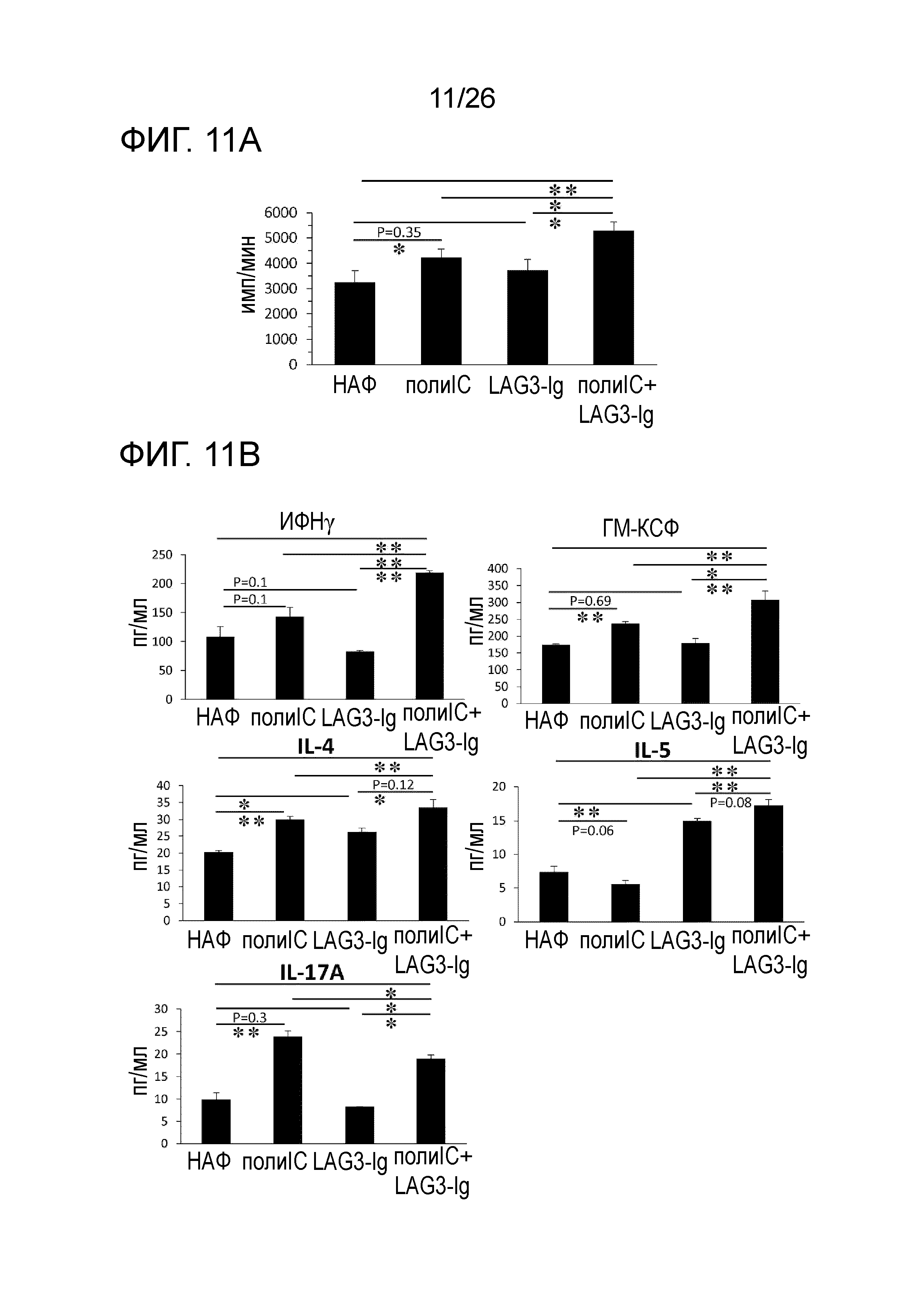
Результаты измерения пролиферативной способности иммуноцитов показаны на Фигуре 11A, а результаты измерения цитокинов показаны на Фигуре 11B.
В случае использования комбинации LAG-3 и поли-IC в качестве адъюванта, пролиферативная способность иммуноцитов увеличилась. Было обнаружено, что продукция цитокинов ИФН-гамма, ГМ-КСФ, IL-4, IL-5 и IL-17A увеличилась при использовании LAG-3 и поли-IC в комбинации в качестве адъюванта.
[0057]
5. Измерение молекул маркеров клеточной поверхности иммуноцитов
Опухолевые клетки P815 подкожно вводили мышам DBA/2 в количестве 5×105 клеток на мышь для получения мышей в модели рака. День введения обозначали как День 0. В День 8 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 9 и День 14 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. Следующие адъюванты использовали в соответствующих группах мышей.
Группа 1: НАФ (50 мкл/мышь)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: LAG-3 (1 мкг/мышь)
Группа 4: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
Из лимфатических узлов в подмышечной или паховой области, лимфатический узел, расположенный близко к участку локализации опухоли, забирали в День 21, и собирали группу положительных по экспрессии CD8 и Vα 8.3 клеток (киллерных Т-клеток) или группу положительных по экспрессии CD4 и Vα 8.3 клеток (Т-хелперов).
Измеряли уровни экспрессии молекул маркеров клеточной поверхности (на CD4 клетках и CD8 клетках), т.е. PD-1, BTLA, TIGIT и LAG-3. В качестве антител против молекул маркеров клеточной поверхности использовали следующие молекулы.
PD-1: антитело против мышиного CD279 (PD-1), PE. Клон: J43 (eBioscience)
BTLA: антитело против мышиного CD272 (BTLA), PE. Клон: 8F4 (eBioscience)
TIGIT: антитело против мышиного TIGIT (Vstm3), PE. Клон: 1G9 (BioLegend)
LAG-3: антитело против мышиного CD223 (LAG-3), PE. Клон: eBioC9B7W (C9B7W) (eBioscience)
Результаты CD8 клеток показаны на Фигуре 12A, и результаты CD4 клеток показаны на Фигуре 12B.
В случае, когда комбинацию LAG-3 и поли-IC использовали в качестве адъюванта, значительные уменьшения уровня экспрессии PD-1, TIGIT и LAG-3 наблюдали как в CD4-положительных клетках, так и в CD8-положительных клетках; однако уменьшение уровня экспрессии BTLA было низким.
[0058]
6. Измерение цитокинов при использовании мышей в модели введения меланомы B16-F10
Мышам C57BL/6 подкожно вводили клетки меланомы B16-F10 (1×105 клеток на мышь) для получения мышей в модели рака. День введения обозначали как День 0. В День 8 подкожно вводили смесь пептида gp100 (50 мкг на мышь) и адъюванта в PBS. Следующие вспомогательные вещества использовали в соответствующих группах мышей. Аминокислотная последовательность пептида gp100 представлена последовательностью KVPRNQDWL (SEQ ID No: 2).
Группа 1: НАФ (50 мкл/мышь)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: LAG-3 (1 мкг/мышь)
Группа 4: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
Из лимфатических узлов в подмышечной или паховой области, лимфатический узел, расположенный близко к участку локализации опухоли (или оба лимфатических узла), забирали в День 14 и выделяли иммуноциты. Иммуноциты (3×105 клеток на лунку) культивировали в присутствии пептида gp100 (10, 5, 2,5 или 0 мкг/мл).
Пролиферативную способность иммуноцитов определяли при добавлении 3H-тимидина (37 кБк/лунка) к супернатанту культуры и измеряли радиоактивность 3H-тимидина, включенного в клетки за последние 10 часов периода культивирования продолжительностью 3 дня.
Количество ИФН-гамма в супернатанте клеток, полученном при культивировании 3 дня в присутствии пептида gp100 (10 мкг/мл), измеряли с помощью набора Bio-Plex Pro mice cytokine 23-Plex Immunoassay kit (BIO-RAD).
Результаты измерения пролиферативной способности иммуноцитов показаны на Фигуре 13A, и результаты измерения количества ИФН-гамма показаны на Фигуре 13B. На Фигуре 13A закрашенный круг обозначает результаты Группы 1, незакрашенный прямоугольник - Группы 2, закрашенный прямоугольник - Группы 3 и незакрашенный круг - Группы 4.
Даже в случае использования модели введения меланомы B16-F10 на мышах, если в качестве адъюванта использовали комбинацию LAG-3 и поли-IC, наблюдали увеличение пролиферативной способности иммуноцитов, специфичных к опухолевому антигену gp100, и увеличение продукции ИФН-гамма.
Было подтверждено, что при использовании комбинации LAG-3 и поли-IC в качестве адъюванта, значительное активирующее действие в отношении иммунной системы может проявляться независимо от системы модели опухоли и типа пептида, служащего в качестве иммунного антигена.
[0059]
7. Эффект подавления роста опухоли при воздействии комбинации иммуноадъювантов.
В качестве адъювантов использовали следующие вещества.
Поли-I:C (агонист TLR3) (Invivogen, SanDiego, USA)
RIBOXXOL (агонист TLR3) (Riboxx, Radebeul, Germany)
MPL (агонист TLR4) (Invivogen, SanDiego, USA)
Имиквимод (агонист TLR7/8) (Invivogen, SanDiego, USA)
CpG (агонист TLR9) (Invivogen, SanDiego, USA)
LAG-3 (Adipogen, SanDiego, USA)
Опухолевые клетки P815 подкожно вводили мышам DBA/2 в количестве 5×105 клеток на мышь для получения мышей в модели рака. День прививки обозначали как День 0. В День 7 внутривенно вводили P1A CTL (2,5×105 клеток на мышь). В День 8 и День 15 подкожно вводили смесь пептида P1A (50 мкг на мышь) и адъюванта в PBS. Мышей распределяли в 9 групп, каждая из которых состояла из 4 или 5 мышей, и использовали следующие адъюванты, соответственно.
Группа 1: только пептид P1A (контроль)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: поли-IC (50 мкг/мышь)+LAG-3 (1 мкг/мышь)
Группа 4: без пептида P1A, поли-IC (50 мкг/мышь)+один LAG-3 (1 мкг/мышь)
Группа 5: RIBOXXOL (100 мкг/мышь)
Группа 6: RIBOXXOL (100 мкг/мышь)+LAG-3 (1 мкг/мышь)
Группа 7: MPL (10 мкг/мышь)+LAG-3 (1 мкг/мышь)
Группа 8: Имиквимод (50 мкг/мышь)+LAG-3 (1 мкг/мышь)
Группа 9: CpG (10 мкг/мышь)+LAG-3 (1 мкг/мышь)
Изменение размера опухоли (мм3) в отношении всех мышей на День 7 и после показано на Фигурах 14-20.
В Группе 1 все 5 из 5 мышей погибли до Дня 40. Четыре из 5 мышей в Группе 2, 5 из 5 мышей в Группе 3, 2 из 5 мышей в Группе 4 и 1 из 5 мышей в Группах 5-7 выжили. Кроме того, в Группе 3, 3 из 5 мышей выживали до Дня 66. Действие комбинации адъювантов было продемонстрировано при сравнении Групп 2-4 и Групп 5 и 6. В Группе 4, где пептид P1A не вводили, все мыши погибли до Дня 43. Было продемонстрировано, что введение адъюванта и пептида P1A является предпочтительным.
[0060]
8. Ингибирование роста опухоли при воздействии комбинации иммуноадъювантов с использованием мышей в модели введения меланомы B16-F10
Мышам C57BL/6 подкожно вводили клетки меланомы B16-F10 (1×105 клеток на мышь) для получения мышей в модели рака.
День прививки обозначали как День 0. В День 5 и День 12, в общей сложности два раза, подкожно вводили смесь пептида gp100 (50 мкг на мышь) и адъюванта в PBS. Следующие адъюванты использовали в соответствующих группах мышей.
Группа 1: НАФ (50 мкл/мышь)
Группа 2: поли-IC (50 мкг/мышь)
Группа 3: LAG-3 (1 мкг/мышь)
Группа 4: LAG-3 (1 мкг/мышь)+поли-IC (50 мкг/мышь)
Изменения размера опухоли (мм3) у всех мышей на День 5 и после показаны на Фигурах 21-24. Все пять мышей погибли в День 31 в Группе 1, в День 35 в Группе 2 и в День 37 в Группе 3. Напротив, пять мышей погибли в Группе 4 в День 57. По сравнению с Группой 1, значимый эффект длительной выживаемости в Группах 2 и 3 не наблюдали; однако время выживаемости в Группе 4 было значительно увеличено по сравнению с любой из Групп 1, 2 и 3.
Список последовательностей в форме открытого текста
[0061]
SEQ ID No: 1 представляет собой аминокислотную последовательность пептида P1A.
SEQ ID No: 2 представляет собой аминокислотную последовательность пептида gp100.