Результат интеллектуальной деятельности: Система-носитель для направленной доставки антибиотиков пенициллинового и антрациклинового ряда
Вид РИД
Изобретение
Изобретение относится к фармацевтике и представляет собой систему-носитель на основе нанопорошка (НП) оксида неметалла с загруженным лекарственным или биологически-активным веществом для его направленной доставки и способ ее получения. Способ включает получение системы-носителя на основе нанопорошков диоксида кремния, допированных диоксидом марганца, методом испарения импульсным электронным пучком (ИЭП) в газе низкого давления, с дальнейшим суспендированием НП в водном растворе лекарства, сопутствующим обработкой полученной лекарственной суспензии НП ультразвуком или перемешиванием, с последующим отделением загруженных НП центрифугированием и промывкой в дистиллированной воде. Также предложены примеры с лекарственными препаратами, демонстрирующие возможность внедрения лекарства предложенным способом в полученную систему-носитель.
Лекарства в традиционной форме проявляют высокую токсичность в здоровых тканях из-за их неспецифического распределения или преждевременной деградации, низкой растворимости в жидкостях организма, низкой проницаемости и низкой биодоступности. Эти ограничения приводят к необходимости снижения вводимых доз в результате повышенного риска побочных эффектов, что серьезно влияет на их эффективность во время лечения.
Системы-носители направленной доставки лекарств применяются для повышения эффективности взаимодействия лекарственного вещества с целевой областью в организме человека при меньшей дозировке, снижая риск возникновения серьезных побочных эффектов в том числе за счет ограничения концентраций лекарственного препарата в нецелевой области.
Для разработки системы-носителя используют различные органические и неорганические материалы, такие как магнитные наночастицы, наночастицы оксидов металлов и неметаллов, лизосомы, белковые и липидные, а также прочие химически синтезированные структуры и высокомолекулярные соединения.
Известен носитель для лекарственных средств и биологически активных веществ, представляющий собой материал, чувствительный к воздействию внешнего магнитного или электрического полей и состоящий из магнитного или сегнетоэлектрического материала (в том числе наночастицы), покрытого пленкой биосовместимого термочувствительного вещества [патент РФ 2373957 / Носитель для лекарственных средств и биологически активных веществ для лечения и диагностики и применение его для создания лекарственных средств и способа регулируемой управляемой доставки лекарственного средства или биологически активного вещества с регулируемой десорбцией его / Тишин A.M., Рочев Ю. А., Горелов А.В.], полученный химическим методом. Для полученного носителя не указана загрузочная способность системы (в том числе на основе наночастиц), как одного из определяющих параметров подобных систем-носителей. Более того для создания носителя поверхность материала дополнительно покрывается пленкой, что повышает трудоемкость процесса, в отличие от предлагаемой системы-носителя, не требующей поверхностной модификации.
Известна система пероральной доставки действующего вещества белковой природы в виде наночастиц со средним размером не более 500 нм [патент РФ 2566069 / Система доставки вещества белковой природы в виде наночастиц и способ ее получения / Ногай С.Ю., Хазанова Е.С., Егоров Д.В.]. Данный способ доставки путем перорального приема имеет ряд ограничений, таких как невозможность доставки противоопухолевых препаратов с высокой токсичностью.
В качестве прототипа был выбран носитель на основе наночастицы, имеющей ядро из диоксида циркония, покрытое оболочкой из оксидов железа, форму, близкую к сферической, и размер в пределах 15-100 нм [патент РФ 2525430 / Носитель для лекарственных средств и биологически активных веществ для лечения и диагностики и способ его получения / Галагудза М.М., Осташев В.Б., Королев Д.В., Афонин М.В., Усков И.С.]. Наночастицы из диоксида циркония, на основе которых разработан данный носитель, имеют размер частиц от 15 нм и площадь удельной поверхности около 100 м2/г, что соизмеримо со свойствами предлагаемой системы. Однако, предлагаемый в настоящей заявке носитель имеет большую пористость и площадь удельной поверхности до 176 м2/г, что является одним из определяющих факторов высокой загрузочной способности. Введение данного носителя осуществляется внутривенно, как и предлагаемую систему-носитель.
Известен способ получения системы для доставки противоопухолевого препарата в клетки опухоли [патент РФ 2657835 / Способ получения системы для доставки противоопухолевого препарата в клетки опухоли / Ефремова М.В., Гаранина А.С., Абакумов М.А., Мажуга А.Г.], включающий смешение в присутствии воды модифицированных полимером наночастиц магнетита, эпитаксиально выращенных на наночастицах золота, с органическим соединением, химически связывающимся с наночастицами и обеспечивающим селективное проникновение наночастиц внутрь клеток опухоли, и водным раствором противоопухолевого препарата. Данный способ имеет ряд этапов, совпадающих с предлагаемым способом, как смешивание суспензии наночастиц с водным раствором лекарства и последующим отделением полученных модифицированных наночастиц центрифугированием. Однако, в данном способе используется химический метод получения наночастиц, существенно отличающийся от предложенного трудоемкостью и материалоемкостью за счет прохождения промежуточных этапов таких, как нагрев до 120°С в атмосфере инертного газа при перемешивании смеси кислот с последующей тщательной промывкой. Более того, получаемая система требует поверхностной модификации, что дополнительно усложняет процесс подготовки системы для доставки.
В качестве прототипа был выбран способ получения наноразмерной системы доставки лекарственных средств на основе диоксида кремния [патент РФ 2372890 / Способ получения наноразмерной системы доставки лекарственных средств на основе диоксида кремния / Жиров А.А., Касаткин И.К., Назаров Г.В., Александровская Н.В., Галан С.Е.]. Данный способ включает в себя метод ультразвуковой обработки на этапе создания системы, что применяется и в предлагаемом способе. Однако в тексте патента рассмотрены способы повышения эффективности доставки и ведения системы в организме человека, но не указана загрузочная способность системы (в том числе на основе наночастиц), как одного из определяющих параметров подобных носителей, а также полученная система является специфичной для доставки лекарственных средств к клеткам головного мозга.
Таким образом, перед авторами стояла задача разработать систему-носитель на основе нанопорошков оксидов металлов для направленной доставки лекарственных веществ, обладающей высокой пористостью, определяющей загрузочную способность носителя и способ ее изготовления, который позволит расширить арсенал средств получения подобных систем с одновременным снижением материалоемкости и трудоемкости данного процесса.
Поставленная задача решена в предлагаемом способе получения системы-носителя на основе нанопорошка диоксида кремния, допированного диоксидом марганца, полученного методом ИЭП в газе низкого давления, с последующим суспендированием НП в водном растворе лекарства, сопутствующим обработкой полученной лекарственной суспензии НП ультразвуком или перемешиванием, с последующим отделением загруженных нанопорошков центрифугированием и промывкой в дистиллированной воде.
Нанопорошки кремния обладают высокой удельной площадью поверхности, возможностью варьирования размеров пор, хорошей термической, химической стабильностью и биосовместимостью. Допант диоксид марганца может выступать в качестве контрастирующего агента для МРТ, что позволит визуализировать процесс доставки лекарственного вещества.
Кроме того, система-носитель может быть разработана на основе нанопорошка диоксида кремния с прочими различными допантами, полученного методом испарения ИЭП, для расширения свойств и сфер применения системы.
В настоящее время из научно-технической и патентной литературы не известны системы доставки на основе нанопорошков, полученных физическим методом испарения импульсным электронным пучком, в состав которого входит допирующая добавка диоксида марганца.
Предлагаемая система-носитель может быть получена следующим образом. Берут субмикронные порошки диоксида кремния (AEROSIL 90) и диоксида марганца (ГОСТ 4470-79) в соотношении (0,95-0,999):(0,001-0,05) соответственно, тщательно перетирают указанные ингредиенты. Полученную смесь прессуют в таблетку диаметром 20-30 мм, высотой 5-12 мм при комнатной температуре. Полученную таблетку в качестве мишени помещают в устройство для получения нанопорошков методом испарения мишени импульсным электронным пучком в газе низкого давления в соответствии с патентом [RU 2353573 / Способ получения нанопорошков и устройство для его реализации / Котов Ю.А., Соковнин С.Ю., Ильвес В.Г. Чанг К.Р]. Мишень испаряют на стеклянную подложку в вакууме (остаточное давление 4-4,5 Па). Время испарения - 10-15 минут. Условия проведения процесса: ускоряющее напряжение в установке - 38 кВ, длительность импульса - 90-100 мкс, частота подачи импульсов - 50-100 Гц, ток пучка - 0,3-0,4А.
Текстурные свойства и морфология полученных НП исследовались методом микроскопии на просвечивающем микроскопе JEM 2100, определение фазового состава НП проводили методом рентгенофазового анализа на дифрактометре XRD 7000, удельная площадь поверхности, объем и размер пор измерялись методом BET-BJH на установке Tristar 3000 V6.03 (Micrometrics, США), термограммы (ДСК-ТГ) были получены на синхронном термоанализаторе Demo-STA-409-PC, совмещенном с масс-спектрометром QMS-403C фирмы NETZSCH.
Согласно данным ВЕТ-анализа (таблица 1), площадь удельной поверхности Sbet увеличивается с увеличением концентрации допанта. Для сравнения в таблице приведены текстурные свойства НП, полученного химическим методом с использованием темплата (образцы №1.4 и 1.5).

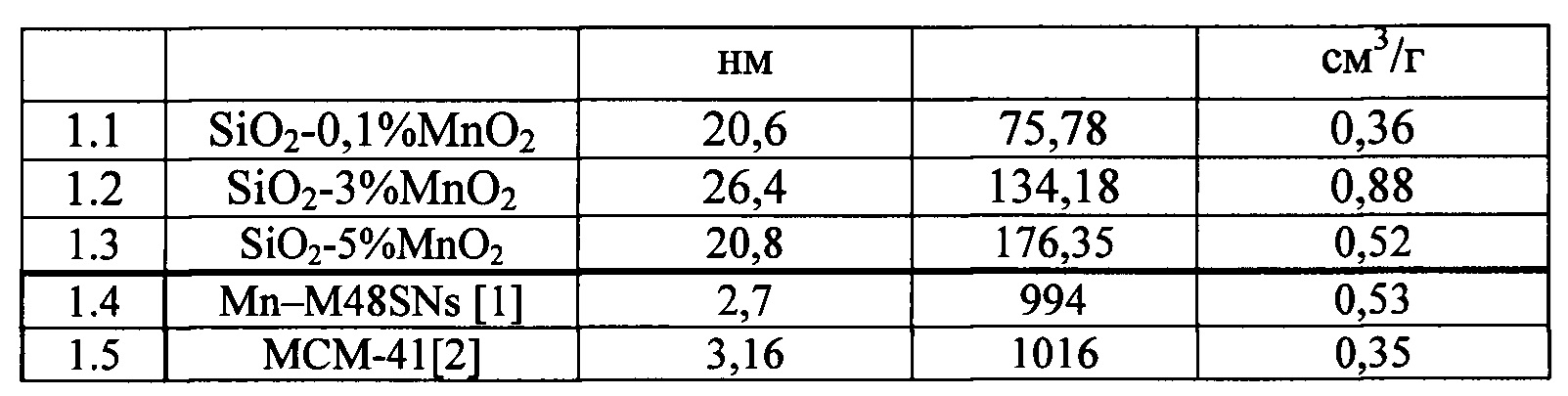
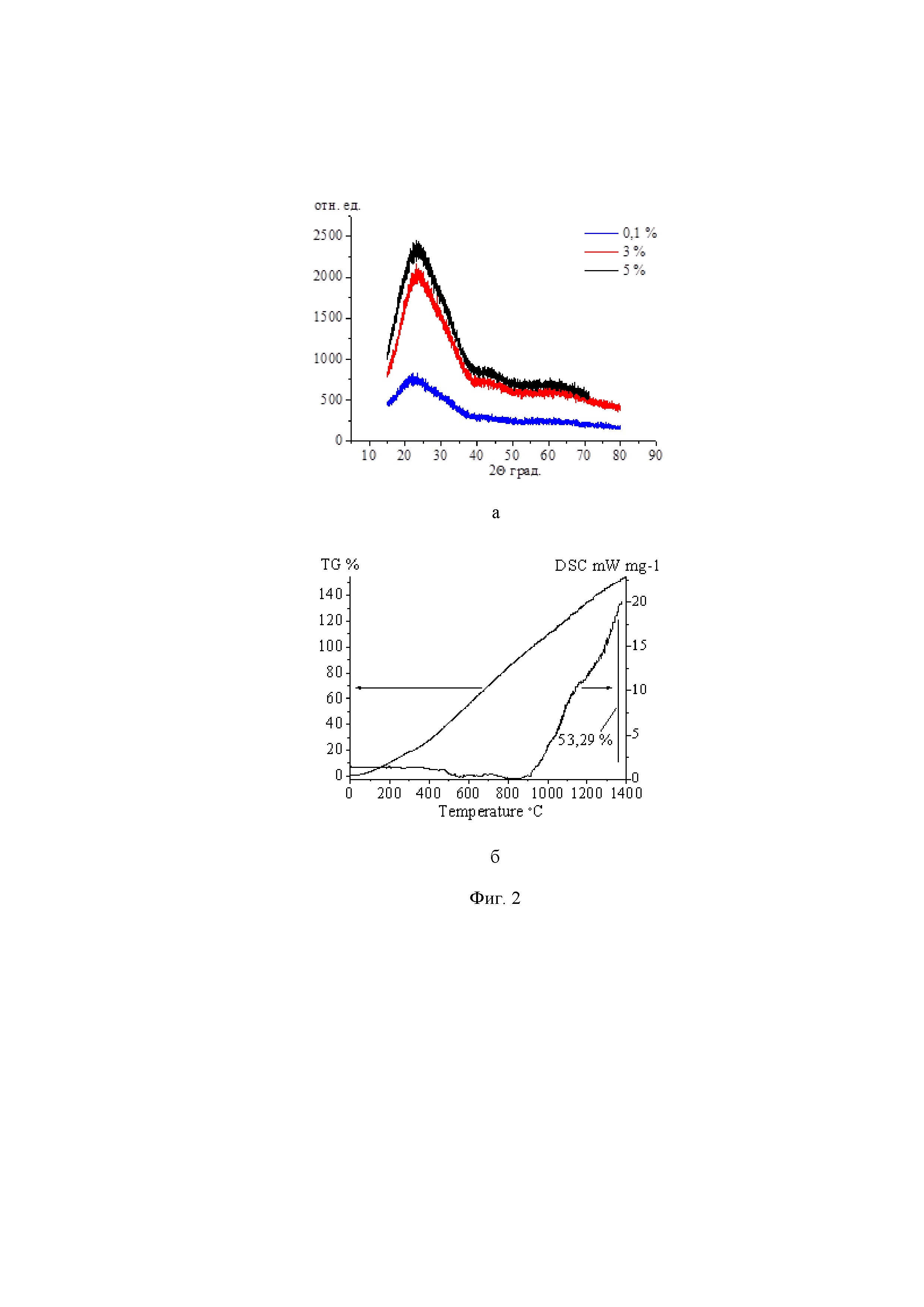
Как видно из данных табл. 1 метод испарения ИЭП позволяет получить НП с высокой пористостью.
Из данных микроскопического анализа следует, что НП представляют собой аморфные агломераты НП с межчастичной пористостью (фиг. 1а, б). На рисунке не видно присутствия упорядоченных мезопор, форма полученных частиц SiO2-MnO2 далека от сферической.
Следует отметить, что в системах доставки лекарств особенно интересны НП с полыми структурами, поскольку они могут позволить эффективно размещать лекарства не только в мезопористых каналах, но и в полых областях [3].
Данные РФА (фиг. 2а) подтверждают, что НП SiO2-MnO2 с различной концентрацией допанта аморфные, фазы оксидов марганца не наблюдаются.
По термограммам зафиксирован прирост массы до 50% в диапазоне температур от 40 до 1400°С, что может быть связано с окислением восстановленного при испарении кремния (фиг. 2б).
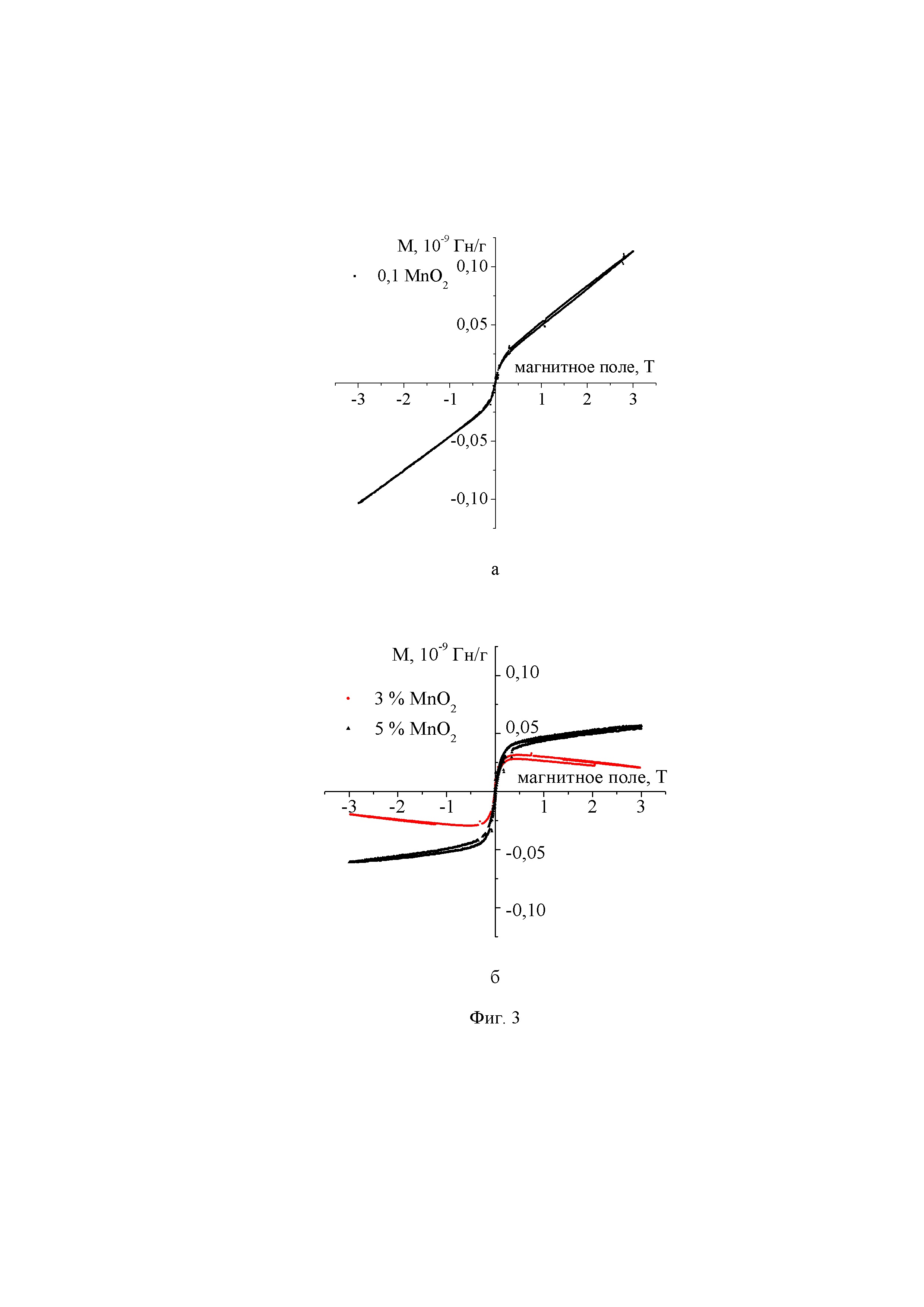
Из кривых намагничивания (фиг. 3) следует, что все НП SiO2-MnO2, обладают ферромагнитными свойствами [4]. При увеличении концентрации допанта диоксида марганца наблюдали усиление ферромагнитного отклика, что могло быть вызвано возрастанием дефектности структуры.
Благодаря наличию магнитных свойств НП SiO2 - MnO2, одним из возможных способов доставки лекарственного вещества является использование экзогенного стимула - внешнего высокоградиентного магнитного поля.
Внедрение лекарства в НП осуществляется путем суспендирования НП в водном растворе лекарственного вещества. После суспендирования образцы обрабатываются в УЗ-ванночке в течение 40 минут или перемешиваются на мешалке в течение 24 часов. Далее суспендированный НП отделяется центрифугированием с частотой не менее 4000 об/мин не менее 10 мин. Затем, отцентрифугированный НП промывается дистиллированной водой, повторно центрифугируется и сушится.
Для иллюстрации свойств НП SiO2 - MnO2, полученного методом испарения импульсным электронным пучком в газе низкого давления используются фиг. 1-3.
На Фиг. 1 представлены ПЭМ-снимки НП SiO2-3%MnO2 при разном увеличении, где а - масштаб 0,2 мкм, б - масштаб 20 нм.
На Фиг. 2 - дифрактограммы НП SiO2-MnO2 (а), типичная кривая нагрева ДСК-ТГ НП (б).
На Фиг. 3-кривые намагничивания в магнитном поле ± 3Т НП SiO2, допированных 0,1% MnO2(а), 3% и 5% MnO2(б).
Применение нанопорошка в качестве системы направленной доставки лекарств иллюстрируется следующими примерами.
Пример 1
Для экспериментов по внедрению/выпуску лекарства было выбрано антибактериальное лекарственное средство «Амоксициллин» (в капсулах по 500 мг, производитель: Hemofarm koncern A.D, Сербия). В состав капсулы «Амоксициллина» входит активное вещество - амоксициллин - полусинтетический антибиотик широкого спектра действия группы пенициллинов, а также вспомогательные вещества - магний стеарат, целлюлоза микрокристаллическая РН 102.
Внедрение лекарства в НП осуществлялось путем суспендирования 20 мг НП SiO2-5%MnO2 в 10 мл водного раствора лекарственного средства «Амоксициллина» с концентрацией Сст (таблица 2), далее образцы Amo-SiO2-5%MnO2.
Часть образцов после суспендирования была обработана в УЗ-ванночке в течение 40 минут и оставлена на 24 часа, вторая часть образцов перемешивалась на мешалке в течение 24 часов. Далее суспендированный НП отделяли центрифугированием (4000 об /мин, 10 мин) и промывали дистиллированной водой.
Для оценки массы загруженного лекарства надосадочную часть исследовали спектрофотометрическим методом на длине волны λ=270 нм, соответствующей максимуму поглощения лекарства. С помощью сравнительного способа количественного анализа относительно контрольного раствора (далее - контроль Amo) используемого лекарства была оценена концентрация лекарственного вещества в надосадочной жидкости.
Выпуск лекарства осуществлялся путем суспендирования высушенных НП в дистиллированной воде спустя 3 суток после суспендирования НП в растворе лекарства, последующем центрифугировании и промывке.
Для оценки высвобождаемого объема лекарства высушенный НП повторно суспендировали в 1 мл дистиллированной воды. После центрифугирования надосадочную часть исследовали на спектрофотометре по методике, аналогичной методике оценки массы загруженного лекарства. По полученным концентрациям выпущенного лекарства Cx и объему исходных суспензий была рассчитана масса внедренного лекарства mв и загрузочная способность НП LC.

Самая низкая Cx=0,0058 мг/мл и LC=0,0029 мг лек./мг НП получена при СФ анализе образца №2.2 (табл. 2), что может быть связано с необходимостью дополнительного воздействия внешних стимулов при высвобождении лекарства
Образец №4 имел более высокую LC=0,09 мг лек./мг НП, что объясняется более подходящим методом внедрения путем перемешивания для данного лекарства.
Пример 2
Для экспериментов по внедрению/выпуску лекарства было выбрано противоопухолевое лекарственное средство «Доксорубицин» (лиофилизат для приготовления раствора для внутрисосудистого и внутрипузырного введения, производитель: Фармфхеми Б.В., Нидерланды). В состав лиофилизата «Доксорубицина» входит активное вещество - доксорубицина гидрохлорид, а также вспомогательные вещества - лактозы моногидрат.
«Доксорубицин» может взаимодействовать с поверхностью чистого диоксида кремния посредством ряда водородных связей и электростатических взаимодействий, что устраняет необходимость функционализации поверхности НП для облегчения загрузки.
Внедрение лекарства в НП осуществлялось путем суспендирования 20 мг НП SiO2-5% MnO2 в 10 мл водного раствора лекарственного средства «Доксорубицина» с концентрацией Сст (таблица 3), далее образцы Dox-SiO2-5%MnO2.
Часть образцов после суспендирования была обработана в УЗ-ванночке в течение 40 минут и оставлена на 24 часа, вторая часть образцов перемешивалась на мешалке в течение 24 часов. Далее суспендированный НП отделяли центрифугированием (4000 об /мин, 10 мин) и промывали дистиллированной водой.
Для оценки массы загруженного лекарства надосадочную часть исследовали спектрофотометрическим методом на длине волны λ=490 нм, соответствующей максимуму поглощения лекарств. С помощью сравнительного способа количественного анализа относительно контрольного раствора (далее - контроль Dox) используемого лекарства была оценена концентрация лекарственного вещества в надосадочной жидкости.
Выпуск лекарства осуществлялся путем суспендирования высушенных НП в дистиллированной воде спустя 3 суток после суспендирования НП в растворе лекарства, последующем центрифугировании и промывке.
Для оценки высвобождаемого объема лекарства высушенный НП повторно суспендировали в 1 мл дистиллированной воды. После центрифугирования надосадочную часть исследовали на спектрофотометре по методике, аналогичной методике оценки массы загруженного лекарства. По полученным концентрациям выпущенного лекарства Cx и объему исходных суспензий была рассчитана масса внедренного лекарства mв и загрузочная способность НП LC.
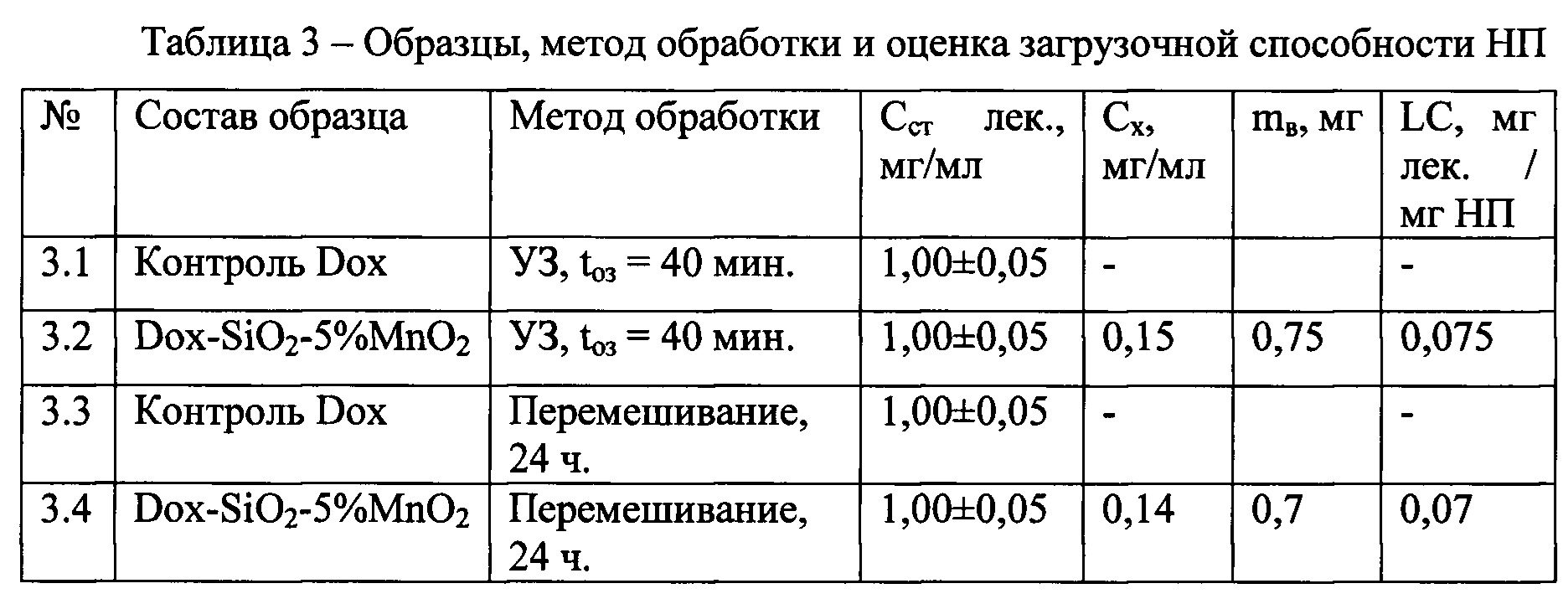
НП из образца №3.2, 3.4 после внедрения лекарства и промывки имели разную структуру: НП, обработанные УЗ, слиплись и образовали плотные разделенные агломераты, в то время как НП после перемешивания сохранили пористый, ватообразный вид.
Сравнивая LC=0,075 мг лек./мг НП образца №3.2 с LC=0,014 мг лек./мг НП образца МСМ-41 [2], видно, что исследуемый НП обладает более высокой загрузочной способностью. Полученные результаты позволяют сделать вывод о влиянии пористости на загрузочную способность. Несмотря на высокую SBET НП МСМ-41, существенно превышающую Sbet исследуемого образца (табл. 1), низкая пористость определяет низкую загрузочную способность.
Использованная литература:
[1] Guillet-Nicolas, R. Manganese-impregnated mesoporous silica nanoparticles for signal enhancement in MRI cell labelling studies / R. Guillet-Nicolas, M. Laprise-Pelletier, M.M. Nair et al. // Nanoscale. - 2013. - V. 5. - I. 23. - P. 11499-11511.
[2] Hu, Y. Natural material-decorated mesoporous silica nanoparticle container for multifunctional membrane-controlled targeted drug delivery / Y. Hu, L. Ke, H. Chen H., et al. // Int. J. Nanomedicine. -2017. - V. 12. - P. 8411-8426.
[3] Li Y., Li N., Pan W., Yu Z., Yang L. and Tang B. Hollow Mesaporous Silica Nanoparticles with Tunable Structures for Controlled Drug Delivery // ACS Appl. Mater. Interfaces, 2017, 9. C. 2123-2129.
[4] Злыгостева О.A., Соковнин С.Ю., Ильвес В.Г. Оценка свойств мезопористого диоксида кремния, допированного диоксидом марганца, полученного импульсным электронным испарением, для применения в биомедицине // Физико-химические аспекты изучения кластеров, наноструктур и наноматериалов: межвуз. сб. науч. тр. / под общей редакцией В.М. Самсонова, Н.Ю. Сдобнякова. Тверь: Твер. гос. ун-т, 2017, том 9. С. 199-204.
Система-носитель для направленной доставки антибиотиков пенициллинового и антрациклинового ряда на основе нанопорошка, обладающая магнитными свойствами, отличающаяся тем, что состоит из аморфного нанопорошка диоксида кремния, допированного диоксидом марганца, причем допирование диоксидом марганца проводят в процессе получения нанопорошка методом испарения импульсным электронным пучком в газе низкого давления, и обладает пористостью до 0,88 см/г и площадью поверхности до 176 м/г.