Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ ЭРЕМОМИЦИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
Вид РИД
Изобретение
Область техники
Изобретение относится к фармацевтической промышленности и касается структуры новых амидов гликопептидного антибиотика эремомицина, содержащих в карбоксамидном фрагменте остаток алкилпиридина, их кватернизованных производных, а также их медицинского применения для лечения инфекций, вызванных грамположительными бактериями.
Уровень техники
Известно, что ванкомицин (1) - важнейший гликопептидный антибиотик, имеющий макроциклический пептидный кор, гликозилированный дисахаридом, состоящий из β-D-глюкозы и ванкозамина [М. Shafer, Т.R. Schneider, G.М. Sheldrick. Structure, 1996, 4, 1509]. Антибактериальная активность ванкомицина и других гликопептидных антибиотиков связана с ингибированием синтеза муреина за счет образования комплекса с терминальными пептидными группами растущих цепей пептидогликана [С. Watanakunakorn. J. Antimicrob. Chemother., 1984, 14, 7].
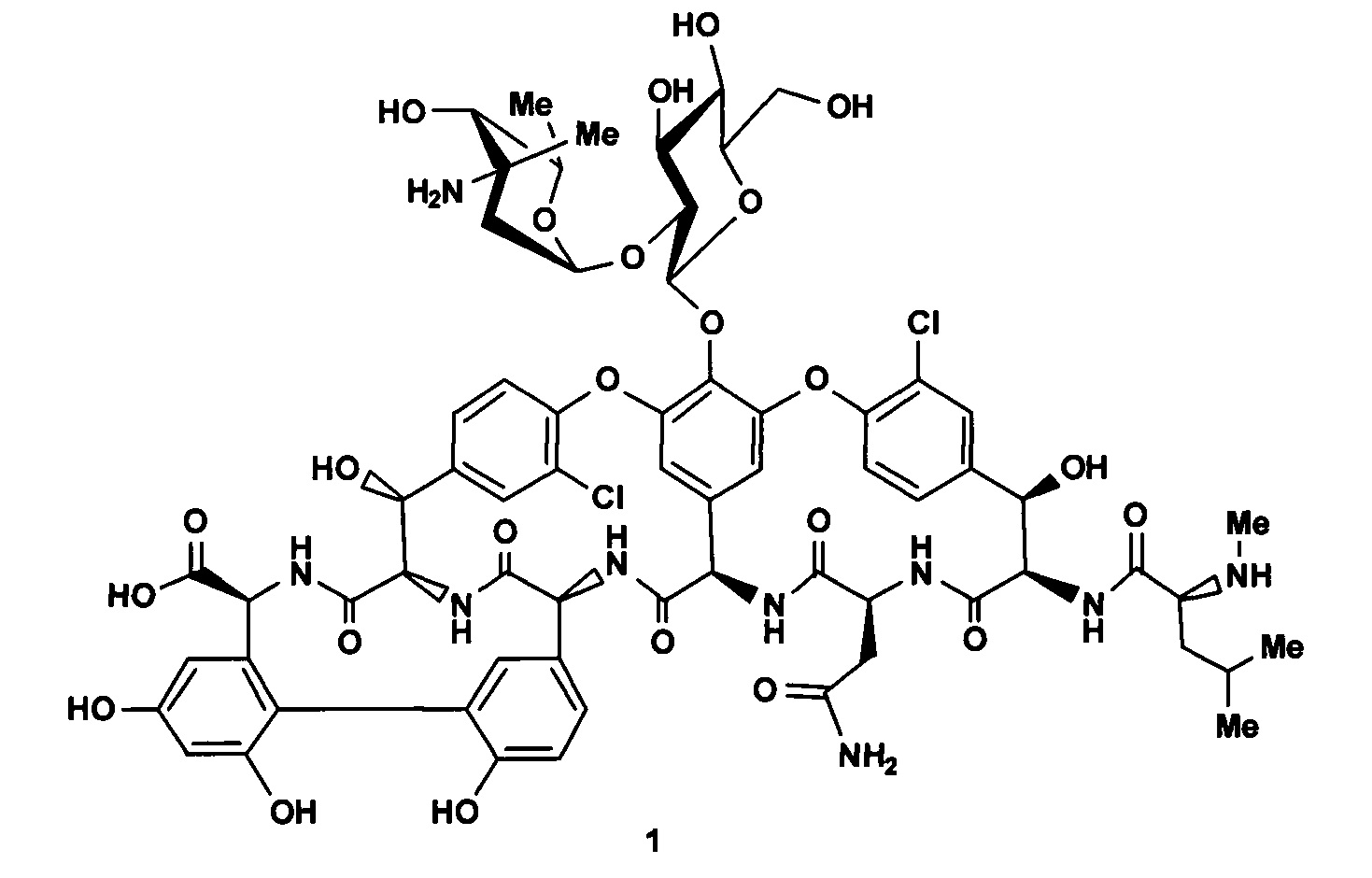
Ванкомицин имеет высокую активность в отношении грамположительных бактерий и до недавнего времени являлся препаратом выбора для лечения тяжелых, устойчивых к антибиотикам бактериальных инфекций, прежде всего, вызванных метициллин-резистентным Staphylococcus aureus (MRSA) [С. Watanakunakorn. J. Antimicrob. Chemother, 1984, 14, 7]. Широкое применение ванкомицина в последние десятилетия привело к распространению устойчивых штаммов энтерококков и стафилококков, имеющих резистентность к гликопептидам (VRE и GISA) [M.G. Page, K. Bush. Curr. Opin. Pharmacol., 2014, 18, 91]. Кроме того, недостатками ванкомицина являются его нефро- и ототоксичность, а также псевдоаллергические реакции, связанные с высвобождением гистамина [S.K. Hubert et al., J Clin Microbiol., 1999, 37, 3590; R.E. Polk. Ann. Pharmacother., 1998, 32, 840].
Показано, что повысить активность, эффективность и безопасность природных гликопептидов, а также преодолеть перекрестную резистентность возможно за счет химической модификации [D. Kahne et al. Chem. Rev., 2005, 105, 425; E.N. Olsufyeva, A.N. Tevyashova. Curr. Topics in Med. Chem., 2017, 17, 2166]. Перспективным направлением в исследовании гликопептидных антибиотиков является синтез на их основе катионных липогликопептидов. Для этого типа производных показано, что за счет увеличения аффинности к мембранам и строительным блокам пептидогликана они обладают значительной активностью в отношении резистентных к ванкомицину бактерий [V. Yarlagadda et al. J. Antibiot., 2014, 67, 1]. Следует также отметить, что катионные агенты, являются высокоэффективными противоинфекционными препаратами, в настоящее время широко применяющимися для лечения и профилактики бактериальных заболеваний [M.S. Butler, М.А.Т. Blaskovich, М.А. Cooper. J. Antibiot. 2017, 70, 3].
Эремомицин 2 - гликопептидный антибиотик, близкий по структуре к ванкомицину, отличительной особенностью которого является дисахарид, присоединенный к D-кольцу и состоящий из β-D-глюкозы и эремозамина, а также эремозамин, присоединенный к 6 аминокислотному остатку [Г.Ф. Гаузе и др. Антибиотики и химиотерапия, 1989, 5, 348].

Эремомицин в экспериментах in vitro и in vivo в 3-5 раз более активен, чем ванкомицин в отношении большинства значимых для клиники грамположительных бактерий, включая MRSA, а также обладает менее выраженными побочными эффектами [I.V. Malkova. Antibiot. Chemother., 1989, 34, 52]. Полусинтетические производные эремомицина также имеют преимущества в биологических свойствах перед аналогичными производными ванкомицина [K.R. Maples et al. J. Med. Chem., 2007, 50, 3681]. Также, для ряда производных эремомицина ранее была отмечена более низкая аллергенность по сравнению с эремомицином [A.Y. Pavlov et al. J. Antibiotics, 1996, 49, 194; Патент РФ №2641912]. Все вышеперечисленное делает эремомицин перспективной базой для создания высокоэффективных полусинтетических антибиотиков.
Раскрытие изобретения
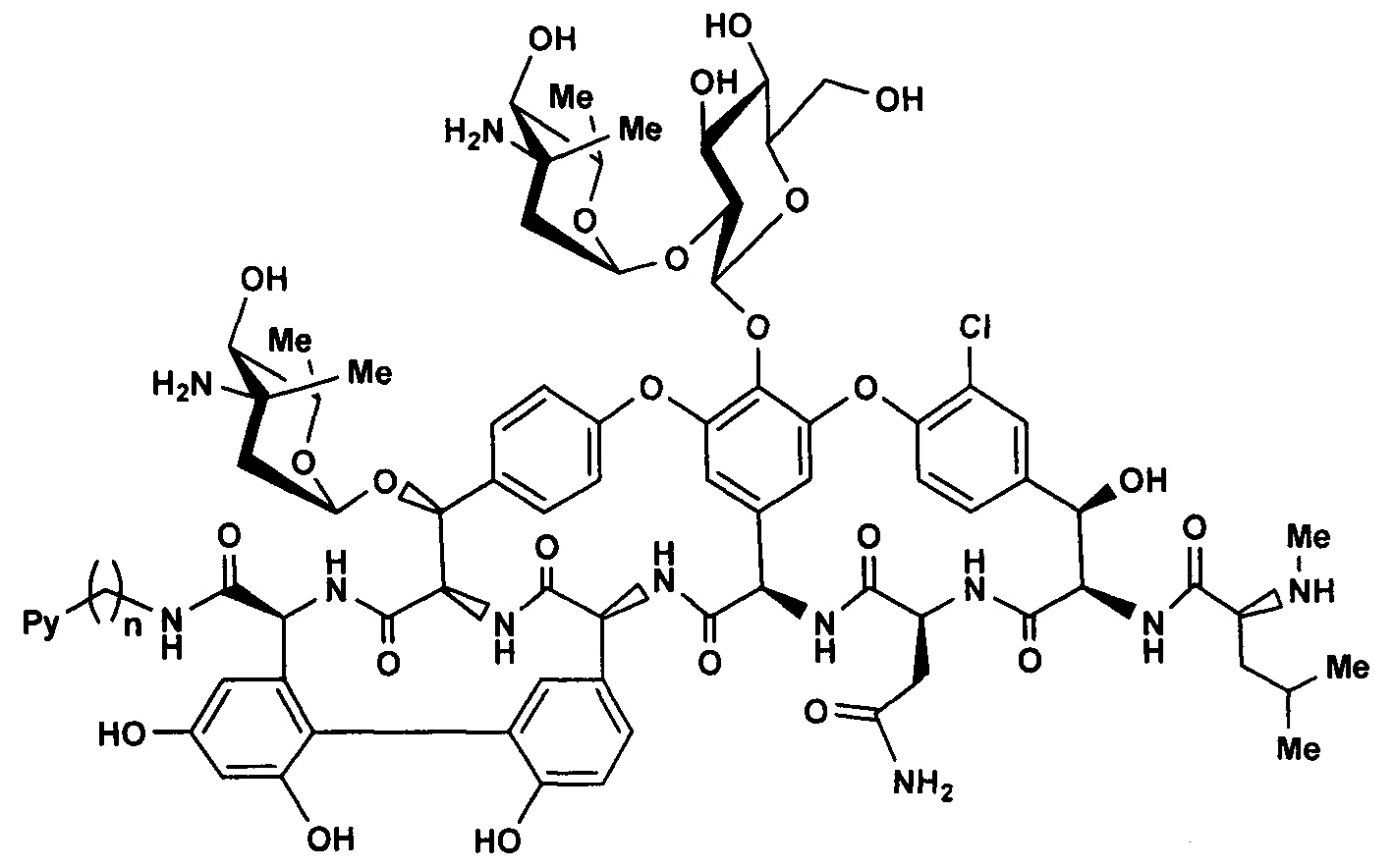
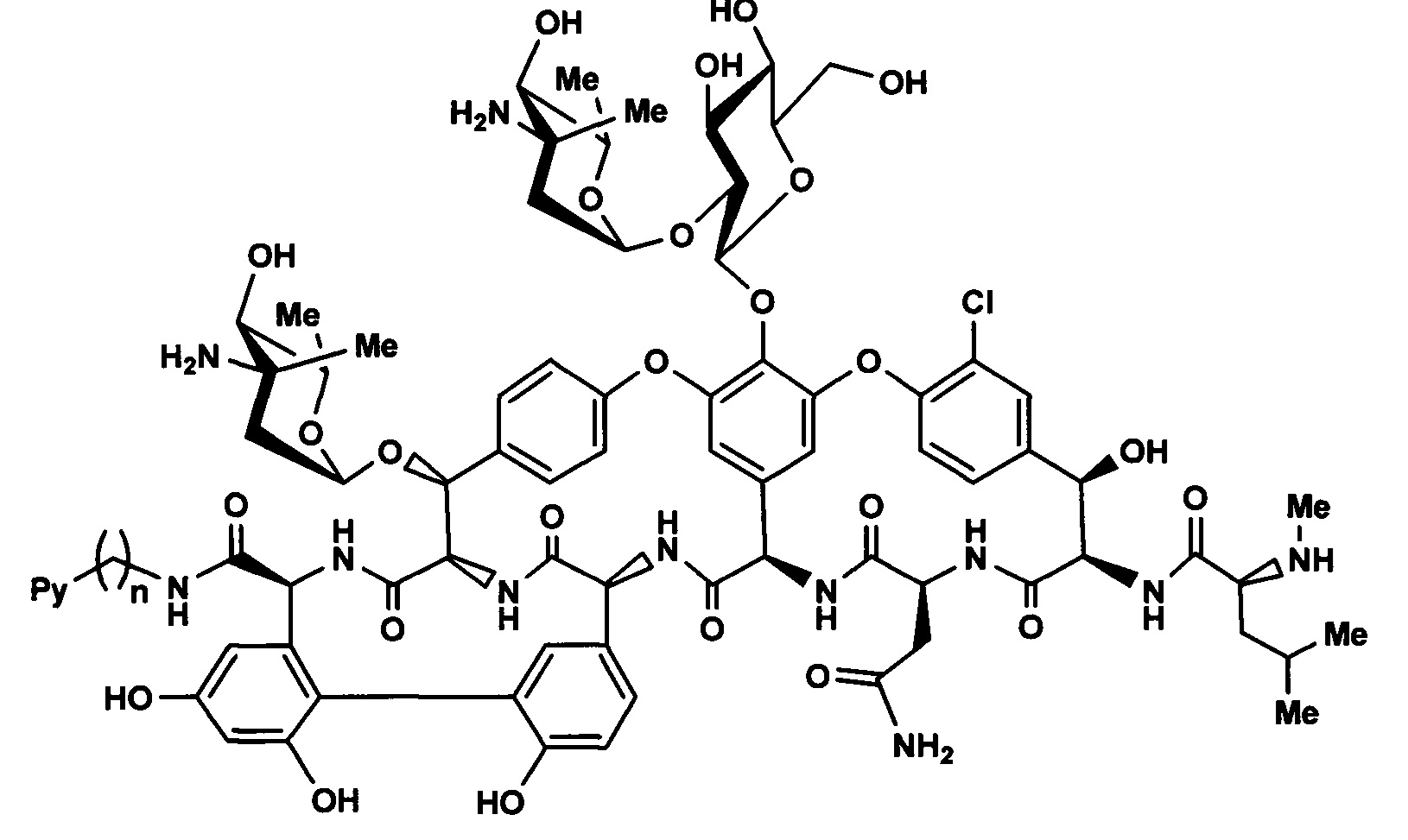
Целью настоящего изобретения ставится создание более эффективных антибактериальных средств на основе новых полусинтетических амидов эремомицина, в частности, на основе пиколиламидов эремомицина и их кватернизованных производных. Найденная новая модификация эремомицина позволяет улучшить фармакологические свойства эремомицина и, в особенности, повысить активность в отношении чувствительных и резистентных к гликопептидам штаммов патогенов. Настоящее изобретение включает соединения, соответствующие формуле 3, их фармакологически приемлемые соли, пригодные для лечения тяжелых, устойчивых к антибиотикам бактериальных инфекций, прежде всего, вызванных штаммами MRSA, GISA (Glycopeptide-Intermediate S. aureus) и VRE (Vancomycin-resistant enterococci).

где Py - независимо означает пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, а также их кватернизованные N-C10-20 алкильные производные; n=1-3.
Соединения формулы 3 могут быть получены конденсацией эремомицина 2 или его солей и соответствующего пиколиламина или его кватернизированного производного, с использованием конденсирующего агента оснований или солей, необходимых для поддержания оптимального рН в подходящем инертном апротонном растворителе (Схема 1).
Схема 1

Сравнительное исследование антибактериальных свойств новых производных эремомицина, соответствующих формуле 3, и используемого в клинике ванкомицина на контрольном штамме S. aureus, а также чувствительных и резистентных штаммах энтерококков показали, что новая модификация карбоксильной группы эремомицина позволяет значительно повысить его активность в отношении резистентных к гликопептидам штаммов при сохранении активности в отношении чувствительных штаммов.
Если не указано иное, термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже.
"Алкил" означает, если не указано иное, одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью, включающий только атомы углерода и водорода и содержащий от 10 до 20 атомов углерода.
"Сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват. Гидраты образуются в том случае, если в качестве растворителя используется вода, а алкоголяты образуются в том случае, если растворителем является спирт.
«Фармацевтически приемлемые соли» соединений означают соли, которые являются фармацевтически приемлемыми и обладают необходимой фармакологической активностью исходного соединения. Такие соли включают кислотно-аддитивные соли неорганических кислот, таких, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких, как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли соляной кислоты, серной кислоты, метансульфоновой кислоты, уксусной кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния.
Исходный эремомицин (2) наработан на опытно-промышленной установке в НИИНА им Г.Ф. Гаузе РуВОР, триэтиламин, диметилсульфоксид, пиколиламины, алкилгалогениды, растворители и прочие реагенты являются коммерческими химическими соединениями, поставляемыми фирмами, такими, как Aldrich Chemical Co.
Примеры, показывающие возможность получения новых производных эремомицина, соответствующих формуле 3, являющихся предметом настоящего изобретения, а также их физико-химические свойства, антибактериальная активность и эффективность in vivo, описанные ниже, приводятся лишь для иллюстрации настоящего изобретения, а не для ограничения объема притязаний.
Пример 1. N-(Пиридин-4-илметил)амид эремомицина (3-1)

При слабом нагревании и интенсивном перемешивании растворяют эремомицина сульфат 2 (0.5 г, 0.29 ммоль) и этилдиизопропиламин (0.08 мл, 4.2 ммоль) в безводном диметилсульфоксиде (12.5 мл). К полученному раствору прибавляют 4-пиколиламин (0.15 г, 1.3 ммоль) и РуВОР (0.19 г, 0.33 ммоль). Через 10 мин к смеси при перемешивании дополнительно прибавляют 4-пиколиламин (0.045 г, 0.4 ммоль) и РуВОР (0.06 г, 0.12 ммоль) и выдерживают 30 мин. К перемешиваемому раствору прибавляют изопропанол (8.5 мл), ацетон (25 мл) и диэтиловый эфир (15 мл). Выпавший осадок отфильтровывают, промывают ацетоном (3×10 мл), петролейным эфиром (10 мл) и высушивают в вакууме. Осадок растворяют в воде (2 мл), при перемешивании прибавляют изопропанол (3-4 мл) до помутнения раствора и повторно осаждают продукт смесью ацетона (25 мл) и диэтилового эфира (15 мл). Выпавший осадок отфильтровывают, промывают ацетоном (3×10 мл), петролейным эфиром (10 мл) и высушивают в вакууме. Получают технический пиколиламид эремомицина с выходом 89% в виде кремового порошка.
Технический продукт растворяют в воде (40-60 мл), и из полученного раствора на ионообменной колонке сорбируют антибиотик на смоле Dowex 50Wx2 (12.5 мл) в NH4+-форме. Смолу промывают водой (60-80 мл), и десорбируют продукт водным раствором (0.25%) аммиака. Контроль фракций проводят методом ТСХ (Silicagel 60 F254, Merck, элюент этилацетат-н-пропанол-25% аммиак, 3:3:4). Фракции, содержащие продукт, объединяют, концентрируют в вакууме до объема ~5 мл. Раствор подкисляют при тщательном перемешивании водным раствором соляной кислоты (1%) до рН ~5, упаривают до объема 1-2 мл, после чего осаждают продукт ацетоном (50 мл). Выпавший осадок отфильтровывают, промывают ацетоном (2×10 мл), диэтиловым эфиром (2×10 мл), петролейным эфиром (8 мл) и сушат в вакууме. Получают 0.31 г (64.6%) гидрохлорида N-(пиридин-4-илметил)амида эремомицина (3-1) в виде кремового порошка. HRMS (ESI) вычислено для C79H96ClN12O25 [M+H]+: 1647.6293; найдено 1647.6290. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.6%) рН=7.8, В - MeCN; градиент В, 8→70% (40 мин): Rt=25.4 мин, чистота 95.9%. Найдено, %: С 51.19, Н 6.11, N 8.85; вычислено для C79H96ClN12O25*3HCl*5Н2О, %: С 51.36, Н 5.89, N 9.10.
Пример 2. N-(Пиридин-3-илметил)амид эремомицина (3-2)

Получают по методике, аналогичной приведенной в примере 1 из эремомицина (2) и 3-пиколиламина. Выход гидрохлорида N-(пиридин-3-илметил)амида эремомицина (3-2) -0.24 г (51%), в виде кремового порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.6%) рН=7.8, В - MeCN; градиент В 8→70% (40 мин): Rt=26.7 мин, чистота 97.6%. HRSM (ESI) вычислено для C83H100ClN12O25 [M+H]+: 1647.6293; найдено 1647.6298.
Пример 3. N-(Пиридин-2-илметил)амид эремомицина (3-3)

Получают по методике, аналогичной приведенной в примере 1 из эремомицина (2) и 2-пиколиламина. Выход гидрохлорида N-пиридин-2-илметил)амида эремомицина (3-3) - 0.30 г (62.5%), в виде кремового порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: A - H3PO4 (0.6%) pH=7.8, В - MeCN; градиент В 8→70% (40 мин): Rt=25.8 мин, чистота 95.5%. HRSM (ESI) вычислено для C81H99ClN11O25 [M+H]+: 1647.6295; найдено 1647.6293.
Пример 4. N-2-(2-пиридил)этиламид эремомицина (3-4)

Получают по методике, аналогичной приведенной в примере 1 из эремомицина (2) и 2-(2-пиридил)этиламина. Выход гидрохлорида N-2-(2-пиридил)этиламида эремомицина (3-4) - 0.25 г (47.4%) в виде кремового порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.6%) рН=7.8, В - MeCN; градиент В 8→70% (40 мин): Rt=26.8 мин, чистота 95.5%. HRSM (ESI) вычислено для C80H98ClN12O25 [M+H]+: 1661.6479; найдено 1661.6468. Найдено, %: С 51.80, Н 6.05, N 8.91; вычислено для C80H98ClN12O2*3HCl*4H2O, %: С 52.12, Н 5.90, N 9.12.
Пример 5. N-((1-Децилпиридин-1-иум-4-ил)метил)амид эремомицина (3-5)

При слабом нагревании и интенсивном перемешивании растворяют сульфат эремомицина (2, 0.5 г, 0.29 ммоль) и триэтиламин (0.2 мл, 1.45 ммоль) в диметилсульфоксиде (12.5 мл). К полученному раствору при перемешивании прибавляют гидрохлорид 4-(аминометил)-1-децилпиридиий хлорида (0.42 г, 1.35 ммоль), РуВОР (0.258 г, 0.5 ммоль) и выдерживают 1 ч. К перемешиваемой реакционной смеси прибавляют изопропанол (8.5 мл), ацетон (25 мл) и диэтиловый эфир (15 мл). Выпавший осадок отфильтровывают, промывают ацетоном (3×10 мл), петролейным эфиром (10 мл) и высушивают в вакууме. Осадок растворяют в воде (2.5 мл), при перемешивании прибавляют изопропанол (3-4 мл) до помутнения раствора и повторно осаждают продукт ацетоном (25 мл) и диэтиловым эфиром (15 мл). Выпавший осадок отфильтровывают, промывают ацетоном (3×10 мл), петролейным эфиром (10 мл) и высушивают в вакууме. Получают технический N-децилпиколиламид эремомицина (3-5) с выходом 83% в виде кремового порошка.
Технический продукт растворяют в 3-5 мл воды и очищают методом обращенно-фазовой хроматографии (элюент вода - этанол). Фракции, содержащие продукт, объединяют, концентрируют в вакууме до объема 2-3 мл, и осаждают продукт ацетоном (50 мл). Выпавший осадок отфильтровывают, промывают ацетоном (2×8 мл), диэтиловым эфиром (2×8 мл), петролейным эфиром (8 мл) и высушивают в вакууме. Получают 0.23 г (40%) гидрохлорида N-децил-4-пиколиламида эремомицина (3-5) в виде почти бесцветного порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10→90% (45 мин): Rt=24.2 мин, чистота 95.6%. HRSM (ESI) вычислено для C89H96ClN12O25 [M]+: 1787.7858; найдено 1787.7856.
Пример 6. N-((1-Додецилпиридин-1-иум-4-ил)метил)амид эремомицина (3-6)

Получают по методике, аналогичной приведенной в примере 5 из эремомицина (2) и гидрохлорида 4-(аминометил)-1-додецилпиридиний хлорида. Выход гидрохлорида 1-додецил-4-пиколиламида эремомицина (3-6) - 0.29 г (56%) в виде кремового порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10→90% (53 мин): Rt=27.0 мин, чистота 95.3%. HRSM (ESI) вычислено для C91H120ClN12O25 [M]+: 1815.8171, найдено 1815.8179.
Пример 7. N-((1-Тетрадецилпиридин-1-иум-4-ил)метил)амид эремомицина (3-7)

Получают по методике, аналогичной приведенной в примере 5 из эремомицина (2) и гидрохлорида 4-(аминометил)-1-тетрадецилпиридиний хлорида. Выход гидрохлорида N-тетрадецил-4-пиколиламида эремомицина (3-7) - 0.15 г (27%) в виде кремового порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10→90% (53 мин): Rt=28.1 мин, чистота 96.1%. HRMS (ESI) вычислено для C91H120ClN12O25 [M]+: 1815.8171, найдено 1815.8179.
Пример 8. N-((1-Гексадецилпиридин-1-иум-4-ил)метил)амид эремомицина (3-8)

Получают по методике, аналогичной приведенной в примере 5 из эремомицина (2) и гидрохлорида 4-(аминометил)-1-гексадецилпиридиний хлорида. Выход гидрохлорида N-гексадецил-4-пиколиламида эремомицина (3-8) - 0.20 г (33%) в виде белого порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10→90% (53 мин): Rt=29.0 мин, чистота 95.2%. HRSM (ESI) вычислено для C95H128ClN12O25 [M]+: 1871.8797, найдено 1871.8791.
Пример 9. N-((1-Тетрадецилпиридин-1-иум-3-ил)метил)амид эремомицина (3-9)

Получают по методике, аналогичной приведенной в примере 5 из эремомицина (2) и гидрохлорида 3-(аминометил)-1-тетрадецилпиридиний хлорида. Выход гидрохлорида N-тетрадецил-3-пиколиламида эремомицина (3-9) - 0.27 г (50%), в виде бесцветного порошка. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=260 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10 90% (45 мин): Rt=27.8 мин, чистота 98.0%. HRSM (ESI) вычислено для C93H124ClN12O25 [M]+: 1843.8480, найдено 1843.8489.
Пример 10. Антибактериальная активность производных 3-1-3-9
Антимикробная активность полусинтетических производных эремомицина, являющихся предметом настоящего изобретения, изучена в сравнении с ванкомицином 1 на штаммах Staphylococcus aureus АТСС 29213, Enterococcus faecalis АТСС 29212, также панели клинических изолятов, включающей чувствительные к ванкомицину штаммы S. epidermidis 533, S. haemoliticus 602. Е. faecalis 6413 и резистентные к гликопептидам штаммы S. aureus 3797, S. aureus 3798, Е. faecium 1, Е. faecium 2, Е. faecium 4, Е. faecium 569, Е. faecium 3567, Е. faecalis 560, Е. gallinarum 1308, полученных из музея лаборатории медицинской микробиологии Государственного научного центра по антибиотикам (ГНЦА). Минимальную подавляющую рост микроорганизмов концентрацию (МПК) для тестируемых соединений определяли микрометодом серийных разведений в бульоне, в соответствии с рекомендациями CLSI.
Полученные результаты, представленные в таблице 1, свидетельствуют, что в большинстве случаев по активности in vitro, амиды эремомицина 3-1 - 3-9, являющиеся предметом настоящего изобретения, превосходят препарат сравнения - ванкомицин (1). Пиридинилалкиламиды эремомицина 3-1 - 3-4 в 2-20 раз более активны, чем ванкомицин, (1) в отношении чувствительных и/или и резистентных к гликопептидам штаммов (Таблица 1). Кватернизация пиридинового ядра хотя и приводит к снижению активности липогликопептидов 3-5 - 3-9 в отношении чувствительных штаммов и штаммов с промежуточной резистентностью (по сравнению с пиридинилалкиламидами 3-1 - 3-4), однако эти производные значительно более активны, чем ванкомицин (1) в отношении высокоустойчивых к гликопептидам штаммов изолятов Е. faecium 569, Е. faecalis 560, Е. gallinarum 1308 и Е. faecium 3567.

* нт - соединение не тестировалось
Пример 11. Антибактериальная эффективность in vivo
Сравнительное исследование эффективности N-((1-тетрадецилпиридин-1-иум-4-ил)метил)амида эремомицина (3-7, пример 7) и ванкомицина (1) проведено на модели стафилококкового сепсиса мышей. В опыте использовали самок мышей колонии SHK, весом 20-22 г. В качестве инфекционного агента использовали Staphylococcus aureus (штамм 10, клинический изолят), адаптированный к росту в in vivo, путем пятикратного пассирования в организме мышей, для повышения вирулентности. Первоначально определялась летальная доза (LD100) стафилококка для данной линии мышей конкретного веса при внутривенном пути заражения. Учет за гибелью мышей проводился ежедневно в течение 10 дней. Летальная доза (LD100) составляла 8×108 КОЕ/мышь. Мышей рассаживали в клетки по 10 голов, заражали внутривенно Staphylococcus aureus в летальной дозе и определяли эффективность испытуемых препаратов по велечине ED50 (т.е. дозы, при которых выживает 50% подопытных животных) Через 30 мин после заражения мышам внутривенно вводили гидрохлорид N-((1-тетрадецилпиридин-1-иум-4-ил)метил)амида эремомицина (3-7) в дозах от 0.25 до 3.5 мг/кг или гидрохлорид ванкомицина (1) в дозах от 2.5 до 7.5 мг/кг. В качестве контроля дозы в опыте присутствовала группа нелеченых животных, зараженных летальной дозой Staphylococcus aureus. Определение ED50 испытуемых препаратов производили в одном опыте при едином контроле, используя метод Баренса (накопления частот). За животными наблюдали в течение 14 дней, ежедневно учитывали гибель. Результаты эксперимента представлены в таблице 2.

На основании экспериментальных данных о выживаемости мышей (таблица 2) были рассчитаны значения показателей эффективности испытуемых препаратов (ED50):
- N-((1-тетрадецилпиридин-1-иум-4-ил)метил)амид эремомицина ED50=0.43 мг/кг;
- Ванкомицин ED50=4.1 мг/кг.
Полученные результаты, представленные в таблице 2, и величина ED50 свидетельствуют, что по эффективности in vivo N-((1-тетрадецилпиридин-1-иум-4-ил)метил)амид эремомицина (3-7), являющийся предметом настоящего изобретения значительно превосходит по эффективности (ED50) препарат сравнения - ванкомицин (1).