Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКАЯ СОЛЬ НИНТЕДАНИБА ДИЭТАНСУЛЬФОНАТА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Ссылка на родственную заявку
Согласно настоящей заявке испрашивается приоритет в соответствии с заявкой на патент Китая №201510112909.0, поданной в Государственное ведомство по интеллектуальной собственности Китая 13 марта 2015, которая включена в настоящий документ посредством ссылки во всей полноте.
Область техники, к которой относится настоящее изобретение
Настоящая заявка относится к области медицинской химии. Более конкретно, настоящая заявка относится к кристаллическому нинтеданибу диэтансульфонату, кристаллической композиции, фармацевтической композиции и способу их получения и применения.
Предшествующий уровень техники настоящего изобретения
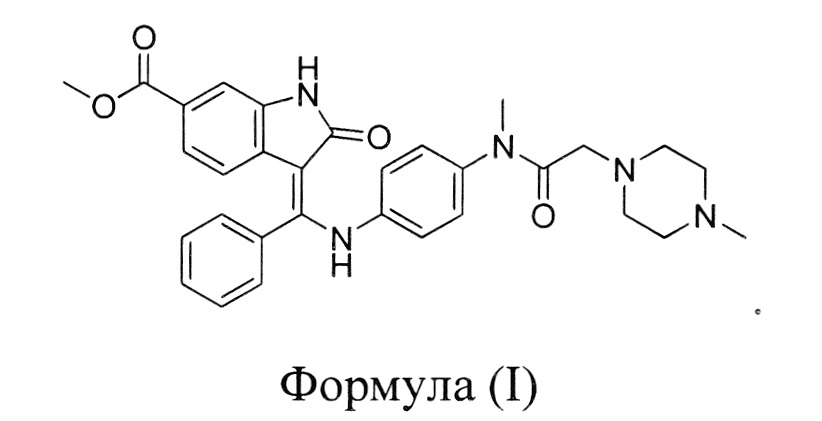
Нинтеданиб/интеданиб, химическое название которого 3-Z-[1-(4-(N-((4-метилпиперазин-1-ил)-метилкарбонил)-N-метиламино)-анилино)-1-фенилметилен]-6-метоксикарбонил-2-индолинон, характеризуется структурой, представленной формулой (I):
Нинтеданиб оказывает ингибирующие действия на различные киназы, в частности рецепторные тирозинкиназы, такие как VEGFR1, VEGFR2, VEGFR3, PDGFR α, PDGFR β, FGFR1, FGFR3, EGFR, HER2, c-Kit, IGF1R, Flt-3 и HGFR. Он может быть использован для лечения неопластических заболеваний, иммунологических заболеваний или патологических состояний, включающих в себя иммунологические составляющие, или фиброзных заболеваний, в частности, идиопатического легочного фиброза.
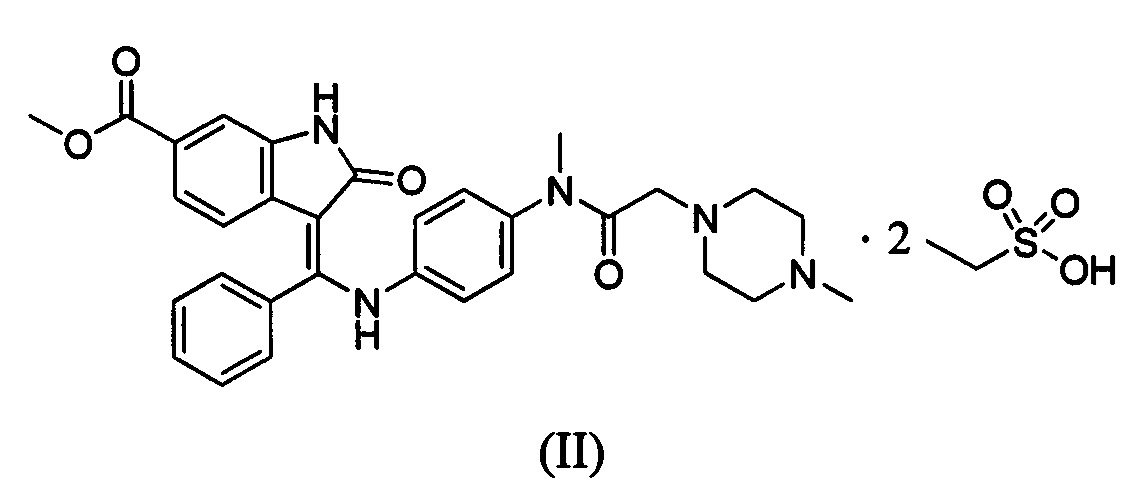
В WO 2012068441 раскрыта аморфная форма и кристаллическая форма нинтеданиба диэтансульфоната формулы (II)
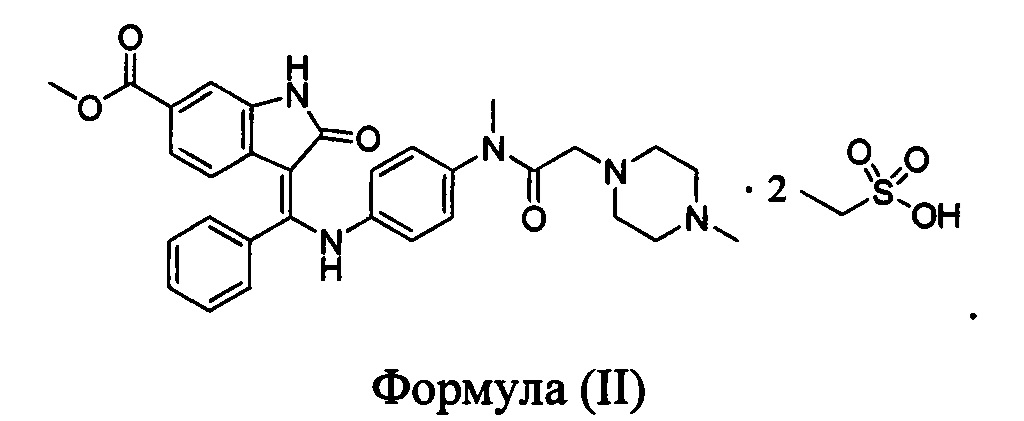
Тем не менее, вышеуказанная кристаллическая форма нинтеданиба диэтансульфоната является не стабильной и легко поглощает влагу в течение хранения, а содержание примесей при хранении значительно возрастает. Химическая стабильность, стабильность в твердом состоянии и срок хранения активного ингредиента являются очень важными факторами с точки зрения получения коммерчески эффективного способа получения или с точки зрения получения фармацевтической композиции, содержащей активное соединение. Таким образом, очень важным для получения и хранения лекарственного средства является обеспечение подходящей формы лекарственного средства, обладающей требуемыми свойствами.
Краткое описание настоящего изобретения
Согласно одному аспекту настоящая заявка относится к кристаллической форме А нинтеданиба диэтансульфоната, представленной формулой (II)
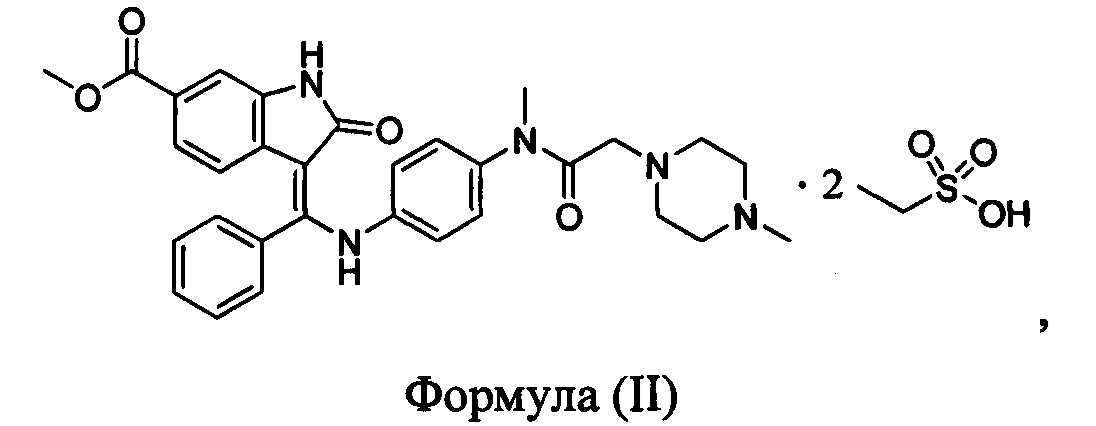
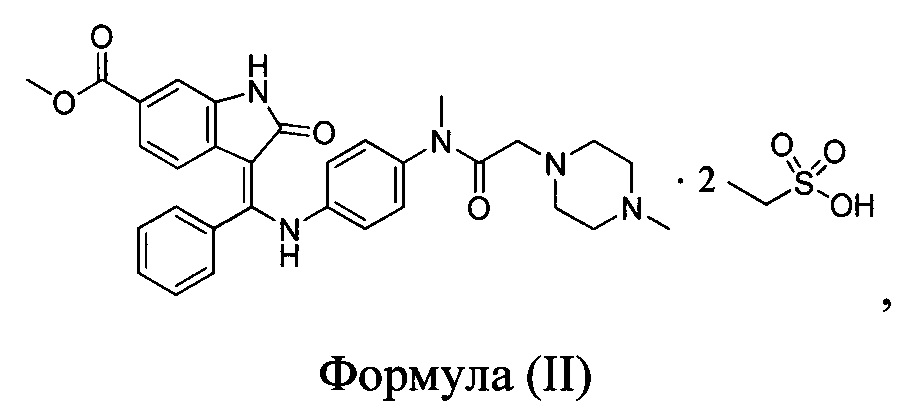
отличающейся тем, что спектр рентгеновской порошковой дифрактометрии кристаллической формы А характеризуется дифракционными пиками, выраженными в значениях 2θ при приблизительно 14,64, 18,79, 19,31, 20,11, 21,20, 22,45 и 26,71 градусов (°).
Согласно другому аспекту настоящая заявка относится к кристаллической композиции, в которой вышеуказанная кристаллическая форма А нинтеданиба диэтансульфоната приходится на долю 50% или более, предпочтительно 80% или более, более предпочтительно 90% или более и наиболее предпочтительно 95% или более по массе кристаллической композиции.
Согласно другому аспекту настоящая заявка относится к фармацевтической композиции, содержащей терапевтически эффективное количество кристаллической формы А нинтеданиба диэтансульфоната или описанной выше кристаллической композиции.
Согласно другому аспекту настоящая заявка относится к применению кристаллической формы А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтический композиции, описанной выше, при изготовлении медикамента для профилактики или лечения заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний, в частности при изготовлении медикамента для лечения немелкоклеточной злокачественной опухоли легкого или идиопатического легочного фиброза.
Согласно другому аспекту настоящая заявка относится к способу профилактики или лечения заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний, причем способ предусматривает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества кристаллической формы А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтический композиции, описанной выше.
Согласно другому аспекту настоящая заявка относится к кристаллической форме А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтической композиции, описанной выше, для применения при профилактике или лечении заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний.
Согласно другому аспекту настоящая заявка относится к способу получения кристаллической формы А нинтеданиба диэтансульфоната или кристаллической композиции, описанной выше, причем способ предусматривает:
(a) растворение нинтеданиба и этансульфоновой кислоты в органическом растворителе или растворение нинтеданиба диэтансульфоната в органическом растворителе; и
(b) нагревание полученной смеси до 40-60°С, а затем добавление ацетона к осажденным кристаллам.
Краткое описание графического материала
На фиг. 1 представлена порошковая рентгеновская дифрактограмма кристаллической формы А нинтеданиба диэтансульфоната, полученной в примере 1.
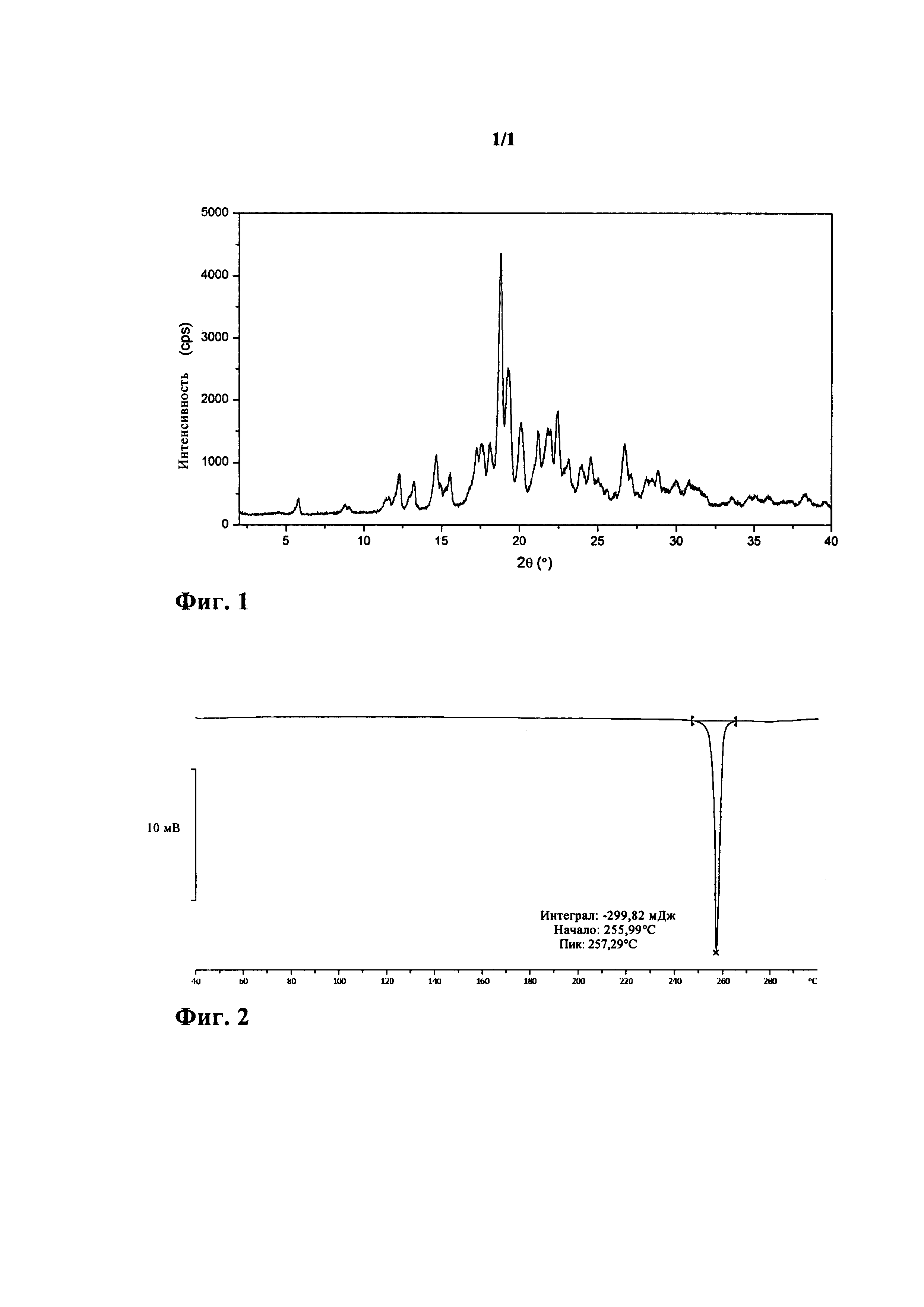
На фиг. 2 представлена термограмма дифференциальной сканирующей калориметрии (DSC) кристаллической формы А нинтеданиба диэтансульфоната, полученной в примере 1.
Подробное описание настоящего изобретения
Определения
Если конкретно не отмечено иное, следующие термины, используемые в описании и приложенной формуле настоящей заявки, характеризуются следующими значениями.
«Млекопитающие» включает в себя людей, домашних животных, таких как лабораторные млекопитающие и домашние питомцы (например, кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади и кролики) и не одомашненные млекопитающие, такие как дикие млекопитающие и т.п.
Термин «фармацевтическая композиция» относится к составу, содержащему соединение по настоящему изобретению и среду, обычно приемлемую в области техники для доставки биологически активного соединения млекопитающему (такому как человек). Среда включает в себя все фармацевтически приемлемые носители для ее применения. Фармацевтическая композиция облегчает введение соединения в организм.
Термин «носитель» определен как соединение, подходящее для доставки соединения в клетки или ткани. Например, диметилсульфоксид (DMSO) обычно использовали как носитель, поскольку он может легко доставлять некоторые органические соединения в клетки или ткани организма.
«Фармацевтически приемлемый носитель» включает в себя без ограничения любые вспомогательные средства, наполнители, глиданты, подсластители, разбавители, консерванты, красители/красящие вещества, ароматизаторы, поверхностно-активные вещества, смачивающие средства, диспергаторы, суспендирующие средства, стабилизаторы, изотонические средства, растворители или эмульгаторы, которые одобрены Государственным управлением по контролю за качеством медикаментов для применения у людей или домашних животных.
«Терапевтически эффективное количество» относится к количеству соединения по настоящему изобретению, которого достаточно при введении млекопитающему, предпочтительно человеку, для лечения вирусной инфекции у млекопитающего, предпочтительно у человека, как определено далее. «Терапевтически эффективное количество» соединения по настоящему изобретению будет изменяться в зависимости от соединения, состояния заболевания и его тяжести, пути введения и возраста млекопитающего, которого лечили. Тем не менее, оно может быть обычным способом определено специалистами настоящей области техники на основании их знаний и раскрытия настоящего изобретения.
Используемый в настоящем описании термин «лечение» включает в себя любое терапевтическое лечение вирусной инфекции у млекопитающего, предпочтительно у человека, которое предусматривает:
(i) ингибирование вирусной инфекции, т.е., предупреждение ее развития;
(ii) облегчение вирусной инфекции, т.е., приведение до выздоровления от вирусной инфекции; или
(iii) снятие симптомов, вызванных вирусной инфекцией.
Варианты осуществления
Согласно одному аспекту настоящая заявка относится к кристаллической форме А нинтеданиба диэтансульфоната, представленной формулой (II)
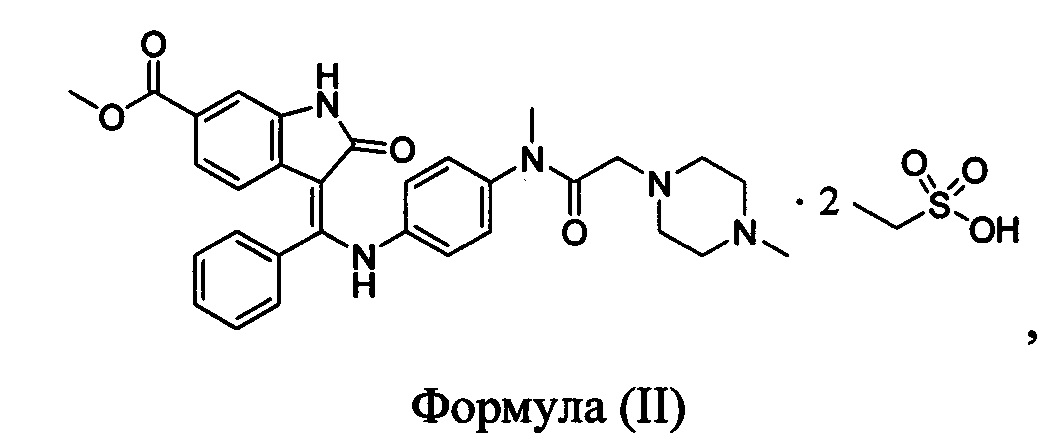
отличающейся тем, что спектр рентгеновской порошковой дифрактометрии кристаллической формы А характеризуется дифракционными пиками, выраженными в значениях 2θ при приблизительно 14,64, 18,79, 19,31, 20,11, 21,20, 22,45 и 26,71 градусов; типично характеризуется дифракционными пиками, выраженными в значениях 2θ при 5,84, 12,27, 14,64, 17,27, 17,61, 18,12, 18,79, 19,31, 20,11, 21,20, 22,45, 24,57 и 26,71 градусов; и более типично характеризуется дифракционными пиками, выраженными в значениях 2θ при 5,84, 12,27, 13,22, 14,64, 15,54, 17,27, 17,61, 18,12, 18,79, 19,31, 20,11,21,20,21,88, 22,45,23,13, 23,95, 24,57 и 26,71 градусов.
Согласно одному варианту осуществления настоящей заявки спектр рентгеновской порошковой дифрактометрии кристаллической формы А нинтеданиба диэтансульфоната по настоящей заявке характеризуется дифракционными пиками, как показано в следующей таблице.
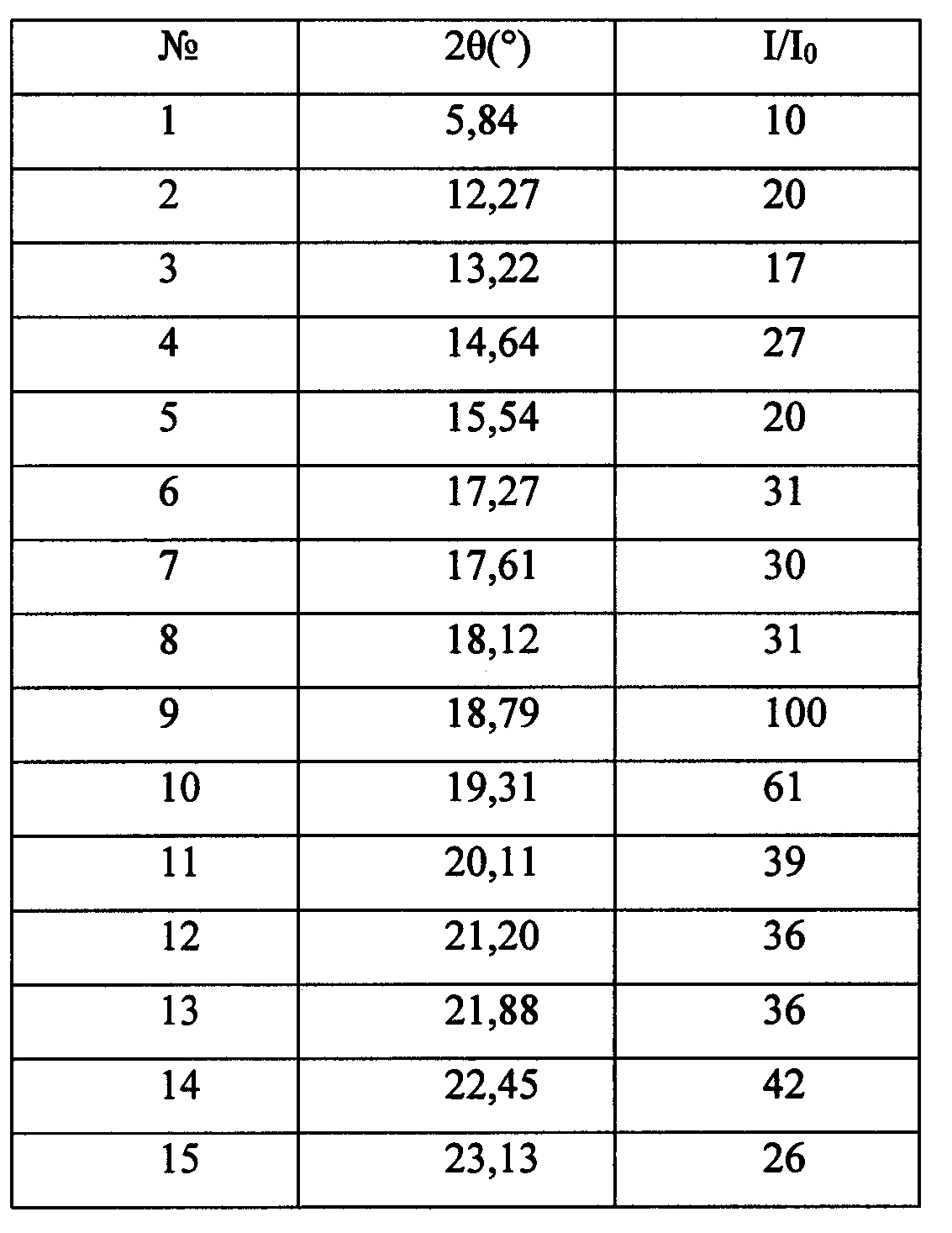

Согласно одному варианту осуществления настоящей заявки кристаллическая форма А нинтеданиба диэтансульфоната по настоящей заявке характеризуется спектром рентгеновской порошковой дифрактометрии, как показано на фигуре 1.
Согласно одному варианту осуществления настоящей заявки кристаллическая форма А нинтеданиба диэтансульфоната по настоящей заявке характеризуется термограммой дифференциальной сканирующей калориметрии (DSC) с абсорбционным пиком при приблизительно 257°C.
Согласно одному варианту осуществления настоящей заявки кристаллическая форма А нинтеданиба диэтансульфоната по настоящей заявке характеризуется термограммой дифференциальной сканирующей калориметрии (DSC), как показано на фигуре 2.
Согласно другому аспекту настоящая заявка относится к кристаллической композиции, в которой вышеуказанная кристаллическая форма А нинтеданиба диэтансульфоната приходится на долю 50% или более, предпочтительно 80% или более, более предпочтительно 90% или более и наиболее предпочтительно 95% или более по массе кристаллической композиции.
Согласно другому аспекту настоящая заявка относится к фармацевтической композиции, содержащей терапевтически эффективное количество кристаллической формы А нинтеданиба диэтансульфоната или описанной выше кристаллической композиции. Фармацевтическая композиция может содержать по меньшей мере один фармацевтически приемлемый носитель.
Согласно другому аспекту настоящая заявка относится к применению кристаллической формы А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтической композиции, описанной выше, при изготовлении медикамента для профилактики или лечения заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний, в частности, при изготовлении медикамента для лечения немелкоклеточной злокачественной опухоли легкого или идиопатического легочного фиброза.
Согласно другому аспекту настоящая заявка относится к способу профилактики или лечения заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний, способ предусматривает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества кристаллической формы А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтический композиции, описанной выше. Млекопитающим предпочтительно является человек.
Согласно другому аспекту настоящая заявка относится к кристаллической форме А нинтеданиба диэтансульфоната, кристаллической композиции или фармацевтический композиции, описанной выше, для применения при профилактике или лечении заболевания или нарушения, выбранного из группы, состоящей из неопластических заболеваний, иммунологических заболеваний, патологических состояний, включающих в себя иммунологические составляющие, и фиброзных заболеваний.
Согласно другому аспекту настоящая заявка относится к способу получения кристаллической формы А нинтеданиба диэтансульфоната или описанной выше кристаллической композиции, способ включает в себя:
(a) растворение нинтеданиба и этансульфоновой кислоты в органическом растворителе или растворение нинтеданиба диэтансульфоната в органическом растворителе; и
(b) нагревание полученной смеси до 40-60°C, а затем добавление ацетона к осажденным кристаллам.
Согласно некоторым вариантам осуществления органический растворитель на стадии (а) представляет собой C1-C6 алкиловый спирт, предпочтительно метанол или этанол, и более предпочтительно метанол. Количество органического растворителя способно растворять нинтеданиб и этансульфоновую кислоту или нинтеданиба диэтансульфонат. Согласно некоторым вариантам осуществления добавляли 10-40 мл органического растворителя, предпочтительно 10-15 мл органического растворителя на моль нинтеданиба или нинтеданиба диэтансульфоната.
Согласно некоторым вариантам осуществления молярное соотношение этасульфоновой кислоты к нинтеданибу на стадии (а) составляет 2-5:1, предпочтительно 3:1.
Согласно некоторым вариантам осуществления нинтеданиба диэтансульфонат на стадии (а) представляет собой аморфный нинтеданиба диэтансульфонат или другие кристаллические формы нинтеданиба диэтансульфоната, например, кристаллический нинтеданиба диэтансульфонат, полученный согласно WO 2012068441.
Согласно некоторым вариантам осуществления объем ацетона на стадии (b) в 2 раза или больше, предпочтительно от 2 до 8 раз больше объема органического растворителя на стадии (а). Предпочтительно, полученную смесь нагревали до 50°C.
Согласно некоторым вариантам осуществления на стадии (b) ацетон добавляли к осажденным кристаллам при перемешивании при поддерживаемой температуре (40-60°C). Иными словами, при добавлении ацетона для кристаллизации температуру поддерживали при 40-60°C.
Согласно некоторым вариантам осуществления способ получения кристаллической формы А нинтеданиба диэтансульфоната или описанной выше кристаллической композиции дополнительно предусматривает:
(c) фильтрацию; и
(d) сушку.
Согласно настоящей заявке спектр рентгеновской порошковой дифрактометрии пробы измеряли при следующих условиях:
Прибор: рентгеновский дифрактометр Bruker D2 X; условия испытания: 30 кв 10 мА; щель: 0,6 мм/3 мм/0,8 мм; целевой тип: Cu; диапазон углов: 5-40°; размер шага: 0,1 с/0,02°.
Согласно настоящей заявке спектр DSC измеряли при следующих условиях: Прибор: дифференциальный термоанализатор Mettler 1 типа; температурный диапазон: 30-270°C; скорость нагревания: 10°C/мин.
Следует отметить, что в спектре рентгеновской порошковой дифрактометрии (XRD) дифрактограмма кристаллического соединения обычно характерна для конкретной кристаллической формы. Относительные интенсивности полос (особенно под малыми углами) могут изменяться в зависимости от эффектов предпочтительной ориентации, возникающих в результате различий условий кристаллизации, размеров частиц и других условий измерения. Таким образом, относительные интенсивности дифракционных пиков не характерны для конкретной кристаллической формы. Это относительные расположения пиков, а не их относительные интенсивности, которым следует уделить больше внимания при определении, является ли кристаллическая форма такой же, что и известная кристаллическая форма. Кроме того, что касается любой представленной кристаллической формы, может существовать небольшая погрешность в положении пиков, что также хорошо известно в области кристаллографии. Например, положение пика может сдвигаться вследствие изменения температуры, движения пробы или калибровки прибора и т.п.при анализе пробы, и погрешность измерения значения 29 иногда составляет приблизительно ± 0,2°. Соответственно, такую погрешность следует учитывать при определении структуры кристалла. Как правило, положение пика выражено в значениях угла 2θ или периода решетки d в диаграмме XRD и простое соотношение преобразования между ними равно d=λ/2sinθ, где d представляет собой период решетки, λ представляет собой длину волны случайного рентгеновского излучения и θ представляет собой угол дифракции. Для той же кристаллической формы того же соединения положение пиков в его спектре XRD характеризуется полным сходством и погрешность относительных интенсивностей может быть больше. Кроме того, необходимо отметить, что из-за некоторых факторов, таких как пониженное содержимое, части дифракционных линий могут отсутствовать при определении смеси. При этом даже полоса может быть характерной для представленной кристаллической формы без зависимости от всех полос пробы с высокой степенью чистоты.
DSC использовали для измерения температуры теплового перехода при поглощении или выделении тепла вследствие изменения структуры кристалла или плавления кристалла. При непрерывном анализе той же кристаллической формы того же соединения погрешность температуры теплового перехода и точки плавления обычно находилась в диапазоне приблизительно ± 5°C, как правило в диапазоне приблизительно ± 3°C. Соединение с указанным пиком DSC или точкой плавления означает, что пик DSC или точка плавления могут изменяться в диапазоне ± 5°C. DSC обеспечивает вспомогательный способ для различия разных кристаллических форм. Различные кристаллические формы могут быть установлены при помощи своих типично различных температур перехода. Необходимо отметить, что пик DSC или точка плавления смеси может изменяться в более широком диапазоне. Более того, из-за распада при процессе плавления вещества температура плавления связана со скоростью нагревания.
Согласно настоящей заявке нинтеданиб может быть получен на основании способа, раскрытого в CN1671660A.
Содержание влаги в кристаллической форме А нинтеданиба диэтансульфоната по настоящей заявке существенно не изменяется после помещения кристаллической формы А в условия высокой влажности (25°C, 92,5% RH) и ускорения условий испытания (40±2°C, 75%±5%RH) на 10 суток, тогда как содержание влаги в кристаллической форме нинтеданиба диэтансульфоната, полученной согласно WO 2012068441, существенно увеличивается при таких же условиях, и из ее свойства очевидно, что кристаллическая форма поглощает влагу с образованием комкования.
Настоящая заявка далее будет описана более подробно с ссылкой на следующие примеры, но она не ограничена следующими примерами.
Пример 1: Получение кристаллической формы А нинтеданиба диэтансульфоната
К 11 мл метанола добавляли 5,4 г нинтеданиба, а затем добавляли приблизительно 3,3 г этансульфоновой кислоты при перемешивании. После растворения нинтеданиба и этансульфоновой кислоты с получением прозрачного раствора температуру полученной смеси повышали до 50°C, а затем к осажденным кристаллам медленно добавляли 45 мл ацетона при перемешивании при поддерживаемой температуре. Кристаллическую форму А нинтеданиба диэтансульфоната получали при помощи фильтрации.
Полученная кристаллическая форма А нинтеданиба диэтансульфоната характеризовалась диаграммой XRD, как показано на фигуре 1, и термограммой DSC, как показано на фигуре 2.
Пример 2: Получение кристаллической формы А нинтеданиба диэтансульфоната
7,6 г кристаллического нинтеданиба диэтансульфоната, полученного согласно WO 2012068441, добавляли к 15 мл метанола и растворяли при помощи нагревания. Затем к осажденным кристаллам медленно добавляли 40 мл ацетона при перемешивании при поддерживаемой температуре 50°C. Кристаллическую форму А нинтеданиба диэтансульфоната получали при помощи фильтрации.
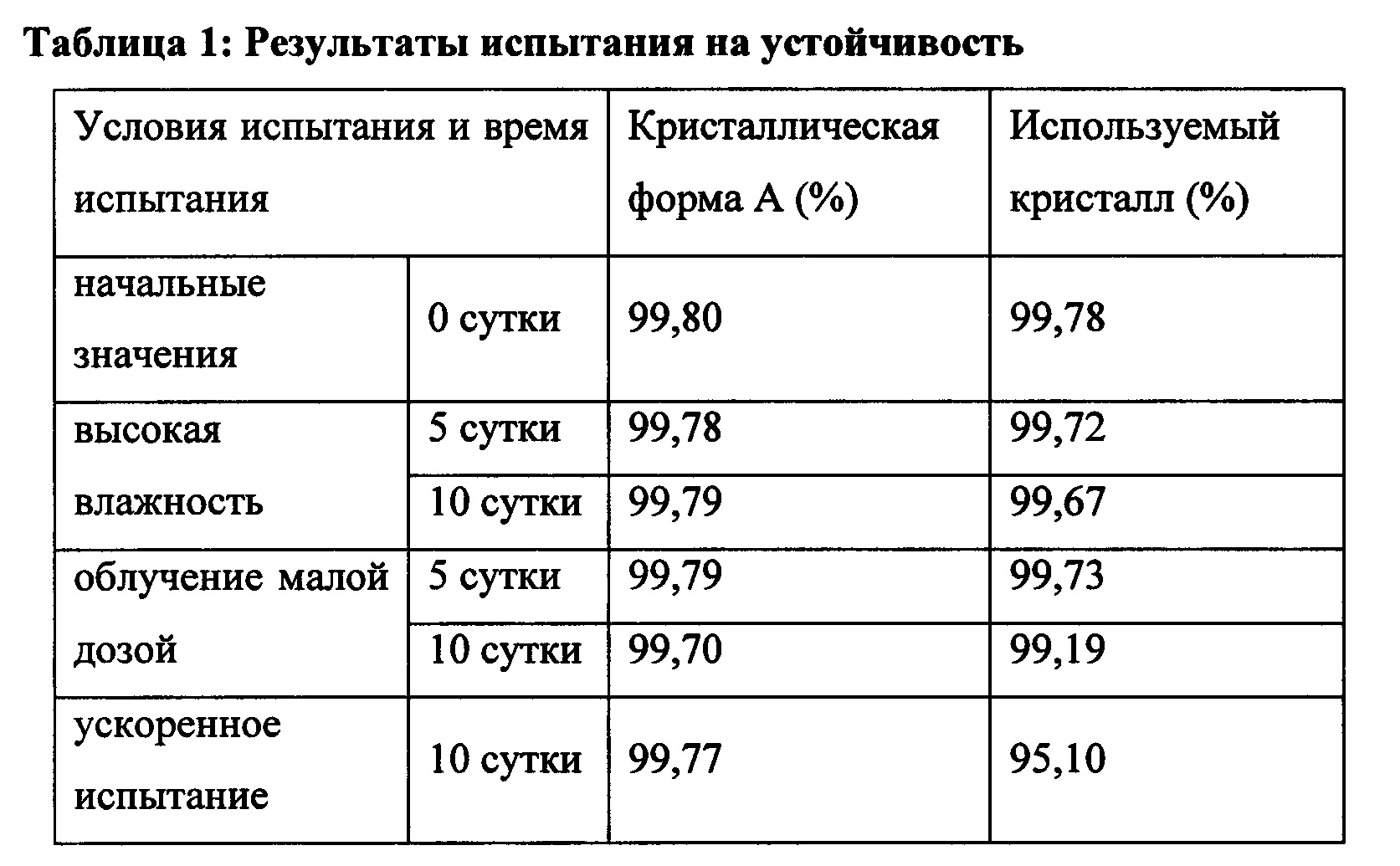
Пример 3: Испытание на устойчивость
Согласно способу испытания факторов воздействия для активных фармацевтических ингредиентов, описанных в Chinese Pharmacopoeia, 2010 edition, Part II, Appendix XIX С, кристаллическую форму А нинтеданиба диэтансульфоната, полученную в примере 1, и кристаллическую форму нинтеданиба диэтансульфоната, полученную согласно WO 2012068441 (используемый кристалл), подвергали испытанию при высокой влажности (25°C, 92,5% RH), испытанию облучения малой дозой 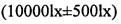 и ускоренному испытанию (40°C±2°C, относительная влажность 75%±5%), соответственно. Испытания проводили в течение 10 суток. Пробы переносили на 0, 5 и 10 сутки для определения их чистоты с целью определения их стабильности. Результаты испытания представлены в таблице 1.
и ускоренному испытанию (40°C±2°C, относительная влажность 75%±5%), соответственно. Испытания проводили в течение 10 суток. Пробы переносили на 0, 5 и 10 сутки для определения их чистоты с целью определения их стабильности. Результаты испытания представлены в таблице 1.
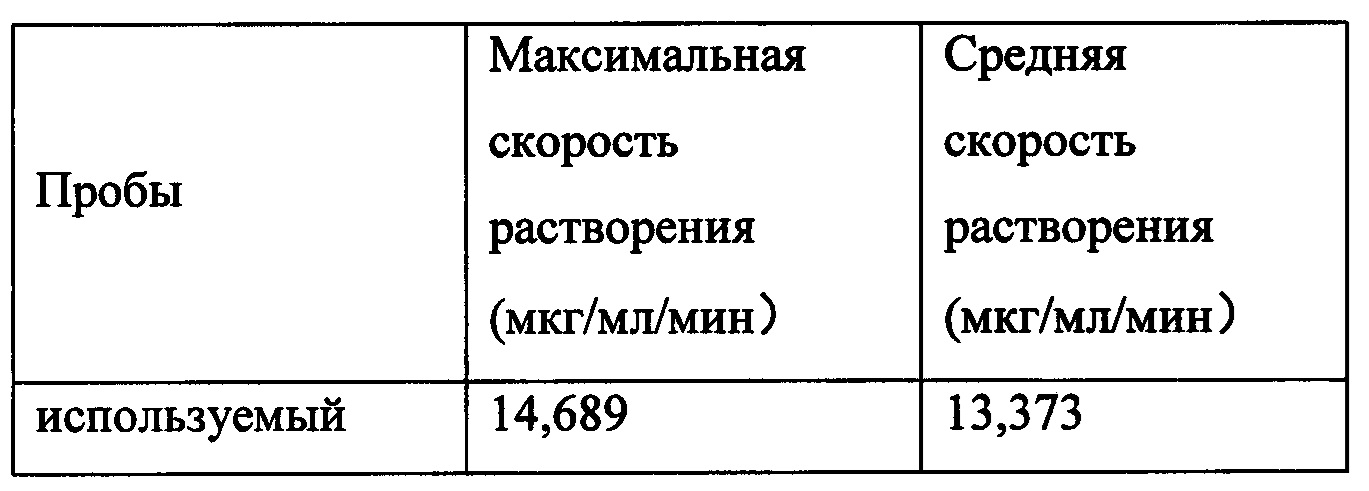
Пример 4: Скорость растворения кристаллической формы А нинтеданиба диэтансульфоната
Скорости истинного растворения кристаллической формы А нинтеданиба диэтансульфоната, полученной в примере 1, и кристаллической формы нинтеданиба диэтансульфоната, полученной согласно WO 2012068441 (используемый кристалл) определяли с применением способа вращающегося диска для определения истинной скорости растворения, описанного в Chapter 1087 of the U.S. Pharmacopeia, и результаты представлены в таблице 2. Среда растворения: 700 мл 0,1 моль/л раствора соляной кислоты, скорость вращения: 300 rpm, длина волны детектора: 287 нм, температура среды: 37°C.

Все патенты, опубликованные патентные заявки, патентные заявки и не патентные публикации, цитируемые в описании настоящей заявки, включены в нее в своей полноте путем ссылки.
Хотя настоящее изобретение было описано с учетом конкретных вариантов осуществления в иллюстративных целях, согласно вышеуказанному содержимому специалистам настоящей области техники следует понимать, что различные модификации могут быть выполнены без отклонения от сущности и объема настоящего изобретения. Соответственно, объем настоящего изобретения следует определять только по приложенной формуле изобретения.