Результат интеллектуальной деятельности: Применение полиакрилата золота в качестве ингибитора роста клеток меланомы человека
Вид РИД
Изобретение
Изобретение относится к области медицинской химии и онкологии и может быть использовано при создании новых противоопухолевых средств для терапии меланомы.
По официальным данным Международного агентства по изучению рака (МАИР, IARC), ежегодно в мире регистрируется около 14 млн. новых случаев злокачественных новообразований (Ахмедова А.А., Шихлярова А.И., Шейко Е.А., Сустретов В.А. Меланома. Некоторые современные аспекты развития и диагностики // Современные проблемы науки и образования. - 2017. - №5.; URL: http://science-education.ru/ru/article/view?id=27024). Около 8 млн. человек ежегодно погибает от них. На меланомы приходится 3-5% всех заболеваний онкологической природы, и эта цифра продолжает расти. Меланома имеет агрессивное течение: средняя 5-летняя выживаемость составляет 18%, медианное значение продолжительности жизни - 7,8 месяца. Меланома безусловно является главной причиной смерти больных с онкопатологией кожи. Среднегодовой темп прироста заболеваемости населения меланомой в мире превышает 5%, что является одним из самых высоких показателей среди всех типов опухолей.
По данным Государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения города Челябинска в 2015 году», подготовленного Управлением Роспотребнадзора по Челябинской области (руководитель Семенов А.И.) и ФБУЗ «Центр гигиены и эпидемиологии в Челябинской области» (главный врач Валеуллина Н.Н.), заболеваемость опухолью нозологического типа «Меланома кожи» (код С43) составила - в 2012 г - 4,54 случаев на 100 тыс. населения; в 2013 г - 7,13 случаев на 100 тыс. населения; в 2014 г 0 7,22 случаев на 100 тыс. населения.
Меланома представляет собой злокачественную опухоль нейроэктодермального происхождения. Меланома возникает за счет злокачественного перерождения меланоцитов дермы. Клинически меланома делится на кожную форму, на которую приходится более 90% всей заболеваемости этой опухолью, и внеквотные формы: меланому хоридеи и глазного яблока, слизистых, оболочек головного и спинного мозга. Для меланомы характерно быстрое и множественное метастазирование, молниеносное прогрессирование и низкая чувствительность к химиотерапевтическим препаратам. Цитологическая структура очагов меланомы отличается высокой степенью полиморфизма: при микроскопическом обследовании биоптатов первичной меланомы выявляются эпителиоидные, веретенообразные, десмопластические клетки. Часто встречаются очаги смешанного морфологического типа. Для первичных клеток меланомы характерен высокий уровень экспрессии регуляторного гена SOX10, транскрипт которого который используется в рутинной диагностике меланомы.
Поскольку для меланомы характерна быстрая выработка устойчивости к любым применяемым цитостатикам, а оперативное лечение осложнено высокой склонностью меланомы к метастазированию и образованию диссеминированных очагов, при лечении этого типа опухоли химиотерапию часто комбинируют с другими типами воздействия. Так в патенте Лихванцевой В.Г.; Бровкиной А.Ф.; Вальского В.В.; Смирнова М.Н.; Летягиной О.В. (Патент RU №2175242, Номер заявки 2000124299/14; Дата подачи заявки 27.09.2000; Дата публикации 27.10.2001) утверждается, что применение комбинированных адъювантных химиотерапевтических агентов на генерализованной стадии увеальной меланомы не сопровождается значительным терапевтическим эффектом или значимым для пациента увеличением продолжительности жизни, и при этом существенно ухудшается ее качество. Больные с трудом выдерживают один-два курса химиотерапии, а затем вынуждены отказываться от лечения [Albert D. et al. Treatment of metastatic uveal melanoma: review and recommendations. - Surv Ophthalmol. - 1992 - vol. 36 - N 6 - p. 429-438].
В публикации [Г.Г. Зиангирова, В.Г. Лихванцева. Опухоли сосудистого тракта глаза. - Последнее слово - Москва. - 2002 г. - Стр. 475] описываются попытки применения химиотерапии в качестве метода лечения меланомы на ранних стадиях неопластического развития были и ранее. Во всех цитируемых работах был отмечен низкий и редкий ответ опухоли на химиотерапию: полный и частичный ответ регистрировался не чаще, чем в 11% всех случаев. При этом показатели выживаемости недиссеминированных форм меланомы у нелеченых пациентов и пациентов, получавших химиотерапию, не показывали статистически значимых различий. В связи с этим, международные протоколы полностью исключают химиотерапию из стандартов лечения меланомы хоридеи на стадиях T1-3 N0M0. Причинами, объясняющими неудовлетворительную эффективность химиотерапии при меланоме хоридеи, были признаны наличие гематоофтальмического барьера и аномально высокая резистентность опухолевых клеток [Г.Г. Зиангирова, В.Г. Лихванцева. Опухоли сосудистого тракта глаза. - Последнее слово - Москва. - 2002 г - Стр. 475; Bedikian AY, Kantarjian Н, Young SE, Bodey GP. Prognosis in metastatic choroidal melanoma. // South Med J. - vol. 74 - pp. 574-577, 1981; Eskelin S, Pyrhonen S, Summanen P, Prause JU, Kivela T: Screening for metastatic malignant melanoma of the uvea revisited. Cancer 85:1151-1159, 1999]. Вместе с тем, в описании изобретения сообщается о чувствительности клеток меланомы к различным химиопрепаратам на основании анализа результатов лечения диссеминированных форм этой опухоли. Российскими стандартами предусмотрено использование для лечения меланомы следующих цитостатиков: дитисен, дакарбазин (производные нитрозомочевины), препараты платины (цисплатин, карбоплатин) и винкаалкалоиды (винбластин, виндезин). Однако их эффективность в варианте монотерапии не превышает 9%.
В литературе известны данные о механизме действия препаратов платины на клетки меланомы. В публикации Zamboni WC, Gervais AC, Egorin MJ, Schellens JH, Zuhowski EG, Pluim D, Joseph E, Hamburger DR, Working PK, Colbern G, Tonda ME, Potter DM, Eiseman JL. Systemic and tumor disposition of platinum after administration of cisplatin or STEALTH liposomal-cisplatin formulations (SPI-077 and SPI-077 В103) in a preclinical tumor model of melanoma. Cancer Chemother Pharmacol. 2004 Apr; 53(4):329-36 сообщается, о результатах лечения модельной меланомы у мышей, вызванной перевиванием им лабораторной клеточной линии меланомы В-16. В качестве химиотерапевтического средства использовали коммерческий препарат на основе платины Цисплатин в дозе 10 мг/кг живого веса, и ПЭГилированные липосомы, содержащие цисплатин - SPI-077 в дозе 10 мг/кг живого веса и SPI-077 В103 в дозе 5 мг/кг живого веса. С помощью микродиализа в динамике прижизненно отбирали образцы плазмы крови животных и исследовали их на содержание платины с помощью пламенного адсорбционного фотометра. Содержание атомов платины исследовалось в самих опухолевых очагах. С целью характеристики механизма действия Цисплатина было показано образование аддуктов платины с парами соседствующих в одной цепи азотистых оснований ДНК: Pt-GG и Pt-AG. Было показано, что максимальное содержание платины в опухолях составляло 3,2±1,9 мкг/г для Цисплатина, 11,9±3,0 для SPI-077 и 3,5±0,3 мкг/г соответственно. Скорость выведения платины из организма в случае Цисплатина составила 0,72±0,46 мкг/мл крови в час.
В работе Li Y, Zhang J, Liu Y, Zhang B, Zhong F, Wang S, Fang Z. MiR-30a-5p confers cisplatin resistance by regulating IGF1R expression in melanoma cells. BMC Cancer. 2018 Apr 11;18(1):404. doi: 10.1186/s12885-018-4233-9 сообщается о результатах исследования механизмов выработки резистентности у клеток меланомы к препаратам платины. Они обнаружили, что при выработке устойчивости к Цисплатину в клетках меланомы существенно повышается уровень экспрессии малой РНК miR-30a-5p по сравнению с неустойчивыми к этому химиотерапевтическому агенту родительскими клетками. Искусственное снижение в клетках уровня продукции miR-30a-5p снижает их устойчивость к данному цитостатику. Авторы установили также, что внутриклеточной мишенью малой РНК miR-30a-5p является рецептор инсулиноподобного фактора роста 1 (IGF1-R). Выключение гена IGF1R с помощью генного нокаута резко снижает чувствительность к Цисплатину, однако, это воздействие одновременно снижает скорость роста клеток меланомы за счет нарушения фосфорилирования серин-треониновой протеинкиназы Р-АКТ (Ser473)) и белка-онкосупрессора Р53.
В публикации Dakup РР, Porter KI, Little АА, Gajula RP, Zhang H, Skornyakov E, Kemp MG, Van Dongen HP A, Gaddameedhi S. The circadian clock regulates cisp latin-induced toxicity and tumor regression in melanoma mouse and human models. Oncotarget. 2018 Feb 20; 9(18):14524-14538. doi: 10.18632/oncotarget.24539. eCollection 2018 Mar 6. С использованием линии трансгенных мышей Per1/2-/-, было показано, что общая токсичность Цисплатина зависит от циркадного суточного ритма организма. Данные частично подтверждены на пациентах с меланомой, получавших лечение Цисплатином.
Применение Цисплатина в качестве лекарственного средства регламентируется Инструкцией по применению лекарственного средства для специалистов Цисплатин/Cisplatin, утвержденной в ряде стран, в частности, в республике Казахстан (приказ Председателя Комитета фармации Министерства здравоохранения Республики Казахстан от 14 июня 2006 года №84). В этой инструкции сообщаются следующие сведения о механизме действия, рекомендуемых дозировках фармакокинетике Цисплатина. Действующее вещество препарата алкилирует нити ДНК, образуя в них кросс-сшивки, подавляет биосинтез нуклеиновых кислот, вызывает гибель клеток. Не обладает специфичностью в отношении клеточного цикла, действует в фазе G0. Двухступенчато превращается в активную форму. На первом этапе тормозит синтез ДНК, РНК и белка, а на втором образует метаболические продукты, действующие только на синтез ДНК. Комплексы платины с цис-расположением атомов галогенов могут образовывать устойчивые хелаты с пуриновыми и пиримидиновыми компонентами молекулы нуклеиновых кислот и таким путем формировать связи внутри одной нити или параллельных нитей двойной спирали ДНК. Блокирование нитей ДНК сохраняется в течение нескольких дней после введения цисплатина. Способность вызывать регрессию первичных опухолей и метастазов отчасти обусловлена и влиянием на иммунную систему организма. При длительном применении возможно проявление отдаленного эффекта - развитие вторичных злокачественных опухолей (включая острый лейкоз).
В опытах на 50 крысах при введении Цисплатина внутрибрюшинно в дозе 1 мг/кг три раза в течение трех недель обнаруживалась гибель 33 животных через 455 дней после первого введения (их них 13 случаев были обусловлены развитием злокачественных новообразований: 12 случаев - лейкоза и 1 случай - фибросаркомы). Мутагенные свойства проявляются в экспериментах на бактериях и культурах клеток животных, где отмечается возникновение хромосомных аберраций. В зависимости от дозы, продолжительности лечения и применения в комбинации с другими противоопухолевыми средствами развиваются необратимые дегенеративные изменения половых желез, приводящие к аменорее или азооспермии. В лабораторных исследованиях при однократном введении собакам и обезьянам в течение 5 дней летальные дозы составляли 30 мг/м2, токсическая доза с максимальным действием - 15 мг/м2, токсическая доза с минимальным действием 7,5 мг/м2 (для собак) и 3,5 мг/м2, максимальные суточные без проявления токсического действия: 3,5 мг/м2 и 1,7 мг/м2 соответственно; ЛД50 у крыс - 44 мг/м2, у мышей 39 мг/м2. При введении мышам наблюдалось эмбриотоксическое и тератогенное действие, токсическое действие на органы мочеполовой системы плода.
Биотрансформируется в печени путем быстрого неферментативного превращения с образованием ряда неактивных метаболитов. Высвобождаемая платина (90%) связывается с белками крови (альбуминами, трансферрином, γ-глобулином) во время экскреторной фазы, а также с клеточными элементами плазмы, в т.ч. с эритроцитами. Цитотоксический эффект присущ только свободной фракции (2-5% от дозы введенного препарата). Т1/2 в реакции комплексообразования Цисплатина с протеинами в условиях тканевых культур составляет менее 3 ч. Высокие концентрации платины определяются в предстательной железе, более низкие - в мочевом пузыре, мышцах, яичке, поджелудочной железе, селезенке и наиболее низкие - в надпочечниках, сердце, легких, кишечнике, вилочковой железе, матке, костях, мозге (поскольку в небольшом количестве проходит через ГЭБ, концентрация Цисплатина при интракраниальных опухолях значительно ниже, чем концентрация в других опухолевых тканях). Высвобождаемая платина обнаруживается в тканях после введения в течение 180 дней и более, причем концентрации платины в опухолевой ткани несколько ниже, чем в органе, где располагается опухоль, и могут быть разными у одного и того же больного в различных очагах метастазирования. Быстро депонируется, преимущественно в печени (при метастатическом поражении печени сродство платины значительно выше) и почках. После в/в болюсного введения кривая снижения концентрации Цисплатина в плазме носит двухфазный характер с Т1/2α - 25-49 мин и Т1/2β 58-73 ч (при анурии - 240 ч). Не связанная с белком цитостатически активная форма препарата имеет следующие значения: Т1/2 - 8-30 мин для быстрой фазы и 40-48 мин - для медленной фазы. После введения дозы 100 мг/м2 соотношение между Цисплатином и общей свободной (ультрафильтрующейся) платиной в плазме крови составляет 0,5-1,1. Экскретируется преимущественно почками (в незначительных количествах с желчью и фекалиями): с мочой выводится 10-40% вводимой дозы в течение 24 ч (при болюсном введении Цисплатина в дозе 40-140 мг/м2 (1-14 мг/кг) в течение суток), 35-51% - при введении Цисплатина в виде 2-3 ч инфузии или 6-8 ч инфузии в дозе 40-100 мг/м2 (1-2,7 мг/кг) в течение 5 дней, 14-30% - при введении Цисплатина в дозах 20, 30, 40 мг/м2. Большая часть дозы, выделяющейся с мочой в течение 1 ч, представляет собой интактный Цисплатин. Почечный клиренс Цисплатина превосходит клиренс креатинина и составляет 62 и 50 мл/мин/м2 при введении Цисплатина в дозе 100 мг/м2 (2,7 мг/кг) в виде 2 ч или 6-7 ч инфузии. При продолжительном курсе химиотерапии и назначении высоких доз наблюдается кумуляция. При нарушениях функции почек и у людей пожилого возраста (вероятно снижение почечной фильтрации) необходимы корректировка режима дозирования и снижение дозы, т.к. возможна кумуляция и увеличение времени воздействия на костный мозг. При проведении диализа в течение 3 ч после введения Цисплатин удаляется из крови. Согласно инструкции, Цисплатин показан при следующих нозологических формах заболеваний: рак яичника, предстательной железы, мочевого пузыря и почечной лоханки, молочной железы, тела и шейки матки, хорионэпителиома матки, рак кожи, надпочечника, легкого, ЖКТ, ЛОР-органов, злокачественные новообразования головы и шеи, нейробластома, лимфогранулематоз, лимфомы, меланома, саркома мягких тканей, остеогенная саркома, метастатический асцит, герминогенные опухоли.
Частота побочных эффектов указана при введении цисплатина в дозах 50 мг/м2 (1,35 мг/кг). Со стороны органов ЖКТ: анорексия, нарушение вкуса, стоматит, тошнота, рвота, желудочно-кишечные кровотечения, нарушение функции печени, гипербилирубинемия.
Со стороны нервной системы и органов чувств: астения, судорожный синдром, головокружение, потеря сознания, гипорефлексия, парестезии, снижение проприоцептивной, вибрационной, вкусовой чувствительности, мышечно-спастический синдром, миелопатия позвоночного столба, периферическая нейропатия, симптом Лермитта, затруднение при ходьбе, нарушение мозгового кровообращения, церебральный артериит, ретробульбарный неврит, синдром неадекватной секреции АДГ, отек соска зрительного нерва, изменение цветового ощущения (особенно в желто-голубой части спектра), неравномерная пигментация сетчатки в области желтого пятна, корковая слепота, снижение равновесия, шум в ушах, ототоксическое действие (31%).
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): миелодепрессия (25-30%): лейкопения, тромбоцитопения, анемия; гемолитическая анемия, кровотечения и кровоизлияния, инфаркт миокарда, тромботическая микроангиопатия, синдром Рейно, отеки нижних конечностей, лица, сердцебиение, тахикардия, гипотензия, сердечная недостаточность.
Со стороны респираторной системы: кашель, стридорозное дыхание.
Со стороны мочеполовой системы: нефротоксичность (28-36%), болезненное, затрудненное мочеиспускание, микрогематурия, гиперурикемия, гиперурикозурия, нефропатия, аменорея, угнетение функции яичников, азооспермия.
Со стороны кожных покровов: алопеция, сыпь, эритематозные высыпания; при в/в введении - образование инфильтрата (экстравазата), повреждение тканей в месте введения (покраснение, припухлость, некроз, фиброз, рубцевание), целлюлит.
Прочие: болевой синдром (боль в спине, боку), развитие инфекций, гипертермия, озноб, гипомагниемия, гипонатриемия, гипокальциемия, гипокалиемия, гипофосфатемия, снижение клиренса креатинина, повышение уровня ACT, мочевины, мочевой кислоты, креатинина, изменение уровня амилаз; аллергические, в т.ч. анафилактоидные реакции.
Анализ сведений инструкции позволяет сделать вывод о том, что в случае введения Цисплатина (Мr=300,04 г/моль) пациентам в максимально допустимых из разрешенных на практике концентраций - 50 мг/кг массы тела, его максимальная усредненная концентрация в организме составляет 170 мкМ. С учетом существования связанного в тканях пула платины средняя скорость выведения ее из организма составляет 10-20 раз в сутки. При этом максимальное содержание платины в очаге меланомы по данным Zamboni et al, 2004 может быть оценено величиной 10 мкМ при той же скорости выведения металла, что и из крови. Таким образом, исследование цитотоксического эффекта препарата сравнения Цисплатин в модельных экспериментах на клетках меланомы in vitro в условиях, приближенных к реальным, целесообразно проводить в диапазоне начальных концентраций от 200 до 3 мкМ. Через 6 часов после начала инкубации целесообразно удалить ростовую среду с тестируемым цитостатиком, заменив ее на свежую.
Наряду с препаратами платины для терапии опухолей используются соединения другого благородного металла - золота. Наиболее известным препаратом, содержащим ион золота (III) является Ауранофин. В работе Garcia A, Machado RC, Grazul RM, Lopes MT,  CC, Dos Santos HF, de Almeida MV, Silva H. Novel antitumor adamantane-azole gold(I) complexes as potential inhibitors of thioredoxin reductase. J Biol Inorg Chem. 2016 Apr; 21(2):275-92. doi: 10.1007/s00775-016-1338-y. Epub 2016 Feb 3. Сообщается о результатах испытания четырех производных четвертичного фосфина золота I со следующими гетероциклическими лигандами: 5-адамантин-1,3-тиазолин-2-тиона, 3-метиладамантан-1,3,4-оксадиазол-2-тиона. С помощью спектроскопии было подтверждено, что атомы серы, не входящие в гетероциклы, образуют координационную сферу атома золота. Цитотоксичность лекарственных кандидатов сопоставлялась с цитотоксичностью Цисплатина и Ауранофина в отношении клеточной линии рака толстой кишки CT26WT, меланомы B16F10, аденокарциномы молочной железы 4Т1 и нормальных клеток почки ВНК-21. Исследованные комплексы золота оказались наиболее эффективными ингибиторами тиоредоксинредуктазы TrxR - одной из основных предполагаемых молекулярных мишеней ионов золота и платины. Эффект ингибирования полностью сохранялся и в присутствии сывороточного альбумина, который способен эффективно связывать комплексы золота и платины и восстанавливать их до металла.
CC, Dos Santos HF, de Almeida MV, Silva H. Novel antitumor adamantane-azole gold(I) complexes as potential inhibitors of thioredoxin reductase. J Biol Inorg Chem. 2016 Apr; 21(2):275-92. doi: 10.1007/s00775-016-1338-y. Epub 2016 Feb 3. Сообщается о результатах испытания четырех производных четвертичного фосфина золота I со следующими гетероциклическими лигандами: 5-адамантин-1,3-тиазолин-2-тиона, 3-метиладамантан-1,3,4-оксадиазол-2-тиона. С помощью спектроскопии было подтверждено, что атомы серы, не входящие в гетероциклы, образуют координационную сферу атома золота. Цитотоксичность лекарственных кандидатов сопоставлялась с цитотоксичностью Цисплатина и Ауранофина в отношении клеточной линии рака толстой кишки CT26WT, меланомы B16F10, аденокарциномы молочной железы 4Т1 и нормальных клеток почки ВНК-21. Исследованные комплексы золота оказались наиболее эффективными ингибиторами тиоредоксинредуктазы TrxR - одной из основных предполагаемых молекулярных мишеней ионов золота и платины. Эффект ингибирования полностью сохранялся и в присутствии сывороточного альбумина, который способен эффективно связывать комплексы золота и платины и восстанавливать их до металла.
Применение золотосодержащего препарата Ауранофин для уничтожения клеток меланомы описано также в работе Sachweh МС, Stafford WC, Drummond CJ, McCarthy AR, Higgins M, Campbell J, Brodin B,  ES, Lain S. Redox effects and cytotoxic profiles of MJ25 and auranofin towards malignant melanoma cells. Oncotarget. 2015 Jun 30;6(18):16488-506. Авторы сообщают, что ген онкосупрессора Р53 редко повреждается в клетках линий меланомы, однако, его экспрессия в них, как правило, снижается или полностью отсутствует за счет повреждения генов-регуляторов экспрессии Р53. Авторы статьи поставили задачу найти соединения, способные восстановить экспрессию Р53 в клетках меланомы. Они описали кандидатную молекулу MJ25 (2-{[2-(1,3-бензотиазол-2-ил-сульфонил)этил]тио}-1,3-бензоксазол), который оказался способен восстановить экспрессию гена Р53 самостоятельно или в сочетании с нутлином-3. MJ25 проявляла выраженную цитотоксичность в отношении клеток меланомы, но не оказывала воздействия на нормальные клетки. Кроме этого, MJ25 проявила способность ингибировать активность тиоредоксинредуктазы 1 (TrxR1) - селен-зависимого фермента, участвующего в подавлении окислительного стресса. Подобно Ауранофину, известному в качестве ингибитора TrxR и разрешенному к применению в США по итогам клинических испытаний для лечения солидных опухолей и лейкозов, MJ25 подавлял рост клеток меланомы в культуре в концентрациях, близких к 1 мкМ. В заключение необходимо отметить, что хотя, по мнению авторов, MJ25 является перспективным лекарственным кандидатом для терапии меланом, ни он, ни его давно известный аналог Ауранофин в практике лечения меланомы в настоящее время не применяются.
ES, Lain S. Redox effects and cytotoxic profiles of MJ25 and auranofin towards malignant melanoma cells. Oncotarget. 2015 Jun 30;6(18):16488-506. Авторы сообщают, что ген онкосупрессора Р53 редко повреждается в клетках линий меланомы, однако, его экспрессия в них, как правило, снижается или полностью отсутствует за счет повреждения генов-регуляторов экспрессии Р53. Авторы статьи поставили задачу найти соединения, способные восстановить экспрессию Р53 в клетках меланомы. Они описали кандидатную молекулу MJ25 (2-{[2-(1,3-бензотиазол-2-ил-сульфонил)этил]тио}-1,3-бензоксазол), который оказался способен восстановить экспрессию гена Р53 самостоятельно или в сочетании с нутлином-3. MJ25 проявляла выраженную цитотоксичность в отношении клеток меланомы, но не оказывала воздействия на нормальные клетки. Кроме этого, MJ25 проявила способность ингибировать активность тиоредоксинредуктазы 1 (TrxR1) - селен-зависимого фермента, участвующего в подавлении окислительного стресса. Подобно Ауранофину, известному в качестве ингибитора TrxR и разрешенному к применению в США по итогам клинических испытаний для лечения солидных опухолей и лейкозов, MJ25 подавлял рост клеток меланомы в культуре в концентрациях, близких к 1 мкМ. В заключение необходимо отметить, что хотя, по мнению авторов, MJ25 является перспективным лекарственным кандидатом для терапии меланом, ни он, ни его давно известный аналог Ауранофин в практике лечения меланомы в настоящее время не применяются.
Приняв за прототип метод химиотерапии меланомы с помощью препарата Цисплатин, описанный в Инструкции по применению лекарственного средства для специалистов Цисплатин/Cisplatin, (приказ Председателя Комитета фармации Министерства здравоохранения Республики Казахстан от 14 июня 2006 года №84), при осуществлении настоящего изобретения с учетом высокой побочной токсичности препарата Цисплатин в рекомендованных дозировках в качестве усовершенствованного аналога был выбран препарат Аурумакрил, описанный в патенте РФ №0002607519 (опубликован 17.01.2017, авторы Абзаева К.А., Белозерская Г.Г., Малыхина Л.С., Жилицкая Л.В., Федорин А.Ю., Бычичко Д.Ю., Лемперт А.Р. «Неполная золотая соль полиакриловой кислоты, способ ее получения и средство на ее основе, обладающее гемостатическим действием при наружном применении»).
Исследования золотосодержащего полимера - неполной соли полиакрилата золота (Аурумакрил), проведенные in vivo на солидных опухолях мышей (карцинома легких Льюис, аденокарцинома Акатол, аденокарцинома Са-755), выявили способность этого соединения эффективно тормозить их рост по сравнению с контролем. Исследование острой токсичности Аурумакрила на мышах линии BDF1 показало, что при однократном в/б введении препарата срединная летальная доза, вызывающая гибель 50% животных (LD50), и максимально переносимая доза (МПД), не приводящая к гибели мышей, составляют 150 и 100 мг/кг, соответственно [Островская Л.А., Воронков М.Г., Корман Д.Б. и др., Биофизика 59 (4), 785 (2014)]. Полученные результаты явились предпосылкой для дальнейшего изучения полиакрилата золота (препарата Аурумакрил) в качестве возможного потенциального противоопухолевого агента.
Технический результат, достижение которого обеспечивается при осуществлении настоящего изобретения, состоит в расширении арсенала химиотерапевтических средств, ингибирующих рост клеток меланомы человека.
Следующие фигуры чертежей поясняют сущность изобретения:
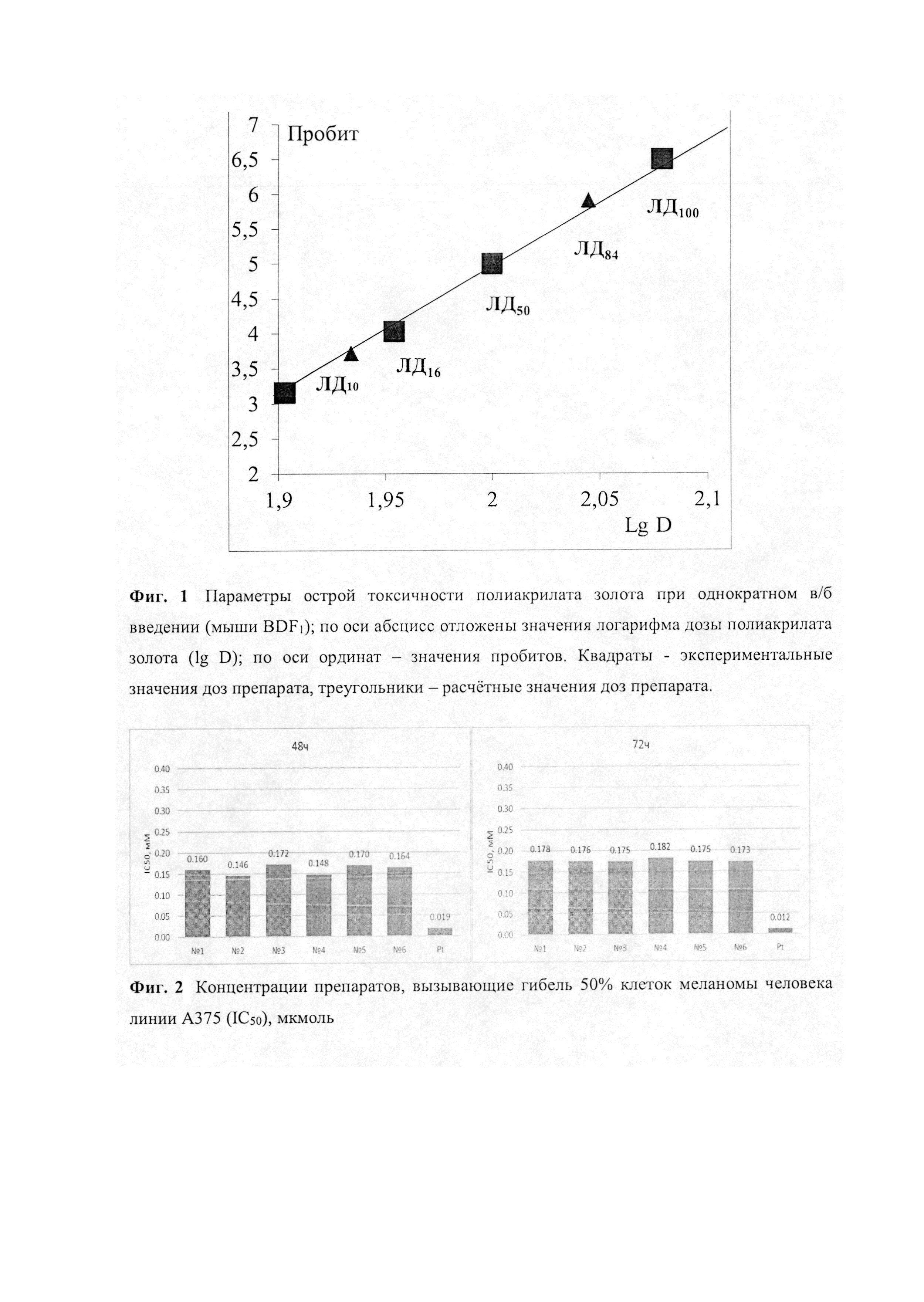
Фиг. 1. - Параметры острой токсичности полиакрилата золота при однократном в/б введении (мыши BDF1); по оси абсцисс отложены значения логарифма дозы полиакрилата золота (lg D); по оси ординат - значения пробитов. Квадраты - экспериментальные значения доз препарата, треугольники - расчетные значения доз препарата.
Фиг. 2. Концентрации препаратов, вызывающие гибель 50% клеток меланомы человека линии A375 (IC50), мкмоль
Фиг. 3. Концентрации препаратов, вызывающие гибель 50% клеток меланомы мыши линии В16 (IC50), мкмоль
Фиг. 4. Концентрация препарата, вызывающая 50% гибель клеток карциномы молочной железы линии MCF7(IC50), мкмоль
Осуществление изобретения
Техническая проблема решается применением в качестве ингибитора роста клеток меланомы человека неполной золотой соли полиакриловой кислоты общей формулы (-СН2-СНСООН-)n(-СН2СНСООАuСl3Н-)m, где n варьирует в диапазоне от 5,6 до 1 799,2, a m - в диапазоне от 5,6 до 144,8.
Полиакрилат золота получают в результате реакции водных растворов деионизованной (очищенной диализом) полиакриловой кислоты и золотохлористоводородной кислоты HAuCl4 при комнатной температуре [RU 2607519, опубл. 10.01.2017].
Терапевтическую эффективность полиакрилата золота в качестве кандидатного лекарственного средства для химиотерапии меланомы устанавливают, относя специфическую терапевтическую активность (IC50 полиакрилата золота в отношении линий меланомы человека (А375) и мыши (В16)) к общей токсичности полиакрилата золота для мышей (острая токсичность при внутрибрюшинном введении). При этом для оценки специфичности терапевтического действия полиакрилата золота в отношении клеток меланомы проводят сравнение терапевтической эффективности действия на клетки меланомы мыши и человека с терапевтической эффективностью этого средства в отношении клеток карциномы молочной железы MCF-7. В качестве препарата сравнения используют Цисплатин, обладающий сходными внутриклеточными молекулярными мишенями, но существенно отличающийся по фармакокинетике иона благородного металла.
Целью изучения острой токсичности является определение переносимых, токсических и летальных доз фармакологического вещества и причин наступления гибели животных с анализом клинической картины интоксикации.
Острая токсичность характеризует способность вещества вызывать гибель животных при однократном введении. При этом используется тот путь введения вещества, при котором была показана специфическая фармакологическая активность препарата.
Продолжительность наблюдения за животными при исследовании острой токсичности составляет 30 суток, причем в первый день после введения препарата животные находятся под непрерывным наблюдением. Проводится регистрация сроков развития интоксикации и гибели животных. Исследования на самцах и самках проводятся раздельно, минимальный размер группы составляет 6 особей грызунов.
Фиксируется общее состояние животных, изменение массы тела, поведенческие реакции, двигательная активность, потребление корма и воды, состояние шерстного и кожного покровов, окраска слизистых оболочек и другие показатели, характеризующие токсическое действие препарата.
Исследование острой токсичности полиакрилата золота проводится в диапазоне доз препарата в пределах от 60 до 150 мг/кг живой массы (содержание золота (III) по результатам определения А22б,5 - 4,64 мкмоль/мг), вводимых в/б однократно в растворе объемом 0,6-1,0 мл. Концентрация препарата в используемых водных растворах колеблется в пределах от 2,0 до 3,2 мг/мл (от 9,29 до 14,86 ммоль Au(III) в 1 л).
Определяют параметры острой токсичности вещества: максимально переносимую дозу (МПД) и токсические дозы ЛД10, ЛД16, ЛД50, ЛД84, ЛД100, вызывающие гибель 10, 16, 50, 84, 100% животных, соответственно.
Параметры острой токсичности вычисляют с использованием наиболее распространенного метода пробит-анализа по Литчфилду и Уилкоксону [Прозоровский В.Б. «Статистическая обработка результатов фармакологических исследований» // Психофармакология и биологическая наркология, 2007, т. 7, №3-4, с. 2090-2120]. График зависимости значений пробитое от логарифма дозы полиакрилата золота, характеризующий токсикометрические параметры препарата, представлен на Фиг. 1.
Вычисление стандартной ошибки ЛД50 - SЛД50 проводится в соответствии с уравнением (1):

где N - количество животных в группах (6 особей), использованных для испытания доз, которые находятся в пределах значений пробитое от 3,5 до 6,5.
Данные, представленные Фиг. 1, позволяют установить, что LD50 для Au(III) в форме полиакрилата золота равна 670 мкмоль/кг, а максимально переносимая доза (МПД), не приводящая к гибели мышей, составляет 464 мкмоль/кг.
Для выявления противоопухолевого эффекта полиакрилата золота проводят изучение цитотоксического действия и механизма противоопухолевого действия вариантов препарата с различной молекулярной массой полимера и соотношением концентрации ионов золота к звену полимера, а также препарата сравнения Цисплатин в условиях in vitro на клетках меланомы человека линии A375. Исследование включает оценку выживаемости клеток после воздействия препарата в диапазоне концентраций иона благородного металла от 1,0 до 2 187 мкМ в течение 6 часов с последующей инкубацией в среде, свободной от цитостатика, в течение 42 часов с помощью МТТ-теста.
Устанавливают цитотоксическую эффективность образцов полиакрилата золота на опухолевые клетки линий А375, В16 и MCF-7 (Таблица 1). Дозозависимость цитотоксического эффекта образцов выражают в виде IC50 (мкМ) после 6 часовой инкубации с Аурумакрилом через 48 часов. Терапевтическую эффективность каждого препарата усредняют для образцов, полученных в различных условиях, и выражают в виде отношения IC50 в отношении конкретной клеточной линии в культуре к величине острой токсичности для мышей (LD50, мкмоль/кг).

* - расчет LD50 делался на основании следующих известных из литературы величин:
1) ЛД50 Цисплатина для мышей 39 мг/м2, приведенных в Инструкции по применению лекарственного средства для специалистов Цисплатин/Cisplatin, утвержденной в ряде стран, в частности, в республике Казахстан (приказ Председателя Комитета фармации Министерства здравоохранения Республики Казахстан от 14 июня 2006 года №84);
2) Коэффициента соотношения поверхности тела и массы мыши, приведенного в публикации Красовский Г.Н., Рахманин Ю.А., Егорова Н. А. Экстраполяция токсикологических данных с животных на человека, http://medzubr.ru/krasovskii-g-n-raklmianm-yu-egorova-n-k78-ekstrapolyatsiya-toksikologicheskikh-dannykh-s-zhivotnykh-?page=3»;
3) MM Цисплатина, равной 300,04 г/моль.
Данные Таблицы 1 свидетельствуют о том, что рассчитанная по соотношению IC50/LD50 терапевтическая эффективность полиакрилата золота для линии меланомы А375 превышает терапевтическую эффективность Цисплатина в 2 раза, для линии меланомы мыши В16 - в 5,3 раза, для линии карциномы молочной железы MCF-7 - в 7,3 раза.
Изобретение проиллюстрировано примерами осуществления в сравнении с прототипом - препаратом Цисплатин.
Пример 1. Получение образцов полиакрилата золота с различной молекулярной массой полимера и соотношением золота (III) и полиакрилатной матрицы.
Для выполнения синтеза были использованы коммерчески доступные полимеры полиакриловой кислоты производства Aldrich (США) следующих молекулярных масс: 1633 Да, 11360 Да, 140000 Да.
В качестве источника золота была использована золотохлористоводородная кислота производства ОАО Аурат (Москва) с содержанием золота 48%.
Для получения золотосодержащих препаратов использовали растворы полимеров 10% вес. Для этого навески полимеров массой 30 мг растворяли в 270 мкл воды. Затем добавляли 60 мкл и 30 мкл водного раствора золотохлористоводородной кислоты концентрации 464 мг/мл для получения препаратов, в которых соотношение аниона АuСl-4 к звену полиакриловой кислоты составило: 1 к 5 и 1 к 10, соответственно. Растворение полимеров проводили в течение 12 часов при комнатной температуре при непрерывном перемешивании на магнитной мешалке. Добавление золотохлористоводородной кислоты к растворам полимеров было осуществлено следующим образом:
к 10% вес. растворам полиакриловой кислоты по каплям добавили 30 мкл водного раствора содержащего 14,2 мг золотохлористоводородной кислоты. В этом случае были получены препараты, в которых соотношение аниона AuCl-4 к звену полиакриловой кислоты составило 1 к 10;
к 10% вес. растворам полиакриловой кислоты по каплям добавили 60 мкл водного раствора содержащего 28,4 мг; В этом случае были получены препараты, в которых соотношение аниона А11СГ4 к звену полиакриловой кислоты составило 1 к 5.
Реакцию вели в течение 12 часов при комнатной температуре при непрерывном перемешивании на магнитной мешалке со скоростью 60 об/мин.
Препараты не подвергали диализу и высушиванию, а хранили при +4°С с соблюдением правил асептики.
Полученные образцы очищали от низкомолекулярных компонент методом проточного диализа. С этой целью были использованы диализные мешки MWCO 15000. Растворы образцов полиакрилата золота объемом от 1,7 до 20 мл помещали в диализные мешки и диализовали против воды в течение 3 часов при комнатной температуре.
Из литературы известно, что золотохлористоводородная кислота в водных растворах при нейтральном и щелочном рН подвергается постепенному гидролизу с высвобождением соляной кислоты и закислением рН (Макотченко Е.В., Малкова В.И., Белеванцев В.И. Электронные спектры поглощения галогенидных комплексов золота(III) в водных растворах. // Координационная химия. 1999. Т. 25, №4, с. 302-309). При кислых значениях рН эта реакция невозможна. При исследовании водного раствора золотохлористоводородной кислоты в 100 мМ НСl было установлено наличие выраженного максимума при λ=226,5 нм, причем коэффициент экстинкции ε составил 3,5×104 л моль-1 см-1. Эта величина хорошо согласуется с литературными данными: при ν=44200см-1 ε=4,0×104 л×моль-1 см-1 (Макотченко Е.В. и соавт., 1999). Коэффициент экстинкции полиакрилатов находился в диапазоне до 106 л моль-1 см-1. Наночастицы золота поглощения при λ=226,5 нм не показывали за исключением эффектов светорассеяния. Поэтому определение содержания золота в ионной форме в модифицированных производных проводилось при λ=226,5 нм в 100 мМ НСl. Для этого аликвоту 10 мкл концентрированного раствора, полученного после диализа каждого синтезированного образца, вносили в раствор 100 мМ НСl объемом 3 мл и определяли А226.5. Для каждого препарата была определена молярная концентрация золота в солевой форме по окончании синтеза (Таблица 2). Вычислялось также соотношение А226,5 (≈[HAuCl4], мкМ) к содержанию общих сухих веществ в образце.

Полученные образцы Аурумакрила использовали для определения цитотоксической активности в отношении клеточных линий в культуре.
Пример 2. Определение цитотоксической активности образцов полиакрилата золота с различной молекулярной массой полимера и соотношением золота (III) и полиакрилатной матрицы и препарата сравнения Цисплатин в отношении линии меланомы человека А375
После измерения содержания золота в ионной форме по показателю А226.5 в каждом из синтезированных образцов были приготовлены рабочие растворы для проведения биологического тестирования цитотоксической активности in vitro на клетках линии меланомы человека А375 с концентрацией ионов Au(III) 12 мМ. Далее для каждого препарата готовили серию разведений в воде с конечными концентрациями благородного металла в ионной форме 2 187, 729, 243, 81, 27, 9, 3, 1 мкМ.
В качестве препарата сравнения был использован Цисплатин (Цисплатин-ЛЭНС, ООО «Лэнс-Фарм», Россия) с концентрацией активного вещества 0,5 мг/мл (1,67 мМ). Для него также готовили серию разведений в воде с конечными концентрациями Pt 100, 50, 25, 12,5, 6,25, 3,13, 1,56 и 0,78 мкМ
В лунки 96-луночного культурального планшета ThermoFisher (США) вносили по 5 000 клеток линии меланомы А375 (АТСС® CRL-1619) и культивировали в среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ/мл глутамина и 50 Ед/мл пенициллина-стрептомицина в течение 24 часов при 37°С и содержании СO2 5% (150 мкл на лунку). На следующий день среду заменяли, в среду объемом 150 мкл, находящуюся в каждой лунке, добавляли разведенный образец препарата Аурумакрил или Цисплатин, в объеме 5 мкл на лунку (разведение в 30 раз) и продолжали инкубацию при 37°С и содержании СО2 5% в течение 6 часов. Среду удаляли, троекратно промывали клетки раствором Хенкса, добавляли по 150 мкл свежей среды с 10% эмбриональной телячьей сывороткой, 2 мМ/мл глутамина и 50 Ед/мл пенициллина-стрептомицина на лунку после чего продолжали инкубацию при 37°С и содержании СО2 5% в течение 48 часов.
В каждую лунку добавляли 15 мкл МТТ-реагента (3-[4,5-диметилтриазол-2-ил]-2,5-дифенилтетразолий бромид, каталожный номер SigmaAldrich 57360-69-7, США) до конечной концентрации 0,5 мг/мл, инкубировали в течение 3 часов и определяли А570 с помощью планшетного спектрофотометра Multiskan FC (ThermoFisherScientific, США). Результаты определения, усредненные по трем независимым определениям, представлены на Фиг. 2.
Результаты Примера 2 позволяют сделать вывод о возможности использования полиакрилата золота в качестве цитотоксического средства для химиотерапии меланомы у человека. IC50 для Au(III) в составе всех шести образцов, полученных в различных условиях, имеет низкое значение при незначительной величине разброса: IС50=160,0±8,8 мкМ.
Пример 3. Определение цитотоксической активности образцов полиакрилата золота с различной молекулярной массой полимера и соотношением золота (III) и полиакрилатной матрицы и препарата сравнения Цисплатин в отношении линии меланомы мыши В16
Исследование цитотоксической активности образцов препарата полиакрилата золота и препарата сравнения Цисплатин в отношении линии меланомы мыши В16 проводили по методике, полностью аналогичной описанной в примере 2. Результаты определения, усредненные по трем независимым определениям, представлены на Фиг. 3.
Результаты Примера 3 позволяют сделать вывод о возможности использования полиакрилата золота в качестве цитотоксического средства для химиотерапии меланомы. IC50 для Au(III) в составе всех шести образцов, полученных в различных условиях ниже, чем в случае линии А375, но величина разброса при этом выше: IC50=l15,1±14,3 мкМ.
Пример 4. Определение цитотоксической активности образцов полиакрилата золота с различной молекулярной массой полимера и соотношением золота (III) и полиакрилатной матрицы и препарата сравнения Цисплатин в отношении карциномы молочной железы линии MCF-7
Исследование цитотоксической активности образцов препарата полиакрилата золота и препарата сравнения Цисплатин в отношении карциномы молочной железы линии МСF-7 проводили по методике, полностью аналогичной описанной в примерах 2 и 3. Результаты определения, усредненные по трем независимым определениям, представлены на Фиг. 4.
Результаты Примера 3 позволяют сделать вывод о перспективности применения препарата полиакрилата золота в качестве средства для химиотерапии карциномы молочной железы. IC50 для Au(III) в составе всех шести образцов, полученных в различных условиях имела то же значение, что и для линии А375, но величина разброса при этом была в 5 раз выше: IC50=162,2±40,1 мкМ.
Применение полиакрилата золота в качестве цитотоксического средства для химиотерапии меланомы.