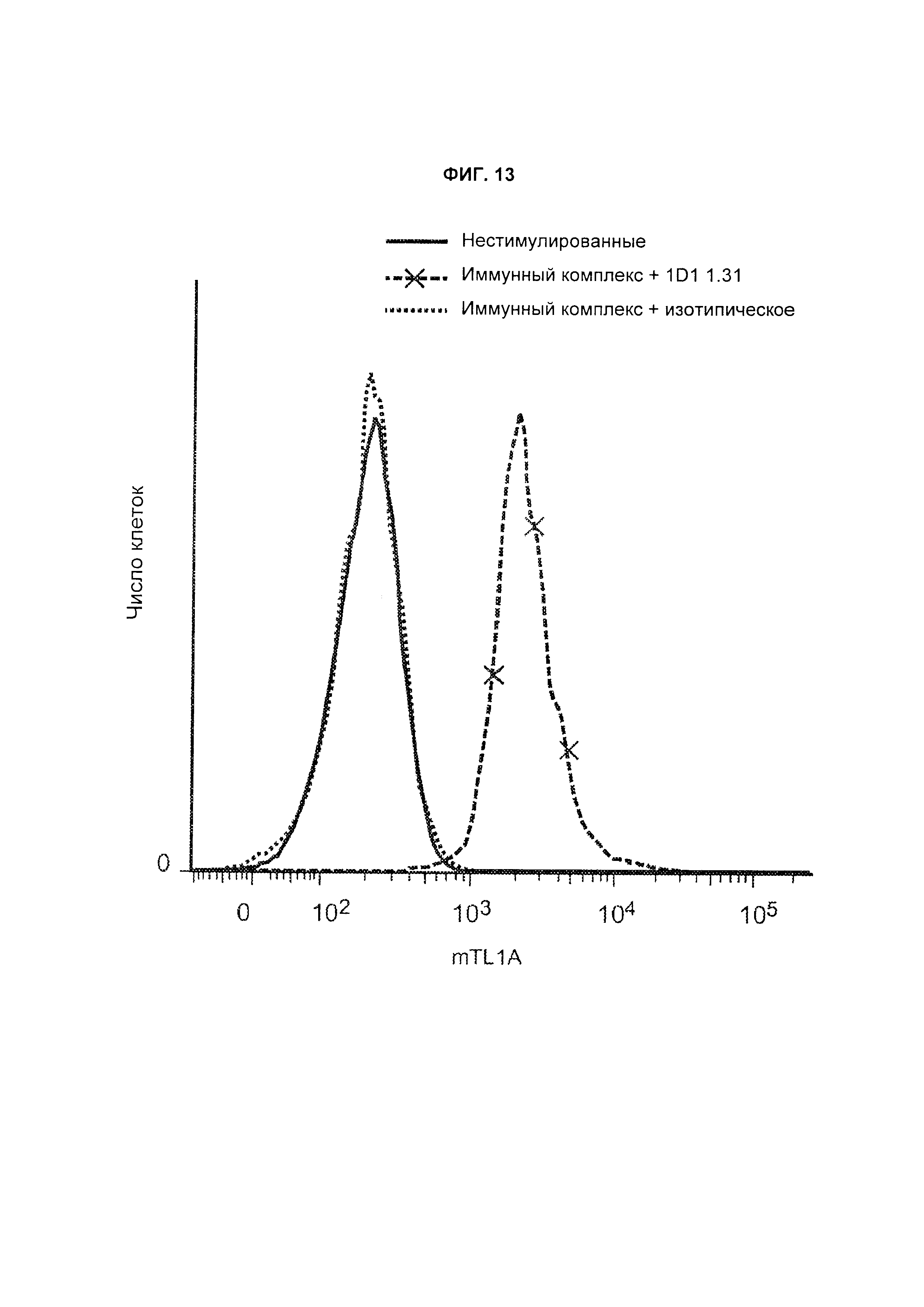
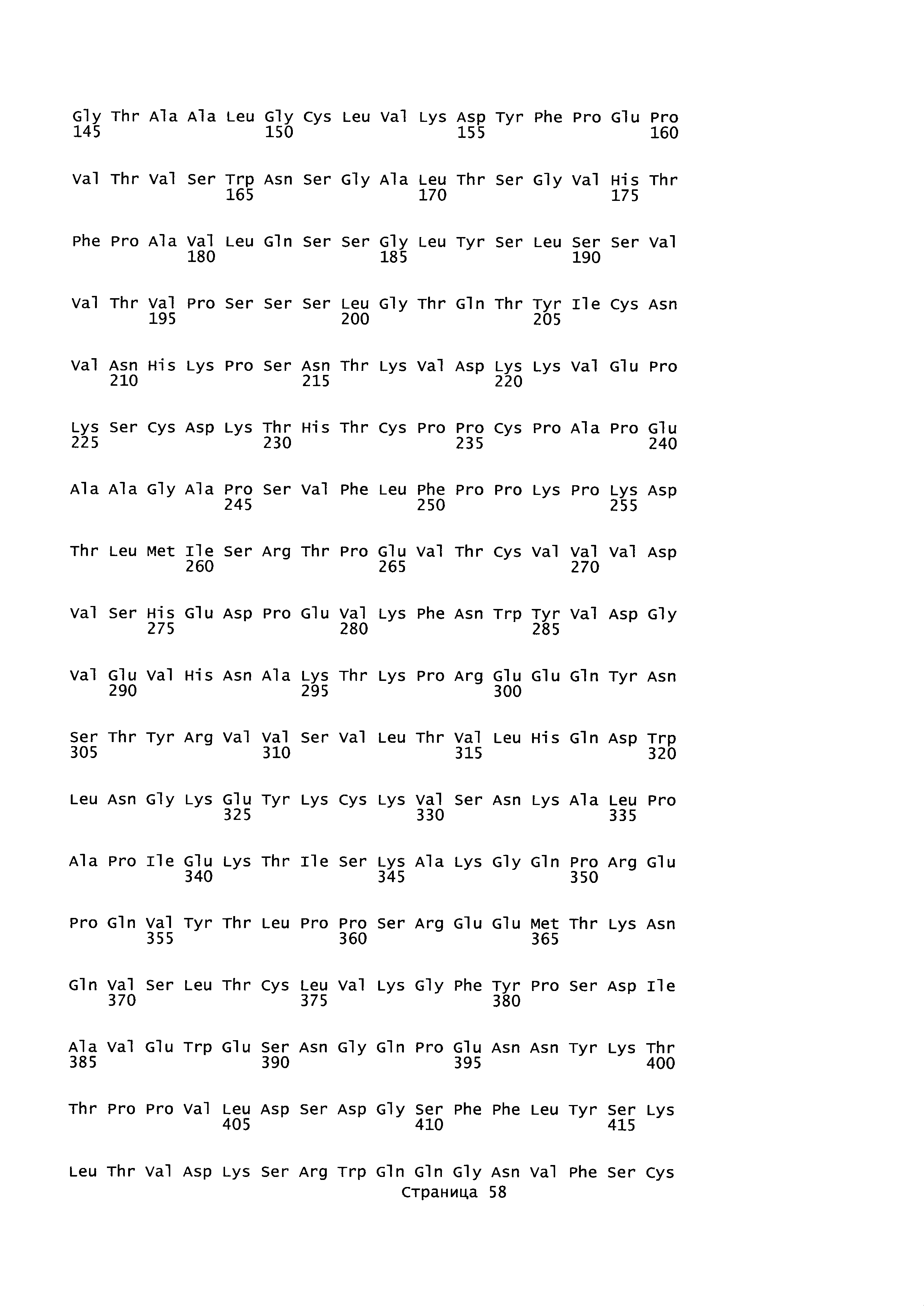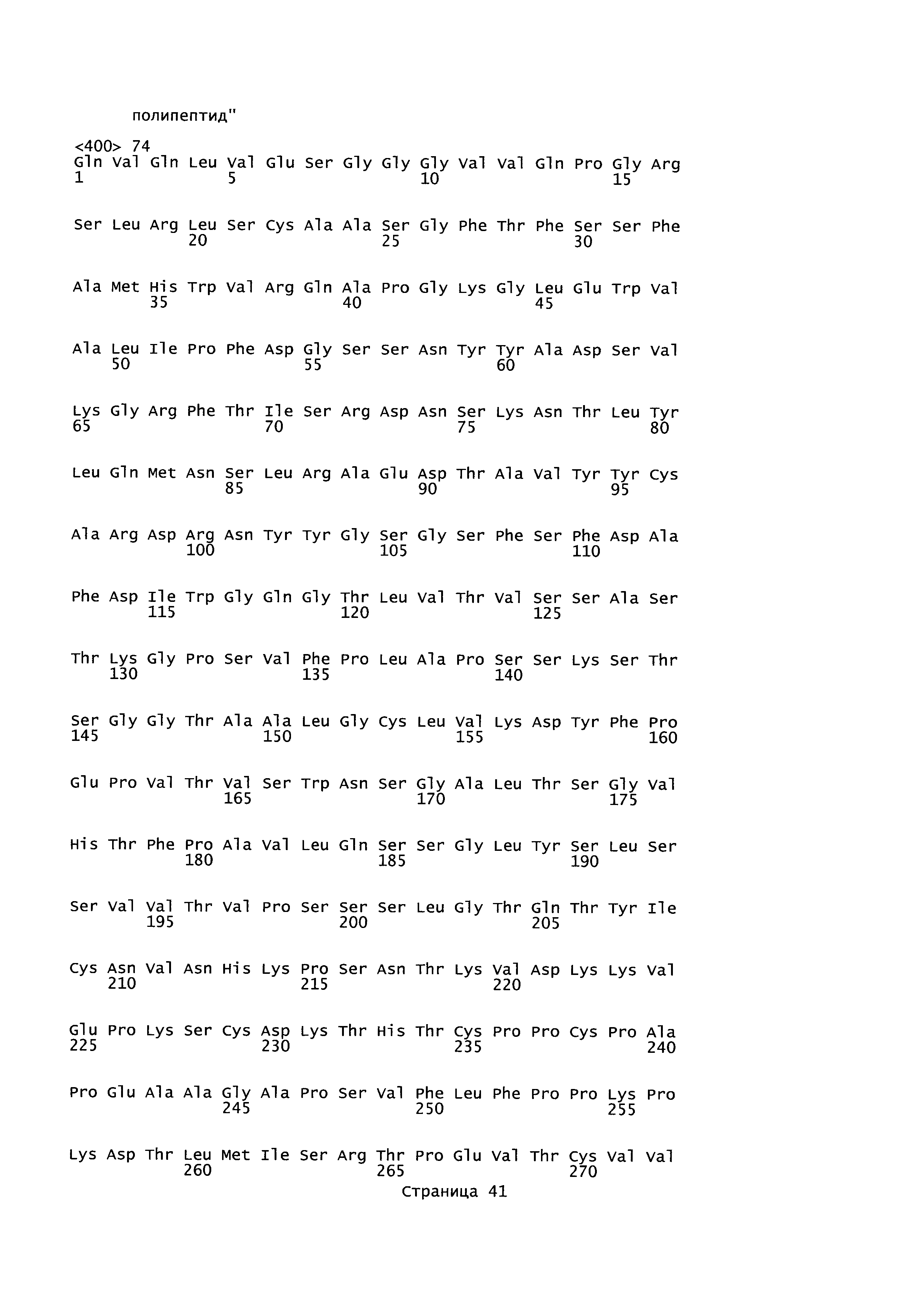Результат интеллектуальной деятельности: Антитела, специфичные в отношении лиганда 1А, подобного фактору некроза опухолей, и их композиции и применения
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам, например, к полноразмерным антителам и их антигенсвязывающим фрагментам, которые специфически связываются с TL1A - лигандом 1А, подобным фактору некроза опухолей (TNF). Изобретение дополнительно относится к композициям, содержащим антитела к TL1A, и к способам применения данных антител в качестве лекарственного средства. Антитела против TL1A являются полезными для лечения и предупреждения заболеваний и расстройств, опосредованных TL1A.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Лиганд 1А, подобный фактору некроза опухолей (TL1A), является членом семейства TNF цитокинов, также известным как TNFSF15. TL1A является единственным известным лигандом в отношении его рецептора, который представляет собой рецептор смерти 3 (DR3), также известного как TNFRSF15. Экспрессия TL1A на антигенпрезентирующих клетках (моноцитах, макрофагах, дендритных клетках) и экспрессия DR3 на эффекторных клетках (T-клетках, NK-клетках (клетки естественные киллеры) и NKT-клетках (Т-клетки естественные киллеры)) сильно зависит от провоспалительных условий (Migone et al, 2002, Immunity 16(3): 479-492; Prehn et al, 2004, Clin. Immunol. 112(1): 66-77; Shih et al, 2009, Eur J Immunol 39(11): 3239-3250). Доказательства in vivo и in vitro поддерживают костимулирующую роль пути TL1A/DR3 на Т-клетках и в усилении функций эффекторных клеток, размножении воспалительных клеток и секреции цитокинов. Кроме того, данный путь связывали с регуляцией патогенных ответов T-хелперов Th1, Th2 и Th17 и ответов NK- и NK-T-клеток в иммуноопосредованных заболеваниях (Papadakis et al, 2004, J Immunol 172(11): 7002-7007; Prehn et al, 2004, Clin. Immunol. 112(1): 66-77; Papadakis et al, 2005, J Immunol 174(8): 4985-4990; Pappu et al, 2008, J Exp Med 205(5): 1049-1062; Takedatsu et al, 2008, Gastroenterology 135(2): 552-567).
Исследования мышей, дефицитных по генам DR3 или TL1A, или мышей, обработанных антителами против TL1A, демонстрируют роль данного пути в целом ряде моделей аутоиммунных заболеваний, таких как IBD (воспалительное заболевание кишечника), астма, рассеянный склероз и артрит (см. Meylan et al., 2008, Immunity 29(1): 79-89.; Pappu et al, 2008; Hsu and Viney, 2011, Mucosal Immun. 4(4): 368-370).
Кроме того, значительный объем литературы из исследований, включающих неклинические виды и человека, наиболее очевидно связывает TL1A с патофизиологией воспалительного заболевания кишечника (IBD), такого как язвенный колит (UC) и болезнь Крона (CD). То есть, многочисленные исследования по полногеномным ассоциациям связали несколько полиморфизмов гена TL1A с UC и CD в популяциях пациентов японского, европейского и азиатского происхождения (Yamazaki et al, 2005. Hum Mol Genet 14(22): 3499-3506.; Barrett et al, 2008, Nat Genet 40(8): 955-962; Kakuta et al, 2009, Hum Mol Genet 18(6): 1089-1098; Jostins et al, 2012, Nature 491(7422): 119-124; Yamazaki et al, 2013, Gastroenterology 144(4): 781-788).
Кроме того, человеческие воспаленные ткани при IBD демонстрируют высокие уровни экспрессии TL1A и DR3, и несколько независимых лабораторий продемонстрировали, что блокада антителом TL1A предупреждает или ослабляет воспаление кишечника в целом ряде мышиных моделей IBD (Bamias et al, 2003, J Immunol 171(9): 4868-4874; Prehn et al, 2004; Bamias et al, 2006, Proc Natl Acad Sci USA 103(22): 8441-8446.; Takedatsu et al, 2008, Gastroenterology 135(2): 552-567; Shih et al, 2009; Kamada et al, 2010, Inflamm Bowel Dis 16(4): 568-575; Meylan et al, 2011, Immunol Rev 244(1): 188-196; Taraban et al, 2011, Mucosal Immunol 4(2): 186-196; Bamias et al, 2012, Dig Liver Dis. 44(1): 30-36).
Несмотря на то, что точная причина IBD, например, CD и UC, остается неясной, было показано, что ингибирование провоспалительных цитокинов и молекул адгезии обеспечивает некоторую терапевтическую пользу. Однако, несмотря на современную медицинскую терапию, для большинства пациентов с CD, в конечном счете, может потребоваться хирургическое вмешательство, и повторные резекции со временем могут приводить к синдрому укороченного кишечника, в конечном счете, приводя к пожизненному парентеральному питанию пациента и ассоциированным с ним осложнениям. Таким образом, существует ощущаемая в течение длительного времени неудовлетворенная потребность в более надежных терапиях для пациентов с CD. Кроме того, существует ощущаемая в течение длительного времени неудовлетворенная потребность в новых терапевтических средствах для лечения или уменьшения интенсивности IBD, включая UC и CD, а также для лечения других заболеваний и состояний, опосредованных TL1A. Настоящее изобретение удовлетворяет данные потребности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Раскрыты выделенные антитела или их антигенсвязывающие фрагменты, которые специфически связываются с лигандом 1А, подобным фактору некроза опухолей (TL1A), а также ассоциированные реактивы, композиции и способы.
B1. Согласно первому аспекту изобретения предложено выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с лигандом 1А, подобным фактору некроза опухолей (TL1A).
Ниже описан целый ряд воплощений (В) этого первого аспекта изобретения, где, для удобства, B1 идентично ему.
B2. Антитело или его антигенсвязывающий фрагмент по B1, которые связываются с человеческим TL1A с аффинностью примерно 4 нМ или менее.
B3. Антитело или его антигенсвязывающий фрагмент по любому из В1-B2, которые связываются с человеческим TL1A с аффинностью примерно 1 нМ или менее.
B4. Антитело или его антигенсвязывающий фрагмент по любому из В1-B3, которые связываются с человеческим TL1A с аффинностью примерно 500 пМ или менее.
B5. Антитело или его антигенсвязывающий фрагмент по любому из В1-B4, которые связываются с человеческим TL1A с аффинностью примерно 250 пМ или менее.
B6. Антитело или его антигенсвязывающий фрагмент по любому из BIBS, которые связываются с человеческим TL1A с аффинностью примерно 100 пМ или менее.
B7. Антитело или его антигенсвязывающий фрагмент по любому из В1-B6, которые связываются с человеческим TL1A с аффинностью примерно 50 пМ или менее.
B8. Антитело или его антигенсвязывающий фрагмент по любому из В1-B7, которые связываются с человеческим TL1A с аффинностью примерно 25 пМ или менее.
B9. Антитело или его антигенсвязывающий фрагмент по любому из BIBS, которые связываются с человеческим TL1A с аффинностью примерно 10 пМ или менее.
B10. Антитело или его антигенсвязывающий фрагмент по любому из В1-В9, которые связываются с человеческим TL1A с аффинностью примерно 5 пМ или менее.
B11. Антитело или его антигенсвязывающий фрагмент по любому из В1-B10, которые связываются с человеческим TL1A с аффинностью примерно 2 пМ или менее.
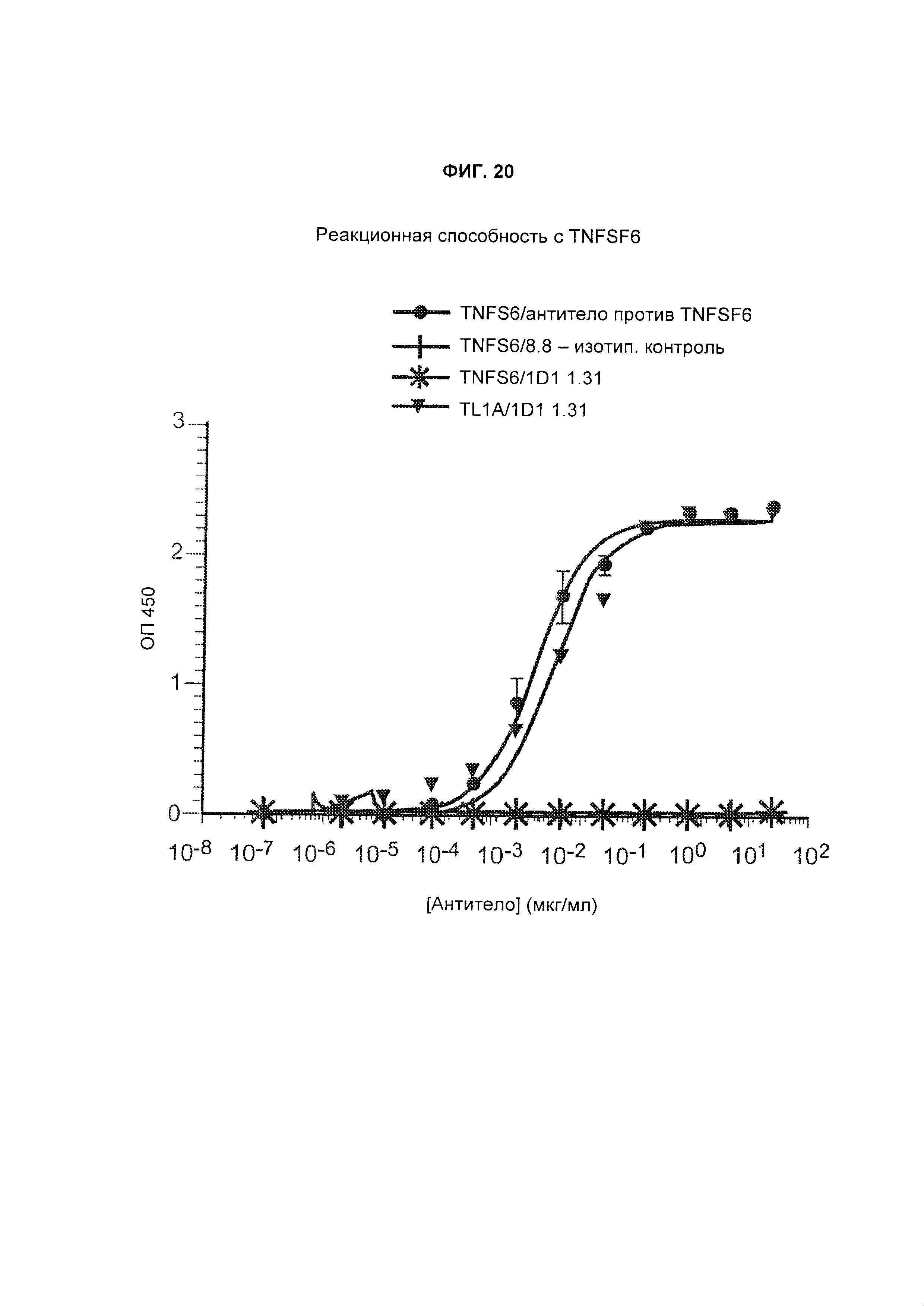
B12. Антитело или его антигенсвязывающий фрагмент по любому из В1-B11, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой TNFSF6.
B13. Антитело или его антигенсвязывающий фрагмент по любому из В1-B12, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой TNFSF10.
B14. Антитело или его антигенсвязывающий фрагмент по любому из В1-B13, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой TNFSF14.
B15. Антитело или его антигенсвязывающий фрагмент по любому из В1-B14, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой TNF-β (фактор некроза опухолей-бета).
B16. Антитело или его антигенсвязывающий фрагмент по любому из В1-B15, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой TNF-α (фактор некроза опухолей-альфа).
B17. Антитело или его антигенсвязывающий фрагмент по любому из В1-B16, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой лимфотоксин α2-β1.
B18. Антитело или его антигенсвязывающий фрагмент по любому из В1-B17, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A представляет собой лимфотоксин α1-β2.
B19. Антитело или его антигенсвязывающий фрагмент по любому из В1-B18, которые имеют меньшую аффинность в отношении человеческого гомолога TL1A, чем в отношении человеческого TL1A, и указанный человеческий гомолог TL1A выбран из группы, состоящей из TNFSF6, TNFSF10, TNFSF14, TNF-β, TNF-α, лимфотоксина α2-β1 и лимфотоксина α1-β2.
B20. Антитело или его антигенсвязывающий фрагмент по любому из В12-B19, которые имеют значение аффинности в отношении человеческого гомолога TL1A, выбранное из группы, состоящей из примерно 1 мкМ или более, примерно 3 мкМ или более, примерно 10 мкМ или более, примерно 30 мкМ или более и примерно 100 мкМ или более.
B21. Антитело или его антигенсвязывающий фрагмент по любому из В12-B20, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 1 мкМ или более.
B22. Антитело или его антигенсвязывающий фрагмент по любому из В12-В20, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 3 мкМ или более.
B23. Антитело или его антигенсвязывающий фрагмент по любому из В12-B22, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 10 мкМ или более.
B24. Антитело или его антигенсвязывающий фрагмент по любому из В12-B23, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 100 мкМ или более.
B25. Антитело или его антигенсвязывающий фрагмент по любому из В12-B24, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 1 мМ или более.
B26. Антитело или его антигенсвязывающий фрагмент по любому из В12-B25, которые имеют аффинность в отношении человеческого гомолога TL1A примерно 1 мкМ или более.
B27. Антитело или его антигенсвязывающий фрагмент по любому из В1-B26, которые имеют аффинность в отношении мышиного TL1A примерно 10 нМ или менее.
B28. Антитело или его антигенсвязывающий фрагмент по любому из В1-B27, которые имеют аффинность в отношении мышиного TL1A примерно 3 нМ или менее.
B29. Антитело или его антигенсвязывающий фрагмент по любому из В1-B28, которые имеют аффинность в отношении мышиного TL1A примерно 1 нМ или менее.
B30. Антитело или его антигенсвязывающий фрагмент по любому из В1-B29, которые имеют аффинность в отношении мышиного TL1A примерно 300 пМ или менее.
B31. Антитело или его антигенсвязывающий фрагмент по любому из В1-B30, которые имеют аффинность в отношении мышиного TL1A примерно 100 пМ или менее.
B32. Антитело или его антигенсвязывающий фрагмент по любому из В1-B31, которые имеют аффинность в отношении человеческого TL1A примерно 100 пМ или менее, аффинность в отношении мышиного TL1A примерно 300 пМ или менее и аффинность в отношении человеческого TNF-α примерно 1 мкМ или более.
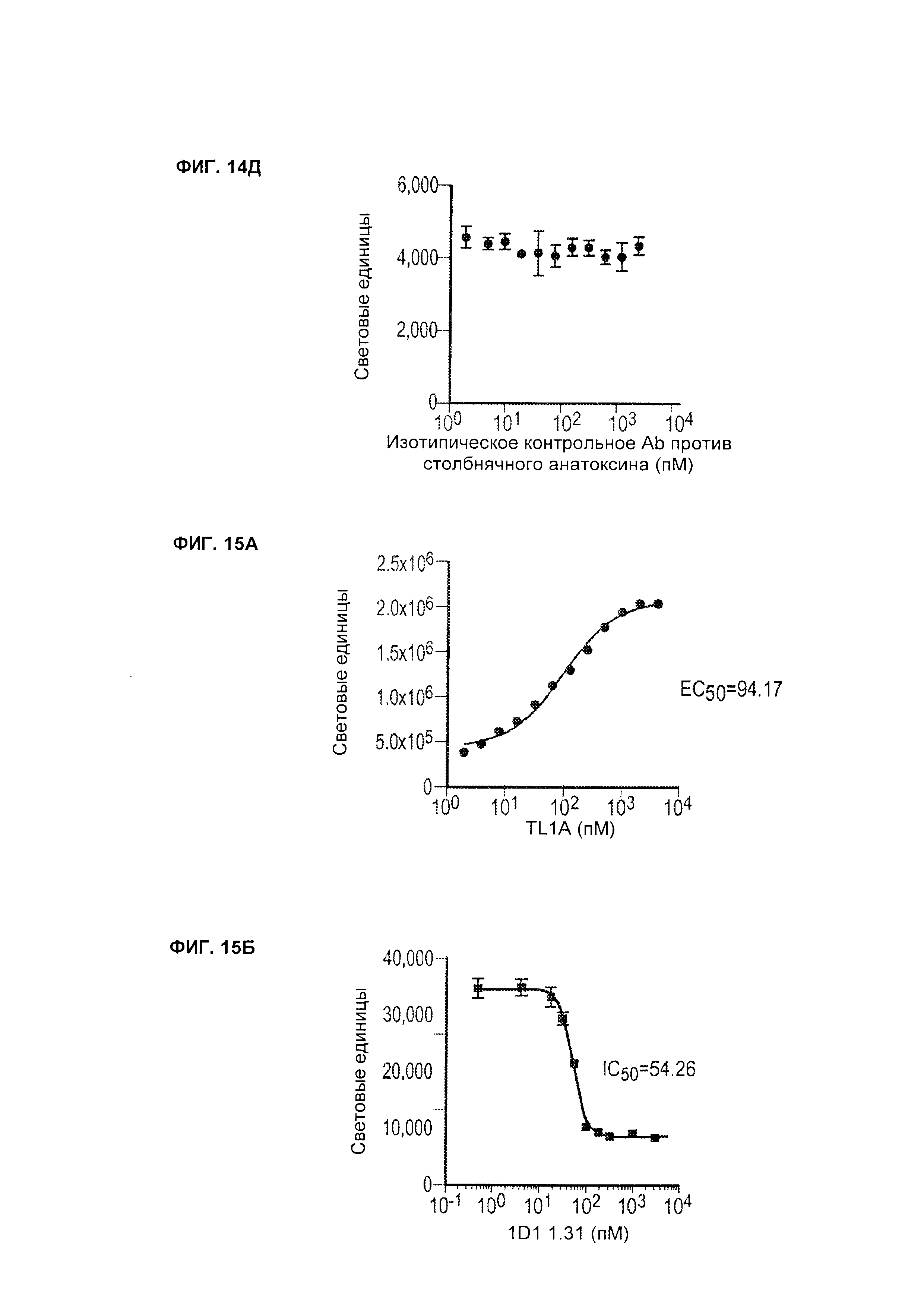
B33. Антитело или его антигенсвязывающий фрагмент по любому из В1-B32, где аффинность антитела или его антигенсвязывающего фрагмента в отношении человеческого TL1A измеряется поверхностным плазмонным резонансом (SPR).
B34. Антитело или его антигенсвязывающий фрагмент по любому из В1-B33, где аффинность представляет собой значение KD, измеренное SPR.
B35. Антитело или его антигенсвязывающий фрагмент по любому из В1-B34, где в SPR используется захваченное антитело и мишень в фазе раствора.
B36. Антитело или его антигенсвязывающий фрагмент по В35, где захваченное антитело иммобилизовано на сенсорном чипе с использованием антитела или его антигенсвязывающей части против изотипа.
B37. Антитело или его антигенсвязывающий фрагмент по B36, где антитело или его антигенсвязывающая часть против изотипа иммобилизована на сенсорном чипе при плотности от примерно 4000 до примерно 13000 единиц ответа.
B38. Антитело или его антигенсвязывающий фрагмент по любому из B33-В37, где измерение SPR по существу проводится согласно протоколу, изложенному в Примере 8.
B39. Антитело или его антигенсвязывающий фрагмент по B33 или В34, где в SPR используется захваченная мишень и антитело в фазе раствора.
B40. Антитело или его антигенсвязывающий фрагмент по любому из B33-В39, где измерение SPR проводится с использованием установки Biacore Т100 или Т200.
B41. Антитело или его антигенсвязывающий фрагмент по любому из В1-В32, где аффинность антитела или его антигенсвязывающего фрагмента в отношении человеческого TL1A измеряется посредством анализа кинетического исключения на основе раствора (KinExA).
B42. Антитело или его антигенсвязывающий фрагмент по В41, где аффинность представляет собой значение KD, измеренное посредством анализа кинетического исключения на основе раствора (KinExA).
B43. Антитело или его антигенсвязывающий фрагмент по любому из В41-В42, где в KinExA используется захваченная мишень на твердой фазе и антитело в фазе раствора.
B44. Антитело или его антигенсвязывающий фрагмент по В43, где антитело и мишень прединкубируют в растворе достаточно долго для достижения равновесия.
B45. Антитело или его антигенсвязывающий фрагмент по В44, где уровень несвязанного антитела измеряют после того, как антитело и мишень достигли равновесия.
B46. Антитело или его антигенсвязывающий фрагмент по любому из В41-B45, где измерение KinExA проводится с использованием установки KinExA 3200 (Sapidyne).
B47. Антитело или его антигенсвязывающий фрагмент по любому из В1-B46, которые представляют собой гуманизированное антитело.
B48. Антитело или его антигенсвязывающий фрагмент по любому из В1-В46, которые представляют собой химерное антитело.
B49. Антитело или его антигенсвязывающий фрагмент по любому из В1-B48, которые содержат домен Fc, имеющий ослабленную эффекторную функцию.
B50. Антитело или его антигенсвязывающий фрагмент по любому из В1-B49, которые содержат константную область, которая имеет ослабленные или устраненные эффекторные функции.
B51. Антитело или его антигенсвязывающий фрагмент по В50, которые не связывается с рецептором Fcγ.
B52. Антитело или его антигенсвязывающий фрагмент по В50-В51, где антитело или его антигенсвязывающая часть содержат эффекторный домен, который содержит аминокислотную последовательность, по меньшей мере примерно на 90% гомологичную последовательности CH2 из человеческого IgG.
B53. Антитело или его антигенсвязывающий фрагмент по В52, где IgG выбран из группы, состоящей из IgG1, IgG2 и IgG4.
B54. Антитело или его антигенсвязывающий фрагмент по любому из В1-B53, где антитело или его антигенсвязывающая часть содержат домен CH2 человеческого IgG1, где домен CH2 содержит одну или более чем одну делецию в положениях, выбранных из группы, состоящей из 234, 235 и 237 (пронумерованных в соответствии с системой нумерации ЕС (Европейский Союз)), или в положениях 241, 242 и 244 SEQ ID NO: 228.
B55. Антитело или его антигенсвязывающий фрагмент по любому из В1-B54, где антитело или его антигенсвязывающая часть содержат домен CH2 человеческого IgG1, где домен СН2 содержит одну или более чем одну замену в положениях, соответствующих положениям, выбранным из группы, состоящей из 234, 235 и 237 (пронумерованных в соответствии с системой нумерации ЕС (см. Kabat et al "Sequences of proteins of immunological interest". Bethesda, US Department of Health and Human Services, NIH, 1991), или в положениях 241, 242 и 244 SEQ ID NO: 228.
B56. Антитело или его антигенсвязывающий фрагмент по В55, где замены могут включать любую аминокислоту, выбранную из группы, состоящей из серина, аланина и пролина.
B57. Антитело или его антигенсвязывающий фрагмент по любому из В1-B56, где антитело или его антигенсвязывающая часть содержат по меньшей мере один из остатков, выбранных из группы, состоящей из L241A, L242A и G244A, согласно нумерации SEQ ID NO: 228.
B58. Антитело или его антигенсвязывающий фрагмент по любому из В1-B57, где антитело или его антигенсвязывающая часть содержат каждый из следующих остатков: L241A, L242A и G244A, согласно нумерации SEQ ID NO: 228.
B59. Антитело или его антигенсвязывающий фрагмент по любому из В1-B58, где антитело или его антигенсвязывающая часть содержат аминокислотную последовательность SEQ ID NO: 257.
B60. Антитело или его антигенсвязывающий фрагмент по любому из В1-B59, где антитело или его антигенсвязывающая часть имеют растворимость по меньшей мере примерно 10 мг/мл.
B61. Антитело или его антигенсвязывающий фрагмент по любому из В1-B60, где антитело или его антигенсвязывающая часть имеют растворимость в водном растворе, выбранную из группы, состоящей из по меньшей мере примерно 20 мг/мл, по меньшей мере примерно 30 мг/мл, по меньшей мере примерно 40 мг/мл, по меньшей мере примерно 50 мг/мл, по меньшей мере примерно 60 мг/мл, по меньшей мере примерно 70 мг/мл, по меньшей мере примерно 80 мг/мл, по меньшей мере примерно 90 мг/мл, по меньшей мере примерно 100 мг/мл, по меньшей мере примерно 125 мг/мл, по меньшей мере примерно 150 мг/мл, по меньшей мере примерно 175 мг/мл и по меньшей мере примерно 200 мг/мл.
B62. Антитело или его антигенсвязывающий фрагмент по В61, где водный раствор имеет pH от примерно pH 5,0 до примерно pH 8,0.
B63. Антитело или его антигенсвязывающий фрагмент по В61-В62, где водный раствор имеет pH от примерно pH 6,0 до примерно pH 7,0.
B64. Антитело или его антигенсвязывающий фрагмент по В61-В63, где водный раствор имеет ионную силу, которая примерно эквивалентна ионной силе буфера на основе физиологического раствора, например, PBS (фосфатно-солевой буферный раствор).
B65. Антитело или его антигенсвязывающий фрагмент по В1-В64, которые обладают термостабильностью с температурой плавления (Tm) примерно 60°C или более при измерении дифференциальной сканирующей калориметрией.
B66. Антитело или его антигенсвязывающий фрагмент по В1-В65, которые обладают термостабильностью с температурой плавления (Tm), выбранной из группы, состоящей из примерно 60°C или более, примерно 65°C или более, примерно 70°C или более и примерно 75°C или более при измерении дифференциальной сканирующей калориметрией.
B67. Антитело или его антигенсвязывающий фрагмент по В1-В66, которые имеют T1% или температуру, при которой белок был развернут на 1%, составляющую по меньшей мере примерно 37°C.
B68. Антитело или его антигенсвязывающий фрагмент по В1-В67, которые имеют T1% или температуру, при которой белок был развернут на 1%, выбранную из группы, состоящей из по меньшей мере примерно 37°C, по меньшей мере примерно 40°C, по меньшей мере примерно 45°C, по меньшей мере примерно 50°C или по меньшей мере примерно 55°C.
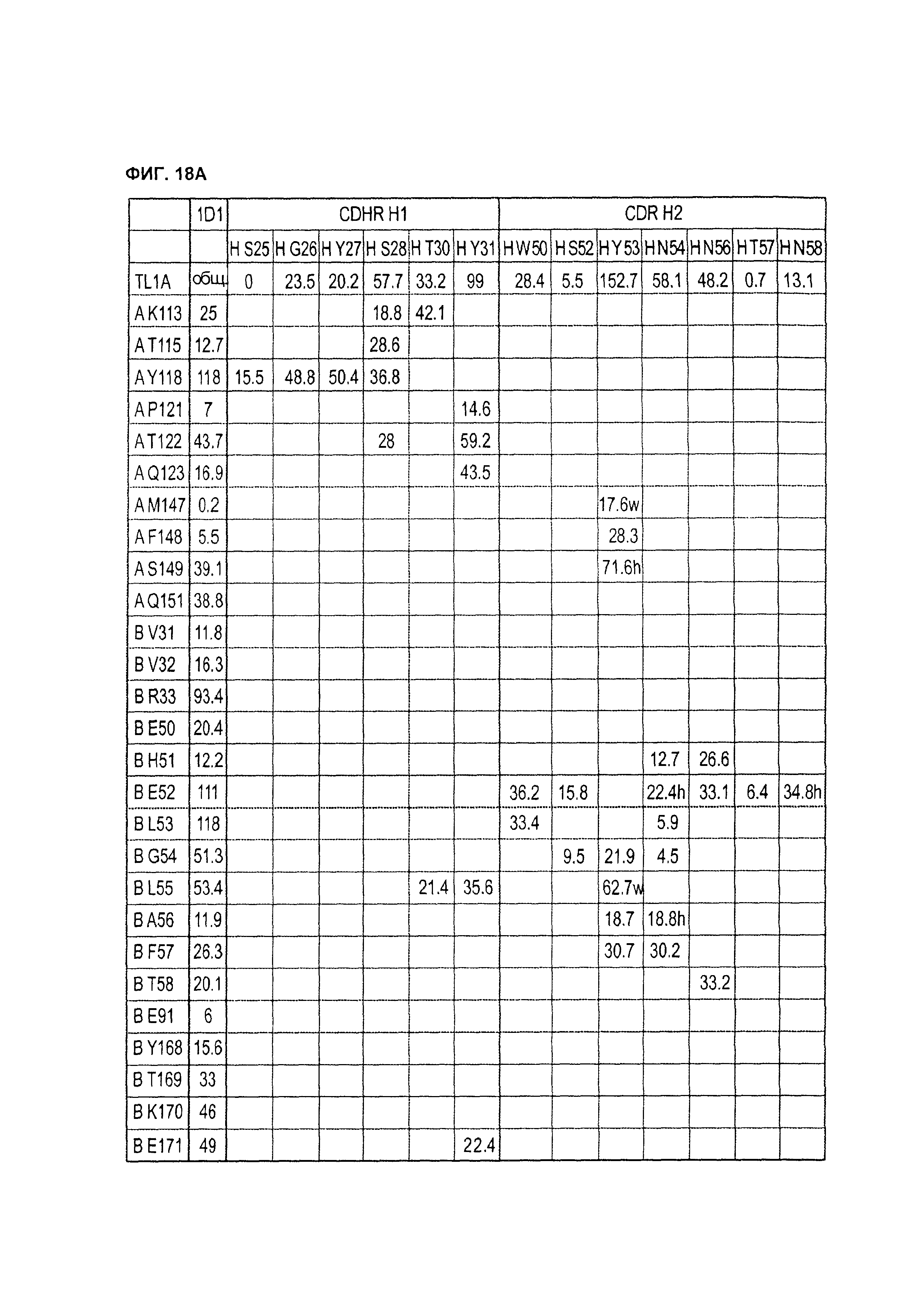
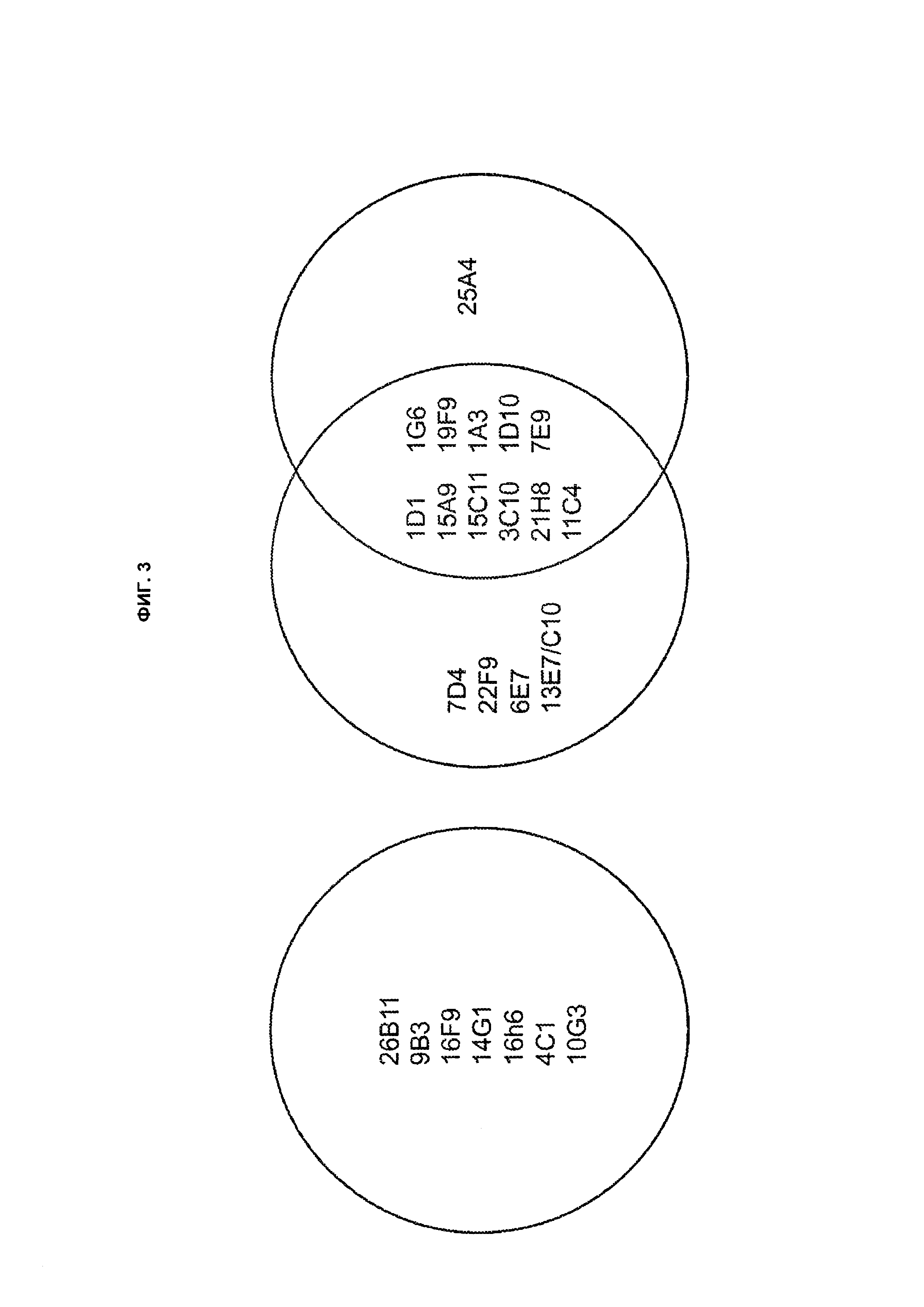
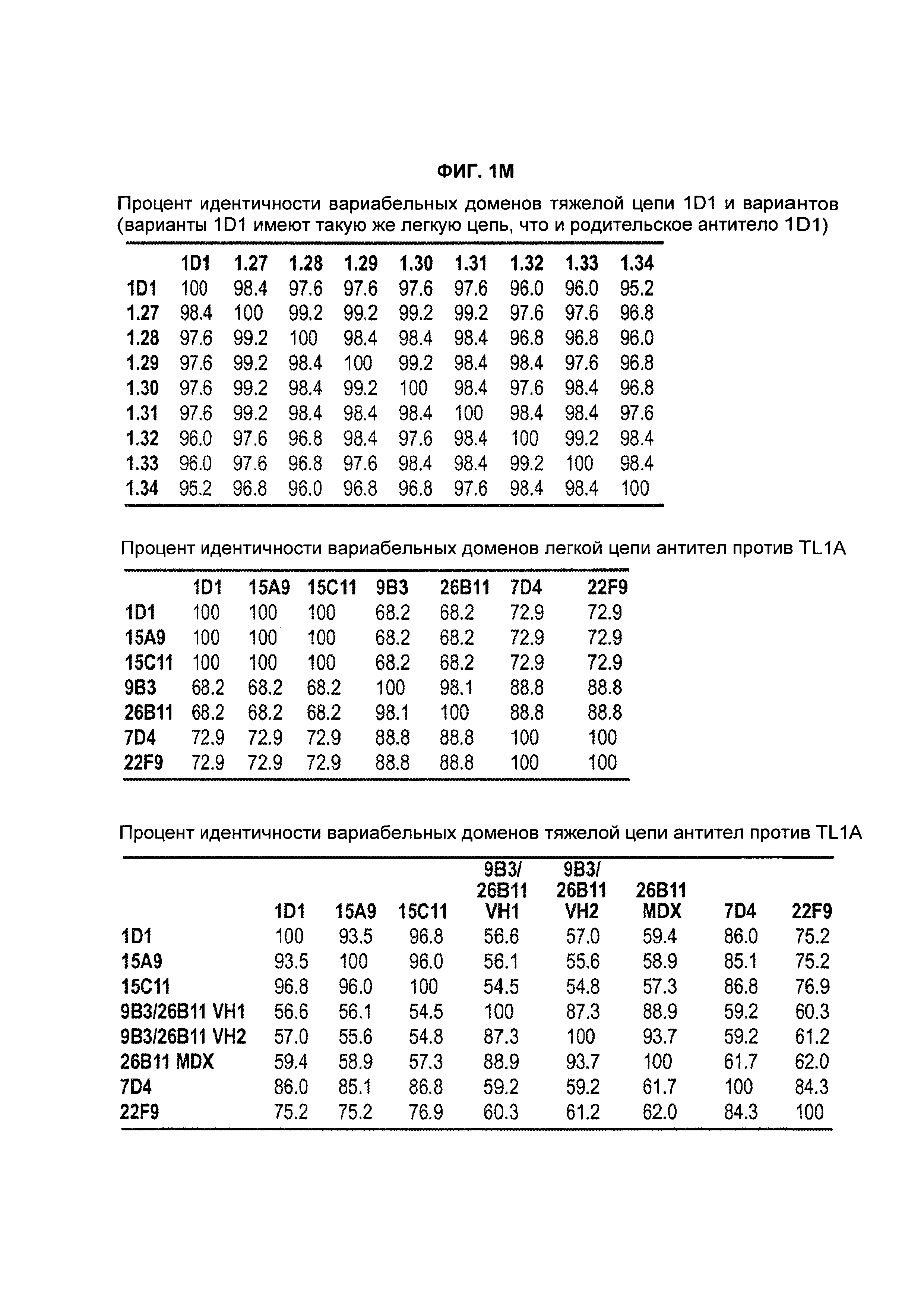
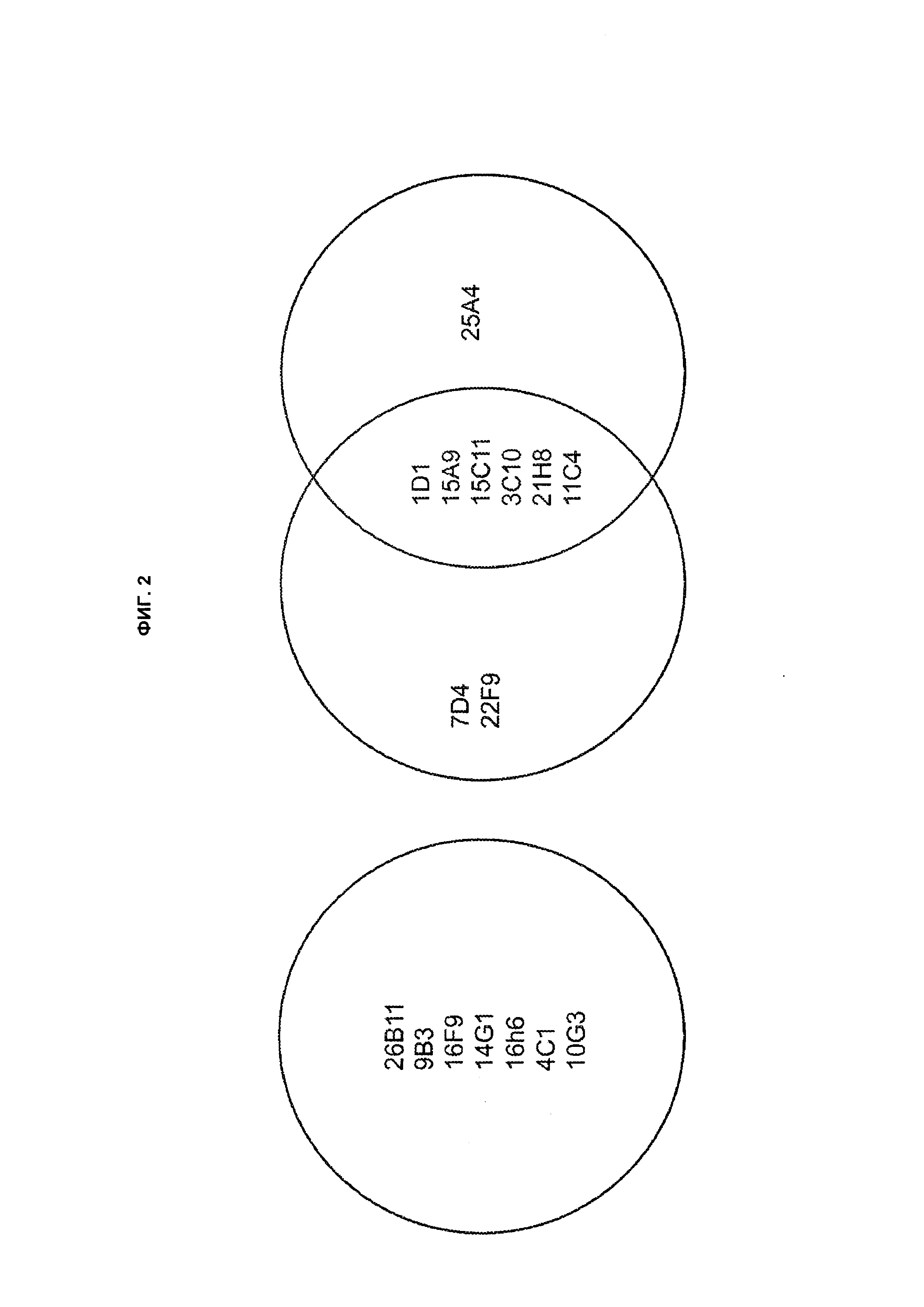
B69. Антитело или его антигенсвязывающий фрагмент по любому из В1-B68, которые конкурируют за связывание с TLA1 или связывается с тем же самым эпитопом TL1A, что и антитело, выбранное из группы, состоящей из 1D1 1.31, 26B11, 9B3, 7D4, 22F9, 15А9 и 15C11, как здесь определено.
B70. Антитело или его антигенсвязывающий фрагмент по любому из В1-B69, которые содержат вариабельную область тяжелой цепи (VH), содержащую:
а. гипервариабельную область один VH (CDR-H1), содержащую аминокислотную последовательность SEQ ID NO: 374;
б. гипервариабельную область два VH (CDR-H2), содержащую аминокислотную последовательность SEQ ID NO: 377; и
в. гипервариабельную область три VH (CDR-H3), содержащую аминокислотную последовательность SEQ ID NO: 380.
B71. Антитело или его антигенсвязывающий фрагмент по любому из B1-B70, которые содержат вариабельную область тяжелой цепи (VH), содержащую:
а. гипервариабельную область один VH (CDR-H1), содержащую аминокислотную последовательность SEQ ID NO: 375;
б. гипервариабельную область два VH (CDR-H2), содержащую аминокислотную последовательность SEQ ID NO: 378; и
в. гипервариабельную область три VH (CDR-H3), содержащую аминокислотную последовательность SEQ ID NO: 381.
B72. Антитело или его антигенсвязывающий фрагмент по любому из В1-B71, которые содержат вариабельную область тяжелой цепи (VH), содержащую:
а. гипервариабельную область один VH (CDR-H1), содержащую аминокислотную последовательность SEQ ID NO: 376;
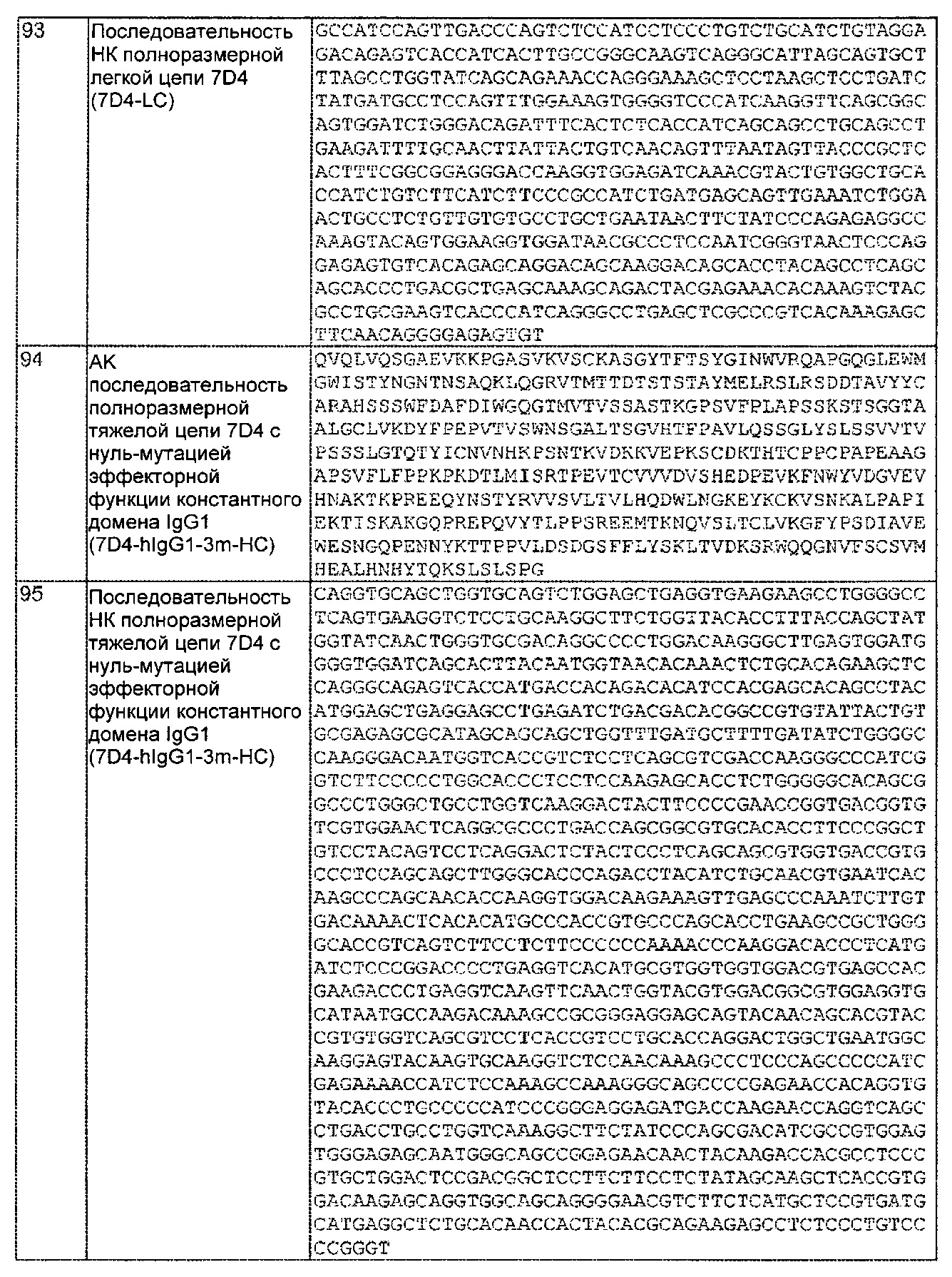
б. гипервариабельную область два VH (CDR-H2), содержащую аминокислотную последовательность SEQ ID NO: 379; и
в. гипервариабельную область три VH (CDR-H3), содержащую аминокислотную последовательность SEQ ID NO: 382.
B73. Антитело или его антигенсвязывающий фрагмент по любому из В1-B72, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 102, 1, 22, 36, 50, 64, 88.
B74. Антитело или его антигенсвязывающий фрагмент по любому из В1-B73, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 102.
B75. Антитело или его антигенсвязывающий фрагмент по любому из В1-B74, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 102, 1, 22, 36, 50, 64, 88.
B76. Антитело или его антигенсвязывающий фрагмент по любому из B1-B75, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO: 102.
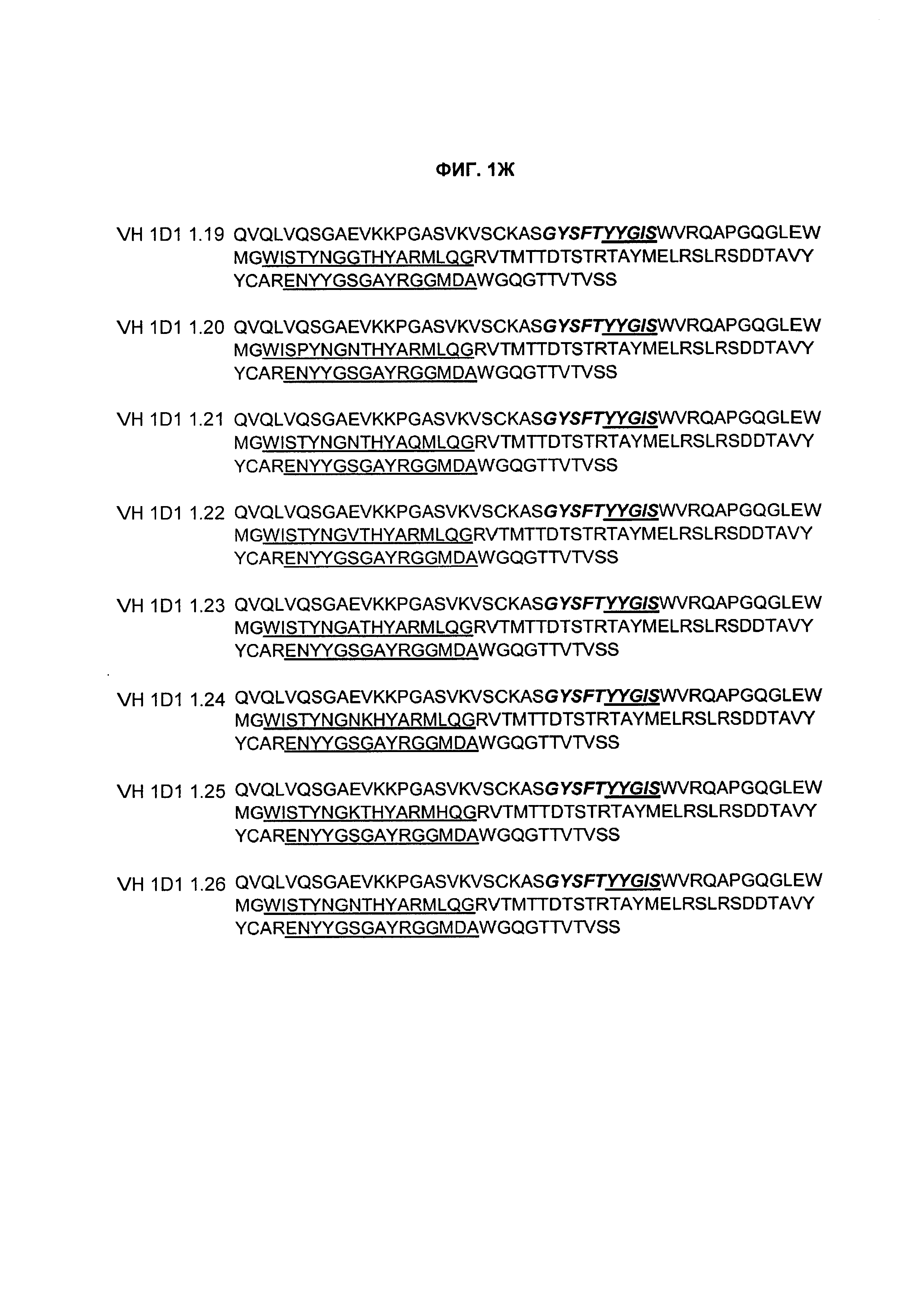
B77. Антитело или его антигенсвязывающий фрагмент по любому из В1-B76, содержащие вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 226, 3, 5, 24, 38, 52, 66, 68, 70, 90, 104, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172, 174, 176, 178, 180, 182, 184, 186, 188, 190, 192, 194, 196, 198, 205, 212, 219, 233, 240 и 247.
B78. Антитело или его антигенсвязывающий фрагмент по любому из B1-B77, содержащие вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность SEQ ID NO: 226.
B79. Антитело или его антигенсвязывающий фрагмент по любому из B1-B78, которые содержат VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112.
B80. Антитело или его антигенсвязывающий фрагмент по любому из B1-B79, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO: 102.
B81. Антитело или его антигенсвязывающий фрагмент по любому из B1-B80, которые содержат VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103.
B82. Антитело или его антигенсвязывающий фрагмент по любому из B1-B81, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, по меньшей мере примерно на 90% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 50, 88 и 64.
B83. Антитело или его антигенсвязывающий фрагмент по любому из B1-B82, которые содержат VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 13, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 14, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 15.
B84. Антитело или его антигенсвязывающий фрагмент по любому из B1-B83, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO: 1.
B85. Антитело или его антигенсвязывающий фрагмент по любому из B1-B84, которые содержат VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 2.
B86. Антитело или его антигенсвязывающий фрагмент по любому из B1-B85, которые содержат VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 58, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 59, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 60.
B87. Антитело или его антигенсвязывающий фрагмент В86, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO: 50.
B88. Антитело или его антигенсвязывающий фрагмент по любому из В86-В87, которые содержат VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 51.
B89. Антитело или его антигенсвязывающий фрагмент по любому из В1-В85, которые содержат VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 76, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 77, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 78.
B90. Антитело или его антигенсвязывающий фрагмент по В89, которые содержат вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO: 64.
B91. Антитело или его антигенсвязывающий фрагмент по любому из B89-B90, которые содержат VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 89.
B92. Антитело или его антигенсвязывающий фрагмент по любому из B1-B91, которые содержат T или R в положении 76 при определении посредством нумерации VH по Kabat.
B93. Антитело или его антигенсвязывающий фрагмент по любому из B1-B92, которые содержат D или E в положении 81 при определении посредством нумерации VH по Kabat.
B94. Антитело или его антигенсвязывающий фрагмент по любому из B1-B93, которые содержат:
а. VH, содержащую:
1. CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 202;
2. CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 203, 210, 217, 224, 231, 238, 245 или 252;
3. CDR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 232, 204, 211, 218, 225, 239, 246 или 253; и
б. VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112.
B95. Антитело или его антигенсвязывающий фрагмент по любому из B1-B94, которые содержат VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 230, аминокислотную последовательность CDR-H2 SEQ ID NO: 231, аминокислотную последовательность CDR-H3 SEQ ID NO: 232, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112.
B96. Антитело или его антигенсвязывающий фрагмент по любому из B1-B95, которые содержат VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 226, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102.
B97. Антитело или его антигенсвязывающий фрагмент по любому из B1-B96, которые содержат VH, содержащую аминокислотную последовательность SEQ ID NO: 226, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102.
B98. Антитело или его антигенсвязывающий фрагмент по любому из B1-B97, которые содержат тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 228, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106.
B99. Антитело или его антигенсвязывающий фрагмент по любому из B1-B98, которые содержат VH, содержащую CDR-H1, CDR-H2 и CDR-H3 VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 227, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103.
B100. Антитело или его антигенсвязывающий фрагмент по любому из B1-B99, содержащие VH, кодируемую нуклеиновой кислотой, кодирующей аминокислотную последовательность SEQ ID NO: 226, и VL, кодируемую нуклеиновой кислотой, кодирующей аминокислотную последовательность SEQ ID NO: 102; или антитело, или его антигенсвязывающий фрагмент по любому из В1-В99, которые содержат VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 227, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103; и
B101. Антитело или его антигенсвязывающий фрагмент по любому из В1-B100, которые содержат тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 229, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107.
B102. Антитело или его антигенсвязывающий фрагмент по любому из B1-B101, которые содержат VH, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VH, имеющей регистрационный номер ATCC (Американская коллекция типовых культур) PTA-120639.
B103. Антитело или его антигенсвязывающий фрагмент по любому из B1-B102, которые содержат VL, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VL, имеющей регистрационный номер ATCC PTA-120640.
B104. Антитело или его антигенсвязывающий фрагмент по любому из В1-В102, которые содержат VH, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VH, имеющей регистрационный номер ATCC PTA-120639, и VL, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VL, имеющей регистрационный номер ATCC PTA-120640.
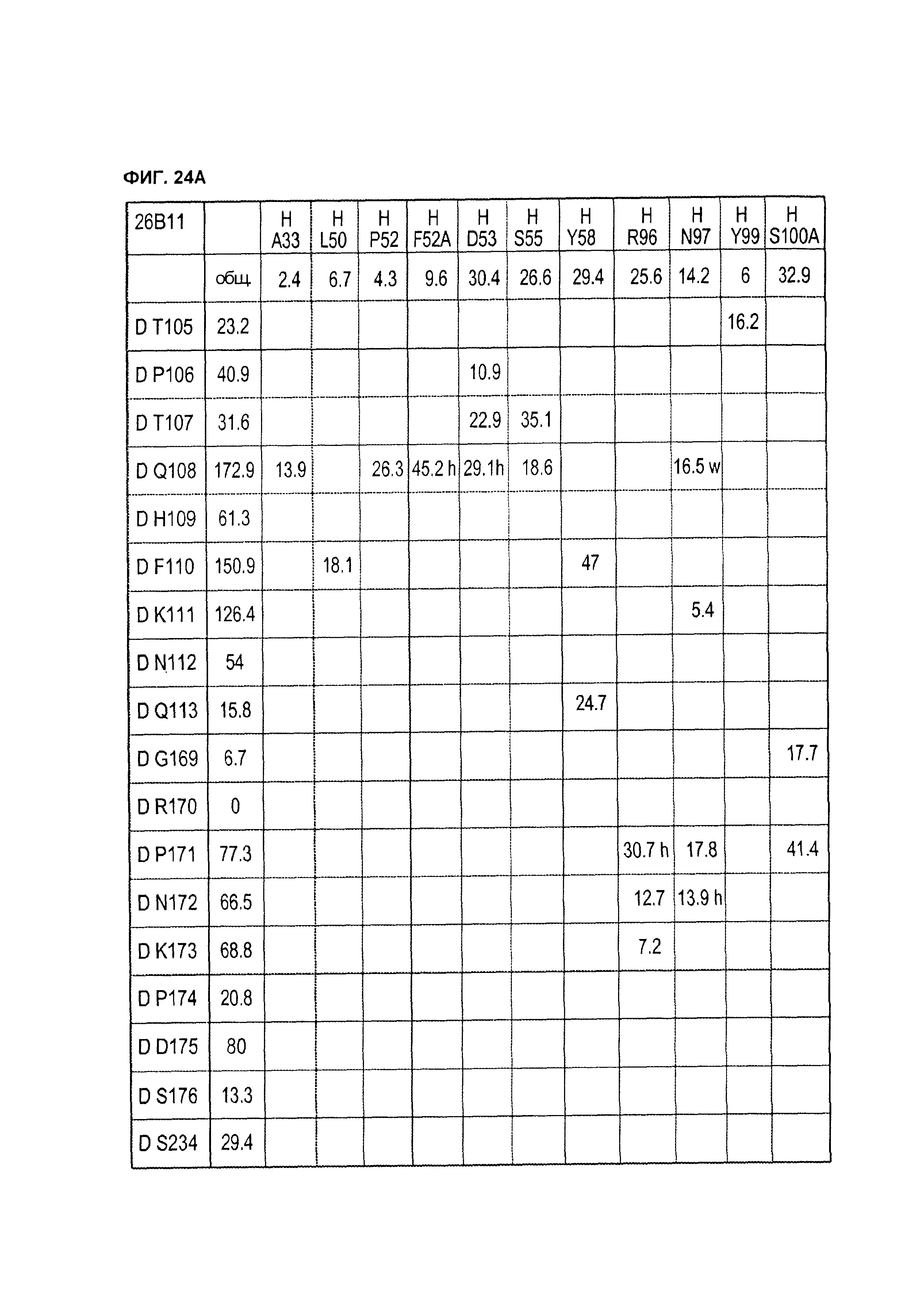
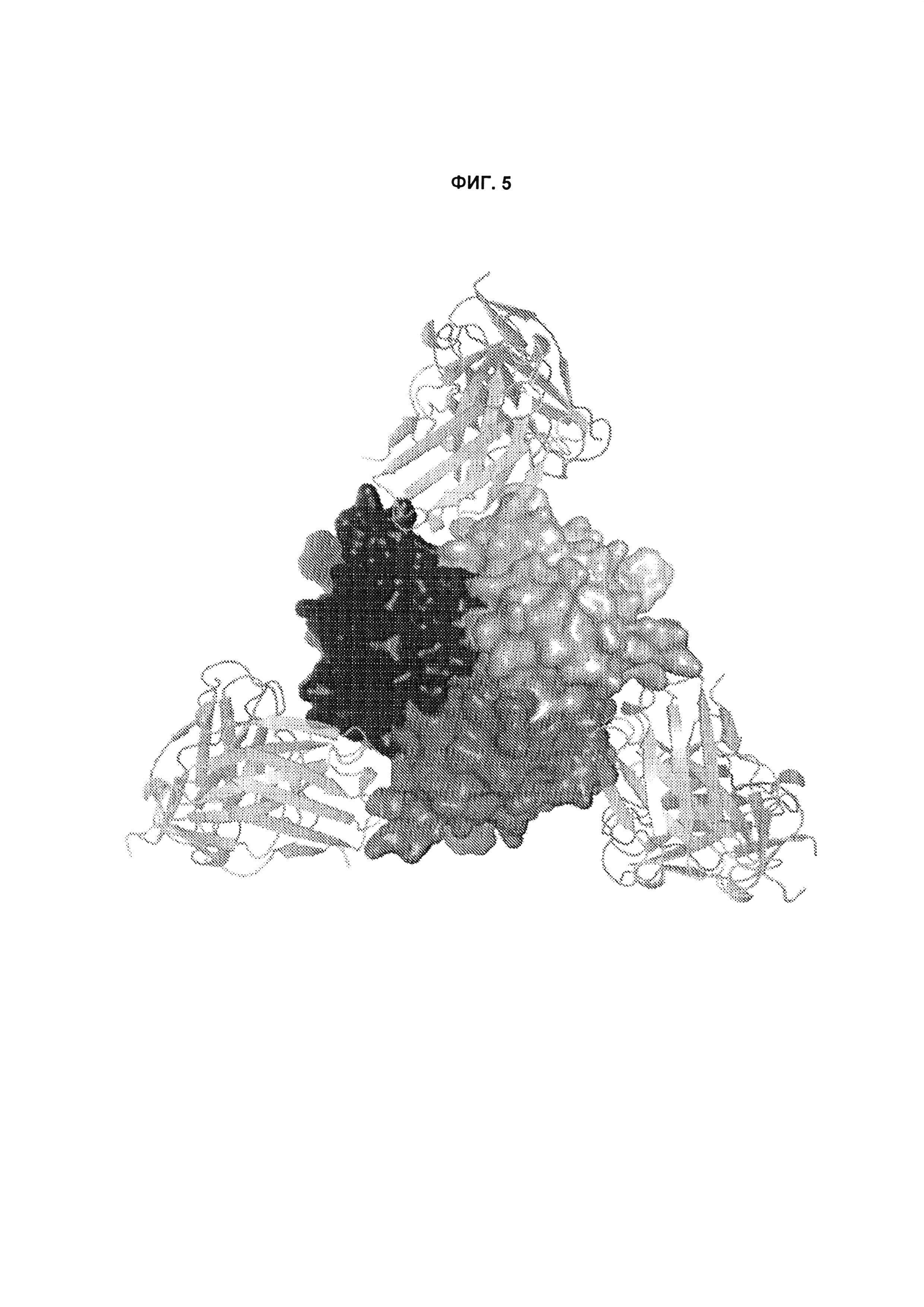
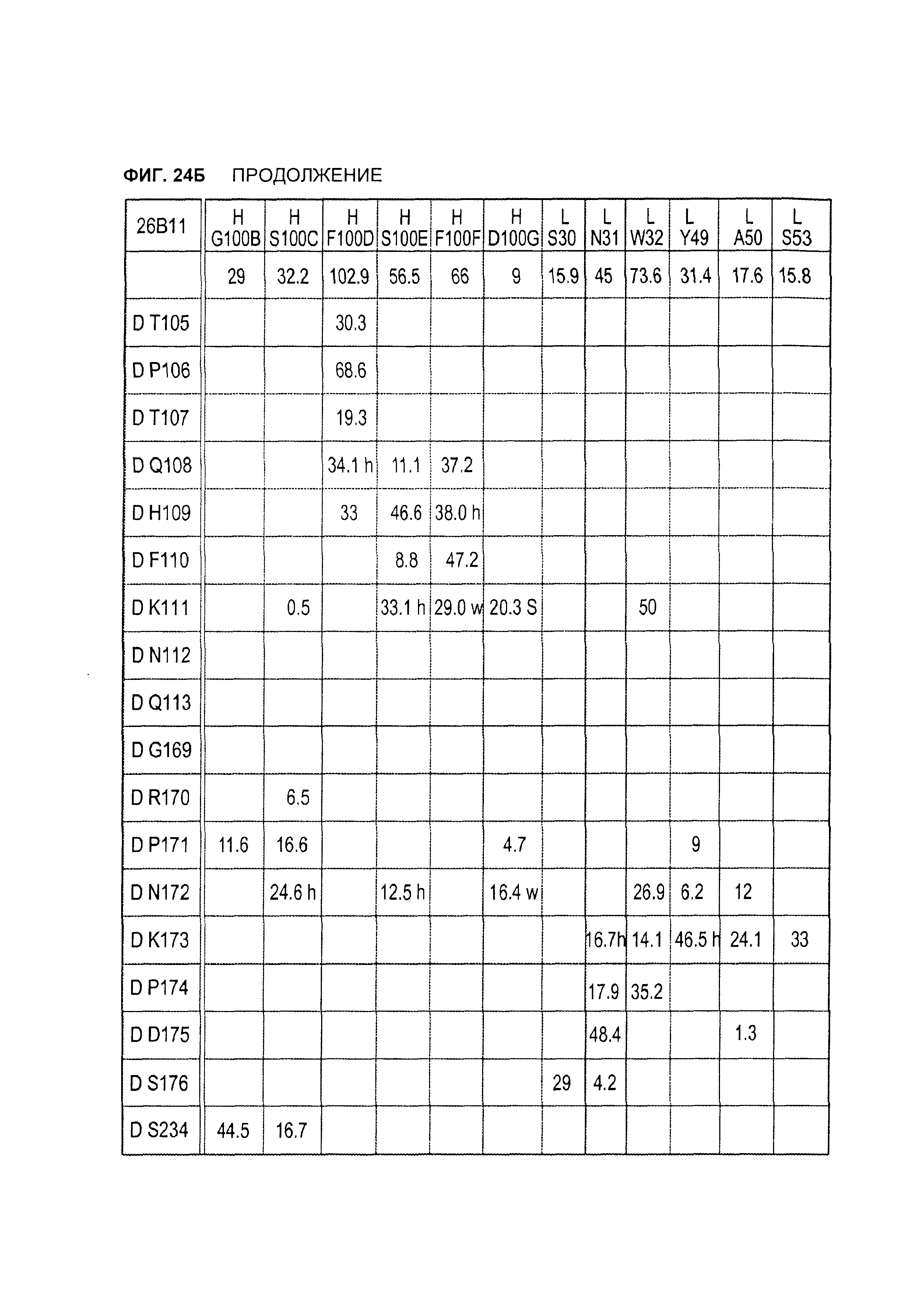
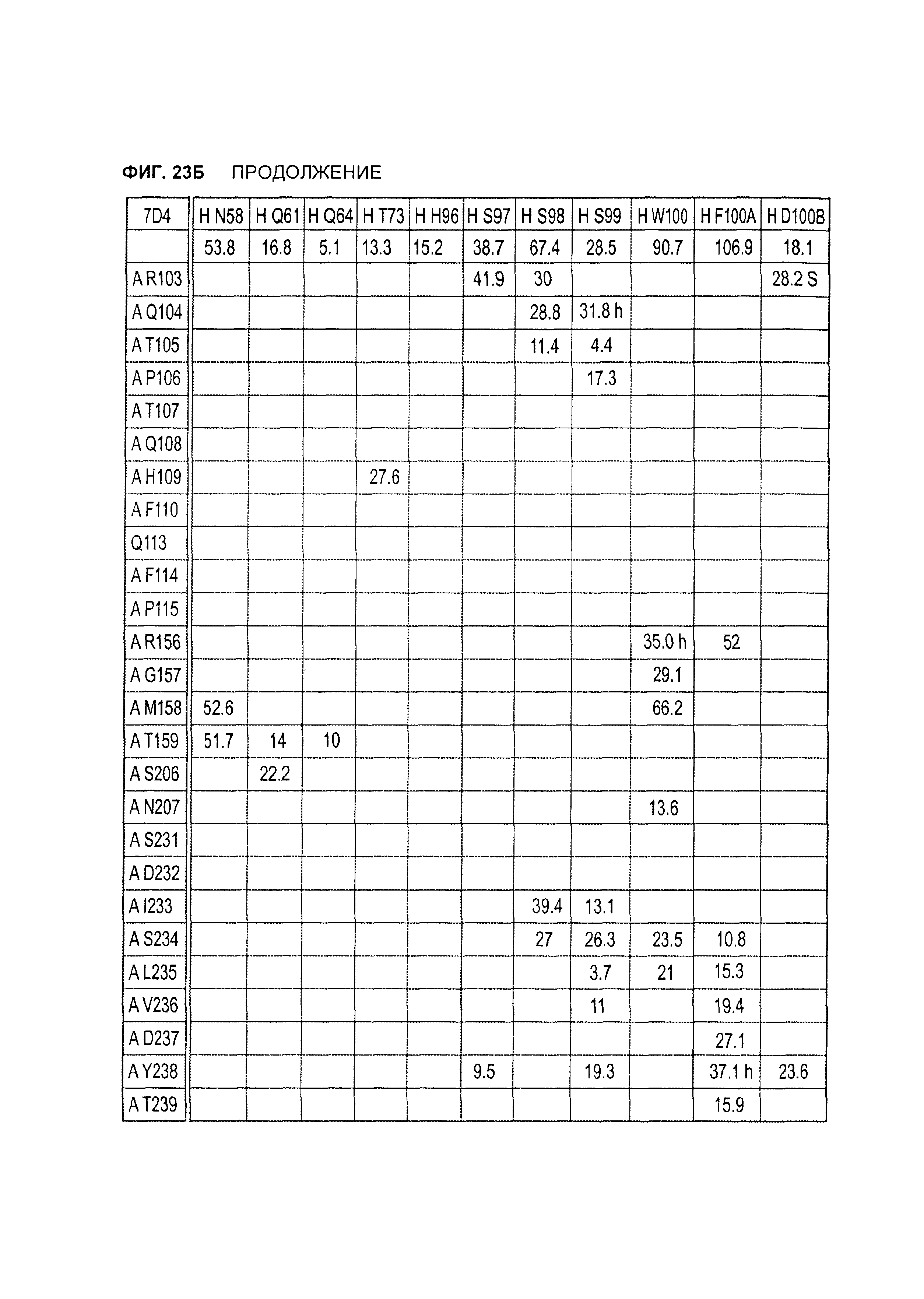
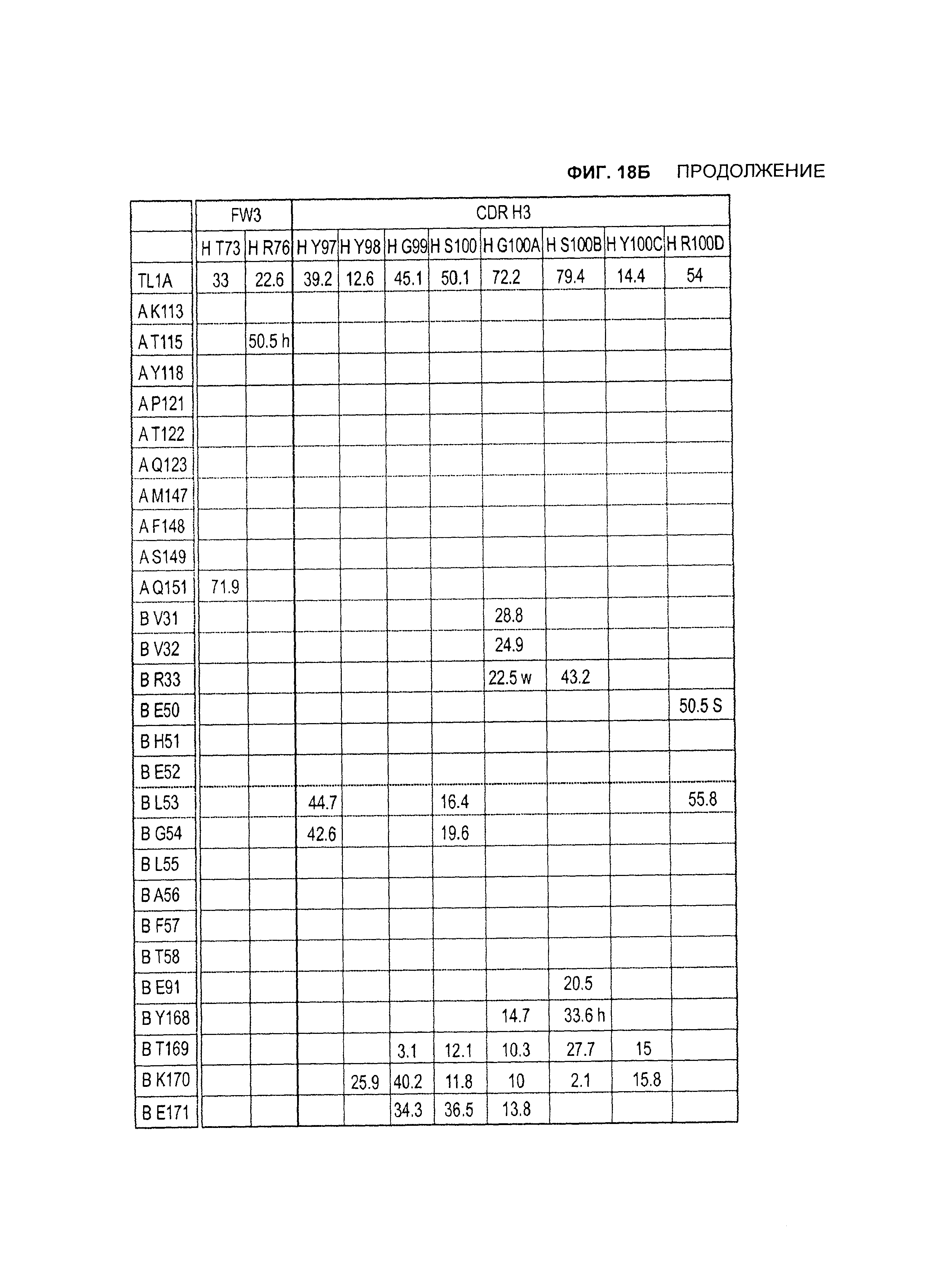
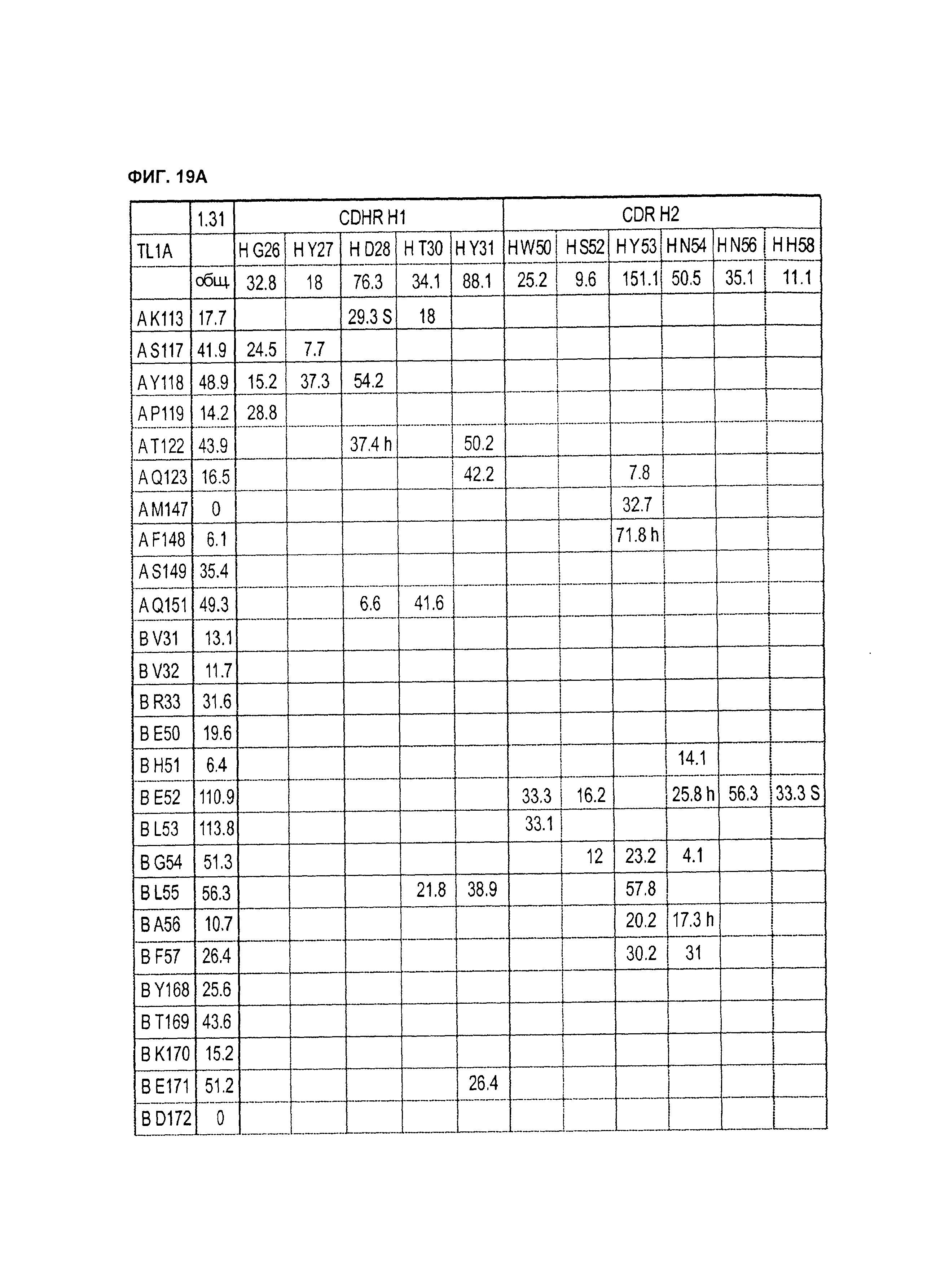
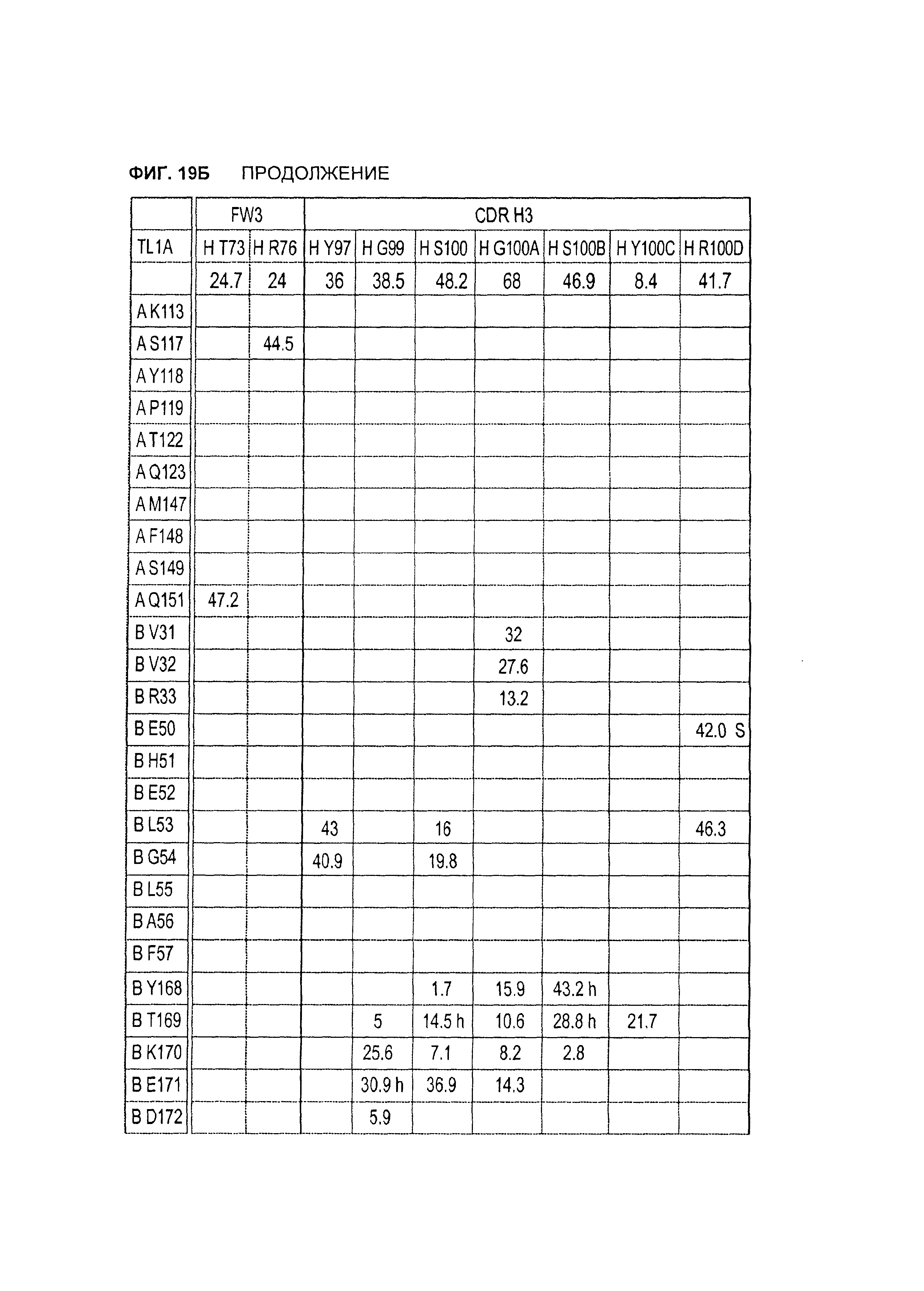
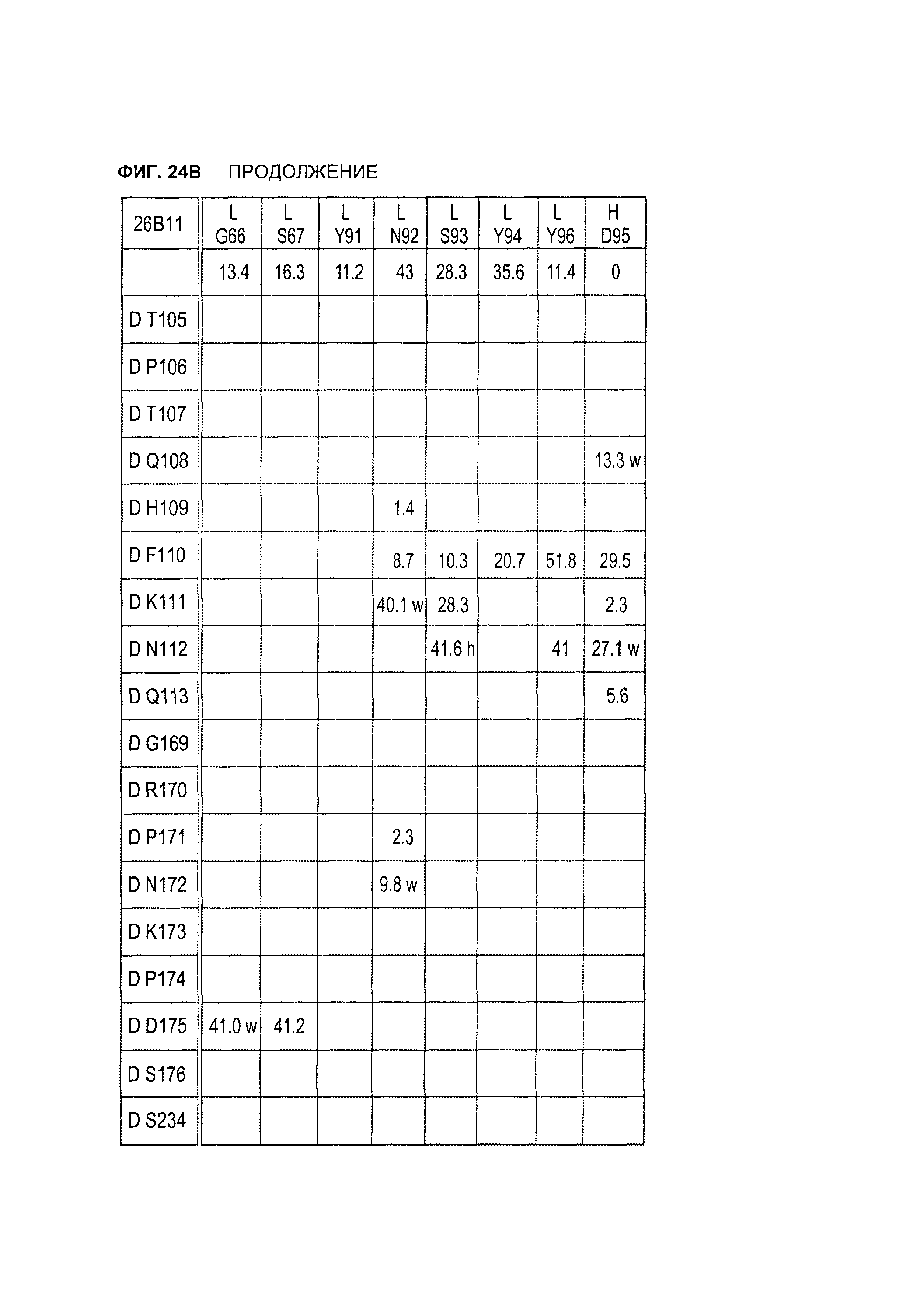
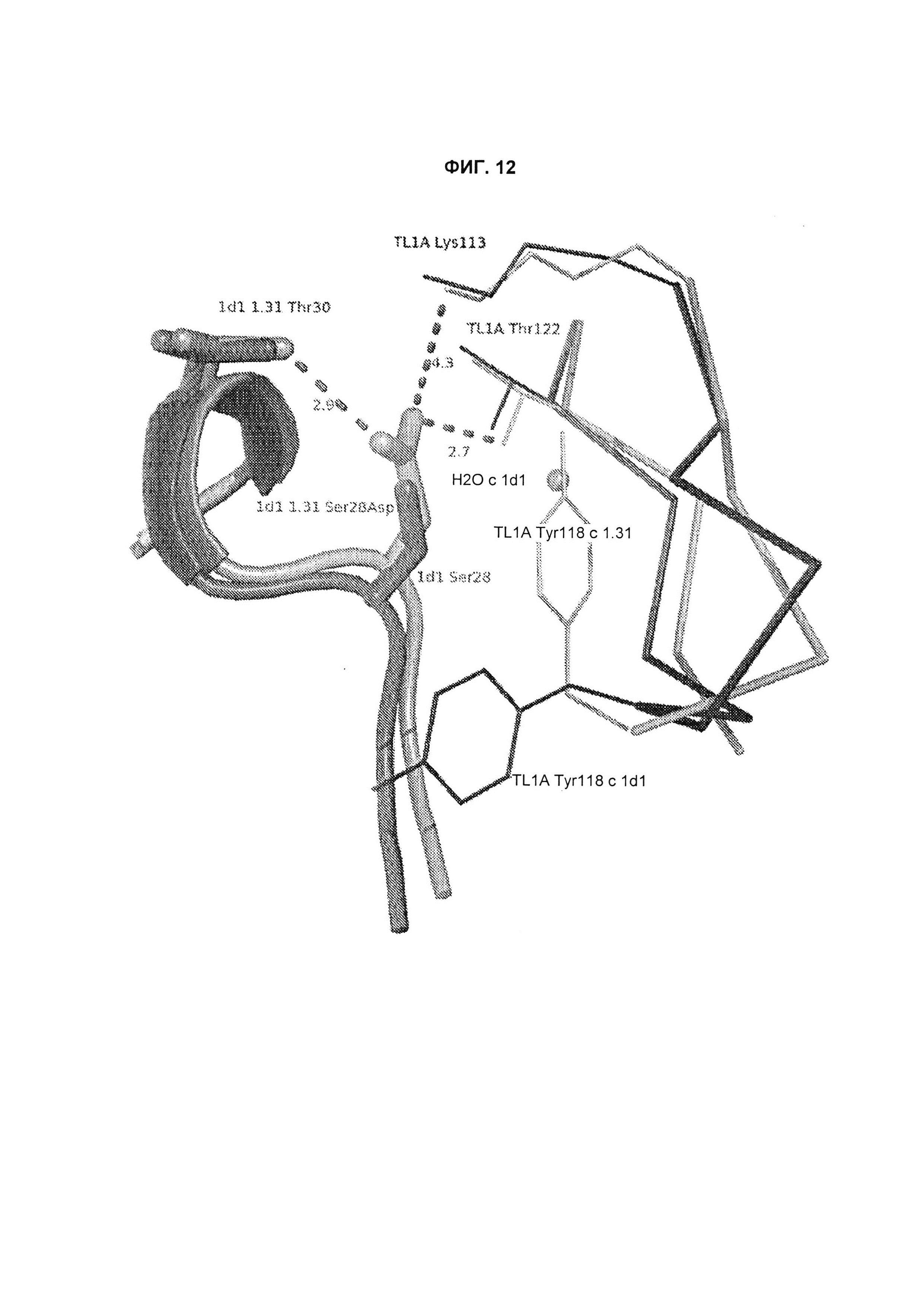
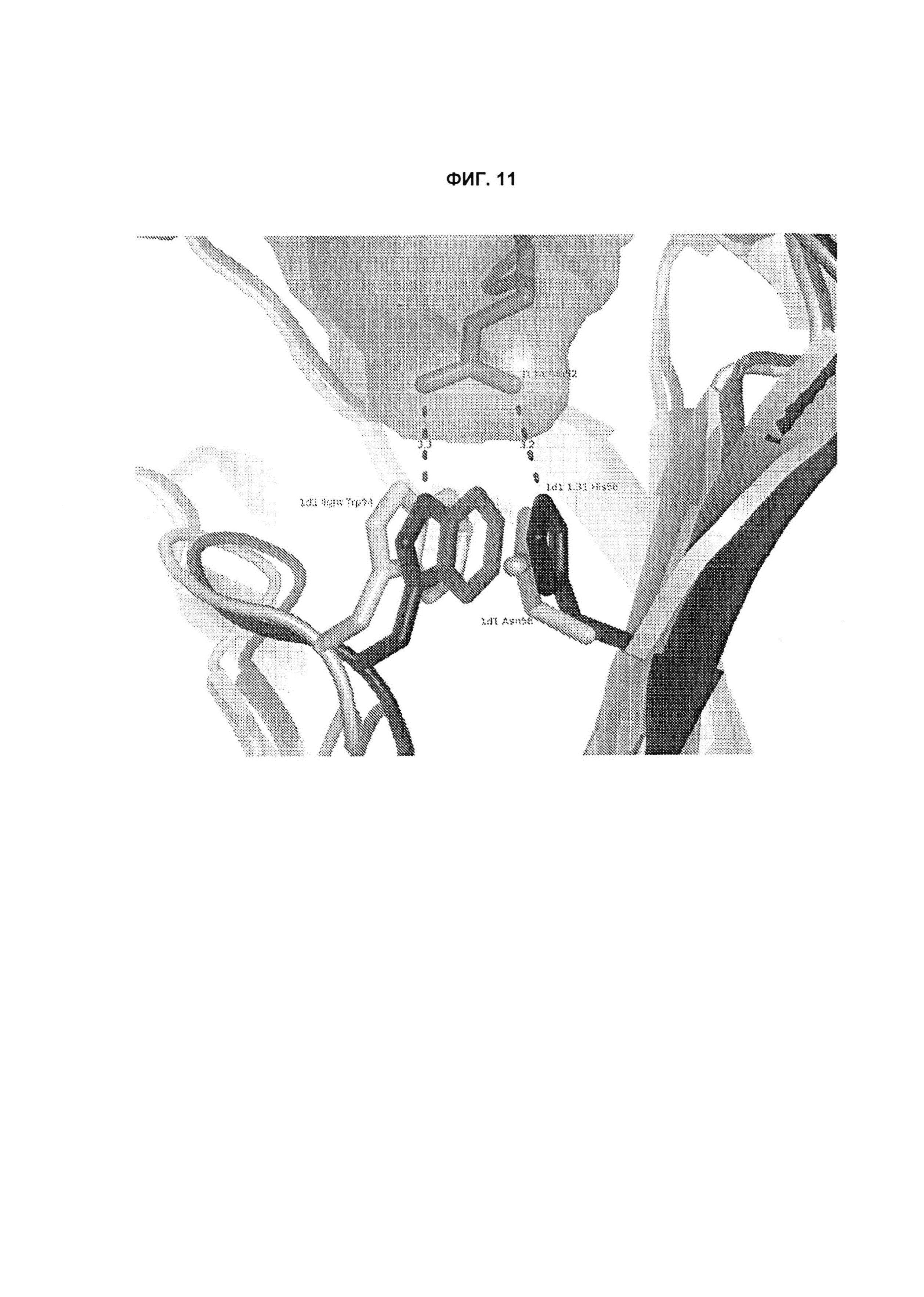
B105. Выделенное антитело или его антигенсвязывающий фрагмент, которое связывается с лигандом 1А, подобным фактору некроза опухолей (TL1A), где данное антитело связывается с эпитопом на TL1A, причем эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из T30, V31, V32, R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Q43, F44, Р45, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, R86, G87, М88, Т89, Е91, G99, R100, Р101, N102, К103, Р104, D105, S106, S136, N137, F139, S161, D162, 1163, S164, L165, V166, D167, Y168, Т169, К170, Е171, D172, N42, F44, К103, Р104, D105, S106, К113, Т115, S117, Y118, Р119, Е120, Р121, Т122, Q123, M147, F148, S149 и Q151 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B106. Антитело или его антигенсвязывающий фрагмент по В1-В105, где антитело связывается с гомомультимером TL1A, причем гомомультимер содержит по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из N42, F44, К103, Р104, D105, S106, К113, Т115, S117, Y118, Р119, Е120, Р121, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из T30, V31, V32, R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Q43, F44, Р45, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, R86, G87, М88, Т89, Е91, G99, R100, Р101, N102, К103, Р104, D105, S106, S136, N137, F139, S161, D162, 1163, S164, L165, V166, D167, Y168, Т169, К170, Е171 и D172, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B107. Антитело или его антигенсвязывающий фрагмент по В1-В106, где антитело связывается с эпитопом на TL1A, содержащим по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Т35, Р36, Т37, Q38, Н39, F40, Q43, Е50, Н51, Е52, L53, G54, L55, А56, F57, R86, G87, М88, S136, N137, S164, L165, Y168, Т169, К170, Е171, К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B108. Антитело или его антигенсвязывающий фрагмент по В1-В107, где антитело связывается с гомомультимером TL1A, и где данный гомомультимер содержит по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из K113, S117, Y118, Р119, Т122, Q123, M147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Т35, Р36, Т37, Q38, Н39, F40, Q43, Е50, Н51, Е52, L53, G54, L55, А56, F57, R86, G87, М88, S136, N137, S164, L165, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B109. Антитело или его антигенсвязывающий фрагмент по В1-В110, где антитело связывается с эпитопом на TL1A, содержащим по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, L53, G54, S164, Y168, Т169, К170, Е171, Y118 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B110. Антитело или его антигенсвязывающий фрагмент по В1-В109, где антитело связывается с гомомультимером TL1A, где данный гомомультимер содержит по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Y118 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, L53, G54, S164, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B111. Антитело или его антигенсвязывающий фрагмент по В1-В110, где антитело связывается с эпитопом на TL1A, содержащим по меньшей мере одну аминокислоту TL1A, выбранную из группы, состоящей из R33, Y168 и Т169, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B112. Антитело или его антигенсвязывающий фрагмент по В1-В111, которые в другом воплощении специфически связываются с TL1A, где антитело связывается с эпитопом на TL1A, содержащим по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170, Е171, К113, Y118, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B113. Антитело или его антигенсвязывающий фрагмент по В1-В112, где антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170, Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B114. Антитело или его антигенсвязывающий фрагмент по В1-В113, где связывание антитела с TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, 1163, S164, Y168, Т169, К170, Е171, N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B115. Антитело или его антигенсвязывающий фрагмент по В1-В114, которые связываются с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где связывание антитела с первым эпитопом на первом мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и связывание антитела со вторым эпитопом на втором мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, 1163, S164, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B116. Антитело или его антигенсвязывающий фрагмент по В1-В115, где связывание антитела с TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168, Е171, N42, К103, D105 и Y118, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B117. Антитело или его антигенсвязывающий фрагмент по В1-В116, где антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где связывание антитела с первым эпитопом на первом мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из N42, К103, D105 и Y118, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и связывание антитела со вторым эпитопом на втором мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B118. Антитело или его антигенсвязывающий фрагмент по В1-В117, где связывание антитела с TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Q38, F40, К41, L53, R86, М88 и Y118, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B119. Антитело или его антигенсвязывающий фрагмент по В1-В118, где антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где связывание антитела с первым эпитопом на первом мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и связывание антитела со вторым эпитопом на втором мономере TL1A вызывает не равное нулю изменение площади скрытой поверхности из-за взаимодействия антитела с аминокислотой TL1A, выбранной из группы, состоящей из R33, Q38, F40, К41, L53, R86 и М88, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
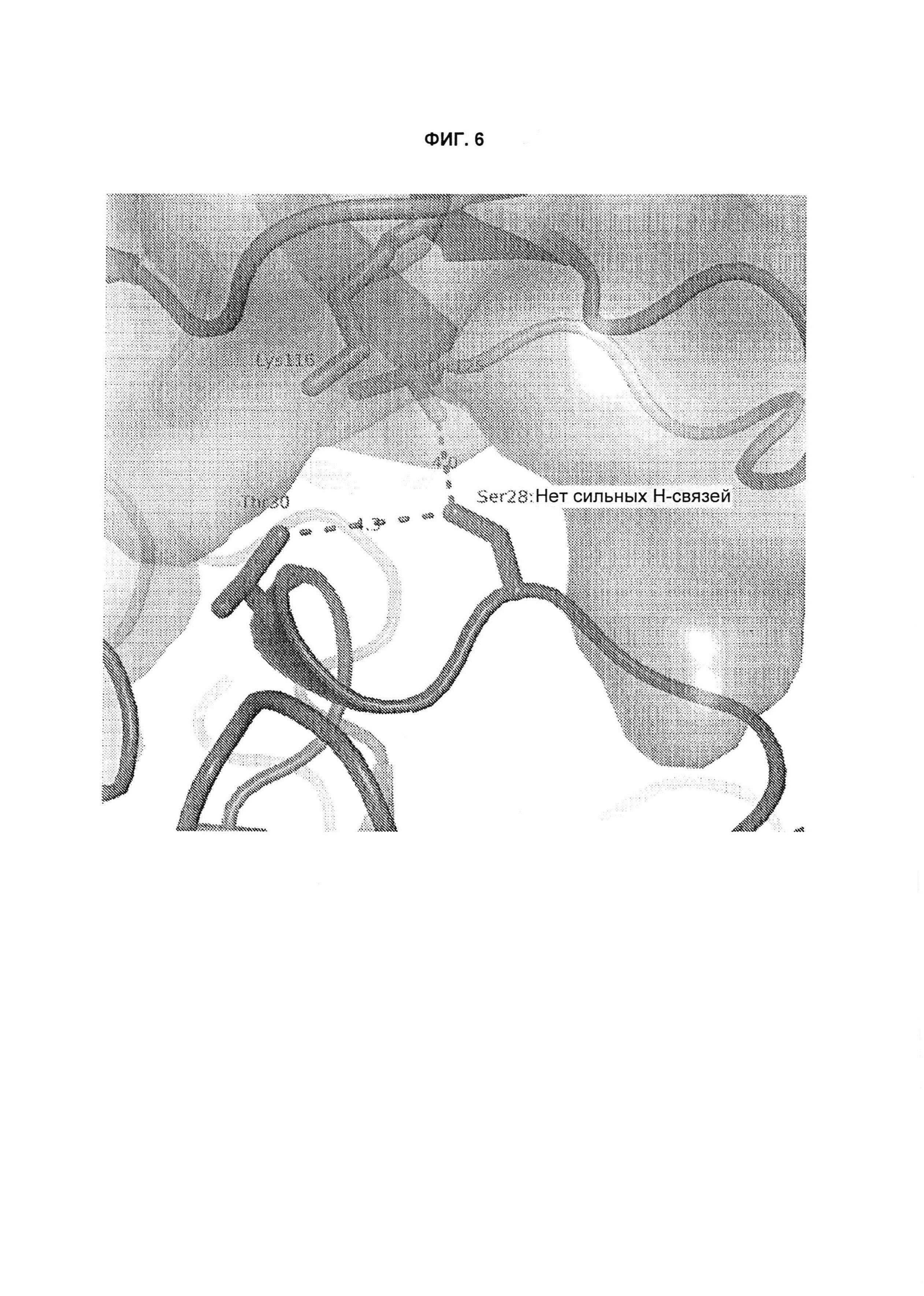
B120. Антитело или его антигенсвязывающий фрагмент по В1-В119, где один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним аминокислотным остатком в TL1A, выбранным из группы, состоящей из А56, D232, Е171, Е52, Н109, К111, К173, N112, N172, N207, Р106, Р171, Q104, Q108, R156, R33, S149, Т122, Т169, Y118, Y168 и Y238, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B121. Антитело или его антигенсвязывающий фрагмент по В1-В120, где один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним аминокислотным остатком в TL1A, выбранным из группы, состоящей из Q108, Н109, К111, N112, Р171, N172 и К173, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B122. Антитело или его антигенсвязывающий фрагмент по В1-В121, где один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним аминокислотным остатком в TL1A, выбранным из группы, состоящей из Q104, Р106, R156, N207, D232 и Y238, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B123. Антитело или его антигенсвязывающий фрагмент по В1-В122, где один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним аминокислотным остатком в TL1A, выбранным из группы, состоящей из Т122, S149, Е52, А56, Y168, Т169, и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B124. Антитело или его антигенсвязывающий фрагмент по В1-В123, где один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним аминокислотным остатком в TL1A, выбранным из группы, состоящей из Y118, S149, R33, Е52, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B125. Антитело или его антигенсвязывающий фрагмент по В1-В124, где один или более чем один аминокислотный остаток антитела участвует в солевом мостике с одним или более чем одним аминокислотным остатком TL1A, выбранным из группы, состоящей из R33, К41, Е50, Е52 и К113, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B126. Антитело или его антигенсвязывающий фрагмент по В1-В125, где описанное здесь антитело или антигенсвязывающий фрагмент связывается с TL1A и участвует в опосредованной водой водородной связи с одним или более чем одним остатком TL1A, который выбран из группы, состоящей из R33, Q38, К41, N42, L55, N102, D105 и М147, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
B127. Антитело или его антигенсвязывающий фрагмент по В1-В126, где описанное здесь антитело или антигенсвязывающий фрагмент связывается с TL1A, когда один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним остатком в TL1A, участвует в опосредованной водой водородной связи с одним или более чем одним остатком TL1A, участвует в солевом мостике с одним или более чем одним остатком TL1A, имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с TL1A, или когда тяжелый атом из одного или более чем одного остатка антитела находится в пределах расстояния  от тяжелого атома в TL1A.
от тяжелого атома в TL1A.
B128. Фармацевтическая композиция, содержащая антитело, его антигенсвязывающий фрагмент по любому из В1-В127 и дополнительно содержащая фармацевтически приемлемый носитель или эксципиент.
B129. Способ предупреждения, уменьшения интенсивности или лечения заболевания, расстройства или состояния, опосредованного TL1A, включающий введение субъекту, нуждающемуся в этом, эффективного количества антитела или его антигенсвязывающего фрагмента по любому из В1-В127, или фармацевтической композиции по В128.
B130. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или фармацевтическая композиция по В128 для применения в предупреждении, уменьшении интенсивности или лечении заболевания, расстройства или состояния, опосредованного TL1A.
B131. Применение антитела или его антигенсвязывающего фрагмента по любому из В1-В127 в изготовлении лекарственного средства для предупреждения, уменьшения интенсивности или лечения заболевания, расстройства или состояния, опосредованного TL1A.
B132. Применение по В131, где заболевание, расстройство или состояние выбрано из группы, состоящей из следующих: воспалительное заболевание кишечника (IBD), болезнь Крона, язвенный колит, астма, аллергии, сахарный диабет, артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориатический артрит, анкилозирующий спондилоартрит, рассеянный склероз, отторжение трансплантата, заболевание «трансплантат против хозяина» (GVHD), спондилоартропатия, первичный склерозирующий холангит, первичный билиарный цирроз, атеросклероз, синдром мочевого пузыря/интерстициальный цистит, дисфункция мочевого пузыря, сепсис, увеит, энцефаломиелит, тяжелая миастения, системная красная волчанка, кожная красная волчанка, аутоиммунный тиреоидит, атопический дерматит, экзематический дерматит, псориаз, синдром Шегрена, склеродермия и васкулит.
B133. Способ выявления TL1A в образце, ткани или клетке, включающий предоставление образца, ткани или клетки и приведение в контакт с антителом или его антигенсвязывающим фрагментом по В1-В127 и выявление указанного антитела.
B134. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент, которые специфически связываются с TL1A по В1-В127.
B135. Выделенная нуклеиновая кислота по В134, где нуклеиновая кислота выбрана из группы, состоящей из следующих:
а. последовательность нуклеиновой кислоты SEQ ID NO: 103;
б. последовательность нуклеиновой кислоты SEQ ID NO: 105;
в. последовательность нуклеиновой кислоты SEQ ID NO: 107;
г. последовательность нуклеиновой кислоты SEQ ID NO: 109;
д. последовательность нуклеиновой кислоты SEQ ID NO: 103 и 105;
е. последовательность нуклеиновой кислоты SEQ ID NO: 107 и 109;
ж. последовательность нуклеиновой кислоты вставки вектора, депонированного как 1D1 1.31 VH, имеющего регистрационный номер ATCC (Американская коллекция типовых культур) PTA-120639;
з. последовательность нуклеиновой кислоты вставки вектора, депонированная как 1D1 1.31 VL, имеющего регистрационный номер ATCC PTA-120640;
и. последовательность нуклеиновой кислоты вставки вектора, депонированного как 1D1 1.31 VH, имеющего регистрационный номер ATCC PTA-120639, и последовательность нуклеиновой кислоты вставки вектора, депонированная как 1D1 1.31 VL, имеющего регистрационный номер ATCC PTA-120640;
й. последовательность нуклеиновой кислоты SEQ ID NO: 227;
к. последовательность нуклеиновой кислоты SEQ ID NO: 229;
л. последовательность нуклеиновой кислоты SEQ ID NO: 227 и 103;
м. последовательность нуклеиновой кислоты SEQ ID NO: 229 и 107;
н. последовательность нуклеиновой кислоты SEQ ID NO: 199;
о. последовательность нуклеиновой кислоты SEQ ID NO: 201;
п. последовательность нуклеиновой кислоты SEQ ID NO: 199 и 103;
р. последовательность нуклеиновой кислоты SEQ ID NO: 201 и 107;
с. последовательность нуклеиновой кислоты SEQ ID NO: 206;
т. последовательность нуклеиновой кислоты SEQ ID NO: 208;
у. последовательность нуклеиновой кислоты SEQ ID NO: 206 и 103;
ф. последовательность нуклеиновой кислоты SEQ ID NO: 208 и 107;
х. последовательность нуклеиновой кислоты SEQ ID NO: 213;
ц. последовательность нуклеиновой кислоты SEQ ID NO: 215;
ч. последовательность нуклеиновой кислоты SEQ ID NO: 213 и 103;
ш. последовательность нуклеиновой кислоты SEQ ID NO: 215 и 107;
щ. последовательность нуклеиновой кислоты SEQ ID NO: 220;
аа. последовательность нуклеиновой кислоты SEQ ID NO: 222;
бб. последовательность нуклеиновой кислоты SEQ ID NO: 220 и 103;
вв. последовательность нуклеиновой кислоты SEQ ID NO: 222 и 107;
гг. последовательность нуклеиновой кислоты SEQ ID NO: 234;
дд. последовательность нуклеиновой кислоты SEQ ID NO: 236;
ее. последовательность нуклеиновой кислоты SEQ ID NO: 234 и 103;
жж. последовательность нуклеиновой кислоты SEQ ID NO: 236 и 107;
зз. последовательность нуклеиновой кислоты SEQ ID NO: 241;
ии. последовательность нуклеиновой кислоты SEQ ID NO: 243;
йй. последовательность нуклеиновой кислоты SEQ ID NO: 241 и 103;
кк. последовательность нуклеиновой кислоты SEQ ID NO: 243 и 107;
лл. последовательность нуклеиновой кислоты SEQ ID NO: 248;
мм. последовательность нуклеиновой кислоты SEQ ID NO: 250;
нн. последовательность нуклеиновой кислоты SEQ ID NO: 248 и 103;
оо. последовательность нуклеиновой кислоты SEQ ID NO: 250 и 107;
пп. последовательность нуклеиновой кислоты SEQ ID NO: 65;
pp. последовательность нуклеиновой кислоты SEQ ID NO: 67;
сс. последовательность нуклеиновой кислоты SEQ ID NO: 69;
тт. последовательность нуклеиновой кислоты SEQ ID NO: 71;
уу. последовательность нуклеиновой кислоты SEQ ID NO: 73;
фф. последовательность нуклеиновой кислоты SEQ ID NO: 75;
хх. последовательность нуклеиновой кислоты SEQ ID NO: 67 и 65;
цц. последовательность нуклеиновой кислоты SEQ ID NO: 69 и 65;
чч. последовательность нуклеиновой кислоты SEQ ID NO: 71 и 65;
шш. последовательность нуклеиновой кислоты SEQ ID NO: 73 и 75;
щщ. последовательность нуклеиновой кислоты SEQ ID NO: 2;
ааа. последовательность нуклеиновой кислоты SEQ ID NO: 4;
ббб. последовательность нуклеиновой кислоты SEQ ID NO: 6;
ввв. последовательность нуклеиновой кислоты SEQ ID NO: 8;
ггг. последовательность нуклеиновой кислоты SEQ ID NO: 10;
ддд. последовательность нуклеиновой кислоты SEQ ID NO: 12;
еее. последовательность нуклеиновой кислоты SEQ ID NO: 4 и 2;
жжж. последовательность нуклеиновой кислоты SEQ ID NO: 6 и 2;
ззз. последовательность нуклеиновой кислоты SEQ ID NO: 10 и 8;
иии. последовательность нуклеиновой кислоты SEQ ID NO: 12 и 8;
ййй. нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 102; и
ккк. нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 226.
В136. Вектор, содержащий нуклеиновую кислоту по В134 или В135.
B137. Клетка-хозяин, содержащая вектор по В136.
B138. Клетка-хозяин по В137, выбранная из группы, состоящей из бактериальной клетки, клетки гриба, клетки насекомого, клетки птицы, растительной клетки или клетки млекопитающего.
B139. Способ получения антитела или его антигенсвязывающего фрагмента, которые специфически связываются с TL1A, включающий культивирование клетки-хозяина по В137 или В138 и выращивание клеток при условиях, когда экспрессируется антитело, и дополнительно включающий выделение антитела.
B140. Выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с лигандом 1А, подобным фактору некроза опухоли (TL1A), и содержит:
а) вариабельную область тяжелой цепи (VH), содержащую:
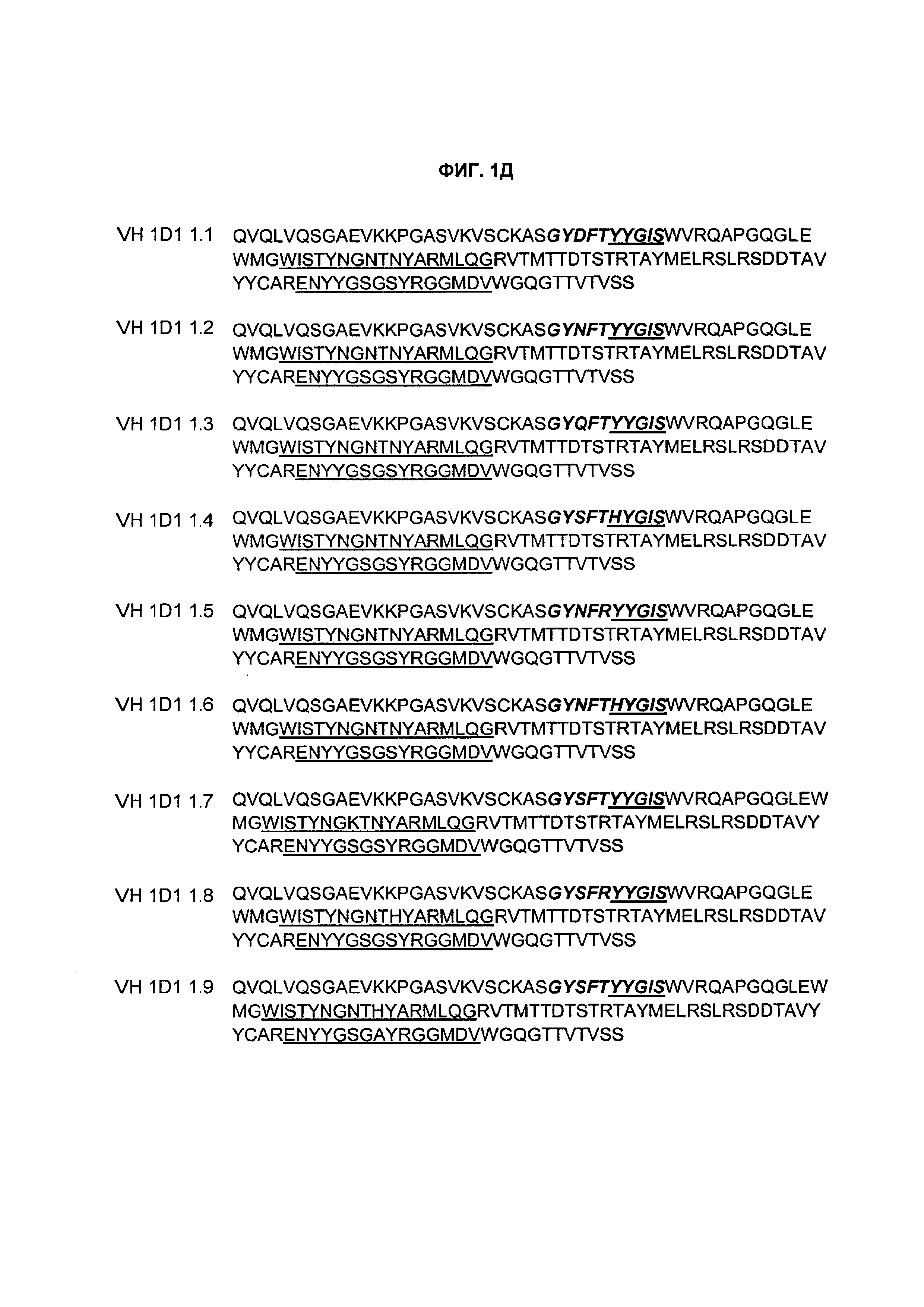
1) гипервариабельную область один VH (CDR-H1), содержащую аминокислотную последовательность GYX1FX2X3YGIS, где X1 представляет собой S, D, Q, N или P; X2 представляет собой T или R; и X3 представляет собой Y или Н (SEQ ID NO: 384);
2) CDR-H2, содержащую аминокислотную последовательность WISX4YNGX5X6X7YAX8MX9QG, где X4 представляет собой T, P, S или A; X5 представляет собой K, A, G, N или V; X6 представляет собой T или K; X7 представляет собой N или Н; X8 представляет собой R или Q; и X9 представляет собой L или Н (SEQ ID NO: 385); и
3) CDR-H3, содержащую аминокислотную последовательность ENYYGSGX9X10RGGMDX11, где X9 представляет собой S или A; X10 представляет собой Y или F; и X11 представляет собой V, G или A (SEQ ID NO: 382);
б) VH, содержащую:
1) CDR-H1, содержащую аминокислотную последовательность GYX1FX2X3YGIS, где X1 представляет собой S, D, Q, N или P; X2 представляет собой T или R; и X3 представляет собой Y или Н (SEQ ID NO: 384);
2) CDR-H2, содержащую аминокислотную последовательность WISX4YNGX5X6X7YAX8MX9QG, где X4 представляет собой Т, Р, S или A; X5 представляет собой K, A, G, N или V; X6 представляет собой T или K; X7 представляет собой N или Н; X8 представляет собой R или Q; и X9 представляет собой L или Н (SEQ ID NO: 385);
3) CDR-H3, содержащую аминокислотную последовательность ENYYGSGX9X10RGGMDX11, где X9 представляет собой S или A; X10 представляет собой Y или F; и X11 представляет собой V, G или A (SEQ ID NO: 382); и
вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 102;
в) VH, содержащую:
1) CDR-H1, содержащую аминокислотную последовательность GYX1FX2X3YGIS, где X1 представляет собой S, D, Q, N или Р; X2 представляет собой T или R; и X3 представляет собой Y или Н (SEQ ID NO: 384);
2) CDR-H2, содержащую аминокислотную последовательность WISX4YNGX5X6X7YAX8MX9QG, где X4 представляет собой T, P, S или A; X5 представляет собой K, A, G, N или V; X6 представляет собой T или K; X7 представляет собой N или Н; X8 представляет собой R или Q; и X9 представляет собой L или Н (SEQ ID NO: 385);
3) CDR-H3, содержащую аминокислотную последовательность ENYYGSGX9X10RGGMDX11, где X9 представляет собой S или A; X10 представляет собой Y или F; и X11 представляет собой V, G или A (SEQ ID NO: 382);
4) Т или R в положении Н76, как определено при нумерации VH по Kabat;
5) D или E в положении Н81, как определено при нумерации VH по Kabat; и
VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112;
г) VH, содержащую:
1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 202;
2) CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 203, 210, 217, 224, 231, 238, 245 или 252;
3) CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 204, 211, 218, 225, 232, 239, 246 или 253; и
VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112;
д) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 113, аминокислотную последовательность CDR-H2 SEQ NO: 114, аминокислотную последовательность CDR-H3 SEQ ID NO: 115, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
е) VH, содержащую аминокислотную последовательность CDR-H1, CDR-Н2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 104, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VLSEQ ID NO: 102;
ж) VH, содержащую аминокислотную последовательность SEQ ID NO: 104, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
з) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 108, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
и) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 105, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
й) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 105, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
к) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 109, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
л) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 230, аминокислотную последовательность CDR-H2 SEQ NO: 231, аминокислотную последовательность CDR-H3 SEQ ID NO: 232, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
м) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 226, и VL, содержащую CDR-L1, CDR-L2, и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
н) VH, содержащую аминокислотную последовательность SEQ ID NO: 226, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
о) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 228, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
п) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 227, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
р) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 227, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
с) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 229, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
т) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 202, аминокислотную последовательность CDR-H2 SEQ NO: 203, аминокислотную последовательность CDR-H3 SEQ ID NO: 204 и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
у) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 198, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
ф) VH, содержащую аминокислотную последовательность SEQ ID NO: 198, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
х) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 200, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
ц) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 199, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ч) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 199, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ш) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 201, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
щ) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 209, аминокислотную последовательность CDR-H2 SEQ NO: 210, аминокислотную последовательность CDR-H3 SEQ ID NO: 211, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
аа) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 205, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
бб) VH, содержащую аминокислотную последовательность SEQ ID NO: 205, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
вв) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 207, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
гг) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 206, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
дд) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 206, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ее) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 208, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
жж) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 216, аминокислотную последовательность CDR-H2 SEQ NO: 217, аминокислотную последовательность CDR-H3 SEQ ID NO: 218, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
зз) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 212, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
ии) VH, содержащую аминокислотную последовательность SEQ ID NO: 212, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
йй) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 214, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
кк) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 213, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
лл) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 213, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
мм) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 215, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
нн) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 223, аминокислотную последовательность CDR-H2 SEQ NO: 224, аминокислотную последовательность CDR-H3 SEQ ID NO: 225, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
оо) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 219, и VL, содержащую CDR-L1, CDR-L2, и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
пп) VH, содержащую аминокислотную последовательность SEQ ID NO: 219, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
рр) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 221, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
сс) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 220, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
тт) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 220, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
уу) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 222, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
фф) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 237, аминокислотную последовательность CDR-H2 SEQ ID NO: 238, аминокислотную последовательность CDR-H3 SEQ ID NO: 239, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
хх) VH, содержащую аминокислотную последовательность CDR-H1, CDR-Н2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 233, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
цц) VH, содержащую аминокислотную последовательность SEQ ID NO: 233, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
чч) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 235, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
шш) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 234, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
щщ) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 234, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ааа) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 236, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
ббб) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 244, аминокислотную последовательность CDR-H2 SEQ NO: 245, аминокислотную последовательность CDR-H3 SEQ ID NO: 246, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
ввв) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 240, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
ггг) VH, содержащую аминокислотную последовательность SEQ ID NO: 240, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
ддд) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 242, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
eee) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 241, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
жжж) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 241, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ззз) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 243, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
иии) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 251, аминокислотную последовательность CDR-H2 SEQ NO: 252, аминокислотную последовательность CDR-H3 SEQ ID NO: 253, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
ййй) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 247, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 102;
ккк) VH, содержащую аминокислотную последовательность SEQ ID NO: 247, и VL, содержащую аминокислотную последовательность SEQ ID NO: 102;
ллл) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 249, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 106;
ммм) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 248, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ннн) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 248, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 103;
ooo) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 250, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 107;
ппп) VH, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VH, имеющей регистрационный номер ATCC PTA-120639, и VL, кодируемую последовательностью нуклеиновой кислоты вставки вектора, депонированной как 1D1 1.31 VL, имеющей регистрационный номер ATCC PTA-120640;
ррр) VL, кодируемую нуклеиновой кислотой, кодирующей аминокислотную последовательность SEQ ID NO: 102; и
ссс) VH, кодируемую нуклеиновой кислотой, кодирующей аминокислотную последовательность SEQ ID NO: 226.
В141. Выделенное антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140, где данное антитело содержит:
a) VH, содержащую:
1) CDR-H1, содержащую аминокислотную последовательность GYTFTSYX1X2X3, где X1 представляет собой G или A; X2 представляет собой I или M; и X3 представляет собой N или Н (SEQ ID NO: 386);
2) CDR-H2, содержащую аминокислотную последовательность WIX4X5X6NGNTX7X8X9QKX10QG, где X4 представляет собой S или N; X5 представляет собой T или A; X6 представляет собой Y или G; X7 представляет собой N или K; X8 представляет собой S или Y; и X9 представляет собой A или S; X10 представляет собой L или F (SEQ ID NO: 387);
3) CDR-H3, содержащую аминокислотную последовательность X11X12SSX13WFDAFDI, где X11 представляет собой A или G; X12 представляет собой H или Y; и X13 представляет собой S или A (SEQ ID NO: 388);
4) D или E в положении Н85 при определении посредством нумерации VH по Kabat; и
VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 96, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 97, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 98;
б) VH, содержащую SEQ ID NO: 52 или SEQ ID NO: 90, и VL, содержащую SEQ ID NO: 50;
в) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 99, аминокислотную последовательность CDR-H2 SEQ NO: 100, аминокислотную последовательность CDR-H3 SEQ ID NO: 101, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 96, аминокислотную последовательность CDR-L2 SEQ ID NO: 97 и аминокислотную последовательность CDR-L3 SEQ ID NO: 98;
г) VH, содержащую аминокислотную последовательность CDR-H1, CDR-Н2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 90, и VL, содержащую аминокислотную последовательность CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 88;
д) VH, содержащую аминокислотную последовательность SEQ ID NO: 90, и VL, содержащую аминокислотную последовательность SEQ ID NO: 88;
е) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 94, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 92;
ж) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемые последовательностью нуклеиновой кислоты SEQ ID NO: 91, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемые последовательностью нуклеиновой кислоты SEQ ID NO: 89;
з) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 91, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 89;
и) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 95, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 93;
й) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 61, аминокислотную последовательность CDR-H2 SEQ NO: 62, аминокислотную последовательность CDR-H3 SEQ ID NO: 63, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 58, аминокислотную последовательность CDR-L2 SEQ ID NO: 59 и аминокислотную последовательность CDR-L3 SEQ ID NO: 60;
к) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 52, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 50;
л) VH, содержащую аминокислотную последовательность SEQ ID NO: 52, и VL, содержащую аминокислотную последовательность SEQ ID NO: 50;
м) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 54;
н) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 53, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 51;
о) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 53, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 51; или
п) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 57, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 55.
В142. Выделенное антитело или его антигенсвязывающий фрагмент по любому из В1-В127, В140 или В141, содержащее:
a) VH, содержащую:
1) CDR-H1, содержащую аминокислотную последовательность GFTFSX1X2AX3H, где X1 представляет собой N или S; X2 представляет собой Y или F; и X3 представляет собой L, М или I (SEQ ID NO: 389);
2) CDR-H2, содержащую аминокислотную последовательность LIX4X5DGSX6X7YYADSVKG, где X4 представляет собой S или P; X5 представляет собой Y или F; X6 представляет собой D, S или N; X7 представляет собой K или N (SEQ ID NO: 390);
3) CDR-H3, содержащую аминокислотную последовательность DRX8YX9X10X11X12SX13SX14DAFDI, где X8 представляет собой E или N; X9 представляет собой C или Y; X10 представляет собой T или G; X11 представляет собой Y или S; X12 представляет собой S или G; X13 представляет собой C или F; X14 представляет собой Y или F (SEQ ID NO: 391);
4) A или T в положении Н85 при определении посредством нумерации VH по Kabat;
5) M или L в положении 108 при определении посредством нумерации VH по Kabat; и
VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 76, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 77, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 78; и F или Y в положении L83, при определении посредством нумерации VL по Kabat.
б) VH, содержащую SEQ ID NO: 66, 68 или 70, и VL, содержащую SEQ ID NO: 1 или 64;
в) VH, содержащую
1) аминокислотную последовательность CDR-H1 SEQ ID NO:79, аминокислотную последовательность CDR-H2 SEQ NO: 80 и аминокислотную последовательность CDR-H3 SEQ ID NO: 81;
2) аминокислотную последовательность CDR-H1 SEQ ID NO: 82, аминокислотную последовательность CDR-H2 SEQ ID NO: 83, и аминокислотную последовательность CDR-H3 SEQ ID NO: 84; или
3) аминокислотную последовательность CDR-H1 SEQ ID NO: 85, аминокислотную последовательность CDR-H2 SEQ ID NO: 86 и аминокислотную последовательность CDR-H3 SEQ ID NO: 87; и
VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 76, аминокислотную последовательность CDR-L2 SEQ ID NO: 77 и аминокислотную последовательность CDR-L3 SEQ ID NO: 78;
г) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 66, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 64;
д) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 68, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 64;
е) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 70, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 64;
ж) VH, содержащую аминокислотную последовательность SEQ ID NO: 66, и VL, содержащую аминокислотную последовательность SEQ ID NO: 64;
з) VH, содержащую аминокислотную последовательность SEQ ID NO: 68, и VL, содержащую аминокислотную последовательность SEQ ID NO: 64;
и) VH, содержащую аминокислотную последовательность SEQ ID NO: 70, и VL, содержащую аминокислотную последовательность SEQ ID NO:64;
й) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 74, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 72;
к) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 67, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
л) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 69, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
м) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 71, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
н) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 67, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
о) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 69, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
п) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 71, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 65;
р) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 75, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 73;
с) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 16, аминокислотную последовательность CDR-H2 SEQ ID NO: 17, аминокислотную последовательность CDR-H3 SEQ ID NO: 18, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 13, аминокислотную последовательность CDR-L2 SEQ ID NO: 14 и аминокислотную последовательность CDR-L3 SEQ ID NO: 15;
т) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 19, аминокислотную последовательность CDR-H2 SEQ ID NO: 20, аминокислотную последовательность CDR-H3 SEQ ID NO:21, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 13, аминокислотную последовательность CDR-L2 SEQ ID NO: 14 и аминокислотную последовательность CDR-L3 SEQ ID NO: 15;
у) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 3, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 1;
ф) VH, содержащую CDR-H1, CDR-H2 и CDR-H3 аминокислотной последовательности VH SEQ ID NO: 5, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3 аминокислотной последовательности VL SEQ ID NO: 1;
х) VH, содержащую аминокислотную последовательность SEQ ID NO: 3, и VL, содержащую аминокислотную последовательность SEQ ID NO: 1;
ц) VH, содержащую аминокислотную последовательность SEQ ID NO: 5, и VL, содержащую аминокислотную последовательность SEQ ID NO: 1;
ч) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 7;
ш) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, и легкую цепь (LC), содержащую аминокислотную последовательность SEQ ID NO: 7;
щ) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 4, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 2;
аа) VH, содержащую CDR-H1, CDR-H2 и CDR-H3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 6, и VL, содержащую CDR-L1, CDR-L2 и CDR-L3, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 2;
бб) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 4, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 2;
вв) VH, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 6, и VL, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 2;
гг) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 10, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 8; или
дд) тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 12, и легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 8.
B143. Выделенное антитело или его антигенсвязывающий фрагмент, которое содержит последовательность VH, по меньшей мере на 84% идентичную последовательности VH SEQ ID NO: 90.
B144. Антитело или его антигенсвязывающий фрагмент по В143, дополнительно содержащее последовательность VL, которая по меньшей мере на 95% идентична VL SEQ ID NO: 88.
B145. Выделенное антитело или его антигенсвязывающий фрагмент, которое содержит последовательность VH, по меньшей мере на 87% идентичную последовательности VH SEQ ID NO: 68.
B146. Выделенное антитело или его антигенсвязывающий фрагмент, которое содержит последовательность VL, по меньшей мере на 98% идентичную последовательности VL SEQ ID NO: 64.
B147. Выделенное антитело или его антигенсвязывающий фрагмент, которое связывается с TL1A, где данное антитело конкурирует за связывание с TL1A с антителом или его антигенсвязывающим фрагментом по любому из В1-В120 или В133-В139.
B148. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В147, имеющее паратоп, который содержит:
а) один или более чем один остаток вариабельного домена тяжелой цепи, выбранный из Gly26, Tyr27, Ser28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, Asn58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B и Arg100D, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104, и один или более чем один остаток вариабельного домена легкой цепи, выбранный из Tyr32 и Trp94, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 102; или
б) один или более чем один остаток вариабельного домена тяжелой цепи Gly26, Asp28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, His58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B, Arg100D, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104, один или более чем один остаток вариабельного домена легкой цепи Tyr32 и Trp94 на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 102.
B149. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В148, где антитело связывается с человеческим TL1A с KD, варьирующей от 4 нМ до 1 пМ.
B150. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В149, где антитело или антигенсвязывающий фрагмент связывается с человеческим TL1A с KD, меньшей чем 2 нМ.
B151. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В150, где антитело связывается с человеческим TL1A с KD, меньшей чем 1 нМ.
B152. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В151, где:
а) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Т115, S117, Y118, Р119, Р121, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
б) антитело связывается с гомомультимером TL1A, причем гомомультимер содержит по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Т115, S117, Y118, Р119, Р121, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
в) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170, и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
г) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
д) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, М147, S149, Q151, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
е) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, М147, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ж) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, М147, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
з) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, М147, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
и) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, М147, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
й) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, М147, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
к) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, S149, R33, Е50, Е52, L53, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
л) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L53, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
м) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из остатков 117-123 SEQ ID NO: 254 и остатков 50-58 SEQ ID NO: 254;
н) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, причем первый эпитоп содержит по меньшей мере одну аминокислоту из остатков 117-123 SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере, причем второй эпитоп содержит по меньшей мере одну аминокислоту из остатков 50-58 SEQ ID NO: 254;
о) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, S149, Е50, Е52, L53, А56, Y168, Т169 и Е171 SEQ ID NO: 254;
п) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, причем первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере, причем второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Е50, Е52, L53, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
р) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, S149, Е50, Е52, А56 и Y168 SEQ ID NO: 254;
с) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, причем первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере, причем второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Е50, Е52, А56 и Y168, согласно номеру SEQ ID NO: 254;
т) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Т115, Y118, Р121, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
у) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Т115, Y118, Р121, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ф) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из Y118, М147, S149, R33, Е50, Е52, L55, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
х) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Y118, М147 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L55, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ц) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Т58, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ч) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Т58, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ш) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из Y118, Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
щ) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Е50, Е52, L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
аа) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
бб) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
вв) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Т122, S149, Е50, Е52, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
гг) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Е50, Е52, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
дд) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, S117, Y118, Т122, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ее) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, S117, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
жж) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
зз) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118 и Т122, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
ии) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
йй) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
кк) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
лл) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
мм) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
нн) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254;
оо) антитело связывается по меньшей мере с одной аминокислотой TL1A, выбранной из группы, состоящей из К113, Y118, Т122, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; или
пп) антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, F148 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В153. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В152, где антитело связывается с TL1A, когда один или более чем один аминокислотный остаток антитела участвует в водородной связи с одним или более чем одним остатком в TL1A, участвует в опосредованной водой водородной связи с одним или более чем одним остатком в TL1A, участвует в солевом мостике с одним или более чем одним остатком в TL1A, имеет не равное нулю изменение площади скрытой поверхности из-за взаимодействия с TL1A, или когда тяжелый атом из одного или более чем одного остатка антитела находится в пределах расстояния 4  от тяжелого атома в TL1A.
от тяжелого атома в TL1A.
B154. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент по любому из В1-В127 или В140-В153.
B155. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент по В154, где указанная нуклеиновая кислота содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из следующих:
а) последовательность нуклеиновой кислоты SEQ ID NO: 103;
б) последовательность нуклеиновой кислоты SEQ ID NO: 105;
в) последовательность нуклеиновой кислоты SEQ ID NO: 107;
г) последовательность нуклеиновой кислоты SEQ ID NO: 109;
д) последовательность нуклеиновой кислоты SEQ ID NO: 103 и 105;
е) последовательность нуклеиновой кислоты SEQ ID NO: 107 и 109;
ж) последовательность нуклеиновой кислоты вставки вектора, депонированного как 1D1 1.31 VH, имеющего регистрационный номер ATCC PTA-120639;
з) последовательность нуклеиновой кислоты вставки вектора, депонированная как 1D1 1.31 VL, имеющего регистрационный номер ATCC PTA-120640;
и) последовательность нуклеиновой кислоты вставки вектора, депонированного как 1D1 1.31 VH, имеющего регистрационный номер ATCC PTA-120639, и последовательность нуклеиновой кислоты вставки вектора, депонированная как 1D1 1.31 VL, имеющего регистрационный номер ATCC PTA-120640;
й) последовательность нуклеиновой кислоты SEQ ID NO: 227;
к) последовательность нуклеиновой кислоты SEQ ID NO: 229;
л) последовательность нуклеиновой кислоты SEQ ID NO: 227 и 103;
м) последовательность нуклеиновой кислоты SEQ ID NO: 229 и 107;
н) последовательность нуклеиновой кислоты SEQ ID NO: 199;
о) последовательность нуклеиновой кислоты SEQ ID NO: 201;
п) последовательность нуклеиновой кислоты SEQ ID NO: 199 и 103;
р) последовательность нуклеиновой кислоты SEQ ID NO: 201 и 107;
с) последовательность нуклеиновой кислоты SEQ ID NO: 206;
т) последовательность нуклеиновой кислоты SEQ ID NO: 208;
у) последовательность нуклеиновой кислоты SEQ ID NO: 206 и 103;
ф) последовательность нуклеиновой кислоты SEQ ID NO: 208 и 107;
х) последовательность нуклеиновой кислоты SEQ ID NO: 213;
ц) последовательность нуклеиновой кислоты SEQ ID NO: 215;
ч) последовательность нуклеиновой кислоты SEQ ID NO: 213 и 103;
ш) последовательность нуклеиновой кислоты SEQ ID NO: 215 и 107;
щ) последовательность нуклеиновой кислоты SEQ ID NO: 220;
аа) последовательность нуклеиновой кислоты SEQ ID NO: 222;
бб) последовательность нуклеиновой кислоты SEQ ID NO: 220 и 103;
вв) последовательность нуклеиновой кислоты SEQ ID NO: 222 и 107;
гг) последовательность нуклеиновой кислоты SEQ ID NO: 234;
дд) последовательность нуклеиновой кислоты SEQ ID NO: 236;
ее) последовательность нуклеиновой кислоты SEQ ID NO: 234 и 103;
жж) последовательность нуклеиновой кислоты SEQ ID NO: 236 и 107;
зз) последовательность нуклеиновой кислоты SEQ ID NO: 241;
ии) последовательность нуклеиновой кислоты SEQ ID NO: 243;
йй) последовательность нуклеиновой кислоты SEQ ID NO: 241 и 103;
кк) последовательность нуклеиновой кислоты SEQ ID NO: 243 и 107;
лл) последовательность нуклеиновой кислоты SEQ ID NO: 248;
мм) последовательность нуклеиновой кислоты SEQ ID NO: 250;
нн) последовательность нуклеиновой кислоты SEQ ID NO: 248 и 103; или
оо) последовательность нуклеиновой кислоты SEQ ID NO: 250 и 107.
В156. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент по В154 или В155, где указанная нуклеиновая кислота содержит следующие:
а) последовательность нуклеиновой кислоты SEQ ID NO: 89;
б) последовательность нуклеиновой кислоты SEQ ID NO: 91;
в) последовательность нуклеиновой кислоты SEQ ID NO: 93;
г) последовательность нуклеиновой кислоты SEQ ID NO: 95;
д) последовательность нуклеиновой кислоты SEQ ID NO: 89 и 91;
е) последовательность нуклеиновой кислоты SEQ ID NO: 93 и 95;
й) последовательность нуклеиновой кислоты SEQ ID NO: 53;
к) последовательность нуклеиновой кислоты SEQ ID NO: 57;
л) последовательность нуклеиновой кислоты SEQ ID NO: 53 и 89;
м) последовательность нуклеиновой кислоты SEQ ID NO: 57 и 93;
н) нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 102; или
о) нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 226.
B157. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент по любому из В154-В156, где указанная нуклеиновая кислота содержит:
а) последовательность нуклеиновой кислоты SEQ ID NO: 65;
б) последовательность нуклеиновой кислоты SEQ ID NO: 67;
в) последовательность нуклеиновой кислоты SEQ ID NO: 69;
г) последовательность нуклеиновой кислоты SEQ ID NO: 71;
д) последовательность нуклеиновой кислоты SEQ ID NO: 73;
е) последовательность нуклеиновой кислоты SEQ ID NO: 75;
ж) последовательность нуклеиновой кислоты SEQ ID NO: 67 и 65;
з) последовательность нуклеиновой кислоты SEQ ID NO: 69 и 65;
и) последовательность нуклеиновой кислоты SEQ ID NO: 71 и 65;
й) последовательность нуклеиновой кислоты SEQ ID NO: 73 и 75;
к) последовательность нуклеиновой кислоты SEQ ID NO: 2;
л) последовательность нуклеиновой кислоты SEQ ID NO: 4;
м) последовательность нуклеиновой кислоты SEQ ID NO: 6;
н) последовательность нуклеиновой кислоты SEQ ID NO: 8;
о) последовательность нуклеиновой кислоты SEQ ID NO: 10;
п) последовательность нуклеиновой кислоты SEQ ID NO: 12;
р) последовательность нуклеиновой кислоты SEQ ID NO: 4 и 2;
с) последовательность нуклеиновой кислоты SEQ ID NO: 6 и 2;
т) последовательность нуклеиновой кислоты SEQ ID NO: 10 и 8; или
у) последовательность нуклеиновой кислоты SEQ ID NO: 12 и 8.
B158. Вектор, содержащий нуклеиновую кислоту по любому из В154-157.
B159. Клетка-хозяин, содержащая нуклеиновую кислоту по любому из В154-157 или вектор по В158.
B160. Клетка-хозяин по В159, где клетка представляет собой бактериальную клетку или клетку млекопитающего.
B161. Способ получения антитела или его антигенсвязывающего фрагмента, которое специфически связывается с TL1A, причем указанный способ включает культивирование клетки-хозяина по В159 или В160 при условиях, когда экспрессируется указанное антитело, и дополнительно включающий выделение указанного антитела.
B162. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент по любому из В1-В127 и В140-В153 и фармацевтически приемлемый носитель или эксципиент.
B163. Способ предупреждения или лечения заболевания, расстройства или состояния, опосредованного TL1A, причем указанный способ включает введение субъекту, нуждающемуся в этом, эффективного количества антитела или его антигенсвязывающего фрагмента по любому из В1-В120 и В133-В145 или фармацевтической композиции по В154.
B164. Антитело или его антигенсвязывающий фрагмент по любому из В1-В127 и В140-В153, или фармацевтическая композиция по В162 для применения в предупреждении или лечении заболевания, расстройства или состояния, опосредованного TL1A.
B165. Применение антитела или его антигенсвязывающего фрагмента по любому из В1-В127 и В140-В153 в изготовлении лекарственного средства для лечения заболевания, расстройства или состояния, опосредованного TL1A.
B166. Способ по В163, антитело или фармацевтическая композиция по В162 или применение по В165, где заболевание, расстройство или состояние представляет собой по меньшей мере одно, выбранное из группы, состоящей из следующих: воспалительное заболевание кишечника (IBD), болезнь Крона, язвенный колит, астма, аллергии, сахарный диабет, артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориатический артрит, анкилозирующий спондилоартрит, рассеянный склероз, отторжение трансплантата, заболевание «трансплантат против хозяина» (GVHD), спондилоартропатия, первичный склерозирующий холангит, первичный билиарный цирроз, атеросклероз, синдром мочевого пузыря/интерстициальный цистит, дисфункция мочевого пузыря, сепсис, увеит, энцефаломиелит, тяжелая миастения, системная красная волчанка, кожная красная волчанка, аутоиммунный тиреоидит, атопический дерматит, экзематический дерматит, псориаз, синдром Шегрена, склеродермия и васкулит.
В159. Способ выявления TL1A в образце, ткани или клетке с использованием антитела или его антигенсвязывающего фрагмента по любому из В1-В127 и В140-В153, включающий приведение образца, ткани или клетки в контакт с антителом и выявление антитела.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Приведенное выше краткое изложение, а также следующее подробное описание изобретения будет лучше понятно при прочтении в сочетании с приложенными графическими материалами. С целью иллюстрации изобретения в графических материалах показаны воплощения, которые в настоящее время являются предпочтительными. Однако следует понимать, что изобретение не ограничивается точными показанными схемами и устройствами.
В графических материалах:
На Фиг. 1, включающей панели А-3, показаны аминокислотные последовательности разных антител против TL1A по изобретению. На всей Фиг. 1 области CDR-H1 домена VH, как определено посредством AntibodyM, изложены жирным шрифтом и курсивом. Области CDR, как определено по Kabat, подчеркнуты. На Фиг. 1А показаны аминокислотные последовательности области VH и VL антител 9B3, 15А9, 15С11 и 22F9. На Фиг. 1Б показаны аминокислотные последовательности области VH и VL антител 26B11, 7D4 и 1D1. На Фиг. 1В и 1Г показаны аминокислотные последовательности области VH ряда антител 1D1, которые подверглись созреванию аффинности посредством фагового дисплея и были обозначены 1D1 D5, 1D1 D18, 1D1 D21, 1D1 D24, 1D1 D25, 1D1 D28, 1D1 D29, 1D1 D31, 1D1 D37, 1D1 D38, 1D1 D39, 1D1 DH3, 1D1 DH8, 1D1 DH9 и 1D1 DH10. На Фиг. 1Д-Фиг. 13 показаны аминокислотные последовательности области VH антител 1D1, которые подверглись созреванию аффинности посредством анализа структуры сокристалла и фагового дисплея, и они обозначены 1D1 1.1-1D1 1.34. Для антител с созревшей аффинностью на Фиг. 1В-Фиг. 13 области VL имеют такую же аминокислотную последовательность, что и область VL родительского антитела 1D1. На Фиг. 1И-1 показано выравнивание аминокислотных последовательностей областей VL 26B11, 7D4 и 1D1, и на Фиг. 1И-2 показано выравнивание последовательности областей VH родительских антител 1D1, 7D4 и 26B11. Каждое из данных антител представляет собой различную категорию/группу эпитопсвязывающих антител. На Фиг. 1Й показано выравнивание аминокислотных последовательностей из антител 7D4 и 22F9, которые имеют общий эпитопсвязывающий элемент. На Фиг. 1К показано выравнивание аминокислотных последовательностей между антителами 26B11 и 9B3, которые имеют общий эпитопсвязывающий элемент. На Фиг. 1Л показано выравнивание аминокислотных последовательностей антитела 1D1 и антител 15А9 и 15С11, которые имеют общий эпитопсвязывающий элемент. На Фиг. 1М-1 показана таблица, показывающая процент идентичности аминокислотной последовательности между доменами VH 1D1 и разных вариантов 1D1 антител против TL1A. На Фиг. 1М-2 показана таблица, показывающая процент идентичности аминокислотной последовательности между доменами VL разных антител против TL1A (1D1, 15А9, 15С11, 9B3, 26B11, 7D4 и 22F9). На Фиг. 1М-3 показана таблица, показывающая процент идентичности аминокислотной последовательности между доменами VH разных антител против TL1A (1D1, 15А9, 15С11, VH1 9B3/26B11, VH2 9B3/26B11, 26B11 MDX, 7D4 и 22F9).
На Фиг. 2 показана диаграмма Венна, показывающая антитела против TL1A согласно элементам эпитопов. Антитела в том же самом круге конкурируют за связывание с человеческим TL1A, тогда как антитела в отдельных кругах не конкурируют за связывание на человеческом TL1A.
На Фиг. 3 показана другая диаграмма Венна антител против TL1A, показывающая антитела согласно элементам эпитопов. Антитела в том же самом круге конкурируют за связывание с человеческим TL1A, тогда как антитела в отдельных кругах не конкурируют за связывание на человеческом TL1A.
На Фиг. 4 показана диаграмма Венна категорий эпитопов антител против TL1A. Антитела в том же самом круге конкурируют за связывание с мышиным TL1A, тогда как антитела в отдельных кругах не конкурируют за связывание на мышином TL1A. На данной Фиг. показаны данные, демонстрирующие то, что поликлональное Ab (антитело) АТ127 не конкурирует с каким-либо из антител в другом круге (1D1, 27F8, 11F5, 3C5, 16B3, 20С10, 16g9 и 6D7), и они также показывают то, что все антитела в круге конкурируют друг с другом за связывание с мышиным TL1A.
На Фиг. 5 показана структура сокристалла трех молекул scFv 1D1 (лента), связанных с тремя мономерами TL1A (модель поверхности с молекулами TL1A, показанными светло-серым, темно-серым и черным). Тяжелая цепь 1D1 ближе к наблюдателю, причем легкая цепь находится позади ее.
На Фиг. 6 показан увеличенный вид выбранной области CDR-H1 (как определено посредством AbM) scFv 1D1, который иллюстрирует то, что остаток серина 28 CDR-H1 не является партнером по образованию сильной водородной связи с любыми остатками TL1A.
На Фиг. 7 показан увеличенный вид выбранной области в CDR-H1 (как определено посредством AbM) scFv 1D1, как показано на Фиг. 6. Данная диаграмма демонстрирует то, что модель показывает, что замена серина 28 аспарагиновой кислотой обеспечивает возможность для сильных взаимодействий (например, водородные связи и солевой мостик).
На Фиг. 8 показана кристаллическая структура Fab антитела против TL1A 7D4, сокристаллизованного с человеческим TL1A. Индивидуальные мономеры TL1A показаны в виде поверхностей светло-серым, темно-серым и черным. Fab 7D4 показаны в виде лент, причем VL показан темно-серым, и VH - светлосерым.
На Фиг. 9 показана модель кристаллической структуры Fab антитела против TL1A 26B11, сокристаллизованного с человеческим TL1A. Данную модель получили путем последовательного наложения кристаллической структуры одного комплекса на структуру тримера TL1A. Индивидуальные мономеры TL1A показаны в виде поверхностей с разными оттенками серого. Fab 26B11 показаны в виде лент, причем легкая цепь показана темно-серым, а тяжелая цепь - светло-серым.
На Фиг. 10 показана кристаллическая структура scFv антитела против TL1A 1D1 1.31, сокристаллизованного с человеческим TL1A. Каждый из индивидуальных мономеров TL1A показан в виде светло-серых, темно-серых и черных поверхностей. scFv 1D1 1.31 показан в виде лент со светло-серой тяжелой цепью и темно-серой легкой цепью.
На Фиг. 11 показано сравнение кристаллической структуры антител против TL1A 1D1 (родительское) и 1D1 1.31 с оптимизированной аффинностью с человеческим TL1A в области, окружающей остаток 58 антител. 1D1 1.31 показано черным (тяжелая цепь справа) и темно-серым (легкая цепь слева). Родительское 1D1 показано светло-серым. TL1A показан в виде тонких палочек.
На Фиг. 12 показано сравнение кристаллической структуры антител против TL1A 1D1 (родительское) и 1D1 1.31 и человеческим TL1A в области, окружающей остаток 28 антител. Родительское 1D1 показано светло-серыми толстыми палочками. 1D1 1.31 показано черными палочками. TL1A показан тонкими палочками, причем конформация из соструктуры родительского 1D1 показана светло-серым, и конформация из соструктуры 1D1 1.31 - черным.
Фиг. 13 представляет собой график, показывающий экспрессию мембраносвязанного TL1A (mTL1A) моноцитами в присутствии и отсутствие антитела 1D1 1.31 против TL1A. Человеческие моноциты из цельной крови стимулировали связанным с планшетом IC (иммуноконъюгат) в течение 4 часов плюс/минус 1D1 1.31, и они демонстрируют пик справа от перекрывающихся пиков, демонстрируемых как изотипическим контролем (светло-серый), так и непростимулированными клетками (темно-серый). Мембранный TL1A выявляли с использованием стрептавидина РЕ (фикоэритрин) и измеряли проточной цитометрией таким образом, что количество TL1A на поверхности клетки, выраженное по абсциссе, варьировало от 0 до 105 mTL1A по мере увеличения флуоресцентного сигнала.
На Фиг. 14, содержащей панели А-Д, показаны графики, демонстрирующие ингибирование NFκB посредством антител против TL1A. На Фиг. 14А показан график, демонстрирующий конститутивную экспрессию DR3 на клетках TF-1 после культивирования в течение ночи без GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор). Конститутивная экспрессия DR3 на клетках TF-1 была продемонстрирована окрашиванием имеющимся в продаже биотинилированным антителом против DR3, с последующим окрашиванием стрептавидином-PE. После окрашивания экспрессию DR3 проверяли анализом проточной цитометрии. Число клеток откладывали на графике относительно средней интенсивности флуоресценции (MFI) как меру экспрессии DR3, которая продемонстрирована увеличением MFI в клетках, окрашенных антителом против DR3 (светло-серый), по сравнению с контрольными клетками, окрашенными стрептавидином-PE (темно-серый). На Фиг. 14Б показан график, иллюстрирующий дозозависимую активацию активности NFκB посредством TL1A в клетках TF-1-NFκB-люцифераза. Клетки TF-1-NFκB-люцифераза стимулировали указанными пМ концентрациями TL1A в течение 6 часов при 37°C. Активность NFκB измеряли по экспрессии люциферазной активности (световые единицы). Относительные световые единицы измеряли люминометром и откладывали на графике против концентраций TL1A. На Фиг. 14B показан репрезентативный график, демонстрирующий дозозависимое ингибирование активации NFκB посредством активности антитела 1D1 1.31 в клетках TF-1-NFκB-люцифераза в ответ на стимуляцию TL1A. Клетки TF-1-NFκB-люцифераза стимулировали 150 пМ TL1A в присутствии указанных концентраций 1D1 1.31 в течение 6 часов при 37°C. Активность NFκB измеряли посредством экспрессии люциферазной активности. Относительные световые единицы измеряли посредством люминометра и откладывали на графике против концентраций 1D1 1.31. На Фиг. 14Г показан график, иллюстрирующий зависимую от дозы TL1A активацию активности NFκB в клетках TF-1-NFκB-люцифераза в присутствии или в отсутствие 3 нМ изотипического контрольного антитела. Клетки TF-1-NFκB-люцифераза стимулировали указанными концентрациями TL1A с или без 3 нМ изотипического контрольного антитела в течение 6 часов при 37°C. Активность NFκB измеряли посредством экспрессии люциферазной активности. Относительные световые единицы измеряли люминометром и откладывали на графике против концентраций TL1A. На Фиг. 14Д показана графическая иллюстрация дозозависимого ингибирования активации NFκB изотипическим контрольным антителом против столбнячного анатоксина в клетках TF-1-NFκB-люцифераза в ответ на стимуляцию TL1A. Клетки TF-1-NFκB-люцифераза стимулировали 150 пМ TL1A в присутствии указанных концентраций изотипического контрольного антитела в течение 6 часов при 37°C. Активность NFκB измеряли по экспрессии люциферазной активности. Относительные световые единицы измеряли люминометром и откладывали на графике против концентраций антитела 1D1 1.31.
Фиг. 15, содержащая панели А и Б, демонстрирует ингибирование каспазной активности в клетках TF-1 антителами против TL1A. На Фиг. 15А показан график, иллюстрирующий зависимую от дозы TL1A активацию каспазной активности в клетках TF-1. Клетки TF-1 стимулировали указанными концентрациями TL1A в течение 6 часов при 37°C в присутствии циклогексимида. Каспазную активность измеряли по активности люциферина, высвобожденной при расщеплении каспазо-специфичного субстрата. Относительные световые единицы измеряли люминометром и откладывали на графике против концентраций TL1A. Показанные данные демонстрируют EC50 (полумаксимальная эффективная концентрация) примерно 94,17. На Фиг. 15Б показан график, иллюстрирующий дозозависимое ингибирование каспазной активности антителом 1D1 1.31 в клетках TF-1 в ответ на стимуляцию TL1A. Клетки TF-1 стимулировали 87 пМ TL1A в присутствии указанных концентраций 1D1 1.31 в течение 6 часов при 37°C в присутствии циклогексимида. Каспазную активность измеряли по активности люциферина, высвобождаемой при расщеплении каспазо-специфичного субстрата. Относительные световые единицы измеряли люминометром и откладывали на графике против концентраций 1D1 1.31. Показанные данные демонстрируют IC50 (полумаксимальная ингибирующая концентрация) примерно 54,26 для Ab 1D1 1.31.
На Фиг. 16, содержащей панели А и Б, показано ингибирование и исчерпывание цитокинов посредством антител против TL1A в человеческой цельной крови. На Фиг. 16А показан график, иллюстрирующий ингибирование секреции IFN гамма посредством 1D1 1.31 при стимуляции человеческой периферической крови иммунным комплексом (IC) и IL-12 (интерлейкин-12) и IL-18. Человеческую периферическую кровь, обработанную 0,5 нг/мл рекомбинантного человеческого IL-12 и 5 нг/мл рекомбинантного человеческого IL-18, стимулировали посредством планшетов, покрытых иммунным комплексом, в течение 24 часов при 37°C (для осуществления повышающей регуляции DR3 на клетках NK (естественный киллер)/NKT (T-клетка естественный киллер) и TL1A на моноцитах соответственно) в отсутствие или в присутствии указанных концентраций 1D1 1.31 или изотипического контрольного антитела. Из данных образцов получали плазму, и в образцах плазмы измеряли IFNγ посредством количественного анализа связывания иммунноглобулина-лиганда с использованием набора Mesoscale (MSD). На Фиг. 16Б показан график, показывающий уменьшение 1D1 1.31 на растворимом TL1A, не содержащем 1D1 1.31 (sTL1A), при стимуляции человеческой периферической крови IC, IL-12 и IL-18. Человеческую периферическую кровь, обработанную 0,5 нг/мл рекомбинантного человеческого IL-12 и 5 нг/мл рекомбинантного человеческого IL-18, стимулировали посредством планшетов, покрытых иммунным комплексом, в течение 24 часов при 37°C (для повышающей регуляции DR3 на клетках NK/NKT и TL1A на моноцитах соответственно) в отсутствие или в присутствии указанных концентраций 1D1 1.31 или изотипического контрольного антитела. Из данных образцов получали плазму, и sTL1A, не содержащий 1D1 1.31, измеряли в образцах плазмы посредством количественного анализа связывания иммунолиганда с использованием Mesoscale (MSD).
На Фиг. 17, содержащей панели А и Б, показано ингибирование и исчерпывание цитокинов посредством антител против TL1A в цельной крови яванского макака. На Фиг. 17А показано ингибирование антителом 1D1 1.31 продукции IFN гамма при стимуляции периферической крови яванского макака IC, IL-12 и IL-18. Периферическую кровь яванского макака, обработанную 1 нг/мл рекомбинантного человеческого IL-12 и 10 нг/мл рекомбинантного человеческого IL-18, стимулировали посредством планшетов, покрытых иммунным комплексом, в течение 24 часов при 37°C (для повышающей регуляции DR3 на клетках NK/NKT и TL1A на моноцитах соответственно) в отсутствие или в присутствии указанных концентраций 1D1 1.31 или изотипического контрольного антитела. Из данных образцов получали плазму, и измеряли в образцах плазмы IFNγ посредством количественного анализа связывания иммуноглобулина-лиганда с использованием набора Mesoscale (MSD). На Фиг. 17Б показан график, иллюстрирующий уменьшение на растворимом TL1A, не содержащем 1D1 1.31, при стимуляции крови яванского макака IC, IL-12 и IL-18. Периферическую кровь яванского макака, обработанную 1 нг/мл рекомбинантного человеческого IL-12 и 10 нг/мл рекомбинантного человеческого IL-18, стимулировали посредством планшетов, покрытых иммунным комплексом, в течение 24 часов при 37°C (для повышающей регуляции DR3 на клетках NK/NKT и TL1A на моноцитах соответственно) в отсутствие или в присутствии указанных концентраций 1D1 1.31 или изотипического контрольного антитела. Из данных образцов получали плазму, и измеряли в образцах плазмы sTL1A, не содержащий 1D1 1.31, посредством количественного анализа связывания иммунолиганда с использованием набора Mesoscale (MSD).
На Фиг. 18А-В показан график, обобщающий нормированную площадь скрытой поверхности  из-за взаимодействий между парами остатков антитела 1D1 и остатков TL1A. Остатки 1D1 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
из-за взаимодействий между парами остатков антитела 1D1 и остатков TL1A. Остатки 1D1 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
На Фиг. 19А-В показан график, обобщающий нормированную площадь скрытой поверхности  из-за взаимодействий между парами остатков антитела 1D1 1.31 и остатков TL1A. Остатки 1D1 1.31 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
из-за взаимодействий между парами остатков антитела 1D1 1.31 и остатков TL1A. Остатки 1D1 1.31 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
На Фиг. 20 показан график, на котором сравнивается связывание 1D1 1.31 с TL1A и TNFSF6. Связывание антитела определяли, как описано в материалах и методах. Данный график представляет 3 независимых эксперимента, выполненных в двойной повторности (n равен 6). 1D1 1.31 связывало TL1A со значением ЕС50 8,4 пг/мл (треугольники с вершиной, направленной вниз), но не связывало TNFSF6 (звездочки). Антитело против TNFSF6 связывало TNFSF6 (круги) со значением EC50 3 пг/мл.
На Фиг. 21 показан график, демонстрирующий ингибирование связывания биотинилированного TL1A с клетками HEK293 (эмбриональной почки человека), экспрессирующими DR3, посредством антитела против TL1A 1D1 1.31. Антитело против TL1A 1D1 1.31 ингибировало связывание 10 мкг/мл биотинилированного TL1A с клетками НЕК293, экспрессирующими DR3, с IC5o 18,68 мкг/мл.
На Фиг. 22А-Д показаны результаты введения антитела против TL1A на воспаление дыхательных путей в мышиной модели HDM. Введение антитела 1D1 приводило к значимому уменьшению общей насыщенности клетками BAL (бронхоальвеолярный лаваж) [Фиг. 22(a)], числа эозинофилов BAL [Фиг. 22(б)], лимфоцитов BAL [Фиг. 22(в)] и макрофагов BAL [Фиг. 22(г)]. Число нейтрофилов BAL, по-видимому, не подвергалось значимой модуляции посредством обработки антителом против TL1A [Фиг. 22(д)], хотя стоит отметить, что нейтрофилы BAL представляют маленькую популяцию клеток в данной модели.
На Фиг. 23А-В показан график, обобщающий нормированную площадь поверхности  , скрытой из-за взаимодействий между парами остатков антитела 7D4 и остатков TL1A. Остатки 7D4 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
, скрытой из-за взаимодействий между парами остатков антитела 7D4 и остатков TL1A. Остатки 7D4 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
На Фиг. 24А-В показан график, обобщающий нормированную площадь поверхности  , скрытой из-за взаимодействий между парами остатков антитела 26B11 и остатков TL1A. Остатки 26B11 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
, скрытой из-за взаимодействий между парами остатков антитела 26B11 и остатков TL1A. Остатки 26B11 обозначены по цепи (H - для тяжелой цепи или L - для легкой цепи), посредством однобуквенного кода аминокислот и номера остатка. Остатки TL1A обозначены по мономеру TL1A/цепи (А или В), посредством однобуквенного кода аминокислот и номера остатка. Пары, которые образуют водородную связь, указаны с использованием «h». Пары, которые образуют солевой мостик, указаны с использованием «S». Пары, которые совместно координируют молекулу воды, указаны с использованием «w».
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь раскрыты антитела, которые специфически связываются с TL1A, и, кроме того, антитела, которые ингибируют его связывание с DR3. Предложены способы получения антител против TL1A, композиции, содержащие данные антитела, и способы применения данных антител. Антитела против TL1A можно использовать в предупреждении, лечении и/или уменьшении интенсивности заболеваний, расстройств или состояний, вызванных и/или ассоциированных с TL1A, таких как связанные с иммунной системой или воспалительные заболевания. Такие заболевания, расстройства или состояния включают без ограничений IBD (воспалительное заболевание кишечника), включающее UC (язвенный колит) и CD (болезнь Крона), астму, рассеянный склероз, псориаз и ревматоидный артрит, как было бы понятно специалисту в данной области, которому предоставлены раскрытые здесь идеи.
Общие методики
Если здесь не определено иначе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны обычным специалистам в данной области. Кроме того, если контекст не требует иного, термины в единственном числе будут включать термины во множественном числе, и термины во множественном числе будут включать термины в единственном числе. В общем, номенклатуры, используемые с связи с методиками культуры клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики, химии белка и нуклеиновых кислот и гибридизации, описанные в данном документе, представляют собой номенклатуры и методики, хорошо известные и обычно используемые в данной области.
В воплощении настоящего изобретения на практике, если не определено иначе, будут использоваться традиционные методики молекулярной биологии (включающие методики генной инженерии), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах квалификации в данной области. Такие методики подробно объясняются в литературе, как, например, в Molecular Cloning: A Laboratory Manual, второе издание (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd. ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, NY (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1998); Coligan et al., Short Protocols in Protein Science, John Wiley & Sons, NY (2003); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Ферментативные реакции и методики очистки проводятся согласно описаниям изготовителей, как обычно осуществляется в данной области или как здесь описано. Номенклатуры, используемые в связи с и лабораторные методики и техники аналитической химии, биохимии, иммунологии, молекулярной биологии, синтетической органической химии и медицинской и фармацевтической химии, описанные в данном документе, представляют собой методики, хорошо известные и обычно используемые в данной области. Для химических синтезов, химических анализов, фармацевтических препаратов, композиций, доставки и лечения пациентов используются стандартные методики.
Определения
Следует понимать, что если не указано иное, следующие термины имеют следующие значения: термин «выделенная молекула» (где молекула представляет собой, например, полипептид, полинуклеотид или антитело или его фрагмент) обозначает молекулу, которая посредством ее происхождения или источника получения (1) не ассоциирована с ассоциированными с ней в природе компонентами, которые сопровождают ее в ее природном состоянии, (2) по существу не содержит других молекул из того же самого вида, (3) экспрессируется клеткой из другого вида или (4) не встречается в природе. Таким образом, молекула, которая синтезируетя химически или экспрессируется в клеточной системе, отличной от клетки, из которой она происходит в природе, будет «выделенной» из компонентов, ассоциированных с ней в природе. Молекула также может быть сделана по существу не содержащей ассоциированных с ней в природе компонентов путем выделения с использованием методик очистки, хорошо известных в данной области. Чистоту или гомогенность молекулы можно анализировать посредством целого ряда способов, хорошо известных в данной области. Например, чистоту образца полипептида можно оценивать с использованием электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида с использованием методик, хорошо известных в данной области. Для определенных целей более высокое разрешение может быть предоставлено посредством применения ВЭЖХ (высокоэффективная жидкостная хроматография) или других способов, хорошо известных в области очистки.
Термин «по существу чистый» в том виде, как он здесь используется, означает то, что целевое соединение является преобладающим присутствующим соединением (т.е. на молярной основе его больше, чем любого другого индивидуального соединения в композиции), и предпочтительно по существу очищенная фракция представляет собой композицию, в которой целевое соединение (например, гликопротеин, включающий антитело или рецептор), содержит по меньшей мере примерно 50 процентов (на молярной основе) всех присутствующих макромолекулярных соединений. В общем, по существу чистая композиция будет содержать больше чем примерно 80 процентов всех макромолекулярных соединений, присутствующих в композиции, более предпочтительно больше, чем примерно 85%, 90%, 95% и 99%. Наиболее предпочтительно целевое соединение очищают до существенной гомогенности (загрязняющие соединения не могут быть выявлены в композиции традиционными способами выявления), где композиция по существу состоит из одного макромолекулярного соединения.
«Антитело» представляет собой молекулу иммуноглобулина, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. Данный термин в том виде, как он здесь используется, охватывает не только интактные поликлональные или моноклональные антитела, но также, если не определено иначе, любую их антигенсвязывающую часть, которая конкурирует с интактным антителом за специфичное связывание, слитые белки, содержащие антигенсвязывающую часть, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антигенсвязывающие части включают, например, Fab, Fab', F(ab')2, Fd, Fv, доменные антитела (dAb, например, антитела акул и верблюдовых), фрагменты, включающие гипервариабельные области (CDR), одноцепочечные вариабельные фрагменты антител (scFv), макситела, минитела, интратела, диатела, триатела, тетратела, v-NAR и bis-scFv, и полипептиды, которые содержат по меньшей мере часть иммуноглобулина, которая является достаточной для придания полипептиду специфичного связывания антигена. Антитело включает антитело любого класса или его антигенсвязывающий фрагмент, как, например, IgG, IgA или IgM (или его подкласс), и антитело не должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела, иммуноглобулины можно приписывать к разным классам. Существуют пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Хорошо известны структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов.
Термины «антигенсвязывающая часть» или «антигенсвязывающий фрагмент» антитела (или просто «часть антитела»), используемые здесь взаимозаменяемо, относятся к одному или более чем одному фрагменту антитела, который сохраняет способность к специфичному связыванию с антигеном (например, TL1A). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела, включают следующие: (1) фрагмент Fab - одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (2) фрагмент F(ab')2 - двухвалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; (3) фрагмент Fd, состоящий из доменов VH и CH1; (4) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; (5) фрагмент dAb (Ward et al., (1989) Nature 341: 544-546), который состоит из домена VH; и (6) выделенная гипервариабельная область (CDR), связанные дисульфидом Fv (dsFv) и антиидиотипические (анти-Id) антитела и интратела. Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, они могут быть связаны с использованием способов генной инженерии посредством синтетического линкера, который позволяет сделать их в виде одной белковой цепи, в которой области VL и VH образуют пару с формированием одновалентных молекул (известных как одноцепочечные Fv (scFv)); см., например, Bird et al. Science 242: 423-426 (1988) и Huston et al. Proc. Natl. Acad. Sci. USA 85: 5879-5883 (1988)). Подразумевается, что такие одноцепочечные антитела также охватываются термином «антигенсвязывающая часть» антитела. Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные, биспецифичные антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким для обеспечения образования пары между двумя доменами на той же самой цепи, принуждая, посредством этого, домены к образованию пары с комплементарными доменами другой цепи и создавая два антигенсвязывающих сайта (см., например, Holliger et al. Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993); Poljak et al., 1994, Structure 2: 1121-1123).
Антитела могут быть получены из любого млекопитающего, включая людей, обезьян, свиней, лошадей, кроликов, собак, кошек, мышей и т.д. или других животных, таких как птицы (например, куры), рыбы (например, акулы) и верблюдовые (например, ламы), но не ограничиваясь ими.
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела (VL) или вариабельной области тяжелой цепи антитела (VH) либо одной, либо в комбинации. Как известно в данной области, каждая из вариабельных областей тяжелой и легкой цепей состоит из четырех каркасных областей (FR), соединенных тремя гипервариабельными областями (CDR), также известными как области, определяющие комплементарность, и они участвуют в образовании антигенсвязывающего сайта антител. Если желательными являются варианты рассматриваемой вариабельной области, особенно с заменой аминокислотных остатков вне области CDR (т.е. в каркасной области), подходящая аминокислотная замена, предпочтительно консервативная аминокислотная замена, может быть идентифицирована путем сравнения рассматриваемой вариабельной области с вариабельными областями других антител, которые содержат последовательности CDR1 и CDR2 в том же каноническом классе, что и рассматриваемая вариабельная область (Chothia and Lesk, J. Mol. Biol. 196(4): 901-917, 1987).
В некоторых воплощениях точное выявление CDR и идентификация остатков, составляющих связывающий сайт антитела, осуществляется путем определения структуры антитела и/или определения структуры комплекса антитело-лиганд. В некоторых воплощениях это можно осуществлять любой из целого ряда методик, известных специалистам в данной области, таких как рентгеноструктурный анализ. В некоторых воплощениях для идентификации или аппроксимации областей CDR можно использовать разные способы анализа. Примеры таких способов включают определение по Kabat, определение по Chothia, определение AbM, контактное определение и конформационное определение, но не ограничиваются ими.
Определение по Kabat является стандартом для нумерации остатков в антителе и обычно используется для идентификации областей CDR. См., например, Johnson & Wu, 2000, Nucleic Acids Res., 28: 214-8. Определение по Chothia является аналогичным определению по Kabat, но в определении по Chothia принимаются во внимание положения определенных областей структурных петель. См., например, Chothia et al., 1986, J. Mol. Biol., 196: 901-17; Chothia et al., 1989, Nature, 342: 877-83. В определении AbM используется интегральный пакет компьютерных программ, разработанных Oxford Molecular Group, которые моделируют структуру антитела. См., например, Martin et al., 1989, Proc Natl Acad Sci (USA), 86:9268-9272; "AbM™, A Computer Program for Modeling Variable Regions of Antibodies," Oxford, UK; Oxford Molecular, Ltd. Определение AbM моделирует третичную структуру антитела из первичной последовательности с использованием комбинации баз знаний и неэмпирических способов, таких как способы, описанные Samudrala et al., 1999, "Ab Initio Protein Structure Prediction Using a Combined Hierarchical Approach," в PROTEINS, Structure, Function and Genetics Suppl., 3: 194-198. Контактное определение основано на анализе доступных кристаллических структур комплексов. См., например, MacCallum et al., 1996, J. Mol. Biol., 5: 732-45. В другом подходе, названном здесь «конформационное определение» CDR, положения CDR могут быть идентифицированы как остатки, которые осуществляют энтальпическое содействие связыванию антигена. См., например, Makabe et al., 2008, Journal of Biological Chemistry, 283: 1156-1166. Кроме того, другие определения границ CDR могут не следовать строго одному из приведенных выше определений, но, тем не менее, будут перекрываться по меньшей мере с частью CDR по Kabat, хотя они и могут быть укорочены или удлинены в свете прогнозирования или экспериментальных данных о том, что конкретные остатки или группы остатков не оказывают значимого влияния на связывание антигена. Термин CDR в том виде, как он здесь используется, может относиться к CDR, определенным любым подходом, известным в данной области, включая комбинации подходов. В использованных здесь способах могут применяться CDR, определенные согласно любому из данных подходов. Для любого данного воплощения, содержащего более чем одну CDR, CDR могут быть определены согласно Kabat, Chothia, расширенному определению, определению AbM, контактному и/или конформационному определениям.
Как обозначено здесь в других местах, определенные положения молекулы антитела могут быть изменены. Под термином «положение» в том виде, как он здесь используется, подразумевается место в последовательности белка. Положения могут быть пронумерованы последовательно или согласно установленному формату, например, для нумерации аминокислотных остатков антитела можно использовать индекс EU (Европейский Союз) и индекс Kabat. Например, положение 297 представляет собой положение в человеческом антителе IgG1. Соответствующие положения определяются, как обозначено выше, обычно посредством выравнивания с другими родительскими последовательностями.
Под термином «остаток» в том виде, как он здесь используется, подразумевается положение в белке и ассоциированная с ним аминокислота. Например, аспарагин 297 (также именуемый Asn297, также именуемый N297) представляет собой остаток в человеческом антителе IgG1.
Термин «моноклональное антитело» в том виде, как он здесь используется, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые типично включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Модификатор «моноклональное» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующий продукции антитела любым конкретным способом. Например, моноклональные антитела, подлежащие применению согласно настоящему изобретению, могут быть получены методикой гибридомы, впервые описанной Kohler and Milstein, 1975, Nature 256: 495, или могут быть получены способами генной инженерии, такими, как описанные в патенте США №4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, например, полученных с использованием методик, описанных в McCafferty et al., 1990, Nature 348: 552-554. Термин «гуманизированное» антитело в том виде, как он здесь используется, относится к формам антител, не являющихся человеческими (например, к мышиным), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося человеческим. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из CDR реципиента заменены остатками из CDR вида, не являющегося человеком (донорное антитело), такого как мышь, крыса или кролик, имеющей желательную специфичность, аффинность и активность. Гуманизированное антитело может содержать остатки, которые не находятся ни в антителе-реципиенте, ни в импортированных CDR или каркасных последовательностях, но включены для дальнейшего уточнения и оптимизации эффективности антитела.
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком, и/или было получено с использованием любой из методик получения человеческих антител, как здесь раскрыто. Данное определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
Подразумевается, что термин «химерное антитело» относится к антителам, в которых последовательности вариабельной области происходят из одного вида, и последовательности константной области происходят из другого вида, как, например, антитело, в котором последовательности вариабельной области происходят из мышиного антитела, и последовательности константной области происходят из человеческого антитела или наоборот. Данный термин также охватывает антитело, содержащее V область из одного индивида из одного вида (например, первой мыши), и константную область из другого индивида из того же самого вида (например, второй мыши).
Термин «антиген» и «Ag» относится к молекулярному элементу, используемому для иммунизации иммунокомпетентного позвоночного, для получения антитела (Ab), которое распознает Ag, или для скрининга экспрессионной библиотеки (например, среди прочих, библиотеки фагового, дрожжевого или рибосомального дисплея). Здесь Ag именуется в более широком смысле и обычно подразумевается то, что он включает молекулы-мишени, которые специфично распознаются Ab, таким образом, включая фрагменты или имитации молекулы, используемой в процессе иммунизации для получения Ab или в скрининге библиотеки для отбора Ab. Таким образом, для связывания антител по изобретению с TL1A антигеном называют полноразмерный TL1A из видов млекопитающих (например, TL1A человека, обезьяны, мыши и крысы), включая мономеры и мультимеры, такие как его димеры, тримеры и т.д., а также усеченные и другие варианты TL1A.
В общем, термин «эпитоп» относится к области или участку антигена, с которым специфически связывается антитело, например, к области или участку, содержащим контактный остаток, который взаимодействует с антителом. Таким образом, термин «эпитоп» относится к той части молекулы, которая способна распознаваться и связываться антителом в одной или более чем одной антигенсвязывающей области антитела. Типично эпитоп определяется в контексте молекулярного взаимодействия между антителом или его антигенсвязывающим фрагментом и соответствующим ему антигеном. Эпитопы часто состоят из поверхностной группировки молекул, такой как боковые цепи аминокислот или сахаров, и имеют специфичные трехмерные структурные характеристики, а также специфичные характеристики заряда. В некоторых воплощениях эпитоп может представлять собой белковый эпитоп. Белковые эпитопы могут быть линейными или конформационными. В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (такой как антитело) находятся линейно вдоль первичной аминокислотной последовательности белка. «Нелинейный эпитоп» или «конформационный эпитоп» содержит в пределах антигенного белка несмежные полипептиды (или аминокислоты), с которыми связывается антитело, специфичное к данному эпитопу. Термин «антигенный эпитоп» в том виде, как он здесь используется, определяется как часть антигена, с которой может специфически связываться антитело, при определении любым способом, хорошо известным в данной области, например, посредством традиционных иммуноанализов. В качестве альтернативы, во время процесса открытия получение и характеристика антител может прояснять информацию о желательных эпитопах. Из данной информации затем возможно осуществление конкурентного скрининга антител на связывание с тем же самым эпитопом. Подходом для достижения этого является проведение исследований по конкуренции и перекрестной конкуренции для нахождения антител, которые конкурируют или перекрестно конкурируют друг с другом за связывание с TL1A, например, антител, конкурирующих за связывание с антигеном.
Термины «аминокислота дикого типа», «IgG дикого типа», «антитело дикого типа» или «mAb дикого типа» в том виде, как они здесь используются, относятся к последовательности амино- или нуклеиновых кислот, которая встречается в природе в пределах определенной популяции (например, человека, мыши, крыс, клеток и т.д.).
Термин «антагонистическое антитело» относится к антителу, которое связывается с мишенью и предотвращает или уменьшает биологический эффект данной мишени. В некоторых воплощениях данный термин может обозначать антитело, которое предотвращает выполнение биологической функции мишенью, с которой оно связывается, например, связывания с ее когнатными рецепторами.
Термин «антагонистическое антитело против TL1A» в том виде, как он здесь используется, относится к антителу, которое способно ингибировать биологическую активность TL1A или активность гомополимера, содержащего TL1A, такого как гомодимер или гомотример, и/или последующее(щие) событие(тия), опосредованное(ные) TL1A, включая связывание с его рецепторами, включающими DR3, и опосредование тем самым сигнализации, но не ограничиваясь ими. Антагонистические антитела против TL1A охватывают антитела, которые блокируют, оказывают антагонистический эффект, подавляют или уменьшают (в любой степени, включая значительную) биологическую активность TL1A, включая последующие события, опосредованные TL1A, такие как связывание DR3 и последующая сигнализация. В целях настоящего изобретения будет явным образом понятно то, что термин «антитело против TL1A» (взаимозаменяемо именуемое «антагонистическое антитело против TL1A», «антагонистическое анти-TL1A антитело») охватывает все ранее идентифицированные термины, названия, функциональные состояния и характеристики, посредством которых сам TL1A, биологическая активность TL1A (включая его способность связываться с рецептором, но не ограничиваясь ей) или последствия биологической активности по существу устраняются, уменьшаются или нейтрализуются в какой-либо значимой степени. В некоторых воплощениях антитело против TL1A связывается с TL1A и предупреждает его связывание и сигнализацию через DR3. В некоторых воплощениях антагонистическую способность характеризуют и/или описывают посредством анализа на основе клеток, такого как анализ ингибирования NFκB или анализ ингибирования каспазы, как здесь раскрыто. В некоторых воплощениях антагонистическая способность описывается в показателях значения IC50 или EC50. В некоторых воплощениях рассматривается то, что антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию блокирует, оказывает антагонистический эффект, подавляет или уменьшает активность TL1A, если оно уменьшает активность TL1A на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%о, 90%, 95% или более относительно активности TL1A в отсутствие антитела.
Как известно в данной области, термин «константная область» антитела относится к константной области легкой цепи антитела или к константной области тяжелой цепи антитела, либо к одной, либо в комбинации.
Термины «полипептид», «олигопептид», «пептид» и «белок» используются здесь взаимозаменяемо для отнесения к цепям аминокислот любой длины. Цепь может быть линейной или разветвленной, или она может содержать модифицированные аминокислоты, и/или может прерываться неаминокислотами. Данные термины также охватывают аминокислотную цепь, которая была модифицирована в природе или посредством вмешательства; например, путем образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгирование с метящим компонентом. В данное определение также включены, например, полипептиды, содержащие один или более чем один аналог аминокислоты (включающие, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Понятно, что полипептиды могут встречаться в виде одиночных цепей или ассоциированных цепей.
Термин «связываться» в контексте антигенсвязывающего белка по изобретению (например, антитела или его антигенсвязывающего фрагмента), связывающегося с аминокислотой на антигене или связывающегося с эпитопом, содержащим аминокислоту на антигене, означает аминокислотный остаток антигена, который участвует в электростатическом взаимодействии с антигенсвязывающим белком, участвует в водородной связи с антигенсвязывающим белком или участвует в опосредованной водой водородной связи с антигенсвязывающим белком, или участвует в солевом мостике с антигенсвязывающим белком, или имеет не равное нулю изменение площади скрытой поверхности из-за взаимодействия с антигенсвязывающим белком и/или тяжелый атом аминокислотного остатка антигена расположен в пределах  от тяжелого атома антигенсвязывающего белка.
от тяжелого атома антигенсвязывающего белка.
Термин «конкурировать» в том виде, как он здесь используется по отношению к антителу, означает то, что первое антитело или его антигенсвязывающая часть связывается с эпитопом по существу аналогичным способом, что и связывание второго антитела или его антигенсвязывающей части, или лиганда, который не является антителом, таким образом, что результат связывания первого антитела с его штатным эпитопом выявляемо снижается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернатива, когда связывание второго антитела с его эпитопом также выявляемо снижается в присутствии первого антитела может, но не обязательно имеет место. То есть, первое антитело может ингибировать связывание второго антитела с его эпитопом без того, что второе антитело ингибирует связывание первого антитела с его соответствующим эпитопом. Однако, когда каждое антитело выявляемо ингибирует связывание другого антитела с его когнатным эпитопом или лигандом, независимо от того, в той же самой, большей или меньшей степени, говорят, что антитела «перекрестно конкурируют» друг с другом за связывание с их соответствующим(щими) эпитопом(пами). Настоящим изобретением охватываются и конкурирующие и перекрестно конкурирующие антитела. Независимо от механизма, посредством которого происходит такая конкуренция или перекрестная конкуренция (например, стерическое препятствие, конформационное изменение или связывание с общим эпитопом или его частью), квалифицированный специалист понял бы, на основе предложенных здесь идей, что такие конкурирующие и/или перекрестно конкурирующие антитела охватываются и могут быть полезными для раскрытых здесь способов.
Термин «контактный остаток» в том виде, как он здесь используется по отношению к антителу или антигену, специфически связываемому им, относится к аминокислотному остатку, присутствующему на антителе/антигене, содержащему по меньшей мере один тяжелый атом (т.е. не водород), который находится в пределах  или менее от тяжелого атома аминокислотного остатка, присутствующего на когнатном антителе/антигене.
или менее от тяжелого атома аминокислотного остатка, присутствующего на когнатном антителе/антигене.
Антитело «взаимодействует с» TL1A в том виде, в котором здесь используется данная фраза, когда равновесная константа диссоциации (KD) равна или меньше чем 5 нМ, предпочтительно меньше чем 1 нМ, предпочтительно меньше чем 100 пМ, предпочтительно меньше чем примерно 50 пМ, более предпочтительно меньше чем примерно 20 пМ, наиболее предпочтительно меньше чем примерно 10 пМ, более предпочтительно меньше чем примерно 5 пМ, еще более предпочтительно меньше чем примерно 2 пМ. Термин «константа диссоциации» иногда используется взаимозаменяемо с «равновесной константой диссоциации» и относится к значению, полученному в титрационном измерении в состоянии равновесия или путем деления константы скорости диссоциации (koff) на константу скорости ассоциации (kon). Константу скорости ассоциации, константу скорости диссоциации и равновесную константу диссоциации используют для представления аффинности связывания антитела с антигеном. Способы определения констант скорости ассоциации и диссоциации хорошо известны в данной области. Применение методик на основе флуоресценции дает высокую чувствительность и способность проверять образцы в физиологических буферах в состоянии равновесия. Можно использовать другие экспериментальные подходы и установки, такие как анализ BIAcore® (анализ биомолекулярного взаимодействия) (например, установку, доступную от BIAcore International АВ, компании GE Healthcare, Уппсала, Швеция). Дополнительно также можно использовать анализ KinExA® (анализ кинетического исключения), доступный от Sapidyne Instruments (Boise, Id.). В одном воплощении константу диссоциации измеряют с использованием способа поверхностного плазмонного резонанса (SPR) (Biacore). В некоторых воплощениях аффинность представляет собой значение KD, измеренное посредством SPR. В других случаях в SPR используется захваченное антитело и мишень в фазе раствора. В некоторых воплощениях захваченное антитело иммобилизуют на сенсорном чипе с использованием антитела против изотипа или его антигенсвязывающей части. Например, антитело против изотипа или его антигенсвязывающая часть может быть иммобилизовано на сенсорном чипе в плотности, составляющей от примерно 4000 до примерно 13000 единиц ответа. Измерение SPR также можно проводить, например, как оно по существу проводится согласно протоколу, изложенному в Примере 8. В некоторых случаях в SPR используется захваченная мишень и антитело в фазе раствора. В некоторых воплощениях измерение SPR проводится с использованием установки Biacore Т100 или Т200. В другом воплощении константа диссоциации измеряется с использованием анализа кинетического исключения на основе раствора (KinExA). В других воплощениях аффинность антитела или его антигенсвязывающего фрагмента в отношении человеческого TL1A измеряется посредством анализа кинетического исключения на основе раствора (KinExA). Например, в некоторых случаях аффинность представляет собой значение KD, измеренное посредством анализа кинетического исключения на основе раствора (KinExA). В других воплощениях в KinExA используется захваченная мишень на твердой фазе и антитело в фазе раствора. В других случаях антитело и мишень предынкубируют в растворе достаточно долго для достижения равновесия. В одном воплощении уровень несвязавшегося антитела измеряют после достижения равновесия антителом и мишенью. В конкретном воплощении измерение KinExA проводится с использованием установки KinExA 3200 (Sapidyne). В одном воплощении антитело взаимодействует с TL1A, когда KD варьирует от примерно 20 пМ до примерно 1 пМ при измерении KinExA. В одном воплощении антитело взаимодействует с TL1A с KD примерно 1,38 пМ при измерении KinExA.
Для измерения аффинности связывания антитела с его антигенами доступен целый ряд методологий, причем одной такой методологией является KinExA™. Анализ кинетического исключения (KinExA™) является универсальной платформой иммуноанализа (на основе проточного спектрофлуориметра), которая способна измерять равновесные константы диссоциации и константы скорости ассоциации и диссоциации для взаимодействий антиген/антитело. Поскольку KinExA™ проводится после получения равновесия, он является полезной методикой для применения для измерения KD высокоаффинных взаимодействий, где скорость диссоциации взаимодействия может быть очень низкой. Применение KinExA™ является особенно подходящим в том случае, когда аффинность антитела и антигена выше, чем может точно прогнозироваться посредством анализа поверхностным плазмонным резонансом. Методологию KinExA™ можно проводить, в общем, как описано Drake et al (2004) Analytical Biochemistry 328, 35-43, которая включена сюда посредством ссылки во всей ее полноте, и также, как подробно описано в разделе Примеров. Термин «поверхностный плазмонный резонанс» в том виде, как он здесь используется, относится к оптическому явлению, которое обеспечивает проведение анализа биоспецифичных взаимодействий в реальном времени посредством выявления изменений концентраций белка в матрице биосенсора, например, с использованием системы BIACORE™.
Антитело, которое «предпочтительно связывается» или «специфически связывается» (используются здесь взаимозаменяемо) с эпитопом, представляет собой термин, хорошо понятный в данной области, и способы для определения такого специфичного или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула демонстрирует «специфичное связывание» или «предпочтительное связывание», если она реагирует или ассоциирует чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело «специфически связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими веществами. Также антитело «специфически связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или с большей продолжительностью с данной мишенью в образце, чем оно связывается с другими веществами, присутствующими в образце. Например, антитело, которое специфично или предпочтительно связывается с эпитопом TL1A, представляет собой антитело, которое связывается с данным эпитопом с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими эпитопами TL1A или эпитопами, не являющимися эпитопами TL1A. Посредством прочтения данного определения также понятно, например, что антитело (или группировка, или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может или не может специфично или предпочтительно связываться со второй мишенью. «Специфичное связывание» или «предпочтительное связывание», как таковое, не обязательно требует (хотя оно и может включать) исключительного связывания. В общем, но не обязательно, ссылка на связывание означает предпочтительное связывание. «Специфичное связывание» или «предпочтительное связывание» включает соединение, например, белок, нуклеиновую кислоту, антитело и тому подобное, которое распознает и связывается со конкретной молекулой, но которое по существу не распознает или не связывается с другими молекулами в образце. Например, антитело или пептидный рецептор, который распознает и связывается с когнатным лигандом или с партнером по связыванию (например, антитело против TL1A, которое связывается с TL1A) в образце, но по существу не распознает или не связывается с другими молекулами в образце, специфически связывается с данным когнатным лигандом или партнером по связыванию. Таким образом, при обозначенных условиях анализа точно определенная связывающая группировка (например, антитело или его антигенсвязывающая часть, или рецептор, или его лигандсвязывающая часть) предпочтительно связывается с конкретной молекулой-мишенью и не связывается в значительном количестве с другими компонентами, присутствующими в тестируемом образце.
Для отбора антитела или пептида, который специфически связывается с интересующей молекулой, можно использовать целый ряд форматов анализа. Например, твердофазный иммуноферментный анализ (ELISA), иммунопреципитация, Biacore™ (GE Healthcare, Piscataway, NJ), KinExA, флуоресцентная сортировка клеток (FACS), Octet™ (ForteBio, Inc., Menlo Park, CA) и вестерн-блоттинг находятся среди многих анализов, которые можно использовать для идентификации антитела, которое специфично реагирует с антигеном или рецептором, или его лигандсвязывающей части, которая специфически связывает когнатный лиганд или партнер связывания. Типично специфичная или селективная реакция будет по меньшей мере в два раза превышать фоновый сигнал или шум, более типично более чем в 10 раз превышать фон, даже более типично более чем в 50 раз превышать фон, более типично более чем в 100 раз превышать фон, еще более типично более чем в 500 раз превышать фон, даже более типично более чем в 1000 раз превышать фон, и даже более типично более чем в 10000 раз превышать фон. Также говорят, что антитело «специфически связывается» с антигеном, когда равновесная константа диссоциации (KD) меньше или равна 1 мкМ, предпочтительно меньше или равна 100 нМ, более предпочтительно меньше или равна 10 нМ, еще более предпочтительно меньше или равна 1 нМ, даже более предпочтительно меньше или равна 100 пМ, еще более предпочтительно меньше или равна 10 пМ и даже более предпочтительно меньше или равна 1 пМ.
Термин «аффинность связывания» используется здесь как мера силы нековалентного взаимодействия между двумя молекулами, например, антителом или его фрагментом и антигеном. Термин «аффинность связывания» используется для описания одновалентных взаимодействий (собственная активность).
Аффинность связывания между двумя молекулами, например, антителом или его фрагментом и антигеном, через одновалентное взаимодействие можно количественно измерять путем определения константы диссоциации (KD). В свою очередь, KD можно определять путем измерения кинетики образования и диссоциации комплекса, используя, например, способ поверхностного плазмонного резонанса (SPR) (Biacore). Константы скорости, соответствующие ассоциации и диссоциации одновалентного комплекса, именуются константа скорости ассоциации ka (или kon) и константа скорости диссоциации kd (или koff) соответственно. KD соотносится с ka и kd через уравнение KD равна отношению kd и ka. Значение константы диссоциации можно определять непосредственно хорошо известными способами и можно рассчитывать даже для сложных смесей такими способами, как, например, способы, изложенные в Caceci et al. (1984, Byte 9: 340-362). Например, KD может быть установлена с использованием анализа связывания на двойном нитроцеллюлозном фильтре, такого как анализ, раскрытый Wong & Lohman (1993, Proc. Natl. Acad. Sci. USA 90: 5428-5432). В данной области известны другие стандартные анализы для оценки способности к связыванию лигандов, таких как антитела, в отношении антигенов-мишеней, включающие, например, ELISA, вестерн-блоттинг, RIA (радиоиммуноанализ) и проточную цитометрию, и другие анализы, проиллюстрированные здесь примерами в других местах. Кинетику связывания и аффинность связывания антитела также можно оценивать стандартными анализами, известными в данной области, такими как поверхностный плазмонный резонанс (SPR), например, с использованием системы Biacore™ или KinExA.
Можно проводить анализ конкурентного связывания, в котором связывание антитела с антигеном сравнивают со связыванием мишени другим лигандом данной мишени, таким как другое антитело или растворимый рецептор, который в противном случае связывается с мишенью. Концентрация, при которой происходит 50%-ное ингибирование, известна как Ki. При идеальных условиях Ki эквивалента KD. Значение Ki никогда не будет меньше, чем KD, так что измерение Ki можно с удобством заменять для получения верхней границы KD.
Следуя приведенному выше определению аффинности связывания, ассоциированные с разными молекулярными взаимодействиями, например, сравнение аффинности связывания разных антител в отношении данного антигена, можно проводить посредством сравнения значений KD в отношении индивидуальных комплексов антитело/антиген. Значения KD в отношении антител или других партнеров по связыванию можно определять с использованием способов, хорошо установленных в данной области. Одним способом определения KD является применение поверхностного плазмонного резонанса, типично с использованием системы биосенсора, такой как система Biacore®.
Аналогично специфичность взаимодействия можно оценивать путем определения и сравнения значения KD в отношении интересующего взаимодействия, например, специфичного взаимодействия между антителом и антигеном, со значением KD не интересующего взаимодействия, например, контрольного антитела, для которого известно, что оно не связывается с TL1A.
Антитело, которое специфически связывается с его мишенью, может связываться с его мишенью с высокой аффинностью, то есть, демонстрируя низкую KD, как обсуждалось выше, и может связываться с другими молекулами, не являющимися мишенями, с меньшей аффинностью. Например, антитело может связываться с молекулами, не являющимися мишенями, с KD 1×10-6 M или более, более предпочтительно 1×10-5 M или более, более предпочтительно 1×10-4 М или более, более предпочтительно 1×10-3 М или более, даже более предпочтительно 1×10-2 М или более. Антитело или его антигенсвязывающий фрагмент по изобретению предпочтительно способно связываться с его мишенью с аффинностью, которая по меньшей мере двухкратно, 10-кратно, 50-кратно, 100-кратно, 200-кратно, 500-кратно, 1000-кратно или 10000-кратно или более выше, чем его аффинность в отношении связывания с другой молекулой, не являющейся TL1A.
Как известно в данной области, термин «область Fc» используется для определения C-концевой области тяжелой цепи иммуноглобулина. «Область Fc» может представлять собой область Fc с природной последовательностью или вариант области Fc. Несмотря на то, что границы области Fc тяжелой цепи иммуноглобулина могут варьировать, обычно определяется, что область Fc тяжелой цепи человеческого IgG простирается от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. Нумерация остатков в области Fc представляет собой нумерацию согласно индексу EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Область Fc иммуноглобулина обычно содержит два константных домена, CH2 и CH3. Как известно в данной области, область Fc может присутствовать в димерной или в мономерной форме.
Термин «рецептор Fc» и «FcR» в том виде, как он здесь используется, описывает рецептор, который связывается с областью Fc антитела. Предпочтительный FcR представляет собой человеческий FcR с природной последовательностью. Кроме того, предпочтительный FcR представляет собой FcR, который связывается с антителом IgG (гамма рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы данных рецепторов, образовавшиеся в результате альтернативного сплайсинга. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют аналогичные аминокислотные последовательности, которые отличаются прежде всего в их цитоплазматических доменах. Обзор FcR дается в Ravetch and Kinet, 1991, Ann. Rev. Immunol., 9: 457-92; Capel et al., 1994, Immunomethods, 4: 25-34 и de Haas et al., 1995, J. Lab. Clin. Med., 126: 330-41. «FcR» также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., 1976, J. Immunol., 117: 587 и Kim et al., 1994, J. Immunol., 24: 249).
«Функциональная область Fc» обладает по меньшей мере одной эффекторной функцией области Fc с природной последовательностью. Типичные «эффекторные функции» включают связывание C1q; комплемент-зависимую цитотоксичность; связывание рецептора Fc; антителозависимую клеточноопосредованную цитотоксичность; фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора B-клеток) и т.д. Такие эффекторные функции обычно требуют того, чтобы область Fc была объединена со связывающим доменом (например, вариабельным доменом антитела или его антигенсвязывающей частью), и могут оцениваться с использованием разных анализов, известных в области оценки таких эффекторных функций антитела.
«Область Fc с природной последовательностью» содержит аминокислотную последовательность, идентичную аминокислотной последовательности области Fc, обнаруженной в природе. «Вариант области Fc» содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности области Fc с природной последовательностью за счет по меньшей мере одной модификации аминокислоты, тем не менее, сохраняет по меньшей мере одну эффекторную функцию области Fc с природной последовательностью. Предпочтительно вариант области Fc имеет по меньшей мере одну аминокислотную замену по сравнению с областью Fc с природной последовательностью или с областью Fc родительского полипептида, например, от примерно одной до примерно десяти аминокислотных замен и, предпочтительно, от примерно одной до примерно пяти аминокислотных замен в области Fc с природной последовательностью или в области Fc родительского полипептида. Приведенный здесь вариант области Fc предпочтительно будет обладать по меньшей мере примерно 80%-ной идентичностью последовательности с областью Fc с нативной последовательностью и/или с областью Fc родительского полипептида и, наиболее предпочтительно, по меньшей мере примерно 90%-ной идентичностью последовательности с ними, более предпочтительно по меньшей мере примерно 95%-ной, по меньшей мере примерно 96%-ной, по меньшей мере примерно 97%-ной, по меньшей мере примерно 98%-ной, по меньшей мере примерно 99%-ной идентичностью последовательности с ними.
Как известно в данной области, термины «полинуклеотид» или «нуклеиновая кислота» используются здесь взаимозаменяемо для названия цепей нуклеотидов любой длины и включают ДНК и РНК. Нуклеотидами могут быть дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в цепь посредством ДНК- или РНК-полимеразы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификация нуклеотидной структуры, при ее наличии, может быть придана до или после сборки цепи. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, как, например, посредством конъюгирования с метящим компонентом. Другие типы модификаций включают, например, «кэпы», замену одного или более чем одного встречающегося в природе нуклеотида аналогом, межнуклеотидные модификации, такие как, например, модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие группировки в виде боковых цепей, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркалирующими агентами (например, с акридином, псораленом и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие агенты, модификации с модифицированными связями (например, альфа аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(дов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами, или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевые OH могут быть фосфорилированными или замещенными аминами или группировками органических кэппирующих групп из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать формы, аналогичные сахарам рибозе или дезоксирибозе, которые обычно известны в данной области, включающие, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги нуклеозидов без оснований, такие как метилрибозид. Одна или более чем одна фосфодиэфирная связь может быть заменена альтернативными связывающими группами. Данные альтернативные связывающие группы включают воплощения, в которых фосфат заменен P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацеталь»), в которых каждый R или R' представляет собой независимо Н или замещенный или незамещенный алкил (1-20 C), возможно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил, но не ограничиваются ими. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем полинуклеотидам, на которые здесь дается ссылка, включая РНК и ДНК.
Термин «вектор» в том виде, как он здесь используется, означает конструкцию, которая способна доставлять и, предпочтительно, экспрессировать один или более чем один интересующий ген или последовательность в клетке-хозяине. Примеры векторов включают вирусные векторы, экспрессионные векторы на основе голой ДНК или РНК, плазмидные, космидные или фаговые векторы, экспрессионные векторы на основе ДНК или РНК, ассоциированные с катионными конденсирующими агентами, экспрессионные векторы на основе ДНК или РНК, инкапсулированные в липосомы, и определенные эукариотические клетки, такие как клетки-продуценты.
Термин «последовательность контроля экспрессии» в том виде, как он здесь используется, означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательность контроля экспрессии может представлять собой промотор, такой как конститутивный или индуцибельный промотор, или энхансер. Последовательность контроля экспрессии связана функциональным образом с последовательностью нуклеиновой кислоты, подлежащей транскрипции.
«Клетка-хозяин» включает индивидуальную клетку или культуру клеток, которая может быть или была реципиентом вектора(ров) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и данное потомство не обязательно может быть полностью идентичным (по морфологии или по набору геномной ДНК) исходной родительской клетке из-за природной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные и/или трансформированные in vivo полинуклеотидом по данному изобретению.
Термин «лечение» в том виде, как он здесь используется, представляет собой подход для получения полезных или желательных клинических результатов. В целях данного изобретения полезные или желательные клинические результаты включают одно или более чем одно из следующего: улучшенная выживаемость (пониженная смертность), уменьшение воспалительного ответа на заболевание, уменьшение количества фиброза ткани, улучшение внешнего вида болезненных поражений, ограничение патологических поражений фокальными участками, пониженная степень поражения из-за заболевания, меньшая продолжительность заболевания и/или уменьшение числа, степени или продолжительности симптомов, относящихся к заболеванию, но не ограничиваются ими. Данный термин включает введение соединений или агентов по настоящему изобретению для предупреждения или задержки начала симптомов, осложнений или биохимических показателей заболевания, облегчения симптомов или остановки или ингибирования дальнейшего развития заболевания, состояния или расстройства. Лечение может быть профилактическим (для предупреждения или задержки начала заболевания, или для предупреждения проявления его клинических или субклинических симптомов) или терапевтическим подавлением или облегчением симптомов после проявления заболевания.
«Уменьшение интенсивности» означает уменьшение или улучшение одного или более чем одного симптома по сравнению с отсутствием введения антитела против TL1A. «Уменьшение интенсивности» также включает сокращение или уменьшение продолжительности симптома.
Термин «эффективная дозировка» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции в том виде, как он здесь используется, представляет собой достаточное количество для того, чтобы воздействовать на любой один или более чем один полезный или желательный результат. В более конкретных аспектах эффективное количество предупреждает, облегчает или уменьшает интенсивность симптомов заболевания или инфекции и/или продлевает выживание субъекта, которого лечат. Для профилактического применения полезные или желательные результаты включают устранение или уменьшение риска, уменьшение тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, представляемые во время развития заболевания. Для терапевтического применения полезные или желательные результаты включают клинические результаты, такие как уменьшение одного или более чем одного симптома заболевания, расстройства или состояния, опосредованного TL1A, уменьшение дозы других лекарственных средств, требующихся для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержку прогрессирования заболевания пациентов. Эффективную дозировку можно вводить за одно или более чем одно введение. Для целей данного изобретения эффективная дозировка лекарственного средства, соединения или фармацевтической композиции представляет собой достаточное количество для осуществления профилактического или терапевтического лечения либо непосредственно, либо опосредованно. Как понятно в клиническом контексте, эффективная дозировка лекарственного средства, соединения или фармацевтической композиции может или не может достигаться в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективная дозировка» может рассматриваться в контексте введения одного или более чем одного терапевтического агента, и может считаться, что один агент дается в эффективном количестве, если, в сочетании с одним или более чем одним другим агентом, может быть достигнут или достигается желательный результат.
«Индивид» или «субъект» представляет собой млекопитающее, более предпочтительно человека. Млекопитающие также включают сельскохозяйственных животных (например, коровы, свиньи, лошади, курицы и т.д.), спортивных животных, домашних животных, приматов, лошадей, собак, кошек, мышей и крыс, но не ограничиваются ими. В некоторых воплощениях индивид считается подверженным риску заболевания, расстройства или состояния, опосредованного или ассоциированного со связыванием TL1A с его рецептором и сигнализацией, опосредованной этим.
Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» в том виде, как он здесь используется, включает любое вещество, которое, при объединении с активным ингредиентом, обеспечивает сохранение ингредиентом биологической активности, и не реагирует с иммунной системой субъекта. Примеры включают любой из стандартных фармацевтических носителей, такой как фосфатно-солевой буферный раствор, вода, эмульсии, такие как эмульсия типа «масло в воде» и разные типы увлажнителей, но не ограничиваются ими. Предпочтительные разбавители для аэрозольного или парентерального введения представляют собой фосфатно-солевой буферный раствор (PBS) или физиологический раствор (0,9%). Композиции, содержащие такие носители, готовят хорошо известными традиционными способами (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000).
Приведенная здесь ссылка на «примерное» значение или параметр включает (и описывает) воплощения, которые направлены на данное значение или параметр как таковой. Например, описание, относящееся к «примерно X» включает описание «X». Числовые интервалы включают числа, ограничивающие интервал. В общем, термин «примерно» относится к указанному значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки указанного значения (например, в пределах 95%-го доверительного интервала среднего значения) или в пределах 10-процентного отклонения от указанного значения, какое бы оно ни было большим. Когда термин «примерно» используется в контексте периода времени (годы, месяцы, недели, сутки и т.д.), термин «примерно» означает данный период времени плюс или минус одно значение следующего подчиненного периода времени (например, примерно 1 год означает 11-13 месяцев; примерно 6 месяцев означает 6 месяцев плюс или минус 1 неделя; примерно 1 неделя означает 6-8 суток; и т.д.) или в пределах 10-процентного отклонения от указанного значения, какое бы оно ни было большим.
Не взирая на то, что числовые интервалы и параметры, отражающие широкий объем изобретения, представляют собой приближения, числовые значения, изложенные в конкретных примерах, приводятся настолько точно, насколько это возможно. Любое числовое значение, однако, по своей природе содержит определенные ошибки, неизбежно возникающие из стандартного отклонения, обнаруженного при соответствующих им тестовых измерениях. Кроме того, следует понимать, что все раскрытые здесь интервалы охватывают любой и все подинтервалы, отнесенные здесь к какой-либо категории. Например, следует рассматривать то, что заявленный интервал «от 1 до 10» включает любой и все подинтервалы между (и включительно) минимальным значением 1 и максимальным значением 10; то есть, все подинтервалы, начинающиеся с минимального значения 1 или более, например, от 1 до 6,1, и заканчивающиеся максимальным значением 10 или менее, например, от 5,5 до 10.
Понятно, что всякий раз, когда воплощения описываются здесь с формулировкой «содержащий», также предлагаются аналогичные в иных отношениях воплощения, описанные в терминах «состоящий из» и/или «по существу состоящий из». Во всем данном описании и формуле изобретения будет понятно, что слово «содержать» или вариации, такие как «содержит» или «содержащий», подразумевает включение заявленного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если иного не требует контекст, термины в единственном числе будут включать термины во множественном числе, и термины во множественном числе будут включать термины в единственном числе. Подразумевается, что любой пример(-ы), после термина «напр.» или «например» не является исчерпывающим или ограничивающим.
Когда аспекты или воплощения изобретения описываются в терминах группы Маркуша или других групп альтернатив, настоящее изобретение охватывает не только всю группу, перечисленную как целое, но и каждого члена группы индивидуально и все возможные подгруппы главной группы, но также и главную группу, за исключением одного или более чем одного из членов группы. В настоящем изобретении также рассматривается явное исключение одного или более чем одного любого члена группы в заявленном изобретении.
Если не определено иначе, все использованные здесь технические и научные термины имеют такое же значение, которое обычно понятно обычному специалисту в данной области, к которой принадлежит данное изобретение. В случае конфликта настоящее описание, включая определения, будет иметь преимущество.
Здесь описаны типичные материалы и методы, хотя в воплощении на практике или тестировании настоящего изобретения также могут быть использованы материалы и методы, аналогичные или эквивалентные описанным здесь материалам и методам. Данные материалы, методы и примеры являются лишь иллюстративными и не предназначены для того, чтобы быть ограничивающими.
Антитела против TL1A
Настоящее изобретение относится к антителам, которые связываются с TL1A. Антитела предпочтительно специфически связываются с TL1A. В частности, изобретение относится к антителам, которые связываются с TL1A, и которые модулируют его активность. Например, антитело или его антигенсвязывающий фрагмент по изобретению может иметь способность уменьшать или ингибировать связывание TL1A с его рецептором DR3 и, посредством этого, уменьшать или ингибировать последующую сигнализацию от рецептора. Изобретение также относится к композициям, содержащим такие антитела, а также к применениям таких антител, включающим терапевтические и фармацевтические применения.
Под термином «TL1A» подразумевается любая встречающаяся в природе форма TL1A, независимо от того, мономерная или мультимерная, включающая димеры, тримеры и т.д., которые могут происходить из любого подходящего организма. Термин «TL1A» в том виде, как он здесь используется, относится к TL1A млекопитающего, такого как человек, крыса или мышь, а также примата, не являющегося человеком, к коровьему, овечьему или свиному TL1A. Предпочтительно TL1A является человеческим (см., например, регистрационный номер Genbank NP_005109, SEQ ID NO: 258). Термин «TL1A» также охватывает фрагменты, варианты, изоформы и другие гомологи таких молекул TL1A. Варианты молекул TL1A обычно будут характеризоваться наличием такого же типа активности, что и встречающийся в природе TL1A, как, например, способности связываться с DR3 и способности индуцировать опосредованную рецептором активность.
TL1A может находиться в гомомультимерной форме. Гомомультимер может содержать две, три, четыре, пять, шесть или более чем шесть мономерных единиц TL1A. В некоторых аспектах гомомультимер может представлять собой гомодимер или гомотример. В некоторых аспектах существуют 3 мономера TL1A в гомомультимере, и гомомультимер TL1A представляет собой гомотример. В некоторых аспектах существуют 2 мономера TL1A в гомомультимере TL1A, и гомомультимер представляет собой гомодимер.
TL1A может содержать один или более чем один, два или более чем два, три или более чем три, четыре или более чем четыре, пять или более чем пять, шесть или более чем шесть, семь или более чем семь, восемь или более чем восемь, девять или более чем девять, десять или более чем десять, двенадцать или более чем двенадцать, или пятнадцать или более чем пятнадцать доступных на поверхности остатков TL1A. Когда TL1A содержит гомомультимерную форму TL1A, тогда мишень может содержать один или более чем один, два или более чем два, три или более чем три, четыре или более чем четыре, пять или более чем пять, шесть или более чем шесть, семь или более чем семь, восемь или более чем восемь, девять или более чем девять, десять или более чем десять, двенадцать или более чем двенадцать, или пятнадцать или более чем пятнадцать доступных на поверхности остатков первой субъединицы TL1A, и один или более чем один, два или более чем два, три или более чем три, четыре или более чем четыре, пять или более чем пять, шесть или более чем шесть, семь или более чем семь, восемь или более чем восемь, девять или более чем девять, десять или более чем десять, двенадцать или более чем двенадцать, или пятнадцать или более чем пятнадцать доступных на поверхности остатков второй субъединицы TL1A.
Молекула-мишень может содержать известный эпитоп из TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению специфически связывается с TL1A и ингибирует взаимодействие с DR3, ингибируя, посредством этого, активность TL1A. Под терминами «активность, опосредованная TL1A», «эффект, опосредованный TL1A», «активность TL1A», «биологическая активность TL1A» или «функция TL1A», используемыми здесь взаимозаменяемо, подразумевается любая активность, опосредованная взаимодействием TL1A с когнатным рецептором, включающая связывание TL1A с DR3, активацию через связывание DR3 последующей экспрессии/секреции цитокинов, особенно провоспалительных цитокинов, таких как IFNγ (интерферон-гамма), IL-6 (интерлейкин-6), TNF-α (фактор некроза опухолей-альфа), IL-17, IL-22, IL-4, IL-5, IL-13, IL-25 и другие цитокины, которые хорошо известны специалистам в данной области, любая другая активность TL1A - либо известная в данной области, либо подлежащая прояснению в будущем, но не ограничивающаяся ими.
Таким образом, в способах по изобретению используется антитело против TL1A или его антигенсвязывающий фрагмент по изобретению, который блокирует, подавляет или уменьшает (например, значительно уменьшает) активность TL1A, включающую последующие события, опосредованные связыванием TL1A с его рецептором, DR3. Антитело против TL1A или его антигенсвязывающий фрагмент по изобретению может демонстрировать любую одну или более чем одну из следующих характеристик: (а) специфичное связывание с TL1A; (б) блокирование взаимодействия TL1A с его рецептором DR3; (в) блокирование, подавление или уменьшение последующих сигнальных событий, которые активируются DR3; и (г) блокирование, подавление или уменьшение любой другой активности TL1A или активности, опосредованной TL1A.
В одном воплощении согласно раскрытию предложено любое из следующего или композиции (включая фармацевтические композиции), содержащие антитело, имеющее последовательность легкой цепи или ее часть, и тяжелую цепь или ее часть, происходящие из следующих антител: 1D1, 1D1 1.27, 1D1 1.28, 1D1 1.29, 1D1 1.30, 1D1 1.31, 1D1 1.32, 1D1 1.33, 1D1 1.34, 15А9, 15С11, 7D4, 22F9, 9B3, 2B11.
Антитела, полезные в настоящем изобретении, могут охватывать моноклональные антитела, поликлональные антитела, фрагменты антител (например, Fab, Fab', F(ab')2, Fv, Fc и т.д.), химерные антитела, биспецифичные антитела, гетероконъюгатные антитела, одноцепочечные (ScFv), их мутанты, слитые белки, содержащие часть антитела (например, доменное антитело), гуманизированные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена требующейся специфичности, включая гликозилированные варианты антител, варианты аминокислотной последовательности антител и ковалентно модифицированные антитела. Антитела могут быть мышиными, крысиными, человеческими или любого другого происхождения (включая химерные или гуманизированные антитела). В некоторых воплощениях антитело против TL1A представляет собой моноклональное антитело. В некоторых воплощениях антитело представляет собой химерное, гуманизированное или человеческое антитело. В конкретном воплощении антитело представляет собой человеческое антитело.
В некоторых случаях антитела по настоящему изобретению определяются гипервариабельными областями («CDR»). В определенных случаях CDR находятся в человеческом вариабельном домене. В другом воплощении CDR находятся в пределах гуманизированного вариабельного домена. В других воплощениях CDR находятся в пределах химерного вариабельного домена. Антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению включает антитело или его антигенсвязывающий фрагмент любого класса, такого как IgG, IgA, IgE или IgM (или его подкласс). В одном воплощении антитело представляет собой IgG, включающий любой из главных подклассов (например, IgG1, IgG2, IgG3, IgG4). В одном воплощении антитело принадлежит к подтипу IgG1. В другом воплощении антитело принадлежит к подтипу IgG2. В других случаях антитело может быть подтипа IgG3. В других случаях антитело может представлять собой IgG4. В других случаях антитело может представлять собой антитело IgA, включая любой из его подтипов. В одном воплощении антитело представляет собой IgA1. В другом воплощении антитело представляет собой IgA2.
В одном воплощении антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению содержит вариабельную область, которая содержит каркасные области, где каркасные области выбраны из группы, состоящей из каркасных областей IgG, IgA, IgM, IgE и IgD. В другом воплощении антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению содержит вариабельную область, которая содержит каркасные области, где каркасные области выбраны из группы, состоящей из каркасных областей IgG1, IgG2, IgG3, IgG4. В еще одном другом воплощении антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению содержит вариабельную область, которая содержит каркасные области, где каркасные области выбраны из группы, состоящей из человеческой, гуманизированной и химерной каркасной области.
Антитела против TL1A по изобретению могут быть получены любым способом, известным в данной области. Общие методики для получения человеческих и мышиных антител известны в данной области и/или описаны в данном документе.
Известные в данной области способы можно использовать для выявления и/или измерения уменьшения, снижения интенсивности или нейтрализации активности TL1A, опосредованных описанными здесь антителами или антигенсвязывающими фрагментами. В некоторых воплощениях антитело против TL1A идентифицируют инкубированием агента-кандидата (например, DR3) с TL1A и отслеживанием связывания и/или сопутствующего уменьшения или ингибирования биологической активности TL1A. Анализ связывания можно проводить, например, с очищенным(ми) полипептидом(-ами) TL1A или с клетками, экспрессирующими в природе разные рецепторы или трансфицированными для экспрессии рецепторов TL1A. В одном воплощении анализ связывания представляет собой конкурентный анализ связывания, где оценивается способность антитела-кандидата конкурировать с известным антителом против TL1A за связывание с TL1A. Данный анализ можно проводить в разных форматах, включая формат ELISA (твердофазный иммуноферментный анализ). В некоторых воплощениях антитело против TL1A идентифицируют инкубированием антитела-кандидата с TL1A и отслеживанием связывания. В некоторых воплощениях антитело против TL1A идентифицируют инкубированием антитела-кандидата (например, человеческого антитела против TL1A) с TL1A и отслеживанием связывания второго антитела против TL1A с TL1A для оценки того, конкурирует ли одно антитело за связывание с TL1A со вторым антителом.
Кроме того, активность антитела-кандидата против TL1A можно измерять известными биопробами для тестирования намеченных биологических активностей. В некоторых воплощениях клеточный анализ in vitro используется для дополнительной характеристики антитела-кандидата против TL1A. Например, биопробы можно использовать для непосредственного скрининга кандидатов. Некоторые из способов идентификации и характеристики антитела против TL1A подробно описаны в Примерах.
Как обсуждалось выше, антитела против TL1A по изобретению демонстрируют одну или более чем одну из следующих характеристик: (а) специфичное связывание с TL1A; (б) блокирование взаимодействия TL1A с его рецептором - DR3 и (в) ослабление или блокирование последующих событий сигнализации. Предпочтительно антитело против TL1A или его антигенсвязывающий фрагмент по изобретению имеет по меньшей мере одну из данных характеристик, более предпочтительно, антитело имеет две или более чем две из данных характеристик. Более предпочтительно антитела имеют все данные характеристики.
Эпитопы TL1A
Антитела против TL1A могут быть охарактеризованы с использованием дополнительных способов, хорошо известных в данной области. Например, одним способом является идентификация эпитопа, с которым оно связывается, или «эпитопное картирование». В данной области имеется много способов картирования и характеристики расположения эпитопов на белках, включая определение кристаллической структуры комплекса антитело-антиген, конкурентные анализы, анализы экспрессии фрагмента гена и анализы на основе синтетических пептидов, как описано, например, в Главе 11 Harlow and Lane, Using Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999. В дополнительном примере для определения последовательности, с которой связывается антитело против TL1A, можно использовать эпитопное картирование. Эпитопное картирование коммерчески доступно из разных источников, например, Pepscan Systems (Edelhertweg 15, 8219 РН Lelystad, Нидерланды). Эпитоп может быть линейным эпитопом, т.е. содержащимся в одном отрезке аминокислот, или конформационным эпитопом, образованным трехмерным взаимодействием аминокислот, которые не обязательно могут содержаться в одном отрезке. Пептиды варьирующей длины (например, по меньшей мере 4-6 аминокислот в длину) могут быть выделены или синтезированы (например, рекомбинантно) и использованы для анализов связывания с антителом против TL1A. В другом примере эпитоп, с которым связывается антитело против TL1A, может быть определен в систематическом скрининге с использованием перекрывающихся пептидов, происходящих из последовательности TL1A, и определения связывания антителом. Согласно анализам экспрессии фрагментов генов открытая рамка считывания, кодирующая TL1A, может быть фрагментирована либо случайно, либо посредством специфических генетических конструкций, и определяется реакционная способность экспрессируемых фрагментов TL1A с антителом, подлежащим тестированию. Фрагменты генов, например, могут быть получены с помощью ПЦР (полимеразная цепная реакция) и затем транскрибированы и транслированы в белок in vitro в присутствии радиоактивных аминокислот. Связывание антитела с радиоактивно мечеными фрагментами TL1A затем определяют посредством иммунопреципитации и гель-электрофореза. Определенные эпитопы также могут быть идентифицированы с использованием больших библиотек последовательностей случайных пептидов, подвергающихся дисплею на поверхности фаговых частиц (фаговые библиотеки) или дрожжей (дрожжевой дисплей). В качестве альтернативы, определенную библиотеку перекрывающихся пептидных фрагментов можно тестировать на связывание с тестируемым антителом в простых анализах связывания. В дополнительном примере для идентификации остатков, требующихся, достаточных и/или необходимых для связывания эпитопа, можно проводить мутагенез антигена, эксперименты по перетасовке домена и мутагенез на основе аланинового сканирования. Например, эксперименты по мутагенезу на основе аланинового сканирования можно проводить с использованием мутантного TL1A, в котором разные остатки полипептида TL1A были заменены аланином. Посредством оценки связывания антитела с мутантным TL1A можно оценивать важность конкретных остатков TL1A для связывания антитела.
Еще одним другим способом, который можно использовать для характеристики антитела против TL1A, является применение конкурентных анализов с другими антителами, для которых известно, что они связываются с таким же антигеном, т.е. с разными фрагментами на TL1A, для определения того, связывается ли антитело против TL1A с тем же самым эпитопом, что и другие антитела. Конкурентные анализы хорошо известны специалистам в данной области.
Кроме того, эпитоп для данной пары связывания антитело/антиген можно определять и характеризовать с разными уровнями детализации с использованием множества экспериментальных и расчетных способов картирования эпитопов. Данные экспериментальные способы включают мутагенез, рентгеноструктурный анализ, спектроскопию ядерного магнитного резонанса (ЯМР), масс-спектрометрию на основе обмена водород/дейтерий (H/D-MC) и разные способы конкурентного связывания, хорошо известные в данной области. Поскольку каждый способ основывается на уникальном принципе, описание эпитопа тесно связано со способом, посредством которого он был определен. Таким образом, эпитоп для данной пары антитело/антиген будет определяться по-разному, в зависимости от использованного способа эпитопного картирования.
На самом подробном уровне эпитоп для взаимодействия между Ag и Ab может быть определен посредством пространственных координат, определяющих контакты атомов, присутствующие во взаимодействии Ag-Ab, а также информации по их относительным вкладам в термодинамику связывания. На менее подробном уровне эпитоп может быть охарактеризован пространственными координатами, определяющими контакты атомов между Ag и Ab. На еще менее подробном уровне эпитоп может быть охарактеризован посредством аминокислотных остатков, которые он содержит, как определено посредством специфического критерия, например, посредством расстояния между атомами (например, тяжелыми атомами, т.е. не являющимися водородом) в Ab и Ag. На еще менее подробном уровне эпитоп может быть охарактеризован посредством функции, например, посредством конкурентного связывания с другими Ab. Эпитоп также может быть определен более общим способом, как содержащий аминокислотные остатки, замена которых другим аминокислотным остатком будет изменять характеристики взаимодействия между Ab и Ag (например, с использованием аланинового сканирования).
В контексте кристаллической структуры, полученной рентгеноструктурным анализом, определенной по пространственным координатам комплекса между антителом, например, фрагментом Fab, и его Ag, приведенный здесь термин «эпитоп», если не определено иначе или не противоречит контексту, конкретно определяется как остатки TL1A, характеризуемые наличием тяжелого атома (т.е. атома, не являющегося водородом) в пределах расстояния  от тяжелого атома в Ab. В качестве альтернативы, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом или с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. В качестве альтернативы, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом, или если он связан водородной связью с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или если он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. Таким образом, считается, что аминокислота на антителе «связывается» с аминокислотой на TL1A, если удовлетворяется по меньшей мере одно из данных условий, например, аминокислотный остаток TL1A имеет тяжелый атом в пределах
от тяжелого атома в Ab. В качестве альтернативы, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом или с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. В качестве альтернативы, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом, или если он связан водородной связью с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или если он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. Таким образом, считается, что аминокислота на антителе «связывается» с аминокислотой на TL1A, если удовлетворяется по меньшей мере одно из данных условий, например, аминокислотный остаток TL1A имеет тяжелый атом в пределах  от тяжелого атома на аминокислотном остатке антитела, аминокислотный остаток TL1A участвует в водородной связи с аминокислотным остатком антитела, аминокислотный остаток TL1A связывается водородной связью с молекулой воды, где та же самая молекула воды также связывается водородной связью с аминокислотным остатком антитела, аминокислотный остаток TL1A участвует в солевом мостике с аминокислотным остатком антитела и аминокислотный остаток TL1A имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом.
от тяжелого атома на аминокислотном остатке антитела, аминокислотный остаток TL1A участвует в водородной связи с аминокислотным остатком антитела, аминокислотный остаток TL1A связывается водородной связью с молекулой воды, где та же самая молекула воды также связывается водородной связью с аминокислотным остатком антитела, аминокислотный остаток TL1A участвует в солевом мостике с аминокислотным остатком антитела и аминокислотный остаток TL1A имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом.
Из того факта, что описания и определения эпитопов, в зависимости от использованного способа эпитопного картирования, получают с разными уровнями подробностей, следует, что сравнение эпитопов для разных Ab на том же самом Ag, аналогичным образом, могут проводиться с разными уровнями подробностей.
Говорят, что эпитопы, описанные на аминокислотном уровне, например, определенные из структуры, полученной рентгеноструктурным анализом, являются идентичными, если они содержат одинаковый набор аминокислотных остатков. Говорят, что эпитопы перекрываются, если имеется по меньшей мере один общий аминокислотный остаток для эпитопов. Говорят, что эпитопы являются отдельными (уникальными), если данные эпитопы не имеют общего аминокислотного остатка.
Говорят, что эпитопы, характеризуемые конкурентным связыванием, являются перекрывающимися, если связывание соответствующими антителами является взаимоисключающим, т.е. связывание одним антителом исключает одновременное или последовательное связывание другим антителом. Говорят, что эпитопы являются отдельными (уникальными), если антиген способен приспосабливаться к одновременному связыванию обоими соответствующими антителами.
Определение термина «паратоп» получают из приведенного выше определения «эпитоп» путем обращения точки зрения. Таким образом, термин «паратоп» относится к области или участку на антителе, который специфически связывается с антигеном, т.е. к аминокислотным остаткам на антителе, которые образуют контакт с антигеном (TL1A) в том виде, в котором термин «контакт» определяется здесь в других местах.
В контексте кристаллической структуры, полученной рентгеноструктурным анализом, определенной пространственными координатами комплекса между антителом, например, фрагментом Fab или двумя фрагментами Fab и его антигеном, приведенный здесь термин «паратоп», если не определено иначе или не противоречит контексту, конкретно определяется как остатки антигена, характеризуемые наличием тяжелого атома (т.е. атома, не являющегося атомом водорода) в пределах расстояния  от тяжелого атома в TL1A. В качестве альтернативы или дополнительно, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом или с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или если он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. Согласно указанному выше говорят, что любые аминокислоты «контактируют» друг с другом.
от тяжелого атома в TL1A. В качестве альтернативы или дополнительно, данный аминокислотный остаток TL1A считается частью эпитопа, если он участвует в водородной связи с антителом или с молекулой воды, которая также связана водородной связью с антителом (опосредованное водой связывание водородными связями), или если он участвует в солевом мостике с остатком на антителе, или если он имеет не равный нулю заряд в скрытой области поверхности из-за взаимодействия с антителом. Согласно указанному выше говорят, что любые аминокислоты «контактируют» друг с другом.
Эпитоп и паратоп для данной пары антитело/антиген могут быть идентифицированы традиционными способами. Например, общее положение эпитопа может быть определено путем оценки способности антитела связываться с разными фрагментами или вариантами полипептидов TL1A. Конкретные аминокислотные остатки в пределах TL1A, которые образуют контакт с антителом (эпитоп), и конкретные аминокислотные остатки в антителе, которые образуют контакт с TL1A (паратоп), также могут быть определены с использованием традиционных способов, таких как способы, описанные в примерах. Например, антитело и молекулу-мишень можно объединять, и можно кристаллизовать комплекс антитело/антиген. Кристаллическую структуру комплекса можно определять и использовать для идентификации специфических сайтов взаимодействия между антителом и его мишенью.
Антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению может связываться с тем же самым эпитопом или доменом TL1A, что и антитела по изобретению, которые здесь конкретно раскрыты. Например, другие еще не идентифицированные антитела по изобретению могут быть идентифицированы посредством сравнения их связывания с TL1A со связыванием любого из следующих моноклональных антител: 1D1, 1D1 1.27, 1D1 1.28, 1D1 1.29, 1D1 1.30, 1D1 1.31, 1D1 1.32, 1D1 1.33, 1D1 1.34, 15А9, 15С11, 7D4, 22F9, 9B3, 2B11 и их варианты; или посредством сравнения функции еще неидентифицированных антител с функцией описанных здесь антител; и/или посредством сравнения эпитопа/контактных остатков на TL1A еще неидентифицированных антител с эпитопом/контактными остатками антител по изобретению. Анализы и пробы, которые можно использовать с целью такой идентификации, включают анализы, оценивающие конкуренцию за связывание TL1A между интересующим антителом или его антигенсвязывающим фрагментом и DR3 в анализах биологической активности, как описано в Примерах 10-14, и в анализах кристаллической структуры антитела.
Такой анализ кристаллической структуры, как здесь раскрыто, проводили для взаимодействия между родительским антителом 1D1 и TL1A и вариантом антитела - 1D1 1.31 и TL1A. Данный анализ более подробно описан в примерах. Связывание эпитопа антитела 1D1 и TL1A, и антитела 1D1 1.31 и TL1A картировали, как также более подробно описано в примерах.
Здесь также раскрыты подробные взаимодействия между TL1A и его природным лигандом - DR3. Ожидалось, что антитела, как таковые, которые «контактируют» с TL1A по тем же самым аминокислотным остаткам, что и DR3, будут препятствовать взаимодействию между TL1A и DR3. В некоторых воплощениях эпитоп TL1A, как таковой, связываемый антителом или его антигенсвязывающим фрагментом по настоящему изобретению, охватывает один или более чем один остаток TL1A, выбранный из T30 (Т100), V31 (V101), V32 (V102), R33 (R103), Е50 (Е120), L53 (L123), G54 (G124), R86 (R156), G87 (G157), М88 (М158), S136 (S206), N137 (N207), F139 (F209), S164 (S234), L165 (L235), Y168 (Y238), Т169 (Т239), К170 (К240), Е171 (Е241), N42 (N112), F44 (F114), К103 (К173), Р104 (Р174), D105 (D175), S106 (S176), S117 (S187), Y118 (Y188), Р119 (Р189), Е120 (Е190), Q151 (Q221), согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254 [нумерация SEQ ID NO: 258 в скобках].
Как показано в Таблице 42, в которой продемонстрированы аминокислоты TL1A, которые взаимодействуют с лигандом DR3 и антителами 1D1 1.31, 1D1, 26B11 и 7B4, несколько описанных здесь антител взаимодействуют с теми же самыми аминокислотами, что и аминокислоты, которые взаимодействуют с лигандом DR3. Следовательно, в конкретном воплощении эпитоп TL1A, связываемый антителом, охватывает один или более чем один остаток TL1A, выбранный из группы, состоящей из V31 (V101), V32 (V102), R33 (R103), Е50 (Е120), L53 (L123), G54 (G124), R86 (R156), G87 (G157), М88 (М158), S136 (S206), N137 (N207), S164 (S234), L165 (L235), Y168 (Y238), Т169 (Т239), К170 (К240), Е171 (Е241), S117 (S187), Y118 (Y188), Р119 (Р189) и Q151 (Q221), согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254 [нумерация SEQ ID NO: 258 в скобках].
Как показано на Фиг. 5, в некоторых воплощениях антитела против TL1A 1D1 и 1D1 1.31 связываются с гомотримером TL1A между двумя мономерами TL1A. Соответственно, одно 1D1 или 1D1 1.31 может связываться с двумя мономерами TL1A одновременно, и маловероятно, что одно антитело связывается со всеми остатками эпитопа на одном мономере TL1A. В качестве альтернативы, возможно, что одно антитело против TL1A или его антигенсвязывающий фрагмент по изобретению может связываться с некоторыми эпитопами на белке TL1A, тогда как другое антитело против TL1A связывается с другими эпитопами.
Таким образом, в некоторых воплощениях эпитоп TL1A, связываемый антителом или его антигенсвязывающим фрагментом по изобретению, охватывает один или более чем один остаток TL1A, выбранный из К113, Т115, S117, Y118, Р119, Р121, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, T58, E91, Y168, Т169, К170 и E171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Принимая во внимание геометрию связывания антител 1D1 и 1D1 1.31 с TL1A между двумя мономерами TL1A, некоторые из связываемых остатков находятся на первом мономере (также именуемом мономер A цепи A TL1A), и другие связываемые остатки находятся на втором мономере (также именуемом мономер B цепи B TL1A). В частности, один или более чем один связываемый остаток эпитопа TL1A на мономере A выбран из К113, Т115, S117, Y118, Р119, Р121, Т122, Q123, М147, F148, S149 и Q151, и один или более чем один связываемый остаток эпитопа TL1A на мономере В выбран из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171. В некотором воплощении эпитопы, находящиеся на мономере A, связываются одним антителом против TL1A, тогда как эпитопы, находящиеся на мономере Б, связываются другим антителом против TL1A.
В другом воплощении антитело против TL1A или его антигенсвязывающий фрагмент по данному раскрытию связывается с эпитопом на TL1A, содержащим один или более чем один остаток TL1A, выбранный из К113, Y118, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один связываемый остаток эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122, Q123, М147, F148, S149, Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один связываемый остаток эпитопа TL1A на мономере В выбран из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В другом воплощении эпитоп TL1A может содержать аминокислотные остатки, выбранные из группы, состоящей из К113, Y118, Т122, М147, S149, Q151, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где один или более чем один связываемый остаток эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122, М147, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один связываемый остаток эпитопа TL1A на мономере B выбран из группы, состоящей из V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где остатки участвуют в электростатических взаимодействиях между антителом против TL1A или его антигенсвязывающим фрагментом по изобретению и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем  , при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
, при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
В другом воплощении эпитоп TL1A может содержать аминокислотные остатки, выбранные из группы, состоящей из К113, Y118, Т122, S149, R33, Е50, Е52, L53, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один связываемый остаток эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один связываемый остаток эпитопа TL1A на мономере B выбран из группы, состоящей из R33, Е50, Е52, L53, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где остатки участвуют в электростатических взаимодействиях между антителом против TL1A или его антигенсвязывающим фрагментом по изобретению и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем  , при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
, при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
В некоторых воплощениях эпитоп TL1A, связываемый антителами против TL1A по настоящему раскрытию, выбран из группы, состоящей из одного или более чем одного аминокислотного остатка 117-123 SEQ ID NO: 254 и остатков 50-158 SEQ ID NO: 254, где один или более чем один остаток на мономере A выбран из остатков 117-123 SEQ ID NO: 254, и один или более чем один остаток на мономере B выбран из остатков 50-58 SEQ ID NO: 254.
В другом воплощении антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, S149, Е50, Е52, L53, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из Е50, Е52, L53, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В другом воплощении антитело против TL1A или его антигенсвязывающий фрагмент согласно раскрытию настоящего изобретения связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, S149, Е50, Е52, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B, выбран из группы, состоящей из Е50, Е52, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В другом воплощении антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Р119, Т122, Q123, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где тяжелый атом остатков находится в пределах  от тяжелого атома аминокислотного остатка антитела 1D1 1.31, когда связываемый TL1A находится с 1D1.
от тяжелого атома аминокислотного остатка антитела 1D1 1.31, когда связываемый TL1A находится с 1D1.
В некоторых воплощениях антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122, F148 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где остатки эпитопа TL1A находится в пределах  от остатков антитела против TL1A при связывании антитела против TL1A с TL1A.
от остатков антитела против TL1A при связывании антитела против TL1A с TL1A.
В другом воплощении антитело 1D1 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Т115, Y118, Р121, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Т115, Y118, Р121, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В другом воплощении антитело 1D1 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из Y118, М147, S149, R33, Е50, Е52, L55, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из Y118, М147 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из R33, Е50, Е52, L55, А56 и Y168, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где эпитопы участвуют в электростатических взаимодействиях между антителом 1D1 и TL1A.
В другом воплощении антитело 1D1 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Т58, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Т58, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где эпитопы участвуют в электростатических взаимодействиях между антителом 1D1 и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем  при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
В некоторых воплощениях антитело 1D1 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из Y118, Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где Y118 находится на мономере A, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где эпитопы участвуют во взаимодействиях, формирующих солевой мостик, между антителом 1D1 и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем  при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
В еще одном другом воплощении антитело 1D1 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Т122, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Т91, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где остатки находятся в пределах  от остатков антитела 1D1, когда TL1A находится с 1D1.
от остатков антитела 1D1, когда TL1A находится с 1D1.
В другом воплощении антитело 1D1 1.31 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149, Q151, V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В другом воплощении антитело 1D1 1.31 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Т122, S149, Е50, Е52, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Т122 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из Е50, Е52, А56, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где эпитопы участвуют в электростатических взаимодействиях между антителом 1D1 1.31 и TL1A.
В другом воплощении антитело 1D1 1.31 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, S117, Y118, Т122, S149, Q151, R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, S117, Y118, Т122, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из R33, Е50, Е52, L53, G54, L55, А56, F57, Y168, Т169 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где эпитопы участвуют в электростатических взаимодействиях между антителом 1D1 1.31 и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем  при связывании с антителом 1D1 1.31.
при связывании с антителом 1D1 1.31.
В некоторых воплощениях антитело 1D1 1.31 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Т122, Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118 и Т122, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из Е50, Е52 и L53, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где эпитопы участвуют во взаимодействиях посредством солевых мостиков между антителом 1D1 и TL1A, или площадь скрытой поверхности, окружающей остаток, больше, чем 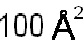 при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
при связывании с антителом против TL1A или его антигенсвязывающим фрагментом по изобретению.
В еще одном другом воплощении антитело 1D1 1.31 связывается с эпитопом на TL1A, содержащим один или более чем один из остатков TL1A, выбранный из К113, Y118, Р119, Т122, Q123, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, где один или более чем один из связываемых остатков эпитопа TL1A на мономере A выбран из группы, состоящей из К113, Y118, Р119, Т122, Q123, F148 и S149, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и где один или более чем один из связываемых остатков эпитопа TL1A на мономере B выбран из группы, состоящей из V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254; где остатки находятся в пределах  от антитела 1D1 1.31, когда связанный TL1A находится с 1D1.
от антитела 1D1 1.31, когда связанный TL1A находится с 1D1.
В другом воплощении антитело 1D1 содержит паратоп, охватывающий один или более чем один остаток вариабельного домена тяжелой цепи, выбранный из Gly26, Tyr27, Ser28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, Asn58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B и Arg100D, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104, и один или более чем один остаток вариабельного домена легкой цепи, выбранный из Tyr32 и Trp94, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 102.
В еще одном другом воплощении антитело 1D1 1.31 содержит паратоп, охватывающий один или более чем один остаток вариабельного домена тяжелой цепи, выбранный из Gly26, Asp28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, His58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B и Arg100D, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104 и один или более чем один остаток вариабельного домена легкой цепи, выбранный из Tyr32 и Trp94, на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 102.
Антитело или его антигенсвязывающий фрагмент по изобретению может иметь способность к конкуренции или перекрестной конкуренции с другим антителом или его антигенсвязывающим фрагментом по изобретению за связывание с TL1A, как здесь описано. Например, антитело или его антигенсвязывающий фрагмент по изобретению может конкурировать или перекрестно конкурировать с описанными здесь антителами за связывание с TL1A или с подходящим фрагментом или вариантом TL1A, который связывается раскрытыми здесь антителами.
То есть, если первое антитело конкурирует со вторым антителом за связывание с TL1A, но оно не конкурирует, когда с TL1A сначала связывается второе антитело, все еще считается, что оно конкурирует со вторым антителом (что также называется однонаправленной конкуренцией). Когда антитело конкурирует с другим антителом, независимо от того, какое антитело сначала связывается с TL1A, тогда антитело перекрестно конкурирует за связывание с TL1A с другим антителом. Такие конкурирующие или перекрестно конкурирующие антитела могут быть идентифицированы на основе их способности конкурировать/перекрестно конкурировать с известным антителом или его антигенсвязывающим фрагментом по изобретению в стандартных анализах связывания. Например, для демонстрации конкуренции/перекрестной конкуренции можно использовать SPR, например, с использованием системы Biacore™, анализы ELISA (твердофазный иммуноферментный анализ) или проточную цитометрию. Такая конкуренция/перекрестная конкуренция может свидетельствовать о том, что два антитела связываются с идентичными, перекрывающимися или аналогичными эпитопами.
Антитело или его антигенсвязывающий фрагмент по изобретению, следовательно, можно идентифицировать способом, который включает анализ связывания, в котором оценивается, способно или не способно тестируемое антитело конкурировать/перекрестно конкурировать с контрольным антителом или его антигенсвязывающим фрагментом по изобретению (например, среди прочих, с 1D1, вариантами 1D1, 7D4, 9B3 и 26B11) за сайт связывания на молекуле-мишени. Способы проведения конкурентных анализов связывания раскрыты в данном документе и/или хорошо известны в данной области. Например, они могут включать связывание контрольного антитела или его антигенсвязывающего фрагмента по изобретению с молекулой-мишенью с использованием условий, при которых антитело может связываться с молекулой-мишенью. Комплекс антитело/мишень можно затем подвергать воздействию тестируемого/второго антитела, и можно оценивать степень, в которой тестируемое антитело способно вытеснять контрольное антитело или его антигенсвязывающий фрагмент по изобретению из комплексов антитело/мишень. Альтернативный способ может включать приведение тестируемого антитела в контакт с молекулой-мишенью при условиях, которые обеспечивают связывание антитела, затем добавление контрольного антитела или его антигенсвязывающего фрагмента по изобретению, которое способно связываться с данной молекулой-мишенью, и оценку степени, в которой контрольное антитело или его антигенсвязывающий фрагмент по изобретению способно вытеснять тестируемое антитело из комплексов антитело/мишень или одновременно связываться с мишенью (т.е. неконкурирующее антитело).
Способность тестируемого антитела ингибировать связывание контрольного антитела или его антигенсвязывающего фрагмента по изобретению с мишенью демонстрирует то, что тестируемое антитело может конкурировать с контрольным антителом или его антигенсвязывающим фрагментом по изобретению за связывание с мишенью, и, таким образом, что тестируемое антитело связывается с тем же самым или по существу тем же самым эпитопом или областью на белке TL1A, что и контрольное антитело или его антигенсвязывающий фрагмент по изобретению. Тестируемое антитело, которое идентифицировано в таком способе как конкурирующее с контрольным антителом или его антигенсвязывающим фрагментом по изобретению, также представляет собой антитело или его антигенсвязывающий фрагмент по настоящему изобретению. Факт того, что тестируемое антитело может связываться с TL1A в той же самой области, что и контрольное антитело или его антигенсвязывающий фрагмент по изобретению и может конкурировать с контрольным антителом или его антигенсвязывающим фрагментом по изобретению, свидетельствует о том, что тестируемое антитело может действовать как лиганд в том же самом сайте связывания, что и антитело или его антигенсвязывающий фрагмент по изобретению, и что тестируемое антитело может, следовательно, имитировать действие контрольного антитела и, таким образом, антитела или его антигенсвязывающего фрагмента по изобретению. Это может быть подтверждено сравнением активности TL1A в присутствии тестируемого антитела с активностью TL1A в присутствии контрольного антитела при идентичных в иных отношениях условиях с использованием анализа, который более подробно описан здесь в других местах.
Контрольное антитело или его антигенсвязывающий фрагмент по изобретению могут представлять собой антитело, как здесь описано, такое как 1D1, 1D1 1.27, 1D1 1.28, 1D1 1.29, 1D1 1.30, 1D1 1.31, 1D1 1.32, 1D1 1.33, 1D1 1.34, 15А9, 15С11, 7D4, 22F9, 9B3, 2B11 или его любой вариант, или фрагмент, как здесь описано, которое сохраняет способность связываться с TL1A. Антитело или его антигенсвязывающий фрагмент по изобретению могут связываться с тем же самым эпитопом, что и описанные здесь контрольные антитела или их любой вариант, или фрагмент, как здесь описано, который сохраняет способность к связыванию с TL1A.
Как здесь ранее утверждалось в других местах, специфичное связывание можно оценивать относительно связывания антитела с молекулой, которая не является мишенью. Данное сравнение можно делать путем сравнения способности антитела связываться с мишенью и с другой молекулой. Это сравнение можно делать, как описано выше при оценке KD или Ki. Другая молекула, используемая в таком сравнении, может представлять собой любую молекулу, которая не является молекулой-мишенью. Предпочтительно другая молекула не является идентичной молекуле-мишени. Предпочтительно молекула-мишень не является фрагментом молекулы-мишени.
KD антитела или его антигенсвязывающего фрагмента по настоящему изобретению могут быть меньше, чем 50 нМ, как, например, меньше, чем 10 нМ, как, например, меньше, чем 5 нМ, как, например, меньше, чем 1 нМ, как, например, меньше, чем 750 пМ, как, например, меньше, чем 500 пМ, как, например, меньше, чем 100 пМ, как, например, меньше, чем 50 пМ, как, например, меньше, чем 25 пМ, как, например, меньше, чем 20 пМ, как, например, меньше, чем 10 пМ, как, например, меньше, чем 9 пМ, как, например, меньше, чем 8 пМ, как, например, меньше, чем 7 пМ, как, например, меньше, чем 6 пМ, как, например, меньше, чем 5 пМ, как, например, меньше, чем 4 пМ, как, например, меньше, чем 3 пМ, как, например, меньше, чем 2 пМ, как, например, меньше, чем 1 пМ, как, например, от 20 пМ до 1 пМ.
В других воплощениях аффинность связывания (KD) антитела против TL1A с TL1A может составлять от примерно 0,001 до примерно 250 нМ. В некоторых воплощениях аффинность связывания составляет любое значение из примерно 200 нМ, примерно 100 нМ, примерно 50 нМ, примерно 10 нМ, примерно 1 нМ, примерно 500 пМ, примерно 100 пМ, примерно 60 пМ, примерно 50 пМ, примерно 20 пМ, примерно 15 пМ, примерно 10 пМ, примерно 5 пМ, примерно 2 пМ или примерно 1 пМ. В некоторых воплощениях аффинность связывания меньше, чем любое значение из примерно 250 нМ, примерно 200 нМ, примерно 100 нМ, примерно 50 нМ, примерно 10 нМ, примерно 1 нМ, примерно 500 пМ, примерно 100 пМ, примерно 50 пМ, примерно 20 пМ, примерно 10 пМ, примерно 5 пМ, примерно 2 пМ или примерно 1 пМ. В некоторых воплощениях KD антитела против TL1A варьирует от примерно 70 пМ до примерно 1 пМ. В некоторых воплощениях KD антитела против TL1A в отношении человеческого TL1A варьирует от примерно 30 пМ до примерно 2 пМ. В некоторых воплощениях аффинность связывания антитела против TL1A или его антигенсвязывающего фрагмента по изобретению составляет примерно 69 пМ, примерно 28 пМ, примерно 25 пМ, примерно 15 пМ, примерно 13 пМ, примерно 10 пМ, примерно 4 пМ и примерно 2 пМ.
Другая молекула, используемая для определения специфичного связывания, может не быть родственной по структуре или функции с мишенью. Например, другая молекула может представлять собой неродственное вещество или сопутствующее вещество в среде.
Другая молекула, используемая для определения специфичного связывания, может быть другой молекулой, участвующей в том же самом пути in vivo, что и молекула-мишень, т.е. TL1A. Путем обеспечения того, что антитело или его антигенсвязывающий фрагмент по изобретению имеет специфичность в отношении TL1A, превышающую специфичность другой такой молекулы, можно избежать нежелательной перекрестной реактивности in vivo.
Антитело или его антигенсвязывающий фрагмент по изобретению может сохранять способность связываться с некоторыми молекулами, которые являются родственными с молекулой-мишенью.
В качестве альтернативы, антитело или его антигенсвязывающий фрагмент по изобретению может иметь специфичность в отношении конкретной молекулы-мишени. Например, оно может связываться с одной молекулой-мишенью, как здесь описано, но может не связываться или может связываться со значительно меньшей аффинностью с другой молекулой-мишенью, как здесь описано. Например, полноразмерный зрелый человеческий TL1A может быть использован в качестве мишени, но антитело, которое связывается с данной мишенью, может не иметь способности к связыванию или может связываться с меньшей аффинностью, например, с другими белками TL1A из других видов, такими как TL1A других млекопитающих.
Антитело или его антигенсвязывающий фрагмент по изобретению может связываться с TL1A и, делая это, может ингибировать активность TL1A.
«Фрагменты» или «части» полипептида или антитела согласно изобретению могут быть получены посредством усечения, например, посредством удаления одной или более чем одной аминокислоты с N и/или C-конца полипептида. Данным способом с N- и/или C-конца могут быть удалены вплоть до 10, вплоть до 20, вплоть до 30, вплоть до 40 или более аминокислотных остатков. Фрагменты также могут быть получены посредством одной или более чем одной внутренней делеции.
Антитело или его антигенсвязывающий фрагмент по изобретению могут представлять собой или могут содержать фрагмент любого из антител 1D1, 1D1 1.27, 1D1 1.28, 1D1 1.29, 1D1 1.30, 1D1 1.31, 1D1 1.32, 1D1 1.33, 1D1 1.34, 15А9, 15С11, 7D4, 22F9, 9B3, 2B11 или их варианта. Антитело или его антигенсвязывающий фрагмент по изобретению могут представлять собой или может содержать антигенсвязывающую часть данного антитела или его вариант. Например, антитело или его антигенсвязывающий фрагмент по изобретению могут представлять собой фрагмент Fab данного антитела или его вариант или могут быть одноцепочечным антителом, полученным из данного антитела или его варианта.
Вариант антитела может содержать 1, 2, 3, 4, 5, вплоть до 10, вплоть до 20, вплоть до 30 или более аминокислотных замен и/или делеций, и/или вставок из обсуждавшихся выше специфических последовательностей и фрагментов. Варианты с «делецией» могут содержать делецию индивидуальных аминокислот, делецию небольших групп аминокислот, как, например, 2, 3, 4 или 5 аминокислот, или делецию более крупных аминокислотных областей, как, например, делецию специфических аминокислотных доменов или других элементов. Варианты со «вставкой» могут содержать вставку индивидуальных аминокислот, вставку небольших групп аминокислот, как, например, 2, 3, 4 или 5 аминокислот, или вставку более крупных аминокислотных областей, как, например, вставку специфических аминокислотных доменов или других элементов. Варианты с «заменой» предпочтительно включают замену одной или более чем одной аминокислоты таким же числом аминокислот и проведение консервативных аминокислотных замен. Например, аминокислота может быть заменена альтернативной аминокислотой, имеющей аналогичные свойства, например, другой основной аминокислотой, другой кислотной аминокислотой, другой нейтральной аминокислотой, другой заряженной аминокислотой, другой гидрофильной аминокислотой, другой гидрофобной аминокислотой, другой полярной аминокислотой, другой ароматической аминокислотой или другой алифатической аминокислотой. Некоторые свойства 20 главных аминокислот, которые можно использовать для выбора подходящих заместителей, являются следующими:
Варианты с заменой имеют в молекуле антитела по меньшей мере один удаленный аминокислотный остаток и другой остаток, вставленный на его место. Представляющие наибольший интерес сайты для мутагенеза путем замен включают гипервариабельные области, но изменения в каркасных областях также рассматриваются. Консервативные замены показаны в Таблице 1 под заголовком «консервативные замены». Если такие замены приводят к изменению биологической активности, тогда могут быть введены показанные ниже более существенные замены, обозначенные как «типичные замены», или как дополнительно описано ниже по отношению к классам аминокислот, и продукты могут быть подвергнуты скринингу.


Существенные модификации биологических свойств антитела осуществляются путем выбора замен, которые значительно отличаются по их эффекту на поддержание (а) структуры полипептидного остова в области замены, например, в виде β-складчатого слоя или спиральной конформации, (б) заряда или гидрофобности молекулы в сайте-мишени или (в) объема боковой цепи. Встречающиеся в природе остатки делят на группы на основе общих свойств боковой цепи:
(1) неполярные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) полярные без заряда: Cys, Ser, Thr, Asn, Gln;
(3) кислотные (отрицательно заряженные): Asp, Glu;
(4) основные (положительно заряженные): Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe, His.
Неконсервативные замены делают путем замены члена одного из данных классов на другой класс.
Например, одним типом замены, которую можно делать, является замена в антителе одного или более чем одного цистеина, который может быть химически реакционноспособным, на другой остаток, такой как, без ограничения, аланин или серии. Например, может иметь место замена неканонического цистеина. Замена может быть сделана в CDR или каркасной области вариабельного домена или в константной области антитела. В некоторых воплощениях цистеин является каноническим. Любой остаток цистеина, не участвующий в поддержании правильной конформации антитела, также может быть заменен, обычно серином, для улучшения окислительной стабильности молекулы и предупреждения неправильного образования поперечных сшивок. Наоборот, цистеиновая связь (связи) может быть добавлена в антитело для улучшения его стабильности, в частности, когда антитело представляет собой фрагмент антитела, такой как фрагмент Fv.
Согласно изобретению также предложены способы генерации, отбора и получения антител против TL1A. Антитела по данному изобретению можно получать посредством методик, известных в данной области. В некоторых воплощениях антитела можно получать рекомбинантно и экспрессировать с использованием любого способа, известного в данной области.
В некоторых воплощениях антитела можно получать и отбирать методикой фагового дисплея. См., например, патенты США №5565332, 5580717; 5733743 и 6265150, и Winter et al., Annu. Rev. Immunol. 12: 433-455, 1994. В качестве альтернативы, можно использовать технологию фагового дисплея для получения человеческих антител и фрагментов антител in vitro (McCafferty et al., Nature 348: 552-553, 1990) из репертуаров генов вариабельного (V) домена иммуноглобулина от неиммунизированных доноров. Согласно данной методике гены V домена антитела клонируют в рамке считывания либо в ген большого, либо малого белка оболочки нитчатого бактериофага, такого как М13 или fd, и подвергают дисплею в виде функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитчатая частица содержит копию одноцепочечной ДНК генома фага, отборы на основе функциональных свойств антитела также приводят к отбору гена, кодирующего антитело, демонстрирующее данные свойства. Таким образом, фаг имитирует некоторые свойства В-клетки. Фаговый дисплей можно проводить в целом ряде форматов; для обзора см., например, Johnson, Kevin S. and Chriswell, David J., Current Opinion in Structural Biology 3: 564-571, 1993. Для фагового дисплея можно использовать несколько источников сегментов V-гена. Clackson et al., Nature 352: 624-628, 1991 выделили разнообразный массив антител против оксазолона из маленькой случайной комбинаторной библиотеки V генов, полученных из селезенок иммунизированных мышей. Может быть сконструирован репертуар V генов из доноров-людей, и могут быть выделены антитела к разнообразному массиву антигенов (включая собственные антигены), по существу следуя методикам, описанным Mark et al., 1991, J. Mol. Biol. 222: 581-597 или Griffith et al., 1993, EMBO J. 12: 725-734. При природном иммунном ответе гены антител с высокой частотой накапливают мутации (соматическая гипермутация). Некоторые введенные изменения будут давать более высокую аффинность, и В-клетки, подвергающие дисплею высокоаффинный поверхностный иммуноглобулин, предпочтительно реплицируются и дифференцируются во время последующей антигенной стимуляции. Этот природный процесс можно имитировать путем применения методики, известной как «перетасовка цепи». (Marks et al., 1992, Bio/Technol. 10: 779-783). В данном способе аффинность «первичных» человеческих антител, полученных фаговым дисплеем, можно улучшать путем последовательной замены генов V области тяжелой и легкой цепи репертуарами встречающихся в природе вариантов (репертуары) генов V домена, полученных от иммунизированных доноров. Эта методика обеспечивает продукцию антител и фрагментов антител с показателями аффинности в пМ-нМ интервале. Стратегия получения очень больших репертуаров фаговых антител (также известных как «мать всех библиотек») была описана Waterhouse et al., Nucl. Acids Res. 21: 2265-2266, 1993. Перетасовку генов также можно использовать для получения человеческих антител из антител грызунов, где человеческое антитело имеет аналогичные показатели аффинности и специфичности по отношению к исходному антителу грызунов. Согласно данному способу, который также называется «импринтинг эпитопа», ген V домена тяжелой или легкой цепи антител грызунов, полученных методикой фагового дисплея, заменяют репертуаром генов V домена человека, создавая грызун-человеческие химеры. Селекция на антигене приводит к выделению человеческих вариабельных областей, способных восстанавливать функциональный антигенсвязывающий сайт, т.е. эпитоп управляет (осуществляет импринтинг) выбором партнера. При повторении данного процесса для того, чтобы заменить оставшийся V домен грызуна, получают человеческое антитело (см. публикацию РСТ № WO 93/06213). В отличие от традиционной гуманизации антител грызунов посредством пересадки CDR, данная методика дает полностью человеческие антитела, которые не имеют остатков каркаса или CDR, происходящих от грызунов.
В некоторых воплощениях антитела можно получать с использованием технологии гибридомы. Рассматривается то, что любой млекопитающий субъект, включающий человека, или клетки от него, продуцирующие антитела, можно подвергать манипуляции для того, чтобы они служили в качестве основы для получения гибридомных линий клеток млекопитающего, включая человека. Путь и схема иммунизации животного-хозяина обычно соответствует установившимся и традиционным методикам стимуляции и продукции антител, как здесь описано далее. Типично животного-хозяина инокулируют внутрибрюшинно, внутримышечно, перорально, подкожно, внутриподошвенно и/или внутрикожно с использованием определенного количества иммуногена, включая такое, как здесь описано.
Гибридомы можно получать из лимфоцитов и бессмертной линии миеломных клеток с использованием общей методики гибридизации соматических клеток Kohler, В. and Milstein, С., 1975, Nature 256: 495-497 или, как модифицировано Buck, D.W., et al., In Vitro, 18: 377-381, 1982. В гибридизации могут использоваться без ограничений доступные миеломные линии, включающие X63-Ag8.653 и миеломные линии из Salk Institute, Cell Distribution Center, San Diego, Calif., США. Обычно данная методика включает слияние миеломных клеток и лимфоидных клеток с использованием вещества, способствующего слиянию клеток, такого как полиэтиленгликоль, или посредством электрических способов, хорошо известных специалистам в данной области. После слияния клетки отделяют от среды для слияния и выращивают в селективной ростовой среде, такой как среда на основе гипоксантина-аминоптерина-тимидина (HAT), для устранения негибридизованных родительских клеток. Любую из описанных здесь сред, дополненную сывороткой или без сыворотки, можно использовать для культивирования гибридом, которые секретируют моноклональные антитела. В качестве другой альтернативы методики слияния клеток, для продукции моноклональных антител против TL1A по рассматриваемому изобретению можно использовать В-клетки, иммортализованные посредством EBV (вирус Эпштейна-Барр). Гибридомы или другие бессмертные линии B-клеток размножают и субклонируют, если это желательно, и супернатанты анализируют на активность против иммуногена посредством традиционных методик иммуноанализа (например, радиоиммуноанализ, ферментативный иммуноанализ или флуоресцентный иммуноанализ).
Гибридомы, которые можно использовать в качестве источника антител, охватывают все производные, потомство клеток родительских гибридом, которые продуцируют моноклональные антитела, специфичные в отношении TL1A или его части.
Гибридомы, которые продуцируют такие антитела, можно выращивать in vitro или in vivo с использованием известных методик. Моноклональные антитела можно выделять из культуральных сред или жидкостей организма посредством традиционных методик очистки иммуноглобулина, таких как осаждение сульфатом аммония, гель-электрофорез, диализ, хроматография и ультрафильтрация, если это желательно. Нежелательную активность, при ее наличии, можно удалять, например, путем пропускания препарата над адсорбентами, сделанными из иммуногена, прикрепленного к твердой фазе, и элюирования или высвобождения желательных антител из иммуногена. Иммунизация животного-хозяина полипептидом TL1A или фрагментом, содержащим целевую аминокислотную последовательность, конъюгированную с белком, который является иммуногенным в виде, подлежащем иммунизации, например, гемоцианином фиссурел, сывороточным альбумином, коровьим тироглобулином или ингибитором трипсина сои с использованием бифункционального или дериватизирующего агента, например, сложного эфира малеимидобензоилсульфосукцинимида (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N равно C равно NR, где R и R1 представляют собой разные алкильные группы, может давать популяцию антител (например, моноклональных антител).
Если это желательно, интересующее антитело против TL1A (моноклональное или поликлональное) может быть секвенировано, и полинуклеотидная последовательность затем может быть клонирована в вектор для экспрессии или размножения. Последовательность, кодирующая интересующее антитело или его антигенсвязывающий фрагмент, можно поддерживать в векторе в клетке-хозяине, и клетку-хозяина затем можно размножать и замораживать для будущего применения. Продукцию рекомбинантных моноклональных антител в культуре клеток можно проводить посредством клонирования генов антитела из В-клеток способами, известными в данной области. См., например, Tiller et al., 2008, J. Immunol. Methods 329, 112; патент США №7314622.
В некоторых воплощениях полинуклеотидную последовательность можно использовать для генетической манипуляции для гуманизации антитела или для улучшения аффинности или других характеристик антитела. Антитела также можно приспосабливать для применения, например, у собак, кошек, приматов, лошадей и жвачных животных.
В некоторых воплощениях полностью человеческие антитела можно получать с использованием имеющихся в продаже мышей, которые были сконструированы для экспрессии специфических белков-иммуноглобулинов человека. Для получения гуманизированных или человеческих антител также можно использовать трансгенных животных, которые сконструированы для получения более желательного (например, полностью человеческие антитела) или более надежного иммунного ответа. Примерами такой технологии являются Xenomouse™ от Abgenix, Inc. (Fremont, СА), HuMAb-Mouse® и ТС Mouse™ от Medarex, Inc. (Princeton, NJ).
Антитела можно получать рекомбинантно путем первоначального выделения антител и клеток, продуцирующих антитела, из животных-хозяев, получения последовательности гена и применения последовательности гена для рекомбинантной экспрессии антитела в клетках-хозяевах (например, в клетках СНО (яичники китайского хомяка)). Другим способом, который можно применять, является экспрессия последовательности антитела в растениях (например, в табаке) или в трансгенном молоке. Были раскрыты способы рекомбинантной экспрессии антител в растениях или в молоке. См., например, Peeters, et al. Vaccine 19: 2756, 2001; Lonberg, N. and D. Huszar Int. Rev. Immunol 13: 65, 1995 и Pollock, et al., J Immunol Methods 231: 147, 1999. Способы получения производных антител, например, доменных, одноцепочечных и т.д., известны в данной области.
Для выделения антител, которые являются специфичными в отношении TL1A, также можно использовать иммуноанализы и методики сортировки на основе проточной цитометрии, такие как сортировка флуоресцентно-активированных клеток (FACS).
ДНК, кодирующую моноклональные антитела, легко выделять и секвенировать с использованием традиционных методик (например, с использованием олигонуклеотидных зондов, которые способны к специфичному связыванию с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. Сразу после выделения ДНК можно помещать в экспрессионные векторы (такие как экспрессионные векторы, раскрытые в публикации РСТ № WO 87/04462), которые затем трансфицируют в клетки-хозяева, такие как клетки Е. coli, обезьяньи клетки COS, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые в противном случае не продуцируют белок-иммуноглобулин, для обеспечения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. См., например, публикацию РСТ № WO 87/04462. ДНК также можно модифицировать, например, путем замены гомологичных мышиных последовательностей кодирующей последовательностью константных доменов человеческой тяжелой и легкой цепи, Morrison et al., Proc. Nat. Acad. Sci. 81: 6851, 1984, или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности неиммуноглобулинового полипептида. Данным способом получают химерные или гибридные антитела, которые имеют специфичность связывания описанного здесь антитела против TL1A.
Фрагменты антитела могут быть получены протеолитической или иной деградацией антител, способами генной инженерии (т.е. одиночные или слитые полипептиды), как описано выше, или посредством химического синтеза. Полипептиды антител, особенно более короткие полипептиды из вплоть до примерно 50 аминокислот, с удобством получают химическим синтезом. Способы химического синтеза известны в данной области и доступны коммерчески. Например, антитело могло бы быть произведено автоматическим синтезатором полипептидов с использованием твердофазного способа. См. также патенты США №5807715; 4816567 и 6331415.
В некоторых воплощениях полинуклеотид содержит последовательность, кодирующую вариабельные области тяжелой цепи и/или легкой цепи антитела против TL1A или его антигенсвязывающего фрагмента по настоящему раскрытию. Последовательность, кодирующая интересующее антитело или его антигенсвязывающий фрагмент, может поддерживаться в векторе в клетке-хозяине, и клетку-хозяина можно затем размножать и замораживать для будущего применения. Здесь дополнительно описаны векторы (включающие экспрессионные векторы) и клетки-хозяева.
Изобретение включает воплощения с созревшей аффинностью. Например, антитела с созревшей аффинностью можно получать методиками, известными в данной области (Marks et al., 1992, Bio/Technology, 10: 779-783; Barbas et al., 1994, Proc Nat. Acad. Sci, USA 91: 3809-3813; Schier et al., 1995, Gene, 169: 147-155; Yelton et al., 1995, J. Immunol., 155: 1994-2004; Jackson et al., 1995, J. Immunol., 154(7): 3310-9; Hawkins et al., 1992, J. Mol. Biol., 226:889-896 и публикация PCT № WO 2004/058184).
Для корректирования аффинности антитела и для характеристики CDR можно использовать следующие способы. Один способ характеристики CDR антитела и/или изменения (как, например, улучшения) аффиности связывания полипептида, такого как антитело, назван «мутагенез на основе сканирования библиотеки». Обычно мутагенез на основе сканирования библиотеки работает следующим образом. Осуществляют замену аминокислоты в одном или более чем одном положении в CDR двумя или более чем двумя (как, например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) аминокислотами с использованием признанных в данной области способов. Это генерирует маленькие библиотеки клонов (в некоторых воплощениях один для каждого положения аминокислоты, которое анализируется), причем каждая имеет сложность, составляющую два или более чем два элемента (если в каждом положении заменены две или более чем две аминокислоты). Обычно библиотека также включает клон, содержащий нативную (незамененную) аминокислоту. Небольшое число клонов, например, примерно 20-80 клонов (в зависимости от сложности библиотеки) из каждой библиотеки подвергают скринингу на аффинность связывания с полипептидом-мишенью (или другой связываемой мишенью), и идентифицируют кандидатов с повышенным, одинаковым, пониженным связыванием или отсутствием связывания. Способы определения аффинности связывания хорошо известны в данной области. Аффинность связывания можно определять, используя, например, анализ поверхностного плазмонного резонанса Biacore™, который выявляет различия в аффинности связывания примерно в 2 раза или более, биосенсор Kinexa®, сцинтилляционный анализ сближения, ELISA, иммуноанализ ORIGEN®, гашение флуоресценции, перенос флуоресценции и/или дрожжевой дисплей. Аффинность связывания также можно подвергать скринингу с использованием подходящей биопробы. Biacore™ является особенно полезным, когда исходное антитело уже связывается с относительно высокой аффинностью, например, с KD примерно 10 нМ или меньше.
В некоторых воплощениях аминокислоту в каждом положении в CDR заменяют (в некоторых воплощениях поочередно) всеми 20 природными аминокислотами с использованием признанных в данной области способов мутагенеза (некоторые из них описаны здесь). Это генерирует небольшие библиотеки клонов (в некоторых воплощениях один для каждого положения аминокислоты, которое анализируется), причем каждая имеет сложность, составляющую 20 элементов (если все 20 аминокислот заменены в каждом положении).
В некоторых воплощениях библиотека, подлежащая скринингу, содержит замены в двух или более чем в двух положениях, которые могут находиться в той же самой CDR или в двух или более чем двух CDR. Таким образом, библиотека может содержать замены в двух или более чем в двух положениях в одной CDR. Данная библиотека может содержать замену в двух или более чем в двух положениях в двух или более чем в двух CDR. Библиотека может содержать замену в 3, 4, 5 или более чем в 5 положениях, причем указанные положения находятся в двух, трех, четырех, пяти или шести CDR. Замену можно получать с использованием кодонов с низкой избыточностью. См., например, Таблицу 2 Balint et al., 1993, Gene 137(1): 109-18.
CDR может представлять собой CDR3 вариабельной области (VH) тяжелой цепи и/или CDR3 вариабельной области (VL) легкой цепи. CDR может представлять собой одну или более чем одну из CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL. CDR может представлять собой CDR по Kabat, CDR по Chothia, расширенную CDR, CDR по AbM, контактную CDR или конформационную CDR.
Кандидатов с улучшенным связыванием можно секвенировать, идентифицируя, посредством этого, мутанта с заменой в CDR, что приводит к улучшенной аффинности (также именуемой «улучшенная» замена). Кандидатов, которые связываются, также можно секвенировать, идентифицируя, посредством этого, замену в CDR, которая сохраняет связывание.
Можно проводить многие циклы скрининга. Например, кандидаты (причем каждый содержит аминокислотную замену в одном или более чем одном положении одной или более чем одной CDR) с улучшенным связыванием также являются полезными для конструирования второй библиотеки, содержащей по меньшей мере исходную и замененную аминокислоту в каждом улучшенном положении CDR (т.е. в положении аминокислоты в CDR, при котором мутант с заменой демонстрировал улучшенное связывание). Получение и скрининг или селекция данной библиотеки дополнительно обсуждается ниже.
Мутагенез на основе сканирования библиотеки также дает средства для характеристики CDR, постольку, поскольку частота клонов с улучшенным связыванием, с одинаковым связыванием, с пониженным связыванием или без связывания также дает информацию, относящуюся к важности аминокислоты в каждом положении для стабильности комплекса антитело-антиген. Например, если положение CDR сохраняет связывание при замене на все 20 аминокислот, данное положение идентифицируют как положение, которое вероятно не требуется для связывания антигена. Наоборот, если положение CDR сохраняет связывание только при небольшой процентной доле замен, данное положение идентифицируют как положение, которое является важным для функции CDR. Таким образом, способы мутагенеза на основе сканирования библиотеки дают информацию относительно положений в CDR, в которых может осуществляться замена на многие другие аминокислоты (включая все 20 аминокислот), и положений в CDR, в которых не может осуществляться замена, или в которых может осуществляться замена только на несколько аминокислот.
Кандидатов с улучшенной аффинностью можно объединять во вторую библиотеку, которая включает улучшенную аминокислоту, исходную аминокислоту в данном положении и может дополнительно включать дополнительные замены в данном положении, в зависимости от сложности библиотеки, которая является желательной или дозволенной, с использованием желательного способа скрининга и отбора. Кроме того, если это желательно, можно осуществлять рандомизацию в смежном положении аминокислоты до по меньшей мере двух или более чем двух аминокислот. Рандомизация смежных аминокислот может обеспечивать дополнительную конформационную гибкость в мутантной CDR, которая, в свою очередь, может обеспечивать или облегчать введение большего числа улучшающих мутаций. Библиотека также может включать замену в положениях, которые не демонстрируют улучшенную аффинность в первом цикле скрининга.
Вторую библиотеку подвергают скринингу или селекции на членов библиотеки с улучшенной и/или измененной аффинностью связывания с использованием любого способа, известного в данной области, включая скрининг с использованием Biacore, анализ с биосенсором Kinexa™ и селекцию с использованием любого способа, известного в данной области для селекции, включая фаговый дисплей, дрожжевой дисплей и рибосомальный дисплей.
Для экспрессии антител против TL1A по настоящему изобретению сначала можно получать фрагменты ДНК, кодирующие области VH и VL, с использованием любого из способов, описанных выше. В последовательности ДНК также можно вводить разные модификации, например, мутации, делеции и/или присоединения, с использованием стандартных способов, известных специалистам в данной области. Например, мутагенез можно проводить с использованием стандартных способов, таких как ПЦР-опосредованный мутагенез, в котором мутировавшие нуклеотиды вставляют в праймеры ПЦР, так что ПЦР-продукт содержит желательные мутации, или сайт-направленный мутагенез.
Изобретение охватывает модификации вариабельных областей, показанные на Фиг. 1, и CDR, указанные на Фиг. 1. Например, данное изобретение включает антитела, содержащие функционально эквивалентные вариабельные области и CDR, которые не оказывают значимого влияния на их свойства, а также варианты, которые имеют повышенную или пониженную активность и/или аффинность. Например, аминокислотную последовательность можно мутировать с получением антитела с желательной аффинностью связывания с TL1A. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или более чем одной делецией или присоединением аминокислы, которые не вызывают значимого вредного изменения функциональной активности, или которые осуществляют созревание (увеличение) аффинности полипептида в отношении его лиганда, или применение химических аналогов.
Вставки в аминокислотную последовательность включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более чем сто остатков, а также вставки внутри последовательности одиночных или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или антитело, слитое с эпитопной меткой. Другие варианты со вставками молекулы антитела включают слияние с N- или С-концом антитела или его антигенсвязывающего фрагмента фермента или полипептида, который увеличивает период полувыведения антитела в кровотоке.
Антитела также могут быть модифицированы, например, в вариабельных доменах тяжелых и/или легких цепей, например, для изменения свойств связывания антитела. Изменения в вариабельной области могут изменять аффинность связывания и/или специфичность. В некоторых воплощениях в домене CDR делают не больше, чем одну-пять консервативных аминокислотных замен. В других воплощениях в домене CDR делают не больше, чем одну-три консервативные аминокислотные замены. Например, мутацию можно сделать в одной или более чем одной области CDR для увеличения или уменьшения KD антитела в отношении TL1A, для увеличения или уменьшения koff или для изменения специфичности связывания антитела. Методики сайт-направленного мутагенеза хорошо известны в данной области. См., например, Sambrook et al., и Ausubel et al., выше.
Модификация или мутация также может быть сделана в каркасной области или в константной области для увеличения периода полувыведения антитела против TL1A. См., например, публикацию РСТ № WO 00/09560. Мутацию в каркасной области или в константной области также можно делать для изменения иммуногенности антитела, для предоставления сайта для ковалентного или нековалентного связывания с другой молекулой или для изменения таких свойств, как фиксация комплемента, связывание FcR и антителозависимая опосредованная клеткой цитотоксичность. Согласно изобретению одно антитело может иметь мутации в любой одной или более чем одной CDR или каркасной области вариабельного домена или в константной области.
Модификации также включают гликозилированные и негликозилированные полипептиды, а также полипептиды с другими посттрансляционными модификациями, такими как, например, гликозилирование с использованием других сахаров, ацетилирование и фосфорилирование. Антитела являются гликозилированными в консервативных положениях в их константных областях (Jefferis and Lund, 1997, Chem. Immunol. 65: 111-128; Wright and Morrison, 1997, TibTECH 15: 26-32). Боковые цепи олигосахаридов иммуноглобулинов влияют на функцию белка (Boyd et al., 1996, Mol. Immunol. 32: 1311-1318; Wittwe and Howard, 1990, Biochem. 29: 4175-4180) и внутримолекулярное взаимодействие между частями гликопротеина, что может влиять на конформацию и презентировать трехмерную поверхность гликоротеина (Jefferis and Lund, выше; Wyss and Wagner, 1996, Current Opin. Biotech. 7: 409-416). Олигосахариды также могут служить для нацеливания данного гликопротеина на определенные молекулы на основе структур специфичного распознавания. Также сообщали о том, что гликозилирование антител влияет на антителозависимую клеточную цитотоксичность (ADCC). В частности, сообщали, что антитела, продуцируемые клетками CHO (яичники китайского хомяка) с регулируемой тетрациклином экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование делящего надвое GlcNAc, имеют улучшенную активность ADCC (Umana et al., 1999, Nature Biotech. 17: 176-180).
Гликозилирование антител обычно является либо N-связанным, либо O-связанным. Термин «N-связанное» относится к присоединению углеводной группировки к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин, аспарагин-Х-треонин и аспарагин-Х-цистеин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводной группировки к боковой цепи аспарагина. Таким образом, присутствие любой из данных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. Термин «O-связанное» гликозилирование относится к присоединению одного из сахаров - N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего к серину или треонину, хотя также могут использоваться и 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу с удобством осуществляется путем изменения аминокислотной последовательности таким образом, что она содержит одну или более чем одну из вышеописанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также можно осуществлять путем добавления или замены в последовательности исходного антитела одного или более чем одного остатка серина или треонина (для сайтов O-связанного гликозилирования).
Картину гликозилирования антител также можно изменять без изменения лежащей в основе нуклеотидной последовательности. Гликозилирование, главным образом, зависит от клетки-хозяина, используемой для экспрессии антитела. Поскольку типом клеток, используемых для экспрессии рекомбинантных гликопротеинов, например, антител, в качестве потенциальных терапевтических средств, редко является природная клетка, можно ожидать вариации в картине гликозилирования антител (см., например, Hse et al., 1997, J. Biol. Chem. 272: 9062-9070).
Помимо выбора клеток-хозяев, факторы, которые влияют на гликозилирование во время рекомбинантной продукции антител, включают способ роста, композицию сред, плотность культуры, насыщенность кислородом, pH, схемы очистки и тому подобное. Предлагали разные способы для изменения картины гликозилирования, достигаемой в конкретном организме-хозяине, включающие введение или сверхэкспрессию определенных ферментов, участвующих в продукции олигосахаридов (патенты США №5047335; 5510261 и 5278299). Гликозилирование или определенные типы гликозилирования можно удалять от гликопротеина ферменативно, например, с использованием эндогликозидазы H (эндо H), N-гликозидазы F, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3. Кроме того, рекомбинантных клеток-хозяев можно генетически модифицировать таким образом, чтобы они были дефектными по процессингу определенных типов полисахаридов. Эти и аналогичные методики хорошо известны в данной области.
Другие способы модификации включают применение методик связывания, известных в данной области, включающих ферментативные способы, окислительное замещение и хелатирование, но не ограничивающихся ими. Модификации можно использовать, например, для присоединения меток для иммуноанализа. Модифицированные полипептиды делают с использованием установившихся в данной области методик, и их можно подвергать скринингу с использованием стандартных анализов, известных в данной области, отдельные из которых описаны ниже и в Примерах.
В некоторых воплощениях антитело содержит модифицированную константную область, которая имеет повышенную или пониженную аффинность связывания с человеческим рецептором Fc гамма, является иммунологически инертной или частично инертной, например, не запускает опосредованный комплементом лизис, не стимулирует антителозависимую клеточную цитотоксичность (ADCC) и не активирует микроглию; или имеет пониженные активности (по сравнению с немодифицированным антителом) в любом одном или более чем одном из следующего: запуск опосредованного комплементом лизиса, стимуляция ADCC или активация микроглии. Для достижения оптимального уровня и/или комбинации эффекторных функций можно использовать разные модификации константной области. См., например, Morgan et al., Immunology 86: 319-324, 1995; Lund et al., J. Immunology 157: 4963-9 157: 4963-4969, 1996; Idusogie et al., J. Immunology 164: 4178-4184, 2000; Tao et al., J. Immunology 143: 2595-2601, 1989 и Jefferis et al., Immunological Reviews 163: 59-76, 1998. В некоторых воплощениях, константная область модифицирована, как описано в Eur. J. Immunol., 1999, 29: 2613-2624; заявке РСТ №PCT/GB99/01441 и/или в заявке на патент Великобритании №9809951.8.
В некоторых воплощениях, константная область антитела может быть модифицирована для того, чтобы избежать взаимодействия с рецептором Fc гамма, комплементом и иммунными системами. Методики получения таких антител описаны в WO 99/58572. Например, константную область можно конструировать так, чтобы она более походила на человеческие константные области, для того, чтобы избежать иммунного ответа, если антитело используется в клинических испытаниях и в лечении людей. См., например, патенты США №5997867 и 5866692.
В некоторых воплощениях константная область модифицирована, как описано в Eur. J. Immunol., 1999, 29: 2613-2624; заявке РСТ №PCT/GB99/01441 и/или в заявке на патент Великобритании №9809951.8. В таких воплощениях Fc может представлять собой Fc человеческого IgG2 или человеческого IgG4. Fc может представлять собой Fc человеческого IgG2, содержащую мутацию с А330Р331 на S330S331 (IgG2Δa), в которой аминокислотные остатки пронумерованы относительно последовательности IgG2 дикого типа. Eur. J. Immunol., 1999, 29:2613-2624. В некоторых воплощениях антитело содержит константную область IgG4, содержащую следующие мутации (Armour et al., 2003, Molecular Immunology 40 585-593): с E233F234L235 на P233V234A235 (IgG4Δc), нумерация в которой осуществляется со ссылкой на IgG4 дикого типа. В еще одном воплощении Fc представляет собой Fc человеческого IgG4 с мутацией E233F234L235 на P233V234A235 с делецией G236 (IgG4Δb). В другом воплощении Fc представляет собой Fc любого человеческого IgG4 (IgG4, IgG4Δb или IgG4Δc), содержащую стабилизирующую шарнирную область мутацию с S228 на Р228 (Aalberse et al., 2002, Immunology 105, 9-19).
В некоторых воплощениях антитело содержит константную область человеческой тяжелой цепи IgG2, содержащую следующие мутации: с А330Р331 на S330S331 (нумерация аминокислот относительно последовательности IgG2 дикого типа). Eur. J. Immunol., 1999, 29: 2613-2624. В других воплощениях константная область является агликозилированной в отношении N-связанного гликозилирования. В некоторых воплощениях константная область является агликозилированной в отношении N-связанного гликозилирования посредством мутирования остатка присоединения олигосахарида и/или фланкирующих остатков, которые являются частью последовательности распознавания N-гликозилирования в константной области. Например, сайт N297 N-гликозилирования может быть мутирован, например, до A, Q, K или Н. См., Tao et al., J. Immunology 143: 2595-2601, 1989 и Jefferis et al., Immunological Reviews 163: 59-76, 1998. В некоторых воплощениях константная область является агликозилированной в отношении N-связанного гликозилирования. Константная область может быть агликозилированной в отношении N-связанного гликозилирования ферментативно (как, например, удалением углевода посредством фермента PNGазы) или посредством экспрессии в клетке-хозяине, дефицитной по гликозилированию.
Другие модификации антител включают антитела, которые были модифицированы, как описано в публикации РСТ № WO 99/58572. Данные антитела содержат, помимо связывающего домена, направленного на молекулу-мишень, эффекторный домен, имеющий аминокислотную последовательность, по существу гомологичную всей или части константной области тяжелой цепи человеческого иммуноглобулина. Данные антитела способны к связыванию молекулы-мишени без запуска значительного зависимого от комплемента лизиса или клеточно-опосредованного разрушения мишени. В некоторых воплощениях эффекторный домен способен специфически связываться с FcRn и/или с FcγRIIb. Они типично основаны на химерных доменах, происходящих из двух или более чем двух доменов CH2 тяжелой цепи человеческого иммуноглобулина. Антитела, модифицированные этим способом, особенно подходят для применения в хронической терапии антителами для того, чтобы избежать воспалительных и других неблагоприятных реакций на традиционную терапию антителами.
В данном раскрытии также предложен константный домен антитела, который может быть дополнительно модифицирован. Известно, что варианты области Fc, например, аминокислотные замены, вставки и/или присоединения, и/или делеции усиливают или уменьшают эффекторную функцию. См., например, Presta et al, 2002, Biochem. Soc. Trans. 30: 487-490; Strohl, 2009, Curr. Opin. Biotechnol. 20(6): 685-691; патенты США 5624821, 5648260, 5885573, 6737056, 7317091; публикации PCT № WO 99/58572, WO 00/42072, WO 04/029207, WO 2006/105338, WO 2008/022152, WO 2008/150494, WO 2010/033736; № публикаций заявок на патенты США 2004/0132101, 2006/0024298, 2006/0121032, 2006/0235208, 2007/0148170; Armour et al., 1999, Eur. J. Immunol. 29(8): 2613-2624 (пониженные ADCC и CDC); Shields et al., 2001, J. Biol. Chem. 276(9): 6591-6604 (пониженные ADCC и CDC); Idusogie et al., 2000, J. Immunol. 164(8): 4178-4184 (повышенные ADCC и CDC); Steurer et al., 1995, J. Immunol. 155(3): 1165-1174 (пониженные ADCC и CDC); Idusogie et al., 2001, J. Immunol. 166(4): 2571-2575 (повышенные ADCC и CDC); Lazar et al., 2006, Proc. Natl. Acad. Sci. USA 103(11): 4005-4010 (повышенная ADCC); Ryan et al., 2007, Mol. Cancer. Ther., 6: 3009-3018 (повышенная ADCC); Richards et al., 2008, Mol. Cancer Ther. 7(8): 2517-2527.
В некоторых воплощениях антитело содержит модифицированную константную область, которая имеет повышенную аффинность связывания в отношении FcRn и/или повышенный период полувыведения в сыворотке по сравнению с немодифицированным антителом.
В процессе, известном как «превращение до последовательности зародышевой линии», определенные аминокислоты в последовательностях VH и VL можно мутировать для того, чтобы они соответствовали последовательностям, обнаруженным в природе в последовательностях VH и VL зародышевой линии. В частности, аминокислотные последовательности каркасных областей в последовательностях VH и VL можно мутировать для того, чтобы они соответствовали последовательностям зародышевой линии для уменьшения риска иммуногенности при введении антитела. Последовательности ДНК зародышевой линии для человеческих генов VH и VL известны в данной области (см., например, базу данных человеческих последовательностей зародышевой линии «Vbase»; см. также Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., 1992, J. Mol. Biol. 227: 776-798 и Cox et al., 1994, Eur. J. Immunol. 24: 827-836).
Другим типом аминокислотной замены, которую можно делать, является удаление в антителе потенциальных протеолитических сайтов. Такие сайты могут встречаться в CDR или в каркасной области вариабельного домена, или в константной области антитела. Замена остатков цистеина и удаление протеолитических сайтов могут уменьшать риск гетерогенности в продукте - антителе и, таким образом, увеличивать его гомогенность. Другим типом аминокислотной замены является устранение аспарагин-глициновых пар, которые образуют потенциальные сайты дезамидирования, путем изменения одного или обоих остатков. В другом примере C-концевой лизин тяжелой цепи антитела против TL1A или его антигенсвязывающего фрагмента по изобретению можно отщеплять или удалять иным способом. В разных воплощениях изобретения тяжелые и легкие цепи антител возможно могут включать сигнальную последовательность.
Как только получают фрагменты ДНК, кодирующие сегменты VH и VL по настоящему изобретению, с данными фрагментами ДНК можно проводить дальнейшие манипуляции путем стандартных методик генной инженерии, например, для превращения генов вариабельной области в гены полноразмерной цепи антитела, в гены фрагмента Fab или в ген scFv. При данных манипуляциях фрагмент ДНК, кодирующий VL и VH, связывают функциональным образом с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Подразумевается то, что термин «связанный функциональным образом», в том виде, в котором он используется в данном контексте, означает, что два фрагмента ДНК связаны так, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются в рамке считывания.
Выделенную ДНК, кодирующую область VH, можно превращать в ген полноразмерной тяжелой цепи путем связывания функциональным образом ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константной области человеческой тяжелой цепи известны в данной области (см., например, Kabat, Е. A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получать стандартной ПЦР-амплификацией. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно представляет собой константную область IgG1 или IgG2. Последовательность константной области IgG может представлять собой любой из разных аллелей или аллотипов, для которых известно, что они встречаются среди разных индивидов, как, например, Gm(1), Gm(2), Gm(3) и Gm(17). Данные аллотипы представляют собой встречающуюся в природе аминокислотную замену в константных областях IgG1. Для гена тяжелой цепи фрагмента Fab ДНК, кодирующую VH, можно связывать функциональным образом с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи. Константная область CH1 тяжелой цепи может происходить из любого из генов тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно превращать в ген полноразмерной легкой цепи (а также в ген легкой цепи Fab) путем связывания функциональным образом ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности генов константной области человеческой легкой цепи известны в данной области (см., например, Kabat, Е. A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получать стандартной ПЦР-амплификацией. Константная область легкой цепи может представлять собой константную область каппа или лямбда. Константная область каппа может принадлежать любому из разных аллелей, для которых известно, что они встречаются у разных индивидов, как, например, Inv(1), Inv(2) и Inv(3). Константную область лямбда можно получать из любого из трех генов лямбда.
Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, связывают функциональным образом с другим фрагментом, кодирующим гибкий линкер, так что последовательности VH и VL можно экспрессировать в виде непрерывного одноцепочечного белка, причем области VL и VH связаны гибким линкером (см., например, Bird et al., 1988, Science 242: 423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85: 5879-5883; McCafferty et al., 1990, Nature 348: 552-554). Примером связывающего пептида является (GGGGS)3 (SEQ ID NO: 383), который образует приблизительно 3,5 нм мостик между карбоксиконцом одной вариабельной области и аминоконцом другой вариабельной области. Конструировали и использовали линкеры с другими последовательностями (Bird et al., 1988, выше). Линкеры, в свою очередь, могут быть модифицированы для дополнительных функций, таких как присоединение лекарственных средств или присоединение к твердым подложкам. Одноцепочечное антитело может быть одновалентным, если используется только один VH и VL, двухвалентным, если используются два VH и VL, или многовалентным, если используются более чем два VH и VL. Могут быть получены биспецифичные или многовалентные антитела, которые специфически связываются с TL1A и с другой молекулой. Одноцепочечные варианты можно получать либо рекомбинантно, либо синтетически. Для синтетической продукции scFv можно использовать автоматический синтезатор. Для рекомбинантной продукции scFv подходящую плазмиду, содержащую полинуклеотид, который кодирует scFv, можно вводить в подходящую клетку-хозяина, либо эукариотическую, такую как дрожжевые, растительные клетки, клетки насекомых или млекопитающих, либо прокариотическую, такую как Е. coli. Полинуклеотиды, кодирующие интересующий scFv, могут быть получены традиционными манипуляциями, такими как лигирование полинуклеотидов. Образующиеся scFv можно выделять с использованием стандартных методик очистки белка, известных в данной области.
Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные биспецифичные антитела, в которых VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким для образования пары между двумя доменами на той же самой цепи, принуждая, посредством этого, домены образовать пары с комплементарными доменами другой цепи и создавая два антигенсвязывающих сайта (см., например, Holliger, P., et al., 1993, Proc. Natl. Acad Sci. USA 90: 6444-6448; Poljak, R.J., et al., 1994, Structure 2: 1121-1123).
Гетероконъюгатные антитела, содержащие два ковалетно связанных антитела, также находятся в пределах объема изобретения. Такие антитела использовали для нацеливания клеток иммунной системы на нежелательные клетки (патент США №4676980) и для лечения инфекции ВИЧ (вирус иммунодефицита человека) (публикации РСТ № WO 91/00360 и WO 92/200373; EP 03089). Гетероконъюгатные антитела можно получать с использованием любых удобных способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты и методики хорошо известны в данной области и описаны в патенте США №4676980.
Химерные или гибридные антитела также можно получать in vitro с использованием известных способов синтетической химии белка, включая способы с участием поперечно сшивающих агентов. Например, иммунотоксины можно конструировать с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реактивов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
Изобретение также охватывает слитые белки, содержащие один или более чем один фрагмент или область из раскрытых здесь антител. В некоторых воплощениях может быть получено слитое антитело, которое содержит все антитело против TL1A или его часть, или его антигенсвязывающий фрагмент по изобретению, связанные с другим полипептидом. В другом воплощении с полипептидом связаны только вариабельные домены антитела против TL1A. В другом воплощении домен VH антитела против TL1A связан с первым полипептидом, тогда как домен VL антитела против TL1A связан со вторым полипептидом, который ассоциирован с первым полипептидом таким образом, что домены VH и VL могут взаимодействовать друг с другом с образованием антигенсвязывающего сайта. В другом предпочтительном воплощении домен VH отделен от домена VL линкером, так что домены VH и VL могут взаимодействовать друг с другом. VH-линкер-VL антитела затем связывают с интересующим полипептидом. Кроме того, можно создавать слитые антитела, в которых два (или более чем два) одноцепочечных антитела связаны друг с другом. Это является полезным, если желательно создать двухвалентное или многовалентное антитело на одной полипептидной цепи, или если желательно создать биспецифичное антитело.
В некоторых воплощениях предложен слитый полипептид, который содержит по меньшей мере 10 смежных аминокислот вариабельной области легкой цепи, показанных в SEQ ID NO: 1, 22, 36, 50, 64, 88 или 102, и/или по меньшей мере 10 аминокислот вариабельной области тяжелой цепи, показанных в SEQ ID NO: 3, 5, 24, 38, 52, 66, 68, 67, 198, 205, 212, 219, 226, 233, 240 или 247. В других воплощениях предложен слитый полипептид, который содержит по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25, по меньшей мере примерно 30 смежных аминокислот вариабельной области легкой цепи и/или по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 смежных аминокислот вариабельной области тяжелой цепи. В другом воплощении слитый полипептид содержит одну или более чем одну CDR. В других воплощениях слитый полипептид содержит CDR3 VH и/или CDR3 VL. Для целей данного изобретения слитый белок содержит одно или более чем одно антитело и другую аминокислотную последовательность, с которой оно не соединяется в природной молекуле, например, гетерологичную последовательность или гомологичную последовательность из другой области. Типичные гетерологичные последовательности включают «метку», такую как метка FLAG или 6His метку (SEQ ID NO: 392), но не ограничиваются ими. Метки хорошо известны в данной области.
Слитый полипептид можно создавать способами, известными в данной области, например, синтетически или рекомбинантно. Типично слитые белки по данному изобретению получают осуществлением экспрессии кодирующего их полинуклеотида с использованием описанных здесь способов генной инженерии, хотя они также могут быть получены и другими способами, известными в данной области, включая, например, химический синтез.
В других воплощениях другие модифицированные антитела можно получать с использованием молекул нуклеиновой кислоты, кодирующих антитело против TL1A. Например, «каппа тела» (III et al., 1997, Protein Eng. 10: 949-57), «минитела» (Martin et al., 1994, EMBO J. 13: 5303-9), «диатела» (Holliger et al., выше), или «янусины» (Traunecker et al., 1991, EMBO J. 10: 3655-3659 и Traunecker et al., 1992, Int. J. Cancer (Suppl.) 7: 51-52) можно получать с использованием стандартных методик молекулярной биологии, следуя идеям описания изобретения.
Например, биспецифичные антитела, моноклональные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных антигенов, могут быть получены с использованием раскрытых здесь антител. Способы получения биспецифичных антител известны в данной области (см., например, Suresh et al., 1986, Methods in Enzymology 121:210). Например, биспецифичные антитела или антигенсвязывающие фрагменты можно получать путем слияния гибридом или связывания фрагментов Fab'. См., например, Songsivilai & Lachmann, 1990, Clin. Exp. Immunol. 79: 315-321, Kostelny et al., 1992, J. Immunol. 148: 1547-1553. Традиционно рекомбинантная продукция биспецифичных антител была основана на соэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, причем две тяжелые цепи имеют разные специфичности (Millstein and Cuello, 1983, Nature 305, 537-539). Кроме того, биспецифичные антитела могут быть образованы в виде «диател» или «янусинов». В некоторых воплощениях биспецифичное антитело связывается с двумя разными эпитопами TL1A. В некоторых воплощениях модифицированные антитела, описанные выше, получают с использованием одного или более чем одного вариабельного домена или области CDR из предложенного здесь антитела против TL1A.
Согласно одному подходу получения биспецифичных антител вариабельные домены антитела с желательными специфичностями связывания (сайты, объединяющие антитело-антиген) сливают с последовательностями константной области иммуноглобулина. Слияние предпочтительно осуществляется с константной областью тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть шарнирной области, области CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, если это желательно, легкой цепи иммуноглобулина, вставляют в отдельные экспрессионные векторы и сотрансфицируют в подходящего организма-хозяина. Это обеспечивает огромную гибкость в корректировании взаимных пропорций трех полипептидных фрагментов в воплощениях, когда неравные соотношения трех полипептидных цепей, использованных в конструкции, обеспечивают оптимальные выходы. Однако можно вставлять кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессионный вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных отношениях приводит к высоким выходам, или когда отношения не имеют особого значения.
В одном подходе биспецифичные антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (предоставляющей вторую специфичность связывания) в другом плече. Данная асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифичной молекулы облегчает отделение желательного биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулинов. Данный подход описан в публикации РСТ № WO 94/04690.
Согласно данному изобретению также предложены композиции, содержащие антитела, конъюгированные (например, связанные) с агентом, который облегчает связывание с твердой подложкой (таким как биотин или авидин). Для простоты ссылка в общем будет сделана на антитела с пониманием того, что данные способы применимы к любым описанным здесь воплощениям по связыванию и/или антагонистичному эффекту на TL1A. Термин «конъюгация» обычно относится к связыванию данных компонентов, как здесь описано. Связывание (которое обычно представляет собой фиксацию данных компонентов в близкой ассоциации, по меньшей мере для введения) может достигаться любым числом способов. Например, возможна непосредственная реакция между агентом и антителом, когда каждый обладает заместителем, способным к реакции с другим участником реакции. Например, нуклеофильная группа, такая как амино- или сульфгидрильная группа, на одном участнике может быть способна к реакции с карбонилсодержащей группой, такой как ангидрид или галогенангидрид, или с алкильной группой, содержащей хорошую уходящую группу (например, галид) на другом участнике.
Антитела могут связываться со многими разными носителями. Носители могут быть активными и/или инертными. Примеры хорошо известных носителей включают полипропилен, полистирол, полиэтилен, декстран, нейлон, амилазы, стекло, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Для целей изобретения природа носителя может быть либо растворимой, либо нерастворимой. Специалистам в данной области будут известны другие подходящие носители для связывания антител, или они смогут устанавливать таковые с использованием рутинного экспериментирования.
Антитело или полипептид по данному изобретению может быть связано с метящим агентом, таким как флуоресцентная молекула, радиоактивная молекула или любые другие метки, известные в данной области. В данной области известны метки, которые обычно дают (либо прямо, либо опосредованно) сигнал.
Как описано с большими подробностями в Примере 1, в данной заявке раскрыты многие антитела против TL1A, которые могут быть охарактеризованы как принадлежащие к одному из трех разных эпитопных «элементов». То есть, антитела, которые сгруппированы друг с другом в один эпитопный элемент, конкурируют друг с другом за связывание с TL1A. Более конкретно, каждое из антитела 1D1, его вариантов с оптимизированной аффинностью и антител 15А9 и 15С11 конкурирует за связывание с TL1A и, таким образом, совместно группируются в первый эпитопный элемент. Антитела 7D4 и 22F9 также конкурируют друг с другом за связывание с TL1A, но связываются с отличным эпитопом, чем другие раскрытые здесь антитела, и, следовательно, группируются во второй эпитопный элемент. Антитела 26B11 и 9B3 конкурируют друг с другом за связывание с TL1A, но также связываются с отличным эпитопом, чем другие раскрытые здесь антитела, и, следовательно, они группируются в третий эпитопный элемент. Подробности относительно антител в каждом эпитопном элементе приведены ниже.
Раскрытые здесь аминокислотные последовательности вариабельного домена легкой цепи (VL), вариабельных доменов тяжелой цепи (VH), полноразмерной легкой цепи (LC) и полноразмерной тяжелой цепи (НС) антител против TL1A обобщены в Таблице 2 посредством идентификационных номеров последовательности. Последовательности нуклеиновой кислоты, кодирующие VL, VH, LC и НС данных антител, обобщены в Таблице 3 посредством идентификационных номеров последовательности. Данные последовательности, обозначенные посредством идентификационных номеров последовательности, приведенных в Таблицах 2 и 3, изложены в таблице Перечень последовательностей (Таблица 40).









Антитело 1D1 и его варианты
В одном воплощении антитело или его антигенсвязывающий фрагмент содержит VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 374; 2) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 377; и 3) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 380. Антитело или его антигенсвязывающий фрагмент согласно данному воплощению также может содержать VL, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную последовательности VL, содержащей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 22, 36, 50, 64, 88 и 102.
В одном воплощении антитело или его антигенсвязывающий фрагмент содержит VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 375; 2) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 378; и 3) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 381. Антитело или его антигенсвязывающий фрагмент согласно данному воплощению также может содержать VL, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную последовательности VL, содержащей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 50, 64 и 102.
В одном воплощении антитело или его антигенсвязывающий фрагмент содержит VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 376; 2) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 379; и 3) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 382. Антитело или его антигенсвязывающий фрагмент согласно данному воплощению также может содержать VL, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную последовательности VL SEQ ID NO: 102.
В одном воплощении антитело или его антигенсвязывающий фрагмент по изобретению содержит VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность GYX1FX2X3YGIS, в которой X1 представляет собой S, D, Q, N или P; X2 представляет собой T или R; и X3 представляет собой Y или Н (SEQ ID NO: 384); 2) CDR-H2, содержащую аминокислотную последовательность WISX4YNGX5X6X7YAX8MX9QG, в которой X4 представляет собой T, P, S или A; X5 представляет собой K, A, G, N или V; X6 представляет собой T или K; X7 представляет собой N или H; X8 представляет собой R или Q; и X9 представляет собой L или Н (SEQ ID NO: 385); и 3) CDR-H3, содержащую аминокислотную последовательность ENYYGSGX9X10RGGMDX11, в которой X9 представляет собой S или A; X10 представляет собой Y или F; и X11 представляет собой V, G или A (SEQ ID NO: 382).
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать VL, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 102.
В другом воплощении антитело или его антигенсвязывающий фрагмент по изобретению может содержать VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность GYX1FX2X3YGIS, в которой X1 представляет собой S, D, Q, N или P; X2 представляет собой T или R; и X3 представляет собой Y или Н (SEQ ID NO: 384); 2) CDR-H2, содержащую аминокислотную последовательность WISX4YNGX5X6X7YAX8MX9QG, в которой X4 представляет собой T, P, S или A; X5 представляет собой K, A, G, N или V; X6 представляет собой T или K; X7 представляет собой N или H; X8 представляет собой R или Q; и X9 представляет собой L или Н (SEQ ID NO: 385); 3) CDR-H3, содержащую аминокислотную последовательность ENYYGSGX9X10RGGMDX11, в которой X9 представляет собой S или A; X10 представляет собой Y или F; и X11 представляет собой V, G или A (SEQ ID NO: 382); 4) Т или R в положении Н76 при определении посредством нумерации VH по Kabat; 5) D или E в положении Н81 при определении посредством нумерации VH по Kabat; и VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112.
В другом воплощении антитело или его антигенсвязывающий фрагмент по изобретению может содержать VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 202; 2) CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 203, 210, 217, 224, 231, 238, 245 или 252; 3) CDR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 204, 211, 218, 225, 232, 239, 246 или 253; и VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать обе из:
а) VH, содержащей аминокислотную последовательность SEQ ID NO: 104, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
б) VH, содержащей аминокислотную последовательность SEQ ID NO: 198, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
в) VH, содержащей аминокислотную последовательность SEQ ID NO: 205, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
г) VH, содержащей аминокислотную последовательность SEQ ID NO: 212, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
д) VH, содержащей аминокислотную последовательность SEQ ID NO: 219, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
е) VH, содержащей аминокислотную последовательность SEQ ID NO: 226, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
ж) VH, содержащей аминокислотную последовательность SEQ ID NO: 233, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
з) VH, содержащей аминокислотную последовательность SEQ ID NO: 240, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
и) VH, содержащей аминокислотную последовательность SEQ ID NO: 247, и VL, содержащей аминокислотную последовательность SEQ ID NO: 102; или
й) VH, содержащей аминокислотную последовательность SEQ ID NO: 24, и VL, содержащей аминокислотную последовательность SEQ ID NO: 22; или
к) VH, содержащей аминокислотную последовательность SEQ ID NO: 38, и VL, содержащей аминокислотную последовательность SEQ ID NO: 36.
В одном аспекте антитело содержит VL, содержащую последовательность SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36. В другом аспекте антитело содержит VH, содержащую аминокислотную последовательность SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38. В другом аспекте антитело содержит вариант данных последовательностей, где такие варианты могут включать как консервативные, так и неконсервативные замены, делеции и/или присоединения, и типично включает пептиды, которые имеют по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с любой из раскрытых здесь специфических последовательностей.
Например, в одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит аминокислотную последовательность цепи VH, как изложено в SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38, или ее вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO:38. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
В другом аспекте согласно данному раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит аминокислотную последовательность цепи VL, как изложено в SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать тяжелую цепь, содержащую VH, содержащую аминокислотную последовательность SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO:212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38, где данное антитело дополнительно содержит константный домен тяжелой цепи. Как здесь более подробно изложено в других местах, константный домен тяжелой цепи антитела может быть выбран из константной области IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно представляет собой константную область IgG1 или IgG2. Последовательность константной области IgG может принадлежать к любому из разных аллелей или аллотипов, для которых известно, что они встречаются среди разных индивидов, как, например, Gm(1), Gm(2), Gm(3) и Gm(17). Для гена тяжелой цепи фрагмента Fab ДНК, кодирующая VH, может быть связана функциональным образом с другой молекулой ДНК, кодирующей только константную область тяжелой цепи CH1. Константная область тяжелой цепи CH1 может происходить от любого гена тяжелой цепи.
В одном аспекте антитело может содержать тяжелую цепь, содержащую VH, выбранную из VH, содержащей аминокислотную последовательность SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38 и дополнительно содержащей константный домен человеческого IgG1 дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 256. В другом аспекте константный домен IgG1 содержит тройную мутацию, уменьшающую или устраняющую эффекторную функцию Fc (hIgG1-3m; SEQ ID NO: 257). В одном аспекте антитело или его антигенсвязывающий фрагмент по изобретению может содержать тяжелую цепь, содержащую VH, содержащую последовательность SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38 и дополнительно содержащую константный домен человеческого IgG1-3m, таким образом, что аминокислотная последовательность полноразмерной тяжелой цепи содержит SEQ ID NO: 108, SEQ ID NO: 200, SEQ ID NO: 207, SEQ ID NO: 214, SEQ ID NO: 221, SEQ ID NO: 228, SEQ ID NO:235, SEQ ID NO: 242, SEQ ID NO: 249, SEQ ID NO: 28 или SEQ ID NO:42.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит полноразмерную тяжелую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 108, SEQ ID NO: 200, SEQ ID NO: 207, SEQ ID NO: 214, SEQ ID NO: 221, SEQ ID NO: 228, SEQ ID NO: 235, SEQ ID NO: 242, SEQ ID NO: 249, SEQ ID NO: 28 или SEQ ID NO: 42, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 108, SEQ ID NO: 200, SEQ ID NO: 207, SEQ ID NO: 214, SEQ ID NO:221, SEQ ID NO: 228, SEQ ID NO: 235, SEQ ID NO: 242, SEQ ID NO: 249, SEQ ID NO: 28 или SEQ ID NO: 42. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 108, SEQ ID NO: 200, SEQ ID NO: 207, SEQ ID NO: 214, SEQ ID NO: 221, SEQ ID NO:228, SEQ ID NO: 235, SEQ ID NO: 242, SEQ ID NO: 249, SEQ ID NO: 28 или SEQ ID NO:42, и где указанное антитело или его антигенсвязывающая часть специфически связывается с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36, где антитело дополнительно содержит константный домен легкой цепи. Как более подробно изложено здесь в других местах, константный домен легкой цепи антитела может быть выбран из константной области Cκ или Cλ, предпочтительно константной области Cκ.
В одном аспекте антитело может содержать легкую цепь, содержащую VL, выбранную из VL, содержащей аминокислотную последовательность SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36 и дополнительно содержащей человеческий константный домен Cλ дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 255, таким образом, что аминокислотная последовательность полноразмерной легкой цепи содержит SEQ ID NO: 106, SEQ ID NO: 26 или SEQ ID NO: 40.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит полноразмерную легкую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 106, SEQ ID NO: 26 или SEQ ID NO: 40, или его вариант. В одном аспекте указанный вариант антитела содержит 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 106, SEQ ID NO: 26 или SEQ ID NO: 40. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 106, SEQ ID NO: 26 или SEQ ID NO: 40, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
Изобретение охватывает антитело или его антигенсвязывающий фрагмент, содержащее три CDR аминокислотной последовательности вариабельного домена тяжелой цепи, кодируемых полинуклеотидной вставкой вектора, депонированной в ATCC (Американская коллекция типовых культур) 17 октября 2013 г. как 1D1 1.31 VH (регистрационный номер ATCC PTA-120639). В одном аспекте антитело или его антигенсвязывающий фрагмент по изобретению содержит аминокислотную последовательность домена VH, кодируемую полинуклеотидной вставкой вектора, депонированной в ATCC как 1D1 1.31 VH (регистрационный номер ATCC PTA-120639).
Изобретение охватывает антитело или его антигенсвязывающий фрагмент, содержащее три CDR аминокислотной последовательности вариабельного домена легкой цепи, кодируемых полинуклеотидной вставкой вектора, депонированной в ATCC 17 октября 2013 г. как 1D1 1.31 VL (регистрационный номер ATCC PTA-120640). В одном аспекте антитело или его антигенсвязывающий фрагмент по изобретению содержит аминокислотную последовательность домена VL, кодируемую полинуклеотидной вставкой вектора, депонированной в ATCC как 1D1 1.31 VL (регистрационный номер ATCC PTA-120640).
Изобретение охватывает антитело или его антигенсвязывающий фрагмент, содержащее три CDR аминокислотной последовательности вариабельного домена легкой цепи, кодируемых полинуклеотидной вставкой вектора, депонированной в ATCC 17 октября 2013 г. как 1D1 1.31 VL (регистрационный номер ATCC PTA-120640), и три CDR аминокислотной последовательности вариабельного домена тяжелой цепи, кодируемых полинуклеотидной вставкой вектора, депонированной в ATCC как 1D1 1.31 VH (регистрационный номер ATCC PTA-120639.
Изобретение охватывает антитело или его антигенсвязывающий фрагмент, содержащее аминокислотную последовательность вариабельного домена легкой цепи, кодируемую полинуклеотидной вставкой вектора, депонированной в ATCC 17 октября 2013 г. как 1D1 1.31 VL (регистрационный номер ATCC PTA-120640), и аминокислотную последовательность вариабельного домена тяжелой цепи, кодируемую полинуклеотидной вставкой вектора, депонированной в ATCC как 1D1 1.31 VH (регистрационный номер ATCC PTA-120639).
Выделенную ДНК, кодирующую область VL, можно превращать в ген полноразмерной легкой цепи (а также в ген легкой цепи Fab) путем связывания функциональным образом ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности человеческих генов константной области легкой цепи известны в данной области (см., например, Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие данные области, можно получать стандартной ПЦР-амплификацией. Константная область легкой цепи может представлять собой константную область каппа или лямбда. Константная область каппа может происходить из любого из разных аллелей, для которых известно, что они встречаются у разных индивидов, таких как Inv(1), Inv(2) и Inv(3). Константная область лямбда может происходить из любого из трех генов лямбда.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент одной из аминокислотных последовательностей VL или VH, показанных на Фиг. 1. Например, антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент из по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 12, по меньшей мере 15, по меньшей мере 18, по меньшей мере 20 или по меньшей мере 25 последовательных аминокислот из VH, содержащей SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24 или SEQ ID NO: 38, или из VL, содержащей SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36. Такой фрагмент будет предпочтительно сохранять одну или более чем одну из функций, обсуждавшихся выше, как, например, способность связываться с TL1A.
Подходящий фрагмент или вариант любой из данных последовательностей VH или VL будет сохранять способность к связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с тем же самым или аналогичным эпитопом или областью молекулы TL1A, что и антитело, из которого он происходит. Он предпочтительно будет сохранять одну или более чем одну дополнительную функцию антитела, из которого он происходит, такую как, среди прочих, способность ингибировать связывание TL1A с его рецептором.
Подходящий фрагмент или вариант последовательности VL предпочтительно будет сохранять аминокислоты в положениях Tyr32 и Trp94 на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 102. Подходящий фрагмент или вариант последовательности VH предпочтительно будет сохранять аминокислоты в положениях Gly26, Tyr27, Ser28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, Asn58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B, Arg100D на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104, или аминокислоты в положениях Gly26, Asp28, Thr30, Tyr31, Trp50, Tyr53, Asn54, Asn56, His58, Thr73, Arg76, Tyr97, Gly99, Ser100, Gly100A, Ser100B, Arg100D на основе нумерации по Kabat по отношению к последовательности SEQ ID NO: 104. Как идентифицировано в Примерах, они представляют собой остатки в последовательностях вариабельного домена легкой и тяжелой цепи 1D1 и 1D1 1.31, которые имеют площадь скрытой поверхности (BSA)  или более, или участвуют в электростатических взаимодействиях при связывании антител с TL1A.
или более, или участвуют в электростатических взаимодействиях при связывании антител с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать область CDR из конкретного идентифицированного здесь антитела, как, например, область CDR из SEQ ID NO: 106, SEQ ID NO: 198, SEQ ID NO: 205, SEQ ID NO: 205, SEQ ID NO: 212, SEQ ID NO: 219, SEQ ID NO: 226, SEQ ID NO: 233, SEQ ID NO: 240, SEQ ID NO: 247, SEQ ID NO: 24, SEQ ID NO: 38, SEQ ID NO: 102, SEQ ID NO: 22 или SEQ ID NO: 36. Такое антитело предпочтительно будет сохранять способность к связыванию с TL1A, как здесь описано.
Например, последовательности CDR антител по изобретению показаны на Фиг. 1, в Таблице 8, Таблице 11 и в Таблице с перечнем последовательностей (Таблица 40) с использованием как определения по Kabat, так и определений AntibodyM.
В одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которые содержат:
а) VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 202; 2) CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 203, 210, 217, 224, 231, 238, 245 или 252; 3) CDR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 204, 211, 218, 225, 232, 239, 246 или 253; и VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 110, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 111, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 112;
б) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 113, аминокислотную последовательность CDR-H2 SEQ ID NO: 114, аминокислотную последовательность CDR-H3 SEQ ID NO: 115, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
в) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 202, аминокислотную последовательность CDR-H2 SEQ ID NO: 203, аминокислотную последовательность CDR-H3 SEQ ID NO: 204, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
г) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 209, аминокислотную последовательность CDR-H2 SEQ ID NO: 210, аминокислотную последовательность CDR-H3 SEQ ID NO: 211, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
д) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 216, аминокислотную последовательность CDR-H2 SEQ ID NO: 217, аминокислотную последовательность CDR-H3 SEQ ID NO: 218, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
е) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 223, аминокислотную последовательность CDR-H2 SEQ ID NO: 224, аминокислотную последовательность CDR-H3 SEQ ID NO: 225, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
ж) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 230, аминокислотную последовательность CDR-H2 SEQ ID NO: 231, аминокислотную последовательность CDR-H3 SEQ ID NO: 232, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
з) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 237, аминокислотную последовательность CDR-H2 SEQ ID NO: 238, аминокислотную последовательность CDR-H3 SEQ ID NO:239, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
и) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 244, аминокислотную последовательность CDR-H2 SEQ ID NO: 245, аминокислотную последовательность CDR-H3 SEQ ID NO: 246, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
й) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 251, аминокислотную последовательность CDR-H2 SEQ ID NO: 252, аминокислотную последовательность CDR-H3 SEQ ID NO: 253, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 110, аминокислотную последовательность CDR-L2 SEQ ID NO: 111 и аминокислотную последовательность CDR-L3 SEQ ID NO: 112;
к) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 33, аминокислотную последовательность CDR-H2 SEQ ID NO: 34, аминокислотную последовательность CDR-H3 SEQ ID NO: 35, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 30, аминокислотную последовательность CDR-L2 SEQ ID NO: 31 и аминокислотную последовательность CDR-L3 SEQ ID NO: 32; или
л) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 47, аминокислотную последовательность CDR-H2 SEQ ID NO: 48, аминокислотную последовательность CDR-H3 SEQ ID NO: 49, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 44, аминокислотную последовательность CDR-L2 SEQ ID NO: 45 и аминокислотную последовательность CDR-L3 SEQ ID NO: 46.
В одном аспекте согласно раскрытию предложен вариант антитела, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций в CDR, перечисленных выше. В другом аспекте вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с перечисленными выше последовательностями CDR, и где антитело или его антигенсвязывающая часть специфически связываются с TL1A.
Антитела 7D4, 22F9 и их варианты
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность GYTFTSYX1X2X3, где X1 представляет собой G или A; X2 представляет собой I или M; и X3 представляет собой N или Н (SEQ ID NO: 386); 2) CDR-H2, содержащую аминокислотную последовательность WIX4X5X6NGNTX7X8X9QKX10QG, где X4 представляет собой S или N; X5 представляет собой Т или А; X6 представляет собой Y или G; X7 представляет собой N или K; X8 представляет собой S или Y; и X9 представляет собой A или S; X10 представляет собой L или F (SEQ ID NO: 387); 3) CDR-H3, содержащую аминокислотную последовательность X11X12SSX13WFDAFDI, где X11 представляет собой A или G; X12 представляет собой H или Y; и X13 представляет собой S или A (SEQ ID NO: 388); 4) D или Е в положении Н85, как определено посредством нумерации VH по Kabat;
и
VL, содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 96, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 97, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 98.
В другом воплощении антитело или его антигенсвязывающий фрагмент по изобретению может содержать VH, содержащую SEQ ID NO: 52 или 90, и VL, содержащую SEQ ID NO: 50.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать оба из:
а) VH, содержащей аминокислотную последовательность SEQ ID NO: 90, и VL, содержащей аминокислотную последовательность SEQ ID NO: 88; или
б) VH, содержащей аминокислотную последовательность SEQ ID NO: 52, и VL, содержащей аминокислотную последовательность SEQ ID NO: 50.
В одном аспекте антитело содержит VL, содержащую последовательность SEQ ID NO: 88 или SEQ ID NO: 50. В другом аспекте антитело содержит вариант данных последовательностей, где такие варианты могут включать и консервативные, и неконсервативные замены, делеции и/или присоединения и типично включают пептиды, которые имеют по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичности последовательности с любой из раскрытых здесь специфических последовательностей.
Например, в одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащее аминокислотную последовательность цепи VL, как изложено в SEQ ID NO:88 или SEQ ID NO: 50, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 88 или SEQ ID NO: 50. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 88 или SEQ ID NO: 50, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащее аминокислотную последовательность цепи VH, как изложено в SEQ ID NO: 90 или SEQ ID NO: 52, или его вариант. В одном аспекте вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций SEQ ID NO: 90 или SEQ ID NO: 52. В другом аспекте вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 90 или SEQ ID NO: 52, и где антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающая часть по изобретению может содержать тяжелую цепь, содержащую VH, содержащую аминокислотную последовательность SEQ ID NO: 90 или SEQ ID NO: 52, где антитело дополнительно содержит константный домен тяжелой цепи. Как здесь более подробно изложено в других местах, константный домен тяжелой цепи антитела может быть выбран из константной области IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно представляет собой константную область IgG1 или IgG2. Последовательность константной области IgG может принадлежать к любому из разных аллелей или аллотипов, для которых известно, что они встречаются у разных индивидов, таких как Gm(1), Gm(2), Gm(3) и Gm(17). Для гена тяжелой цепи фрагмента Fab ДНК, кодирующую VH, можно связывать функциональным образом с другой молекулой ДНК, кодирующей только константную область тяжелой цепи СН1. Константная область тяжелой цепи CH1 может происходить из любого из генов тяжелой цепи.
В одном аспекте антитело может содержать тяжелую цепь, содержащую VH, выбранную из VH, содержащей аминокислотную последовательность SEQ ID NO: 90 или SEQ ID NO: 52, и дополнительно содержащую константный домен человеческого IgG1 дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 256. В другом аспекте константный домен IgG1 содержит тройную мутацию, уменьшающую или устраняющую эффекторную функцию Fc (hIgG1-3m; SEQ ID NO: 257). В одном аспекте антитело или его антигенсвязывающий фрагмент по изобретению может содержать тяжелую цепь, содержащую VH, содержащую последовательность SEQ ID NO: 90 или SEQ ID NO: 52, и дополнительно содержащую константный домен человеческого hIgG1-3m, таким образом, что аминокислотная последовательность полноразмерной тяжелой цепи содержит SEQ ID NO: 94 или SEQ ID NO: 56.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащее полноразмерную тяжелую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 94 или SEQ ID NO: 56, или его вариант. В одном аспекте вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 94 или SEQ ID NO: 56. В другом аспекте вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 94 или SEQ ID NO: 56, и где антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO: 88 или SEQ ID NO: 50, где антитело дополнительно содержит константный домен легкой цепи. Как здесь более подробно изложено в других местах, константный домен легкой цепи антитела может быть выбран из константной области Cκ или Cλ, предпочтительно из константной области Cκ.
В одном аспекте антитело может содержать легкую цепь, содержащую VL, выбранную из VL, содержащей аминокислотную последовательность SEQ ID NO: 88 или SEQ ID NO: 50, и дополнительно содержащей человеческий константный домен Cλ дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 255, таким образом, что аминокислотная последовательность полноразмерной легкой цепи содержит SEQ ID NO: 92 или SEQ ID NO: 54.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащее полноразмерную легкую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 92 или SEQ ID NO: 54, или его вариант. В одном аспекте вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 92 или SEQ ID NO: 54. В другом аспекте вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 92 или SEQ ID NO: 54, и где антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент из одной из аминокислотных последовательностей VL или VH, показанных на Фиг. 1. Например, антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент из по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 12, по меньшей мере 15, по меньшей мере 18, по меньшей мере 20 или по меньшей мере 25 последовательных аминокислот из VH, содержащей SEQ ID NO: 90 или SEQ ID NO: 52, или из VL, содержащей SEQ ID NO: 88 или SEQ ID NO: 50. Такой фрагмент предпочтительно будет сохранять одну или более чем одну функцию, обсуждавшуюся выше, такую как, среди прочих, способность связываться с TL1A, способность ингибировать связывание TL1A с его рецептором DR3, способность ингибировать сигнализацию TL1A через его рецептор.
Подходящий фрагмент или вариант любой из данных последовательностей VH или VL будет сохранять способность к связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с тем же самым или аналогичным эпитопом или областью молекулы TL1A, что и антитело, из которого он происходит. Он предпочтительно будет сохранять одну или более чем одну дополнительную функцию антитела, из которого он происходит, такую как, среди прочих, способность ингибировать связывание TL1A с его рецептором (например, с DR3), способность ингибировать сигнализацию TL1A посредством его рецептора.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать область CDR из конкретного идентифицированного здесь антитела, такую как область CDR из SEQ ID NO: 88, SEQ ID NO: 50, SEQ ID NO: 90 или SEQ ID NO: 50. Такое антитело предпочтительно будет сохранять способность к связыванию с TL1A, как здесь описано.
Например, последовательности CDR антител по изобретению показаны на Фиг. 1 и в таблице с перечнем последовательностей (Таблица 40) с использованием как определения по Kabat, так и определений AntibodyM.
В одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащие:
a) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 99, аминокислотную последовательность CDR-H2 SEQ ID NO: 100, аминокислотную последовательность CDR-H3 SEQ ID NO: 101, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 96, аминокислотную последовательность CDR-L2 SEQ ID NO: 97 и аминокислотную последовательность CDR-L3 SEQ ID NO: 98; или
б) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 61, аминокислотную последовательность CDR-H2 SEQ ID NO: 62, аминокислотную последовательность CDR-H3 SEQ ID NO: 63, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 58, аминокислотную последовательность CDR-L2 SEQ ID NO: 59 и аминокислотную последовательность CDR-L3 SEQ ID NO: 60.
В одном аспекте согласно раскрытию предложен вариант антитела, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к перечисленным выше CDR, как, например, SEQ ID NO: 96-101 или SEQ ID NO: 58-63. В другом аспекте вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с перечисленными выше последовательностями CDR, и где антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитела 26B11, 9B3 и их варианты
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать VH, содержащую: 1) CDR-H1, содержащую аминокислотную последовательность GFTFSX1X2AX3H, где X1 представляет собой N или S; X2 представляет собой Y или F; и X3 представляет собой L, M или I (SEQ ID NO: 389); 2) CDR-H2, содержащую аминокислотную последовательность LIX4X5DGSX6X7YYADSVKG, где X4 представляет собой S или P; X5 представляет собой Y или F; X6 представляет собой D, S или N; X7 представляет собой К или N (SEQ ID NO: 390); 3) а CDR-H3, содержащую аминокислотную последовательность DRX8YX9X10X11X12SX13SX14DAFDI, где X8 представляет собой E или N; X9 представляет собой C или Y; X10 представляет собой Т или G; X11 представляет собой Y или S; X12 представляет собой S или G; X13 представляет собой С или F; X14 представляет собой Y или F; 4) А или Т в положении Н85 при определении посредством нумерации VH по Kabat; 5) М или L в положении 108 при определении посредством нумерации VH по Kabat; и VL содержащую CDR-L1, имеющую аминокислотную последовательность SEQ ID NO: 76, CDR-L2, имеющую аминокислотную последовательность SEQ ID NO: 77, и CDR-L3, имеющую аминокислотную последовательность SEQ ID NO: 78; и F или Y в положении L83 при определении посредством нумерации VL по Kabat.
В другом воплощении антитело или его антигенсвязывающий фрагмент по изобретению могут содержать VH, содержащую SEQ ID NO: 66, 68 или 70, и VL, содержащую SEQ ID NO: 1 или 64.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать оба из:
а) VH, содержащей аминокислотную последовательность SEQ ID NO: 66, и VL, содержащей аминокислотную последовательность SEQ ID NO: 64; или
б) VH, содержащей аминокислотную последовательность SEQ ID NO: 68, и VL, содержащей аминокислотную последовательность SEQ ID NO: 64; или
в) VH, содержащей аминокислотную последовательность SEQ ID NO: 70, и VL, содержащей аминокислотную последовательность SEQ ID NO: 64; или
г) VH, содержащей аминокислотную последовательность SEQ ID NO: 3, и VL, содержащей аминокислотную последовательность SEQ ID NO: 1; или
д) VH, содержащей аминокислотную последовательность SEQ ID NO: 5, и VL, содержащей аминокислотную последовательность SEQ ID NO: 1.
В одном аспекте антитело содержит VL, содержащую последовательность SEQ ID NO: 64 или SEQ ID NO: 1. В другом аспекте антитело содержит вариант данных последовательностей, где такие варианты могут включать и консервативные, и неконсервативные замены, делеций и/или присоединения, и типично включают пептиды, которые имеют по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности по отношению к любой из раскрытых здесь специфических последовательностей.
Например, в одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит аминокислотную последовательность цепи VL, как изложено в SEQ ID NO: 64 или SEQ ID NO: 1, или ее вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 64 или SEQ ID NO: 1. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 64 или SEQ ID NO: 1, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит аминокислотную последовательность цепи VH, как изложено в SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5. В другом аспекте указанный вариант имеет меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать тяжелую цепь, содержащую VH, содержащую аминокислотную последовательность SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5, где антитело дополнительно содержит константный домен тяжелой цепи. Как здесь более подробно изложено в других местах, константный домен тяжелой цепи атитела может быть выбран из константной области IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно представляет собой константную область IgG1 или IgG2. Последовательность константной области IgG может принадлежать к любому из разных аллелей или аллотипов, для которых известно, что они встречаются среди разных индивидов, таких как Gm(1), Gm(2), Gm(3) и Gm(17). Для гена тяжелой цепи фрагмента Fab ДНК, кодирующая VH, может быть связана функциональным образом с другой молекулой ДНК, кодирующей только константную область тяжелой цепи CH1. Константная область тяжелой цепи CH1 может происходить из любого из генов тяжелой цепи.
В одном аспекте антитело может содержать тяжелую цепь, содержащую VH, выбранную из VH, содержащей аминокислотную последовательность SEQ ID NO:66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5 и дополнительно содержащей константный домен человеческого IgG1 дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 256. В другом аспекте константный домен IgG1 содержит тройную мутацию, уменьшающую или устраняющую эффекторную функцию Fc (hIgG1-3m; SEQ ID NO: 257). В одном аспекте антитело или его антигенсвязывающий фрагмент по изобретению может содержать тяжелую цепь, содержащую VH, содержащую последовательность SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5 и дополнительно содержащую константный домен человеческого IgG1-3m, таким образом, что аминокислотная последовательность полноразмерной тяжелой цепи содержит SEQ ID NO: 74, SEQ ID NO: 9 или SEQ ID NO: 11.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит полноразмерную тяжелую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 74, SEQ ID NO: 9 или SEQ ID NO: 11, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 74, SEQ ID NO: 9 или SEQ ID NO: 11. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 74, SEQ ID NO: 9 или SEQ ID NO: 11, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающая часть по изобретению может содержать легкую цепь, содержащую VL, содержащую аминокислотную последовательность SEQ ID NO: 64 или SEQ ID NO: 1, где антитело дополнительно содержит константный домен легкой цепи. Как здесь более подробно изложено в других местах, константный домен легкой цепи антитела может быть выбран из константной области Cκ или Cλ, предпочтительно из константной области Cκ.
В одном аспекте антитело может содержать легкую цепь, содержащую VL, выбранную из VL, содержащей аминокислотную последовательность SEQ ID NO:64 или SEQ ID NO: 1 и дополнительно содержащей константный домен человеческой Cλ дикого типа, содержащий аминокислотную последовательность SEQ ID NO: 255, таким образом, что аминокислотная последовательность полноразмерной легкой цепи содержит SEQ ID NO: 72 или SEQ ID NO: 7.
В другом аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, которое содержит полноразмерную легкую цепь, содержащую аминокислотную последовательность, как изложено в SEQ ID NO: 72 или SEQ ID NO: 7, или его вариант. В одном аспекте указанный вариант антитела содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к SEQ ID NO: 72 или SEQ ID NO: 7. В другом аспекте указанный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с SEQ ID NO: 72 или SEQ ID NO: 7, и где указанное антитело или антигенсвязывающая часть специфически связываются с TL1A.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент одной из аминокислотных последовательностей VL или VH, показанных на Фиг. 1. Например, антитело или его антигенсвязывающий фрагмент по изобретению может содержать фрагмент из по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 12, по меньшей мере 15, по меньшей мере 18, по меньшей мере 20 или по меньшей мере 25 последовательных аминокислот из VH, содержащей SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3 или SEQ ID NO: 5, или из VL, содержащей SEQ ID NO: 72 или SEQ ID NO: 7. Такой фрагмент предпочтительно будет сохранять одну или более чем одну из обсуждавшихся выше функций, таких как способность к связыванию с TL1A.
Подходящий фрагмент или вариант любой из этих последовательностей VH или VL будет сохранять способность к связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с TL1A. Он предпочтительно будет сохранять способность к специфичному связыванию с таким же или с аналогичным эпитопом или участком молекулы TL1A, что и антитело, из которого он происходит. Он предпочтительно будет сохранять одну или более чем одну дополнительную функцию антитела, из которого он происходит, такую как, среди прочих, способность ингибировать связывание TL1A с его рецептором.
Антитело или его антигенсвязывающий фрагмент по изобретению может содержать идентифицированную здесь область CDR из специфичного антитела, такую как область CDR из SEQ ID NO: 66, SEQ ID NO: 68 или SEQ ID NO: 70, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 64 или SEQ ID NO: 1. Такое антитело предпочтительно будет сохранять способность к связыванию с TL1A, как здесь описано.
Например, последовательности CDR антител по изобретению показаны на Фиг. 1 и в Таблице с перечнем последовательностей (Таблица 40) с использованием как определения по Kabat, так и определений AntibodyM.
В одном аспекте согласно раскрытию предложено выделенное антитело или его антигенсвязывающая часть, содержащее:
а) аминокислотную последовательность CDR-H1 SEQ ID NO: 79, аминокислотную последовательность CDR-H2 SEQ ID NO: 80 и аминокислотную последовательность CDR-H3 SEQ ID NO: 81, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 76, аминокислотную последовательность CDR-L2 SEQ ID NO: 77 и аминокислотную последовательность CDR-L3 SEQ ID NO: 78;
б) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 82, аминокислотную последовательность CDR-H2 SEQ ID NO: 83 и аминокислотную последовательность CDR-H3 SEQ ID NO: 84, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 76, аминокислотную последовательность CDR-L2 SEQ ID NO: 77 и аминокислотную последовательность CDR-L3 SEQ ID NO: 78; или
в) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 85, аминокислотную последовательность CDR-H2 SEQ ID NO: 86 и аминокислотную последовательность CDR-H3 SEQ ID NO: 87, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 76, аминокислотную последовательность CDR-L2 SEQ ID NO: 77 и аминокислотную последовательность CDR-L3 SEQ ID NO: 78; или
г) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 16, аминокислотную последовательность CDR-H2 SEQ ID NO: 17, аминокислотную последовательность CDR-H3 SEQ ID NO: 18, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 13, аминокислотную последовательность CDR-L2 SEQ ID NO: 14 и аминокислотную последовательность CDR-L3 SEQ ID NO: 15; или
д) VH, содержащую аминокислотную последовательность CDR-H1 SEQ ID NO: 19, аминокислотную последовательность CDR-H2 SEQ ID NO: 20, аминокислотную последовательность CDR-H3 SEQ ID NO:21, и VL, содержащую аминокислотную последовательность CDR-L1 SEQ ID NO: 13, аминокислотную последовательность CDR-L2 SEQ ID NO: 14 и аминокислотную последовательность CDR-L3 SEQ ID NO: 15.
В одном аспекте согласно раскрытию предложен вариант антитела, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 присоединений и/или делеций по отношению к перечисленным выше CDR. В другом аспекте данный вариант имеет по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с перечисленными выше последовательностями CDR, и где антитело или антигенсвязывающая часть специфически связываются с TL1A.
Полинуклеотиды, векторы и клетки-хозяева
Согласно изобретению также предложены полинуклеотиды, кодирующие любые из антител, включая описанные здесь фрагменты антител и модифицированные антитела, такие как, например, антитела, имеющие ослабленную эффекторную функцию. В другом аспекте согласно изобретению предложен способ получения любого из описанных здесь полинуклеотидов. Полинуклеотиды можно получать и экспрессировать методиками, известными в данной области. Соответственно, согласно изобретению предложены полинуклеотиды или композиции, включающие фармацевтические композиции, содержащие полинуклеотиды, кодирующие любое из следующих антител против TL1A и их антигенсвязывающих фрагментов: VL 1D1 (SEQ ID NO: 102), VH 1D1 (SEQ ID NO: 104), LC (легкая цепь) 1D1 (SEQ ID NO: 106), 1D1-hIgG1-3m-HC (SEQ ID NO: 108), VH 1D1 1.27 (SEQ ID NO: 198), 1D1 1.27-hIgG1-3m-HC (SEQ ID NO: 200), VH 1D1 1.28 (SEQ ID NO: 205), 1D1 1.28-hIgG1-3m-HC (SEQ ID NO: 207), VH 1D1 1.29 (SEQ ID NO: 212), 1D1 1.29-hIgG1-3m-HC (SEQ ID NO: 214), VH 1D1 1.30 (SEQ ID NO:219), 1D1 1.30-hIgG1-3m-HC (SEQ ID NO: 221), VH 1D1 1.31 (SEQ ID NO: 226), 1D1 1.31-hIgG1-3m-HC (SEQ ID NO: 228), VH 1D1 1.32 (SEQ ID NO: 233), 1D1 1.32-hIgG1-3m-HC (SEQ ID NO: 235), VH 1D1 1.33 (SEQ ID NO: 240), 1D1 1.33-hIgG1-3m-HC (SEQ ID NO: 242), VH 1D1 1.34 (SEQ ID NO: 247), 1D1 1.34-hIgG1-3m-HC (SEQ ID NO: 249), VL 15A9 (SEQ ID NO: 22), VH 15A9 (SEQ ID NO: 24), LC 15A9 (SEQ ID NO: 26), 1D1-hIgG1-3m-HC (SEQ ID NO: 28), VL 15C11 (SEQ ID NO: 36), VH 15C11 (SEQ ID NO: 38), LC 15C11 (SEQ ID NO: 40), 15C11-hIgG1-3m-HC (SEQ ID NO:42), VL 7D4 (SEQ ID NO: 88), VH 7D4 (SEQ ID NO: 90), LC 7D4 (SEQ ID NO: 92), 7D4-hIgG1-3m-HC (SEQ ID NO: 94), VL 22F9 (SEQ ID NO: 50), VH 22F9 (SEQ ID NO:52), LC 22F9 (SEQ ID NO:54), 22F9-hIgG1-3m-HC (SEQ ID NO: 56), VL 26B11 (SEQ ID NO: 64), VH1 26B11 (SEQ ID NO: 66), VH2 26B11 (SEQ ID NO: 68), VH-MDX 26B11 (SEQ ID NO: 70), LC 26B11 (SEQ ID NO: 72), 26B11-hIgG1-3m-HC (SEQ ID NO: 74), VL 9B3 (SEQ ID NO: 1), VH1 9B3 (SEQ ID NO: 3); VH2 9B3 (SEQ ID NO: 5), LC 9B3 (SEQ ID NO: 7), 9B3-hIgG1-3m-HC1 (SEQ ID NO: 9), 9B3-hIgG1-3m-HC2 (SEQ ID NO: 11), или их любой фрагмент или часть, имеющую способность к связыванию с TL1A.
Согласно изобретению предложены полинуклеотиды или композиции, содержащие полинуклеотиды, кодирующие любое из следующих антител против TL1A и их антигенсвязывающих фрагментов по изобретению, включая:
VL 1D1 (SEQ ID NO: 102), VH 1D1 (SEQ ID NO: 104), LC 1D1 (SEQ ID NO: 106), 1D1-hIgG1-3m-HC (SEQ ID NO: 108), VH 1D1 1.27 (SEQ ID NO: 198), 1D1 1.27-hIgG1-3m-HC (SEQ ID NO: 200), VH 1D1 1.28 (SEQ ID NO: 205), 1D1 1.28-hIgG1-3m-HC (SEQ ID NO: 207), VH 1D1 1.29 (SEQ ID NO: 212), 1D1 1.29-hIgG1-3m-HC (SEQ ID NO: 214), VH 1D1 1.30 (SEQ ID NO: 219), 1D1 1.30-hIgG1-3m-HC (SEQ ID NO: 221), VH 1D1 1.31 (SEQ ID NO: 226), 1D1 1.31-hIgG1-3m-HC (SEQ ID NO: 228), VH 1D1 1.32 (SEQ ID NO: 233), 1D1 1.32-hIgG1-3m-HC (SEQ ID NO: 235), VH 1D1 1.33 (SEQ ID NO: 240), 1D1 1.33-hIgG1-3m-HC (SEQ ID NO: 242), VH 1D1 1.34 (SEQ ID NO: 247), 1D1 1.34-hIgG1-3m-HC (SEQ ID NO: 249), VL 15A9 (SEQ ID NO: 22), VH 15A9 (SEQ ID NO: 24), LC 15A9 (SEQ ID NO: 26), 1D1-hIgG1-3m-HC (SEQ ID NO: 28), VL 15C11 (SEQ ID NO: 36), VH 15C11 (SEQ ID NO: 38), LC 15C11 (SEQ ID NO: 40), 15C11-hIgG1-3m-HC (SEQ ID NO: 42), VL 7D4 (SEQ ID NO: 88), VH 7D4 (SEQ ID NO: 90), LC 7D4 (SEQ ID NO: 92), 7D4-hIgG1-3m-HC (SEQ ID NO: 94), VL 22F9 (SEQ ID NO: 50), VH 22F9 (SEQ ID NO: 52), LC 22F9 (SEQ ID NO: 54), 22F9-hIgG1-3m-HC (SEQ ID NO: 56), VL 26B11 (SEQ ID NO: 64), VH1 26B11 (SEQ ID NO: 66), VH2 26B11 (SEQ ID NO: 68), VH-MDX 26B11 (SEQ ID NO: 70), LC 26B11 (SEQ ID NO: 72), 26B11-hIgG1-3m-HC (SEQ ID NO: 74), VL 9B3 (SEQ ID NO: 1), VH1 9B3 (SEQ ID NO: 3); VH2 9B3 (SEQ ID NO: 5), LC 9B3 (SEQ ID NO: 7), 9B3-hIgG1-3m-HC1 (SEQ ID NO: 9), 9B3-hIgG1-3m-HC2 (SEQ ID NO: 11) или их любой фрагмент, или часть, имеющая способность к связыванию с TL1A, где последовательность полинуклеотида охватывает последовательность SEQ ID NO: 103 (кодирующую VL 1D1), SEQ ID NO: 105 (кодирующую VH 1D1), SEQ ID NO: 107 (кодирующую LC 1D1), SEQ ID NO: 109 (кодирующую 1D1-hIgG1-3m-HC), SEQ ID NO: 199 (кодирующую VH 1D1 1.27), SEQ ID NO: 201 (кодирующую 1D1 1.27-hIgG1-3m-HC), SEQ ID NO: 206 (кодирующую VH 1D1 1.28), SEQ ID NO: 208 (кодирующую 1D1 1.28-hIgG1-3m-HC), SEQ ID NO: 213 (кодирующую VH 1D1 1.29), SEQ ID NO: 215 (кодирующую 1D1 1.29-hIgG1-3m-HC), SEQ ID NO: 220 (кодирующую VH 1D1 1.30), SEQ ID NO: 222 (кодирующую 1D1 1.30-hIgG1-3m-HC), SEQ ID NO: 227 (кодирующую VH 1D1 1.31), SEQ ID NO: 229 (кодирующую 1D1 1.31-hIgG1-3m-HC), SEQ ID NO: 234 (кодирующую VH 1D1 1.32), SEQ ID NO: 236 (кодирующую 1D1 1.32-hIgG1-3m-HC), SEQ ID NO: 241 (кодирующую VH 1D1 1.33), SEQ ID NO: 243 (кодирующую 1D1 1.33-hIgG1-3m-HC), SEQ ID NO: 248 (кодирующую VH 1D1 1.34), SEQ ID NO: 250 (кодирующую 1D1 1.34-hIgG1-3m-HC), SEQ ID NO: 23 (кодирующую VL 15A9), SEQ ID NO: 25 (кодирующую VH 15А9), SEQ ID NO: 27 (кодирующую LC 15A9), SEQ ID NO: 29 (кодирующую 1D1-hIgG1-3m-HC), SEQ ID NO: 37 (кодирующую VL 15C11), SEQ ID NO: 39 (кодирующую VH 15C11), SEQ ID NO: 41 (кодирующую LC 15C11), SEQ ID NO: 43 (кодирующую 15C11-hIgG1-3m-HC), SEQ ID NO: 89 (кодирующую VL 7D4), SEQ ID NO: 91 (кодирующую VH 7D4, SEQ ID NO: 93 (кодирующую LC 7D4), SEQ ID NO: 95 (кодирующую 7D4-hIgG1-3m-HC), SEQ ID NO: 51 (кодирующую VL 22F9), SEQ ID NO: 53 (кодирующую VH 22F9), SEQ ID NO: 55 (кодирующую LC 22F9), SEQ ID NO: 57 (кодирующую 22F9-hIgG1-3m-HC), SEQ ID NO: 65 (кодирующую VL 26B11), SEQ ID NO: 67 (кодирующую VH1 26B11), SEQ ID NO: 69 (кодирующую VH2 26B11), SEQ ID NO: 71 (кодирующую VH-MDX 26B11), SEQ ID NO: 73 (кодирующую LC 26B11), SEQ ID NO: 75 (кодирующую 26B11-hIgG1-3m-HC), SEQ ID NO: 2 (кодирующую VL 9B3), SEQ ID NO: 4 (кодирующую VH1 9B3), SEQ ID NO: 6 (кодирующую VH2 9B3), SEQ ID NO: 8 (кодирующую LC 9B3), SEQ ID NO: 10 (кодирующую 9B3-hIgG1-3m-HC1), SEQ ID NO: 12 (кодирующую 9B3-hIgG1-3m-HC2) или их любой фрагмент, или часть, имеющие способность к связыванию с TL1A).
В одном воплощении домены VH и VL или их антигенсвязывающий фрагмент, или полноразмерная HC (тяжелая цепь) или LC кодируются отдельными полинуклеотидами. В качестве альтернативы, как VH, так и VL или их антигенсвязывающий фрагмент, или НС и LC кодируются одним полинуклеотидом.
В другом аспекте согласно изобретению предложены полинуклеотиды и их варианты, кодирующие антитело против TL1A, где такие варианты полинуклеотидов имеют по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с любой из конкретных раскрытых здесь конкретных нуклеиновых кислот.
Полинуклеотиды, комплементарные любым таким последовательностям, также охватываются настоящим изобретением. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномную, кДНК или синтетическую) или РНК. Молекулы РНК включают молекулы гяРНК (гетерогенная ядерная РНК), которые содержат интроны и соответствуют молекуле ДНК один к одному, и молекулы мРНК, которые не содержат интроны. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно присутствуют в полинуклеотиде по настоящему изобретению, и полинуклеотид может, но не должен быть связан с другими молекулами и/или веществами подложек.
Полинуклеотиды могут содержать нативную последовательность (т.е. эндогенную последовательность, которая кодирует антитело или его фрагмент) или могут содержать вариант такой последовательности. Варианты полинуклеотдов содержат одну или более чем одну замену, присоединение, делецию и/или вставку таким образом, что иммунореактивность кодируемого полипептида не уменьшается относительно нативной иммунореактивной молекулы. Эффект на иммунореактиность кодируемого полипептида обычно можно оценивать, как здесь описано. Варианты предпочтительно демонстрируют по меньшей мере примерно 70% идентичности, более предпочтительно по меньшей мере примерно 80% идентичности, еще более предпочтительно по меньшей мере примерно 90% идентичности и наиболее предпочтительно по меньшей мере примерно 95% идентичности с полинуклеотидной последовательностью, которая кодирует нативное антитело или его фрагмент.
Говорят, что две полинуклеотидные или полипептидные последовательности являются «идентичными», если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой при выравнивании для максимального соответствия, как описано ниже. Сравнения между двумя последовательностями обычно проводят путем сравнения последовательностей в окне сравнения для идентификации и сравнения локальных участков сходства последовательностей. Термин «окно сравнения» в том виде, как он здесь используется, относится к отрезку из по меньшей мере примерно 20 смежных положений, обычно от 30 до примерно 75 или от 40 до примерно 50, в котором последовательность можно сравнивать с эталонной последовательностью с тем же самым числом смежных положений после оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения можно проводить с использованием программы MegAlign® в пакете биоинформационного программного обеспечения Lasergene® (DNASTAR®, Inc., Madison, WI) с использованием параметров по умолчанию. Данная программа включает несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5: 151-153; Myers, E.W. and Muller W., 1988, CABIOS 4: 11-17; Robinson, E.D., 1971, Comb. Theor. 11: 105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4: 406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80: 726-730.
Предпочтительно «процент идентичности последовательностей» определяется посредством сравнивания двух оптимально выровненных последовательностей в окне сравнения из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать присоединения или делеций (т.е. пропуски) составляющие 20 процентов или менее, обычно от 5 до 15 процентов или от 10 до 12 процентов по сравнению с контрольными последовательностями (которые не содержат присоединения или делеций) для оптимального выравнивания двух последовательностей. Процентная доля рассчитывается путем определения числа положений, в которых в обеих последовательностях встречаются идентичные основания нуклеиновой кислоты или аминокислотные остатки, с получением числа соответствующих положений, деля число соответствующих положений на общее число положений в контрольной последовательности (т.е. размер окна) и умножения результата на 100 с получением процента идентичности последовательности.
Варианты могут также или альтернативно быть по существу гомологичными нативному гену или его части или его комплементарной последовательности. Такие варианты полинуклеотидов способны к гибридизации при умеренно жестких условиях со встречающейся в природе последовательностью ДНК, кодирующей нативное антитело (или с комплементарной последовательностью).
Подходящие «умеренно жесткие условия» включают предварительную промывку в растворе  SSC (хлорид натрия плюс цитрат натрия), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (этилендиаминтетрауксусная кислота) (pH 8,0); гибридизацию при 50°C-65°C,
SSC (хлорид натрия плюс цитрат натрия), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (этилендиаминтетрауксусная кислота) (pH 8,0); гибридизацию при 50°C-65°C,  SSC, в течение ночи; с последующей промывкой дважды при 65°C в течение 20 минут каждым из
SSC, в течение ночи; с последующей промывкой дважды при 65°C в течение 20 минут каждым из  ,
,  и
и  SSC, содержащим 0,1% SDS.
SSC, содержащим 0,1% SDS.
Термины «очень жесткие условия» или «условия высокой жесткости» в том виде, как они здесь используются, представляют собой условия, при которых: (1) используется низкая ионная сила и высокая температура для промывки, например, 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецил сульфат натрия при 50°C; (2) во время гибридизации используется денатурирующий агент, такой как формамид, например, 50% (об./об.) формамида с 0,1% бычьего сывороточного альбумина/0,1% Ficoll/0,1% поливинилпирролидона/50 мМ натрий фосфатный буфер при pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°C; или (3) используется 50% формамид,  SSC (0,75 М NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия,
SSC (0,75 М NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия,  раствор Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфата декстрана при 42°C с промывками при 42°C в
раствор Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфата декстрана при 42°C с промывками при 42°C в  SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C, с последующей промывкой при очень жестких условиях, состоящей из
SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C, с последующей промывкой при очень жестких условиях, состоящей из  SSC, содержащего EDTA, при 55°C. Специалист будет знать, как корректировать температуру, ионную силу и т.д., по мере необходимости, для приспособления к таким факторам, как длина зонда и тому подобное.
SSC, содержащего EDTA, при 55°C. Специалист будет знать, как корректировать температуру, ионную силу и т.д., по мере необходимости, для приспособления к таким факторам, как длина зонда и тому подобное.
Обычным специалистам в данной области будет понятно, что, в результате вырожденности генетического кода, существуют много нуклеотидных последовательностей, которые кодируют полипептид, как здесь описано. Некоторые из данных полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого природного гена. Тем не менее, в настоящем изобретении конкретно рассматриваются полинуклеотиды, которые отличаются из-за различий в использовании кодонов. Кроме того, в пределах объема настоящего изобретения находятся аллели генов, содержащие предложенные здесь полинуклеотидные последовательности. Аллели представляют собой эндогенные гены, которые изменяются в результате одной или более чем одной мутации, такой как делеции, присоединения и/или замены нуклеотидов. Образующаяся мРНК и белок могут, но не обязательно имеют измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методик (таких как гибридизация, амплификация и/или сравнение с последовательностями в базах данных).
Полинуклеотиды по данному изобретению могут быть получены с использованием химического синтеза, способов генной инженерии или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не нуждаются здесь в подробном описании. Для получения желательной последовательности ДНК специалист в данной области может использовать предложенные здесь последовательности и имеющийся в продаже синтезатор ДНК.
Для получения полинуклеотидов с использованием способов генной инженерии полинуклеотид, содержащий желательную последовательность, может быть вставлен в подходящий вектор, и данный вектор, в свою очередь, может быть введен в подходящую клетку-хозяина для репликации и амплификации, как здесь обсуждается далее. Полинуклеотиды могут быть вставлены в клетки-хозяева любыми способами, известными в данной области. Клетки трансформируют посредством введения экзогенного полинуклеотида прямым поглощением, эндоцитозом, трансфекцией, F-спариванием или электропорацией. Сразу после введения экзогенный полинуклеотид может поддерживаться в клетке в виде неинтегрированного вектора (такого как плазмида) или интегрированного в геном клетки-хозяина. Полинуклеотид, амплифицированный таким образом, может быть выделен из клетки-хозяина способами, хорошо известными в данной области. См., например, Sambrook et al., 1989.
В качестве альтернативы, репродукцию последовательностей ДНК обеспечивает ПЦР. Методика ПЦР хорошо известна в данной области и описана в патентах США №4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена посредством применения выделенной ДНК в подходящем векторе и ее вставки в подходящую клетку-хозяина. При репликации клетки ДНК транскрибируется в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как изложено, например, выше в Sambrook et al., 1989.
Подходящие клонирующие векторы могут быть сконструированы согласно стандартным методикам или могут быть выбраны из большого числа клонирующих векторов, доступных в данной области. В то время как выбранный клонирующий вектор может отличаться согласно клетке-хозяину, намеченной к применению, полезные клонирующие векторы обычно будут иметь способность к саморепликации, могут обладать одной мишенью для конкретной эндонуклеазы рестрикции и/или могут нести гены маркера, который можно использовать при отборе клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например, pUC18, pUC19, Bluescript (например, pBS SK+) и их производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и pAT28. Эти и многие другие клонирующие векторы доступны у коммерческих поставщиков, таких как BioRad, Strategene и Invitrogen.
Дополнительно предложены экспрессионные векторы. Экспрессионные векторы обычно представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид согласно изобретению. Подразумевается, что экспрессионный вектор должен быть реплицируемым в клетках-хозяевах либо в виде эписом, либо в виде интегральной части хромосомной ДНК. Подходящие экспрессионные векторы включают плазмиды, вирусные векторы, включающие аденовирусы, аденосателлитные вирусы, ретровирусы, космиды и экспрессионный вектор(-ы), раскрытый в публикации РСТ № WO 87/04462, но не ограничиваются ими. Компоненты вектора обычно могут включать один или более чем один из следующих: сигнальная последовательность; репликатор; один или более чем один маркерный ген; подходящие элементы контроля транскрипции (такие как промоторы, энхансеры и терминатор), но не ограничиваются ими. Для экспрессии (т.е. трансляции) также обычно требуется один или более чем один элемент контроля трансляции, такой как сайты связывания рибосомы, сайты инициации трансляции и терминаторы.
Векторы, содержащие интересующие полинуклеотиды и/или сами полинуклеотиды могут быть введены в клетку-хозяина любым числом подходящих способов, включающих электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DЕАЕ(диэтиламиноэтил)-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфекцию (например, когда вектор представляет собой инфекционный агент, такой как вирус осповакцины). Выбор вводящихся векторов или полинуклеотидов часто будет зависеть от характеристик клетки-хозяина.
Согласно изобретению также предложены клетки-хозяева, содержащие любой из описанных здесь полинуклеотидов. С целью выделения генов, кодирующих интересующие антитело, полипептид или белок, могут использоваться любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК. Неограничивающие примеры клеток-хозяев млекопитающих включают клетки COS, HeLa и CHO (яичники китайского хомяка), но не ограничиваются ими. См. также публикацию РСТ № WO 87/04462. Подходящие клетки-хозяева немлекопитающих включают прокариот (таких как Е. coli или В. subtilis) и дрожжей (таких как S. cerevisae, S. pombe; или К. lactis). Предпочтительно клетки-хозяева экспрессируют кДНК на уровне примерно в 5 раз большем, более предпочтительно в 10 раз большем, даже более предпочтительно в 20 раз большем, чем уровень экспрессии соответствующего интересующего эндогенного антитела или белка, при их наличии, в клетках-хозяевах. Скрининг клеток-хозяев в отношении специфичного связывания с TL1A осуществляется посредством иммуноанализа или FACS (флуоресцентная сортировка клеток). Может быть идентифицирована клетка, сверхэкспрессирующая интересующее антитело или белок.
Экспрессионный вектор может быть использован для прямой экспрессии антитела против TL1A. Специалист в данной области знаком с введением экспрессионных векторов для получения экспрессии экзогенного белка in vivo. См, например, патенты США №6436908; 6413942 и 6376471. Введение экспрессионных векторов включает местное или системное введение, включающее инъекцию, пероральное введение, генную пушку или введение через катетер, или местное введение. В другом воплощении экспрессионный вектор вводится непосредственно в симпатический ствол или ганглий, или в коронарную артерию, предсердие, желудочек сердца или перикард.
Также может использоваться направленная доставка терапевтических композиций, содержащих экспрессионный вектор, или субгеномных полинуклеотидов. Методики доставки ДНК, опосредованной рецептором, описаны, например, в Findeis et al., Trends Biotechnol., 1993, 11: 202; Chiou et al., Gene Therapeutics: Methods And Applications Of Direct Gene Transfer, J.A. Wolff, ed., 1994; Wu et al., J. Biol. Chem., 1988, 263: 621; Wu et al., J. Biol. Chem., 1994, 269: 542; Zenke et al., Proc. Natl. Acad. Sci. USA, 1990, 87: 3655; Wu et al., J. Biol. Chem., 1991, 266: 338. Терапевтические композиции, содержащие полинуклеотид, вводятся в интервале от примерно 100 нг до примерно 200 мг ДНК для местного введения в протоколе генотерапии. На протяжении протокола генотерапии также можно использовать интервалы концентраций от примерно 500 нг до примерно 50 мг, от примерно 1 мкг до примерно 2 мг, от примерно 5 мкг до примерно 500 мкг и от примерно 20 мкг до примерно 100 мкг ДНК. Терапевтические полинуклеотиды и полипептиды могут доставляться с использованием носителей для доставки генов. Носитель для доставки генов может быть вирусного или невирусного происхождения (см., в общем, Jolly, Cancer Gene Therapy, 1994, 1: 51; Kimura, Human Gene Therapy, 1994, 5: 845; Connelly, Human Gene Therapy, 1995, 1: 185 и Kaplitt, Nature Genetics, 1994, 6: 148). Экспрессию таких кодирующих последовательностей можно индуцировать с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Экспрессия кодирующей последовательности может быть либо конститутивной, либо регулируемой.
Векторы на основе вирусов для доставки желательного полинуклеотида и экспрессии в желательной клетке хорошо известны в данной области. Типичные носители на основе вирусов включают рекомбинантные ретровирусы (см., например, публикации РСТ № WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; WO 93/11230; WO 93/10218; WO 91/02805; патенты США №5219740 и 4777127; патент Великобритании №2200651; и патент EP №0345242), векторы на основе альфавируса (например, векторы на основе вируса Синдбис, вируса леса Семлики (ATCC VR-67; ATCC VR-1247), вируса реки Росс (ATCC VR-373; ATCC VR-1246) и вируса венесуэльского лошадиного энцефалита (ATCC VR-923; ATCC VR-1250; ATCC VR 1249; ATCC VR-532)), и векторы на основе аденосателлитного вируса (AAV) (см., например, публикации РСТ № WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655), но не ограничиваются ими. Также может использоваться введение ДНК, связанной с умерщвленным аденовирусом, как описано в Curiel, Hum. GeneTher., 1992, 3: 147.
Также могут использоваться носители и способы невирусной доставки, включающие поликатионную конденсированную ДНК, связанную или не связанную с одним умерщвленным аденовирусом (см., например, Curiel, Hum. Gene Ther., 1992, 3: 147); ДНК, связанную с лигандом (см., например, Wu, J. Biol. Chem., 1989, 264: 16985); носители для доставки на основе эукариотических клеток (см., например, патент США №5814482; публикации РСТ № WO 95/07994; WO 96/17072; WO 95/30763 и WO 97/42338) и нейтрализацию заряда или слияние нуклеиновой кислоты с клеточными мембранами, но не ограничиваются ими. Также может быть получена голая ДНК. Типичные способы введения голой ДНК описаны в публикации РСТ № WO 90/11092 и в патенте США №5580859. Липосомы, которые могут действовать в качестве носителей для доставки генов, описаны в патенте США №5422120; публикациях РСТ № WO 95/13796; WO 94/23697; WO 91/14445 и EP 0524968. Дополнительные подходы описаны в Philip, Mol. Cell Biol., 1994, 14: 2411 и в Woffendin, Proc. Natl. Acad. Sci., 1994, 91: 1581.
Связывание антител
Описанное здесь антитело или его антигенсвязывающий фрагмент селективно связываются с лигандом 1А, подобным фактору некроза опухолей (TL1A). В одном воплощении антитело или его антигенсвязывающий фрагмент связываются с человеческим лигандом 1А, подобным фактору некроза опухолей (hTL1A).
В определенных случаях, особенно при разработке терапевтического средства, для антитела является полезной перекрестная реактивность с TL1A из других видов, которые можно использовать в качестве имитирующих моделей безопасности и/или эффективности. Например, в некоторых случаях токсичность и/или эффективность терапевтического средства можно измерять в имитирующей животной модели конкретного заболевания. В одном воплощении антитело или его антигенсвязывающий фрагмент, как таковые, связываются с человеческим лигандом 1А, подобным фактору некроза опухолей (hTL1A), а также с лигандом 1А, подобным фактору некроза опухолей из по меньшей мере одного другого млекопитающего, выбранного из группы, состоящей из мыши, крысы, собаки и яванского макака. В конкретном воплощении KD антитела в отношении лиганда 1А, подобного фактору некроза опухолей, из по меньшей мере одного другого млекопитающего, выбранного из группы, состоящей из мыши, крысы, собаки и яванского макака, выше не больше чем в 30 раз, например, не больше чем в 20 раз, не больше чем в 15 раз или не больше чем в 10 раз, чем KD антитела в отношении hTL1A. В еще одном другом воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении мышиного TL1A 10 нМ или менее, например, 3 нМ или менее, 1 нМ или менее, 300 пМ или менее, или 100 пМ или менее при измерении посредством SPR.
В другом воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении человеческого TNF альфа 1 мкМ или более, например, 3 мкМ или более, 10 мкМ или более, 30 мкМ или более, 100 мкМ или более при измерении посредством SPR.
В еще одном другом воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении мышиного TL1A 10 нМ или менее, например, 3 нМ или менее, 1 нМ или менее, 300 пМ или менее, или 100 пМ или менее при измерении посредством SPR. В конкретном воплощении антитело или антигенсвязывающий фрагмент имеет аффинность в отношении человеческого TL1A, составляющую 100 пМ или менее, аффинность в отношении мышиного TL1A, составляющую 300 пМ или менее при измерении посредством SPR, и аффинность в отношении человеческого TNF альфа 1 мкМ или более.
В одном воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении человеческого TL1A 4 нМ или менее, например, 1 нМ или менее, 500 пМ или менее, 250 пМ или менее, 100 пМ или менее, 50 пМ или менее, 25 пМ или менее, 10 пМ или менее, 5 пМ или менее при измерении посредством поверхностного плазмонного резонанса (SPR).
В другом воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении человеческого TNF альфа 1 мкМ или более, например, 3 мкМ или более, 10 мкМ или более, 30 мкМ или более, 100 мкМ или более при измерении посредством SPR.
В еще одном другом воплощении антитело или его антигенсвязывающий фрагмент конкурирует с антителом, выбранным из группы, состоящей из 1D1 1.31, 26B11, 9B3, 7D4, 22F9, 15А9 и 15С11, как определено здесь ниже.
В конкретном воплощении антитело или его антигенсвязывающий фрагмент имеют аффинность в отношении человеческого TL1A 100 пМ или менее, аффинность в отношении мышиного TL1A 300 пМ или менее при измерении посредством SPR, и аффинность в отношении человеческого TNF альфа 1 мкМ или более.
В некоторых случаях связывание антитела или его антигенсвязывающего фрагмента с TL1A или любым другим белком можно измерять с использованием поверхностного плазмонного резонанса (SPR). В некоторых воплощениях аффинность представляет собой значение KD, измеренное SPR. В других случаях в SPR используется захваченное антитело и мишень в фазе раствора. В некоторых воплощениях захваченное антитело иммобилизовано на сенсорном чипе с использованием антитела или его антигенсвязывающей части против изотипа. Например, антитело или его антигенсвязывающая часть против изотипа может быть иммобилизовано на сенсорном чипе в плотности от примерно 4000 до примерно 13000 единиц ответа. Измерение посредством SPR также может осуществляться, например, как по существу проводится согласно протоколу, изложенному в Примере 8. В некоторых случаях в SPR используется захваченная мишень и антитело в фазе раствора. В некоторых воплощениях измерение SPR проводится с использованием установки Biacore Т100 или Т200.
В других воплощениях аффинность антитела или его антигенсвязывающего фрагмента в отношении человеческого TL1A измеряется посредством анализа кинетического исключения на основе раствора (KinExA). Например, в некоторых случаях аффинность представляет собой значение KD, измеренное посредством анализа кинетического исключения на основе раствора (KinExA). В других случаях в KinExA используется захваченная мишень на твердой фазе и антитело в фазе раствора. В других случаях антитело и мишень достаточно долго прединкубируются в растворе до достижения равновесия. В одном воплощении уровень несвязавшегося антитела измеряется после достижения антителом и мишенью равновесия. В конкретном воплощении проводится измерение KinExA с использованием установки KinExA 3200 (Sapidyne).
Терапевтические способы
Терапевтические способы включают введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества или эффективного количества антитела против TL1A или антигенсвязывающей части по изобретению и рассматриваются настоящим раскрытием. «Терапевтически эффективное» или «эффективное» количество в том виде, как здесь используется данная фраза, относится к количеству антитела или его части, которое является достаточным количеством для того, чтобы приводить к уменьшению тяжести симптомов заболевания, увеличению частоты и продолжительности периодов заболевания без симптомов или предупреждению ухудшения или инвалидности из-за поражения заболеванием - либо в виде одной дозы, либо согласно схеме со многими дозами, одного или в комбинации с другими агентами. Обычный специалист в данной области может определить такие количества на основе таких факторов, как размер субъекта, тяжесть симптомов субъекта и конкретная выбранная композиция или путь введения. Субъектом может быть человек или животное, не являющееся человеком (например, кролик, крыса, мышь, обезьяна или другой примат низшего порядка).
Антитело или антигенсвязывающая часть по изобретению может вводиться совместно с известными лекарственными средствами, и, в некоторых случаях, само антитело может быть модифицировано. Например, антитело может быть конъюгировано с иммунотоксином или радиоизотопом для потенциального дополнительного увеличения эффективности. В том, что касается совместного введения с дополнительными терапевтическими агентами, такие агенты могут включать цитотоксический агент, радиотоксический агент или иммунодепрессант. Антитело может быть связано с агентом (в виде иммунокомплекса) или может вводиться отдельно от агента. В последнем случае (раздельное введение) антитело может вводиться до, после или сопутствующе с агентом, или может вводиться совместно с другими известными терапиями, например, противораковой терапией, например, радиацией. Совместное введение антител против TL1A или их антигенсвязывающих фрагментов по настоящему раскрытию с терапевтическим агентом дает два агента, которые действуют через разные механизмы и могут давать терапевтический и возможно синергетический эффект в отношении человеческого заболевания.
Раскрытые здесь антитела и антигенсвязывающие части можно использовать в качестве терапевтического или диагностического средства во множестве ситуаций, когда TL1A нежелательным образом экспрессируется или обнаруживается, обзор чего дается, например, в Hsu and Viney, выше. Принимая во внимание участие TL1A в воспалительных путях и в многочисленных заболеваниях, расстройствах и состояниях, многие такие заболевания, расстройства или состояния являются особенно подходящими для лечения антителом или его антигенсвязывающей частью по настоящему изобретению. Соответственно, антитела против TL1A или их антигенсвязывающие фрагменты по данному раскрытию можно использовать в лечении или предупреждении расстройств, опосредованных TL1A. Кроме того, согласно изобретению предложено применение антител против TL1A или их антигенсвязывающих фрагментов по данному раскрытию в изготовлении лекарственного средства для применения в лечении или предупреждении расстройств, опосредованных TL1A. В другом воплощении в данной заявке раскрыты антитела против TL1A или их антигенсвязывающие фрагменты для применения в лечении расстройств, опосредованных TL1A. В другом воплощении в данной заявке раскрыты фармацевтические композиции, содержащие антитела против TL1A или их антигенсвязывающие фрагменты по данному раскрытию, для применения в лечении или предупреждении заболеваний, опосредованных TL1A. Данные опосредованные TL1A заболевания, расстройства или состояния включают следующие: воспалительное расстройство, такое как IBD (воспалительное заболевание кишечника) (включающее болезнь Крона и язвенный колит), астма (включая эндогенную астму и аллергическую астму), аллергии (например, атопическая аллергия), сахарный диабет, артритические расстройства (включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориатический артрит и анкилозирующий спондилоартрит), рассеянный склероз, отторжение трансплантата, болезнь «трансплантат против хозяина» (GVHD), спондилоартропатия, первичный склерозирующий холангит, первичный цирроз печени, атеросклероз, синдром болезненного мочевого пузыря/интерстициальный цистит, дисфункция мочевого пузыря, сепсис, увеит, энцефаломиелит, тяжелая миастения, системная красная волчанка, кожная красная волчанка, аутоиммунный тиреоидит, дерматит (включая атопический дерматит и экзематический дерматит), псориаз, синдром Шегрена, склеродермия и васкулит, но не ограничиваются ими.
Для лечения любого из вышеупомянутых расстройств, фармацевтические композиции для применения согласно настоящему раскрытию можно готовить традиционным способом с использованием одного или более чем одного фармацевтически приемлемого носителя или эксципиента и вводить, как более подробно обсуждается ниже.
Определение терапевтически эффективного количества антитела или антигенсвязывающей части согласно настоящему раскрытию, главным образом, будет зависеть от конкретных характеристик пациента, пути введения и природы расстройства, которое лечат, и более подробно обсуждается ниже.
Введение и дозировка антитела более подробно обсуждаются ниже в других местах.
Диагностические способы
Раскрытые здесь антитела против TL1A или их антигенсвязывающие части можно использовать для диагностического тестирования и визуализации. Например, антитела против TL1A или их антигенсвязывающие части можно использовать в анализе ELISA (твердофазный иммуноферментный анализ). Антитела или их антигенсвязывающие части также можно использовать в виде радиоактивно меченого моноклонального антитела. См., например, Srivastava (ed.), Radiolabeled Monoclonal Antibodies For Imaging And Therapy, Plenum Press (1988); Chase, "Medical Applications of Radioisotopes," in Remington's Pharmaceutical Sciences, 18th Edition, Gennaro et al. (eds.), Mack Publishing Co., pp. 624-652 (1990) и Brown, "Clinical Use of Monoclonal Antibodies," in Biotechnology and Pharmacy, Pezzuto et al. (eds.), Chapman and Hall, pp. 227-249 (1993); Grossman, 1986, Urol. Clin. North Amer. 13: 465-474; Unger et al., 1985, Invest. Radiol. 20: 693-700 и Khaw et al., 1980, Science 209: 295-297. В данной методике, также известной как иммуносцинтиграфия, используется гамма камера для выявления локализации гамма-испускающих радиоактивных изотопов, конъюгированных с моноклональными антителами. Диагностическую визуализацию можно использовать для диагностики рака, аутоиммунного заболевания, инфекционного заболевания и/или сердечно-сосудистого заболевания. (См., например, Brown, выше).
В одном воплощении антитела против TL1A или их антигенсвязывающие фрагменты можно использовать для диагностики связанных с TL1A заболеваний, расстройств или состояний, включая заболевания, относящиеся к иммунной системе. Например, антитела или их антигенсвязывающие фрагменты, наряду с другими применениями, можно использовать для выявления уровней TL1A у пациентов.
Помимо диагностики, антитела против TL1A или их антигенсвязывающие фрагменты можно использовать для отслеживания терапевтических ответов, выявления рецидивов заболевания и принятия последующих клинических решений.
В некоторых воплощениях для целей диагностики и отслеживания радиоактивные изотопы могут быть связаны с фрагментами антитела либо прямо, либо опосредованно путем применения промежуточной функциональной группы. Такие промежуточные функциональные группы включают, например, DTPA (диэтилентриаминпентауксусная кислота) и EDTA (этилендиаминтетрауксусная кислота). Доза радиации, доставленная пациенту, типично поддерживается на таком низком уровне, который только возможен. Это может осуществляться посредством выбора изотопа для наилучшей комбинации минимального периода полувыведения, минимального удерживания в организме и минимального количества изотопа, которое будет обеспечивать выявление и точное измерение. Примеры радиоактивных изотопов, которые могут быть связаны с антителами и подходят для диагностической визуализации, включают 99mTc и 111In.
Исследования показывают, что фрагменты антитела, в частности Fab и Fab', обеспечивают подходящие отношения опухоль/фон. (См., например, Brown, выше).
Антитело против TL1A или его антигенсвязывающие фрагменты с целью диагностики in vivo также могут метиться парамагнитными ионами. Элементы, которые являются особенно полезными для магнитно-резонансной визуализации, включают ионы Gd, Mn, Dy и Fe.
Антитело против TL1A или его антигенсвязывающие фрагменты также может выявлять присутствие TL1A in vitro. В таких иммуноанализах антитело или его антигенсвязывающие фрагменты могут использоваться в жидкой фазе или связанным с твердофазным носителем. Например, интактное антитело или его антигенсвязывающий фрагмент может быть присоединено к полимеру, такому как аминодекстран, для того, чтобы связать компонент в виде антитела с нерастворимой подложкой, такой как покрытый полимером шарик, пластинка или трубка.
В качестве альтернативы, антитело против TL1A или его антигенсвязывающие фрагменты можно использовать для выявления присутствия конкретных антигенов в срезах ткани, полученных из гистологического образца. Такое выявление in situ может осуществляться, например, путем нанесения на срезы ткани антитела против TL1A или его антигенсвязывающего фрагмента, меченых выявляемым агентом. Выявление in situ можно использовать для определения присутствия конкретного антигена и для определения распределения антигена в исследованной ткани. Общие методики выявления in situ хорошо известны обычным специалистам. (См., например, Ponder, "Cell Marking Techniques and Their Application", in Mammalian Development: A Practical Approach, Monk (ed.), IRL Press, pp. 115-138 (1987); Coligan et al., выше).
Выявляемые метки, такие как ферменты, флуоресцентные соединения, агенты, переносящие электроны, и тому подобное, могут быть связаны с носителем традиционными способами, хорошо известными в данной области. Эти меченые носители и конъюгаты антитела, полученные из них, можно использовать для иммуноанализов in vitro и для выявления in situ, в значительной степени благодаря тому, что конъюгат антитела может быть получен прямым присоединением меток к антителу. Загрузка конъюгатов антитела целым рядом меток может увеличивать чувствительность иммуноанализов или гистологических методик, где достигается только малая степень связывания антитела или фрагмента антитела с антигеном-мишенью.
Композиции
Согласно изобретению также предложены фармацевтические композиции, содержащие эффективное количество описанного здесь антитела против TL1A. Здесь также описаны примеры таких композиций, а также то, как их готовить. В некоторых воплощениях композиция содержит одно или более чем одно антитело против TL1A. В других воплощениях антитело против TL1A распознает TL1A. В других воплощениях антитело против TL1A представляет собой человеческое антитело. В других воплощениях антитело против TL1A представляет собой гуманизированное антитело. В некоторых воплощениях антитело против TL1A содержит константную область, которая способна запускать желательный иммунный ответ, такой как опосредованный антителом лизис или ADCC. В других воплощениях антитело против TL1A содержит константную область, которая не запускает ненужные или нежелательные иммунные ответы, такие как опосредованный антителом лизис или ADCC. В других воплощениях антитело против TL1A содержит одну или более чем одну CDR антитела (как, например, одну, две, три, четыре, пять или, в некоторых воплощениях, все шесть CDR).
Понятно, что композиции могут содержать более чем одно антитело против TL1A (например, смесь антител против TL1A, которые распознают разные эпитопы TL1A). Другие типичные композиции содержат более чем одно антитело против TL1A, которые распознают одинаковый эпитоп (эпитопы), или разные виды антител против TL1A, которые связываются с разными эпитопами TL1A. В некоторых воплощениях композиции содержат смесь антител против TL1A, которые распознают разные варианты TL1A.
В некоторых случаях желательно иметь антитело или антигенсвязывающий фрагмент с высокой растворимостью в водном растворе или в фармацевтических композициях. Следовательно, в одном воплощении антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению имеет растворимость в водном растворе по меньшей мере примерно 10 мг/мл, например, по меньшей мере примерно 20 мг/мл, по меньшей мере примерно 30 мг/мл, по меньшей мере примерно 40 мг/мл, по меньшей мере примерно 50 мг/мл, по меньшей мере примерно 60 мг/мл, по меньшей мере примерно 70 мг/мл, по меньшей мере примерно 80 мг/мл, по меньшей мере примерно 90 мг/мл, по меньшей мере примерно 100 мг/мл, по меньшей мере примерно 125 мг/мл, по меньшей мере примерно 150 мг/мл, по меньшей мере примерно 175 мг/мл и по меньшей мере примерно 200 мг/мл. В некоторых случаях водный раствор представляет собой раствор с pH примерно 5,0-9,0. В других случаях pH водного раствора составляет примерно от pH 6,0 до pH 8,0.
Композиция, используемая в настоящем изобретении, может дополнительно содержать фармацевтически приемлемые носители, эксципиенты или стабилизаторы (Remington: The Science and practice of Pharmacy 20th Ed., 2000, Lippincott Williams and Wilkins, Ed. К.E. Hoover), в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и могут содержать буферы, такие как буферы на основе фосфата, цитрата и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем из примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстраны; хелаторы, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ). Здесь дополнительно описаны фармацевтически приемлемые эксципиенты.
Антитело против TL1A и его композиции также можно использовать в сочетании с другими агентами, которые служат для усиления и/или дополнения эффективности агентов.
Согласно изобретению также предложены композиции, включающие фармацевтические композиции, содержащие любой из полинуклеотидов по изобретению. В некоторых воплощениях композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий антитело, как здесь описано. В других воплощениях композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий любое из описанных здесь антител. В других воплощениях композиция содержит один из двух или оба полинуклеотида, содержащих последовательность, показанную в SEQ ID NO: 103 и SEQ ID NO: 105, один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 109, один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 199, один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 201, один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 206, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 208, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 213, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 215, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 220, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 222, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 227, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 229, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 241, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 243, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 103 и SEQ ID NO: 248, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 107 и SEQ ID NO: 250, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 23 и SEQ ID NO: 25, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 27 и SEQ ID NO: 29, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 37 и SEQ ID NO: 39, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 41 и SEQ ID NO: 43, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 89 и SEQ ID NO: 91, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 93 и SEQ ID NO: 95, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 51 и SEQ ID NO: 53, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 55 и SEQ ID NO: 57, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 65 и SEQ ID NO: 67, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 65 и SEQ ID NO: 69, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 65 и SEQ ID NO: 71, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 73 и SEQ ID NO: 75, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 2 и SEQ ID NO: 4, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 2 и SEQ ID NO: 6, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 8 и SEQ ID NO: 10, или один из двух или оба полинуклеотида, показанных в SEQ ID NO: 8 и SEQ ID NO: 12.
В другом аспекте полинуклеотид может кодировать VH, VL и/или как VH, так и VL антитела или его антигенсвязывающего фрагмента по изобретению. То есть, композиция содержит один полинуклеотид или более чем один полинуклеотид, кодирующий антитело или его антигенсвязывающую часть по изобретению.
Фармацевтические композиции по раскрытию также можно вводить в комбинированной терапии, как, например, объединенными с другими агентами. Например, комбинированная терапия может включать антитело против TL1A или его антигенсвязывающий фрагмент по настоящему раскрытию, объединенное с по меньшей мере одной другой терапией, где данная терапия может представлять собой хирургию, иммунотерапию, химиотерапию, обработку радиацией или лекарственную терапию.
Фармацевтические соединения по раскрытию могут включать одну или более чем одну фармацевтически приемлемую соль. Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включают соли, происходящие из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромисто-водородная, йодисто-водородная, фосфористая и тому подобные, а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и тому подобное. Соли присоединения основания включают соли, происходящие из щелочноземельных металлов, таких как натрий, калий, магний, кальций и тому подобные, а также из нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и тому подобное.
Фармацевтическая композиция по раскрытию также может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксданты, такие как аскорбиновая кислота, цистеина гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобное; (2) растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобные; и (3) агенты, хелатирующие металлы, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобные.
Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях по раскрытию, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Подходящую жидкостность можно поддерживать, например, посредством применения веществ покрытий, таких как лецитин, посредством поддержания требующегося размера частиц в случае дисперсий и посредством применения поверхностно-активных веществ.
Данные композиции также могут содержать адъюванты, такие как консерванты, увлажнители, эмульгаторы и диспергирующие агенты. Предупреждение присутствия микроорганизмов может обеспечиваться как методиками стерилизации, так и посредством включения разных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и тому подобных. Также может быть желательным включение в композиции изотоничных агентов, таких как сахара, хлорид натрия и тому подобное. Кроме того, длительное поглощение инъекционной фармацевтической формы может осуществляться включением агентов, которые задерживают поглощение, таких как моностеарат алюминия и желатин.
Фармацевтические композиции типично должны быть стерильными и стабильными при условиях изготовления и хранения. Композицию можно готовить в виде раствора, микроэмульсии, липосом или других упорядоченных структур, подходящих для высокой концентрации лекарственного средства.
Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное) и их подходящие смеси. Подходящую жидкостность можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания требующегося размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Во многих случаях будет подходящим включение в композицию изотоничных агентов, например, сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия. Длительное поглощение инъекционных композиций может осуществляться включением в композицию агента, который задерживает поглощение, например, солей моностеарата и желатина.
Стерильные инъекционные растворы можно получать включением активного соединения в требующемся количестве в подходящем растворителе с одним ингредиентом или с комбинацией перечисленных выше ингредиентов, по мере необходимости, с последующей стерилизующей микрофильтрацией.
Обычно дисперсии получают включением активного соединения в стерильный носитель, который содержит базовую диспергирующую среду и другие требующиеся ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный желательный ингредиент из его раствора, ранее подвергнутого стерилизующей фильтрации.
Фармацевтическую композицию по настоящему раскрытию можно получать, паковать или продавать в композиции, подходящей для глазного введения. Такие композиции, например, могут находиться в форме глазных капель, включающих, например, 0,1-1,0% (масс./масс.) раствора или суспензии активного ингредиента в водном или масляном жидком носителе. Такие капли могут дополнительно содержать буферизующие агенты, соли или один или более чем один другой описанный здесь дополнительный ингредиент. Другие полезные композиции, вводимые в глаз, включают композиции, которые содержат активный ингредиент в микрокристаллической форме или в липосомном препарате.
Термин «дополнительные ингредиенты» в том виде, как он здесь используется, включает без ограничений один или более чем один из следующих: эксципиенты; поверхностно-активные агенты; диспергирующие агенты; инертные разбавители; гранулирующие агенты и разрыхлители; связывающие агенты; смазки; подсластители; ароматизаторы; красители; консерванты; физиологически деградируемые композиции, такие как желатин; водные носители и растворители; масляные носители и растворители; суспендирующие агенты; диспергирующие или увлажняющие агенты; эмульгаторы; мягчители; буферы; соли; загустители; наполнители; эмульгаторы; антиоксиданты; антибиотики; противогрибковые агенты; стабилизаторы и фармацевтически приемлемые полимерные или гидрофобные вещества. Другие «дополнительные ингредиенты», которые могут быть включены в фармацевтические композиции по изобретению, известны в данной области и описаны, например, в Remington's Pharmaceutical Sciences, Genaro, ed., Mack Publishing Co., Easton, PA (1985), которая включена сюда посредством ссылки.
В одном воплощении антитело против TL1A или его антигенсвязывающий фрагмент вводят в составе внутривенной композиции в виде стерильного водного раствора, содержащего 5 мг/мл, или более предпочтительно примерно 10 мг/мл, или еще более предпочтительно примерно 15 мг/мл, или даже более предпочтительно примерно 20 мг/мл антитела с ацетатом натрия, полисорбатом 80 и хлоридом натрия с pH, варьирующим от примерно 5 до 6. Предпочтительно внутривенная композиция представляет собой стерильный водный раствор, содержащий 5 или 10 мг/мл антитела, с 20 мМ ацетата натрия, 0,2 мг/мл полисорбата 80 и 140 мМ хлоридом натрия при pH 5,5. Кроме того, раствор, содержащий антитело или его антигенсвязывающий фрагмент, может содержать, среди многих других соединений, гистидин, маннит, сахарозу, трегалозу, глицин, поли(этилен)гликоль, EDTA, метионин и их любую комбинацию, и многие другие соединения, известные в релевантной области.
В одном воплощении фармацевтическая композиция по настоящему раскрытию содержит следующие компоненты: 100 мг антитела против TL1A или антигенсвязывающего фрагмента по настоящему раскрытию, 10 мМ гистидина, 5% сахарозы и 0,01% полисорбата 80 при pH 5,8. Данная композиция может быть предоставлена в виде лиофилиированного порошка. При растворении порошка в полном объеме композиция сохраняет тот же самый состав. В качестве альтернативы, порошок может быть растворен в половине объема, причем в данном случае композиция содержит 100 мг антитела против TL1A или его антигенсвязывающего фрагмента по настоящему раскрытию, 20 мМ гистидина, 10% сахарозы и 0,02% полисорбата 80 при pH 5,8.
В одном воплощении часть дозы вводится посредством внутривенного болюса, и остальная часть - посредством инфузии композиции антитела. Например, 0,01 мг/кг внутривенной инъекции антитела против TL1A или его антигенсвязывающего фрагмента может даваться в виде болюса, и остальная часть дозы антитела может вводиться посредством внутривенной инъекции. Заданная доза антитела против TL1A или его антигенсвязывающего фрагмента может вводиться, например, на протяжении периода от полутора часов до двух часов или до пяти часов.
В том, что касается терапевтического агента, когда агент, например, представляет собой небольшую молекулу, он может присутствовать в фармацевтической композиции в форме физиологически приемлемого сложного эфира или соли, как, например, в комбинации с физиологически приемлемым катионом или анионом, как хорошо известно в данной области.
Описанные здесь препараты фармацевтических композиций могут быть получены любым способом, известным в области фармакологии или разработанным позднее. В общем, такие подготовительные способы включают стадию приведения активного ингредиента в ассоциацию с носителем или одним или более чем одним вспомогательным ингредиентом и затем, если это необходимо или желательно, формовку или упаковку продукта в желательную одно- или многодозовое лекарственное средство.
В одном воплощении композиции по раскрытию представляют собой апирогенные композиции, которые по существу не содержат эндотоксинов и/или родственных пирогенных веществ. Эндотоксины включают токсины, которые заключены внутри микроорганизма и высвобождаются при разрушении или гибели микроорганизмов. Пирогенные вещества также включают индуцирующие лихорадку термостабильные вещества (гликопротеины) из наружной мембраны бактерий и других микроорганизмов. Оба данных вещества могут вызывать лихорадку, гипотензию и шок при введении человеку. Из-за потенциальных вредных эффектов полезно удалять даже малые количества эндотоксинов из растворов фармацевтического лекарственного средства, вводимого внутривенно. Управление США по контролю качества пищевых продуктов и лекарственных средств (FDA) установило для внутривенного применения лекарственных средств верхнюю границу 5 единиц эндотоксина (EU) на дозу на килограмм массы тела в один одночасовой период (The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1): 223 (2000)). При введении терапевтических белков в количествах нескольких сотен или тысяч миллиграммов на килограмм массы тела полезно удалять даже следовые количества эндотоксина. В одном воплощении уровни эндотоксина и пирогена в композиции составляют меньше, чем 10 EU/мг или меньше, чем 5 EU/мг, или меньше, чем 1 EU/мг, или меньше, чем 0,1 EU/мг, или меньше, чем 0,01 EU/мг, или меньше, чем 0,001 EU/мг. В другом воплощении уровни эндотоксина и пирогена в композиции составляют меньше, чем примерно 10 EU/мг, или меньше, чем примерно 5 EU/мг, или меньше, чем примерно 1 EU/мг, или меньше, чем примерно 0,1 EU/мг, или меньше, чем примерно 0,01 EU/мг, или меньше, чем примерно 0,001 EU/мг.
В одном воплощении раскрытие включает введение композиции, где указанное введение является пероральным, парентеральным, внутримышечным, интраназальным, вагинальным, ректальным, язычным, подъязычным, щечным, внутрищечным, внутривенным, кожным, подкожным или чрескожным.
В другом воплощении раскрытие дополнительно включает введение композиции в комбинации с другими терапиями, такими как хирургия, химиотерапия, гормональная терапия, биологическая терапия, иммунотерапия или лучевая терапия.
В некоторых аспектах композиции и способы по изобретению конкретно предназначены для применения в комбинации с одним или более чем одним продуктом и классом, выбранным из группы, состоящей из следующих: анальгетики, такие как ацетаминофен, натрия напроксен, ибупрофен, трамадол, аспирин, целекоксиб, валдекоксиб, индометацин и другие NSAID (нестероидные противовоспалительные лекарственные средства); игибиторы COX-2 (циклооксигеназа-2); противовоспалительные лекарственные средства; сульфасалазин, мезаламин, бальсалазид и ольсалазин; и кортикостероиды, такие как преднизон и будесонид; иммунодепрессанты, такие как азатиоприн, меркаптопурин, блокаторы TNF (фактор некроза опухолей), такие как инфликсимаб и адалимумаб, метотрексат и циклоспорин; антибиотики, такие как метронидазол и ципрофлоксацин; противодиарейные средства, такие как лоперамид; иммунодепрессанты, такие как азатиоприн, меркаптопурин, кортикостероиды; иммунодепрессанты; ингибиторы Янус киназы-3 (Jak-3); и слабительные средства; антигистаминные препараты, такие как хлорфенирамин, деслоратадин, левоцетиризин, дифенгидрамин, доксиламина сукцинат, трипролидин, клемастин, фенирамин, бромфенирамин, дексбромфенирамин, лоратадин, цетиризин и фексофенадин, амлексанокс, производные алкиламина, кромолин, акривастин, ибудиласт, бамипин, кетотифен, недокромил, омализумаб, диметинден, оксатомид, пемироласт, пирробутамин, пентигетид, теналдин, пикумаст, толпропамин, раматробан, репиринаст, суплатаста тозилат, аминоалкилэфиры, тазаноласт, бромдифенгидрамин, траниласт, карбиноксамин, траксанокс, хлорфеноксамин, дифенилпиалин, эмбрамин, п-метилдифенгидрамин, моксастин, орфенадрин, фенилтолоксамин, сетастин, производные этилендиамина, хлорпирамин, хлоротен, метапирилен, пириламин, таластин, тенилдиамин, тонзиламина гидрохлорид, трипеленнамин, пиперазины, хлорциклизин, клоцинизин, гомохлорциклизин, гидроксизин, трициклические соединения, фенотиазины, меквитазин, прометазин, тиазинамия метилсульфат, азатадин, ципрогептадин, дептропин, деслоратадин, изотифендил, олопатадин, рупатадин, антазолин, астемизол, азеластин, бепотастин, клемизол, эбастин, эмедастин, эпинастин, левокабастин, мебгидролин, мизоластин, фениндамин, терфенадин, тритоквалин.
Дозирование/введение
Для получения фармацевтических или стерильных композиций, включающих антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию, антитело смешивают с фармацевтически приемлемым носителем или эксципиентом. Композиции терапевтических и диагностических агентов можно получать путем смешивания с физиологически приемлемыми носителями, эксципиентами или стабилизаторами в форме, например, лиофилизированных порошков, суспензий, водных растворов, лосьонов или суспензий (см., например, Hardman, et al. (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, N.Y.; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, N. Y.; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, N.Y.).
Выбор схемы введения для терапевтического средства зависит от нескольких факторов, включающих скорость обмена вещества в сыворотке или ткани, уровень симптомов, иммуногенность вещества и доступность клеток-мишеней в биологическом матриксе. В некоторых воплощениях схема введения максимизирует количество терапевтического средства, доставляемого пациенту, согласно приемлемому уровню побочных эффектов. Соответственно, количество доставленного биологического средства отчасти зависит от конкретного вещества и тяжести состояния, которое лечат. Доступно руководство по выбору подходящих доз антител, цитокинов и небольших молекул (см., например, Wawrzynczak, 1996, Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK; Kresina (ed.), 1991, Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, N.Y.; Bach (ed.), 1993, Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, N.Y.; Baert, et al., 2003, New Engl. J. Med. 348: 601-608; Milgrom, et al., 1999, New Engl. J. Med. 341: 1966-1973; Slamon, et al., 2001, New Engl. J. Med. 344: 783-792; Beniaminovitz, et al., 2000, New Engl. J. Med. 342: 613-619; Ghosh, et al., 2003, New Engl. J. Med. 348: 24-32; Lipsky, et al., 2000, New Engl. J. Med. 343: 1594-1602).
Определение подходящей дозы осуществляется лечащим врачом, например, с использованием параметров или факторов, для которых в данной области известно или имеется подозрение, что они воздействуют на лечение, или прогнозируется, что они воздействуют на лечение. В общем, дозирование начинается с количества в некоторой степени меньшего, чем оптимальная доза, и оно затем увеличивается небольшими приращениями, пока не достигается желательный или оптимальный эффект относительно любых отрицательных побочных эффектов. Важные диагностические измерения включают диагностические измерения симптомов, например, воспаления или уровня образующихся воспалительных цитокинов.
Реальные уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему раскрытию могут варьировать таким образом, чтобы получать количество активного ингредиента, которое является эффективным для достижения желательного терапевтического ответа для конкретного пациента, композиции и способа введения, не будучи токсичным для пациента. Выбранный уровень дозировки будет зависеть от множества фармакокинетических факторов, включающих активность конкретных используемых композиций по настоящему раскрытию, или их сложного эфира, соли или амида, путь введения, время введения, скорость экскреции конкретного используемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, используемые в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общее состояние здоровья и предыдущую медицинскую историю пациента, которого лечат, и подобные факторы, хорошо известные в области медицины.
Композиции, содержащие антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию, могут быть предоставлены посредством непрерывной инфузии или посредством доз с интервалами, например, одни сутки, одна неделя или 1-7 раз в неделю. Дозы могут быть предоставлены внутривенно, подкожно, местно, перорально, назально, ректально, внутримышечно, интрацеребрально или посредством ингаляции. Конкретным протоколом дозировки является протокол, включающий максимальную дозу или частоту доз, при которой избегаются значительные нежелательные побочные эффекты. Общая еженедельная доза может составлять по меньшей мере 0,05 мкг/кг массы тела, по меньшей мере 0,2 мкг/кг, по меньшей мере 0,5 мкг/кг, по меньшей мере 1 мкг/кг, по меньшей мере 10 мкг/кг, по меньшей мере 100 мкг/кг, по меньшей мере 0,2 мг/кг, по меньшей мере 1,0 мг/кг, по меньшей мере 2,0 мг/кг, по меньшей мере 10 мг/кг, по меньшей мере 15 мг/кг, по меньшей мере 20 мг/кг, по меньшей мере 25 мг/кг или по меньшей мере 50 мг/кг (см., например, Yang, et al., 2003, New Engl. J. Med. 349: 427-434; Herold, et al., 2002, New Engl. J. Med. 346: 1692-1698; Liu, et al., 1999, J. Neurol. Neurosurg. Psych. 67: 451-456; Portielji, et al., 2003, Cancer. Immunol. Immunother. 52: 133-144). Доза может составлять по меньшей мере 15 мкг, по меньшей мере 20 мкг, по меньшей мере 25 мкг, по меньшей мере 30 мкг, по меньшей мере 35 мкг, по меньшей мере 40 мкг, по меньшей мере 45 мкг, по меньшей мере 50 мкг, по меньшей мере 55 мкг, по меньшей мере 60 мкг, по меньшей мере 65 мкг, по меньшей мере 70 мкг, по меньшей мере 75 мкг, по меньшей мере 80 мкг, по меньшей мере 85 мкг, по меньшей мере 90 мкг, по меньшей мере 95 мкг или по меньшей мере 100 мкг. Число доз, введенных субъекту, может составлять по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, или больше.
Для антител против TL1A или их антигенсвязывающих фрагментов по раскрытию вводимая пациенту дозировка может составлять от 0,0001 мг/кг до 100 мг/кг массы тела пациента. Дозировка может составлять от 0,0001 мг/кг до 20 мг/кг, от 0,0001 мг/кг до 10 мг/кг, от 0,0001 мг/кг до 5 мг/кг, от 0,0001 до 2 мг/кг, от 0,0001 до 1 мг/кг, от 0,0001 мг/кг до 0,75 мг/кг, от 0,0001 мг/кг до 0,5 мг/кг, от 0,0001 мг/кг до 0,25 мг/кг, от 0,0001 до 0,15 мг/кг, от 0,0001 до 0,10 мг/кг, от 0,001 до 0,5 мг/кг, от 0,01 до 0,25 мг/кг или от 0,01 до 0,10 мг/кг массы тела пациента.
Дозировка антитела против TL1A или его антигенсвязывающего фрагмента может быть рассчитана с использованием массы пациента в килограммах (кг), умноженной на дозу, подлежащую введению, в мг/кг. Дозировка антител по раскрытию может составлять 150 мкг/кг или менее, 125 мкг/кг или менее, 100 мкг/кг или менее, 95 мкг/кг или менее, 90 мкг/кг или менее, 85 мкг/кг или менее, 80 мкг/кг или менее, 75 мкг/кг или менее, 70 мкг/кг или менее, 65 мкг/кг или менее, 60 мкг/кг или менее, 55 мкг/кг или менее, 50 мкг/кг или менее, 45 мкг/кг или менее, 40 мкг/кг или менее, 35 мкг/кг или менее, 30 мкг/кг или менее, 25 мкг/кг или менее, 20 мкг/кг или менее, 15 мкг/кг или менее, 10 мкг/кг или менее, 5 мкг/кг или менее, 2,5 мкг/кг или менее, 2 мкг/кг или менее, 1,5 мкг/кг или менее, 1 мкг/кг или менее, 0,5 мкг/кг или менее, или 0,1 мкг/кг или менее от массы тела пациента.
Единичная доза антител против TL1A или их антигенсвязывающих фрагментов по раскрытию может составлять от 0,1 мг до 200 мг, от 0,1 мг до 175 мг, от 0,1 мг до 150 мг, от 0,1 мг до 125 мг, от 0,1 мг до 100 мг, от 0,1 мг до 75 мг, от 0,1 мг до 50 мг, от 0,1 мг до 30 мг, от 0,1 мг до 20 мг, от 0,1 мг до 15 мг, от 0,1 мг до 12 мг, от 0,1 мг до 10 мг, от 0,1 мг до 8 мг, от 0,1 мг до 7 мг, от 0,1 мг до 5 мг, от 0,1 мг до 2,5 мг, от 0,25 мг до 20 мг, от 0,25 до 15 мг, от 0,25 до 12 мг, от 0,25 до 10 мг, от 0,25 до 8 мг, от 0,25 мг до 7 мг, от 0,25 мг до 5 мг, от 0,5 мг до 2,5 мг, от 1 мг до 20 мг, от 1 мг до 15 мг, от 1 мг до 12 мг, от 1 мг до 10 мг, от 1 мг до 8 мг, от 1 мг до 7 мг, от 1 мг до 5 мг, от 1 мг до 2,5 мг.
При дозировке антител против TL1A или их антигенсвязывающих фрагментов по раскрытию у субъекта может достигаться сывороточный титр, составляющий по меньшей мере 0,1 мкг/мл, по меньшей мере 0,5 мкг/мл, по меньшей мере 1 мкг/мл, по меньшей мере 2 мкг/мл, по меньшей мере 5 мкг/мл, по меньшей мере 6 мкг/мл, по меньшей мере 10 мкг/мл, по меньшей мере 15 мкг/мл, по меньшей мере 20 мкг/мл, по меньшей мере 25 мкг/мл, по меньшей мере 50 мкг/мл, по меньшей мере 100 мкг/мл, по меньшей мере 125 мкг/мл, по меньшей мере 150 мкг/мл, по меньшей мере 175 мкг/мл, по меньшей мере 200 мкг/мл, по меньшей мере 225 мкг/мл, по меньшей мере 250 мкг/мл, по меньшей мере 275 мкг/мл, по меньшей мере 300 мкг/мл, по меньшей мере 325 мкг/мл, по меньшей мере 350 мкг/мл, по меньшей мере 375 мкг/мл или по меньшей мере 400 мкг/мл. В качестве альтернативы, при дозировке антител по раскрытию у субъекта может достигаться сывороточный титр, составляющий по меньшей мере 0,1 мкг/мл, по меньшей мере 0,5 мкг/мл, по меньшей мере 1 мкг/мл, по меньшей мере 2 мкг/мл, по меньшей мере 5 мкг/мл, по меньшей мере 6 мкг/мл, по меньшей мере 10 мкг/мл, по меньшей мере 15 мкг/мл, по меньшей мере 20 мкг/мл, по меньшей мере 25 мкг/мл, по меньшей мере 50 мкг/мл, по меньшей мере 100 мкг/мл, по меньшей мере 125 мкг/мл, по меньшей мере 150 мкг/мл, по меньшей мере 175 мкг/мл, по меньшей мере 200 мкг/мл, по меньшей мере 225 мкг/мл, по меньшей мере 250 мкг/мл, по меньшей мере 275 мкг/мл, меньшей мере 300 мкг/мл, по меньшей мере 325 мкг/мл, по меньшей мере 350 мкг/мл, по меньшей мере 375 мкг/мл или меньшей мере 400 мкг/мл.
Дозы антител против TL1A или их антигенсвязывающих фрагментов по раскрытию можно повторять, и введения могут быть разделены по меньшей мере 1 сутками, 2 сутками, 3 сутками, 5 сутками, 10 сутками, 15 сутками, 30 сутками, 45 сутками, 2 месяцами, 75 сутками, 3 месяцами или по меньшей мере 6 месяцами.
Эффективное количество для конкретного пациента может варьировать, в зависимости от таких факторов, как состояние, которое лечат, общее состояние здоровья пациента, способ, путь и доза введения и тяжесть побочных эффектов (см., например, Maynard, et al., 1996, A Handbook of SOPs for Good Clinical Practice, Interpharm Press, Boca Raton, Fla.; Dent, 2001, Good Laboratory and Good Clinical Practice, Urch Publ, London, UK).
Путем введения может быть, например, местное нанесение или нанесение на кожу, инъекция или инфузия посредством внутривенных, внутрибрюшинных, внутримозговых, внутримышечных, внутриглазных, внутриартериальных, внутриспинномозговых введений, введений в область поражения или посредством систем замедленного высвобождения или импланта (см., например, Sidman et al., 1983, Biopolymers 22: 547-556; Langer, et al., 1981, J. Biomed. Mater. Res. 15: 167-277; Langer, 1982, Chem. Tech. 12:98-105; Epstein, et al., 1985, Proc. Natl. Acad. Sci. USA 82: 3688-3692; Hwang, et al., 1980, Proc. Natl. Acad. Sci. USA 77: 4030-4034; патенты США №6350466 и 6316024). Когда необходимо, композиция также может включать солюбилизирующий агент и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции. Кроме того, также можно использовать легочное введение, например, посредством применения ингалятора или небулайзера и композиции с агентом, создающим аэрозоль. См., например, патенты США №6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации РСТ №WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждый из которых включен сюда посредством ссылки во всей его полноте. В одном воплощении антитело против TL1A или его антигенсвязывающий фрагмент, или композиция по раскрытию вводится с использованием технологии легочной доставки лекарственного средства Alkermes AIR™ (Alkermes, Inc., Cambridge, Mass.).
Композиция по настоящему раскрытию также может вводиться посредством одного или более чем одного пути введения с использованием одного или более чем одного из целого ряда способов, известных в данной области. Как будет понятно квалифицированному специалисту, путь и/или способ введения будут варьировать, в зависимости от желательных результатов. Избранные пути введения антител по раскрытию включают внутривенное, внутримышечное, внутрикожное, внутрибрюшинное, подкожное, спинальное или другие парентеральные пути введения, например, посредством инъекции или инфузии. Парентеральное введение может представлять собой способы введения, отличные от энтерального и местного введения, обычно посредством инъекции, и оно включает, без ограничения, внутривенную, внутримышечную, внутриартериальную, подоболочечную, внутрикапсулярную, внутриглазную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную, подпаутинную, внутриспинальную, эпидуральную и надчревную инъекцию и инфузию. В качестве альтернативы, композицию по раскрытию можно вводить посредством непарентерального пути, такого как местный, эпидермальный путь введения или путь введения через слизистую, например, интраназально, перорально, вагинально, ректально, подъязычно или местно.
Если антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию вводятся в системе контролируемого высвобождения или замедленного высвобождения, для достижения контролируемого или замедленного высвобождения можно использовать насос (см. Langer, выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14: 20; Buchwald et al., 1980, Surgery 88: 501; Saudek et al., 1989, N. Engl. J. Med. 321: 514).
Для достижения контролируемого или замедленного высвобождения терапевтических агентов по раскрытию можно использовать полимерные вещества (см., например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. ScL Rev. Macromol. Chem. 23: 61; см. также Levy et al, 1985, Science 11 225: 190; During et al., 19Z9, Ann. Neurol. 25 :351; Howard et al, 1989, J. Neurosurg. 71: 105); патент США №5679377; патент США №5916597; патент США №5912015; патент США №5989463; патент США №5128326; публикацию РСТ № WO 99/15154 и публикацию РСТ № WO 99/20253. Примеры полимеров, используемых в композициях с замедленным высвобождением, включают поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловую кислоту), поли(этилен-со-винилацетат), поли(метакриловую кислоту), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поливиниловый спирт, полиакриламид, полиэтиленгликоль, полилактиды (PLA), полилактиды-со-гликолиды (PLGA) и полиортоэфиры, но не ограничиваются ими. В одном воплощении полимер, используемый в композиции с замедленным высвобождением, является инертным, не содержащим подвергающихся утечке примесей, стабильным при хранении, стерильным и биодеградируемым. Систему контролируемого или замедленного высвобождения можно размещать поблизости от профилактической или терапевтической мишени, что, таким образом, требует лишь доли системной дозы (см., например, Goodson, в Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)).
Системы контролируемого высвобождения обсуждаются в обзоре Langer, 1990, Science 249:1527-1533. Для получения композиций с замедленным высвобождением, содержащих одно или более чем одно антитело по раскрытию или их конъюгаты, можно использовать любую методику, известную специалисту в данной области. См., например, патент США №4526938, международные патентные публикации № WO 91/05548, WO 96/20698, Ning et al., 1996, "Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel," Radiotherapy and Oncology 59: 179-189, Song et al., 1995, "Antibody Mediated Lung Targeting of Long-Circulating Emulsions," PDA Journal of Pharmaceutical Science and Technology 50: 372-397, Cleek et al., 1997, "Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application," Pro. MI. Symp. Control. Rel. Bioact. Mater. 24: 853-854 и Lam et al., 1997, "Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery," Proc. MI. Symp. Control Rel. Bioact. Mater. 24: 759-160, каждая из которых включена сюда посредством ссылки во всей ее полноте.
Если антитело против TL1A или его антигенсвязывающий фрагмент по раскрытию вводится местно, его можно готовить в форме мази, крема, чрескожного пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной специалисту в данной области. См., например, Remington's Pharmaceutical Sciences и Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995). Для не образующих спрей местных лекарственных форм типично используют вязкие-полутвердые или твердые формы, содержащие носитель или один или более чем один эксципиент, совместимый с местным нанесением и имеющий динамическую вязкость, в некоторых случаях, большую, чем вода. Подходящие композиции включают, без ограничения, растворы, суспензии, эмульсии, кремы, мази, порошки, жидкие мази, бальзамы и тому подобное, которые, если это желательно, стерилизуют или смешивают со вспомогательными агентами (например, консервантами, стабилизаторами, увлажнителями, буферами или солями) для воздействия на разные свойства, такие как, например, осмотическое давление. Другие подходящие местные лекарственные формы включают образующие спрей препараты, в которых активный ингредиент, в некоторых случаях в комбинации с твердым или жидким инертным носителем, упакован в смеси с летучим веществом под давлением (например, газообразный пропеллент, такой как фреон) или в пластмассовой бутыли-пульверизаторе. Если это желательно, в фармацевтические композиции и лекарственные формы также можно добавлять увлажнители или смачивающие средства. Примеры таких дополнительных ингредиентов хорошо известны в данной области.
Если композиции, содержащие антитела против TL1A или их антигенсвязывающие фрагменты, вводятся интраназально, их можно готовить в форме аэрозоля, спрея, впрыскивания или в форме капель. В частности, профилактические или терапевтические агенты для применения согласно настоящему раскрытию можно с удобством доставлять в форме аэрозольного спрея из упаковок под давлением или небулайзера с применением подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В случае аэрозоля под давлением, единицу дозировки можно определять путем предоставления клапана для доставки отмеренного количества. Могут быть получены капсулы или картриджи (состоящие, например, из желатина) для применения в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящую порошковую основу, такую как лактоза или крахмал.
Способы совместного введения или лечения вторым терапевтическим агентом, например, цитокином, стероидом, химиотерапевтическим агентом, антибиотиком или радиацией, хорошо известны в данной области (см., например, Hardman, et al. (eds.) (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th ed., McGraw-Hill, New York, N.Y.; Poole and Peterson (eds.) (2001) Pharmacotherapeutics for Advanced Practice: A Practical Approach, Lippincott, Williams and Wilkins, Phila., Pa.; Chabner and Longo (eds.) (2001) Cancer Chemotherapy and Biotherapy, Lippincott, Williams and Wilkins, Phila., Pa.). Эффективное количество терапевтического средства может уменьшать симптомы по меньшей мере на 10 процентов; по меньшей мере на 20 процентов; по меньшей мере на 30 процентов; по меньшей мере на 40 процентов или по меньшей мере на 50 процентов.
Дополнительные терапевтические агенты (например, профилактические или терапевтические агенты), которые можно вводить в комбинации с антителами против TL1A или антигенсвязывающими фрагментами по раскрытию, можно вводить с интервалом меньше чем 5 минут от, меньше чем 30 минут от, 1 час от, примерно 1 час от, от примерно 1 до примерно 2 часов от, от примерно 2 часов до примерно 3 часов от, от примерно 3 часов до примерно 4 часов от, от примерно 4 часов до примерно 5 часов от, от примерно 5 часов до примерно 6 часов от, от примерно 6 часов до примерно 7 часов от, от примерно 7 часов до примерно 8 часов от, от примерно 8 часов до примерно 9 часов от, от примерно 9 часов до примерно 10 часов от, от примерно 10 часов до примерно 11 часов от, от примерно 11 часов до примерно 12 часов от, от примерно 12 часов до 18 часов от, от 18 часов до 24 часов от, от 24 часов до 36 часов от, от 36 часов до 48 часов от, от 48 часов до 52 часов от, от 52 часов до 60 часов от, от 60 часов до 72 часов от, от 72 часов до 84 часов от, от 84 часов до 96 часов от или от 96 часов до 120 часов от введения антител по раскрытию. Два или более чем два терапевтических агента могут быть введены в пределах одного, того же самого посещения пациента.
Антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию и другие терапевтические агенты можно вводить циклически. Циклическая терапия включает введение первой терапии (например, первого профилактического или терапевтического агента) в течение определенного периода времени, с последующим введением второй терапии (например, второго профилактического или терапевтического агента) в течение определенного периода времени, возможно, с последующим введением третьей терапии (например, профилактического или терапевтического агента) в течение определенного периода времени и так далее, и повторение данного последовательного введения, т.е. цикла для того, чтобы уменьшить развитие устойчивости к одной из терапий, для избежания или уменьшения побочных эффектов одной из терапий и/или для улучшения эффективности терапий.
В одном воплощении антитела против TL1A по изобретению можно вводить совместно с композициями для лечения болезни Крона, включающими композиции для ингибирования провоспалительных цитокинов и молекул адгезии, такие как NSAID, 5-аминосалициловая кислота, глюкокортикоиды/кортикостероиды, 6-меркаптопурин или ингибиторы TNF-α, включая адалимумаб, инфликсимаб и другие, которые известны специалистам в данной области.
В некоторых воплощениях антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию можно готовить для обеспечения подходящего распределения in vivo. Например, гематоэнцефалический барьер (ГЭБ) исключает многие высокогидрофильные соединения. Для обеспечения того, чтобы терапевтические соединения по раскрытию пересекали ГЭБ (если это желательно), они могут быть приготовлены, например, в липосомах. Относительно способов получения липосом, см., например, патенты США 4522811, 5374648 и 5399331. Липосомы могут содержать одну или более чем одну группировку, которая селективно транспортируется в конкретные клетки или органы, таким образом, усиливая направленную доставку лекарственного средства (см., например, V.V. Ranade, 1989, J. Clin. Pharmacol. 29: 685). Типичные нацеливающие группировки включают фолат или биотин (см., например, патент США 5416016); маннозиды (Umezawa et al., Biochem. Biophys. Res. Commun. 153: 1038); антитела (P. G. Bloeman et al., 1995, FEBS Lett. 357: 140; M. Owais et al., 1995, Antimicrob. Agents Chemother. 39: 180); рецептор поверхностно-активного белка A (Briscoe et al. (1995) Am. J. Physiol. 1233: 134); pl20 (Schreier et al. (1994) J. Biol. Chem. 269: 9090); см. также К. Keinanen; M.L. Laukkanen, 1994, FEBS Lett. 346: 123; Killion; Fidler, 1994; Immunomethods 4: 273.
Согласно раскрытию предложены протоколы для введения фармацевтической композиции, содержащей антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию, одни или в комбинации с другими терапиями субъекту, нуждающемуся в этом. Терапии (например, профилактические или терапевтические агенты) комбинированных терапий по настоящему раскрытию можно вводить субъекту сопутствующе или последовательно. Терапию (например, профилактические или терапевтические агенты) комбинированных терапий по настоящему раскрытию также можно вводить циклически. Циклическая терапия включает введение первой терапии (например, первого профилактического или терапевтического агента) в течение определенного периода времени, с последующим введением второй терапии (например, второго профилактического или терапевтического агента) в течение определенного периода времени и повторение этого последовательного введения, т.е. цикла, для того, чтобы уменьшить развитие устойчивости к одной из терапий (например, агентам) для того, чтобы избежать или уменьшить побочные эффекты одной из данных терапий (например, агентов) и/или для улучшения эффективности терапий.
Терапии (например, профилактические или терапевтические агенты) комбинированных терапий по раскрытию можно вводить субъекту совместно. Термин «совместно» не ограничивается введением терапий (например, профилактических или терапевтических агентов) точно в то же самое время, но скорее он подразумевает то, что фармацевтическая композиция, содержащая антитела против TL1A или их антигенсвязывающие фрагменты по раскрытию, вводится субъекту в последовательности и в пределах интервала времени, таким образом, что антитела по раскрытию или их конъюгаты могут действовать совместно с другой терапией (терапиями) для предоставления большей пользы, чем если бы они вводились иначе. Например, каждую терапию можно вводить субъекту в то же самое время или последовательно в любом порядке в разные моменты времени; однако, если они не вводятся в то же самое время, их следует вводить достаточно близко во времени таким образом, чтобы предоставить желательный терапевтический или профилактический эффект. Каждую терапию можно вводить субъекту отдельно в любой подходящей форме и любым подходящим путем. В разных воплощениях терапии (например, профилактические или терапевтические агенты) вводятся субъекту менее чем через 15 минут друг от друга, менее чем через 30 минут, менее чем через 1 час друг от друга, примерно через 1 час друг от друга, от примерно 1 часа до примерно 2 часов друг от друга, от примерно 2 часов до примерно 3 часов друг от друга, от примерно 3 часов до примерно 4 часов друг от друга, от примерно 4 часов до примерно 5 часов друг от друга, от примерно 5 часов до примерно 6 часов друг от друга, от примерно 6 часов до примерно 7 часов друг от друга, от примерно 7 часов до примерно 8 часов друг от друга, от примерно 8 часов до примерно 9 часов друг от друга, от примерно 9 часов до примерно 10 часов друг от друга, от примерно 10 часов до примерно 11 часов друг от друга, от примерно 11 часов до примерно 12 часов друг от друга, 24 часа друг от друга, 48 часов друг от друга, 72 часа друг от друга или 1 неделю друг от друга. В других воплощениях две или более чем две терапии (например, профилактические или терапевтические агенты) вводятся в пределах того же самого посещения пациента.
Профилактические или терапевтические агенты комбинированных терапий можно вводить субъекту в той же самой фармацевтической композиции. В качестве альтернативы, профилактические или терапевтические агенты комбинированных терапий можно вводить субъекту сопутствующе в отдельных фармацевтических композициях. Профилактические или терапевтические агенты можно вводить субъекту теми же самыми или отличными путями введения.
Наборы
Согласно изобретению также предложены наборы, содержащие любое или все из описанных здесь антител. Наборы по изобретению включают один или более чем один контейнер, содержащий описанное здесь антитело против TL1A, и инструкции для применения согласно любому из описанных здесь способов по изобретению. В общем, данные инструкции включают описание введения антитела для описанных выше терапевтических лечений. В некоторых воплощениях предложены наборы для получения однодозной единицы введения. В некоторых воплощениях набор может содержать и первый контейнер, содержащий высушенный белок, и второй контейнер, содержащий водную композицию. В некоторых воплощениях включены наборы, содержащие аппликатор, например, одно- или многокамерные предварительно заполненные шприцы (например, шприцы с жидкостью и шприцы с лиофилизатом).
Инструкции, относящиеся к применению антитела против TL1A, обычно включают информацию относительно дозировки, схемы дозировки и пути введения для намеченного лечения. Контейнеры могут представлять собой единичные дозы, объемные упаковки (например, многодозовые упаковки) или субъединичные дозы. Инструкции, поставляемые в наборах по изобретению, типично представляют собой письменные инструкции на этикетке или листке-вкладыше в упаковке (например, лист бумаги, включенный в набор), но также приемлемыми являются машиночитаемые инструкции (например, инструкции, сохраненные на магнитном или оптическом накопительном диске.
Наборы по данному изобретению также находятся в подходящей упаковке. Подходящая упаковка включает флаконы, бутыли, банки, гибкую упаковку (например, запечатанные майларовые или пластмассовые мешки) и тому подобное, но не ограничивается ими. Также рассматриваются упаковки для применения в комбинации с конкретным устройством, таким как ингалятор, устройство для введения в нос (например, атомизатор) или инфузионное устройство, такое как мининасос. Набор может иметь стерильный порт доступа (например, контейнер может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, проницаемую иглой для подкожной инъекции). Контейнер также может иметь стерильный порт доступа (например, контейнер может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, проницаемую иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело против TL1A или его антигенсвязывающий фрагмент по изобретению. Контейнер может дополнительно содержать второй фармацевтически активный агент.
В наборе возможно могут быть предоставлены дополнительные компоненты, такие как буферы и интерпретируемая информация. Обычно набор содержит контейнер и этикетку или вкладыш(-и) в упаковке на или ассоциированные с контейнером.
Согласно изобретению также предложены диагностические наборы, содержащие любое или все из описанных здесь антител. Данные диагностические наборы являются полезными, например, для выявления присутствия TL1A в образце. В некоторых воплощениях диагностический набор можно использовать для индентификации индивида с латентным заболеванием, расстройством или состоянием, которые могут подвергать его риску развития заболевания, расстройства или состояния, опосредованного TL1A. В некоторых воплощениях диагностический набор можно использовать для выявления присутствия и/или уровня TL1A у индивида, у которого подозревается наличие заболевания, опосредованного TL1A.
Диагностические наборы по изобретению включают один или более чем один контейнер, содержащий описанное здесь антитело против TL1A и инструкции для применения согласно любому из описанных здесь способов по изобретению. В общем, данные инструкции включают описание применения антитела против TL1A для выявления присутствия TL1A у индивидов, подверженных риску или подозреваемых в наличии заболевания, опосредованного TL1A. В некоторых воплощениях типичный диагностический набор может быть сконфигурирован так, чтобы он содержал такие реактивы, как, например, антитело против TL1A, образец негативного контроля, образец позитивного контроля и указания для применения набора.
Биологическое депонирование
Репрезентативные материалы по настоящему изобретению депонировали в Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Va. 20110-2209, США, 17 октября 2013 г. Вектор 1D1 1.31 VH, имеющий регистрационный номер ATCC PTA-120639, содержит вставку ДНК, кодирующую вариабельную область тяжелой цепи антитела 1D1 1.31, и вектор 1D1 1.31 VL, имеющий регистрационный номер ATCC PTA-120640, содержит вставку ДНК, кодирующую вариабельную область легкой цепи антитела 1D1 1.31. Депонирования осуществляли согласно положениям Будапештского соглашения по международному признанию депонирования микроорганизмов для целей патентной процедуры и нормам на его основании (Будапештское соглашение). Это обеспечивает поддержание жизнеспособной культуры депонирования в течение 30 лет с даты депонирования. Депонирование будет сделано доступным ATCC согласно условиям Будапештского соглашения и подчиняться соглашению между Pfizer Inc и ATCC, которое обеспечивает постоянную и неограниченную доступность потомства культуры депонирования для публики при выдаче релевантного патента США или при выкладывании в открытый публичный доступ любой патентной заявки США или иностранной патентной заявки, независимо от того, что происходит раньше, и обеспечивает доступность потомства тому, кто определен комиссаром США по патентам и торговым маркам как имеющий право на это согласно разделу 122 капитула 35 U.S.С. (свод законов США) и праву комиссара согласно ему (включая раздел 1.14 капитула 37 C.F.R. (свод федеральных правил США) с особой ссылкой на 886 OG 638).
Правоприобретатель настоящей заявки согласен с тем, что, если культура депонированных материалов умрет или будет потеряна, или повреждена при культивировании при подходящих условиях, данные материалы будут быстро заменены по уведомлению другими материалами такого же типа. Доступность депонированного материала не следует истолковывать как лицензию на воплощение данного изобретения на практике в нарушение прав, предоставляемых властью любого правительства согласно его патентному праву.
Эквиваленты
Следующее письменное описание изобретения считается достаточным для наделения специалиста в данной области способностью воплощать на практике данное раскрытие. Следующее описание и Примеры подробно описывают некоторые типичные воплощения данного раскрытия. Однако будет понятно, что, независимо от того как подробно следующее может проявляться в тексте, данное раскрытие можно воплощать на практике многими способами, и данное раскрытие следует истолковывать согласно приложенной формуле изобретения и ее любым эквивалентам.
Все процитированные здесь ссылки, включающие патенты, патентные заявки, статьи, учебники и тому подобное, и ссылки, процитированные в них, являются тем самым включенными сюда посредством ссылки во всей их полноте.
Типичные воплощения
Данное изобретение далее подробно описано посредством ссылки на следующие экспериментальные примеры. Данные примеры приведены лишь для целей иллюстрации и не предназначены для того, чтобы быть ограничивающими, если не определено иначе. Таким образом, данное изобретение ни в коей мере не следует истолковывать как ограниченное следующими примерами, но скорее следует истолковывать как охватывающее все и любые вариации, которые становятся очевидными как результат предложенных здесь идей.
ПРИМЕРЫ
Пример 1: получение антител против TL1A
Растворимый рекомбинантный человеческий и мышиный белок TL1A временно экспрессировали в клетках НЕК293. Белок TL1A очищали посредством HitrapNTA, Hitrap Q и Sephacryl-200 (все приобретены у GE Healthcare). Образующийся раствор очищенного белка концентрировали и хранили при температуре меньше -80°C. Чистоту подтверждали посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и аналитической SEC (гель-фильтрация).
Рекомбинантный растворимый человеческий и мышиный белок TL1A использовали для иммунизации мышей Medarex КМ и Hco. Некоторые мыши получали чередующийся человеческий и мышиный TL1A, тогда как другие получали только человеческий TL1A. В некоторых случаях мышам еженедельно вводили 3×25 мкг рекомбинантного человеческого TL1A плюс 1×25 мкг рекомбинантного мышиного TL1A в адъюванте Риби, внутрибрюшинно и подкожно. Гибридомы, полученные посредством протокола Е-слияния, получали из мышей, которые демонстрировали реактивность в отношении TL1A, посредством анализа сывороточного титра. Последующие гибридомы подвергали скринингу на продукцию антител, которые связываются с TL1A, но не с TNF-альфа. Те гибридомы, которые демонстрировали специфичное связывание с TL1A, подвергали дополнительному скринингу на нейтрализующие антитела.
Пример 2: эпитоп-специфичная сортировка антител против TL1A посредством SPR
Для характеристики антител против TL1A посредством эпитоп-специфичной сортировки с использованием поверхностного плазмонного резонанса применяли стратегию попарного связывания. Одно антитело непосредственно иммобилизировали посредством аминного связывания на поверхности сенсорного чипа на основе карбоксиметилированного декстрана (СМ5) с использованием установки Biacore 2000 или 3000. Затем в течение примерно 1 минуты инъецировали растворимый рекомбинантный человеческий TL1A или мышиный TL1A, разведенный до 10 нМ в 8,1 мМ Na2HPO4, 1,47 мМ KH2PO4, pH 7,2, 237 мМ NaCl, 2,7 мМ KCl, 3,4 мМ EDTA и 0,01% Tween 20 (PBS-NET), при скорости тока 10 мкл/минуту для достижения уровней связывания на иммобилизированном антителе или его антигенсвязывающем фрагменте, составляющих по меньшей мере 100 единиц ответа (RU). Затем то же самое антитело, которое было иммобилизировано на чипе, инъецировали в концентрации 30 нМ в течение 5 минут для того, чтобы насытить все потенциальные сайты связывания на тримерном TL1A. Повторную инъекцию антитела проводили для подтверждения этого насыщения. Наконец, второе антитело в PBS-NET или только PBS-NET в качестве контроля инъецировали в концентрации 30 нМ в течение 5 минут. Если второе антитело, связывалось с TL1A, насыщенным первым антителом, это указывало на то, что второе антитело, связывалось с неконкурирующим эпитопом на TL1A по сравнению с первым антителом. Если второе антитело не могло связываться с насыщенным TL1A, это указывало на то, что два антитела имели одинаковый или конкурирующий эпитоп на TL1A. Данную стратегию повторяли в отношении лучших нейтрализующих антител. В конце каждого цикла поверхность с иммобилизированным антителом регенерировали либо посредством 30-секундного импульса 3 М MgCl2, либо посредством 0,1%-й TFA (трифторуксусная кислота) посредством двух последовательных 15-секундных импульсов PBS-NET. Все инъекции проводили при 25°C при скорости сбора 10 Гц. Для всех сенсограмм использовали двойной контроль посредством применения и контрольной поверхности, и инъекций буфера.
Эпитоп-специфичная сортировка исходных 15 нейтрализующих антител против человеческого TL1A выявила по меньшей мере два отличных эпитопа (Фиг. 2). В пределах 2-ой эпитопной группы оказывался перекрывающийся эпитоп. Антитело 25А4 связывалось с неконкулирующим эпитопом по отношению к 7D7 и 22F9, тогда как было показано, что оно имеет конкурирующий эпитоп с 1D1. Затем антитела сравнивали относительно 1D1, 7D4 и 25А4 для определения его локализации в пределах этой второй эпитопной группы (Фиг. 3). Кроме того, в пределах первой эпитопной группы каждое из антител 14G1, 4С1 и 10G3 сравнивали относительно иммобилизированного 16F9 для повторного подтверждения из сортировки в отношении связывания с человеческим TL1A. Каждое из этих антител связывается с конкурирующим эпитопом с 16F9, как делают и 26B11 и 9B3. Антитело 1D1 использовали в качестве контроля в отношении связывания с 16F9, так как два данных антитела связываются с человеческим TL1A в неконкурирующих эпитопах.
Эпитоп-специфичную сортировку против мышиного TL1A проводили для восьми антител против TL1A (которые демонстрировали способность нейтрализовать мышиный TL1A в анализе каспазы на основе клеток), а также для имеющегося в продаже поликлонального антитела против TL1A АТ127 (Enzo Life Sciences, Farmingdale, NY). Все антитела против TL1A, отличные от АТ127, связывались с мышиным TL1A в конкурирующих эпитопах. АТ127, по видимому, связывается с мышиным TL1A в отдельном, неперекрывающемся эпитопе (Фиг. 4).
Пример 3: характеристика кинетики связывания нейтрализующих антител с TL1A
Для характеристики кинетики связывания антител против TL1A с TL1A посредством поверхностного плазмонного резонанса каждое антитело против TL1A захватывали путем непосредственной иммобилизации антитела против человеческого IgE (GE Healthcare) на поверхности сенсорного чипа на основе карбоксиметилированного декстрана (СМ5) с использованием установки Biacore Т100 или Т200. Антитело против человеческого IgG иммобилизировали посредством аминного связывания до плотностей примерно 4000-13000 единиц ответа (RU). Каждое антитело против TL1A разводили до 0,075-0,15 мкг/мл в 8,1 мМ Na2HPO4, 1,47 мМ KH2PO4, pH 7,2, 237 мМ NaCl, 2,7 мМ KCl, 3,4 мМ EDTA и 0,01% Tween 20 (PBS-NET) и инъецировали на поверхность с антителом против hIgG в течение примерно 1-2 минут при скорости потока 5 мкл/минуту для достижения низких уровней захвата, таких низких, как 30 RU. После захвата скорость потока увеличивали до 100 мкл/минуту, и инъецировали разные концентрации растворимого рекомбинантного человеческого TL1A, TL1A яванского макака или мышиного TL1A, варьирующие от 0,195 нМ до 100 нМ, в PBS-NET на протяжении 2-3-минутной ассоциации и давали диссоцировать в течение вплоть до 60 минут. В конце каждого цикла всю поверхность с антителом против человеческого IgG (hIgG) регенерировали посредством 30-секундного импульса 3 М MgCl2, с последующими двумя последовательными 15-секундными импульсами PBS-NET. Все инъекции проводили при 25°C при скорости сбора 10 Гц. Для всех сенсограмм использовали двойной контроль посредством применения и контрольной поверхности, и инъекций буфера. Константы скорости определяли посредством аппроксимации данных к модели 1:1 в программе оценки Biacore Т100, Т200 v1.0, или программе BIAevaluation v4.1.1 и уравнения KD равно kd/ka.
Исходно связывание человеческого и мышиного TL1A для отбора антител против TL1A измеряли в реальном времени на установке Biacore Т100. Все антитела связывались с человеческим TL1A или мышиным TL1A с аналогичными равновесными константами диссоциации (KD). Определенные KD также были сравнимыми с определенными ранее в анализах на основе клеток IC50 (данные не показаны).
Для последующей оценки связывания TL1A в реальном времени антитела 1D1, 26B11 и 7D4, которые являются представителями антител, которые связываются с разными эпитопами TL1A, экспрессировали следующим образом. Временную экспрессию рекомбинантных антител против TL1A оценивали посредством котрансфекции V-областей тяжелой и легкой цепи, клонированных в экспрессионные векторы млекопитающих. Например, в каждую 100 мм чашку для культуры ткани (Corning 430176) добавляли 40 мкл TransIT (Mirus MIR2306) к 2 мл Optimem комнатной температуры (Invitrogen-Gibco 11058-021) плюс глутамин в конечной концентрации 2 мМ. Данную смесь Optimem и Trans-IT встряхивали и инкубировали при комнатной температуре в течение 15 минут. В данную смесь добавляли ДНК Maxiprep (8 мкг тяжелой цепи и 8 мкг легкой цепи) и инкубировали при комнатной температуре в течение 15 минут. Данный раствор затем добавляли в p100, содержащую примерно 8 мл ростовой среды (DMEM (среда Игла, модифицированная по Дульбекко) плюс HI FBS плюс пенициллин плюс стрептомицин плюс глутамин). После 24 часов при 37°C, 10% CO2, клетки промывали R1CD1 (бессывороточная ростовая среда), затем в каждую p100 добавляли 10 мл R1CD1 плюс PSG. Кондиционированную среду отбирали через 48 часов при 37°C, 10% CO2, центрифугировали для осаждения клеток, и супернатант удаляли в новую пробирку. Данную процедуру корректировали соответствующим образом для приспособления к большему числу клеток для больших партий для экспрессии.
Кондиционированную среду от временной трансфекции количественно измеряли посредством специфичного ELISA на Fc тотального человеческого IgG. Вкратце, плоскодонный планшет для ELISA (Costar 3590) покрывали в течение ночи при комнатной температуре 100 мкл на каждую лунку 1 мкг/мл антитела козы против человеческого IgG в PBS (Pierce 31125). Планшеты блокировали 100 мкл/лунку раствора 0,02% казеина в PBS в течение минимум 3 часов или вплоть до 24 часов при комнатной температуре. Если планшеты не использовали немедленно, их хранили в течение вплоть до одного месяца при 4°C в буфере для хранения, 0,02% NaN3 в PBS. Стандарт и образцы прогоняли в рядах серийного разведения в буфере для анализа (0,5% бычий сывороточный альбумин плюс 0,02% Tween-20 в PBS) со 100 мкл, добавленными в промытые лунки планшета для ELISA, и инкубировали в течение 3-24 часов при комнатной температуре. Антитело козы против человеческого IgG (Pierce 31413) разводили 1:5000 в буфере для анализа, и 100 мкл добавляли в лунку после промывки планшета и давали инкубироваться в течение 15 минут при комнатной температуре. Планшет промывали и проявляли в 100 мкл на лунку BioFX ТМВ (TMBW-0100-01), реакцию останавливали 100 мкл на лунку 0,18 н. H2SO4, и производили считывание планшета при 450 нм на планшет-ридере Molecular Devices vMax. Неизвестные значения рассчитывали из линейного интервала кривой из серии разведения стандарта. В данном эксперименте антитело 26B11 использовали в качестве количественно измеренной кондиционированной среды, тогда как 1D1 и 7D4 были очищенными на белке А.
Антитела против TL1A захватывали на иммобилизованном антителе против человеческого Fc на сенсорном чипе СМ5 на установке Biacore Т100. Человеческий TL1A (0,4-100 нМ) или TL1A яванского макака (8-200 нМ) инъецировали над захваченными антителами против TL1A. Показанные в таблице константы скорости определяли посредством аппроксимации к модели связывания Лангмюра 1:1 в BiaEvaluation v4.1.1 (аппроксимирующие линии показаны красным). Показанные данные представляют собой среднее и стандартное отклонение по меньшей мере 3 независимых поверхностей между 2 экспериментами. Не наблюдали неспецифичного связывания с иммобилизованным антителом против человеческого Fc растворимого рекомбинантного человеческого TL1A или TL1A яванского макака.
Намеренно поддерживали низкие уровни захвата для обеспечения условий связывания 1:1 для того, чтобы избежать влияния авидности и минимизировать повторное связывание во время диссоциации. При уровнях захвата больше 30 RU наблюдали меньшие скорости диссоциации в отношении антител, которые вероятно были обусловлены данными трудностями (данные не показаны).
В отношении как человеческого TL1A, так и TL1A яванского макака связывание антител против TL1A зависело от концентрации тестируемого TL1A. При наивысших концентрациях цитокина фазу диссоциации иногда увеличивали до 60 минут для достижения по меньшей мере 5%-го уменьшения сигнала связывания. Это минимальное уменьшение, рекомендованное для точного измерения относительно медленных скоростей диссоциации антигена (Katsamba, et al. Kinetic analysis of a high affinity antibody/antigen interaction performed by multiple Biacore users. Analytical Biochemistry 2006 May 15; 352(2): 208-21). При удовлетворении данного условия рассчитывали константы скорости ассоциации и диссоциации между каждым видом TL1A и каждым антителом из сенсограмм связывания с использованием модели связывания Лангмюра 1:1. Значения Kd для связывания антител 1D1, 7D4 и 26B11 с человеческим TL1A и TL1A яванского макака обобщены в Таблице 4.

Пример 4: последовательности антител против TL1A
Лучшие нейтрализующие антитела, представляющие разные эпитопные группы, подвергали селекции для секвенирования. Последовательности были получены для антител против TL1A 1D1, 7D4, 26B11, 15С11, 15А9, 9B3 и 22F9 следующим образом. Интересующие гибридомы против TL1A подвергали отбору для клонирования вариабельных доменов. Из гибридом экстрагировали РНК и получали последовательности ДНК вариабельной области из экспрессируемых антител посредством клонирования ПЦР-ОТ (полимеразная цепная реакция с обратной транскриптазой). В общем, от одного до пяти миллионов субклонированных гибридомных клеток гомогенизировали для выделения общей РНК, обрабатывали посредством QIAShredder с набором RNAeasy Mini от QIAGEN, или число клеток корректировали для применения другого набора от Qiagen, такого как набор RNAeasy micro. Затем получали первую нить кДНК с использованием обратной транскриптазы superscript II или superscript III (Invitrogen). Затем получали двухцепочечные кДНК для вариабельных областей IgG против TL1A и амплифицировали посредством ПЦР с использованием праймеров, специфичных в отношении константных областей и известных 5'-кэпов, таких как SMART IIa oligo. Образующиеся продукты ПЦР-ОТ клонировали в клонирующий вектор TOPO-Blunt, zero blunt, topo ТА или аналогичный вектор (Invitrogen) и секвенировали традиционными способами.
Последовательности перечислены в таблице с перечнем последовательностей (Таблица 40) и показаны на Фиг. 1. Для антител 9B3 и 26B11 из гибридомы клонировали многочисленные тяжелые цепи, и они перечислены в таблице с перечнем последовательностей (Таблица 40) и на Фиг. 1. Для 26B11 проводили эксперименты с конструкциями, имеющими вариабельный домен тяжелой цепи VH2 (SEQ ID NO: 74).
На Фиг. 1И показано выравнивание последовательностей антител 1D1, 7D4 и 26B11, которые представляют 3 эпитопных группы, обсуждавшиеся выше. На Фиг. 1Й показано выравнивание последовательностей VH и VL из антител 7D4 и 22F9, которые связываются с конкурирующими эпитопами TL1A. Данные антитела имеют те же самые области VL, но отличные области VH. В Таблице 5 приведено краткое изложение различий аминокислот между доменами VH антител 7D4 и 22F9. На Фиг. 1К показано выравнивание последовательностей между антителами 26B11 и 9B3, которые связываются с конкурирующими эпитопам TL1A. Данные антитела имеют разные области VL, но каждое продуцирует многочисленные идентичные области VH (VH1, VH2). Антитело 26B11 также продуцирует третий домен VH, названный MDX-VH. В Таблице 6 приведено краткое изложение различий аминокислот между антителами 26B11 и 9B3. На Фиг. 1Л показано выравнивание последовательностей антитела 1D1 и антител 15А9 и 15С11, которые конкурируют за связывание с TL1A. Данные антитела имеют одинаковые VL, но каждое имеет разную область VH. В Таблице 12 приведено краткое изложение различий аминокислот между антителами 1D1, 15А9 и 15С11 и вариантами 1D1 с созревшей аффинностью. Фиг. 1М представляет собой график, описывающий процентную долю идентичности последовательности между разными антителами против TL1A.



Пример 5: созревание аффинности антитела 1D1 против TL1A посредством библиотеки фагового дисплея
а) Конструкция фаговой библиотеки
Планировали три библиотеки, каждая из которых содержала рандомизацию в областях VHCDR1, VHCDR2 или VHCDR3 1D1 (также именуемого здесь «Родительское 1D1» или 1D1 дикого типа, или ДТ 1D1). Рентгеноструктурные исследования IgG 1D1, связанного с тримером человеческого TL1A (см. Пример 6), показали, что VL не была сильно вовлечена во взаимодействие связывания, следовательно, область VL не подвергалась мутагенезу. Использовали два типа рандомизации: бинарную замену олигонуклеотидами, поставленными Eurofins, и спайковый мутагенез олигонуклеотидами, поставленными IDT (Integrated DNA Technologies). В способе бинарной замены аминокислоту дикого типа заменяют кодоном, который включает либо исходную аминокислоту дикого типа, либо близкородственный гомолог. Данный мутагенез обеспечивает введение небольших замен. Спайковый мутагенез включает замену аминокислоты дикого типа всеми другими аминокислотами с частотой 50%.
Несколько высококонсервативных аминокислот сохраняли на протяжении всего построения библиотеки, например, Y31, 151 и D101 не мутировали из-за их консервативности в человеческих антителах. C-концевой конец петли VHCDR2 не мутировали, принимая во внимание ранее полученные данные, которые указывали на важность данных остатков в функции связывания. Некоторые возможно важнейшие положения мутировали только посредством бинарной замены. Другие подвергали двум способам рандомизации; полагали, что данные положения имеют больший потенциал для воздействия на аффинность связывания.
VHCDR3 мутировали сильнее всего, поскольку традиционно данная петля имеет наибольшую роль в определении аффинности. Всю петлю (за исключением D101) мутировали как бинарной заменой, так и спайковым мутагенезом. Для VHCDR3 использовали два олигонуклеотида для спайкового мутагенеза из-за ее длины.
б) Построение фаговой библиотеки
Осуществляли построение мутантных библиотек. Первичные и вторичные ПЦР (SOE) (сращивание генов перекрывающимися расширениями) включали применение высокоточной ДНК-полимеразы Taq Platinum® (Invitrogen) согласно рекомендациям изготовителя. ПЦР-продукты SOE расщепляли рестриктазами, очищали и клонировали в вектор pWRIL-1 в Е. coli TG1. Общие размеры библиотеки рассчитывали путем посева серийных разведений трансформантов на агар 2YT/100 мкг на миллилитр карбенициллина/2% (об./об.) глюкозы (2YT-CG). Общие популяции клеток из каждой электропорации высевали на 22-см чашки для биопроб (Genetix), содержащие 2YT агара/100 мкг на миллилитр карбенициллина/2% (об./об.) глюкозы (2YT-CG), инкубировали в течение ночи при 30°C и, наконец, собирали соскабливанием и ресуспендированием в бульоне 2YT/20% (об./об.) глицерина. Аликвоты библиотек затем замораживали при -80°C.
в) Спасение и селекции фаговых библиотек
Фаговые библиотеки спасали, и проводили селекции двумя разными способами, причем первый представляет собой классический способ в фазе раствора. При данных селекциях библиотеки подвергали селекции на протяжении трех циклов с начальной концентрацией биотинилированного hTL1A 3 нМ, заканчивая 50 пМ в цикле три. Число промывок увеличивали от 12 в цикле один до 18 в цикле три. Также в цикле три включали другую ветвь, содержащую стадию «конкуренции диссоциации», где добавляли 50 нМ избыточный немеченый антиген на 30 мин.
Второй способ селекции включал такой же биотинилированный антиген и шарики в качестве первой стадии. Целью данных селекции является мощное продвижение к высокой аффинности в первом цикле, с последующим мягким выделением во втором цикле. Завершали четыре ветви селекции, две из которых содержали 1 нМ биотинилированный hTL1A в цикле один, причем остальные ветви содержали в цикле один 100 пМ биотинилированный антиген. Первый цикл также включал стадию «конкуренции диссоциации» в течение ночи, где 100 нМ немеченый антиген добавляли на 18 ч. В цикле один также использовали промывку в жестких условиях, причем применяли 13 промывок. Второй цикл селекции включал четыре ветви, две из которых содержали 1 нМ растворимый биотинилированный рекомбинантный человеческий TL1A, причем остальные две содержали 1 нМ растворимый биотинилированный рекомбинантный мышиный TL1A. В цикле два применяли десять промывок.
г) Первичный скрининг - экспрессия и очистка scFv
Для высокопроизводительного скрининга клоны Е. coli высевали на агар 2YT-CG в 22-см кюветах для биопроб (Genetix), переносили в стандартные стерильные 96-луночные планшеты, содержащие бульон 2YT-CG, с использованием сборщика колоний QPix II (Genetix) и выращивали в инкубаторе для планшетов Multitron (Infors AG) при 600 об./мин, 37°C и 80%-й влажности в течение ночи. После роста добавляли глицерин до конечной концентрации 30% (об./об.), и планшеты хранили при минус 80°C или использовали для немедленной инокуляции 96-луночных планшетов с глубокими лунками, содержащими 900 мкл бульона 2YT-CG. Их выращивали при 37°C, 80%-й влажности и при 600 об./мин в течение 5-6 ч; экспрессию индуцировали добавлением IPTG (изопропилтиогалактозид) до конечной концентрации 0,5 мМ, и проводили инкубацию при 28°C в течение ночи. Клетки осаждали центрифугированием при 1260 g и ресуспендировали в 150 мкл ледяного периплазматического буфера [50 мМ Tris-HCl, 1 мМ этилендиаминтетрауксусная кислота и 20% сахароза (масс/об.), pH 8]. Осмотический шок вызывали добавлением 150 мкл/лунку разведения периплазматического буфера 1:5, и образцы помещали на лед на 30 мин. После этого следовало центрифугирование при 3220 g в течение 10 мин, и выделяли супернатант, состоящий из периплазматической фракции, содержащей экспрессируемые scFv. Высокопроизводительный скрининг посредством ELISA или анализ HTRF (гомогенная флуоресценция с временным разрешением) проводили с использованием грубых периплазматических экстрактов в одноточечных анализах.
Для более детального титрования HTRF и анализа каспазной активности проводили мелкомасштабные, одноэтапные очистки scFv. Интересующие клоны Е. coli отбирали на основе эффективности связывания в скрининговом анализе посредством ELISA и HTRF и инокулировали для мелкомасштабной экспрессии и очистки белка.
д) Связывание в ELISA
Планшеты Maxisorp (Nunc) покрывали 1 мкг/мл человеческого или мышиного TL1A в PBS в течение ночи при 4°C. Лунки промывали три раза 250 мкл PBS, содержащего 0,02% (об./об.) Tween-20, с использованием робота для манипуляций с жидкостью Zoomwasher (Titertek) и блокировали в 100 мкл PBS/3% (масс/об.) сухого белка молока с 1% бычьего сывороточного альбумина в течение 1 ч. Неочищенные периплазматические экстракты (50%, об./об.) блокировали в PBS/6% (масс/об.) белке сухого молока с 2% бычьего сывороточного альбумина в течение 1 ч. Блокированные периплазматические экстракты (50%, об./об.) затем инкубировали с антителом против c-myc, конъюгированным с HRP (Roche), в конечной концентрации 1:2500 в течение 30 мин перед добавлением в покрытый планшет для ELISA, инкубацию в котором проводили в течение еще 2 ч. После четырех циклов промывки на Zoomwasher проявляли реакцию с использованием UltraTMB (Pierce) и останавливали добавлением 1:1 0,18 М фосфорной кислоты. Планшет считывали в мультипланшетном ридере EnVision при 450 нм. Все данные откладывали на графике с использованием программ Decision Site 8 (Spotfire) и Prism 5 (GraphPad).
е) Высокопроизводительный конкурентный анализ HTRF
Осуществляли высокопроизводительный конкурентный анализ HTRF для того, чтобы обеспечить идентификацию клонов с улучшенной аффинностью. Родительское антитело 1D1 метили криптатом европия с использованием набора для мечения криптатом (CisBio) согласно инструкциям изготовителя. Конечная реакционная смесь содержала 6 нМ растворимый биотинилированный рекомбинантный человеческий или мышиный TL1A, разведение 1:1600 SA-XL665 (CisBio), разведение 1:1000 родительского 1D1, меченного криптатом европия, и 10% (об./об.) периплазматического экстракта, содержащего интересующий scFv, приготовленные, как описано выше, в общем реакционном объеме 20 мкл в буфере для выявления HTRF (Cisbio). Реактивы последовательно добавляли в 384-луночные черные планшеты малого объема (Nunc) на платформе для работы с жидкостями MiniTrak (Perkin-Elmer). Давали реакциям идти в течение 3 часов при комнатной температуре, и затем осуществляли считывание планшетов на планшет-ридере EnVision Multilabel (Perkin-Elmer) с возбуждением при 340 нм и двумя считываниями испускания при 615 нм (измерение флуоресценции донора на входе от 1D1-криптата европия) и 665 нм (измерение флуоресценции акцептора на выходе от SAXL665). Все считывания выражали в виде процентной доли изменения флуоресценции, %ΔF, как описано ранее (Finlay et al., J. Mol Biol 388(3):541-58 (2009)). Все данные откладывали на графике с использованием программ Decision Site 8 (Spotfire) и Prism 5 (GraphPad).
ж) Переформатирование до IgG, экспрессия и очистка
Отобранные клоны инокулировали из их замороженных маточных растворов и выращивали в течение ночи при 250 об./мин, 37°C в одиночных лунках, содержащих 150 мкл сред 2YT со 100 мкг/мл карбенициллина. Затем 0,5 мкл каждой культуры, выращенной в течение ночи, добавляли в смесь ПЦР. Прямой праймер имел вид: 5' CAACAGCTACAGGCGCGCACTCCCAGGTTCAGCTGGTG 3' (SEQ ID NO: 393), и обратный праймер: 5' GACCGATGGGCCCTTGGTCGACGCTGAGGAGACGGTGAC 3' (SEQ ID NO: 394). Все продукты ПЦР реакций затем объединяли и разделяли на 2%-ном агарозном геле. Вырезали полосу, соответствующую примерно 400 п.н., и очищали с использованием набора для экстракции геля QIAquick (Qiagen). Очищенные ПЦР-продукты затем подвергали расщеплению BssHII при 50° в течение 3 ч, с последующей дезактивацией при 80° в течение 20 мин. Затем в реакционную смесь добавляли 0,6 мкл бычьего сывороточного альбумина  и 3 мкл фермента Sa/I и обеспечивали расщепление при 50° в течение еще 3 ч, с последующей дезактивацией при 65°C в течение 20 мин. Основной объем продуктов расщепления разделяли на 2%-ном агарозном геле, очищали на геле и затем лигировали в экспрессионный вектор, сконструированный для включения нуль-мутации эффекторной функции (также именуемой «тройной мутант» или «3mut») в Fc.
и 3 мкл фермента Sa/I и обеспечивали расщепление при 50° в течение еще 3 ч, с последующей дезактивацией при 65°C в течение 20 мин. Основной объем продуктов расщепления разделяли на 2%-ном агарозном геле, очищали на геле и затем лигировали в экспрессионный вектор, сконструированный для включения нуль-мутации эффекторной функции (также именуемой «тройной мутант» или «3mut») в Fc.
IgG временно экспрессировали в 30 мл клеток НЕК293 (Invitrogen) после стандартной трансфекции. Кондиционированную среду отбирали после 5 суток при 37°C, 7% CO2, и клетки удаляли центрифугированием. Образующийся супернатант фильтровали, и очистку проводили с использованием 40 мкл наконечников со смолой ProPlus с использованием робота MEA (оба от Phynexus Inc). Вкратце, после уравновешивания наконечника в промывочном буфере (Phynexus) через каждый наконечник отбирали 1 мл кондиционированных сред при скорости тока 0,5 мл/мин, 6 раз, для обеспечения захвата IgG смесью смол ProA/G, перед отбрасыванием. Данную стадию повторяли со всеми 30 мл сред в течение ночи. После стадий промывки двумя буферами (Phynexus Inc) захваченный белок элюировали 0,1 М глицином, pH 2, и нейтрализовали 1 М Tris, pH 9. В очищенных белках заменяли буфер на PBS, определяли концентрацию посредством MicroBCA (Thermo) и чистоту - посредством SDS-PAGE в восстанавливающих условиях.
з) Анализ активности каспазы
Очищенные scFv, идентифицированные после исходного скрининга, и, позднее, переформатированные IgG тестировали на их способность нейтрализовать индуцированную TL1A каспазную активность в клетках TF-1 (линия клеток человеческой эритролейкемии) для того, чтобы убедиться, что поддерживалась функциональность. В сутки один клетки TF-1 высевали в плотности 3×105 клеток/мл и инкубировали при 37°C, 5% CO2. В сутки два стимулирующую смесь циклогексимида (20 мкг/мл) и hTL1A (125 нг/мл) инкубировали с серией 3-кратного разведения scFv, начиная с 40 нМ, в течение 30 мин при 37°C. В смесь стимулы-scFv добавляли клетки TF-1 (50000 клеток/лунку). После 6 ч инкубации при 37°C добавляли 100 мкл/лунку реактива Caspase-Glo 3/7 (Promega). Планшет инкубировали при комнатной температуре в течение 15 мин, после чего осуществляли его считывание на планшет-ридере Envision (Perkin-Elmer) при 700 нм. Анализ проводили в двойной повторности, и данные откладывали на графике с использованием программы Prism 5 (GraphPad).
и) Анализ IgG посредством Biacore
Анализ Biacore проводили с использованием биосенсора Т-200, чипов СМ5 серии S и приблизительно 4000 RU (единицы ответа) антитела против человеческого IgG (GE Healthcare), иммобилизованного в 10 мМ иммобилизационном натрий-ацетатном буфере при pH 5,0. Устанавливали условия анализа для минимизации влияния переноса массы, авидности и событий повторного связывания, как описано ниже. Пустую иммобилизацию проводили на отдельной проточной ячейке для вычитания контроля. Очищенные IgG были разведены в подвижном буфере (PBS, 300 мМ хлорид натрия, 3,2 мМ этилендиаминтетрауксусная кислота, 0,01% Tween 20), и низкие уровни (меньше 30 RU) захватывались с использованием скорости тока 100 мкл/мин в течение 2 мин для уменьшения возможного повторного связывания тримерным TL1A. TL1A инъецировали в интервале концентраций (0,4-33 нМ) в подвижном буфере при скорости тока 100 мкл/мин в течение 30 с, с последующими двумя 30 с стадиями регенерации с 3 М хлоридом магния и подвижным буфером. Сенсограммы для каждой концентрации за вычетом контроля анализировали с использованием программы для оценки Biacore Т-200 (v1.0).
к) QC (контроль качества) секвенирования библиотек
Для одиночных колоний из каждой из сконструированных библиотек мутантов scFv 1D1 (VHCDR1, VHCDR2, VHCDR3A и VHCDR3B) проводили QC анализа последовательности. Анализ результатов по последовательностям показал включение всех желательным мутаций во всех положениях, намеченных в стратегии мутагенеза.
л) Идентификация и анализ вариантов с созревшей аффинностью
Из каждой ветви селекции случайным образом отбирали клоны и исходно подвергали скринингу в неочищенном одноточечном перипрепаративном формате. Связывание посредством ELISA идентифицировало клоны, экспрессирующие scFv, связывающиеся с TL1A, обогащенные посредством способа селекции на основе фагового дисплея, с возрастающим числом связывающих агентов, наблюдающихся от цикла один до цикла три обоих подходов селекции. В анализе HTRF измеряется уменьшение флуоресценции, наблюдаемое при связывании родительского IgG 1D1, меченного криптатом европия, с растворимым рекомбинантным человеческим/мышиным TL1A, в присутствии конкурирующих антител scFv. Это обеспечивает идентификацию клонов, которые сильно конкурируют за связывание с исходным эпитопом 1D1, который, как было показано, опосредует биологическую эффективность in vivo. Аналогичным образом, наблюдали увеличение в целом ряде конкурирующих клонов, полученных после цикла 3 селекции. Поскольку концентрация перипрепарата не может быть определена, для того, чтобы определить эффект экспрессии на сигнал анализа для дальнейшего анализа отбирали клоны с %ΔF, аналогичной или лучшей, чем у перипрепарата родительского 1D1. Из классической селекции подвергали скринингу 800 клонов, и 270 отбирали для подтверждающего скрининга и анализа последовательности, тогда как из второго способа селекции подвергали скринингу дополнительные 800 клонов, и 120 отбирали для дальнейшего анализа.
м) Анализ последовательности
Анализ последовательностей клонов, которые были позитивными в первичном скрининге, позволил идентифицировать 40 уникальных последовательностей из классических селекции, и дополнительных 13 уникальных последовательностей из второй селекции, с последующим удалением любых клонов с мотивами гликозилирования (NXS, NXT). Мутации были идентифицированы во всех 3 CDR VH. Последовательности вариабельных доменов тяжелой цепи (VH) для некоторых из этих вариантов приведены в таблице с перечнем последовательностей (Таблица 40) и на Фиг. 1.
Все клоны подвергали дальнейшему анализу в виде очищенных scFv как в конкурентном анализе HTRF, так и в анализе каспазной активности, показывая, что все клоны могли конкурировать с родительским 1D1 за связывание с TL1A и ингибировать каспазную активность в зависимости от концентрации (данные не показаны). scFv затем переформатировали до IgG для дальнейшего анализа, где, аналогичным образом, все наилучшие варианты демонстрировали способность конкурировать с родительским 1D1 в анализе HTRF и ингибировать каспазную активность. Однако ни один анализ не мог быть использован для ранжирования клонов из-за возможного стэкинг-эффекта. Поскольку в анализе каспазы использовали конечную концентрацию TL1A 2 нМ, считается, что клоны прошли через порог выявления анализа, и для того, чтобы точно ранжировать эффективность каждого клона потребовалась бы дальнейшая оптимизация.
Анализ IgG посредством Biacore продемонстрировал целый ряд положительных результатов с KD меньше 2 нМ, и 15 положительных результатов имели KD меньше 1 нМ (Таблица 7). Наибольшие улучшения аффинности с 2-6-кратными увеличениями KD наблюдали в клонах с мутациями в VHCDR3 и VHCDR2, причем все варианты VHCDR3 включают мутацию от Asn до His. Все варианты VHCDR3 включали мутацию от серина (S) до аланина (А) в положении 93. Последовательности вариабельного домена тяжелой цепи (VH) данных вариантов приведены в Таблице 8, таблице с перечнем последовательностей (Таблица 40) и на Фиг. 1. Данные варианты имеют такую же легкую цепь, что и родительское антитело 1D1.




Клоны также тестировали на аффинность в отношении как мышиного TL1A, так и TL1A яванского макака с наблюдаемыми аналогичными увеличениями аффинности (Таблица 9). Увеличения аффинности, главным образом, возникали из-за улучшений скорости диссоциации. Улучшения аффинности также наблюдали при тестировании в отношении межвидовой реактивности против мышиного TL1A и TL1A яванского макака (Таблица 9).

Пример 6: определение кристаллической структуры антитела тип против TL1A
Человеческий TL1A дикого типа образует мультимеры, связанные дисульфидными связями, которые затрудняют очистку и, согласно литературе, приводили к меньшему разрешению кристаллических структур. По этой причине для кристаллизации использовали двойных мутантов C95S/C135S. Мутантный TL1A экспрессировали в Е. coli и очищали с использованием хроматографии с хелатированным Ni, с последующей ионообменной хроматографией и конечной стадией гель-фильтрации.
Фрагменты Fab из родительского IgG 1D1 получали расщеплением папаином. Первоначальные попытки выращивания кристаллов комплекса TL1A с Fab 1D1 не были успешными. Затем scFv-Fc 1D1 экспрессировали в клетках НЕК. scFv-Fc очищали из кондиционированных сред посредством захвата на белке A, и scFv отщепляли от Fc с использованием папаина. Выделенный scFv частично расщепляли по линкеру между доменами VH и VL, но разрезанное вещество все еще имело способность к связыванию с TL1A. Комплекс scFv 1D1 с TL1A образовал в растворе тиоцианата калия и янтарной кислоты кубические кристаллы.
Данные получали с разрешением 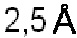 в пучке 17-ID на Advnced Photon Source. Структуру определяли посредством молекулярного замещения с использованием опубликованной структуры TL1A (код PDB - 2RJL) и группы структур вариабельного домена. После повторного построения и уточнения конечное значение Rfree составляет 0,237 с Rwork 0,199. Кристаллическая структура имеет одну копию scFv 1D1, связанную с одним мономером TL1A в асимметричном элементе. Тример образуется посредством кристаллографической симметрии из тригиры, соединяющей противоположные углы элементарной ячейки в кубическом пространстве группы Р432 (Фиг. 5). Антитело взаимодействует со смежными поверхностями двух мономеров, связываясь в той же самой бороздке, которая видна для рецептора-ловушки DCR3 в его соструктуре с TL1A. По аналогии со структурами других членов семейства TNF с их сигнальными рецепторами предполагается, что способ связывания данного антитела приводил бы к прямому блокированию взаимодействия сигнализации с рецептором DR3. Почти весь паратоп содержится в пределах тяжелой цепи.
в пучке 17-ID на Advnced Photon Source. Структуру определяли посредством молекулярного замещения с использованием опубликованной структуры TL1A (код PDB - 2RJL) и группы структур вариабельного домена. После повторного построения и уточнения конечное значение Rfree составляет 0,237 с Rwork 0,199. Кристаллическая структура имеет одну копию scFv 1D1, связанную с одним мономером TL1A в асимметричном элементе. Тример образуется посредством кристаллографической симметрии из тригиры, соединяющей противоположные углы элементарной ячейки в кубическом пространстве группы Р432 (Фиг. 5). Антитело взаимодействует со смежными поверхностями двух мономеров, связываясь в той же самой бороздке, которая видна для рецептора-ловушки DCR3 в его соструктуре с TL1A. По аналогии со структурами других членов семейства TNF с их сигнальными рецепторами предполагается, что способ связывания данного антитела приводил бы к прямому блокированию взаимодействия сигнализации с рецептором DR3. Почти весь паратоп содержится в пределах тяжелой цепи.
Пример 7: компьютерное конструирование точечной мутации с усиленной аффинностью
С использованием кристаллической структуры использовали протокол толерантности последовательности, адаптированный из Smith and Kortemme 2010, общедоступный на http://www.plosone.org/article/info:doi/10.1371/journal.pone.0020451, для идентификации мутаций, которые могут улучшать аффинность связывания 1D1 в отношении TL1A. Данный протокол относительно быстро оценивает очень большое число последовательностей с использованием программного пакета для конструирования белков Rosetta от Университета Вашингтона. Для каждой из CDR тяжелой цепи проводили отдельный эксперимент. Остаткам в пределах определенного расстояния от поверхности контакта TL1A давали варьировать.
Поскольку контактирующие остатки из CDR2 и 3 хорошо отбирались в параллельных оптимизациях на основе фагового дисплея, авторы изобретения сосредоточились на результатах из CDR H1. В частности, было очевидно, что серии 28 в 1D1 был скрыт в поверхности контакта, но не образовывал каких-либо сильных водородных связей (Фиг. 6). Протокол толерантности последовательности предлагал замену аспарагиновой кислоты (Фиг. 7), аспарагинов или глутамина и также одобрял мутацию тирозина до гистидина в положении 31. Эти возможности дополнительно исследовали путем моделирования мутаций с использованием программы SCWRL от Fox Chase Cancer Center и с использованием Macromodel от Schrodinger, Inc. для минимизации и расчета изменения энергии связывания. Затем делали данные мутации (Таблица 10), и образующиеся белки тестировали в отношении связывания.

Модификацию S28D выбирали для комоинирования с наилучшими последовательностями из оптимизаций CDR H2 и H3 посредством фагового дисплея, получая варианты с Kd меньше 0,1 нМ. Данные варианты и их последовательности CDR VH перечислены в Таблице 11 (клоны 1D1 1.1-1.14). Для дальнейшей попытки улучшения аффинности объединяли полезные мутации, обнаруженные при скрининге CDRH2 и CDRH3 посредством фагового дисплея, для поиска синергии (клоны 1D1 1.15-1.26). После анализа всех из этих клонов в наилучшие комбинации CDRH2 и CDRH3 - VH1.27-VH1.34 добавляли мутацию S28D. Последовательности вариабельного домена (VH) тяжелой цепи для каждого из этих вариантов перечислены в Таблице 40 и на Фиг. 1. Данные варианты имеют такую же легкую цепь, что и родительское антитело 1D1.
В Таблице 12 приведено обобщение разных аминокислотных замен в областях VH антитела 1D1 по сравнению с вариантами с созревшей аффинностью из Таблицы 8 и Таблицы 11, а также с антителами 15С11 и 15А9, которые конкурируют за связывание с тем же самым эпитопом TL1A, что и антитело 1D1 (см. Фиг. 1Л).




Пример 8: определение связывания TL1A посредством 1D1 и наилучших клонов с оптимизированной аффинностью посредством Biacore/Kinexa
Для характеристики кинетики связывания разных вариантов 1D1 - антител против TL1A с растворимым рекомбинантным TL1A посредством поверхностного плазмонного резонанаса каждое антитело против TL1A экспрессировали в виде антитела IgG1. Основывали стабильный пул экспрессии антител, распознающих TL1A (родительское 1D1, 7D4 и 26B11), с использованием протокола трасфекции липофектамином. Клетки СНО выращивали до 80%-й конфлюентности; добавляли 25 мкг ДНК и для тяжелой, и для легкой цепей. Во время основания пулов истощившиеся среды заменяли R1 плюс 10% FBS, повторяя эту процедуру на третьи/четвертые сутки схемы. Данные пулы затем адаптировали для бессывороточной суспензии. Это вещество очищали посредством белка A и использовали в качестве контролей в программе.
Новые варианты клонов по отношению к 1D1 тестировали посредством мелкомасштабной экспрессии в 50 мл временных трансфекций НЕК 293. Мелкомасштабная очистка на смоле на основе белка A с использованием экспресс-системы АКТА давала белок, который мог бы быть пропущен в ранних анализах Biacore и анализах на основе клеток для скрининга. Поскольку клоны отбирали для дальнейшей характеристики, проводили временную экспрессию в большем масштабе и получение стабильных линий клеток.
Антитела захватывали через прямо иммобилизованное антитело против человеческого IgG (GE Healthcare) на поверхности сенсорного чипа (СМ5) с карбоксиметилированным декстраном, используя установку Biacore Т100 или Т200. Антитело против человеческого IgG иммобилизировали через аминное связывание до плотностей приблизительно 4000-13000 единиц ответа (RU). Антитела разводили до 0,075-0,15 мкг/мл в 8,1 мМ NA2HPO4, 1,47 мМ KH2PO4, pH 7,2, 237 мМ NaCl, 2,7 мМ KCl, 3,4 мМ EDTA и 0,01% Tween 20 (PBS-NET) и инъецировали на поверхность против hIgG в течение примерно 1-2 минут со скоростью тока 5 мкл/минуту для достижения низких уровней захвата, которые меньше чем 30 RU. После захвата скорость тока увеличивали до 100 мкл/минуту, и инъецировали разные концентрации растворимого рекомбинантного человеческого TL1A (SEQ ID NO: 254), растворимого рекомбинантного TL1A яванского макака (SEQ ID NO: 259), растворимого рекомбинантного TL1A мыши (SEQ ID NO: 260), растворимого рекомбинантного TL1A крысы (SEQ ID NO: 261) или растворимого рекомбинантного TL1A кролика (SEQ ID NO: 262), варьирующие от 0,195 нМ до 100 нМ, в PBS-NET в течение приблизительно 2-3-минутной ассоциации и давали диссоциировать в течение приблизительно 3-60 минут. В конце каждого цикла всю поверхность с антителом против hIgG регенерировали 30-секундным импульсом 3 М MgCl2, с последующими двумя последовательными 15-секундными импульсами PBS-NET. В качестве альтернативы, поверхность регенерировали двумя 30-секундными импульсами ионного раствора, содержащего 0,46 М KSCN, 1,83 М MgCl2, 0,92 М мочевину и 1,83 М гуанидин-HCl, pH 7,4, с последующим одним 30-секундным импульсом PBS-NET. Все инъекции проводили при 25°C при скорости отбора данных 10 Гц. Для всех сенсограмм использовали двойной контроль, применяя и контрольную поверхность и инъекции буфера. Константы скорости определяли путем аппроксимирования данных к модели 1:1 в программе для оценки v1.0 Biacore Т100, Т200 или программе BIAevaluation v4.1.1 и с использованием уравнения KD равно kd/ka.
Равновесную константу диссоциации (KD) каждого антитела против TL1A в отношении человеческого TL1A измеряли с использованием анализа кинетического исключения (KinExA) на установке KinExA 3200 (Sapidyne). Данный анализ включает прединкубирование антитела: смеси антигенов находятся в растворе достаточно долго для достижения равновесия перед измерением уровня несвязавшегося антитела с использованием твердофазного компонента. Для получения твердой фазы двести миллиграммов полиметилметакрилатных шариков (РММА, Sapidyne) покрывали рекомбинантным человеческим TL1A в концентрации 30 мкг/мл в 1 мл PBS, pH 7,4, и перемешивали переворачиванием в течение двух часов при комнатной температуре. Шарики блокировали в течение 1 часа с использованием PBS плюс 10 мг/мл бычьего сывороточного альбумина (бычий сывороточный альбумин, Sigma) при комнатной температуре перед разведением всего вплоть до 27 мл в PBS. Для компонента в растворе каждое антитело поддерживали при постоянной концентрации, тогда как TL1A человека, яванского макака или мыши титровали в широком интервале концентраций - 240 фМ - 100 нМ в PBS плюс 1 мг/мл бычьего сывороточного альбумина. Концентрацию антитела поддерживали либо около оценочной KD для контролируемой кривой KD, либо в концентрации, в 10 или более раз превышающей оценочную KD для контролируемой кривой антигенсвязывающей концентрации (ABC). Для каждой серии титрования включали образец буфера и образец одного антитела. Каждую смесь антитело:TL1A перемешивали кувырканием при комнатной температуре в течение по меньшей мере шести часов до достижения равновесия, и затем каждую смесь инъецировали над твердой фазой шариков, покрытых TL1A, в проточной ячейке установки. Только свободное, не занятое антитело, связавшееся с шариками, выявляли с использованием 500 мкл 0,25 мкг/мл или 1,5 мкг/мл антитела козы против человеческого IgG (H+L), конъюгированного с Alexa-647 (Jackson), доставляемого в проточную ячейку со скоростью 0,25 мл/мин. Шарики пополняли между анализом каждого образца. Сигналы связывания выявленного свободного антитела превращали в процентную долю свободного, несвязавшегося антитела при измерении по образцу, содержащему только антитело, и откладывали на графике против каждой концентрации TL1A. Для каждого антитела KD контролируемых кривых ABC одновременно аппроксимировали с использованием программы n-Curve Analysis v3.1.4 для аппроксимирования кривых к модели «аффинность, неизвестный лиганд» и измеряли равновесную KD.
Для оценки связывания TL1A в реальном времени каждое антитело захватывали через антитело против IgG на поверхностях сенсорных чипов Biacore при низких плотностях меньше 30 RU. Преднамеренно поддерживали низкие уровни захвата для обеспечения условий связывания 1:1, избегания влияния авидности и минимизации повторного связывания во время диссоциации. При уровнях захвата, превышающих 30 RU, для 1D1 наблюдали более медленные скорости диссоциации, которые вероятно были обусловлены данными осложнениями.
Для всех видов TL1A, как и ожидалось, связывание с 1D1 и каждым из клонов с созревшей аффинностью зависело от протестированной концентрации TL1A. При наивысших концентрациях цитокина фазу диссоциации иногда продлевали до 60 минут для достижения по меньшей мере 5%-го уменьшения сигнала связывания. Это является минимальным рекомендованным уменьшением для точного измерения относительно низких скоростей диссоциации антигена. При удовлетворении данного условия из сенсограмм связывания рассчитывали константы скорости ассоциации и диссоциации между каждым видом TL1A и каждым антителом с использованием модели связывания Лангмюра 1:1 (Таблица 13-Таблица 17). Для антител с созревшей аффинностью, которые не удовлетворяли данным критериям при связывании с человеческим TL1A, скорости диссоциации были слишком низкими для измерения, и оценивали, что KD были меньше, чем 100 пМ (Таблица 13).





Анализы кинетического исключения (KinExA) на основе раствора проводили в виде ортогональной методики для измерения значений равновесной KD. Для каждого антитела с созревшей аффинностью с TL1A получали и контролируемую KD, и контролируемую кривую ABC. Кривые также получали для родительского антитела 1D1 и Fab, полученного из антитела 1D1, для применения в качестве компараторов. Анализ N-кривой проводили с использованием модели «аффинность, неизвестный лиганд» для определения равновесной KD для каждого антитела (Таблица 18). Для антител с созревшей аффинностью с KD, которые не могли быть определены поверхностным плазмонным резонансом, измеренные равновесные KD могли отличать данные антитела от родительского антитела 1D1.

Из-за гомотримерного состава TL1A и того факта, что KD KinExA определяются в растворе, возможно, что многовалентные формы TL1A образуют структуры кристаллических решеток с двухвалентными антителами. Следовательно, значения KD KinExA вероятно включают показатель авидности. Показатель авидности антитела 1D1 был определен из-за доступности белка Fab 1D1. Fab 1D1 связывал человеческий TL1A с равновесной KD 3 нМ (Таблица 18). Fab является одновалентным в отношении человеческого TL1A и, соответственно, KD KinExA согласовалась с KD 3,2плюс\минус0,9 нМ от полноразмерного антитела при условиях связывания 1:1 на поверхности сенсорного чипа Biacore. Для измерения KD с человеческим TL1A посредством SPR отсутствовало достаточное количество Fab. По сравнению с KD 127 пМ, измеренным посредством KinExA, показатель авидности для 1D1, по-видимому, составляет 24. Показатели авидности антител с созревшей аффинностью не известны и не обязательно являются такими же, что и наблюдаемый 24-кратный показатель для родительского антитела 1D1.
Пример 9: кристаллические структуры Fab 7D4, Fab 26B11, scFv 1D1 1.31 и DR3 с TL1A
Двойного мутанта TL1A C95S/C135S экспрессировали в Е. coli и очищали, как описано в Примере 6. Фрагмент Fab антитела 7D4 получали путем расщепления полноразмерного IgG папаином и удаления Fc с использованием смолы на основе белка A. Fab смешивали с двойным мутантом TL1A в молярном соотношении 1:1, и образующийся комплекс очищали SEC (гель-фильтрация). Кристаллы комплекса формировались в 100 мМ Tris, pH 8, 25% PEG (полиэтиленгликоль) 400.
Данные получали при разрешении  в пучке 17-ID на Advanced Photon Source. Структуру определяли посредством молекулярного замещения и уточняли до R/Rсвободный 0,187/0,238 (Фиг. 8). Кристаллическая структура имеет одну копию TL1A, связанного с одним фрагментом Fab 7D4 в асимметрической ячейке в группе симметрии кристаллической решетки I213. Что касается 1D1, биологический тример образуется посредством кристаллографической симметрии. В отличие от 1D1, которое взаимодействует с бороздкой связывания рецептора между смежными мономерами TL1A, эпитоп 7D4 почти полностью содержится в одном мономере TL1A. Тем не менее, эпитоп является достаточно широким, так что ожидалось бы, что связывание 7D4 будет непосредственно препятствовать связыванию с рецептором, как видно в анализе нейтрализации на основе клеток.
в пучке 17-ID на Advanced Photon Source. Структуру определяли посредством молекулярного замещения и уточняли до R/Rсвободный 0,187/0,238 (Фиг. 8). Кристаллическая структура имеет одну копию TL1A, связанного с одним фрагментом Fab 7D4 в асимметрической ячейке в группе симметрии кристаллической решетки I213. Что касается 1D1, биологический тример образуется посредством кристаллографической симметрии. В отличие от 1D1, которое взаимодействует с бороздкой связывания рецептора между смежными мономерами TL1A, эпитоп 7D4 почти полностью содержится в одном мономере TL1A. Тем не менее, эпитоп является достаточно широким, так что ожидалось бы, что связывание 7D4 будет непосредственно препятствовать связыванию с рецептором, как видно в анализе нейтрализации на основе клеток.
Для определения соструктуры TL1A с 26B11 того же самого двойного мутанта TL1A объединяли с фрагментом Fab 26B11, и образующийся комплекс очищали SEC. Кристаллы получали в 16% PEG 3350, 250 мМ нитрате аммония, и картину дифракции получали с разрешением  в пучке 17-ID на Advanced Photon Source. Структуру уточняли до значений R/Rсвободный 0,177/0,224 (Фиг. 9). Кристаллографическая асимметрическая ячейка содержит 2 копии комплекса. Неожиданно молекулы TL1A в кристалле не образуют биологически активный тример. Низкий pH кристаллизационного раствора возможно вызывал диссоциацию тримера. Комплекс элюируется из гель-фильтрационной колонки во время, согласующееся с молекулярной массой комплекса 3:3 Fab 26B11 и TL1A, демонстрируя то, что антитело не препятствует тримеризации. Кроме того, при наложении TL1A в комплексе с 26B11 на структуру тримера TL1A отсутствуют наблюдаемые несостыковки между индивидуальными копиями Fab 26B11. Эпитопы 7D4 и 26B11 являются перекрывающимися, несмотря на то, что согласно данным в Примере 2 данные антитела не конкурируют за связывание с TL1A.
в пучке 17-ID на Advanced Photon Source. Структуру уточняли до значений R/Rсвободный 0,177/0,224 (Фиг. 9). Кристаллографическая асимметрическая ячейка содержит 2 копии комплекса. Неожиданно молекулы TL1A в кристалле не образуют биологически активный тример. Низкий pH кристаллизационного раствора возможно вызывал диссоциацию тримера. Комплекс элюируется из гель-фильтрационной колонки во время, согласующееся с молекулярной массой комплекса 3:3 Fab 26B11 и TL1A, демонстрируя то, что антитело не препятствует тримеризации. Кроме того, при наложении TL1A в комплексе с 26B11 на структуру тримера TL1A отсутствуют наблюдаемые несостыковки между индивидуальными копиями Fab 26B11. Эпитопы 7D4 и 26B11 являются перекрывающимися, несмотря на то, что согласно данным в Примере 2 данные антитела не конкурируют за связывание с TL1A.
Для определения соструктуры TL1A с 1D1 1.31 scFv версию антитела с оптимизированной аффинностью экспрессировали в виде слияния с Fc, расщепляли папаином и очищали так же, как и родительское антитело 1D1. Очищенный scFv смешивали с двойным мутантом TL1A, и комплекс очищали посредством SEC. Кристаллы получали в 1800 мМ сульфате аммония, 8,33333% диоксане, 100 мМ MES, pH 6,5, и картину дифракции получали с разрешением  в пучке 17-ID на Advanced Photon Source (Фиг. 10). Асимметричная ячейка содержит одну копию полного тримерного комплекса, состоящего из трех мономеров TL1A и трех молекул 1.31 scFv.
в пучке 17-ID на Advanced Photon Source (Фиг. 10). Асимметричная ячейка содержит одну копию полного тримерного комплекса, состоящего из трех мономеров TL1A и трех молекул 1.31 scFv.
Общий способ связывания 1D1 1.31 с TL1A является таким же, что и для родительского 1D1. Имеются два отличия последовательности между 1D1 1.31 и 1D1, которые, как ожидалось, находятся в пределах поверхности контакта с TL1A: гистидин в 1D1 1.31 по сравнению с аспарагином в 1D1 в положении Н58 и аспарагиновая кислота в 1D1 1.31 по сравнению с серином в положении Н28 (см. Фиг. 11). Как и ожидалось, гистидин формирует по существу такое же взаимодействие, что и исходные аспарагины, с глутаминовой кислотой 55 TL1A, но данное взаимодействие сильнее, так как близость глутаминовой кислоты вероятно повысила бы рКа гистидина до точки, когда он нес бы положительный заряд при физиологическом pH. Аспарагиновая кислота в положении 28 показывает ожидаемую улучшенную координацию связывания водородными связями и комплиментарность заряда относительно родительского серина (см. Фиг. 12). Кроме того, кристаллическая структура демонстрирует измененную конформацию в смежной петле 118-121 TL1A относительно конформации связанного с 1D1. Тирозин 121 TL1A представляет собой другой ротамер, и траектория остова изменена. Y121 боковой цепи образует новые гидрофобные взаимодействия с 1D1 1.31, которые могут способствовать повышенной аффинности данного антитела. В структуре с 1D1 молекула воды занимает положение, сохраняемое Y121 боковой цепи в структуре с 1D1 1.31. Данные различия наблюдаются во всех трех копиях комплекса, но нельзя исключать, что это эффект разных условий кристаллизации, а не различий последовательности между 1D1 и 1D1 1.31.
Аналогичным образом получали кристаллы комплекса TL1A:DR3. Взаимодействие между остатками TL1A и DR3, а также взаимодействие между TL1A и антителами 1D1, 1D1 1.31 (1.31), 7D4 и 26B11 обобщены в Таблице 42. Как показано в Таблице 42, целый ряд аминокислот, включающих T30, V31, V32, R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Q43, F44, Р45, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, R86, G87, М88, Т89, Е91, G99, R100, Р101, N102, К103, Р104, D105, S106, S136, N137, F139, S161, D162, I163, S164, L165, V166, D167, Y168, Т169, К170, Е171, D172, N42, F44, К103, Р104, D105, S106, К113, Т115, S117, Y118, Р119, Е120, Р121, Т122, Q123, М147, F148, S149 и Q151 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, взаимодействуют с по меньшей мере одним из антител 1D1, 1.31, 7D4, 26B11 или DR3; в некоторых случаях аминокислота TL1A может находиться в пределах других субъединиц мультимера TL1A, таким образом, что антитело связывается с гомомультимером TL1A, причем гомомультимер содержит по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из N42, F44, К103, Р104, D105, S106, К113, Т115, S117, Y118, Р119, Е120, Р121, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается с вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из T30, V31, V32, R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Q43, F44, Р45, Е50, Н51, Е52, L53, G54, L55, А56, F57, Т58, R86, G87, М88, Т89, Е91, G99, R100, Р101, N102, К103, Р104, D105, S106, S136, N137, F139, S161, D162, I163, S164, L165, V166, D167, Y168, Т169, К170, Е171 и D172, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
Некоторые из аминокислотных остатков TL1A могут участвовать во взаимодействии с более чем одним из антител 1D1, 1D1 1.31 (1.31), 7D4 и 26B11 или DR3. Как показано в Таблице 42, аминокислоты V31, V32, R33, Т35, Р36, Т37, Q38, Н39, F40, Q43, Е50, Н51, Е52, L53, G54, L55, А56, F57, R86, G87, М88, S136, N137, S164, L165, Y168, Т169, К170, Е171, К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, взаимодействуют по меньшей мере с двумя из антител 1D1, 1.31, 7D4, 26B11 или DR3. В некоторых случаях аминокислота TL1A может находиться в пределах разных субъединиц мультимера TL1A, таким образом, что антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, S117, Y118, Р119, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Т35, Р36, Т37, Q38, Н39, F40, Q43, Е50, Н51, Е52, L53, G54, L55, А56, F57, R86, G87, М88, S136, N137, S164, L165, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
Некоторые из аминокислотных остатков TL1A могут участвовать во взаимодействии с более чем двумя из антител 1D1, 1D1 1.31 (1.31), 7D4 и 26B11 или DR3, как показано в Таблице 42. Следовательно, в одном воплощении антитело против TL1A или его антигенсвязывающий фрагмент согласно настоящему изобретению связывается с одной или более чем одной аминокислотой, выбранной из группы, состоящей из V31, V32, R33, Е50, L53, G54, S164, Y168, Т169, К170, Е171, Y118 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254 и взаимодействует по меньшей мере с тремя из антител 1D1, 1.31, 7D4, 26B11 или с DR3. В некоторых случаях антитело против TL1A может взаимодействовать с аминокислотами TL1A, находящимися в разных субъединицах мультимера TL1A, таким образом, что антитело связывается с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из Y118 и Q151 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, L53, G54, S164, Y168, Т169, К170 и Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
Некоторые аминокислоты TL1A могут участвовать во взаимодействии с более чем тремя из антител 1D1, 1D1 1.31 (1.31), 7D4 и 26B11 или с DR3, как показано в Таблице 42. В одном воплощении антитело против TL1A или его антигенсвязывающий фрагмент согласно настоящему изобретению, как таковые, взаимодействуют с аминокислотой TL1A, выбранной из группы, состоящей из R33, Y168 и Т169, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В других случаях аминокислотный остаток TL1A участвует во взаимодействии с антителами 1D1 и 1D1 1.31. В некоторых воплощениях антитело против TL1A или его антигенсвязывающий фрагмент согласно настоящему изобретению, как таковые, связываются с по меньшей мере одной аминокислотой TL1A, выбранной из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170, Е171, К113, Y118, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. В других случаях антитело может связываться с аминокислотами в пределах разных субъединиц мультимера TL1A. В одном воплощении антитело против TL1A или его антигенсвязывающий фрагмент согласно настоящему изобретению, как таковые, связываются с гомомультимером TL1A, содержащим по меньшей мере первый и второй мономер TL1A, где антитело связывается с первым эпитопом на первом мономере TL1A, где первый эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из К113, Y118, Т122, Q123, М147, F148, S149 и Q151, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, и антитело связывается со вторым эпитопом на втором мономере TL1A, где второй эпитоп содержит по меньшей мере одну аминокислоту, выбранную из группы, состоящей из V31, V32, R33, Е50, Н51, Е52, L53, G54, L55, А56, F57, Y168, Т169, К170, Е171, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
В других случаях связывание антитела с TL1A вызывает не равное нулю изменение площади скрытой поверхности в аминокислоте TL1A. Например, имеет место увеличение площади скрытой поверхности по меньшей мере на  в аминокислотах R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, I163, S164, Y168, Т169, К170, Е171, N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислоты N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151 первой субъединицы TL1A и R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, I163, S164, Y168, Т169, К170 и Е171 второй субъединицы TL1A согласно нумерации SEQ ID NO: 254. В других случаях имеет место увеличение площади скрытой поверхности по меньшей мере на
в аминокислотах R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, I163, S164, Y168, Т169, К170, Е171, N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислоты N42, К103, Р104, D105, К113, S117, Y118, Т122, S149 и Q151 первой субъединицы TL1A и R33, Q34, Т35, Р36, Т37, Q38, Н39, F40, К41, N42, Р45, Е50, L53, G54, L55, F57, Т58, R86, М88, Т89, Р101, N102, К103, Р104, D105, S136, N137, D162, I163, S164, Y168, Т169, К170 и Е171 второй субъединицы TL1A согласно нумерации SEQ ID NO: 254. В других случаях имеет место увеличение площади скрытой поверхности по меньшей мере на  в аминокислотах R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168, Е171, N42, К103, D105 и Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислоты N42, К103, D105 и Y118 первой субъединицы TL1A и R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168 и Е171 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. В других случаях имеет место увеличение площади скрытой поверхности по меньшей мере на
в аминокислотах R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168, Е171, N42, К103, D105 и Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислоты N42, К103, D105 и Y118 первой субъединицы TL1A и R33, Т35, Р36, Q38, Н39, F40, К41, N42, L53, G54, L55, R86, М88, Р101, N102, К103, D105, N137, S164, Y168 и Е171 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. В других случаях имеет место увеличение площади скрытой поверхности по меньшей мере на  в аминокислотах R33, Q38, F40, К41, L53, R86, М88 и Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислота Y118 первой субъединицы TL1A и R33, Q38, F40, К41, L53, R86 и М88 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
в аминокислотах R33, Q38, F40, К41, L53, R86, М88 и Y118 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254. Данные аминокислоты могут присутствовать на разных субъединицах TL1A: например, аминокислота Y118 первой субъединицы TL1A и R33, Q38, F40, К41, L53, R86 и М88 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
Целый ряд аминокислотных остатков TL1A, например, аминокислоты А56, D232, Е171, Е52, Н109, К111, К173, N112, N172, N207, Р106, Р171, Q104, Q108, R156, R33, S149, Т122, Т169, Y118, Y168 и Y238 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, участвуют в связывании водородными связями с DR3 или антителами по настоящему изобретению. Например, как показано в Таблице 42, аминокислоты TL1A Q108, Н109, К111, N112, Р171, N172 и К173 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, участвуют в образовании водородных связей с антителом 26B11. Показано, что для связывания с антителом 7D4 водородные связи образуют Q104, Р106, R156, N207, D232 и Y238. Аминокислоты Y118, S149, R33, Е52, А56 и Y168 согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254, могут образовать водородные связи с антителом 1D1. Аминокислоты Т122, S149, Е52, А56, Y168, Т169 и Е171 могут образовать водородные связи при связывании TL1A с 1.31.
В некоторых случаях антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с TL1A и участвует в образовании водородной связи с молекулой воды, которая также связывается водородной связью с одним или более чем одним остатком TL1A, который выбран из группы, состоящей из R33, Q38, К41, N42, L55, N102, D105 и М147, согласно нумерации аминокислотной последовательности TL1A, как изложено в SEQ ID NO: 254.
Пример 10: связывание антител против TL1A с TL1A клеточной поверхности человеческих моноцитов
Данное исследование демонстрирует то, что TL1A экспрессируется на поверхности моноцитов при стимуляции иммунным комплексом, и что антитело 1D1 1.31 связывается с TL1A клеточной поверхности человеческих моноцитов. Антитело 1D1 1.31, экспрессируемое в виде полноразмерного человеческого IgG1 с нуль-мутациями эффекторной функции в тяжелой цепи Fc (1D1 1.31-hIgG1-3mut), продуцировали в клетках СНО. Изотипическое контрольное антитело представляло собой антитело против столбнячного анатоксина (aTT), которое также представляет собой человеческое антитело IgG1, содержащее такие же три нуль-мутации эффекторной функции, что и 1D1 1.31.
Одноядерные клетки периферической крови (РВМС) выделяли из 100 мл человеческой периферической крови путем исходного разведения цельной крови 50:50 фосфатно-солевым буферным раствором (PBS) и наслаиванием 25 мл разведенной крови над 15 мл Ficoll-Paque. Наслоенную кровь центрифугировали при 930 g в течение 30 минут. После центрифугирования отбирали клеточную поверхность контакта, содержащую РВМС, и дважды промывали 10 мл стерильного PBS. Клетки ресуспендировали в 5 мл лизирующего буфера Pharm (BD Biosciences, Сан-Хосе, Калифорния) и инкубировали при комнатной температуре в течение 5 минут для лизирования загрязняющих эритроцитов. После инкубации клетки дважды промывали средой RPMI 1640, содержащей 10% инактивированной нагреванием фетальной телячей сыворотки (FBS), 10 мМ HEPES, 10 единиц/мл пенициллина/стрептомицина и 2 мМ глутамин, и ресуспендировали в полной среде с конечной концентрацией 2×106 клеток/мл.
Индукцию TL1A на моноцитах периферической крови и окрашивание 1D1 1.31 осуществляли путем посева 2 мл полной среды, содержащей 4×106 РВМС, в 12-луночные планшеты, покрытые IC (иммунный комплекс), в присутствии или в отсутствие 1D1 1.31 и стимулирования клеток в течение 4 часов при 37°C. Индукцию осуществляли с использованием IC, образованного оптимальными концентрациями человеческого IgG и мышиного антитела против человеческого IgG. IC, связанный с планшетом, получали путем инкубирования 500 мкл 0,5 мг/мл человеческого IgG (Jackson ImmunoResearch Laboratories, West Grove, PA) в PBS на лунку 12-луночного планшета в течение 1 часа при 37°C. После инкубации планшеты 3 раза промывали PBS и инкубировали с мышиным антителом против человеческого IgG (Jackson ImmunoResearch Laboratories, Вест Гров, Пенсильвания) в PBS (20 мкг/мл) в течение 1 часа. Покрытые планшеты 3 раза промывали PBS и хранили в PBS до использования.
Экспрессия связанного с мембраной TL1A на человеческих моноцитах была продемонстрирована окрашиванием биотинилированным антителом 1D1 1.31. После 4-часовой стимуляции клетки собирали с использованием захвата/скребка для клеток для отделения прикрепленных клеток от лунок. Отобранные клетки собирали центрифугированием и ресуспендировали в 100 мкл буфера для окрашивания BD Pharmingen™ (FBS; BD Biosciences, Сан-Хосе, Калифорния) и блокировали TruStain FcX (BioLegend™, Сан-Диего, Калифорния) на льду в течение 10 минут. Добавляли антитело против CD14, конъюгированное с тихоокеанским синим (BD Pharmingen™, BD Biosciences, Сан-Хосе, Калифорния), и 10 мкг/мл биотинилированного 1D1 1.31 или изотипического контрольного антитела, и клетки инкубировали на льду в течение 15 минут. После инкубации клетки промывали 3 мл окрашивающего буфера, центрифугировали при 800 g в течение 5 минут и ресуспендировали в 400 мкл окрашивающего буфера, содержащего фикоэритрин (PE)-стрептавидин (разведение 1:1000 флуоресцентно меченого стрептавидина). После инкубации клетки дважды промывали, центрифугировали и ресуспендировали в 400 мкл окрашивающего буфера. Экспрессию связанного с мембраной TL1A измеряли с использованием установки BD LSRFortessa™ и демонстрировали по увеличению средней интенсивности флуоресценции (MFI) по сравнению с биотинилированным изотипическим контрольным антителом.
Связывание 1D1 1.31 со связанным с мембраной TL1A оценивали на стимулированных человеческих моноцитах. Предварительные исследования показали, что моноциты периферической крови в состоянии покоя не экспрессируют конститутивно TL1A, связанный с мембраной. Следовательно, моноциты индуцировали для экспрессии эндогенного TL1A после стимуляции иммунным комплексом (через занятие рецептора Fc) для демонстрации связывания 1D1 1.31 с TL1A клеточной поверхности моноцита. Перед углубленной характеристикой TL1A кинетика повышающей регуляции продемонстрировала максимальную экспрессию в 4 часа после стимуляции IC, момент времени, использованный в последующих исследованиях для демонстрации связывания 1D1 1.31 с моноцитами. Планшеты, покрытые IC, индуцировали экспрессию TL1A на клеточной поверхности моноцитов через 4 часа после стимуляции (Фиг. 13). Клетки, обработанные 1D1 1.31, имели повышенную среднюю интенсивность флуоресценции по сравнению с обработанными изотипическим антителом и нестимулированными контрольными клетками. Специфичность данного связывания подтверждали в конкурентных анализах с использованием очищенных голых антител против TL1A в концентрации 1 и 10 мкг/мл (данные не показаны). Данные результаты иллюстрируют то, что антитело 1D1 1.31 представляет собой антитело против TL1A, которое специфически связывается со связанным с мембраной TL1A, экспрессируемым на стимулированных циркулирующих моноцитах.
Пример 11: ингибирование NFκB антителами против TL1A в клетках TF-1
Для оценки функциональной ингибирующей эффективности и способности антитела 1D1 1.31 ингибировать внутриклеточную сигнализацию TL1A через DR3 данное антитело оценивали в клетках TF-1 (линия клеток эритробластомы), которые конститутивно экспрессируют DR3, и которые были трансдуцированы геном люциферазы, управляемым промотором NFκB.
Антитело 1D1 1.31, экспрессируемое в виде полноразмерного человеческого IgG1 с нуль-мутациями эффекторной функции в тяжелой цепи Fc (1D1 1.31-hIgG1-3mut), продуцировали в клетках СНО. Изотипическое контрольное антитело представляло собой антитело против столбнячного анатоксина (aTT), которое также представляет собой человеческое антитело - IgG1, содержащее такие же три нуль-мутации эффекторной функции, что и 1D1 1.31. Растворимый TL1A (rsTL1A) продуцировали рекомбинантно.
Клетки TF-1 получали из Американской коллекции типовых культур (ATCC, Manassas, VA). Клетки TF-1 происходят из линии клеток человеческой гематопоэтической эритробластомы, полученной из ATCC. Репортерные клетки TF-1-NFκB-люцифераза получали путем инфицирования клеток TF-1 репортером NFκB-люцифераза лентивируса pCignal Lenti (каталожный № CLS-013L; SA Biosciences, Валенсия, Калифорния). Вкратце, высевали 30000 клеток на лунку 24-луночного планшета в 150 мкл RPMI 1640, 10% фетальной телячей сыворотки (FBS) и 2 нг/мл гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF). На следующие сутки их инфицировали 50 мкл (1×) и 100 мкл (2×) NFκB-люциферазного репортера лентивируса pCignal Lenti в присутствии 6 мкг/мл полибрена. Через 4 суток клетки размножали и подвергали воздействию 1 мкг/мл пуромицина для селекции стабильных интегратов. Селекцию продолжали, пока не гибли все клетки с имитацией инфекции. Активность репортера в стабильных пулах оценивали путем обработки клеток TF-1-NFκB-Luc 1× и 2× разными концентрациями TNF или TL1A. Клетки (20000 на 96 лунок в 100 мкл сред без GM-CSF) обрабатывали цитокинами в течение 5 часов при 37°C, 5% CO2. Затем добавляли субстрат - D-люциферин (1500 мкг/мл), и после 10 минут инкубации при 37°C считывали люминисцентный сигнал в люминометре EnVision (PerkinElmer, Waltham, MA). Для последующих исследований отбирали клетки TF-1-NFκB-Luc 2×. Клеткам TF-1 для их долговременного роста требуется либо интерлейкин 13 (IL13), либо GM-CSF. Клетки выращивали в RPMI 1640, содержащей 10% инактивированной нагреванием FBS, 10 мМ HEPES, 1 мМ пируват натрия, 2 нг/мл рекомбинантного человеческого GM-CSF и 1 мкг/мл пуромицина.
Конститутивная экспрессия DR3 на клетках TF-1 была продемонстрирована окрашиванием имеющимся в продаже биотинилированным антителом против DR3. Клетки выращивали в течение ночи без GM-CSF, как описано в Разделе 5.4 для анализа активации каспазы, индуцированной TL1A. Клетки отбирали и ресуспендировали в буфере для окрашивания BD Pharmingen® (FBS) в концентрации 1×106 клеток/мл и инкубировали на льду в течение 15 минут с 10 мкг/мл антитела против DR3. После инкубации клетки промывали 3 мл буфера для окрашивания, центрифугировали при 800 g и ресуспендировали в концентрации 1×106 клеток/мл в том же самом буфере с фикоэритрин (PE)-стрептавидином, с разведением флуоресцентно меченого стрептавидина 1:1000. После инкубации клетки промывали, центрифугировали и ресуспендировали в буфере для окрашивания в концентрации 1×106 клеток/мл. Экспрессию DR3 проверяли посредством анализа проточной цитометрией на установке LSRFortessa™ от BD Biosciences (Сан-Хосе, Калифорния). Экспрессия DR3 демонстрируется по увеличению средней интенсивности флуоресценции (MFI) по сравнению с контролем стрептавидин-РЕ.
Для определения способности rsTL1A активировать транскрипционный фактор NFκB измеряли люциферазную активность в ответ на rsTL1A в клетках TF-1, трансфицированных геном люциферазы под транскрипционным контролем NFκB. Двое суток до эксперимента клетки TF-1 культивировали при плотности клеток 0,3×106 клеток/мл в культуральных средах для TF-1, содержащих пуромицин, но не GM-CSF. Растворы, содержащие 2× каждой из конечных концентраций rsTL1A в 50 мкл сред TF-1 без пуромицина или GM-CSF, получали в двойной повторности в 96-луночных планшетах (плоское дно для планшетов для измерения люминисценции). 8 концентраций rsTL1A титровали в сторону уменьшения 3-кратными разведениями, начиная с 3986 пМ (3968,3; 1322,8; 440,9; 147; 49; 16,3; 5,4 и 1,8 пМ). Данный эксперимент по ответу на дозу TL1A также проводили в присутствии конечной концентрации 3 нМ изотипического контрольного антитела. В данном случае те же самые растворы для определения ответа на дозу TL1A также содержали 2х конечную концентрацию изотипического контрольного антитела. Планшеты затем запечатывали алюминиевой фольгой и помещали на ночь при 4°C до достижения равновесия. На следующие сутки планшеты предварительно нагревали при 37°C в течение 30 минут, клетки собирали, один раз промывали в фосфатно-солевом буферном растворе (PBS), ресуспендировали в концентрации 1×106 клеток/мл в средах для TF-1 без пуромицина или GM-CSF, и 50000 клеток в 50 мкл клеточной суспензии добавляли в 50 мкл предварительно нагретых растворов TL1A и инкубировали в течение 6 часов при 37°C. В 100 мкл содержимого ячеек добавляли сто (100) мкл 2× конечной концентрации 150 мкг/мл люциферина жука, хорошо перемешивали и инкубировали при 37°C в течение 30 минут. Планшеты считывали на люминометре (EnVision, 1 секунда/лунку). Средние относительные единицы люминисценции (RLU) откладывали на графике против log концентраций TL1A или 1D1 1.31.
Определения EC50 и IC50
Получали кривые активации TL1A или кривые ингибирования антителом, откладывая на графике значения люминисценции относительно log концентраций TL1A или антитела соответственно. Из данных графиков определяли значения EC50 (для TL1A) или IC50 (для 1D1 1.31) с использованием аппроксимирующих кривых нелинейной регрессии GraphPad Prism® (версия 5.02, GraphPad Software, Inc., Сан-Диего, Калифорния) и сигмоидной модели ответа в зависимости от log дозы агониста (три параметра) или антагониста (переменный наклон, четыре параметра) (Уравнение 1 для агониста - TL1A и Уравнение 2 для антагониста - 1D1 1.31).
Уравнение 1:
Log(агонист) относительно ответа (три параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧(LogEC50-X))
Уравнение 2:
Log(ингибитор) относительно ответа-переменный наклон (четыре параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧(LogIC50-X)*наклон),
где Y представляет собой значение люминисценции, и X представляет собой концентрацию агониста - TL1A (Уравнение 1) или антагониста - 1D1 1.31 (Уравнение 2), наибольшее значение представляет собой максимальное значение Y, соответствующее верхнему плато сигмоидной кривой, наименьшее значение представляет собой минимальное значение Y, соответствующее нижнему плато сигмоидной кривой, и LogEC50 или LogIC50 представляют собой log концентрации агониста и антагониста соответственно в точке перегиба, находящейся посередине между максимумом и минимумом. Значения EC50 или IC50 были обобщены по всем экспериментам с использованием средних значений и стандартных отклонений (STDEV).
Эффективность и способность 1D1 1.31 ингибировать сигнализацию TL1A через DR3 оценивали в анализе, в котором измеряется активация NFκB в клетках TF-1-NFκB-люцифераза в ответ на стимуляцию TL1A. На Фиг. 14А продемонстрирована конститутивная экспрессия DR3 на клетках TF-1 после культивирования в течение ночи без GM-CSF. Клетки, окрашенные антителом против DR3, конъюгированным с биотином, имели повышенную среднюю интенсивность флуоресценции, чем клетки, обработанные только вторичным детектирующим реактивом на основе стрептавидина. Биотин-TL1A также окрашивал клетки, тогда как ни антитело против DR3, конъюгированное с биотином, ни биотин-TL1A не окрашивали несколько других DR3-негативных клеток, демонстрируя специфичность окрашивания (не показано).
Способность TL1A активировать транскрипцию генов, регулируемую NFκB, оценивали в клетках TF-1-NFκB-люцифераза, стимулированных TL1A. Зависимое от дозы растворимого рекомбинантного человеческого TL1A увеличение активности NFκB проиллюстрировано на Фиг. 14Б для репрезентативного эксперимента. TL1A стимулировал активность NFκB в клетках TF-1-NFκB-люцифераза со средним значением EC50 149 плюс/минус 38 пМ (n равно 8). В данном анализе относительные световые единицы (RLU) увеличивались в 10-15 раз по сравнению с фоном при насыщающих концентрациях TL1A. Зависимое от дозы 1D1 1.31 ингибирование активации NFκB посредством 150 пМ TL1A в клетках TF-1-NFκB-люцифераза показано для репрезентативного эксперимента на Фиг. 14 В. 1D1 1.31 ингибировало активацию NFκB посредством TL1A со средним значением IC50 95 плюс/минус 5,5 пМ (n равно 4). Данные значения функциональной эффективности согласуются с аффинностью связывания 1D1 1.31 в отношении TL1A. Кроме того, аналогичные значения эффективности были рассчитаны в других функциональных исследованиях, измеряющих ингибирование активации каспазной активности в TF-1 (см. Пример 12) или продукцию IFNγ (интерферон-гамма) в ответ на стимуляцию IC, IL-12 (интерлейкин-12) и IL-18 в человеческой цельной крови (см. Пример 13).
Изотипическое контрольное антитело не имело ингибирующего эффекта в данном анализе, как показано на Фиг. 14Г и Фиг. 14Д. На Фиг. 14Г проиллюстрированы результаты для репрезентативного эксперимента. Среднее значение EC50 для стимуляции активности NFκB посредством TL1A в отсутствие изотипического контрольного антитела составляло 103 плюс/минус 27 пМ (n равно 4) и в присутствии изотипического контрольного антитела составляло 110 плюс/минус 18 пМ (n равно 4). Кроме того, эксперимент по ответу на дозу изотипического контрольного антитела с использованием вплоть до 30 нМ TL1A не вызывал ингибирования (проиллюстрировано на Фиг. 14Д). Данные эксперименты показали, что отсутствовало ингибирование, приписываемое изотипическому антителу.
Описанные исследования демонстрируют способность 1D1 1.31 потенциально блокировать последующую сигнализацию от взаимодействия TL1A/DR3, приводящую к активации NFκB в клетках TF-1-NFκB-люцифераза. Данные эксперименты показывают, что 1D1 1.31 является мощным антагонистом сигнализации TL1A/DR3.
Пример 12: ингибирование ответа в виде активации каспазы посредством антител против TL1A
TL1A активирует путь NFκB в клетках TF-1, но также способен индуцировать апоптоз путем активирования каспазного пути при ингибировании пути NFκB ингибиторами синтеза белка, такими как циклогексимид. Целью данного исследования была оценка нейтрализующей активности и эффективности антитела против TL1A 1D1 1.31 в анализе активации каспазы в клетках TF-1 в ответ на стимуляцию растворимым рекомбинантным человеческим TL1A (rsTL1A).
Клетки TF-1 происходили из линии клеток человеческой гематопоэтической эритробластомы, полученной из ATCC. Для долговременного роста клеток TF-1 требуется либо IL-13, либо гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Клетки выращивали в RPMI 1640, содержащей 10% инактивированной нагреванием фетальной телячей сыворотки (FBS), 10 мМ HEPES, 1 мМ пируват натрия и 2 нг/мл рекомбинантного человеческого GM-CSF.
Экспрессия DR3 в клетках TF-1
Конститутивная экспрессия DR3 на клетках TF-1 была продемонстрирована окрашиванием имеющимся в продаже биотинилированным антителом против DR3 (eBiosciences, Сан-Диего, Калифорния). Клетки выращивали в течение ночи без GM-CSF, как описано ниже, для анализа активации каспазы, индуцированной TL1A. Клетки отбирали и ресуспендировали в буфере для окрашивания BD Pharmingen® (FBS; BD Biosciences, Сан-Хосе, Калифорния) в концентрации 1×106 клеток/мл и инкубировали на льду в течение 15 минут с 10 мкг/мл антитела против DR3. После инкубации клетки промывали 3 мл буфера для окрашивания, центрифугировали при 800 g и ресуспендировали в концентрации 1×0106 клеток/мл в том же самом буфере с фикоэритрин (PE)-стрептавидином, с разведением флуоресцентно меченого стрептавидина 1:1000. После инкубации клетки промывали, центрифугировали и ресуспендировали в буфере для окрашивания в концентрации 1×106 клеток/мл. Экспрессию DR3 проверяли посредством анализа проточной цитометрией на установке BD LSRFortessa™. Экспрессия DR3 демонстрируется по увеличению средней интенсивости флуоресценции (MFI) по сравнению с контролем стрептавидин-РЕ.
Активация каспазы в клетках TF-1 посредством растворимого рекомбинантного TL1A
Для определения способности rsTL1A активировать апоптозный путь оценивали активацию каспазы в ответ на экзогенный rsTL1A в клетках TF-1, обработанных циклогексимидом (СНХ) для ингибирования сигнализации в направлении пути NFκB и обеспечения активации каспазы и апоптозного пути. В течение суток до эксперимента клетки TF-1 культивировали при плотности клеток 0,3×106 клеток/мл в культуральных средах для TF-1, содержащих 2 нг/мл GM-CSF. Отдельно в 96-луночных планшетах (плоское дно для планшетов для измерения люминисценции) в тройной повторности готовили растворы, содержащие 2× каждой из конечных концентраций rsTL1A и СНХ (2 нМ конечная концентрация) в 50 мкл сред для TF-1 без GM-CSF. 12 концентраций rsTL1A титровали в сторону уменьшения 2-кратными разведениями, начиная с 3986 пМ (3986; 1984; 992; 496; 248; 124; 62; 31; 15,5; 7,75; 3,88 и 1,94 пМ). На следующие сутки планшеты предварительно нагревали при 37°C в течение 30 минут, клетки собирали, один раз промывали в фосфатно-солевом буферном растворе (PBS), ресуспендировали в концентрации 0,6×106 клеток/мл в средах для TF-1 без GM-CSF, и 30000 клеток в 50 мкл клеточной суспензии добавляли в 50 мкл предварительно нагретых растворов TL1A/CHX и инкубировали в течение 6 часов при 37°C. Добавляли сто (100) мкл набора Caspase-Glo® 3/7 (Promega, Madison, WI) и инкубировали при комнатной температуре в течение 15 минут. Планшеты считывали на люминометре EnVision™ (1 секунда/лунку; PerkinElmer, Waltham, MA). Ранние стадии апоптоза включают активацию каспаз, включая каспазу-3 и -7. Анализ Caspase-Glo® 3/7 представляет собой гомогенный люминисцентный анализ, в котором измеряются активности каспазы-3 и -7 в очищенных ферментативных препаратах или культурах прикрепленных или находящихся в суспензии клеток. В данном анализе предоставлен люминогенный селективный субстрат каспазы-3/7, который содержит тетрапептидную последовательность DEVD (SEQ ID NO: 395) (последовательность распознавания). Данный субстрат расщепляется с высвобождением аминолюциферина - субстрата люциферазы, используемого в образовании свечения. Реактив Caspase-Glo® 3/7 оптимизирован для каспазной активности, люциферазной активности и лизиса клеток. Добавление реактива Caspase-Glo® 3/7 в формате «добавь смесь и измеряй» приводит к лизису клеток, с последующим расщеплением субстрата каспазой и генерацией люминисцентного сигнала «светящего типа». Данный анализ основан на свойствах патентованной термостабильной люциферазы (Ultra-Glo Luciferase®, Promega), приготовленной так, чтобы генерировать стабильный сигнал в широком интервале условий анализа. Люминисценция пропорциональна присутствующему количеству каспазной активности.
Ингибирование антителом 1D1 1.31 активации каспазы посредством растворимого рекомбинантного TL1A в клетках TF-1
Ингибирование антителом 1D1 1.31 активации каспазы оценивали в клетках TF-1 в присутствии СНХ. Вкратце, в течение суток до эксперимента клетки TF-1 культивировали в концентрации 0,3×106 клеток/мл в культуральных средах для TF-1, содержащих 2 нг/мл GM-CSF. Отдельно растворы, содержащие 2х каждой из конечных концентраций антитела, СНХ (20 мкг/мл или 2 нМ конечная концентрация) и rsTL1A (5,5 нг/мл или 87 пМ конечная концентрация) в 50 мкл сред для TF-1 (без GM-CSF), получали в тройной повторности в 96-луночном планшете. Планшеты затем запечатывали алюминиевой фольгой и помещали на ночь при 4°C до достижения равновесия. 10 или 12 точек концентрации антитела титровали в сторону уменьшения 2-и/или 3-кратными разведениями, начиная с 1, 2 или 3 нМ, в зависимости от эксперимента. Для репрезентативного эксперимента на Фиг. 15Б концентрации составляли 3000; 1000; 333; 185; 103; 57; 31,8; 17,6; 4,1 и 0,5 пМ. rsTL1A (87 пМ) рассчитывали как среднюю концентрацию, которая дает полумаксимальный ответ (EC50), в предыдущих экспериментах по ответу в виде активации каспазы, в зависимости от дозы rsTL1A (n равно 3), как было описано выше. На следующие сутки планшеты предварительно нагревали при 37°C в течение 30 минут, клетки собирали, один раз промывали в PBS, ресуспендировали в концентрации 0,6×106 клеток/мл в средах для TF-1 с GM-CSF, и 30000 клеток в 50 мкл клеточной суспензии добавляли в 50 мкл предварительно нагретых растворов антитело/TL1A/CHX и инкубировали в течение 6 часов при 37°C. Добавляли сто (100) мкл набора Caspase-Glo® 3/7 (Promega) и инкубировали при комнатной температуре в течение 15 минут. Планшеты считывали на люминометре (EnVision, 1 секунда/лунку). Параллельно с экспериментами по ответу на ингибирующую дозу 1D1 1.31 проводили эксперимент по ответу на дозу rsTL1A для расчета EC50 для каждого конкретного эксперимента и для подтверждения приблизительного процента максимального ответа, соответствующего 87 пМ - концентрации, используемой для оценки ингибирующей эффективности антитела.
Определения ЕС50 и IC50
Средние значения единиц относительной люминисценции (RLU) откладывали на графике против log концентраций TL1A или 1D1 1.31. Получали кривые активации TL1A или кривые ингибирования антителом, откладывая на графике значения люминисценции относительно log концентраций TL1A и антитела соответственно. Из данных графиков определяли значения EC50 (для TL1A) или IC50 (для 1D1 1.31) с использованием аппроксимирующих кривых нелинейной регрессии GraphPad Prism® (версия 5.02, GraphPad Software, Inc., Сан-Диего, Калифорния) и сигмоидной модели ответа в зависимости от log дозы агониста или антагониста (Уравнение 1 для агониста -TL1A и Уравнение 2 для антагониста - 1D1 1.31).
Уравнение 1:
Log(агонист) относительно ответа (три параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧(LogEC50-X))
Уравнение 2:
Log(ингибитор) относительно ответа-переменный наклон (четыре параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧(LogIC50-Х)*наклон),
где Y представляет собой значение люминисценции, и X представляет собой концентрацию агониста - TL1A (Уравнение 1) или антагониста - 1D1 1.31 (Уравнение 2), наибольшее значение представляет собой максимальное значение Y, соответствующее верхнему плато сигмоидной кривой, наименьшее значение представляет собой минимальное значение Y, соответствующее нижнему плато сигмоидной кривой, и LogEC50 или LogIC50 представляют собой log концентрации агониста и антагониста соответственно в точке перегиба, находящейся посередине между максимумом и минимумом. Значения ЕС50 или IC50 были обобщены по всем экспериментам с использованием средних значений и стандартных отклонений (STDEV).
Эффективность и способность 1D1 1.31 ингибировать сигнализацию TL1A через DR3 оценивали в анализе, в котором измеряется активация каспазы в клетках TF-1 в ответ на стимуляцию TL1A. DR3 конститутивно экспрессировался на клетках TF-1 во время проведения эксперимента по активации каспаз после культивирования в течение ночи без GM-CSF. Клетки, обработанные антителом против DR3, конъюгированным с биотином, имели повышенную среднюю интенсивность флуоресценции, чем клетки, обработанные только вторичным детектирующим реактивом на основе стрептавидина. Биотин-ТНА также окрашивал клетки, тогда как ни антитело против DR3, конъюгированное с биотином, ни биотин-TL1A не окрашивали несколько других DRS-негативных клеток, демонстрируя специфичность окрашивания (не показано).
Индуцированную TL1A активацию каспазы оценивали в клетках TF-1 в присутствии СНХ для блокирования сигнализации через путь NFκB и, следовательно, отклонения последующего механизма сигнализации от рецептора к апоптозному пути через активацию каспазы. Зависимое от дозы увеличение каспазной активности посредством растворимого рекомбинантного TL1A (rsTL1A) проиллюстрировано из репрезентативного эксперимента на Фиг. 15А. TL1A стимулировал каспазную активность в клетках TF-1 со средним значением EC50 90 плюс/минус 7 пМ (n равно 3). В данном анализе RLU возрастали в 3-5 раз по сравнению с фоном при насыщающих концентрациях TL1A. Зависимое от дозы 1D1 1.31 ингибирование активации каспазы посредством 87 пМ TL1A в клетках TF-1 показано из репрезентативного эксперимента на Фиг. 15Б. 1D1 1.31 ингибировало TL1A-зависимое увеличение каспазной активности со средним значением IC50 69 плюс/минус 15 пМ (n равно 3). Данные значения функциональной эффективности согласуются с аффинностью связывания 1D1 1.31 в отношении TL1A. Кроме того, аналогичные значения эффективности рассчитывали в других функциональных исследованиях, измеряющих ингибирование активации NFκB в клетках TF-1 или продукции IFNγ в ответ на стимуляцию иммунным комплексом (IC), IL-12 и IL-18 в человеческой цельной крови.
Данные исследования демонстрируют способность 1D1 1.31 потенциально блокировать последующую сигнализацию от взаимодействия TL1A/DR3, приводящую к активации каспазы и апоптозу в клетках TF-1, обработанных СНХ. Данные исследования показывают, что 1D1 1.31 является мощным антагонистом сигнализации TL1A/DR3.
Пример 13: ингибирование и истощение цитокинов посредством антител против TL1A в цельной человеческой крови
Целью данного исследования была оценка нейтрализующей активности и эффективности антитела 1D1 1.31 против TL1A в анализе на человеческой периферической крови, в котором измеряется секреция цитокинов при условиях повышающей регуляции и активации экспрессируемых на мембране эндогенных TL1A и DR3. В данном анализе экспрессия мембраносвязанной формы TL1A обеспечивает оценку ингибирования обеих форм TL1A - ассоциированной с клеткой и растворимой формы, а также покрытия мишени - растворимого TL1A в физиологически релевантной системе ex vivo человеческой цельной крови.
Для стимуляции человеческой крови иммунным комплексом (IC) планшеты с IC готовили за сутки до эксперимента. Девяносто шести-луночные (96) плоскодонные планшеты для культуры ткани покрывали 50 мкл на лунку 0,5 мг/мл или 0,25 мг/мл человеческого иммуноглобулина G (hIgG) в фосфатно-солевом буферном растворе (PBS) и выдерживали при 4°C в течение ночи. На следующее утро планшеты три раза промывали 150 мкл PBS на лунку. После удаления PBS добавляли 50 мкл на лунку 0,02 мг/мл или 0,08 мг/мл мышиного антитела против человеческого IgG в PBS, и планшеты инкубировали при 37°C в течение 1 часа. Планшеты затем три раза промывали 150 мкл PBS на лунку перед использованием.
Для стимуляции человеческой цельной крови IC, IL-12 и IL-18 приблизительно 10 мл крови от здоровых доноров отбирали в пробирки, покрытые Na гепарином. Образцы крови обычно доставляли при комнатной температуре в пределах одного часа после отбора крови. IL-12 (0,5 нг/мл конечной концентрации) и IL-18 (5 нг/мл конечной концентрации) смешивали с кровью до добавления 190 мкл смеси крови/IL-12/IL-18 в каждую лунку планшетов, покрытых IC. Для оценки ингибирующей эффективности 1D1 1.31 получали кривые доза-ответ с 12 концентрациями путем добавления 10 мкл на лунку 20× конечной концентрации 1D1 1.31 (или изотипического контрольного антитела) в 0,1% бычьем сывороточном альбумине (бычий сывороточный альбумин) в PBS. Концентрации 1D1 1.31 (или изотипического контрольного антитела) составляли 30000; 10000; 3333,33; 1111,11; 370,37; 123,45; 12,34; 1,234; 0,1234; 0,01234; 0,001234 и 0,0001 пМ; и 30000; 10000; 3333,3; 1111,11; 370,37; 37,037; 3,7037; 0,3704; 0,037; 0,002; 9Е-05 и 4.6Е-06 пМ. Все условия воспроизводили в тройной повторности, но контроли (без антитела) повторяли в 10-12 лунках; контроли без стимуляции или с одной стимуляцией (только IC или только IL-12/IL-18) также включали в тройной повторности или с большим числом повторностей. После 24 часов культуры при 37°C добавляли 100 мкл 5%-ного бычьего сывороточного альбумина в PBS и хорошо смешивали с 200 мкл культур крови для разведения плазмы (коэффициент разведения: 1,5). После центрифугирования планшетов при 930 g (2000 об./мин) в течение 15 минут отбирали сто пятьдесят (150) мкл на лунку разведенной плазмы и дополнительно разводили в 4 раза в 5%-ном бычьем сывороточном альбумине в PBS для количественного измерения IFNγ и формы TL1A, не содержащей 1D1 1.31, с использованием анализов связывания на основе лиганда MSD (Mesoscale Discovery, Rockville, MD). IFNγ измеряли с использованием набора для человеческого IFNγ от MSD (кат. № K151AEB-1), следуя инструкциям изготовителя. Для измерения sTL1A в PGRD разрабатывали два анализа: анализ, в котором измеряется только антитело, не связанное с STL1A, и другой анализ, в котором измеряется общий sTL1A (связанный и не связанный с антителом). Вкратце, для измерения sTL1A, не содержащего 1D1 1.31, пустые планшеты от MSD (MSD, каталожный №L15XA-6) покрывали 30 мкл на лунку 2 мкг/мл антитела против TL1A, клон №26B11, в PBS при 4°C в течение ночи. На следующие сутки планшеты три раза промывали 150 мкл на лунку 0,1% Tween 20 в PBS, с последующими 150 мкл на лунку блокирующего раствора (5%-й бычий сывороточный альбумин в PBS), затем планшеты инкубировали при комнатной температуре в течение 1 часа с круговым встряхиванием (1500 об./мин). После промывки планшетов, как упомянуто выше, добавляли образцы разбавленной плазмы и инкубировали при 4°C в течение ночи. На следующие сутки после промывки планшетов добавляли 0,25 мкг/мл выявляющего Ab, меченного сульфо-меткой (антитело против TL1A, клон №1D1-VH-37, от MSD (1D1 D37); 30 мкл на лунку; меченое согласно инструкциям изготовителя), и инкубировали при комнатной температуре в течение 2 часов с круговым встряхиванием (1500 об./мин), с последующим таким же протоколом промывки, который упомянут выше. Стандартные кривые TL1A получали с использованием растворимого рекомбинантного человеческого TL1A. Планшеты считывали, следуя методике изготовителя, стандартную кривую и концентрацию цитокина в плазме рассчитывали с использованием программы MSD. Для выявления общего TL1A (растворимый TL1A, не содержащий 1D1 1.31, и связанный с 1D1 1.31) использовали аналогичный протокол, но с применением неконкурирующих антител как для захвата, так и для выявления.
Кривые доза-ответ ингибирования антителом 1D1 1.31 получали путем откладывания на графике концентраций либо IFNγ, либо растворимого TL1A в пг/мл плазмы относительно log концентраций антитела. Значения IC50 1D1 1.31 определяли из данных графиков с использованием аппроксимирующих кривых нелинейной регрессии GraphPad Prism® (версия 5.02, GraphPad Software, Inc, Сан-Диего, Калифорния) и сигмоидной модели ответа в зависимости от log дозы антагониста (переменный наклон, четыре параметра) (Уравнение 1).
Уравнение 1:
Log(ингибитор) относительно ответа-переменный наклон (четыре параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧((LogIC50-X)*наклон)),
где Y представляет собой концентрацию цитокина, и X представляет собой концентрацию антагониста - 1D1 1.31 (Уравнение 1), наибольшее значение представляет собой максимальное значение Y, соответствующее верхнему плато сигмоидной кривой, наименьшее значение представляет собой минимальное значение Y, соответствующее нижнему плато сигмоидной кривой, и LogIC50 представляют собой log концентрации антагониста соответственно в точке перегиба, находящейся посередине между максимумом и минимумом. Значения IC50 были обобщены по всем экспериментам с использованием средних значений и стандартных отклонений (STDEV).
Эффективность и способность 1D1 1.31 ингибировать активацию эндогенного TL1A первичных клеток, экспрессирующих DR3, в человеческой цельной крови оценивали в анализе, в котором измеряется высвобождение IFNγ в ответ на стимуляцию IC (который повышает экспрессию TL1A на моноцитах) и IL-12 и IL-18 (которые повышают экспрессию CD3 на клетках NK (естественная клетка-киллер) и NKT (естественная T-клетка-киллер). Из-за отсутствия конститутивной экспрессии TL1A и DR3 на лейкоцитах периферической крови и для того, чтобы измерить активацию ниже DR3 (как, например, секрецию IFNγ) при вовлечении эндогенного TL1A, требуется повышающая регуляция экспрессии TL1A на моноцитах и DR3 на отвечающих NK или NKT. Оптимальные стимулирующие условия были получены из предыдущих экспериментов, демонстрирующих кинетику повышающей регуляции TL1A на моноцитах посредством стимуляции IC и повышающей регуляции DR3 на клетках NK и NKT посредством комбинации цитокинов IL-12 и IL-18. Условия одиночной стимуляции (например только IC или только IL-12/IL-18) показали то, что стимуляция IC является достаточной для достигаемых уровней повышающей регуляции TL1A, и что один IL-12/IL-18 является достаточным для повышающей регуляции DR3. Однако вероятно, что оба стимула имеют синергический эффект для оптимального функционального ответа, превышающий их эффекты на повышающую регуляцию экспрессии. Условия также оптимизировали для продукции цитокинов и зависимости данной продукции от TL1A. Средние концентрации IFNγ после стимуляции IC, IL-12 и IL-18 составляли 4089 плюс/минус 2908 пг/мл (интервал 289-8946 пг/мл; в среднем 537-кратная индукция по сравнению с нестимулированной кровью; n равно 14; 8 уникальных доноров). Зависимое от дозы 1D1 1.31 ингибирование продукции IFNγ цельной кровью, стимулированной IC, IL-12 и IL-18, показано для репрезентативного эксперимента на Фиг. 16А. При наивысших насыщающих концентрациях 1D1 1.31 ингибирование достигало максимума без достижения полного ингибирования и свидетельствуя о частичном ингибировании ответа. Это не удивительно, принимая во внимание то, что многие провоспалительные пути приводят к продукции воспалительных цитокинов, и что используемые стимулирующие условия не являются специфичными для пути TL1A/DR3 и вероятно активируют другие пути, помимо пути TL1A/DR3. Измеренному ответу IFNγ вероятно содействовали TL1A-зависимые и независимые пути. Тем не менее, при этих условиях путь TL1A, по-видимому, является главным содействующим в отношении данного ответа, так как среднее максимальное ингибирование секреции IFNγ посредством 1D1 1.31 в данной системе составляло 62% плюс/минус 10%, n равно 14; 8 уникальных доноров; интервал 38-77%, свидетельствуя о том, что TL1A-зависимый ответ объясняет в среднем приблизительно две трети ответа, и что TL1A-независимые механизмы также способствуют общей продукции IFNγ в данной системе анализа. Эффективность 1D1 1.31 определяли путем расчета IC50 для TL1A-зависимого ответа. 1D1 1.31 ингибирует секрецию IFNγ, индуцированную эндогенным TL1A, повышающая регуляция которого в цельной крови осуществляется посредством IC, с IC50 277 плюс/минус 125 пМ (n равно 11; 8 уникальных доноров).
В том же самом анализе человеческой периферической крови, в котором 1D1 1.31 оценивали на подавление им уровней IFNγ в ответ на стимуляцию IC, IL-12 и IL-18, 1D1 1.31 также оценивали на его эффект на уровни STL1A в плазме. Стимуляция цельной человеческой крови IC и IL-12/IL-18 приводила к повышениям эндогенного растворимого TL1A до средних значений 940 плюс/минус 293 пг/мл (Фиг. 16Б; интервал 535-1409 пг/мл; в среднем 50-кратная индукция по сравнению с нестимулированной кровью; n равно 8, 5 уникальных доноров). Данные увеличения STL1A в 24 часа вероятно отражают протеолитическое расщепление из TL1A моноцитарной мембраны, который, как было показано, максимально и временно экспрессируется на моноцитах при стимуляции IC в более ранние моменты времени. Связывание 1D1 1.31 с растворимым TL1A измеряли по дозозависимому и полному истощению растворимого TL1A, не содержащего 1D1 1.31. 1D1 1.31 истощает растворимый TL1A, не содержащий антитело, со средним значением IC50 1,06 плюс/минус 1,68 пМ (n равно 8; 5 уникальных доноров). Присутствие sTL1A подтверждали посредством измерения общего sTL1A (которое также могло выявлять TL1A, связанный с антителом). Ингибирование продукции IFNγ начиналось при концентрациях 1D1 1.31, при которых истощение растворимого TL1A, не содержащего антитело, составляло 90% или более. Различие значений IC50 для истощения sTL1A, не содержащего антитело, и для ингибирования IFNγ свидетельствует о том, что связанная с мембраной активность TL1A возможно опосредует продукцию IFNγ путем опосредования взаимодействий клетки с клеткой. В самом деле, ранние эксперименты по разработке анализа продемонстрировали то, что добавление плазмы, содержащей аналогично высокие концентрации эндогенного растворимого TL1A, в кровь, стимулированную IL-12/IL-18, не было таким эффективным в усилении продукции IFNγ, как стимуляция повышающей регуляции TL1A на моноцитах посредством IC.
Раскрытые здесь данные демонстрируют то, что 1D1 1.31 является мощным ингибитором активности эндогенной мембранной и растворимой формы TL1A в человеческой периферической крови. 1D1 1.31 ингибирует секрецию IFNγ после повышающей регуляции и активации TL1A на моноцитах и DR3 на эффекторных клетках человеческой периферической крови посредством стимуляции IC, IL-12 и IL-18 со средним значением IC50 277 плюс/минус 125 пМ.
Пример 14: ингибирование продукции IFNγ и истощение растворимого TL1A, не содержащего антитело, в ответ на стимуляцию цельной крови яванского макака иммунным комплексом и IL-12/IL-18
Целью данного исследования была оценка нейтрализующей активности и эффективности антитела 1D1 1.31 против TL1A в анализе на периферической крови яванского макака, в котором измеряется секреция цитокинов при условиях повышающей регуляции и активации экспрессируемых на мембране эндогенных TL1A и DR3. В данном анализе экспрессия мебраносвязанной формы TL1A обеспечивает оценку ингибирования обеих форм TL1A - ассоциированной с клеткой и растворимой формы, а также покрытия мишени - растворимого TL1A в физиологически релевантной системе цельной крови яванского макака ex vivo.
Антитело 1D1 1.31, используемое в данных экспериментах, продуцировали в клетках CHO. Изотипическое контрольное антитело представляло собой антитело, которое также представляет собой антитело - человеческий IgG1, содержащее те же самые три нуль-мутации эффекторной функции, что и 1D1 1.31. Растворимый рекомбинантный TL1A яванского макака (rsTL1A яванского макака) (Leu72-Leu251, см. SEQ ID NO: 259) продуцировали с использованием стандартных протоколов, известных в данной области.
Для стимуляции иммунным комплексом (IC) крови яванского макака готовили планшеты с IC в сутки эксперимента. Девяносто шести-луночные (96) плоскодонные планшеты для культуры ткани покрывали 50 мкл на лунку 1 мг/мг человеческого иммуноглобулина G (hIgG) в фосфатно-солевом буферном растворе (PBS) и инкубировали при 37°C в течение 1 часа. Лунки затем три раза промывали 150 мкл PBS на лунку. После удаления PBS добавляли 50 мкл на лунку 0,04 мг/мл мышиного антитела против человеческого IgG в PBS, и инкубировали планшеты при 37°C в течение 1 часа. Планшеты затем промывали до применения три раза 150 мкл PBS на лунку.
Для стимуляции IC, IL-12 и IL-18 кровь яванского макака отбирали в пробирки, покрытые натрий гепарином, и использовали в пределах одного часа после отбора крови. Человеческий IL-12 (конечная концентрация 1 нг/мл) и человеческий IL-18 (конечная концентрация 10 нг/мл) смешивали с кровью перед добавлением в каждую лунку планшетов, покрытых IC, 95 мкл крови/IL-12/IL-18. Для оценки ингибирующей эффективности 1D1 1.31, получали кривые доза-ответ с 12 концентрациями путем добавления 5 мкл на лунку 20х конечной концентрации 1D1 1.31 (или изотипического контрольного антитела) в 0,1%-м бычьем сывороточном альбумине (бычий сывороточный альбумин) в PBS. Концентрации 1D1 1.31 (или изотипического контрольного антитела) для некоторых наборов экспериментов составляли 100000; 33333; 11111; 3703,7; 1234,5; 411,5; 137,17; 13,717; 1,3717; 0,13717; 0,0137 и 0,00137 пМ, и для других наборов экспериментов - 100000; 20000; 4000; 800; 160; 32; 6,4; 0,64; 0,064; 0,0064; 0,00064 и 0,000064 пМ. Все эксперименты проводили в тройной повторности. Контроли включали стимуляцию без антитела, а также контроли без стимуляции или с одиночной стимуляцией (только IC или только IL-12/IL-18) в тройной повторности. После 24 часов культуры при 37°C добавляли 200 мкл 5%-го бычьего сывороточного альбумина в PBS и хорошо смешивали со 100 мкл культур крови для разведения плазмы (коэффициент разведения: 3). После центрифугирования планшетов при 930 g (2000 об./мин) в течение 15 минут отбирали сто пятьдесят (150) мкл на лунку разведенной плазмы и немедленно тестировали для количественного измерения IFNγ и формы TL1A, не содержащей 1D1 1.31, с использованием анализов связывания лиганда на основе MSD (Mesoscale Discovery, Rockville, MD). IFNγ измеряли с использованием набора для человеческого IFNγ от MSD (каталожный №К151АЕВ-1), следуя инструкциям изготовителя. Вкратце, для измерения sTL1A, не содержащего 1D1 1.31, пустые планшеты от MSD (MSD, каталожный №L15XA-6) покрывали 30 мкл на лунку 4 мкг/мл в PBS антитела против TL1A, клон №26B11, при 4°C в течение ночи. На следующие сутки планшеты три раза промывали 150 мкл на лунку 0,1% Tween 20 в PBS, с последующими 150 мкл на лунку блокирующего раствора (5%-ный бычий сывороточный альбумин в PBS), затем планшеты инкубировали при комнатной температуре в течение 1 часа с круговым встряхиванием (1500 об./мин). После промывки планшетов, как упомянуто выше, добавляли 40 мкл образцов плазмы и инкубировали при 4°C в течение 2 часов, с последующими такими же промывками три раза и добавляли 1 мкг/мл выявляющего Ab, меченного сульфо-меткой (антитело против TL1A от MSD, клон №1D1 1.31; 30 мкл на лунку; меченое согласно инструкциям изготовителя). Планшеты инкубировали при комнатной температуре в течение 2 часов с круговым встряхиванием (1500 об./мин), с последующим таким же протоколом промывки планшетов, который упомянут выше. Стандартные кривые TL1A получали с использованием растворимого рекомбинантного TL1A яванского макака. Планшеты считывали, следуя методике изготовителя, стандартную кривую и концентрацию цитокина в плазме рассчитывали с использованием программы MSD согласно инструкциям изготовителя.
Определения IC50
Кривые доза-ответ ингибирования 1D1 1.31 получали путем откладывания на графике концентраций либо IFNγ, либо растворимого TL1A в пг/мл плазмы относительно log концентраций антитела. Значения IC50 1D1 1.31 определяли из данных графиков с использованием аппроксимирующих кривых нелинейной регрессии GraphPad Prism® (версия 5.02, GraphPad Software, Inc, Сан-Диего, Калифорния) и модели сигмоидного ответа в зависимости от log дозы антагониста (переменный наклон, четыре параметра) (Уравнение 1).
Уравнение 1:
Log(ингибитор) относительно ответа-переменный наклон (четыре параметра)
Y равно наименьшее значение плюс (наибольшее значение минус наименьшее значение) деленное на (1+10∧((LogIC50-X)*наклон)),
где Y представляет собой концентрацию цитокина, и X представляет собой концентрацию антагониста - 1D1 1.31 (Уравнение 1), наибольшее значение представляет собой максимальное значение Y, соответствующее верхнему плато сигмоидной кривой, наименьшее значение представляет собой минимальное значение Y, соответствующее нижнему плато сигмоидной кривой, и LogIC50 представляют собой log концентрации антагониста в точке перегиба, находящейся посередине между максимумом и минимумом. Значения IC50 были обобщены по всем экспериментам с использованием средних значений и стандартных отклонений (STDEV).
Ингибирование продукции IFN гамма посредством 1D1 1.31 в цельной крови, активированной иммунным комплексом и IL-12/IL-18
Способность 1D1 1.31 ингибировать эндогенную активацию посредством TL1A первичных клеток, экспрессирующих DR3, в цельной крови яванского макака оценивали в анализе, в котором измеряется высвобождение IFNγ в ответ на стимуляцию IC (который осуществляет повышающую регуляцию экспрессии TL1A на моноцитах) и IL-12 и IL-18 (которые осуществляют повышающую регуляцию экспрессии CD3 на клетках NK и NKT). Экспериментальные условия были адаптированы из анализа, разработанного на человеческой цельной крови и дополнительно оптимизированы для продукции цитокинов в крови яванского макака. Средние концентрации IFNγ после стимуляции IC, IL-12 и IL-18 составляли 222 плюс/минус 220 пг/мл (интервал 99-667 пг/мл; в среднем 222-кратная индукция по сравнению с нестимулированной кровью; n равно 6 обезьян). Данная продукция IFNγ меньше, чем в человеческой крови (4089 плюс/минус 2908 пг/мл), возможно из-за того факта, что для активации пути использовали человеческий IL-12 и IL-18 (вместо IL-12 и IL-18 яванского макака). Тем не менее, стимуляция посредством IC приводила к аналогичным уровням продукции sTL1A, что и в человеческой крови, и система подходила для оценки фармакологической активности тестируемого соединения. Дозозависимое ингибирование посредством 1D1 1.31 продукции IFNγ клетками цельной крови обезьяны, стимулированными IC, IL-12 и IL-18, показано для репрезентативного эксперимента на Фиг. 17А. При наивысших насыщающих концентрациях 1D1 1.31 ингибирование достигало плато максимального ингибирования без достижения полного ингибирования, свидетельствуя о частичном ингибировании ответа. Это не удивительно, принимая во внимание то, что используемые стимулирующие условия не являются специфичными для пути TL1A/DR3 и вероятно также активируют другие пути, которые могут приводить к продукции воспалительных цитокинов. Следовательно, измеренному ответу IFNγ вероятно содействуют зависимые и независимые от TL1A пути. Тем не менее, при данных условиях путь TL1A, по-видимому, оказывает главный вклад в ответ, поскольку среднее максимальное ингибирование секреции IFNγ посредством 1D1 1.31 в данной системе составляло 71% плюс/минус 21% (n равно 6 разных обезьян; интервал составляет 50-99%), свидетельствуя о том, что TL1A-зависимый ответ объясняет в среднем приблизительно две третьих ответа. Данные результаты также были аналогичными в человеческой системе (среднее максимальное ингибирование составляло 62% плюс/минус 10%). Эффективность 1D1 1.31 определяли посредством расчета IC50 для ответа, опосредованного TL1A. 1D1 1.31 ингибирует секрецию IFNγ, вызванную повышающей регуляцией эндогенного TL1A в цельной крови обезьяны посредством IC, с IC50 36 плюс/минус 42 пМ (n равно 6 обезьян; интервал - 6-119 пМ). Данные результаты показывают то, что ингибирующая эффективность 1D1 1.31 в отношении пути TL1A/DR3 яванского макака является аналогичной или большей, чем его эффективность в ингибировании человеческого пути (IC50 277 плюс/минус 125 пМ). В данном анализе не было дозозависимого ингибирования посредством изотипического контрольного антитела.
Уровни растворимого TL1A в цельной крови, активированной иммунным комплексом и IL-12/IL-18 и обработанной 1D1 1.31
В том же самом анализе на человеческой периферической крови, в котором 1D1 1.31 оценивали на подавление им уровней IFNγ в ответ на стимуляцию IC, IL-12 и IL-18, 1D1 1.31 также оценивали на его эффект на уровни sTL1A в плазме. Стимуляция цельной крови обезьяны IC и IL-12/IL-18 приводила к увеличениям эндогенного растворимого TL1A до средних значений 1519 плюс/минус 686 пг/мл (Фиг. 17Б; интервал 485-2597 пг/мл; в среднем 116-кратная индукция по сравнению с нестимулированной кровью; n равно 6 обезьян). Данные значения были аналогичными значениям, измеренным в человеческой цельной крови (940 плюс/минус 293 пг/мл; 50-кратная индукция), и также аналогичными значениям 1430 плюс/минус 211 пг/мл, измеренным при стимуляции крови яванского макака одним IC (без IL-12/IL-18). Данные увеличения sTL1A в 24 часа вероятно отражают протеолитическое отщепление TL1A от моноцитарной мембраны, который, как было показано, максимально и временно экспрессируется на человеческих моноцитах в более ранние моменты времени при стимуляции IC. Связывание 1D1 1.31 с растворимым TL1A измеряли по дозозависимому уменьшению растворимого TL1A, не содержащего 1D1 1.31. 1D1 1.31 истощает растворимый TL1A, не содержащий антитело, со средним значением IC50 22 плюс/минус 35 пМ (интервал 0,114-90 пг/мл; n равно 6 обезьян). Соответствующее человеческое значение IC50 составляло 1,06 плюс/минус 1,68.
Антитело 1D1 1.31 против TL1A ингибирует секрецию IFNγ после активации пути TL1A/DR3 в периферической крови яванского макака посредством стимуляции IC, IL-12 и IL-18 со средним значением IC50 36 плюс/минус 45 пМ. Данные значения указывают на фармакологическую активность у яванского макака и являются сравнимыми с эффективностью 1D1 1.31 в человеческой периферической крови.
Пример 15: биологические анализы с использованием вариантов антитела 1D1
Вышеописанные анализ NFκB, анализ каспазы и анализ цитокина человеческой цельной крови (Примеры 11, 12 и 13) также повторяли с антителами 1D1 1.27, 1D1 1.28, 1D1 1.29, 1D1 1.30, 1D1 1.31, 1D1 1.32, 1D1 1.33 и 1D1 1.34. Результаты данных экспериментов обобщены в Таблице 19. Каждое из антител с созревшей аффинностью демонстрировало улучшенную активность по сравнению с родительским антителом 1D1.


Пример 16: картирование эпитопа TL1A, связанного с родительским антителом 1D1
В настоящем раскрытии говорят, что остатки антигена и антитела связаны водородной связью, если они включают атом - донор водородной связи (связанный с электропозитивным водородом) в одной молекуле, расположенный в пределах  от атома - акцептора водородной связи, имеющего неподеленную пару электронов в другой молекуле.
от атома - акцептора водородной связи, имеющего неподеленную пару электронов в другой молекуле.
Считают, что остатки антитела и антигена образуют солевой мостик, если они содержат положительно заряженный атом в одной молекуле в пределах  от отрицательно заряженного атома в другой молекуле.
от отрицательно заряженного атома в другой молекуле.
Исключение растворителя на остаток определяли путем расчета доступной для растворителя площади поверхности каждого остатка антитела и антигена в комплексе и ее вычитания из суммы доступных для растворителя площадей поверхности двух компонентов, рассматриваемых индивидуально.
Доступную для растворителя площадь поверхности рассчитывали согласно способу Strake and Rupley (J Mol Biol 79 (2): 351-71, 1973). Парные площади скрытой поверхности использовали для оценки индивидуальных вкладов пары остатков из антитела и антигена в общий эффект площади скрытой поверхности на энергию связывания. Поскольку площадь скрытой поверхности не является попарно разложимой, рассчитывали площадь скрытой поверхности каждого остатка в эпитопе в присутствии каждого индивидуального остатка антитела в отсутствие остальной части антитела. Данные индивидуальные вклады затем нормировали таким образом, чтобы сумма всех индивидуальных вкладов всех остатков антитела в площадь скрытой поверхности данного остатка эпитопа была равной общей площади скрытой поверхности данного остатка эпитопа из-за связывания всего антитела. Данный способ повторяли в обратном направлении для индивидуальых вкладов остатков эпитопа в площадь скрытой поверхности остатков антитела. Значение для каждой пары остатков, показанное в таблицах, представляет собой сумму двух данных расчетов для данной пары остатков.
Анализ структуры сокристалла TL1A с 1D1
На основе структур сокристаллов гомологичных членов семейства TNF с их рецепторами ожидается, что TL1A взаимодействует с его рецептором - DR3 на пересечениях между мономерами в пределах четвертичной структуры тримерного TL1A. Эпитоп антитела 1D1 охватывает данное перечечение (Фиг. 5), и, следовательно, ожидалось бы, что оно блокирует активацию рецептора путем непосредственного закрытия поверхности связывания рецептора на TL1A. Геометрия взаимодействия между вариабельным доменом 1D1 и эпитопом на TL1A является таковой, что является невероятным, чтобы одиночная димерная молекула 1D1 могла одновременно связываться с двумя эпитопами на одной тримерной молекуле TL1A.
Картирование эпитопа TL1A с 1D1
Связывание с 1D1 скрывает на TL1A площадь поверхности приблизительно  , причем вклад, составляющий
, причем вклад, составляющий  , обеспечивается одним мономером TL1A (мономером A или цепью А), и вклад, составляющий
, обеспечивается одним мономером TL1A (мономером A или цепью А), и вклад, составляющий  , обеспечивается его соседом (мономером B или цепью В). Остатки из каждого из двух мономеров, которые участвуют во взаимодействии, метят как цепь A или цепь B. Общий вклад каждого остатка в энергию связывания взаимодействия является функцией как электростатических взаимодействий, включающих водородные связи и солевые мостики, так и вандерваальсовой силы, которая связана с площадью скрытой поверхности (BSA).
, обеспечивается его соседом (мономером B или цепью В). Остатки из каждого из двух мономеров, которые участвуют во взаимодействии, метят как цепь A или цепь B. Общий вклад каждого остатка в энергию связывания взаимодействия является функцией как электростатических взаимодействий, включающих водородные связи и солевые мостики, так и вандерваальсовой силы, которая связана с площадью скрытой поверхности (BSA).
На Фиг. 18 показана площадь и на TL1A, и на 1D1, скрытая каждой парой взаимодействующих остатков. В Таблицах 20, 21, 22 и 23 обобщены данные из Фиг. 18, разделенные на области CDR тяжелой и легкой цепей.




В эпитопе имеются 3 ключевых остатка, имеющих площадь скрытой поверхности, большую чем  . Ими являются тирозин 118 (Y118) на цепи A или мономере A TL1A и глутаминовая кислота 52 (Е52) и лейцин 53 (L53) на цепи B или мономере B TL1A. Аргинин 33 на цепи B также имеет большую площадь скрытой поверхности, составляющую
. Ими являются тирозин 118 (Y118) на цепи A или мономере A TL1A и глутаминовая кислота 52 (Е52) и лейцин 53 (L53) на цепи B или мономере B TL1A. Аргинин 33 на цепи B также имеет большую площадь скрытой поверхности, составляющую  . Данные остатки определяют важные взаимодействия на обеих сторонах щели, связывающейся с рецептором.
. Данные остатки определяют важные взаимодействия на обеих сторонах щели, связывающейся с рецептором.
Имеются 9 прямых водородных связей (образованных остатками: Y118, S149, R33, Е50, Е52, А56 и Y168), 4 опосредованные водой водородные связи (М147, R33 и L55) и 1 солевой мостик (E50), наблюдаемые в кристаллической структуре комплекса TL1A-1D1. Они перечислены в Таблице 24. Введение дополнительного связывания водородными связями и взаимодействий на основе солевых мостиков было ответственным за большую часть улучшения, наблюдаемого в версиях 1D1 с оптимизированной аффинностью.

В таблице 25 обобщены остатки эпитопа TL1A, которые, при связывании с родительским антителом 1D1, либо имеют электростатические взаимодействия, либо площадь скрытой поверхности  или более.
или более.

В таблице 26, приведенной ниже, обобщены остатки TL1A, имеющие ключевые взаимодействия с антителом 1D1, а именно площадь скрытой поверхности, большую чем  , или участвующие в скрытых взаимодействиях на основе солевых мостиков.
, или участвующие в скрытых взаимодействиях на основе солевых мостиков.

Кроме того, целый ряд остатков TL1A находится в пределах  от антитела, многие из которых перекрываются с электростатическими взаимодействиями остатков, идентифицированных выше: К113, Y118, Т122, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171. Они представлены в Таблице 27 с аннотациями относительно положения остатков эпитопа на мономерах TL1A.
от антитела, многие из которых перекрываются с электростатическими взаимодействиями остатков, идентифицированных выше: К113, Y118, Т122, F148, S149, Q151, V31, V32, R33, Е50, Е52, L53, G54, L55, А56, F57, Е91, Y168, Т169, К170 и Е171. Они представлены в Таблице 27 с аннотациями относительно положения остатков эпитопа на мономерах TL1A.

Паратоп на антителе 1D1 при связывании с TL1A находится практически целиком в его тяжелой цепи. Области CDR-H1 и CDR-H2 тяжелой цепи контактируют с обеими цепями TL1A. В частности тирозин 31 и тирозин 53 тяжелой цепи 1D1 образуют обширные контакты с обоими мономерами TL1A. CDR-H3 тяжелой цепи образует обширные контакты только с одним мономером TL1A. Также имеются два значимых взаимодействия между петлей каркаса 3 1D1 и TL1A. Несмотря на образование многих меньших контактов, чем тяжелая цепь, легкая цепь 1D1 действительно участвует во взаимодействии с TL1A. Остатки паратопа антитела 1D1 перечислены в Таблице 28.

Пример 17: картирование связывания эпитопа TL1A антителом 1D1 1.31
Анализ структуры сокристалла TL1A c 1.31
Также определяли кристаллическую структуру комплекса TL1A с антителом 1D1 1.31. Способ связывания 1D1 1.31 является по существу таким же, что и способ связывания его родительского антитела. Имеются три отличия последовательности между 1D1 и 1D1 1.31. Замена от серина на аспарагиновую кислоту в остатке 28 тяжелой цепи была предложена вышеописанным компьютерным анализом кристаллической структуры комплекса 1D1:TL1A. Гидроксил серина в комплексе 1D1 не имеет подходящих партнеров для образования водородной связи (Фиг. 11). Замена на аспарагиновую кислоту обеспечивает образование водородной связи с треонином 122 TL1A и образование солевого мостика с лизином 113 TL1A. Имеется дополнительное конформационное изменение некоторых окружающих остатков, так что тирозин 118 TL1A, который в комплексе 1D1-TL1A смотрит наружу, направлен внутрь к центру эпитопа в комплексе с 1D1 1.31.
Замену от аспарагина до гистидина в положении 58 тяжелой цепи обнаружили в результате подхода по оптимизации аффинности на основе фагового дисплея. Постулировали, что гистидин 122 образует более сильное электростатическое взаимодействие с глутаминовой кислотой 52 TL1A (Фиг. 12).
Структурная основа для любого улучшения связывания из-за замены аланина на серии в положении 100B тяжелой цепи антитела менее ясна. Исходный серии не имеет очевидного партнера для образования водородной связи. Не желая быть связанными какой-либо конкретной теорией, может оказаться, что удаление гидроксила серина посредством замены на аланин стабилизирует комплекс путем устранения скрытой полярной группы незадействованными атомами - донором и акцептором водородной связи.
Полный список взаимодействий между 1D1 1.31 и TL1A показан на Фиг. 19 и в Таблицах 29-38. Опосредованные водой водородные связи, наблюдаемые в структуре с 1D1, не видны в структуре с 1D1 1.31. Это может быть обусловлено меньшим разрешением последней структуры. Несмотря на более прочное связывание, общая площадь скрытой поверхности из-за связывания антитела в некоторой степени ниже для 1D1 1.31  , чем для 1D1
, чем для 1D1  . Значительная часть данного различия обусловлена вышеописанным конформационным изменением с участием тирозина 118 TL1A. Не желая быть связанными какой-либо конкретной теорией, усиленное связывание 1D1 1.31 может быть обусловлено улучшенными электростатическими взаимодействиями остатков 28 и 58 тяжелой цепи.
. Значительная часть данного различия обусловлена вышеописанным конформационным изменением с участием тирозина 118 TL1A. Не желая быть связанными какой-либо конкретной теорией, усиленное связывание 1D1 1.31 может быть обусловлено улучшенными электростатическими взаимодействиями остатков 28 и 58 тяжелой цепи.
Имеются 11 прямых волородных связей (образованных остатками Т122, S149, Е50, Е52, А56, Y168, Т169 и Е171) и 3 солевых мостика (К113, Е50, Е52), видимых в кристаллической структуре комплекса TL1A-1D1. Они перечислены в Таблице 29. Введение дополнительного образования водородных связей и взаимодействий на основе солевых мостиков, по-видимому, отвечает за большую часть улучшения аффинности, наблюдаемого по сравнению с 1D1.









Кроме того, целый ряд остатков TL1A находится в пределах  при связывании с антителом 1D1 1.31: K113, Y118, Р119, Т122, Q123, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, K170 и Е171 (Таблица 37).
при связывании с антителом 1D1 1.31: K113, Y118, Р119, Т122, Q123, F148, S149, V31, V32, Е50, Е52, L53, G54, L55, А56, Y168, Т169, K170 и Е171 (Таблица 37).

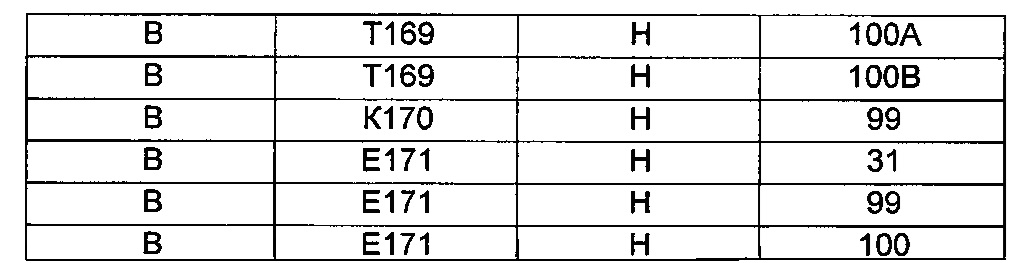
Пример 18: получение антитела 1D1 1.31 против TL1A
Антитело 1D1 1.31 будет предоставлено в виде порошка для раствора для инъекции в дозировке 100 мг/флакон. Лекарственный продукт поставляется в 6 мл прозрачном стеклянном флаконе типа 1, закупоренном покрытой резиновой пробкой и алюминиевым колпачком с отрывной накладкой. Данный лекарственный продукт разработан для растворения либо полным объемом 2,2 мл стерильной воды для инъекции (sWFI) для обеспечения внутривенного введения (в.в.), либо приблизительно половиной объема - 1,0 мл sWFI для обеспечения внутривенного (в.в.) введения или подкожного (п.к.) введения. Данный препарат представляет собой 10 мМ гистидин, 5% сахарозы, 0,01% полисорбата-80, pH 5,8 в виде лиофилизированного порошка и представляет собой 10 мМ гистидин, 5% сахарозы, 0,01% полисорбата-80, pH 5,8, при растворении в полном объеме и представляет собой 20 мМ гистидин, 10% сахарозы, 0,02% полисорбата-80, pH 5,8, при растворении в половине объема.
Все компоненты, используемые в изготовлении лекарственного продукта, и их функции приведены в Таблице 38 ниже.


Переполнение
Для обеспечения того, чтобы из флакона можно было отобрать объем 2 мл после растворения в полном объеме, и из флакона можно было отобрать объем 1 мл после растворения в половине объема, имеется переполнение 0,4 мл. Отсутствуют производственные излишки.
Лекарственный продукт на основе антитела 1D1 1.31 готовят в концентрации 50 мг/мл, и 2,4 мл заполняют в каждый флакон для лиофилизации. Перед дозированием лекарственный продукт растворяют либо полным объемом, либо половиной объема для приспособления к разным объемам и концентрациям инъекции. Для растворения полным объемом во флакон добавляют 2,2 мл стерильной воды для инъекции, что приводит к общему объему после растворения приблизительно 2,4 мл, из которых 2,0 мл может быть отобрано для дозирования. Растворение полным объемом подходит для внутривенного (в.в.) введения. Для растворения половиной объема во флакон добавляют 1,0 мл стерильной воды для инъекции, что приводит к общему объему после растворения приблизительно 1,2 мл, из которых 1,0 мл может быть отобран для дозирования. Растворение половиной объема подходит либо для внутривенного (в.в.) введения, либо подкожного (п.к.) введения. Добавленные во флакон растворяющие объемы как для растворения полным, так и половиной объема учитывают объем лиофилизированного осадка. Тестирование высвобождения и стабильности лекарственного продукта на основе антитела 1D1 1.31 проводится после растворения полным объемом - 2,2 мл стерильной воды для инъекции.
Выбор эксципиентов для лиофильной композиции был сделан для получения, при растворении, подходящего раствора для в.в. инфузии и п.к. инъекции с профилем стабильности, который будет обеспечивать длительный срок хранения лекарственного продукта и надежность в том, что касается отклонений температуры. Кроме того, композиция разработана для того, чтобы быть надежной в том, что касается циклов замораживания и оттаивания лекарственного вещества.
Выбор гистидина с сахарозой и полисорбатом 80 при pH 5,8 был основан на ранней фазы работы по разработке композиции. Полисорбат 80 добавляли в композицию 1D1 1.31 для уменьшения потенциала к образованию агрегатов. Сахарозу выбирали из-за ее стабилизирующего эффекта в отношении лиофилизации и стабильности при хранении. Выбранное для композиции количество сахарозы нацелено на изотоничный раствор при растворении половиной объема.
Проводили исследования по разработке для оценки совместимости и допустимого времени хранения вводимого компонента, которые поддерживают предложенные схемы клинического исследования. Заключением данных исследований является то, что лекарственная форма совместима с вводимыми компонентами, подлежащими применению в предложенных клинических исследованиях, и является стабильной во время приготовления и введения дозы.
Пример 19: специфичность связывания клона 1D1 1.31 антитела против TL1A в отношении TL1A и гомологов
Целью данных исследований была оценка специфичности связывания 1D1 1.31 в отношении человеческого TL1A (TNFSF15) по сравнению с его ближайшими человеческими гомологами: TNFSF6 (лиганд FAS); TNFSF10 (TRAIL); TNFSF14 (LIGHT); TNF-β; TNF-α и изоформы лимфотоксина-β, которые на 36%, 35%, 31%, 30%, 29% и 25% идентичны TL1A соответственно.
Материалы и методы
Селективность связывания 1D1 1.31 оценивали в анализах ELISA на основе планшетов.
Для тестирования связывания 1D1 1.31 с каждым цитокином каждый цитокин и TL1A тестировали отдельно в 96-луночном планшете. Тестирование при всех условиях проводили в двойной повторности. Первые 6 рядов каждого планшета покрывали тестируемым образцом цитокина, и последние два ряда покрывали TL1A в качестве позитивного контроля. Ряды 1 и 2 представляли собой ряды двух повторностей, где тестируемый образец цитокина тестировали на связывание с возрастающими концентрациями соответствующего ему антитела позитивного контроля против цитокина. Ряды 3 и 4 представляли собой ряды двух повторностей, тестируемые относительно возрастающих концентраций изотипичного контрольного антитела 8.8 против TL1A; ряды 5-8 тестировали относительно возрастающих концентраций антитела 1D1 1.31 против TL1A (ряды двойной повторности 5 и 6, содержащие тестируемый образец цитокина, и ряды двойной повторности 7 и 8, содержащие TL1A в качестве позитивного контроля для антитела против TL1A). Эксперимент для каждого цитокина повторяли три раза.
Вкратце, планшеты покрывали цитокином путем добавления 50 мкл 1 мкг/мл раствора цитокина в PBS в каждую лунку (ряды 1-6 покрывали тестируемым образцом цитокина, и ряды 7 и 8 покрывали TL1A) (TNFSF6, TNFSF10, TNFSF14 и TNF-α от R&D Systems, человеческий лимфотоксин α2-β1 и лимфотоксин α1-β2, приобретенные у Sigma, человеческий TNF-β от Peprotech). Планшеты инкубировали в течение ночи при 4°C. После промывки планшетов три раза (3×) 300 мкл PBST с использованием промывочного устройства для планшетов (модель ELx405; BioTek) планшеты блокировали инкубированием в течение 1 часа при комнатной температуре 300 мкл блокирующего буфера (PBST плюс 0,5% BSA) в каждой лунке. Планшеты промывали 3× PBST так же, как описано выше, до добавления 50 мкл соответствующего раствора антитела (как указано выше для разных рядов) в исходной концентрации 25 мкг/мл (с последующими дальнейшими разведениями 1:5 в PBST плюс 0,5% BSA всего для 11 концентраций антитела, варьирующих от 25 мкг/мл до 2×10-6 мкг/мл) и только PBST в качестве контроля. Планшеты инкубировали в течение 1 часа при комнатной температуре и затем промывали пять раз 300 мкл PBST с использованием промывочного устройства для планшетов, с последующим добавлением 50 мкл 1:5000 антитела против человеческого IgG, конъюгированного с HRP (пероксидаза хрена) (от Jackson Immunoresearch) (для выявления антитела против TL1A; изотипического контрольного антитела 8.8 или антитела инфликсимаб против TNF-α); или 1:8000 стрептавидин-HRP (от Pierce/Thermo Scientific) (для выявления биотинилированных антител против человеческих TNFSF6, TNFSF10, TNFSF14 или TNF-β, все от R&D Systems); или 1:5000 антитела против IgG мыши, конъюгированного с HRP (R&D Systems) (для выявления антитела против лимфотоксина), и инкубацией в течение 1 часа при комнатной температуре. Планшеты затем промывали 5 раз PBST с использованием промывочного устройства для планшетов. В каждую лунку добавляли 50 мкл субстрата пероксидазы хрена TMB1 (тетраметилбензидин 1), и планшеты инкубировали в течение 5 минут при комнатной температуре перед добавлением 50 мкл останавливающего раствора (0,18 М H2SO4) (TMB1 от Fisher). Планшеты затем считывали при 450 нм на планшет-ридере (Envision; Perkin Elmer). Получали кривые связывания антитела путем откладывания на графике значений оптической плотности при 450 нм против log концентраций антитела. Из данных графиков определяли значения EC50 (для связывания 1D1 1.31 с TL1A или связывания антитела против цитокина с соответствующим ему цитокином) с использованием GraphPad Prism® (версия 5.02, GraphPad Software, Inc., Сан-Диего, Калифорния), аппроксимирующих кривых нелинейной регрессии и сигмоидной модели ответа в зависимости от log дозы агониста (три параметра).
Результаты
Антитело 1D1 1.31 против TL1A не связывалось с каким-либо из протестированных цитокинов - ближайших гомологов TL1A, но оно связывалось с TL1A на том же самом планшете, на котором были протестированы цитокины-гомологи TL1A. Каждый из протестированных цитокинов связывался с соответствующим ему специфичным антителом против цитокина, за исключением лимфотоксина, для которого связывание было выявлено лишь при очень высоких концентрациях антитела против лимфотоксина.
На Фиг. 20 показаны экспериментальные результаты в отношении тестирования селективности связывания 1D1 1.31 с ближайшим гомологом TL1A - TNFSF6 (n равно 6; 3 независимых эксперимента в двойной повторности). TNFSF6 связывался с антителом против TNFSF6 (кружок), но он не связывался с антителом 1D1 1.31 против TL1A (треугольник с вершиной, направленной вверх). TL1A связывался с 1D1 1.31. Данный график является репрезентативным графиком для всех других протестированных цитокинов, за исключением лимфотоксина, связывание которого со специфичным по отношению к нему антителом против лимфотоксина происходило только при высоких концентрациях антитела.
В Таблице 39 показаны значения EC50, полученные для каждого эксперимента с цитокинами (n равно 6; 3 независимых эксперимента в двойной повторности), для связывания антитела 1D1 1.31 против TL1A с TL1A и для связывания антитела против цитокина с каждым соответствующим цитокином на каждом планшете.
В Таблице 39 обобщены значения EC50, полученные для связывания антитела 1D1 1.31 против TL1A с TL1A и соответствующего антитела против цитокина с соответствующим ему цитокином, в экспериментах в тройной повторности, проведенных для каждого цитокина.

NB - нет связывания; Nd - не применимо, так как это не измеряли. Данные основаны на n, равном 6, из 3 независимых экспериментов, проведенных в двойной повторности. EC50 определяется как концентрация антитела, дающая полумаксимальную оптическую плотность, полученную при насыщающих концентрациях антитела.
Заключение
1D1 1.31 является селективным в отношении связывания с человеческим TL1A и выявляемо не связывается с каким-либо из ближайших гомологов TL1A: TNFSF6, TNFSF10, TNFSF14, TNF-β, TNF-α, лимфотоксином α2-β1 или лимфотоксином α1-β2.
Пример 20: ингибирование взаимодействия TL1A:DR3 с использованием антитела 1D1 1.31 против TL1A
Цель
Целью данного исследования была оценка способности антитела 1D1 1.31 против TL1A ингибировать связывание TL1A с его рецептором DR3 в клетках HEK293, экспрессирующих DR3.
Клетки HEK293, трансфицированные DR3, высевали в 96-луночный круглодонный планшет при плотности клеток 100000 клеток на лунку в PBS 4% FCS и инкубировали в течение 15 минут при 4°C с 10 мкг/мл биотинилированного TL1A и возрастающими концентрациями антитела 1D1 1.31 против TL1A или его изотипического контроля (8.8 IgG1 3m) в интервале концентраций от 0,5 мкг/мл до 250 мкг/мл в 2-кратных разведениях для 10 концентраций. В качестве позитивного контроля клетки инкубировали с биотинилированным TL1A без какого-либо антитела. В параллельном эксперименте биотинилированный TL1A также инкубировали с нетрансфицированными родительскими клетками HEK293 и демонстрировали отсутствие связывания (данные не показаны).
После этой 15-минутной инкубации клетки центрифугировали при 485 g, супернатант отсасывали, и клетки ресуспендировали в растворе стрептавидина-РЕ (BD Biosciences) (разведение 1:500 в PBS/фетальной телячей сыворотке (FCS)). Клетки затем инкубировали в течение 15 минут при 4°C. После инкубации клетки промывали 3 раза тем же самым буфером, ресуспендировали в 200 мкл того же самого буфера, и связывание TL1A проверяли анализом проточной цитометрией на цитометре LSR Fortessa (BD Biosciences).
Анализ данных
Данные анализировали программой FlowJo.
После идентификации синглетных клеток измеряли среднее геометрическое интенсивности флуоресценции популяции клеток в отношении PE. Это является измерением того, сколько стрептавидина-PE находится на клетках, который должен связываться только с TL1A-биотином. Среднее геометрическое неокрашенных клеток вычитали из всех значений в качестве фона. Контрольный фон одного стрептавидинина был аналогичным фону неокрашенных клеток.
Данные откорректированные значения среднего геометрического откладывали на графике относительно log концентрации Ab, и рассчитывали IC50 с использованием программы GraphPad Prism.
РЕЗУЛЬТАТЫ
Было показано, что биотинилированный TL1A связывается с трансфицированными клетками DR3-HEK293 (но не с нетрансфицированными клетками), и данное связывание полностью ингибировалось антителом 1D1 1.31 против TL1A (Фиг. 21). Изотипическое контрольное антитело 8.8 IgG1 3m не показывало какого-либо ингибирования. 1D1 1.31 ингибировало связывание 10 мкг/мл TL1A со значением IC50 18,68 мкг/мл.
ЗАКЛЮЧЕНИЕ
Было показано, что биотинилированный TL1A связывается с трансфицированными клетками DR3-HEK293 (но не с нетрансфицированными клетками), и данное связывание полностью ингибировалось антителом 1D1 1.31 против TL1A, но не изотипическим контрольным антителом 8.8 IgG1 3m. 1D1 1.31 ингибировало связывание 10 мкг/мл биотинилированного TL1A со значением IC50 18,68 мкг/мл.
Пример 21: термостабильность репрезентативных антител
Цель
Целью была характеристика антител против TL1A, полученных созреванием аффинности, и конструкции на основе структуры в отношении термостабильности и подтверждение того, что на стабильность данных антител не влияли мутации.
Способы
Дифференциальную сканирующую калориметрию проводили по существу, как описано в King et al. (2011), Protein Sci., 20 (9): 1546-1557, которая включена сюда посредством ссылки. Вкратце, образцы антител разводили до 0,1 мг/мл в PBS. Sypro Orange разводили из его исходной 5000× концентрации до рабочей концентрации 2,5×. Общий объем 210 мкл делили на четыре лунки в микролуночном планшете для ПЦР и нагревали от 20 до 95°C со скоростью 1°C в минуту. Флуоресценцию получали с использованием фильтров SYBR. После аппроксимации данных до трех распределений Гаусса могли быть определены значения Tm каждого перехода разворачивания, а также начало разворачивания.
Результаты
В Таблице 43 показаны температуры перехода разных мутировавших антител по сравнению с родительским антителом C1D1).

T1% или температуру, при которой белок был развернут на 1% или начало разворачивания, рассчитывали также, как описано в King et al. (там же). Каждая температура плавления относится к плавлению отличной ключевой поверхности контакта. В каноническом антителе TM3 представляет собой температуру, при которой плавится поверхность контакта двух доменов CH3, TM1 представляет собой температуру, при которой плавится поверхность контакта двух доменов CH2, и TM2 представляет собой температуру, при которой плавится поверхность контакта тяжелой и легкой цепи.
Заключение
Все протестированные антитела были стабильными с Tm1, превышающей 65°C, и T1% больше, чем 50°C. Изменения тепловой стабильности могли наблюдаться в Tm2, соответствуя домену Fab.
Пример 22: тест на стабильность при высокой концентрации антител против TL1A
Цель
Стабильность биологических лекарственных средств является очень важной характеристикой для обеспечения того, чтобы терапевтическое средство могло было быть приготовлено с сохранением его безопасности и эффективности в течение определенного периода времени. Тестировали долговременную стабильность антител против TL1A по настоящему изобретению.
Способы
Образцы антител 1D1 1.27, 1D1 1.31 и 1D1 1.32 концентрировали во вращающихся концентраторах Amicon Ultra на 4 мл и Vivaspin 500 с использованием мембран с порогом отсечения 30 кДа. При достижении конечных объемов, типично ~30 мкл, концентрацию всех образцов измеряли с использованием Nanodrop после 10-кратного разведения. Образцы доводили до ~150 мг/мл, затем помещали во флаконы для SEC с 15 мкл покрытия из минерального масла и размещали либо при комнатной температуре, либо при 4°C. Образцы еженедельно измеряли на образование агрегатов. Разделения SEC состояли из 1 мкл инъекций в колонку TOSOH GSK-300 с подвижным буфером - PBS, скорость тока 0,5 мл/мин. Выход рассчитывали с использованием площади под кривой.
Результаты и обсуждение
Образцы концентрировали до 150 мг/мл, и наблюдали хорошую согласованность между показателями выхода Nanodrop и SEC. После 12 недель при комнатной температуре или 4°C наблюдали менее чем 2%-ную агрегацию во всех образцах, за исключением антитела 1D1 1.32, в котором начинала усиливаться агрегация после приблизительно 6 недель, и достигалась приблизительно 7,5%-ная агрегация после 12 недель. Следовательно, в целом данные антитела оказываются стабильными, причем все, за исключением антитела 1D1 1.32, демонстрируют менее чем 5%-ную агрегацию при высокой концентрации после 12 недель при комнатной температуре.
Пример 23: эффективность антител против TL1A в модели аллергического заболевания дыхательных путей, индуцированного домашними пылевыми клещами (HDM)
Общие сведения
DR3, также известный как TNFRSF25, представляет собой рецептор семейства фактора некроза опухолей (TNF), содержащий домен смерти, экспрессируемый на разных поднаборах лимфоидных клеток. TL1A - лиганд семейства TNF для DR3, экспрессируется миелоидными клетками, например, дендритными клетками и способствует накоплению лимфоцитов в воспаленных тканях, а также высвобождению цитокинов, участвующих в иммунных ответах типа-17 и типа-2 [Meylan, F. et al. (2008) The TNF-family receptor DR3 is essential for diverse T cell-mediated inflammatory diseases. Immunity 29, 79-89].
Материалы и методы
Все эксперименты in vivo проводили согласно протоколам, одобренным Институциональным комитетом по уходу и использованию животных Pfizer. Мышиная модель аллергического заболевания дыхательных путей, индуцированного домашними пылевыми клещами (HDM), была ранее описана в Fitz LJ et al. Vol. 46 (2012), pp. 71-79. Вкратце, 8-12-недельных самок мышей BALB/c приобретали в Taconic Farms (Hudson, NY). В сутки исследования 0, 7 и 14 мышей анестезировали изофлураном, и они получали 100 мкг экстракта HDM, введенного каплями внутритрахеально (Dermatophagoides pteronyssinus, Greer Laboratories, Lenoir, NC). Антитела против TL1A (20 мг/кг, клон 1D1 мышиного IgG1-4mut), изотипические контрольные антитела - IgG1 против Eimeria tenella или носитель (физиологический раствор) инъецировали внутрибрюшинно в сутки исследования 0, 2, 4, 7, 9, 11, 14 и 16. Всех животных умерщвляли удушением CO2 в сутки 17, и отбирали образцы жидкости бронхоальвеолярного лаважа (BAL) для оценки воспаления в дыхательной системе. Статистический анализ проводили с использованием U-критерия Манна-Уитни. Различия между группами считали значимыми для значения p меньше 0,05.
Результаты
Модуляция аллергического воспаления дыхательных путей, индуцированного HDM, посредством обработки антителом против TL1A. Общую насыщенность клетками BAL определяли с использованием анализатора Cell-Dyn 3700 (Abbott Laboratories, Abbott Park, IL), тогда как количество отдельных типов клеток получали путем оценки популяций клеток вручную на предметных стеклах cytospin, окрашенных посредством способа Diff-Quik. Данные представляют собой среднее значение плюс/минус SEM (стандартная ошибка среднего) для каждой группы, 9-10 животных/группу. При обработке мышей 3 раза в неделю посредством внутрибрюшинных инъекций антител против TL1A общая насыщенность клетками BAL значимо уменьшалась по сравнению с животными, обработанными носителем (p равно 0,0021). На Фиг. 22 показано, что после 3 еженедельных внутритрахеальных заражений HDM у мышей развивалось надежное воспаление дыхательных путей с преобладанием эозинофилии, хотя также увеличивалось и число лимфоцитов, макрофагов и нейтрофилов BAL. В отличие от контрольного IgG1, введение антитела 1D1 приводило к значимому уменьшению общей насыщенности клетками BAL [Фиг. 22(a)], числа эозинофилов BAL [Фиг. 22(б)] (p меньше 0,0001 по сравнению с животными, обработанными носителем), лимфоцитов BAL [Фиг. 22(в)] (p равно 0,0285) и макрофагов BAL [Фиг. 22(г)] (p равно 0,0207). Число нейтрофилов BAL, по-видимому, значимо не модулировалось обработкой антителом против TL1A [Фиг. 22(д)], хотя следует отметить, что нейтрофилы BAL представляют небольшую популяцию клеток в данной модели.
Заключение
Системное лечение антителом против TL1A, использованное в мышиной модели повторных заражений дыхательных путей HDM, значимо облегчало аллергическое воспаление дыхательных путей, включая эозинофилию.
Пример 24: рандомизированное, двойное слепое, открытое для третьей стороны, плацебо-контролируемое исследование с увеличением дозы фазы 1 для оценки безопасности, переносимости, фармакокинетики и фармакодинамики одиночных внутривенных (в.в) и многих подкожных (п.к.) и внутривенных доз антитела против TL1A (1D1 1.31) у здоровых добровольцев
Цели
Первичными целями данного исследования является определение безопасности и переносимости введения одной (в.в.) и многих инфузий (п.к. и в.в.) 1D1 1.31 у здоровых субъектов.
Вторичными целями являются характеристика РК (фармакокинетического) профиля 1D1 1.31 после однократных в.в. инфузий, а также многократных п.к. и в.в. доз. Кроме того, вторичной целью является оценка иммуногенности 1D1 1.31.
Наконец, поисковые цели данного исследования включают оценку диагностических биомаркеров, которые могут быть информативными в демонстрации фармакологического эффекта 1D1 1.31.
Ожидаемые результаты
Первичными ожидаемыми результатами исследования является определение частоты связанных с лечением ограничивающих дозу или непереносимых нежелательных явлений (AE), частоты, тяжести и причинной взаимосвязи между возникающими после начала лечения AE (TEAE) и прекращением участия в клиническом исследовании из-за нежелательных явлений, возникающих после начала лечения; частоты и величины ненормальных данных лабораторных исследований и идентификация ненормальных и клинически релевантных изменений основных показателей жизнедеятельности, кровяного давления (BP) и параметров электрокардиограммы (ЭКГ).
Вторичные (фармакокинетические) ожидаемые результаты, подлежащие определению валидированным анализом, включают определение сывороточных концентраций 1D1 1.31 после одной дозы (SAD) или многих доз (MAD). РК параметры будут получены некомпартментными способами и будут включать:
 фазу однократной нарастающей дозы (в.в. инфузии): Cmax, Tmax, AUC14 суток, AUCбеск., AUCпоследн., Cmax(dn), AUCбеск.(dn), AUCпоследн.(dn), t1/2, среднее время нахождения (MRT), объем распределения (Vss) и клиренс (CL).
фазу однократной нарастающей дозы (в.в. инфузии): Cmax, Tmax, AUC14 суток, AUCбеск., AUCпоследн., Cmax(dn), AUCбеск.(dn), AUCпоследн.(dn), t1/2, среднее время нахождения (MRT), объем распределения (Vss) и клиренс (CL).
 фазу многократных доз (п.к. дозирование и в.в. инфузия):
фазу многократных доз (п.к. дозирование и в.в. инфузия):
 первая доза: Cmax, Tmax, AUCT, Cmax(dn), AUCT(dn), t1/2, MRT, кажущийся объем распределения (Vz/F), Vss, кажущийся клиренс из всего организма (CL/F) и CL.
первая доза: Cmax, Tmax, AUCT, Cmax(dn), AUCT(dn), t1/2, MRT, кажущийся объем распределения (Vz/F), Vss, кажущийся клиренс из всего организма (CL/F) и CL.
 многократные дозы: Cmax, Tmax, AUCT, Cmax(dn), AUCT(dn), t1/2, MRT, Vz/F, Vss, CL/F, CL, минимальная концентрация в интервале дозирования (Cmin), средняя концентрация в стационарном состоянии (Cav), наблюдаемое отношение накопления (Rac) и колебание от пика до минимума (PTF).
многократные дозы: Cmax, Tmax, AUCT, Cmax(dn), AUCT(dn), t1/2, MRT, Vz/F, Vss, CL/F, CL, минимальная концентрация в интервале дозирования (Cmin), средняя концентрация в стационарном состоянии (Cav), наблюдаемое отношение накопления (Rac) и колебание от пика до минимума (PTF).
• дополнительный параметр: оценка биодоступности (F) для п.к. введения при соответствующей в.в. дозе (отношение AUCτ (п.к., первая доза)/AUC14 суток (в.в. однократная доза), но не ограничиваются ими.
Вторичные (иммуногенность) ожидаемые результаты включают частоту образования антитела против лекарственного средства (ADA).
Поисковые ожидаемые результаты включают оценку высокочувствительного C-реактивного белка (hsCRP), экспрессию гена и концентрацию белка IP-10, общую концентрацию белка TL1A в сыворотке и анализ лейкоцитов.
Схема исследования
Приблизительно 92 здоровых субъекта были собраны в одном месте исследования и помещены в предложенные когорты, перечисленные ниже. К настоящему времени более чем 80 субъектам вводили антитело против TL1A в разных дозах.
Несмотря на то, что раскрытые идеи были описаны со ссылкой на разные применения, способы, наборы и композиции, будет понятно, что можно делать разные изменения и модификации без отступления от предложенных здесь идей и заявленного ниже изобретения. Вышеуказанные примеры приведены для лучшей иллюстрации раскрытых идей и не предназначены для ограничения объема представленных здесь идей. В то время как настоящие идеи были описаны в терминах данных типичных воплощений, квалифицированный специалист легко поймет, что без чрезмерного экспериментирования возможны многочисленные вариации и модификации данных типичных воплощений. Все такие вариации и модификации находятся в пределах объема настоящих идей.
Все процитированные здесь ссылки, включая патенты, патентные заявки, статьи, учебники и тому подобное, и ссылки, процитированные в них, в той степени, в которой они еще не были включены, являются тем самым включенными в данное изобретение посредством ссылки во всей их полноте. В случае, когда один или более чем один из включенных литературных источников или аналогичных материалов отличается от данной заявки или противоречит ей, включая определенные термины, применение терминов, описанные методики или тому подобное, но не ограничиваясь ими, данная заявка будет иметь преимущество.
В приведенном выше описании и Примерах подробно описаны определенные конкретные воплощения изобретения и описан наилучший способ воплощения, рассматриваемый авторами изобретения. Однако будет понятно, что независимо от того, как подробно вышеизложенное может проявляться в тексте, изобретение можно воплощать на практике многими способами, и данное изобретение следует истолковывать согласно приложенной формуле изобретения и любым ее эквивалентам.