МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
[01] Композиции и способы, соответствующие вариантам реализации настоящего изобретения, в общем случае относятся к, по меньшей мере, области медицины, ветеринарной медицины, клеточной биологии, молекулярной биологии, и средам, кондиционированным стволовыми клетками. Варианты реализации настоящего изобретения относятся к стволовым клеткам, культуральной среде, кондиционированной стволовыми клетками, способам получения культуральной среды, кондиционированной стволовыми клетками, а также способам применения стволовых клеток и культуральных сред, кондиционированных стволовыми клетками. В частности, варианты реализации настоящего изобретения относятся к композициям, содержащим среды, кондиционированные стволовыми клетками, а также способам получения и применения таких композиций. Композиции согласно данной заявке можно получать и применять для лечения ран, ухода за ранами и кожей и других медицинских и ветеринарных применений, включая снижение воспаления и раздражения, а также лечение и предотвращение мастита крупного рогатого скота.
УРОВЕНЬ ТЕХНИКИ
[02] Мастит является одним из наиболее распространенных и затратных заболеваний, отрицательно сказывающихся на молочной промышленности, ежегодные экономические потери от которого в мировом масштабе оцениваются в миллиарды долларов. Причинами этих потерь является сокращение надоев молока, снижение композиционного качества, более низкое качество продукта, отбраковка молока в результате наличия остатков антибиотиков, возмещение затрат на выбракованных коров, затраты, связанные с антибиотиками и другими видами лечения, а также повышение затрат на ветеринарное обслуживание. По этим причинам предотвращение и эффективное лечение мастита являются основными целями молочной промышленности.
[03] Мастит крупного рогатого скота относится к воспалению молочной железы, причиной которого могут быть инфекционные агенты и их токсины, физическая травма или химические раздражители. У молочных коров мастит, как правило, вызывают микроорганизмы, в основном такие как Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis и Escherichia coli. Травма соска также делает его более восприимчивым к проникновению, колонизации и инфицированию бактериями. Условия, которые могут стать причинами травмы, включают: неправильное использование доильного оборудования, неправильное использование моющих или чистящих средств для вымени, влажные соски, неправильное смешивание или замораживание растворов для обработки сосков, обморожение, отсутствие подготовки коров или стимуляции перед доением для молокоотдачи, чрезмерное доение и введение применяемых при мастите трубок или катетеров для сосков. На заболеваемость маститом также может оказывать влияние множество других факторов, таких как условия содержания, стресс, общее состояние здоровья коровы и генетическая или наследственная предрасположенность к инфекциям.
[04] Существует две основных категории мастита: клиническая и субклиническая. Обычно Ветеринар-специалист может диагностировать клинический мастит на основании внешнего вида молока, набухания вымени или системных симптомов, которые включают отекшие четверти, водянистое молоко, высокую температуру, сниженный аппетит или повышенную температуру тела. В результате молоко от коров, страдающих от клинического мастита, как правило, отбраковывают. Субклинический (или скрытый) мастит, как правило, не проявляется в виде четко определяемых симптомов и, следовательно, его труднее диагностировать и лечить, но он также приводит к снижению надоев, наличию бактерий в молоке и нежелательным изменениям в составе молока. Более того, из-за затрат, связанных с лечением мастита, субклинический мастит иногда не лечат даже в случае диагностирования, что может приводить к смешиванию молока более низкого качества (от коров с субклиническим маститом) с нормальным молоком в молочном танке перед продажей для потребления населением. Кроме того, мастит всегда приводит к определенному необратимому разрушению ткани молочной железы, которое приводит к снижению надоев. Массовый подсчет соматических клеток (SCC) является общепризнанным показателем общего состояния здоровья стада, при этом повышенные уровни мастита в общем случае коррелируют с повышением SCC. В соответствии с некоторыми исследованиями число соматических клеток в молочном танке, превышающее 700000, может обозначать, что 25-50% стада может болеть маститом.
[05] После диагностирования случаи клинического мастита, как правило, лечат антибиотиками. Антибиотики могут быть эффективным лечением клинического мастита, в частности, в краткосрочной перспективе. Однако применение антибиотиков для лечения мастита также имеет несколько недостатков, включая то, что молоко от коров, проходящих лечение антибиотиками, следует отбраковывать в течение нескольких дней, так как молоко, которое содержит антибиотики не подходит для употребления человеком. Отбраковка молока от проходящих лечение коров является одним из наиболее затратных аспектов мастита. Другие недостатки лечения мастита антибиотиками включают отрицательное воздействие на иммунную систему коровы в целом, что может приводить к снижению надоев. Другим отрицательным моментом является то, что для выбора антибиотика и лечения мастита антибиотиком необходимы профессиональные знания и диагностические методы, что увеличивает стоимость, время и труд ветеринара. Также существует опасение, что один или более бактериальных штаммов станут устойчивыми к антибиотикам, применяемым в настоящее время для лечения мастита. Другим отрицательным моментом является то, что хотя антибиотики могут лечить клинические симптомы мастита, их влияние не распространяется на деградацию молочной альвеолы, результатом которой является снижение надоев. Антибиотики также не могут предотвращать возникновение мастита в будущем. В некоторых случаях лечение симптомов клинического мастита антибиотиками может приводить к утрате одной (или нескольких) молокообразующей(их) четверти(ей), что тоже приводит к снижению надоев.
[06] Были разработаны коммерческие продукты для лечения мастита, которые применяются для снижения в некоторой степени заболеваемости маститом. Однако применяемые в настоящее время коммерчески доступные продукты для лечения мастита также имеют определенные недостатки. Например, применение йода, гипохлорита, диоксида хлора и хлорноватистой кислоты, которые являются одними из активных ингредиентов в типичных продуктах для лечения мастита, было связано с раздражением кожи сосков, что приводит к созданию благоприятных условий для бактерий, вызывающих мастит.
[07] Следовательно, существует постоянная потребность в композициях, которые эффективны против мастита и родственных патологических состояний, легки в употреблении, и у которых отсутствуют или уменьшены недостатки применяемых в настоящее время лекарств. Также существует потребность в композициях, которые не только эффективны в лечении и контроле мастита, но которые обладают также профилактическим или превентивным эффектом. И существует постоянная потребность в композициях, которые эффективны в лечении ран и различных связанных с ранами применениях, лечении патологических состояний кожи, а также тех, которые помогают уменьшить воспаление и раздражение, помимо прочих медицинских применений и состояний.
СУТЬ ИЗОБРЕТЕНИЯ
[08] В соответствии с одним аспектом настоящего изобретения предложена уникальная линия мезенхимальных стволовых клеток, полученных из костного мозга крыс линии Вистар, которая имеет одну или более определенных характеристик. Например, когда 0,7×106 клеток высевают в 75 см2 пробирку и культивируют в течение по меньшей мере 96 часов, линия мезенхимальных стволовых клеток может: (а) продуцировать по меньшей мере 4,5 мМ лактата в течение 24 часов после замены среды; (b) продуцировать по меньшей мере 150 пг/мл GRO/KC в течение 24 часов после замены среды; (с) продуцировать менее чем 250 пг/мл OPG через 24 часа после замены среды; или (d) продуцировать менее чем 80 пг/мл TGF-β3 через 24 часа после замены среды. В соответствии с другим аспектом, когда 0,7×106 клеток высевают в 75 см2 пробирку и культивируют в течение по меньшей мере 150 часов: (е) рН культуральной среды снижается до уровня ниже 7,0 в течение 24 часов после замены среды; или (f) рН культуральной среды снижается по меньшей мере на 0,4 единицы по сравнению с рН культуральной среды в отсутствие клеток в течение 24 часов после замены культуральной среды. Культуральная среда может представлять собой культуральную среду RPMI-1640, дополненную 5% CO2. Кроме того, та же линия стволовых клеток может претерпевать по меньшей мере одно удвоение популяции при рН ниже 7,05. Линия стволовых клеток также может характеризоваться положительной экспрессией маркеров CD29 и CD44 и отрицательной экспрессией маркеров CD11b и CD45.
[09] Отдельный аспект изобретения относится к кондиционированной среде, которую можно получить, поддерживая множество уникальных стволовых клеток в культуральной среде в течение определенного периода кондиционирования. В одном аспекте культуральная среда представляет собой RPMI-1640, дополненную 5% CO2. Клетки можно поддерживать в культуральной среде в различных условиях, в том числе при атмосферной концентрации CO2 или в гипоксических условиях. В соответствии с аспектами изобретения период кондиционирования может варьироваться. Например, период кондиционирования может составлять по меньшей мере 12 часов или он может соответствовать периоду времени, достаточному для того, чтобы кондиционированная среда содержала по меньшей мере 150 пг/мл GRO/KC. В другом аспекте изобретения кондиционированная среда может содержать по меньшей мере одно из следующего: (а) по меньшей мере 500 пг/мл GRO/KC; (b) по меньшей мере 4000 пг/мл VEGF; (с) менее 250 пг/мл OPG; или (d) менее 80 пг/мл TGF-β3.
[10] Другой аспект изобретения относится к композиции и способам получения композиции, которая содержит клетки из уникальной линии стволовых клеток или культуральную среду, кондиционированную стволовыми клетками. Композиция также может содержать один или более противомикробных агентов и/или один или более пленкообразующих агентов. Пленкообразующий агент может присутствовать в концентрации в диапазоне, например, от около 0,01% до около 2% (м/об (масса/объем)). Противомикробный агент может присутствовать в концентрации в диапазоне, например, от около 0,001% до около 1,0% (м/об). Композиция может дополнительно содержать один или более буферизирующих агентов, агентов для регулирования уровня рН, консервантов, кондиционирующих агентов для кожи, сурфактантов, пенообразующих агентов, красителей, хелатирующих агентов и подходящих носителей. В некоторых аспектах изобретения композицию можно обрабатывать, чтобы удалить некоторые или все стволовые клетки. В одном аспекте применяемая в композиции кондиционированная среда содержит VEGF, GRO/KC, ИЛ-10, IP-10, TGF-β1 или TGF-β2. В другом аспекте композиция может содержать кондиционированную среду, которая содержит по меньшей мере 50 пг/мл GRO/KC или по меньшей мере 500 пг/мл VEGF, или по меньшей мере 150 пг/мл TGF-β2. В дополнительном аспекте композиция может содержать кондиционированную среду, которая содержит менее 500 пг/мл OPG или менее 80 пг/мл TGF-β3. В соответствии с аспектами композиции количество VEGF в композиции по меньшей мере в 5 раз превышает количество OPG.
[11] Дополнительный аспект изобретения относится к применению одной или более композиций для лечения или предотвращения мастита. В соответствии с аспектами изобретения применение терапевтически эффективного количества композиции к вымени или соску коровы снижает заболеваемость маститом по меньшей мере на 15% по сравнению с лечением растворами на основе йода. В другом аспекте применение терапевтически эффективного количества композиции к вымени или соску коровы снижает среднее число соматических клеток в молоке коровы по меньшей мере на 15% по сравнению со средним числом соматических клеток до лечения композицией. Способ применения для лечения мастита включает, но не ограничивается, одним или более из местного применения, перорального применения или инъекции. В случае местного применения композицию можно наносить на вымя или сосок коровы путем погружения или распыления. В соответствии с отдельным аспектом способ лечения или предотвращения мастита может включать введение второй композиции, которая также содержит по меньшей мере кондиционированную среду. В одном аспекте вторую композицию применяют в то же время, что и первую композицию. В другом аспекте вторую композицию можно применять в другое время и можно вводить другим способом, например, перорально.
[12] В аспектах изобретения клетки, кондиционированную среду или композицию можно наносить на шовный материал, бандаж, вязаную сетку, имплант, стент, трансплантат, влажную салфетку или периодонтальную прокладку или другие устройства-аппликаторы. Клетки, кондиционированная среда или композиция имеют, кроме мастита, множество других применений, включая, например, лечение ожогов, уход за кожей, ангиогенез, васкулогенез, заживление органов или тканей, косметические средства, воспаление тканей, бактериальные инфекции, лечение ран, диабет, фармацевтические и офтальмологические применения, снижение рубцевания, стимулирование роста волос, иммунотерапию и иммунокоррекцию, трансплантацию кожи, костного мозга или органов, лечение органов или тканей или для лечения других заболеваний человека и животных.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[13] Вышеуказанные и/или другие аспекты настоящего изобретения станут более понятны из подробного описания примеров вариантов их реализации со ссылкой на прилагаемые графические материалы, на которых:
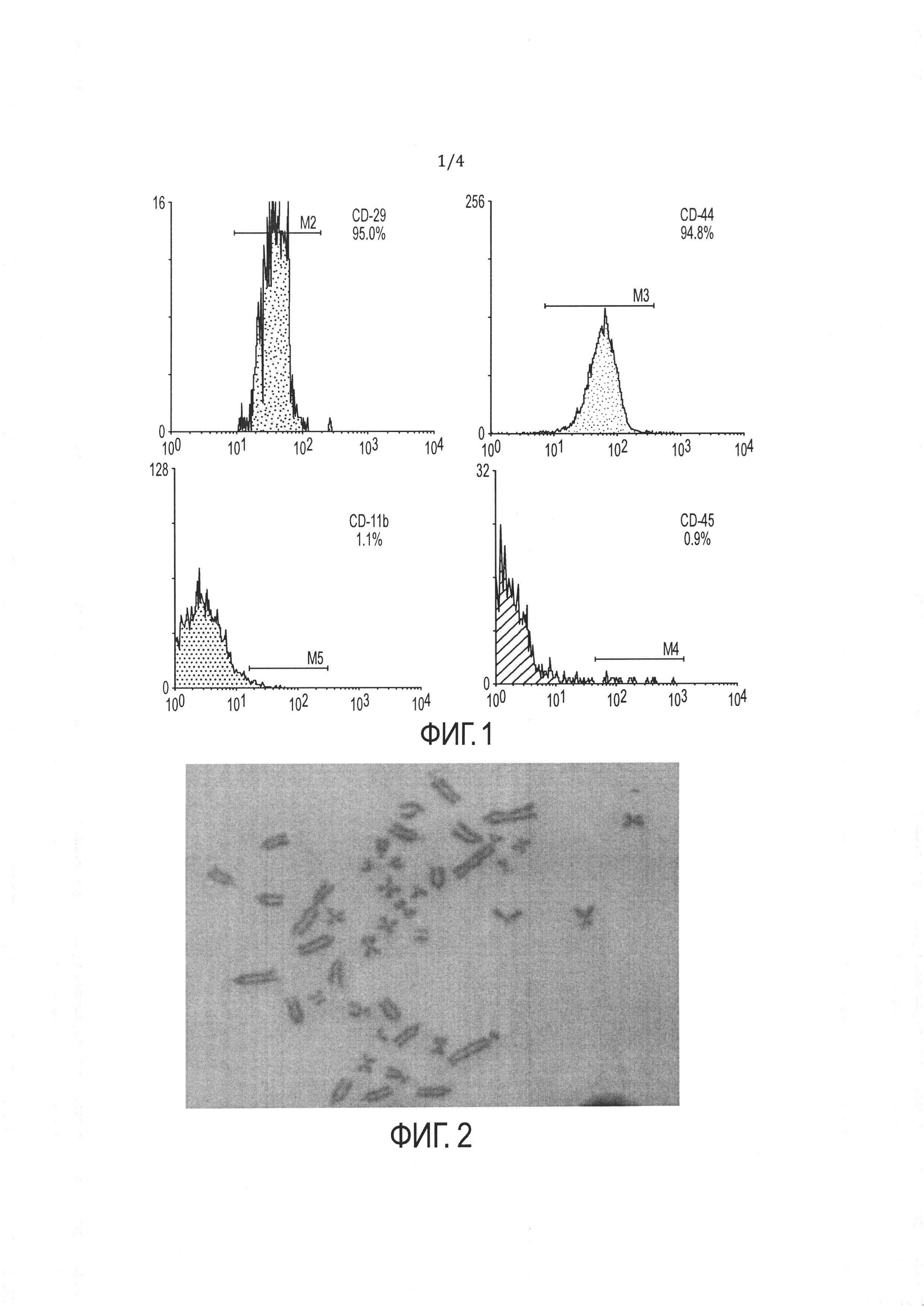
[14] ФИГ. 1 иллюстрирует анализ методом проточной цитометрии маркеров клеточной поверхности hb-MSC, включая тип маркера и относительное процентное содержание маркеров.
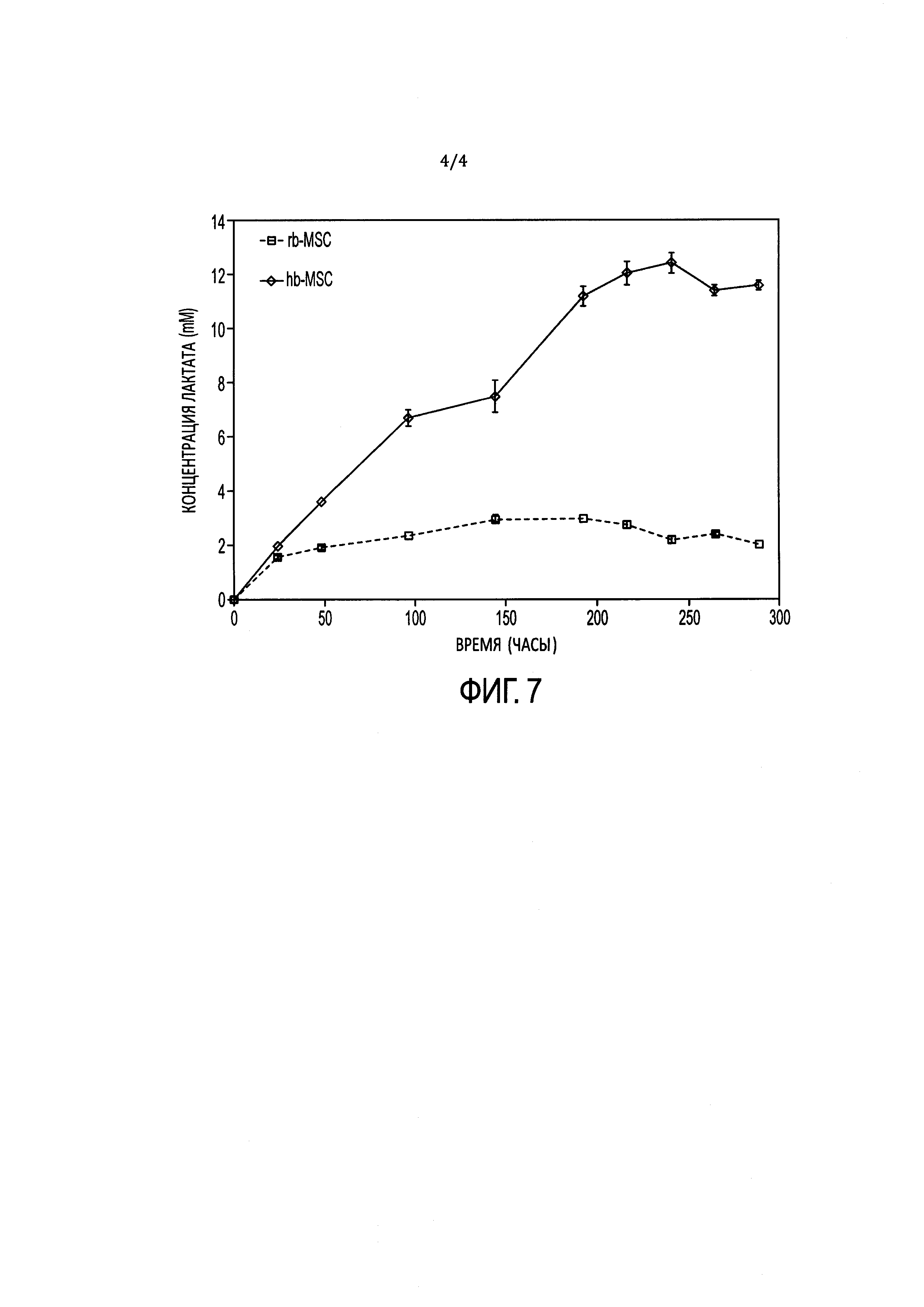
[15] ФИГ. 2 иллюстрирует окрашенные красителем Гимза хромосомы из hb-MSC во время пассажа №9 (р9).
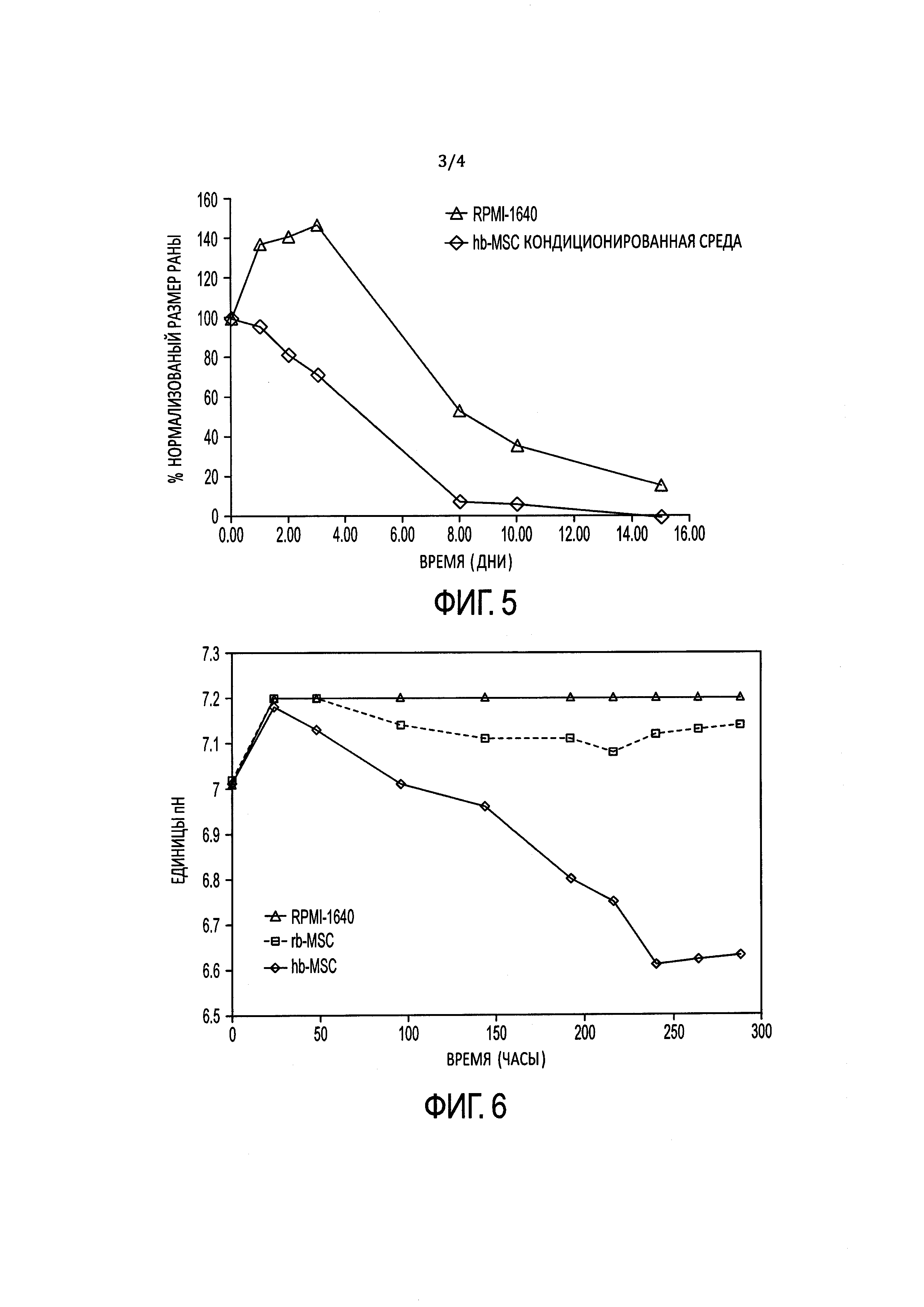
[16] ФИГ. 3 иллюстрирует электрофореграммы ПЦР-анализа hb-MSC и контрольных образцов.
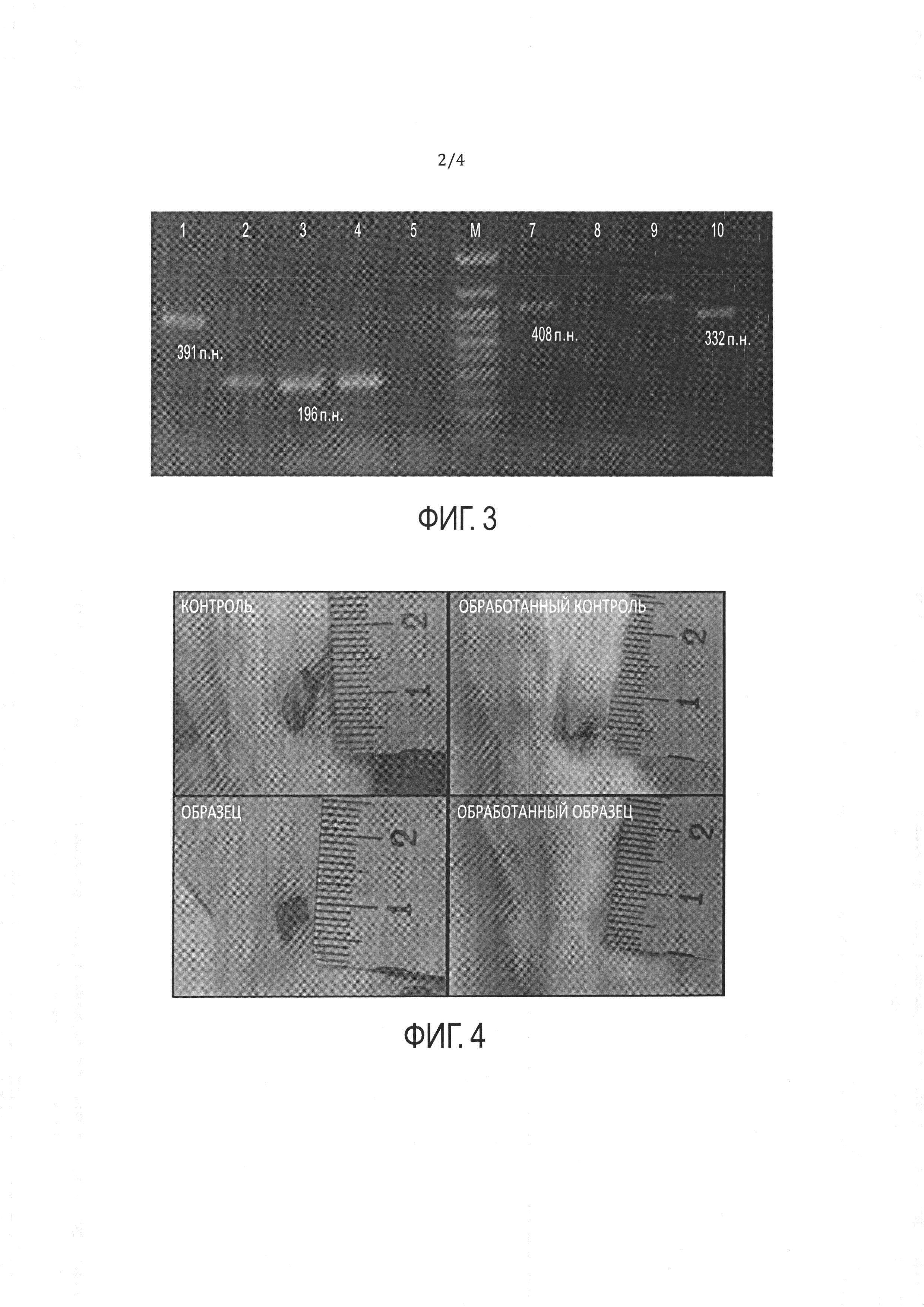
[17] ФИГ. 4 иллюстрирует сравнение ран у мышей через девять дней после
обработки культуральной средой RPMI-1640 и композицией hb-MSC.
[18] ФИГ. 5 иллюстрирует относительную скорость закрытия ран у мышей,
обработанных культуральной средой RPMI-1640 и композицией hb-MSC.
[19] ФИГ. 6 иллюстрирует изменение рН со временем для среды RPMI-1640,
среды, кондиционированной rb-MSC, и среды, кондиционированной hb-MSC.
[20] ФИГ. 7 иллюстрирует изменение концентрации лактата (мМ) в процессе
культивирования клеток hb-MSC и rb-MSC.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[21] Далее по тексту различные примеры вариантов реализации настоящего изобретения будут объяснены со ссылкой на прилагаемые графические материалы. Аспекты изобретения могут быть реализованы в различных формах, не ограничиваясь вариантами реализации, изложенными в данном документе. Следует понимать, что любые заголовки или подзаголовки, используемые в тексте описания, приведены исключительно для удобства и никоим образом не ограничивают объем или значение формулы изобретения. Следует понимать, что употребляемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если иное явно не следует из контекста. В данную заявку также в полном объеме включена посредством ссылки PCT/RU 2015/000831, поданная 1 декабря 2015 г.
[22] Один вариант реализации настоящего изобретения относится к новой линии мезенхимальных стволовых клеток (далее по тексту линия «hb-MSC»). Образец линии hb-MSC депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под номером Н-154. Клеточная линия депонирована под названием MSCR05P09. Экспрессия маркеров клеточной поверхности линии hb-MSC согласуется с экспрессией маркеров мезенхимальной стволовой клетки.
[23] Другой вариант реализации настоящего изобретения относится к среде, кондиционированной hb-MSC, и способу ее получения и применения. Кондиционированная среда содержит множество биологических продуктов, небольших молекул и экзосом, способных выполнять множество биологических функций. Кондиционированную среду можно применять саму по себе или ее можно применять в качестве части композиции.
[24] Другие варианты реализации настоящего изобретения относятся к композициям, а также способам получения и применения композиций, которые могут стимулировать иммунный ответ субъекта, улучшать регенеративные и репаративные процессы в поврежденных тканях, снижать воспаление, иметь противомикробный или антибактериальный эффект, лечить и оказывать профилактическое действие против инфекций, таких как мастит, и применимы в лечении ран и других применениях. hb-MSC, среды, кондиционированные hb-MSC, композиции hb-MSC и их комбинации можно применять по отношению к любому субъекту, включая людей и животных. Например, композиции можно применять для лечения сельскохозяйственных животных, лабораторных животных, животных-компаньонов или людей (вместе называемых «млекопитающие»).
[25] Композиции hb-MSC могут содержать hb-MSC, среду, кондиционированную hb-MSC, или их комбинацию. Варианты реализации композиции могут дополнительно содержать: (1) один или более терапевтических агентов; (2) другие агенты, добавки или ингредиенты, описанные в данном документе; и/или (3) один или более приемлемых носителей. Агенты, добавки и другие ингредиенты выбраны в соответствии с предназначенной для применения средой и могут присутствовать в любом подходящем количестве, необходимом для применения. hb-MSC, среды, кондиционированные hb-MSC, и композиции hb-MSC можно применять в любом состоянии, доставлять любым известным в данной области техники способом и использовать в различных применениях.
[26] В одном варианте реализации изобретения композицию hb-MSC можно применять для лечения мастита у лактирующих животных, таких как молочные коровы. В случае применений, связанных с маститом, композицию можно применять профилактически или для лечения существующей инфекции. При этом применение композиции не ограничено лечением мастита, и композицию можно применять в любых описанных в данном документе целях, включая, например, лечение или защиту против любого инфекционного состояния, лечение ран или применения, связанные с уходом за кожей. Варианты реализации композиций также могут стимулировать иммунный ответ организма и снижать число микроорганизмов в области раны.
[27] Если не указано иное, употребляемое в данном документе выражение «терапевтически эффективное количество» предназначено для характеристики количества композиции hb-MSC и/или противомикробного агента, которое будет способствовать лечению или предотвращению мастита, заживлению ран, уничтожению или ограничению действия бактерий или лечению других нарушений или патологических состояний, раскрытых в данной заявке. «Терапевтически эффективный» может также относиться к снижению тяжести нарушения или частоты заболеваемости по сравнению с субъектами, не проходящими лечение. «Существенное улучшение» означает более чем 15% улучшение.
[28] Клетки пассируют in vitro, используя культуральную среду. Подходящие среды включают, но не ограничиваются этим, RPMI-1640, среду Игла, модифицированную по способу Дульбекко (DMEM), среду Хэма F12, среду Искова, среду МакКоя или любую другую среду, которая содержит достаточно питательных веществ для роста клеток. Такую среду можно приготовить или получить из коммерческих источников.
[29] Лишение мезенхимальных клеток предпочтительной для них среды роста, как правило, приводит к снижению или остановке пролиферации клеток, потере адгезии к пластику и/или изменению клеточной морфологии. Одной из важных переменных, связанных с ростом клеток, является рН среды в процессе клеточной пролиферации. Как правило, стволовые клетки не растут (или имеют сниженную скорость пролиферации), когда условия в культуре отклоняются от физиологического рН. По этой причине культуральная среда, как правило, действует в качестве буфера во время культивирования клеток. Все клетки продуцируют или требуют небольших количеств СО2 для роста и выживания. В некоторых примерах культуральных сред растворенный CO2 находится в равновесии с ионами бикарбоната, а реакцию CO2/бикарбонат используют для создания рН среды. CO2 свободно растворяется в среде и вступает в реакцию с водой с образованием угольной кислоты. По мере того как клетки метаболизируют и продуцируют больше CO2, рН среды уменьшается. Оптимальный диапазон рН от 7,2 до 7,4 можно поддерживать путем добавления в среду бикарбоната натрия (NaHCO3) и регулирования уровня CO2 в атмосфере над средой. Буферная емкость среды определяется по количеству NaHCO3. В общем случае добавляют 5% дополнительного CO2 для достижения оптимального рН при буферной емкости, соответствующей от 1,2 до 2,2 г/л NaHCO3. В другом примере для достижения оптимального рН при буферной емкости, соответствующей 3,7 г/л NaHCO3, добавляют 10% дополнительного CO2. Если количество дополнительного CO2 ниже буферной емкости среды, то рН среды не может поддерживаться на надлежащем уровне, что может привести к старению клеток.
[30] Клеточная культуральная среда может также содержать дополнительные компоненты, такие как витамины, факторы роста, гормоны, белки, сахара и/или антиоксиданты, необходимые для обеспечения или поддержания необходимой клеточной культуры. Следует понимать, что возможно добавление сыворотки, такой как фетальная бычья сыворотка (ФБС). Например, в среду можно добавлять 10% дополнительной ФБС, или можно добавлять плазму крови в том же количестве, что и животную сыворотку. В альтернативном варианте клетки можно также поддерживать и размножать в культуре в отсутствие дополнительной сыворотки и/или дополнительной плазмы крови. Среду, кондиционированную клетками, также можно применять вместо или в дополнение к культуральной среде.
[31] Линию hb-MSC можно выделять из костного мозга крыс линии Вистар. Способ выделения линии hb-MSC в общем случае включает, по меньшей мере: (1) получение Пассажа 1 (pi) клеток из первичных клеток костного мозга крысы; (2) посев p1 крысиных мезенхимальных стволовых клеток в подходящий флакон; (3) первый этап инкубации, на котором клетки инкубируют при первой заданной концентрации CO2 в течение первого инкубационного периода времени; (4) второй этап инкубации, на котором клетки инкубируют при второй заданной концентрации СО2 в течение второго инкубационного периода времени; (5) сбор hb-MSC.
[32] Первичные крысиные стволовые клетки костного мозга получают из костного мозга большеберцовой или бедренной кости крыс линии Вистар в соответствии с хорошо известными методами. После сбора клеток клеточный осадок можно пересуспендировать, высеять в пластиковые флаконы для тканевого культивирования и инкубировать в культуральной среде (например, RPMI-1640, дополненной 10% ФБС) при 37°С в увлажненной атмосфере с 5% CO2. Адгезивные клетки, выросшие приблизительно до 70% конфлюэнтности, называют Пассажем №1 (p1).
[33] В одном варианте реализации изобретения первая заданная концентрация CO2 может быть установлена в соответствии с концентрацией CO2, соответствующей буферной емкости среды, которая, как правило, определяется производителем среды. Например, первая заданная концентрация CO2 может составлять 5%, когда для культивирования используют среду RPMI-1640. В том же варианте реализации изобретения вторая заданная концентрация CO2 может быть снижена по меньшей мере на 50% относительно концентрации CO2, соответствующей буферной емкости среды, которая, как правило, определяется производителем среды. Для среды RPMI-1640 соответствующая концентрация CO2 составляет 5%. Таким образом, в соответствии с одним вариантом реализации указанного способа вторая заданная концентрация CO2 должна быть установлена ниже 2,5%. В другом варианте реализации изобретения вторая заданная концентрация может соответствовать атмосферной концентрации CO2 (т.е. приблизительно 0,03% CO2). Специалисту в данной области техники понятно, что если вторая заданная концентрация CO2 в культуре увеличивается, то может потребоваться увеличение второго инкубационного периода времени (например, может потребоваться один или более дополнительных пассажей) для того, чтобы выделить линию hb-MSC.
[34] В одном варианте реализации изобретения первый инкубационный период времени может составлять от нуля до четырех клеточных пассажей. Следует понимать, что, когда первый инкубационный период времени составляет ноль пассажей, то первый этап инкубации пропускается полностью. В другом варианте реализации первый инкубационный период времени соответствует периоду, начиная от количества часов, необходимого для получения одного удвоения популяции (например, около 20-48 часов), до около 700 часов культивирования. В одном варианте реализации изобретения второй инкубационный период времени может составлять от одного до восьми клеточных пассажей. В дополнительном варианте реализации изобретения второй инкубационный период времени соответствует периоду, начиная от количества часов, необходимого для достижения одного удвоения популяции (например, около 20-48 часов), до примерно 2500 часов культивирования. Например, клетки могут проходить четыре пассажа в атмосфере с 0,03% CO2 в RPMI-1640 с 10% ФБС. Специалисту в данной области техники понятно, что при необходимости концентрацию CO2 можно корректировать во время любого инкубационного этапа.
[35] «Пассаж» следует понимать как перераспределение клеток, с разбавлением или без разбавления, из одного культурального флакона в другой культуральный флакон, содержащий свежую культуральную среду. Например, один клеточный пассаж может включать: (1) посев клеток на поверхность культурального флакона (например, приблизительно 2,0×106 клеток на 175 см2 площади поверхности); (2) добавление культуральной среды (например, RPMI-1640); (3) установление определенной атмосферы CO2; (4) помещение культурального флакона в термостат с установленной соответствующей температурой (например, 37°С); (5) поддержание клеток в культуральном флаконе в течение заданного периода времени («заданного периода культивирования») (6) обеспечение свежей культуральной среды при необходимости для роста клеток; и (7) отделение и пересев клеток.
[36] Для каждого пассажа клетки поддерживают в культуральной среде, при этом заданный период культивирования составляет около 30-700 часов. В одном варианте реализации изобретения заданный период культивирования составляет менее 96 часов. В другом варианте реализации изобретения заданный период культивирования составляет от около 96 до 168 часов. В дополнительном варианте реализации изобретения заданный период культивирования составляет более 168 часов. Кроме того, заданный период культивирования может основываться на конфлюэнтности клеток. В одном варианте реализации изобретения заданный период культивирования составляет время, необходимое для достижения клетками приблизительно 50% конфлюэнтности. В другом варианте реализации клетки пассируют после достижения приблизительно от 50% до 70% конфлюэнтности. В дополнительном варианте реализации изобретения клетки пассируют после достижения приблизительно 70% конфлюэнтности.
[37] Линию hb-MSC можно выделять посредством культивирования клеток при любом количестве измерений (D). Например, клетки можно культивировать, используя гранулы или микроносители (0D), монослои (2D) или 3D-матрицы. Линию hb-MSC можно также выделять, используя разные системы. Линию hb-MSC можно выделять, используя систему с открытой емкостью или систему с закрытой емкостью или их комбинацию. В одном варианте реализации изобретения, линию hb-MSC можно выделять, используя систему с закрытыми емкостями. В системе с закрытыми емкостями флакон для культивирования клеток закрыт непроницаемой крышкой, которая может препятствовать доступу дополнительного CO2. В другом варианте реализации изобретения линию hb-MSC можно выделять, используя открытый флакон в камере для культивирования клеток, что позволяет контролировать концентрацию CO2. В другом варианте реализации изобретения линию hb-MSC можно выделять во флаконе, закрытом газопроницаемой мембраной в камере для культивирования клеток, что позволяет контролировать концентрацию CO2. В одном варианте реализации изобретения для культивирования линии клеток hb-MSC можно использовать плоскопараллельный биореактор. В другом варианте реализации изобретения для культивирования линии клеток hb-MSC можно использовать биореактор с 3D-матрицей. В другом варианте реализации изобретения линию клеток hb-MSC можно культивировать, используя микроносители, в реакторе с мешалкой.
[38] Специалисту в данной области техники понятно, что описанные выше различные способы культивирования клеток приведены только в качестве примеров и не ограничивают объем формулы изобретения. Специалисту в данной области техники также понятно, что процедуры, инкубационные периоды, периоды культивирования, среды, сыворотки или концентрации CO2 и другие переменные могут требовать изменений с учетом поведения клеток в процессе культивирования.
[39] Другой вариант реализации настоящего изобретения относится к уникальной линии hb-MSC. Для подтверждения мезенхимальной природы этой линии можно использовать экспрессию маркеров клеточной поверхности. Маркеры клеточной поверхности можно выявлять при помощи любого подходящего способа, включая, например, проточную цитометрию. Как описано в Примере 4 и показано на ФИГ. 1, способ получения hb-MSC не приводит к изменению поверхностных маркеров hb-MSC, что может привести к выводу о том, что hb-MSC демонстрируют поверхностные маркеры, согласующиеся с маркерами мезенхимальных стволовых клеток костного мозга крыс.
[40] На ФИГ. 2 проиллюстрированы окрашенные красителем Гимза хромосомы из hb-MSC при Пассаже №9 (р9), тогда как на ФИГ. 3 проиллюстрированы результаты анализа методом полимеразной цепной реакции (ПЦР). Гены СОХ-1 и VN1R1 применяли в качестве маркеров для крысиной митохондриальной и ядерной ДНК, соответственно. При Пассаже №9 кариотип является нормальным диплоидным (т.е. 2n=42). Как описано ниже в Примере 1, анализ ПЦР клеточной линии подтвердил, что это крысиные клетки. Специалисту в данной области понятно, что клетки могут проходить любое количество пассажей, при условии, что анализ кариотипа подтверждает генетическую стабильность клеток.
[41] Линия hb-MSC существенно отличается от других линий стволовых клеток, полученных от крыс, что можно проиллюстрировать при помощи ряда различных способов получения характеристик. Крысиные мезенхимальные стволовые клетки, полученные в стандартных условиях, культивировали, чтобы показать различия между типичной крысиной мезенхимальной стволовой клеткой и уникальной линией hb-MSC. Линия типичных крысиных мезенхимальных стволовых клеток, подготовленная в целях сравнения, была названа линией rb-MSC. Для получения линии rb-MSC, p1 крысиных мезенхимальных клеток пассировали в соответствии со стандартными условиями, известными в данной области техники, как описано в Примере 2.
[42] В Примере 5 (и на ФИГ. 6) показано различие в рН среды между линией hb-MSC и линией rb-MSC, что можно использовать, чтобы отличить эти две линии. В другом сравнении линию hb-MSC можно отличить от линии rb-MSC по общей концентрации лактата в культуре. Другой способ отличить линию hb-MSC от линии rb-MSC состоит в сравнении различных факторов, обнаруживаемых в среде, кондиционированной каждой из соответствующих линий, как описано в Примере 6 (и показано в Таблице 3). Конечно, линию hb-MSC также можно охарактеризовать при помощи других способов, известных специалисту в данной области техники.
[43] Варианты реализации настоящего изобретения также относятся к клеткам или клеточным линиям, дифференцировавшимся из hb-MSC. Эти клеточные линии могут включать адипоциты, хондроциты, остеоциты или другие клетки. Способы дифференцировки в адипоциты, хондроциты, остеоциты хорошо известны в данной области техники. Способы генетической модификации стволовых клеток также хорошо известны. Линии стволовых клеток, полученные из генетически модифицированных hb-MSC или любых клеточных линий, дифференцировавшихся из генетически модифицированных hb-MSC, также входят в объем настоящего изобретения.
[44] Специалисту в данной области техники понятно, что различные способы получения характеристик hb-MSC приведены исключительно в иллюстративных целях. Варианты реализации hb-MSC не должны удовлетворять каждому из различных описанных способов получения характеристик, а некоторые варианты реализации могут удовлетворять только одному или более способам получения характеристик, раскрытым в данном документе.
[45] Один из вариантов реализации настоящего изобретения относится к культуральной среде, кондиционированной hb-MSC, называемой далее «кондиционированной hb-MSC средой». В одном варианте реализации изобретения кондиционированная среда может быть получена путем: (1) посева множества hb-MSC в соответствующий флакон; (2) обеспечения культуральной среды; (3) поддержания hb-MSC в культуральной среде в течение периода кондиционирования; и (4) сбора кондиционированной среды. Период кондиционирования может составлять часы, дни или даже недели, в течение которых культуральная среда обогащается биологическими продуктами. При необходимости (например, когда среда кондиционирована таким образом, чтобы биологические продукты, такие как факторы роста, белки и везикулы, достигали необходимых уровней в среде) кондиционированную среду можно собирать. Например, кондиционированную среду можно собирать после культивирования hb-MSC в течение 3, 6, 24, 30, 48, 54, 72, 96, 120, 144, 168, 192, 216, 240, 264, 288, 312 или 366 часов или любого другого временного периода. Специалисту в данной области техники понятно, что доступны другие способы кондиционирования культуральной среды, включая применение биореактора. В некоторых случаях, когда применяют биореактор, способ сбора кондиционированной среды может зависеть от выбранного способа культивирования клеток. Специалисту в данной области техники понятно, что выбранная конфигурация биореактора будет влиять на рост клеток и выбор протокола сбора кондиционированной среды. В одном варианте реализации изобретения применение биореактора сопряжено со сбором партии клеточной культуральной среды в определенный период времени.
Например, кондиционированную среду можно собирать после культивирования hb-MSC в биореакторе в течение 3, 6, 24, 30, 48, 48, 54, 72, 96, 120, 144, 168, 192, 216, 240, 264, 288, 312 или 366 часов или любого другого временного периода. В другом варианте реализации изобретения может быть выбран способ непрерывного сбора кондиционированной среды и непрерывного пополнения свежей культуральной средой. В этом конкретном примере время и скорость сбора могут основываться на ряде факторов клеточного культивирования, таких как рН, концентрация лактата, концентрация растворенного О2 или концентрация конкретного цитокина в кондиционированной среде.
[46] Кондиционированную среду, полученную путем культивирования hb-MSC, можно в случае необходимости обрабатывать в стерильных условиях или стерилизовать. Специалисту в данной области понятно, что сбор кондиционированной среды до прикрепления клеток к применяемому для культивирования флакону приведет к удалению клеток вместе со средой для роста, что может являться нежелательным в зависимости от применения.
[47] В одном варианте реализации изобретения hb-MSC можно использовать повторно для кондиционирования дополнительной среды путем добавления культуральной среды к hb-MSC после удаления кондиционированной среды. Специалисту в данной области понятно, что число повторных использований клеток зависит от числа часов, затрачиваемых на кондиционирование среды, а также от конфлюэнтности клеток. Следует понимать, что кондиционированную hb-MSC среду, собираемую через различные периоды времени (например, каждые 3, 6, 24, 30, 48, 54, 72, 96, 120, 144, 168, 192, 216, 240, 264, 288, 312 или 366 часов, или какой-либо другой период времени), кондиционированную среду, собираемую путем повторного использования hb-MSC в одном пассаже, или среду, собираемую из разных пассажей hb-MSC, можно объединять с целью получения единой кондиционированной hb-MSC среды. Также следует понимать, что для культивирования hb-MSC другими способами, например, с применением 3D-матрицы или биореактора с мешалкой, может требоваться процесс непрерывной замены среды, и такие способы кондиционирования среды и сбора кондиционированной среды также входят в объем изобретения.
[48] Среды, кондиционированные любой клеткой, могут содержать различные биологические продукты, секретированные, выведенные, высвобожденные или полученные иным путем в процессе культивирования. Например, кондиционированная среда может содержать биологические продукты, такие как факторы роста, противовоспалительные факторы, сигнальные факторы, гормоны, регуляторные факторы, ферменты, везикулы, включая экзосомы, или любые другие соединения. Способ культивирования клеток и рН среды может влиять на тип и количество биологических продуктов, высвобождаемых клетками. Также следует понимать, что концентрация клеток, высеянных изначально, может повлиять на количество биологических продуктов, присутствующих в кондиционированной среде. Также понятно, что добавление дополнительной сыворотки будет влиять на исходную концентрацию факторов в среде до кондиционирования, поскольку сыворотка содержит определенные количества различных биологических продуктов. Измерение концентрации этих факторов в среде, кондиционированной hb-MSC, показывает, что эта среда значительно отличается от среды, кондиционированной rb-MSC. Для измерения концентрации факторов, вырабатываемых клетками, можно использовать коммерчески доступные методы анализа (например, методы анализа, доступные от EMD Millipore или Eve Technologies). Следует понимать, что точное измерение будет зависеть от применяемых в анализе пар антител и, таким образом, фиксируемая концентрация факторов может изменяться в зависимости от метода анализа или применяемой измерительной методики. В Примере 6 описано сравнение концентраций факторов для линий rb-MSC и hb-MSC в определенные периоды времени.
[49] В одном варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при концентрации CO2, соответствующей буферной емкости среды, которая, как правило, определяется производителем среды. Для среды RPMI-1640 рекомендуемая концентрация CO2 составляет 5%. В другом варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при концентрации CO2, сниженной не менее чем на 50% относительно концентрации CO2, соответствующей буферной емкости среды, которая, как правило, определяется производителем среды. В другом варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при атмосферной концентрации CO2 (т.е. 0,03% СО2).
[50] В одном варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при атмосферной концентрации О2 (т.е. 17%). В другом варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при концентрации О2, сниженной ниже 10%. В другом варианте реализации изобретения кондиционированную среду можно получать путем поддержания hb-MSC при концентрации О2, сниженной ниже 2%. Сниженную концентрацию О2 (гипоксические условия) можно применять, например, для имитации среды костного мозга in vivo.
[51] В некоторых вариантах реализации изобретения кондиционированную среду можно применять в концентрированном виде. Например, кондиционированную среду можно концентрировать в 1-100 раз при помощи любого известного в данной области техники способа. Соответствующие необходимые концентрации будут зависеть от применения кондиционированной среды.
[52] В одном варианте реализации изобретения чистую собранную кондиционированную среду дополнительно обрабатывают для добавления/удаления и/или концентрирования/разбавления определенных биологических продуктов. Способы, применяемые для выделения и очистки продукта, следует выбирать так, чтобы сохранить оптимальную биологическую активность. Например, может существовать необходимость в очистке фактора роста, регуляторного фактора, пептидного гормона, антитела, экзосомы или любого другого необходимого биологического соединения. Такие способы включают, но не ограничиваются этим, гель-хроматографию, ионно-обменную хроматографию, металл-хелатную аффинную хроматографию,
высокоэффективную жидкостную хроматографию (ВЭЖХ), хроматографию с гидрофобным взаимодействием или центрифугирование. В другом варианте реализации изобретения экзосомы или любые другие везикулы, присутствующие в кондиционированной среде, можно концентрировать в кондиционированной среде или удалять из кондиционированной среды.
[53] В другом варианте реализации изобретения кондиционированная среда может быть лиофилизирована. Лиофилизированную кондиционированную среду можно восстанавливать при помощи любого подходящего разбавителя, включая, без ограничений, физиологический раствор, фосфатно-солевой буферный раствор, среду для культивирования клеток, кондиционированную среду для культивирования клеток, воду или их смеси. Кондиционированную среду можно восстанавливать в той же концентрации, в которой была исходная кондиционированная среда. В отдельном варианте реализации изобретения лиофилизированную кондиционированную среду можно восстанавливать в более концентрированной форме по сравнению с исходной кондиционированной средой с коэффициентом концентрации в интервале от 1 до 100. Специалисту в данной области техники понятно, что восстановление кондиционированной среды для композиции также может привести к изменению рН, вязкости или других физических свойств, необходимых для конкретного применения.
[54] Линию hb-MSC можно применять для кондиционирования широкого спектра культуральных сред. В некоторых вариантах реализации изобретения культуральную среду также можно обогащать дополнительной фетальной сывороткой и/или плазмой крови. В одном варианте реализации изобретения среду кондиционируют в присутствии 20% ФБС. В другом варианте реализации изобретения среду кондиционируют в присутствии 10% ФБС. В другом варианте реализации изобретения среду кондиционируют в присутствии 7% ФБС. В другом варианте реализации изобретения среду кондиционируют в присутствии 3% ФБС. В альтернативном варианте реализации изобретения среду кондиционируют в отсутствие ФБС. В других вариантах реализации изобретения после того, как клетки достигают определенной конфлюэнтности, можно использовать сниженную концентрацию сыворотки или безсывороточную среду в качестве замены для образования низкосывороточной или безсывороточной кондиционированной среды.
[55] Другой вариант реализации настоящего изобретения относится к композициям hb-MSC. Композиции hb-MSC могут содержать терапевтически эффективные количества hb-MSC, кондиционированной hb-MSC среды или их комбинаций, при этом количество будет варьироваться в зависимости от желаемого применения. В другом варианте реализации изобретения в композиции можно применять лиофилизированную кондиционированную hb-MSC среду. Общее количество кондиционированной hb-MSC среды в композиции следует выбирать таким образом, чтобы композиция была эффективной в отношении желаемого применения, и оно может варьироваться от 0,00001 до 99,99% в соотношении масса-объем. Варианты реализации композиции hb-MSC могут дополнительно содержать: (1) один или более терапевтических агентов; (2) другие агенты, добавки или ингредиенты, описанные в данном документе; и/или (3) один или более приемлемых носителей.
[56] Варианты реализации композиции hb-MSC могут содержать кондиционированную hb-MSC среду в комбинации с hb-MSC, rb-MSC или другими клетками, выбранными, на основании применения/назначения среды или композиции. Например, клетки, которые можно добавлять к композиции hb-MSC, могут включать аутологичные клетки, аллогенные клетки или ксеногенные клетки.
[57] В определенных вариантах реализации изобретения композиция hb-MSC может содержать hb-MSC или кондиционированную hb-MSC среду в комбинации с любой другой кондиционированной средой или любой комбинацией кондиционированных сред в любом необходимом соотношении. Композиция hb-MSC может также содержать hb-MSC или кондиционированные hb-MSC среды в комбинации со средами, кондиционированными аутологичными клетками, аллогенными клетками или ксеногенными клетками. В другом примере кондиционированные hb-MSC среды можно комбинировать со средами, кондиционированными человеческими мезенхимальными стволовыми клетками.
[58] В одном варианте реализации изобретения композиция hb-MSC может содержать один или более противомикробных агентов, эффективных против бактерий и других микроорганизмов, включая вызывающие мастит патогены. Композиция hb-MSC также может содержать пленкообразующий агент, который формирует стабильную и сплошную защитную барьерную пленку над целевым участком применения, защищает целевой участок от физического воздействия патогенов или других микроорганизмов в течение заданного периода времени и может действовать как слой с контролируемым высвобождением определенных активных ингредиентов. Варианты реализации композиции hb-MSC могут иметь немедленное и/или длительное действие, в частности, когда композиция содержит как антибактериальный, так и пленкообразующий агенты. Варианты реализации композиции hb-MSC также могут содержать один или более из следующих агентов, добавок или ингредиентов: буферизирующий или регулирующий рН агент, консервант, кондиционирующий агент для кожи, сурфактант, пенообразующий агент, модификатор вязкости, краситель или замутнитель, хелатирующий агент, приемлемый носитель и/или любые их комбинации.
[59] Специалисту в данной области техники понятно, что ингредиенты и их эффективные количества следует выбирать так, чтобы гарантировать продолжительную эффективность и жизнеспособность ингредиентов, в частности, в отношении кондиционированной стволовыми клетками среды, любого пленкообразующего агента и/или любого противомикробного агента. Например, если добавление ингредиента приводит к денатурации биологических материалов кондиционированной стволовыми клетками среды, данный конкретный ингредиент не может быть хорошим кандидатом для конкретного состава композиции. Аналогично, добавление конкретного ингредиента не должно препятствовать образованию стабильной и сплошной защитной барьерной пленки на целевом участке (если композиция содержит пленкообразующий агент) и, в определенных вариантах реализации изобретения, не должно делать пленку небезопасной для потребления животным или человеком.
[60] В одном варианте реализации изобретения композиция hb-MSC может содержать один или более противомикробных агентов. Если не указано иное, употребляемый в данном документе термин «противомикробный» относится к действию, которое направлено на уничтожение или способствует уничтожению микроорганизмов или ингибирует их рост, и включает, например, антибактериальное, противогрибковое, антисептическое, противовирусное, бактерицидное или бактериостатическое действие. В данной заявке термин «противомикробный агент» относится к противомикробным агентам, которые применяют для лечения субъекта. В противоположность этому, как понятно специалисту в данной области техники, «консервант» (обсуждается ниже) применяют, чтобы предотвращать заражение композиции, например, бактериями, вирусами, микоплазмой или грибками.
[61] Примеры противомикробных агентов, которые можно применять в вариантах реализации композиции hb-MSC включают: аминогликозид (например, неомицин), тетрациклин (например, доксициклин), β-лактамы (например, амоксициллин, цефалексин), препараты пептидной природы (например, бацитрацин), препараты гликопептидной природы (например, ванкомицин) лантибиотики (например, анковерин, циннамицин, дурамицин, эпидермин, галлидермин, гардимицин, низин), полимиксины (например, колистин), колицины, микроцины, ферментные антибактериальные препараты (например, лизостафин), фторхинолоны (например, ципрофлоксацин), хлоргексидин, 2-бром-2-нитро-1,3-пропандиол (бронопол) или дополнительные противомикробные агенты с учетом применения. Композиция hb-MSC должна содержать терапевтически эффективное количество одного или более противомикробных агентов, количество которых будет варьироваться в зависимости от класса противомикробного препарата и желаемого применения, но каждый противомикробный агент в общем случае должен находиться в диапазоне от около 0,001% до около 1,0% в соотношении масса-объем (м/об). Следует понимать, что производные и структурные аналоги раскрытых выше противомикробных агентов также включены в объем изобретения. Также следует отметить, что в определенных вариантах реализации изобретения композиция hb-MSC может содержать два или более противомикробных агентов.
[62] В одном варианте реализации изобретения композиция hb-MSC содержит в качестве противомикробного агента низин. Низин представляет собой короткий нетоксичный пептид (лантибиотик), который оказывает бактерицидное действие на многие грамположительные организмы, включая бактерии, отвечающихе за мастит крупного рогатого скота, такие как Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis. Низин также может оказывать бактерицидное действие на некоторые грамотрицательные организмы, в частности, в комбинации с хелатирующим агентом, таким как этилендиаминтетрауксусная кислота (ЭДТА). Композиция hb-MSC может содержать терапевтически эффективное количество низина, например, от 0,001 до около 0,01% (масса/объем).
[63] В одном варианте реализации изобретения композиция hb-MSC также может содержать один или более пленкообразующих агентов, которые формируют стабильную и сплошную пленку или барьер над целевым участком применения (таким как сосок или вымя коровы) и защищают целевой участок от физического воздействия патогенов в течение заданного периода времени. Пленкообразующий агент также может формировать барьер в открытом конце соскового протока, чтобы помочь остановить проникновение вызывающих мастит патогенов. Кроме того, пленкообразующий агент в композиции hb-MSC может действовать как слой с контролируемым высвобождением, продлевая действие кондиционированной среды, любого противомикробного препарата или других агентов, если такие агенты включены в композицию. Включение пленкообразующего агента в композицию hb-MSC может снизить заболеваемость как контагиозным, так и неконтагиозным маститом в молочных стадах.
[64] Композиции в соответствии с настоящим изобретением также могут содержать один или более модификаторов вязкости для регулировки вязкости композиции. Следует понимать, что добавление пленкообразующих агентов может модифицировать вязкость композиции hb-MSC. Модификация вязкости композиции может оказаться благоприятной для применения на целевом участке, например, при использовании раствора для обработки сосков. Хотя все приведенные ниже материалы можно использовать как в целях пленкообразования, так и модификации вязкости, качество пленки, образуемой на целевом участке не обязательно должно коррелировать со свойством материала модифицировать вязкость. Типовые пленкообразующие/модифицирующие вязкость агенты включают производные целлюлозы (например, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиэтилцеллюлозу или карбоксиметилцеллюлозу), поливинилпирролидон, акрилатные полимеры, поливиниловый спирт (ПВС), силиконы, латексы, камеди (например, ксантановая камедь, гуаровая камедь, аравийская камедь, камедь сосны Йохана), крахмалы и производные крахмала (например, гидроксиэтиловый крахмал), арабиноксиланы, глюкоманнаны, глицерин, альгинат натрия или их смеси, производные и структурные аналоги. Следует понимать, что перекрестное связывание описанных выше полимеров входит в объем настоящего изобретения. В одном варианте реализации изобретения пленкообразующим агентом является метилцеллюлоза в концентрации в диапазоне от 0,1% до 1,5% (масса/объем).
[65] Специалисту в данной области техники понятно, что химический состав модифицирующего вязкость агента будет зависеть от желаемого применения. Например, для применений, связанных с маститом, может быть желательно использовать водорастворимые добавки для облегчения удаления композиции с соска и/или вымени перед доением. В другом примере можно использовать нерастворимую в воде добавку, чтобы предотвратить удаление композиции hb-MSC при промывании водой. В другом варианте реализации изобретения композиция hb-MSC может (но не обязательно) содержать материалы, в общем случае считающиеся безопасными (GRAS) или разрешенными пищевыми добавками.
[66] Количество пленкообразующих агентов и контролирующих вязкость агентов в композиции hb-MSC можно корректировать с учетом конкретного применения. Например, в случае местных противомаститных применений количество пленкообразующих агентов и контролирующих вязкость агентов в композиции должно быть достаточным для образования стабильной и сплошной пленки или барьера над целевым участком применения. Аналогично, специалисту в данной области техники понятно, что в определенных композициях, таких как инъецируемые композиции, композиция не должна содержать каких-либо контролирующих вязкость или пленкообразующих агентов. А в случае других применений, таких как средства личной гигиены, применимы композиции промежуточной или средней вязкости. Каждый из пленкообразующих агентов и контролирующих вязкость агентов можно применять на уровне, составляющем от 0 до около 5% (м/об), или от около 0,01 до около 2% (м/об), или от около 0,05 до около 1% (м/об), и они используются для создания вязкости, составляющей приблизительно от 2 до 5000, от 10 до 1000 или от 25 до 500 сП. При этом специалисту в данной области техники понятно, что композиции можно составлять для широкого спектра применений путем изменения количества контролирующих вязкость агентов.
[67] В варианты реализации композиции hb-MSC можно добавлять сурфактанты, помогающие составить композицию для конкретного окружения или применения. Сурфактанты также могут помочь повысить общие моющие свойства состава, солюбилизировать или эмульсифицировать некоторые органические ингредиенты, которые бы в ином случае не растворились или не эмульсифицировались, и облегчить проникновение активных ингредиентов в предназначенный для применения целевой участок, например, кожу или соски молочных коров. В некоторых вариантах реализации изобретения сурфактанты можно использовать, чтобы способствовать образованию наночастиц или везикул, которые относятся к одному варианту реализации композиции hb-MSC согласно настоящему изобретению, что может улучшить проникновение композиции в поверхность целевого участка. Варианты реализации композиции hb-MSC могут включать один или более сурфактантов, каждый в количестве от 0,01% до 6% (м/об). Подходящие сурфактанты включают, но не ограничиваются этим, одно или более из следующих соединений: полисорбаты (серия Твин), октилфеноксиполиэтоксиэтанол (серия Тритон-Х), полоксамеры (ПЛЮРОНИК F-68), глюкозиды (например, н-октил, лаурил или н-децил), катионные агенты (например, лаурамин оксид); цвиттерионные агенты (например, кокамидопропилбетаины), жирные кислоты, глицериды, моноглицериды (например, монолаурат глицерина), дезоксихолат и эфиры дезоксихолата, а также их смеси, производные и структурные аналоги. В одном варианте реализации изобретения сурфактантом является Тритон Х-100 (от 0,01 до 1% м/об).
[68] В некоторых вариантах реализации изобретения функция сурфактанта может заключаться в уменьшении поверхностного натяжения композиции или повышении коллоидной стабильности композиции, которая приводит к пенообразованию. Подходящие пенообразующие агенты включают лауретсульфат натрия, лаурилсульфат натрия или лаурилсульфат аммония. В другом варианте реализации изобретения можно добавлять противопенный агент для разрушения или дестабилизации пенных мицелл. Подходящие противопенные агенты могут включать противопенные вещества на основе силикона, такие как симетикон. Следует понимать, что в данной заявке термин «пенообразующие агенты» включает как пенообразующие, так и противопенные агенты.
[69] В одном варианте реализации изобретения композиция hb-MSC может содержать один или более хелатирующих агентов, таких как, например, этилендиаминтетрауксусная кислота (ЭДТА) и/или ее щелочные соли, которые при применении в комбинации с противомикробным агентом могут повышать эффективность против грамотрицательных бактерий. Другие хелатирующие агенты, которые можно применять, включают, например, другие алкилдиамин тетраацетаты, а также этиленгликоль-бис(β-аминоэтил эфир)-N,N,N',N'-татрауксусную кислоту (ЭГТА), аспарагиновую кислоту и лимонную кислоту, а также их смеси, производные и структурные аналоги. В общем случае каждый хелатирующий агент может составлять от 0,005% до около 1,00% (м/об), но в случае необходимости для применения можно использовать и другие количества. Хелатирующие агенты можно использовать по отдельности или в виде комбинации из нескольких хелатирующих агентов. В одном варианте реализации изобретения хелатирующим агентом является ЭДТА в концентрации от 0,03% до 0,3% (м/об).
[70] Также в композициях hb-MSC можно, необязательно, использовать один или более кондиционирующих агентов для кожи, таких как смягчающие и увлажняющие средства, чтобы сделать кожу более мягкой и эластичной. Такие кондиционирующие агенты также помогают повышать проницаемость кожи, пополнять количество масел и жиров, стимулировать сохранение влаги в коже и помогают предотвратить повреждение кожи вследствие неблагоприятных погодных/окружающих условий или механического повреждения. В применениях, связанных с маститом, механическое повреждение может быть вызвано, например, применением автоматического доильного аппарата. Варианты реализации композиции hb-MSC могут включать один или более кондиционирующих агентов для кожи, каждый в количестве от 0,1% до 30% (м/об). Примеры кондиционирующих агентов для кожи включают один или более из глицерина, пропиленгликоля, полиэтиленгликоля, минерального масла, вазелина, сорбита, лактилата или смесей, производных и структурных аналогов этих агентов. Другие кондиционирующие агенты для кожи могут включать один или более из D-пантенола, гиалуроновой кислоты, поликватерниума-7, стеариновой кислоты, аминокислот шелка, алоэ вера, масла ши и кокосового масла. В одном варианте реализации изобретения кондиционирующим агентом для кожи является глицерин в концентрации от около 1,0% до около 12% (м/об). В другом варианте реализации изобретения кондиционирующим агентом для кожи является гиалуроновая кислота в концентрации от около 0,02% до около 3,0% (м/об). Следует понимать, что в некоторых случаях кондиционирующий агент для кожи также можно применять в качестве носителя (например, в кремах), и в таком случае концентрация материала носителя может составлять до 99%. Специалисту в данной области техники понятно, что также можно применять другие известные кондиционирующие агенты для кожи как часть одного или более вариантов реализации композиции согласно настоящему изобретению. Специалисту в данной области техники также понятно, что в определенных применениях, таких как лечение ран, композиция не должна обязательно содержать какие-либо кондиционирующие агенты для кожи.
[71] Варианты реализации композиции hb-MSC также могут содержать эффективное количество дополнительных ингредиентов, таких как один или более солнцезащитных, устраняющих зуд или обезболивающих агентов. Они включают, но не ограничиваются этим, диоксид титана, оксид цинка, каламин, мяту, ментол, камфору, антигистамины (например, дифенгидрамин), кортикостероиды (например, дексаметазон, гидрокортизон) или местные анестетики (например, лидокаин).
[72] рН композиции hb-MSC можно регулировать путем добавления кислых, основных или буферизирующих компонентов. В случае мастита и заживления ран рН композиции hb-MSC следует выбирать так, чтобы гарантировать продолжительную эффективность и жизнеспособность ингредиентов, в частности, в отношении кондиционированной стволовыми клетками среды, пленкообразующего агента и/или противомикробного агента. В одном варианте реализации изобретения рН раскрытой композиции составляет от 6,5 до 7,5. Любой буферизирующий или регулирующий рН агент, совместимый с применением кондиционированной стволовыми клетками средой, можно применять в качестве буфера в композиции hb-MSC. Примеры подходящих регулирующих рН агентов включают, но не ограничиваются этим, лимонную кислоту, карбонат натрия или бикарбонат натрия, ацетат натрия, дигидрофосфат натрия, гидрофосфат натрия, фосфат натрия и трис(гидроксиметил)-аминометан, борную кислоту или их смеси. Как обсуждалось выше, культуральная среда, применяемая для роста клеток, также может служить буфером. Другим буфером, который можно применять, является фосфатно-солевой буфер.
[73] В дополнительном варианте реализации изобретения композиция может содержать изотонический агент, такой как, например, соль (например, хлорид натрия), сахар или сахарный спирт, аминокислоту (например, L-глицин, L-гистидин, аргинин, лизин, изолейцин, аспарагиновую кислоту) или их смеси, производные и структурные аналоги. Любой сахар или сахарный спирт может включать фруктозу, глюкозу, маннозу, сорбозу, ксилозу, манит, сорбит, галактит, ксилит и арабит. Вышеуказанные сахара или сахарные спирты можно применять отдельно или в комбинации. Не существует фиксированного ограничения на применяемое количество до тех пор, пока сахар или сахарный спирт может растворяться в жидком препарате и не оказывает вредного воздействия на стабилизирующий эффект, достигаемый при помощи способов согласно изобретению. В общем случае каждый изотонический агент может составлять от около 0,001% до около 5,00% (м/об), но в случае необходимости для применения можно использовать другие количества. В одном варианте реализации изобретения изотоническим агентом является хлорид натрия в концентрации от около 0,05% до около 1,5% (м/об).
[74] В композиции hb-MSC необязательно включен краситель, пигмент или замутнитель. В применениях, связанных с контролем мастита, окрашивание целевого участка (например, соска) обеспечивает наличие визуального индикатора применяемого лечения. Примеры подходящих красителей включают, но не ограничиваются этим, любые разрешенные искусственные пищевые красители, такие как FD&C Blue №1, FD&C Green №3, FD&C Red №40, FD&C Yellow №5 и FD&C Yellow №6 или их смеси. В другом варианте реализации изобретения можно использовать пигменты FD&C, чтобы обеспечить суспензию красителя в композиции. В одном варианте реализации изобретения диоксид титана (TiO2) можно применять в комбинации с разными красителями. В другом варианте реализации изобретения краситель может присутствовать в виде микрогранулы или микросферы, которая может быть флуоресцентной. В общем случае краситель добавляют в самом низком возможном количестве, которое позволяет применение.
[75] В одном варианте реализации изобретения композиция hb-MSC содержит приемлемый носитель. Приемлемый носитель может иметь форму, например, жидкости, вязкой жидкости, крема, аэрозоля, лосьона, мази или гидрогеля. В другом варианте реализации изобретения композиция hb-MSC может быть заключена в частицы от нано- до микроразмера. Специалисту в данной области техники понятно, что носители могут включать водные вспомогательные вещества (такие как культуральные среды или вода), неводные вспомогательные вещества, масла, стандартные жирные вещества, традиционные желирующие агенты, суспендирующие агенты, эмульсификаторы и гидрофильные или липофильные активные агенты. Конечно, специалисту в данной области техники понятно, что «приемлемый носитель» может включать смесь двух или более носителей и/или их ингредиентов. Количества этих ингредиентов будут варьироваться в зависимости от применения композиции hb-MSC и желаемого действия. Например, носитель можно добавлять для достижения или усиления желаемого действия других добавок/агентов в композиции, таких как противомикробный агент, пленкообразующий агент или кондиционированная среда. Следует понимать, что приемлемые носители также могут выполнять функциональную роль (например, кондиционирующих агентов для кожи). Эту двойную функцию можно использовать в целях получения состава для конкретного применения. Носитель также можно использовать, чтобы разбавлять или солюбилизировать компоненты композиции. В частности, пленкообразующие агенты (такие как метилцеллюлоза), как правило, составляют от 1 до 2 массовых процентов по отношению к объему водного компонента. В одном варианте реализации изобретения композиция содержит по меньшей мере около 10% материала носителя на основании м/об. В дополнительном варианте реализации изобретения композиция содержит по меньшей мере около 50% материала носителя на основании м/об. В других вариантах реализации изобретения приемлемый носитель составляет по меньшей мере около 75% композиции на сновании м/об. В другом варианте реализации изобретения приемлемый носитель составляет от около 90 до 99% композиции на сновании м/об.
[76] В одном варианте реализации изобретения композиции hb-MSC можно предохранять от заражения бактериями, вирусами, микоплазмой или грибками путем применения стерильных условий обработки во время культивирования и обработки клеток. В другом варианте реализации изобретения композиции hb-MSC могут содержать один или более консервантов в количестве, которое эффективно обеспечивает уровень противомикробной активности в композиции или снижает разрушение противомикробных средств (или других добавок) в композиции. В некоторых вариантах реализации изобретения консерванты могут ограничивать вторичные бактериальные, микотические или амебные инфекции, причиной которых является заражение растворов. В других вариантах реализации изобретения добавление консервантов продлевает срок годности hb-MSC, кондиционированных hb-MSC сред или композиции hb-MSC путем предотвращения биодеградации и поддержания эффективности. В одном примере консерванты могут включать детергенты, оксиданты, хелатирующие агенты или ингибиторы метаболизма, включая пятивалентные препараты сурьмы, четвертичный аммоний и ртутьорганические соединения. Другие примеры консервантов включают тимеросал, крезолы, формалин, бензалкония хлорид, парабен, метилпарабен или этилпарабен, карбоновые кислоты и соли карбоновых кислот, спирты или их смеси, производные и структурные аналоги. В вариантах реализации изобретения спирт может быть этиловым спиртом, изопропиловым спиртом или бензиловым спиртом. В общем случае один или более консервантов могут каждый составлять от 0,0001% до около 5,00% (м/об), но в случае необходимости для применения можно использовать другие количества. В одном варианте реализации изобретения консервантом является бензалкония хлорид в концентрации от около 0,0001% до около 0,01% (м/об). В другом варианте реализации изобретения консервантом может быть этиловый спирт в концентрации от около 0,1% до около 1,5% (м/об).
[77] В других вариантах реализации изобретения композиция hb-MSC может быть дополнительно обогащена дополнительными противовоспалительными агентами, анальгетиками, противогрибковыми препаратами, витаминами, солнцезащитными средствами, агентами для борьбы со свободными радикалами, секвестрирующими агентами, ароматизаторами, филлерами, натуральными продуктами и экстрактами из натуральных продуктов. Добавки могут включать небольшие органические молекулы, металлоорганические соединения, полимеры, неорганические соли, белки, факторы роста, хемокины, ДНК, РНК или ферменты. В дополнительных вариантах реализации изобретения среда может быть обогащена сахарами, белками, инсулином, сигнальными белками или любыми дополнительными небольшими молекулами, включая ароматизаторы или подсластители. Добавки могут также содержать небольшие количества дополнительных веществ, таких как вещества, повышающие изотоничность и химическую стабильность.
[78] В одном варианте реализации изобретения получение композиции hb-MSC включает растворение или смешивание необходимой концентрации противомикробных агентов и/или пленкообразующих агентов в приемлемом носителе. Также можно добавлять дополнительные ингредиенты, такие как буферизирующие или регулирующие рН агенты, консерванты, кондиционирующие агенты для кожи, сурфактанты, пенообразующие агенты, модификаторы вязкости, красители или замутняющие агенты и/или хелатирующие агенты. При необходимости раствор смешивают, например, после добавления одного или более ингредиентов. Композиция hb-MSC может содержать как твердые, так и жидкие ингредиенты. Специалисту в данной области техники понятно, что некоторые ингредиенты можно добавлять в емкость для смешивания в одно и то же время, в то время как другие ингредиенты можно растворять или смешивать в отдельной емкости, а затем добавлять в раствор вместе с оставшимися ингредиентами. Хотя это не является обязательным, кондиционированную hb-MSC среду рекомендуется добавлять в композицию в самом конце. Кондиционированную hb-MSC среду готовят в соответствии с раскрытыми выше способами, которые дополнительно описаны ниже в Примерах. Также рекомендуется брать пробу раствора перед добавлением кондиционированной стволовыми клетками среды, чтобы проверить его рН и другие индикаторы, чтобы гарантировать, что такая комбинация не будет оказывать негативного воздействия на кондиционированную стволовыми клетками среду, например, денатурировать биологический материал среды как следствие слишком высокого или слишком низкого рН. При необходимости рН раствора можно дополнительно регулировать путем добавления регулирующего рН агента. После добавления кондиционированной стволовыми клетками среды раствор снова смешивают, чтобы получить композицию. Следует понимать, что определенные ингредиенты, например, консервант и сурфактант, можно добавлять в кондиционированную стволовыми клетками среду до соединения среды с раствором, содержащим оставшиеся ингредиенты. После смешивания ингредиентов можно определить и при необходимости дополнительно скорректировать вязкость, рН и другие свойства.
[79] Раскрытые в данном документе композиции можно применять в разных целях, включая, но не ограничиваясь этим, любые исследовательские, диагностические, терапевтические или коммерческие цели. Варианты реализации композиции можно также применять для лечения широкого спектра патологических состояний, включая, например, лечение ожогов, уход за кожей, ангиогенез, васкулогенез, заживление органов или тканей, косметические средства, воспаление тканей, бактериальные инфекции, заживление ран, диабет, фармацевтические и офтальмологические применения, снижение рубцевания, стимулирование роста волос, иммунотерапевтические применения и иммунокоррекционную терапию, трансплантацию кожи, костного мозга или органов, лечение органов или тканей, или для лечения других заболеваний людей или животных. В контексте данного документа «лечить» включает лечение, реабилитацию, улучшение, снижение тяжести или сокращение времени протекания заболевания, расстройства или патологического состояния, или любого его показателя или симптома. Следует понимать, что hb-MSC или кондиционированную hb-MSC среду можно применять в тех же или сходных целях, что и композицию hb-MSC.
[80] Композицию hb-MSC также можно использовать для дерматологических или косметических применений, в пищевых добавках или кормовых добавках для животных, для культивирования клеток и в фармацевтических применениях. Композицию hb-MSC можно использовать для профилактического лечения, в ответ на острые повреждения или для лечения хронических повреждений. В одном варианте реализации изобретения композицию hb-MSC можно использовать для лечения человеческих заболеваний или патологических состояний. В другом варианте лечение может включать ветеринарные применения.
[81] В одном варианте реализации изобретения композицию hb-MSC можно с успехом применять в лечении ран, включая острые и хронические раны, переломов костей, повреждений спинного мозга, язвы желудка или диабетической язвы, поджелудочной железы, печени, почек, селезенки, повреждений кровеносных сосудов и других внутренних или внешних ран, а также в заживлении ожогов. Например, композицию hb-MSC можно использовать для местного применения для стимуляции и/или ускорения заживления ран, как описано в Примерах 7, 8, 10 и 11 и показано на ФИГ. 4 и 5. В другом варианте реализации изобретения композицию hb-MSC можно использовать для лечения ран, которые в ином случае требовали бы хирургического вмешательства или дренажа. Например, композиция hb-MSC может обеспечивать повышенную перфузию ткани раны.
[82] Композицию hb-MSC можно использовать в косметическом лечении кожи, включая лечение морщин, межбровных морщин, рубцевания или для восстановления других кожных патологических состояний, например, вызванных вредным воздействием, индуцированным УФ-светом, и нормальным старением.
[83] В одном варианте реализации изобретения композицию hb-MSC применяют для лечения или профилактики мастита у коров. Применение композиции hb-MSC также может приводить к восстановлению или регенерации структурных повреждений молочной железы после мастита. В этом варианте реализации изобретения способ применения композиции hb-MSC включает, но не ограничивается, местным применением композиции hb-MSC на коже соска (или вымени) коровы через заданные интервалы, например, после каждого цикла доения. В профилактическом режиме композицию hb-MSC применяют в отношении всего стада в течение неопределенного времени. Конечно, композицию hb-MSC также можно применять (как профилактически, так и для лечения мастита) в течение заданного периода времени, после которого следует период, в течение которого композицию не применяют. Варианты реализации композиции также можно применять как часть регулярного курса лечения мастита, включая лечение антибиотиками. Например, один способ лечения мастита включает периодическое применение композиции hb-MSC и, если корова инфицирована или инфицируется маститом, лечение этой коровы при помощи курса антибиотиков, прописанных ветеринарным специалистом. Композиция может демонстрировать синергетический эффект при применении с некоторыми типовыми видами лечения мастита. В другом варианте реализации изобретения способ лечения мастита может включать способ лечения коровы композицией hb-MSC без применения антибиотиков, и, таким образом, можно избежать необходимости отбраковывать молоко из-за системного наличия в нем антибиотиков. В другом варианте реализации изобретения способ лечения мастита включает применение первой композиции hb-MSC для лечения коров, у которых был диагностирован мастит, и применение второй композиции hb-MSC в профилактических целях. Например, вторую композицию hb-MSC можно применять к здоровым коровам во время сухостойного периода. Следует понимать, что первую и вторую композиции можно применять разными способами. Например, первая композиция hb-MSC может содержать пленкообразующий агент и ее применяют местно, в то время как вторая композиция hb-MSC не содержит пленкообразующий агент и ее применяют перорально или путем инъекции. В другом варианте реализации изобретения первую и вторую композиции hb-MSC можно применять в одно время по отношению к одному животному, например, животному, страдающему от клинического мастита. В дополнительном варианте реализации изобретения способ лечения может включать один или более этапов, включая этап лечения вариантом реализации композиции hb-MSC и второй вид лечения традиционным средством против мастита (таким как раствор для обработки сосков на основе йода).
[84] В применениях, связанных с маститом, композицию можно применять, например, при помощи «стакана-окунателя» - термин, который в данной индустрии используют для обозначения емкости с открытым верхом, заполненной композицией, при этом соски коровы окунают в композицию после завершения процесса доения. Стакан-окунатель сконструирован так, чтобы сосок животного проходил в открытую часть, но, в то же время, чтобы предотвратить проливание композиции. Композицию также можно применять путем распыления на кожу животного, например, используя аэрозольный баллончик. Композицию не обязательно вытирать с кожи животного после лечения и, если композиция содержит пленкообразующий агент, композицию не следует вытирать, пока в этом не возникнет необходимости. В данном случае термин «применять» или «применяемый» следует воспринимать в широком смысле. Таким образом, кроме раскрытых выше способов местного применения, композицию можно применять местным образом при помощи кисточки, намазывания, покрытия пеной или другими способами, которые приемлемы в молочной индустрии, например, при помощи влажной губки, содержащей композицию. Выражение «местный» также часто относится к композициям, применяемым как ополаскиватели для рта.
[85] Специалисту в данной области техники понятно, что доставка композиции hb-MSC не ограничена местными применениями; в зависимости от применения композицию можно доставлять любым известным в данной области техники способом, включая, но не ограничиваясь этим, энтеральный путь, включая пероральный, буккальный, подъязычный, ректальный, или парентеральный путь, включая внутривенный, подкожный, интрадермальный, трансдермальный, внутримышечный, внутрибрюшинный, ингаляционный, внутриартериальный, интратекальный, в виде интрацистернальной инфузии, или местное применение кожным, трансдермальным, назальным или офтальмическим путем. Как понятно специалисту в данной области техники, составление композиции может меняться в зависимости от способа введения и конкретного применения. Например, если композиция предназначена для внутривенного или внутримышечного применения, композиция не должна содержать пленкообразующий агент. В дополнительном варианте реализации изобретения можно получить композицию hb-MSC для применения в средах с контролируемым замедленным высвобождением.
[86] Следует понимать, что фактические предпочтительные количества, режимы введения и интервалы введения композиции hb-MSC в каждом конкретном случае будут варьироваться в зависимости от конкретной применяемой композиции, конкретных полученных композиций, режима применения, конкретного повреждения и субъекта, подлежащего лечению. Дозы определенных ингредиентов в каждом конкретном случае можно определять, учитывая традиционные факторы, например, при помощи традиционного фармакологического протокола.
[87] Композицию hb-MSC можно применять в любой форме. Например, композиция hb-MSC может иметь форму таблеток, капсул, кожных пластырей, ингаляторов, глазных капель, капель в нос, ушных капель, жидкостей для промывания, суппозиториев, лосьонов, кремов, мазей, инъекций, гелей, гидрогелей, пен, тонких пленок, порошков, сыворотки, бальзамов, кремов-основ, масок для лица, средств для ухода за губами, солнцезащитных средств, средств по уходу за волосами, таких как шампуни, кондиционеры, включая кондиционеры глубокого действия, процедур по уходу за волосами, средств для очищения кожи, отшелушивателей, компактных средств или любые другие подходящие формы, известные специалисту в данной области техники.
[88] В некоторых вариантах реализации изобретения композицию hb-MSC можно применять для покрытия швов, медицинского оборудования или устройств для имплантации. В другом варианте реализации изобретения композицию hb-MSC можно комбинировать с шовными материалами, бандажами, имплантатами, стентами, трансплантатами или использовать в периодонтальных применениях. Композицию hb-MSC также можно применять во влажных салфетках. Композицию hb-MSC также можно добавлять в качестве филлера для ран или добавлять в существующие композиции для заполнения ран для ускорения заживления ран. В другом варианте реализации изобретения композицию hb-MSC можно добавлять в тени для век, прессованные средства макияжа, компактные пудры или другие косметические средства.
[89] В дополнительных вариантах реализации изобретения жидкие препараты композиции hb-MSC могут иметь форму, например, растворов, сиропов или суспензий, или быть представлены в виде сухого продукта для восстановления приемлемым носителем перед использованием.
[90] В другом варианте реализации изобретения композицию hb-MSC можно замораживать на заданный период времени. В альтернативном варианте композицию hb-MSC можно лиофилизировать и замораживать на заданный период времени. В альтернативном варианте композицию hb-MSC можно восстанавливать, как описано выше, и замораживать на заданный период времени. В альтернативном варианте композицию hb-MSC можно хранить или держать при температуре от комнатной температуры (например, около 28°С) и до 0°С. Данный температурный диапазон не является единственным, а специалист в данной области техники может определить альтернативные диапазоны температур, используемые в зависимости от характера применения.
[91] В другом варианте реализации изобретения композицию hb-MSC можно доводить до комнатной температуры перед применением. В альтернативном варианте композицию hb-MSC можно применять при температуре ниже комнатной температуры. В альтернативном варианте композицию hb-MSC можно применять при температуре выше комнатной температуры, пока температура не настолько высока, чтобы денатурировать биологический материал.
ПРИМЕРЫ
[92] Следующие примеры включены, чтобы продемонстрировать определенные варианты реализации изобретения. Если не указано иное, количества ингредиентов приведены на основании процентной доли м/об относительно всей композиции. Специалистам в данной области техники следует понимать, что раскрытые ниже в примерах методики представляют методики, разработанные авторами изобретения, при помощи которых можно реализовать на практике один или более вариантов реализации изобретения. При этом специалистам в данной области техники следует понимать, что в свете настоящего описания в нижеприведенные примеры можно вносить многочисленные изменения, не отступая от сути и объема изобретения.
Пример 1 - Определение вида для клеток hb-MSC
[93] Для подтверждения того, что клетки действительно принадлежат крысам, применяли ПЦР-анализ. В ПЦН-анализе использовали гены СОХ-1 и VN1R1 для митохондриальной и ядерной ДНК, соответственно. Амплификацию гена СОХ-1 проводили, используя мультиплексную ПЦР, в то время как амплификацию гена VN1R1 проводили, используя стандартную ПЦР. Образцы крови, полученные от 38-летнего мужчины, 32-летней женщины и крысы линии Вистар использовали в качестве контроля. ДНК выделяли из культуры клеток, используя коммерчески доступный набор (PREP-GS-GENETICS, DNA Technology, Russia), в соответствии с инструкциями производителя. Все праймеры являются коммерчески доступными и были приобретены у Evrogen, LLC.
[94] Специфическими праймерами, применяемыми для ПЦР-анализа, были:
- COX1-человеческий: 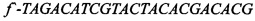 и
и
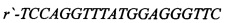 .
.
- COX1-крысиный: 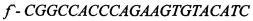 и
и
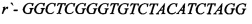 .
.
- VN1R1-человеческий: 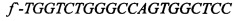 и
и
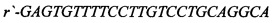 .
.
- VN1R1-крысиный: 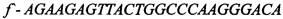 и
и
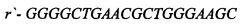 .
.
[95] Электрофорез продуктов ПЦР проводили в 2% агарозном геле при помощи системы для электрофореза SubCellGT (Bio-Rad). Гель визуализировали, используя трансиллюминатор ECX-F15.C (VИber Lourmat). Электрофореграммы показаны на ФИГ. 3. В частности, на ФИГ. 3 на дорожках 1-5 показаны пары оснований гена СОХ1. На дорожке 1 показан результат для контрольной человеческой ДНК, в то время как на дорожке 2 показан результат для контрольной крысиной ДНК. На дорожках 3 и 4 показы результаты для образцов hb-MSC. На дорожке 5 показан отрицательный контроль. На дорожках 7-10 показаны пары оснований гена VN1R1. На дорожке 10 показана смесь контрольных ДНК человека и крысы. На дорожках 9 и 7 показаны результаты для образцов hb-MSC. На дорожке 8 представлен отрицательный контроль. «М» означает дорожку маркера фрагмента ДНК. Электрофорез подтверждает, что hb-MSC были выделены из крыс и не содержат материала из человеческих клеток.
Пример 2 - Культивирование rb-MSC
[96] Культивировали крысиные мезенхимальные стволовые клетки, полученные в стандартных условиях, и оценивали, чтобы показать разницу между уникальной выделенной линией hb-MSC и обычными крысиными мезенхимальными стволовыми клетками (rb-MSC).
[97] Как линию rb-MSC, так и линию hb-MSC выделяли из первичных клеток, полученных из костного мозга большеберцовой или бедренной кости крыс линии Вистар. Культивирование всех клеток происходило в условиях GMP. В одном варианте реализации изобретения процедура получения первичных клеток заключается в следующем. Животных анестезировали и умерщвляли. В стерильных условиях у каждой крысы удаляли бедренные и болынеберцовые кости. Костный мозг экструдировали путем промывки средой MEM-Earle, дополненной 15% фетальной бычьей сывороткой (ФБС). Суспензию из массы костного мозга диспергировали путем пипетирования, последовательно фильтровали через сетчатый 70 мкм нейлоновый фильтр и центрифугировали при 200G в течение 10 мин. Супернатант удаляли, а осадок клеток пересуспендировали в среде. Клетки от одной крысы высевали в пластиковые флаконы и инкубировали при 37°С в увлажненной атмосфере с 5% CO2. На третий день удаляли красные кровяные тельца и другие неадгезивные клетки и добавляли свежую среду с добавками, чтобы обеспечить дальнейший рост. Адгезивные клетки, выращенные до 70% конфлюэнтности, были определены как первичные культуральные клетки (p1).
[98] Чтобы получить линию rb-MSC, p1 крысиных мезенхимальных клеток пассировали в соответствии со стандартными условиями, известными в данной области техники, и в соответствии с инструкциями производителя для RPMI-1640. Клетки p1 промывали раствором Хэнкса, не содержащим ионы Ca2+-Mg2+ (Sigma, США, Н9394-500 мл), и разделяли путем инкубации с 0,25% раствором трипсин-ЭДТА (Sigma, США, Т4424-100 мл) в течение 5-10 минут при 37°С. Затем для инактивации трипсина добавляли раствор Хэнкса, дополненный 5% ФБС (Sigma, США, F6765). Клетки центрифугировали при 200G в течение 10 минут, пересуспендировали в 1-2 мл среды RPMI-1640, дополненной 15% ФБС, и подсчитывали вручную в гемоцитометрической камере Нойбауэра. Затем клетки высевали как р2 в 75 см2 флаконы с плотностью 1,0×106 клеток/флакон, используя среду RPMI-1640 (Sigma, США, R5886), дополненную 15% ФБС (Sigma, США, F6765), 100 единицами/мл пенициллина, 100 мкг/мл стрептомицина (Sigma, США, Р4458), 100 нг/мл амфотерицина (Sigma, США, А2942), 2 мМ L-глутамина (Sigma, США, G7513), 0,005 мл/мл витаминов (ЮОх) для среды RPMI-1640 (Sigma, США, R7256) и 0,005 мл/мл аминокислот для среды RPMI-1640 (Sigma, США, R7131). Флакон с проницаемой стерильной фильтровальной крышкой инкубировали при 37°С в увлажненном инкубаторе в атмосфере с 5% CO2. Среду RPMI-1640 (дополненную 15% ФБС) меняли каждые 3 дня в течение 10-14-дневного периода (или по достижении 70% конфлюэнтности). После Пассажа №2 (р2) клетки высевали в 175 см2 флаконы с плотностью 2×106 клеток/флакон и использовали среду RPMI-1640, дополненную 10% ФБС. Для каждого последующего пассажа клетки высевали аналогичным образом и выращивали до 70% конфлюэнтности. При достижении 70% конфлюэнтности клетки разделяли и повторно высевали в пластиковый культуральный флакон. Пассаж 5 (р5) rb-MSC использовали в качестве сравнения с линией hb-MSC.
Пример 3 - Культивирование hb-MSC
[99] Чтобы получить линию hb-MSC, p1 крысиных мезенхимальных стволовых клеток культивировали в соответствии со следующим способом. Вначале клетки p1 промывали раствором Хэнкса, не содержащим ионы Ca2+-Mg2+ (Sigma, США, Н9394-500 мл), и разделяли путем инкубации с 0,25% раствором трипсин-ЭДТА (Sigma, США, Т4424-100 мл) в течение 5-10 минут при 37°С. Затем для инактивации трипсина добавляли раствор Хэнкса, дополненный 5% ФБС (Sigma, США, F6765). Клетки центрифугировали при 200G в течение 10 минут, пересуспендировали в 1-2 мл среды RPMI-1640, дополненной 15% ФБС, и подсчитывали вручную в гемоцитометрической камере Нойбауэра. Затем клетки высевали как р2 в 75 см2 флаконы с плотностью 1,0×106 клеток/флакон, используя среду RPMI-1640 (Sigma, США, R5886), дополненную 15% ФБС (Sigma, США, F6765), 100 единицами/мл пенициллина, 100 мкг/мл стрептомицина (Sigma, США, Р4458), 100 нг/мл амфотерицина (Sigma, США, А2942), 2 мМ L-глутамина (Sigma, США, G7513), 0,005 мл/мл витаминов (100x) для среды RPMI-1640 (Sigma, США, R7256) и 0,005 мл/мл аминокислот для среды RPMI-1640 (Sigma, США, R.7131). Флакон с проницаемой стерильной фильтровальной крышкой инкубировали при 37°С в увлажненном инкубаторе в атмосфере с 5% CO2. Среду RPMI-1640 (дополненную 15% ФБС) меняли каждые 3 дня в течение 10-14-дневного периода (или по достижении 70% конфлюэнтности).
[100] После Пассажа №2 (р2) клетки высевали в 175 см2 флаконы с плотностью 2×106 клеток/флакон и использовали среду RPMI-1640, дополненную 10% ФБС. Выращивание культур продолжали при 37°С в увлажненном инкубаторе в атмосфере с 5% CO2. После третьего Пассажа (р3), клетки пассировали при сниженной концентрации CO2. Для снижения концентрации CO2 культуральный флакон закрывали непроницаемой крышкой в условиях атмосферного CO2 и инкубировали при 37°С. Дополнительный CO2 во всех последующих пассажах не использовали. Как было описано ранее, добавляли свежую среду RPMI-1640, дополненную 10% ФБС, и меняли каждые 3 или 4 дня в течение приблизительно 14 дней. В каждом пассаже клетки высевали таким же образом и выращивали до 70% конфлюэнтности. При достижении 70% конфлюэнтности клетки разделяли и повторно высевали в пластиковый культуральный флакон. Пассаж 9 (р9) hb-MSC сравнивали с rb-MSC. ПЦР-анализ (Nanodiagostika, LLC, Россия) подтвердил отсутствие загрязнения hb-MSC бактериями, вирусами, микоплазмой или грибками.
[101] Линию hb-MSC сохраняли, используя среды 10% ДМСО и 50% ФБС при температуре жидкого азота в концентрации от 3,0×106 до 5,0×106 клеток в 2-миллилитровых (мл) ампулах.
Пример 4 - Получение характеристик hb-MSC методом проточной цитометрии
[102] Эксперимент с применением проточной цитометрии проводили для определения маркеров клеточной поверхности линий hb-MSC и rb-MSC. В целях этого эксперимента 50 мкл соответствующего антитела добавляли в 100 мкл клеточной суспензии. Суспензию перемешивали на вортексе в течение пяти секунд (BioVortexV1, BioSan) и выдерживали при температуре +4°С в течение 30 минут в отсутствие света. После инкубации смесь разбавляли 500 мл солевого раствора и дважды промывали путем центрифугирования, чтобы удалить избыток реагентов. Каждое центрифугирование проводили при 400G в течение 10 минут (ELMI). Для каждого образца анализировали по меньшей мере 10000 отсчетов. Результаты анализировали при помощи аналитической программы WinMDI 2.7, и они показаны на ФИГ. 1. Обобщенные данные по поверхностным маркерам, экспрессируемым линиями rb-MSC и hb-MSC, представлены ниже в Таблице 1.
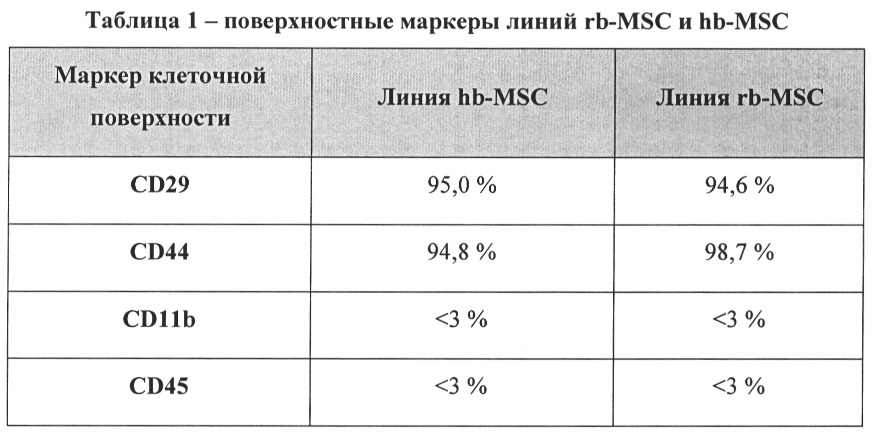
[103] Типичные крысиные мезенхимальные клетки костного мозга демонстрируют положительную экспрессию маркеров CD44, CD29 и отрицательную экспрессию маркеров CD45 и CD1 lb. Как показано выше в Таблице 1, линия hb-MSC демонстрирует поверхностные маркеры, согласующиеся с маркерами мезенхимальных стволовых клеток костного мозга крысы. Это показывает, что способ получения hb-MSC не приводит к изменению поверхностных маркеров клеток.
Пример 5 - Анализ культуральной среды, кондиционированной линиями клеток rb-MSC и hb-MSC
[104] Чтобы сравнить влияние hb-MSC и rb-MSC на культуральную среду, девять (9) отдельных 75 см2 флаконов каждой клеточной линией засевали с плотностью 0,7×106 клеток/флакон. Клетки пассировали в RPMI-1640/10% ФБС, дополненной 5% CO2, в инкубаторе при 37°С. Флаконы с клетками закрывали газопроницаемыми крышками. Всего было проанализировано 9 временных периодов: 24, 48, 96, 144, 192, 216, 240, 264 и 288 часов. В каждый заданный период времени анализировали один флакон клеток. Во всех остающихся флаконах среду меняли через три дня (72 часа), пять дней (120 часов), семь дней (168 часов), а затем ежедневно. Концентрацию лактата и рН среды определяли для каждого из девяти периодов. За исключением измерения через 48 часов, периоды выбирали так, чтобы измерение происходило через 24 часа после замены среды. Лактат исследовали при помощи биохимического анализатора, в трех повторах, при помощи набора для исследования лактата от SPINREACT. Уровень рН измеряли при помощи электронного рН-метра (METTLER TOLEDO InLab VersatИЛе Pro). Для каждого из периодов также определяли количество клеток, а клетки проходили, по меньшей мере, одно удвоение популяции при рН ниже 7,05.
[105] ФИГ. 6 иллюстрирует изменение рН со временем для чистой культуральной среды RPMI-1640, кондиционированной rb-MSC среды и кондиционированной hb-MSC среды, определенный во время сбора клеток, описанных в этом Примере. ФИГ. 7 показывает изменение концентрации лактата (мМ) для линий rb-MSC и hb-MSC в процессе культивирования. «Усы» представляют одно стандартное отклонение в концентрации лактата. Представленная ниже таблица на основе данных ФИГ. 6 и 7 демонстрирует сравнение разных измерений для rb-MSC и hb-MSC в этом Примере.


Пример 6 - Сравнение факторов в средах, кондиционированных линиями клеток rb-MSC и hb-MSC
[106] Линии rb-MSC и hb-MSC можно отличить путем сравнения факторов, вырабатываемых каждой линией, когда линию поддерживают в культуральной среде. Чтобы сравнить факторы, вырабатываемые hb-MSC и rb-MSC, семь (7) отдельных 75 см2 флаконов каждой клеточной линии засевали с плотностью 0,7×106 клеток/флакон. Клетки пассировали в RPMI-1640/10% ФБС, дополненной 5% CO2, в инкубаторе при 37°С. Специалисту в данной области техники понятно, что добавление дополнительной сыворотки будет влиять на исходную концентрацию факторов в среде перед кондиционированием. Флаконы с клетками закрывали газопроницаемыми крышками. Всего было проанализировано 7 временных периодов: 96, 144, 192, 216, 240, 264 и 288 часов. В каждый заданный период времени анализировали один флакон клеток. Во всех остающихся флаконах среду меняли через три дня (72 часа), пять дней (120 часов), семь дней (168 часов), а затем ежедневно. Периоды выбирали так, чтобы измерение происходило через 24 часа после замены среды. Анализ факторов проводили при помощи 27-плексной панели для крысиной матрицы цитокинов/матрицы хемокинов от Eve Technologies, 3-плексной матрицы цитокинов TGF-бета и 1-плексной матрицы костей крысы. Конкретные факторы, сравниваемые в Таблице 3, включают интерлейкин-10 (ИЛ-10), индуцируемый интерфероном гамма белок 10 (IP 10), CXCL1 (GRO/KC), фактор роста эндотелия сосудов (VEGF), остеопротегерин (OPG), трансформирующий фактор роста бета 1 (TGF-β1), трансформирующий фактор роста бета 2 (TGF-β2) и трансформирующий фактор роста бета 3 (TGF-β3). Следует понимать, что мультиплексные измерения зависят от калибровочной кривой и конкретного применяемого антитела и, таким образом, могут в некоторой степени варьироваться, как это понятно специалисту в данной области техники.
[107] Диапазон факторов, наблюдаемых в течение анализируемых временных периодов, приведен в Таблице 3 ниже. Следует понимать, что концентрация факторов может зависеть от временного периода, в течение которого культивируют клетки, и числа клеток во флаконе.
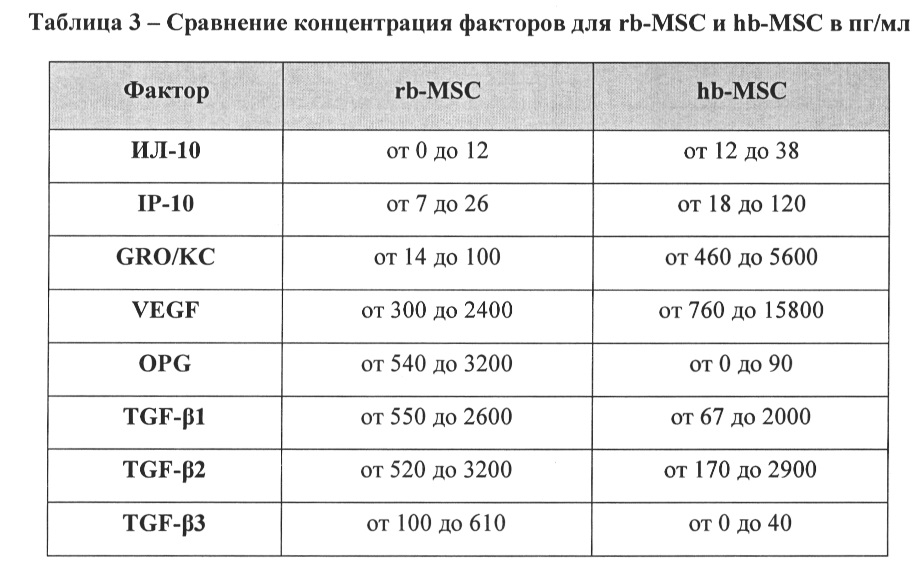
Сравнительный анализ линий rb-MSC и hb-MSC
[108] Существует ряд способов, как отличить линию hb-MSC от линии rb-MSC. Одним из способов, как отличить две линии, является определение рН культуральной среды в процессе роста клеток. В Примере 5 описано определение рН культуральной среды (RPMI-1640), кондиционированной линиями rb-MSC и hb-MSC, в течение периода, составляющего 288 часов. Перед культивированием измеренный уровень рН RPMI-1640 составлял приблизительно 7,01. Как и ожидалось, заданное количество дополнительного CO2 для RPMI-1640 (т.е. 5%) эффективно буферизировало рН контрольной среды RPMI-1640 до 7,2 в течение всего эксперимента. Уровень рН культуры rb-MSC оставался в диапазоне приблизительно между 7,08 и 7,2 в течение всего эксперимента. Однако для hb-MSC рН снизился от значения приблизительно 7,2 через 24 часа до рН приблизительно 6,6 в течение следующих 216 часов, и значение рН оставалось равным приблизительно 6,6 в течение эксперимента. Спустя 150 часов культивирования рН культуральной среды снизился ниже 7,0 в течение 24 часов после замены среды. Аналогично, спустя 150 часов культивирования уровень рН культуральной среды снизился по меньшей мере на 0,4 единицы по сравнению с рН RPMI-1640 в течение 24 часов после замены среды. Разница в рН сред, кондиционированных линиями rb-MSC и hb-MSC, демонстрирует, что эти две линии отличаются.
[109] Другим способом отличить линию hb-MSC от линии rb-MSC является оценка выработки лактата клетками в среде, как описано в Примере 5. ФИГ. 7 показывает, что hb-MSC продуцируют лактат в концентрации, которая превышает концентрацию, вырабатываемую rb-MSC. После приблизительно 96 часов культивирования hb-MSC продуцируют по меньшей мере 4 мМ лактата в течение 24 часов после замены среды и могут вырабатывать вплоть до 12,4 мМ лактата в течение 24 часов после замены среды. В противоположность этому, концентрация лактата, вырабатываемого rb-MSC, никогда не превышает 3 мМ в течение 24 часов после замены среды. Разница в концентрации лактата в средах, кондиционированных линиями rb-MSC и hb-MSC, демонстрируют, что эти две линии отличаются.
[110] Другим способом отличить линию hb-MSC от линии rb-MSC является оценка среды, кондиционированной каждой линией. В целях этого сравнения среду собирали, как описано в Примере 6. Результаты оценки факторов обобщены выше в Таблице 3. Разница в концентрации факторов в средах, кондиционированных rb-MSC и hb-MSC, демонстрирует, что эти две линии отличаются.
[111] В общей сложности, описанные выше способы определения характеристик приводят к выводу, что линия hb-MSC отличается от линии rb-MSC.
Пример 7 - Морфометрическое исследование закрытия ран
[112] Проводили морфометрическое исследование, чтобы отследить процесс заживления ран у лабораторных мышей. Все эксперименты на животных проводили в отделе ветеринарной хирургии Московской государственной академии ветеринарной медицины и биотехнологии имени К.И. Скрябина. Во всех экспериментах использовали белых лабораторных мышей в возрасте от 3 до 5 месяцев с весом около 22-25 граммов. Всего в каждом эксперименте использовали по шесть мышей. Все разрезы приблизительно 0,5 см в диаметре делали в только что выбритой области лопатки каждого анестезированного животного. После выполнения разреза животных распределяли по контрольным и опытным группам, по три мыши на группу. Каждую рану фотографировали для получения цифровых морфометрических параметров. Через тридцать минут после выполнения разреза каждую рану обрабатывали 50 мкл каплей RPMI-1640 или композиции hb-MSC. В этом примере композиция hb-MSC содержала кондиционированную hb-MSC среду, описанную в Примере 6, причем кондиционированные среды, собранные в каждый из разных периодов кондиционирования (96, 144, 192, 216, 240, 264 и 288 часов), смешивали в одной емкости. Композиция также содержала бензалкония хлорид в качестве консерванта и Тритон Х-100 в качестве сурфактанта. Размер раны измеряли один раз в день в течение 15 дней. Композицию hb-MSC и RPMI-1640 применяли к каждому животному в соответствующих группах один раз в день после осмотра раны. Цифровые изображения, показывающие сравнение процесса заживления ран, обработанных композицией hb-MSC и средой RPMI-1640, показаны на ФИГ. 4. На ФИГ. 4 показана мышь из контрольной группы (обработанная RPMI-1640) на 1-й день обработки и та же мышь на 9-й день обработки. На ФИГ. 4 также показана мышь из опытной группы (обработанная композицией hb-MSC) на 1-й день обработки и та же мышь на 9-й день обработки. Влияние обработки на средний размер раны в случае композиции hb-MSC и RPMI-1640 проиллюстрировано на ФИГ. 5.
Пример 8 - Морфометрическое исследование закрытия зараженных бактериями мастита ран
[113] Чтобы оценить эффективность нескольких разных композиций hb-MSC, использовали модель инфицированной раны у мышей. Модель инфицированной раны у мышей в данном эксперименте сходна с моделью, описанной в связи с Примером 7, но имеет два отличия. Во-первых, в данном примере в рану мыши добавляли смесь из бактериальных патогенов, чтобы замедлить природный процесс заживления раны. Смесь разрабатывали в процессе экспериментальных исследований так, чтобы применение бактериальной смеси к ране приводило к равномерному многодневному периоду заживления (отрицательный контроль). Вторым отличием является способ выполнения разреза, применяемый в данном эксперименте. В частности, из свежевыбритой области лопатки каждого находящегося под анестезией животного брали штанцевую биопсию диаметром приблизительно 0,6 см (Epitheasy, Италия). Применение штанцевой биопсии улучшило точность и равномерность размера и глубины ран, так как штанцевая биопсия приводит к получению раны на всю толщу кожи, равномерно и чисто удаляя слои эпидермиса и дермы, оставляя при этом неповрежденной мышечную ткань.
[114] Все эксперименты на животных проводили в отделе ветеринарной хирургии Московской государственной академии ветеринарной медицины и биотехнологии имени К.И. Скрябина. Во всех экспериментах использовали белых лабораторных мышей в возрасте от 3 до 5 месяцев с весом около 22-25 граммов. Исследование проводили следующим образом. После биопсии животных распределяли по контрольным и опытным группам, по меньшей мере по пять мышей на группу. В некоторых случаях использовали более пяти мышей в группе. Каждую рану фотографировали для получения начальных морфометрических параметров. После получения морфометрических параметров каждую рану обрабатывали 50 мкл каплей коктейля из бактериальных патогенов. Смесь патогенов в коктейле содержала штаммы вызывающих мастит бактерий. Концентрации бактериальных патогенов в коктейле выбирали на основании серии экспериментов, разработанных для получения равномерного периода заживления. Через тридцать минут после заражения бактериями каждую рану обрабатывали 50 мкл каплей одной из исследуемых композиций. Исследуемые композиции применяли к каждому животному в соответствующих группах один раз в день после осмотра раны. Цифровые изображения раны получали на первый, второй и четвертый день после биопсии.
[115] В Таблице 4 приведено несколько иллюстративных композиций, применяемых в этом эксперименте, при этом величины представлены в массовых процентах. В Таблице 5 приведены концентрации VEGF и GRO/KC для каждой композиции из Таблицы 4, при этом количество других факторов пропорционально указанно в Таблице 3. Понятно, что эти композиции приведены исключительно в качестве примеров и в этом контексте ничто не следует воспринимать как ограничение изобретения. В этом эксперименте для получения кондиционированной hb-MSC среды использовали трех- и пятислойные флаконы с общей площадью для роста, составляющей 500 см2 и 870 см2, соответственно. Начальная плотность посева составляла около 2,1×106 клеток/флакон как для трехслойного (композиции №5-10), так и для пятислойного флакона (композиция №4). После получения кондиционированной среды составляли композиции, комбинируя перечисленные ингредиенты (за исключением кондиционированной hb-MSC среды) в водном растворе и смешивая их в течение времени, гарантирующего полное растворение. Затем из концентрированного раствора брали пробу, чтобы проверить его рН и другие индикаторы, чтобы гарантировать, что данная комбинация не будет оказывать негативного влияния на кондиционированную стволовыми клетками среду. Далее кондиционированную hb-MSC среду добавляли в концентрированный раствор с растворенными в нем ингредиентами, а полученный комбинированный раствор снова смешивали для получения указанных композиций.
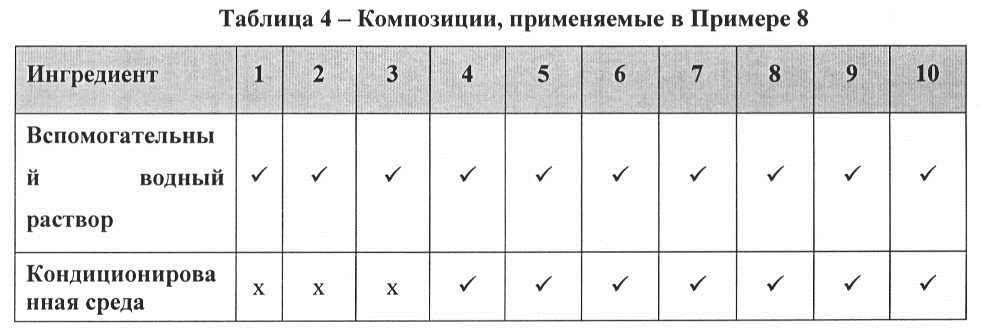
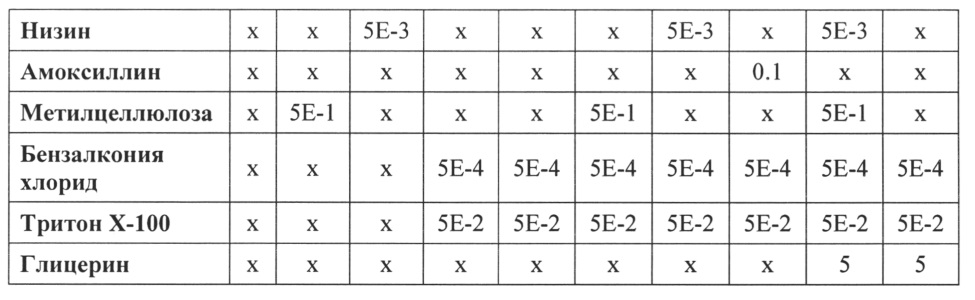
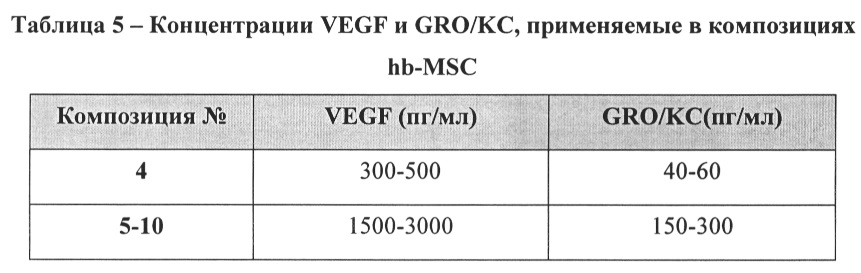
[116] Влияние вышеописанных композиций на процесс заживления ран оценивали двумя способами: (1) при помощи клинической оценки процесса заживления ран; и (2) при помощи морфометрического способа, в котором используется программное обеспечение для анализа цифровых изображений (ImageJ). Для каждой мыши части раны, которые характеризовались кровотечением, гнойным экссудатом, отсутствием формирования эпителиального слоя или отсутствием корок, считали такими, которые находятся в процессе заживления. Части раны, которые характеризовались склеиванием краев, грануляционной тканью, покрытой гладким, светлым и ровным слоем эпителия, или наличием корок, считали заживленными.
[117] Уровень заживления ран выражали как процентную долю поврежденной ткани относительно изначально измеренного размера раны, как показано ниже в Таблице 6.

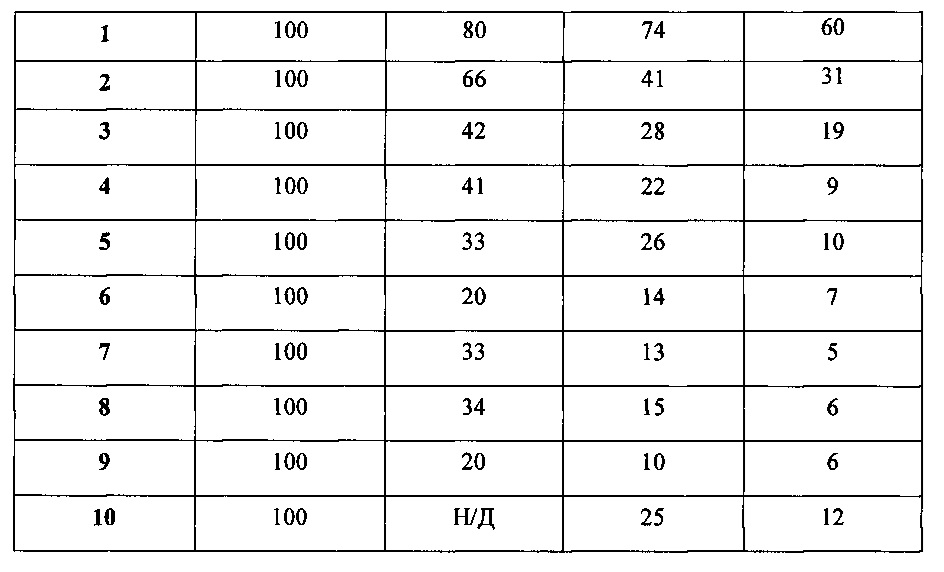
[118] В частности, в Таблице 6 показано, что добавление отдельных компонентов в водный вспомогательный раствор не оказывает такого же влияния на заживление ран, что и композиции, содержащие кондиционированную стволовыми клетками среду. Также показано, что эффективность кондиционированной стволовыми клетками среды не снижается после добавления противомикробных или пленкообразующих агентов; наоборот, результаты демонстрируют синергетический эффект такой комбинации. Например, результаты демонстрируют, что когда композиция содержит кондиционированную стволовыми клетками среду и пленкообразующий агент, композиция неожиданно демонстрирует доставку «с контролируемым высвобождением» в целевой участок применения и характеризуется повышением скорости заживления. Аналогично, при включении противомикробного агента в композицию, может улучшаться как I немедленное, так и длительное действие этой композиции на заживление ран. Результаты также показывают, что применяемые в этом примере композиции являются стабильными, а добавление перечисленных ингредиентов не снижает (а в некоторых случаях повышает) эффективность композиции.
Пример 9 - Оценка пленкообразующих свойств
[119] Проводили эксперимент, чтобы исследовать пленкообразующие свойства композиции, содержащей пленкообразующий агент, в данном случае - метилцеллюлозу. В этом исследовании использовали четыре разных процентных концентрации (м/об) метилцеллюлозы (Methocel, The Dow Chemical Company, 40-100), как показано ниже в Таблице 7.
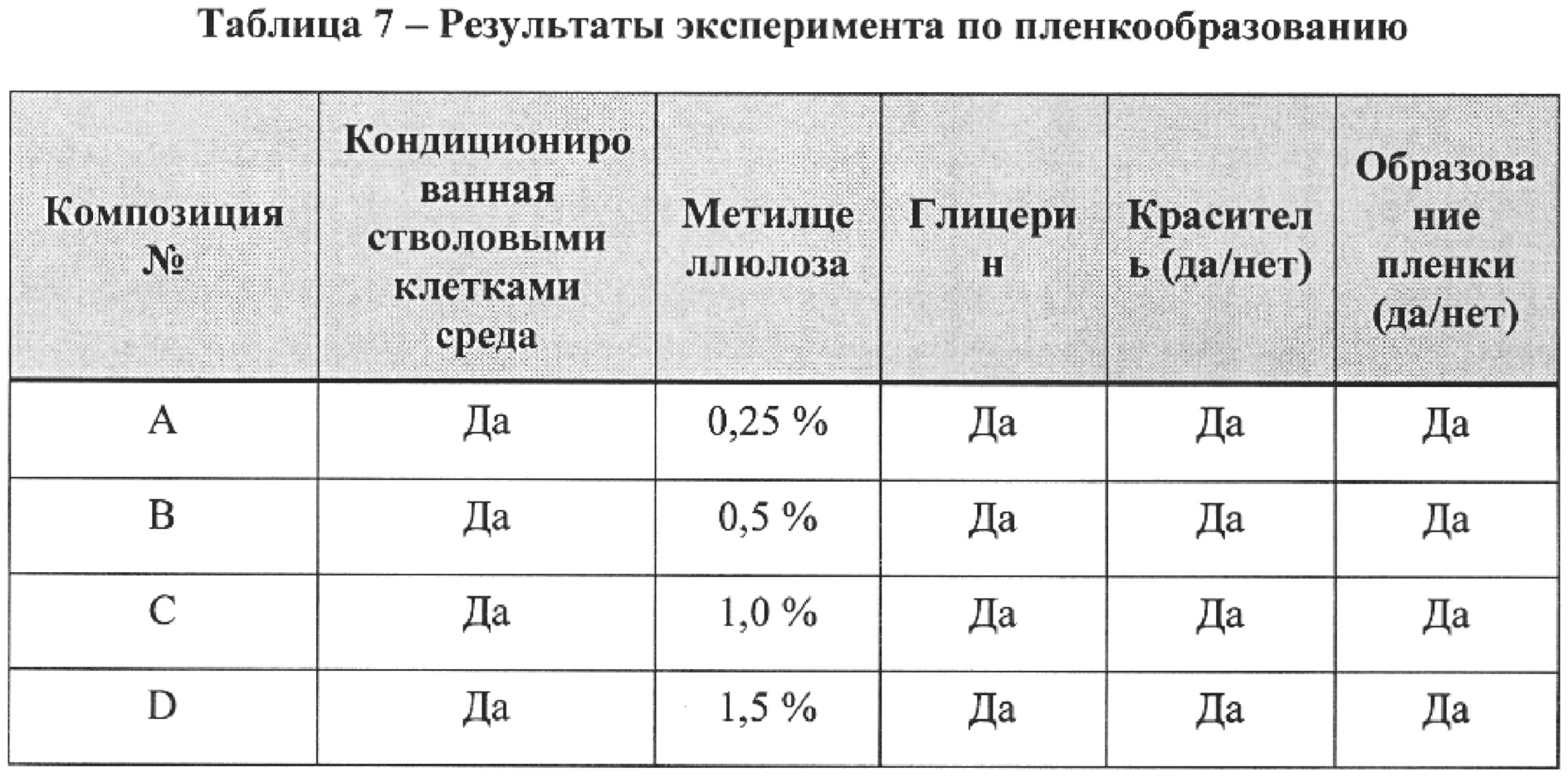
[120] применяемые в этом эксперименте композиции готовили путем добавления метилцеллюлозы, глицерина и красного красителя (F&DC 40) в постоянно перемешиваемый вспомогательный водный раствор и перемешивания до полного растворения метилцеллюлозы. Затем оценивали рН смеси, чтобы гарантировать совместимость с кондиционированной стволовыми клетками средой. Затем кондиционированную стволовыми клетками среду добавляли в предварительно приготовленную композицию и перемешивали. В композиции использовали глицерин в качестве кондиционирующего агента, а красный краситель (F&DC 40) включали, чтобы усилить контрастность образуемой пленки. После полного растворения метилцеллюлозы в композицию на 10 с погружали 15 мл центрифужную пробирку (SPL Life Sciences). Пробирку убирали из композиции, давали высохнуть, после чего оценивали качество образования пленки. Все четыре оцениваемые композиции приводили к образованию пленки на поверхности центрифужной пробирки, демонстрируя, что включение кондиционированной стволовыми клетками среды не оказывает негативного влияния на свойства пленкообразующего агента. Кроме того, такой же эксперимент проводили in vivo, применяя ту же композицию к соскам коровы, используя стакан-окунатель для сосков. Композицию среды, кондиционированной стволовыми клетками, содержащую определенное количество пленкообразующего агента, вливали в стакан-окунатель для сосков (NASCO). Стакан-окунатель для сосков использовали для применения приблизительно 0,75 мл на каждый сосок. Жидкости давали высохнуть, после чего фотографировали и оценивали качество образования пленки. In vivo эксперимент подтвердил результаты эксперимента с центрифужной пробиркой.
Пример 10 - Лечение мастита
[121] Эффективность кондиционированной стволовыми клетками среды в лечении клинического и субклинического мастита оценивали в испытаниях в полевых условиях в течение трех месяцев. Полевые испытания проводили на молочной ферме под Москвой, Россия. Во время эксперимента оценивали всего около 600 коров. Всех коров держали на одной диете и доили, используя одинаковый способ доения. Коров разделяли на две группы: контрольную группу из около 400 коров (разместившуюся в одной части фермы) и группу лечения из около 200 коров (разместившуюся во второй, отдельной части фермы).
[122] Коров в контрольной группе лечили в соответствии с существующими в настоящее время передовыми методами контроля мастита, уже применяемыми на молочной ферме, которые включают обработку после доения раствором для сосков на основе йода до трех раз в день. Коров в группе лечения лечили так же, как и контрольную группу, за исключением того, что вместо раствора для обработки сосков на основе йода использовали композицию кондиционированной стволовыми клетками среды. В группе лечения каждую корову обрабатывали композицией кондиционированной стволовыми клетками среды после каждого доения до трех раз в день. Применяемая в этом эксперименте композиция кондиционированной стволовыми клетками среды соответствует композиции №5 в Примере 8. В обеих группах - контрольной и лечебной - применение раствора для сосков на основе йода и композиции кондиционированной стволовыми клетками среды осуществляли при помощи стандартного стакана-окунателя для сосков.
[123] Каждую группу доили в отдельный молочный танк в целях сбора. Записывали общее число клинических и субклинических случаев для каждой группы, а также для каждой отдельной коровы в группе. Клинический мастит диагностировал ветеринар-специалист. Субклинический мастит диагностировали, используя цифровой определитель мастита (DRAMINSKY), с которым работал ветеринар-специалист. Кроме того, в течение эксперимента для каждой отдельной группы определяли число соматических клеток в молочном танке, используя вискозиметрический анализатор соматических клеток (СОМАТОС-В). Следует отметить, что коров, демонстрирующих симптомы клинического мастита, не доили в молочный танк, как в контрольной, так и в лечебной группе. Группы также анализировали в течение одной недели перед началом лечения, чтобы установить базовый уровень мастита до лечения и число соматических клеток в молочном танке до лечения для каждой группы.
[124] Результаты полевых испытаний представлены в Таблице 8 и включают: (1) уровень заболеваемости маститом у коров, определенных как здоровые (т.е. коров, у которых не было клинического или субклинического мастита) на момент начала эксперимента; и 2) число соматических клеток в молочном танке для контрольной и лечебной групп.
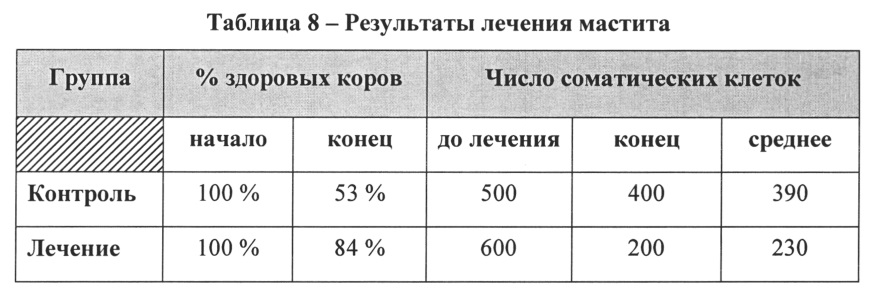
[125] Как показано в Таблице 8, заболеваемость клиническим и субклиническим маститом в группе лечения была на 31% ниже, чем в контрольной группе. Это демонстрирует, что обработка кондиционированной средой обладает профилактическим действием против мастита. Число соматических клеток в молочном танке снизилось на 50% в конце эксперимента. Кроме того, среднее число соматических клеток в молочном танке за трехмесячный экспериментальный период было на 41% ниже по сравнению с контрольной группой. Эти результаты демонстрируют, что обработка композицией кондиционированной среды оказалась эффективной в лечении мастита и демонстрировала профилактический эффект. После эксперимента благоприятное действие композиции сохранялось в течение по меньшей мере двух недель, а в некоторых случаях дольше.
Пример 11 - Терапевтический эффект композиции hb-MSC
[126] Для того, чтобы оценить терапевтический эффект композиции hb-MSC, проводили эксперименты на различных животных, включая собак (65+), кошек (80+), лошадей (40+), сельскохозяйственных животных (25+), грызунов (200+) и пернатых (15+). Композицию hb-MSC использовали для лечения широкого спектра состояний у вышеуказанных исследуемых субъектов. Применяемая в этом примере композиция hb-MSC была такой же, как и в Примере 7. Виды лечения включали: 1) применения для обработки ран, включая участки разреза после хирургического вмешательства; 2) лечение ожогов, включая химические ожоги; 3) язвы, включая диабетические язвы; 4) фистулы, 5) воспаление тканей или бактериальные инфекции, включая гнойные воспаления, конъюнктивит, кератит, мастит, флегмону, гастрит и дерматит; 6) применения в ортопедии, включая переломы костей; и 7) лечение различных тканей, включая кожу, связки и мышечную ткань. В этих экспериментах доставку композиции hb-MSC осуществляли следующими способами: местным, пероральным, назальным, внутривенным, подкожным, интрадермальным, трансдермальным, внутримышечным или внутрибрюшинным. Кроме того, композицию hb-MSC применяли, используя стерильные салфетки, в форме аэрозоля и путем прямого нанесения на пораженный участок (включая применение стаканов-окунателей для сосков). Композиция hb-MSC оказалась эффективной в лечении всех вышеперечисленных патологических состояний, демонстрируя улучшенное регенерирующее действие, ускорение процесса закрытия ран, существенное снижение воспаления и локальной колонизации бактериями, противомикробное действие, ангиогенез и васкулогенез, снижение рубцевания ткани и восстановление волосяных луковиц на пораженном участке. Наблюдавшееся в этих экспериментах значительное регенерирующее действие согласовалось с результатами экспериментов по заживлению ран у мышей, описанных в Примере 7. Все животные оставались здоровыми после обработки композицией hb-MSC. Во всех случаях оценивали токсичность, раздражение, сенсибилизацию и биоаккумуляцию. Исследования крови показали, что в течение 30 дней после введения композиции hb-MSC все измеряемые показатели для всех животных оставались в пределах нормы. Гистологические исследования печени, почек, легких, селезенки, кишечника и мягких тканей не демонстрировали никаких признаков острой или хронической токсичности после применения композиции hb-MSC. Также не было зарегистрировано случаев аллергических реакций, инфекций или других негативных побочных действий. Вместе эти эксперименты демонстрируют, что композицию hb-MSC можно использовать для безопасного и эффективного лечения широкого спектра патологических состояний человека и животных, включая лечение ожогов, уход за кожей, ангиогенез, васкулогенез, заживление органов и тканей, косметические применения, воспаление тканей, бактериальные инфекции, лечение ран, диабет, фармацевтические и офтальмологические применения, снижение рубцевания, стимуляцию роста волос, иммунотерапию и иммунокоррекцию, трансплантацию кожи, костного мозга или органов, лечение органов или тканей, или лечение других заболеваний.
Пример 12 - Термостабильность
[127] Чтобы исследовать термостабильность композиции, содержащей кондиционированную стволовыми клетками среду, проводили эксперимент с повторяющимся циклическим изменением температуры. В частности, в этом эксперименте оценивали композицию №9 из Примера 8. Температурный диапазон во время эксперимента циклически менялся от +4-8°С до +20-25°С. Циклическое изменение температуры осуществляли, помещая композицию в холодильник с температурой +4-8°С на 23 часа, после чего композицию убирали, чтобы восстановить температуру до +20-25°С в течение одного часа. После восстановления температуры композицию изучали визуально в отношении наличия какого-либо осадка или изменения вида композиции. После этого композицию помещали обратно в холодильник для прохождения следующего периода охлаждения и повторяли цикл в течение 11 дней. Результаты эксперимента приведены ниже в Таблице 9. По результатам эксперимента можно заключить, что композиция является стабильной после циклических изменений температуры.
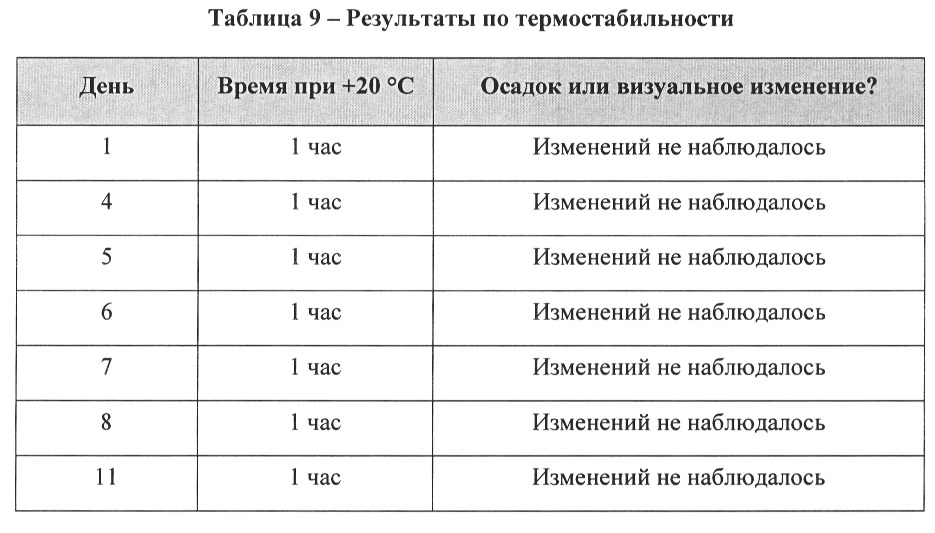
Пример 13 - Стабильность широкого спектра действия
[128] Проводили эксперимент, чтобы оценить стабильность композиции, содержащей кондиционированную среду с некоторым количеством разных добавок. Стабильность оценивали двумя способами: (1) на основании визуального наблюдения (для проверки наличия осадка); и (2) методом ELISA для проверки концентрации VEGF. Всего в этом способе оценивали 14 композиций, а также контрольную кондиционированную стволовыми клетками среду. Каждую исследуемую композицию составляли путем добавления определенного объема или массы коммерческого фармацевтического продукта (определенного в Таблице 10) в 10 мл объем кондиционированной стволовыми клетками среды. После смешивания ингредиентов композицию перемешивали до полного растворения ингредиентов. Во всех случаях кондиционированная стволовыми клетками среда содержала 0,0005% бензалкония хлорид и 0,05% Тритон Х-100. Композиции хранили в течение 48 часов при температуре +4-8°С перед проведением оценки их стабильности и визуально исследовали снова через 168 часов.
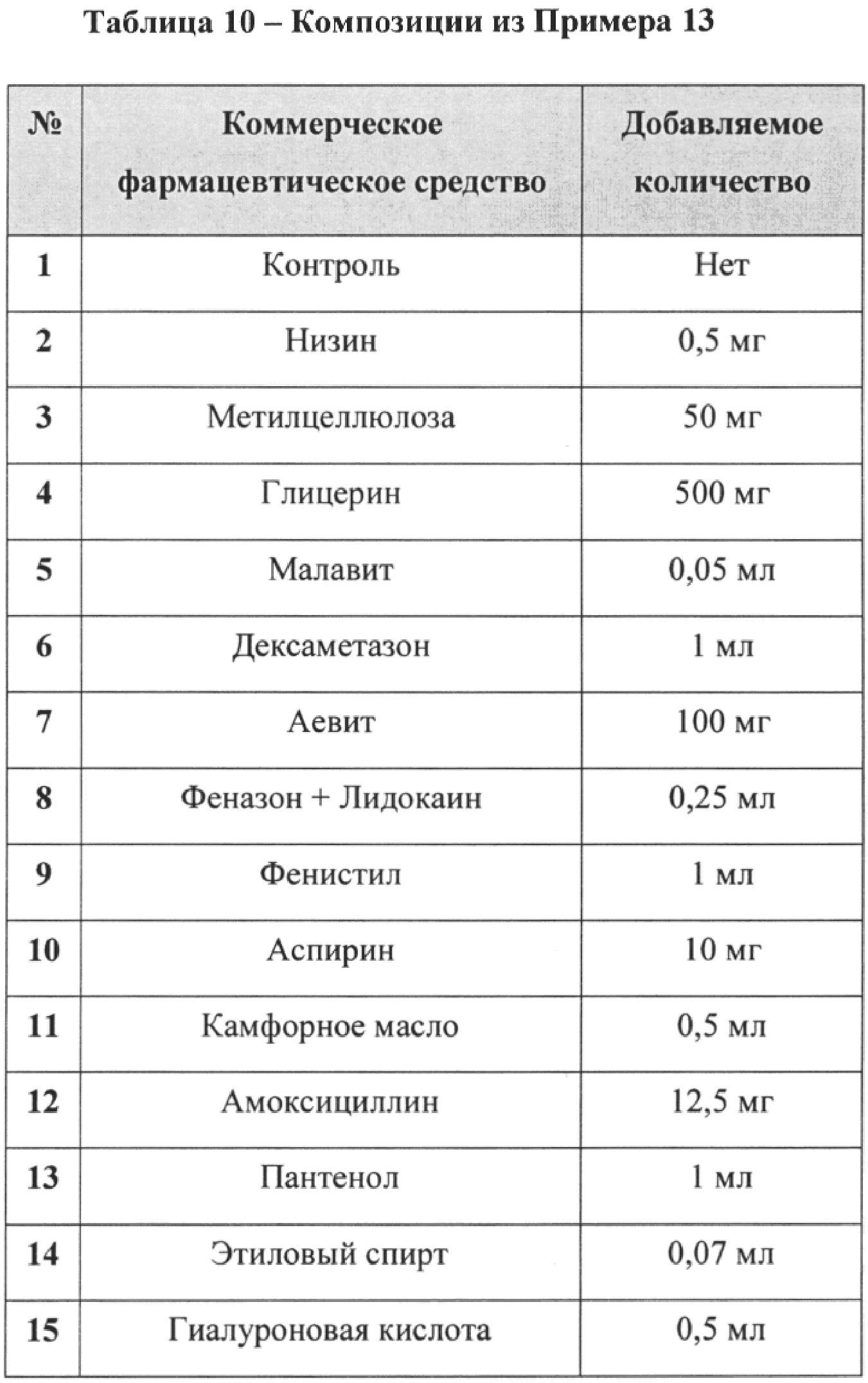
[129] В каждом случае осадок в композиции не наблюдали. Кроме того, во всех случаях количество VEGF существенно не снижалось (на более чем 10%) по сравнению с количеством VEGF в контрольной кондиционированной среде. Таким образом, результаты показывают, что во всех случаях композиция оставалась стабильной, а добавление коммерческих фармацевтических продуктов не оказывало негативного воздействия на кондиционированную стволовыми клетками среду.
[130] Хотя настоящее изобретение частично было проиллюстрировано и описано со ссылкой на примеры и варианты его реализации, подразумевается, что данная заявка включает любые отклонения от настоящего описания, которые относятся к компетенции известной или общепринятой практики в данной области техники, к которой относится это изобретение, а специалистам в данной области техники понятно, что можно осуществлять различные изменения формы и деталей, не отступая от сути и объема настоящего изобретения, определяемых нижеприведенной формулой изобретения и ее эквивалентами.