Результат интеллектуальной деятельности: Низкомолекулярный миметик BDNF как средство для лечения опиоидной зависимости
Вид РИД
Изобретение
Изобретение относится к химико-фармацевтической промышленности и касается нового применения известного гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) в качестве средства для лечения опиоидной зависимости.
По данным официальной статистики ООН, за последние 10 лет отмечается резкий рост числа жителей РФ, страдающих наркоманиями. Каждый год наркотики начинают использовать 90 тысяч граждан России, при том, что на сегодняшний день медицинские учреждения страны могут принять на стационарное лечение не более 50 тысяч наркозависимых в год. Таким образом, в сложившейся ситуации продолжает оставаться актуальной разработка инновационных средств для фармакотерапии болезней зависимости.
Зависимость от психоактивных веществ (ПАВ) часто сочетается с расстройствами настроения и депрессивными расстройствами (Butelman ER et al., Am J Addict. 2017 Sep; 26(6):632-639.). Депрессия, предшествующая возникновению расстройств, связанных с употреблением наркотиков, снижает шансы на стабильную ремиссию при кокаиновой и героиновой зависимостях. В целом, депрессивные расстройства, возникающие до начала формирования зависимостей от ПАВ, уменьшают шансы ремиссии больных наркологического профиля, аналогично депрессиям, индуцированным приемом алкоголя и препаратов опиоидного ряда (Samet S. et al., Addiction. 2013 Jan; 108(1): 115-23). Хроническое применение (более 90 дней) опиоидных анальгетиков значительно повышает риск развития новых приступов депрессии, что влечет за собой включение в курс фармакотерапии антидепрессантов (Scherrer JF et al., J Affect Disord. 2017 Mar 1; 210:125-129).
По данным экспериментальных исследований, селективный ингибитор обратного захвата серотонина флуоксетин (10 мг/кг, в/б, два раза в день в течение 9 дней) купировал проявление отдельных симптомов синдрома отмены морфина у мышей (Singh VP et al., Methods Find Exp Clin Pharmacol. 2003 May; 25(4):273-80). Неселективный ингибитор обратного захвата серотонина и норадреналина венлафаксин ослаблял развитие толерантности и зависимость к морфину за счет модулирующего влияния на L-arginine/NO/cGMP сигнальный каскад (Mansouri МТ et al., Endocr Metab Immune Disord Drug Targets. 2018; 18(4):362-370). С другой стороны, при оценке влияния ингибитора обратного захвата серотонина сертралина на систему вознаграждения мозга с помощью метода обусловленного предпочтения места у крыс показано, что сертралин per se в эффективных дозах демонстрировал подкрепляющие свойства, а в дозе 5 мг/кг усиливал подкрепляющие эффекты морфина, увеличивая время пребывания в ассоциированной с действием морфина камере (Ciubotariu D, Nechifor М., Rev Med Chir Soc Med Nat Iasi. 2014 Jul-Sep; 118(3):712-6). Аналогичное положительное мотивационное влияние в тесте «обусловленное предпочтение места», сходное с действием опиоидных аналгетиков и других ПАВ, проявляли антидепрессанты пароксетин (15 мг/кг) и флуоксетин (5 и 10 мг/кг), при этом трициклический антидепрессант амитриптилин в дозе 10 мг/кг, наоборот, вызывал у животных аверсивную реакцию, или «избегание» места, ассоциированного с действием препарата (Subhan F et al., Eur J Pharmacol. 2000 Nov 24;408(3):257-63).
В исследованиях Assadi A. et al. (2011) при анализе действия синтетических антидепрессантов на морфин-индуцированное предпочтение места у крыс установлено, что все препараты при внутрибрюшинном и интрацеребровентрикулярном введении усиливали вторичные подкрепляющие эффекты морфина (Assadi A. et al., Iran J Pharm Res. 2011 Summer; 10(3):916-26). Морфин действует на систему «награды» путем активации мю-рецепторов, которые облегчают дофаминергическую передачу, серотонин также является мощным стимулятором высвобождения дофамина. Таким образом, можно полагать, что усиление морфин-индуцированной реакции предпочтения места препаратами для лечения депрессивных расстройств может быть связано с увеличением концентрации дофамина и серотонина в синаптической щели, что определяется механизмом действия современных синтетических антидепрессантов.
По данным Zilkha N. et al. (2014), выполненным на крысах, героин при непродолжительном введении способствует формированию депрессивно-подобных симптомов, вызывая изменения содержания BDNF в ряде отделов мозга, сходные с теми, что наблюдаются при моделировании депрессии у животных (Zilkha N. et al., J Neurochem. 2014; 130(4):575-82).
Мозговой нейротрофический фактор (brain-derived neurotrophic factor, BDNF) рассматривается как положительный модулятор разных форм нейрональной пластичности. В контексте формирования аддиктивного поведения роль BDNF наиболее хорошо охарактеризована для химической зависимости, вызываемой кокаином или другими психостимуляторами через их влияние на мезолимбическую дофаминергическую систему (Hall FS. et al., Neuropsychopharmacology. 2003; 28:1485; Graham DL, et al. Nat Neurosci. 2007; 10:1029). Опиаты также действуют на вентральную тегменталъную область-прилежащее ядро (VTA-NAc), чтобы вызвать «подкрепление», стимулируя область «награды» при остром введении и провоцируя формирование зависимости при хроническом применении.
Изучение роли BDNF в патологическом круге вентральная область покрышки-прилежащее ядро (VTA-n.accumbens) является областью повышенного интереса и острых дискуссий при оценке механизма формирования вознаграждения и памяти к опиатам. Недавнее исследование, проведенное Koo и его коллегами (2012), показывает, что BDNF в VTA противодействует подкрепляющим эффектам морфина путем снижения активности в ДА-ергических нейронах, проецируемых в прилежащее ядро (Koo JW. et al., Science. 2012; 338 (6103): 124-8). При изучении роли BDNF-TrkB сигнального пути в VTA-NAc в действии морфина путем оценки вторичных подкрепляющих свойств в тесте «условно-рефлекторное предпочтение места» (УРПМ) показано, что у мышей-нокдаунов по гену bdnf происходит усиление подкрепляющего действия морфина в дозах 5.0 и 15 мг/кг. Аналогичные эффекты были отмечены для мышей-нокдаунов по гену TrkB рецепторов в VTA (Koo JW, et al., Science. 2012; 338(6103):124-8). По-видимому, локальная передача сигналов BDNF в нейронах VTA DA может быть ответственна за регуляцию механизмов «вознаграждения» к морфину. Эти данные расходятся с более ранними работам Vargas-Perez et al. (2009), в которых показано, что BDNF в VTA ни противодействует, ни облегчает «вознаграждение», обусловленное морфином, а только «переключает» подкрепление опиатов с дофамин-независимого на дофамин-зависимое (Vargas-Perez Н, et al., Science. 2009; 324:1732). Это происходит через BDNF-зависимое обращение токов ГАМК в нейронах VTA от ингибирующих к возбуждающим, и полагают, что данный эффект лежит в основе отрицательного аверсивного состояния, связанного с синдромом отмены опиатов (Vargas-Perez Н. et al., J Neurosci. 2014; 34(23): 7899-909).
При хроническом воздействии опиаты индуцируют ряд биохимических и морфологических изменений в VTA. Если влияние опиатов на экспрессию BDNF в VTA противоречиво (Vargas-Perez Н, et al., Science. 2009; 324:1732), то считается доказанным снижение регуляции внутриклеточных сигнальных каскадов, связанных с BDNF и уменьшение размеров тел дофаминергических нейронов в VTA под действием опиатов (Berhow МТ, et al. Neuroscience. 1995; 68:969; Mazei-Robison MS, et al. Neuron. 2011; 72:977), что не наблюдается при использовании психостимуляторов. Некоторые из этих биохимических и морфологических изменений в VTA упраздняются сразу после введения BDNF в указанную область мозга (Berhow МТ, et al. Neuroscience. 1995; 68:969).
Представленные данные свидетельствуют о том, что, в отличие от кокаина и психостимуляторов, опиаты и BDNF могут оказывать противодействующее влияние на дофаминергические нейроны VTA, что позволяет высказать предположение об антагонистической роли эндогенной BDNF-TrkB сигнализации в модулировании адаптивных ответов пути VTA-NAc к хроническому действию опиатов.
Данные научной литературы в отношение BDNF-ергической передачи сигналов в вентральной тегменталъной области при злоупотреблении опиатами не всегда согласуются. В одних исследованиях белок BDNF в VTA был значительно снижен в течение 1-14 дней после прекращения хронической экспозиции с морфином (Chu NN. et al., Brain research. 2007; 1182:90-98), в других работах отмечалось увеличение содержания BDNF через 7 дней после прекращения введения морфина (Mashayekhi FJ. et al., Neurochem Res. 2012; 37:1517-1523). Еще одно исследование показало, что экспрессия мРНК BDNF в VTA не изменялась после хронического применения морфина ни сразу после введения, ни после спонтанной отмены через 24 ч (Numan S. et al., J Comp Neurol. 1999; 403:295-308). Продолжительные морфин-индуцированные изменения BDNF в VTA предположительно опосредованы триметилированием гистона Н3К9, то есть эпигенетической модификацией, которая ассоциируется с подавлением транскрипции на промоторе II гена bdnf (Mashayekhi FJ. et al., Neurochem Res. 2012; 37:1517-1523). Полагают, что угасание аверсивной памяти при отмене морфина требует эпигенетической регуляции транскрипции гена bdnf в вентромедиальной префронтальной коре путем активации сигнального пути ERK-CREB (Wang WS. et al., J Neurosci. 2012; 32(40): 13763-75).
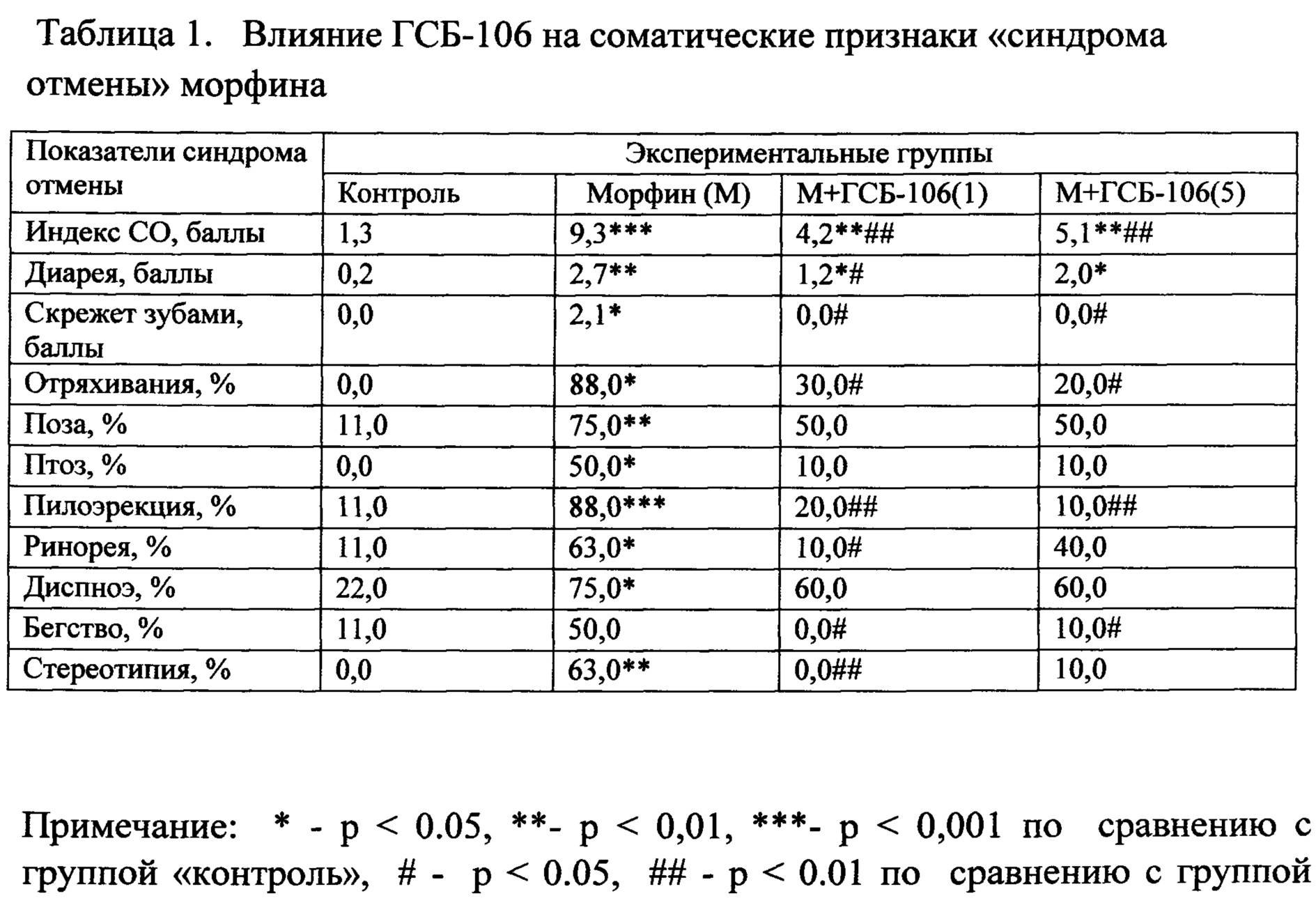
Ранее в НИИ фармакологии имени В.В. Закусова создан низкомолекулярный дипетидный миметик 4-й петли BDNF гексаметилендиамид бис-(N-моносукцинил-L-серил-L-лизина), или ГСБ-106 (рис. 1), обладающий выраженным антидепрессивным действием в опытах in vivo (Гудашева Т.А. и соавт., Биоорган. химия. 2012; 38 (3): 280-290), (Gudasheva ТА, et al., Dokl Biochem Biophys. 2015; 460: 20-2; Povarnina PY, et al., Acta Naturae. 2018; 10 (3): 81-84). На культуре гиппокампальных клеток методом Western blot анализа показана способность низкомолекулярного миметика BDNF соединения ГСБ-106 селективно активировать TrkB рецепторы и его внутриклеточные AKT/MAP киназные сигнальные пути (Гудашева Т.А. и соавт., Доклады академии наук. 2013; 451 (5): 577-580).
Однако, данные о характере возможного антиаддиктивного потенциала у нового психотропного средства с оригинальным механизмом действия в настоящее время отсутствуют.
Животные. Настоящее исследование выполнено на беспородных белых крысах-самцах (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Животных содержали по 6 особей в клетке в условиях вивария ФГБНУ «НИИ фармакологии имени В.В. Закусова» (температура 21-23°С, относительная влажность воздуха 40-60%) при естественной освещенности и свободном доступе к воде и брикетированному корму в течение 10 суток до начала тестирования. Организация и проведение работ осуществлялись в соответствии с приказом Минздрава России №199 от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики». Животные содержались в соответствии с СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Препараты. Морфина гидрохлорид (Минмедбиопром объединение «Чимкентбиофарм», субстанция) растворяли в воде для инъекций и вводили внутрибрюшинно (в/б) в дозе 5 мг/кг из расчета 0.1 мл/100 г массы крысы. Животные контрольной группы получали воду для инъекций. ГСБ-106 (гексаметилендиамид бис-(N-моносукцинил-L-серил-L-лизина)) в виде субстанции, синтезированный в ФГБНУ «НИИ фармакологии имени В.В. Закусова», в эффективной дозе 0.1 мг/кг растворяли в воде для инъекций и вводили в/б из расчета 0.1 мл/100 г массы крысы.
Методики
Тест «условно-рефлекторное предпочтение места» (УРПМ) для оценки вторичных подкрепляющих свойств психоактивных веществ.
Установка для оценки поведения «предпочтения места» у крыс (SD Instruments, San Diego, СА, USA) представляет собой камеру, состоящую из 3-х отсеков: левого (27×22×30 см), правого (27×22×30 см) и центрального (14×22×30 см), имеющих полы разной структуры (левый - гладкий, правый - рифленый, центральный - решетчатый) и по-разному окрашенные стенки (левый отсек с вертикально нанесенными черными линиями на белом фоне, правый отсек - с горизонтальными черными линиями на белом фоне). Отсеки камер могут быть изолированы друг от друга с помощью гильотино-подобных заслонок. Установка снабжена системой индикации движения PAS и соответствующей ей программой PAS764 SDI, сопряженной с компьютером, что позволяет записывать показатели поведения животных online и представлять в форме, адаптированной к стандартным программам Windows.
Тест УРПМ относится к одним из общепринятых и валидированных подходов для оценки способности веществ, влияющих на ЦНС, вызывать формирование лекарственной зависимости у лабораторных животных. Результаты применения теста УРПМ («conditioning place preference») хорошо согласуются с клиническими данными, демонстрирующими активность психотропных веществ у человека при их приеме по медицинским показаниям или при необоснованном нелегальном применении. Реакция «подкрепляемого фармакологическим агентом предпочтения места» использовалась ранее при изучении действия морфина, метамфетамина, кокаина и др.
Для оценки влияния изучаемого лекарственного кандидата на вторичные подкрепляющие эффекты морфина использовали ранее описанную методику с модификациями (Fan Y. et al., Neurosci Bull. 2012; 28(5):567-76; Budygin E A et al. PNAS, 2004; 101 (20): 7781-7786; Buffalari DM et al. Pharmacol Biochem Behav. 2014; 124:320-5).
Процедура тестирования включает пять фаз:
1-я фаза (1-й день эксперимента) - адаптации и снижения выраженности ориентировочной реакции в ходе последующего эксперимента, для чего каждую крысу помещают в центральный отсек камеры на 15 мин при открытых заслонках между отсеками; крысы свободно перемещаются между отсеками камеры;
2-я фаза (2-й день эксперимента) - предварительное тестирование животных (пре-тест) в установке УРПМ в течение 15 минут без введения веществ с автоматической регистрацией перемещения крыс между 3-мя отсеками камеры и фиксированием числа заходов в каждый отсек камеры и времени пребывания животных в каждом из отсеков; данные обрабатываются и животные, находившиеся в одном из отсеков камеры (левом или правом) ≤25% времени по соотношению tсек = лев/прав × 100% исключаются из эксперимента. Оставшиеся после отбора животные в случайном порядке разбиваются на группы и включаются в эксперимент. В ходе предварительного тестирования из опытов могут быть исключены животные как неудовлетворяющие критерию отбора по времени пребывания в левом или правом отсеках камеры, кроме того, не включаются в исследование животные с низким весом и заметными нарушениями общего поведения.
3-я фаза (3-12 дни эксперимента) - обучение (или «обусловливания»), при котором введение исследуемого вещества (или растворителя) сочетается с посадкой животных в определенный отсек камеры. При выполнении обучения лекарственный кандидат, морфин и растворитель (контроль) вводят крысам парентерально и помещают животных в определенный отсек камеры (всегда один и тот же для данного вещества) на 30 минут при опущенной заслонке, отделяющей этот отсек от центрального. Инъекции исследуемого вещества и растворителя чередуют. Таким образом, выполняют 5 сочетаний при введении исследуемого вещества и морфина с посадкой животного в левый отсек камеры через день. Крысы контрольной группы получают ежедневно инъекции растворителя перед посадкой в противоположный опытной группе отсек камеры.
4-я фаза (13-й день эксперимента) - тестирование животных на наличие поведения «предпочтения места» через 24 ч после окончания фазы обучения («тест 1»). В этот день никакие вещества не вводят, регистрируют время пребывания животных в левом и правом отсеках камеры в течение 15 мин при поднятых заслонках между отсеками, что позволяет животным свободно перемещаться внутри пространства камеры.
5-я фаза (21-й день эксперимента) - тестирование животных на наличие поведения «предпочтения места» через 7 суток после последнего введения изучаемых препаратов («тест 2»). В этот день регистрируют время пребывания животных в левом и правом отсеках камеры в течение 15 мин при поднятых заслонках между отсеками, что позволяет животным свободно перемещаться внутри пространства камеры.
Подкрепляющие свойства исследуемого соединения оценивают по разности времени (Δсек) пребывания крыс в определенном, например, левом (ассоциируемым с исследуемым веществом) и правом (ассоциируемым с контрольным раствором) отсеках камеры. Положительные значения соответствуют реакции предпочтения места, отрицательные значения - аверсивной реакции.
Формирование зависимости от опиатов и оценка соматических проявлений синдрома отмены морфина.
У крыс вырабатывали зависимость от морфина и оценивали поведение на наличие специфических признаков синдрома отмены (СО) в соответствии со стандартной схемой, описанной ранее (Константинопольский М.А. и соавт., Экспер. клин, фармакол. 1992. 55 (1): 21-24). Для получения животных, зависимых от морфина, препарат вводили животным в возрастающих дозах 10-20 мг/кг, 2 раза в день через 8 ч в течение 4 суток: 1-е сутки всего - 10 и 10 мг/кг, 2-е сутки - 10 и 20 мг/кг, 3-е сутки - 20 и 20 мг/кг, 4-е сутки - 20 и 20 мг/кг; 5-е сутки - 20 мг/кг утром. Гексаметилендиамид бис-(N-моносукцинил-серил-L-лизина) в дозе 0.1 мг/кг, в/б, вводили однократно за 30 минут до морфина на 5-й день эксперимента. Тестирование животных на наличие специфических признаков синдрома отмены (СО) морфина проводили на 5-й день опыта в течение 5 мин в «открытом поле» (освещенная круглая арена диаметром 80 см) через 15 мин после введения антагониста опиатных рецепторов налоксона ("Du Pont De Nemours Int. S.A., Swiss") в дозе 1.0 мг/кг для провокации СО. Контрольным животным ежедневно в течение 5 дней однократно утром вводили воду для инъекций, а на 5-й день опыта перед тестированием - налоксон в дозе 1.0 мг/кг. Для всех групп регистрировали поведенческие реакции животных (двигательную активность (ДА), стойки, груминг, дефекации) и специфические признаки СО морфина (16 показателей). Дискретные признаки абстиненции (диарею - в баллах, отряхивания и скрежет зубами - по числу актов) оценивали количественно и альтернативно, остальные - в альтернативной форме по принципу «да» - «нет». Суммарный индекс (СИ) выраженности СО для каждого животного и средние значения для опытных и контрольных групп рассчитывали на основании альтернативных признаков при максимально возможной величине СИ, равной 16 баллам. Среднее значение выраженности СО в группе «морфин» (активный контроль) принимали за 100%.
При изучении влияния димерного дипептидного миметика 4-й петли BDNF гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина), обладающего антидепрессивными свойствами, на проявление синдрома отмены морфина у животных со сформированной лекарственной зависимостью впервые показано, что гексаметилендиамид бис-(N-моносукцинил-L-серил-L-лизина) в дозе 0.1 мг/кг сокращал выраженность поведенческих признаков синдрома отмены на 55,2% при однократном и на 45,6% при субхроническом введении по сравнению с группой активного контроля, в частности, устраняя или существенно ослабляя такие признаки физической зависимости как скрежет зубами, пилоэрекция, ринорея, встряхивания лап и головы, попытки бегства.
Статистическую обработку полученных результатов производили при помощи однофакторного дисперсионного анализа (ANOVA), теста Манна-Уитни для независимых групп и теста Вилкоксона для зависимых групп. Проверку нормальности распределения данных осуществляли с помощью критерия Шапиро-Уилкса. Критический уровень значимости α=0.05. Данные представлены в виде средних значение (mean).
Изобретение иллюстрируется следующими примерами
Пример 1. Влияние гексаметилендиамид бис-(N-моносукцинил-L-серил-L-лизина) на формирование подкрепляющих эффектов морфина
Эксперименты выполнены на беспородных крысах-самцах (n=80) с массой тела 220-250 г.
Животных, отобранных в ходе фонового («пре-тест») тестирования, разделяли случайным образом на следующие группы:
группа 1 «Контроль»: вода для инъекций + вода для инъекций (5 инъекций);
группа 2 «ГСБ-106»: вода для инъекций + ГСБ-106 (5 инъекций);
группа 3 «Морфин»»: вода для инъекций (5 инъекций) + морфин (5 инъекций);
группа 4: «ГСБ-106+морфин»: ГСБ-106 (5 инъекций) + морфин (5 инъекций).
В качестве препарата, обладающего выраженным наркогенным потенциалом, использовали агонист опиатных рецепторов морфина гидрохлорид в дозе 5,0 мг/кг, в/б, который демонстрирует выраженные подкрепляющие свойства в тесте УРПМ. Выбор дозы препарата основан на данных литературы и ранее полученных собственных экспериментальных данных (Gong YX. et al., Acta Pharmacol Sin. 2007; 28(1):10-8). Число животных в каждой группе - 11-12.
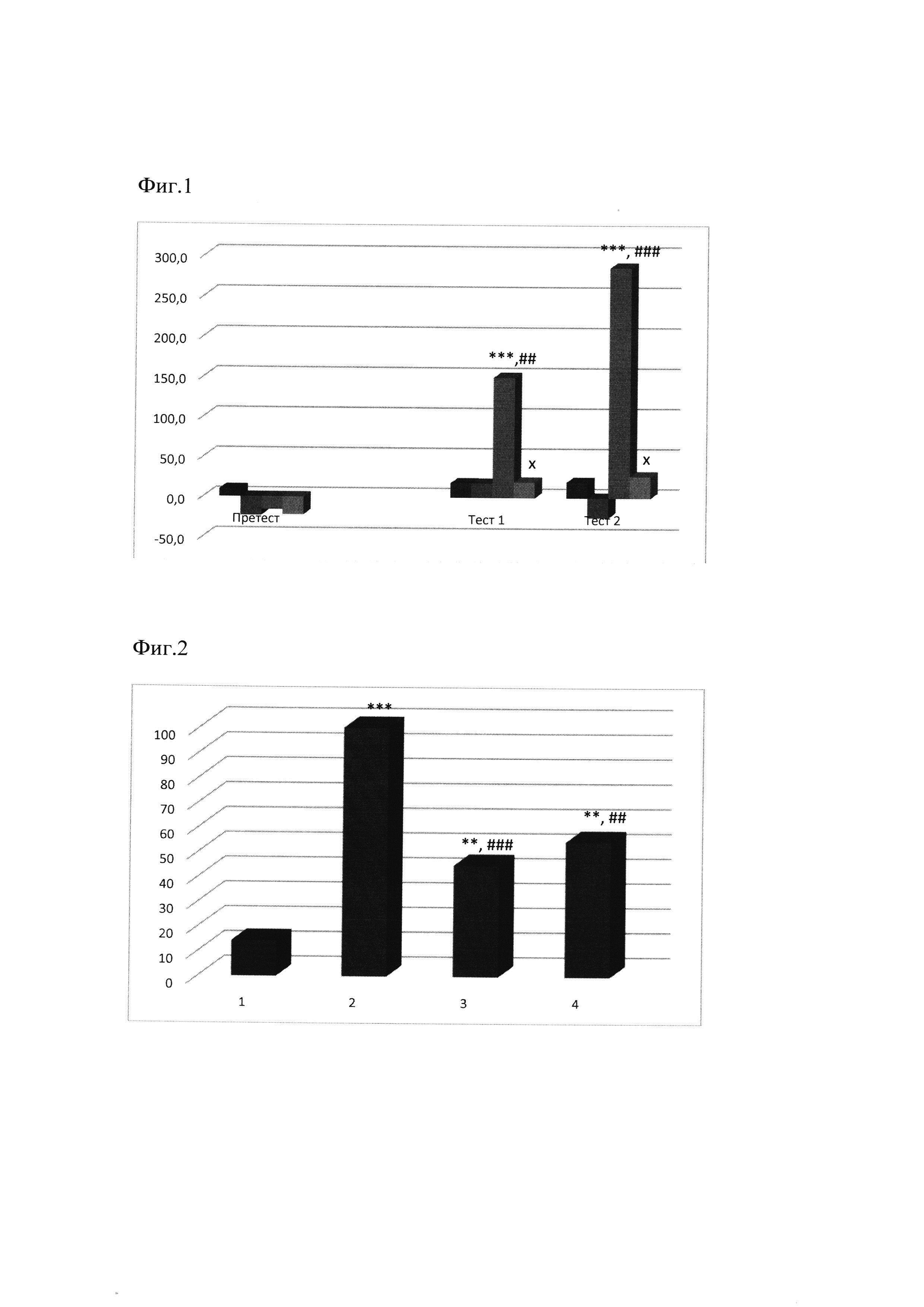
При предварительном тестировании крыс в установке для оценки реакции УРПМ были отобраны крысы, не отличающиеся по предпочтению того или иного отсека и соответствующие критерию отбора более 25% (фиг. 1 «пре-тест»). После введении морфина в дозе 5,0 мг/кг/сутки в течение 5 суток (всего 5 в/б инъекций) отмечалось выраженное устойчивое формирование предпочтения правого отсека камеры, ассоциированного с действием агониста опиатных рецепторов, что значительно превосходит показатели контрольной группы (р<0,01). Морфин статистически значимо увеличивал время пребывания животных в правом отсеке (р<0,001) при первом и втором тестировании по сравнению с данными предварительного тестирования («пре-тест»), то есть эффект предпочтения места, ассоциированного с действием морфина сохранялся в течение 7 дней после последней инъекции опиоидного анальгетика. Одновременно с этим время пребывания животных в левом отсеке камеры снижалось по сравнению с группой «контроль» и пре-тест, что свидетельствует о валидности данной методики для оценки вторичных подкрепляющих свойств психоактивных веществ.
Соединение ГСБ-106 при субхроническом введении в дозе 0,1 мг/кг не влияло на продолжительность пребывания в камере, ассоциированной с действием изучаемого соединения (фиг. 1, «тест 1» и «тест 2»). Более того, при субхроническом введении, за 30 мин предшествующем введению агониста опиатных рецепторов (морфина), низкомолекулярный миметик 4-й петли BDNF препятствовал формированию вторичных подкрепляющих свойств морфина, статистически значимо сокращая время пребывания в правом отсеке камеры, ассоциированном с действием морфина (р<0,05) (фиг. 1, «тест»). Более того, антиаддиктивный эффект ГСБ-106 в дозе 0.1 мг/кг, обладающей антидепрессивным действием в опытах in vivo, сохранялся в течение последующих 7 дней («тест 2»).
Пример 2. Влияние гексаметилендиамид бис-(N-моносукцинил-L-серил-L-лизина) при однократном и субхроническом введении на проявление поведенческих признаков «синдрома отмены» морфина у крыс
Эксперименты выполнены на беспородных крысах-самцах (n=38) с массой тела 220-250 г.
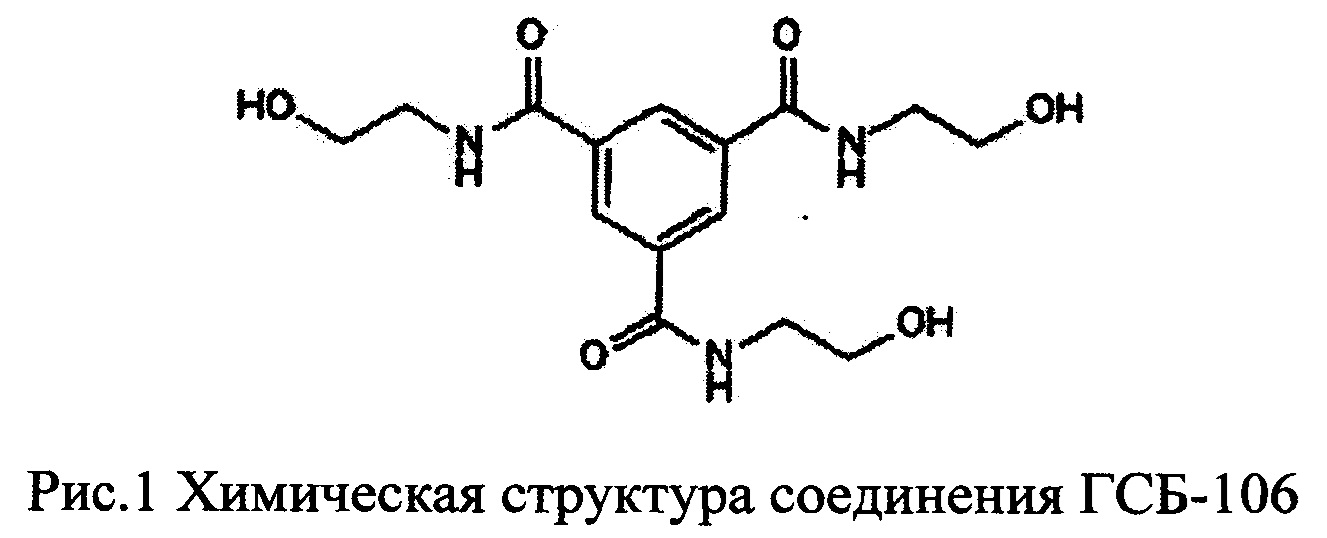
Полученные в данном примере результаты показывают, что гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина), или ГСБ-106, при однократном (1 инъекция) и субхроническом (5 инъекций) введении оказывал существенное влияние на специфические поведенческие показатели синдрома отмены (СО) у крыс, получавших морфин. В сравнении с группой активного контроля «морфин» суммарный индекс СО морфина для группы «М+ГСБ-106(1)» снижался на 55,2% (р<0.01), при этом эффект ГСБ-106 при субхроническом введении был несколько слабее, для группы «М+ГСБ-106(5)» зарегистрировано снижение суммарного индекса СО на 45,6% (р<0.01) (фиг. 2).
Оценивая коррекцию отдельных проявлений СО морфина, следует отметить снижение или полное устранение таких показателей как пилоэрекция (р<0,01), стереотипия (р<0,01), скрежет зубами (р<0,05), ринорея (р<0,05), отряхивания (р<0,05) и попытки к бегству (р<0,05) при однократном введении ГСБ-106 (таблица 1), что указывает на преимущественное влияние низкомолекулярного миметика BDNF на проявление признаков отмены уже сформированной зависимости от опиатов. Менее выраженное, но также статистически достоверное ослабление отдельных признаков синдрома отмены регистрировали при субхроническом введении ГСБ-106 в течение 5 суток вместе с морфином, что прежде всего отразилось на сокращении пилоэрекции (р<0,01), скрежета зубами (р<0,05), отряхиваниях (р<0,05) и попытках к бегству (р<0,05) (таблица 1).
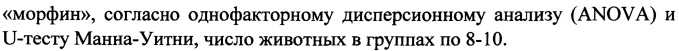
Полученные результаты свидетельствуют о положительном влиянии ГСБ-106 при купировании поведенческих признаков синдрома отмены морфина у крыс со сформированной опиоидной зависимостью при остром и субхроническом введении.
В целом представленные экспериментальные данные опытов in vivo указывают на наличие у ГСБ-106 антиаддиктивного потенциала, проявляющегося в предотвращении формирования вторичных подкрепляющих (мотивационных) эффектов опиоида, и значительном ослаблении соматических проявлений при резкой отмене опиоида.
Таким образом, ранее полученные данные об антидепрессивном компоненте в фармакологическом профиле гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) и доказанное отсутствие собственного наркогенного потенциала позволяют сделать вывод о его высокой эффективности в качестве средства терапии опиоидной зависимости.
Описание чертежей
Фиг. 1. Оценка влияния ГСБ-106 на вторичные подкрепляющие эффекты опиоидного анальгетика морфина
По оси абсцисс представлены экспериментальные группы при предварительном тестировании («претест»), после 5-ти инъекций морфина и ГСБ-106 («тест 1») и через 6 суток после «тест 1» («тест 2»), по оси ординат - разности времени, Δсек, (с). Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций, в/б); 2-й столбец - ГСБ-106 в дозе 0,1 мг/кг, в/б; 3-й столбец - морфин в дозе 5 мг/кг, в/б; 4-й столбец - морфин в дозе 5 мг/кг + ГСБ-106 в дозе 0.1 мг/кг, в/б.
Статистически значимые отличия по сравнению с группой «контроль» (*** - р<0.001), согласно непараметрическому критерию Манна-Уитни; по сравнению с результатами пре-тест для группы «морфин» (## - р<0.01, ### - р<0.001), согласно тесту Вилкоксона для зависимых групп; по сравнению с группой «морфин» (х - р<0.05), согласно непараметрическому критерию Манна-Уитни. Данные представлены в виде средних значений.
Фиг. 2. Оценка влияния ГСБ-106 на суммарный индекс налоксон-индуцированного синдрома отмены у крыс
По оси абсцисс представлены экспериментальные группы, по оси ординат - значения суммарный индекс синдрома отмены в %. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - морфин, 3-й столбец - морфин + ГСБ-106 в дозе 0.1 мг/кг при однократном введении, 4-й столбец - морфин + ГСБ-106 в дозе 0.1 мг/кг при субхроническом введении.
**- р<0,01, *** - р<0,001 по сравнению с группой «контроль», ## - р<0.01, ### - р<0.001 по сравнению с группой «морфин», согласно однофакторному дисперсионному анализу (ANOVA) и U-тесту Манна-Уитни, число животных в группах по 8-10; данные представлены в виде средних значений.
Применение гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) в качестве средства для лечения опиоидной зависимости.