Результат интеллектуальной деятельности: Способ заморозки ооцитов крупного рогатого скота
Вид РИД
Изобретение
Изобретение относится к биотехнологии в сельском хозяйстве и животноводстве, в частности, к области криоконсервации биологических объектов, и может быть использовано для заморозки ооцитов КРС путем витрификации.
На протяжении трех десятилетий уверенно растет популярность трансплантации эмбрионов. Она получила «второе дыхание» с открытием возможностей: замены рискованной в инфекционном плане торговли племенным скотом на биотехнологический экспорт-импорт племенных ресурсов, получения сексированных (с заказанным полом) эмбрионов, технологии вымывания яйцеклеток (ооцитов), их экстракорпорального оплодотворения и доращивания вне организма (in vitro). Технология криоконсервации ооцитов и эмбрионов, а также создание национальных банков наследственного материала племенных животных позволит значительно снизить издержки на закупки импортного КРС, увеличить поголовье скота за счет повышения скорости воспроизводства, что улучшит рентабельность племенных хозяйств. Экспорт чистопородного племенного скота из России практически не осуществляется. Эта проблема также может быть решена за счет экспорта замороженных ооцитов или эмбрионов КРС.
Проблема сохранения наследственного материала ценных пород домашних животных еще не решена. На рынке предлагаются различные методы криоконсервации (витрификации) биологического материала (гамет и тканей), но в большинстве случаев после размораживания регистрируют значительное снижение жизнеспособности и функциональной активности клеток. Остается актуальным вопрос об эффективности криопротекторов и их влиянии на сохранность ДНК, клеточных мембран, органелл во время заморозки и длительного хранения при ультранизких температурах.
Стандартным методом заморозки ооцитов для человека и животных является медленная заморозка с использованием среды с добавлением компонентов животного происхождения (сыворотка КРС, альбумин) и различных криопротекторов: пропандиола (ПД), диметилсульфоксида (ДМСО), этиленгликоля (ЭГ), пропиленгликоля (ПГ) в различных сочетаниях и концентрациях. Криопротекторы ПД, ДМСО, ЭГ и ПГ способны проникать через мембраны ооцитов и клеток стромы, они обеспечивают защиту клеточных структур как внутри, так и вокруг клеток. Эти проникающие криопротекторы часто используют в комбинации с непроникающими, такими как сахароза, глюкоза, глицерин или сывороточный альбумин. Медленная заморозка приводит к образованию кристаллов льда и повреждению структуры ооцита и снижает его жизнеспособность. Считается, что если значительно увеличить скорость заморозки, и, следовательно, уменьшить время контакта биоматериала с криопротекторами, чтобы избежать токсического эффекта, то можно добиться большей выживаемости размороженных (ревитализированных) клеток и тканей.
Существует всего несколько зарубежных фирм, которые представляют свою продукцию для заморозки методом витрификации на Российском рынке. Первыми в разработке метода витрификации ооцитов были японские ученые. Основываясь на высокоэффективном методе витрификации яйцеклеток, первым был создан набор реагентов Cryotop (Китазато, Япония), однако в его составе имеются белки животного происхождения и антибиотики. Японская фирма CryoTech Lab также выпускает подобный набор для витрификации ооцитов и эмбрионов. Однако он содержит только один криопротектор и полисахарид, а также антибиотик и альбумин. Бельгийская фирма FertiPro N.V. выпускает набор VitriFreeze/ThawES, он содержит человеческий альбумин, хотя не содержит антибиотиков. Набор реагентов Medicult Vitrification Cooling (Origio, США) не содержит ДМСО, но включает альбумин человека. Все эти наборы разработаны для заморозки методом витрификации ооцитов и эмбрионов человека, а не для витрификации яйцеклеток и эмбрионов животных.
В Российской базе изобретений существуют несколько способов, среди которых описаны установки для витрификации ооцитов и эмбрионов млекопитающих, среды для культивирования фолликулов млекопитающих животных и человека, способы криосохранения клеток морских беспозвоночных, половых клеток рыб и сперматозоидов КРС, описаны используемые криопротекторы для витрификации ооцитов и эмбрионов млекопитающих (мышей, свиней). Наиболее близкими к предлагаемому техническому решению являются примеры и сущность изобретения, описанные в следующих трех патентах.
Известен «Способ культивирования in vitro овариальных фолликулов» по патенту RU 2286384. В основе изобретения лежит способ получения большого количества зрелых или незрелых фолликулов и/или ооцитов из ткани яичников млекопитающих (мышей). В своем изобретении ученые описывают пример создания и использование банка фолликулов. В данном способе описано, что фолликулы мышей собирают в пластиковые криоампулы (Simport, Quebec, Canada), 25 фолликулов на одну ампулу суспендируют в 150 мкл среды L15 с 10% инактивированной нагреванием фетальной телячьей сыворотки и 1,5 М ДМСО. Далее медленно замораживают с помощью программируемого замораживающего аппарата (Cell Freezer R204; Planer, Sunbury-on-Thames, UK). Фолликулы выдерживают в замораживающей смеси в течение 15 мин при 4°С, затем охлаждают до -7°С со скоростью 2°С в мин. После ручного переноса температуру снижают до -40°С со скоростью -0,3°С в мин до помещения в жидкий азот, где фолликулы очень быстро охлаждались до -110°С со скоростью -50°С в мин. Размораживание фолликулов производят очень быстро путем нагревания криоампул до 37°С. Криопротектор растворяют в три этапа (снижают концентрацию ДМСО от 1,5М до 1М, затем до 0,5М) в течение 15 мин при комнатной температуре. Перед культивированием фолликулы выдерживают 15 мин при 37°С в среде для выделения.
Недостатками данного способа является медленное замораживание, а не витрификация. В качестве объекта используют фолликулы из ткани яичников млекопитающих (мышей), а не ооциты. Авторы используют телячью сыворотку, что увеличивает риск возможного инфицирования биологического материала. Способ медленной заморозки требует применения дополнительного оборудования (программируемый замораживающий аппарат) и не защищает клетки от повреждающего воздействия кристаллов льда. Также способ пригоден только для медленной заморозки фолликулов мышей, а не ооцитов КРР, которые отличаются между собой по ряду физиологических параметров.
Известен способ «Система и устройство (варианты) для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна» по патенту RU 2584584. Данное изобретение может найти применение для криоконсервации ооцитов мышей и свиней. В основе способа лежит описание устройства для загрузки, витрификации и отогревания группы эмбрионов млекопитающих при использовании в качестве носителя полого волокна. Устройство состоит из отрезка полого волокна и капилляра с конусообразным кончиком, отличается тем, что отрезок полого волокна прикрепляют непосредственно к капилляру одноразового использования путем надевания отрезка полого волокна на конусообразный кончик. В примере использования изобретатели описывают способ витрификации путем сверхбыстрого охлаждения объекта, предварительно обработанного в растворах с высокой концентрацией веществ-криопротекторов, таких как, например, диметилсульфоксид (ДМСО), этиленгликоль (ЭГ), сахароза. Технически сверхвысокую скорость охлаждения достигали при прямом погружении в жидкий азот витрифицируемого объекта, общий объем которого не превышал 0,10 мкл. Базовым раствором для проведения витрификации и отогревания эмбрионов являлась среда Тироде с добавлением 20,0% сыворотки крови.
Недостатками данного способа является использование изобретателями криопротекторов в высоких концентрациях в сочетании с сывороткой крови, которая содержит белки животного происхождения и может быть источником инфекции. Также способ пригоден только для витрификации ооцитов мышей и свиней, а не ооцитов КРС, которые отличаются по ряду параметров. Использование полого волокна усложняет процедуру витрификации и делает ее более продолжительной по времени, что может негативно сказаться на качестве ооцитов и эмбрионов после размораживания.
Известен «Способ низкотемпературного консервирования эмбрионов» по патенту SU 1683621. Данное изобретение может найти применение для длительного хранения репродуктивных клеток млекопитающих (мышей). В нем к эмбрионам мышей, полученным на стадии бластомеров, добавляют смесь криопротекторов: глицерина, пропиленгликоля, диметилсульфоксида и 0,4% раствор холина-хлорида, на стандартной фосфатно-солевой среде Дюльбекко до конечной концентрации 4:75- 5,5% каждый. Все процедуры осуществляют при температуре 4-8°С. После эквилибрации эмбрионы разливают в контейнеры, завальцовывают их и погружают на 5-10 с. в порошок цинка, охлажденный до температуры жидкого азота (-196°С). Затем контейнеры переносят в жидкий азот.
Данный способ не относится к криоконсервации ооцитов млекопитающих, а описывает процедуру консервирования эмбрионов. Главными недостатками является осуществление всех процедур при 4-8оС и использование способа для витрификации уже оплодотворенных ооцитов мышей, т.е. эмбрионов, а не ооцитов КРС.
Задачей изобретения является устранение всех указанных недостатков, а именно применение комбинации криопротекторов для криоконсервации ооцитов КРС в подобранных опытным путем условиях. Предлагаемое изобретение позволяет избавиться от формирования разрушающих клетку кристаллов льда в процессе витрификации (прямого погружения биологического материала в жидкий азот), так как происходит замещение воды внутри клетки на специальные вещества - криопротекторы, поэтому метод является более простым в использовании и более эффективным. Предлагаемый способ не требует наличия специальных устройств для криоконсервации биологических объектов, что отличает способ простотой и делает его менее затратным.
Технический результат.
Предлагаемое изобретение позволяет витрифицировать ооциты КРС и получить яйцеклетки животных высокой степени жизнеспособности, с подтвержденной биологической активностью, высокой стабильностью после длительного хранения в жидком азоте и последующей ревитализации (размораживании). Данный способ предназначен для длительного хранения при ультранизких температурах половых клеток (ооцитов) КРС, с целью обеспечения сохранности пород, снижения риска потери племенного ядра от инфекций, повышения скорости воспроизводства рабочего поголовья.
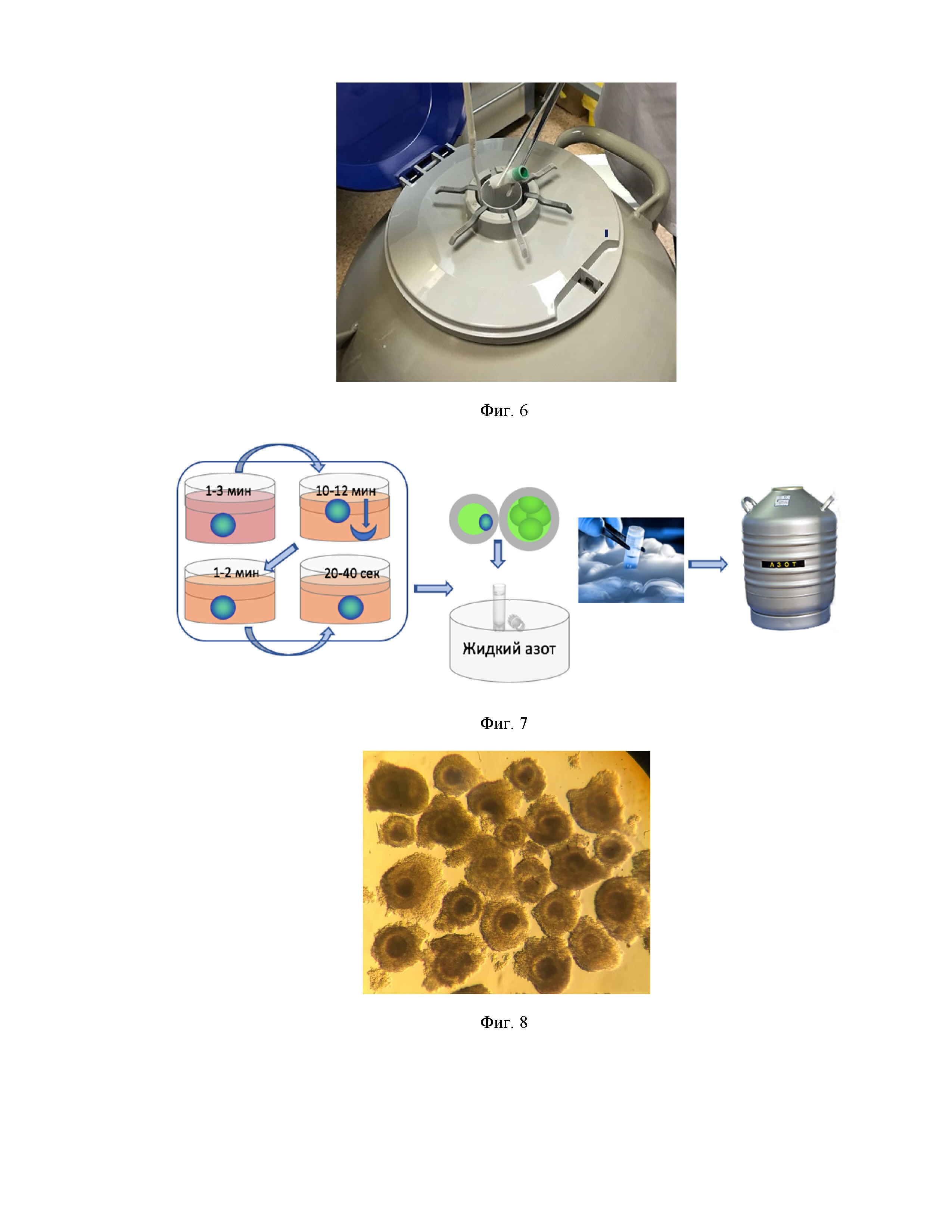
Сущность изобретения включает извлечение из яичников КРС, доставленных в лабораторию в течение нескольких часов при температуре 23-25°С, ооцитов при помощи аспирации из антральных фолликулов больше 2 мм в диаметре, затем морфологического отбора ооцитов для последующей заморозки. Отобранные ооциты подвергают быстрой заморозке путем метода витрификации, который проводят в асептических условиях (в ламинарном боксе). Ооциты помещают в раствор на основе HEPES-буфера на 1-3 мин, далее их перемещают последовательно сначала в витрификационный раствор 1, содержащий комбинацию криопротекторов (ЭГ и ДМСО) в концентрации 5-20% на 10-12 мин. Далее ооциты перемещают на 1-2 мин из раствора 1 в раствор 2, содержащий комбинацию тех же криопротекторов в увеличенной концентрации 20-40%. Затем ооциты перемещают на 20-40 с. из раствора 2 в раствор 3, дополнительно содержащий непроникающий криопротектор (сахарозу) в концентрации 1-10 М. Далее из раствора 3 содержимое с ооцитами в объеме 5-50 мкл переносят в криопробирку, частично погруженную в жидкий азот, затем наглухо закручивают крышку и погружают криопробирку в контейнер с жидким азотом. Далее переносят криопробирку из емкости с жидким азотом в сосуд Дьюара или криохранилище с жидким азотом для длительного хранения. В результате данной процедуры витрификации достигают эффективность ревитализации ооцитов более чем в 80% случаев. Предложенный способ быстрой заморозки может быть в дальнейшем использован для создания национальных банков наследственного материала, а именно ооцитов КРС, также для последующего размораживания ооцитов, их оплодотворения in vitro, культивирования и последующей трансплантации эмбрионов.
Перечень чертежей
Фиг. 1 - Аспирация антральных фолликулов из яичников коров.
Фиг. 2 - Ооциты коров в растворе для выделения.
Фиг. 3 - Планшет со средами для витрификации.
Фиг. 4 - Схема заполнения лунок 4-луночного планшета с помощью стерильного шприца.
Фиг. 5 - Погружение криопробирки в контейнер с жидким азотом.
Фиг. 6 - Перенос криопробирки с ооцитами после витрификации в сосуд Дьюара.
Фиг. 7 - Общая схема процедуры заморозки ооцитов.
Фиг. 8 - Ооциты коров класса А до проведения процедуры витрификации.
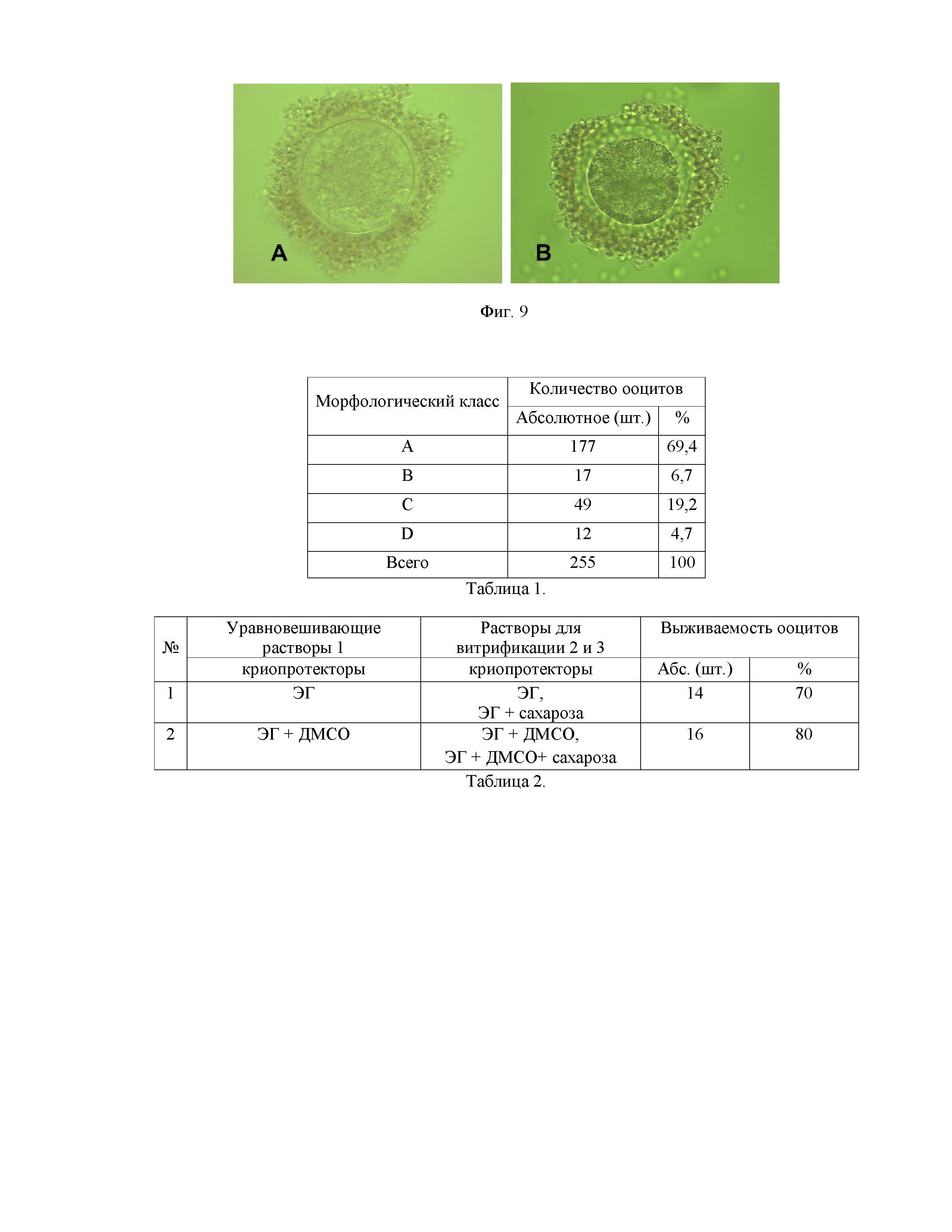
Фиг. 9 - Ооциты коров (ооциты с нормальной морфологией - А, дегенеративные ооциты - В) после витрификации и ревитализации.
Таблица 1 - Классификация ооцитов по морфологии до замораживания.
Таблица 2 - Результаты выживаемости ооцитов после витрификации в средах с разной концентрацией криопротекторов с последующей ревитализацией.
Порядок реализации способа
1. Биоматериал (яичники коров) доставить в лабораторию в течение нескольких часов при комнатной температуре. Ооциты извлечь из яичников при помощи аспирации шприцом из антральных фолликулов больше 2 мм в диаметре (Фиг. 1). Яйцеклетки отмыть физиологическим раствором с HEPES-буфером. Произвести морфологический отбор ооцитов для последующей заморозки (Фиг. 2).
2. Проверить среду для промывки и витрификационные растворы на прозрачность, отсутствие взвесей или помутнения. Тщательно спланировать выполнение всех необходимых манипуляций. Среды всегда использовать только в ламинарном потоке во избежание контаминации. Подогреть все среды до комнатной температуры (20-25°С) в объеме необходимом для проведения процедуры замораживания. Подготовить пинцет и емкость с жидким азотом.
3. С помощью стерильного шприца заполнить лунки 4-луночного планшета (Фиг. 3) в соответствии со следующей схемой (Фиг. 4):
• в первую лунку планшета внесите 300-500 мкл HEPES-буфера (любая среда с буфером HEPES или MOPS),
• во вторую лунку - 300-500 мкл Раствора 1, содержащего комбинацию криопротекторов: ЭГ и ДМСО,
• в третью - 300-500 мкл Раствора 2, содержащего увеличенную концентрацию криопротекторов: ЭГ и ДМСО,
• в четвертую - 300-500 мкл Раствора 3, содержащего ЭГ, ДМСО и непроникающий криопротектор - сахарозу.
4. Далее, приготовить необходимое количество криопробирок и подписать, имея в виду, что в 1 криопробирку можно заморозить до 5-ти ооцитов. В одной подготовленной порции среды может быть проведено до 5 витрификационных циклов для одного индивидуального животного.
• В асептических условиях (ламинарный бокс) поместить ооциты, в первую лунку в HEPES-буфер на 1-3 мин.
• Переместить ооциты из лунки 1, в лунку 2 на 8-12 мин. После перенесения ооцитов из HEPES-буфера (Лунка №1) в Раствор 1 (Лунка №2) ооциты начнут менять форму и сожмутся, а затем вернутся в исходное состояние к первоначальному размеру, данный процесс занимает не более 12 мин.
• Переместить ооциты из лунки 2 в лунку 3 на 1-2 мин.
• Переместить ооциты из лунки 3 в лунку 4 на 20-40 с.
5. Удерживая при помощи пинцета верхний конец открытой криопробирки частично погрузить ее в жидкий азот, ввести кончик наконечника дозатора внутрь криопробирки и капнуть содержимое с 1-5 ооцитами. Затем, удерживая криопробирку пинцетом одной рукой, другой рукой наглухо закрутить крышечку и погрузить криопробирку в контейнер с жидким азотом (Фиг. 5). Полная процедура, включая помещение ооцита в среду Раствор 3, загрузка ооцита в криопробирку и ее запечатывание, должны занимать не более 60 с. перед погружением в жидкий азот.В случае если этот процесс займет более 60 с, полученный результат может ухудшиться и выживаемость ооцитов снизится.
6. Перенести все криопробирки из емкости с жидким азотом в сосуд Дьюара или криохранилище с жидким азотом для длительного хранения (Фиг. 6).
Примеры реализации способа
Пример 1. Отбор ооцитов по морфологическим критериям для витрификации.
В результате аспирации антральных фолликулов яичников 20 коров разной возрастной категории (от 2 до 9 лет) было получено 255 яйцеклеток разной степени зрелости. В среднем от одной коровы было получено по 12 ооцитов. Из всех полученных ооцитов дегенеративных клеток оказалось 30,5%. Для процедуры витрификации были отобраны ооциты только с хорошей морфологией, окруженные клетками кумулюса (КОК), которые соответствовали классу А (Фиг. 8).
После аспирации КОК отмывали в физиологическом растворе или в фосфатно-солевом буфере (ФСБ) с добавлением HEPES-буфера и подсчитывали, распределяя по морфологии, где классу А соответствовали ооциты со всех сторон окруженные клетками кумулюса, В - частично окруженные, С - голые ооциты, Д - с измененными клетками кумулюса. В соответствии с этой классификацией все ооциты распределились следующим образом как представлено в таблице 1. Для процедуры витрификации отбирали КОК класса А.
Пример 2. Выживаемость ооцитов КРС в различных средах.
В ходе работы нами было проведено сравнение выживаемости КОК крупного рогатого скота в средах с ЭГ и в сочетании ЭГ с ДМСО. Для оценки выживаемости ооцитов было разморожено 32 КОК предварительно витрифицированных в растворе ЭГ и ДМСО (n=20) и только в растворе ЭГ (n=20). Быстрое оттаивание ооцитов производили, инкубируя последовательно в двух растворах, основанных на ФСБ, содержащих сахарозу в концентрации 0,5-5 М по 3-5 мин в каждом с двукратным разведением. Показано, что выживаемость для витрифицированных ооцитов в ЭГ была ниже (70%), чем в комбинации ЭГ и ДМСО (80%) (таблица 2). В результате было показано, что для ооцитов крупного рогатого скота эффективнее проводить процедуру витрификации в среде с разными криопротекторами ЭГ и ДМСО, используя их в комбинации.
Пример 3. Сравнение витрификации и медленной заморозки.
Ооциты КРС были заморожены с помощью витрификации и при помощи медленной заморозки в растворе, содержащем ДМСО в концентрации 5-15%. После хранения в жидком азоте 2-14 дней проводили разморозку и ревитализацию ооцитов. Быстрое оттаивание ооцитов производили, инкубируя последовательно в двух растворах сахарозы в разных концентрациях 3-5 мин в каждом. После витрификации в средах для криоконсервации с разной концентрацией ЭГ с ДМСО (Раствор 1, 2 и 3) морфологическая оценка яйцеклеток коров показала, что более 75% ооцитов имели нормальную морфологию (Фиг. 9 - А). А после медленной заморозки в коммерческом растворе с ДМСО и последующего оттаивания имели структурные изменения в морфологии, свойственные дегенеративным ооцитам в 60% случаев (Фиг. 9 - В).
Подтверждение достижения технического результата.
Предложенный способ заморозки ооцитов КРС является простым, так как не требует использования дополнительного оборудования и быстрым, так как в основе способа лежит метод витрификации, а не медленная заморозка. Способ является наименее токсичным за счет применения комбинации криопротекторов в сниженных концентрациях, изобретение позволяет защитить значительную часть ооцитов от повреждений при заморозке, что привело к достижению эффективности ревитализации более чем в 80% случаев. Способ отличается использованием бессывороточной среды, не содержащей белков животного происхождения, что позволяет избежать возможного инфицирования биологического материала и делает продукт пригодным для различных видов млекопитающих. Отсутствие антибиотиков в предлагаемом продукте положительно сказывается на качестве биологического материала.