Результат интеллектуальной деятельности: МОДЕЛЬ СУХОГО КЕРАТОКОНЪЮНКТИВИТА НА ЖИВОТНЫХ И СПОСОБЫ ПРИМЕНЕНИЯ ТАКИХ ЖИВОТНЫХ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Настоящая заявка испрашивает приоритет предварительной заявки на патент США №62/086263, поданной 2 декабря 2014 г., полное содержание которой включено в данный документ посредством ссылки.
ПРЕДПОСЫЛКИ РАСКРЫТИЯ
[0002] Сухой кератоконъюнктивит (DED), или keratoconjunctivitis sicca (KCS), описан в отчете Международного семинара по синдрому сухого глаза (DEWS) 2007 года как «многофакторное заболевание слез и поверхности глаза, которое вызывает симптомы дискомфорта, нарушение зрения и нестабильность слезной пленки с потенциальным повреждением поверхности глаза, которое сопровождается повышенной осмолярностью слезной пленки и воспалением поверхности глаза». (Ocular Surf. 5 (2): 75-92, 2007). Было подсчитано, что у около 3,23 миллиона женщин и 1,68 миллиона мужчин, в общей сложности 4,91 миллиона американцев, в возрасте 50 лет и старше имеется сухой кератоконъюнктивит. Десятки миллионов имеют менее выраженные симптомы и, возможно, более эпизодическое проявление заболевания (Id.).
[0003] Существует две общепризнанные подгруппы сухого кератоконъюнктивита, а именно сухой кератоконъюнктивит, ассоциированный с водным дефицитом/сниженной выработкой слезной жидкости, и сухой кератоконъюнктивит, ассоциированный с повышенным испарением слезной пленки («испарительный сухой кератоконъюнктивит»).
[0004] В группе с водным дефицитом имеется два основных подкласса: сухой кератоконъюнктивит, связанный с синдромом Шегрена (SS), и сухой кератоконъюнктивит, не связанный с SS. При синдроме Шегрена слезные железы являются мишенью системного аутоиммунного процесса. Слезные железы инфильтрируются активированными Т-клетками, которые вызывают гибель ацинарных и канальцевых клеток и гипосекрецию слез. Некоторые аутоиммунные заболевания ассоциированы с синдромом сухого глаза, связанного с SS, такие как ревматоидный артрит, склеродермия, полимиозит, лимфома, амилоидоз, гемохроматоз, саркоидоз и системная красная волчанка (Djalilian AR, et al. Dry eye. In: Krachmer JH, Mannis MJ, Holland EJ, editors. Cornea. 2nd ed. Philadelphia. Elsevier Mosby; 2005). Синдром сухого глаза, не связанный с синдромом Шегрена, представляет собой форму водного дефицита, возникающую в результате слезной дисфункции, когда системные аутоиммунные признаки сухого кератоконъюнктивита, связанного с SS, исключены. Наиболее распространенной формой сухого кератоконъюнктивита, не связанного с SS, является возрастной сухой кератоконъюнктивит (Ocular Surf. 5 (2): 75-92, 2007).
[0005] Испарительный сухой кератоконъюнктивит является следствием повышенной потери воды с поверхности глаза, независимо от нормальной слезной секреторной функции. Его причины были классифицированы как внутренние, например, вызванные заболеванием, поражающими структуры или динамические свойства век, или внешние, когда заболевание поверхности глаза возникает из-за некоторых внешних воздействий, таких как жесткие условия окружающей среды.
[0006] Измененный гормональный статус (например, после менопаузы) может привести к развитию или обострению сухого кератоконъюнктивита. Известно также, что некоторые другие внешние факторы вызывают или способствуют развитию сухого кератоконъюнктивита, такие как износ контактных линз, рефракционная лазерная хирургия, курение и длительные визуальные процессы, такие как использование компьютера, просмотр телевизора и продолжительное чтение. Ухудшение сухого кератоконъюнктивита также ассоциировано с условиями низкой влажности, имеющими место в офисной среде, кондиционерами автомобилей и экстремально жаркой или холодной погодой. Сухой кератоконъюнктивит также может быть вызван такими лекарственными препаратами, как антигистамины, антидепрессанты, антипсихотические средства и диуретики, которые снижают выработку слезной жидкости (Ocular Surf. 5 (2): 75-92, 2007).
[0007] У пациентов с сухим кератоконъюнктивитом наблюдается воспаление конъюнктивы, проявляющееся в виде инфильтратов Т-клеток и повышения активности CD3, CD4 и CD8, а также маркеров активации лимфоцитов CD11а и HLA-DR (Stern ME, et al. Invest Ophthalmol Vis Sci. 43: 2609-2614 (2002)). Таким образом, патогенез сухого кератоконъюнктивита может зависеть от активации Т-клеток и аутоиммунного воспаления. Провоспалительные цитокины, такие как интерлейкин (IL)-1 и металлопротеиназы (ММР) матрикса, также участвуют в патогенезе сухого кератоконъюнктивита. Было обнаружено повышение содержания провоспалительных форм IL-1 (IL-1α и зрелого IL-1β) и снижение содержания биологически неактивного предшественника IL-1β в слезной пленке пациентов с сухим кератоконъюнктивитом (Solomon A, et al. Invest Ophthalmol Vis Sci. 42: 2283-2292 (2001)).
КРАТКОЕ ОПИСАНИЕ РАСКРЫТИЯ
[0008] Настоящее раскрытие относится к модели сухого кератоконъюнктивита на животных. В данном документе раскрыты способы индуцирования сухого кератоконъюнктивита у животного, относящегося к грызунам, который отражает патофизиологию сухого кератоконъюнктивита (DED) у людей. Животное, относящееся к грызунам, может представлять собой мышь или крысу. Дополнительно раскрыты способы применения животных, относящихся к грызунам, с индуцированным сухим кератоконъюнктивитом, например, при тестировании кандидатных средств для лечения DED.
[0009] В раскрытых в данном документе способах DED индуцируют посредством введения скополамина и хлорида бензалкония (ВАС) животному, относящемуся к грызунам.
[0010] Скополамин можно вводить различными способами, включая системное введение, такое как инъекция, трансдермальный пластырь и имплантация насоса грызуну. Например, скополамин можно вводить путем имплантации насоса для обеспечения инфузии в концентрации 0,4-4,0 мг на 20 г веса тела в день. Хлорид бензалкония можно вводить местно на поверхность глаза грызуна. Например, ВАС можно вводить в концентрации 0,05-0,4% один-четыре раза в день.
[0011] Состояние, представляющее собой сухой кератоконъюнктивит у животных, относящихся к грызунам, обработанных скополамином и ВАС, характеризуется сниженной выработкой слезной жидкости и повышенным раздражением слизистой оболочки глаза относительно контрольных уровней (например, глаз у необработанных грызунов). В одном примере сниженную выработку слезной жидкости измеряют путем выявления снижения выработки слезной жидкости относительно контрольных уровней. В другом примере повышенное раздражение слизистой оболочки глаза измеряют путем выявления в глазу одного или более из: повышения количества воспалительных клеток, повышения количества провоспалительных цитокинов в глазу или повышения интенсивности окрашивания флуоресцеином относительно контрольных уровней. Под «снижением» и «повышением» подразумевается разница по меньшей мере на 10%, 20%, 30%, 40%, 50%, 75%, 100% или больше относительно контрольных уровней.
[0012] При введении скополамина и ВАС животному, относящемуся к грызунам, состояние, представляющее собой сухой кератоконъюнктивит, проявляется в течение нескольких дней после введения, например, в течение 5, 7, 10, 14, 21 или 28 дней после введения. В соответствии с раскрытыми в данном документе способами введение скополамина и ВАС может продолжаться в течение одной или более недель, как, например, в течение двух, трех или четырех недель, и до двух месяцев или дольше, если это желательно.
[0013] Дополнительно в данном документе раскрыты способы тестирования эффективности кандидатного средства для лечения сухого кератоконъюнктивита. Способы включают в себя обеспечение животного, относящегося к грызунам, введение скополамина и хлорида бензалкония животному, относящемуся к грызунам, для индукции сухого кератоконъюнктивита у животного, относящегося к грызунам, введение кандидатного средства животному, относящемуся к грызунам, с сухим кератоконъюнктивитом и определение того, является ли указанное кандидатное средство эффективным в лечении сухого кератоконъюнктивита у животного, относящегося к грызунам.
[0014] В некоторых вариантах осуществления кандидатное средство вводят в момент времени после начала введения скополамина и хлорида бензалкония, так что можно оценить эффективность кандидатного средства в отношении облегчения симптомов или состояний DED. Например, кандидатное средство можно вводить через 3, 4, 5, 6, 7, 14 или 28 дней после начала введения скополамина и хлорида бензалкония. Эффективность кандидатного средства можно определить путем измерения повышения выработки слезной жидкости и/или снижения раздражения слизистой оболочки глаза относительно контрольных уровней (например, глаз у животных, получающих скополамин и хлорид бензалкония, но не получающих кандидатное средство).
[0015] В некоторых вариантах осуществления кандидатное средство вводят одновременно с началом введения скополамина и хлорида бензалкония. В этих вариантах осуществления можно оценить способность кандидатного средства предупреждать DED, например, предупреждать или задерживать наступление или ограничивать развитие сухого кератоконъюнктивита. Эффективность кандидатного средства можно определить путем измерения способности кандидатного средства ограничивать или устранять снижение выработки слезной жидкости и/или ограничивать или устранять повышенное раздражение слизистой оболочки глаза относительно контрольных уровней (например, глаз у животных, получающих скополамин и хлорид бензалкония, но не получающих кандидатное средство).
[0016] Кандидатное средство можно вводить местно или системно, что может зависеть от природы кандидатного средства. Примеры местного введения включают в себя введение кандидатного средства в форме капель, спрея или геля в глаз или нос животного, относящегося к грызунам. Примеры системного введения включают пероральное введение, инъекцию или инфузию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
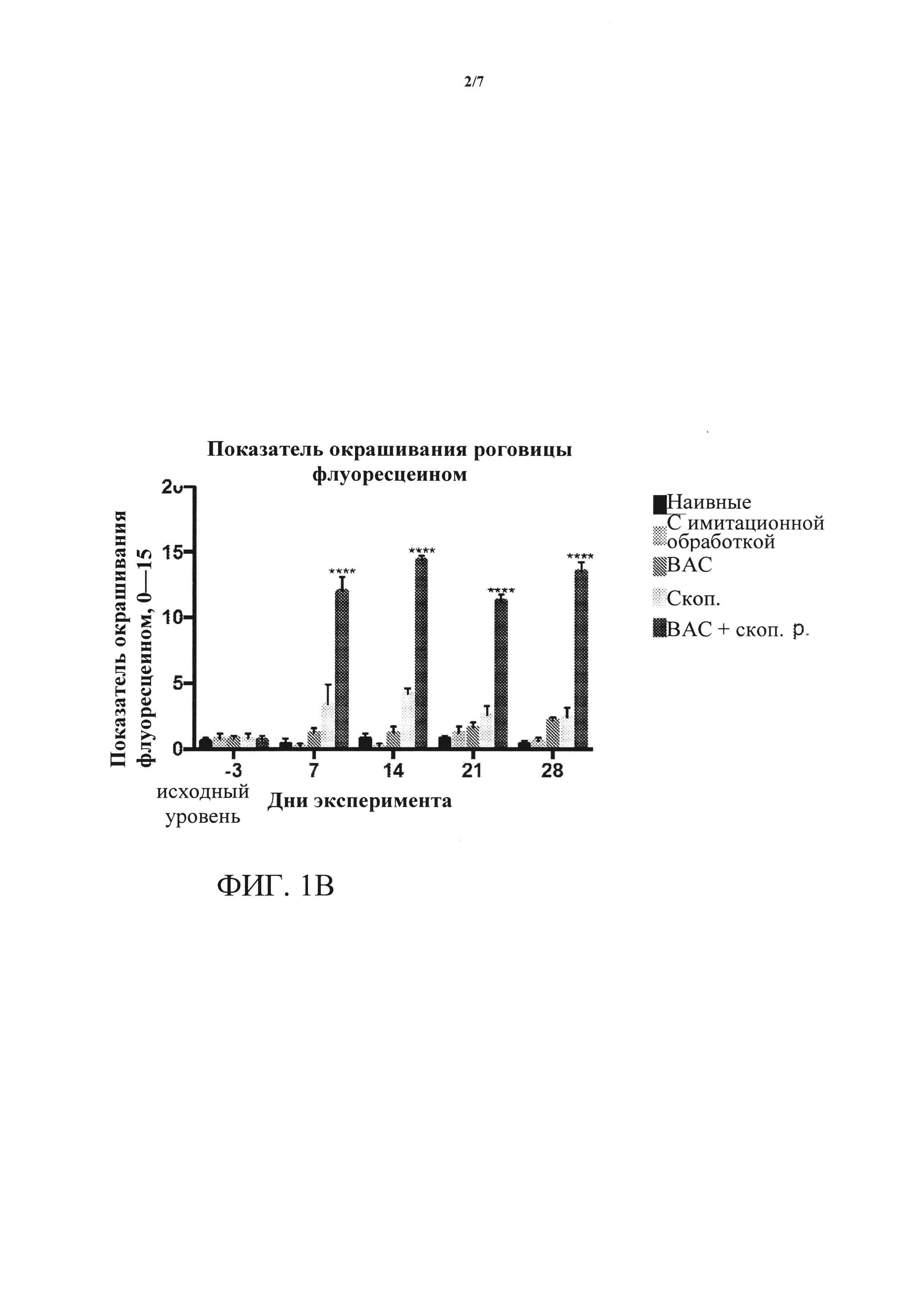
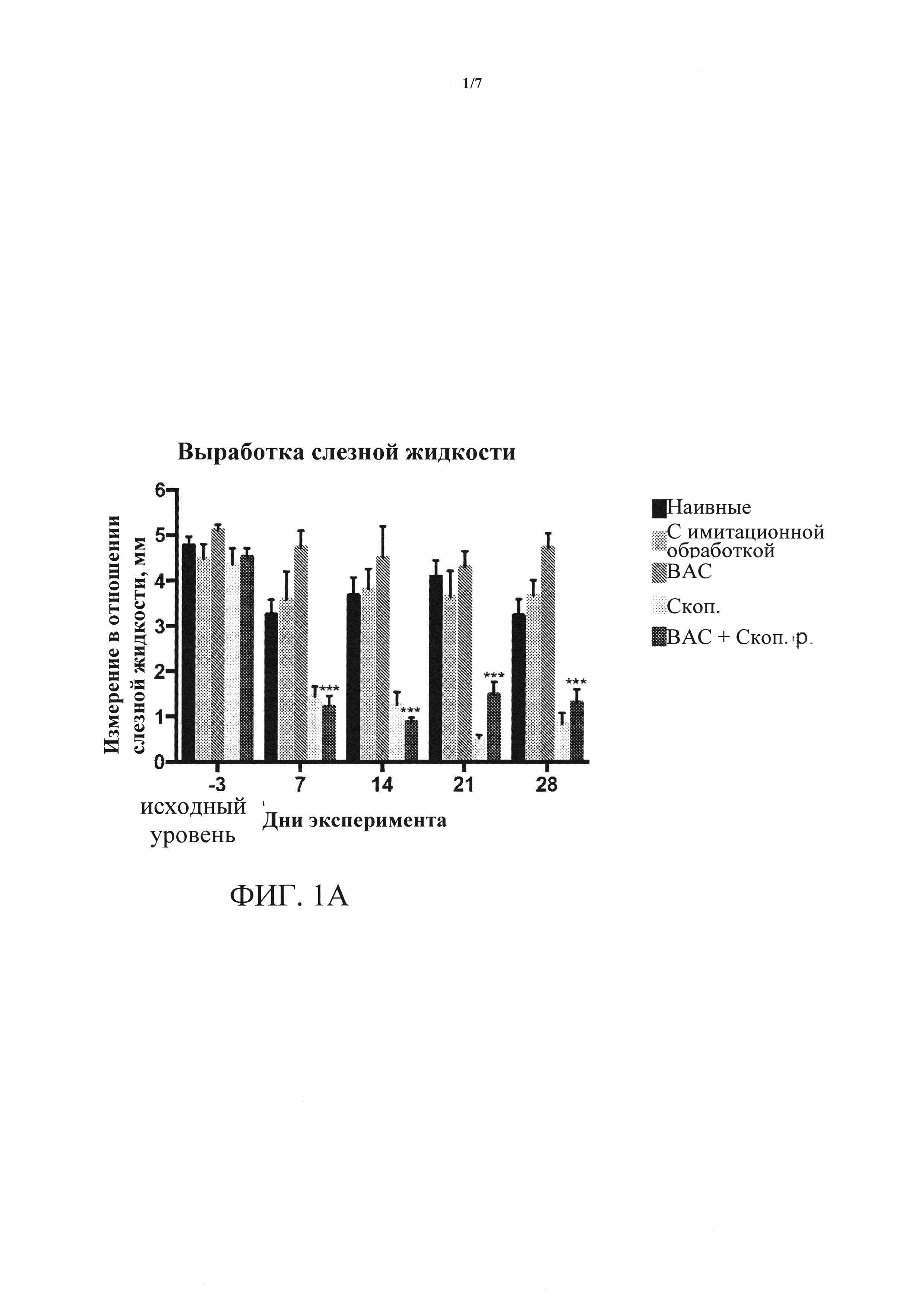
[0017] ФИГУРЫ 1А-1В. (А) представляет собой результаты измерения выработки слезной жидкости либо до начала лечения (день -3, исходный уровень), или в день 7, 14, 21 и 28 после начала лечения; для каждого дня пять столбцов представляют собой измерения слева направо для: наивных, с имитационной обработкой, обработками ВАС, скоп, и ВАС + скоп. Выработка слезной жидкости существенно снижается на протяжении четырех недель введения скополамина (скоп.) и введения хлорида бензалкония плюс скополамин (ВАС + скоп.) относительно контролей или обработки только ВАС. ***=p<0,001. (В) представляет собой результаты измерения показателя окрашивания роговицы флуоресцеином либо до начала лечения (день -3, исходный уровень), или в дни 7, 14, 21 и 28 после начала лечения; для каждого дня пять столбцов представляют собой измерения слева направо для: наивных, с имитационной обработкой, обработками ВАС, скоп, и ВАС + скоп. Окрашивание роговицы флуоресцеином значительно повышается на протяжении четырех недель введения ВАС + скоп, относительно контролен и относительно обработки либо ВАС, либо скоп, по отдельности. ****=p<0,0001.
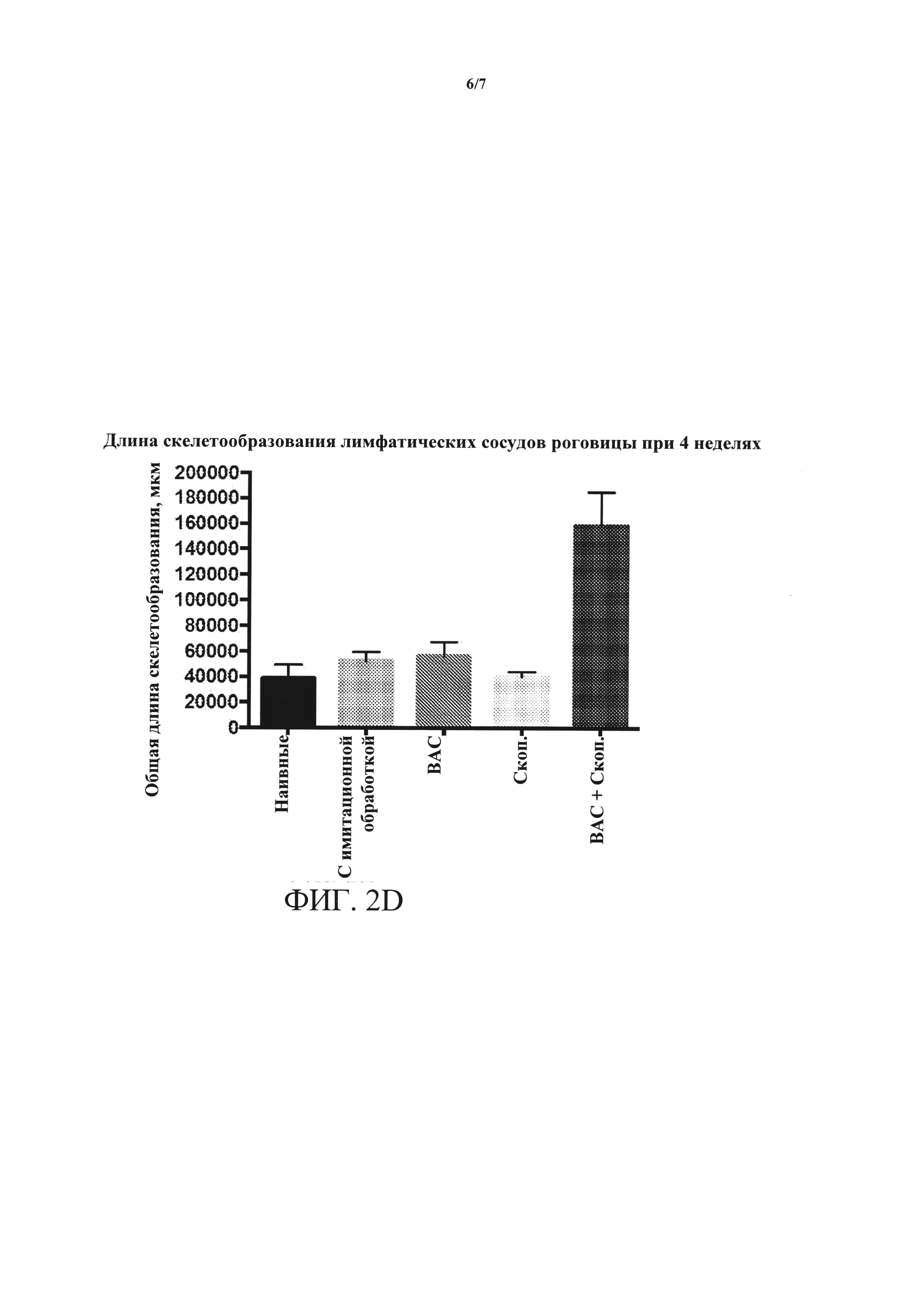
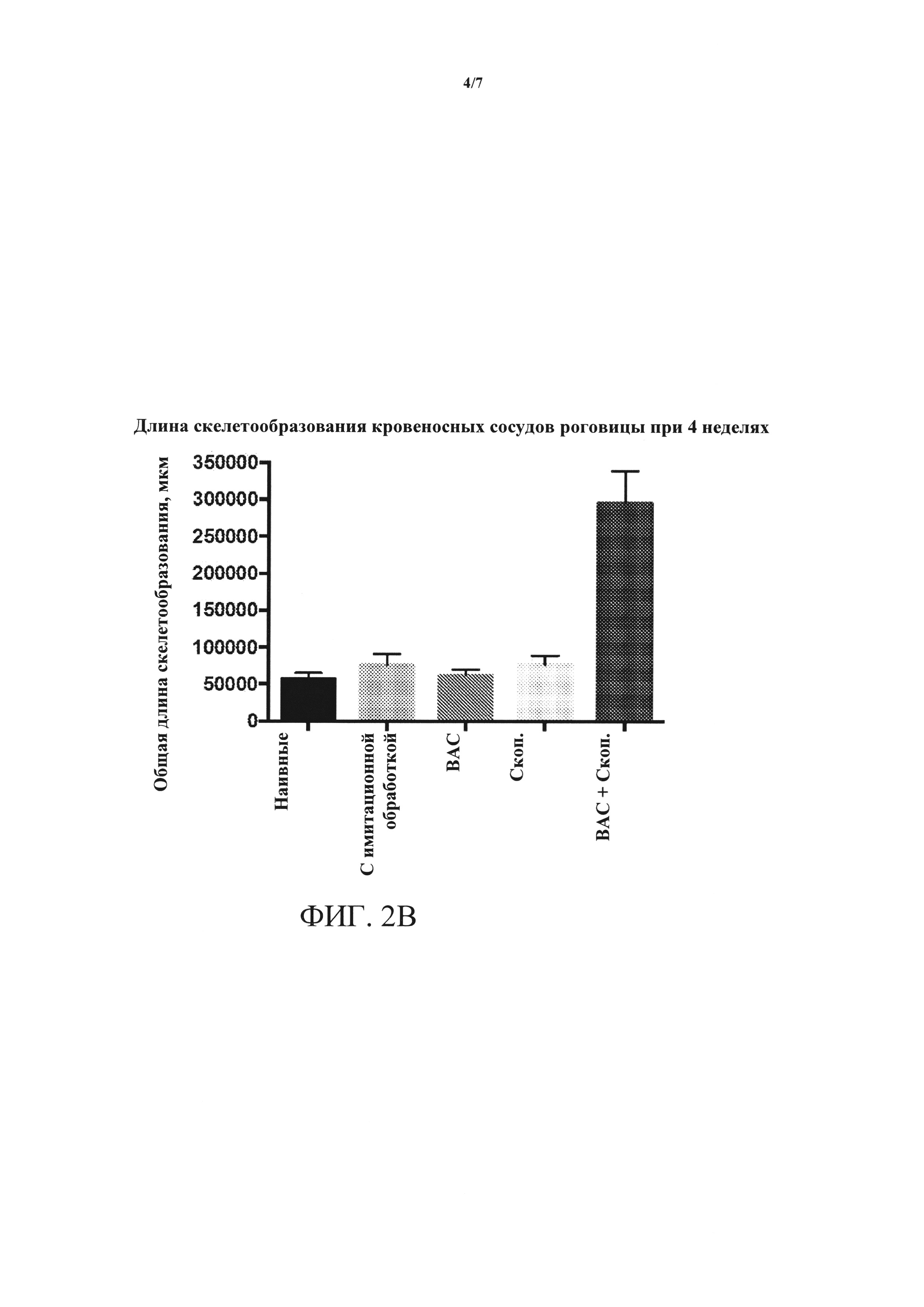
[0018] ФИГУРЫ 2A-2D. (А) ангиогенез роговицы, измеренный по повышенной интенсивности окрашивания клеток CD31+, повышается в глазах, обработанных ВАС + скоп., относительно контролей и относительно обработки либо ВАС, либо скоп, по отдельности. (В) длина скелетообразования (новый кровеносный сосуд) кровеносных сосудов роговицы резко увеличивается на протяжении четырехнедельной обработки в глазах, обработанных ВАС + скоп., относительно контролей и относительно обработки либо ВАС, либо скоп, по отдельности. (С) лимфангиогенез, измеренный по повышенной интенсивности окрашивания клеток LYVE1, повышается в глазах, обработанных ВАС + скоп., относительно контролей и относительно обработки либо ВАС, либо скоп, по отдельности. (D) длина скелетообразования лимфатических сосудов роговицы резко увеличивается на протяжении четырехнедельной обработки в глазах, обработанных ВАС + скоп., относительно контролей и относительно обработки либо ВАС, либо скоп, по отдельности.
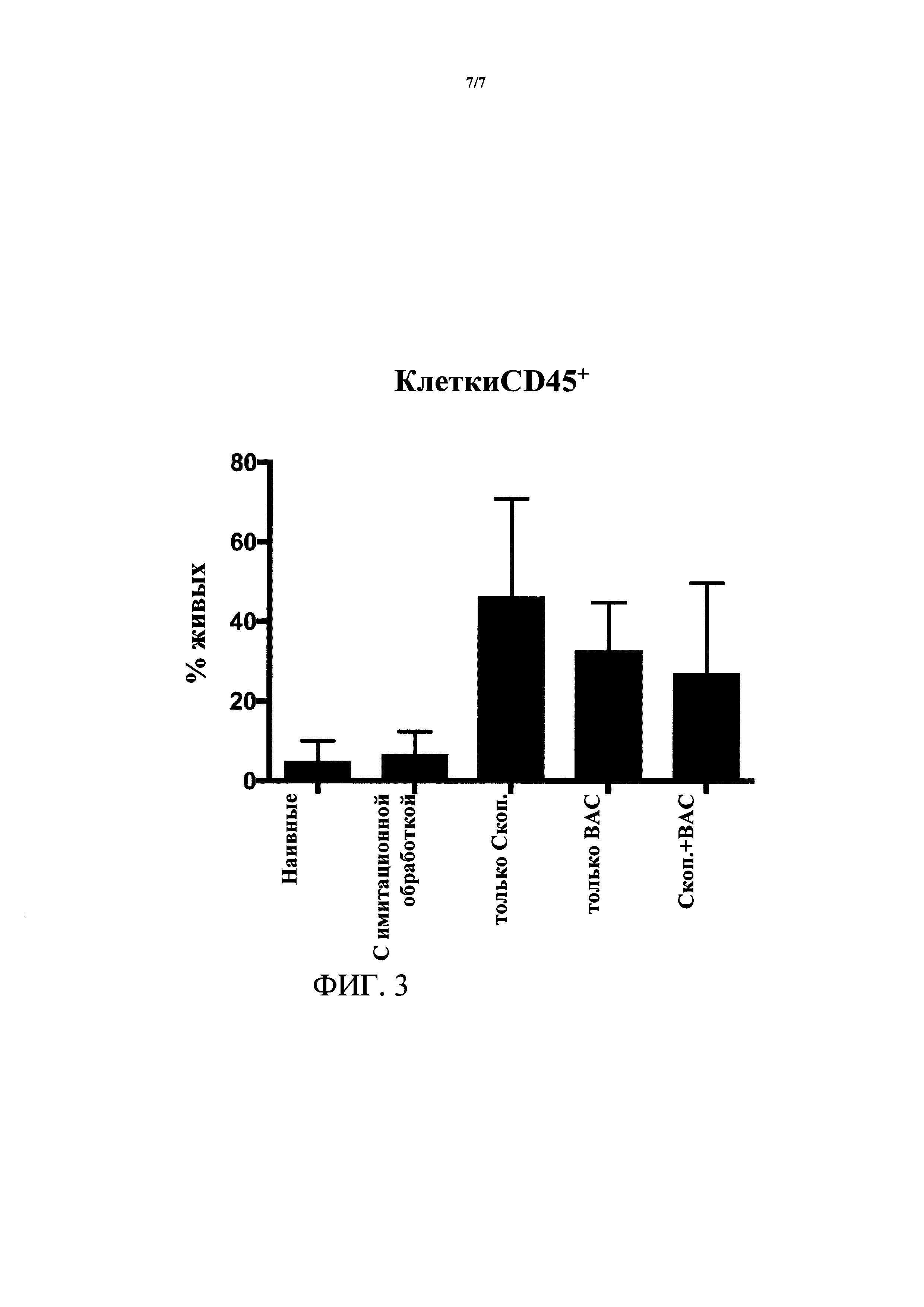
[0019] ФИГ. 3. Исследование с помощью проточной цитометрии внеглазничных слезных желез. Процентная доля клеток CD45+ повышена в клетках, обработанных скоп., ВАС и скоп. + ВАС, относительно контролей.
ПОДРОБНОЕ ОПИСАНИЕ РАСКРЫТИЯ
[0020] В данном документе раскрыты способы индуцирования сухого кератоконъюнктивита у животного, который отражает патофизиологию сухого кератоконъюнктивита (DED) у людей. Дополнительно раскрыты способы применения животных, относящихся к грызунам, с индуцированным сухим кератоконъюнктивитом при тестировании кандидатных средств для лечения DED.
[0021] Сухой кератоконъюнктивит (DED), также известный как синдром сухого глаза (DES) или keratoconjunctivitis sicca (KCS), представляет собой состояние, характеризуемое физиологически одним или более, двумя или более, тремя или более или всеми из следующего: сниженная выработка слезной жидкости, повышенное испарение слезной пленки, воспаление глаз, повышенная осмолярность (содержание солей) слез и повреждение поверхности глаза. Симптомы DED включают в себя дискомфорт в глазах, нарушение зрения и нестабильность слезной пленки.
[0022] В данном документе раскрыты способы индуцирования сухого кератоконъюнктивита у животного, относящегося к грызунам. Способы включают введение скополамина, антихолинергического средства и хлорида бензалкония (ВАС), средства, вызывающего раздражение глаз, животному, относящемуся к грызунам, в количестве и в течение времени, достаточных для индуцирования сухого кератоконъюнктивита у животного. Получаемое расстройство глаз отображает множественные характеристики DED человека.
[0023] При разработке подхода, раскрытого в данном документе, авторы настоящего изобретения смогли индуцировать сухой кератоконъюнктивит у животных, относящихся к грызунам, который имеет близкое сходство с клиническим заболеванием человека. Например, состояния, представляющие собой сухой кератоконъюнктивит, индуцированные с помощью раскрытых способов, достигаются легче и могут длиться в течение недель. Дополнительно, модели на животных, полученные с помощью раскрытых способов, характеризуются как воспалением глаз, так и дефицитом слезной жидкости, обычно наблюдаемыми при сухом кератоконъюнктивите человека. Таким образом, эта модель позволяет изучать патофизиологические изменения при сухом кератоконъюнктивите и тестировать кандидатов в терапевтические лекарственные средства для лечения DED.
Создание сухого кератоконъюнктивита у животного
[0024] На первой стадии способа скополамин вводят в качестве антихолинергического средства и хлорид бензалкония (ВАС) вводят в качестве средства, вызывающего раздражение глаз, животному, относящемуся к грызунам, такому как мышь или крыса.
[0025] Антихолинергическое средство представляет собой вещество, которое блокирует нейротрансмиттер ацетилхолин в центральной и/или периферической нервной системе. Примеры антихолинергических средств включают, например, скополамин, гидрохлорид скополамина, метобромид скополамина, атропин, метилнитрат атропина и сульфат атропина. В способах, описанных в данном документе, антихолинергическим средством является скополамин или гидрохлорид скополамина.
[0026] В раскрытых способах скополамин вводят системно. Способы системного введения включают в себя инъекцию, трансдермальный пластырь и имплантацию насоса, такого как осмотический насос, который позволяет проводить непрерывное введение дозы лабораторным животным. Такие способы системного введения в моделях на животных известны из уровня техники. В конкретных вариантах осуществления скополамин вводят с помощью осмотического мини-насоса. Подходящие осмотические мини-насосы включают, например, осмотические насосы ALZET (Durect Corporation, Купертино, Калифорния).
[0027] Для имплантации насоса грызуна анестезируют и устанавливают насос подкожно. Насос обеспечивает контролируемое количество скополамина. Типичные концентрации скополамина включают 0,1-4,0 мг на 20 г веса тела в день, 0,5-3,5 мг на 20 г веса тела в день, 1,0-3,0 мг на 20 г веса тела в день или приблизительно 2,0 мг на 20 г веса тела в день. Скополамин вводят в течение нескольких дней или нескольких недель, например, 1, 2, 3, 4 недель или больше.
[0028] Средство, вызывающее раздражение глаз, представляет собой вещество, которое приводит к раздражению в глазу. Примеры средств, вызывающих раздражение глаз, включают в себя поверхностно-активные вещества, консерванты, аллергены, мелкие частицы, а также иссушающие средства или условия окружающей среды. В способах, раскрытых в данном документе, средством, вызывающим раздражение глаз, является хлорид бензалкония (ВАС).
[0029] В раскрытых способах ВАС вводят местно на поверхность глаза. ВАС можно вводить в концентрации 0,05-1,0%, а в конкретных вариантах осуществления 0,1-0,2%, в дозировке 0,5-2,0 мкл на дозу, например 1 мкл на дозу. Введение может осуществляться от одного до четырех раз в день, например два раза в день, в течение от одного до трех дней в неделю. В некоторых вариантах осуществления введение осуществляют два раза в день в течение двух дней в неделю. Введение ВАС можно осуществлять в течение одной или более недель, например, 1, 2, 3, 4 недель или больше.
Оценка состояний, представляющих собой сухой кератоконъюнктивит, у модельных животных
[0030] Сухой кератоконъюнктивит подтверждают в модели на животных по выявлению снижения выработки слезной жидкости и повышению раздражения слизистой оболочки глаза относительно контрольных уровней. Сухой кератоконъюнктивит можно дополнительно подтвердить по выявлению усиления ангиогенеза и/или лимфангиогенеза относительно контрольных уровней.
[0031] По всему данному раскрытию контрольные уровни представляют собой уровни в необработанном глазу животного, относящегося к грызунам. Если оценка направлена на эффективность системно применяемого средства, необработанный глаз представляет собой глаз необработанного животного, относящегося к грызунам. Необработанное животное может быть наивным (по сути не получающим обработку) или ложнооперированным животным (получающим имплантированный насос, который не доставляет средство, или который доставляет плацебо, такое как физиологический раствор, животному, или получающим хирургическое вмешательство без фактической имплантации насоса). Если средство наносят местно на глаз, а не системно, контроль может также представлять собой необработанный глаз животного с одним обработанным глазом. В контексте оценки индукции состояний, представляющих собой сухой кератоконъюнктивит, при введении скополамина и ВАС контрольные уровни представляют собой уровни в глазах необработанных животных.
[0032] Сниженную выработку слезной жидкости идентифицируют как снижение выработки слезной жидкости по меньшей мере на 10%, 20%, 30%, 40% или 50% относительно контрольных уровней. Способы измерения выработки слезной жидкости включают фенольный тест с красной нитью (PRT) и тест Ширмера. В тесте PRT животных фиксируют без анестезии и нить, пропитанную феноловым красным (такую как ZONE-QUICK, FCI Ophthalmics, Пембрук, Массачусетс), помещают в медиальный или латеральный кантус (внутренний или внешний угол глаза) или прикасаются к конъюнктивальному или слезному мешку в течение 20 секунд для измерения выработки слезной жидкости. Количество нити, которая становится красной (в результате изменения pH из-за смачивания щелочными слезами), измеряют в миллиметрах. Процедуру можно повторить на другом глазу, чтобы получить 2 измерения для каждой мыши. В тесте Ширмера применяют бумажные полоски для измерения выработки слез. Тест включает в себя помещение небольшой полоски фильтровальной бумаги под нижнее веко (конъюнктивальный мешок). Полоску удерживают на месте в течение нескольких минут. Затем бумагу удаляют и количество влаги измеряют в мм.
[0033] Повышенное раздражение слизистой оболочки глаза идентифицируют путем выявления в глазу одного или более из: повышения количества воспалительных клеток, повышения количества провоспалительных цитокинов в глазу или повышения интенсивности окрашивания флуоресцеином относительно контрольных уровней.
[0034] Повышение количества воспалительных клеток представляет собой повышение по меньшей мере на 10%, 20%, 30%, 40% или 50% одного или более типов воспалительных/иммунных клеток относительно контрольных уровней. Типы воспалительных/иммунных клеток включают миелоидные клетки (включая нейтрофилы, моноциты, эозинофилы и базофилы) и лимфоциты (включая Т-клетки и В-клетки). Воспалительные клетки можно выявить и измерить различными способами, известными из уровня техники. Чаще всего воспалительные клетки измеряют путем определения присутствия/избытка клеток с идентификацией маркеров клеточной поверхности. Например, как миелоидные клетки, так и лимфоциты являются CD45+, и, таким образом, этот маркер можно применять для идентификации присутствия воспалительных клеток относительно невоспалительных клеток. Лимфоцит-специфичные маркеры включают CD3 (идентифицирующий Т-клетки), CD4 (идентифицирующий хелперные Т-клетки), CD8 (идентифицирующий цитотоксические Т-клетки) и В220 или CD19 (идентифицирующий В-клетки). В данной области известны дополнительные маркеры клеточной поверхности, а также антитела и другие средства, с помощью которых обнаруживают эти маркеры. Антитела, с помощью которых обнаруживают эти маркеры, можно применять для идентификации воспалительных клеток, например, путем гистологического исследования ткани роговицы и окрашивания тканевых срезов антителами. Антитела, с помощью которых обнаруживают эти маркеры, также можно использовать путем применения антител к популяции клеток для окрашивания в отношении экспрессии специфических маркеров и анализа клеток с помощью проточной цитометрии для количественного определения клеток, экспрессирующих данные маркеры.
[0035] Повышение содержания провоспалительных цитокинов представляет собой повышение по меньшей мере на 10%, 20%, 30%, 40% или 50% одного или более типов провоспалительных цитокинов относительно контрольных уровней. Провоспалительные цитокины включают в себя интерлейкины (IL), такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, факторы некроза опухолей (TNF), такие как TNF-α, TNF-β, TGF-β (трансформирующий фактор роста-β, CXCL9 и интерфероны (IFN), такие как IFN-γ. Способы измерения провоспалительных цитокинов включают в себя иммунологические анализы, такие как твердофазный иммуноферментный анализ (ELISA), в которых применяют антитела или другие средства, с помощью которых обнаруживают цитокины, для идентификации и количественного определения цитокинов в образце.
[0036] Повышение интенсивности окрашивания флуоресцеином представлено баллом, составляющим более 5, 8, 10 или 12, с применением оценки Национального института глаза (National Eye Institute, NEI). Для окрашивания флуоресцеином флуоресцеин натрия наносят на поверхность глаза животного, как правило, без седации. Через несколько минут после нанесения оценивают окрашивание роговицы флуоресцеином под микроскопом с использованием синего света. Нарушения в глазу, такие как ссадины и воспаление, флуоресцируют с большей интенсивностью относительно здоровой ткани роговицы. Флуоресценцию оценивают с применением стандартов оценки Национального института глаза (NEI). Согласно оценке NEI пять секторов роговицы (центральный, верхний, нижний, назальный и височный) оценивают отдельно по шкале 0-3 для флуоресценции, при этом 0 указывает на отсутствие окрашивания и 3 указывает на обширное окрашивание, с максимальным баллом 15 на глаз. Если используется другой стандарт оценки или метод флуоресценции, повышение интенсивности окрашивания флуоресцеином будет определяться как повышение интенсивности флуоресценции по меньшей мере на 10, 20, 30, 40 или 50% относительно контрольных уровней.
[0037] Измерения ангиогенеза и/или лимфангиогенеза роговицы могут дополнительно подтвердить сухой кератоконъюнктивит. Для изучения ангиогенеза и лимфангиогенеза животное подвергают эвтаназии и роговицу препарируют и инкубируют со средствами, с помощью которых идентифицируют образование новых лимфатических сосудов, такими как антитела к эндотелиальному гиалуронановому рецептору-1 лимфатических сосудов (LYVE1), или средствами, с помощью которых идентифицируют образование новых кровеносных сосудов, такими как антитела к CD31, маркеру эндотелиальных клеток-предшественников. Идентификация областей роста новых кровеносных или лимфатических сосудов может быть применена в качестве дополнительного индикатора ухудшения состояния глаз и развития сухого кератоконъюнктивита.
Тестирование кандидатных средств для лечения сухого кератоконъюнктивита
[0038] Грызуны согласно настоящему раскрытию (крысы и мыши) пригодны для изучения DED и тестирования кандидатных средств для лечения сухого кератоконъюнктивита.
[0039] Соответственно, в данном документе раскрыты способы тестирования эффективности кандидатного средства для лечения сухого кератоконъюнктивита, которые включают введение кандидатного средства животному с DED, индуцированным с использованием раскрытых способов, и тестирование способности кандидата лечить DED.
[0040] Под термином «лечение» подразумевается облегчение симптомов или состояний DED или предупреждение DED (например, предупреждение или задержка наступления или ограничение развития DED).
[0041] Выражения «тестируемое средство» и «кандидатное средство» используются в данном документе взаимозаменяемо для обозначения любого средства, предназначенного для лечения сухого кератоконъюнктивита. Средство может представлять собой рекомбинантную, модифицированную или природную молекулу нуклеиновой кислоты; синтетический, модифицированный или природный пептид; синтетический, модифицированный или природный полипептид, включая антитела; или органическое или неорганическое соединение, включая малые молекулы. Выражение «малая молекула» относится к соединениям с молекулярной массой менее 3000 Дальтон, предпочтительно, менее 2000 или 1500, более предпочтительно, менее 1000 или 800 Дальтон.
[0042] Тестируемое средство, подлежащее оценке, можно вводить животному местно или системно. Например, средство можно вводить в форме глазных капель или интраназального спрея. В качестве альтернативы, средство можно вводить перорально или парентерально, и если вводится парентерально, оно может находиться в форме раствора, суспензии, мази, инъекции, суппозитория и т.п. Подходящую дозу кандидатного средства можно определить на основании веса тела животного и способа введения. Условия введения, такие как время и количество раз введения, также определяются в зависимости от средства, подлежащего применению.
Введение кандидатного средства в начале индукции DED
[0043] В одном варианте осуществления кандидатное средство вводят одновременно с началом индукции DED. В некоторых вариантах осуществления наборы тестируемых животных, относящихся к грызунам, рандомизируют на следующие группы: наивные (необработанные), с имитационной обработкой (системное введение физиологического раствора, имплантация насоса без обработки скополамином или хирургическая операция, аналогичная имплантации насоса, без фактической имплантации насоса), с хлоридом бензалкония плюс скополамин (ВАС плюс скоп.), только с тестируемым средством или с тестируемым средством плюс ВАС плюс скоп. Животным в группах тестируемого средства вводят кандидатное средство одновременно с началом индукции сухого кератоконъюнктивита, то есть начиная с того же дня или в течение той же недели, когда начинается индукция DED. Все обработки проводили в течение по меньшей мере одной, двух, трех или четырех недель. Выработку слезной жидкости и окрашивание роговицы флуоресцеином измеряют в дни 7, 14, 21 и 28. В день 28 животных подвергают эвтаназии и собирают внеглазничную слезную железу и роговицу для дальнейшего изучения.
[0044] Способность кандидатного средства предупреждать, задерживать наступление или ограничивать развитие DED определяют путем выявления способности кандидатного средства сохранять выработку слезной жидкости и/или предупреждать или ограничивать раздражение слизистой оболочки глаза на одинаковых уровнях с контрольными уровнями. В этом контексте контрольные уровни представляют собой уровни для необработанного глаза (то есть глаза без обработки кандидатным средством), который может включать в себяглаз животных, получающих скополамин и хлорид бензалкония, но не получающих кандидатное средство, или один глаз животного, получающего скополамин и хлорид бензалкония, а также кандидатное средство, где кандидатное средство наносится местно на другой глаз того же животного.
[0045] В одном варианте осуществления у животных, получающих тестируемое средство плюс ВАС плюс скоп., не развивается DED, то есть выработка слезной жидкости сохраняется на уровне или в пределах 5%, 10% или 15% от контрольных уровней в течение всего исследования и/или уровни воспаления глаз, измеренные по уровням воспалительных клеток, уровням провоспалительных цитокинов в глазу и/или показателю окрашивания флуоресцеином, сохраняются на уровне или в пределах 5%, 10% или 15% от контрольных уровней в течение всего исследования.
[0046] В другом варианте осуществления животные, получающие тестируемое средство плюс ВАС плюс скоп., демонстрируют задержку наступления симптомов DED, то есть имеет место задержка в развитии сниженной выработки слезной жидкости и/или раздражения слизистой оболочки глаза на одну, две или три недели по сравнению с животными, получающими ВАС плюс скоп., но не получающими кандидатное средство.
[0047] В другом варианте осуществления у животных, получающих тестируемое средство плюс ВАС плюс скоп., развиваются более мягкие симптомы DED, то есть у этих животных происходит снижение выработки слезной жидкости и/или раздражение слизистой оболочки глаза, но снижение выработки слезной жидкости и/или раздражение глаз происходит на уровнях, промежуточных между уровнями у животных, не получающих обработку, индуцирующую DED (например, наивные животные), и уровнями, наблюдаемыми у животных, получающих ВАС плюс скоп., но не получающих тестируемое средство.
Введение кандидатного средства после индукции DED
[0048] В другом варианте осуществления кандидатное средство вводят после начала индукции DED. В некоторых вариантах осуществления животным в группах тестируемого средства вводят кандидатное средство, начиная с одной-двух недель после начала индукции сухого кератоконъюнктивита, то есть между днями 7-14 после начала индукции сухого кератоконъюнктивита. Тестируемое средство вводили в течение одной-трех недель. Выработку слезной жидкости и окрашивание роговицы флуоресцеином измеряют в дни 7, 14, 21 и 28 от начала индукции сухого кератоконъюнктивита. В день 28 животных подвергают эвтаназии и собирают внеглазничную слезную железу и роговицу для дальнейшего изучения.
[0049] Способность кандидатного средства лечить DED определяют путем выявления повышения выработки слезной жидкости и/или снижения раздражения слизистой оболочки глаза у животных, получающих кандидатное средство и ВАС плюс скоп., относительно контрольных уровней, которые в этом контексте могут представлять собой уровни в глазах животных, получающих ВАС плюс скоп., но не получающих кандидатное средство.
ПРИМЕРЫ
Пример 1. Создание у животного состояния, представляющего собой сухой кератоконъюнктивит.
[0050] Животные. Все процедуры, связанные с животными, были рассмотрены и одобрены IACUC Regeneron и проведены в соответствии с постановлением о использовании животных в офтальмологических исследованиях и исследованиях зрения ARVO. Взрослых мышей C57BL/6 (возрастом 8-10 недель) приобрели у Taconic Biosciences (Джермантаун, Нью-Йорк).
[0051] Индукция модели сухого кератоконъюнктивита: 27 взрослыхсамцов мышей C57BL/6 рандомизировали на группы наивных (необработанных), с имитационной обработкой (подвергающихся хирургической операции, эквивалентной хирургической операции для имплантации насоса, но без фактической имплантации насоса и без обработки скополамином или ВАС), с хлоридом бензалкония (ВАС), скополамином (скоп.) или ВАС плюс скоп.
[0052] Имплантация насоса со скополамином. Для группы скоп, мышам подкожно имплантировали осмотический насос, наполненный скоп.(2 мг/20 г веса тела/день), на 4 недели. Мышей анестезировали кетамином (120 мг/кг, IP) и ксилазином (5 мг/кг, IP). С применением асептической микрохирургической техники и операционного микроскопа осмотический мини-насос помещали под кожу спины, затем кожу зашивали и на рану накладывали офтальмологическую мазь с эритромицином для предупреждения инфекции.
[0053] Обработка хлоридом бензалкония. Для обработки ВАС 1 мкл 0,1-0,2% ВАС вводили местно на поверхность правого глаза дважды в день, 2 дня в неделю в течение четырех недель.
[0054] Измерение выработки слезной жидкости и оценка окрашивания роговицы флуоресцеином. Оценку выработки слезной жидкости и окрашивание роговицы флуоресцеином проводили раз в неделю в день 7, 14, 21 и 28. Для измерения выработки слезной жидкости зафиксированному животному в височный мешок глаза (не касаясь роговицы) помещали нить, пропитанную феноловым красным, и удерживали на месте в течение 1 минуты. Влажную часть нити пересчитывали на мм как выработку слезной жидкости. Для окрашивания флуоресцеином 0,5 мкл 2% флуоресцеина натрия помещали на поверхность глаза. Через пять минут после нанесения окрашивание роговицы флуоресцеином оценивали под микроскопом с применением стандартов оценки Национального института глаза (NEI). Для оценки роговицу разделяли на пять секторов (центральный, верхний, нижний, назальный и височный), каждый из которых оценивали по шкале 0-3 для флуоресценции, при этом 0 указывает на отсутствие окрашивания и 3 указывает на обширное окрашивание, с максимальной оценкой 15 на глаз.
[0055] Количественная оценка ангиогенеза роговицы, лимфангиогенеза роговицы и инфильтрации слезной железы. В день 28 после индукции сухого кератоконъюнктивита под глубоким наркозом с применением кетамина (120 мг/кг, IP) и ксилазина (5 мг/кг, IP) глазные яблоки собирали в 4% параформальдегид (PFA) для исследования ангиогенеза и лимфангиогенеза роговицы. Внеглазничные слезные железы собирали для исследования с помощью проточной цитометрии, чтобы проверить инфильтрацию иммунных клеток.
[0056] Гистологический анализ. Роговицу отделяли от глазных яблок, промывали в PBS, блокировали в течение 1 часа при комнатной температуре с 10% нормальной ослиной сывороткой и 1% Triton Х-100 в PBS для блокирования неспецифических сайтов связывания антител. Затем образцы промывали в PBS, инкубировали со смесью антител к эндотелиальному гиалуронановому рецептору-1 лимфатических сосудов (LYVE1) (Regeneron Pharmaceuticals, Inc., Территаун, Нью-Йорк) при 1:1000 и антител к CD31 (Santa Cruz Biotechnology, Санта-Круз, Калифорния) при 1:100 при 4°C в течение ночи. Затем образцы промывали в фосфатно-солевом буферном растворе (PBS) и инкубировали с вторичным антителом, конъюгированным с красителем, антителом осла к IgG(H+L) крысы, конъюгированным с AlexaFluor 488 1:100 (Life Technologies, А21208, Грейсленд, Нью-Йорк) и антителом осла к IgG(H+L) крысы, конъюгированным с AlexaFluor 594 1:400 (Life Technologies, А21207) в течение 2 часов при комнатной температуре. После инкубации образцы промывали в PBS и закрепляли на предметных стеклах. Изображения окрашенных кровеносных и лимфатических сосудов регистрировали с помощью цифровой камеры RT SE Spot, прикрепленной к флуоресцентному микроскопу (Nikon Eclipse 80i). Для анализа изображений использовали программное обеспечение для обработки изображений.
[0057] Проточная цитометрия. После препарирования внеглазничные слезные железы помещали в PBS (Life Technologies) с 3% раствором фетальной бычьей сыворотки (FBS) (Life Technologies). Железы диссоциировали с помощью программы spleen-04 с применением диссоциатора gentleMACS (Miltenyi Biotech, Сан-Диего, Калифорния). Суспензию клеток фильтровали через сетчатый фильтр 70 мкм (Miltenyi Biotech, Сан-Диего, Калифорния) для удаления остатков ткани. Клетки промывали однократно буфером для FACS (PBS с 3% FBS и 2 мМ EDTA) (Life Technologies). Промытые клетки ресуспендировали в буфере для FACS с Аb, блокирующим FcR, (разведение 1:50) (Biolegend, Сан-Диего, Калифорния) и инкубировали в течение 15 минут при 4°C. Клетки центрифугировали с удалением Ab, блокирующего FcR, и дополнительно окрашивали с использованием набора для синего окрашивания мертвых клеток перед фиксацией LIVE/DEAD (разведение 1:500) (Life Technologies) вместе с IgG2b крысы к CD45 мыши, конъюгированным с PerCP-Су5.5, клон 30-F11 (разведение 1:100) (BD Bioscience). Клетки окрашивали в течение 25 мин. при 4°C, после чего проводили две промывки буфером для FACS. Затем клетки ресуспендировали в стабилизирующем фиксаторе (BD) и оценивали на LSRII (BD Bioscience) в соответствии со стандартным протоколом, предоставленным компанией. Данные анализировали с применением FlowJo (Tree Star, Эшленд, Орегон).
[0058] Статистический анализ. Статистический анализ параметрических данных проводили с применением двухстороннего ANOVA и критерия Туки для множественного сравнения (выполненного только для длины сосудов роговицы в исследованиях длины лимфатических сосудов) при помощи GraphPad Prism (версия 6.0а, GraphPad Software Inc., Сан-Диего, Калифорния). Данные показаны как среднее значение ± стандартная ошибка среднего (SEM). Значение p менее 0,05 считалось статистически значимым. *=p<0,05; **=p<0,01; ***=p<0,001; ****=p<0,0001.
[0059] Результаты. Как показано на ФИГ. 1А, после системной доставки скоп, плюс местное введение ВАС выработка слезной жидкости значительно снижалась. Кроме того, заметно повышался показатель окрашивания роговицы (ФИГ. 1В). Это изменение было явным через одну неделю после введения скоп. + Вас.
[0060] Кроме того, как показано на ФИГ. 2А и 2В, длина скелетообразования кровеносных сосудов роговицы значительно увеличивалась через 4 недели после обработки ВАС + скоп. Аналогичным образом, как показано на ФИГ. 2С и 2D, длина скелетообразования лимфатических сосудов роговицы увеличивалась через 4 недели после обработки ВАС + скоп.
[0061] Более того, внеглазничные слезные железы содержали инфильтрат иммунных клеток через 4 недели после обработки, как показано на ФИГ. 3.
[0062] Пример 2. Тестирование способности кандидатного средства предупреждать или ингибировать наступление сухого кератоконъюнктивита
[0063] Для исследования эффективности кандидатных средств для предупреждения или ингибирования развития сухого кератоконъюнктивита набор мышей рандомизировали на следующие группы: наивные (необработанные), с имитационной обработкой (подвергающиеся хирургической операции, эквивалентной имплантации насоса, но без фактической имплантации насоса и без обработки скополамином или ВАС), с хлоридом бензалкония плюс скополамин (ВАС плюс скоп.), только с тестируемым средством или с тестируемым средством плюс ВАС плюс скоп.
[0064] Сухой кератоконъюнктивит индуцировали, как описано выше. Для обработки ВАС плюс скоп, мышам подкожно имплантировали осмотический насос, доставляющий скополамин (2 мг/20 г веса тела/день), и 1 мкл 0,1-0,2% ВАС вводили местно на поверхность правого глаза два раза в день, 2 дня в неделю.
[0065] Животным в группах с тестируемым средством вводили кандидатное средство, начиная с того же дня, когда начиналась индукция сухого кератоконъюнктивита. Кандидатное средство вводили животному в форме глазных капель, интраназального спрея или парентерально в форме раствора для инъекций. Подходящую дозу кандидатного средства и частоту введения определяли на основании веса тела животного и пути введения. Время и частота введения зависит от средства, подлежащего применению. Все обработки проводили в течение по меньшей мере одной, двух, трех или четырех недель. Выработку слезной жидкости и окрашивание роговицы флуоресцеином измеряют в дни 7, 14, 21 и 28. В день 28 животных подвергали эвтаназии и собирали внеглазничную слезную железу и роговицу для проточной цитометрии и гистологии. Также количественно оценивали ангиогенез и лимфангиогенез роговицы.
[0066] Эффективность кандидатного средства определяли путем выявления способности кандидатного средства сохранять выработку слезной жидкости и/или предупреждать или ограничивать раздражение слизистой оболочки глаза относительно контрольных уровней, например, уровней в глазу животных, получающих скополамин и хлорид бензалкония, но не получающих кандидатное средство.
[0067] Пример 3. Тестирование способности кандидатного средства лечить состояние, представляющее собой сухой кератоконъюнктивит
[0068] Для исследования эффективности кандидатного средства в лечении сухого кератоконъюнктивита набор мышей рандомизировали на следующие группы: наивные (необработанные), с имитационной обработкой (подвергающиеся хирургической операции, эквивалентной имплантации насоса, но без фактической имплантации насоса и без обработки скополамином или ВАС), с хлоридом бензалкония плюс скополамин (ВАС плюс скоп.), только с тестируемым средством или с тестируемым средством плюс ВАС плюс скоп.
[0069] Сухой кератоконъюнктивит индуцировали, как описано выше. Для обработки ВАС плюс скоп, мышам подкожно имплантировали осмотический насос, доставляющий скополамин (2 мг/20 г веса тела/день), и 1 мкл 0,1-0,2% ВАС вводили местно на поверхность правого глаза два раза в день, 2 дня в неделю. Способы индукции сухого кератоконъюнктивита имели продолжительность в течение по меньшей мере одной, двух, трех или четырех недель.
[0070] Животным в группах тестируемого средства вводили кандидатное средство, начиная с одной-двух недель после начала индукции сухого кератоконъюнктивита, например, между 7-14 днями после начала индукции сухого кератоконъюнктивита. Кандидатное средство вводили животному в форме глазных капель, интраназального спрея или парентерально в форме раствора для инъекций. Подходящую дозу кандидатного средства и частоту введения определяли на основании веса тела животного и пути введения. Время и частота введения зависит от средства, подлежащего применению. Тестируемое средство вводили в течение одной-трех недель. Выработку слезной жидкости и окрашивание роговицы флуоресцеином измеряют в дни 7, 14, 21 и 28 от начала индукции сухого кератоконъюнктивита. В день 28 животных подвергали эвтаназии и собирали внеглазничную слезную железу и роговицу для проточной цитометрии и гистологии. Также количественно оценивали ангиогенез и лимфангиогенез роговицы.
[0071] Эффективность определяли путем выявления повышения выработки слезной жидкости и/или снижения раздражения слизистой оболочки глаза у животных, получающих кандидатное средство и ВАС плюс скоп., относительно контрольных уровней (например, уровней в глазу животных, получающих ВАС плюс скоп., но не получающих кандидатное средство).