НОВЫЕ АНТАГОНИСТЫ 5-НТ2
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым антагонистам 5-НТ2. Более конкретно, настоящее изобретение относится к таким производным, которые проявляют антагонистическую активность по отношению к рецепторам серотонина 5-НТ2В. Настоящее изобретение также относится к применению указанных соединений в качестве лекарственного средства и их применению для лечения фиброза, сердечно-сосудистых заболеваний, боли, воспалительного заболевания кишечника (ВЗК) и других воспалительных заболеваний, а также к фармацевтическим композициям, содержащим одно или более указанных соединений, и к способам лечения.
УРОВЕНЬ ТЕХНИКИ
Серотонин (5-гидрокситриптамин, 5-НТ) представляет собой хорошо охарактеризованный нейротрансмиттер и вазоактивный амин, который участвует в распространенных нарушениях, в которые вовлечены центральная нервная система, пищеварительная система, сердечно-сосудистая система и дыхательная система (обзора см. в: Berger, М. et al., Annu Rev Med. (2009), 60, 355-366). Периферийный 5-НТ в основном синтезируется и высвобождается энтерохромаффиноцитамив кишечнике. При достижении кровотока он секвестрируется внутри тромбоцитов. В нормальных условиях свободного 5-НТ содержится в плазме на низком уровне и строго регулируется специфическими переносчиками 5-НТ, присутствующими на поверхности, например, тромбоцитов, а также ферментами, разрушающими 5-НТ. При активации тромбоцитов выделяется 5-НТ и наблюдается локальное увеличение концентрации 5-НТ. За прошедшие годы было установлено, что 5-НТ играет значительную роль в функционировании организма млекопитающих. Например, было показано, что он регулирует процессы, такие как сердечно-сосудистая функция, моторики кишечника и контроль мочевого пузыря. Также сообщалось, что 5-НТ и рецепторная система 5-НТ связаны с модуляцией боли, более конкретно, сообщалось, что рецепторы 5-НТ2 играют важную роль в процессе воспалительной боли (Cervantes-Duran С. et al., Neuroscience (2012) 232, 169). Кроме того, несколько исследований показали, что система 5-НТ играет важную роль в регуляции воспаления. Точная функция 5-НТ в воспалении плохо изучена, на эту тему опубликовано всего несколько сообщений, и они противоречивы.
Более глубокое понимание функции 5-НТ появилось по мере того, как было охарактеризовано по меньшей мере 14 разных 5-НТ рецепторов человека, которые сгруппированы в подсемейства на основе их структурных и фармакологических различий. Каждый рецептор обладает уникальным распределением и показывает различные предпочтения для разных лигандов. Указанные рецепторы все представляют собой рецепторы, связанные с G-белком, за исключением рецептора 5-НТ3, который представляет собой лиганд-ионный канал. Некоторые из 5-НТ рецепторов были связаны с эффектами 5-НТ при воспалении.
Семейство рецепторов 5-НТ2 состоит из 3 подтипов, а именно 5-НТ2А, 5-НТ2В и 5-НТ2С. Рецепторы 5-НТ2 имеют значительную степень родства между последовательностями на уровне аминокислот и соединяются с Gq-семейством G-белков. Важная роль рецепторов 5-НТ2 в воспалении была показана на модели артрита, индуцированного каолином/каррагинаном, у крыс, где антагонист рецептора 5-НТ2А кетансерин подавляет образование отека и гипералгезии. Также показано, что миазерин, антагонист 5-НТ2А/2С рецептора, ингибирует выработку цитокинов в культурах синовиальной мембраны РА человека.
Связь между рецептором 5-НТ2В и воспалением менее изучена, однако было показано участие сигнальной передачи 5-НТ2В рецептора в продуцировании IL-1β, IL-6 и TNF-α, вызванном 5-НТ, в сердечных фибробластах мыши (Jaffre F. et al., Circulation (2004) 110(8), 969-74). Экспрессия мРНК рецептора 5-HT2B на воспалительных клетках, таких как макрофаги и фибробласты, обосновывает важность исследования 5-HT2B в качестве мишени для модуляции воспалительного ответа при таких заболеваниях, как ревматоидный артрит. Применение N-бензилиденаминогуанидинов в качестве антагониста рецептора 5-HT2B для этой цели было описано в WO 2011012868 А1.
Ранее сообщалось о том, что 5-HT2B рецептор связан с легочной артериальной гипертензией (ЛАГ) (Thomas М. et al., Pharmacol Ther. (2013) 138(3), 409-17) и для фенотипа мышей, нокаутных по рецептору 5-HT2B, показана его важность для развития сердца. Было продемонстрировано, что 5-НТ через рецептор 5-HT2B регулирует дифференцировку и пролиферацию растущего сердца и сердца взрослого. Кроме того, чрезмерная экспрессия рецептора 5-HT2B у мышей приводит к гипертрофии сердца (Nebigil С.G. et al., Circulation. (2003) 107(25), 3223-9).
В соответствии с этим 5-НТ и его рецепторы, в частности, 5-HT2A и 5-НТ2В, были вовлечены в этиологию некоторых фиброзных расстройств, включая забрюшинный фиброз, карциноидную болезнь сердца, системный склероз, фиброз печени и легких. Фиброз на самом деле является признаком многих различных типов хронических респираторных заболеваний, включая идиопатический легочный фиброз (ИЛФ), легочную артериальную гипертензию (ЛАГ), хроническую обструктивную болезнь легких (ХОБЛ) и астму. О механической связи между фиброзом и 5-НТ впервые сообщалось в 1960-х годах для состояния, называемого карциноидным синдромом, которое вызывается нейроэндокринными карциноидными опухолями, которые выделяют огромные количества 5-НТ. Указанный синдром характеризуется фиброзом ткани, который особенно поражает сердечные клапаны, но также воздействует на другие органы, включая легкие и кожу. Впоследствии было обнаружено, что агонизм на рецепторе 5-HT2B вовлечен в фиброз, вызванный фенфлурамином, применяемым при лечении ожирения и психических расстройств. Фиброз характеризуется повышенной пролиферацией и активацией фибробластов/миофибробластов, что приводит к изменению внеклеточного матричного осаждения, что в конечном итоге приводит к органной недостаточности (Mann, D.A. and Oakley F., Biochim Biophys Acta. (2013) 1832(7), 905-10).
Важным медиатором фиброзного процесса является трансформирующий фактор роста бета, TGF-β. Этот цитокин модулирует различные физиологические процессы посредством регуляции транскрипции. Хорошо известно, что в фибробластах легких человека TGF-β индуцирует дифференцировку миофибробластов с повышением уровней альфа-SMA в внутриклеточных стресс-волокнах, а также с увеличением осаждения матрицы. Многочисленные доказательства подтверждают роль 5-НТ в фиброзе, хотя точный механизм, как именно 5-НТ способствует развитию фиброза, не определен. Показано, что 5-НТ увеличивает уровни мРНК TGF-β через рецептор 5-HT2B, а в моделях фибробластов кожи человека с системным склерозом мРНК TGF-β дозозависимо увеличиваются в ответ на 5-НТ, а также увеличивается экспрессия рецептора 5-HT2B. Это приводит к увеличению экспрессии мРНК коллагена la1, коллагена la2 и фибронектина. Влияние 5-НТ на синтез матрикса блокировалось антагонистом 5-HT2B-рецептора или трансфицированными миРНК 5-HT2B. В том же исследовании показано, что селективные антагонисты 5-HT2B-рецепторов предотвращают кожный фиброз, индуцированный блеомицином, in vivo (Dees С. et al., J. Exp. Med. (2011) 208(5), 961-72). При других фиброзных заболеваниях, таких как фиброз печени, лечение антагонистами 5-HT2B-рецепторов приводило к ослаблению фиброгенеза в модели хронического заболевания печени in vivo (Ebrahimkhani, M.R. et al., Nat Med. (2011) 17(12), 1668-73). Дополнительные данные, свидетельствующие о связи 5-НТ и фиброза, были получены при исследовании пациентов, страдающих ИЛФ, у которых наблюдалась повышенная экспрессия рецепторов 5-НТ2А и 5-НТ2В в фиброзном легком. В другом исследовании была выявлена сильная фибробластная экспрессия рецептора 5-HT2B в фибробластических очагах в образцах легких человека у пациентов с ИЛФ. Кроме того, лечение тергуридом (Terguride), антагонистом рецепторов 5-HT2A и 5-HT2B, уменьшает экспрессию коллагена I типа в TGF-β1 стимулированных фибробластах легких человека. Данный антифибротический эффект также проявляется после лечения антагонистами рецепторов 5-HT2A и 5-HT2B в модели фиброза легких, индуцированного блеомицином (BLM) у мышей (Konigshoff М. et al. Thorax. (2010); 65(11), 949-55 и Fabre A. et al. Eur Respir J. (2008) 32(2), 426-36).
Антагонисты 5-HT2B
В литературе описано множество антагонистов 5-НТ2В различных структурных классов, таких как описанные в WO 2011012868 А1. В двух недавних обзорах по этому вопросу приведены такие соединения, их предполагаемое применение и состояние их разработки (Poissonnet, G., et al., Mini-Reviews in Medicinal Chemistry (2004), 4(3), 325-330 и Brea, J. et al., Current Topics in Medicinal Chemistry (Sharjah, United Arab Emirates) (2010), 10(5), 493-503). К ним относятся димочевины SB206553 и SB215505, производное пиперазина EGIS-7625, 2-амино-4-нафтилпиримидин МТ-500 (RS127445), тиоксантеновые структуры, тергуриды производных алкалоидов спорыньи, тетрагидро-β-карболины, тиенопиримидин PRX-08066 и производные хинолина. Более свежие примеры антагонистов 5-НТ2В, которые также содержат гуанидиновый фрагмент, описаны в US 2009062363 А1.
Структурно связанные антагонисты 5-НТ2В представляют собой N-бензилиденаминогуанидины, такие как N-(2-хлор-3,4-диметоксибензилиденамино)гуанидин (WO 201012868 А1).
1-амидино-3-арил-2-пиразолины
Первое сообщение о классе соединений 1-амидино-3-арил-2-пиразолинов появилось в 1950-х годах, при этом были описаны способы их получения, в ходе которых арильные основания Манниха конденсируют с аминогуанидином (схема 1), 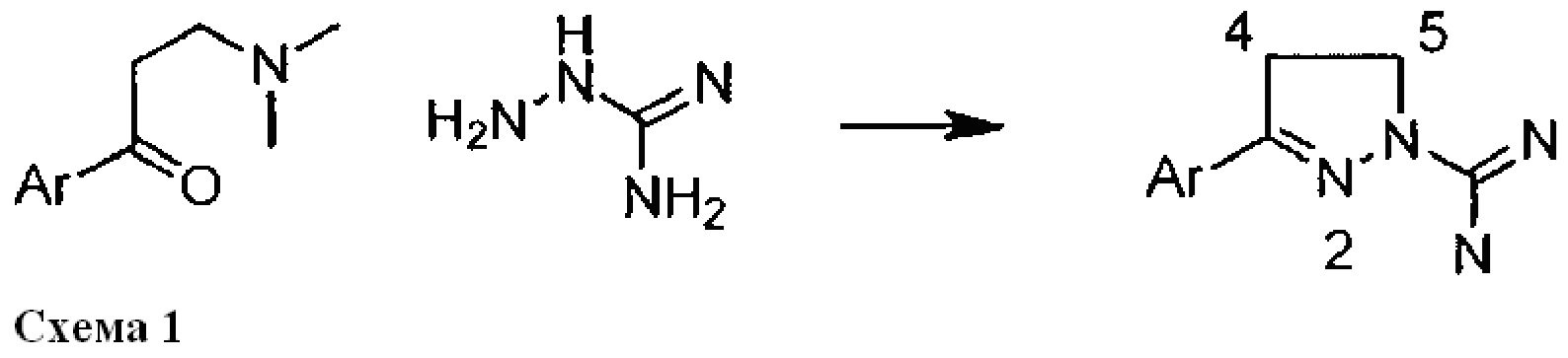
См.: Scott, F. L. and Reilly, J., Chemistry & Industry (London, United Kingdom) (1952), 907-8 и Nitrogen systems. XIV. Scott, F.L. and Scott, M.Т., Chimia (1958), 12, 148-50. Некоторые производные, обычно замещенные в 4- или 5-положении в пиразолиновом кольце и/или в амидиновой группе, позднее получили применение в качестве фармакологически активных соединений. К ним относятся 4-арил-N-сульфонамиды в качестве СВ1-антагонистов и модуляторов калиевых каналов (WO 2001070700 А1 и WO2007125049 А1), 4-гетероциклильные производные в качестве антагонистов PAR-1 (WO 2005007157 A1), N-сульфонамиды в качестве антагонистов 5-НТ6 (WO 2008034863 А2) и 5-арильные производные в качестве ингибиторов некроптоза (Jagtap, P.G., et al., J. Med. Chem. (2007), 50(8), 1886-1895), в качестве ингибиторов МАО (Sahoo, A. et al., Bioorganic & Medicinal Chemistry Letters (2010), 20(1), 132-136 и Jagrat, M. et al., Bioorganic & Medicinal Chemistry Letters (2011), 21(14), 4296-4300) и в качестве противомикробных лекарственных средств (Ferreras, J. A. et al., Bioorganic & Medicinal Chemistry Letters (2011), 21(21), 6533-6537).
Кроме того, сообщалось, что паразамещенные 1-амидино-3-арил-4-метил-2-пиразолины, описанные ниже, также могут быть противовоспалительными и обезболивающими агентами, однако принцип действия не описан (Abd-El G. et al. Arch Pharm Res (2012), 35(5), 807-821).
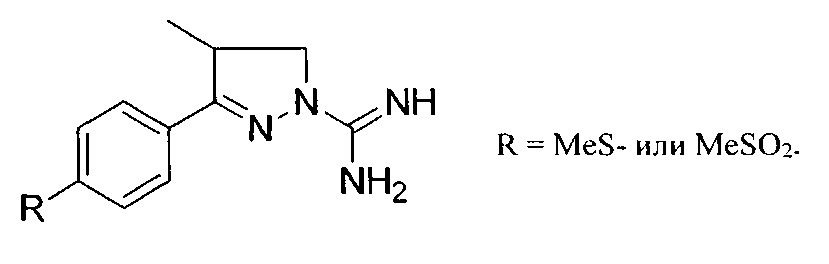
КРАТКОЕ ОПИСАНИЕ
Было обнаружено, что 1-амидино-3-арил-2-пиразолины являются антагонистами 5-HT2B-рецепторов и обладают высокой эффективностью и/или селективностью. В частности, было обнаружено, что замещения некоторых типов усиливают связывание 5-HT2B-рецепторов. Более конкретно, заместители в ортоположении ароматического фрагмента могут обеспечивать повышенную аффинность связывания рецепторов 5-HT2B и, следовательно, повышенную антагонистическую активность. Кроме того, благодаря присутствию пиразолинового кольца в соединениях согласно настоящему изобретению не происходит индуцированная светом цис/транс-изомеризация двойной связи бензимидина, что характерно для вышеупомянутых соединений N-бензилиден-амминогуанидина.
Одной из задач настоящего изобретения является разработка новых 1-амидино-3-арилпиразолинов в качестве антагонистов рецепторов серотонина 5-HT2B для лечения заболеваний, таких как фиброз, сердечно-сосудистые заболевания, боль, воспалительное заболевание кишечника (ВЗК) и других воспалительных заболеваний.
Подробное описание изобретения
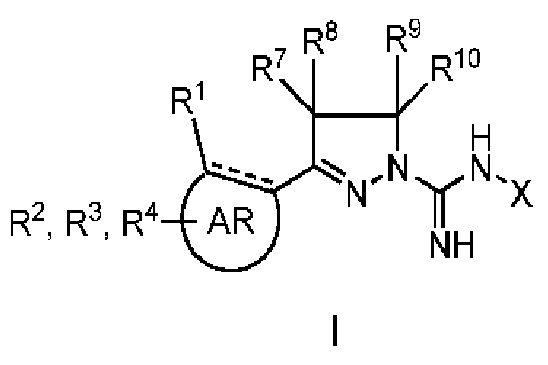
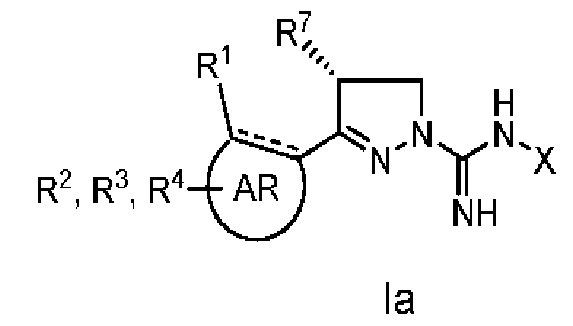
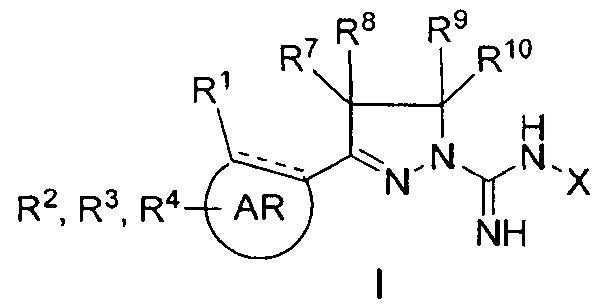
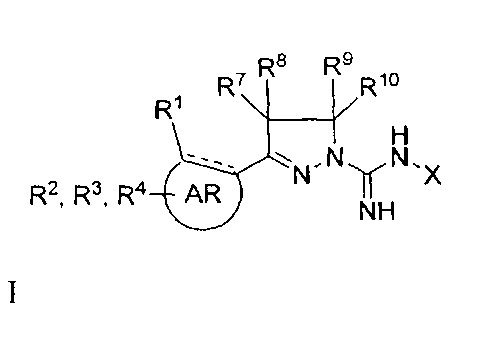
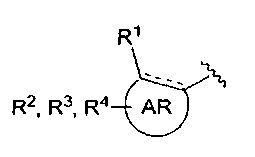
Настоящее изобретение относится к соединению общей формулы I
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
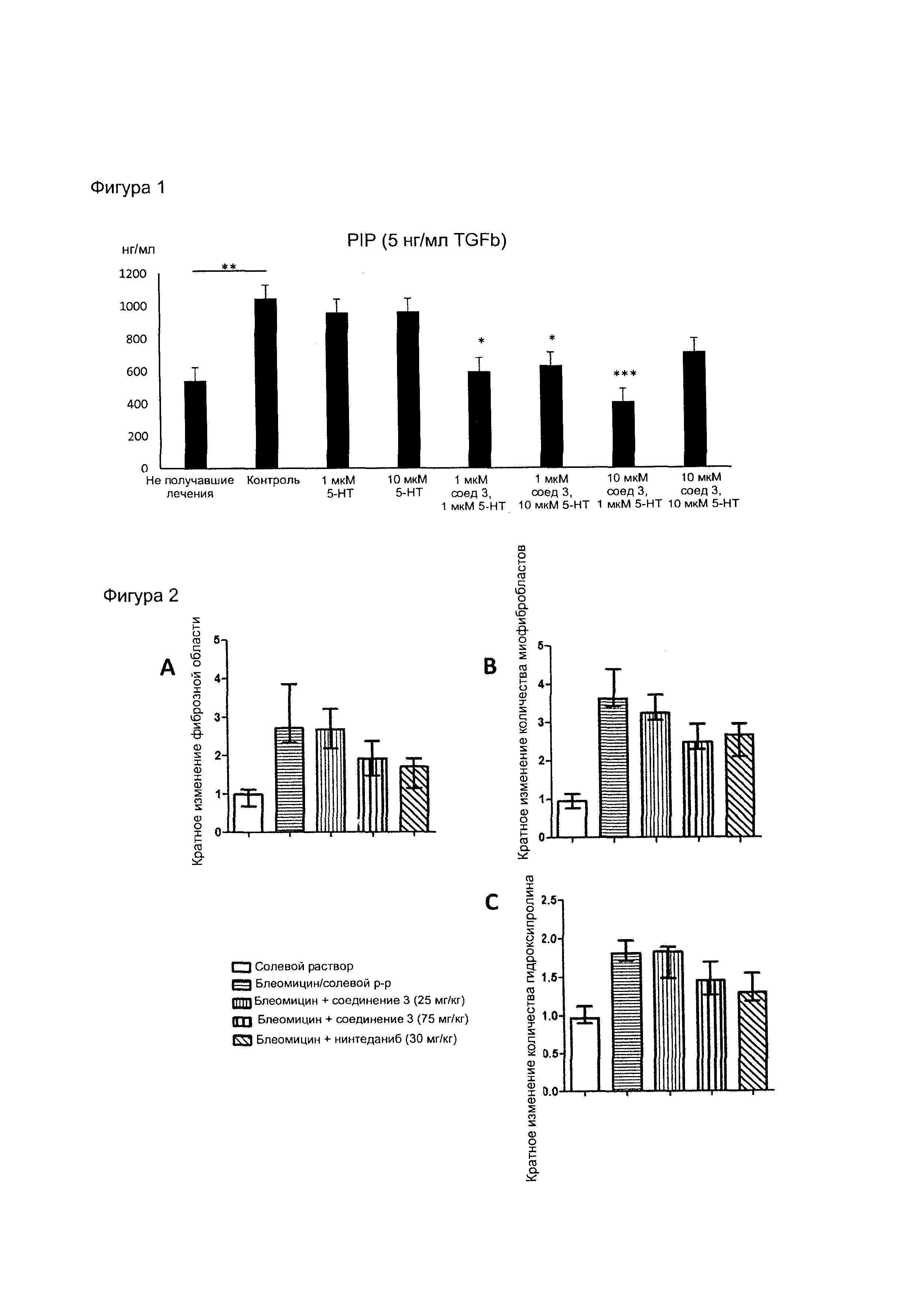
На фиг. 1 представлена гистограмма с данными, демонстрирующими влияние соединения согласно настоящему изобретению на выработку коллагена в нормальных фибробластах легких человека, что указывает на противогрибковую роль.
На фиг. 2 представлена гистограмма с данными, демонстрирующими антифибротические эффекты соединения согласно настоящему изобретению в модели легочного фиброза, индуцированного блеомицином, у мышей. Соединение согласно настоящему изобретению в дозах 75 мг/кг дважды в сутки и нинтеданиб (nintedanib) в дозах 30 мг/кг дважды в сутки облегчали течение индуцированного блеомицином легочного фиброза и уменьшали фиброзную область (А), ингибировали дифференцировку миофибробластов (В) и уменьшали содержание гидроксипролина (С).
Определения
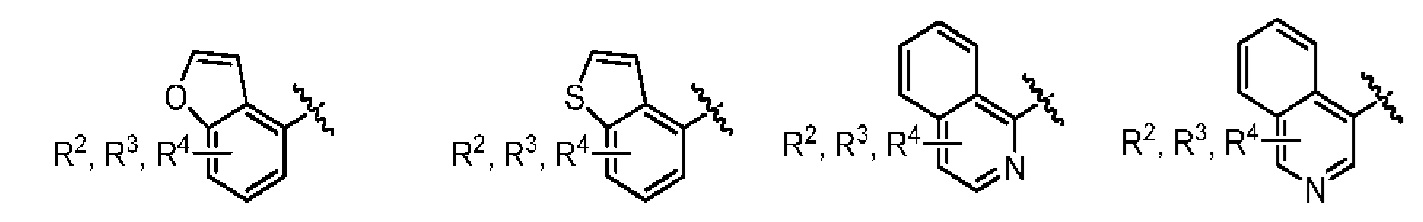
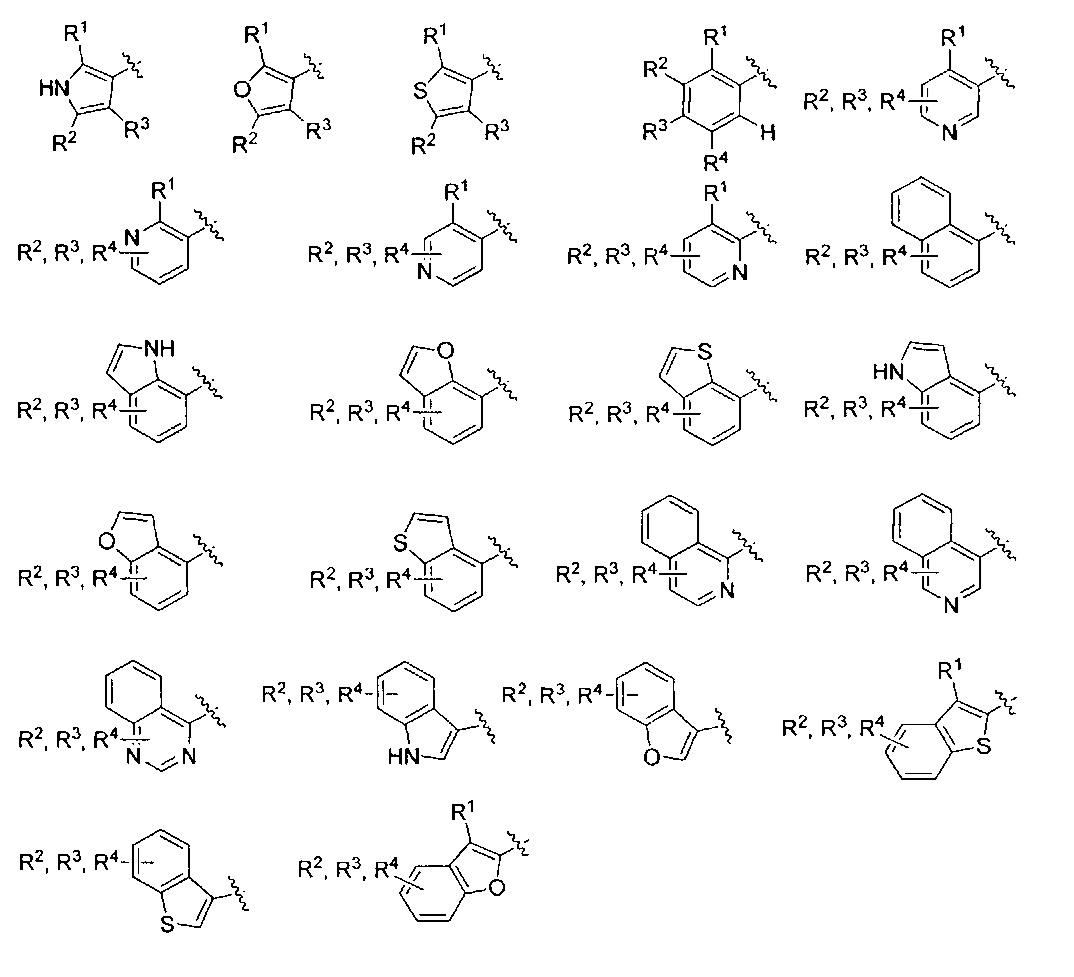
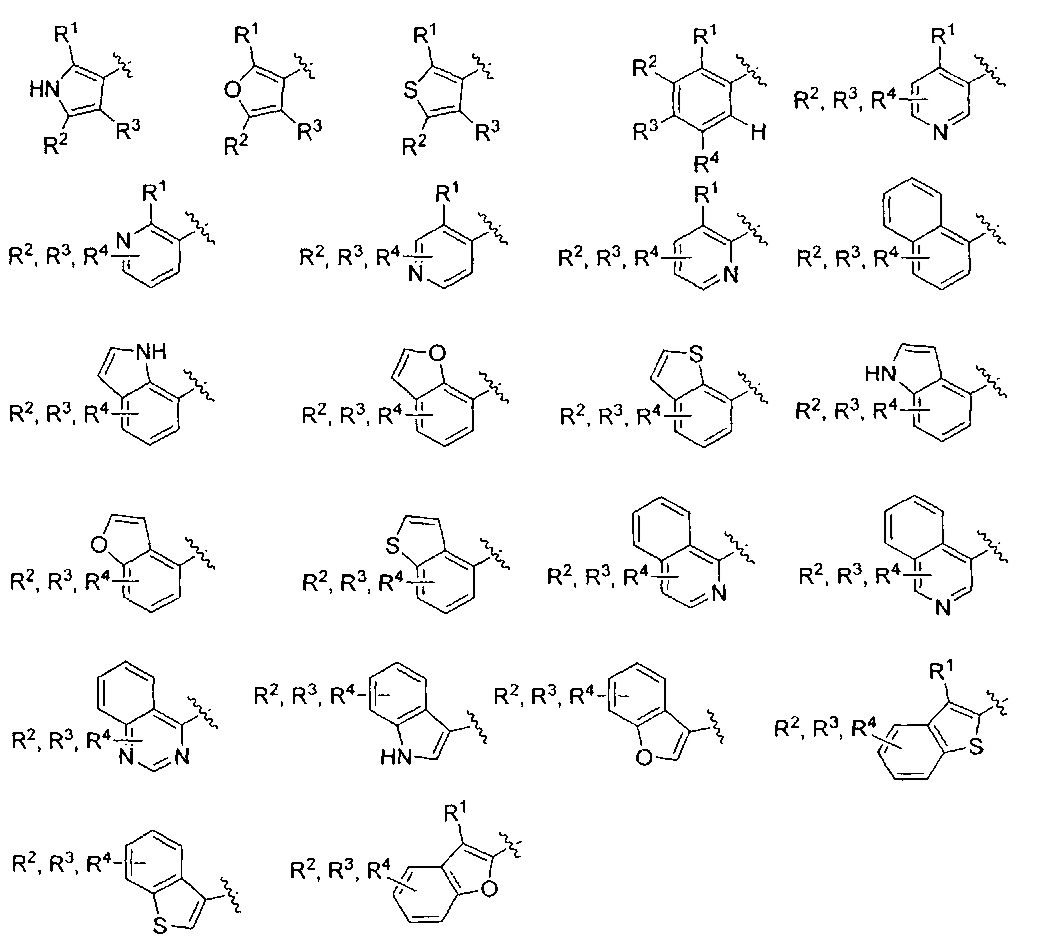
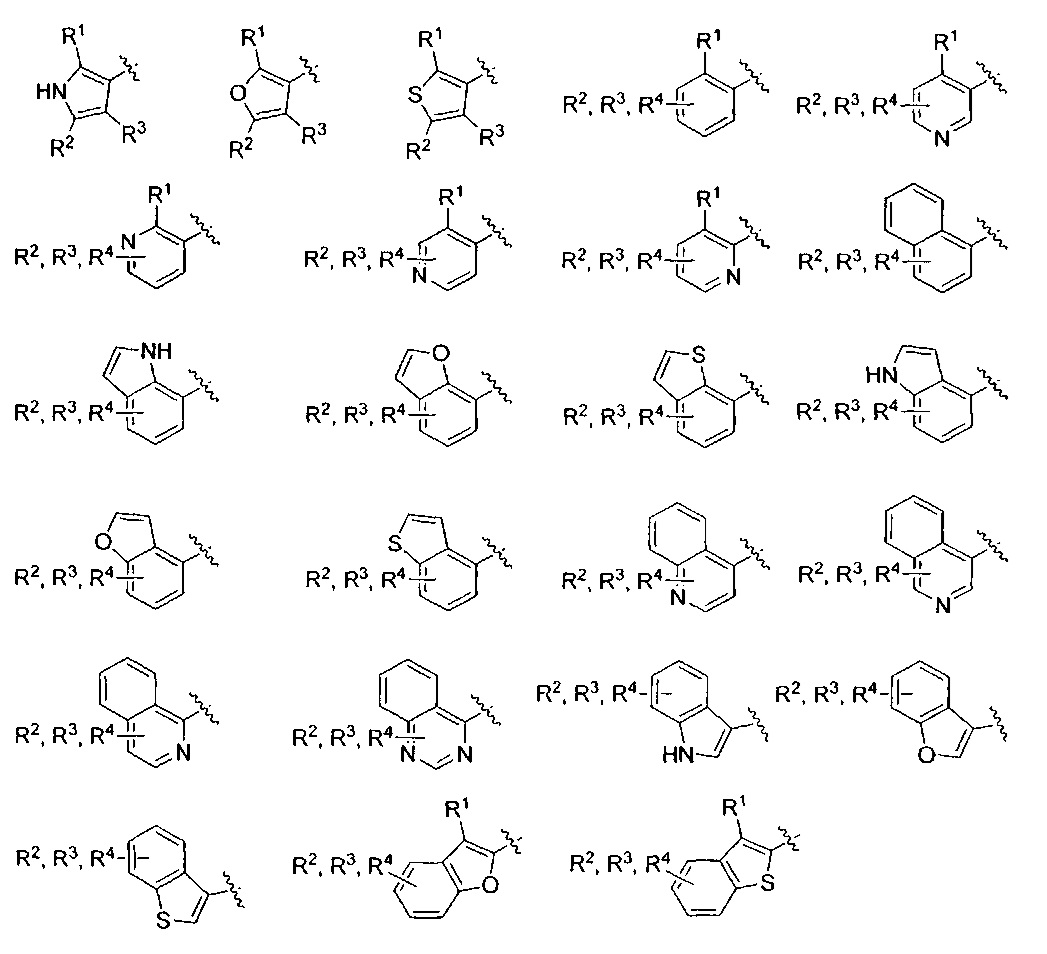
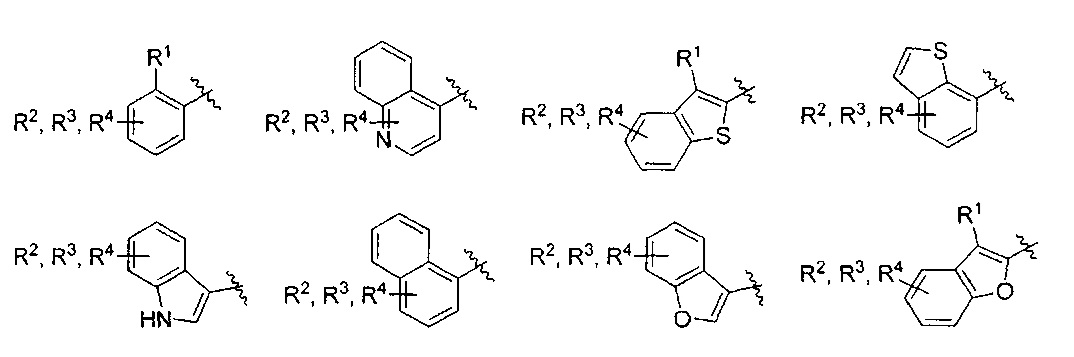
Фраза «5-10-членная моно- или бициклическая ароматическая или гетероароматическая кольцевая система, содержащая 0-4 гетероатома, независимо выбранных из N, О и S» представляет собой, но не ограничивается ими, пирролил, пиразолил, имидазолил, триазолил, тетразолил, фуранил, тиофенил, изоксазолил, оксазолил, оксадиазолил, диоксазолил, тиазолил, фенил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, нафтил, индолил, изоиндолил, индазолил, бензимидазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, нафтиридин, фталазинил, птеридинил, бензофуранил, изобензофуранил, бензотиофенил, изобензотиофенил, бензоксазолил, бензизоксазолил, фуропиридинил, оксазолопиридинил, бензотиазолил, бензизотиазолил, тиенопиридин, этилендиоксифенил или метилендиоксифенил. Подразумевается, что только одно из указанных колец является ароматическим, когда кольцевая система представляет собой метилендиоксифенил или этилендиоксифенил.
Термин «алкил» обозначает неразветвленную или разветвленную алкильную группу, содержащую указанное количество атомов углерода, например, C1-C10 содержит один, два, три, четыре, пять, шесть, семь, восемь, девять или десять атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, гептил, октил, нонил-, децил-, 2-метилбутил, 1-метилбутил, 1-этилпропил, 1,2-диметилпропил, неопентил, 1,1-диметилпропил, 4-метилпентил, 3-петилпентил, 2-метилпентил, 1-метилпентил, 2-этилбутил, 1-этилбутил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 2,3-диметилбутил, 1,3-диметилбутил или 1,2-диметилбутил.
Термин «C1-C15 алкил» обозначает любую насыщенную, неразветвленную или разветвленную алкильную группу, содержащую 1-15 атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, нео-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил или пентадецил и их изомеры.
Термин «С1-С16 алкил» обозначает любую насыщенную, неразветвленную или разветвленную алкильную группу, содержащую 1-16 атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, нео-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил или гексадецил и их изомеры.
Термин «С1-С12 алкил» обозначает любую насыщенную, неразветвленную или разветвленную алкильную группу, содержащую 1-12 атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, нео-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил или додецил и их изомеры.
Термин «C1-С6 алкил» обозначает любую насыщенную, неразветвленную или разветвленную алкильную группу, содержащую 1-6 атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, нео-бутил, трет-бутил, пентил и гексил и их изомеры.
Термин «C3-C5 циклоалкил» обозначает циклопропил, циклобутил или циклопентил.
Термин «С3-С6 циклоалкил» обозначает циклопропил, циклобутил, циклопентил и циклогексил.
Термин «С1-С3 галогеналкил» обозначает метил, замещенный 1-3 атомами галогена, этил, замещенный 1-5 атомами галогена, или н-пропил или изопропил, замещенный 1-7 атомами галогена.
Термин «фторалкил» обозначает алкильную группу, как определено выше, замещенную одним или несколькими атомами фтора.
Термин «С1-С4 фторалкил» обозначает фторалкильную группу, как определено выше, содержащую 1-4 атомов углерода. Примеры С1-С4 фторалкильных групп включают этил, замещенный 1-5 атомами фтора, н-пропил или изопропил, замещенный 1-7 атомами фтора, и бутил, замещенный 1-9 атомами фтора, и их изомеры.
Термин «фторметил» обозначает метильную группу, в которой от 1 до всех атомов водорода замещены атомами фтора. Примеры фторметила включают монофторметил, дифторметил и трифторметил.
Термин «С1-С16 ацил» обозначает алкил, как определено выше, в котором атом углерода, связанный с остальной частью соединения, представляет собой карбонильный углерод, то есть вместо двух атомов водорода указанный атом углерода несет кислород с двойной связью. Примеры C1-C16 ацильных групп включают -С(O)CH3, -СО(CH2)nCH3, где n представляет собой целые числа от 1 до 14.
В одном аспекте настоящее изобретение относится к соединению общей формулы I, где
где
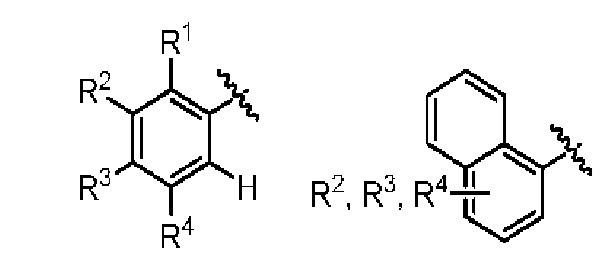
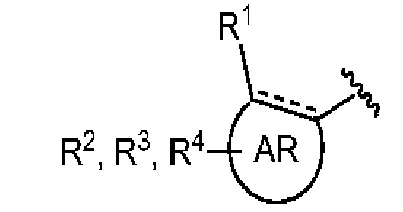
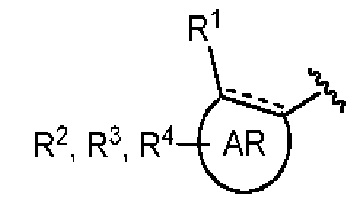
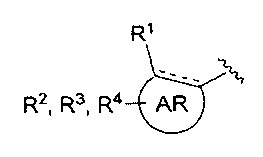
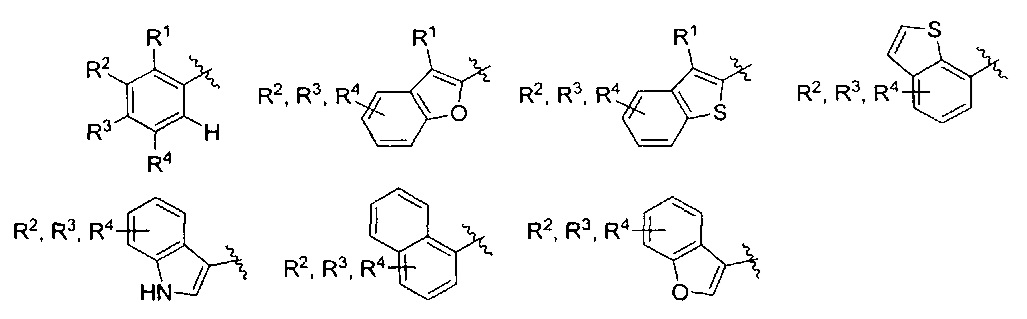
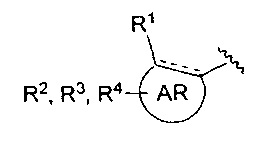
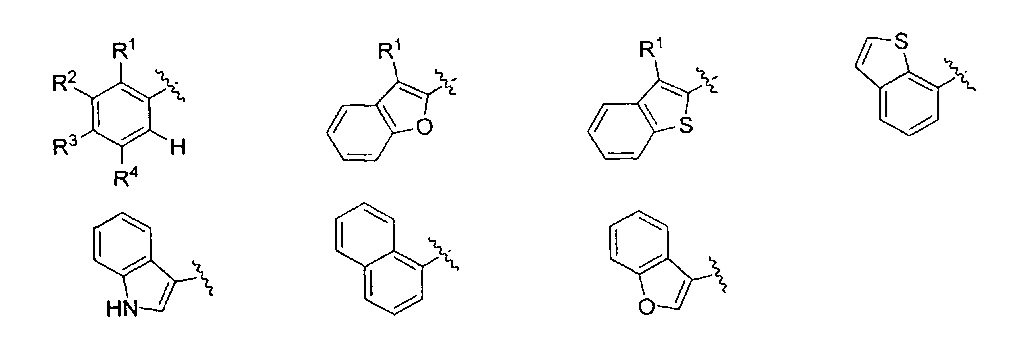
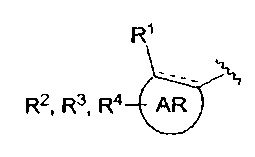
AR представляет собой 5-10-членную моно- или бициклическую ароматическую или гетероароматическую систему колец, содержащую 0-4 гетероатома, независимо выбранных из N, О и S;
R1 выбран из C1-C6 алкила, C3-C5 циклоалкила, C1-C3 галогеналкила, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R6, NR5C(O)R6, NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, фенила, 4-фторфенила, 4-хлорфенила и 4-метоксифенила; или R1 является частью указанной кольцевой системы, когда указанная кольцевая система является бициклической;
R2, R3 и R4 независимо выбраны из R5, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R', NR5C(O)R', NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, 4-фторфенила, 4-хлорфенила и 4-метоксифенила, где R2, R3 и R4 независимо расположены в любом свободном положении указанной моно- или бициклической ароматической или гетероароматической кольцевой системы;
R5 и R6 независимо выбраны из водорода, С1-С16 алкила, C3-C5 циклоалкила, фенила, бензила и С1-С3 галогеналкила;
R7, R8, R9 и R10 независимо выбраны из водорода, метила, этила, н-пропила, изопропила и н-бутила; или выбраны так, что R8 и R9 соединены и образуют 4-, 5-, 6- или 7-членное кольцо;
X выбран из водорода, C1-C16 алкила, С3-С6 циклоалкила, C1-C16 ацила, CN, С1-С4 фторалкила, фенила, бензила, гидрокси, метокси, этокси, С(O)OCH2CH3, 2-фенилэтила и бензилокси, где указанные фенильная, 2-фенилэтильная и бензильная группы необязательно моно-, ди- или тризамещены заместителями, независимо выбранными из С1-С6 алкила, C1-C6 алкокси, C1-C6 фторалкила, F, Cl, Br и I; и
его фармацевтически приемлемые соли, пролекарства, таутомеры и стереоизомеры.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
AR представляет собой 5-10-членную моно- или бициклическую ароматическую или гетероароматическую систему колец, содержащую 0-4 гетероатома, независимо выбранных из N, О и S;
R1 выбран из C1-C6 алкила, C3-C5 циклоалкила, C1-C3 галогеналкила, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R6, NR5C(O)R6, NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, фенила, 4-фторфенила, 4-хлорфенила и 4-метоксифенила; или R1 является частью указанной кольцевой системы, когда указанная кольцевая система является бициклической;
R2, R3 и R4 независимо выбраны из R5, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R', NR5C(O)R', NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, 4-фторфенила, 4-хлорфенила и 4-метоксифенила, где R2, R3 и R4 независимо расположены в любом свободном положении указанной моно- или бициклической ароматической или гетероароматической кольцевой системы;
R5 и R6 независимо выбраны из водорода, С1-С15 алкила, C3-C5 циклоалкила, фенила и C1-C3 галогеналкила;
R7, R8, R9 и R10 независимо выбраны из водорода, метила, этила, н-пропила, изопропила и н-бутила; или выбраны так, что R8 и R9 соединены и образуют 4-, 5-, 6- или 7-членное кольцо;
X выбран из водорода, метила, этила, н-пропила, изопропила, н-бутила, изобутила, необутила, трет-бутила, циклопропила, циклопентила, CF3, CF2CF3, фенила, бензила, гидрокси, метокси, этокси, 2-фенилэтил и бензилокси, где указанные фенильная, 2-фенилэтильная и бензильная группы необязательно моно- или дизамещены заместителями, независимо выбранными из метила, этила, метокси, этокси, изо-пропилокси, F и Cl.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
представляет
где
R1 выбран из метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, бензилокси, ОС(O)OCH2CH3, OCF3, SCH3, S(O)2CH3, OC(O)OR5, OC(O)R5, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, Cl, Br, I, CN и фенила;
R2 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN и фенила;
R3 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN и фенила;
R4 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Br, I, CN и фенила;
R5 представляет собой C1-C15 алкил или фенил;
R7, R8, R9 и R10 независимо выбраны из водорода, метила; или выбраны так, что R8 и R9 соединены и образуют 5- или 6-членное кольцо; и
X выбран из водорода, С1-С12 алкила, С3-С6 циклоалкила, С1-С4 фторалкила, фенила, 2-фенилэтила, бензила, С(O)OCH2CH3 и гидрокси; где указанный фенил, 2-фенилэтил и бензил необязательно моно- или дизамещены заместителями, независимо выбранными из метила, этила, метокси, F и Cl,
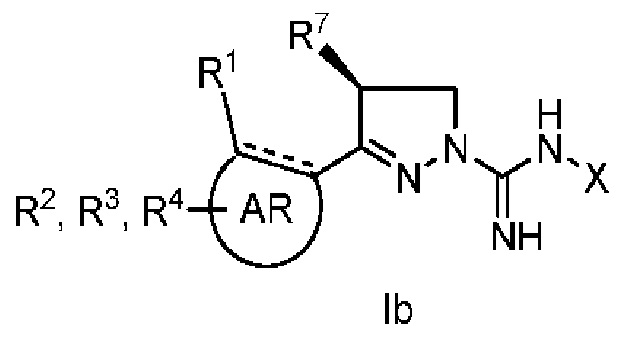
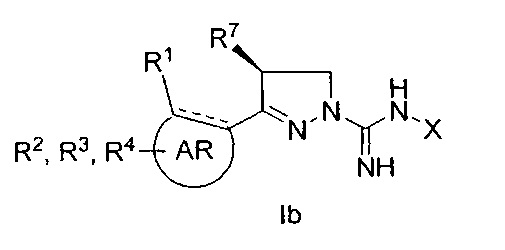
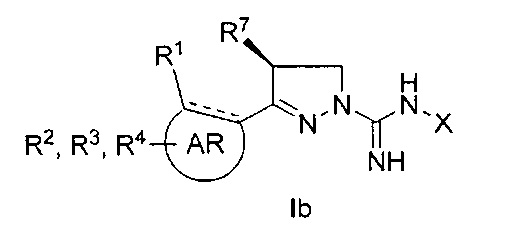
при условии, что, когда R7 представляет собой метил и имеет такую конфигурацию, как показано в формуле Ib,
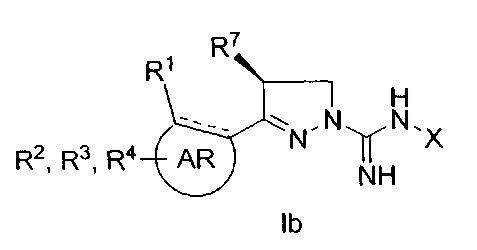
R3 не представляет собой водород; а также
когда X, R3, R7 и R8 одновременно представляют собой водород, R1 не представляет собой метокси.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
Один вариант реализации указанного аспекта относится к соединению формулы I, где R1 выбран из C1-C3-алкила, фторметила, гидрокси, метокси, бензилокси, ОС(O)OCH2CH3, Cl и Br;
R2 выбран из водорода, F и Cl;
R3 выбран из водорода, фторметила и F; и
R4 выбран из водорода и F.
Один вариант реализации указанного аспекта относится к соединению формулы I, где X выбран из водорода, С1-С12 алкила, С3-C6 циклоалкила, фенила, С1-С4 фторалкила, бензила, 2-фенилэтила, С(O)OCH2CH3 и гидроксила, где указанный фенил, 2-фенилэтил и бензил необязательно моно- или дизамещены заместителями, независимо выбранными из метила, фторметила, метокси, F и Cl.
Высокие уровни связывания с рецептором 5-HT2B можно получить для соединений согласно настоящему изобретению с различными вариантами в положении X, как определено в примере 120.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, бензилокси, ОС(O)OCH2CH3, Cl и Br;
R2 выбран из водорода, F и Cl;
R3 выбран из водорода, CF3 и F.
R4 выбран из водорода и F;
R7, R8, R9 и R10 независимо выбраны из водорода и метила; или выбраны так, что R8 и R9 соединены и образуют 5-членное кольцо;
X выбран из водорода, метила, бутила, гексила, додецила, циклогексила, циклопропила, фенила, 2,2,3,3,4,4,4-гептафторбут-1-ила, 2,2,2-трифторэт-1-ила, 4-трифторметилфенила, 4-фторфенила, 2-хлорфенила, 4-хлорфенила, 4-метоксифенила, бензила, CHCH3C6H5, 4-хлорбензила, 4-фторбензила, 2-хлорбензила, 2,4-дихлорбензила, 3,4-дихлорбензила, 4-метоксибензила, 3,5-диметоксибензила, 3,4-диметоксибензила, 3-хлор-4-метоксибензила, 2-фенилэтила, С(O)OCH2CH3 и гидрокси,
при условии, что, когда R7 представляет собой метил и имеет такую конфигурацию, как показано в формуле Ib,

R3 не представляет собой водород; а также
когда X, R3, R7 и R8 одновременно представляют собой водород, R1 не представляет собой метокси.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
Один вариант реализации указанного аспекта относится к соединению формулы I, где
представляет
где
R1 выбран из метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, OC(O)OR5, OC(O)R5, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, Cl, Br, I, CN, фенила и бензилокси;
R2 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN и фенила;
R3 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN и фенила;
R4 выбран из водорода, метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Br, I, CN и фенила;
R5 представляет собой C1-C15 алкил или фенил;
R7, R8, R9 и R10 независимо выбраны из водорода, метила; или выбраны так, что R8 и R9 соединены и образуют 5- или 6-членное кольцо; и
X выбран из водорода, метила, этила, н-пропила, изопропила, циклопропила, циклопентила, CF3, CF2CF3, фенила, 2-фенилэтила, бензила и гидрокси; где указанные фенил, 2-фенилэтил и бензил необязательно моно- или дизамещены заместителями, независимо выбранными из метила, этила, метокси, F и Cl,
при условии, что, когда R7 представляет собой метил и имеет такую конфигурацию, как показано в формуле Ib,
R3 не представляет собой водород; а также
когда X, R3, R7 и R8 одновременно представляют собой водород, R1 не представляет собой метокси.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
Один вариант реализации указанного аспекта относится к соединению формулы I, где R1 выбран из C1-C3-алкила, фторметила, гидрокси, метокси, Cl и Br;
R2 выбран из водорода, F и Cl;
R3 выбран из водорода, фторметила и F; и
R4 выбран из водорода и F.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, Cl и Br;
R2 выбран из водорода, F и Cl;
R3 выбран из водорода, CF3 и F.
R4 выбран из водорода и F;
R7, R8, R9 и R10 независимо выбраны из водорода и метила; или выбраны так, что R8 и R9 соединены и образуют 5-членное кольцо;
X выбран из водорода, метила, бензила, CHCH3C6H5, 4-хлорбензила, 2-хлорбензила, 2,4-дихлорбензила, 3,4-дихлорбензила, 4-метоксибензила, 3,5-диметоксибензила, 3,4-диметоксибензила, 3-хлор-4-метоксибензила, 2-фенилэтила и гидроксила,
при условии, что, когда R7 представляет собой метил и имеет такую конфигурацию, как показано в формуле Ib,
R3 не представляет собой водород; а также
когда X, R3, R7 и R8 одновременно представляют собой водород, R1 не представляет собой метокси.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
R7 представляет собой водород или метил; и
R8, R9 и R10 представляют собой водород.
Один вариант реализации указанного аспекта относится к соединению формулы I, где X представляет собой бензил. Следует понимать, что указанный бензил необязательно моно- или дизамещен заместителями, независимо выбранными из метила, этила, метокси, этокси, изо-пропилокси, F и Cl.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
R7 представляет собой метил; и
R8, R9 и R10 представляют собой водород.
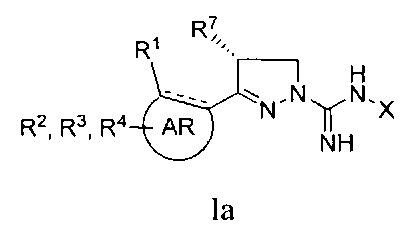
Один вариант реализации указанного аспекта относится к соединению формулы I, где R7 представляет собой метил и имеет конфигурацию, показанную в формуле Ia
Один вариант реализации указанного аспекта относится к соединению формулы I, где указанное соединение выбрано из:
3-(2-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-бромфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2,5-дифторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-изопропилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
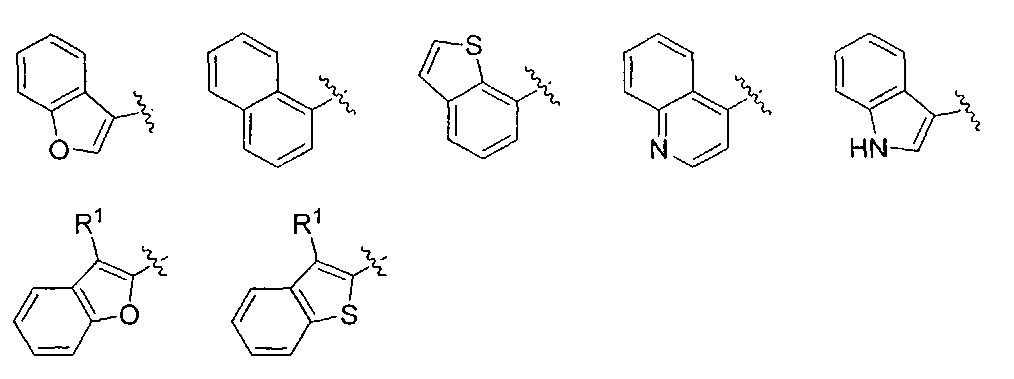
3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензо[b]тиофен-7-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-фторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензофуран-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2,6-дифторфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-5-этил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензофуран-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензо[b]тиофен-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5,6,6а-тетрагидроциклопента[с]пиразол-1(3аН)-карбоксимидамида;
3-(2-аминофенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлор-6-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлор-6-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(S)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(S)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида
3-(5-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-(4-метоксибензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,5-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3-хлор-4-метоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-((R)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-((S)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-фенэтил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2,4-диметоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2,4-дигидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидрокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(1Н-индол-3-ил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида; и
4-метил-3-(хинолин-4-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида.
Один вариант реализации указанного аспекта относится к соединению формулы I, где указанное соединение выбрано из:
3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-бромфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-изопропилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензо[b]тиофен-7-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензофуран-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
4-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензофуран-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензо[b]тиофен-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5,6,6а-тетрагидроциклопента[с]пиразол-1(3аН)-карбоксимидамида;
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида
3-(5-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-(4-метоксибензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,5-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3-хлор-4-метоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-((R)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-(S)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-фенэтил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидрокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(1Н-индол-3-ил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида.
Один вариант реализации указанного аспекта относится к соединению формулы I, где указанное соединение выбрано из:
4-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(S)-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(S)-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бутил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бутил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-циано-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циано-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-фторфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-фторфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-(бензилокси)фенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
этил-((3-(3-хлор-2-((этоксикарбонил)окси)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамата;
этил-((3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамата.
Один вариант реализации указанного аспекта относится к соединению формулы I, где указанное соединение выбрано из:
4-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-бромфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-изопропилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензо[b]тиофен-7-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(бензофуран-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензофуран-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
5-метил-3-(3-метилбензо[b]тиофен-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-хлорфенил)-4,5,6,6а-тетрагидроциклопента[с]пиразол-1(3аН)-карбоксимидамида;
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-гидрокси-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида
3-(5-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(4-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(5-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-(4-метоксибензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,4-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3,5-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(3-хлор-4-метоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-((R)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-((S)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-фенэтил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидрокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(1Н-индол-3-ил)-4-метил-4,5-дигидро-1Н-пиразол- 1-карбоксимидамида;
(S)-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(R)-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
(S)-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бутил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-бутил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-циано-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-фторфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-фторфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
N-(4-хлорфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-(бензилокси)фенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(2-гидроксифенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-метоксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
3-(3-хлор-2-гидроксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида;
этил-((3-(3-хлор-2-((этоксикарбонил)окси)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамата;
этил-((3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамата.
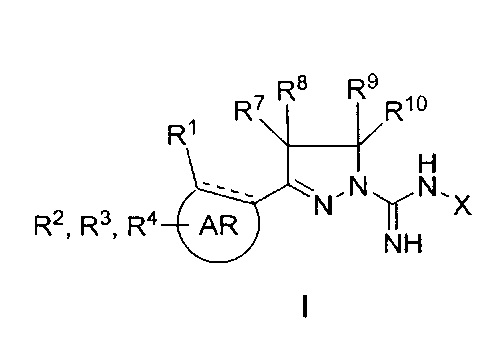
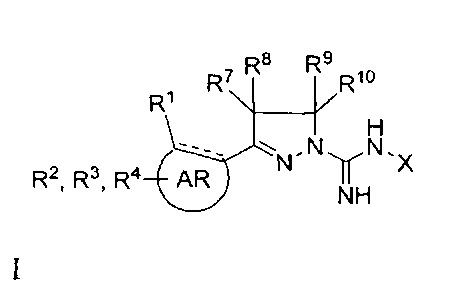
В одном аспекте настоящее изобретение относится к соединению общей формулы I
где
AR представляет собой 5-10-членную моно- или бициклическую ароматическую или гетероароматическую систему колец, содержащую 0-4 гетероатома, независимо выбранных из N, О и S;
R1 выбран из C1-C6 алкила, C3-C5 циклоалкила, С1-С3 галогеналкила, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R6, NR5C(O)R6, NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, фенила, 4-фторфенила, 4-хлорфенила и 4-метоксифенила; или
R1 является частью указанной кольцевой системы, когда указанная кольцевая система является бициклической;
R2, R3 и R4 независимо выбраны из R5, OR5, OC(O)R5, OC(O)OR5, OC(O)NR5R6, SR5, S(O)R5, S(O)2R5, S(O)2OR5, S(O)2NR5R6, NR5R', NR5C(O)R', NR5C(O)NR6R6, C(O)R5, C(O)OR5, C(O)NR5R6, NR5C(O)OR6, F, Cl, Br, I, CN, 4-фторфенила, 4-хлорфенила и 4-метоксифенила, где R2, R3 и R4 независимо расположены в любом свободном положении указанной моно- или бициклической ароматической или гетероароматической кольцевой системы;
R5 и R6 независимо выбраны из водорода, C1-C15 алкила, C3-C5 циклоалкила, фенила и C1-C3 галогеналкила;
R7, R8, R9 и R10 независимо выбраны из водорода, метила, этила, н-пропила, изопропила и н-бутила; или выбраны так, что R8 и R9 соединены и образуют 4-, 5-, 6- или 7-членное кольцо;
X выбран из водорода, метила, этила, н-пропила, изопропила, н-бутила, изобутила, нео-бутила, трет-бутила, циклопропила, циклопентила, CF3, CF2CF3, фенила, бензила, гидрокси, метокси, этокси, 2-фенилэтил и бензилокси, где указанные фенильная, 2-фенилэтильная и бензильная группы необязательно моно- или дизамещены заместителями, независимо выбранными из метила, этила, метокси, этокси, изо-пропилокси, F и Cl; и
его фармацевтически приемлемые соли, пролекарства, таутомеры и стереоизомеры.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
представляет
где
R2, R3 и R4 независимо расположены в любом свободном положении моно- или бициклической ароматической или гетероароматической кольцевой системы;
R1 выбран из метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, OC(O)OR5, OC(O)R5, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN, фенила и бензилокси;
R2, R3 и R4 выбраны из водорода, метила, этила, изопропила, циклопропила, CF3, гидрокси, метокси, этокси, изопропокси, OCF3, SCH3, S(O)2CH3, NH2, NHCH3, N(CH3)2, NHC(O)H, NHC(O)CH3, NHC(O)NH2, NHC(O)NHCH3, NHC(O)N(CH3)2, C(O)CH3, C(O)N(CH3)2, F, Cl, Br, I, CN и фенила;
R5 представляет собой C1-C15 алкил или фенил;
R7, R8, R9 и R10 независимо выбраны из водорода, метила и этила; или выбраны так, что R8 и R9 соединены и образуют 5- или 6-членное кольцо; и
X выбран из водорода, метила, этила, н-пропила, изопропила, циклопропила, циклопентила, CF3, CF2CF3, фенила, 2-фенилэтила, бензила и гидрокси; где указанные фенил, 2-фенилэтил и бензил необязательно моно- или дизамещены заместителями, независимо выбранными из метила, этила, метокси, F и Cl.
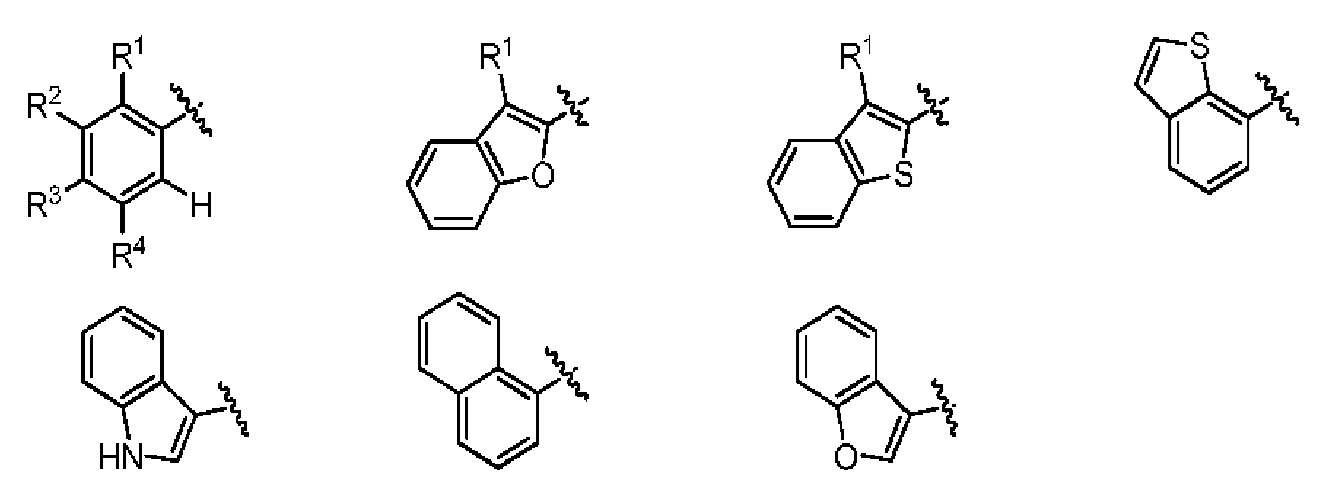
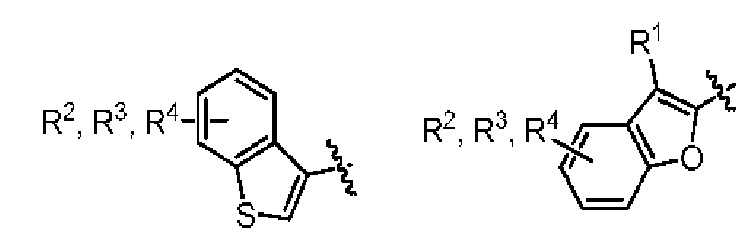
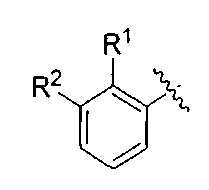
Один вариант реализации указанного аспекта относится к соединению формулы I, где AR выбран из фенила, нафтила, бензотиофенила, хинолинила, индолила и бензофуранила.
Один вариант реализации указанного аспекта относится к соединению формулы I, где

выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, NH2, F, Cl и Br;
R2, R3 и R4 независимо выбраны из водорода, CF3, гидрокси, метокси, F и Cl;
R7, R8, R9 и R10 независимо выбраны из водорода, метила и этила; или выбраны так, что R8 и R9 соединены и образуют 5-членное кольцо;
X выбран из водорода, метила, бензила, CHCH3C6H5, 4-хлорбензила, 2-хлорбензила, 2,4-дихлорбензила, 3,4-дихлорбензила, 4-метоксибензила, 3,5-диметоксибензила, 3,4-диметоксибензила, 3-хлор-4-метоксибензила, 2-фенилэтила и гидрокси.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, NH2, F, Cl и Br;
R2 выбирают из водорода, CF3, гидрокси, метокси, F и Cl.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, NH2, F, Cl и Br; и
R2 выбран из водорода и F.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
выбран из группы
где
R1 выбран из метила, изопропила, CF3, гидрокси, метокси, NH2, F, Cl и Br.
Один вариант реализации указанного аспекта относится к соединению формулы I, где
представляет
где R1 выбран из метила, изопропила, CF3, гидрокси, метокси, NH2, F, Cl, Br, ОС(O)СН3, OC(O)Ph, OC(O)(CH2)14CH3, ОС(O)СН(СН3)2 и ОС(O)ОСН2СН3;
и R2 выбран из водорода, F, Cl и Br.
Другой аспект настоящего изобретения относится к соединению формулы I для применения в качестве лекарственного средства.
Другой аспект настоящего изобретения относится к соединению формулы I для применения при лечении фиброза, сердечно-сосудистых заболеваний, болей, воспалительного заболевания кишечника (ВЗК) или других воспалительных заболеваний. Обычно указанный фиброз выбран из системного склероза, фиброза кожи, фиброза печени, фиброза сердца, фиброза почек, фиброза кишечника, фиброза легкого, включая идиопатический легочный фиброз (ИЛФ) и фиброз, связанный с легочной артериальной гипертензией (ЛАГ), и фиброз, связанный с трансплантацией, хирургическим вмешательством, стенозом или келоидным рубцеванием. Обычно указанное сердечно-сосудистое заболевание выбрано из атеросклероза и гипертонии. Обычно указанная боль выбрана из мигрени и боли, связанной с воспалительными заболеваниями. Обычно указанное воспалительное заболевание кишечника (ВЗК) выбрано из болезни Крона и язвенного колита.
Другой аспект настоящего изобретения относится к соединению формулы I для применения при лечении воспалительных заболеваний суставов, включая ревматоидный артрит (РА) и остеоартрит (OA).
Другой аспект настоящего изобретения относится к применению соединения формулы 1 для получения лекарственного средства для лечения фиброза, сердечно-сосудистых заболеваний, болей, воспалительного заболевания кишечника (ВЗК) или других воспалительных заболеваний. Обычно указанный фиброз выбран из системного склероза, фиброза кожи, фиброза печени, фиброза сердца, фиброза почек, фиброза кишечника, фиброза легкого, включая идиопатический легочный фиброз (ИЛФ) и фиброз, связанный с легочной артериальной гипертензией (ЛАГ), и фиброз, связанный с трансплантацией, хирургическим вмешательством, стенозом или келоидным рубцеванием. Обычно указанное сердечно-сосудистое заболевание выбрано из атеросклероза и гипертонии. Обычно указанная боль выбрана из мигрени и боли, связанной с воспалительными заболеваниями.
Обычно указанное воспалительное заболевание кишечника (ВЗК) выбрано из болезни Крона и язвенного колита.
Другой аспект настоящего изобретения относится к применению соединения формулы I для получения лекарственного средства для лечения воспалительных заболеваний суставов, включая ревматоидный артрит (РА) и остеоартрит (OA).
Другой аспект настоящего изобретения относится к способу лечения фиброза, сердечнососудистых заболеваний, боли, воспалительного заболевания кишечника (ВЗК) или других воспалительных заболеваний, включающий введение терапевтически эффективного количества соединения формулы 1 нуждающемуся в этом пациенту. Обычно указанный фиброз выбран из системного склероза, фиброза кожи, фиброза печени, фиброза сердца, фиброза почек, фиброза кишечника, фиброза легкого, включая идиопатический легочный фиброз (ИЛФ) и фиброз, связанный с легочной артериальной гипертензией (ЛАГ), и фиброз, связанный с трансплантацией, хирургическим вмешательством, стенозом или келоидным рубцеванием. Обычно указанные сердечно-сосудистые заболевания выбраны из атеросклероза и гипертонии. Обычно указанная боль выбрана из мигрени и боли, связанной с воспалительными заболеваниями. Обычно указанное воспалительное заболевание кишечника (ВЗК) выбрано из болезни Крона и язвенного колита.
Другой аспект настоящего изобретения относится к способу лечения воспалительных заболеваний суставов, включая ревматоидный артрит (РА) и остеоартрит (OA), включающему введение терапевтически эффективного количества соединения формулы I нуждающемуся в этом пациенту.
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение формулы I, смешанное с одним или более фармацевтически приемлемыми вспомогательными веществами или носителями. Обычно указанные вспомогательные вещества выбраны из группы, включающей наполнители, смазывающие вещества, ароматизаторы, красители, подслащивающие вещества, буферные агенты, подкисляющие агенты, разбавители и консерванты. Обычно указанные композиции вводят перорально, путем пероральной ингаляции, внутримышечно, внутривенно, внутрибрюшинно или подкожно, при помощи имплантатов, ректально, интраназально или трансдермально; предпочтительно перорально.
Соединения согласно настоящему изобретению можно применять для профилактики и лечения как таковые или предпочтительно в форме фармацевтической композиции. Хотя можно вводить активный ингредиент отдельно, предпочтительно, чтобы он присутствовал в фармацевтическом составе или композиции. Соответственно, настоящее изобретение относится к фармацевтической композиции, содержащей соединение согласно настоящему изобретению и фармацевтически приемлемый разбавитель, вспомогательное вещество или носитель (все вместе именуемые здесь как материалы «носителя»). Фармацевтические композиции согласно настоящему изобретению могут принимать форму фармацевтической композиции, как описано ниже. Таким образом, настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно соединение формулы I совместно с обычными вспомогательными веществами.
Типичные композиции для перорального введения включают суспензии (включая наносуспензии), которые могут содержать, например, микрокристаллическую целлюлозу для придания объема, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве усилителя вязкости и подсластители или ароматизаторы, такие как известные в данной области техники; и таблетки с немедленным высвобождением, которые могут содержать, например, микрокристаллическую целлюлозу, дикальцийфосфат, крахмал, стеарат магния, сульфат кальция, сорбит, глюкозу и/или лактозу и/или другие вспомогательные вещества, связующие вещества, наполнители, разрыхлители, разбавители и смазывающие вещества, известные в данной области техники. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические смолы, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и тому подобное. Разрыхлители включают без ограничения крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное. Соединения формулы I также можно вводить через полость рта сублингвально и/или буккально. Типичные формы, которые можно применять, представляют собой формованные таблетки, прессованные таблетки или лиофилизированные таблетки. Типичные композиции включают композиции, содержащие соединение(-ия) согласно настоящему изобретению с быстрорастворимыми разбавителями, такими как маннит, лактоза, сахароза и/или циклодекстрины. Также в такие составы можно включать высокомолекулярные вспомогательные вещества, такие как целлюлозы (авицел) или полиэтиленгликоли (ПЭГ). Такие составы могут также содержать вспомогательное вещество для облегчения адгезии на слизистых оболочках, такое как гидроксипропилцеллюлоза (НРС), гидроксипропилметилцеллюлоза (НРМС), натрийкарбоксиметилцеллюлоза (SCMC), сополимер малеинового ангидрида (например, Gantrez) и агенты для контроля высвобождения, такие как полиакриловый сополимер (например, Carbopol 934). Для облегчения изготовления и применения можно также добавлять смазывающие вещества, скользящие вещества, ароматизаторы, красители и стабилизаторы. Применяемые в указанных лекарственных формах смазывающие вещества включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Для перорального введения в жидкой форме указанные компоненты для перорального введения, представляющие собой лекарственные средства, можно объединять с любым пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное.
Фармацевтические композиции согласно настоящему изобретению включают фармацевтические композиции, подходящие для перорального, парентерального введения [в том числе подкожного, внутрикожного, внутримышечного, внутривенного (болюсного или инфузионного) и внутрисуставного], ингаляций (включая тонкодисперсные порошки или спреи, которые можно получить при помощи аэрозолей различных типов для распыления отмеренных доз), распылителей или инсуффляторов, ректального, внутрибрюшинного и местного (включая дермальное, буккальное, подъязычное и внутриглазное) введения, хотя наиболее подходящий путь введения может зависеть, например, от состояния и расстройства реципиента.
Составы согласно настоящему изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, сашеты, пилюли или таблетки, каждая из которых содержит заданное количество указанного активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; например, в виде эликсиров, настоек, суспензий (включая наносуспензии) или сиропов; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может также находиться в форме болюса, лекарственной кашки или пасты.
Таблетку можно изготовить прессованием или формованием, необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в соответствующем аппарате активного ингредиента в свободно текучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, смазывающим веществом, инертным разбавителем, смазывающим веществом, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получить формованием в подходящем устройстве смеси указанного порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки необязательно могут быть покрыты оболочкой или на них может быть нанесена насечка и таблетки можно приготовить таким образом, чтобы обеспечить медленное или контролируемое высвобождение указанного активного ингредиента. Соединения согласно настоящему изобретению можно, например, вводить в форме, подходящей для немедленного высвобождения или пролонгированного высвобождения. Немедленное высвобождение или пролонгированное высвобождение может быть достигнуто за счет применения подходящих фармацевтических композиций, содержащих соединения согласно настоящему изобретению, или, в частности, в случае пролонгированного высвобождения, за счет применения таких устройств, как подкожные имплантаты или осмотические насосы. Соединения согласно настоящему изобретению также можно вводить в липосомальной форме. Предпочтительными стандартными дозированными лекарственными формами являются такие, которые содержат эффективную дозу активного ингредиента, как указано выше, или ее соответствующую фракцию.
Следует понимать, что в дополнение к ингредиентам, отдельно упомянутым выше, составы согласно настоящему изобретению могут содержать другие агенты, обычные в данной области техники с учетом типа рассматриваемой композиции, например, составы для перорального введения могут включать вкусовые агенты.
Препараты могут быть удобно представлены в единичной дозированной форме и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. Обычно указанные составы получают путем равномерного и тщательного объединения указанного активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями или и тем, и другим, а затем, если это необходимо, формованием продукта в желаемый состав.
Соединения согласно настоящему изобретению также можно вводить в виде систем доставки липосом, таких как небольшие моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы можно получать из разных фосфолипидов, 1,2-дипальмитоилфосфатидилхолина, фосфатидилэтаноламина (цефалина), фосфатидилсерина, фосфатидилинозитола, дифосфатидилглицерина (кардиолипина) или фосфатидилхолина (лецитина).
Составы, для парентерального введения включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические и растворенные вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии (включая наносуспензии), которые могут включать суспендирующие агенты и загустители. Указанные составы могут быть представлены в однодозовых или многодозовых контейнерах, например, в герметичных ампулах и флаконах, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, когда требуется только добавление стерильного жидкого носителя, например, солевого раствора или воды для инъекций, непосредственно перед использованием. Приготовленные для немедленного приема растворы и суспензии для инъекций можно приготовить из стерильных порошков, гранул и таблеток ранее описанного типа. Примеры композиций для парентерального введения включают растворы или суспензии для инъекций, которые могут содержать, например, подходящие нетоксичные, парентерально приемлемые разбавители или растворители, такие как полиэтиленгликоль, этанол, 1,3-бутандиол, вода, раствор Рингера, изотонический раствор хлорида натрия или другие подходящие диспергирующие или смачивающие и суспендирующие агенты, включая синтетические моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту, полисорбаты и кремофор.
Примеры композиций для назального введения, введения в виде аэрозоля или ингаляции включают растворы в физиологическом растворе, которые могут содержать, например, бензиловый спирт или другие подходящие консерванты, промоторы абсорбции для повышения биодоступности и/или другие солюбилизирующие или диспергирующие агенты, такие как известные в данной области техники.
Составы для ректального введения могут быть представлены в виде суппозитория с обычными носителями, такими как масло какао, синтетические глицеридные эфиры или полиэтиленгликоль. Такие носители обычно твердые при обычных температурах, но они становятся жидкими и/или растворяются в ректальной полости с высвобождением лекарственного средства.
Составы для местного введения во рту, например, буккально или сублингвально, включают пастилки для рассасывания, содержащие активный ингредиент в ароматизированной основе, такой как сахароза и аравийская камедь или трагакант, и пастилки, содержащие активный ингредиент в основе, таком как желатин и глицерин или сахароза и аравийская камедь. Примеры композиций для местного введения содержат местный носитель, такой как Plastibase (минеральное масло, загущенное полиэтиленом).
Разумеется, количество активного ингредиента, которое требуется для достижения терапевтического эффекта, зависит от конкретного соединения, пути введения, субъекта, подлежащего лечению, включая тип, вид, возраст, вес, пол и состояние здоровья субъекта и почечной и печеночной функции субъекта, а также конкретного расстройства или заболевания, подлежащего лечению, а также от его тяжести. Врач или ветеринар с обычной квалификацией может легко определить и назначить эффективное количество лекарственного средства, необходимого для предупреждения, реверсии или прекращения развития состояния.
Пероральные дозы согласно настоящему изобретению при применении для достижения указанных эффектов будут находиться в пределах от примерно 0,01 мг на кг массы тела в сутки (мг/кг/сутки) до примерно 100 мг/кг/сутки, предпочтительно от 0,01 мг на кг тела вес в сутки (мг/кг/сутки) до 10 мг/кг/сутки и наиболее предпочтительно от 0,1 до 5,0 мг/кг/сутки для взрослых людей. Для перорального введения указанные композиции предпочтительно предоставляются в виде таблеток или других формах, представленных в дискретных единицах, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100 и 500 мг активного ингредиента для симптоматической корректировки дозы для пациента, подлежащего лечению. Лекарственное средство обычно содержит от примерно 0,01 мг до примерно 500 мг активного ингредиента. Кроме того, предпочтительные соединения согласно настоящему изобретению можно вводить в интраназальной форме посредством местного применения подходящих интраназальных носителей или через трансдермальные пути с использованием тех форм кожных пластырей, которые хорошо известны специалистам в данной области. Для введения в виде трансдермальной системы доставки введение дозировок будет, конечно, непрерывным, а не прерывистым для всех режимов дозировки.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение общей формулы (I) и дополнительный терапевтический агент.
Соединения общей формулы (I) можно вводить в виде единственного фармацевтического агента или в комбинации с одним или более дополнительными терапевтическими агентами, где указанная комбинация не вызывает неприемлемых побочных эффектов. Указанная фармацевтическая комбинация включает введение одной фармацевтической дозированной композиции, содержащей соединение общей формулы (I) и один или более дополнительных терапевтических агентов, а также введение соединения общей формулы (I) и каждого дополнительного терапевтического агента в виде отдельных фармацевтических лекарственных форм. Например, соединение общей формулы (I) и терапевтический агент можно вводить пациенту вместе в виде одной пероральной дозированной композиции, такой как таблетка или капсула, или каждый агент можно вводить в отдельных лекарственных формах.
Когда применяют отдельные лекарственные формы, соединение общей формулы (I) и один или более дополнительных терапевтических агентов можно вводить по существу в одно и то же время (например, одновременно) или в раздельные разнесенные по времени моменты (например, последовательно).
В частности, соединения согласно настоящему изобретению можно применять в виде комбинированного препарата или в качестве комбинации отдельных препаратов с эффекторами ядерных рецепторов, факторами транскрипции, рецепторами, связанными с G-белком, ионными каналами, интегринами, киназами или ферментами.
В частности, соединения по настоящему изобретению можно применять в виде комбинированного препарата или в качестве комбинации отдельных препаратов с: агонистами глюкокортикоидных рецепторов, например, триамцинолоном, преднизоном, преднизолоном или будесонидом; антагонистами минералокортикоидных рецепторов, например, спиронолактоном, эплереноном или канреноном; агонистами PPAR, например, розиглитазоном, GFT 505, сароглитазаром, пиоглитазоном или фарглитазаром; агонистами FXR, например, обетихолевой кислотой, Рх 102 или урсодезоксихолевой кислотой; агонистами PXR, например, прегненолоном 16α-карбонитрилом; агонистами NR4Al, например, цитоспороном В; Nrf2-активаторами, например, бардоксолона метилом; ингибиторами WNT/β-катенина, например, ICG-001; антагонистами хемокина, например, бинаритом; антагонистами LPA, например, BMS 986020 или SAR 100842; аналогами простациклина, например, (+/-) берапростом натрия, илопростом или трепростинилом; антагонистами AT1-рецептора, например, лозартаном; антагонистами рецептора ЕТА, например, атрацентаном, амбрисентаном, босентаном или мацитентаном; антагонистами CCR5, например, маравироком; антагонистами CCR2, например, RS-504393; антагонистами CXCR4, например, AMD3100; ингибиторами PAR1, например, SCH 79797; SlP-лигандами, например, финголимодом (FTY720); агонистами PTGER, например, (R)-рутипростом (пролекарство); антагонистами PTGFR, например, AL-8810; агонистами LXA4, например, BML-111; агонистами RXFP1; антагонистами 5-НТ2А или 5-НТ2В-рецепторов, например, сарпогрелатом; антагонистами Р2Х7, например, А-438079; блокаторами KCa3.1 / IKCa1, например, TRAM-34; блокаторами каналов Са2 + Т-типа, например, эфонидипином; ингибиторами конранспортера Na-K-Cl, например, торсемидом; ингибиторами интегрина αVβ6, например, CWHM 12; ингибиторами интегрина αVβ1, например, с8; антагонистами галектина 3, например, TD139; ингибиторами TGF-β или р38, например, пирфенидоном или F-351; ингибиторами тирозинкиназы, например, нинтеданибом, иматинибом или нилотинибом; ингибиторами киназы, например, сорафенибом, дазатинибом, барицинибом или танзицертибом; ингибиторами PI3K-mTOR, например, GSK2126458; ингибиторами MK2, например, MMI 0100; антагонистами IGFII, например, PXS 64 или PXS 25; ингибиторами PKCδ, например, роттлерином; ингибиторами р38 MAPK, например, SB239063 или FR-167653; ингибиторами РНК-киназы, например, Y-27632; ингибиторами FAK, например, PF-562271; ингибиторами ALK5, например, SB-431542; ингибиторами SMAD3, например, SIS-3; TGFβ1-ингибирующими пептидами, например, дезиртидом; ингибиторами PDE, например, пентоксифиллином или СТР 499; ингибиторами PDE5, например, силденафилом; ингибиторами NADPH-оксидазы, например, GKT 137831; ингибиторами TAFI, например, UK 396 082; ингибиторами катепсина В, например, VBY 376; ингибиторами каспазы, например, эмрикасаном; ингибиторами LOXL2, например, β-аминопропионитрилом; антагонистами TGM2, например, NTU281; ингибиторами пролилгидроксилазы, например, НОЕ 077 или пиридин-2,4-дикарбоксилатом; ингибиторами ВМР1 или BMP1-подобных протеиназ, например, UK-421045; нейтрофильными эластазами, например, ONO-5046; ингибиторами EPRS, например, галогенгиноном; ингибиторами TNKS1, например, XAV939; ингибиторами АСЕ, например, эналаприлом; ингибиторами АТХ, например, GWJ-A-23; антагонистами AT1-рецептора, например, лозартаном; ингибиторами 5LO, например, зилеутоном; ингибиторами HMG-CoA редуктазы (статинами), например, аторвастатином, флувастатином, ловастатином, питавастатином, правастатином, розувастатином или симвастатином; антагонистами PAI1, например, ТМ5275; связующими FKBP12, например, сиролимусом; связующими S100A9, например, палкинимодом; кофактором переноса метила, например, адеметионином; иммуномодулирующими соединениями, например, талидомидом или помалидомидом; антиоксидантами, нацеленными на митохондрию, например, митохиноном;
производными витаминов, например, пиридоксамином или α-токоферолом; пуриновыми антагонистами, например, азатиоприном; поглотителами ROS или антиоксидантами, например, N-ацетилцистеином, альфа-липоевой кислотой или α-токоферолом; разрушителями микротрубочек, например, колхицином; медными хелаторами, например, D-пеницилламином; алкилаторами, например, циклофосфамидом; ингибиторами экспрессии HSP47 или ингибиторами BET, например, (+) JQ-1; или интерфероном γ-1b.
Далее настоящее изобретение будет описано более подробно при помощи примеров, которые включены для того, чтобы привести описание определенных вариантов осуществления настоящего изобретения, но никоим образом не ограничивают объем настоящего изобретения.
Получение соединений согласно настоящему изобретению
Новые соединения согласно настоящему изобретению можно получать известными способами, описанными в учебниках по органической химии (например, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 7th Edition, Wiley) или в литературе (см., например, WO 2006/072351 и Du, X. et al. J. Med. Chem. 2002, 45, 2695-2707). Таким образом, 2-пиразолиновое кольцо может быть образовано путем взаимодействия ароматических оснований Манниха с гидразином с получением 3-Ar-2-пиразолинов (b), с производными гидразина, такими как аминогуанидины, H2NNHC(NH)NHX (Х=Н, алкил, бензил, фенил или ОН) с получением 1-амидино-3-Ar-2-пиразолинов (d), или с полукарбазидами H2NNHC(S)NHX с получением соответствующих тиокарбонильных производных (с), которые можно превращать в конечные продукты (d) (схема 2). Реакции конденсации с формированием кольца с применением или его производных обычно проводят в полярных растворителях при повышенных температурах, например, в спиртах, таких как МеОН или EtOH, при температуре кипения с обратным холодильником.
3-Ar-2-пиразолины (b) могут дополнительно участвовать на одной или нескольких стадиях реакции с реагентами, которые обеспечивают амидиногруппу с получением 1-амидино-3-арил-2-пиразолинов (d). Способы, описанные в литературе, представляют собой, например, реакции с MeSC(NH)NHX или его солями при повышенной температуре в пиридине или с амидинопиразолом или с ди-Вос-защищенным амидинопиразолом в ТГФ при комнатной температуре с последующим снятием защиты с помощью ТФК (Bernatowicz, М. S. et al. Tetrahedron Letters, Vol. 34, No. 21, 3389-3392, 1993). В других способах тиокарбонильные производные (с) сначала генерируют взаимодействием, например, с изотиоцианатами, XN=C=S, защищенным изотиоцианатом (например, BzNCS, расщепляемым основным гидролизом) или другими формами активированных тиокарбонильных производных, например, реагентами на основе имидазолила. Затем следует активация S-метилированием, например, с применением MeI, и взаимодействие с амином (H2NX) с получением конечных 1-амидино-3-арил-2-пиразолинов (d). См. также схему 5 для аналогичного приготовления исходных материалов гидразина.
В реакционных последовательностях, где «-NHX» включен как в субстрат, так и в реагент, по меньшей мере один «-NHX» представляет собой -NH2.
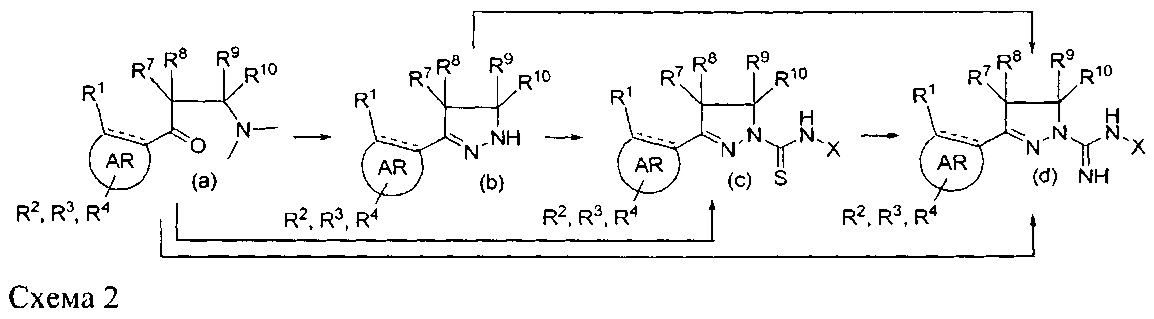
Альтернативно, арилвинилкетоны (е) можно применять в качестве исходных материалов во взаимодействиях с производными гидразина (схема 3).
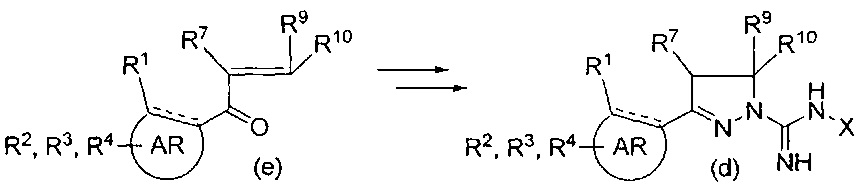
Схема 3
Это позволяет применять более широкий диапазон схемы замещения пиразолинового кольца для заместителей R9 и R10.
Другой способ (WO 2013/006308 А2), подходящий для 4,4-R7,R8-дизамещенных 1-амидино-3-Ar-2-пиразолинов (k), заключается в том, что арил-алкилкетоны, содержащие уходящую группу (LG), отличную от аминогрупп, в β-позиции, такую как галоген или тозилат, взаимодействуют с гидразином или производными гидразина подобно взаимодействиям, приведенным выше (схема 4).
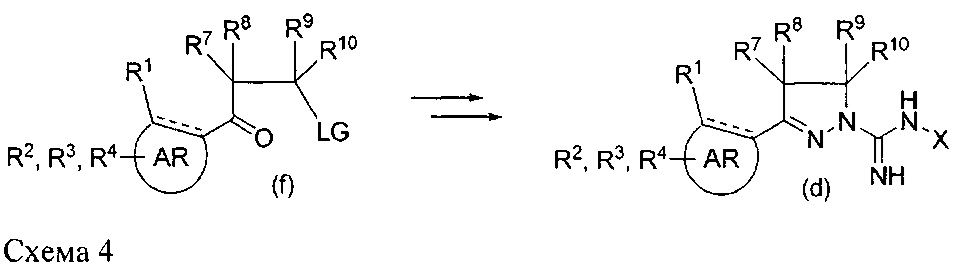
Производные гидразина H2NNHC(NH)NHX и H2NNHC(S)NHX (X такой, как определено для общей формулы I) коммерчески доступны или их можно получить известными способами, см., например, US 4107326. Таким образом, тиосемикарбазиды, которые можно получать путем взаимодействия гидразина с изотиоцианатами, XN = С = S, можно активировать S-метилированием и далее подвергать взаимодействию с аминами (XNH2) или аммиаком с получением производных аминогуанидина H2NNHC(NH)NHX (схема 5). В ходе указанных реакций три N-группы (H2NNH-, -NHX и =NH) взаимозаменяемы, например, гидразин можно подвергать взаимодействию с S-метилированным производным мочевины MeSC(NH)NHX.
Ароматические исходные вещества, применяемые во взаимодействии с производными гидразина, доступы коммерчески или их можно получать несколькими способами, описанными в литературе. Ароматические основания Манниха (а) можно получать из алкиларилкетонов в реакциях типа Манниха с применением формальдегида или эквивалентного реагента, такого как 1,3-диоксолан, и диалкиламина или его соли, например, диметиламмониййодида, или, альтернативно, с применением предварительно полученных соединений иминия, таких как соль Эшенмозера H2CNMe2I.
Для получения арилвинилкетонов существуют несколько путей синтезирования, которые можно найти в учебниках по органической химии March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 7th Edition, Wiley); некоторые из них перечислены ниже:
альдольная конденсация арилкетонов с альдегидами или кетонами; отщепление амина от N-алкилированных оснований Манниха;
реакции отщепления с другими функционализированными арилкетонами, такими как бром- или селенсодержащие производные;
реакции присоединения или замещения алкенильных или алкинильных нуклеофилов к ароматическим карбонильным соединениям (например, альдегидам или амидам Вайнреба), необязательно с последующим восстановлением α,β-тройных связей и/или окислением бензиловых спиртов;
реакции типа Виттига, например, реакции Уодсворта-Хорнера-Эммонса;
ацилирование Фриделя-Крафтса или перегруппировка Фрая;
катализируемое металлом ацилирование ароматических предшественников, например, реакция Сузуки с применением арилбороновых кислот и ацилхлоридов; и
взаимодействие ароматических ацильных производных с нуклеофильными алкенами.
Еще один способ (WO 2012/006308 A2) получения 3-Ar-2-пиразолинов заключается в катализируемом металлом связывании 3-галоген-2-пиразолина (h) с производными арилбороновой кислоты (g) (схема 6).
3-галоген-2-пиразолин может быть получен путем конденсации гидразина с акриловыми исходными веществами с получением 3-оксопиразолидина, соль которого хлорируют и затем необязательно подвергают взаимодействию под NH с электрофильным реагентом, таким как реагент или реагенты с защитной группой (PG), которые обеспечивают амидиногруппу.
В примерах получения разделение при помощи колоночной хроматографии проводили с применением силикагеля Merck SiO2 60 (0,040-0,063 мм). ЯМР-спектры регистрировали на приборах Varian Mercury или Bruker UltraShield (частоты и растворители такие, как указано). Химические названия соединений были получены с использованием Chemdraw (Cambridgesoft).
Пример 1
3-(2-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
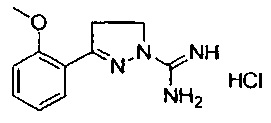
3-(диметиламино)-1-(2-метоксифенил)пропан-1-он
К смеси 2-гидроксиацетофенона (1,36 г, 10,0 ммоль), 1,3-диоксолана (2,96 г, 40,0 ммоль) и диметиламина гидрохлорида (1,02 г, 12,5 ммоль) добавляли три капли (примерно 70 мг) HCl (водный раствор). Указанную реакционную смесь перемешивали при температуре 90°С в закрытом флаконе в течение 3,5 часов. После охлаждения указанную реакционную смесь разбавляли водой (15 мл) и затем промывали EtOAc (2×5 мл). Продукт экстрагировали EtOAc (2×10 мл) после добавления водного раствора NaOH (2 М, 10 мл), затем органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного продукта (1,98 г, 96%), который использовали без дополнительной очистки на следующей стадии.
1Н ЯМР (CDCl3, 400 МГц) δ: 2,27 (s, 6Н), 2,70 (t, 2Н), 3,18 (t, 2Н), 3,90 (s, 3Н), 6,96 (d, 1Н), 7,00 (t, 1Н), 7,45 (t, 1Н), 7,68 (d, 1Н).
3-(2-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
Аминогуанидина гидрохлорид (111 мг, 1,00 ммоль) добавляли к раствору 3-(диметиламино)-1-(2-метоксифенил)пропан-1-она (207 мг, 1,00 ммоль) в EtOH (96%, 2 мл). Указанную реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 2 часов и затем выпаривали растворитель. Остаток очищали колоночной хроматографией на колонке с силикагелем (EtOAc:MeOH:AcOH, 100:0:1, 66:33:1). Элюированный продукт осаждали добавлением EtOAc, собирали фильтрованием и промывали EtOAc и пентаном с получением указанного в заголовке соединения в виде беловатого твердого вещества (60 мг, 24%).
1Н ЯМР (CD3OD, 400 МГц) δ: 3,61 (t, 2Н), 3,86 (s, 3Н), 3,97 (t, 2Н), 6,98 (t, 1Н), 7,08 (d, 1Н), 7,43 (t, 1Н), 7,91 (d, 1Н).
Следующие соединения в примерах 2-16 получали из соответствующих производных ацетофенона тем же способом, как описано выше.
Сравнительный пример 2
2-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
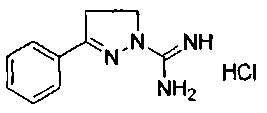
1Н ЯМР (CD3OD, 400 МГц) δ: 3,58 (t, 2Н), 4,08 (t, 2Н), 7,44-7,53 (m, 3Н), 7,88 (d, 2Н).
Пример 3
3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
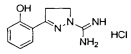
1Н ЯМР (CD3OD, 400 МГц) δ: 3,68 (t, 2Н), 4,02 (t, 2Н), 6,94-7,00 (m, 2Н), 7,38 (t, 1Н), 7,59 (d, 1Н).
Пример 4
3-(2-бромфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид. в качестве примера приведена его 2,2,2-трифторацетатная соль
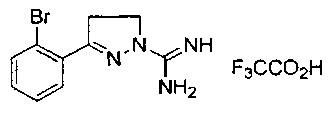
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (С18/MeCN/H2O/1% ТФК).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,60 (t, 2Н), 4,04 (t, 2Н), 7,43 (t, 1Н), 7,51 (t, 1Н), 7,73-7,79 (m, 6Н).
Пример 5
3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
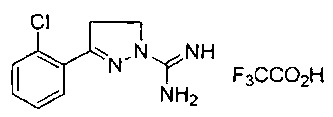
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (С18/MeCN/H2O/1% ТФК).
1H ЯМР ((CD3)2SO, 400 МГц) δ: 3,61 (t, 2Н), 4,04 (t. 2Н), 7,46 (t, 1H), 7,52 (t, 1H), 7,59 (d, 1H), 7,85 (s, 4H), 7,88 (d, 1H).
Пример 6
3-(2-метилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
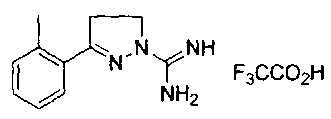
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (C18/MeCN/H2O/1% ТФК).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 2,56 (s, 3Н), 3,54 (t, 2Н), 3,96 (t, 2Н), 7,31-7,39 (m, 3Н), 7,57 (d, 1H), 7,78 (s, 4Н).
Пример 7
3-(2,5-дифторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
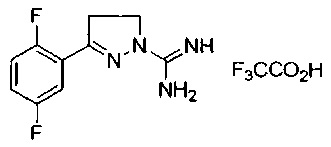
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (С18/MeCN/H2O/1% ТФК).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,52 (t, 2Н), 4,00 (t, 2Н), 7,42 (t, 2Н), 7,87 (s, 4Н), 8,01 (m, 1Н).
Пример 8
3-(2-изопропилфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
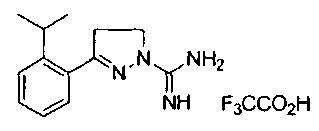
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (С18/MeCN/H2O/1% ТФК).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,20 (d, 6Н), 3,50 (t, 2Н), 3,52 (m, 1Н), 3,99 (t, 2Н), 7,30 (t, 1Н), 7,43-7,50 (m, 3Н), 7,67 (s, 4Н).
Пример 9
3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
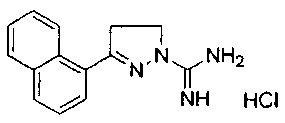
1Н ЯМР (CD3OD, 400 МГц) δ: 3,77 (t, 2Н), 4,09 (t, 2Н), 7,55-7,61 (m, 2Н), 7,66 (t, 1Н), 7,82 (d, 1Н), 7,96 (d, 1Н), 8,03 (d, 1Н), 9,04 (d, 1H).
Пример 10
3-(бензо[b]тиофен-7-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
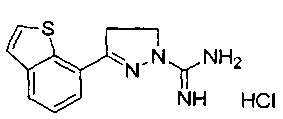
1Н ЯМР (CD3OD, 400 МГц) δ: 3,74 (t, 2Н), 4,11 (t, 2Н), 7,50-7,7,57 (m, 2Н), 7,67-7,75 (m, 2Н), 8,05 (d, 1Н).
Пример 11
3-(2-фторфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
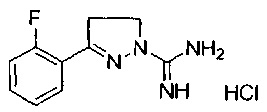
1Н ЯМР (CD3OD, 400 МГц) δ: 3,64 (t, 2Н), 4,07 (t, 2Н), 7,24 (dd, 1Н), 7,29 (t, 1Н), 7,54 (m, 1Н), 8,07 (t, 1Н).
Сравнительный пример 12
3-(нафталин-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
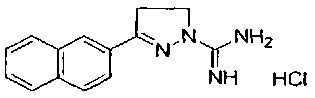
1Н ЯМР (CD3OD, 400 МГц) δ: 3,65 (t, 2Н), 4,08 (t, 2Н), 7,57 (m, 2Н), 7,85-7,97 (m, 3Н), 8,11 (d, 1Н), 8,19 (s, 1Н).
Пример 13
3-(2-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
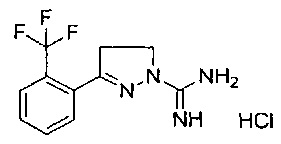
1Н ЯМР (CD3OD, 400 МГц) δ: 3,55 (t, 2Н), 4,12 (t, 2Н), 7,68-7,7,78 (m, 3Н), 7,86 (d, 1Н).
Пример 14
3-(бензофуран-3-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
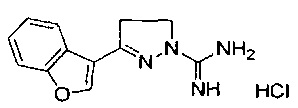
1Н ЯМР (CD3OD, 400 МГц) δ: 3,59 (t, 2Н), 4,05 (t, 2Н), 7,41 (m, 2Н), 7,58 (d, 1Н), 8,32 (s, 1Н), 8,33 (d, 1Н).
Сравнительный пример 15
3-(4-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
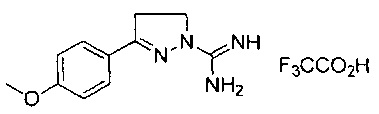
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,46 (t, 2Н), 3,83 (s, 3Н), 3,97 (t, 2Н), 7,05 (d, 2Н), 7,66 (s, 4Н), 7,81 (d, 2Н).
Сравнительный пример 16
3-(3,4-диметоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,46 (t, 2Н), 3,82 (s, 3Н), 3,82 (s, 3Н), 3,98 (t, 2Н), 7,05 (d, 1Н), 7,29 (d, 1Н), 7,55 (s, 1Н), 7,71 (s, 4Н).
Пример 17
3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
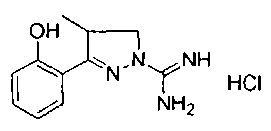
3-(диметиламино)-1-(2-гидроксифенил)-2-метилпропан-1-он
Указанное соединение получали способом, описанным в примере 1, используя в качестве исходного материала 1-(2-гидроксифенил)пропан-1-он (выход 1,49 г, 77%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,23 (d, 3Н), 2,25 (s, 6Н), 2,34 (dd, 1Н), 2,85 (dd, 1Н), 3,74 (m, 1Н), 6,91 (t, 1Н), 6,99 (d, 1Н), 7,47 (t, 1Н), 7,81 (d, 1Н).
3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
Указанное соединение получали способом, описанным в примере 1. Перекристаллизовывали из MeOH-Et2O с получением 767 мг (30%) указанного в заголовке соединения.
1Н ЯМР (CD3OD, 400 МГц) δ: 1,33 (d, 3Н), 3,76 (dd, 1Н), 4,11 (t, 1Н), 4,23 (m, 1Н), 6,96 (t, 1Н), 6,98 (d, 1Н), 7,36 (t, 1Н), 7,65 (d, 1Н).
Следующие соединения получали из соответствующих арилкетонных производных тем же способом, как описано выше.
Пример 18
3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
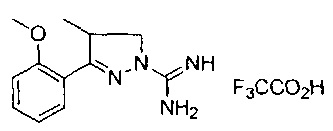
Указанное соединение выделяли в виде ТФК-соли после очистки при помощи ВЭЖХ (C18/MeCN/H2O/1% ТФК).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,10 (d, 3Н), 3,61 (m, 1Н), 3,86 (s, 3Н), 4,04-4,21 (m, 2Н), 7,03 (t, 1Н), 7,16 (d, 1Н), 7,50 (t, 1Н), 7,76 (m, 5Н).
Пример 19
3-(2-хлорфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его йодистоводородная соль
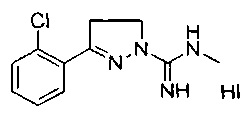
N-метилгидразинкарбоксимидамида гидроиодид
MeI (17,03 г, 120 ммоль) добавляли к раствору гидразинкарботиоамида (9,11 г, 100 ммоль) в МеОН (40 мл). Указанную реакционную смесь перемешивали при температуре 60°С в течение 1 часа. Некоторое количество растворителя (примерно 10 мл) затем выпаривали с удалением остаточного MeI. После охлаждения добавляли раствор MeNH2 в МеОН (15,0 мл, 9,8 М, 147 ммоль) и указанную реакционную смесь перемешивали в течение ночи при температуре 60-70°С, затем концентрировали при пониженном давлении. Остаток кристаллизовали из i-PrOH (40 мл), собирали фильтрованием, промывали i-PrOH (10 мл), EtOAc (10 мл) и пентаном (10 мл) с получением указанного в заголовке соединения (16,13 г, 75%) в виде беловатых кристаллов.
1Н ЯМР (CD3OD, 400 МГц) δ: 2,86 (s, 3Н)
3-(2-хлорфенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидроиодид
Указанное соединение получали согласно способу, описанному в примере 1, с использованием в качестве исходных материалов N-метилгидразинкарбоксимидамида гидроиодида и 1-(2-хлорфенил)этанона.
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 2,88 (s, 3Н), 3,60 (t, 2Н), 4,02 (t, 2Н), 7,42-7,63 (m, 3Н), 7,89 (d, 1Н), 8,00 (s, 3Н).
Пример 20
3-(2-гидроксифенил)-N-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 2,2,2-трифторацетатная соль
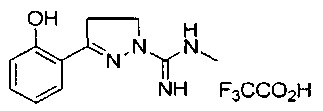
Указанное соединение получали способом, описанным выше.
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 2,88 (d, 3Н), 3,57 (t, 2Н), 3,93 (t, 2Н), 6,94 (t, 1Н), 6,98 (d, 1Н), 7,36 (t, 1Н), 7,68 (d, 1Н), 7,96 (s, 1Н), 8,12 (s, 1Н), 9,70 (s, 1Н).
Пример 21
N-бензил-3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
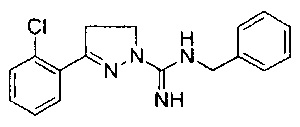
N-бензилгидразинкарбоксимидамида гидроиодид
К раствору гидразинкарботиоамида (9,11 г, 100 ммоль) в МеОН (10 мл) добавляли MeI (17,03 г, 120 ммоль). Указанную реакционную смесь перемешивали в закрытом флаконе при температуре 60°С в течение 75 мин, а затем в открытом флаконе при температуре 70°С в течение 20 мин. После охлаждения добавляли PhCH2NH2 (1,07 г, 10 ммоль) и указанную реакционную смесь перемешивали в течение ночи при температуре 55°С, затем концентрировали при пониженном давлении с получением масла. Продукт кристаллизовали при добавлении по каплям Et2O при энергичном перемешивании и собирали фильтрованием с получением указанного в заголовке соединения (2,848 г, 97%) в виде твердого вещества бледно-оранжевого цвета.
1Н ЯМР (CD3OD, 400 МГц) δ: 4,13 и 4,45 (два изомера, 1:2)(2 s, 2Н), 7,28-7-48 (m, 5Н).
N-бензил-3-(2-хлорфенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Указанное соединение получали согласно способу, описанному в примере 1, с использованием в качестве исходных материалов N-бензилилгидразинкарбоксимидамида гидроиодида и 1-(2-хлорфенил)этанона.
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,42 (t, 2Н), 4,05 (t, 2Н), 4,46 (s, 2Н), 7,34-7,44 (m, 8Н), 7,62 (m, 1Н).
Пример 22
N-бензил-3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид. в качестве примера приведена его 2,2,2-трифторацетатная соль
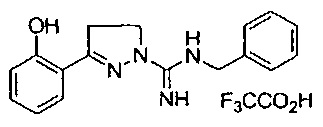
Указанное соединение получали способом, описанным выше.
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 2,83 (t, 2Н), 4,30 (t, 2Н), 4,60 (d, 2Н), 6,93 (d, 1Н), 7,00 (t, 1Н), 7,30-7,44 (m, 6Н), 8,10 (s, 2Н), 8,34 (d, 1Н), 8,50 (s, 1Н), 10,56 (s, 1Н).
Пример 23
5-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
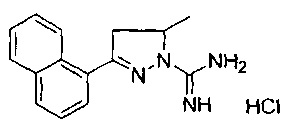
Водн. 5 M NaOH (0,2 мл, 1 экв.) добавляли к раствору 1-(нафталин-1-ил)бут-2-ен-1-она (196 мг, 1,0 ммоль) и аминогуанидингидрохлорида (111 мг, 1,0 ммоль) в 96% EtOH (2 мл). Указанную реакционную смесь перемешивали при температуре 80-90°С в течение 1 часа и затем охлаждали до комнатной температуры, подкисляли 1,5 экв. HCl/EtOH (1 М, 1,5 мл) и затем снова нагревали при температуре кипения с уменьшением объема до примерно 2 мл. Продукт очищали колоночной хроматографией (SiO2, EtOAc-АсОН, 99:1, затем EtOAc-MeOH-AcOH, 99:99:2) и кристаллизовали из МеОН-EtOAc с получением указанного в заголовке соединения (175 мг, 61%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,43 (d, 3Н), 3,37 (dd, 1Н), 4,00 (dd, 2Н), 4,76 (m, 1Н), 7,55-7,62 (m, 2Н), 7,67 (t, 1H), 7,83 (d, 1Н), 7,96 (d, 1Н), 8,03 (d, 1Н), 9,02 (d, 1Н).
Следующие соединения получали из соответствующих α,β-ненасыщенных арилкетонных производных тем же способом, как описано выше.
Пример 24
4-метил-3-(нафталин-1-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
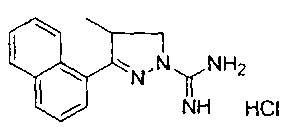
1Н ЯМР (CD3OD, 400 МГц) δ: 1,24 (d, 3Н), 3,79 (m, 1Н), 4,25-4,36 (m, 2Н), 7,54-7,64 (m, 3Н), 7,76 (d, 1Н), 7,95 (d, 1Н), 8,01 (d, 1Н).
Пример 25
3-(2-хлорфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

Метилдиметилфосфонат (682 мг, 5,5 ммоль) добавляли к раствору LiHMDS в ТГФ (11 мл, 1,0 М, 11,0 ммоль) при температуре 0°С. Затем по каплям добавляли метил-2-хлорбензоат (853 мг, 5,0 ммоль), поддерживая внутреннюю температуру реакции ниже 5°С. Указанную реакционную смесь перемешивали при температуре 0°С в течение 2 часов и затем распределяли между NH4Cl (водн., насыщ.) и EtOAc. Водный слой экстрагировали EtOAc, объединенные органические фазы сушили над сульфатом натрия и концентрировали с получением неочищенного диметил(2-(2-хлорфенил)-2-оксоэтил)фосфоната (1,2 г), который использовали на следующей стадии без дополнительной очистки.
К раствору неочищенного фосфоната (279 мг, 1,0 ммоль) и ацетальдегида (88 мг, 2,0 ммоль) в ТГФ-воде добавляли K2CO3 (276 мг, 2,0 ммоль). Указанную реакционную смесь перемешивали в течение 2 часов и затем распределяли между разбавленным Et2O и NH4Cl (водн., насыщ.). Органический слой отделяли, и водный слой экстрагировали Et2O. Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением неочищенного 1-(2-хлорфенил)бут-2-ен-1-она (150 мг), который использовали на следующей стадии без дополнительной очистки.
Водн. 5М NaOH (0,1 мл, 0,5 ммоль) добавляли к раствору неочищенного 1-(2-хлорфенил)бут-2-ен-1-она (90 мг, 0,5 ммоль) и аминогуанидингидрохлорида (55 мг, 0,5 ммоль) в 96% EtOH (2 мл). Указанную реакционную смесь перемешивали при температуре 80-90°С в течение 1 часа и затем охлаждали до комнатной температуры, подкисляли 1,2 экв. HCl/EtOH (1 М, 0,6 мл) и затем снова нагревали при температуре кипения с уменьшением объема до примерно 2 мл. Продукт очищали колоночной хроматографией (SiO2, EtOAc-AcOH, 99:1, затем EtOAc-MeOH-AcOH, 99:99:2) с получением указанного в заголовке соединения (27 мг, 20%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,25 (d, 3Н), 3,21 (d, 2Н), 3,81 (dd, 1Н), 4,83 (m, 1Н), 7,46 (t, 1Н), 7,52 (t, 1Н), 7,59 (d, 1Н), 7,87 (d, 1Н), 7,96 (s, 4Н).
Следующие соединения получали из соответствующих ароматических Ме-сложноэфирных производных тем же способом, как описано выше.
Пример 26
3-(2,6-дифторфенил)-5-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
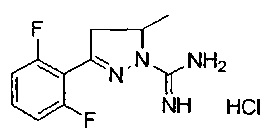
1Н ЯМР (CD3OD, 400 МГц) δ: 1,36 (d, 3Н), 3,18 (d, 2Н), 3,81 (dd, 1Н), 4,74 (m, 1H), 7,14 (t, 2H), 7,55 (m, 1H).
Пример 27
3-(2-хлорфенил)-5-этил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
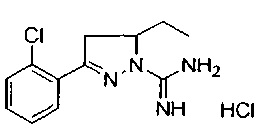
1Н ЯМР (CD3OD, 400 МГц) δ: 0,95 (t, 3Н), 1,77 (m, 2Н), 3,41 (d, 2Н), 3,84 (dd, 1Н), 4,69 (m, 1Н), 7,42 (t, 1Н), 7,48 (t, 1Н), 7,53 (d, 1Н), 7,81 (d, 1Н).
Пример 28
5-метил-3-(3-метилбензофуран-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
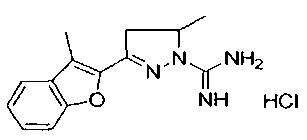
1Н ЯМР (CD3OD, 400 МГц) δ: 1,39 (d, 3Н), 2,59 (s, 3Н), 3,33 (d, 2Н), 3,82 (dd, 1Н), 4,74 (m, 1Н), 7,33 (t, 1Н), 7,43 (t, 1Н), 7,50 (d, 1Н), 7,69 (d, 1Н).
Пример 29
5-метил-3-(3-метилбензо[b]тиофен-2-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
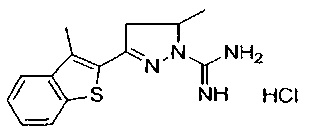
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,27 (d, 3Н), 2,63 (s, 3Н), 3,27 (d, 1Н), 3,86 (dd, 1Н), 4,84 (m, 1Н), 7,46 (m, 2Н), 7,88-78,00 (m, 6Н).
Пример 30
3-(2-хлорфенил)-4,5,6,6а-тетрагидроциклопента[с]пиразол-1(3аН)-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
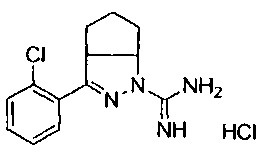
(2-хлорфенил)(циклопент-1-ен-1-ил)метанон
2-хлорбензоилхлорид 5 (8,47 г, 48,4 ммоль) добавляли к хлориду алюминия 7,10 г, 53,2 ммоль), суспендированному в сухом CH2Cl2 (50 мл). Через 5 мин полученный комплекс декантировали из избытка AlCl3 и охлаждали до температуры 0°С. Затем по каплям в течение 0,5 часа добавляли раствор циклопентена (3,30 г, 48,4 ммоль) в сухом CH2Cl2 (50 мл). По завершении добавления указанную смесь добавляли к измельченному льду при энергичном перемешивании. После разделения фаз водную фазу несколько раз экстрагировали CH2Cl2. Объединенные органические фракции промывали NaHCO3, (водн. насыщ.) водой и рассолом, затем сушили. Удалением растворителя было получено масло, к которому сразу добавляли триэтиламин (30 мл). Затем полученную смесь нагревали с обратным холодильником в течение 48 часов. Концентрированием при пониженном давлении было получено масло, которое разбавляли эфиром и промывали HCl (водн., 1 М), NaHCO3 (водн., насыщ.) и солевым раствором. После сушки концентрированием при пониженном давлении получали неочищенный (2-хлорфенил)(циклопент-1-ен-1-ил)метанон (4,5 г, 45%), который использовали на следующей стадии без дополнительной очистки.
3-(2-хлорфенил)-4,5,6,6а-тетрагидроциклопента[с]пиразол-1(3аН)-карбоксимидамида гидрохлорид
К раствору неочищенного (2-хлорфенил)(циклопент-1-ен-1-ил)метанона (1,72 г, 8,4 ммоль) в EtOH (95%, 20 мл) добавляли гидрохлорид аминогуанидина (0,92 г, 8,4 ммоль), а затем 5 М водн. NaOH (1,7 мл, 1 экв.) (осаждение NaCl). Указанную реакционную смесь перемешивали при температуре 80-90°С (кипячение с обратным холодильником) в течение 30-60 мин, ТСХ (EtOAc-AcOH, 99:1, EtOAc-МеОН-АсОН, 99:99:2). Реакционную смесь охлаждали до комнатной температуры и подкисляли 1,1 экв. HCl/EtOH (1 М, 11 мл), а затем снова нагревали с обратным холодильником с уменьшением содержания воды и объема до примерно 2 мл. После охлаждения продукт очищали колоночной хроматографией (SiO2, EtOAc-AcOH, 99:1, затем EtOAc-MeOH-AcOH, 99:99:2) с получением указанного в заголовке соединения (80 мг, 3,2%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,30 (m, 1Н), 1,57 (m, 1H), 1,68 (m, 1Н), 1,84 (m, 1Н), 1,90 (m, 2Н), 4,60 (t, 1Н), 4,93 (m, 1Н), 7,47 (t, 1Н), 7,53 (t, 1Н), 7,60 (d, 1Н), 7,74 (d, 1Н), 7,91 (s, 4Н).
Пример 31
3-(2-аминофенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
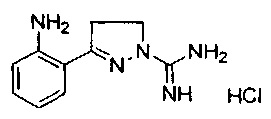
3-(диметиламино)-1-(2-нитрофенил)пропан-1-он
HCl (35% водный раствор, 0,2 мл) добавляли к раствору параформальдегида (1,43 г, 48 ммоль), гидрохлорида диметиламина (11,64 г, 143 ммоль) и 2-нитроацетофенона (18,17 г, 110 ммоль) в этаноле (10 мл). Указанную реакционную смесь нагревали с обратным холодильником в течение 5 часов. Желтоватый раствор разбавляли холодным ацетоном (50 мл) и охлаждали в течение нескольких часов при температуре 0°С. Кристаллы отфильтровывали, промывали ацетоном (2×20 мл), растворяли в воде (20 мл) и затем экстрагировали этилацетатом (2×35 мл). Водный слой обрабатывали карбонатом калия (рН = 10) и экстрагировали этилацетатом (5×35 мл). Органические фазы сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения в виде масла (8,7 г, 77%), которое использовали на следующей стадии без дополнительной очистки.
3-(2-аминофенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
Аминогуанидина гидрохлорид (0,70 мг, 6,3 ммоль) добавляли к раствору 3-(диметиламино)-1-(2-нитрофенил)пропан-1-она (1,40 мг, 6,3 ммоль) в EtOH (95%, 20 мл). Затем добавляли NaOH (водный раствор 5 М, 1,26 мл, 6,3 ммоль) (осаждается NaCl) и указанную реакционную смесь перемешивали при температуре 80-90°С в течение 60 мин. После охлаждения до комнатной температуры указанную реакционную смесь подкисляли 1,1 экв. HCl/EtOH (1 М, 7 мл), снова нагревали с обратным холодильником в течение 0,5 часа и затем концентрировали при пониженном давлении. Остаток растворяли в EtOH (30 мл) и затем добавляли NH4Cl (1,32 г, 25,2 ммоль) и железо (3,53 г, 63,0 ммоль). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 5 часов, охлаждали до комнатной температуры, фильтровали через целит и выпаривали досуха. Продукт очищали колоночной хроматографией с получением указанного в заголовке соединения (150 мг, 10%).
1Н ЯМР (CD3OD, 400 МГц) δ: 3,61 (t, 2Н), 3,95 (t, 2Н), 6,76 (t, 1H), 6,91 (d, 1Н), 7,24 (t, 1Н), 7,36 (d, 1Н).
Пример 32
3-(2-гидроксифенил)-4,4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его 3,3,3-трифторацетатная соль
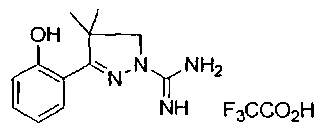
2-(4,4-диметил-4,5-дигидро-1Н-пиразол-3-ил)фенол
Гидразингидрат (647 мг, 12,9 ммоль) добавляли к раствору 3-хлор-1-(2-гидроксифенил)-2,2-диметилпропан-1-она (550 мг, 2,59 ммоль) и NEt3 (522 мг, 5,16 ммоль) в EtOH (абс, 20 мл). Указанную реакционную смесь перемешивали в закрытом флаконе при температуре 130°С в течение 22 часов. После охлаждения реакционную смесь концентрировали при пониженном давлении и распределяли между водой и Et2O. Органическую фазу концентрировали при пониженном давлении и остаток (0,52 г) очищали колоночной хроматографией на колонке с силикагелем (гептан-EtOAc, 5:1) с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (180 мг, 37%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,50 (s, 6Н), 3,30 (s, 2Н), 6,86 (t, 1Н), 7,01 (d, 1H), 7,23 (t, 1H), 7,54 (d, 1H).
трет-бутил (((трет-бутоксикарбонил)имино)(3-(2-гидроксифенил)-4,4-диметил-4,5-дигидро-1Н-пиразол-1-ил)метил)карбамат
К раствору 2-(4,4-диметил-4,5-дигидро-1Н-пиразол-3-ил)фенола (160 мг, 8,41 ммоль) в ТГФ (1,2 мл) добавляли трет-бутил (((трет-бутоксикарбонил)имино)(1Н-пиразол-1-ил)метил)карбамат (260 мг, 8,41 ммоль). Указанную реакционную смесь перемешивали в течение ночи и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (гептан-EtOAc, 10:1, 5:1) с получением указанного в заголовке соединения (136 мг, 37%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,52 (s, 18Н), 1,57 (s, 6Н), 3,94 (s, 2Н), 6,88 (t, 1Н), 7,02 (d, 1H), 7,30 (t, 1H), 7,58 (d, 1H), 9,92 (шир. s, 1H), 10,33 (s, 1H).
3-(2-гидроксифенил)-4,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
Трифторуксусную кислоту (1,8 мл) добавляли к раствору трет-бутил (((трет-бутоксикарбонил)имино)(3-(2-гидроксифенил)-4,4-диметил-4,5-дигидро-1Н-пиразол-1-ил)метил) карбамата (136 мг, 3,14 ммоль) в CH2Cl2 (1,8 мл). Указанную реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч и затем концентрировали при пониженном давлении. Остаток растирали с Et2O (5 мл) с кристаллизацией материала, который собирали фильтрованием, промывали Et2O и сушили с получением указанного в заголовке соединения в виде беловатых кристаллов (99 мг, 91%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,34 (s, 6Н), 3,83 (s, 2Н), 6,90 (t, 1Н), 6,97 (d, 1Н), 7,30-7,39 (m, 2Н), 7,89 (s, 4Н), 9,90 (s, 1Н).
Пример 33
3-(2-хлор-2-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

1-(2-хлор-6-метоксифенил)-3-(диметиламино)пропан-1-он
Было получено (240 мг, 41%) согласно методу, описанному в примере 1.
1Н ЯМР (CDCl3, 400 МГц) δ: 2,27 (s, 6Н), 2,75 (t, 2Н), 2,99 (t, 2Н), 3,82 (s, 3Н), 6,82 (d, 1Н), 6,98 (t, 1Н), 7,26 (t, 1Н).
3-(2-хлор-6-метоксифенил)-4,5-дигидро-1Н-пиразол
Гидразингидрат (0,25 мл, 5,12 ммоль) добавляли к раствору 1-(2-хлор-6-метоксифенил)-3-(диметиламино)пропан-1-она (240 мг, 8,83 ммоль) в EtOH (95% 4 мл). Указанную реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 5 часов. После охлаждения реакционную смесь концентрировали при пониженном давлении с получением неочищенного продукта в виде масла (210 мг), которое использовали на следующей стадии без дополнительной очистки.
3-(2-хлор-6-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
К раствору 3-(2-хлор-6-метоксифенил)-4,5-дигидро-1Н-пиразола (210 мг, 1,00 ммоль) в пиридине (1 мл) в атмосфере аргона добавляли метилкарбамимидотиоата гидроиодид (260 мг, 1,19 ммоль). Указанную реакционную смесь перемешивали при температуре 110°С в течение 1,5 часов. После охлаждения реакционную смесь концентрировали при пониженном давлении и остаток распределяли между CH2Cl2 и водой, к основной реакции добавляли NaOH (водный раствор 1 М) и продукт экстрагировали CH2Cl2. Органическую фазу промывали водой, сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток (210 мг) растворяли в EtOAc (5 мл) и добавляли HCl/MeOH (1 М, 0,91 мл) с осаждением продукта в виде HCl-соли. Добавляли дополнительный EtOAc (5 мл) и после перемешивания в течение 5 мин кристаллы собирали фильтрованием, промывали EtOAc и сушили с получением указанного в заголовке соединения в виде белых кристаллов (200 мг, 69%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,34 (t, 2Н), 3,83 (s, 3Н), 4,07 (t, 2Н), 7,16 (d, 1Н), 7,18 (d, 1Н), 7,49 (t, 1Н), 7,87 (s, 4Н).
Пример 34
3-(2-хлор-6-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
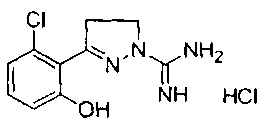
Раствор 1 М BBr3 в МеОН (2,63 мл, 2,63 ммоль) добавляли к раствору 3-(2-хлор-6-метоксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорида (190 мг, 0,66 ммоль) в CH2Cl2 (10 мл) в атмосфере Ar. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли МеОН (20 мл) и после 10-минутного перемешивания указанную реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду (10 мл) и EtOAc (20 мл) и после добавления KHCO3 (водн., насыщ.) для подщелачивания смеси продукт экстрагировали в органическую фазу. Фазы разделяли и затем водную фазу экстрагировали EtOAc (2×15 мл). Комбинированные органические фазы сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток растворяли в МеОН (1 мл), добавляли 1 М HCl в МеОН (0,5 мл) и продукт осаждали добавлением EtOAc (10 мл). Продукт собирали фильтрованием, промывали EtOAc и сушили с получением указанного в заголовке соединения в виде бежевых кристаллов (95 мг, 52%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 3,61 (t, 2Н), 4,05 (t, 2Н), 6,98 (d, 1Н), 7,00 (d, 1Н), 7,30 (t, 1Н), 7,82 (s, 4H), 10,64 (s, 1Н).
Пример 35
(S)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
(изомер 1)
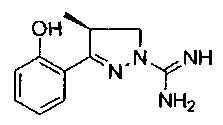
и
Пример 36
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
(изомер 2)
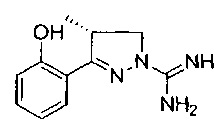
Энантиомеры разделяли и очищали с помощью СФХ (сверхкритическая флюидная хроматография) с использованием колонки Amy-С (20 мм × 250 мм, 5 мкм) с МеОН/СО2 (40%) в качестве элюента (DEA добавляли в качестве модификатора) со скоростью потока, составляющей 50 мл/мин и с УФ-детектированием при длине волны 280 нм.
Рацемат HCl-соли (8,43 г) растворяли в метаноле (50 мг/мл) и вводили в объеме по 0,8 мл (40 мг). Объединенные фракции каждого энантиомера (изомер 1 на 1,22 мин и изомер 2 на 1,77 мин) концентрировали при пониженном давлении и сушили в вакуумной печи при температуре 40°С с получением указанных в заголовке продуктов в виде беловатых кристаллов.
Окончательный анализ проводили при помощи СФХ (колонка Amy-С, 4,6 мм × 250 мм, 5 мкм). В качестве элюента применяли МеОН/СО2 (40%) (DEA добавляли в качестве модификатора) со скоростью потока, составляющей 4 мл/мин.
Для изомера 1:
(S)-конфигурация (определена рентгеноструктурным анализом, см. Пример 37); Выход 3,90 г (46%).
Хим. (чистота 220 нм): 100%
Энантиомерный избыток: 100
Для изомера 2:
(R)-конфигурация (определена рентгеноструктурным анализом, см. Пример 38); Выход 3,50 г (41%).
Хим. (чистота 220 нм): 100%
Энантиомерный избыток: 99,8
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,16 (d, 3Н), 3,56 (dd, 1Н), 3,89 (t, 1Н), 4,14 (m, 1Н), 6,14 (шир. s), 4Н), 6,59 (t, 1Н), 6,77 (d, 1Н), 7,12 (t, 1Н), 7,54 (d, 1Н).
Пример 37
(S)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
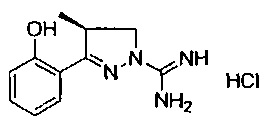
и
Пример 38
(R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
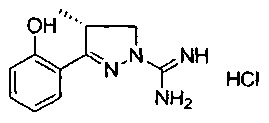
Выделенные энантиомеры, изомер-1 и изомер-2, соответственно, растворяли в EtOH и HCl-соли осаждали добавлением HCL/Et2O (насыщ.). Затем растворители удаляли при температуре 40°С под потоком азота с получением конечного материала в виде беловатого твердого вещества. Образцы каждого энантиомера перекристаллизовывали из i-PrOH с получением кристаллов, подходящих для рентгеноструктурного анализа.
Сбор данных
Для обоих изомеров пластинчатые кристаллы размером примерно 0,1 × 0,1 × 0,02 мм были установлены в нейлоновых петлях с использованием парафинового масла при комнатной температуре. Парафиновое масло использовалось для того, чтобы кристалл легче удерживался в петле. Данные собирали при 100 К на станции I911-3 в лаборатории МАХ (λ = 0,8  ), оснащенной детектором 225 мм marCCD. Все данные были интегрированы с использованием программы XDS и масштабированы с использованием XSCALE.
), оснащенной детектором 225 мм marCCD. Все данные были интегрированы с использованием программы XDS и масштабированы с использованием XSCALE.
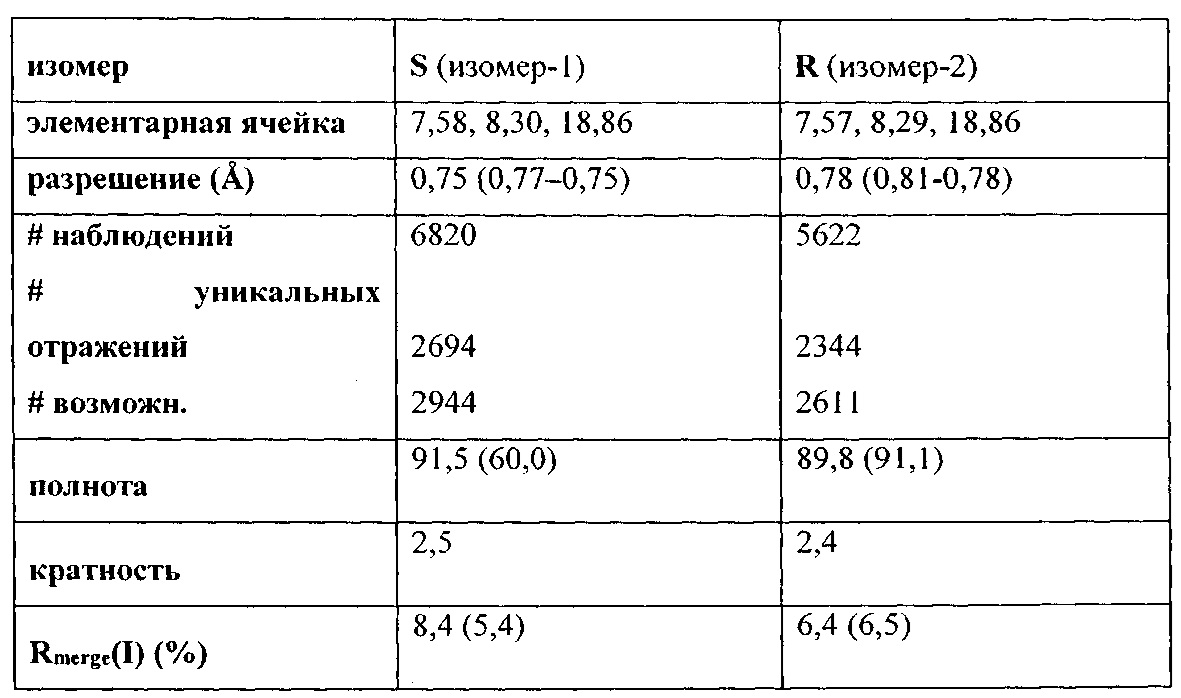
Статистика учитывает, что до уточнения пары Фриделя не были объединены.
Расшифровка и уточнение структуры
Для обоих изомеров пространственная группа была идентифицирована как примитивная орторомбическая согласно программе XDS и более конкретно с использованием программы XPREP (Bruker AXS) идентифицирована как P212121. Обе структуры были расшифрованы с использованием SHELXS3 и уточнены с использованием SHELXL3 в сочетании с графическим интерфейсом SHELXLE4. Для S-изомера (изомер-1) R-конфигурация соединения с одним хлорид-ионом была обнаружена с использованием атомных пиков из прямых методов в SHELXS. Параметр Флэка из SHELXL составлял примерно 1 (0,9±0,1) после уточнения R-конфигурации, что указывает на то, что абсолютная конфигурация была определена неверно. Таким образом, вместо этого было S-изомер (параметр Флэка -0,1±0,1). Конечный R-фактор составляет 4,6% для 2540 Fo>4σ (Fo) и 5,0% для всех 2590 отражений до 0,77 Å.
Для R-изомера (изомера-2) была установлена пространственная группа Р212121 по XPREP, так как эта пространственная группа была идентифицирована для предыдущего изомера и размеры ячейки были идентичны. R-конфигурация соединения с одни хлорид-ионом была корректно установлена по SHELXS с самого начала. Параметр Флэка из SHELXL составлял примерно 0 (-0,1±0,2) после уточнения R-конфигурации, что указывает на то, что абсолютная структура была определена верно. Конечный R-фактор составляет 7,5% для 2268 Fo>4σ (Fo) и 10,2% для всех 2410 отражений до 0,78 Å.
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,18 (d, 3Н), 3,70 (dd, 1Н), 4,10 (t, 1Н), 4,13 (m, 1Н), 6,92 (t, 1Н), 7,01 (d, 1Н), 7,35 (t, 1Н), 7,68 (d, 1Н), 7,87 (s, 4Н), 9,95 (s, 1Н).
Пример 39
3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
3-(диметиламино)-1-(2-метоксифенил)-2-метилпропан-1-он
HCl (водн., конц., 0,85 мл) добавляли к смеси 1-(2-метоксифенил) пропан-1-она (23,6 г, 144 ммоль), 1,3-диоксолана (42,8 г, 578 ммоль) и диметиламина гидрохлорида (14,7 г, 180 ммоль). Реакционную смесь перемешивали при температуре 85°С в закрытом флаконе в течение 4 часов. После охлаждения указанную реакционную смесь смешивали с EtOAc (300 мл) и перемешивали в течение 30 минут, чтобы осадить основание Манниха в виде HCl-соли. Кристаллы собирали фильтрованием, промывали EtOAc и Et2O и сушили с получением 31 г (84%) белых кристаллов. Кристаллы распределяли между водой (250 мл) и CH2Cl2 (250 мл) и экстрагировали в органическую фазу после добавления NaOH (водн., 5 М, 50 мл). Водную фазу экстрагировали CH2Cl2 (100 мл) и объединенные органические фазы промывали водой, сушили (Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого масла (23,2 г, 73%), который использовали без дополнительной очистки на следующей стадии.
1Н ЯМР (CDCl3, 400 МГц) δ: 1,15 (d, 3Н), 2,20 (s, 6Н), 2,29 (dd, 1Н), 2,68 (dd, 1Н), 3,67 (m, 1Н), 3,88 (s, 3Н), 6,94 (d, 1Н), 6,98 (t, 1Н), 7,42 (t, 1Н), 7,55 (d, 1Н).
3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамид
NaOH (водн., 50%, 1,7 мл, примерно 32 ммоль) добавляли к раствору тиосемикарбазида (440 мг, 4,82 ммоль) и 3-(диметиламино)-1-(2-метоксифенил)пропан-1-он (1,07 г мг, 4,82 ммоль) в МеОН (60 мл) в атмосфере Ar. Указанную реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 1,5 ч и затем концентрировали при пониженном давлении. Остаток распределяли в воде и CH2Cl2. Органическую фазу промывали водой и концентрировали при пониженном давлении с получением неочищенного продукта (1,1 г), который очищали колоночной хроматографией на колонке с силикагелем (гептан-EtOAc, 10:4) с получением указанного в заголовке соединения в виде желтого масла (940 мг, 78%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,16 (d, 3Н), 3,87 (s, 3Н), 3,93-4,07 (m, 2Н), 4,47 (t, 1Н), 6,96 (d, 1Н), 7,00 (t, 1Н), 7,42 (t, 1Н), 7,65 (d, 1Н).
Метил 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбимидотиоата гидроиодид
Метилиодид (MeI) (1,06 г, 7,50 ммоль) добавляли к раствору 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамида (930 мг, 3,73 ммоль) в МеОН (5 мл). Указанную реакционную смесь перемешивали в закрытом флаконе при температуре 70°С в течение 4 часов. После охлаждения растворитель выпаривали при пониженном давлении с получением конечный объема примерно 1 мл. Добавляли Et2O (10 мл) и указанную смесь интенсивно перемешивали в течение 1 часа с осаждением продукта, который собирали фильтрованием, промывали Et2O и сушили с получением указанного в заголовке соединения (йодистая соль производного S-метилизотиоурония) в виде бежевых кристаллов (1,32 г, 90%). Этот материал использовали без дополнительной очистки на следующей стадии.
3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидроиодид
MeNH2 (2,0 М в МеОН, 1,6 мл, 3,2 ммоль) добавляли к раствору метил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбимидотиоата гидройодида (0,42 г, 1,07 ммоль) в МеОН (3 мл). Указанную реакционную смесь перемешивали при температуре 70°С в закрытой пробирке в течение 3,5 часов. После охлаждения реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,40 г, количеств.).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,20 (d, 3Н), 3,23 (d, 3Н), 3,87 (s, 3Н), 3,97 (m, 1Н), 4,20 (m, 1Н), 4,53 (t, 1Н), 6,96 (d, 1Н), 7,01 (t, 1Н), 7,45 (t, 1Н), 7,65 (d, 1Н)).
Пример 40
3-(2-гидроксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
BBr3 в CH2Cl2 (4,28 мл, 1 М, 4,28 ммоль) добавляли к раствору 3-(2-метоксифенил)-N,4-диметил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидройодида (0,40 г, 1,07 ммоль) в CH2Cl2 (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. После добавления МеОН (50 мл) и перемешивания в течение 10 мин раствор концентрировали при пониженном давлении. Остаток растворяли в воде, подщелачивали KHCO3 (водн., насыщ.) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2:MeOH:NH3 (водн.), 30:5:1) с получением указанного в заголовке соединения (0,15 г, 60%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,17 (d, 3Н), 2,83 (s, 3Н), 3,64 (dd, 1Н), 3,97 (t, 1Н), 4,09 (m, 1Н), 6,85 (t, 1Н), 6,94 (d, 1Н), 7,29 (t, 1Н), 7,65 (d, 1Н), около 8 (очень шир. s), 3Н).
Пример 41
N-бензил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Бензиламин (132 мг, 1,23 ммоль) добавляли к раствору 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамида (0,400 мг, 1,02 ммоль) в МеОН (3 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 2,5 часов. После охлаждения реакционную смесь распределяли в NaOH (водн., 1 М, 10 мл) и CH2Cl2 (20 мл). Органическую фазу промывали водой и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2:МеОН:NH3 (водн.), 45:5:1) с получением указанного в заголовке соединения (235 мг, 71%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,14 (d, 3Н), 3,66 (dd, 1Н), 3,86 (s, 3Н), 3,97 (m, 1Н), 4,14 (dd, 1Н), 4,46 (s, 2Н), 6,93 (d, 1Н), 6,97 (t, 1Н), 7,26 (t, 1Н), 7,32-7,41 (m, 5Н), 7,62 (d, 1Н).
Пример 42
N-бензил-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид

BBr3 в CH2Cl2 (2,92 мл, 1М, 2,92 ммоль) добавляли к раствору N-бензил-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида (235 мг, 1,07 ммоль) в CH2Cl2 (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. После добавления МеОН (30 мл) раствор концентрировали при пониженном давлении. Остаток распределяли в воде (10 мл) и CH2Cl2 (10 мл), подщелачивали KHCO3 (водн., насыщ.) и разделяли. Водную фазу экстрагировали CH2Cl2 (10 мл) и объединенные органические фазы промывали водой (10 мл), сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2:МеОН:NH3 (водн.), 40:5:1) с получением указанного в заголовке соединения (0,15 г, 67%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,35 (d, 3Н), 3,75 (m, 1Н), 3,86 (dd, 1Н), 3,97 (t, 1Н), 4,46 (s, 2Н), 6,95 (t, 1Н), 7,01 (d, 1Н), 7,26-7,40 (m, 7Н).
Пример 43
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
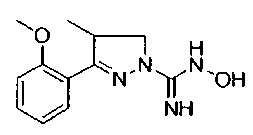
3-(2-метоксифент)-4-метил-N-((тетрагидро-2Н-пиран-2-ил)окси)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Указанное соединение получали способом, описанным в примере 41, с использованием О-(тетрагидро-2Н-пиран-2-ил)гидроксиламина вместо метиламина. Неочищенный продукт очищали колоночной хроматографией на силикагеле (CH2Cl2:МеОН 50:1) с получением указанного в заголовке соединения (295 мг, 75%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,10 (2d, 3Н), 1,52-1,90 (m, 6Н), 3,37-4,05 (m, 5Н), 3,85 (s, 3Н), 5,04 (m, 1Н), 6,92 (d, 1Н), 6,96 (t, 1Н), 7,34 (t, 1Н), 7,62 (d, 1Н).
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Dowex 50×8-400 (Н-форма, 1,7 мэкв/мл, 250 мг) добавляли к раствору 3-(2-метоксифенил)-4-метил-N-((тетрагидро-2Н-пиран-2-ил)окси)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида (295 мг, 0,89 ммоль) в CH2Cl2 (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли NH3 в EtOH (5 М, 5 мл) и после 15-минутного перемешивания раствор отделяли фильтрованием и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2:МеОН 10:1) с получением указанного в заголовке соединения (80 мг, 36%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,12 (d, 3Н), 3,45 (m, 1Н), 3,86 (s, 3Н), 3,87-3,98 (m, 2Н), 6,93 (d, 1Н), 6,98 (t, 1Н), 7,36 (t, 1Н), 7,64 (d, 1Н).
Пример 44
N-гидрокси-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его бромистоводородная соль
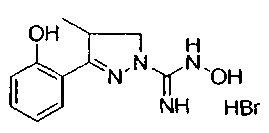
N-гидрокси-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Указанное соединение получали способом, описанным в примере 40. После концентрирования реакционной смеси в МеОН неочищенный продукт в виде HBr-соли очищали колоночной хроматографией на колонке с силикагелем (EtOAc:MeOH:AcOH, 100:10:1) с получением указанного в заголовке соединения (62 мг, 61%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,18 (d, 3Н), 3,65 (dd, 1Н), 4,00 (t, 1Н), 4,09 (m, 1Н), 6,93 (t, 1Н), 6,98 (d, 1Н), 7,35 (t, 1Н), 7,67 (d, 1Н), 8,18 (s, 2Н), 9,80 (s, 1Н), 10,04 (s, 1Н), 11,17 (s, 1Н).
Пример 45
3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
1-(5-фтор-2-метоксифенид)пропан-1-он
MeI (1,12 г, 7,88 ммоль) добавляли к смеси 1-(5-фтор-2-гидроксифенил)пропан-1-она (1,02 г, 6,06 ммоль) и K2CO3 (1,26 г, 9,09 ммоль) в ДМФА (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 мин и затем распределяли в воде (30 мл) и Et2O (40 мл). Органическую фазу промывали водой (2 × 20 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения в виде масла (1,04 г, 91%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,16 (t, 3Н), 2,99 (q, 2Н), 3,89 (s, 3Н), 6,91 (dd, 1Н), 7,14 (ddd, 1Н), 7,41 (dd, 1Н).
3-(диметиламино)-1-(5-фтор-2-метоксифенил)-2-метилпропан-1-он
HCl (водн., конц., 0,052 мл) добавляли к смеси 1-(5-фтор-2-метоксифенил)пропан-1-она (1,58 г, 8,67 ммоль), 1,3-диоксолана (2,58 г, 34,8 ммоль) и диметиламина гидрохлорида (0,883 г, 10,8 ммоль). Реакционную смесь перемешивали при температуре 85°С в закрытом флаконе в течение 4 часов. После охлаждения указанную реакционную смесь смешивали с EtOAc (40 мл) и перемешивали в течение 2 часов с осаждением неочищенного продукта в виде HCl-соли, которую собирали фильтрованием, промывали EtOAc и сушили. Твердый материал (1,95 г) распределяли в воде (30 мл) и CH2Cl2 (50 мл). Смесь подщелачивали добавлением KHCO3 (вод., насыщ.) и продукт экстрагировали в органическую фазу.
Водную фазу экстрагировали CH2Cl2 (25 мл) и объединенные органические фазы промывали водой (30 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде масла (1,45 г, 70%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,15 (d, 3Н), 2,21 (s, 6Н), 2,29 (dd, 1Н), 2,72 (dd, 1Н), 3,69 (m, 1Н), 6,90 (dd, 1Н), 7,13 (ddd, 1Н), 7,29 (dd, 1Н).
3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Аминогуанидина гидрохлорид (673 мг, 6,06 ммоль) добавляли к раствору 3-(диметиламино)-1-(5-фтор-2-метоксифенил)-2-метилпропан-1-она (1,45 г, 6,06 ммоль) в EtOH (96%, 12 мл). Указанную реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 20 ч и затем концентрировали до объема примерно 3,5 мл. Добавляли EtOAc (35 мл) и реакционную смесь перемешивали в течение 15 мин с осаждением неочищенного продукта в виде HCl-соли, которую собирали фильтрованием, промывали EtOAc и сушили. Твердый материал (0,92 г) растворяли в воде (25 мл) и подщелачивали добавлением KHCO3 (водн., насыщ.) и концентрировали досуха при пониженном давлении. К остатку добавляли CH2Cl2 (40 мл) и после 5-минутного перемешивания смесь фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде оранжевой пены (0,60 г, 40%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,15 (d, 3Н), 3,66 (dd, 1Н), 3,84 (s, 3Н), 4,00 (m, 1Н), 4,14(dd, 1Н), 6,86 (dd, IH), 7,05 (ddd, 1Н), 7,40 (dd, 1Н).
Пример 46
3-(5-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в
качестве примера приведена его бромистоводородная соль
BBr3 в CH2Cl2 (4,0 мл, 1М, 4 ммоль) добавляли к раствору 3-(5-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида (0,25 г, 1,0 ммоль) в CH2Cl2 (12 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. После добавления МеОН (10 мл) раствор концентрировали при пониженном давлении. Затем снова добавляли МеОН (10 мл). Раствор концентрировали при пониженном давлении и остаток перекристаллизовывали при температуре 0°С из МеОН (3 мл). Желтоватые кристаллы собирали фильтрованием, промывали Et2O и сушили с получением указанного в заголовке соединения (60 мг, 19%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,18 (d, 3Н), 3,69 (dd, 1Н), 4,05-4,18 (m, 2Н), 6,98 (dd, 1Н), 7,21 (dt, 1Н), 7,62 (dd, 1Н), 7,75 (s, 4Н), 10,01 (s, 1Н).
Пример 47
3-(3-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
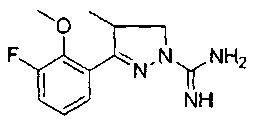
Указанное соединение получали способом, описанным в примере 45.
Выход: 500 мг (55%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,20 (d, 3Н), 3,82 (dd, 1Н), 3,96 (d, 3Н), 4,00 (m, 1Н), 4,38 (t, 1Н), 6,61 (s, 3Н), 7,04 (dt, 1Н), 7,17 (ddd, 1Н), 7,41 (d, 1Н).
Пример 48
3-(3-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в
качестве примера приведена его бромистоводородная соль
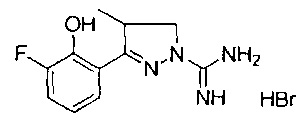
Указанное соединение получали способом, описанным в примере 46.
Выход: 156 мг (42%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,71 (dd, 1Н), 4,05-4,18 (m, 2Н), 6,94 (dt, 1Н), 7,36 (ddd, 1Н), 7,50 (d, 1Н), 7,80 (s, 4Н), 9,92 (s, 1Н).
Пример 49
3-(4-фтор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
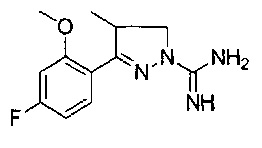
Указанное соединение получали способом, описанным в примере 45.
Выход: 470 мг (75%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,14 (d, 3Н), 3,73 (dd, 1Н), 3,85 (s, 3Н), 4,02 (m, 1Н), 4,26 (t, 1Н), 6,13 (s, 3Н), 6,66 (dd, 1Н), 6,70 (dt, 1Н), 7,64 (dd, 1Н).
Пример 50
3-(4-фтор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в
качестве примера приведена его бромистоводородная соль
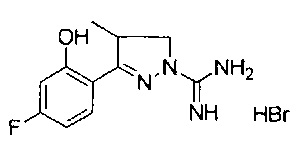
Указанное соединение получали способом, описанным в примере 46.
Выход: 90 мг (25%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,17 (d, 3Н), 3,67 (dd, 1Н), 4,03-4,17 (m, 2Н), 6,77-6,83 (m, 2Н), 7,65-7,80 (m, 5Н), 10,36 (s, 1Н).
Пример 51
3-(5-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
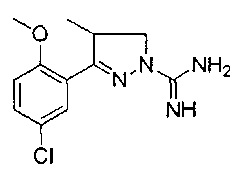
Указанное соединение получали способом, описанным в примере 45.
Выход: 520 мг (27%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,05 (d, 3Н), 3,51 (dd, 1Н), 3,85 (s, 3Н), 3,88 (m, 1Н), 4,00 (t, 1Н), 7,1-7,7 (шир. s, 3Н), 7,15 (d, 1Н), 7,45 (d, 1Н), 7,79 (d, 1Н).
Пример 52
3-(5-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его бромистоводородная соль
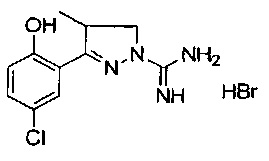
Указанное соединение получали способом, описанным в примере 46.
Выход: 90 мг (38%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,16 (d, 3Н), 3,66 (dd, 1Н), 4,05-4,22 (m, 2Н), 6,97 (d, 1Н), 7,35 (d, 1Н), 7,77 (s, 4Н), 10,5 (шир. s, 1Н).
Пример 53
3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
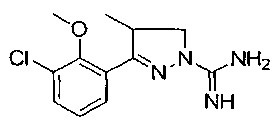
Указанное соединение получали способом, описанным в примере 45.
Выход: 520 мг (54%).
1Н ЯМР (COCl3, 400 МГц) δ: 1,17 (d, 3Н), 3,71 (dd, 1Н), 3,82 (s, 3Н), 3,92 (m, 1H),4,24 (t, 1Н), 5,25 (s, 3Н), 7,10 (t, 1H), 7,44 (dd, 1H), 7,51 (dd, 1H).
Пример 54
3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его бромистоводородная соль
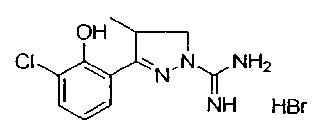
Указанное соединение получали способом, описанным в примере 46.
Выход: 135 мг(36%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,21 (d, 3Н), 3,77 (dd, 1Н), 4,05 (t, 1H), 4,13 (m, 1H), 7,02 (t, 1H), 7,59 (m, 2H), 7,90 (s, 4H), 9,89 (s, 1H).
Пример 55
N-(4-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
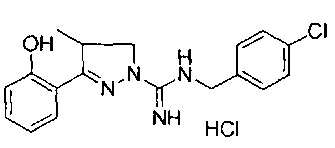
3-(2-гидроксифент)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамид
BBr3 в CH2Cl2 (87 мл, 1М, 87 ммоль) добавляли в течение 30 минут к раствору метил 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамида (7,20 г, 28,9 ммоль) в CH2Cl2 (80 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь охлаждали до температуры 5°С и затем в течение 30 мин добавляли МеОН (80 мл). Смесь концентрировали при пониженном давлении досуха. Затем в указанную смесь повторно добавляли МеОН (100 мл) и смесь концентрировали при пониженном давлении. Остаток перемешивали в МеОН (60 мл) в течение 30 минут с получением суспензии. Твердый материал собирали фильтрованием, промывали холодным МеОН и сушили с получением указанного в заголовке соединения (4,1 г, 60%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,16 (d, 3Н), 3,86-3,97 (m, 2Н), 4,15 (t, 1Н), 6,91 (t, 1Н), 6,95 (d, 1Н), 7,32 (t, 1Н), 7,63 (d, 1Н), 9,75 (s, 1Н).
Метил 3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбимидотиоата гидроиодид
MeI (0,724 г, 5,10 ммоль) добавляли к раствору 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамида (1,00 г, 4,25 ммоль) в МеОН (6 мл). Указанную реакционную смесь перемешивали в закрытом флаконе при температуре 70°С в течение 4 часов и затем оставляли остывать до комнатной температуры с получением суспензии. Добавляли МеОН (6 мл) и указанную смесь перемешивали в течение 10 мин. Твердый материал собирали фильтрованием, промывали холодным МеОН (5 мл) и сушили с получением указанного в заголовке соединения (1,00 г, 64%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,21 (d, 3Н), 2,69 (s, 3Н), 3,79 (dd, 1Н), 4,20-4,33 (m, 2Н), 6,94 (t, 1Н), 6,99 (d, 1Н), 7,40 (t, 1Н), 7,67 (шир. s, 1Н), 10,22 (s, 1Н).
N-(4-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигадро-1Н-пиразол-1-карбоксимидамида гидрохлорид
4-хлорбензиламин (0,156 мг, 1,10 ммоль) добавляли к раствору метил 3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамида гидройодид (0,400 мг, 1,02 ммоль) в МеОН (3 мл). Указанную реакционную смесь перемешивали при кипячении с обратным холодильником в течение 2,5 часов. После охлаждения указанную реакционную смесь распределяли в CH2Cl2 (20 мл) и воде (10 мл) и указанную смесь подщелачивали добавлением KHCO3 (вод., насыщ.). Органическую фазу промывали водой и водную фазу экстрагировали CH2Cl2 (10 мл). Объединенные органические фазы концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2:МеОН:NH3 (водн.), 45:5:1) с получением указанного в заголовке соединения (0,21 г, 61%) в виде стекла. Указанное вещество растворяли в МеОН (2 мл) и добавляли HCl в МеОН (1,75 мл, 0,55 М, 1,0 ммоль) с последующим добавлением EtOAc (10 мл) и Et2O (10 мл) с осаждением HCl-соли, которую собирали фильтрованием, промывали Et2O и сушили с получением указанного в заголовке соединения (0,13 г, 34%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,77 (dd, 1Н), 4,10-4,21 (m, 2Н), 4,59 (s, 2Н), 6.91 (t, 1Н), 7,02 (d, 1Н), 7,34 (t, 1Н), 7,44 (qAB, 4Н), 7,72 (d, 1Н), 8,22 (s, 2Н), 8,79 (s, 1Н), 10,03 (s, 1Н).
Пример 56
N-(2-хлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
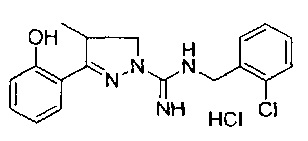
Указанное соединение получали способом, описанным в примере 55. Образование соли при добавлении HCl/МеОН проводили в CH2Cl2 с последующим повторным выпариванием растворителей досуха при пониженном давлении.
Выход: 0,18 г (47%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,21 (d, 3Н), 3,81 (dd, 1Н), 4,13-4,25 (m, 2Н), 4,63 (d, 2Н), 6.92 (t, 1Н), 7,04 (d, 1Н), 7,32-7,43 (m, 4Н), 7,51 (d, 1Н), 8,25 (s, 2Н), 8,68 (t, 1Н), 10,06 (s, 1Н).
Пример 57
N-(2,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
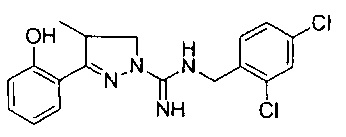
Указанное соединение получали способом, описанным в примере 55, без получения соли.
Выход: 0,183 г (49%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,37 (d, 3Н), 3,80 (m, 1Н), 3,94 (dd, 1Н), 4,02 (t, 1Н), 4,57 (s, 2Н), 6,96 (t, 1Н), 7,03 (d, 1Н), 7,26 (dd, 1Н), 7,30-7,37 (m, 2Н), 7,40 (d, 1Н), 7,58 (d, 1Н).
Пример 58
N-(3,4-дихлорбензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
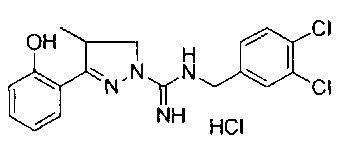
Указанное соединение получали способом, описанным в примере 55.
Выход: 0,17 г (41%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,76 (m, 1Н), 4,10-4,22 (m, 2Н), 4,59 (s, 2Н), 6,92 (t, 1Н), 7,02 (d, 1Н), 7,35 (t, 1Н), 7,41 (d, 1Н), 7,64-7,75 (m, 3Н), 8,22 (s, 2Н), 8,80 (s, 1Н), 10,02 (s, 1H).
Пример 59
3-(2-гидроксифенил)-N-(4-метоксибензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
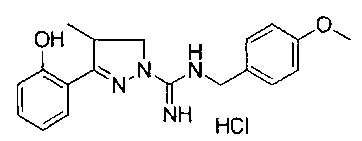
Указанное соединение получали способом, описанным в примере 55.
Выход: 0,11 г (29%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,32 (d, 3Н), 3,74-3,80 (m, 1Н), 3,79 (s, 3Н), 4,12 (t, 1Н), 4,23 (m, 1Н), 4,52 (s, 2Н), 6,90-7,00 (m, 4Н), 7,28-7,40 (m, 3Н), 7,66 (d, 1Н).
Пример 60
N-(3,4-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

Указанное соединение получали способом, описанным в примере 56.
Выход: 0,25 г (62%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,18 (d, 3Н), 3,73 (s, 3Н), 3,73-3,78 (m, 1Н), 3,76 (s, 3Н), 4,09-4,20 (m, 2Н), 4,48 (d, 2Н), 6,89-6,95 (m, 3Н), 7,01 (d, 1Н), 7,07 (s, 1Н), 7,34 (t, 1Н), 7,71 (d, 1Н), 8,14 (s, 2Н), 8,68 (t, 1Н), 9,99 (s, 1Н).
Пример 61
N-(3,5-диметоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
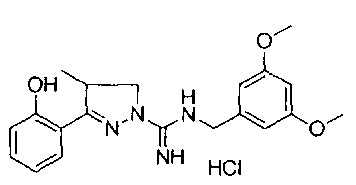
Указанное соединение получали способом, описанным в примере 56.
Выход: 0,24 г (60%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,70-3,80 (m, 1Н), 3,74 (s, 6Н), 4,10-4,20 (m, 2Н), 4,50 (d, 2Н), 6,44 (s, 1Н), 6,58 (s, 2Н), 6,92 (t, 1Н), 7,01 (d, 1Н), 7,34 (t, 1Н), 7,71 (d, 1Н), 8,14 (s, 2Н), 8,71 (t, 1Н), 9,98 (s, 1Н).
Пример 62
N-(3-хлор-4-метоксибензил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
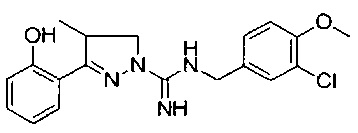
Указанное соединение получали способом, описанным в примере 55, без получения соли.
Выход: 0,20 г (54%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,34 (d, 3Н), 3,80 (m, 1Н), 3,92 (d, 1Н), 4,03 (t, 1Н), 4,47 (s, 2Н), 6,88 (d, 1Н), 6,94 (t, 1Н), 7,00 (d, 1Н), 7,25-7,35 (m, 3Н), 7,41 (s, 1Н).
Пример 63
3-(2-гидроксифенил)-4-метил-N-((R)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
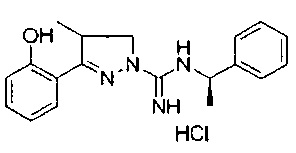
Указанное соединение получали способом, описанным в примере 56.
Выход: 0,040 г (11%).
1Н ЯМР (CDCl3, 400 МГц) δ: (диасмереом. смесь, 1:1) 1,23 и 1,35 (шир. s и d, 3Н), 1,71 (d, 3Н), 1,87 (шир. s, 1Н), 3,88 и 3,96 (2m, 1Н), 4,20-4,43 (m, 2Н), 5,35-5,49 (m, 1Н), 6,95 (t, 1Н), 7,08 (d, 1Н), 7,23-7,40 (m, 5Н), 7,46 (d, 1Н), 7,51 (d, 1Н), 8,29 (шир. s, 2Н), 9,26 и 9,36 (2s, 1Н).
Пример 64
3-(2-гидроксифенил)-4-метил-N-((S)-1-фенилэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
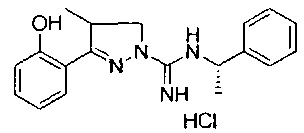
Указанное соединение получали способом, описанным в примере 56.
Выход: 0,036 г (10%).
1Н ЯМР (CD3OD, 400 МГц) δ: (диасмереом. смесь, 1:1) 1,32 (d, 3Н), 1,66 и 1,66 (2d, 3Н), 3,80 (m, 1Н), 4,14 (t, 1Н), 4,23 (m, 1Н), 4,93 (m, 1Н), 6,93-6,99 (m, 2Н), 7,28-7,46 (m, 6Н), 7,67 (d, 1Н).
Пример 65
3-(2-гидроксифенил)-4-метил-N-фенилэтил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
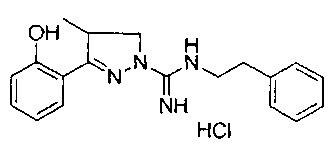
Указанное соединение получали способом, описанным в примере 56.
Выход: 0,105 г (29%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,17 (d, 3Н), 2,89 (t, 2Н), 3,55 (m, 2Н), 3,73 (m, 1Н), 4,03-4,19 (m, 2Н), 6,92 (t, 1Н), 7,04 (d, 1Н), 7,23 (m, 1Н), 7,27-7,37 (m, 5Н), 7,71 (d, 1Н), 8,18 (s, 2Н), 8,26 (t, 1Н), 10,04 (s, 1Н).
Пример 66
3-(2,4-диметоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
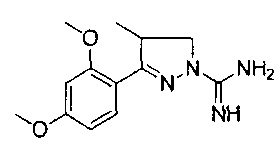
Указанное соединение получали способом, описанным в примере 45.
Выход: 1,10 г (69%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,14 (d, 3Н), 3,66 (dd, 1Н), 3,84 (s, 3Н), 3,84 (s, 3Н), 3,99 (m, 1Н), 4,16 (t, 1Н), 5,69 (s, 3Н), 6,47 (d, 1Н), 6,52 (dd, 1Н), 7,60 (d, 1Н).
Пример 67
3-(2,4-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его бромистоводородная соль
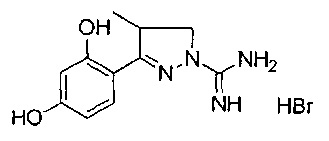
Указанное соединение получали способом, описанным в примере 46, с применением 8 экв. BBr3. Неочищенный продукт очищали колоночной хроматографией на колонке с силикагелем (EtOAc:МеОН:АсОН, 80:20:1) и затем перекристаллизовывали из EtOH (абс).
Выход: 47 мг(12%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,34 (d, 3Н), 3,74 (dd, 1Н), 4,01 (t, 1Н), 4,11 (m, 1Н), 6,39 (s, 1Н), 6,43 (d, 1Н), 7,45 (d, 1Н).
Пример 68
3-(2-метокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
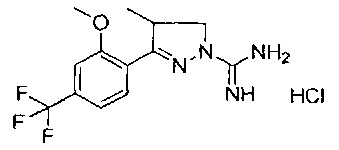
Указанное соединение получали способом, описанным в примере 45, и выделяли в виде HCl-соли без свободного основания.
Выход: 0,34 г (36%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,10 (d, 3Н), 3,66 (dd, 1Н), 3,96 (s, 3Н), 4,11 (m, 1Н), 4,22 (t, 1Н), 7,41 (d, 1Н), 7,46 (s, 1Н), 7,94 (s, 4Н), 7,99 (d, 1Н).
Пример 69
3-(2-гидрокси-4-(трифторметил)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
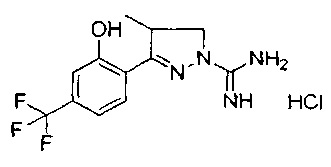
Указанное соединение получали способом, описанным в примере 46.
Выход: 0,22 г (53%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,17 (d, 3Н), 3,69 (m, 1Н), 4,10-4,23 (m, 2Н), 7,26 (d, 1Н), 7,28 (s, 1Н), 7,79 (s, 4Н), 7,95 (d, 1Н), 10,63 (s, 1Н).
Пример 70
3-(1Н-индол-3-ил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

Указанное соединение получали из 1-(1Н-индол-3-ил)-2-метилпроп-2-ен-1-она способом, описанным в примере 23.
Выход: 0,23 г (36%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,33 (d, 3Н), 3,72 (d, 1Н), 3,90-4,02 (m, 2Н), 7,14 (t, 1Н), 7,21 (t, 1Н), 7,46 (d, 1Н), 7,87 (s, 4Н), 8,03 (s, 1Н), 8,37 (d, 1Н), 11,99 (s, 1Н).
Пример 71
4-метил-3-(хинолин-4-ил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
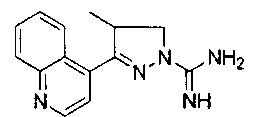
Указанное соединение получали из 2-метил-1-(хинолин-4-ил)проп-2-ен-1-она способом, описанным в примере 23. После завершения реакции указанную реакционную смесь концентрировали при пониженном давлении, и остаток перемешивали с CH2Cl2 (25 мл) в течение 5 мин. Продукт выделяли фильтрованием и концентрированием фильтрата при пониженном давлении с последующей кристаллизацией из EtOAc (20 мл). Кристаллы собирали фильтрованием, промывали Et2O и сушили с получением указанного в заголовке соединения (0,29 мг, 56%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,34 (d, 3Н), 3,63 (m, 1H), 3,90 (dd, 1H), 4,04(t, 1Н), 6,48 (шир. s, 1Н), 7,30 (m, 2H), 7,45 (d, 1H), 7,51 (m, 1H), 8,19 (d, 1H), 8,75 (шир. s, 1H), 9,06 (s, 1H).
Пример 72
(S)*-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
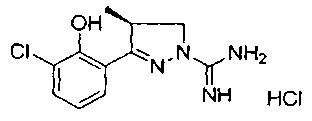
Пример 73
(R)*-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
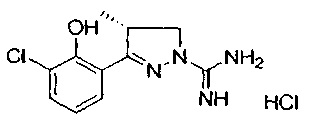
Энантиомеры отделяли и очищали с помощью СФХ (сверхкритическая флюидная хроматография) с использованием колонки Amy-С (20 мм × 250 мм, 5 мкм) с EtOH/СО2 (40%) в качестве элюента (NH3 0,1% добавляли в качестве модификатора) со скоростью потока, составляющей 50 мл/мин, и с УФ-детектированием при длине волны 215 нм.
Рацемат HBr-соли (154 мг) растворяли в метаноле (50 мг/мл) и вводили в объеме по 0,4 мл (20 мг). Объединенные фракции каждого энантиомера (изомер-1 на 2,47 мин и изомер-2 при 3,05 мин) концентрировали при пониженном давлении и затем повторно растворяли в EtOH. HCl-соль каждого энантиомера осаждали добавлением насыщенного раствора HCl в EtOH с последующим выпариванием растворителя и сушкой в вакуумной печи при температуре 40°С с получением указанного в заголовке продукта.
Окончательный хиральный анализ проводили при помощи СФХ (колонка Amy-С, 4,6 мм × 250 мм, 5 мкм). В качестве элюента применяли EtOH/СО2 (40%) (NH3 0,1% добавляли в качестве модификатора) со скоростью потока, составляющей 4 мл/мин.
Химическую чистоту определяли с помощью ВЭЖХ (С 18, вода/MeCN, 0,1% ТФК).
Для изомера 1:
(S)* - конфигурация (на основании биологической активности и абсолютной конфигурации в Примере 37);
Выход 62 мг;
Хим. чистота (240 нм): 99,3%;
Энантиомерный избыток: 97,2.
Для изомера 2:
(R)* - конфигурация (на основании биологической активности и абсолютной конфигурации в Примере 38);
Выход 65 мг;
Хим. чистота (240 нм): 99,4%;
Энантиомерный избыток: 98,8.
Пример 74
N-бензил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
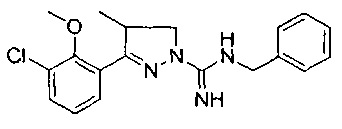
Указанное соединение получали по существу теми же способами, что описаны в примере 39 и примере 41.
1-(3-хлор-2-метоксифенил)-3-(диметиламино)-2-метилпропан-1-он
Исходный материал 1-(3-хлор-2-метоксифенил)пропан-1-он см. в DE 102005014089 А1.
Выход: 45,3 г (68%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,16 (d, 3Н), 2,20 (s, 6Н), 2,28 (dd, 1Н), 2,70 (dd, 1Н), 3,54 (m, 1Н), 3,88 (s, 3Н), 7,11 (t, 1Н), 7,35 (dd, 1Н), 7,48 (dd, 1Н).
3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карботиоамид
Выход: 27,5 г (99%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,18 (d, 3Н), 3,83 (s, 3Н), 3,89 (m, 1Н), 3,99 (dd, 1Н), 4,52 (dd, 1Н), 7,12 (t, 1Н), 7,48 (dd, 1Н), 7,50 (dd, 1Н).
Метил 3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбимидотиоата гидроиодид
Выход: 33,0 г (80%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,14 (d, 3Н), 2,64 (s, 3Н), 3,83 (s, 3Н), 3,73-3,88 (m, 1Н), 3,83 (s, 3Н), 4,17 (m, 1Н), 4,39 (t, 1Н), 7,32 (t, 1Н), 7,58-7,82 (m, 2Н), 9,1-9,7 (2 шир. s, 2Н).
N-бенил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Выход: 2,80 г (77%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,17 (d, 3Н), 3,74 (dd, 1Н),3,81 (s, 3Н), 3,86 (m, 1H), 4,22(t, 1Н), 4,48 (s, 2Н), 7,08 (t, 1Н), 7,28 (tt, 1Н), 7,32-7,43 (m, 5Н), 7,49 (dd, 1Н).
Пример 75
N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
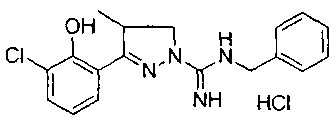
Указанное вещество получали способом, описанным в примере 40, с последующим осаждением соли HCl.
Выход: 1,20 г (40%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 1,22 (d, 3Н), 3,89 (m, 1Н), 4,08-4,20 (m, 2Н), 4,62 (s, 2Н), 7,01 (t, 1Н), 7,31 (m, 1Н), 7,36-7,43 (m, 4Н), 7,55-7,63 (m, 2Н).
Пример 76
(R)*-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
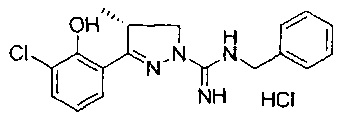
и
Пример 77
(S)*-N-бензил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
Энантиомеры отделяли и очищали с помощью СФХ (сверхкритическая флюидная хроматография) с использованием колонки Amy-С (20 мм × 250 мм, 5 мкм) с EtOH/CO2 (40%) в качестве элюента (NH3 0,1% добавляли в качестве модификатора) со скоростью потока, составляющей 50 мл/мин, и с УФ-детектированием при длине волны 210 нм.
Рацемат HCl-соли (1,00 г) растворяли в метаноле (27 мг/мл) и вводили в объеме по 0,3 мл (8 мг). Объединенные фракции каждого энантиомера (изомер-1 на 1,82 мин и изомер-2 при 2,38 мин) концентрировали при пониженном давлении и затем повторно растворяли в EtOH. HCl-соль каждого энантиомера осаждали добавлением насыщенного раствора HCl в EtOH с последующим выпариванием растворителя и сушкой в вакуумной печи при температуре 40°С с получением указанного в заголовке продукта.
Окончательный хиральный анализ проводили при помощи СФХ (колонка Amy-С, 4,6 мм × 250 мм, 5 мкм). В качестве элюента применяли EtOH/СО2 (35%) (NH3 0,1% добавляли в качестве модификатора) со скоростью потока, составляющей 4 мл/мин.
Химическую чистоту определяли с помощью ВЭЖХ (С 18, вода/MeCN, 0,1% ТФК).
Для изомера 1:
(R)* - конфигурация (на основании биологической активности и абсолютной конфигурации в Примере 38);
Выход 404 мг;
Хим. чистота (240 нм): 98,3%;
Энантиомерный избыток: >95.
Для изомера 2:
(S)* - конфигурация (на основании биологической активности и абсолютной конфигурации в Примере 37);
Выход 364 мг;
Хим. чистота (240 нм): 99,4%;
Энантиомерный избыток: 99,6.
Следующие соединения (примеры 78-91) получали способами, описанными в примере 74, с применением соответствующих аминов или анилина в качестве нуклеофилов. Деметилирование с получением фенольных производных осуществляли с применением способа, описанного в примере 40, необязательно с последующим осаждением HCl-солей.
Пример 78
N-бутил-3-(3-хлор-2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид. в качестве примера приведена его хлористоводородная соль
Выход: 0,34 г (81%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 0,90 (t, 3Н), 1,10 (d, 3Н), 1,33 (m, 2Н), 1,52 (m, 2Н), 3,29 (t, 2Н), 3,72 (dd, 1Н), 3,79 (s, 3Н), 4,02 (m, 1Н), 4,27 (t, 1Н), 7,27 (t, 1Н), 7,66 (dd, 1Н), 7,78 (dd, 1H), 8,14 (s, 3Н).
Пример 79
N-бутил-3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
Выход: 0,13 г (40%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,99 (t, 3Н), 1,24 (d, 3Н), 1,43 (m, 2Н), 1,64 (m, 2Н), 3,3 (t, 2Н, в пике растворителя), 3,62 (dd, 1Н), 4,02 (t, 1Н), 4,31 (m, 1Н), 6,45 (t, 1Н), 7,28 (d, 1Н), 7,36 (d, 1H).
Пример 80
3-(3-хлор-2-метоксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Выход: 0,30 г (91%).
1Н ЯМР (CDCl3, 400 МГц) δ: 0,89 (t, 3Н), 1,24 (d, 3Н), 1,26-1,38 (m, 4Н), 1,43 (m, 2Н), 1,65-1,84 (m, 2Н), 3,63 (q, 2Н), 3,85 (s, 3Н), 4,05-4,16 (m, 2Н), 4,71 (t, 1Н), 6,32 (шир. s, 1Н), 7,15 (t, 1Н), 7,51 (шир. d, 1Н), 7,52 (dd, 1Н), 7,72 (шир. s, 2 Н).
Пример 81
3-(3-хлор-2-гидроксифенил)-N-гексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
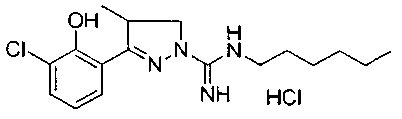
Выход: 82 мг (30%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,93 (t, 3Н), 1,26 (d, 3Н), 1,32-1,46 (m, 6Н), 1,66 (m, 2Н), 3,31 (t, 2Н, в пике растворителя), 3,66 (dd, 1Н), 4,04 (t, 1Н), 4,28 (m, 1Н), 6,58 (t, 1Н), 7,33 (d, 1Н), 7,41 (d, 1Н).
Пример 82
3-(3-хлор-2-метоксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
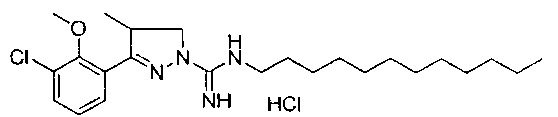
Выход: 0,31 г (70%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,90 (t, 3Н), 1,21 (d, 3Н), 1,23-1,45 (m, 18Н), 1,67 (m, 2Н), 3,34 (t, 2Н, частично в пике растворителя), 3,71 (dd, 1Н), 3,86 (s, 3Н), 4,15 (m, 1Н), 4,27 (t, 1Н), 7,22(t, 1Н), 7,59 (d, 1Н), 7,71 (d, 1Н).
Пример 83
3-(3-хлор-2-гидроксифенил)-N-додецил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
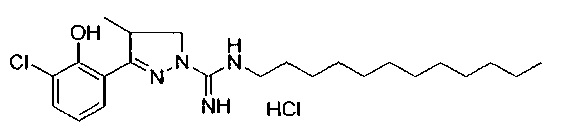
Выход: 135 мг(40%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,90 (t, 3Н), 1,21 (d, 3Н), 1,22-1,45 (m, 18Н), 1,65 (m, 2Н), 3,28 (t, 2Н, частично в пике растворителя), 3,57 (dd, 1Н), 4,00 (t, 1Н), 4,35 (m, 1Н), 6,32 (t, 1Н), 7,23 (d, 1Н), 7,30 (d, 1Н).
Пример 84
3-(3-хлор-2-метоксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида

Выход: 0,16 г (44%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,10-1,35 (m, 3Н), 1,17 (d, 3Н), 1,50 (m, 2Н), 1,64 (m, 1Н), 1,73 (m, 2H), 2,06 (t, 2H), 3,75 (m, 1H), 3,31-3,95 (m, 2H), 3,83 (s, 3Н), 4,39 (t, 1H), 7,11 (t, 1H), 7,45 (dd, 1H), 7,49 (dd, 1H).
Пример 85
3-(3-хлор-2-гидроксифенил)-N-циклогексил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
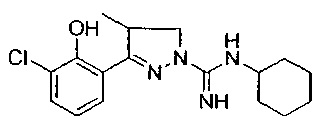
Выход: 90 мг (59%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,18-1,30 (m, 1Н), 1,23 (d, 3Н), 1,42 (m,4Н), 1,69 (m, 1Н), 1,83 (m, 2Н), 1,98 (m, 2Н), 3,47 (m, 1Н), 3,62 (dd, 1Н), 4,01 (t, 1Н), 4,29 (m, 1Н), 6,42 (t, 1Н), 7,27 (d, 1Н), 7,32 (d, 1Н).
Пример 86
3-(3-хлор-2-метоксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
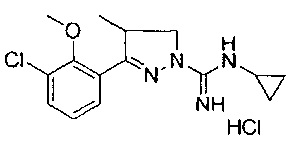
Выход: 0,35 г (87%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,78 (m, 2Н), 0,95 (m, 2Н), 1,20 (d, 3Н), 2,65 (m, 1Н), 3,67 (dd, 1Н), 3,85 (s, 3Н), 4,14 (m, 1Н), 4,25 (dd, 1Н), 7,22 (t, 1Н), 7,58 (dd, 1Н), 7,70 (dd, 1Н).
Пример 87
3-(3-хлор-2-гидроксифенил)-N-циклопропил-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
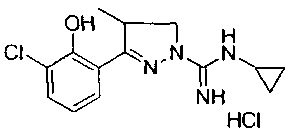
Выход: 65 мг (20%).
1Н ЯМР (CD3OD, 400 МГц) δ: 0,76 (m, 2Н), 0,93 (m, 2Н), 1,25 (d, 3Н), 2,62 (m, 1Н), 3,62 (dd, 1Н), 4,00 (t, 1Н), 4,26 (m, 1Н), 6,56 (t, 1Н), 7,33 (dd, 1Н), 7,39 (dd, 1Н).
Пример 88
3-(3-хлор-2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
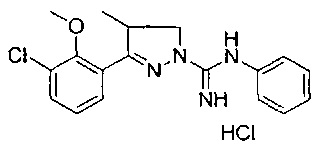
Выход: 30 мг (28%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,26 (d, 3Н), 3,84 (dd, 1H), 3,89 (s, 3Н), 4,23 (m, 1Н), 4,41 (t, 1H), 7,24 (t, 1H), 7,37-7,44 (m, 3H), 7,52 (t, 2H), 7,61 (d, 1H), 7,76 (d, 1H).
Пример 89
3-(3-хлор-2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
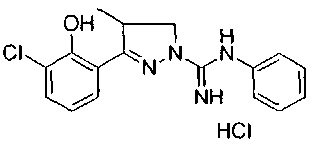
Выход: 80 мг (37%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,37 (d, 3Н), 3,90 (dd, 1Н), 4,22 (m, 2Н), 6,93 (t, 1Н), 7,33-7,40 (m, 3Н), 7,46-7,53 (m, 3Н), 7,59 (d, 1Н).
Пример 90
3-(3-хлор-2-метоксифенил)-N-циано-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
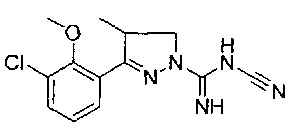
Выход: 105 мг(36%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,06 (d, 3Н), 3,57 (dd, 1Н), 3,78 (s, 3Н), 3,86 (m, 1Н), 4,10 (t, 1Н), 7,23 (t, 1H), 7,53 (s, 2Н), 7,61 (dd, 1Н), 7,80 (dd, 1Н).
Пример 91
3-(3-хлор-2-гидроксифенил)-N-циано-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид

Выход: 0,13 г (18%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,17 (d, 3Н), 3,67 (m, 1Н), 3,85-3,96 (m, 2Н), 6,98 (t, 1Н), 7,51-7,57 (m, 2Н), 7,96 (s, 2Н), 9,97 (s, 1Н).
Пример 92
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

N-((2,2,3,3,4,4,4-гептафторбутил)карбамотиоил)беизамид
Раствор бензоилизотиоцианата (2,63 г, 16,1 ммоль) в ацетоне (5 мл) добавляли к раствору 2,2,3,3,4,4,4-гептафторбутиламина (3,20 г, 16,1 ммоль) в ацетоне (45 мл). После перемешивания при температуре 50°С в течение 8 часов указанную реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (5,9 г, колич.).
1Н ЯМР (CDCl3, 400 МГц) δ: 4,59 (dt, 2Н), 7,55 (t, 2Н), 7,67 (t, 1H), 7,87 (d, 2Н), 9,15 (s, 1Н), 11,19(s, 1Н).
1-(2,2,3,3,4,4,4-гептафторбутил)тиомочевина
Раствор водн. NaOH (16,2 мл, 2 М) добавляли к раствору N-((2,2,3,3,4,4,4-гептафторбутил)карбамотиоил)бензамида (5,83 г, 16,1 ммоль) в МеОН (40 мл). Реакционную смесь перемешивали при температуре 65°С в течение 3 часов. После охлаждения указанную реакционную смесь нейтрализовывали водным раствором HCl (конц., 2,7 мл) и концентрировали при пониженном давлении до примерно половины объема. Полученные кристаллы собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (1,40 г, 34%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 4,50 (шир. t, 2Н), 7,23 (шир. s, 1Н), 7,82 (шир. s, 1Н), 8,01 (t, 1Н).
1-(2,2,3,3,4,4,4-Гетпафторбутил)-2-метилизотиоурония иодид
Раствор 1-(2,2,3,3,4,4-гептафторбутил)тиомочевины (1,40 г, 5,42 ммоль) и MeI (1,53 г, 10,8 ммоль) в МеОН (10 мл) перемешивали при температуре 70°С в закрытом флаконе в течение 4 часов. После охлаждения указанную реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества коричневого цвета (2,17 г, колич.).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 2,66 (s, 3Н), 4,43 (t, 2Н), 9,50 (шир. s, 1Н), 9,75 (шир. s, 1Н), 10,07 (шир. s, 1Н).
((2,2,3,3,4,4,4-гептафторбутил)амино)(гидразинил)метаниминия иодид
Раствор иодида 1-(2,2,3,3,4,4,4-гептафторбутил)-2-метилизотиоурония (2,17 г, 5,42 ммоль) и гидразингидрата (0,407 г, 8,13 ммоль) в МеОН (20 мл) перемешивали при температуре кипения с обратным холодильником в течение 3 часов. После охлаждения указанную реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде коричневого масла, которое застывало при выдерживании (2,10 г, колич.).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 4,19 (t, 2Н), 6,20 (шир. s, 6Н).
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид
NaOH (водн. 50%, 0,7 мл, около 13 ммоль) добавляли к раствору иодида ((2,2,3,3,4,4-гептафторбутил)амино)(гидразинил)метанимимида (650 мг, 1,69 ммоль) и 3-(диметиламино)-1-(2-метоксифенил)-2-метилпропан-1-он (375 мг, 1,69 ммоль) в МеОН (20 мл). Указанную реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 3 ч и затем концентрировали при пониженном давлении. Остаток распределяли в воде и CH2Cl2. Органическую фазу промывали водой и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl-MeOH-NH3 160:10:1) с получением основания указанного в заголовке соединения в виде масла желтого цвета (240 мг, 34%). Указанный остаток растворяли в EtOAc (5 мл) и HCl-соль осаждали добавлением 2М HCl/Et2O, собирали фильтрованием и сушили с получением указанного в заголовке соединения (230 мг, 30%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 1,11 (d, 3Н), 3,72 (dd, 1Н), 3,87 (s, 3Н), 4,13 (m, 1Н), 4,29 (t, 1H), 4,41 (t, 2Н), 7,06 (t, 1Н), 7,18 (d, 1Н), 7,52 (dt, 1Н), 7,80 (dd, 1Н), 8,55-8,70 (2 шир. s, 3Н).
Пример 93
N-(2,2,3,3,4,4,4-гептафторбутил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
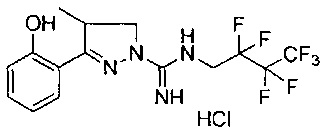
Указанное вещество получали способом, описанным в примере 40, с последующим осаждением HCl-соли.
Выход: 140 мг (72%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,75 (m, 1Н), 4,13-4,23 (m, 2Н), 4,37 (dq, 2Н), 6,93 (t, 1Н), 7,02 (d, 1Н), 7,36 (dt, 1Н), 7,72 (dd, 1Н), 8,55 (шир. s, 2Н), 8,63 (шир. s, 1Н), 10,09 (s, 1H).
Пример 94
3-(2-метоксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
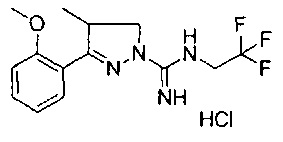
Указанное соединение получали способами, описанными в примере 92, с применением 2,2,2-трифторэтанамина в качестве исходного материала.
Выход: 0,67 г (49%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 1,11 (d, 3H),3,71(dd, 1Н), 3,87 (s, 3Н), 4,12 (m, 1H), 4,23-4,37 (m, 3H), 7,05 (t, 1H), 7,17 (d, 1H), 7,51 (dt, 1H), 7,82 (dd, 1H), 8,60 (s, 2H), 8,72 (s, 1H).
Пример 95
3-(2-гидроксифенил)-4-метил-N-(2,2,2-трифторэтил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
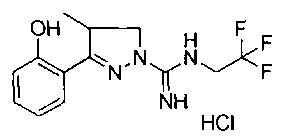
Указанное вещество получали способом, описанным в примере 40, с последующим осаждением HCl-соли.
Выход: 180 мг (69%).
1Н ЯМР (CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,76 (m, 1Н), 4,12-4,23 (m, 2Н), 4,30 (q, 2Н), 6,92 (t, 1Н), 7,03 (d, 1H), 7,35 (dt, 1H), 7,73 (dd, 1H), 8,54 (s, 2H), 8,75 (s, 1H), 10,09 (s, 1H).
Пример 96
3-(2-метоксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
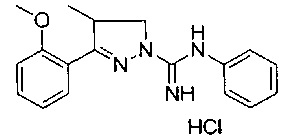
Указанное соединение получали способами, описанными в примере 92, с применением анилина в качестве исходного материала.
Выход: 0,34 г (41%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,15 (d, 3Н), 3,83 (m, 1Н), 3,88 (s, 3Н), 4,15 (m, 1Н), 4,36 (t, 1Н), 7,05 (t, 1Н), 7,19 (d, 1Н), 7,32-7,38 (m, 3Н), 7,46-7,54 (m, 3Н), 7,89 (dd, 1Н), 8,06 (s, 2Н), 10,06 (s, 1Н).
Пример 97
3-(2-гидроксифенил)-4-метил-N-фенил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
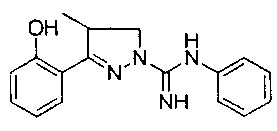
Указанное соединение получали способом, описанным в примере 40.
Выход: 0,13 г (58%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,40 (d, 3Н), 3,78 (m, 1Н), 3,92 (dd, 1Н), 4,06 (t, 1Н), 4,73 (шир. s, 2Н), 6,94-7,07 (m, 5Н), 7,29-7,37 (m, 4Н), 10,00 (шир. s, 1Н).
Пример 98
3-(2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
Указанное соединение получали способами, описанными в примере 92, с применением 4-(трифторметил)анилина в качестве исходного материала.
Выход: 0,14 г (24%).
1H ЯМР ((CD3)2SO, 400МГц) δ: 1,15 (d, 3Н), 3,83-3,94 (m, 1H),3,89 (s, 3Н), 4,16 (m, 1H), 4,41 (шир. t, 1Н), 7,05 (t, 1H), 7,19 (d, 1H), 7,52 (dt, 1H), 7,57 (d, 2H), 7,81-7,88 (m, 3H), 8,37 (s, 2H), 10,43 (шир. s, 1H).
Пример 99
3-(2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

Указанное вещество получали способом, описанным в примере 40, с последующим осаждением HCl-соли.
Выход: 95 мг(41%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,38 (d, 3Н), 3,90 (m, 1Н), 4,24-4,36 (m, 2Н), 6,95-7,00 (m, 2Н), 7,38 (t, 1Н), 7,58 (d, 2Н), 7,71 (d, 1Н), 7,81 (d, 2Н).
Пример 100
N-(4-фторфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
Указанное соединение получали способами, описанными в примере 92, с применением 4-фторанилина в качестве исходного материала.
Выход: 0,16 г (50%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,14 (d, 3Н), 3,83 (m, 1Н), 3,88 (s, 3Н), 4,14 (m, 1Н), 4,36 (t, 1Н), 7,05 (t, 1Н), 7,18 (d, 1Н), 7,32 (t, 2Н), 7,40 (dd, 2Н), 7,51 (dt, 1Н), 7,88 (dd, 1H), 8,03 (s, 2H), 10,09 (s, 1H).
Пример 101
N-(4-фторфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
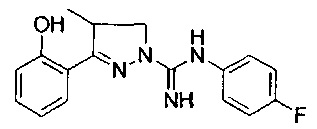
Указанное соединение получали способом, описанным в примере 40.
Выход: 165 мг(56%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,65 (dd, 1Н), 3,79-3,88 (m, 1Н), 3,89 (t, 1Н), 5,89 (s, 2Н), 6,82 (dd, 2Н), 6,92 (t, 1Н), 6,94 (d, 1Н), 7,04 (t, 2Н), 7,27 (dt, 1Н), 7,53 (dd, 1Н), 9,85 (s, 1Н).
Пример 102
N-(4-хлорфенил)-3-(2-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
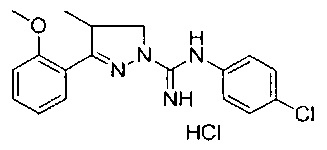
Указанное соединение получали способами, описанными в примере 92, с применением 4-хлоранилина в качестве исходного материала.
Выход: 0,25 г (43%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,14 (d, 3Н), 3,85 (m, 1Н), 3,88 (s, 3Н), 4,15 (m, 1Н), 4,36 (t, 1Н), 7,05 (t, 1Н), 7,18 (d, 1Н), 7,38 (d, 2Н), 7,48-7,56 (m, 3Н), 7,87 (dd, 1Н), 8,12 (s, 2Н), 10,15 (s, 1H).
Пример 103
N-(4-хлорфенил)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
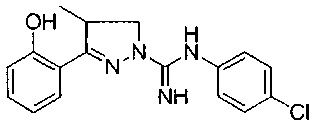
Указанное соединение получали способом, описанным в примере 40.
Выход: 155 мг(77%).
1Н ЯМР ((CD3)2SO, 400 МГц) δ: 1,19 (d, 3Н), 3,65 (dd, 1Н), 3,79-3,88 (m, 1Н), 3,90 (t, 1Н), 6,02 (s, 2Н), 6,84 (d, 2Н), 6,92 (t, 1Н), 6,94 (d, 1Н), 7,25 (d, 2Н), 7,27 (dt, 1Н), 7,54 (dd, 1Н), 9,83 (s, 1Н).
Пример 104
3-(2-(бензилокси)фенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
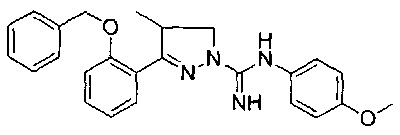
1-(2-(бензилокси)фенил)пропан-1-он
Бензилбромид (68,4 г, 400 ммоль) добавляли к раствору 1-(2-гидроксифенил)пропан-1-она (60,0 г, 400 ммоль) и K2CO3 (111,0 г, 800 ммоль) в ДМФА (400 мл). Указанную реакционную смесь перемешивали при комнатной температуре в течение 20 ч и затем распределяли в Et2O (1 л) и воде (1 л). Органическую фазу промывали водой (2×300 мл), сушили (Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде масла желтого цвета (94,0 г, 98%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,13 (t, 3Н), 3,00 (q, 2Н), 5,17 (s, 2Н), 7,00-7,05 (m, 2Н), 7,33-7,46 (m, 6Н), 7,70 (dd, 1Н).
1-(2-(бензилокси)фенил)-3-(диметиламино)-2-метилпропан-1-он
Указанное соединение получали способами, описанными в примере 1, с применением 1-(2-(бензилокси)фенил)пропан-1-она в качестве исходного материала.
Выход: 39,0 г (66%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,09 (d, 3Н), 2,08 (s, 6Н), 2,31 (dd, 1Н), 2,63 (dd, 1Н), 3,69 (m, 1Н), 5,15 (s, 2Н), 7,00-7,05 (m, 2Н), 7,33-7,46 (m, 6Н), 7,59 (dd, 1Н).
3-(2-(бензилокси)фенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
Указанное соединение получали способами, описанными в примере 92, с применением 4-метоксианилина (с получением гидразинил((4-метоксифенил)амино)метаниминия иодида) и 1-(2-(бензилокси)фенил)-3-(диметиламино)-2-метилпропан-1-она в качестве исходных материалов.
Выход: 0,51 г (45%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,17 (d, 3Н), 3,72 (m, 1Н), 3,80 (s, 3Н), 3,93 (m, 1H), 4,17(t, 1Н), 4,90 (шир. s, 2Н), 5,13 (s, 2Н), 6,87 (d, 2Н), 6,93-7,04 (m, 4Н), 7,34-7,45 (m, 6Н), 7,67 (dd, 1Н).
Пример 105
3-(2-гидроксифенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
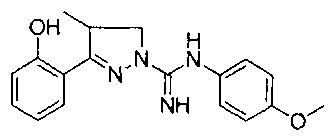
Гидрирование 3-(2-(бензилокси)фенил)-N-(4-метоксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида (480 мг, 1,16 ммоль) в МеОН (25 мл) проводили в атм. Н2 с Pd/C (50 мг, 10%) в качестве катализатора в течение 1 часа (израсходовано 26 мл Н2). Указанную реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,37 г, 98%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,38 (d, 3Н), 3,73-3,85 (m, 1Н), 3,80 (s, 3Н), 3,95 (dd, 1Н), 4,08 (t, 1Н), 6,89 (d, 2Н), 6,93-6,98 (m, 3Н), 7,03 (d, 1Н), 7,31 (dt, 1Н), 7,35 (dd, 1H).
Следующие соединения (примеры 106-117) получали способами, описанными в примере 92, с применением 1-(3-хлор-2-метоксифенил)-3-(диметиламино)-2-метилпропан-1-она и соответствующих производных амина или анилина в качестве исходных материалов. Деметилирование с получением фенольных производных осуществляли с применением способа, описанного в примере 40, необязательно с последующим осаждением HCl-солей.
Пример 106
3-(3-хлор-2-метоксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
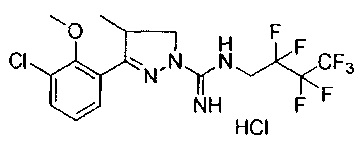
Выход: 0,27 г (38%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,23 (d, 3Н), 3,76 (dd, 1Н), 3,87 (s, 3Н), 4,15-4,38 (m, 4Н), 7,24 (t, 1Н), 7,61 (dd, 1Н), 7,72 (dd, 1Н).
Пример 107
3-(3-хлор-2-гидроксифенил)-N-(2,2,3,3,4,4,4-гептафторбутил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль 
Выход: 0,12 г (51%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,35 (d, 3Н), 3,83 (dd, 1Н), 4,17-4,35 (m, 4Н), 6,99 (t, 1Н), 7,52 (d, 1Н), 7,63 (d, 1Н).
Пример 108
3-(3-хлор-2-метоксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
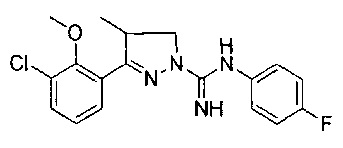
Выход: 0,33 г (42%).
1H ЯМР (CDCl3, 400 МГц) δ: 1,21 (d, 3Н), 3,77 (dd, 1H), 3,86(s, 3Н), 3,88 (m, 1Н),4,25 (t, 1Н), 4,90 (s, 2H), 6,92-7,04 (m, 4H), 7,10 (t, 1H), 7,44 (dd, 1H), 7,54 (dd, 1H).
Пример 109
3-(3-хлор-2-гидроксифенил)-N-(4-фторфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид

Выход: 0,14 г (49%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,39 (d, 3Н), 3,77 (m, 1H), 3,92(dd, 1H), 4,07(t, 1Н), 4,66 (s, 2Н), 6,89-6,95 (m, 3Н), 7,02 (t, 2H), 7,27 (dd, 1H), 7,40 (dd, 1H), 10,64 (s, 1H).
Пример 110
3-(3-хлор-2-метоксифенил)-N-(4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
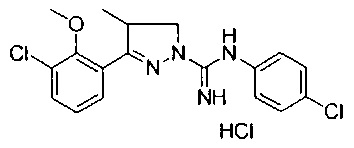
Выход: 197 мг (40%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,26 (d, 3Н), 3,84 (dd, 1Н), 3,89 (s, 3Н), 4,23 (m, 1H), 4,41 (t, 1H), 7,24 (t, 1H), 7,39 (d, 2H), 7,52 (d, 2H), 7,61 (dd, 1H), 7,75 (dd, 1H).
Пример 111
3-(3-хлор-2-гидроксифенил)-N-4-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
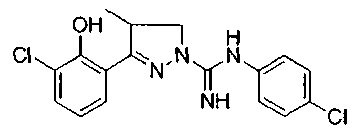
Выход: 0,12 г (74%).
1H ЯМР (CDCl3, 400 МГц) δ: 1,39 (d, 3Н), 3,77 (m, 1Н), 3,91 (dd, 1H), 4,06(t, 1Н),4,67 (s, 2Н), 6,89-6,94 (m, 3Н), 7,26-7,30 (m, 3Н), 7,40 (dd, 1Н), 10,60 (s, 1H).
Пример 112
3-(3-хлор-2-метоксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
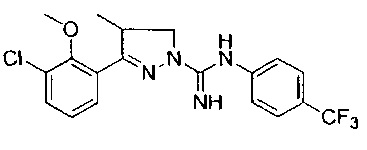
Выход: 0,27 г (27%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,22 (d, 3Н), 3,78 (dd, 1Н), 3,86 (s, 3Н), 3,90 (m, 1Н), 4,27 (t, 1Н), 4,96 (s, 2Н), 7,09 (d, 2Н), 7,11 (t, 1Н), 7,45 (dd, 1Н), 7,54 (dd, 1Н), 7,56 (d, 2Н).
Пример 113
3-(3-хлор-2-гидроксифенил)-4-метил-N-(4-(трифторметил)фенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
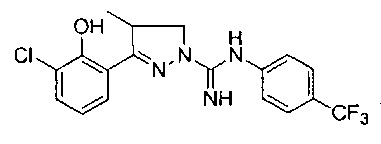
Выход: 0,17 г (72%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,40 (d, 3Н), 3,79 (m, 1Н), 3,94 (dd, 1Н), 4,09 (t, 1Н), 4,75 (шир. s, 2Н), 6,93 (t, 1Н), 7,08 (d, 2Н), 7,29 (dd, 1Н), 7,42 (dd, 1Н), 7,58 (d, 2Н), 10,55 (шир. s, 1Н).
Пример 114
3-(3-хлор-2-метоксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль

Выход: 0,18 г (22%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,27 (d, 3Н), 3,84 (dd, 1Н), 3,90 (s, 3Н), 4,24 (m, 1Н), 4,42 (t, 1Н), 7,24 (t, 1H), 7,45-7,54 (m, 3Н), 7,59-7,66 (m, 2Н), 7,76 (dd, 1Н).
Пример 115
3-(3-хлор-2-гидроксифенил)-N-(2-хлорфенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
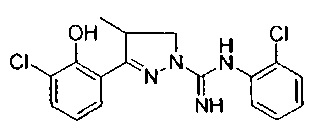
Выход: 80 мг (67%).
1Н ЯМР (CDCl3, 400 МГц) δ: 1,41 (d, 3Н), 3,80 (m, 1Н), 4,00 (dd, 1Н), 4,16 (t, 1Н), 4,67 (шир. s, 2Н), 6,92 (t, 1Н), 7,00 (dt, 1Н), 7,05 (dd, 1Н), 7,23 (dt, 1Н), 7,28 (dd, 1Н), 7,39-7,43 (m, 2Н), 10,58 (шир. s, 1Н).
Пример 116
3-(3-хлор-2-метоксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид, в качестве примера приведена его хлористоводородная соль
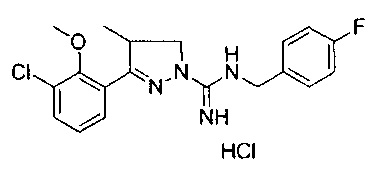
Выход: 0,40 г (49%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,22 (d, 3Н), 3,75 (dd, 1Н), 3,86 (s, 3Н), 4,17 (m, 1Н), 4,32 (dd, 1H), 4,58 (s, 2H), 7,13 (t, 2H), 7,22 (t, 1H), 7,42 (dd, 2H), 7,59 (dd, 1H), 7,72 (dd, 1H).
Пример 117
3-(3-хлор-2-гидроксифенил)-N-(4-фторбензил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамид
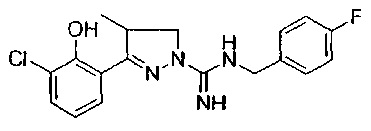
Выход: 0,15 г (51%).
1Н ЯМР (CD3OD, 400 МГц) δ: 1,23 (d, 3Н), 3,63 (dd, 1Н), 4,05 (t, 1Н), 4,35 (m, 1Н), 4,52 (s, 2Н), 6,37 (t, 1Н), 7,11 (t, 2Н), 7,25 (dd, 1Н), 7,34 (dd, 1Н), 7,40 (dd, 2Н).
Пример 118
Этил-((3-(3-хлор-2-((этоксикарбонил)окси)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамат
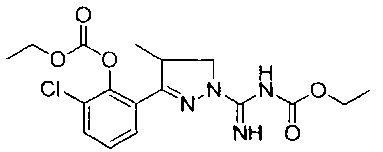
Раствор EtOC(O)Cl (250 мг, 2,31 ммоль) в CH2Cl2 (5 мл) добавляют к раствору 3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидробромида (700 мг, 2,10 ммоль) и NEt3 (470 мг, 4,62 ммоль) в CH2Cl2 (25 мл). Указанную реакционную смесь перемешивали при комнатной температуре в течение ночи и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2, затем CH2Cl2-МеОН 20:1) с получением указанного в заголовке соединения (380 мг, 46%).
1Н ЯМР (CDCl3,400 МГц) δ: 1,24 (d, 3H), 1,33 (t, 3Н), 1,36 (t, 3Н), 3,72 (m, 1H), 3,93(dd, 1Н), 4,12 (t, 1H), 4,15 (q, 2H), 4,33 (q, 2H), 6,60 (s, 1H), 7,30 (t, 1H), 7,45 (dd, 1H), 7,53 (dd, 1H), 8,70 (s, 1H).
Пример 119
Этил-((3-(3-хлор-2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамат
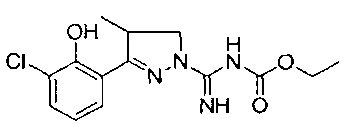
Этил((3-(3-хлор-2-((этоксикарбонил)окси)фенил)-4-метил-4,5-дигидро-1Н-пиразол-1-ил)(имино)метил)карбамат (120 мг, 0,30 ммоль) растворяли в MeONa/MeOH (0,03 М, 10 мл, 0,30 ммоль) и указанную реакционную смесь перемешивали при комнатной температуре в течение ночи. Указанную реакционную смесь нейтрализовывали 2 М HCl/Et2O и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (гептан: EtOAc, 2:1) с получением указанного в заголовке соединения (85 мг, 87%) в виде твердого соединения белого цвета.
1Н ЯМР (CDCl3, 400 МГц) δ: 1,34 (t, 3Н), 1,36 (d, 3Н), 3,79 (m, 1H), 4,03-4,11 (m, 2Н), 4,18 (m, 2Н), 5,96, (шир. s, 1Н), 6,94 (t, 1Н), 7,29 (dd, 1Н), 7,45 (dd, 1Н), 8,91 (шир. s, 1Н), 10,30 (s, 1Н).
Пример 120
5-НТ2В-рецепторное связывание (выполненное в Eurofins Panlabs Taiwan, Ltd.) с белком рецептора человека, экспрессированным в клетках СНО-K1, определяли в анализе смещения лиганда с применением диэтиламида 3Н-лизергиновой кислоты (LSD) в качестве радиолиганда и кетансерина в качестве стандартного эталонного соединения. Данные представлены как % вытеснения радиолиганда при указанных концентрациях соединений, см. таблицу 1 и таблицу 2.
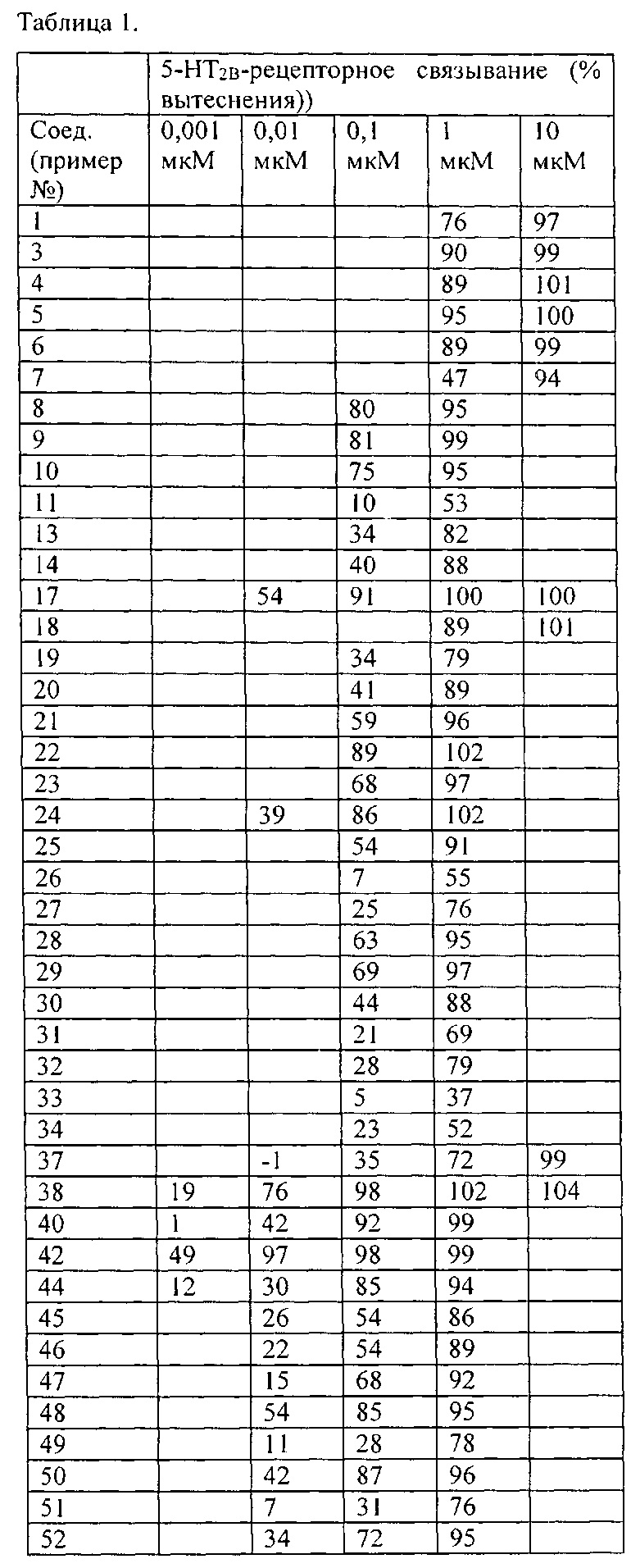
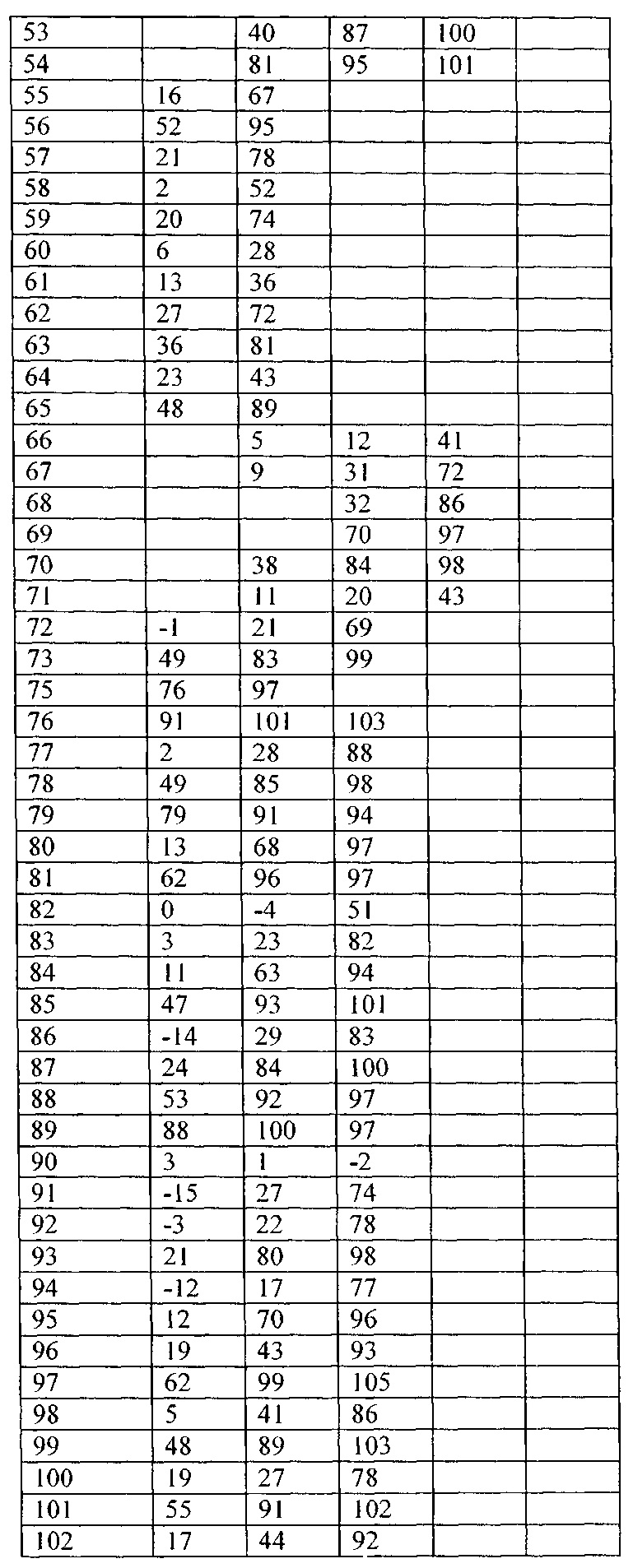

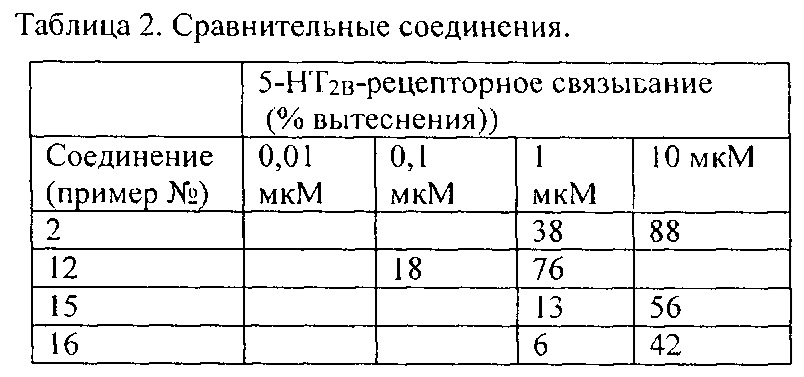
Приведенные результаты показывают явное положительное влияние орто-заместителей в ароматическом кольце на 5-НТ2В-рецепторное связывание.
Пример 121
5-НТ2В-рецепторный антагонизм (выполненный в Eurofins Panlabs Taiwan, Ltd.) определяли в клетках СНО-K1, экспрессирующих белок рецептора человека, в виде ингибирования 5-НТ (5 нМ) стимулированного накопления IP-1, определенное количественно гомогенной флуоресценцией с временным разрешением (HTRF). В качестве стандартного эталонного соединения использовали SB 206553. Антагонистический ответ выражен в виде% ингибирования 5-НТ-индуцированного эффекта.
Приведенные результаты демонстрируют сильные антагонистические эффекты в соответствии с потенциалами связывания рецепторов, см. таблицу 3.
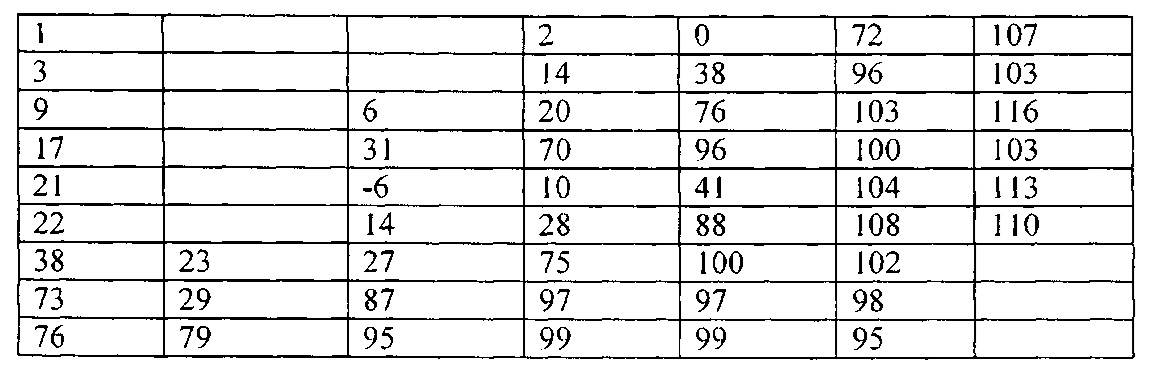
Пример 122
5-НТ2В-рецепторный антагонизм (выполненный в Eurofins Panlabs Taiwan, Ltd.) определяли той же модели, как описано выше в примере 117 без предварительной стимуляции с 5-НТ. Агонистический ответ выражен как % от накопления IP-1, вызванного стимуляцией 5-НТ (1 мкМ).
Приведенные результаты демонстрируют отсутствие антагонистических эффектов всех тестируемых соединений во всех тестируемых концентрациях, см. Таблицу 4.
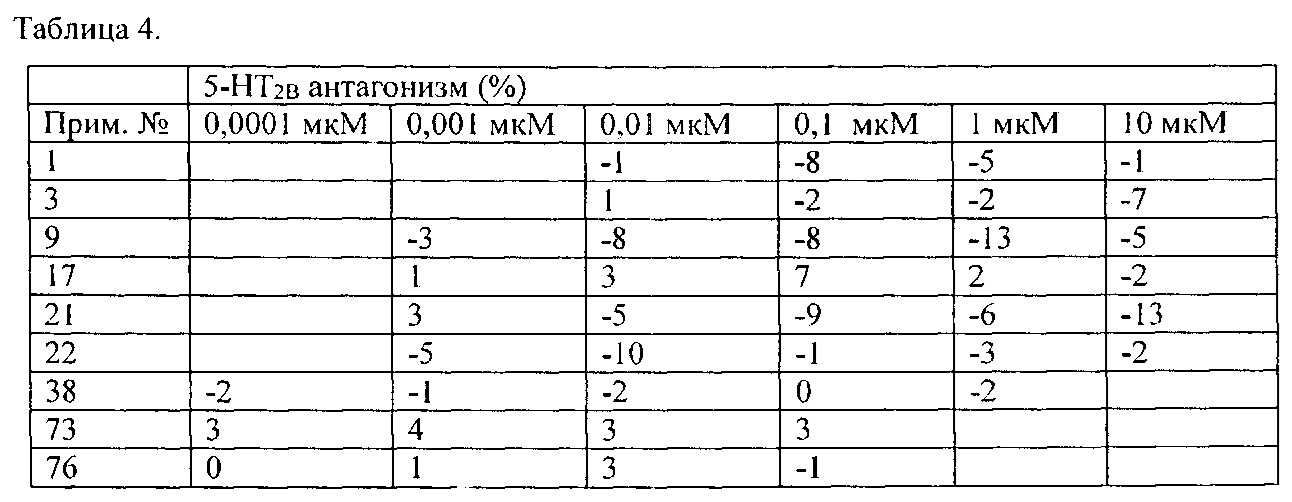
Пример 123
Для определения противовоспалительных свойств соединений in vivo использовали снижение уровней TNF-α в плазме у мышей с индуцированным LPS остром воспалением.
Способ
Мышам (BALB/c, самки, примерно 20 г, 8 мышей в группе) перорально вводили исследуемое соединение (10 или 30 мг/кг в воде) за 30 минут до лечения LPS (10 мкг в солевом растворе, внутрибрюшинно, серотип 055:В5). Альтернативно, исследуемое соединение вводили подкожно в шею (10 или 30 мг/кг в 10% PEG400 в солевом растворе) за 15 мин до введения LPS. Образцы крови собирали через 90 мин после введения LPS и концентрации TNF-α в плазме определяли в дубликатах с помощью ELISA.
Исследуемые соединения
Соединение 1: 3-(2-гидроксифенил)-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид (Пример 3)
Соединение 2: 3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида гидрохлорид (Пример 17)
RS127445: в качестве эталонного соединения (5-НТ2В селективный антагонист)
Результаты
Противовоспалительные эффекты, определяемые как снижение уровня TNF-α в плазме, были продемонстрированы как для соединения 1, так и для соединения 2. Соединение 1, вводимое перорально (оральн.), дозозависимо снижало уровень TNF-α в плазме. Соединение 2 также уменьшало уровень TNF-α при пероральном введении и демонстрировало дозозависимые эффекты при подкожном (подкожн.) введении. По сравнению с эталонным соединением RS127545 соединение 2 показало равные или более высокие противовоспалительные эффекты. Результаты показаны в таблице 5. SEM обозначает стандартное среднее значение ошибки.
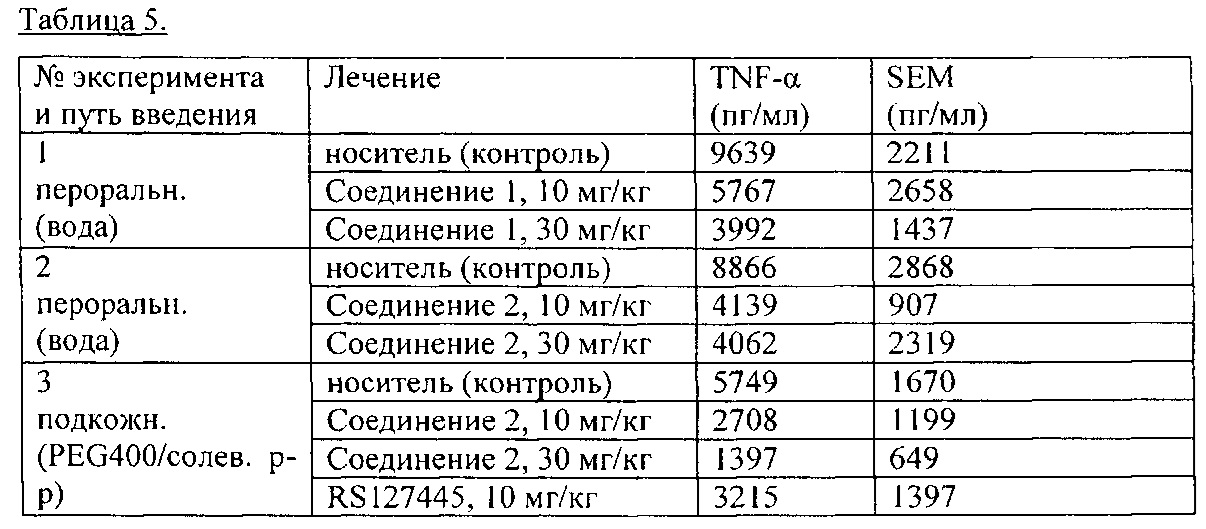
Пример 124
Влияние на выработку коллагена в нормальных фибробластах легких человека.
Нормальные человеческие легочные фибробласты (NHLF, Lonza) культивировали в полной среде FGM-2 (+ FBS) в соответствии с инструкциями производителя. Конфлюэнтные клетки высевали в 24-луночные планшеты для культивирования ткани при 100000 клеток/лунку (4 лунки на каждое состояние) до достижения конфлюэнтности. После того, как клетки стали конфлюэнтными, в течение ночи их выдерживали в условиях сывороточного голодания в бессывороточной среде FGM-2. Через 16 часов бессывороточную среду удаляли и клетки обрабатывали (R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамидом (пример 36, соединение 3) при 1 и 10 мкМ (носитель ddH20). Затем клетки стимулировали 5 мкг/мл рекомбинантного TGF-β1 человека отдельно или в комбинации с 1 мкМ или 10 мкМ 5-НТ. Все соединения для стимулирования были приготовлены в бессывороточной среде FGM-2 (объем 1 мл/лунка). Нестимулированные клетки получали только бессывороточную среду FGM-2. Супернатанты собирали через 48 часов и хранили при температуре -80°С. Выработку коллагена анализировали в супернатантах с использованием С-пептида проколлагена I типа (PIP) ELISA (Takara Bio # MK1010). Жизнеспособность клеток тестировали при помощи анализа LDH (Abcam # Ab102526).
Результаты
Нормальные человеческие легочные фибробласты увеличивали выработку коллагенов при стимуляции при помощи 5 нг/мл TGF-β1 и 5-НТ. Обработка соединением 3 значительно уменьшала выработку коллагенов. Этот результат свидетельствует об антифибротической роли соединения 3. Результаты показаны на фигуре 1.
Пример 125
Антифибротические эффекты в модели вызванного блеомицином легочного фиброза у мышей.
Легочный фиброз индуцировали у самок мышей C57BL/6 путем интратрахеальной инсталляции блеомицина в солевом растворе (50 мкл, 0,5 мг/мл). Лечение было начато в день интратрахеальной инстилляции и продолжалось до 28 дня. Мышам (8 животных на группу) перорально вводили дважды в сутки 25 или 75 мг/кг (R)-3-(2-гидроксифенил)-4-метил-4,5-дигидро-1Н-пиразол-1-карбоксимидамида (Пример 36, соединение 3), растворенного в ddH20. В качестве положительного контроля использовали нинтеданиб (nintedanib) при 30 мг/кг в ddH20 перорально два раза в сутки. В качестве контролен служили мыши, обработанные блеомицином, и обработанные носителем нефиброзные мыши. Животных умерщвляли через 28 дней, а фиброзную область легкого определяли по гистологической оценке участков, окрашенных Сириусом Красным, в соответствии со стандартным протоколом. Содержание коллагена в легочной ткани измеряли с использованием анализа гидроксипролина коллагена, и количество миофибробластов определяли количественно путем окрашивания для α-гладкомышечного актина (α-SMA) в парафиновых срезах.
Результаты
Соединение 3 в дозах 75 мг/кг дважды в сутки и нинтеданиб (nintedanib) в дозах 30 мг/кг дважды в сутки облегчали течение индуцированного блеомицином легочного фиброза и уменьшали фиброзную область (А), ингибировали дифференцировку миофибробластов (В) и уменьшали содержание гидроксипролина (С). Не наблюдалось каких-либо статистически значимых изменений в любом из результатов для соединения 3 в дозах 25 мг/кг дважды в сутки.
n=8 мышей для всех групп. * указывает на значительные изменения с р<0,05 по сравнению с обработанными блеомицином мышами, которым вводили носитель. Результаты показаны на фигуре 2.