Результат интеллектуальной деятельности: КОМПОЗИЦИИ И СПОСОБЫ УМЕНЬШЕНИЯ КОШАЧЬИХ АЛЛЕРГЕНОВ В ОКРУЖАЮЩЕЙ СРЕДЕ
Вид РИД
Изобретение
Перекрестные ссылки на смежные заявки
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №61/918,420, поданной 19 декабря 2013 г., описание которой полностью включено в настоящий документ путем ссылки.
Предпосылки создания изобретения
Область применения изобретения
Изобретение относится по существу к уменьшению или предотвращению аллергий на кошек или их симптомов и, в частности, к композициям и способам уменьшения основного кошачьего аллергена, Fel d 1, в окружающей среде.
Описание области техники
Домашние кошки вырабатывают несколько из наиболее мощных раздражителей, вызывающих аллергическую реакцию, которые воздействуют на людей во всем мире. Степень тяжести симптомов колеблется в диапазоне от небольшого ринита и конъюнктивита до угрожающих жизни астматических реакций. Наиболее известным и мощным аллергеном в кошачьей перхоти является Fel d 1. Fel d 1 вызывает ответы IgE у 90-95% пациентов с аллергией на кошек (van Ree et al., 1999, J. Allergy Clin. Immunol. 104: 1223-1230) и ответственен за 60-90% общей аллергенной активности в кошачьей перхоти (Kleine-Tebbe, et al., 1993 Int. Arch. Allergy Immunol. 100: 256-262).
Были отмечены трехмерные структуры лишь нескольких аллергенов (см. Valenta & Kraft, 2001, Immunol. Rev. 179: 119-127). Биологические функции этих аллергенов разнообразны или неизвестны. Они не имеют какой-либо конкретной биологической или структурной особенности, которая может приводить к тому, что белок действует как аллерген (см. Aalberse, 2000, J. Allergy Clin. Immunol. 106: 228-238). Считается, что на аллергенность влияют структурные особенности белка, которые включают в себя растворимость, стабильность, размер и компактность белка. Эти аспекты отражают зависимость аллергенности от транспорта через барьеры слизистых оболочек и восприимчивости к протеазам (Aalberse, 2000, выше). На аллергенность может также влиять посттрансляционная модификация, например, посредством введения новых эпитопов или изменения растворимости, стабильности, размера, чувствительности к протеазам и/или поглощения и обработки антигенпрезентирующими клетками (Aalberse, 2000, выше). Хотя гликозилирование затрагивает многие из этих процессов, гликозилирование само по себе не является определяющим фактором аллергенности. Многие аллергены являются негликозилированными, в то время как некоторые аллергены являются сильно гликозилированными (Aalberse, 2000, выше). В результате этого для определения основы аллергенности может потребоваться подробное структурное исследование аллергена, и даже после этого можно не получить окончательных результатов.
Fel d 1 представляет собой тетрамерный гликопротеин, образованный двумя гетеродимерами с массой 35 кДа. Каждый димер с массой 18 кДа состоит из двух ковалентно связанных цепей, полученных из двух независимых генов, цепи 1, содержащей 70 остатков, и цепи 2 (у которой есть две изоформы), содержащей 90 или 92 остатка. Была установлена трехмерная структура Fel d 1 (Kaiser et al., 2003, J. Biol. Chem. 278: 37730-37735, Kristensen et al., 1997, Biol. Chem. 378: 899-908). Было установлено, что сворачивание белка имеет поразительное сходство со сворачиванием утероглобина, индуцируемым стероидами цитокиноподобной молекулы с противовоспалительными и иммуномодулирующими свойствами. Относительную локализацию трех эпитопов IgE определили на молекулярной поверхности Fel d 1 на остатках 15-28 (цепь 2), 117-130 и 138-151 (цепь 1) соответственно (Kaiser et al, 2003, выше).
Fel d 1 вырабатывается сальными железами и клетками плоского эпителия и переносится на шерсть при облизывании и уходе за шерстью кошек (Bartholome et al., 1985, J. Allergy Clin. Immunol. 76: 503-506; Charpin et al., 1991, J. Allergy Clin. Immunol. 88: 77-82; Dabrowski et al., 1990, J. Allergy Clin. Immunol. 86: 462-465). Fel d 1 также присутствует в слюнных, перианальных и слезных железах (Anderson et al., 1985, J. Allergy Clin. Immunol. 76: 563-569; van Milligen et al., 1990, Int. Arch. Allergy Appl. Immunol. 92: 375-378). Таким образом, аллерген присутствует внутри животного и на нем, а также переносится посредством маленьких переносимых по воздуху частиц на поверхностях в окружающей среде, в которой находится кошка.
Стратегии, разработанные для контроля реакций на такие аллергены, включают в себя формирование у индивида толерантности к аллергену и простое избегание. Стратегии толерантности предполагают установление или восстановление менее вредных или более продуктивных ответов на экзогенные аллергены. Стратегии индукции толерантности традиционно включали иммунотерапию аллергеном, при которой сенсибилизированного индивида намеренно подвергали воздействию аллергена контролируемым образом, например, посредством серии инъекций или посредством пероральной или назальной абсорбции. Иммунотерапия применяется в течение более 100 лет и является успешной, хотя для формирования приемлемого уровня толерантности могут потребоваться годы. Несмотря на потенциальную эффективность у конкретного индивида, получающего лечение, стратегии толерантности являются дорогостоящими, инвазивными, отнимают много времени, и для их применения необходимо привлекать таких специалистов, как врачи, иммунологи и т.п. Способы лечения для формирования толерантности также имеют определенный уровень риска, связанного с нежелательными реакциями и отрицательными результатами.
Избегание Fel d 1 является в принципе привлекательной стратегией, однако ее сложно реализовать. При исследовании домов, в которых живут кошки, было обнаружено широкое распространение Fel d 1, например, в постели - 96,6%, на полу спальни - 96,9%, на полу гостиной - 96,1% и на диванах - 97,9%. (Geany et al., Pediatrics, 116 (2): August 2005). Одежду школьников из домов, в которых живут кошки, тестировали за пределами дома (в школах), и на ней были обнаружены антигены Fel d 1.
Таким образом, этот антиген окружающей среды влечет существенный риск не только для сенсибилизированных индивидов, живущих в домах с кошками, но и в целом для популяции людей, подверженных аллергии (Gerge & Dreborg, Ped. Allergy Immun., 9 (1): 25-30, 1998). Таким образом, в то время как количество владельцев кошек в Соединенных Штатах Америки растет, аллергии на кошек становятся и остаются главной причиной отказа от кошек и их передачи в приюты для животных (Scarlett et al., 1999, J. Appl. Animal Welfare Sci. 2: 41-57).
Хотя полное избегание Fel d 1 невозможно реализовать на практике, даже минимальное уменьшение количества Fel d 1 могло бы оказать существенное влияние на здоровье сенсибилизированных индивидов. Это может свести к минимуму отказ от животного из-за сенсибилизации человека, живущего в доме.
Предпринимались попытки уменьшить количество кошачьих аллергенов в окружающей среде. Например, в документе U.S. 7,704,532 описаны способы, предназначенные для смягчения аллергических реакций у человека и других чувствительных животных путем непосредственного контакта аллергенов (включая кошачьи аллергены), находящихся на одежде, поверхностях, предметах интерьера, мебели, постельных принадлежностях, растениях и т.п., с композицией, содержащей раствор кислой соли, включая соли алюминия, кальция и/или магния. В документе U.S. 5,826,546 описан способ безводного мытья домашнего животного, включающий применение вспениваемой композиции шампуня в комбинации с дозатором, способным дозировать композицию в виде пены. В зависимости от конкретной потребности домашнего животного композиция может содержать одно или более из анионных детергентов, неионогенных детергентов, амфотерных детергентов, консервантов, бактерицидных средств, антиоксидантов, мягкого мыла, поверхностно-активных веществ, кондиционеров для кожи, таких как экстракты алоэ, отдушек, средств для лечения заражения блохами, таких как масло чайного дерева, регулятора рН, такого как лимонная кислота. В документе U.S. 2011/0135750 описаны способы и композиции, предназначенные для денатурации аллергенов, таких как кошачий Fel d 1, причем композиция содержит комбинацию солей кальция и солей лантана. В документе U.S. 2004/0007251 описаны сухие и влажные очищающие салфетки, содержащие добавку, такую как лектин, протеазу и/или ферментный ингибитор, предположительно способный связывать или расщеплять аллерген, такой как кошачий Fel d 1, и удалять его с поверхности. В документе U.S. 2006/0142394 описаны способы ингибирования экскрементов пылевого клеща и денатурации кератина шерсти животных и/или пыльцы или спор растений с применением композиции, содержащей фермент, способный расщеплять полипептиды так, чтобы они не могли иметь аллергический эффект у человека. В документе U.S. 8,454,953 описаны способы уменьшения или предотвращения аллергии или симптомов аллергических реакций на аллергены, включающие контактирование источника аллергена с композицией, содержащей молекулу, способную ингибировать способность аллергена связываться с тучными клетками у животного, предрасположенного к наличию аллергического ответа. Молекула может представлять собой антитело, специфичное к аллергену, такое как антитело, специфичное к кошачьему аллергену Fel d 1.
Различные доступные в продаже продукты и способы также предназначены для уменьшения аллергенов в окружающей среде. Один из таких способов, который, как считается, подходит для предотвращения или смягчения симптомов аллергических реакций у людей, включая аллергические реакции, вызванные кошачьим Fel d 1, реализуется сначала посредством очистки поверхностей в окружающей среде, а затем нанесения раствора на водной основе, который содержит ингредиент, полученный из экстрактов семян фруктов и овощей, с использованием аппликатора-спрея для обработки поверхностей, таких как матрасы, ковровые покрытия, мягкая мебель, ковры и окна (см. MASTERBLEND®, специальный отчет RESPONSIBLECARE SYSTEM™ ALLERGY RELIEF TREATMENT™, url: masterblend.net). Компания APDC, Inc. (url: apdc-inc.com) производит антиаллергенный спреи ALLER-RX®, который представляет собой жидкую композицию, полученную так, как указано, из растений и встречающихся в природе органических соединений, содержащий диоксид хлора. Другой способ включает непосредственное нанесение композиции, содержащей шампунь и ингредиенты для кондиционирования кожи, непосредственно на шерсть и кожу животного, чтобы удалить аллергены, включая кошачий Fel d 1 (см. ALLERPET® производства компании Allerpet, Inc., г. Нью-Йорк, штат Нью-Йорк, США). Было показано, что непосредственное нанесение композиции на кошку уменьшает количество Fel d 1 в кошачьей шерсти и на ковровом покрытии, на котором находились кошки (LGH Koren, Е Janssen, A Willemse, American Academy of Allergy and Immunology March 1995 Annual Meeting, Eindhoven & Utrecht, Netherlands).
Несмотря на то что, как кратко изложено выше, в данной области доступны некоторые способы и композиции, существует потребность в дополнительных усовершенствованных способах уменьшения Fel d 1 в окружающей среде или превращения его в менее аллергенный или неаллергенный тип. Также существует потребность в композициях, которые позволяют обеспечивать контроль уровня и/или активности Fel d 1, чтобы уменьшить, свести к минимуму или предотвратить аллергическую реакцию у индивидов, предрасположенных к наличию такого ответа.
Изложение сущности изобретения
Следовательно, целью настоящего изобретения является уменьшение или устранение аллергена Fel d 1 из окружающей среды.
Дополнительной целью изобретения является уменьшение или устранение аллергена Fel d 1 из окружающей среды, включая локальную окружающую среду индивида, который может страдать от аллергии на кошек.
Еще одной дополнительной целью изобретения является уменьшение или устранение аллергена Fel d 1 из источников аллергена, например из кошачьей шерсти, кожи, или шкуры, или кошачьей слюны.
Достижение одной или более из этих других целей можно осуществить с применением составов, продуктов, наборов и способов, содержащих ферменты протеазы, которые взаимодействуют с Fel d 1 и по существу разлагают аллергенные эпитопы на Fel d 1, таким образом уменьшая или устраняя его аллергенность.
Другие и дополнительные цели, элементы и преимущества настоящего изобретения будут очевидны специалистам в данной области.
Краткое описание чертежей
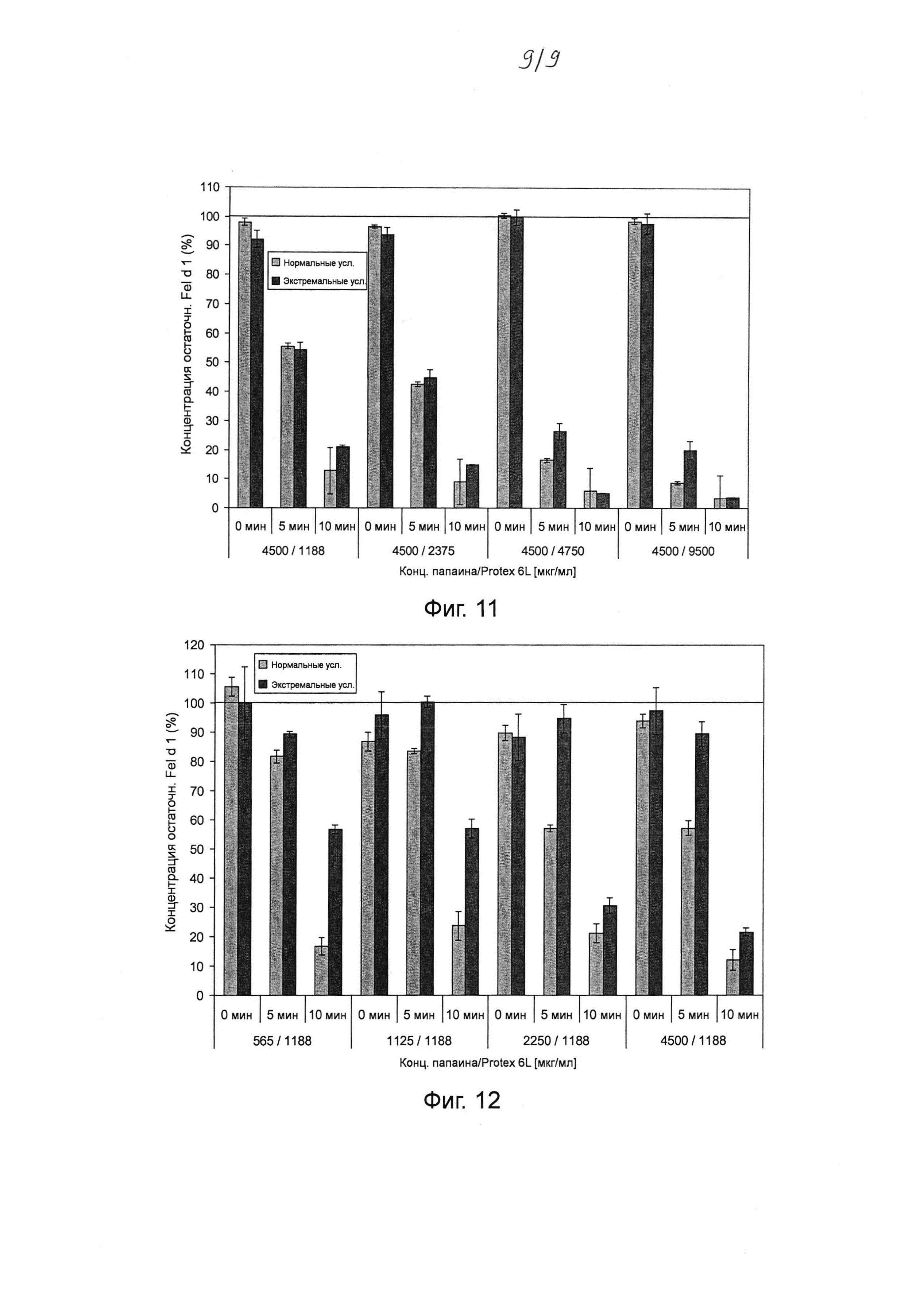
Фиг. 1. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ) демонстрирует полное разложение Fel d 1 под воздействием субтилизина Bacillus licheniformis. Натуральный Fel d 1 (1,9 мкг) инкубировали в течение ночи с субтилизином Bacillus licheniformis (Alcalase®, Novozymes) с активностью 0,1, 1 или 10 ОЕФ с-1 при 37°С либо в буфере трис/HCl (200 мМ, рН 7,8), либо в аммоний-ацетатном буфере (100 мМ, рН 4,0). В качестве контрольных образцов использовали субтилизин (10 ОЕФ с-1) без Fel d 1 и Fel d 1 без субтилизина.
Фиг. 2. Гистограмма, на которой показана остаточная концентрация Fel d 1 после катализируемого протеазой разложения, как определено с помощью твердофазного иммуноферментного анализа (ELISA). Натуральный Fel d 1 (2,5 мкг) инкубировали в течение ночи со всеми тестируемыми коммерческими протеазами (кроме BLAP) в 20 мкл оптимального буфера при минимально необходимых показателях активности до достижения полного разложения Fel d 1 (см. таблицу 2). Образцы разводили и анализировали с помощью ELISA с интервалами времени 20 и 30 минут. В результате разбавления ожидали получить начальную концентрацию Fel d 1, составляющую 12 нг мл-1 (т.е. без разложения). Отрицательный контроль (отр. контр.), не содержащий Fel d 1, положительные контроли, содержащие Fel d 1, инкубировали с различными буферами: полож. контр. 1: буфер трис/HCl (200 мМ, рН 7,8), полож. контр. 2: натрий-фосфатный буфер (100 мМ, рН 7,8), полож. контр. 3: натрий-фосфатный буфер (100 мМ рН 6,0), полож. контр, 4: аммоний-ацетатный буфер (100 мМ, рН 4,0). Катализируемые протеазой разложения выполняли в двух повторах.
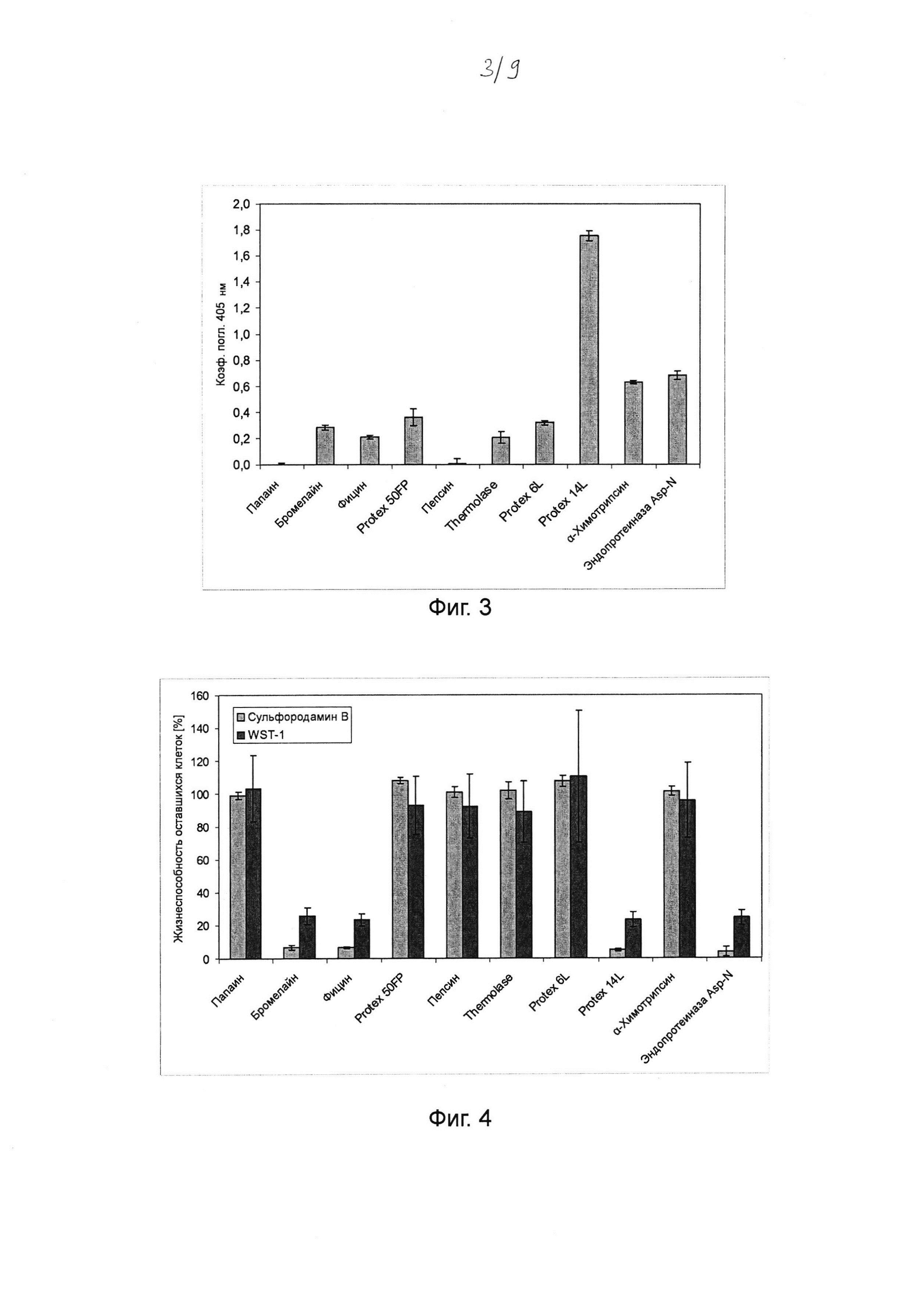
Фиг. 3. Гистограмма, на которой показана кератин-гидролизующая активность протеаз, определенная с помощью анализа с тринитробензолсульфоновой кислотой (TNBS). Порошкообразный кератин инкубировали в течение ночи с хитовыми протеазами в концентрациях и в условиях реакции, которые, как было установлено, являются оптимальными для разложения Fel d 1 (см. таблицу 2). Продукты разложения кератина определяли спектрофотометрически при 405 нм при 10-кратных разбавлениях образцов после реакции связывания с пикрилсульфоновой кислотой (TNBS). Данные представляют собой разницу между коэффициентом поглощения, определенным в образцах и в контрольных образцах с тем же буфером, но без протеазы. Среднее значение и стандартное отклонение определяли в трех независимых повторах эксперимента.
Фиг. 4. Гистограмма, на которой показан цитотоксический эффект протеаз на кератиноциты человека, определенный посредством анализов с сульфородамином В и WST-1. Выращенные до конфлюэнтности первичные кератиноциты человека инкубировали в течение ночи с хитовыми протеазами (в среде культивирования клеток) в концентрациях, которые были идентифицированы как минимально необходимые для разложения 125 мкг мл-1 Fel d 1 (см. таблицу 2). После инкубации определяли жизнеспособность оставшихся клеток для всех клеток на лунку (прикрепленные и отдельные клетки) путем окрашивания (метаболически активных клеток) WST-1. Затем определяли жизнеспособность оставшихся только прикрепленных клеток посредством окрашивания (белков живых клеток) сульфородамином В. Клетки, которые не инкубировали с протеазами, выступали в качестве контроля (соответствует 100% жизнеспособности оставшихся клеток). Среднее значение и стандартное отклонение определяли в трех независимых повторах эксперимента.
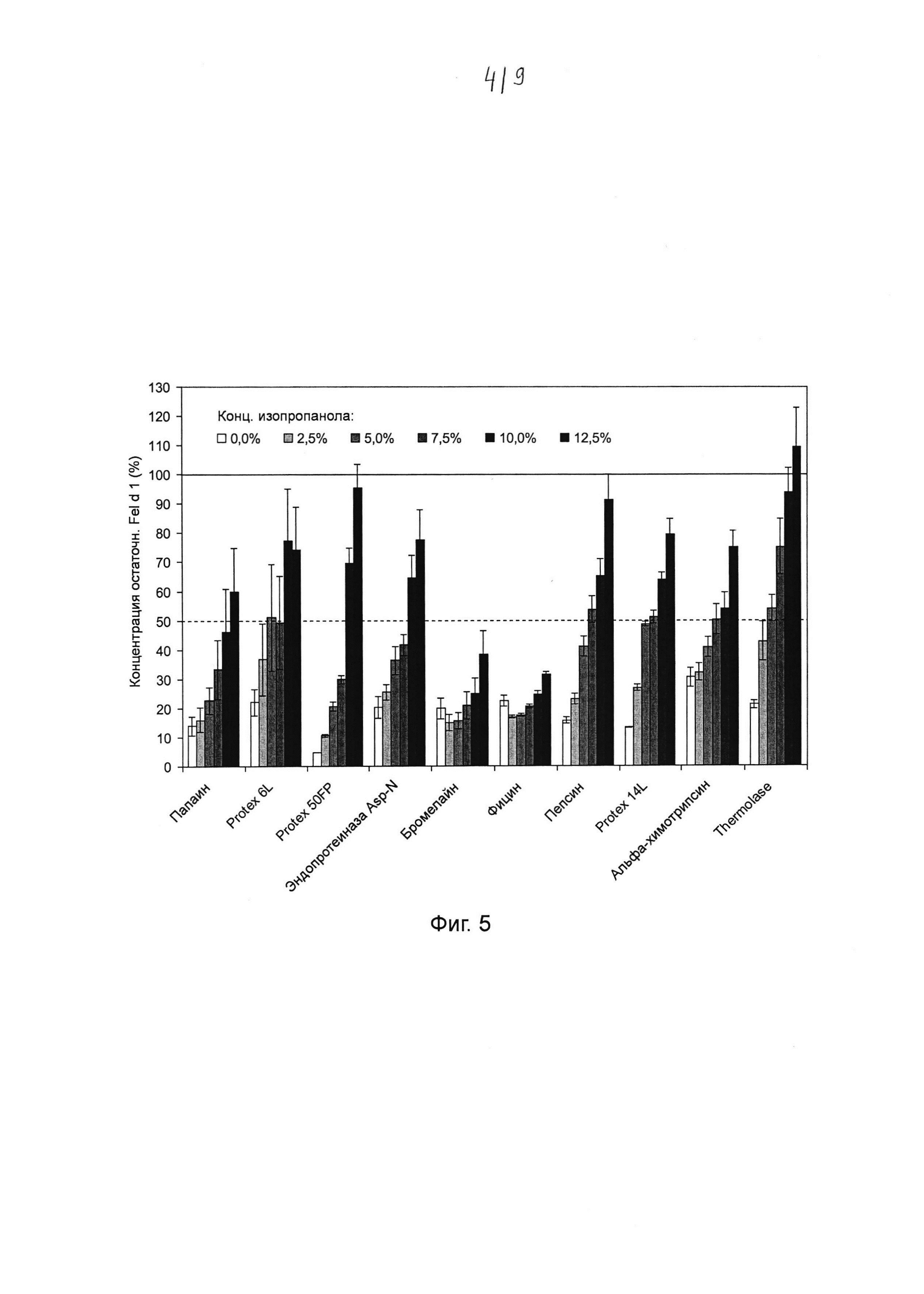
Фиг. 5. Гистограмма, на которой показано воздействие изопропанола на катализируемое протеазой разложение Fel d 1. Хитовые протеазы инкубировали в течение ночи с 0, 2,5%, 5,0%, 7,5%, 10,0% и 12,5% изопропанола в концентрациях и в условиях реакции, которые, как было установлено, являются оптимальными для разложения Fel d 1 (см. таблица 2). Образцы разводили и анализировали с помощью ELISA с интервалом времени 20 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для соответствующих буферных контролей с максимальной концентрацией изопропанола, но без протеазы. Среднее значение и стандартное отклонение определяли в трех независимых повторах эксперимента.
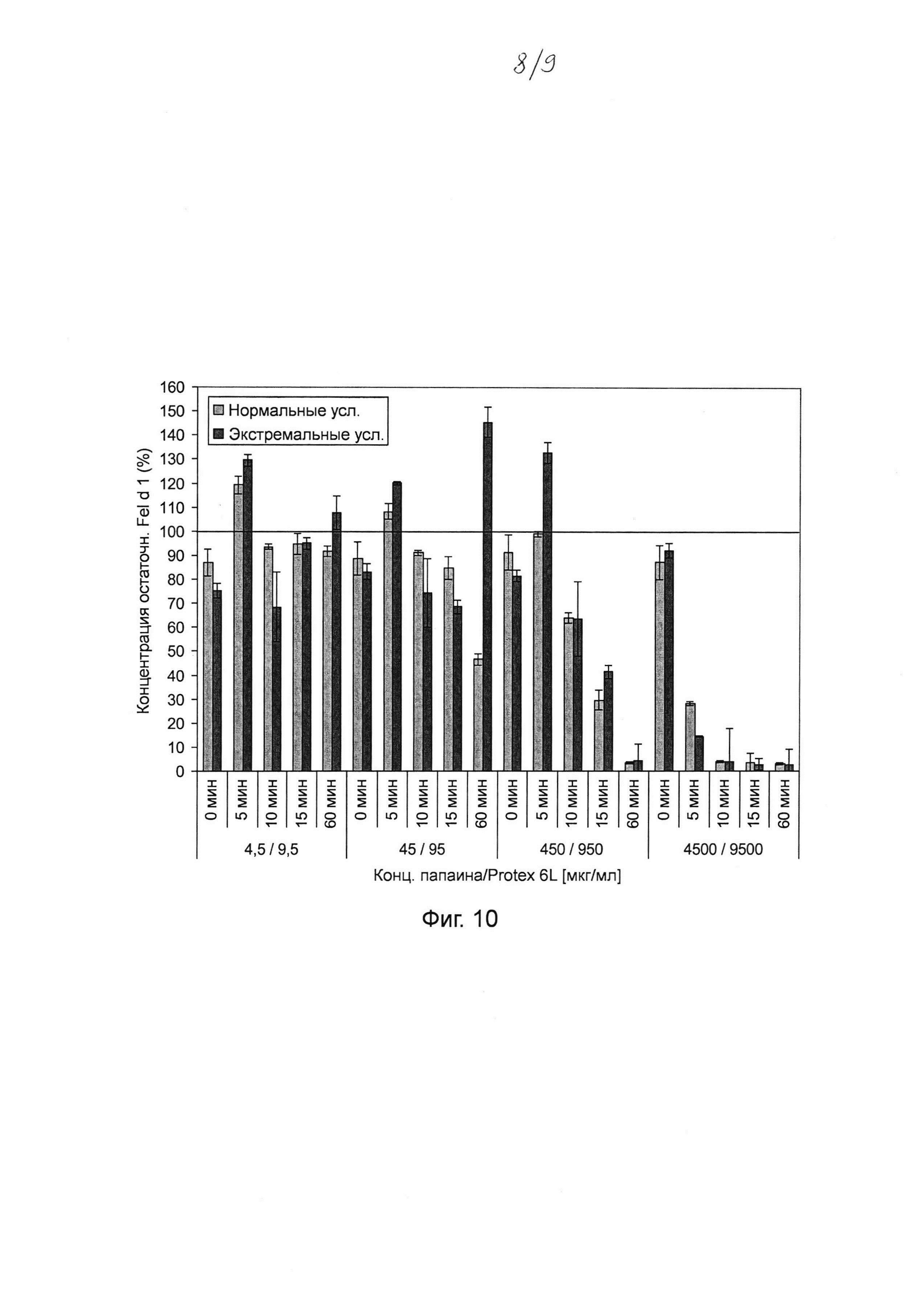
Фиг. 6. График, на котором показано воздействие Tween® 20 на катализируемое протеазой разложение Fel d 1. Хитовые протеазы инкубировали в течение ночи с 0, 10%, 20% и 30% Tween® 20 в концентрациях и в условиях реакции, которые, как было установлено, являются оптимальными для разложения Fel d 1 (см. таблица 2). Образцы разводили и анализировали с помощью ELISA с интервалом времени 20 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для буферных контролей с соответствующими концентрациями Tween® 20, но без протеазы. Среднее значение и стандартное отклонение определяли в трех независимых повторах эксперимента.
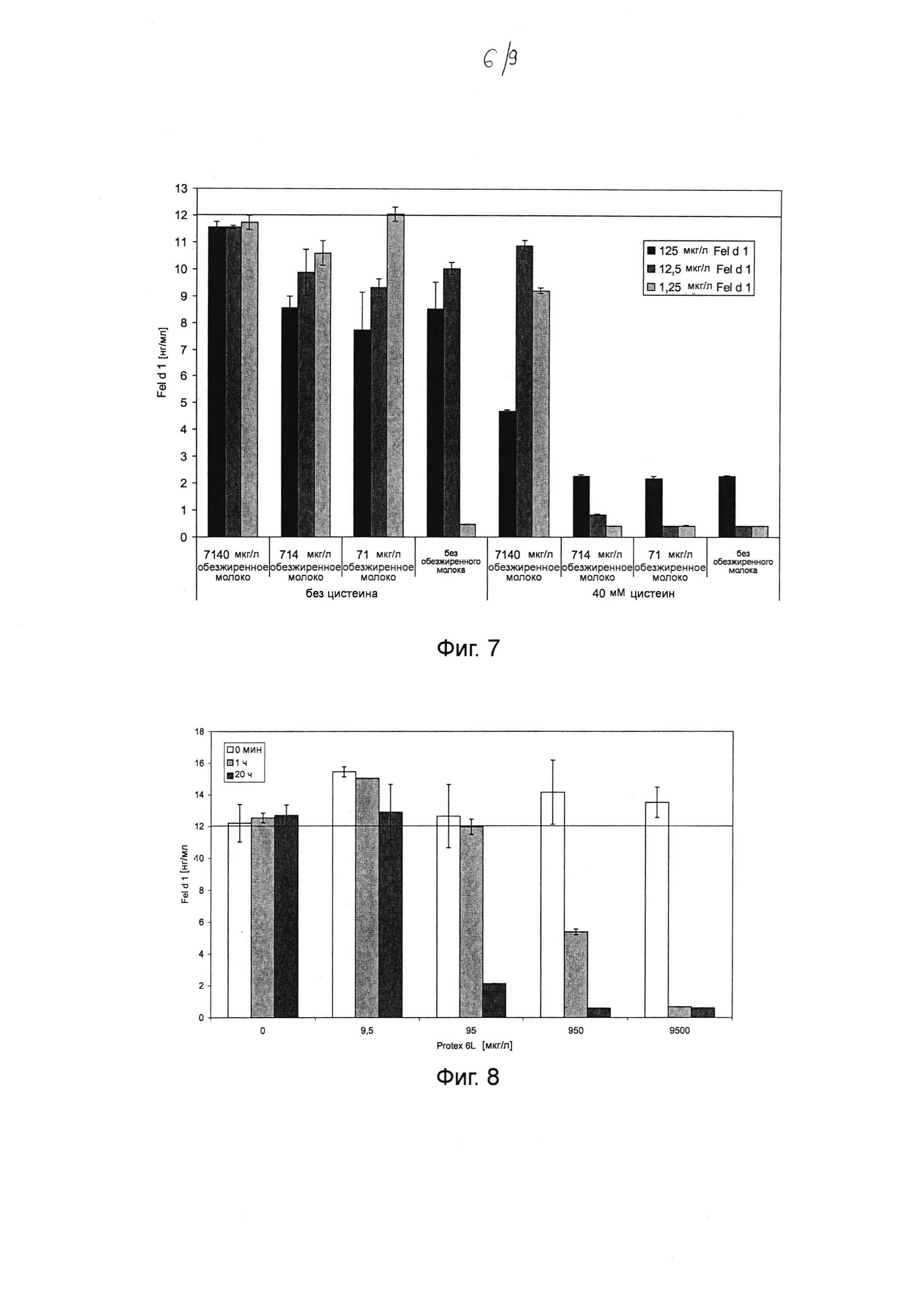
Фиг. 7. Гистограмма, на которой показано воздействие цистеина и различных концентраций обезжиренного молока на катализируемое папаином разложение различных концентраций Fel d 1 в искусственной кошачьей слюне при инкубации в течение ночи при 37°С. Инкубировали 1,25, 12,5 и 125 мкг мл-1 натурального Fel d 1 в течение ночи с 4,65 мкг мл-1 папаина (соответствует 60 ОЕФ с-1 в 20 мкл реакционной смеси, см. таблицу 2) при 37°С в искусственной кошачьей слюне с 0, 71, 714 и 7140 мкг мл-1 обезжиренного молока, с 40 мМ цистеина и без него. После инкубации образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. В результате разбавления ожидали получить максимальную концентрацию Fel d 1, составляющую 12 нг мл-1 (т.е. без разложения). Среднее значение и стандартное отклонение определяли в двух независимых повторах эксперимента.
Фиг. 8. Гистограмма, на которой показано определение Fel d 1 с помощью ELISA после инкубации в течение 1 часа и в течение ночи при 37°С с различными концентрациями субтилизина Bacillus licheniformis (Protex® 6L) в искусственной кошачьей слюне (экстремальные условия). 125 мкг мл-1 натурального Fel d 1 инкубировали в течение 0 мин, 1 часа или 20 часов (в течение ночи) с 0, 9,5, 95, 950 и 9500 мкг мл-1 субтилизина при 37°С в искусственной кошачьей слюне (экстремальные условия). Реакцию останавливали путем добавления 1 мМ фенилметилсульфонилфторида (ФМСФ). Образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. В результате разбавления ожидали получить максимальную концентрацию Fel d 1, составляющую 12 нг мл-1 (т.е. без разложения). Среднее значение и стандартное отклонение определяли в двух независимых повторах эксперимента.
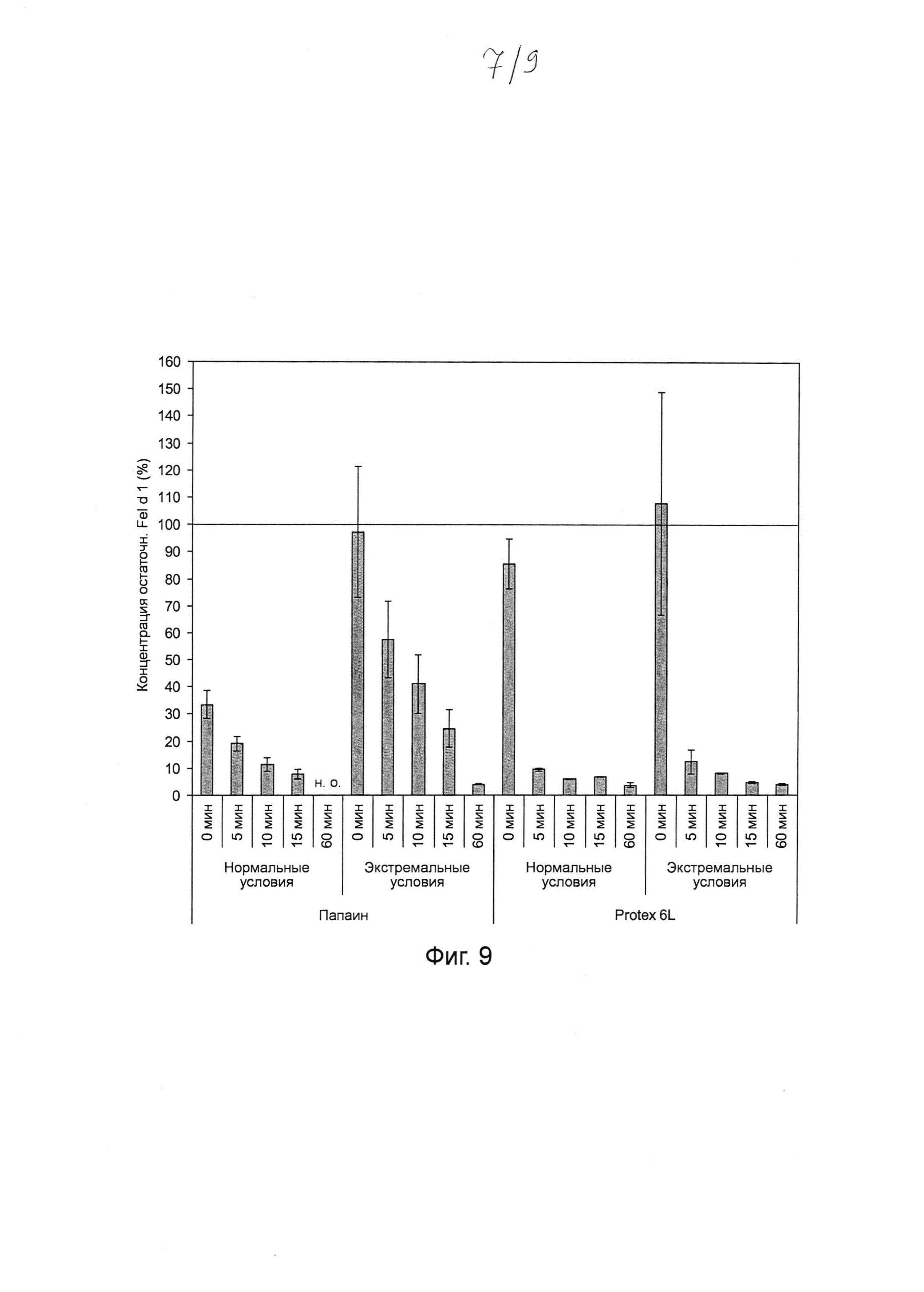
Фиг. 9. Гистограмма, на которой показаны результаты тестирования папаина и субтилизина Bacillus licheniformis (Protex® 6L) при 1000-кратном повышении концентраций для разложения Fel d 1 в искусственной кошачьей слюне после инкубации в течение 5-60 мин. Инкубировали 4,5 мг мл-1 папаина и 9,5 мг мл-1 субтилизина в течение 0, 5, 10, 15 и 60 мин с Fel d 1 в искусственной кошачьей слюне при 37°С в нормальных и экстремальных условиях. Реакцию останавливали путем добавления 100 мкМ Е64 (для папаина) и 1 мМ ФМСФ (для субтилизина). Образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для соответствующих буферных контролей без протеазы. Среднее значение и стандартное отклонение определяли в трех независимых повторах эксперимента. Сокращение: н.о. - не определено.
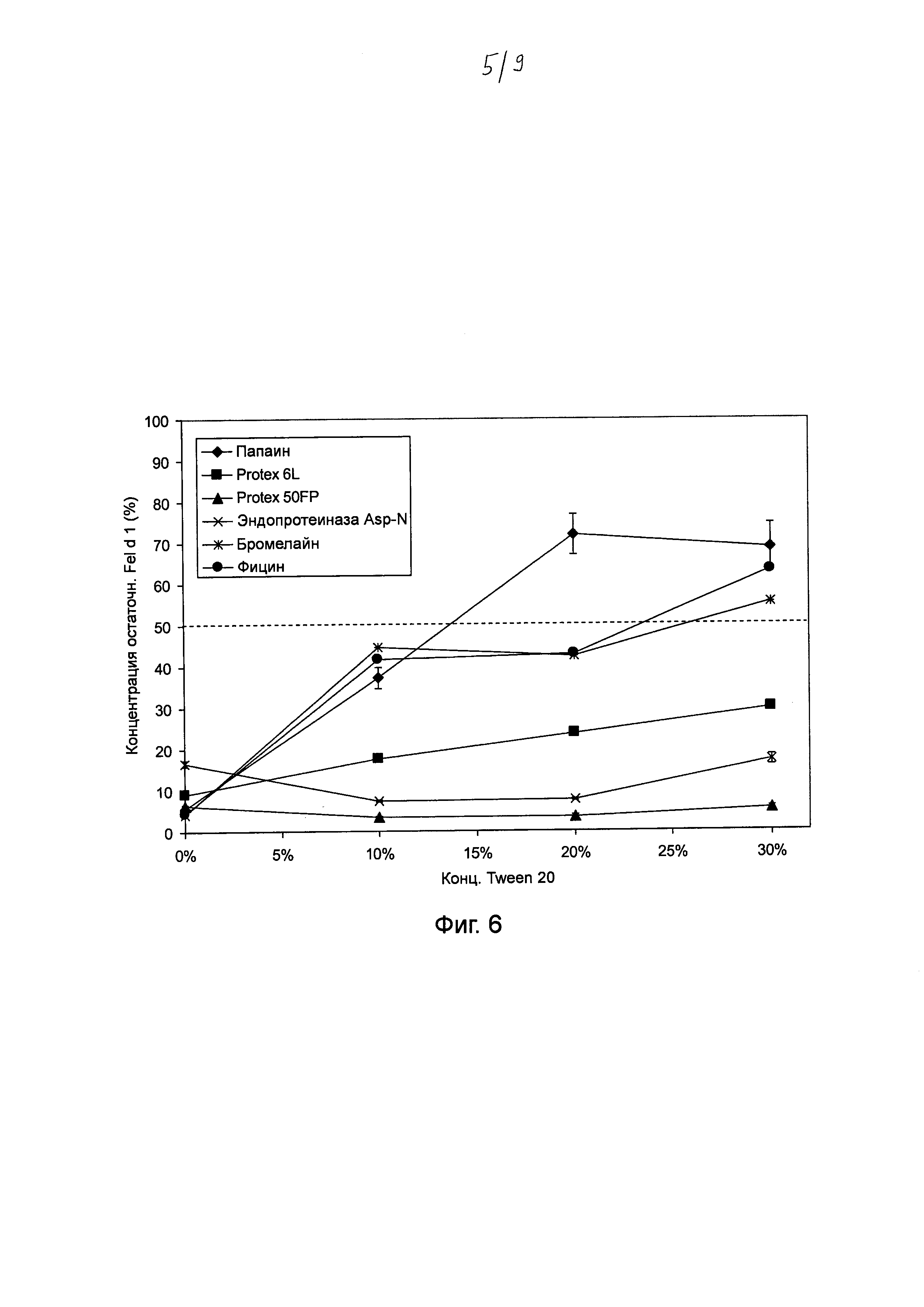
Фиг. 10. Гистограмма, на которой показаны результаты тестирования различных комбинаций концентраций папаина и субтилизина Bacillus licheniformis (Protex® 6L) (при постоянном соотношении) для разложения Fel d 1 в искусственной кошачьей слюне после инкубации в течение 0-60 мин. Различные комбинации концентраций папаина и субтилизина (4,5 и 9,5 мкг мл-1; 45 и 95 мкг мл-1; 450 и 950 мкг мл-1; 4500 и 9500 мкг мл-1 папаина и субтилизина соответственно) инкубировали в течение 0, 5, 10, 15 и 60 мин с Fel d 1 в искусственной кошачьей слюне при 37°С в нормальных и экстремальных условиях. Реакцию останавливали путем добавления 100 мкМ Е64 и 1 мМ ФМСФ. Образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для соответствующих буферных контролей без протеазы. Среднее значение и стандартное отклонение определяли в двух независимых повторах эксперимента.
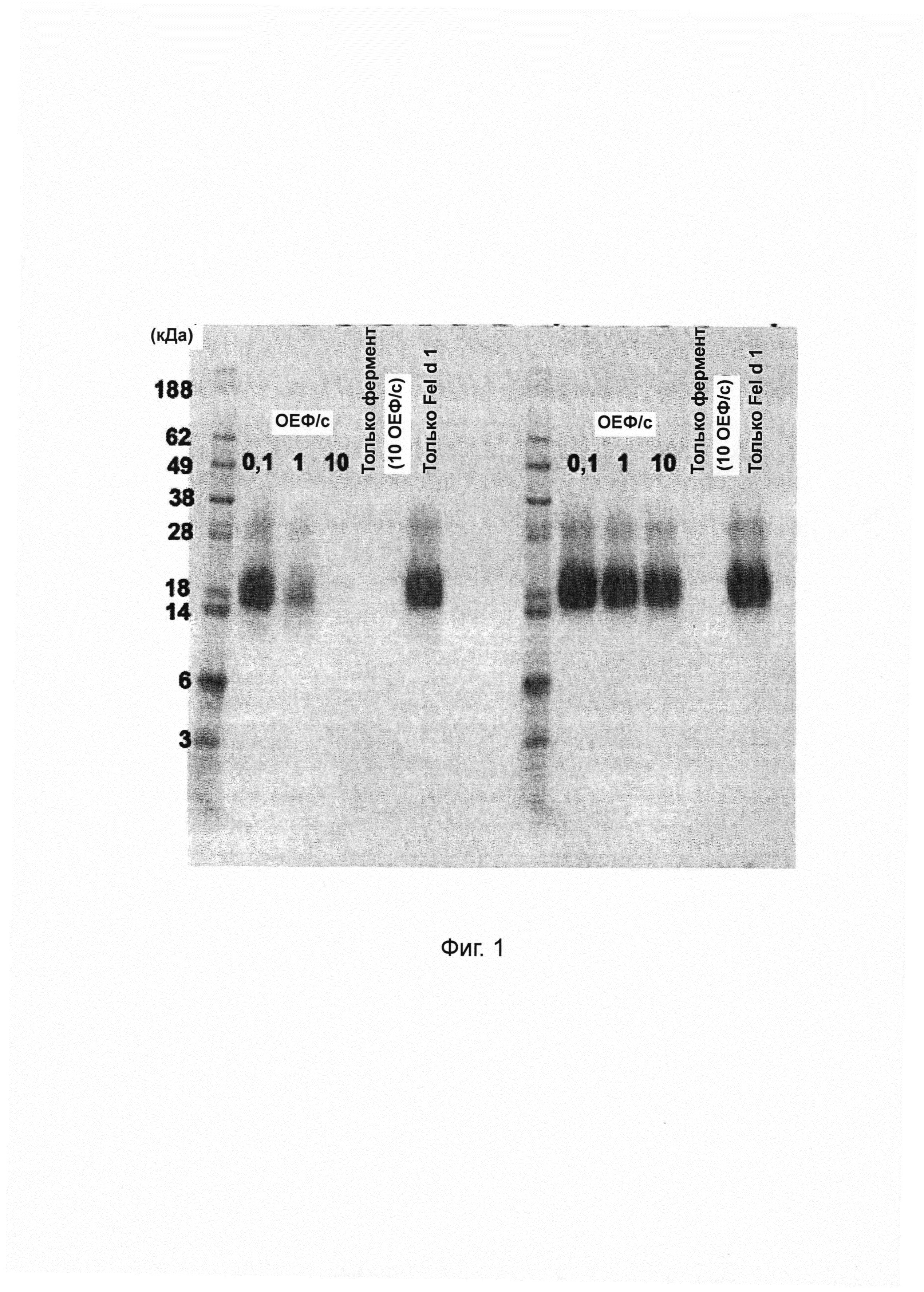
Фиг. 11. Гистограмма, на которой показаны результаты тестирования различных комбинаций концентраций папаина и субтилизина Bacillus licheniformis (Protex® 6L) (при постоянной концентрации папаина) для разложения Fel d 1 в искусственной кошачьей слюне после инкубации в течение 0-10 мин. Различные комбинации концентраций папаина и субтилизина (4500 и 1188 мкг мл-1; 4500 и 2375 мкг мл-1; 4500 и 4750 мкг мл-1; 4500 и 9500 мкг мл-1 папаина и субтилизина соответственно) инкубировали в течение 0, 5 и 10 мин с Fel d 1 в искусственной кошачьей слюне при 37°С в нормальных и экстремальных условиях. Реакцию останавливали путем добавления 100 мкМ Е64 и 1 мМ ФМСФ. Образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для соответствующих буферных контролей без протеазы. Среднее значение и стандартное отклонение определяли в двух независимых повторах эксперимента.
Фиг. 12. Гистограмма, на которой показаны результаты тестирования различных комбинаций концентраций папаина и субтилизина Bacillus licheniformis (Protex® 6L) (при постоянной концентрации субтилизина) для разложения Fel d 1 в искусственной кошачьей слюне после инкубации в течение 0-10 мин. Различные комбинации концентраций папаина и субтилизина (565 и 1188 мкг мл-1; 1125 и 1188 мкг мл-1; 2250 и 1188 мкг мл-1; 4500 и 1188 мкг мл-1 папаина и субтилизина соответственно) инкубировали в течение 0, 5 и 10 мин с Fel d 1 в искусственной кошачьей слюне при 37°С в нормальных и экстремальных условиях. Реакцию останавливали путем добавления 100 мкМ Е64 и 1 мМ ФМСФ. Образцы разводили и анализировали с помощью ELISA с интервалом времени 30 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов в сравнении с Fel d 1 для соответствующих буферных контролей без протеазы. Среднее значение и стандартное отклонение определяли в двух независимых повторах эксперимента.
Подробное описание изобретения
Определения
Используемый в настоящем документе термин «аллергия» является синонимом терминов «аллергический ответ» или «аллергическая реакция». Каждый из терминов относится к состоянию иммунологической реактивности у животного, специфичной к экзогенному антигену (или «аллергену»), который в остальном не является вредным для животного. «Симптом» аллергического ответа относится к любой степени вышеуказанной иммунологической реактивности, например, на молекулярном уровне (в том числе измерение активности или экспрессии белка, или транскрипта, или гена), клеточном уровне, уровне органов, системном уровне или на уровне организма. Такие симптомы могут включать в себя один или более таких уровней. Симптомы могут включать в себя генерализованные явления, такие как воспаление, респираторные жалобы, отечность или расстройство, обычно связанные с аллергией, ринит, отек и аллергические кожные расстройства, включая, без ограничений, атопический дерматит (например, экзему), аллергическую сыпь (например, крапивницу), ангионевротический отек и аллергический контактный дерматит. Более специфические явления, которые являются «симптомами» аллергического ответа, в том числе любое измеримое или наблюдаемое изменение, например, на клеточном уровне, включая, без ограничений, локальные или системные изменения в клеточных популяциях, эозинофилию, рекрутинг и/или активацию иммунных клеток, включая, например, тучные клетки и/или базофилы, изменения в антигенпрезентирующих клетках (включая, без ограничений, FcεRI-несущие дендритные клетки), внутриклеточные или молекулярные изменения, включая измерение или наблюдения одной или более ступеней в иммунологическом каскаде, высвобождение внутриклеточных соединений, которые опосредуют аллергический ответ (например, медиаторов), и изменения в одном или более цитокинах (например, IL-3, IL-5, IL-9, IL-4 или IL-13) или родственных соединениях или антагонистах. Специалисту в данной области будет понятно, что некоторые симптомы, как определено в настоящем документе, измеряются легче, чем другие, и некоторые симптомы измеряются с помощью субъективной оценки или самооценки симптома. Для других симптомов существуют удобные или быстрые способы анализа или измерения для объективной оценки изменений.
Используемый в настоящем документе термин «окружающая среда» включает три компонента, поскольку они относятся к кошачьему аллергену Fel d 1. Иногда их называют «вокруг кошки», «на кошке» и «в кошке». Окружающая среда «вокруг кошки» относится к локальной окружающей среде индивида, который может страдать от аллергий к кошкам, и/или к локальной окружающей среде, в которой проживает кошка. Например, используемой в настоящем документе «окружающей средой» может быть дом, комната, автомобиль, офис, гостиница, двор, гараж и т.п. Любая поверхность неодушевленного предмета, на которой может находиться аллерген, считается частью окружающей среды. Переносимые по воздуху частицы, содержащие аллерген, также считаются частью окружающей среды. Несмотря на то что окружающая среда «вокруг кошки» часто находится внутри помещения, ни один аспект настоящего документа не ограничивает окружающую среду ограниченным пространством, частично или полностью открытым или находящимся за пределами помещения, например, для целей настоящего документа под окружающей средой может подразумеваться патио, настил, лестничная площадка, веранда, беседка, крыльцо или т.п. Окружающая среда также может включать в себя часть животного или все животное, являющееся источником аллергена, например кожу, кошачью шерсть, или слюну на коже или кошачьей шерсти («на кошке»), или полость рта кошки, или находящуюся в ней слюну («в кошке»).
Используемый в настоящем документе термин «индивид» означает отдельное животное любого вида или рода, в том числе человека.
В случае наборов термин «единая упаковка» означает, что компоненты набора физически связаны с одним или более контейнерами или находятся в нем и считаются единицей с точки зрения производства, распространения, продажи или применения. К контейнерам относятся, без ограничений, сумки, ящики или картонные коробки, бутыли, упаковки любого типа, конструкции или материала, завернутые в обычную или термоусадочную пленку, с фиксирующими компонентами (например, сшитые скобами, склеенные или т.п.), или комбинации любого из вышеуказанных. Например, набор в виде единой упаковки может обеспечивать контейнеры с индивидуальными композициями и/или пищевыми композициями, физически связанными таким образом, что они считаются единицей с точки зрения производства, распространения, продажи или применения.
Термин «виртуальная упаковка» означает, что компоненты набора связаны посредством указаний на одном или более компонентах физического или виртуального набора, которые предоставляют для пользователя инструкции о получении других компонентов, например, в сумке или другом контейнере, содержащем один компонент, и указания, которые предоставляют пользователю инструкции о том, что нужно перейти на веб-сайт или использовать приложение на персональном устройстве, обратиться в службу регистрации сообщений или в службу ответа по факсу, просмотреть визуальное сообщение или обратиться к специалисту или инструктору, например, для получения инструкций по применению набора, информации по безопасности или технической информации для одного или более компонентов набора. Примеры информации, которая может быть предоставлена в составе виртуального набора, включают в себя инструкции по применению; информацию по безопасности, такую как перечень данных по безопасности материалов; информацию о токсикологическом контроле; информацию о потенциальных нежелательных реакциях; результаты клинических исследований; диетологическую информацию, такую как пищевая композиция или калорийность; общую информацию о физической активности, физической нагрузке, обмене веществ, выносливости и т.п.
Если конкретно не указано иное, все процентные значения, приведенные в настоящем документе, выражены в расчете на массу сухого вещества композиции. Специалисту в данной области будет понятно, что термин «в расчете на массу сухого вещества» означает, что концентрацию или процентное значение ингредиента в композиции измеряли или определяли после удаления из композиции всей свободной влаги.
Диапазоны в настоящем документе указаны сокращенно, чтобы избежать необходимости в их подробном определении и предоставлении описаний всех и каждого из значений в пределах диапазона. При необходимости можно выбирать любое соответствующее значение в рамках диапазона в качестве верхнего значения, нижнего значения или граничного значения диапазона.
Используемый в настоящем документе термин «приблизительно» указывает на заданное значение плюс или минус 20%, или 15%, или 10%, или 5%, или 1%. Следовательно, термин «приблизительно» используется в качестве сокращения, отражающего представление о том, что небольшие отклонения от указанного буквального значения все же входят в объем изобретения.
Используемое в настоящем документе и в приложенных пунктах формулы изобретения единственное число слова включает в себя множественное число и наоборот, если из контекста явно не следует иное. Таким образом, указание на единственное число по существу включает в себя множественное число соответствующих терминов. Например, использование слова «кошка», «способ» или «продукт» включает в себя множество таких «кошек», «способов» или «продуктов». Аналогичным образом, слова «содержать», «содержит» и «содержащий» следует интерпретировать во включающем, а не исключающем смысле. Аналогично термины «включать в себя», «включающий» и «или» следует толковать во включающем смысле, если такое толкование явно не запрещено контекстом. Используемый в настоящем документе термин «примеры» или «например», особенно если за ним следует перечисление терминов, имеет только примерный и иллюстративный характер и не должен считаться исключающим или исчерпывающим.
Предполагается, что термин «содержащий» включает в себя варианты осуществления, которые охватываются терминами «состоящий по существу из» и «состоящий из». Аналогичным образом, предполагается, что термин «состоящий по существу из» включает в себя варианты осуществления, которые охватываются термином «состоящий из».
Способы и композиции, а также другие преимущества, описанные в настоящем документе, не ограничены конкретной методологией, протоколами и реагентами, описанными в настоящем документе, поскольку, как очевидно специалистам в данной области, они могут быть разными. Кроме того, используемая в настоящем документе терминология служит только для цели описания конкретных вариантов осуществления и не должна ограничивать и не ограничивает объем, описанный или указанный в формуле изобретения.
Если не определено иное, все технические и научные термины, используемые в данной области термины и сокращения, используемые в настоящем документе, имеют значения, обычно понятные специалисту в области(-ях), к которой(-ым) относится изобретение, или в области(-ях), в которой(-ых) используется термин. Хотя любые композиции, способы, изделия или другие средства или материалы, аналогичные или эквивалентные описанным в настоящем документе, могут применяться при реализации настоящего изобретения на практике, в настоящем документе описаны предпочтительные композиции, способы, изделия или другие средства или материалы.
Все патенты, заявки на патенты, публикации и другие ссылки, приведенные или упомянутые в настоящем документе, включены в настоящий документ путем ссылки в объеме, разрешенном контролирующим законодательством. Описание этих ссылок служит только для обобщения утверждений, сделанных в настоящем документе. Не делается каких-либо допущений, что любые такие патенты, заявки на патенты, публикации или ссылки или какая-либо их часть являются важными, существенными или относятся к предшествующему уровню техники. Специально сохранено право ставить под вопрос точность и уместность любых утверждений о том, что такие патенты, заявки на патенты, публикации и другие ссылки являются важными, существенными или относятся к предшествующему уровню техники.
Варианты осуществления изобретения
Предложены композиции, способы, изделия, наборы и упаковки для уменьшения или устранения кошачьего аллергена Fel d 1 из окружающей среды. Источником изобретения частично является открытие авторами изобретения того, что некоторые ферменты, в частности протеолитические ферменты (протеазы), способны разлагать антигенные эпитопы Fel d 1, таким образом уменьшая или устраняя его аллергенный эффект.
В одном аспекте изобретения предусмотрен состав для уменьшения или устранения аллергенности Fel d 1, содержащий по меньшей мере одну протеазу, которая взаимодействует с Fel d 1 и по существу разлагает аллергенные эпитопы на Fel d 1. Эффективные протеазы выбирают из сериновых протеаз, тиоловых протеаз, аспартиловых протеаз, цинковых металлопротеаз или любой их комбинации.
В некоторых вариантах осуществления сериновые протеазы включают в себя субтилизин, протеиназу K, трипсин, альфа-химотрипсин, эндопротеиназу Glu-C и эндопротеиназу Lys-C. При использовании субтилизина его можно получить из видов Bacillus, выбранных из В. licheniformis, В. clausii, В. haloudurans, В. lentus, В. amyloliquefaciens, В. subtilis или любой их комбинации. Тиоловые протеазы могут включать в себя бромелайн, папаин и фицин, которые получают из растительных источников, например из ананаса, папайи и фигового дерева. Аспартиловые протеазы могут включать в себя бычий химозин, эндотиапепсин (например, из Chryphonectria parasitica), мукорпепсин/реннин (например, из Mucor miehei), пепсин (например, свиного происхождения) и аспергиллопепсин (например, из Trichoderma reesei, Aspergillus niger или Aspergillus oryzae). Цинковые металлопротеазы могут включать в себя термолизин (например, из видов Bacillus thermoproteolyticus rokko или Geobacillus) и эндопротеиназу Asp-N (например, из Flavobacterium meningosepticum).
В таблице 1 ниже представлены протеазы, подходящие для применения в настоящем изобретении. Протеазы могут быть очищены из биологического источника или их можно получить из коммерческих источников. Некоторые примеры коммерческих источников приведены в таблице; доступны и многие другие.
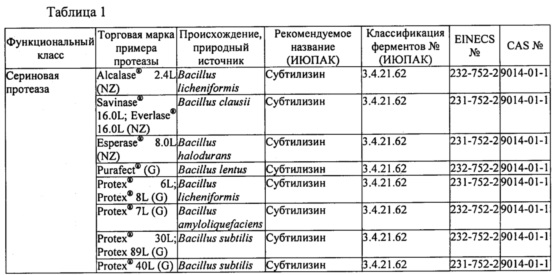
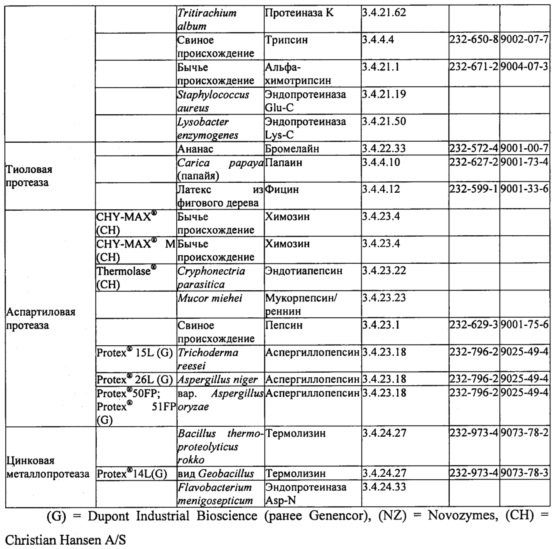
В некоторых вариантах осуществления протеаза или комбинация протеаз в составе уменьшает связывание Fel d 1 с антителами к Fel d 1 по меньшей мере на 50% в условиях, применимых для протеазы или их комбинации, как описано в примерах, что измеряли с помощью одного или более из ELISA, ДСН-ПААГ или любого другого известного способа обнаружения присутствия антигена и/или антигенных эпитопов или связывания антигена с антителами, специфичными к Fel d 1. Например, протеазы могут включать в себя одну или более из субтилизина, протеиназы K, альфа-химотрипсина, трипсина, эндопротеиназы Lys-C, бромелайна, папаина, фицина, химозина, эндотиапепсина, мукорпепсина/реннина, пепсина, аспергиллопепсина, термолизина и эндопротеиназы Asp-N.
Более конкретно, протеаза или комбинация протеаз в составе уменьшает связывание Fel d 1 с антителами к Fel d 1 по меньшей мере на 90% в условиях, применимых для протеазы или комбинации протеаз, как описано в примерах, что измеряли с помощью одного или более из ELISA, ДСН-ПААГ или любого другого известного способа обнаружения присутствия антигена и/или антигенных эпитопов или связывания антигена с антителами, специфичными к Fel d 1. Например, протеазы могут включать в себя одну или более из субтилизина (например, из Bacillus licheniformis, В. clausii, В. lentus, В. amyloliquefaciens и/или В. subtilis), трипсина (например, свиного), альфа-химотрипсина (например, бычьего), бромелайна, папаина, фицина, химозина (например, бычьего), эндотиапепсина, мукорпепсина/реннина, пепсина, аспергиллопепсина (например, из Trichoderma reesei, Aspergillus niger или Aspergillus oryzae), термолизина и эндопротеиназы Asp-N.
В некоторых вариантах осуществления протеазы включают в себя одну или более из папаина, субтилизина из В. licheniformis, аспергиллопепсина из A. oryzae, эндопротеиназы Asp-N, бромелайна, фицина, альфа-химотрипсина, эндотиапепсина из Cryphonectria parasitica, пепсина и термолизина из вида Geobacillus. В конкретных вариантах осуществления протеазы включают в себя одну или более из папаина, субтилизина из В. licheniformis, аспергиллопепсина из A. oryzae и эндопротеиназы Asp-N.
Авторы настоящего изобретения установили, что некоторые протеазы могут особенно подходить для использования в композициях, содержащих спирт или некоторые детергенты. Например, в некоторых вариантах осуществления протеаза или комбинация протеаз уменьшает связывание Fel d 1 с антителами к Fel d 1 по меньшей мере на 50% в присутствии до 7,5% изопропанола в условиях реакции, которые представлены для соответствующих классов ферментов в таблице 2. Эти протеазы могут включать в себя одну или более из фицина, бромелайна, папаина, аспергиллопепсина из Aspergillus oryzae или эндопротеиназы Asp-N. В других вариантах осуществления протеаза или комбинация протеаз уменьшает связывание Fel die антителами к Fel d 1 по меньшей мере на 50% в присутствии неионогенного детергента, например полисорбата 20 (Tween® 20), в концентрации до 10% в условиях реакции, представленных в таблице 2. Эти протеазы могут включать в себя одну или более из аспергиллопепсина из A. oryzae, эндопротеиназы Asp-N, субтилизина из В. licheniformis, папаина, бромелайна и фицина. Стоит ли расширить диапазон?
Состав может дополнительно содержать добавку, которая повышает эффективность фермента при разложении Fel d 1. В некоторых вариантах осуществления добавка представляет собой цистеин или соли/ионы кальция (Са2+), или комбинацию цистеина и солей/ионов кальция, или соединения, которые образуют цистеин или соли/ионы кальция in situ.
В различных вариантах осуществления состав размещен внутри композиции, выбранной, например, из жидкого, твердого или порошкообразного очищающего средства, спрея, влажной тканевой салфетки, влажной салфетки, губки, водорастворимой таблетки, фильтра, пищевой добавки, добавки к маслу или воде, добавки или фильтра для пылесоса, гранул, детергента, дезодоранта для ковровых покрытий и помещений, наполнителя для туалетов, добавки для наполнителей для туалетов, рукавицы, добавки для нетканых изделий, капсулы (таблетки) для стиральной машины, многокамерных жидких таблеток. Кроме того, составы могут размещаться в препарате для перорального введения. В одном аспекте состав может размещаться внутри игрушки, например игрушки для кошек, включая съедобные и несъедобные игрушки.
В некоторых вариантах осуществления состав может представлять собой гранулу, порошок или таблетку, которую перед применением разводят в жидкости (например, воде, буфере или другой жидкости). В других вариантах осуществления состав может представлять собой жидкость или спрей, который можно наносить на поверхность или на животное. Предпочтительно спрей представлен не в виде аэрозоля. Подходящие спреи не в виде аэрозоля могут быть получены в соответствии со способами, известными в данной области.
В некоторых вариантах осуществления составы содержат ферменты, которые, как правило, признаны безопасными для применения в пищевых продуктах и косметических средствах. Такие составы особенно подходят для применения в мыле, шампунях, пенах/муссах, порошках, спреях, кондиционерах, ополаскивателях, гелях, лосьонах, ошейниках, диспергаторах, влажных рукавицах, влажных салфетках, зубных пастах и/или жидкостях для полоскания рта или любых других композициях, подходящих для нанесения на кожу, шерсть, шкуру или в полость рта, или расположены внутри пищевой композиции, или рецептура состава подходит для добавления к любым таким композициям.
В некоторых вариантах осуществления протеаза по существу не взаимодействует с веществами, которые включают в себя кератин, коллаген, эластин, фибронектин, другими белками и волокнами или тканями (в одежде, ковровом покрытии, обивке, шторах и постельных принадлежностях). Подходящие протеазы, которые неактивны на таких белках, включают в себя, без ограничений, папаин и пепсин.
В других вариантах осуществления протеаза может быть активна в отношении кератина и может применяться для уменьшения накопления кератина, которое может происходить при мытье животного шампунем. Например, было обнаружено, что бромелайн, фицин, аспергиллопепсин, эндотиапепсин, некоторые субтилизины, термолизин, эндопротеиназа Asp-N и альфа-химотрипсин разлагают кератин (пример 2).
В другом аспекте изобретения предусмотрен способ получения состава для уменьшения или устранения аллергенности Fel d 1. В целом способ включает объединение по меньшей мере одной протеазы, которая взаимодействует с Fel d 1 и по существу разлагает аллергенные эпитопы на Fel d 1, со средой, в которой протеаза является активной или в которой ее можно сделать активной перед применением. Среда может представлять собой любую среду, удовлетворяющую вышеупомянутым требованиям, включая, без ограничений, жидкости, твердые вещества, гранулы, порошки, влажные тканевые салфетки, влажные салфетки, рукавицы, губки, водорастворимые таблетки, фильтры, пищевые продукты, пищевые добавки, напитки, концентраты для добавления в пищевые продукты и напитки, добавки или фильтры для пылесоса, детергенты, дезодоранты для ковровых покрытий, обивки и помещений, наполнители для туалетов, добавки для наполнителей для туалетов, капсулы (таблетка) для стиральной машины, среди прочих.
Протеазы могут включать в себя любую из протеаз, описанных выше в настоящем документе, или любую их комбинацию в количестве, подходящем для разложения Fel d 1 в достаточной степени, чтобы ингибировать его связывание с антителами к Fel d 1 при воздействии состава на Fel d 1 в окружающей среде (вокруг кошки, на кошке или в кошке). Например, составы, предназначенные для нанесения в окружающую среду и удаления вскоре после этого (например, в течение нескольких минут или часов), такие как очищающее средство, шампунь для домашнего животного или продукт для перорального введения, должны содержать концентрацию протеазы (протеаз), достаточную для разложения Fel d 1 в этот период времени. Кинетические анализы, описанные в примерах, обеспечивают диапазоны концентраций протеаз для достижения такого результата. Например, кинетический анализ папаина и субтилизина из В. licheniformis в искусственной кошачьей слюне показал, что при нормальных условиях в кошачьей слюне более 80% Fel d 1 разлагалось папаином в концентрации 4,5 мг мл-1 и субтилизином в концентрации 9,5 мг мл-1 в течение 5 минут. В составах, предназначенных для того, чтобы они оставались на месте в течение длительного периода времени (например, в течение нескольких часов или ночи), таких как спрей для обивки или ткани или несмываемый мусс, гель, шампунь или спрей, потребуется меньшая концентрация протеазы (протеаз).
Специалист в данной области может измерять разложение Fel d 1 любым способом, известным в данной области. Например, разложение Fel d 1 можно измерять с помощью ELISA и/или ДСН-ПААГ или их комбинации. В конкретном варианте осуществления анализы ELISA используются для количественного определения связывания Fel d 1 с антителами, специфичными к Fel d 1, после воздействия протеазы (протеаз).
В одном варианте осуществления протеазную активность измеряют и стандартизируют с применением стандартного протеазного анализа. С помощью такого анализа можно стандартизировать показатели протеазной активности для разных протеаз и условий анализа. Типичная система для анализа протеазной активности включает в себя субстрат протеазы и подходящий буфер для поддержания протеазной активности, а также может включать в себя разбавители или растворители и другие средства, подходящие для активности протеаз (например, цистеин). Как правило, субстрат выполнен таким образом, что в результате расщепления субстрата протеазой создается обнаруживаемый продукт. Например, в одном типе протеазного анализа применяется белок, например казеин, дериватизированный таким образом, что он содержит флуорофор, который не гасится до тех пор, пока протеаза не расщепит белок. После расщепления протеазой флуорофор отделяется от гасителя и дает количественно обнаруживаемый сигнал флуоресценции.
Другие типы анализов протеазной активности также подходят для применения. Например, в качестве субстрата в анализе можно использовать сукцинилированный белок, такой как казеин. Гидролиз этого субстрата в присутствии протеазы приводит к высвобождению пептидных фрагментов со свободными концевыми аминогруппами. Эти пептиды вступают в реакцию с тринитробензолсульфоновой кислотой (TNBS) с последующим измерением роста коэффициента поглощения в результате образования аддуктов TNB-пептид желтого цвета.
Показатели активности ферментов, определенные с помощью протеазного анализа, могут быть выражены по существу в относительных единицах продукции в секунду и нормализованы на количество ферментного препарата (ОЕП с-1 г-1). В случае флуоресцентного анализа, такого как описанный выше анализ, показатели активности ферментов могут быть выражены, в относительных единицах флуоресценции в секунду и нормализованы на количество ферментного препарата (ОЕФ с-1 г-1).
Способ включает объединение требуемого количества протеазы со средой. Количество протеазы, предназначенной для включения в состав, зависит от того, будет ли он приготовлен в «готовом к применению» виде или в виде концентрата для последующего разбавления.
В другом аспекте изобретения предусмотрен способ уменьшения или устранения аллергена Fel d 1 из окружающей среды. Способ включает контактирование элемента окружающей среды, в котором присутствует Fel d 1, с составом, содержащим по меньшей мере одну протеазу, которая взаимодействует с Fel d 1 и по существу разлагает аллергенные эпитопы на Fel d 1, таким образом уменьшая или устраняя аллерген Fel d 1 из окружающей среды.
В некоторых вариантах осуществления окружающая среда представляет собой среду «вокруг кошки». В одном варианте осуществления Fel d 1 присутствует на поверхности неодушевленного предмета, и состав наносится на поверхность. Типичные поверхности могут включать в себя, помимо прочего, прилавки, полы, стены, мебель, обивку и одежду. В другом варианте осуществления Fel d 1 переносится по воздуху, и состав контактирует с воздухом. Например, состав может быть расположен внутри фильтра, через который проходит воздух, такого как воздушный фильтр для вентилятора, нагревателя или кондиционера воздуха, или фильтр для пылесоса.
В других вариантах осуществления окружающая среда представляет собой среду «на кошке», и состав наносится на область тела животного, на которой присутствует Fel d 1. Например, Fel d 1 может присутствовать на шерсти, шкуре или снаружи на коже животного или в слюне, осажденной на шерсти, шкуре или коже животного. В других вариантах осуществления окружающая среда представляет собой среду «в кошке», как правило, в полости рта животного, где вырабатывается слюна, содержащая Fel d 1, и состав применяется в виде зубной пасты, ополаскивателя, пищи, лакомства, пленкообразующей или снимаемой пены, или спрея, или напитка.
В другом аспекте изобретения предусмотрено изделие (также называется в настоящем документе «продуктом»), содержащее состав, который включает в себя по меньшей мере одну протеазу, которая взаимодействует с Fel d 1 и по существу разлагает аллергенные эпитопы на Fel d 1, и инструкции по применению для уменьшения или устранения аллергена Fel d 1 из окружающей среды. В одном варианте осуществления продукт может быть введен в состав в виде жидкого, твердого или порошкообразного очищающего средства, спрея, влажной тканевой салфетки, влажной салфетки, губки, водорастворимой таблетки, детергента, дезодоранта для ковровых покрытий и тканей, наполнителя для туалетов, добавки для наполнителя для туалетов, рукавицы, добавки для нетканых или тканых изделий, капсулы (таблетки) для стиральной машины, многокамерной жидкой таблетки для нанесения на поверхность неодушевленного предмета. В другом варианте осуществления продукт может быть введен в состав в виде добавки в воздушный фильтр для контактирования с Fel d 1, который переносится по воздуху.
В других вариантах осуществления продукт вводят в состав для нанесения или введения животному, которое вырабатывает Fel d 1. Например, продукт может быть представлен в виде шампуня, кондиционера, ополаскивателя, мусса, геля, спрея, лосьона или порошка для нанесения на шерсть, шкуру или наружно на кожу животного. Альтернативно продукт может быть представлен в виде зубной пасты, пищевого продукта, лакомства или добавки к пищевому продукту или воде для животного для применения в полости рта животного.
Продукты и изделия, такие как описанные в настоящем документе, могут быть эффективны для инактивации Fel d 1 в окружающей среде. В одном варианте осуществления продукты и/или изделия могут уменьшать или инактивировать Fel d 1 в соответствующих окружающих средах по меньшей мере на 10%. В некоторых аспектах Fel d 1 может быть инактивирован с помощью продуктов и/или изделий по меньшей мере на 50%. В других аспектах Fel d 1 может быть инактивирован по меньшей мере на 1%, 5%, 15%, 20%, 30%, 40%, 60%, 70%, 80%, 90% или даже по меньшей мере на 95%.
В некоторых вариантах осуществления продукт представляет собой пищевой продукт или другую пищевую композицию для уменьшения или устранения аллергенности кошачьего аллергена Fel d 1. В одном варианте осуществления пищевой продукт представляет собой сухой корм для домашних животных или лакомство для домашних животных, содержащее состав, в который входит протеаза. Например, состав можно наносить перед упаковкой или транспортировкой посредством припудривания или глазирования составом сухой пищевой композиции. Поскольку пищевой продукт является сухим, активность протеаз во время транспортировки и хранения может сохраняться. Состав также может быть предложен в виде концентрата, который растворяют перед кормлением, или в виде саше или мешочка, содержащего порошкообразный или гранулированный препарат протеазы, которым можно посыпать пищевую композицию или который можно подмешивать в воду или другие жидкие напитки. Состав может быть предложен в виде жидкого состава, который можно наносить, например, непосредственно на пищевую композицию (сухую, влажную или промежуточную композицию) или добавлять в воду или другие жидкие напитки.
В дополнительном аспекте в настоящем изобретении предложены наборы для уменьшения или устранения аллергенности кошачьего аллергена Fel d 1. В целом эти наборы содержат один из вышеупомянутых составов, содержащих протеазу, и инструкции по их применению для устранения аллергена Fel d 1 из окружающей среды.
В одном варианте осуществления набор содержит композицию для очистки или другого удаления Fel d 1 из окружающей среды вокруг кошки, например с поверхности неодушевленного предмета. Для очистки можно использовать, например, жидкое, твердое или порошкообразное очищающее средство, спрей, влажную тканевую салфетку, влажную салфетку, губку, дезодорант для ковровых покрытий и помещений, гранулы или детергент, причем указанная композиция содержит состав для разложения Fel d 1 вместе с инструкциями по применению. В некоторых вариантах осуществления составы с протеазой могут быть предложены в концентрированном виде, и в инструкциях содержатся указания по разведению. В других вариантах осуществления предложен многокомпонентный набор. Например, очищающий набор может содержать очищающее средство в одном контейнере, а состав с протеазой - в другом контейнере, и в инструкциях может быть указано, как пользователю следует объединять компоненты перед применением. Такие варианты осуществления могут быть особенно полезны, если протеазы в составе чувствительны к ингредиентам в очищающем средстве, так что при длительном воздействии они могут быть инактивированы очищающим средством.
Аналогично набор может содержать композицию для стирки ткани, например жидкую, твердую или порошкообразную композицию, водорастворимую таблетку или капсулу (таблетку) для стиральной машины, причем указанная композиция содержит состав для разложения Fel d 1 вместе с инструкциями по применению. В другом варианте осуществления набор содержит воздушный фильтр, например добавку или фильтр для пылесоса, содержащий состав для разложения Fel d 1, вместе с инструкциями по применению. В этих вариантах осуществления составы с протеазой могут быть также предложены в концентрированном виде, и инструкции могут содержать указания по разведению. В других вариантах осуществления предложен многокомпонентный набор. Например, набор для стирки может содержать детергент для стирки в одном контейнере, а состав с протеазой - в другом контейнере, и в инструкциях может быть указано, как пользователю следует объединять компоненты перед применением. Набор воздушного фильтра может содержать воздушный фильтр и состав с протеазой, а также инструкции по их объединению для уменьшения или устранения Fel d 1, переносимого по воздуху.
В другом варианте осуществления набор содержит средства обработки для применения «на кошке», например на шкуре, шерсти или коже. Такие наборы могут включать в себя мыло, шампунь, порошок, спрей, кондиционер, ополаскиватель, мусс, гель, лосьон, ошейник, диспергатор, влажную рукавицу или влажную салфетку, подходящие для нанесения на кожу, шерсть или шкуру (или состав которых подходит для добавления в любые такие композиции), вместе с инструкциями по применению. Состав, содержащий протеазу, может быть включен в композицию для обработки шкуры/шерсти, или он может быть предоставлен отдельно, в виде концентрата или в другом виде, и смешиваться со средством для обработки шкуры/шерсти перед применением. Наборы также могут содержать комбинацию средств для обработки шкуры/шерсти. Например, набор может содержать рукавицу или тканевую салфетку для протирания шкуры и жидкий состав с протеазой. В инструкциях могут быть предложены указания о том, как пропитывать рукавицу или тканевую салфетку жидкостью и наносить на кошку. В качестве другого примера, набор может содержать шампунь и ополаскиватель, спрей, гель или мусс, причем шампунь представляет собой стандартный шампунь для домашнего животного, который не содержит состав с протеазой, и ополаскиватель, спрей, гель или мусс, содержащий состав с протеазой.
В другом варианте осуществления набор содержит композицию для перорального введения, например жидкую, твердую или порошкообразную композицию, влажную тканевую салфетку, влажную салфетку, зубную пасту или жидкость для полоскания рта, причем указанная композиция содержит состав для разложения Fel d 1, подходящий для применения в полости рта (или состав которого подходит для добавления в любые такие композиции), вместе с инструкциями по применению. В другом варианте осуществления набор представляет собой стоматологический набор, содержащий водорастворимую таблетку, которую можно вводить животному, например, путем растворения в питьевой воде.
В другом варианте осуществления набор содержит композицию в съедобной форме, описанную в настоящем документе, в саше или мешочке, прикрепленном к пищевой композиции, такой как упаковка с кормом для домашних животных, или рекомендованную для применения с ним, вместе с инструкциями по смешиванию пищевой композиции с кормом, добавлению композиции в пищу или растворению, смешиванию или добавлению композиции в жидкость, предназначенную для введения животному, получающему пищу, например, в питьевую воду. В другом варианте осуществления набор содержит по меньшей мере пищевую композицию, описанную в настоящем документе, содержащую состав для разложения Fel d 1, вместе с инструкциями по применению. В другом наборе предложен концентрированный вид композиции, а также предусмотрено приспособление или устройство для удобного измерения подходящего; количества концентрата для смешивания, добавления, разбавления или растворения с пищей или жидкостью, которые предлагаются животному. В одном наборе предложена композиция в съедобном виде в удобной дозировке и в комплекте из идентичных упаковок таким образом, что одну упаковку композиции добавляют в одну упаковку (например, емкость) с кормом для домашних животных без необходимости в измерении. Такие наборы могут быть предложены таким образом, что в месте покупки к пакету для каждой упаковки корма для домашних животных добавляют одну упаковку с составом для разложения Fel d 1. Например, двенадцать емкостей с кормом и двенадцать упаковок с композицией упаковывают вместе в один набор.
В любом из описанных выше вариантов осуществления набор может содержать композицию в концентрированном или другом виде, инструкции по применению, включая при необходимости инструкции для получения соответствующего разведения и необязательно один или более из разбавителя или наполнителя, приспособление или измерительное устройство для получения подходящего разведения и аппликатор, такой как разбрызгиватель, распылитель, влажную салфетку или т.п. Такие наборы могут применяться для композиций, составленных для обработки поверхностей, для обработки воздуха в окружающей среде или для обработки животного композицией для наружного применения.
В случае всех таких наборов они могут включать в себя устройства, аппликаторы, разбавители и т.п., которые являются автоматическими или автоматизируют дозирование, разбавление, смешивание, добавление или нанесение композиции для соответствующего применения. Любой из наборов, описанных в настоящем документе, может быть предложен в виде саше или комплекта с другими продуктами для максимального удобства, соблюдения и эффективности применения и покупки. Таким образом, наборы могут включать в себя или могут находиться в комплекте с любым или всеми пищевыми продуктами для домашнего животного, подстилкой для домашнего животного, шампунем или косметическими средствами для домашнего животного, лекарственным препаратом для домашнего животного.
Любой из вышеупомянутых наборов и другие наборы также могут быть предложены в виде виртуальных наборов. Когда набор содержит виртуальную упаковку, в нем предложены инструкции в виртуальной среде в комбинации с одним или более физическими компонентами набора, такими как описанные выше компоненты. Набор содержит по меньшей мере одну композицию, описанную в настоящем документе, и другие компоненты, в том числе необязательные компоненты. Наборы могут содержать компоненты набора в любых из различных комбинаций и/или смесей. В одном варианте осуществления набор включает в себя пакет, содержащий одну или более композиций, и контейнер с кормом для потребления животным. Набор может содержать дополнительные предметы, такие как устройство для смешивания композиций и ингредиентов или устройство для размещения смеси, например миску для корма. В другом варианте осуществления композиции смешивают с дополнительными питательными добавками, такими как витамины и минеральные вещества, которые способствуют хорошему здоровью животного. Дополнительная информация и инструкции предложены в предлагаемой покупателю виртуальной среде, т.е. указания для веб-сайта, службу ответа по факсу или включенное считываемое компьютером устройство, такое как CD-ROM, и/или прикладная программа (арр) для устройства.
В другом аспекте в изобретении предложены средства коммуникации или средства для передачи информации или инструкций по одному или более из составов, способов, композиций, изделий, продуктов и/или наборов, описанных в настоящем документе, для снижения аллергенности или уменьшения количества аллергена Fel d 1 в окружающей среде. В различных вариантах осуществления информация относится к составам, композициям, изделиям или продуктам настоящего изобретения. В других вариантах осуществления информация относится к способам или наборам, описанным в настоящем документе, которые применяются для реализации изобретения на практике. В других вариантах осуществления информация относится к комбинациям любого из вышеперечисленного.
Средства коммуникации содержат одно или более из текстовой; информации, звуковой информации, неподвижных или движущихся изображений, включая анимации или видео. В различных вариантах осуществления средства коммуникации представляют собой одно или более из напечатанного документа, статического или Динамического электронного документа, например гипертекстового документа, считываемого компьютером, или цифрового носителя данных, включая, без ограничений, электронный, оптический или магнитный носитель любого типа, аудиоинформацию, аудио, аудиовизуальную или визуальную демонстрацию или презентацию, или видеоинформацию, как бы она ни была закодирована, причем средство коммуникации показывает или содержит информацию или инструкции, содержащие любую из вышеупомянутой информации. В некоторых вариантах осуществления средства коммуникации представляют собой веб-сайт, страницу или файл «часто задаваемые вопросы» (FAQ), электронный файл или набор из двух или более электронных файлов одного или разных типов, электронную почту или файл электронной почты, визуальную демонстрацию, информационный киоск, брошюру, рекламу, этикетку для упаковки или продукта, листок-вкладыш в упаковку или продукт, рекламный проспект, объявление службы общественной информации, магнитофонный или электронный аудиофайл, включенный в какой-либо носитель информации, считываемый аппаратом или компьютером, видеопленку, видеодиск или электронный видеофайл, включенный в какой-либо носитель информации, считываемый аппаратом или компьютером, DVD, CD-ROM, прикладную программу или т.п. или любую комбинацию из вышеперечисленных средств, содержащую такую информацию или инструкции. Полезная информация включает в себя одно или более из (1) способов и методик объединения и введения аллерген-специфичных молекул и/или других компонентов; (2) контактной информации для людей с аллергией к животным или их опекунов или лиц, осуществляющих уход, полезной в том случае, если у них есть вопрос о наборе, композиции или их применении; (3) информации о питательности пищевых композиций и других компонентах, предоставленных в любом наборе; (4) информации по безопасности, включая, например, информацию об экстренных ситуациях, и дополнительных контактов в случае нежелательной реакции; информации о токсикологическом контроле, перечня данных по безопасности материалов; (5) информации, необходимой для повторного заказа, например, через автоматические системы исполнения; (6) общей информации об аллергиях, аллергенах окружающей среды и способах сведения к минимуму или устранения конкретных аллергенов окружающей среды. Подходящие инструкции могут включать в себя информацию о количествах для смешивания, количествах для введения и о частоте применения. Средства коммуникации пригодны для инструктирования о преимуществах применения настоящего изобретения и предоставления информации об одобренных способах применения изобретения у животного.
В другом аспекте изобретения предложена упаковка, содержащая любое одно или более из составов, композиций, продуктов и/или наборов, описанных в настоящем документе. К упаковке прикреплена этикетка, содержащая слово или слова, рисунок, символ, конструктивную деталь, акроним, слоган, фразу или другое устройство или их комбинацию («устройство» этикетки), которая указывает на то, что содержимое упаковки включает в себя состав с протеазой для уменьшения или устранения аллергена Fel d 1 из окружающей среды.
Примеры
Различные аспекты изобретения можно дополнительно проиллюстрировать представленными ниже примерами. Следует понимать, что эти примеры представлены только для целей иллюстрации и не ограничивают объем изобретения, описанного в настоящем документе, если специально не указано иное.
Пример 1
Набор из 32 протеаз в комбинации с химическими средствами, такими как цистеин, тестировали на способность разлагать Fel d 1. Без ограничения конкретным механизмом, целью катализируемой ферментами инактивации Fel d 1 было определение того, какие протеазы могут разлагать Fel d 1 так, чтобы антитела IgE были неспособны распознавать Fel din связываться с ним, приводя к неспособности устанавливать иммунный ответ и формировать аллергическую реакцию. Протеазы-кандидаты выбирали из нескольких различных семейств протеаз, в том числе сериновых протеаз, тиоловых протеаз, протеаз аспарагиновой кислоты и цинковых металлопротеаз.
Для стандартизации показателей активности и определения оптимальных условий реакции для каждой протеазы-кандидата использовали набор для протеазного анализа ENZCHEK® Protease Assay Kit (зеленая флуоресценция) производства компании Invitrogen, Inc. (г. Карлсбад, штат Калифорния, США) на основе казеина в качестве субстрата, дериватизированного таким образом, что он содержит флуорофор, который не гасится до расщепления протеазой. Показатели активности ферментов, определенные с помощью протеазного анализа, могут быть выражены в относительных единицах флуоресценции в секунду и нормализованы на количество ферментного препарата (ОЕФ с-1 г-1). Для определения соответствующих условий реакции для различных классов ферментов тестировали различные буферы и условия рН при 37°С. В таблице 2 приведены значения рН буфера с лучшими характеристиками и активность (увеличение флуоресценции в секунду, ОЕФ с-1) в расчете на количество препарата протеазы (г-1) по результатам протеазного анализа ENZCHEK® Protease Assay.
Большинство протестированных протеаз (сериновые протеазы, тиоловые протеазы и цинковые металлопротеиназы) продемонстрировали оптимальную активность в реакционных буферах при рН 7,8. Оптимальную активность протеаз аспарагиновой кислоты наблюдали при рН 4,0 или рН 6,0. Некоторые сериновые протеазы и протеазы аспарагиновой кислоты активировали путем добавления соли/ионов кальция (Са2+). Тиоловые протеазы были существенно более активными при добавлении в реакционный буфер цистеина. Эндопротеиназа Lys-C была единственной протеазой, которая в условиях тестирования не демонстрировала активности в протеазном анализе ENZCHEK® Protease Assay.
Чтобы охарактеризовать разложение Fel d 1, различные концентрации протеаз-кандидатов инкубировали с Fel d 1 при 37°С в течении ночи (~18 часов) с последующим разделением белков с помощью гель-электрофореза (ДСН-ПААГ в невосстанавливающих условиях) и окрашивания COOMASSIE®. Типичная реакционная смесь для тестирования разложения Fel d 1 содержала 2,5 мкг натурального Fel d 1 (nFel d 1, LOTOX®, натуральный Feld d 1 получали от компании Indoor Biotechnologies (LTN-FD1-1)) и различные концентрации протеаз-кандидатов в общем объеме реакционной смеси 20 мкл (конечная концентрация Fel d 1 составляла 125 мкг мл-1). Было отмечено, что Fel d 1 представляет собой тетрамерный гликопротеин с массой 35 кДа, образованный двумя гетеродимерами с массой 18 кДа. Таким образом, разложение Fel d 1 оценивали по степени исчезновения полосы белка Fel d 1 на приблизительно 18 кДа. Для большинства протеаз условия оптимизировали для стимулирования полного разложения Fel d 1 минимальной протеазной активностью. Для всех тестируемых протеаз минимальную активность (ОЕФ с-1), а также соответствующее количество фермента (мкг), необходимое для полного разложения 2,5 мкг Fel d 1 в 20 мкл буфера (при оптимальном рН для соответствующей протеазы), оценивали на основании отсутствия полосы Fel d 1 в геле ДСН-ПААГ. Результаты приведены в таблице 2.
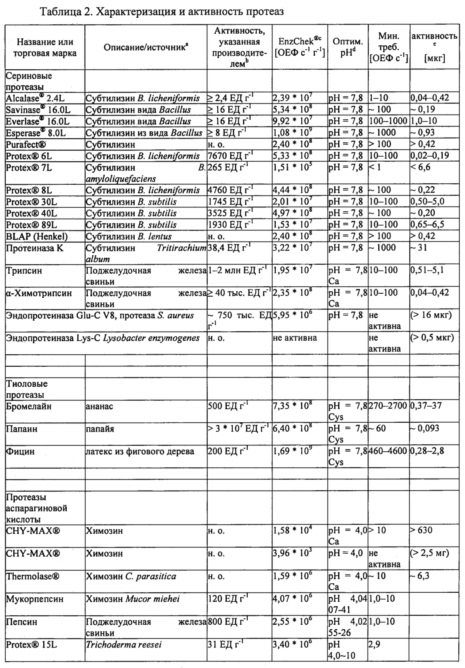
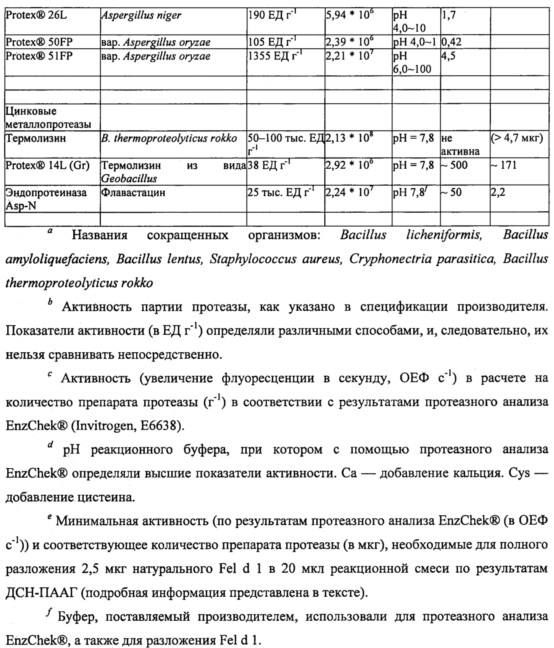
Различные сериновые протеазы-кандидаты были протестированы на способность разлагать Fel d 1. Например, определяли протеолитическую активность субтилизина из В. licheniformis (bl) (ALCALASE® 2.4L, Novozymes A/S Bagsvaerd, Дания) относительно Fel d 1. Натуральный Fel d 1 (1,9 мкг) инкубировали с 0,1, 1 или 10 ОЕФ с-1 субтилизина bl в течение ночи при 37°С в 20 мкл буфера трис/HCl (200 мМ, рН 7,8) или аммоний-ацетатного буфера (100 мМ, рН 4,0). В качестве контрольных образцов использовали субтилизин (10 ОЕФ с-1) без Fel d 1 и Fel d 1 без субтилизина. В соответствии с результатами ДСН-ПААГ и окрашивания COOMASSIE® (фиг. 1) Fel d 1 полностью разлагался при воздействии 10 ОЕФ с-1 субтилизина bl в условиях буфера трис/HCl, но не аммоний-ацетатного буфера. Эти эксперименты показали, что минимальное количество субтилизина bl, необходимое для полного разложения 1,9 мкг Fel d 1 в 20 мкл буфера трис/HCl, составляет 1-10 ОЕФ с-1 (0,04-0,42 мкг).
Для определения минимального количества протеазы, необходимого для разложения Fel d 1, также оценивали субтилизины из В. clausii (be) (SAVINASE® 16.0L, EVERLASE® 16.0L, Novozymes) и В. halodurans (bh) (ESPERASE® 8.0L, Novozymes). В этих экспериментах натуральный Fel d 1 (2,5 мкг) инкубировали с 100 или 1000 ОЕФ с-1 соответствующего субтилизина в течение ночи при 37°С в 20 мкл натрий-фосфатного буфера (100 мМ, рН 7,8). В качестве контрольных образцов использовали протеазу (1000 ОЕФ с-1) без Fel d 1 и Fel d 1 без протеазы. Минимальные количества соответствующих протеаз, необходимые для разложения 2,5 мкг Fel d 1 в 20 мкл, представлены в таблице 2.
Растительные тиоловые протеазы бромелайн, папаин и фицин из съедобных растений ананаса, папайи и фигового дерева, соответственно, оценивали на разложение Fel d L Для проведения экспериментов ДСН-ПААГ натуральный Fel d 1 (2,5 мкг) инкубировали в течение ночи при 37°С с различными количествами папаина, бромелайна или фицина в натрий-фосфатном буфере (100 мМ, рН 7,8), содержащем 40 мМ цистеина. В качестве контрольных образцов использовали только буфер с цистеином, фермент без Fel d 1 в буфере без цистеина и Fel d 1 без фермента (с цистеином и без него). В соответствии с результатами ДСН-ПААГ и окрашивания COOMASSIE® все тиоловые протеазы (бромелайн, папаин и фицин) могли полностью разлагать Fel d 1. Как показано в таблице 2, оптимальные условия для бромелайна, папаина и фицина, определенные посредством протеазного анализа ENZCHEK® Protease Assay, включают в себя рН 7,8 в присутствии цистеина. Более конкретно, по результатам протеазного анализа ENZCHEK® Protease Assay добавление 40 мМ цистеина повышало показатели активности каждого из бромелайна, папаина и фицина в 270, 60 и 460 раз соответственно. В таблице 2 показаны минимальные количества этих протеаз, необходимые для разложения 2,5 мкг Fel d 1 в 20 мкл буфера, содержащего цистеин.
Кроме того, обе протеазы аспарагиновой кислоты, эндотиапепсин из Cryphonectria parasitica (THERMOLASE®, Chr. Hansen, г. Херсхольм, Дания) и химозин бычьего происхождения (CHY-MAX®, Chr. Hansen, г. Херсхольм, Дания), были оптимально активны при рН 4,0 в присутствии солей/ионов кальция (Са2+) (таблица 2). Натуральный Fel d 1 (2,5 мкг) инкубировали в течение ночи при 37°С с 0,1, 1 или 10 ОЕФ с-1 протеаз в 20 мкл аммоний-ацетатного буфера (100 мМ, рН 4,0), содержащего 10 мМ хлорида кальция. В качестве контрольных образцов в этом эксперименте использовали буфер без Fel din Fel d 1 без фермента. В таблице 2 показаны минимальные количества протеаз, необходимые для разложения 2,5 мкг Fel d 1 в 20 мкл буфера, для двух протеаз аспарагиновой кислоты.
Некоторые из протеаз-кандидатов были протестированы на их способность разлагать 2,5 мкг натурального Fel d 1 в 20 мкл оптимального реакционного буфера при 37°С в течение небольших моментов времени инкубации путем добавления ингибитора протеазы через один или два часа, чтобы остановить реакцию. Реакции визуализировали посредством ДСН-ПААГ с последующим окрашиванием COOMASSIE®. Было обнаружено, что для полного разложения Fel d 1 в течение одного часа инкубации при использовании в качестве ингибитора 1 мМ фенилметилсульфонилфторида (ФМСФ) было достаточно 50 ОЕФ с-1 (2,1 мкг) субтилизина bl (ALCALASE® 2.4L). Кроме того, 600 ОЕФ с-1 (0,93 мкг) папаина разлагали большую часть Fel d 1 через один час инкубации при использовании в качестве ингибитора 10 мкМ Е64. 500 ОЕФ с-1 (171 мкг) термолизина из вида Geobacillus (PROTEX® 14L, DuPont Industrial Biosciences) было достаточно для полного разложения 2,5 мкг Fel d 1 после инкубации в течение ночи, но при использовании в качестве ингибитора 10 мМ этилендиаминтетрауксусной кислоты (ЭДТА) через два часа инкубации наблюдалось лишь частичное разложение. Кинетические исследования с использованием ингибиторов протеазы показали, что полного разложения Fel d 1, как правило, можно добиться за меньшее время путем повышения концентрации протеазы. Аналогично, большие количества Fel d 1 могут разлагаться путем повышения концентрации протеазы.
Таким образом, результаты экспериментов протеолиза Fel d 1 с использованием панели из 32 протеаз-кандидатов показали, что протеазы из всех классов могли полностью разлагать Fel d 1. Как показано в таблице 2, протеазы-кандидаты продемонстрировали различные степени активности относительно разложения Fel d 1. Большинство протеаз-кандидатов могли разлагать 2,5 мкг Fel d 1 в 20 мкл при активности менее чем 100 ОЕФ с-1.
Затем с помощью ELISA определяли способность антител, специфичных к Fel d 1, распознавать и связывать Fel d 1 после протеолиза. Натуральный Fel din антитела, специфичные к Fel d 1, получали от компании Indoor Biotechnologies Ltd (Indoor Biotechnologies Ltd, г. Кардифф, Уэльс). Условия ELISA определяли таким образом, чтобы обеспечить надежное количественное определение натурального Fel d 1 в диапазоне концентраций от 0,3 до 12 нг мл-1. Различные протеазы-кандидаты, как показано на фиг. 2, инкубировали с Fel d 1 (2,5 мкг) в течение ночи в 20 мкл оптимального буфера при минимальных показателях активности, необходимых для достижения полного разложения Fel d 1 (см. оптимизированные условия, приведенные в таблице 2). Образцы разводили до конечной теоретической концентрации Fel d 1, составляющей 12 нг мл-1 (начальная концентрация субстрата), и анализировали с помощью ELISA в двух различных временных точках считывания результата анализа (20 и 30 минут). После инкубации Fel d 1 с протеазой-кандидатом для захвата Fel d 1 использовали планшеты, покрытые антителом к Fel d 1. Затем добавляли связанное с ферментом детекторное антитело, которое связывается с Fel d 1, с последующим добавлением субстрата, который был ферментативно преобразован в обнаруживаемый сигнал. Если под действием протеаз Fel d 1 разлагается так, что эпитопы Fel d 1, необходимые для связывания с антителом к Fel d 1, более не присутствуют и/или недоступны, антитела к Fel d 1 не будут связываться с Fel d 1 и в анализе ELISA не будет обнаруживаться сигнал. В качестве контрольного образца для проверки того, что анализ ELISA не влиял на протеазную активность, этот анализ повторяли, но с добавлением определенного количества Fel d 1. Для подтверждения разложения Fel din результатов ELISA для всех тестируемых протеаз проводили описанные выше эксперименты ДСН-ПААГ.
Результаты показаны на фиг. 2. Как показано, полное подавление связывания Fel d 1 с антителами, специфичными к Fel d 1, было достигнуто при использовании нескольких сериновых протеаз субтилизинов, а также трипсина и альфа-химотрипсина; тиоловых протеаз папаина, бромелайна и фицина; протеаз аспарагиновой кислоты, мукорпепсина/реннина, пепсина, аспергиллопепсина, эндотиапепсина и химозина; а также цинковых металлопротеаз термолизина (из Geobacillus) и эндопротеиназы Asp-N. Полного разложения Fel d 1 можно достичь путем повышения концентрации некоторых других протеаз. ДСН-ПААГ дополнительно подтверждал разложение Fel d 1 этими протеазами. Эксперименты ELISA и ДСН-ПААГ в совокупности демонстрируют, что связывание с антителом коррелирует с разложением Fel d 1. Для всех тестируемых протеаз степень разложения Fel d 1, по оценке посредством ДСН-ПААГ, соответствует остаточной концентрации Fel d 1, определенной с помощью ELISA. Без ограничения конкретным механизмом, эти результаты показывают, что продукты разложения Fel d 1 более не содержат эпитопы, которые связываются с антителами, специфичными к Fel d 1, и что катализируемое протеазой разложение Fel d 1 приводит к подавлению связывания Fel d 1 с антителами, специфичными к эпитопу Fel d 1. Таким образом, ожидается, что разложение Fel d 1 протеазами может подавлять аллергические реакции, опосредованные IgE. Большинство тестируемых протеаз были способны полностью разлагать Fel din подавлять связывание полученных продуктов разложения с антителами, специфичными к эпитопу. Характерные протеазы из этих экспериментов, способных полностью разлагать Fel d 1 (далее они называются «хитовыми» протеазами), включают в себя папаин, субтилизин из В. licheniformis (субтилизин bl, PROTEX® 6L), аспергиллопепсин из А. oryzae (аспергиллопепсин ао, PROTEX® 50FP), эндопротеиназу Asp-N, бромелайн, фицин, альфа-химотрипсин, эндотиапепсин из Cryphonectria parasitica (эндотиапепсин ср, THERMOLASE®), пепсин и термолизин из вида Geobacillus (PROTEX® 14L). В таблице 3 приведены свойства этих «хитовых» протеаз с подробной информацией, содержащейся в представленных ниже примерах.
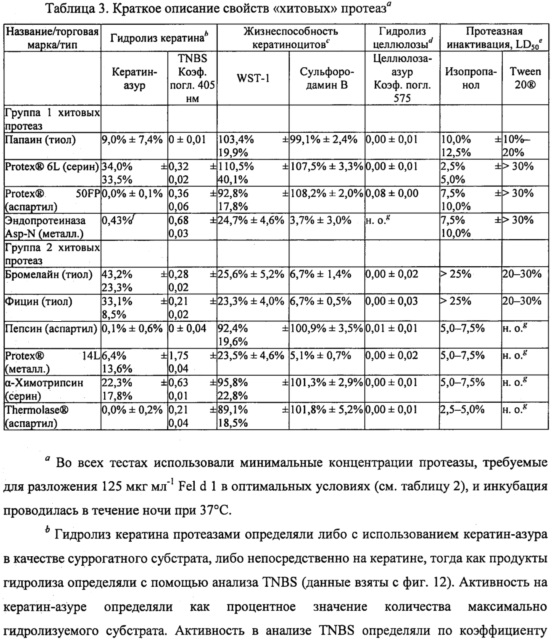

Пример 2
Во всех вариантах применения с использованием опосредованного протеазами разложения Fel d 1 кошка и пользователь будут подвергаться воздействию протеазной активности. Нити белка кератина в большом количестве присутствуют в кератиноцитах рогового слоя эпидермиса (кожи), а также в волосах и ногтях людей и кошек. Таким образом, идентификация протеаз-кандидатов, разлагающих Fel d 1, с пониженной протеолитической активностью в отношении кератина была бы полезна для решения проблем безопасности при разработке продуктов, предназначенных для применения у человека и животных.
Чтобы охарактеризовать субстратную специфичность активных протеаз-кандидатов в отношении физиологически релевантных белков, определяли способность хитовых протеаз-кандидатов, разлагающих Fel d 1, гидролизовать кератин. Кератин-азур (Sigma-Aldrich, K8500) состоит из кератина овечьей шерсти, пропитанного красителем азуром, и используется в качестве субстрата кератина для количественного определения протеазной активности. Кератин-азур инкубировали в течение ночи с хитовыми протеазами в оптимальных условиях (как определено в протеазном анализе ENZCHEK®) и с концентрациями протеаз, которые, как было обнаружено, полностью разлагают 125 мкг мл-1 Fel d 1 (таблица 2). Затем определяли разложение кератин-азура. В трех повторах значительную активность разложения воспроизводимо определяли в этом анализе только для тиоловых протеаз бромелайна и фицина, которые разлагали 43,2%±23,3% и 33,1±8,5% используемого кератин-азура соответственно (таблица 3). Аспартиловые протеазы аспергиллопепсин из A. oryzae (аспергиллопепсин ао, PROTEX® 50FP), эндотиапепсин из Cryphoneciria parasitica (эндотиапепсин ср, THERMOLASE®) и пепсин не были активными, поскольку в среднем они разлагали менее чем 1% кератин-азура (таблица 3).
Чтобы дополнительно охарактеризовать разлагающее действие хитовых протеаз на кератин, выполняли колориметрическое определение продуктов разложения кератина с помощью реакции связывания с реагентом тринитробензолсульфоновой кислотой (TNBS). Этот анализ позволил определить гидролизующую активность всех протестированных ферментов с использованием порошкообразного кератина из овечьей шерсти в качестве субстрата. Папаин и пепсин не продемонстрировали разлагающего действия на кератин. Все другие хитовые протеазы были активными в отношении субстрата кератина. Разлагающее действие термолизина из Geobacillus на кератин было по меньшей мере в два раза выше по сравнению со всеми другими протестированными протеазами (фиг. 3). Результаты анализа кератин-азура, описанного выше, коррелировали с результатами анализа кератина на основе TNBS, за исключением двух протеаз аспарагиновой кислоты: аспергиллопепсина ао и эндотиапепсина ср (таблица 3). На измерения разлагающего действия этих двух протеаз на кератин (протеазы аспарагиновой кислоты и эндопротеиназа Asp-N) могли повлиять условия буфера, как определено посредством анализа TNBS. Это может быть связано с тем, что аммоний-ацетатный буфер (100 мМ, рН 4,0) и буфер с эндопротеиназой Asp-N (поставляемый производителем) при проведении анализа продемонстрировали основной уровень разлагающего действия на кератин в отсутствие протеазы. Кроме того, в анализе на основе TNBS протеолиз определяют непосредственно на кератине, тогда как в анализе с кератин-азуром используют субстрат из дериватизированного кератина, что может также объяснить несоответствия между результатами двух анализов для некоторых из тестируемых хитовых протеаз.
Цитотоксические эффекты хитовых протеаз были протестированы на кератиноцитах, которые использовали в качестве модели живых клеток кожи. Первичную линию клеток кератиноцитов человека культивировали в микропланшетах до конфлюэнтности и тестировали на жизнеспособность клеток после инкубации в течение ночи с минимальными концентрациями хитовых протеаз, которые, как было установлено, полностью разлагают 125 мкг мл-1 Fel d 1 (таблица 2). Поскольку культивируемые клетки млекопитающих в значительной степени чувствительны к изменениям в композиции и рН среды для культивирования клеток, протеазы разводили непосредственно в среде для культивирования клеток. После инкубации с протеазами в течение ночи к клеточной культуре (конфлюэнтный слой и среда) добавляли водорастворимый тетразолий WST-1 (реагент клеточной пролиферации WST-1, Roche Diagnostics). Бесцветный WST-1 восстанавливался до желтого красителя (формазана) вследствие переноса электрона, катализируемого митохондриальными дегидрогеназами живых клеток. Таким образом, образование желтого красителя указывает на жизнеспособность как прикрепленных, так и отдельных клеток. Жизнеспособность только прикрепленных клеток определяли с помощью окрашивания сульфородамином В после инкубации в течение ночи с протеазами. Образование красного цвета является показателем концентрации белка, которая коррелирует с концентрацией прикрепленных клеток. В качестве контрольного образца использовали клетки, которые не инкубировали с протеазами. Для всех протестированных протеаз в обоих анализах были получены сопоставимые результаты (Фиг. 4, таблица 3). Как можно видеть, относительно высокий цитотоксический эффект (низкая жизнеспособность оставшихся клеток) был определен для бромелайна, фицина, термолизина из Geobacillus и эндопротеиназы Asp-N. Все другие хитовые протеазы (папаин, аспергиллопепсин ао, пепсин, эндотиапепсин ср, субтилизин bl и альфа-химотрипсин) не оказывали существенного воздействия на жизнеспособность клеток по сравнению с необработанными клетками (в этом случае жизнеспособность клеток соответствует 100%).
Для протеаз, провоцировавших цитотоксические эффекты в отношении кератиноцитов, невозможно с уверенностью прогнозировать раздражающее воздействие на кожу, поскольку кератиноциты кожи защищены несколькими слоями кератина. Однако для протеаз, которые не провоцируют цитотоксические эффекты, раздражающие воздействия на кожу маловероятны.
Результаты анализа цитотоксичности (фиг. 4) были разделены в меньшей степени, чем в анализе TNBS разложения кератина (фиг. 3). Протеазы либо имели значительный цитотоксический эффект, либо не вызывали цитотоксичности. Однако существовала корреляция между результатами двух анализов. Например, папаин и пепсин не продемонстрировали эффект ни в одном анализе. С другой стороны, цитотоксические эффекты бромелайна, фицина, термолизина Geobacillus и эндопротеиназы Asp-N на кератиноциты были подтверждены анализом TNBS.
Для дальнейшей оценки активности папаина кератиноциты инкубировали в среде для культивирования клеток в течение ночи с папаином в концентрациях, превышающих минимально требуемую концентрацию протеазы, приведенную в таблице 2, в 1000 раз. Это привело к значительным цитотоксическим эффектам, причем жизнеспособность клеток составила 31% и 8% в соответствии с результатами анализов с WST-1 и сульфородамином В соответственно. Для большинства вариантов косметического применения не требуется инкубация в течение ночи. Микроскопическое исследование показало отсутствие значимого открепления клеток после первого часа инкубации даже при увеличенной в 1000 раз концентрации папаина, что указывает на отсутствие цитотоксических эффектов в этот ранний момент времени.
Воздействие препаратов протеазы на волокна целлюлозы тестировали с использованием целлюлозы-азур (Sigma-Aldrich, г. Сент-Луис, штат Миссури, США), которая представляет собой субстрат, аналогичный кератин-азуру. Этот эксперимент проводили для оценки воздействия препаратов хитовых протеаз на хлопчатобумажные ткани. Протеолитический гидролиз целлюлозы определяли с использованием целлюлозы-азур в качестве суррогатного субстрата. Анализ выполняли в двух повторах и в соответствии с рекомендациями производителя. Активность в отношении гидролиза целлюлозы соответствует высвобождению красителя азура, который определяли спектрофотометрически на 575 нм. В качестве положительного контроля использовали 2,5 единицы целлюлазы из Aspergillus niger (Sigma-Aldrich, C1184), и при измерении он имел коэффициент поглощения 0,28±0,01. Из десяти хитовых протеаз только аспергиллопепсин ао (PROTEX® 50FP) продемонстрировал значительную активность при инкубации в течение ночи в буфере, оптимальном для разложения Fel d 1 (таблица 2), что соответствует 28%±2% активности положительного контроля (таблица 3). Целлюлазная активность этой (или любой другой) протеазы была неожиданной, поскольку протеазы, как правило, не используют полисахариды в качестве субстрата. Предположительно этот препарат протеазы представляет собой неочищенный экстракт перепроизводства протеазы из Aspergillus oryzae и, следовательно, содержит другие ферменты, вырабатываемые хозяином экспрессии, такие как целлюлазы.
Большинство хитовых протеаз показали отсутствие или лишь незначительную кератинолитическую активность или цитотоксические эффекты (фиг. 3 и 4 и таблица 3). За исключением препарата аспергиллопепсин ао (PROTEX® 50FP), хитовые протеазы не проявляли активность на целлюлозе-азур, что свидетельствует об их неспособности к разложению хлопчатобумажных тканей. Кроме того, использование в косметических продуктах высоких концентраций протеаз, таких как папаин, указывает на то, что их применение для разложения Fel d 1 может быть безопасно как для пользователя, так и для кошки.
Пример 3
Потенциальные варианты применения включают в себя очищающие средства или влажные салфетки, например, для очистки мебели или других поверхностей, загрязненных Fel d 1. Типичные очищающие средства содержат растворители, такие как денатурированный этанол или изопропанол, в качестве дезинфицирующих средств и средств для растворения жира и замасливателя. Концентрация изопропанола в типичном очистителе для ванной составляет 10-15%. Однако растворители, такие как изопропанол, могут инактивировать ферменты, такие как протеазы. Таким образом, активность хитовых протеаз тестировали в средах, содержащих изопропанол. Поскольку очищающие средства, как правило, разводят водой, разлагающее действие хитовых протеаз на Fel d 1 тестировали в присутствии изопропанола в концентрациях от 0 до 12,5%.
Хитовые протеазы инкубировали в течение ночи с 0, 2,5%, 5,0%, 7,5%, 10,0% и 12,5% изопропанола в концентрациях и в условиях реакции, оптимальных для разложения Fel d 1 (таблица 2). Образцы разводили и анализировали с помощью ELISA со считыванием результатов анализа в момент времени 20 минут. Как показано на фиг.5, остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов, по сравнению с Fel d 1 для соответствующих буферных контролей с максимальной концентрацией изопропанола, но без протеазы. На фиг. 5 показаны средние значения и стандартные отклонения в трех независимых повторах.
За исключением бромелайна и фицина, активность всех протеаз в присутствии 12,5% изопропанола снижалась по меньшей мере на 50%. Наименее чувствительными к изопропанолу были тиоловые протеазы. Папаин, бромелайн и фицин разлагали приблизительно 40-70% добавленного Fel d 1 даже в присутствии 12,5% изопропанола (фиг. 5). В дополнительном эксперименте с 25% изопропанола бромелайн и фицин разлагали более 50% Fel d 1. В противоположность этому протеазы аспарагиновой кислоты были наиболее чувствительны к изопропанолу. В присутствии 12,5% изопропанола наблюдалась инактивация аспергиллопепсина ао (PROTEX® 50FP), пепсина и эндотиапепсина ср более чем на 90%. В качестве контроля в экспериментах с ELISA было обнаружено, что изопропиловый спирт сам по себе значительно не снижал концентрацию Fel d 1. Учитывая это, очевидно, что бромелайн или фицин представляют собой протеазы, которые особенно подходят для разложения Fel d 1, присутствующего в пыли или на поверхностях, с помощью очищающего средства, содержащего изопропанол. Эти протеазы активно разлагали Fel d 1 даже при концентрациях изопропанола, превышающих концентрации, которые используются в типичных вариантах применения для уборки.
Поскольку контакт с кожей, шерстью и шкурой является минимальным и преходящим, не предполагается, что более высокие показатели кератинолитической активности бромелайна и фицина будут оказывать вредное воздействие по сравнению с другими тестируемыми протеазами. Кроме того, бромелайн и фицин обычно считаются безопасными при использовании в косметике (см. выше) или при обработке пищи (например, в качестве размягчителя мяса).
Пример 4
Потенциальные варианты применения для снижения концентрации Fel d 1 на шкуре кошки включают в себя, среди прочих композиций, шампуни или сухие порошки, пены/муссы, содержащие протеазы. По оценкам, в общей сложности на кошке содержится 67 мг Fel d 1. Хотя лишь небольшая часть аллергена переходит в переносимые по воздуху частицы, большое количество Fel d 1 на кошке указывает на значимые преимущества, обеспечиваемые уменьшением количества Fel d 1 в или на шкуре и/или коже кошки. Сообщалось, что применение у кошек обычных шампуней для домашних животных снижает концентрацию Fel d 1 в шерсти, а также концентрацию переносимого по воздуху Fel d 1 в доме, где живет кошка. Эффективность обычных шампуней можно повысить путем добавления протеаз, как описано в настоящем документе.
Большинство составов шампуней содержит смесь различных поверхностно-активных веществ, наибольшим классом из которых являются анионные поверхностно-активные вещества. Неионогенные поверхностно-активные вещества являются вторым по величине классом поверхностно-активных веществ и содержат простой полиэфир или полигидроксильную группу для улучшения растворимости в воде в качестве полярной группы. Неионогенные поверхностно-активные вещества широко используются в средствах для местного применения, поскольку по сравнению с анионными поверхностно-активными веществами они обладают меньшей способностью вызывать раздражение. Это свойство делает неионогенные поверхностно-активные вещества привлекательными для применения в шампунях для домашних животных, содержащих протеазу. TWEEN® 20 (полисорбат 20) часто используется в качестве неионогенного поверхностно-активного вещества в питательных веществах и косметических средствах. В Европейском союзе он зарегистрирован как разрешенная пищевая добавка (Е-432), а также включен в номенклатуру INCI (Международная номенклатура косметических ингредиентов). Поскольку TWEEN® 20 является разрешенной пищевой добавкой, его можно использовать в качестве ингредиента шампуня, и он не вызывает проблем с безопасностью, если кошка случайно проглотит его во время мытья.
Воздействие TWEEN® 20 на разлагающее действие хитовых протеаз относительно Fel d 1 тестировали после инкубации в течение ночи с 0, 10%, 20% и 30% TWEEN® 20, с концентрациями протеаз и в условиях реакции, оптимальных для разложения Fel d 1, как показано в таблице 2. Образцы разводили и анализировали с помощью ELISA со считыванием результатов анализа в момент времени 20 минут. Указанная остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов, по сравнению с Fel d 1 для буферных контролей с соответствующими концентрациями TWEEN® 20, но без протеазы. Средние значения и стандартные отклонения определяли в трех независимых повторах. Все протестированные хитовые протеазы проявили устойчивость к TWEEN® 20. Даже при самой высокой протестированной концентрации 30% TWEEN® 20 ни одна из них не была полностью инактивирована. При концентрации 10% TWEEN® 20 более чем 50% из 125 мкг мл-1 Fel d 1 разлагалось всеми протеазами (фиг. 6, таблица 3). Учитывая, что типичный состав шампуня содержит приблизительно 40% TWEEN® 20 и во время применения он подвергается приблизительно 20-кратному разведению, для сохранения активности разложения Fel d 1 протеазы должны быть активны при концентрациях TWEEN® 20 приблизительно 2%. Таким образом, в соответствии с прогнозами все хитовые протеазы подходят для применения в шампунях.
Продукт для кожи с нейтральным уровнем рН характеризуется уровнем рН приблизительно 5,5, что соответствует уровню рН на коже. TWEEN® 20 даже в самой высокой протестированной концентрации 30% не влиял на разлагающее действие протеазы аспарагиновой кислоты - аспергиллопепсина ао (PROTEX® 50FP) - на Fel d 1 (фиг. 6). Хотя в протеазном анализе ENZCHEK® было установлено, что эта протеаза характеризуется наибольшей активностью при рН 4,0 (см. таблицу 2), она все еще сохраняла 46% активности при рН 6,0. Кроме того, аспергиллопепсин ао (PROTEX® 50FP), не показавший активности разложения при использовании в качестве субстрата кератин-азура (таблица 3), показал лишь минимальную активность в отношении кератина (фиг. 3) и отсутствие значимой цитотоксичности в отношении кератиноцитов (фиг. 4). Эти свойства позволяют предположить, что аспергиллопепсин ао (PROTEX® 50FP) подходит для применения в шампуне, содержащем протеазу, для уменьшения Fel d 1.
Папаин также может быть подходящей альтернативой аспергиллопепсину ао (PROTEX® 50FP) при применении в шампунях. Хотя папаин менее устойчив к TWEEN® 20, чем аспергиллопепсин ао (PROTEX® 50FP), он остается активным при предполагаемых концентрациях TWEEN® 20, которые при применении составляют 2% (фиг. 6). Папаин продемонстрировал сопоставимую активность разложения Fel d 1 при рН 7,4 и рН 6,0, что позволяет применять его в шампуне с нейтральным рН. В анализе TNBS папаин не показал активности в отношении кератина (фиг. 3) и не индуцировал значимую цитотоксичность в отношении кератиноцитов (фиг. 4). Папаин не показал активности на субстрате целлюлозе-азур и, следовательно, скорее всего, не демонстрирует активность разложения в отношении хлопчатобумажных тканей (таблица 3). Папаин также используется в высоких концентрациях в питательных веществах (размягчитель мяса, соусы для барбекю) и косметических средствах (ферментативный пилинг) без необходимости в термоинактивации перед использованием. Папаин с более высокой вероятностью подходит для применения в качестве ингредиента шампуня, даже если кошка случайно проглотит шампунь во время мытья.
Пример 5
Другой вариант применения представляет собой продукт, содержащий протеазу, предназначенный для использования в полости рта кошки, в том числе зубные пасты, ополаскиватели, напитки, корм или лакомства, полоски или пленки. Такие продукты могут снижать концентрацию Fel d 1 во рту кошки - основном источнике аллергена. Для тестирования активности протеаз в условиях, схожих с условиями применения, была создана модель кошачьей слюны. Получение искусственной кошачьей слюны было основано на опубликованных данных получения искусственной слюны человека (McKnight-Hanes & Whitford, 1992, Caries Res. 26: 345-350) (таблица 4).
рН доводят 7,5, что соответствует рН кошачьей слюны. Было установлено, что концентрация Fel d 1 в кошачьей слюне составляет от 0,3 до 45 мкг/мл (вся популяция кошек) и от 2,2 до 12,4 мкг/мл в промежуточной группе, которая представляет собой одну треть всей популяции. Максимальную концентрацию Fel d 1 в искусственной кошачьей слюне определили равной 125 мкг мл-1, поскольку эту концентрацию использовали во всех предыдущих экспериментах, хотя она превышала прогнозируемую максимальную концентрацию Fel d 1 в кошачьей слюне в 2-3 раза.
Для имитации содержания белка в слюне использовали обезжиренное молоко, содержащее приблизительно 35% белка. Обезжиренное молоко также содержит другие компоненты, такие как углеводы, которые связаны со сложным составом настоящей слюны и, следовательно, прогнозировано воспроизводят более реалистичную модель. Сообщалось, что слюна человека у разных индивидов содержит от 0,67 до 2,37 мг мл-1 белка (как определено посредством различных методик с использованием в качестве эталона бычьего сывороточного альбумина). Эта оценка использовалась в качестве приблизительного соответствия содержанию белка в кошачьей слюне. Для искусственной кошачьей слюны было установлено максимальное содержание белка 2,5 мг мл-1, что было представлено 7,14 мг мл-1 обезжиренного молока. Как описано выше, было установлено, что цистеин активирует некоторые протеазы для разложения Fel d 1. Этот эффект был наиболее заметным для тиоловых протеаз, таких как папаин, бромелайн и фицин (см. выше).
Воздействие различных концентраций Fel d 1 и обезжиренного молока, а также потребность в цистеине для разложения Fel d 1 в искусственной слюне тестировали с использованием хитовой протеазы папаина при инкубации в течение ночи при 37°С (фиг. 7). Папаин использовали в минимальной концентрации, необходимой для полного разложения 125 мкг мл-1 Fel d 1 в оптимальных условиях, т.е. в натриево-фосфатном буфере при рН 7,8 (таблица 2). По аналогии с предыдущими экспериментами, проведенными в буфере, было установлено, что для эффективного разложения Fel d 1 папаином в искусственной кошачьей слюне необходимо 40 мМ L-цистеина (фиг. 6), однако эта потребность может быть удовлетворена другими компонентами состава, особенно в пищевых композициях, таких как корм, напиток или лакомство.
Хотя условия реакции в искусственной кошачьей слюне существенно отличались от оптимальных условий реакции, приведенных в таблице 2, большая часть из добавленных 125 мкг мл-1 Fel d 1 разлагалась во время инкубации в течение ночи (в присутствии цистеина) при концентрациях обезжиренного молока до 714 мкг мл-1 (Фиг. 7). Однако активность разложения Fel d 1 снижалась с увеличением концентрации обезжиренного молока, вероятно, из-за более высокой концентрации белка. Белки обезжиренного молока преимущественно состоят из казеина, причем, как было продемонстрировано с помощью протеазного анализа ENZCHEK®, в котором в качестве субстрата используют меченый казеин, папаин гидролизует казеин (таблица 2). Таким образом, казеин и Fel d 1 представляют собой субстраты, конкурирующие за разложение папаином. Следовательно, для полного разложения Fel d 1 при самых высоких концентрациях обезжиренного молока (и в присутствии цистеина) необходимо увеличить концентрацию папаина. Кроме того, более высокая концентрация папаина, вероятно, будет приводить к более быстрому разложению Fel d 1, что было бы предпочтительно для разложения Fel die слюне за период времени, в течение которого кошка потребляет корм для домашних животных или напиток, содержащий протеазу, или в течение которого состав, содержащий протеазу, иным образом воздействует на полость рта.
Для дополнительного тестирования были разработаны два типа искусственной кошачьей слюны (таблица 4). Первый тип представлял собой «экстремальные условия» и содержал 125 мкг мл-1 Fel d 1 (концентрация в 2-3 раза превышает максимальную концентрацию, определенную в кошачьей слюне) и 7140 мкг мл-1 обезжиренного молока (соответствует максимальному содержанию белка, определенному в слюне человека). Эти концентрации аллергена и белка превышают предполагаемые уровни и представлены для оценки избыточной активности протеаз при применении в корме для домашних животных. Второй тип представлял собой «нормальные условия» и содержал 12,5 мкг мл-1 Fel d Т (представляет верхнюю границу концентраций Fel d 1, определенных в промежуточной группе кошек) и 4,5 мкг мл-1 обезжиренного молока (соответствует средней концентрации белка в слюне человека 1,6 мкг мл-1). Эти концентрации аллергена и белка представляют собой средние предполагаемые уровни в слюне большинства кошек.
Для определения активности протеазы, необходимой для разложения Fel d 1, в искусственной кошачьей слюне (в нормальных и экстремальных условия) в течение относительно небольшого периода времени проводили оценку хитовых протеаз папаина, субтилизина bl (PROTEX® 6L), аспергиллопепсина ао (PROTEX® 50FP) и эндопротеиназы Asp-N с помощью дополнительного кинетического анализа при более высоких показателях ферментативной активности. Предварительные эксперименты показали, что для полного разложения Fel d 1 в искусственной кошачьей слюне в экстремальных условиях в течение 1 часа инкубации необходимо увеличение концентрации папаина до 1000 раз - с 4,5 мкг мл-1 (соответствует минимальной концентрации, необходимой для полного разложения Fel d 1 в оптимальных условиях при инкубации в течение ночи, таблица 2) до 4500 мкг мл-1.
Следовательно, для тестирования субтилизина bl в искусственной кошачьей слюне в экстремальных условиях на разложение Fel d 1 через один час и 20 часов инкубации при 37°С (фиг. 8) использовали количества, которые в 10 раз, 100 раз и 1000 раз превышают 9,5 мкг мл-1 субтилизина bl, что представляет собой минимальную концентрацию протеазы, необходимую для разложения 125 мкг мл-1 Fel d 1 в оптимальных условиях при инкубации в течение ночи (таблица 2). Таким образом, 125 мкг мл-1 натурального Fel d 1 инкубировали в течение 0 мин, 1 часа или 20 часов (в течение ночи) с 0, 9,5, 95, 950 и 9500 мкг мл-1 субтилизина bl при 37°С в искусственной кошачьей слюне (экстремальные условия, см. таблица 4). Реакцию останавливали путем добавления 1 мМ ФМСФ. Образцы разводили и анализировали с помощью ELISA со считыванием результатов анализа в момент времени 30 минут. Принимая во внимание разбавление, ожидали получить максимальную концентрацию Fel d 1, составляющую 12 нг мл-1 (т.е. без учета возможности разложения). Средние значения и стандартные отклонения определяли в двух независимых повторах эксперимента. Аналогично предварительным экспериментам с папаином для полного разложения Fel d 1 в искусственной кошачьей слюне в экстремальных условиях в течение 1 часа (фиг. 8) была необходима в 1000 раз более высокая концентрация субтилизина bl.
Для дальнейшего определения эффективности 1000-кратного избытка протеаз проводили кинетические анализы разложения Fel d 1 папаином и субтилизином bl в искусственной кошачьей слюне в нормальных и экстремальных условиях при меньшем времени инкубации (фиг. 9). Папаин и 9,5 мг мл-1 субтилизина bl инкубировали в течение 0, 5, 10, 15 и 60 мин с Fel d 1 в искусственной кошачьей слюне при 37°С в нормальных и экстремальных условиях (таблица 4). Реакции останавливали путем добавления 100 мкМ Е64 (для папаина) и 1 мМ ФМСФ (для субтилизина bl). Образцы разводили и анализировали с помощью ELISA со считыванием результатов анализа в момент времени 30 минут. Остаточная концентрация Fel d 1 представляет собой процентное значение Fel d 1, определенное для образцов по сравнению с Fel d 1 для соответствующих буферных контролей без протеазы. Средние значения и стандартные отклонения определяли в трех независимых повторах. Большая часть Fel d 1 разлагалась в искусственной кошачьей слюне в присутствии субтилизина bl (9,5 мг мл-1) уже через 5 мин как в нормальных, так и в экстремальных условиях. Эксперименты показали, что субтилизин bl был немного эффективнее папаина. Однако в нормальных условиях, которые соответствуют среднему составу кошачьей слюны, более чем 80% Fel d 1 разлагалось папаином (4,5 мг мл-1) в течение 5 минут (фиг. 9). Видимую активность разложения Fel d 1 в этих условиях в момент времени 0 мин потенциально можно объяснить остаточной активностью, несмотря на немедленное добавление ингибитора Е64 для прекращения реакции. В представленных ниже экспериментах этого эффекта удалось избежать путем добавления двух ингибиторов, Е64 и ФМСФ, чтобы прекратить активность комбинаций папаина и субтилизина bl (фиг.10-12).
В контексте применения в корме для домашних животных, в котором кошке со средними концентрациями в слюне Fel d 1 и белка требуется от приблизительно пяти до десяти минут, чтобы съесть корм, предполагается, что как папаин, так и субтилизин bl в протестированных концентрациях будут разлагать аллерген более чем на 80% в течение 5 минут. Обе протестированные концентрации, 4,5 мг мл-1 папаина и 9,5 мг мл-1 субтилизина bl соответственно, представляют собой большой избыток относительно использованного Fel d 1 (125 мкг мл-1). Однако этот избыток фермента способствует ускорению разложения Fel d 1 таким образом, что его большая часть разлагается в течение нескольких минут.
Для определения синергического действия на разложение Fel d 1 тестировали разные комбинации папаина и субтилизина bl, что позволило бы снизить общую концентрацию протеаз, сохраняя при этом эффективность разложения аллергена, сопоставимую с таковой для одной протеазы, при конечном применении в корме для кошек. Тиоловые протеазы папаин и субтилизин bl принадлежат к разным механистическим семействам протеаз и, следовательно, характеризуются разной субстратной специфичностью. Без ограничения конкретным механизмом, предполагается, что две протеазы могут действовать синергически посредством взаимного раскрытия новых сайтов расщепления на полипептидной цепи Fel d 1, что приводит к более быстрому и эффективному разложению по сравнению с разложением, достигнутым при использовании только одной протеазы.
Две протеазы тестировали в комбинации на их способность синергически разлагать Fel d 1 в искусственной кошачьей слюне в концентрациях, которые ранее были протестированы для каждой протеазы в отдельности (4500 мкг мл-1 папаина и 9500 мкг мл-1 субтилизина bl, фиг. 9). Кроме того, разложение Fel d 1 тестировали при концентрациях протеазы, сниженных в 10, 100 и 1000 раз. Для полного разложения Fel d 1 в течение одного часа минимальное необходимое количество для папаина составляет 450 мкг мл-1, а для субтилизина bl - 950 мкг мл-1 (фиг. 10). В комбинации с самыми высокими протестированными концентрациями протеазы (4500 мкг мл-1 папаина и 9500 мкг мл-1 субтилизина bl) полного разложения Fel d 1 достигали через 10 минут (фиг. 10). Этот эффект был сопоставим с эффектом одного субтилизина bl в концентрации 9500 мкг мл-1 (фиг. 9).
Для оценки значимости субтилизина bl его концентрацию изменяли от 1188 до 9500 мкг мл-1, сохраняя постоянную концентрацию папаина (4500 мкг мл-1) (фиг. 11). В комбинации 4500 мкг мл-1 папаина и 9500 или 4750 мкг мл-1 субтилизина bl наблюдали лишь незначительное различие в разложении Fel d 1. Следовательно, комбинация 4500 мкг мл-1 папаина и 4750 мкг мл-1 субтилизина bl будет достаточной для разложения большей части Fel d 1, присутствующего в кошачьей слюне, в течение 10 минут даже в экстремальных условиях. В нормальных условиях, характерных для большинства кошек, комбинация с самой низкой концентрацией субтилизина bl (1188 мкг мл-1) является достаточной для разложения приблизительно 90% Fel die течение 10 минут.
Для оценки значимости папаина его концентрацию изменяли от 565 до 4500 мкг мл-1, сохраняя постоянную концентрацию субтилизина bl на уровне самой низкой протестированной ранее концентрации (1188 мкг мл-1) (фиг. 12). В экстремальных условиях снижения Fel d 1 на 80% через 10 минут достигали только в комбинации с 4500 мкг мл-1 папаина (фиг. 12). Напротив, в нормальных условиях тестируемая концентрация папаина не оказывала существенного влияния на разложение Fel d 1 через 10 минут инкубации. Следовательно, минимальная комбинация протеаз, состоящая из 565 мкг мл-1 папаина и 1188 мкг мл-1 субтилизина bl, будет достаточной для уменьшения содержания Fel d 1 в слюне среднестатистической кошки приблизительно на 80% в течение 10 минут инкубации, например, в то время, когда кошка ест корм для домашних животных или лакомство, или пьет напиток, содержащий протеазы, или когда состав, содержащий протеазу, иным образом воздействует на полость рта кошки.
Пример 6
Разработали прототип влажной салфетки, содержащей функциональные протеазы, который тестировали на инактивацию Fel d 1. Изготавливали партию хлопчатобумажных влажных салфеток (20 см ×20 см), содержащих активный PROTEX® 6L, и протестировали их на инактивацию Fel d 1. Влажные салфетки успешно разлагали Fel d 1. Специфика подробно описана ниже.
Сначала определяли концентрацию PROTEX® 6L, необходимую для влажной салфетки. Требуемая концентрация фермента зависит от количества Fel d 1, который должен быть инактивирован прототипом. На основании данных, предоставленных компанией  Purina, количество Fel d 1 в окружающей среде, которое должно расщепляться прототипом влажной салфетки, составляет приблизительно 25 нг/см2 (=0,25 мг/м2).
Purina, количество Fel d 1 в окружающей среде, которое должно расщепляться прототипом влажной салфетки, составляет приблизительно 25 нг/см2 (=0,25 мг/м2).
Просто установить требуемую концентрацию фермента в прототипе влажной салфетки не представляется возможным, поскольку связывающая способность фермента может, быть ограничена доступными сайтами связывания/поперечной сшивки твердого материала. Таким образом, цель заключалась в том, чтобы максимально увеличить количество иммобилизованного PROTEX® 6L.
В таблице 5 приведены свойства хитовых протеаз, относящиеся к варианту применения и обеспечению безопасности, которые были проанализированы в настоящем документе на основе данных из таблицы 3. Было обнаружено, что протеаза PROTEX® 6L объединяет все характеристики, необходимые для разработки прототипов для вариантов применения, в том числе описанные в примерах 6-10. Она лишь в незначительной степени воздействует на гидролиз кератина и не воздействует на жизнеспособность кератиноцитов, не проявляет активности в отношении целлюлозы и обладает высокой устойчивостью к неионогенным детергентам. Следовательно, для разработки данных прототипов (влажные салфетки, наполнитель для кошачьих туалетов, шампунь, очищающая жидкость) использовали PROTEX® 6L.
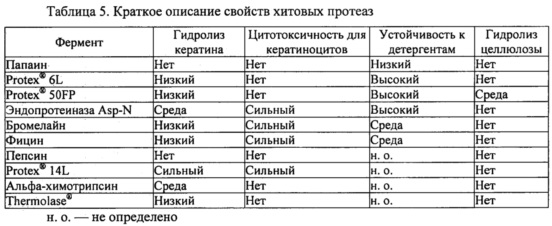
Иммобилизация PROTEX® 6L на хлопчатобумажных влажных салфетках
Изготовление хлопчатобумажных влажных салфеток
Из множества видов хлопчатобумажных тканей для изготовления влажных салфеток выбрали ткань производства компании Molton. Ткань Molton на 100% состоит из хлопкового волокна. Ее шероховатая поверхность и высокое водопоглощение делают ее универсальной очищающей тканью. Размер одной конечной влажной салфетки составляет приблизительно 20 см ×20 см.
Поперечно-сшивающие системы для иммобилизации PROTEX® 6L
Теоретически иммобилизация ферментов на твердом материале может быть достигнута за счет ковалентного связывания фермента посредством химической реакции. Однако отсутствуют четко установленные протоколы, описывающие связывание PROTEX® 6L с хлопковыми волокнами.
В первом скрининге условий для иммобилизации PROTEX® 6L использовали не только фермент и носитель (хлопчатобумажную влажную салфетку), но и два поперечно-сшивающих агента, поскольку несущий материал (хлопок) не имеет групп, которые легко образуют ковалентные связи. Используемый поперечно-сшивающий агент представляет собой двухкомпонентную систему: диамин (пентаэтиленгексамин, ПЭГА) и диальдегид (глутаральдегид, ГА). Компоненты объединяли в постоянном соотношении, и, чтобы указать количество, используемое пропорционально количеству фермента, в основном ссылаются на концентрацию глутаральдегида.
Двухкомпонентная поперечно-сшивающая система должна соответствовать количеству белка. Было установлено, что количество, используемое в пропорции с PROTEX® 6L, имеет решающее значение, поскольку слишком низкие количества не приведут к поперечной сшивке всего фермента или приведут к получению нестабильных составов. Избыточные количества обеспечивают чрезмерную поперечную сшивку с уменьшением конформационной свободы и последующим снижением активности фермента.
Ферментный анализ для определения эффективности иммобилизации для контроля успешности различных условий и протоколов поперечной сшивки определяли ферментную активность после поперечной сшивки и промывки. На этом этапе неудобно определять разлагающее действие поперечно-сшитой протеазы PROTEX® 6L на Fel d 1 непосредственно с помощью ELISA, и это занимает много времени. Для обеспечения гораздо более быстрого скрининга условий поперечной сшивки были выбраны два других ферментативных анализа: анализ NPA на основе гидролиза субстрата п-нитрофенилацетата протеазой или тест ELU на основе гидролиза этиллактата. После определения окончательного протокола поперечной сшивки PROTEX® 6L на маленьких хлопчатобумажных влажных салфетках выполняли крупномасштабную иммобилизацию на целых влажных салфетках. После этого способность к разложению Fel d 1 и ферментную стабильность тестировали непосредственно на целевом субстрате Fel die помощью ELISA.
Окончательное получение иммобилизованного PROTEX® 6L на хлопчатобумажных влажных салфетках
Условия и количества поперечно-сшивающего агента, а также условия и количества ферментных нагрузок определяли экспериментальным путем. После этого проводили крупномасштабные реакции для поперечной сшивки PROTEX® 6L на целых влажных салфетках (20 см ×20 см). Более подробно, жидкий PROTEX® 6L (9,24 мл 4600 ELU/мл PROTEX® 6L) смешивали с 83,2 мл фосфатного буфера (100 мМ, рН 6,5) и добавляли глутаральдегид (конечная концентрация 133 мМ). Поперечную сшивку фермента проводили путем инкубации влажной салфетки в реакционной смеси в течение ночи при комнатной температуре. Влажную салфетку промывали водой, отжимали жидкость и повторно промывали водой и 3% ПЭГ. Наконец, влажную салфетку сушили струей воздуха (21°С) в течение 5 ч.
Таким образом, PROTEX® 6L иммобилизовали на 10 хлопчатобумажных влажных салфетках, другие 10 контрольных влажных салфеток получали таким же образом, за исключением того, что в реакционную смесь не добавляли фермент. Затем тестировали применение влажных салфеток. Определяли способность к инактивации Fel d 1, как описано в примере 10 (таблица 6).
Пример 7
Были разработаны прототипы наполнителя для кошачьих туалетов, содержащие функциональные протеазы, которые тестировали на инактивацию Fel d 1. Более конкретно, изготавливали 260 г наполнителя для кошачьих туалетов (перлит), содержащего активный PROTEX® 6L, и тестировали его на инактивацию Fel d 1. Наполнитель для кошачьих туалетов успешно разлагал Fel d 1. Специфика подробно описана ниже.
Сначала определяли концентрацию PROTEX® 6L, необходимую для прототипа. Требуемая концентрация фермента зависит от количества Fel d 1, который должен быть инактивирован прототипом. На основании данных, предоставленных компанией Nestle Purina, количество Fel d 1, которое должен инактивировать наполнитель для кошачьих туалетов, составляет приблизительно 250 мг.
Просто установить требуемую концентрацию фермента в случае наполнителя для кошачьих туалетов не представляется возможным, поскольку связывающая способность фермента может быть ограничена доступными сайтами связывания/поперечной сшивки твердого материала. Таким образом, цель заключалась в том, чтобы максимально увеличить количество иммобилизованного PROTEX® 6L.
Иммобилизация PROTEX® 6L на наполнителе для кошачьих туалетов
Иммобилизация на бентоните
Некомкующийся наполнитель для кошачьих туалетов Purina Tidy Cats non clumping cat litter Instant Action тестировали на иммобилизацию PROTEX® 6L. Основой для этого наполнителя для кошачьих туалетов является глинистый минерал бентонит. PROTEX® 6L разбавляли водой и добавляли к бентониту, чтобы проверить возможные условия иммобилизации и абсорбции фермента. Однако при добавлении воды к PROTEX® 6L разбавляется 50% глицерина, присутствующего в этой смеси ферментов, что вызывает распад бентонита.
Проводили еще одно тестирование иммобилизации на бентоните с минимальным использованием жидкости. Для этой цели в бентонит непосредственно добавляли небольшие количества PROTEX® 6L, которые могли легко абсорбироваться. Помимо фермента и носителя добавляли два поперечно-сшивающих агента, поскольку несущие материалы не имеют групп, легко образующих ковалентные связи. Используемый поперечно-сшивающий агент представлял собой двухкомпонентную систему: диамин (пентаэтиленгексамин, ПЭГ А) и диальдегид (глутаральдегид, ГА), которые объединяли в постоянном соотношении. Было установлено, что максимальная нагрузка составляет 150-200 мкл жидкости на грамм бентонита. Жидкость необходимо вводить по отдельности в каждую частицу. Поскольку частицы распадаются, после иммобилизации невозможно проводить обработку. Это не является непосредственным недостатком, но после повторной сушки влажного бентонита пыль с ферментом переносятся по воздуху. Однако на этом носителе PROTEX® 6L через пару дней утратил всю активность даже в сухом состоянии. Можно сделать вывод, что тестируемый наполнитель для кошачьих туалетов не подходит для иммобилизации PROTEX® 6L.
Иммобилизация на песке
Песок с размером частиц 1,2 мм тестировали в качестве другого носителя, который большей частью можно смешивать с бентонитом. Помимо фермента повторно использовали два поперечно-сшивающих агента. Песок использовали для того, чтобы продемонстрировать жизнеспособность подхода, в котором фермент иммобилизуют на втором носителе (песке), который затем можно смешивать с другими частицами наполнителя для кошачьих туалетов. Использовали максимальную нагрузку 200 мкл PROTEX® 6L на грамм песка. Однако активность и восстановление были относительно низкими, вероятнее всего, по той причине, что песок не имеет пор и его площадь поверхности мала. Выщелачивание фермента является низким, и, таким образом, песок в принципе представляет собой подходящий материал для ковалентного связывания.
Иммобилизация на перлите
В качестве третьего носителя выбирали перлит. Из-за размера частиц 2,8-6 мм его можно также по большей части смешивать с бентонитом. Для индукции ковалентного связывания помимо фермента снова использовали два поперечно-сшивающих агента (ГА и ПЭГА). Первые эксперименты по иммобилизации показали, что восстановление и выщелачивание фермента PROTEX® 6L являются относительно хорошими для ферментных нагрузок в нижней части диапазона. Ферментные нагрузки свыше 500 мкл/г обеспечивают существенное окрашивание частиц перлита, но при нагрузках в нижней части диапазона он сохраняет яркий белый цвет.
Окончательное получение иммобилизованного PROTEX® 6L на перлите
Очевидно, что для поперечной сшивки PROTEX® 6L с материалом наполнителя для кошачьих туалетов перлит оказался лучше песка и бентонита. Перлит допускает высокую ферментную нагрузку при сохранении низкого уровня выщелачивания фермента. Кроме того, размер его частиц обеспечивает равномерное смешивание с другим материалом наполнителя для кошачьих туалетов. Таким образом, было обнаружено, что перлит является отличным материалом для поперечной сшивки с PROTEX® 6L, и, наконец, получили 260 г перлита, содержащего PROTEX® 6L.
Более подробно, жидкий PROTEX® 6L (60 мл 4600 ELU/мл PROTEX® 6L) смешивали с 472,8 мл холодной воды, добавляли ПЭГА (рН доведен до 7,0, конечная концентрация 20 мМ, 4°С) и глутаральдегид (конечная концентрация 133 мМ), хорошо перемешивали и добавляли к 300 г перлита. Поперечная сшивка фермента осуществлялась путем инкубации частиц перлита в реакционной смеси в течение ночи при комнатной температуре. Перлит промывали водой, 5 мМ фосфатным буфером и водой с 3% ПЭГ. Наконец, частицы перлита сушили в течение ночи при комнатной температуре.
Таким образом, PROTEX® 6L иммобилизовали на 260 г перлита, другой небольшой контрольный образец (1 г перлита) получали таким же образом, за исключением того, что в реакционную смесь не добавляли фермент. Затем тестировали применение перлита. Определяли способность к инактивации Fel d 1, как описано в примере 10 (таблица 6).
Пример 8
Были разработаны прототипы очищающей жидкости, содержащей функциональные протеазы, которые тестировали на инактивацию Fel d 1. Более конкретно, изготавливали 1 литр очищающей жидкости и 50 мл концентрата фермента, содержащего активный PROTEX® 6L, и тестировали их на инактивацию Fel d 1. Прототипы успешно разлагали Fel d 1. Специфика подробно описана ниже.
Сначала определяли концентрацию PROTEX® 6L, необходимую для каждого прототипа. Требуемая концентрация фермента зависит от количества Fel d 1, который должен быть инактивирован соответствующим прототипом. На основании данных, предоставленных компанией Nestle Purina, количество Fel d 1 в окружающей среде, которое должно расщепляться прототипами, составляет приблизительно 25 нг/см2 (=0,25 мг/м2).
Для определения концентрации PROTEX® 6L, необходимой для общего расщепления Fel d 1, с помощью ELISA проводили анализ активности PROTEX® 6L в серии разведений. 3,8 ЕД/мл PROTEX® 6L (единицы даны по анализу на этил-л-лактат (ELU), определенные производителем Genencore) способны полностью расщеплять 2,5 мкг Fel d 1 в оптимальных условиях реакции (буфер трис-HCl, рН 7,8). На основании этих расчетов, включая начальные расчеты для шампуня в примере 9, концентрация PROTEX® 6L была соответствующим образом скорректирована для очищающих жидкостей.
Разработка средства для очистки поверхностей, содержащего PROTEX® 6L
На основании концентрации Fel d 1 на твердых поверхностях определяли требуемое количество PROTEX® 6L и вводили его в основной состав очищающей жидкости (KAR-001). Более подробно, в химический стакан добавляли воду (960 г), затем 10 г феноксиэтанола (консервант), а после этого 30 г Zusolat 1008/85 (жирный спирт производства компании Zschimmer & Schwarz GmbH & Со KG) и 10 г EUXYL® РЕ 9010 и перемешивали. При необходимости рН доводили до 8,0 с помощью NaOH. К этому основному составу (KAR-001) добавляли PROTEX® 6L (9 мл 4600 ELU/мл PROTEX® 6L) с получением состава KAR-001+Е. Наконец, получали 1 литр средства для очистки поверхностей KAR-001, содержащего PROTEX® 6L (KAR-001+Е), а также 2x1 литр средства для очистки поверхностей без PROTEX® 6L (KAR-001-E) и тестировали применение. Определяли способность к инактивации Fel d 1, как описано в примере 10 (таблица 6).
Разработка концентрата фермента, содержащего PROTEX® 6L
Кроме готового к применению средства для очистки поверхностей, которое уже содержит PROTEX® 6L, можно предусмотреть другой вариант применения, который основан на смешивании фермента и жидкого средства для очистки поверхностей непосредственно перед использованием.
Преимущество заключается в том, что фермент можно смешивать с любым другим средством для очистки поверхностей, которое может использовать покупатель. Кроме того, хранение фермента в оптимизированном жидком составе, а не в составе средства для очистки поверхностей, может стабилизировать фермент и привести к повышению ферментативной стабильности. Таким образом, был разработан концентрат фермента, содержащий в 20 раз более концентрированный PROTEX® 6L (по сравнению с готовым к применению средством для очистки поверхностей KAR-001+Е), а также стабилизатор фермента пропиленгликоль. Определяли способность к инактивации Fel d 1 (после разбавления 20 × КАК-001+Е в 1 × средства для очистки поверхностей), как описано в примере 10 (таблица 6).
Пример 9
Были разработаны прототипы шампуня, содержащие функциональные протеазы, которые тестировали на инактивацию Fel d 1. Более конкретно, изготавливали два шампуня для кошек (несмываемый состав, по 1 литру каждого), содержащих активный PROTEX® 6L, и тестировали их на инактивацию Fel d 1. Все прототипы успешно разлагали Fel d 1. Специфика каждого прототипа подробно описана ниже.
Сначала определяли концентрацию PROTEX® 6L, необходимую для прототипа. Требуемая концентрация фермента зависит от количества Fel d 1, который должен быть инактивирован прототипом. Количество Fel d 1 на кошке составляет приблизительно 2 мкг/мг кошачьей шерсти (данные предоставлены Nestle Purina). Поскольку масса шерсти у кошки в среднем составляет 121 г (Avner DB et al., J Allergy Clin Immunol, 1997), общее количество Fel d 1 на кошке, которое необходимо инактивировать с помощью шампуня, составляет приблизительно 250 мг.
Для определения концентрации PROTEX® 6L, необходимой для общего расщепления Fel d 1, с помощью ELISA проводили анализ активности PROTEX® 6L в серии разведений. 3,8 ЕД/мл PROTEX® 6L (единицы даны по анализу на этил-л-лактат (ELU), определенные производителем Genencore) способны полностью расщеплять 2,5 мкг Fel d 1 в оптимальных условиях реакции (буфер трис-HCl, рН 7,8). Затем анализировали активность PROTEX® 6L в шампуне для кошек KFS-002 (см. ниже) для определения активности PROTEX® 6L в составе шампуня. В качестве модели для начальных расчетов активности PROTEX® 6L в жидком составе выбирали KFS-002. С помощью ELISA определили, что для полной инактивации Fel d 1 в KFS-002 требовалось 38,4 ЕД/мл PROTEX® 6L (что приблизительно в 10 раз выше, чем в оптимальном реакционном буфере).
Разработка шампуней, содержащих PROTEX® 6L
Было протестировано несколько пенообразующих составов на основе амфотерного кокамйдопропилбетаина (бетаина), анионного лаурилэфирсульфата натрия (SLE), анионного лаурилсаркозината натрия (SLS), анионного кокоилглютамата натрия/динатрия и неионогенного децилглюкозида, но не все составы продемонстрировали приемлемые результаты.
На основании концентрации Fel d 1 на кошке определяли требуемое количество PROTEX® 6L и вводили его в два основных состава шампуня (KFS-002 и KFS-004a).
Более подробно, в химический стакан добавляли воду (980 г), затем 10 г феноксиэтанола (консервант), а после этого 10 г бетаина (KFS-002) или 10 г SLS (KFS-004а) и 10 г PERLASTAN® L30 и перемешивали. При необходимости рН доводили до 5,5 (KFS-002) или 7,5 (KFS-004a) с помощью NaOH.
К этому основному составу (KFS-002/004a) добавляли 9 мл PROTEX® 6L (4600 ELU/мл PROTEX® 6L) с получением состава KFS-002/004a+E. Наконец, получали 1 литр шампуня KFS-002 и I литр шампуня KFS-004a, содержащего PROTEX® 6L (KFS-002/004а+Е), а также 2 × 1 литр шампуней без PROTEX® 6L (KFS-002/004a-E), после чего тестировали применение. Определяли способность к инактивации Fel d 1, как описано в примере 10 (таблица 6).
Пример 10
Изучали инактивацию Fel d 1 прототипами из примеров 6-9. Данные представлены в таблице 6. Очевидно, что все разработанные прототипы способны инактивировать количества Fel d 1, соответствующие варианту применения.
В описании представлены типичные предпочтительные варианты осуществления изобретения. Несмотря на использование специальных терминов, они применяются только в общем и описательном смысле, а не для ограничения объема изобретения, который изложен в формуле изобретения. В свете вышеуказанных идей возможно множество модификаций и вариантов изобретения. Таким образом, следует понимать, что в рамках объема приложенной формулы изобретение может быть реализовано на практике способами, отличными от конкретно описанных способов.