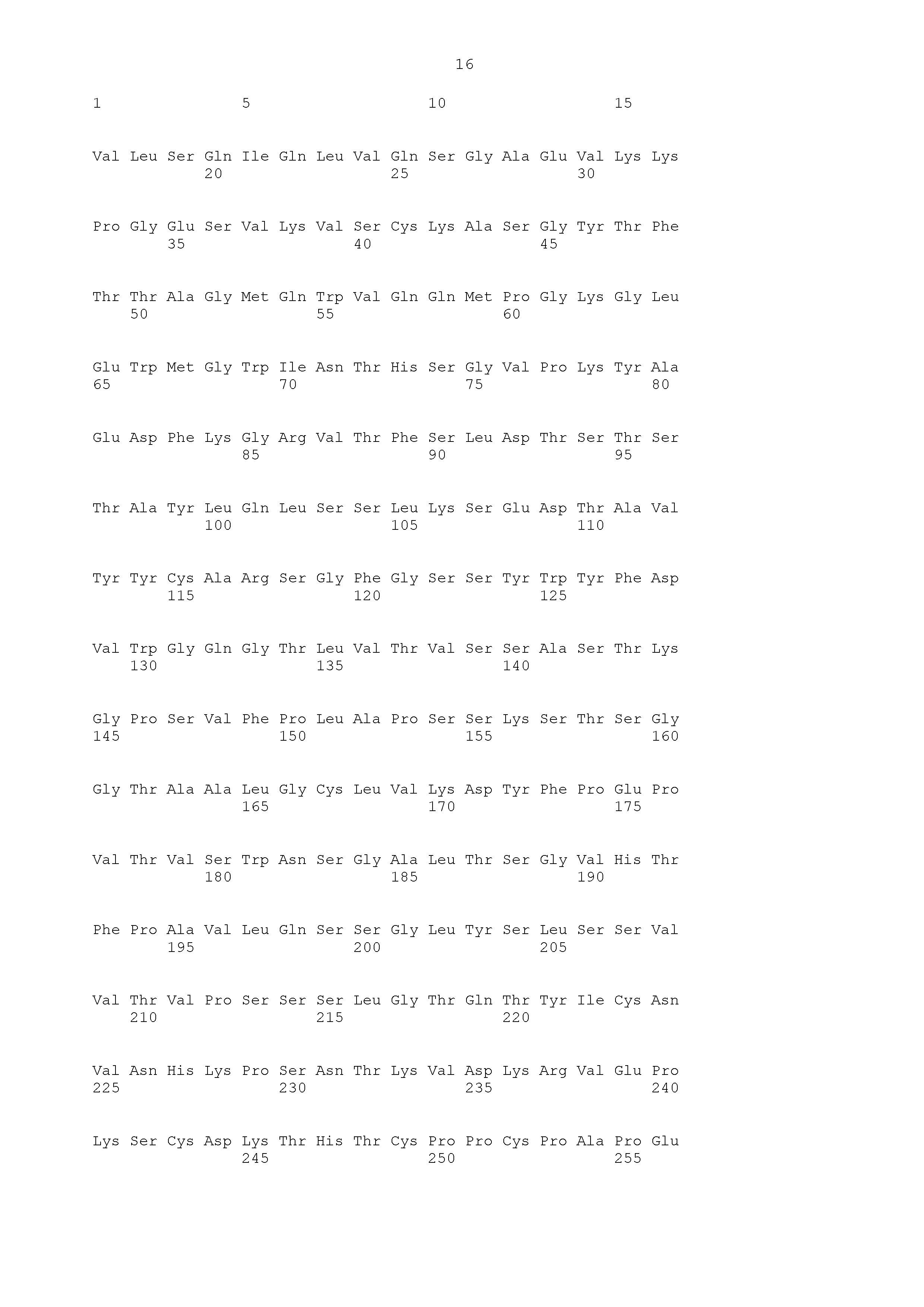Результат интеллектуальной деятельности: КОНЪЮГАТ АНТИ-TROP2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001]
Настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему противоопухолевое лекарственное средство, конъюгированное с анти-TROP2 антителом через линкерную структуру, при этом такой конъюгат является полезным в качестве противоопухолевого лекарственного средства.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002]
Конъюгат антитело-лекарственное средство (ADC) содержит лекарственное средство с цитотоксичностью, конъюгированное с антителом, антиген которого экспрессируется на поверхности раковых клеток и которое также связывается с антигеном, способным к интернализации клетками, и поэтому может доставлять лекарственное средство селективно к раковым клеткам и, как ожидают, будет вызывать аккумуляцию лекарственного средства в раковых клетках и убивать раковые клетки (см. не-патентную литературу 1-3). В качестве ADC, Милотарг (Гемтузумаб озогамицин (зарегистрированная торговая марка)), в котором калихеамицин конъюгирован с анти-CD33 антителом, одобрен в качестве терапевтического средства для лечения острого миелоидного лейкоза. Кроме того, Адцетрис (Брентуксимаб ведотин (зарегистрированная торговая марка)), в котором ауристатин E конъюгирован с анти-CD30 антителом, недавно был одобрен в качестве терапевтического средства для лечения лимфомы Ходжкина и анапластической крупноклеточной лимфомы (см. не-патентную литературу 4). Лекарственные средства, содержащиеся в ADC, одобренных к настоящему времени, таргетируют ДНК или тубулин.
[0003]
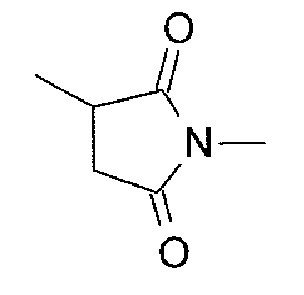
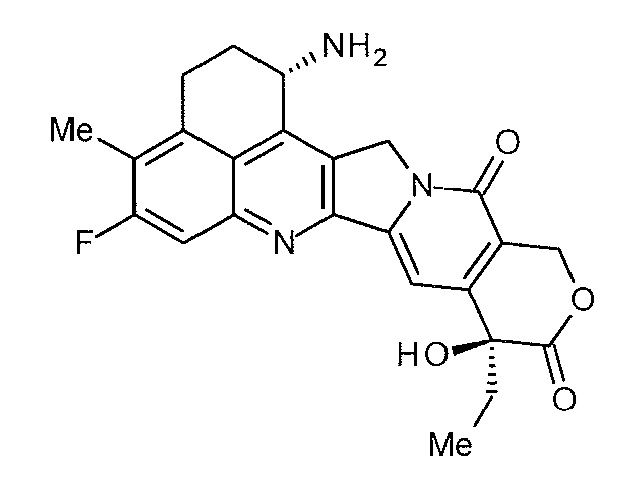
Что касается противоопухолевых низкомолекулярных соединений, известны камптотециновые производные - соединения, которые ингибируют топоизомеразу I для проявления противоопухолевого эффекта. Среди них противоопухолевое соединение, представленное формулой, показанной ниже
[0004]
[Формула 1]
[0005]
(экзатекан, химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)-дион), представляет собой водорастворимое производное камптотецина (Патентная литература 1 и 2). В отличие от иринотекана, используемого в настоящее время в клинических условиях, это соединение не требует активации ферментом для проявления противоопухолевого эффекта. Кроме того, ингибирующее действие на топоизомеразу I выше, чем у SN-38, который представляет собой основное фармацевтически активное вещество иринотекана и топотекана, также используемго в клинических условиях, и более высокая in vitro убивающая клетки активность достигается против различных раковых клеток. В частности, оно демонстрирует эффект против раковых клеток, которые обладают резистентностью к SN-38 или т.п. в результате экспрессии P-гликопротеина. Кроме того, в мышиной модели с подкожно трансплантированной человеческой опухолью, оно продемонстрировало сильный противоопухолевый эффект и, таким образом, прошло клинические испытания, но еще не поставляется на рынок (см. не-патентную литературу 5-10). Остается неясным действует или нет экзатекан эффективно в качестве ADC.
[0006]
DE-310 представляет собой комплекс, в котором экзатекан конъюгирован с биоразлагаемым карбоксиметилдекстран-полиспирт полимером через GGFG пептидный спейсер (Патентная литература 3). Путем преобразования экзатекана в форму полимерного пролекарства, свойство удержания его высоких уровней в крови может сохраняться, и также высокая способность таргетировать участок опухоли пассивно увеличивается путем использования повышенной проницаемости новых образованных кровеносных сосудов в опухоли и свойства удерживания в опухолевых тканях. Что касается DE-310, через расщепление пептидного спейсера ферментом, экзатекан и экзатекан с глицином, связанным с амино группой, непрерывно высвобождаются в качестве основного активного вещества. Как результат, фармакокинетике свойства улучшаются. Было обнаружено, что DE-310 обладает более высокой эффективностью, чем экзатекан, вводимый отдельно, даже при том, что общее количество экзатекана, содержащегося в нем, меньше, чем в случае введения экзатекана отдельно, в соответствии с различными моделями оценки опухоли в не-клинических исследованиях. Было проведено клиническое испытание для DE-310, и также были подтверждены эффективные случаи, в сообщении о которых предполагается, что основное активное вещество аккумулируется в опухоли, а не в нормальных тканях, однако, существует также сообщение, указывающее, что аккумуляция DE-310 и основного активного вещества в опухоли не намного отличается от аккумуляции в нормальных тканях у человека, и, таким образом, никакого пассивного таргетирования у человека не наблюдали (см. не-патентную литературу 11-14). Как результат, DE-310 также не был запущен в серийное производство, и остается неясным действует или нет экзатекан эффективно в качестве лекарственного средства, предназначенного для такого таргетирования.
[0007]
В качестве соединения, относящегося к DE-310, также известен комплекс, в котором структурный элемент, представленный как -NH-(CH2)4-C(=O)-, встроен между -GGFG-спейсером и экзатеканом с образованием -GGFG-NH-(CH2)4-C(=O)-, используемого в качестве спейсерной структуры (Патентная литература 4). Однако противоопухолевый эффект указанного комплекса вообще неизвестен.
[0008]
Человеческий TROP2 (TACSTD2: опухоль-ассоциированный кальциевый сигнальный трансдуктор 2, GA733-1, EGP-1, M1S1; далее указан как hTROP2) представляет собой однопроходный трансмембранного типа 1 мембранный белок, состоящий из 323 аминокислотных остатков. Хотя присутствие мембранного белка, вовлеченного в иммунорезистентность, который является одинаковым для человеческих трофобластов и раковых клеток (Не-патентная литература 15), было предположено ранее, молекула антигена, распознаваемая моноклональным антителом (162-25.3 или 162-46.2) против мембранного белка, в клеточной линии человеческой хориокарциномы была идентифицирована и обозначена как TROP2 как одна из молекул, экспрессируемых в человеческих трофобластах (Не-патентная литература 16). Эта молекула также была обнаружена позднее другими исследователями и также обозначена как опухолевый антиген GA733-1, распознаваемый мышиным моноклональным антителом GA733 (Не-патентная литература 17), полученным путем иммунизации гастральной раковой клеточной линией, или эпителиальный гликопротеин (EGP-1; Не-патентная литература 18), распознаваемый мышиным моноклональным антителом RS7-3G11, полученным путем иммунизации раковыми клетками немелкоклеточного рака легкого. В 1995, однако, TROP2 ген был клонирован, и было подтверждено, что все эти молекулы являются идентичными молекулами (Не-патентная литература 19). ДНК-последовательность и аминокислотная последовательность hTROP2 являются доступными из общей базы данных и могут указываться, например, под номерами доступа NM_002353 и NP_002344 (NCBI).
hTROP2 ген относится к TACSTD семейству генов, вместе с человеческим TROP-1 (EpCAM, EGP-2, TACSTD1) геном, имеющим гомологию около 50% (Не-патентная литература 21). hTROP2 белок состоит из сигнальной последовательности, состоящей из N-концевых 26 аминокислотных остатков, внеклеточного домена, состоящего из 248 аминокислотных остатков, трансмембранного домена, состоящего из 23 аминокислотных остатков, и внутриклеточного домена, состоящего из 26 аминокислотных остатков. Внеклеточный домен содержит четыре N-связанных сайта гликозилирования, и известно, что он имеет кажущуюся молекулярную массу около 10 кДа плюс теоретическое рассчитанное значение 35 кДа (Не-патентная литература 19).
До сих пор не был идентифицирован ни физиологический лиганд hTROP2 ни его молекулярные функции. Было обнаружено, что hTROP2 осуществляет трансдукцию кальциевых сигналов в опухолевых клетках (Не-патентная литература 20). Кроме того, hTROP2 фосфорилируется по внутриклеточному остатку серина 303 протеинкиназой C, которая представляет собой Ca2+-зависимую киназу (Не-патентная литература 18), и содержит PIP2-связывающую последовательность в внутриклеточном домене, что предполагает сигнальные функции в опухолевых клетках (Не-патентная литература 22).
В иммуногистохимическом анализе с использованием клинических образцов было обнаружено, что hTROP2 чрезмерно экспрессируется в различных эпителиальноклеточных карциномах и экспрессируется в эпителиальных клетках в ограниченных типах нормальных тканей при низком уровне экспрессии по сравнению с опухолевыми тканями (Не-патентная литература 23-27). Также сообщалось о том, что экспрессия hTROP2 соотносится с плохим прогнозом колоректального рака (Не-патентная литература 23), гастрального рака (Не-патентная литература 24), панкреатического рака (Не-патентная литература 25), рака полости рта (Не-патентная литература 26) и глиомы (Не-патентная литература 27).
Также сообщалось, на основании моделей с использованием колоректальных раковых клеток, что экспрессия hTROP2 вовлечена в каркас-независимый клеточный рост опухолевых клеток и карциногенез у иммунодефицитных мышей (Не-патентная литература 28).
[0009]
В ответ на такую информацию, предполагающую связь с раком, к настоящему времени было получено множество анти-hTROP2 антител, и они были исследованы на противоопухолевые эффекты. Среди этих антител, раскрывается, например, неконъюгированное антитело, которое само демонстрирует противоопухолевую активность в моделях ксенотрансплантата у голых мышей (Патентная литература 5-8), а также антитело, которое демонстрирует противоопухолевую активность как ADC с цитотоксическим лекарственным средством (Патентная литература 9-12). Однако сила или охват их активности все же недостаточны, и существует неудовлетворенная медицинская потребность в hTROP2 в качестве терапевтической цели.
ПЕРЕЧЕНЬ ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0010]
Патентная литература 1: Японская выложенная патентная заявка № 5-59061
Патентная литература 2: Японская выложенная патентная заявка № 8-337584
Патентная литература 3: Международная публикация № WO 1997/46260
Патентная литература 4: Международная публикация № WO 2000/25825
Патентная литература 5: Международная публикация № WO 2008/144891
Патентная литература 6: Международная публикация № WO 2011/145744
Патентная литература 7: Международная публикация № WO 2011/155579
Патентная литература 8: Международная публикация № WO 2013/077458
Патентная литература 9: Международная публикация № WO 2003/074566
Патентная литература 10: Международная публикация № WO 2011/068845
Патентная литература 11: Международная публикация № WO 2013/068946
Патентная литература 12: Патент США № 7999083
НЕ-ПАТЕНТНАЯ ЛИТЕРАТУРА
[0011]
Не-патентная литература 1: Ducry, L., et al., Bioconjugate Chem. (2010) 21, 5-13.
Не-патентная литература 2: Alley, S. C., et al., Current Opinion in Chemical Biology (2010) 14, 529-537.
Не-патентная литература 3: Damle N.K., Expert Opin. Biol. Ther. (2004) 4, 1445-1452.
Не-патентная литература 4: Senter P. D., et al., Nature Biotechnology (2012) 30, 631-637.
Не-патентная литература 5: Kumazawa, E., Tohgo, A., Exp. Opin. Invest. Drugs (1998) 7, 625-632.
Не-патентная литература 6: Mitsui, I., et al., Jpn J. Cancer Res. (1995) 86, 776-782.
Не-патентная литература 7: Takiguchi, S., et al., Jpn J. Cancer Res. (1997) 88, 760-769.
Не-патентная литература 8: Joto, N. et al., Int J Cancer (1997) 72, 680-686.
Не-патентная литература 9: Kumazawa, E. et al., Cancer Chemother. Pharmacol. (1998) 42, 210-220.
Не-патентная литература 10: De Jager, R., et al., Ann N Y Acad Sci (2000) 922, 260-273.
Не-патентная литература 11: Inoue, K. et al., Polymer Drugs in the Clinical Stage, Edited by Maeda et al. (2003), 145-153.
Не-патентная литература 12: Kumazawa, E. et al., Cancer Sci (2004) 95, 168-175.
Не-патентная литература 13: Soepenberg, O. et al., Clinical Cancer Research, (2005) 11, 703-711.
Не-патентная литература 14: Wente M. N. et al., Investigational New Drugs (2005) 23, 339-347.
Не-патентная литература 15: Faulk WP, et al., Proc. Natl. Acad. Sci.75(4), 1947-1951 (1978).
Не-патентная литература 16: Lipinski M, et al., Proc. Natl. Acad. Sci. 78(8), 5147-5150 (1981).
Не-патентная литература 17: Linnenbach A J, et al., Proc. Natl. Acad. Sci. 86(1), 27-31 (1989).
Не-патентная литература 18: Basu A, et al., Int. J. Cancer, 62(4), 472-479 (1995).
Не-патентная литература 19: Fornaro M, et al., Int. J. Cancer, 62(5), 610-618 (1995).
Не-патентная литература 20: Ripani E, et al., Int. J. Cancer, 76(5), 671-676 (1998).
Не-патентная литература 21: Calabrese G, et al., Cytogenet. Cell Genet., 92(1-2), 164-165 (2001).
Не-патентная литература 22: El Sewedy T, et al., Int. J. Cancer, 75(2), 324-330 (1998).
Не-патентная литература 23: Ohmachi T, et al., Clin. Cancer Res., 12(10), 3057-3063 (2006).
Не-патентная литература 24: Muhlmann G, et al., J. Clin. Pathol., 62(2), 152-158 (2009).
Не-патентная литература 25: Fong D, et al., Br. J. Cancer, 99(8), 1290-1295 (2008).
Не-патентная литература 26: Fong D, et al., Mod. Pathol., 21(2), 186-191 (2008).
Не-патентная литература 27: Ning S, et al., Neurol. Sci., 34(10), 1745-1750 (2013).
Не-патентная литература 28: Wang J, et al., Mol. Cancer Ther., 7(2), 280-285 (2008).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
[0012]
Что касается лечения опухоли антителом, недостаточный противоопухолевый эффект можно наблюдать, даже когда антитело распознает антиген для связывания с опухолевыми клетками, и есть случаи, когда необходимо более эффективное противоопухолевое антитело. Кроме того, многие противоопухолевые низкомолекулярные соединения имеют проблему безопасности, такую как побочный эффект и токсичность, даже если соединения обладают отличным противоопухолевым эффектом, и остается проблема достижения более высокого терапевтического эффекта при большем усилении безопасности. Таким образом, целью настоящего изобретения является обеспечение противоопухолевого лекарственного средства, обладающего отличным терапевтическим эффектом, которое является отличным в том, что касается противоопухолевого эффекта и безопасности.
[0013]
Авторы настоящего изобретения полагали, что, когда противоопухолевое соединение экзатекан преобразуют в конъюгат антитело-лекарственное средство через линкерную структуру путем конъюгации с анти-TROP2 антителом, которое способно таргетировать опухолевые клетки, то есть обладает такими свойствами, как способность распознавания опухолевых клеток, способностью связывания с опухолевыми клетками, свойством интернализации в опухолевых клетках или т.п., может приобретаться убивающая клетки активность на основании антитела, противоопухолевое соединение более надежно может доставляться к опухолевым клеткам для специфического проявления противоопухолевого эффекта соединения в опухолевых клетках, и, таким образом, противоопухолевый эффект наверняка может быть продемонстрирован, и дозу противоопухолевого соединения можно уменьшить по сравнению со случаем введения соединения отдельно, и, таким образом, влияние противоопухолевого соединения на нормальные клетки можно ослабить для достижения большей безопасности.
В этой связи авторы настоящего изобретения создали линкер с специфической структурой, и им удалось получить конъюгат антитело-лекарственное средство, в котором анти-TROP2 антитело и экзатекан конъюгированы друг с другом через линкер, и подтвердить отличный противоопухолевый эффект, демонстрируемый конъюгатом, создав, таким образом, настоящее изобретение.
[0014]
В частности, настоящее изобретение относится к следующему.
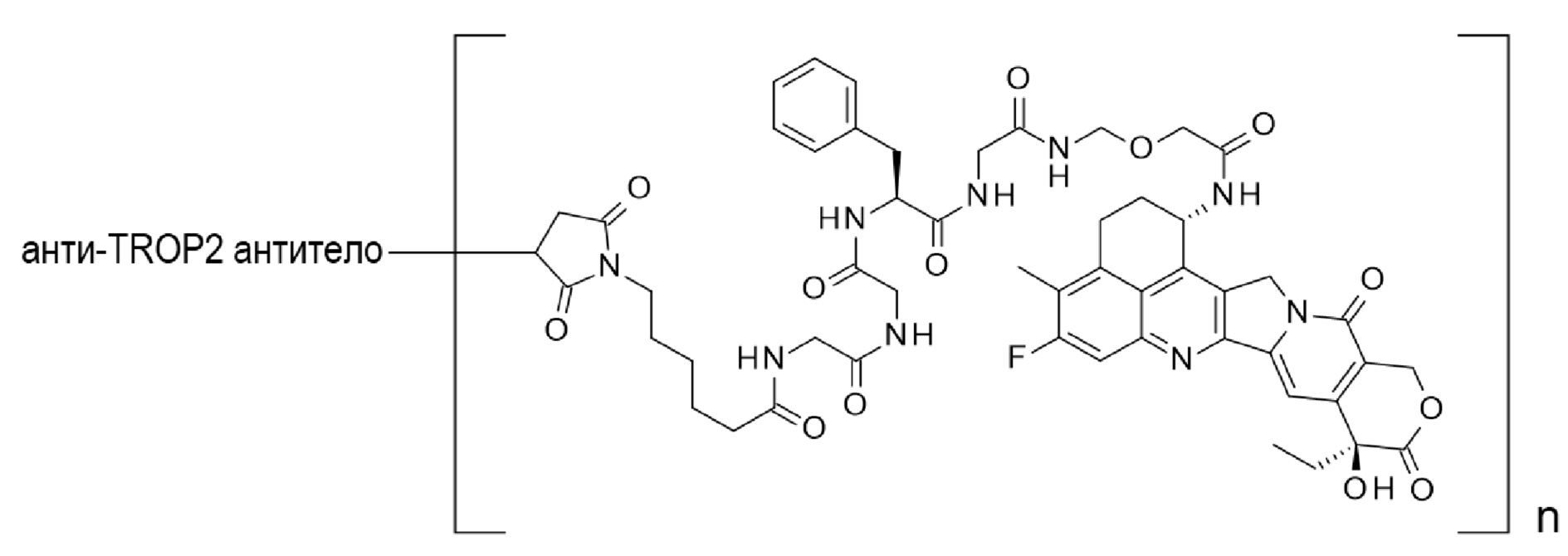
[1] Конъюгат антитело-лекарственное средство, где противоопухолевое соединение, представленное следующей формулой:
[Формула 2]
конъюгировано с анти-TROP2 антителом посредством тиоэфирной связи, которая образуется на участке дисульфидной связи, присутствующей в шарнирной части анти-TROP2 антитела, через линкер, имеющий структуру, представленную следующей формулой:
-L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-
[0015]
Здесь, анти-TROP2 антитело связано с концевой частью L1, противоопухолевое соединение связано с карбонильной группой -(CH2)n2-C(=O)- группировки, с атомом азота амино группы в положении 1 в качестве положения связывания,
где
n1 представляет собой целое число, имеющее значение от 0 до 6,
n2 представляет собой целое число, имеющее значение от 0 до 5,
L1 представляет собой -(Сукцинимид-3-ил-N)-(CH2)n3-C(=O)-,
где n3 представляет собой целое число, имеющее значение от 2 до 8,
L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)- или простую связь,
где n4 представляет собой целое число, имеющее значение от 1 до 6,
LP представляет собой пептидный остаток, состоящий из 2-7 аминокислот,
La представляет собой -O- или простую связь, и
-(Сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 3]
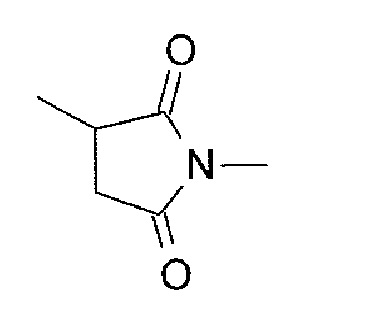
которая связана с анти-TROP2 антителом в положении 3 и связана с метиленовой группой в линкерной структуре, содержащей эту структуру, по атому азота в положении 1.
[0016]
Настоящее изобретение также относится к каждому из следующих.
[2] Конъюгат антитело-лекарственное средство в соответствии с пунктом [1], где пептидный остаток LP представляет собой пептидный остаток, включающий аминокислоту, выбранную из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты.
[3] Конъюгат антитело-лекарственное средство в соответствии с пунктом [1] или [2], где LP представляет собой пептидный остаток, выбранный из следующей группы:
-GGF-,
-DGGF-,
-(D-)D-GGF-,
-EGGF-,
-GGFG-,
-SGGF-,
-KGGF-,
-DGGFG-,
-GGFGG-,
-DDGGFG-,
-KDGGFG-, и
-GGFGGGF-;
где "(D-)D" представляет собой D-аспарагиновую кислоту.
[4] Конъюгат антитело-лекарственное средство в соответствии с пунктом [1] или [2], где LP представляет собой пептидный остаток, состоящий из 4 аминокислот.
[5] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[4], где LP представляет собой тетрапептидный остаток -GGFG-.
[0017]
[6] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[5], где n3 представляет собой целое число, имеющее значение от 2 до 5, и L2 представляет собой простую связь.
[7] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[5], где n3 представляет собой целое число, имеющее значение от 2 до 5, L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)-, и n4 имеет значение 2 или 4.
[8] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[7], где -NH-(CH2)n1-La-(CH2)n2-C(=O)- представляет собой частичную структуру, имеющую длину цепи от 4 до 7 атомов.
[9] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[7], где -NH-(CH2)n1-La-(CH2)n2-C(=O)- представляет собой частичную структуру, имеющую длину цепи 5 или 6 атомов.
[10] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[9], где -NH-(CH2)n1-La-(CH2)n2-C(=O)- представляет собой
-NH-CH2CH2-C(=O)-,
-NH-CH2CH2CH2-C(=O)-,
-NH-CH2CH2CH2CH2-C(=O)-,
-NH-CH2CH2CH2CH2CH2-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-CH2CH2-O-CH2-C(=O)-.
[11] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[9], где -NH-(CH2)n1-La-(CH2)n2-C(=O)- представляет собой
-NH-CH2CH2CH2-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-CH2CH2-O-CH2-C(=O)-.
[0018]
[12] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[9], где структурный фрагмент лекарственное средство-линкер, содержащий лекарственное средство, связанное с -L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-, представляет собой одну лекарственное средство-линкер структуру, выбранную из следующей группы:
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
[0019]
Где -(Сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 4]
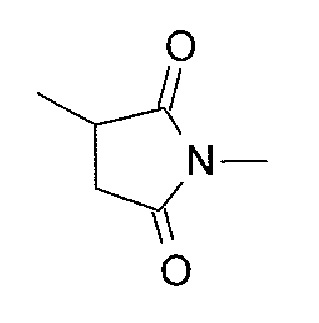
которая связана с анти-TROP2 антителом в положении 3 и связана с метиленовой группой в линкерной структуре, содержащей эту структуру, по атому азота в положении 1,
-(NH-DX) представляет собой группу, представленную следующей формулой:
[Формула 5]
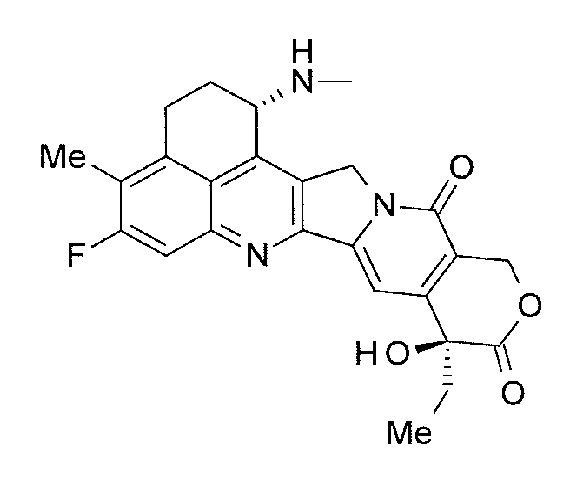
где атом азота амино группы в положении 1 представляет собой положение связывания, и
-GGFG- представляет собой тетрапептидный остаток -Gly-Gly-Phe-Gly-.
[0020]
[13] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[9], где структурный фрагмент лекарственное средство-линкер, содержащий лекарственное средство, связанное с -L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-, представляет собой одну лекарственное средство-линкер структуру, выбранную из следующей группы:
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
[0021]
Здесь, -(Сукцинимид-3-ил-N)-, -(NH-DX) и -GGFG- являются такими, как определено выше.
[0022]
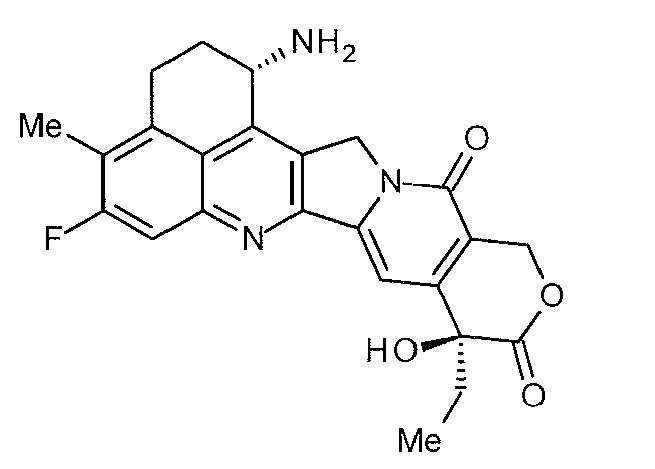
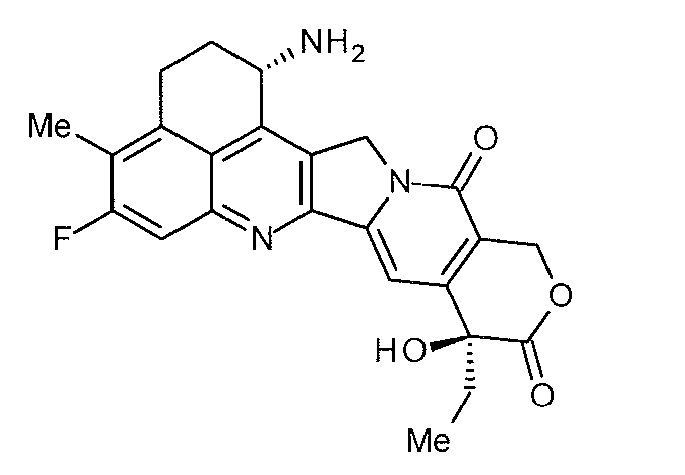
[14] Конъюгат антитело-лекарственное средство, где противоопухолевое соединение, представленное следующей формулой:
[Формула 6]
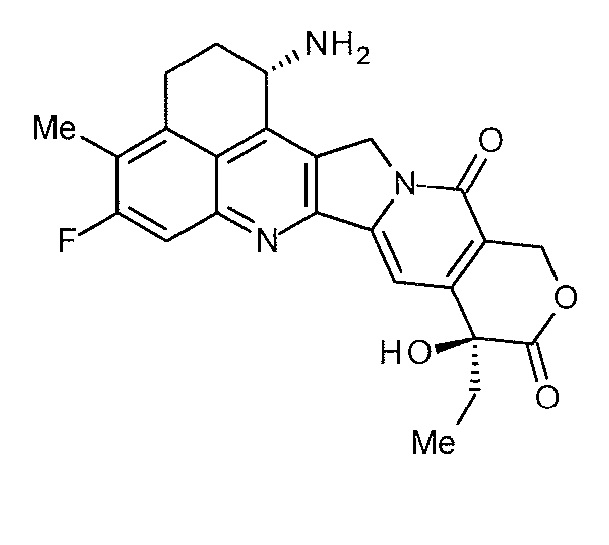
конъюгировано с анти-TROP2 антителом посредством тиоэфирной связи, которая образуется на участке дисульфидной связи, присутствующей в шарнирной части анти-TROP2 антитела, через линкер, имеющий структуру, представленную следующей формулой:
-L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-
где анти-TROP2 антитело связано с концевой частью L1, противоопухолевое соединение связано с карбонильной группой -(CH2)n2-C(=O)-,
где
n1 представляет собой целое число, имеющее значение от 0 до 6,
n2 представляет собой целое число, имеющее значение от 0 до 5,
L1 представляет собой -(Сукцинимид-3-ил-N)-(CH2)n3-C(=O)-,
где n3 представляет собой целое число, имеющее значение от 2 до 8,
L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)- или простую связь,
где n4 представляет собой целое число, имеющее значение от 1 до 6,
LP представляет собой тетрапептидный остаток -GGFG-,
La представляет собой -O- или простую связь, и
-(Сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 7]
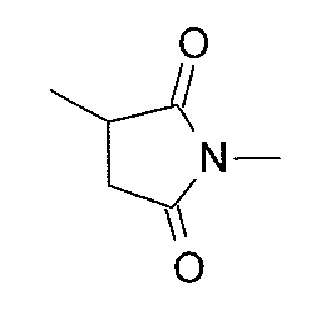
которая связана с анти-TROP2 антителом в положении 3 и связана с метиленовой группой в линкерной структуре, содержащей эту структуру, по атому азота в положении 1.
[0023]
[15] Конъюгат антитело-лекарственное средство в соответствии с пунктом [14], где
n1 имеет значение 3, n2 имеет значение 0, n3 имеет значение 2, L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)-, n4 имеет значение 2, и La представляет собой простую связь,
n1 имеет значение 1, n2 имеет значение 1, n3 имеет значение 5, L2 представляет собой простую связь, и La представляет собой -O-, или
n1 имеет значение 2, n2 имеет значение 1, n3 имеет значение 5, L2 представляет собой простую связь, и La представляет собой -O-.
[16] Конъюгат антитело-лекарственное средство в соответствии с пунктом [14] или [15], где n3 имеет значение 2 или 5, и L2 представляет собой простую связь.
[17] Конъюгат антитело-лекарственное средство в соответствии с пунктом [14] или [15], где n3 имеет значение 2 или 5, L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)-, и n4 имеет значение 2 или 4.
[18] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [14]-[17], где -NH-(CH2)n1-La-(CH2)n2-C(=O)- представляет собой
-NH-CH2CH2CH2-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-CH2CH2-O-CH2-C(=O)-.
[0024]
[19] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [14]-[18], где структурный фрагмент лекарственное средство-линкер, содержащий лекарственное средство, связанное с -L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-, представляет собой одну лекарственное средство-линкер структуру, выбранную из следующей группы:
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX);
[0025]
где -(Сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
[Формула 8]
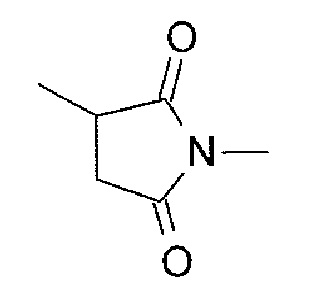
которая связана с анти-TROP2 антителом в положении 3 и связана с метиленовой группой в линкерной структуре, содержащей эту структуру, по атому азота в положении 1,
-(NH-DX) представляет собой группу, представленную следующей формулой:
[Формула 9]
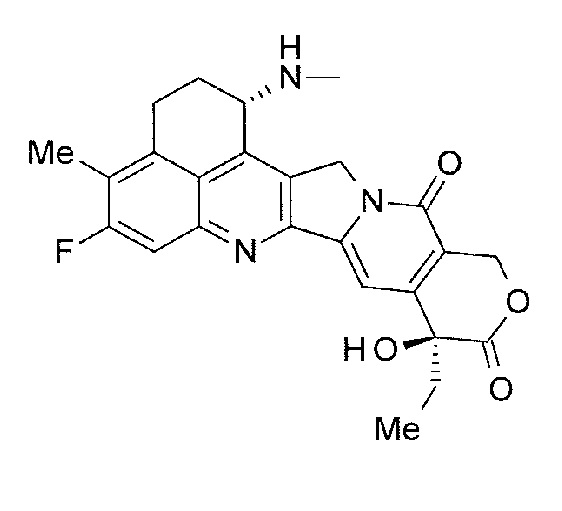
где атом азота амино группы в положении 1 представляет собой положение связывания, и
-GGFG- представляет собой тетрапептидный остаток -Gly-Gly-Phe-Gly-.
[0026]
[20] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [14]-[18], где структурный фрагмент лекарственное средство-линкер, содержащий лекарственное средство, связанное с -L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-, представляет собой одну лекарственное средство-линкер структуру, выбранную из следующей группы:
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
Здесь, -(Сукцинимид-3-ил-N)-, -(NH-DX) и -GGFG- являются такими, как определено выше.
[0027]
[21] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[20], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 1 до 10.
[22] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[20], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 2 до 8.
[23] Конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[20], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 3 до 8.
[0028]
[24] Лекарственное средство, содержащее конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[23], его соль или его гидрат.
[25] Противоопухолевое лекарственное средство и/или противораковое лекарственное средство, содержащее конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[23], его соль или его гидрат.
[26] Противоопухолевое лекарственное средство и/или противораковое лекарственное средство в соответствии с пунктом [25], которое применяют для лечения рака легкого, рака почки, уротелиального рака, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников, панкреатического рака, рака молочной железы, меланомы, рака печени, рака мочевого пузыря, гастрального рака, цервикального рака, рака головы и шеи или эзофагеального рака.
[27] Фармацевтическая композиция, содержащая конъюгат антитело-лекарственное средство в соответствии с любым из пунктов [1]-[23], его соль или его гидрат в качестве активного компонента и фармацевтически приемлемый компонент для формулирования коспозиции.
[28] Фармацевтическая композиция в соответствии с пунктом [27], которую применяют для лечения рака легкого, рака почки, уротелиального рака, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников, панкреатического рака, рака молочной железы, меланомы, рака печени, рака мочевого пузыря, гастрального рака, цервикального рак, рака головы и шеи или эзофагеального рака.
[29] Способ лечения опухоли и/или рака, включающий введение конъюгата антитело-лекарственное средство в соответствии с любым из пунктов [1]-[23], его соли или его гидрата.
[0029]
[30] Способ получения конъюгата антитело-лекарственное средство, включающий взаимодействие соединения, представленного следующей формулой:
(малеимид-N-ил)-(CH2)n3-C(=O)-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-(NH-DX)
с анти-TROP2 антителом или его реакционноспособным производным и конъюгирование лекарственное средство-линкер структуры с антителом способом образования тиоэфирной связи на участке дисульфидной связи, присутствующей в шарнирной части антитела.
[0030]
В формуле, n3 представляет собой целое число, имеющее значение от 2 до 8,
L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)- или простую связь,
где n4 представляет собой целое число, имеющее значение от 1 до 6,
LP представляет собой пептидный остаток, состоящий из 2-7 аминокислот, выбранных из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты,
n1 представляет собой целое число, имеющее значение от 0 до 6,
n2 представляет собой целое число, имеющее значение от 0 до 5,
La представляет собой -O- или простую связь,
(малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
[Формула 10]
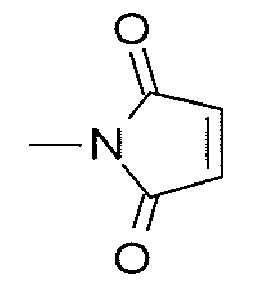
где атом азота представляет собой положение связывания.
-(NH-DX) представляет собой группу, представленную следующей формулой:
[Формула 11]
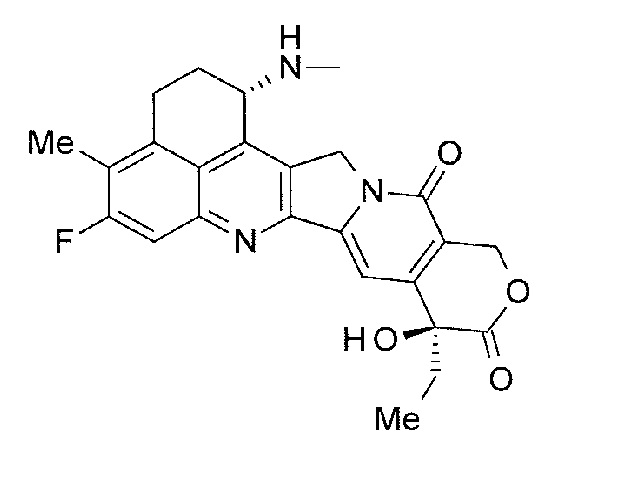
где атом азота амино группы в положении 1 представляет собой положение связывания.
[0031]
[31] Способ получения в соответствии с пунктом [30], где способ конъюгирования лекарственное средство-линкер структуры с анти-TROP2 антителом представляет собой способ восстановления антитела для преобразования антитела в реакционноспособное производное.
[0032]
[32] Способ получения в соответствии с пунктом [30] или [31], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 1 до 10.
[33] Способ получения в соответствии с пунктом [30] или [31], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 2 до 8.
[34] Способ получения в соответствии с пунктом [30] или [31], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 3 до 8.
[35] Конъюгат антитело-лекарственное средство, полученный способом получения в соответствии с любым из пунктов [30]-[34].
[0033]
[36] Конъюгат антитело-лекарственное средство, полученный путем образования тиоэфирной связи на участке сульфидной связи в шарнирной части анти-TROP2 антитела, где анти-TROP2 антитело обрабатывают в восстановительных условиях и затем подвергают взаимодействию с соединением, выбранным из следующей группы:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX), и
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
[0034]
В перечисленных выше, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
[Формула 12]
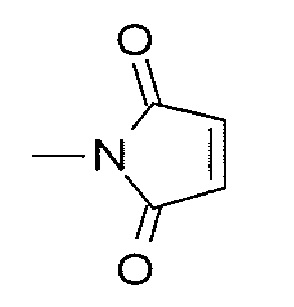
где атом азота представляет собой положение связывания.
-(NH-DX) представляет собой группу, представленную следующей формулой:
[Формула 13]
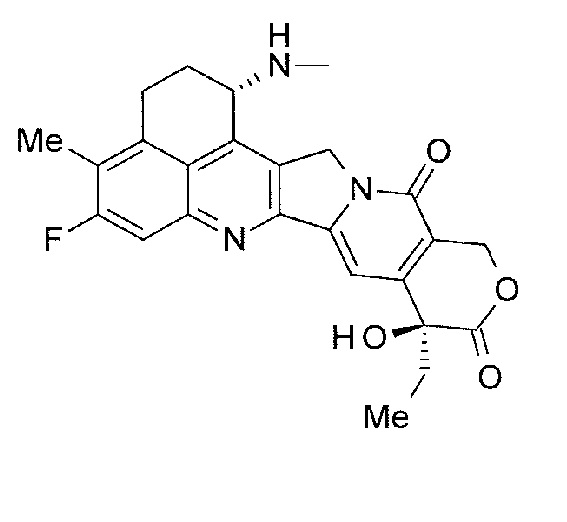
где атом азота амино группы в положении 1 представляет собой положение связывания.
-GGFG- представляет собой тетрапептидный остаток -Gly-Gly-Phe-Gly-.
[0035]
[37] Конъюгат антитело-лекарственное средство, полученный путем образования тиоэфирной связи на участке сульфидной связи, присутствующей в шарнирной части анти-TROP2 антитела, где анти-TROP2 антитело обрабатывают в восстановительных условиях и затем подвергают взаимодействию с соединением, выбранным из следующей группы:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX), и
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
Здесь, (малеимид-N-ил)-, -(NH-DX) и -GGFG- являются такими, как определено выше.
[0036]
[38] Конъюгат антитело-лекарственное средство в соответствии с пунктом [36] или [37], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 1 до 10.
[39] Конъюгат антитело-лекарственное средство в соответствии с пунктом [36] или [37], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 2 до 8.
[40] Конъюгат антитело-лекарственное средство в соответствии с пунктом [36] или [37], где среднее количество конъюгированных единиц выбранной одной лекарственное средство-линкер структуры в расчете на антитело находится в пределах от 3 до 8.
ВЫГОДНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0037]
С использованием конъюгата анти-TROP2 антитело-лекарственное средство, содержащего противоопухолевое соединение экзатекан, конъюгированное через линкер с специфической структурой, может достигаться отличный противоопухолевый эффект и безопасность.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0038]
[Фиг. 1] Фиг. 1 показывает нуклеотидную последовательность (SEQ ID NO: 7) и аминокислотную последовательность (SEQ ID NO: 8) тяжелой цепи cTINA1 антитела.
[Фиг. 2] Фиг. 2 показывает нуклеотидную последовательность (SEQ ID NO: 9) и аминокислотную последовательность (SEQ ID NO: 10) легкой цепи cTINA1 антитела.
[Фиг. 3] Фиг. 3 показывает нуклеотидную последовательность (SEQ ID NO: 11) и аминокислотную последовательность (SEQ ID NO: 12) тяжелой цепи hTINA1-H1.
[Фиг. 4] Фиг. 4 показывает нуклеотидную последовательность (SEQ ID NO: 13) и аминокислотную последовательность (SEQ ID NO: 14) тяжелой цепи hTINA1-H2.
[Фиг. 5] Фиг. 5 показывает нуклеотидную последовательность (SEQ ID NO: 15) и аминокислотную последовательность (SEQ ID NO: 16) тяжелой цепи hTINA1-H3.
[Фиг. 6] Фиг. 6 показывает нуклеотидную последовательность (SEQ ID NO: 17) и аминокислотную последовательность (SEQ ID NO: 18) легкой цепи hTINA1-L1.
[Фиг. 7] Фиг. 7 показывает нуклеотидную последовательность (SEQ ID NO: 19) и аминокислотную последовательность (SEQ ID NO: 20) легкой цепи hTINA1-L2.
[Фиг. 8] Фиг. 8 показывает нуклеотидную последовательность (SEQ ID NO: 21) и аминокислотную последовательность (SEQ ID NO: 22) легкой цепи hTINA1-L3.
[Фиг. 9] Фиг. 9 показывает аминокислотную последовательность (SEQ ID NO: 23) CDRH1 TINA1 антитела, аминокислотую последовательность (SEQ ID NO: 24) его CDRH2, аминокислотную последовательность (SEQ ID NO: 25) его CDRH3, аминокислотную последовательность (SEQ ID NO: 26) его CDRL1, аминокислотную последовательность (SEQ ID NO: 27) его CDRL2 и аминокислотную последовательность (SEQ ID NO: 28) его CDRL3.
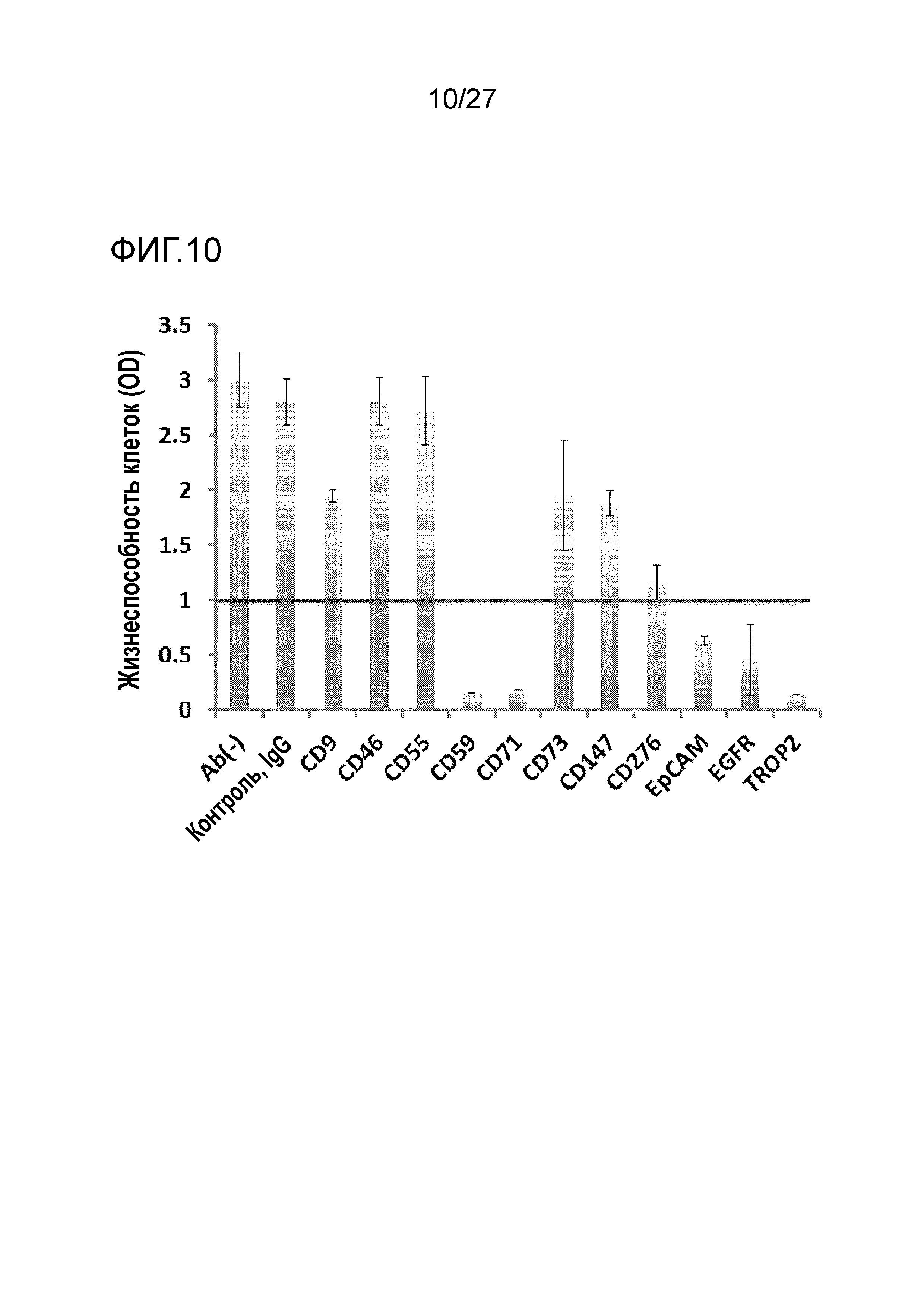
[Фиг. 10] Фиг. 10 показывает способность к клеточной интернализации анти-CD9 антитела, анти-CD46 антитела, анти-CD55 антитела, анти-CD59 антитела, анти-CD71 антитела, анти-CD73 антитела, анти-CD147 антитела, анти-CD276 антитела, анти-EpCAM антитела, анти-EGFR антитела и анти-TROP2 антитела (TINA1 антитело).
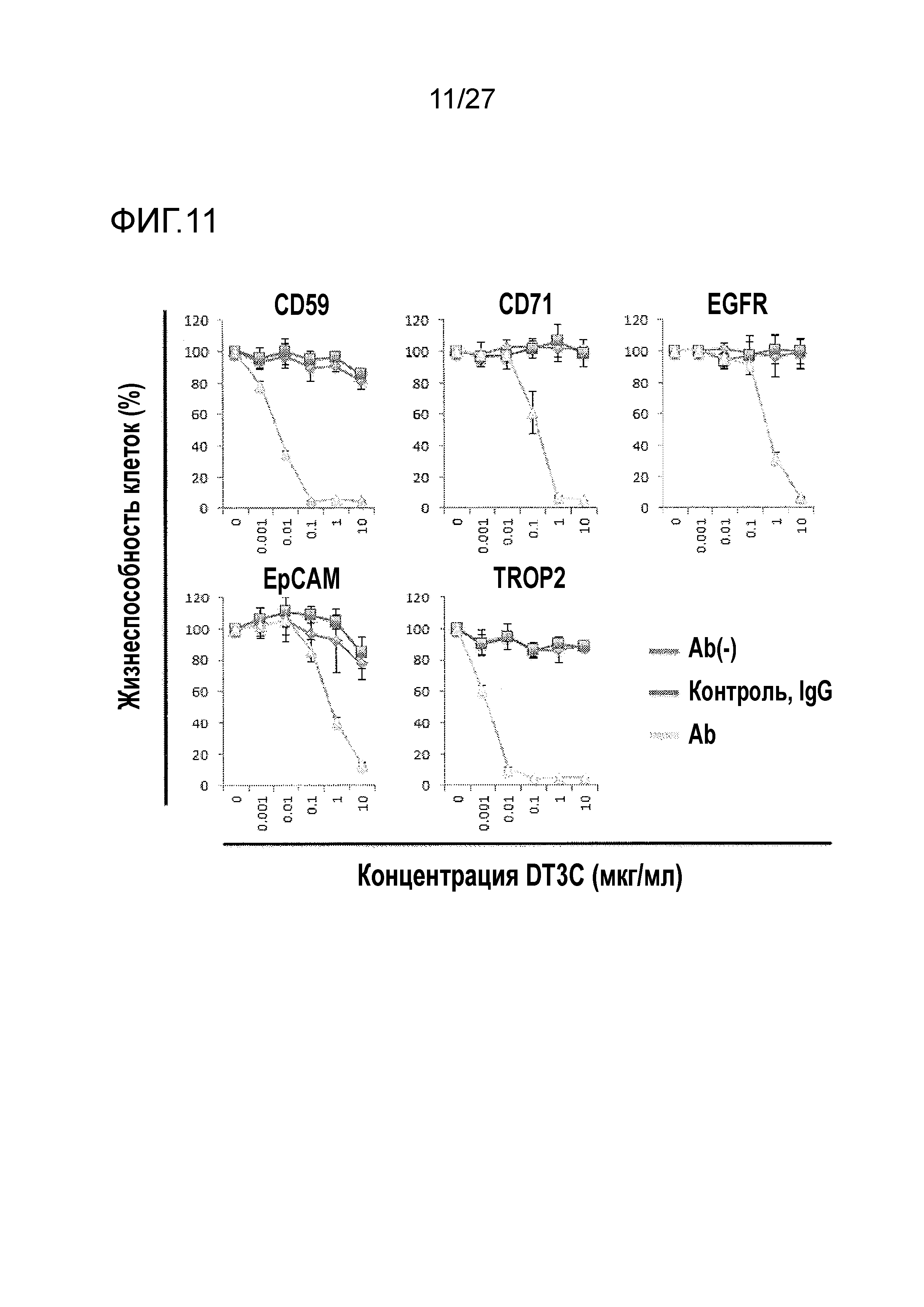
[Фиг. 11] Фиг. 11 показывает способность к клеточной интернализации анти-CD59 антитела, анти-CD71 антитела, анти-EGFR антитела, анти-EpCAM антитела и анти-TROP2 антитела (TINA1 антитело).
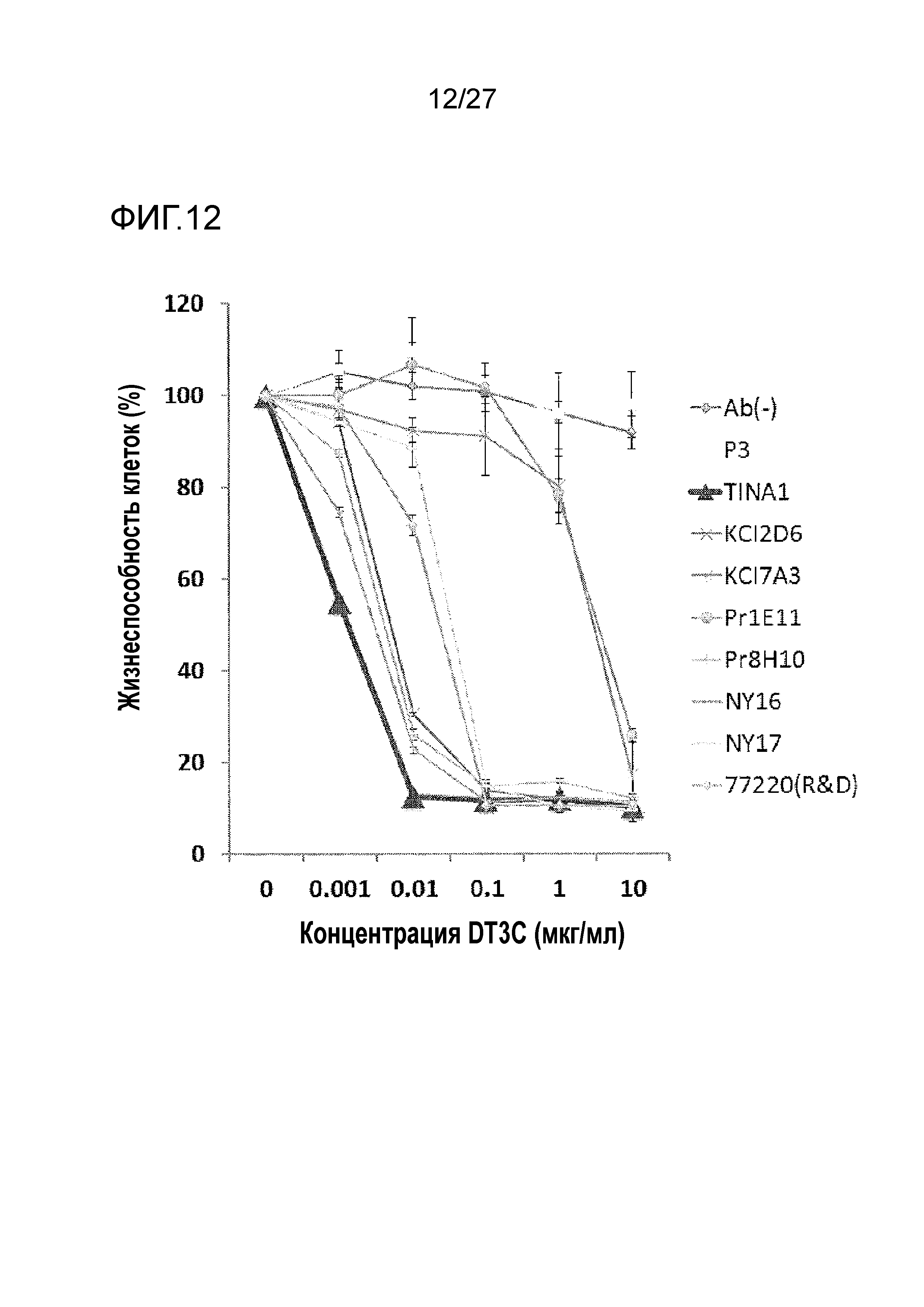
[Фиг. 12] Фиг. 12 показывает способность к клеточной интернализации различных анти-TROP2 антител.
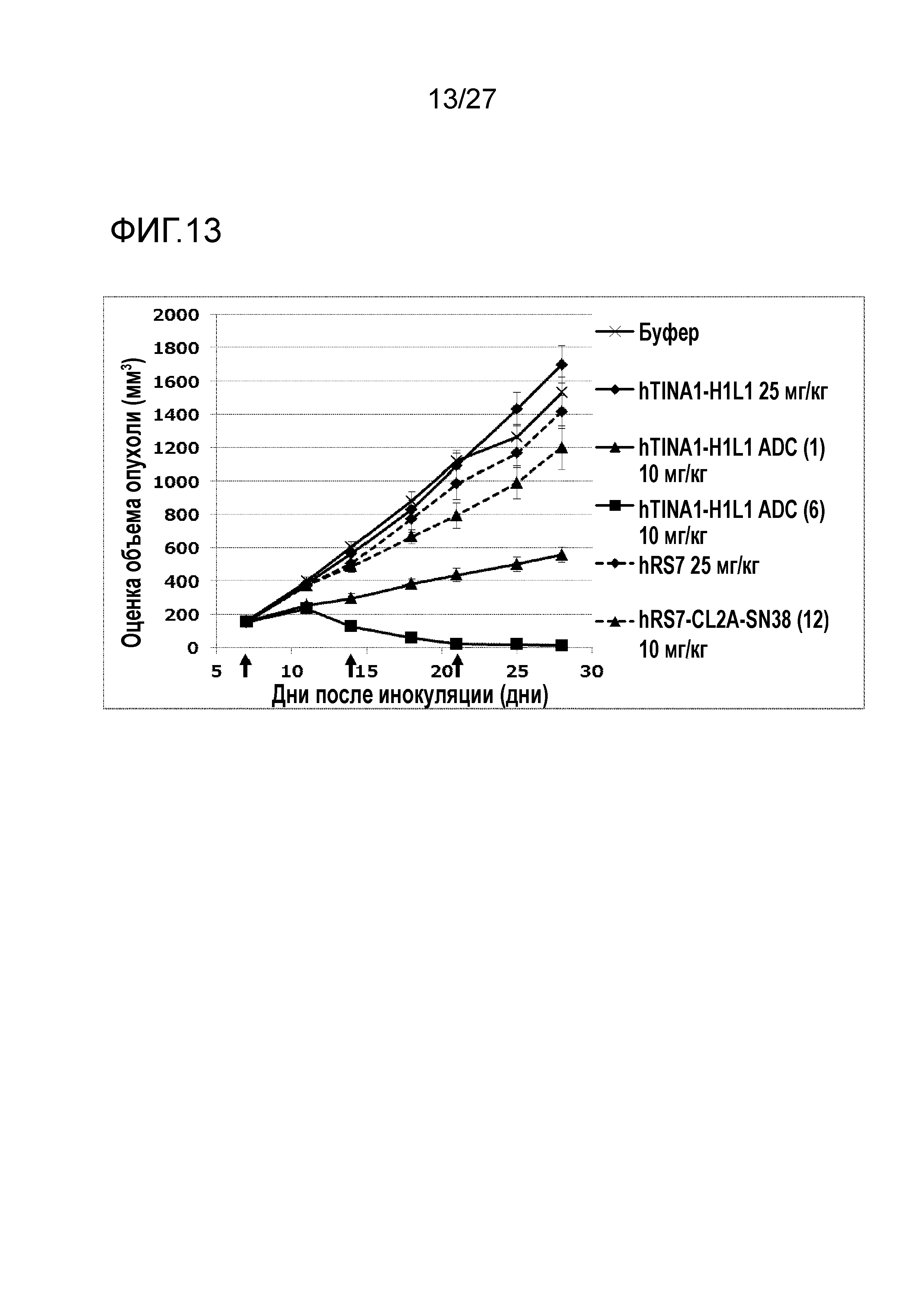
[Фиг. 13] Фиг. 13 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (1), (6) или (12) на клеточную линию колоректального рака человека COLO205, подкожно трансплантированную BALB/c-nu/nu мышам.
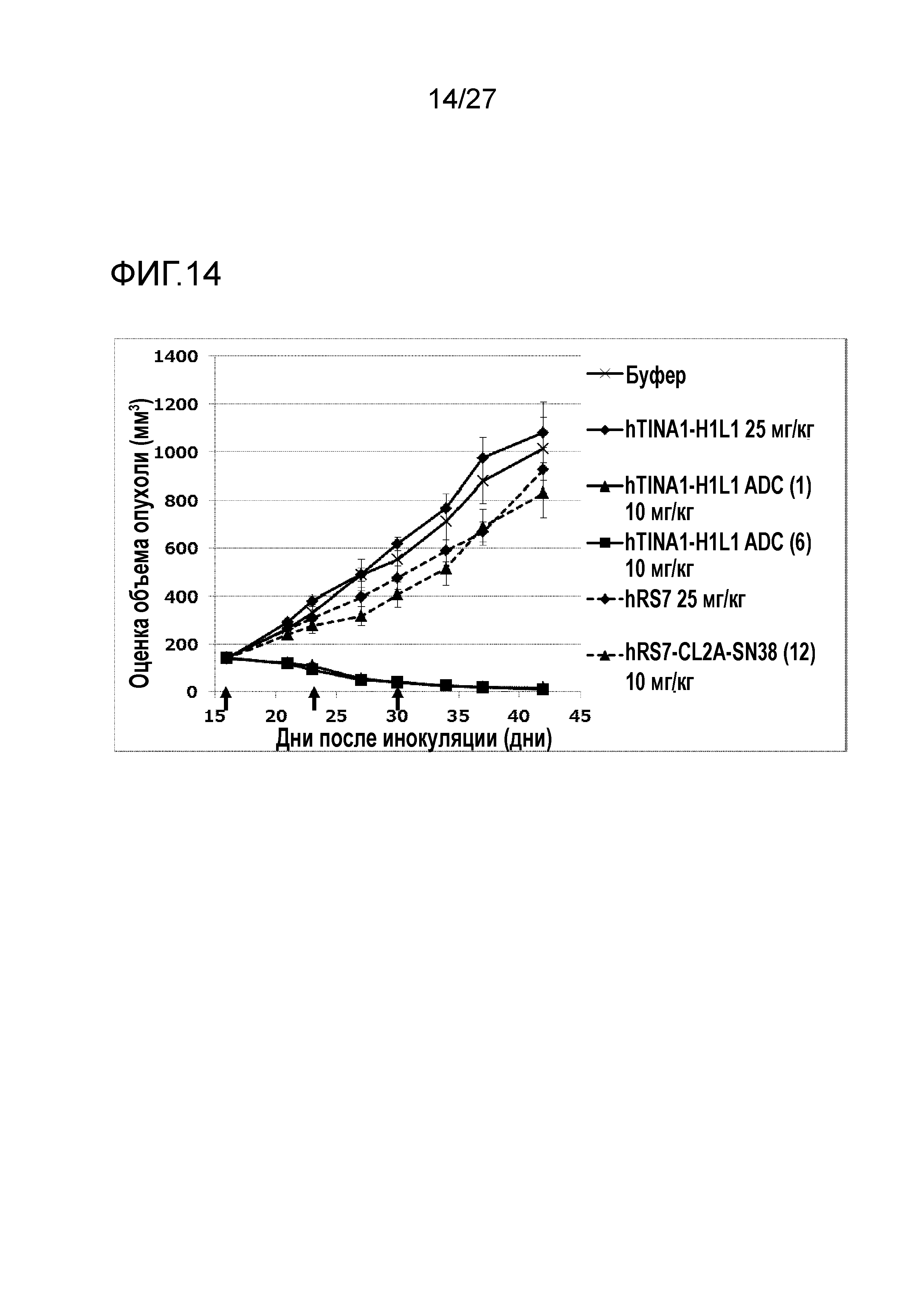
[Фиг. 14] Фиг. 14 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (1), (6) или (12) на клеточную линию панкреатической аденокарциномы человека BxPC-3, подкожно трансплантированную BALB/c-nu/nu мышам.
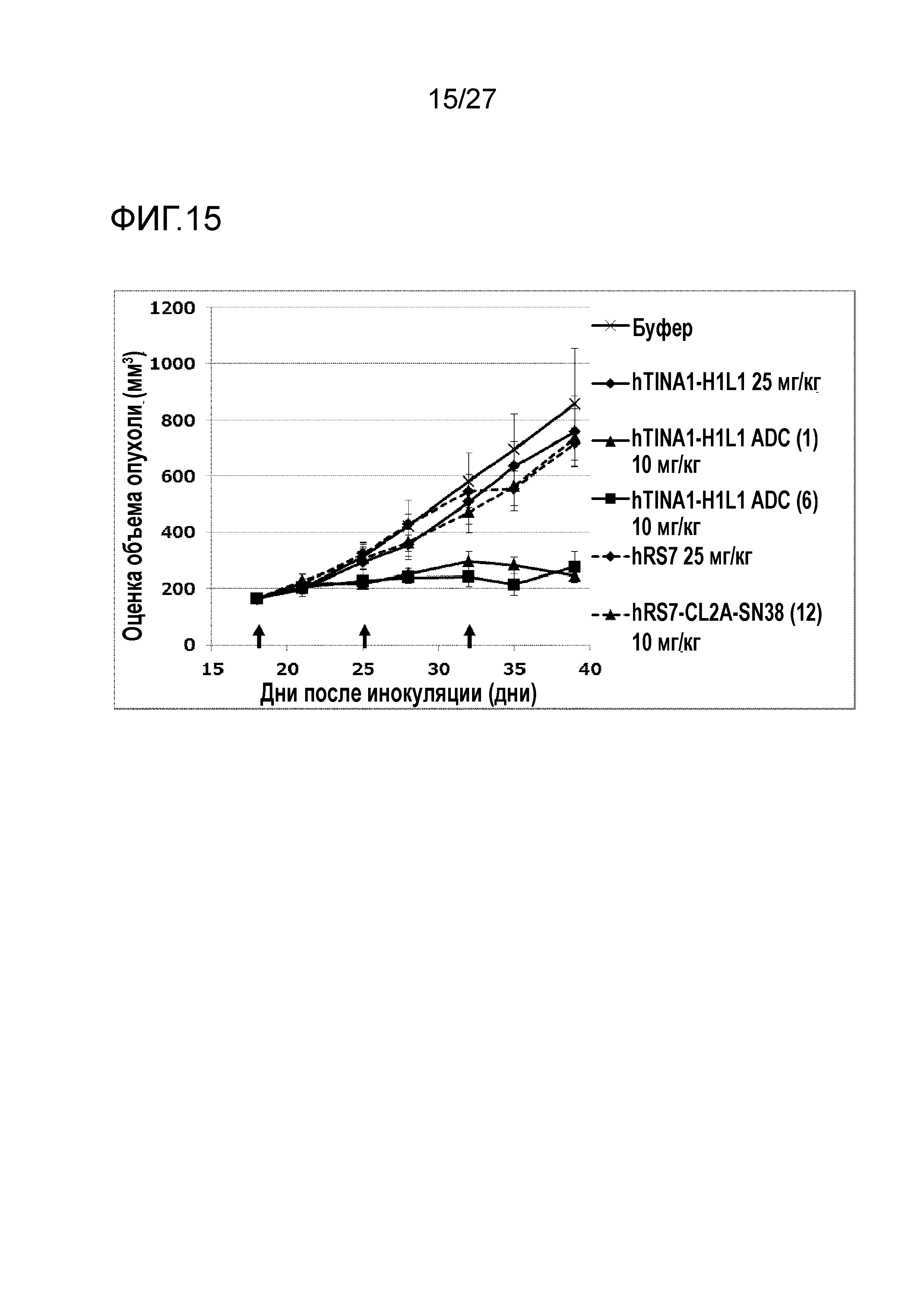
[Фиг. 15] Фиг. 15 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (1), (6) или (12) на клеточную линию панкреатической аденокарцины человека Capan-1, подкожно трансплантированную BALB/c-nu/nu мышам.
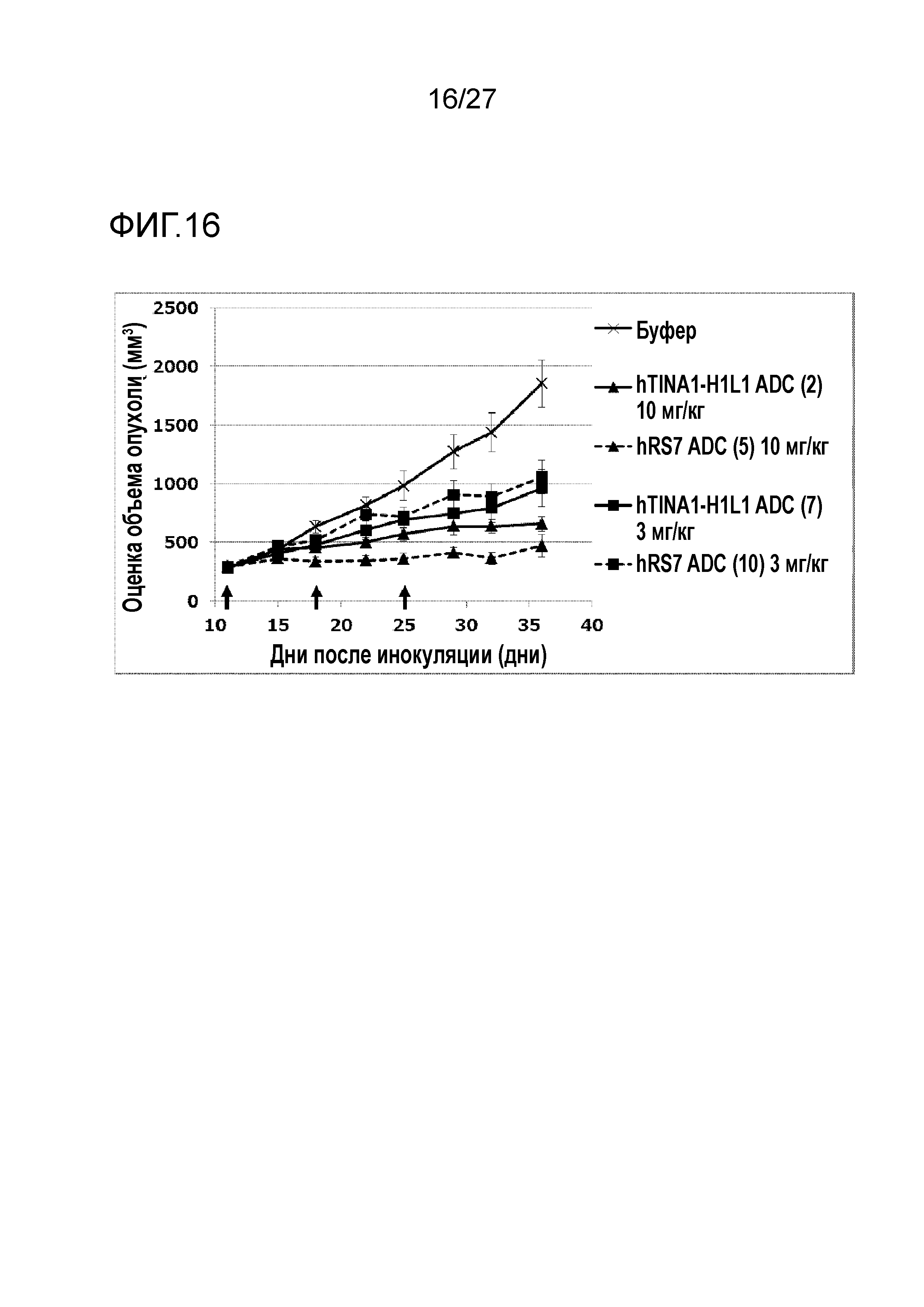
[Фиг. 16] Фиг. 16 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (2), (5), (7) или (10) на клеточную линию колоректального рака человека COLO205, подкожно трансплантированную BALB/c-nu/nu мышам.
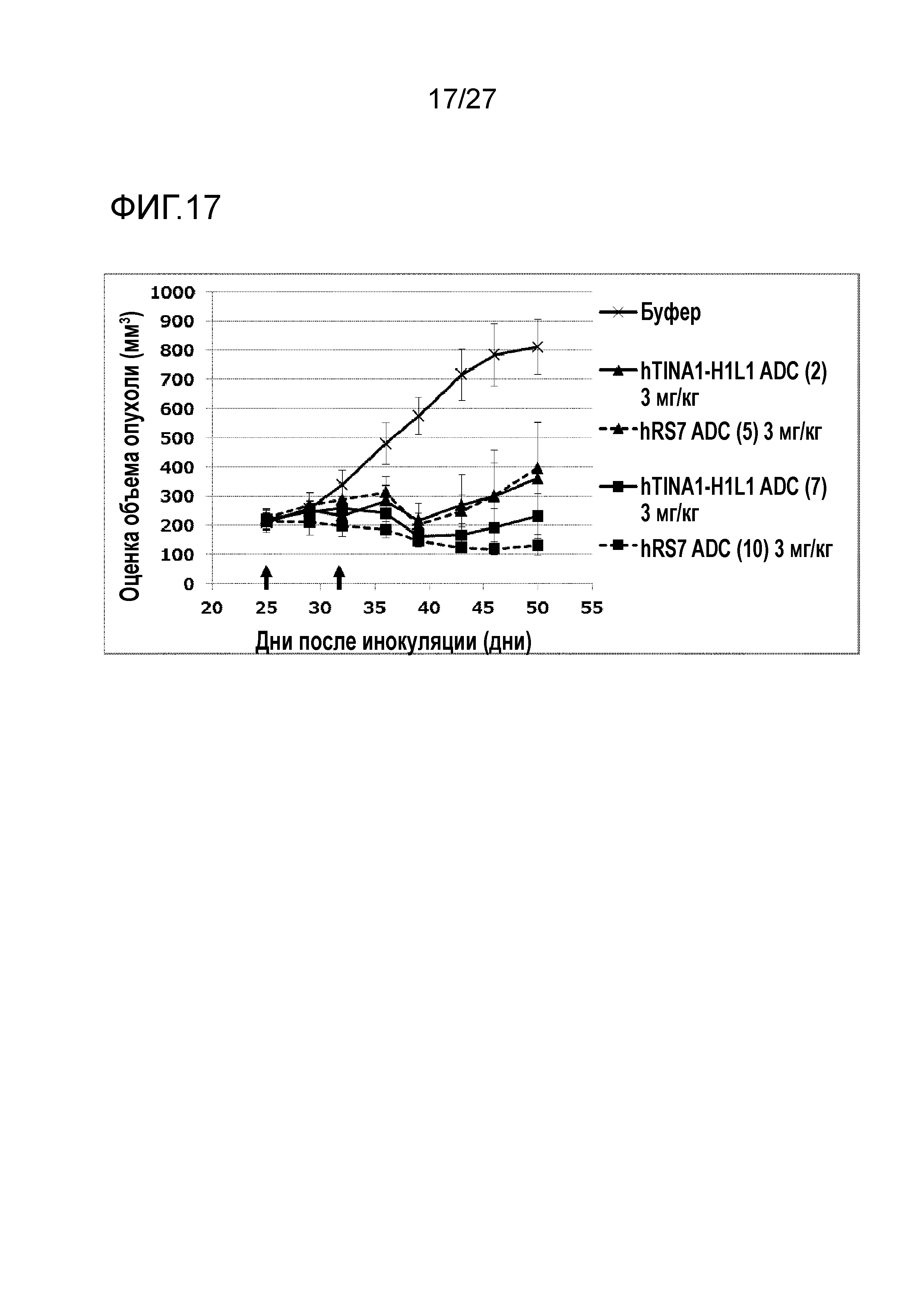
[Фиг. 17] Фиг. 17 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (2), (5), (7) или (10) на клеточную линию панкреатической аденокарциномы человека BxPC-3, подкожно трансплантированную BALB/c-nu/nu мышам.
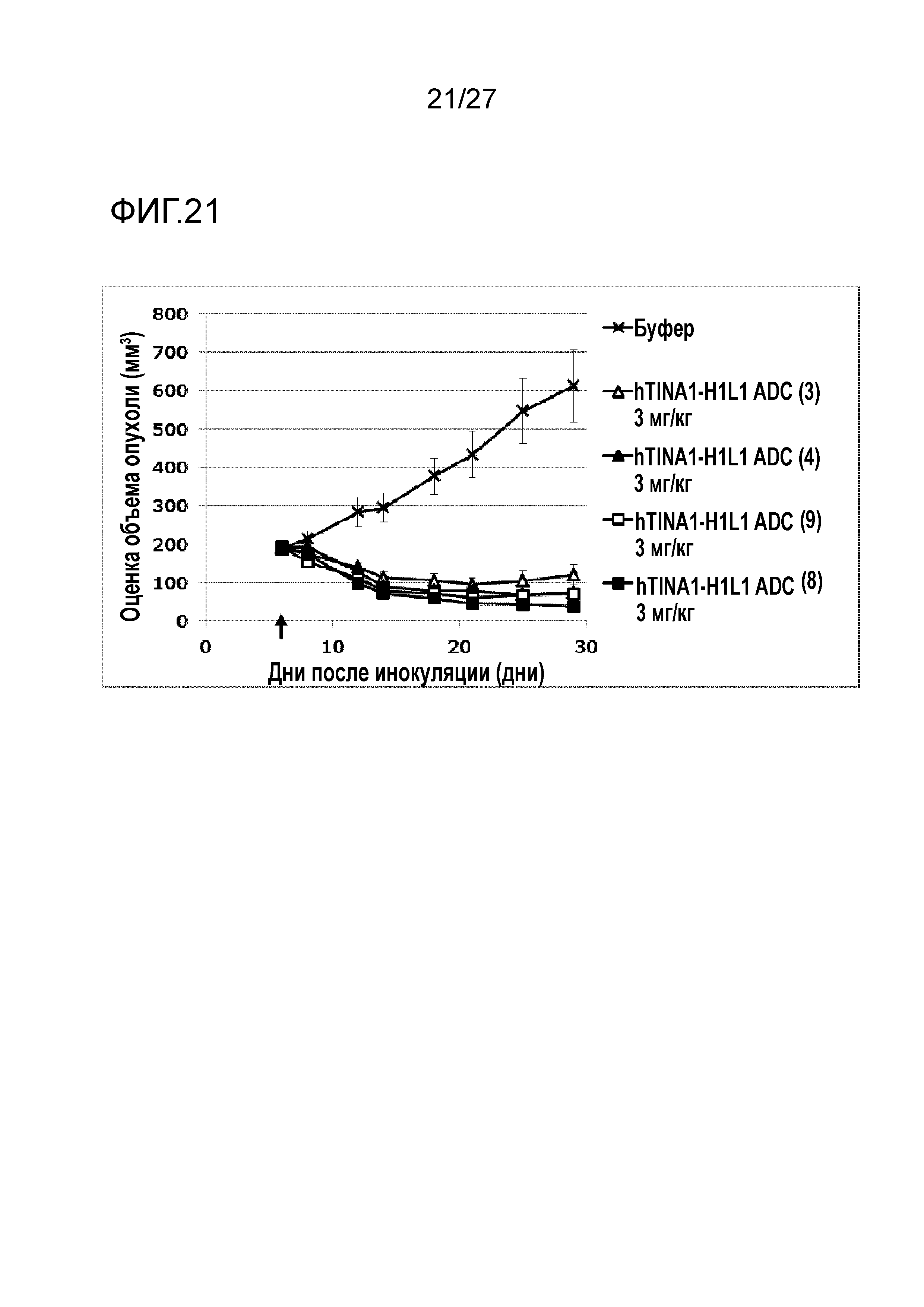
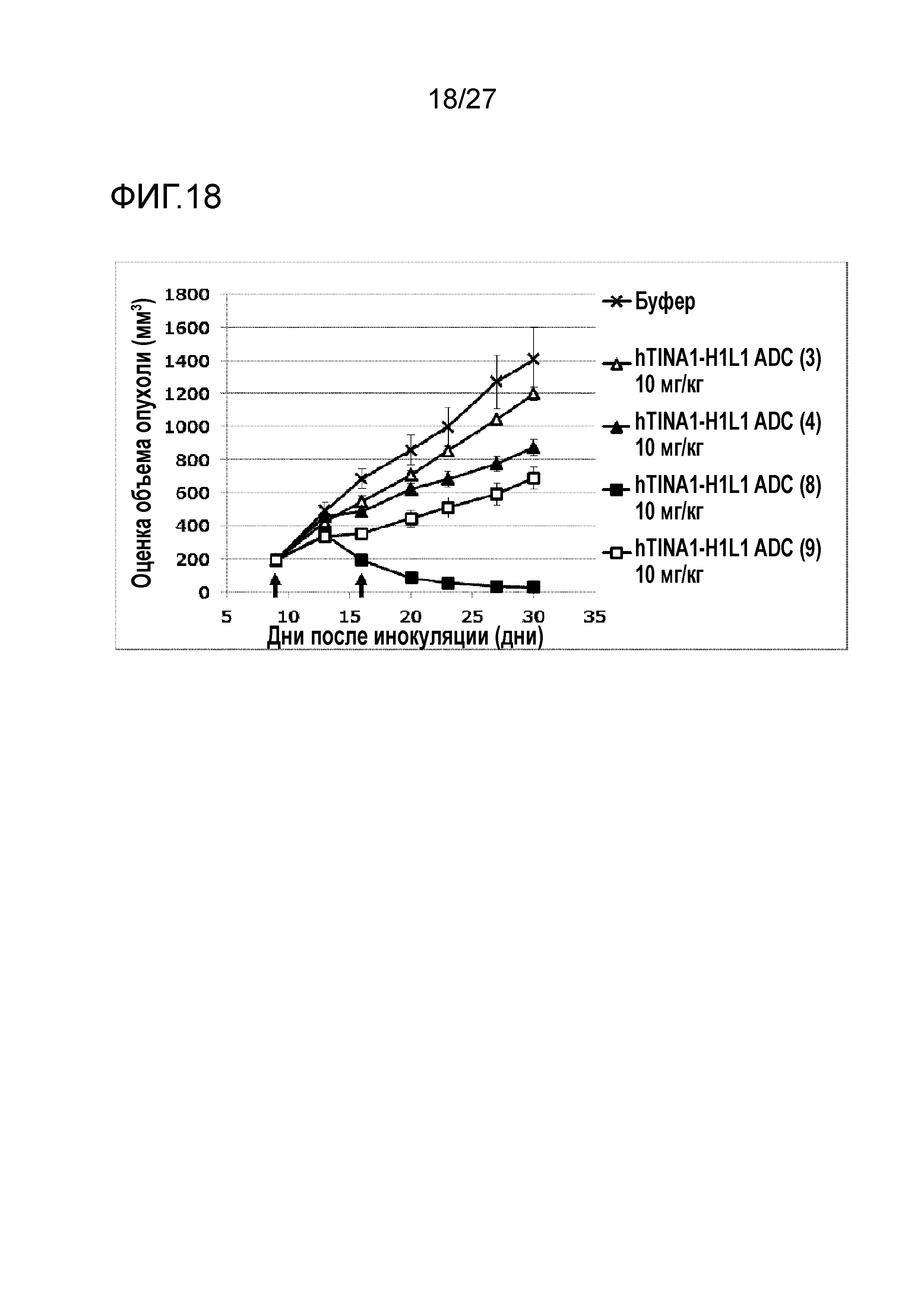
[Фиг. 18] Фиг. 18 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию колоректального рака человека COLO205, подкожно трансплантированную BALB/c-nu/nu мышам.
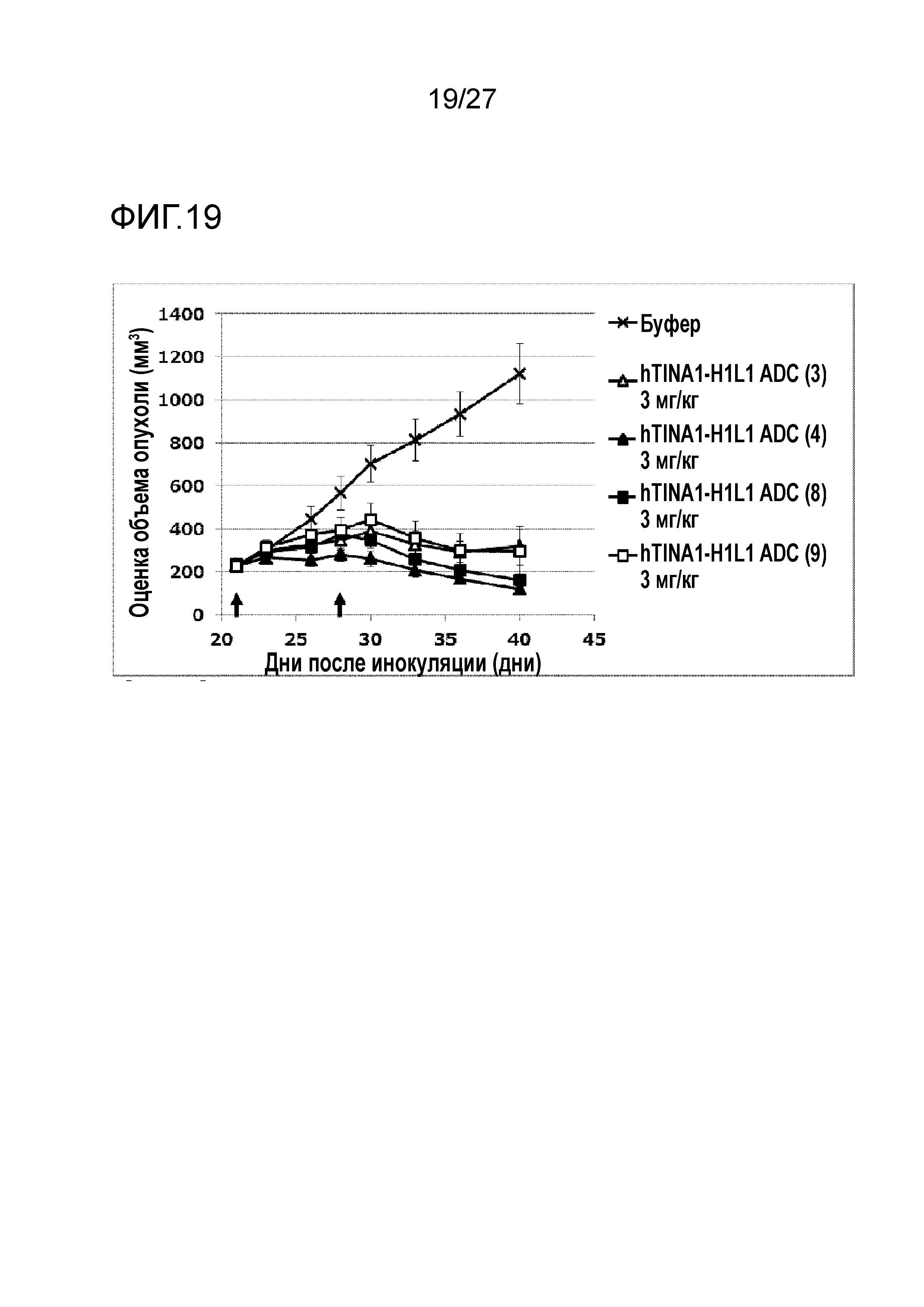
[Фиг. 19] Фиг. 19 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8), или (9) на клеточную линию панкреатической аденокарциномы человека BxPC-3, подкожно трансплантированную BALB/c-nu/nu мышам.
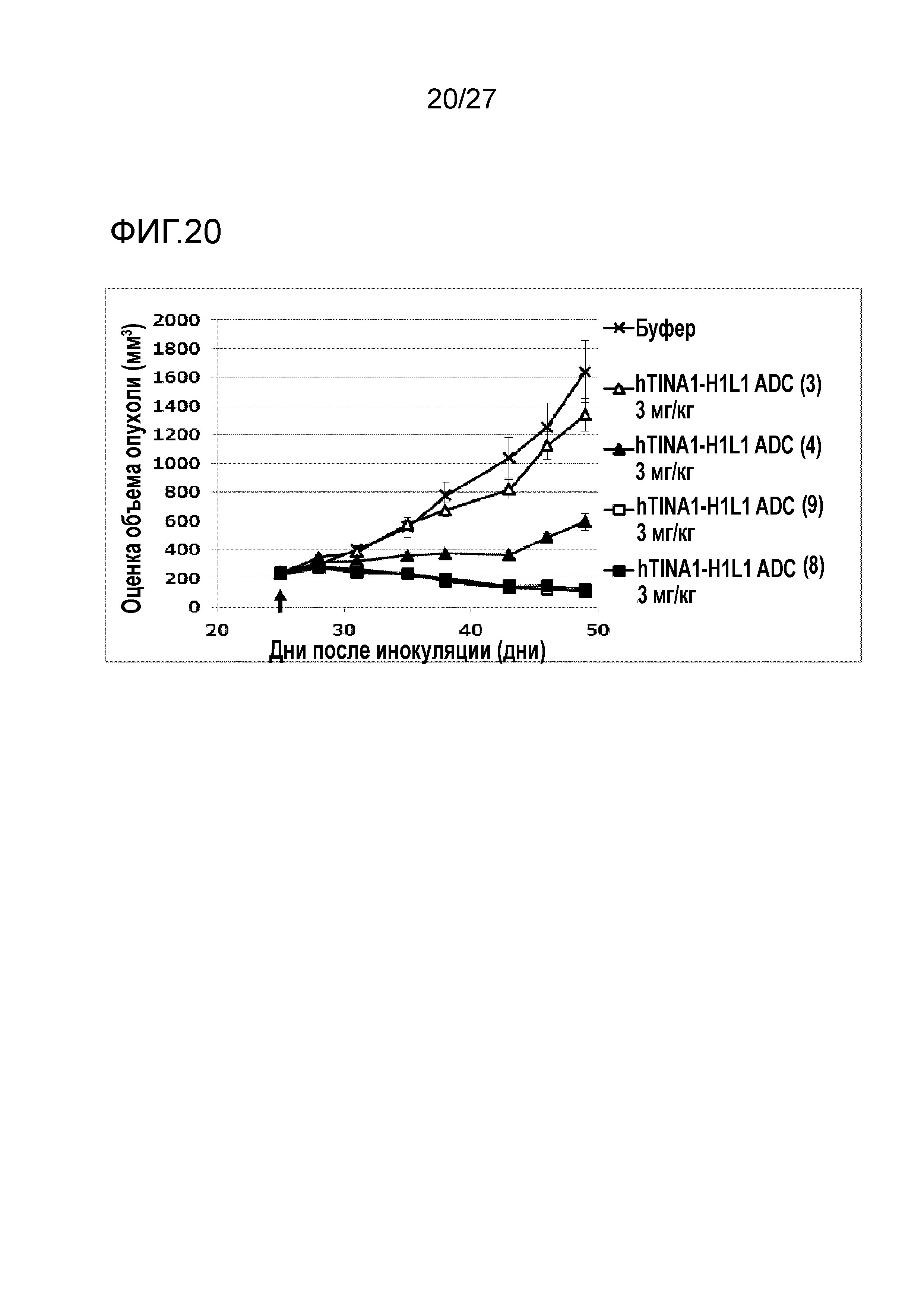
[Фиг. 20] Фиг. 20 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию рака яичников человека NIH:OVCAR-3, подкожно трансплантированную BALB/c-nu/nu мышам.
[Фиг. 21] Фиг. 21 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию гастрального рака человека NCI-N87, подкожно трансплантированную BALB/c-nu/nu мышам.
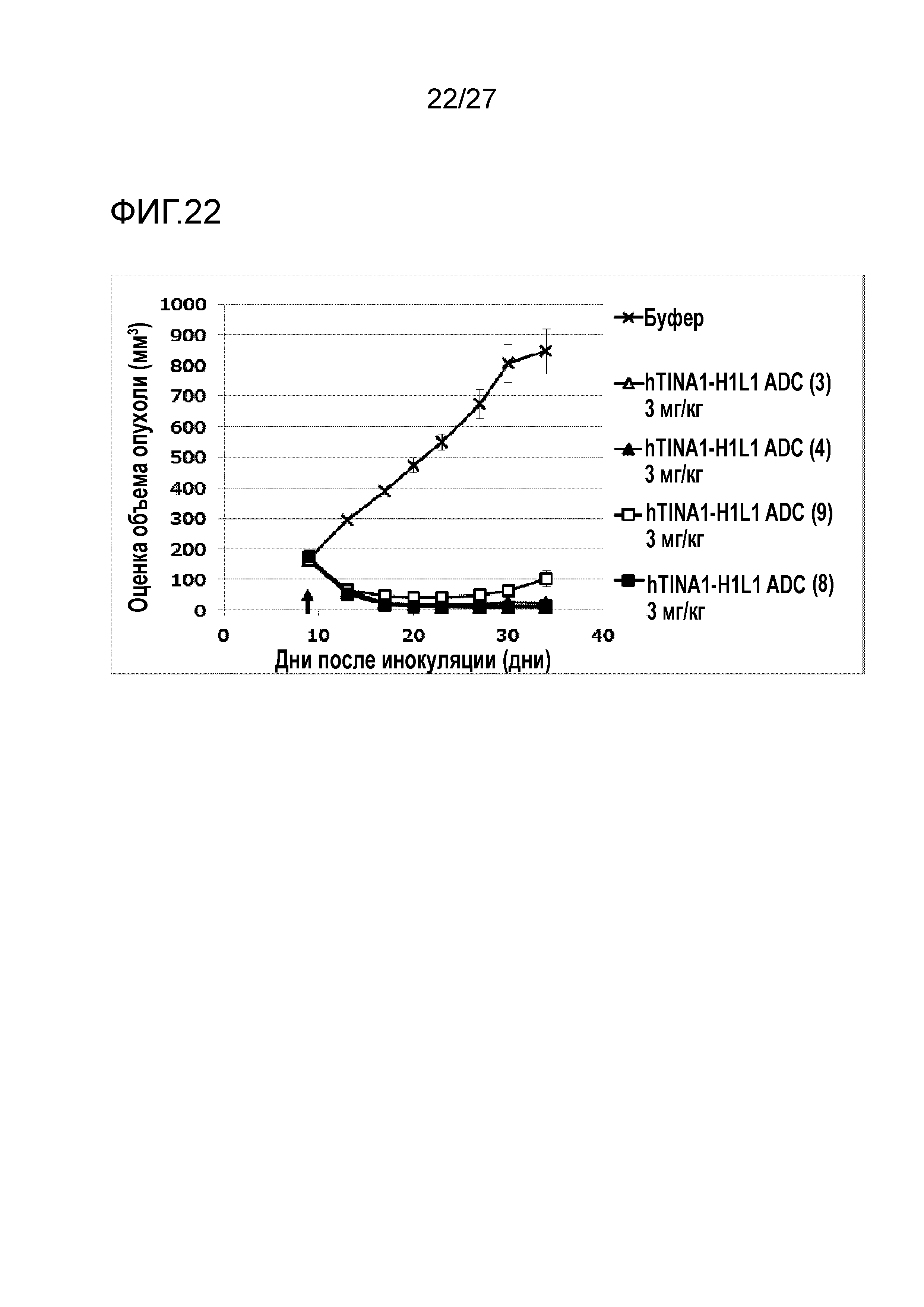
[Фиг. 22] Фиг. 22 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию рака легкого человека NCI-H292, подкожно трансплантированную BALB/c-nu/nu мышам.
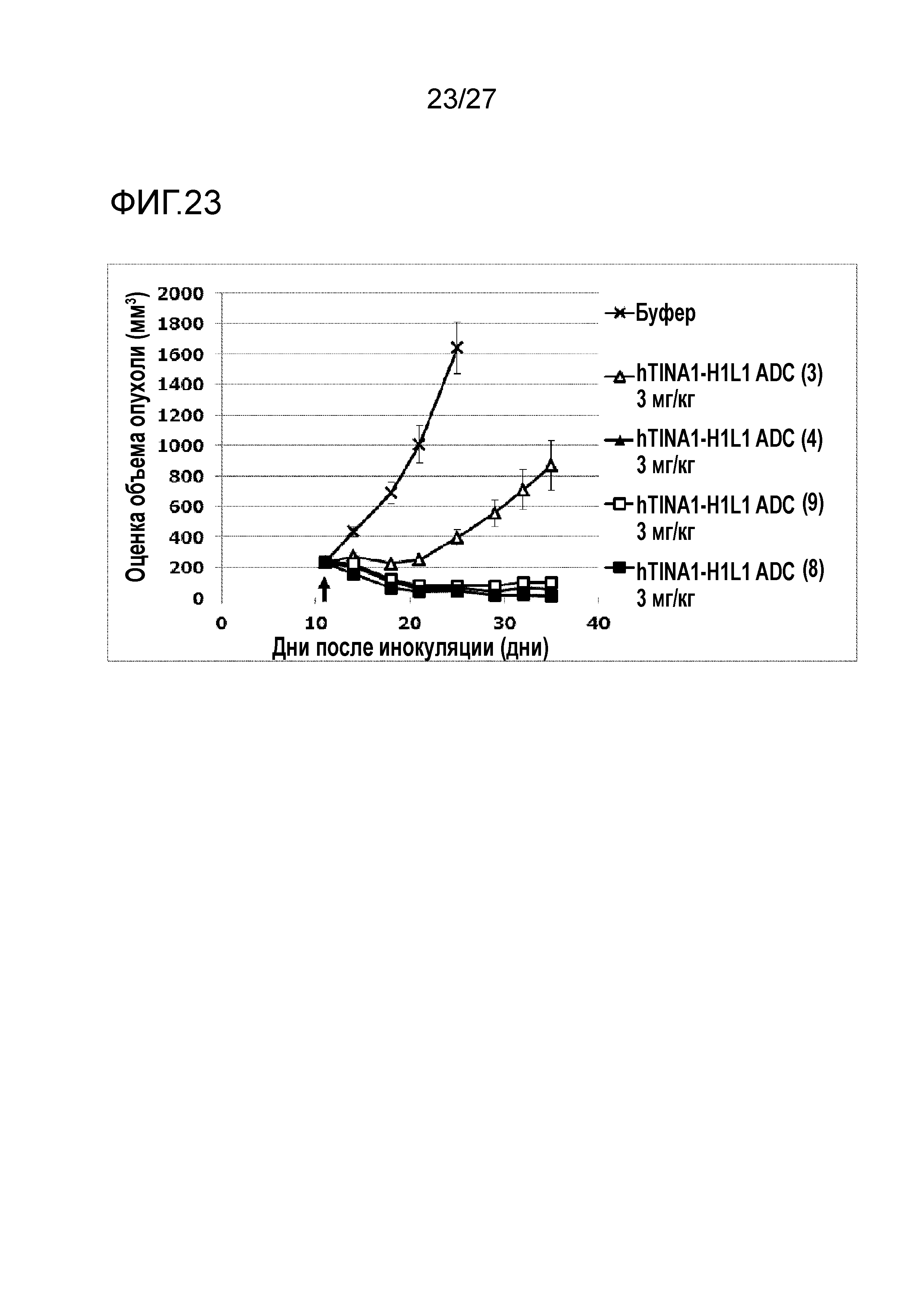
[Фиг. 23] Фиг. 23 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию рака горла человека FaDu, подкожно трансплантированную BALB/c-nu/nu мышам.
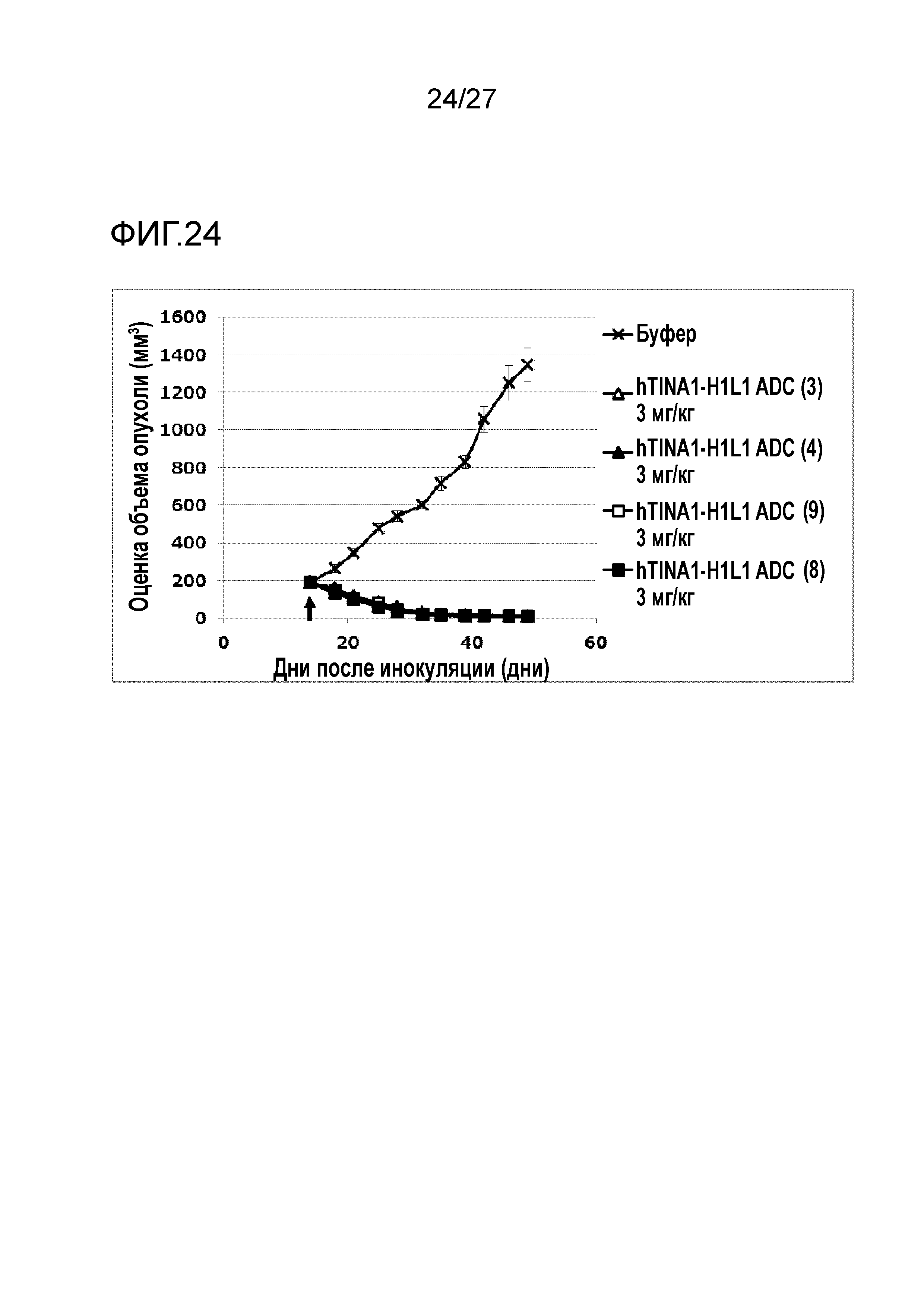
[Фиг. 24] Фиг. 24 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (3), (4), (8) или (9) на клеточную линию панкреатической аденокарциномы человека CFPAC-1, подкожно трансплантированную BALB/c-nu/nu мышам.
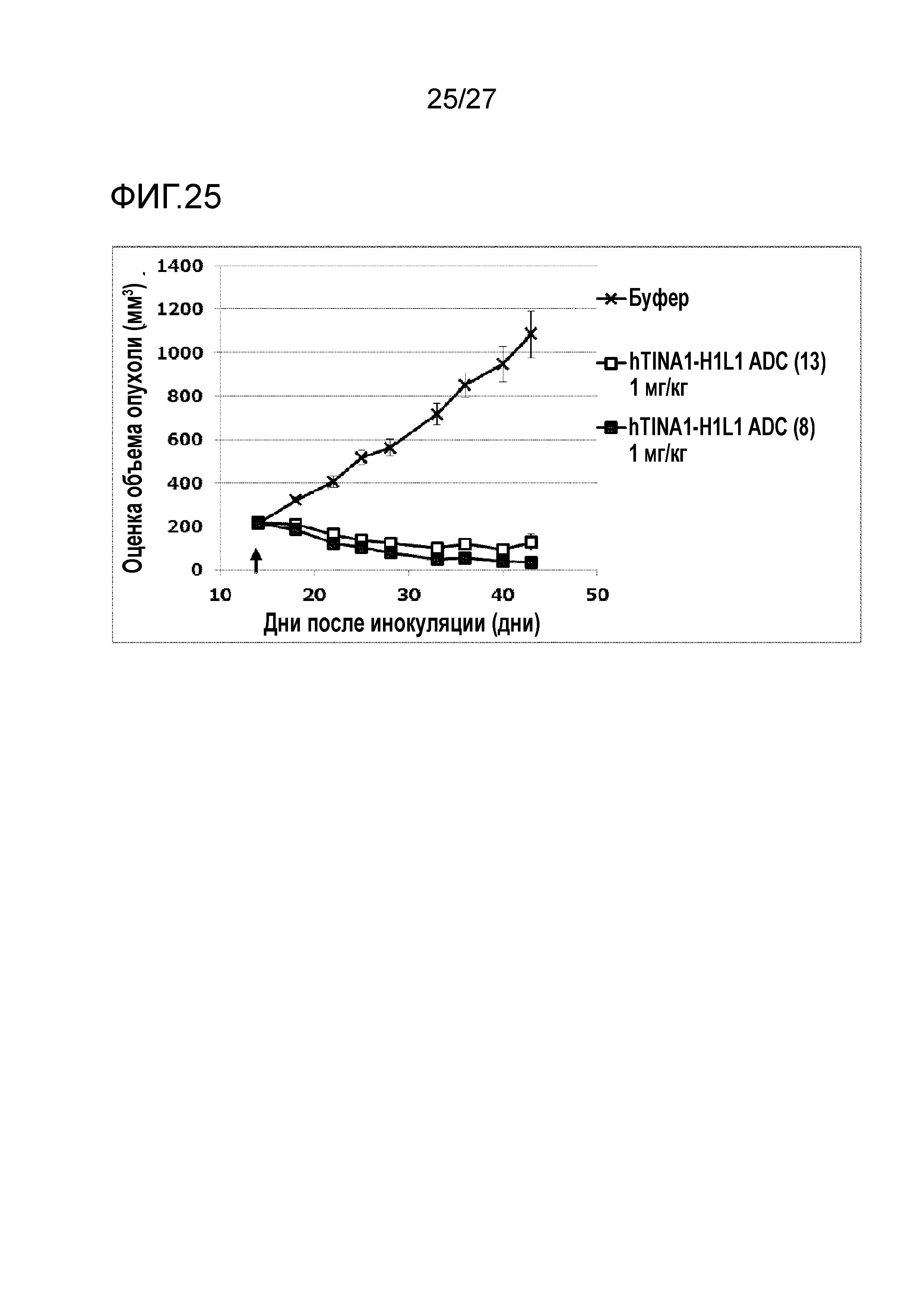
[Фиг. 25] Фиг. 25 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (8) или (13) на клеточную линию панкреатической аденокарциномы человека CFPAC-1, подкожно трансплантированную BALB/c-nu/nu мышам.
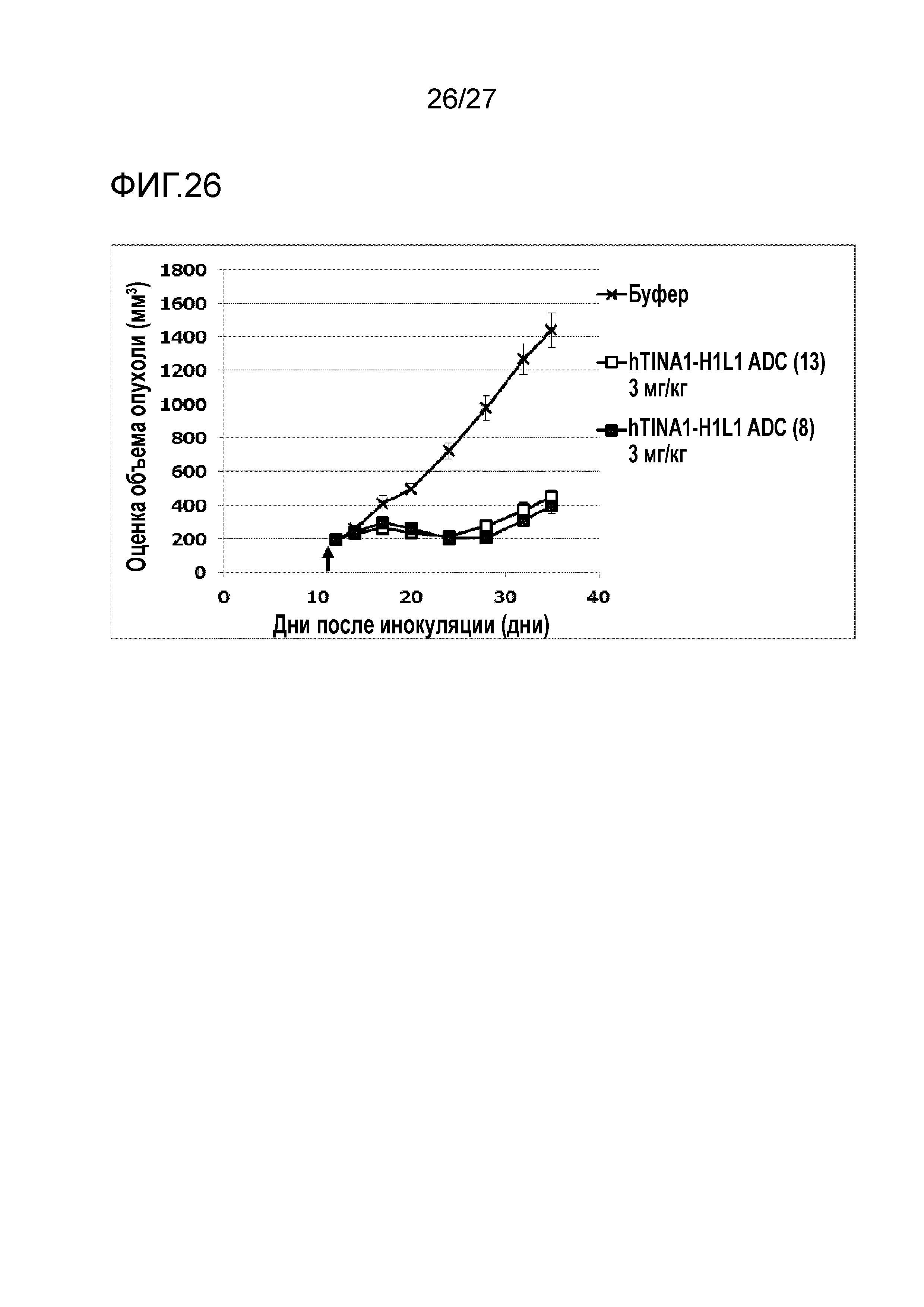
[Фиг. 26] Фиг. 26 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (8) или (13) на клеточную линию панкреатической аденокарциномы человека HPAC, подкожно трансплантированную BALB/c-nu/nu мышам.
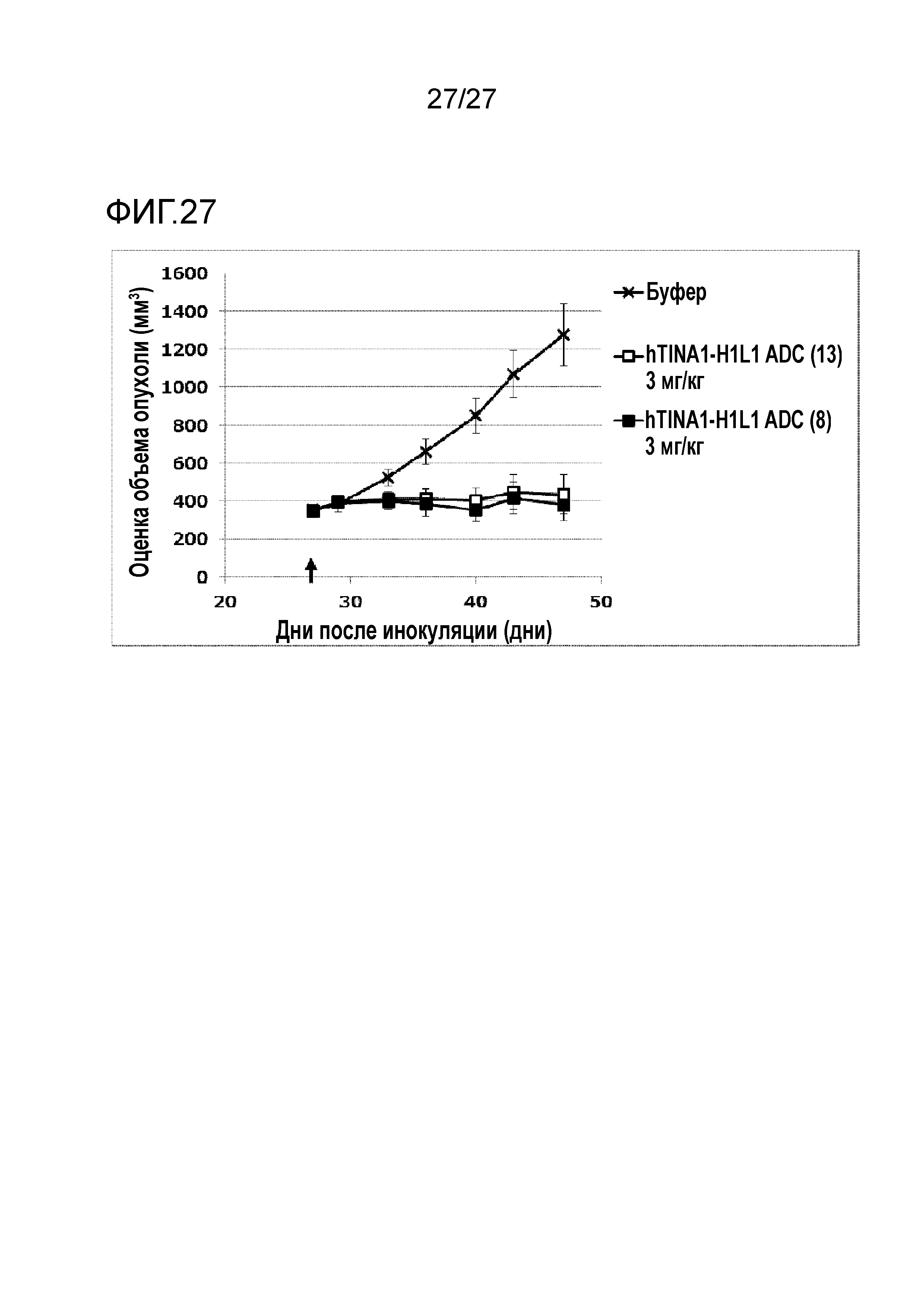
[Фиг. 27] Фиг. 27 показывает противоопухолевый эффект конъюгата антитело-лекарственное средство (8) или (13) на ткани эзофагеального рака человека, подкожно трансплантированные NOD-scid мышам.
ОПИСАНИЕ ВАРИАНТОВ ВОПЛОЩЕНИЯ
[0039]
Далее предпочтительные способы осуществления настоящего изобретения будут описаны со ссылкой на рисунки. Варианты воплощения, описанные ниже, представлены как типичные примеры вариантов воплощения настоящего изобретения и не предназначены для ограничения объема настоящего изобретения.
[0040]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению представляет собой противоопухолевое лекарственное средство, в котором анти-TROP2 антитело конъюгировано с противоопухолевым соединением через линкерную структуру, и подробно описан ниже.
[0041]
[Антитело]
Анти-TROP2 антитело, используемое в конъюгате анти-TROP2 антитело-лекарственное средство по настоящему изобретению, может происходить из любых видов, и предпочтительные примеры видов могут включать человека, крыс, мышей и кроликов. В случае, когда оно происходит из вида, отличного от человека, его предпочтительно подвергают химеризации или гуманизации с использованием хорошо известного метода. Антитело по настоящему изобретению может быть поликлональным антителом или моноклональным антителом, и предпочтительно оно является моноклональным антителом.
Анти-TROP2 антитело способно таргетировать опухолевые клетки, то есть обладает способностью распознавания опухолевой клетки, способностью связывания с опухолевой клеткой, свойством интернализации в опухолевой клетке или т.п., и может быть преобразовано в конъюгат антитело-лекарственное средство путем конъюгации с соединением, обладающим противоопухолевой активностью, через линкер.
Связывающую активность антитела против опухолевых клеток можно подтвердить методом проточной цитометрии. Примеры способа для подтверждения интернализации антитела в опухолевых клетках могут включать (1) анализ визуализации антитела, инкорпорированного в клетки, под флуоресцентным микроскопом с использованием вторичного антитела (флуоресцентно меченного), связывающегося с терапевтическим антителом (Cell Death and Differentiation (2008) 15, 751-761), (2) анализ измерения интенсивности флуоресценции, инкорпорированной в клетки, с использованием вторичного антитела (флуоресцентно меченного), связывающегося с терапевтическим антителом (Molecular Biology of the Cell, Vol. 15, 5268-5282, December 2004), или (3) Mab-ZAP анализ с использованием иммунотоксина, связывающегося с терапевтическим антителом, где токсин высвобождается при инкорпорировании в клетки для ингибирования клеточного роста (Bio Techniques 28: 162-165, January 2000). Рекомбинантный комплексный белок на основе каталитической области дифтерийного токсина и G-белка можно использовать в качестве иммунотоксина.
Поскольку лекарственное средство, конъюгированное в конъюгате антитело-лекарственное средство, проявляет противоопухолевый эффект, предпочтительно, но необязательно, чтобы антитело само обладало противоопухолевым эффектом. Для специфического и селективного проявления убивающей клетки активности противоопухолевого соединения, действующего на опухолевые клетки, важно и также предпочтительно, чтобы антитело обладало свойством интернализации для миграции в опухолевые клетки.
[0042]
Анти-TROP2 антитело можно получить с использованием способа, обычно используемого в данной области техники, который включает иммунизацию животных антигенным полипептидом и сбор и очистку антител, продуцируемых in vivo. Происхождение антигена не ограничивается человеческим происхождением, и животных можно иммунизировать антигеном, происходящим из отличного от человека животного, такого как мышь, крыса и т.п. В этом случае, перекрестная реактивность антител, связывающихся с полученным гетерологичным антигеном и человеческими антигенами, может быть испытана для скрининга антитела, применимого для заболевания человека.
Альтернативно, антитело-продуцирующие клетки, которые продуцируют антитела против антигена, сливают с клетками миеломы в соответствии со способом, известным в данной области техники (например, Kohler and Milstein, Nature (1975) 256, p. 495-497; и Kennet, R. ed., Monoclonal Antibodies,, p. 365-367, Plenum Press, N.Y. (1980)), для создания гибридом, из которых, в свою очередь, могут быть получены моноклональные антитела.
Антиген можно получить с использованием генноинженерных методов для получения клеток хозяина, продуцирующих ген, кодирующий антигенный белок. В частности, получают векторы, которые позволяют осуществлять экспрессию гена для такого антигена, и переносят в клетки хозяина так, чтобы экспрессировался этот ген. Антиген, экспрессируемый таким образом, может быть очищен. Антитело также можно получить с использованием способа иммунизации животных описанными выше генноинженерными антиген-экспрессирующими клетками или клеточной линией, экспрессирующей антиген.
Анти-TROP2 антитело можно получить с использованием процедуры, известной в данной области техники.
[0043]
Анти-TROP2 антитело, которое можно использовать в настоящем изобретении, конкретно не ограничивается, и, например, предпочтительно можно использовать антитела, охарактеризованные аминокислотными последовательностями, представленными в Перечне последовательностей в настоящей заявке. Анти-TROP2 антитело, используемое в настоящем изобретении, предпочтительно имеет свойства, описанные ниже.
(1) Антитело, имеющее следующие свойства:
(a) специфически связывается с TROP2 и
(b) обладает активностью интернализации в TROP2-экспрессирующих клетках путем связывания с TROP2.
(2) Антитело в соответствии с (1), где TROP2 представляет собой человеческий TROP2.
(3) Антитело в соответствии с (1) или (2), где антитело содержит CDRH1, включающую аминокислотную последовательность, представленную в SEQ ID NO: 23, CDRH2, включающую аминокислотную последовательность, представленную в SEQ ID NO: 24, и CDRH3, включающую аминокислотную последовательность, представленную в SEQ ID NO: 25, в качестве определяющих комплементарность областей тяжелой цепи, и CDRL1, включающую аминокислотную последовательность, представленную в SEQ ID NO: 26, CDRL2, включающую аминокислотную последовательность, представленную в SEQ ID NO: 27, и CDRL3, включающую аминокислотную последовательность, представленную в SEQ ID NO: 28, в качестве определяющих комплементарность областей легкой цепи.
(4) Антитело в соответствии с любым из пунктов (1)-(3), где его константная область представляет собой константную область человеческого происхождения.
(5) Антитело в соответствии с любым из пунктов (1)-(4), где антитело представляет собой гуманизированное антитело.
(6) Антитело в соответствии с (5), где антитело содержит вариабельную область тяжелой цепи, включающую аминокислотую последовательность, выбранную из группы, включающей (a) аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 12, (b) аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, (c) аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 16, (d) аминокислотную последовательность, имеющую по меньшей мере 95% или более высокую гомологию с любой из последовательностей (a) - (c), и (e) аминокислотную последовательность, полученную из любой из последовательностей (a) - (c) путем делеций, замен или добавлений по меньшей мере одной аминокислоты, и вариабельную область легкой цепи, включающую аминокислотую последовательность, выбранную из группы, включающей (f) аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, (g) аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 20, (h) аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 22, (i) аминокислотную последовательность, имеющую по меньшей мере 95% или более высокую гомологию с любой из последовательностей (f)-(h), и (j) аминокислотную последовательность, полученную из любой из последовательностей (f) - (h) путем делеций, замен или добавлений по меньшей мере одной аминокислоты.
(7) Антитело в соответствии с пунктом (6), где антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из группы, состоящей из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 20, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 22, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 20, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 22, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 16, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 16, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 20, и вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 16, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 22.
(8) Антитело в соответствии с пунктом (7), где антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из группы, состоящей из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 14, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 20, и вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-140 в SEQ ID NO: 16, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-129 в SEQ ID NO: 22.
(9) Антитело в соответствии с пунктом (6) или (7), где антитело включает тяжелую цепь и легкую цепь, выбранные из группы, состоящей из тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 20, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 22, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 20, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 22, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 20, и тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 22.
(10) Антитело в соответствии с пунктом (6) или (7), где антитело включает тяжелую цепь и легкую цепь, выбранные из группы, состоящей из тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 20, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 22, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 20, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 22, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 20, и тяжелой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, представленную в SEQ ID NO: 22.
(11) Антитело в соответствии с пунктом (8), где антитело включает тяжелую цепь и легкую цепь, выбранные из группы, состоящей из тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 14, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 20, и тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-470 в SEQ ID NO: 16, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-234 в SEQ ID NO: 22.
(12) Антитело в соответствии с любым из пунктов (1)-(11), где антитело не содержит лизиновый остаток на карбоксильном конце тяжелой цепи.
(13) Антитело, полученное способом получения антитела в соответствии с любым из пунктов (1)-(12), где способ включает следующие стадии: культивирование клетки хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, кодирующий антитело; и сбор антитела, представляющего интерес, из культур, полученных на предыдущей стадии.
[0044]
Далее будет описано анти-TROP2 антитело, используемое в изобретении.
Термины "рак" и "опухоль", как они используются в настоящей заявке, имеют одинаковое значение.
Термин "ген", как он используется в настоящей заявке, включает не только DNA, но также его мРНК, его кДНК и его кРНК.
Термин "полинуклеотид", как он используется в настоящей заявке, используется с тем же значением, что и нуклеиновая кислота, и также включает ДНК, РНК, зонды, олигонуклеотиды и праймеры.
Термины "полипептид" и "белок", как они используются в настоящей заявке, имеют одинаковое значение.
Термин "клетка", как он используется в настоящей заявке, также включает клетки у отдельного животного и культивируемые клетки.
Термин "TROP2", как он используется в настоящей заявке, имеет такое же значение, как и TROP2 белок.
Термин "CDR", как он используется в настоящей заявке, относится к определяющей комплементарность области (CDR). Известно, что каждая тяжелая и легкая цепь молекулы антитела имеет три определяющие комплементарность области (CDRs). CDR также называют гипервариабельным доменом, и он присутствует в вариабельной области каждой тяжелой и легкой цепи антитела. Он представляет собой сайт, который имеет необычно высокую вариабельность в своей первичной структуре, и существует три отдельных CDR в первичной структуре каждой тяжелой и легкой полипептидной цепи. В настоящем описании, что касается CDRs антитела, CDR тяжелой цепи представлены как CDRH1, CDRH2 и CDRH3 от амино-концевого участка аминокислотной последовательности тяжелой цепи, и CDRs легкой цепи представлены как CDRL1, CDRL2 и CDRL3 от амино-концевого участка аминокислотной последовательности легкой цепи. Эти сайты находятся в непосредственной близости друг к другу в третичной структуре и определяют специфичность в отношении антигена, с которым связывается антитело.
Фраза "гибридизацию осуществляют в жестких условиях", как она используется в настоящей заявке, относится к способу, в котором гибридизацию осуществляют в условиях, в которых идентификация может достигаться путем осуществления гибридизации при 68°C в коммерчески доступном растворе для гибридизации ExpressHyb Hybridization Solution (изготовитель Clontech, Inc.) или путем осуществления гибридизации при 68°C в присутствии 0,7-1,0 M NaCl с использованием фильтра, содержащего иммобилизованную на нем ДНК, с последующим осуществлением промывки при 68°C с использованием 0,1-2 × SSC раствора (1 × SSC раствор состоит из 150 мМ NaCl и 15 мМ цитрата натрия), или в условиях эквивалетных этим.
[0045]
1. TROP2
TROP2 представляет собой член TACSTD семейства, экспрессируемый в трофобластах человека, и представляет собой однопроходный трансмембранный типа 1 мембранный белок, вовлеченный в иммунорезистентность, который является одинаковым для человеческих трофобластов и раковых клеток.
Что касается TROP2 белка для использования в изобретении, TROP2 белок можно непосредственно очистить из TROP2-экспрессирующих клеток человека или отличного от человека млекопитающего (такого как крыса или мышь) и использовать, или можно получить и использовать фракцию клеточных мембран описанных выше клеток. Кроме того, TROP2 можно получить путем его синтеза in vitro или продукции в клетке хозяина генно-инженерным метотом. В генной инженерии, в частности, после того как TROP2 кДНК встраивают в вектор, способный экспрессировать TROP2 кДНК, TROP2 белок можно получить путем его синтеза в растворе, содержащем фермент, субстрат и энергетическое вещество, необходимое для транскрипции и трансляции, или путем экспрессии TROP2 в другой прокариотической или эукариотической трансформированной клетке хозяина. Альтернативно, описанные выше генно-инженерные TROP2-экспрессирующие клетки или клеточную линию, экспрессирующую TROP2, можно использовать в качестве TROP2 белка.
ДНК-последовательность и аминокислотная последовательность TROP2 являются доступными в публичной базе данных и могут быть указаны, например, под номерами доступа NM_002353 и NP_002344 (NCBI).
Кроме того, белок, который состоит из аминокислотной последовательности, где одна или несколько аминокислот заменены, делетированы и/или добавлены в любой из описанных выше аминокислотных последовательностей TROP2, а также обладает биологической активностью эквивалетной активности белка, также включен в TROP2.
TROP2 белок человека включает сигнальную последовательность, состоящую из N-концевых 26 аминокислотных остатков, внеклеточный домен, состоящий из 248 аминокислотных остатков, трансмембранный домен, состоящий из 23 аминокислотных остатков, и внутриклеточный домен, состоящий из 26 аминокислотных остатков.
[0046]
2. Получение анти-TROP2 антитела
Антитело против TROP2 по настоящему изобретению можно получить с использованием способа, обычно используемого в данной области техники, который включает иммунизацию животного при помощи TROP2 или произвольного полипептида, выбранного из аминокислотной последовательности TROP2, и сбор и очистку антитела, продуцируемого in vivo. Биологический вид TROP2, который можно использовать в качестве антигена, не ограничивается человеком, и животное можно иммунизировать при помощи TROP2, происходящим из животного, отличного от человека, такого как мышь или крыса. В этом случае, путем исследования перекрестной реактивности между антителом, связывающимся с полученным гетерологичным TROP2 и человеческим TROP2, можно выбрать антитело, применимое для заболевания человека.
Кроме того, моноклональное антитело можно получить из гибридомы, полученной путем слияния антитело-продуцирующих клеток, которые продуцируют антитело против TROP2, с клетками миеломы в соответствии с известным способом (например, Kohler and Milstein, Nature, (1975) 256, pp. 495-497; Kennet, R. ed., Monoclonal Antobodies, pp. 365-367, Plenum Press, N.Y. (1980)).
TROP2, который можно использовать в качестве антигена, можно получить путем экспрессии TROP2 гена в клетке хозяина методом генной инженерии.
В частности, получают вектор, способный экспрессировать TROP2 ген, и полученным вектором трансфицируют клетку хозяина для экспрессии гена и затем экспрессированный TROP2 очищают.
Альтернативно, описанные выше генно-инженерные TROP2-экспрессирующие клетки или клеточную линию, экспрессирующую TROP2, можно использовать в качестве TROP2 белка. Далее подробно описан способ получения антитела против TROP2.
[0047]
(1) Получение антигена
Примеры антигена для использования для получения анти-TROP2 антитела включают TROP2 или полипептид, состоящий из частичной аминокислотной последовательности, включающей по меньшей мере 6 следующих подряд аминокислот из TROP2, или производное, полученное путем добавления определенной аминокислотной последовательности или носителя.
TROP2 можно очистить непосредственно из опухолевых тканей или опухолевых клеток человека и использовать. Кроме того, TROP2 можно получить путем синтеза in vitro или путем его продуцирования в клетке хозяина генно-инженерным методом.
Что касается генной инженерии, в частности, после того как TROP2 кДНК встраивают в вектор, способный экспрессировать TROP2 кДНК, антиген можно получить путем его синтеза в растворе, содержащем фермент, субстрат и энергетическое вещество, необходимое для транскрипции и трансляции, или путем экспрессии TROP2 в другой прокариотической или эукариотической трансформированной клетке хозяина.
Кроме того, антиген также можно получить в виде секреторного белка путем экспрессии гибридного белка, полученного путем лигирования внеклеточного домена TROP2, который представляет собой мембранный белок, с константной областью антитела в подходящей системе хозяин-вектор.
TROP2 кДНК можно получить, например, при помощи так называемого ПЦР способа, в котором полимеразную цепную реакцию (далее указана как "ПЦР"; см. Saiki, R. K., et al., Science, (1988) 239, pp. 487-489) осуществляют с использованием кДНК библиотеки, экспрессирующей TROP2 кДНК в качестве матрицы, и праймеров, которые специфически амплифицируют TROP2 кДНК.
В качестве примера in vitro синтеза полипептида, например, можно указать, но не ограничиваясь этим, Быструю Систему Трансляции (RTS) изготовитель Roche Diagnostics, Inc.
Примеры прокариотических клеток хозяина включают Escherichia coli и Bacillus subtilis. Для трансформирования клеток хозяина целевым геном, клетки хозяина трансформируют плазмидным вектором, включающим репликон, т.е. точку начала репликации, происходящую из вида, совместимого с хозяином, и регуляторную последовательность. Кроме того, вектор предпочтительно содержит последовательность, способную сообщать фенотипическую селективность трансформированной клетке.
Примеры эукариотических клеток хозяина включают клетки позвоночных, клетки насекомых и клетки дрожжей. В качестве клеток позвоночных, например, часто используют COS клетки обезьян (Gluzman, Y., Cell, (1981) 23, pp. 175-182, ATCC CRL-1650; ATCC: American Type Culture Collection), мышиные фибробласты NIH3T3 (ATCC No. CRL-1658) и дигидрофолатредуктаза-дефицитные штаммы (Urlaub, G. And Chasin, L. A., Proc. Natl. Acad. Sci. USA (1980) 77, pp. 4126-4220) клеток яичников китайского хомячка (CHO клетки; ATCC: CCL-61); и т.п., однако, клетки не ограничиваются этим.
Полученный таким образом трансформант можно культивировать в соответствии со способом, обычно используемым в данной области техники, и путем культивирования трансформанта целевой полипептид продуцируется внутриклеточно или внеклеточно.
Подходящую для культивирования среду сможет выбрать специалист в данной области из различных традиционно используемых сред для культивирования в зависимости от используемых клеток хозяина. Если используют Escherichia coli, например, можно использовать LB среду, дополненную антибиотиком, таким как ампициллин или IPMG, по мере необходимости.
Рекомбинантный белок, продуцируемый трансформантом внутриклеточно или внеклеточно путем такого культивирования, может быть отделен и очищен любым из различных известных способов разделения на основании физического или химического свойства белка.
Конкретные примеры способов включают обработку традиционным агентом осаждения белка, ультрафильтрацию, различные типы жидкостной хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, диализ и комбинацию таких способов.
Кроме того, путем присоединения метки из шести гистидиновых остатков к рекомбинантному белку, экспрессию которого осуществляют, белок может быть эффективно очищен на колонке с никелем для аффинной хроматографии. Альтернативно, путем присоединения IgG Fc области к рекомбинантному белку, экспрессию которого осуществляют, белок может быть эффективно очищен на колонке с белком A.
Путем комбинирования описанных выше способов легко можно получить большое количество целевого полипептида с высоким выходом и высокой чистотой.
Описанный выше трансформант как таковой также можно использовать в качестве антигена. Альтернативно, клеточную линию, экспрессирующую TROP2, можно использовать в качестве антигена. Примеры такой клеточной линии могут включать линии рака легких человека NCI-H322, PC14, NCIH-H2122 и LCAM1, линию рака предстательной железы человека PC3, линии панкреатического рака человек BxPC-3, Capan-1 и PK-1, линию рака яичников человека SKOV3 и линию колоректального рака человека COLO205, хотя клеточная линия в соответствии с настоящим изобретением не ограничивается этими клеточными линиями, при условии, что линии экспрессируют TROP2.
[0048]
(2) Получение анти-TROP2 моноклонального антитела
Примеры антитела, специфически связывающегося с TROP2, включают моноклональное антитело, специфически связывающееся с TROP2, и способ получения такого антитела описан ниже.
Получение моноклонального антитела, как правило, требует осуществления следующих рабочих стадий:
(a) очистка биополимера, который можно использовать в качестве антигена, или получение антиген-экспрессирующих клеток;
(b) получение антитело-продуцирующих клеток иммунизацией животного путем введения инъекции антигена, сбор крови, анализ титра антител для определения времени удаления селезенки;
(c) получение клеток миеломы (далее указаны как "миелома");
(d) слияние антитело-продуцирующих клеток с миеломой;
(e) скрининг группы гибридом, продуцирующих желаемое антитело;
(f) разделение гибридом на одноклеточные клоны (клонирование);
(g) необязательно, культивирование гибридомы или выращивание животного с имплантированной гибридомой для получения большого количества моноклонального антитела;
(h) исследование полученного таким образом моноклонального антитела на биологическую активность и специфичность связывания или анализ антитела на свойства в качестве меченого реагента; и т.п.
Далее, способ получения моноклонального антитела, следуя описанным выше стадиям, будет описан подробно, однако, способ не ограничивается этим, и, например, можно использовать антитело-продуцирующие клетки, отличные от клеток селезенки и миеломы.
[0049]
(a) Очистка антигена
В качестве антигена можно использовать TROP2, полученный способом, описанным выше, или его частичный пептид.
Кроме того, мембранную фракцию, полученную из рекомбинантных клеток, экспрессирующих TROP2, или сами рекомбинантные клетки, экспрессирующие TROP2, а также частичный пептид белка по настоящему изобретению, химически синтезированный способом, известным специалистам в данной области, также можно использовать в качестве антигена.
Кроме того, клеточную линию, экспрессирующую TROP2, также можно использовать в качестве антигена.
[0050]
(b) Получение антитело-продуцирующих клеток
Антиген, полученный на стадии (a), смешивают с адъювантом, таким как полный или неполный адъювант Фрейнда, или вспомогательным веществом, таким как алюминия-калия сульфат, и полученную смесь используют в качестве иммуногена для иммунизации экспериментального животного. В альтернативном способе, экспериментальное животное иммунизируют антиген-экспрессирующими клетками в качестве иммуногена. В качестве экспериментального животного можно безбоязненно использовать любое животное, используемое в известном способе получения гибридом. В частности, можно использовать, например, мышь, крысу, козу, овцу, корову, лошадь или т.п. Однако, с точки зрения простоты доступности миеломных клеток для слияния с экстрагированными антитело-продуцирующими клетками, предпочтительно используют мышь или крысу в качестве животного для иммунизации.
Кроме того, штамм мыши или крысы, который можно использовать, конкретно не ограничивается, и в случае мыши, например, можно использовать различные штаммы, такие как A, AKR, BALB/c, BDP, BA, CE, C3H, 57BL, C57BL, C57L, DBA, FL, HTH, HT1, LP, NZB, NZW, RF, R III, SJL, SWR, WB и 129 и т.п., и в случае крысы, можно использовать, например, Wistar, Low, Lewis, Sprague, Dawley, ACI, BN, Fischer и т.п.
Эти мышей и крыс можно получить от компаний-производителей/дистрибьюторов экспериментальных животных, например, CLEA Japan, Inc. и Charles River Laboratories Japan, Inc.
При рассмотрении совместимости слияния с миеломными клетками, описанными ниже, в случае мыши штамм BALB/c, а в случае крысы штаммы Wistar и Low являются особенно предпочтительными в качестве животного для иммунизации.
Кроме того, с учетом антигенной гомологии между человеком и мышью, также предпочтительно использовать мышь, имеющую пониженную биологическую функцию для удаления аутоантител, то есть мышь с аутоиммунным заболеванием.
Возраст такой мыши или крысы на момент иммунизации предпочтительно составляет 5-12 недель, более предпочтительно 6-8 недель.
Для иммунизации животного TROP2 или его рекомбинантом, можно использовать, например, известный способ, описанный подробно, например, в Weir, D. M., Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987); Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher Springfield, Illinois (1964) или т.п.
Из этих способов иммунизации конкретный предпочтительный в настоящем изобретении способ представляет собой, например, следующий.
А именно, сначала фракцию мембранного белка, служащего в качестве антигена, или клетки, в которых вызывают экспрессию антигена, внутрикожно или интраперитонеально вводят животному. Однако комбинация обоих путей введения является предпочтительной для повышения эффективности иммунизации, и когда внутрикожное введение осуществляют в первой половине, и интраперитонеальное введение осуществляют в следующей половине или только как последнее введение, эффективность иммунизации особенно повышается.
Схема введения антигена варьируется в зависимости от типа животного, подлежащего иммунизации, индивидуальных особенностей или т.п. Однако, как правило, схема введения, в которой частота введенияя антигена составляет от 3 до 6 раз и интервал дозирования составляет от 2 до 6 недель, является предпочтительной, и более предпочтительной является схема введения, в которой частота введения антигена составляет от 3 до 4 раз и интервал дозирования составляет от 2 до 4 недель.
Кроме того, доза антигена варьируется в зависимости от типа животного, индивидуальных особенностей или т.п., однако, дозу, как правило, устанавливают на уровне 0,05-5 мг, предпочтительно около 0,1-0,5 мг.
Бустер-иммунизацию осуществляют через 1-6 недель, предпочтительно 1-4 недель, более предпочтительно 1-3 недель после введения антигена, описанного выше. Когда иммуноген представляет собой клетки, используют от 1×106 до 1×107 клеток.
Доза антигена на момент времени осуществления бустер-иммунизации варьируется в зависимости от типа или размера животного или т.п., однако, в случае, например, мыши, дозу, как правило, устанавливают на уровне 0,05-5 мг, предпочтительно 0,1-0,5 мг, более предпочтительно около 0,1-0,2 мг. Когда иммуноген представляет собой клетки, используют от 1×106 до 1×107 клеток.
Клетки селезенки или лимфоциты, включая антитело-продуцирующие клетки, асептически выделяют у иммунизированного животного через 1-10 дней, предпочтительно 2-5 дней, более предпочтительно 2-3 дня после бустер-иммунизации. В это время измеряют титр антител, и, если животное, имеющее достаточно повышенный титр антител, используют в качестве источника антитело-продуцирующих клеток, последующую процедуру можно осуществить более эффективно.
Примеры способа измерения титра антител, который можно использовать в настоящем изобретении, включают RIA метод и ELISA метод, но способ не ограничивается этим. Например, если используют ELISA, измерение титра антител в настоящем изобретении можно осуществить в соответствии с процедурами, описанными ниже.
Сначала очищенный или частично очищенный антиген адсорбируют на поверхности твердой фазы, такой как 96-луночный планшет для ELISA, и поверхность твердой фазы, не содержащую никакого адсорбированного антигена, покрывают белком, не связанным с антигеном, таким как бычий сывороточный альбумин (BSA). После промывки поверхности, поверхность приводят в контакт с серийно разведенным образцом (например, мышиная сыворотка) в качестве первичного антитела для обеспечения возможности связывания содержащегося в образце антитела с антигеном.
Затем, в качестве вторичного антитела, добавляют антитело, против мышиного антитела, меченное ферментом, и обеспечивают возможность связывания с мышиным антителом. После промывки добавляют субстрат для фермента и измеряют изменение поглощения, которое происходит из-за проявления цвета, индуцируемого разложением субстрата или т.п., и титр антител рассчитывают на основании полученных показателей.
Выделение антитело-продуцирующих клеток из клеток селезенки или лимфоцитов иммунизированного животного можно осуществить в соответствии с известным способом (например, Kohler et al., Nature (1975), 256, p. 495; Kohler et al., Eur. J. Immunol. (1977), 6, p. 511; Milstein et al., Nature (1977), 266, p. 550; Walsh, Nature (1977), 266, p. 495). Например, в случае клеток селезенки, можно использовать общий способ, в котором антитело-продуцирующие клетки выделяют путем гомогенизации селезенки с получением клеток через фильтрацию с использованием сита из нержавеющей стали и суспендирования клеток в минимальной эссенциальной среде Игла (MEM).
[0051]
(c) Получение миеломных клеткок (далее указаны как "миелома")
Миеломные клетки, которые можно использовать для клеточного слияния, конкретно не ограничиваются, и подходящие клетки можно выбрать из известных клеточных линий. Однако, учитывая удобство, когда гибридому выбирают из слитых клеток, предпочтительно использовать HGPRT (гипоксантин-гуанинфосфорибозилтрансфераза)-дефицитный штамм, процедура выбора которого хорошо известна.
Более конкретно, примеры HGPRT-дефицитного штамма включают X63-Ag8(X63), NS1-ANS/1(NS1), P3X63-Ag8.U1(P3U1), X63-Ag8.653(X63,653), SP2/0-Ag14(SP2/0), MPC11-45.6TG1.7(45.6TG), FO, S149/5XXO и BU.1, выделенные от мышей; 210.RSY3.Ag.1.2.3(Y3), выделенный от крыс; и U266AR(SKO-007), GM1500⋅GTG-A12(GM1500), UC729-6, LICR-LOW-HMy2(HMy2) и 8226AR/NIP4-1(NP41), выделенные от человека. Эти HGPRT-дефицитные штаммы доступны, например, от ATCC или т.п.
Эти клеточные штаммы субкультивируют в подходящей среде, такой как среда с 8-азагуанином (среда, полученная путем добавления 8-азагуанина к RPMI 1640 среде, дополненной глутамином, 2-меркаптоэтанолом, гентамицином и фетальной телячьей сывороткой (далее указана как "FBS")), модифицированная Исковом среда Дульбекко (IMDM) или среда Дульбекко, модифицированная Иглом (DMEM). В этом случае, за 3-4 дня до осуществляния клеточного слияния клетки субкультивируют в нормальной среде (например, ASF104 среда (изготовитель Ajinomoto Co., Ltd.), содержащая 10% FCS) для обеспечения не менее чем 2 × 107 клеток в день слияния клеток.
[0052]
(d) Клеточное слияние
Слияние между антитело-продуцирующими клетками и миеломными клетками можно подходящим образом осуществить в соответствии с известным способом (Weir, D. M. Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987); Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher, Springfield, Illinois (1964), etc.) в таких условиях, чтобы процент выживания клеток сильно не уменьшался.
В качестве такого способа можно использовать, например, химический способ, в котором антитело-продуцирующие клетки и миеломные клетки смешивают в растворе, содержащем полимер, такой как полиэтиленгликоль, при высокой концентрации, физический способ с использованием электрической стимуляции или т.п. Из этих способов, конкретный пример химического способа описан ниже.
А именно, в случае, когда используют полиэтиленгликоль в растворе, содержащем полимер при высокой концентрации, антитело-продуцирующие клетки и миеломные клетки смешивают в растворе полиэтиленгликоля, имеющего молекулярную массу 1500-6000, более предпочтительно 2000-4000, при температуре от 30 до 40°C, предпочтительно от 35 до 38°C, в течение 1-10 минут, предпочтительно 5-8 минут.
[0053]
(e) Выбор группы гибридом
Способ выбора гибридом, полученных путем описанного выше клеточного слияния, конкретно не ограничивается. Обычно используют HAT (гипоксантин, аминоптерин, тимидин) способ выбора (Kohler et al., Nature (1975), 256, p. 495; Milstein et al., Nature (1977), 266, p. 550).
Этот способ эффективен, когда гибридомы получены с использованием миеломных клеток HGPRT-дефицитного штамма, которые не могут выживать в присутствии аминоптерина. То есть путем культивирования неслитых клеток и гибридом в HAT среде, дают возможность выжить и пролиферировать только гибридомам, резистентным к аминоптерину.
[0054]
(f) Деление на одноклеточные клоны (клонирование)
В качестве метода клонирования для гибридом можно использовать известный метод, такой как метод с использованием метилцеллюлозы, метод с использованием мягкой агарозы или метод серийных разведений (см., например, Barbara, B. M. and Stanley, M. S.: Selected Methods in Cellular Immunology, W. H. Freeman and Company, San Francisco (1980)). Из этих методов особенно предпочтительным является метод трехмерного культивирования, такой какой метод с использованием метилцеллюлозы. Например, группу гибридом, полученных путем клеточного слияния, суспендируют в метилцеллюлозной среде, такой как ClonaCell-HY Selection Medium D (изготовитель StemCell Technologies, Inc., #03804), и культивируют. Затем образовавшиеся колонии гибридом собирают, таким образом, можно получить моноклональные гибридомы. Собранные соответствующие колонии гибридом культивируют, и гибридому, которую подтверждают как имеющую стабильный титр антител в полученном супернатанте культуры гибридом, выбирают в качестве TROP2 моноклональное антитело-продуцирующего гибридомного штамма.
[0055]
Примеры полученного таким образом гибридомного штамма включают TROP2 гибридому TINA1. В настоящем описании, антитело, продуцируемое TROP2 гибридомой TINA1, указано как "TINA1 антитело" или просто "TINA1".
Вариабельная область тяжелой цепи TINA1 антитела имеет аминокислотную последовательность, представленную в SEQ ID NO: 2 в Перечне последовательностей. Кроме того, вариабельная область легкой цепи TINA1 антитела имеет аминокислотную последовательность, представленную в SEQ ID NO: 4 в Перечне последовательностей.
[0056]
(g) Получение моноклонального антитела путем культивирования гибридомы
Путем культивирования выбранной таким образом гибридомы можно осуществить эффективное получение моноклонального антитела. Однако предпочтительно до культивирования осуществить скрининг гибридомы, которая продуцирует целевое моноклональное антитело.
Для такого скрининга можно использовать известный способ.
Измерение титра антител в настоящем изобретении можно осуществить, например, методом ELISA, который объясняется в пункте (b), описанном выше.
Гибридому, полученную способом, описанным выше, можно хранить в замороженном состоянии в жидком азоте или в морозильнике при -80°C или ниже.
После завершения клонирования среду HT заменяют нормальной средой и осуществляют культивирование гибридомы.
Крупномасштабное культивирование осуществляют путем ротации культуры с использованием большого культурального сосуда или путем центрифугирования культуры. Из супернатанта, полученного путем крупномасштабного культивирования, можно получить моноклональное антитело, которое специфически связывается с белком по настоящему изобретению, путем очистки с использованием способа, известного специалистам в данной области, такого как гель-фильтрация.
Кроме того, гибридому вводят путем инъекции в брюшную полость мыши того же штамма, что и гибридома (например, описанного выше BALB/c), или Nu/Nu мыши для пролиферации гибридомы, посредством чего можно получить асциты, содержащие большое количество моноклонального антитела по настоящему изобретению.
В случае, когда гибридому вводят в брюшную полость, если за 3-7 дней до этого вводят минеральное масло, такое как 2,6,10,14-тетраметилпентадекан (пристан), можно получить большее количество асцитов.
Например, предварительно вводят иммуносупрессант путем инъекции в брюшную полость мыши того же штамма, что и гибридома, для инактивации T клеток. Через 20 дней после этого 106-107 клеток гибридомного клона суспендируют в бессывороточной среде (0,5 мл) и суспензию вводят в брюшную полость мыши. Как правило, когда брюшная полость увеличивается и наполняется асцитами, асциты собирают от мыши. Этим способом можно получить моноклональное антитело при концентрации, которая примерно в 100 раз или более выше, чем концентрация в культуральном растворе.
Моноклональное антитело, полученное способом, описанным выше, можно очистить способом, описанным, например, в Weir, D. M., Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987).
Полученное таким образом моноклональное антитело имеет высокую антиген-специфичность в отношении TROP2.
[0057]
(h) Анализ моноклонального антитела
Изотип и подкласс полученного таким образом моноклонального антитела можно определить следующим образом.
Прежде всего, примеры способа идентификации включают метод Оухтерлони, метод ELISA и метод RIA.
Метод Оухтерлони является простым, но когда концентрация моноклонального антитела является низкой, необходима процедура конденсации.
С другой стороны, когда используют метод ELISA или метод RIA, путем непосредственного взаимодействия культурального супернатанта с антиген-адсорбированной твердой фазой и с использованием антител, соответствующих различным изотипам и подклассам иммуноглобулинов, в качестве вторичных антител, можно идентифицировать изотип и подкласс моноклонального антитела.
Кроме того, в качестве более простого способа также можно использовать коммерчески доступный идентификационный набор (например, Mouse Typer Kit, изготовитель Bio-Rad Laboratories, Inc.) или т.п. Кроме того, количественное определение белка можно осуществить методом Фолина-Лоури и методом расчета на основании поглощения при 280 нм (1,4 (OD 280)=Иммуноглобулин 1 мг/мл).
Кроме того, даже когда моноклональное антитело получают отдельно и независимо путем осуществления снова стадий (a)-(h) в пункте (2), можно получить антитело, обладающее цитотоксической активностью эквивалетной активности TINA1 антитела. В качестве одного примера такого антитела можно указать антитело, которое связывается с тем же эпитопом, что и TINA1 антитело. Если новое полученное моноклональное антитело связывается с частичным пептидом или частичной третичной структурой, с которой связывается TINA1 антитело, можно определить, что моноклональное антитело связывается с тем же эпитопом, что и TINA1 антитело. Кроме того, путем подтверждения, что моноклональное антитело конкурирует с TINA1 антителом за связывание с TROP2 (то есть моноклональное антитело ингибирует связывание между TINA1 антителом и TROP2), можно определить, что моноклональное антитело связывается с тем же эпитопом, что и анти-TROP2 антитело, даже если специфическая последовательность эпитопа или структура не определена. Когда подтверждают, что моноклональное антитело связывается с тем же эпитопом, что и анти-TROP2 антитело, можно с уверенностью ожидать, что моноклональное антитело обладает аффинностью связывания с антигеном и биологической активностью, эквивалетной активности TINA1 антитела.
[0058]
(3) Другие антитела
Антитело по настоящему изобретению включает не только описанное выше моноклональное антитело против TROP2, но также рекомбинантное антитело, полученное путем искусственной модификации в целях снижения гетерологичной антигенности для человека, такое как химерное антитело, гуманизированное антитело и человеческое антитело. Эти антитела можно получить с использованием известного способа.
В качестве химерного антитела, можно указать в качестве примера антитело, в котором вариабельная и константная области антитела происходят из разных видов, например, химерное антитело в котором происходящая из мыши или крысы вариабельная область антитела связана с имеющей человеческое происхождение константной областью антитела (см. Proc. Natl. Acad. Sci. USA, 81, 6851-6855, (1984)).
В качестве гуманизированного антитела, можно указать в качестве примера антитело, полученное путем интегрирования только определяющей комплементарность области (CDR) в антитело человеческого происхождения (см. Nature (1986) 321, pp. 522-525), и антитело, полученное путем прививки части аминокислотных остатков каркаса, а также CDR последовательности к человеческому антителу методом CDR-прививки (Международная публикация № WO 90/07861).
Однако гуманизированное антитело, полученное из TINA1 антитела, не ограничивается конкретным гуманизированным антителом, при условии, что гуманизированное антитело имеет все 6 типов CDR последовательностей TINA1 антитела. Вариабельная область тяжелой цепи TINA1 антитела содержит CDRH1 (TAGMQ), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 23 в Перечне последовательностей, CDRH2 (WINTHSGVPKYAEDFKG), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 24 в Перечне последовательностей, и CDRH3 (SGFGSSYWYFDV), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 25 в Перечне последовательностей. Кроме того, вариабельная область легкой цепи TINA1 антитела содержит CDRL1 (KASQDVSTAVA), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 26 в Перечне последовательностей, CDRL2 (SASYRYT), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 27 в Перечне последовательностей, и CDRL3 (QQHYITPLT), состоящую из аминокислотной последовательности, представленной в SEQ ID NO: 28 в Перечне последовательностей.
[0059]
В качестве примера гуманизированного антитела мышиного антитела TINA1, можно указать произвольную комбинацию тяжелой цепи, включающую вариабельную область тяжелой цепи, состоящую из любой из (1) аминокислотной последовательности, состоящей из аминокислотных остатков 20-140 SEQ ID NO: 12, 14 или 16 в Перечне последовательностей, (2) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или более с аминокислотной последовательностью (1), описанной выше, и (3) аминокислотной последовательности, где одна или несколько аминокислот в аминокислотной последовательности (1), описанной выше, делетированы, заменены или добавлены, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из любой из (4) аминокислотной последовательности, состоящей из аминокислотных остатков 21-129 SEQ ID NO: 18, 20 или 22 в Перечне последовательностей, (5) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или более с аминокислотной последовательностью (4), описанной выше, и (6) аминокислотной последовательности, где одна или несколько аминокислот в аминокислотной последовательности (4), описанной выше, делетированы, заменены или добавлены.
Термин "несколько", как он используется в настоящей заявке, относится к 1-10, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3 или 1 или 2.
[0060]
В качестве аминокислотнной замены в настоящем описании, консервативная аминокислотная замена является предпочтительной. Консервативная аминокислотная замена относится к замене, происходящей в группе аминокислот, относящихся к боковым цепям аминокислот. Предпочтительными аминокислотными группами являются следующие: кислотная группа (аспарагиновая кислота и глутаминовая кислота); оснóвная группа (лизин, аргинин и гистидин); не-полярная группа (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан); и незаряженное полярное семейство (глицин, аспарагин, глутамин, цистеин, серин, треонин и тирозин). Более предпочтительные аминокислотные группы представляют собой следующие: алифатическая гидрокси группа (серин и треонин); амид-содержащая группа (аспарагин и глутамин); алифатическая группа (аланин, валин, лейцин и изолейцин); и ароматическая группа (фенилаланин, триптофан и тирозин). Такую аминокислотную замену предпочтительно осуществляют в пределах, которые не ухудшают свойства вещества, имеющего исходную аминокислотную последовательность.
[0061]
В качестве антитела, которое имеет предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 12, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 12, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 12, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 14, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 14, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 14, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 16, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 16, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 20-140 SEQ ID NO: 16, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из положений аминокислот 21-129 SEQ ID NO: 22.
[0062]
Кроме того, в качестве антитела, которое имеет более предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 22.
[0063]
В качестве антитела, которое имеет наиболее предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-140 SEQ ID NO: 12, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-129 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-140 SEQ ID NO: 14, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-129 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-140 SEQ ID NO: 14, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-129 SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 20-140 SEQ ID NO: 16, и легкой цепи, включающей вариабельную область, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков 21-129 SEQ ID NO: 22.
[0064]
Кроме того, в качестве антитела, которое имеет другую более предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 20; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 22; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 22.
[0065]
В качестве антитела, которое имеет еще более предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-470 SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 22.
[0066]
Кроме того, в качестве антитела, которое имеет даже еще более предпочтительную комбинацию тяжелой цепи и легкой цепи, описанную выше, можно указать в качестве примера антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-469 SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-469 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-469 SEQ ID NO: 14, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 20; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 20-469 SEQ ID NO: 16, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из положений аминокислот 21-234 SEQ ID NO: 22.
[0067]
Путем комбинирования последовательности, имеющей высокую гомологию с описанной выше аминокислотной последовательностью тяжелой цепи, с последовательностью, имеющей высокую гомологию с описанной выше аминокислотной последовательностью легкой цепи, можно выбрать антитело, обладающее биологической активностью, эквивалетной активности каждого из описанных выше антител. Такая гомология представляет собой, как правило, гомологию 80% или более, предпочтительно гомологию 90% или более, более предпочтительно гомологию 95% или более, наиболее предпочтительно гомологию 99% или более. Кроме того, путем комбинирования аминокислотной последовательности, где от одного до нескольких аминокислотных остатков заменены, делетированы или добавлены в аминокислотной последовательности тяжелой цепи или легкой цепи, также можно выбрать антитело, обладающее биологической активностью, эквивалетной активности каждого из описанных выше антител.
[0068]
Гомологию между двумя аминокислотными последовательностями можно определить с использованием параметров по умолчанию Blast алгоритма, версия 2.2.2 (Altschul, Stephen F., Thomas L. Madden, Alejandro A. Schaeffer, Jinghui Zhang, Zheng Zhang, Webb Miller, and David J. Lipman (1997), "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25: 3389-3402). Blast алгоритм можно использовать также через интернет с доступом к сайту www.ncbi.nlm.nih.gov/blast.
[0069]
В аминокислотной последовательности тяжелой цепи, представленной в SEQ ID NO: 12, 14 или 16 в Перечне последовательностей, аминокислотная последовательность, состоящая из аминокислотных остатков 1-19, представляет собой сигнальную последовательность, аминокислотая последовательность, состоящая из аминокислотных остатков 20-140, представляет собой вариабельную область, и аминокислотная последовательность, состоящая из аминокислотных остатков 141-470, представляет собой константную область. Последовательности SEQ ID NO: 12, 14 и 16 показаны на Фиг. 3, 4 и 5, соответственно.
Кроме того, в аминокислотной последовательности легкой цепи, представленной в SEQ ID NO: 18, 20 или 22 в Перечне последовательностей, аминокислотная последовательность, состоящая из аминокислотных остатков 1-20, представляет собой сигнальную последовательность, аминокислотная последовательность, состоящая из аминокислотных остатков 21-129, представляет собой вариабельную область, и аминокислотная последовательность, состоящая из аминокислотных остатков 130-234, представляет собой константную область. Последовательности SEQ ID NO: 18, 20 и 22 показаны на Фиг. 6, 7 и 8, соответственно.
[0070]
Кроме того, антитело по настоящему изобретению включает человеческое антитело, которое связывается с TROP2. Анти-TROP2 человеческое антитело относится к человеческому антителу, содержащему только последовательность антитела, происходящую из хромосомы человека. Анти-TROP2 человеческое антитело можно получить способом с использованием мыши, продуцирующей человеческое антитело, имеющее фрагмент хромосомы человека, включающий гены тяжелой и легкой цепи человеческого антитела (см. Tomizuka, K. et al., Nature Genetics (1997) 16, pp. 133-143; Kuroiwa, Y. et al., Nucl. Acids Res. (1998) 26, pp. 3447-3448; Yoshida, H. et al., Animal Cell Technology: Basic and Applied Aspects vol. 10, pp. 69-73 (Kitagawa, Y., Matuda, T. and Iijima, S. eds.), Kluwer Academic Publishers, 1999; Tomizuka, K. et al., Proc. Natl. Acad. Sci. USA (2000) 97, pp. 722-727, etc.).
[0071]
Такую продуцирующую человеческое антитело мышь можно создать, в частности, следующим способом. Создают генетически модифицированное животное, у которого локусы эндогенных генов тяжелой и легкой цепи иммуноглобулина были разорваны и вместо этого были вставлены локусы генов тяжелой и легкой цепи человеческого иммуноглобулина через вектор, представляющий собой искусственную дрожжевую хромосому (YAC) или т.п., путем получения нокаут-животного и трансгенного животного и спаривания этих животных.
Кроме того, в соответствии с методом рекомбинантной ДНК, путем использования кДНК, кодирующих каждую из таких тяжелой цепи и легкой цепи человеческого антитела, и предпочтительно вектора, включающего такие кДНК, эукариотные клетки трансформируют и трансформированную клетку, которая продуцирует рекомбинантное человеческое моноклональное антитело, культивируют, посредством чего антитело также может быть получено из культурального супернатанта.
Здесь, в качестве хозяина можно использовать, например, эукариотные клетки, предпочтительно клетки млекопитающего, такие как CHO клетки, лимфоциты или миеломные клетки.
[0072]
Кроме того, также известен способ получения человеческого антитела с применением фагового дисплея, которое выбрано из библиотеки человеческих антител (см. Wormstone, I. M. et al., Investigative Ophthalmology & Visual Science. (2002) 43 (7), pp. 2301-2308; Carmen, S. et al., Briefings in Functional Genomics and Proteomics (2002), 1 (2), pp. 189-203; Siriwardena, D. et al., Ophthalmology (2002) 109 (3), pp. 427-431, etc.).
Например, можно использовать способ с применением фагового дисплея, в котором вариабельная область человеческого антитела экспрессируется на поверхности фага в виде одноцепочечного антитела (scFv), и можно выбрать фаг, который связывается с антигеном (Nature Biotechnology (2005), 23, (9), pp. 1105-1116).
Путем анализа гена фага, выбранного на основании связывания с антигеном, можно определить последовательность ДНК, кодирующую вариабельную область человеческого антитела, которое связывается с антигеном.
Если определена ДНК-последовательность scFv, которое связывается с антигеном, человеческое антитело можно получить путем получения вектора экспрессии, включающего эту последовательность, и введения вектора подходящему хозяину для ее экспрессии (Международная публикация № WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, WO 95/15388; Annu. Rev. Immunol. (1994) 12, pp. 433-455; Nature Biotechnology (2005) 23 (9), pp. 1105-1116).
Если полученное таким образом человеческое антитело связывается с частичным пептидом или частичной третичной структурой, с которыми связывается TINA1 антитело, можно определить, что человеческое антитело связывается с тем же эпитопом, что и TINA1 антитело. Кроме того, путем подтверждения, что человеческое антитело конкурирует с TINA1 антителом за связывание с TROP2 (то есть человеческое антитело ингибирует связывание между TINA1 антителом и TROP2), можно определить, что человеческое антитело связывается с тем же эпитопом, что и TINA1 антитело, даже если специфическая последовательность или структура эпитопа не была определена. Когда подтверждают, что человеческое антитело связывается с тем же эпитопом, что и TINA1 антитело, можно с уверенностью ожидать, что человеческое антитело обладает биологической активностью, эквивалетной активности TINA1 антитела.
Химерные антитела, гуманизированные антитела или человеческие антитела, полученные способом, описанным выше, оценивают на свойство связывания с антигеном известным способом или т.п., и можно выбрать предпочтительное антитело.
[0073]
В качестве одного примера другого критерия для использования в сравнении свойств антител, можно указать стабильность антител. Дифференциальная сканирующая калориметрия (ДСК) представляет собой инструмент для быстрого и точного измерения средней температуры термической денатурации (Tm), которую можно использовать в качестве подходящего показателя относительной конформационной стабильности белков. Путем измерения Tm значений с использованием ДСК и сравнения значений можно определить разницу в термостабильности. Известно, что стабильность при хранении антител показывает некоторую корреляцию с термостабильностью антител (Lori Burton, et. al., Pharmaceutical Development and Technology (2007) 12, pp. 265-273), и предпочтительное антитело можно выбрать с использованием термостабильности в качестве критерия оценки. Примеры других критериев для выбора антитела включают следующие: выход в подходящей клетке хозяина является ввысоким; и агрегируемость в водном растворе является низкой. Например, антитело, которое показывает самый высокий выход, не всегда демонстрирует самую высокую термостабильность, и поэтому необходимо выбрать антитело, наиболее подходящее для введения человеку, путем осуществления всесторонней оценки на основании описанных выше критериев.
[0074]
В настоящее изобретение также включен модифицированный вариант антитела. Модифицированный вариант относится к варианту, который получают подвергая антитело по настоящему изобретению химической или биологической модификации. Примеры химически модифицированного варианта включают варианты, химически модифицированные путем связывания химической группы с аминокислотным скелетом, варианты, химически модифицированные N-связанной или O-связанной углеводной цепью, и т.д. Примеры биологически модифицированного варианта включают варианты, полученные путем посттрансляционной модификации (такие как N-связанное или O-связанное гликозилирование, N- или C-концевой процессинг, де-амидирование, изомеризация аспарагиновой кислоты или окисление метионина), и варианты, в которых метиониновый остаток был добавлен к N концу путем экспрессии в прокариотической клетке хозяина.
Кроме того, антитело, меченное таким образом, чтобы обеспечить детекцию или выделение антитела или антигена по настоящему изобретению, например, фермент-меченное антитело, флуоресцентно-меченное антитело и аффинно-меченное антитело, также включены в значение модифицированного варианта. Такой модифицированный вариант антитела по настоящему изобретению является полезным для улучшения стабильности и удержания в кровотоке антитела, снижения его антигенности, детекции или выделения антитела или антигена и т.д.
[0075]
Кроме того, регулируя модификацию гликана, который связывают с антителом по настоящему изобретению (гликозилирование, дефукозилирование и т.д.), можно повысить антитело-зависимую клеточную цитотоксическую активность. Способ регулирования модификации гликана антител известен из Международной публикации № WO 1999/54342, WO 2000/61739, WO 2002/31140 и т.д. Однако способ не ограничивается этим. Антитело по настоящему изобретению также включает антитело, в котором модификация гликана регулируется.
В случае, когда антитело получают, выделяя сначала ген антитела, и затем вводят этот ген подходящему хозяину, можно использовать комбинацию подходящего хозяина и подходящего экспрессирующего вектора. Конкретные примеры гена антитела включают комбинацию гена, кодирующего последовательность тяжелой цепи антитела, описанного в настоящем описании, и гена, кодирующего последовательность его легкой цепи. Когда трансформируют клетку хозяина, можно вставить последовательность гена тяжелой цепи и последовательность гена легкой цепи в один и тот же экспрессирующий вектор, а также в разные экспрессирующие векторы отдельно.
В случае, когда используют эукариотные клетки в качестве хозяина, можно использовать животные клетки, растительные клетки и эукариотные микроорганизмы. В качестве примера животных клеток можно указать клетки млекопитающих, например, обезьяньи COS клетки (Gluzman, Y., Cell, (1981) 23, pp. 175-182, ATCC CRL-1650), мышиные фибробласты NIH3T3 (ATCC No. CRL-1658) и дигидрофолатредуктаза-дефицитные штаммы (Urlaub, G. and Chasin, L. A., Proc. Natl. Acad. Sci. USA (1980) 77, pp. 4126-4220) клеток яичников китайского хомячка (CHO клетки; ATCC: CCL-61).
В случае, когда используют прокариотические клетки, например, Escherichia coli и Bacillus subtilis можно указать в качестве примера.
Путем введения гена желаемого антитела в эти клетки через трансформацию и культивирования трансформированных таким образом клеток in vitro можно получить антитело. В описанном выше способе культивирования, выход может иногда варьировать в зависимости от последовательности антитела, и поэтому из антител, обладающих эквивалетной активностью связывания, используя выход в качестве критерия оценки, можно выбрать антитело, которое легко можно получить в качестве фармацевтического средства. Поэтому в антитело по настоящему изобретению, также включено антитело, полученное способом получения антитела, отличающимся тем, что он включает стадию культивирования трансформированной клетки хозяина и стадию сбора желаемого антитела из культивированного продукта, полученного на стадии культивирования.
[0076]
Известно, что лизиновый остаток на карбоксильном конце тяжелой цепи антитела, которое продуцируется в культивированной клетке млекопитающего, делетирован (Journal of Chromatography A, 705: 129-134 (1995)), и также известно, что два аминокислотных остатка (глицин и лизин) на карбоксильном конце тяжелой цепи антитела, которое продуцируется в культивированной клетке млекопитающего, делетированы, и новый пролиновый остаток на карбоксильном конце амидирован (Analytical Biochemistry, 360: 75-83 (2007)). Однако такая делеция и модификация последовательности тяжелой цепи не влияют на аффинность связывания с антигеном и эффекторную функцию (активация комплемента, антитело-зависимая клеточная цитотоксичность и т.д.) антитела. Поэтому в антитело в соответствии с настоящим изобретением также включено антитело, подвергаемое такой модификации, и функциональный фрагмент антитела, а также охватываются делеционный вариант, в котором одна или две аминокислоты делетированы на карбоксильном конце тяжелой цепи, вариант, полученный амидированием делеционного варианта (например, тяжелая цепь, в которой карбокси-концевой пролиновый остаток амидирован), и т.п. Тип делеционного варианта, включающий делецию на карбоксильном конце тяжелой цепи антитела в соответствии с изобретением не ограничивается описанными выше вариантами, при условии, что аффинность связывания с антигеном и эффекторная функция сохраняются. Две тяжелых цепи антитела в соответствии с изобретением могут быть одного типа, выбранного из группы, состоящей из полноразмерной тяжелой цепи и описанного выше делеционного варианта, или могут быть двух типов в комбинации, выбранной из них. На отношение количества каждого делеционного варианта может влиять тип культивируемых клеток млекопитающего, которые продуцируют антитело в соответствии с изобретением, и условия культивирования, однако, в качестве примера можно указать случай, где один аминокислотный остаток на карбоксильном конце делетирован в каждой из двух тяжелых цепей, содержащихся в качестве основных компонентов в антителе в соответствии с изобретением.
[0077]
В качестве примера изотипа антитела по настоящему изобретению, например, можно указать IgG (IgG1, IgG2, IgG3, IgG4), предпочтительным примером является IgG1 или IgG2.
[0078]
В качестве примера биологической активности антитела, в основном, можно указать антиген-связывающую активность, активность интернализации в клетках, экспрессирующих антиген, путем связывания с антигеном, действие, нейтрализующее активность антигена, действие, повышающее активность антигена, антитело-зависимую клеточную цитотоксичность (ADCC), комплемент-зависимую цитотоксичность (CDC) и антитело-зависимый клеточно-опосредованный фагоцитоз (ADCP). Функцией антитела по настоящему изобретению является активность связывания с TROP2, предпочтительно активность интернализации в TROP2-экспрессирующих клетках путем связывания с TROP2. Кроме того, антитело по настоящему изобретению может обладать ADCC активностью, CDC активностью и/или ADCP активностью, помимо активности интернализации в клетках.
[0079]
Полученное антитело можно очистить до гомогенности. Выделение и очистку антитела можно осуществить с использованием традиционного метода разделения и очистки белков. Например, антитело можно выделить и очистить путем подходящего выбора и сочетания колоночной хроматографии, фильтрации, ультрафильтраци, осаждения солей, диализа, препаративного электрофореза на полиакриламидном геле, электрофореза с изоэлектрическим фокусированием и т.п. (Strategies for Protein Purification and Characterization: A Laboratory Course Manual, Daniel R. Marshak et al. eds., Cold Spring Harbor Laboratory Press (1996); Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory (1988)), но способ не ограничивается этим.
Примеры такой хроматографии включают аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрационную хроматографию, обращенно-фазовую хроматографию и адсорбционную хроматографию.
Такую хроматографию можно осуществить с использованием жидкостной хроматографии, такой как высоко-эффективная жидкостная хроматография или жидкостная хроматография быстрого разрешения.
В качестве примера колонки для использования в аффинной хроматографии, можно указать колонку с Белком A и колонку с Белком G. Например, использование колонки с Белком A, Hyper D, POROS, Сефарозой FF (Pharmacia) и т.п. можно указать в качестве примера.
Кроме того, используя носитель, содержащий иммобилизованный на нем антиген, антитело также можно очистить с использованием свойства связывания антитела с антигеном.
[0080]
[Противоопухолевое соединение]
Раскрывается противоопухолевое соединение, которое используют в конъюгате анти-TROP2 антитело-лекарственное средство по настоящему изобретению. Противоопухолевое соединение, используемое в настоящем изобретении, конкретно не ограничивается, если оно представляет собой соединение, обладающее противоопухолевым эффектом и содержащее группу заместителя или частичную структуру, обеспечивающую возможность связывания с линкерной структурой. Когда часть или весь линкер расщепляется в опухолевых клетках, группа противоопухолевого соединения высвобождается для проявления противоопухолевого эффекта противоопухолевого соединения. Поскольку линкер отщепляется в положении связывания с лекарственным средством, противоопухолевое соединение высвобождается в его немодифицированной структуре для проявления присущего ему противоопухолевого эффекта.
В качестве противоопухолевого соединения, используемого в настоящем изобретении, предпочтительно можно использовать экзатекан (((1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)-дион; показан в представленной ниже формуле), одно из производных камптотецина.
[0081]
[Формула 14]
[0082]
Хотя он обладает отличным противоопухолевым эффектом, экзатекан не является коммерческим продуктом, поставляемым на рынок в качестве противоопухолевого лекарственного средства. Соединение легко можно получить известным способом, и амино группу в положении 1 предпочтительно можно использовать в качестве положения связывания с линкерной структурой. Кроме того, хотя экзатекан также может высвобождаться в опухолевых клетках в то время, как часть линкера все еще присоединена к нему, он представляет собой отличное соединение, демонстрирующее отличный противоопухолевый эффект даже в такой структуре.
Поскольку экзатекан имеет структуру камптотецина, известно, что равновесие сдвигается к структуре с замкнутым лактоновым кольцом (замкнутое кольцо) в кислой водной среде (например, pH 3 или подобный), но оно сдвигается к структуре с открытым лактоновым кольцом (раскрытое кольцо) в водно-щелочной среде (например, pH 10 или подобный). Конъюгат лекарственного средства с введенным экзатекановым остатком, соответствующим структуре с замкнутым кольцом и структуре с раскрытым кольцом, как ожидают, также будет иметь такой же противоопухолевый эффект, и само собой разумеется, что любое из этих состояний охватывается объемом настоящего изобретения.
[0083]
Другие примеры противоопухолевого соединения могут включать доксорубицин, даунорубицин, митомицин C, блеомицин, циклоцитидин, винкристин, винбластин, метотрексат, противоопухолевое средство на основе платины (цисплатин или его производные), таксол или его производные и камптотецин или его производные (противоопухолевое средство, описанное в Японской выложенной патентной заявке № 6-87746).
[0084]
Что касается конъюгата антитело-лекарственное средство, количество конъюгированных молекул лекарственного средства на молекулу антитела является ключевым фактором, влияющим на эффективность и безопасность. Получение конъюгата антитело-лекарственное средство осуществляют путем определения реакционных условий, включая количество используемого сырья и реагентов для реакции, чтобы иметь постоянное количество конъюгированных молекул лекарственного средства, и конъюгат антитело-лекарственное средство, как правило, получают в виде смеси, содержащей разные количества конъюгированных молекул лекарственного средства, в отличие от химической реакции низкомолекулярного соединения. Количество молекул лекарственного средства, конъюгированных в молекуле антитела, выражают или охарактеризовывают средним значением, то есть средним количеством конъюгированных молекул лекарственного средства. Если специально не указано иное в качестве принципа, количество конъюгированных молекул лекарственного средства означает среднюю величину, за исключением случая конъюгата антитело-лекарственное средство, имеющего определенное количество конъюгированных молекул лекарственного средства, который включен в смесь конъюгатов антитело-лекарственное средство, имеющих разное количество конъюгированных молекул лекарственного средства. Количество молекул экзатекана, конъюгированных с молекулой антитела, является контролируемым, и в качестве среднего количества конъюгированных молекул лекарственного средства на антитело можно присоединить примерно от 1 до 10 молекул экзатекана. Предпочтительно от 2 до 8, и более предпочтительно от 3 до 8 молекул. В то же время, специалист в данной области сможет рассчитать реакцию для конъюгирования необходимого количества молекул лекарственного средства с молекулой антитела на основании описания Примеров настоящей заявки и сможет получить конъюгат антитело-лекарственное средство с контролируемым количеством молекул экзатекана.
[0085]
[Линкерная структура]
Что касается конъюгата анти-TROP2 антитело-лекарственное средство по настоящему изобретению, далее раскрывается линкерная структура для конъюгирования противоопухолевого соединения с анти-TROP2 антителом. Линкер имеет структуру следующей формулы:
-L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-
Антитело связывается с концевой частью L1 (конец противоположный связыванию с L2), и противоопухолевое соединение связывается с карбонильной группой -La-(CH2)n2-C(=O)-.
n1 представляет собой целое число, имеющее значение от 0 до 6, и предпочтительно представляет собой целое число, имеющее значение от 1 до 5, и более предпочтительно 1-3.
[0086]
1. L1
L1 представлен следующей структурой
-(Сукцинимид-3-ил-N)-(CH2)n3-C(=O)-.
В представленной выше структуре, n3 представляет собой целое число, имеющее значение от 2 до 8, и "-(Сукцинимид-3-ил-N)-" имеет структуру, представленную следующей формулой:
[0087]
[Формула 15]
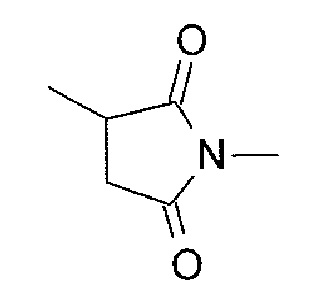
[0088]
Положение 3 представленной выше частичной структуры представляет собой положение связывания с анти-TROP2 антителом. Связь с анти-TROP2 антителом в положении 3 характеризуется связыванием с образованием тиоэфира. Атом азота в положении 1 структурного элемента связан с атомом углерода метилена, который присутствует линкере, включающем эту структуру. В частности, -(Сукцинимид-3-ил-N)-(CH2)n3-C(=O)-L2- представляет собой структуру, представленную следующей формулой (здесь, "антитело-S-" происходит из антитела).
[0089]
[Формула 16]
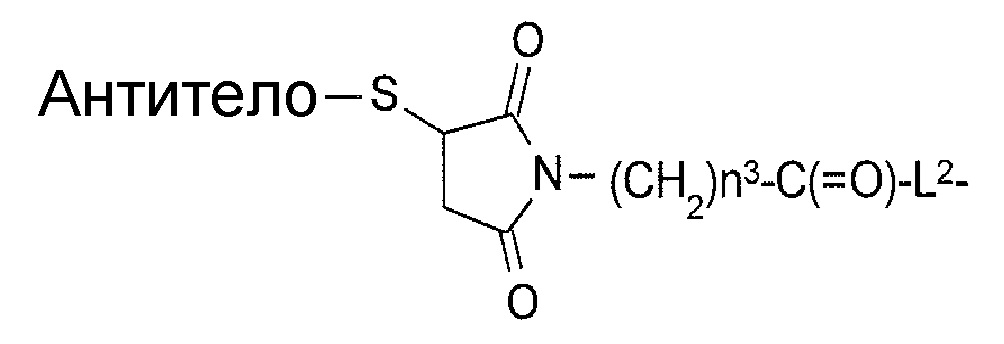
[0090]
В формуле, n3 представляет собой целое число, имеющее значение от 2 до 8, и предпочтительно от 2 до 5.
[0091]
Конкретные примеры L1 могут включать
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-.
[0092]
2. L2
L2 представляет собой линкер, представленный следующей структурой:
-NH-(CH2CH2-O)n4-CH2CH2-C(=O)-,
L2 может не присутствовать, и в таком случае L2 представляет собой простую связь. В структуре выше, n4 представляет собой целое число, имеющее значение от 1 до 6, и предпочтительно от 2 до 4. L2 связан с L1 по его концевой амино группе и связан с LP по его карбонильной группе на другом конце.
[0093]
Конкретные примеры L2 могут включать
-NH-CH2CH2-O-CH2CH2-C(=O)-,
-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-,
-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-,
-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-,
-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-,
-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-.
[0094]
3. LP
LP представляет собой пептидный остаток, состоящий из 2-7 аминокислот. В частности, он состоит из олигопептидного кАтатка, в котором от 2 до 7 аминокислот связаны пептидной связью. LP связан с L2 по его N концу и связан с амино группой -NH-(CH2)n1-La-(CH2)n2-C(=O)- фрагмента линкера по его C концу.
[0095]
Аминокислота, содержащаяся в LP группе в линкере конкретно не ограничивается, однако, ее примеры включают L- или D-аминокислоту, предпочтительно L-аминокислоту. И это может быть аминокислота, имеющая структуру, такую как β-аланин, ε-аминокапроновая кислота или γ-аминомасляная кислота, в добавление к α-аминокислоте, кроме того, это может быть аминокислота не-природного типа, такая как N-метилированная аминокислота.
Аминокислотная последовательность LP конкретно не ограничивается, но примеры содержащейся в ней аминокислоты включают фенилаланин (Phe; F), тирозин (Tyr; Y), лейцин (Leu; L), глицин (Gly; G), аланин (Ala; A), валин (Val; V), лизин (Lys; K), цитруллин (Cit), серин (Ser; S), глутаминовую кислоту (Glu; E) и аспарагиновую кислоту (Asp; D).
Среди них, предпочтительные примеры включают фенилаланин, глицин, валин, лизин, цитруллин, серин, глутаминовую кислоту и аспарагиновую кислоту. В зависимости от типа аминокислоты, можно контролировать картину высвобождения лекарственного средства. Количество аминокислот может быть от 2 до 7.
[0096]
Конкретные примеры LP могут включать
-GGF-,
-DGGF-,
-(D-)D-GGF-,
-EGGF-,
-GGFG-,
-SGGF-,
-KGGF-,
-DGGFG-,
-GGFGG-,
-DDGGFG-,
-KDGGFG-,
-GGFGGGF-.
В перечисленных выше, "(D-)D" представляет собой D-аспарагиновую кислоту.
Особенно предпочтительные примеры LP для конъюгата антитело-лекарственное средство по настоящему изобретению могут включать тетрапептидный остаток -GGFG-.
[0097]
4. La-(CH2)n2-C(=O)-
La в La-(CH2)n2-C(=O)- представляет собой структуру -O- или простую связь. n2 представляет собой целое число, имеющее значение от 0 до 5, более предпочтительно от 0 до 3, более предпочтительно 0 или 1.
Примеры La-(CH2)n2-C(=O)- могут включать группы, имеющие следующие структуры:
-O-CH2-C(=O)-,
-O-CH2CH2-C(=O)-,
-O-CH2CH2CH2-C(=O)-,
-O-CH2CH2CH2CH2-C(=O)-,
-O-CH2CH2CH2CH2CH2-C(=O)-,
-CH2-C(=O)-,
-CH2CH2-C(=O)-,
-CH2CH2CH2-C(=O)-,
-CH2CH2CH2CH2-C(=O)-,
-CH2CH2CH2CH2CH2-C(=O)-.
Из них
-O-CH2-C(=O)-,
-O-CH2CH2-C(=O)- или
случай, когда La представляет собой простую связь, и n2 имеет значение 0, являются предпочтительными.
[0098]
Конкретные примеры структуры, представленной как -NH-(CH2)n1-La-(CH2)n2-C(=O)-, в линкере могут включать
-NH-CH2-C(=O)-,
-NH-CH2CH2-C(=O)-,
-NH-CH2-O-CH2-C(=O)-,
-NH-CH2CH2-O-C(=O)-,
-NH-CH2CH2-O-CH2-C(=O)-,
-NH-CH2CH2CH2-C(=O)-,
-NH-CH2CH2CH2CH2-C(=O)-,
-NH-CH2CH2CH2CH2CH2-C(=O)-.
[0099]
Более предпочтительным является -NH-CH2CH2CH2-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-CH2CH2-O-C(=O)-.
[0100]
В линкере длина цепи -NH-(CH2)n1-La-(CH2)n2-C(=O)- предпочтительно представляет собой цепь, имеющую длину от 4 до 7 атомов, и более предпочтительно цепь, имеющую длину 5 или 6 атомов.
[0101]
Что касается конъюгата анти-TROP2 антитело-лекарственное средство по настоящему изобретению, считается, что, когда конъюгат анти-TROP2 антитело-лекарственное средство проникает внутрь опухолевых клеток, линкерная группа отщепляется и производное лекарственного средства, имеющее структуру, представленную как NH2-(CH2)n1-La-(CH2)n2-C(=O)-(NH-DX), высвобождается с проявлением противоопухолевого действия. Примеры противоопухолевого производного, демонстрирующего противоопухолевый эффект путем высвобождения из конъюгата антитело-лекарственное средство по настоящему изобретению, включают противоопухолевое производное, имеющее структурную группу, в которой структура, представленная как -NH-(CH2)n1-La-(CH2)n2-C(=O)- линкера, содержит концевую амино группу, и особенно предпочтительные включают следующие.
NH2-CH2CH2-C(=O)-(NH-DX),
NH2-CH2CH2CH2-C(=O)-(NH-DX),
NH2-CH2-O-CH2-C(=O)-(NH-DX),
NH2-CHCH2-O-CH2-C(=O)-(NH-DX).
При этом, в случае NH2-CH2-O-CH2-C(=O)-(NH-DX), было подтверждено, что, поскольку аминальная структура в молекуле является нестабильной, она снова претерпевает саморазложение с высвобождением следующего
HO-CH2-C(=O)-(NH-DX). Такие соединения также можно предпочтительно использовать в качестве промежуточного продукта способа получения конъюгата антитело-лекарственное средство по настоящему изобретению.
[0102]
Для конъюгата антитело-лекарственное средство по настоящему изобретению, в котором в качестве лекарственного средства используют экзатекан, предпочтительно, чтобы структурный фрагмент лекарственное средство-линкер [-L1-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-(NH-DX)], имеющий следующую структуру, был связан с антителом. Среднее конъюгированное количество указанных структурных фрагментов лекарственное средство-линкер на антитело может быть от 1 до 10. Предпочтительно оно составляет от 2 до 8, и более предпочтительно от 3 до 8.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
Среди них, более предпочтительными являются следующие.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
Особенно предпочтительными являются следующие.
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
[0103]
Что касается линкерной структуры для конъюгирования анти-TROP2 антитела и лекарственного средства в конъюгате антитело-лекарственное средство по настоящему изобретению, предпочтительный линкер можно сконструировать путем связывания предпочтительных структур, показанных для каждой части линкера, раскрываемого выше. Что касается структуры линкера, предпочтительно используют линкеры со следующей структурой. При этом, левый конец структуры представляет собой положение связывания с антителом, а правый конец представляет собой положение связывания с лекарственным средством.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Среди них, более предпочтительными являются следующие.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Особенно предпочтительные включают следующие.
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
[0104]
[Способ получения]
Далее представлены объяснения, касающиеся репрезентативного способа получения конъюгата антитело-лекарственное средство по настоящему изобретению или получения его промежуточного соединения. При этом, соединения описаны ниже с номером соединения, показанным в каждой формуле реакции. В частности, они указываются как "соединение формулы (1)", "соединение (1)" или т.п. Соединения с другими номерами также описаны аналогичным образом.
[0105]
1. Способ получения 1
Конъюгат антитело-лекарственное средство, представленный формулой (1), который связан со структурным фрагментом лекарственное средство-линкер через тиоэфир, можно получить, например, следующим способом.
[0106]
[Формула 17]
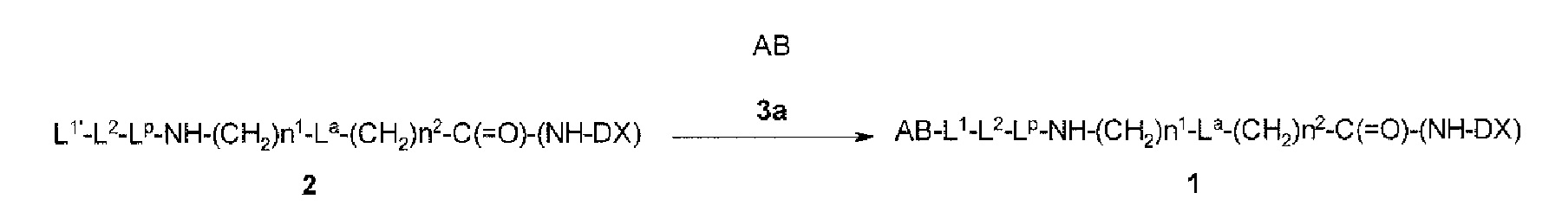
[0107]
[В формуле, AB представляет собой антитело, содержащее сульфгидрильную группу, и L1' представляет собой L1 линкерную структуру, в которой концевая часть линкера представляет собой малеимидильную группу (формула показана ниже)
[0108]
[Формула 18]
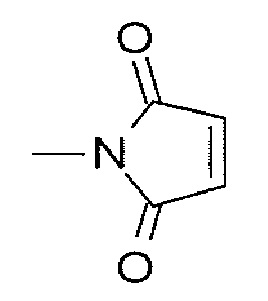
[0109]
(в формуле, атом азота представляет собой положение связывания),
и, например, представляет собой группу, в которой -(сукцинимид-3-ил-N)- часть в -(сукцинимид-3-ил-N)-(CH2)n3-C(=O)- группе L1 представляет собой малеимидильную группу. Кроме того, -(NH-DX) представляет собой структуру, представленную следующей формулой:
[0110]
[Формула 19]
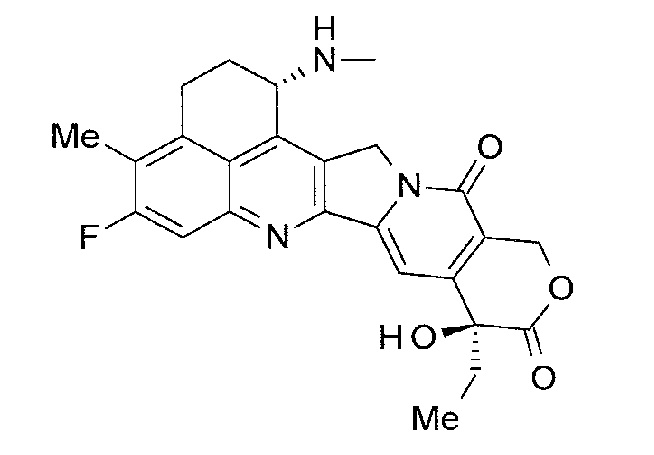
[0111]
и представляет собой группу, образованную путем удаления одного атома водорода амино группы в положении 1 экзатекана.]
[0112]
Кроме того, соединение формулы (1) в представленной выше формуле реакции интерпретируется как структура, в которой один структурный фрагмент, соответствующий фрагменту от лекарственного средства до конца линкера, связывается с одним антителом. Однако это только описание, представленное для удобства, и на самом деле существует множество случаев, где несколько структурных фрагментов связаны с одной молекулой антитела. То же относится и к способу получения, описанному ниже.
[0113]
Конъюгат антитело-лекарственное средство (1) можно получить путем взаимодействия соединения (2), которое может быть получено способом, описанным ниже, с антителом (3a), содержащим сульфгидрильную группу.
Антитело (3a), содержащее сульфгидрильную группу, можно получить способом, хорошо известным в данной области техники (Hermanson, G.T, Bioconjugate Techniques, pp. 56-136, pp. 456-493, Academic Press (1996)). Примеры включают: реагент Трота подвергают взаимодействию с амино группой антитела; N-сукцинимидил S-ацетилтиоалканоаты подвергают взаимодействию с амино группой антитела с последующим взаимодействием с гидроксиламином; после взаимодействия с N-сукцинимидил 3-(пиридилдитио)пропионатом антитело подвергают взаимодействию с восстановителем; антитело подвергают взаимодействию с восстановителем, таким как дитиотреитол, 2-меркаптоэтанол и трис(2-карбоксиэтил)фосфин гидрохлорид (TCEP), для восстановления дисульфидной связи в шарнирной части в антителе с образованием сульфгидрильной группы, но не ограничиваются этим.
В частности, путем использования 0,3-3 молярных эквивалентов TCEP в качестве восстановителя на дисульфид в шарнирной части в антителе и взаимодействия с антителом в буферном растворе, содержащем хелатообразующий агент, можно получить антитело с частично или полностью восстановленным дисульфидом в шарнирной части в антителе. Примеры хелатообразующего агента включают этилендиаминтетрауксусную кислоту (EDTA) и диэтилентриаминпентауксусную кислоту (DTPA). Его можно использовать при концентрации от 1 мМ до 20 мМ. Примеры буферного раствора, который можно использовать, включают раствор фосфата натрия, бората натрия или ацетата натрия. В частности, путем взаимодействия антитела с TCEP при 4°C-37°C в течение 1-4 часов можно получить антитело (3a), содержащее частично или полностью восстановленную сульфгидрильную группу.
При этом, путем осуществления реакции для добавления сульфгидрильной группы к фрагменту лекарственное средство-линкер, фрагмент лекарственное средство-линкер может быть конъюгирован посредством тиоэфирной связи.
С использованием от 2 до 20 молярных эквивалентов соединения (2) на антитело (3a), содержащее сульфгидрильную группу, можно получить конъюгат антитело-лекарственное средство (1), в котором конъюгированы от 2 до 8 молекул лекарственного средства на антитело. В частности, достаточно добавить раствор, содержащий соединение (2), растворенное в нем, к буферному раствору, содержащему антитело (3a), содержащее сульфгидрильную группу, для реакции. Здесь, примеры буферного раствора, который можно использовать, включают раствор ацетата натрия, фосфата натрия и бората натрия. pH для реакции находится на уровне 5-9, и более предпочтительно реакцию осуществляют при около pH 7. Примеры растворителя для растворения соединения (2) включают органический растворитель, такой как диметилсульфоксид (ДМСО), диметилформамид (DMF), диметилацетамид (DMA) и N-метил-2-пиридон (NMP).
Достаточно, когда органический растворитель, содержащий соединение (2), растворенное в нем, добавляют при 1-20% об./об. к буферному раствору, содержащему антитело (3a), содержащее сульфгидрильную группу, для реакции. Температура реакции составляет 0-37°C, более предпочтительно 10-25°C, и время реакции составляет от 0,5 до 2 часов. Реакцию можно остановить путем дезактивации реактивности непрореагировавшего соединения (2) тиол-содержащим реагентом. Примеры тиол-содержащего реагента включают цистеин и N-ацетил-L-цистеин (NAC). Более конкретно, 1-2 молярных эквивалета NAC добавляют к используемому соединению (2), и реакцию можно остановить путем инкубации при комнатной температуре в течение 10-30 минут.
Полученный конъюгат антитело-лекарственное средство (1) можно подвергнуть, после концентрирования, буферного обмена, очистки и измерения концентрации антитела и среднего количества конъюгированных молекул лекарственного средства на молекулу антитела в соответствии с общими процедурами, описанными ниже, идентификации конъюгата антитело-лекарственное средство (1).
[0114]
Общая процедура A: Концентрирование водного раствора антитела или конъюгата антитело-лекарственное средство
В Amicon Ultra (50000 MWCO, Millipore Corporation) контейнер добавляли раствор антитела или конъюгата антитело-лекарственное средство и раствор антитела или конъюгата антитело-лекарственное средство концентрировали путем центрифугирования (центрифугирование в течение 5-20 минут при 2000 G - 3800 G) с использованием центрифуги (Allegra X-15R, Beckman Coulter, Inc.).
Общая процедура B: Измерение концентрации антитела
С использованием УФ-детектора (Nanodrop 1000, Thermo Fisher Scientific Inc.) осуществляли измерение концентраци антитела в соответствии со способом, указанным изготовителем. В то же время, использовали 280 нм коэффициент поглощения, разный для каждого антитела (1,3 млмг-1см-1-1,8 млмг-1см-1).
Общая процедура C-1: Буферный обмен для антитела
NAP-25 колонку (Cat. No. 17-0852-02, GE Healthcare Japan Corporation) с использованием Sephadex G-25 носителя уравновешивали фосфатным буфером (10 мМ, pH 6,0; указывается как PBS6,0/EDTA в описании изобретения), содержащем хлорид натрия (137 мМ) и этилендиаминтетрауксусную кислоту (EDTA, 5 мМ), в соответствии со способом, указанным изготовителем. Водный раствор антитела вводили в количестве 2,5 мл в одну NAP-25 колонку и затем фракцию (3,5 мл), которую элюировали при помощи 3,5 мл PBS6,0/EDTA, собирали. Полученную фракцию концентрировали с использованием Общей процедуры A. После измерения концентрации антитела с использованием Общей процедуры B концентрацию антитела доводили до 10 мг/мл с использованием PBS6,0/EDTA.
Общая процедура C-2: Буферный обмен для антитела
NAP-25 колонку (Cat. No. 17-0852-02, GE Healthcare Japan Corporation) с использованием Sephadex G-25 носителя уравновешивали фосфатным буфером (50 мМ, pH 6,5; указывается как PBS6,5/EDTA в описании изобретения), содержащем хлорид натрия (50 мМ) и EDTA (2 мМ), в соответствии со способом, указанным изготовителем. Водный раствор антитела вводили в количестве 2,5 мл в одну NAP-25 колонку и затем фракцию (3,5 мл), которую элюировали при помощи 3,5 мл PBS6,5/EDTA, собирали. Полученную фракцию концентрировали с использованием Общей процедуры A. После измерения концентрации антитела с использованием Общей процедуры B, концентрацию антитела доводили до 20 мг/мл с использованием PBS6,5/EDTA.
Общая процедура D: Очистка конъюгата антитело-лекарственное средство
NAP-25 колонку уравновешивали любым буфером, выбранным из коммерчески доступного фосфатного буфера (PBS7,4, Cat. No. 10010-023, Invitrogen), натрийфосфатного буфера (10 мМ, pH 6,0; указывается как PBS6,0), содержащего хлорид натрия (137 мМ), и ацетатного буфера, содержащего сорбит (5%) (10 мМ, pH 5,5; указывается как ABS в описании изобретения). Водный раствор конъюгата антитело-лекарственное средство вводили в количестве около 1,5 мл в NAP-25 колонку и затем элюировали при помощи буфера в количестве, указанном изготовителем, для сбора фракции антитела. Собранную фракцию снова наносили на NAP-25 колонку и, повторяя от 2 до 3 раз в целом процесс гель-фильтрационной очистки для элюирования буфером, получали конъюгат антитело-лекарственное средство, не включающий неконъюгированное лекарственное средство-линкер и низкомолекулярное соединение (трис(2-карбоксиэтил)фосфин гидрохлорид (TCEP), N-ацетил-L-цистеин (NAC) и диметилсульфоксид).
Общая процедура E: Измерение концентрации антитела в конъюгате антитело-лекарственное средство и среднего количества конъюгированных молекул лекарственного средства на молекулу антитела (1).
Концентрацию конъюгированного лекарственного средства в конъюгате антитело-лекарственное средство можно рассчитать путем измерения УФ-поглощения водного раствора конъюгата антитело-лекарственное средство при двух длинах волн 280 нм и 370 нм, с последующим осуществлением расчета, как показано ниже.
Поскольку общее поглощение при любой длине волны равно сумме поглощений каждого поглощающего свет химического вещества, которые присутствуют в системе (аддитивность поглощения), когда молярные коэффициенты поглощения антитела и лекарственного средства остаются такими же до и после конъюгациии между антителом и лекарственным средством, концентрацию антитела и концентрацию лекарственного средства в конъюгате антитело-лекарственное средство выражают следующими уравнениями.
A280=AD,280+AA,280=εD,280CD+εA,280CA Уравнение (I)
A370=AD,370+ AA,370=εD,370CD+εA,370CA Уравнение (II)
В представленных выше уравнениях, A280 представляет собой поглощение водного раствора конъюгата антитело-лекарственное средство при 280 нм, A370 представляет собой поглощение водного раствора конъюгата антитело-лекарственное средство при 370 нм, AA,280 представляет собой поглощение антитела при 280 нм, AA,370 представляет собой поглощение антитела при 370 нм, AD,280 представляет собой поглощение предшественника конъюгата при 280 нм, AD,370 представляет собой поглощение предшественника конъюгата при 370 нм, εA,280 представляет собой молярный коэффициент поглощения антитела при 280 нм, εA,370 представляет собой молярный коэффициент поглощения антитела при 370 нм, εD,280 представляет собой молярный коэффициент поглощения предшественника конъюгата при 280 нм, εD,370 представляет собой молярный коэффициент поглощения предшественника конъюгата при 370 нм, CA представляет собой концентрацию антитела в конъюгате антитело-лекарственное средство, и CD представляет собой концентрацию лекарственного средства в конъюгате антитело-лекарственное средство.
Что касается εA,280, εA,370, εD,280 и εD,370 в представленных выше уравнениях, используют предварительно полученные значения (расчетное значение на основании вычисления или измерения значения, полученного УФ-измерением соединения). Например, εA,280 можно рассчитать из аминокислотной последовательности антитела с использованием известного метода расчета (Protein Science, 1995, vol. 4, 2411-2423). εA,370, как правило, равен нулю. εD,280 и εD,370 можно получить на основании закона Бугера-Ламберта-Бера's (Поглощение=молярная концентрация × молярный коэффициент поглощения × длина поглощающего слоя) путем измерения поглощения раствора, в котором предшественник конъюгата, подходящий для использования, растворяют при определенной молярной концентрации. Путем измерения A280 и A370 водного раствора конъюгата антитело-лекарственное средство и решения параллельных уравнений (I) и (II) с использованием полученных значений, можно получить CA и CD. Кроме того, путем деления CD на CA можно получить среднее количество конъюгированного лекарственного средства на антитело.
[0115]
Общая процедура F: Измерение среднего количества конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство - (2).
Среднее количество конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство также можно определить при помощи высоко-эффективной жидкостной хроматографии (ВЭЖХ) с использованием способа, описанного ниже, в дополнение к описанной выше Общей процедуре E.
[F-1. Получение образца для ВЭЖХ анализа (восстановление конъюгата антитело-лекарственное средство)]
Раствор конъюгата антитело-лекарственное средство (около 1 мг/мл, 60 мкл) смешивают с водным раствором дитиотреитола (DTT) (100 мМ, 15 мкл). Смесь инкубируют при 37°C в течение 30 минут для расщепления дисульфидной связи между L цепью и H цепью конъюгата антитело-лекарственное средство. Полученный образец используют в ВЭЖХ анализе.
[F-2. ВЭЖХ анализ]
ВЭЖХ анализ осуществляют в следующих условиях измерения:
ВЭЖХ система: ВЭЖХ система Agilent 1290 (Agilent Technologies, Inc.)
Детектор: УФ-спектрометр (измерение длины волны: 280 нм)
Колонка: PLRP-S (2,1×50 мм, 8 мкм, 1000 ангстрем; Agilent Technologies, Inc., P/N PL1912-1802)
Температура колонки: 80°C
Подвижная фаза A: 0,04% водный раствор трифторуксусной кислоты (TFA)
Подвижная фаза B: раствор ацетонитрила, содержащий 0,04% TFA
Программа градиента: 29%-36% (0 мин-12,5 мин), 36%-42% (12,5-15 мин), 42%-29% (15 мин-15,1 мин), 29%-29% (15,1 мин-25 мин)
Объем вводимой пробы: 15 мкл
[F-3. Анализ данных]
[F-3-1] По сравнению с L цепью (L0) и H цепью (H0) неконъюгированного антитела, лекарственное средство-конъюгированные L цепь (L цепь, связанная с одной молекулой лекарственного средства: L1) и H цепи (H цепь, связанная с одной молекулой лекарственного средства: H1, H цепь, связанная с двумя молекулами лекарственного средства: H2, H цепь, связанная с тремя молекулами лекарственного средства: H3) демонстрируют более высокую гидрофобность пропорционально количеству конъюгированных молекул лекарственного средства и, таким образом, имеют большее время удерживания. Поэтому эти цепи элюируют в порядке L0 и L1 или H0, H1, H2 и H3. Детектируемые пики могут быть приписаны любой из L0, L1, H0, H1, H2 и H3 путем сравнения времени удерживания с L0 и H0.
[F-3-2] Поскольку лекарственное средство-линкер имеет УФ-абсорбцию, значения площади пиков корректируют в ответ на количество конъюгированных молекул лекарственное средство-линкер в соответствии со следующей формулой с использованием молярных коэффициентов поглощения L цепи, H цепи и лекарственного средства-линкера.
[0116]
[Формула 1]

[0117]
[Формула 2]

[0118]
Здесь, что касается коэффициента молярной экстинкции (280 нм) L цепи или H цепи каждого антитела, можно использовать значение, рассчитанное из аминокислотной последовательности L цепи или H цепи каждого антитела известным способом расчета (Protein Science, 1995, vol. 4, 2411-2423). В случае hTINA, коэффициент молярной экстинкции 34690 и коэффициент молярной экстинкции 95000 использовали в качестве расчетного значения для L цепи или H цепи, соответственно, в соответствии с его аминокислотной последовательностью. Что касается коэффициента молярной экстинкции (280 нм) лекарственного средства-линкера, использовали измеренный коэффициент молярной экстинкции (280 нм) соединения, в котором малеимидная группа была преобразована в сукцинимидный тиоэфир путем взаимодействия каждого лекарственного средства-линкера с меркаптоэтанолом или N-ацетилцистеином.
[F-3-3] Отношение площадей пиков (%) каждой цепи рассчитывают для всех скорректированных значений площадей пиков в соответствии со следующей формулой.
[0119]
[Формула 3]

[0120]
[F-3-4] Среднее количество конъюгированных молекул лекарственного средства на молекулу антитела в конъюгате антитело-лекарственное средство рассчитывают в соответствии со следующей формулой.
Среднее количество конъюгированных молекул лекарственного средства=(L0 отношение площадей пиков × 0+L0 отношение площадей пиков × 1+H0 отношение площадей пиков × 0+H1 отношение площадей пиков × 1+H2 отношение площадей пиков × 2+H3 отношение площадей пиков × 3)/100 × 2
[0121]
Соединение, представленное формулой (2), в Способе получения 1, представляет собой соединение, представленное следующей формулой:
(малеимид-N-ил)-(CH2)n3-C(=O)-L2-LP-NH-(CH2)n1-La-(CH2)n2-C(=O)-(NH-DX)
В формуле,
n3 представляет собой целое число, имеющее значение от 2 до 8,
L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)- или простую связь,
где n4 представляет собой целое число, имеющее значение от 1 до 6,
LP представляет собой пептидный остаток, состоящий из 2-7 аминокислот, выбранных из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты
n1 представляет собой целое число, имеющее значение от 0 до 6,
n2 представляет собой целое число, имеющее значение от 0 до 5,
La представляет собой -O- или простую связь,
(малеимид-N-ил)- представляет собой малеимидильную группу (2,5-диоксо-2,5-дигидро-1H-пиррол-1-ильную группу), представленную следующей формулой:
[0122]
[Формула 20]
[0123]
где атом азота представляет собой положение связывания,
-(NH-DX) представляет собой группу, представленную следующей формулой:
[0124]
[Формула 21]
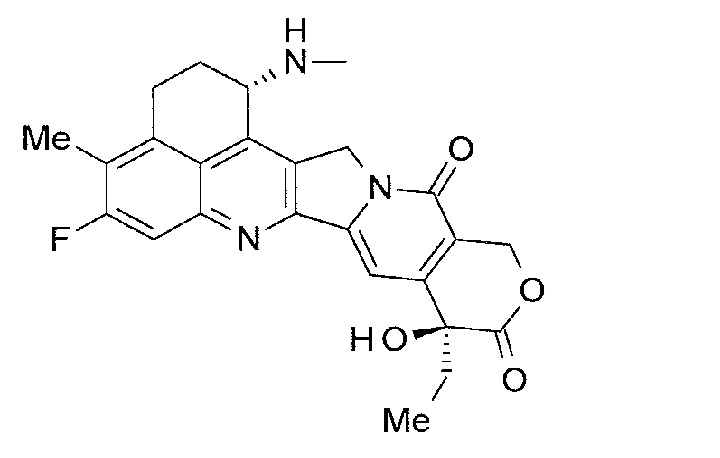
[0125]
где атом азота амино группы в положении 1 представляет собой положение связывания.
[0126]
Когда L2 представляет собой простую связь или -NH-(CH2CH2-O)n4-CH2CH2-C(=O)-, соединение, в котором n4 представляет собой целое число, имеющее значение от 2 до 4, является предпочтительным в качестве промежуточного продукта способа получения.
Что касается пептидного остатка LP, соединение, содержащее пептидный остаток, включающий аминокислоту, выбранную из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты, является предпочтительным в качестве промежуточного продукта способа получения. Из таких пептидных остатков, соединение, в котором LP представляет собой пептидный остаток, состоящий из 4 аминокислот, является предпочтительным в качестве промежуточного продукта способа получения. Более конкретно, соединение, в котором LP представляет собой тетрапептидный остаток -GGFG- является предпочтительным в качестве промежуточного продукта способа получения.
[0127]
Кроме того, что касается -NH-(CH2)n1-La-(CH2)n2-, соединение, содержащее -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта способа получения. Соединение, содержащее -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2, является более предпочтительным.
[0128]
Кроме того, в соединении, представленном формулой (2), соединение, в котором n3 представляет собой целое число, имеющее значение от 2 до 5, L2 представляет собой простую связь, и -NH-(CH2)n1-La-(CH2)n2- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта способа получения. Соединение, в котором -NH-(CH2)n1-La-(CH2)n2- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является более предпочтительным. Соединение, в котором n3 представляет собой целое число, имеющее значение от 2 или 5, является еще более предпочтительным.
[0129]
Кроме того, в соединении, представленном формулой (2), соединение, в котором n3 представляет собой целое число, имеющее значение от 2 до 5, L2 представляет собой -NH-(CH2CH2-O)n4-CH2CH2-C(=O)-, n4 представляет собой целое число, имеющее значение от 2 до 4, и -NH-(CH2)n1-La-(CH2)n2- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта способа получения. Соединение, в котором n4 представляет собой целое число, имеющее значение от 2 или 4, является более предпочтительным. Соединение, в котором -NH-(CH2)n1-La-(CH2)n2- представляет собой -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является еще более предпочтительным.
[0130]
В качестве примера таких предпочтительных промежуточных соединений, полезных в получении соединения по настоящему изобретению, можно указать следующие.
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
[0131]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению можно получить путем взаимодействия соединения лекарственное средство-линкер, выбранного из описанной выше группы промежуточных соединений способа получения, с анти-TROP2 антителом или его реакционноспособным производным и образования тиоэфирной связи на участке дисульфидной связи, присутствующей в шарнирной части анти-TROP2 антитела. В этом случае предпочтительно используют реакционно-способное производное анти-TROP2 антитела. В частности, реакционноспособное производное, полученное путем восстановления анти-TROP2 антитела, является предпочтительным.
[0132]
Ниже представлены соединения, являющиеся более предпочтительными в качестве промежуточных соединений в способе получения.
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
[0133]
Из описанной выше группы промежуточных соединений, соединение, представленное следующей формулой:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2-O-CH2CH2-O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX) или
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
является еще более предпочтительным соединением.
[0134]
Чтобы гарантировать определенное количество конъюгата, множество конъюгатов, полученных в аналогичных условиях получения, чтобы они содержали эквивалетное количество молекул лекарственного средства (например, около±1), можно смешать для получения новых партий. В этом случае, среднее количество лекарственных средств попадает в пределы средних количеств лекарственных средств в конъюгатах до смешивания.
[0135]
2. Способ получения 2
Соединение, представленное формулой (2), в качестве промежуточного соединения, используемого в предыдущем способе получения, и его фармакологически приемлемую соль можно получить, например, следующим способом.
[0136]
[Формула 22]
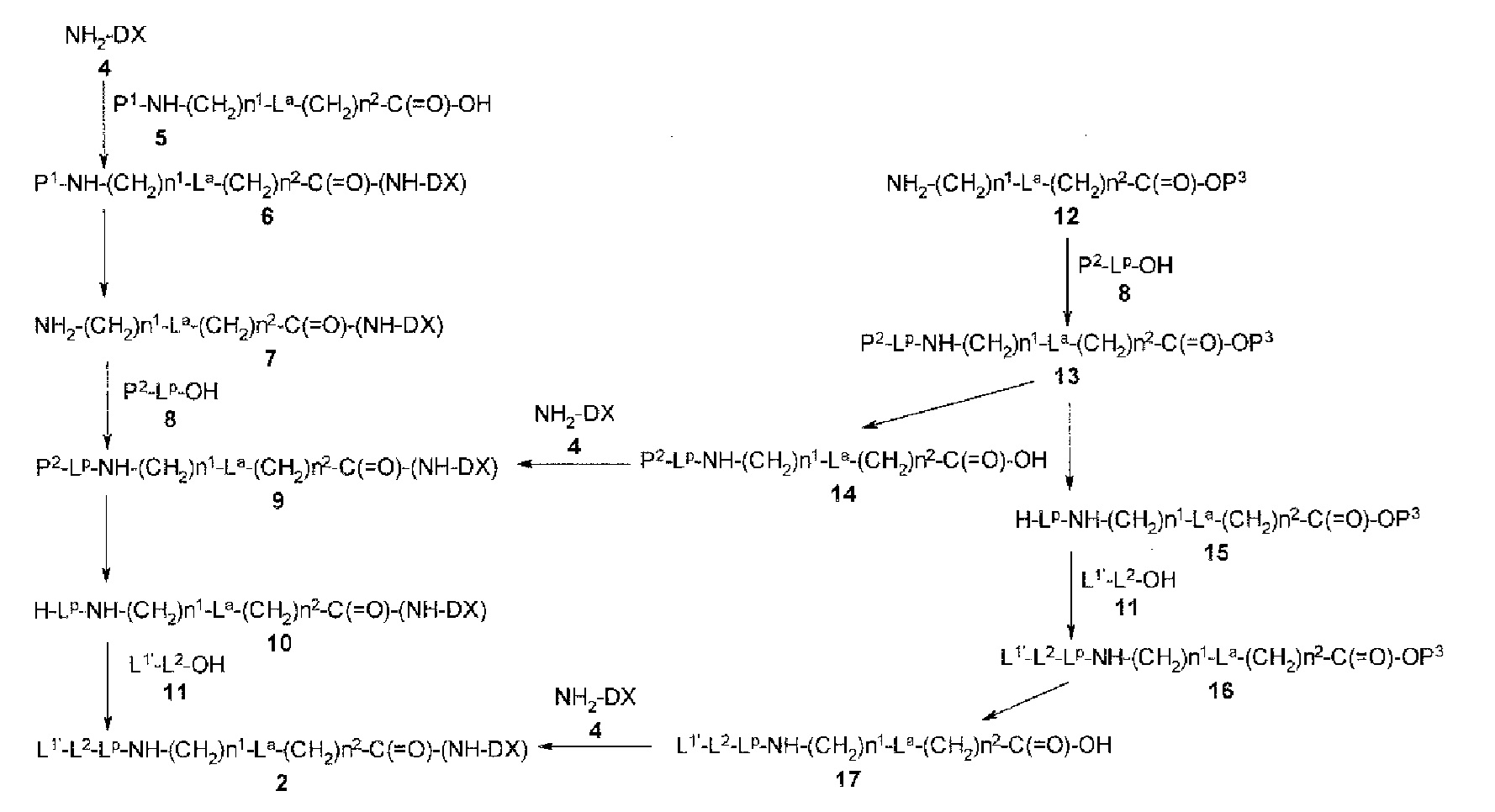
[0137]
В формуле, L1' представляет собой малеимидильную группу, и P1, P2 и P3 каждый представляет собой защитную группу.
[0138]
Соединение (6) можно получить путем дериватизации карбоновой кислоты (5) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и его взаимодействия с NH2-DX (4) или его фармакологически приемлемой солью в присутствии основания. NH2-DX (4) представляет собой экзатекан (химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)-дион).
Для этой реакции можно использовать реагенты и условия реакции, которые традиционно используют для синтеза пептидов. Существуют различные виды активного сложного эфира. Например, его можно получить путем взаимодействия фенолов, таких как п-нитрофенол, N-гидроксибензотриазол, N-гидроксисукцинимид или т.п., с карбоновой кислотой (5) с использованием агента конденсации, такого как N,N'-дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид. Кроме того, активный сложный эфир также можно получить путем взаимодействия карбоновой кислоты (5) с пентафторфенилтрифторацетатом или т.п.; взаимодействия карбоновой кислоты (5) с 1-бензотриазолилокситрипирролидинофосфоний гексафторфосфитом; взаимодействия карбоновой кислоты (5) с диэтилцианофосфонатом (метод всаливания); взаимодействия карбоновой кислоты (5) с трифенилфосфином и 2,2'-дипиридилдисульфидом (метод Мукаяма); взаимодействия карбоновой кислоты (5) с триазиновым производным, таким как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид (DMTММ); или т.п. Кроме того, реакцию также можно осуществить, например, способом с использованием галогенангидрида кислоты, в котором карбоновую кислоту (5) обрабатывают галогенангидридом кислоты, таким как тионилхлорид и оксалилхлорид, в присутствии основания.
Путем взаимодействия активного сложного эфира, смешанного ангидрида кислоты или галогенангидрида карбоновой кислоты (5), полученных как описано выше, с соединением (4) в присутствии подходящего основания в инертном растворителе при температуре реакции -78°C-150°C можно получить соединение (6). При этом, "инертный растворитель" означает растворитель, который не ингибирует целевую реакцию, для которой используют этот растворитель.
[0139]
Конкретные примеры основания, используемого для каждой стадии, описанной выше, могут включать карбонат, алкоксид, гидроксид или гидрид щелочного металла или щелочно-земельного металла, включая карбонат натрия, карбонат калия, этоксид натрия, бутоксид калия, гидроксид натрия, гидроксид калия, гидрид натрия и гидрид калия, металлоорганическое основание, представленное алкиллитием, включая н-бутиллитий, диалкиламинолитием, включая диизопропиламид лития; металлоорганическое основание биссилиламина, включая бис(триметилсилил)амид лития; и органическое основание, включая третичный амин или азот-содержащее гетероциклическое соединение, такое как пиридин, 2,6-лутидин, коллидин, 4-диметиламинопиридин, триэтиламин, N-метилморфолин, диизопропилэтиламин и диазабицикло[5.4.0]ундец-7-ен (DBU).
[0140]
Примеры инертного растворителя, который используют для реакции по настоящему изобретению, включают галогенированный углеводородый растворитель, такой как дихлорметан, хлороформ и тетрахлорид углерода; эфирный растворитель, такой как тетрагидрофуран, 1,2-диметоксиэтан и диоксан; ароматический углеводородный растворитель, такой как бензол и толуол; и амидный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид и N-метилпирролидин-2-он. В дополнение к ним, в некоторых случаях можно использовать сульфоксидный растворитель, такой как диметилсульфоксид и сульфолан; кетоновый растворитель, такой как ацетон и метилэтилкетон; и спиртовой растворитель, такой как метанол и этанол. Кроме того, эти растворители можно смешивать для использования.
[0141]
Что касается защитной группы P1 для концевой амино группы соединения (6), можно использовать защитную группу для амино группы, которую, как правило, используют для синтеза пептидов, например, трет-бутилоксикарбонильную группу, 9-флуоренилметилоксикарбонильную группу и бензилоксикарбонильную группу. Примеры другой защитной группы для амино группы могут включать алканоильную группу, такую как ацетильная группа; алкоксикарбонильную группу, такую как метоксикарбонильная группа и этоксикарбонильная группа; арилметоксикарбонильную группу, такую как параметоксибензилоксикарбонильная группа и пара (или орто)нитробензилоксикарбонильная группа; арилметильную группу, такую как бензильная группа и трифенилметильная группа; ароильную группу, такую как бензоильная группа; и арилсульфонильную группу, такую как 2,4-динитробензолсульфонильная группа и ортонитробензолсульфонильная группа. Защитную группу P1 можно выбрать в зависимости от, например, свойства соединения, содержащего амино группу, подлежащую защите.
Путем удаления защитной группы P1 для концевой амино группы полученного соединения (6) можно получить соединение (7). Для такой процедуры удаления защиты можно выбрать реагенты и условия в зависимости от защитной группы.
Соединение (9) можно получить путем дериватизации карбоновой кислоты пептида (8) с N концом, защищенным группой P2, в активный сложный эфир, смешанный ангидрид кислоты или т.п. и взаимодействия этого соединения с полученным соединением (7). Реакционные условия, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между карбоновой кислотой пептида (8) и соединением (7), можно соответствующим образом выбрать и использовать из тех, которые описаны для синтеза соединения (6). Защитную группу P2, можно соответствующим образом выбрать и использовать из тех, которые описаны для защитной группы соединения (6), и выбор можно сделать на основании, например, свойств соединения, содержащего амино группу, подлежащую защите. Поскольку это, как правило, используют для синтеза пептидов, повторяя последовательно реакцию и процедуру удаления защиты аминокислоты или содержащейся в пептиде карбоновой кислоты (8) для элонгации, также можно получить соединение (9).
Путем удаления защитной группы P2 для амино группы полученного соединения (9) можно получить соединение (10). Для такой процедуры удаления защиты можно выбрать реагенты и условия в зависимости от защитной группы.
Можно получить соединение (2) путем дериватизации карбоновой кислоты (11) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и взаимодействия этого соединения с полученным соединением (10). Реакционные условия, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между карбоновой кислотой (11) и соединением (10), можно соответствующим образом выбрать и использовать из тех, которые описаны для синтеза соединения (6).
[0142]
Соединение (9) также можно получить, например, следующим способом.
Соединение (13) можно получить путем дериватизации карбоновой кислоты пептида (8) с N концом, защищенным группой P2, в активный сложный эфир, смешанный ангидрид кислоты или т.п. и взаимодействия этого соединения в присутствии основания аминовым соединением (12), содержащем карбокси группу, защищенную группой P3. Реакционные условия, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между карбоновой кислотой пептида (8) и соединением (12), можно соответствующим образом выбрать и использовать из тех, которые описаны для синтеза соединения (6).
Защитная группа P2 для амино группы соединения (13) может быть защищена защитной группой, которую традиционно используют.
В частности, примеры защитной группы для гидроксильной группы включают алкоксиметильную группу, такую как метоксиметильная группа; арилметильную группу, такую как бензильная группа, 4-метоксибензильная группа и трифенилметильная группа; алканоильную группу, такую как ацетильная группа; ароильную группу, такую как бензоильная группа; и силильную группу, такую как трет-бутилдифенилсилильная группа. Карбокси группа может быть защищена, например, в виде сложного эфира алкильной группой, такой как метильная группа, этильная группа и трет-бутильная группа, аллильной группой или арилметильной группой, такой как бензильная группа. Примеры защитной группы для амино группы включают, например, алкилоксикарбонильную группу, такую как трет-бутилоксикарбонильная группа, метоксикарбонильная группа и этоксикарбонильная группа; аллилоксикарбонильную группу или арилметоксикарбонильную группу, такую как 9-флуоренилметилоксикарбонильная группа, бензилоксикарбонильная группа, параметоксибензилоксикарбонильная группа и пара (или орто)нитроyбензилоксикарбонильная группа; алканоильную группу, такую как ацетильная группа; арилметильную группу, такую как бензильная группа и трифенилметильная группа; ароильную группу, такую как бензоильная группа; и арилсульфонильную группу, такую как 2,4-динитробензолсульфонильная группа или ортонитробензолсульфонильная группа.
Что касается защитной группы P3 для карбокси группы, можно использовать защитную группу, традиционно используемую в качестве защитной группы для карбокси группы в химии органического синтеза, в частности, синтеза пептидов. Конкретные примеры включают сложные эфиры с алкильной группой, такой как метильная группа, этильная группа или трет-бутильная группа, аллиловые сложные эфиры и бензиловые сложные эфиры, и защитную группу можно соответствующим образом выбрать из описанных выше защитных групп. В таком случае, предпочтительно, чтобы защитная группа для амино группы и защитная группа для карбокси группы были такими, которые предпочтительно удаляют разным способом или в разных условиях. Например, репрезентативный пример включает комбинацию, в которой P2 представляет собой трет-бутилоксикарбонильную группу, и P3 представляет собой бензильную группу. Защитные группы можно выбрать из указанных выше групп в зависимости от, например, свойств соединения, содержащего амино группу и карбокси группу, подлежащие защите. Для удаления защитных групп реагенты и условия можно выбрать в зависимости от защитной группы.
Путем удаления защитной группы P3 для карбокси группы полученного соединения (13) можно получить соединение (14). Для такой процедуры удаления защиты реагенты и условия выбирают в зависимости от защитной группы.
Соединение (9) можно получить путем дериватизации полученного соединения (14) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и взаимодействия с соединением (4) в присутствии основания. Для этой реакции также можно использовать реагенты и условия реакции, которые, как правило, используют для синтеза пептидов, и реакционные условия, реагенты, основание и инертный растворитель, используемые для этой реакции, можно соответствующим образом выбрать из тех, которые описаны для синтеза соединения (6).
[0143]
Соединение (2) также можно получить, например, следующим способом.
Путем удаления защитной группы P2 для амино группы соединения (13) можно получить соединение (15). Для такой процедуры удаления защиты можно выбрать реагенты и условия в зависимости от защитной группы.
Соединение (16) можно получить путем дериватизации карбоновокислотного производного (11) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и взаимодействия этого соединения с полученным соединением (15) в присутствии основания. Реакционные условия, реагенты, основание и инертный растворитель, используемые для образования амидной связи между карбоновой кислотой пептида (11) и соединением (15), можно соответствующим образом выбрать из тех, которые описаны для синтеза соединения (6).
Путем удаления защитной группы для карбокси группы полученного соединения (16) можно получить соединение (17). Эту процедуру удаления защиты можно осуществить подобно удалению защиты карбокси группы для получения соединения (14).
Соединение (2) можно получить путем дериватизации соединения (17) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и взаимодействия этого соединения с соединением (4) в присутствии основания. Для этой реакции также можно использовать реагенты и условия реакции, которые, как правило, используют для синтеза пептидов, и реакционные условия, реагенты, основание и инертный растворитель, используемые для этой реакции, можно соответствующим образом выбрать из тех, которые описаны для синтеза соединения (6).
[0144]
3. Способ получения 3
Соединение, представленное формулой (2) промежуточного соединения, также можно получить следующим способом.
[0145]
[Формула 23]
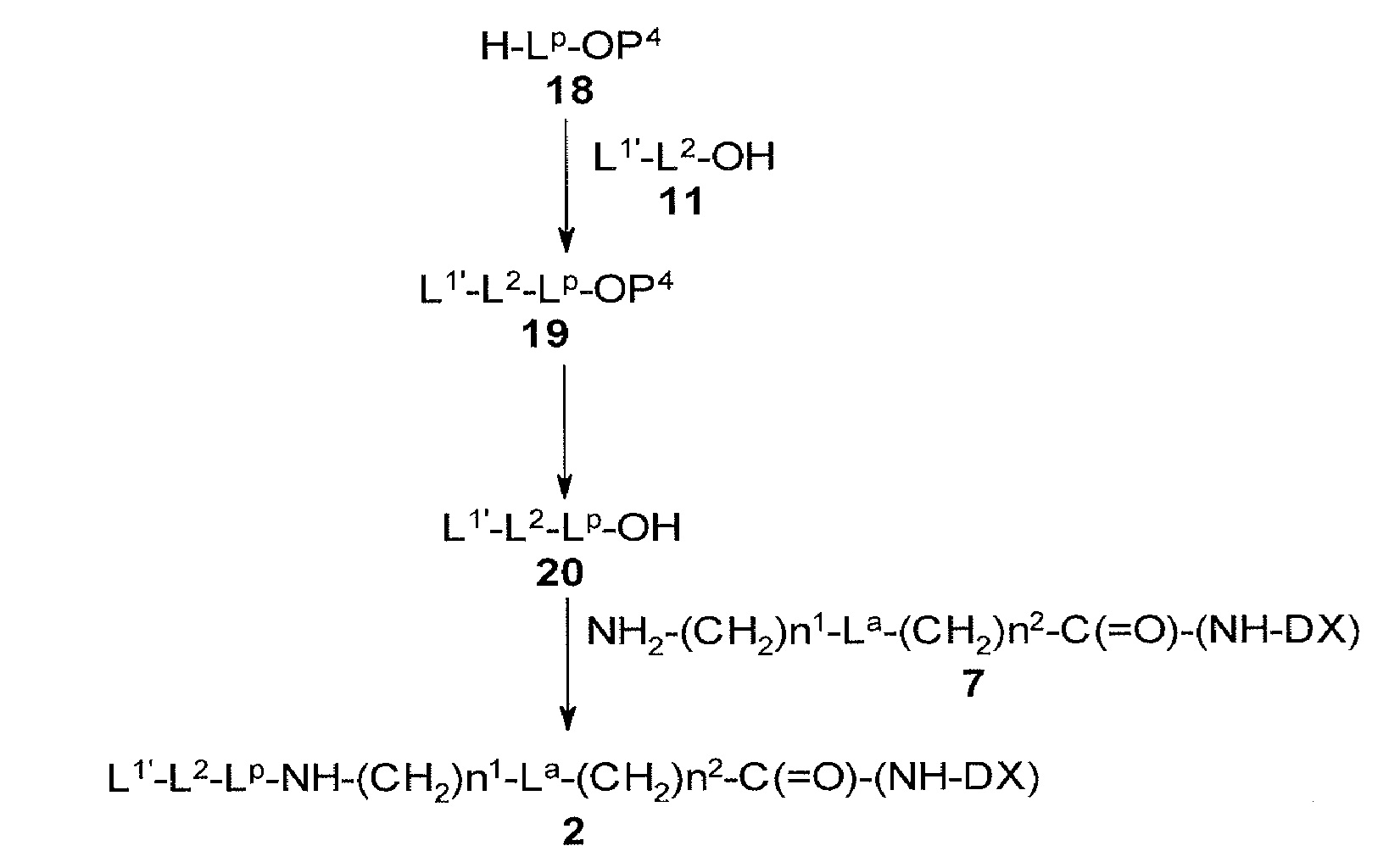
[0146]
В формуле, L1' соответствует L1, имеющему структуру, в которой концевая группа преобразована в малеимидильную группу, и P4 представляет собой защитную группу.
[0147]
Соединение (19) можно получить путем дериватизации соединения (11) в активный сложный эфир, смешанный ангидрид кислоты или т.п. и взаимодействия этого соединения в присутствии основания с карбоновой кислотой пептида (18) с C концом, защищенным группой P4. Реакционные условия, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между карбоновой кислотой пептида (18) и соединением (11), можно соответствующим образом выбрать из тех, которые описаны для синтеза соединения (6). Защитную группу P4 для карбокси группы соединения (18) можно соответствующим образом выбрать из защитных групп, описанных выше.
Путем удаления защитной группы для карбокси группы полученного соединения (19) можно получить соединение (20). Эту процедуру удаления защиты можно осуществить подобно удалению защиты карбокси группы для получения соединения (14).
Соединение (2) можно получить путем дериватизации полученного соединения (20) в активный сложный эфир, смешанный ангидрид кислоты или т.п. и взаимодействия этого соединения с соединением (7). Для этой реакции также можно использовать реагенты и условия реакции, которые, как правило, используют для синтеза пептидов, и реакционные условия, реагенты, основание и инертный растворитель, используемые для этой реакции, можно соответствующим образом выбрать из тех, которые описаны для синтеза соединения (6).
[0148]
4. Способ получения 4
Ниже подробно описан способ получения соединения (10b), которое имеет n1=1, La=O в промежуточном соединении (10), описанном в Способе получения 2. Соединение, представленное формулой (10b), его соль или сольват можно получить, например, в соответствии со следующим способом.
[0149]
[Формула 24]
[0150]
В формуле, LP имеет значение, определенное выше, L представляет собой ацильную группу, которая представляет собой алканоильную группу, такую как ацетильная группа, или ароильную группу, такую как бензоильная группа, атом водорода или т.п., X и Y каждый представляют собой олигопептид, состоящий из 1-3 аминокислот, P5 и P7 каждый представляет собой защитную группу для амино группы, и P6 представляет собой защитную группу для карбокси группы.
[0151]
Соединение, представленное формулой (21), можно получить с использованием или с применением способа, описанного в Японской выложенной патентной заявке № 2002-60351 или в литературе (J. Org. Chem., Vol. 51, page 3196, 1986), и осуществляя процедуры удаления защитных групп или модификации функциональных групп, если необходимо. Альтернативно, его также можно получить путем обработки аминокислоты с защищенной концевой амино группой или амида кислоты олигопептида с защищенной амино группой альдегидом или кетоном.
Путем взаимодействия соединения (21) с соединением (22), содержащем гидроксильную группу, при температуре в пределах от низкотемпературных условий охлаждения до комнатной температуры в инертном растворителе в присутствии кислоты или основания можно получить соединение (23).
Примеры кислоты, которую можно использовать, могут включать неорганическую кислоту, так как фтористоводородная кислота, хлористый водород, серная кислота, азотная кислота, фосфорная кислота и борная кислота; органическую кислоту, такую как уксусная кислота, лимонная кислота, паратолуолсульфоновая кислота и метансульфоновая кислота; и кислоту Льюиса, такую как тетрафторборат, хлорид цинка, хлоридолова, хлорид алюминия и хлорид железа. Из них, сульфоновые кислоты являются предпочтительными, в частности, паратолуолсульфоновая кислота. Что касается основания, любое из указанных выше оснований можно соответствующим образом выбрать и использовать. Предпочтительные примеры таких оснований включают алкоксид щелочного металла, такой как трет-бутоксид калия; гидроксид щелочного металла, такой как гидроксид натрия и гидроксид калия; гидрид щелочного металла, такой как гидрид натрия и гидрид калия; металлоорганическое основание, представленное диалкиламинолитием, такое как диизопропиламид лития; и металлоорганическое основание биссилиламина, такое как бис(триметилсилил)амид лития. Примеры растворителя, который можно использовать для этой реакции, включают эфирный растворитель, такой как тетрагидрофуран и 1,4-диоксан; и ароматический углеводородный растворитель, такой как бензол и толуол. Эти растворители можно получить в виде смеси с водой. Кроме того, защитная группа для амино группы, представленная как P5, конкретно не ограничивается, при условии, что она представляет собой группу, традиционно используемую для защиты амино группы. Репрезентативные примеры включают защитные группы для амино группы, которые описаны в Способе получения 2. Однако в данной реакции может быть случай, когда защитная группа для амино группы, представленная как P5, отщепляется. В таком случае, необходимо осуществить взаимодействие с подходящим реагентом для защиты амино группы, если это может потребоваться, с введением защитной группы снова.
Соединение (24) можно получить путем удаления защитной группы P6 соединения (23). Здесь, репрезентативные примеры защитной группы для карбокси группы, представленной как P6, описаны в Способе получения 2, и из них можно выбрать подходящую группу. В соединении (23) желательно, чтобы защитная группа P5 для амино группы и защитная группа P6 для карбокси группы были такими, которые удаляют разным способом или в разных условиях. Например, репрезентативный пример включает комбинацию, в которой P5 представляет собой 9-флуоренилметилоксикарбонильную группу, и P6 представляет собой бензильную группу. Защитные группы можно выбрать в зависимости от, например, свойств соединения, содержащего амино группу и карбокси группу, подлежащие защите. Для удаления защитных групп выбирают реагенты и условия в зависимости от защитной группы.
Соединение (26) можно получить путем дериватизации карбоновой кислоты (24) в активный сложный эфир, смешанный ангидрид кислоты, галогенангидрид кислоты или т.п. и взаимодействия этого соединения с соединением (4) или его фармакологически приемлемой солью с получением соединения (25), с последующим удалением защитной группы P5 полученного соединения (25). Для этой реакции между соединением (4) и карбоновой кислотой (24) и реакции удаления защитной группы P6 можно использовать те же реагенты и реакционные условия, которые описаны для Способа получения 2.
Соединение (10b) можно получить путем взаимодействия соединения (26) с аминокислотой, содержащей защищенную концевую амино группу, или олигопептидом (27), содержащим защищенную амино группу, с получением соединения (9b) и удаления защитной группы P7 полученного соединения (9b). Защитная группа для амино группы, представленная как P7, конкретно не ограничивается, при условии, что ее, как правило, используют для защиты амино группы. Репрезентативные примеры включают защитные группы для амино группы, которые описаны в Способе получения 2. Для удаления защитной группы реагенты и условия выбирают в зависимости от защитной группы. Для этой реакции между соединением (26) и соединением (27) можно использовать реагенты и условия реакции, которые традиционно используют для синтеза пептидов. Соединение (10b), полученное указанным выше способом, можно преобразовать в соединение (1) по настоящему изобретению в соответствии со способом, описанным выше.
[0152]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению, когда его оставляют на воздухе или перекристаллизовывают, например, для очистки, может абсорбировать влагу и содержать адсорбированную воду или превращаться в гидрат, и такое соединение и соль, содержащая воду, также включены в настоящее изобретение.
Соединение, меченное различными радиоактивными или не-радиоактивными изотопами, также включено в настоящее изобретение. Один или несколько атомов, содержащихся в конъюгате антитело-лекарственное средство по настоящему изобретению, могут содержать атомный изотоп в не существующем в природе отношении. Примеры атомного изотопа включают дейтерий (2H), тритий (3H), иод-125 (125I) и углерод-14 (14C). Кроме того, соединение по настоящему изобретению может быть мечено радиоактивным изотопом, таким как тритий (3H), иод-125 (125I), углерод-14 (14C), медь-64 (64Cu), цирконий-89 (89Zr), иод-124 (124I), фтор-18 (18F), индий-111 (111I), углерод-11 (11C) и иод-131 (131I). Соединение, меченное радиоактивным изотопом, является полезным в качестве терапевтического или профилактического средства, реагента для исследований, такого как реагент для анализа, и средства для диагностики, такого как in vivo диагностического визуализирующего агента. Не будучи связанным с радиоактивностью, любой изотопный вариант конъюгата антитело-лекарственное средство по настоящему изобретению охватывается объемом настоящего изобретения.
[0153]
[Лекарственные средства]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению демонстрирует цитотоксическую активность против раковых клеток, и, таким образом, его можно использовать в качестве лекарственного средства, особенно в качестве терапевтического средства и/или профилактического средства от рака.
А именно, конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению можно селективно использовать в качестве лекарственного средства для химиотерапии, которая представляет собой основной способ для лечения рака, и, как результат, можно отсрочить развитие раковых клеток, ингибировать их рост и затем убивать раковые клетки. Это может обеспечить для раковых пациентов возможность не иметь симптомы, вызываемые раком, или достижения улучшения QOL раковых пациентов и достижения терапевтического эффекта, поддерживая жизнь раковых пациентов. Даже если конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению не осуществляет уничтожение раковых клеток, он способен достигать более высокого QOL раковых пациентов с достижением их более долгого периода выживания, путем ингибирования или контроля роста раковых клеток.
В такой лекарственной терапии его можно использовать в качестве лекарственного средства отдельно, а также лекарственного средства в комбинации с дополнительной терапией в адъювантной терапии, и можно использовать в сочетании с хирургической операцией, лучевой терапией, гормональной терапией или т.п. Кроме того, его также можно использовать в качестве лекарственного средства для лекарственной терапии в неоадъювантной терапии.
Помимо терапевтического применения, описанного выше, эффект подавления роста минорного количества метастатических раковых клеток и затем их уничтожения путем связывания с этими раковыми клетками также можно ожидать благодаря свойству связывания антитела с антигеном. В частности, когда экспрессию TROP2 подтверждают в первичных раковых клетках, можно ожидать ингибирования раковых метастазов или профилактический эффект при введении конъюгата анти-TROP2 антитело-лекарственное средство по настоящему изобретению. Например, можно ожидать эффекта ингибирования и уничтожения раковых клеткок в жидкости организма при образовании метастазов или эффекта, например, ингибирования и уничтожения минорных количеств раковых клеток сразу после имплантации в любой ткани. Кроме того, можно ожидать ингибирования раковых метастазов или профилактического эффекта, в частности, после хирургического удаления рака. Соответственно, можно ожидать эффекта ингибирования раковых метастазов.
Можно ожидать, что конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению будет проявлять терапевтический эффект путем при введении пациентам в качестве системной терапии и дополнительно путем местного введения в раковые ткани.
[0154]
Примеры типа рака, для которого применяют конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению, включают рак легкого, рак почки, уротелиальный рак, колоректальный рак, рак предстательной железы, мультиформную глиобластому, рак яичников, панкреатический рак, рак молочной железы, меланому, рак печени, рак мочевого пузыря, гастральный рак, цервикальный рак, рак головы и шеи или эзофагеальный рак, однако, не ограничиваются этим, при условии, что он представляет собой раковую клетку, экспрессирующую, в раковой клетке как субъекте лечения, белок, который антитело, присутствующее в конъюгате антитело-лекарственное средство, может распознавать.
[0155]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению предпочтительно можно вводить млекопитающему, но более предпочтительно его вводят человеку.
[0156]
Вещества, используемые в фармацевтической композиции, содержащей конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению, можно соответствующим образом выбрать и использовать из добавок для формулирования композиций или т.п., которые, как правило, используют в данной области техники, с учетом дозы или используемой для введения концентрации.
[0157]
Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению можно вводить в виде фармацевтической композиции, содержащей по меньшей мере один фармацевтически подходящий ингредиент. Например, указанная выше фармацевтическая композиция типично содержит по меньшей мере один фармацевтический носитель (например, стерилизованную жидкость). Здесь, жидкость включает, например, воду и масло (минеральное масло и масло животного происхождения, растительного происхождения или синтетического происхождения). Масло может представлять собой, например, арахисовое масло, соевое масло, минеральное масло или кунжутное масло. Вода является более типичным носителем, когда фармацевтическую композицию, указанную выше, вводят внутривенно. Физиологический солевой раствор, водный раствор декстрозы и водный раствор глицерина также можно использовать в качестве жидкого носителя, в частности, в растворе для инъекций. Подходящий фармацевтический носитель известен в данной области техники. Если желательно, композиция, указанная выше, также может содержать следовые количества увлажнителя, эмульгатора или pH буферного агента. Примеры подходящего фармацевтического носителя раскрыты в "Remington's Pharmacetical Sciences" by E. W. Martin. Композиции соответствуют способу введения.
[0158]
Известны различные системы доставки, и их можно использовать для введения конъюгата анти-TROP2 антитело-лекарственное средство по настоящему изобретению. Примеры пути введения включают внутрикожный, внутримышечный, интраперитонеальный, внутривенный и подкожный пути, но не ограничиваются этим. Введение можно осуществить путем инъекции или болюсной инъекции, например. В соответствии со специальным предпочтительным вариантом воплощения, введение конъюгата антитело-лекарственное средство осуществляют путем введения инъекции. Парентеральное введение является предпочтительным путем введения.
[0159]
В соответствии с репрезентативным вариантом воплощения, фармацевтическая композиция предназначена в качестве фармацевтической композиции, подходящей для внутривенного введения человеку в соответствии с традиционными процедурами. Композиция для внутривенного введения типично представляет собой раствор в стерильном и изотоническом водном буферном растворе. Если необходимо, лекарственное средство может содержать солюбилизирующее вещество и местные анестетики для облегчения боли в месте инъекции (например, лигнокаин). Как правило, ингредиент, указанный выше, обеспечивают индивидуально либо в виде лиофилизированного порошка либо безводного концентрата, содержащегося в контейнере, который получают в виде герметично закрытой ампулы или саше, содержащих определенное количество активного вещества, или в виде смеси в стандартной лекарственной форме. Когда лекарственное средство находится в форме для введения путем инъекции, его можно вводить из флакона с инъекционным раствором, который содержит стерильную воду или солевой раствор фармацевтической степени чистоты. Когда лекарственное средство вводят путем инъекции, можно обеспечить ампулу со стерильной водой или солевым раствором для инъекций, чтобы указанные выше ингредиенты смешивать друг с другом перед введением.
[0160]
Фармацевтическая композиция по настоящему изобретению может представлять собой фармацевтическую композицию, содержащую только конъюгат анти-TROP2 антитело-лекарственное средство, раскрытый в настоящей заявке, или фармацевтическую композицию, содержащую конъюгат анти-TROP2 антитело-лекарственное средство и по меньшей мере одно средство для лечения рака, помимо конъюгата. Конъюгат анти-TROP2 антитело-лекарственное средство по настоящему изобретению можно вводить с другим средством для лечения рака. Противораковый эффект может соответственно усиливаться. Другое противораковое средство, используемое для этих целей, можно вводить субъекту одновременно с конъюгатом антитело-лекарственное средство, отдельно от него или после его введения, и введение можно осуществлять, варьируя интервал между введениями для каждого. Примеры средства для лечения рака включают абраксан, паклитаксел, цисплатин, гемцитабин, иринотекан (CPT-11), паклитаксел, преметрексед, сорафениб, винорелбин, лекарственные средства, описанные в Международной публикации № WO 2003/038043, LH-RH аналоги (лейпрорелин, гозерелин или т.п.), эстрамустин фосфат, антагонист эстрогена (тамоксифен, ралоксифен или т.п.) и ингибитор ароматазы (анастрозол, летрозол, эместен или т.п.), но этим не ограничиваются, при условии, что это лекарственное средство, которое обладает противоопухолевой активностью.
[0161]
Фармацевтическую композицию можно сформулировать в виде лиофилизированного препарата или жидкого препарата, в виде препарата, содержащего желаемую композицию и имеющего требуемую чистоту. Когда композиция сформулирована в виде лиофилизированного препарата, это может быть препарат, содержащий подходящие для формулирования добавки, которые используют в данной области. Также, что касается жидкой композиции, ее можно сформулировать в виде жидкого препарата, содержащего различные добавки для формулирования, которые используют в данной области.
[0162]
Композиция и концентрация фармацевтической композиции могут варьироваться в зависимости от способа введения. Однако конъюгат анти-TROP2 антитело-лекарственное средство, содержащийся в фармацевтической композиции по настоящему изобретению, может проявлять фармацевтический эффект даже при низкой дозе, когда конъюгат антитело-лекарственное средство имеет более высокую аффинность к антигену, то есть более высокую аффинность (= более низкое Kd значение), выраженную как константа диссоциации (то есть Kd значение) для антигена. Таким образом, что касается определения дозы конъюгата антитело-лекарственное средство, дозу можно определить в свете ситуации, касающейся аффинности между конъюгатом антитело-лекарственное средство и антигеном. Когда конъюгат антитело-лекарственное средство по настоящему изобретению вводят человеку, например, около 0,001-100 мг/кг можно вводить один раз или вводить несколько раз с интервалом один раз в течение 1-180 дней.
Примеры
[0163]
Настоящее изобретение более конкретно описывается в свете примеров, представленных ниже. Однако настоящее изобретение не ограничивается ими. Кроме того, это ни в коем случае нельзя рассматривать как ограничение. Кроме того, если специально не указано иное, реагент, растворитель и исходное вещество, описанные в описании изобретения, легко можно получить от коммерческого поставщика.
[0164]
[Пример 1: Иммунизация мыши и получение гибридомы]
1-1) Получение клетки для использования в иммунизации мыши
5×106 NCI-H322 клеток (клеточная линия немелкоклеточного рака легкого человека, ATCC CRL-5806; ATCC: American Type Culture Collection) культивировали в RPMI-1640 (Roswell Park Memorial Institute-1640) среде (10 мл) в течение 5 дней, затем извлекали, промывали при помощи PBS (фосфат-буферный солевой раствор) два раза и ресуспендировали в PBS (500 мкл).
[0165]
1-2) Иммунизация мыши
Для первой иммунизации каждую BALB/c мышь (6-недельного возраста) интраперитонеально иммунизировали NCI-H322 клетками (1×107 клеток). Для второй-пятой иммунизаций мышь интраперитонеально иммунизировали с использованием 1×106 NCI-H322 клеток с 1-недельными интервалами. Для шестой (конечной) иммунизации мышь иммунизировали через хвостовую вену и интраперитонеально NCI-H322 клетками при 1×106 клеток/200 мкл PBS для каждого пути. Клетки селезенки выделяли через 3 дня после конечной иммунизации.
[0166]
1-3) Получение клеток селезенки иммунизированной мыши
Селезенку иммунизированной мыши вырезали, затем измельчали и суспендировали в RPMI 1640 10% FBS (фетальная бычья сыворотка)(+) среде. Клеточную суспензию пропускали через клеточный фильтр (100 мкм, BD Falcon) и затем центрифугировали при 1500 об/мин при комнатной температуре в течение 5 минут и супернатант сливали. Трис-NH4Cl раствор (20 мМ Трис-HCl pH 7,5, 0,83% NH4Cl; 10 мл) добавляли к остатку, с последующей обработкой при комнатной температуре в течение 5 минут. RPMI 1640 FBS(+) среду (10 мл) добавляли к клеточной суспензии и смесь пропускали через клеточный фильтр и затем центрифугировали при 1500 об/мин при комнатной температуре в течение 5 минут. Супернатант сливали и клетки селезенки ресуспендировали в RPMI 1640 FBS(-) среде (10 мл).
[0167]
1-4) Получение миеломных клеток
P3U1 клетки (клеточная линия миеломы мыши) извлекали и центрифугировали при 1500 об/мин при комнатной температуре в течение 5 минут. EDTA (0,02%) раствор (10 мл) добавляли к P3U1 клеткам, с последующей обработкой при 37°C в течение 5 минут. Суспензию P3U1 клеток центрифугировали при 1500 об/мин при комнатной температуре в течение 5 минут. Супернатант сливали и ресуспендировали в RPMI 1640 FBS(-) среде (10 мл).
[0168]
1-5) Клеточное слияние
Клетки селезенки и клетки миелома смешивали при соотношении 5:1 и центрифугировали (1200 об/мин, 5 минут). Полученные клетки в осажденной фракции хорошо отделялись друг от друга, и затем постепенно добавляли полиэтиленгликоль-4000 (PEG-4000; 1 мл) в течение примерно 1 минуты при перемешивании. Затем RPMI среду (1 мл) добавляли к жидкости, содержащей клетки, несколько раз с интервалом 1 минута и затем добавляли RPMI среду для доведения общего количества до 50 мл. Клеточную суспензию центрифугировали (900 об/мин, 5 минут), и полученные клетки в осажденной фракции слегка отделялись друг от друга, и затем их осторожно суспендировали в HAT среде (PRMI 1640 среда, дополненная 10% фетальной бычьей сывороткой и HAT добавкой к среде; 100 мл). Суспензию переносили при 200 мкл/лунка в 96-луночный планшет для культур и культивировали до 50% конфлюентности в 5% CO2 инкубаторе при 37°C.
[0169]
1-6) Скрининг гибридомы с использованием варианта аденовируса FZ33
NCI-H322 клетки высевали при 5×103 клеток/лунка в 96-луночный планшет и культивировали при 37°C в течение 48 часов. Клетки промывали при помощи PBS 150 мкл/лунка два раза и культуральный супернатант каждой гибридомы (50 мкл) добавляли в каждую лунку и осуществляли взаимодействие при 4°C в течение 1 часа. Клетки промывали при помощи PBS 150 мкл/лунка два раза. Аденовирус Ax3CAZ3-FZ33 (β-галактозидаза-экспрессирующий аденовирус, модифицированный Z33 волокном, чтобы связываться с антителом (см. публикацию патентной заявки США № 2012/0237518)), разбавляли RPMI1640(-) средой до концентрации 3×106 вирусных частиц/100 мкл (1×103 вирусных частиц/клетка) и этот разбавленный раствор добавляли в каждую лунку при 100 мкл/лунка. После взаимодействия при 4°C в течение 1 часа клетки промывали при помощи PBS 150 мкл/лунка два раза. Добавляли RPMI1640 FBS(+) среду при 100 мкл/лунка и клетки культивировали при 37°C в течение 24 часов. NCI-H322 клетки, обработанные образцом для анализа, содержащим β-Gal репортерный ген, с использованием Galacto-Light Plus Reporter Gene Assay System (Applied Biosystems, Inc.), промывали при помощи PBS 200 мкл/лунка. Добавляли лизисный раствор при 50 мкл/лунка и смесь оставляли при комнатной температуре в течение 10 минут. Этот клеточный лизат (10 мкл) разбавляли 100-кратно при помощи Galacton-Plus Galacto Reaction Buffer Diluent, затем добавляли в White microwell SH 96-луночный планшет (Nunc/Thermo Fisher Scientific, Inc.) и осуществляли взаимодействие при комнатной температуре в течение 1 часа. Добавляли акселератор II при 150 мкл/лунка. Хемилюминесценцию измеряли в течение 5 секунд с использованием лабораторного счетчика Wallac 1420 ARVOsx (PerkinElmer, Inc.) и инфекционную дозу вируса в NCI-H322 клетках указывали в виде среднего значения в секунду как RLU (количество люминесценции). В скрининге гибридомной группы, осуществляемом таким образом, клон, измеренное значение (RLU) которого было 5000 RLU или больше, выбирали из всей группы (минимум: 1383 RLU, среднее: 10914 RLU, максимум: 78746 RLU). Сначала, в качестве первичного скрининга, 81 положительных лунок выбирали из 960 гибридомных лунок, полученных путем одноклеточного слияния. В качестве валидационного скрининга, анализ затем осуществляли в двух повторах с использованием такого же подхода, как в первичном скрининге. Когда лунку, показавшую измеренное значение 5000 RLU или выше в обоих испытаниях, считали как положительную, 52 положительные лунки выбирали из 81 лунок, полученных в первичном скрининге. Выбранные клоны субклонировали от 2 до 4 раз для установления 44 моноклональных гибридомных клеточных линий.
[0170]
[Пример 2: Очистка антитела из гибридомы]
Пристан (2,6,10,14-тетраметилпентадекан; 0,5 мл) интраперитонеально вводили заранее каждой мыши 8-10-недельного возраста или «голой» мыши, которую затем выращивали в течение 2 недель. Каждую моноклональное антитело-продуцирующую гибридому, полученную в Примере 1, интраперитонеально вводили путем инъекции мыши. Через 10-21 дней гибридоме давали возможность вызывать развитие асцитной опухоли и асциты затем собирали. Полученные асциты центрифугировали для удаления твердых частиц. Затем антитела очищали путем высаливания с использованием 40-50% раствора сульфата аммония, способа осаждения каприловой кислотой, колонки с DEAE-Сефарозой и колонки с G-белком и IgG или IgM фракции собирали и использовали как очищенные моноклональные антитела.
[0171]
[Пример 3: Идентификация антигена, с которым связывается антитело, продуцируемое гибридомой]
Антиген идентифицировали на TINA1 - антитело, продуцируемое гибридомой, полученное в Примере 2.
[0172]
3-1) Иммунопреципитация биотин-меченного клеточно-поверхностного белка с использованием TINA1 антитела
5×106 NCI-H322 клеток выделяли и промывали при помощи PBS три раза. EZ-Link Сульфо-NHS-Биотин (Pierce/Thermo Fisher Scientific, Inc.) суспендировали в PBS при концентрации 0,1 мг/мл. NCI-H322 клетки подвергали вращению при комнатной температуре в течение 30 минут в биотин/PBS растворе, затем промывали раствором 100 мМ глицин/PBS (25 мл) два раза и затем промывали при помощи PBS (25 мл) три раза. Клетки, промытые таким образом, ресуспендировали в лизисном буфере (150 мМ NaCl, 50 мМ Трис-HCl pH 7,6, 1% NP-40+ингибитор протеазы, 1 таблетка/50 мл Complete без EDTA (Hoffmann-La Roche Ltd.); 2 мл) и обрабатывали при 4°C в течение 30 минут. Белок G-Сефароза/лизисный буфер (50% суспензия; 30 мкл), полученный путем замены буфера Белка G-Сефарозы (Protein G Sepharose 4 Fast Flow (GE Healthcare Japan Corporation)) лизисным буфером, добавляли к клеточному лизату и смесь вращали при 4°C в течение 1 часа и затем центрифугировали при 4°C в течение 5 минут для выделения супернатанта. TINA1 антитело (3 мкг) добавляли к супернатанту и смесь вращали при 4°C в течение 1 часа. Затем добавляли Белок G-Сефароза/лизисный буфер (50% суспензия; 60 мкл) и смесь вращали при 4°C в течение 2 часов. Белок G-Сефарозу промывали лизисным буфером (1 мл) шесть раз и затем ресуспендировали в 1×SDS буфер для образца/5% 2-ME (2-меркаптоэтанол) буфере (62,5 мМ Трис-HCl (pH 6,8 при 25°C), 2% (масс/об) SDS, 10% глицерина и 0,01% (масс/об) фенолового красного). Суспензию обрабатывали при 100°C в течение 5 минут и раствор затем извлекали и использовали в качестве образца для SDS-PAGE (электрофорез на полиакриламидном геле).
[0173]
3-2) SDS-PAGE и Вестерн-блоттинг
SDS-PAGE образец, полученный в 3-1), подвергали электрофорезу при 20 мА с использованием Ready Gels J 5-20% (Bio-Rad Laboratories, Inc.) и затем переносили промоканием при 0,1 мА/см2 из геля на мембрану. Мембрану промывали при помощи PBS-T (PBS(-)-0,05% Tween 20) в течение 5 минут и затем блокировали в течение 1 часа. Мембрану промывали при помощи PBS-T в течение 5 минут три раза и затем осуществляли взаимодействие с конъюгатом Стрептавидин-пероксидаза хрена (Amersham Biosciences Corp.; разбавленный 2000-кратно при помощи PBS-T для использования) в течение 1 часа. Мембрану промывали при помощи PBS-T в течение 10 минут четыре раза и целевую полосу затем определяли с использованием ECL реагентов для детекции вестерн-блоттингом (Amersham Biosciences Corp.) и Hyperfilm ECL (Amersham Biosciences Corp.). NCI-H322 клетки, меченные биотином с использованием процедур Примера 3-1), подвергали иммунопреципитации с использованием KCI7A3 антитела, антиген которого уже был обнаружен как представляющий собой TROP2 методом масс-спектрометрии, или TINA1 антитела и полученные иммуноосажденные продукты анализировали при помощи SDS-PAGE и Вестерн-блоттинга в присутствии или в отсутствие DTT. В любом случае использования KCI7A3 антитела или TINA1 антитела, полосу определяли при молекулярной массе 46 кДа в отсутствие DTT, и полосу определяли при молекулярной массе 37 кДа в образцах, дополненных DTT.
[0174]
3-3) FACS анализ
Поскольку было предсказано, что антиген TINA1 антитела представляет собой TROP2, на основании характерной полосы, анализ гиперэкспрессии способом переноса генов осуществляли без масс-спектрометрии. Как результат FACS анализа, TINA1 антитело продемонстрировало сильный положительный ответ в CHOK1 клетках, экспрессирующих человеческий TROP2, указывая на то, что антигеном TINA1 антитела является TROP2. Подобный FACS анализ осуществляли с использованием клеточной линии рака легкого PC14, клеточной линии рака легкого NCI-H322, клеточной линии рака легкого NCI-H2122, клеточной линии рака легкого LCAM1, клеточной линии рака легкого LC2/ad, панкреатической раковой клеточной линии MIAPaCa2, панкреатической раковой клеточной линии PK-1, клеточной линии рака предстательной железы PC3, колоректальной раковой клеточной линии HCT116, клеточной линии меланомы A375, клеточной линии рака яичников SKOV3, гематопоэтической опухолевой клеточной линии RPMI8226, гематопоэтической опухолевой клеточной линии K562, PBMC (мононуклеарные клетки периферической крови человека) и человеческих тромбоцитов. Все исследованные клеточные линии рака легкого были TROP2-положительными, и PC3, PK1 и SKOV3 были положительными в качестве клеточных линий, за исключением клеточных линий рака легкого. С другой стороны, все из нормальных клеток крови были отрицательными.
[0175]
[Пример 4: Измерение активности интернализации антител]
4-1) Система оценки активности интернализации антител
Рекомбинантный гибридный белок DT3C получали для измерения активности интернализации и иммунотоксической активности антитела. Этот DT3C представляет собой белок, содержащий каталитический домен дифтерийного токсина (DT) и три антитело-связывающие области белка G. DT3C специфически связывается с Fc фрагментом антитела, является стабильным и индуцирует гибель клеток путем ингибирования синтеза белка при поглощении в клетках. С использованием этой системы эффект интернализации антитела и его убивающий клетки эффект посредством иммунотоксина можно наблюдать одновременно (Yamaguchi, M., Hamada, H., et al., Biochemical and Biophysical Research Communications 454 (2014) 600-603).
[0176]
4-2) Оценка активности интернализации и активности иммунотоксина с использованием DT3C
4 мкг/мл DT3C добавляли при 25 мкл/лунка в 96-луночный планшет, затем культуральные супернатанты 11 гибридом, полученных способом Примера 1 или эквивалетным способом, каждый добавляли при 25 мкл/лунка в планшет и планшет инкубировали при комнатной температуре в течение 30 минут. Антигены, распознаваемые антителами, продуцируемыми гибридомами, отличными от TINA1 антитело-продуцирующей гибридомы, были заранее подтверждены как представляющие собой CD9, CD46, CD55, CD59, CD71, CD73, CD147, CD276, EpCAM или EGFR. 2×104 клеток/мл (RPMI1640 среда, дополненная FBS с низкой концентрацией IgG 20%) NCI-H322 клеток высевали при 50 мкл/лунка. После инкубации при комнатной температуре в течение 30 минут клетки культивировали в течение 3 дней в CO2 инкубаторе при 37°C. После культивирования супернатант удаляли и в планшет добавляли 10% WST-10%FBS-RPMI1640 при 100 мкл/лунка. После инкубации в течение 1 часа в CO2 инкубаторе при 37°C количество жизнеспособных клеток измеряли с использованием считывающего устройства для микропланшетов (OD450-OD640, infinite 200, Tecan Trading AG). Из культуральных супернатантов оцениваемых гибридомных клеток, антитела против CD59, CD71, EGFR, EpCAM или TROP2, как было подтверждено, обладают сильной активностью интернализации и активностью иммунотоксина (Фиг. 10).
[0177]
4-3) Разница в активности интернализации и активности иммунотоксина между антителами против CD59, CD71, EGFR, EpCAM или TROP2
Каждый разбавленный раствор DT3C (0, 0,004, 0,04, 0,4, 4 или 40 мкг/мл) добавляли при 25 мкл/лунка в 96-луночный планшет, затем каждое антитело (40 мкг/мл) добавляли при 25 мкл/лунка в планшет и планшет инкубировали при комнатной температуре в течение 30 минут. Затем высевали 2×104 клеток/мл (RPMI1640 среда, дополненная FBS с низкой концентрацией IgG 20%) NCI-H322 клеток при 50 мкл/лунка. После инкубации при комнатной температуре в течение 30 минут клетки культивировали в течение 3 дней в CO2 инкубаторе при 37°C. После культивирования супернатант удаляли и в планшет добавляли 10% WST-1-10% FBS-RPMI1640 при 100 мкл/лунка. После инкубации в течение 1 часа в CO2 инкубаторе при 37°C количество жизнеспособных клеток измеряли с использованием планшет-ридера (OD450 - OD640). Из оцениваемых антител, TINA1, антитело против TROP2, имело самую сильную активность интернализации и активность иммунотоксина (Фиг. 11).
[0178]
4-4) Разница в активности интернализации и активности иммунотоксина между клонами анти-TROP2 антитела
Анти-TROP2 антитела TINA1 (иммуноген: линия рака легкого NCI-H322), KCL7A3 и KCL2D6 (иммуноген: панкреатическая раковая клеточная линия KCL-MOH1), Pr1E11 и Pr8H10 (иммуноген: клеточная линия рака предстательной железы Pc-1) и NY16 и NY17 (иммуноген: панкреатическая раковая клеточная линия PK-1), полученные способом Примера 1 или эквивалетным способом, и коммерчески доступный 77220 (R&D Systems Inc.) оценивали на их активность интернализации и активность иммунотоксина таким же способом, как в Примере 4-3). В результате, из 8 анти-TROP2 антител TINA1 антитело имело самую сильную активность (Фиг. 12).
[0179]
[Пример 5: Определение нуклеотидной последовательности кодирующей вариабельную область кДНК гена TINA1 антитела и получение химерного TINA1 (далее указано как cTINA1) антитело]
5-1) Определение нуклеотидной последовательности кодирующей вариабельную область кДНК гена TINA1 антитела
5-1-1) Получение мРНК из TINA1 антитело-продуцирующей гибридомы
Для амплификации кДНК, кодирующих вариабельные области TINA1 антитела, мРНК получали из TINA1 антитело-продуцирующей гибридомы с использованием набора для выделения мРНК (Roche Applied Science).
[0180]
5-1-2) Синтез кДНК (5'-RACE-Ready кДНК)
кДНК (5'-RACE-Ready кДНК) синтезировали с использованием мРНК (100 нг), полученной в 5-1-1), и Набора SMARTer RACE для амплификации кДНК (Clontech Laboratories, Inc.).
[0181]
5-1-3) Амплификация кДНК, кодирующей вариабельную область тяжелой цепи TINA1 антитела, при помощи 5ʹ-RACE ПЦР и определение последовательности
UPM (Universal Primer A Mix: включен в Набор SMARTer RACE для амплификации кДНК) и олигонуклеотид, имеющий последовательность 5'-AGAGTTCCAGGTCAAGGTCACTGGCTCAGG-3' (SEQ ID NO: 33: праймер mG2aVR2) использовали в качестве праймеров для амплификации кДНК вариабельной области гена тяжелой цепи при помощи ПЦР. Использовали UPM, включенный в Набор SMARTer RACE для амплификаци кДНК (Clontech Laboratories, Inc.), и mG2aVR2 был сконструирован из последовательности константной области тяжелой цепи (IgG2a) мыши из базы данных.
кДНК, кодирующую вариабельную область тяжелой цепи TINA1 антитела, амплифицировали при помощи 5ʹ-RACE ПЦР с использованием этого набора праймеров и кДНК (5'-RACE-Ready кДНК), синтезированной в Примере 5-1-2), в качестве матрицы. Эту ПЦР осуществляли в соответствии в руководством, включенном в набора SMARTer RACE для амплификаци кДНК (Clontech Laboratories, Inc.), по программе ступенчатой ПЦР с использованием KOD-плюс (Toyobo Co., Ltd.) в качестве полимеразы.
кДНК, кодирующую вариабельную область тяжелой цепи, амплифицированную при помощи 5ʹ-RACE ПЦР, очищали с использованием Набора MinElute для очистки продуктов ПЦР (QIAGEN N.V.) и затем клонировали с использованием набора Zero Blunt TOPO PCR Cloning Kit (Invitrogen Corp.). Нуклеотидную последовательность клонированной кДНК, кодирующей вариабельную область тяжелой цепи, анализировали путем секвенирования. Праймеры, используемые для секвенирования, представляли собой описанный выше праймер mG2aVR2, сконструированный из последовательности константной области тяжелой цепи мыши из базы данных, и NUP (Nested Universal Праймер A: включенный в Набор SMARTer RACE для амплификаци кДНК).
Анализ секвенирования осуществляли с использованием устройства для анализа последовательностей генов ("ABI PRISM 3700 DNA Analyzer" или "Applied Biosystems 3730×l Analyzer", Applied Biosystems, Inc.) и реакции секвенирования с использованием Gene Amp 9700 (Applied Biosystems, Inc.).
Установленная нуклеотидная последовательность кДНК, кодирующей вариабельную область тяжелой цепи TINA1 антитела, показана в SEQ ID NO: 1 в Перечне последовательностей, и аминокислотная последовательность, кодируемая ею, показана в SEQ ID NO: 2.
[0182]
5-1-4) Амплификация кДНК, кодирующей вариабельную область легкой цепи TINA1 антитела, при помощи 5ʹ-RACE ПЦР и определение последовательности
UPM (Universal Primer A Mix: включенный в Набор SMARTer RACE для амплификаци кДНК) и олигонуклеотид, имеющий последовательность 5'-AGTCCAACTGTTCAGGACGCCATTTTGTCG-3' (SEQ ID NO: 34: праймер mKVR2), использовали в качестве праймеров для амплификации кДНК вариабельной области гена легкой цепи TINA1 антитела при помощи ПЦР. Использовали UPM, включенный в Набор SMARTer RACE для амплификаци кДНК (Clontech Laboratories, Inc.), и mKVR2 был сконструирован из последовательности константной области легкой цепи мыши из базы данных.
кДНК, кодирующую вариабельную область легкой цепи TINA1 антитела, амплифицировали при помощи 5ʹ-RACE ПЦР с использованием этого набора праймеров и кДНК (5'-RACE-Ready кДНК), синтезированной в Примере 5-1-2), в качестве матрицы. Эту ПЦР осуществляли в соответствии в руководством, включенным в набора SMARTer RACE для амплификаци кДНК (Clontech Laboratories, Inc.), по программе ступенчатой ПЦР с использованием KOD-Plus-(Toyobo Co., Ltd.) в качестве полимеразы.
кДНК, кодирующую вариабельную область легкой цепи, амплифицированную при помощи 5ʹ-RACE ПЦР, очищали с использованием Набора MinElute для очистки продуктов ПЦР (QIAGEN N.V.) и затем клонировали с использованием набора Zero Blunt TOPO PCR Cloning Kit (Invitrogen Corp.). Нуклеотидную последовательность клонированной кДНК, кодирующей вариабельную область легкой цепи, анализировали путем секвенирования.
Праймеры, используемые для секвенирования, представляли собой описанные выше праймер mKVR2, сконструированный из последовательности константной области легкой цепи мыши из базы данных, и NUP.
В анализе секвенирования и реакции секвенирования использовали описанное выше оборудование.
Установленная нуклеотидная последовательность кДНК, кодирующей вариабельную область легкой цепи TINA1 антитела, показана в SEQ ID NO: 3 в Перечне последовательностей, и аминокислотная последовательность, кодируемая ею, показана в SEQ ID NO: 4.
[0183]
5-2) Получение cTINA1 антитела
5-2-1) Конструирование pCMA-LK вектора экспрессии легкой цепи химерного и гуманизированного антитела
Фрагмент около 5,4 т.п.н., полученный путем расщепления плазмиды pкDNA3,3-TOPO/LacZ (Invitrogen Corp.) рестрикционными ферментами XbaI и PmeI, и ДНК фрагмент, содержащий последовательность ДНК, кодирующую сигнал секреции κ цепи человека и константную область κ цепи человека, которая показана в SEQ ID NO: 5, лигировали с использованием набора In-Fusion Advantage PCR Cloning Kit (Clontech Laboratories, Inc.) с получением pкDNA3.3/LK.
pкDNA3.3/LK использовали в качестве матрицы в ПЦР с использованием набора праймеров, описанного ниже. Полученный фрагмент около 3,8 т.п.н. подвергали фосфорилированию и затем самолигированию для конструирования pCMA-LK вектора экспрессии легкой цепи химерного и гуманизированного антитела, содержащего сигнальную последовательность, сайт клонирования и ген константной области κ цепи человека ниже от CMV промотора.
Набор праймеров
5'-tataccgtcgacctctagctagagcttggc-3' (SEQ ID NO: 35: праймер 3.3-F1)
5'-gctatggcagggcctgccgccccgacgttg-3' (SEQ ID NO: 36: праймер 3.3-R1)
[0184]
5-2-2) Конструирование pCMA-G1 вектора экспрессии тяжелой цепи химерного и гуманизированного антитела IgG1-типа
ДНК фрагмент pCMA-LK, не содержащий последовательность ДНК, кодирующую сигнал секреции κ цепи человека и константную область κ цепи человека в результате расщепления XbaI и PmeI ферментами, и ДНК фрагмент, содержащий ДНК последовательность, кодирующую аминокислоты сигнальной последовательности тяжелой цепи человека и константной области IgG1 человека, показанную в SEQ ID NO: 6, лигировали с использованием набора In-Fusion Advantage PCR Cloning Kit (Clontech Laboratories, Inc.) для конструирования экспрессирующего вектора pCMA-G1 для экспрессии тяжелой цепи химерного и гуманизированного антитела IgG1-типа, содержащего сигнальную последовательность, сайт клонирования и ген константной области тяжелой цепи IgG1 человека ниже от CMV промотора.
[0185]
5-2-3) Конструирование вектора экспрессии тяжелой цепи cTINA1 антитела
ДНК фрагмент, содержащий кДНК, кодирующую вариабельную область тяжелой цепи TINA1 антитела, амплифицировали с использованием кДНК, кодирующей вариабельную область тяжелой цепи, полученной в Примере 5-1-3), в качестве матрицы, KOD-Plus-(Toyobo Co., Ltd.) и набора праймеров, описанного ниже, и вставляли в расщепленный рестрикционным ферментом BlpI сайт pCMA-G1 вектора экспрессии тяжелой цепи химерного и гуманизированного антитела IgG1-типа с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories, Inc.) для конструирования вектора экспрессии тяжелой цепи cTINA1 антитела. Полученный экспрессирующий вектор был обозначен как "pCMA-G1/cTINA1". Нуклеотидная последовательность тяжелой цепи cTINA1 антитела показана в SEQ ID NO: 7, и аминокислотная последовательность, кодируемая ею, показана в SEQ ID NO: 8. Нуклеотидная последовательность SEQ ID NO: 7 и аминокислотная последовательность SEQ ID NO: 8 также описаны на Фиг. 1.
Набор праймеров для тяжелой цепи cTINA1 антитела
5'-CCAGATGGGTGCTGAGCCAGATCCAGTTGGTGCAGTCTGGACCTGAG-3' (SEQ ID NO: 37: праймер TINA1H-F)
5'-CTTGGTGGAGGCTGAGCTGACGGTGACCGCGGTCCCTGCGCCCCAGAC-3' (SEQ ID NO: 38: праймер TINA1H-R)
[0186]
5-2-4) Конструирование вектора экспрессии легкой цепи cTINA1 антитела
ДНК фрагмент, содержащий кДНК, кодирующую вариабельную область легкой цепи TINA1 антитела, амплифицировали с использованием кДНК, кодирующей вариабельную область легкой цепи, полученной в Примере 5-1-4), в качестве матрицы, KOD-Plus-(Toyobo Co., Ltd.) и набора праймеров, описанного ниже, и вставляли в расщепленный рестрикционным ферментом BsiWI сайт многоцелевого вектора экспрессии легкой цепи химерного и гуманизированного антитела pCMA-LK с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories, Inc.) для конструирования вектора экспрессии легкой цепи cTINA1 антитела. Полученный экспрессирующий вектор был обозначен как "pCMA-LK/cTINA1". Нуклеотидная последовательность легкой цепи cTINA1 антитела показана в SEQ ID NO: 9, и аминокислотная последовательность, кодируемая ею, показана в SEQ ID NO: 10. Нуклеотидная последовательность SEQ ID NO: 9 и аминокислотная последовательность SEQ ID NO: 10 также описаны на Фиг. 2.
Набор праймеров для легкой цепи cTINA1 антитела
5'-ATCTCCGGCGCGTACGGCGACATTGTGATGACCCAGTCTCACAAATTC-3' (SEQ ID NO: 39: праймер TINA1L-F)
5'-GGAGGGGGCGGCCACAGCCCGTTTCAGCTCCAGCTTGGTCCCAGC-3' (SEQ ID NO: 40: праймер TINA1L-R)
[0187]
5-2-5) Маломасштабное получение cTINA1 антитела
FreeStyle 293F клетки (Invitrogen Corp.) субкультивировали и культивировали в соответствии с инструкциями.
1×107 FreeStyle 293F клетки (Invitrogen Corp.) в логарифмической фазе роста разбавляли FreeStyle 293 средой для экспрессии (Invitrogen Corp.) до 9,6 мл, затем высевали в 30-мл квадратный сосуд Square Storage Bottle (Nalgene/Thermo Fisher Scientific, Inc.) и затем культивировали при встряхивании при 90 об/мин в течение 1 часа в 8% CO2 инкубаторе при 37°C. Полиэтиленимин (Polyscience #24765; 30 мкг) растворяли в Opti-Pro SFM (Invitrogen Corp.; 200 мкл). Затем вектор экспрессии легкой цепи (6 мкг) и вектор экспрессии тяжелой цепи (4 мкг), полученные с использованием набора плазмид PureLink HiPure (Invitrogen Corp.), добавляли к Opti-Pro SFM (Invitrogen Corp.; 200 мкл). Смешанный раствор вектор экспрессии/Opti-Pro SFM (200 мкл) добавляли к полиэтиленимин/Opti-Pro SFM смешанному раствору (200 мкл) и смесь осторожно перемешивали, затем оставляли на 5 минут и затем добавляли к FreeStyle 293F клеткам. Культуральный супернатант, полученный путем встряхивания культуры при 90 об/мин в течение 7 дней в 8% CO2 инкубаторе при 37°C, фильтровали через Minisart-Plus фильтр (Sartorius AG) и использовали в качестве образца для оценки.
Человеческое химерное TINA1 антитело, полученное путем комбинации pCMA-G1/cTINA1 и pCMA-LK/cTINA1, было обозначено как "cTINA1 антитело".
[0188]
[Пример 6: Конструирование гуманизированного антитела мышиного анти-TROP2 моноклонального антитела]
6-1) Конструирование гуманизированного варианта TINA1
6-1-1) Молекулярное моделирование вариабельной области TINA1
Молекулярное моделирование вариабельных областей TINA1 осуществляли способом, известным в данной области техники как гомологичное моделирование (Methods in Enzymology, 203, 121-153 (1991)). Вариабельные области TINA1, определенные выше, сравнивали с первичными последовательностями (трехмерные структуры, полученные из рентгеновских кристаллических структур, являются доступными) вариабельных областей человеческого иммуноглобулина, зарегистрированными в Protein Data Bank (Nuc. Acid Res. 35, D301-D303 (2007)). В результате, 1ZEA было выбрано как имеющее самую высокую гомологию последовательности с вариабельной областью тяжелой цепи TINA1, среди антител, имеющих подобную делецию в их каркасах. Также, 3IU4 было выбрано как имеющее самую высокую гомологию последовательности с вариабельной областью легкой цепи TINA1. Трехмерные структуры каркасных областей были получены в качестве "каркасной модели" путем комбинирования координат 1ZEA и 3IU4, соответствующих тяжелой цепи и легкой цепи TINA1. Затем типичную конформацию каждой CDR встраивали в каркасную модель.
В завершение, осуществляли расчет энергии для исключения неблагоприятного межатомного контакта для получения возможных молекулярных моделей вариабельных областей TINA1 с точки зрения энергии. Эти процедуры осуществляли с использованием коммерчески доступной программы прогнозирования трехмерных белковых структур Discovery Studio (Accelrys, Inc.).
[0189]
6-1-2) Конструирование аминокислотной последовательности для гуманизированного TINA1
Гуманизированное TINA1 антитело конструировали способом, известным в данной области техники как прививка CDR (Proc. Natl. Acad. Sci. USA 86, 10029-10033 (1989)). Акцепторное антитело выбирали на основании гомологии аминокислот в каркасных областях. Последовательности каркасных областей TINA1 сравнивали с последовательностями всех человеческих каркасных областей, зарегистрированных в базе данных Kabat (Nuc. Acid Res., 29, 205-206 (2001)) аминокислотных последовательностей антител. В результате, HuPR1A3 антитело было выбрано в качестве акцептора на основании 74% гомологии его последовательности, что касается каркасных областей. Аминокислотные остатки каркасных областей в HuPR1A3 выравнивали с аминокислотными остатками каркасных областей TINA1 для определения положений аминокислот, которые не совпадали в этих последовательностях. Положения этих остатков анализировали с использованием трехмерной модели TINA1, сконструированной выше. Затем, донорные остатки для прививки на акцептор выбирали в соответствии с критериями, указанными в Queen et al. (Proc. Natl. Acad. Sci. USA 86, 10029-10033 (1989)). Некоторые донорные остатки, выбранные таким образом, переносили в акцепторное антитело для конструирования последовательности гуманизированного TINA1, описанной в Примерах ниже.
[0190]
6-2) Гуманизация тяжелой цепи TINA1
6-2-1) Тяжелая цепь hTINA1-H1-типа:
Гуманизированная тяжелая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 21 (изолейцин) валином, аминокислоты в положении 28 (пролин) аланином, аминокислоты в положении 30 (лейцин) валином, аминокислоты в положении 35 (глутаминовая кислота) аланином, аминокислоты в положении 36 (треонин) серином, аминокислоты в положении 38 (аргинин) лизином, аминокислоты в положении 39 (изолейцин) валином, аминокислоты в положении 57 (глутамин) аргинином, аминокислоты в положении 58 (лизин) глутамином, аминокислоты в положении 59 (метионин) аланином, аминокислоты в положении 62 (лизин) глутамином, аминокислоты в положении 65 (лизин) глутаминомовой кислотой, аминокислоты в положении 67 (изолейцин) метионином, аминокислоты в положении 87 (фенилаланин) валином, аминокислоты в положении 88 (аланин) треонином, аминокислоты в положении 89 (фенилаланин) изолейцином, аминокислоты в положении 91 (лейцин) аланином, аминокислоты в положении 92 (глутаминовая кислота) аспарагиновой кислотой, аминокислоты в положении 95 (аланин) треонином, аминокислоты в положении 102 (изолейцин) лейцином, аминокислоты в положении 104 (аспарагин) серином, аминокислоты в положении 107 (аспарагин) серином, аминокислоты в положении 111 (треонин) аланином, аминокислоты в положении 112 (треонин) валином, аминокислоты в положении 114 (фенилаланин) тирозином, аминокислоты в положении 132 (аланин) глутамином и аминокислоты в положении 135 (аланин) лейцином, что касается тяжелой цепи TINA1, показанной в SEQ ID NO: 8 в Перечне последовательностей, была обозначена как "тяжелая цепь hTINA1-H1-типа".
Аминокислотная последовательность тяжелой цепи hTINA1-H1-типа описана в SEQ ID NO: 12 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-140, и последовательность, состоящая из аминокислотных остатков 141-470, в аминокислотной последовательности SEQ ID NO: 12 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 12, описана в SEQ ID NO: 11 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-420, и последовательность, состоящая из нуклеотидов 421-1410, в нуклеотидной последовательности SEQ ID NO: 11 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 11 и аминокислотная последовательность SEQ ID NO: 12 также описаны на Фиг. 3.
[0191]
6-2-2) Тяжелая цепь hTINA1-H2-типа:
Гуманизированная тяжелая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 21 (изолейцин) валином, аминокислоты в положении 28 (пролин) аланином, аминокислоты в положении 30 (лейцин) валином, аминокислоты в положении 35 (глутаминовая кислота) аланином, аминокислоты в положении 36 (треонин) серином, аминокислоты в положении 38 (аргинин) лизином, аминокислоты в положении 39 (изолейцин) валином, аминокислоты в положении 57 (глутамин) аргинином, аминокислоты в положении 58 (лизин) глутамином, аминокислоты в положении 59 (метионин) аланином, аминокислоты в положении 62 (лизин) глутамином, аминокислоты в положении 65 (лизин) глутаминомовой кислотой, аминокислоты в положении 67 (изолейцин) метионином, аминокислоты в положении 87 (фенилаланин) валином, аминокислоты в положении 88 (аланин) треонином, аминокислоты в положении 89 (фенилаланин) изолейцином, аминокислоты в положении 92 (глутаминовая кислота) аспарагиновой кислотой, аминокислоты в положении 95 (аланин) треонином, аминокислоты в положении 102 (изолейцин) лейцином, аминокислоты в положении 104 (аспарагин) серином, аминокислоты в положении 107 (аспарагин) серином, аминокислоты в положении 111 (треонин) аланином, аминокислоты в положении 112 (треонин) валином, аминокислоты в положении 114 (фенилаланин) тирозином, аминокислоты в положении 132 (аланин) глутамином и аминокислоты в положении 135 (аланин) лейцином, что касается тяжелой цепи TINA1, показанной в SEQ ID NO: 8 в Перечне последовательностей, была обозначена как "тяжелая цепь hTINA1-H2-типа".
Аминокислотная последовательность тяжелой цепи hTINA1-H2-типа описана в SEQ ID NO: 14 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-140, и последовательность, состоящая из аминокислотных остатков 141-470, в аминокислотной последовательности SEQ ID NO: 14 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 14, описана в SEQ ID NO: 13 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-420, и последовательность, состоящая из нуклеотидов 421-1410, в нуклеотидной последовательности SEQ ID NO: 13 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 13 и аминокислотная последовательность SEQ ID NO: 14 также описаны на Фиг. 4.
[0192]
6-2-3) Тяжелая цепь hTINA1-H3-типа:
Гуманизированная тяжелая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 28 (пролин) аланином, аминокислоты в положении 30 (лейцин) валином, аминокислоты в положении 36 (треонин) серином, аминокислоты в положении 38 (аргинин) лизином, аминокислоты в положении 39 (изолейцин) валином, аминокислоты в положении 58 (лизин) глутамином, аминокислоты в положении 65 (лизин) глутаминомовой кислотой, аминокислоты в положении 67 (изолейцин) метионином, аминокислоты в положении 87 (фенилаланин) валином, аминокислоты в положении 88 (аланин) треонином, аминокислоты в положении 92 (глутаминовая кислота) аспарагиновой кислотой, аминокислоты в положении 95 (аланин) треонином, аминокислоты в положении 102 (изолейцин) лейцином, аминокислоты в положении 104 (аспарагин) серином, аминокислоты в положении 107 (аспарагин) серином, аминокислоты в положении 111 (треонин) аланином, аминокислоты в положении 112 (треонин) валином, аминокислоты в положении 114 (фенилаланин) тирозином, аминокислоты в положении 132 (аланин) глутамином и аминокислоты в положении 135 (аланин) лейцином, что касается тяжелой цепи TINA1, показанной в SEQ ID NO: 8 в Перечне последовательностей, была обозначена как "тяжелая цепь hTINA1-H3-типа ".
Аминокислотная последовательность тяжелой цепи hTINA1-H3-типа описана в SEQ ID NO: 16 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-140 и последовательность, состоящая из аминокислотных остатков 141-470, в аминокислотной последовательности SEQ ID NO: 16 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 16, описана в SEQ ID NO: 15 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-420, и последовательность, состоящая из нуклеотидов 421-1410, в нуклеотидной последовательности SEQ ID NO: 15 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 15 и аминокислотная последовательность SEQ ID NO: 16 также описаны на Фиг. 5.
[0193]
6-3) Гуманизация легкой цепи TINA1
6-3-1) Легкая цепь hTINA1-L1-типа:
Гуманизированная легкая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 23 (валин) глутамином, аминокислоты в положении 28 (гистидин) пролином, аминокислоты в положении 29 (лизин) серином, аминокислоты в положении 30 (фенилаланин) серином, аминокислоты в положении 31 (метионин) лейцином, аминокислоты в положении 33 (треонин) аланином, аминокислоты в положении 40 (серин) треонином, аминокислоты в положении 62 (глутамин) лизином, аминокислоты в положении 63 (серин) аланином, аминокислоты в положении 80 (аспарагиновая кислота) серином, аминокислоты в положении 83 (треонин) серином, аминокислоты в положении 90 (аланин) аспарагиновой кислотой, аминокислоты в положении 93 (фенилаланин) лейцином, аминокислоты в положении 98 (валин) лейцином, аминокислоты в положении 100 (аланин) пролином, аминокислоты в положении 103 (лейцин) фенилаланином, аминокислоты в положении 120 (аланин) глутамином, аминокислоты в положении 126 (лейцин) изолейцином и аминокислоты в положении 129 (аланин) треонином, что касается TINA1 легкой цепи, показанной в SEQ ID NO: 10 в Перечне последовательностей, была обозначена как "легкая цепь hTINA1-L1-типа".
Аминокислотная последовательность легкой цепи hTINA1-L1-типа описана в SEQ ID NO: 18 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-20, последовательность, состоящая из аминокислотных остатков 21-129, и последовательность, состоящая из аминокислотных остатков 130-234, в аминокислотной последовательности SEQ ID NO: 18 соответствуют сигнальной последовательности, вариабельной области легкой цепи и константной области легкой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 18, описана в SEQ ID NO: 17 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-60, последовательность, состоящая из нуклеотидов 61-387, и последовательность, состоящая из нуклеотидов 388-702, в нуклеотидной последовательности SEQ ID NO: 17 кодируют сигнальную последовательность, последовательность вариабельной области легкой цепи и последовательность константной области легкой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 17 и аминокислотная последовательность SEQ ID NO: 18 также описаны на Фиг. 6.
[0194]
6-3-2) Легкая цепь hTINA1-L2-типа:
Гуманизированная легкая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 28 (гистидин) пролином, аминокислоты в положении 29 (лизин) серином, аминокислоты в положении 30 (фенилаланин) серином, аминокислоты в положении 31 (метионин) лейцином, аминокислоты в положении 33 (треонин) аланином, аминокислоты в положении 40 (серин) треонином, аминокислоты в положении 62 (глутамин) лизином, аминокислоты в положении 63 (серин) аланином, аминокислоты в положении 80 (аспарагиновая кислота) серином, аминокислоты в положении 83 (треонин) серином, аминокислоты в положении 90 (аланин) аспарагиновой кислотой, аминокислоты в положении 93 (фенилаланин) лейцином, аминокислоты в положении 98 (валин) лейцином, аминокислоты в положении 100 (аланин) пролином, аминокислоты в положении 103 (лейцин) фенилаланином, аминокислоты в положении 120 (аланин) глутамином, аминокислоты в положении 126 (лейцин) изолейцином и аминокислоты в положении 129 (аланин) треонином, что касается легкой цепи TINA1, показанной в SEQ ID NO: 10 в Перечне последовательностей, была обозначена как "легкая цепь hTINA1-L2-типа".
Аминокислотная последовательность легкой цепи hTINA1-L2-типа описана в SEQ ID NO: 20 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-20, последовательность, состоящая из аминокислотных остатков 21-129, и последовательность, состоящая из аминокислотных остатков 130-234, в аминокислотной последовательности SEQ ID NO: 20 соответствуют сигнальной последовательности, вариабельной области легкой цепи и константной области легкой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 20, описана в SEQ ID NO: 19 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-60, последовательность, состоящая из нуклеотидов 61-387, и последовательность, состоящая из нуклеотидов 388-702, в нуклеотидной последовательности SEQ ID NO: 19 кодируют сигнальную последовательность, последовательность вариабельной области легкой цепи и последовательность константной области легкой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 19 и аминокислотная последовательность SEQ ID NO: 20 также описаны на Фиг. 7.
[0195]
6-3-3) Легкая цепь hTINA1-L3-типа:
Гуманизированная легкая цепь TINA1, сконструированная с использованием замены аминокислоты в положении 28 (гистидин) пролином, аминокислоты в положении 29 (лизин) серином, аминокислоты в положении 30 (фенилаланин) серином, аминокислоты в положении 31 (метионин) лейцином, аминокислоты в положении 33 (треонин) аланином, аминокислоты в положении 40 (серин) треонином, аминокислоты в положении 62 (глутамин) лизином, аминокислоты в положении 63 (серин) глутамином, аминокислоты в положении 80 (аспарагиновая кислота) серином, аминокислоты в положении 83 (треонин) серином, аминокислоты в положении 90 (аланин) аспарагиновой кислотой, аминокислоты в положении 93 (фенилаланин) лейцином, аминокислоты в положении 98 (валин) лейцином, аминокислоты в положении 100 (аланин) пролином, аминокислоты в положении 103 (лейцин) фенилаланином, аминокислоты в положении 120 (аланин) глутамином, аминокислоты в положении 126 (лейцин) изолейцином и аминокислоты в положении 129 (аланин) треонином, что касается TINA1 легкой цепи, показанной в SEQ ID NO: 10 в Перечне последовательностей, была обозначена как "легкая цепь hTINA1-L3-типа".
Аминокислотная последовательность легкой цепи hTINA1-L3-типа описана в SEQ ID NO: 22 в Перечне последовательностей. Последовательность, состоящая из аминокислотных остатков 1-20, последовательность, состоящая из аминокислотных остатков 21-129, и последовательность, состоящая из аминокислотных остатков 130-234, в аминокислотной последовательности SEQ ID NO: 22 соответствуют сигнальной последовательности, вариабельной области легкой цепи и константной области легкой цепи, соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 22, описана в SEQ ID NO: 21 в Перечне последовательностей. Последовательность, состоящая из нуклеотидов 1-60, последовательность, состоящая из нуклеотидов 61-387, и последовательность, состоящая из нуклеотидов 388-702, в нуклеотидной последовательности SEQ ID NO: 21 кодируют сигнальную последовательность, последовательность вариабельной области легкой цепи и последовательность константной области легкой цепи, соответственно. Нуклеотидная последовательность SEQ ID NO: 21 и аминокислотная последовательность SEQ ID NO: 22 также описаны на Фиг. 8.
[0196]
[Пример 7: Конструирование вектора для экспрессии hTINA1 антитела и получение антитела]
7-1) Конструирование вектора для экспрессии тяжелой цепи hTINA1
7-1-1) Конструирование вектора для экспрессии hTINA1-H1
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-H1, показаную в положениях нуклеотидов 36-437 нуклеотидной последовательности hTINA1-H1, представленной в SEQ ID NO: 11 в Перечне последовательностей. ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-H1, амплифицировали с использованием синтезированного ДНК фрагмента в качестве матрицы, KOD-Plus-(Toyobo Co., Ltd.) и набора праймеров, описанного ниже, и вставляли в расщепленный рестрикционным ферментом BlpI сайт pCMA-G1 вектора экспрессии химерной и гуманизированной тяжелой цепи IgG1-типа с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories, Inc.) для конструирования вектора экспрессии hTINA1-H1. Полученный вектор экспрессии был обозначен как "pCMA-G1/hTINA1-H1".
Набор праймеров
5'-agctcccagatgggtgctgagc-3' (SEQ ID NO: 41: праймер EG-Inf-F)
5'-gggcccttggtggaggctgagc-3' (SEQ ID NO: 42: праймер EG1-Inf-R)
[0197]
7-1-2) Конструирование вектора для экспрессии hTINA1-H2
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-H2, показанную в положениях нуклеотидов 36-437 нуклеотидной последовательности hTINA1-H2, представленной в SEQ ID NO: 13 в Перечне последовательностей, и вектор экспрессии hTINA1-H2 конструировали таким же способом, как в Примере 7-1-1). Полученный вектор экспрессии был обозначен как "pCMA-G1/hTINA1-H2".
[0198]
7-1-3) Конструирование вектора для экспрессии hTINA1-H3
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-H3, показанную в положениях нуклеотидов 36-437 нуклеотидной последовательности hTINA1-H3, представленной в SEQ ID NO: 15 в Перечне последовательностей, и конструировали вектор экспрессии hTINA1-H3 таким же способом, как в Примере 7-1-1). Полученный вектор экспрессии был обозначен как "pCMA-G1/hTINA1-H3".
[0199]
7-2) Конструирование вектора экспрессии легкой цепи hTINA1
7-2-1) Конструирование вектора экспрессии hTINA1-L1
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-L1, показанную в положениях нуклеотидов 38-402 нуклеотидной последовательности hTINA1-L1, представленной в SEQ ID NO: 17 в Перечне последовательностей. ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-L1, амплифицировали с использованием синтезированного ДНК фрагмента в качестве матрицы, KOD-Plus-(Toyobo Co., Ltd.) и набора праймеров, описанного ниже, и вставляли в расщепленный рестрикционным ферментом BsiWl сайт вектора pCMA-LK для экспрессии легкой цепи химерного и гуманизированного антитела с использованием набора In-Fusion HD PCR Cloning Kit (Clontech Laboratories, Inc.) для конструирования вектора экспрессии hTINA1-L1. Полученный вектор экспрессии был обозначен как "pCMA-LK/hTINA1-L1".
Набор праймеров
5'-ctgtggatctccggcgcgtacggc-3' (SEQ ID NO: 43: праймер CM-LKF)
5'-ggagggggcggccaccgtacg-3' (SEQ ID NO: 44: праймер KCL-Inf-R)
[0200]
7-2-2) Конструирование вектора для экспрессии hTINA1-L2
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-L2, показанную в положениях нуклеотидов 38-402 нуклеотидной последовательности hTINA1-L2, представленной в SEQ ID NO: 19 в Перечне последовательностей, и конструировали вектор экспрессии hTINA1-L2 таким же способом, как в Примере 7-2-1). Полученный вектор экспрессии был обозначен как "pCMA-LK/hTINA1-L2".
[0201]
7-2-3) Конструирование вектора экспрессии hTINA1-L3
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область hTINA1-L3, показанную в положениях нуклеотидов 38-402 нуклеотидной последовательности hTINA1-L3, представленной в SEQ ID NO: 21 в Перечне последовательностей, и вектор экспрессии hTINA1-L3 конструировали таким же способом, как в Примере 7-2-1). Полученный вектор экспрессии был обозначен как "pCMA-LK/hTINA1-L3".
[0202]
7-3) Получение и очистка hTINA1 антитела
7-3-1) Маломасштабное получение hTINA1 антитела
Каждое антитело получали таким же способом, как в Примере 5-2-5).
hTINA1 антитело, полученное путем комбинации pCMA-G1/hTINA1-H1 и pCMA-LK/hTINA1-L1, было обозначено как "hTINA1-H1L1"; hTINA1 антитело, полученное путем комбинации pCMA-G1/hTINA1-H2 и pCMA-LK/hTINA1-L1, было обозначено как "hTINA1-H2L1"; hTINA1 антитело, полученное путем комбинации pCMA-G1/hTINA1-H2 и pCMA-LK/hTINA1-L2, было обозначено как "hTINA1-H2L2"; и hTINA1 антитело, полученное путем комбинации pCMA-G1/hTINA1-H3 и pCMA-LK/hTINA1-L3, было обозначено как "hTINA1-H3L3".
[0203]
7-3-2) Получение hTINA1 антитела
hTINA1-H1L1, hTINA1-H2L1, hTINA1-H2L2 и hTINA1-H3L3 получали следующим способом.
FreeStyle 293F клетки (Invitrogen Corp.) субкультивировали и культивировали в соответствии с инструкциями. 1,2×109 FreeStyle 293F клеток (Invitrogen Corp.) в логарифмической фазе роста высевали в 3-л колбу Фернбаха Эрленмейера (Corning Inc.), затем разбавляли средой для экспрессии FreeStyle 293 (Invitrogen Corp.) до 1,0×106 клеток/мл и затем культивировали при встряхивании при 90 об/мин в течение 1 часа в 8% CO2 инкубаторе при 37°C. Полиэтиленимин (Polyscience #24765; 3,6 мг) растворяли в Opti-Pro SFM (Invitrogen Corp.; 20 мл). Затем вектор экспрессии легкой цепи (0,8 мг) и вектор экспрессии тяжелой цепи (0,4 мг), полученные с использованием набора плазмид PureLink HiPure (Invitrogen Corp.) добавляли к Opti-Pro SFM (Invitrogen Corp.; 20 мл). Смешанный раствор вектор экспрессии/Opti-Pro SFM (20 мл) добавляли к полиэтиленимин/Opti-Pro SFM смешанному раствору (20 мл) и смесь осторожно перемешивали, затем оставляли на 5 минут и затем добавляли к FreeStyle 293F клеткам. Культуральный супернатант, полученный путем встряхивания культуры при 90 об/мин в течение 7 дней в 8% CO2 инкубаторе при 37°C, фильтровали через одноразовый капсульный фильтр (ADVANTEC #CCS-045-E1H).
[0204]
7-3-3) Очистка hTINA1 антитела
Каждое антитело очищали из культурльного супернатанта, полученного в 7-3-2) выше, в две стадии с использованием rProtein A аффинной хроматографии (4-6°C) и керамического гидроксиапатита (комнатная температура). Стадии замены буфера после очистка rProtein A аффинной хроматографией и после очистки керамическим гидроксиапатитом осуществляли при 4-6°C. Сначала культуральный супернатант наносили на MabSelect SuRe (изготовитель GE Healthcare Japan Corporation, HiTrap колонка), уравновешенную при помощи PBS. После введения всего культурального супернатанта в колонку, колонку промывали при помощи PBS в количестве, составляющем по меньшей мере два объема колонки. Затем антитело-содержащие фракции собирали путем элюирования раствором 2 M аргинингидрохлорида (pH 4,0). Осуществляли замену буфера в фракциях на PBS путем диализа (Thermo Fisher Scientific, Inc., Slide-A-Lyzer Dialysis Cassette) и затем разбавляли 5-кратно буфером 5 мМ фосфата натрия и 50 мМ MES (pH 7,0). Полученный раствор антитела наносили на колонку с керамическим гидроксиапатитом (Bio-Rad Laboratories, Inc., Bio-Scale CHT Type-I Hydroxyapatite Column), уравновешенную буфером 5 мМ NaPi, 50 мМ MES и 30 мМ NaCl (pH 7,0). Антитело-содержащие фракции собирали путем элюирования с линейным градиентом концентрации с использованием хлорида натрия. Осуществляли замену буфера в фракциях на HBSor (25 мМ гистидина/5% сорбита, pH 6,0) путем диализа (Thermo Fisher Scientific, Inc., Slide-A-Lyzer Dialysis Cassette). В завершение, фракции концентрировали и доводили до IgG концентрации 20 мг/мл или выше с использованием центрифужного UF фильтровального устройства VIVASPIN 20 (отсечка молекулярной массы: UF10K, Sartorius AG, 4°C) и использовали в качестве очищенного образца.
[0205]
[Ссылочный Пример 1: Получение вектора экспрессии hRS7 антитела и получение антитела]
hRS7 антитело получали на основании аминокислотных последовательностей легкой цепи и тяжелой цепи, описанных в Международной публикации № WO 2003/074566.
1-1) Конструирование вектора экспрессии тяжелой цепи hRS7 антитела
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область тяжелой цепи hRS7 антитела, показанную в положениях нуклеотидов 36-437 нуклеотидной последовательности тяжелой цепи hRS7 антитела, представленной в SEQ ID NO: 29 в Перечне последовательностей, и вектор экспрессии тяжелой цепи hRS7 антитела конструировали таким же способом, как в Примере 7-1-1). Полученный вектор экспрессии был обозначен как "pCMA-G1/hRS7". Аминокислотная последовательность тяжелой цепи hRS7 антитела показана в SEQ ID NO: 30 в Перечне последовательностей.
[0206]
1-2) Конструирование вектора экспрессии легкой цепи hRS7 антитела
Cинтезировали (GeneArt Artificial Gene Sequence service) ДНК фрагмент, содержащий последовательность ДНК, кодирующую вариабельную область легкой цепи hRS7 антитела, показанную в положениях нуклеотидов 38-402 нуклеотидной последовательности легкой цепи hRS7 антитела, представленной в SEQ ID NO: 31 в Перечне последовательностей, и вектор экспрессии легкой цепи hRS7 антитела конструировали таким же способом, как в Примере 7-2-1). Полученный вектор экспрессии был обозначен как "pCMA-LK/hRS7". Аминокислотная последовательность тяжелой цепи hRS7 антитела показана в SEQ ID NO: 32 в Перечне последовательностей.
[0207]
1-3) Получение и очистка hRS7 антитела
1-3-1) Получение hRS7 антитела
hRS7 антитело получали таким же способом, как в Примере 7-3-2), комбинированием pCMA-G1/hRS7 и pCMA-LK/hRS7.
[0208]
1-3-2) Очистка hRS7 антитела
Антитело очищали из культурльного супернатанта, полученного в 1-3-1), таким же способом, как в Примере 7-3-3).
[0209]
[Пример 8: Измерение аффинности связывания с антигеном hTINA1 антитела и hRS7 антитела]
8-1) Измерение аффинности связывания с антигеном с использованием антитела (культуральный супернатант), полученного в малом масштабе
Каждое антитело анализировали на его константу диссоциации для антигена (Recombinant Human TROP-2 Fc chimera) с использованием Biacore 3000 (GE Healthcare Japan Corporation) способом захвата антитела в виде лиганда на иммобилизованном анти-человеческом IgG (Fab) антителе и анализа антигена в качестве аналита. Около 2000 RU анти-человеческого IgG (Fab) антитела (Human Fab capture kit, GE Healthcare Japan Corporation) ковалентно связывали с сенсорным чипом CM5 (BIAcore, Inc.) способом аминного связывания. Подобным образом, это антитело было иммобилизовано на эталонной проточной ячейке. Используемый подвижный буфер представлял собой HBS-EP+ (10 мМ HEPES pH 7,4, 0,15 M NaCl, 3 мМ EDTA, 0,05% Поверхностно-активное вещество P20). Культуральный супернатант, содержащий антитело, добавляли в течение 80 секунд на чип с иммобилизованным анти-человеческим IgG (Fab) антителом и затем серийные разведения антигена (1-1000 нМ) каждое добавляли при скорости потока 30 мкл/мин в течение 300 секунд. Затем фазу диссоциации контролировали в течение 600 секунд. Добавляли 10 мМ Gly-HCl (pH 1,5), содержащий 20% ДМСО, в качестве восстанавливающего раствора при скорости потока 10 мкл/мин в течение 60 секунд. Данные анализировали с использованием модели бивалентного связывания аналитической программы (BIAevaluation software, version 4.1) для расчета константы скорости ассоциации kon, константы скорости диссоциации koff и константы диссоциации (KD; KD=koff/kon).
[0210]
|
Связывающая активность с использованием культурального супернатанта в качестве образца антитела
[0211]
8-2) Измерение аффинности связывания с антигеном с использованием очищенного антитела
Каждое антитело анализировали на его константу диссоциации для антигена (Recombinant Human TROP-2 Fc chimera) с использованием Biacore 3000 (GE Healthcare Japan Corporation) способом захвата антитела в виде лиганда на иммобилизованном анти-человеческом IgG (Fab) антителе и анализа антигена в качестве аналита. Около 2000 RU анти-человеческого IgG (Fab) антитела (Human Fab capture kit, GE Healthcare Japan Corporation) ковалентно связывали с сенсорным чипом CM5 (BIAcore, Inc.) способом аминного связывания. Подобным образом, это антитело было иммобилизовано на эталонной проточной ячейке. Используемый подвижный буфер представлял собой HBS-EP+ (10 мМ HEPES pH 7,4, 0,15 M NaCl, 3 мМ EDTA, 0,05% Поверхностно-активное вещество P20). Антитело добавляли в течение 1 минуты на чип с иммобилизованным анти-человеческим IgG (Fab) антителом и затем серийные разведения антигена (1-1000 нМ) каждое добавляли при скорости потока 30 мкл/мин в течение 300 секунд. Затем фазу диссоциации контролировали в течение 600 секунд. Добавляли два раза 25 мМ NaOH, разбавленного подвижным буфером, в качестве восстанавливающего раствора при скорости потока 100 мкл/мин в течение 3 секунд. Данные анализировали таким же способом, как описано выше.
[0212]
|
Измерение связывающей активности с использованием очищенного антитела в качестве образца антитела
[0213]
[Пример 9: Получение hTINA1-H1L1 ADC (1)]
[0214]
[Формула 25]
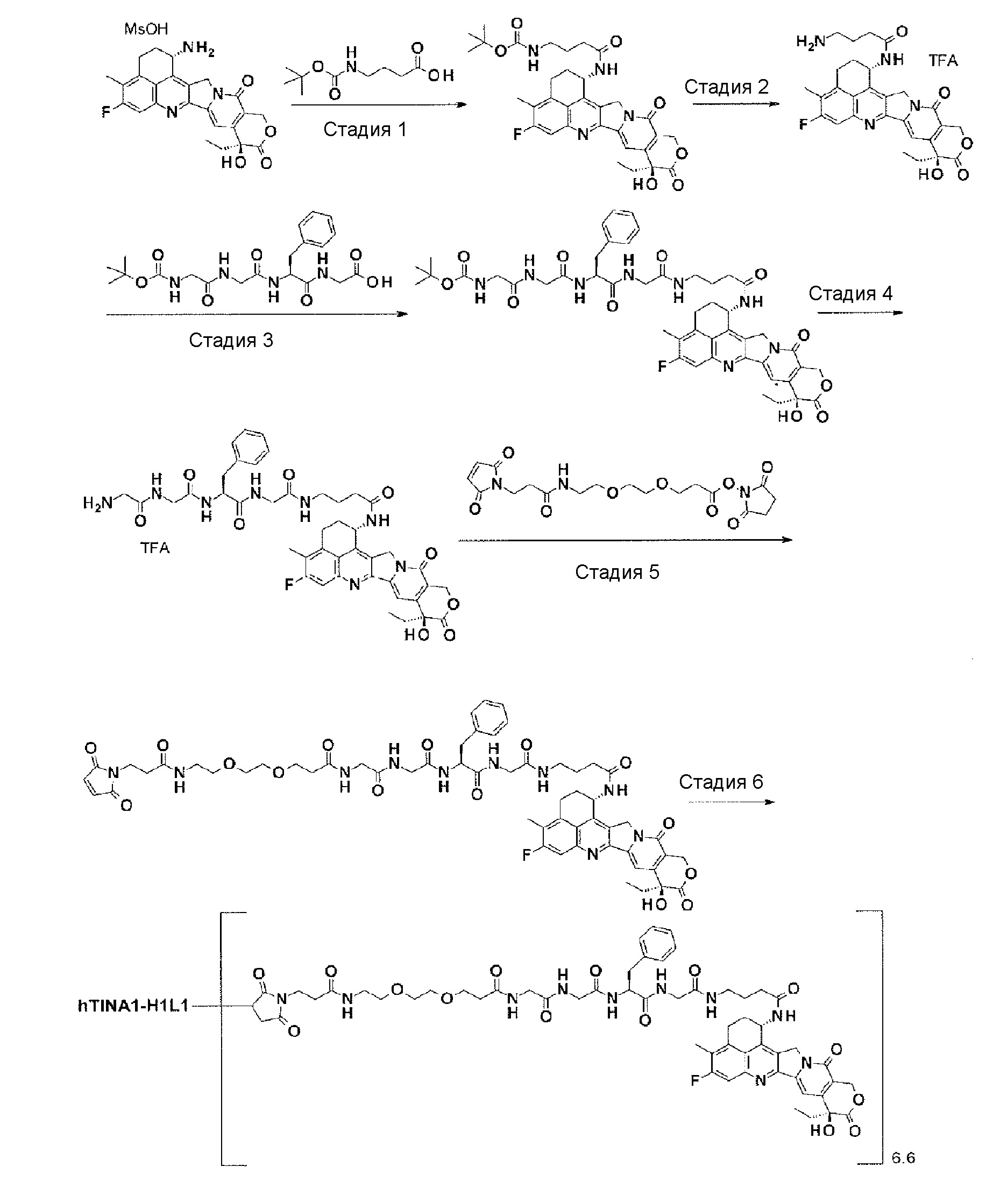
[0215]
Стадия 1: трет-Бутил (4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)карбамат
4-(трет-Бутоксикарбониламино)бутановую кислоту (0,237 г, 1,13 ммоль) растворяли в дихлорметане (10 мл), добавляли N-гидроксисукцинимид (0,130 г, 1,13 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,216 г, 1,13 ммоль) и перемешивали в течение 1 часа. Реакционный раствор добавляли по каплям к раствору N,N-диметилформамида (10 мл), содержащего экзатекан мезилат (0,500 г, 0,94 ммоль) и триэтиламин (0,157 мл, 1,13 ммоль), и перемешивали при комнатной температуре в течение 1 дня. Растворитель удаляли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (об/об)] с получением указанного в заголовке соединения (0,595 г, количественный выход).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,2 Гц), 1,31 (9H, с), 1,58 (1H, т, J=7,2 Гц), 1,66 (2H, т, J=7,2 Гц), 1,89-1,82 (2H, м), 2,12-2,21 (3H, м), 2,39 (3H, с), 2,92 (2H, т, J=6,5 Гц), 3,17 (2H, с), 5,16 (1H, д, J=19,2 Гц), 5,24 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,59-5,55 (1H, м), 6,53 (1H, с), 6,78 (1H, т, J=6,3 Гц), 7,30 (1H, с), 7,79 (1H, д, J=11,0 Гц), 8,40 (1H, д, J=8,6 Гц).
MS (APCI) m/z: 621 (M+H)+.
[0216]
Стадия 2: 4-Амино-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]бутанамид трифторацетат
Соединение (0,388 г, 0,61 ммоль), полученное на Стадии 1 выше, растворяли в дихлорметане (9 мл). Добавляли трифторуксусную кислоту (9 мл) и смесь перемешивали в течение 4 часов. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-разделенный органический слой хлороформ:метанол:вода=7:3:1 (об./об./об.)] с получением указанного в заголовке соединения (0,343 г, количественный выход).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,2 Гц), 1,79-1,92 (4H, м), 2,10-2,17 (2H, м), 2,27 (2H, т, J=7,0 Гц), 2,40 (3H, с), 2,80-2,86 (2H, м), 3,15-3,20 (2H, м), 5,15 (1H, д, J=18,8 Гц), 5,26 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,54-5,61 (1H, м), 6,55 (1H, с), 7,32 (1H, с), 7,72 (3H, шир.с), 7,82 (1H, д, J=11,0 Гц), 8,54 (1H, д, J=8,6 Гц).
MS (APCI) m/z: 521 (M+H)+.
[0217]
Стадия 3: N-(трет-Бутоксикарбонил)глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
N-(трет-Бутоксикарбонил)глицилглицил-L-фенилаланилглицин (0,081 г, 0,19 ммоль) растворяли в дихлорметане (3 мл), добавляли N-гидроксисукцинимид (0,021 г, 0,19 моль) и 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0,036 г, 0,19 ммоль) и затем перемешивали в течение 3,5 часов. Реакционный раствор добавляли по каплям к раствору N,N-диметилформамида (1,5 мл), содержащего соединение (0,080 г, 0,15 ммоль), полученное на Стадии 2 выше, и перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (об./об.)] с получением указанного в заголовке соединения (0,106 г, 73%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,36 (9H, с), 1,71 (2H, м), 1,86 (2H, т, J=7,8 Гц), 2,15-2,19 (4H, м), 2,40 (3H, с), 2,77 (1H, дд, J=12,7, 8,8 Гц), 3,02 (1H, дд, J=14,1, 4,7 Гц), 3,08-3,11 (2H, м), 3,16-3,19 (2H, м), 3,54 (2H, д, J=5,9 Гц), 3,57-3,77 (4H, м), 4,46-4,48 (1H, м), 5,16 (1H, д, J=19,2 Гц), 5,25 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,55-5,60 (1H, м), 6,53 (1H, с), 7,00 (1H, т, J=6,3 Гц), 7,17-7,26 (5H, м), 7,31 (1H, с), 7,71 (1H, т, J=5,7 Гц), 7,80 (1H, д, J=11,0 Гц), 7,92 (1H, т, J=5,7 Гц), 8,15 (1H, д, J=8,2 Гц), 8,27 (1H, т, J=5,5 Гц), 8,46 (1H, д, J=8,2 Гц).
MS (APCI) m/z: 939 (M+H)+.
[0218]
Стадия 4: Глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид трифторацетат
Соединение (1,97 г, 2,10 ммоль), полученное на Стадии 3 выше, растворяли в дихлорметане (7 мл). После добавления трифторуксусной кислоты (7 мл) смесь перемешивали в течение 1 часа. Растворитель удаляли при пониженном давлении и к смеси добавляли толуол для азеотропной перегонки. Полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-разделенный органический слой хлороформ:метанол:вода=7:3:1 (об/об/об)] с получением указанного в заголовке соединения (1,97 г, 99%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,71-1,73 (2H, м), 1,82-1,90 (2H, м), 2,12-2,20 (4H, м), 2,40 (3H, с), 2,75 (1H, дд, J=13,7, 9,4 Гц), 3,03-3,09 (3H, м), 3,18-3,19 (2H, м), 3,58-3,60 (2H, м), 3,64 (1H, д, J=5,9 Гц), 3,69 (1H, д, J=5,9 Гц), 3,72 (1H, д, J=5,5 Гц), 3,87 (1H, дд, J=16,8, 5,9 Гц), 4,50-4,56 (1H, м), 5,16 (1H, д, J=19,2 Гц), 5,25 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,55-5,60 (1H, м), 7,17-7,27 (5H, м), 7,32 (1H, с), 7,78-7,81 (2H, м), 7,95-7,97 (3H, м), 8,33-8,35 (2H, м), 8,48-8,51 (2H, м).
MS (APCI) m/z: 839 (M+H)+.
[0219]
Стадия 5: N-{3-[2-(2-{[3-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)пропаноил]амино}этокси)этокси]пропаноил}глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
К раствору соединения (100 мг, 0,119 ммоль), полученного на Стадии 4 выше, в N,N-диметилформамиде (1,20 мл) добавляли диизопропилэтиламин (20,8 мкл, 0,119 ммоль) и N-сукцинимидил 3-(2-(2-(3-малеинимидпропанамид)этокси)этокси)пропаноат (50,7 мг, 0,119 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=5:1 (об./об.)] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (66,5 мг, 48%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,85 (3H, т, J=7,4 Гц), 1,65-1,74 (2H, м), 1,77-1,90 (2H, м), 2,07-2,19 (4H, м), 2,30 (2H, т, J=7,2 Гц), 2,33-2,36 (2H, м), 2,38 (3H, с), 2,76 (1H, дд, J=13,7, 9,8 Гц), 2,96-3,18 (9H, м), 3,42-3,44 (4H, м), 3,53-3,76 (10H, м), 4,43 (1H, тд, J=8,6, 4,7 Гц), 5,14 (1H, д, J=18,8 Гц), 5,23 (1H, д, J=18,8 Гц), 5,38 (1H, д, J=17,2 Гц), 5,42 (1H, д, J=17,2 Гц), 5,52-5,58 (1H, м), 6,52 (1H, с), 6,98 (2H, с), 7,12-7,17 (1H, м), 7,18-7,25 (4H, м), 7,29 (1H, с), 7,69 (1H, т, J=5,5 Гц), 7,78 (1H, д, J=11,3 Гц), 7,98-8,03 (2H, м), 8,11 (1H, д, J=7,8 Гц), 8,16 (1H, т, J=5,7 Гц), 8,23 (1H, т, J=5,9 Гц), 8,44 (1H, д, J=9,0 Гц).
MS (APCI) m/z: 1149 (M+H)+.
[0220]
Стадия 6: Конъюгат антитело-лекарственное средство (1)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (10,0 мл) собирали в 50-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,317 мл; 4,6 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,500 мл). После подтверждения, что раствор имел pH 7,4±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей комнатную температуру, к смеси добавляли диметилсульфоксид (0,567 мл). Затем диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного на описанной выше Стадии 5 (0,635 мл; 9,2 эквивалентов на молекулу антитела), добавляли к смеси и перемешивали с использованием цилиндрического вращающего устройства (MTR-103, изготовитель AS ONE Corporation) для конъюгирования лекарственного средства-линкера с антителом при комнатной температуре в течение 40 минут. Затем к смеси добавляли водный раствор (0,127 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре еще в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 35,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=4964 (измеренное среднее значение) и εD,370=18982 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,70 мг/мл, выход антитела: 94,5 мг (95%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 6,6.
[0221]
[Пример 10: Получение hTINA1-H1L1 ADC (2)]
[0222]
[Формула 26]
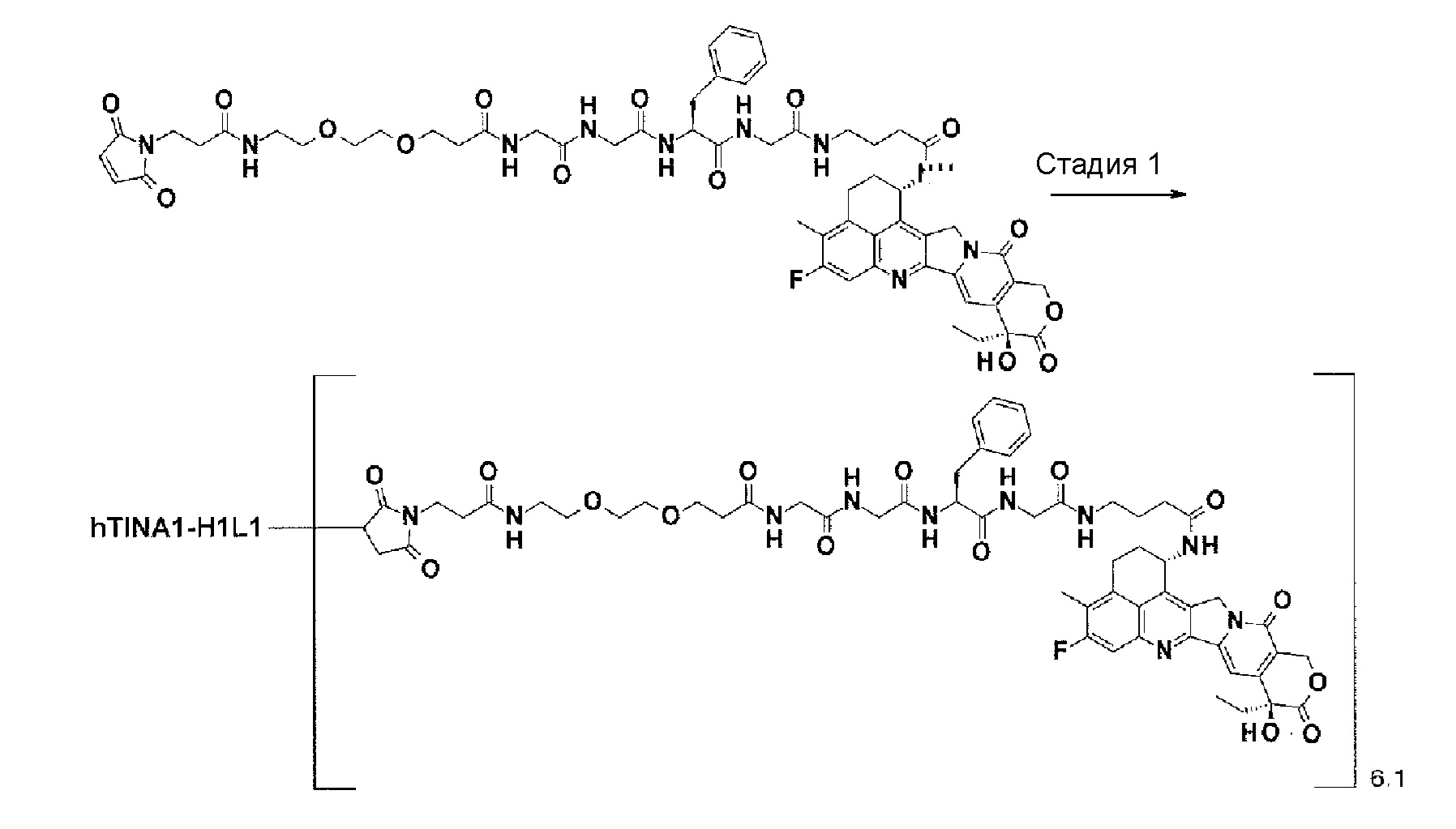
[0223]
Стадия 1: Конъюгат антитело-лекарственное средство (2)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (2,00 мл) собирали в 4-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0690 мл; 5,0 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,100 мл). После подтверждения, что раствор имел pH 7,4±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, к смеси добавляли диметилсульфоксидный раствор (0,127 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 5 Примера 9, и инкубировали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0190 мл; 13,8 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали с использованием цилиндрического вращающего устройства для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 9,00 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=4964 (измеренное среднее значение) и εD,370=18982 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,08 мг/мл, выход антитела: 18,7 мг (94%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 6,1.
[0224]
[Пример 11: Получение hTINA1-H1L1 ADC (3)]
[0225]
[Формула 27]
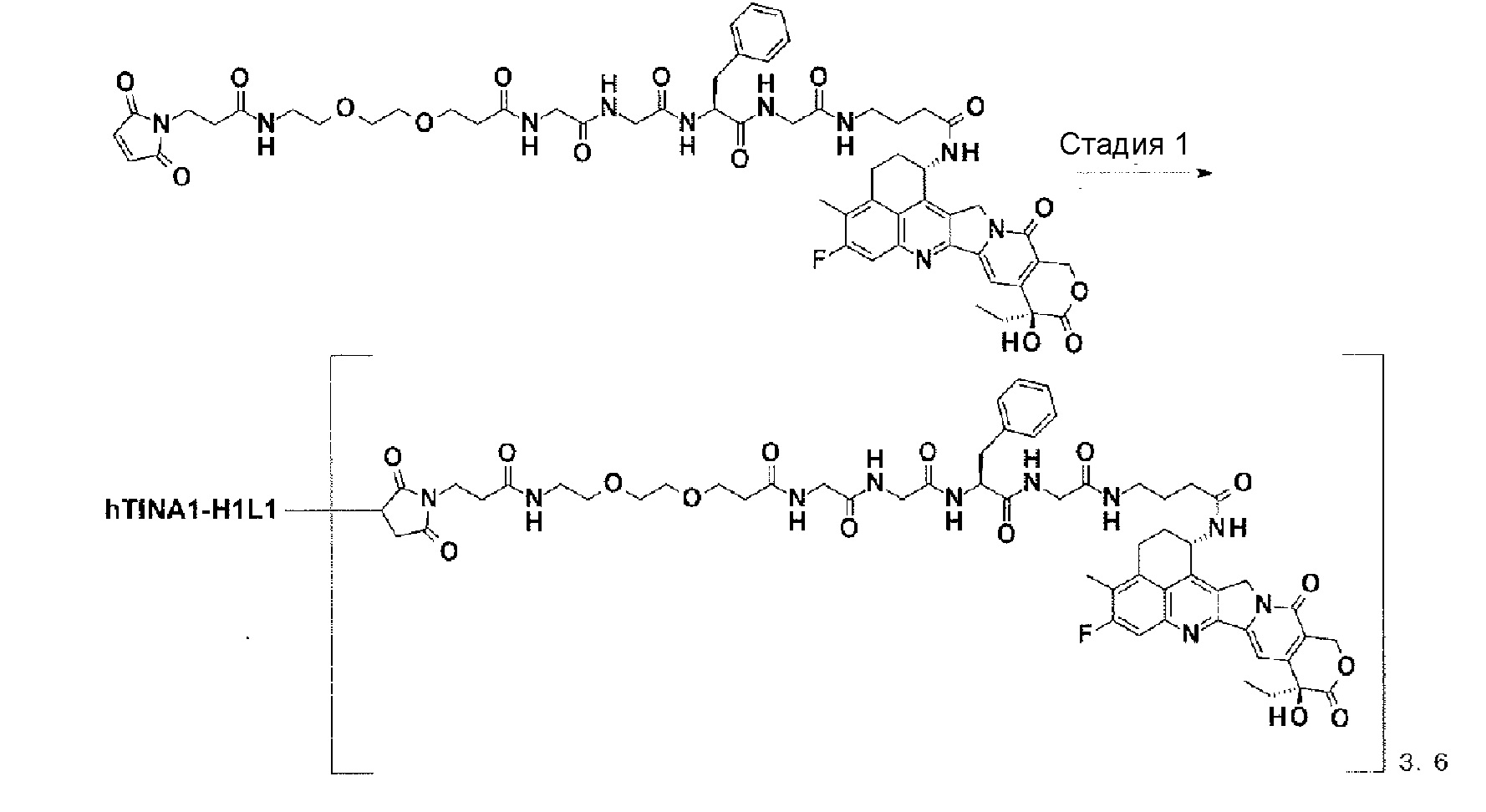
[0226]
Стадия 1: Конъюгат антитело-лекарственное средство (3)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (5,0 мл) собирали 15-мл контейнер, добавляли водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0813 мл) при перемешивании и затем перемешивали при 37°C в течение 10 минут. После добавления к смеси водного раствора 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0745 мл; 2,3 эквивалентов на молекулу антитела) при перемешивании и затем подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем перемешивания при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После перемешивания указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, постепенно добавляли по каплям диметилсульфоксидный раствор (0,162 мл; 5,0 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 5 Примера 9, и перемешивали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0418 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 21,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общих процедур E и F, описанных в Способе получения 1 (использовали εD,280=4964 (измеренное среднее значение) и εD,370=18982 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,19 мг/мл, выход антитела: 46,0 мг (92%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 3,6, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 3,6.
[0227]
[Пример 12: Получение hTINA1-H1L1 ADC (4)]
[0228]
[Формула 28]
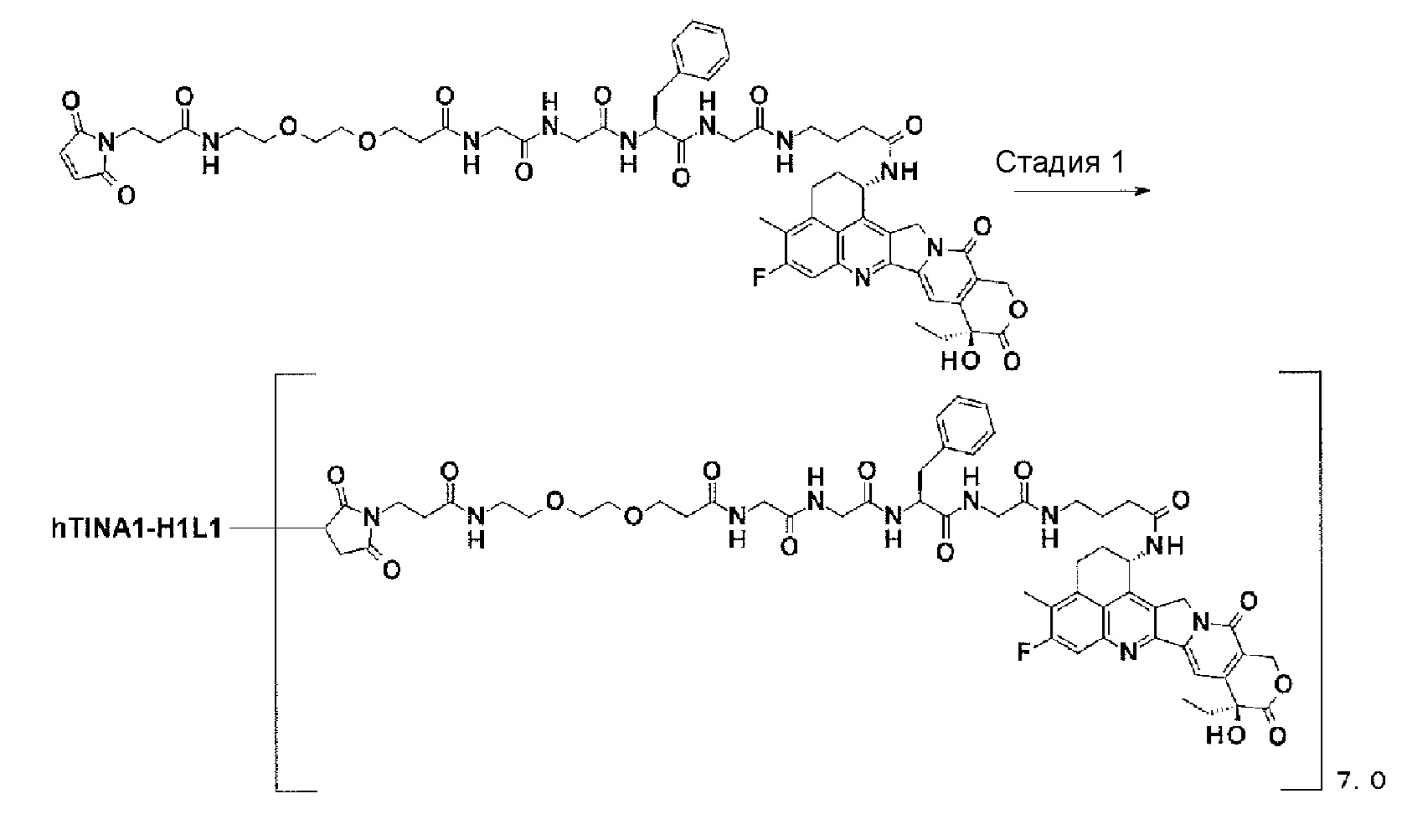
[0229]
Стадия 1: Конъюгат антитело-лекарственное средство (4)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10,0 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (5,00 мл) собирали в 15-мл контейнер, добавляли водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0813 мл) при перемешивании и затем перемешивали при 37°C в течение 10 минут. После добавления к смеси водного раствора 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,162 мл; 5,0 эквивалентов на молекулу антитела) при перемешивании и затем подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем перемешивания при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После перемешивания указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, постепенно добавляли по каплям диметилсульфоксидный раствор (0,389 мл; 12,0 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 5 Примера 9, и перемешивали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0418 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 21,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общих процедур E и F, описанных в Способе получения 1 (использовали εD,280=4964 (измеренное среднее значение) и εD,370=18982 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,19 мг/мл, выход антитела: 46,0 мг (92%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 7,0, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 7,0.
[0230]
[Ссылочный Пример 13: Получение hRS7 ADC (5)]
[0231]
[Формула 29]
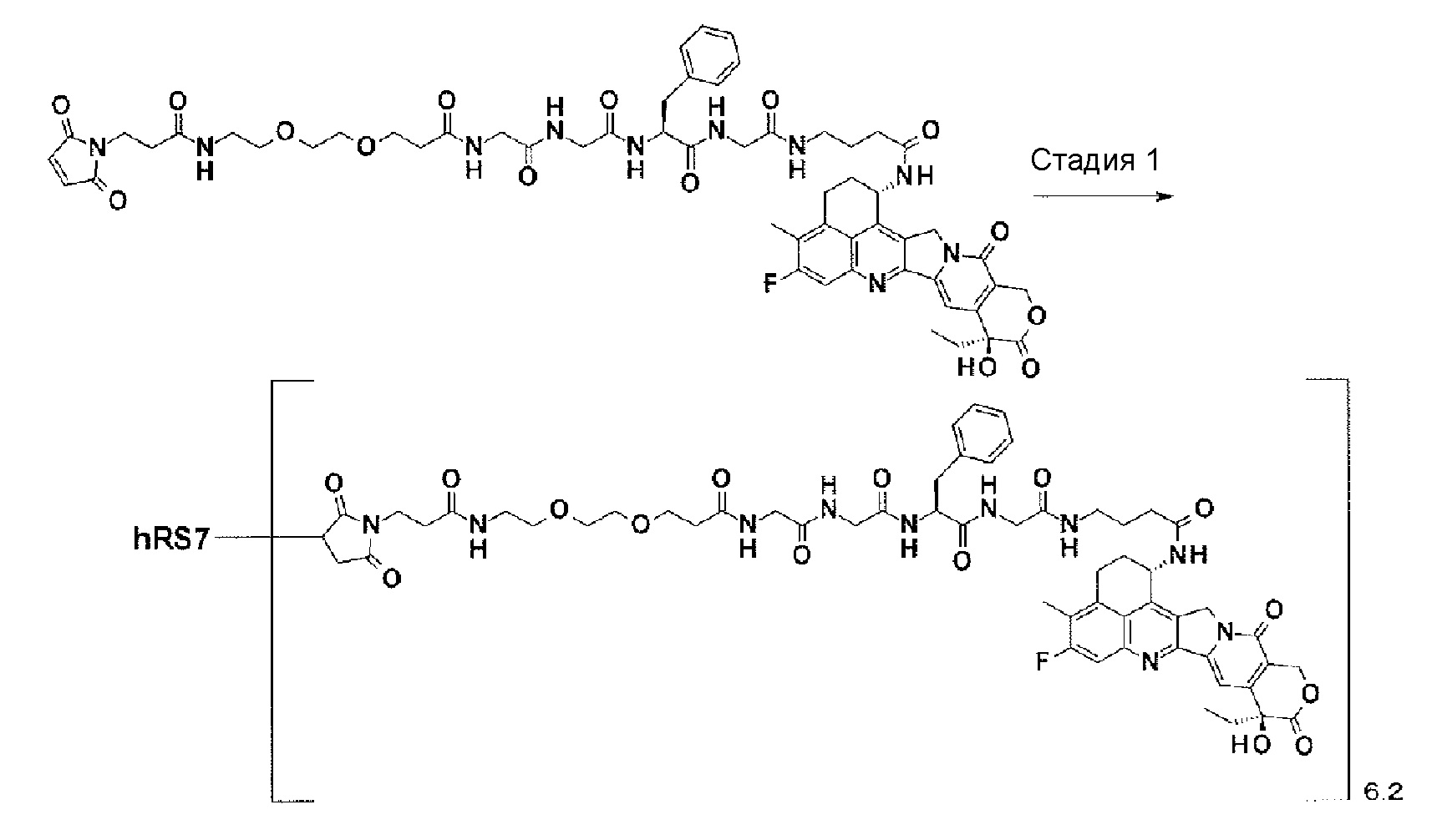
[0232]
Стадия 1: Конъюгат антитело-лекарственное средство (5)
Восстановление антитела: Получали раствор hRS7, полученного в Ссылочном Примере 1, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,56) и Общей процедуры C, описанной в Способе получения 1. Раствор (2,0 мл) собирали в 4-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0690 мл; 5,0 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,100 мл). После подтверждения, что раствор имел pH 7,4±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, к смеси добавляли диметилсульфоксидный раствор (0,127 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 5 Примера 9, и инкубировали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0190 мл; 13,8 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали с использованием цилиндрического вращающего устройства для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 9,00 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=4964 (измеренное среднее значение) и εD,370=18982 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,04 мг/мл, выход антитела: 18,4 мг (92%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 6,2.
[0233]
[Пример 14: Получение hTINA1-H1L1 ADC (6)]
[0234]
[Формула 30]
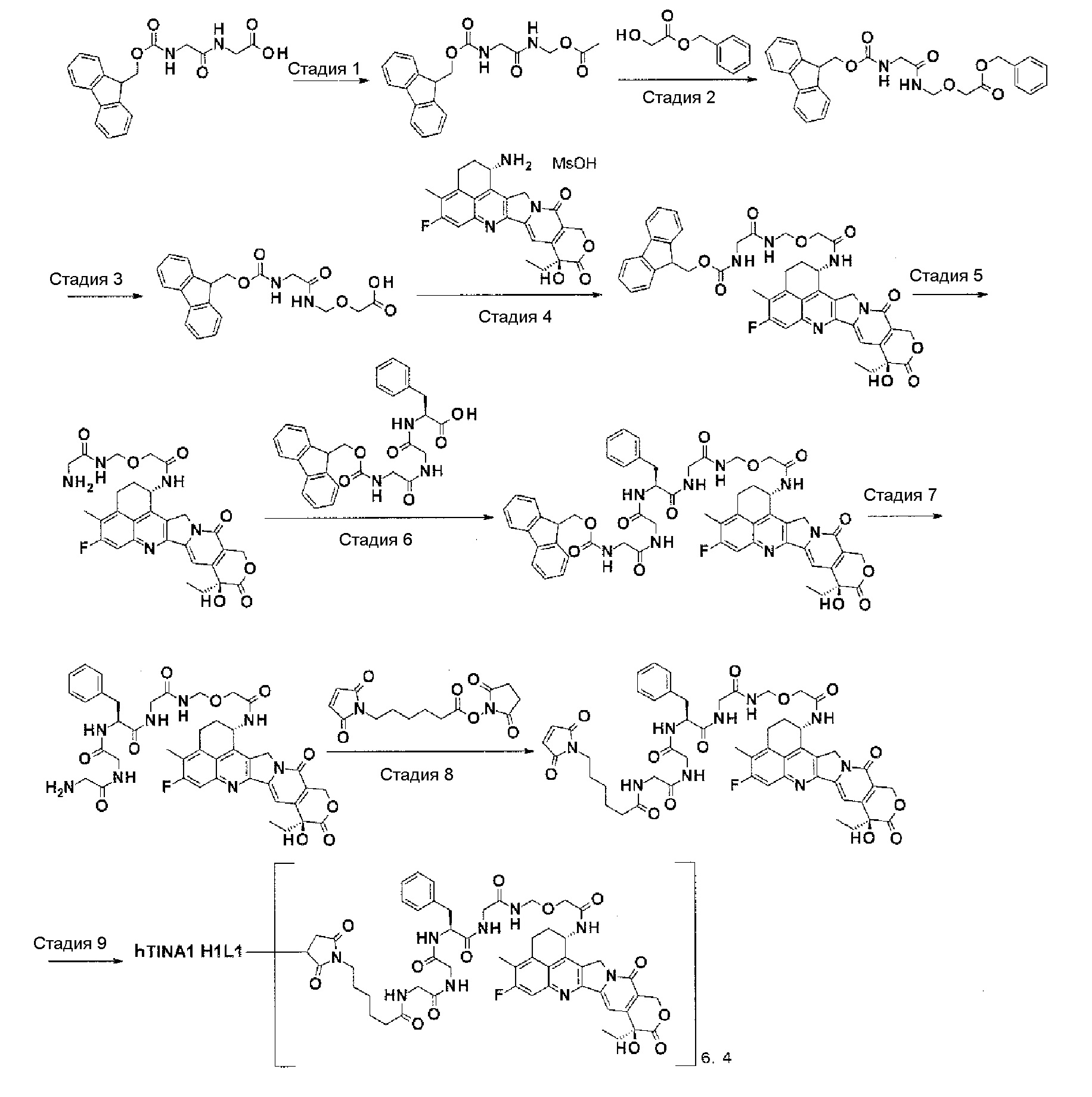
[0235]
Стадия 1: ({N-[(9H-Флуорен-9-илметокси)карбонил]глицил}амино)метилацетат
К смеси, содержащей N-9-флуоренилметоксикарбонилглицилглицин (4,33 г, 12,2 ммоль), тетрагидрофуран (120 мл) и толуол (40,0 мл), добавляли пиридин (1,16 мл, 14,7 ммоль) и тетраацетат свинца (6,84 г, 14,7 ммоль) и нагревали при температуре кипения с обратным холодильником в течение 5 часов. После охлаждения реакционного раствора до комнатной температуры нерастворимые вещества удаляли фильтрованием через Целит и концентрировали при пониженном давлении. Полученные остатки растворяли в этилацетате и промывали водой и насыщенным солевым раствором и затем органический слой сушили над безводным сульфатом магния. После удаления растворителя при пониженном давлении полученные остатки очищали колоночной хроматографией на силикагеле [гексан:этилацетат=9:1 (об./об.)-этилацетат] с получением указанного в заголовке соединения в виде бесцветного твердого вещества (3,00 г, 67%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,07 (3H, с), 3,90 (2H, д, J=5,1 Гц), 4,23 (1H, т, J=7,0 Гц), 4,46 (2H, д, J=6,6 Гц), 5,26 (2H, д, J=7,0 Гц), 5,32 (1H, шир.с), 6,96 (1H, шир.с), 7,32 (2H, т, J=7,3 Гц), 7,41 (2H, т, J=7,3 Гц), 7,59 (2H, д, J=7,3 Гц), 7,77 (2H, д, J=7,3 Гц).
[0236]
Стадия 2: Бензил [({N-[(9H-Флуорен-9-илметокси)карбонил]глицил}амино)метокси]ацетат
К раствору в тетрагидрофуране (40,0 мл) соединения (3,68 г, 10,0 ммоль), полученного на Стадии 1 выше, и бензилгликолята (4,99 г, 30,0 ммоль), добавляли трет-бутоксид калия (2,24 г, 20,0 ммоль) при 0°C и перемешивали при комнатной температуре в течение 15 минут. К реакционному раствору добавляли этилацетат и воду при 0°C и экстрагировали этилацетатом и хлороформом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Полученные остатки растворяли в диоксане (40,0 мл) и воде (10,0 мл), добавляли гидрокарбонат натрия (1,01 г, 12,0 ммоль) и 9-флуоренилметилхлороформиат (2,59 г, 10,0 ммоль) и перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [гексан:этилацетат=100:0 (об./об.)-0:100] с получением указанного в заголовке соединения в бесцветного маслянистого вещества (1,88 г, 40%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,84 (2H, д, J=5,5 Гц), 4,24 (3H, т, J=6,5 Гц), 4,49 (2H, д, J=6,7 Гц), 4,88 (2H, д, J=6,7 Гц), 5,15-5,27 (1H, м), 5,19 (2H, с), 6,74 (1H, шир.с), 7,31-7,39 (7H, м), 7,43 (2H, т, J=7,4 Гц), 7,61 (2H, д, J=7,4 Гц), 7,79 (2H, д, J=7,4 Гц).
[0237]
Стадия 3: [({N-[(9H-Флуорен-9-илметокси)карбонил]глицил}амино)метокси]уксусная кислота
Соединение (1,88 г, 3,96 ммоль), полученное на Стадии 2 выше, растворяли в этаноле (40,0 мл) и этилацетате (20,0 мл). После добавления катализатор палладия на углероде (376 мг) смесь перемешивали в атмосфере водород при комнатной температуре в течение 2 часов. Нерастворимые вещества удаляли фильтрованием через Целит и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного твердого вещества (1,52 г, количественный выход).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 3,62 (2H, д, J=6,3 Гц), 3,97 (2H, с), 4,18-4,32 (3H, м), 4,60 (2H, д, J=6,7 Гц), 7,29-7,46 (4H, м), 7,58 (1H, т, J=5,9 Гц), 7,72 (2H, д, J=7,4 Гц), 7,90 (2H, д, J=7,4 Гц), 8,71 (1H, т, J=6,5 Гц).
[0238]
Стадия 4: 9H-Флуорен-9-илметил(2-{[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]амино}-2-оксоэтил)карбамат
При охлаждении льдом, к раствору экзатекан мезилата (0,283 г, 0,533 ммоль), N-гидроксисукцинимида (61,4 мг, 0,533 ммоль) и соединения (0,205 г, 0,533 ммоль), полученное на Стадии 3 выше, в N,N-диметилформамиде (10,0 мл) добавляли N,N-диизопропилэтиламин (92,9 мкл, 0,533 ммоль) и N,N'-дициклогексилкарбодиимид (0,143 г, 0,693 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-разделенный органический слой хлороформ:метанол:вода=7:3:1 (об./об./об.)] с получением указанного в заголовке соединения в виде бледно-коричневого твердого вещества (0,352 г, 82%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,81 (3H, т, J=7,4 Гц), 1,73-1,87 (2H, м), 2,06-2,20 (2H, м), 2,34 (3H, с), 3,01-3,23 (2H, м), 3,58 (2H, д, J=6,7 Гц), 3,98 (2H, с), 4,13-4,25 (3H, м), 4,60 (2H, д, J=6,7 Гц), 5,09-5,22 (2H, м), 5,32-5,42 (2H, м), 5,50-5,59 (1H, м), 6,49 (1H, с), 7,24-7,30 (3H, м), 7,36 (2H, т, J=7,4 Гц), 7,53 (1H, т, J=6,3 Гц), 7,66 (2H, д, J=7,4 Гц), 7,75 (1H, д, J=11,0 Гц), 7,84 (2H, д, J=7,4 Гц), 8,47 (1H, д, J=8,6 Гц), 8,77 (1H, т, J=6,7 Гц).
MS (ESI) m/z: 802 (M+H)+.
[0239]
Стадия 5: N-[(2-{[(1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,881 г, 1,10 ммоль), полученного на Стадии 4 выше, в N,N-диметилформамиде (11,0 мл) добавляли пиперидин (1,1 мл) и перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении с получением смеси, содержащей указанное в заголовке соединение. Смесь использовали для следующей реакции без дополнительной очистки.
[0240]
Стадия 6: N-[(9H-Флуорен-9-илметокси)карбонил]глицилглицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
При охлаждении льдом к раствору в N,N-диметилформамиде (50,0 мл) смеси (0,439 ммоль), полученной на Стадии 5 выше, N-гидроксисукцинимида (0,101 г, 0,878 ммоль) и N-[(9H-флуорен-9-илметокси)карбонил]глицилглицил-L-фенилаланина (Японская выложенная патентная заявка № 2002-60351; 0,440 г, 0,878 ммоль), добавляли N,N'-дициклогексилкарбодиимид (0,181 г, 0,878 ммоль) и перемешивали при комнатной температуре в течение 4 дней. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (об./об.)] с получением указанного в заголовке соединения в виде бледно-оранжевого твердого вещества (0,269 г, 58%).
MS (ESI) m/z: 1063 (M+H)+.
[0241]
Стадия 7: Глицилглицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,269 г, 0,253 ммоль), полученного на Стадии 6 выше, в N,N-диметилформамиде (4,00 мл) добавляли пиперидин (0,251 мл, 2,53 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении с получением смеси, содержащей указанное в заголовке соединение. Смесь использовали для следующей реакции без дополнительной очистки.
[0242]
Стадия 8: N-[6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицилглицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,253 ммоль), полученного на Стадии 7 выше, в N,N-диметилформамиде (10,0 мл) добавляли N-сукцинимидил 6-малеимид гексаноат (0,156 г, 0,506 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Растворитель удаляли при пониженном давлении и полученные остатки очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (об./об.)] с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (0,100 г, 38%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,83 (3H, т, J=7,2 Гц), 1,09-1,21 (2H, м), 1,33-1,47 (4H, м), 1,75-1,90 (2H, м), 2,00-2,23 (4H, м), 2,36 (3H, с), 2,69-2,81 (1H, м), 2,94-3,03 (1H, м), 3,06-3,22 (2H, м), 3,23-3,74 (8H, м), 3,98 (2H, с), 4,39-4,50 (1H, м), 4,60 (2H, д, J=6,7 Гц), 5,17 (2H, с), 5,39 (2H, с), 5,53-5,61 (1H, м), 6,50 (1H, с), 6,96 (2H, с), 7,11-7,24 (5H, м), 7,28 (1H, с), 7,75 (1H, д, J=11,0 Гц), 7,97 (1H, т, J=5,7 Гц), 8,03 (1H, т, J=5,9 Гц), 8,09 (1H, д, J=7,8 Гц), 8,27 (1H, т, J=6,5 Гц), 8,48 (1H, д, J=9,0 Гц), 8,60 (1H, т, J=6,5 Гц).
MS (ESI) m/z: 1034 (M+H)+.
[0243]
Стадия 9: Конъюгат антитело-лекарственное средство (6)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (10,0 мл) собирали в 50-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,317 мл; 4,6 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,500 мл). После подтверждения, что раствор имел pH 7,4±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей обычную температуру, к смеси добавляли диметилсульфоксид (0,567 мл). Затем к смеси добавляли диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного на описанной выше Стадии 8 (0,635 мл; 9,2 эквивалентов на молекулу антитела), и перемешивали с использованием цилиндрического вращающего устройства для конъюгирования лекарственного средства-линкера с антителом при комнатной температуре в течение 40 минут. Затем к смеси добавляли водный раствор (0,127 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре еще в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 35,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=5178 (измеренное среднее значение) и εD,370=20217 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,70 мг/мл, выход антитела: 94,5 мг (95%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 6,4.
[0244]
[Пример 15: Получение hTINA1-H1L1 ADC (7)]
[0245]
[Формула 31]
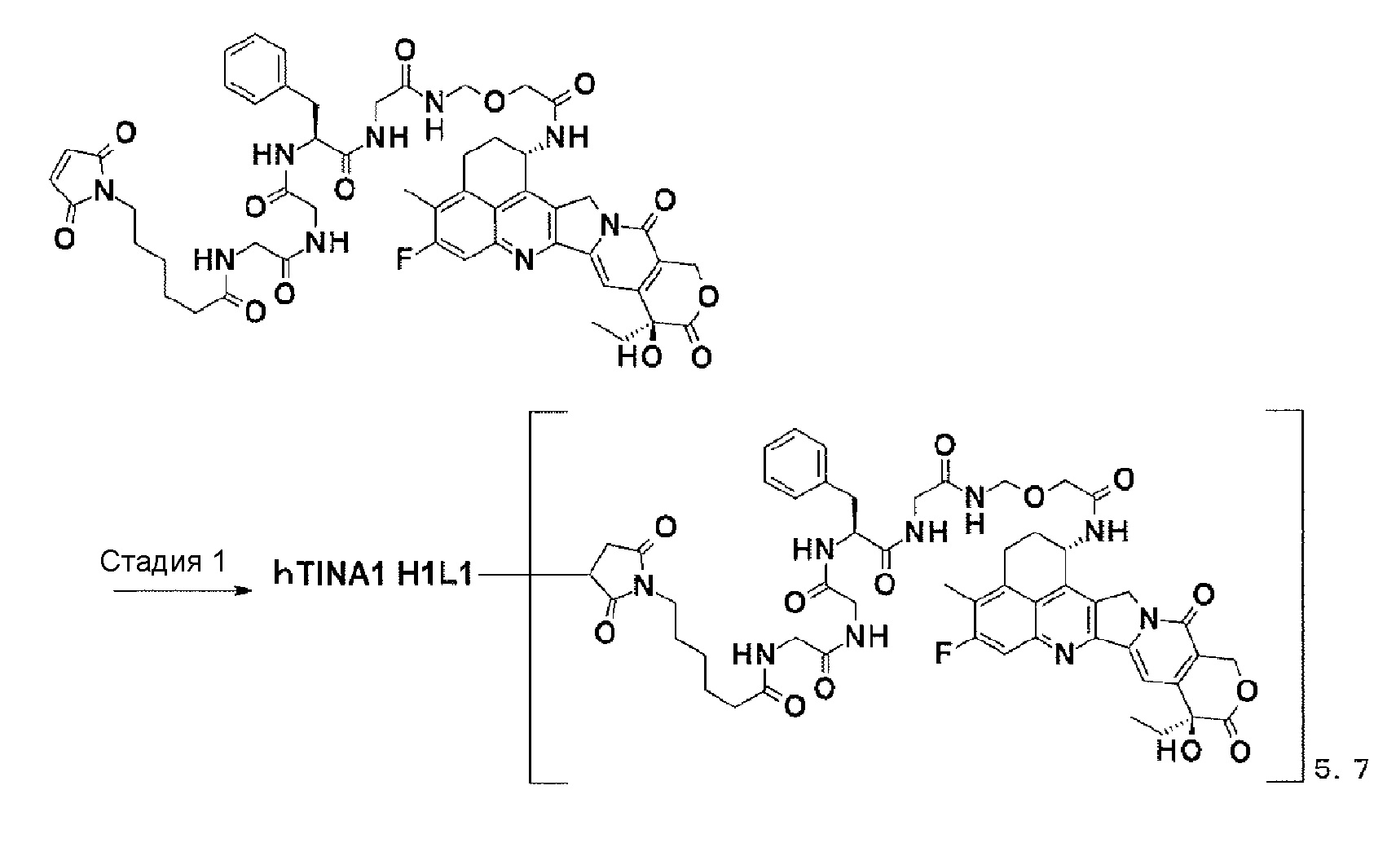
[0246]
Стадия 1: Конъюгат антитело-лекарственное средство (7)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (2,0 мл) собирали в 4-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0690 мл; 5,0 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0299 мл). После подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, к смеси добавляли диметилсульфоксидный раствор (0,127 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 8 Примера 14, и инкубировали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0190 мл; 13,8 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали с использованием цилиндрического вращающего устройства для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 9,00 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=5178 (измеренное среднее значение) и εD,370=20217 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,04 мг/мл, выход антитела: 18,4 мг (92%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 5,7.
[0247]
[Пример 16: Получение hTINA1-H1L1 ADC (8)]
[0248]
[Формула 32]
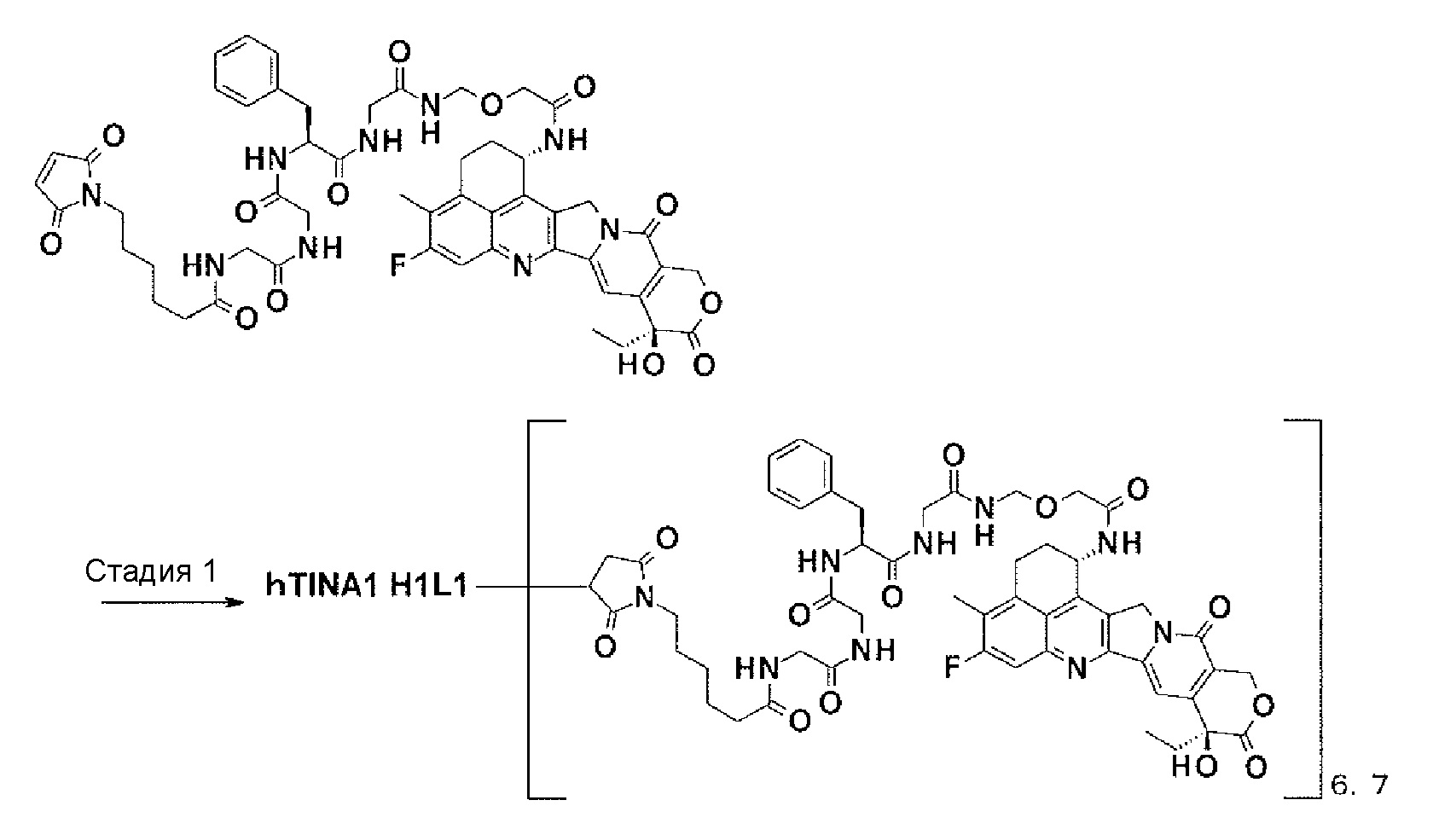
[0249]
Стадия 1: Конъюгат антитело-лекарственное средство (8)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (30,0 мл) собирали в 100-мл контейнер, добавляли водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,4875 мл) при перемешивании и затем перемешивали при 37°C в течение 10 минут. После добавления к смеси водного раствора 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,9721 мл; 5,0 эквивалентов на молекулу антитела) при перемешивании и затем подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем перемешивания при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После перемешивания указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, постепенно добавляли по каплям диметилсульфоксидный раствор (2,33 мл; 12,0 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 8 Примера 14, и перемешивали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,251 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 98,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство. Затем раствор концентрировали в соответствии с Общей процедурой A, описанной в Способе получения 1, с получением 17,5 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общих процедур E и F, описанных в Способе получения 1 (использовали εD,280=5178 (измеренное среднее значение) и εD,370=20217 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 14,6 мг/мл, выход антитела: 256 мг (85%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 6,7, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 7,0.
[0250]
[Пример 17: Получение hTINA1-H1L1 ADC (9)]
[0251]
[Формула 33]
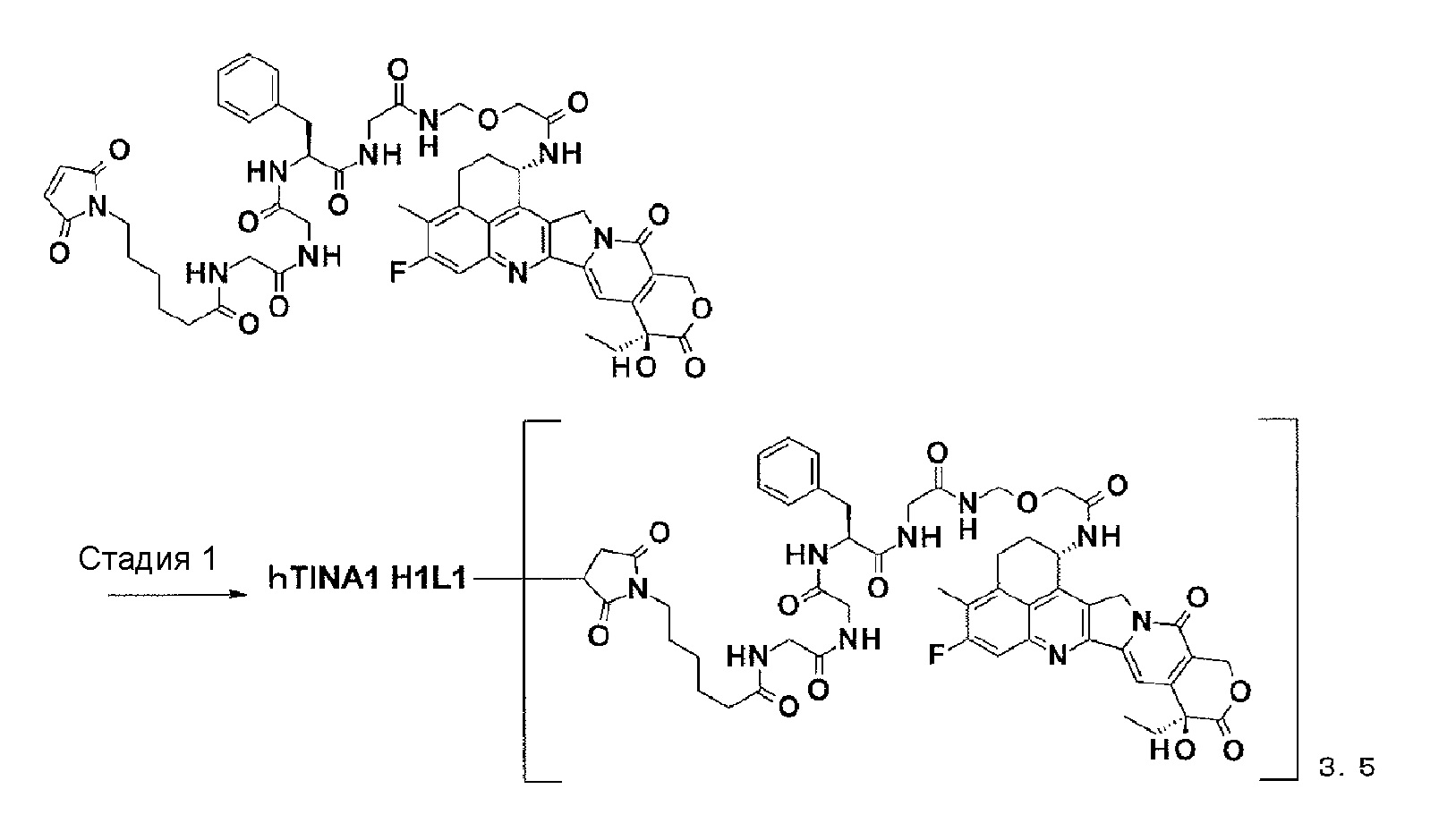
[0252]
Стадия 1: Конъюгат антитело-лекарственное средство (9)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (5,0 мл) собирали в 15-мл контейнер, добавляли водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0813 мл) при перемешивании и затем перемешивали при 37°C в течение 10 минут. После добавления к смеси водного раствора 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0778 мл; 2,4 эквивалентов на молекулу антитела) при перемешивании и затем подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем перемешивания при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После перемешивания указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, постепенно добавляли по каплям диметилсульфоксидный раствор (0,162 мл; 5,0 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 8 Примера 14, и перемешивали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0418 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 21,0 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общих процедур E и F, описанных в Способе получения 1 (использовали εD,280=5178 (измеренное среднее значение) и εD,370=20217 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,26 мг/мл, выход антитела: 47,5 мг (95%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 3,5, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 3,6.
[0253]
[Ссылочный Пример 18: Получение hRS7 ADC (10)]
[0254]
[Формула 34]
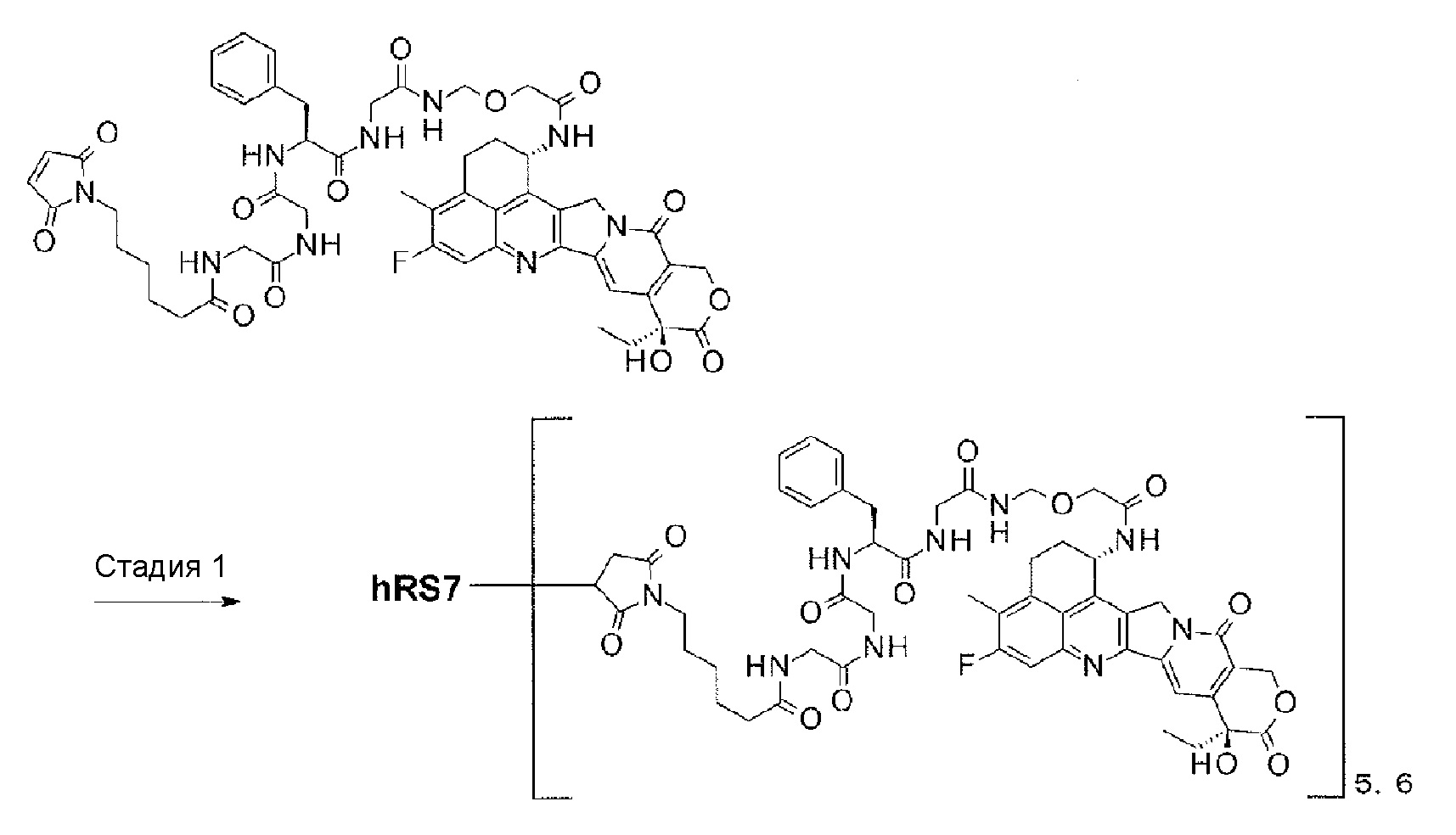
[0255]
Стадия 1: Конъюгат антитело-лекарственное средство (10)
Восстановление антитела: Получали раствор hRS7, полученного в Ссылочном Примере 1, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,56) и Общей процедуры C, описанной в Способе получения 1. Раствор (2,0 мл) собирали в 4-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0690 мл; 5,0 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0299 мл). После подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, к смеси добавляли диметилсульфоксидный раствор (0,1269 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 8 Примера 14, и инкубировали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C в течение 1 часа. Затем к смеси добавляли водный раствор (0,0190 мл; 13,8 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали с использованием цилиндрического вращающего устройства для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 9,00 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1 (использовали εD,280=5178 (измеренное среднее значение) и εD,370=20217 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 2,07 мг/мл, выход антитела: 18,6 мг (93%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 5,6.
[0256]
[Пример 19: Получение hTINA1-H1L1 ADC (11)]
[0257]
[Формула 35]
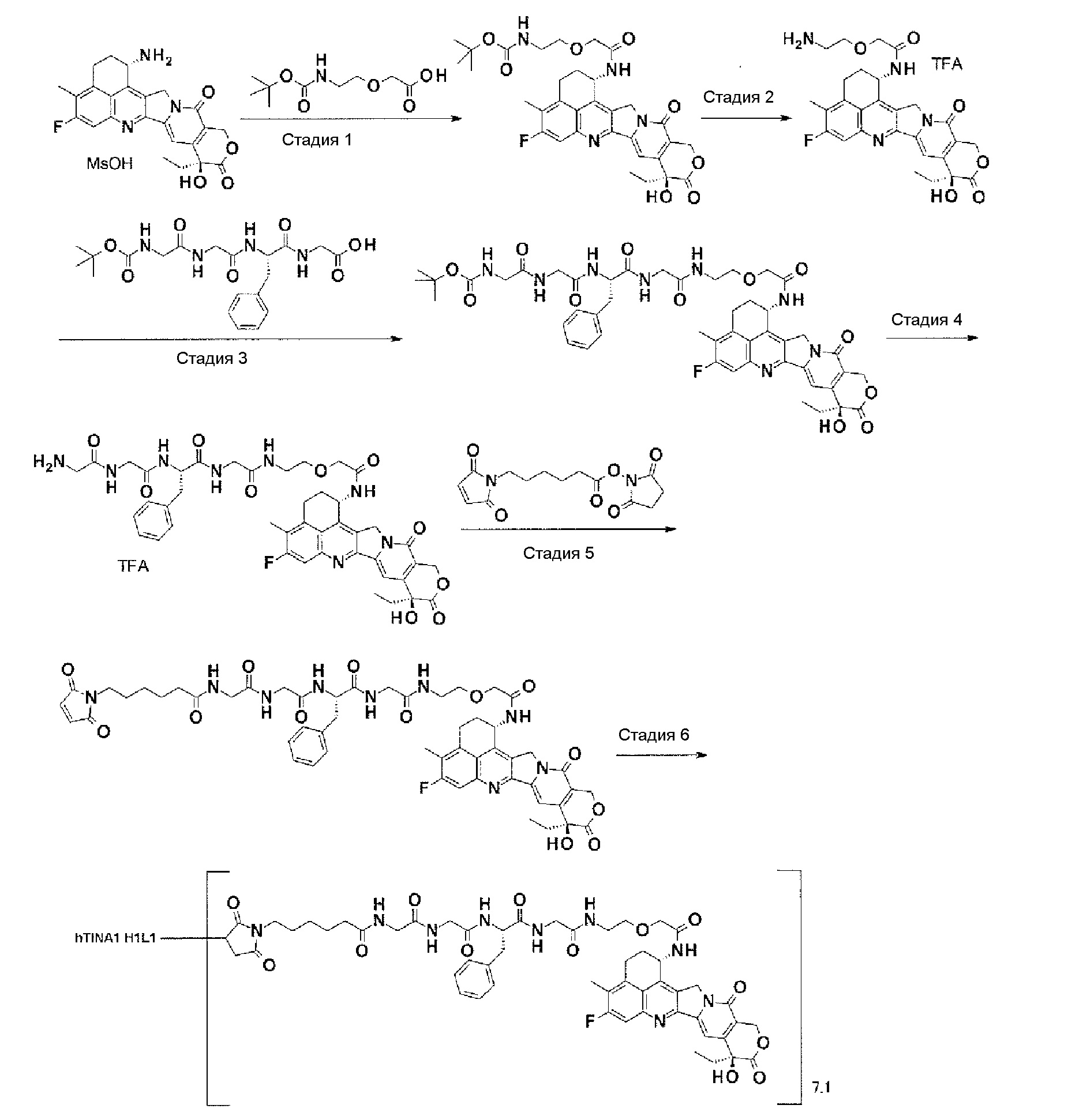
[0258]
Стадия 1: трет-Бутил [2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]карбамат
Осуществляли взаимодействие экзатекан мезилата (3,10 г, 5,47 моль) таким же способом, как на Стадии 1 Примера 1, с использованием {2-[(трет-бутоксикарбонил)амино]этокси}уксусной кислоты (J. Med. Chem., 1992, Vol. 35, p. 2928; 1,55 г, 6,01 ммоль) вместо 4-(трет-Бутоксикарбониламино)бутановой кислоты с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (2,56 г, 73%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,3 Гц), 1,26 (9H, с), 1,81-1,91 (2H, м), 2,13-2,22 (2H, м), 2,40 (3H, с), 3,08-3,26 (4H, м), 3,43-3,53 (2H, м), 4,00 (1H, д, J=15,1 Гц), 4,05 (1H, д, J=15,1 Гц), 5,14 (1H, д, J=18,7 Гц), 5,22 (1H, д, J=18,7 Гц), 5,40 (1H, д, J=16,6 Гц), 5,44 (1H, д, J=16,6 Гц), 5,59-5,66 (1H, м), 6,53 (1H, с), 6,86 (1H, т, J=5,4 Гц), 7,31 (1H, с), 7,79 (1H, д, J=10,9 Гц), 8,49 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 637 (M+H)+.
[0259]
Стадия 2: 2-(2-Аминоэтокси)-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]ацетамид трифторацетат
Осуществляли взаимодействие соединения (1,50 г, 2,36 моль), полученного на Стадии 1 выше, таким же способом, как на Стадии 2 Примера 1, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (1,50 г, количественный выход).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,87 (3H, т, J=7,5 Гц), 1,81-1,92 (2H, м), 2,15-2,23 (2H, м), 2,41 (3H, с), 3,05 (2H, т, J=5,1 Гц), 3,15-3,23 (2H, м), 3,71 (2H, т, J=5,1 Гц), 4,10 (2H, с), 5,19 (1H, д, J=18,7 Гц), 5,24 (1H, д, J=18,7 Гц), 5,43 (2H, с), 5,58-5,66 (1H, м), 6,55 (1H, с), 7,33 (1H, с), 7,73-7,84 (4H, м), 8,55 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 537 (M+H)+.
[0260]
Стадия 3: N-(трет-Бутоксикарбонил)глицилглицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид
Осуществляли взаимодействие соединения (554 мг, 0,85 ммоль), полученного на Стадии 2 выше, таким же способом, как на Стадии 3 Примера 1, с получением указанного в заголовке соединения (775 мг, 95%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,85 (3H, т, J=7,3 Гц), 1,36 (9H, с), 1,78-1,89 (2H, м), 2,13-2,22 (2H, м), 2,39 (3H, с), 2,71 (1H, дд, J=13,4, 9,8 Гц), 2,95 (1H, дд, J=13,4, 4,3 Гц), 3,09-3,23 (1H, м), 3,23-3,32 (2H, м), 3,40-3,62 (8H, м), 3,73 (1H, дд, J=16,5, 5,5 Гц), 4,03 (2H, с), 4,39-4,47 (1H, м), 5,17 (1H, д, J=18,9 Гц), 5,25 (1H, д, J=18,9 Гц), 5,41 (1H, д, J=16,8 Гц), 5,45 (1H, д, J=16,8 Гц), 5,57-5,64 (1H, м), 6,54 (1H, с), 6,99 (1H, т, J=5,8 Гц), 7,13-7,26 (5H, м), 7,31 (1H, с), 7,76-7,82 (2H, м), 7,90 (1H, т, J=5,2 Гц), 8,13 (1H, д, J=7,9 Гц), 8,27 (1H, т, J=5,8 Гц), 8,49 (1H, д, J=8,5 Гц).
MS (APCI) m/z: 955 (M+H)+.
[0261]
Стадия 4: Глицилглицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид трифторацетат
Осуществляли взаимодействие соединения (630 мг, 0,659 ммоль), полученного на Стадии 3 выше, таким же способом, как на Стадии 4 Примера 1, с получением указанного в заголовке соединения (588 мг, 92%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,86 (3H, т, J=7,3 Гц), 1,79-1,90 (2H, м), 2,13-2,22 (2H, м), 2,39 (3H, с), 2,71 (1H, дд, J=13,4, 10,1 Гц), 2,99 (1H, дд, J=13,4, 4,3 Гц), 3,09-3,23 (1H, м), 3,24-3,32 (3H, м), 3,41-3,71 (7H, м), 3,86 (1H, дд, J=16,8, 5,8 Гц), 4,04 (2H, с), 4,52 (1H, тд, J=9,0, 4,1 Гц), 5,17 (1H, д, J=18,9 Гц), 5,25 (1H, д, J=18,9 Гц), 5,41 (1H, д, J=16,5 Гц), 5,45 (1H, д, J=16,5 Гц), 5,56-5,65 (1H, м), 6,55 (1H, с), 7,13-7,26 (5H, м), 7,32 (1H, с), 7,80 (1H, д, J=11,0 Гц), 7,87-8,01 (4H, м), 8,29-8,36 (2H, м), 8,46-8,55 (2H, м).
MS (APCI) m/z: 855 (M+H)+.
[0262]
Стадия 5: N-[6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицилглицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид
Осуществляли взаимодействие соединения (240 мг, 0,247 ммоль), полученного на Стадии 4 выше, таким же способом, как на Стадии 5 Примера 1, с использованием триэтиламина (31,4 мкл, 0,22 ммоль) вместо диизопропилэтиламина и с использованием N-сукцинимидил 6-малеимидгексаноата (95,3 мг, 0,31 ммоль) вместо N-сукцинимидил 3-(2-(2-(3-малеинимидпропанамид)этокси)этокси)пропаноата, с получением указанного в заголовке соединения (162 мг, 62%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 0,86 (3H, т, J=7,6 Гц), 1,13-1,22 (2H, м), 1,40-1,51 (4H, м), 1,78-1,90 (2H, м), 2,09 (2H, т, J=7,6 Гц), 2,14-2,21 (2H, м), 2,39 (3H, с), 2,74 (1H, дд, J=13,6, 9,7 Гц), 2,96 (1H, дд, J=13,6, 4,5 Гц), 3,08-3,24 (1H, м), 3,24-3,30 (1H, м), 3,33-3,40 (4H, м), 3,47-3,68 (7H, м), 3,72 (1H, дд, J=16,6, 5,7 Гц), 4,03 (2H, с), 4,42 (1H, тд, J=8,6, 4,2 Гц), 5,17 (1H, д, J=18,7 Гц), 5,25 (1H, д, J=18,7 Гц), 5,40 (1H, д, J=17,2 Гц), 5,44 (1H, д, J=17,2 Гц), 5,57-5,64 (1H, м), 6,52 (1H, с), 6,99 (2H, с), 7,13-7,25 (5H, м), 7,31 (1H, с), 7,74-7,81 (2H, м), 7,99 (1H, т, J=5,7 Гц), 8,03-8,11 (2H, м), 8,22 (1H, т, J=5,7 Гц), 8,47 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 1048 (M+H)+.
[0263]
Стадия 6: Конъюгат антитело-лекарственное средство (11)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (3,0 мл) собирали в 15-мл контейнер, добавляли водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,0488 мл) при перемешивании и затем перемешивали при 37°C в течение 10 минут. После добавления к смеси водного раствора 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,0972 мл; 5,0 эквивалентов на молекулу антитела) при перемешивании и затем подтверждения, что раствор имел pH 7,0±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем перемешивания при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После перемешивания указанного выше раствора в течение 10 минут на водяной бане, имеющей температуру 15°C, постепенно добавляли по каплям диметилсульфоксидный раствор (0,2333 мл; 12,0 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного на Стадии 8 Примера 11, и перемешивали для конъюгирования лекарственного средства-линкера с антителом на водяной бане, имеющей температуру 15°C, в течение 1 часа. Затем к смеси добавляли водный раствор (0,0251 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре в течение 20 минут.
Очистка: Полученный раствор подвергали очистке с использованием Общей процедуры D, описанной в Способе получения 1, с получением 14 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общих процедур E и F, описанных в Способе получения 1 (использовали εD,280=5193 (измеренное среднее значение) и εD,370=20347 (измеренное среднее значение)), получали следующие характеристические значения.
Концентрация антитела: 1,93 мг/мл, выход антитела: 27,0 мг (90%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 7,1, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 7,0.
[0264]
[Ссылочный Пример 2: Получение hRS7-CL2A-SN38 (12)]
[0265]
[Формула 36]
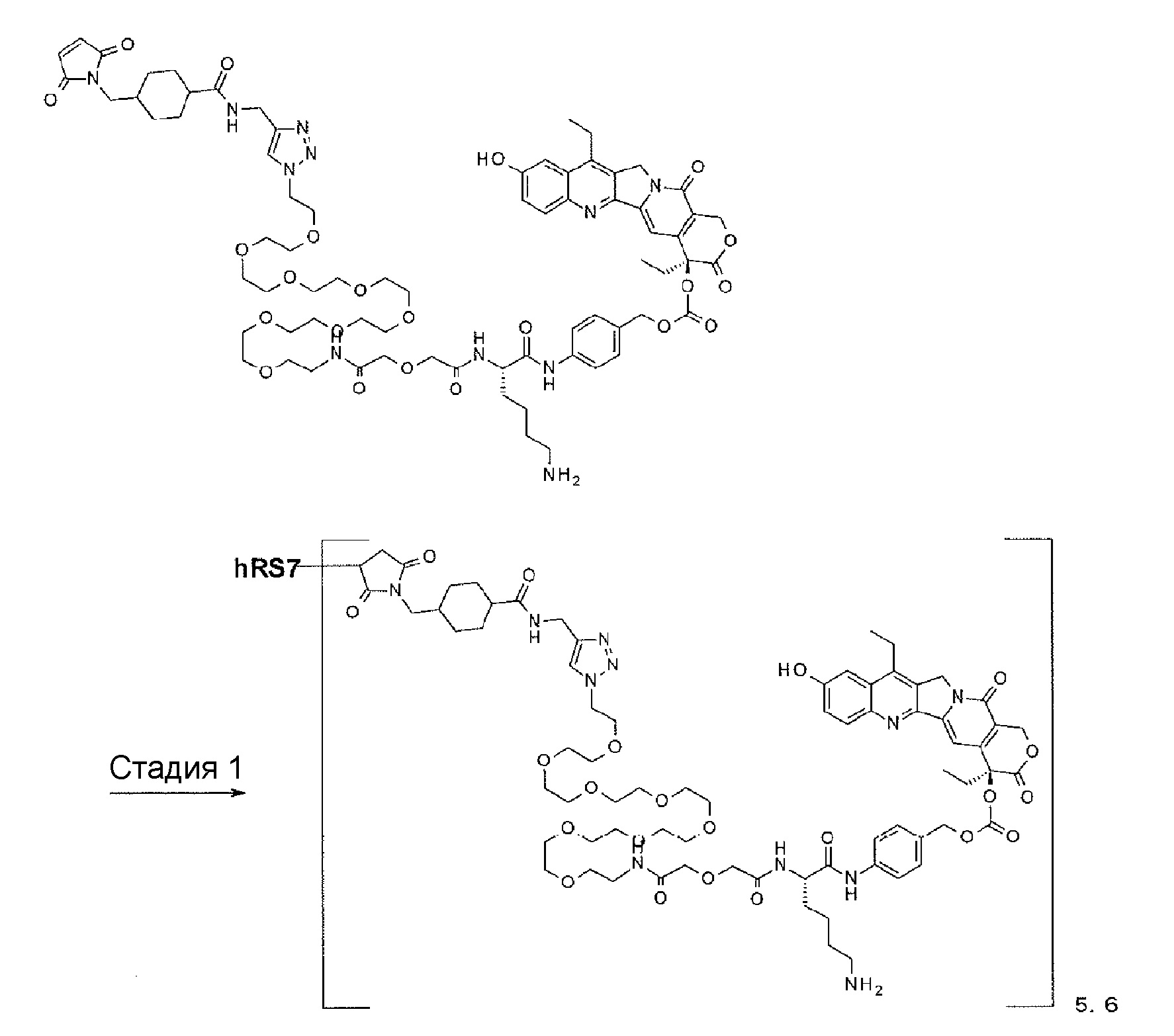
[0266]
Стадия 1: Конъюгат антитело-лекарственное средство (12)
Восстановление антитела: Получали раствор hRS7, полученного в Ссылочном Примере 1, с концентрацией антитела 10 мг/мл с PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (10,0 мл) собирали в 50-мл пробирку и добавляли водный раствор 10 мМ TCEP (Tokyo Chemical Industry Co., Ltd.) (0,317 мл; 4,6 эквивалентов на молекулу антитела) и водный раствор 1 M дикалия гидрофосфата (Nacalai Tesque, Inc.; 0,500 мл). После подтверждения, что раствор имел pH 7,4±0,1, дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 1 часа.
Конъюгация между антителом и лекарственным средством-линкером: После инкубации указанного выше раствора в течение 10 минут на водяной бане, имеющей обычную температуру, к смеси добавляли диметилсульфоксид (0,567 мл). Затем к смеси добавляли диметилсульфоксидный раствор, содержащий 10 мМ CL2A-SN38, синтезированного в соответствии с Патентной публикацией США № 2011/0293513 (0,635 мл; 9,2 эквивалентов на молекулу антитела), и перемешивали с использованием цилиндрического вращающего устройства для конъюгирования лекарственного средства-линкера с антителом при комнатной температуре в течение 40 минут. Затем к смеси добавляли водный раствор (0,127 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (Sigma-Aldrich Co. LLC) и перемешивали для завершения реакции лекарственного средства-линкера при комнатной температуре еще в течение 20 минут.
Очистка: Вышеуказанный реакционный раствор подвергали два раза поочередно гель-фильтрации и очистке, описанной в Общей процедуре D способа получения, и затем подвергали подобным образом гель-фильтрационной очистке на NAP-25 колонке с использованием раствора 25 мМ трегалозы, содержащего полисорбат 80 (0,01%). Затем полученный элюат (35 мл) лиофилизировали.
Определение физико-химических характеристик: С использованием Общей процедуры E, описанной в Способе получения 1, для элюата перед лиофилизацией получали следующие характеристические значения.
Концентрация антитела: 2,78 мг/мл, выход антитела: 97,3 мг (97%), и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,6.
[0267]
[Пример 20: Получение hTINA1-H1L1 ADC (13)]
[0268]
[Формула 37]
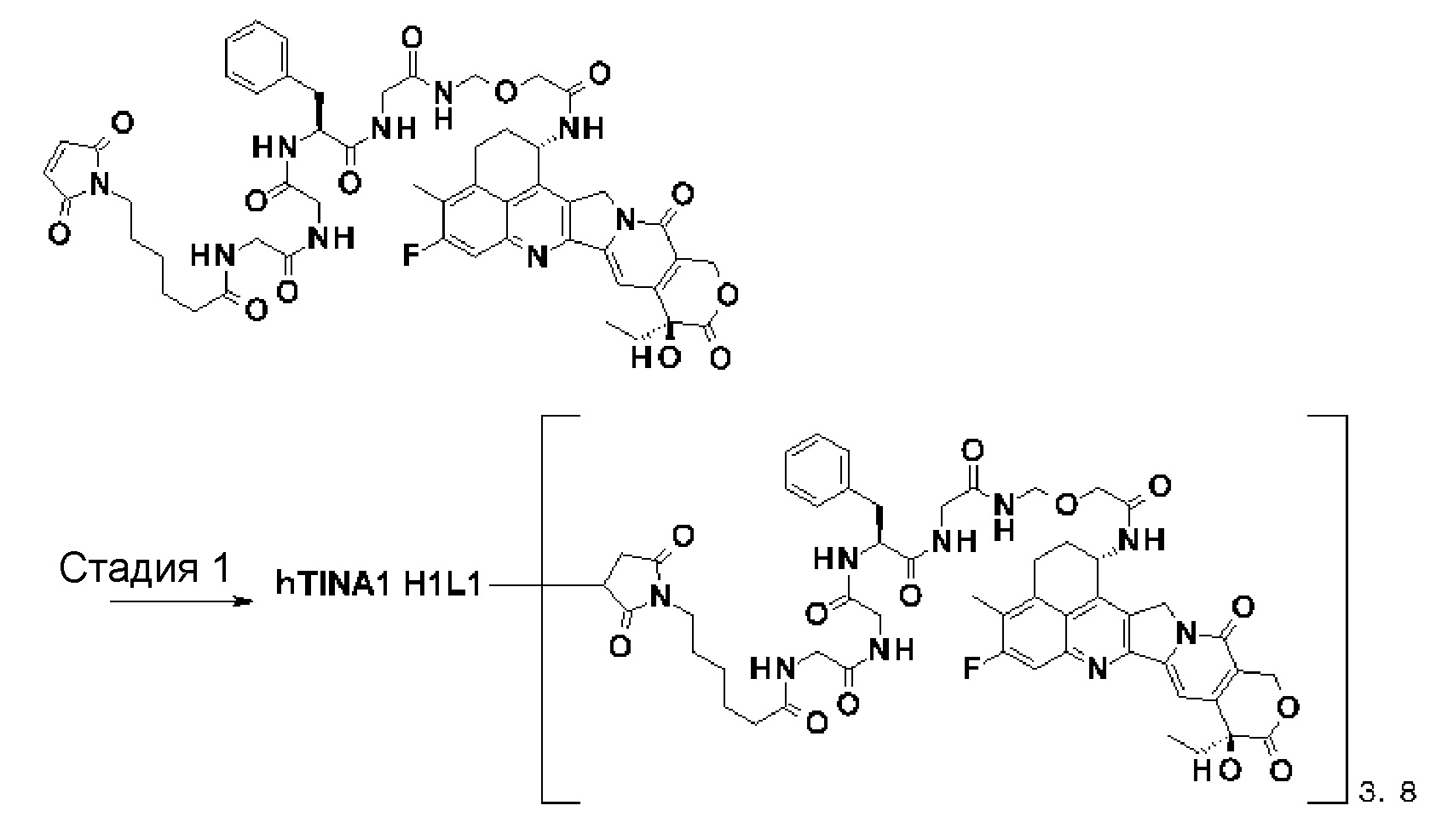
[0269]
Стадия 1: Конъюгат антитело-лекарственное средство (13)
Восстановление антитела: Получали раствор hTINA1-H1L1, полученного в Примере 7, с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA с использованием Общей процедуры B (использовали коэффициент поглощения при 280 нм, равный 1,54) и Общей процедуры C, описанной в Способе получения 1. Раствор (100 мл) помещали в 250-мл поликарбонатную колбу Эрленмейера, добавляли водный раствор 1 M дикалия гидрофосфата (1,4 мл) при комнатной температуре при перемешивании с использованием магнитной мешалки и затем добавляли водный раствор 10 мМ TCEP (1,62 мл; 2,5 эквивалентов на молекулу антитела). После подтверждения, что раствор имел pH 7,0±0,1, перемешивание прекращали и дисульфидную связь в шарнирной части в антителе восстанавливали путем инкубации при 37°C в течение 2 часов.
Конъюгация между антителом и лекарственным средством-линкером: После охлаждения вышеуказанного раствора до 15°C постепенно добавляли по каплям ДМСО (3,24 мл) при перемешивании. Затем постепенно добавляли по каплям ДМСО раствор, содержащий 10 мМ соединения, полученного на Стадии 8 Примера 14 (1,76 мл; 5,0 эквивалентов на молекулу антитела). Этот раствор перемешивали для конъюгирования лекарственного средства-линкера с антителом при 15°C в течение 1 часа. Затем к смеси добавляли водный раствор (0,324 мл; 5,0 эквивалентов на молекулу антитела) 100 мМ NAC при перемешивании и инкубировали для завершения реакции непрореагировавшего лекарственного средства-линкера при комнатной температуре еще в течение 20 минут.
Очистка: 20% водный раствор уксусной кислоты (около 0,52 мл) и ABS (100 мл) постепенно добавляли к вышеуказанному раствору при перемешивании для доведения pH раствора до 5,5±0,1. Этот раствор подвергали микрофильтрации (0,45 мкм, PVDF мембрана) для удаления белой мутности и получения около 200 мл фильтрата. Этот фильтрат подвергали ультрафильтрационной очистке с использованием ультрафильтрационного устройства, состоящего из ультрафильтрационной мембраны (Merck Japan, Pellicon XL Cassette, Ultracell 30 кДа), шлангового насоса (Cole-Parmer International, MasterFlex Pump model 77521-40, Pump Head model 7518-00) и цилиндра (Cole-Parmer International, MasterFlex Tube L/S16). В частности, при добавлении по каплям ABS (общее количество 1600 мл) в качестве буферного раствора для очистки к реакционному раствору осуществляли ультрафильтрационную очистку для удаления неконъюгированных молекул лекарственное средство-линкер и других низкомолекулярных реагентов, также заменяя буферный раствор на ABS, и затем концентрировали раствор. Полученный очищенный раствор подвергали микрофильтрации (0,22 мкм, PVDF мембрана) с получением 88 мл раствора, содержащего указанный в заголовке конъюгат антитело-лекарственное средство.
Определение физико-химических характеристик: С использованием Общей процедуры E и Общей процедуры F (использовали εD,280=5178 и εD,370=20217) получали следующие характеристические значения.
Концентрация антитела: 9,96 мг/мл, выход антитела: 876 мг (88%), среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры E: 3,8, и среднее количество конъюгированных молекул лекарственного средства (n) на молекулу антитела, измеренное с использованием Общей процедуры F: 3,8.
[0270]
[Пример 21: Оценка противоопухолевого эффекта ADC]
21-a) Противоопухолевый эффект ADC - (1)
Мышь: 5-6-недельным самкам BALB/c-nu/nu мышей (Charles River Laboratories Japan, Inc.) давали акклиматизироваться в течение 4-7 дней в SPF условиях перед использованием в эксперименте. Мышам давали стерилизованную твердую пищу (FR-2, Funabashi Farms Co., Ltd) и давали стерилизованную водопроводную воду (полученную путем добавления 5-15 ч/млн раствора гипозлорита натрия).
Анализ и расчет экспрессии: во всех исследованиях, длинную ось и короткую ось опухоли измеряли два раза в неделю с использованием электронно-цифрового циркуля (CD-15C, Mitutoyo Corp.) и рассчитывали объем опухоли (мм3). Расчет экспрессии показан ниже.
Объем опухоли (мм3)=1/2×Длинная ось (мм)×[Короткая ось (мм)]2
[0271]
Все конъюгаты антитело-лекарственное средство разбавляли физиологическим солевым раствором (Otsuka Pharmaceutical Factory, Inc.) и использовали в объеме 10 мл/кг для внутривенного введения в хвост каждой мыши. Человеческую колоректальную раковую клеточную линию COLO205 закупали у ATCC и суспендировали в физиологическом солевом растворе. 2×106 клеток суспензии подкожно трансплантировали в правую часть брюшной полости каждой самки BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 7. Конъюгат антитело-лекарственное средство (1), (6) или (12) внутривенно вводили при дозе 10 мг/кг в хвост каждой мыши в Дни 7, 14 и 21. Неконъюгированное hTINA1-H1L1 антитело и hRS7 антитело, каждое, вводили в качестве отрицательного контроля при дозе 25 мг/кг таким же путем, как указано выше. Введение конъюгата антитело-лекарственное средство (1) или (6) значительно уменьшало объем опухоли по сравнению с введением конъюгата антитело-лекарственное средство (12), и оба конъюгата антитело-лекарственное средство проявили эффект ингибирования роста опухоли (Фиг. 13). На этой Фиг. ось абсцисс показывает количество дней, а ось ординат показывает объем опухоли.
[0272]
21-b) Противоопухолевый эффект ADC - (2)
Человеческую панкреатическую клеточную линию аденокарциномы Bx-PC3, которую закупали у ATCC, трансплантировали каждой самке BALB/c-nu/nu мыши и затем пересаживали в качестве твердого опухолевого трансплантата. Этот опухолевый трансплантат подкожно трансплантировали в правую часть брюшной полости каждой самки BALB/c-nu/nu мышей (День 0) и мышей рандомизированно делили на группы в День 16. Конъюгат антитело-лекарственное средство (1), (6) или (12) внутривенно вводили при дозе 10 мг/кг в хвост каждой мыши в Дни 16, 23 и 30. Неконъюгированное hTINA1-H1L1 антитело и hRS7 антитело, каждое, вводили в качестве отрицательного контроля при дозе 25 мг/кг таким же путем, как указано выше. Введение конъюгата антитело-лекарственное средство (1) или (6) значительно уменьшало объем опухоли по сравнению с введением конъюгата антитело-лекарственное средство (12), и оба конъюгата антитело-лекарственное средство проявили эффект ингибирования роста опухоли (Фиг. 14).
[0273]
21-c) Противоопухолевый эффект ADC - (3)
Человеческую панкреатическую клеточную линию аденокарцинома Capan-1, которую закупали у ATCC, трансплантировали каждой самке BALB/c-nu/nu мыши и затем пересаживали в качестве твердого опухолевого трансплантата. Этот опухолевый трансплантат подкожно трансплантировали в правую часть брюшной полости каждой самки BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 18. Конъюгат антитело-лекарственное средство (1), (6) или (12) внутривенно вводили при дозе 10 мг/кг в хвост каждой мыши в Дни 18, 25 и 32. Неконъюгированное hTINA1-H1L1 антитело и hRS7 антитело, каждое, вводили в качестве отрицательного контроля при дозе 25 мг/кг таким же путем, как указано выше. Введение конъюгата антитело-лекарственное средство (1) или (6) значительно уменьшало объем опухоли по сравнению с введением конъюгата антитело-лекарственное средство (12), и оба конъюгата антитело-лекарственное средство проявили эффект ингибирования роста опухоли (Фиг. 15).
[0274]
21-d) Противоопухолевый эффект ADC - (4)
COLO205 подкожно трансплантировали каждой самке BALB/c-nu/nu мыши таким же способом, как в Примере 21-a) (День 0), и мышей рандомизированно делили на группы в День 11. Конъюгат антитело-лекарственное средство (2) или (5) при дозе 10 мг/кг и конъюгат антитело-лекарственное средство (7) или (10) при дозе 3 мг/кг внутривенно вводили, соответственно, в хвост каждой мыши в Дни 11, 18 и 25. Все конъюгаты антитело-лекарственное средство (2), (5), (7) и (10), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 16).
[0275]
21-e) Противоопухолевый эффект ADC - (5)
Bx-PC3 подкожно трансплантировали каждой самке BALB/c-nu/nu мыши таким же способом, как в Примере 21-b) (День 0), и мышей рандомизированно делили на группы в День 25. Конъюгат антитело-лекарственное средство (2), (5), (7) или (10) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в Дни 25 и 32. Все конъюгаты антитело-лекарственное средство (2), (5), (7) и (10), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 17).
[0276]
21-f) Противоопухолевый эффект ADC - (6)
COLO205 подкожно трансплантировали каждой самке BALB/c-nu/nu мыши таким же способом, как в Примере 21-a) (День 0), и мышей рандомизированно делили на группы в День 9. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 10 мг/кг в хвост каждой мыши в Дни 9 и 16. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 18).
[0277]
21-g) Противоопухолевый эффект ADC - (7)
Bx-PC3 подкожно трансплантировали каждой самке BALB/c-nu/nu мыши таким же способом, как в Примере 21-b) (День 0), и мышей рандомизированно делили на группы в День 21. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в Дни 21 и 28. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 19).
[0278]
21-h) Противоопухолевый эффект ADC - (8)
8 × 106 клетки человеческой клеточной линии рака яичников NIH:OVCAR-3, которые закупали у ATCC, суспендировали в Matrigel (Becton, Dickinson and Company) и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 25. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 25. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 20).
[0279]
21-i) Противоопухолевый эффект ADC - (9)
1×107 клетки человеческой гастральной раковой клеточной линии NCI-N87, которые закупали у ATCC, суспендировали в физиологическом солевом растворе и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 6. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 6. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 21).
[0280]
21-j) Противоопухолевый эффект ADC - (10)
5×106 клетки человеческой клеточной линии рака легкого NCI-H292, которые закупали у ATCC, суспендировали в физиологическом солевом растворе и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 9. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 9. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 22).
[0281]
21-k) Противоопухолевый эффект ADC - (11)
3×106 клетки человеческой клеточной линии рака горла FaDu, которые закупали у ATCC, суспендировали в физиологическом солевом растворе и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 11. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 11. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 23).
[0282]
21-l) Противоопухолевый эффект ADC - (12)
4×106 клетки человеческой панкреатической клеточной линии аденокарциномы CFPAC-1, которые закупали у ATCC, суспендировали в физиологическом солевом растворе и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 14. Конъюгат антитело-лекарственное средство (3), (4), (8) или (9) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 14. Все конъюгаты антитело-лекарственное средство (3), (4), (8) и (9), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 24).
[0283]
21-m) Противоопухолевый эффект ADC - (13)
CFPAC-1 подкожно трансплантировали каждой самке BALB/c-nu/nu мыши таким же способом, как в Примере 21-l (День 0), и мышей рандомизированно делили на группы в День 14. Конъюгат антитело-лекарственное средство (8) или (13) внутривенно вводили при дозе 1 мг/кг в хвост каждой мыши в День 14. Все конъюгаты антитело-лекарственное средство (8) или (13), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 25).
[0284]
21-n) Противоопухолевый эффект ADC - (14)
3×106 клетки человеческой панкреатической клеточной линии аденокарциномы HPAC, которые закупали у ATCC, суспендировали в физиологическом солевом растворе и подкожно трансплантировали каждой самке BALB/c-nu/nu мыши (День 0) и мышей рандомизированно делили на группы в День 12. Конъюгат антитело-лекарственное средство (8) или (13) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 12. Все конъюгаты антитело-лекарственное средство (8) или (13), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 26).
[0285]
21-o) Противоопухолевый эффект ADC - (15)
Человеческие эзофагеальные раковые ткани, полученные от Japan Health Sciences Foundation, подкожно трансплантировали каждой NOG мыши (Central Institute for Experimental Animals) и давали расти. Полученный опухолевый трансплантат затем подкожно трансплантировали каждой самке NOD-scid мыши (Charles River Laboratories Japan, Inc.) (День 0) и мышей рандомизированно делили на группы в День 27. Конъюгат антитело-лекарственное средство (8) или (13) внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши в День 27. Оба конъюгата антитело-лекарственное средство (8) и (13), которые вводили, проявили эффект ингибирования роста опухоли (Фиг. 27).
[0286]
[Пример 22: Оценка эффекта ингибирования клеточного роста, демонстрируемого ADC]
BxPC3, NCI-H292, NIH:OVCAR-3, CFPAC-1, FaDu, человеческую клеточную линию аденокарциномы легкого Calu-3 (ATCC) и человеческую клеточную линию рака яичников CaOV3 (ATCC) в качестве TROP2 антиген-положительных клеточных линий и человеческую клеточную линию рака легкого Calu-6 (ATCC) и человеческую клеточную линию меланомы кожи A375 (ATCC) в качестве TROP2 антиген-отрицательных клеточных линий использовали в оценке эффекта ингибирования клеточного роста, проявляемого каждым ADC. BxPC3 и NCI-H292 подготавливали с использованием RPMI1640 Среды (Gibco), содержащей 10% фетальную бычью сыворотку (Moregate Biotech), NIH:OVCAR-3 подготавливали с использованием RPMI1640 Среды, содержащей 20% содержащей фетальную бычью сыворотку и 0,01 мг/мл инсулина (Invitrogen Corp.), CFPAC-1 подготавливали с использованием модифицированной Исковом среды Дульбекко (Gibco), содержащей 10% фетальную бычью сыворотку, FaDu, Calu-3 и Calu-6 подготавливали с использованием минимальной эссенциальной среды Игла (ATCC), содержащей 10% фетальную бычью сыворотку, и CaOV3 и A375 подготавливали с использованием модифицированной Иглом среды Дульбекко (Gibco), содержащей 10% фетальную бычью сыворотку, так, чтобы каждая среда содержала 2,2×106 клеток/мл. Каждую клеточную суспензию высевали при 90 мкл/лунка в 96-луночный микропланшет для клеточной культуры. Конъюгат антитело-лекарственное средство (4) или (8), разбавленный RPMI1640 Средой до 100 нМ, 20 нМ, 4 нМ, 0,8 нМ, 0,16 нМ, 0,032 нМ или 0,0064 нМ, или RPMI1640 Среду для сравнения добавляли при 10 мкл/лунка и клетки культивировали в условиях 5% CO2 при 37°C в течение 6 дней. После культивирования микропланшет извлекали из инкубатора и оставляли выстаиваться при комнатной температуре в течение 30 минут. К культуральному раствору добавляли равное количество CellTiter-Glo Luminescent Cell Viability Assay (Promega) и перемешивали в течение 10 минут с использованием смесительного устройства для планшетов. После лизиса клеток измеряли интенсивность люминесценции с использованием планшет-ридера
Процент ингибирования клеточного роста после культивирования в течение 6 дней рассчитывали в соответствии со следующим уравнением:
Ингибирование клеточного роста (%)=a/b×100
a: Среднее значение из лунок с образцом после культивирования в течение 6 дней - Среднее значение из не содержащих образец лунок в начале культивирования
b: Среднее значение из лунок, в которые добавляли среду, после культивирования в течение 6 дней - Среднее значение из не содержащих среду лунок в начале культивирования
GI50 значение рассчитывали в соответствии со следующим уравнением:
GI50 (нМ)=antilog((50-f)×(LOG10(d)-LOG10(c))/(f-e)+LOG10(d))
c: Концентрация c образца
d: Концентрация d образца
e: Процент ингибирования клеточного роста при концентрации c образца
f: Процент ингибирования клеточного роста при концентрации d образца
Концентрации c и d устанавливают отношение c>d, пересекающее 50% ингибирование клеточного роста.
[0287]
Конъюгаты антитело-лекарственное средство (4) и (8) продемонстрировали эффект ингибирования клеточного роста GI50 <1 (нМ) на TROP2 антиген-положительные клеточные линии BxPC3, NCI-H292, NIH:OVCAR-3, CFPAC-1, FaDu, Calu-3 и CaOV3. С другой стороны, эти конъюгаты антитело-лекарственное средство не демонстрируют никакого эффекта ингибирования клеточного роста (>100 (нМ)) на TROP2 антиген-отрицательные клеточные линии Calu-6 и A375.
Свободный текст Перечня последовательностей
[0288]
SEQ ID NO: 1: Нуклеотидная последовательность кДНК, кодирующей вариабельную область тяжелой цепи TINA1 антитела
SEQ ID NO: 2: Аминокислотная последовательность вариабельной области тяжелой цепи TINA1 антитела
SEQ ID NO: 3: Нуклеотидная последовательность кДНК, кодирующей вариабельную область легкой цепи TINA1 антитела
SEQ ID NO: 4: Аминокислотная последовательность вариабельной области легкой цепи TINA1 антитела
SEQ ID NO: 5: Нуклеотидная последовательность, кодирующая сигнал секреции κ цепи человека и константную область κ цепи человека
SEQ ID NO: 6: Нуклеотидная последовательность, кодирующая сигнал секреции тяжелой цепи человека и константную область человеческого IgG1
SEQ ID NO: 7: Нуклеотидная последовательность тяжелой цепи cTINA1 антитела
SEQ ID NO: 8: Аминокислотная последовательность тяжелой цепи cTINA1 антитела
SEQ ID NO: 9: Нуклеотидная последовательность легкой цепи cTINA1 антитела
SEQ ID NO: 10: Аминокислотная последовательность легкой цепи cTINA1 антитела
SEQ ID NO: 11: Нуклеотидная последовательность hTINA1-H1
SEQ ID NO: 12: Аминокислотная последовательность hTINA1-H1
SEQ ID NO: 13: Нуклеотидная последовательность hTINA1-H2
SEQ ID NO: 14: Аминокислотная последовательность hTINA1-H2
SEQ ID NO: 15: Нуклеотидная последовательность hTINA1-H3
SEQ ID NO: 16: Аминокислотная последовательность hTINA1-H3
SEQ ID NO: 17: Нуклеотидная последовательность of hTINA1-L1
SEQ ID NO: 18: Аминокислотная последовательность of hTINA1-L1
SEQ ID NO: 19: Нуклеотидная последовательность hTINA1-L2
SEQ ID NO: 20: Аминокислотная последовательность hTINA1-L2
SEQ ID NO: 21: Нуклеотидная последовательность hTINA1-L3
SEQ ID NO: 22: Аминокислотная последовательность hTINA1-L3
SEQ ID NO: 23: Аминокислотная последовательность CDRH1 TINA1 антитела
SEQ ID NO: 24: Аминокислотная последовательность CDRH2 TINA1 антитела
SEQ ID NO: 25: Аминокислотная последовательность CDRH3 TINA1 антитела
SEQ ID NO: 26: Аминокислотная последовательность CDRL1 TINA1 антитела
SEQ ID NO: 27: Аминокислотная последовательность CDRL2 TINA1 антитела
SEQ ID NO: 28: Аминокислотная последовательность CDRL3 TINA1 антитела
SEQ ID NO: 29: Нуклеотидная последовательность тяжелой цепи hRS7 антитела
SEQ ID NO: 30: Аминокислотная последовательность тяжелой цепи hRS7 антитела
SEQ ID NO: 31: Нуклеотидная последовательность легкой цепи hRS7 антитела
SEQ ID NO: 32: Аминокислотная последовательность легкой цепи hRS7 антитела
SEQ ID NO: 33: Праймер mG2aVR2
SEQ ID NO: 34: Праймер mKVR2
SEQ ID NO: 35: Праймер 3.3-F1
SEQ ID NO: 36: Праймер 3.3-R1
SEQ ID NO: 37: Праймер TINA1H-F
SEQ ID NO: 38: Праймер TINA1H-R
SEQ ID NO: 39: Праймер TINA1L-F
SEQ ID NO: 40: Праймер TINA1L-R
SEQ ID NO: 41: Праймер EG-Inf-F
SEQ ID NO: 42: Праймер EG1-Inf-R
SEQ ID NO: 43: Праймер CM-LKF
SEQ ID NO: 44: Праймер KCL-Inf-R