КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ КОЖНЫХ РУБЦОВ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет обычной патентной заявки США номер 13/829876, поданной 14 марта 2013, по которой испрашивается приоритет предварительной патентной заявки США номер 61/699160, поданной 10 сентября 2012. Полное изложение этих заявок включено в настоящее описание посредством ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Описанное изобретение относится к областям клеточной и молекулярной биологии, пептидам и терапевтическим способам применения.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
1. Киназы
Киназы представляют собой широко распространенную группу ферментов, которые катализируют реакцию переноса фосфорила от донора фосфата (обычно аденозин-5'-трифосфата (АТФ)) к субстрату рецептора. Хотя все киназы катализируют главным образом одну и ту же реакцию переноса фосфорила, они демонстрируют заметное различие в субстратной специфичности, структуре и каскадах реакций, в которых они принимают участие. Последняя классификация всех доступных киназных последовательностей (приблизительно 60000 последовательностей) показывает, что киназы могут быть сгруппированы в 25 семейств гомологичных (обозначающих происходящих от общего предшественника) белков. Эти семейства киназ собраны в 12 кратные группы, исходя из сходства структурной укладки. Далее, 22 из 25 семейств (приблизительно 98,8% всех последовательностей) принадлежать 10 кратным группам для которых известна структурная укладка. Из других 3 семейств полифосфаткиназа образует отличающуюся группу укладки, а 2 оставшихся семейства оба представляют собой единые мембранные киназы и включают группу конечной укладки. Эти группы укладки не только включают некоторые из наиболее широко распространенных укладок белка, таких как укладка Россмана (три или более параллельных β цепей, связанных двумя α спиралями в топологическом порядке β-α-β-α-β), укладка по типу ферредоксина (обычная α+β укладка белка с характерной βαββαβ вторичной структурой вдоль остова), укладка TIM-цилиндров (означающая консервативную укладку белка, состоящую из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова), и антипараллельная β-цилиндрическая укладка (бета цилиндр представляет собой большой бета-складчатый слой, который скручивается и сворачивается спиралью с образованием закрытой структуры, в которой первая цепь представляет собой водород, связанный с последней), а также все основные классы (все α, все β, α+β, α/β) структур белка. В пределах группы укладки ядро нуклеотид-связывающего домена каждого семейства имеет такое же строение, и топология белкового ядра является либо идентичной, либо связанной круговой перестановкой. Гомология между семействами в пределах группы укладки не предполагается.
Группа I (23124 последовательностей) киназ объединяет протеинкиназы S/T-Y, атипичные протеинкиназы, липидкиназы и ферменты захвата АТФ и дополнительно включает проиенткиназы S/T-Y и семейство атипичных протеинкиназ (22074 последовательностей). Эти киназы включают: холинкиназы (EC 2.7.1.32); протеинкиназы (EC 2.7.137); киназы фосфорилазы (EC 2.7.1.38); гомосеринкиназы (EC 2.7.1.39); I-фосфатидилинозитол 4-киназы (EC 2.7.1.67); стрептомицин 6-киназы (EC 2.7.1.72); этаноламинкиназы (EC 2.7.1.82); стрептомицин 3'-киназы (EC 2.7.1.87); канамицинкиназы (EC 2.7.1.95); киназы 5-метилтиорибозы (EC 2.7.1.100); виомицинкиназы (EC 2.7.1.103); киназы [гидроксиметилглутарил-CoA редуктазы (NADPH2)] (EC 2.7.1.109); протеинтирозинкиназы (EC 2.7.1.112); киназы [изоцитратдегидрогеназы (NADP+)] (EC 2.7.1.116); киназы [легкой цепи миозина] (EC 2.7.1.117); гидромицин-B киназы (EC 2.7.1.119); кальций/кальмодулин-зависимые протеинкиназы (EC 2.7.1.123); родопсинкиназы (EC 2.7.1.125); киназы [бета-адренергических рецепторов] (EC 2.7.1.126); киназы [тяжелой цепи миозина] (EC 2.7.1.129); киназы [Tau-белка] (EC 2.7.1.135); макролид 2'-киназы (EC 2.7.1.136); I-фосфатидилинозитол 3-киназы (EC 2.7.1.137); киназы субъединицы [РНК-полимеразы] (EC 2.7.1.141); фосфатидилинозитол-4,5-бифосфат 3-киназы (EC 2.7.1.153); и фосфатидилинозитол-4-фосфат 3-киназы (EC 2.7.1.154). Группа I дополнительно содержит семейство липидкиназ (321 последовательность). Эти киназы включают: I-фосфатидилинозитол-4-фосфат 5-киназы (EC 2.7.1.68); I D-мио-инозитол-трифосфат 3-киназы (EC 2.7.1.127); инозитол-тетракисфосфат 5-киназы (EC 2.7.1.140); I-фосфатидилинозитол-5-фосфат 4-киназы (EC 2.7.1.149); I-фосфатидилинозитол-3-фосфат 5-киназы (EC 2.7.1.150); инозитол-полифосфат мультикиназы (EC 2.7.1.151); и инозитол-гексакифосфаткиназы (EC 2.7.4.21). Группа I дополнительно содержит киназы захвата АТФ (729 последовательностей) которые включают инозитол-тетракисфосфат I-киназы (EC 2.7.1.134); пируват, фосфатдикиназы (EC 2.7.9.1); и пируват, водные дикиназы (EC 2.7.9.2).
Группа II (17071 последовательность) киназы включает киназы Россмана. Группа II включает семейство P-петлевых киназ (7732 последовательности). Они включают глюконокиназы (EC 2.7.1.12); фосфорибулокиназы (EC 2.7.1.19); тимидинкиназы (EC 2.7.1.21); рибозилникотинамидкиназы (EC 2.7.1.22); дефосфо-CoA киназы (EC 2.7.1.24); аденилилсульфаткиназы (EC 2.7.1.25); пантотенаткиназы (EC 2.7.1.33); протеинкиназы (бактериальные) (EC 2.7.1.37); уридинкиназы (EC 2.7.1.48); шикиматкиназы (EC 2.7.1.71); дезоксицитидинкиназы (EC 2.7.1.74); дезоксиаденозинкиназы (EC 2.7.1.76); полинуклеотид 5'-гидроксил-киназы (EC 2.7.1.78); 6-фосфофрукто-2-киназы (EC 2.7.1.105); дезоксигуанозинкиназы (EC 2.7.1.113); тетраацилдисахарид 4'-киназы (EC 2.7.1.130); дезоксинуклеозидкиназы (EC 2.7.1.145); аденозилкобинамидкиназы (EC 2.7.1.156); полифосфаткиназы (EC 2.7.4.1); фосфомевалонаткиназы (EC 2.7.4.2); аденилаткиназы (EC 2.7.4.3); нуклеозид-фосфаткиназы (EC 2.7.4.4); гуанилаткиназы (EC 2.7.4.8); тимидилаткиназы (EC 2.7.4.9); нуклеозид-трифосфат-аденилаткиназы (EC 2.7.4.10); (дезокси)нуклеозид-фосфаткиназы (EC 2.7.4.13); цитидилаткиназы (EC 2.7.4.14); и уридилаткиназы (EC 2.7.4.22). Группа II дополнительно содержит семейство фосфоенолпируваткарбоксикиназ (815 последовательностей). Эти ферменты включают протеинкиназы (HPr киназы/фосфатазы) (EC 2.7.1.37); фосфоенолпируваткарбоксикиназы (GTP) (EC 4.1.1.32); и фосфоенолпируваткарбоксикиназы (ATP) (EC 4.1.1.49). Группа II дополнительно содержит семейство фосфоглицераткиназ (1351 последовательность). Эти ферменты включают фосфоглицераткиназы (EC 2.7.2.3) и фосфоглицераткиназы (GTP) (EC 2.7.2.10). Группа II дополнительно содержит семейство аспартокиназ (2171 последовательность). Эти ферменты включают карбаматкиназы (EC 2.7.2.2); аспартаткиназы (EC 2.7.2.4); ацетилглутаматкиназы (EC 2.7.2.8 1); глутамат 5-киназы (EC 2.7.2.1) и уридилаткиназы (EC 2.7.4.). Группа II дополнительно содержит семейство киназ наподобие фосфофруктокиназ (1998 последовательностей). Эти ферменты включают 6-фосфофруктокиназы (EC 2.7.1.1 1); NAD(+) киназы (EC 2.7.1.23); I-фосфофруктокиназы (EC 2.7.1.56); дифосфат-фруктоза-6-фосфат I-фосфотрансферазы (EC 2.7.1.90); сфинганинкиназы (EC 2.7.1.91); диацилглицеролкиназы (EC 2.7.1.107); и церамидкиназы (EC 2.7.1.138). Группа II дополнительно содержит рибокиназа-подобное семейство (2722 последовательности). Эти ферменты включают: глюкокиназы (EC 2.7.1.2); кетогексокиназы (EC 2.7.1.3); фруктокиназы (EC 2.7.1.4); 6-фосфофруктокиназы (EC 2.7.1. 11); рибокиназы (EC 2.7.1.15); аденозинкиназы (EC 2.7.1.20); пиридоксалькиназы (EC 2.7.1.35); 2-дегидро-3-дезоксиглюконокиназы (EC 2.7.1.45); гидроксиметилпиримидинкиназы (EC 2.7.1.49); гидроксиэтилтиазолкиназы (EC 2.7.1.50); I-фосфофруктокиназы (EC 2.7.1.56); инозинкиназы (EC 2.7.1.73); 5-дегидро-2-дезоксиглюконокиназы (EC 2.7.1.92); тагатоза-6-фосфаткиназы (EC 2.7.1.144); АДФ-зависимые фосфофруктокиназы (EC 2.7.1.146); АДФ-зависимые глюкокиназы (EC 2.7.1.147); и фосфометилпиримидинкиназы (EC 2.7.4.7). Группа II дополнительно включает семейство тиаминпирофосфокиназ (175 последовательностей), которое включает тиаминфирофосфокиназы (EC 2.7.6.2). Группа II дополнительно включает семейство глицераткиназ (107 последовательностей) которое включает глицераткиназы (EC 2.7.1.31).
Группа III киназ (10973 последовательностей) включает киназы с укладкой на подобие ферредоксина. Группа III дополнительно включает семейство нуклеозид-дифосфаткиназ (923 последовательности). Эти ферменты включают нуклеозид-дифосфаткиназы (EC 2.7.4.6). Группа III дополнительно включает семейство HPPK киназ (609 последовательностей). Эти ферменты включают 2-амино-4-гидрокси-6-гидроксиметилдигидроптеридинпирофосфокиназы (EC 2.7.6.3). Группа III дополнительно включает семейство гуанидокиназ (324 последовательности). Эти ферменты включают гуанидоацетаткиназы (EC 2.7.3.1); креатинкиназы (EC 2.7.3.2); аргининкиназы (EC 2.7.3.3); и ломбрицинкиназы (EC 2.7.3.5). Группа III дополнительно включает семейство гистидинкиназ (9117 последовательностей). Эти ферменты включают протеинкиназы (гистидинкиназы) (EC 2.7.1.37); киназы [пируватдегидрогеназы (липоамид)] (EC 2.7.1.99); и киназы [3-метил-2-оксибутаноатдегидронезаны (липоамид)] (EC 2.7.1.115).
Группа IV киназ (2768 последовательностей) объединяет киназы наподобие рибонуклеазы H. Эти ферменты включают гексокиназы (EC 2.7.1.1); глюкокиназы (EC 2.7.1.2); фруктокиназы (EC 2.7.1.4); рамнулокиназы (EC 2.7.1.5); маннокиназы (EC 2.7.1.7); глюконокиназы (EC 2.7.1.12); L-рибулокиназы (EC 2.7.1.16); ксилулокиназы (EC 2.7.1.17); эритритолкиназы (EC 2.7.1.27); глицеролкиназы (EC 2.7.1.30); пантотенаткиназы (EC 2.7.1.33); D-рибулокиназы (EC 2.7.1.47); L-фуколокиназы (EC 2.7.1.51); L-ксилулокиназы (EC 2.7.1.53); киназы аллозы (EC 2.7.1.55); 2-дегидро-3-дезоксигалактонокиназы (EC 2.7.1.58); N-ацетилглюкозаминкиназы (EC 2.7.1.59); N-ацилманнозаминкиназы (EC 2.7.1.60); полифосфат-глюкозафосфотрансферазы (EC 2.7.1.63); бета-глюкозидкиназы (EC 2.7.1.85); ацетаткиназы (EC 2.7.2.1); бутираткиназы (EC 2.7.2.7); киназы жирных кислот с разветвленной цепью (EC 2.7.2.14); и пропионаткиназы (EC 2.7.2.15).
Группа V киназ (1119 последовательностей) объединяет TIM β-циллирические киназы. Эти ферменты включают пируваткиназы (EC 2.7.1.40).
Группа VI киназ (885 последовательностей) объединяет GHMP киназы. Эти ферменты включают галактокиназы (EC 2.7.1.6); мевалонаткиназы (EC 2.7.1.36); гомосеринкиназы (EC 2.7.1.39); L-арабинокиназы (EC 2.7.1.46); фукокиназы (EC 2.7.1.52); шикиматкиназы (EC 2.7.1.71); 4-(цитидин 5'-дифосфо)-2-C-метил-D-эритриолкиназы (EC 2.7.1.148); и фосфомевалонаткиназы (EC 2.7.4.2).
Группа VII киназ (1843 последовательности) объединяет AIR синтетаза-подобные киназы. Эти ферменты включают тиамин-фосфаткиназы (EC 2.7.4.16) и селенид, водные дикиназы (EC 2.7.9.3).
Группа VIII киназ (565 последовательностей) объединяет рибофлавинкиназы (565 последовательностей). Эти ферменты включают рибофлавинкиназы (EC 2.7.1.26).
Группа IX киназ (197 последовательностей) объединяет дигидроксиацетонкиназы. Эти ферменты включают глицеринкиназы (EC 2.7.1.29).
Группа X киназ (148 последовательностей) объединяет гипотетические глицераткиназы. Эти ферменты включают глицераткиназы (EC 2.7.1.31).
Группа XI киназ (446 последовательностей) объединяет полифосфаткиназы. Эти ферменты включают полифосфаткиназы (EC 2.7.4.1).
Группа XII киназ (263 последовательности) объединяет интегральные мембранные киназы. Группа XII включает семейство долихолкиназ. Эти ферменты включают долихолкиназы (EC 2.7.1.108). Группа XII дополнительно включает семейство ундекапренолкиназ. Эти ферменты включают ундекапренолкиназы (EC 2.7.1.66).
Киназы играют незаменимую роль в многочисленных клеточных метаболических и сигнальных путях, и находятся среди наиболее хорошо изученных ферментов на структурном, биохимическом и клеточном уровне. Несмотря на тот факт, что все киназы используют один и тот же донор фосфата (в большинстве случаев, АТФ) и катализируют, по всей видимости, одну и ту же реакцию переноса фосфорила, они демонстрируют заметное различие в структурной укладке и механизмах распознавания субстрата. Вероятно, это происходит, главным образом, вследствие различной природы структур и свойств их субстратов.
1.1. Митоген-активированная протеинкиназа (MAPK)-активированные протеинкиназы (MK2 и MK3)
Различные группы MAPK-активированных протеинкиназ (MAP-KAPK) были определены после митоген-активированных протеинкиназ (MAPK). Эти ферменты осуществляют трансдукцию сигналов к белкам-мишеням, которые не являются прямыми субстратами MAPK и, следовательно, служат для передачи зависимых от фосфорилирования сигналов MAPK каскадами для различных клеточных функций. Одна из этих групп образована тремя MAPKAPK: MK2, MK3 (также известной как 3pK), и MK5 (также обозначенной PRAK). Активированные митоген-активированными протеинкиназами протеинкиназы 2 (также называемые «MAPKAPK2», «MAPKAP-K2», «MK2») представляют собой киназы семейства серин/треониновых (Ser/Thr) протеинкиназ. MK2 является высокогомологичной в отношении MK3 (приблизительно 75% аминокислотной идентичности). Киназные домены MK2 и MK3 являются наиболее сходными (приблизительно 35% - 40% идентичность) с кальций/кальмодулин-зависимыми протеинкиназами (CaMK), киназой фосфорилазы b и C-концевым киназным доменом (CTKD) изоформ рибосомальной S6 киназы (RSK). Ген MK2 кодирует два транскрипта альтернативного сплайсинга из 370 аминокислот (MK2A) и 400 аминокислот (MK2B). Ген MK3 кодирует один транскрипт из 382 аминокислот. Белки MK2- и MK3 являются высокогомологичными, при этом MK2A обладает более короткой C-концевой областью. C-конец MK2B содержит функциональную, состоящую из двух частей, последовательность, локализованную в ядре (NLS) (Lys-Lys-Xaa-Xaa-Xaa-Xaa-Xaa-Xaa-Xaa-Xaa-Xaa-Xaa-Lys-Arg-Arg-Lys-Lys; SEQ ID NO: 21), которая не присутствует в более короткой изоформе MK2A, указывая на то, что альтернативный сплайсинг определяет клеточную локализацию изоформ MK2. MK3 обладает сходной последовательностью с ядерной локализацией. Последовательность с ядерной локализацией, обнаруженная как в MK2B, так и в MK3, охватывает D домен (Leu-Leu-Lys-Arg-Arg-Lys-Lys; SEQ ID NO: 22), который, как было показано, опосредует специфическое взаимодействие MK2B и MK3 с p38α и p38β. MK2B и MK3 также имеют функциональный сигнал ядерного экспорта (NES), расположенный N-терминально по отношению к NLS и D домену. NES в MK2B является достаточным для запуска ядерного экспорта после стимуляции, процесса, который может быть ингибирован под действием лептомицина B. Последовательность, N-терминальная по отношению к каталитическому домену в MK2 и MK3, богата пролином и содержит один (MK3) или два (MK2) гипотетических Src гомологичных 3 (SH3) домен-связывающих сайтов, исследования которых показали для MK2, опосредование связывания с SH3 доменом c-Abl in vitro. Недавние исследования дают основания предполагать, что этот домен вовлечен в MK2-опосредованную миграцию клеток.
MK2B и MK3 расположены преимущественно в ядре неактивных клеток, тогда как MK2A присутствует в цитоплазме. Как MK2B, так и MK3 легко экспортируются в цитоплазму посредством механизма, зависимого от белка, поддерживающего хромосомные области (CRM1) при стрессорном воздействии. Ядерный экспорт MK2B, по-видимому, опосредуется путем активации киназы, поскольку фосфомиметическая мутация Thr334 в пределах активационной петли киназы повышает цитоплазматическую локализацию MK2B. Не ограничиваясь теорией, считается, что MK2B и MK3 могут содержать постоянно активный клеточный сигнал внутриядерной локализации (NLS) и регулируемый фосфорилированием сигнал ядерного экспорта (NES).
MK2 и MK3, по-видимому, экспрессируются повсеместно, с повышенной относительной экспрессией в тканях сердца, легких, почек, репродуктивных органов (молочных железах и тестикулах), коже и скелетных мышцах, а также в иммунологических клетках, таких как белые клетки крови/лейкоциты и дендритные клетки.
1.1.1. Активация
Различные активаторы p38α и p38β эффективно стимулируют активность MK2 и MK3. p38 опосредует in vitro и in vivo фосфорилирование MK2 на четырех пролин-ориентированных сайтах: Thr25, Thr222, Ser272, и Thr334. Из этих сайтов только Thr25 не является консервативным в MK3. Не ограничиваясь теорией, хотя функция фосфорилированного Thr25 неизвестна, его локализация между двумя SH3 домен-связывающими сайтами дает возможность предположить, что он может регулировать взаимодействия белок-белок. Thr222 в MK2 (Thr201 в MK3) располагается в активационной петле киназного домена и было показано, что является необходимым для активности MK2 и MK3 киназ. Thr334 в MK2 (Thr313 в MK3) располагается C-терминально по отношению к каталитическому домену и является необходимым для киназной активности. Кристаллическая структура MK2 была проанализирована, и не ограничиваясь теорией, дает основание предполагать, что Thr334 фосфорилирование может служить в качестве переключения для ядерного импорта и экспорта MK2. Фосфорилирование Thr334 также может ослаблять или нарушать связывание C конца MK2 с каталитическим доменом, воздействуя на NES и способствуя ядерному экспорту.
Исследования показали, что хотя p38 способен активировать MK2 и MK3 в ядре, экспериментальное доказательство дает основание предполагать, что активация и ядерный экспорт MK2 и MK3 соединены зависимым от фосфорилирования конформационным переключением, что также обусловливает стабилизацию и локализацию p38, и клеточная локализация самого p38 контролируется под действием MK2 и, возможно, MK3. Дополнительные исследования показали, что ядерный p38 экспортируется в цитоплазму в комплексе с MK2 после фосфорилирования и активации MK2. Взаимодействие между p38 и MK2 может быть важным для стабилизации p38, поскольку исследования показывает, что уровни p38 ниже в MK2-дефицитных клетках и экспрессия каталитически неактивного белка MK2 восстанавливает уровни p38.
1.1.2. Субстраты и функции
MK2 имеет много общих субстратов с MK3. Оба фермента имеют сопоставимые предпочтения субстратов и фосфорилируют пептидные субстраты со схожими кинетическими константами. Было обнаружено, что минимальная последовательность, необходимая для эффективного фосфорилирования, под действием MK2, представляет собой Hyd-Xaa-Arg-Xaa-Xaa-pSer/pThr (SEQ ID NO: 22), где Hyd представляет собой объемный гидрофобный остаток.
Накапливающиеся исследования показали, что MK2 фосфорилирует целый ряд белков, которые включают, но не ограничиваются, 5-липооксигеназу (ALOX5), гомолог B цикла клеточного деления 25 (CDC25B), гомолог С цикла клеточного деления 25 (CDC25C), эмбриональный летальный, аномального зрения, дрозофила-подобный белок 1 (ELAVL1), гетерогенный ядерный рибонуклеопротеин A0 (HNRNPA0), белок 1 фактора теплового шока 1 (HSF1), белок теплового шока бета-1 (HSPB1), кератин 18 (KRT18), кератин 20 (KRT20), LIM домен киназы 1 (LIMK1), лимфоцит-специфичный белок 1 (LSP1), полиаденилат-связывающий белок 1 (PABPC1), поли(A)-специфичную рибонуклеазу (PARN), CAMP-специфичную 3',5'-циклическую фосфодиэстеразу 4A (PDE4A), RCSD домен содержащий 1 (RCSD1), полипептид 3 рибосомальной протеин S6 киназы, 90 кДа (RPS6KA3), белок 3, связывающий TGF-бета активированную киназу 1/MAP3K7 (TAB3), и тристетрапролин (TTP/ZFP36).
Белок теплового шока бета-1 (также называемый HSPB1 или HSP27) представляет собой индуцируемый стрессом цитозольный белок, который повсеместно присутствует в нормальных клетках и является представителем небольшого семейства белков теплового шока. Синтез HSPB1 индуцируется под действием теплового шока и других стрессов окружающей среды или физиологических стрессов, таких как УФ излучение, гипоксия и ишемия. Помимо его гипотетической роли в терморезистентности, HSPB1 вовлечен в выживание и восстановление клеток, подверженных стрессовым условиям.
Экспериментальное доказательство подтверждает роль p38 в регуляции биосинтеза цитокинов и клеточной миграции. Направленная делеция гена mk2 у мышей указывает на то, что хотя p38 опосредует активацию многих сходных киназ, MK2, по-видимому, является ключевой киназой, ответственной за эти p38-зависимые биологические процессы. Утрата MK2 приводит (i) к нарушению липополисахарид (LPS)-индуцированному синтезу цитокинов, таких как фактор некроза опухоли альфа (TNF-α), интерлейкин-6 (IL-6), и гамма интерферон (IFN-γ) и (ii) к изменениям в миграции эмбриональных фибробластов мыши, клеток гладкой мускулатуры и нейтрофилов.
В соответствии с ролью MK2 в воспалительных и иммунных ответах, мыши с недостаточностью MK2 демонстрировали повышенную восприимчивость к инфекции Listeria monocytogenes и сниженную опосредованную воспалением нейрональную гибель после очаговой ишемии. Поскольку уровни белка p38 также значительно снижаются в клетках с дефицитом MK2, необходимо различать, были ли эти фенотипы только в результате утраты MK2. Для достижения этого мутантные формы MK2 были экспрессированы в клетках с дефицитом MK2, и эти результаты показали, что каталитическая активность MK2 не обязательно восстанавливала уровни p38, но требовалась для регуляции биосинтеза цитокинов.
Исследования нокаута или нокдауна MK2 обеспечивают сильную поддержку того, что активированная MK2 усиливает стабильность мРНК IL-6 посредством фосфорилирования белков, взаимодействующих с богатой АУ 3' нетранслируемой областью мРНК IL-6. В частности, было показано, что MK2 главным образом отвечает за фосфорилирование hnRNPA0, мРНК-связывающего белка, который стабилизирует РНК IL-6. Кроме того, в некоторых дополнительных исследованиях, изучающих различные воспалительные заболевания, было обнаружено, что уровни про-воспалительных цитокинов, таких как IL-6, IL-1β, TNF-α и IL-8, повышаются в индуцированной мокроте от пациентов со стабильной хронической обструктивной болезнью легких (COPD) или из альвеолярных макрофагов курильщиков (Keatings V. et al, Am J Resp Crit Care Med, 1996, 153:530-534; Lim, S. et al., J Respir Crit Care Med, 2000, 162:1355-1360).
1.1.3. Регуляция трансляции мРНК.
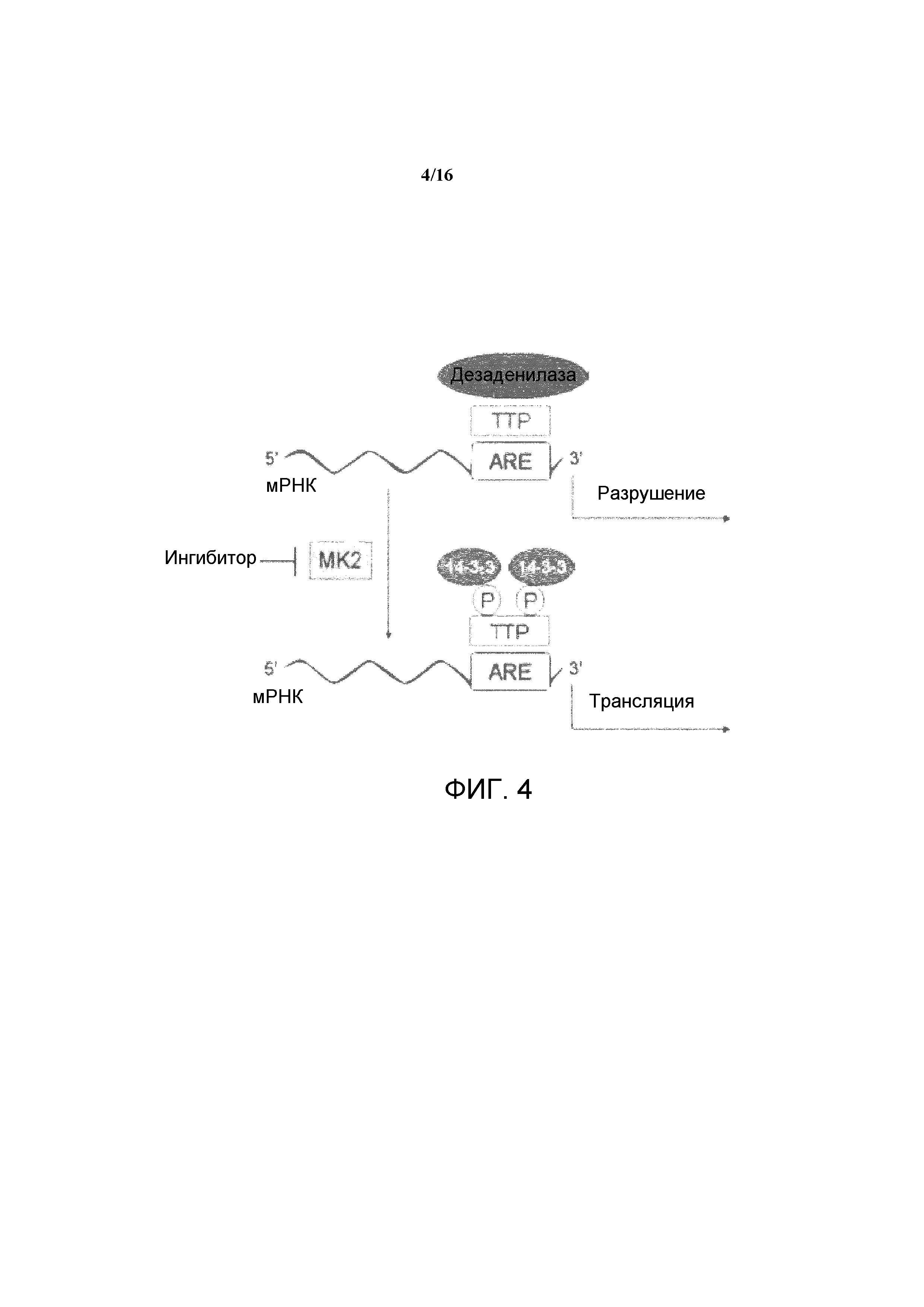
Предыдущие исследования с использованием мышей с нуль-мутацией MK2 или клеток с дефицитом MK2, показали, что MK2 повышает продукцию воспалительных цитокинов, в том числе, TNF-α, IL-1, и IL-6, путем повышения скорости трансляции их мРНК. Значительные снижения транскрипции, процессинга и шеддинга TNF-α не могли быть определены у мышей с недостаточностью MK2. Известно, что сигнальный путь p38 играет важную роль в регуляции стабильности мРНК, и MK2 представляет вероятную мишень, посредством которой p38 опосредует эту функцию. Исследования с использованием мышей с недостаточностью MK2 показали, что каталитическая активность MK2 необходима для его действий на продукцию цитокинов и миграцию, давая возможность предположить, что не ограничиваясь теорией, MK2 фосфорилирует мишени, вовлеченные в стабильность мРНК. В соответствии с этим, было показано, что MK2 связывается и/или фосфорилирует гетерогенный ядерный рибонуклеопротеин (hnRNP) A0, тристетрапролин (TTP), поли(A)-связывающий белок PABP1, и HuR, повсеместно экспрессируемый представитель ELAV (эмбрионально-летальный нарушенного зрения у Drosophila melanogaster) семейства РНК-связывающих белков. Известно, что эти субстраты связываются или совместно выделяются с мРНК, которые содержат АУ-богатые элементы в 3' нетранслируемой области, давая возможность предположить, что MK2 может регулировать стабильность мРНК, богатых АУ, таких как TNF-α. В настоящее время неизвестно, играет ли MK3 аналогичную роль, но LPS обработка фибробластов с недостаточностью MK2 полностью прекращает фосфорилирование hnRNP A0, давая основание предполагать, что MK3 не способна компенсировать утрату MK2.
MK3 принимает участие с MK2 в фосфорилировании киназы эукариотического фактора элонгации 2 (eEF2). Киназа eEF2 фосфорилирует и инактивирует eEF2. Активность eEF2 является важной для элонгации мРНК во время трансляции, и фосфорилирование eEF2 на Thr56 в результате приводит к терминации трансляции мРНК. Фосфорилирование MK2 и MK3 киназы eEF2 на Ser377 дает возможность предположить, что эти ферменты могут модулировать активность киназы eEF2 и тем самым регулировать элонгацию трансляции мРНК.
1.1.4. Транскрипционная регуляция под действием MK2 и MK3
Ядерная MK2, сходная со многими MK, вносит вклад в фосфорилирование фактора, связывающего цАМФ-респонсивный элемент (CREB), активацию транскрипционного фактора-1 (ATF-1), фактора ответа сыворотки (SRF) и фактора транскрипции ER81. Сравнение клеток дикого типа и клеток с дефицитом MK2, показало, что MK2 является главной SRF киназой, индуцированной стрессом, говоря о роли MK2 в опосредуемом стрессом немедленно раннем ответе. Как MK2, так и MK3 взаимодействует с основным спираль-петля-спираль фактором транскипции E47 in vivo и фосфорилирует E47 in vitro. Было обнаружено, что MK2-опосредованное фосфорилирование E47 подавляет транскрипционную активность E47 и тем самым ингибирует E47-зависимую генную экспрессию, давая основание предполагать, что MK2 и MK3 могут регулировать тканеспецифичную генную экспрессию и клеточную дифференцировку.
1.1.5. Другие мишени MK2 и MK3
Также были идентифицированы некоторые другие субстраты MK2 и MK3, отражающие различные функции MK2 и MK3 в некоторых биологических процессах. Поддерживающий белок 14-3-3ζ является физиологическим субстратом MK2. Исследования показывают, что 14-3-3ζ взаимодействует с целым рядом компонентов клеточных сигнальных путей, включая протеинкиназы, фосфатазы и факторы транскрипции. Дополнительные исследования показали, что MK2-опосредованное фосфорилирование 14-3-3ζ на Ser58 негативно сказывается на его связывающей активности, давая основание предполагать, что MK2 может влиять на регуляцию некоторых сигнальных молекул, обычно регулируемых под действием 14-3-3ζ.
Дополнительные исследования показали, что MK2 также взаимодействует и фосфорилирует субъединицу p16 семичленного Arp2 и Arp3 комплекса (p16-Arc) на Ser77. p16-Arc играет роль в регуляции актинового цитоскелета, давая основание предполагать, что MK2 может быть вовлечена в этот процесс. Дополнительные исследования показали, что небольшой белок теплового шока HSPB1, лимфоцит-специфичный белок LSP-1 и виментин фосфорилируются под действием MK2. HSPB1 представляет особый интерес, поскольку образует крупные олигомеры, которые могут действовать в качестве молекулярных шаперонов и защищать клетки от теплового шока и окислительного стресса. При фосфорилировании HSPB1 теряет способность образовывать крупные олигомеры и неспособен блокировать полимеризацию актина, давая основание предполагать, что MK2-опосредованное фосфорилирование HSPB1 выполняет гомеостатическую функцию, нацеленную на регуляцию динамики актина, которая в противном случае была бы дестабилизирована во время стресса. Также было показано, что MK3 фосфорилирует HSPB1 in vitro и in vivo, но ее роль в условиях стресса еще не выяснена.
Также было показано, что HSPB1 связывается с полиубихитиновыми цепями и с протеасомой 26S in vitro и in vivo. Сигнальный путь убихитин-протеасома вовлечен в активацию фактора транскрипции NF-каппа B (NF-κB) путем разрушения его главного ингибитора, I каппа B-альфа (IκB-альфа), и было показано, что гиперэкспрессия HSPB1 повышает ядерную релокализацию NF-каппа B (NF-κB), ДНК связывание и транскрипционную активность, индуцированную этопозидом, TNF-альфа и интерлейкином-1 бета (IL-1β). Кроме того, предыдущие исследования показали, что HSPB1 в условиях стресса содействует разрушению убихитиновых белков, таких как фосфорилированный I каппа B-альфа (IκB-альфа); и что эта функция HSPB1 объясняет его анти-апоптотические свойства посредством усиления активности NF-каппа B (NF-κB) (Parcellier, A. et al., Mol Cell Biol, 23(16): 5790-5802, 2003).
MK2 и MK3 также могут фосфорилировать 5-липоксигеназу. 5-липоксигеназа катализирует начальные стадии образования воспалительных медиаторов, лейкотриенов. Также было показано, что тирозингидроксилаза, гликогенсинтаза и Akt фосфорилируются под действием MK2. Наконец, MK2 фосфорилирует белок-супрессор опухолевого роста туберина на Ser1210, создавая сайт стыковки для 14-3-3ζ. Туберин и гамартин обычно образуют функциональный комплекс, который отрицательно регулирует клеточный рост посредством антагонистического mTOR-зависимого сигнального пути, давая основание предполагать, что p38-опосредованная активация MK2 может регулировать клеточный рост путем повышения связывания 14-3-3ζ с туберином.
Накапливающиеся исследования показали, что реципрокное взаимовлияние между p38 MAPK-путем и трансдуктором сигнала и опосредованной активатором транскрипции 3 (STAT3) сигнальной трансдукцией формирует критическую ось, последовательно активируемую в моделях стимуляции липополисахаридом (LPS). Было показано, что сбалансированная активация этой оси необходима как для индукции, так и для распространения воспалительного ответа макрофагов, а также для контроля за фазой разрешения, которая в значительной мере запускается под действием IL-10 и замедленной активации STAT3 (Bode, J. et al., Cellular Signalling, 24: 1185-1194, 2012). Кроме того, другое исследование показало, что MK2 контролирует LPS-индуцированную экспрессию гена IFNβ и последующую IFNβ-опосредованную активацию STAT3 под действием нейтрализующих эффектов отрицательной регуляции MK3 на LPS-индуцированную p65 и IRF3-опосредованную передачу сигнала. Это исследование далее показало, что в макрофагах с нуль-мутацией mk2/3, IFNβ-зависимая активация STAT3 происходит независимо от IL-10, поскольку, в отличие от IFNβ-, нарушенная экспрессия IL-10 не восстанавливается при дополнительном истощении MK3 в макрофагах с нуль-мутацией mk2/3 (Ehlting, C. et al., J. Biol. Chem., 285(27): 24113-24124).
1.2. Ингибирование киназ
Эукариотические протеинкиназы составляют одно из наиболее крупных суперсемейств гомологичных белков, которые связаны за счет их каталитических доменов. Наиболее родственные протеинкиназы специфичны в отношении либо серин/треонинового, либо тирозинового фосфорилирования. Протеинкиназы играют ключевую роль в клеточном ответе на внеклеточные стимулы. Таким образом, стимуляция протеинкиназ считается одним из наиболее распространенных механизмов активации в системах трансдукции сигнала. Известно, что многие субстраты подвергаются фосфорилированию под действием множества протеинкиназ, и было опубликовано значительное количество информации о первичной последовательности каталитических доменах различных протеинкиназ. Эти последовательности имеют большое количество общих остатков, вовлеченных в связывание АТФ, катализ и поддержание структурной целостности. Большинство протеинкиназ имеет достаточно консервативный каталитический домен 30-32 кДа.
В исследованиях была предпринята попытка идентифицировать и использовать регуляторные элементы протеинкиназ. Эти регуляторные элементы включают ингибиторы, антитела и блокирующие пептиды.
1.2.1. Ингибиторы
Ингибиторы ферментов представляют собой молекулы, которые связываются с ферментами, тем самым снижая ферментативную активность. Связывание ингибитора может остановить вхождение субстрата в активный сайт фермента и/или препятствовать ферменту катализировать его реакцию (как у ингибиторов, направленных на АТФ-связывающий сайт киназы). Связывание ингибитора является либо обратимым, либо необратимым. Необратимые ингибиторы обычно взаимодействуют с ферментом и изменяют его химически (например, путем модификации ключевых аминокислотных остатков, необходимых для ферментативной активности), таким образом, что он больше не способен катализировать свою реакцию. В отличие от этого, обратимые ингибиторы связываются нековалентно, и различные типы ингибирования образуются в зависимости от того, связываются ли эти ингибиторы с ферментом, фермент-субстратным комплексом или и тем, и другим.
Ингибиторы ферментов зачастую оценивают по их специфичности и силе действия. Термин «специфичность» в контексте настоящего изобретения относится к селективному присоединению ингибитора или отсутствию его связывания с другими белками. Термин «сила действия» в контексте настоящего изобретения относится к константе диссоциации ингибитора, которая показывает концентрацию ингибитора, необходимую для ингибирования фермента.
Ингибиторы протеинкиназ были изучены для использования в качестве инструмента в регуляции активности протеинкиназ. Ингибиторы были изучены для использования, например, с циклин-зависимой (Cdk) киназой, MAP киназой, серин/треонин киназой, с протеинтирозинкиназами семейства Src, тирозинкиназами, кальмодулин-зависимыми киназами (CaM), казеинкиназами, киназой контрольной точки (Chkl), киназой 3 гликогенсинтазы (GSK-3), c-Jun N-концевой киназой (JNK), митоген-активированной протеинкиназой 1 (MEK), киназой легкой цепи миозина (MLCK), протеинкиназой A, Akt (протеинкиназой B), протеинкиназой C, протеинкиназой G, протеинтирозинкиназой, Raf киназой и Rho киназой.
1.2.2. Низкомолекулярные ингибиторы MK2
Хотя были созданы индивидуальные ингибиторы, которые нацелены на MK2 по меньшей мере с умеренной селективностью в отношении других киназ, было трудно получить соединения с подходящей растворимостью и проницаемостью. В результате, существует сравнительно немного биохимически эффективных ингибиторов MK2, которые были перспективными в доклинических испытаниях in vivo (Edmunds, J. и Talanian, MAPKAP Kinase 2 (MK2) as a Target for Anti-inflammatory Drug Discovery. In Levin, J and Laufer, S (Ed.), RSC Drug Discovery Series No. 26, p 158-175, the Royal Society of Chemistry, 2012; включено посредством ссылки в полном объеме).
Большинство описанных ингибиторов MK2 представляют собой классических тип I ингибиторов по данным кристаллографических или биохимических исследований. Как таковые, они связываются с АТФ сайтом киназы и, таким образом, конкурируют с внутриклеточным АТФ (рассчитанная концентрация 1 мM - 5 мM) для ингибирования фосфорилирования и активации киназы. Характерные примеры низкомолекулярных ингибиторов MK2 включают, но не ограничиваются
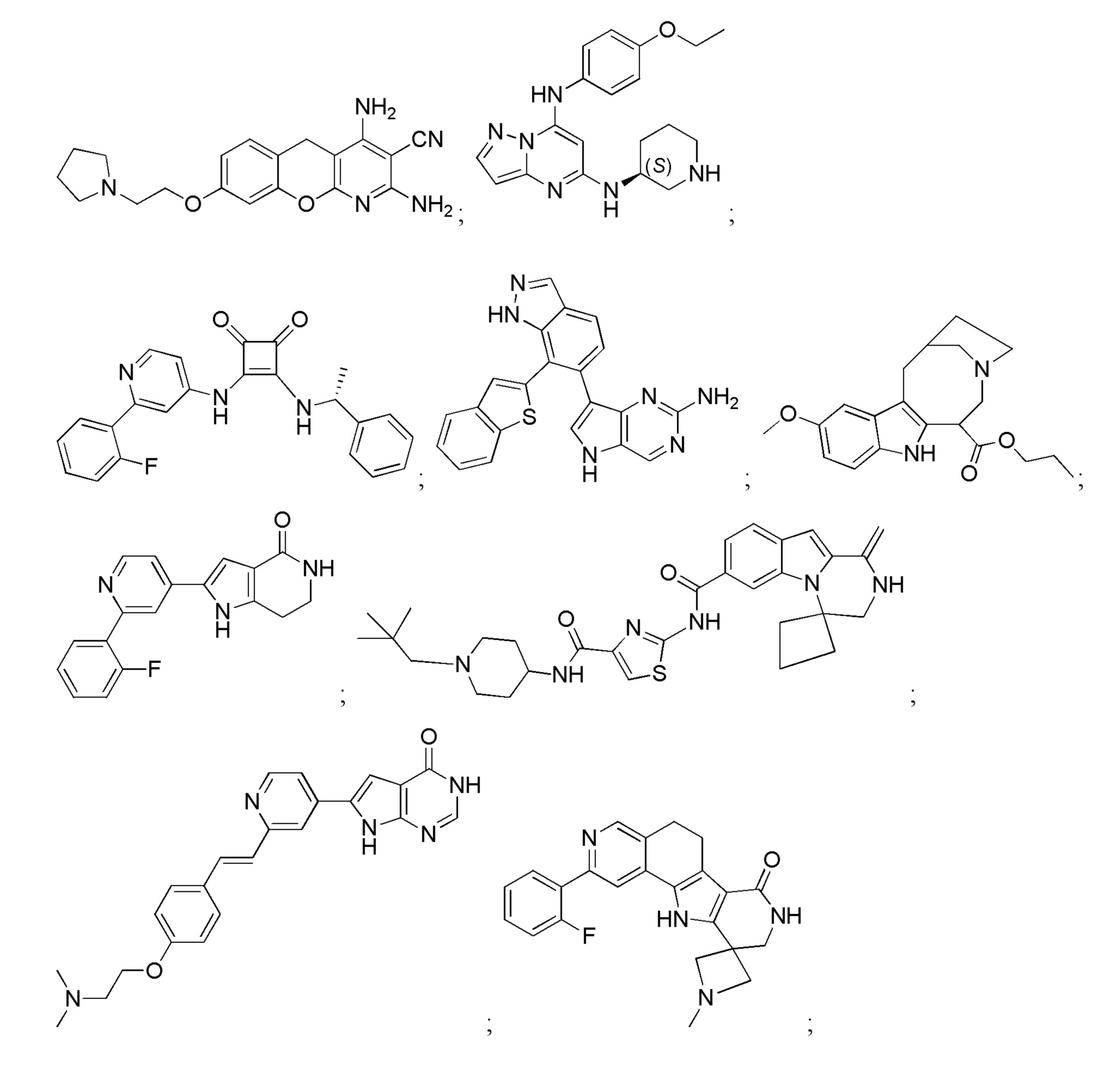

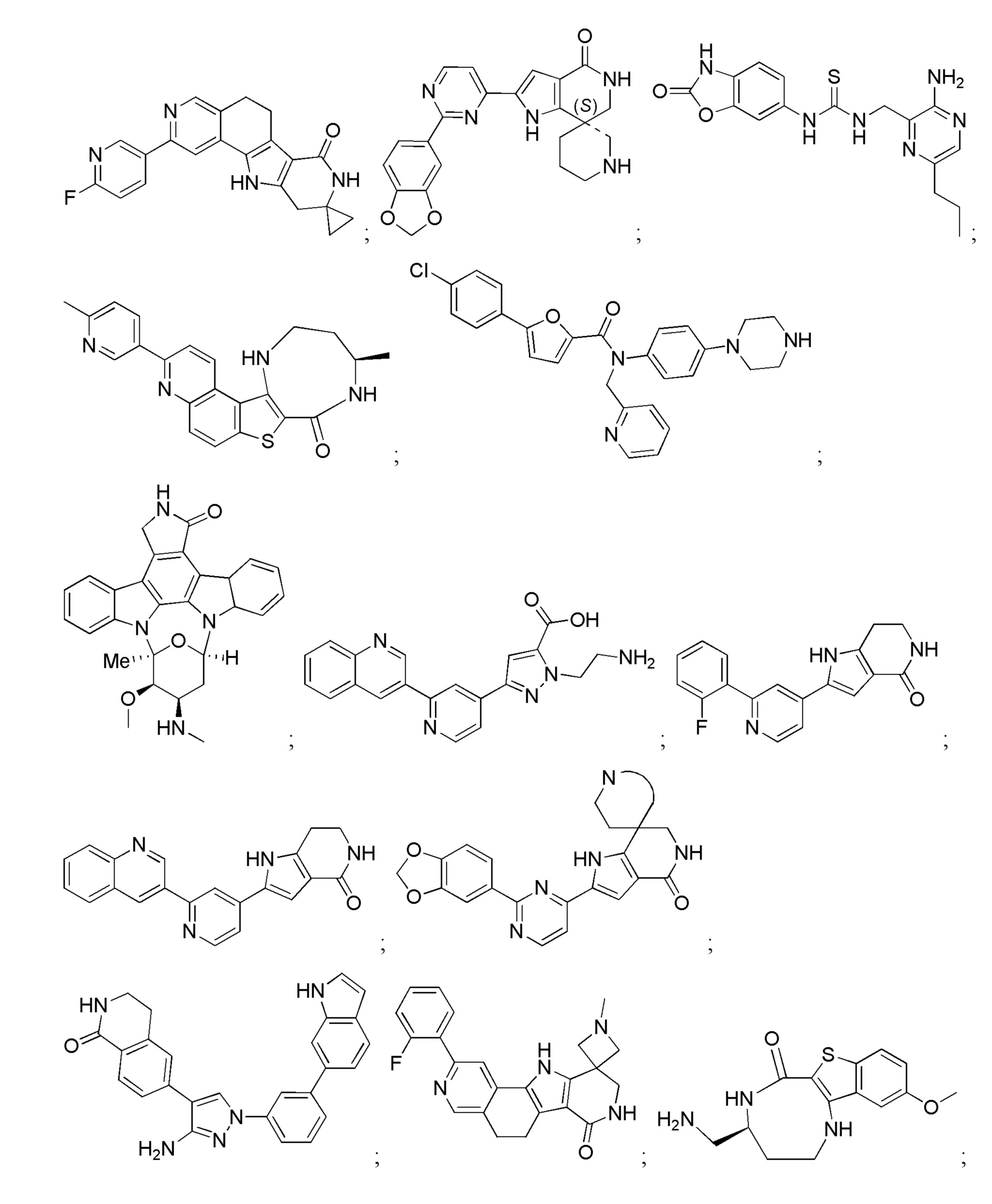

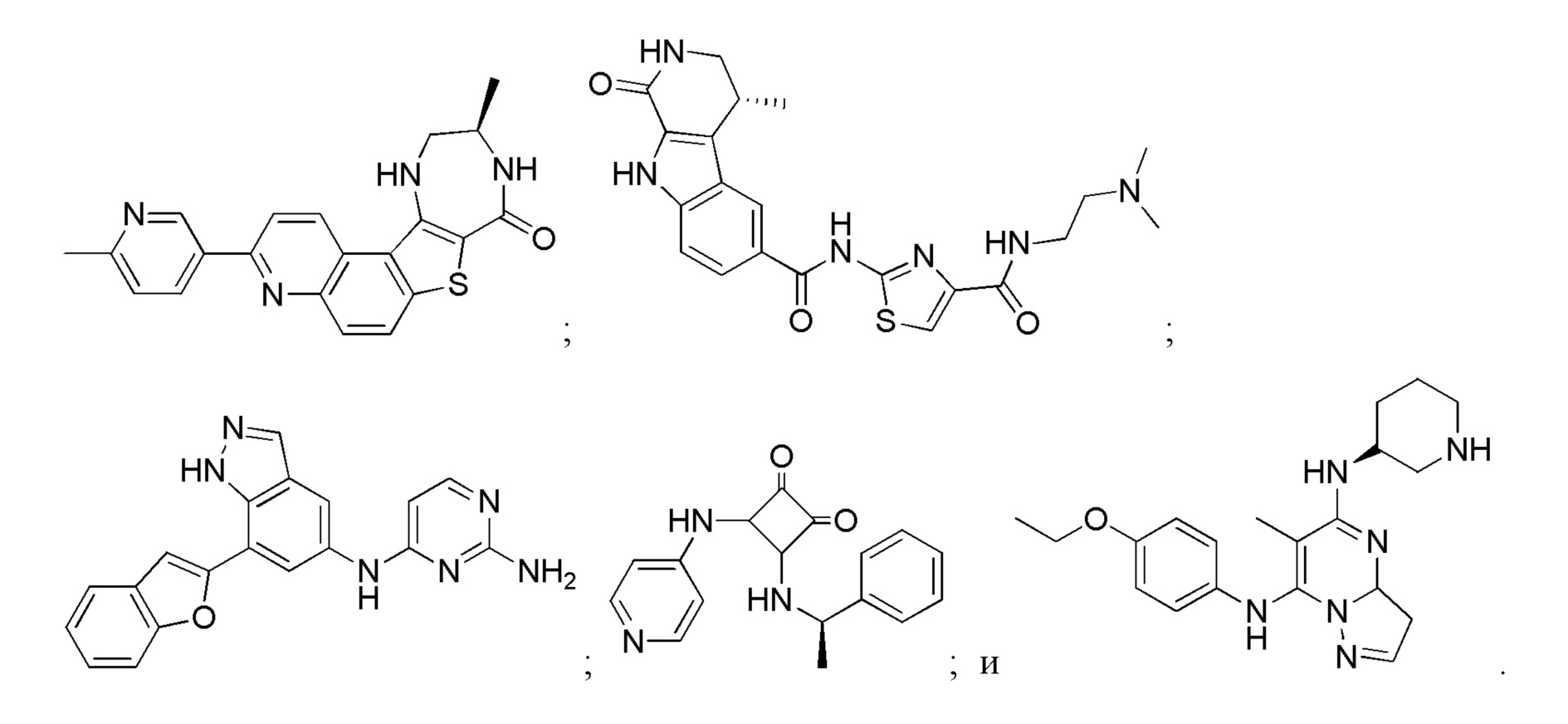
1.2.3. Блокирующие пептиды
Пептид представляет собой химическое соединение, которое состоит из цепи двух или более аминокислот, при этом карбоксильная группа одной аминокислоты в цепи соединена с аминогруппой другой посредством пептидной связи. Пептиды были использованы, в том числе, в исследовании структуры и функции белков. Синтетические пептиды могут быть использованы, среди прочего, в качестве зондов для того, чтобы увидеть, где происходят взаимодействия белок-пептид. Ингибиторные пептиды могут быть использованы, в том числе, в клинических исследованиях для проверки действия пептидов на ингибирование протеинкиназ, онкобелков и других нарушений.
Было изучено применение некоторых блокирующих пептидов. Например, внеклеточные регулируемые сигналом киназы (ERK), MAPK протеинкиназы, являются необходимыми для пролиферации и дифференцировки клеток. Для активации MAPK требуется каскадный механизм, посредством которого MAPK фосфорилируется под действием вышележащей MAPKK (MEK), которая затем, в свою очередь, фосфорилируется третьей киназой MAPKKK (MEKK). ERK ингибиторный пептид действует как MEK ловушка путем связывания с ERK.
Другие блокирующие пептиды включают ингибиторный пептид, родственный аутокамтиду-2 (AIP). Этот синтетический пептид является высокоспецифичным и мощным ингибитором Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII). AIP является нефосфорилируемым аналогом аутокамтида-2, высоко селективным пептидным субстратом для CaMKII. AIP ингибирует CaMKII с IC50 100 нМ (IC50 представляет собой концентрацию ингибитора, необходимую для получения 50% ингибирования). AIP ингибирование является неконкурентным в отношении синтида-2 (CaMKII пептидный субстрат) и АТФ, но конкурентным в отношении аутокамтида-2. На ингибирование не влияет присутствие или отсутствие Ca2+/кальмодулина. Активность CaMKII ингибируется полностью под действием AIP (1 µM) тогда как PKA, PKC и CaMKIV не подвержены влиянию.
Другие блокирующие пептиды включают ингибиторный пептид протеинкиназы 5 клеточного деления (Cdk5) (CIP). Cdk5 фосфорилирует белок микротрубочек tau на специфичных для болезни Альцгеймера фосфо-эпитопах при ассоциации с p25. p25 является усеченным активатором, который образуется из физиологического Cdk5 активатора p35 при воздействии амилоидных β пептидов. При нейрональной инфекции CIP, CIP селективно ингибируют активность p25/Cdk5 и подавляют нарушенное фосфорилирование tau в нейронах коры головного мозга. Причины специфичности, демонстрируемой CIP полностью не понятны.
Дополнительные блокирующие пептиды были изучены для киназы 2, регулируемой внеклеточным стимулом (ERK2), ERK3, p38/HOG1, протеинкиназы C, казеинкиназы II, Ca2+/кальмодулин киназы IV, казеинкиназы II, Cdk4, Cdk5, ДНК-зависимой протеинкиназы (DNA-PK), серин/треонин-протеинкиназы PAK3, фосфоинозитид (PI)-3 киназы, PI-5 киназы, PSTAIRE (cdk высококонсервативная последовательность), рибосомальной S6 киназы, GSK-4, киназы зародышевого центра (GCK), SAPK (стресс-активированной протеинкиназы), SEK1 (стресс-сигнальной киназы) и киназы фокальной адгезии (FAK).
1.2.4. Конкурентные ингибиторы белкового субстрата
Большинство из ингибиторов протеинкиназ, разработанных к настоящему времени, являются конкурентами АТФ. Этот тип молекулы конкурирует за АТФ-связывающий сайт киназы и зачастую демонстрирует нецелевые эффекты вследствие серьезных ограничений в их специфичности. Низкая специфичность этих ингибиторов имеет место вследствие того факта, что АТФ-связывающий сайт является высоко консервативным среди различных протеинкиназ. Не-АТФ конкурентные ингибиторы, с другой стороны, ожидается, что такие как субстрат-конкурентные ингибиторы, являются более специфичными, поскольку субстрат-связывающие сайты имеют определенную степень вариабельности среди различных протеинкиназ.
Хотя субстрат-конкурентные ингибиторы обычно имеют слабое связывающее взаимодействие с ферментом-мишенью in vitro, исследования показали, что химические модификации могут улучшать специфическую аффинность связывания и in vivo эффективность субстратных ингибиторов (Eldar-Finkelman, H. et al., Biochim, Biophys. Acta, 1804(3):598-603, 2010). Кроме того, субстрат-конкурентные ингибиторы демонстрируют лучшую эффективность в клетках, чем в бесклеточных условиях во многих случаях (van Es, J. et al., Curr. Opin. Gent. Dev. 13:28-33, 2003).
В попытке повысить специфичность и силу действия в ингибировании протеинкиназ, также были разработаны бисубстратные ингибиторы. Бисубстратные ингибиторы, которые состоят их двух конъюгированных фрагментов, каждый нацеленный на разные сайты связывания бисубстратного фермента, образуют особую группу ингибиторов протеинкиназ, которые имитируют два природных субстрата/лиганда, и которые одновременно связываются с двумя областями заданных киназ. Принципиальным преимуществом бисубстратных ингибиторов является их способность генерировать больше взаимодействий с ферментом-мишенью, что могло в результате приводить к улучшенной аффинности и селективности конъюгатов, по сравнению с односайтовыми ингибиторами. Примеры бисубстратных ингибиторов включают, но не ограничиваются, конъюгаты нуклеотид-пептид, конъюгаты производных аденозина и пептида, и конъюгаты пептидов с мощными АТФ-конкурентными ингибиторами.
1.2.5. Домены белковой трансдукции
Плазматическая мембрана представляет труднопреодолимый барьер для введения макромолекул в клетки. Почти для всех лекарственных средств для оказания их эффектов по меньшей мере одна клеточная мембрана должна быть преодолена. Традиционная разработка лекарственных средств с низкой молекулярной массой основана на случайном открытии молекул, проникающих в мембрану, со способностью модулировать функцию белка. Хотя молекулы с низкой молекулярной массой остаются доминирующей терапевтической моделью, многие из этих молекул страдают недостаточной специфичностью, побочными эффектами и токсичностью. Информационно-насыщенные макромолекулы, которые обладают функциями модуляции белка, в значительной степени превосходящие функции молекул с низкой молекулярной массой, могут быть разработаны путем рационального моделирования лекарственных средств, исходя из молекулярных, клеточных и структурных данных. Однако, плазматическая мембрана является непроницаемой для большинства молекул размер которых превышает 500 Да. Следовательно, способность пептидов, пенетрирующих клетки, таких как основной домен транс-активатора транскрипции (Tat), проходить через клеточную мембрану и доставлять макромолекулярный груз in vivo, может значительно облегчить рациональное моделирование терапевтических белков, пептидов и нуклеиновых кислот.
Домены белковой трансдукции (PTD) представляют собой класс пептидов, способных пенетрировать плазматическую мембрану клеток млекопитающих и переносить соединения многих типов и молекулярной массы через мембрану. Эти соединения включают эффекторные молекулы, такие как белки, ДНК, конъюгированные пептиды, олигонуклеотиды и небольшие частицы, такие как липосомы. В тех случаях, когда PTD химически связаны или слиты с другими белками, полученные в результате слитые пептиды сохраняют способность входить в клетки. Хотя точный механизм трансдукции неизвестен, не считают, что интернализация этих белков является опосредованной рецепторами или белками-переносчиками. Длина PTD обычно составляет 10-16 аминокислот и PTD могут быть сгруппированы в соответствии с их составом, как, например, пептиды, богатые аргинином и/или лизином.
Применение PTD, способы переносить эффекторные молекулы в клетки, становится все более привлекательным при моделировании лекарственных средств, поскольку они способствуют клеточному поглощению транспортируемых молекул. Эти пептиды, пенетрирующие клетки, в основном классифицируют как амфипатические (означая наличие как полярного, так и неполярного конца) или катионные (означая или относящиеся к содержащим сеть положительно заряженных атомов) в зависимости от их последовательности, обеспечивают технологию неинвазивной доставки макромолекул. PTD зачастую называют «троянскими пептидами», «последовательностями транслокации мембраны» или «белки клеточной проницаемости» (CPP). PTD также могут быть использованы для содействия новым ингибиторам HSPB1 киназы для пенетрации клеточных мембран. (смотри заявки США № 11/972459 под названием «Polypeptide Inhibitors of HSPB1 Kinase and Uses Therefor», поданной 10 января 2008, и № 12/188109, под названием «Kinase Inhibitors and Uses Thereof», поданной 7 августа 2008, содержания каждой заявки включено посредством ссылки в полном объеме).
1.2.5.1. Вирусные белки, содержащие PTD
Первые белки, описанные как обладающие свойствами трансдукции, были вирусного происхождения. Эти белки все еще являются наиболее общепринятыми моделями действия PTD. HIV-1 трансактиватор транскрипции (Tat) и HSV-1 VP 22 белок являются наиболее хорошо охарактеризованными вирусными PTD содержащими белками.
Tat (HIV-1 транс-активаторный генный продукт) представляет собой полипептид из 86 аминокислот, который действует как мощный транскрипционный фактор интегрированного генома HIV-1. Tat действует на вирусный геном, стимулируя репликацию вируса в латентно-инфицированных клетках. Свойства транслокации Tat белка дают ему возможность активировать инфицированные клетки, находящиеся в состоянии покоя, и он может быть вовлечен в примирование неинфицированных клеток для последующего инфицирования путем регуляции многих клеточных генов, включая цитокины. Минимальный PTD Tat представляет собой белковую последовательность из 9 аминокислот RKKRRQRRR (TAT49-57; SEQ ID NO: 20). Исследования с использованием более длинного фрагмента Tat показали успешную трансдукцию слитых белков до 120 кДа. Было показано, что добавление множественных Tat-PTD, а также синтетических производных Tat, опосредует мембранную транслокацию. Слитые белки, содержащие PTD Tat, были использованы в качестве терапевтических функциональных групп в экспериментах, включающих злокачественные опухоли, транспортирующие белок смерти в клетки, и модели заболеваний нейродегенеративных нарушений.
Механизм, используемый трансдуцирующими пептидами для проникновения через клеточные мембраны был предметом значительного интереса, поскольку исследователи пытались понять биологию, лежащую в основе трансдукции. Ранее сообщения о том, что Tat-трансдукция происходила под действием неэндоцитозного механизма, в большинстве случаев были отвергнуты как надуманные, хотя другие пенетрирующие клетку пептиды могли быть захвачены путем прямого разрушения мембраны. Недавние сведения о том, что трансдукция Tat и других PTD происходит путем микропиноцитоза, особой формы эндоцитоза, создали новую модель в исследовании этих пептидов. Расширенное знание о механизме трансдукции помогло улучшить эффективность трансдукции с конечной целью клинического успеха (Snyder E. and Dowdy, S., Pharm Res., 21(3):389-393, 2004).
Имеющаяся в настоящее время модель Tat-опосредованной белковой трансдукции представляет собой многостадийный процесс, который включает связывание Tat с поверхностью клетки, стимуляцию макропиноцитоза, захват Tat и транспортировку в макропиносомы, и эндосомальное выделение в цитоплазму. Считается, что первая стадия, связывание с клеточной поверхностью, происходит через повсеместно распространенные цепи гликанов на поверхности клетки. Стимуляция макропиноцитоза под действием Tat происходит под действием неизвестного механизма, который может включать связывание с белком клеточной поверхности или происходит посредством протеогликанов или гликолипидов. Захват посредством макропиноцитоза, формы жидкофазного эндоцитоза, используемого всеми типами клеток, необходим для Tat и полиаргининовой трансдукции. Конечная стадия в Tat трансдукции представляет собой выход из макропиносом в цитоплазму; этот процесс, вероятно, зависит от pH, понижающегося в эндомомах, что, наряду с другими факторами, облегчает перестройку мембраны под действием Tat и высвобождает Tat и его груз (т.е. пептид белок или лекарственное средство, и так далее) в цитоплазму (Snyder E. и Dowdy, S., Pharm Res., 21(3):389-393, 2004).
VP22 представляет собой белок наружной оболочки HSV-1, структурной части вириона HSV. VP22 способен к рецептор-независимой транслокации и накапливается в ядре. Это свойство VP22 классифицирует этот белок как PTD содержащий пептид. Слитые белки, содержащие полноразмерный VP22, были эффективно транслоцированы через плазматическую мембрану.
1.2.5.2. Гомеопротеины, обладающие свойствами межклеточной транслокации
Гомеопротеины представляют собой высоко консервативные трансактивирующие факторы транскрипции, вовлеченные в морфологические процессы. Они связываются с ДНК через специфическую последовательность из 60 аминокислот. ДНК-связывающий гомеодомен является наиболее высоко консервативной последовательностью гомеопротеина. Некоторые гомеопротеины были описаны как демонстрирующие PTD-подобную активность; они способны к эффективной транслокации через клеточные мембраны энергонезависимым и эндоцитознезависимым путем без специфичности типа клеток.
Белок Antennapedia (Antp) представляет собой транс-активирующий фактор, способный к транслокации через клеточные мембраны; минимальная последовательность, способная к транслокации, представляет собой пептид из 16 аминокислот, соответствующий третьей спирали белкового гомеодомена (HD). Интернализация этой спирали происходит при 4°C, давая основание предполагать, что этот процесс не зависит от эндоцитоза. Пептиды вплоть до 100 аминокислот, продуцировались в виде слитых белков с AntpHD пенетрирующим клеточные мембраны.
Другие гомеодомены, способные к транслокации, включают гомеодомен Fushi tarazu (Ftz) и Engrailed (En). Многие гомеодомены имеют общую высококонсервативную третью спираль.
1.2.5.3. PTD человека
PTD человека могут обойти потенциальные проблемы иммуногенности при введении пациенту человеку. Пептиды с последовательностями PTD включают: Hoxa-5, Hox-A4, Hox-B5, Hox-B6, Hox-B7, HOX-D3, GAX, MOX-2, и FtzPTD. Все эти белки имеют общую последовательность, обнаруженную в AntpPTD. Другие PTD включают Islet-1, интерлейкин-1 (IL-1), фактор некроза опухоли (TNF) и гидрофобную последовательность из сигнального пептида фактора роста капоши-фибробластов или фактора роста фибробластов 4 (FGF-4), которая способна к энерго-, рецепторно- и эндоцитоз-зависимой транслокации. Неподтвержденные PTD включают представителей семейства факторов роста фибробластов (FGF). FGF представляют собой полипептидные факторы роста, которые регулируют пролиферацию и дифференцировку целого ряда клеток. В некоторых публикациях сообщалось о том, что основной фактор роста фибробластов (FGF-2) демонстрирует нестандартную интернализацию, сходную с интернализацией VP-22, Tat и гомодоменов. Также сообщалось, что кислый FGF (FGF-1) транслоцировал клеточные мембраны при таких низких температурах, как 4°C. Однако, не существует никаких убедительных доказательств относительно домена, ответственного за свойства интернализации или транслокации слитых белков (Beerens, A. et al., Curr Gene Ther., 3(5):486-494, 2003).
1.2.5.4. Синтетические PTD
Некоторые пептиды были синтезированы в попытке создать более эффективные PTD и для выяснения механизмов, посредством которых PTD переносят белки через клеточные мембраны. Многие из этих синтетических PTD основаны на существующих и широко освещенных в документах пептидах, тогда как другие выбраны по их основным остаткам и/или положительным зарядам, которые, как полагают, являются важными для функции PTD. Несколько из таких синтетических PTD показали улучшенные свойства транслокации по сравнению с существующими доменами (Beerens, A. et al., Curr Gene Ther., 3(5):486-494, 2003). Примеры Tat-производных синтетических PTD включают, например, но не ограничиваются, WLRRIKAWLRRIKA (SEQ ID NO: 12); WLRRIKA (SEQ ID NO: 13); YGRKKRRQRRR (SEQ ID NO: 14); WLRRIKAWLRRI (SEQ ID NO: 15); FAKLAARLYR (SEQ ID NO: 16); KAFAKLAARLYR (SEQ ID NO: 17); и HRRIKAWLKKI (SEQ ID NO: 18).
2. Анатомия и физиология кожи
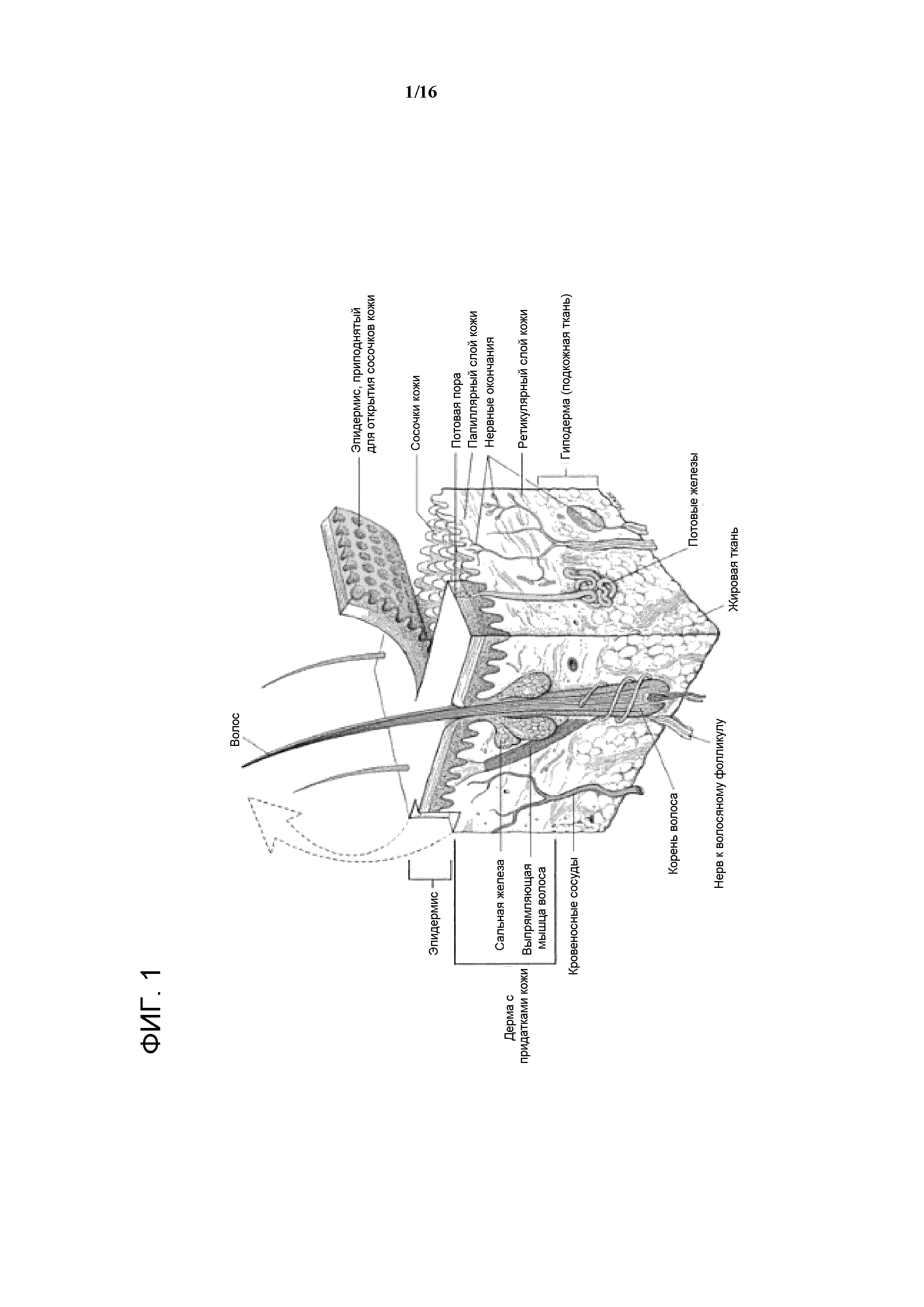
Кожа является самым крупным органом в организме, состоящим из нескольких слоев, и играет важную роль в биологическом гомеостазе. Ее повторное сближение над поверхностью раны уже давно является первым признаком завершения значительной части заживления раны. Это повторное закрытие дефекта восстанавливает защитную функцию кожи, которая включает защиту от бактерий, токсинов и механических усилий, а также обеспечивает барьер для удерживания необходимой жидкости в организме. Эпидермис, который состоит из нескольких слоев, начиная с рогового слоя, является наружным слоем кожи. Внутренний слой кожи представляет собой глубокую дерму. Кожа выполняет множество функций, в том числе, терморегуляцию, метаболическую функцию (метаболизм витамина D) и иммунологические функции. На Фигуре 1 представлена диаграмма анатомии кожи.
Эпидермис
Быстрое и эффективное закрытие раны является функцией эпидермиса. Эпидермис обеспечивает буферную зону организма от окружающей среды. Он обеспечивает защиту от травмы, исключает токсины и микроорганизмы и обеспечивает полупроницаемую мембрану, сохраняя жизненно важные жидкости организма в защитной оболочке. Традиционно, эпидермис делили на несколько слоев, из которых два являются физиологически наиболее важными. Базально-клеточный слой или герминативный слой, является важным вследствие того, что он является первичным источником регенеративных клеток. В процессе заживления ран это площадь, которая в большинстве случаев претерпевает митоз. Верхний эпидермис, в том числе роговой и гранулярный слой, представляет собой другую область формирования нормальной функции эпидермального барьера.
В тех случаях, когда эпидермис поврежден, организм является объектом инвазии внешних агентов и потери жидкости организма. Заживление эпидермальных ран главным образом происходит путем клеточной миграции. Кластеры эпидермальных клеток мигрируют в область повреждения и покрывают дефект. Эти клетки являются фагоцитирующими и очищают поверхность от дебриса и сгустков плазмы. Клетки репарации происходят из локальных источников, которые главным образом представляют собой наросты дермы из смежных интактных областей кожи. Заживление происходит быстро, и кожа регенерирует и остается не покрытой рубцами. Волдыри являются примерами эпидермальных ран. Они могут быть небольшими везикулами или крупными вздутиями (волдыри диаметром больше 1 см).
Роговой слой и кислотная мантия
Роговой слой представляет бессосудистую многослойную структуру, которая функционирует в качестве барьера для окружающей среды и предотвращает потерю воды через эпидермис. Недавние исследования показали, что ферментативная активность вовлечена в образование кислотной мантии в роговом слое. Совместно, кислотная мантия и роговой слой делают кожу менее проницаемой для воды и других полярных соединений и опосредовано защищают кожу от инвазии микроорганизмов. В норме рН поверхности кожи составляет от 4 до 6,5 у здоровых людей; это значение варьирует в соответствии с областью кожи на теле. Такой низкий рН образует кислотную мантию, которая усиливает барьерную функцию кожи. Повреждение рогового слоя повышает рН кожи, и, следовательно, подверженность кожи бактериальным кожным инфекциям.
Другие слои эпидермиса
Другие слои эпидермиса ниже рогового слоя включают блестящий слой, зернистый слой, шиповатый слой и базальный слой. Каждый содержит живые клетки со специализированными функциями (Фигура 2). Например, меланин, который продуцируется меланоцитами в эпидермисе, отвечает за цвет кожи. Клетки Лангерганса вовлечены в иммунологический процессинг.
Наросты дермы
Наросты дермы, которые включают волосяные фолликулы, сальные и потовые железы, ногти на пальцах рук и ног, берут начало в эпидермисе и выступают в дерму волосяные фолликулы и сальные и потовые железы способствуют быстрой реэпителиализации эпителиальными клетками ран, которые не проникают через дерму (называемые неполнослойными ранами). Сальные железы отвечают за секрет, который смазывает кожу, поддерживая ее мягкой и упругой. Больше всего их на лице и они не многочисленны на ладонях рук и ступнях ног. Секрет потовых желез контролирует рН кожи для предотвращения инфекций кожи. Потовые железы, кровеносные сосуды кожи и небольшие мышцы в коже (ответственные за «гусиную кожу») контролируют температуру на поверхности тела. Нервные окончания в коже включают рецепторы боли, прикосновения, тепла и холода. Утрата этих нервных окончаний повышает риск разрушения кожных покровов за счет снижения толерантности в ткани к внешним воздействиям.
Базальная мембрана как отделяет, так и соединяет эпидермис и дерму. В тех случаях, когда эпидермальные клетки в базальной мембране делятся, одна клетка остается, а другие мигрируют через зернистый слой в поверхностный роговой слой. На поверхности клетки гибнут и образуют кератин. Сухой кератин на поверхности называют чешуйками. Гиперкератоз (утолщенные слои кератина) зачастую обнаруживаемый на пятках, указывает на утрату сальных желез и потовых желез, если пациент страдает диабетом. С возрастом базальная мембрана атрофируется; разделение между базальной мембраной и дермой является одной из причин разрывов кожи в пожилом возрасте.
Дерма
Дерма, или собственно кожа, представляет собой сосудистую структуру, которая поддерживает и питает эпидермис. Кроме того, существуют чувствительные нервные окончания в дерме, которые передают сигналы о боли, давлении, тепле и холоде. Дерма делится на два слоя: поверхностная дерма состоит из внеклеточного матрикса (коллагена, эластина и основного вещества) и содержит кровеносные сосуды, лимфатические, эпителиальные клетки, соединительную ткань, мышечную, жировую и нервную ткань. Кровоснабжение дермы отвечает за питание эпидермиса и регуляцию температуры тела. Фибробласты отвечают за продукцию компонентов коллагена и эластина кожи, которые придают ей тургор. Фибронектин и гиалуроновая кислота секретируются фибробластами.
Глубокая дерма расположена над подкожной жировой клетчаткой; она содержит более крупные сети кровеносных сосудов и нити коллагена для обеспечения прочности при растяжении. Она также состоит из фиброэластической соединительной ткани, которая имеет желтый цвет и состоит, главным образом из коллагена. Фибробласты также присутствуют в этом слое ткани. Хорошо васкуляризированная дерма выдерживает давление в течение более длительных периодов времени, чем подкожная ткань или мышца. Коллаген в коже придает коже ее прочность. Кожные раны, например, трещины или гнойники, вовлекают эпидермис, базальную мембрану и дерму. Обычно повреждения кожи заживают быстро. Трещины в коже могут выделять сыворотку, кровь или гной и приводить к образованию тромбов или струпа. Гнойники представляют собой заполненные гноем везикулы, которые зачастую представлены инфицированным волосяным фолликулом.
3. Биология заживления ран
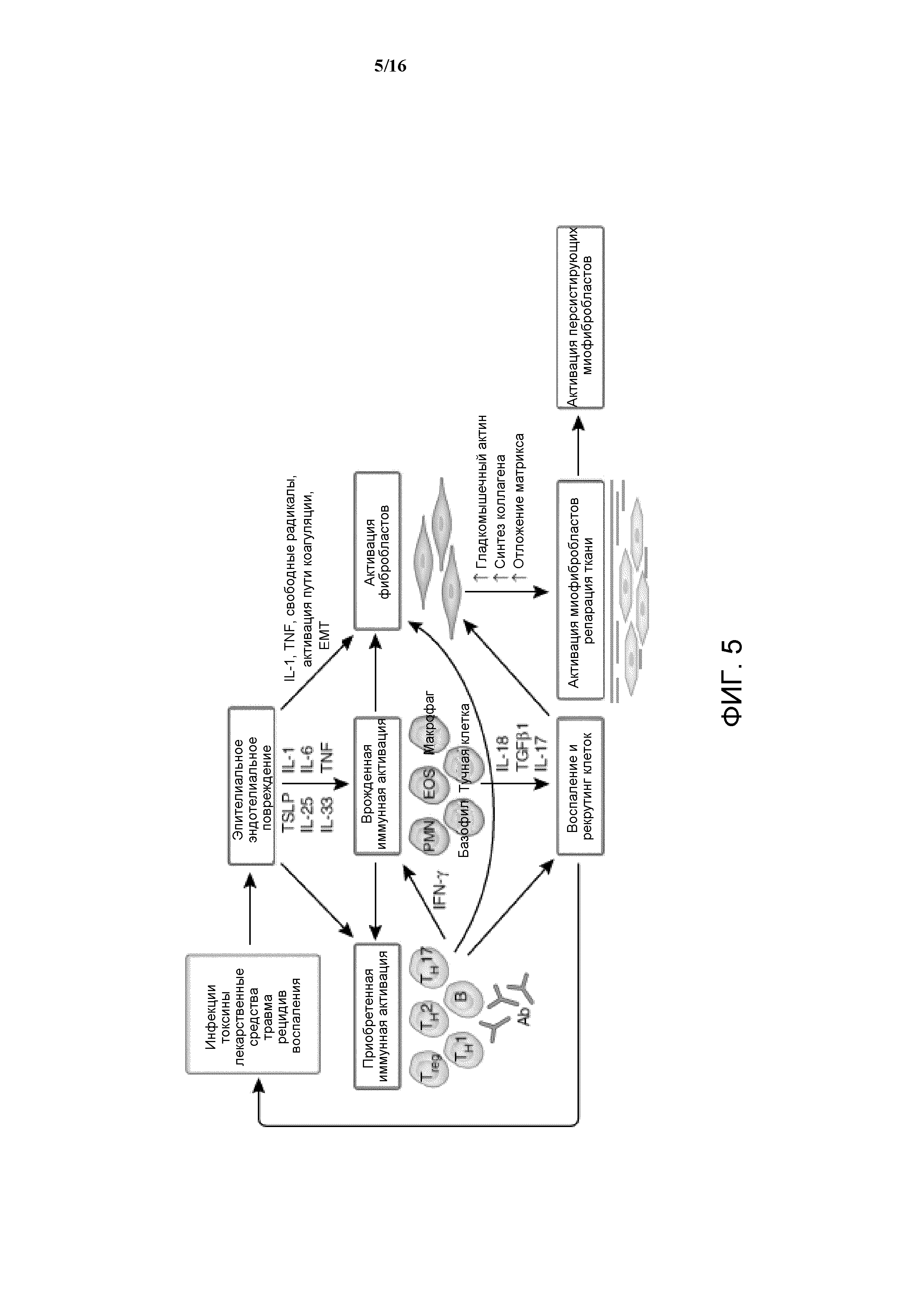
Заживление ран представляет собой динамический, интерактивный процесс, вовлекающий растворимые медиаторы, клетки крови, внеклеточный матрикс и клетки паренхимы. Заживление ран протекает через три перекрывающиеся динамические фазы: (1) фаза воспаления, (2) пролиферативная фаза и (3) фаза ремоделирования.
Фаза воспаления запускается повреждением капилляров, что приводит к образованию тромба/временного матрикса, состоящего из фибрина и фибронектина. Этот временный матрикс заполняет дефект ткани и обеспечивает входящий поток эффекторных клеток. Тромбоциты, находящиеся в тромбе, высвобождают множество цитокинов, которые принимают участие в накоплении клеток воспаления (таких как нейтрофилы, моноциты и макрофаги, среди прочих), фибробластов и эндотелиальных клеток (EC) (Фигура 5).
За фазой воспаления следует пролиферативная фаза, в которую активный ангиогенез создает новые капилляры, что дает возможность осуществлять доставку питательных веществ к месту раны, в частности, для поддержания пролиферации фибробластов. Фибробласты, присутствующие в грануляционной ткани, активируются и приобретают фенотип наподобие гладкомышечных клеток, затем называемых миофибробластами. Миофибробласты синтезируют и откладывают компоненты внеклеточного матрикса (ECM), которые замещают временный матрикс. Они также обладают сократительными свойствами, опосредуемыми α-гладкомышечным актином, организованным в пучки микрофиламентов или волокна напряжения. Миофибробластная дифференцировка фибробластных клеток начинается с появления протомиофибробласта, волокна напряжения которого содержат только β- и γ-цитоплазматические актины. Протомиофибробласты могут превращаться в дифференцированные миофибробласты, волокна напряжения которых содержат α-гладкомышечный актин.
Третья фаза заживления включает постепенное ремоделирование грануляционной ткани и реэпителизацию. Этот процесс ремоделирования опосредуется преимущественно протеолитическими ферментами, в частности, матриксными металлопротеиназами (MMP) и их ингибиторами (TIMP, тканевые ингибиторы металлопротеиназ). Во время реэпителизации коллаген III типа, основной компонент грануляционной ткани, постепенно замещается коллагеном I типа, основным структурным компонентом дермы. Эластин, который вносит вклад в эластичность кожи и отсутствует в грануляционной ткани, также появляется снова. Клеточная плотность нормализуется посредством апоптоза клеток сосудов и миофибробластов (рассасывание).
3.1. Воспаление
Повреждение тканей вызывает разрушение кровеносных сосудов и транссудацию компонентов крови. Тромб восстанавливает гемостаз и предоставляет временный внеклеточный матрикс для миграции клеток. Тромбоциты не только облегчают формирование гемостатического слоя, а также секретируют некоторые медиаторы заживления ран, такие как тромбоцитарный фактор роста, который привлекает и активирует макрофаги и фибробласты (Heldin, C. and Westermark B., In: Clark R., ed. The molecular and cellular biology of wound repair, 2nd Ed. New York, Plenum Press, pp. 249-273, (1996)). Было выдвинуто предположение, однако, что в отсутствие геморрагии, тромбоциты не являются обязательными для заживления ран; многочисленные вазоактивные медиаторы и хемотактические факторы образуются посредством коагуляции и активированных путей комплемента и посредством поврежденных или активированных клеток паренхимы, которые, как было показано, привлекают воспалительные лейкоциты в место повреждения (Id.).
Инфильтрирующие нейтрофилы очищают раневую область от чужеродных частиц и бактерий, а затем выталкиваются со струпом (погибшая ткань, которая отделяется (сбрасывается) со здоровой кожи или фагоцитируется макрофагами). В ответ на специфические хемоаттрактанты, такие как фрагменты белков внеклеточного матрикса, трансформирующий фактор роста β (TGF-β) и моноцитарный хемоаттрактантный белок 1 (MCP-1), моноциты также инфильтрируют место раны и становятся активированными макрофагами, которые высвобождают факторы роста (такие как тромбоцитарный фактор роста и сосудистый эндотелиальный фактор роста), которые инициируют образование грануляционной ткани. Макрофаги связываются со специфическими белками внеклеточного матрикса посредством их интегриновых рецепторов, действие, которое стимулирует фагоцитоз микроорганизмов и фрагментов внеклеточного матрикса макрофагами (Brown, E. Phagocytosis, Bioessays, 17:109-117 (1995)). Исследования показали, что адгезия к внеклеточному матриксу также стимулирует моноциты к претерпеванию метаморфоза в воспалительные или репаративные макрофаги. Эти макрофаги играют важную роль в переходе между воспалением и репарацией (Riches, D., In Clark R., Ed. The molecular and cellular biology of wound repair, 2nd Ed. New York, Plenum Press, pp. 95-141). Например, адгезия индуцирует моноциты и макрофаги для экспрессии колониестимулирующего фактора 1 (CSF-1), цитокина, необходимого для выживания моноцитов и макрофагов; фактора некроза опухоли α (TNF-α), мощного воспалительного цитокина; и тромбоцитарного фактора роста (PDGF), мощного хемоаттрактанта и митогена для фибробластов. Было показано, что другие цитокины экспрессируемые моноцитами и макрофагами, включают трансформирующий фактор роста (TGF-α), интерлейкин-1 (IL-1), трансформирующий фактор роста β (TGF-β) и инсулиноподобный фактор роста I (IGF-I) (Rappolee, D. et al., Science, 241, pp. 708-712 (1988)). Было предположено, что моноцитарные и макрофагальные факторы роста необходимы для инициации и развития образования новой ткани в ранах, поскольку у животных с истощением макрофагов нарушен процесс заживления ран (Leibovich, S. and Ross, R., Am J Pathol, 78, pp 1-100 (1975)).
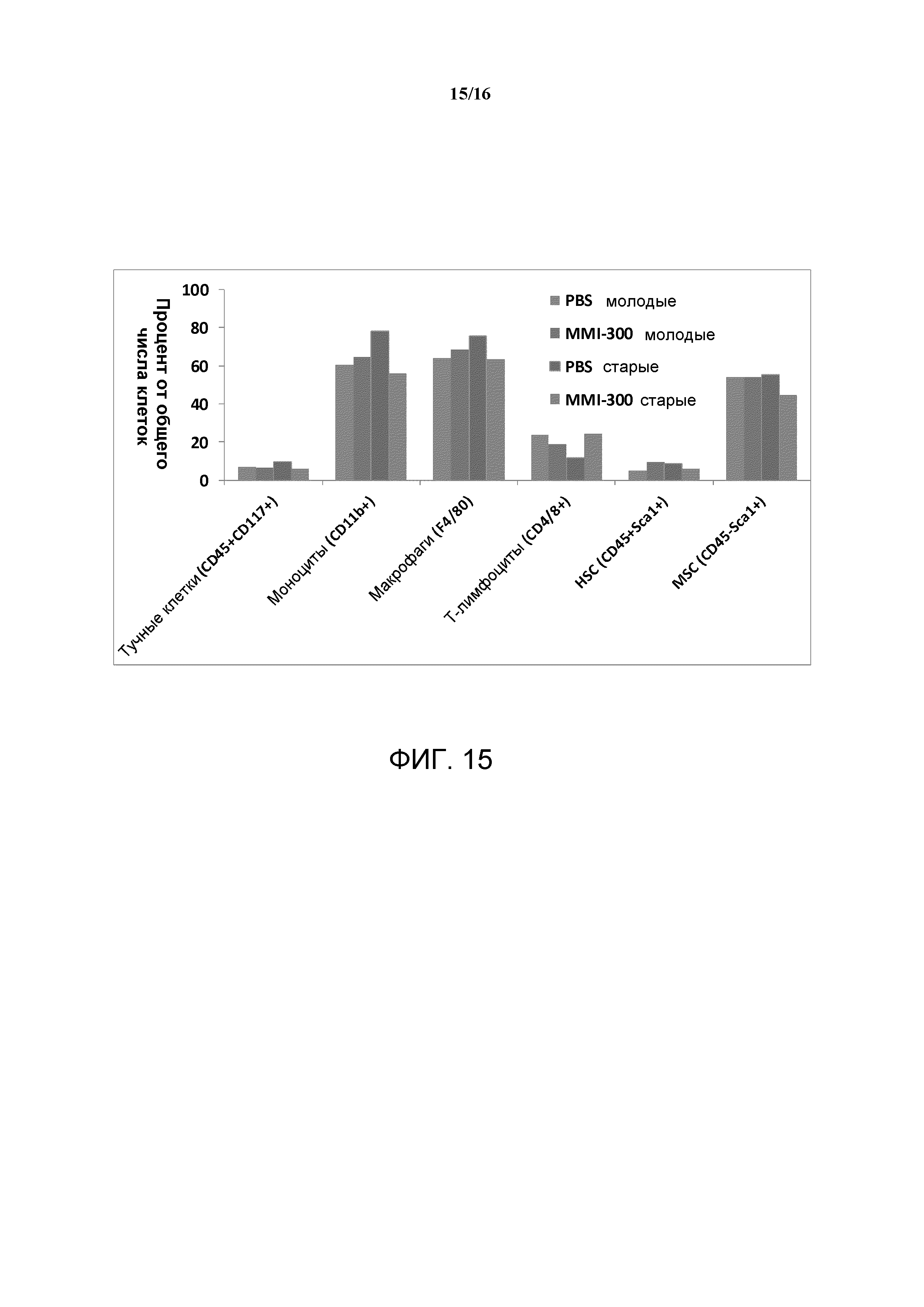
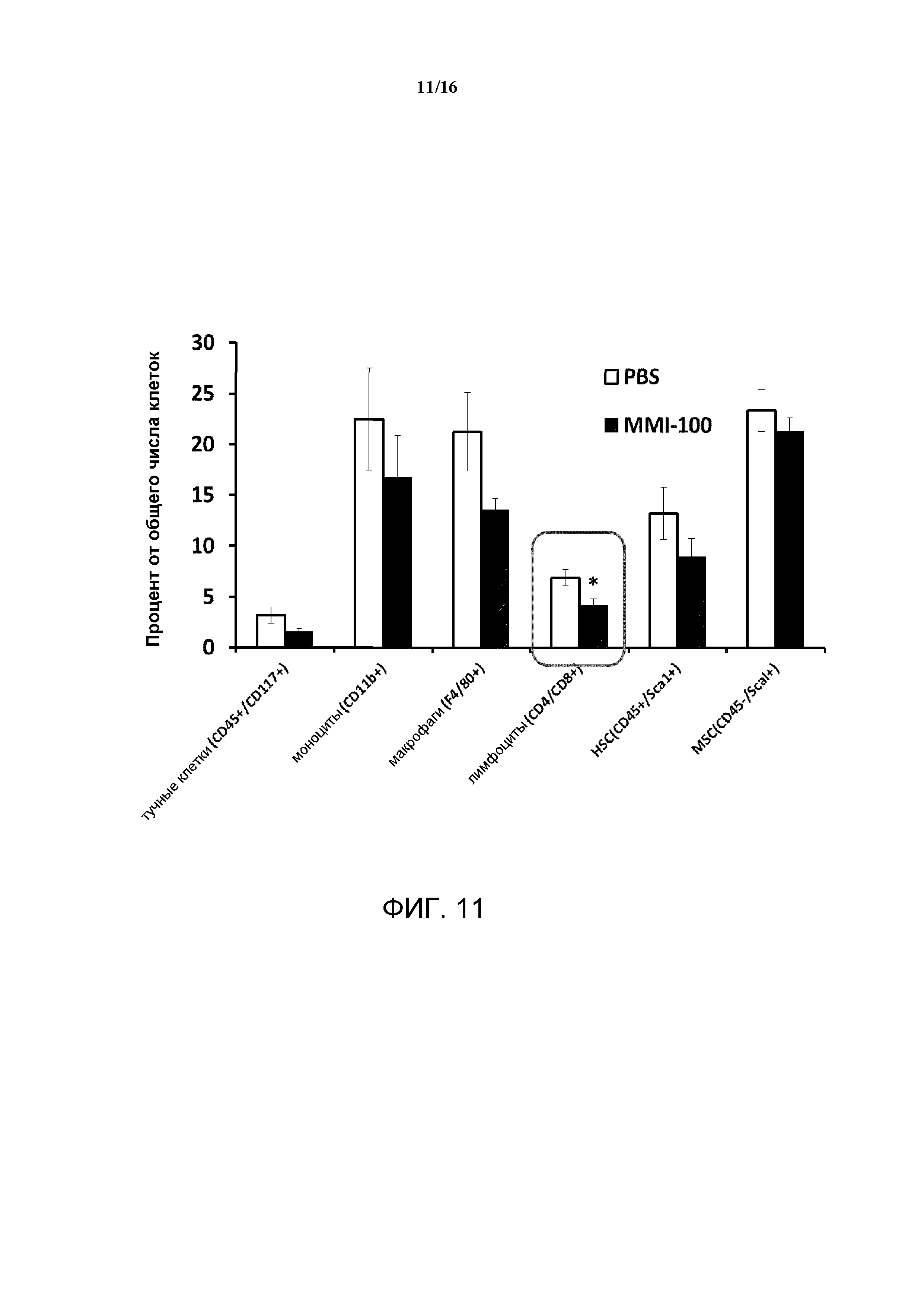
Заживление ран представляет собой сложный биологический процесс, который регулируется многочисленными факторами роста, цитокинами и хемокинами. MK2 является главным регулятором экспрессии цитокинов и хемокинов, который может привлекать локальные и циркулирующие иммуномодулирующие клетки в места ранений. Недавнее исследование с культивированными кератиноцитами показало, что истощение MK2 посредством использования малых интерферирующих РНК резко снижает способность кератиноцитов продуцировать некоторые цитокины, в том числе, фактор некроза опухоли (TNF) и интерлейкин-8 (IL-8) (Johansen et al., J Immunol, 176:1431-1438, 2006). Аналогичным образом исследования in vivo показали, что уровни экспрессии некоторых цитокинов и хемокинов, таких как интерлейкин-6 (IL-6), хемокин, выделяемый Т-клетками при активации (RANTES), фактор некроза опухоли-альфа (TNF-α), и интерлейкин-1 бета (IL-1β), значительно снижались в ранах мышей с нуль-мутацией MK2. Эти данные дают возможность предположить, что сигнальный путь MK2 представляет важный биохимический путь, который контролирует способность инфильтрирующих рану иммуномодулирующих клеток продуцировать цитокины и хемокины.
3.2. Эпителиализация
Реэпителиализация ран начинается в течение нескольких часов после повреждения. Эпидермальные клетки из придатков кожи, таких как волосяные фолликулы, быстро удаляют коагулировавшую кровь и поврежденную строму из раневого пространства. В это же время клетки подвергаются фенотипической альтерации, которая включает ретракцию внутриклеточных тонофиламентов (Paladini, R. et al., J. Cell Biol, 132, pp. 381-397 (1996)); растворение большинства межклеточных десмосом, которые обеспечивает физические связи между клетками; и образование периферических цитоплазматических актиновых филаментов, которые дают возможность клеткам двигаться и мигрировать (Goliger, J. и Paul, D. Mol Biol Cell, 6, pp. 1491-1501 (1995); Gabbiani, G. et al., J Cell Biol, 76, PP. 561-568 (1978)). Кроме того, клетки эпидермиса и дермы больше не прилипают друг к другу, вследствие растворения гемидесмосомных связей между эпидермисом и базальной мембраной, что дает возможность осуществлять латеральное движение эпидермальных клеток. Экспрессия интегриновых рецепторов на эпидермальных клетках дает им возможность взаимодействовать с целым рядом белков внеклеточного матрикса (например, фибронектином и витронектином) которые чередуются с стромальным коллагеном I типа на краю раны и переплетаютя с фибриновым сгустком в раневом пространстве (Clark, R., J Invest Dermatol, 94, Suppl, pp. 128S-134S (1990)). Миграция эпидермальных клеток разделяет рану, отделяя иссушенный струп (погибшая ткань, которая отделяется (слущивается) от здоровой кожи) от жизнеспособной ткани. По-видимому, путь разделения определяется матрицей интегринов, которые экспрессируют мигрирующие эпидермальные клетки на своих клеточных мембранах.
Разрушение внеклеточного матрикса, который необходим в том случае, если эпидермальные клетки предназначены для миграции между коллагеновой дермой и фибриновым струпом, зависит от продукции коллагеназы эпидермальными клетками (Pilcher, B. et al., J Cell Biol, 137, pp. 1445-1457 (1997)), а также активации плазмина активатором плазминогена, продуцируемым эпидермальными клетками (Bugge, T. et al., Cell, 87, 709-719 (1996)). Активатор плазминогена также активирует коллагеназу (матриксную металлопротеиназу-1) (Mignatti, P. et al., Proteinases and Tissue Remodeling. In Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, 427-474 (1996)) и облегчает разрушение коллагена и белков внеклеточного матрикса.
Через один - два дня после повреждения эпидермальные клетки на краю раны начинают пролиферировать позади активно мигрирующих клеток. Стимулы для миграции и пролиферации эпидермальных клеток во время реэпителиализации не были определены, но было предложено несколько вариантов. Отсутствие соседних клеток на краю раны (эффект «свободного края») может быть сигналом как для миграции, так и для пролиферации эпидермальных клеток. Местное высвобождение факторов роста и повышенная экспрессия рецеторов факторов роста также может стимулировать эти процессы. Ведущие претенденты включают эпидермальный фактор роста (EGF), трансформирующий фактор роста-α (TGF-α) и фактор роста кератиноцитов (KGF) (Nanney, L. and King, L. Epidermal Growth Factor and Transforming Growth Factor-α. In Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, pp. 171-194 (1996); Werner, S. et al., Science, 266, pp. 819--822 (1994); Abraham, J. and Klagsburn, M. Modulation of Wound Repair by Members of the Fiborblast Growth Factor family. У Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, pp. 195-248 (1996)). При наступлении эпителиализации, белки базальной мембраны снова появляются в очень упорядоченной последовательности от края раны во внутрь наподобие молнии (Clark R. et al., J. Invest Dermatol, 79, pp. 264-269 (1982)). Эпидермальные клетки возвращаются к своему нормальному фенотипу, вновь плотно прикрепляясь к восстановленной базальной мембране и подлежащей дерме.
3.3. Образование грануляционной ткани
Новая строма, зачастую называемая грануляционной тканью, начинает проникать в пространство раны приблизительно через четыре дня после повреждения. Многочисленные новые капилляры обеспечивают новую строму грануляционными свойствами. Макрофаги, фибробласты и кровеносные сосуды двигаются в раневое пространство в одно и то же время (Hunt, T. ed. Wound Healing and Wound Infection: Theory and Surgical Practice. New York, Appleton-Century-Crofts (1980)). Макрофаги обеспечивают постоянный источник факторов роста, необходимых для стимуляции фиброплазии и ангиогенеза; фибробласты продуцируют новый внеклеточный матрикс, необходимый для поддержания клеточного прорастания; и кровеносные сосуды несут кислород и питательные вещества, необходимые для поддержания метаболизма клеток.
Было показано, что факторы роста, в особенности тромбоцитарный фактор роста 4 (PDGF-4) и трансформирующий фактор роста β-1 (TGF- β1) (Roberts, A. and Sporn, M, Transforming Growth Factor-1, У Clark, R. ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, pp. 275-308 (1996)) во взаимодействии с молекулами внеклеточного матрикса (Gray, A. et al., J Cell Sci, 104, pp. 409-413 (1993); Xu, J. and Clark, R., J Cell Biol, 132, pp. 239-149 (1996)), стимулируют фибробласты ткани вокруг раны к пролиферации, экспрессии соответствующих рецепторов интегрина и миграции в раневое пространство. Сообщалось, что тромбоцитарный фактор роста ускоряет заживление хронических пролежней (Robson, M. et al., Lancet, 339, pp. 23-25 (1992) и диабетических язв (Steed, D., J Vasc Surg, 21, pp. 71-78 (1995)). В некоторых других случаях основной фактор роста фибробластов (bFGF) был эффективен для лечения хронических пролежней (Robson, M. et al., Ann Surg, 216, pp. 401-406 (1992).
Структурные молекулы вновь образованного внеклеточного матрикса, называемого временным матриксом (Clark, R. et al., J. Invest Dermatol, 79, pp. 264-269, 1982), вносят свой вклад в образование грануляционной ткани, обеспечивая поддерживающую структуру или канал для клеточной миграции. Эти молекулы включают фибрин, фибронектин и гиалуроновую кислоту (Greiling, D. and Clark R., J. Cell Sci, 110, pp. 861-870 (1997)). Предполагалось, что появление рецепторов фибронектина и соответствующих рецепторов интегрина, которые связывают фибронектин, фибрин или и то, и другое, на фибробластах, является стадией, ограничивающей скорость образования грануляционной ткани. Хотя фибробласты отвечают за синтез, отложение и ремоделирование внеклеточного матрикса, сам внеклеточный матрикс может оказывать положительное или отрицательное воздействие на способность фибробластов выполнять эти задачи, и в общем на взаимодействием с их окружением (Xu, J. and Clark, R., J Cell Sci, 132, pp. 239-249 (1996); Clark, R. et al., J Cell Sci, 108, pp. 1251-1261).
Для движения клеток в тромб поперечно сшитого фибрина или в плотно переплетенный внеклеточный матрикс требуется активная протеолитическая система, которая может расчистить путь для миграции клеток. Предполагают, что целый ряд ферментов, производных фибробластов, помимо сывороточного плазмина, являются потенциальными кандидатами для решения этой задачи, включая активатор плазминогена, коллагеназы, желатиназу А и стромелизин (Mignatti, P. et al., Proteinases and Tissue Remodeling. In Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, 427-474 (1996); Vaalamo, M. et al., J Invest Dermatol, 109, pp. 96-101 (1997)). После миграции в раны фибробласты начинают синтез внеклеточного матрикса. Временный внеклеточный матрикс постепенно заменяется коллагеновым матриксом, возможно, в ответ на передачу сигнала трансформирующего фактора роста-β1 (TGF-β1) (Clark, R. et al., J Cell Sci, 108, pp. 1251-1261 (1995); Welch, M. et al., J. Cell Biol, 110, pp. 133-145 (1990))
После избыточного отложения коллагенового матрикса в ране фибробласты прекращают продуцировать коллаген, и богатая фибробластами грануляционная ткань заменяется относительно бесклеточным рубцом. Клетки в ране подвергаются апоптозу, запускаемому неизвестными сигналами. Сообщалось о том, что нарушение регуляции этого процесса происходит при фиброзных нарушениях, таких как келоидные образования, гипертрофические рубцы, очаговая склеродермия и склеродермия.
3.4. Неоваскуляризация
Образование новых кровеносных сосудов (неоваскуляризация) необходимо для поддержания вновь образованной грануляционной ткани. Ангиогенез представляет собой сложный процесс, который основан на внеклеточном матриксе в раневом ложе, а также миграции и митогенной стимуляции эндотелиальных клеток (Madri, J. et al., Angiogenesis in Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, pp. 355-371 (1996)). Индукция ангиогенеза изначально приписывалась кислому или основному фактору роста фибробластов. Впоследствии также было обнаружено, что многие другие молекулы обладают ангиогенной активностью, включая сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста-β (TGF-β), ангиогенин, ангиотропин, ангиопоэтин-1 и тромбоспондин (Folkman, J. and D'Amore, P, Cell, 87, pp. 1153-1155 (1996)).
Предполагалось, что низкое давление кислорода и повышенный уровень молочной кислоты также стимулируют ангиогенез. Эти молекулы индуцируют ангиогенез путем стимуляции продукции основного фактора роста фибробластов (FGF) и сосудистого эндотелиального фактора роста (VEGF) макрофагами и эндотелиальными клетками. Например, сообщалось о том, что активированные эпидермальные клетки раны секретируют огромные количества фактора роста сосудистых эндотелиальных клеток (VEGF) (Brown, L. et al., J Exp Med, 176, 1375-1379 (1992)).
Была выдвинута гипотеза, что основной фактор роста фибробластов создает объективные предпосылки для ангиогенеза в течение первых трех дней репарации раны, тогда как фактор роста сосудистых эндотелиальных клеток является важным для ангиогенеза во время образования грануляционной ткани с 4 по 7 день (Nissen, N. et al., Am J Pathol, 152, 1445-1552 (1998)).
Помимо факторов ангиогенеза было показано, что соответствующие внеклеточный матрикс и эндотелиальные рецепторы для временного матрикса необходимы для ангиогенеза. Пролиферирующие микрососудистые эндотелиальные клетки, смежные с раной и находящиеся в ране, временно откладывают повышенные количества фибронектина в сосудистой стенке (Clark, R. et al., J. Exp Med, 156, 646-651 (1982)). Поскольку для ангиогенеза требуется экспрессия функциональных фибронектиновых рецепторов эндотелиальными клетками (Brooks, P. et al., Science, 264, 569-571 (1994)), предполагалось, что периваскулярный фибронектин действует в качестве канала для движения эндотелиальных клеток в рану. Кроме того, было показано, что экспрессия и активность протеазы также необходимы для ангиогенеза (Pintucci, G. et al., Semin Thromb Hemost, 22, 517-524 (1996)).
Была предложена следующая серия событий, приводящих к ангиогенезу. Повреждение вызывает деструкцию ткани и гипоксию. Факторы ангиогенеза, такие как кислый и основной фактор роста фибробластов (FGF), высвобождаются сразу же из макрофагов после разрушения клеток, и продукция фактора роста сосудистых эндотелиальных клеток стимулируется гипоксией. Протеолитические ферменты, высвобождаемые в соединительную ткань, разрушают белки внеклеточного матрикса. Фрагменты этих белков притягивают моноциты периферической крови в место повреждения, где они становятся активированными макрофагами и высвобождают факторы ангиогенеза. Некоторые макрофагальные факторы ангиогенеза, такие как основной фактор роста фибробластов (bFGF), стимулируют эндотелиальные клетки к высвобождению активатора плазминогена и проколлагеназы. Активатор плазминогена превращает плазминоген в плазмин и проколлагеназу для активации коллагеназы, и во взаимодействии эти две протеазы расщепляют базальные мембраны. Фрагментация базальной мембраны позволяет эндотелиальным клеткам, стимулированным факторами ангиогенеза, мигрировать и образовывать новые кровеносные сосуды в месте повреждения. При заполнении раны новой грануляционной тканью ангиогенез прекращается и многие из новых кровеносных сосудов распадаются в результате апоптоза (Ilan, N. et al., J Cell Sci, 111, 3621-3631 (1998)). Предполагалось, что эта запрограммированная гибель клеток регулируется целым рядом молекул матрикса, таких как тромбоспондины 1 и 2, и антиангиогенными факторами, такими как ангиостатин, эндостатин и ангиопоэтин 2 (Folkman, J., Angiogenesis and angiogenesis inhibition: an overview, EXS, 79, 1-8, (1997)).
3.5. Закрытие раны и реорганизация внеклеточного матрикса
Заживление раны включает сложное и организованное взаимодействие клеток, внеклеточного матрикса и цитокинов. Во время второй недели заживления, фибробласты фенотип миофибробластов, характеризующийся крупными тяжами актин-содержащих микрофиламентов, расположенных вдоль цитоплазматической поверхности плазматической мембраны клеток и связями клетка-клетка и клетка-матрикс (Welch, M. et al., J Cell Biol, 110, 133-145 (1990); Desmouliere, A. and Gabbiani, G. The role of the myofibroblast in wound healing and fibrocontractive diseases. In Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, pp. 391-423 (1996)). Появление миофибробластов соответствует началу уплотнения соединительной ткани и закрытия раны. Предполагалось, что для закрытия требуется стимуляция трансформирующим фактором роста (TGF)-β1 или β2 и тромбоцитарным фактором роста (PDGF), прикрепление фибробластов к коллагеновому матриксу посредством интегриновых рецепторов и поперечное сшивание между отдельными тяжами коллагена. (Montesano, R. и Orci, Proc Natl Acad Sci USA, 85, 4894-4897 (1988); Clark, R. et al., J Clin Invest, 84, 1036-1040 (1989); Schiro, J. et al., Cell, 67, 403-410 (1991); Woodley, D. et al., J Invest Dermatol, 97, 580-585 (1991)).
Ремоделирование коллагена во время перехода от грануляционной ткани в рубец зависит от непрерывного синтеза и катаболизма коллагена с низкой скоростью. Разрушение коллагена в ране контролируется несколькими протеолитическими ферментами, называемыми матриксными металлопротеиназами (MMP), которые секретируются макрофагами, эпидермальными клетками и эндотелиальными клетками, а также фибробластами (Mignatti, P. et al., Proteinases and Tissue Remodeling. In Clark, R. Ed. The molecular and cellular biology of wound repair. 2nd Ed. New York, Plenum Press, 427-474 (1996)). Было выдвинуто предположение, что различные фазы репарации раны основаны на различных сочетаниях матриксных металлопротеиназ и тканевых ингибиторах металлопротеиназ (Madlener, M. et al, Exp Cell Res, 242, 201-210 (1998)).
Раны достигают только примерно 20 процентов их конечной прочности в первые три недели, во время которых фибриллярный коллаген накапливался сравнительно быстро и был ремоделирован закрытием раны. После этого, скорость, при которой раны приобретают прочность при растяжении, является медленной, отражая гораздо более медленную скорость накопления коллагена и ремоделирования коллагена с образованием крупных коллагеновых тяжей и увеличением числа межмолекулярных поперечных связей. Тем не менее, предполагалось, что раны никогда не достигают такой же прочности на разрыв (усилия, при котором кожа разрывается) как неповрежденная кожа, и что, при максимальной прочности прочность рубца составляет только 70 процентов прочности нормальной кожи (Levenson, S. et al., Ann Surg, 161. 293-308 (1965)).
4. Методики ушивания раны
Методики ушивания раны формировались, начиная с самого раннего развития шовного материала, включая такие ресурсы, как синтетические нити для сшивания раны, рассасывающиеся нити, шовные скобки, пластыри и адгезивные соединения. Создание нитей для сшивания раны из синтетического материала наряду со стандартизацией традиционных материалов (например, кетгута, шелка) было сделано для получения превосходных эстетических результатов. Аналогичным образом, создание природных клеев, хирургических скобок, пластырей и, совсем недавно, цианоакрилатных тканевых клеев для замены шовного материала, дополнило набор методик ушивания ран. Цианоакрилатные тканевые клеи представляют собой жидкие мономеры, которые полимеризуются при контакте с тканевыми поверхностями в экзотермической реакции, создавая прочную, но гибкую пленку, которая соединяет смыкаемые края раны.
Хирургическое ушивание раны облегчает биологические процессы заживления за счет соединения краев раны и прямого смыкания слоев кожи, что служит для минимизации образования новой ткани в ране. Однако, происходит ремоделирование раны и прочность при растяжении достигается между вновь сомкнутыми краями. Ушивание может служить как функциональным, так и эстетическим целям, которые включают удаление мертвого пространства путем сближения подкожных тканей, минимизации образования рубца посредством осторожного выравнивания эпидермиса, и предотвращение образования атрофического рубца путем точной эверсии краев кожи. В тех случаях, когда мертвое пространство ограничено противоположными краями раны, тогда новая ткань имеет ограниченное пространство для роста. Соответственно, атравматическая обработка тканей, совместно с предотвращением плотного смыкания и чрезмерного натяжения вносит свой вклад в достижение лучшего результата.
Шовный материал
Общая классификация шовного материала включает природные и синтетические материалы, рассасывающиеся и нерассасывающиеся материалы и хирургические мононити и многонитевые материалы.
Природные материалы являются более традиционными и продолжают использоваться сегодня при наложении швов. Примеры природных материалов включают кетгут, шелк и даже хлопок. Кетгут является рассасывающимся, а хлопок и шелк - нет. Считается, что кетгут представляет собой хирургические мононити, тогда как шелк и хлопок представляют собой сплетенные многонитевые материалы.
Синтетические материалы вызывают меньшую реакцию и результирующая воспалительная реакция вокруг шовного материла минимизируется. Для наложения швов доступны различные рассасывающиеся и нерассасывающиеся синтетические материалы.
Рассасывающийся шовный материал применяется для раны, которая быстро заживает и требуется минимальная временная поддержка, и используются для снятия напряжения на краях раны. Было показано, что современный рассасывающийся шовный материал сохраняет свою прочность до начала процесса абсорбции. Примеры рассасывающегося шовного материала включают хирургические мононитевые Monocryl® (полиглекапрон), Maxon® (полигликолид-триметиленкарбонат) и PDS® (полидиоксанон). Плетенные рассасывающиеся шовные материалы включают Vicryl® (полиглактин), и Dexon® (полигликолевая кислота).
Нерассасывающиеся шовные материалы предлагают более длительную механическую поддержку по сравнению с рассасывающимися шовными материалами, которые теряют свою прочность при растяжении до полной абсорбции. Кетгут может выдерживать 4-5 дней в значениях прочности при растяжении. В хромированной форме (т.е., обработанный солями хромовой кислоты), кетгут может выдерживать вплоть до 3 недель. Vicryl® и Dexon® сохраняют прочность при растяжении в течение 7-14 дней, хотя полная абсорбция занимает несколько месяцев. Политриметиленкарбонатный шовный материал (Maxon®) и Polydioxanone (PDS®) считается длительно рассасывающимся шовным материалом, рассасывание которого продолжается несколько недель и также требуется несколько месяцев для полной абсорбции. Нерассасывающийся шовный материал имеет различную прочность при растяжении и может подвергаться некоторой степени деградации. Шелк имеет наименьшую прочность, а нейлон имеет самую высокую прочность, хотя Prolene® сопоставимы. Как нейлон, так и Prolene® требуют дополнительных скручиваний, чтобы сохранить узлы на месте. Полиэфир имеет высокую степень прочности при растяжении и Novafil® одобрен в связи с его эластическими свойствами. Нерассасывающиеся шовный материал включает нейлон, Prolene® (полипропилен), Novafil® (полибутэфир), PTFE (политетрафторэтилен), сталь и полиэфир. Нейлоновый и стальной шовный материал может представлять собой хирургические мононити или многонитевой шовный материал. Prolene®, Novafil® и PTFE представляют собой хирургические мононити. Полиэфирный шовный материал является плетенным.
Хирургические мононити (одна нить шовного материала) имеют меньшее трение при протягивании через ткани, но подвержены повреждению техническими средствами. Инфекция предотвращается при использовании хирургических мононитей, в отличие от плетеного многонитевого шовного материала, который потенциально может испытывать бактериальное заражение.
Клеи
Проблемы (например, реактивность, преждевременная реабсорбция) могут возникать с шовным материалом и приводить к нежелательному результату, как косметически, так и функционально. Применение хирургических клеев может упростить закрытие кожи. Некоторые клеи были разработаны для уменьшения этой проблемы и для облегчения ушивания раны. Одно вещество, цианоакрилат, легко образует прочную гибкую связь.
Октил-2-цианоакрилат (Dermabond®, Ethicon, Somerville, NJ) является единственным цианоакрилатным тканевым клеем, одобренным Управлением США по надзору в сфере пищевых продуктов и лекарственных средств (FDA) для поверхностного закрытия кожи. Октил-2-цианоакрилат следует использовать только для поверхностного закрытия кожи и не следует имплантировать подкожно. Подкожные шовные материалы используют для снятия напряжения с краев кожи до нанесения октил-2-цианоакрилата. Размещение подкожного шовного материала помогает отвести края кожи и минимизировать возможность смешения цианоакрилата в подкожные ткани.
Тканевые клеи на основе фибрина могут быть получены из аутологичных источников или смешанной крови. Обычно их используют для остановки кровотечения, и они могут плотно закрывать ткани. Хотя они не имеют соответствующей прочности при растяжении для закрытия кожи, фибриновые тканевые клеи могут быть использованы для фиксации кожных лоскутов или плотного закрытия истечений спинномозговой жидкости. Коммерческие препараты, такие как Tisseel® (Baxter) и Hemaseel® (Haemacure) представляют собой одобренные FDA фибриновые тканевые клеи, изготовленные из источников смешанной крови. Эти фибриновые тканевые клеи являются относительно прочными и могут быть использованы для фиксации тканей. Аутологичные формы фибриновых тканевых клеев могут быть изготовлены из плазмы пациентов. Концентрация фибриногена в аутологичных препаратах меньше, чем в смешанных формах, следовательно, эти формы имеют более низкую прочность при растяжении.
Другие материалы
Шовные скобки обеспечивают быстрый способ ушивания раны и связаны с уменьшением степени раневой инфекции. Шовные скобки состоят из нержавеющей стали, которая, как было показано, менее реактивна, чем традиционный материал для наложения швов. Для наложения шва скобками требуется минимальное проникновение в кожу и, следовательно, меньшее количество микроорганизмов переносится в нижние слои кожи. Шовные скобки являются более дорогими, чем традиционный шовный материал, а также требуется большая осторожность при установке, в особенности при обеспечении эверсии краев раны. Однако, при должной установке полученное в результате образование рубца косметически эквивалентно таковому при других методиках.
Закрытие с использованием пластырей или полосок пластырей впервые было описано во Франции в 1500 годах. Этот способ позволяет соединить и закрепить края раны. Пористые бумажные пластыри (например, Steri-Strips®) использующиеся в настоящее время, напоминают их более ранние шины и используются для обеспечения должной репозиции раны и для обеспечения дополнительного усиления прочности шовного материала. Эти пластыри могут быть использованы либо с шовным материалом, либо отдельно. Зачастую, кожные клеи (например, Mastisol®, настойка бензоина) помогают в адгезии пластырей.
Новые продукты, такие как ClozeX® (Wellesley, MA) клеевые полоски, дают возможность быстро и эффективно ушить рану, что в результате приводит к соответствующему косметическому результату. Кроме того, ушивание раны с помощью клеевых полосок может быть значительно дешевле, чем наложение швов или использование тканевого клея. Однако, клеевые полоски не подходят для многих типов резаных ран.
5. Кожный рубец
Рубец представляет собой фиброзную ткань, которая замещает нормальные ткани, разрушенные повреждением или заболеванием. Повреждение наружного слоя кожи заживает путем восстановления ткани и в этих случаях рубцевание является слабым. Однако, в тех случаях, когда повреждается толстый слой ткани под кожей, восстановление является более сложным. Основа состоит из коллагеновых волокон (белка, который в природе продуцируется организмом), и обычно в результате это приводит к образованию резко выделяющегося рубца. После заживления раны рубец продолжает изменяться, поскольку образуется новый коллаген и кровеносные сосуды возвращаются к норме, что позволяет большинству рубцов исчезать и улучшать внешний вид на протяжении двух лет после повреждения. Однако, существует некоторое видимое подтверждение повреждения и волосяные фолликулы и потовые железы не образуются снова. Рана не становится рубцом, пока кожа полностью не заживет. Патологические состояния кожи, такие как экзема и псориаз и повреждения, такие как небольшие ожоги или солнечные ожоги, не образуют рубцов, поскольку кожа является поврежденной или все еще восстанавливается. Однако, эти патологические состояния могли бы приводить к образованию незначительного рубца, если кожа была поцарапана до заживления внешнего слоя кожи.
Кожный рубец представляет собой кожную фиброзную замещающую ткань, которая образуется в результате ранения, которое заживало путем рассасывания, а не регенерации. На окончательный внешний вид влияет, в основном, интервал между ранением и полным заживлением 2 - 3 недели спустя. Сформировавшись, рубец подвергается нескольким различным макро- и микроскопическим изменениям во время процесса созревания и завершается, в среднем через год (Bond, J. et al., Plastic and Reconstructive Surgery, vol. 121, No. 5, pp. 1650-1658, (2008)). У пациентов моложе 30 лет демонстрируется более медленная скорость созревания рубца и окончательный внешний вид хуже, чем у пациентов старше 55 лет. Краснота рубца исчезает через 7 месяцев и, в отличие от красноты (покраснения) в другом месте, не отражает воспалительный процесс (после первого месяца) (Bond J. et al, Plastic and Reconstructive Surgery, vol. 121, no. 2., pp. 487-496, 2008). Рубец лишен кожных выростов и никогда не достигает такой же прочности при растяжении, как окружающая его кожа (Beanes, S. et al., Expert Reviews in Molecular Medicine, vol. 5, no. 8, pp. 1-22, (2003)).
Ткань рубца состоит главным образом из беспорядочного коллагенового внеклеточного матрикса. Он продуцируется миофибробластами, которые дифференцируются из фибробластов дермы в ответ на ранение, что вызывает повышение локальной концентрации трансформирующего фактора роста-β, секретируемого белка, который существует по меньшей мере в трех изоформах, называемых TGF-β1, TGF-β2 и TGF-β3 (совместно называемых TGF-β). TGF-β является важным цитокином, связанным с фиброзом во многих типах тканей (Beanes, S. et al., Expert Reviews in Molecular Medicine, vol. 5, no. 8, pp. 1-22 (2003)).
Миофибробласты характеризуются наличием сократительного аппарата, который содержит тяжи актиновых микрофиламентов, связанных с сократительными белками, такими как немышечный миозин, который является аналогом тонофибрилл, которые были описаны у культивированных фибробластов. Эти актиновые тяжи заканчиваются на поверхности миобласта в фибронексусах, особом адгезивном комплексе, который использует трансмембранные интегрины для связывания внутриклеточного актина с внеклеточными фибриллами фибронектина. Большинство миофибробластов экспрессируют альфа-актин-2 (ACTA2; также называемый альфа-гладкомышечным актином или α-SMA), и экспрессия ACTA2 и коллагена типа I в миофибробластах координируется и регулируется трансформирующим фактором роста-β1 (TGF-β1) (Tomasek, J. et al., Nat. Rev. Mol. Cell. Biol., 3: 349-363). Кроме того, предыдущие исследования показали, что интегрины играют важную роль в TGF-β-индуцированной дифференцировке миофибробластов (Lygoe, K. et al., Wound Repair Regen, 12(4):461-470, 2004). ACTA2, TGF-β, and Integrins are currently the principal targets to suppress scarring (Beausang, E. et al., Plastic and Reconstructive Surgery, vol. 102, no. 6, pp. 1954-1961 (1998); Niessen, F. et al., Plastic and Reconstructive Surgery, vol. 102, no. 6, pp. 1962-1972 (1998)).
6. Типы кожных рубцов
Репарация кожной ткани в результате приводит к широкому спектру типов рубцов, начиная от «нормальной» тонкой линии до целого ряда аномальных рубцов, включая распространенные рубцы, атрофические рубцы, рубцовые контрактуры, гипертрофические рубцы и келоидные рубцы.
6.1. Распространенные (растянутые) рубцы
Распространенные (растянутые) рубцы появляются в тех случаях, когда тонкие линии хирургических рубцов становятся растянутыми и расширенными, что обычно случается через три недели после хирургического вмешательства. Обычно они представляют собой плоские, бледные, мягкие бессимптомные рубцы зачастую видимые после хирургического вмешательства на колене или плече. Растяжки (абдоминальные стрии) после беременности являются вариантами распространенных рубцов, при которых было повреждение до дермы и подкожных тканей, но эпидермис является поврежденным. В зрелых распространенных рубцах отсутствует валик, утолщение или узловое уплотнение, что отличает их от гипертрофических рубцов.
6.2. Атрофические рубцы
Атрофические рубцы являются плоскими и опущены ниже окружающей кожи. В основном они являются небольшими и зачастую окружены изрезанным или втянутым центром. Образование атрофических рубцов может быть результатом хирургического вмешательства, травмы и таких широко распространенных заболеваний как юношеские угри и ветряная оспа (ветрянка).
6.3. Рубцовые контрактуры
Рубцы, которые пересекают суставы или кожу, образованные под прямым углом, подвержены развитию укорочения или контрактуры. Рубцовые контрактуры встречаются в тех случаях, когда рубец не полностью созрел, зачастую имеют тенденцию к гипертрофии, и обычно являются инвалидизирующими и дисфункциональными. Они широко распространены после ожоговой травмы через сустав или вогнутостей кожных швов.
6.4. Патологические рубцы
Считается, что причиной патологических рубцов является нарушение регуляции клеточного содержимого раны и синтеза коллагена (M. Sharad, Indian Journal of Dermatology, Venereology and Leprology, vol. 71, no. 1, pp. 3-8, 2005). Патологические рубцы являются гиперчувствительными к трансформирующему фактору роста-бета1 (TGF-β1); экспрессия фактора роста соединительной ткани (CTGF) повышается в 150 раз и в 100 раз при гипертрофических и келлоидных рубцах, соответственно, в ответ на TGF-β1 по сравнению с нормальными фибробластами (Colwell, A et al., Plastic and Reconstructive Surgery, vol. 116, no. 5, pp. 1387-1390 (2005)). Также играет роль неэффективность апоптоза. Келоидные фибробласты, в частности, являются высоко резистентными к апоптозу, опосредованному синтазой жирных кислот и опухолевым генам-суппрессорам p53 и p63, которые вовлечены в индукцию апоптоза (Nedelec, B. et al., Surgery, vol. 130, no. 5, pp. 798-808 (2001); Chodon, T. et al., American Journal of Pathology, vol. 157, no. 5, pp. 1661-1669 (2000); Tanaka, A. et al., Journal of Dermatological Science, vol. 34, no. 1, pp. 17-24, (2004); De Felice, B. et al., Molecular Genetics and Genomics, vol. 272, no. 1, pp. 28-34 (2004)). Кроме того, также существуют предрасполагающие системные признаки. Пациенты с ожогами, у которых впоследствии развиваются гипертрофические рубцы, имеют более высокие сывороточные уровни интерлейкина-10 (IL-10), TGF-β1, и повышенное число интерлейкин-4 (IL-4)-положительных Th2 клеток вскоре после ожоговой травмы, по сравнению с теми, у кого развиваются нормальные рубцы (Tredget, E. et al., Journal of Interferon and Cytokine Research, vol. 26, no. 3, pp. 179-189 (2006)). Семейный кластерный анализ и заметно более высокая предрасположенность пациентов афро-карибского происхождения к развитию келоидов дали возможность предположить, что имеет место большой генетический вклад локусов подверженности образованию келоидов, обнаруженных на хромосомах 2q23 и 7p11 (Bayat, A. et al, British Journal of Plastic Surgery, vol. 58, no. 7, pp. 914-921 (2005); Marneros, A. et al., Journal of Investigative Dermatology, vol. 122, no. 5, pp. 1126-1132 (2004)).
Гипертрофические рубцы (красные или темные и выступающие)
Гипертрофические рубцы представляют собой выступающие рубцы, которые остаются в пределах границ первоначального повреждения, в основном спонтанно регрессирующие после начального повреждения. Гипертрофические рубцы являются твердыми, выступающими, красными, зудящими, болезненными и сморщенными. Обычно они появляются после ожоговой травмы на туловище и конечностях. Клинически и гистологически гипертрофические рубцы и келоидные рубцы очень похожи, но в отличие от келоидов, гипертрофические рубцы увеличиваются путем нажатия на границы рубца, тогда как келоиды захватывают окружающую ткань. Гипертрофические рубцы со временем становятся зрелыми и уплощаются. Без лечения келоиды обычно сохраняются неопределенное время.
Гипертрофические рубцы демонстрируют такие же витые, гиалинизированные коллагеновые тяжи, что и келоиды, и являются более васкуляризированными и с большим содержанием клеток, чем нормальные рубцы. В гипертрофических рубцах появляется два типа фибробластов. Один является нециклическим и не пролиферирует; другой тип, присутствующий в меньшем количестве, быстро пролиферирует и демонстрирует активный синтез.
Келоидные рубцы (красные или темные и выступающие)
Келоидные рубцы представляют собой доброкачественные фиброзные пролиферации в коже, которые возникают после травмы кожи. Они выступают над поверхностью кожи и выходят за границы первоначальной раны. Эти рубцы являются постоянными и не регрессируют с течением времени. Зачастую келоиды косметически являются обезображивающими и могут быть болезненными. Степень рубцевания не является прямо пропорциональной тяжести первоначальной раны (Datubo-Brown, D., Br J Plast Surg, 43:70-77, (1990); Murray, J. Demartol Clin, 11:697-708 (1993)). Чрезмерное рубцевание в келоидную ткань связано с избыточным отложением и недостаточным разрушением коллагена и других внеклеточных белков, в том числе, хондроитин-4-сульфата (C4S), фибронектина и эластина. Гистологически, келоидная ткань отличается от других вследствие беспорядочной ориентации коллагеновых волокон. Отдельные коллагеновые волокна являются утолщенными, гиалинизированными и высоко эозинофильными. Эти волокна обычно упорядочены в узлы или «витки» (Murray, J. Demartol Clin, 11:697-708 (1993)). Этиология образования келоидов остается плохо изученной. Последовательность заживления раны заметно не отличается от таковой, наблюдаемой в нормальных рубцах. Главное различие между келоидами и нормальными рубцами лежит в степени фиброплазии, количестве основного межклеточного вещества и временных рамках активного клеточного метаболизма.
Келоиды могут быть воспаленными, зудящими и болезненными, особенно во время их фазы роста. Часто наблюдаются на мочке уха после прокалывания ушей, дельтовидно после вакцинации, на грудине после акне, ветряной оспы, травмы или хирургического вмешательства. Сообщалось, что некоторые люди генетически предрасположены к келоидам с расами со смуглой кожей, являющимися более предрасположенными к ним, хотя имеется небольшое количество крупных эпидемиологических исследований.
Промежуточные рубцы
Рубцы, которые трудно отнести к какой-либо категории, были названы промежуточными рубцами. Однако, если выступающий рубец остается активно формирующимся через год, возможным диагнозом является истинный келоид, тогда как гипертрофические рубцы должны демонстрировать некоторые признаки регрессии в течение этого времени.
7. Механизмы образования патологических рубцов
7.1. Роль миофибробластов
Различные цитокины и факторы роста были изучены на их роль в заживлении ран. TGF-β1, мощный индуктор дифференцировки миофибробластов, действует непосредственно на образование грануляционной ткани и активацию фиброгенных клеток. Помимо их специфической индукции экспрессии альфа-актина-2 (ACTA2), TGF-β способствует отложению внеклеточного матрикса (ECM). TGF-β1 не только индуцирует синтез ECM (в частности, фибриллярных коллагенов и фибронектина), а также снижает активность металлопротеиназы (MMP) способствуя экспрессии тканевых ингибиторов металлопротеиназы (TIMP). Действие TGF-β1 на дифференцировку миофибробластов требует ED-A фибронектин, иллюстрируя важную роль компонентов ECM в активности растворимых медиаторов. Недавно было показано, что ED-A фибронектин индуцирует дифференцировку легочных фибробластов посредством связывания с α4β7 рецептором интегрина и путем MAPK/Erk 1/2-зависимой передачи сигнала; однако, некоторые другие исследования показали, что этот интегрин не экспрессируется фибробластами кожи, давая основание предполагать, что специфические механизмы вовлечены в различные популяции фибробластов.
7.2. Роль механического стресса
Активность миофибробластных клеток зависит от механического окружения, которое модулируется сократительными свойствами этих клеток и их тесной связи с внеклеточным матриксом (ECM). Особенности дифференцировки миофибробластов, таких как волокна напряжения, ED-A фибронектин и экспрессия ACTA2, появляются раньше в грануляционной ткани, подверженной повышенному механическому натяжению, оказываемому шинированием рану во всю толщину кожи пластической рамкой. Аналогичным образом, фибробласты, культивированные на субстратах переменной жесткости, адаптируют различные фенотипы, мягкие поверхности, связанные с недостатком волокон нагрузки. Более того, усилия сдвига, оказываемые потоком жидкости, могут индуцировать продукцию и дифференцировку фибробластов, культивируемых на коллагеновых гелях, трансформирующего фактора роста-β1 (TGF-β1), в отсутствие других внешних стимулов, таких как обработка цитокинами. Было показано, что все эти процессы включают двухстороннюю связь между эпидермальными клетками и клетками соединительной ткани, что определяет нормальную или патологическую природу репарации тканей.
7.3. Происхождение миофибробластов
Миофибробласты могут происходить из различных типов клеток, в том числе, но не только, локально задействованных фибробластов соединительной ткани. Заметная фенотипическая гетерогенность фибробластных клеток наблюдалась в соединительной ткани. Различные субпопуляции располагаются в различных локализациях в пределах органа и демонстрируют специфические свойства активации и дезактивации. По меньшей мере три субпопуляции были идентифицированы в дерме, а именно, поверхностные фибробласты дермы, ретикулярные фибробласты (которые располагаются в глубокой дерме) и фибробласты, связанные с волосяными фолликулами.
Эти субпопуляции демонстрируют заметные различия при раздельном культивировании. Периваскулярные клетки также были вовлечены как в нормальную, так и патологическую репарацию ткани. При диффузном кожном системном склерозе микроваскулярные перицины представляют связь между микрососудистым повреждением и фиброзом посредством трансдифференцировки в миофибробласты. Недавно были идентифицированы эндотеликальные клетки (EC) как возможный источник опухолевых (мио)фибробластов. Многие исследования предполагают, что эпителиально-мезенхимальная трансдифференцировка незлокачественных эпителиальных или происходящих из эпителия клеток карциномы является основным источником миофибробластов, связанных с фиброзом и опухолями. Более того, локальные мезенхимальные стволовые клетки, вероятно, вовлечены в репарацию тканей. Эти мезенхимальные стволовые клетки были описаны в кожном влагалище, которое окружает волосяной фолликул, покрывающие эпителиальные стволовые клетки. Они также вовлечены в регенерацию дермального гребня и могут становиться миофибробластами в ответ на травму. Очаги, содержащие как эпителиальные стволовые клетки, так и мезенхимальные стволовые клетки, могут составлять объединенную нишу. Недавние исследования привели к выводу, что мезенхимальные стволовые клетки из подкожного жира ответственны за накопление коллагена в рубцах. Было показано, что мезенхимальные стволовые клетки из костного мозга, которые не являются гематопоэтическими клетками-предшественниками, вносят вклад в поддержание и регенерацию соединительных тканей через приживление и дифференцировку в ранозаживляющие миофибробласты. Приживление в поврежденных органах модулируется тяжестью повреждения. Внутривенно введенные мезенхимальные стволовые клетки, однако, демонстрируют очень плохое приживление в здоровых органах.
Исследования показали, что циркулирующие клетки, называемые фиброцитами, также вовлечены в процесс репарации ткани. Фиброциты проникают в поврежденную кожу наряду с воспалительными клетками и приобретают фенотип миофибробластов. Фиброциты заполняют участки ожоговой травмы, где они стимулируют местный воспалительный ответ и продуцируют белки внеклеточного матрикса, таким образом, внося вклад в образование гипертрофического рубца (HS). Перицины, эндотелиальные клетки, эпителиальные клетки, местные мезенхимальные стволовые клетки, мезенхимальные стволовые клетки, происходящие из костного мозга, и фиброциты могут представлять альтернативные источники миофибробластов, в тех случаях, когда местные ресурсы перегружены, в частности, после тяжелого острого поражения (например, обширных ожогов) или в затяжных ситуациях, таких как фиброз. Предполагалось, что эти различные типы клеток генерируют субпопуляции миофибробластов, фенотип которых может модулироваться их взаимодействиями с соседними клетками и внеклеточным матриксом.
7.4. Гипертрофические рубцы и келоиды
Аномальная репарация ран является результатом нарушенного ремоделирования грануляционной ткани, приводящего, например, к образованию гипертрофических или келоидных рубцов. В отличие от гипертрофических рубцов, келоидные рубцы не содержат ACTA2, возможно, вследствие присутствия протомиофибробластов, которые могут откладывать большие количества внеклеточного матрикса (ECM), но не способны к развитию достаточных сил для сокращения повреждения. Многочисленные миофибробласты экспрессируют ACTA2 в гипертрофических рубцах, объясняя, почему контрактуры наблюдаются только с гипертрофическими рубцами, а не с келоидами. Однако, использование ACTA2 для проведения различия гипертрофических рубцов и келоидов недавно снова обсуждалось, давая основание предполагать, что этот белок может экспрессироваться в обеих патологических ситуациях. Келоиды содержат толстые коллагеновые волокна, тогда как гипертрофические рубцы содержат тонкие волокна, организованные в узлы. Таким образом, созревание коллагена и система MMP/TIMP играют важную роль в чрезмерном образовании рубцов. Например, экспрессия лизилгидроксилазы (LH)-2b, варианта сплайсинга LH-2, фермента, вовлеченного в перекрестное сшивание коллагеновых волокон, было связано с патологическим фиброзом.
При гипертрофических рубцах и келоидах грануляционная ткань продолжает расти вследствие чрезмерной секреции факторов роста и/или недостаточности молекул, необходимых для апоптоза или ремоделирования внеклеточного матрикса. Гипертрофические рубцы содержат избыток микрососудов, большинство из которых частично или полностью закрыты вследствие гиперпролиферации и функциональной регрессии эндотелиальных клеток, индуцированной гиперактивностью (мио)фибробластов, и чрезмерной продукции коллагена. Очаговая активация экспрессии p53, которая ингибирует апоптоз, наблюдалась в ситуациях чрезмерного рубцевания. Например, предполагалось, что ранняя механическая нагрузка в пролиферативной фазе заживления ран продуцирует гипертрофические рубцы путем ингибирования апоптоза посредством Akt-зависимого механизма.
Изменения внеклеточного матрикса также, по-видимому, являются важными в процессе апоптоза: in vivo, покрывая грануляционную ткань васкуляризированный кожный лоскут индуцирует активацию металлопротеиназы и уменьшение тканевых ингибиторов металлопротеиназы (TIMP), приводя к быстрой потере клеток грануляционной ткани путем апоптоза. Окружение матрикса также может модулировать апоптоз фибробластов in vitro. Hic-5, белок фокальной адгезии, который активируется под действием TGF-β1, является необходимым компонентом механизмов, регулирующих аутокринную продукцию TGF-β1, приводя в результате к патогенному фенотипу миофибробластов. Более того, механическое сжатие гипертрофических рубцов может восстанавливать строение, наблюдаемое в нормальной рубцовой ткани и запускать апоптоз миофибробластов. Эпителий также может быть вовлечен в избыточное рубцевание. Например, исследование показало, что при гипертрофических рубцах кератиноциты экспрессируют активированный CD36-позитивный фенотип (экспрессия CD36 в нормальных кератиноцитах отсутствует, появляясь только в ответ на специфические стимулы). Предполагалось, что образование гипертрофического рубца происходит не только вследствие кожной дисфункции, а является результатом нарушения дермальных-эпидермальных взаимодействий, вовлекающих нейрогормональные факторы. Механический стресс стимулирует механо-чувствительные болевые рецепторы в кожных чувствительных волокнах, что высвобождает нейропептиды, вовлеченные в сосудистые модификации и активацию фибробластов. Недавно было показано, что окклюзионная терапия уменьшает кожный фиброз путем гидратирования эпидермиса и изменения про- и антифибротических сигналов, продуцированных после повреждения.
8. Механобиология образования рубцов
Во время роста и развития тела человека, кожа увеличивается в размерах для покрытия растущего скелета и мягких тканей и постоянно подвергается воздействию внешних и внутренних механических сил. Эти внешние силы включают напряжения кожа-растяжение (например, вследствие движения тела) и внешние стимулы (например, царапины). Внутренние силы включают напряжение внеклеточного матрикса (ECM) посредством лежащего в основе роста скелета, и усилие сдвига жидкости и гидростатическое и осмотическое давление внеклеточной жидкостью (ECF). После повреждения кожи механофизиологические состояния изменяются под действием заживления ран, образования грануляционной ткани, закрытия раны и эпителиализацию. Коагуляция и воспаление вызывают отек и изменения циркуляции крови в коже и ране, тем самым воздействуя на основанную на ECF механофизиологию. Более того, пролиферативная фаза и фаза ремоделирования, которые начинаются в течение 1 недели с момента повреждения и могут продолжаться в течение месяцев, вызывают образование грануляционной ткани и закрытие раны под действием активности миофибробластов. Эти механофизиологические изменения поврежденной кожи значительно влияют на степень рубцевания (Ogawa, R., Wound Rep Reg, 19, S2-S9, 2011).
8.1. Клеточные и тканевые ответы на механические силы на кожных ранах
Механические силы, в том числе, напряжение растяжения, усилие сдвига, царапины, сдавление и гидростатическое и осмотическое давление могут восприниматься клеточными механорецепторами/механосенсорами и/или рецепторами нервных волокон (включая механочувствительные (MS) болевые рецепторы) которые обеспечивают соматическое восприятие механической силы. Клеточные механорецепторы включают механочувствительные ионные каналы (например, Ca2+, K+, Na+ и Mg2+), цитоскелет (например, актиновые филаменты) и молекулы клеточной адгезии (CAM) (например, интегрины). Немигрирующие клетки кожи прикрепляются к внеклеточному матриксу посредством молекул клеточной адгезии, и цитоскелет соединяется с механочувствительными ионными каналами и молекулами клеточной адгезии. Затем внеклеточный матрикс разрушается под действием механических сил, таких как натяжение кожи, цитоскелет изменяется и механочувствительные ионные каналы активируются. В отличие от этого, давление, основанное на внеклеточной жидкости (ECF), не может активировать механочувствительные ионные каналы через изменение цитоскелета, поскольку гидростатическое давление влияет на входящий поток ионов, а не на форму клетки. Клетки преобразуют механические стимулы в электрические сигналы через механорецепторы, тем самым ускоряя клеточную пролиферацию, ангиогенез и эпителиализацию через различные пути механотрансдукции. В частности, сигнальные пути трансформирующего фактора роста (TGF-β)/Smad, интегрина, G белка митоген-активированной протеинкиназы, фактора некроза опухоли(TNF)/NF-kB, Wnt/β-катенина, интерлейкина и ионов кальция были предметом тщательного исследования в образовании кожных рубцов. TGF-β вовлечен в реакции рубцовой ткани на механические силы.
Например, было показано, что келоидные фибробласты, подвергнутые воздействию механической силы в образовании равномерного двухосного натяжения, продуцируют больше TGF-β1 и -β2, чем нормальные кожные фибробласты. Другое исследование показало, что растяжение миофибробластного внеклеточного матрикса в присутствии механически соединенных стрессовых волокон немедленно активирует латентный TGF-β1, по сравнению с расслабленными тканями; и что ткани под воздействием стресса демонстрируют повышенную активацию Smad2/3, которые являются нижележащими мишенями пути передачи сигнала TGF-β1.
G белки являются дополнительными мембранными белками, которые модулируют пути механотрансдукции. Механическая стимуляция изменяет конформацию G белка, приводя к изменениям подобным факторам роста, которые инициируют каскады вторичных мессенджеров и инициируют клеточный рост. Кальциевые ионные механочувствительные каналы вовлечены в активацию фосфолипазы С, что может приводить к активации протеинкиназы C и последующей активации эпидермального фактора роста (EGF). Полагают, что эти пути механотрансдукции связаны с образованием кожных рубцов в качестве клеточного ответа.
На тканевом уровне чувствительные волокна действуют в качестве механических стимулов рецепторов в коже. Механические стимулы воспринимаются механочувствительными болевыми рецепторами, и сигналы передаются дорсальным корешковым ганглиям, которые содержат тела нейрональных клеток в афферентных нервах спинного мозга. В результате это приводит к высвобождению нейропептидов из периферических окончаний первичных афферентных чувствительных нейронов, которые иннервируют кожу и часто контактируют с клетками эпидермиса и дермы. Эти нейропептиды могут напрямую модулировать функции кератиноцитов, фибробластов, клеток Лангерганса, тучных клеток, эндотелиальных клеток микрососудов кожи и инфильтрирующих иммунных клеток. Вещество P (SP), белок, кодируемый геном кальцитонина (CGRP), нейрокинин A, вазоактивный интестинальный пептид и соматостатин представляют собой нейропептиды, которые эффективно модулируют функции кожи и иммунных клеток, в том числе, пролиферацию клеток, продукцию цитокинов, презентацию антигенов, чувствительную нейротрансмиссию, деградацию тучных клеток и расширение сосудов, и повышают проницаемость сосудов в физиологических или патофизиологических условиях.
Эти провоспалительные ответы называют нейрогенным воспалением. Вещество P и белок, кодируемый геном кальцитонина (CGRP) действуют через рецептор нейрокинина 1 и рецептор CGRP1, соответственно, и синтезируются во время регуляции фактора роста нервов (NGF). Некоторыми также предполагалась взаимосвязь между ожогом и аномальными рубцами (например, келоидами и гипертрофическими рубцами) и нейрогенным воспалением/активностью нейропептидов.
8.2. Клиническое подтверждение взаимосвязи между механическими силами и образованием рубцов
Хотя соответствующая степень внутреннего натяжения является необходимой для затягивания раны, внешняя механическая сила также вносит вклад в образование рубца после ранения. Исследования показали, что механические силы способствуют росту фибропролиферативных заболеваний кожи, таких как гипертрофические рубцы и келоиды. Следовательно, соблюдение баланса этих сил является важным для предотвращения образования рубцов.
Келоиды и гипертрофические рубцы могут составлять две стадии непрерывного заболевания с единственным отличием между ними в интенсивности хронического воспалительного процесса. Хотя различие между келоидом и гипертрофическим рубцом остается неопределенной относительно гиалинизации образованных коллагеновых тяжей, было показано, что воспаление келоида гораздо больше, чем при гипертрофическом рубце, и было показано, что воспаление каждого больше, чем при зрелом рубце. Интенсивность воспаления отражает степень ангиогенеза в рубце и вокруг него, включая красноту самого рубца и кожи, прилегающей к рубцу. Келоиды демонстрируют красноту рубца и прилегающей к нему кожи; в отличие от этого, краснота на прилегающей коже не наблюдается при гипертрофических рубцах. Предполагалось, что эти особенности воспаления тесно связаны с чувствительностью к механическим силам, хотя могут быть вовлечены многие другие пусковые механизмы хронического воспаления.
Гипертрофические рубцы могут возникать в любом месте на теле, особенно в тех случаях, когда рубец является длинным, широким и расположен на часто двигающемся суставе. Длинные и широкие рубцы могут вызывать дисбаланс сил растяжения кожи на соседних рубцах и иногда могут вызывать контрактуру рубца. Пластические хирурги разделяют рубцы и высвобождают контрактуры, используя геометрические пластины (например, z- и w-пластины) и небольшие волновые разрезы для лечения рубцов и рубцовых контрактур. В отличие от этого, плотные рубцы редко встречаются на коже черепа и передней поверхности голени. Даже у пациентов с келоидами или гипертрофическими рубцами, покрывающими все тело, плотные рубцы на коже черепа или передней поверхности голени являются редкими. Общим для этих участков является то, что кости лежат непосредственно под кожей; следовательно, кожа в этих участках редко подвержена натяжению. Исходя из специфичности участка развития рубца, было высказано предположение, что механические силы могут не только способствовать росту келоидов/гипертрофических рубцов, а также могут быть первичным пусковым механизмом для их образования.
8.3. Взаимодействия между ростом рубца и направлением растягивающего натяжения
Гипертрофические рубцы не выходят за границы первоначальной раны, и, таким образом, растут только вертикально. В отличие от этого, келоиды растут и распространяются как вертикально, так и горизонтально, аналогично во многих отношениях медленно растущим злокачественным опухолям. Результатом их роста в горизонтальном направлении являются характерные формы, которые зависят от их местоположения. Например, келоиды, на передней поверхности груди растут по типу наподобие «клешни краба», тогда как келоиды на плечах растут в форме «бабочки». Эти типы отражают преобладающие направления натяжения кожи в этих местах. Анализ методом конечных элементов распределения механических сил вокруг келоидов показал высокое натяжение кожи на краях келоида и низкое натяжение в центрах келоидов. Этот результат показывает, почему келоиды обычно прекращают рост в центральных областях. Распространение келоидов происходит в направлении натягивания кожи, и эластичность кожи в окрестности келоида прямо коррелирует со степенью натяжения кожи. Эти наблюдения привели к предположению, что натяжение кожи тесно связано с профилем и степенью роста келоида, и что различия в профилях роста между гипертрофическими рубцами и нормальными рубцами и келоидов могут отражать различия в их ответной реакции на натяжение кожи.
9. Клинические стратегии механобиологии для профилактики и лечения рубцов
Для ограничения растяжения кожи и внешних механических стимулов во время заживления раны/рубцевания, раны или рубцы следует покрывать фиксируемыми материалами, такими как ленты, бинты, предметы одежды или листами силикагеля. Рандомизированное контролируемое испытание (RCT) показало, что ленточная фиксация помогала предотвратить образование гипертрофического рубца после кесарева сечения у 70 пациентов, со значительным уменьшением объема рубца при использовании бумажной ленты. Другие RCT показали, что силикагелевое обертывание значительно уменьшает частоту возникновения гипертрофических рубцов или келоидов. Также было показано, что силикагелевое обертывание уменьшает натяжение на краях рубцов, предполагающее важный механизм образования гипертрофических рубцов.
Контроль жидкости также может помочь профилактике и лечению рубцов путем индукции градиентов гидростатического давления и усилий сдвига, которые изменяют экспрессию генов посредством механочувствительных ионных каналов. Следовательно, контроль механических сил, основанных на внеклеточной жидкости (ECF) (усилия сдвига жидкости, гидростатическое давление и осмотическое давление) может достигаться посредством различных устройств или материалов (например, вакуумное ушивание, раневые повязки).
Исходя из описанных взаимосвязей между образованием рубца и механобиологией, было предложено несколько возможных терапевтических подходов для лечения рубцов. В отношении нейрогенного воспаления было предположено, что нейропептидная блокада с использованием длительной локальной анестезии является эффективной для лечения аномальных рубцов. Активность периферических нервов, в том числе, высвобождение нейропептидов, может контролироваться посредством центральной нервной системы. Механорецепторы и нейропептиды могут быть ингибированы, например, посредством блокаторов ионных каналов, интегринов или рецепторов нейропептидов. Например, блокаторы кальциевых каналов уже применяются для лечения рубцов, где было показано, что они уменьшают образование внеклеточного матрикса и ингибируют пролиферацию фибробластов и гладкомышечных клеток сосудов (Ogawa, R., Wound Repair and Regeneration, 19(S1), S2-S9, (2011))
10. Анализ заживления царапанных ран in vitro
Анализ заживления царапанных ран in vitro представляет собой эффективный и экономичный способ изучения заживления ран in vitro. Этот способ имитирует миграцию клеток во время заживления ран in vivo и основан на наблюдении, что при образовании нового искусственного разрыва, так называемой «царапины», в конфлюэнтном клеточном монослое, клетки на краю вновь образованного разрыва будут двигаться в направлении разрыва для закрытия «царапины» пока новые контакты клетка-клетка не установятся заново. Основные стадии включают создание «царапины» на монослое клеток, получение изображений в начале и через равные промежутки времени во время миграции клеток для затягивания царапины, и сравнение изображений для определения скорости клеточной миграции (Rodriquez, L. et al., Methods Mol Biol., 294:23-29, 2005; Liang, C-C et al., Nature Protocols, 2:329-333, 2007).
Одним из основных преимуществ этого простого способа является то, что он имитирует до некоторой степени миграцию клеток in vivo. Например, удаление части эндотелия в кровеносных сосудах будет индуцировать миграцию эндотелиальных клеток (EC) в эрозированную область для закрытия раны. Более того, профили миграции, либо в виде не плотно соединенных популяций (например, фибробластов) или в виде пластов клеток (например, эпителиальных и EC) также имитируют поведение этих клеток во время миграции in vivo. Другим преимуществом анализа царапин in vitro является его особенная пригодность для изучения регуляции миграции путем взаимодействия клеток с внеклеточным матриксом (ECM) и взаимодействий клетка-клетка. В других популярных способах, таких как анализы в камере Бойдена, получение клеток в суспензии до проведения анализов разрушает взаимодействия клетка-клетка и клетка-ECM. Кроме того, анализ царапин in vitro также совместим с микроскопией, в том числе, визуализацией живых клеток, позволяя анализировать сигнальные события внутри клетки (например, путем визуализации белков, меченных зеленым флуоресцирующим белком (GFP) для подклеточной локализации или резонансным переносом энергии флуоресценции для взаимодействий белок-белок) во время миграции клеток (Liang, C-C et al., Nature Protocols, 2:329-333, 2007).
Миграционный путь отдельных клеток в лидирующем крае царапины можно проследить с помощью замедленной микроскопии и программного обеспечения для анализа изображений. Получение изображения в начале эксперимента с помощью флуоресцентной микроскопии может зарегистрировать клетки с экспрессией экзогенного гена или эндогенных генов с отрицательной регуляцией под действием РНК интерференции (например, используя GFP маркер). Сравнивая пути этих клеток с окружающими контрольными клетками в тех же экспериментальных условиях, возможно определение роли конкретного гена в регуляции направленной клеточной миграции с использованием этого анализа (Liang, C-C et al., Nature Protocols, 2:329-333, 2007).
Разработанный и более подходящий для определения миграции популяции клеток, анализ царапин in vitro также был объединен с другими методиками, такими как микроинъекция или генная трансфекция, для оценки эффектов экспрессии экзогенных генов на миграцию отдельных клеток (Etienne-Manneville, S. et al., Cell, 106, 489-498, 2001; Fukata, Y. et al., J. Cell Biol.,145, 347-361, 1999; Abbi, S. et al., Mol. Biol. Cell., 13:3178-3191, 2002).
11. Животные модели гипертрофического рубца и келоидного рубцевания
Хотя клеточная культура может быть использована для верификации механизма действия новой терапии и для установления безопасного интервала доз для человека, прогнозируемая модель in vivo необходима для оценки безопасности и эффективности лечения у людей. Были предприняты попытки конструирования подходящих животных моделей твердых рубцов с использованием мышей, крыс и кроликов; однако, эти модели, особенно для келоидов, управляются больше острым воспалительным ответом, чем хроническим воспалением, приводящим к образованию незрелого рубца. Гипертрофическая мышиная модель, основанная на нагрузке механической силы, показала, что рубцы, подвергнутые натяжению, демонстрируют меньший апоптоз, и что воспалительные клетки и механические силы способствуют фиброзу. Эти сведения дают возможность предположить, что механические силы интенсивно модулируют поведение клеток в рубце.
Существует несколько животных моделей образования гипертрофических и келоидных рубцов: (1) гетерологичное гипертрофическое рубцевание или келоидный имплантат у животных с иммунодефицитом (бестимусные мыши и крысы) (Kischer, C. et al., J Trauma 29:672-677 (1989); Kischer, C. et al., Anat Rec; 225:189-196(1989)); (2) гетерологичное гипертрофическое рубцевание или келоидный имплантат в иммунологически привилегированную область (защечный мешок хомяка) (Hochman, B. et al., Acta Cir Bras, 20:200-212 (2005)); (3) гипертрофическое рубцевание или индукция келоида посредством химически опосредованного повреждения (морские свинки) (Aksoy, M. et al., Aesthetic Plast Surg, 26:388-396 (2002)); (4) гипертрофическое рубцевание или индукция келоида в особых анатомических участках (ухо кролика) (Morris, D. et al., Plast Reconstr Surg 100:674-81 (1997); и (5) гипертрофическое рубцевание или индукция келоида в глубоких кожных ранах в свиной модели (Silverstein, P. et al., Ann Res Progress Report of the US Army Institute of Surgical Research (section 37) (1972); Silverstein, P. et al., Hypertrophic scar in the experimental animal. In: The ultrastructure of collagen. Springfield, IL: Thomas (1976); Zhu, K. et al., Burns, 29: 649-64 (2003); Zhu, K. et al, Burns, 30:518-30 (2004)).
|
Шкалы оценки рубцовой деформации были разработаны для количественной оценки внешнего вида рубца в ответ на лечение. В настоящее время существует по меньшей мере пять шкал оценки рубцовой деформации, которые первоначально были разработаны для оценки субъективных параметров объективным путем (Таблица 2): Ванкуверская шкала оценки рубцовой деформации (VSS), Манчестерская шкала оценки рубцовой деформации (MSS), шкала оценки состояния рубцов пациентом и наблюдателем (POSAS), визуально-аналоговая шкала (VAS), и шкала оценки рубцов Стоуни Брук (SBSES). Эти шкалы оценки, зависимые от наблюдателя, рассматривают такие факторы, как высота или толщина, эластичность, площадь поверхности, структура, пигментация и васкуляризация (Nedelec, B. et al. J Burn Care Rehabil. 21:205-12 (2000)). Диапазон измерений пересекает непрерывные значения. Таким образом, указанные оценочные шкалы используют для определения изменения у индивидуума, но не между индивидуумами. Шкалы оценки рубцовой деформации зачастую используют для научной работы и являются полезными для изучения небольших линейных рубцов. Шкалы оценки рубцовой деформации только минимально пригодны для изучения крупных рубцов и для оценки функциональных воздействий рубцевания (Fearmonti, R. et al., Eplasty, 10:e43, 2010). Не является необычным для индивидуальных исследований обезображивающих рубцов создание собственных клинических шкал для оценки рубцовой деформации по согласованию с регулирующими органами, как в исследовании Juvista® группой Renovo PLC, которая использовала собственную универсальную сравнительную шкалу рубцовой деформации после согласия EMA в качестве основного критерия оценки, который имел преимущество оценки на основе фотографий подлежащих оценки независимой согласительной комиссии клинических экспертов (Renovo Corporate Presentation, December 2010).
|
12.1 Ванкуверская шкала оценки рубцовой деформации (VSS)
Ванкуверская шкала оценки рубцовой деформации (VSS), впервые описанная Sullivan в 1990, возможно, является, пожалуй, самым известным способом оценки ожоговых рубцов (Nedelec, B. et al., J Burn Care Rehabil. 21:205-12 (2000); Sullivan, T. et al., J Burn Care Rehabil. 11:256-60 (1990). Она оценивает четыре переменных: наличие кровеносных сосудов, высота/толщина, эластичность и пигментация. Восприятие пациентами их соответствующих рубцов не включено в общий балл. VSS остается широко применимым для оценки лечения и определения исхода при изучении ожогов.
12.2. Визуально-аналоговая шкала (VAS)
Многомерная визуально-аналоговая шкала (VAS) представляет собой основанную на фотографиях шкалу, полученную в результате оценки стандартизированных цифровых фотографий в 4 измерениях (пигментация, наличие кровеносных сосудов, приемлемость и комфорт наблюдателя) плюс контур. Суммируются отдельные баллы для получения одной суммарной оценки в интервале от «отлично» до «плохо». Была показана высокая надежность наблюдателя и внутренняя согласованность по сравнению с оценкой экспертной комиссией, но показала только умеренную надежность при использовании среди непрофессиональных анализов (Duncan, J. et al. PRS. 118(4):909-18 (2006); Durani, P. et al., J Plastic Reconstr Aesth Surg, 62:713-20 (2009); Micomonaco, D. et al., J Otolaryngol Head Neck Surg 38(1):77-89 (2009)).
12.3. Шкала оценки состояния рубцов наблюдателем и пациентом (POSAS)
Шкала оценки состояния рубцов наблюдателем и пациентом (POSAS) включает субъективные симптомы боли и зуда и распространяется на объективные данные, полученные по VSS. Она состоит из двух числовых шкал: шкалы оценки состояния рубцовой ткани пациентом и шкалы оценки состояния рубцовой ткани наблюдателем. Она оценивает наличие кровеносных сосудов, пигментацию, толщину, рельеф, эластичность и площадь поверхности и включает оценки пациентом боли, зуда, цвета, ригидности, толщины и рельефа. POSAS представляет собой только шкалу, которая рассматривает субъективные симптомы боли и зуда, но как другие шкалы, она также лишена функциональных измерений в отношении затрагивает ли боль или зуд качество жизни. POSAS применялась к постхирургическим рубцам и используется для оценки линейных рубцов после хирургического вмешательства по поводу рака груди. По имеющимся данным она показывает внутреннюю согласованность и согласованность заключений различных исследований по сравнению с VSS с дополнительным преимуществом получения оценок пациентов.
12.4. Манчестерская шкала оценки рубцовой деформации (MSS)
Манчестерская шкала оценки рубцовой деформации (MSS) (Beausang, E. et al. Plast Reconstr Surg. 102:1954 (1998)) отличается от POSAS тем, что она включает суммарную VAS, которая добавляется к баллам индивидуальных свойств. Она оценивает и классифицирует семь параметров рубцовой деформации: цвет шрама (абсолютное, слабое, очевидное или общее несоответствие с окружающей кожей), структуру кожи (матовая или блестящая), взаимосвязь с окружающей кожей (в интервале от нахождения на одном уровне до келоида), структура (в интервале от нормальной до твердой), края (отчетливо видимые или нечеткие), размер (<1 см, 1-5 см, >5 см), и одиночные или множественные. Два балла от двух шкал складывают вместе с получением обобщенной оценки для рубца, с более высокими баллами представляющими клинически неблагоприятные рубцы. Эти данные анализируют в сочетании со сведениями, касающимися расы, этнического происхождения, анамнеза, причины, симптомов, лечения и ответных реакций. В отличие от VSS, MSS группирует вместе присутствие кровеносных сосудов и пигментацию под заголовком «несоответствие цвета» относительно окружающей ткани, что позволяет достичь лучшего межэкспертного согласия по сравнению с VSS. Таким образом, она применима для более широкого ряда рубцов и хорошо подходит для послеоперационных рубцов. Однако, MSS не была использована в исследовании, возможно, вследствие широкого применения VSS и POSAS.
12.5. Шкала оценки рубцов Стоуни Брук (SBSES)
Шкала оценки рубцов Стоуни Брук (SBSES) была предложена в 2007 Singer et al (Singer, A. et al., Plast Reconstr Surg. 120(7):1892-7 (2007)) и представляет собой 6-бальную порядковую шкалу для оценки раны, разработанную для определения краткосрочного косметического исхода ран от 5 до 10 дней после повреждения до удаления швов. Она включает оценки индивидуальных черт с двоичным показателем ответной реакции (1 или 0) для каждого, а также общий вид, с получением в результате балла в интервале от 0 (худший) до 5 (лучший). SBSES только недавно была предложена для использования в исследовании, поскольку она была разработана для определения краткосрочных, а не долгосрочных исходов ран. Таким образом, она имеет ограниченное применение в отношении оценки патологических рубцов.
13. Терапевтические стратегии для лечения рубцевания кожи
В Таблице 3 перечислены примеры доступных в настоящее время терапевтических стратегий для лечения гипертрофического рубцевания.
|
13.1. Нацеливание медиаторов воспаления
Воспалительный ответ является нормальным компонентом процесса заживления ран, который служит и в качестве иммунологического барьера для инфекции, и в качестве стимула для фиброза для закрытия места повреждения. Результаты наблюдений патологических образцов, полученных у человека и заживления фетальных ран, дают основание предполагать, что устойчивый воспалительный ответ может лежать в основе чрезмерного фиброза, наблюдаемого при образовании гипертрофического рубца. Тучные клетки, макрофаги и лимфоциты, все были вовлечены в этот процесс. Например, было показано, что тучные клетки непосредственно регулируют активность стромальных клеток in vitro, а также сильно связаны с индукцией фиброза in vivo. Механическая активность, возрастные изменения и замедленная эпителиализация, все было вовлечено в качестве стимулирующих факторов интенсивного воспалительного ответа.
После повреждения кожи происходит повреждение эндотелия агрегация тромбоцитов, что в результате приводит к секреции цитокинов, включающих семейство трансформирующего фактора роста (TGF)-β, тромбоцитарные факторы роста (PDGF) и эпидермальные факторы роста (EGF). Эти цитокины стимулируют пролиферацию фибробластов и секрецию матрикса, и индуцируют рекрутинг лейкоцитов. Лейкоциты, в свою очередь, усиливают активность фибробластов, борьбу с инфекций и повышают проницаемость сосудов и прорастание внутрь. Они осуществляют это действие посредством семейства трансформирующего фактора роста-бета (TGF-β), факторов роста фибробластов (FGFs), сосудистых эндотелиальных факторов роста (VEGF) и других факторов. Активация простагландинов и Sma и Mad родственные белки (SMAD) также повышает пролиферацию воспалительных клеток и уменьшает разрушение матрикса.
Sma и Mad родственные белки (SMAD) представляют собой семейство эволюционно консервативных внутриклеточных медиаторов, которые регулируют активность определенных генов, а также клеточный рост и пролиферацию. SMAD выполняют свою функцию как часть сигнального пути трансформирующего фактора роста бета (TGF-β), который передает сигналы от внешней стороны клетки к ядру. Название «SMAD» введено в употребление с идентификацией SMAD1 человека по отношению к сходству их последовательности с белками SMA и MAD (Mothers Against Decapentaplegic homology).
Передача сигнала посредством TGF-β1 инициируется фосфорилированием, опосредованным рецепторами I и II типа. Активированный TGF-β1 рецептор I фосфорилирует SMAD2 и SMAD3 (R-Smads) на их C концах, которому противодействует ингибиторные SMAD6 и SMAD-7 (I-Smads). После фосфорилирования R-SMAD образуют комплексы с SMAD4 (Co-SMAD), перемещаются в ядро и активируют транскрипцию внеклеточного гена. R-Smad также фосфорилируются под действием MAPK, в частности, на линкерной области, которая соединяет мостиком N-концевой MH1 и C-концевой MH2 домены. BMP используют специфический внутриклеточный сигнальный каскад для нацеливания на гены через R-SMADS (SMAD1,5,8), Co-SMAD (SMAD4) и I-SMADS (SMAD6,7).
Известно, что SMAD7 является внутриклеточным антагонистом сигнального пути TGF-β, он ингибирует TGF-β-индуцированные транскрипционные ответы, тогда как SMAD6 является известным ингибитором TGF-β и BMP (костного морфогенного белка, представителя суперсемейства TGF-β). Сигнальная ось TGF-β /Smad2/3 и BMP(4/7)/Smad1 была вовлечена в клинический IPF (Neininger, A. et al., J Biol Chem 277:3065-3068, 2002; Broekelmann, T. et al., Proc Natl Acad Sci USA, 88:6642-6646, 1991; Fernandez, I.E. и Eickelberg, O., Proc Am Thorac Soc 9:111-116, 2012.; Murray, L.A., PLoS One 3:e4039, 2008; Aad, G., et al., Phys Rev Lett, 105:161801, 2010; Jonigk, D. et al., Virchows Arch 457:369-380, 2010; Zhang, K. et al., Am J Pathol 147:352-361, 1995; Kim, K. et al., J Clin Invest 119:213-224, 2009; Cutroneo, K.R. и Phan, S.H, J Cell Biochem 89:474-483, 2003; Flechsig, P. et al., Clin Cancer Res 18:3616-3627, 2012).
Повышенные уровни TGF-β1 и β2, а также сниженные уровни TGF-β3 были связаны с гипертрофическим рубцеванием посредством стимуляции воспалительных клеток, пролиферации фибробластов, адгезии, продукции матрикса и сокращения. В подтверждение этих наблюдений противовоспалительные средства (ингибиторы цитокинов, кортикостероиды, интерфероны α и β и метотрексат) были использованы с некоторым успехом для уменьшения образования рубца. Например, было показано, то блокирующие функцию анти-TGF-β1 и β2 антитела могут уменьшать рубцевание ран при резанных ранах у крыс (Shah, M. et al., J Cell Sci 107:1137-57, 1994). Это экспериментально подтвержденный подход также обусловливал разработку рекомбинантного TGF-β3 (Avotermin; Juvista®), ранние результаты клинических испытаний которого показали некоторую эффективность для обеспечения ускоренного и постоянного улучшения рубцевания (Ferguson, M.W. et al., Lancet, 373: 1264-74, 2009), но не в опорных исследованиях.
Повышенная сосудистая плотность, обширная обструкция микрососудов и деформированные сосуды также наблюдались при гипертрофических рубцах, давая основание предполагать, что структурные изменения могут объяснять персистирующую высокую плотность воспалительных клеток, наблюдаемую при гипертрофических рубцах.
Другие примеры средств против рубцов, которые были использованы при лечении гипертрофических рубцов и келоидов, включают EXC001 (анти-смысловая РНК против фактора роста соединительной ткани (CTGF); Excaliard Pharmaceuticals), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20); Capstone Therapeutics Corp), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2; Promedior), PXL01 (синтетический пептид, полученный из лактоферрина человека; PharaSurgics AB), DSC127 (аналог ангиотензина; Derma Sciences, Inc), RXI-109 (соединение самодоставляющейся РНКи, которое нацеливает фактор роста соединительной ткани (CTGF); Galena Biopharma), TCA (трихлоруксусная кислота; Isfahan University of Medical Sciences), Botox® (Capital District Health Authority and Allergan); ботулиновый токсин типа A (Chang Gung Memorial Hospital), 5-фторурацил, блеомицин, экстракт лука, пентоксифиллин, пролил-4-гидроксилаза, гидроксилазу, верапамил, такролимус и средства против TNF-α, тамоксифен, третиноин, колхицин, антагонисты кальция, траниласт, цинк и витамин Е (Koc, E. et al., Dermatologic Surgery, vol. 34, no. 11, pp. 1507-1514 (2008); Lope, L. et al., Journal of Investigative Dermatology, vol. 129, no. 3, pp. 590-598 (2009); Rawlins, J. et al., Burns, vol. 32, no. 1, pp. 42-45 (2006); Kim I. et al, Wound Repair и Regeneration, vol. 11, no. 5, pp. 368-372 (2003); Copcu, E. et al., Journal of Burn Care и Rehabilitation, vol. 25, no. 1, pp. 1-7 (2004); Kim, A. et al., Journal of the American Academy of Dermatology, vol. 45, no. 5, pp. 707-711(2001); LaDuca, J. и Gaspari, A., Dermatologic Clinics, vol. 19, no. 4, pp. 617-635, (2001)).
13.2. Направленное эпителиально-мезенхимальное взаимодействие
Эпителиальные клетки выполняют ряд важных функций в нормальной физиологии кожи, которые включают действие в качестве ниш для стволовых клеток и участие в сложных сигнальных путях для регуляции функции мезенхимальных клеток. Конечным результатом является постоянное обновление слоев кожи и регуляция отложения матрикса и ремоделирование. Заменители кожи клеточной основы пользуются преимуществом регенеративной природы кожи и используются клинически для покрытия ран, но их применимость в последующем образовании рубца остается неизвестной. Предполагалось, что эпидермальные стволовые клетки действуют во взаимодействии с мезенхимальными клетками в кожном сосочке, функционируя для привлечения новых клеток в места регенерации кожи, но было показано, что крупные травматические повреждения кожи (например, после ожоговых травм) разрушают немигрирующую популяцию эпидермальных стволовых клеток и не могут быть спонтанно регенерированы.
Помимо их регенеративной функции, было показано, что эпителиальные клетки модулируют пролиферацию и активность мезенхимальных клеток в нормальной коже и во время заживления ран и образования рубца. При заживлении ран эпителиальные клетки способствуют фиброзу и рубцеванию посредством многочисленных путей, таких как, без ограничения, путей, вовлекающих SMAD, включая сигнальные пути, через которые передают сигнал представители семейства TGF-β, фосфоинозитид-3 киназа (PI3K) и фактор роста соединительной ткани (CTGF). Эпителиальные клетки стимулируют фибробласты во время образования гипертрофического рубца и сами фибробласты подвергаются характерным изменениям во время процесса рубцевания. В дальнейшем фибробласты остаются в активном состоянии, участвуя в аутокринной петле цитокинов, что поддерживает фиброз. Фибробласты гипертрофического рубца также имеют существенно измененные профили клеточного апоптоза, продукции матрикса и разрушения матрикса. Неясно, однако, меняются ли эти профибротические свойства вследствие генетической предрасположенности, или они являются вторичными по отношению к уникальным условиям, присутствующим в окружающей среде раны.
13.3. Направленность физического окружения
После повреждения рана представляет собой сложную и механически уникальную окружающую среду с многочисленными уровнями взаимодействия между клетками и окружающей средой. Фибробласты и кератиноциты реагируют на плотность и ориентацию коллагена и других компонентов матрикса. В результате клетки рядом с краем раны пролиферируют, в то время как те, которые дальше от края раны, являются менее активными. В это же время, эти клетки активно продуцируют и ремоделируют окружающий матрикс. Было предположено, что этот хрупкий баланс, который отвечает за быстрый и здоровый ответ на повреждение, при нарушении ведет к аномальному заживлению ран.
Исследования показали, что клетки в коже также способны к ответной реакции на их механическое окружение. В частности, молекулы клеточной поверхности, такие как семейство интегринов, активируются под действием механических сил, приводя к повышенному выживанию фибробластов, а также к ремоделированию отложенного коллагена и фибрина. Хотя внутриклеточный сигнальный путь, вовлеченный в этот процесс, является сложным и полностью не изученным, регуляторы транскрипции, было обнаружено, что такие как AKT/протеинкиназа B и киназа фокальной адгезии (FAK) являются важными элементами. Было показано, что пролиферация кератиноцитов и миграция регулируются сходным образом под действием механического стресса. После повреждения ткани механотрансдукция выполняет биологическую функцию для оповещения о наличии дефекта ткани. Клетки испытывают наиболее высокие уровни механического стресса на краю монослоя и, аналогичным образом, край раны испытывает высокие уровни механического стресса. Было предположено, что эти стрессы могут развиться для стимулирования компонентов заживления раны и инициации репарации. Различия в экзогенных силах могут действовать для изменения клеточной активации в среде при заживлении раны и, при гиперактивации, приводят к образованию гипертрофического рубца. Кожа, подвергшаяся высокому уровню стресса (вторично по отношению к травме или движению сустава) обычно демонстрирует активное образование гипертрофического рубца.
Давление кислорода представляет собой другой компонент физического окружения, который может отвечать за образование рубца. Предполагалось, что изменения уровней транскрипционного фактора индуцированного гипоксией фактора (HIF)-1α во время развития кожи эмбриона, частично ответственны за переход от безрубцового к рубцовому заживлению. Изменяющиеся уровни HIF-1α в свою очередь в результате приводят к изменениям в количестве нижележащих белков, включая трансформирующий фактор роста-бета3 (TGF-β3) и сосудистый эндотелиальный фактор роста (VEGF). Изменения сигнальных путей при гипоксии вносят вклад в созревание кожи эмбриона и развитие фенотипа рубцевания после нанесения раны. Также было показано, что изменения в давлении кислорода и повышение активных форм кислорода опосредуют раннее образование рубца в тканях, например, в легких и сердце.
13.4. Хирургические способы лечения рубцов
После хирургического вмешательства обычно следует рецидив, если не используются вспомогательная терапия, поскольку новая хирургическая рана подвергается воздействию тех же механических и биохимических сил первоначального повреждения. Сообщалось, что частота рецидивов находится в интервале 45-100%, когда хирургическое вмешательство проводят в качестве монотерапии (Mathangi-Ramakrishnan K et al., Plast Reconstr Surg 1974; 53, pp. 276-80 (1974); Cosman, B. и Wolff, M. Plast Reconstr Surg, 50, pp. 163-6 (1972); Lawrence, W., Ann Plast Surg, 27, pp.164-78 (1991)). Более того, предполагалось, что келоиды, которые рецидивировали после хирургического вмешательства, рецидивируют с большей вероятностью, если их снова удалить операционным путем (Cosman, B. et al., Plast Reconstr Surg, 27, pp. 335-58 (1961); Kovalic, J. и Perez, C., Int J Radiat Oncol Biol Phys, 17, pp. 77-80 (1989)).
13.5. Заменители кожи
Было показано, что качество заживления кожных ран улучшается при использовании каркасов в качестве материалов для реплантации кожи. Материалы для реплантации кожи должны защищать раны от инфекции и потери жидкости; они должны быть достаточно стабильными, чтобы функционировать в качестве предварительного матрикса; не должны вызывать иммунологических реакций; и состав, размер пор и разлагаемость заменителя должны поддерживать миграцию клеток и функцию (Arabi, S. et al., PLoS Medicine, 4(9), e234, 1-7). В Таблице 4 показаны примеры доступных в настоящее время материалов для реплантации кожи.
|
13.5.1. Природные биологические материалы
Природные биологические материалы, такие как трупная кожа человека или свиньи или подслизистая оболочка тонкой кишки свиньи (Oasis®), могут быть использованы в качестве заменителей кожи, поскольку они обеспечивают структурно интактный природный трехмерный (3D) внеклеточный матрикс (ECM) коллагена и эластина. Для улучшения материалов для замены кожи, было предпринято несколько попыток для удаления клеточных остатков. Грубые методы могут удалить остатки клеток очень эффективно, но зачастую они разрушают структуру внеклеточного матрикса, тогда как мягкие методы менее эффективны в удалении всех клеточных остатков. Удаление клеточных остатков может достигаться с использованием различных методик. При производсте Alloderm®, например, донорскую кожу обрабатывают NaCl-SDS, что в результате приводит к сохранению базальной мембраны и хорошим иммунологическим свойствам как в in vitro, так и в исследованиях на животных. Использование природных тканей человека или животных также требует широкомасштабных процедур стерилизации для предотвращения передачи возможных заболеваний. Было показано, что методы агрессивной стерилизации наподобие этиленоксида или гамма-излучения индуцируют структурные изменения в дерме, тогда как обработка глицерином показала небольшое воздействие на структуру кожи.
13.5.2. Структурные биологические материалы
Заменители кожи могут быть получены из очищенных биологических молекул посредством лиофилизации. В качестве основного компонента часто используют коллаген. Для контрольных аспектов, таких как размер пор и взаимосвязанность, различные методики сушки вымораживанием (FD) были использованы во время получения каркасов. Свойства могут быть подобраны путем дополнения заменителей гликозаминогликанами (GAG) и поперечным связыванием. Использование очищенных биологических компонентов позволяет осуществлять отбор материалов с низким антигенным потенциалом или без него. Точно контролируемое получение в результате приводит к получению продуктов с хорошо определенным составом и свойствами. Много различных молекул, таких как факторы роста и компоненты матрикса, может быть добавлено к этому продукту. Примеры сконструированных заменителей кожи, используемых для лечения, включают, но не ограничиваются, бислойные бесклеточные матрицы для регенерации кожи (например, Integra® (Integra™ Life Sciences), Renoskin® (Perouse Platie), и Hyalomatrix® (Anika Therapeutics)) и однослойные ячеистые матрицы для регенерации кожи (например, Pelnac® (Gunze Ltd.), Matriderm® (Dr. Suwelack Skin & Health Care AG), однослойные Integra® (Integra™ Life Sciences), Alloderm™ (LifeCell), Strattice® (LifeCell), Permacol® (Tissue Science Laboratories), и Glyaderm® (Euro Skin Bank)).
Коллаген, основной компонент заменителей кожи, содержит телопептиды, расположенные на концах трехспиральной молекулы коллагена, которые могут индуцировать иммунный ответ. Однако, заменители, основанные на коллагене, содержащем телопептиды, не отторгались, давая основание предполагать, возможная иммуногенность телопептидов в коллагене не мешает применению коллагена при заживлении ран. Альтернативно, разрушение коллагена может быть уменьшено путем добавления внеклеточных компонентов для защиты коллагена от разрушения металлопротеиназой. Например, было показано, что резистентность коллагеновых каркасов к коллагеназам могла быть повышена путем добавления гликозаминогликанов, таких как хондроитин 6-сульфат, хондроитин 4-сульфат, дерматансульфат, гепарин и гепарансульфат. Использование гликозаминогликанов также обеспечивает возможность контролировать определенные механические свойства и размеры пор каркасов. Была выдвинута гипотеза, что покрытие коллагеновых волокон фибронектином, гиалуроновой кислотой или эластином могло стабилизировать заменители кожи в свиной модели полнослойной раны.
Исследования показали, что васкуляризация заменителей кожи является важной для высокого процента успеха и может быть вызвана добавлением внеклеточных компонентов. Применение коллаген/хондроитин-6-сульфатных каркасов наподобие Integra® требует вплоть до 3 недель для полной васкуляризации заменителя кожи. Одновременное применение матрикса и расщепленного кожного трансплантата в результате приводит к отторжению трансплантата вследствие антиангиогенных свойств хондроитин-6-сульфата, как показано в анализе хорионаллантоисной мембраны (CAM). В отличие от этого, эластин и пептиды, производные эластина, способствовали ангиогенезу в анализе CAM и было показано, что пептиды, производные эластина, действуют в качестве хемоаттрактантов для гладко-мышечных клеток сосудов. Применение коллаген/эластиновых каркасов показало повышенную васкуляризацию через одну неделю после ранения в свиной модели эксцизионной раны.
13.5.3 Синтетические заменители
Заменители кожи также могут быть сконструированы из не-биологических молекул, которые не присутствуют в нормальной коже. Некоторые синтетические заменители были протестированы в in vitro или в экспериментах на животных для оценки их потенциала в качестве заменителей кожи. Материалы, созданные для этой цели, должны обеспечить предварительную трехмерную поддержку и взаимодействовать с клетками для контроля за их функцией и для управления сложными процессами формирования и регенерации ткани.
Для фибробластов и других клеток требуются сайты связывания и хемотактические сигналы в материале для миграции и пролиферации. Взаимодействия на синтетических материалах, таких как пластик для тканевых культур, однако, заметно отличаются от таковых в природном внеклеточном матриксе. Структура и состав субстратов, которые влияют на адгезию, миграцию, передачу сигнала и клеточную функцию, следовательно, могут затруднять биологическую функцию синтетических материалов в качестве заменителей кожи. Для улучшения использования синтетических матриц при применении в тканевой инженерии, могут быть включены последовательности биомиметических белков, такие как RGD (аргинин-глицин-аспартат) последовательности. Было показано, что включение этих RGD последовательностей в само-собирающиеся гидрогели, облегчает миграцию и персистенцию фибробластов и приводит в результате к более природной морфологии клеток, а также к увеличению взаимодействий клетка-матрикс, таких как сжатие.
Гидрогели (само-собирающиеся пептиды (SAP))
Самосборка позволяет осуществлять оптимальный контроль за структурой и составом каркаса. В методиках используются специально разработанные пептиды, которые автоматически собираются в трехмерные структуры в соответствующих условиях посредством образования многочисленных нековалентных слабых химических связей. Полученные в результате пептидные гидрогели представляют фиброзное наноокружение для клеток, которое аналогично коже. Само-собирающиеся пептиды могут быть получены недорого в большой партии и снижать риск передачи заболеваний, поскольку при получении этих каркасов используют неприродные материалы.
Твердая конструкция произвольной формы (SFF)
Твердая конструкция произвольной формы (SFF), также известная как быстрое прототипирование, представляет собой набор методик, посредством которых создают трехмерные каркасы путем нанесения отдельных слоев с помощью одной из многочисленных различных контролируемых компьютером методик распыления или печати. SFF методики позволяют создавать практически неограниченные формы каркасов, от ушей до миниатюрных домов. Кроме того, эти методики также позволяют осуществлять нанесение жизнеспособных клеток с уровнем контроля и точностью, которые невозможно достичь с такими подходами, как ES.
13.6. Излучение
В качестве монотерапии лучевая терапия используется не часто. При объединении с хирургическим вмешательством, сообщалось, что частота рецидивов после лучевой терапии составляет 10-20% (Sclafani, A. et al., Dermatol Surg, 22, pp. 569-74 (1996); Ragoowansi, R et al., Br J Plast Surg, 54, pp. 504-8 (2001)). Некоторыми исследователями рекомендуется доза по меньшей мере 1500GY, доставляемая частями в течение 10 дней после хирургического вмешательства (Doombos, J. et al., Int J Radiat Oncol Biol Phys, 18, pp. 833-839 (1990)). Ингибирование пролиферации фибробластов и ангиогенеза во время чрезмерно увеличенного процесса заживления ран является предполагаемым механизмом действия.
13.7. Прессотерапия
Впервые о компрессионной терапии для келоидов сообщалось в 1960-х. Механизм, посредством которого непрерывное давление уменьшает размер и толщину гипертрофических рубцов и келоидов, полностью не изучен. Некоторые исследования дают основание полагать, что непрерывное давление оказывает свой эффект путем создания ишемии тканей, снижая тканевой метаболизм и повышая активность коллагеназы. Другие теории включают индуцированное давлением высвобождение металлопротеиназы-9 или простагландина E2, что может осуществлять смягчение рубца путем индукции ремоделирования внеклеточного матрикса.
13.8. Криотерапия
Криотерапия была использована в качестве монотерапии и в сочетании с другими методиками для лечения келоидных и гипертрофических рубцов. Механизм, посредством которого криотерапия оказывает свое терапевтическое действие, зависит от индуцированного замораживанием ишемического повреждения до микроциркуляции. Замораживание индуцирует повреждение сосудов и циркуляторный стаз, приводя к кислородной недостаточности с возможным некрозом (Shaffer J. et al., J Am Acad Dermatol, 46, S63-97 (2002); Alster, T и West, T. Ann Plast Surg, 39, pp. 418-32 (1997)). Терапия обычно включает обработку всего рубца двумя или тремя циклами замораживания-оттаивания по 30 секунд каждый. Предполагалось, что криотерапия является более эффективной при объединении с другими процедурами, такими как введение внутрь рубца кортикостероидов (Lahiri, A. et al., Br J Plast Surg, 54, pp. 633-635 (2001)).
13.9. Силикагелевые пластины и другие повязки
В многочисленных исследованиях сообщалось о значительном смягчении рубцов и уменьшении зуда после наложения местной силикагелевой пластины или подушки по меньшей мере на 12 часов ежедневно в течение 2-4 месяцев. Силиконовые пластины также были использованы для профилактики образования гипертрофических рубцов (Gold, M. et al., Dermatol Surg, 27, pp. 641-642 (2001)). Хотя механизм действия полностью не изучен, предполагалось, что гидратация, не давление или силикон, может приводить к модификации фибробластов (Beranak, J., Dermatol Surg, 23, pp. 401-405 (1997)).
13.10. Лазер
Новые лазеры, такие как неразрушающий фракционный лазер, использовались для лечения рубцевания, хотя подтверждение их эффективности является по большей части эпизодическим (Mustoe, T., British Medical Journal, vol. 328, no. 7452, pp. 1329-1330 (2004)). Было показано, что импульсные лазеры на красителе (PDL) могут быть использованы для лечения резистентных келоидов в сочетании с введением стероидов внутрь поврежедения (Mustoe, T. et al., Plastic and Reconstructive Surgery, vol. 110, no. 2, pp. 560-571 (2002); Kuo, Y. et al., Lasers in Surgery and Medicine, vol. 36, No. 1, pp. 31-37 (2005)). Также было показано, что лечение лазером способно уплощать гипертрофические рубцы и уменьшать эритему (красноту кожи), хотя с противоречивыми сообщениями об успехе (Smit, J. et al., British Journal of Plastic Surgery, vol. 58, no. 7, pp. 981-987 (2005)). В некоторых исследованиях сообщалось, что так называемая «лазерная сварка» кожных ран лучше продуцирует рубцы у крыс (Gulsoy, Z et al., Lasers in Medical Science, vol. 21, no. 1, pp. 5-10 (2006)).
Образование кожных рубцов является огромной медицинской проблемой приблизительно с 100 миллионами пациентов, приобретающих рубцы каждый год (Bush, J. et al., Wound Rep Reg, 19: S32-S37, 2011). Люди с аномальным рубцеванием кожи могут столкнуться с физическими, эстетическими, психологическими и социальными последствиями, которые могут быть связаны со значительными эмоциональными и финансовыми затратами. Однако, уменьшение рубца и устранение остается нереализованной потребностью медицины вследствие трудностей в их лечении.
14. Роль сигнального пути p38 MAPK-MK2 в заживлении кожных ран
Было показано, что p38 митоген-активированная протеинкиназа (MAPK) и ее выше лежащие и ниже лежащие сигнальные молекулы играют важную роль в ответе на клеточный стресс от стимулов (Saklatvala, Curr Opin Pharmacol, 4:372-377, 2004; Edmunds, J. and Talanian, MAPKAP Kinase 2 (MK2) as a Target for Anti-inflammatory Drug Discovery. In Levin, J and Laufer, S (Ed.), RSC Drug Discovery Series No. 26, p 158-175, the Royal Society of Chemistry, 2012).
Существует четыре изоформы p38 (т.е., p38α, p38β, p38γ, и p38δ) с p38α наиболее явно связанной с воспалением. Цитокины и другие внеклеточные стимулы (такие как факторы роста, повреждение ДНК и окислительный стресс) посылают сигнал через многочисленные рецепторы и другие механизмы для активации каскада киназ, начиная с MAP3K (например, MEKK3 или TAK1), затем MAP2K (например, MKK3 или MKK6), и затем MAPK (например, p38α) (Фигура 3). Посредством прямых и опосредованных эффектов, включая стабилизацию, транслокацию и трансляцию мРНК, p38 играет основную роль в продукции провоспалительных цитокинов, таких как TNF-α, IL-6, и IFN-γ, а также индукции других провоспалительных цитокинов, таких как COX-2.
В основном, в покоящихся клетках, p38 MAPK и MK2 физически связаны вместе в ядре. Клеточный стресс вызывает фосфорилирование p38 MAPK под действием вышележащей киназы, такой как MKK3 (Kim et al., Am J Physiol Renal Physiol, 292:F1471-1478, 2007). Активированная p38 MAPK затем фосфорилирует MK2 по остаткам Thr-222, Ser-272 и/или Thr-334 (Engel et al., EMBO J, 17: 3363-3371, 1998). Активированная MK2 и p38, все еще физически связанные вместе, перемещаются в цитоплазму, где они фосфорилируют их соответствующий белок-мишень (Ben-Levy et al., Curr Biol, 8:1049-1057, 1998).
В свою очередь, активированная MK2 опосредует фосфорилирование HSPB1 в ответ на стресс, приводя к диссоциации HSPB1 и крупных олигомеров небольших белков теплового шока (sHsps), тем самым ослабляя активности их шаперонов и способность эффективно защищать от окислительного стресса.
MK2 также вовлечена в воспалительные и иммунные ответы путем регуляции пост-транскрипционной продукции фактора некроза опухоли (TNF) и IL-6. Эта активность опосредуется фосфорилированием белков, связывающих элементы (ARE), богатые аденином и уридином (AU), таких как эмбриональный летальный фактор, нарушения зрения, дрозофила-подобный 1 (ELAVL1), гетерогенный ядерный рибонуклеопротеин A0 (HNRNPA0), полиаденилат-связывающий белок 1 (PABPC1), и тристетрапролин (TTP/ZFP36), которые, в свою очередь, регулируют стабильность и трансляцию мРНК TNF-α и IL-6. Фосфорилирование TTP/ZFP36, основного пост-транскрипционного регулятора TNF-α, способствует его связыванию с белками 14-3-3 и уменьшает его аффинность к мРНК ARE, тем самым ингибирует разрушение ARE-содержащего транскрипта (Фигура 4).
Кроме того, MK2 также играет важную роль в поздней контрольной точке G2/M после повреждения ДНК посредством процесса пост-транскрипционной стабилизации мРНК. После повреждения ДНК MK2 релокализуется из ядра в цитоплазму и фосфорилирует гетерогенный ядерный рибонуклеопротеин A0 (HNRNPA0) и поли(A)-специфичную рибонуклеазу (PARN), приводя к стабилизации мРНК блокировки роста и белка 45A, индуцированного повреждением ДНК (GADD45A). Кроме того, исследования показали, что MK2 вовлечена в сигнальный путь toll-подобного рецептора (TLR) в дендритных клетках и при остром TLR-индуцированном макропиноцитозе путем фосфорилирования и активации киназы рибосомального белка S6, 90 кДа, полипептид 3 (RPS6KA3).
Хотя ферменты на каждом уровне упомянутого выше сигнального каскада p38 MAPK были исследованы для открытия анти-цитокиновых лекарственных средств, трудно сделать общие выводы о том, как вышележащие и нижележащие мишени в таком пути могли меняться в своем потенциале для эффективности. Например, вышележащие мишени могут оказывать многочисленные эффекты, повышая эффективность, но их могли обойти другие сигнальные механизмы, ограничивая действие ингибирования. Аналогичным образом трудно предсказать нежелательные побочные эффекты. Следовательно, специфические свойства сигнальных механизмов, наподобие таковых пути p38 должны рассматриваться в каждом отдельном случае для выбора наилучших мишеней, исходя из эмпирического опыта. (Edmunds, J. and Talanian, MAPKAP Kinase 2 (MK2) as a Target for Anti-inflammatory Drug Discovery. In Levin, J и Laufer, S (Ed.), RSC Drug Discovery Series No. 26, p 158-175, the Royal Society of Chemistry, 2012).
Действительно, хотя было много сообщений об ингибиторах p38 с многообещающими свойствами in vitro и в моделях заболеваний на животных, ни один не достиг клинического успеха (Edmunds, J. and Talanian, MAPKAP Kinase 2 (MK2) as a Target for Anti-inflammatory Drug Discovery. In Levin, J and Laufer, S (Ed.), RSC Drug Discovery Series No. 26, p 158-175, the Royal Society of Chemistry, 2012). Многие мишени помимо тех, которые связаны с продукцией цитокинов, регулируются p38, согласуясь с наблюдаемым плейотропным проявлением их ингибирования и говоря о многочисленных механизмах токсичности и даже провоспалительных эффектах. Например, в гепатоцитах, p38 прямо и опосредовано отрицательно регулирует JNK, тем самым модулируя чувствительность гепатоцитов к липополисахариду (LPS) и индуцированной TNF-α клеточной гибели; это может быть важным механизмом индуцированной ингибированием p38 печеночной токсичности. Кроме того, активация MSK1 и MSK2 под действием p38 может индуцировать экспрессию противовоспалительного цитокина IL-10, и, следовательно, ингибирование p38 может оказывать провоспалительный эффект, который вносит вклад в наблюдаемую транзиторную суппрессию маркеров воспаления под действием ингибиторов p38. Таким образом, существуют важные проблемы, что как противовоспалительная стратегия, ингибирование p38 не приведет в результате к адекватной эффективности или приемлемой безопасности.
С другой стороны, MK2 привлекла широкое внимание в качестве потенциальной мишени для поиска новых лекарственных средств, когда было получено сообщение, что нокаут мыши с дефицитом MK2 являются жизнеспособными и фертильными, и с нарушением продукции TNF-α. В спленоцитах, полученных от этих животных, нарушена продукция нескольких провоспалительных цитокинов, в том числе, TNF-α, IL-6 и IFN-γ и сами животные являются резистентными к коллаген-индуцированному артриту, мышиной модели ревматоидного артрита (RA), а также индуцированному овальбумином воспалении дыхательных путей, мышиной модели астмы. Вводимые перорально, ингибиторы MK2 могут блокировать острую системную индукцию TNF-α под действием LPS у крыс и могут уменьшать отек подушечек лап в модели артрита, индуцированного клеточными стенками стрептококков (SCW). Эти результаты дают возможность предположить, что MK2 опосредует большинство или все воспалительные сигналы каскада p38, тогда как другие субстраты p38 регулируют пути, ответственные за токсичность или сниженную эффективность; и что ингибирование MK2 может обещать ингибирование p38 для противовоспалительной эффективности, в то же время предоставляя более благоприятный профиль безопасности.
Недавние исследования выключения гена MK2 показали, что MK2 может быть вовлечена в заживление кожных ран. Например, было показано, что на кинетические показатели заживления ран значительно влияет отсутствие MK2 в эксцизионных ранах. Гистологическое исследование показало более высокий уровень акантоза (означающего увеличение толщины шиповатого слоя эпидермиса) мигрирующего раневого слоя кератиноцитов, а также более высокий уровень отложения коллагена в грануляционной ткани ран у мышей дикого типа, чем у мышей с выключенным геном MK2. Это исследование дополнительно показало, что на экспрессию многих цитокинов и хемокинов значительно влияли различные дни после ранения; и что задержка скорости заживления ран у мышей с выключенным геном MK2 может быть значительно улучшена путем пассивного переноса макрофагов с интактным MK2. Эти результаты указывали на важную роль экспрессии гена MK2 в макрофагах, принимающих участие в процессе заживления кожных ран (Thuraisingam et al., J Invest Dermatol., 130(1):278-286, 2010).
Учитывая, что нарушение миграции клеток, пролиферации, воспаления и синтеза и секреции белков внеклеточного матрикса и цитокинов и ремоделирования во время процессов заживления ран связаны с образованием патологических рубцов в тканях кожи, эти прежние исследования указывают на то, что направленное воздействие на нарушенную активность MK2 в кожных ранах может быть эффективным средством для лечения, уменьшения или предотвращения образования рубца в тканях кожи.
Хотя попытки поиска новых лекарственных средств MK2 объединили одновременный анализ эффективности in vitro, растворимости, клеточной проницаемости и клиренса для получения потенциально низкодозируемых соединений, in vivo активности ингибиторов MK2 с низкой молекулярной массой препятствовало ограниченное ингибирование продукции TNF-α в цельной крови, предположительно вследствие трудности достижения уровней несвязанной плазмы в избытке значений EC50 клеточного анализа. Помимо трудностей, возникших в связи с высокой АТФ аффинностью нефосфорилированной MK2, наблюдались слабые корреляции между ингибированием рекомбинантной MK2 и эффективностью клеточных исследований серии соединений, указывающие на дальнейшие сложности, такие как изменчивость аналог-специфичных свойств, что влияет на клеточную эффективность, например, пенетрацию мембраны (Edmunds, J. and Talanian, MAPKAP Kinase 2 (MK2) as a Target for Anti-inflammatory Drug Discovery. In Levin, J and Laufer, S (Ed.), RSC Drug Discovery Series No. 26, p 158-175, the Royal Society of Chemistry, 2012).
Описанное изобретение предлагает подходы к участию в процессе образования кожного рубца путем использования пенетрирующего клетку пептидного ингибитора MK2.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом описанное изобретение относится к фармацевтической композиции для использования при лечения кожных рубцов у пациента, нуждающегося в этом, содержащей терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2) содержащего полипептидный ингибитор MK2 с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент, и фармацевтически приемлемый носитель, где пациент, нуждающийся в этом страдает от раны, а терапевтическое количество является эффективным (a) для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны и (b) для лечения кожного рубца у пациента, таким образом, чтобы уменьшалось по сравнению с контролем по меньшей мере одно из следующего: размер раны, область раны и образование витков коллагена в ране.
В соответствии с одним вариантом осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, операционную рану, растяжение, или сочетания указанного. В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, послеоперационный рубец, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец выбран из группы, состоящей из гипертрофического рубца, келоидного рубца, атрофического рубца, рубцовой контрактуры, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом растяжения, расположенного в непосредственной близости от сустава, в том числе, коленного, локтевого, лучезапястного, плечевого, тазобедренного, остистого отростка, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом царапины, рваной раны, разреза, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, аутоиммунного заболевания кожи, или сочетания указанного. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности по меньшей мере одной киназы, выбранной из группы, состоящей из митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), рецептора факторов роста BDNF/NT-3 (TrkB), или сочетания указанного без существенного ингибирования нецелевого белка. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для снижения либо уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране; либо количества по меньшей мере одной иммуномодулирующей клетки или клетки-предшественника, инфильтрирующей рану, либо и того, и другого. В соответствии с другим вариантом осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов, фиброцитов, или сочетания указанного. В соответствии с другим вариантом осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки или сочетания указанного.
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, выбранное из группы, состоящей из противовоспалительного средства, обезболивающего средства, дезинфицирующего средства, или сочетания указанных средств. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид P человека/пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трихлоруксусную кислоту), ботулиновый токсин типа A, или сочетания указанного. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство выбрано из группы, состоящей из масла семян шиповника, витамина E, 5-фторурацила, блеомицина, экстракта лука, пентоксифиллина, пролил-4-гидроксилазы, верапамила, такролимуса, тамоксифена, третиноина, колхицина, траниласта, цинка, антибиотика и их сочетаний.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1); и представляет собой полипептид аминокислотной последовательности выбранной из группы, состоящей из YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), YARAAARQARAKALARQLAVA (SEQ ID NO: 5), YARAAARQARAKALARQLGVA (SEQ ID NO: 6) или HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид представляет собой полипептид аминокислотной последовательности YARAAARQARA (SEQ ID NO: 11), и второй полипептид включает терапевтический домен, последовательность которого по меньшей мере на 70 процентов идентична аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2) и выбран из группы, состоящей из полипептида аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8), полипептида аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9), полипептида аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид включает домен белковой трансдукции, функционально эквивалентный YARAAARQARA (SEQ ID NO: 11) и представляет собой полипептид аминокислотной последовательности, выбранной из группы, состоящей из WLRRIKAWLRRIKA (SEQ ID NO: 12), WLRRIKA (SEQ ID NO: 13), YGRKKRRQRRR (SEQ ID NO: 14), WLRRIKAWLRRI (SEQ ID NO: 15), FAKLAARLYR (SEQ ID NO: 16), KAFAKLAARLYR (SEQ ID NO: 17), и HRRIKAWLKKI (SEQ ID NO: 18); и второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления фармацевтически приемлемый носитель представляет собой носитель контролируемого высвобождения. В соответствии с другим вариантом осуществления фармацевтически приемлемый носитель включает частицы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии по меньшей мере одного гена, с которым связано образование рубца или белка, с которым связано образование рубца в ране, выбранного из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (C-C мотив) лиганда 2 (CCL2) (или моноцитарного хемотактического белка-1 (MCP-1)), рецептора 2 хемокина (C-C мотив) (CCR2), EGF-подобного модуль-содержащего муцин-подобного наподобие гормонального рецептора 1 (EMR1) или sma/mad-родственного белка (SMAD).
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит ингибитор MK2 низкой молекулярной массы, где ингибитор MK2 низкой молекулярной массы представляет собой аналог пирролопиридона или полициклический аналог лактама. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 100 мг/кг массы тела.
В соответствии с другим аспектом описанное изобретение относится к способу лечения кожного рубца у пациента, нуждающегося в этом, где пациент, нуждающийся в этом, страдает от раны, где указанный способ включает введение пациенту фармацевтической композиции, содержащей терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2), содержащего полипептидный ингибитор MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент, и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным (a) для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны и (b) для лечения кожного рубца у пациента, таким образом, чтобы уменьшалось по сравнению с контролем по меньшей мере одно из следующего: размер раны, область раны и образование витков коллагена в ране.
В соответствии с одним вариантом осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, операционную рану, растяжение, или сочетания указанного. В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, послеоперационный рубец, или сочетания указанных. В соответствии с другим вариантом осуществления патологический рубец выбран из группы, состоящей из гипертрофического рубца, келоидного рубца, атрофического рубца, рубцовой контрактуры, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом растяжения, расположенного в непосредственной близости от сустава, в том числе, коленного, локтевого, лучезапястного, плечевого, тазобедренного, остистого отростка, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом царапины, рваной раны, разреза, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, аутоиммунного заболевания кожи, или сочетания указанного. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза, или сочетания указанного.
В соответствии с другим вариантом осуществления применение является местным. В соответствии с другим вариантом осуществления применение осуществляется посредством наложения повязки, содержащей фармацевтическую композицию. В соответствии с другим вариантом осуществления по меньшей мере одна поверхность повязки пропитана фармацевтической композицией. В соответствии с другим вариантом осуществления повязка выбрана из группы, состоящей из марлевой повязки, сетчатого перевязочного материала, альгинатной повязки, полиуретановой повязки, силиконовой повязки, повязки с синтетическим полимерным каркасом, или сочетания указанного. В соответствии с другим вариантом осуществления повязка представляет собой окклюзионную повязку, выбранную из группы, состоящей из пленочной повязки, полупроницаемой пленочной повязки, гидрогелевой повязки, гидроколлоидной повязки, и их сочетания. В соответствии с другим вариантом осуществления применение осуществляется посредством замены кожи, где фармацевтическая композиция заключена в заменитель кожи, который обеспечивает трехмерный каркас. В соответствии с другим вариантом осуществления заменитель кожи изготовлен из биологического материала, структурного биологического материала или синтетического материала. В соответствии с другим вариантом осуществления природный биологический материал включает трупную кожу человека, свиную трупную кожу или подслизистый слой тонкой кишки свиньи. В соответствии с другим вариантом осуществления природный биологический материала содержит матрицу. В соответствии с другим вариантом осуществления природный биологический материал по существу состоит из матрицы, которая в достаточной мере лишена клеточных остатков. В соответствии с другим вариантом осуществления структурный биологический материал включает коллаген, гликозаминогликан, фибронектин, гиалуроновую кислоту, эластин, или сочетания указанного. В соответствии с другим вариантом осуществления структурный биологический материал представляет собой двухслойную неячеистую матрицу регенерации кожи или однослойную ячеистую матрицу для регенерации кожи. В соответствии с другим вариантом осуществления синтетический заменитель кожи содержит гидрогель. В соответствии с другим вариантом осуществления синтетический заменитель кожи дополнительно содержит RGD пептид с аминокислотной последовательностью аргинин-глицин-аспартат.
В соответствии с другим вариантом осуществления введение осуществляют внутрибрюшинно, внутривенно, внутрикожно, внутримышечно или в сочетании указанного. В соответствии с другим вариантом осуществления введение осуществляют посредством инъекционного устройства, пропитанного фармацевтической композицией перед введением. В соответствии с другим вариантом осуществления инъекционное устройство выбрано из группы, состоящей из иглы, канюли, катетера, шовного материала, или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента для внутрикожной инъекции находится в диапазоне от 50 нг/100 мкл/линейный сантиметр края раны до 500 нг/100 мкл/линейный сантиметр края раны. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента для внутрибрюшинного введения находится в диапазоне от 70 мкг/кг до 80 мкг/кг.
В соответствии с другим вариантом осуществления введение осуществляют в однократной дозе за один раз. В соответствии с другим вариантом осуществления введение осуществляют многократными дозами в течение периода времени по меньшей мере одного дня, по меньшей мере одной недели, по меньшей мере одного месяца, по меньшей мере одного года, или сочетания указанных периодов времени. В соответствии с другим вариантом осуществления введение осуществляют по меньшей мере однократно ежедневно, по меньшей мере однократно еженедельно или по меньшей мере однократно ежемесячно.
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, выбранное из группы, состоящей из противовоспалительного средства, обезболивающего средства, дезинфицирующего средства, или сочетания указанного. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трифторуксусную кислоту), ботулиновый токсин типа A, или сочетания указанного. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство выбрано из группы, состоящей из масла семян шиповника, витамина E, 5-фторурацила, блеомицина, экстракта лука, пентоксифиллина, пролил-4-гидроксилазы, верапамила, такролимуса, тамоксифена, третиноина, колхицина, траниласта, цинка, антибиотика, и их сочетания.
В соответствии с другим вариантом осуществления введение осуществляют до, во время или после ушивания раны. В соответствии с другим вариантом осуществления ушивание раны осуществляют по меньшей мере с помощью наложения подкожного шва, по меньшей мере одной хирургической скобки, по меньшей мере одного лейкопластыря, хирургического клея, или сочетания указанного. В соответствии с другим вариантом осуществления хирургический клей содержит октил-2-цианоакрилат или фибриновый тканевый клей.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1); и представляет собой полипептид аминокислотной последовательности выбранной из группы, состоящей из YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), YARAAARQARAKALARQLAVA (SEQ ID NO: 5), YARAAARQARAKALARQLGVA (SEQ ID NO: 6), или HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид представляет собой полипептид аминокислотной последовательности YARAAARQARA (SEQ ID NO: 11), и второй полипептид включает терапевтический домен, последовательность которого имеет по меньшей мере 70 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2) и выбран из группы, состоящей из полипептида аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8), полипептида аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9), полипептида аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид включает домен белковой трансдукции функционально эквивалентный YARAAARQARA (SEQ ID NO: 11) и представляет собой полипептид аминокислотной последовательности выбранной из группы, состоящей из WLRRIKAWLRRIKA (SEQ ID NO: 12), WLRRIKA (SEQ ID NO: 13), YGRKKRRQRRR (SEQ ID NO: 14), WLRRIKAWLRRI (SEQ ID NO: 15), FAKLAARLYR (SEQ ID NO: 16), KAFAKLAARLYR (SEQ ID NO: 17), и HRRIKAWLKKI (SEQ ID NO: 18); и второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности по меньшей мере одной киназы выбранной из группы, состоящей из митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), рецептора факторов роста BDNF/NT-3 (TrkB), или сочетания указанного без существенного ингибирования нецелевого белка. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии по меньшей мере одного гена, с которым связано образование рубца или белка, с которым связано образование рубца в ране, выбранного из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD).
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для снижения либо уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране; либо количества по меньшей мере одной иммуномодулирующей клетки или клетки-предшественника, инфильтрирующей рану, либо и того, и другого. В соответствии с другим вариантом осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов, фиброцитов, или сочетания указанного. В соответствии с другим вариантом осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки, или сочетания указанного.
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит ингибитор MK2 с низкой молекулярной массой, где ингибитор MK2 с низкой молекулярной массой представляет собой аналог пирролопиридона или полициклический аналог лактама.
В соответствии с другим аспектом описанное изобретение относится к повязке для использования при лечении кожного рубца у пациента, нуждающегося в этом, где пациент, нуждающийся в этом, страдает от раны, где повязка содержит фармацевтическую композицию, содержащую терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2) содержащей полипептидный ингибитор MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент, и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным (a) для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны и (b) для лечения кожного рубца у пациента, таким образом, чтобы уменьшалось по сравнению с контролем по меньшей мере одно из следующего: размер раны, область раны и образование витков коллагена в ране.
В соответствии с одним вариантом осуществления повязка выбрана из группы, состоящей из марлевой повязки, сетчатого перевязочного материала, альгинатной повязки, полиуретановой повязки, силиконовой повязки, коллагеновой повязки, синтетического полимерного каркаса, пропитанного пептидом шовного материала или сочетания указанного. В соответствии с другим вариантом осуществления повязка представляет собой окклюзионную повязку, выбранную из группы, состоящей из пленочной повязки, полупроницаемой пленочной повязки, гидрогелевой повязки, гидроколлоидной повязки и их сочетания. В соответствии с другим вариантом осуществления повязка дополнительно содержит заменитель кожи, заключенный в ней или находящийся на поверхности повязки с фармацевтически приемлемой композицией, и где заменитель кожи обеспечивает трехмерный внеклеточный каркас. В соответствии с другим вариантом осуществления заменитель кожи изготовлен из природного биологического материала, структурного биологического материала или синтетического материала. В соответствии с другим вариантом осуществления природный биологический материал включает трупную кожу человека, свиную трупную кожу или подслизистый слой тонкой кишки свиньи. В соответствии с другим вариантом осуществления природный биологический материал содержит матрицу. В соответствии с другим вариантом осуществления природный биологический материал по существу состоит из матрицы, которая в достаточной мере лишена клеточных остатков. В соответствии с другим вариантом осуществления структурный биологический материал включает коллаген, гликозаминогликан, фибронектин, гиалуроновую кислоту, эластин, или сочетания указанного. В соответствии с другим вариантом осуществления структурный биологический материал представляет собой двухслойную неячеистую матрицу регенерации кожи или однослойную ячеистую матрицу для регенерации кожи. В соответствии с другим вариантом осуществления синтетический заменитель кожи содержит гидрогель. В соответствии с другим вариантом осуществления синтетический заменитель кожи дополнительно содержит пептид RGD с аминокислотной последовательностью аргинин-глицин-аспартат.
В соответствии с другим вариантом осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, операционную рану, растяжение, или сочетания указанного. В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, послеоперационный рубец, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец выбран из группы, состоящей из гипертрофического рубца, келоидного рубца, атрофического рубца, рубцовой контрактуры, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом растяжения, расположенного в непосредственной близости от сустава, в том числе, коленного, локтевого, лучезапястного, плечевого, тазобедренного, остистого отростка, или сочетания указанного. В соответствии с другим вариантом осуществления патологический рубец является результатом царапины, рваной раны, разреза, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, аутоиммунного заболевания кожи, или сочетания указанного. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза, или сочетания указанного. В соответствии с другим вариантом осуществления повязка представляет собой механо-активную повязку, дополнительно содержащую дезинфицирующее средство, фактор роста, витамин, коагулянт, или сочетания указанного.
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство, выбранное из группы, состоящей из противовоспалительного средства, обезболивающего средства, дезинфицирующего средства, или сочетания указанного. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трифторуксусную кислоту), ботулиновый токсин типа A, или сочетания указанного. В соответствии с другим вариантом осуществления дополнительное терапевтическое средство выбрано из группы, состоящей из масла семян шиповника, витамина E, 5-фторурацила, блеомицина, экстракта лука, пентоксифиллина, пролил-4-гидроксилазы, верапамила, такролимуса, тамоксифена, третиноина, колхицина, траниласта, цинка, антибиотика, и их сочетание.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1); и представляет собой полипептид аминокислотной последовательности выбранной из группы, состоящей из YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), YARAAARQARAKALARQLAVA (SEQ ID NO: 5), YARAAARQARAKALARQLGVA (SEQ ID NO: 6), или HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид представляет собой полипептид аминокислотной последовательности YARAAARQARA (SEQ ID NO: 11), и второй полипептид включает терапевтический домен, последовательность которого имеет по меньшей мере 70 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2) и выбран из группы, состоящей из полипептида аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8), полипептида аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9), полипептида аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10). В соответствии с другим вариантом осуществления функциональный эквивалент полипептида YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид включает домен белковой трансдукции функционально эквивалентный YARAAARQARA (SEQ ID NO: 11) и представляет собой полипептид аминокислотной последовательности, выбранной из группы, состоящей из WLRRIKAWLRRIKA (SEQ ID NO: 12), WLRRIKA (SEQ ID NO: 13), YGRKKRRQRRR (SEQ ID NO: 14), WLRRIKAWLRRI (SEQ ID NO: 15), FAKLAARLYR (SEQ ID NO: 16), KAFAKLAARLYR (SEQ ID NO: 17), и HRRIKAWLKKI (SEQ ID NO: 18); и второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления фармацевтически приемлемый носитель представляет собой носитель с контролируемым высвобождением. В соответствии с другим вариантом осуществления фармацевтически приемлемый носитель включает частицы.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности по меньшей мере одной киназы выбранной из группы, состоящей из митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), рецептора факторов роста BDNF/NT-3 (TrkB), или сочетания указанного без существенного ингибирования нецелевого белка. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии по меньшей мере одного гена, с которым связано образование рубца или белка, с которым связано образование рубца в ране, выбранного из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD).
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для снижения либо уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране; либо количества по меньшей мере одной иммуномодулирующей клетки или клетки-предшественника, инфильтрирующей рану, либо и того, и другого. В соответствии с другим вариантом осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов, фиброцитов, или сочетания указанного. В соответствии с другим вариантом осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки, или сочетания указанного.
В соответствии с другим вариантом осуществления фармацевтическая композиция дополнительно содержит ингибитор MK2 с низкой молекулярной массой, где ингибитор MK2 с низкой молекулярной массой представляет собой аналог пирролопиридона или полициклический аналог лактама.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Патент или комплект материалов заявки содержит по меньшей мере один чертеж, выполненный в цвете. Копии этого патента или патентной заявки с цветным чертежом (чертежами) будут предоставлены Ведомством по запросу и при оплате необходимой пошлины.
На ФИГУРЕ 1 показана анатомия кожи.
На ФИГУРЕ 2 показаны слои эпидермиса.
На ФИГУРЕ 3 показан сигнальный каскад p38 MAPK-MK2.
На ФИГУРЕ 4 показана модель для анти-TNF-α последствий ингибирования MK2.
На ФИГУРЕ 5 показан общий вид репарации раны и фиброза.
На ФИГУРЕ 6 показано приблизительное сравнение внешнего вида рубца у мыши, обработанной PBS, и мыши, обработанной MMI-0100. Масштабная линейка = 2 мм.
На ФИГУРЕ 7 показано сравнение площади рубца между контрольными мышами и мышами, обработанными MMI-100 (SEQ ID NO: 1). Края рубца были идентифицированы, и площадь рубца количественно анализировали, используя программное обеспечение Image J. Площади рубца сравнивали, используя t-критерий Стъюдента; n = 5; *, P=0,011.
На ФИГУРЕ 8 показано гистологическое сравнение рубцов у мышей, обработанных MMI-0100 (SEQ ID NO: 1) с группой, обработанной PBS. Области рубцов очерчены и площади измерены с использованием программного обеспечения Image J. Масштабная линейка = 100 мкм.
На ФИГУРЕ 9 показано сравнение площади поперечного сечения рубцов, обработанных контролем (PBS) или MMI-0100 (SEQ ID NO: 1). n=5, *, P=0,015.
На ФИГУРЕ 10 показано сравнение количественной полимеразной цепной реакции с обратной транскриптазой (qОТ-ПЦР) транскриптов гена, связанного с образованием рубца группы, обработанной PBS (n=3) и группы, обработанной MMI-0100 (SEQ ID NO: 1) (n=4). *, P= 0,016.
На ФИГУРЕ 11 показано сравнение клеточной популяции в областях рубца группы, обработанной PBS (n=5) и группы, обработанной MMI-0100 (SEQ ID NO: 1) (n=4). *, P= 0,02.
На ФИГУРЕ 12 показано приблизительное сравнение внешнего вида рубца у мыши, обработанной PBS, и мыши, обработанной MMI-0300, на 4 день и на 14 день. Разметка масштабной линейки = 2,2 см.
На ФИГУРЕ 13 показано гистологическое сравнение рубцов у мышей, обработанных MMI-0300 (SEQ ID NO: 3), с группой, обработанной PBS. Области рубца очерчены, и площади измерены с использованием программного обеспечения Image J.
На ФИГУРЕ 14 показано сравнение количественной полимеразно-цепной реакции с обратной транскриптазой (qОТ-ПЦР) транскриптов гена, связанного с образованием рубцов, группы, обработанной PBS (n=3), и группы, обработанной MMI-0300 (n=6).
На ФИГУРЕ 15 показано сравнение клеточной популяции в области рубца у молодых и старых животных в группах, обработанных PBS и MMI-0100 (SEQ ID NO: 1).
На ФИГУРЕ 16 показан размер ран в процентах (проц.) размера ран у свиней, породы дюрок красной масти в 0 день для участков раны, обработанных MMI-100 (300 мкМ) (1й столбец), MMI-100 (30 мкМ) (2й столбец), и PBS контролем (3й столбец). Звездочка указывает статистическую значимость (p < 0,05).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Словарь терминов
Термин «царапины» в контексте настоящего изобретения относится к обдиранию или стиранию поверхности тела путем трения.
Термин «применение» в контексте настоящего изобретения означает введение или нанесение. Термин «введение» в контексте настоящего изобретения включает введение in vivo, а также введение непосредственно в ткань ex vivo. В основном введение может быть системным (т.е., воздействие на весь организм), например, пероральным, защечным, парентеральным (например, внутривенным, внутриартериальным, подкожным, внутрибрюшинным (т.е., в полость тела), и т.д.), местным, ингаляционным путем или путем вдувания (т.е. через ротовую полость или через нос), или ректально в составах дозированных единиц, содержащих обычно применяемые нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители, по желанию, или может быть локальным, например, посредством инъекции, имплантации, трансплантации, местного нанесения или парентерально, но не только.
В контексте настоящего изобретения термин «антитело» включает, в качестве примера, как природные, так и неприродные антитела. В частности, термин «антитело» включает поликлональные антитела и моноклональные антитела, и их фрагменты. Более того, термин «антитело» включает химерные антитела и полностью синтетические антитела и их фрагменты.
Антитела представляют собой сывороточные белки, молекулы которых имеют небольшие площади их поверхности, которые комплементарны небольшим химическим группам на их мишенях. Эти комплементарные области (называемые паратопами или антиген-связывающими сайтами) которых существует по меньшей мере две на молекулу антитела, и в некоторых типах молекул антитела десять, восемь или в некоторых видах 12, могут взаимодействовать с соответствующей им комплементарной областью на антигене (антигенной детерминантой или эпитопом) для связывания нескольких молекул поливалентного антигена вместе с образованием решетчатой структуры.
Основная структурная единица полноразмерной молекулы антитела состоит из четырех полипептидных цепей, двух идентичных легких (L) цепей (каждая содержит примерно 220 аминокислот) и двух идентичных тяжелых (H) цепей (каждая обычно содержит примерно 440 аминокислот). Две тяжелые цепи и две легкие цепи удерживаются вместе путем объединения нековалентных и ковалентных (дисульфидных) связей. Молекула состоит из двух идентичных половин, каждая с идентичным антигенсвязывающим сайтом, состоящим из N-концевой области легкой цепи и N-концевой области тяжелой цепи. Обе тяжелые и легкие цепи обычно объединяются с образованием антигенсвязывающей поверхности.
Антитела человека демонстрируют два типа легких цепей, κ и λ; отдельные молекулы иммуноглобулина в основном представляют собой только одну или другую. В нормальной сыворотке было обнаружено, что 60% молекул имеют κ детерминанты и 30 процентов λ. Было обнаружено, что многие другие виды демонстрируют два типа легких цепей, но их количественные соотношения варьируют. Например, у мыши и крысы λ цепи содержат только лишь незначительный процент совокупной величины; у собак и кошек κ цепей очень мало; у лошадей не встречается κ цепь; кролики могут иметь от 5 до 40% λ, в зависимости от вида и аллотипа локуса b; и легкие цепи цыплят являются более гомологичными λ, чем κ.
У млекопитающих существует пять класов антител, IgA, IgD, IgE, IgG и IgM, каждый со своим собственным классом тяжелой цепи - α (для IgA), δ (для IgD), ε (для IgE), γ (для IgG) и μ (для IgM). Кроме того, существует четыре подкласса иммуноглобулинов IgG (IgG1, IgG2, IgG3, IgG4), имеющих γ1, γ2, γ3 и γ4 тяжелые цепи соответственно. В секретируемой форме IgM представляет собой пентамер, состоящий из пяти четырех-цепочечных единиц, дающих в целом 10 антигенсвязывающих сайтов. Каждый пентамер содержит одну копию J цепи, которая ковалентно встроена между двумя смежными хвостовыми областями.
Все пять классов иммуноглобулинов отличаются от других сывороточных белков тем, что они демонстрируют широкий диапазон электрофоретической подвижности и не являются гомогенными. Эта гетерогенность - то, что отдельные молекулы IgG, например, отличаются одна от другой суммарным зарядом - является свойством, присущим иммуноглобулинам.
Принцип комплементарности, который зачастую сравнивают с соответствием ключа с замком, вовлекает относительно слабую прочность связи (гидрофобные и водородные связи, ван дер Ваальсовы силы и ионные взаимодействия), которые способны действовать эффективно только когда две взаимодействующие молекулы могут подойти очень близко друг к другу, и действительно, так близко, что выступающие атомы, входящие в состав молекулы или группы атомов одной молекулы могут встраиваться в комплементарные углубления или впадины в другой. Взаимодействия антиген-антитело демонстрируют высокую степень специфичности, которая проявляется на многих уровнях. Снижение до молекулярного уровня конкретно означает, что объединение участков антител с антигеном обладает комплементарностью вовсе не похожую на антигенные детерминанты неродственного антигена. В каждом случае, когда антигенные детерминанты двух различных антигенов имеют некоторое структурное сходство, может встречаться некоторая степень соответствия одной детерминанты в объединяющем участке нескольких антител с другими, и что этот феномен вызывает перекрестные реакции. Перекрестные реакции имеют важное значение в понимании комплементарности или специфичности реакций антиген-антитело. Иммунологическая специфичность или комплементарность делает возможным выявление малых количеств примесей/загрязнений среди антигенов.
Моноклональные антитела (mAb) могут быть получены путем слияния клеток селезенки мыши от иммунизированного донора с миеломной клеточной линией мышей с получением устойчивых гибридомных клонов мыши, которые растут на селективных средах. Гибридомная клетка представляет собой иммортализованную гибридную клетку, полученную в результате in vitro слияния антитело-секретирующей B клетки с миеломной клеткой. Иммунизация in vitro, которая относится к первичной активации антиген-специфичных В-клеток в культуре, представляет собой другой общепризнанный способ получения мышиных моноклональных антител.
Различные библиотеки вариабельных генов тяжелой (VH) и легкой (Vκ и Vλ) цепей из лимфоцитов периферической крови также могут быть амплифицированы путем амплификации в полимеразно-цепной реакции (PCR). Гены, кодирующие единичные полипептидные цепи, в которых вариабельные домены тяжелой и легкой цепи соединены посредством полипептидного спейсера (одноцепочечные Fv или scFv) могут быть получены путем случайного комбинирования V-генов тяжелой и легкой цепи, используя ПЦР. Комбинаторная библиотека затем может быть клонирована для дисплея на поверхности нитевидных бактериофагов путем слияния с минорным белком оболочки на верхушке фага.
Методика направленной селекции основана на шаффлинге V гене иммуноглобулина человека с V генами иммуноглобулина грызунов. Этот способ охватывает (i) шаффлинг репертуара легких цепей λ человека с доменом вариабельной области тяжелой цепи (VH) мышиного моноклонального антитела, взаимодействующего с антигеном, представляющим интерес; (ii) отбор Fab, которые наполовину являются Fab человека в отношении этого антигена (iii) использование отобранных генов легкой цепи λ в качестве «стыковочных доменов» для библиотеки тяжелых цепей человека во второй перетасовке для выделения клона Fab фрагментов, имеющих гены легкой цепи человека; (v) трансфекцию миеломных клеток мыши путем электропорации векторами экспрессии клеток млекопитающих, содержащих эти гены; и (vi) экспрессию V генов Fab, взаимодействующих с антигеном в виде полного IgG1, λ молекулы антитела в миеломе мыши.
Термин «антибиотик» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать бактерии и другие микроорганизмы, используемые, главным образом, при лечении инфекционных заболеваний. Примеры антибиотиков включают, но не ограничиваются, пенициллин G; метициллин; нафциллин; оксациллин; клоксациллин; диклоксациллин; ампициллин; амоксициллин; тикарциллин; карбенициллин; мезлоциллин; азлоциллин; пиперациллин; имипенем; азтреонам; цефалотин; цефаклор; цефокситин; цефуроксим; цефоницид; цефметазол; цефотетан; цефпрозил; лоракарбеф; цефетамет; цефоперазон; цефотаксим; цефтизоксим; цефтриаксон; цефтазидим; цефепим; цефиксим; цефподоксим; цефсулодин; флероксацина; налидиксовой кислоты; норфлоксацин; ципрофлоксацин; офлоксацин; эноксацин; ломефлоксацин; циноксацин; доксициклин; миноциклин; тетрациклин; амикацин; гентамицин; канамицин; нетилмицин; тобрамицина; стрептомoмицин; азитромицин кларитромицин; эритромицин; эритромицин эстолат; эритромицин этилсукцината; эритромицин глюкогептонат; эритромицин лактобионат; стеарат эритромицин; ванкомицин; тейкопланин; хлорамфеникол; клиндамицин; триметоприм; сульфаметоксазол; нитрофурантоин; рифампицин; мупироцин; метронидазол; цефалексин; рокситромицин; со-амоксиклавуанат; сочетания пиперациллина и тазобактама; и их различные соли, кислоты, основания и другие производные. Антибактериальные антибиотики включают, но не ограничиваются, пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, аминогликозиды, монобактамы, гликопептиды, хинолоны, тетрациклины, макролиды, фторхинолоны и фторхинолоны.
Термин «противогрибковое средство» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать грибки. Противогрибковые средства включают, но не только, амфотерицин B, кандицидин, дермостатин, филипин, фунгихромин, хачимицин, хамицин, лучензомицин, мепартрицин, натамицин, нистатин, пецилоцин, перимицин, азасерин, грисеофулвин, олигомицины, неомицин, пирролнитрин, сикканин, туберцидин, виридин, бутенафин, нафтифин, тербинафин, бифоназол, бутоконазол, хлордантоин, хлормидазол, клоканазол, клотримазол, эконазол, энилконазол, фентиконазол, флутримазол, изоконазол, кетоконазол, lanoconazole, миконазол, омоконазол, оксиконазола, сертаконазол, сулконазол, тиоконазол, толциклат, толиндат, толнафтат, флуконавл, итраконазол, саперконазола, терконазола, акрисорцин, аморолфин, бифенамин, бромсалицилхлоранилид, бклозамид, пропионат кальция, хлорфенезин, циклопирокс, клоксихин, капараффинат, диамтазол, эксаламид, флуцитозин, гелетазол, гексетидин, лофлукарбан, нифурател, йодид калия, пропионовую кислоту, пиритион, салициланилид, пропионат натрия, сулбентин, тенонитрозол, триацетин, юджотион, ундециленовую кислоту и пропионат цинка.
Термин «дезинфицирующее средство» в контексте настоящего изобретения относится к средству, которое обладает способностью ингибировать распространение инфекционного агента, такого как, инфекционный микроорганизм, например, бактерии, вируса, нематоды, паразита и так далее. Приводимые в качестве примера дезинфицирующие средства могут включать антибиотик, противогрибковое средство, противовирусное средство, противопротозойное средство и так далее.
Термин «противовоспалительное средство» в контексте настоящего изобретения относится к средству, которое уменьшает воспаление. Термин «стероидное противовоспалительное средство» в контексте настоящего изобретения относится к любому из многочисленных соединений, содержащих 17-углеродную 4-кольцевую систему и включает стеролы, различные гормоны (как анаболические стероиды) и гликозиды. Термин «нестероидное противовоспалительное средство» относится к большой группе средств, которые по действию подобны аспирину, в том числе, ибупрофен (Advil)®, напроксен натрия (Aleve)® и ацетаминофен (Tylenol)®.
Термин «антипротозойное средство» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать простейших, главным образом, используемых при лечении заболеваний, вызываемых простейшими. Примеры антипротозойных средств без ограничения включают пириметамин (Daraprim®) сульфадиазин и лейковорин.
Термин «противовирусное средство» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать репликацию или разрушать вирусы, используемых, главным образом, при лечении вирусных заболеваний. Противовирусные средства включают, но не ограничиваются, Ацикловир, Цидофовир, Цитарабин, дидезоксиаденозин, диданозина, эдоксудин, Фамцикловир, флоксуридин, ганцикловир, идоксуридин, изозин пранобекс, ламивудин, MADU, пенцикловир, соривудин, ставудин, трифлуридин, валацикловир, видарабин, заицитабин, зидовудин, ацеманнан, ацетиллейцин, амантадин, амидиномицин, делавирдин, фоскамет, индинавир, интерферон-α, интерферон-β, интерферон-γ, кетоксал, лизоцим, метисазон, мороксидин, невирапин, подофиллотоксин, рибавирин, римантадин, ритонавир2, сахинавир, стаилимицин, статолон, тромантадин, зидовудин (AZT) и ксеназойную кислоту.
Термин «атрофический рубец» в контексте настоящего изобретения относится к рубцу, который является плоским и опущен ниже окружающей кожи. Обычно они небольшие и зачастую окружены вдавленным или вогнутым центром. Образование атрофических рубцов может быть результатом хирургического вмешательства, травмы и таких распространенных заболеваний как обыкновенные угри и ветряная оспа (ветрянка).
Термин «аутоиммунное нарушение» в контексте настоящего изобретения относится к заболеванию, нарушениям или патологическим состояниям, при которых иммунная система организма, которая обычно борется с инфекциями и вирусами, извращена и поражает собственную нормальную здоровую ткань организма.
Термин «отрыв» в контексте настоящего изобретения относится к насильственному отрыву или отделению структуры тела или части, либо в результате повреждения, либо преднамеренной хирургической процедуры.
Термин «биоразлагаемый», в контексте настоящего изобретения относится к материалу, который будет активно разрушаться или пассивно на протяжении периода времени под действием простых химических процессов, под действием ферментов организма или под действием аналогичных биологически активных механизмов.
Термин «биомиметический» в контексте настоящего изобретения относится к материалам, веществам, устройствам, процессам или системам, которые имитируют или «подражают» природные материалы, производимые живыми организмами.
Термин «ожог» в контексте настоящего изобретения относится к повреждению тканей, вызванному контактом с нагреванием, пламенем, химическими веществами, электричеством или излучением. Ожоги первой степени демонстрируют покраснение; ожоги второй степени демонстрируют образование пузырей (пятно волдыря); ожоги третьей степени демонстрируют некроз (гибель клеток) по всей коже. Ожоги первой и второй степени являются поверхностными ожогами, ожоги третьей степени являются глубокими ожогами.
Термин «носитель» в контексте настоящего изобретения описывает вещество, которое не вызывает значительного раздражения в организме и не подавляет биологическую активность и свойства пептида композиции по настоящему изобретению. Носители должны быть достаточно высокой чистоты и достаточно низкой токсичности, чтобы сделать их пригодными для введения млекопитающему, подвергаемому лечению. Носитель может быть инертным, или может обладать фармацевтическими преимуществами. Термины «эксципиент», «носитель» или «наполнитель» используются взаимозаменяемо для обозначения веществ-носителей, подходящих для составления и введения фармацевтически приемлемых композиций, описанных в настоящей заявке. Носители и наполнители, используемые в настоящем изобретении, включают любые такие вещества, известные из уровня техники, которые являются нетоксичными и не взаимодействуют с другими компонентами.
Термин «коагулянт» в контексте настоящего изобретения относится к любому средству, которое способствует свертыванию крови. Приводимые в качестве примера коагулянты включают, но не ограничиваются, тромбин, протромбин, фибриноген, и так далее.
Термин «компонент» в контексте настоящего изобретения относится к составной части, элементу или ингредиенту.
Термин «патологическое состояние» в контексте настоящего изобретения относится к различным состояниям здоровья и включает нарушения или заболевания, вызванные любым лежащим в основе механизмом или нарушением, повреждением и активацией здоровых тканей и органов.
Термин «контакт» и все его грамматические формы в контексте настоящего изобретения относится к положению или состоянию прикосновения или непосредственной или локальной близости.
Термин «контролируемое высвобождение» в контексте настоящего изобретения относится к любому составу, содержащему лекарственное средство, в котором регулируется тип и профиль высвобождения лекарственного средства из состава. Это относится к составам немедленного высвобождения, а также к составам, в которых высвобождение не является немедленным, включающим, но не ограничивающимся, составы длительного высвобождения и составы замедленного высвобождения.
Термин «закрытая травма» в контексте настоящего изобретения относится к повреждению, при котором кожный покров не нарушен. Закрытая травма возникает, когда кровеносные сосуды повреждены или нарушены в результате удара по коже. Приподнятая область ушиба или гематомы является результатом утечки крови из этих поврежденных кровеносных сосудов в ткани, а также результатом ответа организма на повреждение.
Термин «раздавленная рана» в контексте настоящего изобретения относится к гематоме или закрытой травме в результате сдавления между двумя твердыми телами.
Термин «кожный рубец» в контексте настоящего изобретения относится к кожной фиброзной замещающей ткани, которая является результатом раны, которая заживала путем рассасывания, а не регенерации.
Термин «цитокин» в контексте настоящего изобретения относится к растворимым белковым веществам с низкой молекулярной массой, секретируемым клетками, которые оказывают целый ряд воздействий на другие клетки. Цитокины опосредуют многие важные физиологические функции, в том числе, рост, развитие, заживление ран и иммунный ответ. Они действуют путем связывания с их рецепторами, специфичными для клеток, расположенными на клеточной мембране, что позволяет им запускать различные каскады сигнальной трансдукции в клетке, которые в конечном счете приведут к биохимическим и фенотипическим изменениям в клетках-мишенях. В основном, цитокины действуют локально, но, чтобы использовать терминологию гормонов, могут оказывать аутокринные, паракринные или даже эндокринные воздействия. Они включают цитокины I типа, которые охватывают многие интерлейкины, а также некоторые гематопоэтические факторы роста; цитокины II типа, включающие интерфероны и интерлейкин-10; молекулы, родственные фактору некроза опухоли («TNF»), включающие TNF-α и лимфотоксин; представителей суперсемейства иммуноглобулинов, включая интерлейкин 1 («IL-1»); и хемокины, семейство молекул, которые играют важную роль в самых различных иммунологических и воспалительных функциях. Один и тот же цитокин может оказывать различные эффекты на клетку в зависимости от статуса клетки; воспалительные цитокины могут продуцироваться практически всеми ядерными клетками, например, эндо/эпителиальными клетками и макрофагами. Цитокины зачастую регулируют экспрессию и запускают каскады реакций других цитокинов.
Термин «замедленное высвобождение» в контексте настоящего изобретения в его обычном смысле относится к лекарственному составу, в котором существует время задержки между введением этого состава и высвобождением лекарственного средства из него. «Замедленное высвобождение» может включать или не включать постепенное высвобождение лекарственного средства на протяжении длительного периода времени, и, таким образом, может быть или может не быть «длительного высвобождения».
Термин «иммуномодулирующая клетка (клетки)» в контексте настоящего изобретения относится к клетке (клеткам), которые обладают способностью усиливать или ослаблять иммунные ответы путем экспрессии хемокинов, цитокинов и других медиаторов иммунных реакций.
Термин «воспалительные цитокины» или «медиаторы воспаления» в контексте настоящего изобретения относится к молекулярным медиаторам воспалительного процесса, которые могут модулировать, являясь либо про-, либо противовоспалительными по своему действию. Эти растворимые, способные к диффузии молекулы, действуют как местно, в участке повреждения ткани и инфекции, так и более отдаленных участках. Некоторые медиаторы воспаления активируются воспалительным процессом, тогда как другие синтезируются и/или высвобождаются из клеточных источников в ответ на острое воспаление или другими растворимыми медиаторами воспаления. Примеры медиаторов воспаления воспалительной реакции включают, но не ограничиваются, протеазы плазмы, комплемент, кинины, белки свертывания крови и фибринолитические белки, липидные медиаторы, простагландины, лейкотриены, фактор активации тромбоцитов (PAF), пептиды и амины, в том числе, но не только, гистамин, серотонин и нейропептиды, про-воспалительные цитокины, в том числе, но не только, интерлейкин-1-бета (IL-1β), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли-альфа (TNF-α), интерферон-гамма (IF-γ), и интерлейкин-12 (IL-12).
Среди про-воспалительных медиаторов известно, что IL-1, IL-6 и TNF-α активируют гепатоциты в острой фазе ответа на синтез белков острой фазы, которые активируют комплемент. Комплемент представляет собой систему белков плазмы, которые взаимодействуют с патогенами, чтобы обозначить их для деструкции фагоцитами. Белки комплемента могут быть активированы непосредственно патогенами или опосредовано патоген-связанным антителом, приводя к каскаду реакций, которые происходят на поверхности патогенов и образуют активные компоненты с различными эффекторными функциями. IL-1, IL-6 и TNF-α также активируют эндотелий костного мозга для мобилизации нейтрофилов, и действуют в качестве эндогенных пирогенов, повышая температуру тела, что помогает выведению инфекций из организма. Основным эффектом цитокинов является действие на гипоталамус, изменяя регуляцию температуры тела, и на мышечные и жировые клетки, стимулируя катаболизм мышечных и жировых клеток для подъема температуры тела. При повышенных температурах уменьшается репликация бактерий и вирусов, хотя адаптивная иммунная система действует более эффективно.
Термин «интерлейкин (IL)» в контексте настоящего изобретения относится к цитокину, секретируемому лейкоцитами и действующему на лейкоциты. Интерлейкины регулируют рост клеток, дифференцировку и подвижность и стимулируют иммунные ответы, такие как воспаление. Примеры интерлейкинов включают интерлейкин-1 (IL-1), интерлейкин-1β (IL-1β), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), и интерлейкин-12 (IL-12).
Термин «фактор некроза опухоли» или «TNF» в контексте настоящего изобретения относится к цитокину, вырабатываемому белыми клетками крови в ответ на антиген или инфекцию, который индуцирует некроз (гибель) опухолевых клеток и имеет широкий диапазон про-воспалительных действий. Фактор некроза опухоли также является многофункциональным цитокином с воздействиями на метаболизм липидов, коагуляцию, резистентность к инсулину и функцию эндотелиальных клеток, выстилающих кровеносные сосуды.
Термин «замедленное высвобождение» в контексте настоящего изобретения в его обычном смысле относится к составу, в котором существует время задержки между введением этого состава и высвобождением лекарственного средства из него. «Замедленное высвобождение» может включать или не включать постепенное высвобождение лекарственного средства на протяжении длительного периода времени, и, таким образом, может быть или может не быть «длительного высвобождения».
Термин «заболевание» или «нарушение», в контексте настоящего изобретения относится к расстройству здоровья или состоянию патологического функционирования.
Термины «доза» и «дозировка» используются взаимозаменяемо для обозначения количества лекарственного средства или другого лечебного средства, применяемого или наносимого полностью за один раз или в долевых количествах в заданный период времени.
Термин «лекарственное средство» в контексте настоящего изобретения относится к терапевтическому средству или любому веществу, отличному от продукта питания, используемого в профилактике, диагностике, облегчении состояния, лечебном воздействии или лечении заболевания.
Термин «эффективное количество» относится к количеству, необходимому или достаточному для реализации желаемого биологического эффекта.
Термин «хирургическая рана» в контексте настоящего изобретения относится к ране в результате хирургического иссечения или удаления ткани. Термин «хирургическая рана» включает, но не ограничивается, разрывы, царапины, порезы, колотые раны, или рваные раны в эпителиальном слое кожи, которые могут распространяться на дермальный слой и даже на подкожную жировую клетчатку и за ее пределы.
Термин «внеклеточный матрикс» в контексте настоящего изобретения относится к веществу, производному ткани, или биосинтезированному веществу, которое обладает способностью поддерживать рост клеток или культуры клеток.
Термин «отложение внеклеточного матрикса» в контексте настоящего изобретения относится к секреции клетками фиброзных элементов (например, коллагена, эластина и ретикулина), белков выстилки (например, фибронектина, ламинина) и молекул, заполняющих пространство (например, гликозаминогликанов).
Термин «состав» в контексте настоящего изобретения относится к смеси, полученной в соответствии с формулой, рецептом или методикой.
Термин «функциональный эквивалент» в контексте настоящего изобретения относится к пептиду, имеющему аналогичные или идентичные эффекты или применение. Например, функциональные эквиваленты полипептида MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) по настоящему изобретению обладают активностями ингибирования киназы или кинетическими параметрами, которые аналогичны или идентичны таковым полипептида MMI-0100 (SEQ ID NO: 1) in vitro, ex vivo или in vivo. Подобным образом «функциональный эквивалент» пептида YARAAARQARA (SEQ ID NO: 11) обладает способностью пенетрировать плазматическую мембрану клеток млекопитающих, и переносить соединения многих типов через мембрану, которая аналогична или идентична таковой пептида YARAAARQARA (SEQ ID NO: 11).
Термин «носитель для доставки гена» в контексте настоящего изобретения относится к компоненту, который облегчает доставку в клетку кодирующей последовательности для экспрессии полипептида в клетке. Носителем для доставки гена может быть любой компонент или носитель, способный выполнять доставку гена или кДНК в клетку, например, липосома, вирусная частица или вектор экспрессии.
Термин «грануляция» в контексте настоящего изобретения относится к процессу, посредством которого небольшие красные выступы наподобие зерна образуются на обнаруженной поверхности в процессе заживления.
Термин «гранулематозное воспаление» в контексте настоящего изобретения относится к воспалительной реакции, характеризующейся преобладанием нормальных макрофагов относительно эпителиоидных макрофагов с многоядерными гигантскими клетками или без них и соединительной тканью.
Термин «гидрофильный» в контексте настоящего изобретения относится к материалу или веществу, имеющему аффинность к полярным веществам, таким как вода. Термин «липофильный» в контексте настоящего изобретения относится к предпочтению или обладанию аффинностью к неполярному окружению по сравнению с полярным или водным окружением.
Термин «рана высокого натяжения» в контексте настоящего изобретения относится к ране, возникающей в областях суставов или близко к суставам, в том числе, области локтя или колена, или рядом с ними. Другие области «ран высокого натяжения» включают раны средней части грудины и раны после кесарева сечения.
Термин «гипертрофический рубец» в контексте настоящего изобретения относится к состоянию кожи, характеризующемуся формированием чрезмерной приподнятой рубцовой ткани, но не растущей за пределы границы первоначальной раны.
Термин «значение IC50» в контексте настоящего изобретения относится к концентрации ингибитора, которая необходима для ингибирования 50% заданного биологического процесса или компонента процесса (т.е. фермента, клетки или клеточного рецептора).
Термин «в непосредственной близости» в контексте настоящего изобретения относится к очень близкому расстоянию.
Термин «операционная рана» в контексте настоящего изобретения относится к ране, нанесенной чистым разрезом, как острым инструментом.
Термин «воспаление» в контексте настоящего изобретения относится к физиологическому процессу, посредством которого васкуляризированные ткани отвечают на повреждение. Смотри, например, FUNDAMENTAL IMMUNOLOGY, 4th Ed., William E. Paul, ed. Lippincott-Raven Publishers, Philadelphia (1999) на 1051-1053, включено в настоящее описание посредством ссылки. Во время процесса воспаления растворимые медиаторы воспаления воспалительной реакции работают вместе с клеточными компонентами системным образом в попытке сдержать и устранить агенты, вызывающие физическое недомогание. Термин «медиаторы воспаления» в контексте настоящего изобретения относится к молекулярным медиаторам воспалительного процесса. Эти растворимые, способные к диффузии молекулы, действуют как местно, в участке повреждения ткани и инфекции, так и более отдаленных участках. Некоторые медиаторы воспаления активируются воспалительным процессом, тогда как другие синтезируются и/или высвобождаются из клеточных источников в ответ на острое воспаление или другими растворимыми медиаторами воспаления. Примеры медиаторов воспаления воспалительного процесса включают, но не ограничиваются, протеазы плазмы, комплемент, кинины, белки свертывания крови и фибринолитические белки, липидные медиаторы, простагландины, лейкотриены, фактор активации тромбоцитов (PAF), пептиды и амины, в том числе, но не только, гистамин, серотонин и нейропептиды, про-воспалительные цитокины, в том числе, но не только, интерлейкин-1, интерлейкин-4, интерлейкин-6, интерлейкин-8, фактор некроза опухоли (TNF), интерферон-гамма, и интерлейкин 12.
Термины «ингибирующие», «ингибируют» или «ингибирование» в контексте настоящего изобретения относятся к уменьшению количества или скорости процесса, к полной остановке процесса или к уменьшению, ограничению или блокировке действия или функции указанного. Ингибирование может включать уменьшение или снижение количества, скорости, функции действия или процесса вещества по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%. Термины «дополнительно ингибирующие», «дополнительно ингибируют» или «дополнительное ингибирование» в контексте настоящего изобретения относится к уменьшению количества или скорости второго процесса, остановке второго процесса полностью или к снижению, ограничению или блокировке его действия или функции в дополнение к уменьшению количества или скорости первого процесса, остановке первого процесса полностью или к снижению, ограничению или блокировке действия или функции указанного. Термин «профиль ингибирования» в контексте настоящего изобретения относится к характерному профилю уменьшения количества или скорости снижения, блокировки или ограничения действия более чем одного белка или фермента. Термины «по существу ингибирующие», «по существу ингибируют», «по существу ингибированы» или «существенное ингибирование» в контексте настоящего изобретения относятся к ингибированию киназной активности по меньшей мере на 65%.
Термин «ингибитор» в контексте настоящего изобретения относится ко второй молекуле, которая связывается с первой молекулой, тем самым снижая активность первой молекулы. Ингибиторами ферментов являются молекулы, которые связываются с ферментами, тем самым снижая ферментную активность. Связывание ингибитора может остановить вхождение субстрата в активный сайт фермента и/или помешать ферменту катализированию его реакции. Связывание ингибитора является либо обратимым, либо необратимым. Необратимые ингибиторы обычно взаимодействуют с ферментом и изменяют его химически, например, путем модификации ключевых аминокислотных остатков, необходимых для ферментативной активности. В отличие от этого, обратимые ингибиторы связываются нековалентно и осуществляют различные типы ингибирования в зависимости от того, связываются ли ингибиторы с ферментом, фермент-субстратным комплексом, или и тем, и другим. Ингибиторы ферментов часто оценивают по их специфичности и эффективности.
Термин «инъекция», в контексте настоящего изобретения относится к введению в подкожную ткань, мышечную ткань, вену, артерию или другие каналы или полости тела с применением силы.
Термин «повреждение» в контексте настоящего изобретения относится к поражению или негативному воздействию на структуру или функцию организма, вызванному внешним агентом или силой, которые могут быть физическими или химическими.
Термин «выделенный» в контексте настоящего изобретения относится к веществу, такому как, но не только, нуклеиновая кислота, пептид, полипептид или белок, которое: (1) по существу или главным образом свободно от компонентов, которые обычно сопровождают или взаимодействуют с ним, находящиеся в его природном окружении. Термины «по существу свободный» или «главным образом свободный» в контексте настоящего изобретения относятся к значительно или существенно свободному, или примерно более чем на 95% свободному или примерно более чем на 99% свободному. Выделенное вещество необязательно включает вещество, не находящееся с этим веществом в его природном окружении; или (2) если вещество находится в его природном окружении, это вещество было синтетическим путем (не природным) изменено преднамеренным вмешательством человека в состав и/или помещено в клетку в такой локализации (например, геном или внутриклеточные органеллы), которая не является природной для вещества, находящегося в этом окружении. Изменение для получения в результате синтетического вещества может быть выполнено у вещества в его естественном состоянии или удаленного из его естественного состояния.
Термин «келоид» или «келоидный рубец» в контексте настоящего изобретения относится к доброкачественной фиброзной пролиферации в дерме, которая возникает после травмы кожи. Келоидные рубцы поднимаются над поверхностью кожи и выходят за границы первичной раны.
Термин «киназа» в контексте настоящего изобретения относится к ферменту, который катализирует фосфорилирование субстрата под действием аденозинтрифосфата (АТФ).
Термин «рваная рана» в контексте настоящего изобретения относится к разорванной ране и рваной ране или случайной резанной ране.
Термин «продолжительное» высвобождение в контексте настоящего изобретения означает, что имплант сконструирован и расположен для доставки терапевтических уровней активного ингредиента по меньшей мере в течение примерно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 29, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 48, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 дней.
Термин «проявление» в контексте настоящего изобретения относится к демонстрации или выявлению характерных признаков или симптомов болезни. Таким образом, термин «кожное проявление» в контексте настоящего изобретения относится к демонстрации или выявлению характерных признаков или симптомов заболевания на коже.
Термин «механо-активная повязка» в контексте настоящего изобретения относится к медицинскому или хирургическому покрытию для раны, которое выполнено съемно прикрепляемым к поверхности кожи рядом с раной для стягивания раны.
Термин «модулируют» в контексте настоящего изобретения означает: регулируют, изменяют, адаптируют или приспосабливают к определенному критерию или количественному соотношению.
Термин «неоваскуляризация» в контексте настоящего изобретения относится к росту новых кровеносных сосудов в результате чего улучшается подача кислорода и питательных веществ. Аналогичным образом термин «ангиогенез» относится к процессу васкуляризации, включающему развитие новых капиллярных кровеносных сосудов.
Термин «нуклеиновая кислота» в контексте настоящего изобретения относится к дезоксирибонуклеотидному или рибонуклеотидному полимеру либо в односпиральной, либо в двухспиральной форме, и если не ограничено иным образом, охватывает известные аналоги, имеющие сущность природных нуклеотидов в том, что они гибридизируются с одноцепочечными нуклеиновыми кислотами сходным образом с природными нуклеотидами (например, пептидные нуклеиновые кислоты).
Термин «нуклеотид» в контексте настоящего изобретения относится к химическому соединению, которое состоит из гетероциклического основания, сахара и одной или более фосфатных групп. В самых распространенных нуклеотидах основание является производным пурина или пиримидина, а сахар представляет собой пентозу дезоксирибозу или рибозу. Нуклеотиды являются мономерами нуклеиновых кислот, связывая вместе три или более для образования нуклеиновой кислоты. Нуклеотиды являются структурными единицами РНК, ДНК и некоторых кофакторов, в том числе, но не только, CoA, FAD, DMN, NAD и NADP. Пурины включают аденин (A) и гуанин (G); пиримидины включают цитозин (C), тимин (T) и урацил (U).
Термин «нецелевой белок» в контексте настоящего изобретения относится к белку, на который может воздействовать фармацевтическая композиция, но действие которого не является первичным терапевтическим эффектом этой композиции.
Термин «функционально связанный» в контексте настоящего изобретения относится к связи, в которой два или более белковых домена или пептида лигированы или объединены с помощью технологии рекомбинантных ДНК или химической реакции, таким образом, что каждый белковый домен или полипептид полученного в результате слитого пептида сохраняет свою первоначальную функцию. Например, SEQ ID NO: 1 сконструирована путем функционального связывания домена белковой трансдукции (SEQ ID NO: 26) с терапевтическим доменом (SEQ ID NO: 2), тем самым образуя слитый пептид, который обладает как функцией пенетрации клетки последовательности SEQ ID NO: 26 и функцией последовательности SEQ ID NO: 2 ингибировать киназу MK2.
Термин «парентеральное» в контексте настоящего изобретения относится к введению в организм путем инъекции (т.е., введению посредством инъекции) вне желудочно-кишечного тракта, в том числе, например, подкожно (т.е., инъекция под кожу), внутримышечно (т.е., инъекция в мышцу); внутривенно (т.е., инъекция в вену) или инфузионными способами. Парентерально вводимая композиция доставляется с использованием иглы, например, хирургической иглы. Термин «хирургическая игла» в контексте настоящего изобретения относится к любой игле, приспособленной для введения жидких (т.е., обладающих способностью течь) композиций в выбранную анатомическую структуру. Инъекционные препараты, такие как стерильные инъецируемые водные или масляные суспензии, могут быть получены в соответствии с известным способом, с использованием подходящих диспергирующих или увлажняющих средств и суспендирующих агентов.
Термины «частицы» в контексте настоящего изобретения относятся к чрезвычайно малым компонентам, например, фемочастицы (10-15 м), пикочастицы (10-12), наночастицы (10-9 м), микрочастицы (10-6 м), милличастицы (10-3 м)), которые могут содержаться во всем или в части ингибитора MK2, как описано в настоящем изобретении.
Следующие термины в контексте настоящего изобретения описывают взаимосвязь последовательностей между двумя или более нуклеиновыми кислотами или полинуклеотидами: (a) «эталонная последовательность», (b) «окно сравнения», (c) «идентичность последовательностей», (d) «процент идентичности последовательностей» и (e) «существенная идентичность».
(a) Термин «эталонная последовательность» относится к последовательности, используемой в качестве основы для сравнения последовательностей. Эталонная последовательность может представлять собой подгруппу определенной последовательности или всю определенную последовательность; например, в виде сегмента полноразмерной кДНК или генной последовательности, или всей последовательности кДНК или генной последовательности.
(b) Термин «окно сравнения» относится к непрерывному и определенному сегменту полинуклеотидной последовательности, где полинуклеотидная последовательность может сравниваться с эталонной последовательностью и где часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е., разрывы) по сравнению с эталонной последовательностью (которая не содержит добавления или делеции) для оптимального выравнивания двух последовательностей. В основном, окно сравнения в длину составляет по меньшей мере 20 смежных нуклеотидов, и, необязательно, может составлять по меньшей мере 30 смежных нуклеотидов в длину, по меньшей мере 40 смежных нуклеотидов в длину, по меньшей мере 50 смежных нуклеотидов в длину, по меньшей мере 100 смежных нуклеотидов в длину или длинее. Специалистам в данной области понятно, что во избежание высокого сходства с эталонной последовательностью вследствие включения разрывов в полинуклеотидную последовательность, обычно вводят штраф за разрыв и вычитают из количества совпадений.
Способы выравнивания последовательностей для сравнения хорошо известны из уровня техники. Оптимальное выравнивание последовательностей для сравнения можно провести с помощью алгоритма локальной гомологии Smith и Waterman, Adv. Appl. Math. 2:482 (1981); алгоритма гомологичного выравнивания Needleman и Wunsch, J. Mol. Biol. 48:443 (1970); поиском метода подобия Pearson и Lipman, Proc. Natl. Acad. Sci. 85:2444 (1988); с помощью компьютерных реализаций этих алгоритмов, в том числе, но не только: CLUSTAL in the PC/Gene program by Intelligenetics, Mountain View, Calif.; GAP, BESTFIT, BLAST, FASTA, and TFASTA in the Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 575 Science Dr., Madison, Wis., USA; программа CLUSTAL хорошо описана Higgins и Sharp, Gene 73:237-244 (1988); Higgins and Sharp, CABIOS 5:151-153 (1989); Corpet, et al., Nucleic Acids Research 16:10881-90 (1988); Huang, et al., Computer Applications in the Biosciences 8:155-65 (1992), и Pearson, et al., Methods in Molecular Biology 24:307-331 (1994). Семейство программ BLAST, которые могут быть использованы для поисков баз данных подобия, включает: BLASTN для нуклеотидных запрашиваемых последовательностей по базе данных нуклеотидных последовательностей; BLASTX для нуклеотидных запрашиваемых последовательностей по базе данных белковых последовательностей; BLASTP для белковых запрашиваемых последовательностей по базе данных белковых последовательностей; TBLASTN для белковых запрашиваемых последовательностей по базе данных нуклеотидных последовательностей; и TBLASTX для нуклеотидных запрашиваемых последовательностей по базе данных нуклеотидных последовательностей. Смотри, Current Protocols in Molecular Biology, Chapter 19, Ausubel, et al., Eds., Greene Publishing and Wiley-Interscience, New York (1995).
Если не указано иное, значения идентичности/сходства последовательностей, представленные в настоящем описании, относятся к значению, полученному с использованием пакета программ BLAST 2.0, используя параметры по умолчанию. Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997). Программное обеспечение для проведения анализов BLAST является общедоступным, например, через Национальный центр биотехнологической информации. Этот алгоритм включает сначала установление пар последовательностей с высоким баллом (HSP) путем идентификации коротких слов длины W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительно оцененному пороговому баллу T при выравнивании со словом той же длины в последовательности из базы данных. T называют порогом оценки соседнего слова (Altschul et al., supra). Эти начальные попадания соседних слов действуют в качестве затравок для начала поиска для нахождения более длинных HSP, содержащих их. Попадания слов затем распространяют в обоих направлениях вдоль каждой последовательности по мере того, как совокупный балл выравнивания может быть увеличен. Совокупные баллы вычисляют, используя для нуклеотидных последовательностей параметры M (премиальный балл за пару совпадающих остатков; всегда>0) и N (штрафной балл за несовпадающие остатки; всегда<0). Для аминокислотных последовательностей используют матрицу замен для вычисления совокупного балла. Распространение попаданий слов в каждом направлении останавливают, когда: совокупный балл выравнивания падает на величину X от его максимально достигаемого значения; совокупный балл стремится к нулю или ниже вследствие накопления одного или более выравниваний остатков с отрицательными баллами; или достигается конец одной из последовательностей. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) в качестве параметров по умолчанию используется длина слова (W) 11, ожидание (E) 10, пороговое значение 100, M=5, N=-4, и сравнение обеих цепей. Для аминокислотных последовательностей в программе BLASTP в качестве параметров по умолчанию используют длину слова (W) 3, ожидание (E) 10, и матрицу замен BLOSUM62 (смотри Henikoff & Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915).
Помимо вычисления процента идентичности последовательностей алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями (смотри, например, Karlin & Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787 (1993)). Одно определение сходства, предоставляемое алгоритмом BLAST, представляет собой наименьшую суммарную вероятность (P(N)), которая обеспечивает показатель вероятности, в соответствии с которым совпадение между двумя нуклеотидными или аминокислотными последовательностями произошло бы случайно. BLAST поиски исходят из того, что белки могут быть смоделированы в виде случайных последовательностей. Однако, многие реальные белки содержат области неслучайных последовательностей, которые могут представлять собой гомополимерные участки, повторы с коротким интервалом, или области, богатые одной или более аминокислотами. Такие области низкой сложности могут быть выровнены между неродственными белками, даже если другие участки белка полностью отличаются. Целый ряд программ-фильтров может быть использован для уменьшения таких выравниваний низкой сложности. Например, SEG (Wooten and Federhen, Comput. Chem., 17:149-163 (1993)) и XNU (Claverie and States, Comput. Chem., 17:191-201 (1993)) фильтры низкой сложности могут быть использованы отдельно или в сочетании.
(c) Термин «идентичность последовательностей» или «идентичность» в отношении двух последовательностей нуклеиновых кислот или полипептидных последовательностей в контексте настоящего изобретения относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия в определенном окне сравнения. В тех случаях, когда процент идентичности последовательностей используется в отношении белков, признается, что положения остатков, которые не являются идентичными, зачастую отличаются консервативными аминокислотными заменами, т..е, где аминокислотные остатки заменены другими аминокислотными остатками со сходными химическими свойствами. (например, заряд или гидрофобность) и, следовательно, не меняют функциональные свойства молекулы. Где последовательности отличаются консервативными заменами, процент идентичности последовательностей может быть увеличен для внесения поправки на консервативную природу замены. Говорят, что последовательности, которые отличаются такими консервативными заменами имеют «сходство последовательностей» или «сходство». Средства для такой корректировки хорошо известны специалистам в данной области. Обычно это включает оценку в баллах консервативной замены как частичное, а не полное несоответствие, тем самым, увеличивая процент идентичности последовательностей. Таким образом, например, идентичной аминокислоте присваивают балл 1, а неконсервативной замене присваивают балл ноль, консервативной замене присваивают балл между нулем и 1. Вычисляют оценку в баллах консервативных замен, например, в соответствии с алгоритмом Meyers и Miller, Computer Applic. Biol. Sci., 4:11-17 (1988) например, как это реализовано в программе PC/GENE (Intelligenetics, Mountain View, Calif., USA).
(d) Термин «процент идентичности последовательностей» в контексте настоящего изобретения означает величину, определяемую путем сравнения двух оптимально выровненных последовательностей в окне сравнения, где часть полипептидной последовательности в окне сравнения может содержать добавления или делеции (т.е., разрывы) по сравнению с эталонной последовательностью (которая не содержит добавления или делеции) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения числа положений, в которых встречается идентичное основание нуклеиновой кислоты или аминокислотный остаток в обеих последовательностях с получением в результате числа совпавших положений, деления числа совпавших положений на общее число положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
(e) Термин «существенная идентичность» полинуклеотидных последовательностей означает, что полинуклеотид включает последовательность, которая имеет по меньшей мере 70% идентичность последовательности, по меньшей мере 80% идентичность последовательности, по меньшей мере 90% идентичность последовательности и по меньшей мере 95% идентичность последовательности, по сравнению с эталонной последовательностью, используя одну из программ выравнивания, описанных с использованием стандартных параметров. Специалисту в данной области будет понятно, что эти значения могут быть должным образом скорректированы для определения соответствующей идентичности белков, кодируемых двумя нуклеотидными последовательностями, принимая во внимание вырожденность кодонов, сходство аминокислот, расположение рамки считывания и подобное. Существенная идентичность аминокислотных последовательностей для этих целей обычно означает идентичность последовательности по меньшей мере 60%, или по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. Другим указанием, что нуклеотидные последовательности по существу идентичны, является то, что две молекулы гибридизируются друг с другом в жестких условиях. Однако, нуклеиновые кислоты, которые не гибридизируются друг с другом в жестких условиях, остаются по существу идентичными, если полипептиды, которые они кодируют, являются по существу идентичными. Это может встречаться, например, когда копию нуклеиновой кислоты создают с использованием максимальной вырожденности кодона, позволяемой генетическим кодом. Одним указанием на то, что две последовательности нуклеиновой кислоты являются по существу идентичными, является то, что полипептид, который кодирует первая нуклеиновая кислота, иммунологически перекрестно реагирует с полипептидом, кодируемым второй нуклеиновой кислотой.
Термин «патологический рубец» в контексте настоящего изобретения относится к рубцу, возникающему в результате заболевания, нарушения, патологического состояния или повреждения.
Термин «фармацевтически приемлемый носитель» в контексте настоящего изобретения относится к одному или нескольким совместимым твердым или жидким наполнителям, разбавителям или инкапсулирующим веществам, которые подходят для введения человеку или другому позвоночному животному. Компоненты фармацевтической композиции также способны смешиваться таким образом, что отсутствует взаимодействие, которое бы значительно снижало желаемую фармацевтическую эффективность.
Термин «фармацевтически приемлемая соль» означает те соли, которые в рамках медицинской точки зрения подходят для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и подобного, и сопоставимы с разумным соотношением польза/риск.
Термин «фармацевтическая композиция» в контексте настоящего изобретения относится к композиции, которая используется для профилактики, снижения степени выраженности, лечения или иного лечебного воздействия на целевое патологическое состояние или заболевание.
Термин «профилактика» в контексте настоящего изобретения относится к предотвращению, препятствованию или избежанию случая, появления или возникновения события, процесса или действия.
Термин «пролекарство» в контексте настоящего изобретения означает пептид или производное, которое находится в неактивной форме и которое превращается в активную форму путем биологического превращения после введения пациенту.
Термин «колотая рана» в контексте настоящего изобретения относится к ране, в которой отверстие относительно небольшое по сравнению с глубиной, нанесенной узким острым предметом.
Термин «рекомбинантный» в контексте настоящего изобретения относится к веществу, полученному с помощью генной инженерии.
Термин «сниженный» или «снижать» в контексте настоящего изобретения относится к уменьшению, понижению, ослаблению или устранению степени, интенсивности, выраженности, размера, количества, плотности или числа.
Термин «реэпителиализация» в контексте настоящего изобретения относится к восстановлению эпителия над оголенной поверхностью (например, раной).
Термин «высвобождение» и его различные грамматические формы относится к растворению активного лекарственного компонента и диффузии растворенных или солюбилизированных видов путем объединения следующих процессов: (1) гидратации матрикса, (2) диффузии раствора в матрикс; (3) растворения лекарственного средства; и (4) диффузии растворенного лекарственного средства из матрикса.
Термин «сниженный» или «снижение» в контексте настоящего изобретения относится к уменьшению, понижению, ослаблению, ограничению или устранению степени, интенсивности, выраженности, размера, количества, плотности числа или появления нарушения у индивидуумов с риском развития этого нарушения.
Термин «ремоделирование» в контексте настоящего изобретения относится к замене и/или деваскуляризации грануляционной ткани.
Термин «каркас» в контексте настоящего изобретения относится к веществу или структуре, используемым для усиления или стимуляции роста клеток и/или образования ткани. Каркас обычно представляет собой трехмерную пористую структуру, которая обеспечивает матрицу для роста клеток.
Термин «рубец» в контексте настоящего изобретения относится к фиброзной ткани, замещающей нормальную ткань, разрушенную повреждением или заболеванием. Термин «рубцевание» в контексте настоящего изобретения относится к состоянию, когда фиброзная ткань замещает нормальную ткань, разрушенную повреждением или заболеванием. Термин «область рубца» в контексте настоящего изобретения относится к участку нормальной ткани, которая разрушена повреждением или заболеванием и замещена фиброзной тканью.
Термин «рубцовая контрактура» или «контрактурный рубец» в контексте настоящего изобретения относится к необратимому натяжению кожи, которое может влиять на подлежащие мышцы и сухожилия, что ограничивает подвижность и возможное повреждение или дегенерацию нервов. Контрактуры развиваются, когда нормальные эластичные соединительные ткани замещаются неэластичной фиброзной тканью, что делает ткани резистентными к растяжению и препятствует нормальному движению пораженной области.
Термин «ген, связанный с образованием рубцов» в контексте настоящего изобретения относится к участку ДНК, кодирующему белок, который активируется в ответ на рубцевание как часть нормального процесса заживления ран. Термин «продукт гена, связанного с образованием рубцов» в контексте настоящего изобретения относится к белку, который экспрессируется в ответ на рубцевание как часть нормального процесса заживления ран.
Термин «сходный» используется взаимозаменяемо с терминами аналогичный, сопоставимый или похожий, означая наличие общих свойств или характеристик.
Термины «субъект» или «индивидуум» или «пациент» используются взаимозаменяемо и относятся к представителю видов млекопитающих животных, в том числе, но не только, мыши, крысе, кошке, козе, овце, лошади, хомяку, хорьку, утконосу, свинье, собаке, морской свинке, кролику и примату, такому как, например, обезьяна, человекообразная обезьяна или человек.
Выражение «пациент, нуждающийся в таком лечении» в контексте настоящего изобретения относится к пациенту, который пострадал или пострадает от раны, результатом которой может быть кожный рубец, если контекст и использование этого выражения не указывают иное.
Термин «по существу чистый» в контексте настоящего изобретения относится к терапевтическому средству, которое было по существу отделено от веществ с которыми это средство могло быть связано в живых системах или во время синтеза. В соответствии с несколькими вариантами осуществления по существу чистое терапевтическое средство составляет по меньшей мере 70% чистоты, по меньшей мере 75% чистоты, по меньшей мере 80% чистоты, по меньшей мере 85% чистоты, по меньшей мере 90% чистоты, по меньшей мере 95% чистоты, по меньшей мере 96% чистоты, по меньшей мере 97% чистоты, по меньшей мере 98% чистоты, или по меньшей мере 99% чистоты.
Термин «предрасположенный» в контексте настоящего изобретения относится к представителю группы риска.
Термин «длительное высвобождение» (также называемый «пролонгированным высвобождением») в контексте настоящего изобретения в его обычном смысле относится к лекарственному составу, который обеспечивает постепенное высвобождение терапевтического средства на протяжении длительного периода времени, и который предпочтительно, хотя не обязательно, в результате приводит к практически постоянным уровням средства на протяжении длительного периода времени.
Термин «симптом» в контексте настоящего изобретения относится к явлению, которое возникает в результате конкретного заболевания или нарушения и сопровождает его и служит в качестве его признака.
Термин «синдром» в контексте настоящего изобретения, относится к группе симптомов, свидетельствующих о каком-то заболевании или патологическом состоянии.
Термин «функциональная группа» в контексте настоящего изобретения относится к функциональной группе молекулы. Термин «функциональная группа направленного действия» в контексте настоящего изобретения относится к функциональной группе, присоединенной к молекуле, которая направляет молекулу на специфическую мишень, тип клетки или ткань.
Термин «терапевтическое средство» в контексте настоящего изобретения относится к лекарственному средству, молекуле, нуклеиновой кислоте, белку, композиции или другому веществу, которое обеспечивает терапевтический эффект. Термин «активный» в контексте настоящего изобретения относится к ингредиенту, компоненту или элементу композиций по настоящему изобретению ответственному за предполагаемый терапевтический эффект. Термины «терапевтическое средство» и «активное вещество» используются взаимозаменяемо. Термин «терапевтический компонент» в контексте настоящего изобретения относится к терапевтически эффективной дозе (т.е., дозе и частоте введения) которая устраняет, снижает или предотвращает прогрессирование конкретного проявления заболевания в процентах населения. Примером обычно используемого терапевтического компонента является ED50, которая описывает дозу в конкретной дозировке, которая является терапевтически эффективной для проявления конкретного заболевания у 50% населения.
Термин «терапевтический эффект» в контексте настоящего изобретения относится к последствию лечения, результаты которого оцениваются желательными и благоприятными. Терапевтический эффект может включать, прямо или опосредовано, задержку, уменьшение устранение проявления заболевания. Терапевтический эффект также может включать, прямо или опосредовано, задержку, уменьшение или устранение прогрессирования проявления заболевания.
Термины «терапевтическое количество», «терапевтически эффективное количество» или «количество, эффективное» одного или нескольких активных веществ представляет собой количество, которое является достаточным для обеспечения предполагаемого положительного воздействия лечения. Эффективное количество активных веществ, которое может быть использовано, в основном находится в интервале от 0,1 мг/кг массы тела примерно до 50 мг/кг массы тела. Однако, уровни доз основаны на самых разнообразных факторах, включая тип повреждения, возраст, массу тела, пол, медицинское состояние пациента, тяжесть состояния, путь введения, конкретно используемое активное вещество. Таким образом, режим дозирования может варьировать в широких пределах, но может быть определен хирургом обычным образом, используя стандартные способы.
Термин «терапевтический эффект» в контексте настоящего изобретения относится к последствию лечения, результаты которого оцениваются желательными и благоприятными. Терапевтический эффект может включать, прямо или опосредовано, задержку, уменьшение устранение проявления заболевания. Терапевтический эффект также может включать, прямо или опосредовано, задержку, уменьшение или устранение прогрессирования проявления заболевания.
Термин «местный» в контексте настоящего изобретения относится к нанесению композиции на или непосредственно под точку нанесению. Выражение «местное нанесение» описывает нанесение на одну или несколько поверхностей, включая эпителиальные поверхности. Местное нанесение также может включать применение чрескожного нанесения, например, пластырей или устройств для ионтофореза, которые получают в соответствии с методиками и способами, хорошо известными из уровня техники. Термины «трансдермальная система доставки», «трансдермальный пластырь» или «пластырь» относятся к адгезивной системе, расположенной на коже, для доставки медленно высвобождаемой дозы лекарственного средств(а) путем перехода от лекарственной формы через кожу, чтобы она была доступной для распределения через системный кровоток. Трансдермальные пластыри представляют собой общепринятую методику, используемую для доставки большого разнообразия фармацевтических препаратов, в том числе, но не только, скополамин от укачивания, нитроглицерин для лечения стенокардии, клонидин от гипертензии, эстрадиол от симптомов пост-менопаузы и никотин при отказе от курения. Пластыри, подходящие для использования в настоящем изобретении, включают, но не ограничиваются (1) матриксный пластырь; (2) резервуарный пластырь; (3) многослойный пластырь, в котором лекарственное средство содержится в клеевом составе; и (4) монолитный пластырь, в котором лекарственное средство содержится в клеевом составе; TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS, pp. 249-297 (Tapash K. Ghosh et al. eds., 1997), включено посредством ссылки в полном объеме. Эти пластыри хорошо известны из уровня техники и в основном являются коммерчески доступными.
Термин «травматическая рана» в контексте настоящего изобретения относится к ране, которая является результатом повреждения.
Термин «лечить» или «лечение» включает подавление, по существу ингибирование, замедление или обратное развитие прогрессирования заболевания, патологического состояния, нарушения или повреждения, по существу облегчение клинических или эстетических симптомов заболевания, патологического состояния, нарушения или повреждения, по существу профилактику появления клинических или эстетических симптомов заболевания, патологического состояния, нарушения или повреждения, и защиту от причиняющих вред или беспокоящих симптомов. Термин «лечить» или «лечение» в контексте настоящего изобретения дополнительно относится к осуществлению одного или более из следующего: (a) уменьшению тяжести заболевания, патологического состояния, нарушения или повреждения; (b) ограничению развития симптомов, характерных для этого заболевания, патологического состояния, нарушения или повреждения, подвергаемого лечению; (c) ограничению ухудшения симптомов заболевания, патологического состояния, нарушения или повреждения, подвергаемого лечению; (d) ограничению рецидивов заболевания, патологического состояния, нарушения или повреждения у пациентов, у которых ранее имелось это заболевание, патологическое состояние, нарушение или повреждение; и (e) ограничению рецидивов симптомов у пациентов, у которых в прошлом были симптомы этого заболевания, патологического состояния, нарушения или повреждения.
Термин «язва» в контексте настоящего изобретения относится к повреждению кожи, которое характеризуется образованием гноя и некроза (гибель окружающей ткани) обычно в результате воспаления или ишемии.
Термин «рана» в контексте настоящего изобретения относится к нарушению нормальной целостности структур, вызванному воздействием физической (например, механической) силы, биологических или химических средств. Термин «рана» включает, но не ограничивается, операционные раны, эксцизионные раны, рванные раны, колотые раны, порезы и подобные. Термин «размеры раны» в контексте настоящего изобретения относится к физическому измерению нарушения нормальной целостности структур, вызванного воздействием физической (например, механической) силы, биологических или химических средств.
Термин «полнослойная рана» в контексте настоящего изобретения относится к разрушению ткани, распространяющемуся через второй слой кожи (дерму) с вовлечением нижележащей подкожной ткани, и, возможно, мышцы или кости; ткань может выглядеть белоснежной, серой или коричневой с плотной кожистой текстурой.
Термин «неполнослойная рана» в контексте настоящего изобретения относится к разрушению ткани сквозь первый слой кожи (эпидермис), распространяясь на дерму, но не сквозь нее.
Термин «витамин» в контексте настоящего изобретения, относится к любому из различных органических веществ, необходимых в ничтожных количествах для питания большинства животных, действующему особенно в качестве коферментов и предшественников коферментов в регуляции метаболических процессов. Неограничивающие примеры витаминов, применяемых в контексте настоящего изобретения включают витамин A и его аналоги и производные: ретинол, ретиналь, ретинилпальмитат, ретиноевую кислоту, третиноин, изо-третиноин (известные как ретиноиды), витамин Е (токоферол и его производные), витамин С (L-аскорбиновую кислоту и ее эфиры и другие производные), витамин B3 (ниацинамид и его производные), альфа-оксикислоты (например, гликолевую кислоту, молочную кислоту, винную кислоту, яблочную кислоту, лимонную кислоту, и т.д.) и бета гидрокси кислоты (например, салициловую кислоту и т.п.).
Термин «затягивание раны» в контексте настоящего изобретения относится к заживлению раны, таким образом, что края раны соединяются с образованием непрерывного барьера.
Термин «заживление раны» в контексте настоящего изобретения относится к процессу регенерации с индукцией временной и пространственной программы заживления, в том числе, но не только, процессам воспаления, грануляции, неоваскуляризации, миграции фибробластов, эндотелиальных и эпителиальных клеток, отложению внеклеточного матрикса, реэпителиализации и ремоделирования.
I. Композиции для лечения, уменьшения или предотвращения кожных рубцов
В соответствии с одним аспектом описанное изобретение относится к фармацевтической композиции для использования при лечении кожного рубца у пациента, который пострадал или страдает от раны, к фармацевтической композиции, содержащей терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2) содержащей полипептидный ингибитор MK2 или его функциональный эквивалент, и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным для уменьшения области рубца у пациента.
Ингибитор MK2
В соответствии с одним вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) представляет собой полипептидный ингибитор MK2 или его функциональный эквивалент. В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 выбран из группы, состоящей из полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), полипептида MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), полипептида MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), и полипептида MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с одним вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 90 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 95 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19)
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) дополнительно содержит ингибитор MK2 с низкой молекулярной массой. Приводимые в качестве примера ингибиторы MK2 с низкой молекулярной массой были описаны у Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 15: 1587 (2005); Wu, J. -P. et al., Bioorg. Med. Chem. Lett., 17: 4664 (2007); Trujillo, J. I. et al., Bioorg. Med. Chem. Lett., 17: 4657 (2007); Goldberg, D. R. et al., Bioorg. Med. Chem. Lett., 18: 938 (2008); Xiong, Z. et al., Bioorg. Med. Chem. Lett., 18: 1994 (2008); Anderson, D. R. et al., J. Med. Chem., 50: 2647 (2007); Lin, S. et al., Bioorg. Med. Chem. Lett., 19: 3238 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4878 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4882 (2009); Harris, C. M. et al., Bioorg. Med. Chem. Lett., 20: 334 (2010); Schlapbach, A. et al., Bioorg. Med. Chem. Lett., 18: 6142 (2008); и Velcicky, J. et al., Bioorg. Med. Chem. Lett., 20: 1293 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
В соответствии с некоторыми такими вариантами осуществления ингибитор МК2 с низкой молекулярной массой включает, но не ограничивается:
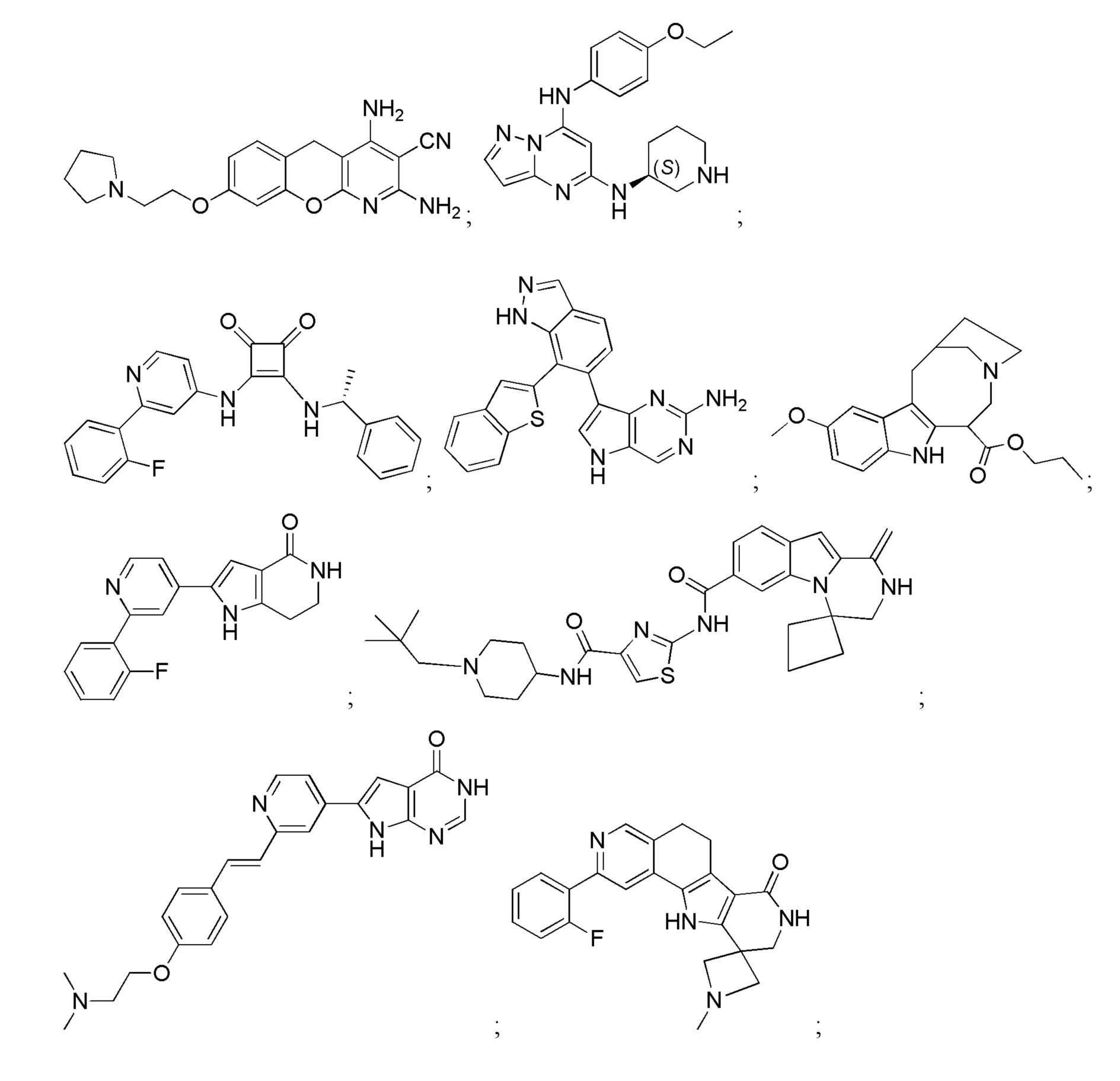

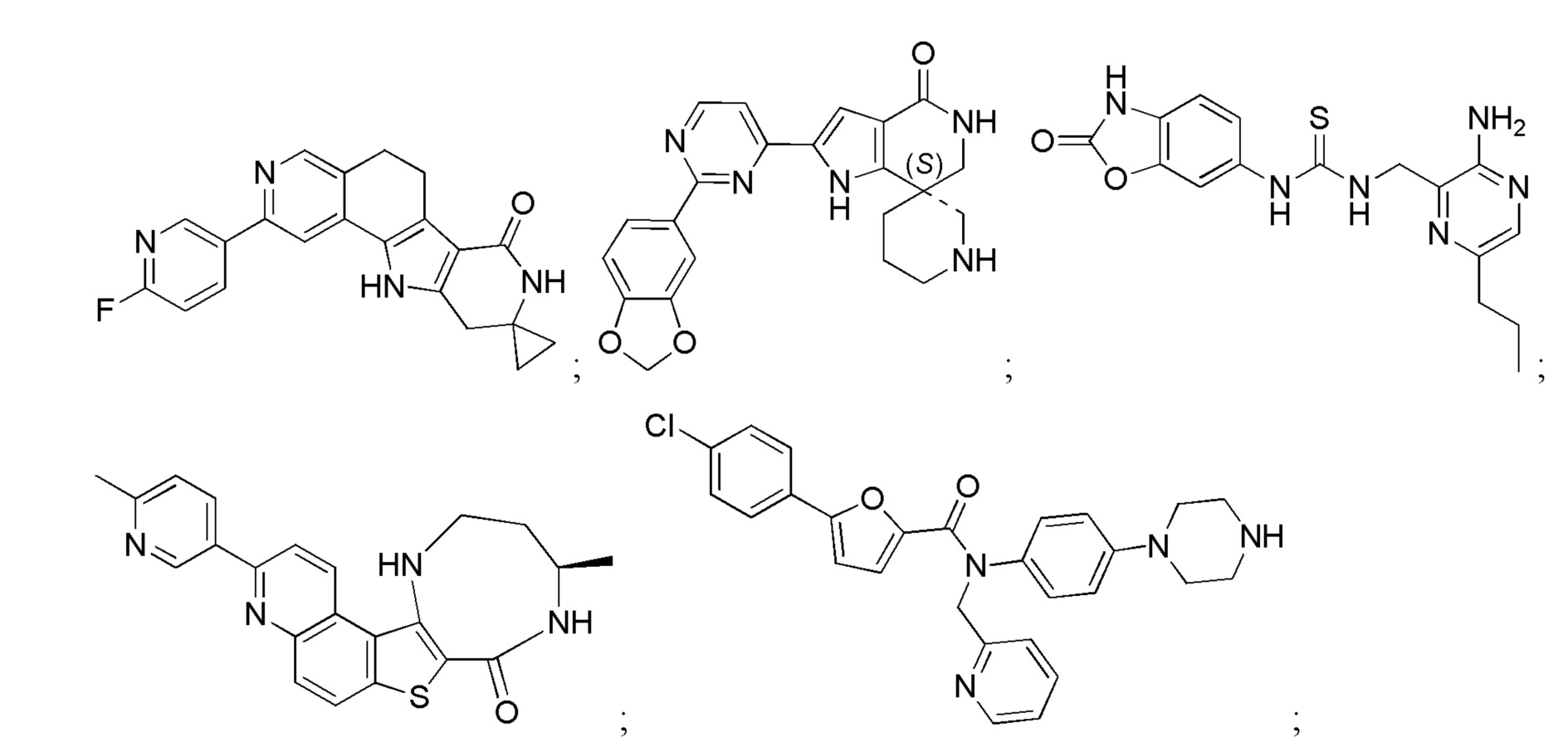
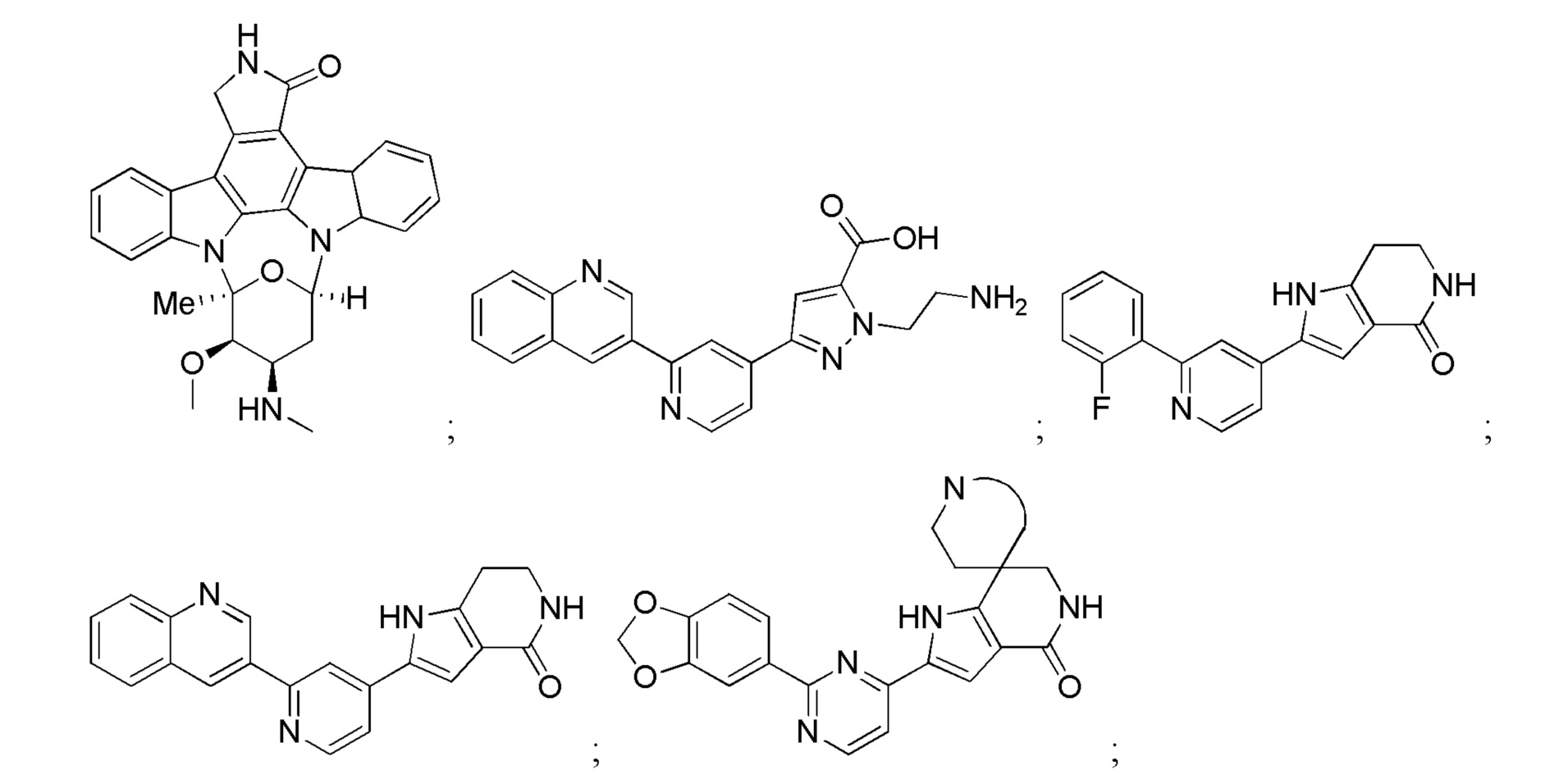
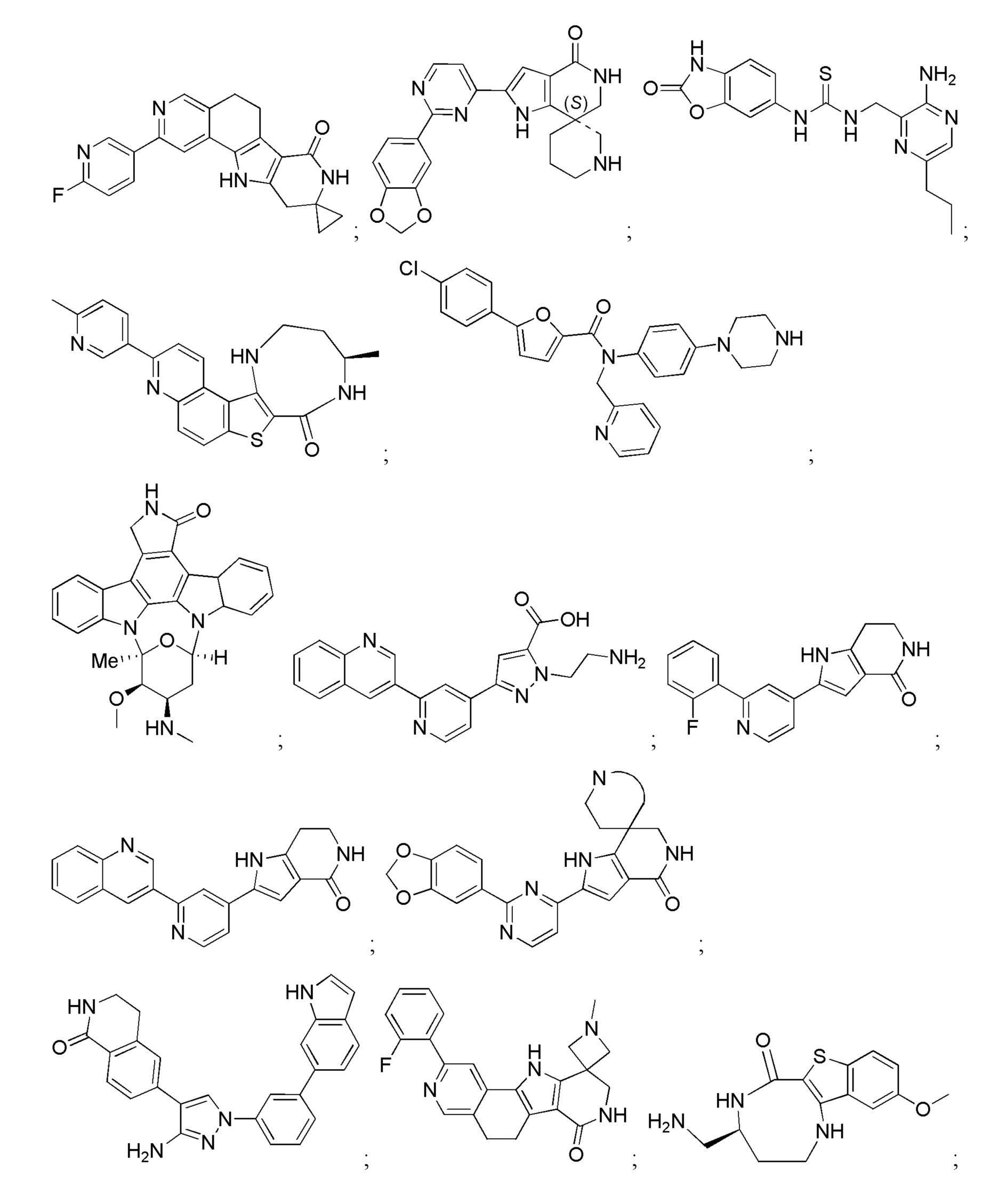
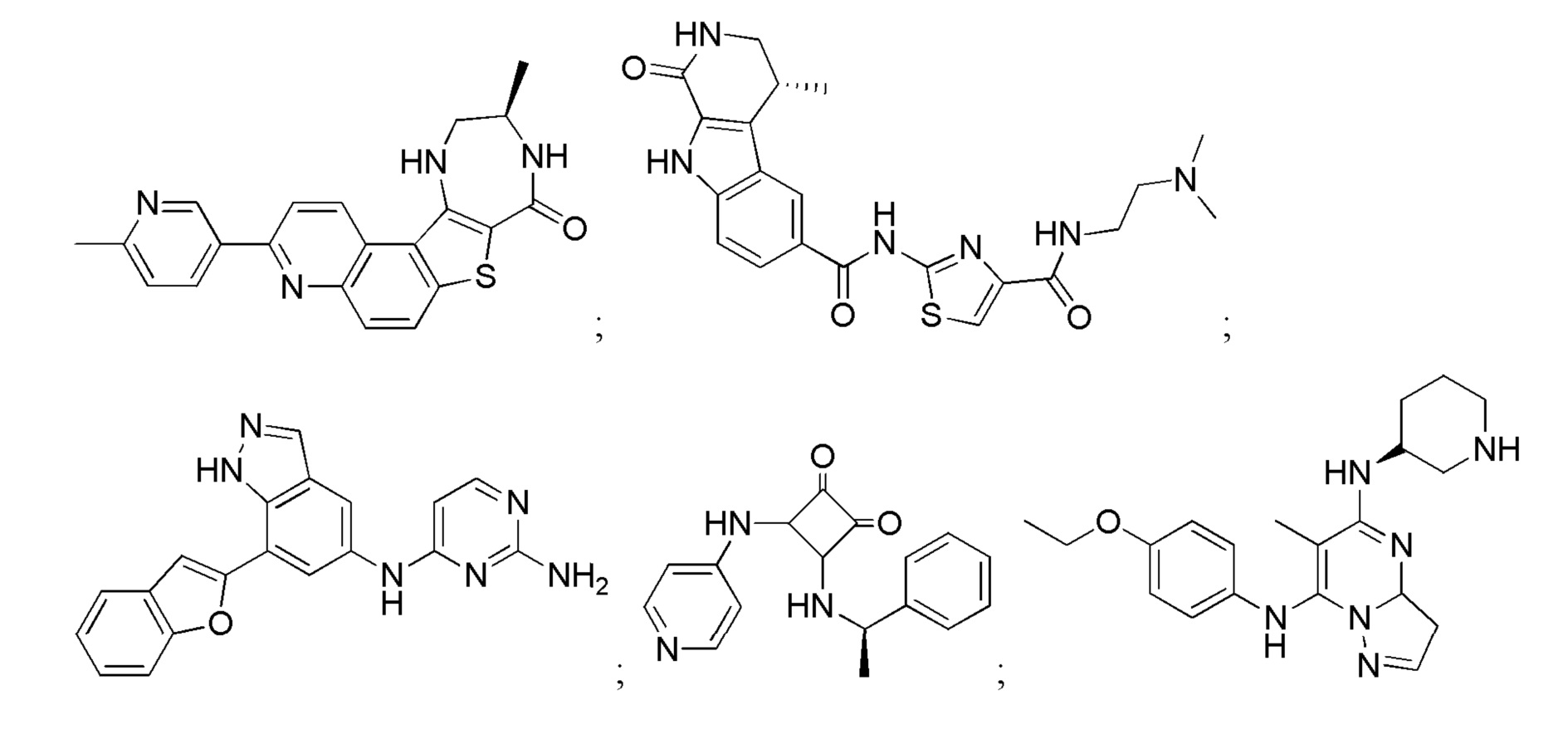
или сочетания указанного.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой конкурирует с АТФ за связывание с MK2. В соответствии с несколькими вариантами осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина или полициклический аналог лактама.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина. Приводимые в качестве примера аналоги пирролопиридина описаны у Anderson, D. R. et al., «Pyrrolopyridine inhibitors of mitogen-activated protein kinase-activated protein kinase 2 (MK-2)», J. Med. Chem., 50: 2647-2654 (2007), полное описание этого документа включено в настоящую заявку посредством ссылки. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы I:  , где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II:
, где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II:  , где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
, где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой полициклический аналог лактама. Приводимые в качестве примера полициклические аналоги лактама описаны у Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part I», Bioorg. Med. Chem. Lett., 20: 4715-4718 (2010); и Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part II», Bioorg. Med. Chem. Lett., 20: 4719-4723 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
Кожный рубец
В соответствии с одним вариантом осуществления кожный рубец может быть результатом заживления раны. В соответствии с другим вариантом осуществления рана характеризуется нарушенной активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани по сравнению с активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани здорового контрольного пациента.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью улучшать выравнивание коллагеновых волокон в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения образования витков коллагена в ране.
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ускорения заживления раны по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня или по меньшей мере 30 дней введения. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по данным визуально-аналоговой шкалы (VAS), цветового соответствия (CM), оценки матовости/блеска (M/S), оценки контура (С), оценки деформации (D), оценки степени плотности ткани (Т), или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по меньшей мере в течение 30 дней введения.
В соответствии с несколькими вариантами осуществления фармацевтическая композиция обладает способностью модулировать экспрессию гена, связанного с образованием рубцов или продукта гена, связанного с образованием рубцов. В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для модуляции экспрессии гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии матричной РНК (мРНК) гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня продукта гена, связанного с образованием рубцов, экспрессируемого геном, связанного с образованием рубцов.
В соответствии с некоторыми такими вариантами осуществления ген, связанный с образованием рубцов, кодирует одно или более из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с одним вариантом осуществления ген, связанный с образованием рубцов, кодирует трансформирующий фактор роста-β1 (TGF-β1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокиновый (С-С мотив) лиганд 2 (CCL2) (или моноцитарный хематактический белок-1 (MCP-1)). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокиновый (С-С мотив) рецептор 2 (CCR2). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует sma/mad-родственный белок (SMAD).
В соответствии с некоторыми такими вариантами осуществления продукт гена, связанного с образованием рубцов, выбран из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) лиганд 2 (CCL2) (или моноцитарный хематактический белок-1 (MCP-1)). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) рецептор 2 (CCR2). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой sma/mad-родственного белка (SMAD).
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью уменьшать инфильтрацию в рану одного или более типов воспалительных или стволовых клеток, в том числе, без ограничения, моноцитов, фиброцитов, макрофагов, лимфоцитов и тучных или дендритных клеток.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной иммуномодулирующей клетки. В соответствии с некоторыми такими вариантами осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов или фиброцитов. В соответствии с одним вариантом осуществления иммуномодулирующая клетка представляет собой тучную клетку. В соответствии с другим вариантом осуществления тучная клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и CD117. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой моноцит. В соответствии с другим вариантом осуществления моноцит характеризуется экспрессией маркеров клеточной поверхности, в том числе, без ограничения, CD11b. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой макрофаг. В соответствии с другим вариантом осуществления макрофаг характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, F4/80. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой T-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит представляет собой хелперный Т-лимфоцит или цитотоксический Т-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD4, CD8, или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной клетки-предшественника. В соответствии с некоторыми такими вариантами осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки, или сочетания указанного. В соответствии с одним вариантом осуществления клетка-предшественник представляет собой гематопоэтическую стволовую клетку. В соответствии с другим вариантом осуществления гематопоэтическая стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и Sca1. В соответствии с другим вариантом осуществления клетка-предшественник представляет собой мезенхимальную стволовую клетку. В соответствии с другим вариантом осуществления мезенхимальная стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, Sca1, а не CD45.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня матричной РНК (мРНК) трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня белка трансформирующего фактора роста-β (TGF-β) в ране.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня медиатора воспаления в ране. В соответствии с несколькими вариантами осуществления медиатор воспаления, модулируемый таким образом, может представлять собой, без ограничения, интерлейкин-1 (IL-1), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли (TNF), интерферон-гамма (IFN-γ), интерлейкин 12 (IL-12), или сочетания указанного.
В соответствии с несколькими вариантами осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, или сочетания указанного. В соответствии с одним вариантом осуществления рана представляет собой царапины. В соответствии с другим вариантом осуществления рана представляет собой рваную рану. В соответствии с другим вариантом осуществления рана представляет собой раздавленную рану. В соответствии с другим вариантом осуществления рана представляет собой закрытую травму. В соответствии с другим вариантом осуществления рана представляет собой колотую рану. В соответствии с другим вариантом осуществления рана представляет собой отрыв. В соответствии с другим вариантом осуществления рана представляет собой ожог. В соответствии с другим вариантом осуществления рана представляет собой язву.
В соответствии с другим вариантом осуществления рана представляет собой операционную рану.
В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, означающий рубец, возникающий как результат заболевания, нарушения, патологического состояния или повреждения.
В соответствии с другим вариантом осуществления патологический рубец представляет собой гипертрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой келоид.
В соответствии с другим вариантом осуществления патологический рубец представляет собой атрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой рубцовую контрактуру.
В соответствии с другим вариантом осуществления кожный рубец представляет собой послеоперационный рубец.
В соответствии с другим вариантом осуществления гипертрофический рубец появляется в результате растяжения. В соответствии с другим вариантом осуществления растяжение расположено в непосредственной близости от сустава. В соответствии с другим вариантом осуществления сустав представляет собой коленный сустав, локтевой сустав, лучезапястный сустав, плечевой сустав, тазобедренный сустав, остистый отросток, все суставы пальцев, или сочетания указанного. Термин «в непосредственной близости» в контексте настоящего изобретения относится к очень близкому расстоянию. В соответствии с одним вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 15 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 0,005 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,005 мм примерно до 0,01 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,01 мм примерно до 0,05 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,05 мм примерно до 0,1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,1 мм примерно до 0,5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,5 мм примерно до 1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 мм примерно до 2 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 мм примерно до 3 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 мм примерно до 4 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 мм примерно до 5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 мм примерно до 6 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 мм примерно до 7 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 мм примерно до 8 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 мм примерно до 9 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 мм примерно до 1 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 cm примерно до 2 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 см примерно до 3 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 см примерно до 4 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 см примерно до 5 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 см примерно до 6 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 см примерно до 7 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 см примерно до 8 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 см примерно до 9 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 см примерно до 10 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 10 см примерно до 11 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 11 см примерно до 12 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 12 см примерно до 13 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 14 см примерно до 15 см.
В соответствии с несколькими вариантами осуществления патологический рубец появляется в результате царапины, рваной раны, включения, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, или сочетания указанного. В соответствии с одним вариантом осуществления патологический рубец появляется в результате царапины. В соответствии с другим вариантом осуществления патологический рубец появляется в результате рваной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате включения. В соответствии с другим вариантом осуществления патологический рубец появляется в результате раздавленной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате закрытой травмы. В соответствии с другим вариантом осуществления патологический рубец появляется в результате колотой раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате отрыва. В соответствии с другим вариантом осуществления патологический рубец появляется в результате ожога. В соответствии с другим вариантом осуществления патологический рубец появляется в результате язвы.
Кожные рубцы, связанные с аутоиммунным заболеванием кожи
Термин «аутоиммунное заболевание» в контексте настоящего изобретения относится к заболеванию, нарушениям или патологическим состояниям, при которых иммунная система организма, которая обычно борется с инфекциями и вирусами, извращена и поражает собственную нормальную здоровую ткань. У высших организмов многочисленные механизмы иммунологической толерантности устраняют или инактивируют лимфоциты, которые несут рецепторы, специфичные для аутоантигенов. Однако, некоторые аутореактивные лимфоциты могут уклоняться от таких механизмов и находиться в пуле периферических лимфоцитов.
Аутоиммунитет вызывается сложным взаимодействием многочисленных генных продуктов, в отличие от иммунодефицитных заболеваний, при которых один доминирующий генетический признак зачастую является основным определяющим фактором заболевания. (Обзор представлен у Fathman, C. G. et al., «An array of possibilities for the study of autoimmunity» Nature, 435(7042): 605-611 (2005); Anaya, J.-M., «Common mechanisms of autoimmune diseases (the autoimmune tautology)», Autoimmunity Reviews, 11(11): 781-784 (2012)). Аутоиммунные заболевания являются основными причинами заболеваемости и смертности по всему миру и плохо поддаются лечению. (Обзор, например, представлен у Hayter, S. M. et al., «Updated assessment of the prevalence, spectrum and case definition of autoimmune disease», Autoimmunity Reviews, 11(10): 754-765 (2012); и Rioux, J. D. et al., «Paths to understanding the genetic basis of autoimmune disease», Nature, 435(7042): 584-589 (2005)).
Один механизм, посредством которого сдерживается патогенный потенциал таких аутореактивных лимфоцитов, представляет собой механизм при участии специализированной линии регуляторных T (TR) клеток. Эти клетки были мишенью для терапевтического воздействия при большом числе аутоиммунных нарушений (Обзор представлен у Kronenberg, M. et al., «Regulation of immunity by self-reactive T cells», Nature, 435(7042): 598-604 (2005)).
Другие компоненты патологического каскада при аутоиммунных нарушениях, которые привлекают внимание, включают, например, факторы, вовлеченные в направленное движение лимфоцитов к тканям-мишеням; ферменты, которые являются важными для пенетрации кровеносных сосудов и внеклеточного матрикса иммунными клетками; цитокины, которые опосредуют патологию в тканях; различные типы клеток, которые опосредуют повреждение в зоне заболевания, клеточные антигены; специфические адаптивные рецепторы, в том числе, T-клеточный рецептор (TCR) и иммуноглобулин; и токсические медиаторы, такие как компоненты комплемента и оксид азота. (Обзор у Feldmann, M. et al., «Design of effective immunotherapy for human autoimmunity», Nature, 435(7042): 612-619 (2005)).
Хотя мутации в одном гене могут вызывать аутоиммунитет, большинство аутоиммунных заболеваний связано с многочисленными вариантами последовательностей (Обзор у Rioux, J. D. et al., «Paths to understanding the genetic basis of autoimmune disease», Nature, 435(7042): 584-589 (2005); и Goodnow, C. C. et al., «Cellular and genetic mechanisms of self-tolerance and autoimmunity», Nature, 435(7042): 590-596 (2005)). Аутоиммунные нарушения могут быть связаны с хроническим воспалением. Такие аутоиммунные нарушения хорошо известны как «аутовоспалительные заболевания». (Обзор представлен у Hashkes, P.J. et al., «Autoinflammatory syndromes», Pediatr. Clin. North Am., 59(2): 447-470 (2012)).
Системный аутоиммунитет охватывает аутоиммунные состояния, при которых аутореактивность не ограничена одним органом или системой органов. Это определение включает, но не ограничивается, аутоиммунные заболевания, включая проявления аутоиммунных заболеваний кожи, таких как системная красная волчанка (SLE), системный склероз (склеродермия), пузырчатка, витилиго, герпетиформный дерматит, псориаз, и так далее. Кожная SLE является распространенным системным аутоиммунным заболеванием, которое включает специфические проявления, такие как сыпь «бабочка», фоточувствительный дерматит с высыпаниями на коже и дисковидные повреждения, а также васкулит и алопецию. SLE характеризуется наличием антиядерных антител (ANA) и связана с хроническим воспалением. Склеродермия (или системный склероз) отмечен воспалением с последующим отложением ANA в коже и внутренних органах. Склеродермия, характеризуемая заметным уменьшением кровообращения в периферических артериях дистальных кончиков пальцев (зачастую стимулируемым холодными температурами) известна как болезнь Рейно. Пузырчатка включает группу аутоиммунных заболеваний с образованием пузырей, характеризуемых индуцированным аутоантителами разъединением эпидермальных клеток (акантолиз). Пузырчатка клинически проявляется мягкими волдырями и эрозиями кожи. Витилиго представляет собой заболевание кожи, связанное с депигментацией, которое может быть связано с другими аутоиммунными нарушениями, такими как аутоиммунный полиэндокринный синдром I типа. Витилиго характеризуется присутствием анти-меланоцитраных аутоантител, инфильтрацией кожной CD4+ и CD8+ T-лимфоцитами и гиперэкспрессией профилей цитокинов I типа. Герпетиформный дерматит (DH) пожизненное заболевание кожи, сопровождающееся сильным зудом, полиморфными пузырями, связанное с чувствительностью к глютену. Преобладающим аутоантигеном при DH является тканевая трансглутаминаза, находящаяся в кишечнике и в коже. Псориаз представляет собой распространенное аутоиммунное заболевание кожи с генетической основой, поражающее 1-3% европиоидной популяции. Псориаз характеризуется гиперкератозом, эпидермальной гиперплазией (акантозом) и воспалением и расширением капилляров кожи. (Paul, W. E., «Chapter 1: The immune system: an introduction», Fundamental Immunology, 4th Edition, Ed. Paul, W. E., Lippicott-Raven Publishers, Philadelphia (1999); Nancy, A. -L. and Yehuda, S., «Prediction and prevention of autoimmune skin disorders», Arch. Dermatol. Res., 301: 57-64 (2009)).
В соответствии с некоторыми другими вариантами осуществления фармацевтическая композиция способна лечить кожные рубцы, связанные с аутоиммунным заболеванием кожи. В соответствии с некоторыми такими вариантами осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза, или сочетания указанного. В соответствии с одним вариантом осуществления аутоиммунное заболевание кожи представляет собой системную красную волчанку (SLE). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой системный склероз (склеродермию). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой пузырчатку. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой витилиго. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой герпетиформный дерматит. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой псориаз.
Действие на киназную активность
В соответствии с некоторыми другими вариантами осуществления фармацевтическая композиция может быть выбрана, исходя из ее способности ингибировать или не ингибировать одну или более выбранных киназ, выбранных из группы, состоящей из гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Abl), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (T3151) (Abl (T3151)), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Y253F) (Abl (Y253F)), киназы анапластической лимфомы (ALK), гена, связанного с лейкозом Абельсона (Arg), каталитической субъединицы альфа-1 5'-АМФ-активированной протеинкиназы (AMPKα1), каталитической субъединицы альфа-2 5'-АМФ-активированной протеинкиназы (AMPKα2), AMPK-связанной протеинкиназы 5 (ARK5), киназы 1, регулирующей сигнал апоптоза (ASK1), киназы Aurora B (Aurora-B), AXL рецепторной тирозинкиназы (Axl), цитоплазматической тирозиновой протеинкиназы (Bmx), киназы рака груди (BRK), тирозинкиназы Брутона (BTK), тирозинкиназы Брутона (R28H) (BTK (R28H)), Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI), Ca2+/кальмодулин-зависимой протеинкиназы IIβ (CaMIIβ), Ca2+/кальмодулин-зависимой протеинкиназы IIγ (CaMKIIγ), Ca2+/кальмодулин-зависимой протеинкиназы δ (CaMKIδ), Ca2+/кальмодулин-зависимой протеинкиназы IIδ (CaMKIIδ), Ca2+/кальмодулин-зависимой протеинкиназы IV (CaMKIV), киназы клеточного деления 2 (CDK2/циклинE), киназы клеточного деления 3 (CDK3/циклинE), киназы клеточного деления 6 (CDK6/циклинD3), киназы клеточного деления 7 (CDK7/циклинH/MAT1), киназы клеточного деления 9 (CDK9/циклин T1), киназы контрольной точки 2 (CHK2), киназы контрольной точки 2 (1157T) (CHK2 (1157T)), киназы контрольной точки 2 (R145W) (CHK2 (R145W)), прото-онкогенных тирозин-протеинкиназ cKit (D816V) (cKit (D816V)), C-src тирозинкиназы (CSK), Raf прото-онкогенной серин/треонин протеинкиназы (c-RAF), прото-онкогенных тирозин-протеинкиназ (cSRC), гибель-ассоциированной протеинкиназы 1 (DAPK1), гибель-ассоциированной протеинкиназы 2 (DAPK2), протеинкиназы миотонической дистрофии (DMPK), DAP киназа-зависимой апоптоз-индуцирующей протеинкиназы 1 (DRAK1), рецептора эпидермального фактора роста (EGFR), рецептора эпидермального фактора роста (EGFR L858R), рецептора эпидермального фактора роста L861Q (EGFR (L861Q)), Eph рецептора A2 (EphA2) (EphA2), Eph рецептора A3 (EphA3), Eph рецептора A5 (EphA5), Eph рецептора B2 (EphB2), Eph рецептора B4 (EphB4), гомолога 4 вирусного онкогена эритробластного лейкоза (ErbB4), c-Fes белка тирозинкиназы (Fes), рецептора 2 фактора роста фибробластов (FGFR2), рецептора 3 фактора роста фибробластов (FGFR3), рецептора 4 фактора роста фибробластов (FGFR4), рецептора 3 Fms-подобной тирозинкиназы (Flt3), протоонкогенного FMS (Fms), ядерной протеинкиназы, специфичной для гаплоидных зародышевых клеток (Haspin), рецептора, родственного рецептору инсулина (IRR), интерлейкин-1 рецептор-ассоциированной киназы 1 (IRAK1), интерлейкин-1 рецептор-ассоциированной киназы 4 (IRAK4), IL2-индуцируемой Т-клеточной киназы (Itk), рецептора, содержащего домен вставки киназы (KDR), лимфоцитарной клеточно-специфичной протеин-тирозинкиназы (Lck), лимфоцит-ориентированной киназы (LOK), Lyn тирозинпротеинкиназы (Lyn), MAP киназа-активированной протеинкиназы 2 (MK2), MAP киназа-активированной протеинкиназы 3 (MK3), MEK1, материнской эмбриональной киназы с лейциновой застежкой (MELK), c-Mer протоонкогенной тирозинкиназы (Mer), c-Met протоонкогенной тирозинкиназы (Met), c-Met протоонкогенной тирозинкиназы D1246N (Met (D1246N)), c-Met протоонкогенной тирозинкиназы Y1248D (Met Y1248D), Misshapen/NIK-родственной киназы (MINK), MAP киназы киназы 6 (MKK6), киназы легкой цепи миозина (MLCK), киназы 1 различных линий дифференцировки (MLK1), киназы 2, интегрирующей сигнал MAP киназы (MnK2), родственной киназе миотонической дистрофии CDC42-связывающей киназы альфа (MRCKα), родственной киназе миотонической дистрофии CDC42-связывающей киназы бета (MRCKβ), митоген- и стресс-активируемой протеинкиназы 1 (MSK1), митоген- и стресс-активируемой протеинкиназы 2 (MSK2), мышечно-специфичной серинкиназы 1 (MSSK1), протеинкиназы 1, подобной STE20 млекопитающих (MST1), протеинкиназы 2, подобной STE20 млекопитающих (MST2), протеинкиназы 3, подобной STE20 млекопитающих (MST3), тирозинпротеинкиназы рецептора скелетных мышц (MuSK), немитотической А-родственной киназы 2 (NEK2), немитотической А-родственной киназы 3 (NEK3), немитотической А-родственной киназы 11 (NEK11), киназы 1 рибосомального белка S6 70 кДа (p70S6K), PAS домен содержащей серин/треонин киназы (PASK), субъединицы гамма-2 киназы фосфорилазы (PhKγ2), Pim-1 киназы (Pim-1), протеинкиназы B альфа (PKBα), протеинкиназы B бета (PKBβ), протеинкиназы B гамма (PKBγ), протеинкиназы C, альфа (PKCα), протеинкиназы C, бета1 (PKCβ1), протеинкиназы C, бета II (PKCβII), протеинкиназы C, гамма (PKCγ), протеинкиназы C, эпсилон (PKCε), протеинкиназы C, иота (PCKτ), протеинкиназы C, мю (PKCμ), протеинкиназы C, зета (PKCζ), протеинкиназы D2 (PKD2), цГМФ-зависимой протеинкиназы 1 альфа (PKG1α), цГМФ-зависимой протеинкиназы 1 бета (PKG1β), киназы 2, родственной протеинкиназе С (PRK2), богатой пролином тирозинкиназы 2 (Pyk2), рецептора протоонкогенных тирозин-протеинкиназ Ret V804L (Ret (V804L)), взаимодействующей с рецептором серин-треонинкиназы 2 (RIPK2), Rho-ассоциированной протеинкиназы I (ROCK-I), Rho-ассоциированной протеинкиназы II (ROCK-II), киназы 1 рибосомального белка S6 (Rsk1), киназы 2 рибосомального белка S6 (Rsk2), киназы 3 рибосомального белка S6 (Rsk3), киназы 4 рибосомального белка S6 (Rsk4), стресс-активированной протеинкиназы 2A T106M (SAPK2a, T106M), стресс-активированной протеинкиназы 3 (SAPK3), сыворотка/глюкокортикоид регулируемой киназы (SGK), сыворотка/глюкокортикоид регулируемой киназы 2 (SGK2), сыворотка/глюкокортикоид регулируемой киназы 3 (SGK3), прото-онкогенных тирозин-протеинкиназ Src 1-530 (Src, 1-530), серин/треонин-протеинкиназы 33 (STK33), тирозинкиназы селезенки (Syk), белка 1 тысяча и одной аминокислоты (TAO1), белка 2 тысяча и одной аминокислоты (TAO2), белка 3 тысяча и одной аминокислоты (TAO3), TANK-связывающей киназы 1 (TBK1), Tec протеинтирозинкиназы (Tec), киназы 2 эндотелиальных клеток внутренней оболочки (Tie2), рецептора тирозинкиназы A (TrkA), рецептора факторов роста BDNF/NT-3 (TrkB), TXK тирозинкиназы (Txk), WNK протеинкиназы 2 с недостаточностью лизина (WNK2), WNK протеинкиназы 3 с недостаточностью лизина (WNK3), гомолога 1 вирусного онкогена саркомы Ямагучи (Yes), протеинкиназы 70 кДа, ассоциированной с зета-цепью (TCR) (ZAP-70) и ZIP киназы (ZIPK).
В соответствии с некоторыми другими вариантами осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 50% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 75% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 80% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 85% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 90% киназной активности МК2 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 95% киназной активности МК2 киназы.
В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) с активностью ингибирования IC50 по меньшей мере примерно 12 мкM.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3). В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 50% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 70% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 75% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 80% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 85% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 90% киназной активности МК3 киназы. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 95% киназной активности МК3 киназы.
В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3) с активностью ингибирования IC50 по меньшей мере примерно 16 мкM.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 50% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 ингибирует киназную активность Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI) с активностью ингибирования IC50 по меньшей мере примерно 12 мкM.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 ингибирует киназную активность рецептора факторов роста BDNF/NT-3 (TrkB) с активностью ингибирования IC50 по меньшей мере примерно 5 мкМ.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) и киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) и киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2); и (2) дополнительного ингибирования киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI).
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) и киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) и киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2); и (2) дополнительного ингибирования киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 65% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 70% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 75% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 80% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 85% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 90% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 90% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 50% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 65% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 70% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 75% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 80% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 85% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 92% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 95% киназной активности МК2 киназы; и (2) дополнительного ингибирования по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью ингибировать киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), и киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), и киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с другим вариантом осуществления терапевтическое количество является эффективным (1) для ингибирования киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2); (2) дополнительного ингибирования киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI); (3) дополнительного ингибирования киназной активности рецептора факторов роста BDNF/NT-3 (TrkB). В соответствии с несколькими вариантами осуществления терапевтическое количество является эффективным (1) для ингибирования по меньшей мере 50%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2); (2) дополнительного ингибирования по меньшей мере 50%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% киназной активности кальций/кальмодулин-зависимой протеинкиназы I (CaMKI); (3) дополнительного ингибирования по меньшей мере 50%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% киназной активности рецептора факторов роста BDNF/NT-3 (TrkB).
В соответствии с несколькими вариантами осуществления ингибиторный профиль полипептида аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент зависит от дозы, пути введения, типа клеток, или сочетания указанного.
В соответствии с несколькими вариантами осуществления по меньшей мере один ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) или его функциональный эквивалент по настоящему изобретению по существу ингибирует по меньшей мере одной киназы выбранной из группы, состоящей из: гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Abl), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (T3151) (Abl (T3151)), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Y253F) (Abl (Y253F)), киназы анапластической лимфомы (ALK), гена, связанного с лейкозом Абельсона (Arg), 5'-каталитической субъединицы альфа-1 АМФ-активированной протеинкиназы (AMPKα1), 5'-каталитической субъединицы альфа-2 АМФ-активированной протеинкиназы (AMPKα2), AMPK-родственной протеинкиназы 5 (ARK5), киназы 1, регулирующей сигнал апоптоза (ASK1), киназы Aurora B (Aurora-B), AXL рецепторной тирозинкиназы (Axl), цитоплазматической тирозиновой протеинкиназы (Bmx), киназы рака груди (BRK), тирозинкиназы Брутона (BTK), тирозинкиназы Брутона (R28H) (BTK (R28H)), Ca2+/кальмодулин-зависимой протеинкиназы I (CaMKI), Ca2+/кальмодулин-зависимой протеинкиназы IIβ (CaMIIβ), Ca2+/кальмодулин-зависимой протеинкиназы IIγ (CaMKIIγ), Ca2+/кальмодулин-зависимой протеинкиназы δ (CaMKIδ), Ca2+/кальмодулин-зависимой протеинкиназы IIδ (CaMKIIδ), Ca2+/кальмодулин-зависимой протеинкиназы IV (CaMKIV), киназы клеточного деления 2 (CDK2/циклинE), киназы клеточного деления 3 (CDK3/циклинE), киназы клеточного деления 6 (CDK6/циклинD3), киназы клеточного деления 7 (CDK7/циклинH/MAT1), киназы клеточного деления 9 (CDK9/циклин T1), киназы контрольной точки 2 (CHK2), киназы контрольной точки 2 (1157T) (CHK2 (1157T)), киназы контрольной точки 2 (R145W) (CHK2 (R145W)), прото-онкогенных тирозин-протеинкиназ cKit (D816V) (cKit (D816V)), C-src тирозинкиназы (CSK), Raf прото-онкоген серин/треонин протеинкиназы (c-RAF), прото-онкогенных тирозин-протеинкиназ (cSRC), гибель-ассоциированной протеинкиназы 1 (DAPK1), гибель-ассоциированной протеинкиназы 2 (DAPK2), протеинкиназы миотонической дистрофии (DMPK), DAP киназа-зависимой апоптоз-индуцирующей протеинкиназы 1 (DRAK1), рецептора эпидермального фактора роста (EGFR), рецептора эпидермального фактора роста (EGFR L858R), рецептора эпидермального фактора роста L861Q (EGFR (L861Q)), Eph рецептора A2 (EphA2) (EphA2), Eph рецептора A3 (EphA3), Eph рецептора A5 (EphA5), Eph рецептора B2 (EphB2), Eph рецептора B4 (EphB4), гомолога 4 вирусного онкогена эритробластного лейкоза (ErbB4), тирозинкиназы c-Fes белка (Fes), рецептора 2 фактора роста фибробластов (FGFR2), рецептора 3 фактора роста фибробластов (FGFR3), рецептора 4 фактора роста фибробластов (FGFR4), рецептора 3 Fms-подобной тирозинкиназы (Flt3), FMS прото-онкогена (Fms), ядерной протеинкиназы, специфичной для гаплоидных зародышевых клеток (Haspin), рецептора, родственного рецептору инсулина (IRR), Интерлейкин-1 рецептор-ассоциированной киназы 1 (IRAK1), Интерлейкин-1 рецептор-ассоциированной киназы 4 (IRAK4), IL2-индуцируемой Т-клеточной киназы (Itk), рецептора, содержащего домен вставки киназы (KDR), лимфоцитарной клеточно-специфичной протеин-тирозинкиназы (Lck), лимфоцит-ориентированной киназы (LOK), Lyn тирозин протеинкиназы (Lyn), MAP киназа-активированной протеинкиназы 2 (MK2), MAP киназа-активированной протеинкиназы 3 (MK3), MEK1, материнской эмбриональной киназы с лейциновой застежкой (MELK), c-Mer протоонкогенной тирозинкиназы (Mer), c-Met протоонкогенной тирозинкиназы (Met), c-Met протоонкогенной тирозинкиназы D1246N (Met (D1246N)), c-Met протоонкогенной тирозинкиназы Y1248D (Met Y1248D), Misshapen/NIK-родственной киназы (MINK), MAP киназы киназы 6 (MKK6), киназы легкой цепи миозина (MLCK), киназы 1 различных линий дифференцировки (MLK1), киназы 2, интегрирующей сигнал MAP киназы (MnK2), родственной киназе миотонической дистрофии CDC42-связывающей киназы альфа (MRCKα), родственной киназе миотонической дистрофии CDC42-связывающей киназы бета (MRCKβ), митоген- и стресс-активируемой протеинкиназы 1 (MSK1), митоген- и стресс-активируемой протеинкиназы 2 (MSK2), мышечно-специфичной серин киназы 1 (MSSK1), протеинкиназы 1, подобной STE20 млекопитающих (MST1), протеинкиназы 2, подобной STE20 млекопитающих (MST2), протеинкиназы 3, подобной STE20 млекопитающих (MST3), тирозинпротеинкиназы рецептора скелетных мышц (MuSK), немитотической А-родственной киназы 2 (NEK2), немитотической А-родственной киназы 3 (NEK3), немитотической А-родственной киназы 11 (NEK11), киназы 1 рибосомального белка S6 70 кДа (p70S6K), PAS домен содержащей серин/треонин киназы (PASK), субъединицы гамма-2 киназы фосфорилазы (PhKγ2), Pim-1 киназы (Pim-1), протеинкиназы B альфа (PKBα), протеинкиназы B бета (PKBβ), протеинкиназы B гамма (PKBγ), протеинкиназы C, альфа (PKCα), протеинкиназы C, бета1 (PKCβ1), протеинкиназы C, бета II (PKCβII), протеинкиназы C, гамма (PKCγ), протеинкиназы C, эпсилон (PKCε), протеинкиназы C, иота (PCKτ), протеинкиназы C, мю (PKCμ), протеинкиназы C, зета (PKCζ), протеинкиназы D2 (PKD2), цГМФ-зависимой протеинкиназы 1 альфа (PKG1α), цГМФ-зависимой протеинкиназы 1 бета (PKG1β), киназы 2, родственной протеинкиназе С (PRK2), богатой пролином тирозинкиназы 2 (Pyk2), прото-онкогенных тирозин-протеинкиназ receptor Ret V804L (Ret (V804L)), взаимодействующей с рецептором серин-треонинкиназы 2 (RIPK2), Rho-ассоциированной протеинкиназы I (ROCK-I), Rho-ассоциированной протеинкиназы II (ROCK-II), киназы 1 рибосомального белка S6 (Rsk1), киназы 2 рибосомального белка S6 (Rsk2), киназы 3 рибосомального белка S6 (Rsk3), киназы 4 рибосомального белка S6 (Rsk4), стресс-активированной протеинкиназы 2A T106M (SAPK2a, T106M), стресс-активированной протеинкиназы 3 (SAPK3), сыворотка/глюкокортикоид регулируемой киназы (SGK), сыворотка/глюкокортикоид регулируемой киназы 2 (SGK2), сыворотка/глюкокортикоид регулируемой киназы 3 (SGK3), прото-онкогенных тирозин-протеинкиназ Src 1-530 (Src, 1-530), серин/треонин-протеинкиназы 33 (STK33), тирозинкиназы селезенки (Syk), белка 1 тысяча и одной аминокислоты (TAO1), белка 2 тысяча и одной аминокислоты (TAO2), белка 3 тысяча и одной аминокислоты (TAO3), TANK-связывающей киназы 1 (TBK1), Tec протеинтирозинкиназы (Tec), киназы 2 эндотелиальных клеток внутренней оболочки (Tie2), рецептора А тирозинкиназы (TrkA), рецептора факторов роста BDNF/NT-3 (TrkB), TXK тирозинкиназы (Txk), WNK протеинкиназы 2 с недостатком лизина (WNK2), WNK протеинкиназы 3 с недостатком лизина (WNK3), гомолог 1 вирусного онкогена саркомы Ямагучи (Yes), протеинкиназы 70 кДа, ассоциированной с зета-цепью (TCR) (ZAP-70), и ZIP киназы (ZIPK). В соответствии с несколькими вариантами осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) выбран из группы, состоящей из полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), полипептида MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), полипептида MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), и полипептида MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с некоторыми другими вариантами осуществления по меньшей мере два ингибитора митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), выбраны из группы, состоящей из полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), полипептида MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), полипептида MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), и полипептида MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7) по существу ингибируют киназу выбранную из группы, состоящей из: киназы анапластической лимфомы (ALK), киназы рака груди (BRK), тирозинкиназы Брутона (BTK), Ca2+/кальмодулин-зависимой протеинкиназы I (включая CaMKIδ), Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII, включая CaMKIIβ, CaMKIIδ и CaMKIIγ), Ca2+/кальмодулин-зависимой протеинкиназы IV (CaMKIV), киназы контрольной точки 2 (CHK2 (R145W)), прото-онкогенных тирозин-протеинкиназ cKit (D816V) (cKit (D816V)), C-src тирозинкиназы (CSK), прото-онкогенных тирозин-протеинкиназ (cSRC), гибель-ассоциированной протеинкиназы 1 (DAPK1), гибель-ассоциированной протеинкиназы 2 (DAPK2), DAP киназа-зависимой апоптоз-индуцирующей протеинкиназы 1 (DRAK1), рецептора эпидермального фактора роста (EGFR), рецептора эпидермального фактора роста L861Q (EGFR (L861Q)), Eph рецептора A2 (EphA2), Eph рецептора A3 (EphA3), Eph рецептора A5 (EphA5), Eph рецептора B2 (EphB2), гомолога 4 вирусного онкогена эритробластного лейкоза (ErbB4), тирозинкиназы c-Fes белка (Fes), рецептора 2 фактора роста фибробластов (FGFR2), рецептора 3 фактора роста фибробластов (FGFR3), и рецептора 4 фактора роста фибробластов (FGFR4), рецептора 3 Fms-подобной тирозинкиназы (Flt3), рецептора, родственного рецептору инсулина (IRR), лимфоцит-ориентированной киназы (LOK), Lyn тирозин протеинкиназы (Lyn), MAP киназа-активированной протеинкиназы 2 (MK2), MAP киназа-активированной протеинкиназы 3 (MK3), материнской эмбриональной киназы с лейциновой застежкой (MELK), киназы легкой цепи миозина (MLCK), митоген- и стресс-активируемой протеинкиназы (MSK1), протеинкиназы 1, подобной STE20 млекопитающих (MST1), протеинкиназы 2, подобной STE20 млекопитающих (MST2), немитотической А-родственной киназы 11(NEK11), киназы 1 рибосомального белка S6 70 кДа (p70S6K), PAS домен содержащей серин/треонин киназы (PASK), Pim-1 киназы (Pim-1), протеинкиназы B, гамма (PKBγ), протеинкиназы C, мю (PKCμ), протеинкиназы D2 (PKD2), киназы 2, родственной протеинкиназе С (PRK2), сыворотка/глюкокортикоид регулируемой киназы 3 (SGK3), протоонкогенных тирозин-протеинкиназ Src (Src), тирозинкиназы селезенки (Syk), Tec протеинтирозинкиназы (Tec), киназы 2 эндотелиальных клеток внутренней оболочки (Tie2), рецептора А тирозинкиназы (TrkA), рецептора факторов роста BDNF/NT-3 (TrkB), протеинкиназы 70 кДа, ассоциированной с зета-цепью (TCR) (ZAP-70) и ZIP киназы (ZIPK).
Комбинированная терапия
В соответствии с несколькими вариантами осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство.
В соответствии с некоторыми такими вариантами осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трифторуксусную кислоту), ботулиновый токсин типа A, или сочетания указанного.
В соответствии с другим вариантом осуществления дополнительное терапевтическое средство представляет собой противовоспалительное средство.
В соответствии с несколькими вариантами осуществления противовоспалительное средство представляет собой стероидное противовоспалительное средство. Термин «стероидное противовоспалительное средство» в контексте настоящего изобретения относится к любому из многочисленных соединений, содержащих 17-углеродную 4-кольцевую систему и включает стеролы, различные гормоны (в виде анаболических стероидов) и гликозиды. Характерные примеры стероидных противовоспалительных средств включают, без ограничения, кортикостероиды, такие как гидрокортизон, гидроксилтриамцинолон, альфа-метилдексаметазон, дексаметазон-фосфат, беклометазона дипропионаты, клобетазола валерат, десонид, дезоксиметазон, дезоксикортикостерона ацетат, дексаметазон, дихлоризон, дифлукортолона валерат, флуадренолон, флуклоролона ацетонид, флуметазона пивалат, флуосинолона ацетонид, флуоцинонид, сложные бутиловые эфиры флукортина, флуокортолон, флупреднидена (флупреднилидена) ацетат, флурандренолон, галцинонид, гидрокортизона ацетат, гидрокортизона бутират, метилпреднизолон, триамцинолона аетонид, кортизон, кортодоксон, флуцетонид, флудрокортизон, дифлуорозона диацетат, флурадренолон, флудрокортизон, дифлорозона диацетат, флурадренолона ацетонид, медризон, амцинафел, амцинафид, бетаметазон и баланс его сложных эфиров, хлоропреднизон, хлорпреднизона ацетат, клокортелон, слесцинолон, дихлоризон, дифлурпреднат, флуслоронид, флунизолид, флуорометалон, флуперолон, флупреднизолон, ридрокортизона валерат, гидрокортизона циклопентилпропионат, гидрокортамат, мепреднизон, параметазон, преднизолон, преднизон, беклометазона дипропионат, триамцинолон, и их смеси.
В соответствии с другим вариантом осуществления противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Термин «нестероидное противовоспалительное средство» в контексте настоящего изобретения относится к большой группе средств, которые подобны аспирину по своему действию, в том числе, но не только, ибупрофен (Advil®), напроксен натрий (Aleve®) и ацетаминофен (Tylenol®). Дополнительные примеры нестероидных противовоспалительных средств, которые используются в контексте описанного изобретения включают без ограничения, оксикамы, такие как пироксикам, изоксикам, теноксикам, судоксикам, и CP-14,304; дисалцид, бенорилат, трилизат, сафаприн, солприн, дифлунизал и фендозал; производные уксусной кислоты, такие как диклофенак, фенклофенак, индометацин, сулиндак, толметин, изоксепак, фурофенак, тиопинак, зидометацин, ацематацин, фентиазак, зомепирак, клинданак, оксепинак, фелбинак, и кеторолак; фенаматы, такие как мефенамовая, меклофенамовая, флуфенамовая, нифлумовая и толфенамовая кислоты; производные пропионовой кислоты, такие как беноксапрофен, флурбипрофен, кетопрофен, фенопрофен, фенбуфен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, миропрофен, тиоксапрофен, супрофен алминопрофен, и тиапрофеновая кислота; пиразолы, такие как фенилбутазон, оксифенбутазон, фепразон, азапропазон и триметазон. Также могут быть использованы смеси этих нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, этофенамат, производное флуфенаминовой кислоты, является особенно полезным для местного применения.
В соответствии с другим вариантом осуществления противовоспалительное средство включает, без ограничения, трансформирующий фактор роста-бета3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α), или сочетания указанного.
В соответствии с несколькими вариантами осуществления терапевтический пептид по настоящему изобретению не оказывает воздействия на нормальное заживление раны. В соответствии с некоторыми другими вариантами осуществления терапевтический пептид по настоящему изобретению способен оказывать антибактериальное воздействие на рану.
В соответствии с несколькими вариантами осуществления дополнительное средство представляет собой обезболивающее средство. В соответствии с несколькими вариантами осуществления обезболивающее средство облегчает боль путем повышения порога болевой чувствительности без нарушения сознания или изменения других сенсорных модальностей. В соответствии с некоторыми такими вариантами осуществления обезболивающее средство представляет собой неопиоидное обезболивающее средство. «Неопиоидные анальгетики» представляют собой природные или синтетические вещества, которые уменьшают боль, но не являются опиоидными анальгетиками. Примеры неопиоидных анальгетиков включают, но не ограничиваются, этодолак, индометацин, сулиндак, толметин, мелоксикам, пироксикам, ацетаминофен, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрий, оксапрозин, аспирин, холин трисалицилат магния, дифлунизал, меклофенамовую кислоту, мефенамовую кислоту, и фенилбутазон. В соответствии с некоторыми другими вариантами осуществления анальгетик представляет собой опиоидный анальгетик. «Опиоидные анальгетики», «опиоид», или «наркотические анальгетики» представляют собой природные или синтетические вещества, которые связываются с опиоидными рецепторами в центральной нервной системе, оказывая агонистическое действие. Примеры опиоидных анальгетиков включают, но не ограничиваются, кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, прококсифен, бупренорфин, буторфанол, дезоцин, нальбуфин и пентазоцин.
В соответствии с другим вариантом осуществления дополнительным средством является дезинфицирующее средство. В соответствии с другим вариантом осуществления дезинфицирующим средством является антибиотик. Термин «антибиотик» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать бактерии, и другие микроорганизмы, используемые, главным образом, при лечении инфекционных заболеваний. Примеры антибиотиков включают, но не ограничиваются, пенициллин G; метициллин; нафциллин; оксациллин; клоксациллин; диклоксациллин; ампициллин; амоксициллин; тикарциллин; карбенициллин; мезлоциллин; азлоциллин; пиперациллин; имипенем; азтреонам; цефалотин; цефаклор; цефокситин; цефуроксим; цефоницид; цефметазол; цефотетан; цефпрозил; лоракарбеф; цефетамет; цефоперазон; цефотаксим; цефтизоксим; цефтриаксон; цефтазидим; цефепим; цефиксим; цефподоксим; цефсулодин; флероксацина; налидиксовой кислоты; норфлоксацин; ципрофлоксацин; офлоксацин; эноксацин; ломефлоксацин; циноксацин; доксициклин; миноциклин; тетрациклин; амикацин; гентамицин; канамицин; нетилмицин; тобрамицина; стрептомoмицин; кларитромицин; эритромицин; эритромицин эстолат; эритромицин этилсукцината; эритромицин глюкогептонат; эритромицин лактобионат; стеарат эритромицин; ванкомицин; тейкопланин; хлорамфеникол; клиндамицин; триметоприм; сульфаметоксазол; нитрофурантоин; рифампицин; мупироцин; метронидазол; цефалексин; рокситромицин; со-амоксиклавуанат; сочетания пиперациллина и тазобактама; и их различные соли, кислоты, основания и другие производные. антибактериальные антибиотики включают, но не ограничиваются, пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, аминогликозиды, монобактамы, гликопептиды, хинолоны, тетрациклины, макролиды, фторхинолоны и фторхинолоны.
Другие примеры по меньшей мере одного дополнительного терапевтического средства, включают, но не ограничиваются, масло шиповника, витамин Е, 5-фторурацил, блеомицин, экстракт лука, пентоксифиллин, пролил-4-гидроксилазу, верапамил, циклоспорин, тамоксифен, третиноин, колхицин, антагонист кальция, траниласт, цинк, антибиотик, и их сочетание.
Уменьшение нецелевых воздействий
В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует киназную активность по меньшей мере одной киназы, выбранной из группы митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI), рецептора факторов роста BDNF/NT-3 (TrkB), или сочетания указанных, без значительного ингибирования активности одного или более нецелевых белков. В соответствии с некоторыми такими вариантами осуществления нецелевой белок представляет собой нецелевую киназу или нецелевой рецептор.
В соответствии с несколькими вариантами осуществления нецелевой белок выбран из группы, состоящей из гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Abl), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (T3151) (Abl (T3151)), гомолога вирусного онкогена мышиного лейкоза Абельсона 1 (Y253F) (Abl (Y253F)), киназы анапластической лимфомы (ALK), гена, связанного с лейкозом Абельсона (Arg), 5'-каталитической субъединицы альфа-1 АМФ-активированной протеинкиназы (AMPKα1), 5'-каталитической субъединицы альфа-2 АМФ-активированной протеинкиназы (AMPKα2), AMPK-родственной протеинкиназы 5 (ARK5), киназы 1, регулирующей сигнал апоптоза (ASK1), киназы Aurora B (Aurora-B), AXL рецептороной тирозинкиназы (Axl), цитоплазматической тирозиновой протеинкиназы (Bmx), киназы рака груди (BRK), тирозинкиназы Брутона (BTK), тирозинкиназы Брутона (R28H) (BTK (R28H)), Ca2+/кальмодулин-зависимой протеинкиназы IIβ (CaMIIβ), Ca2+/кальмодулин-зависимой протеинкиназы IIγ (CaMKIIγ), Ca2+/кальмодулин-зависимой протеинкиназы δ (CaMKIδ), Ca2+/кальмодулин-зависимой протеинкиназы IIδ (CaMKIIδ), Ca2+/кальмодулин-зависимой протеинкиназы IV (CaMKIV), киназы клеточного деления 2 (CDK2/циклинE), киназы клеточного деления 3 (CDK3/циклинE), киназы клеточного деления 6 (CDK6/циклинD3), киназы клеточного деления 7 (CDK7/циклинH/MAT1), киназы клеточного деления 9 (CDK9/циклин T1), киназы контрольной точки 2 (CHK2), киназы контрольной точки 2 (1157T) (CHK2 (1157T)), киназы контрольной точки 2 (R145W) (CHK2 (R145W)), прото-онкогенных тирозин-протеинкиназ cKit (D816V) (cKit (D816V)), C-src тирозинкиназы (CSK), Raf прото-онкогенной серин/треонин протеинкиназы (c-RAF), прото-онкогенных тирозин-протеинкиназ (cSRC), гибель-ассоциированной протеинкиназы 1 (DAPK1), гибель-ассоциированной протеинкиназы 2 (DAPK2), протеинкиназы миотонической дистрофии (DMPK), DAP киназа-зависимой апоптоз-индуцирующей протеинкиназы 1 (DRAK1), рецептора эпидермального фактора роста (EGFR), рецептора эпидермального фактора роста (EGFR L858R), рецептора эпидермального фактора роста L861Q (EGFR (L861Q)), Eph рецептора A2 (EphA2) (EphA2), Eph рецептора A3 (EphA3), Eph рецептора A5 (EphA5), Eph рецептора B2 (EphB2), Eph рецептора B4 (EphB4), гомолога 4 вирусного онкогена эритробластного лейкоза (ErbB4), тирозинкиназы c-Fes белка (Fes), рецептора 2 фактора роста фибробластов (FGFR2), рецептора 3 фактора роста фибробластов (FGFR3), рецептора 4 фактора роста фибробластов (FGFR4), рецептора 3 Fms-подобной тирозинкиназы (Flt3), FMS прото-онкогена (Fms), ядерной протеинкиназы, специфичной для гаплоидных зародышевых клеток (Haspin), рецептора, родственного рецептору инсулина (IRR), интерлейкин-1 рецептор-ассоциированной киназы 1 (IRAK1), интерлейкин-1 рецептор-ассоциированной киназы 4 (IRAK4), IL2-индуцируемой Т-клеточной киназы (Itk), рецептора, содержащего домен вставки киназы (KDR), лимфоцитарной клеточно-специфичной протеин-тирозинкиназы (Lck), лимфоцит-ориентированной киназы (LOK), Lyn тирозин протеинкиназы (Lyn), MEK1, материнской эмбриональной киназы с лейциновой застежкой (MELK), c-Mer протоонкогенной тирозинкиназы (Mer), c-Met протоонкогенной тирозинкиназы (Met), c-Met протоонкогенной тирозинкиназы D1246N (Met (D1246N)), c-Met протоонкогенной тирозинкиназы Y1248D (Met Y1248D), Misshapen/NIK-родственной киназы (MINK), MAP киназы киназы 6 (MKK6), киназы легкой цепи миозина (MLCK), киназы 1 различных линий дифференцировки (MLK1), киназы 2, интегрирующей сигнал MAP киназы (MnK2), родственной киназе миотонической дистрофии CDC42-связывающей киназы альфа (MRCKα), родственной киназе миотонической дистрофии CDC42-связывающей киназы бета (MRCKβ), митоген- и стресс-активируемой протеинкиназы 1 (MSK1), митоген- и стресс-активируемой протеинкиназы 2 (MSK2), мышечно-специфичной серин киназы 1 (MSSK1), протеинкиназы 1, подобной STE20 млекопитающих (MST1), протеинкиназы 2, подобной STE20 млекопитающих (MST2), протеинкиназы 3, подобной STE20 млекопитающих (MST3), тирозинпротеинкиназы рецептора скелетных мышц (MuSK), немитотической А-родственной киназы 2 (NEK2), немитотической А-родственной киназы 3 (NEK3), немитотической А-родственной киназы 11 (NEK11), киназы 1 рибосомального белка S6 70 кДа (p70S6K), PAS домен содержащей серин/треонин киназы (PASK), субъединицы гамма-2 киназы фосфорилазы (PhKγ2), Pim-1 киназы (Pim-1), протеинкиназы B альфа (PKBα), протеинкиназы B бета (PKBβ), протеинкиназы B гамма (PKBγ), протеинкиназы C, альфа (PKCα), протеинкиназы C, бета1 (PKCβ1), протеинкиназы C, бета II (PKCβII), протеинкиназы C, гамма (PKCγ), протеинкиназы C, эпсилон (PKCε), протеинкиназы C, иота (PCKτ), протеинкиназы C, мю (PKCμ), протеинкиназы C, зета (PKCζ), протеинкиназы D2 (PKD2), цГМФ-зависимой протеинкиназы 1 альфа (PKG1α), цГМФ-зависимой протеинкиназы 1 бета (PKG1β), киназы 2, родственной протеинкиназе С (PRK2), богатой пролином тирозинкиназы 2 (Pyk2), прото-онкогенных тирозин-протеинкиназ receptor Ret V804L (Ret (V804L)), взаимодействующей с рецептором серин-треонинкиназы 2 (RIPK2), Rho-ассоциированной протеинкиназы I (ROCK-I), Rho-ассоциированной протеинкиназы II (ROCK-II), киназы 1 рибосомального белка S6 (Rsk1), киназы 2 рибосомального белка S6 (Rsk2), киназы 3 рибосомального белка S6 (Rsk3), киназы 4 рибосомального белка S6 (Rsk4), стресс-активированной протеинкиназы 2A T106M (SAPK2a, T106M), стресс-активированной протеинкиназы 3 (SAPK3), сыворотка/глюкокортикоид регулируемой киназы (SGK), сыворотка/глюкокортикоид регулируемой киназы 2 (SGK2), сыворотка/глюкокортикоид регулируемой киназы 3 (SGK3), прото-онкогенных тирозин-протеинкиназ Src 1-530 (Src, 1-530), серин/треонин-протеинкиназы 33 (STK33), тирозинкиназы селезенки (Syk), белка 1 тысяча и одной аминокислоты (TAO1), белка 2 тысяча и одной аминокислоты (TAO2), белка 3 тысяча и одной аминокислоты (TAO3), TANK-связывающей киназы 1 (TBK1), Tec протеинтирозинкиназы (Tec), киназы 2 эндотелиальных клеток внутренней оболочки (Tie2), рецептора А тирозинкиназы (TrkA), TXK тирозинкиназы (Txk), WNK протеинкиназы 2 с недостатком лизина (WNK2), WNK протеинкиназы 3 с недостатком лизина (WNK3), гомолог 1 вирусного онкогена саркомы Ямагучи (Yes), протеинкиназы 70 кДа, ассоциированной с зета-цепью (TCR) (ZAP-70) и ZIP киназы (ZIPK).
В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 ингибирует связывающую активность нецелевого белка с активностью ингибирования величины IC50 по меньшей мере примерно 30 мкМ.
В соответствии с несколькими вариантами осуществления нецелевая киназа выбрана из группы, состоящей из киназы анапластической лимфомы (ALK), 5'-каталитической субъединицы альфа-1 АМФ-активированной протеинкиназы (AMPKα1), 5'-каталитической субъединицы альфа-2 АМФ-активированной протеинкиназы (AMPKα2), AMPK-родственной протеинкиназы 5 (ARK5), киназы 1, регулирующей сигнал апоптоза (ASK1), Aurora киназы B (Aurora-B), AXL receptor тирозинкиназы (Axl), цитоплазматической тирозиновой протеинкиназы (Bmx), киназы рака груди (BRK), тирозинкиназы Брутона (BTK), тирозинкиназы Брутона (R28H) (BTK (R28H)), Ca2+/кальмодулин-зависимой протеинкиназы IIβ (CaMIIβ), Ca2+/кальмодулин-зависимой протеинкиназы IIγ (CaMKIIγ), Ca2+/кальмодулин-зависимой протеинкиназы δ (CaMKIδ), Ca2+/кальмодулин-зависимой протеинкиназы IIδ (CaMKIIδ), Ca2+/кальмодулин-зависимой протеинкиназы IV (CaMKIV), киназы клеточного деления 2 (CDK2/циклинE), киназы клеточного деления 3 (CDK3/циклинE), киназы клеточного деления 6 (CDK6/циклинD3), киназы клеточного деления 7 (CDK7/циклинH/MAT1), киназы клеточного деления 9 (CDK9/циклин T1), киназы контрольной точки 2 (CHK2), киназы контрольной точки 2 (1157T) (CHK2 (1157T)), киназы контрольной точки 2 (R145W) (CHK2 (R145W)), прото-онкогенных тирозин-протеинкиназ cKit (D816V) (cKit (D816V)), C-src тирозинкиназы (CSK), Raf прото-онкоген серин/треонин протеинкиназы (c-RAF), прото-онкогенных тирозин-протеинкиназ (cSRC), гибель-ассоциированной протеинкиназы 1 (DAPK1), гибель-ассоциированной протеинкиназы 2 (DAPK2), протеинкиназы миотонической дистрофии (DMPK), DAP киназа-зависимой апоптоз-индуцирующей протеинкиназы 1 (DRAK1), рецептора 3 Fms-подобной тирозинкиназы (Flt3), ядерной протеинкиназы, специфичной для гаплоидных зародышевых клеток (Haspin), рецептора, родственного рецептору инсулина (IRR), Интерлейкин-1 рецептор-ассоциированной киназы 1 (IRAK1), интерлейкин-1 рецептор-ассоциированной киназы 4 (IRAK4), IL2-индуцируемой Т-клеточной киназы (Itk), лимфоцитарной клеточно-специфичной протеин-тирозинкиназы (Lck), лимфоцит-ориентированной киназы (LOK), Lyn тирозин протеинкиназы (Lyn), MEK1, материнской эмбриональной киназы с лейциновой застежкой (MELK), c-Mer протоонкогенной тирозинкиназы (Mer), c-Met протоонкогенной тирозинкиназы (Met), c-Met протоонкогенной тирозинкиназы D1246N (Met (D1246N)), c-Met протоонкогенной тирозинкиназы Y1248D (Met Y1248D), Misshapen/NIK-родственной киназы (MINK), MAP киназы киназы 6 (MKK6), киназы легкой цепи миозина (MLCK), киназы 1 различных линий дифференцировки (MLK1), киназы 2, интегрирующей сигнал MAP киназы (MnK2), родственной киназе миотонической дистрофии CDC42-связывающей киназы альфа (MRCKα), родственной киназе миотонической дистрофии CDC42-связывающей киназы бета (MRCKβ), митоген- и стресс-активируемой протеинкиназы 1 (MSK1), митоген- и стресс-активируемой протеинкиназы 2 (MSK2), мышечно-специфичной серин киназы 1 (MSSK1), протеинкиназы 1, подобной STE20 млекопитающих (MST1), протеинкиназы 2, подобной STE20 млекопитающих (MST2), протеинкиназы 3, подобной STE20 млекопитающих (MST3), тирозинпротеинкиназы рецептора скелетных мышц (MuSK), немитотической А-родственной киназы 2 (NEK2), немитотической А-родственной киназы 3 (NEK3), немитотической А-родственной киназы 11 (NEK11), киназы 1 рибосомального белка S6 70 кДа (p70S6K), PAS домен содержащей серин/треонин киназы (PASK), субъединицы гамма-2 киназы фосфорилазы (PhKγ2), Pim-1 киназы (Pim-1), протеинкиназы B альфа (PKBα), протеинкиназы B бета (PKBβ), протеинкиназы B гамма (PKBγ), протеинкиназы C, альфа (PKCα), протеинкиназы C, бета1 (PKCβ1), протеинкиназы C, бета II (PKCβII), протеинкиназы C, гамма (PKCγ), протеинкиназы C, эпсилон (PKCε), протеинкиназы C, иота (PCKτ), протеинкиназы C, мю (PKCμ), протеинкиназы C, зета (PKCζ), протеинкиназы D2 (PKD2), цГМФ-зависимой протеинкиназы 1 альфа (PKG1α), цГМФ-зависимой протеинкиназы 1 бета (PKG1β), киназы 2, родственной протеинкиназе С (PRK2), богатой пролином тирозинкиназы 2 (Pyk2), прото-онкогенных тирозин-протеинкиназ receptor Ret V804L (Ret (V804L)), взаимодействующей с рецептором серин-треонинкиназы 2 (RIPK2), Rho-ассоциированной протеинкиназы I (ROCK-I), Rho-ассоциированной протеинкиназы II (ROCK-II), киназы 1 рибосомального белка S6 (Rsk1), киназы 2 рибосомального белка S6 (Rsk2), киназы 3 рибосомального белка S6 (Rsk3), киназы 4 рибосомального белка S6 (Rsk4), стресс-активированной протеинкиназы 2A T106M (SAPK2a, T106M), стресс-активированной протеинкиназы 3 (SAPK3), сыворотка/глюкокортикоид регулируемой киназы (SGK), сыворотка/глюкокортикоид регулируемой киназы 2 (SGK2), сыворотка/глюкокортикоид регулируемой киназы 3 (SGK3), прото-онкогенных тирозин-протеинкиназ Src 1-530 (Src, 1-530), серин/треонин-протеинкиназы 33 (STK33), тирозинкиназы селезенки (Syk), белка 1 тысяча и одной аминокислоты (TAO1), белка 2 тысяча и одной аминокислоты (TAO2), белка 3 тысяча и одной аминокислоты (TAO3), TANK-связывающей киназы 1 (TBK1), Tec протеинтирозинкиназы (Tec), киназы 2 эндотелиальных клеток внутренней оболочки (Tie2), рецептора А тирозинкиназы (TrkA), TXK тирозинкиназы (Txk), WNK протеинкиназы 2 с недостатком лизина (WNK2), WNK протеинкиназы 3 с недостатком лизина (WNK3), гомолог 1 вирусного онкогена саркомы Ямагучи (Yes), протеинкиназы 70 кДа, ассоциированной с зета-цепью (TCR) (ZAP-70) и ZIP киназы (ZIPK).
В соответствии с несколькими вариантами осуществления нецелевой белок представляет собой нецелевую киназу. В соответствии с некоторыми такими вариантами осуществления фармацевтическая композиция ингибирует менее 50% киназной активности нецелевой киназы. В соответствии с таким вариантом осуществления фармацевтическая композиция ингибирует менее 65% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 50% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 40% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 20% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 15% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 10% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 9% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 8% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 7% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 6% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 5% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 4% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 3% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 2% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 1% киназной активности нецелевой киназы. В соответствии с другим вариантом осуществления фармацевтическая композиция характеризуется повышением киназной активности нецелевой киназы.
В соответствии с несколькими вариантами осуществления нецелевой белок представляет собой нецелевой рецептор. В соответствии с некоторыми такими вариантами осуществления фармацевтическая композиция ингибирует менее 50% связывающей активности нецелевого рецептора. В соответствии с таким вариантом осуществления фармацевтическая композиция ингибирует менее 65% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 50% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 40% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 20% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 15% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 10% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 9% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 8% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 7% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 6% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 5% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 4% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 3% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 2% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция ингибирует менее 1% связывающей активности нецелевого рецептора. В соответствии с другим вариантом осуществления фармацевтическая композиция повышает связывающую активность нецелевого рецептора.
В соответствии с несколькими вариантами осуществления нецелевой рецептор выбран из группы, состоящей из ангиотензина 2, бомбезина, меланокортина 4, нейрокинина 2, нейропептида Y, серотонина 2А, вазоактивного интестинального пептида и активируемых кальцием К+ каналов низкой проводимости. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой ангиотензин 2. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой бомбезин. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой меланокортин 4. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой нейрокинин 2. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой нейропептид Y. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой серотонин 2A. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой вазоактивный интестинальный пептид. В соответствии с одним вариантом осуществления нецелевой рецептор представляет собой активируемый кальцием K+ канал низкой проводимости.
В соответствии с несколькими вариантами осуществления одна или несколько других выбранных киназ, которые по существу не ингибируются, выбраны из группы Ca2+/кальмодулин-зависимой протеинкиназы II (CaMKII, включая ее субъединицу CaMKIIδ), протоонкогенной серин/треонин-протеинкиназы (PIM-1), клеточной саркомы (c-SRC), тирозинкиназы селезенки (SYK), c-Src тирозинкиназы (CSK) и рецептора инсулин-подобного фактора роста 1 (IGF-1R).
В соответствии с несколькими вариантами осуществления для повышения лекарственной эффективности и для уменьшения накопления полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента в нецелевых тканях, полипептид по настоящему изобретению аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент может быть связан или ассоциирован с фунциональной группой, обеспечивающей направленную доставку, которая направляет полипептид к специфическому типу клеток или ткани. Примеры функциональной группы, обеспечивающей направленную доставку, включают, но не ограничиваются, (i) лиганд для известного или неизвестного рецептора или (ii) соединение, пептид или моноклональное антитело, которое связывается со специфической молекулой-мишенью, например, пептидом или углеводом, экспрессируемым на поверхности специфического типа клеток. В соответствии с другим вариантом осуществления функциональный эквивалент полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид представляет собой полипептид аминокислотной последовательности YARAAARQARA (SEQ ID NO: 11), и второй полипептид включает терапевтический домен, последовательность которого имеет существенную идентичность с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 70 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 80 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 90 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 95 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2).
В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8). В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9). В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10); смотри, например, опубликованную заявку США № 2009-0196927, опубликованную заявку США № 2009-0149389 и опубликованную заявку США № 2010-0158968, каждая из которых включена в настоящее описание посредством ссылки в полном объеме.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид включает домен белковой трансдукции функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), и второй полипептид is аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17). В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
Терапевтическое количество/Доза
В соответствии с несколькими вариантами осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,00001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,0001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,001 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,01 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,1 мг/кг (или 100 мкг/кг) массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 1 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 10 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 2 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 3 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 4 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 5 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 60 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 70 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 80 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 90 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 90 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 80 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 70 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 60 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 50 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 40 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 30 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 20 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,01 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,001 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,0001 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,00001 мг/кг массы тела.
В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 25 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 2 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 2 мкг/кг/сутки до 3 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 3 мкг/кг/сутки до 4 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 4 мкг/кг/сутки до 5 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора фармацевтической композиции находится в интервале от 5 мкг/кг/сутки до 6 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 6 мкг/кг/сутки до 7 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 7 мкг/кг/сутки до 8 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 8 мкг/кг/сутки до 9 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 9 мкг/кг/сутки до 10 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 5 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 5 мкг/кг/сутки до 10 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 10 мкг/кг/сутки до 15 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 15 мкг/кг/сутки до 20 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 25 мкг/кг/сутки до 30 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 30 мкг/кг/сутки до 35 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 35 мкг/кг/сутки до 40 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 40 мкг/кг/сутки до 45 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 45 мкг/кг/сутки до 50 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 50 мкг/кг/сутки до 55 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 55 мкг/кг/сутки до 60 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 60 мкг/кг/сутки до 65 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 65 мкг/кг/сутки до 70 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 70 мкг/кг/сутки до 75 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 80 мкг/кг/сутки до 85 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 85 мкг/кг/сутки до 90 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 90 мкг/кг/сутки до 95 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 95 мкг/кг/сутки до 100 мкг/кг/сутки.
В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 1 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 2 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 5 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 10 мкг/кг/сутки.
Составы
Полипептидный ингибитор МК2 или его функциональный эквивалент можно вводить в форме фармацевтически приемлемой соли. При использовании в медицине соли должны быть фармацевтически приемлемыми, но нефармацевтически приемлемые соли удобно использовать для поучения их фармацевтически приемлемых солей. Такие соли включают, но не ограничиваются, соли, полученные из следующих кислот: хлористоводородной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, п-толуолсульфоновой, винной, лимонной, метансульфокислоты, муравьиной, малоновой, янтарной, нафталин-2-сульфоновой и бензолсульфоновой. Также, такие соли могут быть получены как соли щелочного или щелочноземельного металла, такие как соли натрия, калия или кальция группы карбоновой кислоты. Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, P. H. Stahl, et al. описывают фармацевтически приемлемые соли подробно в «Handbook of Pharmaceutical Salts: Properties, Selection, и Use» (Wiley VCH, Zurich, Switzerland: 2002). Эти соли могут быть получены in situ во время конечного выделения и очистки соединений, описанных в настоящем изобретении, или могут быть получены путем отдельного взаимодействия функциональной группы свободного основания с подходящей органической кислотой. Характерные кислотно-аддитивные соли включают, но не ограничиваются, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат , метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Также основные азот-содержащие группы могут быть кватернизированы такими агентами, как низшие алкилгалиды, такие как метил, этил, пропил, и бутил хлориды, бромиды и йодиды; диалкилсульфаты как диметил, диэтил, дибутил и диамилсульфаты; галиды с длинной цепью, такие как децил, лаурил, миристил и стеарил хлориды, бромиды и йодиды; арилалкилгалиды, наподобие бензила и фенэтилбромиды и другие. Таким образом получают водные или растворимые в масле или диспергируемые продукты. Примеры кислот, которые могут быть использованы для образования фармацевтически приемлемых кислотно-аддитивных солей, включают такие неорганические кислоты, как соляная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота и такие органические кислоты, как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота. Основно-аддитивные соли могут быть получены in situ во время конечного выделения и очистки соединений, описанных в настоящем изобретении, путем взаимодействия функциональной группы, содержащей карбоновую кислоту, с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла или с аммиаком или органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают, но не ограничиваются, катионы, основанные на щелочных металлах или щелочноземельных металлах, такие как соли лития, натрия, калия, кальция, магния и алюминия и подобные, и нетоксичные катионы четвертичного аммония и катионы аминов, включая аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин и подобные. Другие характерные органические амины, подходящие для образования основно-аддитивных солей, включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и подобные. Фармацевтически приемлемые соли также могут быть получены с использованием стандартных методик, хорошо известных из уровня техники, например, путем взаимодействия достаточно основного соединения, такого как амин, с подходящей кислотой, предоставляющей физиологически приемлемый анион. Также могут быть получены соли щелочного металла (например, натрия, калия или лития) или щелочноземельного металла (например, кальция или магния) карбоновых кислот.
Лекарственные составы могут быть удобно представлены в единичной дозированной форме и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию объединения терапевтического средства (средств), или фармацевтически приемлемой соли или ее сольвата («активное соединение») с носителем, который состоит из одного или более вспомогательных веществ. В основном, лекарственные составы получают однородного и тщательного объединения активного агента с жидкими носителями или мелкоизмельченными твердыми носителями или и тем, и другим, а затем, при необходимости, придают продукту форму желаемого состава.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель с контролируемым высвобождением. Термин «контролируемое высвобождение» означает любой состав, содержащий лекарственное средство, в котором тип и профиль высвобождения лекарственного средства из состава контролируется. Контролируемое высвобождение включает как составы немедленного высвобождения, так и составы медленного высвобождения в том числе, но не только, составы длительного высвобождения и замедленного высвобождения. В соответствии с несколькими вариантами осуществления контролируемое высвобождение фармацевтической композиции опосредуется изменениями температуры. В соответствии с некоторыми другими вариантами осуществления контролируемое высвобождение фармацевтической композиции опосредуется изменениями pH.
Инъекционные депо-формы могут быть получены путем формирования микроинкапсулированных матриц терапевтического средства/лекарственного вещества в биоразлагаемых полимерах, таких как, но не только, сложные полиэфиры (полигликолид, полимолочная кислота и их сочетания), сополимеры сложных полиэфиров и полиэтиленгликоля, биополимеры, производные полиаминов, полиангидриды, сложные полиортоэфиры, полифосфазены, ацетат-изобутират сахарозы (SAIB), фотополимеризуемые биополимеры, природные биополимеры, белковые полимеры, коллаген и полисахариды. В зависимости от соотношения лекарственного средства и полимера и природы конкретно используемого полимера, можно контролировать скорость высвобождения лекарственного средства. Такие лекарственные составы длительного действия могут быть получены с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в подходящем масле) или ионобменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Депо-инъекционные составы также могут быть получены путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель с замедленным высвобождением. В соответствии с другим вариантом осуществления носитель с замедленным высвобождением включает биоразлагаемый полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой синтетический полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой природный полимер.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель длительного высвобождения. В соответствии с другим вариантом осуществления носитель длительного высвобождения включает биоразлагаемый полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой синтетический полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой природный полимер.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель кратковременного высвобождения. Термин «кратковременное» высвобождение в контексте настоящего изобретения, означает, что имплант выполнен и составлен для доставки терапевтических уровней активного ингредиента примерно в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 часов. В соответствии с некоторыми другими вариантами осуществления носитель кратковременного высвобождения доставляет терапевтические уровни активного ингредиента примерно в течение 1, 2, 3 или 4 дней.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель длительного высвобождения. В соответствии с другим вариантом осуществления носитель длительного высвобождения включает биоразлагаемый полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой синтетический полимер.
В соответствии с несколькими вариантами осуществления носитель включает частицы. Термин «частицы» в контексте настоящего изобретения относится к чрезвычайно малому компоненту (например, наночастицы, микрочастицы или, в некоторых случаях, более крупные) в которых или на которых содержится композиция, описанная в настоящем изобретении.
Композиции также могут содержать соответствующие адъюванты, включая, без ограничения, консерванты, увлажнители, эмульгаторы и диспергирующие агенты. Защита от действия микроорганизмов может быть обеспечена различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и подобными. Также может быть желательным включать изотонические агенты, например, сахара, хлорид натрия и подобные. Пролонгированное всасывание инъекционной фармацевтической формы может быть достигнута при использовании агентов, задерживающих абсорбцию, например, моностеарат алюминия и желатин.
В соответствии с несколькими вариантами осуществления полипептиды по настоящему изобретению ковалентно присоединены к полимерным цепям полиэтиленгликоля (PEG). В соответствии с некоторыми другими вариантами осуществления полипептиды по настоящему изобретению сшиты с углеводородами для получения углеводород-сшитых пептидов, которые способны образовывать стабильную альфа-спиральную структуру (Schafmeister, C. et al., J. Am. Chem. Soc., 2000, 122, 5891-5892, включено в настоящее описание посредством ссылки в полном объеме).
В соответствии с некоторыми другими вариантами осуществления полипептиды по настоящему изобретению инкапсулированы или заключены в микросферы, нанокапсулы, липосомы или микроэмульсии, или содержат d-аминокислоты для повышения стабильности, для удлинения доставки или для изменения активности пептидов. Эти методики хорошо известны из уровня техники и могут продлевать стабильность и высвобождение одновременно на часы и дни, или задерживать поглощение лекарственного средства близлежащими клетками.
II. Повязки для лечения, уменьшения или профилактики кожных рубцов
В соответствии с другим аспектом описанное изобретение относится к повязке для использования при лечении кожного рубца у пациента, нуждающегося в этом, содержащей фармацевтическую композицию, содержащую терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2), содержащего полипептидный ингибитор или его функциональный эквивалент, и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным для лечения, уменьшения или профилактики кожного рубца у пациента.
Повязки
В соответствии с одним вариантом осуществления примеры подходящих повязок для целей настоящего изобретения включают, но не ограничиваются, марлевую повязку, сетчатый перевязочный материал, альгинатную повязку, полиуретановую повязку, силиконовую повязку, коллагеновую повязку, синтетический полимерный каркас, пропитанный пептидом шовный материал, или сочетания указанного.
Марлевые повязки могут прилипать к поверхности раны и повреждают раневое ложе при удалении. В результате чего марлевые повязки используют в основном при легких ранах или в качестве вторичных повязок.
Сетчатые перевязочные материалы не прилипают к поверхностям раны. Они подходят для использования при плоских неглубоких ранах, и применяются у пациентов с чувствительной кожей. Примеры сетчатых перевязочных материалов включают, но не ограничиваются, Jelonet® и Paranet®.
Альгинатные повязки состоят из альгината кальция (компонента водорослей). При контакте с раной кальций в повязке обмениваться с натрием из раневой жидкости и это превращает повязку в гель, который поддерживает влажную раневую среду. Эти повязки хороши для эксудирующих ран и помогают в хирургической обработке отторжения некротических масс раны. В основном альгинатные повязки не используют на ранах со скудным эксудатом, поскольку они будут вызывать сухость и образование корок. Альгинатные повязки меняют ежедневно. Примеры альгинатных повязок включают, но не ограничиваются, Kaltostat® и Sorbsan®.
Полиуретановые повязки и повязки из силиконового пеноматериала созданы для абсорбции больших количеств эксудатов. Они поддерживают влажную раневую среду, но не используются как альгинаты или гидроколлоиды для хирургической обработки. В основном их не используют на ранах со скудным эксудатом, поскольку они будут вызывать сухость и образование корок. Примеры полиуретановых повязок и повязок из силиконового пеноматериала включают, но не ограничиваются, Allevyn® и Lyofoam®.
Коллагеновые повязки в основном представлены в форме прокладок, гелей или частиц. Они способствуют отложению вновь образованного коллагена в раневом ложе и абсорбируют эксудат и обеспечивают влажную среду.
Другие подходящие повязки включают окклюзионные повязки. Термин «окклюзионные повязки» в контексте настоящего изобретения относится к повязкам, которые предотвращают достижение воздухом или бактериями раны или повреждения, и которые удерживают влагу, тепло, жидкости организма и лекарственные средства. Традиционные повязки, такие как марлевые и прокладки из перфорированного перевязочного материала (неадгезивные прокладки) способствуют высыханию поверхности раны, а также и прилипают к ней. При удалении повязка сдирает вновь образованный эпителий, вызывая кровотечение и удлинение процесса заживления. Поскольку рана является сухой и треснувшей, движение зачастую является болезненным и сдержанным. Исследования показали, что окклюзионные повязки предотвращают высушивание и образование струпа путем удержания влаги рядом с раневым ложе. В соответствии с некоторыми такими вариантами осуществления окклюзионные повязки представляют собой полностью окклюзионные повязки. В соответствии с некоторыми другими вариантами осуществления окклюзионные повязки являются полупроницаемыми повязками. Примеры пережимающих повязок для целей настоящего изобретения включают, но не ограничиваются, пленочные повязки (полностью окклюзионные повязки), полупроницаемые пленочные повязки, гидрогелевые повязки, гидроколлоидные повязки или сочетания указанного.
Пленочные повязки и полупроницаемые пленочные повязки содержат слои материалов, которые могут быть использованы для покрытия ран. Такие повязки могут содержать стерильные материалы. Подходящие материалы, из которых могут быть изготовлены пленки, включают полиуретан и хитин. Пленочные повязки (или полупроницаемые пленочные повязки) могут быть покрыты адгезивами, такими как акриловые адгезивы, для облегчения их фиксации в требуемых местах. Повязки этого типа могут быть прозрачными и, следовательно, дают возможность проверять течение процесса заживления раны. Эти повязки в основном подходят для неглубоких ран со скудным эксудатом. Примеры пленочных или полупроницаемых пленочных повязок включают, но не ограничиваются, OpSite® и Tegaderm®.
Гидрогелевые повязки главным образом состоят из воды в сложной сети волокон, которые удерживают полимерный гель интактным. Вода высвобождается для поддержания влажности раны. Эти повязки могут быть использованы для некротических ран или ран с загрязненным раневым ложе для регидратации и удаления омертвевших тканей. Их не используют для умеренно и обильно эксудирующих ран. Примеры гидрогелевых повязок включают, но не ограничиваются, Tegagel®, Intrasite®.
Гидроколлоидные повязки состоят из гидрофильных частиц, таких как желатин и пектин, соединенных вместе гидрофобным адгезивным матриксом, и покрыты наружным пленочным или пенистым слоем. Когда гидроколлоиды наносят на рану, любой эксудат в области контакта с раной абсорбируется с образованием разбухшего геля, который заполняет рану и обеспечивает контролируемый градиент абсорбции для остальной повязки. Это создает теплую влажную среду, которая способствует санации раны и заживлению. В зависимости от выбранной гидроколлоидной повязки, они могут подходить для использования в ранах с легким - обильным эксудатом, отторгающих некротические массы или гранулирующих ран. Повязки этого типа доступны во многих формах (адгезивные или неадгезивные прокладки, пасты, порошки), но чаще всего в виде самоклеящихся прокладок. Примеры гидроколлоидных повязок включают, но не ограничиваются, DuoDERM® и Tegasorb®.
Специалист в данной области будет осведомлен, что подходящие повязки для заживления ран, используемые на конкретной ране, могут быть выбраны с учетом типа раны, размера раны и процесса заживления раны.
В соответствии с несколькими вариантами осуществления повязка по настоящему изобретению включает механо-активные повязки. В соответствии с некоторыми такими вариантами осуществления механо-активные повязки выполняют для прикрепления на поверхности кожи рядом с раной с возможностью удаления для натяжения раны. Механо-активные повязки могут защищать рану от эндогенного стресса, исходящего от самой кожи (например, стресса, передаваемого ране через роговой слой, эпидермальную или дермальную ткань), и/или экзогенного стресса (например, стресса, передаваемого ране через физические движения тела или мышечную активность). В некоторых таких вариантах осуществления механо-активные повязки защищают рану от эндогенного стресса без влияния экзогенного стресса на рану. В некоторых других варинатах осуществления механо-активные повязки защищают рану от экзогенного стресса без влияния эндогенного стресса на рану.
Механо-активные повязки могут прикрепляться с возможностью удаления к поверхности кожи различными путями. Например, механо-активные повязки могут быть прикреплены к поверхности кожи с возможностью удаления с использованием клея, с использованием прошивного устройства, или и того, и другого. Подходящие клеи включают, но не ограничиваются, отверждающиеся под давлением клеи на основе полиакрила, на основе полисобутилена и на основе силикона. Подходящие прошивные устройства включают, но не ограничиваются, микроиглы, шовный материал, фиксаторы, шовные скобки, микроскарификаторы и подобное.
В соответствии с несколькими вариантами осуществления механо-активная повязка представляет собой устройство для экранирования напряжений, которое изготавливают, используя силиконовые полимерные пластины (NuSil, Lafayette, CA) и клей, отверждаемый под давлением (NuSil) прикрепленные Teflon® расширяющим пластинам (DuPont, Wilmington, DE) (Gurtner, G. et al., Ann Surg, 254: 217-225, 2011, включено посредством ссылки).
В соответствии с некоторыми другими вариантами осуществления механо-активная повязка включает активное соединение, которое может быть использовано в ускорении процесса заживления ран в некоторых аспектах. Примеры активного соединения включают, но не ограничиваются, дезинфицирующее средство, фактор роста, витамин (например, витамин E), коагулянт, который способствует коагуляции крови (например, тромбин), или сочетания указанного.
В соответствии с другим вариантом осуществления повязка дополнительно содержит заменитель кожи, который заключен в повязку, или находится на поверхности повязки с фармацевтической композицией по настоящему изобретению и обеспечивает трехмерный внеклеточный каркас.
В соответствии с несколькими вариантами осуществления заменитель кожи наносят на рану до ее ушивания. В соответствии с некоторыми другими вариантами осуществления заменитель кожи наносят на рану во время ушивания раны. В соответствии с некоторыми другими вариантами осуществления заменитель кожи наносят на рану после ушивания раны.
В соответствии с другим вариантом осуществления заменитель кожи изготовлен из природного биологического материала, в том числе, но не только, трупной кожи человека, трупной кожи свиньи и подслизистой оболочки тонкой кишки свиньи. В соответствии с другим вариантом осуществления природный биологический материал содержит матрицу. В соответствии с другим вариантом осуществления природный биологический материал главным образом состоит из матрицы, которая по существу лишена остатков клеток.
В соответствии с другим вариантом осуществления заменитель кожи представляет собой структурный биологический материал. Примеры подходящих структурных биологических материалов включают, но не ограничиваются, коллаген, гликозаминогликан, фибронектин, гиалуроновую кислоту, эластин и их сочетания. В соответствии с другим вариантом осуществления структурный биологический материал представляет собой двухслойную неячеистую матрицу для регенерации кожи. В соответствии с другим вариантом осуществления структурный биологический материал представляет собой однослойную ячеистую матрицу для регенерации кожи.
В соответствии с другим вариантом осуществления заменитель кожи представляет собой синтетический заменитель кожи. В соответствии с другим вариантом осуществления синтетический заменитель кожи содержит пептид аминокислотной последовательности аргинин-глицин-аспартат (RGD). В соответствии с другим вариантом осуществления пептид аминокислотной последовательности аргинин-глицин-аспартат (RGD) представляет собой биомиметический пептид. В соответствии с другим вариантом осуществления синтетический заменитель кожи содержит гидрогель.
Ингибитор MK2
В соответствии с одним вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) представляет собой полипептидный ингибитор MK2 или его функциональный эквивалент. В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 выбран из группы, состоящей из полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), полипептида MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), полипептида MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), и полипептида MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с одним вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 90 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 95 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19)
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) дополнительно содержит ингибитор MK2 с низкой молекулярной массой. Приводимые в качестве примера ингибиторы MK2 с низкой молекулярной массой были описаны у Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 15: 1587 (2005); Wu, J. -P. et al., Bioorg. Med. Chem. Lett., 17: 4664 (2007); Trujillo, J. I. et al., Bioorg. Med. Chem. Lett., 17: 4657 (2007); Goldberg, D. R. et al., Bioorg. Med. Chem. Lett., 18: 938 (2008); Xiong, Z. et al., Bioorg. Med. Chem. Lett., 18: 1994 (2008); Anderson, D. R. et al., J. Med. Chem., 50: 2647 (2007); Lin, S. et al., Bioorg. Med. Chem. Lett., 19: 3238 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4878 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4882 (2009); Harris, C. M. et al., Bioorg. Med. Chem. Lett., 20: 334 (2010); Schlapbach, A. et al., Bioorg. Med. Chem. Lett., 18: 6142 (2008); и Velcicky, J. et al., Bioorg. Med. Chem. Lett., 20: 1293 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
В соответствии с некоторыми такими вариантами осуществления ингибитор МК2 с низкой молекулярной массой включает, но не ограничивается:

или сочетания указанного.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой конкурирует с АТФ за связывание с MK2. В соответствии с несколькими вариантами осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина или полициклический аналог лактама.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина. Приводимые в качестве примера аналоги пирролопиридина описаны у Anderson, D. R. et al., «Pyrrolopyridine inhibitors of mitogen-activated protein kinase-activated protein kinase 2 (MK-2)», J. Med. Chem., 50: 2647-2654 (2007), полное описание этого документа включено в настоящую заявку посредством ссылки. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы I: 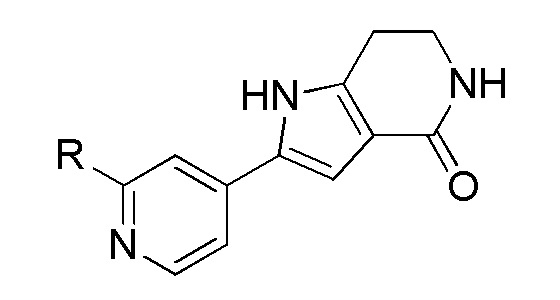 , где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II:
, где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II:  , где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
, где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой полициклический аналог лактама. Приводимые в качестве примера полициклические аналоги лактама описаны у Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part I», Bioorg. Med. Chem. Lett., 20: 4715-4718 (2010); и Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part II,» Bioorg. Med. Chem. Lett., 20: 4719-4723 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
Кожные рубцы
В соответствии с одним вариантом осуществления кожный рубец может быть результатом заживления раны. В соответствии с другим вариантом осуществления рана характеризуется нарушенной активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани по сравнению с активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани здорового контрольного пациента.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью улучшать выравнивание коллагеновых волокон в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения образования витков коллагена в ране.
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ускорения заживления раны по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по данным визуально-аналоговой шкалы (VAS), цветового соответствия (CM), оценки матовости/блеска (M/S), оценки контура (С), оценки деформации (D), оценки степени плотности ткани (Т), или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 30 дней введения.
В соответствии с несколькими вариантами осуществления фармацевтическая композиция обладает способностью модулировать экспрессию гена, связанного с образованием рубцов или продукта гена, связанного с образованием рубцов. В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для модуляции экспрессии гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии матричной РНК (мРНК) гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня продукта гена, связанного с образованием рубцов, экспрессируемого геном, связанного с образованием рубцов.
В соответствии с некоторыми такими вариантами осуществления ген, связанный с образованием рубцов, кодирует одно или более из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с одним вариантом осуществления ген, связанный с образованием рубцов, кодирует Трансформирующий фактор роста-β1 (TGF-β1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует Фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует Интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокинового (С-С мотив) рецептора 2 (CCR2). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует sma/mad-родственного белка (SMAD).
В соответствии с некоторыми такими вариантами осуществления продукт гена, связанного с образованием рубцов, выбран из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) лиганд 2 (CCL2) (или моноцитарный хематактический белок-1 (MCP-1)). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) рецептор 2 (CCR2). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой sma/mad-родственный белок (SMAD).
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью уменьшать инфильтрацию в рану одного или более типов воспалительных или стволовых клеток, в том числе, без ограничения, моноцитов, фиброцитов, макрофагов, лимфоцитов и тучных или дендритных клеток.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной иммуномодулирующей клетки. В соответствии с некоторыми такими вариантами осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов или фиброцитов. В соответствии с одним вариантом осуществления иммуномодулирующая клетка представляет собой тучную клетку. В соответствии с другим вариантом осуществления тучная клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и CD117. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой моноцит. В соответствии с другим вариантом осуществления моноцит характеризуется экспрессией маркеров клеточной поверхности, в том числе, без ограничения, CD11b. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой макрофаг. В соответствии с другим вариантом осуществления макрофаг характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, F4/80. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой T-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит представляет собой хелперный Т-лимфоцит или цитотоксический Т-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD4, CD8, или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной клетки-предшественника. В соответствии с некоторыми такими вариантами осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки, или сочетания указанного. В соответствии с одним вариантом осуществления клетка-предшественник представляет собой гематопоэтическую стволовую клетку. В соответствии с другим вариантом осуществления гематопоэтическая стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и Sca1. В соответствии с другим вариантом осуществления клетка-предшественник представляет собой мезенхимальную стволовую клетку. В соответствии с другим вариантом осуществления мезенхимальная стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, Sca1 и не CD45.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня матричной РНК (мРНК) трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня белка трансформирующего фактора роста-β (TGF-β) в ране.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня медиатора воспаления в ране. В соответствии с несколькими вариантами осуществления медиатор воспаления, модулируемый таким образом, может представлять собой, без ограничения, интерлейкин-1 (IL-1), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли (TNF), интерферон-гамма (IFN-γ), интерлейкин 12 (IL-12), или сочетания указанного.
В соответствии с несколькими вариантами осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, или сочетания указанного. В соответствии с одним вариантом осуществления рана представляет собой царапины. В соответствии с другим вариантом осуществления рана представляет собой рваную рану. В соответствии с другим вариантом осуществления рана представляет собой раздавленную рану. В соответствии с другим вариантом осуществления рана представляет собой закрытую травму. В соответствии с другим вариантом осуществления рана представляет собой колотую рану. В соответствии с другим вариантом осуществления рана представляет собой отрыв. В соответствии с другим вариантом осуществления рана представляет собой ожог. В соответствии с другим вариантом осуществления рана представляет собой язву.
В соответствии с другим вариантом осуществления рана представляет собой операционную рану.
В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, означающий рубец, возникающий как результат заболевания, нарушения, патологического состояния или повреждения.
В соответствии с другим вариантом осуществления патологический рубец представляет собой гипертрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой келоид.
В соответствии с другим вариантом осуществления патологический рубец представляет собой атрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой рубцовую контрактуру.
В соответствии с другим вариантом осуществления кожный рубец представляет собой послеоперационный рубец.
В соответствии с другим вариантом осуществления гипертрофический рубец появляется в результате растяжения. В соответствии с другим вариантом осуществления растяжение расположено в непосредственной близости от сустава. В соответствии с другим вариантом осуществления сустав представляет собой коленный сустав, локтевой сустав, лучезапястный сустав, плечевой сустав, тазобедренный сустав, остистый отросток, все суставы пальцев, или сочетания указанного. Термин «в непосредственной близости» в контексте настоящего изобретения относится к очень близкому расстоянию. В соответствии с одним вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 15 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 0,005 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,005 мм примерно до 0,01 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,01 мм примерно до 0,05 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,05 мм примерно до 0,1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,1 мм примерно до 0,5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,5 мм примерно до 1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 мм примерно до 2 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 мм примерно до 3 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 мм примерно до 4 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 мм примерно до 5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 мм примерно до 6 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 мм примерно до 7 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 мм примерно до 8 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 мм примерно до 9 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 мм примерно до 1 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 см примерно до 2 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 см примерно до 3 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 см примерно до 4 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 см примерно до 5 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 см примерно до 6 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 см примерно до 7 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 см примерно до 8 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 см примерно до 9 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 см примерно до 10 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 10 см примерно до 11 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 11 см примерно до 12 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 12 см примерно до 13 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 14 см примерно до 15 см.
В соответствии с несколькими вариантами осуществления патологический рубец появляется в результате царапины, рванной раны, включения, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, или сочетания указанного. В соответствии с одним вариантом осуществления патологический рубец появляется в результате царапины. В соответствии с другим вариантом осуществления патологический рубец появляется в результате рванной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате включения. В соответствии с другим вариантом осуществления патологический рубец появляется в результате раздавленной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате закрытой травмы. В соответствии с другим вариантом осуществления патологический рубец появляется в результате колотой раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате отрыва. В соответствии с другим вариантом осуществления патологический рубец появляется в результате ожогa. В соответствии с другим вариантом осуществления патологический рубец появляется в результате язвы.
Кожные рубцы, связанные с аутоиммунным заболеванием кожи
Термин «аутоиммунное заболевание» в контексте настоящего изобретения относится к заболеванию, нарушениям или патологическим состояниям, при которых иммунная система организма, которая обычно борется с инфекциями и вирусами, извращена и поражает собственную нормальную здоровую ткань. У высших организмов многочисленные механизмы иммунологической толерантности устраняют или инактивируют лимфоциты, которые несут рецепторы, специфичные для аутоантигенов. Однако, некоторые аутореактивные лимфоциты могут уклоняться от таких механизмов и находиться в пуле периферических лимфоцитов.
Аутоиммунитет вызывается сложным взаимодействием многочисленных генных продуктов, в отличие от иммунодефицитных заболеваний, при которых один доминирующий генетический признак зачастую является основным определяющим фактором заболевания. (Обзор представлен у Fathman, C. G. et al., «An array of possibilities for the study of autoimmunity» Nature, 435(7042): 605-611 (2005); Anaya, J.-M., «Common mechanisms of autoimmune diseases (the autoimmune tautology)», Autoimmunity Reviews, 11(11): 781-784 (2012)). Аутоиммунные заболевания являются основными причинами заболеваемости и смертности по всему миру и плохо поддаются лечению. (Обзор, например, представлен у Hayter, S. M. et al., «Updated assessment of the prevalence, spectrum and case definition of autoimmune disease», Autoimmunity Reviews, 11(10): 754-765 (2012); и Rioux, J. D. et al., «Paths to understanding the genetic basis of autoimmune disease», Nature, 435(7042): 584-589 (2005)).
Один механизм, посредством которого сдерживается патогенный потенциал таких аутореактивных лимфоцитов, представляет собой механизм при участии специализированной линии регуляторных T (TR) клеток. Эти клетки были мишенью для терапевтического воздействия при большом числе аутоиммунных нарушений (Обзор представлен у Kronenberg, M. et al., «Regulation of immunity by self-reactive T cells», Nature, 435(7042): 598-604 (2005)).
Другие компоненты патологического каскада при аутоиммунных нарушениях, которые привлекают внимание, включают, например, факторы, вовлеченные в направленное движение лимфоцитов к тканям-мишеням; ферменты, которые являются важными для пенетрации кровеносных сосудов и внеклеточного матрикса иммунными клетками; цитокины, которые опосредуют патологию в тканях; различные типы клеток, которые опосредуют повреждение в зоне заболевания, клеточные антигены; специфические адаптивные рецепторы, в том числе, T-клеточный рецептор (TCR) и иммуноглобулин; и токсические медиаторы, такие как компоненты комплемента и оксид азота. (Обзор у Feldmann, M. et al., «Design of effective immunotherapy for human autoimmunity», Nature, 435(7042): 612-619 (2005)).
Хотя мутации в одном гене могут вызывать аутоиммунитет, большинство аутоиммунных заболеваний связано с многочисленными вариантами последовательностей (Обзор у Rioux, J. D. et al., «Paths to understanding the genetic basis of autoimmune disease», Nature, 435(7042): 584-589 (2005); и Goodnow, C. C. et al., «Cellular and genetic mechanisms of self-tolerance and autoimmunity», Nature, 435(7042): 590-596 (2005)). Аутоиммунные нарушения могут быть связаны с хроническим воспалением. Такие аутоиммунные нарушения хорошо известны как «аутовоспалительные заболевания». (Обзор представлен у Hashkes, P.J. et al., «Autoinflammatory syndromes», Pediatr. Clin. North Am., 59(2): 447-470 (2012)).
Системный аутоиммунитет охватывает аутоиммунные состояния, при которых аутореактивность не ограничена одним органом или системой органов. Это определение включает, но не ограничивается, аутоиммунные заболевания, включая проявления аутоиммунных заболеваний кожи, таких как системная красная волчанка (SLE), системный склероз (склеродермия), пузырчатка, витилиго, герпетиформный дерматит, псориаз, и так далее. Кожная SLE является распространенным системным аутоиммунным заболеванием, которое включает специфические проявления, такие как сыпь «бабочка», фоточувствительный дерматит с высыпаниями на коже и дисковидные повреждения, а также васкулит и алопецию. SLE характеризуется наличием антиядерных антител (ANA) и связана с хроническим воспалением. Склеродермия (или системный склероз) отмечен воспалением с последующим отложением ANA в коже и внутренних органах. Склеродермия, характеризуемая заметным уменьшением кровообращения в периферических артериях дистальных кончиков пальцев (зачастую стимулируемым холодными температурами) известна как болезнь Рейно. Пузырчатка включает группу аутоиммунных заболеваний с образованием пузырей, характеризуемых индуцированным аутоантителами разъединением эпидермальных клеток (акантолиз). Пузырчатка клинически проявляется мягкими волдырями и эрозиями кожи. Витилиго представляет собой заболевание кожи, связанное с депигментацией, которое может быть связано с другими аутоиммунными нарушениями, такими как аутоиммунный полиэндокринный синдром I типа. Витилиго характеризуется присутствием анти-меланоцитратных аутоантител, инфильтрацией кожной CD4+ и CD8+ T-лимфоцитами и гиперэкспрессией профилей цитокинов I типа. Герпетиформный дерматит (DH) пожизненное заболевание кожи, сопровождающееся сильным зудом, полиморфными пузырями, связанное с чувствительностью к глютену. Преобладающим аутоантигеном при DH является тканевая трансглутаминаза, находящаяся в кишечнике и в коже. Псориаз представляет собой распространенное аутоиммунное заболевание кожи с генетической основой, поражающее 1-3% европиоидной популяции. Псориаз характеризуется гиперкератозом, эпидермальной гиперплазией (акантозом) и воспалением и расширением капилляров кожи. (Paul, W. E., «Chapter 1: The immune system: an introduction», Fundamental Immunology, 4th Edition, Ed. Paul, W. E., Lippicott-Raven Publishers, Philadelphia (1999); Nancy, A.-L. and Yehuda, S., «Prediction and prevention of autoimmune skin disorders», Arch. Dermatol. Res., 301: 57-64 (2009)).
В соответствии с некоторыми другими вариантами осуществления фармацевтическая композиция способна лечить кожные рубцы, связанные с аутоиммунным заболеванием кожи. В соответствии с некоторыми такими вариантами осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза, или сочетания указанного. В соответствии с одним вариантом осуществления аутоиммунное заболевание кожи представляет собой системную красную волчанку (SLE). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой системный склероз (склеродермию). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой пузырчатку. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой витилиго. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой герпетиформный дерматит. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой псориаз.
Комбинированная терапия
В соответствии с несколькими вариантами осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство.
В соответствии с некоторыми такими вариантами осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трифторуксусную кислоту), ботулиновый токсин типа A, или сочетания указанного.
В соответствии с некоторыми другими вариантами осуществления дополнительное терапевтическое средство представляет собой противовоспалительное средство.
В соответствии с несколькими вариантами осуществления противовоспалительное средство представляет собой стероидное противовоспалительное средство. Термин «стероидное противовоспалительное средство», в контексте настоящего изобретения, относится к любому из многочисленных соединений, содержащих 17-углеродную 4-кольцевую систему и включает стеролы, различные гормоны (в виде анаболических стероидов) и гликозиды. Характерные примеры стероидных противовоспалительных средств включают, без ограничения, кортикостероиды, такие как гидрокортизон, гидроксилтриамцинолон, альфа-метил дексаметазон, дексаметазон-фосфат, беклометазона дипропионаты, клобетазола валерат, десонид, дезоксиметазон, дезоксикортикостерона ацетат, дексаметазон, дихлоризон, дифлукортолона валерат, флуадренолон, флуклоролона ацетонид, флуметазона пивалат, флуосинолона ацетонид, флуоцинонид, сложные бутиловые эфиры флукортина, флуокортолон, флупреднидена (флупреднилидена) ацетат, флурандренолон, галцинонид, гидрокортизона ацетат, гидрокортизона бутират, метилпреднизолон, триамцинолона аетонид, кортизон, кортодоксон, флуцетонид, флудрокортизон, дифлуорозона диацетат, флурадренолон, флудрокортизон, дифлорозона диацетат, флурадренолона ацетонид, медризон, амцинафел, амцинафид, бетаметазон и баланс его сложных эфиров, хлоропреднизон, хлорпреднизона ацетат, клокортелон, слесцинолон, дихлоризон, дифлурпреднат, флуслоронид, флунизолид, флуорометалон, флуперолон, флупреднизолон, ридрокортизона валерат, гидрокортизона циклопентилпропионат, гидрокортамат, мепреднизон, параметазон, преднизолон, преднизон, беклометазона дипропионат, триамцинолон, и их смеси.
В соответствии с другим вариантом осуществления противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Термин «нестероидное противовоспалительное средство» в контексте настоящего изобретения относится к большой группе средств, которые подобны аспирину по своему действию, в том числе, но не только, ибупрофен (Advil®), напроксен натрий (Aleve®), и ацетаминофен (Tylenol®). Дополнительные примеры нестероидных противовоспалительных средств, которые используются в контексте описанного изобретения включают без ограничения, оксикамы, такие как пироксикам, изоксикам, теноксикам, судоксикам, и CP-14,304; дисалцид, бенорилат, трилизат, сафаприн, солприн, дифлунизал и фендозал; производные уксусной кислоты, такие как диклофенак, фенклофенак, индометацин, сулиндак, толметин, изоксепак, фурофенак, тиопинак, зидометацин, ацематацин, фентиазак, зомепирак, клинданак, оксепинак, фелбинак, и кеторолак; фенаматы, такие как мефенамовая, меклофенамовая, флуфенамовая, нифлумовая и толфенамовая кислоты; производные пропионовой кислоты, такие как беноксапрофен, флурбипрофен, кетопрофен, фенопрофен, фенбуфен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, миропрофен, тиоксапрофен, супрофен алминопрофен, и тиапрофеновая кислота; пиразолы, такие как фенилбутазон, оксифенбутазон, фепразон, азапропазон и триметазон. Также могут быть использованы смеси этих нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, этофенамат, производное флуфенаминовой кислоты, является особенно полезным для местного применения.
В соответствии с другим вариантом осуществления противовоспалительное средство включает, без ограничения, трансформирующий фактор роста-бета3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α), или сочетания указанного.
В соответствии с несколькими вариантами осуществления дополнительным средством является обезболивающее средство. В соответствии с несколькими вариантами осуществления обезболивающее средство облегчает боль путем повышения порога болевой чувствительности без нарушения сознания или изменения других сенсорных модальностей. В соответствии с некоторыми такими вариантами осуществления обезболивающее средство представляет собой неопиоидное обезболивающее средство. В соответствии с некоторыми такими вариантами осуществления обезболивающее средство представляет собой неопиоидное обезболивающее средство. «Неопиоидные анальгетики» представляют собой природные или синтетические вещества, которые уменьшают боль, но не являются опиоидными анальгетиками. Примеры неопиоидных анальгетиков включают, но не ограничиваются, этодолак, индометацин, сулиндак, толметин, мелоксикам, пироксикам, ацетаминофен, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрий, оксапрозин, аспирин, холин трисалицилат магния, дифлунизал, меклофенамовую кислоту, мефенамовую кислоту, и фенилбутазон. В соответствии с некоторыми другими вариантами осуществления анальгетик представляет собой опиоидный анальгетик. «Опиоидные анальгетики», «опиоид», или «наркотические анальгетики» представляют собой природные или синтетические вещества, которые связываются с опиоидными рецепторами в центральной нервной системе, оказывая агонистическое действие. Примеры опиоидных анальгетиков включают, но не ограничиваются, кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, прококсифен, бупренорфин, буторфанол, дезоцин, нальбуфин и пентазоцин.
В соответствии с другим вариантом осуществления дополнительное средство представляет собой дезинфицирующее средство. В соответствии с другим вариантом осуществления дезинфицирующим средством является антибиотик. Термин «антибиотик» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать бактерии, и другие микроорганизмы, используемые, главным образом, при лечении инфекционных заболеваний. Примеры антибиотиков включают, но не ограничиваются, пенициллин G; метициллин; нафциллин; оксациллин; клоксациллин; диклоксациллин; ампициллин; амоксициллин; тикарциллин; карбенициллин; мезлоциллин; азлоциллин; пиперациллин; имипенем; азтреонам; цефалотин; цефаклор; цефокситин; цефуроксим; цефоницид; цефметазол; цефотетан; цефпрозил; лоракарбеф; цефетамет; цефоперазон; цефотаксим; цефтизоксим; цефтриаксон; цефтазидим; цефепим; Цефиксим; Цефподоксим; цефсулодин; флероксацин; налидиксовую кислоту; норфлоксацин; ципрофлоксацин; офлоксацин; эноксацин; ломефлоксацин; циноксацин; доксициклин; миноциклин; тетрациклин; амикацин; гентамицин; канамицин; нетилмицин; тобрамицина; oстрептомицин; кларитромицин; эритромицин; эритромицин эстолат; эритромицин этилсукцината; эритромицин глюкогептонат; эритромицин лактобионат; стеарат эритромицин; ванкомицин; тейкопланин; хлорамфеникол; клиндамицин; триметоприм; сульфаметоксазол; нитрофурантоин; рифампицин; мупироцин; метронидазол; цефалексин; рокситромицин; со-амоксиклавуанат; сочетания пиперациллина и тазобактама; и их различные соли, кислоты, основания и другие производные. Антибактериальные антибиотики включают, но не ограничиваются, пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, аминогликозиды, монобактамы, гликопептиды, хинолоны, тетрациклины, макролиды, фторхинолоны и фторхинолоны.
Другие примеры по меньшей мере одного дополнительного терапевтического средствоа, включают, но не ограничиваются, масло шиповника, витамин Е, 5-фторурацил, блеомицин, экстракт лука, пентоксифиллин, пролил-4-гидроксилазу, верапамил, циклоспорин, тамоксифен, третиноин, колхицин, антагонист кальция, траниласт, цинк, антибиотик, или сочетания указанного.
III. Способы лечения, уменьшения или профилактики кожных рубцов
В соответствии с другим аспектом описанное изобретение относится к способу лечения кожного рубца у пациента, который пострадал или страдает от раны, где указанный способ включает введение пациенту фармацевтической композиции, содержащей терапевтическое количество ингибитора митоген-активированной протеинкиназы - активированной протеинкиназы 2 (MK2) содержащей полипептидный ингибитор или его функциональный эквивалент, и фармацевтически приемлемый носитель, где терапевтическое количество является эффективным для уменьшения области рубца у пациента.
Ингибитор MK2
В соответствии с одним вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) представляет собой полипептидный ингибитор MK2 или его функциональный эквивалент. В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 выбран из группы, состоящей из полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), полипептида MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), полипептида MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), полипептида MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4), и полипептида MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7). В соответствии с одним вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4). В соответствии с другим вариантом осуществления полипептидный ингибитор МК2 представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет существенную идентичность последовательности с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 80 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 90 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1). В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) имеет по меньшей мере 95 процентную идентичность с аминокислотной последовательностью YARAAARQARAKALARQLGVAA (SEQ ID NO: 1).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19)
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0300 аминокислотной последовательности FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0400 аминокислотной последовательности KAFAKLAARLYRKALARQLGVAA (SEQ ID NO: 4).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLAVA (SEQ ID NO: 5).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид аминокислотной последовательности YARAAARQARAKALARQLGVA (SEQ ID NO: 6).
В соответствии с другим вариантом осуществления функциональный эквивалент полипептидного ингибитора MK2 MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой полипептид MMI-0500 аминокислотной последовательности HRRIKAWLKKIKALARQLGVAA (SEQ ID NO: 7).
В соответствии с другим вариантом осуществления ингибитор митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) дополнительно содержит ингибитор MK2 с низкой молекулярной массой. Приводимые в качестве примера ингибиторы MK2 с низкой молекулярной массой были описаны у Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 15: 1587 (2005); Wu, J.-P. et al., Bioorg. Med. Chem. Lett., 17: 4664 (2007); Trujillo, J. I. et al., Bioorg. Med. Chem. Lett., 17: 4657 (2007); Goldberg, D. R. et al., Bioorg. Med. Chem. Lett., 18: 938 (2008); Xiong, Z. et al., Bioorg. Med. Chem. Lett., 18: 1994 (2008); Anderson, D. R. et al., J. Med. Chem., 50: 2647 (2007); Lin, S. et al., Bioorg. Med. Chem. Lett., 19: 3238 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4878 (2009); Anderson, D. R. et al., Bioorg. Med. Chem. Lett., 19: 4882 (2009); Harris, C. M. et al., Bioorg. Med. Chem. Lett., 20: 334 (2010); Schlapbach, A. et al., Bioorg. Med. Chem. Lett., 18: 6142 (2008); и Velcicky, J. et al., Bioorg. Med. Chem. Lett., 20: 1293 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
В соответствии с некоторыми такими вариантами осуществления ингибитор МК2 с низкой молекулярной массой включает, но не ограничивается:
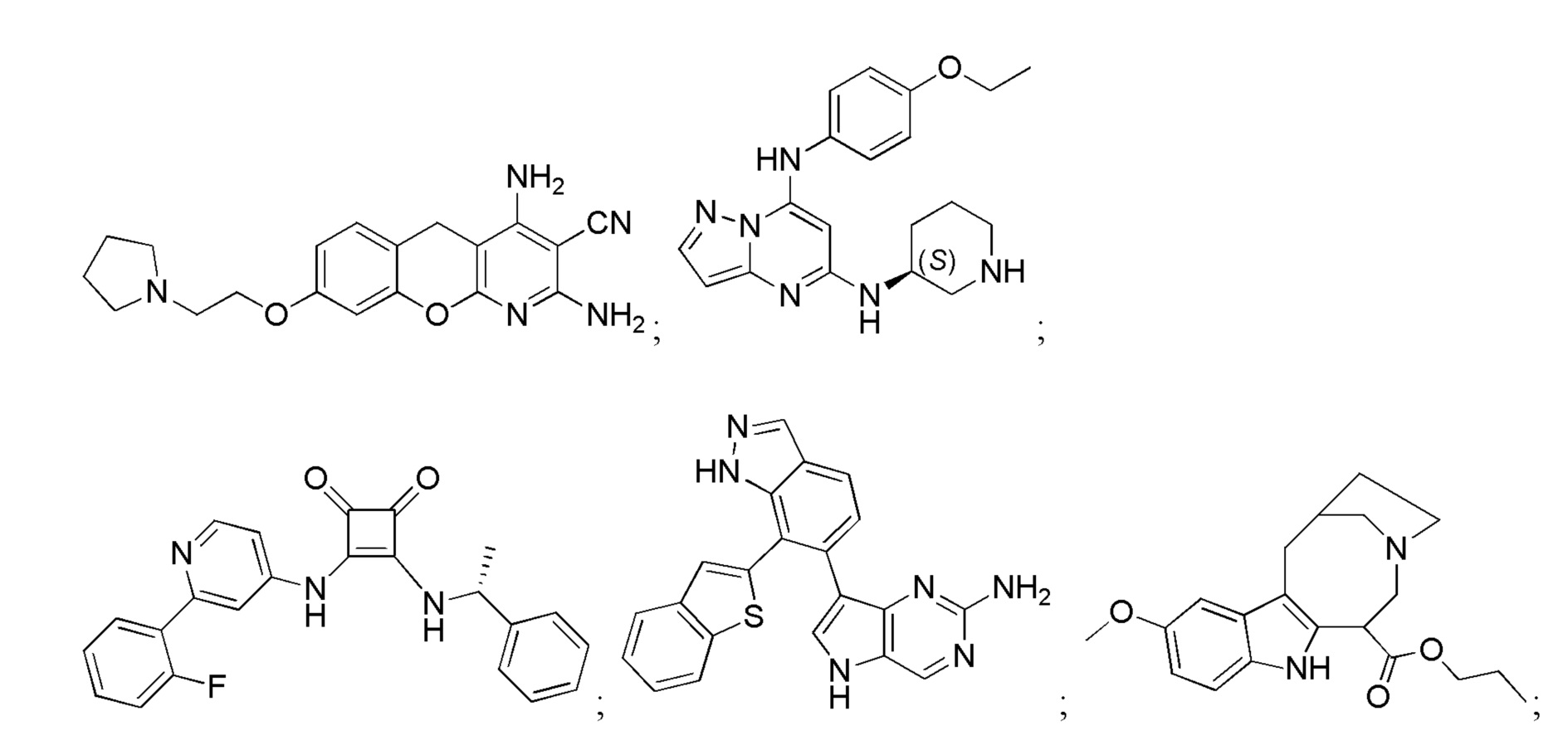
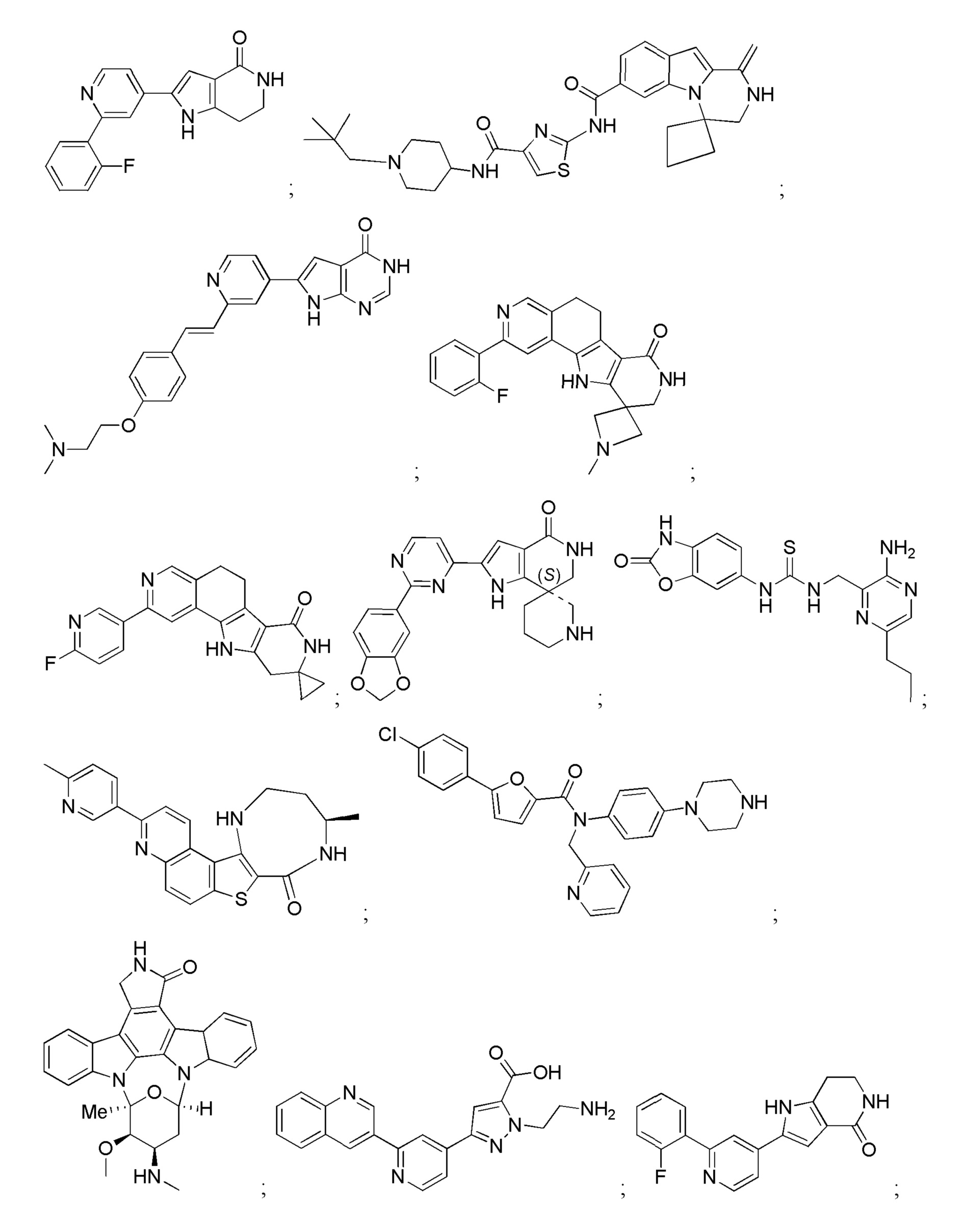

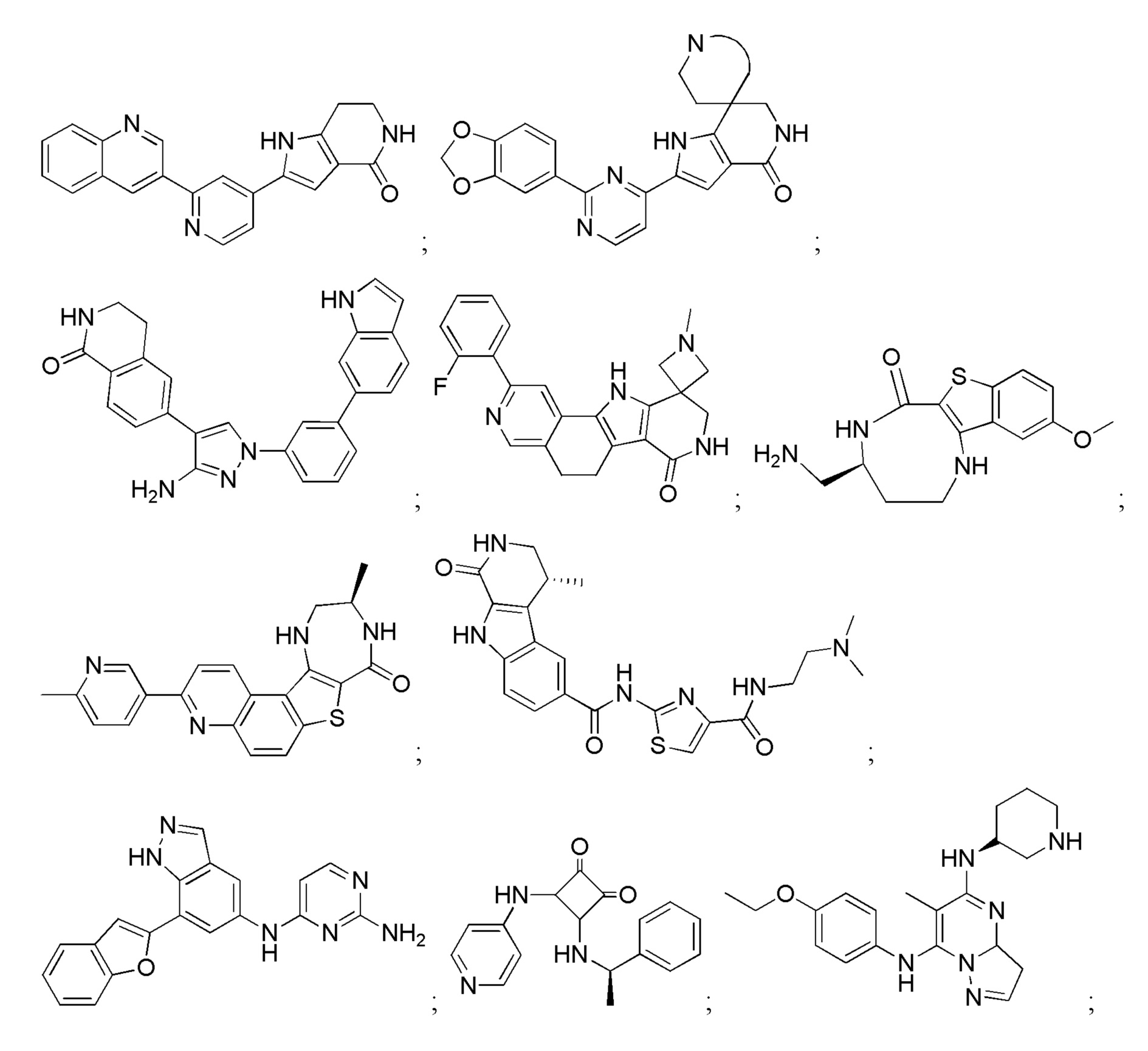
или сочетания указанного.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой конкурирует с АТФ за связывание с MK2. В соответствии с несколькими вариантами осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина или полициклический аналог лактама.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой аналог пирролопиридина. Приводимые в качестве примера аналоги пирролопиридина описаны у Anderson, D. R. et al., «Pyrrolopyridine inhibitors of mitogen-activated protein киназа-активированной протеинкиназы 2 (MK-2)», J. Med. Chem., 50: 2647-2654 (2007), полное описание этого документа включено в настоящую заявку посредством ссылки. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы I: 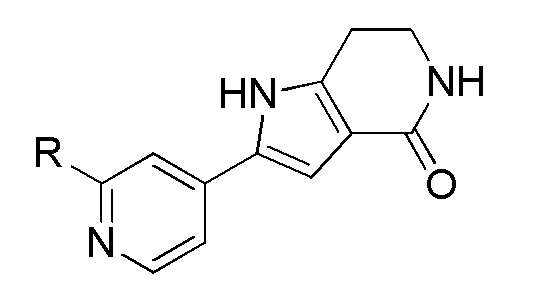 , где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II:
, где R представляет собой H, Cl, фенил, пиридин, пиримидин, тиенил, нафтил, бензотиенил или хинолин. В соответствии с другим вариантом осуществления аналог пирролопиридина представляет собой 2-арилпиридиновое соединение формулы II: 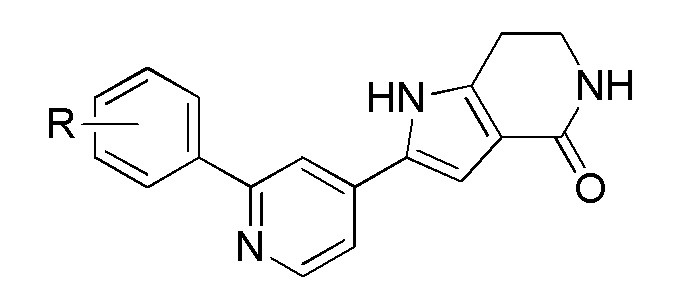 , где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
, где R представляет собой OH, Cl, F, CF3, CN, ацетил, метокси, NH2, CO2H, CONH-циклопропил, CONH-циклопентил, CONH-циклогексил, CONHCH2-фенил, CONH(CH2)2-фенил, или CON(метил)CH2-фенил.
В соответствии с другим вариантом осуществления ингибитор МК2 с низкой молекулярной массой представляет собой полициклический аналог лактама. Приводимые в качестве примера полициклические аналоги лактама описаны у Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part I», Bioorg. Med. Chem. Lett., 20: 4715-4718 (2010); и Recesz, L. et al., «In vivo and in vitro SAR of tetracyclic MAPKAP-K2 (MK2) inhibitors: Part II», Bioorg. Med. Chem. Lett., 20: 4719-4723 (2010), полное описание каждого из этих документов включено в настоящую заявку посредством ссылки.
Кожный рубец
В соответствии с одним вариантом осуществления кожный рубец может быть результатом заживления раны. В соответствии с другим вариантом осуществления рана характеризуется нарушенной активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани по сравнению с активностью митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2) в ткани здорового контрольного пациента.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения распространенности, тяжести или и того, и другого, кожного рубца без нарушения нормального заживления раны.
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью улучшать выравнивание коллагеновых волокон в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения образования витков коллагена в ране.
В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для ускорения заживления раны по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения размера раны по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения рубцевания по сравнению с контролем по данным визуально-аналоговой шкалы (VAS), цветового соответствия (CM), оценки матовости/блеска (M/S), оценки контура (С), оценки деформации (D), оценки степени плотности ткани (Т), или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем. В соответствии с некоторыми такими вариантами осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере в течение 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 11 дней, по меньшей мере 12 дней, по меньшей мере 13 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, или по меньшей мере 30 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 1 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 2 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 3 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 4 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 5 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 6 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 7 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 8 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 9 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 10 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 11 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 12 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 13 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 14 дней введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 21 дня введения.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения области рубца по сравнению с контролем по меньшей мере на 1%, по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по меньшей мере в течение 30 дней введения.
В соответствии с несколькими вариантами осуществления фармацевтическая композиция обладает способностью модулировать экспрессию гена, связанного с образованием рубцов или продукта гена, связанного с образованием рубцов. В соответствии с одним вариантом осуществления терапевтическое количество является эффективным для модуляции экспрессии гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня экспрессии матричной РНК (мРНК) гена, связанного с образованием рубцов. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня продукта гена, связанного с образованием рубцов, экспрессируемого геном, связанного с образованием рубцов.
В соответствии с некоторыми такими вариантами осуществления ген, связанный с образованием рубцов, кодирует одно или более из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с одним вариантом осуществления ген, связанный с образованием рубцов, кодирует трансформирующий фактор роста-β1 (TGF-β1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует хемокинового (С-С мотив) рецептора 2 (CCR2). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления ген, связанный с образованием рубцов, кодирует sma/mad-родственный белок (SMAD).
В соответствии с некоторыми такими вариантами осуществления продукт гена, связанного с образованием рубцов, выбран из группы, состоящей из трансформирующего фактора роста-β1 (TGF-β1), фактора некроза опухоли-α (TNF-α), коллагена, интерлейкина-6 (IL-6), хемокинового (С-С мотив) лиганда 2 (CCL2) (или моноцитарного хематактического белка-1 (MCP-1)), хемокинового (С-С мотив) рецептора 2 (CCR2), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (EMR1), или sma/mad-родственного белка (SMAD). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой фактор некроза опухоли-α (TNF-α). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой коллаген. В соответствии с другим вариантом осуществления коллаген представляет собой коллаген типа 1α2 (col1α2) или коллаген типа 3α1 (col 3α1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой интерлейкин-6 (IL-6). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) лиганд 2 (CCL2) (или моноцитарный хематактический белок-1 (MCP-1)). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой хемокиновый (С-С мотив) рецептор 2 (CCR2). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой EGF-подобный модуль-содержащий муцин-подобный белок наподобие гормонального рецептора 1 (EMR1). В соответствии с другим вариантом осуществления продукт гена, связанного с образованием рубцов, представляет собой sma/mad-родственный белок (SMAD).
В соответствии с другим вариантом осуществления фармацевтическая композиция обладает способностью уменьшать инфильтрацию в рану одного или более типов воспалительных или стволовых клеток, в том числе, без ограничения, моноцитов, фиброцитов, макрофагов, лимфоцитов и тучных или дендритных клеток.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной иммуномодулирующей клетки. В соответствии с некоторыми такими вариантами осуществления иммуномодулирующая клетка выбрана из группы, состоящей из моноцитов, тучных клеток, дендритных клеток, макрофагов, Т-лимфоцитов или фиброцитов. В соответствии с одним вариантом осуществления иммуномодулирующая клетка представляет собой тучную клетку. В соответствии с другим вариантом осуществления тучная клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и CD117. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой моноцит. В соответствии с другим вариантом осуществления моноцит характеризуется экспрессией маркеров клеточной поверхности, в том числе, без ограничения, CD11b. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой макрофаг. В соответствии с другим вариантом осуществления макрофаг характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, F4/80. В соответствии с другим вариантом осуществления иммуномодулирующая клетка представляет собой T-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит представляет собой хелперный Т-лимфоцит или цитотоксический Т-лимфоцит. В соответствии с другим вариантом осуществления Т-лимфоцит характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD4, CD8, или сочетания указанного.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения инфильтрации в рану по меньшей мере одной клетки-предшественника. В соответствии с некоторыми такими вариантами осуществления клетка-предшественник выбрана из группы, состоящей из гематопоэтической стволовой клетки, мезенхимальной стволовой клетки, или сочетания указанного. В соответствии с одним вариантом осуществления клетка-предшественник представляет собой гематопоэтическую стволовую клетку. В соответствии с другим вариантом осуществления гематопоэтическая стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, CD45 и Sca1. В соответствии с другим вариантом осуществления клетка-предшественник представляет собой мезенхимальную стволовую клетку. В соответствии с другим вариантом осуществления мезенхимальная стволовая клетка характеризуется экспрессией маркера (маркеров) клеточной поверхности, в том числе, без ограничения, Sca1 и не CD45.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня экспрессии трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня матричной РНК (мРНК) трансформирующего фактора роста-β (TGF-β) в ране. В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для уменьшения уровня белка трансформирующего фактора роста-β (TGF-β) в ране.
В соответствии с другим вариантом осуществления терапевтическое количество является эффективным для модуляции уровня медиатора воспаления в ране. В соответствии с несколькими вариантами осуществления медиатор воспаления, модулируемый таким образом, может представлять собой, без ограничения, интерлейкин-1 (IL-1), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли (TNF), интерферон-гамма (IFN-γ), интерлейкин 12 (IL-12), или сочетания указанного.
В соответствии с несколькими вариантами осуществления рана представляет собой царапины, рваную рану, раздавленную рану, закрытую травму, колотую рану, отрыв, ожог, язву, или сочетания указанного. В соответствии с одним вариантом осуществления рана представляет собой царапины. В соответствии с другим вариантом осуществления рана представляет собой рваную рану. В соответствии с другим вариантом осуществления рана представляет собой раздавленную рану. В соответствии с другим вариантом осуществления рана представляет собой закрытую травму. В соответствии с другим вариантом осуществления рана представляет собой колотую рану. В соответствии с другим вариантом осуществления рана представляет собой отрыв. В соответствии с другим вариантом осуществления рана представляет собой ожог. В соответствии с другим вариантом осуществления рана представляет собой язву.
В соответствии с другим вариантом осуществления рана представляет собой операционную рану.
В соответствии с другим вариантом осуществления кожный рубец представляет собой патологический рубец, означающий рубец, возникающий как результат заболевания, нарушения, патологического состояния или повреждения.
В соответствии с другим вариантом осуществления патологический рубец представляет собой гипертрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой келоид.
В соответствии с другим вариантом осуществления патологический рубец представляет собой атрофический рубец.
В соответствии с другим вариантом осуществления патологический рубец представляет собой рубцовую контрактуру.
В соответствии с другим вариантом осуществления кожный рубец представляет собой послеоперационный рубец.
В соответствии с другим вариантом осуществления гипертрофический рубец появляется в результате растяжения. В соответствии с другим вариантом осуществления растяжение расположено в непосредственной близости от сустава. В соответствии с другим вариантом осуществления сустав представляет собой коленный сустав, локтевой сустав, лучезапястный сустав, плечевой сустав, тазобедренный сустав, остистый отросток, все суставы пальцев, или сочетания указанного. Термин «в непосредственной близости» в контексте настоящего изобретения относится к очень близкому расстоянию. В соответствии с одним вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 15 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,001 мм примерно до 0,005 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,005 мм примерно до 0,01 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,01 мм примерно до 0,05 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,05 мм примерно до 0,1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,1 мм примерно до 0,5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 0,5 мм примерно до 1 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 мм примерно до 2 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 мм примерно до 3 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 мм примерно до 4 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 мм примерно до 5 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 мм примерно до 6 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 мм примерно до 7 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 мм примерно до 8 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 мм примерно до 9 мм. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 мм примерно до 1 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 1 см примерно до 2 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 2 см примерно до 3 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 3 см примерно до 4 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 4 см примерно до 5 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 5 см примерно до 6 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 6 см примерно до 7 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 7 см примерно до 8 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 8 см примерно до 9 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 9 см примерно до 10 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 10 см примерно до 11 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 11 см примерно до 12 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 12 см примерно до 13 см. В соответствии с другим вариантом осуществления это расстояние составляет примерно от 14 см примерно до 15 см.
В соответствии с несколькими вариантами осуществления патологический рубец появляется в результате царапины, рванной раны, включения, раздавленной раны, закрытой травмы, колотой раны, отрыва, ожога, язвы, или сочетания указанного. В соответствии с одним вариантом осуществления патологический рубец появляется в результате царапины. В соответствии с другим вариантом осуществления патологический рубец появляется в результате рванной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате включения. В соответствии с другим вариантом осуществления патологический рубец появляется в результате раздавленной раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате закрытой травмы. В соответствии с другим вариантом осуществления патологический рубец появляется в результате колотой раны. В соответствии с другим вариантом осуществления патологический рубец появляется в результате отрыва. В соответствии с другим вариантом осуществления патологический рубец появляется в результате ожога. В соответствии с другим вариантом осуществления патологический рубец появляется в результате язвы.
В соответствии с некоторыми другими вариантами осуществления фармацевтическая композиция способна лечить кожные рубцы, связанные с аутоиммунным заболеванием кожи. В соответствии с некоторыми такими вариантами осуществления аутоиммунное заболевание кожи выбрано из группы, состоящей из системной красной волчанки (SLE), системного склероза (склеродермии), пузырчатки, витилиго, герпетиформного дерматита, псориаза, или сочетания указанного. В соответствии с одним вариантом осуществления аутоиммунное заболевание кожи представляет собой системную красную волчанку (SLE). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой системный склероз (склеродермию). В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой пузырчатку. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой витилиго. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой герпетиформный дерматит. В соответствии с другим вариантом осуществления аутоиммунное заболевание кожи представляет собой псориаз.
Стадия введения
В соответствии с одним вариантом осуществления фармацевтическую композицию вводят системно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят перорально. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят внутрибрюшинно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят внутримышечно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят внутривенно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят парентерально. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят внутриартериально.
В соответствии с другим вариантом осуществления фармацевтическую композицию наносят локально. В соответствии с другим вариантом осуществления фармацевтическую композицию наносят местно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят внутрикожно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят посредством внутрикожной инъекции. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят подкожно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят чрескожно.
В соответствии с другим вариантом осуществления фармацевтическую композицию вводят посредством инъекционного аппарата. В соответствии с несколькими вариантами осуществления инъекционный аппарат выбран из группы, состоящей из иглы, каннюли, катетера, шовного материала или сочетания указанного. В соответствии с одним вариантом осуществления инъекционный аппарат представляет собой иглу. В соответствии с другим вариантом осуществления инъекционный аппарат представляет собой каннюлю. В соответствии с другим вариантом осуществления инъекционный аппарат представляет собой катетер. В соответствии с другим вариантом осуществления инъекционный аппарат представляет собой шовный материал.
В соответствии с другим вариантом осуществления инъекционный аппарат пропитывают фармацевтической композицией до введения.
В соответствии с другим вариантом осуществления фармацевтическую композицию вводят за один раз в виде однократной дозы.
В соответствии с другим вариантом осуществления фармацевтическую композицию вводят в виде множественных доз на протяжении периода времени.
В соответствии с несколькими вариантами осуществления фармацевтическую композицию вводят в рану до ушивания раны. В соответствии с некоторыми другими вариантами осуществления фармацевтическую композицию вводят в рану во время ушивания раны. В соответствии с некоторыми другими вариантами осуществления фармацевтическую композицию вводят в рану после ушивания раны.
В соответствии с несколькими вариантами осуществления фармацевтическую композицию вводят многократно в течение суток. В соответствии с некоторыми другими вариантами осуществления фармацевтическую композицию вводят многократно в течение суток, что совпадает со сменой повязки.
В соответствии с другим вариантом осуществления периодом времени является день, неделя, месяц, год или любое их количество. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят ежедневно в течение периода времени по меньшей мере одна неделя. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят еженедельно в течение периода времени по меньшей мере один месяц. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят ежемесячно в течение периода времени по меньшей мере два месяца. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят повторно на протяжении периода времени по меньшей мере один год. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят по меньшей мере однократно ежемесячно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят по меньшей мере однократно еженедельно. В соответствии с другим вариантом осуществления фармацевтическую композицию вводят по меньшей мере однократно ежедневно.
В соответствии с другим вариантом осуществления фармацевтическую композицию вводят в место ранения посредством наложения повязки, содержащей фармацевтическую композицию. В соответствии с другим вариантом осуществления по меньшей мере одна поверхность повязки пропитана этой композицией. Примеры повязок, подходящих для целей настоящего изобретения, включают, но не ограничиваются, марлевую повязку, сетчатый перевязочный материал, альгинатную повязку, полиуретановую повязку, силиконовую повязку, и коллагеновую повязку, синтетический полимерный каркас, или сочетания указанного. В соответствии с другим вариантом осуществления другие подходящие повязки включают окклюзионную повязку, в том числе, но не только, пленочные повязки, полупроницаемые пленочные повязки, гидрогелевые повязки, гидроколлоидные повязки или сочетания указанного.
В соответствии с другим вариантом осуществления фармацевтическая композиция заключена в заменитель кожи, который обеспечивает трехмерный внеклеточный каркас.
В соответствии с другим вариантом осуществления заменитель кожи изготовлен из природного биологического материала, в том числе, но не только, трупной кожи человека, трупной кожи свиньи и подслизистой тонкой кишки свиньи. В соответствии с другим вариантом осуществления природный биологический материал включает матрицу. В соответствии с другим вариантом осуществления природный биологический материал по существу состоит из матрицы, которая по существу лишена остатков клеток.
В соответствии с другим вариантом осуществления заменитель кожи представляет собой структурный биологический материал. Примеры структурных биологических материалов, подходящих для целей настоящего изобретения, включают, но не ограничиваются, коллаген, гликозаминогликан, фибронектин, гиалуроновую кислоту, эластин или сочетания указанного. В соответствии с некоторыми такими вариантами осуществления структурный биологический материал представляет собой двухслойную, неячеистую матрицу для регенерации кожи. В соответствии с другим вариантом осуществления структурный биологический материал представляет собой однослойную, ячеистую матрицу для регенерации кожи.
В соответствии с другим вариантом осуществления заменитель кожи представляет собой синтетический заменитель кожи. В соответствии с другим вариантом осуществления синтетический заменитель кожи дополнительно содержит RGD пептид аминокислотной последовательности аргинин-глицин-аспартат. В соответствии с другим вариантом осуществления синтетический заменитель кожи содержит гидрогель.
Местное нанесение также может включать применение чрескожного нанесения, например, пластырей или устройств для ионтофореза, которые получают в соответствии с методиками и способами, хорошо известными из уровня техники. Термины «трансдермальная система доставки», «трансдермальный пластырь» или «пластырь» относятся к адгезивной системе, расположенной на коже, для доставки медленно высвобождаемой дозы лекарственного средств(а) путем перехода от лекарственной формы через кожу, чтобы она была доступной для распределения через системный кровоток. Трансдермальные пластыри представляют собой общепринятую методику, используемую для доставки большого разнообразия фармацевтических препаратов, в том числе, но не только, скополамин от укачивания, нитроглицерин для лечения стенокардии, клонидин от гипертензии, эстрадиол от симптомов пост-менопаузы и никотин при отказе от курения. Пластыри, подходящие для использования в настоящем изобретении, включают, но не ограничиваются (1) матриксный пластырь; (2) резервуарный пластырь; (3) многослойный пластырь, в котором лекарственное средство содержится в клеевом составе; и (4) монолитный пластырь, в котором лекарственное средство содержится в клеевом составе; TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS, pp. 249-297 (Tapash K. Ghosh et al. eds., 1997), включено посредством ссылки в полном объеме. Эти пластыри хорошо известны из уровня техники и в основном являются коммерчески доступными.
В соответствии с другим вариантом осуществления фармацевтическую композицию вводят перед, во время или после ушивания раны.
В соответствии с другим вариантом осуществления ушивание раны осуществляют путем наложения швов, скобок, нанесения хирургического клея, или сочетания указанного.
В соответствии с другим вариантом осуществления хирургический клей включает лейкопластырь, октил-2-цианоакрилат или фибриновый тканевой клей.
В соответствии с другим вариантом осуществления ушивание раны осуществляют посредством подкожного наложения швов. Не ограничиваясь теорией, считается, что наложение подкожных швов способно ослаблять натяжение краев кожи до нанесения хирургического клея.
Состав
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель с контролируемым высвобождением. Термин «контролируемое высвобождение» означает любой лекарственный состав, в котором характер и профиль высвобождения лекарственного средства из состава контролируется. Это включает составы с немедленным, а также медленным высвобождением, с составами медленного высвобождения, включающими, но не только, составы длительного высвобождения и замедленного высвобождения.
Инъекционные депо-формы могут быть получены путем формирования микроинкапсулированных матриц терапевтического средства/лекарственного вещества в биоразлагаемых полимерах, таких как, но не только, сложные полиэфиры (полигликолид, полимолочная кислота и их сочетания), сополимеры сложных полиэфиров и полиэтиленгликоля, биополимеры, производные полиаминов, полиангидриды, сложные полиортоэфиры, полифосфазены, ацетат-изобутират сахарозы (SAIB), фотополимеризуемые биополимеры, природные биополимеры, белковые полимеры, коллаген и полисахариды. В зависимости от соотношения лекарственного средства и полимера и природы конкретно используемого полимера, можно контролировать скорость высвобождения лекарственного средства. Такие лекарственные составы длительного действия могут быть получены с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в подходящем масле) или ионобменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Депо-инъекционные составы также могут быть получены путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель с замедленным высвобождением. В соответствии с другим вариантом осуществления носитель с замедленным высвобождением включает биоразлагаемый полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой синтетический полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой природный полимер.
В соответствии с несколькими вариантами осуществления носитель представляет собой носитель длительного высвобождения. В соответствии с другим вариантом осуществления носитель длительного высвобождения включает биоразлагаемый полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой синтетический полимер. В соответствии с другим вариантом осуществления биоразлагаемый полимер представляет собой природный полимер.
В соответствии с несколькими вариантами осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно дополнительное терапевтическое средство.
В соответствии с некоторыми такими вариантами осуществления дополнительное терапевтическое средство включает EXC001 (антисмысловую РНК против фактора роста соединительной ткани (CTGF)), AZX100 (фосфопептидный аналог белка теплового шока 20 (HSP20)), PRM-151 (рекомбинантный сывороточный амилоид человека P/Пентаксин 2), PXL01 (синтетический пептид, полученный из лактоферрина человека), DSC127 (аналог ангиотензина), RXI-109 (соединение самодоставляющейся РНКи, которая нацелена на фактор роста соединительной ткани (CTGF)), TCA (трифторуксусную кислоту), Ботулиновый токсин типа A, или сочетания указанного.
Комбинированная терапия
В соответствии с некоторыми другими вариантами осуществления дополнительное терапевтическое средство представляет собой противовоспалительное средство.
В соответствии с некоторыми такими вариантами осуществления противовоспалительное средство представляет собой стероидное противовоспалительное средство. Термин «стероидное противовоспалительное средство», в контексте настоящего изобретения, относится к любому из многочисленных соединений, содержащих 17-углеродную 4-кольцевую систему и включает стеролы, различные гормоны (в виде анаболических стероидов) и гликозиды. Характерные примеры стероидных противовоспалительных средств включают, без ограничения, кортикостероиды, такие как гидрокортизон, гидроксилтриамцинолон, альфа-метил дексаметазон, дексаметазон-фосфат, беклометазона дипропионаты, клобетазола валерат, десонид, дезоксиметазон, дезоксикортикостерона ацетат, дексаметазон, дихлоризон, дифлукортолона валерат, флуадренолон, флуклоролона ацетонид, флуметазона пивалат, флуосинолона ацетонид, флуоцинонид, сложные бутиловые эфиры флукортина, флуокортолон, флупреднидена (флупреднилидена) ацетат, флурандренолон, галцинонид, гидрокортизона ацетат, гидрокортизона бутират, метилпреднизолон, триамцинолона аетонид, кортизон, кортодоксон, флуцетонид, флудрокортизон, дифлуорозона диацетат, флурадренолон, флудрокортизон, дифлорозона диацетат, флурадренолона ацетонид, медризон, амцинафел, амцинафид, бетаметазон и баланс его сложных эфиров, хлоропреднизон, хлорпреднизона ацетат, клокортелон, слесцинолон, дихлоризон, дифлурпреднат, флуслоронид, флунизолид, флуорометалон, флуперолон, флупреднизолон, ридрокортизона валерат, гидрокортизона циклопентилпропионат, гидрокортамат, мепреднизон, параметазон, преднизолон, преднизон, беклометазона дипропионат, триамцинолон, и их смеси.
В соответствии с некоторыми другими вариантами осуществления противовоспалительное средство представляет собой нестероидное противовоспалительное средство. Термин «нестероидное противовоспалительное средство» в контексте настоящего изобретения относится к большой группе средств, которые подобны аспирину по своему действию, в том числе, но не только, ибупрофен (Advil®), напроксен натрий (Aleve®), и ацетаминофен (Tylenol®). Дополнительные примеры нестероидных противовоспалительных средств, которые используются в контексте описанного изобретения включают без ограничения, оксикамы, такие как пироксикам, изоксикам, теноксикам, судоксикам, и CP-14,304; дисалцид, бенорилат, трилизат, сафаприн, солприн, дифлунизал и фендозал; производные уксусной кислоты, такие как диклофенак, фенклофенак, индометацин, сулиндак, толметин, изоксепак, фурофенак, тиопинак, зидометацин, ацематацин, фентиазак, зомепирак, клинданак, оксепинак, фелбинак, и кеторолак; фенаматы, такие как мефенамовая, меклофенамовая, флуфенамовая, нифлумовая и толфенамовая кислоты; производные пропионовой кислоты, такие как беноксапрофен, флурбипрофен, кетопрофен, фенопрофен, фенбуфен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, миропрофен, тиоксапрофен, супрофен алминопрофен, и тиапрофеновая кислота; пиразолы, такие как фенилбутазон, оксифенбутазон, фепразон, азапропазон и триметазон. Также могут быть использованы смеси этих нестероидных противовоспалительных средств, а также дерматологически приемлемые соли и сложные эфиры этих средств. Например, этофенамат, производное флуфенаминовой кислоты, является особенно полезным для местного применения.
В соответствии с другим вариантом осуществления противовоспалительное средство включает, без ограничения, трансформирующий фактор роста-бета3 (TGF-β3), средство против фактора некроза опухоли-альфа (TNF-α), или сочетания указанного.
В соответствии с несколькими вариантами осуществления дополнительным средством является обезболивающее средство. В соответствии с несколькими вариантами осуществления обезболивающее средство облегчает боль путем повышения порога болевой чувствительности без нарушения сознания или изменения других сенсорных модальностей. В соответствии с некоторыми такими вариантами осуществления обезболивающее средство представляет собой неопиоидное обезболивающее средство. «Неопиоидные анальгетики» представляют собой природные или синтетические вещества, которые уменьшают боль, но не являются опиоидными анальгетиками. Примеры неопиоидных анальгетиков включают, но не ограничиваются, этодолак, индометацин, сулиндак, толметин, мелоксикам, пироксикам, ацетаминофен, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрий, оксапрозин, аспирин, холин трисалицилат магния, дифлунизал, меклофенамовую кислоту, мефенамовую кислоту, и фенилбутазон. В соответствии с некоторыми другими вариантами осуществления анальгетик представляет собой опиоидный анальгетик. «Опиоидные анальгетики», «опиоид», или «наркотические анальгетики» представляют собой природные или синтетические вещества, которые связываются с опиоидными рецепторами в центральной нервной системе, оказывая агонистическое действие. Примеры опиоидных анальгетиков включают, но не ограничиваются, кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, прококсифен, бупренорфин, буторфанол, дезоцин, нальбуфин и пентазоцин.
В соответствии с другим вариантом осуществления дополнительное средство представляет собой дезинфицирующее средство. В соответствии с другим вариантом осуществления дезинфицирующим средством является антибиотик. Термин «антибиотик» в контексте настоящего изобретения означает любую группу химических веществ, обладающих способностью ингибировать рост или разрушать бактерии, и другие микроорганизмы, используемые, главным образом, при лечении инфекционных заболеваний. Примеры антибиотиков включают, но не ограничиваются, пенициллин G; метициллин; нафциллин; оксациллин; клоксациллин; диклоксациллин; ампициллин; амоксициллин; тикарциллин; карбенициллин; мезлоциллин; азлоциллин; пиперациллин; имипенем; азтреонам; цефалотин; цефаклор; цефокситин; цефуроксим; цефоницид; цефметазол; цефотетан; цефпрозил; лоракарбеф; цефетамет; цефоперазон; цефотаксим; цефтизоксим; цефтриаксон; цефтазидим; цефепим; цефиксим; цефподоксим; цефсулодин; флероксацина; налидиксовую кислоту; норфлоксацин; ципрофлоксацин; офлоксацин; эноксацин; ломефлоксацин; циноксацин; доксициклин; миноциклин; тетрациклин; амикацин; гентамицин; канамицин; нетилмицин; тобрамицина; стрептомицин; кларитромицин; эритромицин; эритромицин эстолат; эритромицин этилсукцината; эритромицин глюкогептонат; эритромицин лактобионат; стеарат эритромицин; ванкомицин; тейкопланин; хлорамфеникол; клиндамицин; триметоприм; сульфаметоксазол; нитрофурантоин; рифампицин; мупироцин; метронидазол; цефалексин; рокситромицин; со-амоксиклавуанат; сочетания пиперациллина и тазобактама; и их различные соли, кислоты, основания и другие производные. Антибактериальные антибиотики включают, но не ограничиваются, пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, аминогликозиды, монобактамы, гликопептиды, хинолоны, тетрациклины, макролиды, фторхинолоны и фторхинолоны.
Другие примеры по меньшей мере одного дополнительного терапевтического средства включают, но не ограничиваются, масло шиповника, витамин Е, 5-фторурацил, блеомицин, экстракт лука, пентоксифиллин, пролил-4-гидроксилазу, верапамил, циклоспорин, тамоксифен, третиноин, колхицин, антагонист кальция, траниласт, цинк, антибиотик, и их сочетания.
Снижение нецелевых воздействий
В соответствии с несколькими вариантами осуществления для усиления лекарственной эффективности и для уменьшения накопления полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функционального эквивалента в тканях, не являющихся тканями-мишенями, полипептид по настоящему изобретению аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) или его функциональный эквивалент может быть соединен или связан с функциональной группой для направленной доставки, которая направляет полипептид к специфическому типу клеток или ткани. Примеры функциональной группы для направленной доставки включают, но не ограничиваются, (i) лиганд для известного или неизвестного рецептора или (ii) соединение, пептид или моноклональное антитело, которое связывается со специфической молекулярной мишенью, например, пептидом или углеводом, экспрессируемым на поверхности специфического типа клеток.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид представляет собой полипептид аминокислотной последовательности YARAAARQARA (SEQ ID NO: 11), и второй полипептид включает терапевтический домен, последовательность которого по существу идентична аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 70 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 80 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 90 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2). В соответствии с другим вариантом осуществления второй полипептид имеет по меньшей мере 95 процентную идентичность последовательности с аминокислотной последовательностью KALARQLGVAA (SEQ ID NO: 2), и фармацевтическая композиция ингибирует киназную активность митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2).
В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLAVA (SEQ ID NO: 8).
В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVA (SEQ ID NO: 9).
В соответствии с другим вариантом осуществления второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 10); смотри, например, опубликованную заявку США № 2009-0196927, опубликованную заявку США № 2009-0149389 и опубликованную заявку США № 2010-0158968, каждая из которых включена в настоящее описание посредством ссылки в полном объеме.
В соответствии с другим вариантом осуществления функциональный эквивалент полипептида MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) представляет собой слитый пептид, содержащий первый полипептид, функционально связанный со вторым полипептидом, где первый полипептид включает домен белковой трансдукции функционально эквивалентный YARAAARQARA (SEQ ID NO: 11), и второй полипептид представляет собой полипептид аминокислотной последовательности KALARQLGVAA (SEQ ID NO: 2).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRIKA (SEQ ID NO: 12).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKA (SEQ ID NO: 13).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности YGRKKRRQRRR (SEQ ID NO: 14).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности WLRRIKAWLRRI (SEQ ID NO: 15).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности FAKLAARLYR (SEQ ID NO: 16).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности KAFAKLAARLYR (SEQ ID NO: 17).
В соответствии с другим вариантом осуществления первый полипептид представляет собой полипептид аминокислотной последовательности HRRIKAWLKKI (SEQ ID NO: 18).
Терапевтическое количество/Доза
Терапевтические средства в композициях доставляются в терапевтически эффективных количествах. Совместно со сведениями, представленными в настоящем описании, выбирая среди различных активных соединений и учитывая такие факторы, как эффективность, относительная биодоступность, масса тела пациента, тяжесть побочных эффектов и предпочтительный путь введения, может быть составлен эффективный профилактический или терапевтический режим лечения, который не вызывает значительной токсичности и остается эффективным для лечения конкретного пациента. Эффективное количество для любого конкретного применения может варьировать в зависимости от таких факторов, как заболевание или патологическое состояние, подвергаемое лечению, конкретно вводимого терапевтического средства (средств), размера тела пациента или тяжести заболевания или патологического состояния. Специалист в данной области может эмпирически определить эффективное количество конкретного терапевтического средства (средств) без необходимости проведения лишних экспериментов. В основном предпочтительно использовать максимальную дозу, то есть наиболее высокую безопасную дозу согласно некоторым медицинским представлениям. Термины «доза» и «дозировка» в настоящем описании используют взаимозaменяемо.
Для любого соединения, описанного в настоящей заявке, терапевтически эффективное количество может быть первоначально определено, по предварительным исследованиям in vitro и/или моделей животных. Терапевтически эффективная доза также может быть определена по клиническим данным для терапевтического средства (средств), которые были протестированы у людей и для соединений, которые, как известно, проявляют сходную терапевтическую активность, как другие родственные активные агенты. Применяемую дозу можно корректировать, исходя из относительной биодоступности и эффективности вводимого соединения. Корректировка дозы для достижения максимальной эффективности, исходя из способов, описанных выше и других способов, хорошо известна из уровня техники и находится в компетенции специалиста.
В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 по настоящему изобретению вводят путем кожной инъекции через инъекционный аппарат, пропитанный фармацевтически приемлемой композицией. В соответствии с некоторыми такими вариантами осуществления инъекционный аппарат представляет собой шовный материал. В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 по настоящему изобретению вводят путем кожной инъекции посредством пропитанного инъекционного аппарата в интервале доз от 50 нг/100 мкл/линейный сантиметр края раны до 1000 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 50 нг/100 мкл/линейный сантиметр края раны до 100 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 100 нг/100 мкл/линейный сантиметр края раны до 150 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 150 нг/100 мкл/линейный сантиметр края раны до 200 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 200 нг/100 мкл/линейный сантиметр края раны до 250 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 250 нг/100 мкл/линейный сантиметр края раны до 300 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 300 нг/100 мкл/линейный сантиметр края раны до 350 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 350 нг/100 мкл/линейный сантиметр края раны до 400 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 400 нг/100 мкл/линейный сантиметр края раны до 450 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 450 нг/100 мкл/линейный сантиметр края раны до 500 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 500 нг/100 мкл/линейный сантиметр края раны до 550 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 550 нг/100 мкл/линейный сантиметр края раны до 600 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 600 нг/100 мкл/линейный сантиметр края раны до 650 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 650 нг/100 мкл/линейный сантиметр края раны до 700 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 700 нг/100 мкл/линейный сантиметр края раны до 750 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 750 нг/100 мкл/линейный сантиметр края раны до 800 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 800 нг/100 мкл/линейный сантиметр края раны до 850 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 850 нг/100 мкл/линейный сантиметр края раны до 900 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 900 нг/100 мкл/линейный сантиметр края раны до 950 нг/100 мкл/линейный сантиметр края раны. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 для кожной инъекции посредством пропитанного инъекционного аппарата составляет от 950 нг/100 мкл/линейный сантиметр края раны до 1000 нг/100 мкл/линейный сантиметр края раны.
В соответствии с несколькими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется во время ушивания раны, а затем через 24 часа после ушивания раны.
В соответствии с несколькими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется многократно в течение суток. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется многократно в течение суток совпадая с заменой повязки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется ежедневно. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется ежедневно, совпадая с заменой повязки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется через день. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется через день, совпадая с заменой повязки.
В соответствии с несколькими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством инъекционного аппарата, пропитанного фармацевтической композицией однократно во время ушивания раны, а затем через 24 часа после ушивания раны. В соответствии с некоторыми такими вариантами осуществления инъекционный аппарат представляет собой шовный материал.
В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 по настоящему изобретению вводят путем кожной инъекции посредством инъекционного аппарата, пропитанного фармацевтически приемлемой композицией. В соответствии с некоторыми такими вариантами осуществления инъекционный аппарат представляет собой шовный материал. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата многократно в течение суток. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата многократно в течение суток, совпадая с заменой повязки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата ежедневно. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата ежедневно, совпадая с заменой повязки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата через день. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 доставляется путем кожной инъекции посредством пропитанного инъекционного аппарата через день, совпадая с заменой повязки.
В соответствии с несколькими вариантами осуществления полипептидный ингибитор МК2 вводят внутрибрюшинно в интервале доз от 70 мкг/кг до 80 мкг/кг за один раз ежедневно, еженедельно, или в альтернативные дни или недели. В соответствии с некоторыми другими вариантами осуществления полипептидный ингибитор МК2 вводят внутрибрюшинно в дозе 75 мкг/кг за один раз ежедневно, еженедельно, или в альтернативные дни или недели.
В соответствии с несколькими вариантами осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,00001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,0001 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,001 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,01 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,1 мг/кг (или 100 мкг/кг) массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 1 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 10 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 2 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 3 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 4 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 5 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 60 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 70 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 80 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 90 мг/кг массы тела примерно до 100 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 90 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 80 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 70 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 60 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 50 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 40 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 30 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 20 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 10 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,1 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,01 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,001 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,0001 мг/кг массы тела. В соответствии с другим вариантом осуществления терапевтическое количество полипептидного ингибитора MK2 фармацевтической композиции представляет собой количество примерно от 0,000001 мг/кг массы тела примерно до 0,00001 мг/кг массы тела.
В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 25 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 2 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 2 мкг/кг/сутки до 3 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 3 мкг/кг/сутки до 4 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 4 мкг/кг/сутки до 5 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 5 мкг/кг/сутки до 6 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 6 мкг/кг/сутки до 7 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 7 мкг/кг/сутки до 8 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 8 мкг/кг/сутки до 9 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 9 мкг/кг/сутки до 10 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 1 мкг/кг/сутки до 5 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 5 мкг/кг/сутки до 10 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 10 мкг/кг/сутки до 15 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 15 мкг/кг/сутки до 20 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 25 мкг/кг/сутки до 30 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 30 мкг/кг/сутки до 35 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 35 мкг/кг/сутки до 40 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 40 мкг/кг/сутки до 45 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 45 мкг/кг/сутки до 50 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 50 мкг/кг/сутки до 55 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 55 мкг/кг/сутки до 60 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 60 мкг/кг/сутки до 65 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 65 мкг/кг/сутки до 70 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 70 мкг/кг/сутки до 75 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 80 мкг/кг/сутки до 85 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 85 мкг/кг/сутки до 90 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 90 мкг/кг/сутки до 95 мкг/кг/сутки. В соответствии с некоторыми другими вариантами осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции находится в интервале от 95 мкг/кг/сутки до 100 мкг/кг/сутки.
В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 1 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 2 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 5 мкг/кг/сутки. В соответствии с другим вариантом осуществления терапевтическая доза полипептидного ингибитора MK2 фармацевтической композиции составляет 10 мкг/кг/сутки.
Составы терапевтического средства (средств) можно вводить в фармацевтически приемлемых растворах, которые могут содержать, в установленном порядке, фармацевтически приемлемые концентрации соли, буферных агентов, консервантов, совместимых носителей, адъювантов и, необязательно, других терапевтических ингредиентов.
Если не определено иное, все технические и научные термины, использованные в настоящем описании, имеют то же значение, которое обычно понимается специалистом, в той области, которой принадлежит настоящее изобретение. Хотя любые способы и вещества, сходные или эквивалентные описанным в настоящем изобретении, также могут быть использованы при осуществлении или тестировании описанного изобретения, на данный момент описаны предпочтительные способы и вещества. Все публикации, упомянутые в настоящем описании, включены в него посредством ссылки для раскрытия и описания способов и/или веществ, в связи с которыми приводятся эти публикации.
В тех случаях, когда представлен диапазон значений, следует понимать, что каждое промежуточное значение до десятых долей единицы нижнего предела, если из контекста явным образом не следует иное, между верхним и нижним пределами этого диапазона и любое другое указанное или промежуточное значение в указанном диапазоне входят в объем настоящего изобретения. Верхний и нижний пределы этих меньших диапазонов, которые независимо могут быть включены в меньшие диапазоны, также входят в объем настоящего изобретения, с учетом любого конкретного исключенного предела в указанном диапазоне. В тех случаях, когда установленный диапазон включает один или оба предела, диапазоны, исключающие любой из двух или оба вместе этих включенных пределов, также входят в объем настоящего изобретения.
Следует отметить, что в контексте настоящего изобретения и в прилагаемой формуле изобретения формы единственного числа включают ссылки на формы множественного числа, если из контекста явным образом не следует иное. Все технические и научные термины, используемые в настоящем описании, имеют такое же значение.
Публикации, рассмотренные в настоящем описании, содержания которых включены в описание посредством ссылки, представлены только для их раскрытия до даты подачи настоящей заявки. Ничего в настоящей заявке не должно быть истолковано как признание того, что описанное изобретение не имеет права датировать задним числом такую публикацию на основании более раннего изобретения. Далее, представленные даты публикации, могут отличаться от фактических дат публикации, которые могут нуждаться в независимом подтверждении.
Описанное изобретение может быть выполнено в других конкретных формах, не отклоняясь от его сущности и существенных признаков, и, соответственно, ссылка должна быть сделана на прилагаемую формулу изобретения, а не на вышеизложенное описание, определяющую объем настоящего изобретения.
ПРИМЕРЫ
Следующие примеры предложены для того, чтобы предоставить специалистам в данной области полное раскрытие и описание осуществления и использования настоящего изобретения, и не предназначены для ограничения объема того, что авторы изобретения рассматривают в качестве своего изобретения и представления, что приведенные ниже примеры представляют собой все или единственно проведенные эксперименты. Были предприняты попытки обеспечить точность в отношении используемых чисел (например, количеств, температуры и т.д.), но должны учитываться некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой части по массе, молекулярная масса представляет собой усредненную молекулярную массу, температура дана в градусах по Цельсию, а давление равно или близко к атмосферному.
Пример 1. IC50 и специфичность MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1)
Значение IC50 (половина максимальной ингибирующей концентрации) для полипептидных ингибиторов MK2 по настоящему изобретению, MMI-0100 аминокислотной последовательности YARAAARQARAKALARQLGVAA (SEQ ID NO: 1), MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), MMI-0300 (FAKLAARLYRKALARQLGVAA; SEQ ID NO: 3); MMI-0400 (KAFAKLAARLYRKALARQLGVAA; SEQ ID NO: 4); и MMI-0500 (HRRIKAWLKKIKALARQLGVAA; SEQ ID NO: 7) определяли, используя функцию Millipore's IC50 Profiler Express service. Этот количественный анализ определяет, какое количество ингибитора необходимо для ингибирования 50% заданного биологического процесса или компонента процесса (т.е. фермента, клетки или клеточного рецептора) [IC50]. В частности, в этих анализах положительно заряженный субстрат фосфорилируется радиоактивно меченой фосфатной группой АТФ, если каназа не ингибируется пептидным ингибитором. Положительно заряженный субстрат затем притягивается к отрицательно заряженной фильтровальной мембране, количественно анализируется с помощью сцинтилляционного счета и сравнивается с контролем 100% активности.
Концентрации АТФ в пределах 15 мкM условной Km для АТФ были выбраны в связи с тем, что концентрация АТФ около Km может позволять киназам иметь такую же относительную величину активности фосфорилирования.
Кроме того, полипептидные ингибиторы MK2 по настоящему изобретению могут дифференциально ингибировать селективную группу киназ, которые вовлечены в заживление кожных ран или образование рубца in vivo.
Следовательно, для идентификации потенциальных внутриклеточных киназ, на которые воздействуют полипептидные ингибиторы MK2 по настоящему изобретению, специфичность MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1) и его функциональных эквивалентов MMI-0200 аминокислотной последовательности YARAAARQARAKALNRQLGVA (SEQ ID NO: 19), MMI-0300 (FAKLAARLYRKALARQLGVAA; SEQ ID NO: 3); MMI-0400 (KAFAKLAARLYRKALARQLGVAA; SEQ ID NO: 4); и MMI-0500 (HRRIKAWLKKIKALARQLGVAA; SEQ ID NO: 7) оценивали путем определения активности всех 266 киназ человека, доступных для тестирования в профилировании киназ Millipore (Смотри Таблицу 5). Во время анализа были определены киназы, которые были ингибированы более чем на 65% под действием MMI-0100 (YARAAARQARAKALARQLGVAA; SEQ ID NO: 1); MMI-0200 (YARAAARQARAKALNRQLGVA; SEQ ID NO: 19); MMI-0300 (FAKLAARLYRKALARQLGVAA; SEQ ID NO: 3); MMI-0400 (KAFAKLAARLYRKALARQLGVAA; SEQ ID NO: 4); и MMI-0500 (HRRIKAWLKKIKALARQLGVAA; SEQ ID NO: 7).
Как показано в Таблице 5, при 100 мкM, полипептидные ингибиторы MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) ингибировали специфическую группу киназ и показали очень ограниченное ингибирование нецелевой киназы. Более конкретно, полипептидные ингибиторы MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) ингибировали in vitro более 65% киназной активности митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI, серин/треонин-специфичной протеинкиназы) и рецептора факторов роста BDNF/NT-3 (TrkB, тирозинкиназа).
|
Полипептидный ингибитор МК2 MMI-0100 (SEQ ID NO: 1) селективно ингибирует киназы, выбранные из группы митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI, серин/треонин-специфичной протеинкиназы) и рецептора факторов роста BDNF/NT-3 (TrkB, тирозинкиназа). В Таблице 6 перечислены значения IC50 MMI-100 (SEQ ID NO: 1) с выбранными киназами и нецелевыми белками (включая нецелевые киназы и нецелевые рецепторы). Как показано в Таблице 6, значения IC50 для полипептидного ингибитора МК2 MMI-0100 (SEQ ID NO: 1) с киназами, выбранными из группы митоген-активированной протеинкиназы-активированной протеинкиназы 2 (MK2), митоген-активированной протеинкиназы-активированной протеинкиназы 3 (MK3), кальций/кальмодулин-зависимой протеинкиназы I (CaMKI, серин/треонин-специфичной протеинкиназы) и рецептора факторов роста BDNF/NT-3 (TrkB, тирозинкиназа) находятся в интервале между 4,6 мкМ и 15,8 мкМ. В отличие от этого, значения IC50 для полипептидного ингибитора МК2 MMI-0100 (SEQ ID NO: 1) с интервалом нецелевых белков между 34,1 мкМ и 180,6 мкМ.
Таблица 6. Значения IC50 MMI-0100 (SEQ ID NO: 1) с выбранными киназами и нецелевыми белками (включая нецелевые киназы и нецелевые рецепторы)
|
Пример 2. Оценка нецелевых эффектов полипептидных ингибиторов MK2
Нецелевые эффекты полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) оценивали, используя анализы связывания Cerep, которые действуют в соответствии с принципом конкурентного анализа с использованием в каждом анализе радиомеченного лиганда и источника рецептора. Первичный скрининг проводили при 1 - 10 мкМ в двух повторах, с последующим определением IC50, в тех случаях, когда тестируемый пептидный ингибитор демонстрировал более 50% ингибирование от контрольного значения. Каждый анализ связывания проводили в 6 контрольных лунках с носителем или без него плюс 8 точек доза-ответ релевантного эталонного соединения. Полипептидный ингибитор МК2 MMI-0100 (SEQ ID NO: 1) показал менее 30% ингибирование нецелевых белков ангиотензин 2, бомбезин, меланокортин 4, нейрокинин 2, нейропептид Y, серотонин 2A, вазоактивный интестинальный пептид и активированного кальцием K+ канала низкой проводимости.
В Таблице 7 перечислен % активности нецелевых рецепторов при 100 мкМ полипептидного ингибитора MK2 MMI-0100 (SEQ ID NO: 1).
Таблица 7. % активности выбранных нецелевых рецепторов с 100 мкМ MMI-0100 (SEQ ID NO: 1)
|
Пример 3. Оценка эффективности полипептидных ингибиторов MK2 с использованием мышиной модели гипертрофического рубцевания, индуцированного механической нагрузкой
Накопленные данные показали (1) что механический стресс, применяемый к заживающий ране, является достаточным для образования гипертрофических рубцов у мышей; и (2) что мышиная модель гипертрофического рубцевания воспроизводит все особенности гипертрофического рубцевания у людей путем усиления механических стрессорных факторов, воздействующих на раны у мышей для достижения уровней, обычно испытываемых ранами человека (Arabi, S. et al., FASEB J. 21, 3250-3261 (2007), полное содержание этого документа включено в настоящее описание посредством ссылки).
Мышиная модель гипертрофического рубцевания применима для исследования патофизиологии гипертрофического рубцевания у людей. Например, подобно гипертрофическим рубцам человека рубцы мышей увеличиваются и демонстрируют эпидермальное утолщение с придаточными структурами и волосяными фоликулами, отсутствующими в дерме. В мышиной модели гипертрофических рубцов коллаген упорядочен в компактные пласты параллельные направлению прилагаемой механической нагрузки с фибробластами, выравнивая с коллагеновыми волокнами. Подобно гипертрофическим рубцам у человека, механически индуцированные рубцы также демонстрируют значительную инфильтрацию тучными клетками; гиперваскуляризацию, классическую особенность гипертрофических рубцов, витки коллагена, которые часто наблюдаются в зрелых гипертрофических рубцах человека; и гиперплазию клеток.
Эффективность полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) по настоящему изобретению в лечении гипертрофического рубцевания была проверена с использованием этой мышиной модели.
В качестве опытного исследования была протестирована эффективность полипептидного ингибитора MK2 MMI-0100 (SEQ ID NO: 1). Количество животных в каждой группе составляло n = 5 мышей в контрольной группе (получающей фосфатно-буферный солевой раствор (PBS)) и в экспериментальной группе (получающей MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)). Одну из трех доз (3 мкМ, 30 мкМ и 100 мкМ) MMI-100 (от 57,75 мкг/кг до 75 мкг/кг (примерно 2 мкг на мышь) вводили экспериментальной группе мышей путем внутрибрюшинной инъекции ежедневно с 0 по 14 день. 2 см операционные раны были сделаны на коже спины у мышей в 0 день. На 4 день шовный материал удаляли и устройство для дистракции кожи располагали на коже спины мышей вдоль раны у каждой мыши. Поскольку у одной мыши в группе, обработанной MMI-0100 (MMI-0100- #5) рана не заживала на 4 день, шовный материал MMI-0100- #5 оставался на месте в течение дополнительных 4 дней для этой мыши.
Дорсальную кожу дистрактировали латерально вдоль обеих сторон края раны со скоростью дистракции 1 мм/день с 4 до 7 дня, а затем 2 мм/день с 8 по 14 день. Для мыши MMI-0100- #5, шовный материал удаляли на 7 день дистракцию кожи нагружали с 8 по 14 день. На 14 день кожные раны фотографировали в цифровой форме и области рубца измеряли с помощью программного обеспечения Image J. Ткань собирали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования.
На ФИГУРЕ 6 показано приблизительное сравнение внешнего вида рубца у мыши, обработанной PBS с внешним видом рубца у мыши, обработанной MMI-0100. Масштабная линейка = 2 мм. На ФИГУРЕ 7 показано сравнение области рубца между контрольными мышами и мышами, обработанными MMI-100 (SEQ ID NO: 1. Края рубца были идентифицированы и области рубца были количественно анализированы с использованием программного обеспечения Image J. Области рубца сравнивали с использованием t-критерия Стъюдента; n = 5; *, P=0,011. Как показано на Фигурах 6 и 7, и в Таблице 8, мыши, обработанные MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) демонстрировали меньшее воспаление и меньшее образование рубца по сравнению с контрольными мышами, обработанными PBS.
|
Образцы ран собирали и подвергали FACS анализу для определения инфильтрации иммунных клеток в контрольных и экспериментальных гипертрофических рубцах. Срезы ткани расщепляли коллагеназой, сортировали и метили моноклональными антителами крысы, например, против макрофагов (11b+/F4/80+), тучных клеток (CD117+), и T-лимфоцитов (CD4+/CD8+). В соответствии с другими вариантами осуществления могут быть проанализированные другие типы клеток; и межклеточный поток фосфора может быть использован при изучении восходящей и нисходящей киназной активности, в частности, вышележащей p38 MAPK и активации/фосфорилирования MK2, а также нижележащих субстратов, таких как HSP27/HSP25, TPP, среди прочего.
Анализ генной экспрессии в образцах кожи проводили с использованием qПЦР с праймерами против хемокинового (С-С мотив) лиганда 2 (ccl2), хемокинового (С-С мотив) рецептора 2 (ccr2), коллагена типа 1α2 (col1α2), коллагена типа 3α1 (col 3α1), EGF-подобного модуль-содержащего муцин-подобного белка наподобие гормонального рецептора 1 (emr1), интерлейкина-6 (IL-6) и трансформирующего фактора роста-бета1 (TGF-β1).
Цифровые фотографии делали в день хирургического вмешательства и каждые два дня после этого. Общий внешний вид рубца оценивали путем определения края раны и вычисления площади гипертрофического рубца.
Гистологическое сравнение рубцов
Площади рубца у мышей, обработанных MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) и PBS контролями анализировали гистологически. Образцы рубцов от каждой мыши фиксировали в 10% формалине и заключали в парафин. Делали срезы и окрашивали гематоксилином и эозином (H&E) для оценки отложения рубцовой ткани. На ФИГУРЕ 8 показано гистологическое сравнение рубцов у мышей, обработанных MMI-0100 (SEQ ID NO: 1) и мышей, из группы, обработанной PBS. Площади рубцов были очерчены и площади измеряли, используя программное обеспечение Image J. Масштабная линейка = 100 мкм. На ФИГУРЕ 9 показано сравнение площади поперечного среза рубцов, обработанных контролем (PBS) или MMI-0100 (SEQ ID NO: 1). n=5, *, P=0,015. Как показано на Фигуре 8, в отличие от мышей, обработанных PBS, которые демонстрировали витки коллагеновых волокон в области рубцов, коллагеновые волокна мышей, обработанных MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1) были выровнены параллельно поверхности кожи в области рубца. У некоторых мышей, обработанных MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)), области рубца трудно было обнаружить микроскопически. Кроме того, мыши, обработанные MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) также демонстрировали значительно уменьшенные области рубцов, которые гистологически сравнивали с контрольными мышами, обработанными PBS (Фигура 9; n=5, *, p=0,015).
Обработка с использованием MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) снижает транскипцию генов, связанных с образованием рубцов
Изучали действие обработки с использованием MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) на транскрипцию генов, связанных с образованием рубцов. С этой целью 2×2 мм2 кожи в области рубца собирали для экстракции РНК. Поскольку выходы РНК были низкими в двух образцах кожи из группы, обработанной PBS (PBS-1 и PBS-5) и в одном образце кожи из группы, обработанной MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) (MMI-0100 - #1), тесты qОТ-ПЦР проводили, используя РНК, экстрагированные из трех мышей в группе, обработанной PBS и из четырех мышей в группе, обработанной MMI-0100 (Таблица 9).
На ФИГУРЕ 10 показано сравнение, выполненное с помощью количественной полимеразно-цепной реакции с обратной транскриптазой (qRT-PCR) транскриптов гена, связанного с образованием рубцов. PBS группа, n=3; MMI группа, n=4, *, P= 0,016. Как показано на ФИГУРЕ 10, мыши, обработанные MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) показали значительную модуляцию экспрессии TGF-β1 в области рубца, по сравнению с контрольными мышами (*, p=0,015), и сопоставимую модуляцию других генов, связанных с образованием рубца (хотя не достигая значимости p<0,05 в этом небольшом эксперименте). Хотя уровень самого TGF-β1 не измеряли, в других вариантах осуществления могли быть измерены уровни белка. Не ограничиваясь теорией, это указывает на то, что MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) может модулировать уровни мРНК TGF-β1.
|
MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) уменьшает инфильтрацию иммунных клеток и значительно уменьшает инфильтрацию лимфоцитов
Для дальнейшего изучения действия MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) на инфильтрацию иммуномодулирующих и иммунных клеток-предшественников в раневые ткани, образцы кожи (5×30 мм2 прямоугольный) области рубца брали на анализ у мышей, обработанных PBS или MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)). Образцы кожи расщепляли либеразой и высвобожденные клетки метили флуоресцентно меченными антителами против CD45, scar-1, F4/80, CD11b, cKIT, и CD4/8. На ФИГУРЕ 11 показано сравнение клеточных популяций в области рубца от мышей, обработанных MMI-0100 и PBS. PBS группа, n=5 *, P=0,02. Как показано в Таблице 10 и на Фигуре 11, обработка с использованием MMI-0100 (YARAAARQARAKALARQLGVAA (SEQ ID NO: 1)) значительно снижала инфильтрацию CD4+/CD8+ лимфоцитов в область рубца (n=5, *, P=0,02), и последовательно уменьшала тучные/дендритные клетки, макрофаги и другие моноцитарные и стволовые клетки-предшественники, хотя не достигалась статистическая значимость p<0,05 в этом небольшом эксперименте.
|
Используя группы PBS контрольных мышей, одну дозу MMI-0100 (50 мкг/кг) вводят ежедневно внутрибрюшинной инъекцией, начиная на 42 день (т.е., через 6 недель после контрольного рассечения) и продолжая до 70 дня. Параллельной группе PBS контрольных мышей вводили контроль (PBS) для сравнения. Дорсальную кожу дистрактировали латерально вдоль обеих сторон края раны со скоростью дистракции 1 мм/день с 46 дня по 49 день, а затем 2 мм/день с 50 дня по 70 день. На 70 день кожные раны фотографировали в цифровом формате, и площадь рубца измеряли с помощью программного обеспечения Image J. Ткани брали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования, как описано выше.
Пример 3. Оценка эффективности внутрибрюшинного введения полипептидного ингибитора MK2 MMI-0300 (SEQ ID NO: 3) с использованием мышиной модели гипертрофического рубцевания, индуцированного механической нагрузкой
Эффективность внутрибрюшинного введения полипептидного ингибитора MK2 MMI-0300 (SEQ ID NO: 3) тестировали, используя мышей n = 4 на контрольную группу (получающую фосфатно-буферный солевой раствор (PBS)) и n = 6 мышей на экспериментальную группу (получающую MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)). Экспериментальной группе вводили 50 мкг/кг полипептидного ингибитора MK2 MMI-0300 (SEQ ID NO: 3) ежедневно внутрибрюшинной инъекцией ежедневно, начиная в 0 день, до 14 дня. Одна мышь в контрольной группе умерла.
Дорсальную кожу дистрактировали латерально вдоль обеих сторон краев раны со скоростью дистракции 1 мм/день с 4 дня по 7 день, а затем 2 мм/день с 8 дня по 14 день. На 14 день кожные раны фотографировали в цифровом формате и площадь рубца определяли с помощью программного обеспечения Image J. Ткани брали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования, как описано выше.
На ФИГУРЕ 12 показано приблизительное сравнение внешнего вида рубца у мыши, обработанной PBS, и мыши, обработанной MMI-0300 (SEQ ID NO: 3) на 4 день и на 14 день (масштабная линейка = 2,2 см). Как показано на Фигуре 12, мышь, обработанная MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3), демонстрировала меньшее воспаление и меньшее образование рубца, по сравнению с контрольной мышью, обработанной PBS.
Гистологическое сравнение рубцов
Области рубцов мышей, обработанных MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)) и PBS анализировали гистологически. Для гистологического анализа образцы рубца от каждой мыши фиксировали в 10% формалине и заключали в парафин. Готовили срезы и окрашивали гематоксилином и эозином (H&E) для оценки отложения ткани. На ФИГУРЕ 13 показано гистологическое сравнение рубцов у мышей, обработанных MMI-0300 (SEQ ID NO: 3) с мышью в группе, обработанной PBS. Области рубца очерчены и площади измеряли, используя программное обеспечение Image J.
Транскрипция генов, связанных с образованием рубцов
Изучали действие обработки с использованием MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)) на транскрипцию генов, связанных с образованием рубцов. С этой целью 2×2 мм2 кожи в области рубца собирали для экстракции РНК. qОТ-ПЦР проводили, используя РНК, экстрагированные из мышей в группе, обработанной PBS, и группе, обработанной MMI-0300.
На ФИГУРЕ 14 показано сравнение количественной полимеразно-цепной реакции с обратной транскриптазой (qОТ-ПЦР) транскриптов гена, связанного с образованием рубцов. PBS группа, n=3; MMI группа, n=6. Как показано на ФИГУРЕ 14, мыши, обработанные MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)), показали значительную модуляцию экспрессии ccl2 и TGF-β1 в области рубца, по сравнению с контрольными мышами.
FACS анализ области рубца
Для дальнейшего изучения действия MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)) на инфильтрацию иммуномодулирующих и иммунных клеток-предшественников в ткани раны, образцы кожи (5×30 мм2 прямоугольные) области рубца собирали от молодых и старых мышей, обработанных PBS или MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)). Образцы кожи расщепляли либеразой, и высвобожденные клетки метили флуоресцентно мечеными антителами против CD45, scar-1, F4/80, CD11b, cKIT, и CD4/8. На ФИГУРЕ 15 показано сравнение клеточной популяции в области рубца с молодыми и старыми животными из групп, обработанными PBS и MMI-0100 (SEQ ID NO: 1). Как показано на Фигуре 15, обработка с использованием MMI-0300 (FAKLAARLYRKALARQLGVAA (SEQ ID NO: 3)) показала уменьшение макрофагов и других моноцитарных и стволовых клеток-предшественников.
Пример 4. Оценка эффективности местного нанесения полипептидных ингибиторов MK2 с использованием мышиной модели гипертрофического рубцевания, индуцированного механической нагрузкой
Эффективность местного нанесения полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) по настоящему изобретению оценивали, используя мышиную модель гипертрофического рубцевания, индуцированного механической нагрузкой, описанную в Примере 2. Одну из трех доз (3 мкМ, 30 мкМ и 100 мкМ) для каждого полипептидного ингибитора MK2 вводят ежедневно местным нанесением, начиная в 0 день и до 14 дня, используя влажную повязку, пропитанную раствором, содержащим полипептидный ингибитор МК2.
Дорсальную кожу дистрактировали латерально вдоль обеих сторон края раны со скоростью дистракции 1 мм/день с 4 до 7 дня, а затем 2 мм/день с 8 по 14 день. На 14 день, кожные раны фотографировали в цифровом формате, и площадь рубца определяли с помощью программного обеспечения Image J. Ткань собирали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования, как описано выше.
Пример 5. Оценка эффективности местной внутрикожной инъекции полипептидных ингибиторов МК2 с использованием мышиной модели гипертрофического рубцевания, индуцированного механической нагрузкой
Эффективность местной внутрикожной инъекции полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) по настоящему изобретению оценивают, используя мышиную модель гипертрофического рубцевания, индуцированного механической нагрузкой, описанную в Примере 2. Одну из трех доз (3 мкМ, 30 мкМ и 100 мкМ) каждого полипептидного ингибитора МК2 вводят ежедневно местной внутрикожной инъекцией, начиная с 0 дня по 14 день.
Дорсальную кожу дистрактировали латерально вдоль обеих сторон края раны со скоростью дистракции 1 мм/день с 4 до 7 дня, а затем 2 мм/день с 8 по 14 день. На 14 день, кожные раны фотографировали в цифровом формате, и площадь рубца определяли с помощью программного обеспечения Image J. Ткани собирали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования, как описано выше.
Пример 6. Оценка эффективности внутрибрюшинных инъекций полипептидных ингибиторов МК2 с использованием мышиной модели гипертрофического рубцевания, индуцированного механической нагрузкой
Эффективность внутрибрюшинной инъекции полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1), MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) по настоящему изобретению по настоящему изобретению оценивают, используя мышиную модель гипертрофического рубцевания, индуцированного механической нагрузкой, описанную в Примере 2. Одну из трех доз (3 мкМ, 30 мкМ и 100 мкМ) каждого полипептидного ингибитора МК2 вводят ежедневно внутрибрюшинной инъекцией, начиная с 0 дня по 14 день.
Дорсальную кожу дистрактировали латерально вдоль обеих сторон края раны со скоростью дистракции 1 мм/день с 4 до 7 дня, а затем 2 мм/день с 8 по 14 день. На 14 день, кожные раны фотографировали в цифровом формате, и площадь рубца определяли с помощью программного обеспечения Image J. Ткани собирали для экстракции РНК, активированного флуоресценцией сортинга клеток (FACS) и гистологического исследования, как описано выше.
Пример 7. Количественный флуоресцентный анализ заживления царапанных ран
Действие MMI-0100 (SEQ ID NO: 1) или его функциональных эквивалентов MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) на заживление ран анализируют путем изучения мигрирующего фенотипа фибробластов человека в количественном флуоресцентном анализе заживления ран.
Анализ заживления царапанных ран представляет собой анализ в режиме реального времени, основанного на детекции с помощью инфракрасной флуоресценции для чувствительного и точного количественного анализа миграции клеток in vitro и использует липофильный индикатор для окрашивания живых клеток, т.е., 1,1'-диоктадецил-3,3,3',3'-тетраметилиндотрикарбоцианина йодид (DiR), для точной визуализации затягивания раны (Menon, M. et al., Cell Motility and the Cytoskeleton 66: 1041-1047, 2009, включено в настоящее описание посредством ссылки в полном объеме).
Для изучения действия MMI-0100 (SEQ ID NO: 1) или его функциональных эквивалентов, соответствующее количество фибробластов человека окрашивают с использованием DiR путем инкубирования суспензии фибробластов с DiR при 37°C в течение 15-20 минут. DiR-окрашенные клетки промывают дважды PBS для удаления любого избытка DiR и ресуспендируют с полной культуральной средой. Соответствующее количество DiR-окрашенных клеток высевали на 96-луночный планшет. Высеянные клетки из конфлюентного монослоя (например, через 12-24 часа после высевания), царапины наносили на предварительно окрашенные конфлюентные клеточные монослои, используя наконечник пипетки. Затем MMI-0100 (SEQ ID NO: 1) или его функциональные эквиваленты, или контрольный пептид вносят в каждую лунку. Изображения пораненных клеток сканируют в различные интервалы времени, используя флуоресцентный сканер. Изображения анализируют, используя программное обеспечение Image J, и вычисляют индекс миграции.
Пример 8. In vivo оценка противорубцовой активности полипептидных ингибиторов MK2 у свиней породы дюрок красной масти
Противорубцовую эффективность полипептидных ингибиторов MK2 MMI-0100 (SEQ ID NO: 1) или их функциональных эквивалентов MMI-0200 (SEQ ID NO: 19), MMI-0300 (SEQ ID NO: 3); MMI-0400 (SEQ ID NO: 4); и MMI-0500 (SEQ ID NO: 5) по сравнению с плацебо анализировали, используя раны всей толщины кожи у свиней породы дюрок красной масти. Две дозы (30 мкМ и 300 мкМ) полипептидного ингибитора MK2 MMI-0100 (SEQ ID NO: 1) оценивали на протяжении 70 дней и раны оценивали как на скорость заживления, так и относительную тяжесть формирования рубца.
Двух коммерчески выращенных самок свиней породы дюрок красной масти (40-50 кг) кормили кормом, не содержащим антибиотиков и воду давали без ограничения на протяжении 10 дневного периода акклиматизации, во время которого проводили комплексное ветеринарное обследование здоровья, чтобы удостовериться в здоровье животных до начала исследования. За день до хирургического вмешательства (день 0, животных анестезировали телазолом (тилетамин/золазепам; 5 мг/кг, внутримышечно); небольшую часть дорсальной поверхности хвоста обрезали лезвием Oster # 40. Пластырь с фентанилом, Duragesic (50 мкг/час) прикрепляли к бритой коже для лечения послеоперационной боли.
В 0 день свиньям предварительно вводили атропин путем внутримышечной инъекции (0,05 мг/кг) с последующим введением телазола (тилетамин/золазепам; 4,4 мг/кг внутримышечно) с последующей интубацией и ингаляцией 2 - 5 процентной смеси изофлурана с кислородом. Наносили ранение на дорсальную и латеральную сторону грудной клетки свиньи, используя лезвие # 40 Oster, и промывали мылом, не содержащим противомикробного компонента. Квадратные иссечения во всю толщину кожи параллельно остистому отростку (2 см на каждой стороне, 4 колонки по 5 иссечений, по меньшей мере на расстоянии 2 см), были сделаны на 0 день путем срезания до подкожной ткани, используя лезвие-скальпель #10, или используя площадь трепанации 2 см. Полное удаление жировых куполов необходимо для соответствующего образования рубцовой ткани. Раствор эпинефрина (разведение 1:10000) наносили на марлевые тампоны до завершения гемостаза (приблизительно 10 минут).
Перед лечением ран кусок полискина 4” X 4” использовали для покрытия ран. Настойку бензоина использовали для удерживания полискина и тестируемых или контрольных изделий на месте. Обработки проводили на 0 день, 1 и 4. Свинью #1 обрабатывали MMI-0100 (300 мкМ) с левой стороны и PBS с правой стороны. Свинью #2 обрабатывали MMI-0100 (30 мкМ) с левой стороны и PBS с правой стороны. Тестируемое вещество и контрольное вводили в раневое пространство, используя шприц с иглой 26G. Все раны были покрыты гигроскопичной прокладкой голубого цвета в качестве вторичной повязки и обматывали слоем эластичного бинта. Для облегчения боли от послеоперационной и биопсийной раны, пластырь с фентанилом меняли каждые три дня на протяжении всего исследования. Повязки меняли на 1, 4 и 7 день. На 11 день повязки удаляли.
Измерения размера раны проводили, используя цифровые штангенциркули на 0, 1, 4, 7, 11, 13 и 28 день. Для каждой раны штангенциркули использовали для измерения расстояния через наиболее широкие части раны, а также через наиболее узкую часть. Цифровые фотографии получали до и во время хирургического вмешательства и перед измерениями каждого дня. (Фотографии не показаны).
На Фигуре 16 показан размер ран как процент (проц.) размера раны у свиней породы дюрок красной масти в 0 день в местах ранения, обработанных MMI-0100 (300 мкМ) (1й столбец), MMI-0100 (30 мкМ) (2й столбец) и PBS контролем (3й столбец). Звездочка указывает статистическую значимость (p<0,05). Клиническая оценка рубцевания показала, что концентрация 30 мкМ MMI-0100 осуществляется по паритету с PBS контролем в отношении визуальных оценок внешнего вида рубца. В отличие от этого доза MMI-0100 300 мкМ формировала рубцы, которые были внешне несколько хуже, чем в других двух тестируемых/контрольных группах.
На 56 и 70 день раны оценивали клинически визуальной оценкой в баллах неинформированным ветеринаром. Общая оценка была выполнена с использованием визуальной аналоговой шкалы (VAS) в виде вертикальной отметки на 10 см линии с баллом (0), указывающим на отличный рубец и десять (10), указывающим на плохой рубец. Этот балл (см) добавляли к сумме баллов индивидуальных параметров с получением общего балла для каждого рубца. Помимо баллов VAS, рубцы также оценивали в баллах по цветовому соответствию с окружающей кожей (светлее - темнее) (идеальное соответствие = 1; слабое несоответствие = 2; явное несоответствие = 3; грубое несоответствие = 4); как матовый или блестящий (матовый = 1; блестящий = 2); по контуру (вровень с окружающей кожей = 1; слегка выступающий/неровный = 2; гипертрофический = 3; келоидный = 4); как деформированный (нет = 1; слабо выраженный = 2; умеренный = 3; тяжелый = 4); и по структуре (нормальный = 1; просто пальпируемый = 2; плотный = 3; твердый = 4). В Таблице 11 показаны баллы VAS и клинические определения цветового соответствия (CM), матовый - блестящий (M/S), контура (C), деформации (D), структуры (T) на 56 и 70 день для участков ран, обработанных MMI-0100 (в концентрации 300 мкМ), MMI-0100 (в концентрации 30 мкМ) и PBS.
Таблица 11. Клинические (визуальные) оценки участков ран
|
Во время смены повязки на 13, 28, 41, 56 и 70 день проводили клинические оценки отека, грануляции и эритемы. Отек оценивали по 5 балльной шкале. (1 = отека нет (норма); 2 = легкий отек; 3 = умеренный отек; 4 = тяжелый отек; 5 = очень тяжелый отек). Грануляцию оценивали по 4 балльной шкале. (1 = отсутствие видимой грануляционной ткани; 2 = грануляционная ткань частично покрывающая основание раны; 3 = грануляционная ткань полностью покрывающая основание раны, но не заполняющая объем раны; 4 = грануляционная ткань полностью заполняющая объем раны). Эритему оценивали по 5 балльной шкале. (1 = нет эритемы (норма); 2 = слабая эритема; 3 = умеренная эритема; 4 = тяжелая эритема; 5 = очень тяжелая эритема). Животных скарифицировали на 70 день и проводили биопсии. Гистопатологическое исследование образования рубца проводили по цифровой шкале. Патологоанатом оценивал ряд параметров рубцов и общее заживление ран. В Таблице 13 показан средний балл данных патологоанатомических исследований тестируемых групп (MMI-0100 (300 мкМ); и MMI-0100 (30 мкМ)) и контрольной PBS группы.
Таблица 12. Средний балл данных патологоанатомических исследований для тестируемых групп (MMI-0100 (300 мкМ); и MMI-0100 (30 мкМ)) и контрольной группы PBS
|
Результаты показывают, что доза 30 мкМ MMI-0100 ускоряла заживление раны при оценке на 7 и 13 день по сравнению с PBS контролем, и доза 300 мкМ того же вещества. Доза 30 мкМ MMI-0100 показала уменьшение размера раны на 10% на 7 день и на 5% на 13 день по сравнению с PBS контролем. Рубцевание выглядело слегка хуже для ран, обработанных дозой 300 мкМ на 56 день, тогда как доза 30 мкМ была равноценна PBS контролю. К 70 дню различия между обработкой и контролями были менее явными, но следовали тенденциям, аналогичным тем, которые наблюдались на 70 день. Результаты патологоанатомического исследования не достигали статистической значимости для любого из измеренных параметров, но тенденции наблюдались в дозе 30 мкМ, свидетельствуя об улучшениях как суммарного уменьшения рубца, так и повышении скорости ремоделирования ткани.
ЭКВИВАЛЕНТЫ
Хотя настоящее изобретение было описано со ссылкой на его конкретные варианты осуществления, должно быть понятно специалистам в данной области, что могут быть сделаны различные изменения и могут быть заменены эквиваленты, не отклоняясь от истинной сущности и объема изобретения. Кроме того, многочисленные модификации могут быть сделаны для адаптации конкретной ситуации, материала, химического соединения, процесса, стадии или стадий процесса, к действительной сущности и объему настоящего изобретения. Все такие модификации входят в объем прилагаемой формулы изобретения.