КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ АНЕМИИ
Вид РИД
Изобретение
[0001] По настоящей заявке испрашивается приоритет предварительных патентных заявок США с номерами 61/834808, поданной 13 июня 2013 г.; 61/889478, поданной 10 октября 2013 г.; 61/898890, поданной 1 ноября 2013 г.; 61/898885, поданной 1 ноября 2013 г.; и 61/912185, поданной 5 декабря 2013 г., каждая из которых включена в данное описание в качестве ссылки в полном объеме.
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к применению ингибитора пролилгидроксилазы HIF для лечения или профилактики анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, или анемия, связанная с ним, анемия, связанная с химиотерапией или возникающая в результате нее, или анемия, связанная со СПИДом. Кроме того, настоящее изобретение относится к ингибиторным соединениям пролилгидроксилазы HIF и их фармацевтически приемлемым солям, композициям, включающим ингибиторные соединения пролилгидроксилазы HIF, а также к способам лечения или профилактики заболеваний, таких как заболевания периферических сосудов (PVD), ишемическая болезнь сердца (ИБС), сердечная недостаточность, ишемия, гипоксия и анемия. Кроме того, настоящее изобретение относится к конкретным дозам и схемам дозирования при использовании ингибитора пролилгидроксилазы HIF для лечения или профилактики анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, или анемия, связанная с ним, анемия, связанная с химиотерапией или возникающая в результате нее, или анемия, связанная со СПИДом.
2. УРОВЕНЬ ТЕХНИКИ
2.1. Индуцируемый гипоксией фактор
[0003] Индуцируемый гипоксией фактор (HIF) представляет собой транскрипционный фактор, который является ключевым регулятором ответов на гипоксию. В ответ на условия гипоксии, т.е. на снижение уровней кислорода в клеточном окружении, HIF активирует транскрипцию ряда генов-мишеней, включая ген, кодирующий эритропоэтин. HIF представляет собой гетеродуплекс, включающий альфа- и бета-субъединицу. В то время как бета-субъединица, как правило, присутствует в избытке и не зависит от давления кислорода, альфа-субъединица HIF обнаруживается в клетках только в условиях гипоксии. В этой связи аккумуляция HIF-альфа регулируется в первую очередь гидроксилированием двух остатков пролина семейством пролилгидроксилаз, известных как пролилгидроксилазы HIF, где гидроксилирование одного или обоих остатков пролина приводит к быстрой деградации HIF-альфа. Соответственно, ингибирование пролилгидроксилазы HIF приводит к стабилизации и аккумуляции HIF-альфа (т.е. деградация HIF-альфа уменьшается), что ведет к увеличению количества HIF-альфа, доступной для образования гетеродимера HIF и позитивной регуляции генов-мишеней, таких как ген эритропоэтина. С другой стороны, активация пролилгидроксилазы HIF приводит к дестабилизации HIF-альфа (т.е. деградация HIF-альфа увеличивается), что приводит к уменьшению количества HIF-альфа, доступной для образования гетеродимера HIF и негативной регуляции генов-мишеней, таких как VEGF.
[0004] Семейство индуцируемых гипоксией факторов включает HIF-1-альфа, HIF-2-альфа и HIF-3-альфа.
[0005] Новый класс ингибиторов пролилгидроксилазы и их использование для лечения или профилактики заболеваний, облегчающихся в результате модуляции пролилгидроксилазы индуцируемого гипоксией фактора (HIF), описаны в патенте США No. 7811595, который включен в настоящий документ в качестве ссылки в полном объеме. Синтез таких ингибиторов пролилгидроксилазы описан в патентной публикации США 2012/0309977, которая включена в настоящее описание в качестве ссылки в полном объеме. Такие соединения ингибируют пролилгидроксилазу HIF, тем самым стабилизируя HIF-альфа. Как следствие стабилизации HIF-альфа, увеличивается продукция эндогенного эритропоэтина (ЕРО). Как и для всех лекарств, правильные дозировки и схемы дозирования имеют существенное значение для достижения желаемого или оптимального терапевтического эффекта без побочных эффектов или нежелательных побочных эффектов при лечении больных, страдающих такими заболеваниями, как анемия. Действительно, многие активные соединения не доходят до стадии клинических испытаний, потому что не может быть найден эффективный и безопасный режим дозирования.
[0006] Таким образом, существует потребность в безопасных, эффективных и нетоксичных дозах и схемах дозирования, при которых либо избегаются, либо уменьшаются негативные или нежелательные эффекты, обеспечивается оптимальный терапевтический эффект или и то и другое, то есть обеспечивается желаемый терапевтический профиль.
2.2. Эритропоэтин
[0007] Лечение анемии, связанной с хронической болезнью почек (CKD), с использованием агентов стимулирующих эритропоэз, часто приводит к длительным гиперфизиологическим уровням эритропоэтина (EPO), которые вовлечены в рост нежелательных побочных эффектов со стороны сердечнососудистой системы, включая гипертонию и тромбоэмболические осложнения. Поэтому существует потребность в лечении анемии, связанной с хронической болезнью почек (CKD), без длительных гиперфизиологических уровней эритропоэтина (EPO).
2.3. Метаболизм железа
[0008] HIF регулирует транскрипцию ряда генов-мишеней, включая гены, кодирующие белки, вовлеченные в метаболизм железа. Хотя железо считается необходимым для живых клеток, избыточное накопление железа связано с образованием токсичных свободных радикалов и прогрессирующим повреждением тканей. Избыток железа может также приводить к более высокому риску осложнений со стороны сердечнососудистой системы и тромбоэмболических осложнений. Избыток железа может быть обусловлен, например, переливаниями крови или анемиями, которые возникают из-за неэффективного эритропоэза. Существует потребность в лечении анемии без увеличения риска перегрузки железом.
2.4. Гепцидин
[0009] В условиях анемии или гипоксии увеличивается экспрессия не только эритропоэтина, что ведет к стимуляции эритропоэтической активности, но параллельно снижается экспрессия гена гепцидина. Гепцидин блокирует действие ферропортина. Ферропортин вызывает выход железа из клеток. Поэтому, когда экспрессия гепцидина у индивидуума уменьшается, действие ферропортина разблокируется, и железо высвобождается из клеток, тем самым увеличивая риск перегрузки железом индивидуума. Существует потребность в лечении анемий без снижения уровней гепцидина, особенно в тех случаях, когда избыток железа является проблемой. Эритроферрон идентифицирован как супрессор гепцидина (Kautz et al. 2014, Nature Genetics, Advance Online Publication on June 1, 2014, Identification of erythroferron as an erythroid regulator of iron metabolism).
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
3.1. Дозирование
[0010] В настоящем документе раскрываются схемы дозирования, в которых конкретные дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, вводят в соответствии с определенной схемой дозирования для модуляции пролилгидроксилазы HIF, тем самым стабилизируя HIF-альфа, и в результате этого осуществляя лечение анемии (например, анемии, вторичной относительно хронического заболевания почек). Смотри раздел 5.2 для описания этих формул и соединений. Дополнительно в настоящем документе раскрываются конкретные дозы и единицы дозированных форм соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В конкретных вариантах осуществления соединение представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту. В некоторых конкретных вариантах осуществления соединение представляет собой фармацевтически приемлемую соль соединения 1. В некоторых конкретных вариантах осуществления соединение представляет собой сольват соединения 1. В некоторых конкретных вариантах осуществления соединение представляет собой гидрат соединения 1.
[0011] В некоторых вариантах осуществления в настоящем документе описываются способы лечения или профилактики заболевания, облегчающегося в результате модуляции пролилгидроксилазы HIF, включающие введение больному, страдающему заболеванием, облегчаемым в результате модуляции пролилгидроксилазы HIF, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В конкретных вариантах осуществления соединение представляет собой соединение 1. В конкретных вариантах осуществления соединение представляет собой соединение 7.
[0012] В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, для описанного в настоящем документе применения составляет приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточная доза составляет 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,1 мг/кг, 3,2 мг/кг, 3,3 мг/кг, 3,4 мг/кг, 3,5 мг/кг, 3,6 мг/кг, 3,7 мг/кг, 3,8 мг/кг, 3,9 мг/кг или 4 мг/кг.
[0013] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики анемии, такой как анемия, вторичная относительно хронического заболевания почек, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, в частности, суточная доза соединения 1 составляет приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточная доза составляет 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,1 мг/кг, 3,2 мг/кг, 3,3 мг/кг, 3,4 мг/кг, 3,5 мг/кг, 3,6 мг/кг, 3,7 мг/кг, 3,8 мг/кг, 3,9 мг/кг или 4 мг/кг.
[0014] В некоторых вариантах осуществления в настоящем документе предлагается единица дозированной лекарственной формы, включающая соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, в частности, соединение 1 в количестве приблизительно 150 мг. В некоторых таких вариантах осуществления единица дозированной лекарственной формы представляет собой таблетку или капсулу.
[0015] В некоторых вариантах осуществления в настоящем документе предлагаются способы поддержания уровня гемоглобина у больного, страдающего анемией, такой как анемия, вторичная по отношению к хронической болезни почек, на уровне, по меньшей мере, приблизительно 8,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл, по меньшей мере, приблизительно 8,5 г/дл и на уровне или ниже 13,0 г/дл, по меньшей мере, приблизительно 9,0 г/дл и на уровне или ниже 13,0 г/дл, по меньшей мере, приблизительно 9,5 г/дл и на уровне или ниже 13,0 г/дл или, по меньшей мере, приблизительно 10,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл, включающие введение эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, в частности, соединения 1, больному, страдающему анемией. В некоторых таких вариантах осуществления в настоящем документе предлагается поддержание уровня гемоглобина у больного, страдающего анемией, на уровне, по меньшей мере, приблизительно 11,0 г/дл, таком как, по меньшей мере, приблизительно 11,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл, включающее введение эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, в частности, соединения 1. В некоторых таких вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, в частности, соединения 1, составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 или приблизительно 750 мг. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день, или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточная доза составляет 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,1 мг/кг, 3,2 мг/кг, 3,3 мг/кг, 3,4 мг/кг, 3,5 мг/кг, 3,6 мг/кг, 3,7 мг/кг, 3,8 мг/кг, 3,9 мг/кг или 4 мг/кг.
[0016] В некоторых вариантах осуществления в настоящем документе предлагаются способы повышения уровня гемоглобина у больного, страдающего анемией, такой как анемия при хроническом заболевании почек, по меньшей мере, приблизительно на 0,1 г/дл, по меньшей мере, приблизительно на 0,2 г/дл, по меньшей мере, приблизительно на 0,3 г/дл, по меньшей мере, приблизительно на 0,4 г/дл, по меньшей мере, приблизительно на 0,5 г/дл, по меньшей мере, приблизительно на 0,6 г/дл, по меньшей мере, приблизительно на 0,7 г/дл, по меньшей мере, приблизительно на 0,8 г/дл, по меньшей мере, приблизительно на 0,9 г/дл, по меньшей мере, приблизительно на 1,0 г/дл, по меньшей мере, приблизительно на 1,1 г/дл, по меньшей мере, приблизительно на 1,2 г/дл, по меньшей мере, приблизительно на 1,3 г/дл, по меньшей мере, приблизительно на 1,4 г/дл, или, по меньшей мере, приблизительно на 1,5 г/дл по отношению к базальному уровню гемоглобина у больного, включающие введение эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, предпочтительно соединения 1, больному, страдающему анемией. В некоторых таких вариантах осуществления такая суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[0017] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения или профилактики анемии у больного, где способ включает введение больному фармацевтически эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, где фармацевтически эффективное количество подходит для повышения уровня гемоглобина, по меньшей мере, приблизительно на 0,5 г/дл, по меньшей мере, приблизительно на 0,6 г/дл, по меньшей мере, приблизительно на 0,7 г/дл, по меньшей мере, приблизительно на 0,8 г/дл, по меньшей мере, приблизительно на 0,9 г/дл, по меньшей мере, приблизительно на 1,0 г/дл, по меньшей мере, приблизительно на 1,2 г/дл, или, по меньшей мере, приблизительно на 1,5 г/дл по сравнению с базальным уровнем гемоглобина у больного, при условии:
a) восстановления или поддержании суточного паттерна уровней EPO в сыворотке;
b) повышения суммарной связывающей способности для железа;
c) повышения суммарной связывающей способности для железа без значительного увеличения общих уровней железа; и/или
c) отсутствия существенного снижения уровней гепцидина.
[0018] В некоторых вариантах осуществления в настоящем документе предлагается соединение, как раскрыто в разделе 5.2, для лечения заболевания, состояния или нарушения, как раскрыто в разделах 5.4 и 5.7, в дозе, как раскрыто в 5.5.
3.2. Эритропоэтин
[0019] В некоторых вариантах осуществления в настоящем документе предлагаются различные способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с пониженной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, с тем, чтобы повысить уровень гемоглобина относительно базального уровня гемоглобина у больного, при этом имитируя суточную вариацию уровней EPO в сыворотке здоровых индивидуумов, где ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата.
[0020] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с пониженной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, так чтобы повысить уровень гемоглобина относительно базального уровня гемоглобина у больного, где период времени между введением, по меньшей мере, одной из упомянутых последовательных доз и введением непосредственно предшествующей дозы представляет собой период времени, достаточный для возможности возвращения уровня сывороточного EPO у больного приблизительно к базальному уровню сывороточного EPO, где ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанные с введением экзогенного EPO, сведены к минимуму.
[0021] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с пониженной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, так чтобы повысить уровень гемоглобина относительно базального уровня гемоглобина у больного, где перед добавлением одной или более доз после первоначальной дозы уровень EPO в сыворотке возвращается приблизительно к базальному уровню, где ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанные с введением экзогенного EPO, сведены к минимуму.
[0022] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с пониженной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, так чтобы повысить уровень гемоглобина относительно базального уровня гемоглобина у больного без значительного увеличения уровня сывороточного EPO по отношению к базальному уровню сывороточного EPO, где ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанные с введением экзогенного EPO, сведены к минимуму.
[0023] В некоторых таких вариантах осуществления уровень сывороточного EPO возвращается приблизительно к базальному уровню в течение приблизительно одной недели, приблизительно шести дней, приблизительно пяти дней, приблизительно четырех дней, приблизительно трех дней, приблизительно двух дней, приблизительно через двадцать четыре часа, приблизительно через восемнадцать часов или приблизительно через двенадцать часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, раскрытых в настоящем документе.
[0024] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределу приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл или приблизительно 1 мМЕ/мл базального уровня EPO.
[0025] В некоторых вариантах осуществления уровень гемоглобина повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается на приблизительно 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[0026] В некоторых вариантах осуществления уровень гемоглобина повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[0027] В некоторых вариантах осуществления уровень гемоглобина повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[0028] В некоторых вариантах осуществления уровень гемоглобина повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[0029] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хроническому заболеванию почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[0030] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[0031] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат.
[0032] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[0033] В некоторых вариантах осуществления в настоящем документе предлагается соединение, как раскрыто в разделе 5.2, для лечения заболевания, состояния или нарушения, как раскрыто в разделах 5.4 и 5.7, в дозе, как раскрыто в 5.5, в частности, в дозе, подходящей для имитации природного суточного паттерна EPO (см раздел 5.3.1).
3.3. Метаболизм железа
[0034] Традиционно считалось, что для того, чтобы эффективно лечить заболевание или состояние, связанное с уменьшенной эндогенной продукцией эритропоэтина (ЕРО), такое как анемия или анемия, вторичная относительно хронического заболевания почек, желательно увеличение уровней сывороточного железа и повышение насыщения трансферрина (TSAT). Неожиданно обнаружено, что заболевание или состояние, связанное с уменьшенной эндогенной продукцией эритропоэтина (ЕРО), или заболевание или состояние, связанное с дефицитом эндогенной продукции гемоглобина, такое как анемия или анемия, вторичная относительно хронического заболевания почек, можно эффективно лечить с помощью повышения суммарной связывающей способности для железа, а не повышения уровней сывороточного железа, что приводит к уменьшению насыщения трансферрина. Соответственно, нежелательные побочные эффекты, связанные с повышением уровней сывороточного железа, можно уменьшить или избежать.
[0035] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, так чтобы повысить суммарную связывающую способность для железа (TIBC) относительно базальной TIBC у больного, без существенного повышения уровня железа относительно базального уровня железа в сыворотке.
[0036] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения или профилактики анемии у больного, где способ включает введение больному фармацевтически эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В определенных более конкретных вариантах осуществления фармацевтически эффективное количество соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, подходит для повышения TIBC до, по меньшей мере, приблизительно 10 мкг/дл, по меньшей мере, приблизительно 20 мкг/дл, по меньшей мере, приблизительно 30 мкг/дл, по меньшей мере, приблизительно 40 мкг/дл, по меньшей мере, приблизительно 50 мкг/дл или, по меньшей мере, приблизительно 60 мкг/дл по сравнению с исходным TIBC и/или повышения уровня гемоглобина, по меньшей мере, приблизительно на 0,5 г/дл, по меньшей мере, приблизительно на 0,6 г/дл, по меньшей мере, приблизительно на 0,7 г/дл, по меньшей мере, приблизительно на 0,8 г/дл, по меньшей мере, приблизительно на 0,9 г/дл, по меньшей мере, приблизительно на 1,0 г/дл, по меньшей мере, приблизительно на 1,2 г/дл, или, по меньшей мере, приблизительно на 1,5 г/дл по отношению к базальному уровню гемоглобина, в то время как у больного:
a) восстанавливается или поддерживается суточный паттерн уровней EPO в сыворотке; и/или
b) суммарное железо поддерживается на уровнях до лечения (т.е. без существенного увеличения уровней суммарного железа); и/или
c) уровни гепцидина существенно не снижаются.
[0037] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), со сведением к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с повышением уровня сывороточного железа, включающий введение больному, страдающему заболеванием или состоянием, связанным с пониженной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить суммарную связывающую способность для железа (TIBC) относительно базальной TIBC у больного, без существенного повышения уровня железа относительно базального уровня железа в сыворотке.
[0038] В некоторых вариантах осуществления насыщение трансферрина (TSAT) снижается по отношению к базальному TSAT. В некоторых вариантах осуществления уровень сывороточного железа снижается по отношению к базальному уровню сывороточного железа.
[0039] В некоторых вариантах осуществления, TIBC увеличивается, по меньшей мере, приблизительно на 10 мкг/дл, по меньшей мере, приблизительно на 20 мкг/дл, по меньшей мере, приблизительно на 30 мкг/дл, по меньшей мере, приблизительно на 40 мкг/дл, по меньшей мере, приблизительно на 50 мкг/дл или, по меньшей мере, приблизительно на 60 мкг/дл по сравнению с базальной TIBC.
[0040] В некоторых вариантах осуществления повышение TIBC по отношению к базальной TIBC происходит в течение приблизительно 1 недели, в течение приблизительно 2 недель, в течение приблизительно 3 недель, в течение приблизительно 4 недель, в течение приблизительно 5 недель или в течение приблизительно более 6 недель.
[0041] В некоторых вариантах осуществления уровень железа в сыворотке увеличивается менее чем приблизительно на 20 мкг/дл, менее чем приблизительно на 15 мкг/дл, менее чем приблизительно на 10 мкг/дл, или менее чем приблизительно на 5 мкг/дл по сравнению с базальным уровнем железа сыворотки.
[0042] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хроническому заболеванию почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[0043] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день.
[0044] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[0045] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой гетероциклический карбоксамид. В некоторых таких вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа выбран из пиридинкарбоксамида, хинолинкарбоксамида и изохинолинкарбоксамида. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата.
[0046] В некоторых вариантах осуществления в настоящем документе предлагается соединение, как раскрыто в разделе 5.2, для лечения заболевания, состояния или нарушения, как раскрыто в разделах 5.4 и 5.7, в дозе, как раскрыто в 5.5, в частности, в дозе, подходящей для повышения суммарной связывающей способности для железа, как описано в разделе 5.3.2.
3.4. Гепцидин
[0047] Неожиданно обнаружено, что определенные типы анемии, такие как нетяжелая анемия, вторичная относительно хронического заболевания почек, нетяжелая анемия, вторичная относительно хронической сердечной недостаточности, или идиопатическая анемия старения, можно лечить путем повышения уровней сывороточного гемоглобина без снижения экспрессии гепцидина. Соответственно, экспрессия гепцидина является сходной с экспрессией у здоровых взрослых людей, и он нормально функционирует в качестве регулятора транспорта железа.
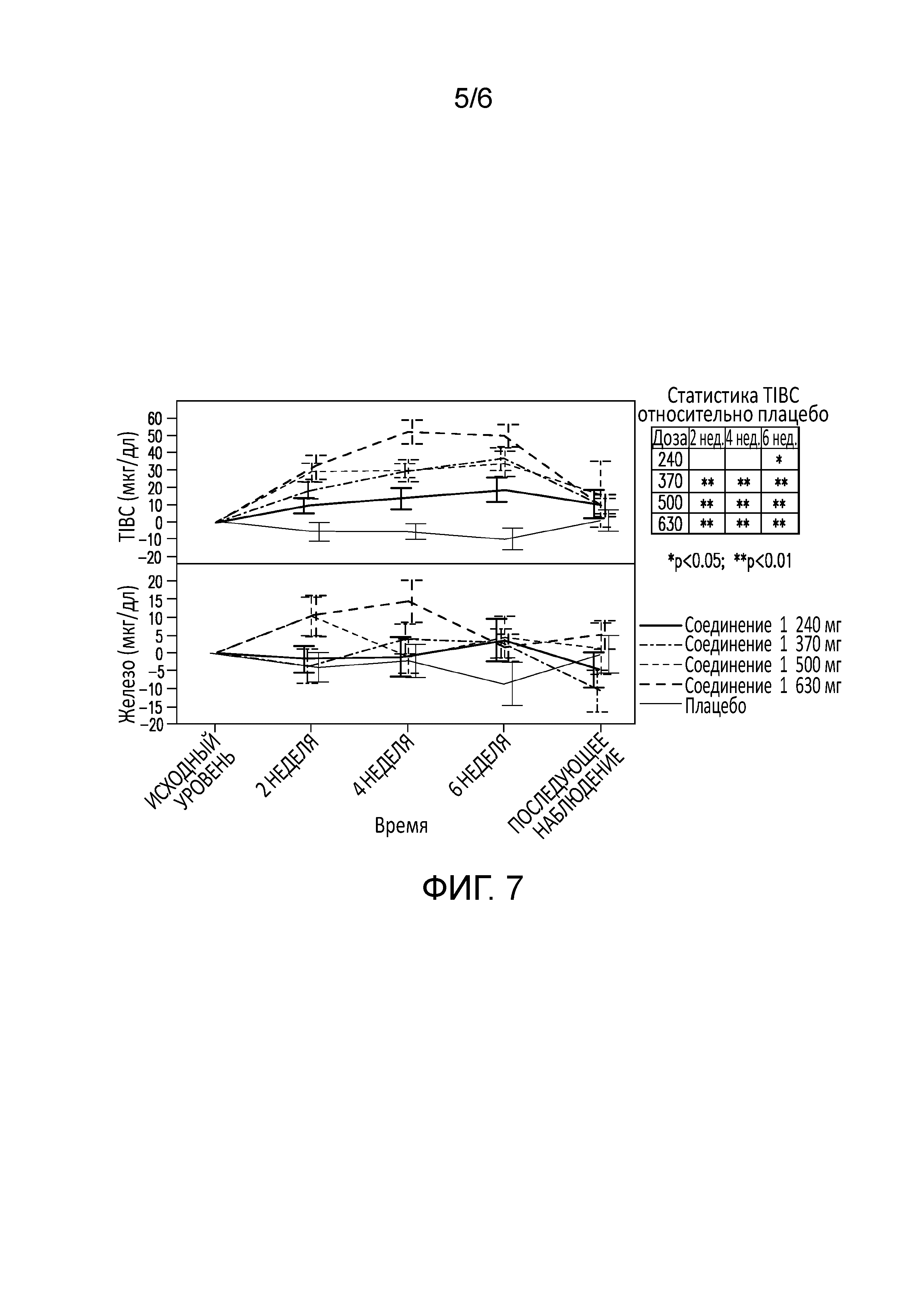
[0048] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения заболевания или состояния, выбранного из нетяжелой анемии, вторичной относительно хронического заболевания почек, нетяжелой анемии, вторичной относительно хронической сердечной недостаточности, или идиопатической анемии старения, включающий введение больному, страдающему нетяжелой анемией, вторичной относительно хронического заболевания почек, нетяжелой анемией, вторичной относительно хронической сердечной недостаточности, или идиопатической анемией старения, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровни гемоглобина в сыворотке по отношению к базальному уровню гемоглобина в сыворотке больного, без существенного снижения экспрессии гепцидина относительно базального уровня экспрессии гепцидина.
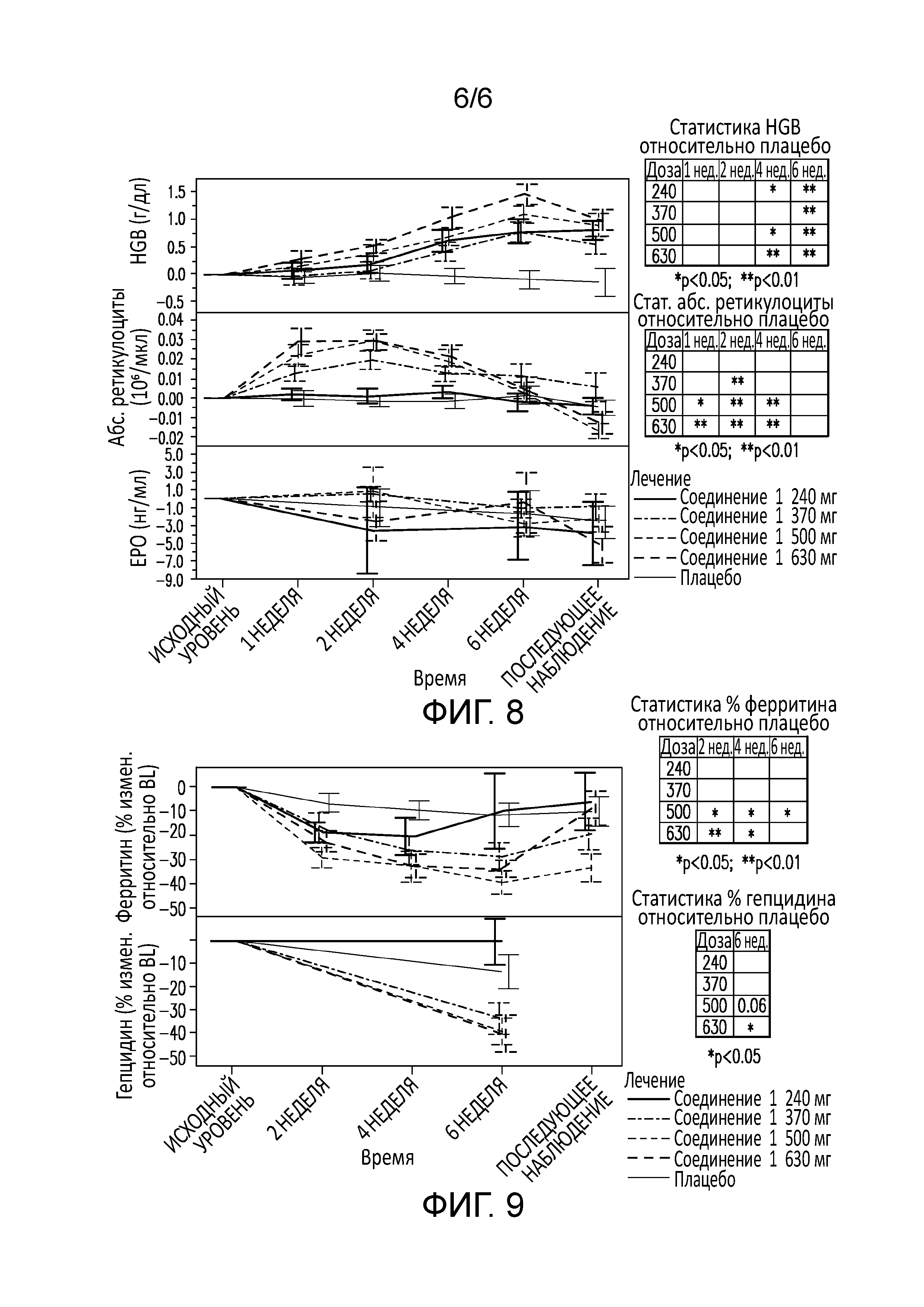
[0049] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение одной недели. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,1 г/дл в течение одной недели.
[0050] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение двух недель. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,1 г/дл в течение двух недель.
[0051] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение трех недель. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,5 г/дл в течение трех недель.
[0052] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение четырех недель. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,6 г/дл в течение четырех недель.
[0053] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение пяти недель. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,6 г/дл в течение пяти недель.
[0054] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение шести недель. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается по отношению к базальному уровню гемоглобина приблизительно на 0,6 г/дл в течение шести недель.
[0055] В некоторых вариантах осуществления экспрессия гепцидина уменьшается менее чем приблизительно на 20%, менее чем приблизительно на 15%, менее чем приблизительно на 10% по сравнению с базальным уровнем экспрессии гепцидина, менее чем приблизительно на 5%, менее чем приблизительно на 4%, менее чем приблизительно 3%, менее чем приблизительно 2%, или менее чем приблизительно на 1% по сравнению с базальным уровнем экспрессии гепцидина.
[0056] В некоторых вариантах осуществления заболевание или состояние представляет собой нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек. В некоторых вариантах осуществления заболевание или состояние представляет собой нетяжелую застойную сердечную недостаточность. В некоторых вариантах осуществления заболевание или состояние представляет собой идиопатическую анемию старения.
[0057] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[0058] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой гетероциклический карбоксамид. В некоторых таких вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа выбран из пиридинкарбоксамида, хинолинкарбоксамида и изохинолинкарбоксамида.
[0059] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[0060] В некоторых вариантах осуществления в настоящем документе предлагается соединение, как раскрыто в разделе 5.2, для лечения заболевания, состояния или нарушения, как раскрыто в разделах 5.4 и 5.7, в дозе, как раскрыто в 5.5, в частности, в дозе, подходящей для лечения анемии без снижения уровней гепцидина, как описано в разделе 5.3.3, и/или увеличения уровней эритроферрона, как описано в разделе 5.3.4.
4. КРАТКОЕ ОПИСАНИЕ ФИГУР
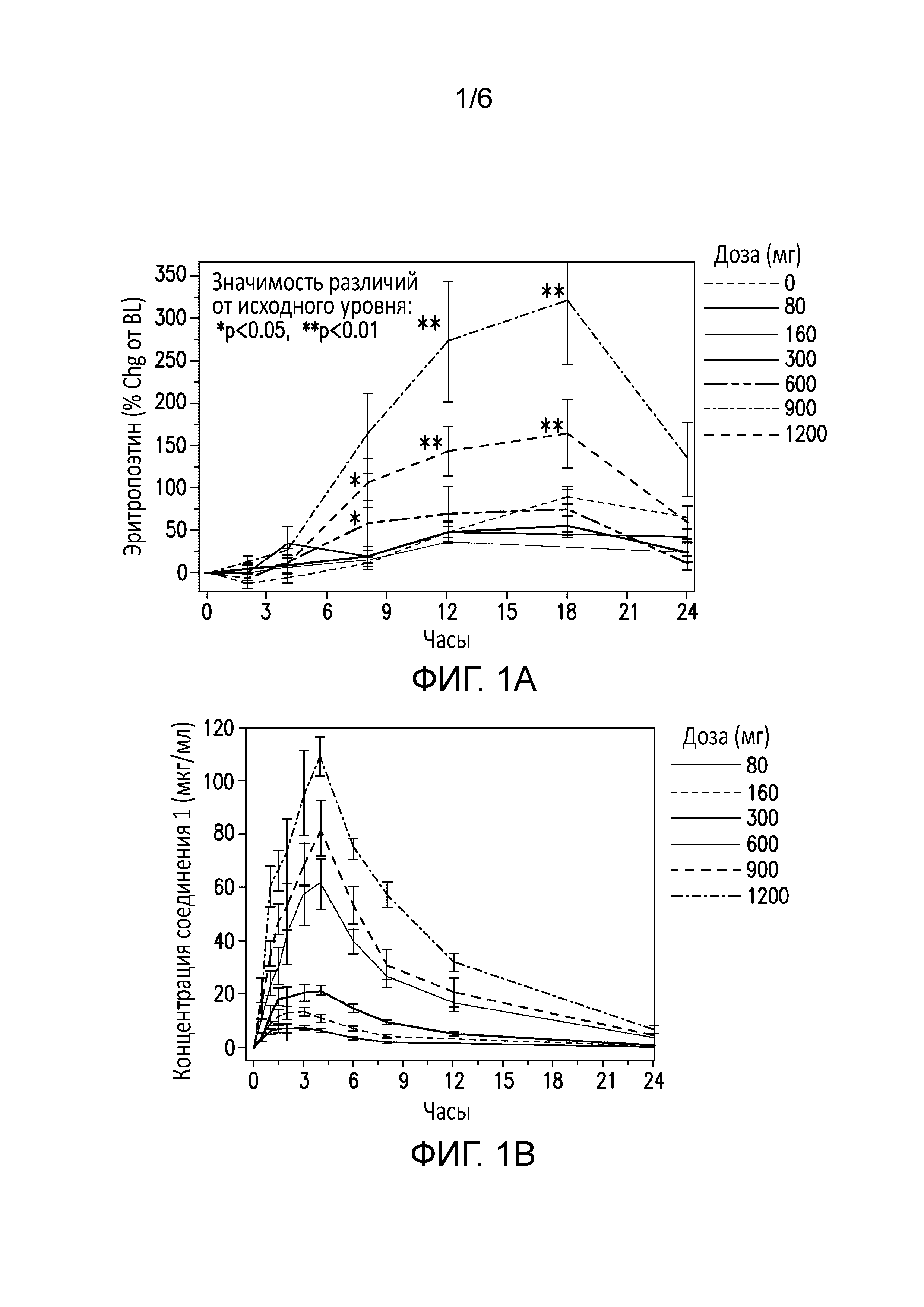
[0061] На фиг. 1a представлена концентрация соединения 1 в сыворотке здоровых взрослых мужчин на протяжении двадцати четырех часов.
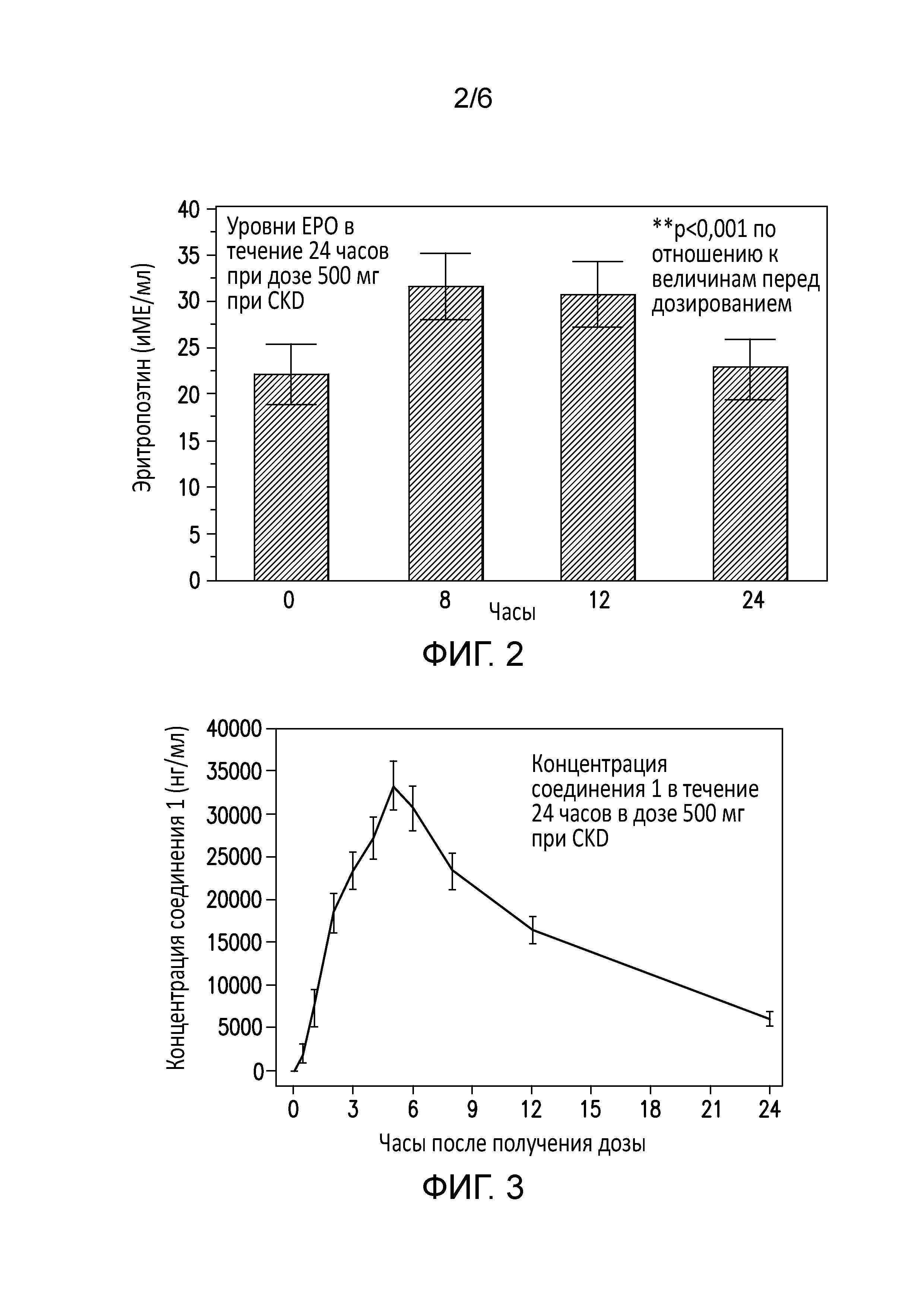
[0062] На фиг. 1b представлен ответ EPO у здоровых взрослых мужчин на протяжении двадцати четырех часов после введения соединения 1.
[0063] На фиг. 2 представлены уровни EPO на протяжении двадцати четырех часов у больных с анемией, вторичной по отношению к хронической болезни почек, после введения соединения 1.
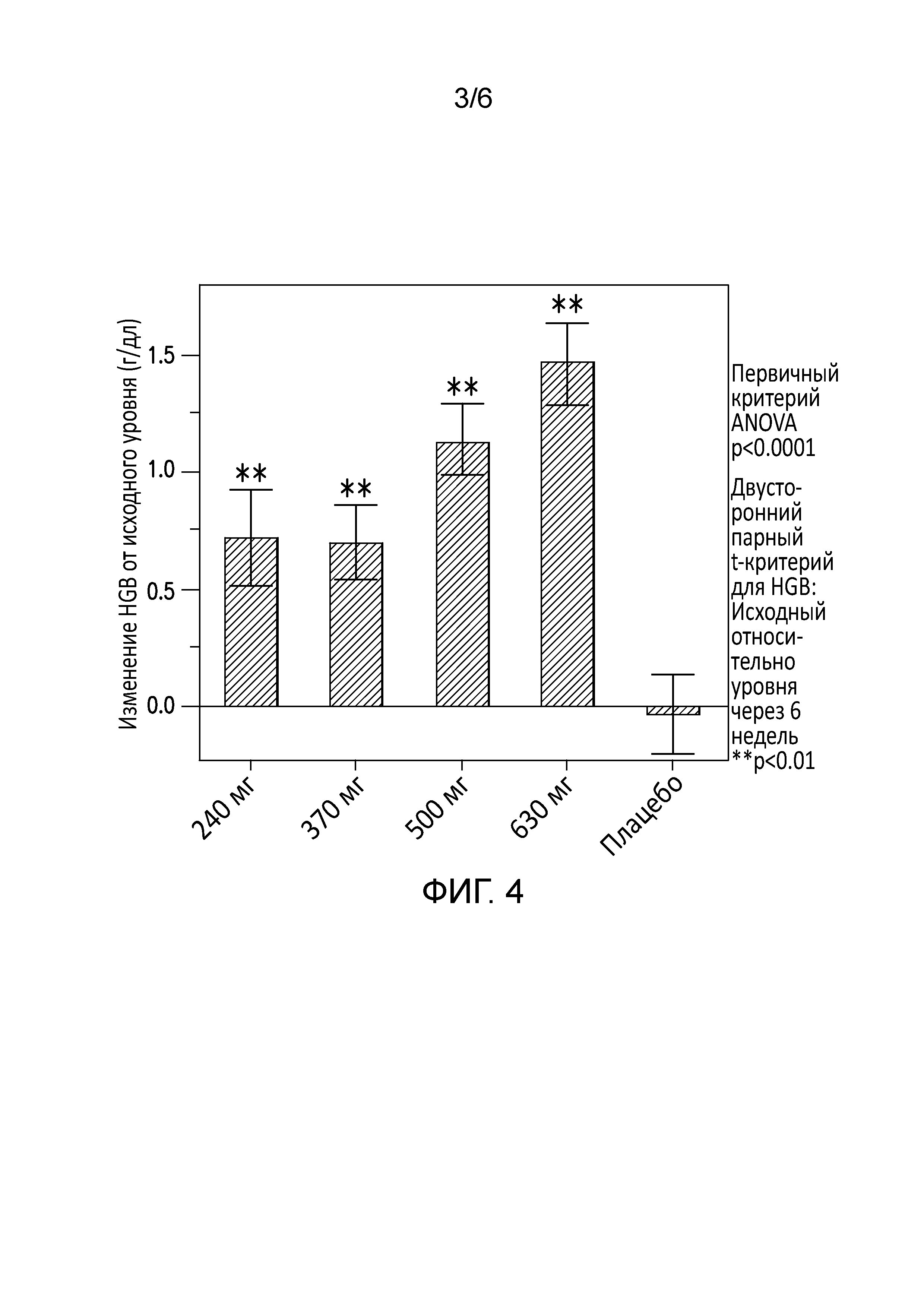
[0064] На фиг. 3 представлена концентрация соединения 1 у больных с анемией, вторичной по отношению к хронической болезни почек, на протяжении двадцати четырех часов.
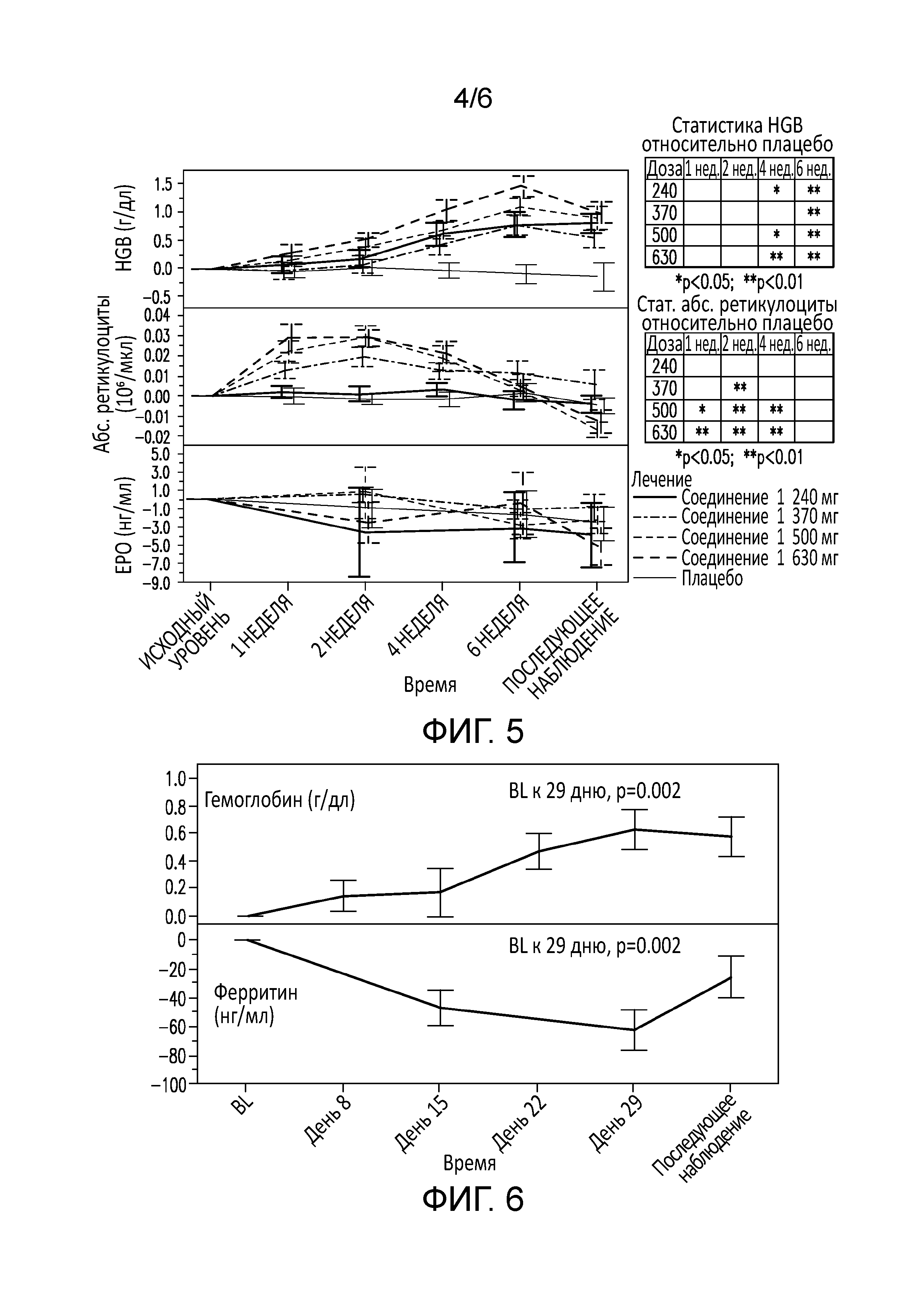
[0065] На фиг. 4 показано изменение гемоглобина от базального уровня у больных с анемией, вторичной по отношению к хронической болезни почек, при введении различных доз соединения 1.
[0066] На фиг. 5 представлены уровни гемоглобина, ретикулоцитов и EPO у больных с анемией, вторичной по отношению к хронической болезни почек, в течение шести недель лечения соединением 1.
[0067] На фиг. 6 представлено среднее (±SE) абсолютное изменение от среднего исходного уровня для гемоглобина и ферритина в исследовании с повышением дозы у больных с анемией, вторичной по отношению к хронической болезни почек.
[0068] На фиг. 7 представлено увеличение суммарной связывающей способности для железа у больных с анемией, вторичной по отношению к хронической болезни почек, в течение шести недель, в то же время показано отсутствие значительного увеличения уровней сывороточного железа при лечении соединением 1.
[0069] На фиг. 8 показано увеличение уровней сывороточного гемоглобина по отношению к исходному у больных с анемией, вторичной по отношению к хронической болезни почек, в течение шести недель лечения соединением 1.
[0070] На фиг. 9 показано, что при низких дозах экспрессия гепцидина не снижается по сравнению с базальным уровнем у больных с анемией, вторичной по отношению к хронической болезни почек, в течение шести недель лечения соединением 1.
5. ПОДРОБНОЕ ОПИСАНИЕ
[0071] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения или профилактики анемии у больного, где способ включает введение больному фармацевтически эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, где фармацевтически эффективное количество подходит для повышения уровня гемоглобина, по меньшей мере, приблизительно на 0,2 г/дл, 0,3 г/дл, 0,4 г/дл, 0,5 г/дл, по меньшей мере, приблизительно на 0,6 г/дл, по меньшей мере, приблизительно на 0,7 г/дл, по меньшей мере, приблизительно на 0,8 г/дл, по меньшей мере, приблизительно на 0,9 г/дл, по меньшей мере, приблизительно на 1,0 г/дл, по меньшей мере, приблизительно на 1,2 г/дл или, по меньшей мере, приблизительно на 1,5 г/дл по сравнению с базальным уровнем гемоглобина у больного, при этом: a) восстанавливая или поддерживая суточный паттерн уровней EPO в сыворотке; и/или b) повышая суммарную связывающую способность для железа; и/или c) повышая суммарную связывающую способность для железа без значительного увеличения общего уровня железа; и/или c) без существенного снижения уровней гепцидина.
5.1. Определения и сокращения
[0072] В некоторых вариантах осуществления при использовании во всем описании и формуле изобретения настоящего изобретения слово «включать» и другие формы слова, такие как «включающий» и «включает», обозначают включение, но без ограничения, и не предназначены для исключения, например, других добавок, компонентов, целых чисел или стадий. В некоторых вариантах осуществления при использовании в описании и прилагаемой формуле изобретения форм единственного числа «a», «an» и «the» включаются ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылка на «композицию» включает смеси двух или более таких композиций. В некоторых вариантах осуществления «необязательный» или «необязательно» означает, что описываемое далее событие или условие может или не может существовать, и что описание включает случаи, когда событие или условие имеет место, и случаи, когда они не существуют.
[0073] При применении в настоящем описании «алкильная» группа представляет собой насыщенную линейную или разветвленную цепь нециклического углеводорода, имеющего, например, от 1 до 12 атомов углерода, от 1 до 9 атомов углерода, от 1 до 6 атомов углерода, от 1 до 4 атомов углерода или от 2 до 6 атомов углерода. Типичные алкильные группы включают -метил, -этил, -н-пропил, -н-бутил, -н-пентил и -н-гексил; в то время как разветвленные алкилы включают -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и тому подобное.
[0074] Единицы C1-6 алкила включают следующее неограничивающие примеры: метил (C1), этил (С2), н-пропил (С3), изопропил (С3), н-бутил (С4), втор-бутил (C4), изобутил (С4), трет-бутил (С4), н-пентил (С5), трет-пентил (С5), неопентил (С5), изопентил (С5), втор-пентил (С5), 3-пентил (С5), н-гексил (С6), изогексил (С6), неогексил (С6), 3-метилпентил (С6), 4-метилпентил (С6), 3-метилпентан-2-ил (С6), 4-метилпентан-2-ил (С6), 2,3-диметилбутил (С6), 3,3-диметилбутан-2-ил (С6), 2,3-диметилбутан-2-ил (С6) и тому подобное.
[0075] При применении в настоящем описании «алкенильная» группа представляет собой частично ненасыщенную прямую или разветвленную цепь нециклического углеводорода, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и имеющую, например, от 1 до 6 атомов углерода. Типичные алкенильные группы включают пропенил и тому подобное.
[0076] При применении в настоящем описании «алкинильная» группа представляет собой частично ненасыщенную прямую или разветвленную цепь нециклического углеводорода, содержащую, по меньшей мере, одну углерод-углеродную тройную связь и имеющую, например, от 2 до 6 атомов углерода. Типичные алкинильные группы включают пропинил, бутинил и тому подобное.
[0077] При использовании в настоящем документе термин «алкоксильная» группа представляет собой алкил-О-группу, в которой алкильная группа представляет собой определенное в данном описании. Типичные алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси и н-бутокси.
[0078] При использовании в настоящем документе «циклоалкильная» группа представляет собой насыщенную циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, имеющую одно циклическое кольцо. Типичные циклоалкильные группы включают циклопропил, циклобутил и циклопентил.
[0079] При использовании в настоящем документе «циклоалкенильная» группа представляет собой частично ненасыщенную циклоалкильную группу, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и от 3 до 6 атомов углерода, имеющую одно циклическое кольцо. Типичные циклоалкенильные группы включают циклопропенил и циклобутенил.
[0080] При использовании в настоящем документе группа «циклоалкокси» представляет собой циклоалкил-О-группу, в которой циклоалкильная группа представляет собой определенное в данном описании. Типичные циклоалкоксигруппы включают циклопропилокси, циклобутилокси и циклопентилоксигруппу.
[0081] При использовании в настоящем документе группа «галогеналкил» представляет собой алкильную группу, как определено в настоящем документе выше, с одним или более (например, от 1 до 5) атомами водорода, замещенными атомами галогена. Типичные галогеналкильные группы включают CF3, CHF2, CH2F, CC13, CF3CH2CH2 и CF3CF2.
[0082] При использовании в настоящем документе группа «галогенциклоалкил» представляет собой циклоалкильную группу, как определено выше в настоящем изобретении, с одним или более (например, от 1 до 5) атомами водорода, замещенными атомами галогена. Типичные галогенциклоалкильные группы включают 2,2-дифторциклопропил, 2,2-дихлорциклопропил, 2,2 дибромциклопропил, тетрафторциклопропил, 3,3-дифторциклобутил и 2,2,3,3- тетрафторциклобутил.
[0083] При использовании в настоящем документе группа «гетероциклоалкил» представляет собой насыщенное кольцо из от 4 до 7 атомов, предпочтительно из 5 или 6 атомов кольца, где 1 или 2 члена кольца выбираны из группы, состоящей из О, S и NR'', и остальные атомы являются атомами углерода. В кольцах нет смежных атомов кислорода и/или серы. Типичные гетероциклоалкильные группы представляют собой пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, оксазолинил, тетрагидрофуранил, тетрагидротиофенил и тетрагидротиопиранил.
[0084] При использовании в настоящем документе группа «арил» представляет собой ароматическую моноциклическую или мультициклическую кольцевую систему, включающую от 6 до 10 атомов углерода. Типичные арильные группы включают фенил и нафтил.
[0085] При использовании в настоящем документе «гетероарил» представляет собой бициклическую или конденсированную с бензолом гетероароматическую группу из одного кольца из от 5 до 10 атомов, включающих от 2 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S, предлагаемых так, что кольца не включают смежные атомы кислорода и/или серы. N-оксиды азота кольца также включаются. Типичные гетероарильные группы с одним кольцом включают пиридил, оксазолил, изоксазолил, оксадиазолил, фуранил, пирролил, тиенил, имидазолил, пиразолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, пиразинил, пиримидил, пиридазинил и триазолил. Типичные бициклические гетероарильные группы представляют собой нафтиридил (например, 1,5 или 1,7), имидазопиридил, пиридопиримидинил и 7-азаиндолил. Типичные конденсированные с бензолом гетероарильные группы включают индолил, хинолил, изохинолил, фталазинил, бензотиенил (т.е. тианафтенил), бензимидазолил, бензофуранил, бензоксазолил, бензизоксазолил, бензотиазолил и бензофуразанил. Охватываются все позиционные изомеры, например, 2-пиридил, 3-пиридил и 4-пиридил.
[0086] В целях настоящего изобретения термины «соединение», «аналог» и «композиция химических веществ» одинаково хорошо подходят для ингибиторов фермента пролилгидроксилазы HIF, описанных в настоящем документе, включая все энантиомерные формы, диастереомерные формы, соли, таутомеры и тому подобное. Соединения, описанные в настоящем документе, включают все формы солей, например, соли как основных групп, в частности, аминов, а также соли кислотных групп, в частности, карбоновых кислот. Ниже приведены неограничивающие примеры анионов, которые могут образовывать фармацевтически приемлемые соли с основными группами: хлорид, бромид, иодид, сульфат, бисульфат, карбонат, бикарбонат, фосфат, формиат, ацетат, пропионат, бутират, пируват, лактат, оксалат, малонат, малеат, сукцинат, тартрат, фумарат, цитрат и тому подобное. Ниже приведены неограничивающие примеры катионов, которые могут образовывать фармацевтически приемлемые соли анионной формы кислотных групп-заместителей в описанных в настоящем документе соединениях: натрий, литий, калий, кальций, магний, цинк, висмут и тому подобное. Ниже приведены неограничивающие примеры катионов, которые могут образовывать фармацевтически приемлемые соли анионной формы заместителей фенольных групп, групп ариловых спиртов или гетероариловых спиртов описанных в настоящем документе соединений: натрий, литий и калий. В некоторых вариантах осуществления термины «соединение», «аналог» и «композиция химических веществ» используются в данном описании взаимозаменяемо.
[0087] Следует отметить, что если имеется несоответствие между изображенной структурой и названием, присвоенным этой структуре, изображенной структуре предоставляется большее значение. Кроме того, если стереохимия структуры или части структуры не показана, например, полужирной или пунктирной линией, структуру или часть структуры следует интерпретировать как охватывающую все ее стереоизомеры.
[0088] При использовании в настоящем документе термин «анемия» является признанным в данной области техники и определяется порогом гемоглобина следующим образом:
|
Анемия может быть хронической (например, анемия, вторичная по отношению к хронической болезни почек, анемия, вторичная по отношению к хронической сердечной недостаточности, идиопатическая анемия старения, анемия хронических заболеваний, таких как воспалительное заболевание кишечника или ревматоидный артрит, миелодиспластический синдром, фиброз костного мозга и другие апластические или диспластические анемии), подострой (например, анемия, индуцированная химиотерапией, такой как химиотерапия для лечения рака, гепатита С или других хронических заболеваний, которые снижают работу костного мозга), острой (например, потеря крови после травмы или операция), относящейся к питанию (например, дефицит железа или витамина В12), или относящейся к гемоглобинопатиям (например, серповидноклеточная анемия, талассемия и т.д.) или анемией из-за недоношенности, или анемией из-за донорства аутологичной крови.
[0089] При использовании в настоящем документе термин «нетяжелая анемия» относится к больному, имеющему анемию с уровнем гемоглобина, по меньшей мере, 9,0 г/дл. В некоторых таких вариантах осуществления нетяжелая анемия относится к анемии у больного, при которой больному не требуется переливание крови.
[0090] При использовании в настоящем документе термин «доза(ы)» означает количество соединения или его фармацевтически приемлемой соли, сольвата или гидрата для одномоментного введения. Доза может включать одну единицу дозированной лекарственной формы, или в качестве альтернативы может включать более одной единицы дозированной лекарственной формы (например, одна доза может включать две таблетки), или даже менее одной единицы дозированной лекарственной формы (например, одна доза может включать половину таблетки). Соответственно, если соединение вводят в суточной дозе 450 мг один раз в день, то доза соединения может составлять три таблетки, каждая из которых включает 150 мг соединения, вводимого один раз в день.
[0091] При использовании в настоящем документе термин «суточная доза» обозначает количество соединения или его фармацевтически приемлемой соли, сольвата или гидрата, которое вводят в течение 24-часового периода. Соответственно, суточная доза может быть введена вся за один раз (т.е. дозирование один раз в день) или, альтернативно, суточная доза может быть разделена таким образом, чтобы вводить соединение два раза в день, три раза в день или даже четыре раза в день. Когда суточную дозу вводят каждый день без перерыва, дозирование обозначается как «непрерывное» дозирование.
[0092] При использовании в настоящем документе термин «единица дозированной лекарственной формы (форм)» включает таблетки; капсуловидные таблетки; капсулы, такие как мягкие эластичные желатиновые капсулы; саше; облатки; пастилки; подушечки; дисперсии; порошки; растворы; гели; жидкие лекарственные формы, подходящие для перорального введения больному или введения через слизистую оболочку, включая суспензии (например, водные или неводные жидкие суспензии), эмульсии (например, эмульсии масла-в-воде или жидкую эмульсию воды-в-масле), растворы и эликсиры; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть восстановлены для обеспечения жидких единиц дозированных лекарственных форм, подходящих для перорального или парентерального введения больному. Единица дозированной лекарственной формы необязательно должна быть введена в виде одноразовой дозы и необязательно единица дозированной лекарственной формы представляют собой полную дозу.
[0093] При использовании в настоящем документе «эффективное количество» относится к такому количеству соединения или его фармацевтически приемлемой соли, сольвата или гидрата, которое достаточно для обеспечения терапевтического преимущества при лечении заболевания или для задержки или сведения к минимуму симптомов, связанных с заболеванием. Некоторые предпочтительные эффективные количества описаны в настоящем документе. В некоторых вариантах осуществления соединение представляет собой соединение, раскрытое в настоящем документе.
[0094] При использовании в настоящем документе термины «предотвращать», «предотвращение» и «профилактика» известны в данной области техники, и при использовании в отношении состояния, такого как местный рецидив (например, боль), болезнь, такая как рак, комплекс синдромов, такой как сердечная недостаточность или любое другое патологическое состояние, хорошо понятны в данной области техники и включают введение соединения, представленного в данном документе, или его фармацевтически приемлемой соли, сольвата или гидрата, которое снижает повторение или задерживает наступление симптомов патологического состояния у индивидуума по сравнению с индивидуумом, который не получал композицию. В некоторых вариантах осуществления соединение представляет собой соединение, которое не описано в настоящем документе. В некоторых вариантах осуществления состояние представляет собой заболевание или состояние, связанное с уменьшенной эндогенной продукцией эритропоэтина (ЕРО), или заболевание или состояние, связанное с дефицитом эндогенной продукции гемоглобина, такое как анемия или анемия, вторичная по отношению к хронической болезни почек.
[0095] При использовании в настоящем документе термины «лечить», «подвергать лечению» и «лечение» относятся к обратному развитию, снижению или купированию симптомов, клинических признаков и основного патологического состояния таким образом, чтобы улучшить или стабилизировать состояние индивидуума. Термины «лечить» и «лечение» также относятся к ликвидации или облегчению заболевания или симптомов, связанных с заболеванием. В некоторых вариантах осуществления такие термины относятся к сведению к минимуму распространения или ухудшения заболевания в результате введения соединения, предлагаемого в настоящем документе, или его фармацевтически приемлемой соли, сольвата или гидрата больному с таким заболеванием.
[0096] При использовании в настоящем документе термин «фармацевтически приемлемая соль» относится к соли, полученной из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые аддитивные соли оснований соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, включают, но не ограничиваются этим, натрий, литий, калий, кальций, магний, цинк, висмут, аммоний (включая замещенный алкилом аммоний), аминокислоты (например, лизин, орнитин, аргинин или глутамин) трометамин и меглумин. Подходящие нетоксичные кислоты включают, но не ограничиваются этим, неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этансульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористоводородная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислота и п-толуолсульфоновая кислота. Другие примеры солей хорошо известны в данной области техники, смотри, например, Remington Pharmaceutical Sciences 22nd ed., Pharmaceutical Press, (2012).
[0097] В некоторых вариантах осуществления под «фармацевтически приемлемым» подразумевают вещество, которое не является биологически или иным образом нежелательным, т.е. вещество может вводиться индивидууму вместе с соответствующим активным соединением, не вызывая клинически неприемлемых биологических эффектов или неблагоприятного взаимодействия с любым из других компонентов фармацевтической композиции, в которой оно находится.
[0098] При использовании в настоящем документе термин «гидрат» обозначает соединение, предлагаемое в данном документе, или его фармацевтически приемлемую соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными силами.
[0099] При использовании в настоящем документе термин «сольват» обозначает соединение, предлагаемое в данном документе, или его фармацевтически приемлемую соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество растворителя, отличного от воды, связанного нековалентными межмолекулярными силами.
[00100] При использовании в настоящем документе и, если не указано иное, термин «приблизительно» или «примерно» обозначает приемлемую ошибку для конкретной величины, как определяется специалистом с обычной квалификацией в данной области техники, что отчасти зависит от того, как измеряется или определяется величина. В некоторых вариантах осуществления термин «приблизительно» или «примерно» обозначает в пределах 1, 2, 3 или 4 стандартных отклонений. В некоторых вариантах осуществления термин «приблизительно» или «примерно» обозначает в пределах 50%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% или 0,05% от заданной величины или диапазона. В некоторых вариантах осуществления диапазоны могут быть выражены в настоящем документе как от «приблизительно» одной конкретной величины и/или до «приблизительно» другой конкретной величины. Когда представлен такой диапазон, другой аспект включает от одной конкретной величины и/или до другой конкретной величины. Аналогичным образом, когда значения выражены как приближения с использованием предшествующего «приблизительно», следует понимать, что конкретная величина образует другой аспект. Следует также понимать, что конечные точки каждого из диапазонов являются значимыми как по отношению к другой конечной точке, так и независимо от другой конечной точки. Следует также понимать, что существует ряд величин, раскрытых в настоящем документе, и что каждая величина также раскрывается в настоящем документе как «приблизительное» данной величины в дополнение к самой величине. Например, если раскрывается величина «10», то «приблизительно 10» также раскрывается. Следует также понимать, что, когда раскрывается величина, то «менее или равно величине», «более или равно величине» и возможные диапазоны между величинами также раскрываются, как это соответственно понятно специалисту в данной области техники. Например, если раскрывается величина «10», то «менее или равно 10», а также «более или равно 10» также раскрывается. Следует также понимать, что во всей заявке данные предоставляются в различных форматах, и что эти данные предоставляются как конечные точки и начальные точки, и диапазоны для любого сочетания точек данных. Например, если раскрываются конкретная точка данных «10» и конкретная точка данных «15», следует понимать, что рассматриваются как раскрытые более, более или равно, менее, менее или равно, и равно 10 и 15, а также между 10 и 15. Следует также понимать, что каждая единица между двумя конкретными единицами также раскрывается. Например, если раскрываются 10 и 15, то также раскрываются 11, 12, 13 и 14.
[00101] В некоторых вариантах осуществления термин индивидуум или больной может относиться к млекопитающему, такому как человек, мышь, собака, осел, лошадь, крыса, морская свинка, птица или обезьяна. В конкретных вариантах осуществления индивидуум или больной является человеком или пациентом.
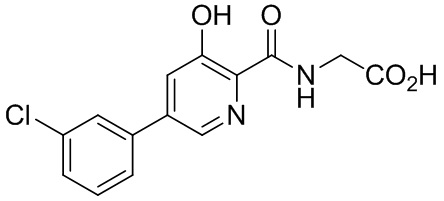
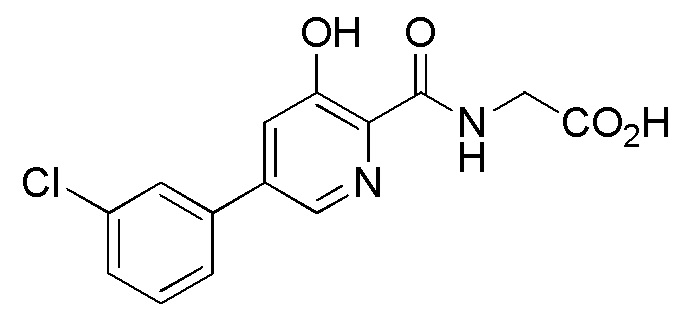
[00102] В некоторых вариантах осуществления соединение, предлагаемое в настоящем документе, представляет собой соединение 1, а именно {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту, имеющую структуру
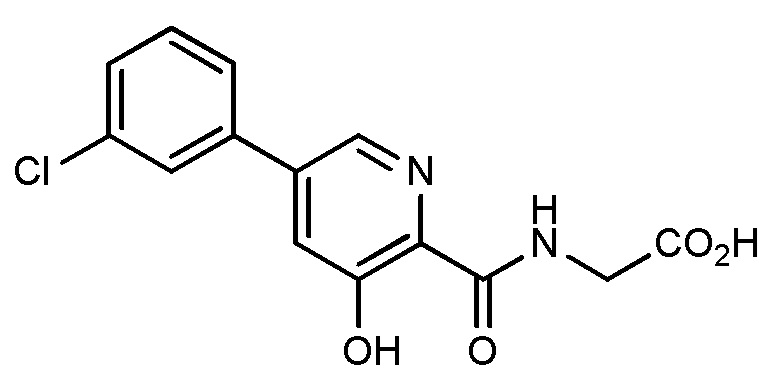
[00103] В некоторых вариантах осуществления соединение может представлять собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту, в то время как в некоторых альтернативных вариантах осуществления соединение может представлять собой фармацевтически приемлемую соль {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых альтернативных вариантах осуществления соединение может представлять собой сольват {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых альтернативных вариантах осуществления соединение может представлять собой гидрат {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых предпочтительных вариантах осуществления изобретение относится к соединению в его родительской форме (то есть, не в форме соли, сольвата или гидрата). В некоторых альтернативных предпочтительных вариантах осуществления изобретение относится к соединению или его фармацевтически приемлемой соли.
[00104] В настоящем описании термин «пролилгидроксилаза HIF» является признанным в данной области техники и может быть сокращенно представлен как «PHD». Пролилгидроксилаза HIF также известна как «белок, содержащий домен пролилгидроксилазы», что может быть сокращенно представлено как «PHD». В связи с этим существует три различных изоформы PHD, PHD1, PHD2 и PHD3, называемые также EGLN2, EGLN1 и EGLN3 или HPH3, HPH2 и HPH1, соответственно. В некоторых вариантах осуществления пролилгидроксилаза HIF может обозначать конкретный фермент (например, пролилгидроксилаза HIF-1α, пролилгидроксилаза HIF-2α и/или пролилгидроксилаза HIF-3α).
5.2. Соединения
[00105] В некоторых вариантах осуществления соединение для использования со способами, представленными в настоящем документе, представляет собой модулятор пролилгидроксилазы HIF. В более конкретных вариантах осуществления соединение для использования со способами, представленными в настоящем документе, представляет собой модулятор пролилгидроксилазы HIF-1-альфа. В других, более специфических вариантах осуществления соединение для использования со способами, представленными в настоящем документе, представляет собой модулятор пролилгидроксилазы HIF-2-альфа. В некоторых, еще более специфических вариантах осуществления, соединение для использования со способами, представленными в настоящем документе, представляет собой модулятор пролилгидроксилазы HIF-2-альфа, который является более активным в отношении пролилгидроксилазы HIF-2-альфа, чем в отношении пролилгидроксилазы HIF-1-альфа, по меньшей мере, на 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 100%, 125%, 150%, 175%, 200% , 250%, 500%, 750% или, по меньшей мере, на 1000%). Таким образом, в некоторых вариантах осуществления соединение, предлагаемое в настоящем документе для использования с предлагаемыми в настоящем документе способами, предпочтительно стабилизирует HIF-2-альфа больше чем HIF-1-альфа. Чтобы определить предпочтительную стабилизацию HIF-2-альфа относительно HIF-1-альфа, могут быть определены концентрации HIF-1-альфа и HIF-2-альфа у индивидуума, не получавшего и получавшего тестируемое соединение, с помощью ИФА наборов HIF-1-альфа и HIF-2-альфа. Необходимо соблюдать осторожность, чтобы первичные антитела в соответствующих наборах не имели перекрестных реакций с другим HIF (т.е. первичное антитело против HIF-1-альфа реагирует иммуноспецифически с HIF-1-альфа и не реагирует перекрестно с HIF-2-альфа; первичное антитело против HIF-2-альфа реагирует иммуноспецифически с HIF-2-альфа и не реагирует перекрестно с HIF-1-альфа).
[00106] В некоторых вариантах осуществления соединение по изобретению, которое представляет собой ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа, является гетероциклическим карбоксамидом. В некоторых таких вариантах осуществления гетероциклический карбоксамид выбран из пиридилкарбоксамида, хинолинкарбоксамида и изохинолинкарбоксамида.
[00107] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа имеет структуру формулы (I):
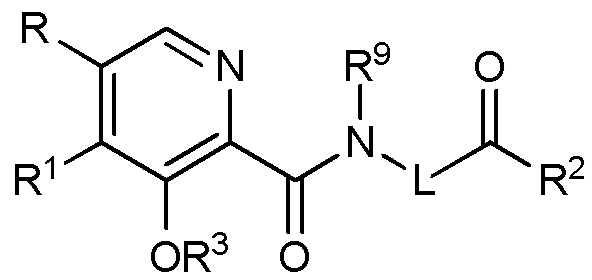
Формула (I)
или его фармацевтически приемлемой соли, сольвата или гидрата, где
R и R1, каждый независимо представляет собой:
(i) водород
(ii) замещенный или незамещенный фенил; или
(iii) замещенный или незамещенный гетероарил;
указанное замещение выбрано из
(i) С1-С4-алкила;
(ii) С3-C4 циклоалкила;
(iii) C1-C4 алкокси;
(iv) С3-C4 циклоалкокси;
(v) С1-С4 галогеналкила;
(vi) С3-С4 галогенциклоалкила;
(vii) галогена;
(viii) циано;
(ix) NHC(O)R4;
(x) C(O)NR5aR5b; и
(xi) гетероарила; или
(xii) двух заместителей, которые взятые вместе образуют конденсированное кольцо, имеющее от 5 до 7 атомов;
R4 представляет собой С1-С4 алкил или С3-C4 циклоалкил;
R5a и R5b, каждый независимо, выбран из:
(i) водорода;
(ii) С1-С4-алкила;
(iii) С3-C4 циклоалкила; или
(iv) R5a и R5b, взятые вместе образуют кольцо, имеющее от 3 до 7 атомов;
R2 выбран из
(i) OR6
(ii) NR7aR7b; и
R6 выбран из водорода и С1-С4-алкила или С3-C4 циклоалкила;
R7a и R7b, каждый независимо выбран из:
(i) водорода;
(ii) С1-С4-алкила или С3-C4 циклоалкила; или
(iii) R7a и R7b, взятые вместе образуют кольцо, имеющее от 3 до 7 атомов;
R3 выбран из водорода, метила и этила;
L представляет собой линкерную единицу, имеющую структуру -[C(R8aR8b)]n-
R8a и R8b, каждый независимо друг от друга выбран из водорода, метила и этила;
n представляет собой целое число от 1 до 3; и
R9 выбран из водорода и метила.
[00108] В некоторых более специфических вариантах осуществления в формуле (I) R и R1, оба не являются водородом.
[00109] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа имеет структуру формулы (II):
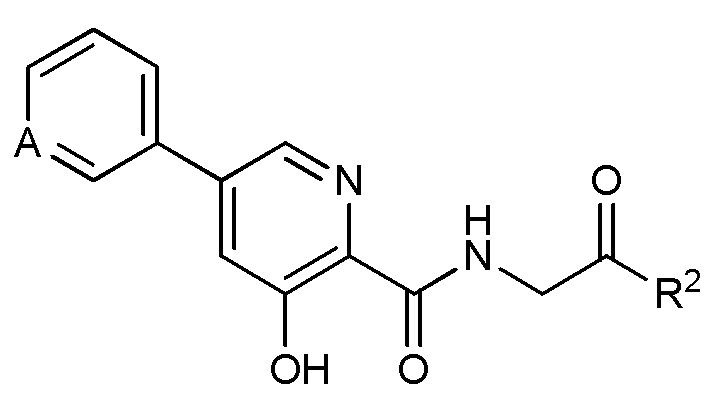
Формула (II)
или его фармацевтически приемлемой соли, сольвата или гидрата, в которой
A выбран из группы, состоящей из CR’, N, N+-O- и N+(C1-C6 алкила);
R’ выбран из группы, состоящей из H, C1-C6 алкила, C3-C6 циклоалкила, C2-C6 алкенила, C3-C6 циклоалкенила, C2-C6 алкинила, C4-C7 гетероциклоалкила, C6-C10 арила, C5-C10 гетероарила, NH2, NHR’’, N(R’’)2, NHC(O)R’’, NR’’C(O)R’’, F, Cl, Br, I, OH, OR’’, SH, SR’’, S(O)R’’, S(O)2R’’, S(O)NHR’’, S(O)2NHR’’, S(O)NR’’2, S(O)2NR’’2, C(O)R’’, CO2H, CO2R’’, C(O)NH2, C(O)NHR’’, C(O)NR’’2, CN, CH2CN, CF3, CHF2, CH2F, NH(CN), N(CN)2, CH(CN)2, C(CN)3; и
R’’ независимо выбран из группы, состоящей из C1-C6 алкила, C3-C6 циклоалкила, C4-C7 гетероциклоалкила, C6-C10 арила и C5-C10 гетероарила; и где C1-C6 алкил, C3-C6 циклоалкил или C4-C7 гетероциклоалкил необязательно замещены оксо, NH2, NHR’’, N(R’’)2, F, Cl, Br, I, OH, OR’’, SH, SR’’, S(O)R’’, S(O)2R’’, S(O)NHR’’, S(O)2NHR’’, S(O)NR’’2, S(O)2NR’’2, C(O)R’’, CO2H, CO2R’’, C(O)NH2, C(O)NHR’’, C(O)NR’’2, CN, CH2CN, CF3, CHF2, CH2F, NH(CN), N(CN)2, CH(CN)2, C(CN)3; и где C6-C10 арил или C5-C10 гетероарил необязательно замещены C1-C6 алкилом, C3-C6 циклоалкилом, C2-C6 алкенилом, C3-C6 циклоалкенилом, C2-C6 алкинилом, C4-C7 гетероциклоалкилом, C6 арилом, C5-C6 гетероарилом, NH2, NHR’’, N(R’’)2, NHC(O)R’’, NR’’C(O)R’’, F, Cl, Br, I, OH, OR’’, SH, SR’’, S(O)R’’, S(O)2R’’, S(O)NHR’’, S(O)2NHR’’, S(O)NR’’2, S(O)2NR’’2, C(O)R’’, CO2H, CO2R’’, C(O)NH2, C(O)NHR’’, C(O)NR’’2, CN, CH2CN, CF3, CHF2, CH2F, NH(CN), N(CN)2, CH(CN)2 или C(CN)3; и где две группы R’’ у азота, взятые вместе образуют кольцо, имеющее от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, включая атом азота, к которому присоединены две группы R’’;
R2 выбран из:
(i) OR6;
(ii) NR7aR7b; и
R6 выбран из водорода и C1-C4 алкила или C3-C4 циклоалкила;
R7a и R7b, каждый независимо выбран из:
(i) водорода;
(ii) С1-С4-алкила или С3-C4 циклоалкила; или
(iii) R7a и R7b, взятые вместе образуют кольцо, имеющее от 3 до 7 атомов.
[00110] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение, имеющее структуру формулы (III)
Формула (III),
или его фармацевтически приемлемую соль, сольват или гидрат, где
R выбран из
(i) -OR1; или
(ii) -NR2R3; или
(iii) -OM1;
R1 представляет собой:
(i) водород; или
(ii) C1-C6 алкил или C3-C6 циклоалкил;
R2 и R3, каждый независимо выбран из:
(i) водорода;
(ii) C1-C4 алкила или C3-C4 циклоалкила; или
(iii) R2 и R3 могут быть взяты вместе с образованием кольца, имеющего от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, включая атом азота, к которому R2 и R3 присоединены; и
M1 выбран из катиона; и
R4 представляет собой:
(i) -OH; или
(ii) -OM2; и
M2 представляет собой катион.
[00111] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение, имеющее структуру формулы (IV)
Формула (IV),
или его фармацевтически приемлемой соли, сольвата или гидрата, где
R выбран из
i) -OR1; или
(ii) -NR2R3; или
(iii) -OM1;
R1 представляет собой:
(i) водород; или
(ii) C1-C6 алкил или C3-C6 циклоалкил;
R2 и R3, каждый независимо выбран из:
(i) водорода;
(ii) C1-C4 алкила или C3-C4 циклоалкила; или
(iii) R2 и R3 могут быть взяты вместе с образованием кольца, имеющего от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, включая атом азота, к которому R2 и R3 присоединены; и
M1 выбран из катиона; и
R4 представляет собой:
(i) -OH; или
(ii) -OM2; и
M2 представляет собой катион.
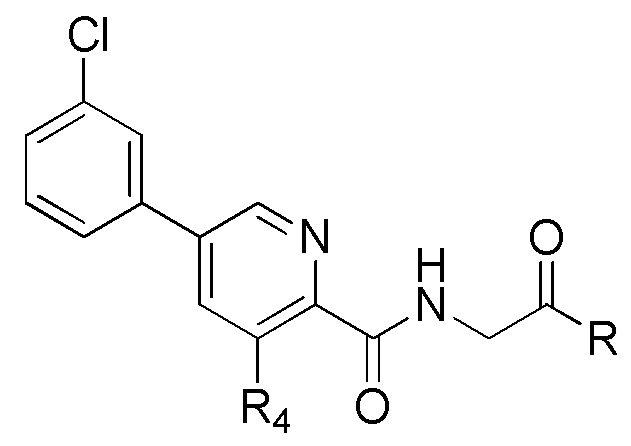
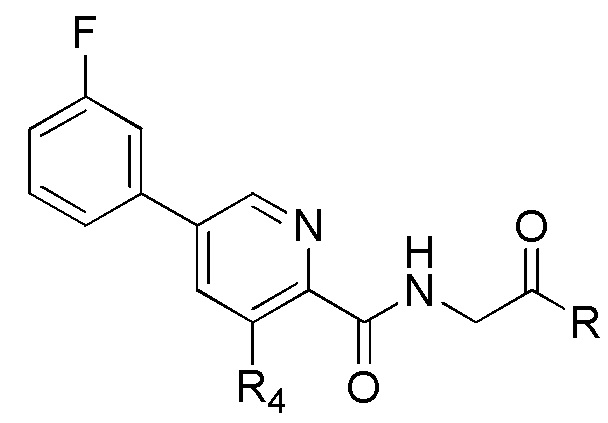
[00112] Ингибиторные соединения пролилгидроксилазы HIF, описанные в настоящем документе, являются незамещенными или замещенными 3-гидроксипиридин-2-карбоксамидами, имеющими структуру, показанную в формуле (V) ниже:
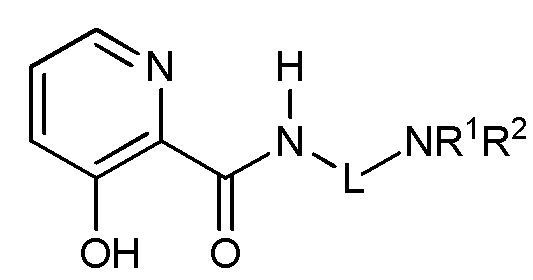
Формула (V)
и их фармацевтически приемлемыми солями и таутомерами, где L представляет C1-C6 алкил; и где R1 и R2 независимо представляют собой Н или C1-C6 алкил.
[00113] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту (соединение 1):
Соединение 1
или ее фармацевтически приемлемую соль, сольват или гидрат.
[00114] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 2, имеющее структуру:
Соединение 2
или его фармацевтически приемлемую соль, сольват или гидрат.
[00115] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 3, имеющее структуру
Соединение 3
или его фармацевтически приемлемую соль, сольват или гидрат.
[00116] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 4, имеющее структуру
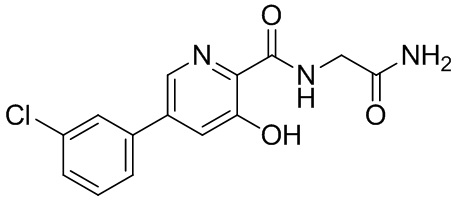
Соединение 4
или его фармацевтически приемлемую соль, сольват или гидрат.
[00117] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 5, имеющее структуру
Соединение 5
или его фармацевтически приемлемую соль, сольват или гидрат.
[00118] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 6, имеющее структуру
Соединение 6
или его фармацевтически приемлемую соль, сольват или гидрат.
[00119] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7, имеющее структуру:
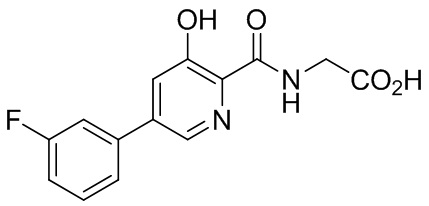
Соединение 7
или его фармацевтически приемлемую соль, сольват или гидрат.
[00120] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 8, имеющее структуру:
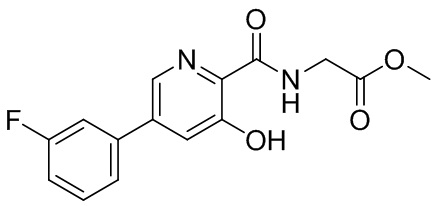
Соединение 8
или его фармацевтически приемлемую соль, сольват или гидрат.
[00121] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 9, имеющее структуру
Соединение 9
или его фармацевтически приемлемую соль, сольват или гидрат.
[00122] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 10, имеющее структуру
Соединение 10
или его фармацевтически приемлемую соль, сольват или гидрат.
[00123] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 11, имеющее структуру
Соединение 11
или его фармацевтически приемлемую соль, сольват или гидрат.
[00124] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 12, имеющее структуру
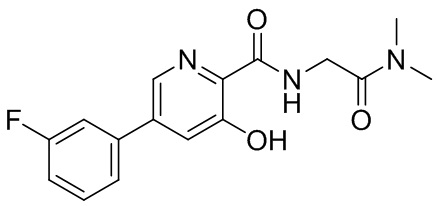
Соединение 12
или его фармацевтически приемлемую соль, сольват или гидрат.
[00125] В некоторых вариантах осуществления стабилизатор HIF представляет собой соединение 13, имеющее структуру
Соединение 13
имеющее название N-(2-аминоэтил)-3-гидрокси-пиридин-2-карбоксамид, включая его фармацевтически приемлемые соли и таутомеры. Таутомеры соединения 13 включают следующее:
[00126] В некоторых вариантах осуществления метаболит соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12 или соединения 13, может быть использован с методами, представленными в настоящем документе. В некоторых более конкретных вариантах осуществления такой метаболит представляет собой фенольный глюкуронид или ацил-глюкуронид.
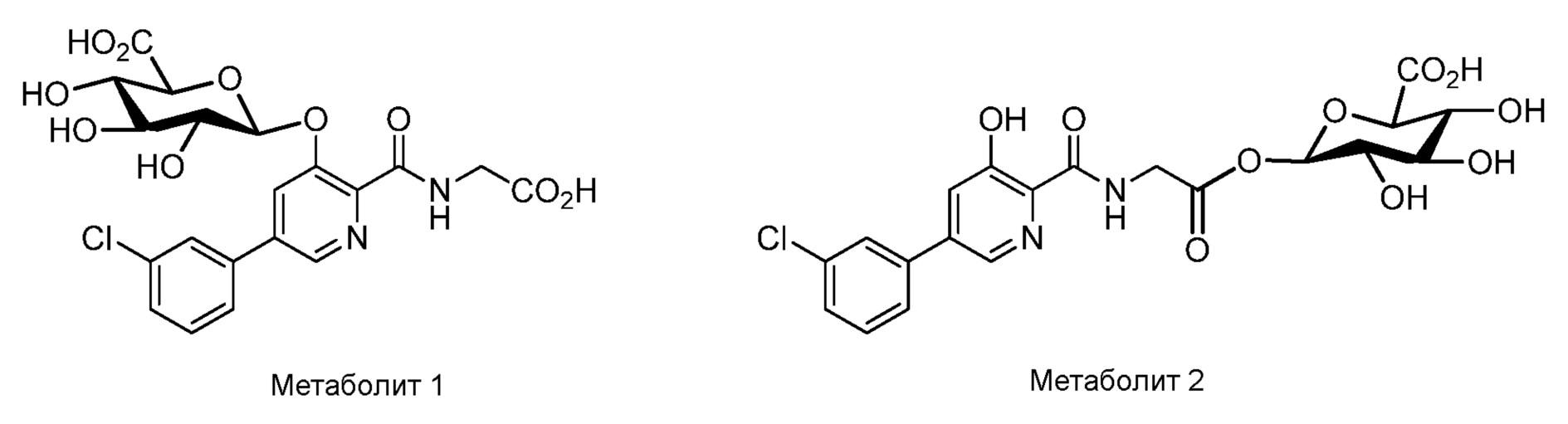
[00127] Соединение 13 может быть получено с использованием реагентов и методов, известных в данной области техники, включая способы, предлагаемые в китайской публикации заявки на патент CN 85107182 А, опубликованной 8 апреля 1987 г., и немецкой публикации заявки на патент DE 3530046 Al, опубликованной 13 марта 1986 г., полное содержание каждой из которых включено в настоящий документ в качестве ссылки.
5.3. Способ лечения и профилактики
[00128] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения и/или профилактики анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающий введение больному, страдающему анемией, эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, такого как соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, где суточная доза включает приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточная доза составляет 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,1 мг/кг, 3,2 мг/кг, 3,3 мг/кг, 3,4 мг/кг, 3,5 мг/кг, 3,6 мг/кг, 3,7 мг/кг, 3,8 мг/кг, 3,9 мг/кг или 4 мг/кг. В некоторых вариантах осуществления в настоящем документе предлагается ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа, такой как соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, для применения в способе лечения анемии, такой как анемия, вторичная по отношению к хронической болезни почек, включающем введение ингибитор пролилгидроксилазы HIF или стабилизатора HIF-альфа в суточной дозе приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточная доза составляет 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,1 мг/кг, 3,2 мг/кг, 3,3 мг/кг, 3,4 мг/кг, 3,5 мг/кг, 3,6 мг/кг, 3,7 мг/кг, 3,8 мг/кг, 3,9 мг/кг или 4 мг/кг. В некоторых вариантах осуществления соединение представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват {[5- (3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль 2-(5(3-фторфенил)-3- гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват 2-(5-(3-фторфенил)-3- гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат 2-(5-(3-фторфенил)-3- гидроксипиколинамидо)уксусной кислоты.
[00129] В некоторых таких вариантах осуществления суточная доза включает приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг соединения, фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления суточная доза составляет приблизительно 150 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 300 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 450 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 600 мг.
[00130] В некоторых вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек 3, 4 или 5 стадии. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больного ранее не лечили от анемии, такой, как анемия, вторичная по отношению к хронической болезни почек. В некоторых альтернативных вариантах осуществления больного ранее лечили от анемии, такой, как анемия, вторичная по отношению к хронической болезни почек. В некоторых вариантах осуществления больной не поддается лечению рекомбинантным эритропоэтином.
[00131] В некоторых вариантах осуществления суточную дозу вводят непрерывно. В некоторых вариантах осуществления суточную дозу вводят неопределенный срок, такой как более 42 последовательных дней, или даже более чем 90 дней подряд. В некоторых альтернативных вариантах осуществления суточную дозу вводят в течение, по меньшей мере, одной недели и до 30 дней подряд, до 35 дней подряд, или даже до 40 дней подряд. В некоторых вариантах осуществления суточную дозу вводят перорально один раз в день. В некоторых вариантах осуществления суточную дозу вводят перорально в виде разделенной дозы, вводимой два раза в день. В некоторых вариантах осуществления суточную дозу вводят в определенное время суток. В еще более конкретных вариантах осуществления суточную дозу вводят в ранний полдень. В конкретном варианте осуществления больной страдает хроническим заболеванием почек, и соединение (смотри раздел 5.2) вводят в то же время суток, в частности, в позднее утро, в ранний полдень, более конкретно сразу перед ленчем, сразу после ленча, между ленчем и 2 часами дня, между 10 часами утра и 2 часами дня, в 10 часов утра, в 11 часов утра, в 12 часов дня, в 1 час дня или в 2 часа дня.
[00132] В некоторых вариантах осуществления уровень гемоглобина больного поддерживают на уровне 8,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл, по меньшей мере, приблизительно 8,5 г/дл и на уровне или ниже 13,0 г/дл, по меньшей мере, приблизительно 9,0 г/дл и на уровне или ниже 13,0 г/дл, по меньшей мере, приблизительно 9,5 г/дл и на уровне или ниже 13,0 г/дл, или, по меньшей мере, приблизительно 10,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл. В некоторых таких вариантах осуществления уровень гемоглобина поддерживают на уровне, по меньшей мере, приблизительно 11,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл. В некоторых таких вариантах осуществления уровень гемоглобина поддерживают на уровне, по меньшей мере, приблизительно 11,0 г/дл и на уровне или ниже приблизительно 12,0 г/дл. В некоторых вариантах осуществления эти значения учитывают с поправкой на рост, пол и возраст больного.
[00133] В некоторых вариантах осуществления введение соединения, предлагаемого в данном документе (смотри раздел 5.2), приводит к увеличению уровня гемоглобина, по меньшей мере, приблизительно на 0,1 г/дл, по меньшей мере, приблизительно на 0,2 г/дл, по меньшей мере, приблизительно на 0,3 г/дл, по меньшей мере, приблизительно на 0,4 г/дл, по меньшей мере, приблизительно на 0,5 г/дл, по меньшей мере, приблизительно на 0,6 г/дл, по меньшей мере, приблизительно на 0,7 г/дл, по меньшей мере, приблизительно на 0,8 г/дл, по меньшей мере, приблизительно на 0,9 г/дл, по меньшей мере, приблизительно на 1,0 г/дл, по меньшей мере, приблизительно на 1,1 г/дл, по меньшей мере, приблизительно на 1,2 г/дл, по меньшей мере, приблизительно на 1,3 г/дл, по меньшей мере, приблизительно на 1,4 г/дл, или, по меньшей мере, приблизительно на 1,5 г/дл по сравнению с базальным уровнем гемоглобина.
[00134] В некоторых вариантах осуществления соединение необязательно вводят в сочетании с другим лекарственным средством. В некоторых таких вариантах осуществления другое лекарство представляет собой железосодержащую добавку, такой как сульфат железа, глюконат железа или фумарат железа, который можно вводить, по меньшей мере, через два часа после введения соединения. В некоторых вариантах осуществления железосодержащую добавку вводят в таком количестве, чтобы ферритин поддерживался на уровне от приблизительно 50 нг/мл до приблизительно 300 нг/мл. В некоторых вариантах осуществления железосодержащую добавку вводят перорально в суточной дозе приблизительно 50 мг элементарного железа. В некоторых вариантах осуществления железосодержащую добавку вводят по мере необходимости, тогда как в определенных альтернативных вариантах осуществления препарат железа вводят непрерывно и/или в течение неопределенного срока.
[00135] В некоторых вариантах осуществления другой лекарственный препарат представляет собой агент, стимулирующий эритропоэз (ESA), такой как миметик эритропоэтина. В некоторых вариантах осуществления другой лекарственный препарат представляет собой продукт rhEPO, такой как эпоэтин альфа, эпоэтин бета, дарбэпоэтин или пегинесатид. В некоторых вариантах осуществления ESA вводят в качестве экстренной терапии, тогда как в некоторых альтернативных вариантах осуществления ESA вводят постоянно и/или неопределенный срок.
[00136] В некоторых таких вариантах осуществления суточную дозу соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата, корректируют во время курса лечения. В частности, проводят мониторинг лечения с использованием обычных тестов, таких как, например, измерение артериального давления, гематокрита, уровня гемоглобина и/или числа эритроцитов. В зависимости от результата этих тестов, корректируется суточная доза, т.е. увеличивается или уменьшается. В более конкретных вариантах осуществления лечение начинают с использованием суточной дозы приблизительно 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг , 170 мг, 180 мг, 190 мг, 200 мг, 210 мг, 220 мг, 230 мг, 240 мг, 250 мг, 260 мг, 270 мг, 280 мг, 290 мг, 300 мг, 310 мг, 320 мг, 330 мг, 340 мг, 350 мг, 360 мг, 370 мг, 380 мг, 390 мг, 400 мг, 410 мг, 420 мг, 430 мг, 440 мг или суточной дозы приблизительно 450 мг соединения, его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления суточная доза впоследствии увеличивается приблизительно на 50 мг, 100 мг, 150 мг или 200 мг. В некоторых вариантах осуществления суточная доза впоследствии уменьшается приблизительно на 50 мг, 100 мг, 150 мг или 200 мг. В некоторых вариантах осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00137] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата; изменение уровня гемоглобина у больного после введения суточной дозы соединения и затем еще раз в более поздний период времени, где, когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина снижается менее чем приблизительно на 0,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина изменяется на приблизительно до 0,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 10,0 до приблизительно 10,9 г/дл, и уровень гемоглобина снижается менее чем приблизительно на 0,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; введение скорректированной суточной дозы соединения, которая составляет на 150 мг больше суточной дозы. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00138] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата; изменение уровня гемоглобина у больного после введения суточной дозы соединения и затем еще раз в более поздний период времени, где, когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина растет более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 10,0 до приблизительно 10,9 г/дл, и уровень гемоглобина растет более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина составляет от приблизительно 11,0 до приблизительно 12,2 г/дл, и уровень гемоглобина растет от приблизительно на 1,0 г/дл до приблизительно на 1,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина снижается приблизительно на 0,4 г/дл или повышается приблизительно на 0,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина растет от приблизительно на 0,5 г/дл до приблизительно на 0,9 г/дл по сравнению с уровнем, измеренным в более ранний период времени; введение скорректированной суточной дозы соединения, которая составляет на 150 мг менее суточной дозы. В некоторых вариантах осуществления суточная доза соединения составляет приблизительно 450 мг. В некоторых вариантах осуществления соединение представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели.
[00139] В некоторых вариантах осуществления в настоящем документе предлагаются способ лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающий введение больному, страдающему анемией, суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата; изменение уровня гемоглобина у больного после введения суточной дозы соединения и затем еще раз в более поздний период времени, где, когда уровень гемоглобина у больного составляет от приблизительно 11,0 до приблизительно 12,2 г/дл, и уровень гемоглобина растет приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина повышается от приблизительно на 1,0 до приблизительно 1,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина повышается выше, чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или введение скорректированной суточной дозы соединения, которая составляет на 300 мг менее суточной дозы. В некоторых вариантах осуществления суточная доза соединения составляет приблизительно 450 мг. В некоторых вариантах осуществления соединение представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления суточная доза соединения составляет приблизительно 450 мг. В некоторых вариантах осуществления соединение представляет собой 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели.
[00140] В некоторых вариантах осуществления изобретение относится к способу лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающему введение больному, страдающему анемией, суточной дозы соединения, которое представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат, где суточная доза составляет приблизительно 450 мг.
[00141] В некоторых таких вариантах осуществления суточная доза увеличивается приблизительно на 150 мг, так что суточная доза соединения составляет приблизительно 600 мг. В некоторых вариантах осуществления суточная доза уменьшается приблизительно на 150 мг, так что суточная доза соединения составляет приблизительно 300 мг. В некоторых вариантах осуществления суточная доза уменьшается приблизительно на 300 мг, так что суточная доза соединения составляет приблизительно 150 мг.
[00142] В некоторых вариантах осуществления соединение представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту. В некоторых вариантах осуществления соединение представляет собой фармацевтически приемлемую соль {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой сольват {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых вариантах осуществления соединение представляет собой гидрат {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты.
[00143] В некоторых вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больного ранее не лечили от анемии, такой, как анемия, вторичная по отношению к хроническому заболеванию почек. В некоторых альтернативных вариантах осуществления больного ранее лечили от анемии, такой, как анемия, вторичная по отношению к хроническому заболеванию почек.
[00144] В некоторых вариантах осуществления изобретение относится к способу лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающему введение больному, страдающему анемией, суточной дозы соединения, которое представляет собой {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту или ее фармацевтически приемлемую соль, сольват или гидрат; измерение уровня гемоглобина у больного после введения суточной дозы соединения и затем еще раз в более поздний период времени, где, когда уровень гемоглобина у больного составляет от приблизительно 11,0 до приблизительно 12,2 г/дл, и уровень гемоглобина растет более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина повышается от приблизительно на 1,0 до приблизительно 1,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина растет более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или введение скорректированной суточной дозы соединения, которая составляет на 300 мг менее суточной дозы. В некоторых вариантах осуществления суточная доза соединения составляет приблизительно 450 мг.
5.3.1 Суточные вариации уровня эритропоэтина в сыворотке
[00145] Фаза I клинических испытаний на здоровых взрослых мужчинах показала, что соединение 1, ингибитор пролилгидроксилазы HIF, было в состоянии повысить уровень гемоглобина в сыворотке, в то время как уровни EPO в сыворотке возвращались приблизительно к исходным уровням в пределах двадцати четырех часов после введения. Впоследствии неожиданно было обнаружено, что у больных, страдающих заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией эритропоэтина (EPO), или заболеванием или состоянием, связанным с дефицитом эндогенной продукции гемоглобина, таким как анемия или анемия, вторичная по отношению к хроническому заболеванию почек, путем введения последовательных доз типа ингибиторного соединения пролилгидроксилазы HIF, описанного в данном документе, можно увеличить уровни гемоглобина сыворотки у указанных больных при имитации суточной вариации уровней EPO в сыворотке здоровых людей и без существенного повышения базальных уровней EPO в сыворотке больных. Это стало неожиданным результатом по ряду причин. Например, этот результат был неожиданным в связи с тем фактом, что период полураспада соединения у таких больных был приблизительно в два раза больше по сравнению с периодом полураспада у здоровых взрослых мужчин. Соответственно, специалист в данной области техники должен был ожидать, что возвращение EPO к базальному уровню должно занимать существенно больше времени у больных с нарушениями работы почек, потенциально приводя к длительным, гиперфизиологическим уровням EPO и нежелательным побочным эффектам, обычно связанным с введением экзогенного EPO. Кроме того, этот результат был неожиданным, поскольку почка является основным источником продукции эритропоэтина в организме человека. Таким образом, особенно в отношении больных, страдающих заболеванием или состоянием, связанным с почечной недостаточностью, специалист в данной области техники не должен ожидать, что введение соединения, предлагаемого в данном документе, может привести к увеличению уровней сывороточного гемоглобина у больного, в то же время также имитируя суточную вариацию уровней EPO в сыворотке здоровых людей и не повышая базальных уровней EPO в сыворотке больных. Такой неожиданный результат позволяет вводить больным, страдающим заболеванием или состоянием, связанным с пониженной эндогенной продукцией эритропоэтина (EPO), или заболеванием или состоянием, связанным с эндогенной продукцией гемоглобина, таким как анемия или анемия, вторичная по отношению к хроническому заболеванию почек, достаточное количество последовательных доз соединения, как описано в настоящем документе, например, соединения 1, так чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, в то же время одновременно имитируя суточную вариацию уровней EPO в сыворотке здоровых людей, и существенно не увеличивая базальный уровень эритропоэтина (ЕРО) сыворотки.
[00146] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения и/или профилактики анемии у индивидуума, причем способ включает введение индивидууму фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для имитации суточной вариации уровня эритропоэтина сыворотки. Более конкретно, введение фармацевтически эффективного количества соединения, предлагаемого в данном документе, увеличивает остаточные уровни мРНК EPO и/или белка EPO приблизительно на 0%, не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или не более чем на 50% по отношению к остаточным уровням мРНК EPO и/или белка EPO до лечения и/или по отношению к остаточным уровням мРНК EPO и/или белка EPO у индивидуума без анемии, в то же время, увеличивая пиковые уровни EPO в сыворотке в течение циркадного цикла, по меньшей мере, на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, или, по меньшей мере, на 150% по отношению к пиковым уровням EPO в сыворотке до лечения (или по сравнению со здоровым индивидуумом без анемии). В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата.
[00147] Более конкретно фармацевтически эффективное количество является подходящим для имитации суточной вариации эритропоэтина в сыворотке без увеличения эритропоэтина в сыворотке выше базальных уровней, где базальные уровни представляют собой суточный базальный уровень EPO у здорового добровольца без анемии.
[00148] В некоторых вариантах осуществления фармацевтически эффективное количество является подходящим для повышения уровней EPO при измерении площади под кривой при откладывании уровней белка EPO в течение 24-часового периода времени. 12-часовой период, в течение которого уровень белка EPO находится на своем самом низком суточном уровне (остаточном) представляет собой «остаточный период»; 12-часовой период, в течение которого уровень белка EPO находится на своем самом высоком суточном уровне (пиковое значение) представляет собой «пиковый период». В некоторых вариантах осуществления, по меньшей мере, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или, по меньшей мере, 95% или 100% увеличения уровней EPO возникает в пиковый период.
[00149] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, в то же время, имитируя суточную вариацию уровней EPO в сыворотке здоровых лиц. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых таких вариантах осуществления побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанные с введением экзогенного EPO, сведены к минимуму.
[00150] Более конкретно, введение соединения, предлагаемого в данном документе, индивидууму с заболеванием или состоянием, связанным с пониженной эндогенной продукцией эритропоэтина (ЕРО), осуществляется в дозе, которая увеличивает остаточные уровни мРНК EPO и/или белка EPO приблизительно на 0%, не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или не более чем на 50% по отношению к остаточным уровням мРНК EPO и/или белка EPO до лечения и/или по отношению к остаточным уровням мРНК EPO и/или белка EPO у индивидуума без анемии, в то же время увеличивая пиковые уровни мРНК EPO и/или белка EPO в течение циркадного цикла, по меньшей мере, на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или, по меньшей мере, на 100% по отношению к пиковым уровням мРНК EPO и/или белка EPO до лечения и/или по отношению к остаточным уровням мРНК EPO и/или белка EPO у индивидуума без анемии.
[00151] Более конкретно, фармацевтически эффективное количество является подходящим для имитации у индивидуума с заболеванием или состоянием, связанным с пониженной эндогенной продукцией эритропоэтина (ЕРО), суточной вариации эритропоэтина в сыворотке без увеличения эритропоэтина в сыворотке выше базальных уровней, где базальный уровень представляет собой суточный базальный уровень EPO у здорового добровольца без анемии. В некоторых таких вариантах осуществления суточный цикл имитируется, но амплитуда суточной вариации уровней EPO в сыворотке увеличивается. Например, уровни EPO увеличиваются, по меньшей мере, на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, или, по меньшей мере, на 95% или 100% в течение пикового периода, но остаточные уровни значительно не увеличиваются.
[00152] В некоторых таких вариантах осуществления уровень сывороточного EPO возвращается приблизительно к базальному уровню в течение приблизительно одной недели, приблизительно шести дней, приблизительно пяти дней, приблизительно четырех дней, приблизительно трех дней, приблизительно двух дней, приблизительно через двадцать четыре часа, приблизительно через восемнадцать часов или приблизительно через двенадцать часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа.
[00153] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределам приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл, или приблизительно 1 мМЕ/мл базального уровня EPO.
[00154] В некоторых вариантах осуществления уровень гемоглобина повышается от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[00155] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[00156] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[00157] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00158] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хронической болезни почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек 3, 4 или 5 стадии. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[00159] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[00160] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, где период времени между введением, по меньшей мере, одной из указанных последовательных доз и введением непосредственно предшествующей дозы является достаточным периодом времени для возможности возвращения уровня сывороточного EPO у больного приблизительно к исходному уровню EPO в сыворотке. В некоторых более конкретных вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В еще более конкретных вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В еще более конкретных вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых таких вариантах осуществления побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанных с введением экзогенного EPO, сведены к минимуму.
[00161] В некоторых таких вариантах осуществления уровень сывороточного EPO возвращается приблизительно к базальному уровню в течение приблизительно одной недели, приблизительно шести дней, приблизительно пяти дней, приблизительно четырех дней, приблизительно трех дней, приблизительно двух дней, приблизительно через двадцать четыре часа, приблизительно через восемнадцать часов или приблизительно через двенадцать часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа.
[00162] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределам приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл или приблизительно 1 мМЕ/мл базального уровня EPO.
[00163] В некоторых вариантах осуществления уровень гемоглобина повышается от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[00164] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[00165] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[00166] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00167] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хронической болезни почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек 3, 4 или 5 стадии. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[00168] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[00169] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, где перед добавлением одной или более доз после первоначальной дозы уровень сывороточного EPO возвращается приблизительно к исходному уровню. В некоторых более конкретных вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В определенных конкретных вариантах осуществления соединение представляет собой соединение 1. В определенных конкретных вариантах осуществления соединение представляет собой соединение 7. В некоторых таких вариантах осуществления побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанных с введением экзогенного EPO, сведены к минимуму.
[00170] В некоторых таких вариантах осуществления уровень сывороточного EPO возвращается приблизительно к базальному уровню в течение приблизительно одной недели, приблизительно шести дней, приблизительно пяти дней, приблизительно четырех дней, приблизительно трех дней, приблизительно двух дней, приблизительно через двадцать четыре часа, приблизительно через восемнадцать часов или приблизительно через двенадцать часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа.
[00171] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределам приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл или приблизительно 1 мМЕ/мл базального уровня EPO.
[00172] В некоторых вариантах осуществления уровень гемоглобина повышается от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[00173] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[00174] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[00175] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00176] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хронической болезни почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек 3, 4 или 5 стадии. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[00177] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[00178] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного без существенного увеличения уровня EPO в сыворотке относительно базального уровня сывороточного EPO, где ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В определенном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В определенном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых таких вариантах осуществления побочные эффекты со стороны сердечнососудистой системы и риск тромбоэмболических осложнений, связанных с введением экзогенного EPO, сведены к минимуму.
[00179] В некоторых таких вариантах осуществления уровень сывороточного EPO возвращается приблизительно к базальному уровню в течение приблизительно одной недели, приблизительно шести дней, приблизительно пяти дней, приблизительно четырех дней, приблизительно трех дней, приблизительно двух дней, приблизительно через двадцать четыре часа, приблизительно через восемнадцать часов или приблизительно через двенадцать часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа.
[00180] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределам приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл или приблизительно 1 мМЕ/мл базального уровня EPO.
[00181] В некоторых вариантах осуществления уровень гемоглобина повышается от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[00182] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[00183] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[00184] В некоторых вариантах осуществления уровень гемоглобина повышается в пределах от приблизительно на 0,1 до приблизительно на 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00185] В некоторых вариантах осуществления заболевание или состояние представляет собой анемию. В некоторых таких вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хронической болезни почек (CKD). В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой хроническое заболевание почек 3, 4 или 5 стадии. В некоторых таких вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек.
[00186] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[00187] У нормальных, здоровых взрослых людей существует нормальная суточная вариация уровня эритропоэтина (EPO) в сыворотке, когда выозникает рост уровней в сыворотке с последующим возвращением к базальным уровням EPO в сыворотке. Это означает, что EPO обнаруживается в сыворотке и демонстрирует колебания в течение 24-часового периода с хорошо выраженным ритмом с максимальным уровнем в полдень с последующим возвращением к исходному уровню, который варьируется у индивидуумов.
[00188] Уровни EPO в сыворотке могут быть определены, например, с использованием биологических анализов in vivo, биологических анализов in vitro и иммунологических анализов. В некоторых вариантах осуществления уровни EPO в сыворотке, описанные в настоящем документе, определяют с помощью иммунологического анализа, например, анализа ELISA.
[00189] Уровни гемоглобина в сыворотке могут быть определены, например, с помощью стандартного подхода CBC, где эритроциты лизируют и феррицианид калия окисляет гемоглобин до метгемоглобина, который при объединении с цианистым калием образует цианметгемоглобин. Коричневую окраску измеряют спектрофотометрически, и представляются данные о соответствующем гемоглобине.
[00190] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO) или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной продукцией эндогенного EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, в то же время имитируя суточную вариацию уровней EPO в сыворотке здоровых людей. В некоторых таких вариантах осуществления в настоящем документе предлагается способ лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO) или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с введением экзогенного EPO. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00191] В некоторых вариантах осуществления в настоящем изобретении предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO) или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной продукцией эндогенного EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, в то же время так чтобы период времени между введением, по меньшей мере, одной из указанных последовательных доз и введением непосредственно предшествующей дозы являлся достаточным периодом времени для возможности возвращения уровня EPO в сыворотке больного приблизительно к исходному уровню EPO в сыворотке. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с введением экзогенного EPO. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00192] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной продукцией эндогенного EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного, где перед добавлением одной или более доз после первоначальной дозы уровень сывороточного EPO возвращается приблизительно к исходному уровню. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с введением экзогенного EPO. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00193] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной продукцией эндогенного EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить уровень гемоглобина по отношению к базальному уровню гемоглобина у больного без существенного повышения уровня сывороточного EPO по отношению к исходному уровню EPO в сыворотке. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с введением экзогенного EPO. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00194] В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (EPO), или заболевания или состояния, связанного с уменьшенной продукцией гемоглобина, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с введением экзогенного EPO.
[00195] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к базальному уровню в течение одной недели, в течение шести дней, в течение пяти дней, в течение четырех дней в течение трех дней, в течение двух дней, в течение двадцати четырех часов, в течение восемнадцати часов, или в течение двенадцати часов после введения дозы ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа.
[00196] В некоторых вариантах осуществления уровень EPO в сыворотке возвращается к пределам приблизительно 5 мМЕ/мл, приблизительно 4 мМЕ/мл, приблизительно 3 мМЕ/мл, приблизительно 2 мМЕ/мл или приблизительно 1 мМЕ/мл базального уровня EPO.
[00197] В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на от приблизительно 0,1 до 1,0 г/дл, от приблизительно 0,1 до приблизительно 0,9 г/дл, от приблизительно 0,1 до приблизительно 0,8 г/дл, от приблизительно 0,1 до приблизительно 0,7 г/дл, от приблизительно 0,1 до приблизительно 0,6 г/дл, или от приблизительно 0,1 до приблизительно 0,5 г/дл в течение периода времени, например, приблизительно одной недели, приблизительно двух недель, приблизительно трех недель, или приблизительно четырех недель, по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается, по меньшей мере, приблизительно на 0,1 г/дл, приблизительно на 0,2 г/дл, приблизительно на 0,3 г/дл, приблизительно на 0,4 г/дл, приблизительно на 0,5 г/дл, приблизительно на 0,6 г/дл, приблизительно на 0,7 г/дл, приблизительно на 0,8 г/дл, приблизительно на 0,9 или приблизительно на 1,0 г/дл в течение периода времени, например, приблизительно одной недели, приблизительно двух недель, приблизительно трех недель или приблизительно четырех недель по сравнению с базальным уровнем гемоглобина.
[00198] В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00199] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики анемии (например, анемии, вторичной по отношению к хроническому заболеванию почек или связанной с ним, анемии, вторичной по отношению к хроническому заболеванию сердца, идиопатической анемии старения, анемии хронических заболеваний, миелодиспластического синдрома, фиброза костного мозга, других апластических или диспластических анемий, анемии, индуцированной химиотерапией, (включая химиотерапию для лечения рака, гепатита С или лекарственную терапию других хронических заболеваний, которые подавляют работу костного мозга), анемии, возникающей в результате потери крови, анемии, возникающей в результате дефицита железа, анемии, возникающей в результате дефицита витамина В12, серповидноклеточной анемии или талассемии), включающие введение больному, страдающему анемией, эффективного количества соединения, раскрытого в настоящем документе, например, соединения 1, где у больного имитируется суточный паттерн экспрессии EPO в ответ на указанное введение, как описано выше. В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества соединения, раскрытого в настоящем документе, такого как соединение 1, где у больного имитируется суточный паттерн экспрессии EPO в ответ на указанное введение, как описано выше.
[00200] В некоторых вариантах осуществления в настоящем документе предлагается лечение или профилактика анемии, вторичной по отношению к хроническому заболеванию почек (CKD), включающее введение больному, страдающему анемией, вторичной по отношению к CKD, эффективного количества соединения, раскрытого в настоящем документе, например, соединения 1. Такие суточные дозы могут быть введены перорально, предпочтительно один раз в день. В некоторых вариантах осуществления суточную дозу вводят один раз в день. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1, 2, 3, 4 или 5. В некоторых таких вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 2. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 4. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 5. В некоторых вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больной является больным на диализе, и эти больные могут быть отнесены к страдающим терминальной стадией почечной недостаточности (ESRD). В некоторых таких вариантах осуществления анемия, такая как анемия, вторичная по отношению к CKD или ERSRD, может быть устойчивой к лечению агентом, стимулирующим эритропоэз, включая продукт rhEPO, например, эпоэтин-альфа, эпоэтин-бета, дарбэпоэтин или пегинесатид. В некоторых вариантах осуществления больного ранее лечили от анемии, тогда как в некоторых альтернативных вариантах осуществления больного ранее не лечили от анемии.
[00201] В некоторых вариантах осуществления больной является больным, страдающим хроническим заболеванием почек. В некоторых более конкретных вариантах осуществления больной не имеет циркадных паттернов экспрессии эндогенного EPO в кровотоке. В некоторых вариантах осуществления соединение (т.е. соединение, раскрытое в разделе 5.2) вводят для имитации нормального и эндогенного циркадного паттерна EPO (т.е. паттерна здорового человека), так что пик экспрессии EPO происходит между 6 вечера и полночью. В некоторых вариантах осуществления соединение вводят в такое время, что пик EPO возникает ранее, чем пик кортизола, в частности, так, что пик EPO предшествует пику кортизола приблизительно на 1 час, приблизительно на 2 часа, приблизительно на 3 часа, приблизительно на 4 часа, приблизительно на 5 часов, приблизительно на 6 часов, приблизительно на 7 часов или приблизительно на 8 часов. В некоторых вариантах осуществления пик кортизола возникает утром. В некоторых вариантах осуществления соединение вводят в 8 часов утра, в 9 часов утра, в 10 часов утра, в 11 часов утра, в 12 часов полудня, в 1 час дня, или в 2 часа дня. В некоторых вариантах осуществления соединение вводят после завтрака. В некоторых вариантах осуществления соединение вводят между завтраком и 8 часами утра, 9 часами утра, 10 часами утра, 11 часами утра, 12 часами полудня, 1 часом дня, или 2 часами дня. В некоторых вариантах осуществления соединение вводят перед ленчем. В некоторых вариантах осуществления соединение вводят между завтраком и ленчем. В некоторых вариантах осуществления соединение вводят после ленча. В некоторых вариантах осуществления соединение вводят между ленчем и 2 часами дня. В некоторых вариантах осуществления соединение вводят каждый день в одно и то же время или приблизительно в одно и то же время. В конкретном варианте осуществления в настоящем изобретении предлагается способ лечения анемии у индивидуума с хронической болезнью почек, где суточную дозу в 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг вводят между утром и 2 часами дня в одно и то же время каждый день.
5.3.2. Суммарная связывающая способность для железа
[00202] Клинические испытания фазы 2a показали, что у больных CKD стадии 3, 4 или 5 соединение 1, ингибитор пролилгидроксилазы HIF, было способно увеличить уровни TIBC через 6 недель после введения по сравнению с больными, получавшими плацебо. Неожиданно оказалось, что повышение уровней TIBC не было связано с увеличением уровней сывороточного железа. Кроме того, было также обнаружено, что соединение 1 вызывало в результате дозозависимое увеличение TIBC и уменьшение TSAT, что предполагает, что введение соединения 1 приводит к повышению мобилизации железа.
[00203] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения или профилактики заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией ЕРО, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, как описано в настоящем документе, где фармацевтически эффективное количество ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или, по меньшей мере, на 50%. В более конкретных вариантах осуществления фармацевтически эффективное количество подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или, по меньшей мере, на 50%, в то время как уровни общего сывороточного железа не увеличены или увеличены не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или самое большее 25%. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00204] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), включающий введение больному, страдающему заболеванием или состоянием, которое поддается лечению путем увеличения эндогенной продукции EPO, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, как описано в настоящем документе, где фармацевтически эффективное количество ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или, по меньшей мере, на 50%. В более конкретных вариантах осуществления фармацевтически эффективное количество подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или, по меньшей мере, на 50%, в то время как уровни общего сывороточного железа не увеличены или увеличены не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или самое большее 25%. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00205] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения или профилактики анемии у больного, включающий введение больному, страдающему анемией, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, как описано в настоящем документе, где фармацевтически эффективное количество ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или, по меньшей мере, на 50%. В более конкретных вариантах осуществления фармацевтически эффективное количество подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или, по меньшей мере, на 50%, в то время как уровни общего сывороточного железа не увеличены или увеличены не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или самое большее 25%. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00206] В некоторых вариантах осуществления анемия представляет собой, например, анемию, вторичную по отношению к хроническому заболеванию почек или связанную с ним, анемию, вторичную по отношению к хроническому заболеванию сердца, идиопатическую анемию старения, анемию хронического заболевания, миелодиспластический синдром, фиброз костного мозга, другие апластические или диспластические анемии, анемию, индуцированную химиотерапией (включая химиотерапию для лечения рака, гепатита С или лекарственную терапию других хронических заболеваний, которые подавляют работу костного мозга), анемию, возникающую в результате потери крови, анемию, возникающую в результате дефицита железа, анемию, возникающую в результате дефицита витамина В12, серповидноклеточную анемию или талассемию.
[00207] В определенных, более конкретных вариантах осуществления анемия представляет собой анемию, вторичную по отношению к хроническому заболеванию почек (CKD), и суточная доза ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа может быть введена перорально, предпочтительно один раз в день. В некоторых вариантах осуществления суточную дозу вводят один раз в день. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1, 2, 3, 4 или 5. В некоторых таких вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 2. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 4. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 5. В некоторых вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больной является больным на диализе, и эти больные могут быть отнесены к страдающим терминальной стадией почечной недостаточности (ESRD). В некоторых таких вариантах осуществления анемия, такая как анемия, вторичная по отношению к CKD или ERSRD, может быть устойчивой к лечению агентом, стимулирующим эритропоэз, включая продукт rhEPO, например, эпоэтин-альфа, эпоэтин-бета, дарбэпоэтин или пегинесатид. В некоторых вариантах осуществления больного ранее лечили от анемии, тогда как в некоторых альтернативных вариантах осуществления больного ранее не лечили от анемии.
[00208] В некоторых вариантах осуществления заболевание или состояние, связанное с уменьшенной эндогенной продукцией EPO, представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек. В некоторых вариантах осуществления заболевание или состояние, которое можно лечить путем увеличения эндогенной продукции EPO, представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек.
[00209] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения или профилактики заболевания или состояния, связанного с уменьшенной эндогенной продукцией гемоглобина у больного, включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией гемоглобина, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, как описано в настоящем документе, где фармацевтически эффективное количество ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или, по меньшей мере, на 50%. В более конкретных вариантах осуществления фармацевтически эффективное количество подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или, по меньшей мере, на 50%, в то время как уровни общего сывороточного железа не увеличены или увеличены не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или самое большее 25%. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00210] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения или профилактики заболевания или состояния, которое излечивается путем повышения эндогенной продукции гемоглобина, включающий введение больному, страдающему заболеванием или состоянием, которое излечивается путем повышения эндогенной продукции гемоглобина, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, как описано в настоящем документе, где фармацевтически эффективное количество ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, или, по меньшей мере, на 50%. В более конкретных вариантах осуществления фармацевтически эффективное количество подходит для увеличения суммарной связывающей способности для железа у больного, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или, по меньшей мере, на 50%, в то время как уровни общего сывороточного железа не увеличены или увеличены не более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или самое большее 25%. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00211] В некоторых вариантах осуществления заболевание или состояние, связанное с уменьшенной эндогенной продукцией гемоглобина представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек. В некоторых вариантах осуществления заболевание или состояние, которое можно лечить путем повышения эндогенной продукции гемоглобина представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек.
[00212] В некоторых вариантах осуществления, сывороточное железо может быть определено с помощью теста на основе метода FerroZine без депротеинизации. Образцы анализируют на приборе Roche Modular Instrument c использованием реагентов Roche Diagnostics Reagents. В кислых условиях железо освобождается от трансферрина. Детергент просветляет липемические образцы. Аскорбат восстанавливает высвобожденные ионы Fe3+ до ионов Fe2+, которые затем вступают в реакцию с FerroZine с образованием окрашенного комплекса. Интенсивность цвета прямо пропорциональна концентрации железа и может быть измерена фотометрически.
[00213] В некоторых вариантах осуществления ненасыщенная связывающая способность для железа (UIBC) может быть определена путем добавления сыворотки к щелочному буферному/восстанавливающему раствору, содержащему известную концентрацию железа для насыщения доступных сайтов связывания на трансферрине. Хромоген Ferrozine реагирует только с Fe2+; поэтому восстановитель железа добавляют для уверенности в том, что все железо присутствует в форме двухвалентного железа. Избыток несвязанного двухвалентного железа взаимодействует с хромогеном Ferrozine с образованием пурпурного комплекса, который измеряется спектрофотометрически. Ненасыщенная связывающая способность для железа (UIBC) равна измеренной разности концентраций добавленного раствора железа и избытка несвязанного железа. TIBC сыворотки равна суммарному железу сыворотки плюс UIBC и, следовательно, может быть рассчитана с использованием результатов UIBC и определений сывороточного железа.
[00214] Суммарная связывающая способность для железа (TIBC) является мерой способности крови связывать железо с трансферрином и осуществляется путем забора крови и измерения максимального количества железа, которое может переноситься кровью. Соответственно, TIBC иллюстрирует количество циркулирующего трансферрина, который содержит два сайта связывания для транспорта железа из мест запасания железа к эритроидным клеткам-предшественникам.
[00215] Измерения уровня сывороточного железа показывают, насколько много железа содержится в плазме. Количество железа, которое содержится в сыворотке, зависит от способности к мобилизации железа, запасаемого в клетках. Этот процесс мобилизации железа контролируется ферропортином и гепцидином, которые работают совместно для регуляции количества железа, которое экспортируется в плазму. Ферропортин транспортирует железо в клетки и из клеток, в то время как гепцидин регулирует действие ферропортина, тем самым определяя, будет ли железо высвобождаться в плазму или оставаться в клетке. Соответственно, существует возможность сохранения большого количества железа в клетках при относительно низких уровнях железа в сыворотке в зависимости от активности ферропортина и гепцидина.
[00216] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить TIBC относительно базальной TIBC у больного без существенного увеличения уровня сывороточного железа по отношению к базальному уровню. В некоторых таких вариантах осуществления в настоящем изобретении предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией EPO, при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с повышением уровней сывороточного железа. В некоторых таких вариантах осуществления заболевание или состояние представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек.
[00217] В некоторых вариантах осуществления в настоящем изобретении предлагается способ лечения заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), включающий введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, которое поддается лечению путем увеличения эндогенной продукции EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы повысить TIBC относительно базальной TIBC у больного без существенного увеличения уровня сывороточного железа по отношению к базальному уровню. В некоторых таких вариантах осуществления в настоящем изобретении предлагаются способы лечения заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), при сведении к минимуму побочных эффектов со стороны сердечнососудистой системы и риска тромбоэмболических осложнений, связанных с повышением уровней сывороточного железа. В некоторых таких вариантах осуществления заболевание или состояние представляет собой анемию, такую как анемия, вторичная по отношению к хронической болезни почек.
[00218] В некоторых вариантах осуществления TIBC повышается приблизительно на 10 мкг/дл, приблизительно на 20 мкг/дл, приблизительно на 30 мкг/дл, приблизительно на 40 мкг/дл, приблизительно на 50 мкг/дл 60 мкг/дл, приблизительно на 70 мкг/дл, приблизительно на 80 мкг/дл, приблизительно на 90 мкг/дл или приблизительно на 100 мкг/дл по сравнению с базальной TIBC. В некоторых вариантах осуществления TIBC повышается, по меньшей мере, приблизительно на 10 мкг/дл, по меньшей мере, приблизительно на 20 мкг/дл, по меньшей мере, приблизительно на 30 мкг/дл, по меньшей мере, приблизительно на 40 мкг/дл, по меньшей мере, приблизительно на 50 мкг/дл, по меньшей мере, приблизительно на 60 мкг/дл, по меньшей мере, приблизительно на 70 мкг/дл, по меньшей мере, приблизительно на 80 мкг/дл, по меньшей мере, приблизительно на 90 мкг/дл или, по меньшей мере, приблизительно на 100 мкг/дл. В некоторых вариантах осуществления TIBC повышается на в пределах от приблизительно 10 мкг/дл до 60 мкг/дл, от приблизительно 10 мкг/дл до приблизительно 50 мкг/дл, от приблизительно 10 мкг/дл до приблизительно 40 мкг/дл, от приблизительно 10 мкг/дл до приблизительно 30 мкг/дл или от приблизительно 10 мкг/дл до приблизительно 20 мкг/дл. В некоторых вариантах осуществления TIBC повышается на от 20 мкг/дл до приблизительно 60 мкг/дл, от приблизительно 30 мкг/дл до приблизительно 60 мкг/дл, от 40 мкг/дл до приблизительно 60 мкг/дл или от приблизительно 50 мкг/дл до приблизительно 60 мкг/дл.
[00219] В некоторых таких вариантах осуществления повышение TIBC происходит в течение приблизительно 1 недели, приблизительно 2 недель, приблизительно 3 недель, приблизительно 4 недель, приблизительно 5 недель или приблизительно 6 недель по отношению к базальной TIBC.
[00220] В некоторых вариантах осуществления уровень сывороточного железа увеличивается менее чем на приблизительно 20 мкг/дл, менее чем на приблизительно 15 мкг/дл, менее чем на приблизительно 10 мкг/дл, или менее чем на приблизительно 5 мкг/дл по сравнению с базальным уровнем железа в сыворотке. В некоторых вариантах осуществления уровень сывороточного железа увеличивается на приблизительно от 0 мкг/дл до приблизительно 20 мкг/дл, от приблизительно 0 мкг/дл до приблизительно 15 мкг/дл, от приблизительно 0 мкг/дл до приблизительно 10 мкг/дл, или от приблизительно 0 мкг/дл до приблизительно 5 мкг/дл.
5.3.3. Уровни гепцидина
[00221] Фаза 2a клинических испытаний показала, что у больных с CKD на стадии 3, 4 или 5, соединение 1, ингибитор пролилгидроксилазы HIF, способно увеличить уровни сывороточного гемоглобина через 6 недель после введения по сравнению с исходным уровнем и по сравнению больными, получавшими плацебо. Неожиданно оказалось, что увеличение уровня гемоглобина не было связано с уменьшением уровней гепцидина.
[00222] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для увеличения пиковых уровней EPO в сыворотке в течение циркадного цикла, по меньшей мере, на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, или, по меньшей мере, на 150% по отношению к остаточным уровням EPO в сыворотке, без снижения сывороточных уровней гепцидина более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или более чем на 20% по отношению к уровням гепцидина до введения ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления заболевание или состояние, которое относится к снижению эндогенной продукции EPO, представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек, нетяжелую анемию, вторичную по отношению к сердечной недостаточности и идиопатическую анемию старения.
[00223] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, которое поддается лечению путем увеличения эндогенной продукции ЕРО, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для увеличения пиковых уровней EPO в сыворотке в течение циркадного цикла, по меньшей мере, на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110%, 120%, 130%, 140%, или, по меньшей мере, на 150% по отношению к остаточным уровням EPO в сыворотке без снижения сывороточных уровней гепцидина более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или более чем на 20% по отношению к уровням гепцидина до введения ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления заболевание или состояние, которое поддается лечению путем повышения эндогенной продукции EPO, представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек, нетяжелую анемию, вторичную по отношению к сердечной недостаточности и идиопатическую анемию старения.
[00224] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, связанного с эндогенной продукцией гемоглобина, включающие введение больному, страдающему заболеванием или состоянием, связанным с эндогенной продукцией гемоглобина, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для увеличения пиковых уровней гемоглобина, по меньшей мере, на 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18% или, по меньшей мере, на 20% по отношению к уровням гепцидина до лечения без снижения сывороточных уровней гепцидина более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или более чем на 20% по отношению к уровням гепцидина до введения ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления заболевание или состояние, которое относится к пониженной эндогенной продукции гемоглобина, представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек, нетяжелую анемию, вторичную по отношению к сердечной недостаточности и идиопатическую анемию старения.
[00225] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции гемоглобина, включающие введение больному, страдающему заболеванием или состоянием, которое поддается лечению путем увеличения эндогенной продукции гемоглобина, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для увеличения пиковых уровней гемоглобина, по меньшей мере, на 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18% или, по меньшей мере, на 20% по отношению к уровням гепцидина до лечения без снижения сывороточных уровней гепцидина более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или более чем на 20% по отношению к уровням гепцидина до введения ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления заболевание или состояние, которое поддается лечению путем повышения эндогенной продукции EPO, представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек, нетяжелую анемию, вторичную по отношению к сердечной недостаточности и идиопатическую анемию старения.
[00226] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики анемии у больного, включающие введение больному, страдающему анемией, фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для увеличения пиковых уровней гемоглобина, по меньшей мере, на 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18% или, по меньшей мере, на 20% по отношению к уровням гепцидина до лечения без снижения сывороточных уровней гепцидина более чем на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или более чем на 20% по отношению к уровням гепцидина до введения ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2, или его фармацевтически приемлемой соли, сольвата или гидрата. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В частности, ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления заболевание или состояние, которое поддается лечению путем повышения эндогенной продукции EPO, представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек (CKD), нетяжелую анемию, вторичную по отношению к сердечной недостаточности и идиопатическую анемию старения. В некоторых вариантах осуществления анемия представляет собой, например, анемию, вторичную по отношению к хроническому заболеванию почек или связанную с ним, анемию, вторичную по отношению к хроническому заболеванию сердца, идиопатическую анемию старения, анемию хронического заболевания, миелодиспластический синдром, фиброз костного мозга, другие апластические или диспластические анемии, анемию, индуцированную химиотерапией (включая химиотерапию для лечения рака, гепатита С или лекарственную терапию других хронических заболеваний, которые подавляют работу костного мозга), анемию, возникающую в результате потери крови, анемию, возникающую в результате дефицита железа, анемию, возникающую в результате дефицита витамина В12, серповидноклеточную анемию или талассемию).
[00227] В некоторых вариантах осуществления такие суточные дозы могут быть введены перорально, предпочтительно один раз в день. В некоторых вариантах осуществления суточную дозу вводят один раз в день. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1, 2, 3, 4 или 5. В некоторых таких вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 2. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 4. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 5. В некоторых вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больной является больным на диализе, и эти больные могут быть отнесены к страдающим терминальной стадией почечной недостаточности (ESRD). В некоторых таких вариантах осуществления анемия, такая как анемия, вторичная по отношению к CKD или ERSRD, может быть устойчивой к лечению агентом, стимулирующим эритропоэз, включая продукт rhEPO, например, эпоэтин-альфа, эпоэтин-бета, дарбэпоэтин или пегинесатид. В некоторых вариантах осуществления больного ранее лечили от анемии, тогда как в некоторых альтернативных вариантах осуществления больного ранее не лечили от анемии.
[00228] В некоторых вариантах осуществления, экспрессия гепцидина может быть определена, как описано в Ganz, T. et al., “Immunoassay for human serum hepcidin” Blood 112: 4292-4297 (2008). Вкратце, антитела к человеческому гепцидину очищали на колонках протеина А стафилококка в соответствии с протоколом производителя; 96-луночные планшеты покрывали антителом и инкубировали со 100 мкл (стандартных образцов) или с 200 мкл (образцов с очень низкой концентрацией гепцидина) в разведении сыворотки 1:20 или разведении мочи 1:10 в физиологическом растворе, забуференном трис-буфером, содержащем 0,05% Твин-20 (TBS-твин 20), с 10 нг/мл биотинилированного гепцидина-25, добавляемого в качестве метки. Стандартные кривые получали путем последовательного 2-кратного разведения синтетического гепцидина 4000 нг/мл в буфере TBS-твин 20, содержащем метку. Целостность и биологическую активность синтетического гепцидина и биотинилированного гепцидина верифицировали с помощью масс-спектрометрии и с помощью биоанализа клеток НЕК-293, экспрессирующих ферропортин-зеленый флуоресцентный белок. После промывания проводили анализ со стрептавидин-пероксидазой и тетраметилбензидином. Ферментативную реакцию останавливали с помощью серной кислоты, и планшет считывали при 450 нм на микропланшетном ридере DTX 880. Стандартные кривые подбирали с 12-точечной подгонкой, используя программное обеспечение GraphPad Prism. Затем подогнанную кривую использовали для преобразования показаний поглощения образца в концентрацию гепцидина.
[00229] Уровни гемоглобина сыворотки могут быть определены, например, с использованием стандартного подхода CBC, где эритроциты лизируют, и феррицианид калия окисляет гемоглобин до метгемоглобина, который при объединении с цианистым калием образует цианметгемоглобин. Коричневый цвет измеряют спектрофотометрически, и представляют соответствующий уровень гемоглобина.
[00230] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, связанного с пониженной эндогенной продукцией эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, связанным с уменьшенной эндогенной продукцией EPO, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы поднять уровень гемоглобина в сыворотке по отношению к исходному уровню гемоглобина в сыворотке без существенного увеличения гепцидина относительно базального уровня. В некоторых вариантах осуществления заболевание или состояние, связанное с уменьшенной продукцией эндогенного EPO, выбирают из нетяжелой анемии, вторичной по отношению к хроническому заболеванию почек, нетяжелой анемии, вторичной по отношению к сердечной недостаточности и идиопатической анемии старения.
[00231] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения заболевания или состояния, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), включающие введение больному, страдающему заболеванием или состоянием, которое поддается лечению путем увеличения эндогенной продукции эритропоэтина (ЕРО), достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы поднять уровень гемоглобина в сыворотке по отношению к исходному уровню гемоглобина в сыворотке без существенного увеличения гепцидина относительно базального уровня. В некоторых таких вариантах осуществления заболевание или состояние представляет собой анемию, например, нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек, нетяжелую анемию, вторичную по отношению к сердечной недостаточности или идиопатическую анемию старения. В некоторых вариантах осуществления заболевание или состояние, которое поддается лечению путем увеличения эндогенной продукции EPO, выбирают из нетяжелой анемии, вторичной по отношению к хроническому заболеванию почек, нетяжелой анемии, вторичной по отношению к сердечной недостаточности и идиопатической анемии старения.
[00232] В некоторых вариантах осуществления уровень сывороточного гемоглобина повышается от приблизительно на 0,1 до приблизительно на 1,0 г/дл, от приблизительно на 0,1 до приблизительно на 0,9 г/дл, от приблизительно на 0,1 до приблизительно на 0,8 г/дл, от приблизительно на 0,1 до приблизительно на 0,7 г/дл, от приблизительно на 0,1 до приблизительно на 0,6 г/дл, или от приблизительно на 0,1 до приблизительно на 0,5 г/дл в течение периода времени, например, приблизительно одной недели, приблизительно двух недель, приблизительно трех недель, приблизительно четырех недель, приблизительно пяти недель или приблизительно шести недель по отношению к исходному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается, по меньшей мере, приблизительно на 0,1 г/дл, приблизительно на 0,2 г/дл, приблизительно на 0,3 г/дл, приблизительно на 0,4 г/дл, приблизительно на 0,5 г/дл, приблизительно на 0,6 г/дл, приблизительно на 0,7 г/дл, приблизительно на 0,8 г/дл, приблизительно на 0,9 или приблизительно на 1,0 г/дл в течение периода времени, например, приблизительно одной недели, приблизительно двух недель, приблизительно трех недель, приблизительно четырех недель, приблизительно пяти недель или приблизительно шесть недель по отношению к базальному уровню гемоглобина.
[00233] В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение пяти недель по отношению к базальному уровню гемоглобина. В некоторых вариантах осуществления уровень гемоглобина повышается приблизительно на 0,6 г/дл в течение шести недель по отношению к базальному уровню гемоглобина.
[00234] В некоторых вариантах осуществления экспрессия гепцидина уменьшается менее чем приблизительно на 20%, менее чем приблизительно на 15%, менее чем приблизительно на 10%, менее чем приблизительно на 5%, менее чем приблизительно на 4%, менее чем приблизительно на 3%, менее чем приблизительно на 2% или менее чем приблизительно на 1% по отношению к исходному уровню экспрессии гепцидина. В некоторых вариантах осуществления экспрессия гепцидина уменьшается на от приблизительно 0% до приблизительно 20%, от приблизительно 0% до приблизительно 15%, от приблизительно 0% до приблизительно 10% или от приблизительно 0% до приблизительно 5%, от приблизительно 0% до приблизительно 4%, от приблизительно 0% до приблизительно 3%, от приблизительно 0% до приблизительно 2% или от приблизительно 0% до приблизительно 1% по отношению к базальному уровню экспрессии гепцидина. В некоторых вариантах осуществления экспрессия гепцидина уменьшается приблизительно на 20%, приблизительно на 15%, приблизительно на 10%, приблизительно на 5%, приблизительно на 4%, приблизительно на 3%, приблизительно на 2% или приблизительно на 1% по отношению к базальному уровню экспрессии гепцидина.
5.3.4. Уровни эритроферрона
[00235] В некоторых вариантах осуществления в настоящем документе предлагается способ лечения заболевания или состояния, выбранного из нетяжелой анемии, вторичной по отношению к хронической болезни почек, нетяжелой анемии, вторичной по отношению к застойной сердечной недостаточности, и идиопатической анемии старения, включающий введение больному, страдающему нетяжелой анемией, вторичной по отношению к хронической болезни почек, нетяжелой анемией, вторичной по отношению к застойной сердечной недостаточности, и идиопатической анемией старения, достаточного количества последовательных доз ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа так, чтобы поднять уровни гемоглобина в сыворотке больного по отношению к базальному уровню гемоглобина сыворотки без существенного увеличения экспрессии эритроферрона относительно базального уровня экспрессии эритроферрона.
[00236] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение одной недели по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,1 г/дл в течение одной недели по отношению к базальному уровню гемоглобина.
[00237] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение двух недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,1 г/дл в течение двух недель по отношению к базальному уровню гемоглобина.
[00238] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение трех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,5 г/дл в течение трех недель по отношению к базальному уровню гемоглобина.
[00239] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,6 г/дл в течение четырех недель по отношению к базальному уровню гемоглобина.
[00240] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение пяти недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,6 г/дл в течение пяти недель по отношению к базальному уровню гемоглобина.
[00241] В некоторых вариантах осуществления уровень гемоглобина в сыворотке повышается на приблизительно от 0,1 до приблизительно 1,0 г/дл в течение шести недель по отношению к базальному уровню гемоглобина. В некоторых таких вариантах осуществления уровень гемоглобина в сыворотке повышается приблизительно на 0,6 г/дл в течение шести недель по отношению к базальному уровню гемоглобина.
[00242] В некоторых вариантах осуществления транскрипция эритроферрона повышается менее чем приблизительно на 20%, менее чем приблизительно на 15%, менее чем приблизительно на 10% по отношению к исходному уровню транскрипции эритроферрона, менее чем приблизительно на 5%, менее чем приблизительно на 4%, менее чем приблизительно на 3%, менее чем приблизительно на 2% или менее чем приблизительно на 1% по отношению к исходному уровню транскрипции эритроферрона при измерении РНК, например, с помощью ПЦР-РВ (смотри SEQ ID NO: 3).
[00243] В некоторых вариантах осуществления, экспрессия белка эритроферрона увеличивается менее чем приблизительно на 20%, менее чем приблизительно на 15%, менее чем приблизительно на 10% по отношению к исходному уровню экспрессии эритроферрона, менее чем приблизительно на 5%, менее чем приблизительно на 4%, менее чем приблизительно на 3%, менее чем приблизительно на 2% или менее чем приблизительно на 1% по отношению к исходному уровню экспрессии эритроферрона при измерении, например, с помощью вестерн-блоттинга белка эритроферрона (см SEQ ID NO: 2).
[00244] В некоторых вариантах осуществления заболевание или состояние представляет собой нетяжелую анемию, вторичную по отношению к хроническому заболеванию почек. В некоторых вариантах осуществления заболевание или состояние представляет собой нетяжелую застойную сердечную недостаточность. В некоторых вариантах осуществления заболевание или состояние представляет собой идиопатическую анемию старения.
[00245] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят один раз в день. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа вводят перорально.
[00246] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой гетероциклический карбоксамид. В некоторых таких вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа выбран из пиридинкарбоксамида, хинолинкарбоксамида и изохинолинкарбоксамида.
[00247] В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 и метаболита 2 или их фармацевтически приемлемой соли, сольвата или гидрата. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
5.4. Заболевания, связанные с модуляцией пролилгидроксилазы HIF
[00248] Варианты настоящего раскрытия также относятся к способам лечения и/или профилактики, и/или управления среди прочего заболеванием периферических сосудов (PVD); ишемической болезнью сердца (ИБС); сердечной недостаточностью; ишемией; анемией; заживлением ран; язвами; ишемическими язвами; недостаточным кровоснабжением; плохим капиллярным кровотоком; атеросклерозом малых артерий; венозным застоем; атеросклеротическими поражениями (например, в коронарных артериях); стенокардией; инфарктом миокарда; диабетом; гипертензией; болезнью Бюргерса; заболеваниями, связанными с аномальными уровнями VEGF, GAPDH и/или ЕРО; болезнью Крона; язвенным колитом; псориазом; саркоидозом; ревматоидным артритом; гемангиомами; болезнью Ослера-Вебера-Рандю; наследственной геморрагической телеангиэктазией; солидными опухолями или опухолями крови и синдромом приобретенного иммунодефицита; предсердными аритмиями; ишемическими тканевыми повреждениями в таких тканях, как: ткань сердца, такая как миокард и желудочки сердца, скелетная мышца, неврологические ткани, например, мозжечок, внутренними органами, такими как желудок, кишечник, поджелудочная железа, печень, селезенка и легкое, и дистальными частями конечностей, такими как пальцы рук и ног. В частности, в настоящем документе предлагаются способы лечения и/или профилактики, и/или управления среди прочего заболеванием периферических сосудов (PVD); ишемической болезнью сердца (ИБС); сердечной недостаточностью; ишемией; анемией; заживлением ран; язвами; ишемическими язвами; недостаточным кровоснабжением; плохим капиллярным кровотоком; атеросклерозом малых артерий; венозным застоем; атеросклеротическими поражениями (например, в коронарных артериях); стенокардией; инфарктом миокарда; диабетом; гипертензией; болезнью Бюргерса; заболеваниями, связанными с аномальными уровнями VEGF, GAPDH и/или ЕРО; болезнью Крона; язвенным колитом; псориазом; саркоидозом; ревматоидным артритом; гемангиомами; болезнью Ослера-Вебера-Рандю; наследственной геморрагической телеангиэктазией; солидными опухолями или опухолями крови и синдромом приобретенного иммунодефицита; предсердными аритмиями; ишемическими тканевыми повреждениями в таких тканях, как: ткань сердца, такая как миокард и желудочки сердца, скелетная мышца, неврологические ткани, например, мозжечок, внутренними органами, такими как желудок, кишечник, поджелудочная железа, печень, селезенка и легкое, и дистальными частями конечностей, такими как пальцы рук и ног, где способ включает введение фармацевтически эффективного количества ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, где фармацевтически эффективное количество подходит для уменьшения тяжести или частоты, по меньшей мере, одного симптома этих заболеваний, при этом:
a) восстанавливается или поддерживается суточный паттерн уровней EPO в сыворотке;
b) повышается суммарная связывающая способность для железа;
c) повышается суммарная связывающая способность для железа без значительного увеличения общих уровней железа; и/или
d) существенно не снижаются уровни гепцидина.
[00249] Атеросклеротическое PVD может быть представлено в трех вариантах:
1) бессимптомным PVD, диагностируемым на основании неинвазивного тестирования (как правило, при физикальном осмотре);
2) перемежающейся хромотой с симптомами боли в ногах при упражнениях; и
3) критической ишемией конечностей с болью в ногах в покое и угрожающими для конечностей ишемическими изменениями (как правило, незаживающими или инфицированными кожными изъязвлениями).
[00250] Варианты настоящего раскрытия также относятся к способам регуляции кровотока, доставки кислорода и/или использования энергии в ишемических тканях, где способы могут включать введение человеку эффективного количества одного или более соединений или их фармацевтически приемлемых солей или таутомеров, раскрытых в настоящем документе.
[00251] Соединения и композиции, указанные в настоящем документе, могут иметь ряд вариантов использования и быть направленными на некоторые нерешенные медицинские потребности, в частности:
1) обеспечение композициями, эффективными в качестве ингибиторов пролилгидроксилазы HIF, тем самым стимулируя ангиогенный ответ в ткани человека, обеспечивая в результате этого способом увеличения кровотока, доставки кислорода и утилизации энергии в ишемических тканях;
2) обеспечение композициями, эффективными в качестве ингибиторов пролилгидроксилазы белка HIF человека, и тем самым увеличивая концентрацию HIF-1 альфа, что приводит к более сильной активации и поддержанию различных биологических путей, которые представляют собой нормальный ответ на гипоксию клеток;
3) обеспечение композициями, эффективными в отношении стимуляции ответа EPO в клетках, и тем самым повышая содержание эритроцитов путем контроля пролиферации и дифференцировки эритроидных клеток-предшественников в эритроциты;
4) обеспечение композициями, эффективными в отношении стимуляции ангиогенного ответа, и тем самым увеличивая количество и плотность кровеносных сосудов и в результате этого облегчая неблагоприятные последствия гипертензии и сахарного диабета, такие как хромота, ишемические язвы, ускоренная гипертензия и почечная недостаточность;
5) обеспечение композициями, которые активируют транскрипцию гена фактора роста эндотелия сосудов (VEGF) в гипоксических клетках, тем самым усиливая стимуляцию важных биологических реакций, в частности, вазодилятацию, проницаемость сосудов и миграцию и пролиферацию эндотелиальных клеток;
6) обеспечение композициями, которые вызывают выработку растворимого VEGF, ингибитора VEGF, в гипоксических клетках, тем самым усиливая стимуляцию важных биологических реакций, в частности, антиангиогенной активности.
[00252] Таким образом, эти и другие нерешенные медицинские потребности решаются с помощью ингибиторов пролилгидроксилазы HIF по настоящему раскрытию, которые способны регулировать кровоток, доставку кислорода и утилизацию энергии в ишемических тканях, ишемия которых вызвана недостаточной регуляцией пролилгидроксилазы HIF. Специалистам в данной области техники также должно быть понятно, что ингибирование ферментов пролилгидроксилаз HIF-1-альфа должно оказывать другие положительные терапевтические эффекты на ткани человека и на облегчение симптомов и патологических состояний, отличных от тех симптомов или патологических состояний, которые конкретно указаны в настоящем изобретении. Однако так как возникает больше подробностей, касающихся патологических состояний и условий, связанных с процессом ангиогенеза, эти еще нераскрытые или еще неизвестные условия должны положительно реагировать на композиции, которые стимулируют собственный ответ организма на гипоксию и другие условия, связанные с низким уровнем кислорода крови.
[00253] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате модуляции пролилгидроксилазы HIF, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате модуляции пролилгидроксилазы HIF, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино} уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления соединение вводят от одного до трех раз, например, один, два или три раза в течение 24-часового периода. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания, облегчаемого в результате модуляции пролилгидроксилазы HIF, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате модуляции пролилгидроксилазы HIF, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты один раз в день. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания, облегчаемого в результате модуляции пролилгидроксилазы HIF, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате модуляции пролилгидроксилазы HIF, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты один раз в день. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00254] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования пролилгидроксилазы HIF (например, PHDl, PHD2 и/или PHD3), включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования пролилгидроксилазы HIF, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHDl, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD1, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHDl, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD1, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHD2, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD2, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHD2, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD2, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHD3, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD3, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате ингибирования PHD3, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования PHD3, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе.
[00255] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-альфа (например, HIF-1-альфа, HIF-2-альфа и/или HIF-3-альфа), включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате стабилизации HIF-альфа, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-1α, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате стабилизации HIF-1α, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-1α, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате стабилизации HIF-1α, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-2-альфа, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования HIF-2-альфа, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-2-альфа, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате ингибирования HIF-2-альфа, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе.
[00256] В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-3-альфа, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате стабилизации HIF-3-альфа, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, облегчаемого в результате стабилизации HIF-3-альфа, включающие введение больному, страдающему заболеванием или нарушением, облегчаемым в результате стабилизации HIF-3-альфа, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе.
[00257] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или нарушения, связанного со снижением эндогенной продукции эритропоэтина (EPO), включающие введение больному, страдающему заболеванием или нарушением, связанным со снижением эндогенной продукции EPO, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемами дозирования, описанными в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00258] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики анемии (например, анемии, вторичной по отношению к хроническому заболеванию почек или связанной с ним, анемии, вторичной по отношению к хроническому заболеванию сердца, идиопатической анемии старения, анемии хронических заболеваний, миелодиспластического синдрома, фиброза костного мозга, других апластических или диспластических анемий, анемии, индуцированной химиотерапией, (включая химиотерапию для лечения рака, гепатита С или лекарственную терапию других хронических заболеваний, которые снижают работу костного мозга), анемии, возникающей в результате потери крови, анемии, возникающей в результате дефицита железа, анемии, возникающей в результате дефицита витамина В12, серповидноклеточной анемии или талассемии), включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения анемии, например, анемии, вторичной по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления в настоящем документе предлагаются способы лечения анемии, например, анемии, вторичной по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00259] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики анемии, вторичной по отношению к хроническому заболеванию почек (CKD), включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день. В некоторых вариантах осуществления суточную дозу вводят один раз в день. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1, 2, 3, 4 или 5. В некоторых таких вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3, 4 или 5. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 1. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 2. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 3. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 4. В некоторых вариантах осуществления CKD представляет собой хроническое заболевание почек стадии 5. В некоторых вариантах осуществления хроническое заболевание почек представляет собой преддиализное хроническое заболевание почек. В некоторых вариантах осуществления больной является больным на диализе, и эти больные могут быть отнесены к страдающим терминальной стадией почечной недостаточности (ESRD). В некоторых таких вариантах осуществления анемия, такая как анемия, вторичная по отношению к CKD или ERSRD, может быть устойчивой к лечению агентом, стимулирующим эритропоэз, включая продукт rhEPO, например, эпоэтин-альфа, эпоэтин-бета, дарбэпоэтин или пегинесатид. В некоторых вариантах осуществления больного ранее лечили от анемии, тогда как в некоторых альтернативных вариантах осуществления больного ранее не лечили от анемии.
[00260] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, связанного с ангиогенезом, включающие введение больному, страдающему заболеванием или состоянием, связанным с ангиогенезом, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых вариантах осуществления в настоящем документе предлагаются способы регуляции ангиогенеза, включающие введение больному эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых вариантах осуществления в настоящем документе предлагаются способы регуляции ангиогенеза, включающие введение больному эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00261] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, влияющего на уровень VEGF или GAPDH, включающие введение больному, страдающему заболеванием или состоянием, влияющим на уровень VEGF или GAPDH, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00262] В некоторых вариантах осуществления в настоящем документе предлагаются способы стимуляции заживления ран, включающие введение больному, имеющему рану, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00263] В некоторых вариантах осуществления в настоящем документе предлагаются способы повышения реваскуляризации поврежденной ткани или повышения васкуляризации, включающие введение больному, имеющему поврежденную ткань, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых вариантах осуществления в настоящем документе предлагаются способы васкуляризации ишемической ткани, включающие введение больному, имеющему ишемическую ткань, эффективного количества {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых вариантах осуществления в настоящем документе предлагаются способы васкуляризации ишемической ткани, включающие введение больному, имеющему ишемическую ткань, эффективного количества 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00264] В некоторых вариантах осуществления в настоящем документе предлагаются способы стимуляции роста замещающего кожного трансплантата, включающие введение больному, имеющему кожный трансплантат, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00265] В некоторых вариантах осуществления в настоящем документе предлагаются способы стимуляции репарации ткани в контексте направленной регенерации ткани (GTR), включающие введение больному эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00266] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения или профилактики заболевания или состояния, выбранного из диабетической ретинопатии, дегенерации желтого пятна, рака, серповидно-клеточной анемии, саркоидоза, сифилиса, эластической псевдоксантомы, болезни Педжета, окклюзии вен, окклюзию артерий, сонных обструктивной болезни артерий, хронического увеита/витреита, микобактериальных инфекций, болезни Лайма, системной красной волчанки, ретинопатии недоношенных, болезни Илза, болезни Бехчета, инфекций, вызывающих ретинит или хориоидит, предполагаемого гистоплазмоза глаз, заболевания Беста, миопии, ямок диска зрительного нерва, болезни Штаргардта, парспланита, хронического отслоения сетчатки, синдрома повышенной вязкости, токсоплазмоза, осложнений после лазерной травмы, заболеваний, связанных с рубеозом и пролиферативной витреоретинопатией, болезни Крона и язвенного колита, псориаза, саркоидоза, ревматоидного артрита, гемангиомы, болезни Ослера-Вебера-Рандю или наследственной геморрагической телеангиэктазии, солидных опухолей или опухолей крови, синдрома приобретенного иммунодефицита, ишемии скелетных мышц и миокарда, инсульта, ишемической болезни сердца, заболевания периферических сосудов и заболевания коронарных артерий, включающие введение больному, страдающему таким заболеванием или нарушением, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) в соответствии с дозой и/или схемой дозирования, описанной в настоящем документе. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
5.5. Дозы и режимы дозирования
[00267] В настоящем документе описаны различные параметры управления режимом дозирования ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа для профилактики и/или лечения различных заболеваний и нарушений, как описано в разделе 5.4, таких как анемия (например, анемия, вторичная по отношению к хронической болезни почек). В этом разделе приведены некоторые конкретные дозы для таких вариантов использования ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа. В некоторых вариантах осуществления такая доза представляет собой исходную дозу в начале лечения. В других вариантах осуществления такая доза представляет собой скорректированную дозу в более позднее время прохождения курса лечения. В некоторых вариантах осуществления ингибитор пролилгидроксилазы HIF или стабилизатор HIF-альфа представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата. В конкретном варианте осуществления соединение представляет собой соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В конкретном варианте осуществления соединение представляет собой соединение 7 или его фармацевтически приемлемую соль, сольват или гидрат.
[00268] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), которая составляет от приблизительно 100 мг до приблизительно 1200 мг, от приблизительно 200 мг до приблизительно 1000 мг, от приблизительно 400 мг до приблизительно 800 мг, или от приблизительно 450 мг до приблизительно 600 мг, или от приблизительно 300 мг до приблизительно 600 мг. В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) составляет от приблизительно 150 мг до 600 мг. В некоторых вариантах осуществления суточная доза соединения составляет от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 300 до приблизительно 600 мг, или от приблизительно 600 мг до приблизительно 750 мг. В некоторых вариантах осуществления суточная доза составляет приблизительно 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг , 800 мг, 850 мг, 900 мг, 950 мг, 1000 мг, 1050 мг, 1100 мг, 1150 мг или даже приблизительно 1200 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых вариантах осуществления суточная доза составляет, по меньшей мере, приблизительно 300 мг, по меньшей мере, приблизительно 450 мг, или даже, по меньшей мере, приблизительно 600 мг.
[00269] В некоторых вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, или приблизительно 600 мг. В некоторых вариантах осуществления суточная доза составляет не 240 мг, 370 мг, 500 мг или 630 мг соединения 1. В некоторых вариантах осуществления суточная доза составляет приблизительно 240 мг, 370 мг, 500 мг или приблизительно 630 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты).
[00270] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, где соединение имеет структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбрано из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), где соединение вводят непрерывно и/или неопределенный срок.
[00271] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), где суточная доза составляет приблизительно 450 мг. В некоторых таких вариантах осуществления суточная доза, составляющая приблизительно 450 мг, включает три стандартные лекарственные формы, такие как три таблетки, каждая из которых содержит приблизительно 150 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых вариантах осуществления суточная доза, составляющая приблизительно 450 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) может быть увеличена приблизительно на 150 мг, так что суточная доза соединения составляет приблизительно 600 мг. В некоторых вариантах осуществления суточная доза, составляющая 450 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты может быть уменьшена приблизительно на 150 мг, так что суточная доза соединения составляет приблизительно 300 мг. В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) может быть уменьшена приблизительно на 300 мг, так что суточная доза соединения составляет приблизительно 150 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена приблизительно на 75 мг, приблизительно на 100 мг, приблизительно на 125 мг, приблизительно на 150 мг, приблизительно на 175 мг, приблизительно на 200 мг, приблизительно на 225 мг, приблизительно на 250 мг, приблизительно на 275 мг или приблизительно на 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до 300 мг, от приблизительно 100 мг до приблизительно 300 мг, от приблизительно 125 мг до приблизительно 300 мг, от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 175 мг до приблизительно 300 мг, от приблизительно 200 мг до приблизительно 300 мг, от приблизительно 225 мг до приблизительно 300 мг, от приблизительно 250 мг до приблизительно 300 мг или от приблизительно 275 мг до приблизительно 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 225 мг или от приблизительно 125 мг до приблизительно 200 мг. В некоторых таких вариантах осуществления суточная доза не превышает приблизительно 600 мг или приблизительно 750 мг.
[00272] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), где соединение можно вводить непрерывно и/или неопределенный срок, например в течение более 42 дней подряд. В некоторых таких вариантах осуществления суточная доза соединения составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг.
[00273] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), где уровни гемоглобина больного поддерживают на уровне, по меньшей мере, приблизительно 10,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл. В некоторых таких вариантах осуществления уровни гемоглобина поддерживают на уровне, по меньшей мере, приблизительно 11,0 г/дл и на уровне или ниже приблизительно 13,0 г/дл. В некоторых таких вариантах осуществления уровни гемоглобина поддерживают на уровне, по меньшей мере, приблизительно 11,0 г/дл и на уровне или ниже приблизительно 12,0 г/дл. В некоторых таких вариантах осуществления суточная доза соединения составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг.
[00274] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), где уровень гемоглобина больного увеличивается, по меньшей мере, приблизительно на 1,2 г/дл по сравнению с исходным уровнем гемоглобина. В некоторых таких вариантах осуществления суточная доза соединения составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг.
[00275] В некоторых вариантах осуществления введение соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), может быть приостановлено, если уровень гемоглобина равен или выше 13,0 г/дл. В некоторых таких вариантах осуществления введение соединения может быть возобновлено, когда уровень гемоглобина равен или ниже 12,5 г/дл.
[00276] В некоторых вариантах осуществления уровни гемоглобина контролируются, и доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), может быть отрегулирована на основании уровня гемоглобина и/или изменения уровня гемоглобина. В некоторых вариантах осуществления эта доза может быть отрегулирована путем либо увеличения, либо уменьшения количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), на 150 мг или даже на 300 мг.
[00277] В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), может быть увеличена после определенного периода времени, начиная со дня получения больным суточной дозы соединения. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели.
[00278] В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), может быть отрегулирована один раз в течение периода времени. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели.
[00279] В некоторых вариантах осуществления суточная доза соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), не повышают, если уровень гемоглобина увеличился более чем на 1,2 г/дл по сравнению с исходным уровнем гемоглобина.
[00280] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, которое представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты); измерение уровня гемоглобина у больного после введения суточной дозы соединения и затем повторно в более поздний период времени, где, когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина снизился менее чем приблизительно на 0,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина изменился приблизительно на 0,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 10,0 до приблизительно 10,9 г/дл, и уровень гемоглобина снизился менее чем приблизительно на 0,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; введение скорректированной суточной дозы соединения, которая составляет приблизительно на 150 мг больше, чем суточная доза. В некоторых таких вариантах осуществления соединение вводят один раз в день, и оно может быть введено перорально. В некоторых вариантах осуществления суточная доза составляет приблизительно 450 мг, так что, когда суточная доза увеличивается приблизительно на 150 мг, скорректированная суточная доза составляет приблизительно 600 мг. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена приблизительно на 75 мг, приблизительно на 100 мг, приблизительно на 125 мг, приблизительно на 150 мг, приблизительно на 175 мг, приблизительно на 200 мг, приблизительно на 225 мг, приблизительно на 250 мг, приблизительно на 275 мг или приблизительно на 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до 300 мг, от приблизительно 100 мг до приблизительно 300 мг, от приблизительно 125 мг до приблизительно 300 мг, от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 175 мг до приблизительно 300 мг, от приблизительно 200 мг до приблизительно 300 мг, от приблизительно 225 мг до приблизительно 300 мг, от приблизительно 250 мг до приблизительно 300 мг, или от приблизительно 275 мг до приблизительно 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 225 мг или от приблизительно 125 мг до приблизительно 200 мг. В некоторых вариантах осуществления скорректированная суточная доза не превышает 600 мг или 750 мг.
[00281] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, которое представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты); измерение уровня гемоглобина у больного после введения суточной дозы соединения и затем повторно в более поздний период времени, где, когда уровень гемоглобина у больного составляет менее приблизительно 10,0 г/дл, и уровень гемоглобина повысился более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 10,0 г/дл до приблизительно 10,9 г/дл, и уровень гемоглобина повысился более чем на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 11,0 до приблизительно 12,2 г/дл, и уровень гемоглобина повысился от приблизительно на 1,0 г/дл до приблизительно 1,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина снизился приблизительно на 0,4 г/дл или повысился приблизительно на 0,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,2 г/дл, и уровень гемоглобина повысился от приблизительно на 0,5 до приблизительно 0,9 г/дл по сравнению с уровнем, измеренным в более ранний период времени; введение скорректированной суточной дозы соединения, которая составляет приблизительно на 150 мг меньше, чем суточная доза. В некоторых таких вариантах осуществления соединение вводят один раз в день, и оно может быть введено перорально. В некоторых вариантах осуществления суточная доза составляет приблизительно 450 мг, так что, когда суточная доза снижается приблизительно на 150 мг, скорректированная суточная доза составляет приблизительно 300 мг. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена приблизительно на 75 мг, приблизительно на 100 мг, приблизительно на 125 мг, приблизительно на 150 мг, приблизительно на 175 мг, приблизительно на 200 мг, приблизительно на 225 мг, приблизительно на 250 мг, приблизительно на 275 мг или приблизительно на 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до 300 мг, от приблизительно 100 мг до приблизительно 300 мг, от приблизительно 125 мг до приблизительно 300 мг, от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 175 мг до приблизительно 300 мг, от приблизительно 200 мг до приблизительно 300 мг, от приблизительно 225 мг до приблизительно 300 мг, от приблизительно 250 мг до приблизительно 300 мг, или от приблизительно 275 мг до приблизительно 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 225 мг или от приблизительно 125 мг до приблизительно 200 мг. В некоторых вариантах осуществления скорректированная суточная доза не превышает 600 мг или 750 мг.
[00282] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение больному, страдающему анемией, суточной дозы соединения, которое представляет собой соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты); измерение уровня гемоглобина у больного после введения суточной дозы соединения и затем повторно в более поздний период времени, где, когда уровень гемоглобина у больного составляет от приблизительно 11,0 до приблизительно 12,2 г/дл, и уровень гемоглобина увеличивается на более чем приблизительно 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина увеличивается от приблизительно на 1,0 до приблизительно на 1,4 г/дл по сравнению с уровнем, измеренным в более ранний период времени; или когда уровень гемоглобина у больного составляет от приблизительно 12,3 до приблизительно 12,9 г/дл, и уровень гемоглобина увеличивается более чем приблизительно на 1,5 г/дл по сравнению с уровнем, измеренным в более ранний период времени, введение скорректированной суточной дозы соединения, которая составляет приблизительно на 300 мг менее суточной дозе. В некоторых вариантах осуществления соединение вводят один раз в день, и оно может быть введено перорально. В некоторых вариантах осуществления суточная доза составляет 450 мг, так что, когда исходная суточная доза уменьшается приблизительно на 300 мг, скорректированная суточная доза составляет приблизительно 150 мг. В некоторых вариантах осуществления период времени составляет от приблизительно одной недели до приблизительно восьми недель, например, от приблизительно двух недель до приблизительно семи недель, от приблизительно трех недель до приблизительно шести недель или приблизительно четыре недели. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена приблизительно на 75 мг, приблизительно на 100 мг, приблизительно на 125 мг, приблизительно на 150 мг, приблизительно на 175 мг, приблизительно на 200 мг, приблизительно на 225 мг, приблизительно на 250 мг, приблизительно на 275 мг или приблизительно на 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до 300 мг, от приблизительно 100 мг до приблизительно 300 мг, от приблизительно 125 мг до приблизительно 300 мг, от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 175 мг до приблизительно 300 мг, от приблизительно 200 мг до приблизительно 300 мг, от приблизительно 225 мг до приблизительно 300 мг, от приблизительно 250 мг до приблизительно 300 мг, или от приблизительно 275 мг до приблизительно 300 мг. В некоторых вариантах осуществления суточная доза может быть увеличена или уменьшена на величину от приблизительно 75 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 225 мг или от приблизительно 125 мг до приблизительно 200 мг. В некоторых вариантах осуществления скорректированная суточная доза не превышает 600 мг или 750 мг.
[00283] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, связанной с CKD, у больного, проходящего гемодиализ, где указанный способ включает введение больному фармацевтически эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, приблизительно за 8 часов, 7 часов, 6 часов, 5 часов, 4 часа, 3 часа, 2 часа или 1 час, или за приблизительно от 7 часов до 8 часов, от 6 часов до 7 часов, от 5 часов до 6 часов, от 4 часов до 5 часов, от 3 часов до 4 часов, от 2 часов до 3 часов, от 1 часа до 2 часов или приблизительно за 1 час до начала процедуры гемодиализа.
[00284] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, связанной с CKD, у больного, проходящего гемодиализ, где указанный способ включает введение больному фармацевтически эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, приблизительно через 8 часов, 7 часов, 6 часов, 5 часов, 4 часа, 3 часа, 2 часа или 1 час, или через приблизительно от 7 часов до 8 часов, от 6 часов до 7 часов, от 5 часов до 6 часов, от 4 часов до 5 часов, от 3 часов до 4 часов, от 2 часов до 3 часов, от 1 часа до 2 часов или приблизительно через 1 час после завершения процедуры гемодиализа.
[00285] В некоторых вариантах осуществления предлагаемый способ в настоящем документе дополнительно включает стадию мониторинга, на которой определяют сывороточную концентрацию метаболита соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2. В более конкретных вариантах осуществления определяют концентрацию в сыворотке фенольного глюкуронида и/или ацилглюкуронида соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2. В еще более конкретных вариантах осуществления определяют концентрацию сывороточного фенольного глюкуронида и/или ацилглюкуронида соединения 1, т.е. метаболита 1 или метаболит 2 (см раздел 5.2). В некоторых еще более конкретных вариантах осуществления суточную дозу корректируют в соответствии с сывороточной концентрацией метаболита.
5.6. Комбинированная терапия
[00286] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) с другим лекарством. Такая комбинированная терапия может быть достигнута путем одновременного, последовательного или раздельного дозирования индивидуальных компонентов лечения. Кроме того, при введении в качестве компонента такой комбинированной терапии, соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) и другой лекарственный препарат могут быть синергичными, так что суточная доза одного или обоих компонентов может быть уменьшена по сравнению с дозой любого компонента, которая обычно дается при монотерапии. В качестве альтернативы, при введении в качестве компонента такой комбинированной терапии соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) и другой лекарственный препарат могут быть аддитивными, так что суточная доза каждого из компонентов является сходной или такой же, что и доза любого компонента, которая обычно дается при монотерапии.
[00287] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения нетяжелой анемии, вторичной по отношению к хроническому заболеванию почек, нетяжелой анемии, вторичной по отношению к застойной сердечной недостаточности, и идиопатической анемии старения, включающие введение больному, страдающему анемией, суточной дозы в ингибитора пролилгидроксилазы HIF или стабилизатора HIF-альфа, такого как соединение, имеющее структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединение, выбранное из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, соединения, описанного в данном документе, такого как соединение 1), где соединение вводят непрерывно и/или неопределенный срок, и где соединение вводят с другим лекарственным средством.
[00288] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) больному, страдающему анемией, где соединение необязательно вводят в сочетании с железосодержащей добавкой, такой как сульфат железа, глюконат железа или фумарат железа. В некоторых таких вариантах осуществления железосодержащую добавку вводят через, по меньшей мере, один час, по меньшей мере, два часа, по меньшей мере, три часа, по меньшей мере, четыре часа или даже, по меньшей мере, через шесть часов после введения соединения. В некоторых вариантах осуществления железосодержащую добавку вводят в таком количестве, что ферритин поддерживается на уровне приблизительно от 50 нг/мл до 300 нг/мл. В некоторых вариантах осуществления железосодержащую добавку вводят перорально в суточной дозе, по меньшей мере, приблизительно 50 мг элементарного железа. В некоторых вариантах осуществления железосодержащую добавку вводят перорально в дозе приблизительно 50 мг элементарного железа. В некоторых вариантах осуществления железосодержащую добавку вводят внутривенно. В некоторых вариантах осуществления железосодержащую добавку вводят непрерывно и/или неопределенный срок, например в течение более 42 дней подряд. В некоторых альтернативных вариантах осуществления железосодержащую добавку вводят по мере необходимости таким образом, чтобы ферритин поддерживался на уровне от приблизительно 50 нг/мл до приблизительно 300 нг/мл. В некоторых таких вариантах осуществления суточная доза соединения составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00289] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек, включающие введение соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты) больному, страдающему анемией, где соединение необязательно вводят в сочетании с агентом, стимулирующим эритропоэз (ESA), таким как миметик эритропоэтина. В некоторых таких вариантах осуществления ESA представляет собой продукт rhEPO, включая, но, не ограничиваясь этим, эпоэтин альфа, эпоэтин бета, дарбэпоэтин или пегинесатид. В некоторых таких вариантах осуществления ESA вводят в виде экстренной терапии. В некоторых альтернативных вариантах осуществления ESA вводят непрерывно и/или неопределенный срок, такой как более 42 дней подряд. В некоторых таких вариантах осуществления суточная доза соединения составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
5.7. Группы больных
[00290] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек (CKD), включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где возраст больного составляет, по меньшей мере, 50 лет, по меньшей мере, не менее 60 лет, по меньшей мере, 65 лет, по меньшей мере, 70 лет, или даже, по меньшей мере, 80 лет. В некоторых вариантах осуществления больной является гериатрическим больным. В некоторых вариантах осуществления возраст больного составляет менее 18 лет. В некоторых вариантах осуществления больной является педиатрическим больным. В определенном варианте осуществления возраст больного составляет, по меньшей мере, 18 лет. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00291] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек (CKD), включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной является членом субпопуляции, выбранной из субпопуляций белой расы, латиноамериканцев, черной расы и азиатов. В некоторых вариантах осуществления больной является членом субпопуляции, выбранной из мужчин и женщин. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00292] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению к хроническому заболеванию почек (CKD), включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной имеет дополнительное заболевание или состояние, выбранное из рака, СПИДа, застойной сердечной недостаточности, гипертрофии левого желудочка, диабета, гипертензии, дислипидемии, хронической сердечной недостаточности, инсульта, усталости, депрессии и когнитивного нарушения или любого их сочетания. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00293] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной не поддается лечению ESA, такому как миметик эритропоэтина. В некоторых вариантах осуществления ESA представляет собой продукт rhEPO, включая, но, не ограничиваясь этим, эпоэтин альфа, эпоэтин бета, дарбэпоэтин или пегинесатид. В некоторых таких вариантах осуществления ESA вводят в виде экстренной терапии. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00294] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где у больного насыщение трансферрином (TSAT) составляет, по меньшей мере, 15%, по меньшей мере, 18% или даже, по меньшей мере, 20%. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00295] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной имеет уровень ферритина, по меньшей мере, 50 нг/мл или даже, по меньшей мере, 100 нг/мл. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00296] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной имеет уровень ферритина, по меньшей мере, 50 нг/мл с насыщением трансферрина, по меньшей мере, 18%, или уровень ферритина не менее 100 нг/мл с насыщением трансферрина, по меньшей мере, 15%. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00297] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной имеет индекс массы тела (ИМТ) менее 42 или менее 44 кг/м2. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00298] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения анемии, такой как анемия, вторичная по отношению CKD, включающие введение больному, страдающему анемией, эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты), в соответствии с дозой и/или схемой дозирования, описанной в данном документе, где больной имел переливание эритроцитов в пределах 11 недель или 12 недель от начала лечения соединением. В некоторых альтернативных вариантах осуществления больной не имел переливания эритроцитов в пределах 11 недель или 12 недель от начала лечения соединением. В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг, приблизительно 600 мг или приблизительно 750 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления суточная доза составляет приблизительно 150 мг, приблизительно 300 мг, приблизительно 450 мг или приблизительно 600 мг. Такие суточные дозы могут быть введены перорально, один раз в день, два раза в день или три раза в день, предпочтительно один раз в день.
[00299] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения нетяжелой анемии, вторичной по отношению к хроническому заболеванию почек, нетяжелой анемии, вторичной по отношению к застойной сердечной недостаточности, и идиопатической анемии старения, включающие введение больному, страдающему анемией, суточной дозы соединения, раскрытого в настоящем документе, например, соединения 1, где соединение вводят непрерывно и/или неопределенный срок.
[00300] В некоторых вариантах осуществления в настоящем документе предлагаются способы лечения и/или профилактики перегрузки железом у больного, причем указанный способ включает введение больному эффективного количества соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединения 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединения 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых вариантах осуществления указанная стадия введения осуществляется в соответствии с дозой и/или схемой дозирования, описанной в данном документе.
5.8. Фармацевтические композиции
[00301] Фармацевтические композиции могут быть использованы для получения индивидуальных отдельных единиц лекарственных форм. Фармацевтические композиции и единицы лекарственных форм, представленные в настоящем документе, включают соединение, как представлено в настоящем документе, или его фармацевтически приемлемую соль, сольват или гидрат (например, родительское соединение). Фармацевтические композиции и единицы лекарственных форм могут дополнительно содержать один или более наполнителей.
[00302] В некоторых вариантах осуществления фармацевтические композиции и единицы лекарственных форм включают один или более наполнителей. Подходящие наполнители хорошо известны специалистам в данной области фармации, и неограничивающие примеры подходящих наполнителей приведены в данном описании. Подходит ли конкретный наполнитель для включения в фармацевтическую композицию или единицу лекарственной формы зависит от множества факторов, хорошо известных в данной области техники, включая, но, не ограничиваясь этим, путь, через который единица лекарственной формы будет введена больному. Например, пероральные единицы лекарственных форм, такие как таблетки, могут содержать наполнители, которые не подходят для использования в парентеральных лекарственных формах. Пригодность конкретного наполнителя может также зависеть от конкретных активных ингредиентов лекарственной формы. Например, распад некоторых активных ингредиентов может ускоряться под действием некоторых наполнителей, таких как лактоза, или при контакте с водой. Активные ингредиенты, которые включают первичные или вторичные амины, особенно чувствительны к такому ускоренному распаду. Следовательно, предлагаются фармацевтические композиции и единицы лекарственных форм, которые содержат мало лактозы и других моно- или дисахаридов, если содержат их вообще. При применении в настоящем документе термин «свободный от лактозы» означает, что количество лактозы, если она присутствует, недостаточно, чтобы значительно увеличить скорость деградации активного ингредиента.
[00303] Композиции, свободные от лактозы, могут включать наполнители, которые хорошо известны в данной области техники, и перечислены, например, в Фармакопее США (USP) 25 NF20 (2002). В целом композиции, свободные от лактозы, включают активные ингредиенты, связующий агент/наполнитель и смазывающий агент в фармацевтически совместимых и фармацевтически приемлемых количествах. В одном варианте осуществления свободные от лактозы единицы лекарственных форм включают активные ингредиенты, микрокристаллическую целлюлозу, предварительно желатинированный крахмал и стеарат магния.
[00304] Предлагаются также безводные фармацевтические композиции и единицы лекарственных форм, так как вода может облегчать деградацию некоторых соединений. Например, добавление воды (например, 5%) широко признано в фармацевтической отрасли как средство имитации долговременного хранения для определения характеристик, таких как срок годности или стабильность составов с течением времени. Смотри, например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В действительности, вода и тепло ускоряют распад некоторых соединений. Таким образом, действие воды на состав может иметь большое значение, так как с влагой и/или влажностью обычно встречаются в процессе получения, обработки, упаковки, хранения, транспортировки и использования составов.
[00305] Безводнуюд фармацевтическую композицию необходимо получить и хранить таким образом, чтобы поддерживалась ее безводная природа. Соответственно, безводные композиции в одном варианте осуществления упаковываются с использованием материалов, известных как предотвращающие воздействие воды, так что они могут быть включены в подходящие наборы составов. Примеры подходящих упаковочных материалов включают, но не ограничиваются этим, герметически опечатывающую фольгу, пластик, контейнеры единиц лекарственных форм (например, флаконы), блистерные упаковки и контурные упаковки.
[00306] Предлагаются также фармацевтические композиции и единицы лекарственных форм, которые включают одно или более соединений, которые снижают скорость, с которой активный ингредиент будет разлагаться. Такие соединения, которые обозначаются в настоящем документе как «стабилизаторы», включают, но не ограничиваются этим, антиоксиданты, такие как аскорбиновая кислота, рН-буферы или солевые буферы.
[00307] Как и в случае количества и типов наполнителей, количество и конкретные типы активных ингредиентов в единице лекарственной формы могут различаться в зависимости от таких факторов, как, но, не ограничиваясь этим, путь, с помощью которого они должны вводиться больным.
5.8.1. Пероральные единицы лекарственных форм
[00308] Фармацевтические композиции, пригодные для перорального введения, могут быть предоставлены в виде отдельных единиц лекарственных форм, таких как, но, не ограничиваясь этим, таблетки (например, жевательные таблетки), капсуловидные таблетки, капсулы и жидкости и (например, ароматизированные сиропы). Такие единицы лекарственных форм содержат предварительно определенные количества активных ингредиентов и могут быть получены способами фармации, хорошо известными специалистам в данной области техники. Смотри в целом Remington’s The Science and Practice of Pharmacy, 21st Ed., Lippincott Williams & Wilkins (2005).
[00309] Пероральные лекарственные формы, представленные в настоящем документе, получают с помощью объединения активных ингредиентов в однородную смесь, по меньшей мере, с одним наполнителем согласно обычным методам получения фармацевтических композиций. Наполнители могут иметь широкое разнообразие форм в зависимости от формы препарата, требуемой для введения. Например, наполнители, пригодные для использования в единицах лекарственных форм в виде пероральной жидкости или аэрозоля, включают, но не ограничиваются этим, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители. Примеры наполнителей, пригодных для использования в единицах твердых пероральных лекарственных форм (например, в порошках, таблетках, капсулах и капсуловидных таблетках) включают, но не ограничиваются этим, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, смазывающие агенты, связующие агенты и дезинтеграторы.
[00310] В одном варианте осуществления пероральные лекарственные формы представляют собой таблетки или капсулы, и в этом случае используют твердые наполнители. В другом варианте осуществления таблетки могут быть покрыты с помощью стандартных водных или неводных способов. Такие единицы лекарственных форм могут быть получены любым из способов фармации. В общем, фармацевтические композиции и единицы лекарственных форм получают путем равномерного и тщательного смешивания активных ингредиентов с жидкими носителями, с тонко измельченными твердыми носителями или с обоими, и затем продукту придают желаемую форму, если это необходимо.
[00311] Например, таблетка может быть получена прессованием или формованием. Прессованные таблетки могут быть получены прессованием в соответствующем аппарате активных ингредиентов в свободно-текучей форме, такой как порошок или гранулы, необязательно смешанных с наполнителем. Формованные таблетки могут быть изготовлены формованием в соответствующем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
[00312] Примеры наполнителей, которые могут быть использованы в пероральных единицах лекарственных форм, представленных в настоящем документе, включают, но не ограничиваются этим, связующие агенты, наполнители, разрыхлители и смазывающие агенты. Связующие агенты, пригодные для использования в фармацевтических композициях и единицах лекарственных форм, включают, но не ограничиваются этим, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновая кислота, другие альгинаты, порошковый трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальциевую соль карбоксиметилцеллюлозы, карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, предварительно желатинизированный крахмал, гидроксипропилметилцеллюлозу (например, Nos. 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
[00313] Подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются этим, агенты, продаваемые как AVICEL-PH-101, AVICEL-PH-103 AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), и их смеси. Конкретный связующий агент представляет собой смесь микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы, продаваемой как AVICEL RC-581. Подходящие безводные наполнители или добавки или наполнители или добавки с низкой влажностью включают AVICEL-PH-103™ и крахмал 1500 LM. Другие подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются этим, силикатизированную микрокристаллическую целлюлозу, такую как агенты, продаваемые как PROSOLV 50, 90, PROSOLV PROSOLV HD90, PROSOLV 90 LM и их смеси.
[00314] Примеры наполнителей, пригодных для использования в фармацевтических композициях и лекарственных формах, предлагаемых в настоящем документе, включают, но не ограничиваются этим, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраны, каолин, маннит, кремниевую кислоту, сорбит, крахмал, предварительно желатинизированный крахмал и их смеси. Связующий агент или наполнитель в фармацевтических композициях в одном варианте осуществления присутствует в количестве от приблизительно 50 до приблизительно 99 массовых процентов от фармацевтической композиции или единицы лекарственной формы.
[00315] В некоторых вариантах осуществления наполнители могут включать, но не ограничиваются этим, блок-сополимеры этиленоксида и пропиленоксида. Такие блок-сополимеры могут продаваться как POLOXAMER или PLURONIC, и включают, но не ограничиваются этим, POLOXAMER 188 NF, POLOXAMER 237 NF, POLOXAMER 338 NF, POLOXAMER 437 NF и их смеси.
[00316] В некоторых вариантах осуществления наполнители могут включать, но не ограничиваются этим, изомальт, лактозу, лактит, маннит, сорбит, ксилит, эритрит и их смеси.
[00317] В композициях могут быть использованы разрыхлители для получения таблеток, которые распадаются при воздействии водной среды. Таблетки, которые содержат слишком много разрыхлителя, могут разрыхляться при хранении, тогда как таблетки, которые содержат его слишком мало, могут не разрыхляться с желаемой скоростью или при желаемых условиях. Таким образом, достаточное количество разрыхлителя, которое является, ни слишком большим, ни слишком маленьким для нежелательного изменения высвобождения активных ингредиентов, может быть использовано для формования твердых пероральных единиц лекарственных форм. Количество используемого разрыхлителя варьируется в зависимости от типа состава, и легко определяется специалистами в данной области техники. В одном варианте осуществления фармацевтические композиции содержат от приблизительно 0,5 до приблизительно 15 массовых процентов разрыхлителя или от приблизительно 1 до приблизительно 5 массовых процентов разрыхлителя.
[00318] Разрыхлители, которые можно использовать в фармацевтических композициях и единицах лекарственных форм, включают, но не ограничиваются этим, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, повидон, кросповидон, полакрилин калия, натрия крахмала гликолят, картофельный крахмал или крахмал тапиоки, другие крахмалы, предварительно желатинированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
[00319] Смазывающие агенты, которые могут быть использованы в фармацевтических композициях и единицах лекарственных форм, включают, но не ограничиваются этим, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, стеарилфумарат натрия, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные смазывающие агенты включают, например, силоидный силикагель (AEROSIL200, производимый WR Grace Co., Baltimore, MD), коагулированный аэрозоль синтетического кремнезема (продаваемый Degussa Co., Piano, TX), CAB-O-SIL (пирогенный коллоидный продукт диоксида кремния, продаваемый Cabot Co, of Boston, MA), и их смеси. Если они используются вообще, смазывающие агенты могут быть использованы в количестве менее чем приблизительно 1 массовый процент от фармацевтических композиций или единиц лекарственных форм, в которые они были включены.
[00320] В некоторых вариантах осуществления пероральная единица лекарственной формы включает соединение, силикатизированную микрокристаллическую целлюлозу, натрия крахмал гликолят, блок-сополимер этиленоксида и пропиленоксида, стеарилфумарат натрия и коллоидный диоксид кремния. В некоторых вариантах осуществления пероральная единица лекарственной формы включает соединение в количестве от приблизительно 5% до приблизительно 75% по массе, силикатизированную микрокристаллическую целлюлозу в количестве от приблизительно 15% до приблизительно 85%, натрия крахмал гликолят в количестве от приблизительно 2% до приблизительно 10%, блок-сополимер этиленоксида и пропиленоксида в количестве от приблизительно 2% до приблизительно 10%, стеарилфумарат натрия в количестве 0,2% до приблизительно 2% и коллоидный диоксид кремния в количестве от приблизительно 0,2% до приблизительно 2% от массы пероральной единицы лекарственной формы.
[00321] В некоторых вариантах осуществления пероральная единица лекарственной формы включает соединение, микрокристаллическую целлюлозу, изомальт, натрия крахмал гликолят, лаурилсульфат натрия, повидон, коллоидный диоксид кремния и стеарат магния. В некоторых вариантах осуществления пероральная единица лекарственной формы содержит соединение в количестве от приблизительно 40% до приблизительно 50%, микрокристаллическую целлюлозу в количестве от приблизительно 40% до приблизительно 50%, изомальт в количестве от 0% до приблизительно 5%, натрия крахмал гликолят в количестве от приблизительно 5% до приблизительно 10%, лаурилсульфат натрия в количестве от 0,2% до приблизительно 2%, повидон в количестве приблизительно от 2% до приблизительно 10%, коллоидный диоксид кремния в количестве от 0,1% до приблизительно 1% и стеарат магния в количестве от приблизительно 0,1% до приблизительно 1% от массы пероральной единицы лекарственной формы.
[00322] В некоторых вариантах осуществления в настоящем документе предлагаются единицы лекарственных форм, которые включают от приблизительно 100 мг до приблизительно 1200 мг, от приблизительно 200 мг до приблизительно 1000 мг, от приблизительно 400 мг до приблизительно 800 мг или от приблизительно 450 мг до приблизительно 600 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединение 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединение 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты).
[00323] В некоторых вариантах осуществления в настоящем документе предлагаются единицы лекарственных форм, которые включают приблизительно 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг, 1000 мг, 1050 мг, 1100 мг, 1150 или даже приблизительно 1200 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединение 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединение 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых вариантах осуществления единица лекарственной формы включает приблизительно 40 мг, приблизительно 120 мг, приблизительно 150 мг, приблизительно 185 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг или даже приблизительно 315 мг соединения, имеющего структуру формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), или соединения, выбранного из соединения 1, соединения 2, соединения 3, соединения 4, соединение 5, соединения 6, соединения 7, соединения 8, соединения 9, соединения 10, соединения 11, соединение 12, соединения 13, метаболита 1 или метаболита 2, или их фармацевтически приемлемой соли, сольвата или гидрата (в частности, {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты или 2-(5-(3-фторфенил)-3-гидроксипиколинамидо)уксусной кислоты). В некоторых таких вариантах осуществления единица лекарственной формы представляет собой капсулу, включающую приблизительно 40 мг, приблизительно 120 мг, приблизительно 185 мг, приблизительно 200 мг, приблизительно 200, приблизительно 250 мг или даже приблизительно 300 мг соединения. В некоторых таких вариантах осуществления единица лекарственной формы представляет собой таблетку, включающую 150 мг соединения. В некоторых таких вариантах осуществления единица лекарственной формы представляет собой таблетку, включающую приблизительно 315 мг соединения.
[00324] Жидкие единицы лекарственных форм для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси.
[00325] Кроме инертных разбавителей пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, ароматизаторы, красители, отдушки и консерванты.
[00326] Суспензии в дополнение к активному ингибитору(ам) могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси.
[00327] Некоторые варианты осуществления иллюстрируется следующими неограничивающими примерами.
6. Примеры
6.1. Дизайн исследования
[00328] Фаза 2b, рандомизированного, двойного слепого, контролируемого плацебо исследования было разработана для оценки фармакодинамического гематологического ответа, безопасности и переносимости вводимой перорально 5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты при дозировании в течение 20 недель больным с анемией, вторичной по отношению к CKD, со скоростью клубочковой фильтрацией (СКФ) категории G3a-G5 (преддиализной). Только больных категории G5, которые были еще не на диализе, включали в исследование.
[00329] Индивидуумов отбирала исследовательская группа в зависимости от их статуса ESA (агента, стимулирующего эритропоэз) при отборе (интактные, ранее получавшие лечение или получавшие активное лечение). При использовании централизованной системы рандомизации индивидуумов распределяли двойным слепым образом в соотношении 2:1 в каждую исследовательскую группу либо с получением 5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты, либо плацебо и начинали дозированное введение трех (3) таблеток, 150 мг каждая, один раз в день в суммарной дозе 450 мг, вводимой перорально один раз в день. Индивидуумы должны быть рандомизированы для поддержания баланса между индивидуумами, получавшими плацебо, и индивидуумами, получавшими 5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту, в отношении: 1) статуса CKD (СКФ категории G3a/b, G4 или G5); и 2) наличия или отсутствия у них сахарного диабета.
[00330] Исследуемое лекарство испытуемые получали один раз в день в амбулаторных условиях в течение 20 недель подряд. Гемоглобин (HGB) контролировался при каждом исследовательском визите в процессе дозирования и использовался для определения необходимости коррекции дозы исследуемого препарата. Концентрацию гемоглобина (Hb) представляли как граммы гемоглобина на децилитр крови (г/дл). Так как в эритроцитах содержится приблизительно 33% гемоглобина, концентрация гемоглобина в цельной крови обычно составляет приблизительно одну треть от гематокрита (HCT). Традиционно, гемоглобин измеряется с помощью метода цианметгемоглобина, в котором лизирующий агент добавляют к образцу разведенной крови. Лизирующий агент разрушает все эритроциты в образце и высвобождает гемоглобин в жидкость, так что образец затем представляет собой раствор гемоглобина. Гемоглобин превращается в форму, называемую цианметгемоглобином, и его концентрация считывается с помощью спектрофотометра с длиной волны, установленной на пике оптической плотности цианметгемоглобина. Концентрация гемоглобина затем вычисляется по оптической плотности раствора.
[00331] В качестве альтернативы концентрация гемоглобина может быть определена с использованием прибора HemoCue®, с помощью которого можно измерять концентрацию гемоглобина в капиллярной, венозной или артериальной цельной крови. Реакция в кювете HemoCue® представляет собой модифицированную реакцию азидметгемоглобина. Мембраны эритроцитов разрушаются под действием дезоксихолата натрия, высвобождая гемоглобин. Нитрит натрия превращает железо гемоглобина из двухвалентного железа в состояние трехвалентного железа с образованием метгемоглобина, который затем соединяется с азидом с образованием азидметгемоглобина. На фотометре используется метод двойного измерения длины волны, 570 нм и 880 нм для компенсации помутнения.
[00332] Наконец, концентрация гемоглобина может быть определена с использованием неинвазивного метода, такого как Masimo Total Hemoglobin (SpHb®), который дает возможность неинвазивного и непрерывного мониторинга гемоглобина.
[00333] Доза корректируется в соответствии с руководствами по коррекции доз (смотри ниже). При необходимости в ходе исследования назначают препарат железа для поддержания уровней ферритина от 50 нг/мл до 300 нг/мл.
[00334] Несмотря на то, что основным результатом данного исследования является ответ HGB, в этом исследовании должны также оцениваться определенные нейрокогнитивные функции и сообщаемые больным параметры исхода (PRO) для оценки воздействия на когнитивные функции, подавленное настроение и усталость.
6.2. Оценка нейрокогнитивных функций и сообщаемых больным параметров исхода
[00335] Это исследование должно включать оценки определенных нейрокогнитивных функций и параметров PRO для оценки воздействия на когнитивные функции, подавленное настроение и усталость. Больные с анемией, вторичной по отношению к CKD, испытывают ряд неблагоприятных симптомов, которые могут быть сведены к минимуму и/или уменьшены в результате эффективного лечения. Они включают симптомы когнитивных нарушений, подавленное настроение, усталость и другие.
6.3. Включение и исключение индивидуумов.
[00336] Индивидуумов отбирали для исследования на основе следующих критериев включения и исключения.
[00337] Критерии включения. Индивидуумы должны соответствовать всем следующим критериям включения, чтобы быть допущенными:
1. Возраст от 18 до 82 лет включительно;
2. Диагноз хронического заболевания почек (относительно заболевания почек: в соответствии с клиническими рекомендациями улучшения всеобщих исходов 2012 для оценки и управления хроническим заболеванием почек) с СКФ категорий G3a-G5, еще без проведения диализа и без планирования начала диализа в период исследования;
3. Расчетная ожидаемая скорость клубочковой фильтрации (eGFR) ≥10 и ≤65 мл/мин/1,73 м2 при скрининговом визите. (eGFR) рассчитывается с помощью уравнения креатинина 2009 CKD-EPI);
4. Анемия, вторичная по отношению к CKD, со статусом ESA и скринингом HGB, которые соответствуют критериям для одной из следующих групп
Интактные (никогда не получавшие ESA [группа 1]) с HGB ≤10,5 г/дл при скрининге; или
Ранее получавшие лечение (ранее получавшие ≥1 дозу ESA и находящиеся после отмены терапии ESA ≥11 недель на момент скрининга [Группа 2]) с HGB ≤10,5 г/дл при скрининге; или
Активно получающие лечение (активно и постоянно получающие лечение EAS как минимум в течение 3 месяцев до скрининга, где доза ESA не изменялась в течение введения последних двух доз, и предписанный интервал дозирования ESA составляет ≤4 недели в течение 3 предыдущих месяцев [группа 3]) с HGB ≥9,5 и ≤12 г/дл при скрининге). Индивидуумы, которые не попадают в одну из этих трех групп, не могут быть включены;
5. Ферритин ≥50 нг/мл с насыщением трансферрина (TSAT) ≥18%, или ферритином ≥100 нг/мл с TSAT ≥15%.
6. Понимание процедур и требований исследования и предоставление письменного информированного согласия и разрешения на защиту от раскрытия информации о здоровье.
[00338] Критерии исключения. Индивидуумы, которые характеризуются любым из следующего, не отвечают требованиям включения в исследование:
1. Женщины, которые беременны или кормят грудью, и женщины детородного возраста, которые не могут или не хотят использовать приемлемый метод контрацепции;
2. Невазэктомированные мужчины, которые не могут или не хотят использовать приемлемый метод контрацепции;
3. ИМТ >44,0 кг/м2;
4. Анемия, первично обусловленная гемолизом (гемолитическая анемия), активное кровотечение или недавняя кровопотеря;
5. Трансфузия эритроцитов в пределах 11 недель до скринингового визита, или ожидаемая необходимость трансфузии во время исследования;
6. Терапия андрогенами в течение предшествующих 21 дней до скринингового визита;
7. Внутривенное получение железа в течение последних 4 недель до скринингового визита;
8. Доказательства активной инфекции, если центральный монитор и исследователь не согласны, что индивидуум подходит для данного исследования;
9. История хронического заболевания печени или признаков дисфункции печени (аспартаттрансаминаза (AST) или аланинаминотрансфераза (ALT) > 1,8 x верхнего предела нормальной (ULN), щелочная фосфатазы > 2x ULN или общий билирубин > 1,5x ULN);
10. Скрининг электрокардиограммы с QTc > 500 мсек (при использовании формулы Базетта в методе коррекции частоты сердечного ритма);
11. Неконтролируемая гипертензия (диастолическое давление крови > 110 мм рт.ст. или систолическое давление крови > 190 мм рт.ст. при скрининге);
12. Застойная сердечная недостаточность класса III или IV по классификации Нью-Йоркской ассоциации сердца;
13. Инфаркт миокарда, острый коронарный синдром или инсульт в течение 6 месяцев до скринингового визита;
14. История синдрома миелодисплазии или фиброза костного мозга;
15. Индивидуумы с выявленным диабетическим парезом желудка, которые либо получают симптоматическое лечение, либо не поддаются терапии (сам диабет не является причиной исключения индивидуумов из участия в исследовании);
16. Любая история активного злокачественного образования или лечения злокачественного образования в предыдущие 2 года за исключением операбельных базальноклеточной карциномы кожи, плоскоклеточного рака кожи, рака шейки матки in situ или резекции доброкачественных полипов толстой кишки;
17. История системной красной волчанки (SLE);
18. Возрастная макулярная дегенерация (AMD), диабетический макулярный отек или активная диабетическая пролиферативная ретинопатия, которая, вероятно, потребует лечения в ходе испытания (сама болезнь не входит в критерии исключения);
19. История тромбоза глубоких вен (DVT) в предыдущие 3 месяца, требующая активного лечения;
20. История гемосидероза;
21. История предшествующей или плановой трансплантации органа или трансплантации стволовых клеток или костного мозга (трансплантация роговицы не входит в критерии исключения);
22. Использование исследуемого препарата или участие в исследовательских испытаниях в течение 45 дней или 5 периодов полураспада исследуемого препарата, в зависимости от того, что длится дольше, перед скрининговым визитом;
23. Предыдущее участие в данном исследовании или предшествующее получение 5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты в другом клиническом исследовании или предшествующее получение другого ингибитора пролилгидроксилазы HIF;
24. Другое тяжелое острое или хроническое патологическое или психическое состояние или лабораторные аномалии, которые могут увеличить риск, связанный с участием в исследовании, или с исследованием введения лекарства, или могут вмешиваться в интерпретацию результатов исследования и в заключение исследователя, должно делать индивидуума не подходящим для включения в исследование.
6.4. Лечение индивидуумов
[00339] Индивидуумы выбираются исследовательской группой в зависимости от их статуса ESA при скрининге (интактные, ранее получавшие лечение или активно получающие лечение). Индивидуумы в группе 3 (активно получающие лечение) должны прекратить прием своего ESA до рандомизации. Рандомизация и первая доза исследуемого лекарства должны происходить приблизительно в одно и то же время, чтобы индивидуум в другой раз получал следующую дозу перед лечением своим ESA.
[00340] Индивидуумы, отнесенные к получающим либо 5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусную кислоту, либо плацебо, будут начинать дозирование с трех таблеток (по 150 мг каждая) один раз в день. Исследуемое лекарство будет приниматься один раз в день в течение 20 недель подряд.
[00341] HGB контролируется на протяжении всего исследования для определения того, надо ли корректировать дозу исследуемого лекарства или приостанавливать введение. Доза корректируется в соответствии с Руководством по корректировке доз. Изменения дозы выполняются путем изменения количества таблеток, принимаемых в день, причем каждая таблетка содержит 150 мг соединения 1.
[00342] Исследователи могут назначить железосодержащую добавку по мере необходимости в ходе исследования для поддержания Исследователи должны назначить железосодержащую добавку по мере необходимости в ходе исследования для поддержания ферритина ≥50 нг/мл и ≤300 нг/мл. В целом, для лечения может быть использовано только пероральное железо, и может быть назначена минимальная суточная доза 50 мг элементарного железа. Исследователям рекомендуется назначать железосодержащую добавку, когда ферритин у индивидуума попадает в определенный диапазон (от ≥50 до ≤300 нг/мл) для предотвращения его падения ниже нижней границы диапазона. Индивидуумы с уровнями ферритина >300 нг/мл не должны получать железосодержащую добавку (перорально или внутривенно).
[00343] Индивидуумы, уже получающие пероральные препараты железа в качестве части их плана лечения, могут продолжать свою текущую схему лечения (пока их ферритин составляет ≤300 нг/мл, и они получают терапевтический эквивалент минимальной суточной дозы 50 мг элементарного железа перорально). Индивидуумы, уже получающие пероральные препараты железа в качестве части их плана лечения, но с ферритином >300 нг/мл, должны прекратить свою текущую схему лечения железом во время рандомизации.
[00344] Дозирование исследуемого лекарства должно быть приостановлено, если HGB поднимается до >13,0 г/дл, и не должно инициироваться заново, пока HGB не снизится до ≤12,5 г/дл. (Факторы, которые могут временно изменить уровень HGB, должны быть рассмотрены перед приостановлением дозирования). HGB должен определяться каждые 2 недели в течение этого периода времени.
[00345] После того, как HGB снизился до ≤12,5 г/дл, дозирование исследуемого лекарства инициируется заново следующим образом: 1) если у индивидуума его доза была понижена в течение двухнедельного периода до приостановления дозирования, дозирование возобновляется с уровня не выше последней дозы; или 2) если у индивидуума его доза не была понижена в течение двухнедельного периода до приостановления дозирования, дозирование возобновляется в дозе на 150 мг ниже, чем последний уровень дозы, принимаемый индивидуумом.
[00346] Руководство по коррекции дозы
1. Перед внесением любых изменений дозы или приостановлением дозирования должны быть рассмотрены факторы, которые могут временно изменить уровень HGB (например, баланс жидкости, например, перегрузка жидкостью или обезвоживание, инфекция, госпитализация, трансфузия, пропущенные дозы, острая кровопотеря). Исследователи имеют возможность отсрочить корректировку дозы вплоть до 7 дней, если есть подозрение, что временные факторы являются ведущей причиной изменения HGB. Решение отложить или продолжить коррекцию дозы должно быть подтверждено повторным определением HGB в пределах 7 дней (документированным CBC, выполненным центральной лабораторией).
2. Доза должна быть скорректирована на основании измерения HGB.
3. Снижение дозы разрешено в любое время либо из-за толерантности, либо из-за HGB.
4. Доза может быть увеличена, начиная с 4 недели, следуя руководящим принципам коррекции дозы (таблица 1). Доза не может быть увеличена после 12-й недели визита. В общем, только одна коррекция дозы должна быть сделана в четырехнедельный период.
5. Доза исследуемого лекарства не должна быть увеличена, если HGB индивидуума увеличился на ≥1,2 г/дл от среднего перед использованием дозы.
6. Доступные уровни доз включают: 150 (1 таблетка), 300 (2 таблетки), 450 (3 таблетки) и 600 (4 таблетки) мг в сутки.
7. Коррекции дозы должны происходить на основе следующих критериев:
|
[00347] Необязательная экстренная терапия ESA. Начиная с 6-й недели индивидуумам разрешается (хотя и не требуется) повышать свой HGB с помощью экстренной терапии ESA. Индивидуумы должны соответствовать критериям HGB для экстренной терапии ESA в дополнение к испытываемому клинически значимому ухудшению их анемии или симптомов анемии. Критерии для начала экстренной терапии и направленного спасения HGB при экстренной терапии должны определяться по статусу ESA индивидуумов на этапе включения. Экстренная терапия ESA должна проводиться по усмотрению исследователя.
[00348] Исследователи должны использовать свои местные институтские руководящие принципы дозирования ESA при введении в качестве экстренной терапии. Терапия ESA должна быть прекращена, как только достигается направленное спасение HGB, как указано в таблице 2.
|
[00349] Индивидуумы, получающие экстренную терапию ESA, должны продолжать принимать исследуемое лекарство. Доза исследуемого лекарства не должна меняться или корректироваться в начале или в течение экстренной терапии ESA. Доза исследуемого лекарства должна поддерживаться в течение экстренной терапии ESA, до тех пор, пока HGB не поднимется до ≥13,0 г/дл. Если HGB поднимается до ≥13,0 г/дл, дозирование исследуемого лекарства и экстренная терапия ESA должны быть приостановлены. После завершения экстренной терапии ESA дозу исследуемого лекарства следует продолжать регулировать в соответствии с Руководством по коррекции доз.
6.5. Фармацевтическая композиция
6.5.1. Составы капсул 40 мг, 200 мг и 300 мг
[00350] Составы капсул получали следующим образом:
|
6.5.2. Составы капсул 120 мг, 185 мг, 250 мг и 315 мг
[00351] Составы капсул получали следующим образом:
|
6.5.3 Состав таблетки 150 мг
[00352] Состав таблеток получают следующим образом:
|
6.5.4. Состав таблетки 315 мг
[00353] Состав таблетки 315 мг получают следующим образом с использованием процесса влажного гранулирования:
|
6.5.5. Альтернативный состав таблетки 315 мг
[00354] Состав таблетки 315 мг может быть получен следующим образом с использованием процесса влажного гранулирования:
|
6.5.6. Состав таблетки 100 мг
[00355] Состав таблетки 100 мг может быть получен следующим образом с использованием процесса влажного гранулирования:
|
6.5.7. Состав таблетки 250 мг
[00356] Состав таблетки 250 мг может быть получен следующим образом с использованием процесса влажного гранулирования:
|
6.6. Суточный цикл EPO
[00357] Клинические данные, полученные к настоящему времени, показывают, что соединение 1 стимулирует умеренное дозозависимое суточное увеличение уровней ЕРО, сходное по типу физиологическому суточному ответу, без увеличения базального уровня EPO. На протяжении этих исследований соединение 1 продемонстрировало четкий и соответствующий паттерн дозозависимости ответа как в случае фармакокинетики, так и фармакодинамики с последовательным увеличением EPO, ретикулоцитов и HGB. Гематологический ответ сопровождался дозозависимыми изменениями параметров, связанных с железом, с уменьшением гепцидина и ферритина, и с увеличением суммарной связывающей способности для железа (TIBC). Такое сочетание изменений показывает, что соединение 1 увеличивает гемопоэз путем координируемого ответа. Кроме того, это достигается с помощью умеренного увеличения суточного пикового уровня EPO, но без увеличения базальных (перед введением дозы) уровней (способом, который имитирует физиологический суточный ответ у здоровых индивидуумов).
6.6.1. Фаза I исследования
[00358] На фазе 1 исследования рост EPO был пропорционален дозе соединения 1. На фазе 1a исследования разовой возрастающей дозы (SAD) наблюдалось существенное дозозависимое увеличение через 8, 12, 18 и 24 часа после введения дозы (фиг. 1) в группах с 900 и 1200 мг по сравнению с плацебо (р <0,01). Кроме того, когорты с 600 мг демонстрировали существенное увеличение через 8 часов (р = 0,034).
[00359] Аналогичный ответ наблюдался на фазе 1b исследования множественных возрастающих доз (MAD). Пиковые концентрации EPO характеризовались дозозависимым увеличением. Независимо от группы дозирования, концентрация EPO по существу возвращалась к исходной до следующей утренней дозы, поддерживая таким образом суточный паттерн ответа. На 7-й день в группе с плацебо наблюдался профиль ответа ЕРО, сходный с профилем группы с 500 мг, опять возможно из-за потери крови из-за флеботомии в процессе исследования (приблизительно 230 мл с дня -1 до дня 8).
6.6.2. Фаза IIa исследования
[00360] Современное лечение анемии, связанной с хроническим заболеванием почек (CKD), с помощью стимулирующих эритропоэз агентов (ESAs) могут привести к гиперфизиологическим уровням циркулирующего эритропоэтина (EPO), которые сохраняются в течение нескольких дней, такой профиль может быть связан с увеличением побочных эффектов со стороны сердечнососудистой системы и тромбоэмболическими осложнениями. Соединение 1, вводимое в дозе 500 мг больным, страдающим анемией, вторичной по отношению к CKD, как показано, вызывает возвращение EPO к исходному уровню в течение 24 часов (фиг. 2). Это верно, несмотря на тот факт, что период полужизни соединения 1 у больных с анемией, вторичной по отношению к CKD, значительно больше (фиг. 3) по сравнению с периодом полужизни у здоровых индивидуумов (фиг. 1b). Соединение 1, как показано, индуцирует умеренный суточный рост уровней EPO у больных с CKD, имитируя физиологический диурнальный ответ у здоровых индивидуумов. На фазе 2a рандомизированного двойного слепого контролируемого плацебо испытания 93 больных с CKD стадии 3, 4 или 5 (не на диализе) получали плацебо или соединение 1 в группах со следующими дозами: 240, 370, 500 или 630 мг один раз в день в течение 6 недель. Через 6 недель соединение 1 значительно увеличивало HGB по сравнению с исходным уровнем в группах со всеми дозами по сравнению с плацебо (ANOVA, р<0,0001), как показано на фиг. 5. Увеличение HGB возникало без увеличения базального (до введения дозы) уровня EPO (уровня до введения суточной дозы соединения 1). Результаты, полученные через 6 недель, также выявили дозозависимое увеличение суммарной связывающей способности для железа и снижение гепцидина, предполагая усиленную мобилизацию железа. Наблюдалось выраженное дозозависимое увеличение HGB, начиная с самой низкой дозы, как показано на фиг. 4. Эритропоэтин измеряли исходно, через 2 недели, в конце лечения и при завершении наблюдения. Как показано на фиг. 5, уровни гемоглобина увеличивались с течением времени, в то время как уровни EPO в сыворотке существенно не возрастали с течением времени. Таким образом, соединение 1 значительно увеличивает HGB у больных с анемией, обусловленной CKD, индуцируя умеренный суточный рост уровней EPO с паттерном, сходным с физиологическим суточным ответом, и усиливая мобилизацию железа.
[00361] На фазе 2a исследования по увеличению дозы, 10 больных с CKD получали соединение 1 один раз в день в течение 28 дней. Дозирование начинали в дозе 400 мг у больных со стадией 3 CKD и в дозе 300 мг у больных со стадией 4 CKD. Дозу увеличивали на 100 мг каждую неделю, когда абсолютное количество ретикулоцитов (ARD) не повышалось на 18000 относительно среднего исходного уровня (BL). Результаты, включая больных с CKD со стадиями 3 и 4, показали, что гемоглобин возрастал с 9,91 г/дл при BL до 10,54 г/дл на 29 день. Ферритин снижался с 334,10 нг/мл при BL до 271,70 нг/мл на 29 день, демонстрируя, что соединение 1 является хорошо переносимым и повышает уровень гемоглобина при снижении ферритина дозозависимым образом у больных со стадией 3 или 4 CKD. Стойкое повышение гемоглобина и одновременное снижение ферритина в течение исследования свидетельствуют о том, что начальная эффективная суточная доза соединения 1 находится между 300 и 400 мг. На фиг. 6 показано среднее (±SE) абсолютное изменение от среднего исходного уровня для гемоглобина и ферритина.
6.7. Суммарная связывающая способность для железа
[00362] На фазе 2a рандомизированного двойного слепого контролируемого плацебо клинического испытания 93 больных с CKD стадии 3, 4 или 5 (не на диализе) получали плацебо или соединение 1 в группах со следующими дозами: 240, 370, 500 или 630 мг один раз в день в течение 6 недель. Через 6 недель соединение 1 значительно увеличивало TIBC по сравнению с исходной в группах со всеми дозами по сравнению с плацебо (ANOVA, р<0,0001), как показано на фиг. 7. Увеличение TIBC возникало без увеличения уровня сывороточного железа (по отношению к исходному). Результаты, полученные через 6 недель, также выявили дозозависимое увеличение суммарной TIBC и снижение TSAT из-за отсутствия повышения уровня сывороточного железа, предполагая усиленную мобилизацию железа. TIBC и сывороточные уровни железа измеряли исходно, через 2 недели, 4 недели, в конце лечения (через 6 недель) и при завершении наблюдения.
6.8. Экспрессия гепцидина
[00363] На фазе 2a рандомизированного двойного слепого контролируемого плацебо испытания 93 больных с CKD стадии 3, 4 или 5 (не на диализе) получали плацебо или соединение 1 в группах со следующими дозами: 240, 370, 500 или 630 мг один раз в день в течение 6 недель. Через 6 недель соединение 1 значительно увеличивало уровень гемоглобина по сравнению с исходным в группах со всеми дозами по сравнению с плацебо (ANOVA, р<0,0001), как показано на фиг. 8. Важно отметить, что при низких дозах соединения 1, например, в группе с 240 мг, увеличение сывороточного гемоглобина не сопровождалось уменьшением экспрессии гепцидина, как показано на фиг. 9.
6.9. N-(2-аминоэтил)-3-гидрокси-пиридин-2-карбоксамид
6.9.1. Методы
[00364] Тест на активность EGLN-1: активность фермента EGLN-1 (или EGLN-3) определяли с помощью масс-спектрометрии (матрично-активированной лазерной десорбции/ионизации, MS времени пролета, MALDI-TOF MS - для подробностей анализа смотри ссылку (Greis et al., 2006). Рекомбинантный человеческий EGLN-1-179/426 получали как описано выше и в данных приложения. Полноразмерный рекомбинантный EGLN-3 человека получали таким же образом; однако для теста было необходимо использовать гибрид His-МВР-TVMV-EGLN-3 из-за нестабильности расщепленного белка. Для обоих ферментов, пептид HIF-1α, соответствующий остаткам 556-574 (DLDLEALAPYIPADDDFQL), использовался в качестве субстрата. Реакцию проводили в суммарном объеме 50 мкл, содержащем TrisCl (5 мМ, рН 7,5), аскорбат (120 мкΜ), 2-оксоглутарат (3,2 мкΜ), HIF-1α (8,6 мкМ) и бычий сывороточный альбумин (0,01%). Для инициации реакции добавляли предварительно определенное количество фермента для гидроксилирования 20% субстрата в течение 20 минут. При использовании добавления ферментов соединения получали в диметилсульфоксиде в 10-кратной конечной концентрации для анализа. Реакцию останавливали через 20 минут при комнатной температуре путем добавления 10 мкл реакционной смеси к 50 мкл раствора матрицы для масс-спектрометрии (α-циано-4-гидроксикоричная кислота, 5 мг/мл в 50% ацетонитриле/0,1% TFA, 5 мМ NH4PO4). Два микролитра смеси наносили на пластины-мишени MALDI-TOF MS для анализа анализатором протеомики MALDI-TOF MS Applied Biosystems (Foster City, CA) 4700, снабженным лазером Nd:YAG (355 нм, длительность импульса 3 нс, частота повторения 200 Гц). Гидроксилированный пептидный продукт идентифицировали по массе, превышающей субстрат на 16 Да. Данные, определяемые как процент превращения субстрата в продукт, анализировали в GraphPad Prism 4 для вычисления величин IC50.
[00365] Определение VEGF методом ELISA: клетки НЕК293 высевали в 96-луночные планшеты, покрытые полилизином, в количестве 20000 клеток на лунку в среде DMEM (10% FBS, 1% NEAA, 0,1% глютамин). После инкубации в течение ночи клетки промывали 100 мкл Opti-MEM (Gibco, Carlsbad, CA) для удаления сыворотки. Соединение 13 в ДМСО последовательно разбавляли (начиная с 100 мкМ) в среде Opti-MEM и добавляли к клеткам. Кондиционные среды анализировали на VEGF с помощью набора Quantikine для иммуноферментного определения VEGF человека (R&D Systems, Minneapolis, MN). Измерения оптической плотности при 450 нм записывали с использованием Spectra Max 250 (Molecular Devices, Sunnyvale, CA). Данные, определенные как % от стимуляции DFO, использовали для вычисления величин ЕС50 с помощью программного обеспечения GraphPad Prism 4 (San Diego, CA).
[00366] Исследование ишемии задних конечностей мышей: Всю работу на животных проводили в соответствии с руководством по уходу и использованию лабораторных животных (National Academy of Sciences; Copyright ©1996) и институтскими руководящими принципами по уходу и использованию животных Procter and Gamble Pharmaceuticals. Для исследования использовали самцов мышей С57В1/6 возраста от девяти до десяти недель из Charles River Laboratory (Portage, MI). Мыши получали перорально носитель (водный карбонатный буфер, 50 мМ, рН 9,0) или соединение 13 в носителе в дозе 50 мг/кг или 100 мг/кг. Животные получали дозу три раза: на 1 день в 8 часов утра и 5 часов вечера, на 2 день в 8 часов утра. Через один час после первой дозы выполняли одностороннее лигирование артерии под наркозом с использованием изофлурана. Бедренную артерию лигировали проксимально от прохождения подколенной артерии. На противоположной конечности можно осуществить ложную операцию. Лигирование проводили попеременным образом на правой и левой задних конечностях. Через два часа после дозирования в 8 часов утра на 2 день получали кровь пункцией желудочка при анестезии мышей изофлураном. Образцы сыворотки для анализа EPO получали с использованием пробирок с гелем для отделения сыворотки от сгустка. Сердце, печень и икроножные мышцы собирали с мгновенным замораживанием в жидком азоте и хранили при -80°С до использования.
[00367] Метод определения EPO в сыворотке: EPO в сыворотке мыши определяли с помощью набора Quantikine для иммуноферментного определения эритропоэтина мыши (R&D Systems, Minneapolis, MN) в соответствии с инструкциями производителя.
[00368] Определение HIF в тканях мышей с помощью вестерн-блоттинга: Ткани от мышей, которые хранили при -80°С, переводили в порошкообразное состояние с помощью охлажденных жидким азотом ступки и пестика. Экстракты ядер получали с использованием набора NE-PER (Pierce Biotechnology). Для иммунопреципитации ядерный экстракт добавляли к моноклональному антителу против HIF-1α (Novus, Littleton, CO) при соотношении ткани к антителу 200:1. Суспензию инкубировали в конической центрифужной микропробирке в течение 4 час при 4°С. Затем в пробирку добавляли шарики агарозы с присоединенным протеином A/G (40 мкл 50% суспензии). После перемешивания с переворачиванием в течение ночи при 4°С шарики промывали 3 раза охлажденным на льду забуференным фосфатом физиологическим раствором. Затем шарики обрабатывали для SDS-PAGE с помощью 40 мкл буфера Лэммли для образцов. Белки, разделенные на SDS-PAGE, переносили на нитроцеллюлозные мембраны с помощью системы XCell-II Blot Module (Invitrogen, Carlsbad, CA). Блоты блокировали 5% BSA перед инкубацией с кроличьим антителом против HIF-1α в разведении 1:100 (Novus). Блоты затем могут быть промыты забуференным трисом физиологическим раствором/твином-20 и проинкубированы со вторичными козьими антителами против иммуноглобулинов кролика, конъюгированными с пероксидазой хрена (Pierce, Rockford, IL). Блоты проявляли с помощью реагента ECL (Amersham, Piscataway, NJ). Изображения блотов фиксировали с помощью сканера Epson Expression 1600.
6.9.2. Экспериментальный анализ предполагаемых ингибиторов пролилгидроксилазы HIF
[00369] Цель исследования: оценить активность предполагаемых ингибиторов пролилгидроксилазы фактора, индуцируемого гипоксией (HIF), в отношении ингибирования активности фермента пролилгидроксилазы HIF и тем самым стабилизации HIF (активация HRE люциферазы) и увеличить продукцию EPO (иммуноферментный анализ ЕРО) в клеточной линии человека (клетки Нер3В).
[00370] Материалы и методы: Культура клеток: клетки гепатоцеллюлярной карциномы человека (Нер3В) клетки получали от Американской коллекции типовых культур (АТСС, Mannassas, VA) и культивировали в соответствии с рекомендациями АТСС. Клетки культивировали при 37°С в атмосфере 95% воздуха и 5% CO2 в увлажненном инкубаторе. Соединение 13 разводили до маточной концентрации 50 мМ в ДМСО (Sigma).
[00371] Обработка клеток: клетки Нер3В высевали на 24-луночные планшеты. Подгруппы культур Нер3В трансфицировали репортерной плазмидой HIF (pHRE-люцифераза) в течение ночи. (Смотри Sheta, et al., Oncogene. 2001 Nov 15;20(52):7624-34). Клетки экспонировали с носителем (1:1000 ДМСО) или с тестируемым соединением 13 при 50 мкм в течение 18 часов при 37°С в атмосфере 95% воздуха и 5% CO2 в увлажненном инкубаторе.
[00372] Анализ: После 48-часового культивирования клеточные супернатанты последовательно собирали, центрифугировали при 15000 х g в течение 15 минут при 4°С для осаждения обломков клеток.
[00373] Анализ индукции EPO in vitro: секретируемые уровни EPO определяли с помощью по специфического иммуноферментного анализа (MesoScale Discovery, Gaithersburg, MD) в соответствии с инструкциями производителя.
[00374] Анализ ингибирования пролилгидроксилазы HIF in vitro: Клеточные лизаты анализировали с помощью анализа репортерного гена двойной люциферазы (Promega, Madison, WI, USA). Наблюдаемую активность люциферазы светлячков нормализовали на котрансфецированную люциферазу Renilla.
[00375] Результаты исследования: Соединение 13 тестировали на его способность ингибировать активность фермента пролилгидроксилазы HIF и тем самым стабилизировать HIF (активация HRE люциферазы) и повышать продукцию EPO (иммуноанализ EPO) in vitro в клеточной линии человека (клетки Нер3В) по сравнению с носителем ДМСО в качестве отрицательного контроля. Соединение 13 анализировали в двух параллельных пробах. Рассчитывали кратность изменений по сравнению с контрольным носителем. Соединение 13 тестировали при концентрации 50 мкм. Соединение рассматривали как неактивное, если его активность превышала контроль в ≤1,0 раз. Полученные значения при определении индукции EPO in vitro и анализе ингибирования пролилгидроксилазы HIF приведены в таблице 1 и таблице 2. Неожиданно установлено, что соединение 13 действует и как ингибитор активности фермента пролилгидроксилазы HIF, и как стимулятор продукции EPO.
|
|
[00376] Несмотря на то, что конкретные варианты осуществления настоящего изобретения были проиллюстрированы и описаны, специалистам в данной области техники должно быть очевидно, что различные другие изменения и модификации могут быть сделаны без отступления от сущности и объема изобретения. Оно, следовательно, предназначено для покрытия в прилагаемой формуле изобретения всех таких изменений и модификаций, которые находятся в пределах объема этого раскрытия.