Результат интеллектуальной деятельности: Штамм микроспоридии Nosema pyrausta для борьбы с луговым мотыльком Loxostege sticticalis
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности, к защите растений от особо опасного сельскохозяйственного вредителя, многоядного насекомого-фитофага: лугового мотылька Loxostege sticticalis (L.).
Различные виды микроспоридий обладают высокой вирулентностью по отношению к насекомым и оказывают регулирующий эффект на популяции чешуекрылых фитофагов (Токарев и др., 2007 [1]; Фролов и др., 2008 [2]; Solter et al., 1997 [3]). Виды рода Nosema имеют важное значение в ограничении численности вредных чешуекрылых, таких как Choristoneura fumiferanae, Tortrix viridana, Diatraea saccharalis и др. (Franz, Huger, 1971 [4]; Wilson, 1973 [5]; Lipa, 1976 [6]; Simoes et al., 2015 [7]). Способность микроспоридий длительное время сохраняться в популяциях насекомых за счет различных способов горизонтальной и вертикальной передачи и снижать показатели жизнеспособности, репродуктивной активности и устойчивости к негативным факторам внешней среды позволяет достигать долговременного эффекта на популяции вредителей сельского и лесного хозяйства.
В природных популяциях лугового мотылька на территории Евразии выявлен целый ряд микроспоридий (Исси и др., 1980 [8]; Malysh et al., 2013 [9]; 2018 [10]). Наиболее вирулентные формы, способные вызывать эпизоотии, относятся к роду Tubulinosema (Malysh et al., 2013 [9]), который включает, в том числе, виды, способные заражать человека (Choudhary et al., 2011 [11]; Meissner et al., 2012 [12]; Connors et al., 2017 [13]). Следовательно, применять паразитов этой группы для защиты культурных растений не представляется возможным из-за их потенциальной опасности для человека. С целью поиска перспективных продуцентов из природных популяций лугового мотылька были выделены микроспоридии трех видов: Tubulinosema loxostegi, Nosema sp.и Nosema ceranae, естественная зараженность лугового мотылька составила 35,4 и 3%, соответственно. В лабораторных биотестах зараженность насекомых составила 75%, 52 и 5%, соответственно, при этом смертность на 15-е сутки после заражения составила не более 20% и примерно 80% насекомых во всех вариантах достигло фазы имаго, что свидетельствует об относительно невысокой вирулентности указанных микроспоридий (Malysh et al., 2018 [10]). Таким образом, указанные изоляты обладают низкой эффективностью и не перспективны для борьбы с данным видом вредителя. В настоящее время не известно каких-либо штаммов микроспоридий, которые можно было бы рекомендовать для производства биоинсектицидов против лугового мотылька.
С другой стороны, из литературы известно, что высокой вирулентностью обладает микроспоридия Nosema pyrausta, паразитирующая в стеблевом кукурузном мотыльке Ostrinia nubilalis, оказывающая заметный эффект регуляции численности и способная вызывать депрессии популяций насекомого-хозяина (Siegel et al., 1988 [14]), который относится к тому же семейству (Pyraloidea, Crambidae), что и луговой мотылек. По литературным данным, штаммы этого вида микроспоридий неизвестны, кроме того, его активность против лугового мотылька не испытывалась.
Задачей изобретения является новый штамм микроспоридии Nosema pyrausta с повышенной вирулентностью для эффективного подавления численности лугового мотылька.
Поставленная задача решена путем создания штамма М-1 ВИЗР методами культивирования природных изолятов микроспоридии в лабораторных условиях, отборе лабораторных реизолятов и тестировании их вирулентности в отношении лугового мотылька. Штамм Npyr2-LS1 был отобран как наиболее вирулентный из различных вариантов штаммов, полученных от природного изолята Npyr2 и депонирован в Государственной коллекции микроорганизмов ФГБНУ ВИЗР под регистрационным номером М-1 ВИЗР.
Исходным материалом для отбора высоковирулентного штамма были природные изоляты микроспоридий Nosema pyrausta Npyr1, Npyr2 (Краснодарский край, 2014-2016 гг.), NpyrASM1 (Амурская область, 2008 г.) и NpyrMONG1 (Гомельская область, Республика Беларусь, 2016 г. ) из стеблевых мотыльков рода Ostrinia. Споры микроспоридий использовали для экспериментального заражения а) лабораторной культуры кукурузного мотылька Ostrinia nubilalis с целью массовой наработки спор и б) лабораторной культуры лугового мотылька с целью получения штаммов паразита и тестирования их вирулентности.
Штамм М-1 ВИЗР был отобран как наиболее вирулентный по отношению к гусеницам лугового мотылька. Для селекции по признаку вирулентности, были выделены природные изоляты, один из которых (Npyr2) был отобран для получения штаммов путем размножения микроспоридии на гусеницах лугового мотылька. Штамм М-1 ВИЗР был отобран как наиболее вирулентный и депонирован в Государственной коллекции микроорганизмов ФГБНУ ВИЗР.
Идентификация видовой принадлежности штамма проведена на основании светомикроскопического анализа формы и размеров спор, электронно-микроскопического анализа тонкого строения спор и нуклеотидной последовательности гена малой субъединицы рибосомальной РНК SSU rRNA (Tokarev et al., 2015 [15]). Дополнительная идентификация проведена методом генотипирования по локусам большой субъединицы РНК-полимеразы РНК RPB1 (Grushevaya et al., 2018 [16]) и гексокиназы НК (Tokarev et al., 2018 [17]).
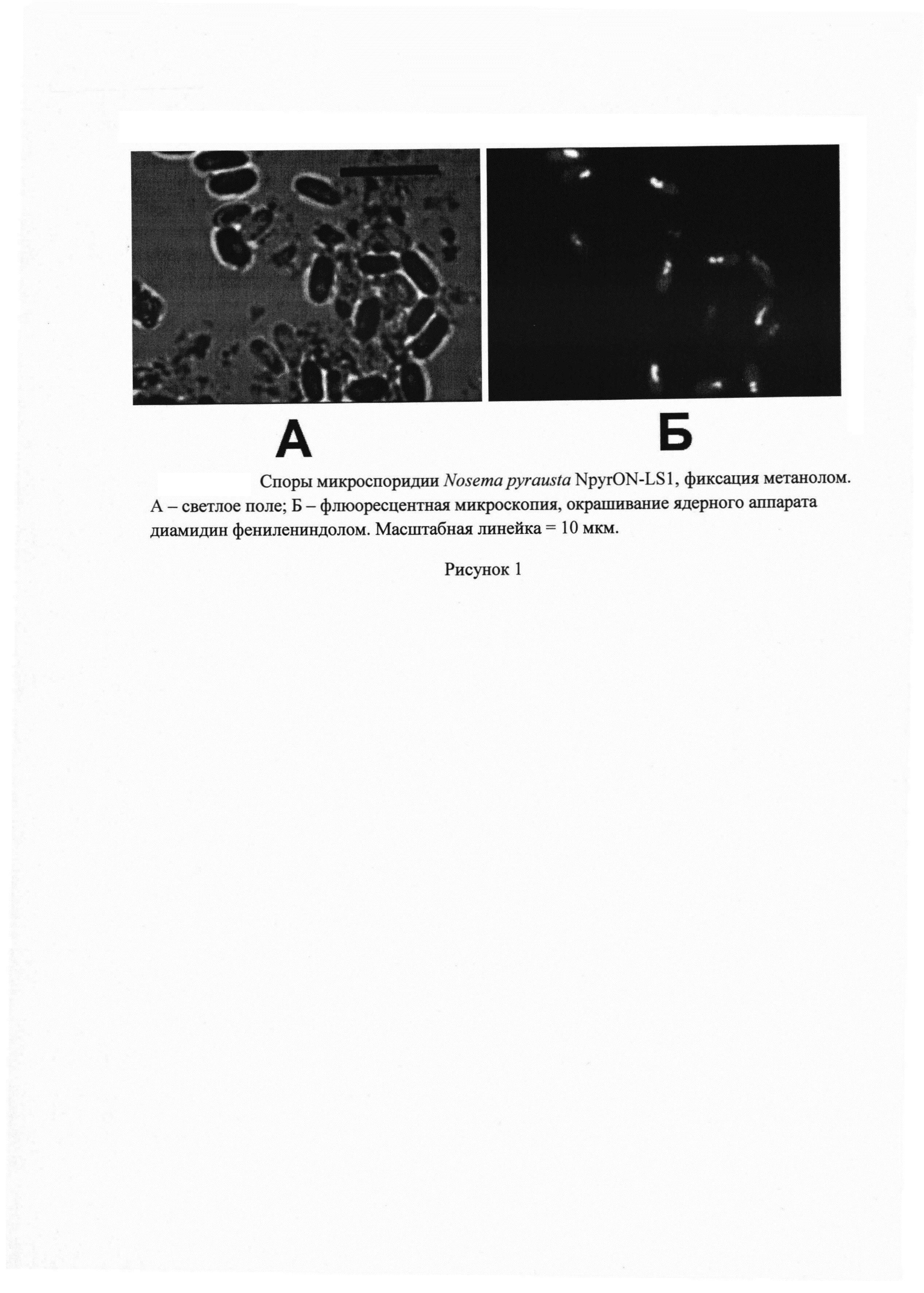
Штамм обладает овально-цилиндрическими спорами. Длина спор составляет от 4 до 5 мкм, в среднем 4.6 мкм. Ширина спор составляет от 2 до 3 мкм, в среднем 2.5 мкм. Отношение длины к ширине составляет 1.8. Окрашивание фиксированных метанолом препаратов ДНК-специфичным флюорохромом ДАФИ позволяет выявить два ядра, расположенных рядом друг с другом в центре споры (рисунок 1). По данным трансмиссионной электронной микроскопии, клеточная оболочка состоит из электронно-плотной экзоспоры толщиной 10 мкм и электронно-прозрачной эндоспоры толщиной 120-150 мкм; в апикальной части эндоспора более тонкая, 30-50 мкм. Поляропласт двухчастный, передняя и задняя части состоят из толстых и тонких пластин, соответственно. Полярная трубка трехслойная, имеет 10 витков одинакового диаметра.
Нуклеотидная последовательность гена малой субъединицы рибосомальной РНК (SSU rRNA) штамма на 100% соответствует таковой, депонированной в Генбанке под номером доступа НМ566196 для Nosema pyrausta, и на 99.7% совпадает с гомологичной последовательностью Nosema bombycis (типового вида рода Nosema) под номером AY209011. Локус RPB1 обладает полиморфизмом, обусловленным наличием множественных молекулярных гаплотипов в пределах одного анализируемого образца. Это приводит к наложению пиков на хроматограмме при прямом секвенировании образца и требует анализа нуклеотидных последовательностей клональных вариантов с использованием молекулярного клонирования, что существенно затрудняет однозначную идентификацию паразита (рисунок 2). По локусу HK такого полиморфизма не наблюдается, что дает возможность секвенирования целевого ампликона без необходимости его клонирования. Нуклеотидная последовательность гена HK штамма, депонированная в Генбанке под номером доступа МН669406, на 90.4% совпадает с гомологичной последовательностью в геноме N. bombycis под номером KB910227 между позициями 876 и 2162. Нуклеотидная последовательность гена НК депонирована в Генбанке под номером доступа МН669406.
Пример 1. Получение биомассы исходного изолята микроспоридии Nosema pyrausta.
Собранных в природе гусениц стеблевых мотыльков рода Ostrinia вскрывали и просматривали мазки жирового тела и слюнных желез в световой микроскоп. При обнаружении спор микроспоридии зараженные ткани переносили в пластиковую пробирку Эппендорфа объемом 1.5 мл, добавляли 100 мкл дистиллированной воды и гомогенизировали пластиковым пестиком в течение 30 сек. Пробирки центрифугировали при 4000 g в течение 5 мин. Надосадочную жидкость декантировали, осадок ресуспендировали в 1 мл дистиллированной воды и подсчитывали концентрацию спор в камере Горяева. Для получения биомассы (спор микроспоридии) проводили заражение гусениц II возраста кукурузного мотылька в дозировке 105 спор на гусеницу (Grushevaya et al., 2018 [16]). Для этого 150 гусениц через 1-3 дня после линьки отсаживали на сложенный в несколько слоев отрезок листа офисной бумаги в герметично закрытую емкость на 2 часа без корма. Споры микроспоридии N. pyrausta в количестве 5×106 смешивали с порцией стандартной искусственной питательной среды (ИПС) (Фролов, 1992 [18]) массой 5 г. и прилепляли на дно стеклянной банки объемом 0,5 л. В банку с кормом, содержащим споры, пересаживали ранее отсаженных гусениц, банку накрывали слоем плотной ткани, фиксировали резинкой и переворачивали вверх дном. После полного потребления корма со спорами гусениц пересаживали в банку с ИПС без добавления корма и содержали при температуре +24°С и фотопериоде 18С:6Т в течение 20-30 дней до окукливания. Выживших куколок отбирали через 3-5 дней после окукливания, и хранили в холодильнике в течение 5-10 дней. Куколок в количестве 100 экземпляров помещали в стеклянный гомогенизатор, объемом 20 мл, добавляли 10 мл дистиллированной воды и гомогенизировали тефлоновым пестиком. Гомогенат процеживали через слой марли для удаления хитиновых покровов насекомых, помещали в пластиковую центрифужную пробирку объемом 15 мл и центрифугировали при 4000 g в течение 10 мин. Надосадочную жидкость декантировали, осадок ресуспендировали в 10 мл дистиллированной воды и центрифугировали повторно. Данным методом получали 5 млрд спор, в среднем 50 млн спор на куколку. Хранение полученной биомассы осуществляли в пластиковых пробирках в виде осадка под слоем дистиллированной воды в бытовом холодильнике при температуре +8-12°С.
Пример 2. Определение вирулентности изолятов N. pyrausta.
Споры исходных изолятов, полученные, как описано в Примере 1, использовали для заражения гусениц лугового мотылька по Malysh et al. (2018 [10]). Для этого отсаживали по 20 шт. гусениц II, III и IV возрастов в стеклянные чашки Петри диаметром 11 см на отрезок офисной бумаги на 2 часа без корма. От стебля лебеды отделяли лист с длинным черешком. Черешок помещали в пластиковую пробирку Эппендорфа объемом 1.5 мл, заполненную водой, и закрывали ватным тампоном. Лист растения равномерно смачивали с двух сторон водной суспензией спор микроспоридии, 2×105 спор в объеме 20-50 мкл, и подсушивали в течение 5-10 мин при комнатной температуре. Пробирку с листом, обработанным споровой суспензией, помещали в чашку Петри с гусеницами, и после полного потребления корма сменяли корм на обычные листья лебеды (без обработки). Смену корма и учет смертности проводили ежедневно. В качестве интегрального показателя вирулентности рассчитывали количество дней, необходимое для достижения 50%-ной смертности насекомых: полулетальное время LT50.
При заражении гусениц III возраста, смертность насекомых от заражения природными изолятами N. pyrausta составила 100% через 15 дней после заражения. Гибель насекомых происходила на стадии гусеницы или куколки. Согласно полученным данным, исходный изолят N. pyrausta Npyr2 обладал максимальной вирулентностью по сравнению с другими природными изолятами: смертность гусениц III возраста на 50-е, 10-е и 15-е сутки составила 30%, 55% и 100%, LT50=9 дней (таблица 1, строка 1).
Пример 3. Получение и определение вирулентности штамма N. pyrausta М-1 ВИЗР.
Споры, выделенные из куколок лугового мотылька, погибших от заражения изолятом Npyr2, как описано в Примере 2, использованы для получения штамма микроспории методом размножения на лабораторной культуре лугового мотылька. Для этого гусениц IV возраста лугового мотылька заражали спорами микроспоридии и через 15 дней выделяли споры из куколок, как описано в Примере 2. Образцы спор штамма использовали для тестирования вирулентности на гусеницах III возраста лугового мотылька, как описано в Примере 2. Штамм М-1 ВИЗР показал следующие показатели вирулентности: смертность тест-насекомых на 50-е, 10-е и 15-е сутки составила 40, 70 и 100%, LT50=7 дней (таблица 1, строка 2).
Таким образом, штамм микроспоридии N. pyrausta М-1 ВИЗР обладает высокой вирулентностью, значительно превышающей вирулентность аналогов, в частности, микроспоридии Tubulinosema loxostegi (таблица 1, строка 3), и может быть использован для микробиологической защиты растений от особо опасного сельскохозяйственного вредителя - лугового мотылька. Вирулентность штамма М-1 ВИЗР, определяемая как смертность насекомых на 10-е сутки и полулетальное время, выше на 27-28% по сравнению с исходным изолятом.
Литература
1. Токарев Ю.С., Малыш Ю.М., Дубинина Е.В., Алексеев А.Н., Фролов А.Н., Исси И.В. Значение микроспоридий для микробиологического контроля численности вредных членистоногих. Защита и карантин растений. 2007. №12. С. 14-16.
2. Фролов А.Н., Малыш Ю.М., Токарев Ю.С. Особенности биологии и прогнозирования динамики численности лугового мотылька Pyrausta sticticalis L. (Lepidoptera, Pyraustidae) в период низкой его численности в Краснодарском крае. Энтомологическое обозрение. 2008. Т. 87(2). С.291-302.
3. Solter L.F., Maddox J.V., McManus M.L. Host specificity of microsporidia (Protista: Microspora) from European populations of Lymantria dispar (Lepidoptera: Lymantriidae) to indigenous North American Lepidoptera. Journal of Invertebrate Pathology. 1997. V. 69. P. 135-150.
4. Franz J.M., Huger A.M. Microsporidia causing the collapse of an outbreak of the green tortrix Tortrix viridana L. in Germany. Proc. Int. Colloq. Insect Pathol. 4th College Park, MD. 1971. P. 48-53.
5. Wilson G.G. Incidence of microsporidia in a field population of a spruce budworm. Can For Serv. Bi-monthly Res. Notes. 1973. V. 29. P. 35-60.
6. Lipa J.J. Microsporidians parasitizing the green tortrix in Poland and their role in the collapse of the tortrix outbreak in Puszcza Niepolomicka during 1970-1974. Acta Protozool. 1976. V. 15. P. 529-536.
7. Simoes R.A., Feliciano J.R., Solter L.F., Delalibera I.Jr. Impacts of Nosema sp.(Microsporidia: Nosematidae) on the sugarcane borer, Diatraea saccharalis (Lepidoptera: Crambidae). J. Invertebr Pathol. 2015. V. 129. P.7-12.
8. Исси И.В., Симчук П.М., Радищева Д.Ф. Микроспоридиоз лугового мотылька Loxostege sticticalis L. (Lepidoptera, Pyralididae). Бюллетень ВИЗР. 1980. Т. 48. С. 3-6.
9. Malysh J.M., Kononchuk A.G., Nurzhanov A.A., Frolov A.N., Issi I.V., Tokarev Y.S. Morphological and genetic diversity of microsporidia infecting beet webworm Loxostege sticticalis L. (Pyraloidea: Crambidae) in Russia. Eurasian Entomol. J. 2013. V. 12. P. 543-548.
10. Malysh J.M., Ignatieva A.N., Artokhin K.S., Frolov A.N., Tokarev Y.S. Natural infection of the beet webworm Loxostege sticticalis L. (Lepidoptera: Crambidae) with three Microsporidia and host switching in Nosema ceranae. Parasitology Research. 2018. V. 117(9). P. 3039-3044.
11. Choudhary M.M., Metcalfe M.G., Arrambide K., Bern C, Visvesvara G.S., Pieniazek N.J., Bandea R.D., DeLeon-Carnes M., Adem P., Choudhary M.M., Zaki S.R., Saeed M.U. Tubulinosema sp.microsporidian myositis in immunosuppressed patient. Emerging and Infectious Diseases. 2011. V. 17. P. 1727-1730.
12. Meissner E.G., Bennett J.E., Qvarnstrom Y., da Silva A., Chu E.Y., Tsokos M., Gea-Banacloche J. Disseminated microsporidiosis in an immunosupplpressed patient. Emerging and Infectious Diseases. 2012. V. 18. P. 1155-1158.
13. Connors W.J., Carson J.A., Chan W.W., Parkins M.D. Albendazole-responsive disseminated Tubulinosema acridophagus in a patient with chronic lymphocytic leukaemia. Clin Microbiol Infect. 2017. V. 23(9). P. 684-685.
14. Siegel J.P., Maddox J.V., Ruesink W.G. Seasonal progress of Nosema pyrausta in the European corn borer, Ostrinia nubilalis. Journal of Invertebrate Pathology. 1988. V. 52. P. 130-136.
15. Tokarev Y.S., Malysh J.M., Kononchuk A.G., Seliverstova E.V., Frolov A.N., Issi I.V. Redefinition of Nosema pyrausta (Perezia pyraustae Paillot 1927) basing upon ultrastructural and molecular phylogenetic studies. Parasitol. Res. 2015. V. 114(2). P. 759-761.
16. Grushevaya I.V., Ignatieva A.N., Malysh S.M., Senderskiy I.V., Zubarev I.V., Kononchuk A.G. Spore dimorphism in Nosema pyrausta (Microsporidia, Nosematidae): from morphological evidence to molecular genetic verification. Acta Protozoologica. 2018. V. 57. P. 49-52.
17. Tokarev Y.S., Timofeev S.A., Malysh J.M., Tsarev A.A., Ignatieva A.N., Tomilova O.G., Dolgikh V.V. Hexokinase as a versatile molecular genetic marker for Microsporidia. Parasitology. 2018. V. 15. P. 1-7.
18. Фролов A.H. Изменчивость кукурузного мотылька и устойчивость к нему кукурузы: Дисс. на соиск. учен. степ, доктора биол. наук. СПб: ВИЗР. 1992. 780 с.
*Исходный изолят Nosema pyrausta
**Новый штамм Nosema pyrausta
***Аналог
Штамм микроспоридии Nosema pyrausta M-l ВИЗР для борьбы с луговым мотыльком Loxostege sticticalis.