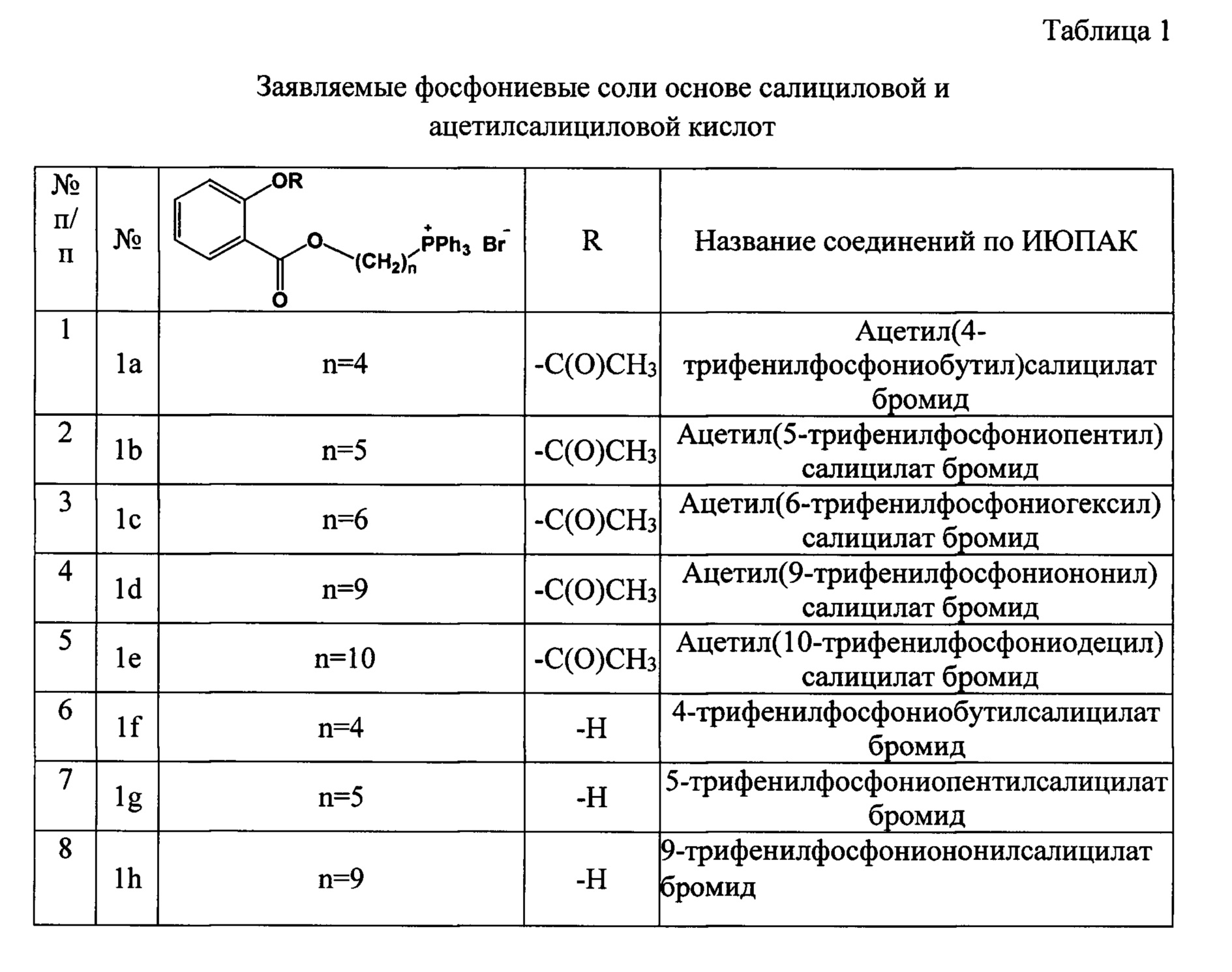
Результат интеллектуальной деятельности: Фосфониевые соли на основе салициловой и ацетилсалициловой кислот, обладающие антибактериальной и антиоксидантной активностью"
Вид РИД
Изобретение
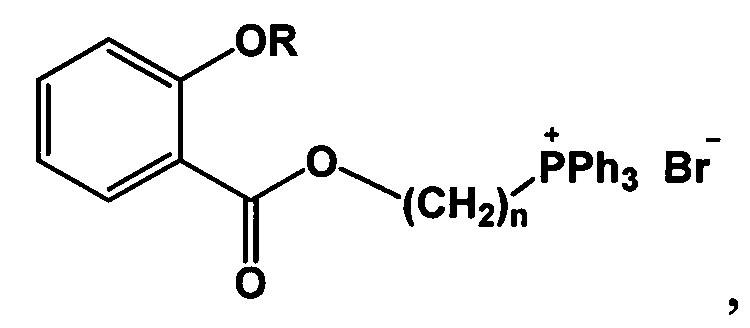
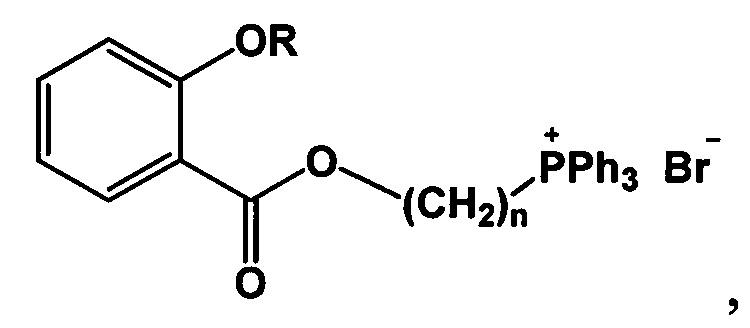
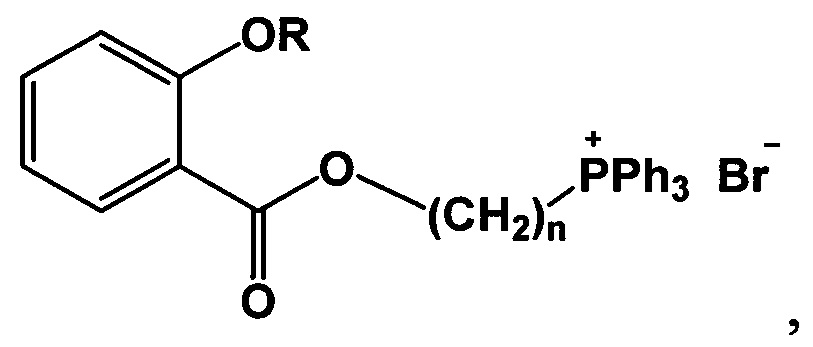
Изобретение относится к области органической химии, в частности к новым фосфониевым солям на основе салициловой и ацетилсалициловой кислот формулы 1
где при R=Ac, n=4, 5, 6, 9, 10,
при R=Н, n=4, 5, 9,
которые могут быть применены в фармакологии и медицине в качестве антибактериальных и антиоксидантных средств.
За последние 20 лет феномен антибактериальной резистентности затронул все части Земного шара. Если раньше только в больницах наблюдались инфекции, на которые не действуют антибиотики, то в настоящее время резистентные бактерии выходят за стены госпиталей. Общество может вернуться в эпоху до открытия антибиотиков, когда простая инфекция могла означать смертельный приговор больному. Уже сегодня ряд бактерий проявляют устойчивость ко многим лекарствам, из-за чего такие инфекции как, например, гемофильные и пневмонии становятся практически неизлечимыми. Более того, исчезновение возможности эффективного предупреждения инфекций с помощью антибиотиков может сделать невозможным выполнение многих современных медицинских вмешательств и диагностических тестов. Всемирная Организация здравоохранения (ВОЗ) определяет резистентность к противомикробным препаратам как одну из величайших угроз здоровью человека и предложила глобальный план борьбы с устойчивостью к противомикробным препаратам (World Health Organization (WHO), Global Action Plan on Antimicrobial Resistance, 2015. http://www.who.int/antimicrobial-resistance/globalaction-plan/en/). В 2017 ВОЗ опубликовала список устойчивых к антибиотикам патогенов, который является ориентиром при разработке новых препаратов против существующих инфекций (World Health Organization, Antibiotic-resistant priority pathogens list, 2017. http://www.who.int/mediacentre/news/-releases/2017/bacteria-antibiotics-needed/en/).
Многие бактерии обладают широким спектром вирулентных факторов, одним из которых является способность бактерий формировать биопленки на органических и синтетических поверхностях. Многие штаммы грамположительных бактерий (S. pneumoniae, S. aureus, Е. faecium) формируют биопленки, что значительно сужает круг возможных терапевтических препаратов. Разработка новых подходов антибактериальной терапии является острой необходимостью. В последнее время интенсивно развивается направление, связанное с поиском антибактериальных соединений, нацеленных на бактериальную биоэнергетику (Hardsa K., Cook G.M., Targeting bacterial energetics to produce new antimicrobials, Drug Resistance Updates 2018, 36, 1-12). С 2012 года широко применяется новый антитуберкулезный препарат бедаквилин. Данный препарат является первым принципиально новым средством для лечения туберкулеза за 40 лет. Бактерицидное действие препарата обусловлено специфическим ингибированием протонной помпы АТФ-синтазы микобактерий.
Данные исследований последних лет указывают на то, что соединения, содержащие в своем составе трифенилфосфониевую (ТФФ) группу, могут стать альтернативой в лечении инфекций, вызываемых резистентными к антибиотикам бактериями. Действие этих соединений направлено на биоэнергетические процессы в клетке, которые связаны с клеточной мембранной. В работе (Хайлова Л.С., Назаров П.А., Сумбатян Н.В., Коршунова Г.А., Рокицкая Т.И., Дедухова В.И., Антоненко Ю.Н, Скулачев В.П. Разобщающее и токсическое действие алкил-трифенилфосфониевых катионов на митохондрии и бактерии Bacillus subtilis в зависимости от длины алкильного фрагмента, Биохимия, 2015, том 80, вып. 12, с. 1851-1860) исследовалось действие липофильных катионов этой серии на бактерии. Было замечено разобщение окислительного фосфорилирования у бактерий и угнетение их роста. На сегодняшний день нет никаких сообщений о развитии резистентности к производным трифенилфосфония среди грамположительных микроорганизмов. Есть предположение, что данный подход поможет победить устойчивость бактерий к антибиотикам.
По современным представлениям как повышенная, так и пониженная продукция клетками эндогенных АФК (активные формы кислорода) связана с множественными патологическими состояниями и заболеваниями. К последним относятся злокачественные новообразования, атеросклероз, сахарный диабет, нейродегенеративные и сосудистые заболевания, патологии иммунной системы. Окислительный стресс является основным патофизиологическим признаком хронической обструктивной болезни легких и муковисцидоза (A. Hector, М. Griese, D. Hartl, Oxidative stress in cystic fibrosis lung disease: an early event, but worth targeting, Eur. Respir. J. 44, 2014, 17-19; F. Galli, A. Battistoni, R. Gambari, A. et al. Oxidative stress and antioxidant therapy in cystic fibrosis, Biochim. Biophys. Acta 1822, 2012, 690-713). Легкие у пациентов с муковисцидозом постоянно находятся в цикле: инфекция-воспаление-обструкция. Прерывание этого цикла инновационными препаратами замедляет прогрессирование заболевания, улучшает качество жизни больного. Вышеописанное явление предполагает введение в практику новых терапевтических стратегий, направленных на антиоксидантные пути в клетке совместно с антибактериальной активностью новых препаратов.
Проблема сохранения качества, а также увеличения срока годности товара актуальна для медицинской, косметической и пищевой промышленности. Используемое сырье и растворы подвержены воздействию не только микробиологических, но и окислительных факторов. Разработка антибактериальных соединений, которые могут действовать в качестве пищевых консервантов без увеличения резистентности бактерий, имеет первостепенное значение. Требования к новым пищевым антиоксидантам обусловлено негативным потребительским восприятием синтетических антиоксидантов, таких как бутилгидроксианизол и бутилгидрокситолуол, которые показали токсические и канцерогенные эффекты на моделях животных (H.-J. Suh, M.-S. Chung, Y.-H. Cho, et al. Estimated daily intakes of butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT) and tert-butyl hydroquinone (TBHQ) antioxidants in Korea, Food Addit. Contam. 22 (2005) 1176-1188).
Создание соединений, сочетающих в себе антибактериальную и антиоксидантную активность без токсического воздействия на здоровье человека, очень актуально и ожидаемо.
Основываясь на симбиотической теории, было выдвинуто предположение, что митохондриально направленные антиоксиданты, снижающие потенциал мембраны митохондрий, могут являться эффективными антибиотиками (Nazarov Р.А., Osterman I.A., Tokarchuk А. et al. Mitochondria-targeted antioxidants as highly effective antibiotics. Sci Rep.2017, 7, 1, 1394). Было обнаружено новое свойство митохондриально направленного антиоксиданта SkQ1, синтетического производного трифенилфосфония, убивать бактерии за счет снижения их мембранного потенциала.
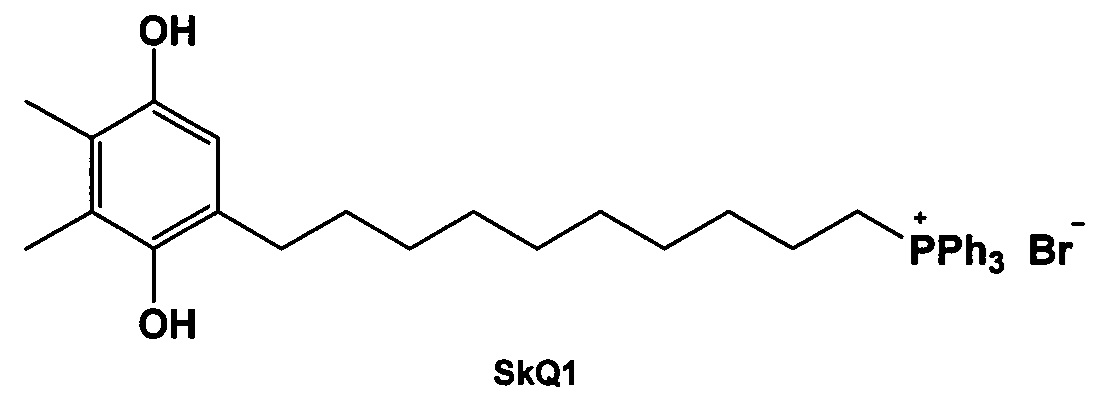
Плотников и соавторы (Plotnikov E.Y., Morosanova М.А., Pevzner I.В., et al. Protective effect of mitochondria-targeted antioxidants in an acute bacterial infection, P. Natl. Akad. Sci. USA 2013, E3100-E3108) показали, что SkQ1 обладает более высокой антиоксидантной активностью, чем Trolox (водорастворимый аналог витамина Е обычно используется в качестве эталона для измерения антиоксидантной активности). В дальнейшем SkQ1 был также признан эффективным антибактериальным средством против S. aureus, В. subtilis, E. coli и Mycobacterium sp.
Задачей изобретения является создание новых антибактериальных средств, обладающих одновременно антиоксидантной активностью и при этом не оказывающих токсического воздействия на организм, расширяющих ассортимент средств указанного назначения.
Техническим результатом является свойство новых соединений проявлять одновременно антибактериальную и антиоксидантную активность и при этом не оказывать токсическое воздействие на организм. Технический результат также состоит в расширении арсенала средств указанного назначения.
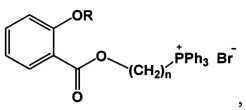
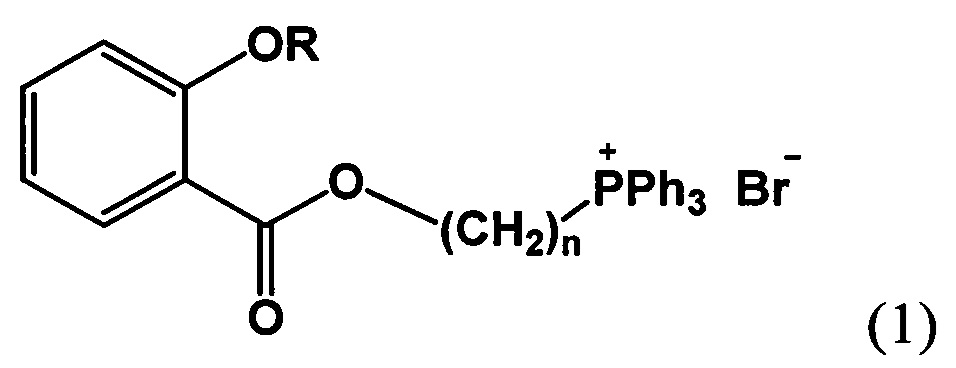
Поставленная задача решается, и технический результат достигается заявляемыми новыми фосфониевыми солями на основе салициловой и ацетилсалициловой кислот формулы 1

где при R=Ac, n=4, 5, 6, 9, 10, при R=Н, n=4, 5, 9.
Для удобства восприятия сведения о структуре новых заявляемых соединений сведены в таблицу 1.
Предлагаемые соединения формулы 1 проявляют антибактериальную и антиоксидантную активность без токсического воздействия.
Ацетилсалициловая кислота (аспирин) - нестероидный противовоспалительный препарат (НПВС), которому свойственны три основных эффекта: противовоспалительный, жаропонижающий и менее выраженный обезболивающий. Главная роль в реализации противовоспалительного эффекта аспирина отводится способности тормозить биосинтез одних из основных медиаторов воспаления -простагландинов.
Салициловая кислота - нестероидный противовоспалительный препарат, способный ингибировать рост биопленок Staphylococcus epidermidis (Muller Е., Al-Attar J., Wolff A., Farber B. Mechanism of Salicylate-Mediated Inhibition of Biofilm in Staphylococcus epidermidis, J. Infect. Dis. 1998, 177, 501-503), P. aeruginosa (Jagani S., Chelikani R., Kim D.S. Effects of phenol and natural phenolic compounds on biofilm formation by Pseudomonas aeruginosa, Biofouling, 2009, 25, 321-324; Prithiviraj В., Bais H.P., Weir Т., et al. Down Regulation of Virulence Factors of Pseudomonas aeruginosa by Salicylic Acid Attenuates Its Virulence on Arabidopsis thaliana and Caenorhabditis elegans, Infect. Immun. 2005, 73, 5319-5328), проявляет антибактериальное действие на модели бактериального эндокардита на кроликах, вызванного Staphylococcus aureus (Kupferwasser L, Yeaman M, Shapiro S, et al. Acetylsalicylic acid reduces vegetation bacterial density, hematogenous bacterial dissemination, and frequency of embolic events in experimental Staphylococcus auteus, Circulation 1999, 99, 2791-2797), уменьшает прикрепление P. aeruginosa и & epidermidis к эпителиальным клеткам роговицы человека in vitro (Bandara B.M., Sankaridurg P.R., Willcox M.D.P. Non-steroidal anti inflammatory agents decrease bacterial colonisation of contact lenses and prevent adhesion to human corneal epithelial cells, Curr. Eye Res. 2004, 29, 245-251). Проведенные исследования показали, что салициловая кислота является ингибирующим агентом AHL сигнальных молекул в QS системах (Chang C.-Y., Krishnan Т., Wang Н., et al. Non-antibiotic quorum sensing inhibitors acting against N-acyl homoserine lactone synthase as druggable target, Sci. Rep. 2014, 4, 7245). В медицинской практике широко используют ряд производных салициловой кислоты: ацетилсалициловую кислоту (аспирин), салицилат натрия, салициламид, метилсалицилат в качестве анальгетиков, антипиритиков и антиагрегантов.
Фосфониевые соли на основе салициловой и ацетилсалициловой кислот не известны из предшествующего уровня техники, и антибактериальная активность производных салициловой и ацетилсалициловой кислот, содержащих в своем составе ТФФ-группу, ранее не описывалась.
Поставленная задача решается, и технический результат также достигается заявляемым способом получения фосфониевых солей на основе производных салициловой и ацетилсалициловой кислот формулы 1, включающим взаимодействие в инертной атмосфере, например, аргона или азота, галогеналкильных эфиров салициловой и ацетилсалициловой кислот формулы 2 с избытком трифенилфосфина в подходящем растворителе, в качестве которого наиболее оптимально использовать ацетонитрил, при температуре кипения растворителя до завершения реакции - в течение порядка 6-8 часов. Далее выделяют целевой продукт известными способами.
Ниже приведена схема синтеза фосфониевых солей на основе салициловой и ацетилсалициловой кислот формулы 1.
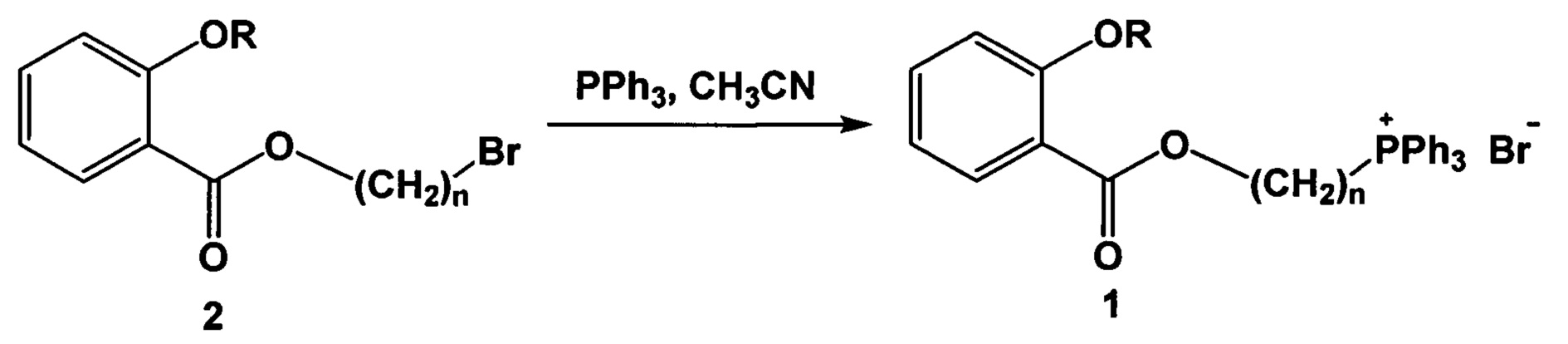
где при R=Ac, n=4, 5, 6, 9, 10,
при R=H, n=4, 5, 9.
Исходные галогеналкильные эфиры салициловой и ацетилсалициловой кислот формулы 2 были синтезированы по стандартной методике (Wodnicka A., Huzar Е., Synthesis and photoprotective properties of new salicylic and vanillic acid derivatives, Current Chemistry Letters 2017, 6, 125-134).
Характеристики соединений формулы 2 приведены в соответствующих примерах, иллюстрирующих изобретение.
Контроль за прохождением реакции осуществляют методом ТСХ.
Салициловая кислота, ацетилсалициловая кислота, 1,4-дибромбутан, 1,5-дибромпентан, 1,6-дибромгексан, 1,9-дибромнонан, 1,10-дибромдекан, и трифенилфосфин использованы марки х.ч. фирмы Acros Organics, ацетонитрил - х.ч. фирмы ЗАО Вектон, пластины для ТСХ фирмы Сорбфил.
Изобретение иллюстрируется примерами получения заявляемых соединений формулы 1 и исследованиями их антибактериальной и антиоксидантной активности, а также оценкой их цитотоксичности.
Пример 1.
Ацетил(4-трифенилфосфониобутил)салицилат бромид - 1а.
В круглодонную колбу помещают 0.63 г (2.0 ммоль) соединения 2а, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина и при перемешивании нагревают в течение 7 часов при температуре 82°С (температура кипения ацетонитрила - 81.6°С) в атмосфере аргона. Контроль за прохождением реакции осуществляют методом ТСХ до исчезновения пика исходного галогеналкильного соединения 2а. Затем растворитель удаляют отгонкой в вакууме (12 Торр), остаток растворяют в 3 мл CHl3 и осаждают петролейным эфиром, образовавшийся маслянистый остаток отделяют. Выход 1.03 г (90%). Маслянистое вещество. ИКС, ν, см-1: 3413, 2866, 1764 (С=O), 1717 (С=O), 1606, 1485, 1438, 1368, 1295, 1255, 1196, 1161, 1113, 1085, 996, 752, 723, 690. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.71-1.81 (2Н, м, CH2), 2.20-2.25 (2Н, м, CH2), 2.30 (3Н, с, С(О)CH3), 3.97-4.04 (2Н, м, CH2P), 4.35 (2Н, т, J=5.9 Гц, С(O)CH2), 7.09 (1Н, д д, J=8.0, 1.0 Гц, H-Сар), 7.27 (1Н, д д д, J=7.7, 7.6, 1.0 Гц, H-Сар), 7.61 (1Н, д д д, J=7.7, 7.7, 1.7 Гц, H-Сар), 7.6-7.9 (16Н, м, H-Сар). 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 19.6 (СН2, д, J=3.9 Гц), 21.0, 22.1 (СН2, д, J=51 Гц), 28.9 (СН2, д, J=16.9 Гц), 63.6, 118.0 (д, J=88.8 Гц, Сипсо), 123.1, 123.7, 125.9, 130.4 (д, J=12.6 Гц, СН), 131.4, 133.6 (д, J=10.2 Гц, СН), 133.8, 135.0 (д, J=3.0 Гц, СН), 150.6, 164.2, 169.6; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.3; Масс спектр (MALDI-TOF), m/z: 497.19 [М-Br]+ (вычислено 577.45:[М]+).
Ацетил (4-бромбутил)салицилат - 2а:
Выход (75%). Маслянистое вещество. ИКС, ν, см-1: 3078, 2961, 2852, 1768 (С=O), 1721 (С=O), 1607, 1580, 1486, 1452, 1368, 1294, 1254, 1194, 1161, 1134, 1081, 1041, 1011, 959, 916, 877, 818, 794, 753, 704, 671, 650. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.89-1.96 (2Н, м, CH2), 1.98-2.05 (2Н, м, CH2), 2.36 (3H, с, С(О)CH3), 3.47 (2Н, т, J=6.5 Гц, CH2 Br), 4.32 (2Н, т, J=6.3 Гц, С(O)CH2), 7.12 (1Н, д д, J=8.1, 1.0 Гц, H-Сар), 7.32 (1Н, д д д, J=7.7, 7.5, 1.1 Гц, H-Сар), 7.57 (1H, д д д, J=7.5, 7.5, 1.7 Гц, H-Сар), 8.01 (1Н, д д, J=7.8, 1.7 Гц, H-Сар, Найдено, %: С 49.3; Н 4.80, Br 25.36. C13H15BrO4, Вычислено, %: С 49.54; Н 4.80, Br 25.35.
Пример 2.
Ацетил(5-трифенилфосфониопентил) салицилат бромид - 1b получают аналогично примеру 1 из 0.65 г (2.0 ммоль) соединения 2b, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.0 г (90%). Маслянистое вещество. ИКС, ν, см-1: 3401, 2907, 1766 (С=O), 1718 (С=O), 1607, 1588, 1485, 1451, 1439, 1368, 1295, 1257, 1197, 1162, 1114, 1083, 1041, 1011, 997, 918, 751, 724, 691. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.6-1.8 (6Н, м, CH2), 2.30 (3H, с, С(О)CH3), 3.84-3.91 (2Н, м, CH2P), 4.21 (2Н, т, J=5.9 Гц, С(O)CH2), 7.07 (1H, д д, J=8.0, 0.9 Гц, H-Сар), 7.29 (1H, д д д, J=7.6, 7.6, 1.0 Гц, H-Сар), 7.54 (1H, д д д, J=7.5, 7.9, 1.7 Гц, H-Сар), 7.65-7.86 (15Н, м, H-Сар), 7.95 (1Н, д д, J=8.0, 0.9 Гц, H-Сар), 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 21.1, 22.2 (СН2, д, J=3.8 Гц), 22.8 (СН2, д, J=50.3 Гц), 26.8 (СН2, д, J=16.2 Гц), 28.1, 64.5, 118.2 (д, J=86.0 Гц, Сипсо), 123.5, 126.7, 130.5 (д, J=12.5 Гц, СН), 131.7, 133.6 (д, J=10.0 Гц, СН), 133.8, 135.0 (д, J=3.0 Гц, СН), 150.6, 164.3, 169.6; 31Р ЯМР (COCl3, 162 МГц) δP, м.д.: 24.5; Масс спектр (MALDI-TOF), m/z: 511.1 [М-Br]+ (вычислено 591.48:[М]+).
Ацетил(5-бромпентил)салицилат - 2b:
Выход (73%). Маслянистое вещество. ИКС, ν, см-1: 3079, 2944, 2867, 1770 (С=О), 1720 (С=O), 1607, 1579, 1485, 1452, 1368, 1294, 1261, 1195, 1161, 1134, 1082, 1041, 1010, 959, 916, 877, 856, 816, 795, 753, 705. 1НЯМР (CDCl3, 400 МГц) δ, м.д.: 1.5-1.6 (2Н, м, CH2), 1.7-1.8 (2Н, м, CH2), 1.9-2.0 (2Н, м, CH2), 2.36 (3H, с, С(О)CH3), 3.44 (2Н, т, J=6.7 Гц, CH2Br), 4.3 (2Н, т, J=6.6 Гц, С(O)CH2), 7.1 (1Н, д д, J=8, 1.0 Гц, H-Сар), 7.3 (1Н, д д д, J=7.7, 7.7, 1.2 Гц, H-Сар), 7.57 (1Н, д д д, J=8, 8, 1.7 Гц, Н-Сар), 8.01 (1Н, д д, J=7.8, 1.65 Гц, H-Сар, Найдено, %: С 51.0; Н 5.18, Br 24.2. C14H17BrO4, Вычислено, %: С 51.08; Н 5.21, Br 22.27.
Пример 3.
Ацетил(6-трифенилфосфониогексил) салицилат бромид - 1с получают аналогично примеру 1 из 0.68 г (2.0 ммоль) соединения 1с, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.0 г (87%). Маслянистое вещество. ИКС, ν, см-1: 3394, 2936, 2863, 1767 (С=O), 1718 (С=O), 1607, 1588, 1485, 1451, 1439, 1368, 1295, 1260, 1197, 1161, 1114, 1082, 1042, 997, 922, 751, 725, 692. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.4 (2Н, м, CH2), 1.6-1.7 (6Н, м, CH2), 2.28 (3H, с, С(О)CH3), 3.76-3.81 (2Н, м, CH2P), 4.2 (2Н, т, J=6.4 Гц, С(O)CH2), 7.06 (1Н, д, J=8.0 Гц, H-Сар), 7.28 (1Н, д д, Н-Сар), 7.53 (1H, д д д, J=7.5, 7.9, 1.5 Гц, H-Сар), 7.66-7.83 (15Н, м, H-Сар), 7.96 (1Н, д J=6.5 Гц, H-Сар), 13С ЯМР(CDCl3, 100.6 МГц) SC, м.д.: 21.07, 22.6, 22.75 (СН2, д, J=50.2 Гц), 25.5, 28.3, 29.8 (СН2, д, J=15.7 Гц), 64.9, 118.3 (д, J=85.8 Гц, Сипсо), 123.4, 126.0, 130.5 (д, J=12.1 Гц, СН), 131.7, 133.6 (д, J=10.0 Гц, СН), 133.7, 135.0, 150.6, 164.4, 169.6; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.8; Масс спектр (MALDI-TOF), m/z: 525.2 [М-Br]+ (вычислено 605.51:[М]+).
Ацетил(6-бромгексил)салицилат - 2с:
Выход (72%). Маслянистое вещество. ИКС, ν, см-1: 3078, 2938, 2861, 1771 (С=O), 1722 (С=O), 1607, 1580, 1485, 1452, 1368, 1294, 1258, 1196, 1160, 1134, 1083, 1042, 1010, 958, 916, 876, 816, 795, 753, 705. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.4-1.5 (4Н, м, CH2), 1.6-1.7 (2Н, м, CH2), 1.8-1.9 (2Н, м, CH2), 2.3 (3H, с, С(О)CH3), 3.37 (2Н, т, J=6.7 Гц, CH2Br), 4.25 (2Н, т, J=6.6 Гц, С(O)CH2), 7.0 (1Н, д д, J=8, 1.0 Гц, H-Сар), 7.27 (1Н, д д д, J=7.7, 7.7, 1.1 Гц, H-Сар), 7.51 (1H, д д д, J=8, 8, 1.7 Гц, H-Сар), 8.0 (1H, д д, J=7.8, 1.5 Гц, H-Сар, Найдено, %: С 52.3; Н 5.51, Br 23.2. C15H19BrO4, Вычислено, %: С 52.49; Н 5.58, Br 23.28.
Пример 4.
Ацетил(9-трифенилфосфониононил) салицилат бромид - 1d получают аналогично примеру 1 из 0.77 г (2.0 ммоль) соединения 2d, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.15 г (90%). Маслянистое вещество. ИКС, ν, см-1: 3402, 2928, 2857, 1767(С=O), 1719 (С=O), 1670, 1608, 1587, 1485, 1438, 1368, 1296, 1251, 1197, 1159, 1114, 1084, 997, 922, 918, 750, 723, 691. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.2-1.3 (8Н, м, CH2), 1.6-1.7 (6Н, м, CH2), 2.3 (3H, с, С(O)CH3), 3.75 (2Н, м, CH2P), 4.2 (2Н, т, J=6.7 Гц, С(O)CH2), 7.07 (1Н, д д, J=8.0, 0.94 Гц, H-Сар), 7.29 (1Н, д д д, J=7.8, 7.7, 0.75, H-Сар), 7.52 (1Н, д д д, J=8.0, 8.0, 1.7 Гц, H-Сар), 7.6-7.8 (15Н, м, H-Сар), 8.0 (1Н, д д J=7.9, 1.6 Гц, H-Сар), 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 18.5, 20.1, 20.3 (СН2, д, J=48 Гц), 23.3, 26.0, 26.5, 26.5, 27.8 (СН2, д, J=15.5 Гц), 28.4, 62.7, 115.9 (д, J=85.8 Гц, Сипсо), 121.0, 121.2, 123.5, 128.0 (д, J=12.5 Гц, СН), 129.2, 131.1 (д, J=10.0 Гц, СН), 131.2. 132.4 (д, J=2.7 Гц, СН), 148.1, 162.0, 167.1; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.3; Масс спектр (MALDI-TOF), m/z: 567.3 [М-Br]+ (вычислено 646.2:[М]+).
Ацетил(9-бромнонил)салицилат - 2d:
Выход (68%). Маслянистое вещество. ИКС, ν, см-1: 3077, 2930, 2856, 1772 (С=O), 1722 (С=O), 1608, 1579, 1485, 1452, 1368, 1294, 1259, 1195, 1160, 1134, 1082, 1041, 1010, 958, 915, 816, 753, 705. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.3-1.4 (10Н, м, CH2), 1.7-1.8 (2Н, м, CH2), 1.8-1.9 (2Н, м, CH2), 2.3 (3H, с, С(O)CH3), 3.4 (2Н, т, J=6.8 Гц, CH2Br), 4.2 (2Н, т, J=6.7 Гц, С(O)CH2), 7.1 (1Н, д д, J=8, 0.9 Гц, H-Сар), 7.3 (1Н, д д д, J=7.6, 7.6, 1.0 Гц, H-Сар), 7.54 (1Н, д д д, J=8, 8, 1.7 Гц, H-Сар), 8.0 (1Н, д д, J=7.8, 1.65 Гц, H-Сар, Найдено, %: С 55.87; Н 6.51, Br 20.73. C18H25BrO4, Вычислено, %: С 56.11; Н 6.54, Br 20.74.
Пример 5.
Ацетил(10-трифенилфосфониодецил) салицилат бромид - 1е получают аналогично примеру 1 из 0.79 г (2.0 ммоль) соединения 2е, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.25 г (95%). Маслянистое вещество. ИКС, ν, см-1: 3392, 2928, 2856, 1768 (С=O), 1719 (С=O), 1606, 1587, 1485, 1438, 1368, 1294, 1258, 1196, 1161, 1114, 1082, 1041, 1010, 997, 918, 794, 752, 724, 692; 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.2-1.3 (10Н, м, CH2), 1.6-1.7 (6Н, м, CH2), 2.3 (3H, с, С(O)CH3), 3.73 (2Н, м, CH2P), 4.2 (2Н, т, J=6.7 Гц, С(O)CH2), 7.07 (1Н, дд, J=8.0, 0.94 Гц, H-Сар), 7.29 (1Н, д д д, J=7.8, 7.7, 0.75, H-Сар), 7.52 (1Н, д д д, J=8.0, 8.0, 1.7 Гц, H-Сар), 7.6-7.8 (15Н, м, H-Сар), 7.9 (1Н, д д J=7.9, 1.6 Гц, H-Сар), 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 21.0, 22.5 (СН2, д, J=52.5 Гц), 22.7, 25.8, 28.6, 29.1, 29.3, 30.3 (СН2, д, J=15.3 Гц), 65.2, 118.4 (д, J=85.7 Гц, Сипсо), 123.5, 123.7, 126, 130.5 (д, J=12.4 Гц, СН), 131.7, 133.7 (д, J=9.4 Гц, СН), 135, 135, 150.6, 164.5, 169.6; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.9; Масс спектр (MALDI-TOF), m/z: [М-Br]+ (вычислено 660.2:[М]+).
Ацетил(10-бромдецил)салицилат - 2е:
Выход (65%). Маслянистое вещество. ИКС, ν, см-1: 3078, 2930, 2855, 1772 (С=O), 1722 (С=O), 1608, 1485, 1452, 1368, 1294, 1258, 1196, 1160, 1134, 1082, 1041, 1010, 958, 915, 816, 752, 704. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.3-1.4 (12Н, м, CH2), 1.7-1.8 (2Н, м, CH2), 1.8-1.9 (2Н, м, CH2), 2.3 (3H, с, С(O)CH3), 3.4 (2Н, т, J=6.8 Гц, CH2Br), 4.2 (2Н, т, J=6.7 Гц, С(O)CH2), 7.1 (1H, д д, J=8.0, 1.0 Гц, H-Сар), 7.3 (1Н, д д д, J=7.6, 7.6, 1.0 Гц, H-Сар), 7.57 (1Н, д д д, J=8, 8, 1.7 Гц, H-Сар), 8.0 (1Н, д д, J=7.8, 1.7 Гц, H-Сар, Найдено, %: С 57.0; Н 6.78, Br 20.0. C19H27BrO4, Вычислено, %: С 57.15; Н 6.82, Br 20.01.
Пример 6.
4-трифенилфосфониобутилсалицилат бромид - 1f получают аналогично примеру 1 из 0.54 г (2.0 ммоль) соединения 2f, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 0.96 г (90%). Маслянистое вещество. ИКС, ν, см-1: 3353, 1664, 1610, 1484, 1439, 1396, 1328, 1298, 1248, 1222, 1159, 1113, 771, 751, 723, 691; 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.7-1.8 (2Н, м, CH2), 2.1-2.3 (2Н, м, CH2), 3.9-4.0 (2Н, м, CH2P), 4.4 (2Н, т, J=6 Гц, С(O)CH2), 6.8 (1Н, д д д, J=7.5, 7.6, 1 Гц, H-Сар), 6.9 (1Н, д д, J=8.3, 0.6, H-Сар), 7.4 (1Н, д д д, J=13, 1.2, 1.7 Гц, H-Сар), 7.6 (1Н, д д J=8, 1.6 Гц, H-Сар), 7.6-7.9 (15Н, м, H-Сар), 10.6 (ОН); 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 19.1 (СН2, д, J=3.8 Гц), 22.1 (СН2, д, J=50.8 Гц), 28.9 (СН2, д, J=16.9 Гц), 63.9, 112.2, 117.5, 118.5 (д, J=86 Гц, Сипсо), 119.1, 129.7, 130.5 (д, J=12.5 Гц, СН), 133.6 (д, J=10 Гц, СН), 135.0 (д, J=3 Гц, СН), 135.7, 161.5, 169.9; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.6; Масс спектр (MALDI-TOF), m/z: 455.11 [М-Br]+ (вычислено 534.1:[М]+).
4-бромбутилсалицилат - 2f:
Выход (78%). Маслянистое вещество. ИКС, ν, см-1: 3187, 2962, 2924, 2851, 1675 (С=O), 1614, 1586, 1468, 1469, 1395, 1326, 1302, 1250, 1215, 1158, 1138, 1092, 1033, 867, 801,758, 701. 1H ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.9-2.0 (4Н, м, CH2), 3.5 (2Н, т, J=6.5 Гц, CH2Br), 4.4 (2Н, т, J=6.0 Гц, С(O)CH2), 6.9 (1Н, д д д, J=8.0, 8.0, 1.0 Гц, H-Сар), 7.0 (1Н, д д, J=8.4, 0.8 Гц, H-Сар), 7.5 (1H, д д д, J=7.8, 7.8, 1.7 Гц, H-Сар), 7.8 (1Н, д д, J=8.0, 1.7 Гц, H-Сар, Найдено, %: С 48.24; Н 4.80, Br 28.74. C11H13BrO3, Вычислено, %: С 48.37; Н 4.80, Br 29.26.
Пример 7.
5-трифенилфосфониопентилсалицилат бромид - 1g получают аналогично примеру 1 из 0.57 г (2.0 ммоль) соединения 2g, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.0 г (92%). Маслянистое вещество. ИКС, ν, см-1: 3185, 2941, 2865, 1673, 1614, 1586, 1486, 1400, 1326, 1302, 1251, 1215, 1158, 1138, 1090, 1033, 954, 866, 801, 758, 731, 702, 667; 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.7 (2Н, м, CH2), 1.8 (4Н, м, CH2), 3.9 (2Н, м, CH2P), 4.3 (2Н, т, J=5.7 Гц, С(O)CH2), 6.8 (1Н, д д д, J=8.0, 8.0, 0.9 Гц, H-Сар), 6.9 (1Н, д д, J=8.3, H-Сар), 7.4 (1Н, д д д, J=7.8, 7.8, 1.7 Гц, H-Сар), 7.6 (1H, д д J=8, 1.6 Гц, H-Сар), 7.4-7.9 (16Н, м, H-Сар), 10.7 (ОН); 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 22.3, 22.9 (СН2, д, J=50.0 Гц), 26.8 (СН2, д, J=16.1 Гц), 28.1, 64.8, 112.5, 117.4, 118.8 (д, J=85.8 Гц, Сипсо), 119.2, 129.9, 130.5 (д, J=12.5 Гц, СН), 133.8 (д, J=10 Гц, СН), 135.0 (д, J=3 Гц, СН), 135.6, 161.6, 170.1; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 24.6; Масс спектр (MALDI-TOF), m/z: 469.0 [М-Br]+ (вычислено 549.4: [М]+).
5-бромпентилсалицилат - 2g:
Выход (75%). Маслянистое вещество. ИКС, ν, см-1: 3185, 2941, 2865, 1673 (С=O), 1614, 1586, 1486, 1467, 1400, 1326, 1302, 1251, 1215, 1158, 1138, 1091, 1033, 954, 866, 801, 758, 702. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.6-1.7 (2Н, м, CH2), 1.8-1.9 (2Н, м, CH2), 1.9-2.0 (2Н, м, CH2), 3.4 (2Н, т, J=6.7 Гц, CH2Br), 4.3 (2Н, т, J=6.5 Гц, С(O)CH2), 6.8 (1Н, д д д, J=8.0, 8.0, 1.0 Гц, H-Сар), 7.0 (1Н, д д, J=8.3, 0.8 Гц, H-Сар), 7.5 (1Н, д д д, J=7.8, 7.8, 1.7 Гц, H-Сар), 7.8 (1Н, д д, J=8.0, 1.7 Гц, H-Сар, Найдено, %: С 49.75; Н 5.25, Br 27.64. C12H15BrO3, Вычислено, %: С 50.19; Н 5.27, Br 27.83.
Пример 8.
9-трифенилфосфониононилсалицилат бромид - 1h получают аналогично примеру 1 из 0.68 г (2.0 ммоль) соединения 2h, 15 мл ацетонитрила и 1.57 г (6.0 ммоль) трифенилфосфина. Выход 1.02 г (85%). Маслянистое вещество. ИКС, ν, см-1: 3386, 2927, 2856, 1670, 1613, 1587, 1485, 1466, 1438, 1397, 1327, 1300, 1249, 1216, 1159, 1114, 1091, 1031, 996, 751, 723, 691; 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.2-1.3 (10Н, м, CH2), 1.6-1.7 (4Н, м, CH2), 3.7 (2Н, м, CH2P), 4.3 (2Н, т, J=6.6 Гц, С(O)CH2), 6.8 (1Н, д д, J=7.8, 7.3, Гц, H-Сар), 6.9 (1Н, д, J=8.3, Гц, Н-Сар), 7.4 (1Н, д д, J=7.2, 7.2, Гц, H-Сар), 7.6-7.8 (17Н, м, H-Сар), 10.7 (ОН); 13С ЯМР (CDCl3, 100.6 МГц) δC, м.д.: 22.6, 23.0 (СН2, д, J=50 Гц), 25.8, 28.4, 29.0, 30.3 (СН2, д, J=15.5 Гц), 65.4, 112.6, 117.4, 118.3 (д, J=85.8 Гц, Сипсо), 119.1, 129.9, 130.5 (д, J=12.5 Гц, СН), 132.0, 133.6 (д, J=10 Гц, СН), 135.0 (д, J=3 Гц, СН), 135.5, 161.5, 170.2; 31Р ЯМР (CDCl3, 162 МГц) δP, м.д.: 25.3; Масс спектр (MALDI-TOF), m/z: 525.2 [М-Br]+ (вычислено 605.6:[М]+).
9-бромнонилсалицилат - 2h:
Выход (70%). Маслянистое вещество. ИКС, ν, см-1: 3181, 2930, 2856, 1674 (С=O), 1614, 1586, 1486, 1467, 1396, 1326, 1302, 1251, 1214, 1187, 1158, 1138, 1091, 1033,954, 758, 702. 1Н ЯМР (CDCl3, 400 МГц) δ, м.д.: 1.3-1.4 (10Н, м, CH2), 1.7-1.9 (2Н, м, CH2), 3.4 (2Н, т, J=6.8 Гц, CH2Br), 4.3 (2Н, т, J=6.6 Гц, С(O)CH2), 6.9 (1Н, д д д, J=8.0, 8.0, 1.0 Гц, H-Сар), 7.0 (1Н, д д, J=8.3, 0.8 Гц, H-Сар), 7.5 (1Н, д д д, J=7.8, 7.8, 1.7 Гц, H-Сар), 7.9 (1Н, д д, J=8.0, 1.7 Гц, H-Сар, Найдено, %: С 55.57, Н 6.65, Br 23.11. C16H23BrO3, Вычислено, %: С 55.99, Н 6.75, Br 23.28.
Биологическая активность заявляемых соединений.
Антибактериальная активность соединений формулы 1.
При изучении антибактериальной активности использовались бактерии музейных штаммов из коллекции АТСС грамотрицательных и грамположительных бактерий Е. coli АТСС 25922, S. aureus АТСС 29213. Бактериостатическую активность определяют методом серийных разведений в среде Мюллера-Хинтона (Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; Approved standard M7-A4, 9th ed.; Clinical and Laboratory Standards Institute: Wayne, 1997; Vol. 26, pp. 9-16). Стерильные серийно разведенные растворы соединений смешивают с бактериальными инокулятами в 96-луночном планшете, инкубируют 24 часа при 37°С при умеренном перемешивании и определяют минимальную ингибирующую концентрацию (МИК). За МИК принимают минимальную концентрацию исследуемого соединения, обеспечивающую полное подавление видимого роста исследуемого штамма. Также применяют модифицированный метод, в котором используется среда, дополненная индикатором. Рост микроорганизмов сопровождается изменением рН среды и, соответственно, окраски индикатора. В работе используют феноловый красный (0.018 г/л). В качестве отрицательного контроля используют чистую питательную среду, положительным контролем служит инокулюм без испытуемого соединения. В качестве препаратов сравнения выбраны ацетилсалициловая кислота, ацетил(6-бромгексил)салицилат, ципрофлоксацин, амикацин и цефтазидин. Результаты исследований представлены в таблице 2.
Результаты показывают, что ТФФ-группа существенно повышает бактериостатическую активность соединений по сравнению с ацетилсалициловой кислотой и ацетил(6-бромгексил)салицилатом в отношении грамположительных бактерий S. aureus.
Данные таблицы 2 иллюстрируют, что в случае S. aureus заявляемые соединения формулы 1 проявляют антибактериальную активность в 32-510 раз выше по сравнению с препаратом сравнения - ацетилсалициловой кислотой и в 16-255 раз по сравнению с препаратом сравнения - ацетил(6-бромгексил)салицилатом. При этом бактериостатическая активность заявляемых соединений возрастает с увеличением длины линкера (до 10 атомов углерода): для фосфониевых солей ацетилсалициловой кислоты 1а-1е значение минимальной ингибирующей концентрации (МИК) уменьшается с 15.6 мкМ до 0.98 мкМ, и для фосфониевых солей салициловой кислоты 1f-1h - с 7.8 мкМ до 3.9 мкМ.
Для грамотрицательных бактерий Е. coli подобного эффекта ТФФ-группы не наблюдалось.
Для сравнительного анализа антибактериальной активности было определено значение минимальной ингибирующей концентрации (МИК) для известных антибиотиков, как ципрофлоксацин (1.5 мкМ), амикацин (0.8 мкМ) и цефтазидим (14.3 мкМ). Данные таблицы 2 свидетельствуют, что соединения-лидеры 1d и 1е проявляют в отношении грамположительных бактерий S. aureus антибактериальную активность на уровне амикацина, по сравнению с ципрофлоксацином - выше в 1.5 раза, а по сравнению с цефтазидимом - в 14.6 раз. Все заявленные соединения формулы 1 проявляют антибактериальную активность на уровне или более высокую по сравнению с цефтазидимом (14.3 мкМ): для 1а и 1b МИК=15.6 мкМ, для 1c, 1f, 1g МИК=7.8 мкМ (примерно в 2 раза), для 1h МИК=3.9 мкМ (примерно в 6.7 раз).
Таким образом результаты таблицы 2 показывают, что выбранные производные ацетилсалициловой и салициловой кислот формулы 1 проявляют подобную или более высокую антибактериальную активность по сравнению с препаратами сравнения, включая антибиотики различных семейств, такие как фторхинолоны (ципрофлоксацин), аминогликозиды (амикацин) и бета-лактамы (цефтазидим).
Бактерицидную активность соединений оценивают по МБК -минимальной бактерицидной концентрации (Barry A.L., Craig W.A., Nadler H., et al. Methods for determining bactericidal activity of antimicrobial agents: approved guideline / Clinical and Laboratory Standards Institute - 1999. - V. 26). Для определения МБК выполняют те же операции, что и при определении МИК в жидкой среде. Через 24 часа после культивирования бактерий с соединениями, отбирают аликвоту из каждой лунки, в которых не наблюдался рост бактерий. Аликвоту высевают на чашки Петри с агаризованной питательной средой в асептических условиях. После 24-часовой инкубации анализируют наличие бактериальных колоний и определяют число колониеобразующих единиц (КОЕ). МБК представляет собой минимальную концентрацию препарата, при которой не происходит роста бактерий на твердой среде. На практике отсутствие колоний означает, что число КОЕ уменьшается на 99.9% (Konate K., Mavoungou J.F., Lepengue A.N., et al. Antibacterial activity against beta-lactamase producing Methicillin and Ampicillin-resistants Staphylococcus aureus: Fractional Inhibitory Concentration Index (FICI) determination / Ann. Clin. Microbiol. Antimicrob. 2012, V. 11, P. 18).
Значения МБК для соединения-лидера Id составляет для штамма бактерий Е. coli 125 мкМ, для S. aureus - 2 мкМ.
Сопоставление бактериостатического и бактерицидного эффекта препарата указывает на механизм его действия (Kohanski М.А., Dwyer D.J., Hayete В., et al. A common mechanism of cellular death induced by bactericidal antibiotics, Cell, 2007, 130, 797-810). Так, бактериостатический агент предотвращает рост бактерий (т.е. он удерживает их в стационарной фазе роста), а бактерицидный уничтожает бактерии. Считается, что препарат обладает бактерицидным механизмом действия, если отношение МБК к МИК ≤ 4. Фактор МБК к МИК для 1d в отношении Е. coli равен 1, для S. aureus 2. Таким образом установлено, что 1d оказывает бактерицидное действие на исследуемые грамположительные бактерии, так как фактор МБК к МИК составляет 2 (Peterson L.R., Shanholtzer C.J. Tests for bactericidal effects of antimicrobial agents: technical performance and clinical relevance, Clinical microbiology reviews, 1992, 420-432). Следует отметить, что столь низкие отношения МБК к МИК встречаются у антибактериальных соединений достаточно редко. Это дополнительно указывает на высокую бактерицидную активность исследуемых соединений. Можно предположить, что подобная активность обусловлена, в том числе, мицеллообразующими, мембраноповреждающими и проникающими свойствами фосфониевых солей формулы 1. Антиоксидантная активность заявляемых соединений Для наглядной демонстрации изученной антиоксидантной активности соединений приведены данные для соединения-лидера 1d.
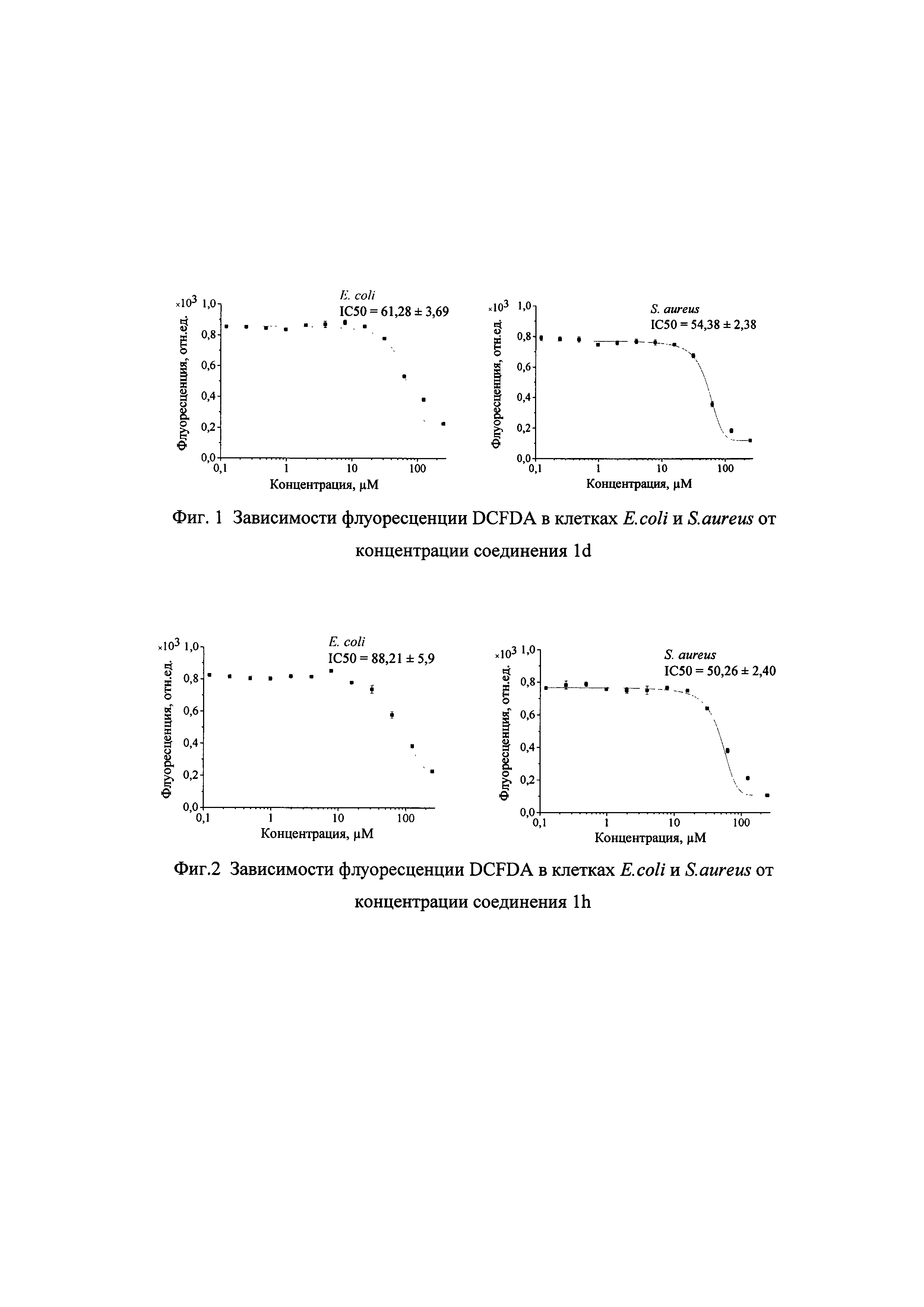
Антиоксидантные свойства соединения Id оценивают с использованием микропланшетного анализатора Infinite М200 PRO microplate analyzer (TECAN). Уровень АФК детектируют с использованием флуоресцентного зонда DCFDA (5 мкМ) при λex=488 нм и λem=535 нм (Akhmadishina, R.A., Kuznetsova, E.V., Sadrieva, G.R., et al. Glutathione salts of O,O-diorganyl dithiophosphoric acids: synthesis and study as redox modulating and antiproliferative compounds. Peptides, 2018, 99, 179-188). Ночную культуру E.coli и S. aureus центрифугируют 15 мин при 4000 об/мин 4°С. Надосадок удаляют пипеткой, а осадок разбавляют раствором PBS 1х до концентрации 10×108 кл/мл и 15×108 кл/мл для Е. coli и S. aureus соответственно. В качестве индикатора добавляют DCFDA, конечная концентрация которого составляет 50 мкМ. Пробы инкубируют 1 час в термостате при 37°С, 50 об/мин. После инкубации пробы центрифугируют двукратно при 4000 об/мин в течение 10 мин при 4°С для максимального удаления DCFDA, который не проник в клетку (все процедуры проводят на льду). Клеточный осадок ресуспендируют в PBS 1х, потом раскапывают по 94 мкл в 96-луночные планшеты, в которых уже предварительно серийно развели по 5 мкл с 0.1 до 250 мкМ и 1 мкл индуктор-SO1 (конечная концентрация 100 мкМ). Планшеты инкубируют в темном месте при 37°С. После 1 часа инкубации немедленно измеряют флуоресценцию индикатора. На фигуре 1 и 2 приведены зависимости флуоресценции DCFDA в клетках E. coli и S. aureus от концентрации для соединений 1d и 1h соответственно. Установлено, что фосфониевая соль ацетилсалициловой кислоты 1d (фигура 1) и фосфониевая соль салициловой кислоты 1h (фигура 2) ингибируют флуоресценцию индикатора в бактериях с полумаксимальной концентрацией 62 мкМ (Е. coli), 54.3 мкМ (S. aureus) для соединения 1d и 88.2 мкМ (Е. coli), 50.2 мкМ (S. aureus) для соединения 1h, что свидетельствует об их антиоксидантной активности.
Оценка цитотоксичности заявленных соединений
Оценка цитотоксичности приведена на примере соединения 1d in vitro (МТТ-тест) (Tsepaeva, O.V., Nemtarev, A.V., Abdullin, T.I., et al. Design, synthesis, and cancer cell growth inhibitory activity of triphenylphosphonium derivatives of the triterpenoid betulin. J. Nat. Prod., 2017, 80, 2232-2239) для фибробластов кожи человека (HSF).
Для оценки цитотоксичности соединения 1d определяют параметр IC50 - полумаксимальной ингибирующей концентрации, при которой рост клеток в культуре подавляется на 50 процентов. Исходный раствор соединения 1d готовят в ДМСО. Клетки HSF культивируют в присутствии соединения 1d в концентрационном диапазоне от 2 нМ до 12.5 мкМ в течение 72 часов. Жизнеспособность клеток представлена относительно контрольных клеток, культивировавшихся без соединения 1d (100%). Полумаксимальная ингибирующая концентрация (IC50) вычислялась на основании зависимости жизнеспособности клеток от концентрации с помощью программного пакета OriginPro (Kamalov, M.I., Dang, Т., Petrova, N.V., et al. Self-assembled nanoformulation of methylprednisolone succinate with carboxylated block copolymer for local glucocorticoid therapy. Colloids and Surf. В Biointerfaces, 2018, 164, 78-88). Результаты показывают, что значение IC50 соединения 1d для фибробластов кожи человека (HSF) составляет 4.9±0.5 мкМ. По сравнению со значением МИК по отношению к грамположительным бактериям S. aureus (0,98 мкМ), полумаксимальная ингибирующая концентрация 1d для HSF оказалась в 5 раз выше. Таким образом, фосфониевые соли салициловой и ацетилсалициловой кислот формулы 1 обладают пониженной цитотоксичностью для фибробластов кожи человека по сравнению с грамположительными бактериями.
Таким образом, предложены новые антибактериальные средства - фосфониевые соли на основе салициловой и ацетилсалициловой кислот, обладающие одновременно антиоксидантной активностью, при этом не оказывающие токсического воздействия на организм и расширяющие ассортимент известных лекарственных средств указанного назначения.
Заявляемые новые соединения в связи с установленной их высокой антибактериальной и антиоксидантной активностью, низкой токсичностью представляет интерес как новый антибактериальный препарат мультитаргетного действия.
Предлагаемый способ получения заявляемых соединений является простым и позволяет в мягком режиме получать целевые соединения с выходом 85-95%.