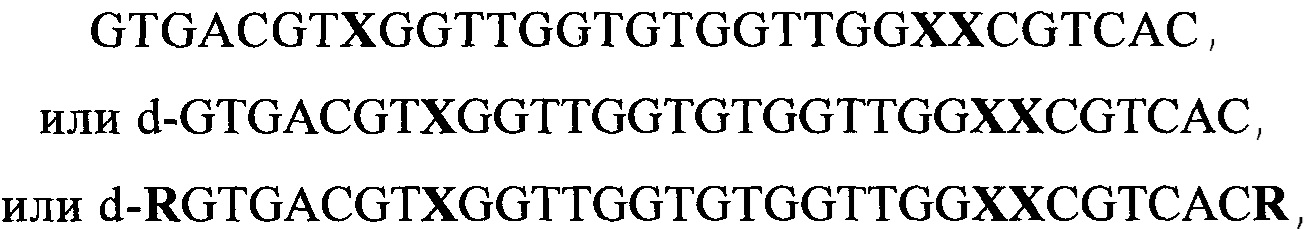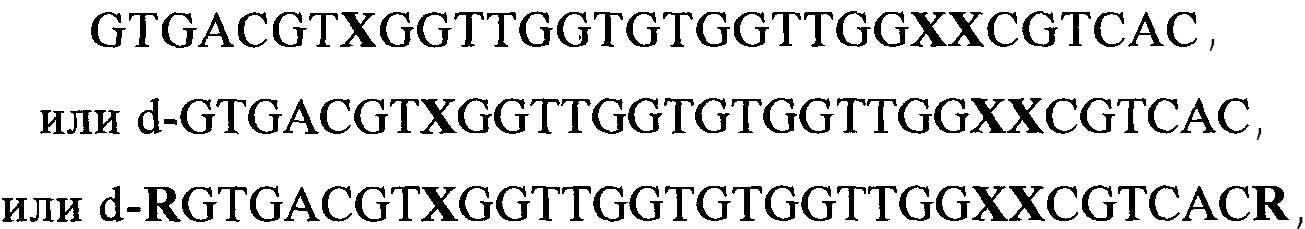Результат интеллектуальной деятельности: ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ
Вид РИД
Изобретение
Область техники
Изобретение относится к области нанобиотехнологии и молекулярной медицины и касается ДНК аптамеров к экзосайту I тромбина, активно взаимодействующих с протромбином. Данные соединения могут быть использованы для создания медицинских препаратов, останавливающих внутрисосудистое тромбообразование.
Уровень техники
Как известно, формирование внутрисосудистого тромба вызывает серьезные заболевания, такие как инфаркт миокарда, ишемический инсульт и другие. В настоящее время в клинической практике для профилактики и лечения тромбозов используются три класса лекарств, с различным механизмом действия: (1) антикоагулянты - лекарства, влияющие на свертываемость крови путем ингибирования образования фибрина (гепарин и его производные, непрямые антикоагулянты, прямые ингибиторы тромбина); (2) тромболитики - препараты, способствующие растворению уже образовавшегося тромба (стрептокиназа, урокиназа и др.) и (3) антиагреганты - препараты, ингибирующие агрегацию тромбоцитов (например, аспирин) [Федеральное руководство по использованию лекарственных средств. Выпуск X, (Чучалин А.Г., Белоусов Ю.Б., Яснецов В.В. ред.) Министерство здравоохранения и социального развития Российской федерации, Фонд «Здоровье», Москва, 2009, стр. 63-78 и 137-150].
Нарушения гемостаза, включающие развитие внутрисосудистого тромбообразования, связано с тромбином. Тромбин - это главный протеолитический фермент системы гемостаза, образующийся из своего неактивного предшественника протромбина в результате воздействия активированного фактора X. Протромбин вырабатывается печенью в количестве, приблизительно, 3 мкМ, но он не обладает протеолитической активностью, как тромбин [Панченко Е.П., Добровольский Ф.Б. Тромбозы в кардиологии. Механизмы развития и возможности терапии, 1999, Москва, Спорт и культура, с. 5-6, 25, 38, 40, 41, 56, 464].
Структура протромбина изучена неполностью, лишь с помощью методов белковой химии. Показано, что расщепление двух связей при Арг271 и Арг320 в протромбине переводят его в промежуточные продукты: мейзотромбин, претромбин-2, фрагменты 1+2, порядок и образование которых зависит от условий, в которых протекает гидролиз. В растворе в условиях дефицита витамина К вначале гидролизуется связь Арг271-Тре272 с образованием фрагмента 1+2 и претромбина-2. Изолированный претромбин-2 активируется значительно медленнее, чем протромбин. В присутствии витамина К первой расщепляется связь Арг320-Илей321, и промежуточным продуктом является мейзотромбин, в котором две половины исходной молекулы связаны дисульфидным мостиком. Мейзотромбин обладает только одной протеолитической активностью, активируя протеин С и является мощным вазоконстриктором, т.е. молекулой, которая вызывает сужение кровеносных сосудов и уменьшение кровотока в них. Мейзотромбин не обладает прокоагулянтной активностью тромбина и не активируется антитромбином III. Включение протромбина в протромбиназный комплекс необходимо для быстрой генерации тромбина в местах повреждения сосудов. Протромбин связывается непосредственно с анионными поверхностями фосфолипидной мембраны, где он взаимодействует с ферментом, фактором Ха и его кофактором, фактором Va. Тромбин катализирует две реакции, играющие ключевую роль в процессе остановки кровотечений (гемостаза) и внутрисосудистого тромбообразования - превращение фибриногена в фибрин, а также активацию и агрегацию тромбоцитов, содержащих на своей поверхности PAR (Protease Activated Receptor - рецепторы активируемые протеазами), которые акцептируют тромбин [Lane DA, Philippou Н, Huntington JA, Directing thrombin Blood, 2005, 106: 2605-2612]. Антикогаулянтные препараты, относящиеся к классу прямых ингибиторов тромбина, блокируют только активный центр (дабигатран и аргатробан), либо активный центр и экзосайт I (бивалирудин) [Arsenault KA, Hirsh J, Whitlock RP, Eikelboom JW, Direct thrombin inhibitors in cardiovascular disease, Nat RevCardiol, 2012, 9: 402-414]. Известные на сегодня ингибиторы тромбина относятся к классу антикоагулянтов. Отмечается, что их крупным недостатком является взаимодействие не только с экзосайтом I, но и с активным центром тромбина. Поэтому они могут подавлять не только прокоагулянтные, но и антикоагулянтные реакции тромбина.
Новое направление в создании лекарств на основе нуклеиновых кислот привело к развитию системы селекции небольших молекул ДНК, обладающих уникальной третичной структурой и биологическими свойствами. [Sun Н, Zu Y, Aptamers and their applications in nanomedicine, Small, 2015, 11: 2352-2364; Lee JF, Stovall GM, Ellington AD, Aptamer therapeutics advance, Current Opinion in Chemical Biology, 2006, 10:282-289].
Аптамеры - это короткие однонитевые фрагменты ДНК, которые селектируют на выбранные белковые мишени. Был разработан метод селекции (СЕЛЕКС), позволяющий выделять целевые молекулы нуклеиновых кислот, из большого набора (более 1015) индивидуальных молекул, называемого комбинаторной библиотекой [Tuerk С, Gold L, Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase, Science, 1990, 249: 505-510; Ellington AD, Szostak JW, In vitro selection of RNA molecules that bind specific ligands, Nature, 1990, 346: 818-8224-5]. Некоторые аптамеры могут не только узнавать свои мишени, но и ингибировать их биологическую активность.
В основе узнающей способности аптамера к молекуле мишени лежит его пространственная структура, которая позволяет аптамеру, подобно белковому антителу, узнавать эпитоп на поверхности белка. В последние годы аптамеры рассматривают как потенциальные фармакологические субстанции, которые могут быть использованы для разработки лекарственных препаратов. Аптамеры по специфичности и аффинности взаимодействия с молекулами мишенями не уступают моноклональным антителам. Как фармакологические соединения, они имеют ряд существенных преимуществ перед антителами. Аптамеры неиммуногенны, их можно производить с помощью химического синтеза, не используя биологических продуцентов, а кроме того для аптамерных препаратов достаточно легко создаются антидоты (на основе комплементарных последовательностей) для срочной блокады возможных нежелательных побочных реакций [Rusconi СР., Yeh A., Lyerly Н.K., et al. Blocking the initiation of coagulation by RNA aptamers to factor Vila, Thromb Haemost, 2000, 84: 841-848; Rusconi CP, Roberts JD, Pitoc GA, Nimjee SM, White RR, Quick GJr, Scardino E, Fay WP, Sullenger В A, Antidote-mediated control of an anticoagulant aptamer in vivo, 2004, Nat. Biotechnol., 22: 1423-1428].
ДНК-аптамеры образуют специфический комплекс с тромбином, ингибируя его избыточную активность, тем самым замедляя и даже приостанавливая образование тромбов. Взаимодействие аптамеров с другими белками каскада свертывания крови пока не изучены. Важным является изучение взаимодействия аптамеров с предшественником тромбина - протромбином. В литературе мало сведений о связывании аптамеров с протромбином [Kretz С A, Stafford AR, Fredenburgh JC, Weitz JI, HD1, a Thrombin-directed Aptamer, Binds Exosite 1 on Prothrombin with High Affinity and Inhibits Its Activation by Prothrombinase, JBC, 2006, 281 (49): 37477-37485; Spiridonova VA, Barinova KV, Glinkina KA, Melnichuk AV, Gainutdynov AA, Safenkova IV, Dzantiev BB, A family of DNA aptamers with varied duplex region length that forms complexes with thrombin, 2015, FEBS Lett., 589 (16):2043-2049]. Нужно отметить, что структура тромбина изучена методом рентгеноструктурного анализа и доказано существование районов связывания ингибиторов как в области фибриноген-связывающего сайта, так и по гепарин-связывающему сайту. Структура протромбина не установлена рентгеноструктурным анализом, и точное расположение сайтов I и сайта II для нее неизвестно. Методами белковой химии установлено, что экзосайт II (гепариновый) полностью закрыт, а экщзосайт I открыт частично. Попытка установить возможность связывания ДНК-аптамеров с протромбином позволит снизить в будущем дозы вводимого терапевтического агента, что, в свою очередь, сместит равновесие реакции образования тромбина из протромбина в сторону неактивной формы белка. Известны ингибиторы тромбообразования, которые взаимодействуют с тромбином, но нет сведений о их взаимодействии с протромбином. Следовательно, при ингибировании протромбина возможно использование меньшей дозировки лекарственного препарата, что облегчит нагрузку на выводящую систему организма. Например, в заявке на изобретение №2009146170/10 от 15.12.2009 рассматривается аптамер RE31, который связывается с тромбином, но нет данных о его комплексообразовании с протромбином.
В публикации Kretz С.А. е.а. [Kretz СА, Stafford AR, Fredenburgh JC, Weitz JI, HD1, a Thrombin-directed Aptamer, Binds Exosite 1 on Prothrombin with High Affinity and Inhibits Its Activation by Prothrombinase, JBC, 2006, 281 (49): 37477-37485] было исследовано взаимодействие 15-звенного аптамера HD22 (15ТВА) с протромбином в комплексе с протромбиназой. Был сделан вывод, что экзосайт I на протромбине существует, но в частичноизмененном виде. Для аптамеров второго поколения, которые включают как G-квадруплексную, так и дуплексную структуры, сродство к экзосайту I. резко возрастает в сравнении с аптамером 15ТВА, что указывает на дополнительные участки связывания аптамера с белком. В заявке на изобретение №2012110221/10 от 17.08.2010 приведены структуры аптамеров к белку, называемому ингибитором тканевого пути (TAFI). Этот аптамер имеет сложную структуру и влияет на процесс свертывания крови тем, что взаимодействует с TAFI и блокирует его функцию, но точных данных о его взаимодействии с другими белковыми факторами не представлены.
Одно из направлений, связанное с возможностью фармакологического использования аптамеров - создание на их основе антитромботических препаратов. В частности, можно использовать аптамеры для подавления протромботических реакций тромбина. В отличие от известных антикоагулянтов - прямых ингибиторов тромбина и, в том числе, ингибитора для внутривенного введения - бивалирудина, ДНК-аптамеры не действуют на активный центр тромбина, а взаимодействуя с экзосайтом I, блокируют его связывание с субстратами (фибриноген, клеточные рецепторы тромбина и др.).
Раскрытие изобретения
Задачей изобретения является поиск эффективных средств ингибирования тромбообразования через протромбин - предшественника тромбина - с помощью ДНК аптамеров (олигонуклеотидов).
Сущность настоящего изобретения заключается в создании ДНК-аптамеров (олигонуклеотидов), обладающих антикоагулянтными свойствами, эффективно связывающихся с протромбином, отвечающих общей формуле (1):
GTGACGTXGGTTGGTGTGGTTGGXXCGTCAC (1),
где X выбирают из числа четырех нуклеотидов А или G или С или Т.
Предпочтительно олигонуклеотид к экзосайту I тромбина, характеризуется следующей нуклеотидной последовательностью (2), включающей формулу (1):
d-RGTGACGTXGGTTGGTGTGGTTGGXXCGTCACR (2)
или
d-GTGACGTXGGTTGGTGTGGTTGGXXCGTCAC (3)
где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - заместитель, выбранный из NH2 группы и/или PEG, при этом в качестве заместителей используют аминогексанол (ИНг-группа), который этерифицирует фосфатную группу на 5'- и/или 3'-конце и/или PEG, который присоединяют по 5'- и/или 3'-концу. При этом как минимум один из присоединенных по 5'- и/или 3'-концу заместителей представляет собой полиэтиленгликоль (PEG).
Ниже представлены возможные варианты реализации структуры аптамеров RE8G, RE24A, RE25A, RE8Gm, RE24Am, RE25Am:
RE8G: d-GTGACGTGGGTTGGTGTGGTTGGGGCGTCAC
RE24A: d-GTGACGTAGGTTGGTGTGGTTGGAGCGTCAC
RE25A: d-GTGACGTAGGTTGGTGTGGTTGGGACGTCAC
RE8Gm: d-CACTGGTGGGTTGGTGTGGTTGGGGCCAGTG
RE24Am: d-CACTGGTAGGTTGGTGTGGTTGGAGCCAGTG
RE25Am: d-CACTGGTAGGTTGGTGTGGTTGGGACCAGTG
Технический результат изобретения - синтез ДНК аптамеров (олигонуклеотидов), которые связываются с протромбином, замедляя процесс перехода протромбина в тромбин, тем самым снижая концентрацию тромбина в кровотоке.
Краткое описание чертежей
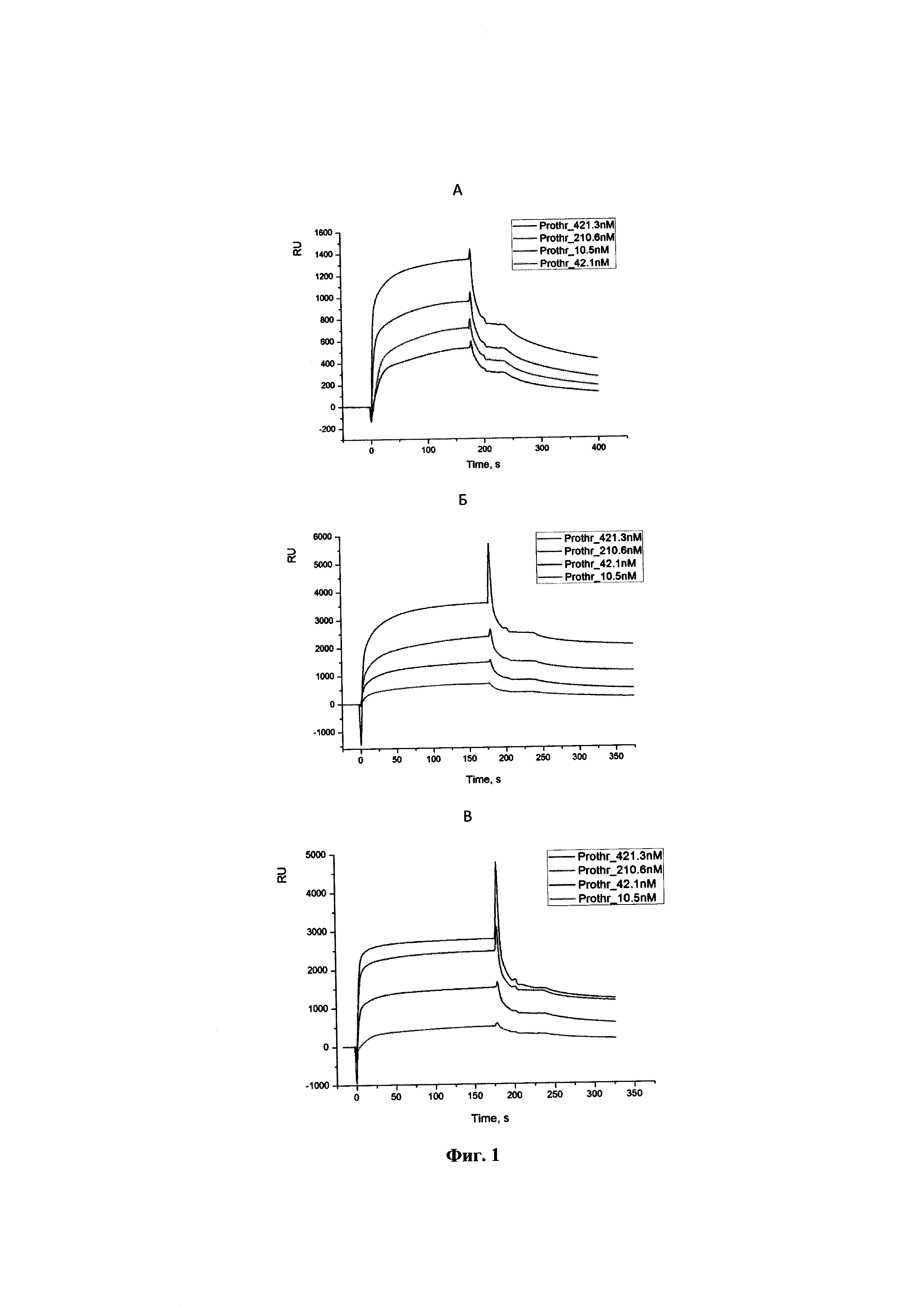
На фиг. 1 приведены сенсограммы образования комплекса протромбина с аптамерами RE8G (A), RE24A (Б), RE25A (В), которые были иммобилизованы на поверхности чипов Sensor Chip SA за счет образования комплекса биотин:стрептавидин. Буфер 20 mM HEPES-KOH, рН=7,2, 140 mM NaCl, 5 mM KCl.
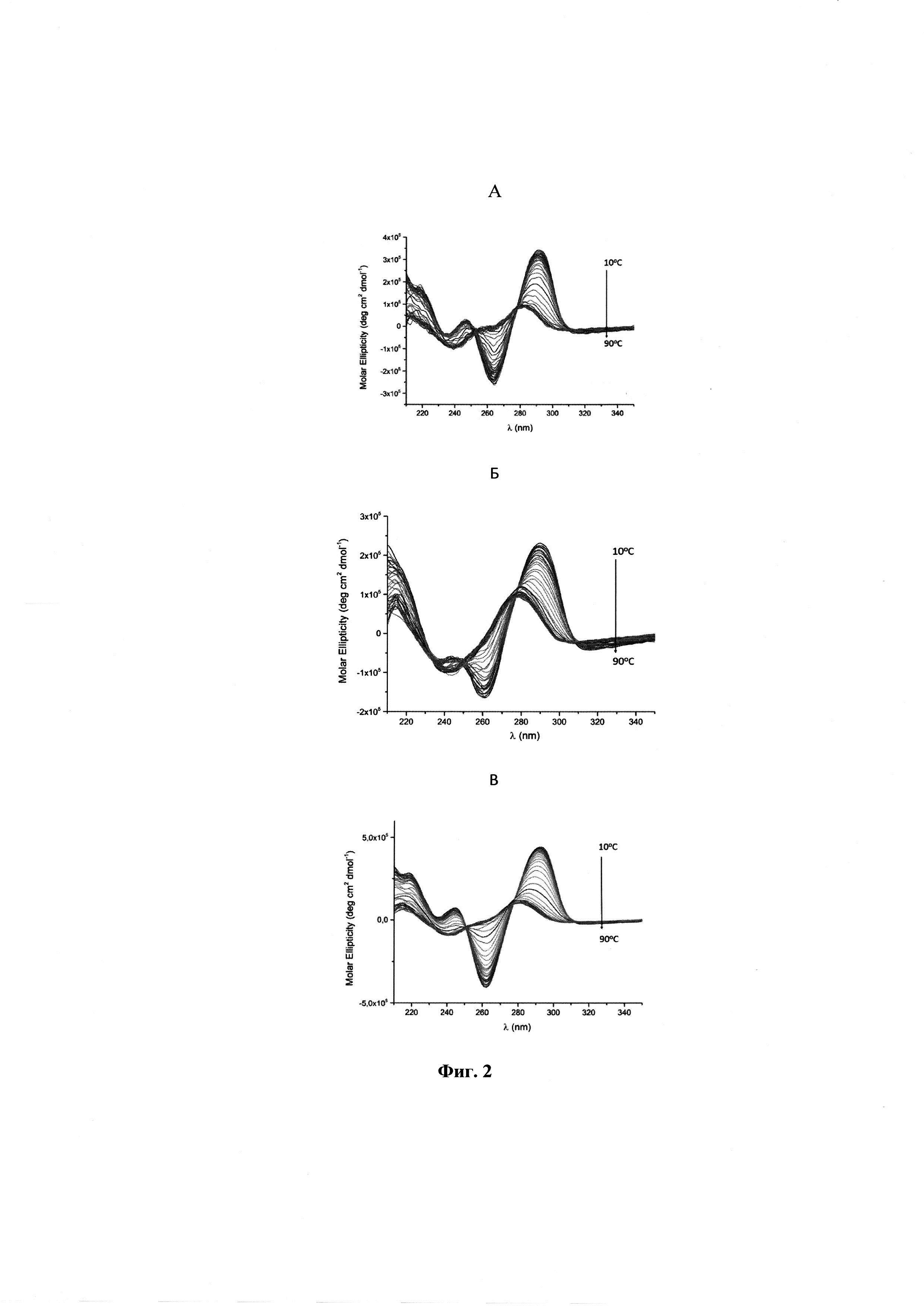
На фиг. 2 приведены спектры кругового дихроизма аптамеров RE8G (A), RE24A (Б), RE25A (В).
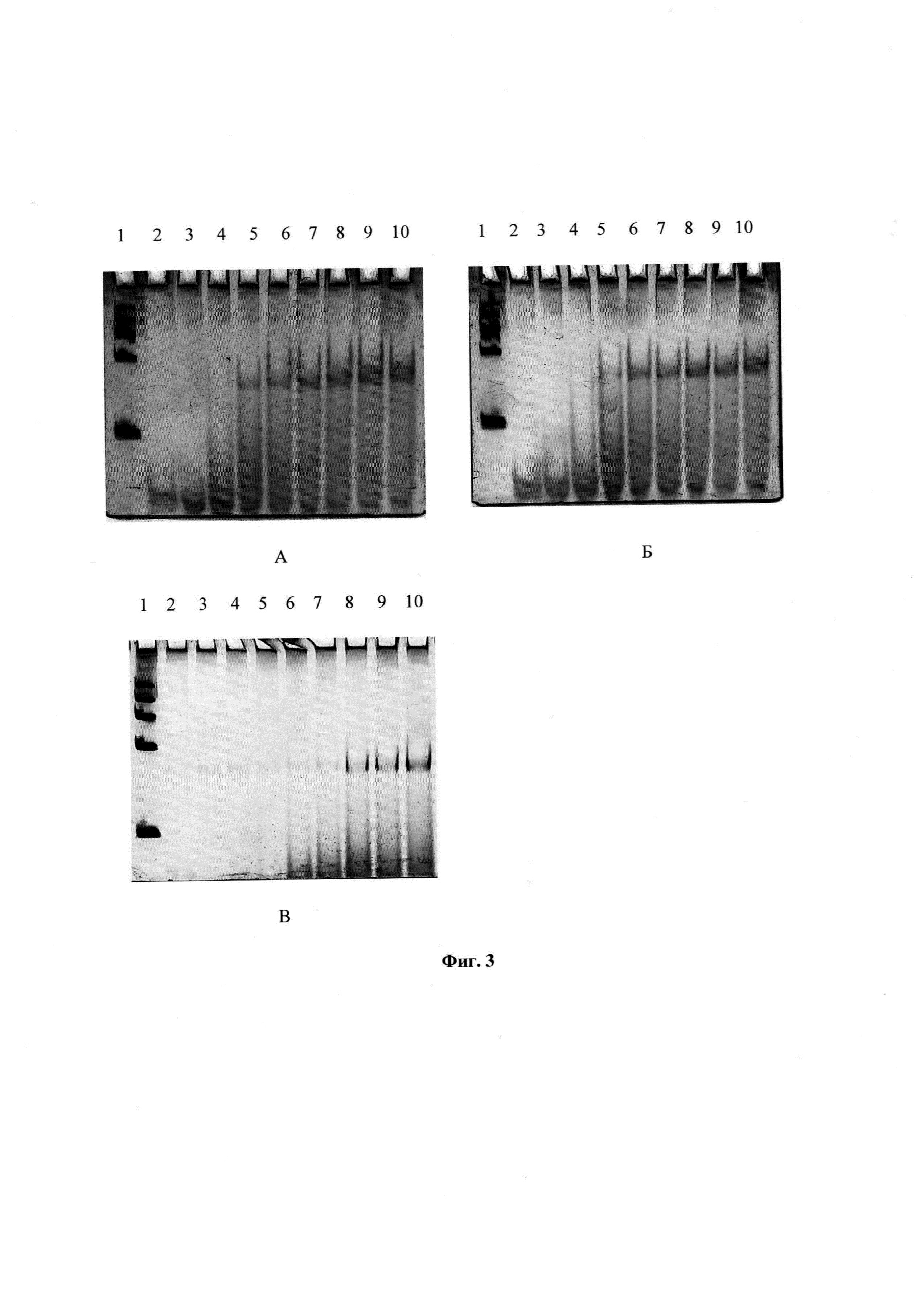
На фиг. 3А - Электрофорез в 8% ПААГ комплекса протромбина с RE24A. Дорожки 2-10 - комплексы ДНК-аптамера с протромбином. Концентрация аптамера = 400 nM.
Концентрации протромбина: 2-0 nM; 3-242 nM; 4-415 nM; 5-830 nM; 6-1245 nM; 7-2075 nM; 8-2905 nM; 9-4150 nM; 10-6050 nM.
На фиг. 3Б - Электрофорез в 8% ПААГ комплекса протромбина с RE25A. Дорожки 2-10 - комплексы ДНК-аптамера с протромбином. Концентрация аптамера = 400 nM.
Концентрации протромбина: 2-0 nM; 3-242 nM; 4-415 nM; 5-830 nM; 6-1245 nM; 7-2075 nM; 8-2905 nM; 9-4150 nM; 10-6050 nM.
На фиг. 3В - Электрофорез в 8% ПААГ комплекса протромбина с RE8G. Дорожки 2-10 - комплексы ДНК-аптамера с протромбином. Концентрация аптамера = 400 nM.
Концентрации протромбина: 2-0 nM; 3-242 nM; 4-415 nM; 5-830 nM; 6-1245 nM; 7-2075 nM; 8-2905 nM; 9-4150 nM; 10-6050 nM.
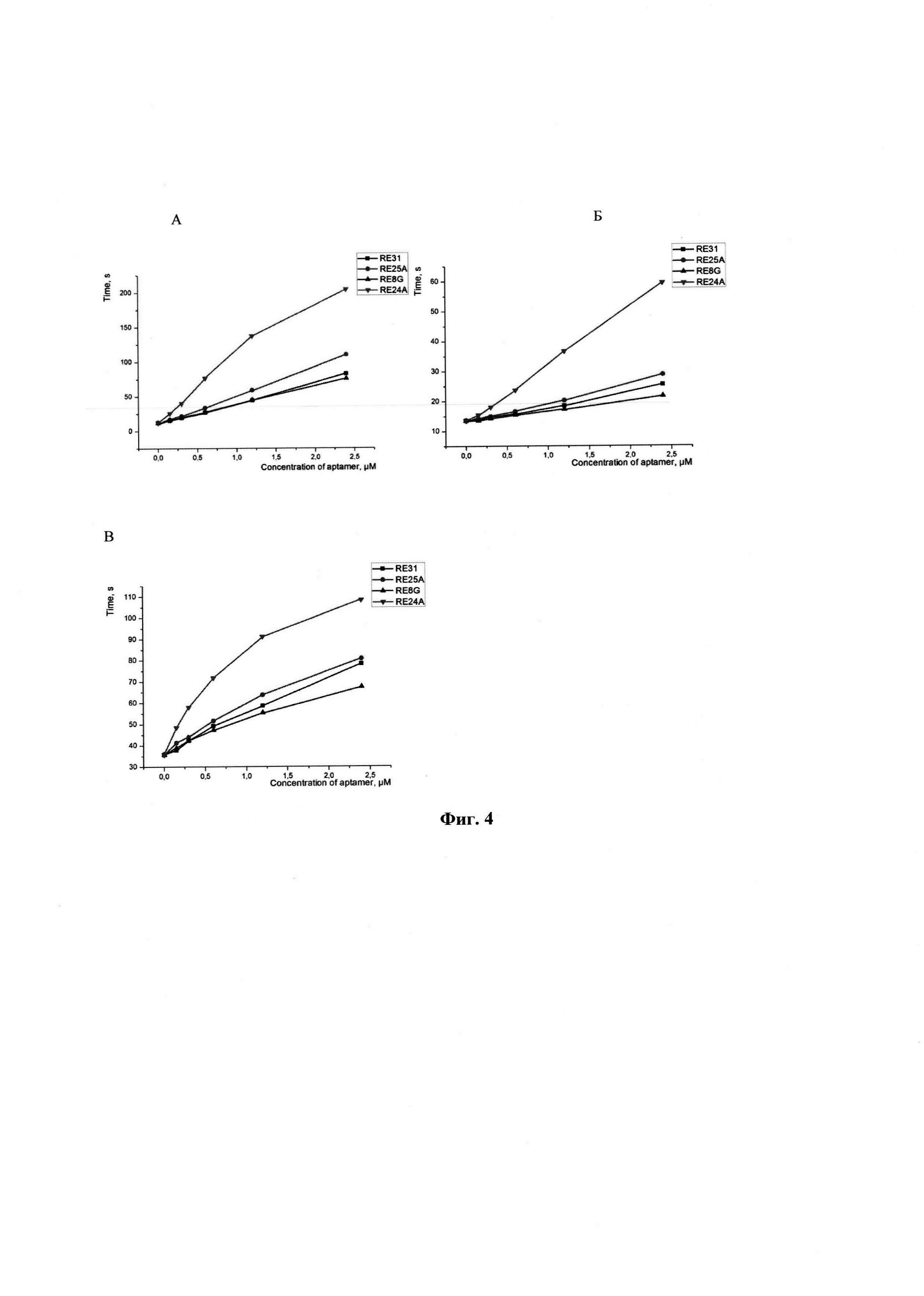
На фиг.4 приведены данные влияния аптамеров на активацию системы свертывания крови и образование фибрина исследовали, измеряя (А) - тромбиновое время (ТВ), (Б) - протромбиновое время (ПВ), (В) - активированное частичное тромбопластиновое время (АЧТВ) пула плазм человека, где  - RE31,
- RE31,  - RE25A,
- RE25A,  - RE8G,
- RE8G,  - RE24A. Измерения выполняли на анализаторе "STA-compact" с использованием наборов реактивов "STA Neoplastin Plus", "STA АРТТ", "STA Thrombin" и "PoolNorm" производства "Diagnostica Stago" (Франция).
- RE24A. Измерения выполняли на анализаторе "STA-compact" с использованием наборов реактивов "STA Neoplastin Plus", "STA АРТТ", "STA Thrombin" и "PoolNorm" производства "Diagnostica Stago" (Франция).
Исходно аптамеры добавляли к аликвотам нормальной плазмы до концентрации 2,4 мкМ, затем готовили 3-4 геометрических разведения нормальной плазмой. Во всех перечисленных выше тестах объем плазмы составлял 1/3 от объема реакционной смеси, и конечная концентрация аптамеров составляла от 0 до 0,8 мкМ.
Осуществление изобретения
Настоящее изобретение поясняется конкретными примерами выполнения, которые не являются единственно возможным, но наглядно демонстрирует возможность достижения требуемого технического результата.
Базовую олигонуклеотидную последовательность аптамера синтезировали на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных (синтонов) нуклеотидов. Синтез ДНК-аптамеров по изобретению осуществляли по стандартной методике на твердофазном носителе (Oligonucleotide Synthesis, M.J.Gait ed, 1984; Sambrook, Fntsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989). Синтез проведен твердофазным методом на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных нуклеотидов.
В реактор объемом 1 мл подают растворы нуклеотидов для синтеза базовой последовательности. Первая стадия присоединения 3'-концевого нуклеозида проводится вручную. В реактор подают раствор амидофосфита нуклеозидов в концентрации 0,5 мкМ. Получаемый продукт промывают 300 мкл ацетонитрила. Далее добавляют следующий амидофосфит нуклеозида. После окончания реакции снова промывают ацетонитрилом и продолжают синтез по программе, заложенной в компьютере. Масштаб синтеза составлял 0,1-0,2 мкмоля/г. [Reese С.В. Oligo- and poly-nucleotides: 50 years of chemical synthesis, Org. Biomol. Chem.(2005) 3 (21): 3851-3868; Caruthers M.H. A brief review of DNA and RNA chemical synthesis, Biochem. Soc. Trans. (2011) 39: 575-580; Atkinson T. and Smith M. Oligonucleotide Synthesis: A Practical Approach. / Ed. Gait M. J. Ox: Oxford University Press. 1984. P. 35-81.]
В качестве полимерного носителя использованы стеклянные шарики CPG (control pore glass) с размером пор 500 и 1000 А. Первый нуклеозид 3'-гидроксильной группой был присоединен к карбоксильной группе модифицированного полимерного носителя.
Каждый цикл синтеза состоял из четырех этапов:
- детритилирование для удаления диметокситритильной группы обработкой трихлоруксусной кислотой и освобождения 5'-ОН группы;
- присоединение нуклеотида в виде Р-цианэтил-М^-бис-диизопропиламидофосфита нуклеозида;
- β-цианэтильная группа удаляется после завершения синтеза обработкой аммиаком. Активирующим реагентом при конденсации является тетразол.
- кэширование. Присоединение амидофосфита на стадии конденсации не происходит количественно, поэтому около 2% 5'-ОН групп не вступают в реакцию. На последующих этапах синтеза к ним могут присоединяться нуклеотиды, что, в конечном счете, приводит к пропускам в последовательности нуклеотидов. В связи с этим необходимо проводить защиту свободных 5'-ОН групп, т.е. кэпирование, реакцией уксусного ангидрида в присутствии N-метилимидазола.
- окисление фосфитного эфира до фосфатного йодом в пиридине.
При необходимости, после окончания синтеза основной олигонуклеотидной последовательности на 5'-конец вводится нужная модификация. Сначала вводят гликольную группировку, которая фосфорилирована по концевой гидроксильной группе. На 5'-концевой остаток фосфора присоединяют аминогексанол, так что концевой становится алифатическая аминогруппа.
Введение аминогруппы на 3'-конец проводят по аналогичной схеме - после снятия олигонуклеотида с полимерного носителя фосфитного эфира окисляют до фосфатного производного и присоединяют к нему гексанол, который образует эфир с пятивалентным концевым фосфорным остатком, а аминогруппа остается экспонированной в раствор. Масштаб синтеза составлял 0,1-0,2 мкмоля/г.
При введении полиэтиленгликоля нуклеотид, закрепленный на стекле, этерифицируют полиэтиленгликолем (PEG), затем фосфорилируют для дальнейших работ. При введении полиэтиленгликоля на 3' - конец используют спейсеры - небольшие по длине олигонуклеотидные последовательности, которые позволяют придать гибкость полимерной цепочке и дают возможность далее присоединять протяженные гликольные звенья нужной длины.
Отщепление олигодезоксирибонуклеотида с полимерного носителя и снятие защитных групп проводят следующим образом. Полимер из колонки помещают в пробирку на 1,5 мл, заливают 0,5 мл конц. NH3 и инкубируют при комнатной температуре 1,5-2,0 часа. Осадок собирали центрифугированием, промывали 0,3 мл конц. NH3, супернатанты объединяли и выдерживали при 55° 10-12 часов. После охлаждения раствора аммиак упаривают и остаток растворяют в 1 мл дистиллированной воды.
Анализ реакционной смеси проводят на хроматографе Tracor, колонка 4×250 мм с обращенно-фазовым сорбентом Диасорб С16Т с размером пор 7 мкм. Колонку предварительно уравновешивают буфером: 48 мМ фосфат калия (рН=7,0), 2 мМ дигидрофосфат тетрабутиламмония, 5% ацетонитрил, при 45° и скорости потока 1 мл/мин. Измерения проводят при 260 нм, вещество вводят шприцем в объеме 2,5 мкл. На хроматограмме реакционной смеси, кроме целевого олигонуклеотида, как правило, видны более короткие продукты. Их образование связано с невозможностью полного проведения конденсации, со 100% выходом. Препаративное разделение реакционной смеси проводят обращенно-фазовой хроматографией. Носитель тот же, который используется в первом случае. Как правило, объем реакционной смеси составляет 0,5-1,0 мл. Вещество элюируется в следующем диапазоне (50-80%) буфера 48 мМ фосфат калия (рН=7,0), 2 мМ дигидрофосфат тетрабутиламмония, 40% ацетонитрил. Собранное вещество многократно упаривают при добавлении 1 мл 50% раствора метанола в воде для удаления следов аммония. Удаление 5'-0-диметокситритильной защиты проводят в 1,5 мл 80% уксусной кислоты, 30 мин при комнатной температуре. Для удаления уксусной кислоты раствор многократно упаривают на роторном испарителе, добавляя каждый раз 1,5 мл 50% раствора метанола в воде. Полученный продукт растворяют в 1 мл воды. Для определения количества полученного олигонуклеотида по окончании разделения проводили обработку хроматограмм, интегрируя площадь пиков и рассчитывали концентрацию целевого продукта по формуле S×4×10-6.
Пример 1. Комплексообразование предлагаемых аптамеров с протромбином Исследование комплексообразования аптамеров с протромбином проводили с помощью поверхностного плазмонного резонанса (ППР). Как известно, ППР является высокочувствительным методом выявления присутствия даже незначительного количества разных биологических молекул. На чипе Sensor Chip SA, на внешней его поверхности тонкой золотой пленки биохимическими методами иммобилизуют мономолекулярный слой аптамера (с концентрацией 2 мкМ). Структура чипа такова, что по узким капиллярам пропускают раствор аналита, в котором находится изучаемый белок (концентрацию протромбина варьировали от 10,5 до 421 нМ). Протромбин вводили по 30 мкл. Скорость ввода пробы в проточную ячейку составляла 10 мкл/мин. После каждого ввода ячейку промывали 10 мкл 2М NaCl. Все измерения проводили на приборе Biocore X. Полученные сенсограммы были обработаны пакетом программ BIACOREX. Детектором ППР служит специальное оптическое устройство, рабочая поверхность которого находится в непосредственном физическом контакте с раствором исследуемого образца. Любое изменение взаимодействия на поверхности золотой пленки фиксируется. Сигнал, измеренный в специальных единицах (RU = Response Unit), пропорционален количеству белка (1000 RU=1 пкг связанного белка на квадратный миллиметр). Результаты представлены в виде сенсограмм, которые отражают изменения резонансного сигнала как функции времени (фиг. 1А, Б, В). Для связывания аптамеров с протромбином использовали буфер следующего состава: 20 mM HEPES-KOH, рН=7,2, 140 mM NaCl, 5 mM KCl (состав буфера аналогичен солевому составу крови). Сенсограммы образования комплекса протромбина с аптамерами RE8G (фиг. 1А), RE24A (фиг. 1Б), RE25A (фиг. 1В), которые были иммобилизованы на поверхности чипов Sensor Chip SA за счет образования комплекса биотин-стрептавидин показали устойчивое и специфическое образование комплексов с протромбином, предшественником тромбина в системе свертывания крови.
Из графиков сенсограмм видно, что все представленные аптамеры имеют высокое сродство к протромбину.
Пример 2. Изучение структуры и стабильности предлагаемых аптамеров с помощью спектрометра кругового дихроизма (КД).
Нуклеиновые кислоты являются оптически активными веществами, пространственная организация которых влияет на спектр кругового дихроизма. Метод КД-спектроскопии основан на различной способности хиральных веществ поглощать левополяризованный и правополяризованный свет. Здесь играет роль как магнитный, так и дипольный момент перехода электронов в возбужденное состояние, в отличие от УФ-поглощения, где эффект обусловлен дипольным моментом перехода электронов. КД-спектроскопию используют для изучения пространственных структур, связывания лигандов и изучения влияния катионов, эффектов химических модификаций. Метод КД-спектроскопии широко применяется для изучения полиморфизмов G-квадруплексов. G-квадруплексы очень распространены в геноме, в частности в теломерных областях. G-квадруплексы играют огромную роль в ряде таких процессов, как репликация, рекомбинация, транскрипция и трансляция. Аптамеры RE8G, RE24A, RE25A имеют в своем составе G-квадруплексные структуры.
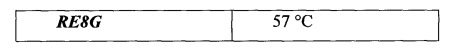
Исследование аптамеров проводили с помощью КД-спектрометра CHIRASCAN (Applied Photophysics Ltd, Великобритания). Спектры КД-спектроскопии записывали в кювете с длиной оптического пути 1 см, в буфере 10 мМ Трис-HCl, рН=7,4, 140 мМ NaCl, и 5 мМ KCl на КД-спектрометре с термоэлектрическим регулятором температуры. Полученные спектры RE8G, RE24A, RE25A (фиг. 2А, Б, В) имеют характеристические экстремумы, соответствующие антипараллельному G-квадруплексу: два положительных при 292 нм и 246 нм, и отрицательный при 264 нм. Спектры КД-спектроскопии RE8G, RE24A, RE25A при разных температурах пересекаются в двух изобестических точках, что указывает на существование в растворе только двух структур - денатурированной и G-квадруплексной. Спектры КД регистрировали в интервале длин волн от 210 до 350 нм, и в интервале температур от 10°С до 90°С с шагом 2°С при средней скорости нагрева 1°С/мин. Представленные спектры позволили рассчитать температуры плавления полученных структур (таблица 1). Так, для аптамера RE24A она составила 49°С, для аптамера RE25A - 54°С, для аптамера RE8G - 57°С. Различие в температурах плавления отражает стабильность данных молекул в растворе, т.к. наблюдаемые нуклеотидные изменения в переходной области от дуплекса к квадруплексу связаны с перекрыванием азотистых оснований, удерживаемых за счет π→π электронных переходов.

Пример 3. Изучение комплексообразования предлагаемых аптамеров с протромбином с помощью электрофореза в нативных условиях
Предложенные структуры аптамеров были изучены на способность специфически взаимодействовать с протромбином в условиях электрофореза в полиакриламидном геле в неденатурирующих условиях. В подтверждение того, что комплексы аптамерных ДНК с тромбином и протромбином, действительно, собираются, изучали комплексообразование с помощью электрофореза в нативных условиях. Были подобраны условия для наиболее наглядного разделения комплексов и несвязавшенося части молекул аптамера. Было показано комплексообразование со всеми аптамерами изучаемого ряда. Надо отметить, что аптамеры удерживаются в комплексе с протромбином не за счет ковалентных связей, а только за счет слабых взаимодействий (водородные связи, гидрофобные взаимодействия, Ван-дерВаальсовые силы). Под действием электрического поля неспецифические комплексы распадаются. Специфичность комплексов аптамеров с протромбином была показана с помощью электрофореза в полиакриламидном геле (ПААГ). Электрофорез проводили в 8% ПААГ. Концентрация аптамеров в каждом случае составляла 400 nM.
Комплексы аптамера RE24A с протромбином создавали при увеличивающихся концентрациях протромбина: 242 nM; 415 nM; 830 nM; 1245 nM; 2075 nM; 2905 nM; 4150 nM; 6050 nM.
Комплексы аптамера RE25A с протромбином создавали при увеличивающихся концентрациях протромбина: 242 nM; 415 nM; 830 nM; 1245 nM; 2075 nM; 2905 nM; 4150 nM; 6050 nM.
Комплексы аптамера RE8G с протромбином создавали при увеличивающихся концентрациях протромбина: 242 nM; 415 nM; 830 nM; 1245 nM; 2075 nM; 2905 nM; 4150 nM; 6050 nM.
На электрофореграммах четко видны зоны как свободного аптамера, который не связался и зоны комплексов, в которых присутствует и аптамер и протромбин. Эти зоны движутся гораздо медленнее зон одних аптамеров (фиг. 3А, Б, В). Электрофореграммы окрашивали красителем Сибр грен, который окрашивает зоны фрагментов ДНК и их комплексов с белком. Обработку изображений на электрофореграммах и математических данных осуществляли с помощью программ GIMP, ImageJ, OriginPro 8.1. На основе полученных результатов были построены изотермы связывания. Они были линеаризованы в координатах Скетчарда. По тангенсу угла наклона и полувысоте подъема кривой, были рассчитаны константы диссоциации комплексов, которые характеризуют сродство аптамера к протромбину.
Пример 4. Влияние аптамеров на тромбиновое время (ТВ), протромбиновое время (ПВ) и активированное частичное тромбопластиновое время (АЧТВ)
Предлагаемые аптамеры были проверены по медицинским тестам: тромбиновое время, протромбиновое время, активированное частичное тромбопластиновое время (АЧТВ), т.е. был проведен анализ влияния ДНК аптамеров на систему свертывания крови. Тем самым была подтверждена гипотеза о влиянии данных аптамерных структур как на протромбин, так и на сам тромбин. Были проведены опыты на плазме крови человека. В тесте "Тромбиновое время", который определяет конечную стадию свертывания - агрегацию фибриногена, а точнее его фибрилловых нитей, показано, что все представленные аптамеры удлиняют время образования сгустка после добавления тромбина к нормальной человеческой плазме. Наиболее эффективным ингибитором оказался RE24A, который в концентрации 0,5 мкМ показал удлинение с 14 до 75 секунд. Это показывает, что данный аптамер способен связывать и ингибировать внесенный тромбин в присутствии других белков плазмы, суммарная концентрация которых много выше, чем добавленный тромбин (85 мг/мл против ~1 мкг/мл). Для сравнения три других аптамера: RE31 (контроль), RE25A, RE8G удлиняли время ингибирования до такой же степени при концентрациях в 3-4 раза больше. Измерения степени ингибирования проводили в кювете коагулометра, в которой находилось 0,1 мл цитратной плазмы человека, куда добавляли 0,1 мл раствора аптамера в буфере 20 мМ HEPES-KOH (рН = 7,4), содержащим 150 мМ NaCl и 5 мМ KCl. После инкубирования в течение 1-2 минут реакцию стартовали 0,1 мл раствора тромбина активностью 5 Е/мл. Далее регистрировали время образования сгустка (фиг. 4).
В следующих сериях экспериментов изучали влияние аптамера на свертывание крови по внешнему пути, т.е. в процессе активации образования тромбина из протромбина, в присутствии эндогенного тромбина. При концентрации 0,5 мкМ аптамер RE24A проявляет себя активнее, удлиняет время образования тромба в 2 раза, в сравнении с остальными аптамерами. В качестве контроля сравнения использовали результаты ингибирования аптамером RE31, который был запатентован ранее (Патент РФ №2401306, МПК А61К 31/712, опубл. 10.10.2010, Бюл. №28). В тесте АЧТВ, характеризующем активацию внутреннего пути свертывания крови, в котором участвуют FXII/калликреин, FXI, FIX, FX и тромбин, а также положительные обратные реакции тромбина, т.е. активация FVIII и FV, аптамер RE24A оказался наиболее эффективным ингибитором. При концентрации 0,5 мкМ удлинение составляло 70 секунд против 35 секунд в контроле.
Тромбиновое время характеризует присутствие фибриногена в данном образце плазмы. Был использован тромбин STA Thrombin (607681) + KCl до 5 мМ, а все аптамеры были разведены плазмой - Pool Norm 109702 - до концентрации 2,4 мкМ (0,8 мкМ - конечная концентрация в пробе). Далее было сделано геометрическое разведение этой же плазмой.
Представленные в примерах результаты сродства аптамеров RE31, RE25A, RE8G, к протромбину представляется принципиально важным, т.к. в отличие от применяемых в настоящее время антитромбитических препаратов, ингибирующих активность тромбина, аптамеры связываются только с экзосайтом-1 - участком "узнавания" тромбином своих многочисленных субстратов, ингибиторов и кофакторов. Согласно приведенным данным, этот участок открыт и в протромбине, что делает возможным остановку образования тромба на более ранних стадиях системы свертывания крови. Это открывает возможность в использовании аптамеров как агентов, селективно ингибирующих лишь одну из функций тромбина.
Предложенные аптамеры связываются не только с тромбином, но с его предшественником - протромбином, который присутствует в кровотоке постоянно и тем самым вносит ингибирующий эффект на более ранних стадиях системы свертывания крови.
Известные, на сегодняшний день, низкомолекулярные прямые ингибиторы тромбина не взаимодействуют с протромбином. В отличие от них ДНК аптамеры на основе нуклеиновых кислот, а именно: RE8G, RE24A, RE25A, обладают узконаправленным действием как на тромбин, так и на протромбин. Они связываются с экзосайтом I тромбина (фибриноген-связывающим), который в свою очередь открыт и доступен в структуре протромбина. Сродство данных аптамеров к протромбину намного выше, чем заявленное в работе Kretz е.а. [Kretz СА, Stafford AR, Fredenburgh JC, Weitz JI, HD1, a Thrombin-directed Aptamer, Binds Exosite 1 on Prothrombin with High Affinity and Inhibits Its Activation by Prothrombinase, JBC, 2006, 281 (49): 37477-37485] (5 нМ против 86 нМ, указанных в статье). Они могут быть использованы для создания медицинских препаратов, останавливающих внутрисосудистое тромбообразование, которое чревато тяжелыми последствиями: инсульт, инфаркт и другие. К достоинствам ДНК аптамеров можно отнести создание антидота, т.е. такой молекулы, которая будет разрушать комплекс аптамера с белком. Также ДНК аптамеры не вызывают аллергических реакций в организме. За счет использования заявляемых аптамеров повышается эффективность антитромботической терапии при лечении тромбозов различной локализации, за счет ингибирования тромбообразования через предшественника тромбина - протромбина, с помощью ДНК аптамеров (олигонуклеотидов), которые связываются как с тромбином, так и с протромбином, замедляя процесс перехода протромбина в тромбин, тем самым снижая концентрацию тромбина в кровотоке.
Предложенные модифицированные ДНК-аптамеры связываются с протромбином и, как следствие, ингибируют активность тромбина в плазме крови человека. При внутривенном введении экспериментальным животным они циркулируют в кровотоке дольше, чем базовые аптамеры. Данные аптамеры способны служить основой для создания лекарственных антитромботических препаратов нового поколения.