Результат интеллектуальной деятельности: ТИАЗОЛОПИРИМИДИНОНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ РЕЦЕПТОРОВ NMDA
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к некоторым тиазолопиримидиноновым соединениям, фармацевтическим композициям, содержащим такие соединения, и способам лечения неврологических и психиатрических состояний, и других заболеваний и медицинских состояний с помощью таких соединений и фармацевтических композиций. Настоящее изобретение также относится к некоторым тиазолопиримидиноновым соединениям для применения в модуляции активности рецепторов NMDA.
УРОВЕНЬ ТЕХНИКИ
[0002] N-метил-D-аспартат (NMDA) рецепторы играют важную роль в различных функциях центральной нервной системы, таких как синаптическая передача и синаптическая пластичность, а также в базовых функциях, таких как регулирование долгосрочной потенциации, долгосрочной депрессии и опыта, зависимой синаптической обработки. Costa et al., "A Novel Family of Negative and Positive Allosteric Modulators of NMDA Receptors," J. Pharmacol. Exp. Ther. 2010, 335, 614-621, на 614. Возбуждающая нервная передача в этих рецепторах регулируется нейромедиатором, L-глутаматом, и агонистом NMDA. PCT Intl. Publ. № WO 2007/006175, абзацы 2-3. NMDA-рецепторы представляют собой управляемые лигандами ионные каналы, содержащие семь субъединиц: GluN1, GluN2A-D, и GluN3A-B. Costa на с. 615. NR2A и NR2B субъединицы участвовали в связывании глутамата с рецептором, в то время как субъединица NR1 может играть определенную роль в связывании с рецептором ко-агониста глицином. Трехмерные структуры с глутамат- и глицин-связывающих карманов рецепторов NMDA, были охарактеризованы, что позволяет разрабатывать более подтип-специфичные модуляторы
[0003] Модуляция этих рецепторов приводит к изменениям в обучении и памяти, также модуляторы активности рецептора NMDA рассматриваются как потенциальные лекарства для неврологических и психических состояний, включая боль, невропатическую боли, боль при воспалении, периферическую невропатию, инсульт, эпилепсию, нейродегенерацию, шизофрению, наркоманию, расстройства настроения, посттравматическое стрессовое расстройство, судороги, конвульсии, возрастное ухудшение памяти и депрессию, Costa на с. 614. Модуляция активности рецептора NMDA связана с нейропротективной ролью, с применением для лечения инсульта, черепно-мозговой травмы, ишемии и нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, амиотрофический латеральный склероз и болезнь Крейтцфельдта Якоба. Costa cc. 614-615
[0004] Существует конкретная необходимость в модуляторах NMDA рецепторов, которые демонстрируют селективность в отношении подтипа среди членов семейства рецепторов NMDA. Селективные агенты будут обладать оптимальной терапевтической активностью со сниженным потенциалом тяжелых побочных эффектов. Costa с. 615.
[0005] Остается необходимость в сильных модуляторах рецепторов NMDA с необходимыми фармацевтическими свойствами. Было обнаружено, что некоторые тиазолопиримидиноновые производные в контексте настоящего изобретения обладают активностью модулирования рецепторов NMDA.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
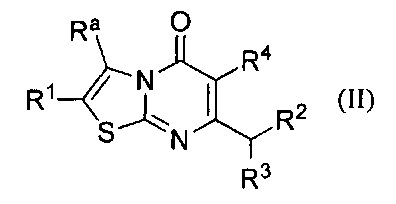
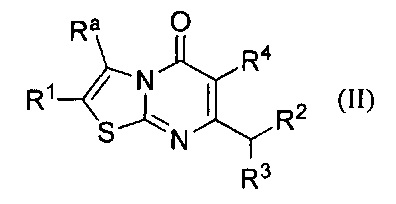
[0006] В одном аспекте настоящее изобретение относится к соединению формулы II:
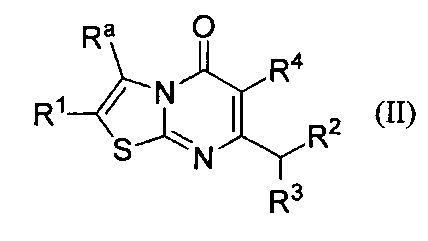
где
Ra представляет собой С1-6алкил или С2-6алкенил, каждый возможно замещен одним или более Rb заместителями; С2-6алкинил; галоген; -С(O)Rc; -NRdRe; -C(O)NRdRe; -C(S)NRdRe; -C(=N-OH)-C1-4алкил; -ОС1-4алкил; -ОС1-4галоалкил; -SC1-4алкил; -SO2C1-4алкил; циано; С3-6циклоалкилвозможно замещенный одним или более Rf заместителями; или фенильное, моноциклическое гетероарильное или гетероциклоалкильное кольцо, каждое кольцо возможно замещено одним или более Rg заместителями;
где каждый заместитель Rb независимо выбран из группы, состоящей из -ОН, -С1-4алкокси, -NRdRe, -C(O)NRdRe, -SC1-4алкила, -SO2C1-4алкила, циано, галогена, С3-6циклоалкила, и моноциклического гетероарила;
Rc представляет собой С1-4алкил, -С1-4галоалкил, С3-6циклоалкил, или моноциклический азот-связанный гетероциклоалкил;
Rd представляет собой Н или С1-4алкил;
Re представляет собой Н; С1-4алкил возможно замещенный -CN, -CF3, -ОН, или моноциклический гетероциклоалкил; С3-6циклоалкил; -ОН; или -OC1-4алкокси;
или Rd и Re взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклоалкил, возможно замещенный С1-4алкилом или -ОН;
каждый Rf заместитель независимо выбран из группы, состоящей из: С1-4алкила возможно замещенного -ОН, циано, или С1-4алкокси; -ОН; галогена; C1-4галоалкила; -CONH2; и циано; и
каждый Rg заместитель независимо выбран из группы, состоящей из С1-4алкила, -CF3, галогена, -NH2, -ОСН3, циано, и -ОН;
R1 выбран из группы, состоящей из Н, C1-6алкила; С1-4галоалкила, С3-6циклоалкила, галогена, -ОС1-4алкила, -ОС1-4галоалкила, циано, и -С(O)С1-4алкила; или Ra и R1 взятые вместе с атомами углерода, к которым они присоединены, образуют 5 - 7-членное кольцо, возможно содержащее О или NH, и возможно замещенное одним или более Rh заместителями;
где каждый заместитель Rh независимо представляет собой -С(O)NRiRj, циано, или представляет собой С1-4алкил возможно замещенный -ОН, -ОСН3, циано, или -С(O)NRiRj; или две группы Rh, присоединенные к одному и тому же атому углерода и взятые вместе с углеродом, к которому они присоединены, образуют карбонил или С3-6циклоалкил;
где Ri и Rj каждый независимо представляет собой Н или С1-4алкил;
R2 представляет собой -Rm, -ORm, или -NRmRn;
где Rm представляет собой арил или гетероарил, каждый возможно замещен одним или более Rs заместителями;
где каждый заместитель Rs независимо выбран из группы, состоящей из C1-4алкила, С2-4алкенила (возможно замещенного галогеном), С2-4алкинила, С1-4галоалкила, С1-4алкокси, С1-4алкил-ОН, С1-4галоалкокси, галогена, циано, С3-6циклоалкила (возможно замещенного -ОН или галогеном), моноциклического гетероарила, -NH2, -NO2, -NHSO2C1-4алкила, и -SO2C1-4алкила;
Rn представляет собой Н, С1-4галоалкил, или С1-4алкил возможно замещенный -ОН или С1-4алкокси;
или Rm и Rn взятые вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или пиперидиновое кольцо, возможно замещенное С1-4алкилом и возможно конденсированное с фенилом, где указанный фенил возможно замещен галогеном;
R3 представляет собой Н или метил; и
R4 представляет собой Н или фтор;
или его фармацевтически приемлемой соли.
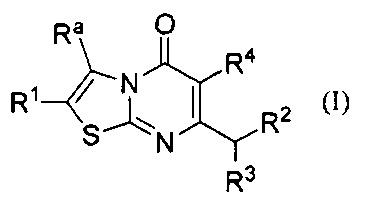
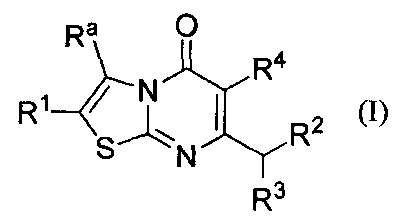
[0007] В одном аспекте, настоящее изобретение относится к соединению формулы I:
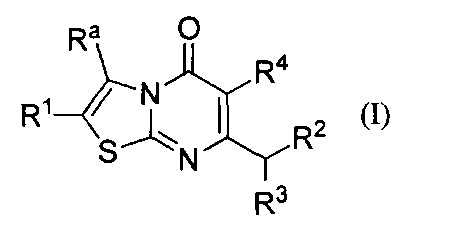
где
Ra представляет собой C1-6алкил возможно замещенный одним или более Rb заместителями; С2-6алкенил; С2-6алкинил; галоген; -C(O)Rc; -NRdRe; -C(O)NRdRe; -C(S)NRdRe; -С(=N-ОН)-С1-4алкил; -SO2C1-4алкил; циано; С3-6циклоалкил возможно замещенный одним или более Rf заместителями; или фенильное, моноциклическое гетероарильное или гетероциклоалкильное кольцо, каждое кольцо возможно замещено одним или более Rg заместителями;
где каждый заместитель Rb независимо выбран из группы, состоящей из -ОН, -С1-4алкокси, -NRdRe, -C(O)NRdRe, -SC1-4алкила, -SO2C1-4алкила, циано, галогена, и моноциклического гетероарила;
Rc представляет собой С1-4алкил, -С1-4галоалкил, С3-6циклоалкил, или моноциклический азот-связанный гетероциклоалкил;
Rd представляет собой Н или С1-4алкил;
Re представляет собой Н; С1-4алкил возможно замещенный -CN, -CF3, -ОН, или моноциклический гетероциклоалкил; С3-6циклоалкил; -ОН; или -OC1-4алкокси;
или Rd и Re, взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклоалкил, возможно замещенный С1-4алкил или -ОН;
каждый Rf заместитель независимо выбран из группы, состоящей из: С1-4алкила возможно замещенного -ОН, циано, или С1-4алкокси; С1-4галоалкила; -CONH2; и циано; и
каждый Rg заместитель независимо выбран из группы, состоящей из С1-4алкила, -CF3, галогена, -NH2, -ОСН3, циано, и -ОН;
R1 выбран из группы, состоящей из Н, С1-6алкила; С1-4галоалкила, и С3-6циклоалкила; или Ra и R1 взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7-членное кольцо, возможно содержащее О или NH, и возможно замещенное одним или более Rh заместителями;
где каждый заместитель Rh независимо представляет собой -С(O)NRiRj, циано, или представляет собой С1-4алкил возможно замещенный -ОН, -ОСН3, циано, или -С(O)NRiRj; или две группы Rh, присоединенные к одному и тому же атому углерода и взятые вместе с углеродом, к которому они присоединены, образуют карбонил или С3-6циклоалкил;
где Ri и Rj каждый независимо представляет собой Н или С1-4алкил;
R2 представляет собой -Rm, -ORm, или -NRmRn;
где Rm представляет собой арил или гетероарил, каждый возможно замещен одним или более Rs заместителями;
где каждый заместитель Rs независимо выбран из группы, состоящей из C1-4алкила, С1-4галоалкила, С1-4алкокси, С1-4алкил-ОН, С1-4галоалкокси, галогена, циано, С3-6циклоалкила, -NHSO2C1-4алкила, и -SO2C1-4алкила;
Rn представляет собой Н, С1-4галоалкил, или С1-4алкил возможно замещенный -ОН или С1-4алкокси;
или Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или пиперидиновое кольцо, возможно замещенное С1-4алкилом и возможно конденсированное с фенилом, где указанный фенил возможно замещен галогеном;
R3 представляет собой Н или метил; и
R4 представляет собой Н или фтор;
или его фармацевтически приемлемой соли.
[0008] В дополнительном аспекте настоящее изобретение относится к фармацевтическим композициям, каждая содержит эффективное количество по меньшей мере одного соединения Формулы I или II, или фармацевтически приемлемой соли соединения Формулы I или II. Фармацевтические композиции по настоящему изобретению могут дополнительно содержать по меньшей мере один фармацевтически приемлемый эксципиент.
[0009] В другом аспекте, настоящее изобретение относится к способу лечения субъекта, страдающего от заболевания или медицинского состояния, опосредованного активностью рецепторов NMDA, содержащий введение нуждающемуся в таком лечении субъекту эффективного количества по меньшей мере одного соединения Формулы I или II или фармацевтически приемлемой соли соединения Формулы I или II, или содержащий введение нуждающемуся в таком лечении субъекту эффективного количества фармацевтической композиции, содержащей эффективное количество по меньшей мере одного соединения Формулы I или II или фармацевтически приемлемой соли соединения Формулы I или II.
[0010] Аспект настоящего изобретения относится к применению соединения Формулы I или II, или его фармацевтически приемлемой соли, для получения лекарственного средства, применяемого при лечении, предотвращении, ингибировании или элиминации заболевания или медицинского состояния, опосредованного активностью рецепторов NMDA.
[0011] Аспект настоящего изобретения относится к применению соединения Формулы I или II, или его фармацевтически приемлемой соли, для получения лекарственного средства, применяемого при лечении, предотвращении, ингибировании или элиминации заболевания или медицинского состояния, опосредованного активностью рецепторов NMDA.
[0012] В другом аспекте соединения Формулы I или II, и их фармацевтически приемлемые соли, применяются в качестве модуляторов рецепторов NMDA. Так, настоящее изобретение относится к способу модуляции активности рецепторов NMDA, включая случаи, когда рецептор NMDA находится у субъекта, содержащий воздействие на рецептор NMDA эффективного количества по меньшей мере одного соединения Формулы I или II, или фармацевтически приемлемой соли соединения Формулы I или II.
[0013] В еще одном аспекте настоящее изобретение направлено на способы получения соединений Формулы I или II, и их фармацевтически приемлемых солей.
[0014] В некоторых воплощениях соединений, фармацевтических композиций, и способов настоящего изобретения соединение Формулы I или II представляет собой соединение выбранное из тех видов, которые описаны или примеры которых приведены в подробном изложении изобретения ниже, или представляет собой фармацевтически приемлемую соль такого соединения.
[0015] Дополнительные воплощения, признаки и преимущества настоящего изобретения будут ясны из следующего подробного описания и через примеры настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ И ПРЕДПОЧТИТЕЛЬНЫЕ ВОПЛОЩЕНИЯ
[0016] Для краткости, раскрытие публикаций, цитированных в данном описании, включая патенты и патентные заявки, включены в данное описание в качестве ссылки во всей их полноте
[0017] Большинство химических названий в настоящем изобретении составлялись с использованием номенклатуры ИЮПАК. Некоторые химические названия составлялись с использованием различных номенклатур или альтернатив или коммерческих названий, известных в уровне техники. В случае противоречий между названиями и структурами соединений, структуры являются главнее.
Общие определения
[0018] Как применялось выше, и на протяжении настоящего описания, следующие термины, если не указано иного, должны пониматься, как имеющие следующие значения. Если определение отсутствует, применяется обычное определение, известное квалифицированным в уровне техники специалистам. Если предложенное в настоящем изобретении определение противоречит или является отличным от определения, предложенном в любой из цитируемых публикаций, главным является определение, данное здесь.
[0019] Как здесь используется, термины "включающий," "вмещающий" и "содержащий" используются в их открытом, неограничивающем смысле.
[0020] Как здесь используется, единственное число, включает также множественное число, если контекст ясно не говорит об ином.
[0021] С целью более точного описания, некоторые количественные выражения, данные здесь, не определяются с помощью термина "приблизительно." Это необходимо понимать так, что независимо от того, используется ли термин "приблизительно" явным образом или нет, каждое количество, данное здесь, предназначено для обозначения фактически данного количества, а также предназначено для обозначения приближения к такому фактическому количеству, которое может быть обоснованно, подразумеваться на основании обычных знаний в области техники, включая эквиваленты и приближения в результате условий эксперимента или измерений для таких фактических данных значений. Всякий раз, когда выход дан в процентах, такой выход относится к массе соединения, для которого дан выход по отношению к максимальному количеству того же вещества, которое может быть получено в конкретных стехиометрических условиях. Концентрации, которые даны в процентах, относятся к массовым соотношениям, если не указано иного.
[0022] Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, которое обычно понимает средний специалист в данной области, к которой принадлежит настоящее изобретение. Несмотря на то, что любые способы и материалы, подобные или эквивалентные описанным в настоящем описании, также могут быть использованы на практике или при тестировании настоящего изобретения, предпочтительные способы и материалы описаны ниже. Все публикации, упомянутые здесь, включены в настоящее описание посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми эти публикации цитируются.
[0023] [0023] Если иное не указано, способы и методики настоящих вариантов осуществления, как правило, выполнены в соответствии с традиционными способами, хорошо известными в данной области техники, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании. См., например, Loudon, Organic Chemistry, 4th edition, New York: Oxford University Press, 2002, pp. 360-361, 1084-1085; Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition, Wiley-Interscience, 2001.
Химические определения
[0024] Как здесь используется, "алкил" относится к насыщенной, с, обладающей от 1 до 10 атомов углерода. Типичные алкильные группы включают, без ограничения, метил, этил, н-пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-1-бутил, 2-этил-1-бутил, бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, и т.д., и более длинные алкильные группы, такие как гептил, октил и т.д.. Как здесь используется, "низший алкил" означает алкил, обладающий от 1 до 6 атомами углерода.
[0025] Термин "алкенил" относится к углеводородной группе с линейной или разветвленной цепью, обладающей от 2 до 6 атомов углерода и предпочтительно от 2 до 4 атомов углерода, и обладающей по меньшей мере 1, предпочтительно от 1 до 2 участками ненасыщенной двойной связи. Этот термин включает, в качестве примера, би-винил, аллил и бут-3-ен-1-ил. Охватываемые данным термином являются цис и транс-изомеры или смеси этих изомеров.
[0026] Термин "аклинил" относится к моновалентной углеводородной группе с линейной или разветвленной цепью, обладающей от 2 до 6 атомов углерода и предпочтительно от 2 до 3 атомов углерода, и обладающей по меньшей мере 1, предпочтительно от 1 до 2 участками ненасыщенной тройной связи. Примеры таких алкинильных групп включают ацетиленил (-С≡СН), и пропаргил (-СН2С≡СН).
[0027] Термин "алкокси", как здесь используется, включает -О-(алкил), где алкил определен выше.
[0028] "Арил" означает моно-, би- или трициклическую ароматическую группу, где все кольца группы являются ароматическими и все кольцевые атомы представляют собой углерод. Для би- или трициклических систем, индивидуальные ароматические кольца конденсированы друг с другом. Примерами арильных групп являются 6- и 10-членные арилы. Дополнительные примеры арильных групп включают, без ограничения, фенил, нафтален и антрацен.
[0029] Термин "циано", как здесь используется, означает заместитель, обладающий атомом углерода, который соединен с атомом азота тройной связью.
[0030] Термин "дейтерий", как здесь используется, означает стабильный изотоп водорода, обладающий одним протоном и одним нейтроном.
[0031] Термин "гало" представляет собой хлоро, фторо, бромо или йодо. В некоторых воплощениях гало представляет собой хлоро, фторо или бромо. Термин "галоген", как здесь используется, относится к фтору, хлору, брому или йоду.
[0032] Термин "галоалкил" представляет собой алкильную группу, замещенную одним, двумя, тремя или более атомами галогена. Примеры галоалкильных групп включают фторметил, дифторметил, трифторметил, фторэтил, трифторэтил и трифторпропил.
[0033] Термин "гидрокси" означает группу -ОН.
[0034] Термин "оксо" означает группу =O, и может быть присоединен к атому углерода или атому серы.
[0035] Термин "N-оксид" относится к окисленной форму атома азота.
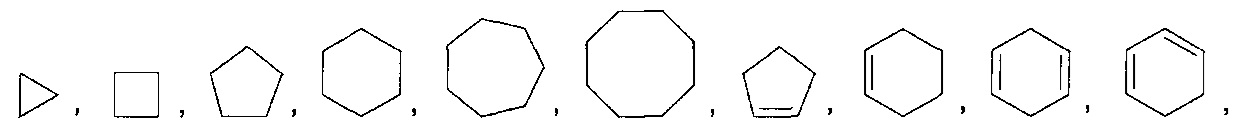
[0036] Как здесь используется, термин "циклоалкил" относится к насыщенному или частично насыщенному, моноциклическому, конденсированному полициклическому, мостиковому полициклическому или спирополициклическому карбоциклу, обладающему от 3 до 15 кольцевых атомов углерода. Неограничивающим типом циклоалкильных групп являются насыщенные или частично насыщенные, моноциклические карбоциклы, обладающие от 3 до 6 атомами углерода. Иллюстративные примеры циклоалкильных групп включают, без ограничения, следующие остатки:
 и
и 
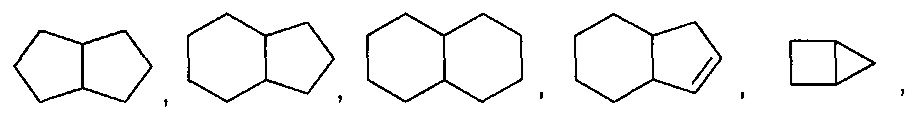
[0037] "Гетероциклоалкил", как здесь используется, относится к моноциклической или конденсированной, мостиковой или спиро полициклической кольцевой структуре, которая является насыщенной или частично насыщенной и обладает от трех до 12 кольцевых атомов, выбранных из атомов углерода и до трех гетероатомов, выбранных из азота, кислорода и серы. Кольцевая структура может возможно содержать до двух оксогрупп на кольцевых атомах углерода или серы, или N-оксид. Иллюстративные гетероциклоалкильные группы включают, без ограничения:
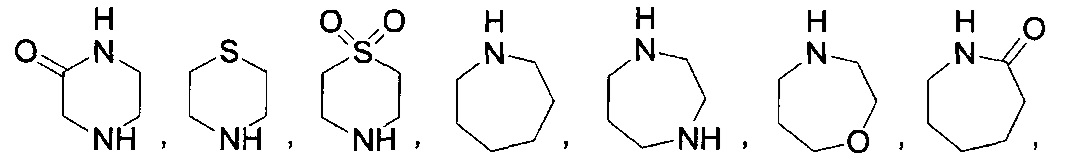
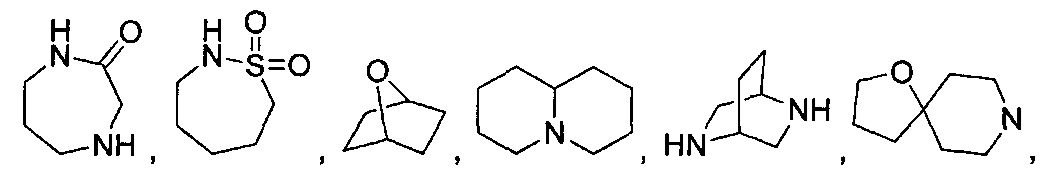
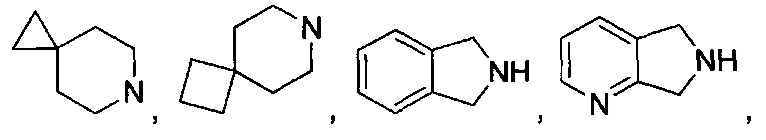 и
и 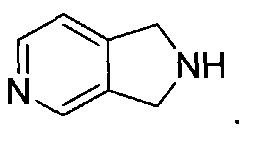
Гетероциклоалкильные группы могут быть углерод-связанные, т.е. они присоединены к остатку молекулы через атом углерода, или азот-связанные, т.е. они присоединены к остатку молекулы через атом азота.
[0038] Как здесь используется, термин "гетероарил" относится к моноциклическому, или конденсированному полициклическому, ароматическому гетероциклу, обладающему от трех до 15 кольцевыми атомами, которые выбраны из углерода, кислорода, азота и серы. Подходящие гетероарильные группы не включают кольцевые системы, которые должны быть заряжены, чтобы быть ароматическими, такие как пирилий. Подходящие 5-членные гетероарильные кольца (такие как моноциклический гетероарил или как часть полициклического гетероарила) одним кольцевым атомом кислорода, серы или азота, или одним азотом плюс одним кислородом или серой, или 2, 3, или 4 кольцевыми атомами азота. Подходящие 6-членные гетероарильные кольца (такие как моноциклический гетероарил или как часть полициклического гетероарила) обладают 1, 2, или 3 кольцевыми атомами азота. Примеры гетероарильных групп включают, без ограничения, пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
[0039] Квалифицированный специалист будет понимать, что молекулы гетероарильных, циклоалкильных и гетероциклоалкильных групп, перечисленных или показанных выше не являются исчерпывающими, и что дополнительные виды в пределах объема этих определенных терминов также могут быть выбраны.
[0040] Как здесь используется, термин "замещенный" означает, что указанная группа или остаток несет один или несколько подходящих заместителей. Как здесь используется, термин "незамещенный" означает, что указанная группа не несет заместителей. Как здесь используется, термин "необязательно замещенный" означает, что указанная группа является незамещенной или замещена указанным количеством заместителей. Там, где термин "замещенный" используется для описания структуры, подразумевается, что замещение может произойти в любом положении системы с учетом доступной валентности
[0041] Как здесь используется, выражение "один или более заместителей" означает от одного до максимально возможного числа замещений, которое может произойти в любом положении системы с учетом доступной валентности. В определенном воплощении изобретения один или более заместителей означает 1, 2, 3, 4, или 5 заместителей. В другом воплощении один или более заместителей означает 1, 2, или 3 заместителя
[0042] Предполагается, что атом, который представлен здесь с незаполненной валентностью, обладает достаточным количеством атомов водорода, чтобы заполнить валентность атома
[0043] Когда любая переменная (например, алкил или Ra) встречается более чем в одном месте, в любой формуле или описании, представленных здесь, значение этой переменной в каждом случае не зависит от ее значения в каждом другом случае
[0044] Численные диапазоны, как здесь используется, предназначены для включения последовательных целых чисел. Например, диапазон, выраженный как "от 0 до 4" или "0-4" включает 0, 1, 2, 3 и 4.
[0045] Когда показан многофункциональный остаток, точка присоединения к остальной части формулы может быть в любой точке многофункционального остатка. В некоторых воплощениях точки присоединения обозначается линией или дефисом. Например, арилокси- относится к остатку, в котором атом кислорода является точкой присоединения к остову молекулы, в то время как арил присоединен к атому кислорода
[0046] Номенклатура, использованная в данном описании для названий соединений настоящего изобретения, иллюстрируется в приведенных здесь примерах. Эта номенклатура в основном была получена с использованием коммерчески доступного программного обеспечения LexiChem TK software (OpenEye, Santa Fe, New Mexico).
[0047] Любая приведенная здесь формула предназначена для представления соединений, имеющих структуры, изображенные структурной формулой, а также некоторые варианты или формы. Например, соединения любой приведенной здесь формулы может иметь асимметричные или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Все стереоизомеры, включая оптические изомеры, энантиомеры и диастереомеры соединений общей формулы и их смеси считаются подпадающими под объем формулы. Кроме того, некоторые структуры могут существовать в виде геометрических изомеров (т.е. цис- и транс-изомеры), в виде таутомеров или в виде атропизомеров. Все такие изомерные формы и их смеси рассматриваются здесь как часть настоящего изобретения. Таким образом, любая формула, приведенная в данном описании предназначена для представления рацемата, одной или более энантиомерных форм, одной или более диастереоизомерных форм, одной или более таутомерных или атропизомерных форм, а также их смесей.
[0048] Соединения, описанные здесь, включают фармацевтически приемлемые солевые формы соединений Формулы I или II. Термин "фармацевтически приемлемая соль" относится к соли в виде свободной кислоты или основания соединения Формулы I или II, которая не является токсичной, является физиологически переносимой, является совместимой с фармацевтической композицией, в которой она сформулирована, и является другими характеристиками подходящей для формулирования и/или введения субъекту. Ссылка на соединение в настоящем описании, понимается как включающая ссылку на фармацевтически приемлемую соль указанного соединения, если не указано иного
[0049] Соли соединений включают кислые соли, образованные с неорганическими и/или органическими кислотами, а также основные соли, образованные неорганическими и/или органическими основаниями. Кроме того, если данное соединение содержит как основную группу, такую как, без ограничения, пиридин или имидазол, так и кислотную группу, такую как, без ограничения, карбоновую кислоту, специалист в данной области техники будет понимать, что соединение может существовать в виде цвиттериона ("внутренняя соль"); такие соли включены в термин "соль", как здесь используется. Соли соединений по изобретению могут быть получены, например, посредством взаимодействия соединения с количеством подходящей кислоты или основания, таким как эквивалентное количество, в среде, такой как та, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией
[0050] Иллюстративные кислотно-аддитивные соли включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидроиодиды изоникотинаты, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты (также называемые тозилаты) и т.д.
[0051] Примеры основных солей включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями (например, органическими аминами), такие как дициклогексиламины, трет-бутиловые амины, а также соли с аминокислотами, такими как аргинин, лизин и т.д.
[0052] Кроме того, кислоты и основания, которые, как правило, считаются подходящими для образования фармацевтически пригодных солей из фармацевтических соединений обсуждаются, например, у Р. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts: Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al., J. Pharm. Sci. (1977) 66(1) 1-19. Эти документы включены сюда посредством ссылки.
[0053] Дополнительно, любое соединение, описанное в настоящем изобретении, предназначено для обозначения также любой несольватированной формы, или гидрата или сольвата такого соединения, а также их смеси, даже если такие формы не указаны в явном виде. "Сольват" означает физическую ассоциацию соединения по изобретению с одной или более молекулами растворителя. Эта физическая ассоциация включает различные степени ионной и ковалентной связи, в том числе водородные связи. В некоторых случаях сольват может быть выделен, например, когда одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. "Сольват" включает как фазу в растворе, так и выделенные сольваты. Подходящие сольваты включают соли, образованные с фармацевтически приемлемыми растворителями, такими как вода, этанол, и т.д. В некоторых воплощениях растворитель представляет собой воду, а сольваты представляют собой гидраты. Соединение Формулы I или II, включая любые гидратные или сольватные формы, может находится в виде кристаллической полиморфной модификации, аморфного твердого вещества, или в нетвердой форме.
[0054] Настоящее изобретение также относится к фармацевтически приемлемым пролекарствам соединений Формулы I или II, и способам лечения с использованием таких фармацевтически приемлемых пролекарств. Термин "пролекарство" означает предшественник назначенного соединения, который после введения субъекту дает соединение в естественных условиях с помощью химического или физиологического процесса, такого как сольволиз или ферментативное расщепление, или в физиологических условиях (например, пролекарство при доведении до физиологического рН превращается в соединение Формулы I или II). "Фармацевтически приемлемое пролекарство" является пролекарством, которое является нетоксичным, биологически терпимой, и другим образом подходящим для формулирования и/или введения субъекту. Иллюстративные методики отбора и получения подходящих пролекарственных производных описаны, например, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Пролекарства включают, без ограничения, сложные эфиры, амиды, сульфонаты и фосфонатные эфиры.
[0055] Настоящее изобретение также относится к фармацевтически активным метаболитам соединений Формулы I или II, и применению таких метаболитов в способах по изобретению. "Фармацевтически активный метаболит" означает фармакологически активный продукт метаболизма соединения Формулы I или II, или его солей в организме. Пролекарства и активные метаболиты соединения могут быть определены с применением обычных техник, известных или доступных в уровне техники. См., например, Bertolini et al., J. Med. Chem. 1997, 40, 2011-2016; Shan et al., J. Pharm. Sci. 1997, 86 (7), 765-767; Bagshawe, Drug Dev. Res. 1995, 34, 220-230; Bodor, Adv. Drug Res. 1984, 13, 255-331; Bundgaard, Design of Prodrugs (Elsevier Press, 1985); и Larsen, Design and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds., Harwood Academic Publishers, 1991).
[0056] Любая формула, представленная здесь, также предназначена как для обозначения меченных изотопами форм соединений, так и для немеченных форм. Меченные изотопами соединения имеют структуры, представленные формулами, приведенными здесь, исключением того, что один или более атомов заменены атомами, имеющими выбранную атомную массу или массовое число. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 2Н, 3Н, 11С, 13С, 14С, 15N, 18О, 17О, 31P, 32P, 35S, 18F, 36Cl, и 125I, соответственно. Такие меченные изотопами соединения могут быть полезны при исследованиях метаболизма (например, С14), исследованиях кинетики реакций (с, например 2Н или 3Н), методах детекции или визуализации [таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ)] включая анализ распределения лекарств или субстратов в тканях, или при радиационном лечении пациентов. В частности, 18F или 11С меченое соединение может быть особенно подходящим для исследований ПЭТ или ОФЭКТ. Кроме того, замещение более тяжелыми изотопами, в частности, дейтерием (т.е. 2H), может давать определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенный в естественных условиях период полураспада или снижение требований дозировки. Меченные изотопами соединения настоящего изобретения и пролекарства обычно могут быть получены путем проведения методик, описанных в схемах или в примерах и препаратах, данных ниже, заменой на легкодоступный меченный изотопом реагент немеченого изотопом реагента. Кроме того, Замещение более тяжелыми изотопами, такими как дейтерий, может давать определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенный в естественных условиях период полураспада или сниженная дозировка. Меченные изотопами соединения по данному изобретению и их пролекарства могут быть получены путем проведения техник, описанных в схемах и в примерах и препаратах, данных ниже, заменой на легкодоступный меченный изотопом реагент немеченого изотопом реагента.
[0057] Использование терминов "соль", "сольват", "полиморф", "пролекарство" и т.д. в отношении соединений, описанных в данном документе, предназначено для применения в равной степени к соли, сольвату, полиморфной модификации и пролекарственной формы энантиомеров, стереоизомеров, ротамеров, таутомеров, атропизомеров и рацематов соединений по изобретению
[0058] Также рассматриваемыми здесь являются способы синтеза соединений Формулы I или II.
Соединения по изобретению
[0059] В некоторых воплощениях (а) Формулы I или (b) Формулы II, Ra представляет собой С1-6алкил возможно замещенный одним или более Rb заместителями. В некоторых воплощениях Ra представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, или изопентил, каждый возможно замещен одним или более Rb заместителями. В некоторых воплощениях Ra представляет собой С1-6алкил возможно замещенный одним или двумя заместителями Rb.
[0060] В некоторых воплощениях каждый Rb независимо представляет собой -ОН, метокси, этокси, -NRdRe, -С(O)NRdRe, тиометил, тиоэтил, метансульфонил, этансульфонил, циано, фтор, хлор, бром, пирролил, пиразолил, имидазолил, фуранил, тиофенил, триазолил, тетразолил, оксазолил, или тиазолил. В других воплощениях каждый Rb независимо представляет собой -ОН, -С(O)NHCH3, -CF3, метокси, этокси, фтор, -С(O)NH2, -С(O)N(СН3)2, -N(СН3)2, метансульфонил, тиометил, циано, пиразолил, 6-окса-1-азаспиро[3.3]гептан-1-ил, азетидинил, 3-гидроксиазетидинил, пирролидинил, или гидроксиэтиламино.
[0061] В других воплощениях Ra представляет собой С1-6алкенил или C1-6алкинил. В некоторых воплощениях Ra представляет собой этенил, изопропенил, или пропинил.
[0062] В некоторых воплощениях Ra представляет собой галоген. В некоторых воплощениях Ra представляет собой бром, хлор, фтор, или йод.
[0063] В других воплощениях Ra представляет собой -C(O)Rc; -NRdRe; -C(O)NRdRe; -C(S)NRdRe; -С(=N-ОН)-С1-4алкил; или -SO2C1-4алкил. В других воплощениях Ra представляет собой -C(O)NRdRe.
[0064] В некоторых воплощениях Rc представляет собой метил, этил, пропил, изопропил, бутил, фторметил, дифторметил, трифторметил, циклопропил, циклобутил, циклопентил, циклогексил, азетидинил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, оксетанил, тетрагидрофуранил, или тетрагидропиранил. В других воплощениях Rc представляет собой этил, циклопропил, метил, оксетанил, или трифторметил.
[0065] В некоторых воплощениях Rd представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, или трет-бутил. В некоторых воплощениях Re представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, цианометил, трифторэтил, гидроксиэтил, 2-гидрокси-1-метилэтил, гидроксипропил, циклопропил, гидрокси, метокси, или оксетанилметил. В других воплощениях Rd и Re взятые вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, оксетанил, тетрагидрофуранил, тетрагидропиранил, или 6-окса-1-азаспиро[3.3]гептан-1-ил, каждый возможно замещен С1-4алкилом или -ОН.
[0066] В других воплощениях Ra представляет собой циано.
[0067] В других воплощениях Ra представляет собой С3-6циклоалкил возможно замещенный одним или более Rf заместителями. В некоторых воплощениях Ra представляет собой циклопропил, циклобутил, циклопентил, или циклогексил, каждый возможно замещен одним или более Rf заместителями. В других воплощениях Ra представляет собой циклопропил, возможно замещенный одним или более заместителями Rf.
[0068] В некоторых воплощениях каждый Rf независимо представляет собой: метил, этил, пропил, или изопропил, каждый возможно замещен -ОН, циано, метокси, или этокси; С1-4фторалкил; -CONH2; или циано. В других воплощениях каждый Rf независимо представляет собой гидроксиметил, метил, циано, трифторметил, цианометил, метоксиметил, фторметил, гидроксиметил, 1-гидрокси-1-метил-этил, или -CONH2.
[0069] В некоторых воплощениях Ra представляет собой фенил, моноциклическое гетероарильное или гетероциклоалкильное кольцо, каждое кольцо возможно замещено одним или более заместителями Rg. В других воплощениях Ra представляет собой фенил, пирролил, фуранил, тиофенил, пиразолил, имидазолил, оксазолил, тиазолил, триазолил, пиридил, пиримидинил, пиридазинил, пиразинил, или пиримидинил, каждый возможно замещен одним или более заместителями Rg. В некоторых воплощениях Ra возможно замещен одним или двумя заместителями Rg. В некоторых воплощениях каждый Rg независимо представляет собой метил, этил, пропил, изопропил, -CF3, фтор, хлор, -NH2, -ОСН3, циано, или -ОН. В других воплощениях каждый Rg независимо представляет собой фтор, метил, -NH2, -CF3, хлор, метокси, или циано.
[0070] В некоторых воплощениях Ra и R1 взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7-членное кольцо, возможно содержащее О или NH, и возможно замещенное одним или более заместителями Rh. В других воплощениях Ra и R1, взятые вместе с атомами углерода, к которым они присоединены, образуют циклопентенил, циклогексенил, дигидрофуранил, дигидропиранил, дигидропирролил, или тетрагидропиридин, каждый возможно замещен одним или более заместителями Rh. В некоторых воплощениях каждый Rh независимо представляет собой: метил, этил, или пропил, каждый возможно замещен гидрокси, циано, метокси, или -С(O)N(СН3)2; -C(O)NRiRj; или циано. В других воплощениях каждый Rh независимо представляет собой гидроксипропил, гидроксиэтил, гидроксиметил, метил, циано, метоксиметил, -С(O)NH2, или -СН2С(O)N(СН3)2. Альтернативно, две группы Rh, присоединенные к одному и тому же атому углерода, взяты вместе с углеродом, к которому они присоединены с образованием циклопентила или карбонила.
[0071] В некоторых воплощениях R1 представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, фторметил, фторметил, трифторметил, фторэтил, трифторэтил, циклопропил, циклобутил, циклопентил, или циклогексил. В других воплощениях R1 представляет собой Н, метил, изопропил, трифторметил, или циклопропил.
[0072] В некоторых воплощениях R2 представляет собой Rm. В других воплощениях R2 представляет собой -ORm. В других воплощениях R2 представляет собой -NRmRn. В некоторых воплощениях Rm представляет собой фенил, нафтил, пиридил, пиразинил, пиридазинил, пирролил, пиразолил, триазолил, имидазолил, фуранил, оксазолил, изоксазолил, тиофенил, тиазолил, изотиазолил, индолил, индазолил, хинолинил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, нафтил, пиридил, индазолил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой пиразолил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm возможно замещен одним или двумя заместителями Rs. В некоторых воплощениях каждый Rs независимо представляет собой метил, этил, пропил, изопропил, бутил, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метокси, этокси, изопропокси, гидроксиметил, гидроксиэтил, трифторметокси, фтор, хлор, бром, йод, циано, циклопропил, циклобутил, циклопентил, циклогексил, -NHSO2C1-2алкил, или -SO2C1-2алкил. В других воплощениях каждый Rs независимо представляет собой фтор, хлор, трифторметил, циано, метил, метокси, циклопропил, -NHSO2CH3, фторэтил, этил, пропил, дифторметил, гидроксиметил, фторметил, или метансульфонил.
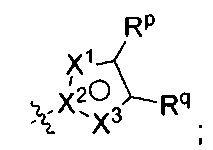
[0073] В других воплощениях R2 представляет собой Rm и Rn представляет собой
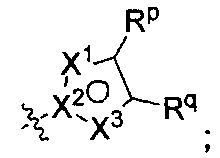
где по меньшей мере один из X1, X2, и X3 представляет собой N, а другие два независимо представляют собой N, NRr, О, S, или C-Rr;
Rp и Rr каждый независимо представляет собой Н; С1-4галоалкил; С1-4алкил возможно замещенный -ОН; галоген; циано; или С3-6циклоалкил; и
Rq представляет собой Н или фтор;
или Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный галогеном.
[0074] В некоторых воплощениях X1 и X2 каждый представляет собой N, a X3 представляет собой C-Rr. В других воплощениях X2 представляет собой N, а X1 и X3 каждый независимо представляет собой C-Rr. В других воплощениях X1, X2, и X3 каждый представляет собой N.
[0075] В некоторых воплощениях Rp и Rr каждый независимо представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метил, этил, гидроксиметил, гидроксиэтил, хлор, циано, циклопропил, циклобутил, или циклопентил. В других воплощениях Rp представляет собой трифторметил, хлор, метил, гидроксиэтил, циклопропил, циано, дифторметил, или этил. В других воплощениях Rr представляет собой этил, трифторметил, метил, хлор, Н, гидроксиэтил, циклопропил, или циано.
[0076] В некоторых воплощениях Rq представляет собой Н или фтор. В других воплощениях Rq и Rr взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный фтором.
[0077] В некоторых воплощениях Rn представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, или трифторэтил, или представляет собой метил или этил, возможно замещенный -ОН, метокси, или этокси. В других воплощениях Rn представляет собой Н, метил, этил, фторэтил, дифторэтил, или трифторэтил.
[0078] В некоторых воплощениях Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют дигидроиндол, возможно замещенный метилом или фтором.
[0079] В некоторых воплощениях R3 представляет собой Н. В других воплощениях R3 представляет собой метил.
[0080] В некоторых воплощениях R4 представляет собой Н. В других воплощениях R4 представляет собой фтор.
[0081] В некоторых воплощениях соединение Формулы (I) представляет собой соединение Формулы (I-A):
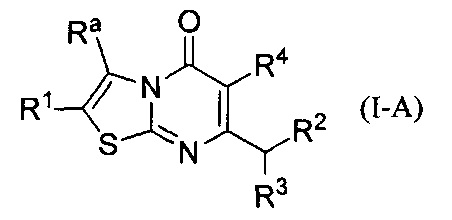
где
Ra представляет собой -C(O)NRdRe;
где Rd представляет собой Н или С1-4алкил;
Re представляет собой Н; С1-4алкил возможно замещенный -CN, -CF3, -ОН, или моноциклическим гетероциклоалкилом; С3-6циклоалкил; -ОН; или -OC1-4алкокси;
или Rd и Re, взятые вместе с атомом азота, к которому они присоединены, образуют гетероциклоалкил, возможно замещенный С1-4алкилом или -ОН;
R1 выбран из группы, состоящей из Н, C1-6алкила; С1-4галоалкила, и С3-6циклоалкила;
R2 представляет собой -Rm, -ORm, или -NRmRn;
где Rm представляет собой арил или гетероарил, каждый возможно замещен одним или более заместителями Rs;
где каждый заместитель Rs независимо выбран из группы, состоящей из C1-4алкила, С1-4галоалкила, С1-4алкокси, С1-4алкил-ОН, С1-4галоалкокси, галогена, циано, С3-6циклоалкила, -NHSO2C1-4алкила, и -SO2C1-4алкила;
Rn представляет собой Н, С1-4галоалкил, или С1-4алкил возможно замещенный -ОН или С1-4алкокси;
или Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или пиперидиновое кольцо, возможно замещенное С1-4алкилом и возможно конденсированное с фенилом, где указанный фенил возможно замещен галогеном;
R3 представляет собой Н или метил; и
R4 представляет собой Н или фтор;
или его фармацевтически приемлемая соль.
[0082] В некоторых воплощениях соединений Формулы (I-А), Rd представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, или трет-бутил. В некоторых воплощениях Re представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, цианометил, трифторэтил, гидроксиэтил, 2-гидрокси-1-метилэтил, гидроксипропил, циклопропил, гидрокси, метокси, или оксетанилметил. В других воплощениях Rd и Re, взятые вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, оксетанил, тетрагидрофуранил, тетрагидропиранил, или 6-окса-1-азаспиро[3.3]гептан-1-ил, каждый возможно замещен С1-4алкилом или -ОН.
[0083] В некоторых воплощениях R1 представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, фторметил, фторметил, трифторметил, фторэтил, трифторэтил, циклопропил, циклобутил, циклопентил, или циклогексил. В других воплощениях R1 представляет собой Н, метил, изопропил, трифторметил, или циклопропил.
[0084] В некоторых воплощениях R2 представляет собой Rm. В других воплощениях R2 представляет собой -ORm. В других воплощениях R2 представляет собой -NRmRn. В некоторых воплощениях Rm представляет собой фенил, нафтил, пиридил, пиразинил, пиридазинил, пирролил, пиразолил, триазолил, имидазолил, фуранил, оксазолил, изоксазолил, тиофенил, тиазолил, изотиазолил, индолил, индазолил, хинолинил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, нафтил, пиридил, индазолил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой пиразолил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm возможно замещен одним или двумя заместителями Rs. В некоторых воплощениях каждый Rs независимо представляет собой метил, этил, пропил, изопропил, бутил, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метокси, этокси, изопропокси, гидроксиметил, гидроксиэтил, трифторметокси, фтор, хлор, бром, йод, циано, циклопропил, циклобутил, циклопентил, циклогексил, -NHSO2C1-2алкил, или -SO2C1-2алкил. В других воплощениях каждый Rs независимо представляет собой фтор, хлор, трифторметил, циано, метил, метокси, циклопропил, -NHSO2CH3, фторэтил, этил, пропил, дифторметил, гидроксиметил, фторметил, или метансульфонил.
[0085] В других воплощениях R2 представляет собой Rm, a Rm представляет собой 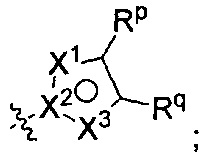
где по меньшей мере один из X1, X2, и X3 представляет собой N, а другие два независимо представляют собой N, NRr, О, S, или C-Rr;
Rp и Rr каждый независимо представляет собой Н; С1-4галоалкил; С1-4алкил возможно замещенный -ОН; галоген; циано; или С3-6циклоалкил; и
Rq представляет собой Н или фтор;
или Rq и Rr взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный галогеном.
[0086] В некоторых воплощениях X1 и X2 каждый представляет собой N, a X3 представляет собой C-Rr. В других воплощениях X2 представляет собой N, а X1 и X3 каждый независимо представляет собой C-Rr. В других воплощениях X1, X2, и X3 каждый представляет собой N.
[0087] В некоторых воплощениях Rp и Rr каждый независимо представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метил, этил, гидроксиметил, гидроксиэтил, хлор, циано, циклопропил, циклобутил, или циклопентил. В других воплощениях Rp представляет собой трифторметил, хлор, метил, гидроксиэтил, циклопропил, циано, дифторметил, или этил. В других воплощениях Rr представляет собой этил, трифторметил, метил, хлор, Н, гидроксиэтил, циклопропил, или циано.
[0088] В некоторых воплощениях Rq представляет собой Н или фтор. В других воплощениях Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный фтором.
[0089] В некоторых воплощениях Rn представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, или трифторэтил, или представляет собой метил или этил, возможно замещенный -ОН, метокси, или этокси. В других воплощениях Rn представляет собой Н, метил, этил, фторэтил, дифторэтил, или трифторэтил.
[0090] В некоторых воплощениях Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют дигидроиндол, возможно замещенный метилом или фтором.
[0091] В некоторых воплощениях R3 представляет собой Н. В других воплощениях R3 представляет собой метил.
[0092] В некоторых воплощениях R4 представляет собой Н. В других воплощениях R4 представляет собой фтор.
[0093] В некоторых воплощениях соединение Формулы (I) представляет собой соединение Формулы (I-B):
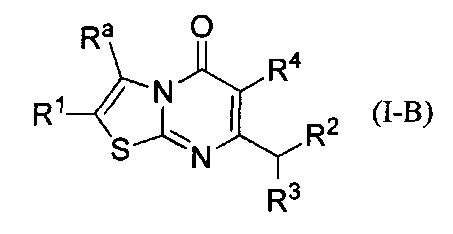
где
Ra представляет собой циклопропил, возможно замещенный одним или более заместителями Rf;
каждый заместитель Rf независимо выбран из группы, состоящей из: С1-4алкила возможно замещенного -ОН, циано, или С1-4алкокси; С1-4галоалкила; -CONH2; и циано; и
R1 выбран из группы, состоящей из Н, С1-6алкила; С1-4галоалкила, и С3-6циклоалкила;
R2 представляет собой -Rm, -ORm, или -NRmRn;
где Rm представляет собой арил или гетероарил, каждый возможно замещен одним или более заместителями Rs;
где каждый заместитель Rs независимо выбран из группы, состоящей из С1-4алкила, С1-4галоалкила, С1-4алкокси, С1-4алкил-ОН, С1-4галоалкокси, галогена, циано, С3-6циклоалкила, -NHSO2C1-4алкила, и -SO2C1-4алкила;
Rn представляет собой Н, С1-4галоалкил, или С1-4алкил возможно замещенный -ОН или С1-4алкокси;
или Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или пиперидиновое кольцо, возможно замещенное С1-4алкилом и возможно конденсированное с фенилом, где указанный фенил возможно замещен галогеном;
R3 представляет собой Н или метил; и
R4 представляет собой Н или фтор;
или его фармацевтически приемлемая соль.
[0094] В некоторых воплощениях Формулы (I-B), каждый Rf независимо представляет собой: метил, этил, пропил, или изопропил, каждый возможно замещен -ОН, циано, метокси, или этокси; С1-4фторалкил; -CONH2; или циано. В других воплощениях каждый Rf независимо представляет собой гидроксиметил, метил, циано, трифторметил, цианометил, метоксиметил, фторметил, гидроксиметил, 1-гидрокси-1-метил-этил, или -CONH2. В некоторых воплощениях Ra представляет собой циклопропил, возможно замещенный одним или двумя заместителями Rf.
[0095] В некоторых воплощениях R1 представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, фторметил, фторметил, трифторметил, фторэтил, трифторэтил, циклопропил, циклобутил, циклопентил, или циклогексил. В других воплощениях R1 представляет собой Н, метил, изопропил, трифторметил, или циклопропил.
[0096] В некоторых воплощениях R2 представляет собой Rm. В других воплощениях R2 представляет собой -ORm. В других воплощениях R2 представляет собой -NRmRn. В некоторых воплощениях Rm представляет собой фенил, нафтил, пиридил, пиразинил, пиридазинил, пирролил, пиразолил, триазолил, имидазолил, фуранил, оксазолил, изоксазолил, тиофенил, тиазолил, изотиазолил, индолил, индазолил, хинолинил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, нафтил, пиридил, индазолил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой пиразолил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm возможно замещен одним или двумя заместителями Rs. В некоторых воплощениях каждый Rs независимо представляет собой метил, этил, пропил, изопропил, бутил, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метокси, этокси, изопропокси, гидроксиметил, гидроксиэтил, трифторметокси, фтор, хлор, бром, йод, циано, циклопропил, циклобутил, циклопентил, циклогексил, -NHSO2C1-2алкил, или -SO2C1-2алкил. В других воплощениях каждый Rs независимо представляет собой фтор, хлор, трифторметил, циано, метил, метокси, циклопропил, -NHSO2CH3, фторэтил, этил, пропил, дифторметил, гидроксиметил, фторметил, или метансульфонил.
[0097] В других воплощениях R2 представляет собой Rm, a Rm представляет собой 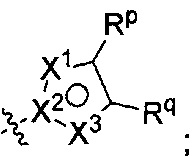
где по меньшей мере один из X1, X2, и X3 представляет собой N, а другие два независимо представляют собой N, NRr, О, S, или C-Rr;
Rp и Rr каждый независимо представляет собой Н; С1-4галоалкил; С1-4алкил возможно замещенный -ОН; галоген; циано; или С3-6циклоалкил; и
Rq представляет собой Н или фтор;
или Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены образуют фенил, возможно замещенный галогеном.
[0098] В некоторых воплощениях X1 и X2 каждый представляет собой N, a X3 представляет собой С-Rr. В других воплощениях X2 представляет собой N, а X1 и X3 каждый независимо представляет собой C-Rr. В других воплощениях X1, X2, и X3 каждый представляет собой N.
[0099] В некоторых воплощениях Rp и Rr каждый независимо представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метил, этил, гидроксиметил, гидроксиэтил, хлор, циано, циклопропил, циклобутил, или циклопентил. В других воплощениях Rp представляет собой трифторметил, хлор, метил, гидроксиэтил, циклопропил, циано, дифторметил, или этил. В других воплощениях Rr представляет собой этил, трифторметил, метил, хлор, Н, гидроксиэтил, циклопропил, или циано.
[00100] В некоторых воплощениях Rq представляет собой Н или фтор. В других воплощениях Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный фтором.
[0100] В некоторых воплощениях Rn представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, или трифторэтил, или представляет собой метил или этил, возможно замещенный -ОН, метокси, или этокси. В других воплощениях Rn представляет собой Н, метил, этил, фторэтил, дифторэтил, или трифторэтил.
[0101] В некоторых воплощениях Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют дигидроиндол, возможно замещенный метилом или фтором.
[0102] В некоторых воплощениях R3 представляет собой Н. В других воплощениях R3 представляет собой метил.
[0103] В некоторых воплощениях R4 представляет собой Н. В других воплощениях R4 представляет собой фтор.
[0104] В некоторых воплощениях соединение Формулы (I) представляет собой соединение Формулы (I-C):
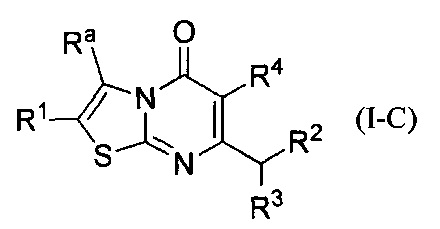
Ra представляет собой моноциклическое гетероарильное кольцо, возможно замещенное одним или более заместителями Rg;
каждый заместитель Rg независимо выбран из группы, состоящей из С1-4алкила, -CF3, галогена, -NH2, -ОСН3, циано, и -ОН;
R1 выбран из группы, состоящей из Н, C1-6алкила; С1-4галоалкила, и С3-6циклоалкила;
R2 представляет собой -Rm, -ORm, или -NRmRe;
где Rm представляет собой арил или гетероарил, каждый возможно замещен одним или более заместителями Rs заместителями;
где каждый заместитель Rs независимо выбран из группы, состоящей из C1-4алкила, С1-4галоалкила, С1-4алкокси, С1-4алкил-ОН, С1-4галоалкокси, галогена, циано, С3-6циклоалкила, -NHSO2C1-4алкила, и -SO2C1-4алкила;
Rn представляет собой Н, С1-4галоалкил, или С1-4алкил возможно замещенный -ОН или С1-4алкокси;
или Rm и Rn, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидиновое или пиперидиновое кольцо, возможно замещенное С1-4алкилом и возможно конденсированное с фенилом, где указанный фенил возможно замещен галогеном;
R3 представляет собой Н или метил; и
R4 представляет собой Н или фтор;
или его фармацевтически приемлемая соль.
[0105] В некоторых воплощениях Формулы (I-C), Ra представляет собой пирролил, фуранил, тиофенил, пиразолил, имидазолил, оксазолил, тиазолил, триазолил, пиридил, пиримидинил, пиридазинил, пиразинил, или пиримидинил, каждый возможно замещен одним или более заместителями Rg. В некоторых воплощениях Ra возможно замещен одним или двумя заместителями Rg. В некоторых воплощениях каждый Rg независимо представляет собой метил, этил, пропил, изопропил, -CF3, фтор, хлор, -NH2, -ОСН3, циано, или -ОН. В других воплощениях каждый Rg независимо представляет собой фтор, метил, -NH2, -CF3, хлор, метокси, или циано.
[0106] В некоторых воплощениях R1 представляет собой Н, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, фторметил, фторметил, трифторметил, фторэтил, трифторэтил, циклопропил, циклобутил, циклопентил, или циклогексил. В других воплощениях R1 представляет собой Н, метил, изопропил, трифторметил, или циклопропил.
[0107] В некоторых воплощениях R2 представляет собой Rm. В других воплощениях R2 представляет собой -ORm. В других воплощениях R2 представляет собой -NRmRn. В некоторых воплощениях Rm представляет собой фенил, нафтил, пиридил, пиразинил, пиридазинил, пирролил, пиразолил, триазолил, имидазолил, фуранил, оксазолил, изоксазолил, тиофенил, тиазолил, изотиазолил, индолил, индазолил, хинолинил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, нафтил, пиридил, индазолил, или изохинолинил, каждый возможно замещен одним или более заместителями Rs. В других воплощениях Rm представляет собой пиразолил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm представляет собой фенил, возможно замещенный одним или более заместителями Rs. В других воплощениях Rm возможно замещен одним или двумя заместителями Rs. В некоторых воплощениях каждый Rs независимо представляет собой метил, этил, пропил, изопропил, бутил, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метокси, этокси, изопропокси, гидроксиметил, гидроксиэтил, трифторметокси, фтор, хлор, бром, йод, циано, циклопропил, циклобутил, циклопентил, циклогексил, -NHSO2C1-2алкил, или -SO2C1-2алкил. В других воплощениях каждый Rs независимо представляет собой фтор, хлор, трифторметил, циано, метил, метокси, циклопропил, -NHSO2CH3, фторэтил, этил, пропил, дифторметил, гидроксиметил, фторметил, или метансульфонил.
[0108] В других воплощениях R2 представляет собой Rm, а Rm представляет собой 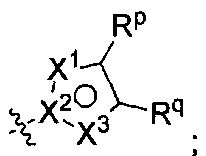
где по меньшей мере один из X1, X2, и X3 представляет собой N, а другие два независимо представляют собой N, NRr, О, S, или C-Rr;
Rp и Rr каждый независимо представляет собой Н; С1-4галоалкил; С1-4алкил возможно замещенный -ОН; галоген; циано; или С3-6циклоалкил; и
Rq представляет собой Н или фтор;
или Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный галогеном.
[0109] В некоторых воплощениях X1 и X2 каждый представляет собой N, а X3 представляет собой C-Rr. В других воплощениях X2 представляет собой N, а X1 и X3 каждый независимо представляет собой C-Rr. В других воплощениях X1, X2, и X3 каждый представляет собой N.
[0110] В некоторых воплощениях Rp и Rr каждый независимо представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, трифторэтил, метил, этил, гидроксиметил, гидроксиэтил, хлор, циано, циклопропил, циклобутил, или циклопентил. В других воплощениях Rp представляет собой трифторметил, хлор, метил, гидроксиэтил, циклопропил, циано, дифторметил, или этил. В других воплощениях Rr представляет собой этил, трифторметил, метил, хлор, Н, гидроксиэтил, циклопропил, или циано.
[0111] В некоторых воплощениях Rq представляет собой Н или фтор. В других воплощениях Rq и Rr, взятые вместе с атомами углерода, к которым они присоединены, образуют фенил, возможно замещенный фтором.
[0112] В некоторых воплощениях Rn представляет собой Н, фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, или трифторэтил, или представляет собой метил или этил, возможно замещенный -ОН, метокси, или этокси. В других воплощениях Rn представляет собой Н, метил, этил, фторэтил, дифторэтил, или трифторэтил.
[0113] В некоторых воплощениях Rm и Rn взятые вместе с атомом азота, к которому они присоединены, образуют дигидроиндол, возможно замещенный метилом или фтором.
[0114] В некоторых воплощениях R3 представляет собой Н. В других воплощениях R3 представляет собой метил.
[0115] В некоторых воплощениях R4 представляет собой Н. В других воплощениях R4 представляет собой фтор.
[0116] В некоторых воплощениях соединения, описанные здесь, являются соединениями Формулы II или их фармацевтически приемлемые соли. Соединения Формулы II включают такие, в которых каждая переменная определена независимо, как здесь описано для Формулы I, I-A, I-B, или I-C, или комбинации указанных определений. Дополнительные воплощения Формулы II включают соединения, в которых Ra представляет собой -SCH3, -СН2-циклопропил, дифторциклопропил, гидроксициклопропил, -OCH2CF3, -СН=СН-CN, или -СН=СН-CONH2. Дополнительные воплощения Формулы II включают соединения, в которых R1 представляет собой хлор, метокси, циано, этокси, трифторэтокси, или ацетил. Дополнительные воплощения Формулы II включают соединения, в которых Rs представляет собой фтор-изопропенил, этинил, гидроксициклопропил, фторциклопропил, -NH2, -NO2, или тиазолил.
[0117] В других воплощениях соединения представляют собой соединения Формулы III:
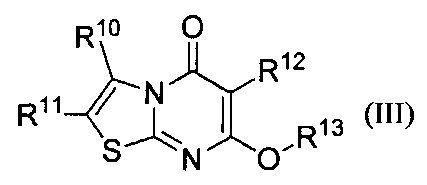
где:
R10 представляет собой С1-4алкил, С1-4галоалкил, или циано, или С3-6циклоалкил возможно замещенный -С1-4алкил-ОН,
R11 представляет собой С1-4алкил; или R10 и R11, взятые вместе с атомами углерода, к которым они присоединены, образуют С5-6циклоалкил;
R12 представляет собой -Н или галоген; и
R13 представляет собой фенил, возможно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, С1-4галоалкила, и циано;
и их фармацевтически приемлемые соли.
[0118] Дополнительные воплощения включают фармацевтические композиции, содержащие по меньшей мере одно соединение Формулы III, или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент, и способ лечения субъекта, страдающего от заболевания или медицинского состояния, опосредованных активностью рецепторов NMDA, содержащий введение субъекту, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения Формулы III, или его фармацевтически приемлемой соли.
[0119] Воплощения настоящего изобретения также включают соединения, в которых каждая переменная определена независимо, как описано выше.
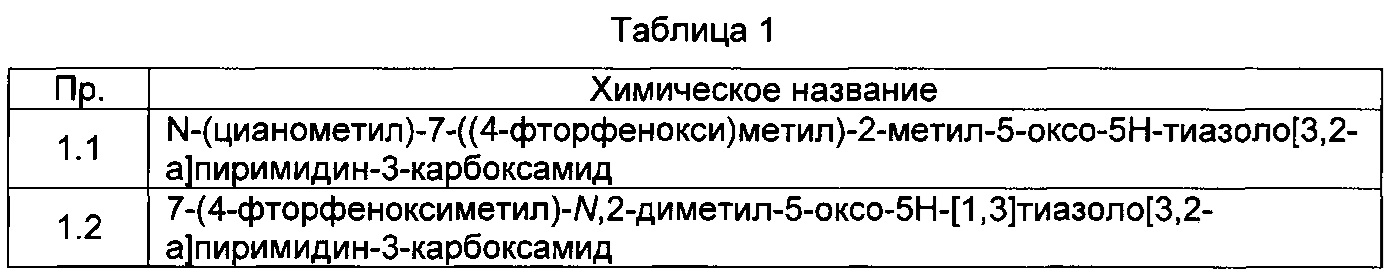
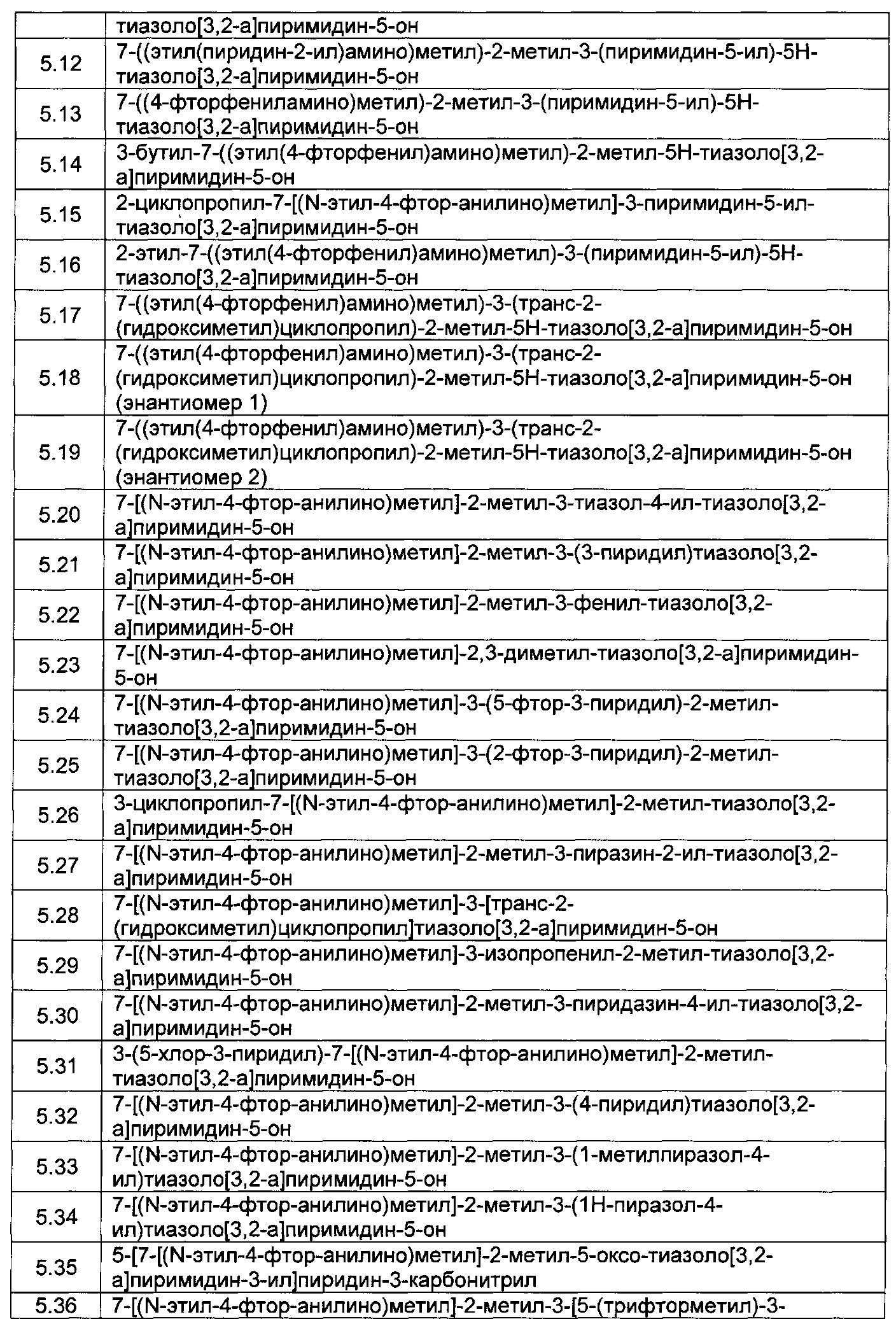
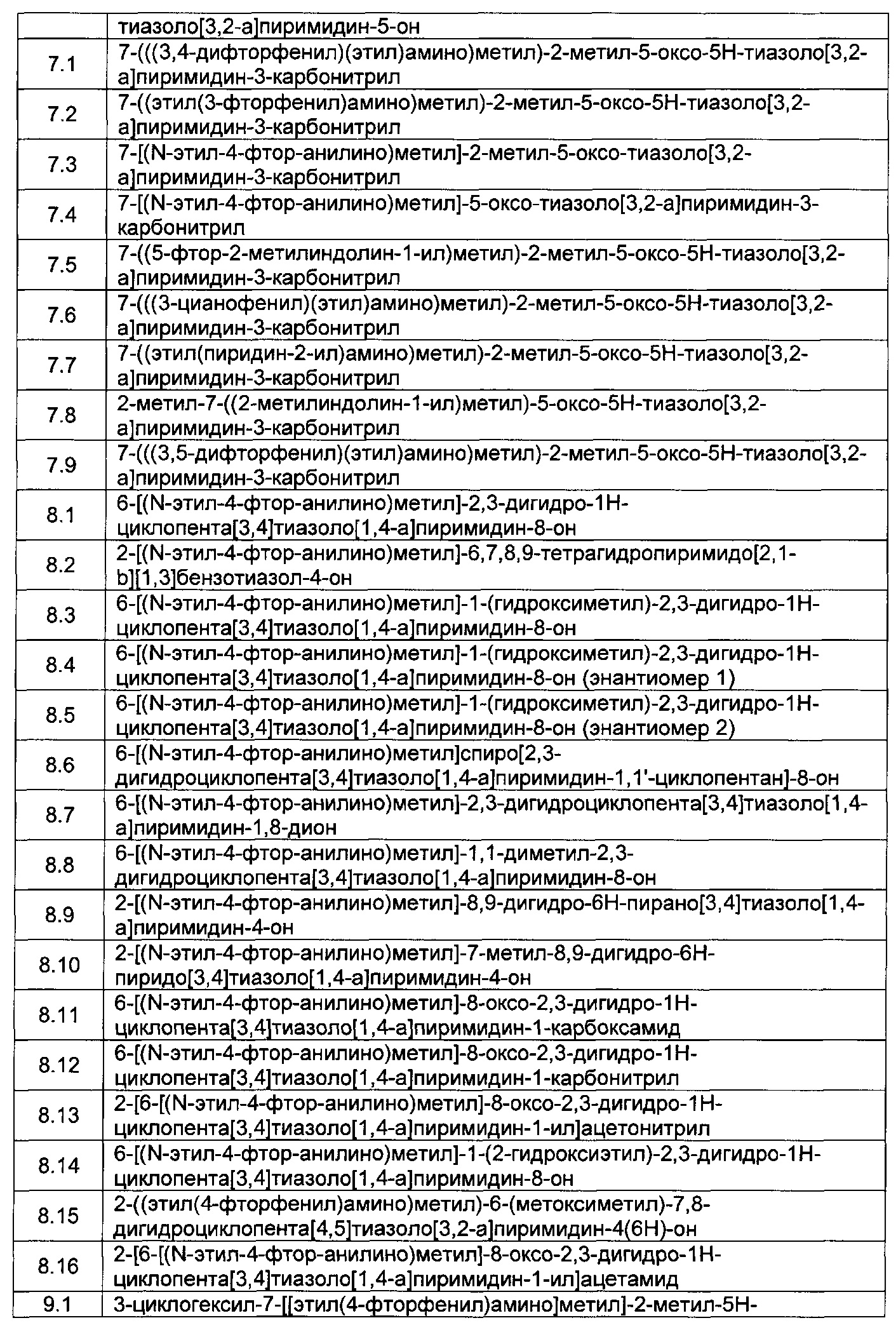
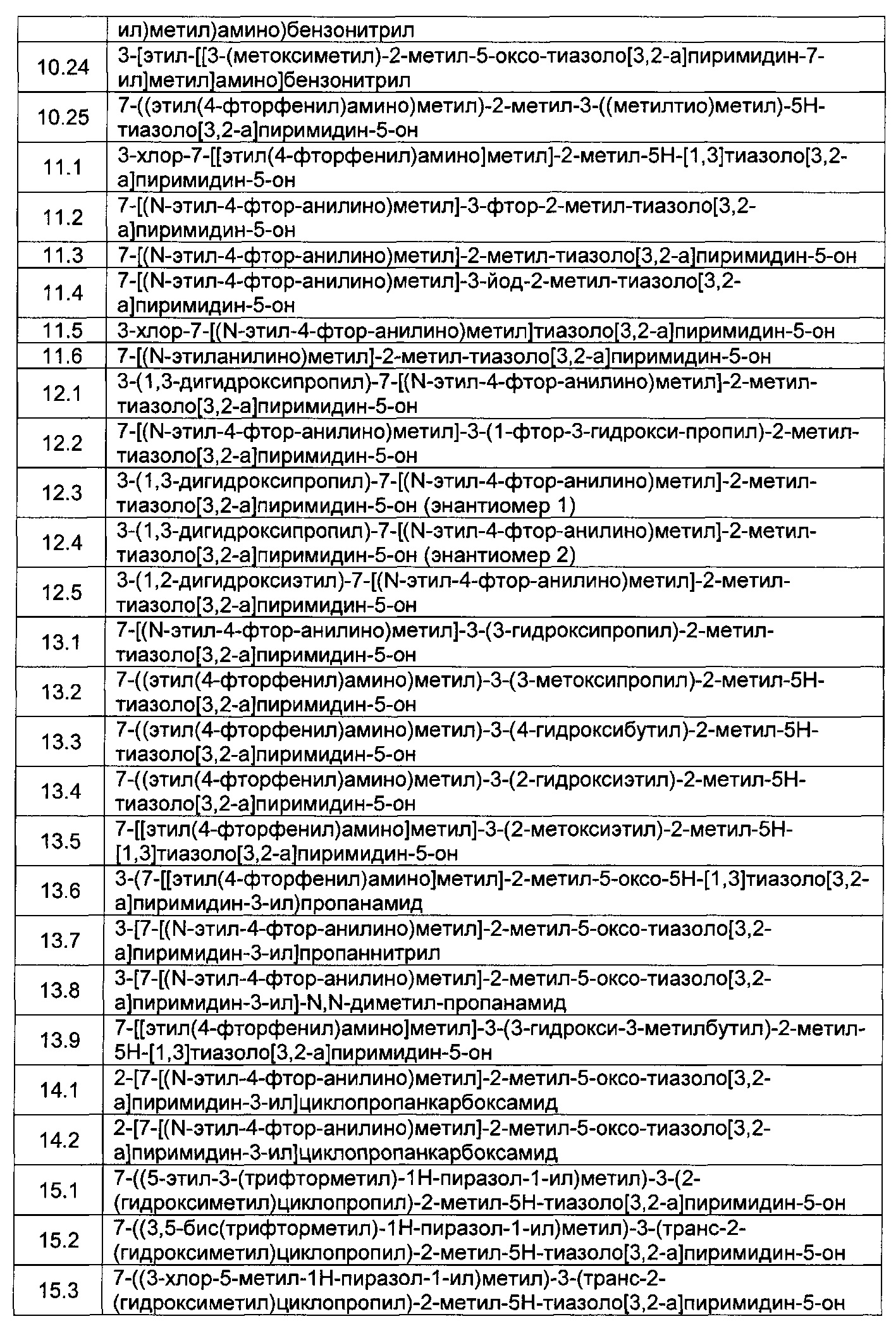
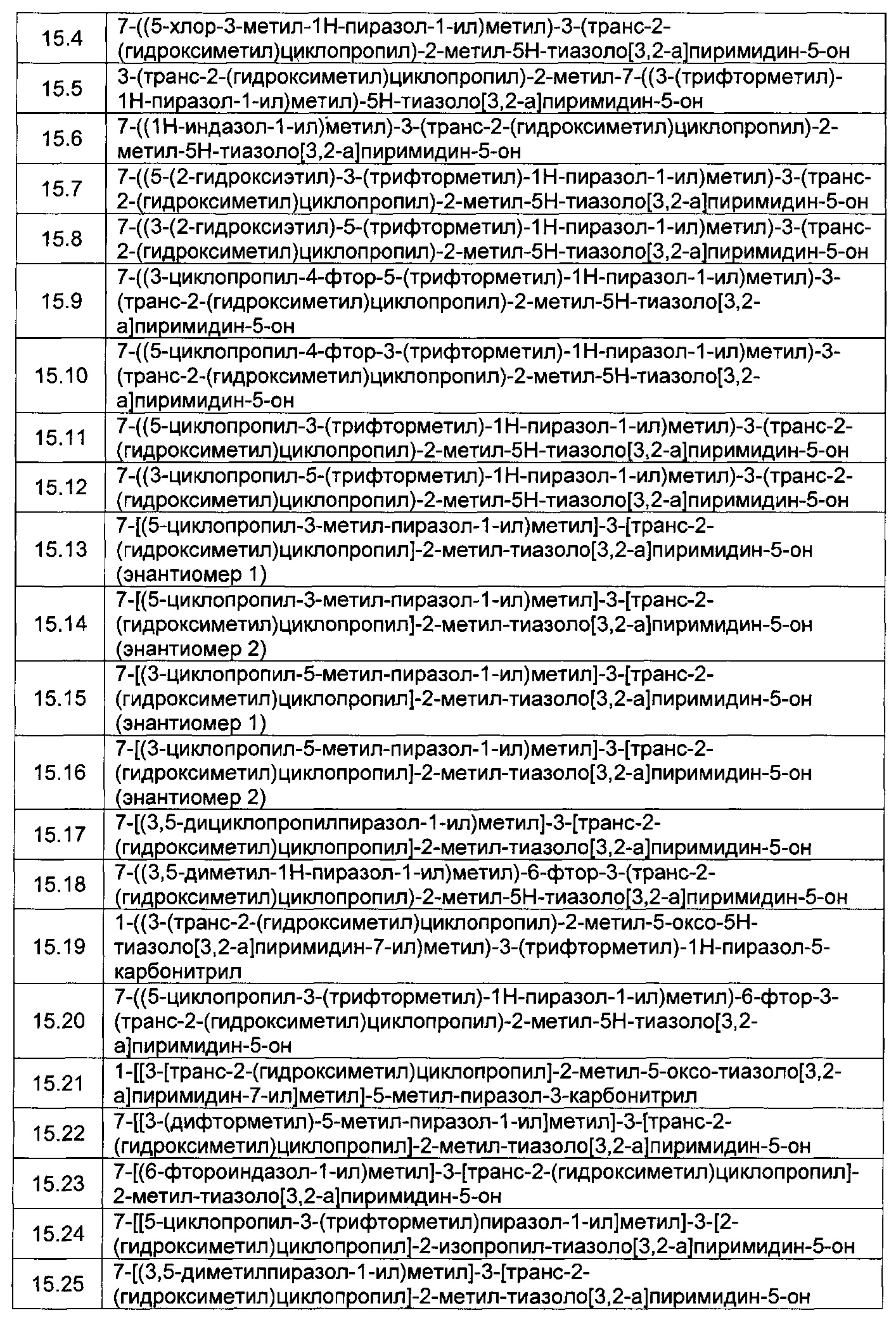
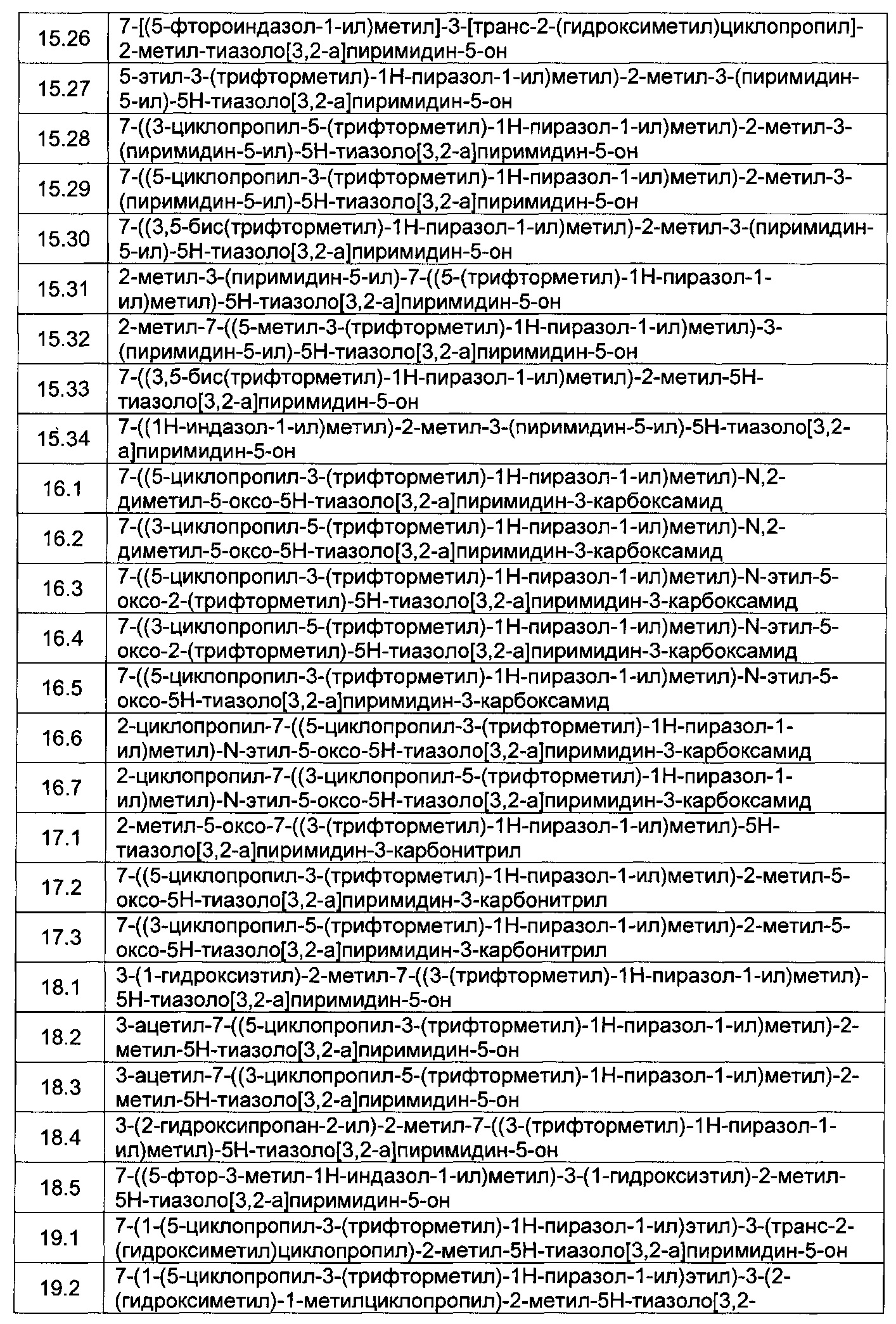
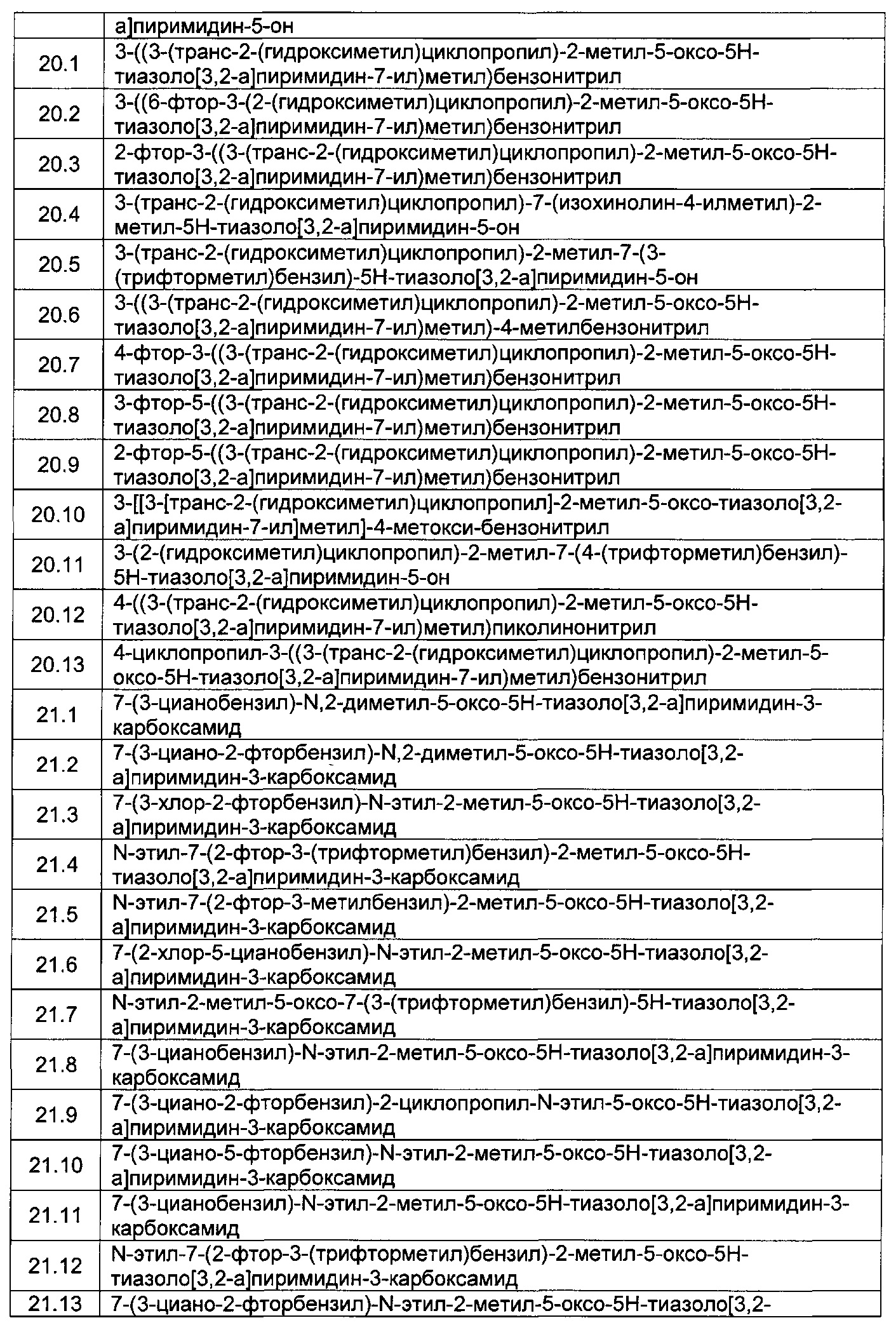
[0120] В некоторых воплощениях соединение Формулы I или II представляет собой соединение, выбранное из группы, состоящей из соединений в Таблице 1, и их фармацевтически приемлемых солей:





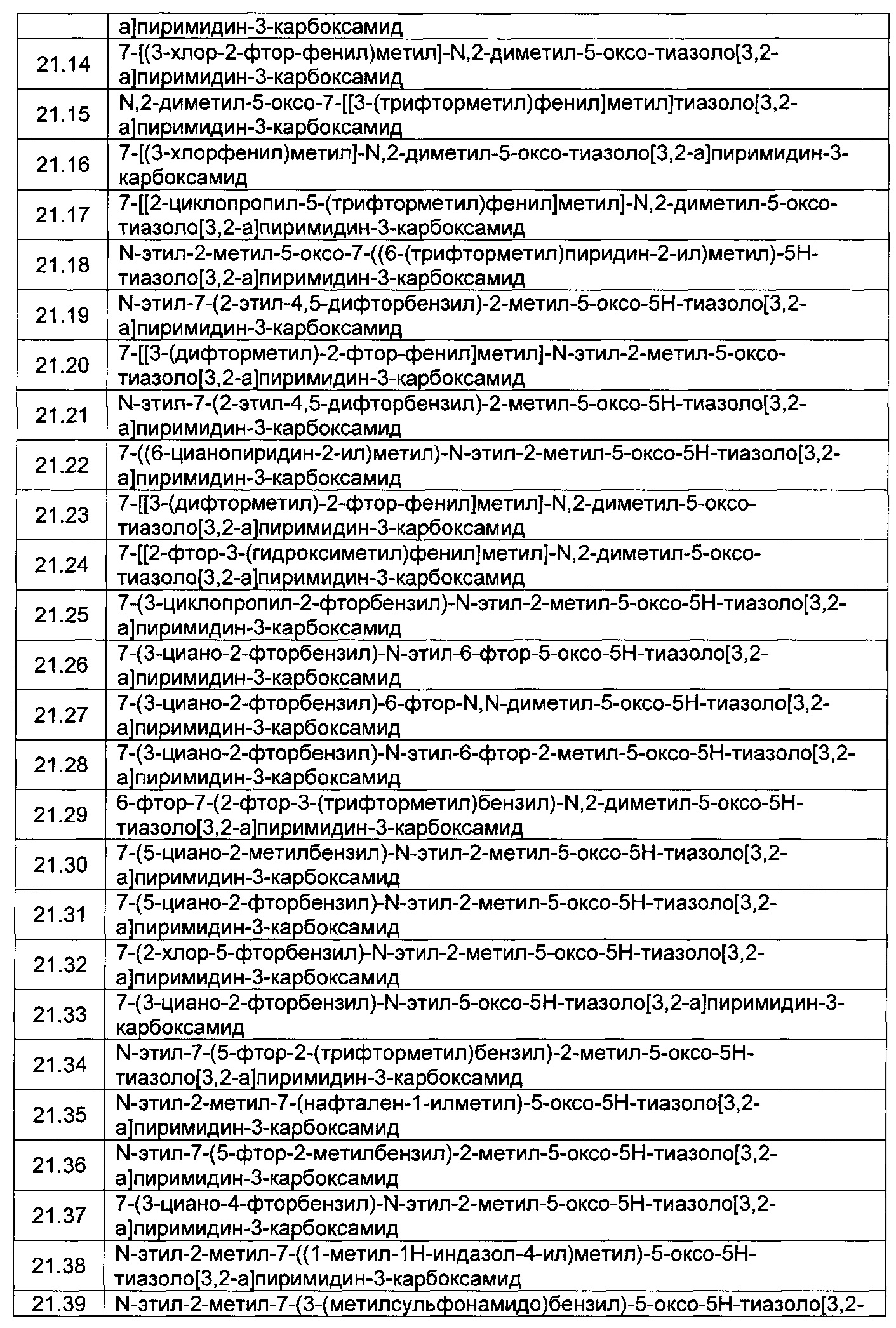
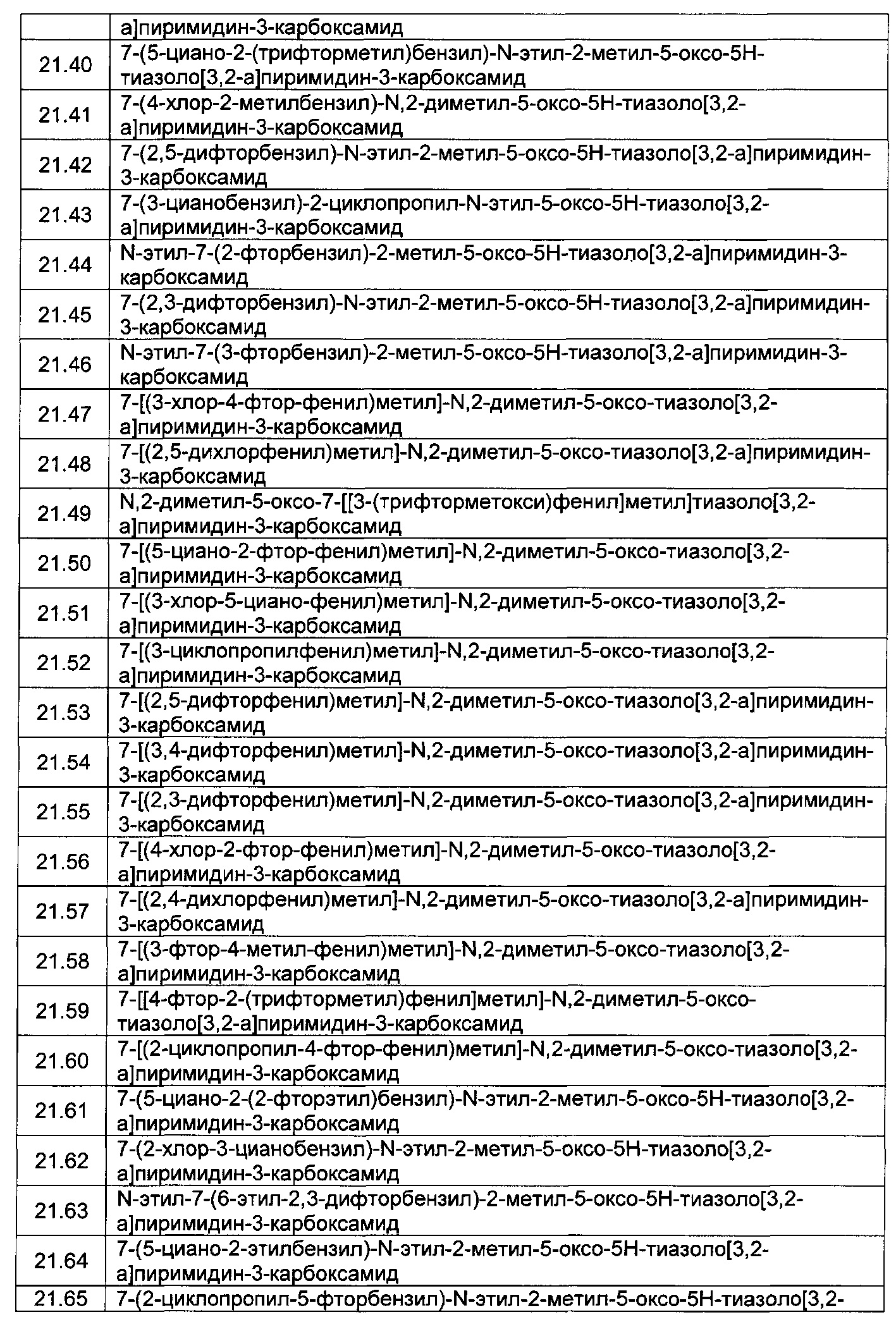


[0121] В некоторых воплощениях соединение Формулы I или II представляет собой соединение, выбранное из группы, состоящей из соединений в Таблице 2, и их фармацевтически приемлемых солей:


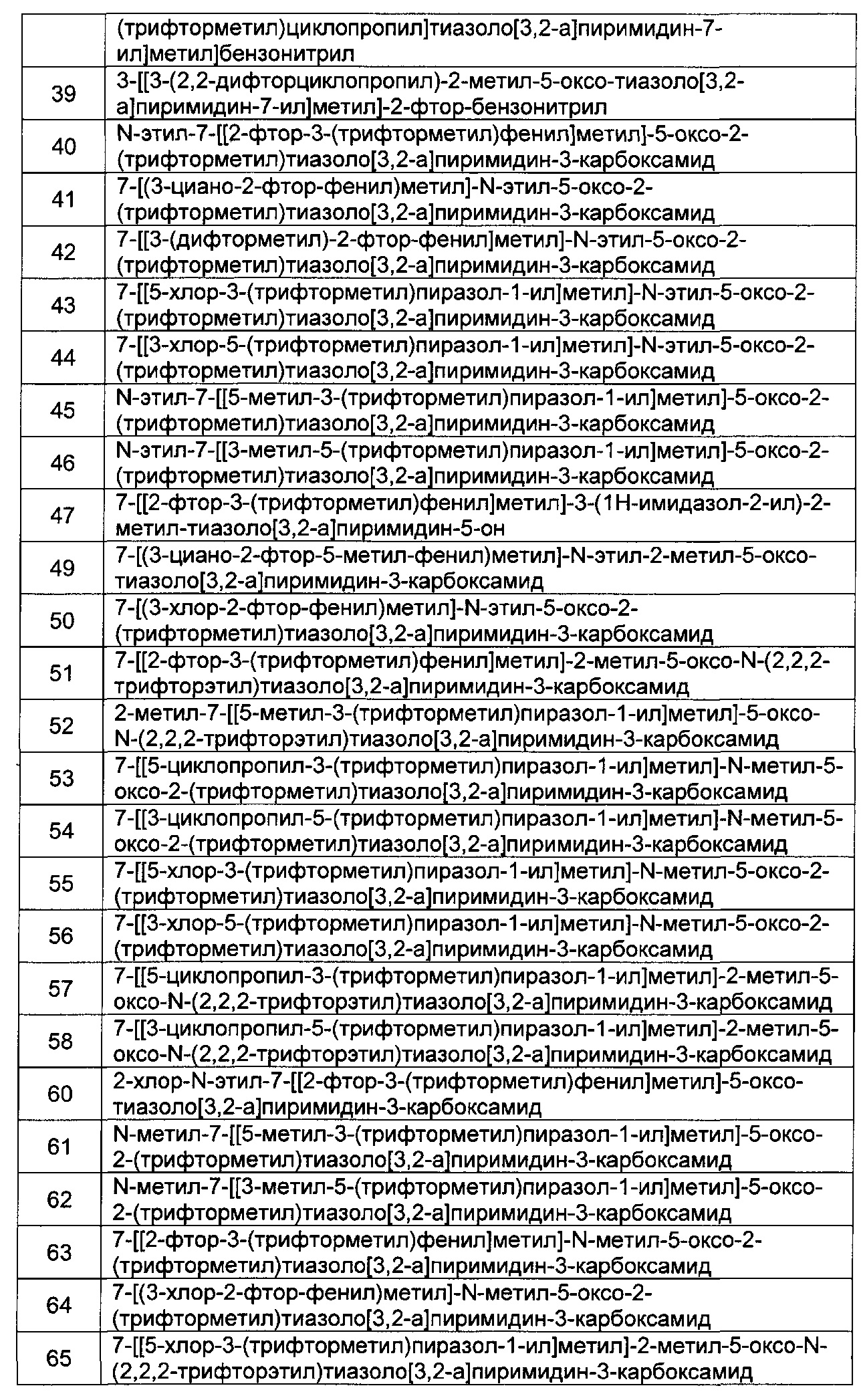

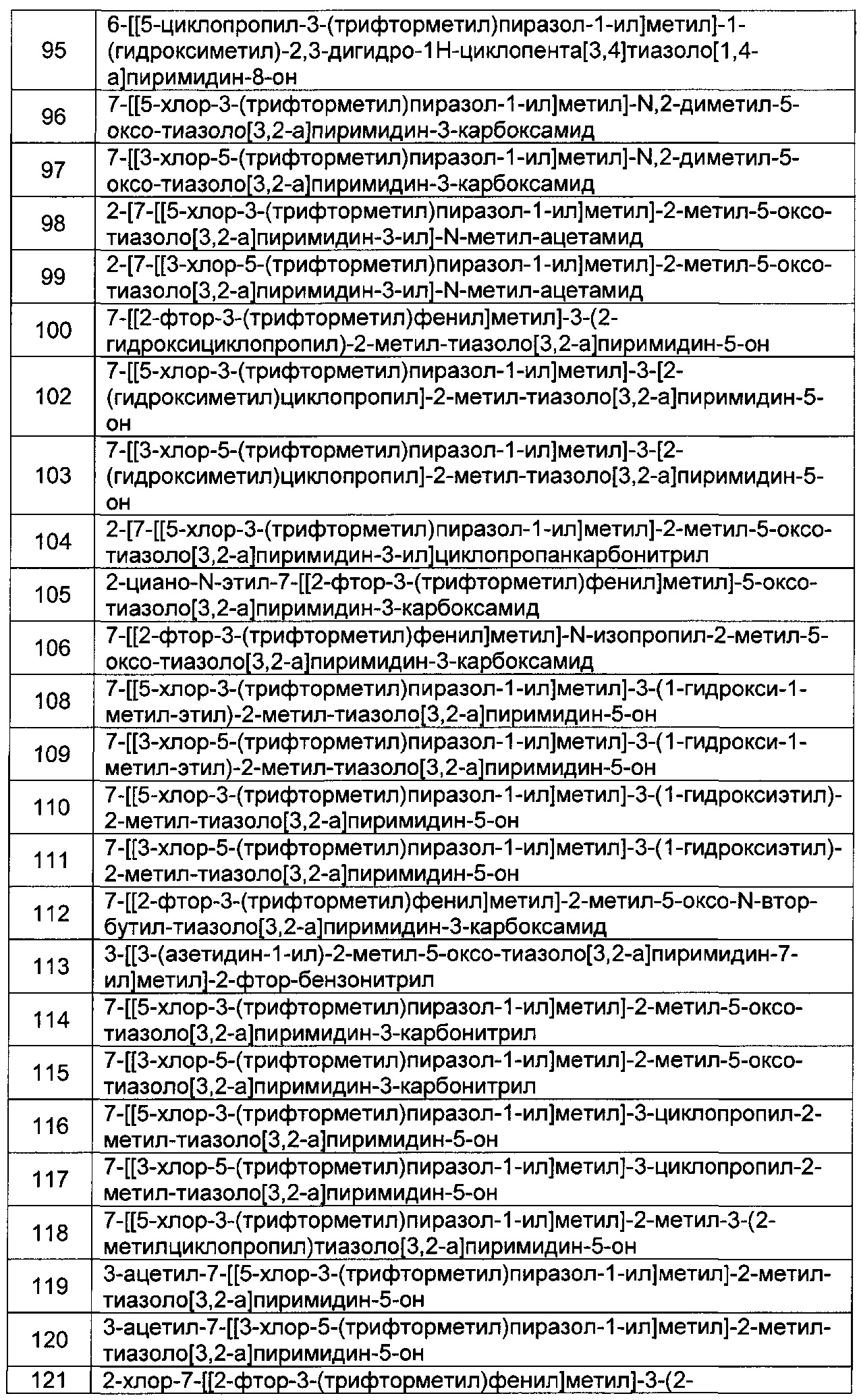
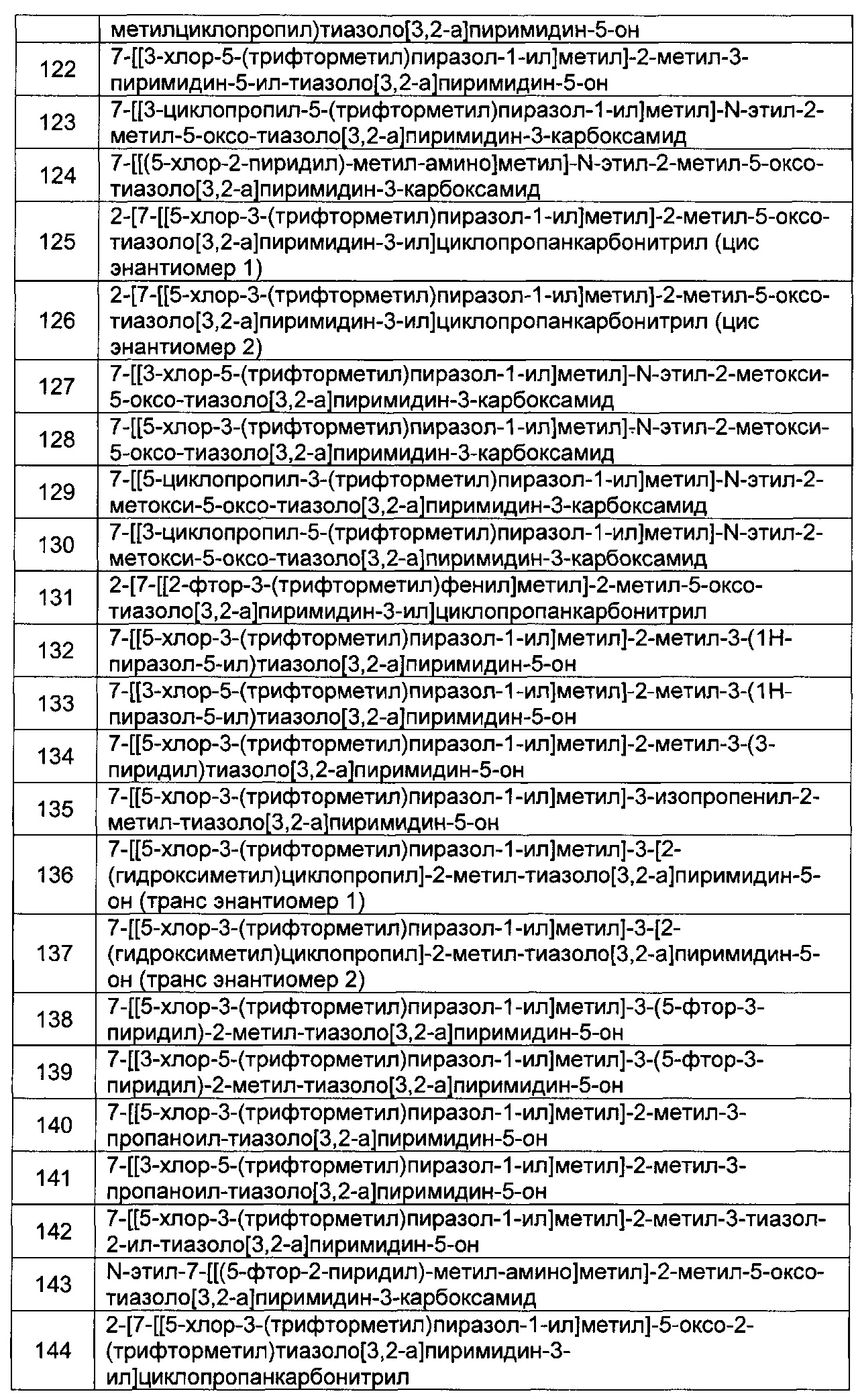


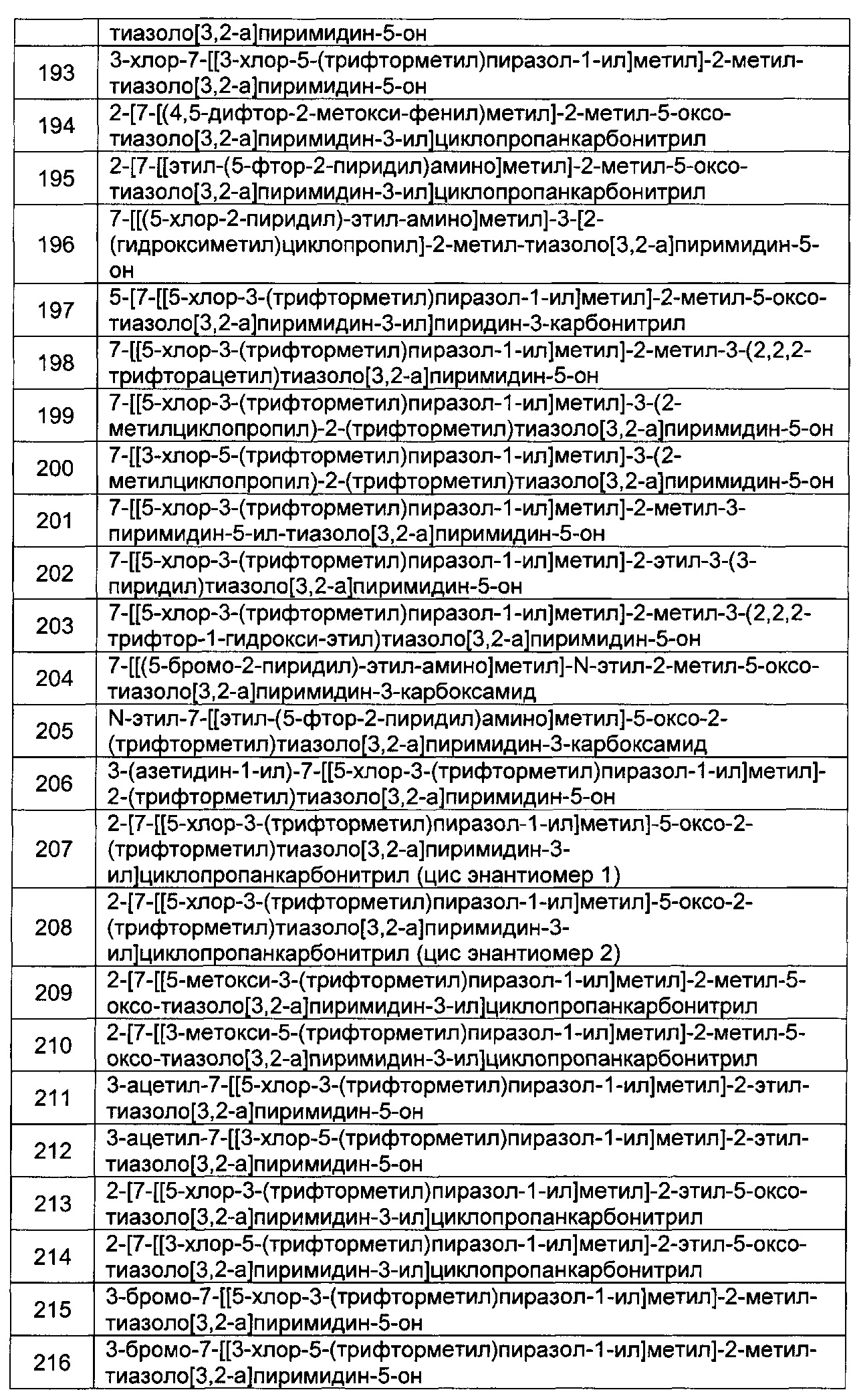
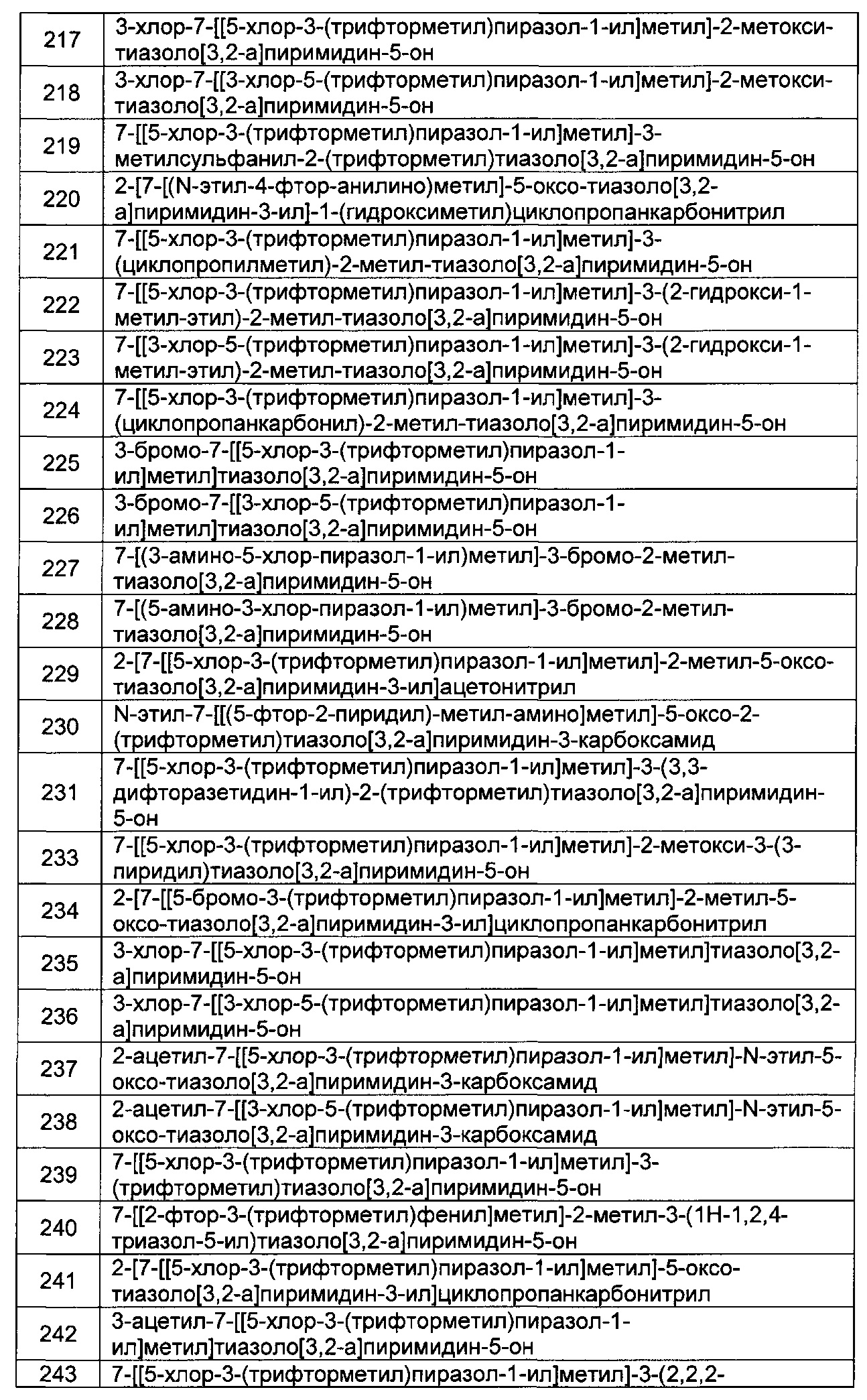

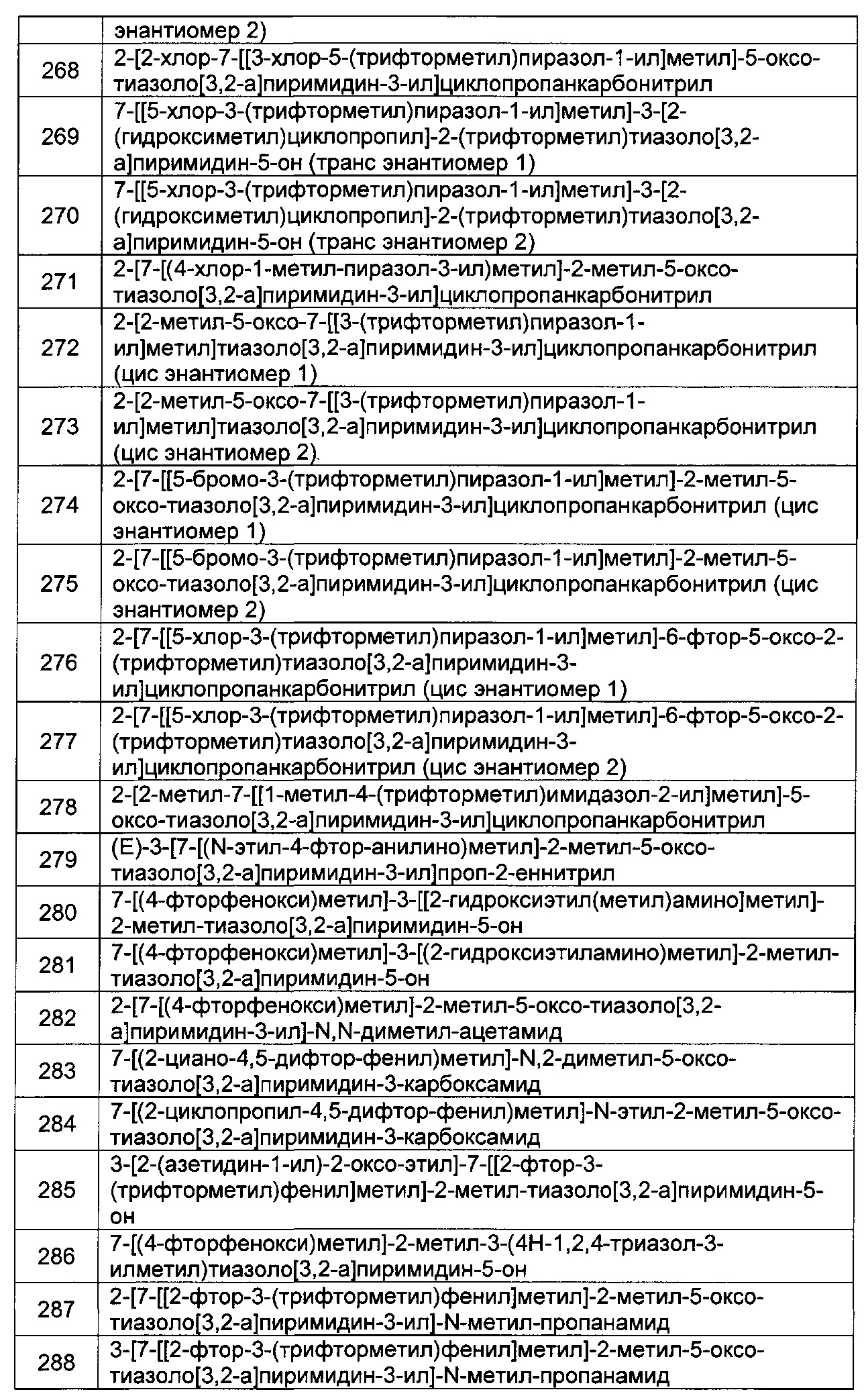




[0122] В некоторых воплощениях соединение Формулы III представляет собой соединение, выбранное из группы, состоящей из соединений в Таблице 3, и их фармацевтически приемлемых солей:

Фармацевтическое описание
[0123] Как здесь используется, термин "субъект" включает млекопитающих и немлекопитающих. Примеры млекопитающих включают, без ограничения, любой представитель класса млекопитающих: людей; не относящихся к человеку приматов, таких как шимпанзе и другие виды обезьян и мартышек; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; и лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и т.д. Примеры немлекопитающих включают, без ограничения, птиц, рыб и т.д. В одном воплощении настоящего изобретения, млекопитающее является человеком.
[0124] "Пациент" охватывает человека или животное.
[0125] Термин "ингибитор" относится к молекуле, такой как соединение, лекарство, активатор фермента или гормон, которая блокирует или другим образом нарушает конкретную биологическую активность.
[0126] Термин "модулятор" относится к молекуле, такой как соединение настоящего изобретения, которая увеличивает или уменьшает, или другим образом влияет на активность данного фермента или белка.
[0127] Как здесь используется, термины "лечить" или "лечение" охватывают как "профилактическое", так и "терапевтическое" лечение. "Профилактическое" лечение предназначено для обозначения отсрочки развития заболевания, симптома заболевания, или медицинского состояния, подавляя симптомы, которые могут возникнуть, или уменьшая риск развития или рецидива заболевания или симптомов. "Терапевтическое" лечение включает снижение тяжести или торможение ухудшения существующего заболевания, симптома или состояния. Таким образом, лечение включает в себя ослабление или предотвращение ухудшения существующих симптомов заболевания, предотвращение возникновения дополнительных симптомов, ослабление или предотвращение основных метаболических причин симптомов, ингибирование расстройства или заболевания, например, прекращение развития расстройства или заболевания, облегчение расстройства или заболевания, регрессию расстройства или заболевания, облегчение состояния, вызванного заболеванием или расстройством, или замедление симптомов заболевания или расстройства.
[0128] Термины "эффективное количество" или "терапевтически эффективное количество" относятся к достаточному количеству агента для получения желаемого биологического результата. Этим результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания или медицинского состояния, или любое другое желаемое изменение биологической системы. Например, "эффективное количество" для терапевтического применения является количеством соединения или композиции, содержащей соединение, которое требуется для получения клинически значимых изменений в состоянии заболевания, симптомах или медицинском состоянии. Соответствующее "эффективное" количество в каждом отдельном случае может быть определено квалифицированным специалистом в данной области техники с использованием обычного экспериментирования. Таким образом, выражение "эффективное количество", как правило, относится к количеству, при котором активное вещество имеет терапевтически желаемый эффект. Эффективные количества или дозы соединений воплощений настоящего изобретения могут быть установлены с помощью обычных способов, таких как моделирование, эскалация дозы или клинические исследования с учетом обычных факторов, например, способа или пути введения или доставки лекарственных средств, фармакокинетики агента, тяжести и течения инфекции, состояния здоровья субъекта, состояния и веса, а также мнения лечащего врача. Примерная доза находится в пределах от около 1 мкг до 2 мг активного агента на килограмм массы тела субъекта в сутки, предпочтительно приблизительно от 0,05 до 100 мг/кг/день, или примерно от 1 до 35 мг/кг/день, или около от 0,1 до 10 мг/кг/сут. Общая доза может быть дана в виде одной или раздельных единиц дозировки (например, BID, TID, QID).
[0129] После того, как произошло улучшение заболевания у пациента, доза может быть скорректирована для профилактического или поддерживающего лечения. Например, доза или частота введения, или оба компонента могут быть уменьшены в зависимости от симптомов, до уровня, при котором обеспечивается желаемый терапевтический или профилактический эффект. Конечно, если симптомы были облегчены до подходящего уровня, лечение может быть прекращено. Пациенты могут, однако, нуждаться в периодическом лечении на долговременной основе при любом рецидиве симптомов. Пациенты могут также нуждаться в хроническом лечении на долгосрочной основе.
[0130] Фармацевтическая композиция по настоящему изобретению содержит по меньшей мере одно соединение Формулы (I) или его фармацевтически приемлемую соль. Фармацевтические композиции могут дополнительно содержать один или более фармацевтически приемлемых наполнителей. Фармацевтически приемлемый наполнитель представляет собой вещество, которое является нетоксичным и другим образом биологически пригодно для введения субъекту. Такие наполнители облегчают введение соединений, описанных здесь, и совместимы с активным ингредиентом. Примеры фармацевтически приемлемых наполнителей включают стабилизаторы, смазывающие вещества, вещества предотвращающие слипание, вещества способствующие скольжению, поверхностно-активные вещества, разбавители, антиоксиданты, связывающие вещества, хелатирующие агенты, покрывающие агенты, красители, наполнители, эмульгаторы, буферы, модификаторы рН, или модифицирующие вкус агенты. В предпочтительных вариантах осуществления, фармацевтические композиции в соответствии с воплощениями настоящего изобретения являются стерильными композициями. Стерильные композиции включают композиции, которые находятся в соответствии с национальными и местными правилами, регулирующими такие композиции. Фармацевтические композиции могут быть получены с использованием способов компаундирования, известных или которые становятся доступными специалистам в данной области.
[0131] Фармацевтические композиции и соединения, описанные здесь, могут быть приготовлены в виде растворов, эмульсий, суспензий, дисперсий, или комплексов включения, таких как циклодекстрины в подходящих фармацевтических растворителях или носителях, или в виде пилюли, таблетки, пастилки, суппозитория, саше, драже, гранул, порошка, порошка для восстановления, или капсулы вместе с твердыми носителями в соответствии с обычными способами, известными в области техники для приготовления различных лекарственных форм. Фармацевтические композиции вариантов осуществления могут вводиться подходящим способом доставки, таким как пероральный, парентеральный, ректальный, назальный, местный или глазной пути, или путем ингаляции. Предпочтительно, композиции составляют для внутривенного или перорального введения.
[0132] Дополнительным воплощением изобретения является способ получения фармацевтической композиции, содержащей по меньшей мере одно соединение настоящего изобретения и, возможно, один или более фармацевтически приемлемых эксципиентов.
[0133] В некоторых аспектах настоящее изобретение относится к способам лечения заболеваний или состояний, опосредованных активацией или деактивацией рецепторов NMDA, или которые в основном опосредованы активностью рецепторов NMDA. Такое заболевание или состояние является одним или более выюранным из группы, состоящей из боли, невропатической боли, боли при воспалении, периферической невропатии, инсульта, эпилепсии, нейродегенерации, шизофрении, наркомании, расстройства настроения, посттравматического стрессового расстройства, судорог, конвульсий, возрастного ухудшения памяти, депрессии, инсульта, черепно-мозговой травмы, ишемии, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, бокового амиотрофического склероза или болезни Крейтцфельда-Якоба. В частности, заболевание или состояние представляет собой шизофрению.
[0134] Еще одним аспектом настоящего изобретения является способ лечения, предотвращения, ингибирования или устранения заболевания или состояния у пациентов посредством модуляции, активации или ингибирования активности рецепторов NMDA у указанных пациентов посредством введения терапевтически эффективного количества по меньшей мере одного соединения настоящего изобретения, где указанное заболевание или состояние выбрано из группы, состоящей из боли, невропатической боли, боли при воспалении, периферической невропатии, инсульта, эпилепсии, нейродегенерации, шизофрении, наркомании, расстройства настроения, посттравматического стрессового расстройства, судорог, конвульсий, возрастного ухудшения памяти, депрессии, инсульта, черепно-мозговой травмы, ишемии, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, бокового амиотрофического склероза или болезни Крейтцфельда-Якоба.
[0135] Еще одним аспектом настоящего изобретения является применение соединения, как здесь описано, в качестве положительного аллостерического модулятора (РАМ) рецептора NMDA. Настоящее изобретение включает способ модуляции и/или усиления активности рецептора NMDA посредством приведения в контакт рецептора в аллостерическом сайте связывания и по меньшей мере одного соединения, как здесь описано, или фармацевтической композиции, содержащей указанное соединение. Кроме того, соединения по настоящему изобретению могут применяться в качестве подтипа селективного для NR2A-содержащих рецепторов NMDA. Изобретение также относится к способу модуляции NR2A-содержащих рецепторов NMDA посредством приведения в контакт рецептора с по меньшей мере одним соединением по изобретению или фармацевтической композицией, содержащей такое соединение.
[0136] Фармацевтические композиции и соединения, описанные здесь, могут быть приготовлены в виде растворов, эмульсий, суспензий, дисперсий, или комплексов включения, таких как циклодекстрины в подходящих фармацевтических растворителях или носителях, или в виде пилюли, таблетки, пастилки, суппозитория, саше, драже, гранул, порошка, порошка для восстановления, или капсулы вместе с твердыми носителями в соответствии с обычными способами, известными в области техники для приготовления различных лекарственных форм. Фармацевтические композиции вариантов осуществления могут вводиться подходящим способом доставки, таким как пероральный, парентеральный, ректальный, назальный, местный или глазной пути, или путем ингаляции. Предпочтительно, композиции составляют для внутривенного или перорального введения.
[0137] Для перорального введения соединения воплощений настоящего изобретения могут быть представлены в твердой форме, такой как таблетки или капсулы, или в виде раствора, эмульсии или суспензии. Для получения пероральных композиций соединения воплощений настоящего изобретения могут быть сформулированы с получением дозировки, например, от приблизительно 0,01 до приблизительно 50 мг/кг в день, или от приблизительно 0,05 до приблизительно 20 мг/кг в день, или приблизительно от 0,1 до приблизительно 10 мг/кг в день. Пероральные таблетки могут включать активный ингредиент(ы) в смеси с совместимыми фармацевтически приемлемыми эксципиентами, такими как разбавители, дезинтегрирующие агенты, связующие агенты, смазывающие агенты, подсластители, вкусовые агенты, окрашивающие агенты и консервирующие агенты. Подходящие инертные наполнители включают карбонат натрия и кальция, фосфат натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит, и т.д. Типичные жидкие пероральные эксципиенты включают этанол, глицерин, воду и т.д. Крахмал, поливиниловый-пирролидон (PVP), натрийкрахмалгликолят, микрокристаллическая целлюлоза и альгиновая кислота являются примерами дезинтегрирующих агентов. Связующие агенты могут включать крахмал и желатин. Смазывающий агент, если присутствует, может представлять собой стеарат магния, стеариновую кислоту или тальк. Если необходимо, таблетки могут быть покрыты таким материалом как глицерилмоностеарат или глицерилдистеарат, для задержки всасывания в желудочно-кишечном тракте, или могут быть покрыты энтеросолюбильным покрытием.
[0138] Капсулы для перорального введения включают твердые и мягкие желатиновые капсулы. Для приготовления твердых желатиновых капсул, активный ингредиент(ы) может быть смешан с твердым, полутвердым или жидким разбавителем. Мягкие желатиновые капсулы могут быть получены посредством смешивания активного ингредиента с водой, маслом, таким как арахисовое масло или оливковое масло, жидким парафином, смесью моно- и диглицеридов короткоцепочечных жирных кислот, полиэтиленгликолем 400 или пропиленгликолем.
[0139] Жидкости для перорального введения могут быть в виде суспензий, растворов, эмульсий или сиропов, или могут быть лиофилизированы или представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед использованием. Такие жидкие композиции могут необязательно содержать: фармацевтически приемлемые наполнители, такие как суспендирующие агенты (например, сорбит, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия и т.д.); неводные носители, например, масло (например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, спирт, этил или воду; консерванты (например, метил или пропил-п-гидроксибензоат или сорбиновую кислоту); смачивающие агенты, такие как лецитин; и, если необходимо, ароматизаторы или красители.
[0140] Композиции согласно изобретению могут быть приготовлены для ректального введения в виде суппозиториев. Для парентерального применения, в том числе внутривенного, внутримышечного, внутрибрюшинного, интраназального, или подкожного пути, агенты воплощений настоящего изобретения могут быть представлены в виде стерильных водных растворов или суспензий, забуференных до соответствующего рН и изотоничности или в парентерально приемлемом масле. Подходящие водные носители включают раствор Рингера и изотонический раствор хлорида натрия. Такие формы могут быть представлены в виде единичной дозы, такой как ампулы или одноразовые устройства для инъекций, в многодозовых форм, таких как флаконы, из которых соответствующая доза может быть взята, или в твердой форме, или предварительно концентрированы для применения при подготовке инъекционного препарата. Иллюстративные дозы для инфузий находятся в интервале приблизительно от 1 до 1000 мкг/кг/минута агента, смешанного с фармацевтическим носителем в течение периода времени от нескольких минут до нескольких дней
[0141] Для назального, ингаляционного или перорального введения, фармацевтические композиции по настоящему изобретению могут быть введены с применением, например, композиции для распыления, также содержащей подходящий носитель.
[0142] Для местного применения соединения согласно воплощениям настоящего изобретения предпочтительно получают в виде кремов или мазей или подобного носителя, подходящего для местного применения. Для местного введения соединения согласно изобретению могут быть смешаны с фармацевтическим носителем при концентрации от примерно 0,1% до примерно 10% препарата к носителю. Другой способ введения агентов согласно воплощениям может использовать композицию в виде пластыря для осуществления трансдермальной доставки
[0143] Фактически используемая дозировка может варьироваться в зависимости от потребностей пациента и тяжести состояния, подлежащего лечению. Определение соответствующей схемы приема лекарственного средства для конкретной ситуации находится в компетенции специалиста в данной области. Для удобства общую дневную дозу можно разделить и вводить по порциям в течение дня по мере необходимости
[0144] Количество и частота введения соединений по настоящему изобретению и/или их фармацевтически приемлемых солей будут регулироваться в соответствии с решением лечащего врача с учетом таких факторов, как возраст, состояние и размер пациента, а также тяжесть симптомов, подвергаемых лечению. Типичная рекомендуемая дневная схема приема лекарственного средства для перорального введения может составлять от примерно 1 мг/сутки до примерно 500 мг/сутки, предпочтительно от 1 мг/сутки до 200 мг/сутки, за две-четыре разделенные дозы.
[0145] Еще одним воплощением настоящего изобретения является фармацевтическая композиция, содержащая по меньшей мере одно соединение Формулы I или II, или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент, и дополнительно содержащая один или более дополнительных активных агентов. Способы лечения, как здесь описано, включают схемы, при которых соединение по настоящему изобретению и по меньшей мере один дополнительный активный агент вводят одновременно или последовательно
[0146] Выражение "дополнительный активный агент" в основном относится к агентам, которые нацелена на ту же или другую болезнь, симптом или медицинское состояние в качестве основного терапевтического средства. Дополнительные активные агенты могут лечить, облегчать, снижать или смягчать побочные эффекты, вызванные введением первичных терапевтических агентов.
Примеры
[0147] Иллюстративные, неограничивающие, химические соединения и способы, используемые при получении соединений по настоящему изобретению, будут описаны со ссылкой на конкретные примеры, которые следуют далее. Специалистам в данной области техники будет понятно, что другие пути синтеза могут быть использованы для синтеза соединений по настоящему изобретению. Хотя конкретные исходные материалы и реагенты изображены и обсуждаются в настоящем документе, другие исходные материалы и реагенты могут быть легко замещены с получением различных производных и/или условий реакции. Кроме того, многие из приведенных в качестве примера соединений, полученных с помощью описанных способов, могут быть дополнительно модифицированы в свете настоящего описания с использованием обычной химии, хорошо известной специалистам в данной области техники.
[0148] Специалист будет понимать, что для получения различных соединений настоящего изобретения, исходные материалы могут быть подходяще выбраны, чтобы в конечном счете, желаемые заместители будут проходить по схеме реакции с или без защиты как подходит с получением желаемого продукта. В качестве альтернативы может быть необходимым или желательным использовать в месте в конечном счете желаемого заместителя подходящую группу, которая может быть проведена через схему реакции и заменена в случае необходимости с желаемым заместителем. Каждая из реакций, изображенных на реакционных схемах, предпочтительно проводится при температуре от примерно 0°С до температуры кипения используемого растворителя.
[0149] В способах получения соединений по настоящему изобретению может быть предпочтительным отделить продукты реакции друг от друга и/или от исходных веществ. Требуемые продукты каждой стадии или последовательности действий могут быть разделены и/или очищены до желаемой степени однородности с помощью методик, распространенных в данной области техники. Как правило, такое разделение включает многофазную экстракцию, кристаллизацию из растворителя или смеси растворителей, дистилляцию, сублимацию или хроматографию. Хроматография может включать любое количество способов, в том числе, например: обратнофазовую и нормальнофазовую; эксклюзионную; ионообменную; высокого, среднего и низкого давления жидкостную хроматографию; аналитическую в малом масштабе; с псевдодвижущимся слоем (SMB) и препаративную тонко- или толстослойную хроматографию, а также методы тонкослойной и флэш-хроматографии в малом масштабе.
[0150] Смеси диастереомеров могут быть разделены на их индивидуальные диастереомеры на основе их физико-химических различий с помощью способов, хорошо известных квалифицированным специалистам в данной области техники, такими как, например, Хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены путем превращения энантиомерной смеси в смесь диастереомеров посредством взаимодействия с соответствующим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера, или образованием смеси диастереомерных солей, например, с винной кислотой или хиральным амином), разделением диастереомеров посредством, например, фракционной кристаллизации или хроматографическими способами, и преобразованием (например, гидролизом или обессоливанием) отдельных диастереомеров в соответствующие чистые энантиомеры. Энантиомеры также могут быть разделены с использованием хиральной колонки ВЭЖХ или получены непосредственно путем хирального синтеза. Хиральные центры соединений настоящего изобретения могут быть обозначены как "R" или "S", как это определено в Рекомендациях ИЮПАК 1974. Обогащенные или очищенные энантиомеры можно выделить способами, применяемыми для выделения других хиральных молекул с асимметричными атомами углерода, такими как оптическое вращение и круговой дихроизм.
Общие экспериментальные условия
[0151] Если не указано иного, 1H NMR спектры записывали при комнатной температуре с использованием спектрометра Varian Unity Inova (400 MHz) с кюветой трройного резонанса 5 мм. Химические сдвиги выражали в ppm (милионных долях) по отношению к тетраметилсилану. Использовались следующие аббревиатуры: br = широкий сигнал, s = синглет, d = дуплет, dd = двойной дуплет, t = триплет, q = квартет, m = мультиплет.
[0152] Эксперименты в микроволновой печи проводились с использованием СЕМ Discover, Smith Synthesiser или Biotage Initiator 60™, которые применяли одномодовый резонатор и нестационарное поле, оба дают воспроизводимость и регулировку. Могут быть достигнуты температуры 40-250°С и давление вплоть до 30 бар.
[0153] Высокоэффективная жидкостная хроматография - масс-спектрометрия (ЖХМС) эксперименты использовали для обнаружения ассоциированных ионных масс. Спектрометры обладали источником электрораспыления, работающим в режиме определения положительных и отрицательных ионов. Дополнительную детекцию проводили с использованием испарительного детектора светорассеяния Sedex 85.
[0154] Следующие примеры иллюстрируют получение репрезентативных соединения по настоящему изобретению. Если не указано иного, все реагенты и растворители обладали стандартной коммерческой чистотой и использовались без дополнительной очистки. Квалифицированные специалисты будут понимать, какие исходные вещества, реагенты и условия, описанные в примерах, могут быть изменены и дополнительные стадии применены для получения соединений, охватываемых настоящим изобретением.
Способ 1:
Пример 1.1: N-(цианометил)-7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
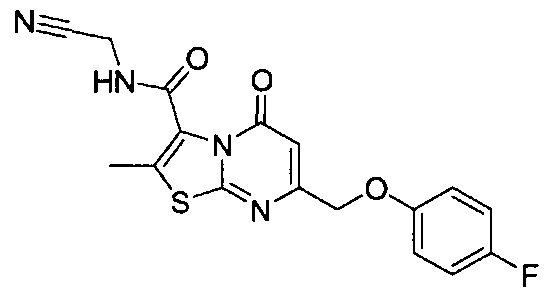
Стадия 1: Метил 3-бромо-2-оксобутаноат.
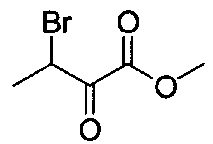
[0155] К раствору метил 2-оксобутаноата (1.00 г, 8.61 ммоль) в хлороформе (20 мл) добавили бромоводород в уксусной кислоте (40%, 1 мл) и бром (1.40 г, 8.76 ммоль) по каплям при перемешивании при комнатной температуре. Реакционную смесь перемешивали в течение 1 ч при 70°С. После охлаждения до комнатной температуры, получившийся раствор сконцентрировали под вакуумом с получением метил 3-бромо-2-оксобутаноата в виде желтого масла (1.60 г, 95%). Сигнал ЖХМС отсутствовал.
Стадия 2: Метил 2-амино-5-метил-1,3-тиазол-4-карбоксилат
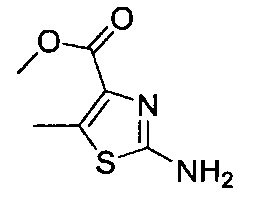
[0156] К раствору метил 3-бромо-2-оксобутаноата (1.60 г, 8.20 ммоль) в 1,4-диоксане (30 мл) добавили тиомочевину (625 мг, 8.21 ммоль) при перемешивании. Получившийся раствор кипятили с обратным холодильником в течение 3 ч на масляной бане. После охлаждения до комнатной температуры, осадки собрали посредством фильтрации и высушили под вакуумом с получением метил 2-амино-5-метил-1,3-тиазол-4-карбоксилата в виде серого осадка (900 мг, 64%). ЖХМС (ESI): М+H+ = 173.
Стадия 3: Метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилат.
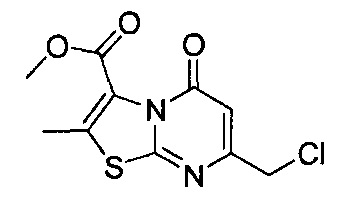
[0157] К смеси метил 2-амино-5-метил-1,3-тиазол-4-карбоксилата (200 мг, 1.16 ммоль) и этил 4-хлор-3-оксобутаноата (390 мг, 2.32 ммоль) добавили полифосфорную кислоту (5 мл). Реакционную смесь перемешивали 1 ч при 110°С. Затем реакционную смесь погасили водой (20 мл). Значение рН раствора довели до рН 8 с помощью гидроксида натрия (водн., 10 моль/л) и экстрагировали дихлорметаном (2×100 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1) с получением метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата в виде светло-желтого осадка (120 мг, 38%). ЖХМС (ESI): M+H+ = 273.
Стадия 4: Метил 7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилат.
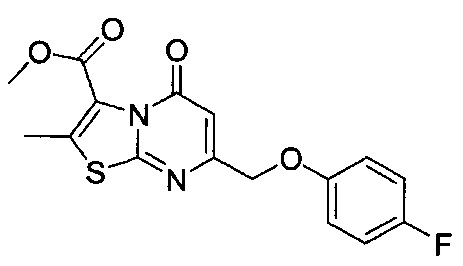
[0158] К раствору метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (200 мг, 0.73 ммоль), йодида калия (60 мг, 0.37 ммоль) и карбоната калия (200 мг, 1.45 ммоль) в ацетонитриле (15 мл) добавили 4-фторфенол (125 мг, 1.12 ммоль). После перемешивания в течение 2 ч при 85°С, реакционную смесь охладили до комнатной температуры и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1) с получением метил 7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата в виде белого осадка (220 мг, 86%). ЖХМС (ESI): М+H+ = 349; 1H NMR (300 MHz, CDCl3) δ 7.02-6.92 (m, 2H), 6.91-6.86 (m, 2H), 6.48 (s, 1H), 4.92 (s, 2H), 3.98 (s, 3H), 2.45 (s, 3H).
Стадия 5: 7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоновая кислота.
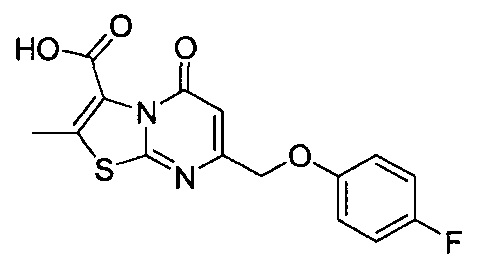
[0159] К раствору метил 7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата (5.00 г, 14.3 ммоль) в тетрагидрофуране (400 мл) и воде (200 мл) добавили гидроксид лития (7.00 г, 167 ммоль). Получившийся раствор перемешивали при 25°С в течение 30 ч. После того, как исходное вещество израсходовалось (по данным ТСХ), рН раствора довели до 7 с помощью 2 н хлороводорода. Затем раствор сконцентрировали под вакуумом до преципитирования осадка. Осадки отфильтровали и промыли тетрагидрофураном с получением 7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоновой кислоты в виде белого осадка (1.70 г, 36%). ЖХМС (ESI): M+H+ = 335.
Стадия 6: N-(цианометил)-7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
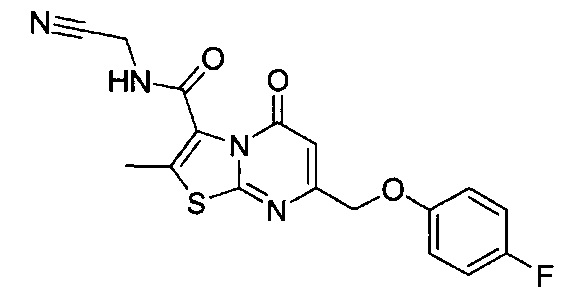
[0160] К раствору 7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоновой кислоты (100 мг, 0.30 ммоль), 2-аминоацетонитрила гидрохлорида (56 мг, 0.61 ммоль), триэтиламина (90 мг, 0.90 ммоль), 4-диметиламинопиридина (4 мг, 0.03 ммоль) и 1-гидроксибензотризола (80 мг, 0.60 ммоль) в N,N-диметилформамиде (8 мл) добавили N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид (115 мг, 0.6 ммоль) при перемешивании. Получившийся раствор перемешивали в течение ночи и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с элюцией дихлорметаном/метанолом (30:1) с получением N-(цианометил)-7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде белого осадка (22.7 мг, 20%). ЖХМС (ESI): M+H+ = 373; 1H NMR (300 MHz, DMSO-d6) δ 9.22 (m, 1H), 7.18-7.03 (m, 4H), 6.30 (s, 1H), 5.02 (s, 2H), 4.36-4.31 (m, 2H), 2.34 (s, 3H).
[0161] Следующие примеры получили аналогично тому, как это описано для Примера 1.1:
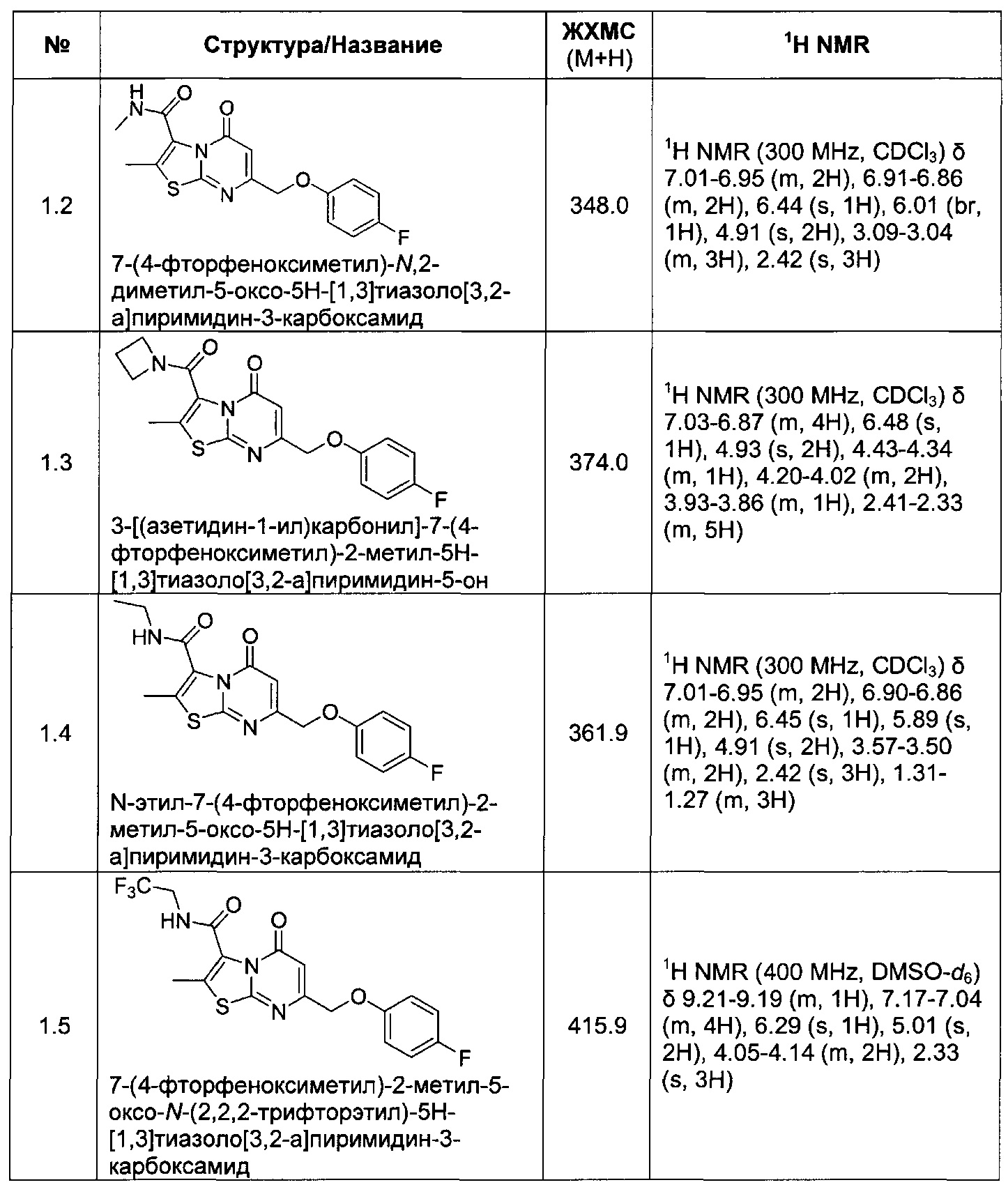
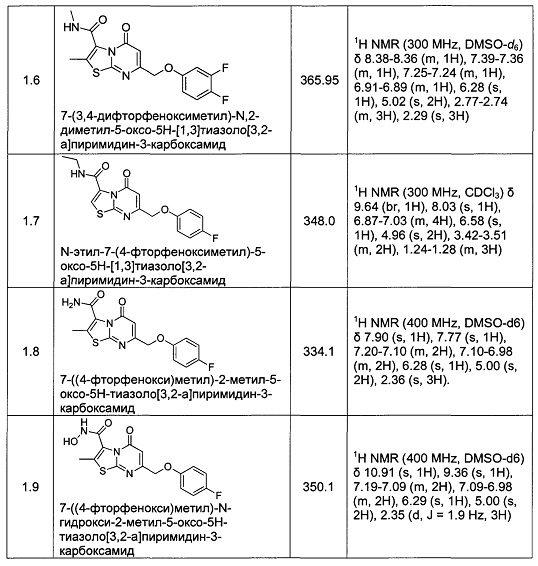
[0162] Следующие дополнительные соединения получили с использованием описанных выше способов.
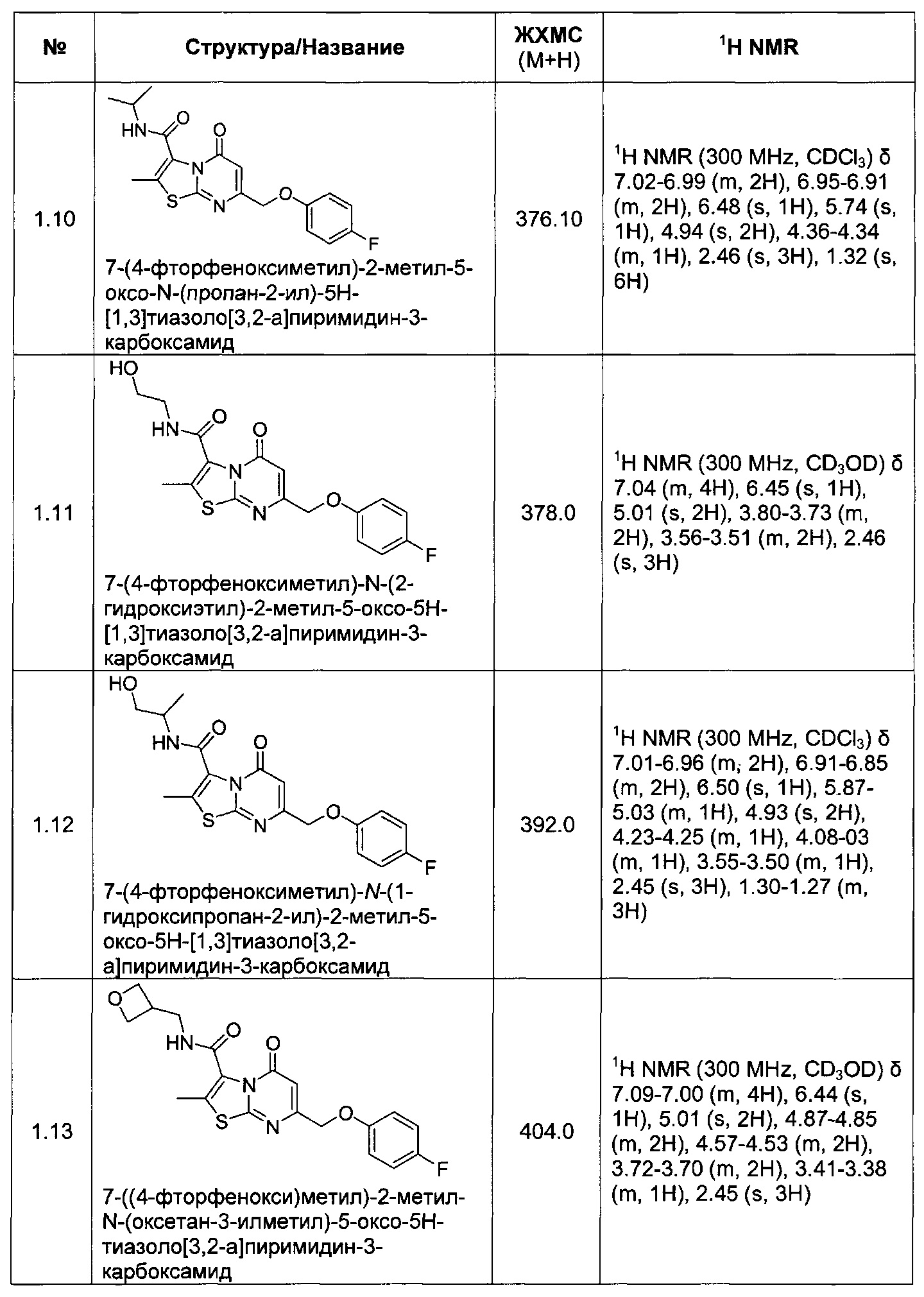
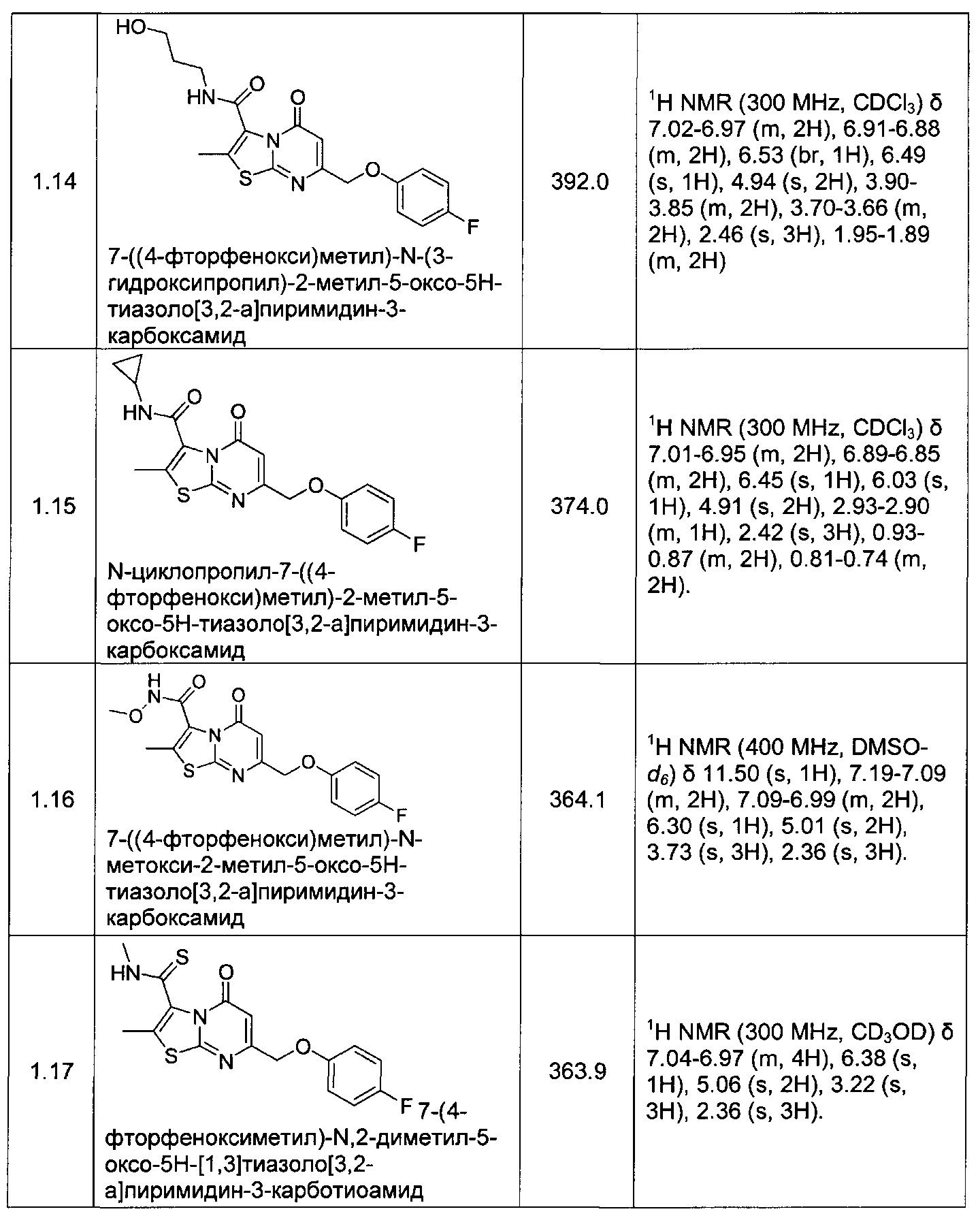
Способ 2:
Пример 2.1: 7-((4-фторфенокси)метил)-2-метил-3-пропионил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0163] К раствору метил 7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (из Примера 1.1, Стадия 4; 100 мг, 0.29 ммоль) в тетрагидрофуране (2 мл) добавили этилмагния бромид (0.14 мл, 0.32 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь затем погасили посредством добавления воды, экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с помощью смеси этилацетат/петролейный эфир (1:3) с получением 7-((4-фторфенокси)метил)-2-метил-3-пропионил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (91.9 мг, 92%). ЖХМС (ESI): M+H+ = 347.0.
Пример 2.2: 7-((4-фторфенокси)метил)-3-(1-гидроксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
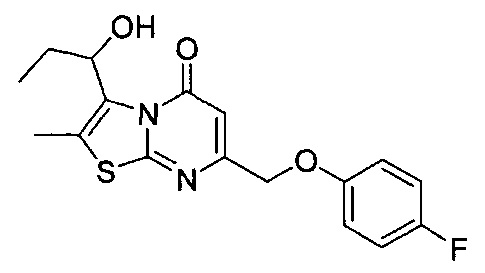
[0164] К раствору 7-((4-фторфенокси)метил)-2-метил-3-пропионил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 2.1; 20.0 мг, 0.060 ммоль) в метаноле (10 мл) добавили борогидрид натрия (4.70 мг, 0.13 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили насыщенным водным хлоридом аммония (20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50:1) с получением 7-((4-фторфенокси)метил)-3-(1-гидроксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (4.50 мг, 21%). ЖХМС (ESI): М+H+ = 349.0; 1H NMR (300 MHz, CD3OD) δ 7.05-7.03 (m, 4H), 6.50 (s, 1H), 5.11-5.01 (m, 1H), 4.89 (s, 2H), 2.51 (s, 3Н), 1.96-1.83 (m, 2H), 0.97-0.92 (m, 3H).
[0165] Следующие примеры получили аналогично тому, как это описано для Примера 2.1 и 2.2:
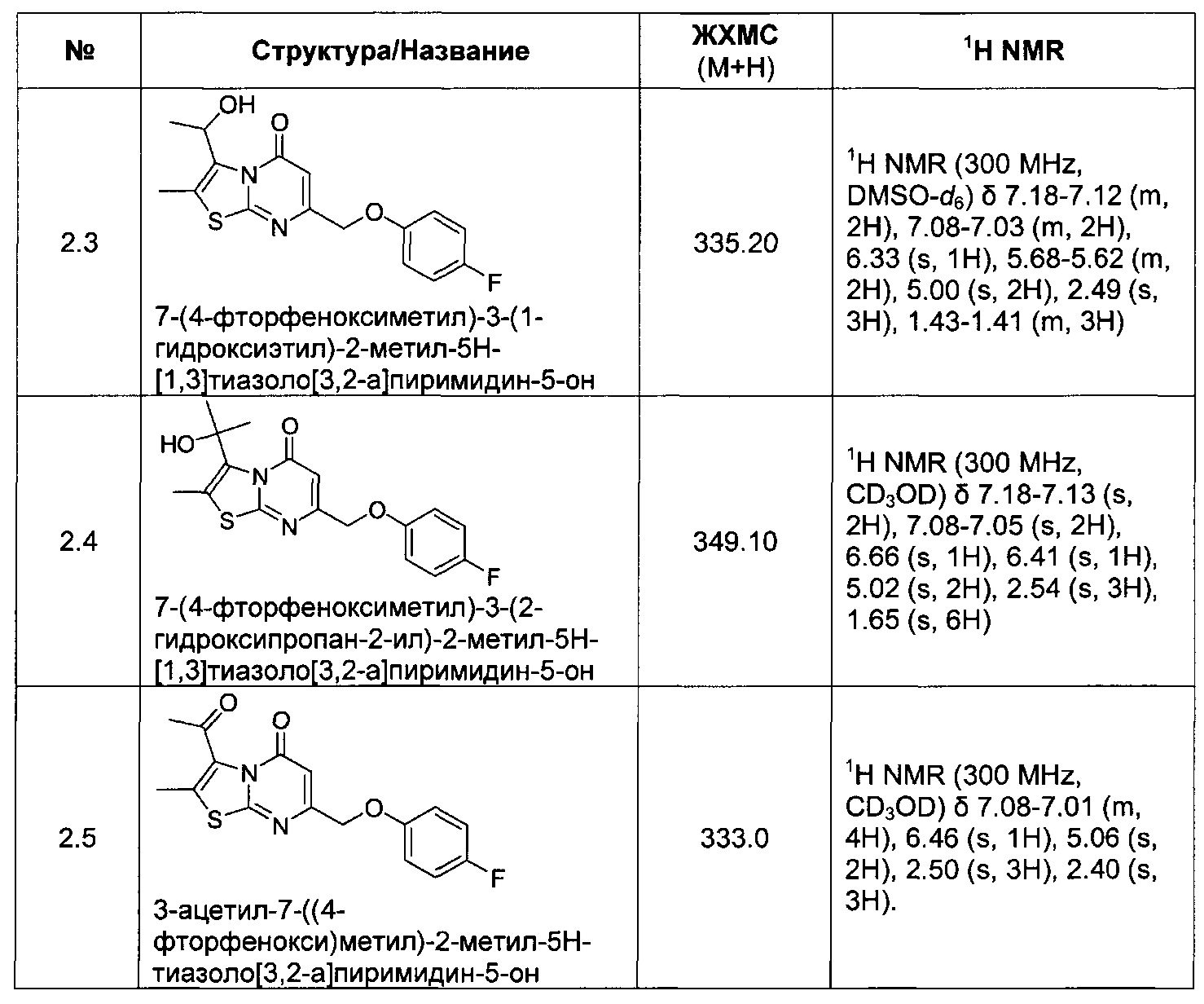
Пример 2.6: 2-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)-N-метилацетамид.
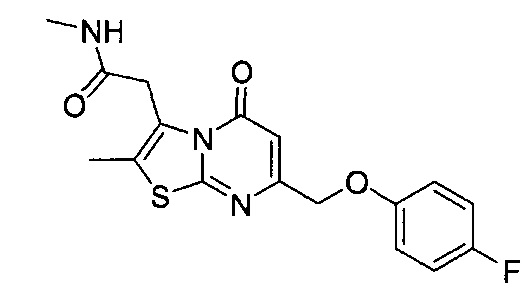
Стадия 1: 7-((4-фторфенокси)метил)-3-(гидроксиметил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
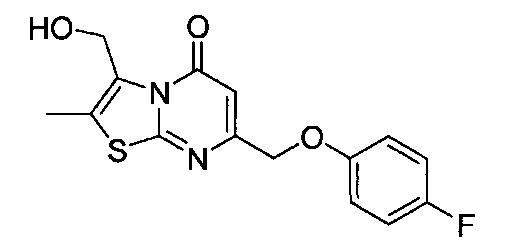
[0166] В 25-мл круглодонную колбу в атмосфере азота добавили раствор метил 7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (из Примера 1.1, Стадия 5) (200 мг, 0.57 ммоль) в тетрагидрофуране (20 мл) и раствор диизобутилалюминия гидрид в толуоле (1.1 моль/л, 1 мл). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Реакционную смесь погасили водой (30 мл), экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (50:1) с получением 7-((4-фторфенокси)метил)-3-(гидроксиметил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (150 мг, 77%). ЖХМС (ESI): M+H+ = 321.0; 1H NMR (300 MHz, CDCl3) δ 7.02-6.87 (m, 4H), 6.48 (s, 1H), 4.93 (s, 2H), 4.76 (s, 2H), 2.44 (s, 3H).
Стадия 2: 3-(хлорометил)-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
[0167] К раствору 7-(4-фторфеноксиметил)-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 0.62 ммоль) в дихлорметане (5 мл) добавили тионилхлорид (0.5 мл) и N,N-диметилформамид (10 мг, 0.14 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре и затем сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (50/1) с получением 3-(хлорометил)-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (150 мг, 71%). ЖХМС (ESI): M+H+ = 339.0; 1H NMR (400 MHz, CDCl3) δ 7.01-6.96 (m, 2H), 6.92-6.89 (m, 2H), 6.47 (s, 1H), 5.26 (s, 2H), 4.91 (s, 2H), 2.45 (s, 3H).
Стадия 3: Метил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]ацетат.
[0168] К раствору 3-(хлорометил)-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 0.59 ммоль) в метаноле (5 мл) добавили 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорид (60 мг, 0.08 ммоль), карбонат калия (163 мг, 1.18 ммоль). Реакционную смесь перемешивали в течение 3 ч при 25°С в атмосфере монооксида углерода (5 атм). После фильтрации, фильтрат сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (50/1) с получением метил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]ацетата в виде белого осадка (120 мг, 56%). ЖХМС (ESI): М+H+ = 363.2; 1H NMR (400 MHz, CDCl3) δ 7.01-6.95 (m, 2H), 6.91-6.86 (m, 2H), 6.37 (s, 1H), 4.89 (s, 2H), 4.19 (s, 2H), 3.75 (s, 3Н), 2.33 (s, 3H).
Стадия 4: 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]-N-метилацетамид.
[0169] Раствор метил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]ацетата (70 мг, 0.19 ммоль) и метиламина в этаноле (30%, 5 мл) добавили в 25-мл круглодонную колбу. Получившийся раствор перемешивали в течение 30 мин при 40°С и затем сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (10/1) с получением 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]-N-метилацетамида в виде белого осадка (38 мг, 54%). ЖХМС (ESI): М+Н+ = 362.0; 1H NMR (300 MHz, CDCl3) δ 7.02-6.87 (m, 5H), 6.44 (s, 1H), 4.92 (s, 2H), 4.12 (s, 2H), 2.78-2.76 (m, 3Н), 2.51 (s, 3Н).
[0170] Следующие примеры получили с использованием способов, аналогичных описанным выше
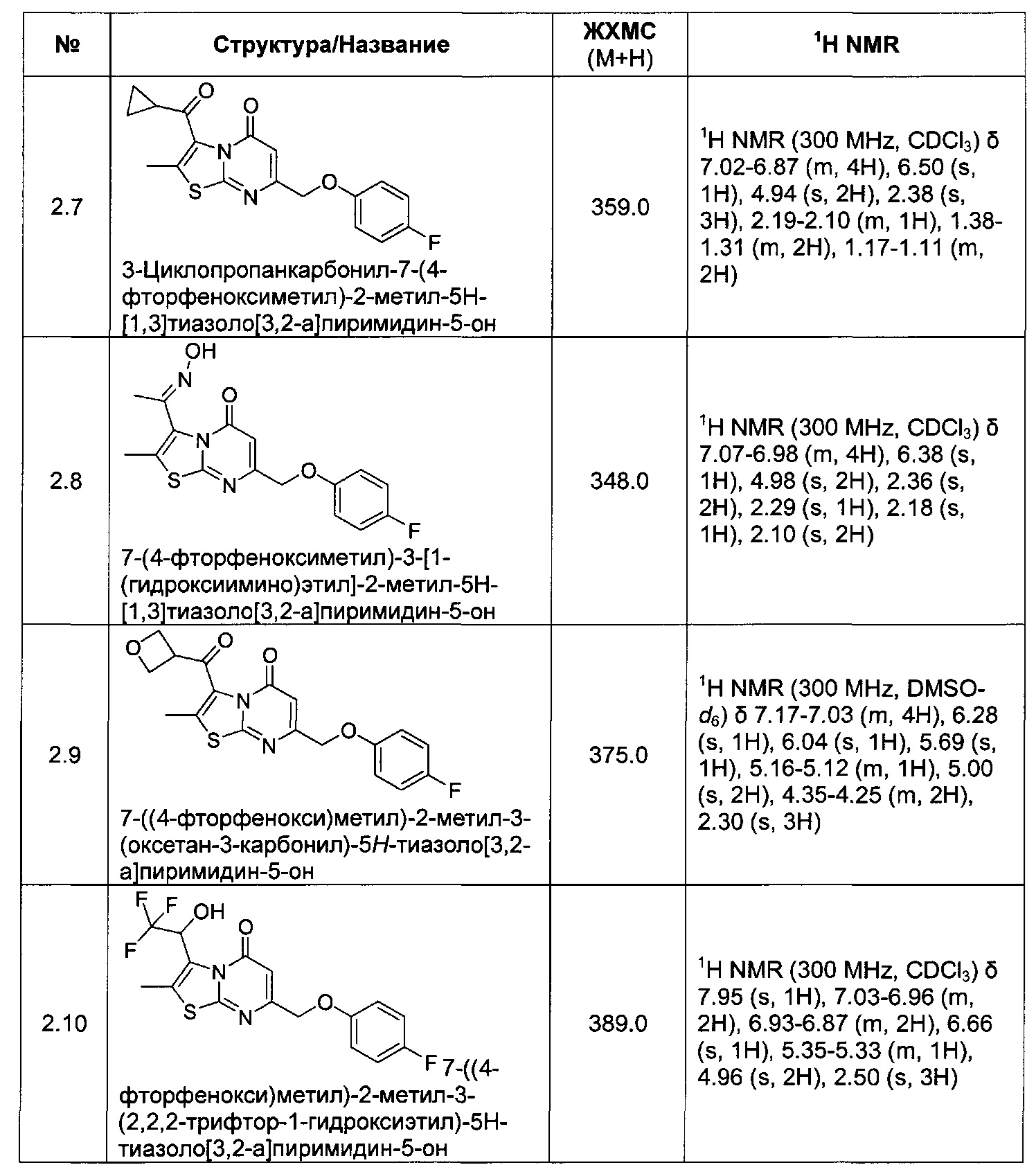
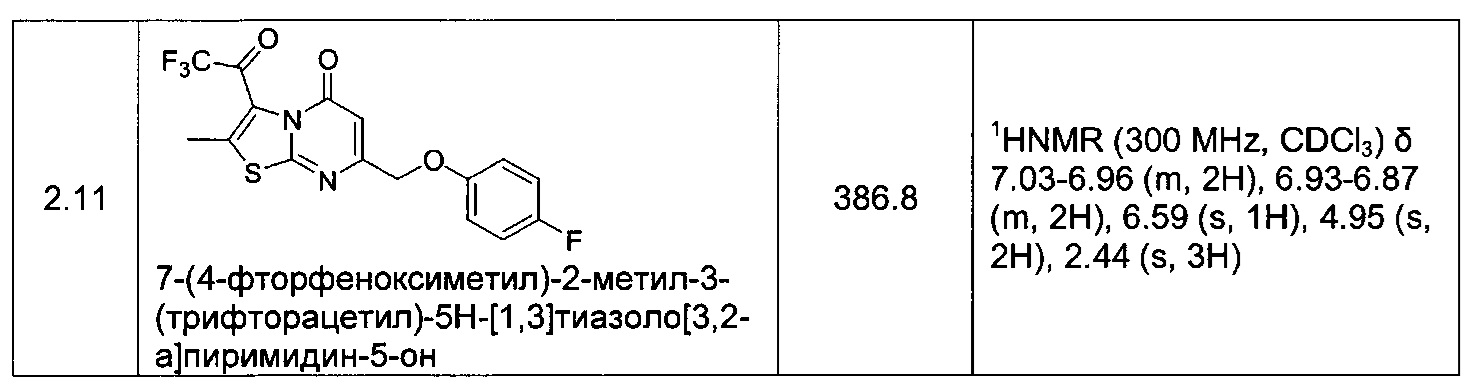
Способ 3:
Пример 3.1: 2-циклопропил-N-этил-7-((4-фторфенокси)метил)-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
Стадия 1: 7-(хлорометил)-2-циклопропил-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0171] К раствору 2-амино-5-циклопропил-N-этилтиазол-4-карбоксамида (2.53 г, 12.8 ммоль) в полифосфорной кислоте (16.0 г) добавили этил 4-хлор-3-оксобутаноат (4.20 г, 25.5 ммоль). Получившийся раствор перемешивали в течение 1 ч при 110°С. Затем реакционную смесь погасили водой (80 мл) и значение рН раствора довели до рН 7 с помощью раствора гидроксида натрия (1 моль/л). Реакционную смесь экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором (30 мл), высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (5/1) с получением 7-(хлорометил)-2-циклопропил-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамида в виде коричневого осадка (905 мг, 24%). ЖХМС (ESI): М+Н+ = 312.0.
Стадия 2: 2-циклопропил-N-этил-7-((4-фторфенокси)метил)-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0172] Раствор 7-(хлорометил)-2-циклопропил-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамида (100 мг, 0.32 ммоль) в ацетонитриле (10 мл) обработали йодидом калия (27.0 мг, 0.16 ммоль), карбонатом калия (88.0 мг, 0.64 ммоль) и 4-фторфенолом (72.0 мг, 0.64 ммоль). Реакционную смесь затем перемешивали в течение ночи при 80°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50/1) с получением 2-циклопропил-N-этил-7-(4-фторфеноксиметил)-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде белого осадка (36.4 мг, 29%). ЖХМС (ESI): М+H+ = 388.0; 1HNMR (300 MHz, CDCl3) δ 7.00-6.95 (m, 2H), 6.90-6.84 (m, 2H), 6.44 (s, 1H), 5.91 (s, 1H), 4.90 (s, 2H), 3.57-3.53 (m, 2H), 2.19-2.09 (m, 1H), 1.32-1.27 (m, 3H), 1.22-1.08 (m, 2H), 0.90-0.83 (m, 2H).
[0173] Следующие примеры получили аналогично тому, как это описано для Примера 3.1:
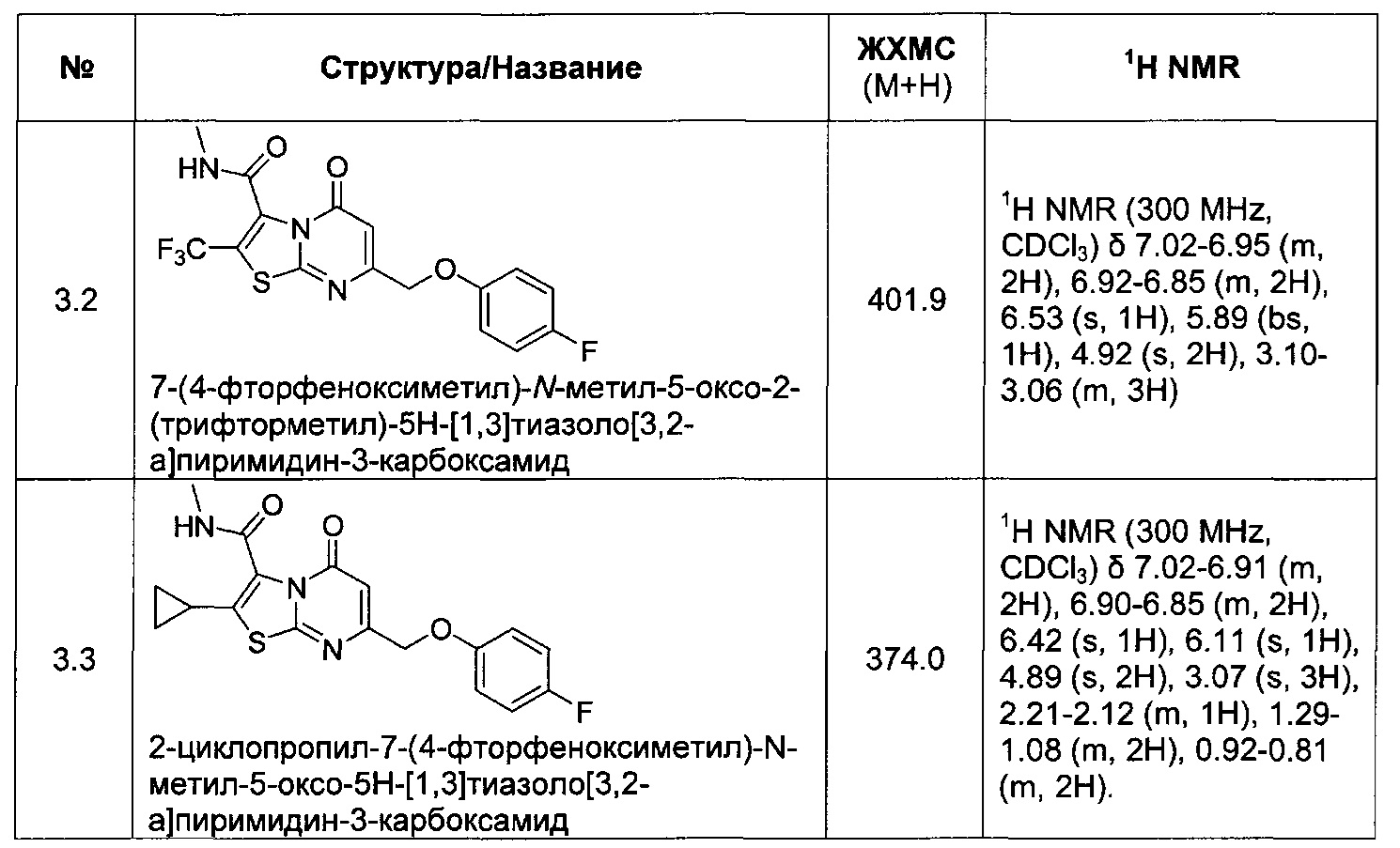
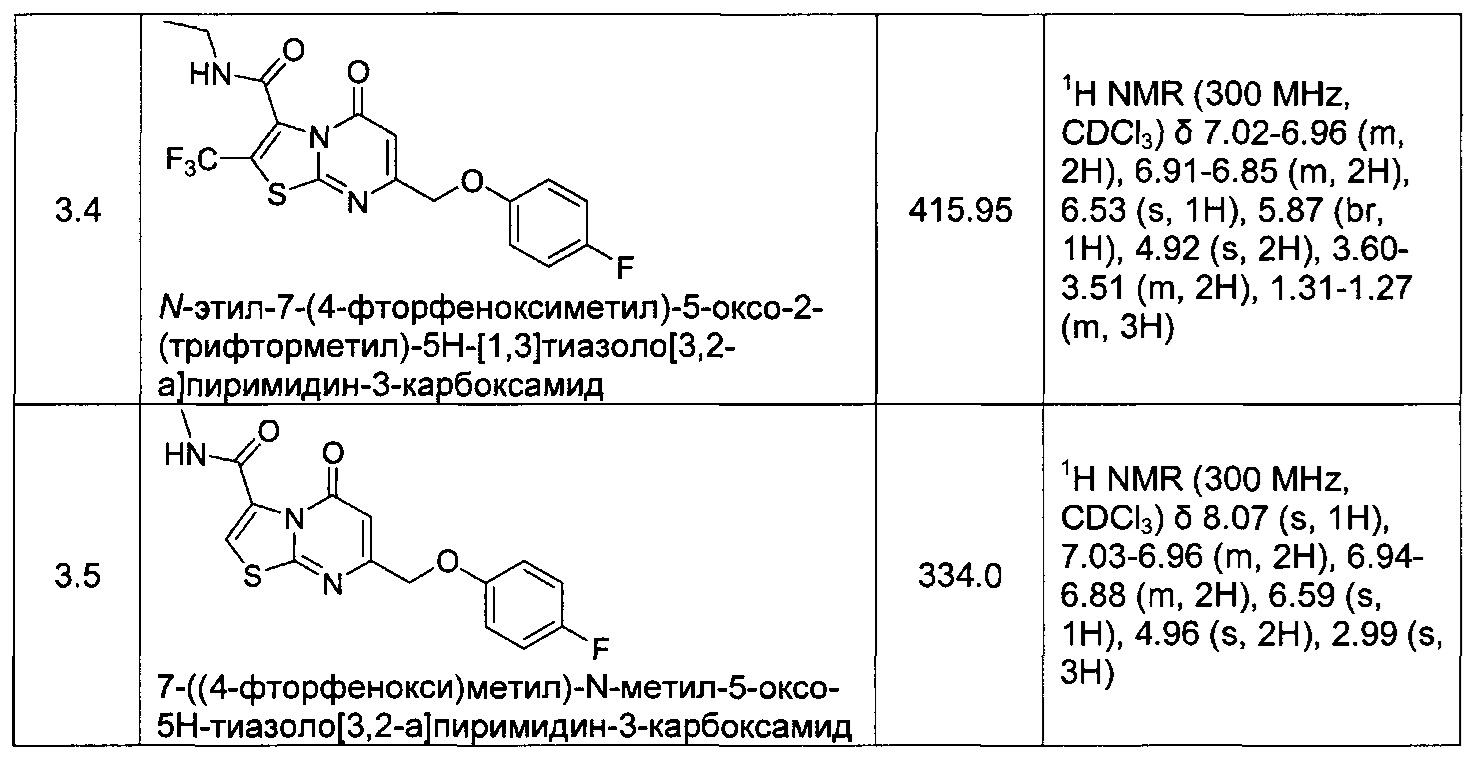
[0174] Следующий пример получили с использованием способов, аналогичных описанным выше.
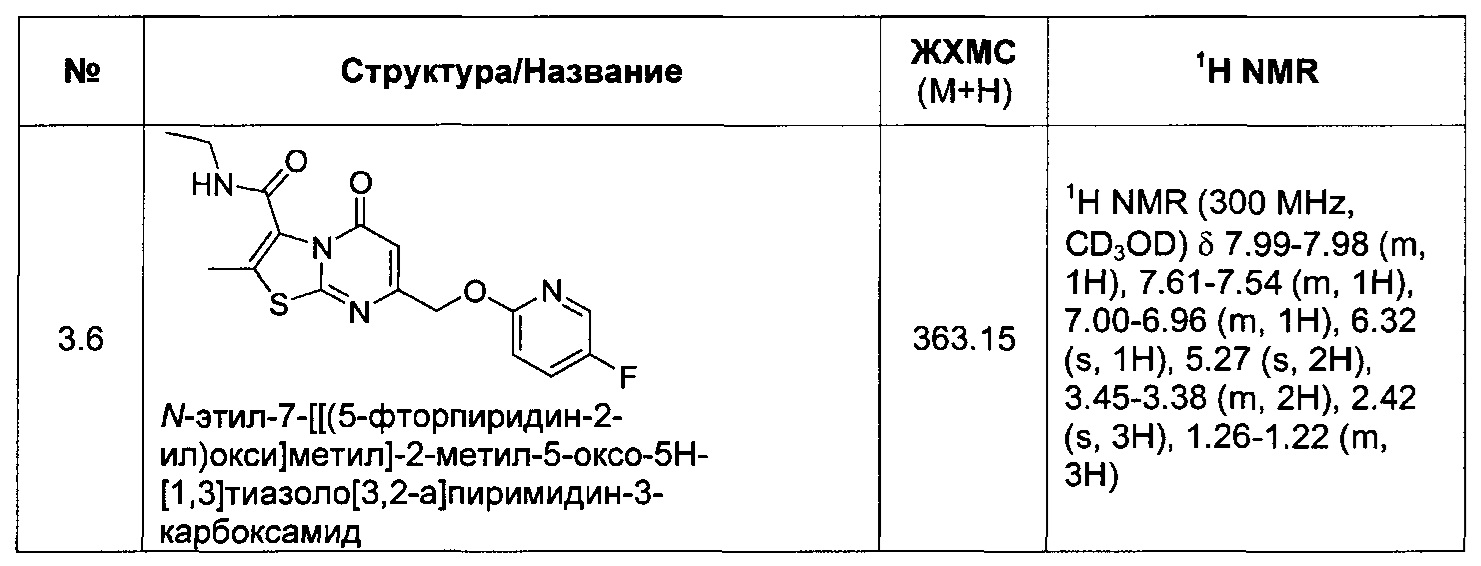
Способ 4:
Пример 4.1: 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
Пример 4.2: 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (энантиомер 1).
Пример 4.3: 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (энантиомер 2).
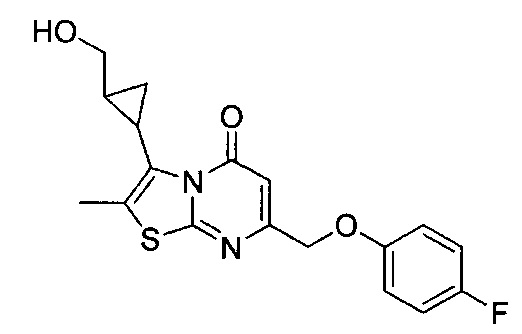
Стадия 1: трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил)метокси)силан.
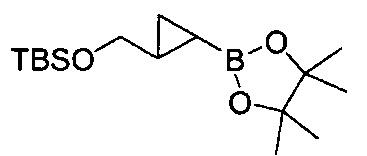
[0175] Диэтилцинк (1.0 М в гексане) (200 мл, 200 ммоль) добавили к свежедистиллированному дихлорметану (200 мл) в атмосфере азота. Затем раствор трифторуксусной кислоты (15.4 мл, 200 ммоль) в дихлорметане (100 мл) добавили по каплям при 0°С. После перемешивания в течение 30 мин, раствор дийодометана (16.1 мл, 200 ммоль) в дихлорметане (100 мл) добавили при 0°С. После дополнительных 30 мин перемешивания, раствор (Е)-трет-бутилдиметил(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллилокси)силан (30.0 г, 100 ммоль) в дихлорметане (100 мл) добавили при 0°С. Получившийся раствор перемешивали 2 ч при комнатной температуре и затем погасили водой. Реакционную смесь экстрагировали дихлорметаном (1000 мл × 2), промыли солевым раствором, и органический слой затем высушили над безводным сульфатом натрия и сконцентрировали с получением трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил)метокси)силана в виде бесцветного масла (30 г, 96%). 1Н NMR (300 MHz, CDCl3) δ 3.58-3.53 (m, 1H), 3.44-3.38 (m, 1H), 1.17 (s, 12H), 0.87 (s, 9H), 0.66-0.63 (m, 1H), 0.54-0.49 (m, 1H), 0.06 (s, 6H), -0.35 to -0.25 (m, 2H).
Стадия 2: Калия транс-2-(гидроксиметил)циклопропилтрифторборат.
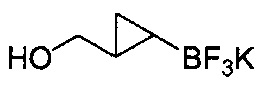
[0176] К раствору трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил)метокси)силана (30.0 г, 100 ммоль) в метаноле (300 мл) добавили раствор дифторида калия (32.0 г, 400 ммоль) в воде (100 мл) по каплям при 0°С. После перемешивания 1.5 ч при комнатной температуре, реакционную смесь сконцентрировали при пониженном давлении. Получившийся осадок суспендировали в ацетоне (1 л) и кипятили с обратным холодильником 20 мин. Гетерогенную смесь затем отфильтровали для удаления дифторида калия и фильтрат сконцентрировали. Экстракцию повторили для отфильтрованного осадка. Объединенные фильтраты сконцентрировали и растворили в минимальном количестве ацетона с последующим медленным добавлением этилового эфира до тех пор, пока раствор не стал мутным. Смесь отфильтровали и осадок собрали с получением калия транс-2-(гидроксиметил)циклопропилтрифторбората (7.00 г, 40%). 1H NMR (300 MHz, CDCl3) δ 4.01-3.97 (m, 1H), 3.44-3.37 (m, 1H), 2.83-2.75 (m, 1H), 0.58-0.48 (m, 1H), 0.01 to -0.03 (m, 1H), -0.21 to -0.25 (m, 1H), -0.94 to -0.97 (m, 1H).
Стадия 3: 2-(5-метилтиазол-2-ил)изоиндолин-1,3-дион.
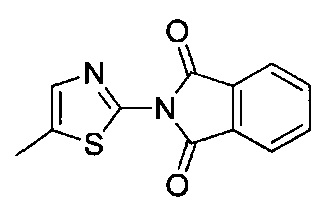
[0177] 5-Метилтиазол-2-амин (200 г, 1.75 моль) и ангидрид фталевой кислоты (272.4 г, 1.84 моль) суспендировали в диоксане (2.5 л) и нагревали при 110°С в течение ночи. ТСХ (ДХМ/МеОН = 20:1) показала, что реакция завершилась. Смесь сконцентрировали, и остаток очистили с помощью колоночной хроматографии на силикагеле (ДХМ/МеОН = 50:1~20:1) с получением 2-(5-метилтиазол-2-ил)изоиндолин-1,3-диона (240 г, 56%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 245.1; 1H NMR (400 MHz, CDCl3) δ 8.01-7.99 (m, 2H), 7.84-7.82 (m, 2H), 7.46 (s, 1H), 2.51 (s, 3H).
Стадия 4: 2-(4-бромо-5-метилтиазол-2-ил)изоиндолин-1,3-дион.
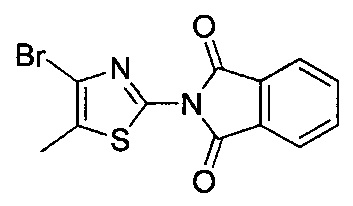
[0178] К смеси 2-(5-метилтиазол-2-ил)изоиндолин-1,3-диона (250 г, 0.819 моль) в ТГФ (2 л) добавили N-бромсукцинимид (330 г, 1.85 моль) по порциям при комнатной температуре. Затем смесь перемешивали в течение ночи при 30°С. ЖХМС показала, что реакция завершилась. Смесь разбавили водой и этилацетатом. Смесь отфильтровали и фильтрационный осадок высушили с получением 2-(4-бромо-5-метилтиазол-2-ил)изоиндолин-1,3-диона (210 г, 75%) в виде желтого осадка. ЖХМС (ESI): М+Н+ = 323.1, 325.1; 1H NMR (400 MHz, DMSO-d6) δ 8.03-8.00 (m, 2H), 7.95-7.93 (s, 2H), 2.41 (s, 3Н).
Стадия 5: 4-бромо-5-метилтиазол-2-амин.
[0179] Смесь 2-(4-бромо-5-метилтиазол-2-ил)изоиндолин-1,3-диона (152 г, 0.471 моль) и моногидратгидразина (29.5 г, 0.495 моль) в EtOH (1.5 л) перемешивали в течение ночи при 20°С. ТСХ (100% ДХМ) показала, что реакция завершилась. Смесь затем сконцентрировали и остаток очистили с помощью колоночной хроматографии на силикагеле (100% ДХМ) с получением 4-бромо-5-метилтиазол-2-амина (67 г, 73%) в виде белого осадка. ЖХМС (ESI): M+H+ = 193.1; 1H NMR (400 MHz, CDCl3) δ 8.52 (br, 1H), 5.11 (br, 1H), 2.23 (s, 1H).
Стадия 6: 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0180] Смесь 4-бромо-5-метилтиазол-2-амина (60 г, 0.31 моль) и 4-хлор-3-оксо-бутаноата (62 г, 0.37 моль) в РРА (500 г) перемешивали в течение 2 ч при 110°С. ЖХМС показала, что реакция завершилась. Водный слой экстрагировали с помощью ДХМ (300 мл × 3). Объединенные органические слои промыли водой (200 мл × 3) и солевым раствором (200 мл), высушили над Na2SO4 и сконцентрировали. Остаток очистили с помощью хроматографии на силикагеле (ДХМ/МеОН = 100:1-50:1) с получением 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (50 г, 55%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 293.1, 295.1; 1H NMR (400 MHz, CDCl3) δ 6.39 (s, 1H), 4.39 (s, 2H), 2.38 (s, 3Н).
Стадия 7: 3-бромо-7-((4-фторфенокси)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0181] К раствору 3-бромо-7-(хлорометил)-2-метил-5H-тиазоло[3,2-а]пиримидин-5-она (20 г, 0.068 ммоль) в ацетонитриле (300 мл) добавили 4-фторфенол (9.20 г, 0.082 ммоль), йодид калия (5.68 г, 0.034 ммоль), и карбонат калия (26.1 г, 0.136 ммоль). Смесь перемешивали в течение 3 ч при 80°С и затем охладили до комнатной температуры. После фильтрации и концентрирования, остаток очистили посредством хроматографии смесью этилацетат/петролейный эфир (1/1) с получением 3-бромо-7-((4-фторфенокси)метил)-2-метил-5H-тиазоло[3,2-а]пиримидин-5-она (20 г, 80%) в виде желтого осадка. ЖХМС (ESI): М+Н+ = 369.1, 371.1; 1H NMR (300 MHz, CDCl3) δ 7.01-6.95 (m, 2H), 6.92-6.86 (m, 2H), 6.44 (s, 1H), 4.88 (s, 2H), 2.36 (s, 3Н).
Стадия 8: 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он и 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (энантиомер 1 и энантиомер 2).
[0182] 3-бромо-7-((4-фторфенокси)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он (500 мг, 1.36 ммоль), карбонат натрия (430 мг, 4.07 ммоль), 1,1'-бис(дифенилфосфино)-ферроценпалладия дихлорид (200 мг, 0.27 ммоль), калия органотрифторбораты (500 мг, 2.80 ммоль), 1,4-диоксан (12 мл) и воду (3 мл) поместили в 30-мл закрытую пробирку. Реакционную смесь перемешивали при 120°С в течение 1.5 ч при воздействии микроволнового излучения. Затем реакционную смесь экстрагировали дихлорметаном, промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (2/1) с получением 7-(4-фторфеноксиметил)-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (Пример 4.1) в виде светло-желтого осадка (3.00 г, 30%). ЖХМС (ESI): М+Н+ = 361.1; 1HNMR (300 MHz, CDCl3) δ 7.04-6.98 (m, 2H), 6.93-6.89 (m, 2H), 6.48 (s, 1H), 4.92 (s, 2H), 4.09-4.05 (m, 1H), 3.16-3.09 (m, 1H), 2.41 (s, 3Н), 2.36-2.28 (m, 1H), 1.31-1.28 (m, 1H), 1.07-1.00 (m, 2H).
[0183] Пример 4.1 очистили с помощью хиральной препаративной ВЭЖХ при следующих условиях (Prep-SFC80): Колонка, Chiralpak IC, 2*25 см, 5 мкм; подвижная фаза, CO2 и EtOH (0.2% DEA) (поддерживая 65% CO2 в 13 минут); Детектор, УФ 220 нм с получением двух энантиомеров.
[0184] Пик (9.93 мин): Энантиомер 1 (1.09 г, 10%). ЖХМС (ESI): М+Н+ = 361.0; 1H NMR (300 MHz, CDCl3) δ 7.03-6.87 (m, 4H), 6.46 (s, 1H), 4.91 (s, 2H), 4.08-4.03 (m, 1H), 3.16-3.08 (m, 1H), 2.40 (s, 3Н), 2.31-2.23 (m, 1H), 1.32-1.26 (m, 1H), 1.07-0.96 (m, 2H).
[0185] Пик (11.06 мин): Энантиомер 2 (0.96 г, 10%). ЖХМС (ESI): M+H+ = 361.0; 1H NMR (300 MHz, CDCl3) δ 7.02-6.89 (m, 4H), 6.47 (s, 1H), 4.91 (s, 2H), 4.08-4.03 (m, 1H), 3.16-3.09 (m, 1H), 2.40 (s, 3Н), 2.30-2.28 (m, 1H), 1.30-1.25 (m, 1H), 1.07-1.01 (m, 2H).
[0186] Следующие примеры получили аналогично тому, как это описано для Примера 4.1, 4.2, и 4.3:
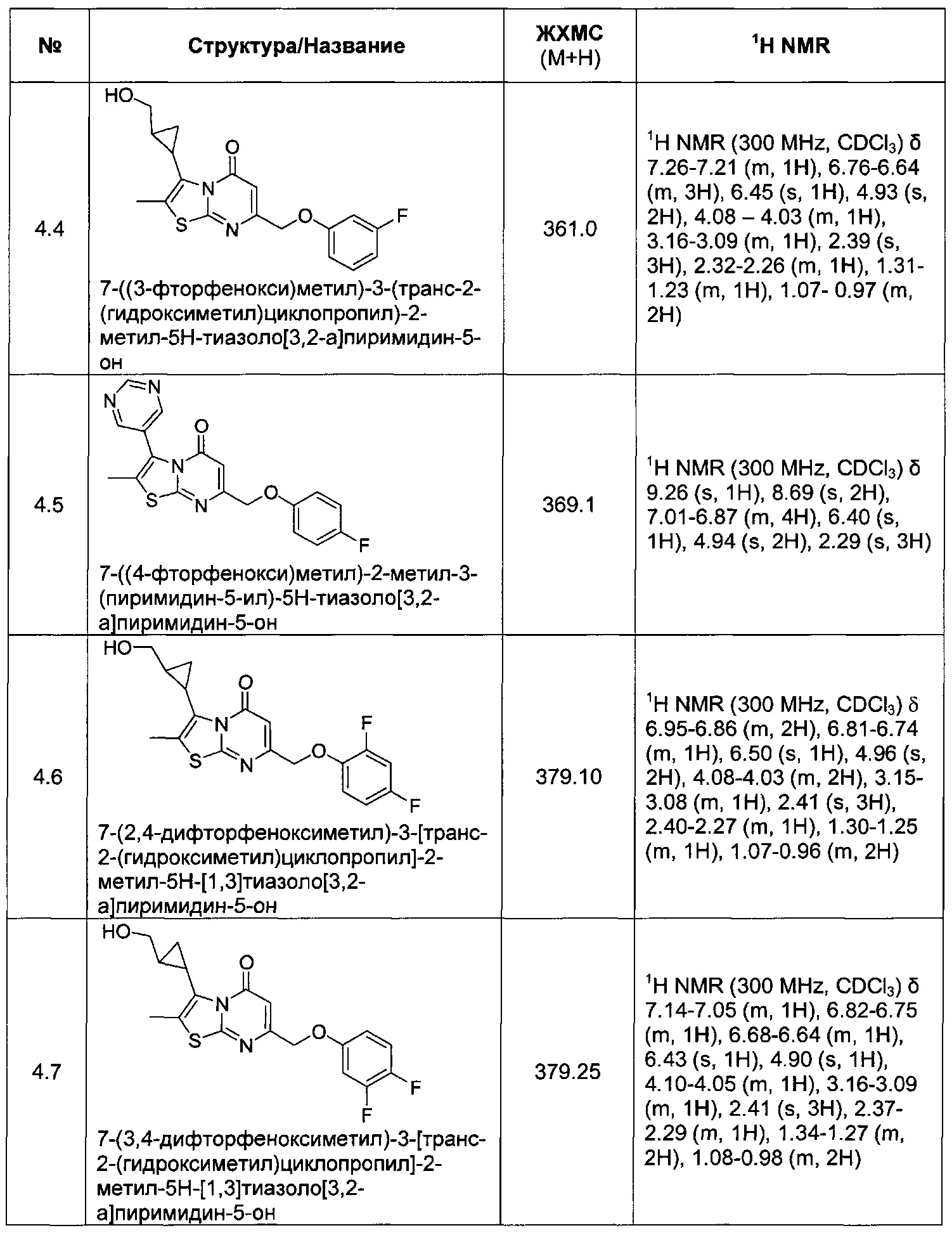
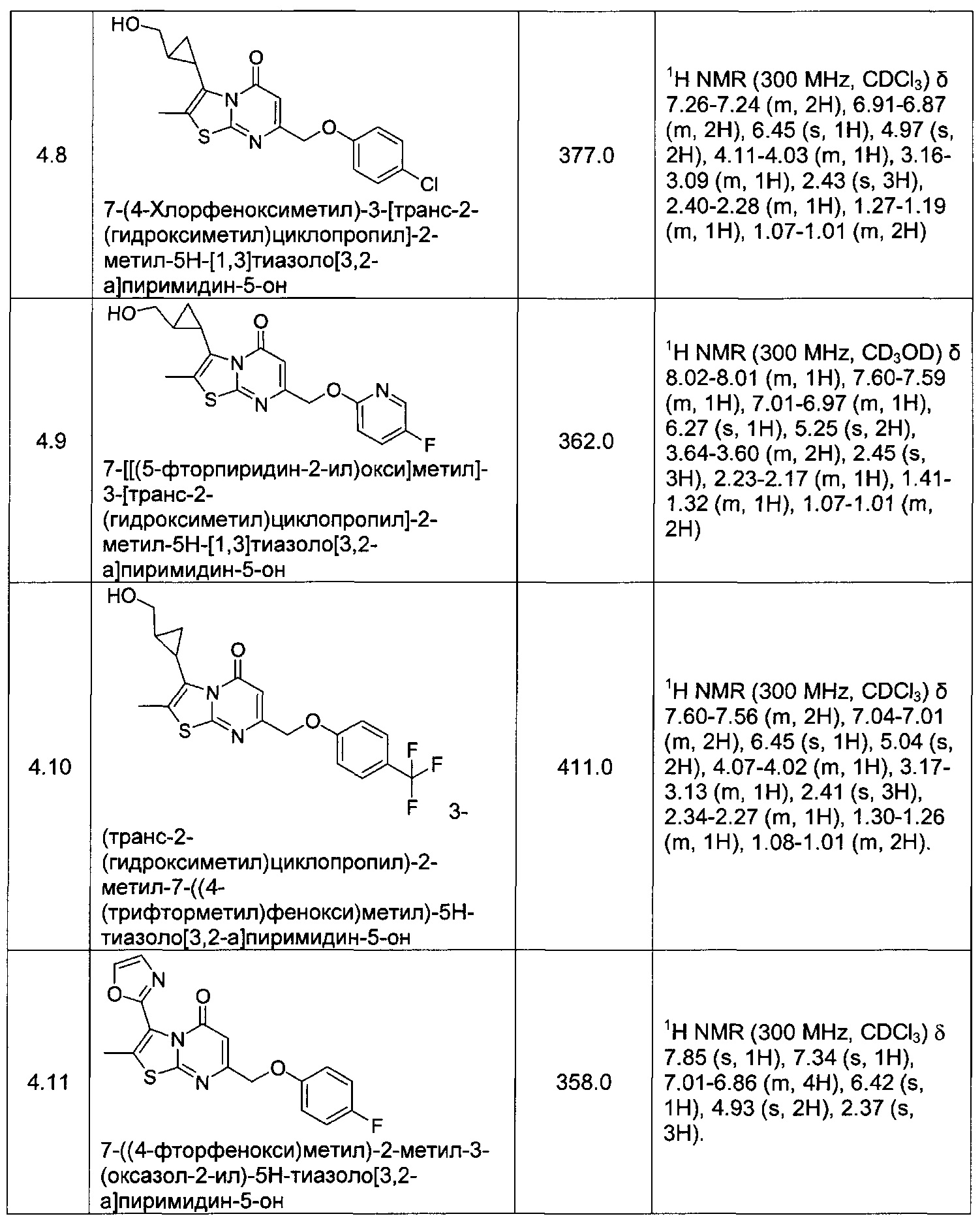
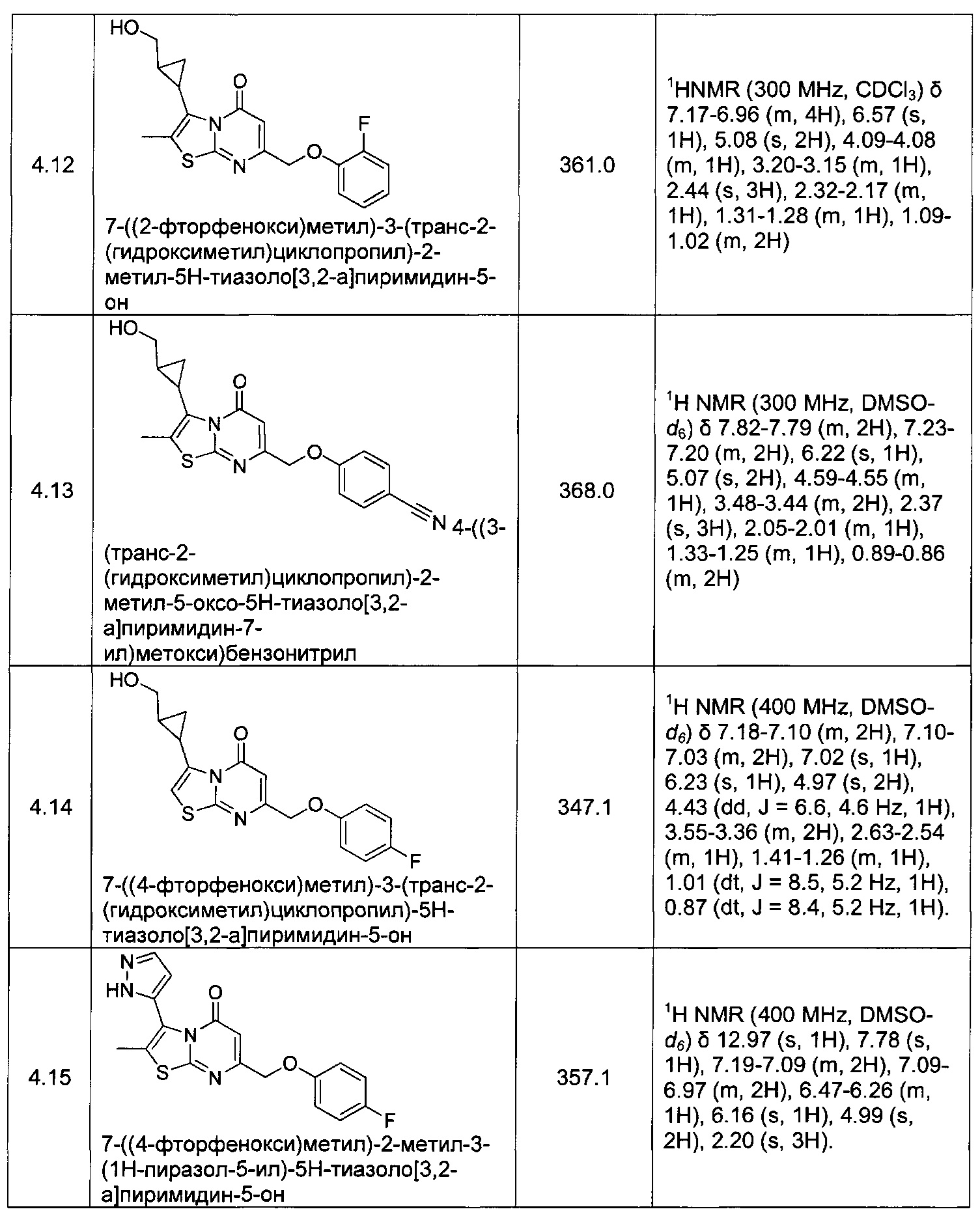
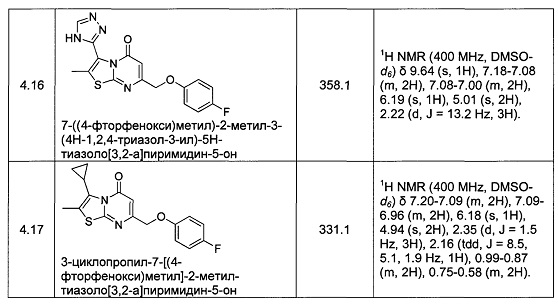
Пример 4.18: цис-2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбонитрил
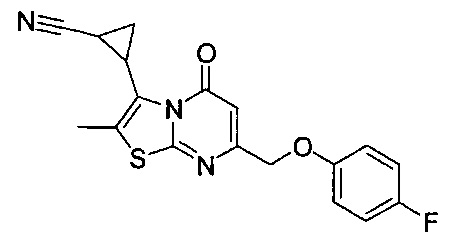
и
Пример 4.18А: транс-2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбонитрил.
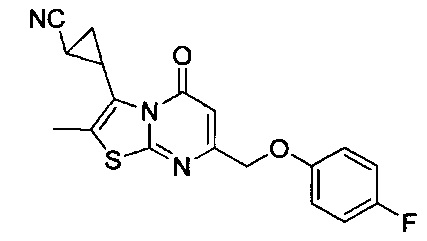
Стадия 1: Этил 2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропанкарбоксилат.
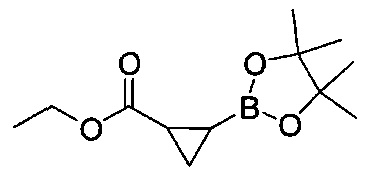
[0187] К раствору 2-этенил-4,4,5,5-тетраметил-1,3,2-диоксаборолана (10.0 г, 4.38 ммоль) и ацетата палладия (166 мг, 0.44 ммоль) в эфире (50 мл) добавили этил 2-диазоацетат (6.60 г, 5.47 ммоль) в эфире (20 мл) по каплям в течение 10 мин при комнатной температуре. Ацетат палладия (166 мг, 0.44 ммоль) и этил 2-диазоацетат (6.60 г, 5.47 ммоль) в эфире (20 мл) снова добавили по каплям в течение других 10 мин. Получившийся раствор затем перемешивали в течение 1 ч при комнатной температуре. После фильтрации через активный оксид алюминия, фильтрат сконцентрировали под вакуумом с получением этил 2-(тетраметил-1,3,2-диоксаборолан-2-ил)циклопропан-1-карбоксилата в виде желтого масла (24.0 г). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: Этил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксилат.
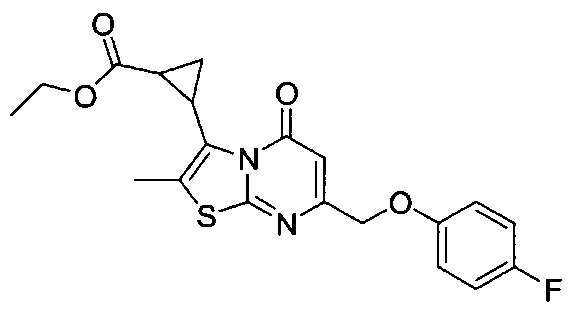
[0188] К раствору 3-бромо-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 7) (500 мг, 1.35 ммоль), этил 2-(4,4,5,5-тетраметил-1,3-диоксолан-2-ил)циклопропан-1-карбоксилата (2.25 г, 6.37 ммоль) и карбоната калия (697 мг, 5.20 ммоль) в смеси 5:1 ацетонитрил/вода (12 мл) добавили 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорид (54.7 мг, 0.06 ммоль). Получившийся раствор перемешивали в течение 1 ч при 120°С в 20-мл пробирке для микроволновой печи. Затем увеличили масштаб способа до 5 г (10 порций) с использование того же способа. После концентрирования под вакуумом, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением этил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксилата в виде красного масла (1.50 г, 28%). ЖХМС (ESI): М+H+ = 403.0.
Стадия 3: 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоновая кислота.
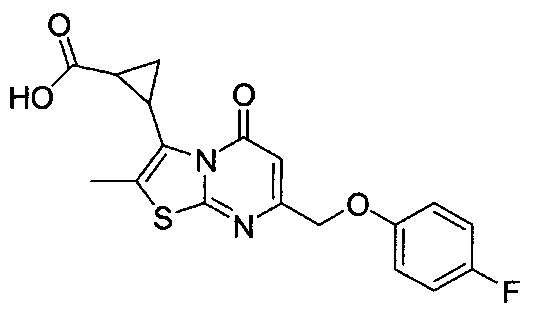
[0189] К раствору этил 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксилата (1.50 г, 3.75 ммоль) в тетрагидрофуране/воде (100/10 мл) добавили гидроксид лития (850 мг, 35.5 ммоль) и раствор перемешивали в течение ночи при комнатной температуре. Значение рН раствора довели до 4-5 с помощью хлороводорода (1 моль/л). Получившийся раствор экстрагировали этилацетатом (2×200 мл) и высушили над безводным сульфатом магния. После фильтрации, фильтрат сконцентрировали под вакуумом с получением 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоновой кислоты в виде желтого масла (800 мг, 57%). ЖХМС (ESI): M+H+ = 375.0.
Стадия 4: 2-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксамид.
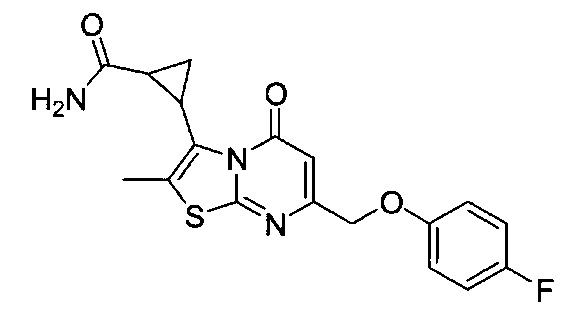
[0190] К раствору 2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоновой кислоты (800 мг, 2.25 ммоль), триэтиламина (325 мг, 3.25 ммоль) в тетрагидрофуране (100 мл) добавили пропан-2-илхлорформиат (325 мг, 2.75 ммоль). Раствор перемешивали в течение 20 мин при комнатной температуре. Затем добавили гидроксид аммония (10 мл, 2.60 ммоль) и раствор перемешивали в течение дополнительных 20 мин при комнатной температуре. Получившийся раствор экстрагировали этилацетатом (2×100 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 3% метанола в дихлорметане с получением 2-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксамида в виде белого осадка (500 мг, 62%).
Стадия 5: 2-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбонитрил.
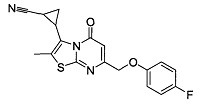
[0191] К раствору 2-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксамида (500 мг, 1.20 ммоль) в дихлорметане (100 мл) добавили 1,8-диазабицикло[5.4.0]ундец-7-ен (100 мл) и этилдихлорфосфат (50 мл). После перемешивания в течение 30 мин при комнатной температуре, реакционную смесь погасили водой (50 мл) и экстрагировали дихлорметаном (3×20 мл) и объединенный органический слой промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ при следующих условиях: (1#-Pre-HPLC-005(Waters)): Колонка, SunFire Prep C18 OBD Колонка, 5 мкм, 19*150 мм; подвижная фаза, вода с 10 ммоль NH4HCO3 и CH3CN (50.0% CH3CN до 82.0% за 10 мин, снижая до 50.0% за 2 мин); Детектор, УФ 254/220 нм с получением цис (Пример 4.18; 200 мг, 42%) и транс (Пример 4.18А; 60 мг, 12%) изомеров.
[0192] Пример 4.18: ЖХМС (ESI): M+H+ = 356.2; 1H NMR (300 MHz, CD3OD) δ 7.07-7.01 (m, 4H), 6.40 (s, 1H), 4.97 (s, 2H), 3.10-2.92 (m, 1H), 2.42 (s, 3H), 2.05-1.96 (m, 1H), 1.84-1.77 (m, 1H), 1.62-1.55 (m, 1H).
[0193] Примеры 4.19 и 4.20: Рацемический цис изомер (Пр. 4.18) очистили с помощью хиральной препаративной ВЭЖХ при следующих условиях (препаративная ВЭЖХ-032): Колонка, Chiralpak IA, 2*25 см, 5 мкм; подвижная фаза, Hex (1%TEA)/EtOH (поддерживая 50.0% EtOH в течение 12 минут), поток, 1.0 мл/мин; Детектор, УФ 254 нм с получением двух энантиомеров.
[0194] Пример 4.19 (цис энантиомер 1): Получили в виде белого осадка (58.6 мг, 16%). Хиральная препаративная ВЭЖХ время задержки, 6.48 мин; ЖХМС (ESI): M+H+ = 356.2; 1H NMR (400 MHz, CDCl3) δ 7.03-7.00 (m, 2H), 6.92-6.89 (m, 2H), 6.46 (s, 1H), 4.90 (s, 2H), 3.02-3.01 (m, 1H), 2.42 (s, 3H), 1.88-1.83 (m, 1H), 1.74-1.69 (m, 1H), 1.48-1.42 (m, 1H).
[0195] Пример 4.20 (цис энантиомер 2): Получили в виде белого осадка (67.8 мг, 19%). Хиральная препаративная ВЭЖХ время задержки, 8.80 мин; ЖХМС (ESI): M+H+ = 356.2; 1H NMR (300 MHz, CD3OD) δ 7.08-7.01 (m, 4H), 6.40 (s, 1H), 4.96 (s, 2H), 2.98-2.94 (m, 1H), 2.42 (s, 3H), 2.05-1.96 (m, 1H), 1.84-1.77 (m, 1H), 1.62-1.55 (m, 1H).
[0196] Примеры 4.21 и 4.22: Рацемический транс изомер (Пр. 4.18А) очистили с помощью хиральной препаративной ВЭЖХ при следующих условиях (препаративная ВЭЖХ-032): Колонка, Chiralpak IA, 2*25 см, 5 мкм; подвижная фаза, Hex (1%TEA)/IPA (поддерживая 50.0% IPA в течение 8 минут), поток, 1.0 мл/мин; Детектор, УФ 254 нм с получением двух энантиомеров.
[0197] Пример 4.21 (транс энантиомер 1): Получили в виде белого осадка (7.1 мг, 1%). Хиральная препаративная ВЭЖХ время задержки, 2.28 мин; ЖХМС (ESI): M+H+ = 356.2; 1H NMR (400 MHz, CDCl3) δ 7.05-6.91 (m, 4H), 6.47 (s, 1H), 4.92 (s, 2H), 3.01-2.95 (m, 1H), 2.43 (s, 3Н), 2.06-2.00 (m, 1H), 1.86-1.70 (m, 1H), 1.62-1.57 (m, 1H).
[0198] Пример 4.22 (транс энантиомер 2): Получили (4.4 мг, 0.5%). Хиральная препаративная ВЭЖХ время задержки, 3.97 мин; ЖХМС (ESI): M+H+ = 356.2; 1H NMR (400 MHz, CDCl3) δ 7.05-6.93 (m, 2H), 6.95-6.91 (m, 2H), 6.47 (s, 1H), 4.92 (s, 2H), 3.01-2.95 (m, 1H), 2.43 (s, 3Н), 2.06-2.66 (m, 1H), 1.86-1.80 (m, 1H), 1.60-1.52 (m, 1H).
Пример 4.23: 7-(4-фторфеноксиметил)-3-[цис-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
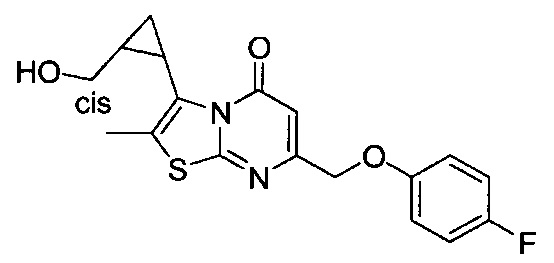
Стадия 1: трет-бутилдиметил[[3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ин-1-ил]окси]силан.
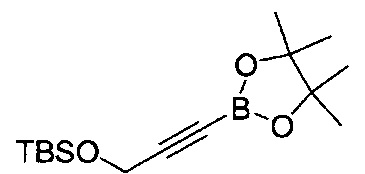
[0199] К раствору трет-бутилдиметил(проп-2-ин-1-илокси)силана (200 мг, 1.17 ммоль) в тетрагидрофуране (6 мл) добавили 2.5 М н-бутиллитий (0.57 мл, 1.42 ммоль) по каплям при -78°С. Получившийся раствор перемешивали в течение 0.5 ч при -78°С. Затем 4,4,5,5-тетраметил-2-(пропан-2-илокси)-1,3,2-диоксаборолан (230 мг, 1.24 ммоль) добавили по каплям при -78°С. Получившемуся раствору дали прореагировать в течение дополнительных 4 ч при поддержании температуры при -78°С. Затем реакционную смесь погасили хлороводородом в этиловом эфире (1 моль/л). После концентрирования под вакуумом, остаток разбавили этиловым эфиром (20 мл) и осадки отфильтровали. Фильтрат сконцентрировали с получением трет-бутилдиметил[[3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ин-1-ил]окси]силана в виде светло-желтой жидкости (260 мг, 75%). 1H NMR (300 MHz, CDCl3) δ 4.35 (s, 2H), 1.27 (s, 12H), 0.90 (s, 9H), 0.12 (s, 6H).
Стадия 2: трет-бутилдиметил[[(2Z)-3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ен-1-ил]окси]силан.
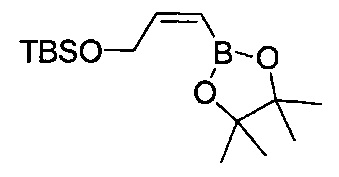
[0200] К суспензии гидрида бис(циклопентадиенил)циркония хлорида (230 мг, 0.88 ммоль) в тетрагидрофуране (5 мл) добавили трет-бутилдиметил[[3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ин-1-ил]окси]силана (260 мг, 0.88 ммоль) в тетрагидрофуране (2 мл) по каплям при перемешивании при комнатной температуре. Получившийся раствор перемешивали в течение ночи при комнатной температуре и затем погасили водой (5 мл). Получившуюся смесь перемешивали в течение дополнительного 1 ч при комнатной температуре и экстрагировали дихлорметаном (2×20 мл). Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1/50) с получением трет-бутилдиметил[[(2Z)-3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ен-1-ил]окси]силана в виде бесцветного масла (200 мг, 76%). 1H NMR (400 MHz, CDCl3) δ 6.58-6.47 (m, 1H), 5.35-5.30 (m, 1H), 4.34-4.33 (m, 2H), 1.27 (s, 12H), 0.90 (s, 9H), 0.12 (s, 6H).
Стадия 3: трет-бутилдиметил[[2-(тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил]метокси]силан.
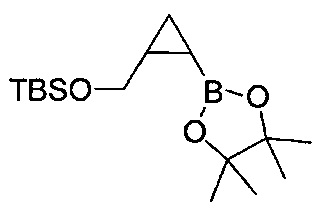
[0201] Диэтилцинк (1.0 М в гексанах) (4 мл, 4 ммоль) добавили к свежедистиллированному дихлорметану (4 мл) в атмосфере азота. Затем трифторуксусную кислоту (0.31 мл, 4.00 ммоль) в дихлорметане (2 мл) добавили по каплям при 0°С. После перемешивания в течение 20 мин, раствор диэтилцинка в гексанах (0.32 мл, 4.00 ммоль) в дихлорметане (2 мл) добавили при 0°С. После дополнительных 20 мин перемешивания, раствор трет-бутилдиметил[[(2Z)-3-(тетраметил-1,3,2-диоксаборолан-2-ил)проп-2-ен-1-ил]окси]силана (600 мг, 2.01 ммоль) в дихлорметане (2 мл) добавили при 0°С. Затем получившийся раствор перемешивали 1 ч при комнатной температуре и погасили водой. Реакционную смесь экстрагировали дихлорметаном (100 мл × 2), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали с получением трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил)метокси)силана в виде бесцветного масла (600 мг, 96%).
Стадия 4: Калия цис-2-(гидроксиметил)циклопропилтрифторборат.
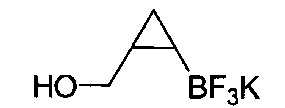
[0202] К раствору трет-бутилдиметил((2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопропил)метокси)силана (600 мг, 2.00 ммоль) в метаноле (4 мл) добавили дифтоид калия (630 мг, 8 ммоль) в воде (2 мл) по каплям при 0°С. После перемешивания 1.5 ч при комнатной температуре, реакционную смесь сконцентрировали под вакуумом. Получившийся осадок суспендировали в ацетоне (20 мл) и кипятили с обратным холодильником 20 мин. Гетерогенную смесь затем отфильтровали для удаления дифторида калия и фильтрат сконцентрировали. Процесс экстракции повторили для отфильтрованного осадка. Объединенные фильтраты сконцентрировали и растворили в минимальном количестве ацетона с последующим медленным добавлением этилового эфира до тех пор, пока раствор не стал мутным. Осадки собрали посредством фильтрации и высушили с получением соединения, указанного в заголовке, в виде белого осадка (150 мг, 43%).
Стадия 5: 7-(4-фторфеноксиметил)-3-[цис-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
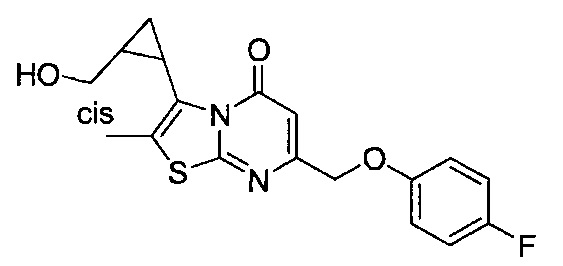
[0203] 3-бромо-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (из Примера 4.1, Стадия 7) (100 мг, 0.27 ммоль,), 1,1'-бис(дифенилфосфино)ферроцен-палладия дихлорид (20.0 мг, 0.03 ммоль), карбонат натрия (60.0 мг, 0.57 ммоль), калия цис-2-(гидроксиметил)циклопропилтрифторборат (100 мг, 0.56 ммоль), ацетонитрил (3 мл) и воду (0.5 мл) поместили в 10-мл закрытую пробирку. Конечную реакционную смесь нагревали в микроволновой печи в течение 1.5 ч при 120°С. Смесь экстрагировали дихлорметаном (20 мл), промыли солевым раствором (10 мл), высушили над безводным сульфатом натрия и сконцентрировали. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (2:1) с получением 7-(4-фторфеноксиметил)-3-[2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (23.5 мг, 24%). ЖХМС (ESI): M+H+ = 361.0; 1H NMR (300 MHz, CDCl3) δ 7.02-6.88 (m, 4H), 6.45 (s, 1H), 4.90 (s, 2H), 3.69-3.64 (m, 1H), 3.17-3.11 (m, 1H), 2.55-2.47 (m, 1H), 2.42 (s, 3Н), 1.68-1.59 (m, 1H), 1.47-1.40 (m, 1H), 0.83-0.77 (m, 1H).
Пример 4.24: транс-7-(4-фторфеноксиметил)-2-метил-3-[2-(трифторметил)циклопропил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
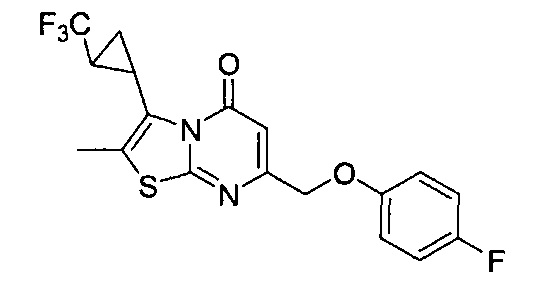
Стадия 1: 2-диазо-1,1,1-трифторэтан.
[0204] К раствору 2,2,2-трифторэтан-1-амина гидрохлорид (3.24 г, 23.9 ммоль) в воде (5 мл) и этиловом эфире (10 мл) добавили по каплям раствор нитрита натрия (1.84 г, 26.7 ммоль) в воде (2 мл). Получившийся раствор перемешивали в течение 3 ч при комнатной температуре. Осадки отфильтровали с получением 2-диазо-1,1,1-трифторэтана в виде светло-желтой жидкости (1.32 г, 51%). Сигнал ЖХМС отсутствовал.
Стадия 2: 4,4,5,5-Тетраметил-2-[2-(трифторметил)циклопропил]-1,3,2-диоксаборолан.
[0205] К раствору 2-диазо-1,1,1-трифторэтана (530 мг, 4.82 ммоль) в эфире (100 мл) добавили ацетат палладия (50.0 мг, 0.22 ммоль). Затем 2-этенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0.66 г, 4.29 ммоль) и ацетат палладия (50.0 мг, 0.22 ммоль) добавили при перемешивании в течение 20 мин. Затем получившийся раствор перемешивали в течение 1 ч при комнатной температуре, осадки отфильтровали. Получившийся раствор сконцентрировали под вакуумом с получением 4,4,5,5-тетраметил-2-[2-(трифторметил)циклопропил]-1,3,2-диоксаборолана в виде темно-зеленого масла (580 мг, 51%).
Стадия 3: транс-7-(4-фторфеноксиметил)-2-метил-3-[2-(трифторметил)циклопропил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
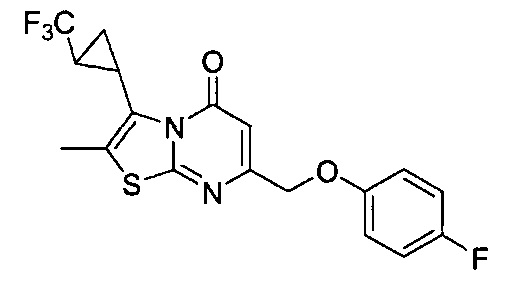
[0206] К раствору 4,4,5,5-тетраметил-2-[2-(трифторметил)циклопропил]-1,3,2-диоксаборолана (384 мг, 1.63 ммоль) в ацетонитриле (3 мл) и воде (1 мл) добавили 3-бромо-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (300 мг, 0.81 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорид (59 мг, 0.08 ммоль) и карбонат натрия (12 мг). Получившийся раствор перемешивали в течение 1.5 ч при 120°С в атмосфере азота и затем разбавили водой (5 мл). После экстракции дихлорметаном (3×30 мл), объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Условия: (препаративная ВЭЖХ-005): Колонка, Xbridge Prep C18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль дикарбонатом аммония и ацетонитрил (35.0% ацетонитрил до 59.0% в течение 10 мин); Детектор, УФ 254/220 нм) с получением 7-(4-фторфеноксиметил)-2-метил-3-[2-(трифторметил)циклопропил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (4.40 мг, 1%). ЖХМС (ESI): М+H+ = 399.2; 1Н NMR (300 MHz, CDCl3) δ 7.02-6.96 (m, 2H), 6.92-6.87 (m, 1H), 6.42 (s, 1H), 4.90 (s, 2H), 2.81-2.76 (m, 1H), 2.42 (s, 3H), 1.98-1.87 (m, 1H), 1.55-1.48 (m, 1H), 1.18-1.10 (m, 1H).
Пример 4.25: 7-(4-фторфеноксиметил)-2-метил-3-(2-метилциклопропил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
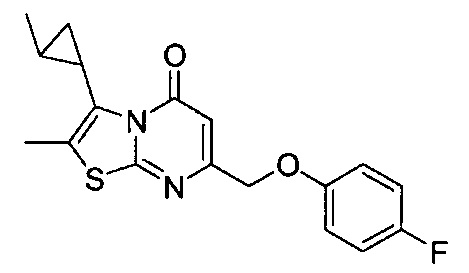
Стадия 1: 4,4,5,5-Тетраметил-2-(2-метилциклопропил)-1,3,2-диоксаборолан.
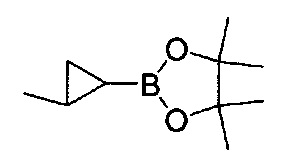
[0207] К раствору 1 М диэтилцинка в гексанах (0.36 мл, 0.36 ммоль) в дихлорметане (4 мл) добавили раствор трифторуксусной кислоты (408 мг, 3.58 ммоль) в дихлорметане (4.0 мл), с последующим раствором дийодометана (957 мг, 3.57 ммоль) в дихлорметане (4.0 мл) в атмосфере азота и реакционный раствор перемешивали в течение 40 мин при 0°С. Затем добавили раствор 4,4,5,5-тетраметил-2-[(1Е)-проп-1-ен-1-ил]-1,3,2-диоксаборолана (300 мг, 1.79 ммоль) в дихлорметане (2 мл) и реакционную смесь перемешивали в течение дополнительных 50 мин при комнатной температуре. Реакционную смесь погасили насыщенным раствором хлорида аммония (10 мл), экстрагировали петролейным эфиром (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 4,4,5,5-тетраметил-2-(2-метилциклопропил)-1,3,2-диоксаборолана в виде желтого осадка (300 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): M+H+ = 376.1; 1H NMR (300 MHz, CD3OD) δ 1.21 (s, 12H), 1.08-1.06 (m, 3Н), 0.95-0.91 (m, 1H), 0.69-0.65 (m, 1H), 0.38-0.32 (m, 1H), -0.42 до -0.47 (m, 1H).
Стадия 2: 7-(4-фторфеноксиметил)-2-метил-3-(2-метилциклопропил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
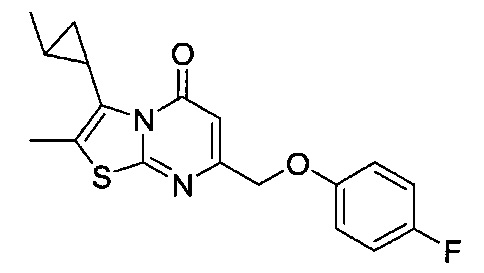
[0208] К раствору 3-бромо-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 7) (100 мг, 0.27 ммоль) в ацетонитриле/воде (1.5/0.5 мл) добавили 4,4,5,5-тетраметил-2-(2-метилциклопропил)-1,3,2-диоксаборолан (100 мг, 0.55 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорид (20.3 мг, 0.03 ммоль) и карбонат натрия (57.0 мг, 0.54 ммоль). Реакционную смесь нагревали под микроволновым излучением в течение 90 мин при 120°С. Реакционную смесь затем сконцентрировали под вакуумом и получившийся остаток очистили посредством хроматографии дихлорметаном/метанолом (50/1) с получением 7-(4-фторфеноксиметил)-2-метил-3-(2-метилциклопропил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (17.6 мг, 18%). ЖХМС (ESI): M+H+ = 345.1; 1Н NMR (300 MHz, CDCl3) δ 7.01-6.95 (m, 2H), 6.91-6.86 (m, 2H), 6.38 (s, 1H), 4.88 (s, 2H), 2.36 (s, 3Н), 1.94-1.90 (m, 1H), 1.24-1.22 (m, 3Н), 1.03-0.95 (m, 1H), 0.93-0.85 (m, 2H).
Пример 4.26: транс-2-[2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]ацетонитрил.
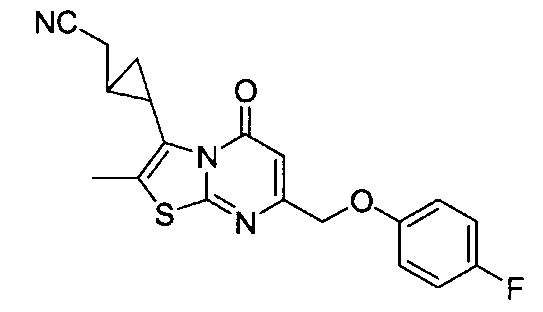
Стадия 1: [2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]метилметансульфонат.
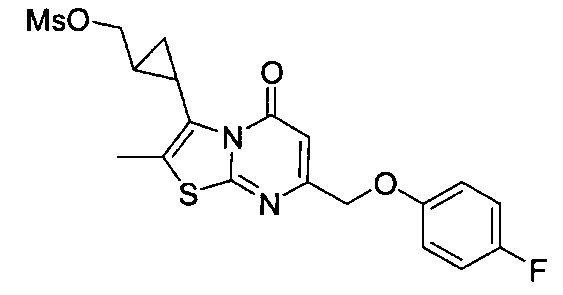
[0209] К раствору 7-((3-фторфенокси)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 8) (40.0 мг, 0.11 ммоль) в дихлорметане (51 мл) добавили триэтиламин (34.0 мг, 0.34 ммоль) и метансульфонилхлорид (38.0 мг). После перемешивания в течение 1 ч при комнатной температуре, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью 2% метанола в дихлорметане с получением [2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]метилметансульфоната в виде серо-белого осадка (40.0 мг, 82%). ЖХМС (ESI): М+Н+ = 439; 1H NMR (300 MHz, CDCl3) δ 7.03-6.89 (m, 4H), 6.41 (s, 1H), 4.95 (s, 2H), 4.65-4.59 (s, 2H), 2.43 (s, 3Н), 2.42-2.21 (m, 1H), 1.56-1.02 (m, 3Н).
Стадия 2: транс-2-[2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]ацетонитрил.
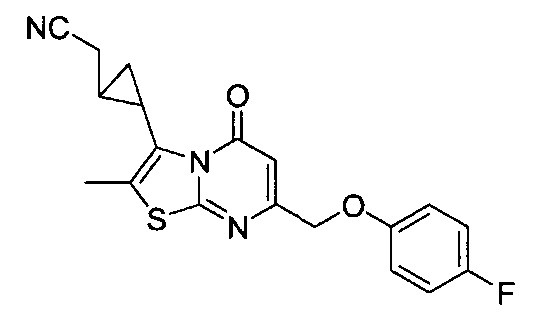
[0210] К раствору [2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]метилметансульфоната (50.0 мг, 0.11 ммоль) в диметилсульфоксиде (5 мл) добавили цианид натрия (50.0 мг). Получившийся раствор перемешивали в течение 1 ч при 90°С. После охлаждения до комнатной температуры, реакционную смесь разбавили дихлорметаном (10 мл), промыли водой (4×5 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством препаративной ВЭЖХ (Условия: Колонка, SunFire Prep C18 OBD Колонка, 5 мкм, 19*150 мм; подвижная фаза, вода с 10 ммоль бикарбонатом аммония и ацетонитрилом (18.0% ацетонитрил до 28.0% в течение 10 мин, повышая до 95.0% в течение 2 мин, понижая до 18.0% в течение 2 мин); Детектор, УФ 254/220 нм) с получением 2-[2-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропил]ацетонитрила в виде белого осадка (8.90 мг, 21%). ЖХМС (ESI): М+H+ = 370.0; 1H NMR (300 MHz, CDCl3) δ 7.04-6.89 (m, 4H), 6.41 (s, 1H), 4.94 (s, 2H), 3.02-2.95 (m, 1H), 2.56-2.45 (m, 1H), 2.42 (s, 3Н), 2.06-1.96 (m, 1H), 1.32-1.23 (m, 2H), 1.20-1.09 (m, 1H).
[0211] Следующие примеры получили аналогично тому, как это описано для Примера 4.26:
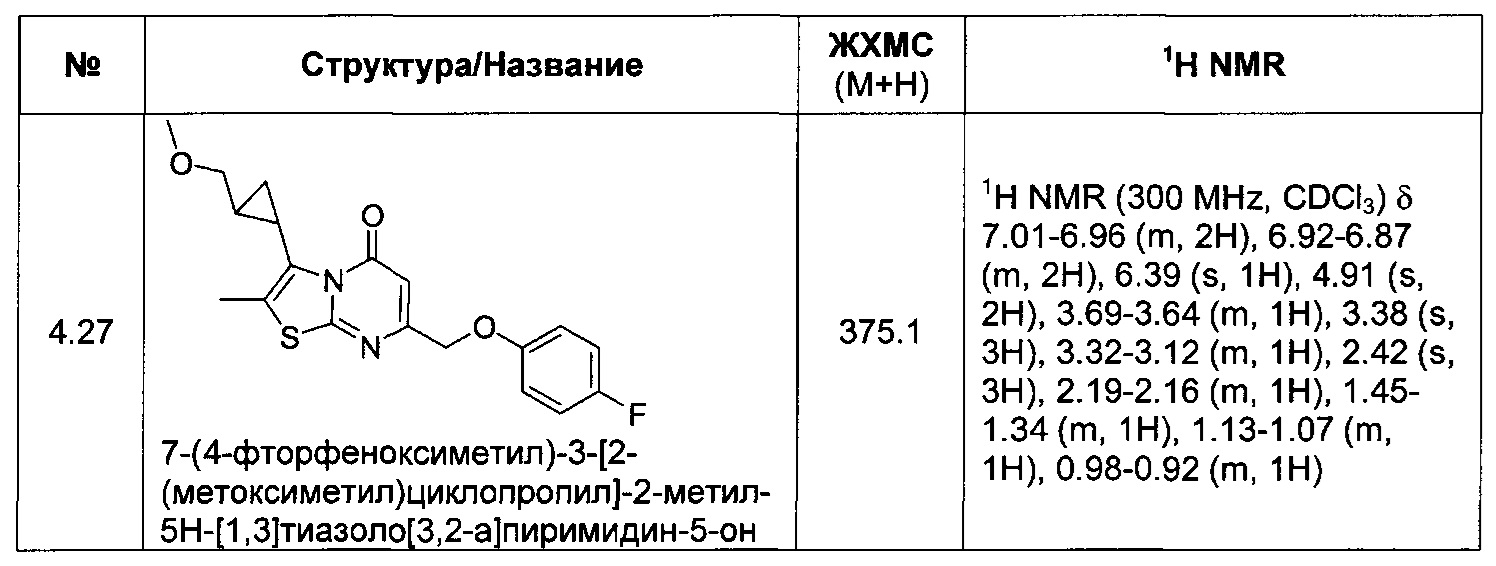
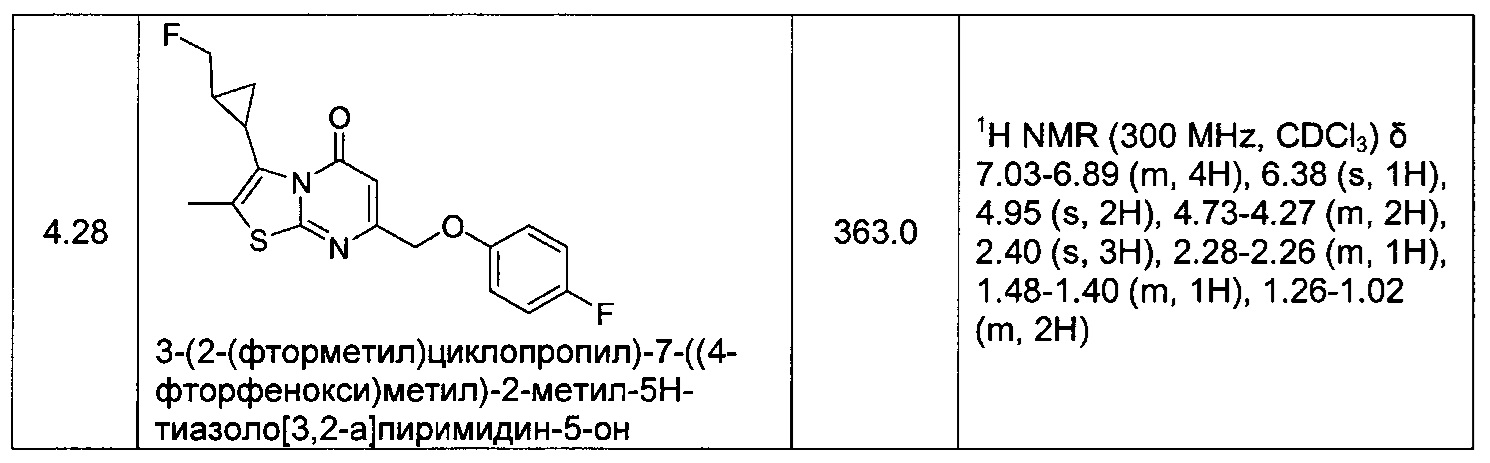
Пример 4.29: 6-фтор-7-((4-фторфенокси)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
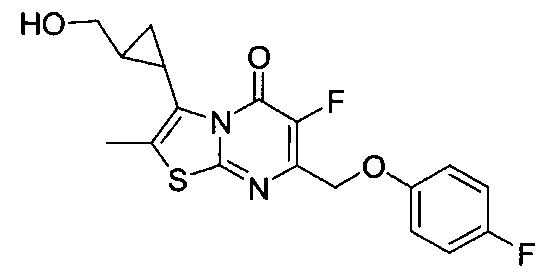
Стадия 1: 3-бромо-7-(хлорометил)-6-фтор-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
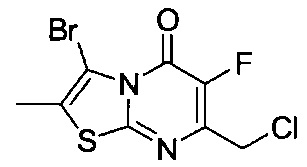
[0212] В 30-мл закрытую пробирку, продутую и поддерживаемую под азотом добавили раствор 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (500 мг, 1.70 ммоль) в ацетонитриле (20 мл) и 1-хлорметил-4-фтор-1,4-диазонийбицикло[2.2.2]октана бис(тетрафторборат) (Selectfluor®; 600 мг, 1.69 ммоль). Получившийся раствор перемешивали в течение 3 ч при 75°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном с получением 3-бромо-7-(хлорометил)-6-фтор-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (250 мг, 40%). ЖХМС (ESI): М+H+ = 311.0, 313.0; 1H NMR (300 MHz, CDCl3) δ 4.55 (s, 2H), 2.41 (s, 3Н).
Стадия 2: 3-бромо-6-фтор-7-((4-фторфенокси)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
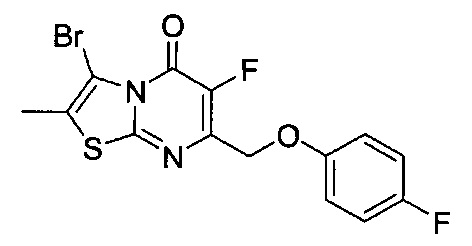
[0213] К раствору 3-бромо-7-(хлорометил)-6-фтор-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (300 мг, 0.96 ммоль) в ацетонитриле (20 мл) добавили йодид калия (83.0 мг, 0.48 ммоль), карбонат калия (276 мг, 2.00 ммоль) и 4-фторфенол (224 мг, 2.00 ммоль). Реакционную смесь перемешивали в течение ночи при 80°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с помощью смеси этилацетат/петролейный эфир (1/2) с получением 3-бромо-6-фтор-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (50.0 мг, 11%). ЖХМС (ESI): М+Н = 387.0, 389.0.
Стадия 3: 6-фтор-7-((4-фторфенокси)метил)-3-(2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
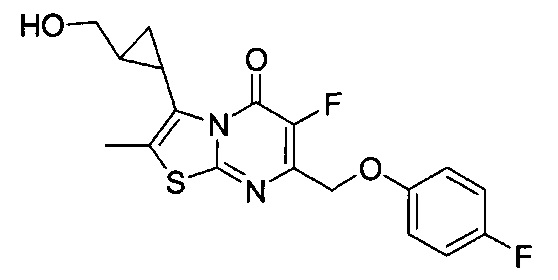
[0214] В 10-мл закрытую пробирку, продутую и поддерживаемую под азотом добавили раствор 3-бромо-6-фтор-7-(4-фторфеноксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (150 мг, 0.39 ммоль) в ацетонитриле/воде (3/1 мл), 1,1'-бис(дифенилфосфино)ферроцен-палладия дихлорид (29.0 мг, 0.04 ммоль), карбонат натрия (82.0 мг, 0.77 ммоль) и калия транс-2-(гидроксиметил)циклопропилтрифторборат (из Примера 4.1, Стадия 2) (138 мг, 0.78 ммоль). Реакционную смесь перемешивали в течение 1.5 ч при 120°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем дихлорметаном/метанолом (100/1) с получением 6-фтор-7-((4-фторфенокси)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (26.1 мг, 18%). ЖХМС (ESI): M+H+ = 379.0; 1H NMR (300 MHz, CDCl3) δ 6.98-6.91 (m, 4H), 5.02 (s, 2H), 4.06-4.01 (m, 1H), 3.25-3.18 (m, 1H), 2.39 (s, 3Н), 2.33-2.27 (m, 1H), 1.30-1.25 (m, 1H), 1.08-0.99 (m, 2H).
Пример 4.30: 7-(4-фторфеноксиметил)-3-(3-гидроксипропил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
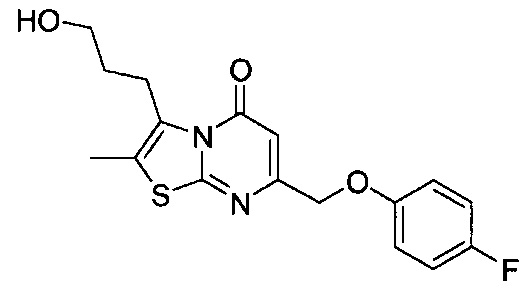
Стадия 1: Этил (Е)-этил 3-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилат.
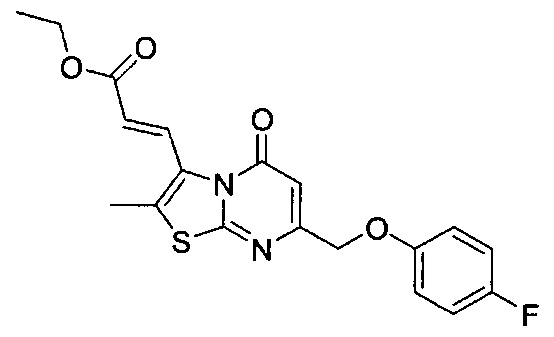
[0215] К раствору 3-бромо-7-((3-фторфенокси)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 7) (205 мг, 0.56 ммоль) в ацетонитриле (5 мл) добавили этил проп-2-еноат (110 мг, 1.10 ммоль), три-толилфосфин (25 мг), трис(дибензилиденацетон)дипалладий (33.0 мг, 0.04 ммоль) и триэтиламин (110 мг, 1.09 ммоль). Реакционную смесь перемешивали в течение ночи при 90°С в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом и остаток очистили посредством хроматографии с помощью 3% этилацетата в петролейном эфире с получением этил (Е)-этил 3-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилата в виде серо-белого осадка (58.0 мг, 27%). ЖХМС (ESI): M+H+ = 389.0.
Стадия 2: этил 3-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)пропаноат.
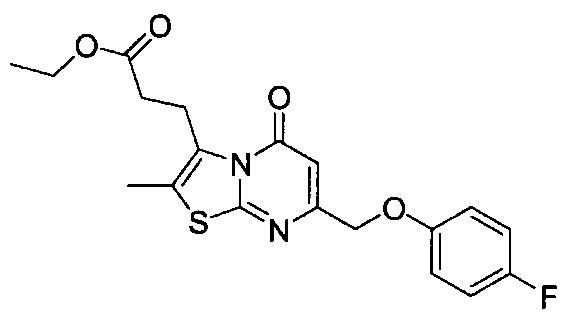
[0216] К раствору этил (Е)-этил 3-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилата (58.0 мг, 0.15 ммоль) в метаноле (5 мл) добавили палладий на угле (50.0 мг). Реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода (1.5 атм). Затем осадки отфильтровали, получившуюся смесь сконцентрировали под вакуумом с получением этил 3-(7-((4-фторфенокси)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)пропаноата (52.0 мг, 89%) в виде белого осадка. ЖХМС (ESI): М+H+ = 391.0.
Стадия 3: 7-(4-фторфеноксиметил)-3-(3-гидроксипропил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
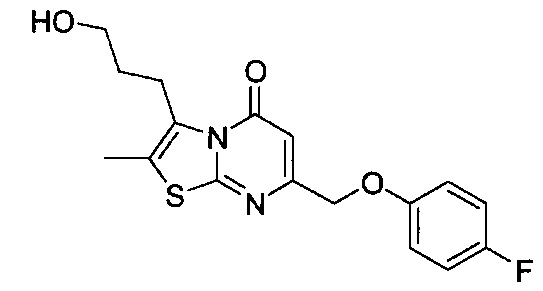
[0217] К раствору этил 3-[7-(4-фторфеноксиметил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]пропаноата (42.0 мг, 0.11 ммоль) в тетрагидрофуране (4 мл) и метаноле (1 мл) добавили борогидрид лития (23.0 мг). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой (5 мл), экстрагировали дихлорметаном (3×10 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью 3% метанола в дихлорметане с получением 7-(4-фторфеноксиметил)-3-(3-гидроксипропил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (6.3 мг, 1.7%). ЖХМС (ESI): M+H+ = 349.1; 1H NMR (300 MHz, CDCl3) δ 7.02-6.91 (m, 4H), 6.46 (s, 1H), 4.92 (s, 2H), 3.70-3.65 (m, 2H), 3.36-3.32 (m, 2H), 2.36 (s, 3Н), 1.96-1.89 (m, 2H).
[0218] Следующие соединения получили с использованием способов, аналогичных описанным выше
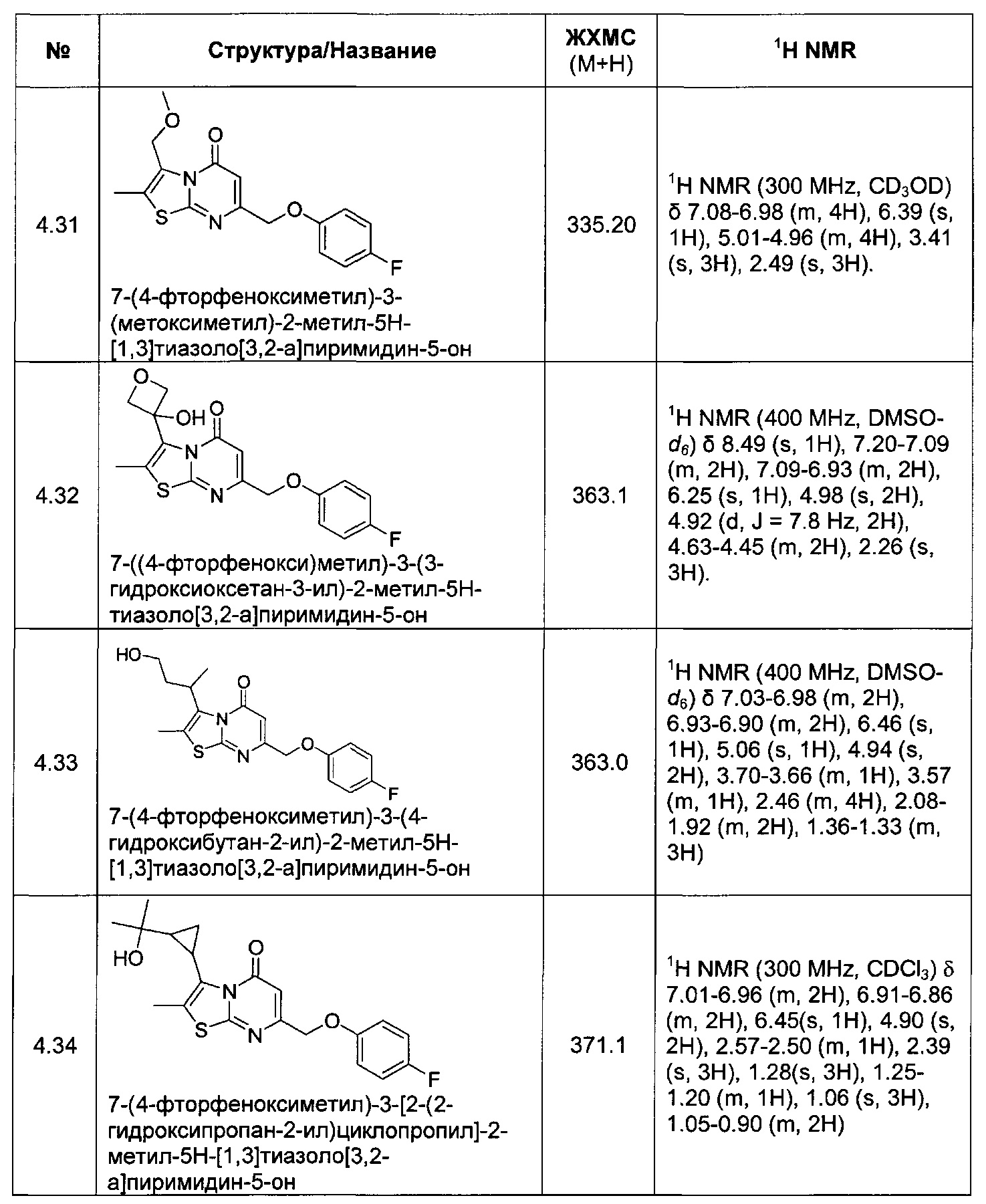
Способ 5:
Пример 5.1: 7-[(N-этил-4-фтор-анилино)метил]-2-метил-3-пиримидин-5-ил-тиазоло[3,2-а]пиримидин-5-он.
Стадия 1: 3-бромо-7-((этил(4-фторфенил)амино)метил)-2-метил-5H-тиазоло[3,2-а]пиримидин-5-он.
[0219] Смесь 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (30 г, 0.1 моль), N-этил-4-фторанилина (18.5 г, 0.13 моль), карбоната калия (28.2 г, 0.2 моль) и йодида натрия (7.66 г, 0.05 моль) в ацетонитриле нагревали в течение ночи при 80°С. Затем смесь охладили до комнатной температуры, разбавили насыщенным водным раствором хлорида аммония (300 мл) и экстрагировали дихлорметаном (200 мл ×3). Объединенные органические слои промыли водой и солевым раствором, высушили над сульфатом натрия и сконцентрировали. Остаток тритурировали дихлорметаном с получением 3-бромо-7-((этил(4-фторфенил)амино)метил)-2-метил-5H-тиазоло[3,2-а]пиримидин-5-она (21 г, 54%) в виде серо-белого осадка.
Стадия 2: 7-[(N-этил-4-фтор-анилино)метил]-2-метил-3-пиримидин-5-ил-тиазоло[3,2-а]пиримидин-5-он.
[0220] К раствору 3-бромо-7-((этил(4-фторфенил)амино)метил)-2-метил-5H-тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.13 ммоль) в ацетонитриле/Н2О (1.3/0.5 мл) добавили (пиримидин-5-ил)бороновую кислоту (20.3 мг, 0.16 ммоль), карбонат натрия (40.5 мг, 0.379 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (9.7 мг, 0.013 ммоль). Реакционную смесь нагревали при воздействии микроволнового излучения в течение 20 мин при 120°С. После охлаждения до комнатной температуры, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (95/5) с получением 7-[(N-этил-4-фтор-анилино)метил]-2-метил-3-пиримидин-5-ил-тиазоло[3,2-а]пиримидин-5-она (14.8 мг, 30.0%) в виде серо-белого осадка. ЖХМС (ESI): М+H+ = 396.1; 1Н NMR (400 MHz, DMSO-d6) δ 9.18 (s, 1Н), 8.83 (s, 2H), 6.98 (t, J=8.8 Hz, 2H), 6.62 (dd, J=9.2, 4.4 Hz, 2H), 5.85 (s, 1Н), 4.36 (s, 2H), 3.47 (q, J=7.0 Hz, 2H), 2.22 (s, 3H), 1.13 (t, J=7.0 Hz, 3H).
[0221] Следующие примеры получили аналогично тому, как это описано для Примера 5.1:
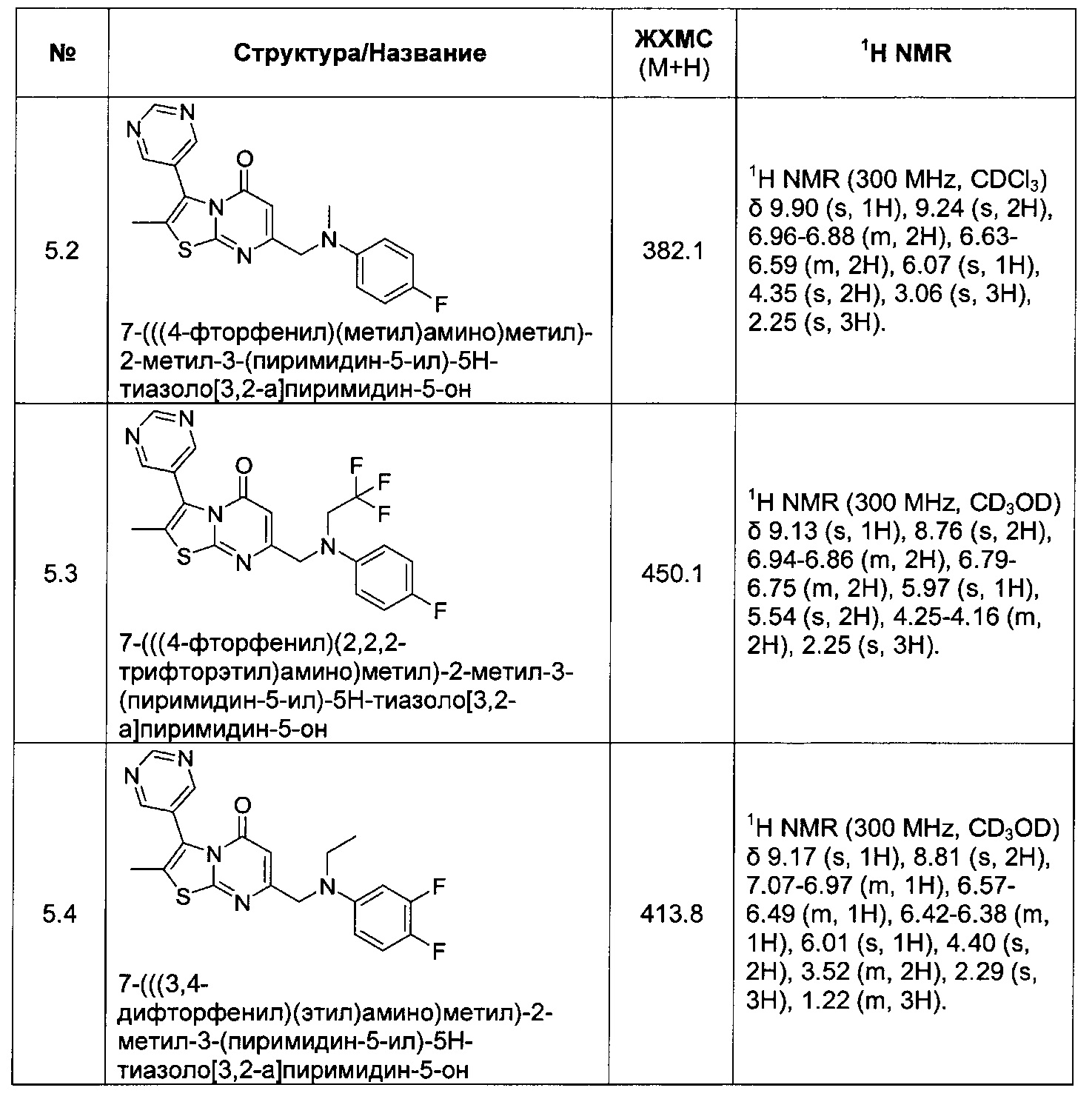
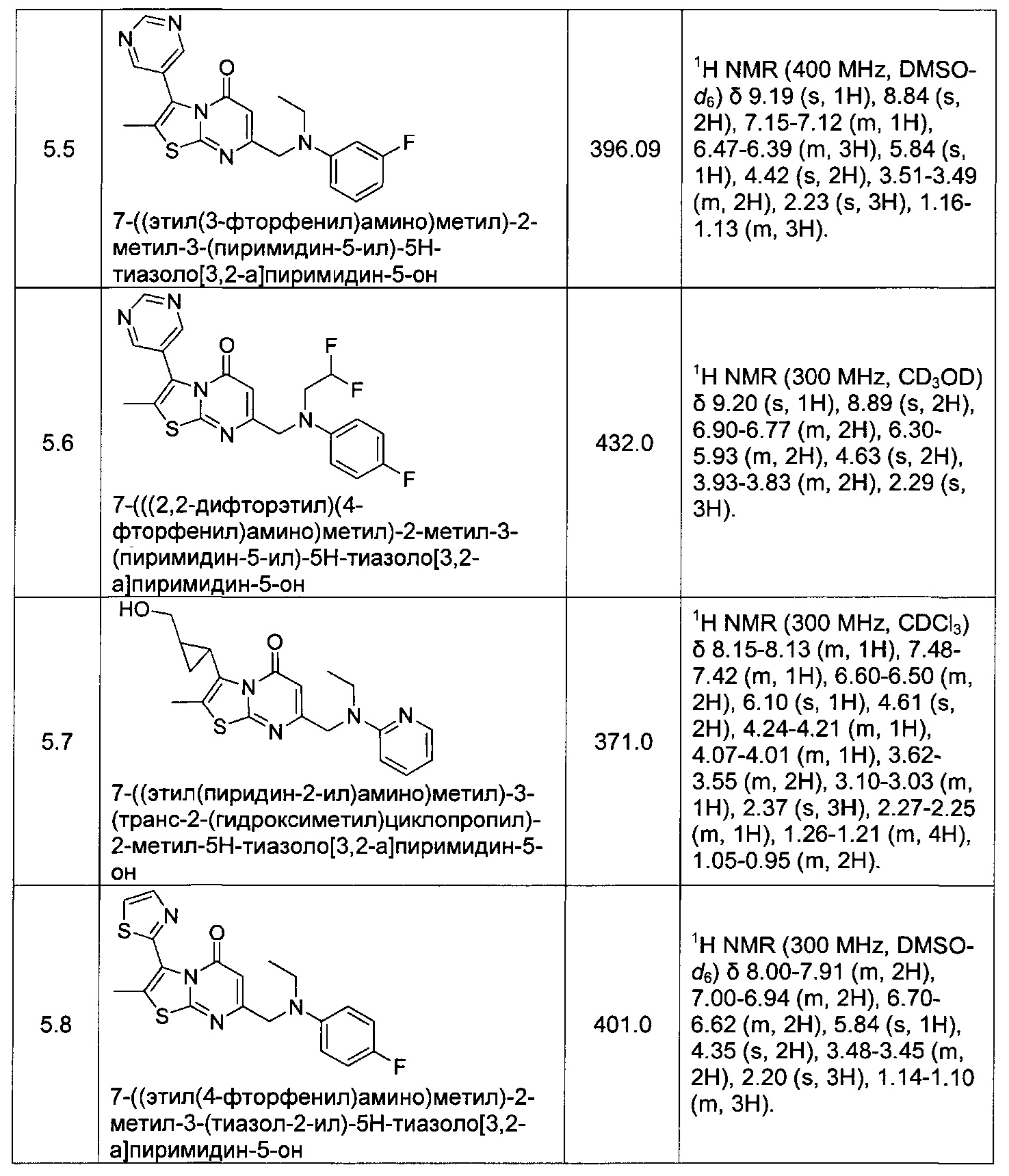
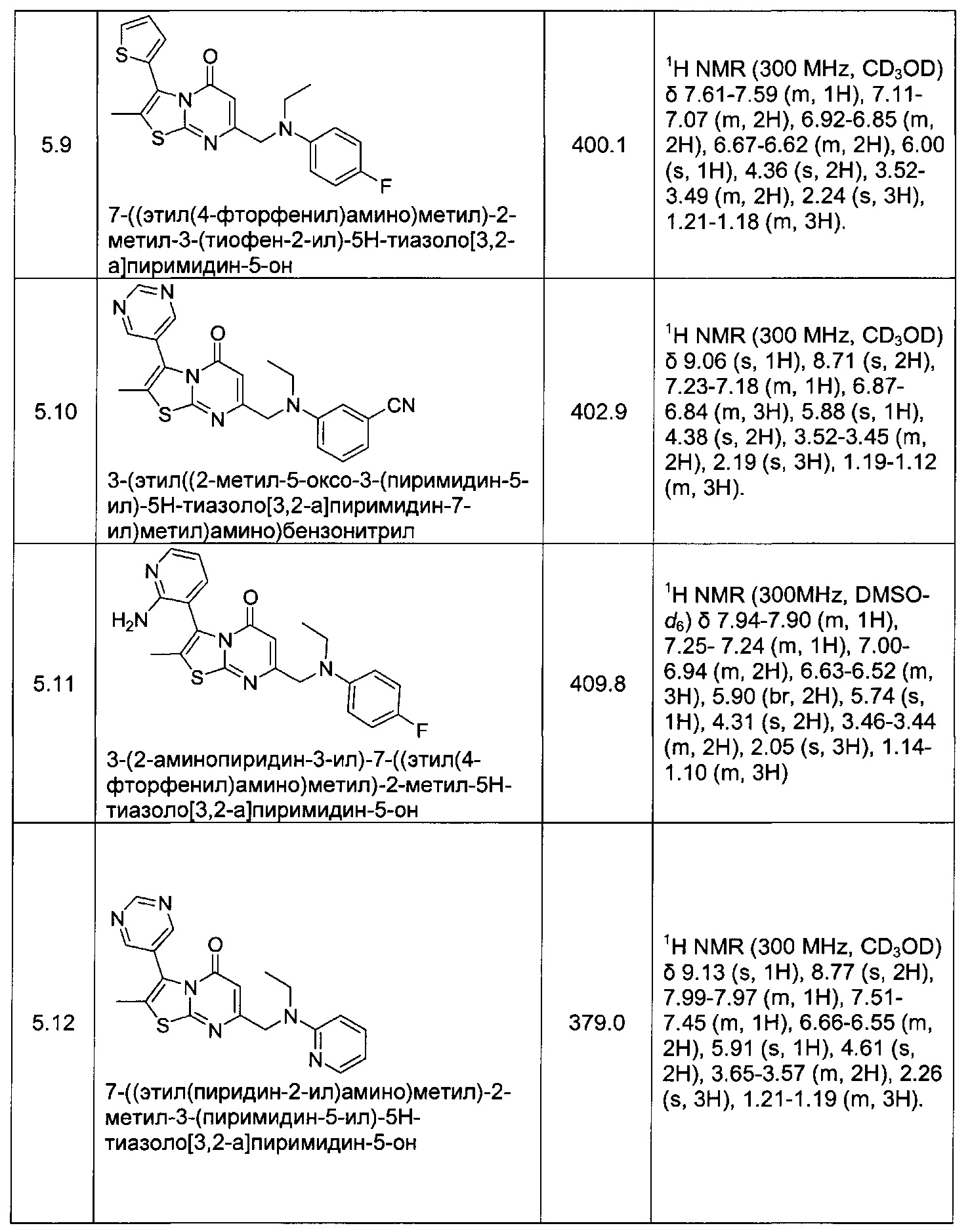
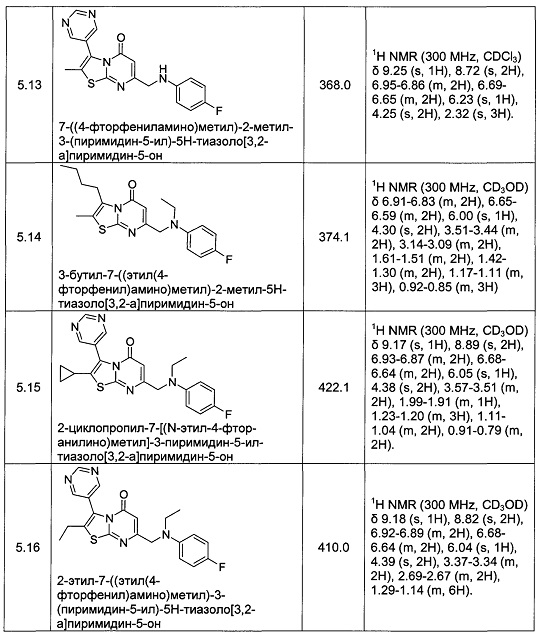
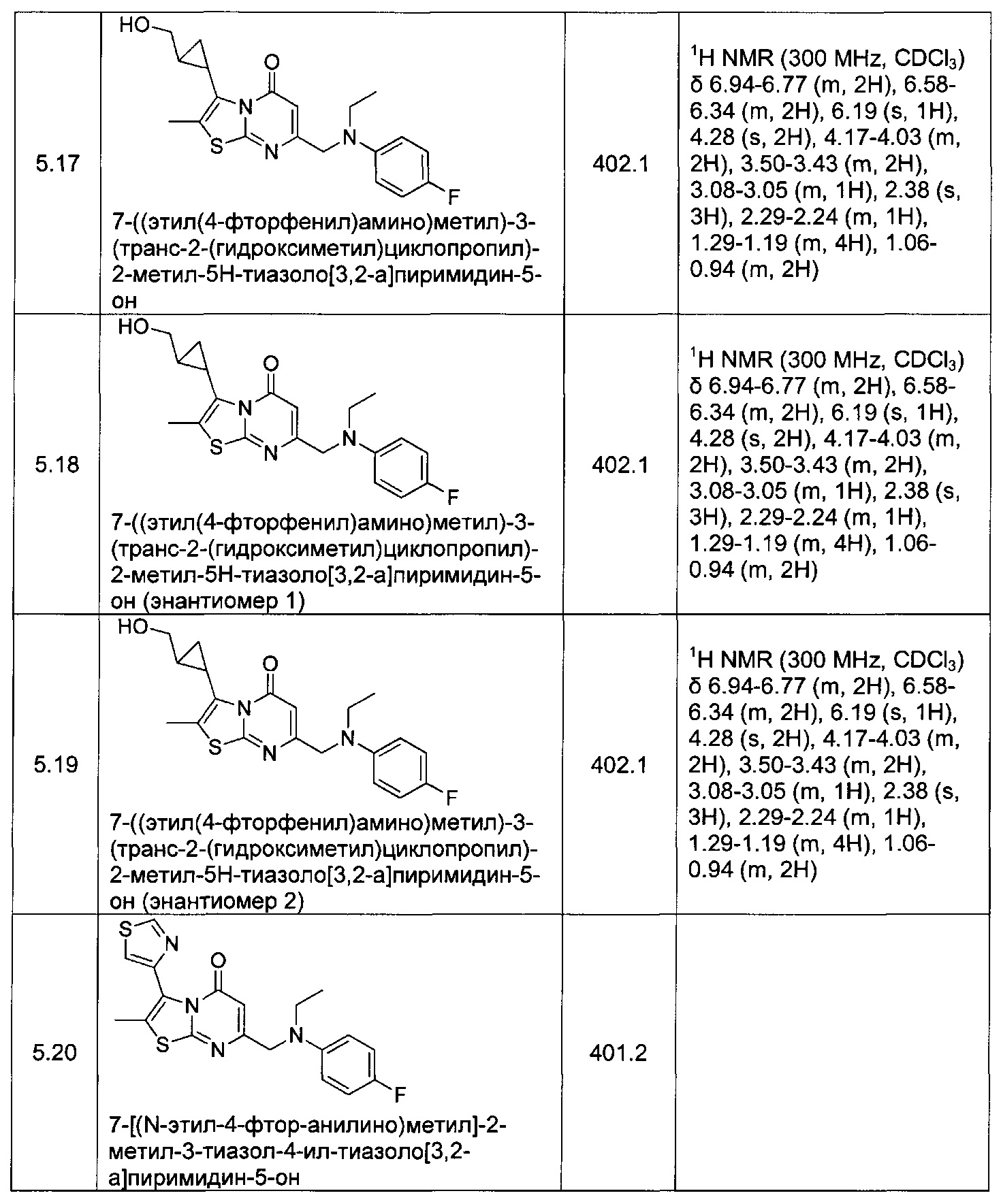
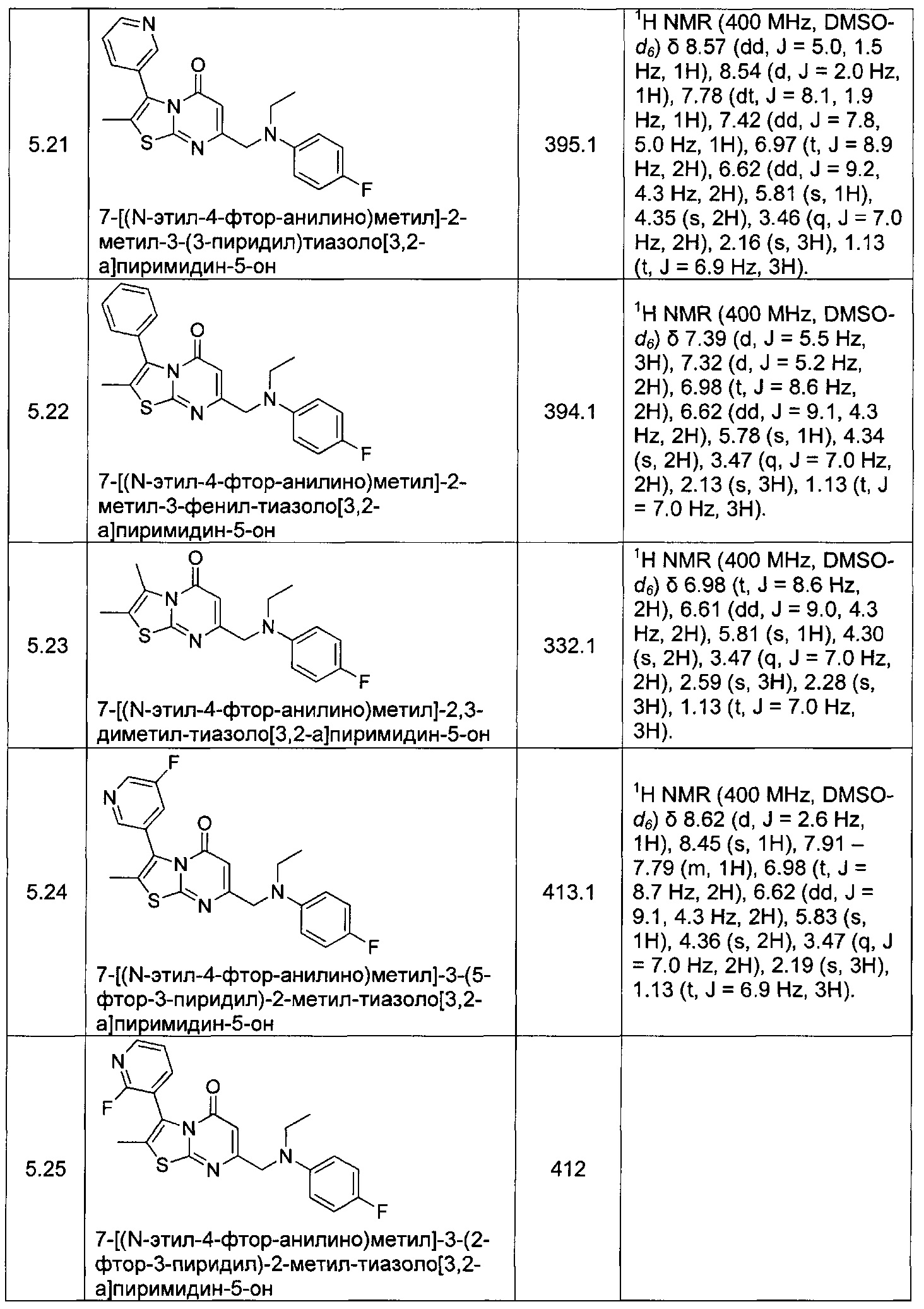
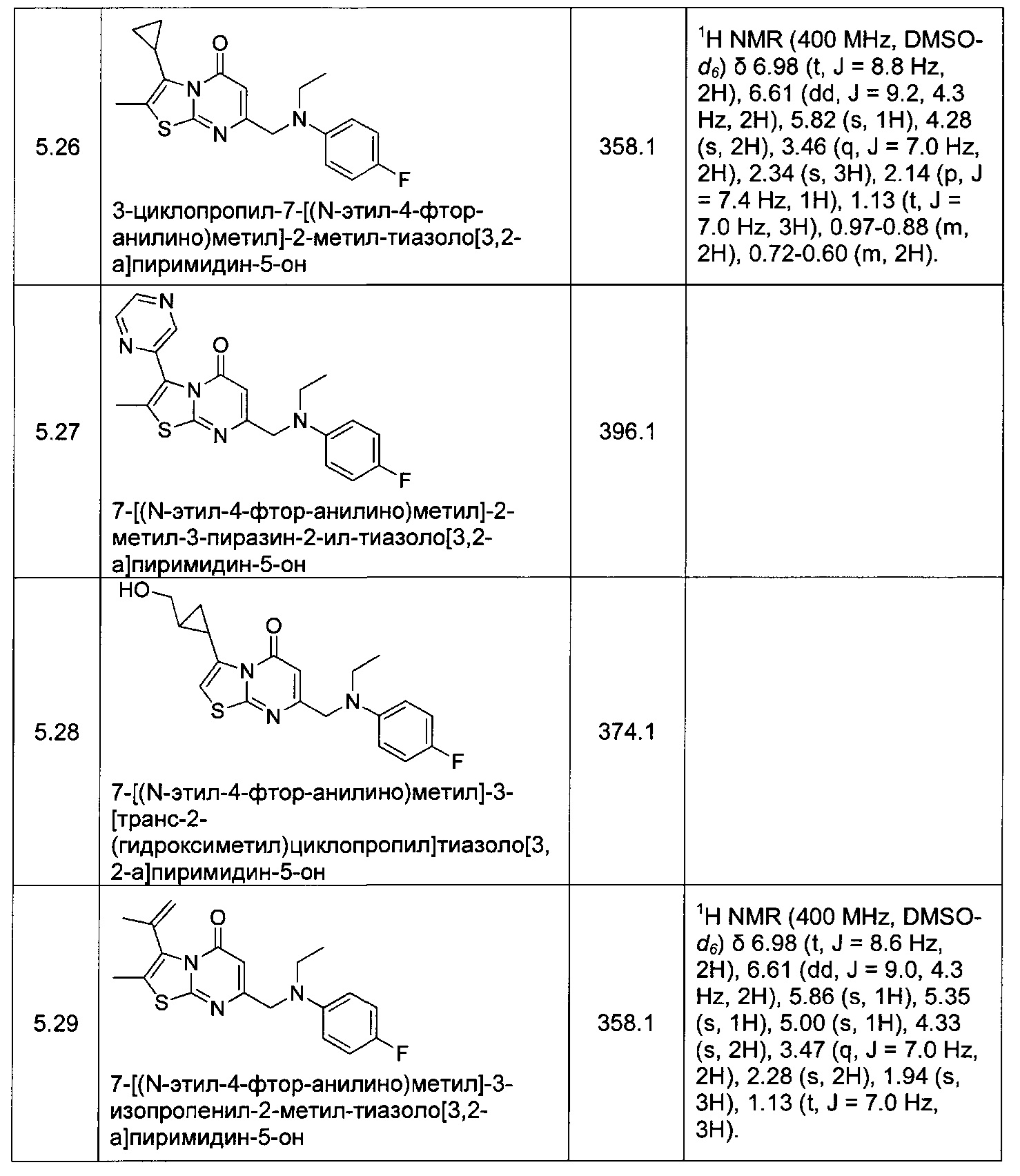
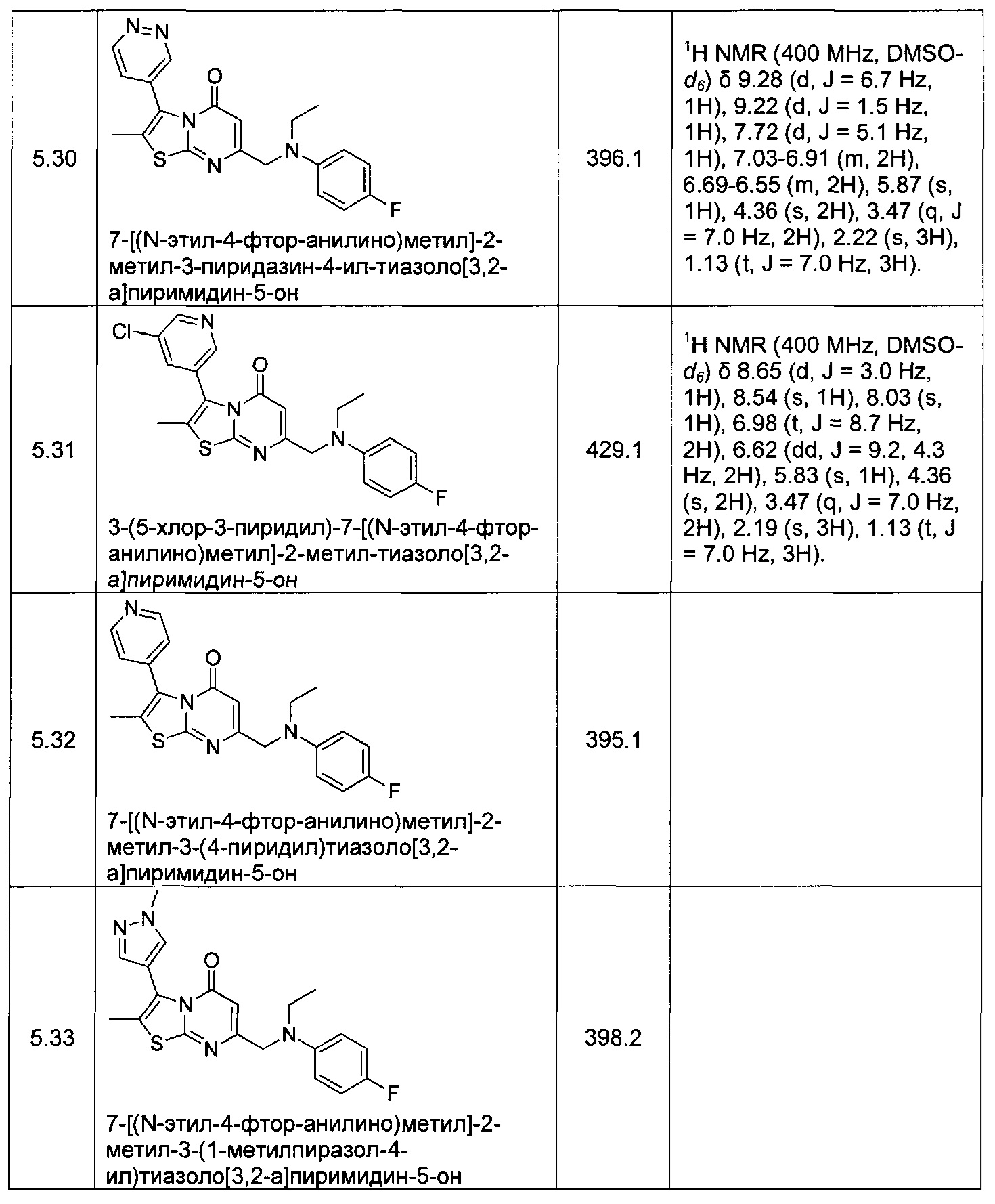
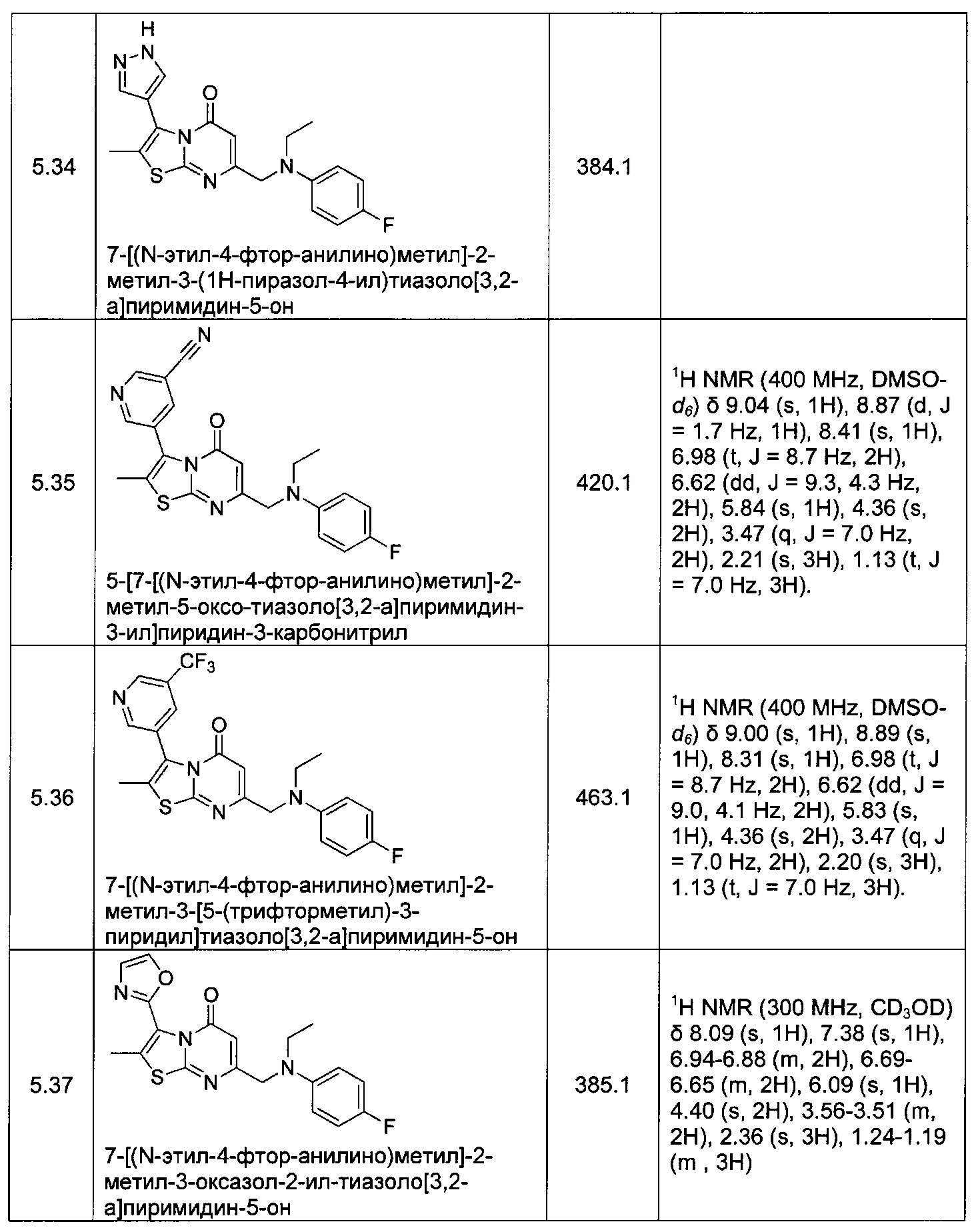
Пример 5.38: 7-((этил(4-фторфенил)амино)метил)-2-метил-3-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
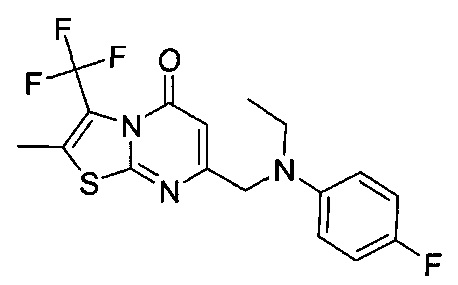
[0222] К раствору 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (200 мг, 0.50 ммоль) в N-метил-пирролидоне (5 мл) добавили йодид меди(I) (12 мг, 0.06 ммоль) и метил 2,2-дифтор-2-(фторсульфонил)ацетат (146 мг, 0.76 ммоль). Реакционный раствор перемешивали в течение 8 ч при 120°С. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением 7-[[этил(4-фторфенил)амино]метил]-2-метил-3-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (21.1 мг, 11%) в виде белого осадка. ЖХМС (ESI): M+H+ = 385.8; 1H NMR (300 MHz, CDCl3) δ 6.94-6.88 (m, 2H), 6.59-6.54 (m, 2H), 6.24 (s, 1H), 4.28 (s, 2H), 3.46-3.43 (m, 2H), 2.60-2.51 (m, 3H), 1.24-1.22 (m, 3H).
Пример 5.39: 7-((этил(4-фторфенил)амино)метил)-3-(транс-2-(фторметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
Стадия 1: (2-(7-((этил(4-фторциклогекса-2,4-диенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропил)метилметансульфонат.
[0223] К раствору 7-((этил(4-фторциклогекса-2,4-диенил)амино)метил)-3-(2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 5.17) (50 мг, 0.13 ммоль) в дихлорметане (5 мл) добавили метансульфонилхлорид (22 мг, 0.19 ммоль) и триэтиламин (26 мг, 0.26 ммоль). Реакционную смесь перемешивали 30 минут при комнатной температуре. Реакционный раствор сконцентрировали под вакуумом с получением (2-(7-((этил(4-фторциклогекса-2,4-диенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропил)метилметансульфоната (60 мг, неочищенный).
Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 7-((этил(4-фторфенил)амино)метил)-3-(транс-2-(фторметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
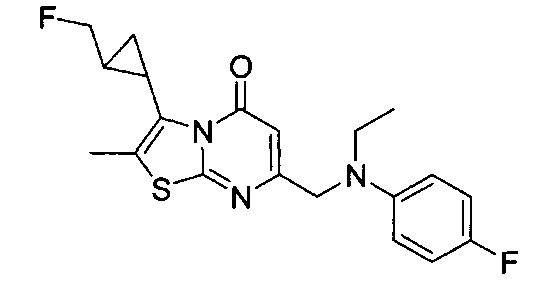
[0224] К раствору [2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропил]метилметансульфоната (60 мг, 0.13 ммоль) в пропан-2-оле (0.5 мл) добавили фторид цезия (45.6 мг, 0.30 ммоль). Реакционную смесь перемешивали в течение 90 мин при 80°С и затем сконцентрировали под вакуумом. Остаток очистили посредством препаративной ВЭЖХ с получением 7-[[этил(4-фторфенил)амино]метил]-3-[транс-2-(фторметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (3.1 мг, 6.0%). ЖХМС (ESI): M+H+ = 390.1; 1H NMR (300 MHz, CDCl3) δ 6.95-6.89 (m, 2H), 6.72-6.65 (m, 2H), 6.12 (s, 1H), 4.72-4.26 (m, 2H), 3.52-3.45 (m, 2H), 2.41 (s, 3Н), 2.28-2.22 (m, 1H), 1.71-1.58 (m, 1H), 1.26-1.15 (m, 4H), 1.08-1.01 (m, 1H).
Пример 5.40: 3-этил-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
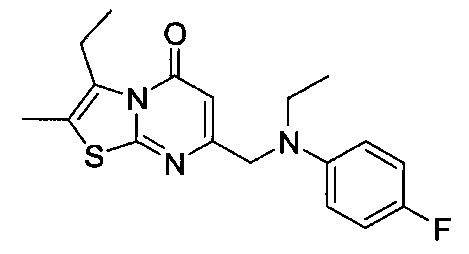
[0225] К раствору 3-этенил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (полученного способом, аналогичным Примеру 5.1) (75.0 мг, 0.22 ммоль) в метаноле (15 мл) добавили палладий на угле (100 мг). Реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода. После фильтрации фильтрат сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/5) с получением 3-этил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (50 мг, 60%). ЖХМС (ESI): M+H+ = 346.1; 1H NMR (300 MHz, CDCl3) δ 6.96-6.90 (m, 2H), 6.73-6.67 (m, 2H), 6.14 (s, 1H), 4.30 (s, 2H), 3.54-3.47 (m, 2H), 3.19-3.14 (m, 2H), 2.32 (s, 3H), 1.38-1.24 (m, 6H).
[0226] Следующее соединение получили с использованием способов, аналогичных Примеру 5.40:
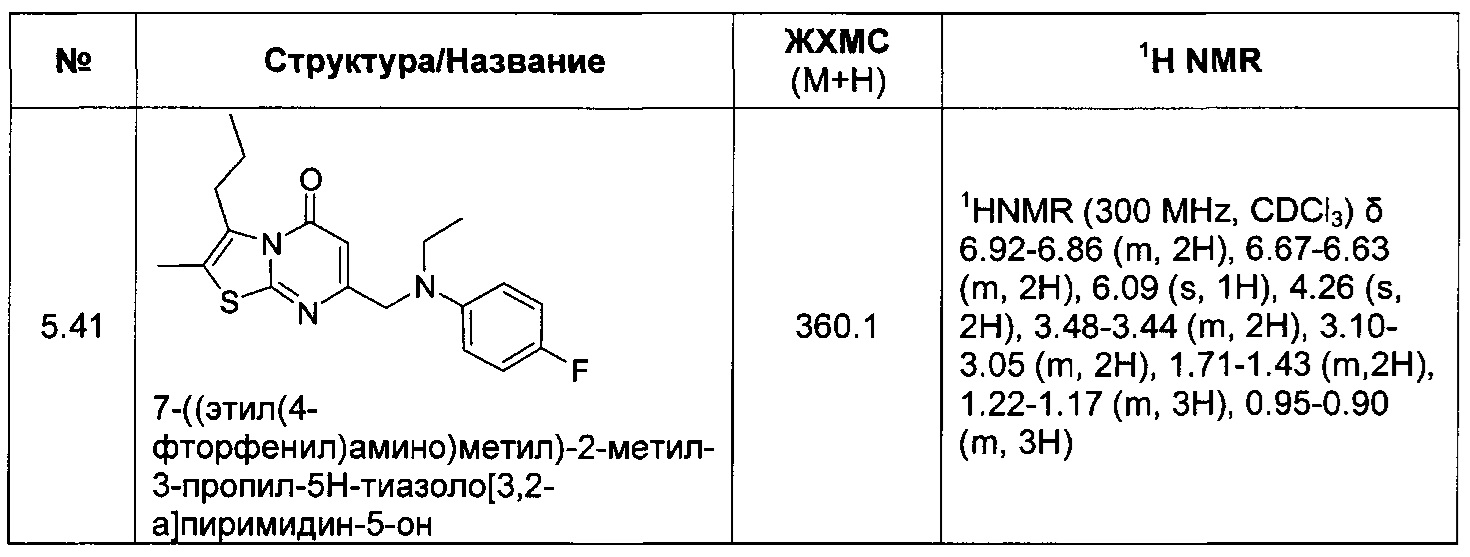
[0227] Следующие соединения получили с использованием способов, аналогичных описанным выше
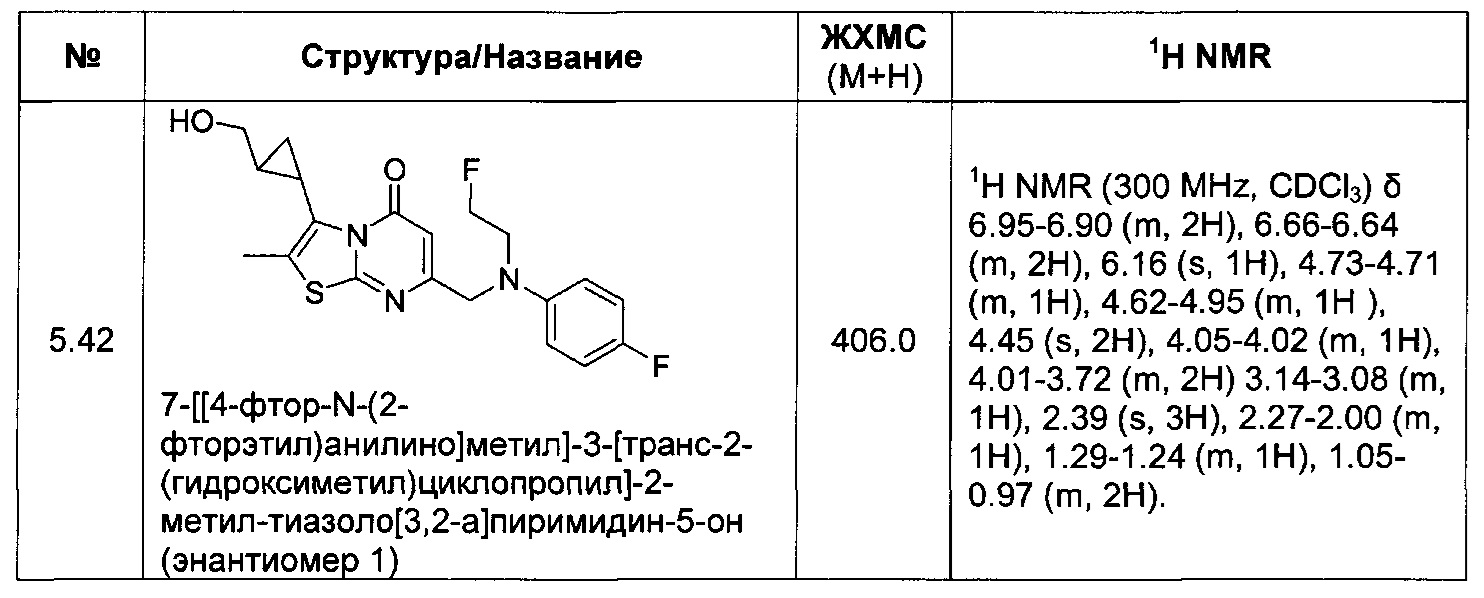
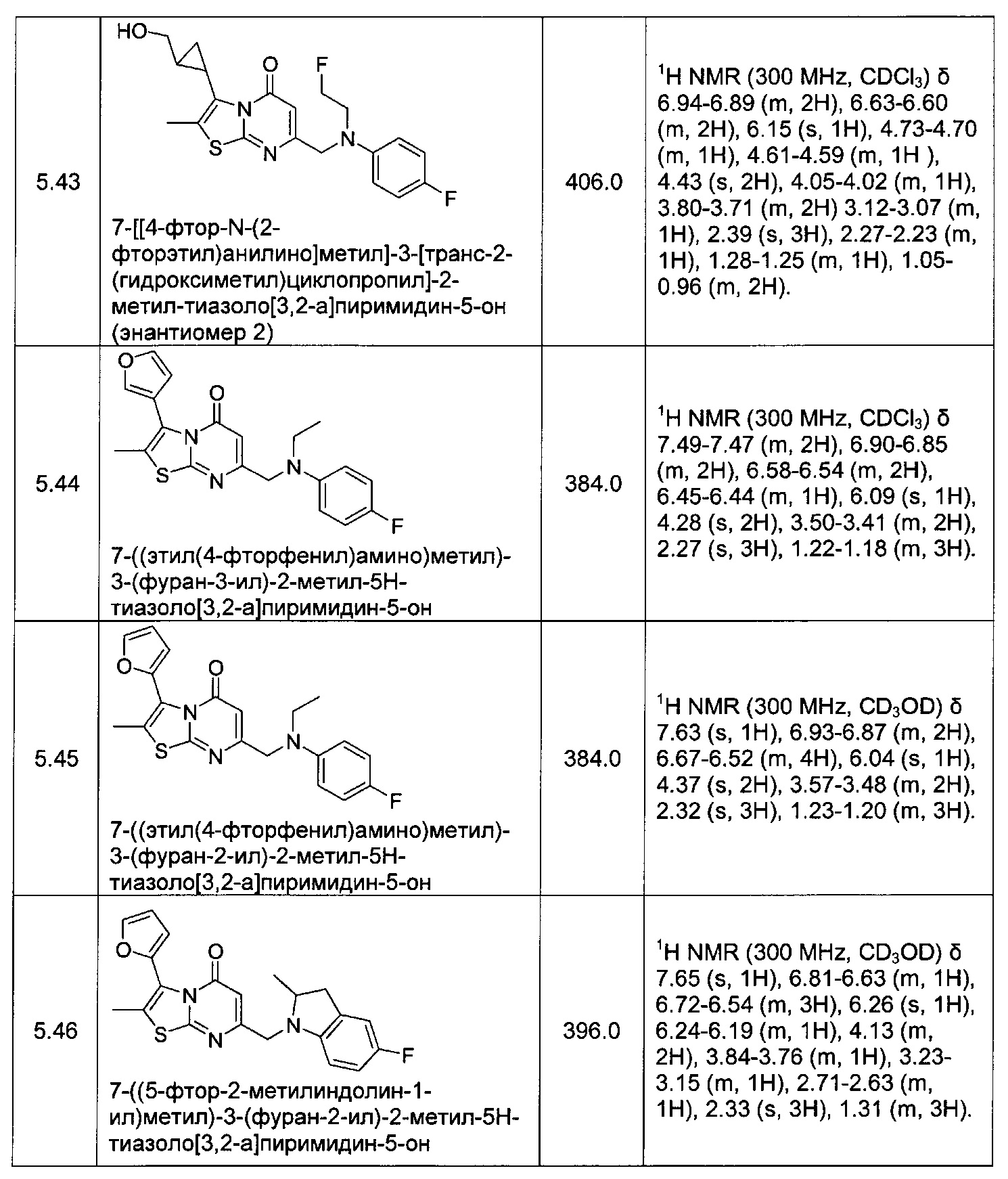
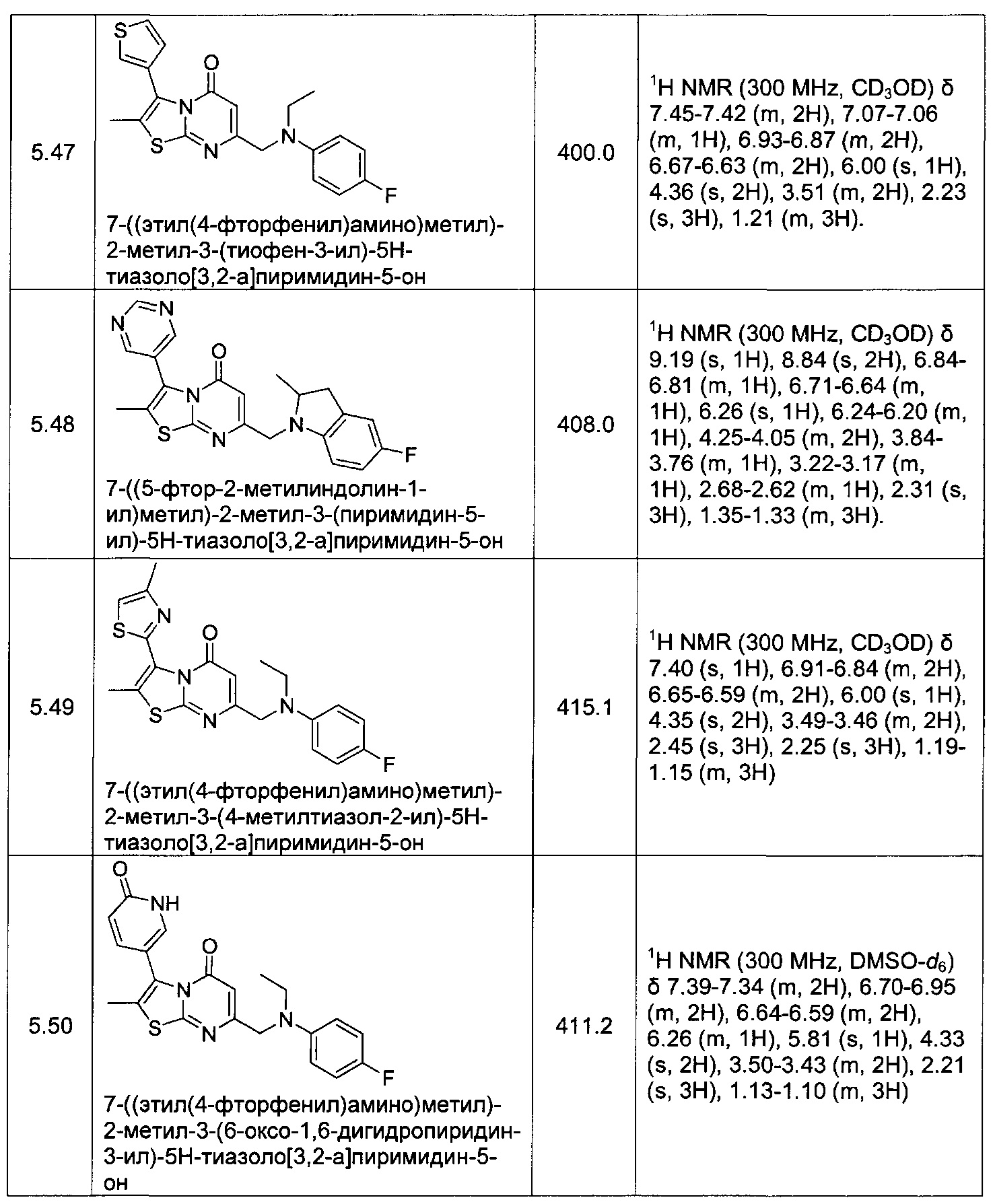
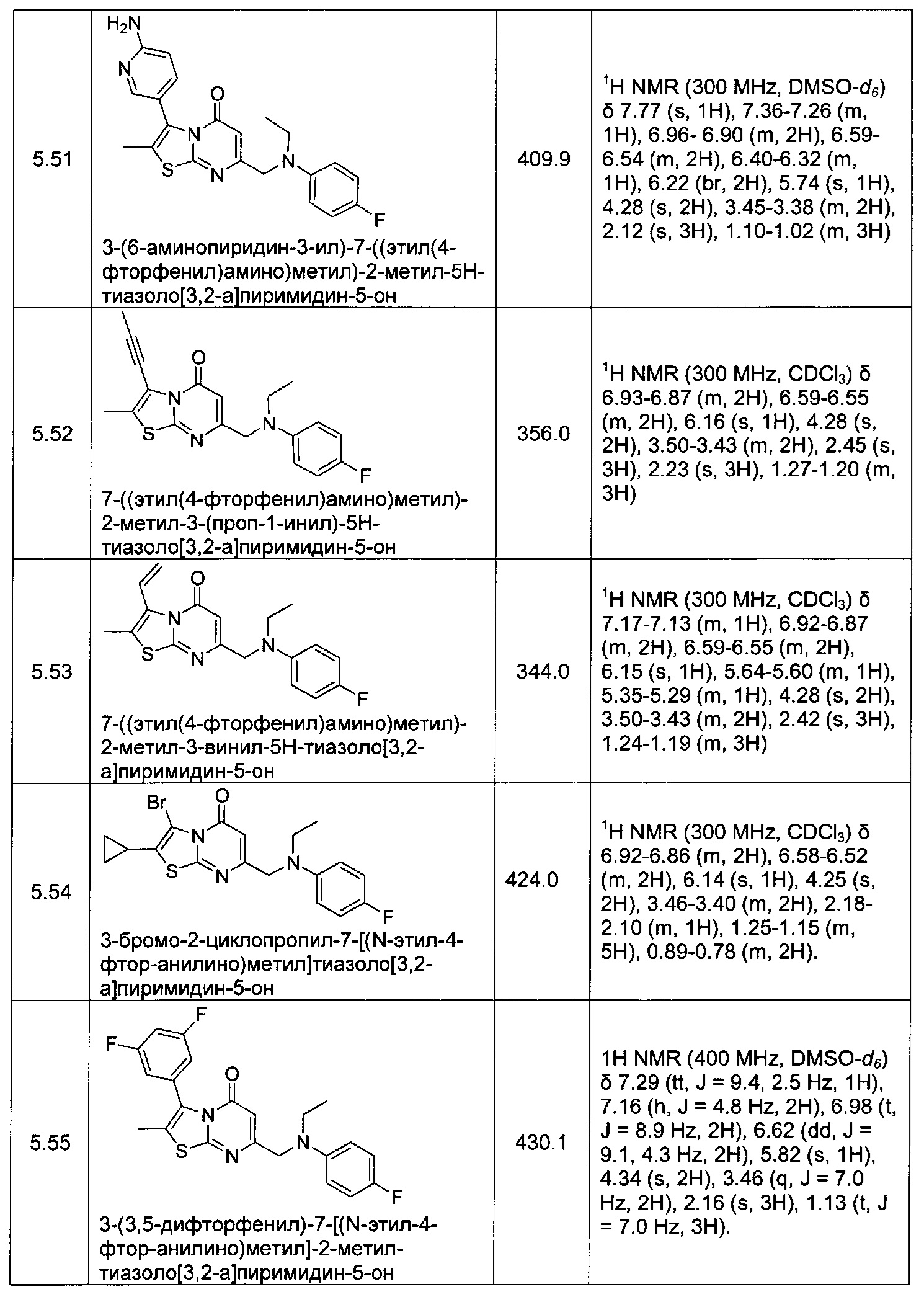
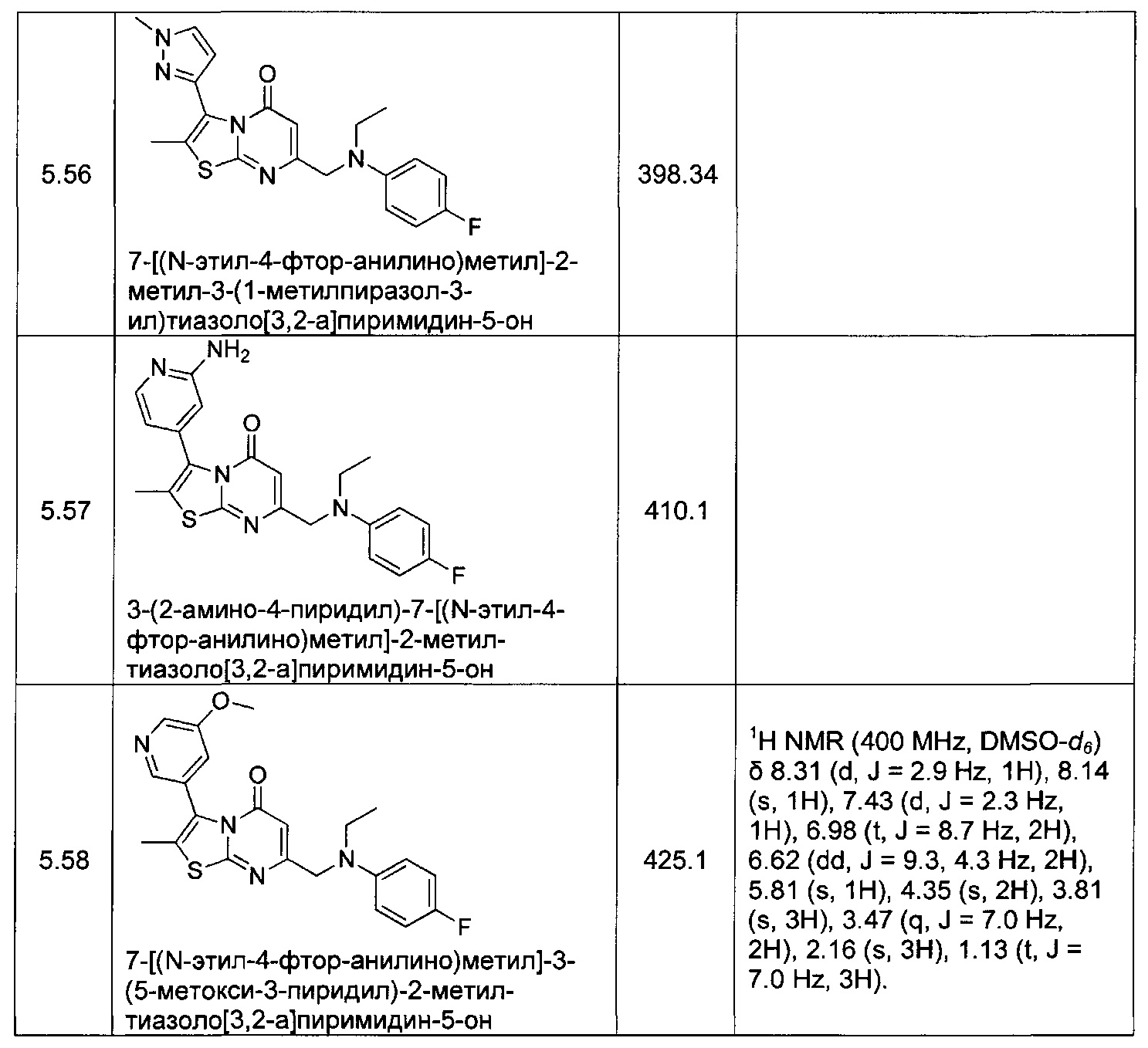
Способ 6:
Пример 6.1: 7-((этил(4-фторфенил)амино)метил)-2-метил-3-морфолино-5Н-тиазоло[3,2-а]пиримидин-5-он.
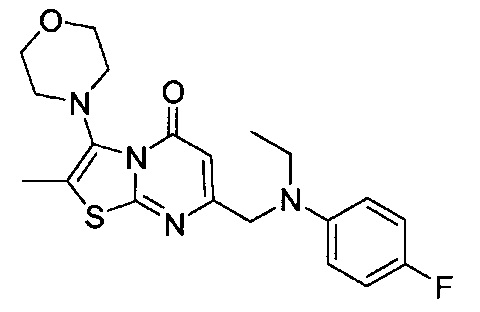
[0228] К раствору 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (250 мг, 0.63 ммоль) (из Примера 5.1, Стадия 1) в диметилсульфоксиде (3 мл) добавили фосфат калия (268 мг, 1.26 ммоль), L-пролин (22.0 мг, 0.19 ммоль), морфолин (165 мг, 1.89 ммоль) и йодид меди (18.0 мг, 0.09 ммоль). Реакционную смесь перемешивали в течение ночи при 90°С. Получившуюся смесь погасили водой (50 мл), экстрагировали этилацетатом (30 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением 7-[[этил(4-фторфенил)амино]метил]-2-метил-3-(морфолин-4-ил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (29.5 мг, 12%). ЖХМС (ESI): M+H+ = 403.0; 1H NMR (300 MHz, CDCl3) δ 6.93-6.87 (m, 2H), 6.61-6.57 (m, 2H), 6.15 (s, 1H), 3.91-3.87 (m, 2H), 3.76-3.59 (m, 4H), 3.50-3.43 (m, 2H), 2.64-2.60 (m, 2H), 2.40 (s, 3H), 1.25-1.20 (m, 3H).
[0229] Следующие примеры получили аналогично тому, как это описано для Примера 6.1:
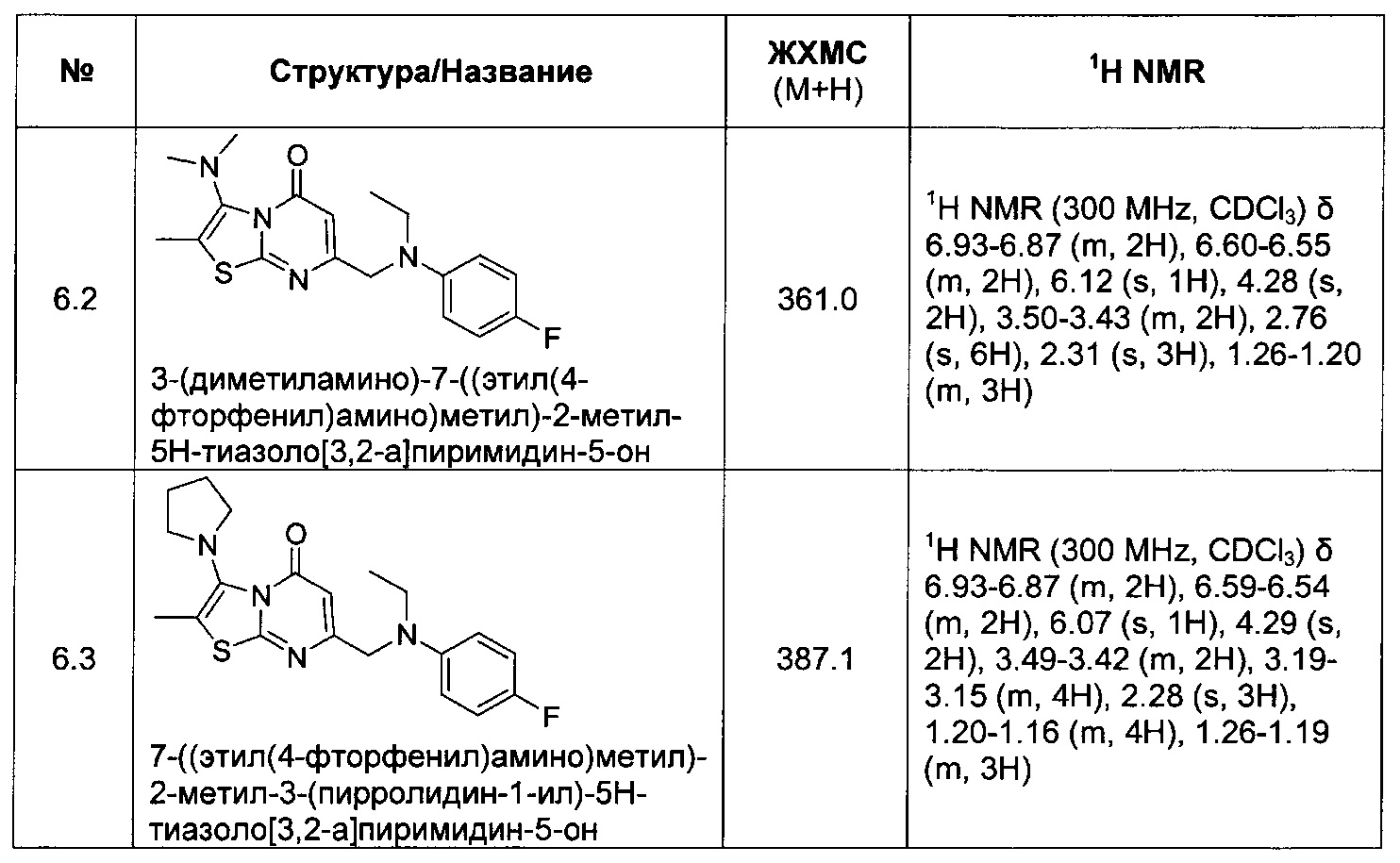
Способ 7:
Пример 7.1: 7-(((3,4-дифторфенил)(этил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбонитрил.
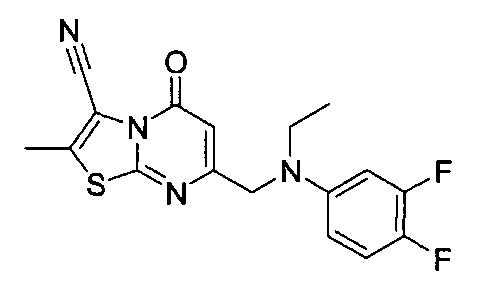
[0230] К раствору 3-бромо-7-[[(3,4-дифторфенил)(этил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (полученного способом, аналогичным Пример 5.1, Стадия 1) (100 мг, 0.24 ммоль) в N,N-диметилформамиде (5 мл) добавили цианид меди (43.0 мг, 0.48 ммоль). Реакционный раствор перемешивали в течение 1.5 ч при 100°С. Реакционный раствор погасили водой (50 мл), экстрагировали дихлорметаном, промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (20/1) с получением 7-[[(3,4-дифторфенил)(этил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбонитрила (43.1 мг, 47%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 361.0; 1H NMR (400 MHz, CD3OD) δ 7.08-7.01 (m, 1H), 6.59-6.53 (m, 1H), 6.430-6.40 (m, 1H), 6.16 (s, 1H), 4.41 (s, 2H), 3.56-3.51 (m, 2H), 2.67 (s, 3H), 1.31-1.21 (m, 3H).
[0231] Следующие примеры получили аналогично тому, как это описано для Примера 7.1:
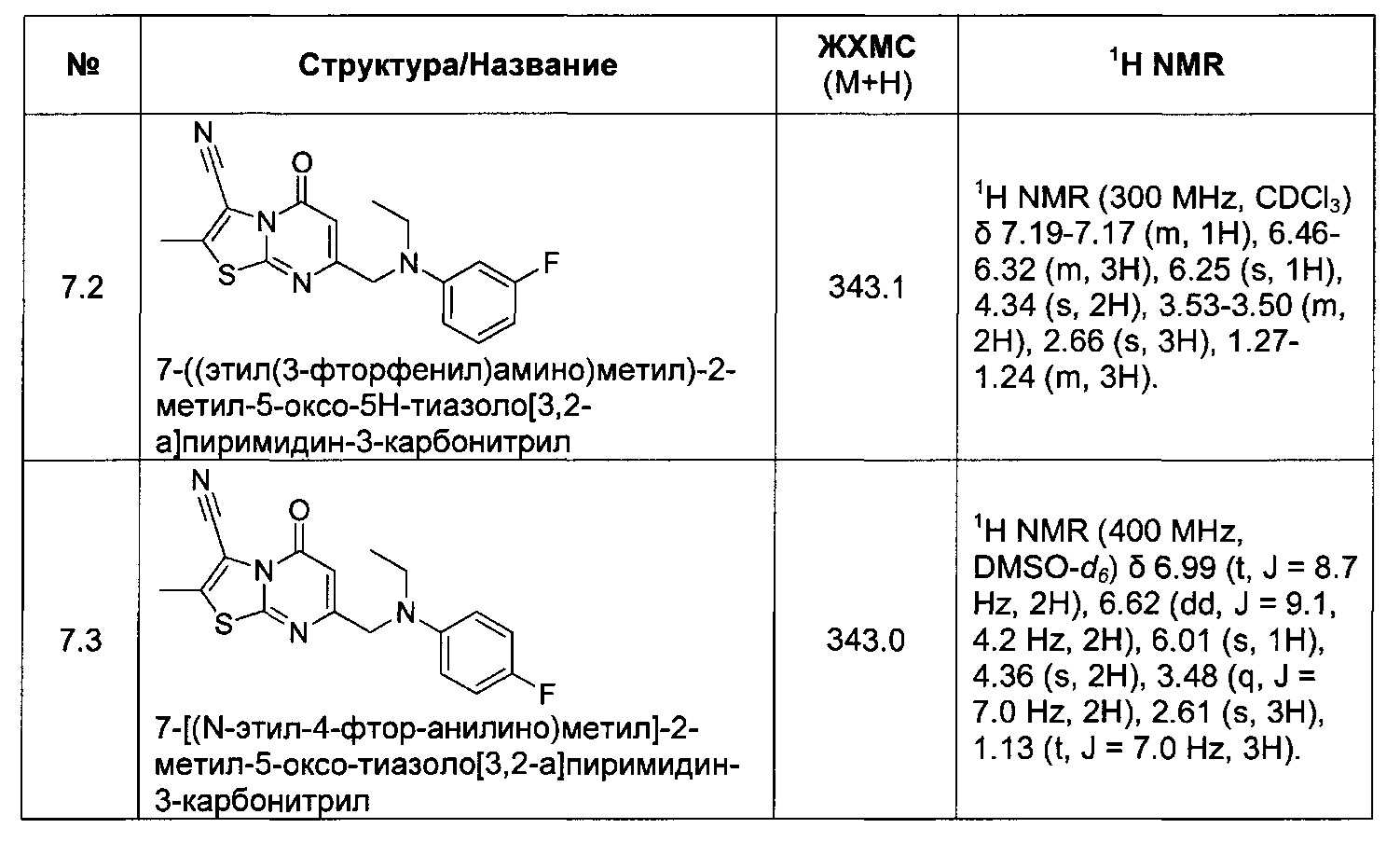
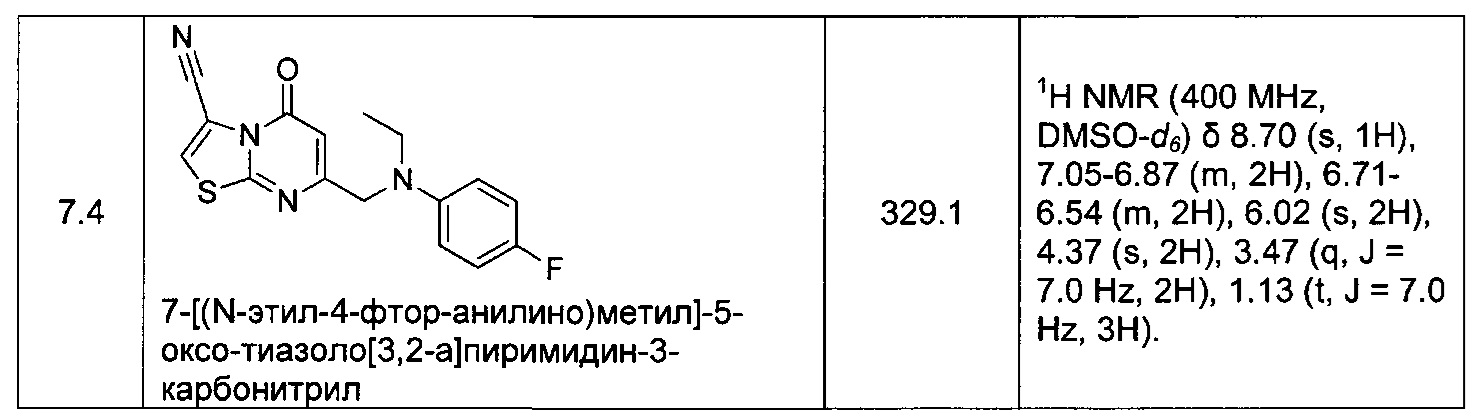
[0232] Следующие соединения получили с использованием способов, аналогичных описанным выше
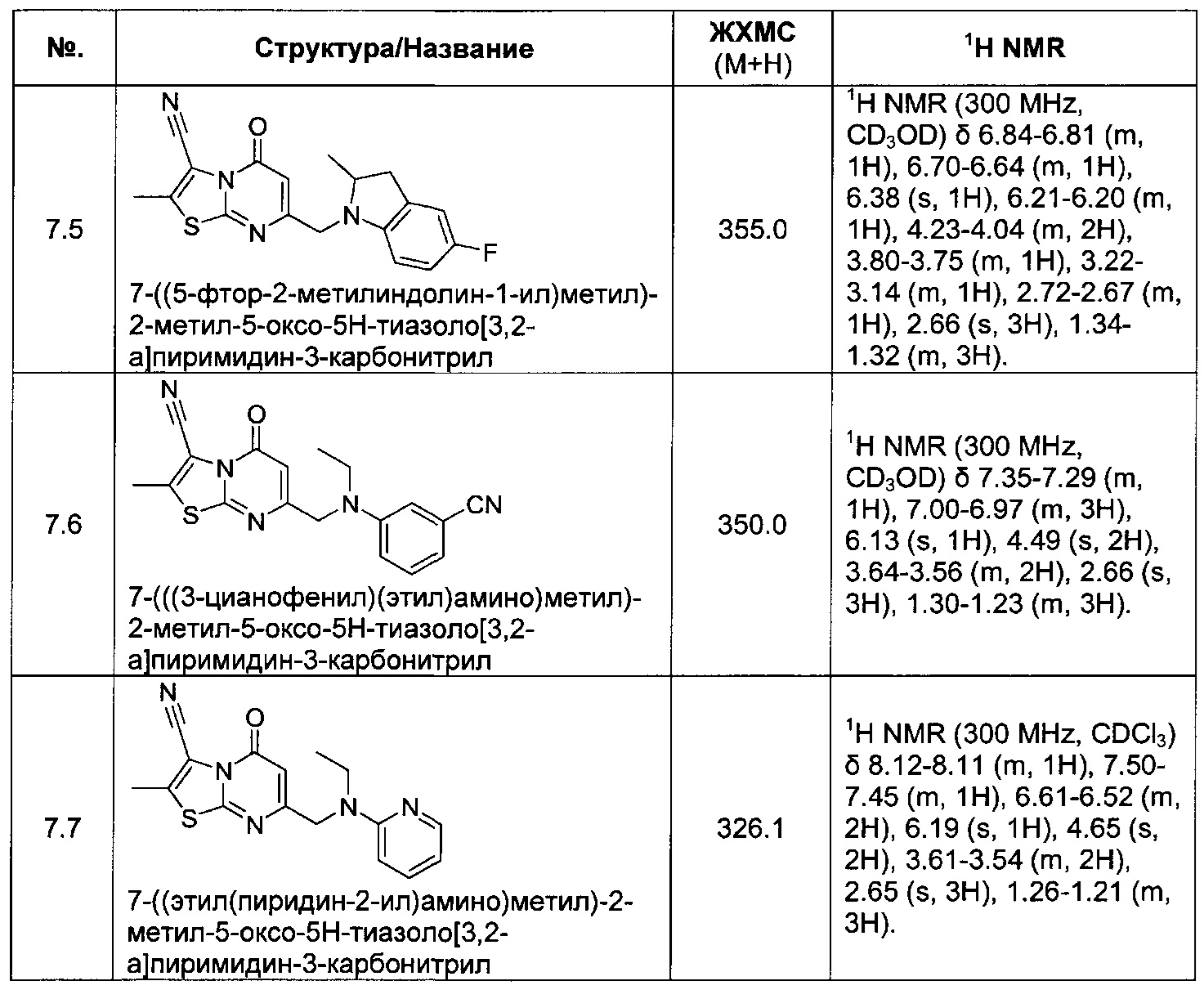
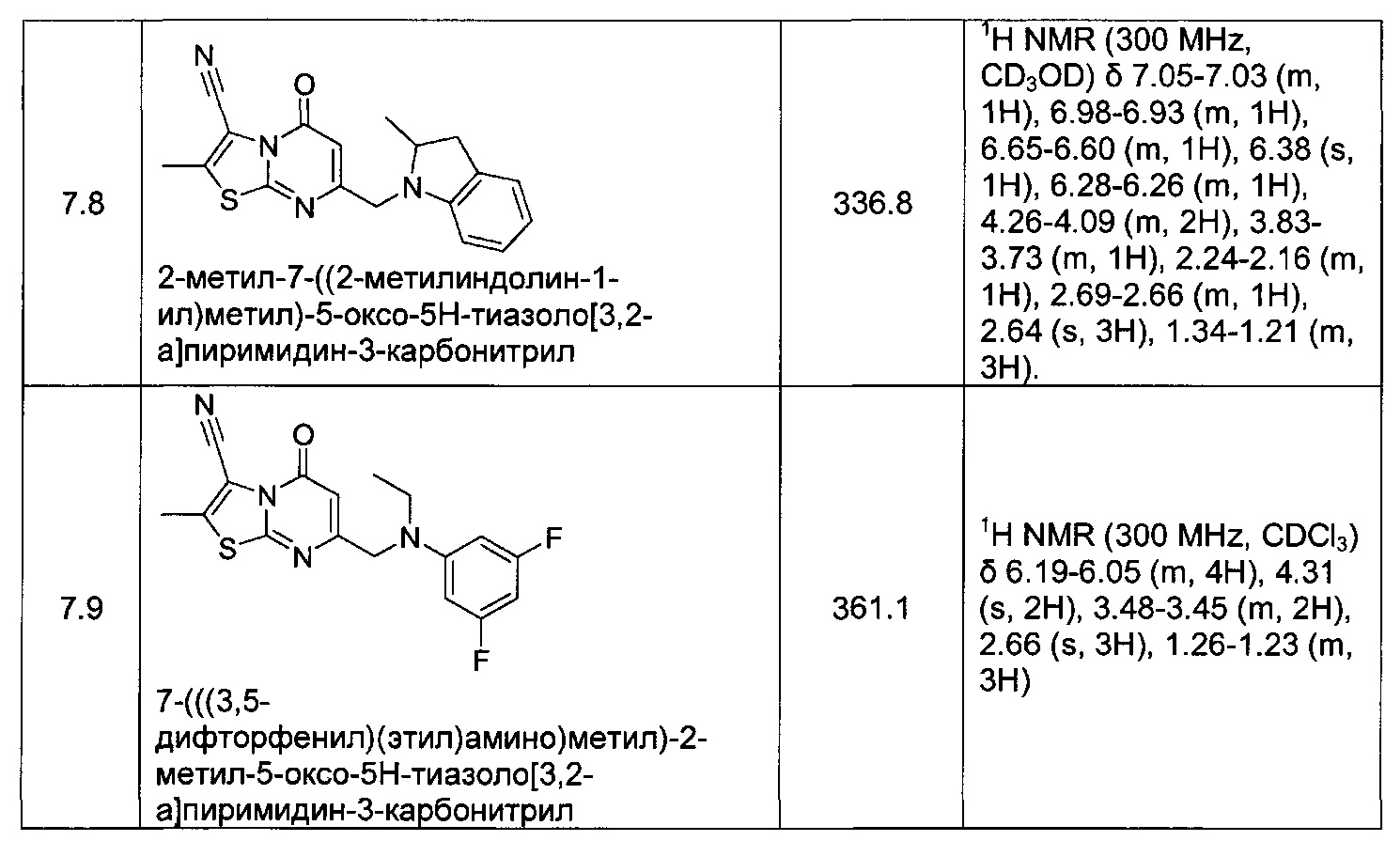
Способ 8:
Пример 8.1: 6-[(N-этил-4-фтор-анилино)метил]-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-он.
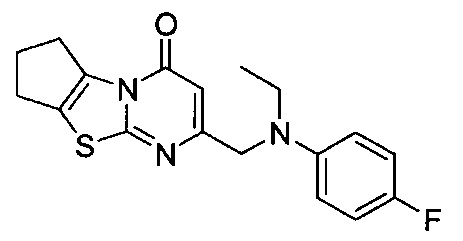
Стадия 1: 2-бромциклопентан-1-он.
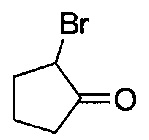
[0233] К раствору циклогексанона (5.00 г, 50.9 ммоль) в диметилсульфоксиде (30 мл) добавили N-бромсукцинимид (11.1 г, 62.4 ммоль). Реакционную смесь перемешивали 20 мин при комнатной температуре и затем погасили водой (300 мл). Реакционную смесь экстрагировали дихлорметаном (100 мл × 2), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 2-бромциклопентан-1-она в виде светло-желтого масла (5.6 г, 58%). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Сигнал ЖХМС отсутствовал.
Стадия 2: 4Н,5Н,6Н-циклопента[d][1,3]тиазол-2-амин.
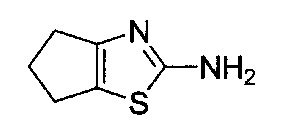
[0234] К раствору 2-бромциклопентан-1-она (5.50 г, 33.7 ммоль) в этаноле (50 мл) добавили тиомочевину (3.30 г, 43.4 ммоль) и бикарбонат натрия (4.80 г, 57.1 ммоль). Реакционную смесь перемешивали при кипении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, Реакционную смесь погасили водой (200 мл), экстрагировали дихлорметаном (100 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 4Н,5Н,6Н-циклопента[а][1,3]тиазол-2-амина в виде коричневого осадка (2.0 г, 42%). ЖХМС (ESI): М+H+ = 141.1.
Стадия 3: 10-(хлорометил)-7-тиа-1,9-диазатрицикло[6.4.0.0'[2,6]]додека-2(6),8,10-триен-12-он.
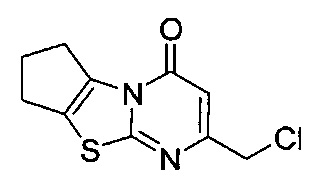
[0235] Смесь 4Н,5Н,6Н-циклопента[а][1,3]тиазол-2-амина (2.00 г, 14.3 ммоль) и этил 4-хлор-3-оксобутаноата (3.50 г, 21.3 ммоль) в полифосфорной кислоте (15 мл) перемешивали в течение 1 ч при 110°С. Реакционную смесь охладили до комнатной температуры, разбавили водой (30 мл) и перемешивали в течение 1 ч при 80°С. После охлаждения до комнатной температуры реакционную смесь погасили водой (200 мл), и значение рН раствора довели до рН 8-9 с помощью карбоната калия, экстрагировали дихлорметаном (100 мл × 3), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 20% этилацетата в петролейном эфире с получением 10-(хлорометил)-7-тиа-1,9-диазатрицикло[6.4.0.0'[2,6]]додека-2(6),8,10-триен-12-она в виде коричневого осадка (150 мг, 4.0%). ЖХМС (ESI): М+H+ = 241.1.
Стадия 4: 6-[(N-этил-4-фтор-анилино)метил]-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-он.
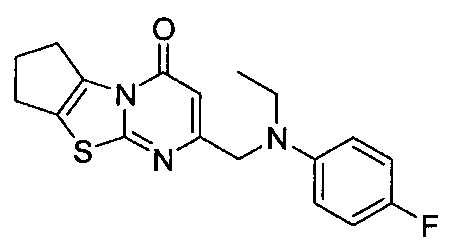
[0236] К раствору 10-(хлорометил)-7-тиа-1,9-диазатрицикло[6.4.0.0'[2,6]]додека-2(6),8,10-триен-12-она (150 мг, 0.62 ммоль) в ацетонитриле (20 мл) добавили N-этил-4-фторанилин (105 мг, 0.75 ммоль), карбонат калия (150 мг, 0.62 ммоль), и йодид калия (52 мг, 0.31 ммоль). Реакционную смесь перемешивали в течение ночи при 60°С. После охлаждения до комнатной температуры, реакционную смесь погасили водой (100 мл), экстрагировали дихлорметаном (50 мл × 3), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 33% этилацетата в петролейном эфире с получением 6-[(N-этил-4-фтор-анилино)метил]-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-она в виде коричневого осадка (47.8 мг, 22%). ЖХМС (ESI): М+H+ = 343.7; 1H NMR (300 MHz, DMSO-d6) δ 7.00-6.94 (m, 2Н), 6.61-6.58 (m, 2H), 5.87 (s, 1H), 4.32 (s, 2H), 3.50-3.43 (m, 2H), 3.19-3.13 (m, 2H), 2.85-2.72 (m, 2H), 3.37-2.30 (m, 2H), 1.16-1.09 (m, 3H).
[0237] Следующие примеры получили аналогично тому, как это описано для Примера 8.1:
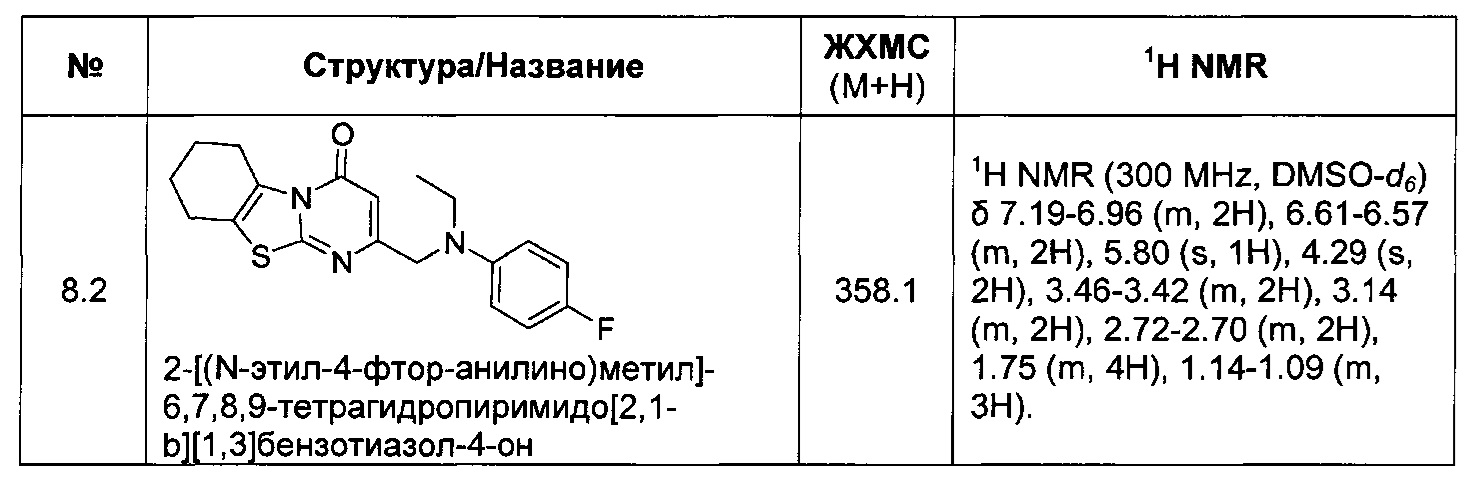
Пример 8.3: 6-[(N-этил-4-фтор-анилино)метил]-1-(гидроксиметил)-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-он.
Стадия 1: этил 3-бромо-2-оксоциклопентанкарбоксилат.
[0238] К раствору этил 3-бромо-2-оксоциклопентанкарбоксилата (780 мг, 5.00 ммоль) в хлороформе (15 мл) добавили бром (800 мг, 5.01 ммоль) по каплям при перемешивании. Получившийся раствор перемешивали в течение 2 ч при комнатной температуре. Получившуюся смесь сконцентрировали под вакуумом с получением этил 3-бромо-2-оксоциклопентанкарбоксилата в виде светло-желтого масла (1.30 г). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Сигнал ЖХМС отсутствовал.
Стадия 2: этил 2-амино-5,6-дигидро-4Н-циклопента[d]тиазол-4-карбоксилат.
[0239] К раствору этил 3-бромо-2-оксоциклопентанкарбоксилата (1.30 г, 5.53 ммоль) в 1,4-диоксане (20 мл) добавили тиомочевину (420 мг, 5.52 ммоль). Получившийся раствор кипятили с обратным холодильником в течение 12 ч. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (20/1) с получением этил-2-амино-5,6-дигидро-4Н-циклопента[d]тиазол-4-карбоксилата в виде светло-желтого осадка (600 мг, 51%). ЖХМС (ESI): M+H+ = 213; 1H NMR (300 MHz, DMSO-d6) δ 6.90 (br, 2H), 4.12-4.08 (m, 2H), 3.68-3.63 (m, 1H), 2.82-2.40 (m, 4H), 1.29-1.25 (m, 3Н).
Стадия 3: Этил 6-(хлорометил)-8-оксо-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-1-карбоксилат.
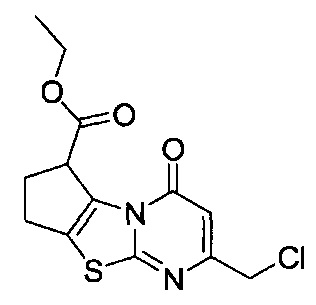
[0240] К раствору этил-2-амино-5,6-дигидро-4Н-циклопента[d]тиазол-4-карбоксилата (1.00 г, 4.70 ммоль) и 4-метилбензолсульфоновой кислоты (170 мг, 1.00 ммоль) в толуоле (30 мл) добавили метил 4-хлор-3-оксобутаноат (1.40 г, 9.40 ммоль). Реакционную смесь перемешивали в течение 12 ч при 125°С с помощью аппарата Дена-Старка для отделения воды. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2) с получением этил 6-(хлорометил)-8-оксо-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-1-карбоксилата в виде светло-желтого осадка (150 мг, 10%). ЖХМС (ESI): M+H+ = 313.0; 1H NMR (300 MHz, CDCl3) δ 6.30 (s, 1H), 4.46-4.40 (m, 1H), 4.33 (s, 2H), 4.22-4.18 (m, 2H), 3.03-2.87 (m, 3H), 2.62-2.54 (m, 1H), 1.29-1.25 (m, 3H).
Стадия 4: этил 2-((этил(4-фторфенил)амино)метил)-4-оксо-4,6,7,8-тетрагидроциклопента[4,5]тиазоло[3,2-а]пиримидин-6-карбоксилат.
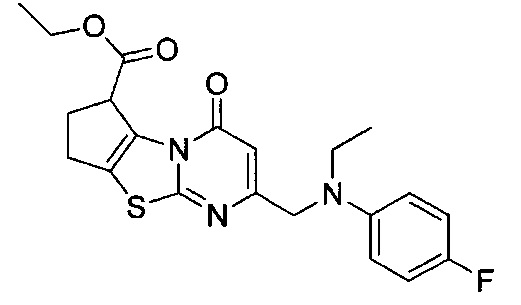
[0241] К раствору этил 10-(хлорометил)-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоксилата (50.0 мг, 0.16 ммоль), йодида калия (14 мг, 0.08 ммоль) и карбоната калия (45 мг, 0.33 ммоль) в ацетонитриле (5 мл) добавили N-этил-4-фторанилин (33.0 мг, 0.24 ммоль). Реакционную смесь перемешивали в течение ночи при 80°С. После фильтрации и концентрирования под вакуумом, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением этил 10-[[этил(4-фторфенил)амино]метил]-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоксилата в виде светло-желтого полутвердого вещества (17.2 мг, 26%). ЖХМС (ESI): М+Н+ = 416.0; 1H NMR (300 MHz, CDCl3) δ 6.92-6.87 (m, 2H), 6.60-6.55 (m, 2H), 6.14 (s, 1H), 4.50-4.45 (m, 1H), 4.30 (s, 2H), 4.22-4.17 (m, 2H), 3.48-3.41 (m, 2H), 3.02-2.85 (m, 3H), 2.60-2.55 (m, 1H), 1.29-1.19 (m, 6H).
Стадия 5: 10-[[этил(4-фторфенил)амино]метил]-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоновая кислота.
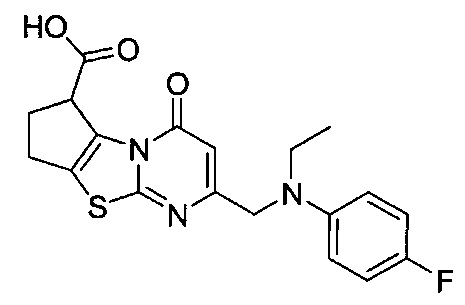
[0242] К раствору этил 10-[[этил(4-фторфенил)амино]метил]-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоксилата (40 мг, 0.10 ммоль), тетрагидрофурана (2 мл) и воды (2 мл) добавили гидроксид лития (12 мг, 0.50 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Значение рН раствора довели до рН 2 с помощью соляной кислоты (1 моль/л) и экстрагировали дихлорметаном (2×20 мл). Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 10-[[этил(4-фторфенил)амино]метил]-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоновой кислоты (30 мг, 80%) в виде светло-желтого осадка.
Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 6: 6-[(N-этил-4-фтор-анилино)метил]-1-(гидроксиметил)-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-он.
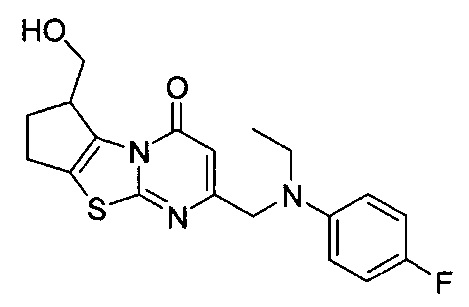
[0243] К раствору 10-[[этил(4-фторфенил)амино]метил]-12-оксо-7-тиа-1,9-диазатрицикло[6.4.0.0^[2,6]]додека-2(6),8,10-триен-3-карбоновая кислота (110 мг, 0.28 ммоль)и триэтиламин (60 мг, 0.57 ммоль) в тетрагидрофуране (10 мл) добавили хлор(пропан-2-илокси)метанон (70 мг, 0.57 ммоль) и реакционную смесь перемешивали 0.5 ч при комнатной температуре. Затем добавили борогидрид натрия (22 мг, 0.58 ммоль) в воде (0.5 мл). Получившийся раствор перемешивали в течение дополнительного 1 ч при комнатной температуре. Реакционную смесь погасили насыщенным водным хлоридом аммония и экстрагировали дихлорметаном (3×20 мл). Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/1) с получением 6-[(N-этил-4-фтор-анилино)метил]-1-(гидроксиметил)-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-она (51.2 мг, 48%) в виде белого осадка. ЖХМС (ESI): M+H+ = 374.0; 1H NMR (400 MHz, CDCl3) δ 6.94-6.90 (m, 2H), 6.60-6.57 (m, 2H), 6.27 (s, 1H), 4.35 (s, 2H), 3.98-3.91 (m, 2H), 3.75-3.70 (m, 2H), 3.49-3.47 (m, 2H), 3.01-2.95 (m, 1H), 2.88-2.82 (m, 1H), 2.74-2.68 (m, 1H), 2.27-2.22 (m, 1H), 1.26-1.23 (m, 3H).
Примеры 8.4 и 8.5: 6-[(N-этил-4-фтор-анилино)метил]-1-(гидроксиметил)-2,3-дигидро-1Н-циклопента[3,4]тиазоло[1,4-а]пиримидин-8-он (энантиомеры 1 и 2).
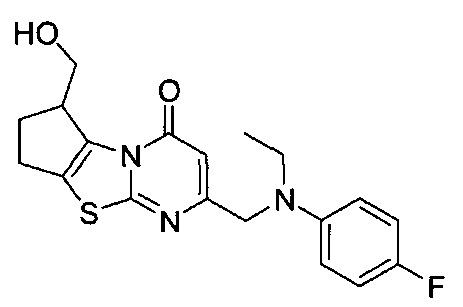
[0244] Продукт примера 8.3 дополнительно очистили с помощью хиральной СКЖХ на колонке Chiralpak AD (2×15 см) с элюцией 25% метанолом (0.1% NH4OH)/CO2 при 100 бар при скорости потока 70 мл/мин. Выделенные пики анализировали на колонке Chiralpak AD (50×0.46 см) с элюцией 25% метанолом (0.1% NH4OH)/CO2, при 120 бар (скорость потока 5 мл/мин, 220 нм). Из этого выделенного отделили два изомера.
[0245] Пример 8.4 (пик 2: энантиомер 2): Время задержки = 1.45 мин; ЖХМС (ESI): М+H+ = 374.0; 1H NMR (400 MHz, CDCl3) δ 6.94-6.90 (m, 2H), 6.60-6.57 (m, 2H), 6.27 (s, 1H), 4.35 (s, 2H), 3.98-3.91 (m, 2H), 3.75-3.70 (m, 2H), 3.49-3.47 (m, 2H), 3.01-2.95 (m, 1H), 2.88-2.82 (m, 1H), 2.74-2.68 (m, 1H), 2.27-2.22 (m, 1H), 1.26-1.23 (m, 3H).
[0246] Пример 8.5 (пик 1. энантиомер 1): Время задержки = 0.59 мин; ЖХМС (ESI): М+Н+ = 374.0 1H NMR (400 MHz, CDCl3) δ 6.94-6.90 (m, 2H), 6.60-6.57 (m, 2H), 6.27 (s, 1H), 4.35 (s, 2H), 3.98-3.91 (m, 2H), 3.75-3.70 (m, 2H), 3.49-3.47 (m, 2H), 3.01-2.95 (m, 1H), 2.88-2.82 (m, 1H), 2.74-2.68 (m, 1H), 2.27-2.22 (m, 1H), 1.26-1.23 (m, 3H).
[0247] Следующие соединения получили с использованием способов, аналогичных описанным выше
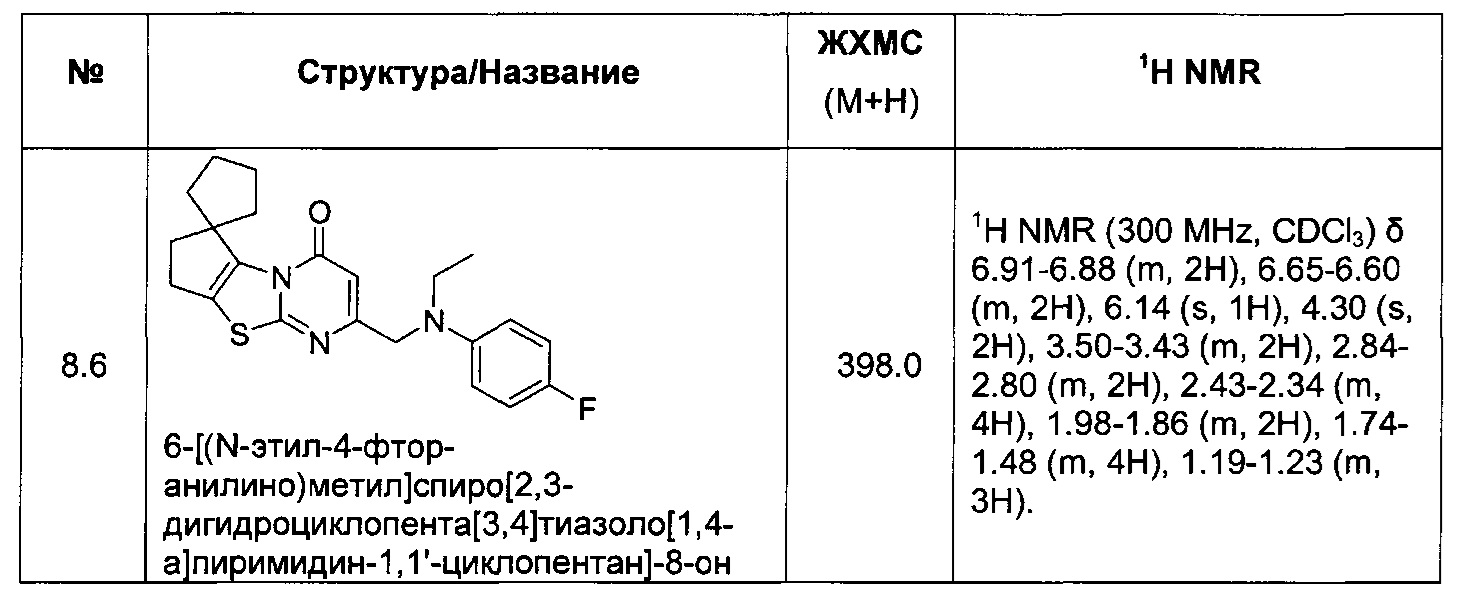
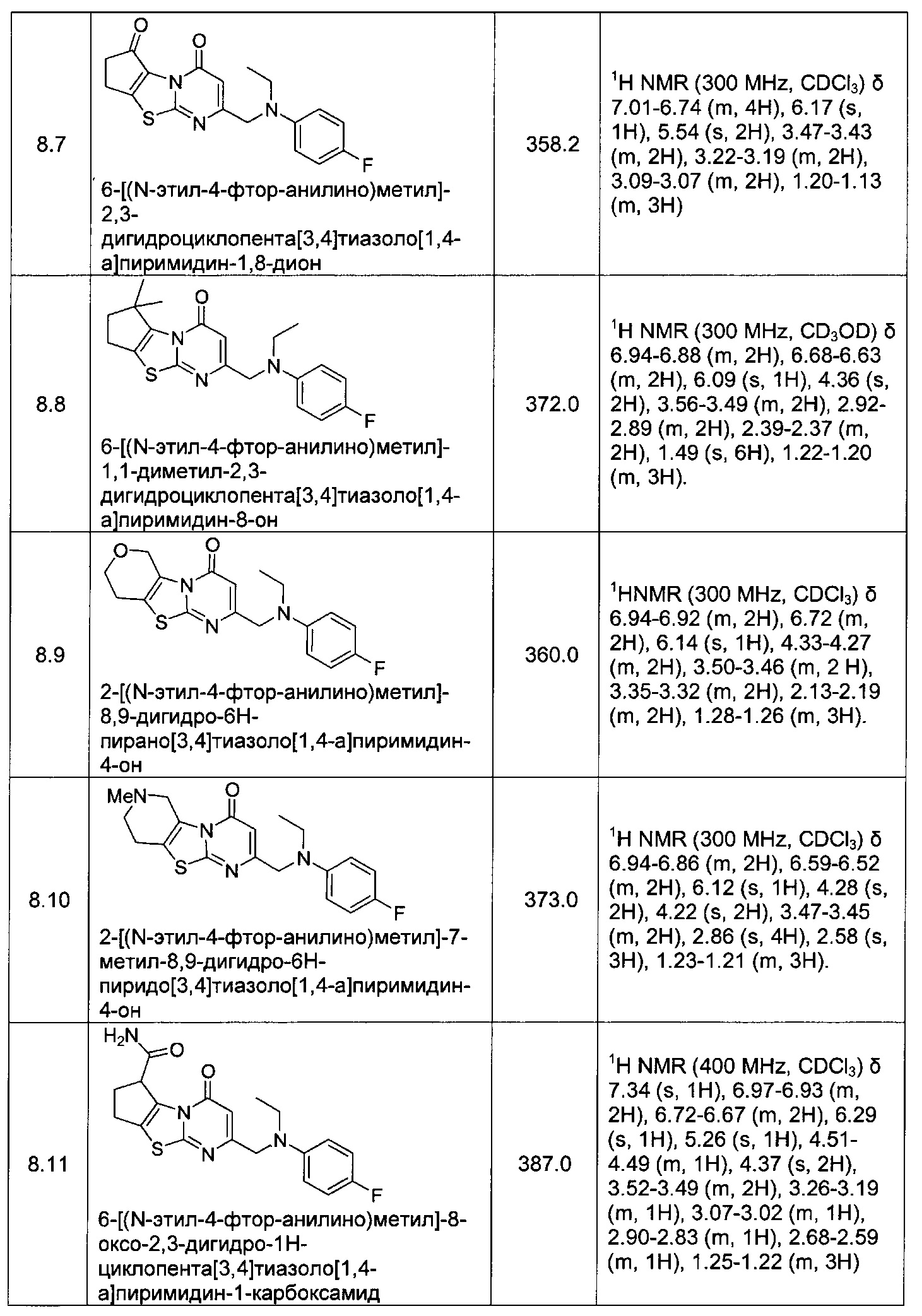
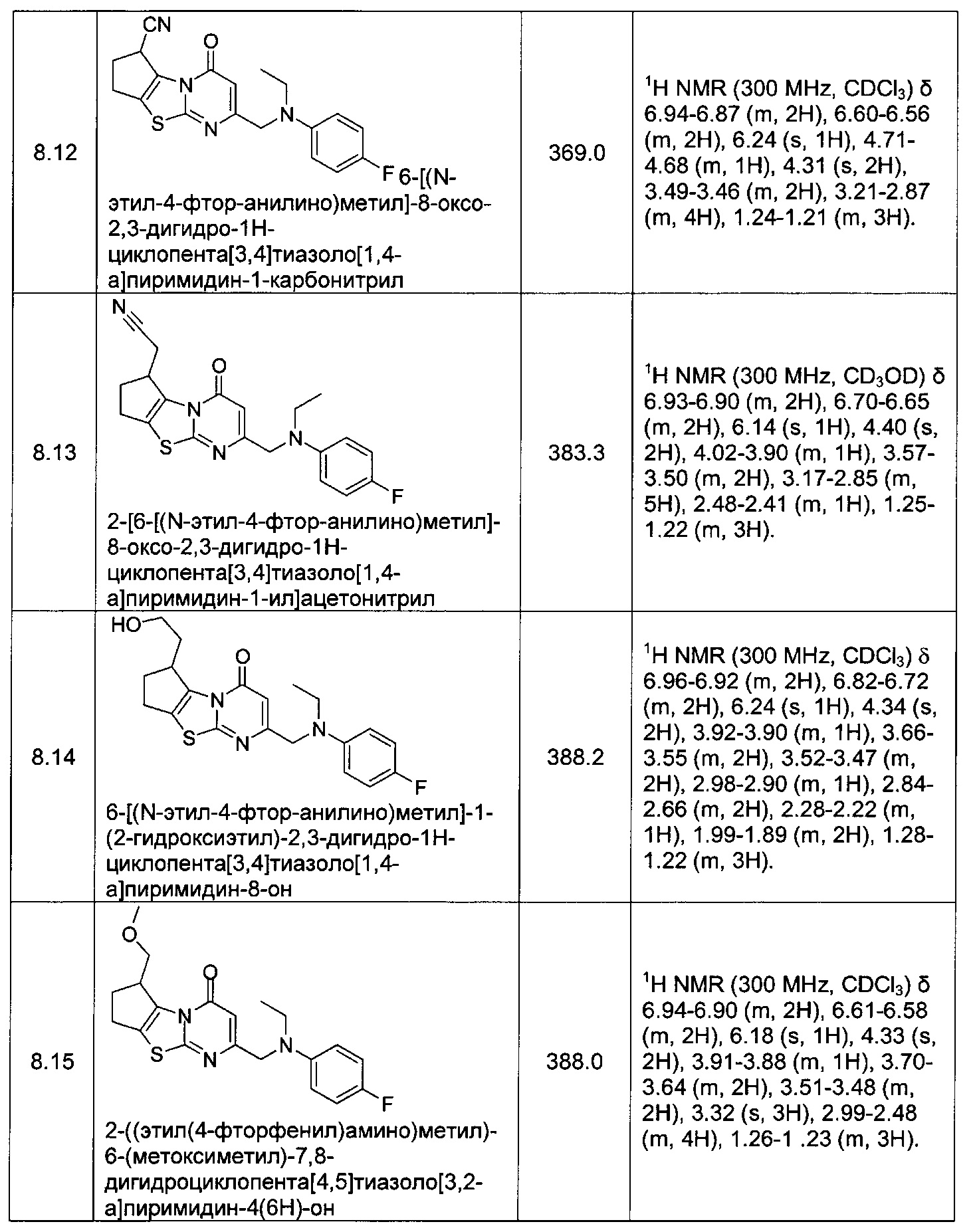
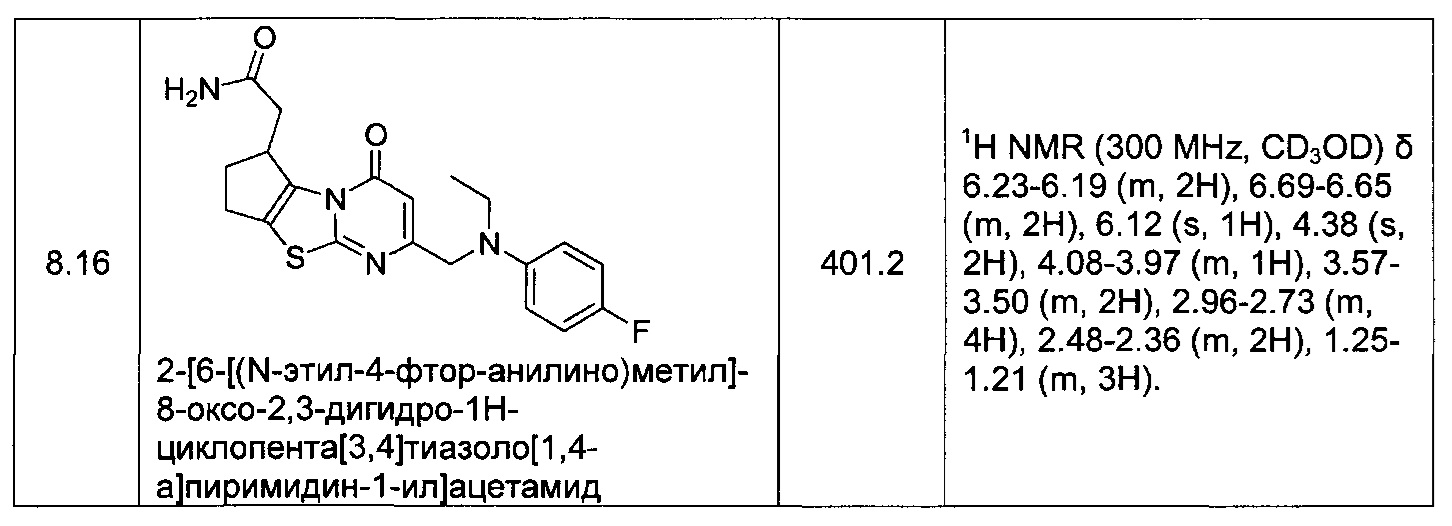
Способ 9:
Пример 9.1: 3-циклогексил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
Стадия 1: 4-(циклогекс-1-ен-1-ил)-5-метил-1,3-тиазол-2-амин.
[0248] К раствору 4-бромо-5-метил-1,3-тиазол-2-амина (из Примера 4.1, Стадия 5) (130 мг, 0.67 ммоль) в 1,4-диоксане (2 мл) добавили 2-(циклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (140 мг, 0.67 ммоль), фосфата калия (171 мг, 0.81 ммоль) и тетракис(трифенилфосфин)палладия (78 мг, 0.070 ммоль). Реакционную смесь перемешивали в течение 2 ч при 90°С и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью 3.3% метанола в дихлорметане с получением 4-(циклогекс-1-ен-1-ил)-5-метил-1,3-тиазол-2-амина в виде желтого осадка (140 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): M+H+ = 194.8.
Стадия 2: 4-циклогексил-5-метил-1,3-тиазол-2-амин.
[0249] К раствору 4-(циклогекс-1-ен-1-ил)-5-метил-1,3-тиазол-2-амина (140 мг, 0.72 ммоль) в МеОН (20 мл) добавили Pd/C (100 мг) и хлороводород (0.1 мл, 12 моль/л). Реакционную смесь перемешивали в течение ночи при 40°С в атмосфере водорода (5 атм), затем отфильтровали и сконцентрировали под вакуумом с получением 4-циклогексил-5-метил-1,3-тиазол-2-амина в виде желтого осадка (130 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): M+H+ = 197.1.
Стадия 3: 7-(хлорометил)-3-циклогексил-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
[0250] К раствору 4-циклогексил-5-метил-1,3-тиазол-2-амина (130 мг, 0.66 ммоль) в полифосфорной кислоте (10 мл) добавили этил 4-хлор-3-оксобутаноат (164 мг, 1.00 ммоль). Реакционную смесь перемешивали в течение 1 ч при 100°С и затем погасили водой (100 мл). Значение рН довели до рН 8-9 с помощью раствора гидроксида натрия (1 М). Получившийся раствор экстрагировали дихлорметаном (50 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/1) с получением 7-(хлорометил)-3-циклогексил-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (49 мг, 25%). ЖХМС (ESI): M+H+ = 297.1.
Стадия 4: 3-циклогексил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
[0251] К раствору 7-(хлорометил)-3-циклогексил-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (49 мг, 0.17 ммоль) в ацетонитриле (20 мл) добавили карбонат калия (46 мг, 0.33 ммоль), йодид калия (14 мг, 0.08 ммоль) и N-этил-4-фторанилин (28 мг, 0.20 ммоль). Реакционную смесь перемешивали в течение ночи при 60°С и затем погасили водой (100 мл). Реакционную смесь экстрагировали дихлорметаном (50 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением 3-циклогексил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серого осадка (8.8 мг, 13%). ЖХМС (ESI): М+H+ = 399.9; 1H NMR (300 MHz, CDCl3) δ 6.94-6.85 (m, 2H), 6.58-6.54 (m, 2H), 6.07 (s, 1H), 4.25 (s, 2H), 3.48-3.41 (m, 2H), 2.41 (s, 3Н), 1.87-1.71 (m, 6H), 1.41-1.30 (m, 4H), 1.25-1.20 (m, 3Н).
[0252] Следующий пример получили аналогично тому, как это описано для Примера 9.1:
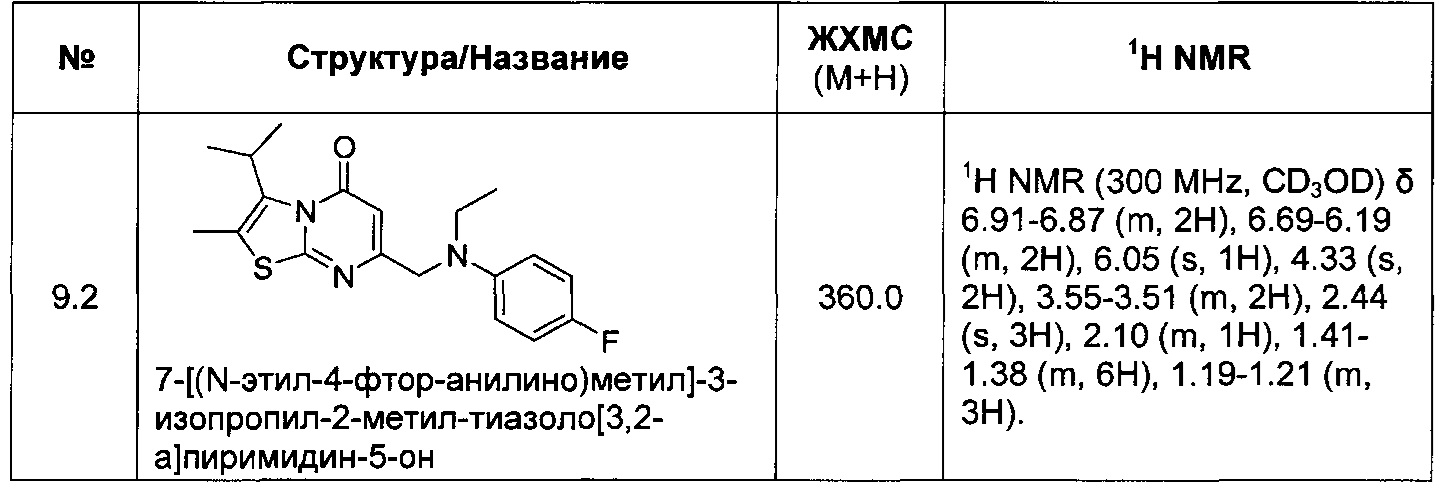
[0253] Следующие соединения получили с использованием способов, аналогичных описанным выше
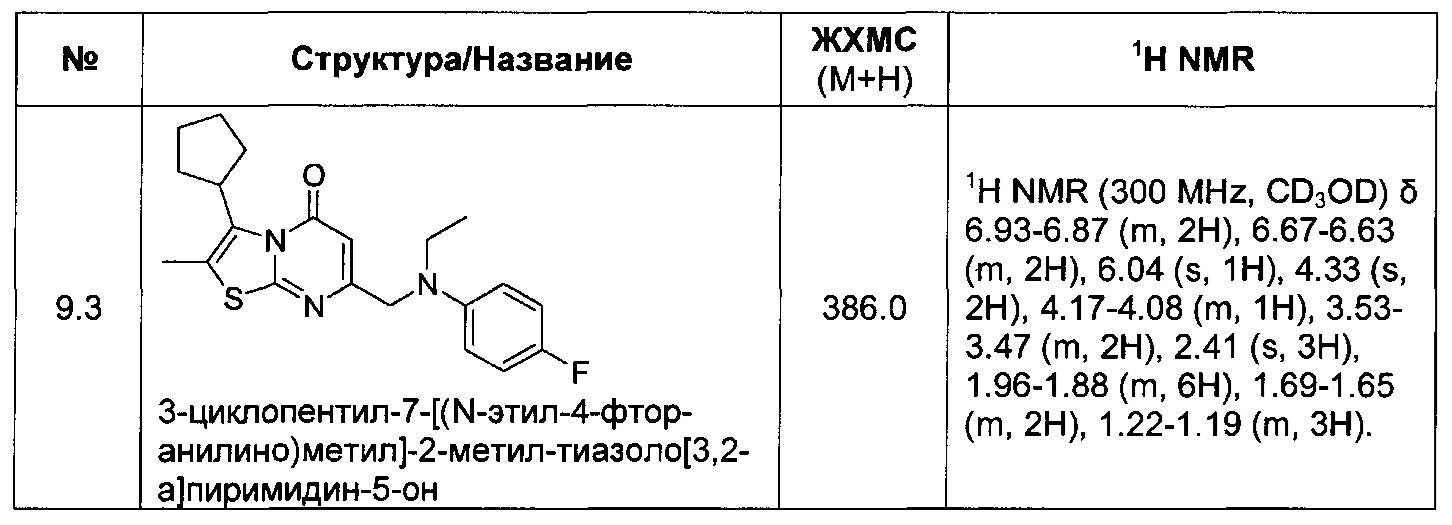
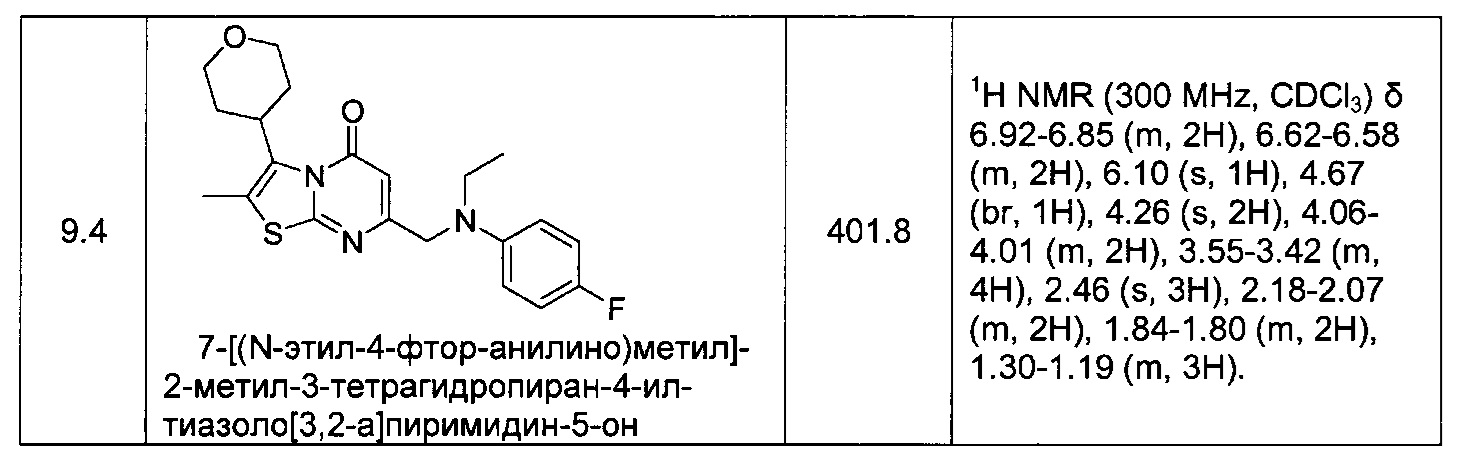
Способ 10:
Пример 10.1: 3-циклобутил-7-[(N-этил-4-фтор-анилино)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
Стадия 1: 2-бромо-1-циклобутилпропан-1-он.
[0254] К раствору 1-циклобутилпропан-1-она (2.50 г, 22.3 ммоль) в метаноле (50 мл) добавили бром (3.87 г, 24.2 ммоль) в атмосфере азота. Реакционный раствор перемешивали в течение ночи при комнатной температуре и затем сконцентрировали под вакуумом с получением 2-бромо-1-циклобутилпропан-1-она в виде желтого масла (3.5 г). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 4-Циклобутил-5-метил-1,3-тиазол-2-амин.
[0255] К раствору 2-бромо-1-циклобутилпропан-1-она (3.50 г, 31.3 ммоль) в этаноле (30 мл) добавили тиомочевину (1.5 г, 19.71 ммоль). Реакционный раствор нагревали до кипения с обратным холодильником в течение 1 ч и затем сконцентрировали под вакуумом. Остаток растворили в дихлорметане (50 мл) и осадки отфильтровали. Получившийся раствор сконцентрировали под вакуумом с получением 4-циклобутил-5-метил-1,3-тиазол-2-амина в виде желтого осадка (600 мг, 18%). ЖХМС (ESI): M+H+ = 169.0.
Стадия 3: 6-(хлорометил)-3-циклобутил-2-метил-3аН,4Н-тиено[2,3-b]пиридин-4-он.
[0256] К раствору 4-циклобутил-5-метил-1,3-тиазол-2-амина (335 мг, 1.99 ммоль) добавили полифосфорную кислоту (5 мл) и этил 4-хлор-3-оксобутаноат (492 мг, 2.99 ммоль). Реакционный раствор перемешивали в течение 1 ч при 110°С. Значение рН раствора довели до рН 9-10 с помощью водного раствора гидроксида натрия (2 М). Реакционную смесь экстрагировали дихлорметаном (5×100 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 6-(хлорометил)-3-циклобутил-2-метил-3аН,4Н-тиено[2,3-b]пиридин-4-она в виде коричневого осадка (300 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): М+H+ = 269.0.
Стадия 4: 3-Циклобутил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
[0257] К раствору 7-(хлорометил)-3-циклобутил-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (300 мг, 1.12 ммоль) в ацетонитриле (20 мл) добавили йодид калия (93 мг, 0.56 ммоль), карбонат калия (309 мг, 2.24 ммоль), и N-этил-4-фторанилин (311 мг, 2.23 ммоль). Получившийся раствор перемешивали в течение 5 ч при 70°С. После концентрирования под вакуумом, неочищенный продукт очистили посредством препаративной ВЭЖХ при следующих условиях (Agilent 1200: Колонка, X-Brigde C18; подвижная фаза, 0.05% NH4HCO3 в воде и CH3CN (CH3CN 20% до 60% в течение 15 мин); Детектор, УФ254) с получением 3-циклобутил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (36.1 мг, 8%). ЖХМС (ESI): М+H+ = 371.8; 1H NMR (300 MHz, CD3OD) δ 6.93-6.86 (m, 2H), 6.69-6.62 (m, 2H), 6.01 (s, 1H), 4.44-4.35 (m, 1H), 4.31 (s, 2H), 3.53-3.49 (m, 2H), 2.48 (s, 3H), 2.45-2.35 (m, 2H), 1.89-1.80 (m, 1H), 2.06-1.94 (m, 1H), 1.22-1.19 (m, 3H).
[0258] Следующие примеры получили аналогично тому, как это описано для Примера 10.1:
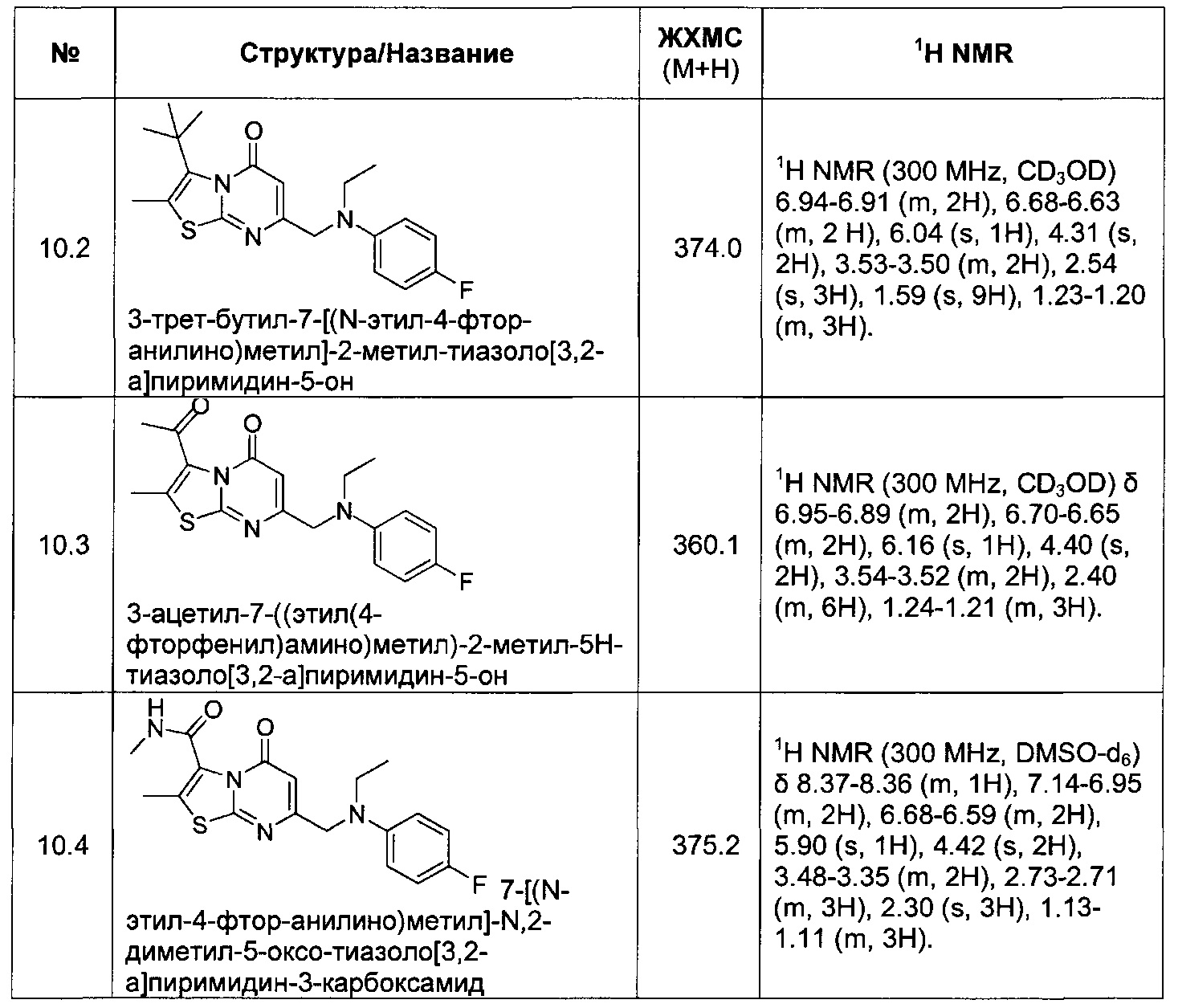
Пример 10.5: 7-[(N-этил-4-фтор-анилино)метил]-3-(1-гидрокси-1-метил-этил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
[0259] К раствору 3-ацетил-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 10.3) (70 мг, 0.19 ммоль) в тетрагидрофуране (15 мл) добавили метилмагния бромид в тетрагидрофуране (1 моль/л, 0.42 мл). Реакционную смесь перемешивали в течение 48 ч при комнатной температуре и затем погасили насыщенным водным раствором хлорида аммония (20 мл). Получившуюся смесь экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50/1) с получением 7-[[этил(4-фторфенил)амино]метил]-3-(2-гидроксипропан-2-ил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (40 мг, 52%). ЖХМС (ESI): М+Н+ = 376.1; 1H NMR (300 MHz, CD3OD) δ 6.95-6.89 (m, 2H), 6.70-6.65 (m, 2H), 6.24 (s, 1H), 4.39 (s, 2H), 3.56-3.50 (m, 2H), 2.58 (s, 3Н), 1.73 (s, 6H), 1.24-1.21 (m, 3H).
Пример 10.6: 7-[(N-этил-4-фтор-анилино)метил]-3-(1-гидроксиэтил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
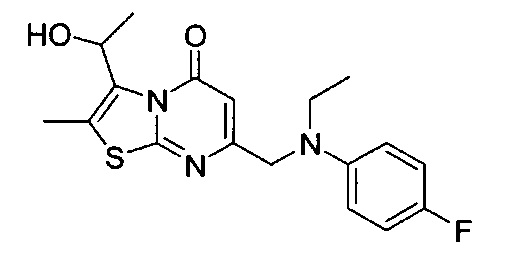
Стадия 1: 7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбальдегид.
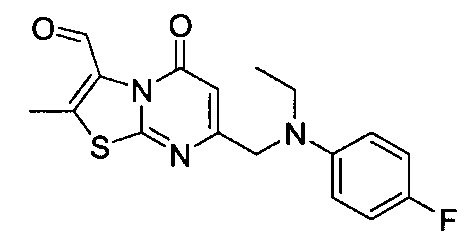
[0260] К раствору 3-бромо-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (200 мг, 0.51 ммоль) в тетрагидрофуране (10 мл) добавили н-бутиллитий (0.3 мл, 2.5 моль/л) при -78°С, затем перемешивали 30 мин при такой температуре. Этилформиат (75.8 мг, 1.02 ммоль) добавили в реакционную смесь при -78°С и дали ее нагреться до комнатной температуры в течение 1 часа. Получившийся реакционный раствор погасили водой (20 мл), экстрагировали дихлорметаном (30 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 20% этилацетата в петролейном эфире с получением 7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбальдегида. ЖХМС (ESI): M+H+ = 345.1.
Стадия 2: 7-[(N-этил-4-фтор-анилино)метил]-3-(1-гидроксиэтил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
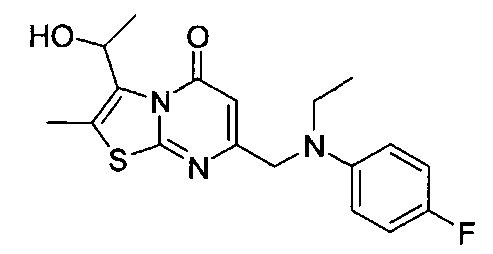
[0261] К раствору 7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (200 мг, 0.58 ммоль) (из Примера 11.4) в тетрагидрофуране (15 мл) добавили метилмагния бромид (1.3 мл, 0.5 моль/л). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили хлоридом аммония (насыщ., 20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением 7-[[этил(4-фторфенил)амино]метил]-3-(1-гидроксиэтил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (67.5 мг, 31%). ЖХМС (ESI): М+H+ = 362.1; 1H NMR (300 MHz, CD3OD) δ 6.95-6.88 (m, 2H), 6.71-6.65 (m, 2H), 6.20 (s, 1H), 5.43-5.36 (m, 1H), 4.39 (s, 2H), 3.56-3.51 (m, 2H), 2.50 (s, 3Н), 1.54-1.51 (m, 3H), 1.24-1.21 (m, 3H).
Пример 10.7: 3-[(диметиламино)метил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
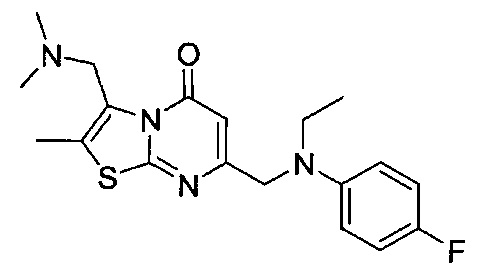
[0262] К раствору 7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (из Примера 10.6, Стадия 1) (100 мг, 0.29 ммоль) в метаноле (30 мл) добавили гидрохлорид диметиламина (118 мг, 1.45 ммоль), триэтиламин (161 мг, 1.59 ммоль) и цианоборогидрид натрия (55 мг, 0.88 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем погасили водой (50 мл). Реакционную смесь экстрагировали дихлорметаном (30 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 25% этилацетата в петролейном эфире с получением 3-[(диметиламино)метил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого осадка (11.1 мг, 10%). ЖХМС [M+H]+ = 374.85; 1H NMR (300 MHz, CDCl3) δ 6.92-6.84 (m, 2H), 6.58-6.54 (m, 2H), 6.14 (s, 1H), 4.28 (s, 2H), 4.05 (bs, 2H), 3.48-3.41 (m, 2H), 2.44-2.39 (m, 9H), 1.26-1.19 (m, 3H).
[0263] Следующие примеры получили аналогично тому, как это описано для Примера 10.7:
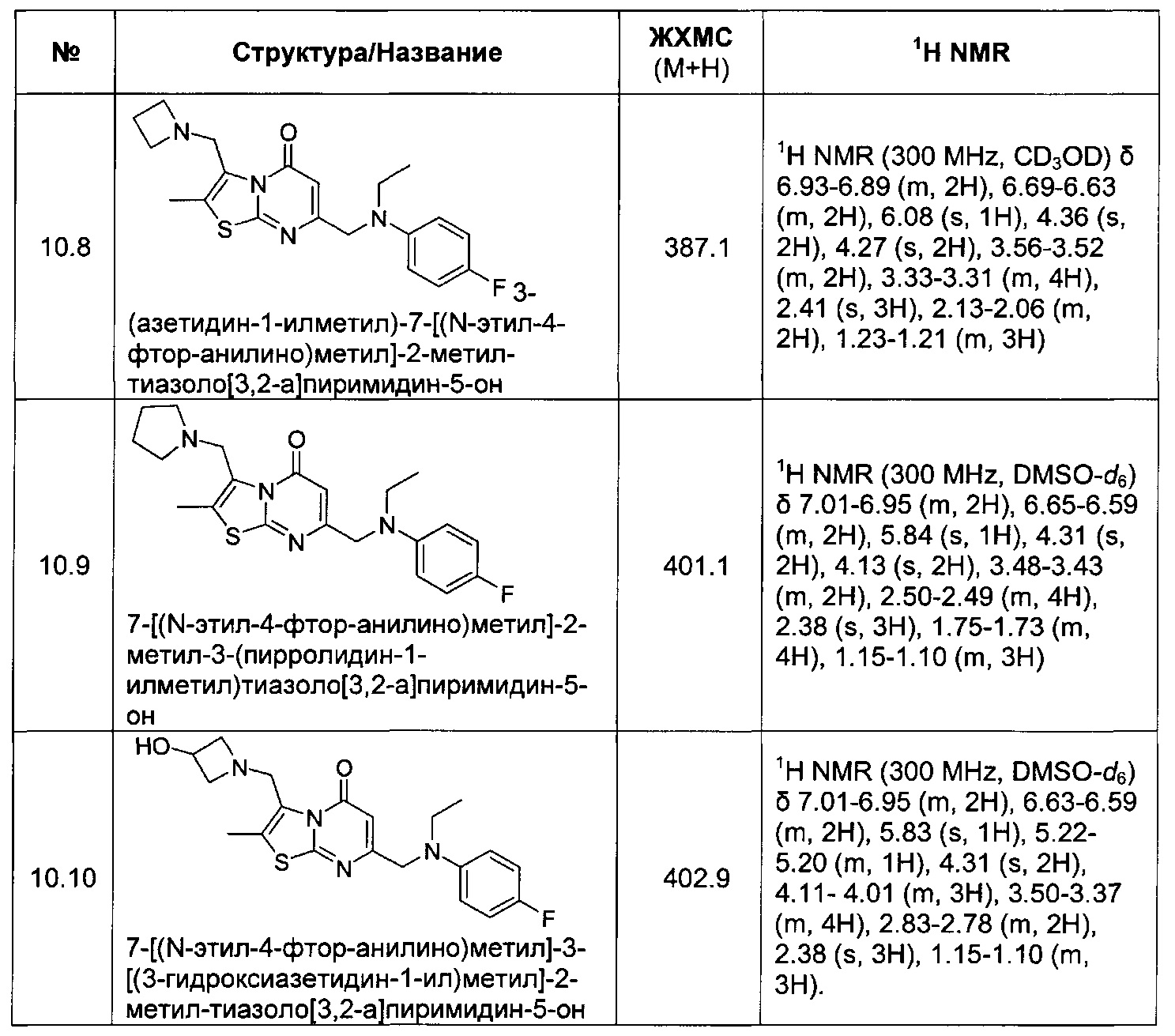
Пример 10.11: 7-[(N-этил-4-фтор-анилино)метил]-2-метил-3-(2,2,2-трифтор-1-гидрокси-этил)тиазоло[3,2-а]пиримидин-5-он.
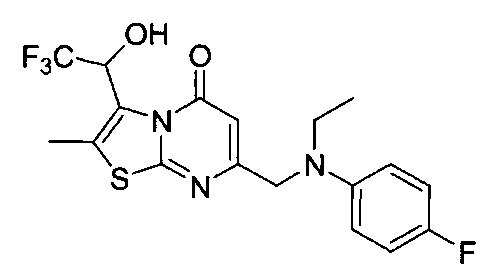
[0264] К раствору тетрабутиламмония фторида (113 мг, 0.43 ммоль) в тетрагидрофуране (10 мл) добавили 4 Å молекулярные сита (200 мг) и затем перемешивали в течение 0.5 ч при -20°С. Добавили раствор 7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (из Примера 10.6, Стадия 1) (300 мг, 0.87 ммоль), триметил(трифторметил)силана (617 мг, 4.35 ммоль) и 4 Å молекулярных сит (100 мг) в тетрагидрофуране (20 мл). Реакционную смесь перемешивали в течение дополнительных 3 ч при -30°С. Реакционную смесь погасили водой (50 мл), экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (50/1) с получением 7-[[этил(4-фторфенил)амино]метил]-2-метил-3-(2,2,2-трифтор-1-гидроксиэтил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (32.4 мг, 9.0%). ЖХМС (ESI): M+H+ = 416.0; 1Н NMR (300 MHz, CD3OD) δ 6.95-6.89 (m, 2H), 6.69-6.64 (m, 2H), 6.12 (s, 1H), 4.87 (s, 1H), 4.37 (s, 2H), 3.55-3.50 (m, 2H), 2.63 (s, 3H), 1.24-1.20 (m, 3H).
Пример 10.12: 7-((этил(4-фторфенил)амино)метил)-3-(гидроксиметил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
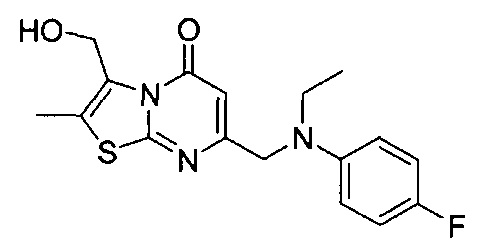
[0265] К раствору 7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (из Примера 10.6, Стадия 1) (100 мг, 0.29 ммоль) в тетрагидрофуране (10 мл) добавили воду (2 мл) и борогидрид натрия (33 мг, 0.87 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем погасили водой (50 мл). Получившийся раствор экстрагировали этилацетатом (30 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 50% этилацетата в петролейном эфире с получением 7-[[этил(4-фторфенил)амино]метил]-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (60 мг, 60%). ЖХМС (ESI): M+H+ = 347.9; 1H NMR (300 MHz, CDCl3) δ 6.93-6.86 (m, 2H), 6.59-6.54 (m, 2H), 6.26 (s, 1H), 4.75-4.73 (m, 2H), 4.49-4.45 (m, 1H), 4.32 (s, 2H), 3.52-3.44 (m, 2H), 2.44 (s, 3H), 1.25-1.19 (m, 3H).
Пример 10.13: 7-[[этил(4-фторфенил)амино]метил]-3-(метоксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
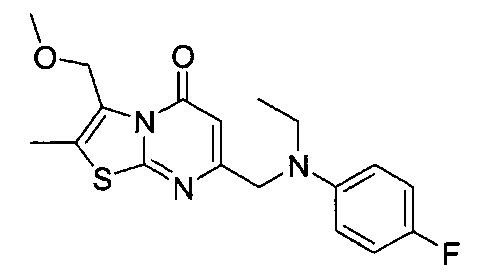
[0266] К раствору 7-[[этил(4-фторфенил)амино]метил]-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (60 мг, 0.17 ммоль) в тетрагидрофуране (10 мл) добавили гидрид натрия (11 мг, 0.28 ммоль) и йодометан (30 мг, 0.21 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем погасили водой (100 мл). Получившийся раствор экстрагировали дихлорметаном (50 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали лоб вакуумом. Остаток очистили посредством хроматографии с помощью 50% этилацетата в петролейном эфире, с получением 7-[[этил(4-фторфенил)амино]метил]-3-(метоксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого полутвердого вещества (1.4 мг, 2.0%). ЖХМС (ESI): M+H+ = 362.1; 1H NMR (300 MHz, CDCl3) δ 6.93-6.87 (m, 2H), 6.61-6.60 (m, 2H), 6.16 (s, 1H), 4.93 (s, 2H), 4.28 (s, 2H), 3.45-3.42 (m, 5H), 2.45 (s, 3H), 1.33-1.21 (m, 3H).
Пример 10.14: 7-[[этил(4-фторфенил)амино]метил]-2-метил-3-(1Н-пиразол-1-илметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
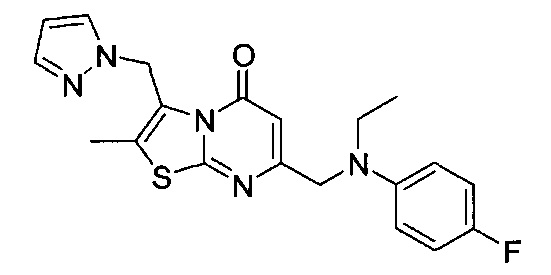
[0267] К раствору 7-[[этил(4-фторфенил)амино]метил]-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 10.12) (100 мг, 0.29 ммоль), 1Н-пиразола (39.2 мг, 0.58 ммоль) и трифенилфосфина (135 мг, 0.52 ммоль) в тетрагидрофуране (5 мл) добавили диизопропилазодикарбоксилат (105 мг, 0.52 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После концентрирования под вакуумом неочищенный остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (100/1) с получением 7-[[этил(4-фторфенил)амино]метил]-2-метил-3-(1Н-пиразол-1-илметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (10.0 мг, 8.0%). ЖХМС (ESI): М+H+ = 398.1; 1H NMR (300 MHz, CD3OD) δ 7.76 (s, 1H), 7.45 (s, 1H), 6.93-6.87 (m, 2H), 6.68-6.62 (m, 2H), 6.25 (s, 1H), 6.05 (s, 1H), 5.90 (s, 2H), 4.34 (s, 2H), 3.53-3.47 (m, 2H), 2.58 (s, 3Н), 1.22-1.19 (m, 3Н).
Пример 10.15: 7-[(N-этил-4-фтор-анилино)метил]-2-метил-3-(метилсульфонилметил)тиазоло[3,2-а]пиримидин-5-он.
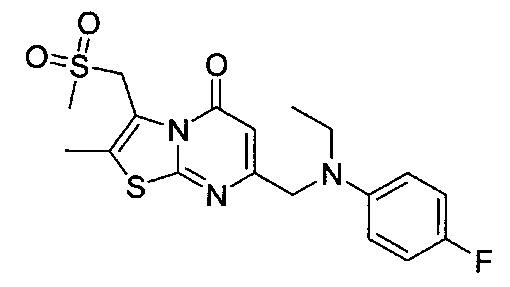
Стадия 1: (7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)метилметансульфонат.
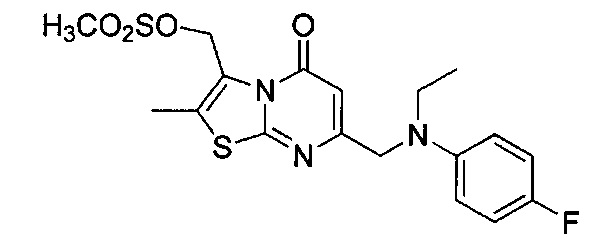
[0268] К раствору 7-[[этил(4-фторфенил)амино]метил]-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 10.12) (100 мг, 0.28 ммоль) в дихлорметане (15 мл) добавили триэтиламин (58 мг, 0.58 ммоль) и метансульфонилхлорид (50 мг, 0.44 ммоль) при 0°С. Реакционную смесь перемешивали в течение 30 мин при 0°С и затем сконцентрировали под вакуумом. Неочищенный продукт использовали сразу на следующей стадии.
Стадия 2: 7-[[этил(4-фторфенил)амино]метил]-3-(метансульфонилметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
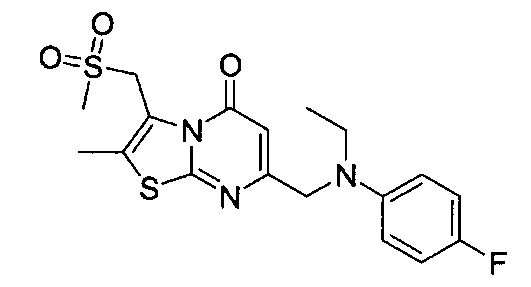
[0269] К раствору (7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)метилметансульфоната (120 мг, 0.28 ммоль) в этаноле (30 мл) добавили метансульфинат натрия (202 мг, 1.98 ммоль). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 2 ч при 80°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (30/1) с получением 7-[[этил(4-фторфенил)амино]метил]-3-(метансульфонилметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (2.8 мг, 2%). ЖХМС (ESI): M+H+ = 409.9; 1Н NMR (300 MHz, DMSO-d6) δ 6.94-6.88 (m, 2H), 6.57-6.52 (m, 2H), 5.84 (s, 1H), 5.28 (s, 2H), 4.27 (s, 2H), 3.41-3.36 (m, 2H), 2.93 (s, 3Н), 2.39 (s, 3Н), 1.08-1.03 (m, 3H) и 3-(этоксиметил)-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (22.1 мг, 21%). ЖХМС (ESI): М+Н+ = 409.9; 1H NMR (300 MHz, DMSO-d6) δ 6.94-6.88 (m, 2H), 6.57-6.52 (m, 2H), 5.84 (s, 1H), 5.28 (s, 2H), 4.27 (s, 2H), 3.41-3.36 (m, 2H), 2.93 (s, 3Н), 2.39 (s, 3Н), 1.08-1.03 (m, 3Н).
[0270] Следующие примеры получили аналогично тому, как это описано для Примера 10.15:
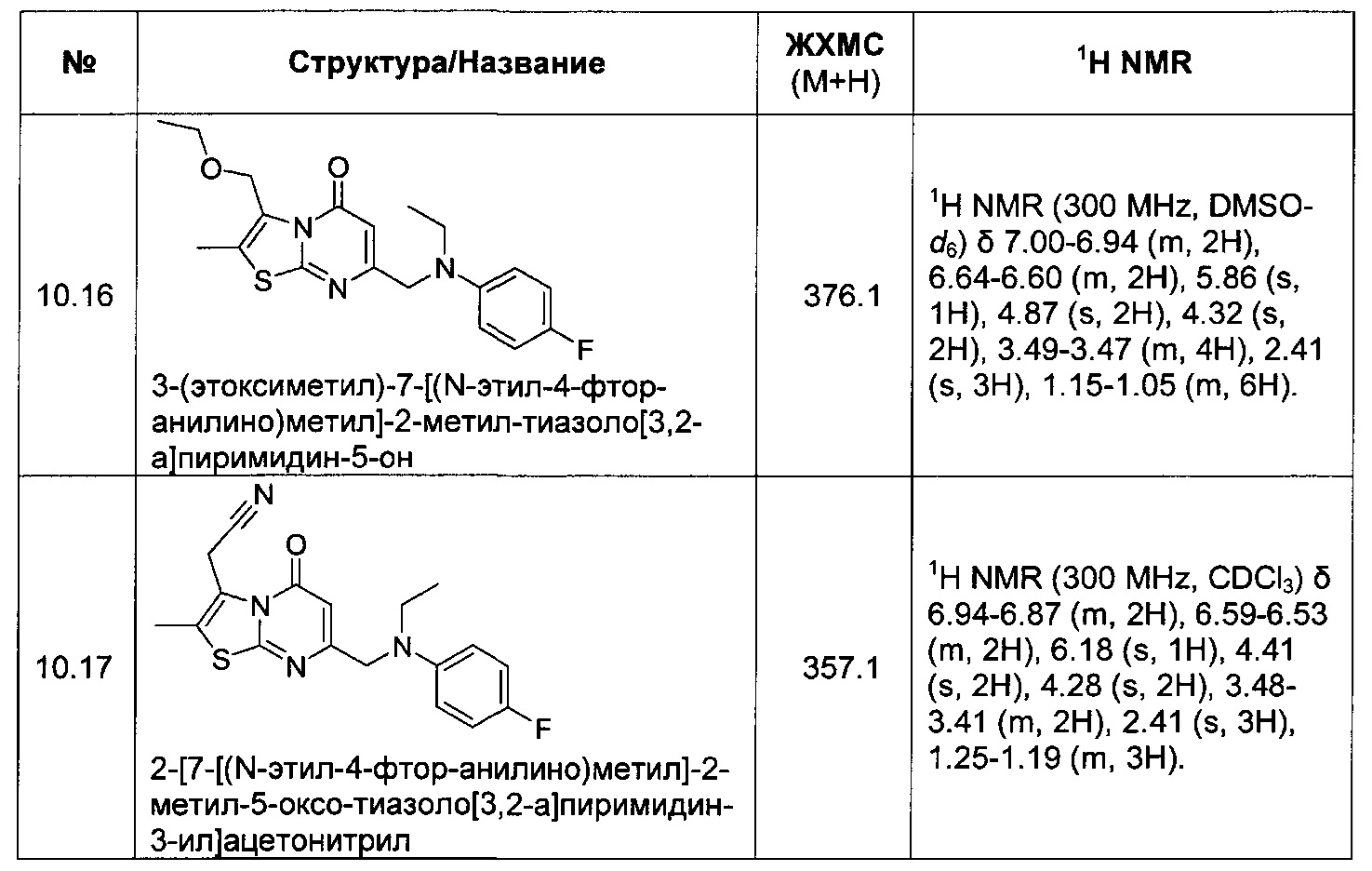
[0271] Следующие соединения получили с использованием способов, аналогичных описанным выше

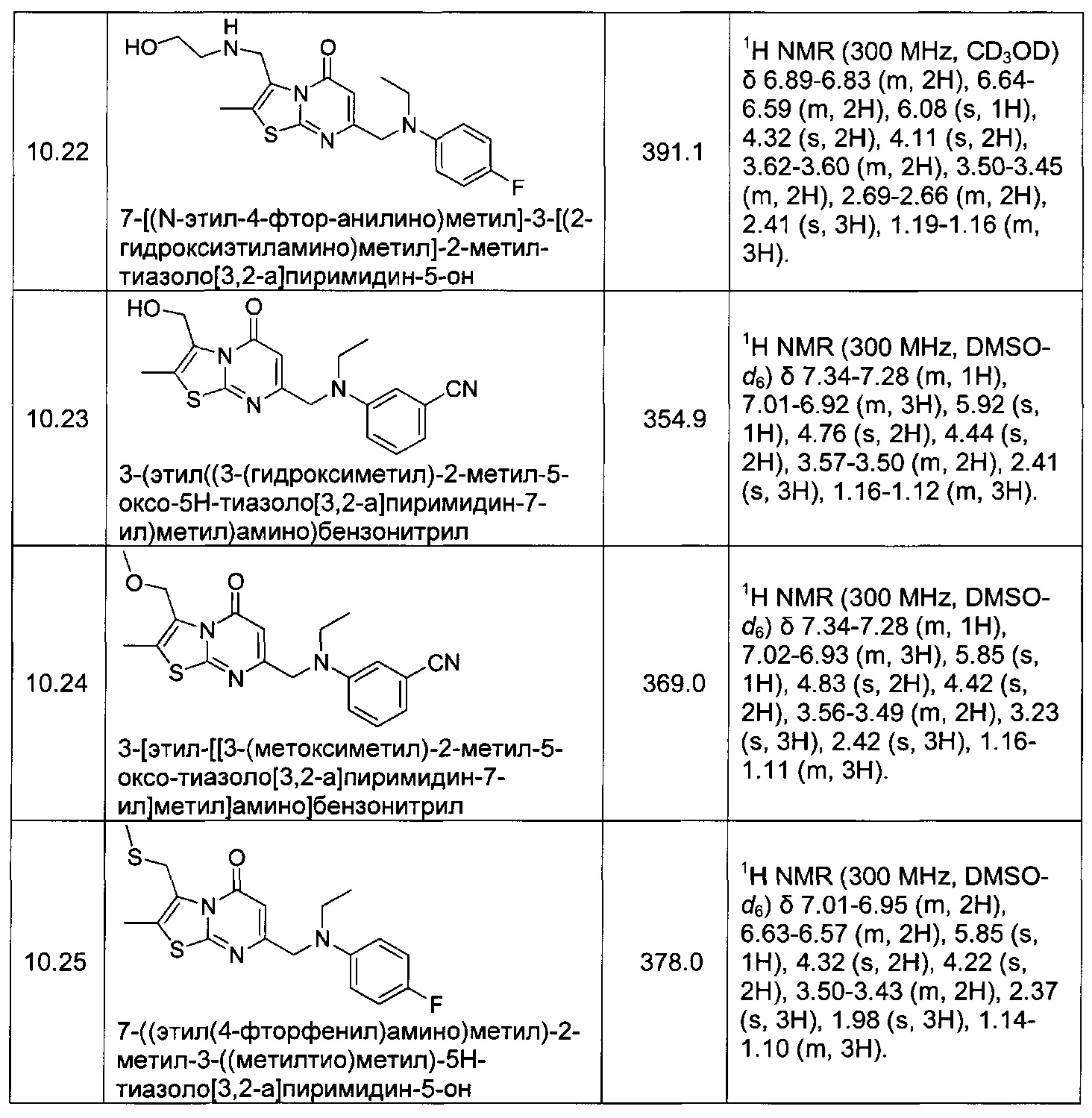
Способ 11
Пример 11.1: 3-хлор-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
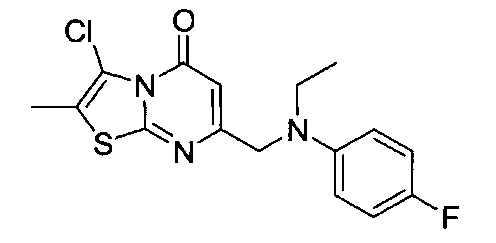
[0272] К раствору 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (100 мг, 0.25 ммоль) в тетрагидрофуране (20 мл) добавили н-бутиллитий (0.12 мл, 2.5 моль/л) по каплям при -80°С. Реакционный раствор перемешивали в течение 30 мин при -80°С. В реакционную смесь добавили N-хлорсукцинимид (40 мг, 0.30 ммоль) при -80°С. Реакционную смесь медленно нагрели до комнатной температуры в течение 30 мин. Затем реакционную смесь погасили посредством добавления 100 мл воды, экстрагировали этилацетатом (30 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 33% этилацетата в петролейном эфире с получением 3-хлор-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (16.4 мг, 18%). ЖХМС (ESI): М+Н+ = 351.9; 1H NMR (300 MHz, CDCl3) δ 6.94-6.88 (m, 2H), 6.61-6.57 (m, 2H), 6.16 (s, 1H), 4.27 (s, 2H), 4.50-4.43 (m, 2H), 2.36 (s, 3H), 1.26-1.20 (m, 3H).
[0273] Следующие примеры получили аналогично тому, как это описано для Примера 11.1:
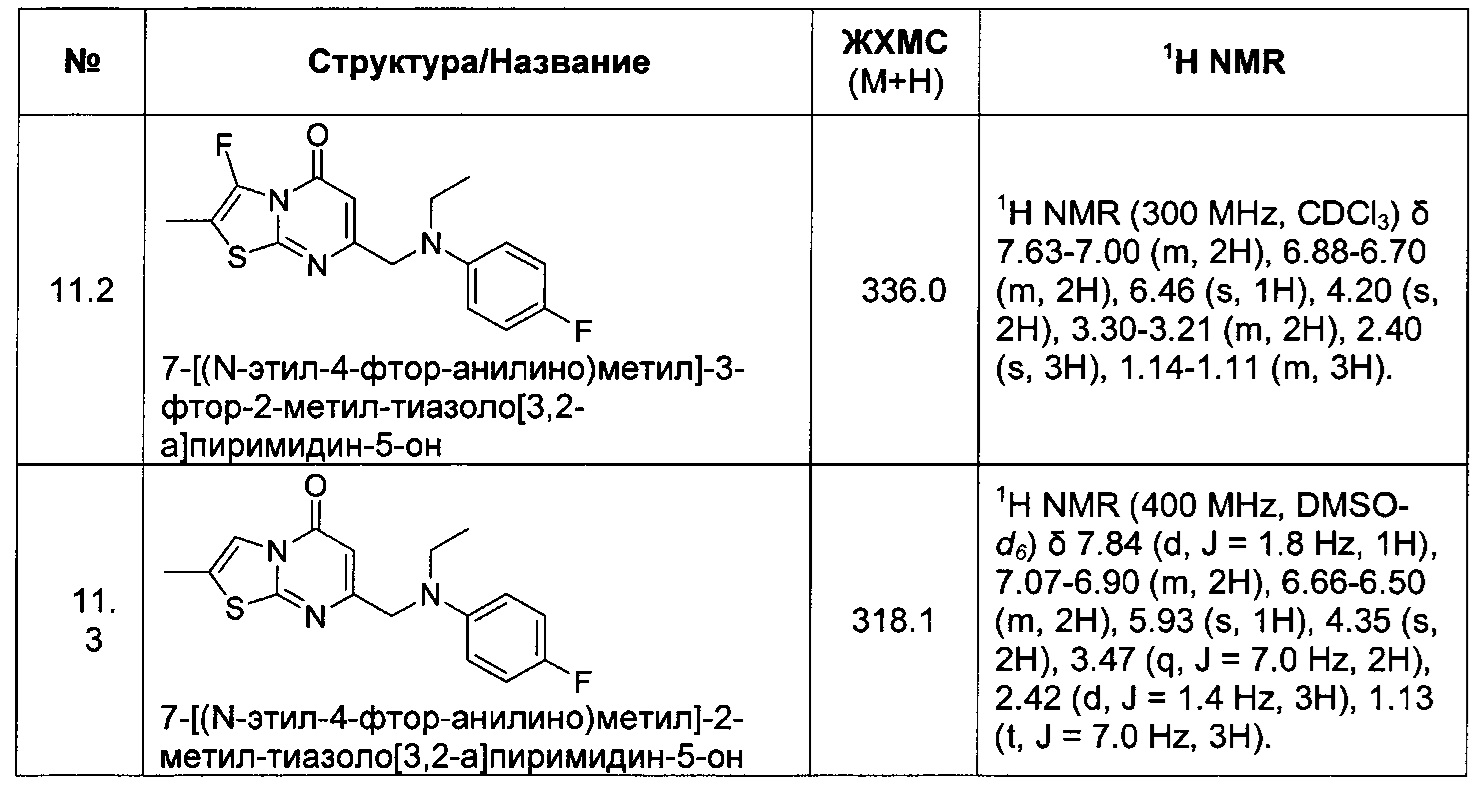
[0274] Следующие соединения получили с использованием способов, аналогичных описанным выше
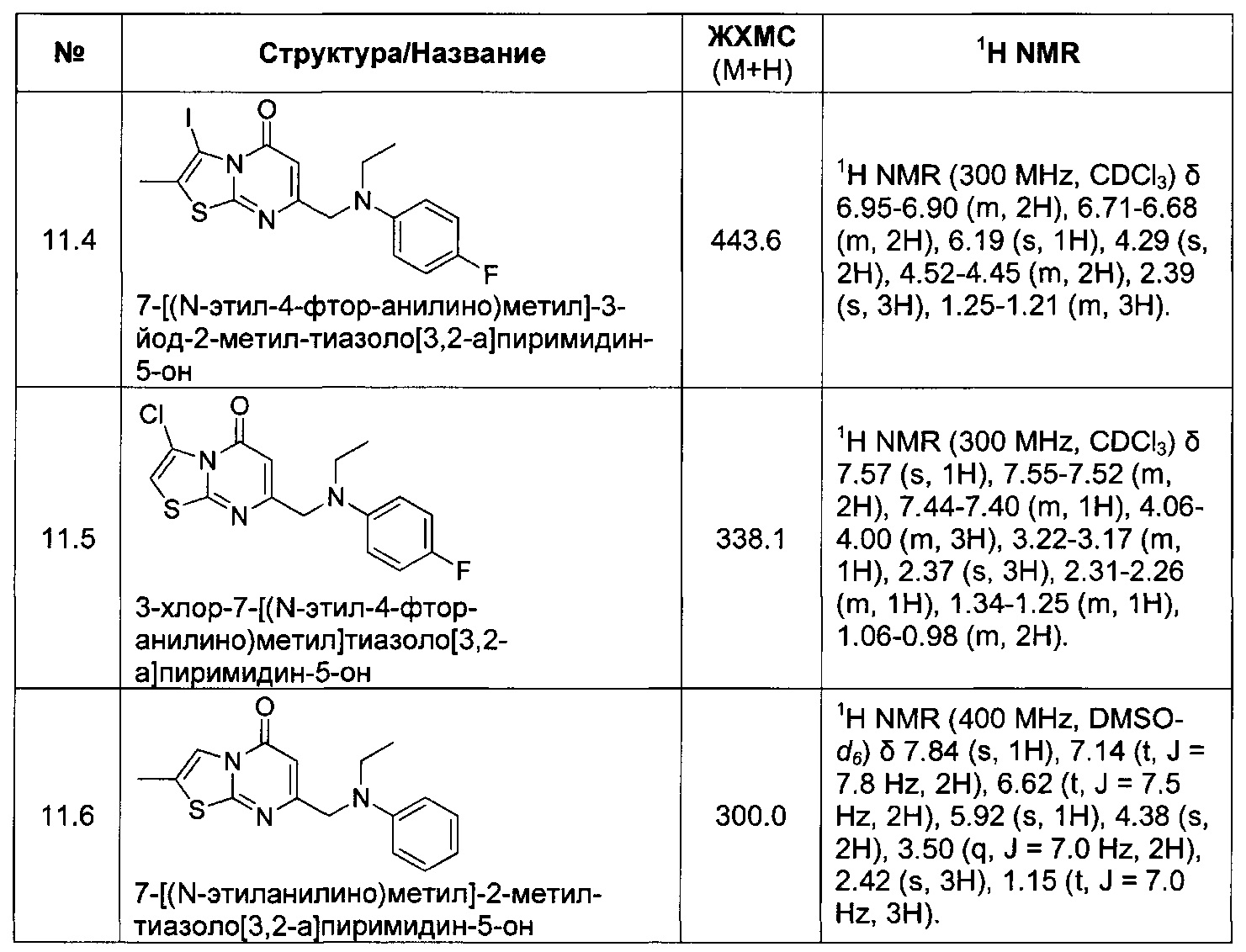
Способ 12:
Пример 12.1: 3-(1,3-дигидроксипропил)-7-[(N-этил-4-фтор-анилино)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
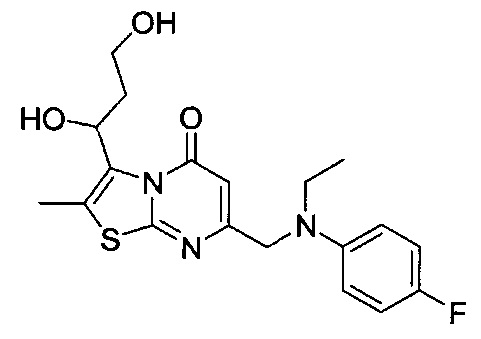
Стадия 1: 3-[3-(Бензилокси)-1-гидроксипропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
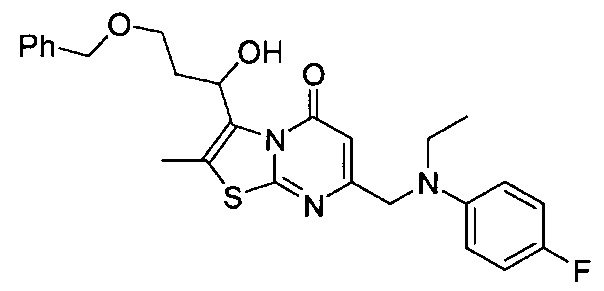
[0275] К раствору 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (600 мг, 1.51 ммоль) в тетрагидрофуране (50 мл) добавили н-бутиллитий в тетрагидрофуране (2.4 М, 3 мл, 7.2 ммоль) при -80°С. После перемешивания при -80°С в течение 0.5 ч, 3-(бензилокси)пропаналь (500 мг, 3.05 ммоль) добавили в реакционную смесь. Получившийся раствор перемешивали в течение 1.5 ч при -80°С. Затем реакционную смесь погасили водой (50 мл), экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 3-[3-(бензилокси)-1-гидроксипропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого осадка (500 мг). Неочищенный продукт использовали на следующей стадии без очистки. ЖХМС (ESI): M+H+ = 482.0.
Стадия 2: 3-(1,3-Дигидроксипропил)-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
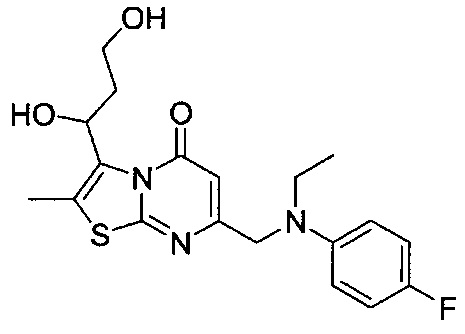
[0276] К раствору 3-[3-(бензилокси)-1-гидроксипропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (500 мг, 1.04 ммоль) в дихлорметане (50 мл) добавили раствор трихлорида бора (10 мл, 1 моль/л) в дихлорметане (10 мл) при -20°С. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь погасили насыщенным водным раствором хлорида аммония (50 мл), экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/1) с получением 3-(1,3-дигидроксипропил)-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серо-белого осадка (136.4 мг, 32%). ЖХМС (ESI): М+Н+ = 392.1; 1H NMR (300 MHz, CD3OD) δ 6.95-6.88 (m, 2H), 6.70-6.65 (m, 2H), 6.22 (s, 1H), 5.32-5.27 (m, 1H), 4.40 (s, 2H), 3.75-3.67 (m, 1H), 3.57-3.49 (m, 3H), 2.51 (s, 3H), 2.22-2.10 (m, 1H), 2.00-1.94 (m, 1H), 1.24-1.22 (m, 3H).
Пример 12.2: 7-[(N-этил-4-фтор-анилино)метил]-3-(1-фтор-3-гидрокси-пропил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
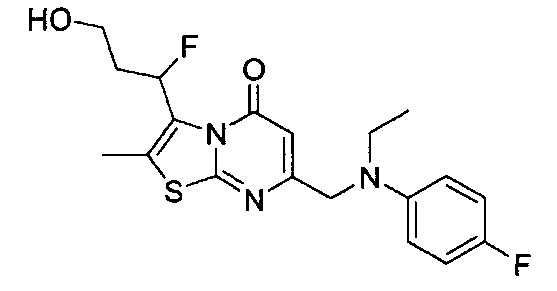
Стадия 1: 3-(3-(трет-бутилдиметилсилилокси)-1-фторпропил)-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
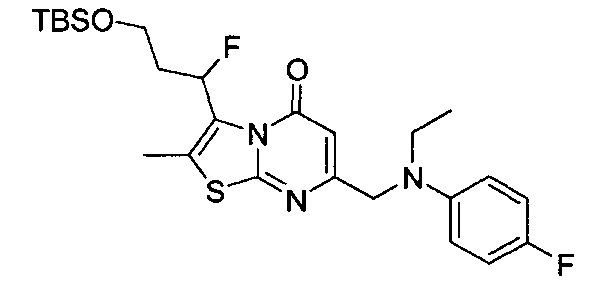
[0277] К раствору 3-[3-[(трет-бутилдиметилсилил)окси]-1-гидроксипропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (полученный способом, аналогичным Примеру 12.1, Стадия 1) (120 мг, 0.24 ммоль) в дихлорметане (20 мл) добавили диэтиламиносеры трифторид (57.4 мг, 0.36 ммоль) по каплям при -78°С. Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили насыщенным водным раствором бикарбоната натрия (20 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 3-[3-[(трет-бутилдиметилсилил)окси]-1-фторпропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде желтого масла (100 мг). ЖХМС (ESI): М+Н+ = 508.1.
Стадия 2: 7-[[этил(4-фторфенил)амино]метил]-3-(1-фтор-3-гидроксипропил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
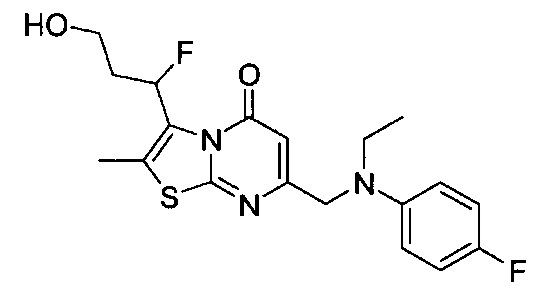
[0278] К раствору 3-[3-[(трет-бутилдиметилсилил)окси]-1-фторпропил]-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.10 ммоль) в тетрагидрофуране (15 мл) добавили хлороводород (1 М, 2.5 мл) по каплям при перемешивании. Получившийся раствор перемешивали в течение 3 ч при комнатной температуре. Затем реакционную смесь погасили насыщенным водным раствором бикарбоната натрия (20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (30/1) с получением 7-[[этил(4-фторфенил)амино]метил]-3-(1-фтор-3-гидроксипропил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого осадка (12.2 мг, 30%). ЖХМС (ESI): M+H+ = 394.1; 1H NMR (300 MHz, CD3OD) δ 6.94-6.76 (m, 3H), 6.68-6.64 (m, 2H), 6.07 (s, 1H), 4.35 (s, 2H), 3.79-3.71 (m, 2H), 3.55-3.48 (m, 2H), 2.52 (s, 3H), 2.40-2.52 (m, 2H), 1.23-1.20 (m, 3H).
Примеры 12.3 и 12.4: 3-(1,3-дигидроксипропил)-7-[(N-этил-4-фтор-анилино)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (энантиомеры 1 и 2).
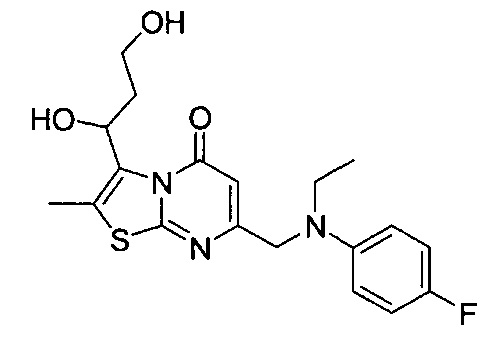
[0279] Продукт примера 12.1 дополнительно очистили с помощью хиральной СКЖХ на колонке Chiralpak AD (2×15 см) с элюцией 25% метанолом (0.1% NH4OH)/CO2 при 100 бар при скорости потока 70 мл/мин. Выделенные пики анализировали на колонке Chiralpak AD (50×0.46 см) с элюцией 25% метанолом (0.1% NH4OH)/CO2, при 120 бар (скорость потока 5 мл/мин, 220 нм). Из этого выделенного получили два изомера.
[0280] Пример 12.3 (пик 1: энантиомер 1): Время задержки = 1.54 мин; ЖХМС (ESI): М+Н+ = 392.1; 1H NMR (300 MHz, CD3OD) δ 6.95-6.88 (m, 2H), 6.70-6.65 (m, 2Н), 6.22 (s, 1H), 5.32-5.27 (m, 1H), 4.40 (s, 2H), 3.75-3.67 (m, 1H), 3.57-3.49 (m, 3H), 2.51 (s, 3H), 2.22-2.10 (m, 1H), 2.00-1.94 (m, 1H), 1.24-1.22 (m, 3H).
[0281] Пример 12.4 (пик 2. энантиомер 2): Время задержки = 1.63 мин; ЖХМС (ESI): М+Н+ = 392.1; 1H NMR (300 MHz, CD3OD) δ 6.95-6.88 (m, 2H), 6.70-6.65 (m, 2H), 6.22 (s, 1H), 5.32-5.27 (m, 1H), 4.40 (s, 2H), 3.75-3.67 (m, 1H), 3.57-3.49 (m, 3H), 2.51 (s, 3H), 2.22-2.10 (m, 1H), 2.00-1.94 (m, 1H), 1.24-1.22 (m, 3H).
[0282] Следующий пример получили аналогично тому, как это описано для Примера 12.1:
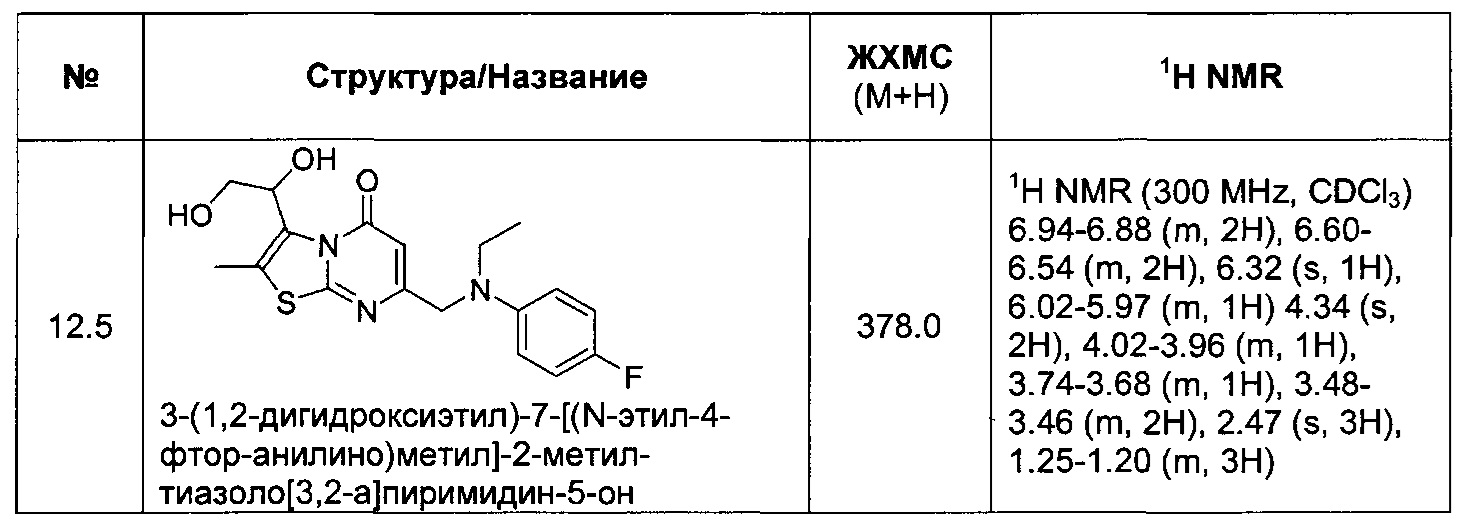
Способ 13:
Пример 13.1: 7-[(N-этил-4-фтор-анилино)метил]-3-(3-гидроксипропил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
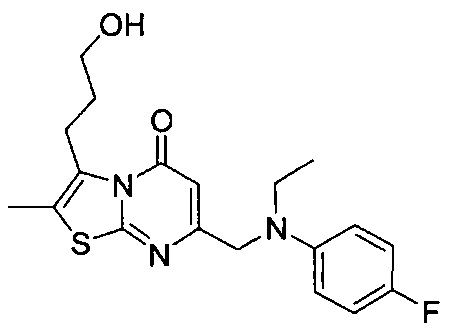
Стадия 1: (Е)-этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилат.
[0283] К раствору 3-бромо-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (400 мг, 1.01 ммоль), три(о-толил)фосфина (60 мг, 0.20 ммоль), триэтиламина (200 мг, 1.98 ммоль) и трис(дибензилиденацетон)дипалладия(0) (50 мг, 0.05 ммоль) в ацетонитриле (20 мл) добавили этилакрилат (200 мг, 2.00 ммоль). Реакционную смесь перемешивали в течение 3 ч при 90°С и затем сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением (Е)-этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилата в виде светло-желтого осадка (280 мг, 67%). ЖХМС (ESI): M+H+ = 416.0; 1H NMR (300 MHz, CDCl3) δ 8.26-8.20 (m, 1H), 6.94-6.90 (m, 2H), 6.62-6.59 (m, 2H), 6.20 (s, 1H), 6.02-5.98 (m, 1H), 4.31-4.27 (m, 4H), 3.50-3.47 (m, 2H), 2.48 (s, 3Н), 1.37-1.22 (m, 6H).
Стадия 2: Этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)пропаноат.
[0284] К раствору (Е)-этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)акрилата в метаноле(10 мл) добавили 10% палладий на угле и реакционный раствор перемешивали 12 ч при комнатной температуре в атмосфере водорода (1.5 атм). После фильтрации получившийся раствор сконцентрировали под вакуумом с получением этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)пропаноата в виде светло-желтого осадка (180 мг, 90%). ЖХМС (ESI): M+H+ = 418.0; 1H NMR (300 MHz, CDCl3) δ 6.94-6.88 (m, 2H), 6.62-6.58 (m, 2H), 6.12 (s, 1H), 4.28 (s, 2H), 4.13-4.10 (m, 2H), 3.51-3.41 (m, 4H), 2.74-2.71 (m, 2H), 2.37 (s, 3Н), 1.26-1.20 (m, 6H).
Стадия 3: 7-((этил(4-фторфенил)амино)метил)-3-(3-гидроксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
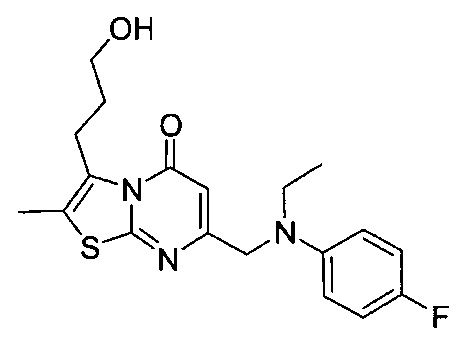
[0285] К раствору этил-3-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)пропаноата (180 мг, 0.43 ммоль) в метаноле (10 мл) добавили борогидрид лития (20 мг, 0.91 ммоль) при 0°С. Получившийся раствор перемешивали в течение 5 ч при комнатной температуре. Затем реакционную смесь погасили насыщенным водным раствором хлорида аммония (20 мл), экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над безводным сульфатом натрия, и затем сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (30/1) с получением 7-((этил(4-фторфенил)амино)метил)-3-(3-гидроксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого осадка (100 мг, 62%). ЖХМС (ESI): M+H+ = 376.0; 1H NMR (400 MHz, CDCl3) δ 6.94-6.90 (m, 2H), 6.63-6.59 (m, 2H), 6.15 (s, 1H), 4.31 (s, 2H), 3.68-3.66 (m, 2H), 3.50-3.47 (m, 2H), 3.35-3.32 (m, 2H), 2.36 (s, 3Н), 1.95-1.90 (m, 2H), 1.22-1.19 (m, 3H).
Пример 13.2: 7-((этил(4-фторфенил)амино)метил)-3-(3-метоксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
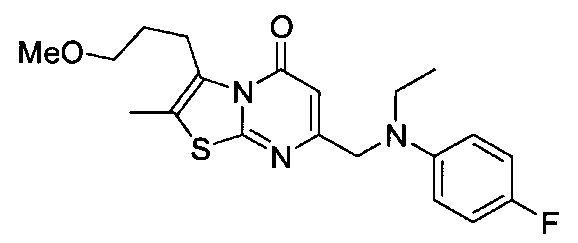
[0286] К раствору 7-((этил(4-фторфенил)амино)метил)-3-(3-гидроксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.13 ммоль) в тетрагидрофуране (5 мл) добавили гидрид натрия (7.0 мг, 60%, 0.29 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Затем йодометан (100 мг, 0.70 ммоль) добавили в реакционную смесь и получившийся раствор перемешивали 12 ч при комнатной температуре. Реакционную смесь погасили водой со льдом (10 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/3) с получением 7-((этил(4-фторфенил)амино)метил)-3-(3-метоксипропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого полутвердого вещества (7.9 мг, 15%). ЖХМС (ESI): М+H+ = 390.1; 1H NMR (300 MHz, CDCl3) δ 6.91-6.82 (m, 2H), 6.56-6.52 (m, 2H), 6.07 (s, 1H), 4.24 (s, 2H), 3.46-3.33 (m, 4H), 3.30 (s, 3H), 3.21-3.18 (m, 2H), 2.29 (s, 3H), 1.93-1.85 (m, 2H), 1.22-1.19 (m, 3H).
[0287] Следующий пример получили аналогично тому, как это описано для Примеров 13.1 и 13.2:
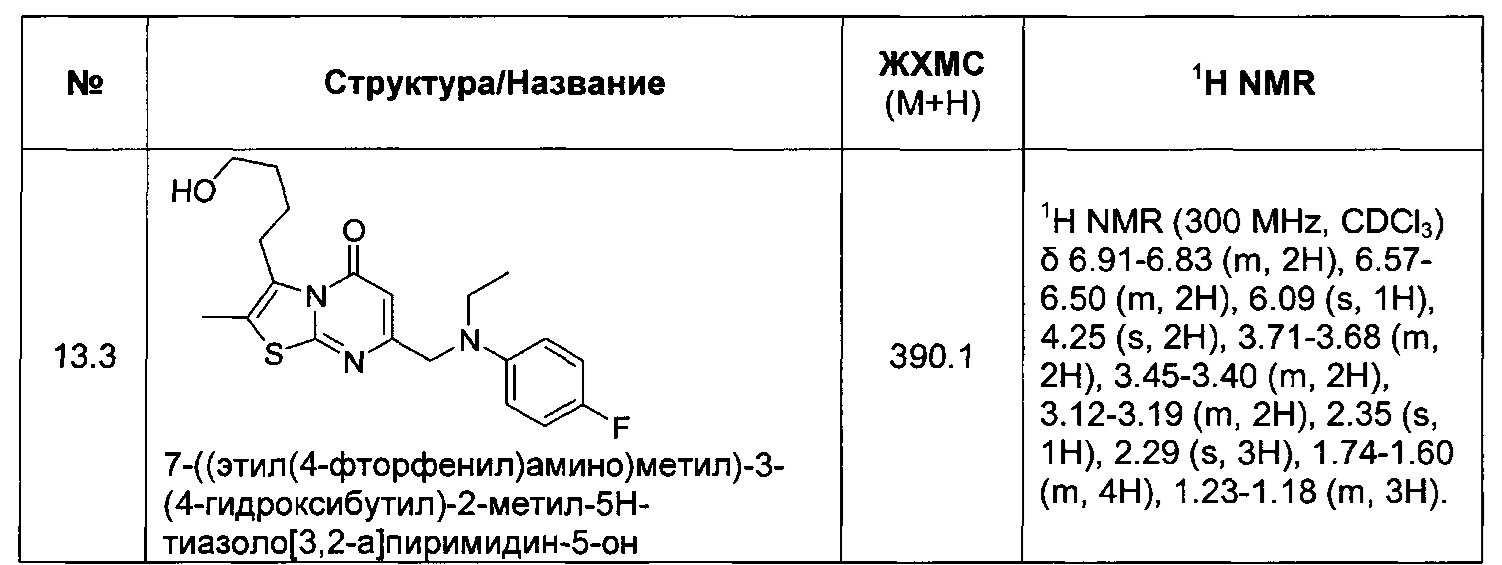
Пример 13.4: 7-((этил(4-фторфенил)амино)метил)-3-(2-гидроксиэтил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
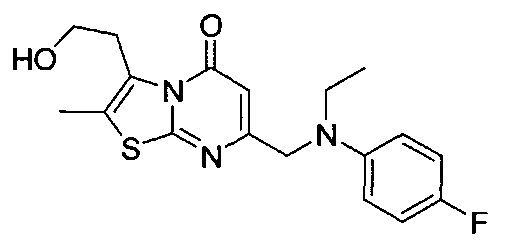
Стадия 1: 3-[(Е)-2-этоксивинил]-7-[(N-этил-4-фтор-анилино)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
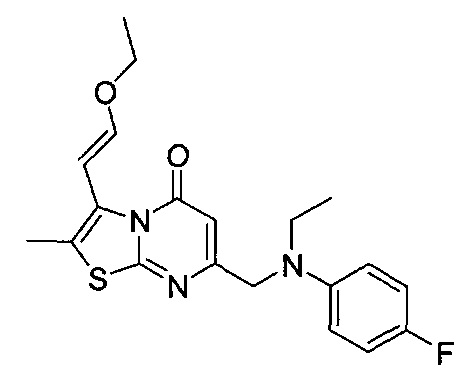
[0288] К раствору 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (50 мг, 0.13 ммоль) в 1,4-диоксане/воде (0.6/0.2 мл) добавили 2-[(Е)-2-этоксиэтенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан (40 мг, 0.20 ммоль), фосфат калия (80 мг, 0.38 ммоль) и тетракис(трифенилфосфин)палладий (20 мг, 0.02 ммоль). Получившийся раствор перемешивали в течение 3 ч при 90°С в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/5) с получением соединения, указанного в заголовке, в виде светло-желтого осадка (16.9 мг, 35%). ЖХМС (ESI): M+H+ = 388.0; 1H NMR: (300 MHz, CDCl3): δ 6.93-6.85 (m, 2H), 6.60-6.51 (m, 2H), 6.52-5.48 (m, 1H), 6.34-6.19 (m, 1H), 6.10 (s, 1H), 4.27 (s, 2H), 3.99-3.92 (m, 2H), 3.53-3.42 (m, 2H), 2.38 (s, 3Н), 1.38-1.35 (m, 3H), 2.23-2.19 (m, 3H).
Стадия 2: 2-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)ацетальдегид.
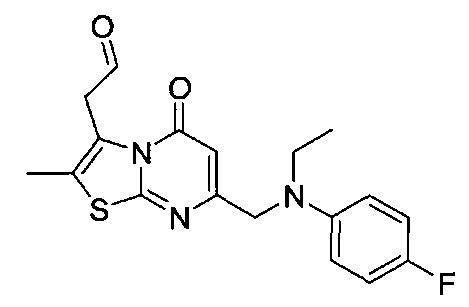
[0289] К раствору (Е)-3-(2-этоксивинил)-7-((этил(4-фторфенил)амино)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в ацетоне добавили 3 н хлороводород (15 мл). Получившийся раствор кипятили с обратным холодильником в течение 3 ч на масляной бане. Значение рН раствора довели до рН 8 насыщенным водным раствором бикарбоната натрия. Смесь экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 2-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)ацетальдегида в виде светло-желтого масла (180 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 3: 7-((этил(4-фторфенил)амино)метил)-3-(2-гидроксиэтил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
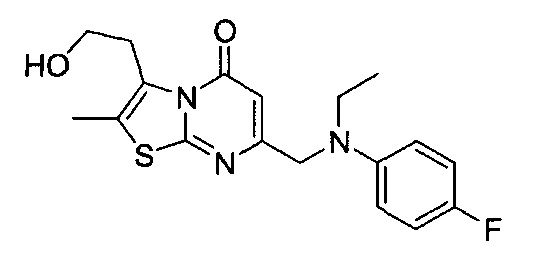
[0290] К раствору 2-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)ацетальдегида (180 мг, 0.50 ммоль) в метаноле (10 мл) добавили борогидрид натрия (40 мг, 1.06 ммоль) при 0°С. После перемешивания в течение ночи при комнатной температуре, реакционную смесь погасили насыщенным водным хлоридом аммония (20 мл). Получившийся раствор экстрагировали дихлорметаном (3×50 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (30/1) с получением 7-((этил(4-фторфенил)амино)метил)-3-(2-гидроксиэтил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (90 мг, 50%). ЖХМС (ESI): M+H+ = 362.0; 1H NMR (300 MHz, CDCl3) δ 6.90-6.84 (m, 2H), 6.55-6.50 (m, 2H), 6.14 (s, 1H), 4.26 (s, 2H), 3.89-3.87 (m, 2H), 3.47-3.39 (m, 4H), 2.32 (s, 3H), 1.21-1.18 (m, 3Н).
Пример 13.5: 7-[[этил(4-фторфенил)амино]метил]-3-(2-метоксиэтил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
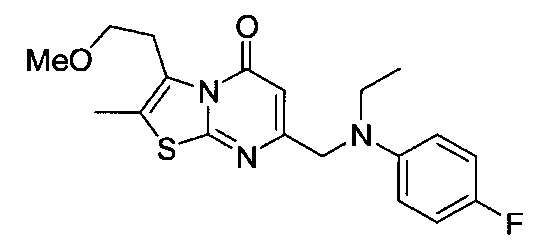
[0291] К раствору 7-[[этил(4-фторфенил)амино]метил]-3-(2-гидроксиэтил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.14 ммоль) в тетрагидрофуране (5 мл) добавили гидрид натрия (11 мг, 0.46 ммоль) при 0°С. После перемешивания 0.5 ч при комнатной температуре, в реакционную смесь добавили йодометан (11 мг, 0.08 ммоль). После перемешивания 3 ч при комнатной температуре, реакционную смесь погасили водой со льдом (20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/3) с получением 7-[[этил(4-фторфенил)амино]метил]-3-(2-метоксиэтил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серого полутвердого вещества (11.5 мг, 22%). ЖХМС (ESI): М+Н+ = 376.0; 1H NMR (300 MHz, CDCl3) δ 6.94-6.85 (m, 2H), 6.60-6.54 (m, 2H), 6.10 (s, 1H), 4.28 (s, 2H), 3.69-3.66 (m, 2H), 3.49-3.39 (m, 4H), 3.31 (s, 3Н), 2.33 (s, 3Н), 1.23-1.21 (m, 3H).
Пример 13.6: 3-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропанамид.
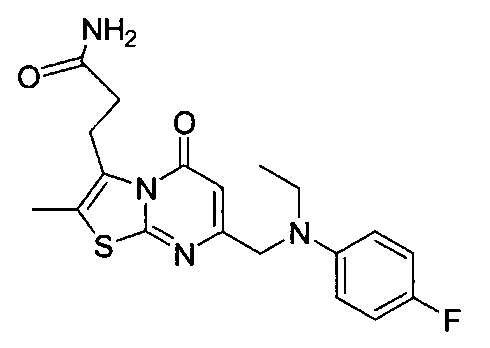
[0292] К раствору этил 3-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропаноата (из Примера 13.1, Стадия 2) (50 мг, 0.12 ммоль) в 10 мл закрытой пробирке добавили 1 М аммоний в метаноле (3 мл, 3 ммоль). Реакционную смесь закрыли и перемешивали в течение ночи при 80°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (20/1) с получением 3-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропанамида в виде серо-белого осадка (10 мг, 21%). ЖХМС (ESI): M+H+ = 389.0; 1H NMR (300 MHz, CDCl3) δ 6.97-6.92 (m, 2H), 6.74-6.72 (m, 2H), 6.19 (s, 1H), 4.32 (s, 2H), 3.54-3.43 (m, 4H), 2.60-2.57 (m, 2H), 2.38 (s, 3Н), 1.27-1.24 (m, 3H).
Пример 13.7: 3-[7-[(N-этил-4-фтор-анилино)метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]пропаннитрил.
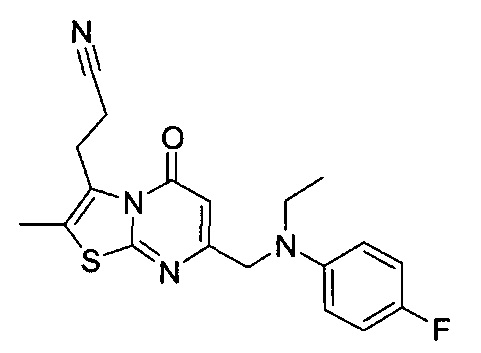
[0293] К раствору 3-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропанамида (50 мг, 0.13 ммоль) и триэтиламина (30 мг, 0.30 ммоль) в дихлорметане (10 мл) добавили (трифторметан)сульфонила трифторметансульфонат (40 мг, 0.14 ммоль) при 0°С и затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь погасили насыщенным водным бикарбонатом натрия, экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/1) с получением 3-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропаннитрила в виде серо-белого осадка (14 мг, 29%). ЖХМС (ESI): М+Н+ = 370.9; 1Н NMR (300 MHz, CDCl3) δ 6.92-6.86 (m, 2H), 6.65-6.60 (m, 2H), 6.13 (s, 1H), 4.27 (s, 2H), 3.49-3.41 (m, 4H), 2.87-2.86 (m, 2H), 2.42 (s, 3H), 1.22-1.19 (m, 3H).
[0294] Следующее соединение получили с использованием способов, аналогичных описанным выше
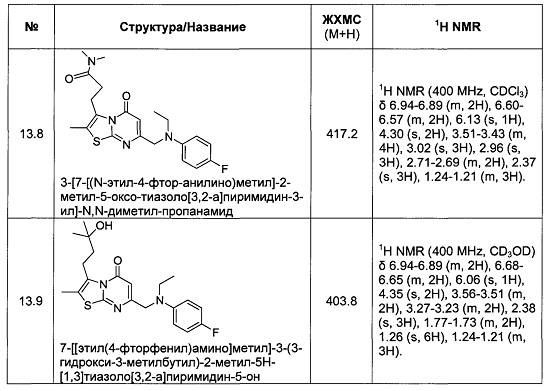
Способ 14:
Пример 14.1: 2-[7-[(N-этил-4-фтор-анилино)метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]циклопропанкарбоксамид.
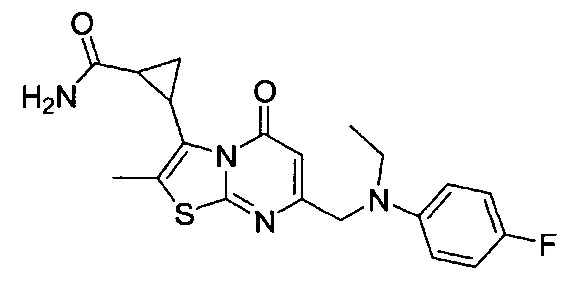
Стадия 1: этил 2-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксилат.
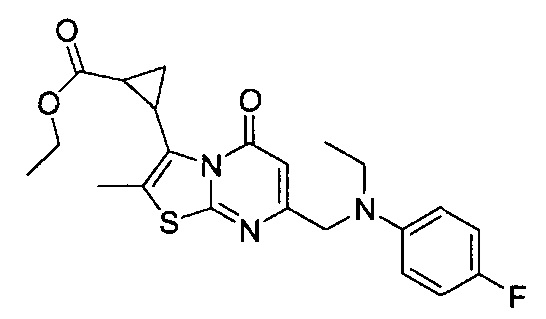
[0295] В пробирку для микроволновой печи с раствором 3-бромо-7-[[этил(4-фторфенил)амино]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 5.1, Стадия 1) (200 мг, 0.51 ммоль) в ацетонитриле/воде (5/1 мл) добавили этил 2-(4,4,5,5-тетраметил-1,3-диоксолан-2-ил)циклопропан-1-карбоксилат (из Примера 4.8, Стадия 1) (900 мг, 2.55 ммоль), карбонат калия (279 мг, 2.04 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (19 мг, 0.025 ммоль). Получившийся раствор перемешивали в течение 1 ч при 120°С. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением этил 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксилата (80 мг, 37%) в виде желтого масла. ЖХМС (ESI): M+H+ = 430.1.
Стадия 2: 2-(7-((этил(4-фторфенил)амино)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоновая кислота.
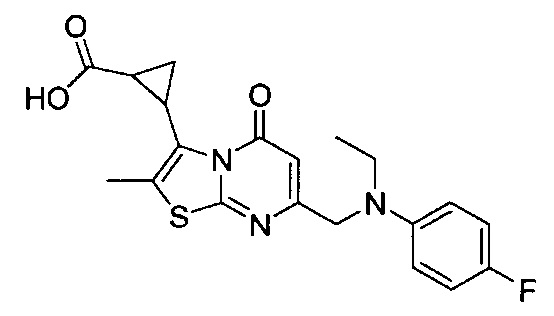
[0296] К раствору этил 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксилата (80 мг, 0.18 ммоль) в тетрагидрофуране/воде (20/3 мл) добавили гидроксид лития (22 мг, 0.90 ммоль). После перемешивания в течение ночи при комнатной температуре, значение рН раствора довели до рН 4-5 с помощью 1 н HCl. Реакционную смесь экстрагировали этилацетатом (200 мл), промыли солевым раствором, высушили над безводным сульфатом магния, сконцентрировали под вакуумом с получением 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоновой кислоты в виде желтого масла (80 мг). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): M+H+ = 402.1.
Стадия 3: 2-[7-[(N-этил-4-фтор-анилино)метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]циклопропанкарбоксамид.
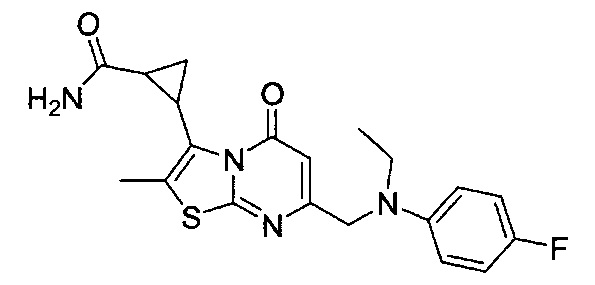
[0297] К раствору 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоновой кислоты (50 мг, 0.12 ммоль) в тетрагидрофуране (10 мл) добавили триэтиламин (25 мг, 0.24 ммоль), хлор(пропан-2-илокси)метанон (22.8 мг, 0.19 ммоль). Реакционный раствор перемешивали в течение 10 мин при комнатной температуре. В реакционную смесь добавили 1 М аммоний в метаноле (1 мл, 1 ммоль). Реакционный раствор перемешивали в течение дополнительных 20 мин при комнатной температуре. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (20/1) с получением 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксамида в виде желтого осадка (35 мг, 70%). ЖХМС (ESI): M+H+ = 400.9; 1H NMR (400 MHz, CD3OD) δ 6.86-6.83 (m, 2H), 6.67-6.59 (m, 2H), 6.01 (s, 1H), 4.28 (s, 2H), 3.54-3.41 (m, 2H), 2.63-2.61 (m, 1H), 2.38 (s, 3H), 1.87-1.81 (m, 1H), 1.58-1.52 (m, 1H), 1.28-1.15 (m, 4H).
Пример 14.2: 2-[7-[(N-этил-4-фтор-анилино)метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]циклопропанкарбоксамид.
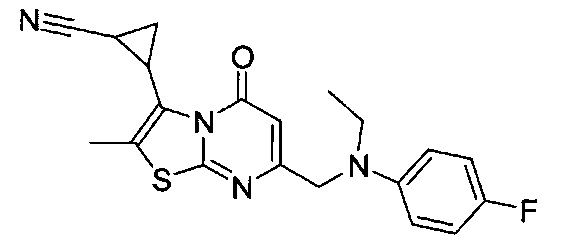
[0298] К раствору 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксамида (40 мг, 0.10 ммоль) в тетрагидрофуране (10 мл) добавили трифторуксусный ангидрид (105 мг, 0.50 ммоль) и триэтиламин (60.6 мг, 0.60 ммоль). Реакционный раствор затем перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом (100 мл). Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством препаративной ВЭЖХ с получением 2-(7-[[этил(4-фторфенил)амино]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбонитрила в виде серо-белого осадка (5.4 мг, 14%). ЖХМС (ESI): М+Н+ = 383.0; 1H NMR (400 MHz, CD3OD) 6.94-6.90 (m, 2H), 6.69-6.56 (m, 2H), 6.11 (s, 1H), 4.34 (s, 2H), 3.56-3.51 (m, 2H), 2.94-2.90 (m, 1H), 1.99-1.94 (m, 1H), 1.80-1.76 (m, 1H), 1.60-1.55 (m, 1H), 1.25-1.21 (m, 3H)
Способ 15:
Пример 15.1: 7-((5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(2-{гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
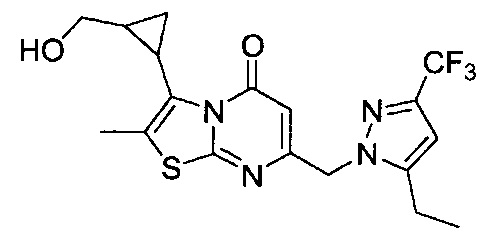
Стадия 1: 1,1,1-трифторгексан-2,4-дион
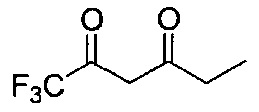
[0299] К раствору этил 2,2,2-трифторацетата (4.20 г, 29.6 ммоль) в тетрагидрофуране (120 мл) добавили (трет-бутокси)калий (2.70 г, 24.1 ммоль), бутан-2-он (1.44 г, 20.0 ммоль). Получившийся раствор перемешивали в течение 12 ч при комнатной температуре. Затем реакционную смесь погасили водой, экстрагировали этилацетатом (3×100 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом с получением 1,1,1-трифторгексан-2,4-диона (600 мг, 18%) в виде желтого осадка. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 5-этил-3-(трифторметил)-1Н-пиразол.
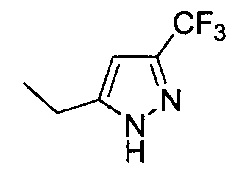
[0300] К раствору 1,1,1-трифторгексан-2,4-диона (350 мг, 2.08 ммоль) в этаноле (20 мл) добавили моногидратгидразин (135 мг, 2.19 ммоль). Получившийся раствор перемешивали в течение 12 ч при 80°С на масляной бане. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (100:1) с получением 5-этил-3-(трифторметил)-1Н-пиразола (140 мг, 41%) в виде серо-белого осадка.
Стадия 3: 3-бромо-7-((5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
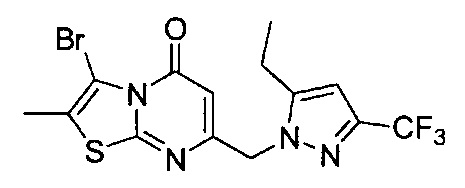
[0301] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (165 мг, 0.56 ммоль) в CH3CN (20 мл) добавили йодид калия (46 мг, 0.28 ммоль), карбонат калия (155 мг, 1.12 ммоль) и 5-этил-3-(трифторметил)-1Н-пиразол (110 мг, 0.67 ммоль). Получившийся раствор перемешивали в течение 12 ч при 80°С на масляной бане. Получившуюся смесь погасили водой (10 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1:2.5) с получением 3-бромо-7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (150 мг, 63%) в виде светло-желтого осадка.
Стадия 4: этил 2-(7-((5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксилат.
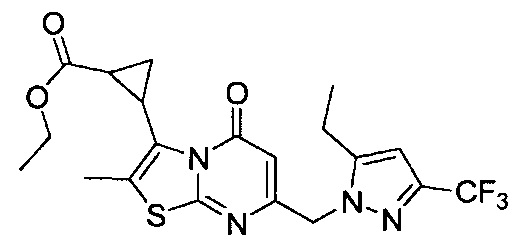
[0302] К раствору 3-бромо-7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.8, Стадия 1) (160 мг, 0.38 ммоль) в CH3CN (2 мл) добавили карбонат калия (166 мг, 1.20 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (30 мг, 0.04 ммоль), этил 2-(4,4,5,5-тетраметил-1,3-диоксолан-2-ил)циклопропан-1-карбоксилат (184 мг, 0.76 ммоль) и воду (0.6 мл). Реакционную смесь облучали в микроволновой печи в течение 1 ч при 120°С. Получившуюся смесь погасили водой (10 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2) с получением 2-(7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксилата (50 мг, 29%) в виде серо-белого осадка.
Стадия 5: 2-(7-((5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоновая кислота.
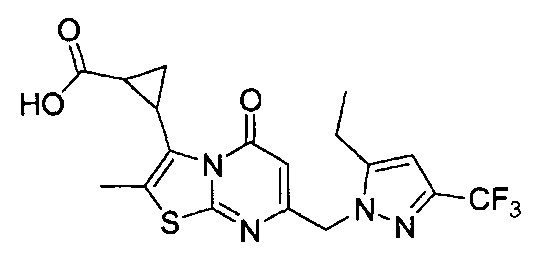
[0303] К раствору 2-(7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоксилата (50 мг, 0.11 ммоль) в тетрагидрофуране (15 мл) добавили раствор гидроксида лития (8 мг, 0.33 ммоль) в воде (1 мл). Получившийся раствор перемешивали в течение 12 ч при комнатной температуре. Значение рН раствора довели до рН 5 с помощью водной соляной кислоты. Получившийся раствор экстрагировали 3×20 мл этилацетата, промыли солевым раствором, высушили над безводным сульфатом магния, и сконцентрировали под вакуумом с получением 2-(7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоновой кислоты (40 мг, неочищенный) в виде красноватого осадка.
Стадия 6: 7-((5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
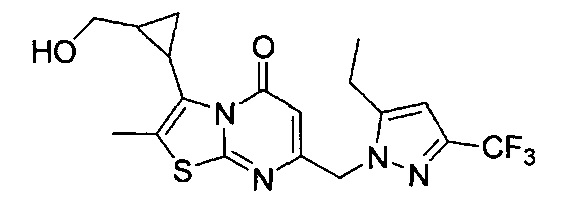
[0304] К раствору 2-(7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбоновой кислоты (30 мг, 0.07 ммоль) в тетрагидрофуране (10 мл) добавили триэтиламин (14 мг, 0.14 ммоль) и хлор(пропан-2-илокси)метанон (17 мг, 0.14 ммоль). Получившийся раствор перемешивали в течение 2 ч при комнатной температуре. Затем добавили раствор борогидрида натрия (8 мг, 0.21 ммоль) в воде (0.5 мл). Получившийся раствор перемешивали в течение 12 ч при комнатной температуре. Затем реакционную смесь погасили посредством добавления насыщенного водного раствора хлорида аммония, экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1.5) с получением 7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (9.4 мг, 32%) в виде светло-желтого осадка. ЖХМС (ESI): [M+H]+ 413.1; 1H NMR (300 MHz, CD3OD) δ 6.51 (s, 1H), 5.67 (s, 1H), 5.25 (s, 2H), 3.64-3.54 (m, 2H), 2.77-2.69 (m, 2H), 2.42 (s, 3H), 2.15-2.11 (m, 1H), 1.45-1.29 (m, 4H), 1.27-1.12 (m, 2H).
[0305] Следующие примеры получили аналогично тому, как это описано для Примера 15.1:
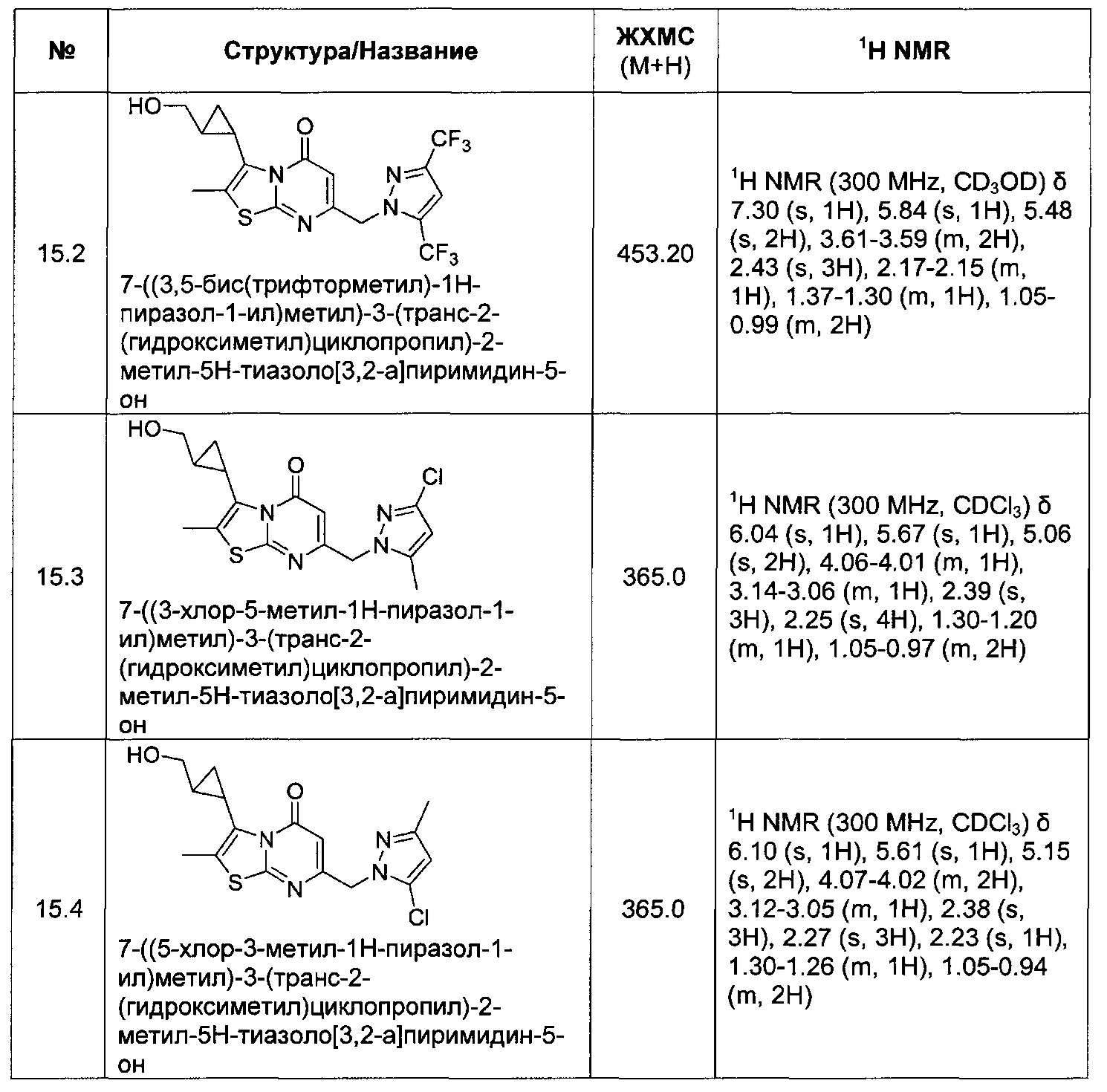
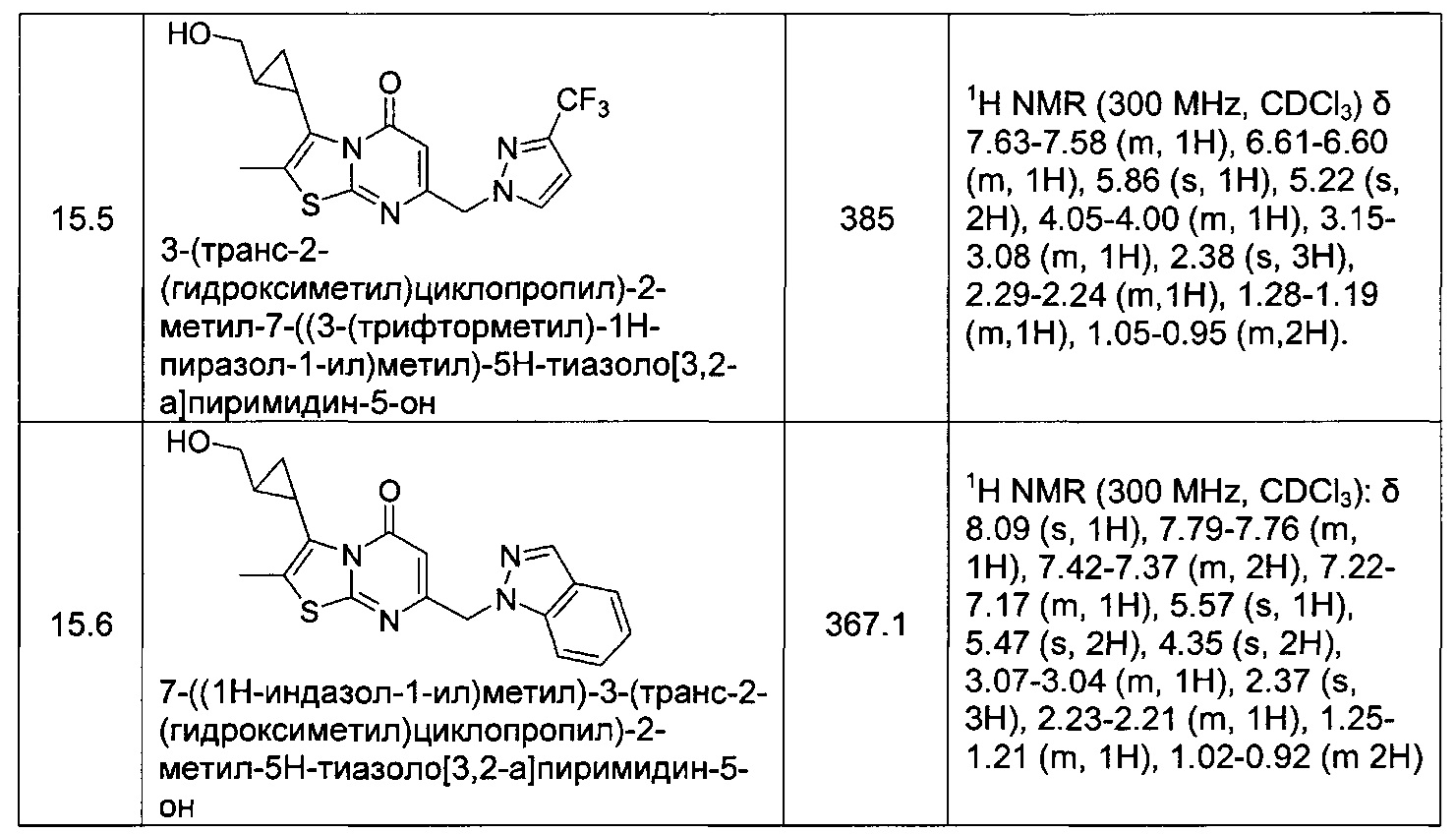
Пример 15.7 и 15.8: 7-((5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
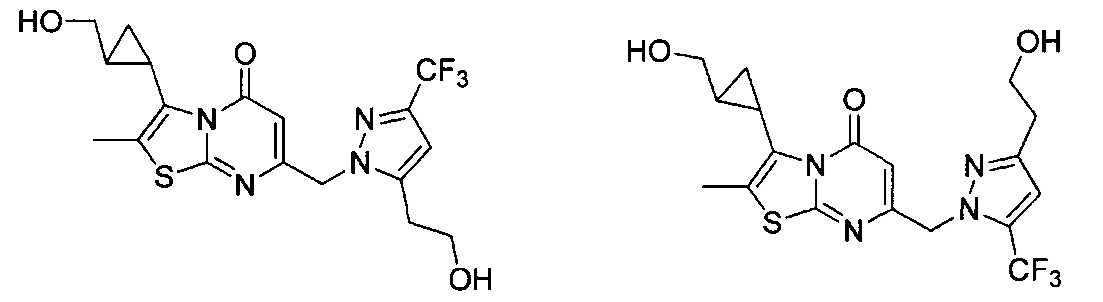
Стадия 1: ((бут-3-инилокси)метил)бензол.
[0306] Смесь бут-3-ин-1-ола (3.0 г, 42.8 ммоль), гидрида натрия (3.0 г, 125.0 ммоль), (бромметил)бензола (7.2 г, 42.1 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение ночи. Получившуюся смесь экстрагировали дихлорметаном, промыли солевым раствором, промыли солевым раствором и сконцентрировали под вакуумом с получением неочищенного [(бут-3-ин-1-илокси)метил]бензола (2.6 г, 38%) в виде желтого масла. 1H NMR (300 MHz, CDCl3) δ 7.30-7.27 (m, 5H), 4.81 (s, 2H), 3.64-3.59 (m, 2H), 2.55-2.49 (m, 2H), 2.02-2.00 (m, 1H).
Стадия 2: 6-(бензилокси)-1,1,1-трифторгекс-3-ин-2-он.
[0307] К раствору [(бут-3-ин-1-илокси)метил]бензола (1.00 г, 6.24 ммоль) в тетрагидрофуране (20 мл) добавили бутиллитий (2.5 М в гексанах; 3.0 мл, 7.50 ммоль) по каплям при -78°С. Получившийся раствор перемешивали в течение 0.5 ч при -78°С и добавили 2,2,2-трифторэтил 2,2,2-трифторацетат (1.47 г, 7.50 ммоль), трифторборана эфират (1.15 г, 7.50 ммоль) в реакционную смесь и перемешивали в течение дополнительных 3 ч при -78°С. Получившуюся смесь промыли солевым раствором, экстрагировали дихлорметаном (3×100 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии с помощью смеси этилацетат/петролейный эфир (1:100) с получением 6-(бензилокси)-1,1,1-трифторгекс-3-ин-2-она (0.6 г, 38%) в виде желтого масла. 1H NMR (300 MHz, CDCl3) δ 7.40-7.27 (m, 5H), 4.58 (s, 2H), 3.72-3.68 (m, 2H), 2.83-2.79 (m, 2H).
Стадия 3: 5-(2-(бензилокси)этил)-3-(трифторметил)-1Н-пиразол.
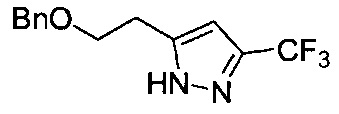
[0308] Смесь 6-(бензилокси)-1,1,1-трифторгекс-3-ин-2-она (0.6 г, 2.34 ммоль) в моногидратгидразине (0.5 г, 10 ммоль) и этаноле (10 мл) перемешивали при 85°С в течение 3 ч. Получившуюся смесь экстрагировали дихлорметаном (3×100 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 5-[2-(бензилокси)этил]-3-(трифторметил)-1Н-пиразола (0.6 г, 95%) в виде желтого масла. 1H NMR (300 MHz, CDCl3) δ 7.40-7.29 (m, 5H), 6.32 (s, 1H), 4.57 (s, 2H), 3.76-3.72 (m, 2H), 2.96-2.92 (m, 2H).
Стадия 4: 2-(3-(трифторметил)-1Н-пиразол-5-ил)этанол.
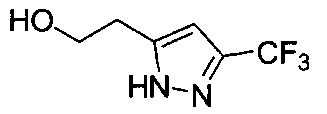
[0309] Смесь 5-[2-(бензилокси)этил]-3-(трифторметил)-1Н-пиразола (400 мг, 1.48 ммоль), палладия на угле (150 мг), O-(гидроксихлорил)оксиданола (0.01 мл) в метаноле (15 мл) и тетрагидрофуране (4 мл) перемешивали при комнатной температуре в течение 70 мин под водородом. Осадки отфильтровали и получившуюся смесь сконцентрировали под вакуумом с получением 2-[3-(трифторметил)-1Н-пиразол-5-ил]этан-1-ола (250 мг, 95%) в виде коричневого осадка. ЖХМС [М+Н]+ = 181.0.
Стадия 5: 3-бромо-7-((5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 3-бромо-7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
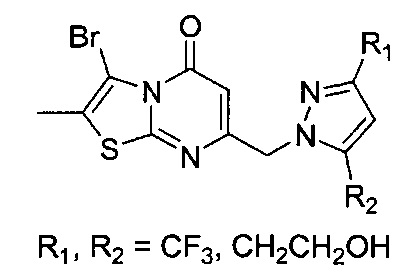
[0310] Смесь 2-(3-(трифторметил)-1Н-пиразол-5-ил)этан-1-ола (480 мг, 2.66 ммоль), 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (300 мг, 1.02 ммоль), карбоната калия (690 мг, 4.99 ммоль), и йодида калия (0.28 г, 1.70 ммоль) в CH3CN (15 мл) перемешивали при 85°С в течение 2 ч. Получившуюся смесь экстрагировали дихлорметаном (3×100 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством колоночной хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1:2) с получением смеси 3-бромо-7-[[5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она и 3-бромо-7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (470 мг, 40%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 437.0, 439.0.
Стадия 6: 7-((5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
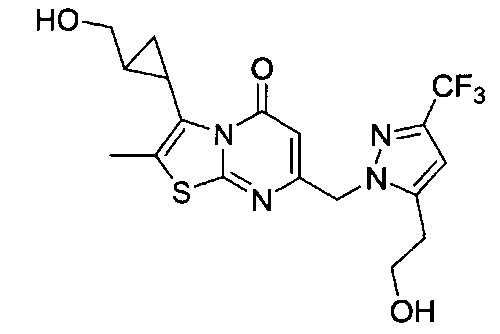 и
и 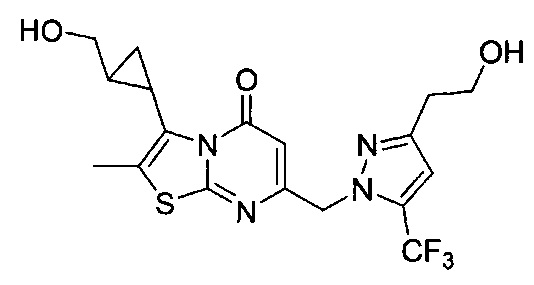
[0311] Смесь 3-бромо-7-[[5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 0.46 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорида (35 мг, 0.05 ммоль), карбоната натрия (100 мг, 0.94 ммоль), калия транс-2-(гидроксиметил)циклопропилтрифторбората (из Примера 4.1, Стадия 2) (160 мг, 0.90 ммоль) в CH3CN (6 мл) и H2O (2 мл) облучали микроволновым излучением в течение 1.5 ч при 120°С в закрытой пробирке. Получившуюся смесь экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством препаративной ВЭЖХ (Xselect CSH Prep C18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 0.03% NH3-H2O и MeCN (23.0% MeCN до 28.0% в течение 20 мин)) с получением 7-[[5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (19.7 мг, 10.2%) в виде белого осадка и 7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (4.3 мг, 2.2%).
[0312] Пример 15.7: 7-[[5-(2-гидроксиэтил)-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он. ЖХМС (ESI): [М+Н]+ = 429.1; 1H NMR (300 MHz, CDCl3) δ 6.46 (s, 1H), 5.81 (s, 1H), 5.24 (s, 2H), 4.04-3.93 (m, 1H), 3.91-3.89 (m, 2H), 3.13-3.06 (m, 1H), 2.94-2.90 (m, 4H), 2.38 (s, 3H), 2.27-2.21 (m, 1H), 1.27-1.16 (m, 1H), 1.01-0.90 (m, 2H).
[0313] Пример 15.8: 7-((3-(2-гидроксиэтил)-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он. ЖХМС (ESI): [М+Н]+ = 429.0; 1H NMR (300 MHz, CDCl3) δ 6.91 (s, 1H), 5.56 (s, 1H), 5.26 (s, 2H), 4.06-4.01 (m, 1H), 3.96-3.92 (m, 2H), 3.12-3.06 (m, 1H), 2.94-2.89 (m, 2H), 2.38 (s, 3H), 2.21-2.15 (m, 1H), 1.27-1.16 (m, 1H), 1.03-0.90 (m, 2H).
Пример 15.9 и 15.10: 7-((3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 7-((5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
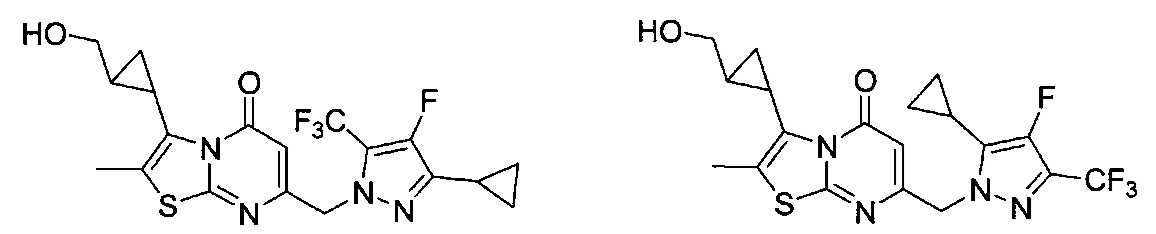
Стадия 1: 1-циклопропил-4,4,4-трифторбутан-1,3-дион.
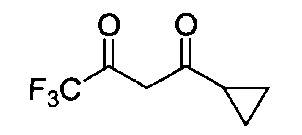
[0314] Смесь металлического натрия (276 мг, 12.0 ммоль) и этанола (20 мл) перемешивали в течение 20 минут при комнатной температуре. В реакционную смесь добавили 1-циклопропилэтан-1-он (1.42 мг, 0.0200 ммоль) и этил 2,2,2-трифторацетат (840 мг, 5.91 ммоль) и получившийся раствор перемешивали в течение 2 дней при комнатной температуре. Реакционную смесь погасили водой (50 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, и высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 1-циклопропил-4,4,4-трифторбутан-1,3-диона (737 мг, 69%) в виде бесцветного масла. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 3-циклопропил-5-(трифторметил)-1Н-пиразол.
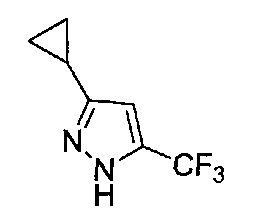
[0315] К раствору 1-циклопропил-4,4,4-трифторбутан-1,3-диона (400 мг, 2.22 ммоль) в этаноле (20 мл) добавили моногидратгидразина (132 мг, избыток) и получившийся раствор перемешивали в течение 2 дней при 80°С. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 2% метанола в дихлорметане с получением 3-циклопропил-5-(трифторметил)-1Н-пиразола (258 мг, 66%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н]+ = 177.0; 1H NMR (300 MHz, CDCl3) δ 6.27 (s, 1H), 2.08-1.95 (m, 1H), 2.77-2.64 (m, 2H), 1.11-1.02 (m, 2H).
Стадия 3: 5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол.
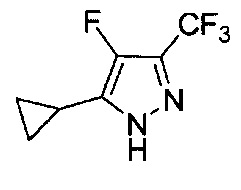
[0316] К раствору 5-циклопропил-3-(трифторметил)-1Н-пиразола (500 мг, 2.84 ммоль) в CH3CN (10 мл), поддерживаемую в инертной атмосфере азота, добавили Selectfluor® (1.0 г, 2.84 ммоль). Получившийся раствор перемешивали в течение 12 ч при 75°С. Получившуюся смесь затем сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 1% метанола в дихлорметане с получением 5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразола (280 мг, 51%) в виде желтого осадка. ЖХМС (ESI): [M+H]+ = 195.0; 1H NMR (300 MHz, CDCl3) δ 1.81 (m, 1H), 1.03 (m, 2H), 0.85 (m, 2H).
Стадия 4: 3-бромо-7-((3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 3-бромо-7-((5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
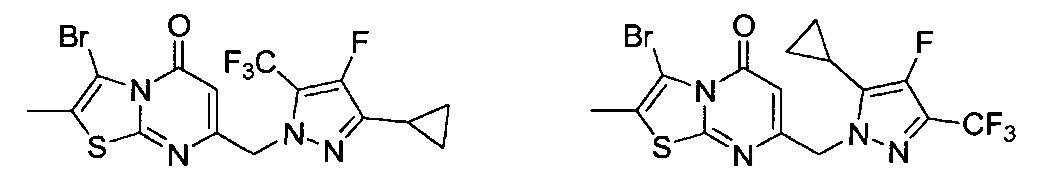
[0317] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (250 мг, 0.85 ммоль) в CH3CN (20 мл) добавили 5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол (200 мг, 1.03 ммоль), йодида калия (80 мг, 0.42 ммоль), карбонат калия (250 мг, 1.81 ммоль). Получившийся раствор перемешивали в течение 12 ч при 80°С. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:3) с получением 3-бромо-7-[[3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (100 мг, 20%) в виде светло-желтого осадка (ЖХМС (ESI): [М+Н]+ = 452.2) и 3-бромо-7-[[5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 50%) в виде светло-желтого осадка (ЖХМС (ESI): [М+H]+ = 452.0).
Стадия 5: 7-((3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он (Пример 15.9).
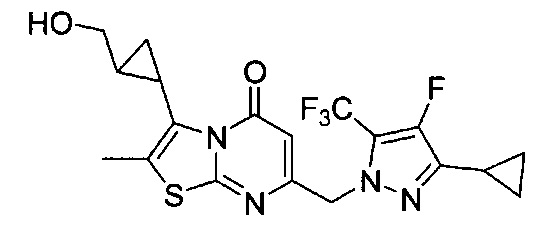
[0318] К раствору 3-бромо-7-[[3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (90 мг, 0.20 ммоль) в CH3CN (2 мл) в атмосфере азота, добавили карбонат натрия (43 мг, 0.41 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (30 мг, 0.04 ммоль), калия транс-2-(гидроксиметил)циклопропилтрифторборат (из Примера 4.1, Стадия 2) (140 мг, 0.79 ммоль) и воду (0.6 мл). Реакционную смесь нагревали при воздействии микроволнового излучения в течение 90 мин при 120°С. Реакционную смесь затем погасили водой (10 мл), экстрагировали этилацетатом (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с помощью смеси этилацетат/петролейный эфир (1:1), получив 7-[[3-циклопропил-4-фтор-5-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (10.5 мг, 12%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 442.9; 1H NMR (300 MHz, CD3OD) δ 5.65 (s, 1H), 5.18 (s, 1H), 5.21 (s, 2H), 3.59 (m, 2H), 2.48 (s, 3H), 2.18 (m, 1H), 1.90 (m, 1H), 1.34 (m, 2H), 0.98 (m, 3H), 0.84 (m, 2H).
Стадия 6: 7-((5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он (Пример 15.10).
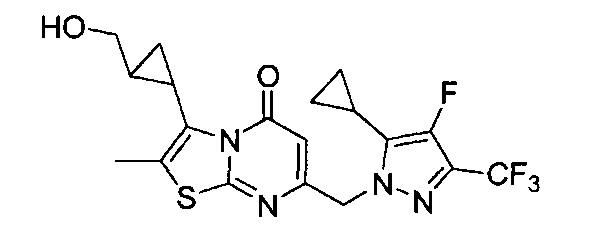
[0319] В 10-мл закрытую пробирку, продутую и поддерживаемую в инертной атмосфере азота, поместили 3-бромо-7-[[5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он (100 мг, 0.22 ммоль), ацетонитрил (2 мл), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (34 мг, 0.05 ммоль), карбонат натрия (48 мг, 0.45 ммоль), калия транс-2-(гидроксиметил)циклопропилтрифторборат (из Примера 4.1, Стадия 2) (153 мг, 0.86 ммоль) и воду (0.6 мл). Реакционную смесь облучали микроволновым излучением в течение 90 мин при 120°С. Получившийся раствор экстрагировали этилацетатом (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1), с получением 7-[[5-циклопропил-4-фтор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (18.5 мг, 19%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н]+ = 443.0; 1H NMR (300 MHz, CD3OD) δ 5.85 (s, 1H), 5.38 (s, 2H), 3.65 (m, 2H), 2.43 (s, 3H), 2.12 (m, 1H), 1.80 (m, 1Н), 1.32 (m, 2H), 0.99 (m, 4H), 0.85 (m, 2H).
[0320] Следующие примеры получили аналогично тому, как это описано для Примера 15.7-15.10:
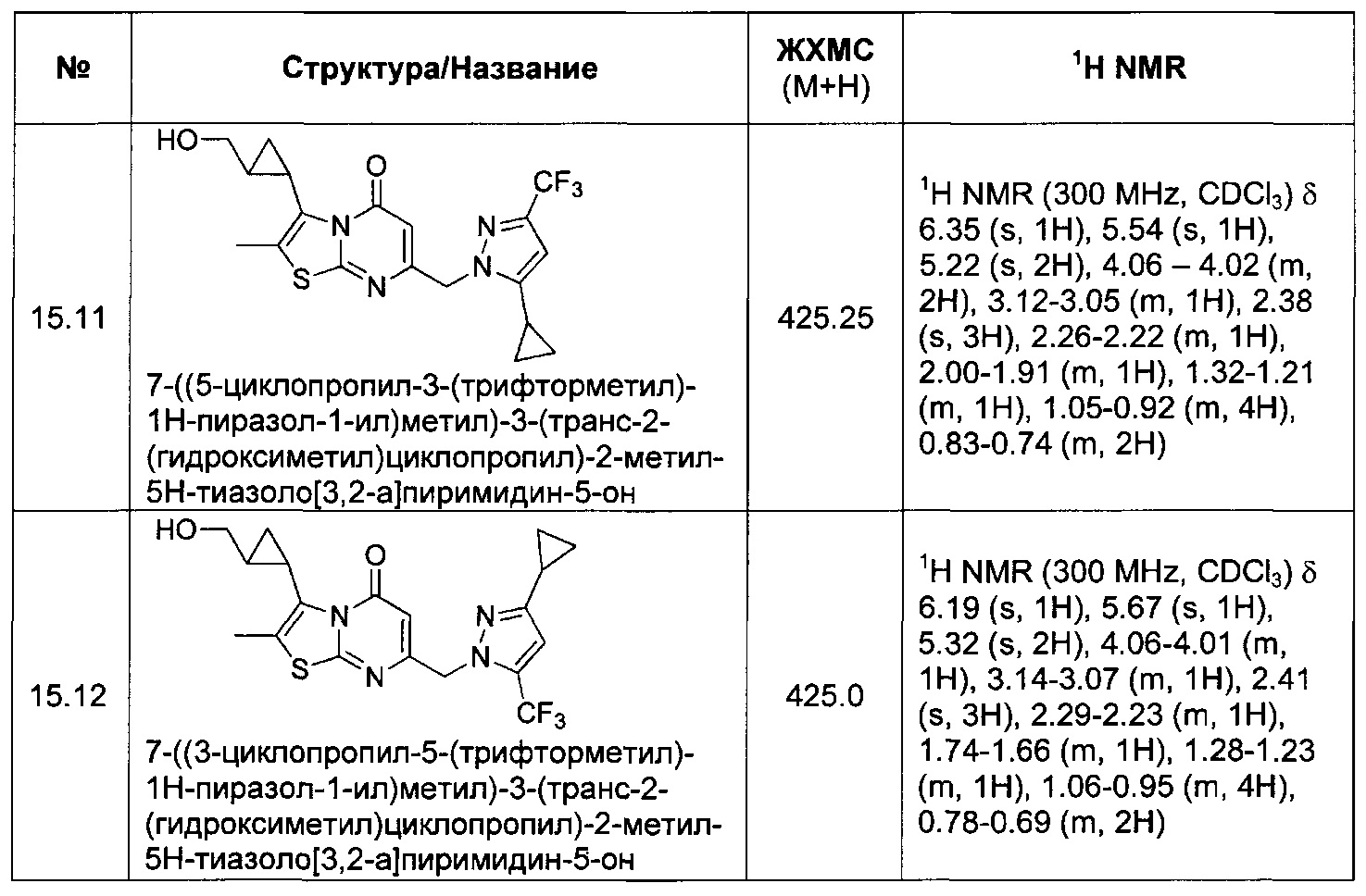
Примеры 15.13, 15.14, 15.15, и 15.16: 7-[(5-циклопропил-3-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (энантиомеры 1 и 2) и 7-[(3-циклопропил-5-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (энантиомеры 1 и 2).
[0321] Примеры 15.13, 15.14, 15.15 и 15.16 получили способом, аналогичным 15.7, где 2-[3-(трифторметил)-1Н-пиразол-5-ил]этан-1-ол заменили на 5-циклопропил-3-метил-1Н-пиразол на Стадии 5. В соответствии с методикой кросс-сочетания на Стадии 6, неочищенный продукт очистили посредством препаративной ВЭЖХ (Колонка, XBridge Prep C18 OBD Колонка, 19*150 мм, 5 мкм; подвижная фаза, CH3CN и вода с 0.5% NH3H2O (35% CH3CN до 45% в течение 10 мин); Детектор, УФ 254/220 нм) с получением смеси рацемического 7-[(5-циклопропил-3-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-она и рацемического 7-[(3-циклопропил-5-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-она (60 мг, 70%) в виде белого осадка. Этот материал очистили с помощью хиральной ВЭЖХ (Колонка, CHIRALCEL, OJ-H (2×25 см, 5 мкм); подвижная фаза, Нех : EtOH = 85:15, 25 минут, скорость потока, 20 мл/мин; Детектор, УФ 254/220 нм) с получением четырех изомеров:
[0322] Пример 15.13: 7-[(5-циклопропил-3-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (пик 1, энантиомер 1). Время задержки = 8.2 мин; Выход = 4.2 мг, 5.0%; ЖХМС (ESI): M+H+ = 271.1; 1H NMR (300 MHz, CDCl3) δ 5.75 (s, 1H), 5.68 (s, 1H), 5.31 (s, 2H), 4.06-3.98 (m, 2H), 3.15-3.03 (m, 1H), 2.37 (s, 3H), 2.28-2.20 (m, 4H), 1.63-1.57 (m, 1H), 1.23-1.13 (m, 1H), 1.02-0.83 (m, 4H), 0.70-0.61 (m, 2H).
[0323] Пример 15.14: 7-[(5-циклопропил-3-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (пик 2, энантиомер 2). Время задержки = 10 мин; Выход = 2.8 мг, 3.3%; ЖХМС (ESI): M+H+ = 271.1; 1H NMR (300 MHz, CDCl3) δ 5.75 (s, 1H), 5.68 (s, 1H), 5.31 (s, 2H), 4.06-3.98 (m, 2H), 3.15-3.03 (m, 1H), 2.37 (s, 3H), 2.28-2.20 (m, 4H), 1.63-1.57 (m, 1H), 1.23-1.13 (m, 1H), 1.02-0.83 (m, 4H), 0.70-0.61 (m, 2H).
[0324] Пример 15.15: 7-[(3-циклопропил-5-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (пик 3, энантиомер 1). Время задержки = 14.8 мин; Выход = 6.9 мг, 8.2%; ЖХМС (ESI): M+H+ = 271.1; 1H NMR (300 MHz, CDCl3) δ 5.75 (s, 1H), 5.57 (s, 1H), 5.08 (s, 2H), 4.04-4.00 (m, 2H), 3.12-3.05 (m, 1H), 2.37 (s, 3H), 2.28-2.19 (m, 4H), 1.94-1.86 (m, 1H), 1.23-1.11 (m, 1H), 1.02-0.86 (m, 4H), 0.71-0.63 (m, 2H).
[0325] Пример 15.16: 7-[(3-циклопропил-5-метил-пиразол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он (пик 4, энантиомер 2). Время задержки = 17.6 мин; Выход = 14.6 мг, 17.4%; ЖХМС (ESI): М+Н+ = 271.1; 1H NMR (300 MHz, CDCl3) δ 5.75 (s, 1H), 5.57 (s, 1H), 5.08 (s, 2H), 4.04-4.00 (m, 2H), 3.12-3.05 (m, 1H), 2.37 (s, 3H), 2.28-2.19 (m, 4H), 1.94-1.86 (m, 1H), 1.23-1.11 (m, 1H), 1.02-0.86 (m, 4H), 0.71-0.63 (m, 2H).
[0326] Следующие примеры получили способом, аналогичным предшествующим примерам:
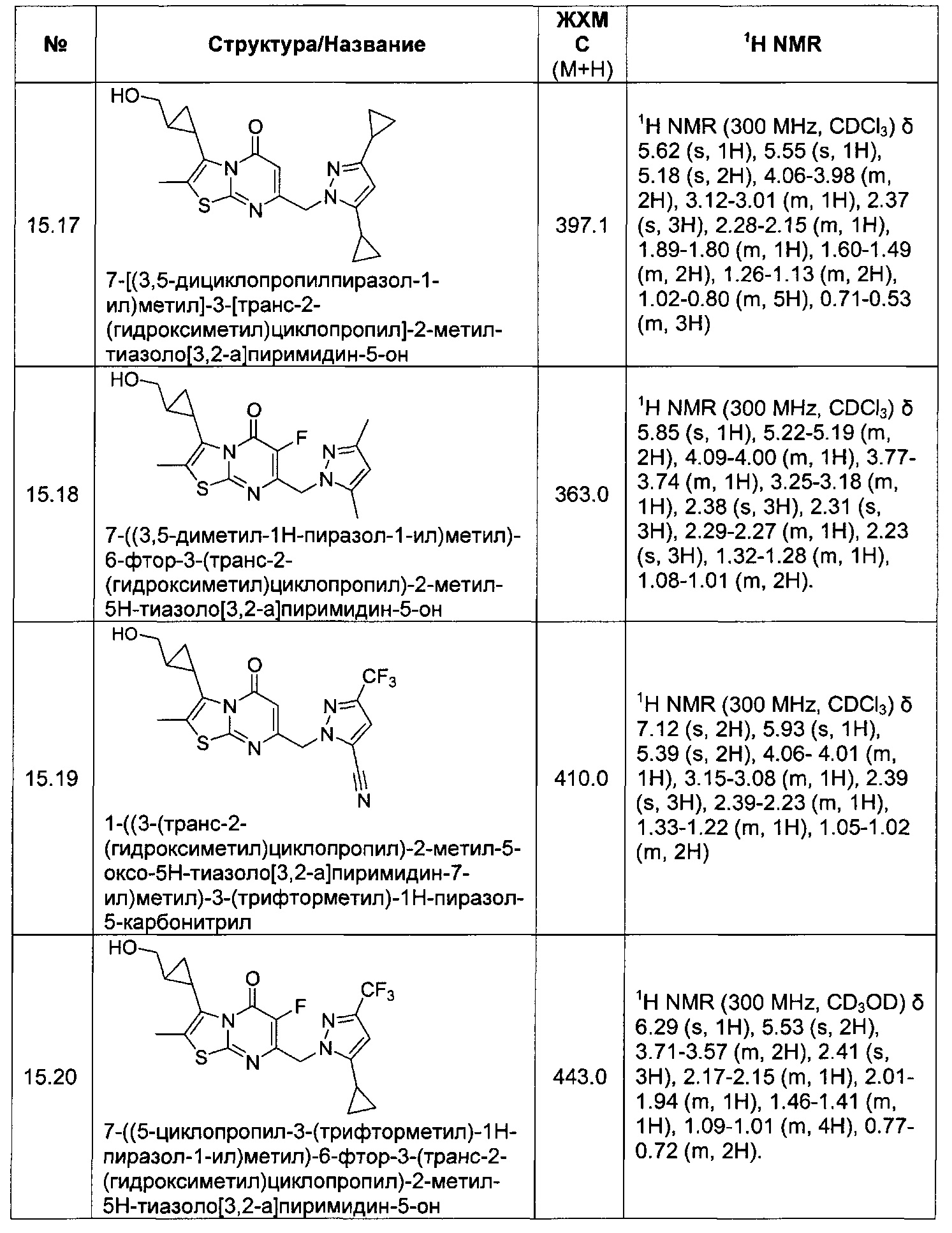
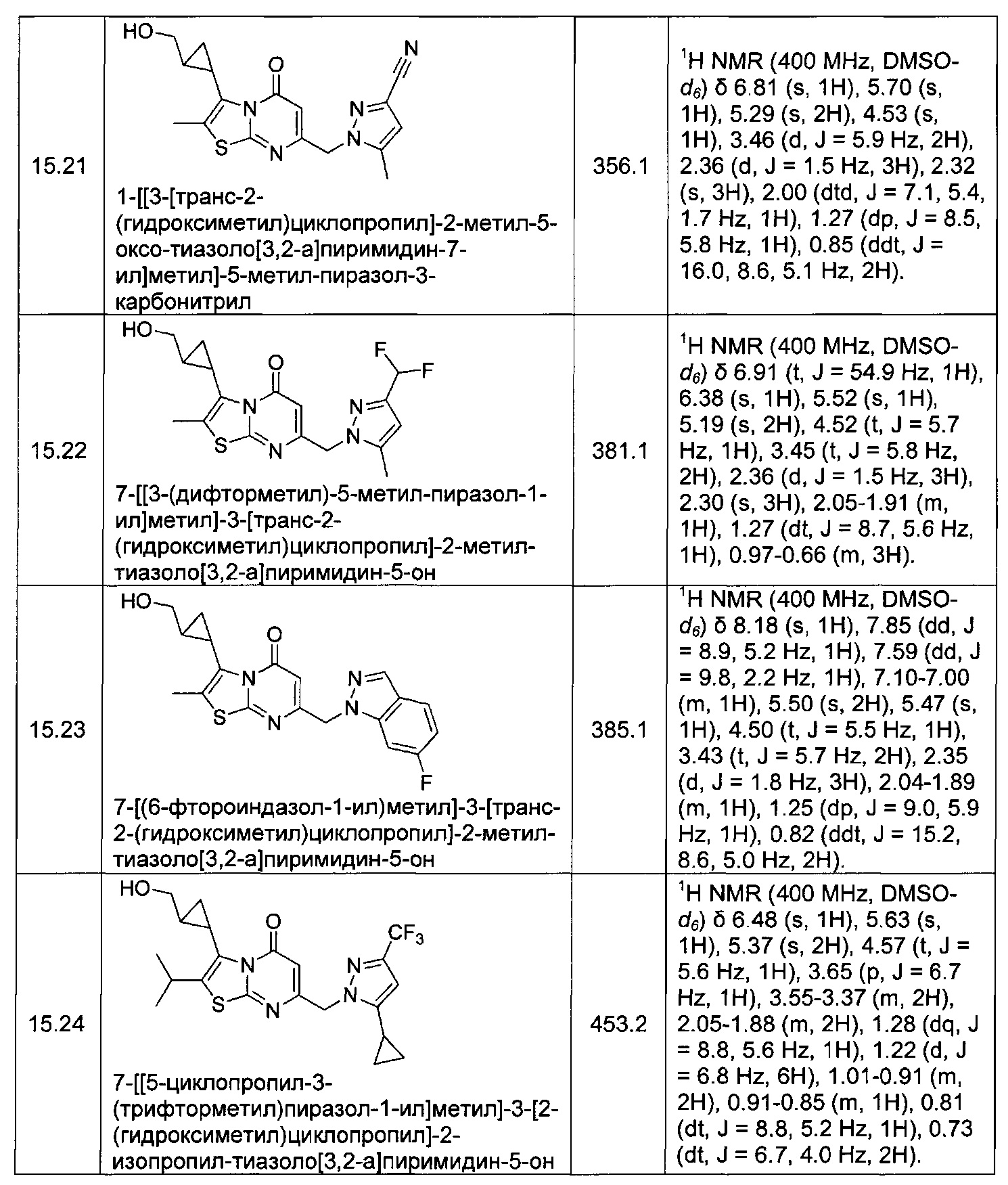
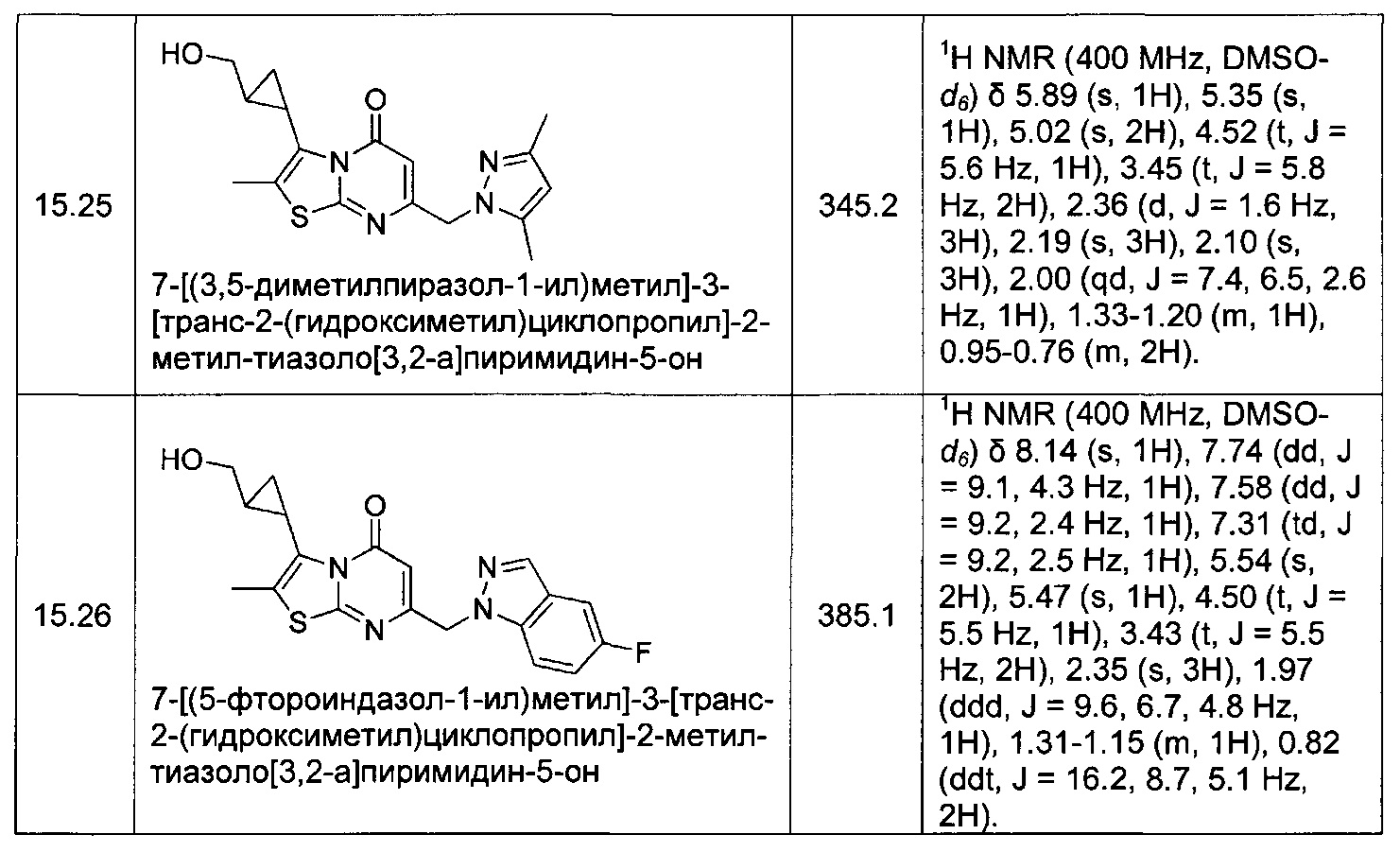
Пример 15.27: 5-этил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-3-(пиримидин-5-ил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
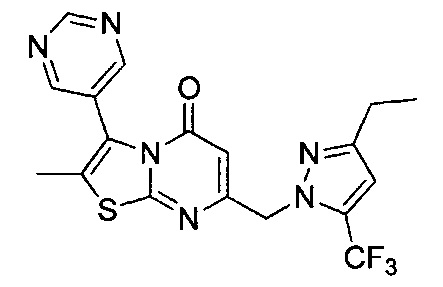
[0327] К раствору 3-бромо-7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 15.1, Стадия 3) (80 мг, 0.19 ммоль), 1,4-диоксана (2 мл), фосфата калия (80 мг, 0.38 ммоль), тетракис(трифенилфосфин)палладия (22 мг, 0.02 ммоль) и воды (0.2 мл) в 1,4-диоксане (2 мл) в атмосфере азота, добавили (пиримидин-5-ил)бороновую кислоту (47 мг, 0.38 ммоль). Получившийся раствор перемешивали в течение 3 ч при 90°С на масляной бане. Получившуюся смесь погасили водой (10 мл), и экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1) с получением 7-[[5-этил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-3-(пиримидин-5-ил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (18.9 мг, 24%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 462.0; 1H NMR (300 MHz, CD3OD) δ 9.18 (s, 1Н), 8.82 (s, 2H), 6.52 (s, 1H), 5.70 (s, 1H), 5.31 (s, 2H), 2.80-2.72 (m, 2H), 2.30 (s, 3H), 1.34-1.29 (m, 3H).
Пример 15.28 и 15.29: 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-3-(пиримидин-5-ил)-5Н-тиазоло[3,2-а]пиримидин-5-он и 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-3-(пиримидин-5-ил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
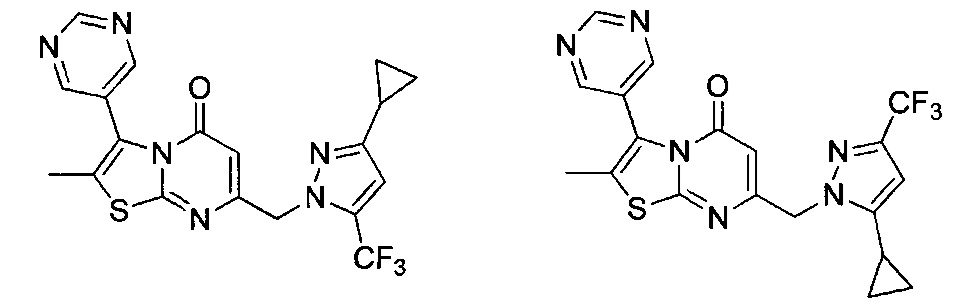
Стадия 1: 3-бромо-7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он и 3-бромо-7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
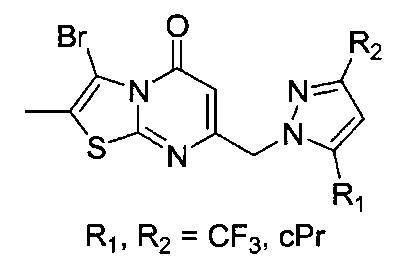
[0328] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (373 мг, 1.27 ммоль) в CH3CN (10 мл) добавили 3-циклопропил-5-(трифторметил)-1Н-пиразол (из Примера 15.9, Стадия 2) (450 мг, 2.55 ммоль), карбонат цезия (223 мг, 0.68 ммоль) и йодид калия (160 мг). Получившийся раствор перемешивали в течение ночи при 80°С. Осадки отфильтровали и получившуюся смесь сконцентрировали под вакуумом. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Xbridge Shield RP18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 0.03% NH3.Н2О и CH3CN (10.0% CH3CN до 32.0% в течение 10 мин, повышая до 100.0% за 1 мин, поддерживая 100.0% в течение 1 мин, понижая до 10.0% в течение 2 мин); Детектор, УФ 254 нм) с получением 3-бромо-7-[[3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (18 мг, 3%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 434.9; 1Н NMR (300 MHz, CDCl3) δ 6.36 (s, 1H), 5.54 (s, 1H), 5.21 (s, 2H), 2.35 (s, 3H), 1.90-2.01 (m, 1H), 0.94-1.00 (m, 2H), 0.71-0.79 (m, 2H)) и 3-бромо-7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (54 мг, 10%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 434.9; 1H NMR (300 MHz, CDCl3) δ 6.18 (s, 1H), 5.66 (s, 1H), 5.30 (s, 2H), 2.36 (s, 3Н), 1.72-1.65 (m, 1H), 1.03-0.98 (m, 2H), 0.76-0.71 (m, 2H)).
Стадия 4: 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-3-(пиримидин-5-ил)-5Н-тиазоло[3,2-а]пиримидин-5-он (Пример 15.28).
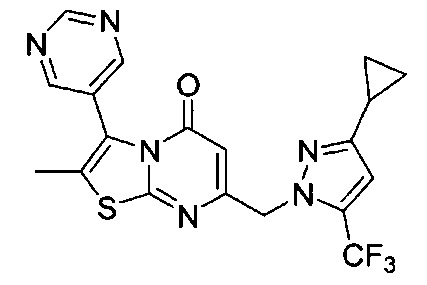
[0329] К раствору 3-бромо-7-[[3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (12 мг, 0.03 ммоль) в CH3CN (1.5 мл) и воде (0.5 мл) добавили (пиримидин-5-ил)бороновую кислоту (7 мг, 0.060 ммоль), фосфат калия (12 мг, 0.06 ммоль) и тетракис(трифенилфосфин)палладий (2.0 мг, 10 ммоль %). После перемешивания 1 ч при 100°С в атмосфере азота, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью 1% метанола в дихлорметане. Неочищенный продукт очистили посредством препаративной ВЭЖХ (SunFire Prep С18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль NH4HCO3 и CH3CN (30.0% CH3CN до 60.0% в течение 8 мин, повышая до 95.0% в течение 2 мин, понижая до 30.0% в течение 2 мин); Детектор, УФ 254/220 нм) с получением 7-[[3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-3-(пиримидин-5-ил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (6.1 мг, 51%) в виде белого осадка. ЖХМС (ESI): [M+H]+ = 433.2; 1Н NMR (300 MHz, CDCl3) δ 9.26 (s, 1H), 8.70 (s, 2H), 6.35 (s, 1H), 5.49 (s, 1H), 5.26 (s, 2H), 2.29 (s, 3Н), 1.98-1.88 (m, 1Н), 0.99-0.93 (m, 2H), 0.76-0.74 (m, 2H).
Стадия 5: 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-3-(пиримидин-5-ил)-5Н-тиазоло[3,2-а]пиримидин-5-он (Пример 15.29).
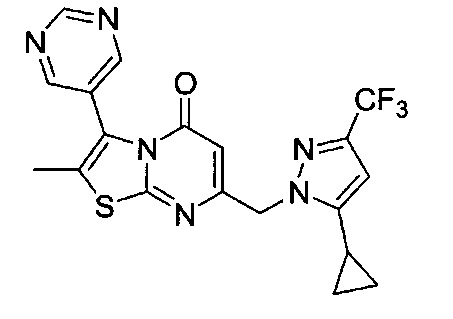
[0330] К раствору 3-бромо-7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (33 мг, 0.08 ммоль) в CH3CN (1.5 мл) и воде (0.5 мл) добавили (пиримидин-5-ил)бороновую кислоту (21 мг, 0.17 ммоль), фосфат калия (35 мг, 0.16 ммоль) и тетракис(трифенилфосфин)палладий (6 мг, 0.01 ммоль). После перемешивания 1 ч при 100°С в атмосфере азота, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 1% метанола в дихлорметане. Неочищенный продукт очистили посредством препаративной ВЭЖХ (SunFire Prep C18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль NH4HCO3 и CH3CN (30.0% CH3CN повышая до 60.0% в течение 8 мин, повышая до 95.0% в течение 2 мин, понижая до 30.0% в течение 2 мин); Детектор, УФ 254/220 нм) с получением 7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-3-(пиримидин-5-ил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (29.2 мг, 89%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 433.2; 1H NMR (300 MHz, CDCl3) δ 9.26 (s, 1H), 8.70 (s, 2H), 6.18 (s, 1H), 5.64 (s, 1H), 5.35 (s, 2H), 2.29 (s, 3H), 1.77-1.68 (m, 1H), 1.04-0.98 (m, 2H), 0.75-0.70 (m, 2H).
[0331] Следующие примеры получили аналогично тому, как это описано для Примеров 15.27, 15.28, и 15.29:
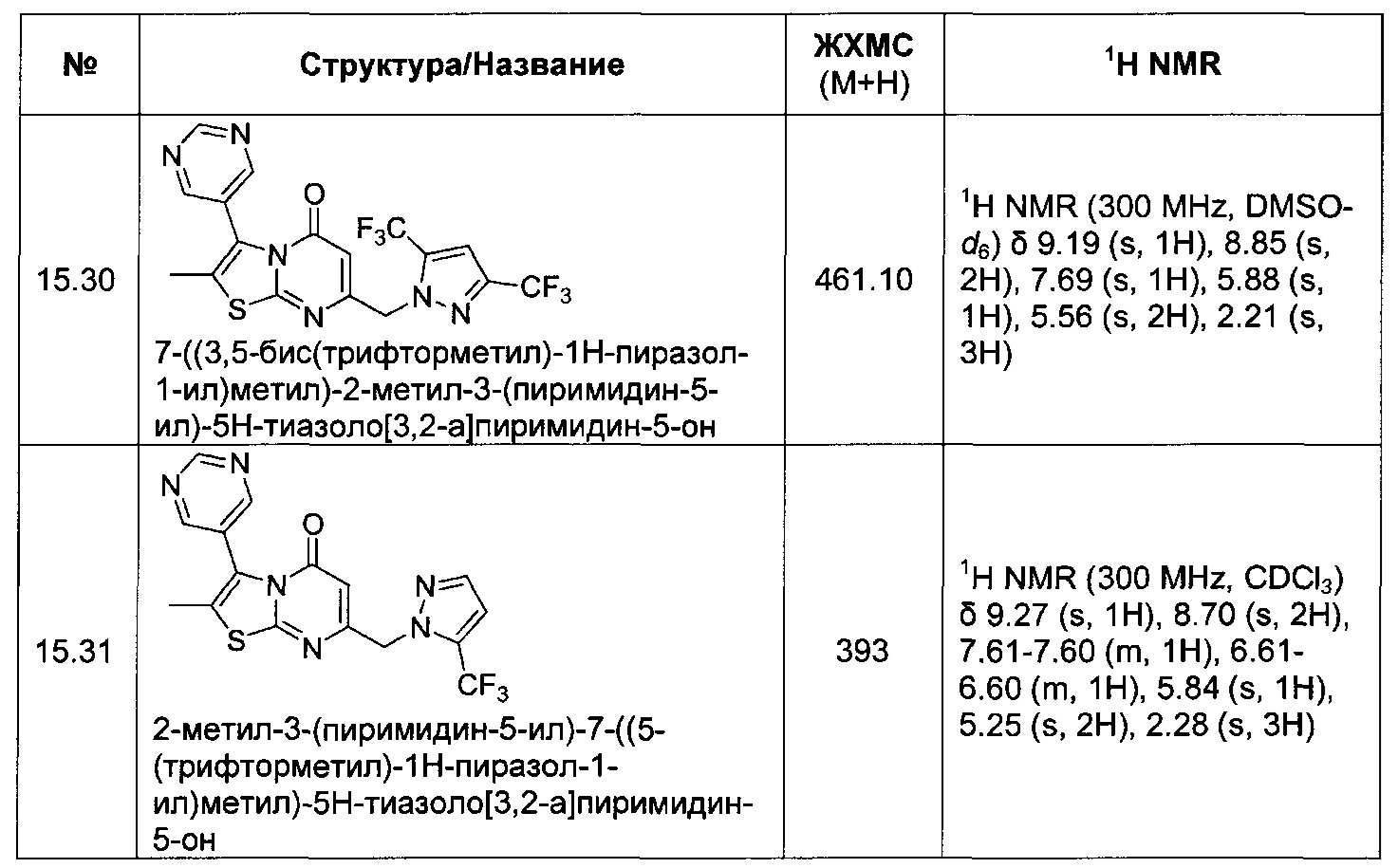
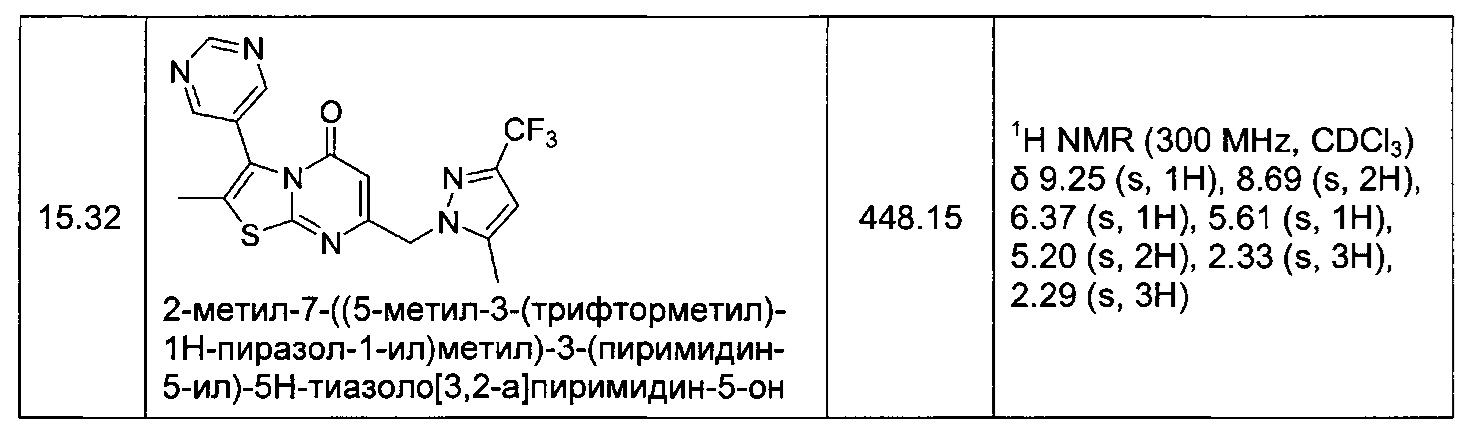
[0332] Следующие соединения получили с использованием способов, аналогичных описанным выше
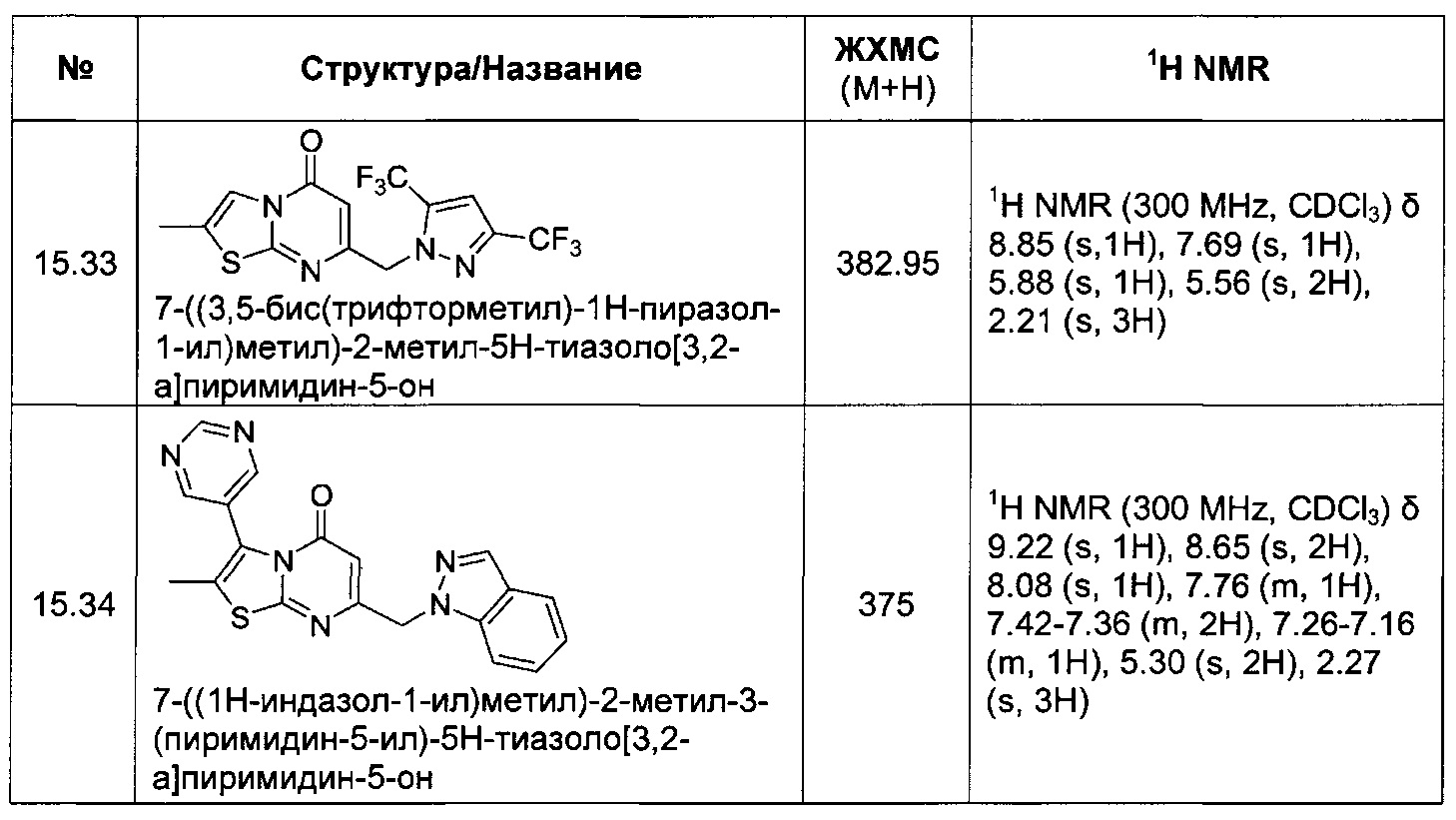
Способ 16:
Пример 16.1 и 16.2: 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид и 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
 и
и 
Стадия 1: этил 2-оксобутаноат.
[0333] В 10 л 4-горлышковую круглодонную колбу, продутую и поддерживаемую в инертной атмосфере азота, поместили диэтилоксалат (300 г, 2.05 моль, 1.00 экв.) и тетрагидрофуран (4.4 л), с последующим этилмагния бромидом (740 мл, 1.08 экв.) по каплям при перемешивании при -10°С в течение 2 ч. Получившийся раствор перемешивали при -10°С в течение 30 мин и погасили посредством добавления 500 мл 3 М хлороводорода. Значение рН раствора довели до рН 4 с помощью хлороводорода (3 моль/л) и получившийся раствор экстрагировали 2×1 л дихлорметана. Объединенные органические слои промыли 1×2 л хлорида натрия, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 200 г (неочищенного) этил 2-оксобутаноата в виде желтого масла.
Стадия 2: этил 3-бромо-2-оксобутаноат.
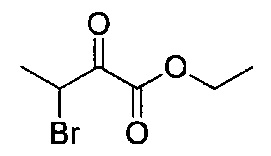
[0334] В 10-л 4-горлышковую круглодонную колбу поместили этил 2-оксобутаноат (265 г, 2.04 моль, 1.00 экв.), хлороформ (5 л), раствор HBr в АсОН (500 мл), и Br2 (325 г, 2.03 моль, 1.00 экв.). Получившийся раствор перемешивали при 70°С в течение 2 ч, охладили до комнатной температуры и сконцентрировали под вакуумом с получением 392.9 г (92%) этил 3-бромо-2-оксобутаноата в виде коричневого масла.
Стадия 3: этил 2-амино-5-метил-1,3-тиазол-4-карбоксилат.
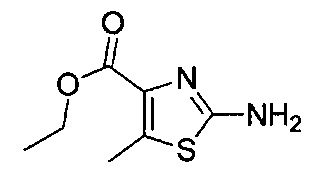
[0335] В 10-л круглодонную колбу поместили этил 3-бромо-2-оксобутаноат (392.9 г, 1.88 моль, 1.00 экв.), 1,4-диоксан (3.5 л), и тиомочевину (143.8 г, 1.89 моль, 1.01 экв.). Получившийся раствор перемешивали в течение ночи при 100°С и охладили до комнатной температуры. Осадки затем собрали посредством фильтрации, промыли Et2O и высушили под вакуумом с получением 310 г (89%) этил 2-амино-5-метил-1,3-тиазол-4-карбоксилата в виде светло-коричневого осадка.
Стадия 4: 2-амино-N,5-диметил-1,3-тиазол-4-карбоксамид.
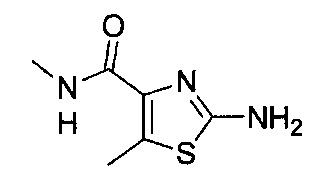
[0336] В 1-л химический реактор высокого давления поместили этил 2-амино-5-метил-1,3-тиазол-4-карбоксилат (140 г, 751.75 ммоль, 1.00 экв.) и 30% метиламин в EtOH (500 мл). Получившийся раствор перемешивали в течение ночи при 85°С и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с элюцией дихлорметаном/метанолом (20/1) с получением 80 г (62%) 2-амино-N,5-диметил-1,3-тиазол-4-карбоксамида в виде желтого осадка.
Стадия 5: 7-(хлорометил)-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
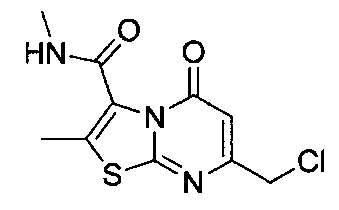
[0337] В 3-л 3-горлышковую круглодонную колбу поместили 2-амино-N,5-диметил-1,3-тиазол-4-карбоксамид (80 г, 467.24 ммоль, 1.00 экв.), этил 4-хлор-3-оксобутаноат (154 г, 935.68 ммоль, 2.00 экв.) и полифосфорную кислоту (РРА) (800 г). Получившийся раствор перемешивали при 110°С в течение 2 ч, охладили до 80°С и погасили посредством добавления 100 мл воды. Значение рН раствора довели до рН 8 с помощью гидроксида натрия (10% водн.). Осадки отфильтровали и фильтрат экстрагировали дихлорметаном (5 л × 5). Объединенные органические слои высушили над безводным Na2SO4 и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с элюцией дихлорметаном/метанолом (20/1) с получением 80 г (63%) 7-(хлорометил)-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде желто-коричневого осадка. ЖХМС (ESI): [М+Н]+ = 272; 1H NMR (400 MHz, DMSO-d6): δ 8.38 (q, J=4.8 Hz, 1H), 6.39 (s, 1H), 4.60 (s, 2H), 2.74 (d, J=4.8 Hz, 3H), 2.30 (s, 3H).
Стадия 6: 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид (Пример 16.1) и 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид (Пример 16.2).
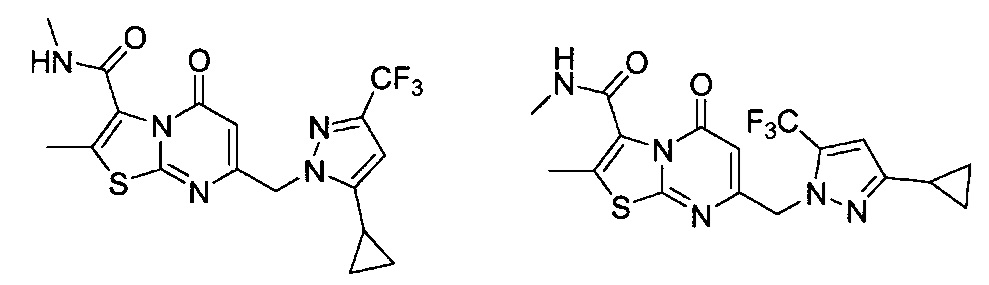
[0338] К раствору 7-(хлорометил)-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (100 мг, 0.37 ммоль), йодида калия (30 мг, 0.19 ммоль) и карбоната калия (100 мг, 0.74 ммоль) в CH3CN (10 мл) добавили 5-циклопропил-3-(трифторметил)-1Н-пиразол (из Примера 15.9, Стадия 2) (80 мг, 0.45 ммоль). Реакционную смесь перемешивали 3 ч при 85°С на масляной бане. После фильтрации для удаления осадков и концентрирования под вакуумом, остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (2:1) с получением 7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (50.4 мг, 33%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 412.0; 1Н NMR (300 MHz, CDCl3) δ 6.27 (bs, 1H), 6.19 (s, 1H), 5.64 (s, 1H), 5.32 (s, 2H), 3.03 (m, 3Н), 2.40 (s, 3H), 1.71-1.65 (m, 1H), 1.03-0.97 (m, 2H), 0.76-0.66 (m, 2H)) и 7-[[3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил]метил]-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (20.7 мг, 14%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 411.9; 1Н NMR (300 MHz, CDCl3) δ 6.36 (s, 1H), 5.94 (br, 1H), 5.56 (s, 1H), 5.24 (s, 2H), 3.03 (m, 3Н), 2.42 (s, 3H), 1.98-1.89 (m, 1H), 0.99-0.91 (m, 2H), 0.76-0.66 (m, 2H)).
Пример 16.3 и 16.4: 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-N-этил-5-оксо-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид и 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-N-этил-5-оксо-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
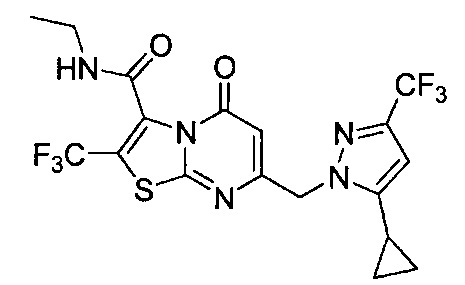 и
и 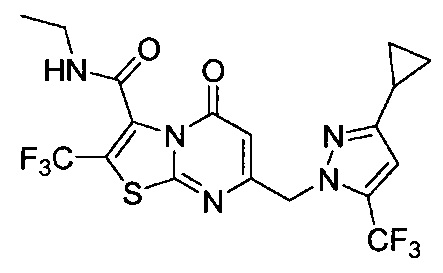
Стадия 1: метил 2-амино-5-йодотиазол-4-карбоксилат.
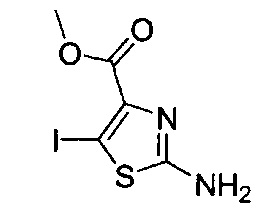
[0339] К раствору метил 2-амино-1,3-тиазол-4-карбоксилата (20 г, 0.13 моль) в дихлорметане (300 мл) добавили N-йодсукцинимид (34 г, 0.15 моль) по порциям. Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь промыли насыщенным водным Na2SO3 (3×150 мл). Органический слой высушили над безводным сульфатом натрия. После фильтрации, фильтрат сконцентрировали с получением метил 2-амино-5-йод-1,3-тиазол-4-карбоксилата (21 г, 58%) в виде рыжеватого осадка.
Стадия 2: метил 5-йодотиазол-4-карбоксилат.
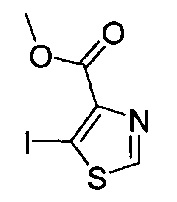
[0340] К раствору метил 2-амино-5-йод-1,3-тиазол-4-карбоксилата (21 г, 0.074 моль) в тетрагидрофуране (400 мл) добавили трет-бутилнитрил (11.5 г, 0.11 моль). Получившийся раствор перемешивали в течение 1 ч при 50°С на масляной бане. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:5) с получением метил 5-йод-1,3-тиазол-4-карбоксилата (8 г, 40%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 269.9; 1H NMR (300 MHz, CDCl3) δ 8.95 (s, 1H), 3.97 (s, 3H).
Стадия 3: метил 5-(трифторметил)тиазол-4-карбоксилат.
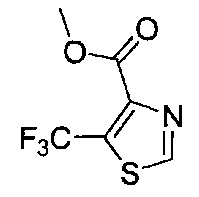
[0341] К раствору метил 5-йод-1,3-тиазол-4-карбоксилата (8.00 г, 29.7 ммоль) и йодида меди (8.70 г, 45.7 ммоль) в N,N-диметилформамиде (200 мл) добавили метил 2,2-дифтор-2-(фторсульфонил)ацетат (8.70 г, 45.3 ммоль). Получившийся раствор перемешивали в течение ночи при 80°С на масляной бане. После фильтрации для удаления осадков и концентрирования под вакуумом, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:5) с получением метил 5-(трифторметил)-1,3-тиазол-4-карбоксилата (4 г, 64%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 212.0; 1H NMR (300 MHz, CDCl3) δ 8.91 (s, 1H), 4.00 (s, 3H).
Стадия 4: N-этил-5-(трифторметил)тиазол-4-карбоксамид.
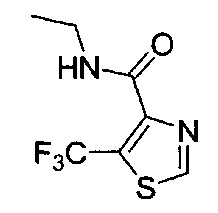
[0342] Смесь метил 5-(трифторметил)-1,3-тиазол-4-карбоксилата (1 г, 4.74 ммоль) и этиламина в этаноле (10 мл) поместили в 30-мл закрытую пробирку. Получившийся раствор перемешивали в течение ночи при 50°С на масляной бане. После концентрирования под вакуумом, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:5) с получением N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (400 мг, 38%) в виде светло-желтого масла. ЖХМС (ESI): [М+Н]+ = 225.0; 1H NMR (300 MHz, CDCl3) δ 8.79 (s, 1H), 7.42 (br, 1H), 3.55-3.46 (m, 2H), 1.27 (m, 3H).
Стадия 5: 2-бромо-N-этил-5-(трифторметил)тиазол-4-карбоксамид.
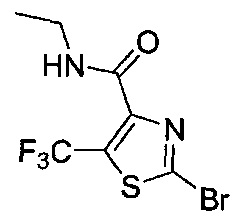
[0343] К раствору N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (200 мг, 0.89 ммоль) в тетрагидрофуране (3 мл) добавили н-бутиллитий (2.5 М в гексанах; 1.1 мл, 2.70 ммоль) по каплям при перемешивании при -78°С. Получившийся раствор перемешивали в течение 30 мин при -78°С. Затем тетрабромид углерода (900 мг, 2.70 ммоль) в тетрагидрофуране (5 мл) добавили по каплям при перемешивании при -78°С. После перемешивания 1 ч при -78°С, реакционную смесь погасили водой со льдом, экстрагировали дихлорметаном (2×30 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:10) с получением 2-бромо-N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (40 мг, 15%) в виде светло-желтого осадка. ЖХМС (ESI): [M+H]+ = 302.8, 304.8; 1H NMR (300 MHz, CDCl3) δ 3.53-3.44 (m, 2H), 1.27 (m, 3H).
Стадия 6: 2-амино-N-этил-5-(трифторметил)тиазол-4-карбоксамид.
[0344] Смесь 2-бромо-N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (500 мг, 1.65 ммоль), 1,4-диоксана (5 мл) и аммония (5 мл) поместили в 30-мл закрытую пробирку. Получившийся раствор перемешивали в течение ночи при 70°С на масляной бане. Получившуюся смесь экстрагировали CH2Cl2 (20 мл × 2), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1) с получением 2-амино-N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (250 мг, 63%) в виде светло-желтого полутвердого вещества. ЖХМС (ESI): [М+Н]+ = 240.0; 1H NMR (300 MHz, CDCl3) δ 7.15 (br, 1H), 5.24 (br, 2H), 3.48-3.39 (m, 2H), 1.22 (m, 3H).
Стадия 7: 7-(хлорометил)-N-этил-5-оксо-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0345] К смеси 2-амино-N-этил-5-(трифторметил)-1,3-тиазол-4-карбоксамида (250 мг, 1.05 ммоль) и этил 4-хлор-3-оксобутаноата (350 мг, 2.13 ммоль) добавили полифосфорную кислоту (5 г, избыток). Получившуюся смесь перемешивали в течение 1.5 ч при 110°С на масляной бане. Затем реакционную смесь погасили посредством добавления воды и значение рН раствора довели до рН 8 с помощью водного гидроксида натрия. Получившуюся смесь экстрагировали дихлорметаном (100 мл × 2), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/этилацетатом (10:1) с получением 7-(хлорометил)-N-этил-5-оксо-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (200 мг, 56%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 339.9; 1H NMR (300 MHz, CDCl3) δ 6.49 (s, 1H), 5.90 (br, 1H), 4.41 (s, 2H), 3.60-3.51 (m, 2H), 1.22 (m, 3H).
Стадия 8: 7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-N-этил-5-оксо-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид (Пример 16.3) и 7-((3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-N-этил-5-оксо-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид (Пример 16.4).
[0346] К раствору 7-(хлорометил)-N-этил-5-оксо-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (80 мг, 0.24 ммоль) и карбоната калия (80 мг, 2.00 экв.) в ацетонитриле (8 мл) добавили 5-циклопропил-3-(трифторметил)-1Н-пиразол (из Примера 15.9, Стадия 2) (50 мг, 0.28 ммоль). Получившийся раствор перемешивали в течение 3 ч при 80°С на масляной бане. После фильтрации для удаления осадков и концентрирования под вакуумом, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2) с получением 7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-5-оксо-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (26.3 мг, 23%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 480.0; 1H NMR (300 MHz, CDCl3) δ 6.20 (s, 1H), 5.89 (bs, 1H), 5.77 (s, 1H), 5.35 (s, 2H), 3.59-3.50 (m, 2H), 1.73-1.61 (m, 1H), 1.22 (m, 3Н), 1.07-1.00 (m, 2H), 0.76-0.70 (m, 2H)) и 7-[[3-циклопропил-5-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-5-оксо-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (16.5 мг, 15%) в виде белого осадка (ЖХМС (ESI): [М+Н]+ = 480.0; 1H NMR (300 MHz, CDCl3) δ 6.38 (s, 1H), 5.84 (bs, 1H), 5.67 (s, 1H), 5.25 (s, 2H), 3.59-3.50 (m, 2H), 1.98-1.89 (m, 1H), 1.22 (m, 3Н), 0.99-0.91 (m, 2H), 0.78-0.73 (m, 2H)).
[0347] Следующий пример получили аналогично тому, как это описано для Примеров 16.1, 16.2, 16.3, и 16.4:
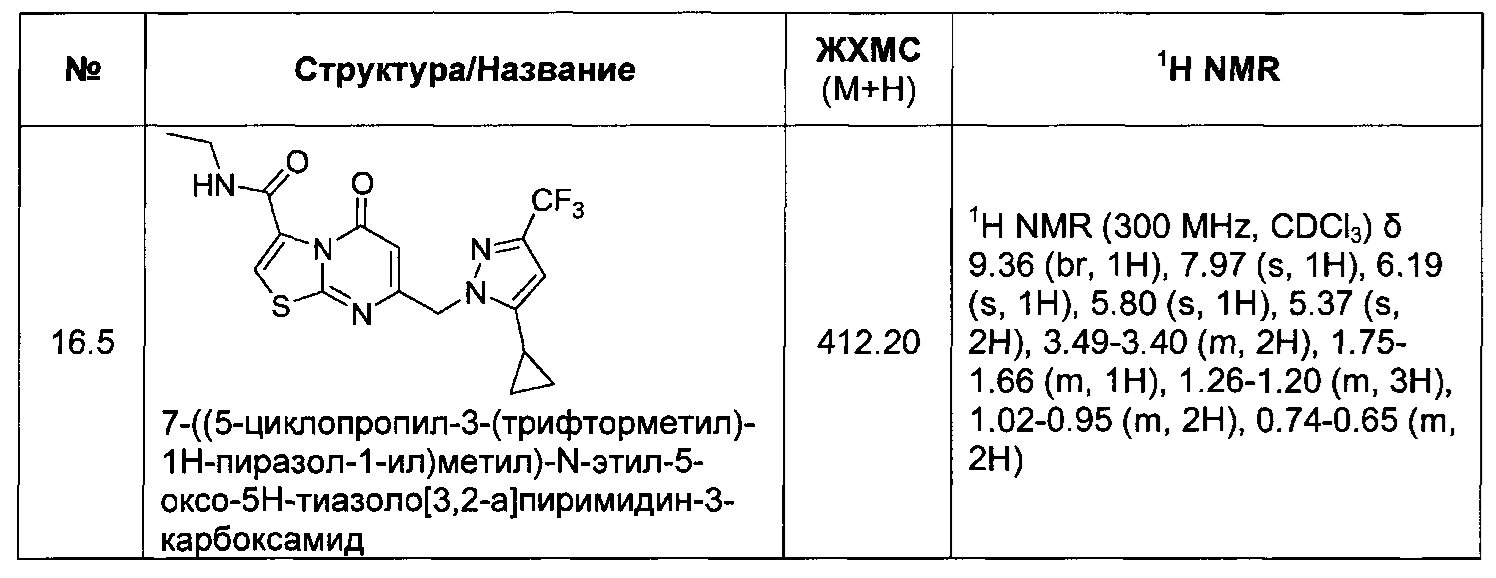
[0348] Следующие соединения получили с использованием способов, аналогичных описанным выше
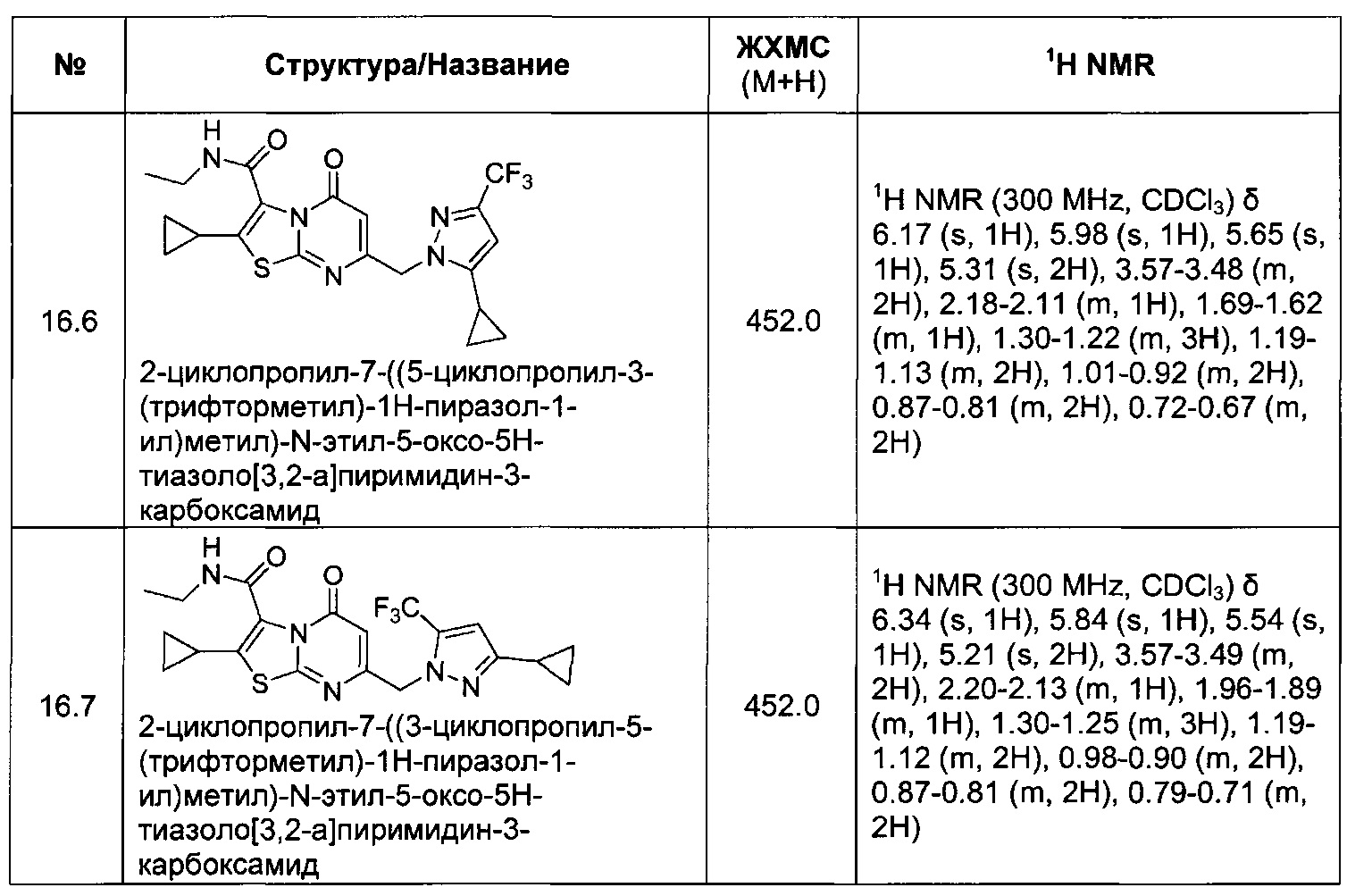
Способ 17:
Пример 17.1: 2-метил-5-оксо-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-3-карбонитрил.
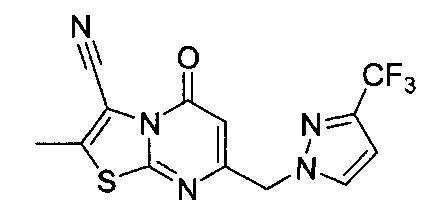
Стадия 1: 3-бромо-2-метил-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
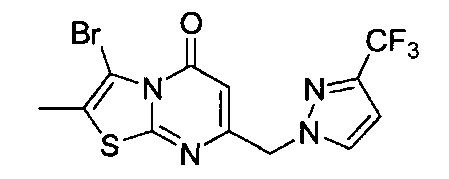
[0349] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (300 мг, 0.76 ммоль) в CH3CN (5 мл) добавили 3-(трифторметил)-1Н-пиразол (125 мг, 0.92 ммоль), карбонат калия (316 мг, 2.29 ммоль) и йодид калия (63 мг, 0.38 ммоль). Получившийся раствор нагревали до кипения с обратным холодильником в течение ночи. Осадки отфильтровали и фильтрат сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (50/1) с получением 3-бромо-2-метил-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 67%) в виде белого осадка.
Стадия 2: 2-метил-5-оксо-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-3-карбонитрил.
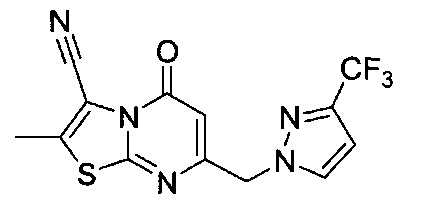
[0350] К раствору 3-бромо-2-метил-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (120 мг, 0.31 ммоль) в N,N-диметилформамиде (2 мл) добавили цианид меди(I) (32 мг, 0.36 ммоль). Получившийся раствор перемешивали в течение 1 ч при 100°С. Затем реакционную смесь погасили посредством добавления воды. Осадки отфильтровали и фильтрат экстрагировали этилацетатом (3×10 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/5) с получением 2-метил-5-оксо-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбонитрила (10.2 мг, 10%) в виде белого осадка. ЖХМС (ESI): [M+H]+ = 340; 1H NMR (300 MHz, CDCl3) δ 7.59 (m, 1H), 6.62 (m, 1H), 5.99 (s, 1H), 5.24 (s, 2H), 2.67 (s, 3Н).
[0351] Следующие примеры получили аналогично тому, как это описано для Примера 17.1:
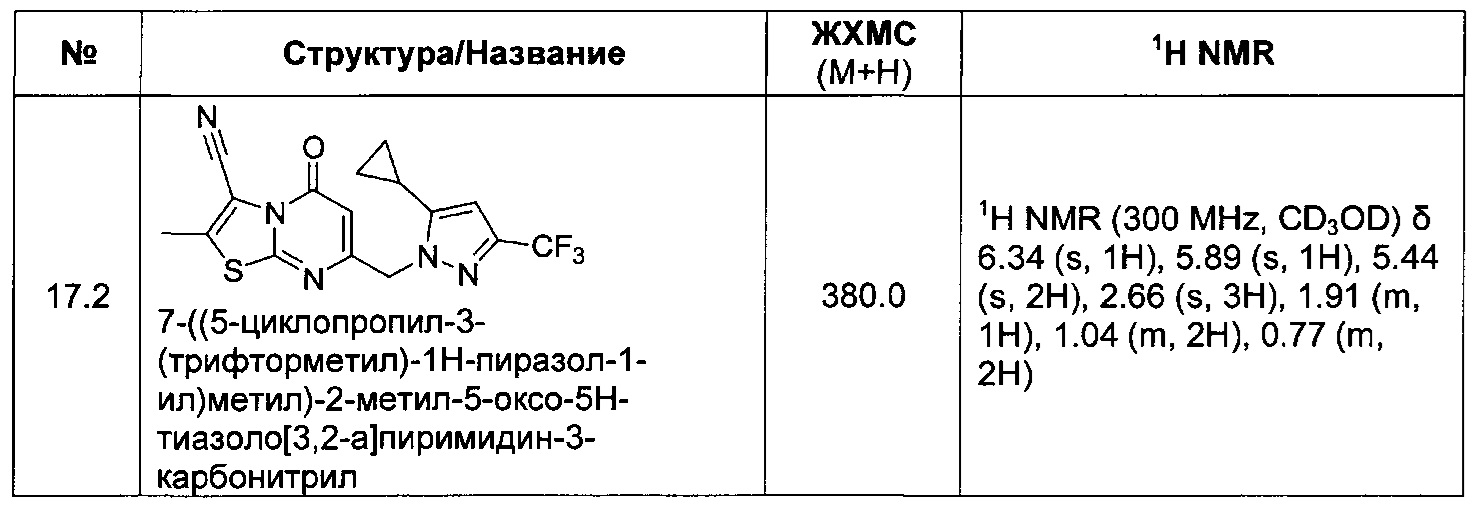
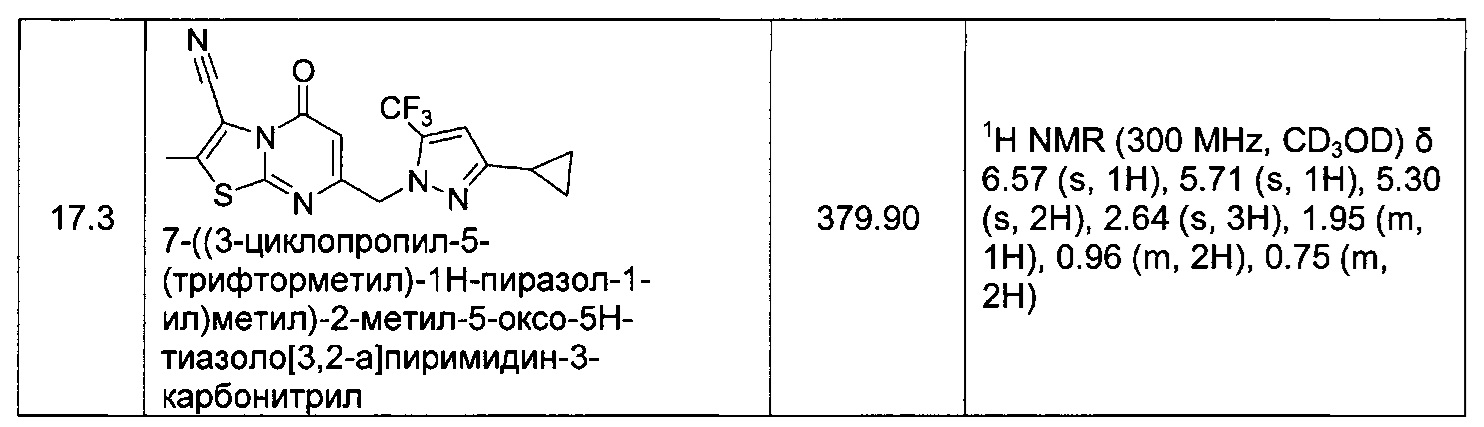
Способ 18:
Пример 18.1: 3-(1-гидроксиэтил)-2-метил-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
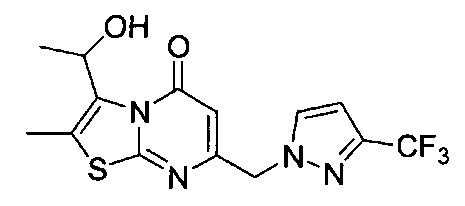
Стадия 1: 4-бромопентан-2,3-дион.
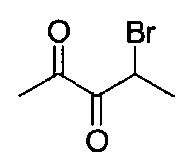
[0352] К раствору пентан-2,3-диона (1.00 г, 9.99 ммоль) в хлороформе (30 мл) добавили бром (1.60 г, 10.01 ммоль) и бромоводород в уксусной кислоте (33 мас. %; 3 капли). Получившийся раствор перемешивали в течение 3 ч при 50°С. Получившийся раствор сконцентрировали с получением 4-бромопентан-2,3-диона в виде осадка (1.79 г). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 1-(2-амино-5-метилтиазол-4-ил)этанон.
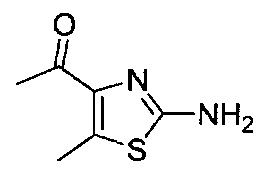
[0353] К раствору 4-бромопентан-2,3-диона (1.79 г, 10.00 ммоль) в этаноле (50 мл) добавили тиомочевину (760 мг, 9.98 ммоль). Получившийся раствор перемешивали в течение 1 ч при 100°С и затем охладили до комнатной температуры. Смесь отфильтровали с получением 1-(2-амино-5-метил-1,3-тиазол-4-ил)этан-1-она в виде серо-белого осадка (1.2 г, 65%). ЖХМС (ESI): [M+H]+ = 157.0.
Стадия 3: 3-ацетил-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
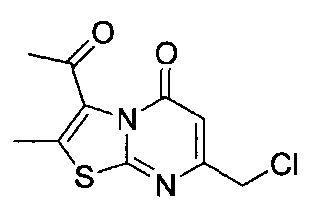
[0354] К раствору 1-(2-амино-5-метил-1,3-тиазол-4-ил)этан-1-она (300 мг, 1.92 ммоль) добавили этил 4-хлор-3-оксобутаноат (474 мг, 2.88 ммоль) и полифосфорную кислоту (10 мл). Получившийся раствор перемешивали в течение 1 ч при 110°С и затем охладили до комнатной температуры. Получившийся раствор разбавили водой (20 мл) и значение рН раствора довели до 8. Получившийся раствор экстрагировали и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/1) с получением 3-ацетил-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого осадка (70.0 мг, 12%). ЖХМС (ESI): [М+Н]+ = 257.0; 1Н NMR (300 MHz, CDCl3) δ 6.46 (s, 1H), 4.42 (s, 2H), 2.52 (s, 3H), 2.39 (s, 3H).
Стадия 4: 3-ацетил-2-метил-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
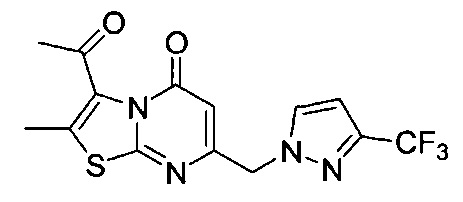
[0355] К раствору 3-ацетил-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 0.78 ммоль) в CH3CN (25 мл) добавили йодид калия (68 мг, 0.39 ммоль), карбонат калия (220 мг, 1.59 ммоль) и 3-(трифторметил)-1Н-пиразол (160 мг, 1.18 ммоль). Получившийся раствор перемешивали в течение 12 ч при 80°С на масляной бане. Получившуюся смесь погасили водой (10 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2) с получением 3-ацетил-2-метил-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (195 мг, 70%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 357.1; 1Н NMR (300 MHz, CDCl3) δ 7.61 (m, 1H), 6.62 (m, 1H), 5.91 (s, 1H), 5.25 (s, 2H), 2.45 (s, 3H), 2.38 (s, 3H).
Стадия 5: 3-(1-гидроксиэтил)-2-метил-7-((3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
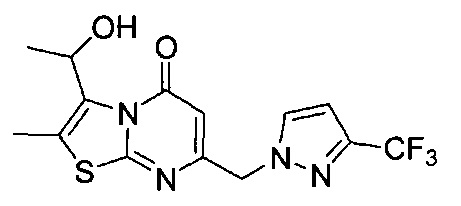
[0356] К раствору 3-ацетил-2-метил-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (30 мг, 0.08 ммоль) в метаноле (10 мл) добавили борогидрид натрия (13 мг, 0.34 ммоль). Получившийся раствор перемешивали в течение 12 ч при комнатной температуре на масляной бане. Затем реакционную смесь погасили водным хлоридом аммония (10 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом магния и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:1) с получением 3-(1-гидроксиэтил)-2-метил-7-[[3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (11.7 мг, 39%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 359.0; 1H NMR (300 MHz, CD3OD) δ 7.94-7.93 (m, 1H), 6.70 (m, 1H), 5.97 (s, 1H), 5.47-5.40 (m, 1H), 5.38 (m, 2H), 2.48 (s, 3H), 1.52 (m, 3H).
[0357] Следующие примеры получили аналогично тому, как это описано для Примера 18.1:
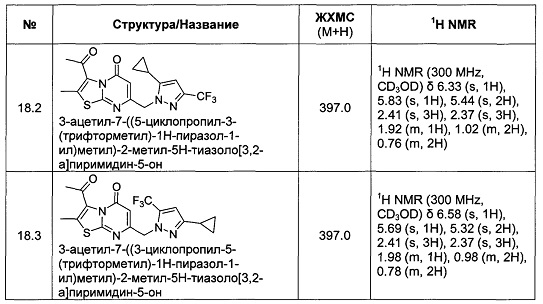
[0358] Следующие соединения получили с использованием способов, аналогичных описанным выше
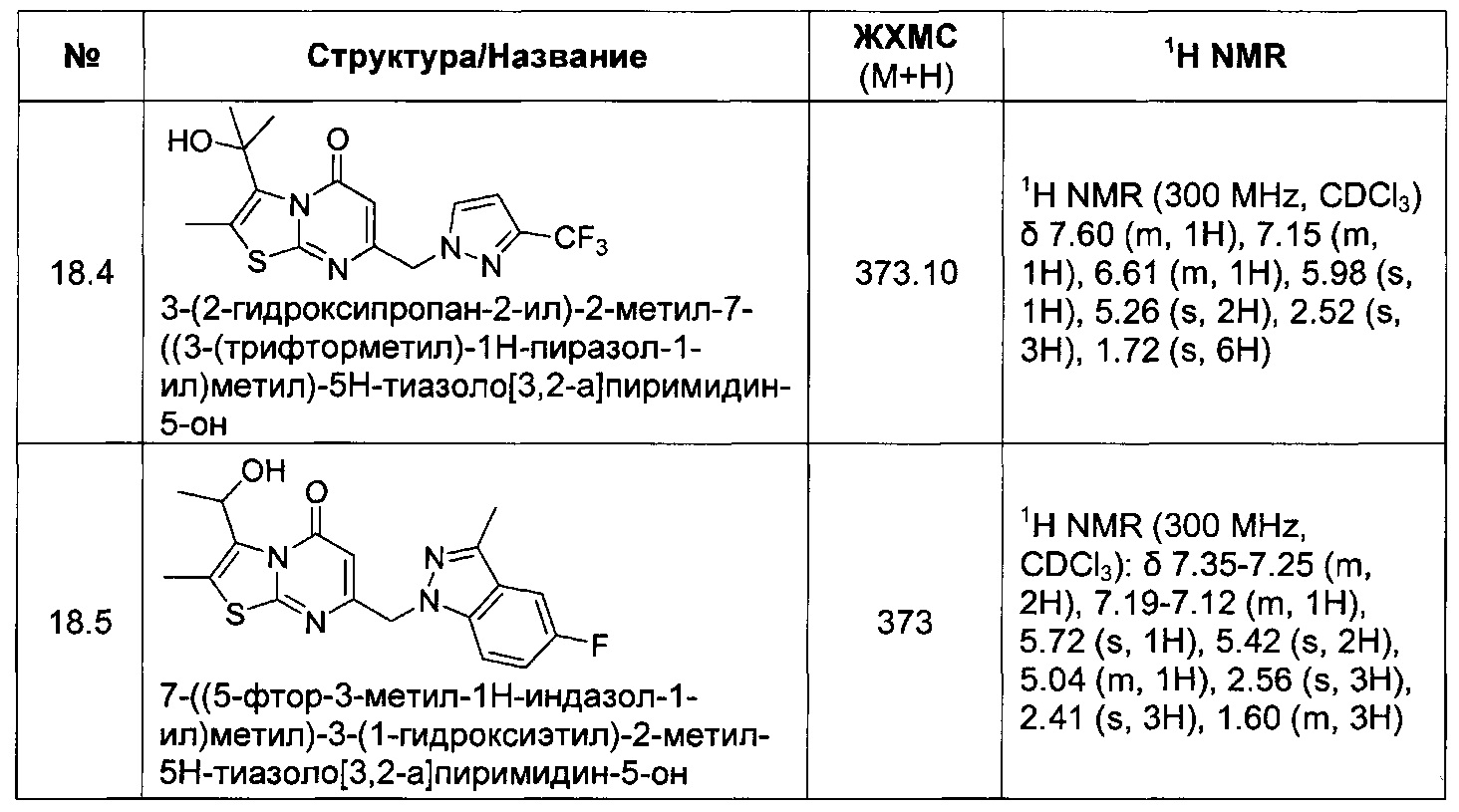
Способ 19:
Пример 19.1: 7-(1-(5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)этил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
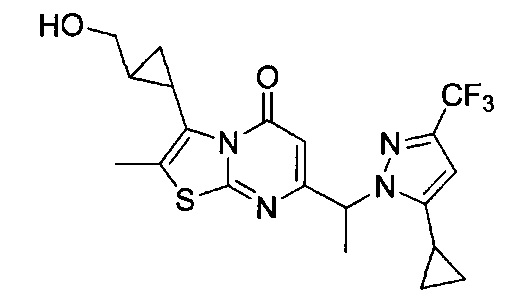
Стадия 1: 3-(транс-2-((трет-бутилдиметилсилилокси)метил)циклопропил)-7-((5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
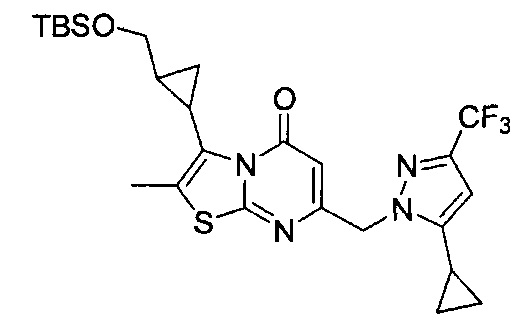
[0359] К раствору 7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 15.11) (120 мг, 0.28 ммоль) в дихлорметане (30 мл) добавили трет-бутилдиметилсилилхлорид (177 мг, 1.18 ммоль), имидазол (80 мг, 1.18 ммоль) и 4-диметиламинопиридин (5 мг, кат.). Получившийся раствор перемешивали в течение ночи при 50°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1:2) с получением 3-(2-[[(трет-бутилдиметилсилил)окси]метил]циклопропил)-7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (120 мг, 67%) в виде желтого масла. ЖХМС (ESI): [М+Н]+ = 539.0. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: 3-(транс-2-((трет-бутилдиметилсилилокси)метил)циклопропил)-7-(1-(5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)этил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0360] К раствору 3-(2-[[(трет-бутилдиметилсилил)окси]метил]циклопропил)-7-[[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (120 мг, 0.22 ммоль) в тетрагидрофуране (20 мл) добавили н-бутиллитий (1.5 мл, 85% в гексанах) и метилйодид (158 мг, 1.11 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой (20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток затем очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2) с получением 3-(транс-2-[[(трет-бутилдиметилсилил)окси]метил]циклопропил)-7-[1-[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]этил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (50 мг, 35%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 553.0.
Стадия 3: 7-(1-(5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил)этил)-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0361] К раствору 3-(транс-2-[[(трет-бутилдиметилсилил)окси]метил]циклопропил)-7-[1-[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]этил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.09 ммоль) в этаноле (30 мл) добавили 0.5% хлороводород в этаноле (10 мл). Получившийся раствор перемешивали в течение 2 ч при комнатной температуре. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (100:1) с получением 7-[1-[5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]этил]-3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (14.3 мг, 34%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 439.0; 1H NMR (300 MHz, CD3OD) δ 6.18 (s, 2H), 6.17 (s, 1H), 5.59-5.54 (m, 1H), 4.05-4.01 (m, 1H), 3.14-3.07 (m, 1H), 2.41 (s, 3Н), 2.28-2.22 (m, 1H), 1.96-1.93 (m, 3Н), 1.69-1.64 (m, 1H), 1.27-1.23 (m, 1H), 1.03-0.72 (m, 4H), 0.73-0.62 (m, 2H).
[0362] Следующее соединение получили с использованием способов, аналогичных описанным выше
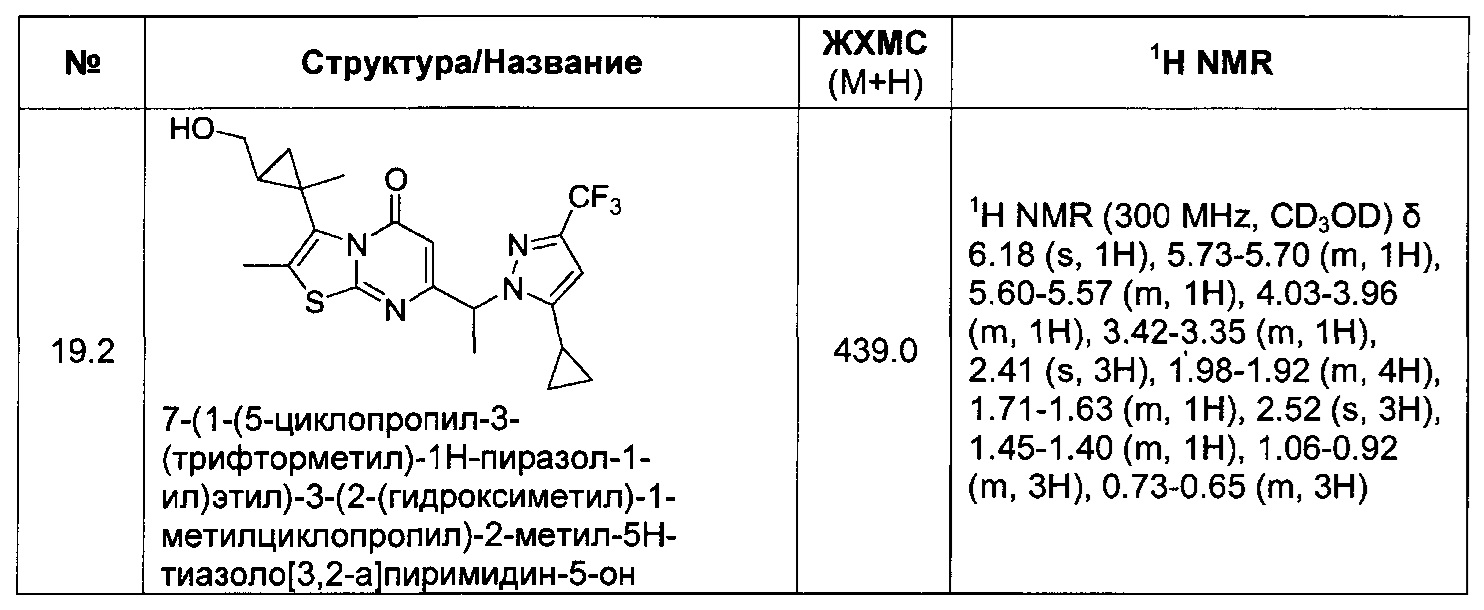
Способ 20:
Пример 20.1: 3-((3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
Стадия 1: 3-((3-бромо-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
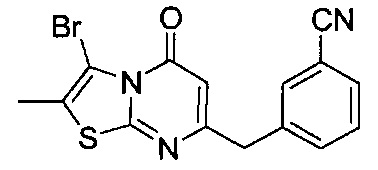
[0363] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (500 мг, 1.70 ммоль) в 1,4-диоксане/Н2О (3/1 мл) добавили тетракис(трифенилфосфин)палладий (198 мг, 0.17 ммоль), фосфат калия (726 мг, 3.42 ммоль) и (3-цианофенил)бороновую кислоту (302 мг, 2.06 ммоль). Получившийся раствор перемешивали в течение ночи при 80°С. После охлаждения до комнатной температуры, получившуюся смесь экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором (1×30 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1:2) с получением 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (102 мг, 17%) в виде коричневого осадка. ЖХМС (ESI): [М+Н]+ = 360.0, 362.0; 1H NMR (300 MHz, CDCl3) δ 7.65-7.41 (m, 4H), 6.04 (s, 1H), 3.91 (s, 2H), 2.35 (s, 3H).
Стадия 2: 3-((3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
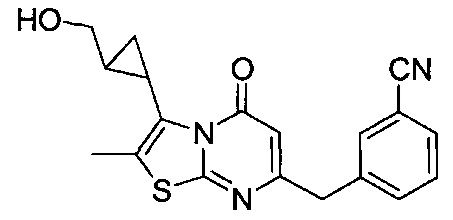
[0364] К раствору 3-((3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрила (80 мг, 0.22 ммоль) в CH3CN/H2O (3/1 мл) добавили [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (16.7 мг, 0.02 ммоль), карбонат натрия (47.2 мг, 0.45 ммоль) и калия транс-2-(гидроксиметил)циклопропилтрифторборат (из Примера 4.1, Стадия 2) (79.3 мг, 0.45 ммоль). Реакционную смесь облучали в микроволновой печи в течение 1.5 ч при 120°С. Получившуюся смесь экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором (10 мл), высушили над сульфатом натрия. После концентрирования под вакуумом, остаток очистили на колонке с силикагелем с элюцией дихлорметаном/метанолом (50:1) с получением 3-([3-[транс-2-(гидроксиметил)циклопропил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (16.6 мг, 21%) в виде белого осадка. ЖХМС (ESI): [M+H]+ = 352.0; 1H NMR (300 MHz, CDCl3) δ 7.62-7.58 (m, 3Н), 7.50-7.44 (m, 1H), 6.02 (s, 1H), 4.04-4.00 (m, 1H), 3.99 (s, 2H), 3.20-3.13 (m, 1H), 2.42 (s, 3Н), 2.26-2.25 (m, 1H), 1.28-1.25 (m, 1H), 1.05-1.00 (m, 2H).
Пример 20.2: 3-((6-фтор-3-(2-(гидроксиметил)циклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
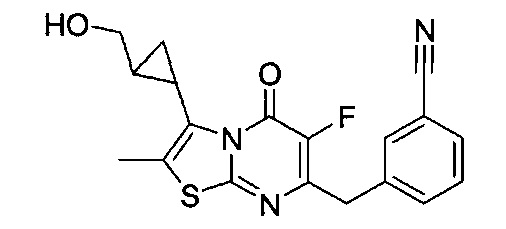
Стадия 1: 3-((3-бромо-6-фтор-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
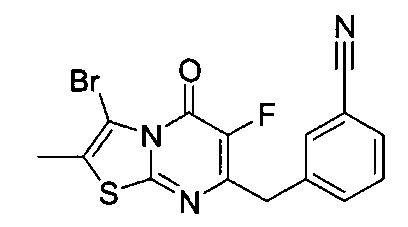
[0365] К раствору 3-бромо-7-(хлорометил)-6-фтор-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.29, Стадия 1) (130 мг, 0.42 ммоль) в 1,4-диоксане/H2O (3/1, 4 мл) добавили тетракис(трифенилфосфин)палладий (48 мг, 0.04 ммоль), фосфат калия (179 мг, 0.84 ммоль), и (3-цианофенил)бороновую кислоту (74 мг, 0.50 ммоль). Получившийся раствор перемешивали в течение ночи при 80°С, затем получившуюся смесь сконцентрировали под вакуумом и остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:3) с получением 3-([3-бромо-6-фтор-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (36 мг, 23%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 377.9.
Стадия 2: 3-((6-фтор-3-(транс-2-(гидроксиметил)циклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
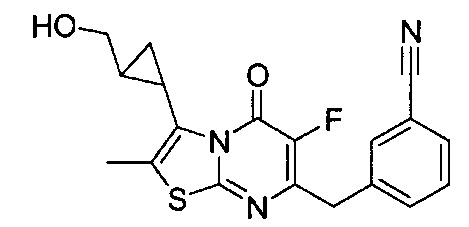
[0366] К раствору 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрила (100 мг, 0.26 ммоль) в CH3CN/Н2О (3/1 мл) в инертной атмосфере азота добавили [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (20 мг, 0.03 ммоль), карбонат натрия (56.2 мг, 0.53 ммоль), и калия транс-2-(гидроксиметил)циклопропилтрифторборат (из Примера 4.1, Стадия 2) (94.4 мг, 0.53 ммоль). Получившийся раствор перемешивали в течение 90 мин при 120°С. Смесь сконцентрировали под вакуумом, и остаток очистили посредством хроматографии дихлорметаном/метанолом (50:1) с получением 2-фтор-3-([3-[транс2-(гидроксиметил)циклопропил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила в виде серо-белого осадка (9.9 мг, 10%). ЖХМС (ESI): [М+Н]+ = 370.0; 1H NMR (300 MHz, CDCl3) δ 7.57 (s, 1H), 7.55-7.52 (m, 2H), 7.41-7.40 (m, 1H), 4.06-3.96 (m, 3Н), 3.22-3.17 (m, 1H), 2.37 (s, 3Н), 2.30-2.10 (m, 1H), 1.34-1.25 (m, 1H), 1.06-0.98 (m, 2H).
[0367] Следующие примеры получили аналогично тому, как это описано для Примера 20.1 и 20.2:
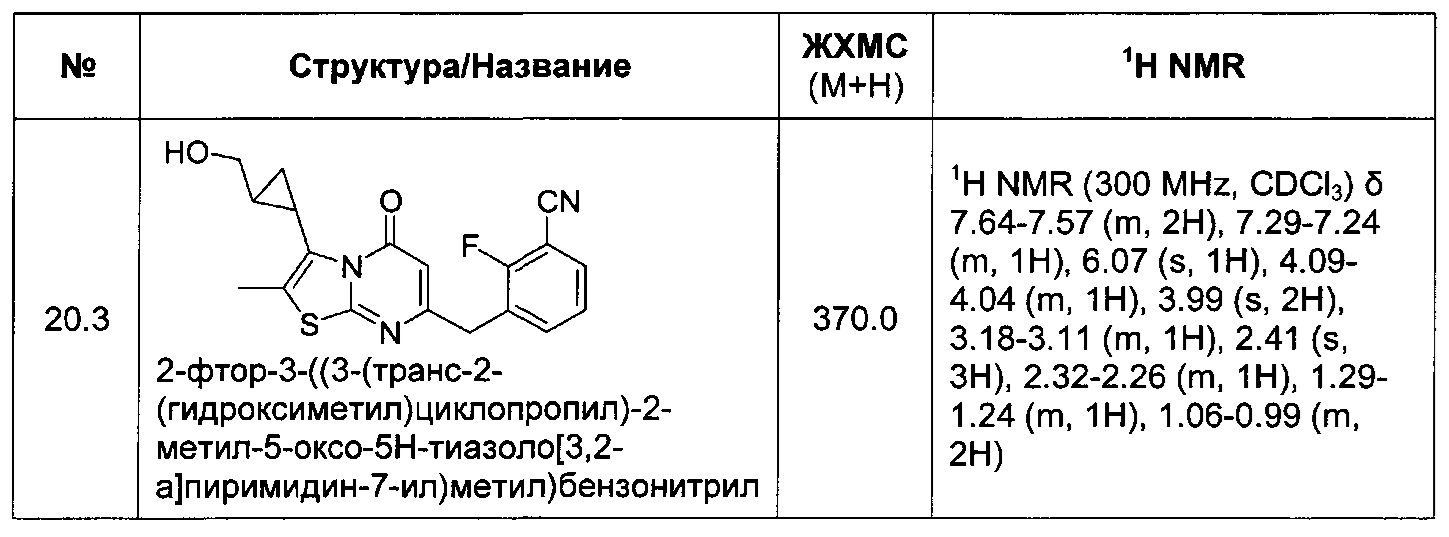
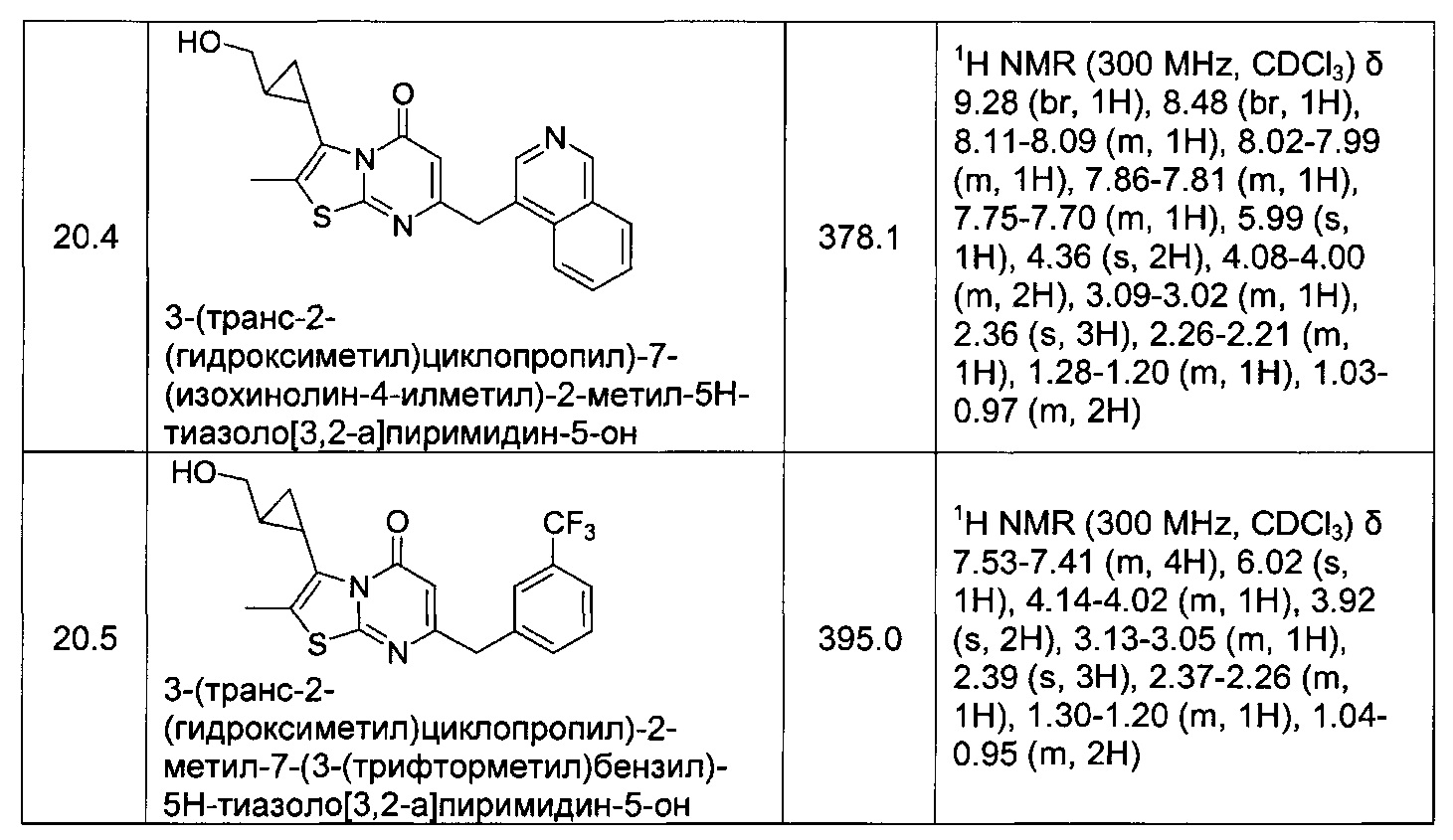
[0368] Следующие соединения получили с использованием способов, аналогичных описанным выше
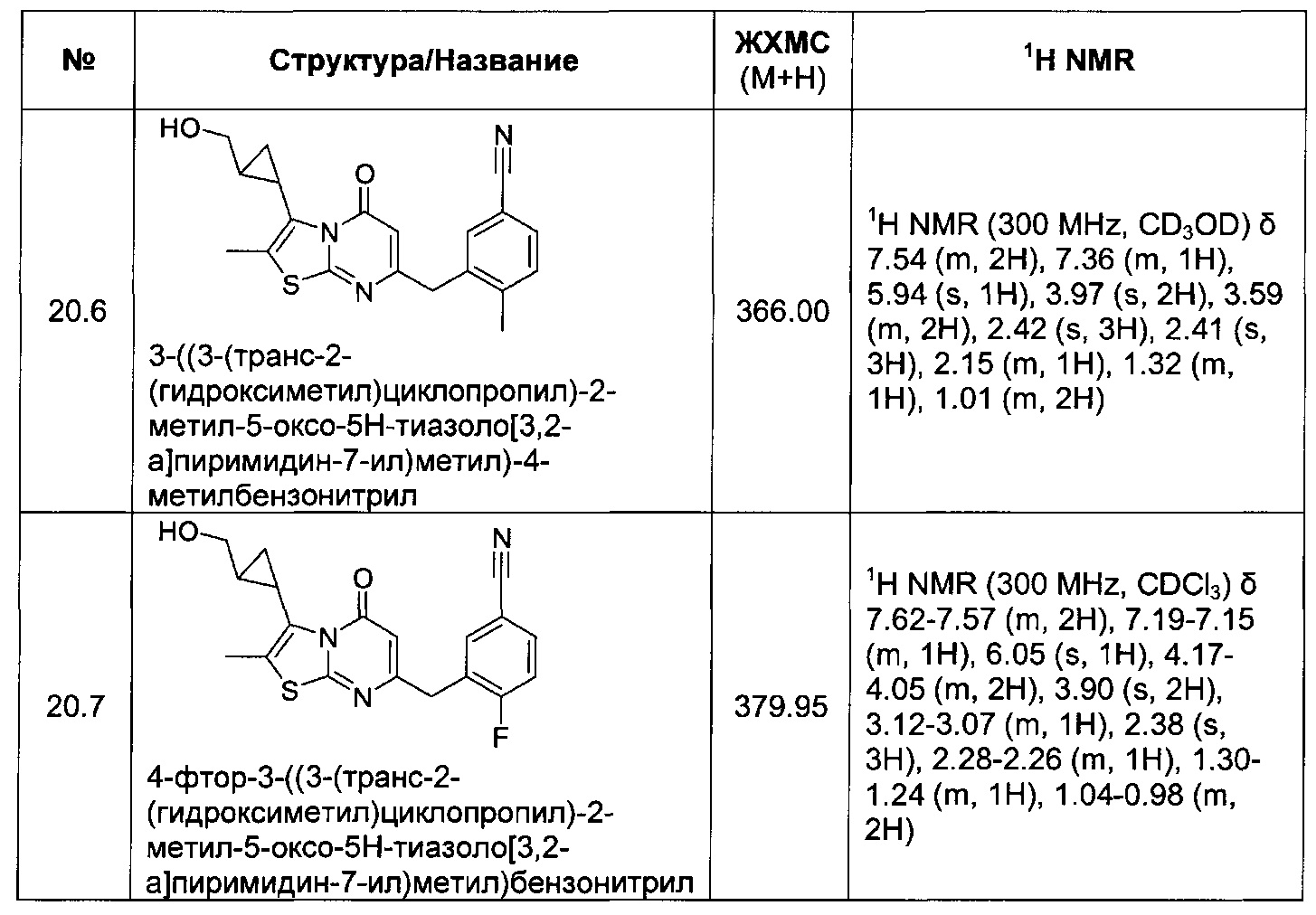
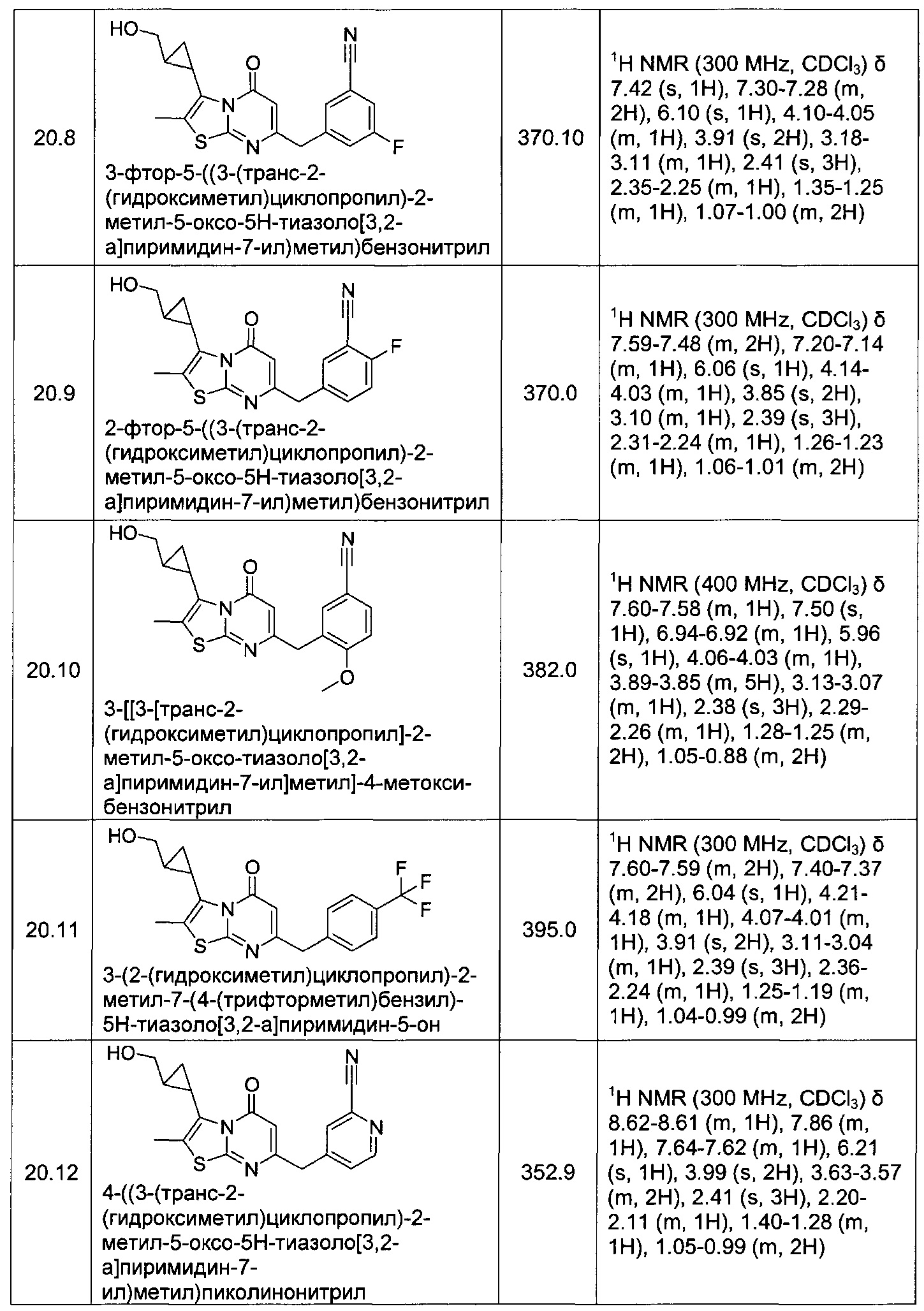
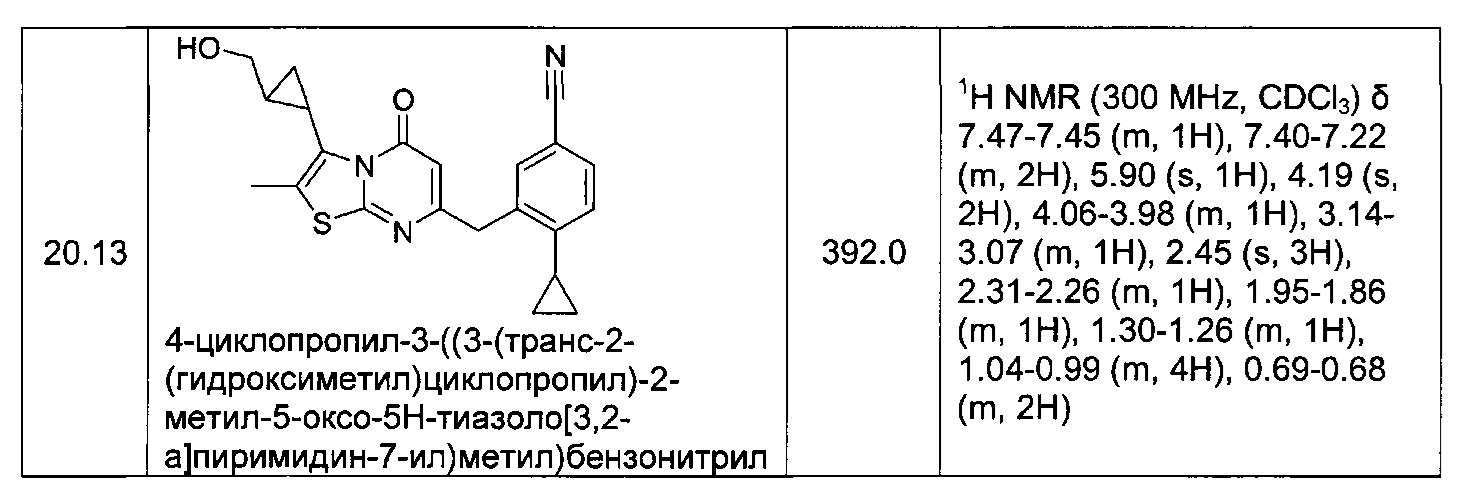
Способ 21:
Пример 21.1: 7-(3-цианобензил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
Стадия 1: 7-(3-цианобензил)-N,2-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0369] 7-(хлорометил)-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид (из Примера 16.1, Стадия 5) (50 мг, 0.18 ммоль), (3-цианофенил)бороновую кислоту (56 мг, 0.38 ммоль), тетракис(трифенилфосфин)палладий (20 мг, 0.019 ммоль), фосфат калия (80 мг, 0.38 ммоль), 1,4-диоксан (1.5 мл) и воду (0.5 мл) поместили в 10-мл закрытую пробирку. Получившийся раствор перемешивали в течение 2 ч при 80°С на масляной бане. После охлаждения до комнатной температуры, получившуюся смесь экстрагировали CH2Cl2 (20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (20:1) с получением 7-[(3-цианофенил)метил]-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (29.1 мг, 47%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 339.0; 1H NMR (300 MHz, CDCl3) δ 7.61-7.40 (m, 4H), 6.08 (s, 1H), 5.96 (br, 1H), 3.90 (s, 2H), 3.05 (m, 3Н), 2.41 (s, 3Н).
[0370] Следующие примеры получили аналогично тому, как это описано для Примера 21.1:
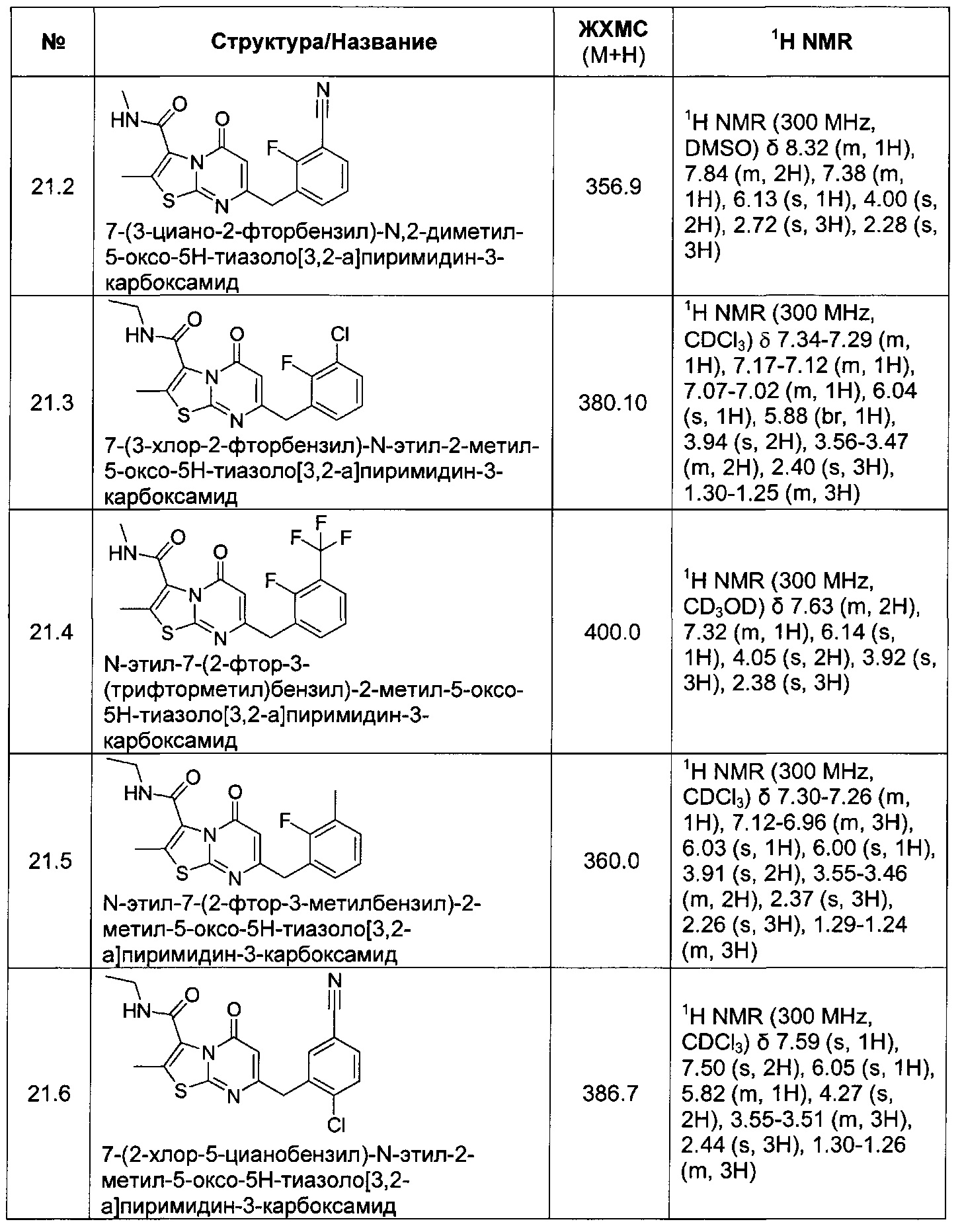
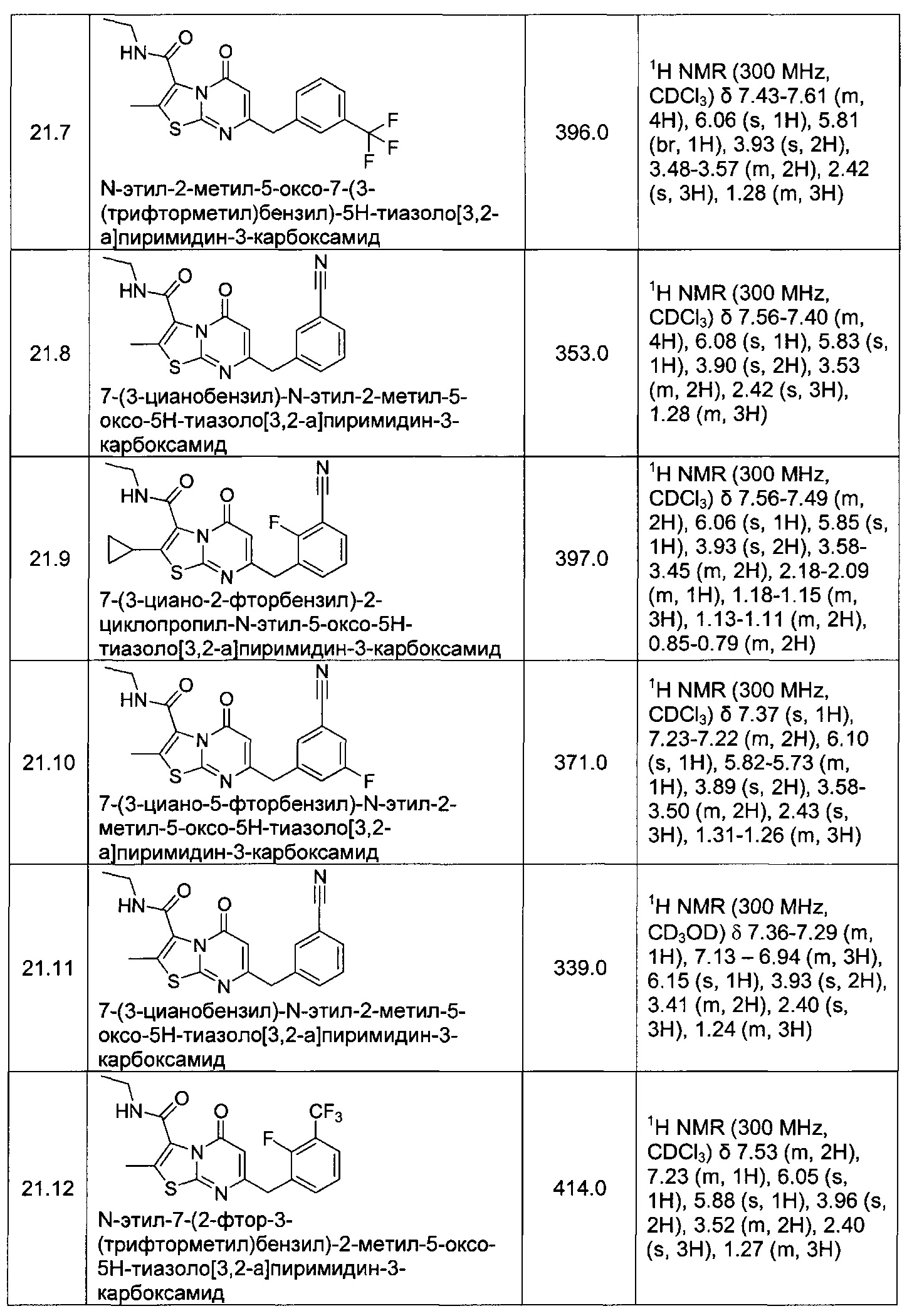
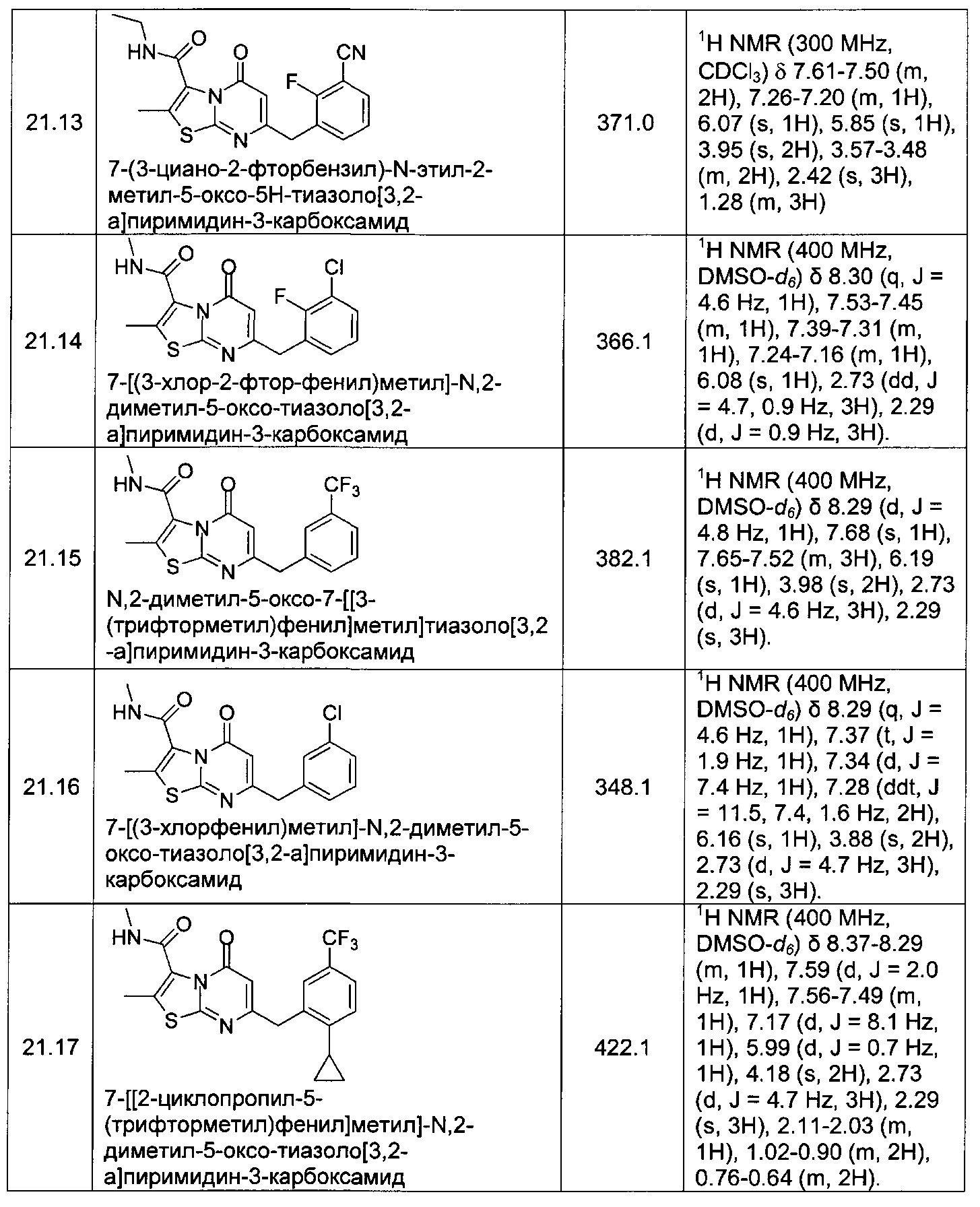
Пример 21.18: N-этил-2-метил-5-оксо-7-((6-(трифторметил)пиридин-2-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
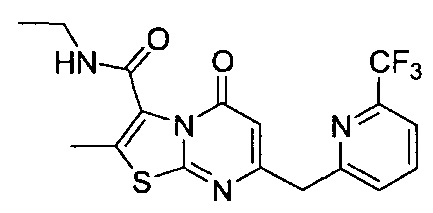
Стадия 1: бис(пинаколато)дибор.
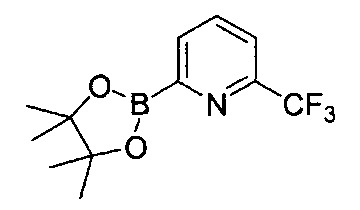
[0371] К раствору 2-бромо-6-(трифторметил)пиридина (500 мг, 2.21 ммоль) в 1,4-диоксане (10 мл) в атмосфере азота, добавили ацетат калия (862 мг, 8.78 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (330 мг, 0.45 ммоль), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (609 мг, 2.40 ммоль). Получившийся раствор перемешивали в течение 12 ч при 90°С. Смесь отфильтровали для удаления осадков и сконцентрировали под вакуумом с получением [6-(трифторметил)пиридин-2-ил]бороновой кислоты (500 мг, неочищенная) в виде черного осадка. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): [M+H]+ = 191.9.
Стадия 2: N-этил-2-метил-5-оксо-7-((6-(трифторметил)пиридин-2-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
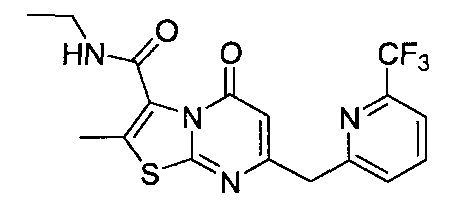
[0372] К раствору 7-(хлорометил)-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (полученного способом, аналогичным Примеру 16.1, Стадия 5) (50 мг, 0.17 ммоль) в 1,4-диоксане (2 мл) в атмосфере азота добавили карбонат натрия (36 мг, 0.34 ммоль), [6-(трифторметил)пиридин-2-ил]бороновую кислоту (50 мг, 0.26 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (13 мг, 0.02 ммоль), и воду (0.2 мл). Реакционную смесь облучали микроволновым излучением в течение 20 мин при 120°С. Получившийся раствор затем экстрагировали этилацетатом (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (20:1) с получением N-этил-2-метил-5-оксо-7-[[6-(трифторметил)пиридин-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (22.8 мг, 33%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 397.1; 1H NMR (400 MHz, CDCl3) δ 7.81 (m, 1H), 7.60 (m, 1H), 7.53 (m, 1H), 6.26 (s, 1H), 5.89 (s, 1H), 4.15 (s, 2H), 3.51 (m, 2H), 2.41 (s, 3H), 1.28 (m, 3Н).
Пример 21.19: N-этил-7-(2-этил-4,5-дифторбензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
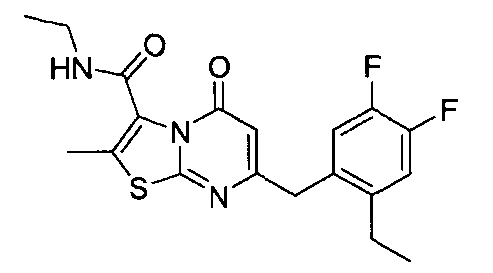
Стадия 1: 1-(бензилокси)-2-бромо-4,5-дифторбензол.
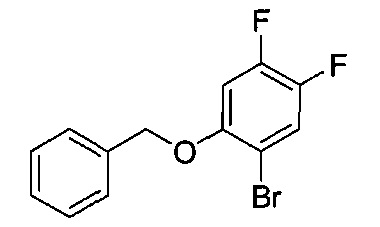
[0373] К смеси 2-бромо-4,5-дифторфенола (500 мг, 2.39 ммоль, 1.00 экв.) и карбонат калия (800 мг, 5.80 ммоль) в CH3CN (10 мл) добавили (бромметил)бензол (610 мг, 3.57 ммоль). Получившийся раствор перемешивали в течение 3 ч при 80°С на масляной бане. После фильтрации для удаления осадков и концентрирования, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:30) с получением 1-(бензилокси)-2-бромо-4,5-дифторбензола (600 мг, 84%) в виде бесцветного масла. 1H NMR (300 MHz, CDCl3) δ 7.46-7.32 (m, 5H), 6.82-6.76 (m, 1H), 5.10 (s, 2H).
Стадия 2: 1-(бензилокси)-4,5-дифтор-2-винилбензол.
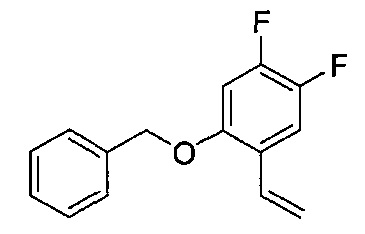
[0374] 1-(Бензилокси)-2-бромо-4,5-дифторбензол (560 мг, 1.87 ммоль), тетракис(трифенилфосфин)палладий (200 мг, 0.19 ммоль), фосфат калия (800 мг, 3.78 ммоль), 1,4-диоксан (10 мл), воду (1 мл) и 2-этенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан (580 мг, 3.77 ммоль) поместили в 30-мл закрытую пробирку. Реакционную смесь перемешивали в течение 5 ч при 80°С на масляной бане. После фильтрации для удаления осадков и концентрирования, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:10) с получением 1-(бензилокси)-2-этенил-4,5-дифторбензола (350 мг, 76%) в виде светло-желтого масла. 1H NMR (300 MHz, CDCl3) δ 7.69-7.29 (m, 6H), 7.07-6.95 (m, 1H), 6.81-6.71 (m, 1H), 5.69-5.63 (m, 1H), 5.29-5.25 (m, 1H), 5.04 (s, 2H).
Стадия 3: 2-этил-4,5-дифторфенола.
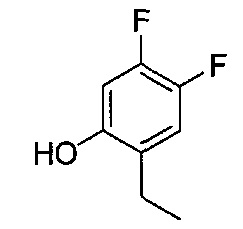
[0375] К смеси 1-(бензилокси)-2-этенил-4,5-дифторбензола (350 мг, 1.42 ммоль) в метаноле (10 мл) добавили палладий на угле (20 мг). Получившуюся реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода (1 атм). После фильтрации для удаления катализатора, фильтрат сконцентрировали под вакуумом с получением 2-этил-4,5-дифторфенола (200 мг, 89%) в виде светло-желтого масла. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 4: 2-этил-4,5-дифторфенила трифторметансульфонат.
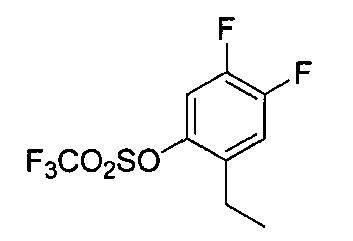
[0376] К смеси 2-этил-4,5-дифторфенола (200 мг, 1.26 ммоль) и триэтиламина (260 мг, 2.58 ммоль) в дихлорметане (10 мл) добавили трифторуксусный ангидрид (680 мг, 2.42 ммоль) по каплям при перемешивании при 0°С. Получившийся раствор перемешивали в течение 30 мин при 0°С. Затем реакционную смесь погасили посредством добавления воды, экстрагировали дихлорметаном (10 мл × 2), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 2-этил-4,5-дифторфенила трифторметансульфоната (180 мг, 50%) в виде светло-желтого масла. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 5: 2-(2-этил-4,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан.
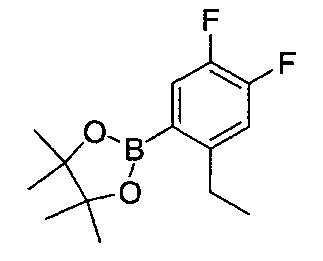
[0377] К смеси 2-этил-4,5-дифторфенила трифторметансульфоната (180 мг, 0.62 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорида (50 мг, 0.07 ммоль), ацетата калия (120 мг, 1.23 ммоль) в 1,4-диоксане (5 мл) добавили 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (240 мг, 0.93 ммоль). Получившуюся смесь перемешивали в течение ночи при 90°С на масляной бане в атмосфере азота. После фильтрации для удаления осадков и концентрирования, остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:10) с получением 2-(2-этил-4,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (140 мг, 84%) в виде светло-желтого масла. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 6: N-этил-7-(2-этил-4,5-дифторбензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
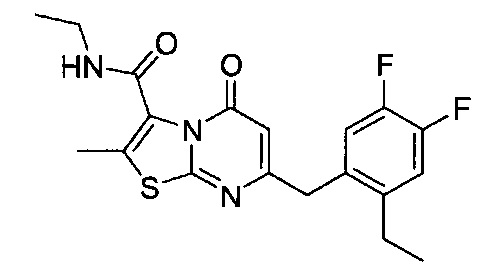
[0378] 7-(хлорометил)-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид (полученный аналогично тому, как это описано для Примера 16.1, Стадия 5) (100 мг, 0.35 ммоль, 1.00 экв.), 2-(2-этил-4,5-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (140 мг, 0.52 ммоль, 1.50 экв.), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (30 мг, 0.10 экв.), карбонат натрия (75 мг, 2.00 экв.), 1,4-диоксан (3 мл) и воду (0.3 мл) поместили в 10 мл закрытую пробирку. Реакционную смесь облучали микроволновым излучением в течение 30 мин при 120°С. Получившийся раствор разбавили 30 мл дихлорметана, промыли 2×10 мл солевого раствора, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (40:1) с получением N-этил-7-[(2-этил-4,5-дифторфенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (17.9 мг, 13%) в виде серо-белого осадка. ЖХМС (ESI): [M+H]+ = 392.0; 1H NMR (300 MHz, CDCl3) δ 7.04-6.91 (m, 2H), 5.88 (s, 1H), 5.82 (br, 1H), 3.84 (s, 2H), 3.58-3.48 (m, 2H), 2.59-2.52 (m, 2H), 2.42 (s, 3Н), 1.28 (m, 3Н), 1.17 (m, 3Н).
Пример 21.20: 7-[[3-(дифторметил)-2-фтор-фенил]метил]-N-этил-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
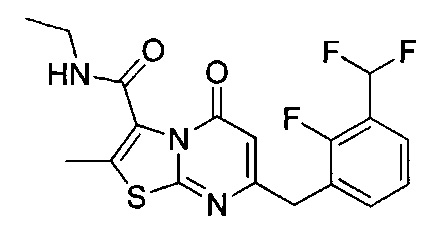
Стадия 1: 3-бромо-2-фторбензальдегид.
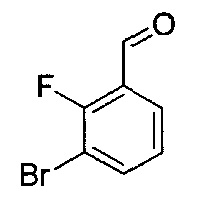
[0379] К раствору (3-бромо-2-фтор-фенил)метанола (2.750 г, 13.413 ммоль) в дихлорметане (50 мл) добавили диоксид магния (9.32 г, 107.31 ммоль) и получившуюся смесь перемешивали при 45°С в течение ночи. После завершения реакции реакционную смесь отфильтровали через диатомитовую землю и промыли дихлорметаном с получением 3-бромо-2-фтор-бензальдегида в виде белого осадка (2.24 г, 83%). 1Н NMR (400 MHz, DMSO-d6) δ 10.19 (dt, J=1.3, 0.7 Hz, 1H), 8.05 (tdd, J=6.8, 3.1, 1.5 Hz, 1H), 7.85 (ddt, J=7.9, 6.4, 1.5 Hz, 1H), 7.37 (tdt, J=7.8, 1.6, 0.8 Hz, 1H).
Стадия 2: 1-бромо-3-(дифторметил)-2-фторбензол.
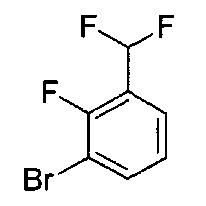
[0380] К раствору 3-бромо-2-фторбензальдегида (1980 мг, 9.5581 ммоль) в дихлорметане (30 мл, 468.0 ммоль) в инертной атмосфере добавили диэтиламиносеры трифторид (2.53 мл, 19.116 ммоль) при 0°С, и смесь перемешивали в течение 1 ч при 0°С. Смесь нагрели до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь осторожно погасили насыщенным раствором бикарбоната натрия. Реакционную смесь затем разбавили этилацетатом (300 мл) и органический слой промыли насыщенным раствором бикарбоната натрия и солевым раствором, затем сконцентрировали досуха и очистили посредством хроматографии (0-50% этилацетат в гептане в течение 20 минут) с получением 1-бромо-3-(дифторметил)-2-фторбензола (1.35 г, 61%). 1H NMR (400 MHz, DMSO-d6) δ 7.93 (ddq, J=7.9, 6.8, 1.2 Hz, 1H), 7.66 (ddq, J=7.6, 6.4, 1.2 Hz, 1H), 7.33 (td, J=7.9, 1.0 Hz, 1H), 7.24 (t, J=54.1 Hz, 1H).
Стадия 3: 2-[3-(дифторметил)-2-фтор-фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан.
[0381] Смесь 1-бромо-3-(дифторметил)-2-фторбензола (1.18 г, 5.09 ммоль) и бис(пинаколато)дибора (2.59 г, 10.2 ммоль) 1,1'-бис(дифенилфосфино)ферроцена палладия дихлорида (280 мг, 0.382 ммоль) и ацетата калия (1.50 г, 15.3 ммоль) в 1,4-диоксане (15 мл) нагревали при 100°С в течение ночи. Реакционную смесь отфильтровали через диатомитовую землю и сконцентрировали. Неочищенный материал очистили посредством хроматографии (0-50% этилацетат в гептане) с получением 2-[3-(дифторметил)-2-фтор-фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана в виде светло-желтого осадка (1.11 г, 80%). 1H NMR (400 MHz, DMSO-d6) δ 7.86-7.73 (m, 2H), 7.36 (t, J=7.5 Hz, 1H), 7.18 (t, J=54.4 Hz, 1H), 1.31 (s, 12H).
Стадия 4: 7-[[3-(дифторметил)-2-фтор-фенил]метил]-N-этил-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0382] Смесь 7-(хлорометил)-N-этил-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамида (полученного способом, аналогичным Примеру 16.1, Стадия 5) (75 мг, 0.262 ммоль), 2-[3-(дифторметил)-2-фтор-фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана (214 мг, 0.787 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорида (14.4 мг, 0.0197 ммоль) и карбоната калия (110 мг, 0.787 ммоль) в ацетонитриле (3 мл) и воде (0.75 мл) нагревали при 120°С в микроволновой печи в течение 40 минут. Реакционную смесь отфильтровали через диатомитовую землю и сконцентрировали. Неочищенный материал очистили посредством хроматографии (0-100% этилацетат в гептане) с получением 7-[[3-(дифторметил)-2-фтор-фенил]метил]-N-этил-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамида (49.6 мг, 47%). ЖХМС (ESI): [М+Н]+ = 396.1; 1H NMR (400 MHz, DMSO-d6) δ 8.37 (t, J=5.7 Hz, 1H), 7.55 (q, J=8.0 Hz, 2H), 7.38-7.02 (m, 2H), 6.08 (s, 1H), 3.97 (s, 2H), 3.27-3.16 (m, 2H), 2.29 (s, 3H), 1.09 (t, J=7.2 Hz, 3H).
[0383] Следующие примеры получили аналогично тому, как это описано для Примера 21.18, 21.19, и 21.20:
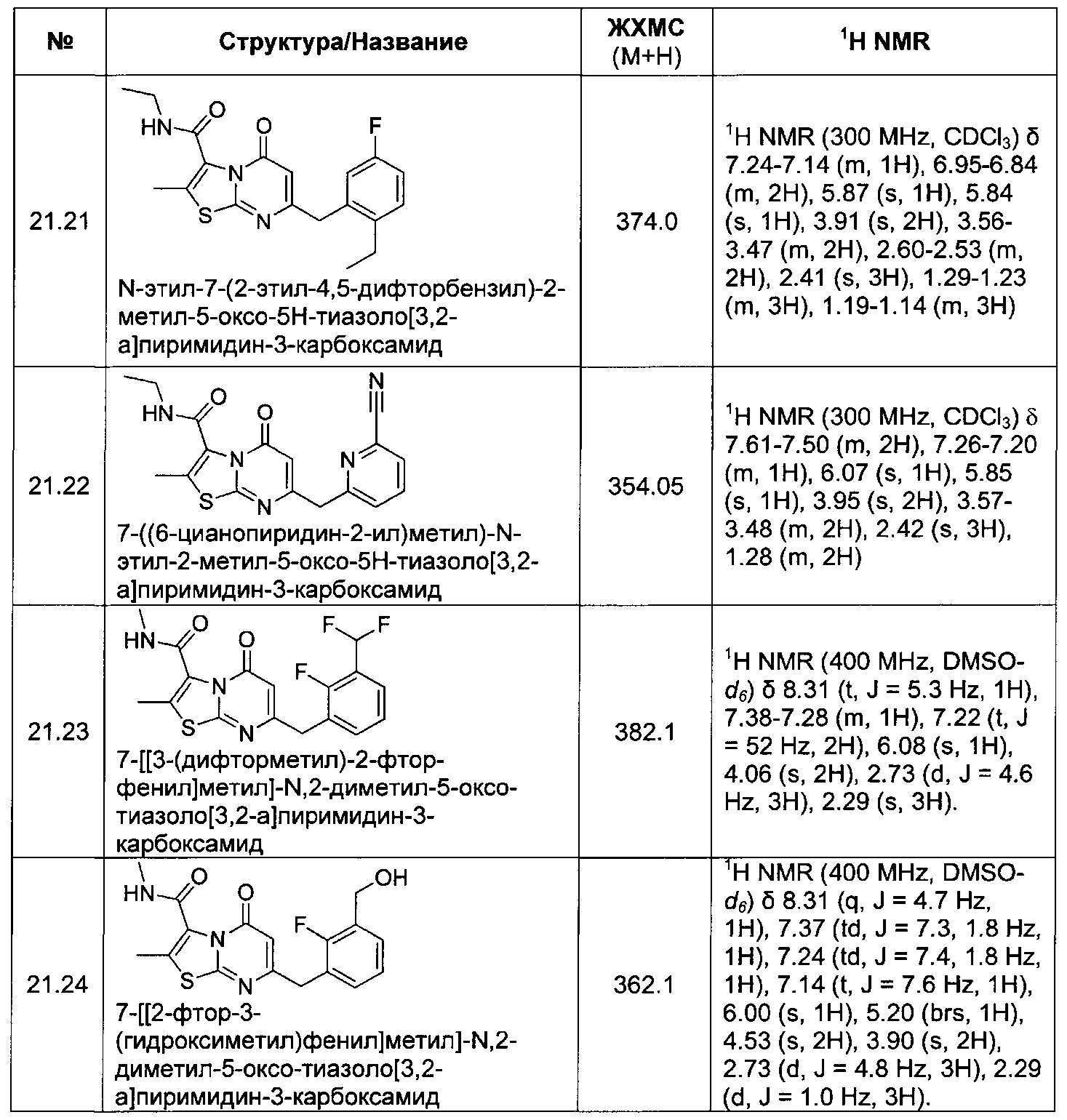
Пример 21.25: 7-(3-циклопропил-2-фторбензил)-N-этил-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0384] К раствору 7-[(3-хлор-2-фторфенил)метил]-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (полученного способом, аналогичным Примеру 21.14) (70 мг, 0.18 ммоль) в диоксане (2 мл) и воде (0.5 мл) добавили циклопропилбороновую кислоту (35 мг, 0.41 ммоль), ацетат палладия (28 мг, 0.12 ммоль) и трициклогексилфосфин (21 мг). После перемешивания в течение ночи при 90°С в атмосфере азота, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 2% метанола в дихлорметане. Неочищенный продукт очистили посредством препаративной ВЭЖХ (SunFire Prep С18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза А, вода с 10 ммоль NH4HCO3 и подвижная фаза В, CH3CN; 50.0% CH3CN повышая 82.0% в течение 10 мин, понижая до 50.0% в течение 2 мин; Детектор, УФ 254/220 нм) с получением 7-[(3-циклопропил-2-фторфенил)метил]-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (16.8 мг, 24%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 386.10; 1H NMR (300 MHz, CDCl3) δ 7.26-6.96 (m, 2H), 6.96-6.78 (m, 1H), 6.05 (s, 1H), 5.85 (br, 1H), 3.95 (s, 2H), 3.58-3.42 (m, 2H), 2.42 (s, 3Н), 2.10-2.02 (m, 1H), 1.28 (m, 3H), 1.00-0.94 (m, 2H), 0.73-0.68 (m, 2H).
Пример 21.26: 7-(3-циано-2-фторбензил)-N-этил-6-фтор-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
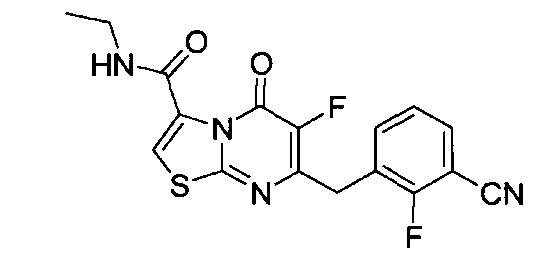
Стадия 1: 7-(3-циано-2-фторбензил)-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
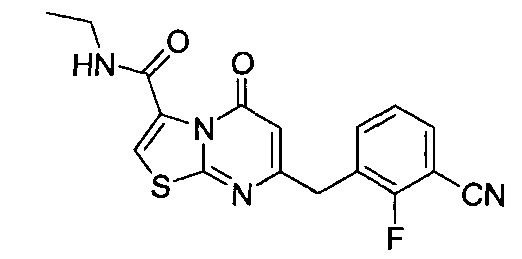
[0385] К раствору 7-(хлорометил)-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (полученного способом, аналогичным Пример 16.1, Стадия 5) (100 мг, 0.37 ммоль) в 1,4-диоксане/воде (2 мл/0.5 мл) добавили (3-циано-2-фторфенил)бороновую кислоту (121 мг, 0.73 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (28 мг, 0.04 ммоль), и карбонат натрия (78 мг, 0.74 ммоль). Реакционную смесь облучали микроволновым излучением в течение 45 мин при 100°С. Получившуюся смесь сконцентрировали под вакуумом и очистили посредством хроматографии дихлорметаном/метанолом (30:1) с получением 7-[(3-циано-2-фторфенил)метил]-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (69 мг, 53%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 357.0.
Стадия 2: 7-(3-циано-2-фторбензил)-N-этил-6-фтор-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
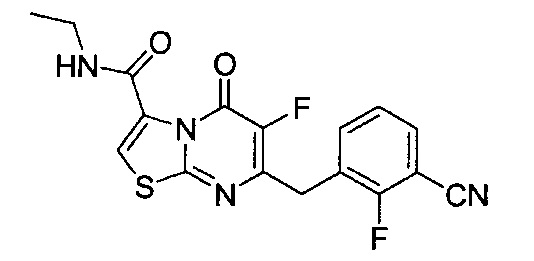
[0386] К раствору 7-[(3-циано-2-фторфенил)метил]-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (30 мг, 0.08 ммоль) в CH3CN (3 мл) добавили Selectfluor® (30 мг, 0.24 ммоль). Получившийся раствор перемешивали в течение 1.5 ч при 75°С. Получившуюся смесь охладили до комнатной температуры и сконцентрировали под вакуумом, и остаток очистили посредством хроматографии дихлорметаном/метанолом (30:1) с получением 7-[(3-циано-2-фторфенил)метил]-N-этил-6-фтор-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (8 мг, 25%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 375.0; 1H NMR (300 MHz, CDCl3) δ 7.73-7.65 (m, 2H), 7.58 (s, 1H), 7.36-7.31 (m, 1H), 4.20 (s, 2H), 3.33-3.31 (m, 2H), 1.29-1.10 (m, 3Н).
Пример 21.27: 7-(3-циано-2-фторбензил)-6-фтор-N,N-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
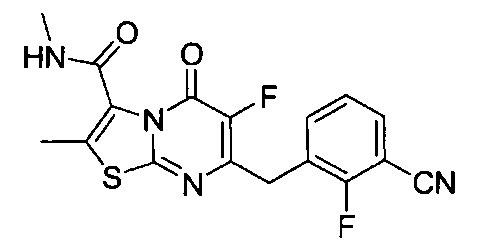
Стадия 1: 7-(хлорометил)-6-фтор-N,N-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0387] К раствору 7-(хлорометил)-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (из Примера 16.1, Стадия 5) (500 мг, 1.84 ммоль) в CH3CN (10 мл) добавили Selectfluor® (980 мг, 2.76 ммоль) и получившийся раствор перемешивали в течение 4 ч при 75°С. Получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (5:1) с получением 7-(хлорометил)-6-фтор-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (110 мг, 21%) в виде светло-желтого осадка. ЖХМС (ESI): [М+Н]+ = 290.0.
Стадия 2: 7-(3-циано-2-фторбензил)-6-фтор-N,N-диметил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
[0388] К раствору 7-(хлорометил)-6-фтор-N,2-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (100 мг, 0.35 ммоль) в 1,4-диоксане (2 мл) в атмосфере азота добавили (3-циано-2-фторфенил)бороновую кислоту (86 мг, 0.52 ммоль), карбонат натрия (74 мг, 0.70 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (26 мг, 0.04 ммоль), и воду (0.2 мл). Реакционную смесь облучали микроволновым излучением в течение 20 мин при 120°С. Получившийся раствор экстрагировали этилацетатом (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/этилацетатом (2:3), с получением 7-[(3-циано-2-фторфенил)метил]-6-фтор-N,N-диметил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (18 мг, 14%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н]+ = 374.9; 1Н NMR (300 MHz, CDCl3) δ 7.56 (m, 2H), 7.21 (m, 1H), 5.97 (s, 1H), 4.09 (m, 2H), 3.05 (m, 3H), 2.41 (s, 3Н).
[0389] Следующие примеры получили аналогично тому, как это описано для Примера 21.26 и 21.27:
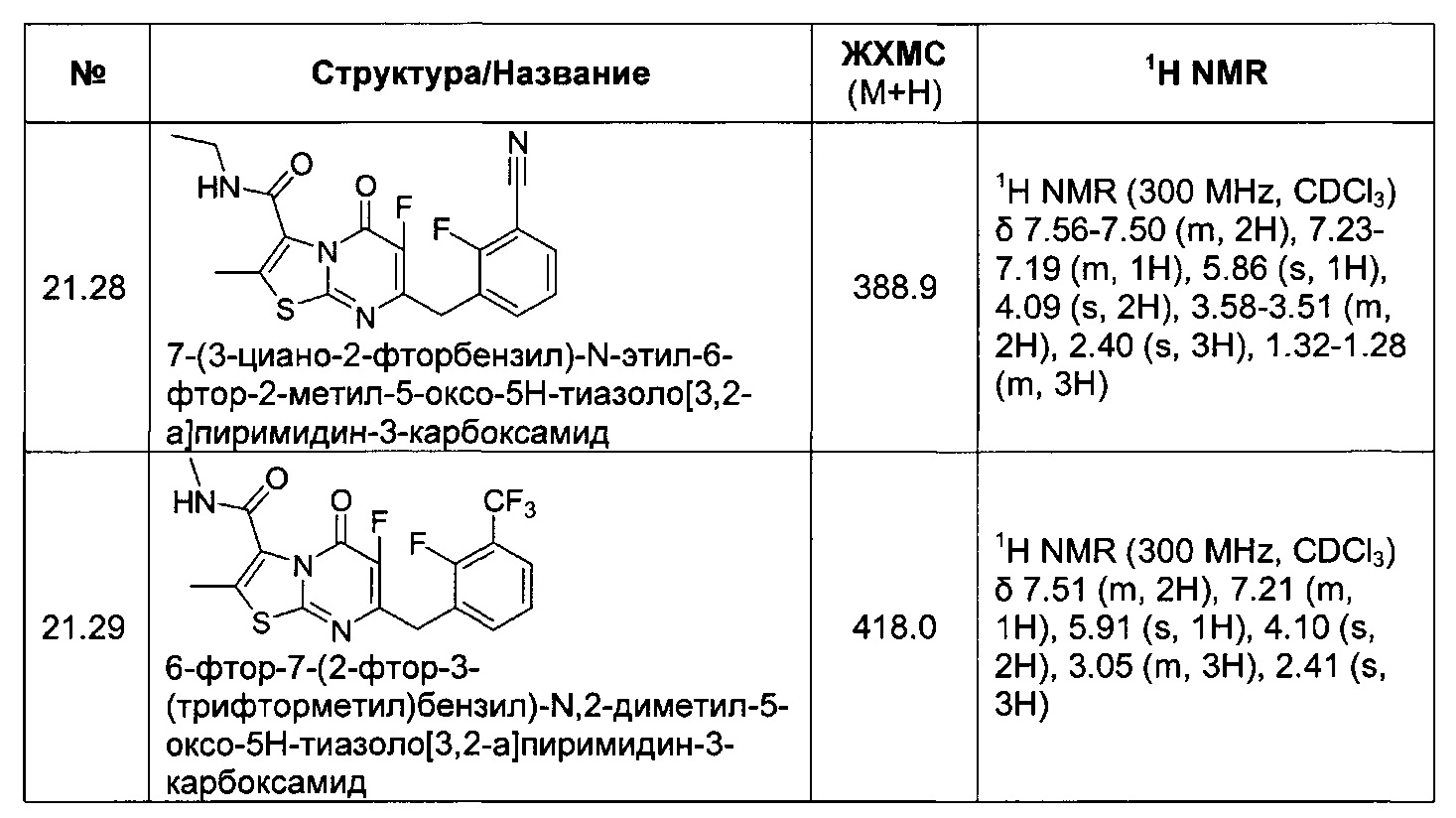
[0390] Следующие соединения получили с использованием способов, аналогичных описанным выше
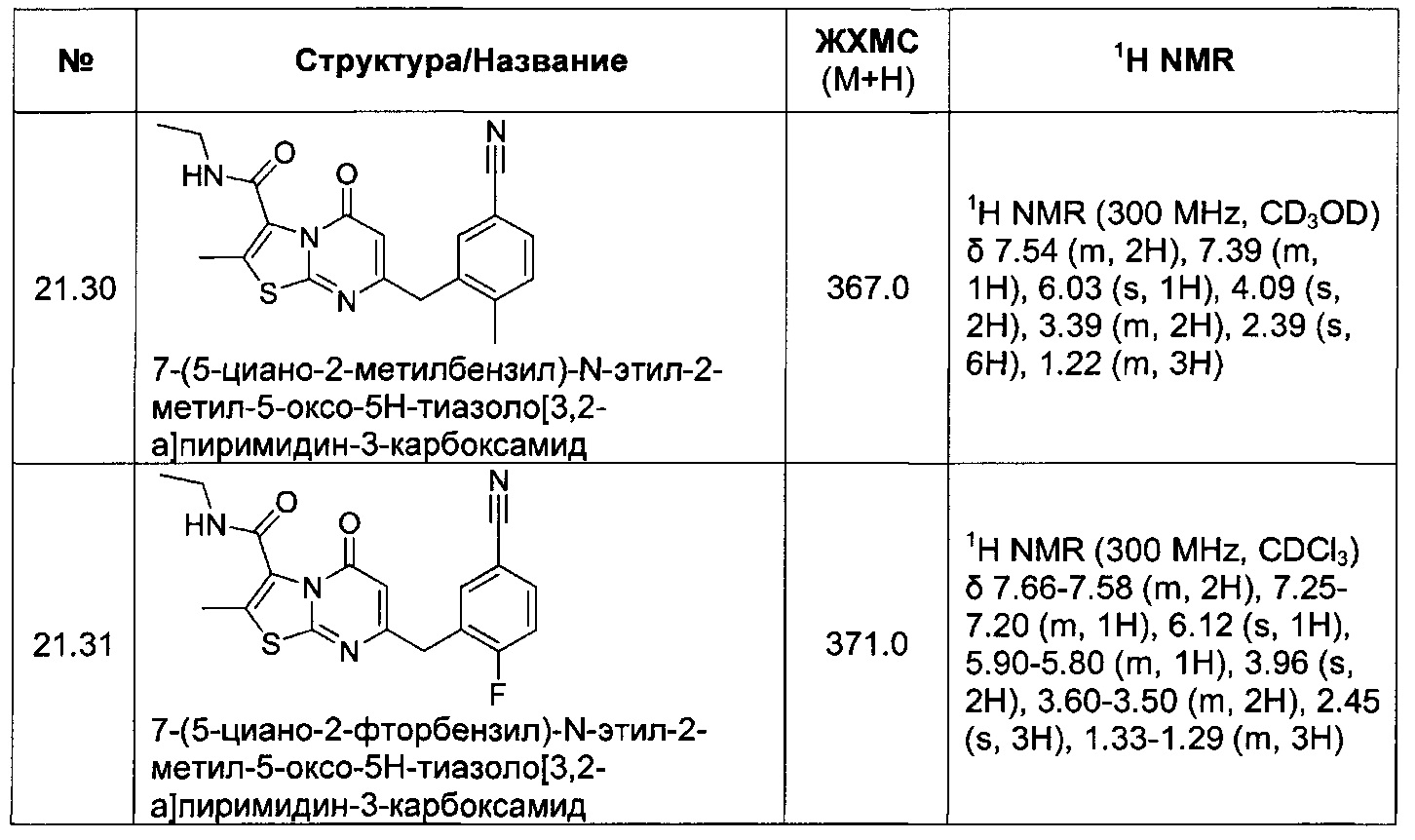
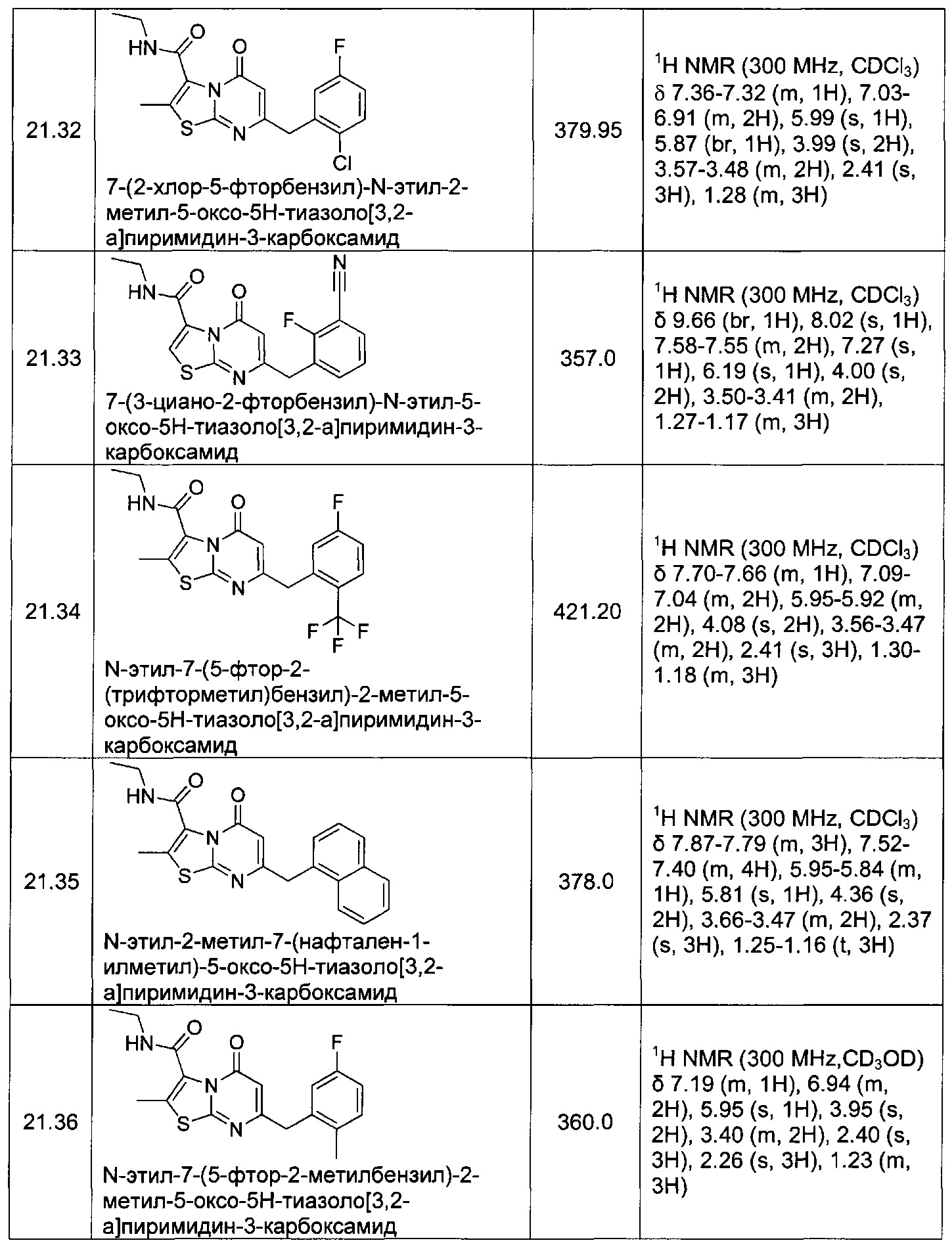
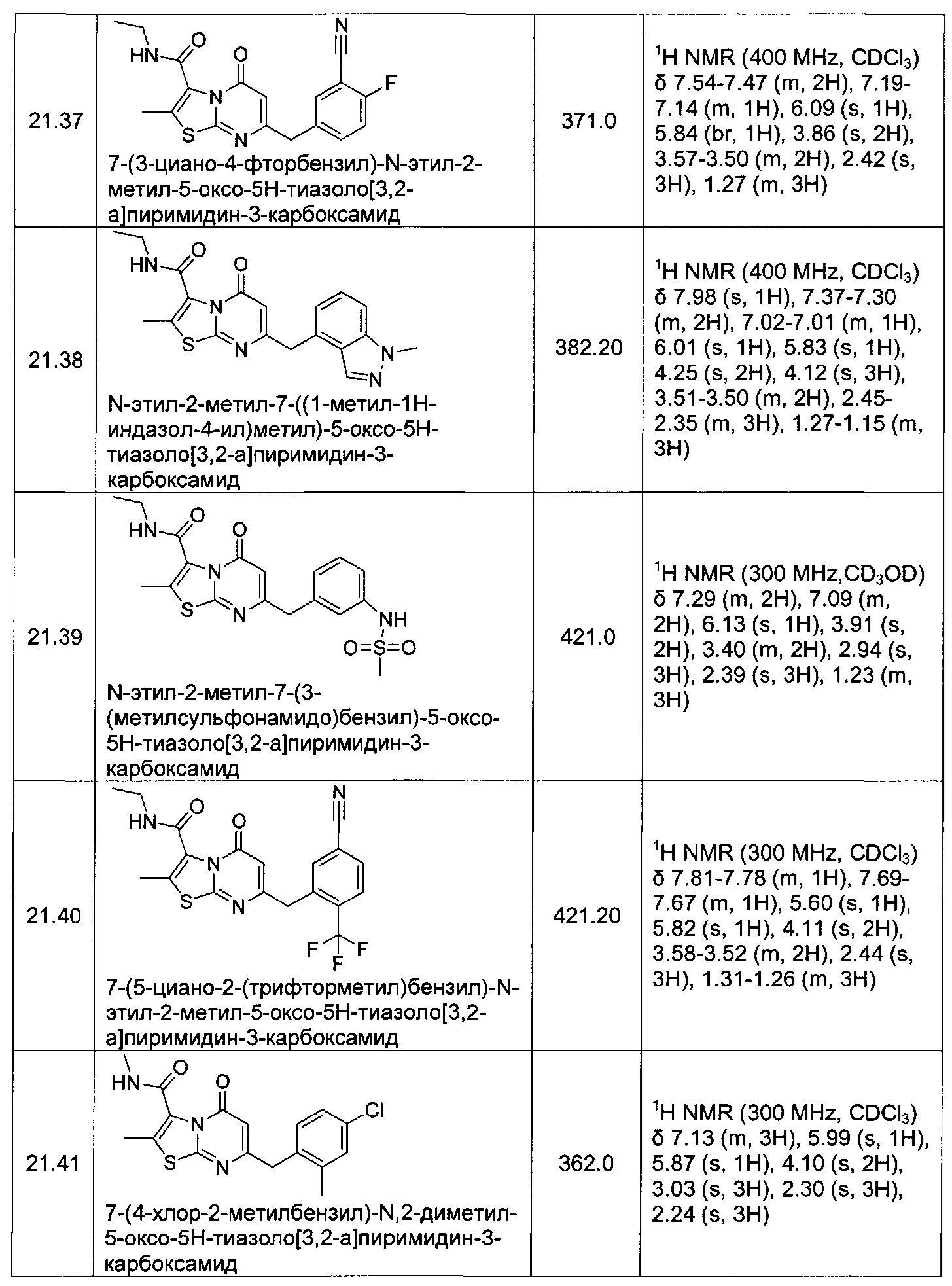
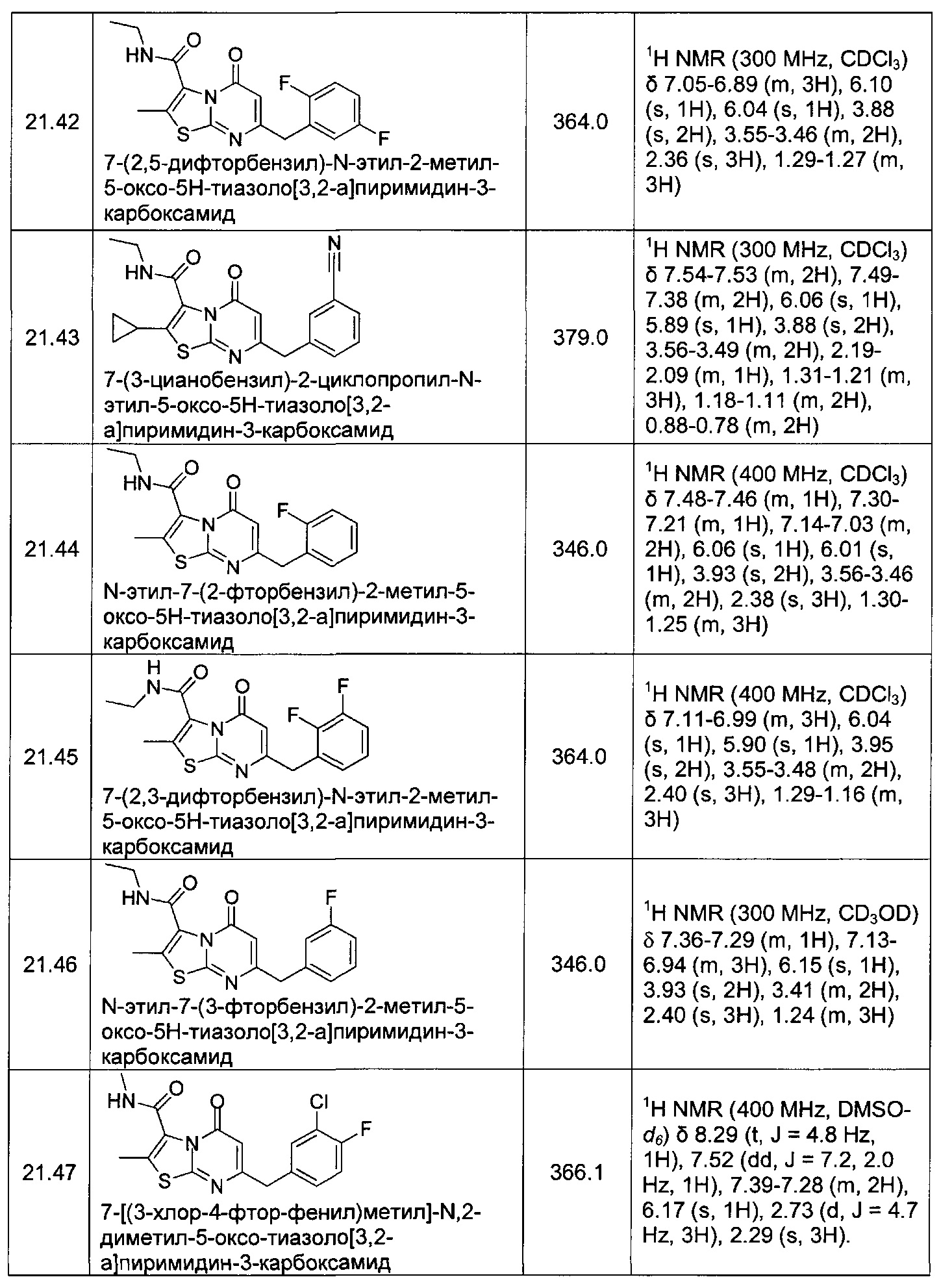
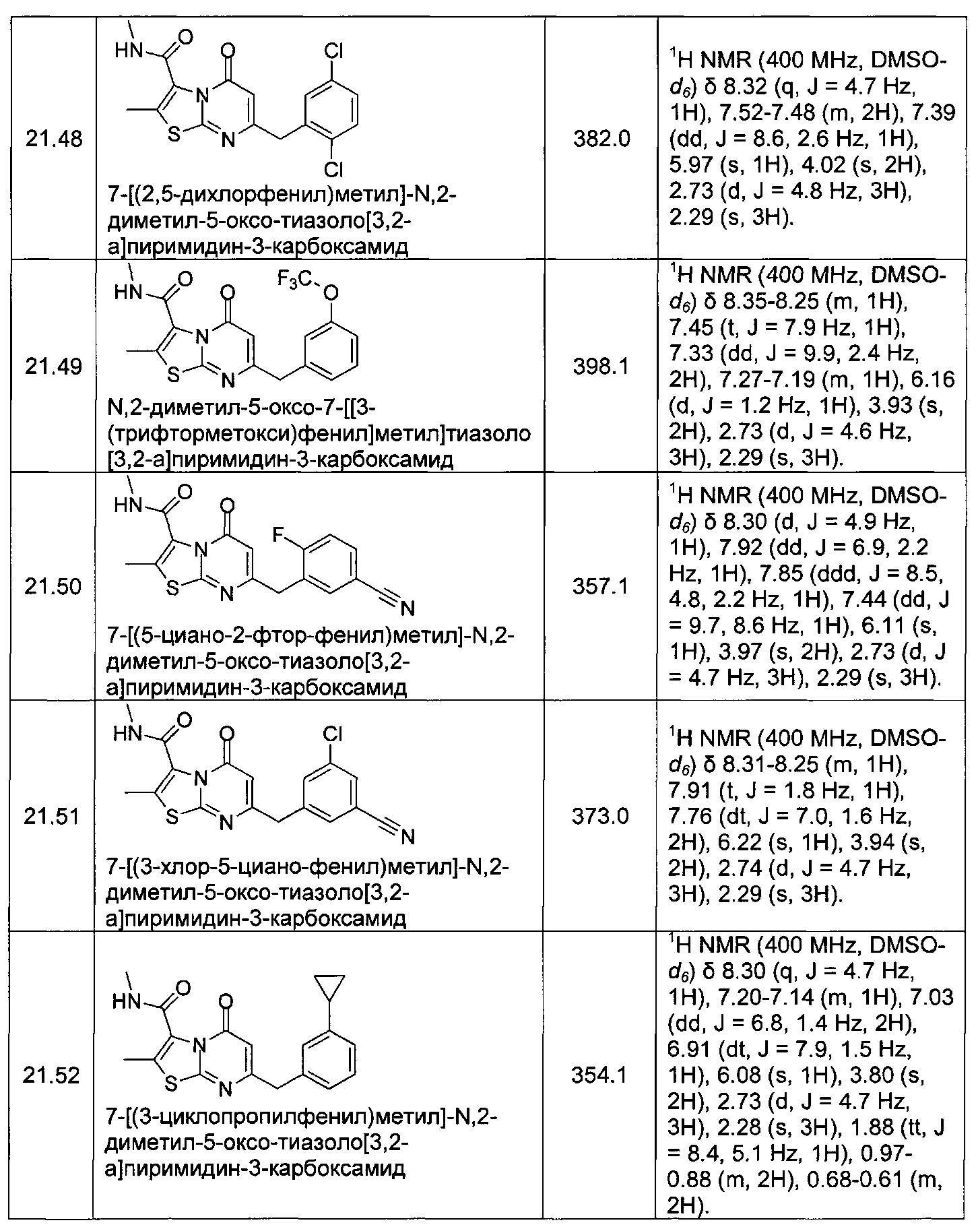
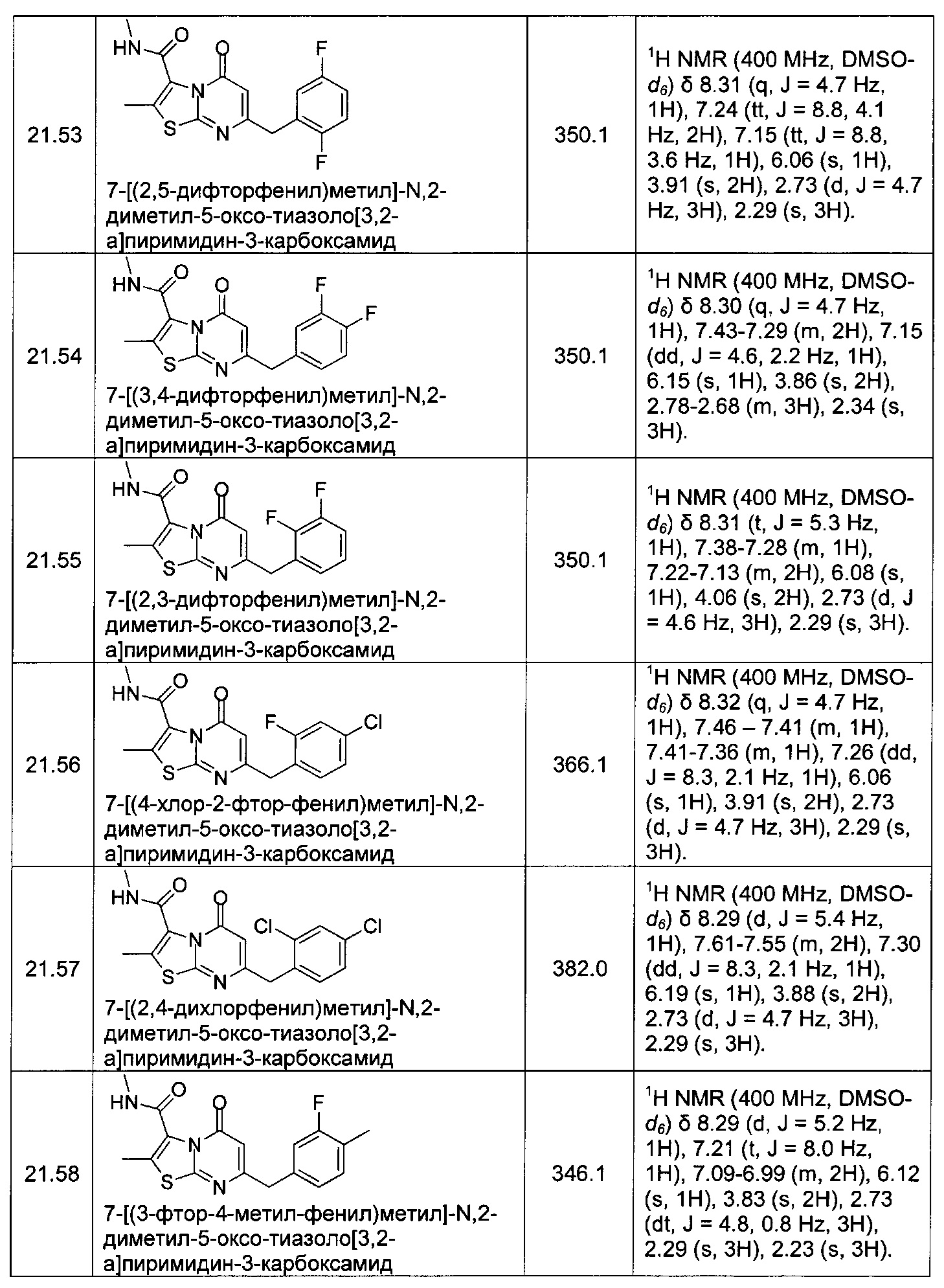
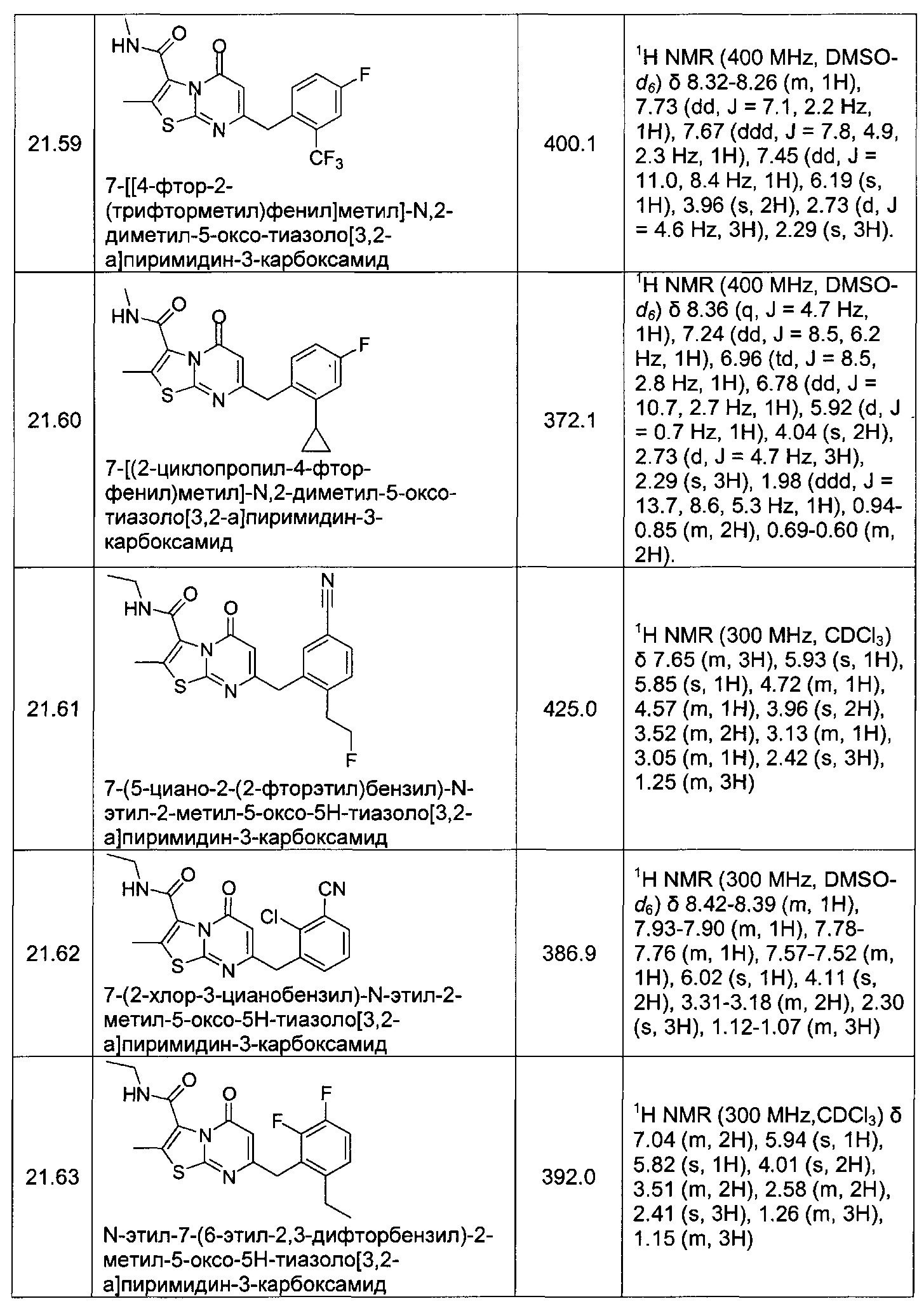
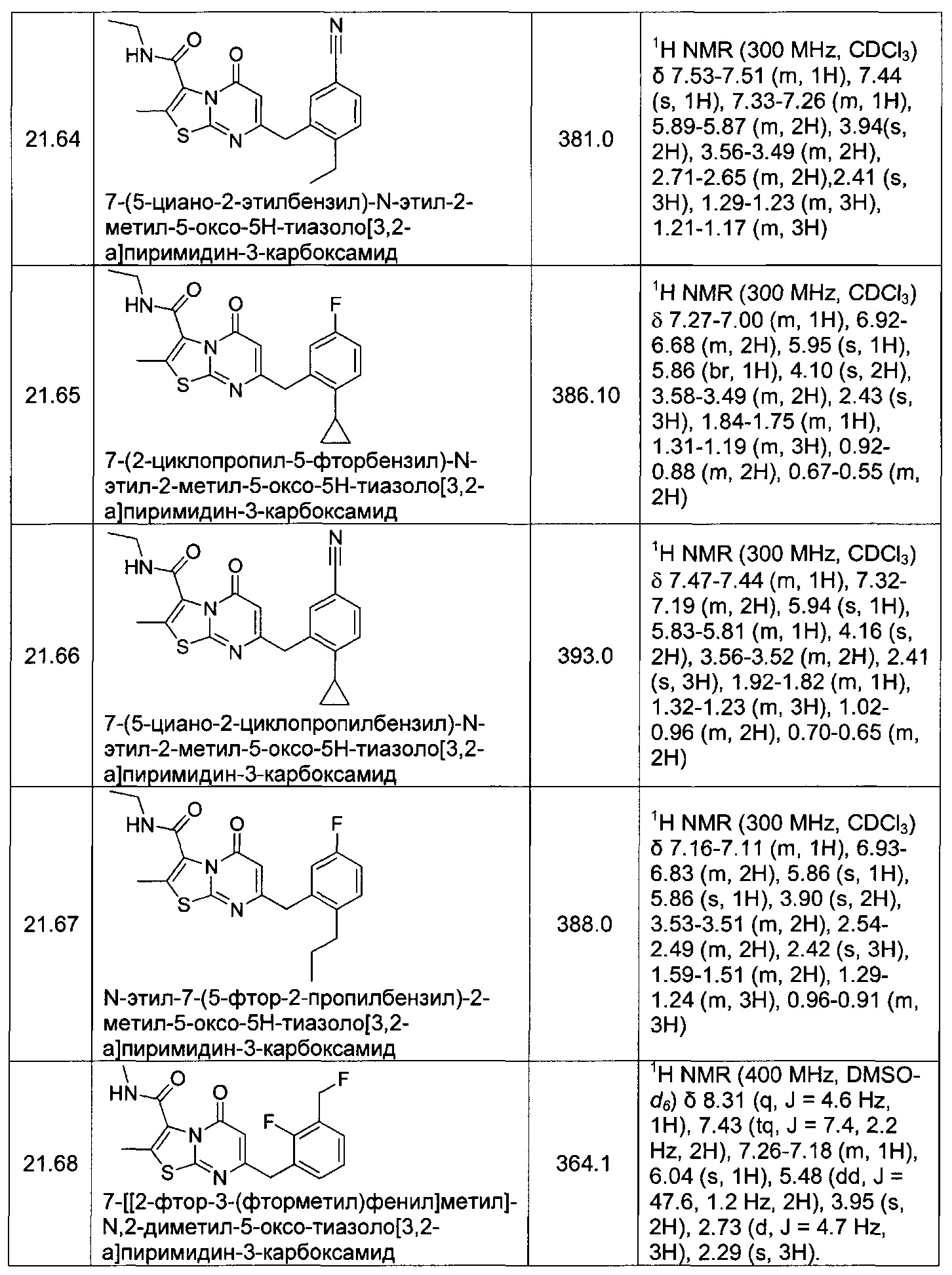
Способ 22:
Пример 22.1: N-этил-7-(1-(2-фтор-3-(трифторметил)фенил)этил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
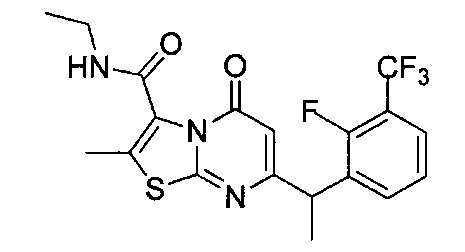
Стадия 1: N-этил-7-(1-(2-фтор-3-(трифторметил)фенил)этил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
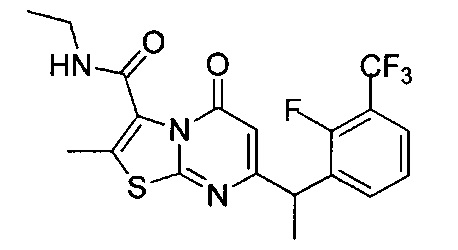
[0391] К -78°С раствору N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (из Примера 21.12) (200 мг, 0.48 ммоль) в тетрагидрофуране (20 мл) добавили н-бутиллитий (2.5 М в гексанах; 1 мл). Через 30 мин при -78°С добавили йодометан (235 мг, 1.66 ммоль). Получившийся раствор перемешивали в течение 3 ч при комнатной температуре. Затем реакционную смесь погасили водой (20 мл), экстрагировали дихлорметаном (3×30 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50:1) с получением N-этил-7-[1-[2-фтор-3-(трифторметил)фенил]этил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (52.7 мг, 25%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 428.0; 1H NMR (300 MHz, CDCl3) δ 7.60-7.48 (m, 2H), 7.20-7.19 (m, 1H), 6.13 (s, 1H), 5.92 (m, 1H), 4.42-4.34 (m, 2H), 3.56-3.48 (m, 2H), 2.40 (s, 3Н), 1.64-1.62 (m, 3H), 1.30-1.25 (m, 3Н).
[0392] Следующее соединение получили с использованием способов, аналогичных описанным выше
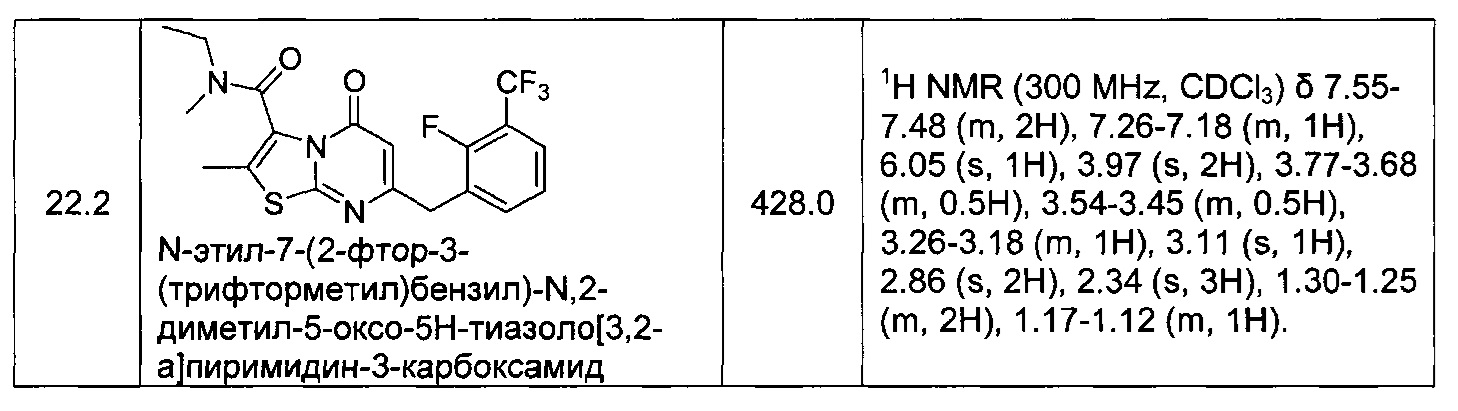
Способ 23:
Пример 23.1: 3-((3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
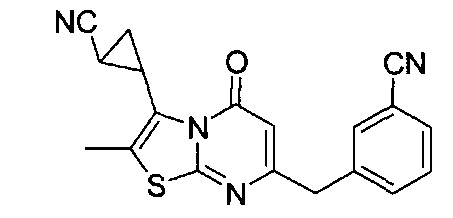
Стадия 1: 3-((3-бромо-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
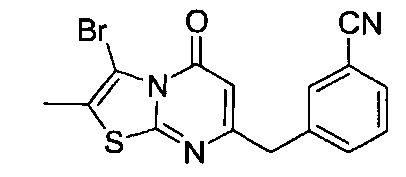
[0393] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (500 мг, 1.70 ммоль) в 1,4-диоксане/H2O (3/1 мл) добавили (3-цианофенил)бороновую кислоту (300 мг, 2.04 ммоль), тетракис(трифенилфосфин)палладий (197 мг, 0.17 ммоль) и фосфат калия (730 мг, 3.44 ммоль). Получившийся раствор перемешивали в течение ночи при 80°С. После охлаждения до комнатной температуры, получившуюся смесь промыли солевым раствором (30 мл), экстрагировали дихлорметаном (3×20 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле с помощью смеси этилацетат/петролейный эфир (1:2) с получением 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила в виде светло-коричневого осадка (522 мг, 85%). ЖХМС [М+Н]+ = 360.0, 362.0.
Стадия 2: этил 2-(7-(3-цианобензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксилат.
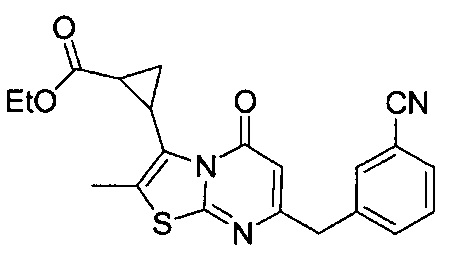
[0394] К раствору 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (200 мг, 0.56 ммоль) в CH3CN/H2O (3/1 мл) добавили этил 2-(тетраметил-1,3,2-диоксаборолан-2-ил)циклопропан-1-карбоксилат (из Примера 4.18, Стадия 1) (267 мг, 1.11 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (42 мг, 0.06 ммоль) и карбонат калия (154 мг, 1.11 ммоль). Реакционную смесь нагревали при воздействии микроволнового излучения в течение 1.5 ч при 120°С. Получившуюся смесь промыли солевым раствором (20 мл), экстрагировали дихлорметаном (3×20 мл), высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50:1) с получением этил 7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата (68 мг 35%) в виде коричневого осадка. ЖХМС (ESI): [М+Н]+ = 394.0.
Стадия 3: 2-(7-(3-цианобензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоновая кислота.
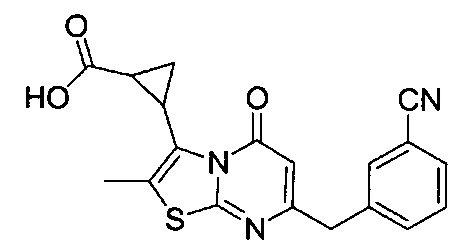
[0395] К раствору 7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксилата (68 мг, 0.17 ммоль) в ТГФ/H2O (2/1 мл) добавили гидроксид лития (73 мг, 1.7 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре. рН раствора довели до рН 7 с помощью раствора соляной кислоты (водн.) и получившуюся смесь экстрагировали этилацетатом (3×20 мл), промыли солевым раствором, высушили над сульфатом натрия и сконцентрировали под вакуумом с получением 2-[7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоновой кислоты (80 мг, неочищенная) в виде коричневого осадка. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): [М+Н]+ = 366.0.
Стадия 4: 2-(7-(3-цианобензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбоксамид.
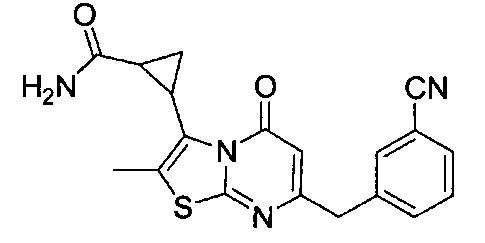
[0396] К раствору 2-[7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоновой кислоты (80 мг, 0.22 ммоль) в тетрагидрофуране (5 мл) добавили пропан-2-ил хлорформиат (40.4 мг, 0.33 ммоль), триэтиламин (44 мг, 0.43 ммоль) и аммоний (2 мл, 25 мас. % в воде). Получившийся раствор перемешивали в течение 1 ч при комнатной температуре и сконцентрировали под вакуумом, и остаток очистили посредством хроматографии дихлорметаном/метанолом (30:1) с получением 2-[7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксамида (21 мг, 26%) в виде коричневого осадка. ЖХМС (ESI): [М+Н]+ = 364.9.
Стадия 5: 3-((3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)бензонитрил.
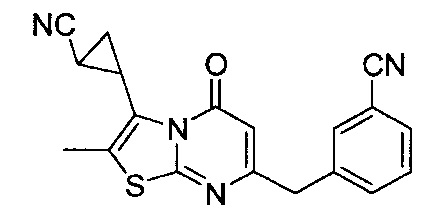
[0397] К раствору 2-[7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбоксамида (17 мг, 0.05 ммоль) в метиленхлориде (10 мл) добавили 1,8-диазабицикло[5.4.0]ундец-7-ен (0.25 мл) и этоксифосфоноил дихлорид (0.25 мл). Получившийся раствор перемешивали в течение 1 ч при комнатной температуре. Затем реакционную смесь погасили водой (30 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, и сконцентрировали под вакуумом. Остаток очистили на колонке с силикагелем с элюцией дихлорметаном/метанолом (50:1) с получением 3-[[3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил]бензонитрила (12.6 мг, 78%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н]+ = 347.0; 1H NMR (300 MHz, CDCl3) δ 7.69-7.60 (m, 3H), 7.53-7.47 (m, 1H), 6.16 (s, 1H), 3.94 (s, 2H), 2.92-2.88 (m, 1H), 2.39 (s, 3H), 1.96-1.92 (m, 1H), 1.81-1.74 (m, 1H), 1.59-1.52 (m, 1H).
Пример 23.2: 3-((3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)-2-фторбензонитрил.
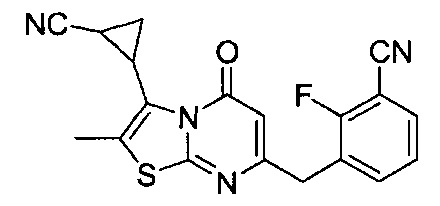
Стадия 1: 3-((3-бромо-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)-2-фторбензонитрил.
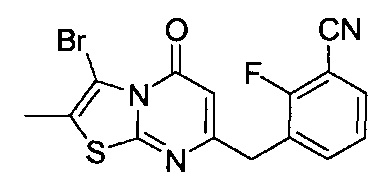
[0398] Смесь 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (из Примера 4.1, Стадия 6) (500 мг, 1.70 ммоль), фосфата калия (733 мг, 3.45 ммоль), тетракис(трифенилфосфин)палладия (198 мг, 0.17 ммоль), (3-циано-2-фторфенил)бороновой кислоты (339 мг, 2.06 ммоль), 1,4-диоксана (6 мл) и воды (1 мл) перемешивали в течение ночи при 80°С в 30-мл закрытой пробирке. Получившуюся смесь разбавили солевым раствором и экстрагировали 3×30 мл дихлорметана, и объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия, и сконцентрировали под вакуумом. Остаток очистили с помощью хроматографии на силикагеле дихлорметаном/метанолом (80:1) с получением 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрила (70 мг, 11%) в виде желтого осадка. ЖХМС (ESI): [М+Н]+ = 378.
Стадия 2: 3-((3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)-2-фторбензонитрил.
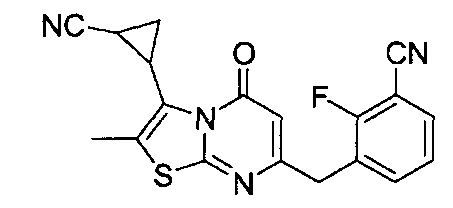
[0399] К раствору 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрила (100 мг, 0.26 ммоль) в 1,4-диоксане/Н2О (2 мл/0.5 мл) добавили тетракис(трифенилфосфин)палладий (31 мг, 0.03 ммоль,), фосфат калия (112 мг, 0.53 ммоль), и калия транс-2-цианоциклопропилтрифторборат (полученный аналогично тому, как это описано для Примера 4.1, Стадия 2) (92 мг, 0.53 ммоль). Получившийся раствор перемешивали в течение 3 ч при 80°С. После фильтрации для удаления осадков, фильтрат сконцентрировали под вакуумом и очистили посредством хроматографии дихлорметаном/метанолом (100:1) с получением 3-[[3-(2-цианоциклопропил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил]-2-фторбензонитрила (16 мг, 17%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 364.9; 1H NMR (300 MHz, CDCl3) δ 7.60-7.54 (m, 2H), 7.28-7.21 (m, 1H), 6.03 (s, 1H), 3.94 (s, 2H), 3.00-2.94 (m, 1H), 2.43 (s, 3Н), 1.90-1.80 (m, 1H), 1.79-1.70 (m, 1H), 1.45-1,35 (m, 1H).
[0400] Следующий пример получили аналогично тому, как это описано для Примера 23.1 и 23.2:
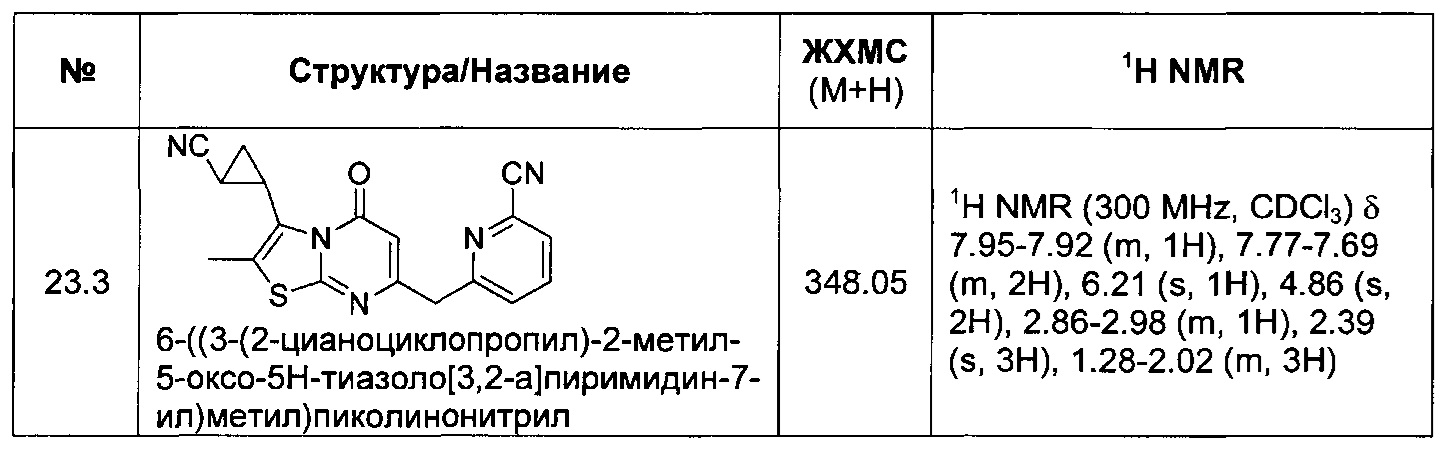
[0401] Следующее соединение получили с использованием способов, аналогичных описанным выше
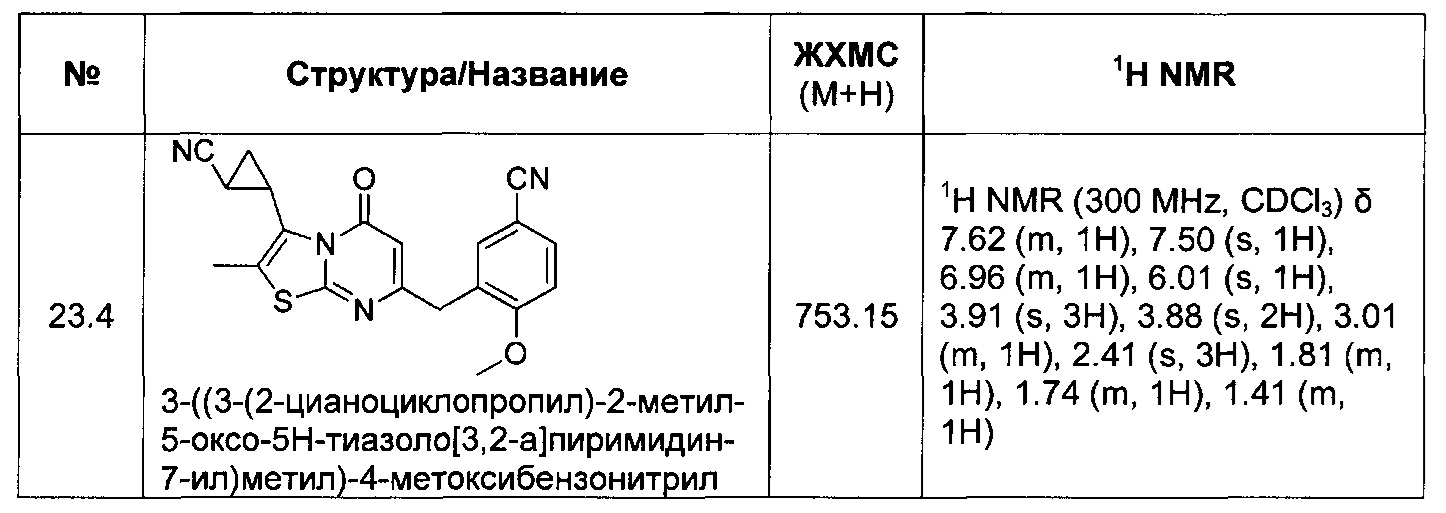
Способ 24:
Пример 24.1: 2-метил-3-(пиримидин-5-ил)-7-(3-(трифторметил)бензил)-5Н-тиазоло[3,2-а]пиримидин-5-он
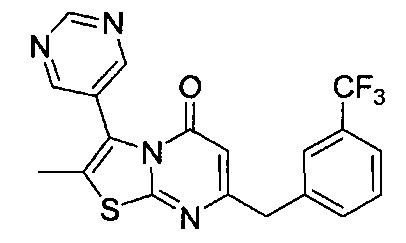
[0402] К раствору 3-бромо-2-метил-7-[[3-(трифторметил)фенил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (полученного аналогично тому, как это описано для Примера 21.1, Стадия 1) (60 мг, 0.15 ммоль) в 1,4-диоксане (2 мл) добавили (пиримидин-5-ил)бороновую кислоту (37 мг, 0.30 ммоль), фосфат калия (64 мг, 0.30 ммоль), тетракис(трифенилфосфин)палладий (17 мг, 0.01 ммоль) и воду (0.2 мл). Получившийся раствор перемешивали в течение 3 ч при 90°С на масляной бане. Получившийся раствор погасили водой (10 мл), экстрагировали дихлорметаном (3×20 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток затем очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:2.5) с получением 2-метил-3-(пиримидин-5-ил)-7-[[3-(трифторметил)фенил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (27.7 мг, 46%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н+41]+ 444.1; 1H NMR (300 MHz, CD3OD) δ 9.18 (s, 1H), 8.82 (s, 2H), 7.65-7.55 (m, 4H), 6.11 (s, 1Н), 4.03 (s, 2H), 2.28 (s, 3H).
[0403] Следующие примеры получили аналогично тому, как это описано для Примера 24.1:
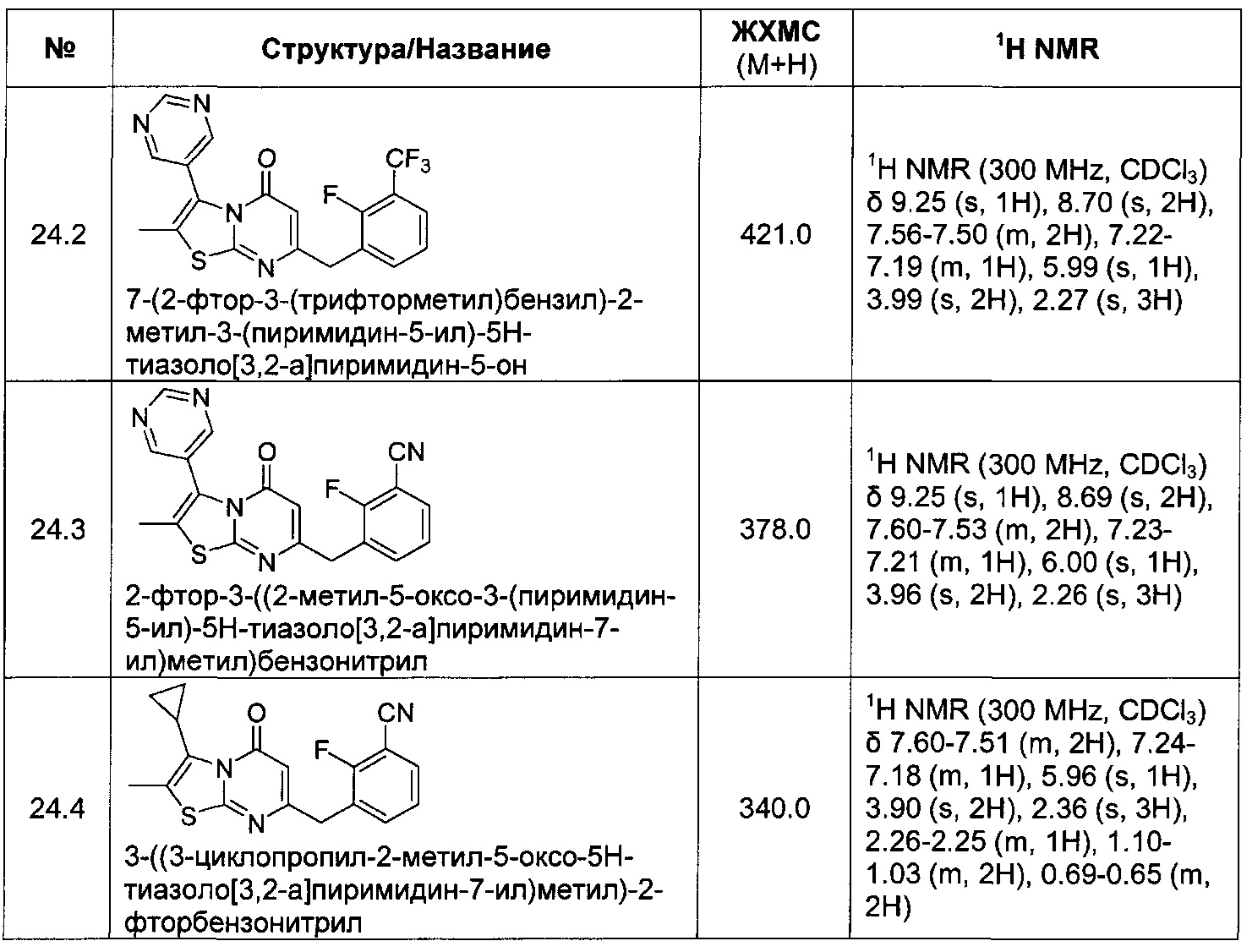
[0404] Следующие соединения получили с использованием способов, аналогичных описанным выше
Способ 25:
Пример 25.1: 7-(3-циано-2-фторбензил)-2-метил-5-оксо-N-(2,2,2-трифторэтил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
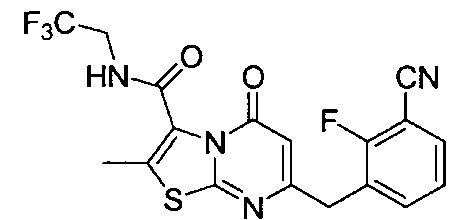
Стадия 1: этил 7-(3-циано-2-фторбензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилат.
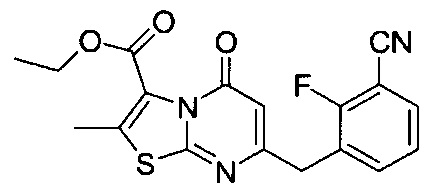
[0405] К раствору этил 7-(хлорометил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата (500 мг, 1.74 ммоль) в диоксане (2 мл) и воде (0.5 мл) добавили (3-циано-2-фторфенил)бороновую кислоту (375 мг, 2.27 ммоль), карбонат натрия (370 мг, 3.49 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (77 мг, 0.11 ммоль). После перемешивания 20 минут при 120°С в атмосфере азота, получившуюся смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 10% этилацетата в дихлорметане с получением этил 7-[(3-циано-2-фторфенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата (23.1 мг, 18%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ = 372.0; 1H NMR (300 MHz, CDCl3) δ 7.72-7.66 (m, 2H), 7.36-7.31 (m, 1H), 6.19 (s, 1H), 4.44-4.37 (m, 2H), 4.06 (s, 2H), 2.43 (s, 3Н), 1.36 (m, 3Н).
Стадия 2: 7-(3-циано-2-фторбензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоновая кислота.
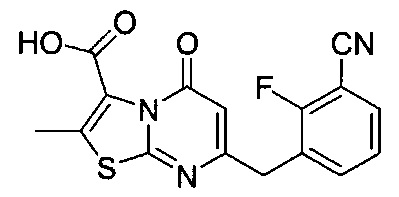
[0406] К раствору этил 7-[(3-циано-2-фторфенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксилата (полученного аналогично тому, как это описано для Примера 21.1) (100 мг, 0.27 ммоль) в тетрагидрофуране (3 мл) добавили гидроксид лития (64 мг, 2.67 ммоль) в воде (3 мл). Получившийся раствор перемешивали в течение 3 дней при комнатной температуре. Реакционную смесь разбавили дихлорметаном (20 мл) и водой (5 мл). рН водного слоя довели до рН 6 с помощью хлороводорода. Получившийся раствор экстрагировали дихлорметаном (3×10 мл), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 7-[(3-циано-2-фторфенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоновой кислоты (22 мг, 24%) в виде коричневого осадка. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХМС (ESI): [М+Н]+ = 344.0.
Стадия 3: 7-(3-циано-2-фторбензил)-2-метил-5-оксо-N-(2,2,2-трифторэтил)-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
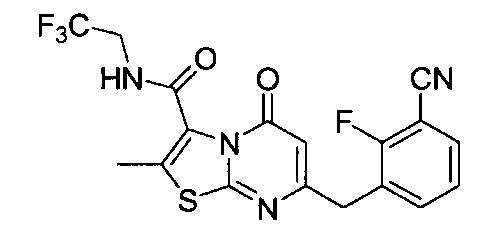
[0407] К раствору 7-[(3-циано-2-фторфенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоновой кислоты (60 мг, 0.17 ммоль) в N,N-диметилформамиде (9 мл) добавили 2,2,2-трифторэтан-1-амин (36 мг, 0.36 ммоль), N-гидроксибензотриазол (36 мг, 0.27 ммоль), N,N-диизопропилэтиламин (66 мг, 0.51 ммоль) и 1,1'-тиокарбонилдиимидазол (48 мг, 0.27 ммоль). После перемешивания в течение 5 ч при комнатной температуре, смесь разбавили водой (5 мл). Получившийся раствор экстрагировали дихлорметаном (20 мл × 3), промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью 1% метанола в дихлорметане. Неочищенный продукт очистили посредством препаративной ВЭЖХ (SunFire Prep C18 OBD Колонка, 5 мкм, 19 × 150 мм; подвижная фаза, вода с 10 ммоль NH4HCO3 и CH3CN (50.0% CH3CN повышая до 82.0% в течение 10 мин, понижая до 50.0% в течение 2 мин); Детектор, УФ 254/220 нм) с получением 7-[(3-циано-2-фторфенил)метил]-2-метил-5-оксо-N-(2,2,2-трифторэтил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (20.8 мг, 28%) в виде белого осадка. ЖХМС (ESI): [М+Н]+ 424.95; 1H NMR (300 MHz, CD3OD) δ 7.72-7.66 (m, 2H), 7.36-7.31 (m, 1H), 6.19 (s, 1H), 4.15-4.06 (m, 4H), 2.40 (s, 3H).
[0408] Следующий пример получили аналогично тому, как это описано для Примера 25.1:
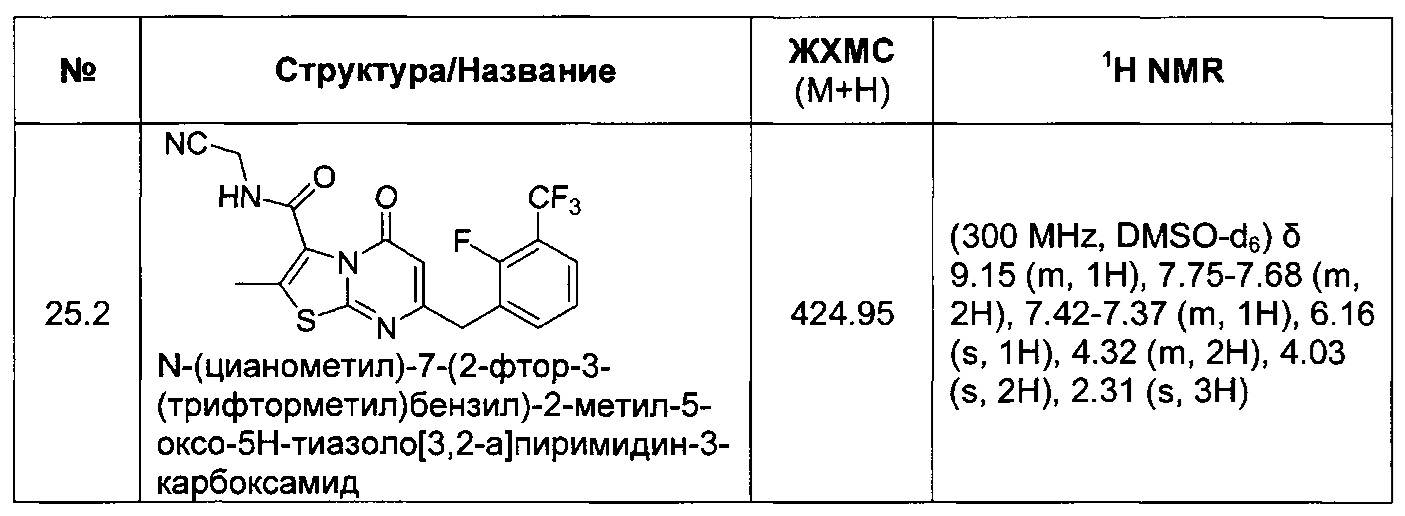
Способ 26:
Пример 26.1: 7-(3-цианобензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбонитрил.
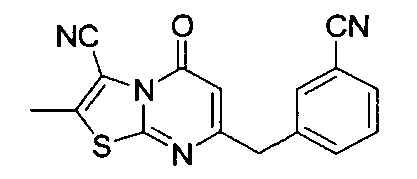
Стадия 1: 7-(3-цианобензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбонитрил.
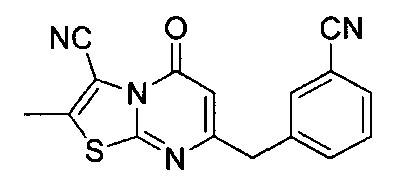
[0409] К раствору 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (из Примера 21.1, Стадия 1) (100 мг, 0.28 ммоль) в N,N-диметилформамиде (10 мл) в инертной атмосфере добавили цианид меди (49 мг, 0.55 ммоль). Получившийся раствор перемешивали в течение 1 ч при 100°С. После охлаждения до комнатной температуры, реакционную смесь сконцентрировали под вакуумом. Остаток очистили посредством хроматографии дихлорметаном/метанолом (50:1) с получением 7-[(3-цианофенил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбонитрила (8.4 мг, 10%) в виде серо-белого осадка. ЖХМС (ESI): [М+Н]+ = 306.9; 1H NMR (300 MHz, CDCl3) δ 7.60-7.56 (m, 2H), 7.51-7.41 (m, 2H), 6.17 (s, 1H), 3.91 (s, 2H), 2.65 (s, 3H).
[0410] Следующий пример получили аналогично тому, как это описано для Примера 26.1:
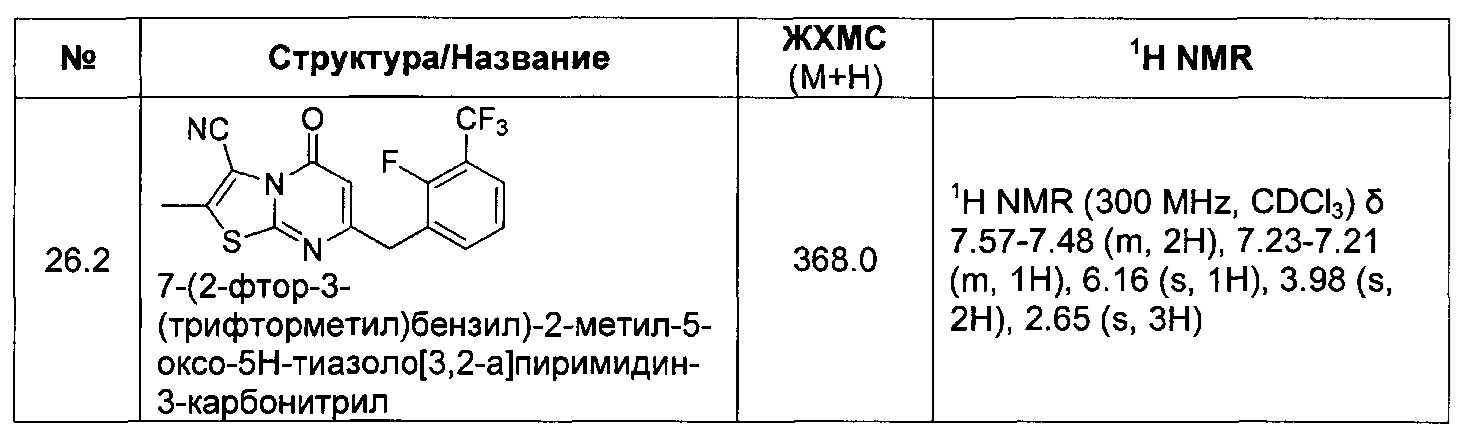
[0411] Следующие соединения получили с использованием способов, аналогичных описанным здесь.
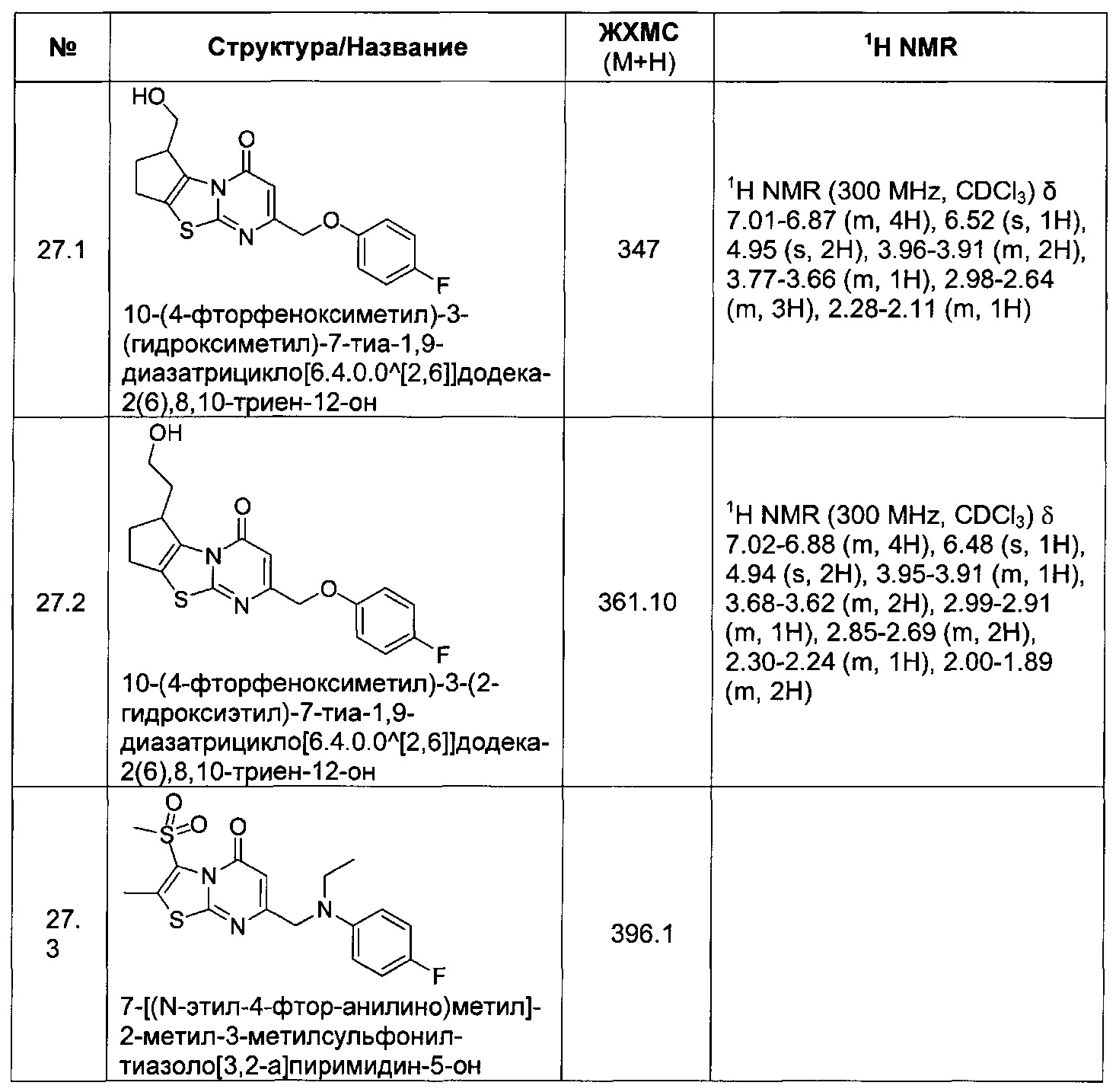
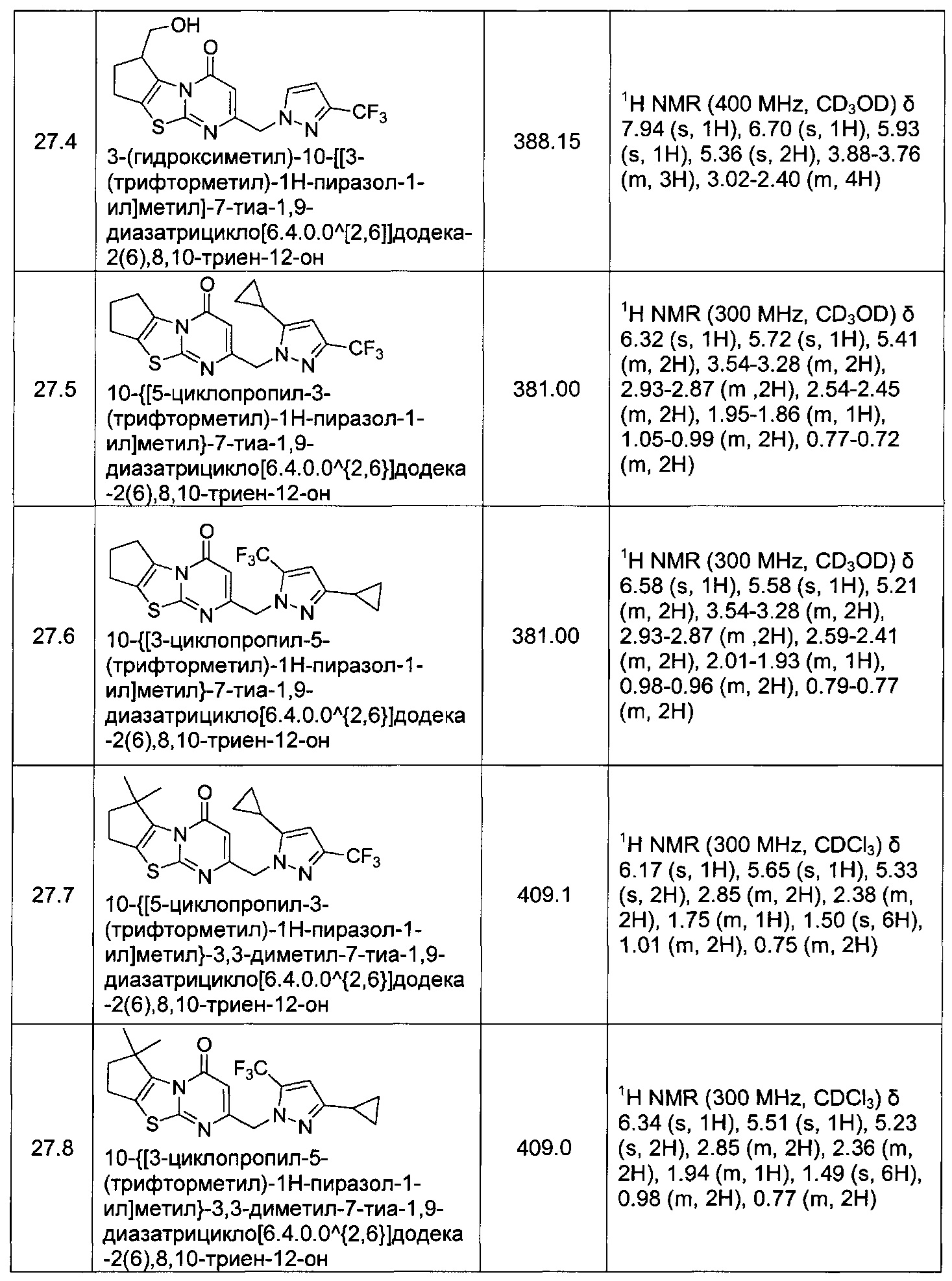
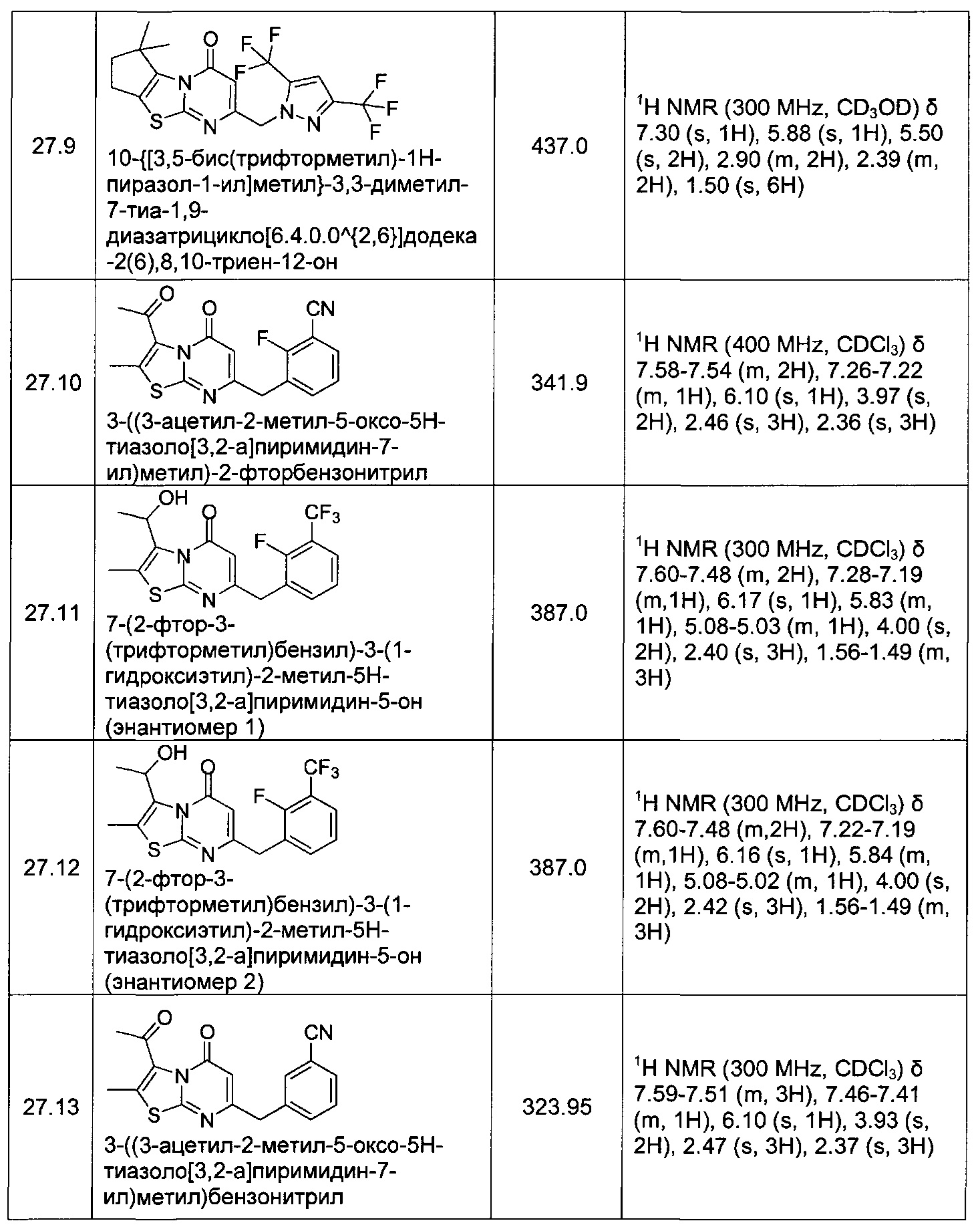
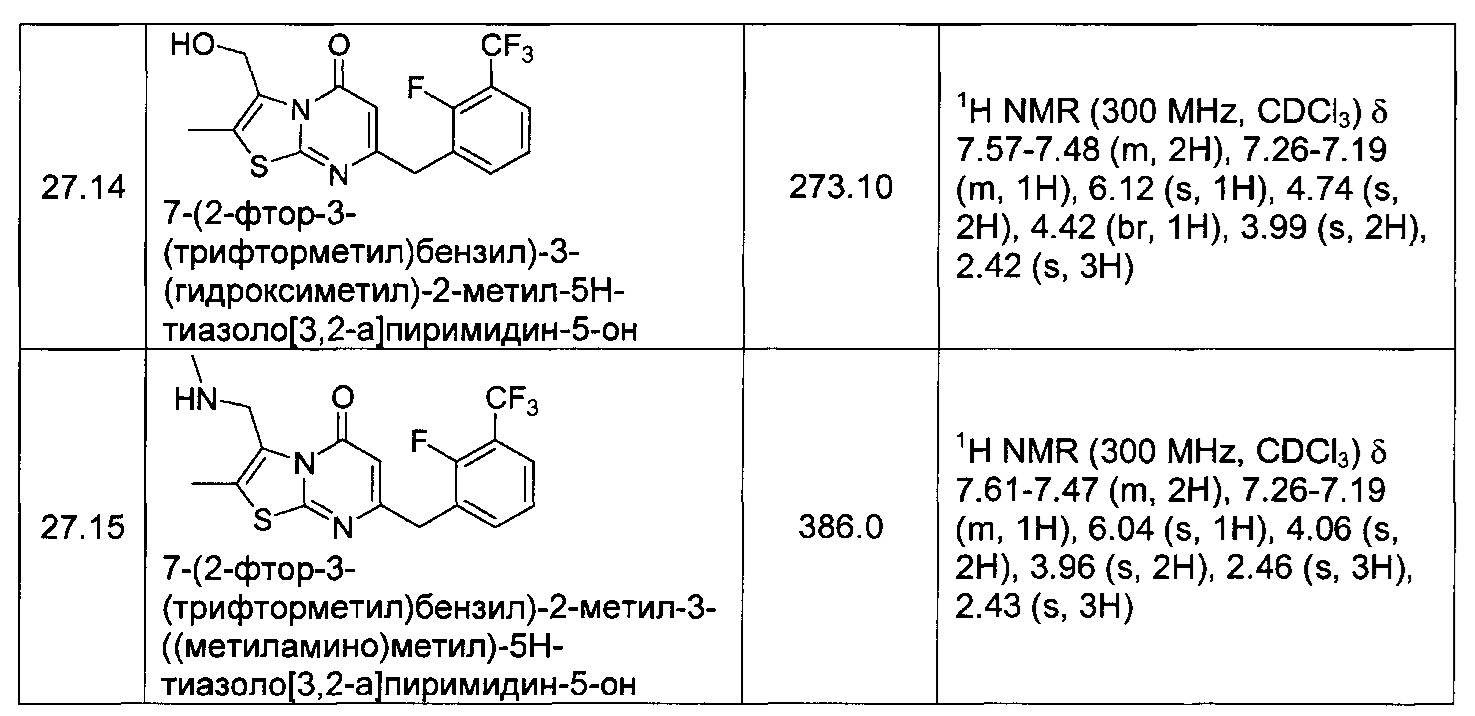
Пример 12: 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[3-(трифторметил)фенокси]тиазоло[3,2-а]пиримидин-5-он
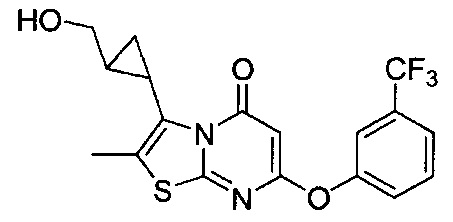
Стадия 1: 7-гидрокси-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0412] К раствору 5-метил-1,3-тиазол-2-амина (10 г, 87.6 ммоль) в ксилене (300 мл) добавили 1,3-диметилпропандиоат (23 г, 174 ммоль) и перемешивали в течение ночи при 150°С. Получившуюся смесь сконцентрировали под вакуумом с получением 7-гидрокси-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (14.6 г, 91%) в виде светло-коричневого осадка. ЖХМС (ESI): M+H+ = 183.0;
Стадия 2: 7-хлор-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
[0413] К раствору 7-гидрокси-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (30 г, 165 ммоль) в оксихлориде фосфора (250 мл, 2.68 моль) перемешивали в течение 5 ч при 110°С. Получившийся раствор сконцентрировали под вакуумом. Остаток очистили посредством хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (30/1) с получением 7-хлор-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (2.34 г, 7%) в виде желтого осадка. ЖХМС (ESI): М+Н+ = 201.0.
Стадия 3: 2-метил-7-(3-(трифторметил)фенокси)-5Н-тиазоло[3,2-а]пиримидин-5-он.
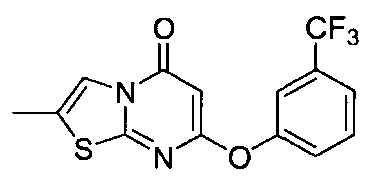
[0414] К раствору 7-хлор-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (500 мг, 2.50 ммоль) в N,N-диметилформамиде (50 мл) добавили 3-(трифторметил)фенол (808 мг, 5 ммоль) и карбонат калия (1.03 г, 7.5 ммоль). Получившийся раствор перемешивали в течение ночи при 100°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 2-метил-7-(3-(трифторметил)фенокси)-5Н-тиазоло[3,2-а]пиримидин-5-она (500 мг, 61%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 327.0.
Стадия 4: 3-бромо-2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
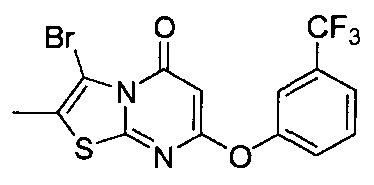
[0415] К раствору 2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (500 мг, 1.53 ммоль) в тетрагидрофуране (30 мл) по каплям добавили н-бутиллитий (1.5 мл, 2.5 моль/л) при -78°С в инертной атмосфере азота, и реакционную смесь перемешивали в течение 30 минут при -78°С. 1-бромопирролидин-2,5-дион (300 мг, 1.69 ммоль) добавили при -78°С и получившийся раствор медленно нагрели до комнатной температуры. Реакционную смесь погасили с помощью 30 мл воды, затем экстрагировали и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии на силикагеле с элюцией смесью дихлорметан/петролейный эфир (10/1) с получением 3-бромо-2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (100 мг, 13%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 405.0.
Стадия 5: 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
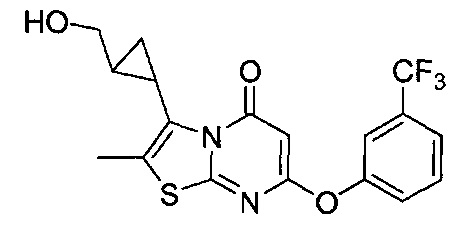
[0416] К раствору 3-бромо-2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (30 мг, 0.07 ммоль) в ацетонитриле/воде (2 мл/0.5 мл) добавили бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (6 мг, 0.01 ммоль), карбонат натрия (16 мг, 0.15 ммоль), и калия транс-2-(гидроксиметил)циклопропилтрифторборат (26 мг, 0.15 ммоль). Реакционную смесь облучали микроволновым излучением в течение 90 мин при 120°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[3-(трифторметил)фенокси]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (1.2 мг, 4%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 396.9; 1H NMR (300 MHz, CDCl3) δ 7.57-7.52 (m, 2H), 7.40 (s, 1H), 7.35-7.31 (m, 1H), 5.58 (s, 1H), 4.08-4.05 (m, 1H), 3.12-3.07 (m, 1H), 2.38 (s, 3H), 2.29-2.26 (m, 1H), 1.28-1.26 (m, 1H), 1.06-0.99 (m, 2H).
Пример 24: 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[[4-(трифторметил)тиазол-2-ил]метил]тиазоло[3,2-а]пиримидин-5-он
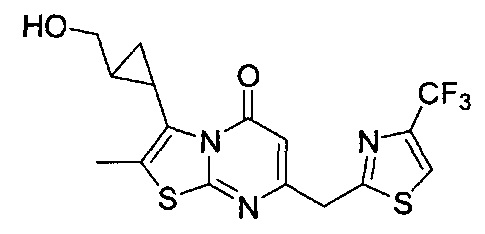
Стадия 1: Метил 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетат.
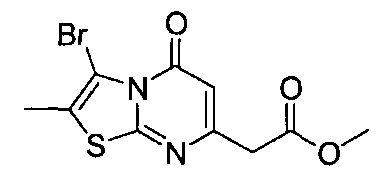
[0417] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (19.4 г, 66.1 ммоль) в метаноле (200 мл) добавили [1,1''-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (5.0 г, 6.83 ммоль) и триэтиламин (20 г, 197 ммоль), и реакционную смесь поместили в атомсферу СО (г) при 5 атм. Получившийся раствор перемешивали в течение 12 ч при комнатной температуре и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением метил 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетата (12.4 г, 59%) в виде желтого осадка. ЖХМС (ESI): М+H+ = 317.0.
Стадия 2: 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетамид.
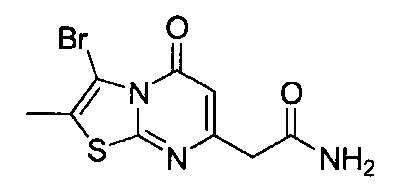
[0418] К раствору метил 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетата (3 г, 9.46 ммоль) в метаноле (20 мл) добавили NH3 в метаноле (40 мл, 5 моль/л). Реакционную пробирку закрыли и получившийся раствор перемешивали в течение 6 ч при 60°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (5/1) с получением 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетамида (689 мг, 24%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 302.0.
Стадия 3: 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]этантиоамид.
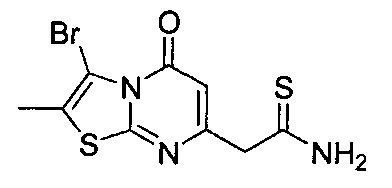
[0419] К раствору 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]ацетамида (689 мг, 2.28 ммоль) в тетрагидрофуране (20 мл) добавили 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид (2.8 г, 6.92 ммоль). Получившийся раствор перемешивали в течение 1 ч при 65°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (3/1) с получением 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]этантиоамида (334 мг, 46%) в виде желтого осадка. ЖХМС (ESI): М+H+ = 318.0.
Стадия 4: 3-бромо-2-метил-7-[[4-(трифторметил)-1,3-тиазол-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
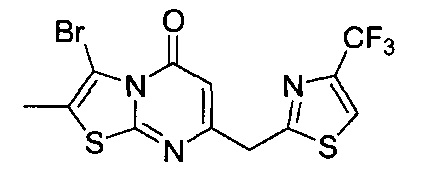
[0420] К раствору 2-[3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]этантиоамида (200 мг, 0.63 ммоль) в этаноле (10 мл) добавили 3-бромо-1,1,1-трифторпропан-2-он (180 мг, 0.94 ммоль). Получившийся раствор перемешивали в течение 1 ч при 100°С, и получившуюся смесь сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (40/1) с получением 3-бромо-2-метил-7-[[4-(трифторметил)-1,3-тиазол-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (164 мг, 64%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 410.0.
Стадия 5: 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[[4-(трифторметил)-1,3-тиазол-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
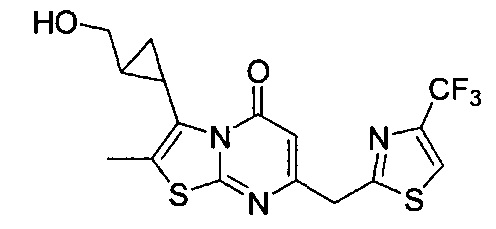
[0421] К раствору 3-бромо-2-метил-7-[[4-(трифторметил)-1,3-тиазол-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (164 мг, 0.40 ммоль) в ацетонитриле/воде (2 мл/0.5 мл) добавили калия транс-2-(гидроксиметил)циклопропилтрифторборат (143 мг, 0.80 ммоль), [1,1''-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (30 мг, 0.04 ммоль), и карбонат натрия (85 мг, 0.80 ммоль). Реакционную смесь облучали микроволновым излучением в течение 1.5 ч при 120°С, и получившуюся смесь сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 3-[2-(гидроксиметил)циклопропил]-2-метил-7-[[4-(трифторметил)-1,3-тиазол-2-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (7.7 мг, 5%) в виде серо-белого осадка. ЖХМС (ESI): М+Н+ = 402.0; 1H NMR (300 MHz, CDCl3) δ 7.71 (s, 1H), 6.22 (s, 1H), 4.30 (s, 2H), 4.08-4.04 (m, 1H), 3.16-3.09 (m, 1H), 2.39 (s, 3Н), 2.30-2.22 (m, 1H), 1.28-1.07 (m, 1H), 1.05-1.03 (m, 2H).
Пример 28: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
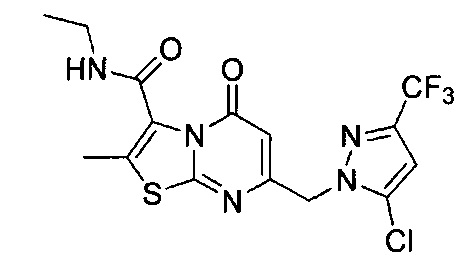
Стадия 1: Этил 3-бромо-2-оксобутаноат.
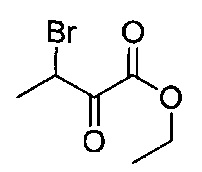
[0422] В каждую из двух 3000-мл 3-горлышковых круглодонных колбы, продутых и поддерживаемых в инертной атмосфере азота, поместили дихлорметан (1500 мл) и этил 2-оксобутаноат (286 г, 2.20 моль, 1.00 экв.) с последующим добавлением дибромана (352 г, 2.20 моль, 1.00 экв.) по каплям при перемешивании при 0-5°С. Получившиеся растворы перемешивали при 25°С в течение ночи. Объединенные реакционные смеси погасили посредством добавления 3000 мл насыщенного водного бикарбоната натрия. Получившийся раствор экстрагировали 2×500 мл дихлорметана и объединенные органические слои высушили над безводным Na2SO4 и сконцентрировали под вакуумом с получением 780 г (85%) этил 3-бромо-2-оксобутаноата в виде желтого масла.
Стадия 2: Этил 2-амино-5-метилтиазоле-4-карбоксилата гидробромид.
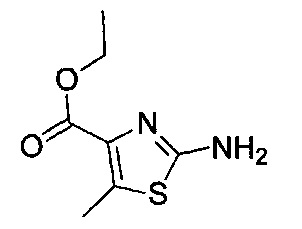
[0423] В каждую из трех 3000-мл круглодонных колб поместили этанол (2100 мл), тиомочевину (101.5 г, 1.33 моль, 1.03 экв.), и этил 3-бромо-2-оксобутаноат (270 г, 1.29 моль, 1.00 экв.). Получившиеся растворы перемешивали при 85°С на масляной бане в течение ночи. Объединенные реакционные смеси охладили до комнатной температуры и отфильтровали с получением 840 г (неочищенного) этил 2-амино-5-метилтиазоле-4-карбоксилата гидробромида в виде светло-желтого осадка.
Стадия 3: 2-амино-N-этил-5-метил-1,3-тиазол-4-карбоксамид.
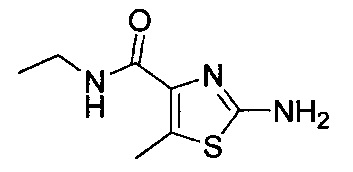
[0424] В 50000-мл химический реактор для работы под давлением поместили раствор этанамина в этаноле (3500 мл) и этил 2-амино-5-метилтиазол-4-карбоксилата гидробромида (400 г, 2.15 моль, 1.00 экв.). Получившийся раствор перемешивали при 120°С в течение 64 ч. Эту реакцию повторили один раз. Объединенные результирующие смеси сконцентрировали под вакуумом. Остаток нанесли на силикагелевую колонку с элюцией дихлорметаном/метанолом (20:1) с получением 300 г (38%) 2-амино-N-этил-5-метил-1,3-тиазол-4-карбоксамида в виде желтого осадка.
Стадия 4: 7-(хлорометил)-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
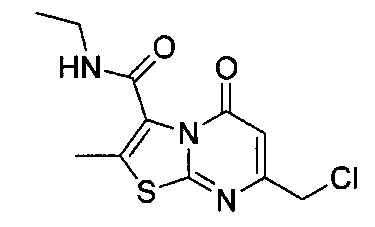
[0425] В каждую из двух 3000-мл 3-горлышковых круглодонных колб поместили РРА (1500 г), этил 4-хлор-3-оксобутаноат (603 г, 3.66 моль, 4.50 экв.), и 2-амино-N-этил-5-метил-1,3-тиазол-4-карбоксамид (150 г, 809.73 ммоль, 1.00 экв.). Получившиеся растворы перемешивали при 110°С в течение 2 ч. Объединенные реакционные смеси охладили до 80°С и осторожно погасили посредством добавления 450 мл воды. рН раствора довели до 8 с помощью насыщенного водного карбоната натрия. Осадки собрали посредством фильтрации и промыли с помощью ДХМ с получением 260 г (56%) 7-(хлорометил)-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде желтого осадка.
Стадия 5: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
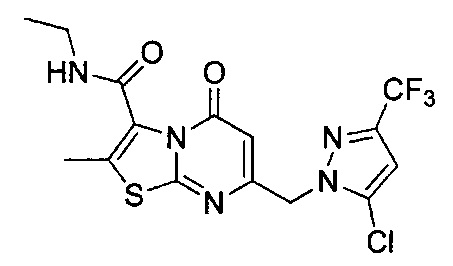
[0426] В каждую из двух 3000-мл круглодонных колб, продутых и поддерживаемых в инертной атмосфере азота поместили CH3CN (1500 мл), карбонат калия (126 г, 911.66 ммоль, 2.00 экв.), KI (38 г, 0.50 экв.), 5-хлор-3-(трифторметил)-1Н-пиразол (160 г, 938.31 ммоль, 2.00 экв.), и 7-(хлорометил)-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид (130 г, 454.94 ммоль, 1.00 экв.). Получившиеся растворы перемешивали при 80°С в течение 4 ч. Объединенные реакционные смеси охладили до комнатной температуры, сконцентрировали под вакуумом, и растворили в 8 л этилацетата. Осадки отфильтровали. Получившийся фильтрат сконцентрировали под вакуумом. Неочищенный продукт перекристаллизовали из EtOAc. Остаток нанесли на силикагелевую колонку с элюцией петролейным эфиром/EtOAc/ДХМ (1:1:1). Неочищенный продукт очистили посредством ВЭЖХ (Колонка: SO230330-2, С18, 330 г, 20-45 мкм, 100 А; 254 нм, 220 нм; CH3CN:0.05%TFA/H2O = 40%-65%, 20 мин) с получением 50 г (13%) 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде белого осадка. ЖХМС (ESI): М+Н+ = 420; 1H NMR (300 MHz, CDCl3) δ 6.58 (s, 1H), 5.93 (s, 1H), 5.72 (s, 1H), 3.47-3.56 (m, 2H), 2.42 (s, 3Н), 1.25-1.30 (t, J=7.2 Hz, 3H).
Пример 39: 3-[[3-(2,2-Дифторциклопропил)-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-7-ил]метил]-2-фтор-бензонитрил.
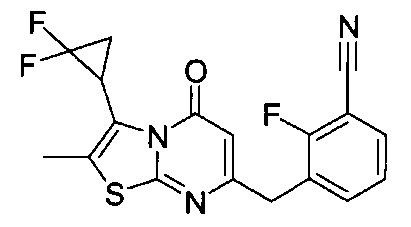
Стадия 1: 3-((3-бромо-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)-2-фторбензонитрил.
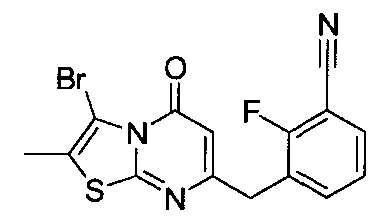
[0427] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (500 мг, 1.70 ммоль) в 1,4-диоксане/воде (10 мл/1 мл) в закрытой пробирке добавили (3-циано-2-фторфенил)бороновую кислоту (420 мг, 2.55 ммоль), бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (125 мг, 0.17 ммоль), и карбонат натрия (370 мг, 3.49 ммоль). Получившийся раствор перемешивали в течение 12 ч при 80°С, и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (80/1) с получением 3-((3-бромо-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-7-ил)метил)-2-фторбензонитрила (150 мг, 23%) в виде светло-желтого осадка. ЖХМС (ESI): [M+H] = 378.0.
Стадия 2: 3-([3-этенил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрил.
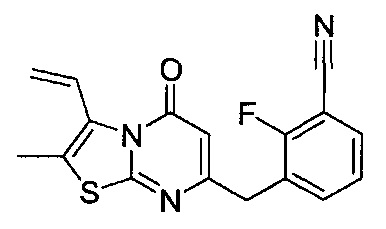
[0428] К раствору 2-этенил-4,4,5,5-тетраметил-1,3,2-диоксаборолане (244 мг, 1.58 ммоль) в 1,4-диоксане/воде (1.5 мл/0.5 мл) добавили 3-([3-бромо-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрил (300 мг, 0.79 ммоль), карбонат натрия (168 мг, 1.59 ммоль), и 1,1'-бис(дифенилфосфино)ферроценпалладия дихлорид (50 мг, 0.07 ммоль). Получившийся раствор перемешивали в течение 2 ч при 90°С. Реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (40/1) с получением 2-фтор-3-([2-метил-5-оксо-3-[2-(трифторметил)циклопропил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)бензонитрила (178 мг, 69%) в виде белого осадка. ЖХМС (ESI): М+H+ = 326.0.
Стадия 3: 3-[[3-(2,2-Дифторциклопропил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил]-2-фторбензонитрил.
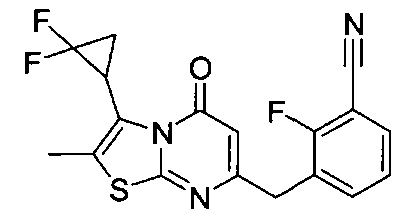
[0429] К раствору 3-([3-этенил-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил)-2-фторбензонитрила (80 мг, 0.25 ммоль) в тетрагидрофуране (8 мл) добавили йодид натрия (72 мг, 0.48 ммоль) и триметил(трифторметил)силан (176 мг, 1.29 ммоль). Получившийся раствор перемешивали в течение 2 ч при 65°С. Реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ (Колонка, XBridge Prep C18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль мононатрия гидрокарбонат и ацетонитрил (24.0% ацетонитрил, повышая до 46.0% в течение 10 мин); Детектор, УФ 254/220 нм) с получением 3-[[3-(2,2-дифторциклопропил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-7-ил]метил]-2-фторбензонитрила в виде белого осадка (15.4 мг, 17%). ЖХМС (ESI): М+Н+ = 376.0; 1Н NMR (300 MHz, CDCl3) δ 7.61-7.53 (m, 2H), 7.26-7.20 (m, 1H), 5.99 (s, 1H), 3.93 (s, 2H), 2.80-2.74 (m, 1H), 2.40 (s, 3Н), 1.98-1.84 (m, 1H), 1.60-1.46 (m, 1H).
Пример 47: 7-[[2-фтор-3-(трифторметил)фенил]метил]-3-(1Н-имидазол-2-ил)-2-метил-тиазоло[3,2-а]пиримидин-5-она гидрат)
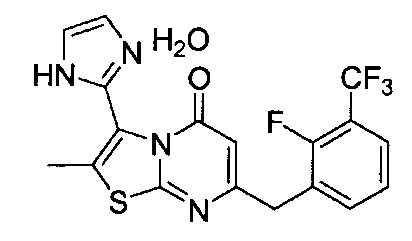
Стадия 1: Метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилат.
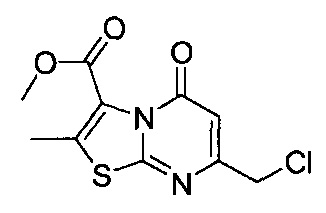
[0430] К раствору метил 2-амино-5-метилтиазол-4-карбоксилата (5 г, 26.8 ммоль) в РРА (30 мл) добавили этил 4-хлор-3-оксобутаноат (8.82 г, 53.6 ммоль), и перемешивали в течение 1 ч при 110°С. Смесь погасили водой, и значение рН раствора довели до 7 с помощью гидроксида натрия (1 моль/л). Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (10/1) с получением метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (3.2 г, 45%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 273.0.
Стадия 2: Метил 7-(2-фтор-3-(трифторметил)бензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилат.
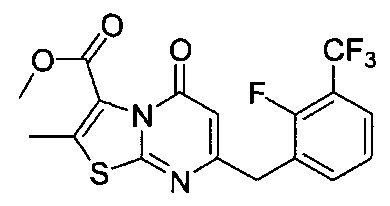
[0431] К раствору метил 7-(хлорометил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (900 мг, 3.14 ммоль) в 1,4-диоксане/воде (10 мл/0.5 мл) добавили 2-фтор-3-(трифторметил)фенилбороновую кислоту (982 мг, 4.72 ммоль), бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (150 мг, 0.21 ммоль), и карбонат калия (869 мг, 6.29 ммоль). Получившийся раствор перемешивали в течение 14 ч при 90°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением метил 7-(2-фтор-3-(трифторметил)бензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (800 мг, 62%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 401.0.
Стадия 3: 7-(2-фтор-3-(трифторметил)бензил)-3-(гидроксиметил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
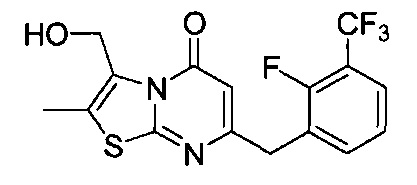
[0432] К раствору метил 7-(2-фтор-3-(трифторметил)бензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксилата (300 мг, 0.72 ммоль) в дихлорметане (10 мл) добавили DIBAL-H (2 мл, 1 моль/л в толуоле) при -78°С. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре, и затем погасили водой. Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (2/1) с получением 7-(2-фтор-3-(трифторметил)бензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбальдегида (136 мг, 50%) в виде белого осадка. ЖХМС (ESI): М+H+ = 373.0.
Стадия 4: 7-(2-фтор-3-(трифторметил)бензил)-2-метил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбальдегид.
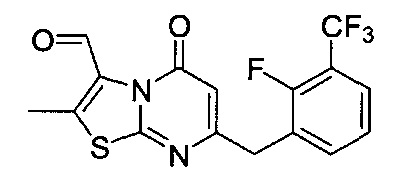
[0433] К раствору 7-[[2-фтор-3-(трифторметил)фенил]метил]-3-(гидроксиметил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.13 ммоль) в дихлорметане (5 мл) добавили 1,1-бис(ацетилокси)-3-оксо-3H-1|^[5],2-бензйодаоксол-1-илацетат (85 мг, 0.20 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (40/1) с получением 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (38 мг, 76%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 326.0.
Стадия 5: 7-[[2-фтор-3-(трифторметил)фенил]метил]-3-(1Н-имидазол-2-ил)-2-метил-тиазоло[3,2-а]пиримидин-5-она гидрат.
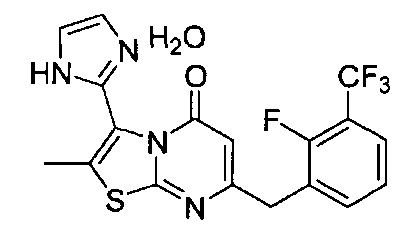
[0434] К раствору 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбальдегида (38 мг, 0.10 ммоль) в этаноле (2 мл) добавили аммоний (0.2 мл, 5.71 ммоль) и оксальальдегид (200 мг, 3.45 ммоль). Получившийся раствор перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ (Колонка, XBridge Prep C18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль мононатрий гидрокарбоната и ацетонитрил (24.0% ацетонитрил повышая до 46.0% в течение 10 мин); Детектор, УФ 254/220 нм) с получением 7-[[2-фтор-3-(трифторметил)фенил]метил]-3-(1Н-имидазол-2-ил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она моногидрата в виде серо-белого осадка (4.5 мг, 10%). ЖХМС [М+Н]+ 371.0; 1H NMR (300 MHz, CDCl3) δ 10.82 (br, 1H), 7.56-7.48 (m, 2H), 7.25-7.17 (m, 3Н), 6.03 (s, 1H), 5.02 (br, 2H), 3.98 (s, 2H), 2.56 (s, 3Н).
Пример 91: N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метокси-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
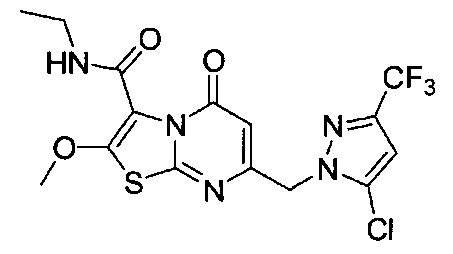
Стадия 1: 2-амино-N-этил-5-метокси-1,3-тиазол-4-карбоксамид.
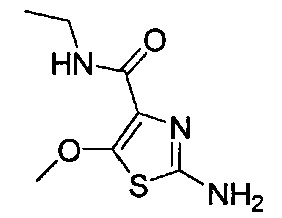
[0435] К раствору 2-амино-5-хлор-N-этил-1,3-тиазол-4-карбоксамида (1.00 г, 4.86 ммоль) в метаноле (5 мл) добавили метоксид натрия (1.05 г, 19.4 ммоль). Получившийся раствор перемешивали в течение 2 ч при 50°С и затем погасили водой. Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (20/1) с получением 2-амино-N-этил-5-метокси-1,3-тиазол-4-карбоксамида (300 мг, 31%) в виде серо-белого осадка. ЖХМС (ESI): М+Н+ = 202.0.
Стадия 2: 7-(хлорометил)-N-этил-2-метокси-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
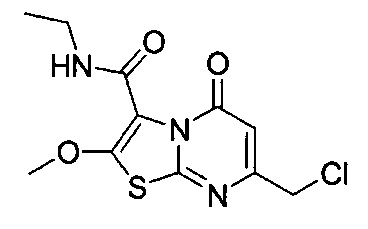
[0436] К раствору 2-амино-N-этил-5-метокси-1,3-тиазол-4-карбоксамида (2.50 г, 12.4 ммоль) в полифосфорной кислоте (30 мл) добавили этил 4-хлор-3-оксобутаноат (4.09 г, 24.8 ммоль). Получившийся раствор перемешивали в течение 3 ч при 60°С. Реакционную смесь разбавили метанолом (50 мл) и значение рН раствора довели до 7 с помощью триэтиламина. В смесь добавили воду (200 мл), и получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 7-(хлорометил)-N-этил-2-метокси-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (190 мг, 5%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 302.0.
Стадия 3: N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метокси-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
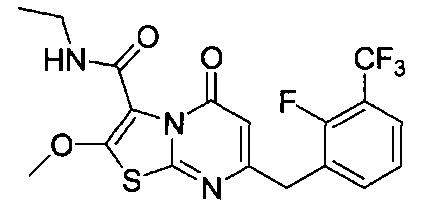
[0437] К раствору 7-(хлорометил)-N-этил-2-метокси-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (280 мг, 0.93 ммоль) в 1,4-диоксане/воде (1.5 мл/0.5 мл) добавили [2-фтор-3-(трифторметил)фенил]бороновую кислоту (400 мг, 1.92 ммоль), трициклогексилфосфан (260 мг, 0.93 ммоль), диацетоксипалладий (100 мг, 0.45 ммоль), и фосфат калия (400 мг, 1.88 ммоль). Получившийся раствор перемешивали в течение ночи при 90°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ при следующих условиях (1#-Pre-HPLC-005(Waters)): Колонка, SunFire Prep C18 OBD Колонка, 5 мкм, 19*150 мм; подвижная фаза, вода с 10 ммоль мононатрий гидрокарбонатом и ацетонитрил (50.0% ацетонитрил, повышая до 82.0% в течение 10 мин, понижая до 50.0% в течение 2 мин); Детектор, УФ 254/220 нм с получением N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метокси-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (31.6 мг, 8%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 430.1; 1H NMR (400 MHz, CD3OD) δ 7.68-7.61 (m, 2H), 7.36-7.32 (m, 1H), 6.19 (s, 1H), 4.08 (s, 5H), 3.41-3.32 (m, 2H), 1.25-1.21 (m, 3H).
Пример 105: 2-циано-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
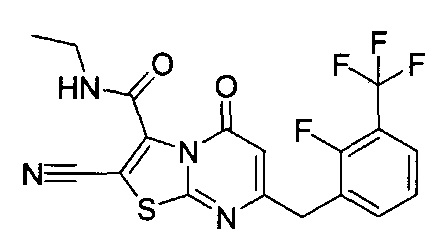
Стадия 1: 2-амино-N-этилтиазол-4-карбоксамид.
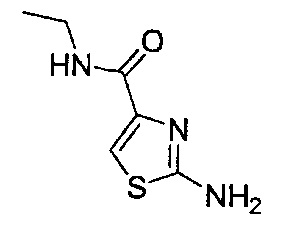
[0438] Раствор этил 2-аминотиазол-4-карбоксилата (11.5 г, 72.7 ммоль) в этанамине/этаноле (100 мл, 30%) перемешивали в течение 2 ч при 110°С в закрытой пробирке, и получившийся раствор сконцентрировали под вакуумом с получением 2-амино-N-этилтиазол-4-карбоксамида (12.3 г, 99%). ЖХМС (ESI): M+H+ = 172.0.
Стадия 2: 2-амино-5-хлор-N-этилтиазол-4-карбоксамид.
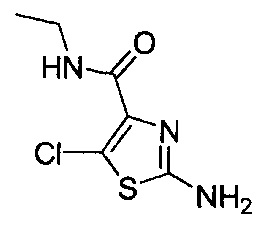
[0439] К раствору 2-амино-N-этилтиазол-4-карбоксамида (12.3 г, 71.8 ммоль) в N,N-диметилформамиде (100 мл) добавили N-хлорсукцинимид (10.5 г, 79.0 ммоль). Получившийся раствор перемешивали в течение ночи при 50°С и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (8/1) с получением 2-амино-5-хлор-N-этилтиазол-4-карбоксамида (7.6 г, 51%) в виде коричневого осадка. ЖХМС (ESI): М+Н+ = 206.0.
Стадия 3: 2-хлор-7-(хлорометил)-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
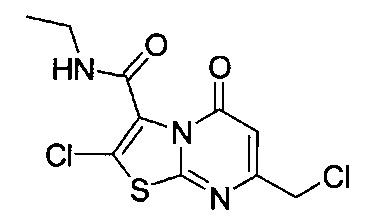
[0440] К раствору 2-амино-5-хлор-N-этилтиазол-4-карбоксамида (12.4 г, 60.3 ммоль) в полифосфорной кислоте (30 мл) добавили этил-4-хлор-3-оксобутаноат (20 г, 121 ммоль). Реакционную смесь перемешивали в течение 1 ч при 110°С. Реакционную смесь погасили водой со льдом, и рН раствора довели до 7 с помощью гидроксида натрия (1 моль/л). Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 2-хлор-7-(хлорометил)-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамида (4.7 г, 25%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 305.0, 307.0.
Стадия 4: 2-хлор-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
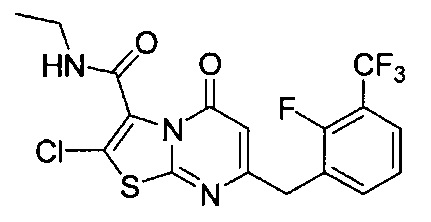
[0441] К раствору 2-хлор-7-(хлорометил)-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (100 мг, 0.33 ммоль) в 1,4-диоксане/воде (1.5 мл/0.5 мл) добавили 2-фтор-3-(трифторметил)фенил]бороновую кислоту (100 мг, 0.48 ммоль), карбонат калия (90 мг, 0.65 ммоль), и [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (50 мг, 0.07 ммоль). Получившийся раствор перемешивали в течение ночи при 90°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ (Колонка, XBridge Prep С18 OBD Колонка, 5 мкм, 19×150 мм; подвижная фаза, вода с 10 ммоль мононатрия гидрокарбонатом и ацетонитрил (24.0% ацетонитрил, повышая до 46.0% в течение 10 мин); Детектор, УФ 254/220 нм) с получением 2-хлор-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (13.4 мг, 9%) в виде белого осадка. ЖХМС (ESI): М+H+ = 434.0; 1H NMR (300 MHz, CDCl3) δ 7.61-7.44 (m, 2H), 7.31-7.19 (m, 1H), 6.10(s, 1H), 5.84(br, 1H), 3.96 (s, 2H), 3.59-3.50 (m, 2H), 1.32-1.20 (m, 3H).
Стадия 5: Метил 3-(этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоксилат.
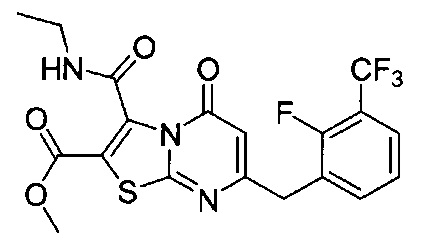
[0442] К раствору 2-хлор-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (500 мг, 1.15 ммоль) в метаноле (10 мл) добавили триэтиламин (233 мг, 2.30 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (85 мг, 0.12 ммоль). Получившийся раствор перемешивали в течение 6 ч при 50°С в атмосфере монооксида углерода при 10 атм и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (20/1) с получением метил 3-(этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоксилата (350 мг, 66%) в виде коричневого осадка. ЖХМС (ESI): М+Н+ = 458.0.
Стадия 6: 3-(Этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоновая кислота.
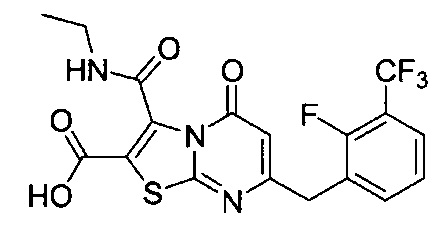
[0443] К раствору метил 3-(этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоксилата (170 мг, 0.37 ммоль) в тетрагидрофуране/воде (6 мл/2 мл) добавили гидроксид лития (110 мг, 4.59 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. рН раствора довели до 6 с помощью водного раствора HCl (1 моль/л). Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом с получением 3-(этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоновой кислоты (110 мг, 67%) в виде коричневого осадка. ЖХМС (ESI): M-H- = 442.0.
Стадия 7: 3-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2,3-дикарбоксамида.
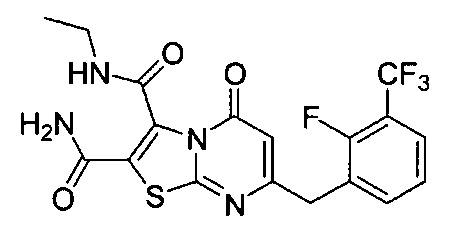
[0444] К раствору 3-(этилкарбамоил)-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2-карбоновой кислоты (300 мг, 0.68 ммоль) в дихлорметане (5 мл) добавили триэтиламин (200 мг, 1.98 ммоль) и хлор(пропан-2-илокси)метанон (166 мг, 1.35 ммоль) при 0°С. Смесь перемешивали в течение 20 мин при комнатной температуре, и затем добавили гидроксид аммония (0.5 мл, 30%). Получившийся раствор перемешивали в течение 2 ч при комнатной температуре и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/метанолом (50/1) с получением 3-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2,3-дикарбоксамид (152 мг, 51%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 443.0.
Стадия 8: 2-циано-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
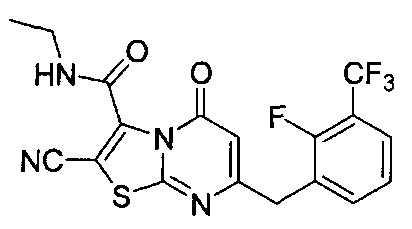
[0445] К раствору 3-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-2,3-дикарбоксамида (152 мг) в дихлорметане (5 мл) добавили триэтиламин (0.5 мл) и трифторуксусный ангидрид (0.2 мл, 0.93 ммоль). Получившийся раствор перемешивали в течение 30 мин при комнатной температуре и сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ВЭЖХ (Колонка, SunFire Prep C18 OBD Колонка, 5 мкм, 19*150 мм; подвижная фаза, вода с 10 ммоль мононатрия гидрокарбоната и ацетонитрил (50.0% ацетонитрил, повышая до 82.0% в течение 10 мин, понижая до 50.0% в течение 2 мин); Детектор, УФ 254/220 нм) с получением 2-циано-N-этил-7-[[2-фтор-3-(трифторметил)фенил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (7.4 мг, 5%) в виде серо-белого осадка. ЖХМС (ESI): M+H+ = 424.9; 1H NMR (300 MHz, CDCl3) δ 7.61-7.54 (m, 1H), 7.50-7.46 (m, 1H), 7.26-7.21 (m, 1H), 6.55 (br, 1H), 6.18 (s, 1H), 3.99 (s, 2H), 3.61-3.52 (m, 2H), 1.33-1.26 (m, 3H).
Пример 153: 7-[(5-Циклопропилтриазол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
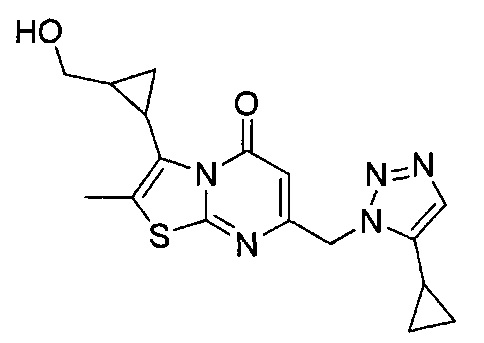
Стадия 1: 7-(Азидометил)-3-бромо-2-метил-тиазоло[3,2-а]пиримидин-5-он.
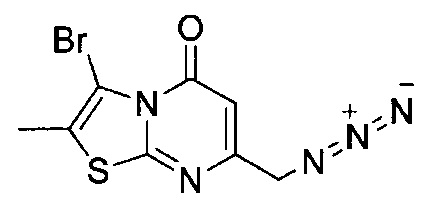
[0446] Азид натрия (134 мг, 2.04 ммоль) в воде (0.85 мл) добавили в раствор 3-бромо-7-(хлорометил)-2-метил-тиазоло[3,2-а]пиримидин-5-она (200 мг, 0.68 ммоль) в ацетонитриле (3.4 мл, 0.2 М). Смесь перемешивали при комнатной температуре в течение 20 ч и при 50°С в течение дополнительных 20 ч. Добавили воду (10 мл) и продукт отделили посредством фильтрации. Осадок промыли холодной водой и гептаном и высушили под вакуумом с получением 7-(азидометил)-3-бромо-2-метил-тиазоло[3,2-а]пиримидин-5-она в виде бежевого осадка (167 мг, 82%). ЖХМС (ESI): M+H+ = 300.1, 302.1; 1H NMR (400 MHz, DMSO-d6) δ 6.21 (d, J=0.8 Hz, 1H), 4.35 (s, 2H), 2.33 (s, 3H).
Стадия 2: 3-бромо-7-[(5-циклопропилтриазол-1-ил)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
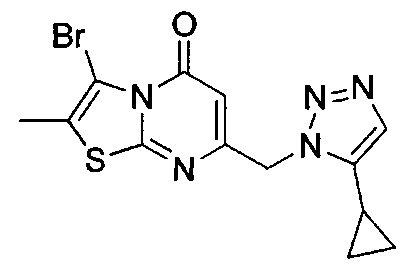
[0447] Дегазированный раствор хлоро(пентаметилциклопентадиенил)бис(трифенилфосфин)рутения(II) (12 мг, 0.01 ммоль) в 1,4-диоксане (1.5 мл) с N2 добавили в раствор 7-(азидометил)-3-бромо-2-метил-тиазоло[3,2-а]пиримидин-5-она (89 мг, 0.29 ммоль) и этинилциклопропана (59 мг, 0.89 ммоль) в 1,4-диоксане (1.5 мл) под N2. Смесь закрыли и перемешивали при 60°С в течение 20 ч. Неочищенную смесь абсорбировали на диатомитовой земле и очистили с помощью флеш-хроматографии (0-5% МеОН/ДХМ градиент) с получением 3-бромо-7-[(5-циклопропилтриазол-1-ил)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-она в виде бежевого осадка (90 мг, 83%). ЖХМС (ESI): M+H+ = 366.1, 368.1; 1H NMR (400 MHz, Хлороформ-d) δ 7.35 (s, 1H), 5.78 (s, 1H), 5.45 (s, 2H), 2.36 (s, 3H), 1.71-1.65 (m, 1H), 1.07-0.97 (m, 2H), 0.76-0.67 (m, 2H).
Стадия 3: 7-[(5-Циклопропилтриазол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-он.
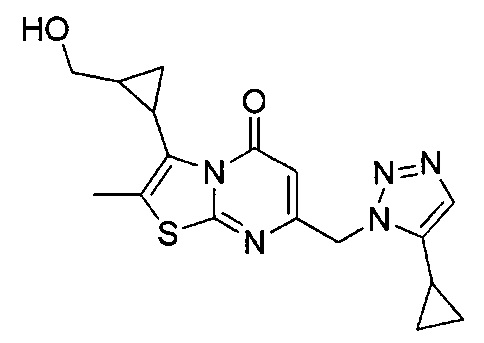
[0448] Pd[dppf]Cl2 (18 мг, 0.02 ммоль) добавили в раствор 3-бромо-7-[(5-циклопропилтриазол-1-ил)метил]-2-метил-тиазоло[3,2-а]пиримидин-5-она (90 мг, 0.24 ммоль), калия трифтор-[2-(гидроксиметил)циклопропил]борана (65 мг, 0.37 ммоль), и K2CO3 (68 мг, 0.49 ммоль) в 1,4-диоксане/воде (1.5 мл, 10:1) под N2 в пробирке для микроволновой печи. Пробирку закрыли и нагревали при 120°С в течение 45 мин в микроволновой печи. Неочищенную реакционную смесь отфильтровали через слой диатомитовой земли и фильтрат сконцентрировали досуха. Неочищенный продукт очистили с помощью флеш-хроматографии (0-10% МеОН/ДХМ градиент) с получением 7-[(5-циклопропилтриазол-1-ил)метил]-3-[2-(гидроксиметил)циклопропил]-2-метил-тиазоло[3,2-а]пиримидин-5-она в виде белого осадка (16 мг, 18%). ЖХМС (ESI): М+Н+ = 358.2; 1H NMR (400 MHz, DMSO-d6) δ 7.44 (s, 1H), 5.73 (s, 1H), 5.51 (s, 2H), 4.54 (t, J=5.5 Hz, 1H), 3.46 (t, J=5.7 Hz, 2H), 2.37 (s, 3H), 2.06-1.95 (m, 1H), 1.93-1.82 (m, 1H), 1.34-1.21 (m, 1H), 0.99-0.91 (m, 2H), 0.90-0.78 (m, 2H), 0.71-0.60 (m, 2H).
Пример 206: 3-(азетидин-1-ил)-7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-2-(трифторметил)тиазоло[3,2-а]пиримидин-5-он.
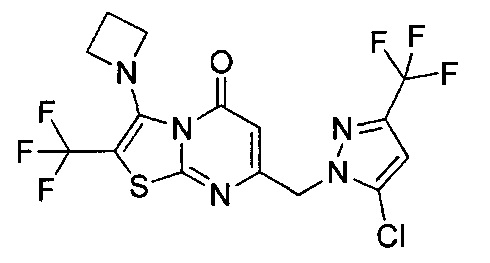
[0449] Смесь 3-бромо-7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-2-(трифторметил)тиазоло[3,2-а]пиримидин-5-она (50 мг, 0.10 ммоль), азетидина гидрохлорида (12 мг, 0.12 ммоль), и K2CO3 (36 мг, 0.26 ммоль) в ацетонитриле (0.5 мл) перемешивали при 80°С в течение 3 ч и при комнатной температуре в течение 20 ч. Смесь отфильтровали для удаления солей и абсорбировали на диатомитовой земле. Неочищенный продукт очистили с помощью флеш-хроматографии (10% EtOAc/гептан) с последующей второй очисткой с помощью препаративной ВЭЖХ с получением 3-(азетидин-1-ил)-7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-2-(трифторметил)тиазоло[3,2-а]пиримидин-5-она в виде желтого лиофилизированного осадка (11 мг, 24%). ЖХМС (ESI): M+H+ = 458.0; 1H NMR (400 MHz, DMSO-d6) δ 7.14 (s, 1H), 5.86 (s, 1H), 5.37 (s, 2H), 4.20 (td, J=7.6, 7.1, 1.8 Hz, 4H), 2.24 (р, J=7.7 Hz, 2H).
Примеры 207 и 208: 2-(7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-(трифторметил)-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-ил)циклопропанкарбонитрил (энантиомеры).
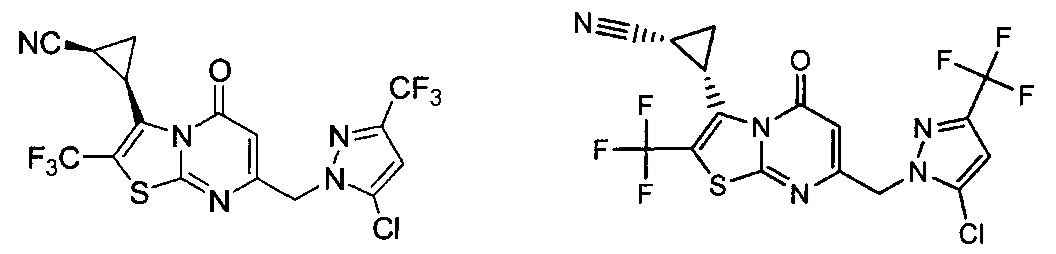
Стадия 1: N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамид.
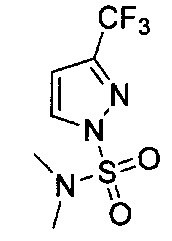
[0450] В 20-л 4-горлышковую круглодонную колбу, продутую и поддерживаемую в инертной атмосфере азота, поместили 3-(трифторметил)-1Н-пиразол (1000 г, 7.35 моль, 1.00 экв.), CH3CN (10 л), и 1,4-диазабицикло[2.2.2]октан (990 г, 8.83 моль, 1.20 экв.) с последующим добавлением N,N-диметилсульфамоилхлорида (1156 г, 8.05 моль, 1.10 экв.) по каплям при перемешивании при 0°С. Получившийся раствор перемешивали при комнатной температуре в течение 3 ч, сконцентрировали под вакуумом, разбавили 10 л H2O, и экстрагировали 3×5 л этилацетата. Объединенные органические слои промыли с помощью 2×5 л солевого раствора, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток нанесли на колонку с силикагелем с элюцией дихлорметаном с получением 1700 г (95%) N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамида в виде бесцветного масла.
Стадия 2: 5-хлор-N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамид.
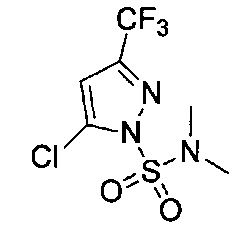
[0451] В 20-л 4-горлышковую круглодонную колбу, продутую и поддерживаемую в инертной атмосфере азота, поместили N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамид (1200 г, 4.93 моль, 1.00 экв.) и тетрагидрофуран (10 л) с последующим добавлением n-BuLi (2.5 М в гексане) (2.37 л, 1.20 экв.) по каплям при перемешивании при -78°С. Смесь перемешивали при -70 до -80°С в течение 1 ч. К ней добавили раствор C2Cl6 (1605 г, 1.40 экв.) в тетрагидрофуране (2.5 л) по каплям при перемешивании при -70°С. Получившийся раствор перемешивали при -70°С в течение 3 ч, погасили посредством добавления 1000 мл насыщенного водного NH4Cl, и экстрагировали 2×1 л этилацетата. Объединенные органические слои промыли 2×3 л солевого раствора, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Остаток нанесли на колонку с силикагелем с элюцией с помощью смеси этилацетат/петролейный эфир (1:30) с получением 1120 г (82%) 5-хлор-N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамида в виде светло-желтого масла.
Стадия 3: 5-хлор-3-(трифторметил)-1Н-пиразол.
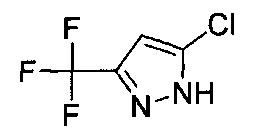
[0452] В 10-л 4-горлышковую круглодонную колбу поместили 5-хлор-N,N-диметил-3-(трифторметил)-1Н-пиразол-1-сульфонамид (2200 г, 7.92 моль, 1.00 экв.) и дихлорметан (2000 мл) с последующим добавлением трифторуксусной кислоты (1500 мл, 3.00 экв.) по каплям при перемешивании при 0°С. Получившийся раствор перемешивали при комнатной температуре в течение 5 ч, сконцентрировали под вакуумом, и разбавили 6 л H2O. рН раствора довели до 8-9 с помощью бикарбоната натрия. Получившийся раствор экстрагировали 3×4 л этилацетата. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом. Неочищенный продукт очистили с помощью дистилляции при пониженном давлении (15 мм рт.ст.) и фракцию собрали при 52-65°С. Неочищенный продукт перекристаллизовали из ДХМ/н-гексана (1:50) с получением 520 г (38%) 5-хлор-3-(трифторметил)-1Н-пиразола в виде белого осадка. ЖХМС (ESI): М+Н+ = 171.
Стадия 4: 2-(Тетраметил-1,3,2-диоксаборолан-2-ил)циклопропан-1-карбонитрил.
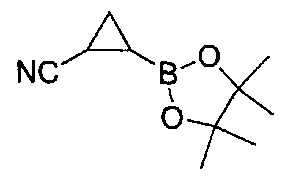
[0453] В 30-мл закрытую пробирку, продутую и поддерживаемую в инертной атмосфере азота, в раствор циклопропанкарбонитрила (1.0 г, 14.9 ммоль) в тетрагидрофуране (12.2 мл) добавили [Ir(COD)OMe]2 (320 мг, 0.25 ммоль), бис(пинаколато)дибор (1.59 г, 12.5 ммоль) и 2,9-диметилфенантролин (50.5 мг, 0.49 ммоль). Реакционную смесь перемешивали при 90°С в течение 18 ч и сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1:4) с получением 2-(тетраметил-1,3,2-диоксаборолан-2-ил)циклопропан-1-карбонитрила в виде светло-желтого масла (1 г, неочищенный).
Стадия 5: Калия 2-(циано)циклопропилтрифторборат.
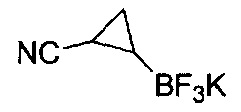
[0454] К раствору 2-(тетраметил-1,3,2-диоксаборолан-2-ил)циклопропан-1-карбонитрила (180 г, неочищенный) в метаноле (4.5 л) добавили дифторан калия (9.98 г, 129 ммоль) в Н2О (2 л). Получившуюся реакционную смесь перемешивали при комнатной температуре в течение 12 ч и сконцентрировали под вакуумом. Остаток промыли пропан-2-оном (6×1.5 л). Фильтрат сконцентрировали под вакуумом, растворили в воде (5 л), и промыли с помощью ДХМ (3×3 л) и EtOAc (3×3 L). Водный слой высушили сублимацией с получением 2-(трифтор-лямбда4-боранил)циклопропан-1-карбонитрила калия в виде белого осадка (151.9 г, приблизительно 30% за две стадии).
Стадия 6: 5-бромо-1,3-тиазол-2-амин.
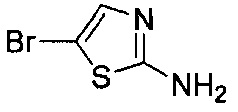
[0455] К смеси бикарбоната натрия (5.8 кг, 69.04 моль, 3.00 экв.) в воде (30 л) и дихлорметане (20 л) добавили 5-бромо-1,3-тиазол-2-амина гидробромид (6 кг, 23.08 моль, 1.00 экв.) по порциям. Получившуюся смесь перемешивали при комнатной температуре в течение 4 ч и экстрагировали дихлорметаном. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением 5-бромо-1,3-тиазол-2-амина в виде серого осадка (2.9 кг, 70%).
Стадия 7: 5-бромо-2-хлор-1,3-тиазол.
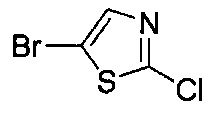
[0456] К раствору 5-бромо-1,3-тиазол-2-амина (1 кг, 5.59 моль, 1.00 экв.) в CH3CN (7 л) добавили CuCl (0.83 кг, 8.4 моль, 1.5 экв.) с последующим добавлением t-BuONO (1.15 кг, 11.2 моль, 2.00 экв.) по каплям при перемешивании. Реакционную смесь перемешивали при 70°С в течение ночи, охладили до комнатной температуры, погасили водой, и экстрагировали дихлорметаном. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали. Остаток очистили посредством хроматографии с элюцией смесью диэтиловый эфир/петролейный эфир (1/20) с получением 5-бромо-2-хлор-1,3-тиазола в виде желтого осадка (0.4 кг, 36%).
Стадия 8: 4-бромо-2-хлор-5-йод-1,3-тиазол.
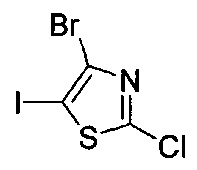
[0457] К раствору 5-бромо-2-хлор-1,3-тиазола (500 г, 2.52 моль, 1.00 экв.) в тетрагидрофуране (8 л) добавили LDA (1517 мл, 2 моль/л, 3 ммоль, 1.20 экв.) по каплям при перемешивании при -70°С в атмосфере азота. Получившийся раствор перемешивали при -70°С в течение 2 ч. К этой реакционной смеси добавили раствор I2 (967 г, 3.81 моль, 1.50 экв.) в тетрагидрофуране (3 л) по каплям при перемешивании при -70°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи, погасили водой и экстрагировали дихлорметаном. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением остатка, который очистили посредством хроматографии с элюцией смесью этилацетат/петролейный эфир (1:50) с получением 4-бромо-2-хлор-5-йод-1,3-тиазола (500 г, 61%) в виде серого осадка.
Стадия 9: 4-бромо-2-хлор-5-(трифторметил)-1,3-тиазол.
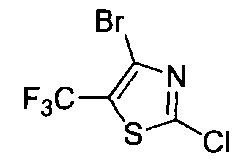
[0458] К смеси 4-бромо-2-хлор-5-йод-1,3-тиазола (500 г, 1.54 моль, 1.00 экв.) в N,N-диметилформамиде (5 л) добавили CuI (440 г, 2.31 моль, 1.50 экв.) и метил 2,2-дифтор-2-(фторсульфонил)ацетат (593 г, 3.09 моль, 2.00 экв.). Реакционную смесь перемешивали при 80°С в течение ночи в атмосфере азота, охладили до комнатной температуры, и отфильтровали. Фильтрат разбавили водой и экстрагировали эфиром. Объединенные органические слои промыли солевым раствором, высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением остатка, который очистили посредством хроматографии с элюцией смесью диэтиловый эфир/петролейный эфир (1/20) с получением 4-бромо-2-хлор-5-(трифторметил)-1,3-тиазола в виде светло-желтого масла (300 г, неочищенный), которое использовали на следующей стадии без дополнительной очистки.
Стадия 10: 4-бромо-5-(трифторметил)-1,3-тиазол-2-амин.
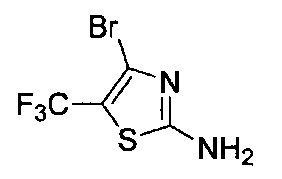
[0459] К раствору 4-бромо-2-хлор-5-(трифторметил)-1,3-тиазола (300 г, 1.13 моль, 1.00 экв.) в 1,4-диоксане (2 л) добавили NH3/Н2О (28%, 2 л). Получившийся раствор перемешивали при 50°С в течение ночи. Получившийся раствор экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением остатка, который очистили посредством хроматографии с люцией с помощью смеси этилацетат/петролейный эфир (1:8) с получением 4-бромо-5-(трифторметил)-1,3-тиазол-2-амина в виде светло-желтого осадка (160 г, 42% за 2 стадии).
Стадия 11: 3-бромо-7-(хлорометил)-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
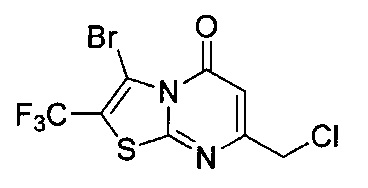
[0460] К смеси 4-бромо-5-(трифторметил)-1,3-тиазол-2-амина (320 г, 1.30 моль, 1.00 экв.) в РРА (3200 г) добавили этил 4-хлор-3-оксобутаноат (1068 г, 6.49 моль, 5.00 экв.). Получившуюся смесь перемешивали при 130°С в течение 2 ч, погасили посредством добавления воды, и экстрагировали этилацетатом. Объединенные органические слои высушили над безводным сульфатом натрия и сконцентрировали под вакуумом с получением остатка, который очистили посредством хроматографии с элюцией с помощью смеси этилацетат/петролейный эфир (1/10) с получением 3-бромо-7-(хлорометил)-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде светло-желтого осадка (306 г, 68%). ЖХМС (ESI): M+H+ = 348.9.
Стадия 12: 3-бромо-7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
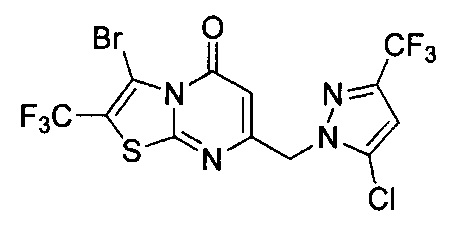
[0461] К смеси 3-бромо-7-(хлорометил)-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-5-она (1 г, 2.88 ммоль) в ацетонитриле (10 мл) добавили карбонат натрия (610 мг, 5.75 ммоль) и 5-хлор-3-(трифторметил)-1Н-пиразол (590 мг, 3.45 ммоль). Получившуюся смесь перемешивали в течение ночи при 80°С. Через 30 итераций в таком же масштабе, смеси объединили, затем отфильтровали и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1:20) с получением 3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-5-она (13.5 г, 40%) в виде светло-желтого осадка и 3-бромо-7-((3-хлор-5-(трифторметил)-1Н-пиразол-1-ил)метил)-2-(трифторметил)-5Н-тиазоло[3,2-а]пиримидин-5-она (6.0 г, 15%) в виде светло-желтого осадка. ЖХМС (ESI): M+H+ = 480.9.
Стадия 13: 2-(7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-5-оксо-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбонитрил (цис энантиомеры).
[0462] К смеси 3-бромо-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (500 мг, 1.03 ммоль) в 1,4-диоксане/воде (10 мл/1 мл) добавили [бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (171 мг, 0.23 ммоль), карбонат натрия (500 мг, 4.68 ммоль), и калия 2-(трифтор-лямбда4-боранил)циклопропан-1-карбонитрил (500 мг, 2.87 ммоль). Получившуюся смесь перемешивали в течение ночи при 85°С. Реакцию повторили 20 раз в таком же объеме и объединили. Получившуюся смесь экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/2) с получением рацемического продукта (4.5 г, 46%). Затем рацемический продукт разделили с помощью сверхкритической жидкостной хроматографии (Колонка: Phenomenex Lux 5u Cellulose-4,250*50 мм; Подвижная фаза: CO2 : MeOH = 50:50; Скорость потока: 160 мл/мин; детектор: 220 нм) с получением двух энантиомеров. Энантиомер 1 (пик 1, 1.88 г, 20%, белый осадок): Время задержки: 4.43 мин; ЖХМС (ESI): M+H+ = 468.0; 1H NMR (400 MHz, CDCl3) δ 6.60 (s, 1H), 5.81 (s, 1H), 5.27 (s, 2H), 3.11-3.00 (m, 1H), 1.91-1.80 (m, 2H), 1.65-1.62 (m, 1H). Пик 2 (энантиомер 2, 1.89 г, 20%, белый осадок): Время задержки: 5.59 мин; ЖХМС (ESI): M+H+ = 468.0; 1H NMR (400 MHz, CDCl3) δ 6.63 (s, 1H), 5.84 (s, 1H), 5.29 (s, 2H), 3.15-3.07 (m, 1H), 1.95-1.86 (m, 2H), 1.68-1.59 (m, 1H).
Пример 220: 2-[7-[(N-этил-4-фтор-анилино)метил]-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрил.
Стадия 1: 7-(хлорометил)-3-(гидроксиметил)тиазоло[3,2-а]пиримидин-5-он.
[0463] К метил 7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксилату (0.2 г, 0.77 ммоль) в 4 мл метанола при КТ добавили борогидрид натрия (0.11 г, 2.9 ммоль) в течение 1 мин с экзотермией. Через 5 мин добавили дополнительное количество NaBH4 (50 мг), что привело к выделению газа. Через 1 ч смесь разделили между CH2Cl2 и 1 н HCl (водн). Фазы разделили и водную фазу экстрагировали с помощью CH2Cl2. Объединенные органические фазы высушили над Na2SO4 и сконцентрировали на силикагеле для очистки с использованием CombiFlash® (12 г колонка, 0-80% EtOAc в CH2Cl2, 15 мин) с получением 36 мг (20%) 7-(хлорометил)-3-(гидроксиметил)тиазоло[3,2-а]пиримидин-5-она в виде рыжего осадка.
Стадия 2: 7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-карбальдегид.
[0464] К 7-(хлорометил)-3-(гидроксиметил)тиазоло[3,2-а]пиримидин-5-ону (36 мг, 0.16 ммоль) в 5 мл CH2Cl2 добавили окись алюминия (0.34 г, 3.3 ммоль), затем хлорформиат пиридиния (0.17 г, 0.78 ммоль). Смесь перемешивали в течение ночи, затем отфильтровали через диатомитовую землю и сконцентрировали на силикагеле для очистки с помощью CombiFlash® (4 г колонка, 0-80% EtOAc в CH2Cl2, 15 мин) с получением 28 мг (78%) 7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-карбальдегида в виде бесцветного осадка.
Стадия 3: (Е)-3-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-2-циано-проп-2-еноат.
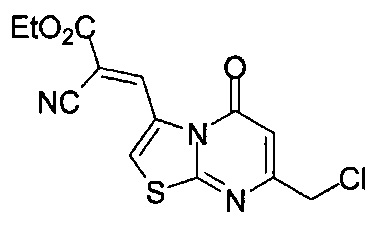
[0465] К раствору 7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-карбальдегида (80 мг, 0.35 ммоль) и этилцианоацетата (40 мг, 0.35 ммоль) в 5 мл CH2Cl2 добавили 1 каплю пиперидина, что дало ярко желтое окрашивание. Через 2 ч, смесь сконцентрировали на силикагеле для очистки с помощью CombiFlash® (4 г колонка, 0-40% EtOAc в CH2Cl2, 15 мин) с получением 66 мг (58%) этил (Е)-3-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-2-циано-проп-2-еноата в виде желтого осадка.
Стадия 4: Этил 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-циано-циклопропанкарбоксилат.
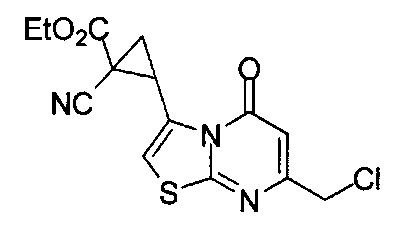
[0466] К раствору триметилсульфоксония йодида (69 мг, 0.31 ммоль) в 1 мл ДМСО при КТ добавили гидрид натрия (60% дисперсия в парафиновом масле, 12 мг, 0.31 ммоль). Смесь перемешивали 5 мин, в это время этил (Е)-3-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-2-циано-проп-2-еноат (66 мг, 0.20 ммоль) в 1 мл ДМСО быстро добавили по каплям, что привело к темно-оранжевому окрашиванию. Смесь перемешивали 1 ч, затем разделили между EtOAc и водой. Фазы разделили и водную фазу экстрагировали EtOAc. Объединенные органические фазы промыли солевым раствором, высушили над Na2SO4, и сконцентрировали на силикагеле для очистки с помощью CombiFlash® (12 г колонка, 0-80% EtOAc в CH2Cl2, 15 мин) с получением 14 мг (20%) этил 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-циано-циклопропанкарбоксилата в виде единственного диастереомера.
Стадия 5: 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрил.
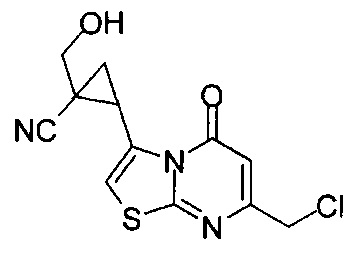
[0467] К раствору этил 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-циано-циклопропанкарбоксилата (14 мг, 0.04 ммоль) в 2 мл МеОН при 0°С добавили борогидрид натрия (22 мг, 0.58 ммоль) за одну порцию. Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь сконцентрировали, затем разделили между CH2Cl2 и 1н HCl (водн). Фазы разделили, и водную фазу экстрагировали CH2Cl2. Объединенные органические фазы высушили над Na2SO4 и сконцентрировали. Вышеуказанный процесс повторили (3 мл МеОН и 40 мг NaBH4 добавили при комнатной температуре) для проведения полной конверсии. Обработали как и ранее и сконцентрировали на силикагеле для очистки с помощью CombiFlash® (4 г колонка, 0-100% EtOAc в CH2Cl2, 15 мин), получив 11 мг (90%) 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрила в виде бесцветного осадка.
Стадия 6: 2-[7-[(N-этил-4-фтор-анилино)метил]-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрил.
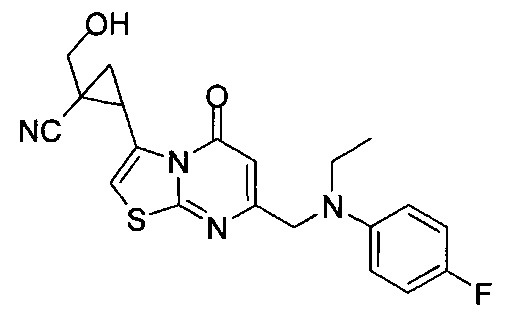
[0468] Смесь N-этил-4-фтор-анилина (8 мг, 0.06 ммоль) и 2-[7-(хлорометил)-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрила (11 мг, 0.04 ммоль) в 2 мл ацетонитрила перемешивали в течение 3 дней. Смесь сконцентрировали на силикагеле для очистки с помощью CombiFlash® (4 г колонка, 0-100% EtOAc в CH2Cl2, 15 мин) с получением 7 мг (47%) 2-[7-[(N-этил-4-фтор-анилино)метил]-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]-1-(гидроксиметил)циклопропанкарбонитрила в виде бесцветного осадка. 1H NMR (400 MHz, Хлороформ-d) δ 6.93 (m, 2Н), 6.7 (s, 1Н), 6.61 (m, 2H), 6.25 (s, 1Н), 4.33 (s, 2H), 4.16 (m, 2H), 3.48 (m, 2H), 3.32 (d, J=11.2 Hz, 1Н), 3.25 (ddd, J=8.5, 7.1, 1.5 Hz, 1Н), 1.76 (m, 1Н), 1.55 (dd, J=8.3, 6.3 Hz, 1Н), 1.24 (t, J=7.1 Hz, 3H). MS m/z 399.13 (M+H).
Пример 222: 7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-3-(2-гидрокси-1-метил-этил)-2-метил-тиазоло[3,2-а]пиримидин-5-он.
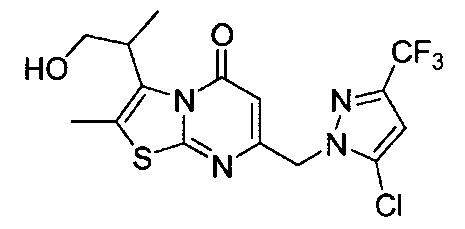
Стадия 1: Метил 2-метил-3-оксопентаноат.
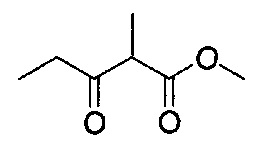
[0469] К раствору метил 3-оксопентаноата (10 г, 76.8 ммоль) в тетрагидрофуране (20 мл) добавили карбонат калия (21 г, 152 ммоль) и йодометан (12 г, 84.5 ммоль). Получившуюся смесь перемешивали в течение 5 ч при 70°С, и затем охладили до комнатной температуры. Смесь сконцентрировали под вакуумом с получением метил 2-метил-3-оксопентаноата в виде желтого масла (12 г, неочищенный).
Стадия 2: Метил 4-бромо-2-метил-3-оксопентаноат.
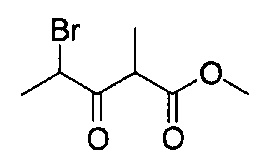
[0470] К раствору метил 2-метил-3-оксопентаноата (9.00 г, 62.4 ммоль) в хлороформе (25 мл, 310 ммоль) добавили Br2 (12 г, 75.1 ммоль). Получившийся раствор перемешивали в течение 12 ч при 25°С, и затем сконцентрировали под вакуумом с получением метил 4-бромо-2-метил-3-оксопентаноата (13 г, 93%) в виде желтого масла.
Стадия 3: Этил 2-(2-амино-5-метил-1,3-тиазол-4-ил)пропаноат.
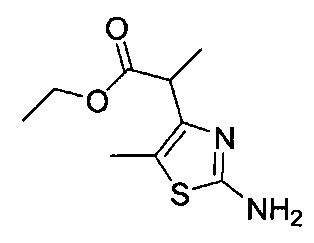
[0471] К раствору метил 4-бромо-2-метил-3-оксопентаноата (10 г, 44.8 ммоль) в этаноле (100 мл, 1.72 моль) добавили тиомочевину (4.8 г, 63.1 ммоль). Получившийся раствор перемешивали в течение 12 ч при 110°С. Реакционную смесь охладили до комнатной температуры и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением этил 2-(2-амино-5-метил-1,3-тиазол-4-ил)пропаноата (8 г, 83%) в виде желтого масла. ЖХМС(ESI):M+H+ = 215.1.
Стадия 4: Этил 2-[7-(хлорометил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]пропаноат.
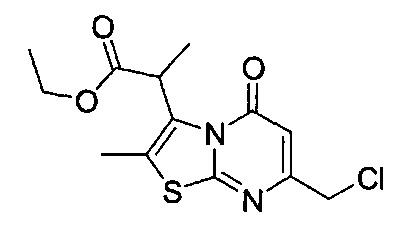
[0472] К раствору этил 2-(2-амино-5-метил-1,3-тиазол-4-ил)пропаноата (10 г, 46.7 ммоль) в полифосфорной кислоте (54 г, 469 ммоль) добавили этил 4-хлор-3-оксобутаноат (6.6 г, 40.1 ммоль). Получившийся раствор перемешивали в течение 1 ч при 110°С и затем охладили до комнатной температуры. рН раствора довели до 7 с помощью карбоната натрия (5%). Получившийся раствор экстрагировали этилацетатом и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением этил 2-[7-(хлорометил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]пропаноата в виде коричневого осадка (13 г, 88%). ЖХМС (ESI): M+H+ = 315.0.
Стадия 5: Этил 2-(7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропаноат.
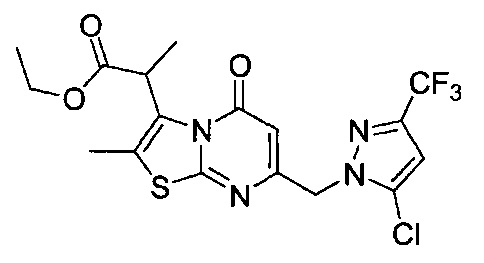
[0473] К раствору этил 2-[7-(хлорометил)-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]пропаноата (2 г, 6.35 ммоль) в ацетонитриле (30 мл) добавили 5-хлор-3-(трифторметил)-1Н-пиразол (1.1 г, 6.45 ммоль), йодид калия (1.06 г, 6.39 ммоль), и карбонат калия (2.2 г, 15.9 ммоль). Получившуюся смесь перемешивали в течение 2 ч при 90°С, охладили до комнатной температуры и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/4) с получением этил 2-(7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропаноата (2.9 г, неочищенный) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 449.0.
Стадия 6: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-(1-гидроксипропан-2-ил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
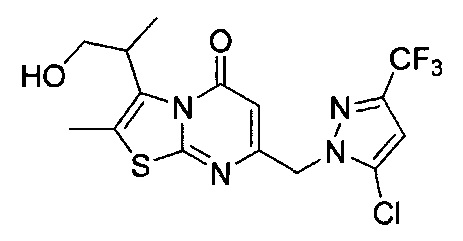
[0474] К раствору метил 2-(7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)пропаноата (60 мг, 0.14 ммоль) в дихлорметане (6 мл) добавили DIBAL-H (40 мг, 0.28 ммоль) при 0°С. Получившийся раствор перемешивали в течение 12 ч при 25°С, и реакционную смесь затем погасили водой. Получившийся раствор экстрагировали этилацетатом и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией дихлорметаном/этилацетатом (2/1) с получением 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-(1-гидроксипропан-2-ил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (28.7 мг, 51%) в виде светло-желтого масла. ЖХМС (ESI): M+H+ = 407.1; 1H NMR (400 MHz, CDCl3) δ 6.60 (s, 1H), 5.68 (s, 1H), 5.27 (s, 2H), 3.94-3.90 (m, 2H), 2.43 (s, 3H), 1.74 (m, 1H), 1.38-1.37 (m, 3H).
Пример 240: 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-3-(1Н-1,2,4-триазол-5-ил)тиазоло[3,2-а]пиримидин-5-он.
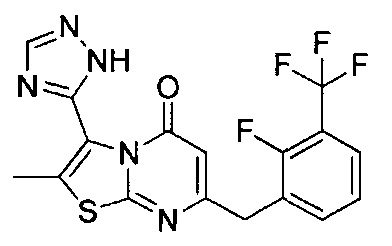
Стадия 1. Метил 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксилат.
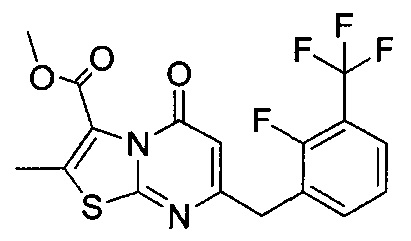
[0475] Pd[dppf]Cl2 (108 мг, 0.15 ммоль) добавили в раствор метил 7-(хлорометил)-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксилата (400 мг, 1.47 ммоль), [2-фтор-3-(трифторметил)фенил]бороновой кислоты (457 мг, 2.20 ммоль), и K2CO3 (405 мг, 2.93 ммоль) в 1,4-диоксане/воде (9 мл, 10:1) под N2. Смесь перемешивали при 90°С в течение 20 ч. Реакционную смесь отфильтровали через диатомитовую землю и промыли с помощью EtOAc. Неочищенный продукт абсорбировали на диатомитовой земле и очистили с помощью флеш-хроматографии (0-60% EtOAc/гептан градиент) с получением метил 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксилата в виде оранжевого осадка (409 мг, 70%). ЖХМС (ESI): М+H+ = 401.0; 1H NMR (400 MHz, DMSO-d6) δ 7.70 (q, J=8.1 Hz, 2H), 7.38 (t, J=7.8 Hz, 1H), 6.18 (s, 1H), 4.03 (s, 2H), 3.84 (s, 3Н), 2.38 (s, 3Н).
Стадия 2. 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоновая кислота.
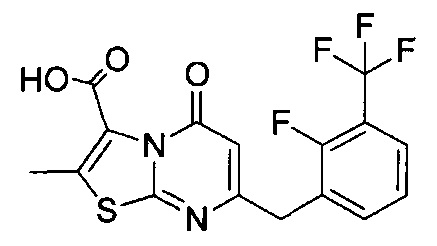
[0476] Метил 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксилат (365 мг, 0.91 ммоль) растворили в ТГФ (9 мл) и добавили LiOH 2 М (4.5 мл, 9.12 ммоль). Смесь перемешивали при 60°С в течение 6 ч. Смесь экстрагировали с помощью ДХМ (3×20 мл). Водный слой подкислили с помощью 1 н HCl и экстрагировали с помощью ДХМ (4×20 мл). Органические слои высушили над MgSO4, отфильтровали и сконцентрировали с получением 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоновой кислоты в виде неочищенного бежевого осадка (186 мг, 53%). ЖХМС (ESI): M+H+ = 387.1.
Стадия 3. 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
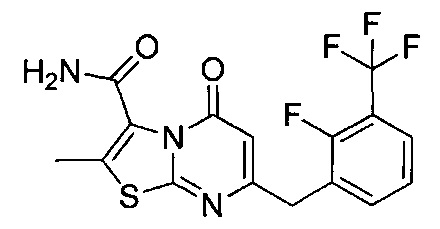
[0477] Оксалилхлорид (42 мкл, 0.47 ммоль) добавили в раствор 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоновой кислоты (90 мг, 0.23 ммоль) и ДМФ (2 мкл, 0.02 ммоль) в ДХМ (1.5 мл) при 0°С. Смесь перемешивали при комнатной температуре в течение 30 мин и затем реакционную смесь сконцентрировали досуха. Растворитель заменили на ТГФ (0.6 мл) и добавили раствор аммония в 1,4-диоксане (0.5 моль/л, 4 мл, 1.86 ммоль) при 0°С. Смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь разделили в воде/ДХМ и экстрагировали с помощью ДХМ (3×10 мл). Органические фазы промыли солевым раствором, высушили над MgSO4, отфильтровали и сконцентрировали с получением 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамида в виде неочищенного бледно-желтого осадка (73 мг, 81%). ЖХМС (ESI): M+H+ = 386.2.
Стадия 4. 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-3-(1Н-1,2,4-триазол-5-ил)тиазоло[3,2-а]пиримидин-5-он.
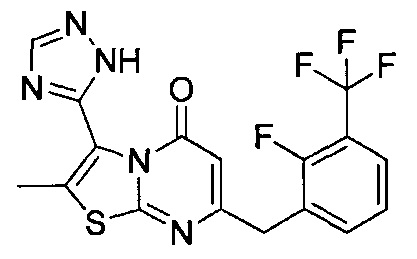
[0478] 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид (73 мг, 0.19 ммоль) в N,N-диметилформамида диметилацетале (1.9 мл, 14.2 ммоль) перемешивали при 100°С в течение 4 ч. Смесь сконцентрировали, обработали уксусной кислотой (1.9 мл, 32.7 ммоль) и гидразином (120 мкл, 3.78 ммоль), и перемешивали при 100°С в течение 2 ч. Реакционную смесь сконцентрировали и очистили с помощью препаративной ВЭЖХ и лиофилизации с получением 7-[[2-фтор-3-(трифторметил)фенил]метил]-2-метил-3-(1Н-1,2,4-триазол-5-ил)тиазоло[3,2-а]пиримидин-5-она в виде бежевого осадка (19 мг, 25%). ЖХМС (ESI): M+H+ = 410.1; 1H NMR (~2:1 соотношение таутомеров триазола, * обозначает пики второстепенного таутомера, 400 MHz, DMSO-d6) δ 14.19 (s, 1H), 8.52 (s, 1H), 7.79-7.65 (m, 2H), 7.39 (t, J=7.8 Hz, 1H), 6.13* (s, 0.3H), 6.04 (s, 0.7H), 4.02 (s, 2H), 2.33* (s, 1H), 2.18 (s, 2H).
Пример 244: 3-ацетил-7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-2-метокси-тиазоло[3,2-а]пиримидин-5-он.
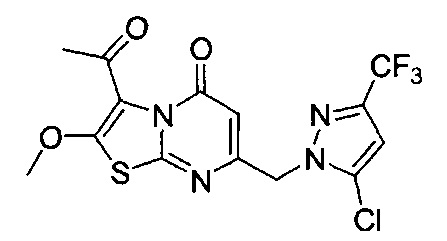
Стадия 1: 5-Метокситиазол-2-амин.
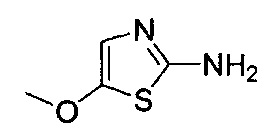
[0479] К раствору 5-бромо-1,3-тиазол-2-амина гидробромида (26 г, 100 ммоль) в метаноле (100 мл) добавили по каплям метоксид натрия (12 г, 222 ммоль) в 40 мл метанола при 0°С. Получившийся раствор перемешивали в течение 1 ч при комнатной температуре и реакционную смесь разбавили этилацетатом. Осадки отфильтровали и фильтрат сконцентрировали под вакуумом с получением 5-метокси-1,3-тиазол-2-амина (6.5 г, неочищенный) в виде рыжего осадка. ЖХМС (ESI): M+H+ = 131.0.
Стадия 2: 2-(5-Метокситиазол-2-ил)изоиндолин-1,3-дион.
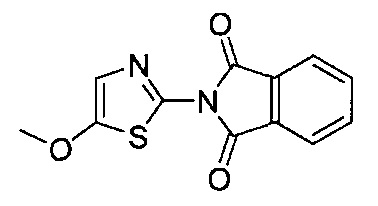
[0480] К раствору 5-метокси-1,3-тиазол-2-амина (6.50 г, неочищенный) в ацетонитриле (100 мл) добавили этил 1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-карбоксилат (10.9 г, 49.9 ммоль). Получившийся раствор перемешивали в течение ночи при 50°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией смесью дихлорметан/петролейный эфир (3/1) с получением 2-(5-метокси-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (5 г, 38%) в виде светло-коричневого осадка. ЖХМС (ESI): M+H+ = 261.0.
Стадия 3: 2-(4-хлор-5-метокситиазол-2-ил)изоиндолин-1,3-дион.
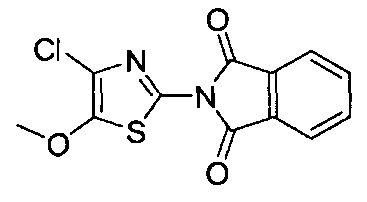
[0481] Раствор 2-(5-метокси-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (4.00 г, 15.4 ммоль) в ацетонитриле (100 мл) обработали N-хлорсукцинимидом (2.16 г, 16.2 ммоль) и затем перемешивали в течение 2 ч при 90°С. Получившуюся смесь сконцентрировали под вакуумом с получением 2-(4-хлор-5-метокси-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (4.6 г, неочищенный) в виде оранжевого осадка. ЖХМС (ESI): M+Н+ = 295.0.
Стадия 4: 4-хлор-5-метокситиазол-2-амин.
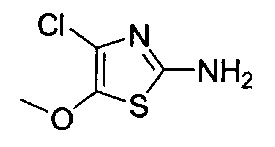
[0482] К раствору 2-(4-хлор-5-метокси-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (4.6 г, 15.6 ммоль) в метаноле (50 мл) добавили NH2NH2⋅H2O (15 мл, 308 ммоль). Получившийся раствор перемешивали в течение 4 ч при комнатной температуре. Осадки отфильтровали и фильтрат сконцентрировали под вакуумом с получением 4-хлор-5-метокси-1,3-тиазол-2-амина (2 г, 78%) в виде светло-коричневого осадка. ЖХМС (ESI): M+H+ = 165.0.
Стадия 5: 3-хлор-7-(хлорометил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-он.
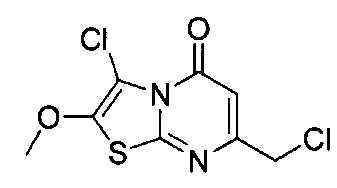
[0483] К раствору 4-хлор-5-метокси-1,3-тиазол-2-амина (2.00 г, 12.1 ммоль) в РРА (30 г, 260 ммоль) добавили этил 4-хлор-3-оксобутаноат (6.00 г, 36.4 ммоль). Получившийся раствор перемешивали в течение 2 ч при 60°С и затем погасили водой со льдом. Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением 3-хлор-7-(хлорометил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (1.5 г, 47%) в виде светло-коричневого осадка. ЖХМС (ESI): M+H+ = 265.0.
Стадия 6: 3-хлор-7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-он.
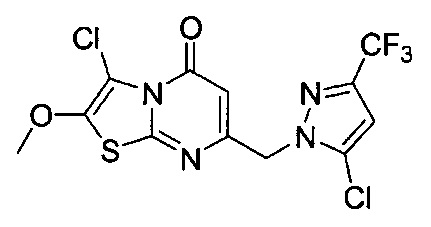
[0484] К раствору 3-хлор-7-(хлорометил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (100 мг, 0.38 ммоль) в ацетонитриле (2 мл) добавили 5-хлор-3-(трифторметил)-1Н-пиразол (78 мг, 0.46 ммоль) и карбонат калия (104 мг, 0.75 ммоль). Получившийся раствор перемешивали в течение 2 ч при 80°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ТСХ с помощью смеси этилацетат/петролейный эфир (1/2) с получением 3-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (24.4 мг, 16%) в виде белого осадка. ЖХМС (ESI): M+H+ = 399.9; 1H NMR (300 MHz, CDCl3) δ 6.58 (s, 1H), 5.73 (s, 1H), 5.23 (s, 2H), 4.02 (s, 3H).
Стадия 7: 7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(1-этоксивинил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-он.
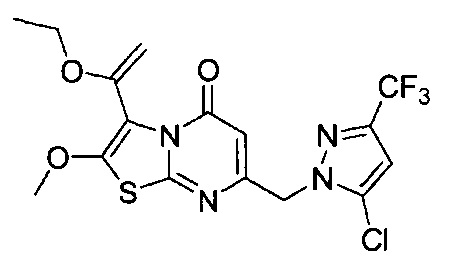
[0485] К раствору 3-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (300 мг, 0.752 ммоль) в 1,4-диоксане (8 мл) добавили трибутил(1-этоксиэтенил)станнан (543 мг, 1.504 ммоль), DIEA (194 мг, 1.50 ммоль), и бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (106 мг, 0.151 ммоль). Получившийся раствор перемешивали в течение ночи при 80°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ТСХ с помощью смеси этилацетат/петролейный эфир (1:2) с получением 7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(1-этоксивинил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (180 мг, 55%) в виде светло-желтого масла. ЖХМС (ESI): M+H+ = 435.0.
Стадия 8: 3-ацетил-7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-он.
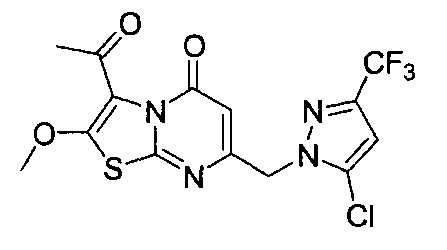
[0486] К раствору 7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-3-(1-этоксивинил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (180 мг, 0.414 ммоль) в дихлорметане (10 мл) добавили раствор хлороводорода в 1,4-диоксане (0.5 мл, насыщенный). Получившийся раствор перемешивали в течение 30 мин при комнатной температуре и затем сконцентрировали под вакуумом. Остаток очистили с помощью препаративной ТСХ с помощью смеси этилацетат/петролейный эфир (1/1) с получением 3-ацетил-7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-метокси-5Н-тиазоло[3,2-а]пиримидин-5-она (64.7 мг, 38%) в виде белого осадка. ЖХМС (ESI): M+H+ = 407.0; 1H NMR (300 MHz, CDCl3) δ 6.58 (s, 1H), 5.81 (s, 1H), 5.27 (s, 2H), 4.05 (s, 3H), 2.50 (s, 3H).
Пример 250: 7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-3-пропаноил-2-(трифторметил)тиазоло[3,2-а]пиримидин-5-он.
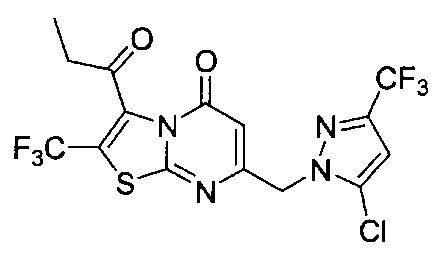
Стадия 1: Метил 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоксилат.
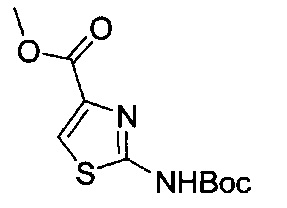
[0487] К раствору 2-амино-1,3-тиазол-4-карбоксилата (20 г, 126 ммоль) и 4-диметиламинопиридина (1.54 г, 12.6 ммоль) в дихлорметане/тетрагидрофуране (200 мл/200 мл) добавили ди-трет-бутилдикарбонат (33 г, 151 ммоль). Получившийся раствор перемешивали в течение 12 ч при комнатной температуре и затем сконцентрировали под вакуумом. Остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/2) с получением метил 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоксилата (28 г, 86%) в виде серо-белого осадка. ЖХМС (ESI): М+H+ = 259.0.
Стадия 2: 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоновая кислота.
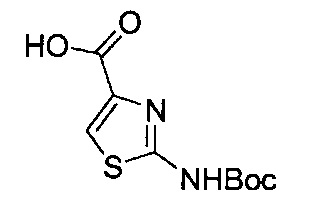
[0488] К раствору метил 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоксилата (28 г, 108 ммоль) в тетрагидрофуране (300 мл) добавили раствор гидроксида лития (10.4 г, 433 ммоль) в воде (150 мл). Получившуюся смесь перемешивали в течение 12 ч при комнатной температуре. рН раствора довели до 4 с помощью соляной кислоты (2 моль/л). Осадки собрали посредством фильтрации с получением 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоновой кислоты (20 г, 76%) в виде серо-белого осадка. ЖХМС (ESI): М+Н+ = 245.0.
Стадия 3: трет-бутил N-[4-[метокси(метил)карбамоил]-1,3-тиазол-2-ил]карбамат.
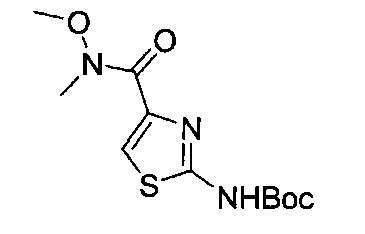
[0489] К смеси 2-[[(трет-бутокси)карбонил]амино]-1,3-тиазол-4-карбоновой кислоты (20.0 г, 81.9 ммоль) в дихлорметане (400 мл) добавили метокси(метил)амина гидрохлорид (16.0 г, 164 ммоль), HATU (37.4 г, 98.3 ммоль), и триэтиламин (16.6 г, 164 ммоль). Получившуюся смесь перемешивали в течение 4 ч при комнатной температуре. Затем реакционную смесь погасили водой, затем экстрагировали этилацетатом и сконцентрировали под вакуумом с получением трет-бутил N-[4-[метокси(метил)карбамоил]-1,3-тиазол-2-ил]карбамат (20 г, 85%) в виде светло-красного осадка. ЖХМС (ESI): M+H+ = 288.0.
Стадия 4: трет-бутил N-(4-пропаноил-1,3-тиазол-2-ил)карбамат.
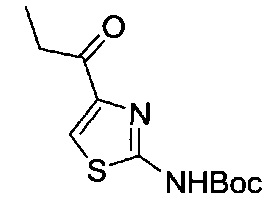
[0490] К раствору трет-бутил N-[4-[метокси(метил)карбамоил]-1,3-тиазол-2-ил]карбамата (5.00 г, 17.4 ммоль) в тетрагидрофуране (100 мл, 1.23 моль) добавили бромо(этил)магний (4.59 мл, 34.8 ммоль) при -70°С. Получившийся раствор перемешивали в течение 12 ч при комнатной температуре. Реакционную смесь разбавили насыщенным водным NH4Cl (30 мл), экстрагировали этилацетатом, и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением трет-бутил N-(4-пропаноил-1,3-тиазол-2-ил)карбамата (1.3 г, 29%) в виде светло-желтого осадка. ЖХМС (ESI): М+Н+ = 257.0.
Стадия 5: 1-(2-амино-1,3-тиазол-4-ил)пропан-1-он.
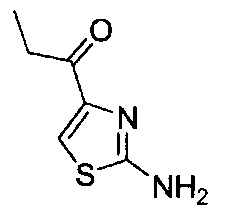
[0491] К раствору трет-бутил N-(4-пропаноил-1,3-тиазол-2-ил)карбамата (1.3 г, 5.07 ммоль) в дихлорметане (15 мл) добавили трифторуксусную кислоту (24 мл). Получившийся раствор перемешивали в течение 2 ч при 0°С и затем сконцентрировали под вакуумом. Остаток растворили в дихлорметане и затем промыли бикарбонатом натрия (1 моль/л). Органические слои сконцентрировали под вакуумом с получением 1-(2-амино-1,3-тиазол-4-ил)пропан-1-она (750 мг, 90%) в виде светло-желтого осадка. ЖХМС (ESI): M+H+ = 157.0.
Стадия 6: 1-(2-амино-5-йод-1,3-тиазол-4-ил)пропан-1-он.
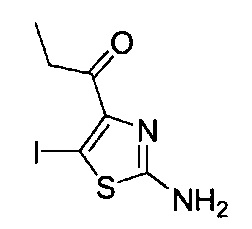
[0492] К раствору 1-(2-амино-1,3-тиазол-4-ил)пропан-1-она (850 мг, 5.44 ммоль) в дихлорметане (20 мл) добавили N-йод-сукцинимид (1.35 г, 5.99 ммоль). Получившуюся смесь перемешивали в течение 12 ч при комнатной температуре и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением 1-(2-амино-5-йод-1,3-тиазол-4-ил)пропан-1-она (1 г, 65%) в виде коричневого осадка. ЖХМС (ESI): М+H+ = 283.0.
Стадия 7: 2-(5-йодо-4-пропаноил-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-дион.
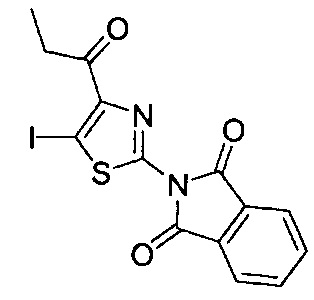
[0493] К раствору 1-(2-амино-5-йод-1,3-тиазол-4-ил)пропан-1-она (500 мг, 1.77 ммоль) и триэтиламина (89.7 мг, 0.89 ммоль) в дихлорметане (30 мл) добавили этил 1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-карбоксилат (777 мг, 3.54 ммоль). Получившуюся смесь перемешивали в течение 12 ч при 40°С, и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/2) с получением 2-(5-йод-4-пропаноил-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (450 мг, 62%) в виде светло-красного осадка. ЖХМС (ESI): M+H+ = 413.0.
Стадия 8: 2-(5-йодо-4-пропаноил-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-дион.
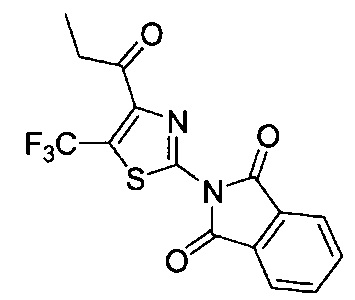
[0494] К раствору 2-(5-йод-4-пропаноил-1,3-тиазол-2-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона (450 мг, 1.09 ммоль) в N,N-диметилформамиде (10 мл) добавили этил 2,2-дифтор-2-(фторсульфонил)ацетат (450 мг, 2.18 ммоль) и йодид меди(I) (416 мг, 2.18 ммоль). Получившуюся смесь перемешивали в течение 2 ч при 80°С и затем сконцентрировали под вакуумом. Остаток растворили в дихлорметане (20 мл), и осадки отфильтровали. Получившийся раствор сконцентрировали под вакуумом с получением 2-[4-пропаноил-5-(трифторметил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-изоиндол-1,3-диона (230 мг, 59%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 355.0.
Стадия 9: 1-[2-амино-5-(трифторметил)-1,3-тиазол-4-ил]пропан-1-он.
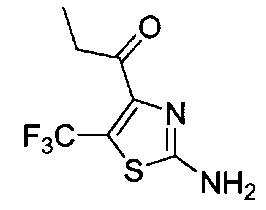
[0495] К раствору 2-[4-пропаноил-5-(трифторметил)-1,3-тиазол-2-ил]-2,3-дигидро-1Н-изоиндол-1,3-диона (230 мг, 0.65 ммоль) в ацетонитриле (10 мл) добавили моногидратгидразина (0.31 мл, 6.38 ммоль). Получившийся раствор перемешивали в течение 30 мин при комнатной температуре. После концентрирования остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением 1-[2-амино-5-(трифторметил)-1,3-тиазол-4-ил]пропан-1-она (60 мг, 41%) в виде светло-желтого масла. ЖХМС (ESI): M+H+ = 225.0.
Стадия 10: 7-(хлорометил)-3-пропаноил-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
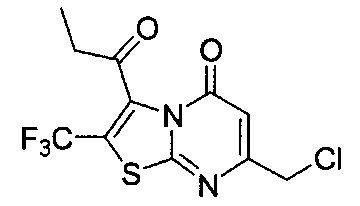
[0496] К смеси 1-[2-амино-5-(трифторметил)-1,3-тиазол-4-ил]пропан-1-она (60 мг, 0.27 ммоль) в полифосфорной кислоте (1 г, 8.69 ммоль) добавили этил 4-хлор-3-оксобутаноат (220 мг, 1.34 ммоль). Получившуюся смесь перемешивали в течение 12 ч при 130°С. Затем реакционную смесь погасили водой (25 мл), экстрагировали этилацетатом и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/2) с получением 7-(хлорометил)-3-пропаноил-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (15 мг, 17%) в виде желтого осадка. ЖХМС (ESI): M+H+ = 325.0.
Стадия 11: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-пропаноил-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
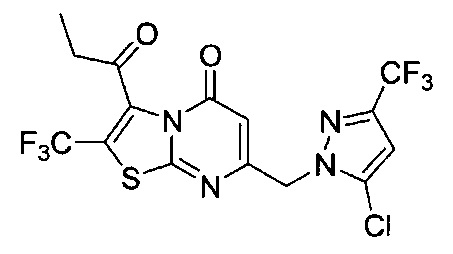
[0497] К смеси 7-(хлорометил)-3-пропаноил-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (15 мг, 0.05 ммоль) в ацетонитриле (3 мл, 57.1 ммоль) добавили карбонат калия (13 мг, 0.09 ммоль) и 5-хлор-3-(трифторметил)-1Н-пиразол (10 мг, 0.06 ммоль). Получившуюся смесь перемешивали в течение 2 ч при 80°С. После фильтрации и концентрирования остаток очистили посредством хроматографии с помощью смеси этилацетат/петролейный эфир (1/3) с получением 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-3-пропаноил-2-(трифторметил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (4.5 мг, 21%) в виде светло-коричневого осадка. ЖХМС (ESI): М+H+ = 459.0; 1H NMR (400 MHz, CDCl3) δ 6.60 (s, 1H), 5.83 (s, 1H), 5.31 (s, 2H), 2.97-2.83 (m, 2H), 1.29-1.25 (m, 3H).
Пример 251: 2-[7-[(3,5-Дихлорпиразол-1-ил)метил]-2-метил-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]циклопропанкарбонитрил.
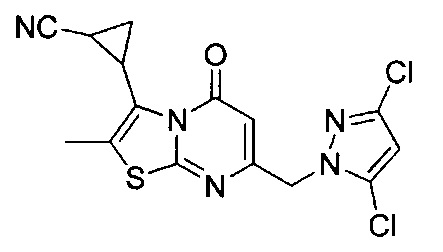
Стадия 1: N,N-диметил-1Н-пиразол-1-сульфонамид.

[0498] Раствор 1Н-пиразола (30 г, 440 ммоль) в тетрагидрофуране (500 мл) обработали гидридом натрия (26 г, 648 ммоль, 60%) при 0°С, и затем перемешивали в течение 1 ч при 0°С. N,N-диметилсульфамоилхлорид (95 г, 661 ммоль) добавили по каплям при 0°С. Получившийся раствор перемешивали в течение дополнительных 2 ч при комнатной температуре и затем погасили водой. Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/6) с получением N,N-диметил-1Н-пиразол-1-сульфонамида (58 г, 75%) в виде бесцветного масла. ЖХМС (ESI): M+H+ = 175.0.
Стадия 2: 5-хлор-N,N-диметил-1Н-пиразол-1-сульфонамид.
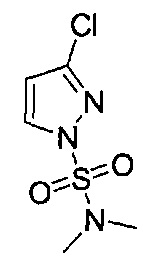
[0499] К раствору N,N-диметил-1Н-пиразол-1-сульфонамида (37.2 г, 212 ммоль) в тетрагидрофуране (600 мл) добавили по каплям n-BuLi (127 мл, 2.5 ммоль/L) при -78°С. Получившийся раствор перемешивали в течение 1 ч при -78°С. Гексахлорэтан (75.4 г, 318 ммоль) в тетрагидрофуране (400 мл) добавили по каплям при -78°С. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/6) с получением 5-хлор-N,N-диметил-1Н-пиразол-1-сульфонамида в виде красного масла (39.5 г, 89%). ЖХМС (ESI): М+H+ = 209.0.
Стадия 3: 5-хлор-1Н-пиразол.
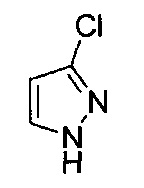
[0500] К раствору 5-хлор-N,N-диметил-1Н-пиразол-1-сульфонамида (30 г, 143 ммоль) в дихлорметане (500 мл) добавили трифторуксусную кислоту (45.7 г, 401 ммоль). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и погасили водой. рН раствора довели до 8 с помощью насыщенного бикарбоната натрия. Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом с получением 5-хлор-1Н-пиразола в виде рыжеватого осадка (14 г, 95%). ЖХМС (ESI): M+H+ = 103.0.
Стадия 4: 5-хлор-1-нитро-1Н-пиразол
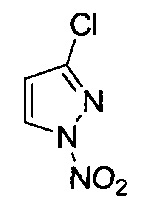
[0501] К раствору 5-хлор-1Н-пиразола (14 г, 136 ммоль) в уксусной кислоте/уксусном ангидриде (36 мл/92 мл) добавили дымящуюся азотную кислоту (36 мл). Получившийся раствор перемешивали в течение ночи при комнатной температуре, и затем разбавили водой (500 мл). Осадки собрали посредством фильтрации с получением 5-хлор-1-нитро-1Н-пиразола в виде желтого осадка (7 г, 35%).
Стадия 5: 5-хлор-3-нитро-1Н-пиразол.
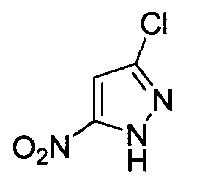
[0502] Раствор 5-хлор-1-нитро-1Н-пиразола (3 г, 20.3 ммоль) в метоксибензоле (53.6 мл) перемешивали в течение ночи при 130°С. Получившийся раствор разбавили смесью H2O : петролейный эфир (1:1), затем экстрагировали гидроксидом натрия (10%) и водные слои объединили. рН раствора довели до 2 с помощью соляной кислоты (3 моль/л). Получившийся раствор экстрагировали этилацетатом и сконцентрировали под вакуумом с получением 5-хлор-3-нитро-1Н-пиразола в виде желтого осадка (2.7 г, 90%).
Стадия 6: 3-бромо-7-[(5-хлор-3-нитро-1Н-пиразол-1-ил)метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
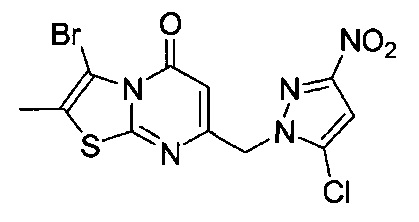
[0503] К раствору 3-бромо-7-(хлорометил)-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (400 мг, 1.36 ммоль) в ацетонитриле (50 мл) добавили 5-хлор-3-нитро-1Н-пиразол (211 мг, 1.43 ммоль), KI (113 мг, 0.68 ммоль), и карбонат калия (565 мг, 4.09 ммоль). Получившийся раствор перемешивали в течение 2 ч при 80°С, охладили, экстрагировали дихлорметаном, и затем сконцентрировали под вакуумом с получением 3-бромо-7-[(5-хлор-3-нитро-1Н-пиразол-1-ил)метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде серого осадка (20 мг, 4%). ЖХМС (ESI): M+H+ = 405.0.
Стадия 7: 7-((3-амино-5-хлор-1Н-пиразол-1-ил)метил)-3-бромо-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-он.
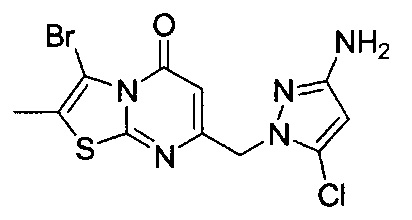
[0504] К раствору 3-бромо-7-((5-хлор-3-нитро-1Н-пиразол-1-ил)метил)-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она (30 мг, 0.066 ммоль) в этаноле/воде (5 мл/1 мл) добавили порошок железа (29 мг, 0.52 ммоль) и хлорид аммония (35 мг, 0.660 ммоль). Реакционную смесь перемешивали в течение 2 ч при 80°С, охладили и экстрагировали дихлорметаном. Объединенную органическую фазу сконцентрировали под вакуумом с получением 7-((3-амино-5-хлор-1Н-пиразол-1-ил)метил)-3-бромо-2-метил-5Н-тиазоло[3,2-а]пиримидин-5-она в виде серого осадка (10 мг, 4%). ЖХМС (ESI): M+H+ = 375.0.
Стадия 8: 3-бромо-7-[(3,5-дихлор-1Н-пиразол-1-ил)метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
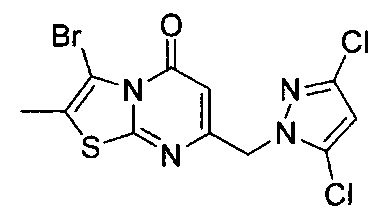
[0505] К раствору 7-[(5-амино-3-хлор-1Н-пиразол-1-ил)метил]-3-бромо-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (1 г, 2.67 ммоль) в ацетонитриле (10 мл) добавили трет-бутилнитрит (495 мг, 4.80 ммоль) и хлорид меди(I) (715 мг, 5.32 ммоль). Получившуюся смесь перемешивали в течение 1 ч при 25°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением 3-бромо-7-[(3,5-дихлор-1Н-пиразол-1-ил)метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (200 мг, 19%) в виде желтого осадка. ЖХМС (ESI): М+Н+ = 395.0.
Стадия 9: 2-[7-[(3,5-дихлор-1Н-пиразол-1-ил)метил]-2-метил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил]циклопропан-1-карбонитрил.
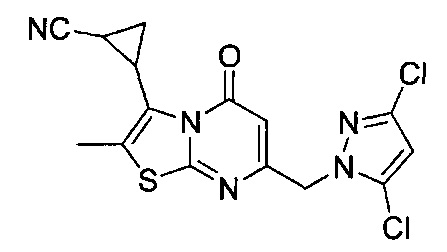
[0506] К раствору 3-бромо-7-[(3,5-дихлор-1Н-пиразол-1-ил)метил]-2-метил-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (150 мг, 0.38 ммоль) в ацетонитриле/воде (4 мл/0.4 мл) добавили калия 2-(трифтор-лямбда4-боранил)циклопропан-1-карбонитрил (263 мг, 1.52 ммоль), карбонат натрия (80 мг, 0.75 ммоль), и [бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (27 мг, 0.037 ммоль). Получившийся раствор перемешивали в течение 14 ч при 90°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением рацемического продукта (45 мг, 31%). Рацемический продукт разделили с помощью хиральной ВЭЖХ при следующих условиях (Колонка: Chiralpak ic 0.46*25 см, 5 мкм; Подвижная фаза: 100% MeOH-HPLC; Скорость потока: 1 мл/мин; детектор: 254 нм) с получением соединения, указанного в заголовке, в виде белого осадка (13.3 мг, 9%). Время задержки: 9.18 мин; ЖХМС (ESI): M+H+ = 381.0; 1H NMR (300 MHz, CDCl3) δ 6.25 (s, 1H), 5.71 (s, 1H), 5.14 (s, 2H), 2.99-2.94 (m, 1H), 2.39 (s, 3Н), 1.84-1.79 (m, 1H), 1.69-1.66 (m, 1H), 1.45-1.35 (m 1H).
Пример 258: 7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-2-(дифторметил)-N-этил-5-оксо-тиазоло[3,2-а]пиримидин-3-карбоксамид.
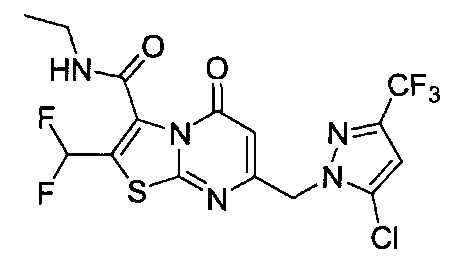
Стадия 1: 2-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
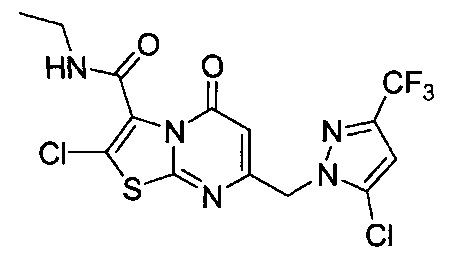
[0507] К раствору 2-хлор-7-(хлорометил)-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (2 г, 6.53 ммоль) в ацетонитриле (10 мл) добавили 5-хлор-3-(трифторметил)-1Н-пиразол (872 мг, 5.11 ммоль), йодид калия (542 мг, 3.26 ммоль), и карбонат калия (1.8 г, 13 ммоль). Получившуюся смесь перемешивали в течение 1 ч при 80°С и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением 2-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (1.1 г, 38%) в виде желтого осадка. ЖХМС (ESI): М+Н+ = 441.0.
Стадия 2: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-этенил-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
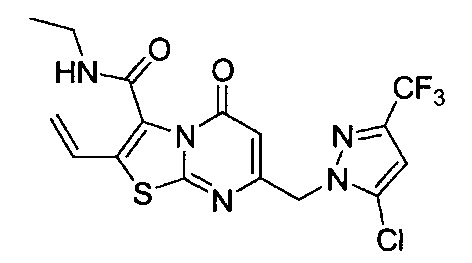
[0508] К раствору 2-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (500 мг, 1.14 ммоль) в 1,4-диоксане/воде (15 мл/1 мл) добавили 2-этенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан (349 мг, 2.27 ммоль), карбонат натрия, (238 мг, 2.25 ммоль) и [бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (83 мг, 0.11 ммоль). Получившийся раствор перемешивали в течение 14 ч при 90°С и затем сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-этенил-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде желтого осадка (200 мг, 41%). ЖХМС (ESI): M+H+ = 432.0.
Стадия 3: 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-формил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамид.
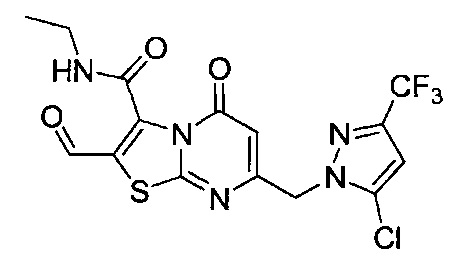
[0509] К раствору 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-этенил-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (175 мг, 0.41 ммоль) в 1,4-диоксане/воде (5 мл/3 мл) добавили тетраоксид осмия (1.03 мг, 0.004 ммоль), N-метилморфолин-N-оксид (94.83 мг, 0.811 ммоль), и периодата натрия (173 мг, 0.81 ммоль). Получившийся раствор перемешивали в течение 14 ч при 25°С и сконцентрировали. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/2) с получением 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-формил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (50 мг 28%) в виде светло-желтого осадка. ЖХМС (ESI): M+H+ = 456.0.
Стадия 4: 7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-2-(дифторметил)-N-этил-5-оксо-5Н-тиазоло[3,2-а]пиримидин-3-карбоксамид.
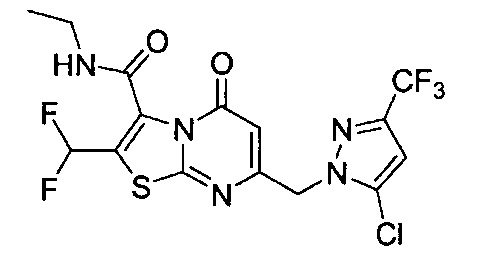
[0510] К раствору 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-N-этил-2-формил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида (100 мг, 0.23 ммоль) в дихлорметане (20 мл) добавили бис(2-метоксиэтил)амино]серы трифторид (510 мг, 2.31 ммоль) при 0°С. Получившийся раствор перемешивали в течение 14 ч при 25°С, и затем погасили водой. Получившийся раствор экстрагировали этилацетатом и сконцентрировали под вакуумом с получением 7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-2-(дифторметил)-N-этил-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-карбоксамида в виде белого осадка (21.2 мг, 20%). ЖХМС (ESI): M+H+ = 456.0; 1H NMR (400 MHz, CDCl3) δ 7.10-6.83 (m, 1H), 6.59 (s, 1H), 6.37 (s, 1H), 5.80 (s, 1H), 5.30 (s, 2H), 3.54-3.47 (m, 2H), 1.28-1.25 (m, 3Н).
Примеры 266 и 267: 2-[2-хлор-7-[[5-хлор-3-(трифторметил)пиразол-1-ил]метил]-5-оксо-тиазоло[3,2-а]пиримидин-3-ил]циклопропанкарбонитрил (цис энантиомеры).
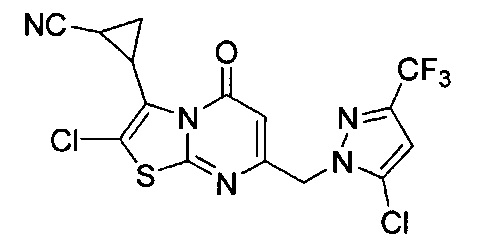
Стадия 1: трет-бутил N-(4-бромо-5-хлор-1,3-тиазол-2-ил)карбамат.
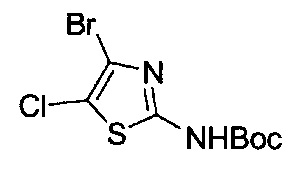
[0511] К раствору трет-бутил N-(5-бромо-1,3-тиазол-2-ил)карбамата (5 г, 17.9 ммоль) в тетрагидрофуране (100 мл) добавили по каплям LDA (29.4 мл, 2 моль/л) при -78°С, и получившуюся смесь перемешивали в течение 1 ч при -78°С. Затем смесь добавили в раствор гексахлорэтана (14 г, 59.1 ммоль) в тетрагидрофуране (50 мл) при -78°С. Реакционную смесь перемешивали в течение дполнительных 15 ч при комнатной температуре. Реакционную смесь погасили водой, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/9) с получением трет-бутил N-(4-бромо-5-хлор-1,3-тиазол-2-ил)карбамата (4.07 г, 72%) в виде коричневого масла. ЖХМС (ESI): М+Н+ = 313.0.
Стадия 2: 4-бромо-5-хлор-1,3-тиазол-2-амин.
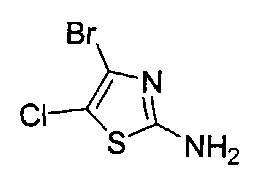
[0512] К раствору трет-бутил N-(4-бромо-5-хлор-1,3-тиазол-2-ил)карбамата (4.07 г, 13.0 ммоль) в дихлорметане (20 мл) добавили трифторуксусную кислоту (29.7 г, 260 ммоль), и реакционную смесь перемешивали в течение 15 ч при комнатной температуре. РН раствора довели до 7 с помощью насыщенного бикарбоната натрия, затем экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/5) с получением 4-бромо-5-хлор-1,3-тиазол-2-амина (1.02 г, 37%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 213.0.
Стадия 3: 3-бромо-2-хлор-7-(хлорометил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-он.
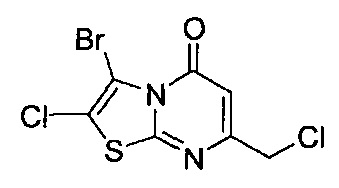
[0513] К раствору 4-бромо-5-хлор-1,3-тиазол-2-амина (700 мг, 3.28 ммоль) в полифосфорной кислоте (2.81 г, 24.4 ммоль) добавили этил 4-хлор-3-оксобутаноат (1.08 г, 6.56 ммоль). Реакционную смесь перемешивали в течение 1 ч при 110°С и охладили до комнатной температуры. Затем реакционную смесь погасили водой и рН раствора довели до 7 с помощью гидроксида натрия (1 моль/л). Получившийся раствор экстрагировали дихлорметаном и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/3) с получением 3-бромо-2-хлор-7-(хлорометил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (900 мг, 87%) в виде коричневого осадка. ЖХМС (ESI): M+H+ = 313.0.
Стадия 4: 3-бромо-2-хлор-7-((5-хлор-3-(трифторметил)-1Н-пиразол-1-ил)метил)-5Н-тиазоло[3,2-а]пиримидин-5-он.
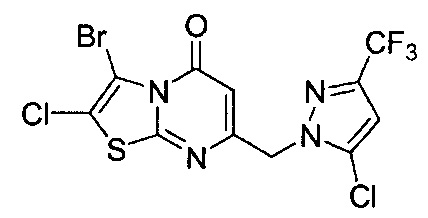
[0514] К раствору 3-бромо-2-хлор-7-(хлорометил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (500 мг, 1.59 ммоль) в ацетонитриле (10 мл) добавили 5-хлор-3-(трифторметил)-1Н-пиразол (327 мг, 1.92 ммоль), йодид калия (133 мг, 0.80 ммоль), и карбонат калия (442 мг, 3.20 ммоль). Получившийся раствор перемешивали в течение 2 ч при 80°С и охладили. Осадок отфильтровали и фильтрат сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/9) с получением 3-бромо-2-хлор-7-(хлорометил)-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она в виде коричневого осадка (300 мг, 60%). ЖХМС (ESI): M+H+ = 448.0.
Стадия 5: 2-(2-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-5-оксо-5Н-[1,3]тиазоло[3,2-а]пиримидин-3-ил)циклопропан-1-карбонитрил (энантиомер 1).
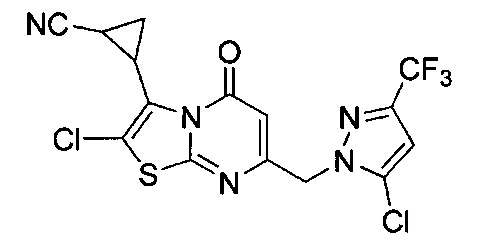
[0515] К раствору 3-бромо-2-хлор-7-[[5-хлор-3-(трифторметил)-1Н-пиразол-1-ил]метил]-5Н-[1,3]тиазоло[3,2-а]пиримидин-5-она (100 мг, 0.22 ммоль) в 1,4-диоксане/воде (3 мл/0.3 мл) добавили калия 2-(циано)циклопропилтрифторборат (77.2 мг, 0.45 ммоль), [бис(дифенилфосфино)ферроцен]палладий(II) дихлорид (16.3 мг, 0.022 ммоль), и фосфат калия (94.8 мг, 0.45 ммоль). Получившийся раствор перемешивали в течение 14 ч при 85°С и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии на силикагеле с элюцией с помощью смеси этилацетат/петролейный эфир (1/1) с получением рацемического продукта (40 мг, 41%). Затем рацемический продукт разделили с помощью хиральной ВЭЖХ при следующих условиях (Колонка: Phenomenex Lux 5u Cellulose-4, AXIA Packed 250*21.2 мм, 5 мкм; Подвижная фаза: 100% МеОН; Скорость потока: 20 мл/мин; детектор: 254 нм/220 нм) с получением двух энантиомеров. Энантиомер 1 (пик 1, белый осадок, 7.5 мг, 8%): Время задержки: 1.54 мин; ЖХМС (ESI): M+H+ = 434.0; 1H NMR (400 MHz, CDCl3) δ 6.59 (s, 1H), 5.74 (s, 1H), 5.24 (s, 2H), 2.98-2.93 (m, 1H), 1.88-1.82 (m, 2H), 1.66-1.61 (m, 1H). Энантиомер 2 (пик 2, 6.1 мг, 6%): Время задержки: 2.06 мин; ЖХМС (ESI): M+H+ = 434.0; 1H NMR (400 MHz, CDCl3) δ 6.59 (s, 1H), 5.75 (s, 1H), 5.24 (s, 2H), 2.99-2.89 (m, 1H), 1.88-1.82 (m, 2H), 1.66-1.61 (m, 1H).
[0516] Следующие примеры получили с использованием способов, аналогичных описанным в соответствующей колонке Референсном способе или Примере (Реф. способ или Пр.). Надлежащие аналитические данные получили для каждого соединения.
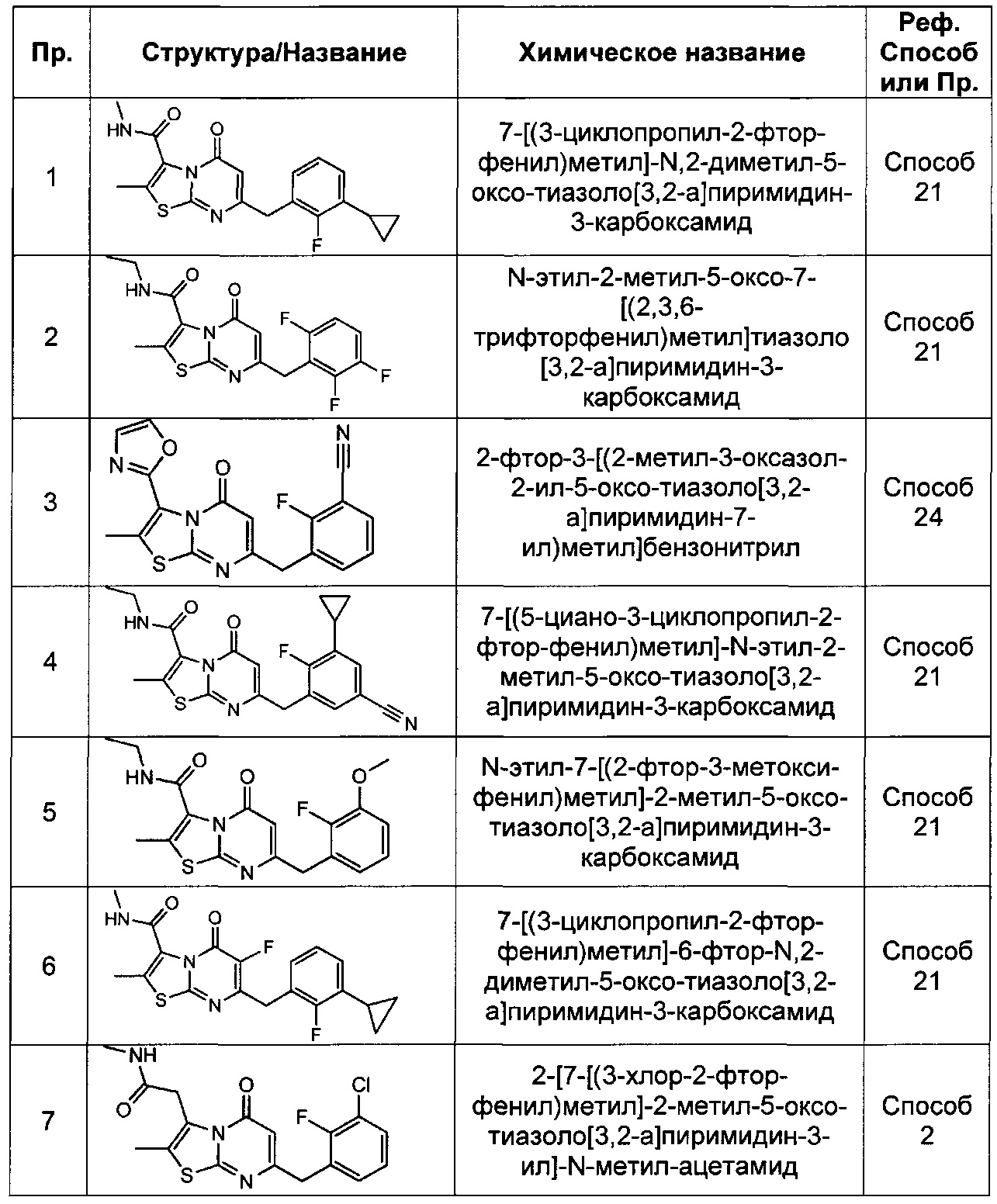
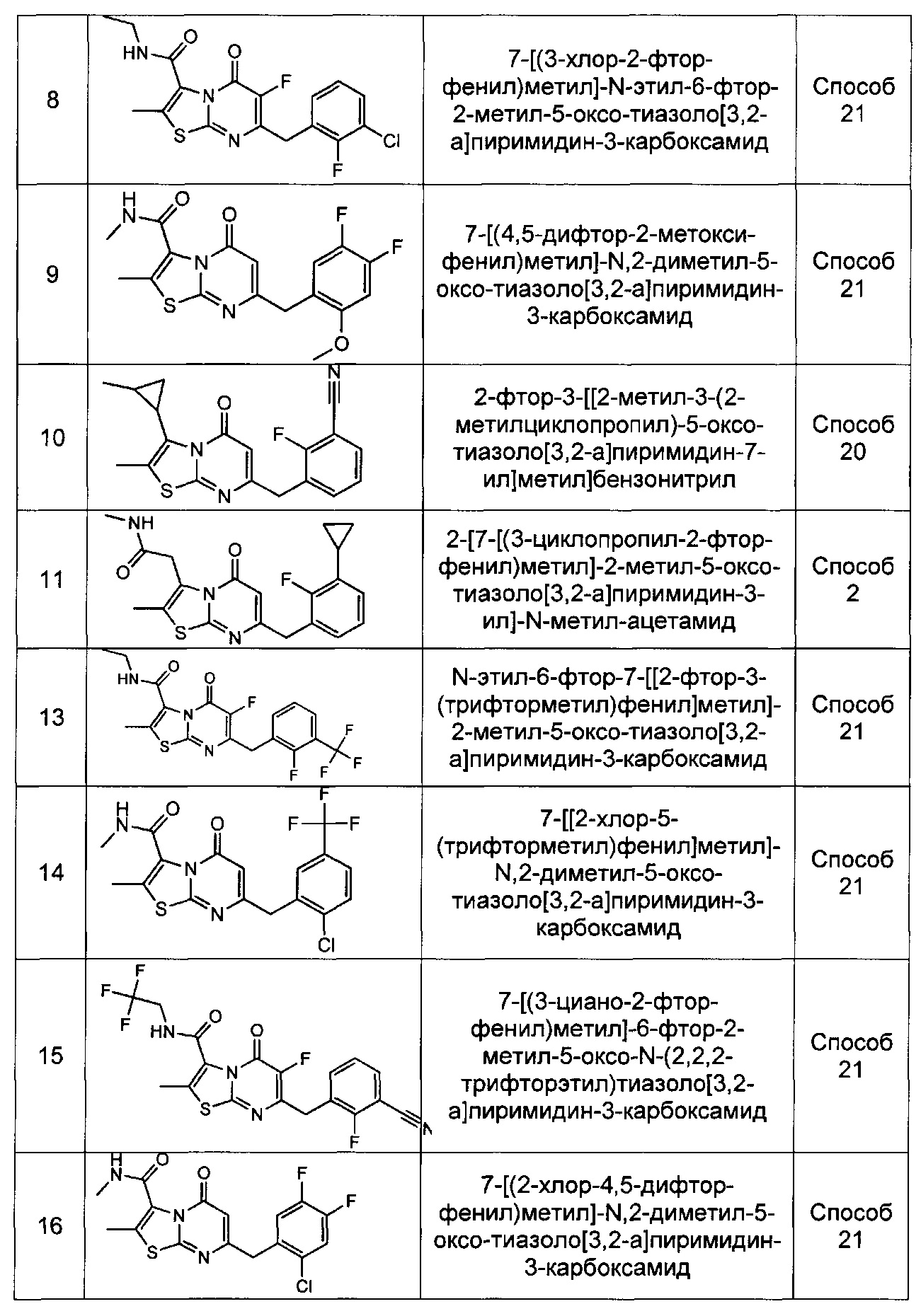
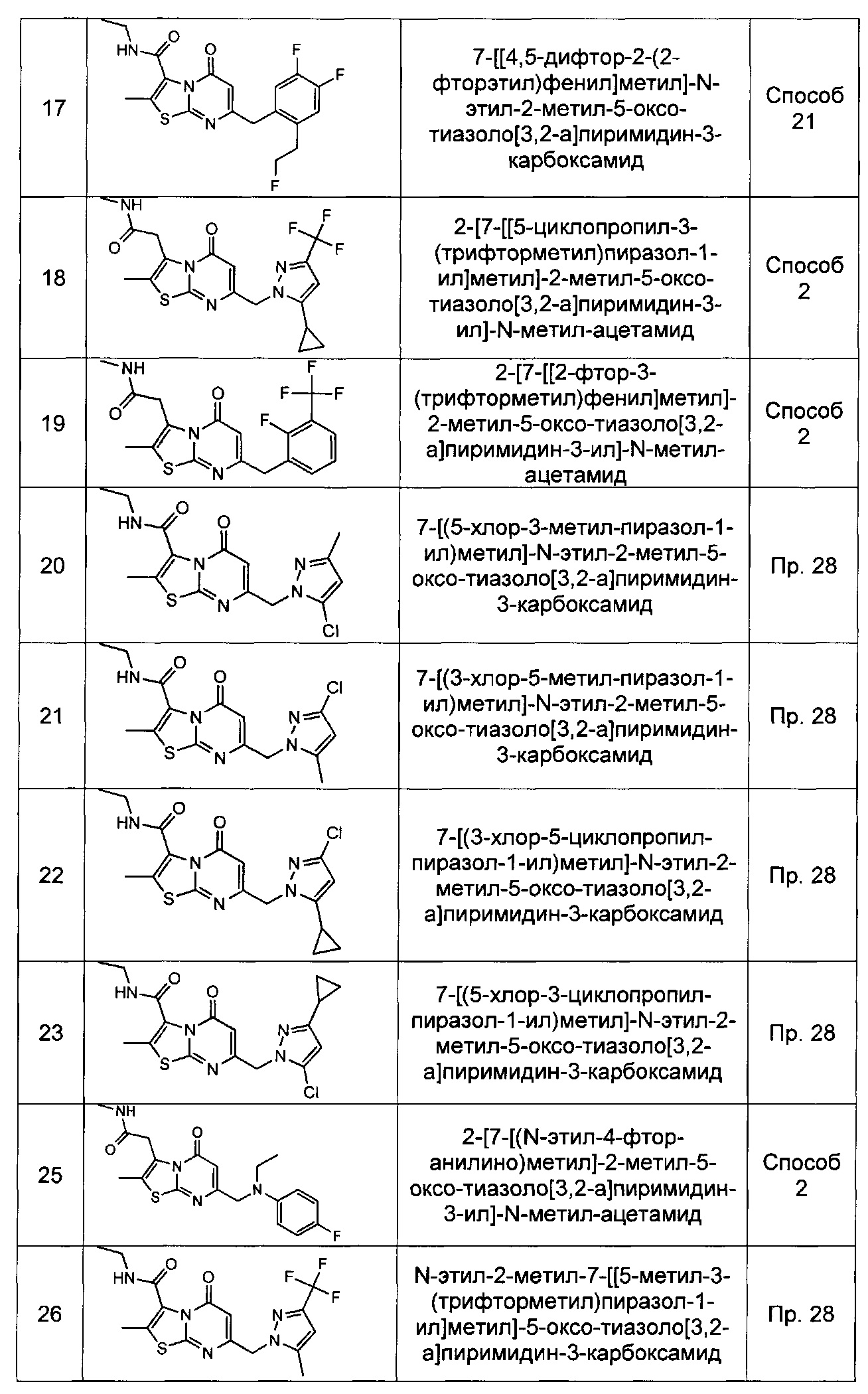
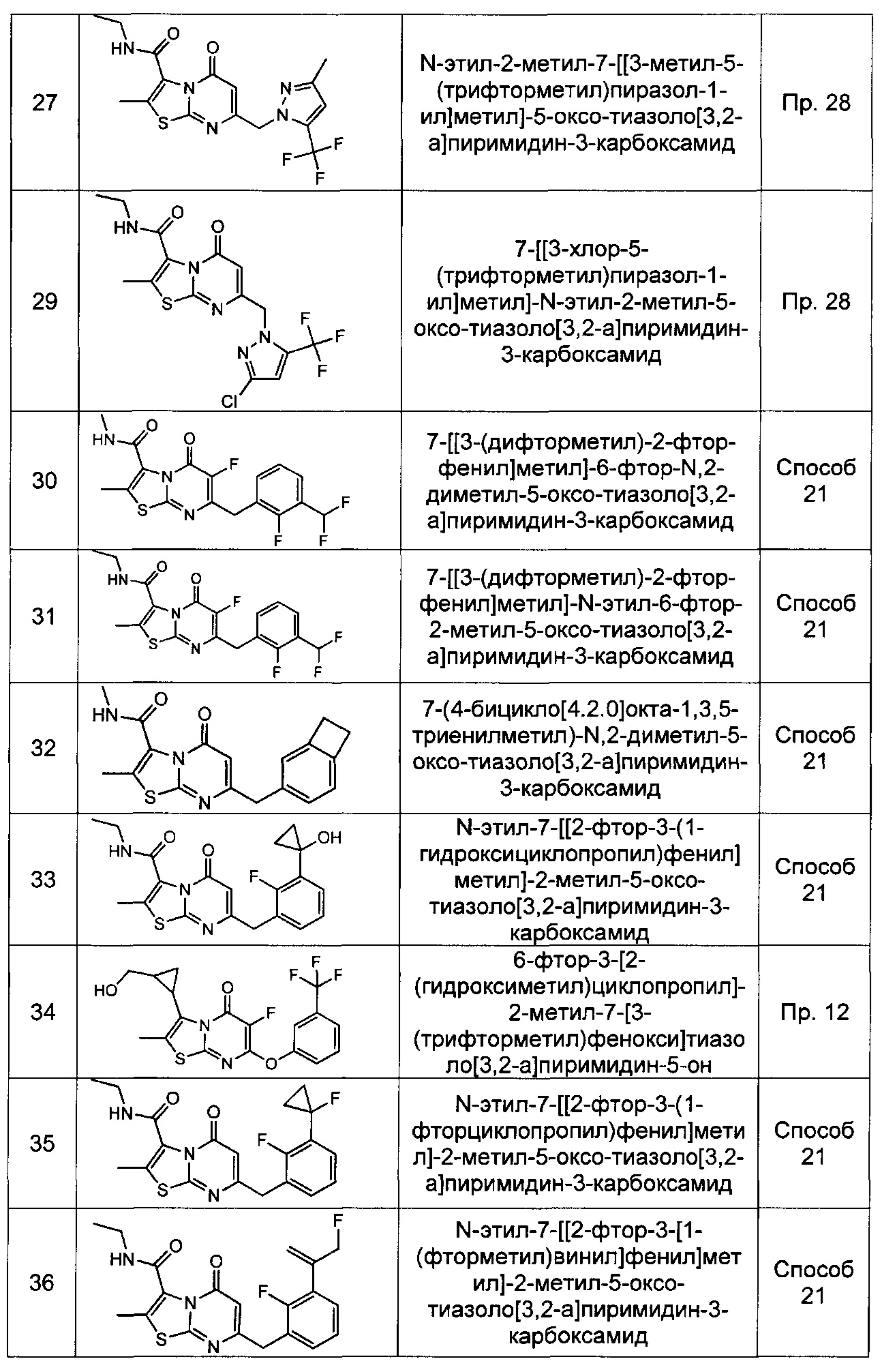
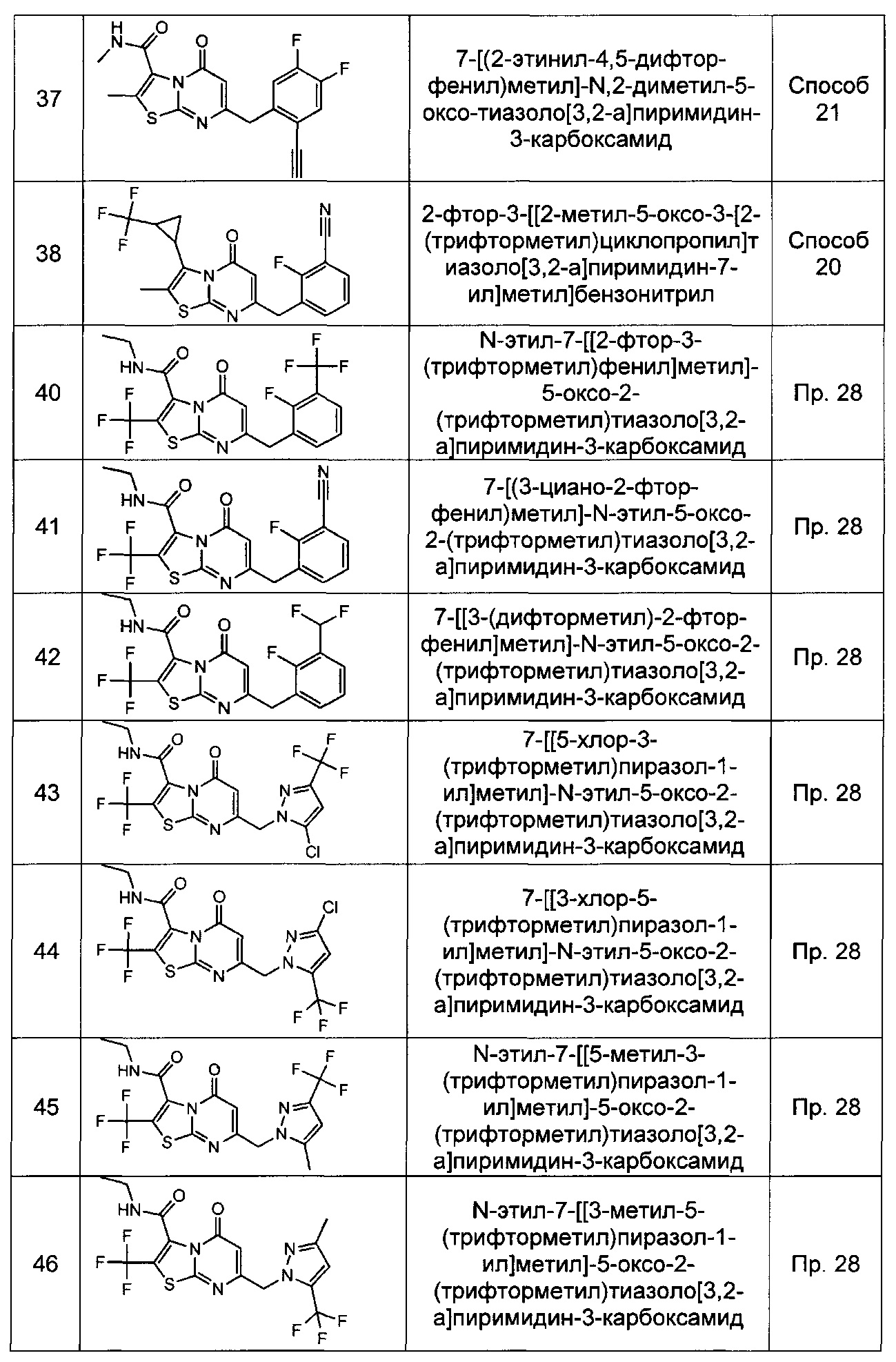
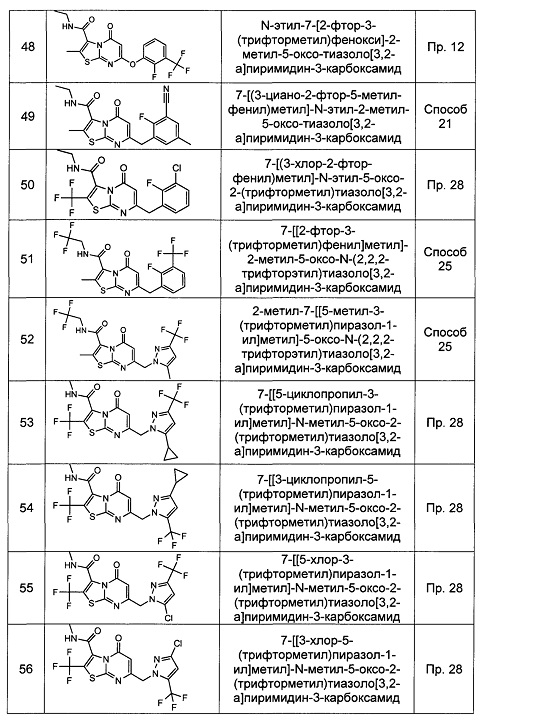
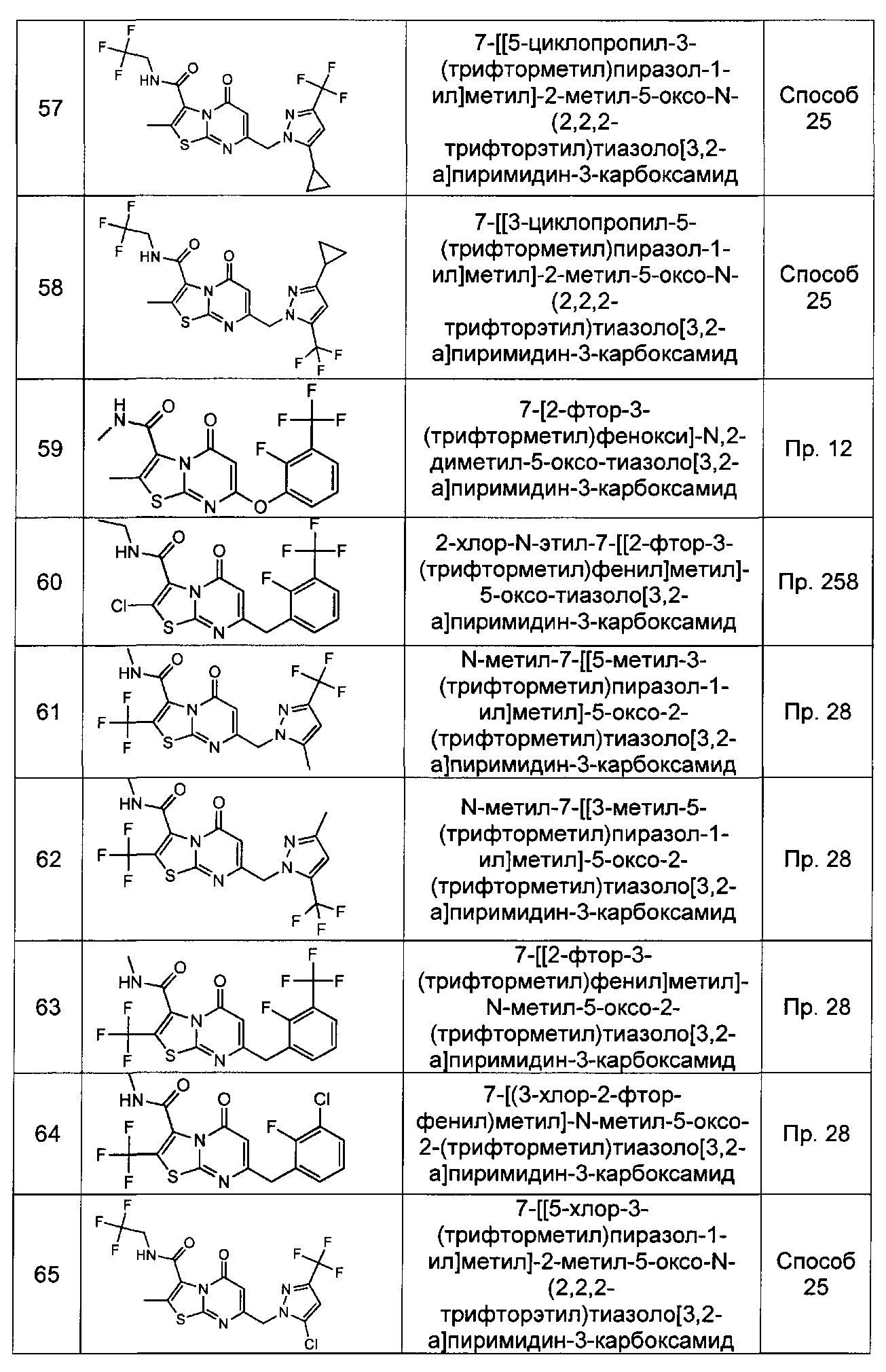
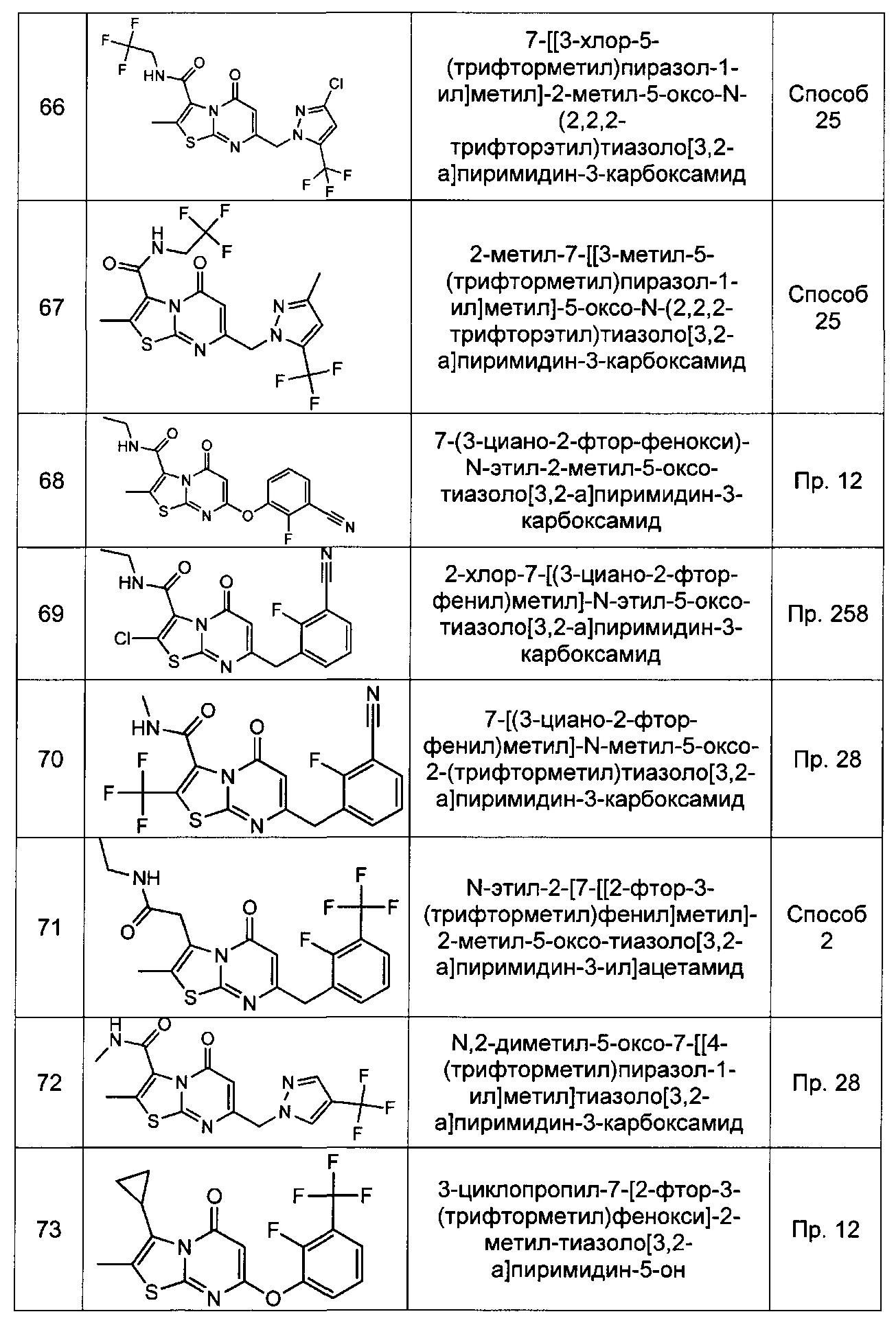
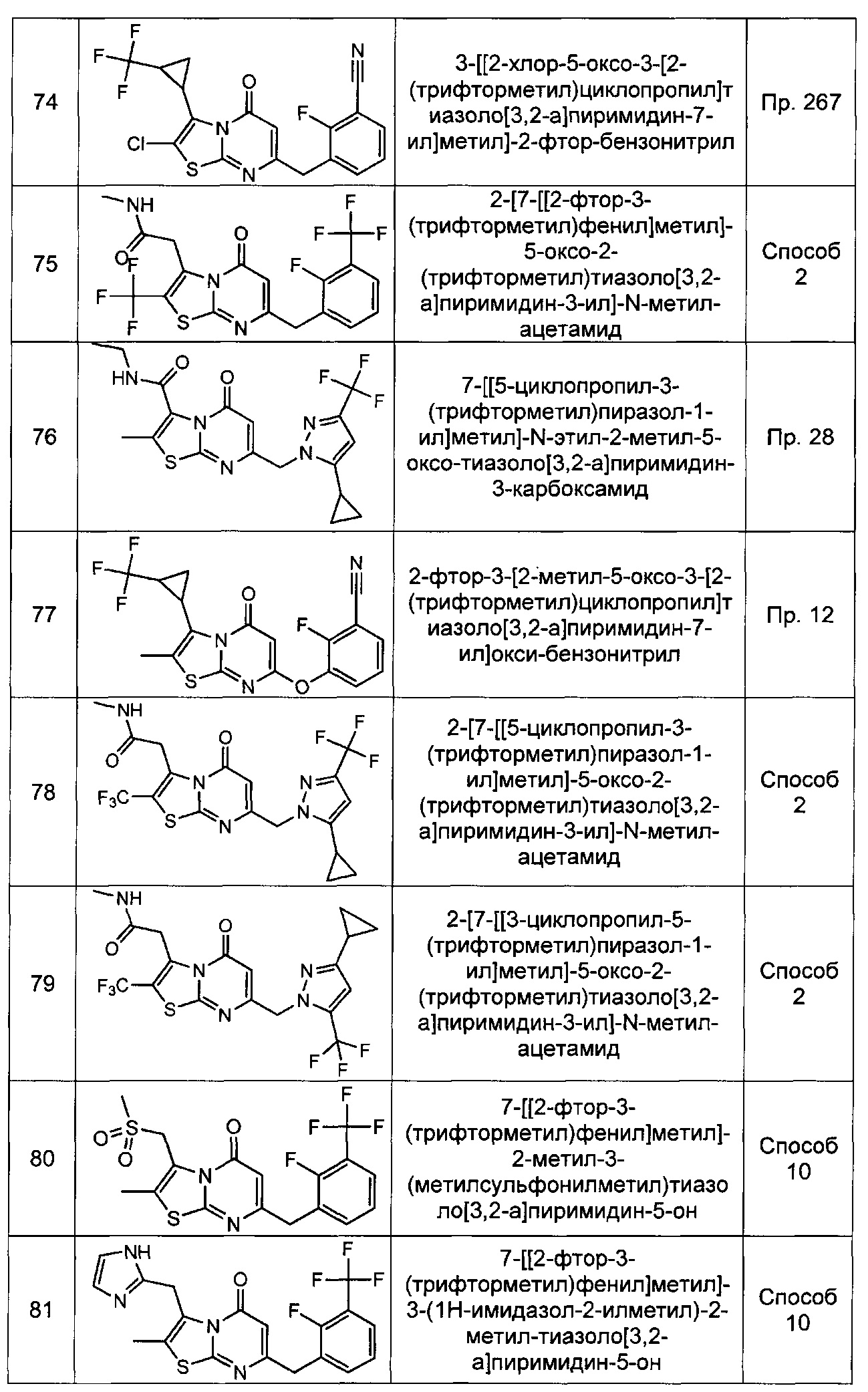
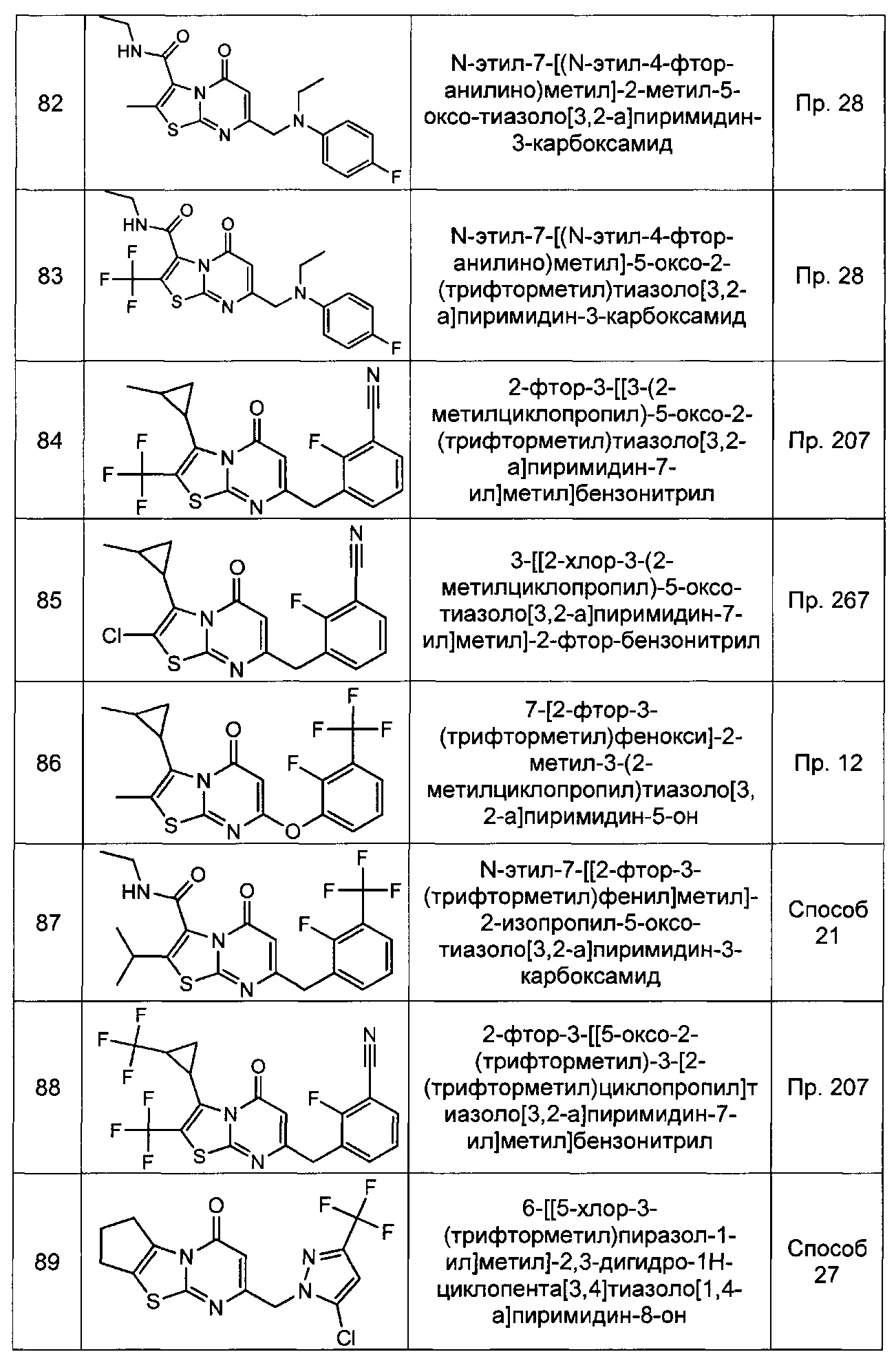
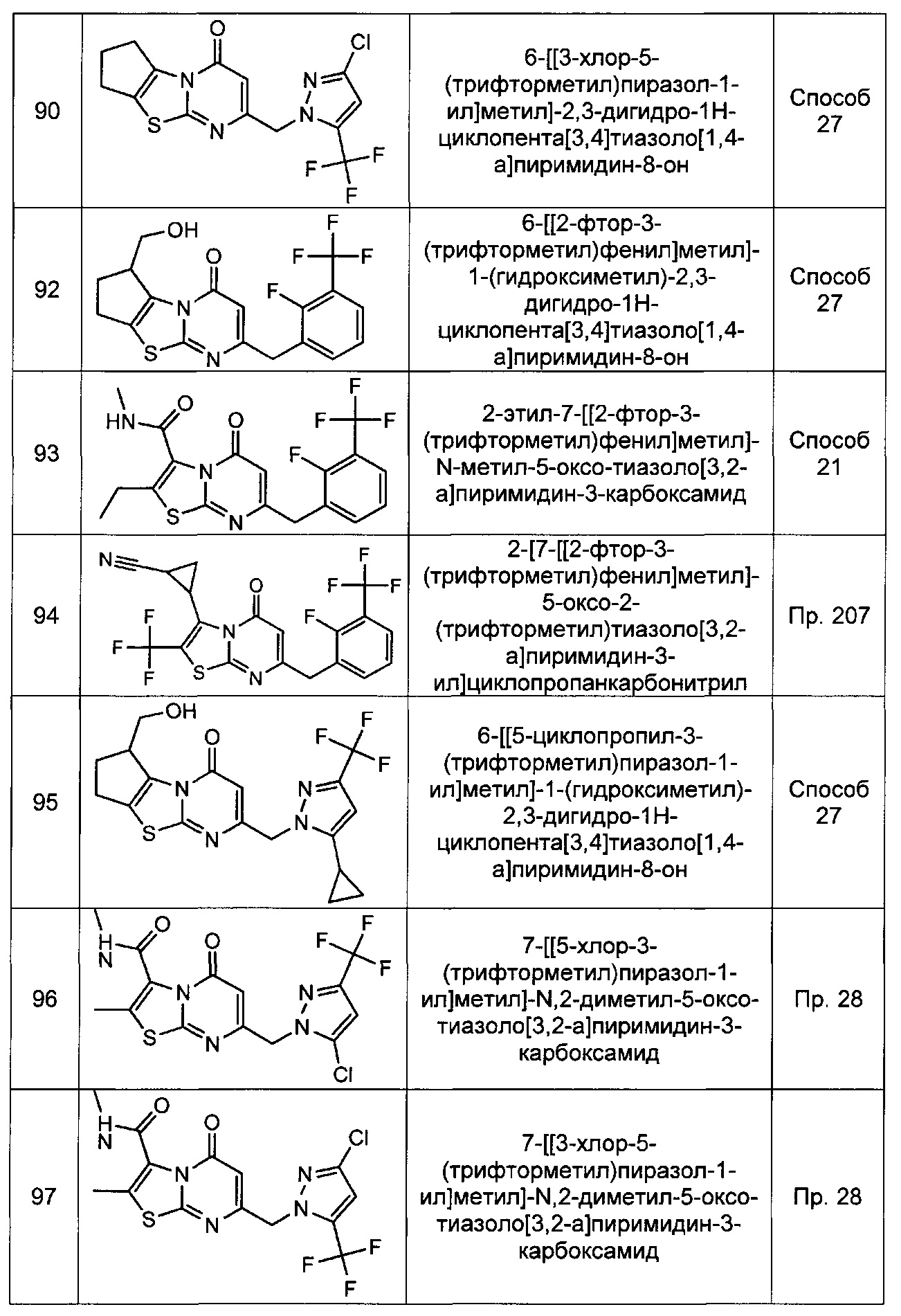
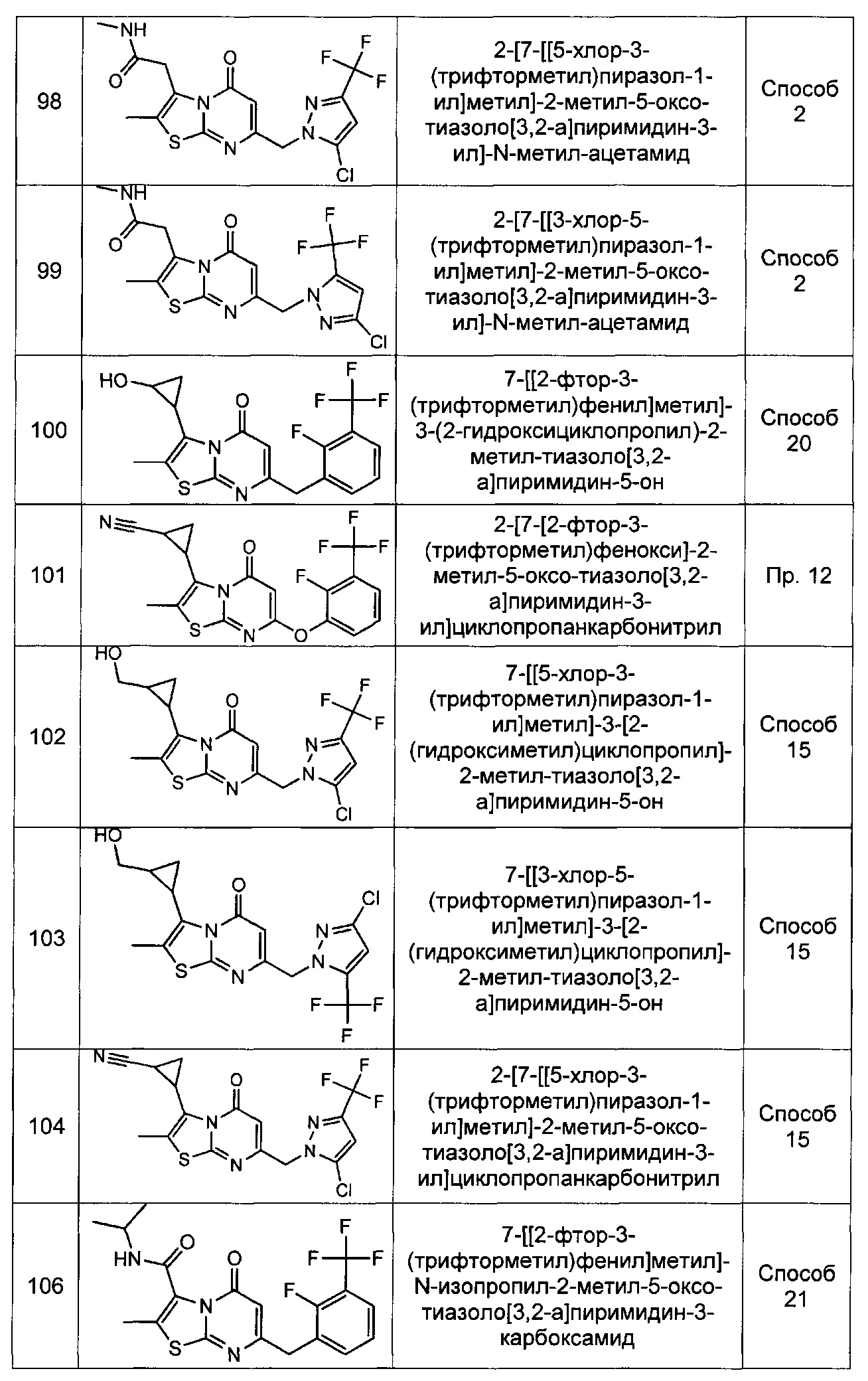
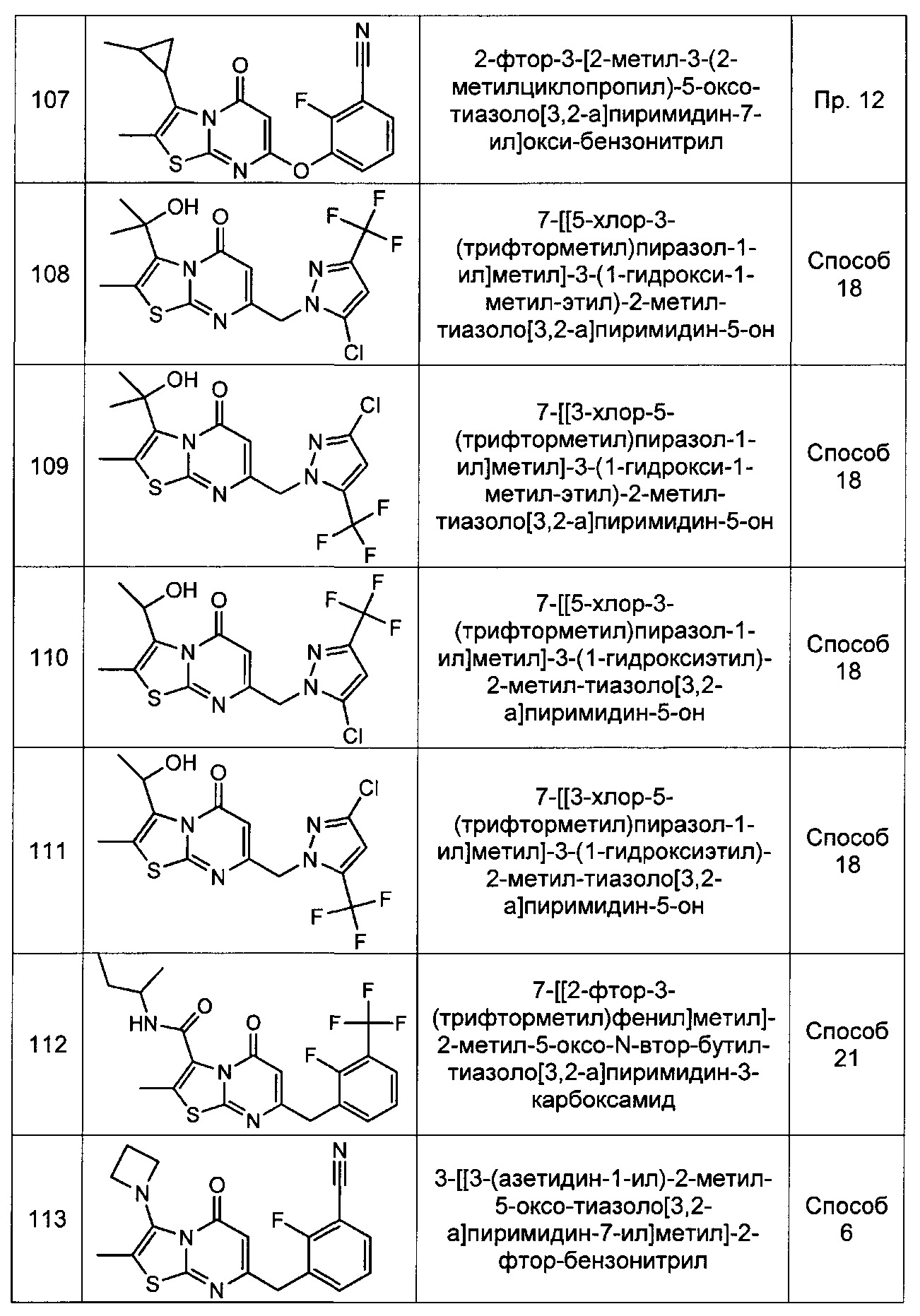
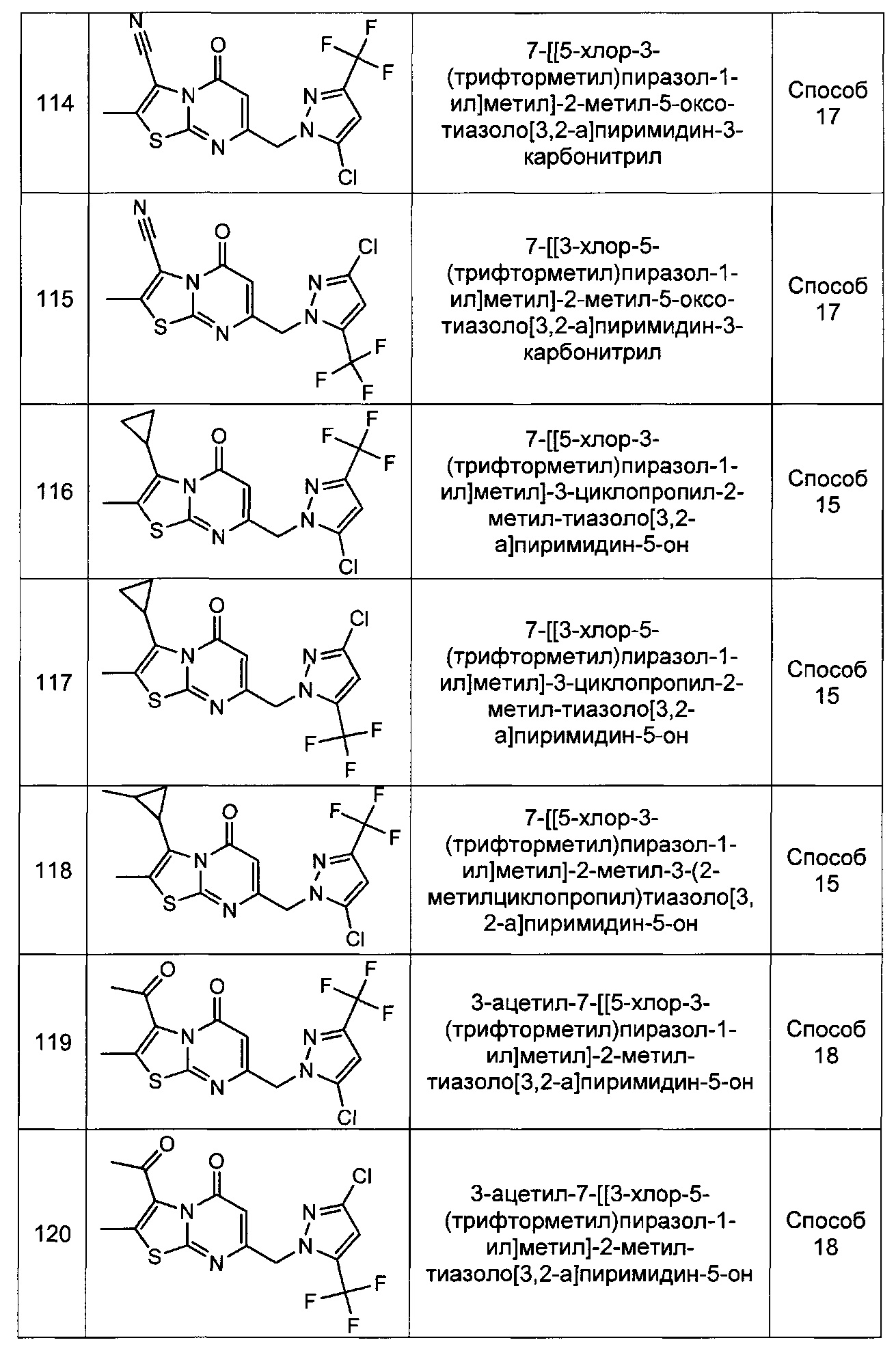
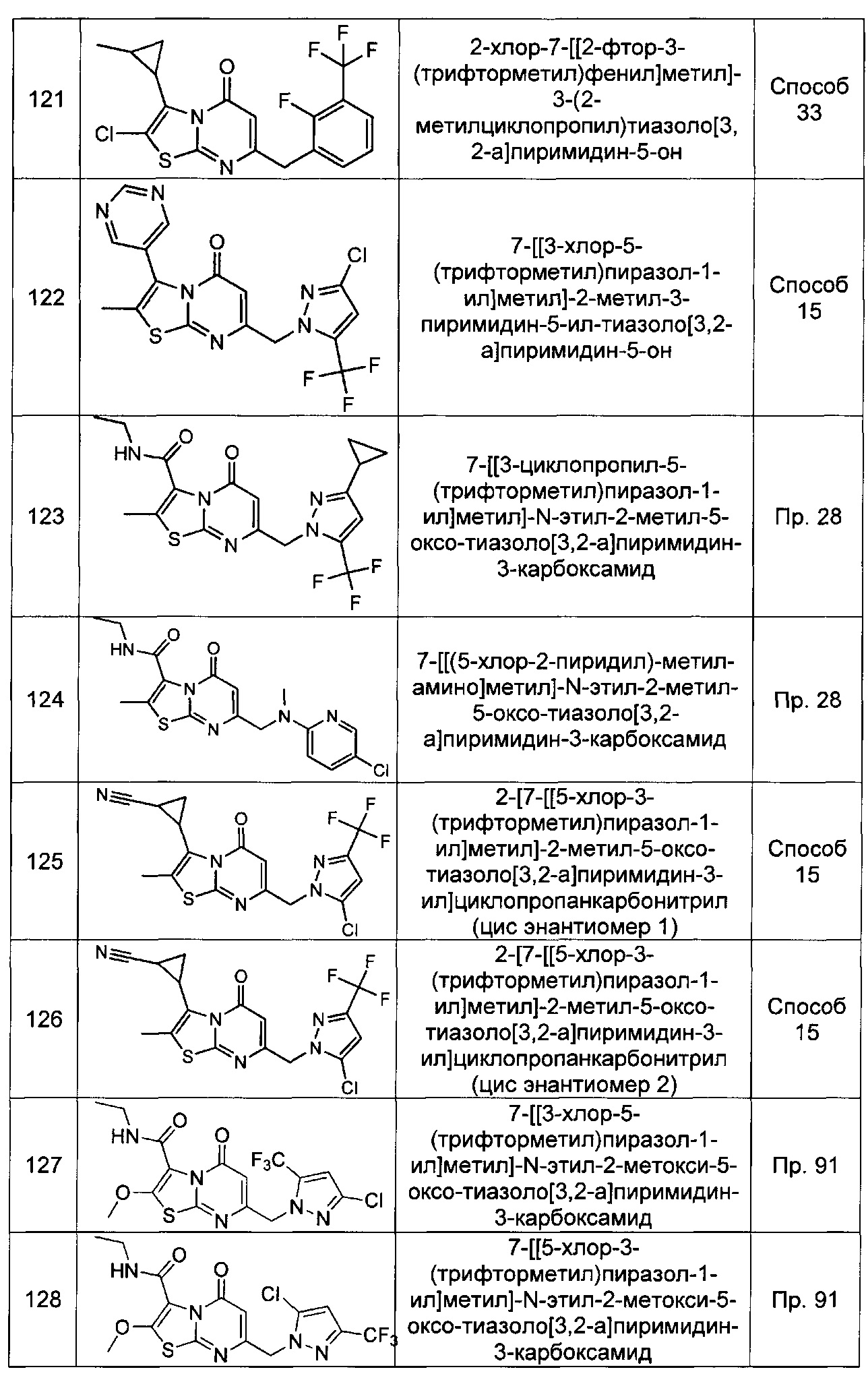
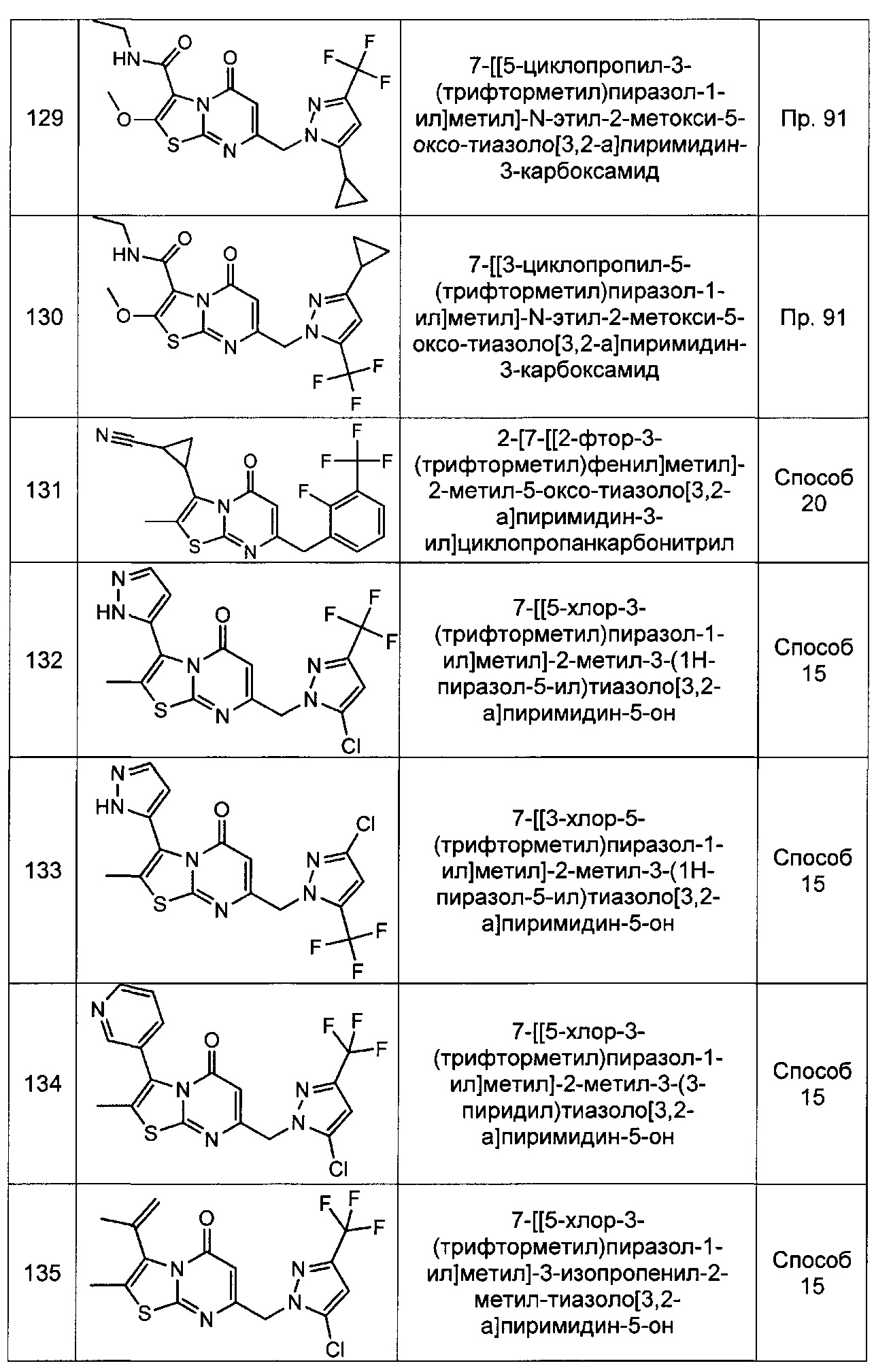
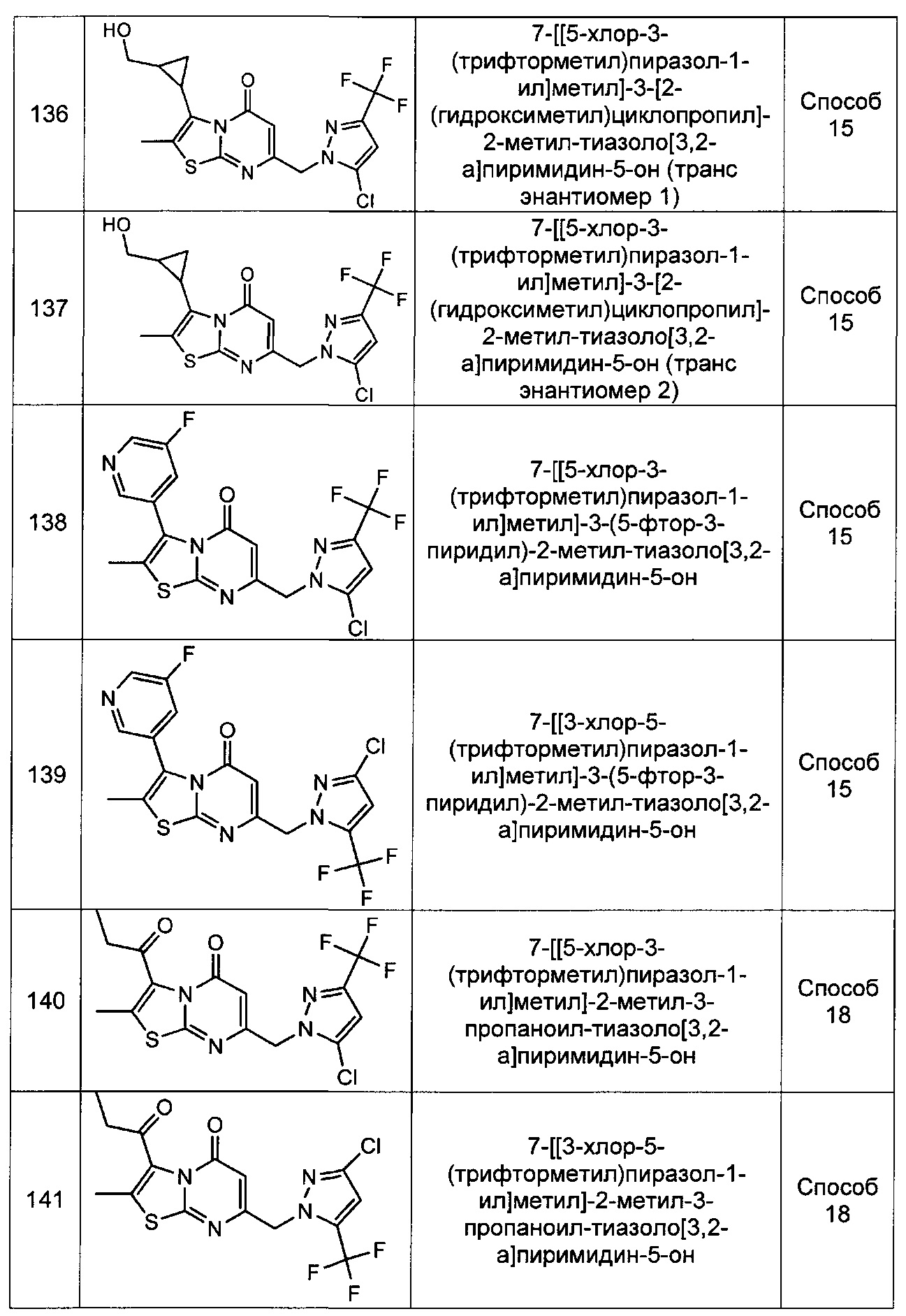
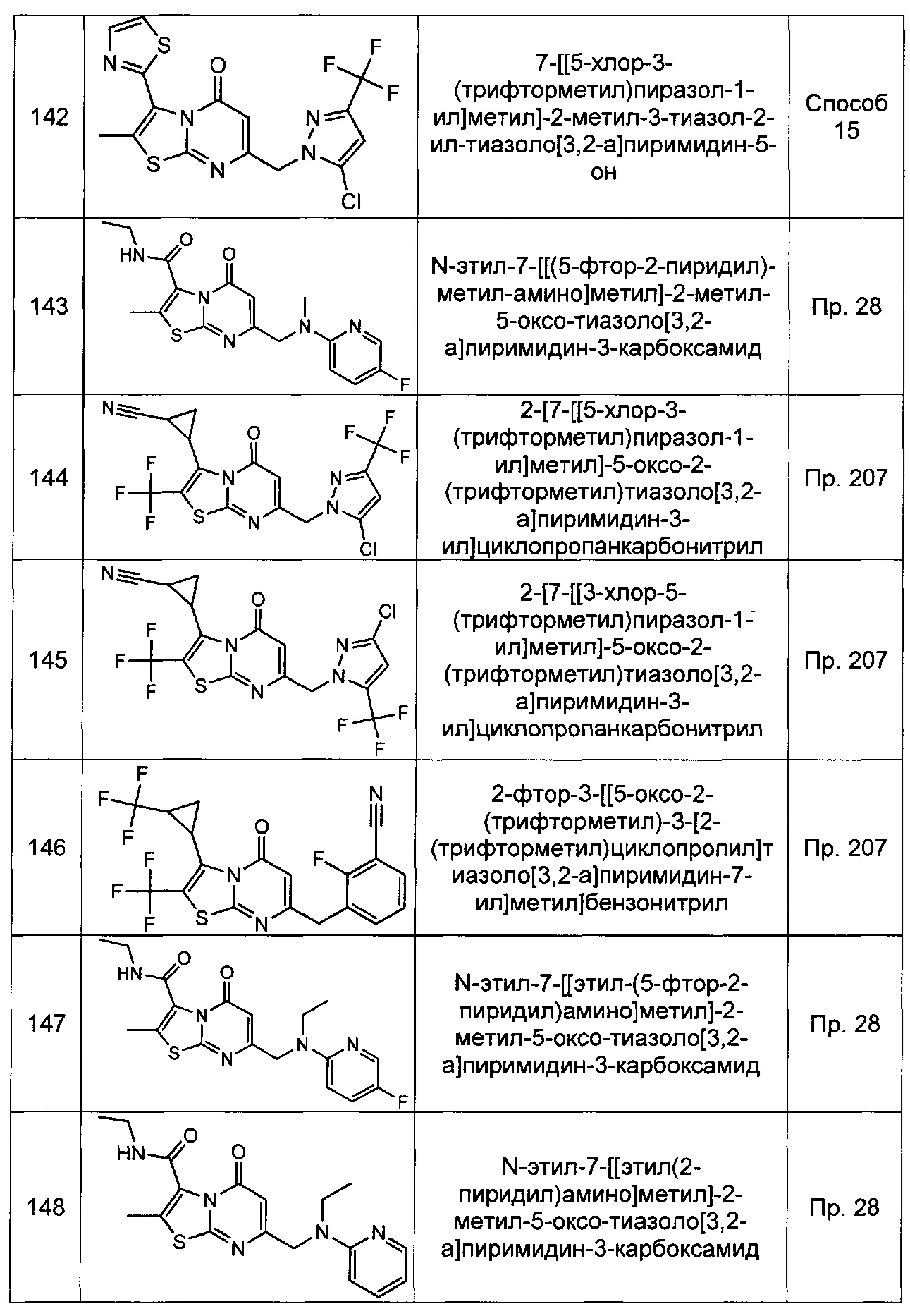
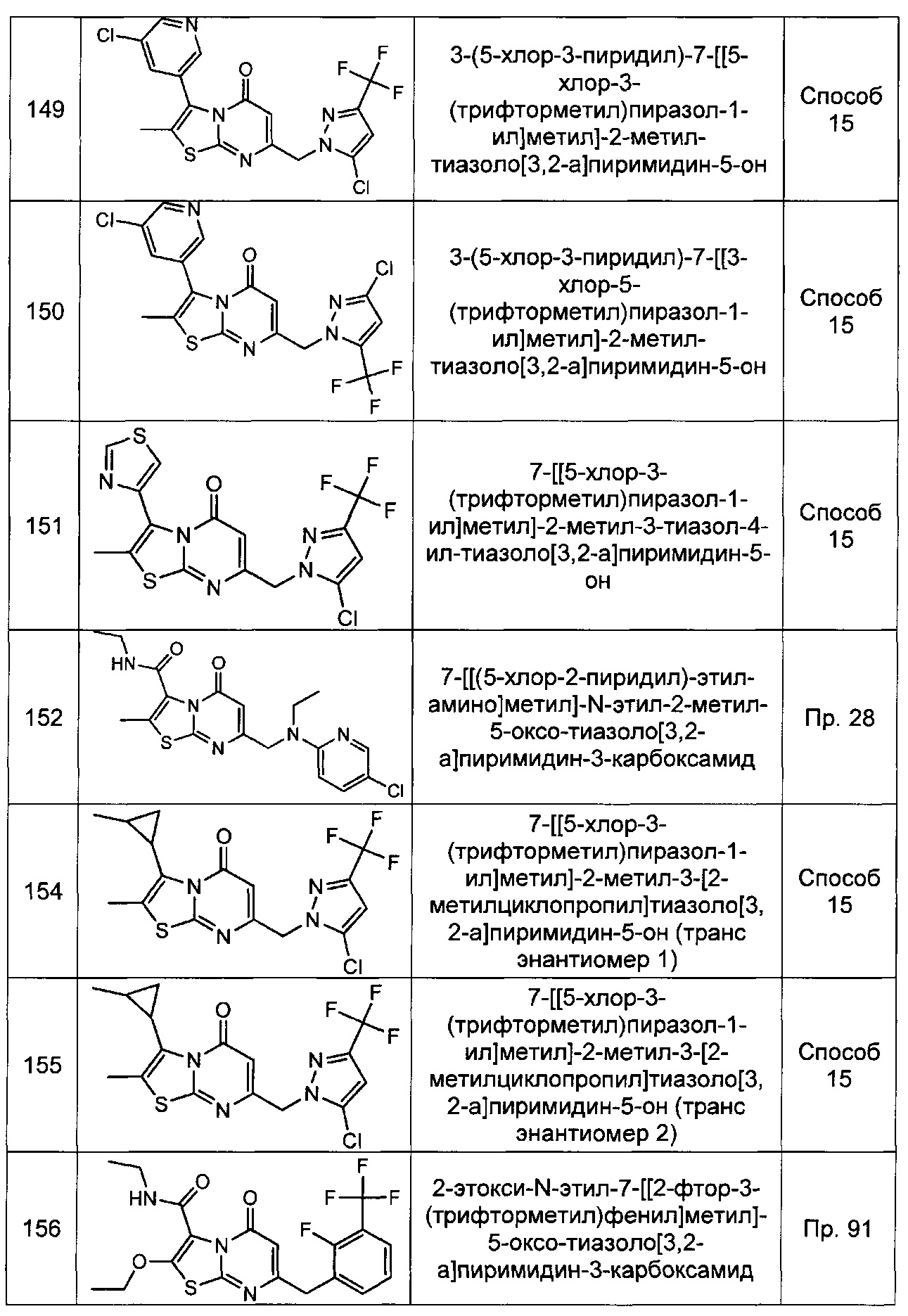
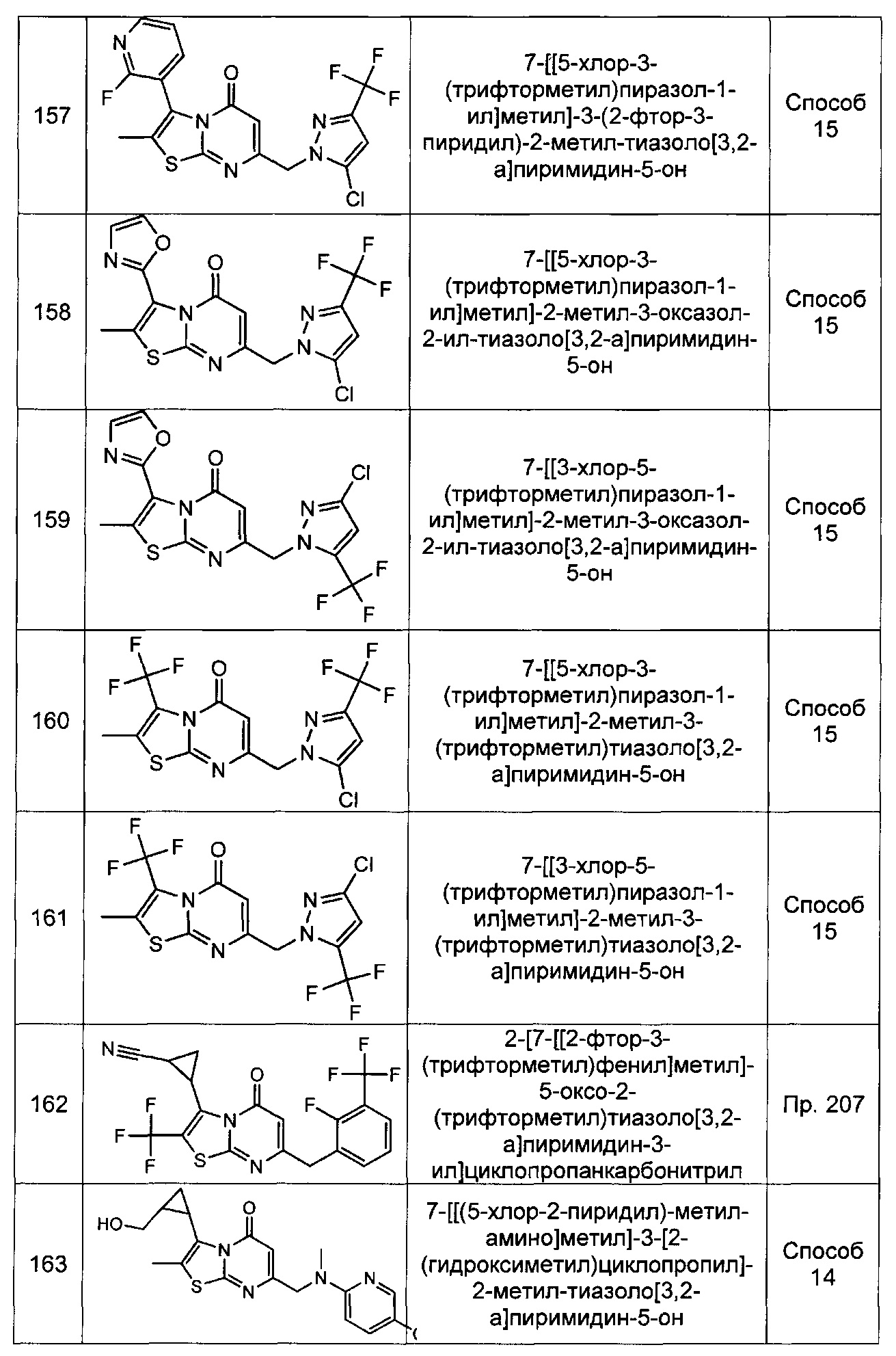
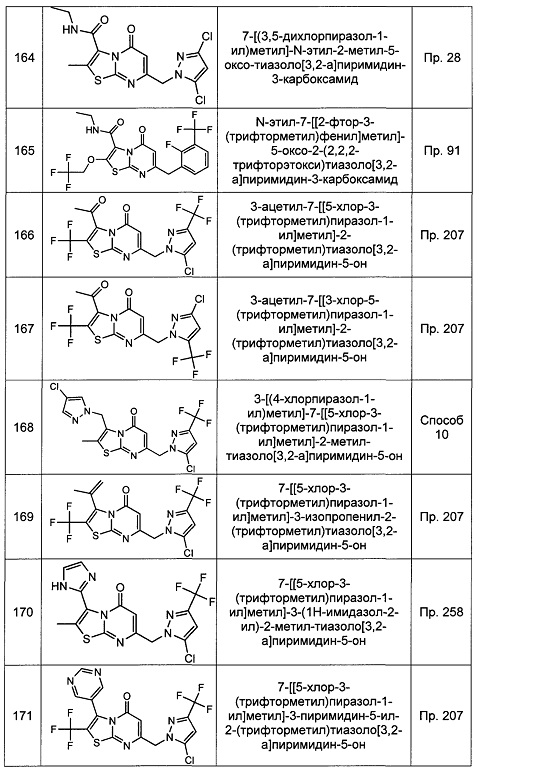
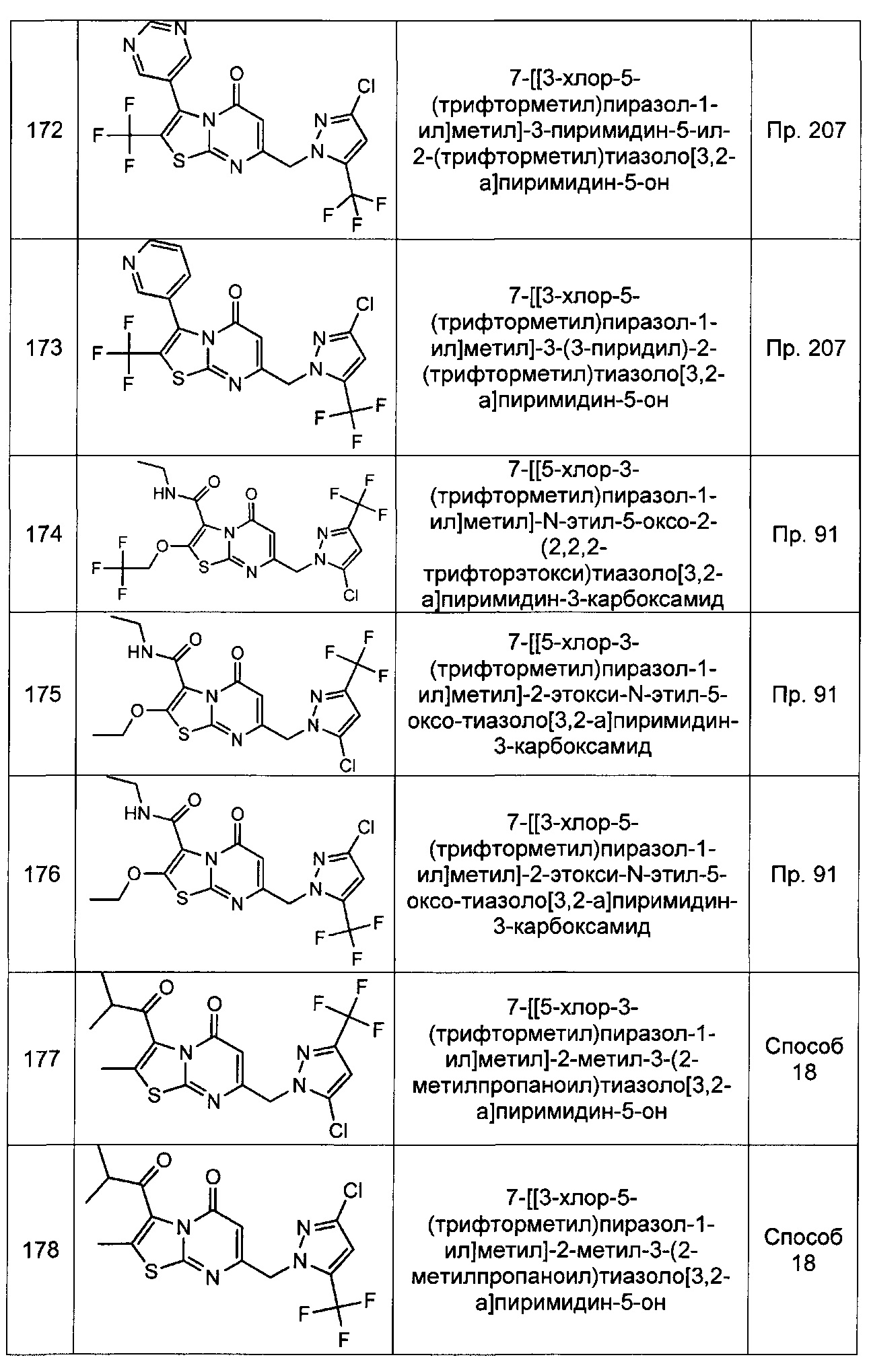
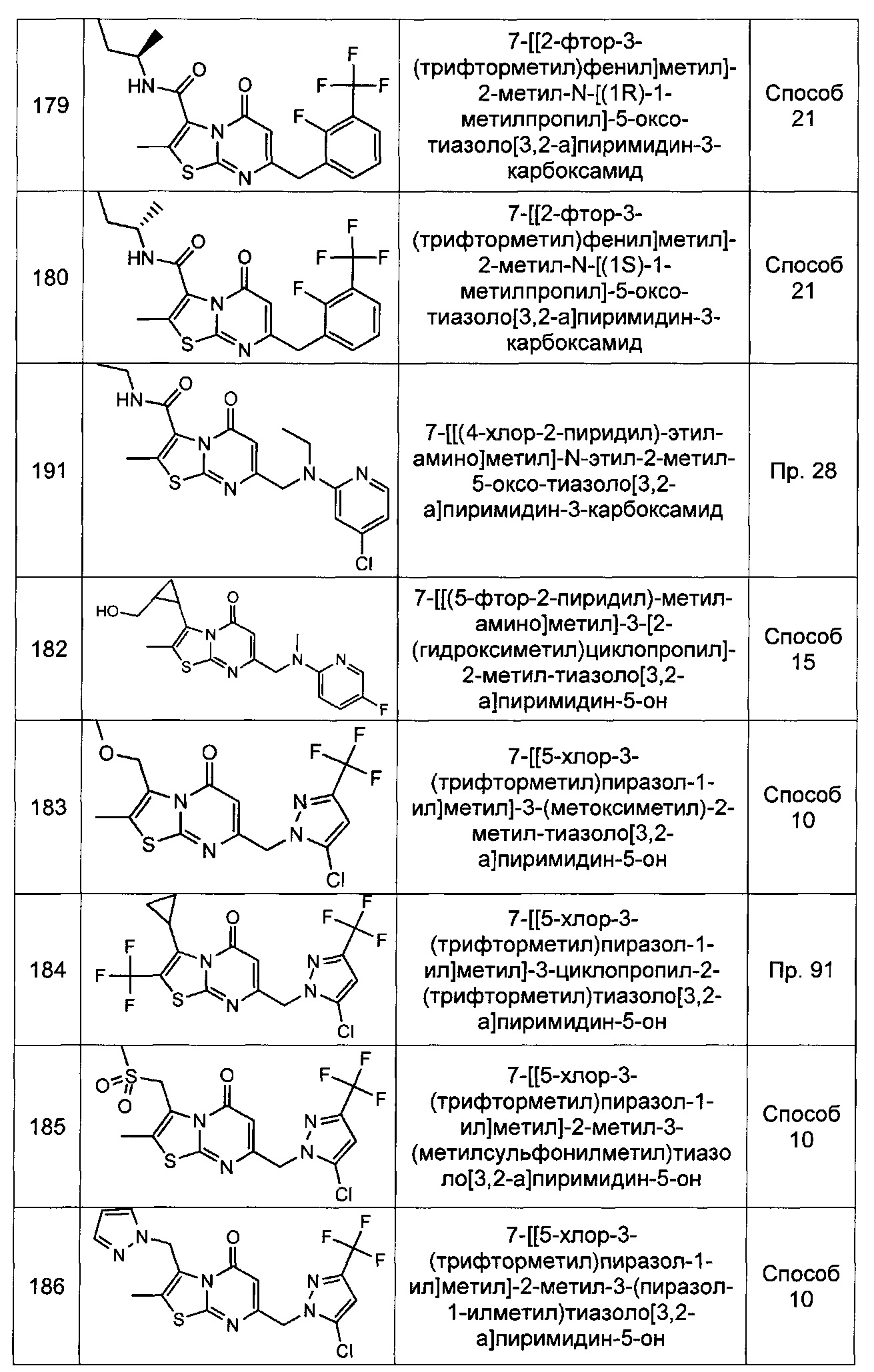
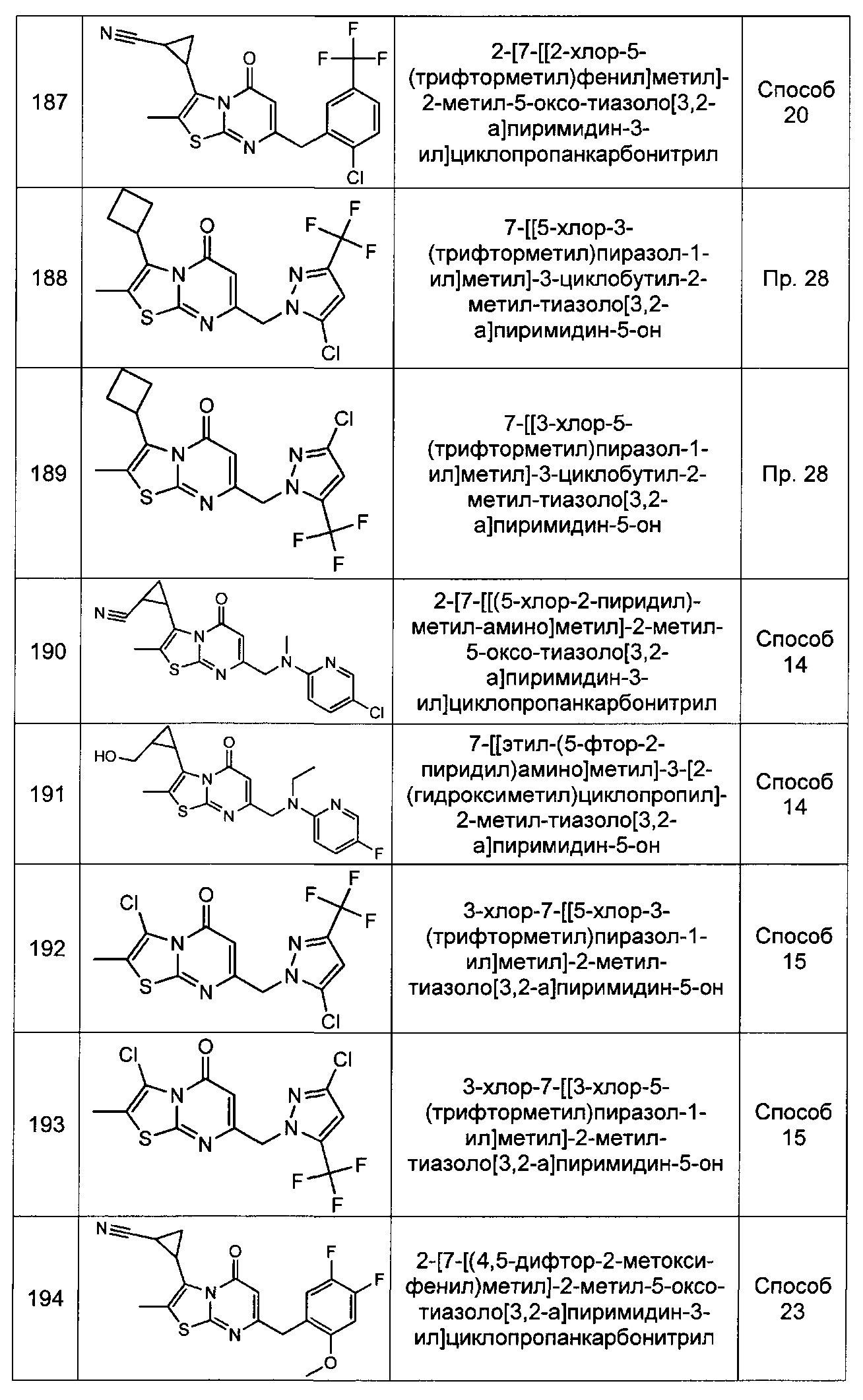
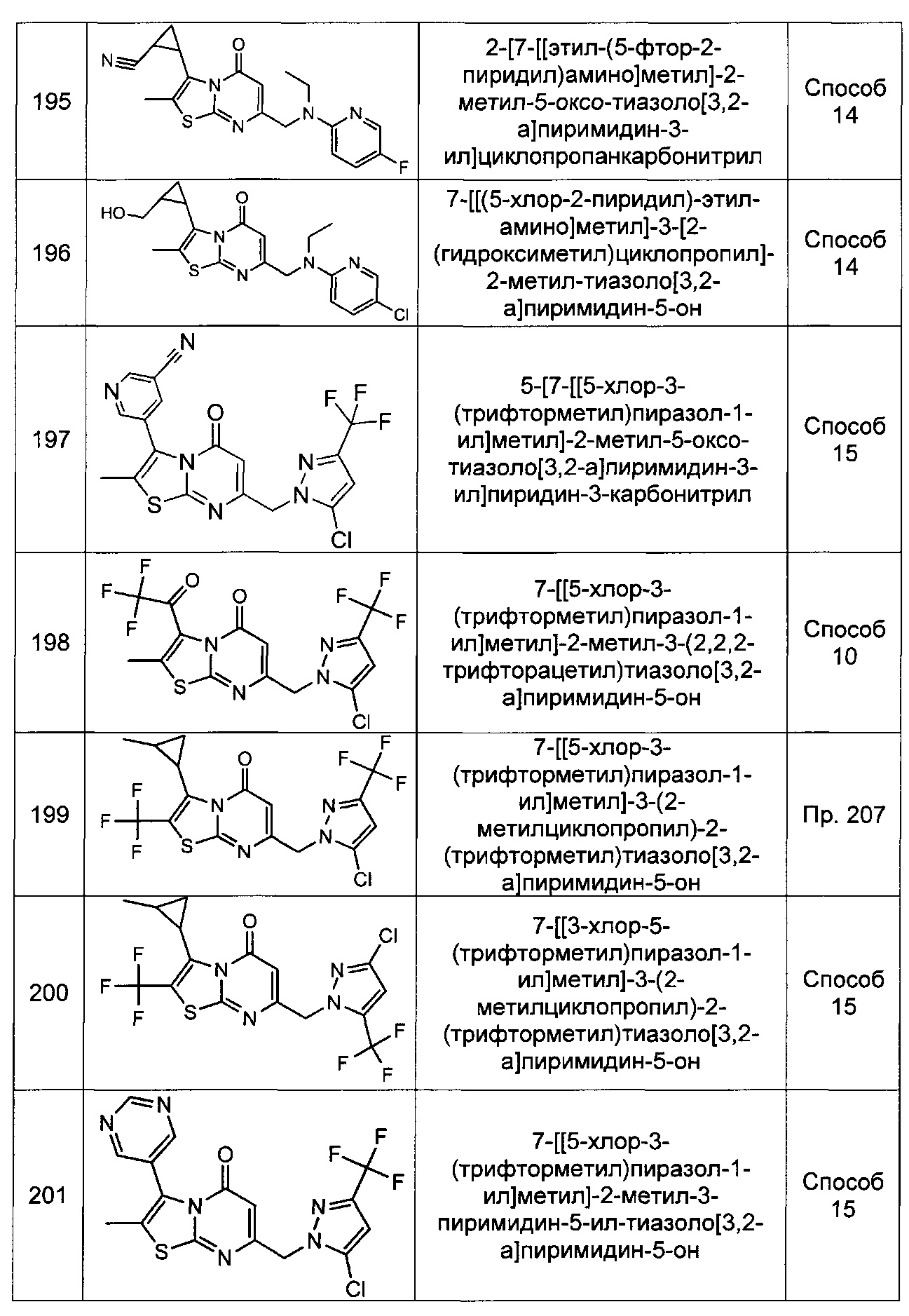
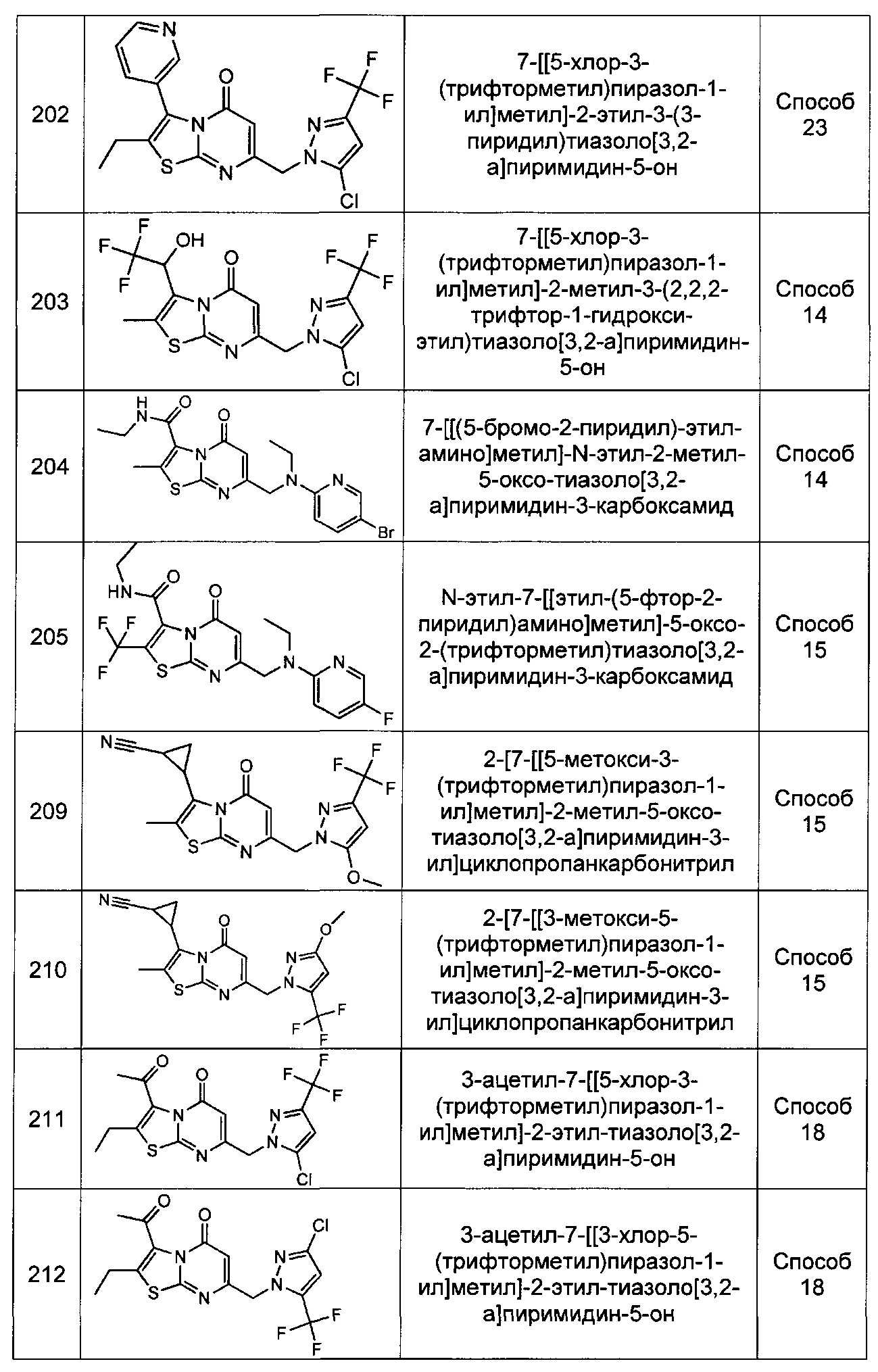
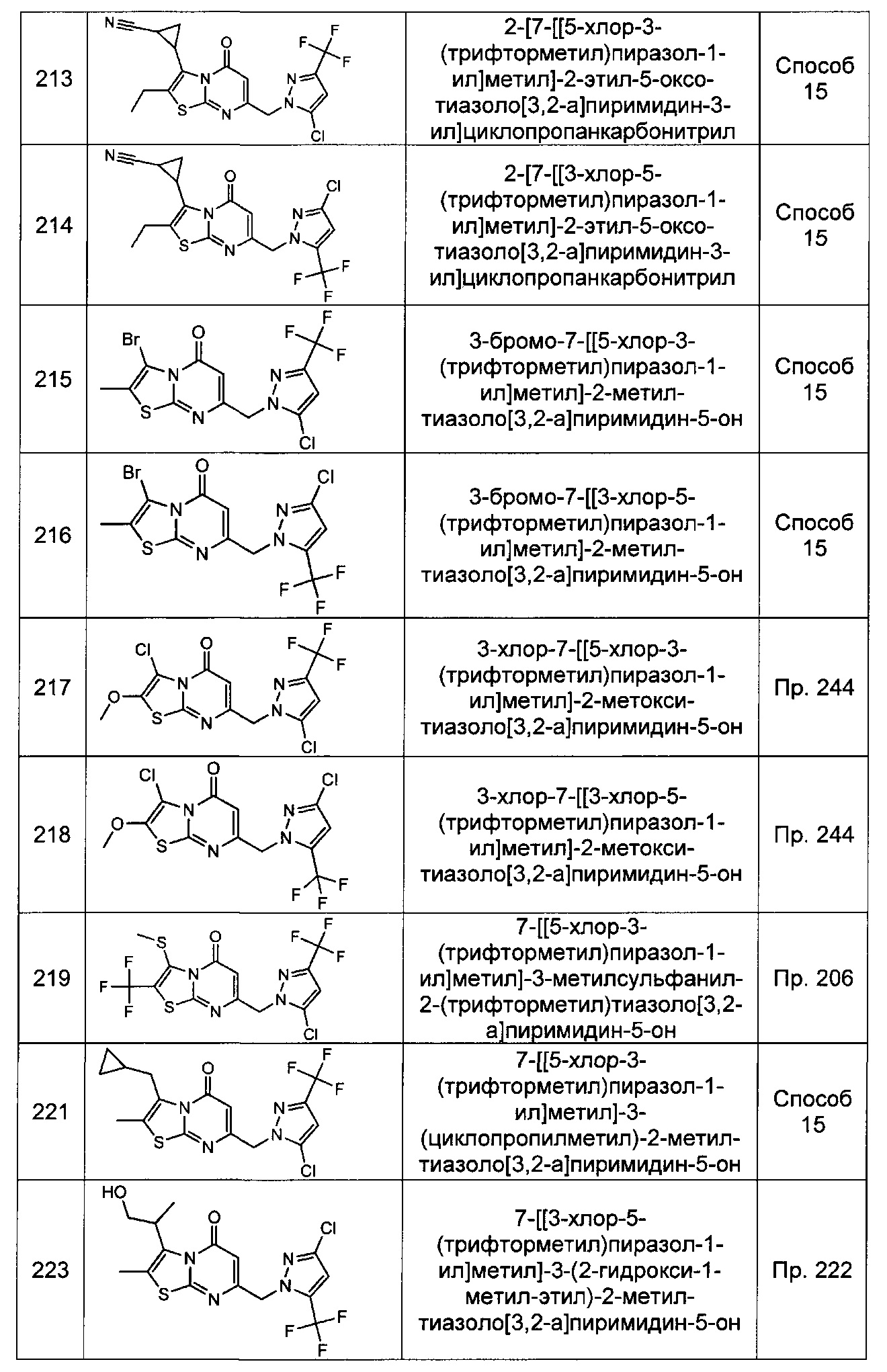
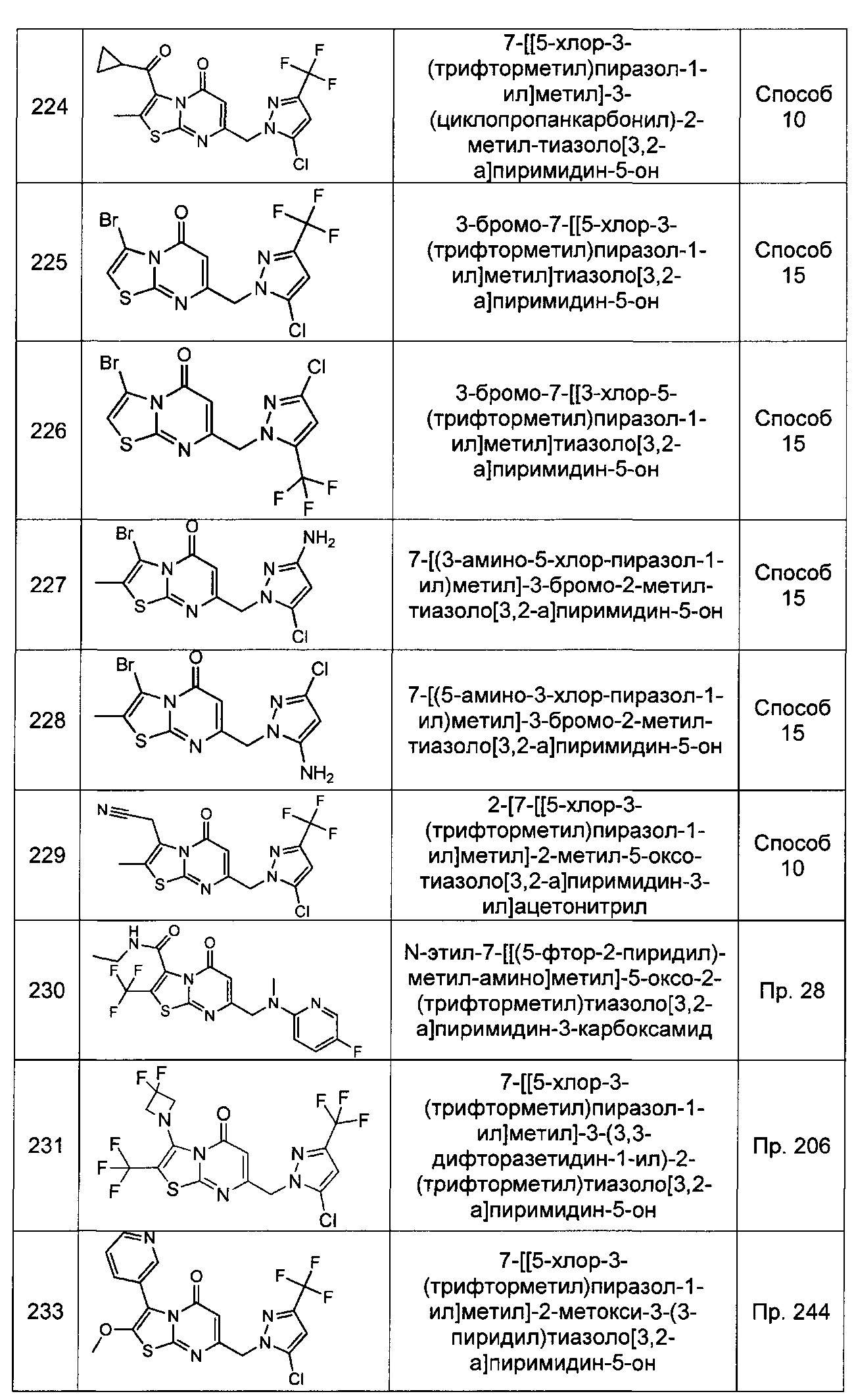
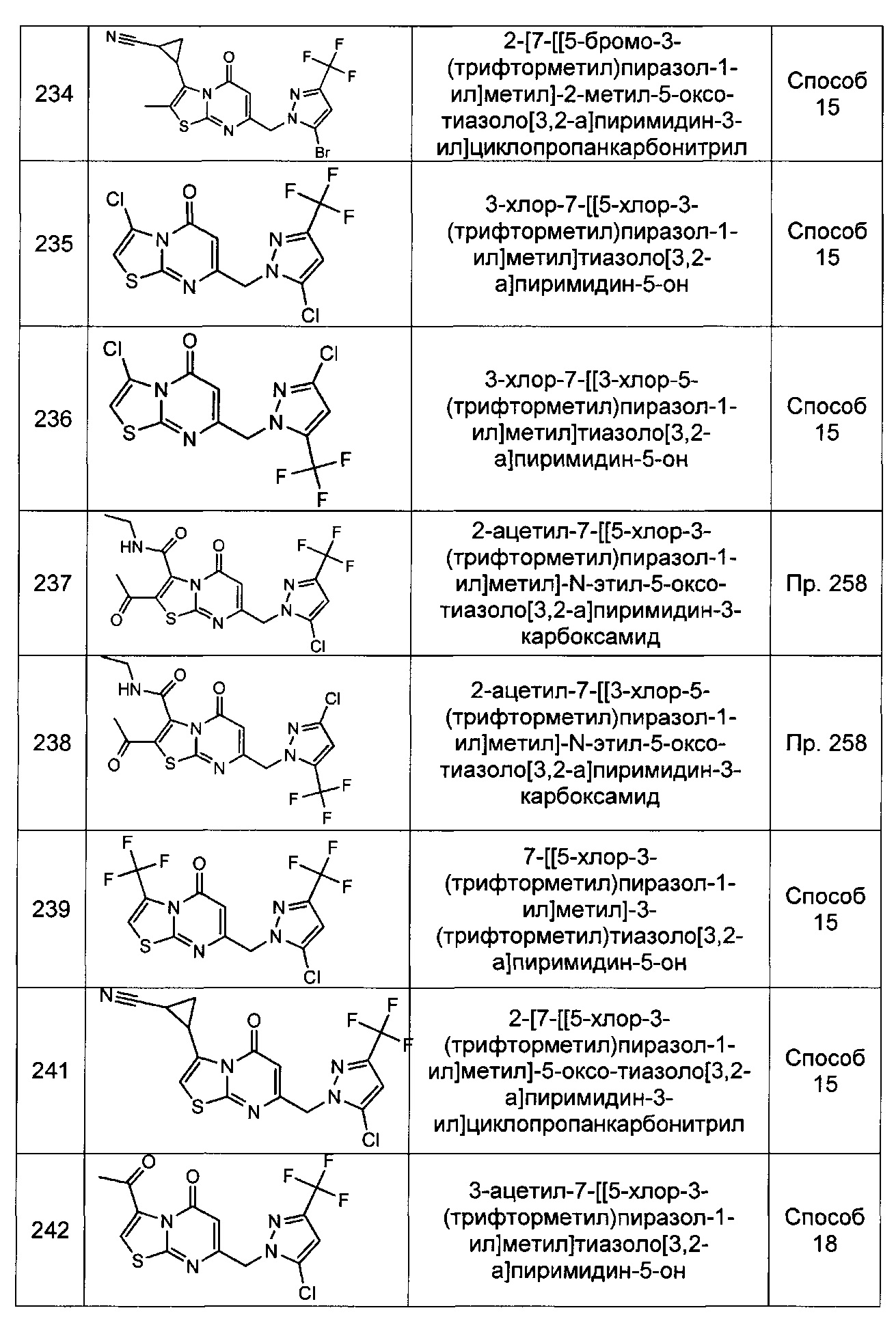
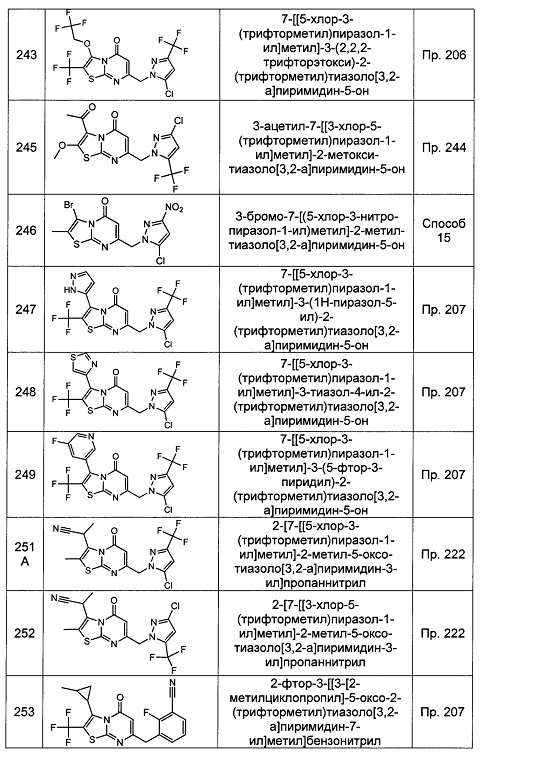
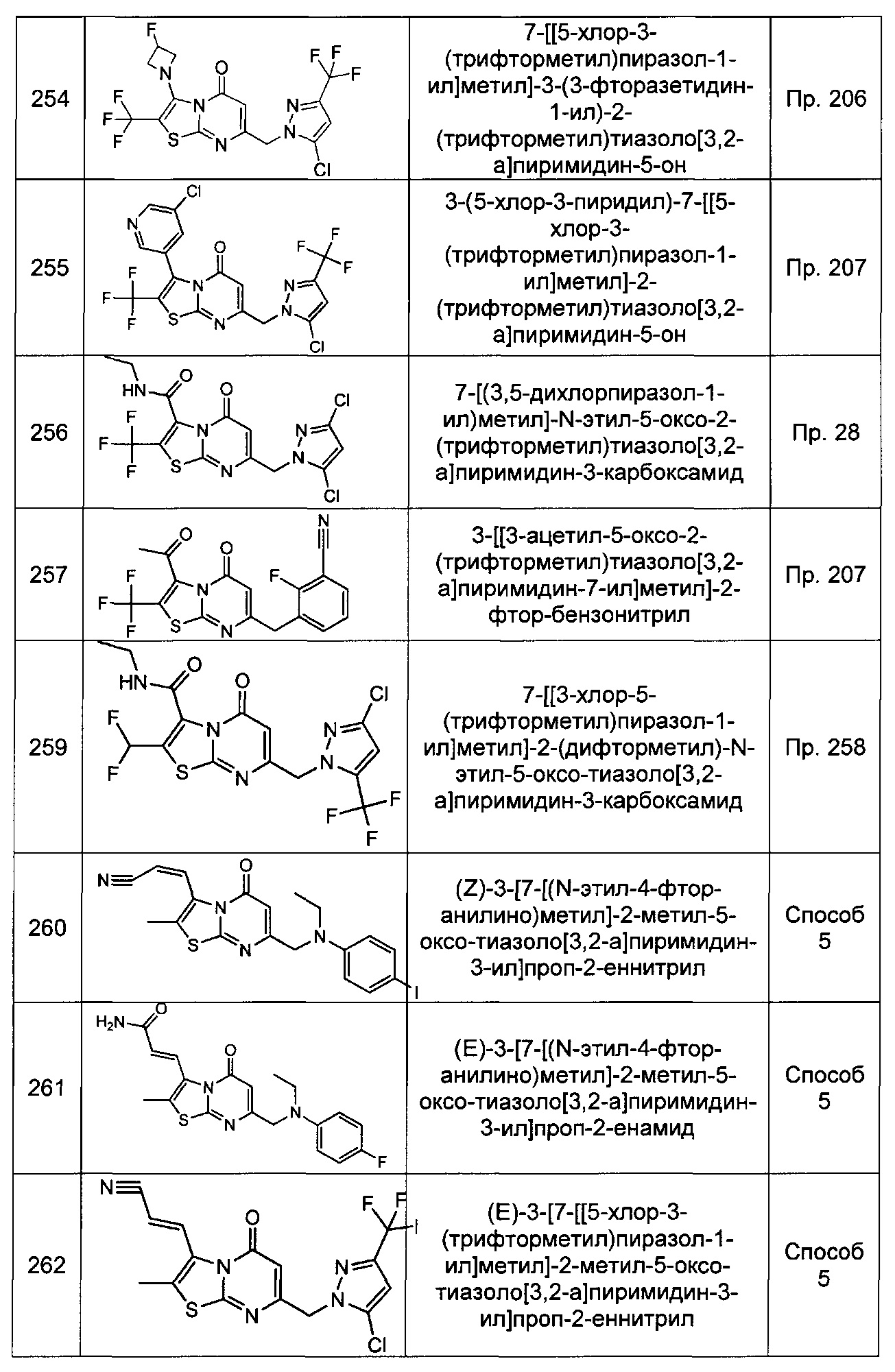
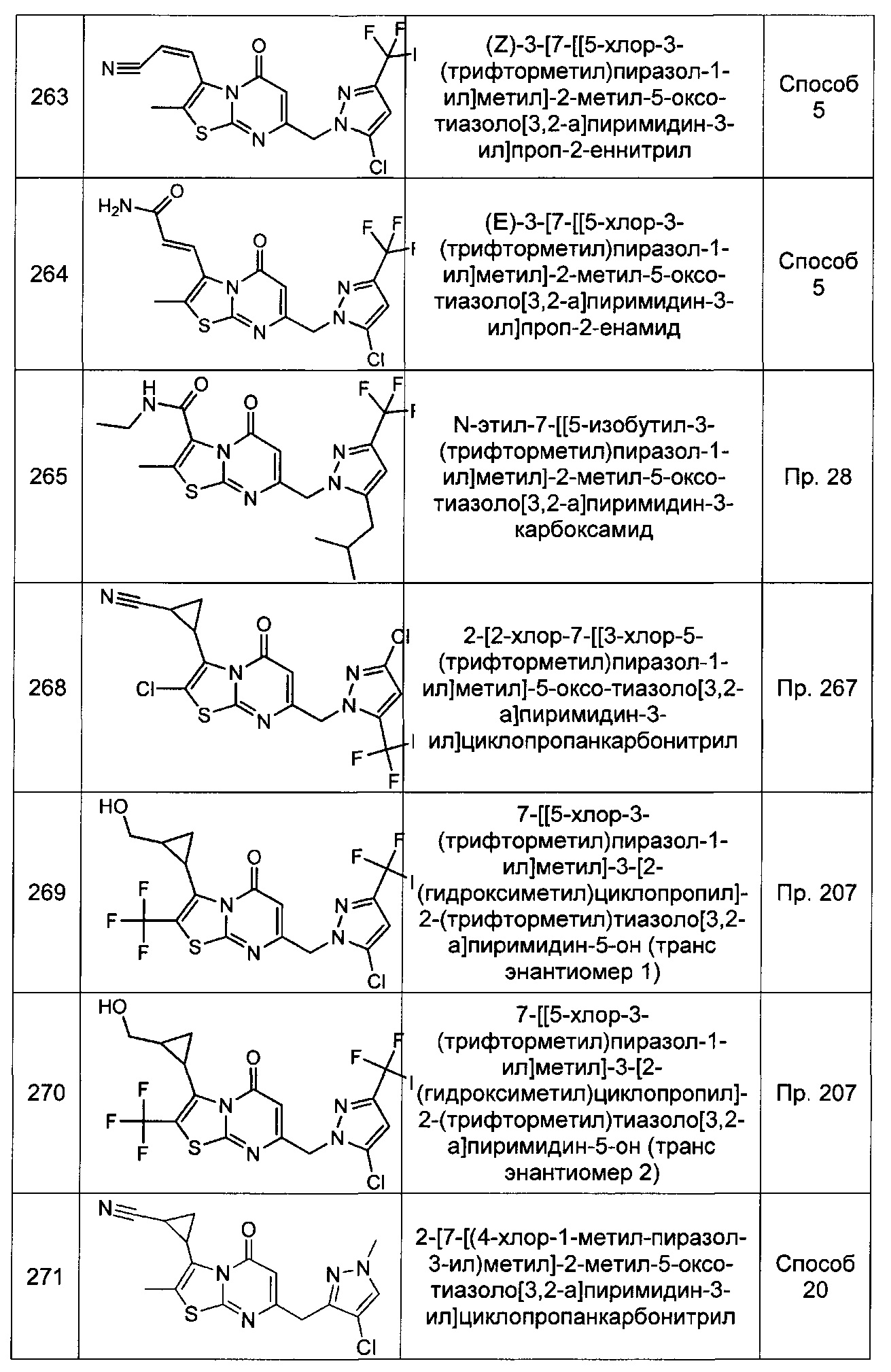
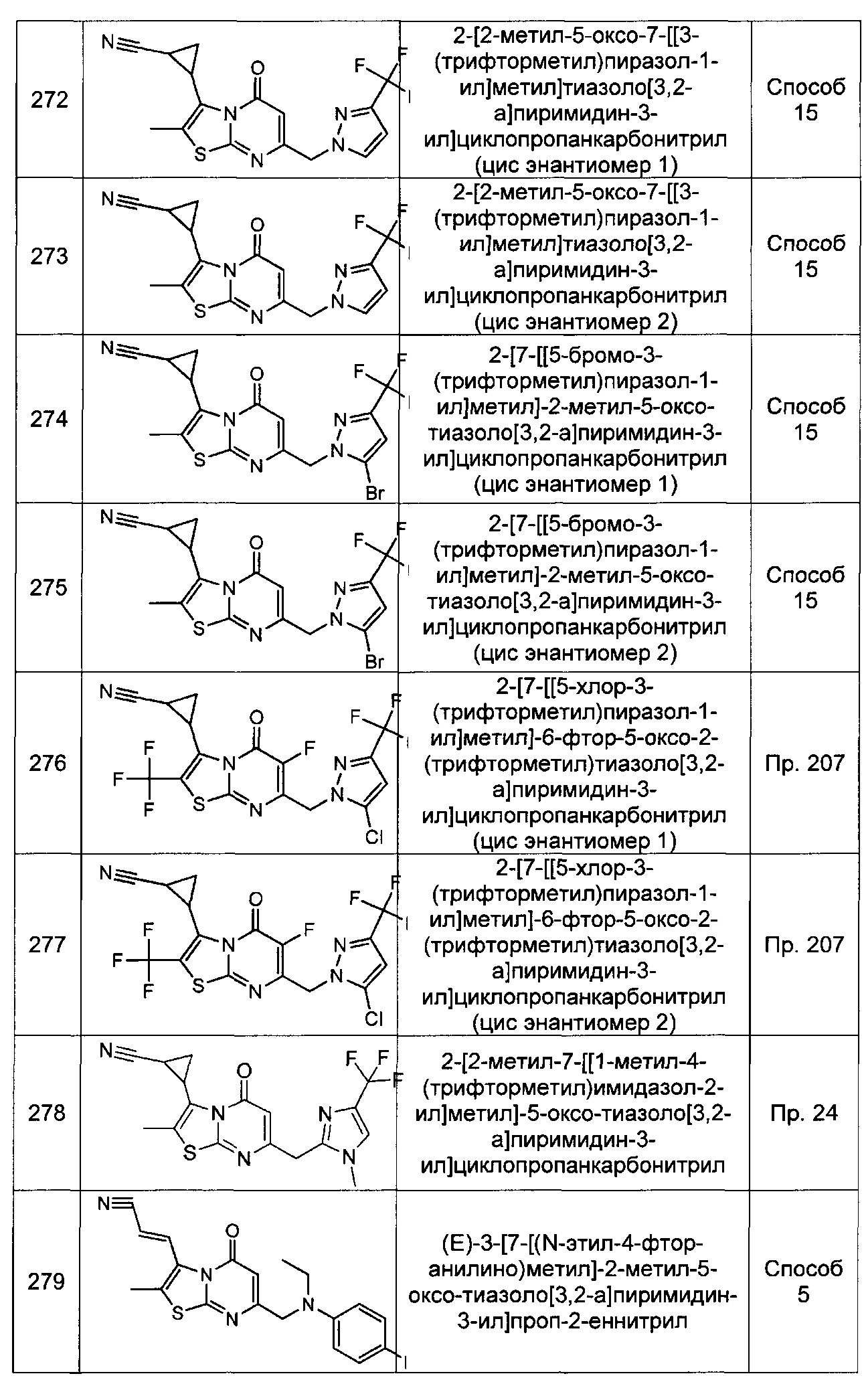
[0517] Следующие соединения получили с использованием способов, аналогичных описанным здесь. Надлежащие аналитические данные получили для каждого соединения.
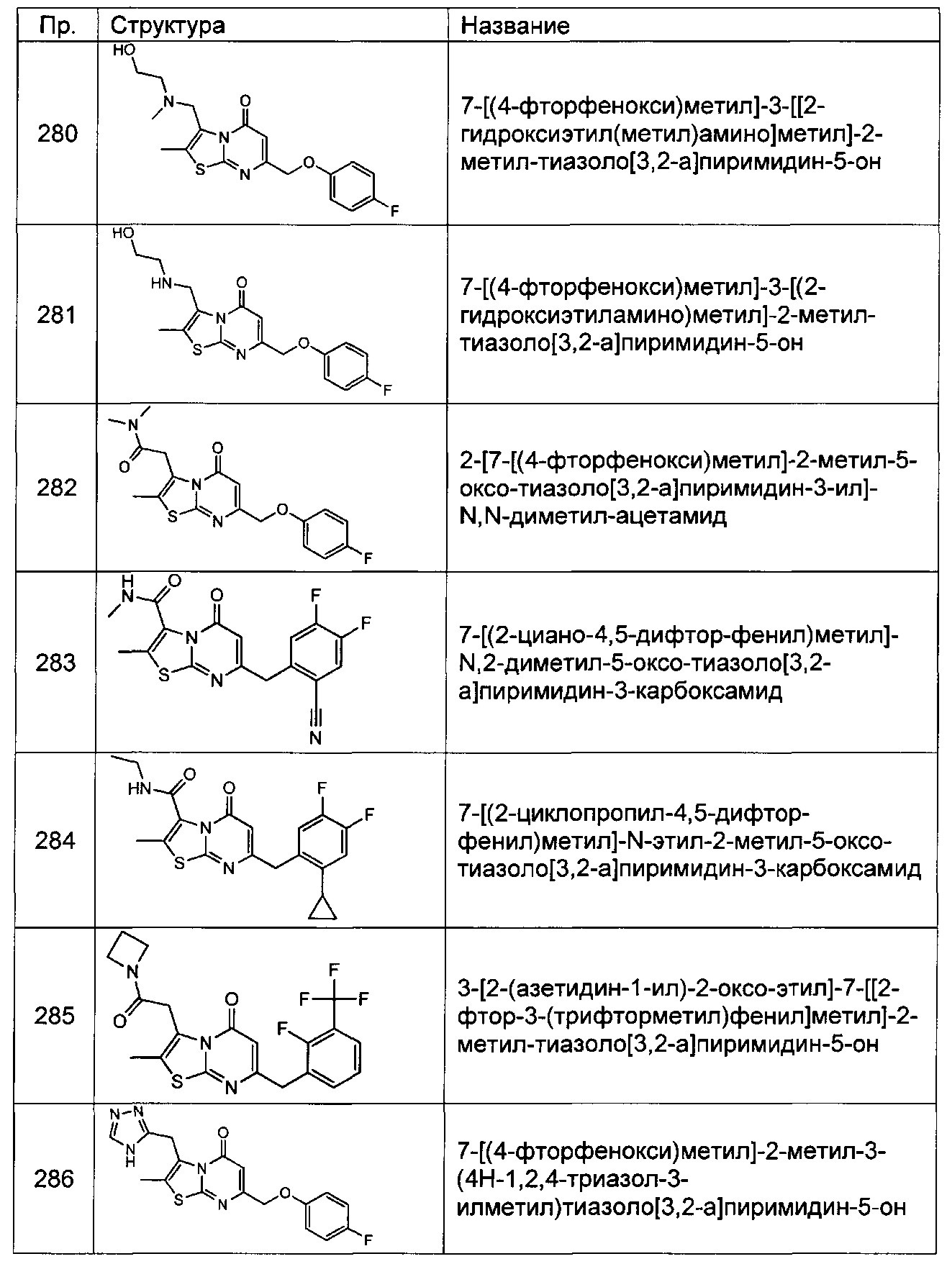
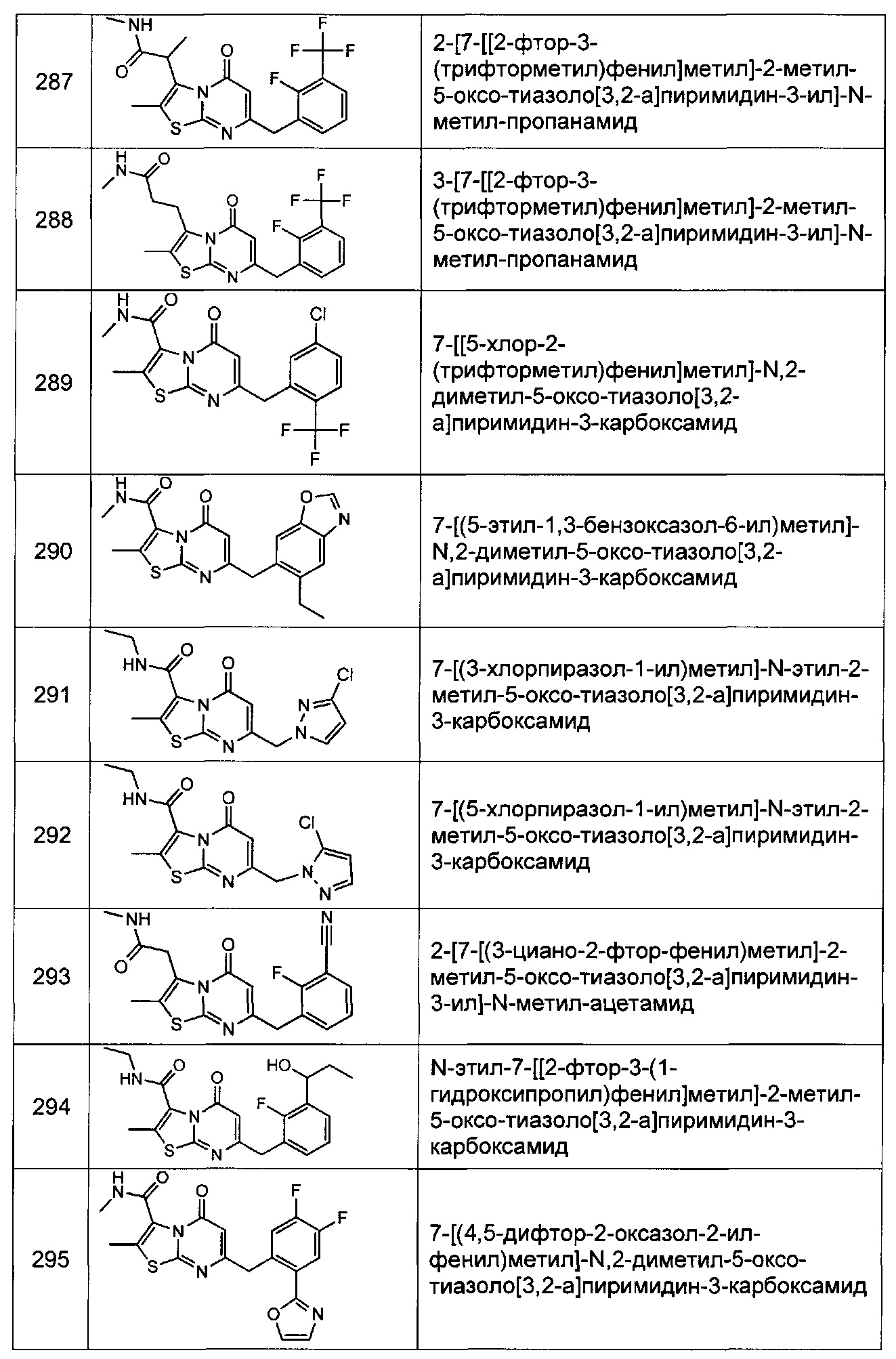
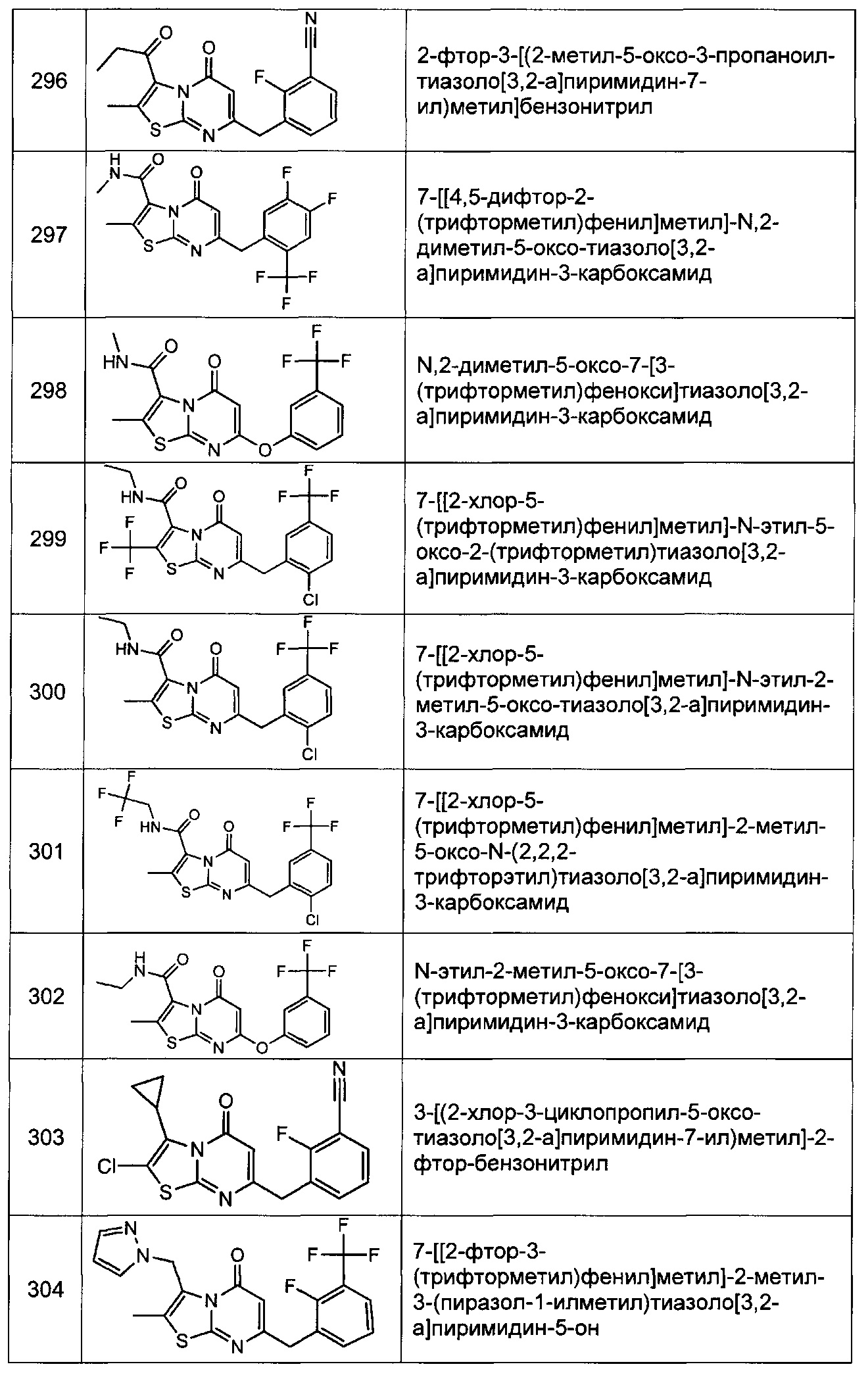
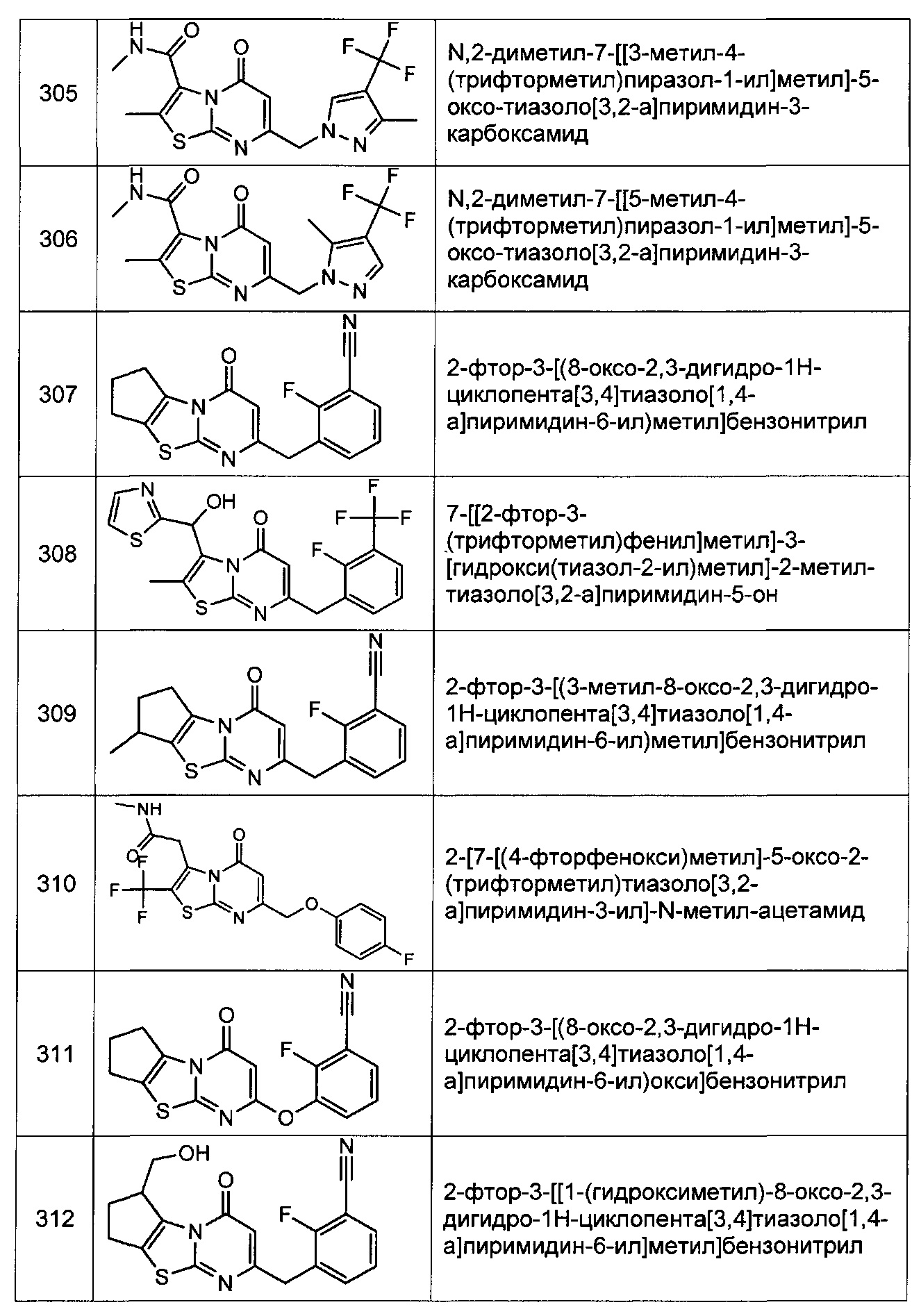
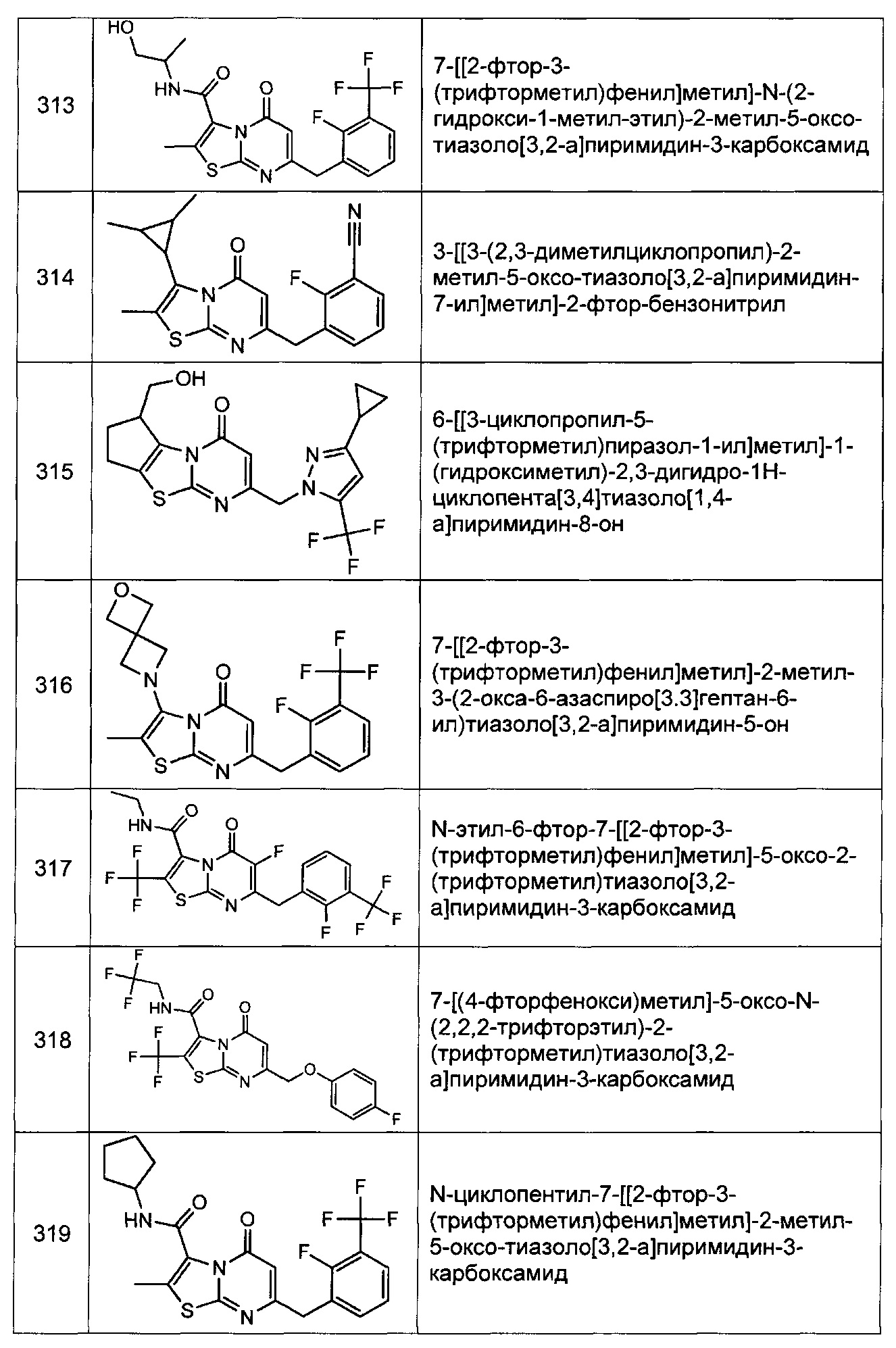
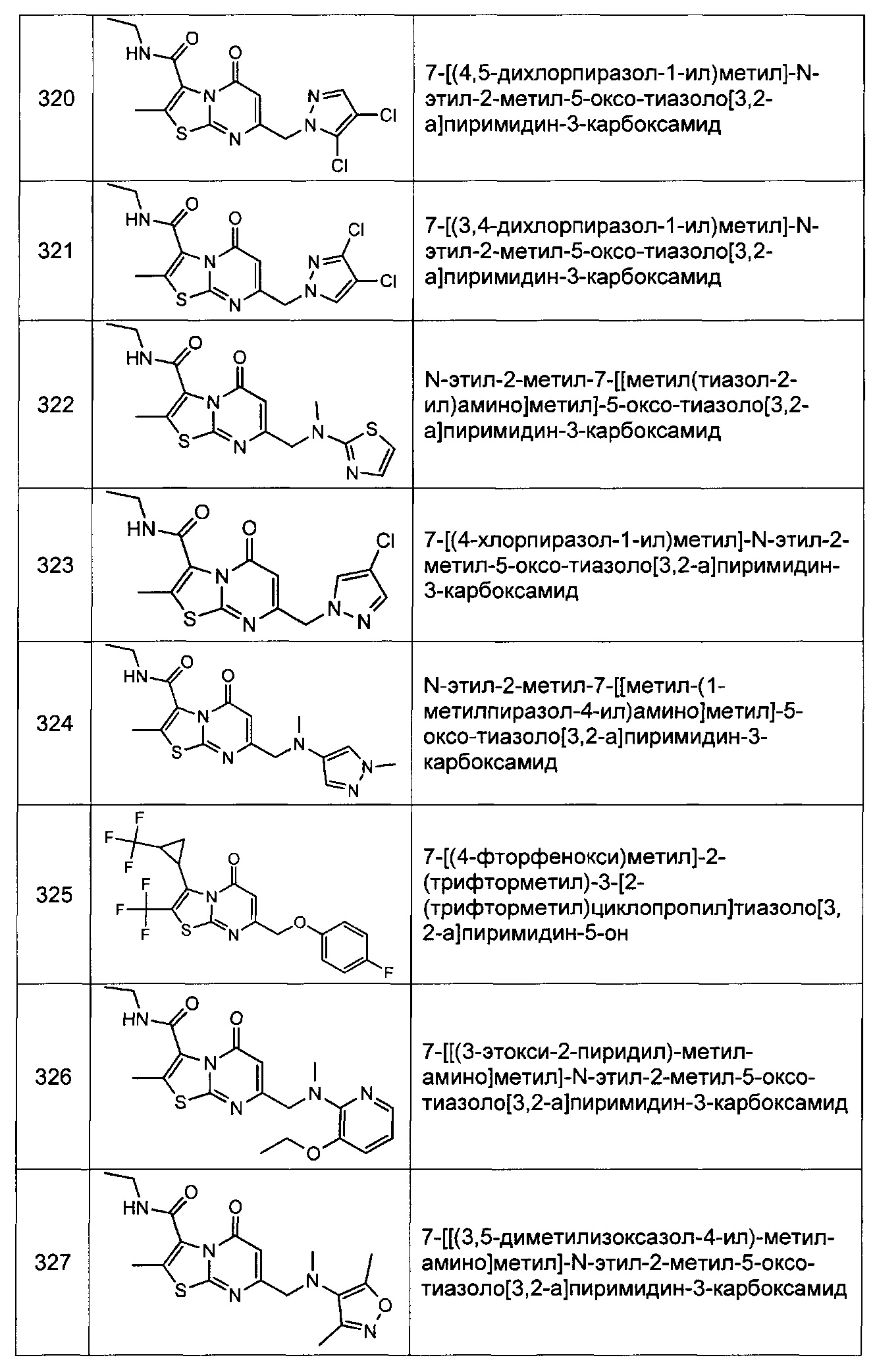
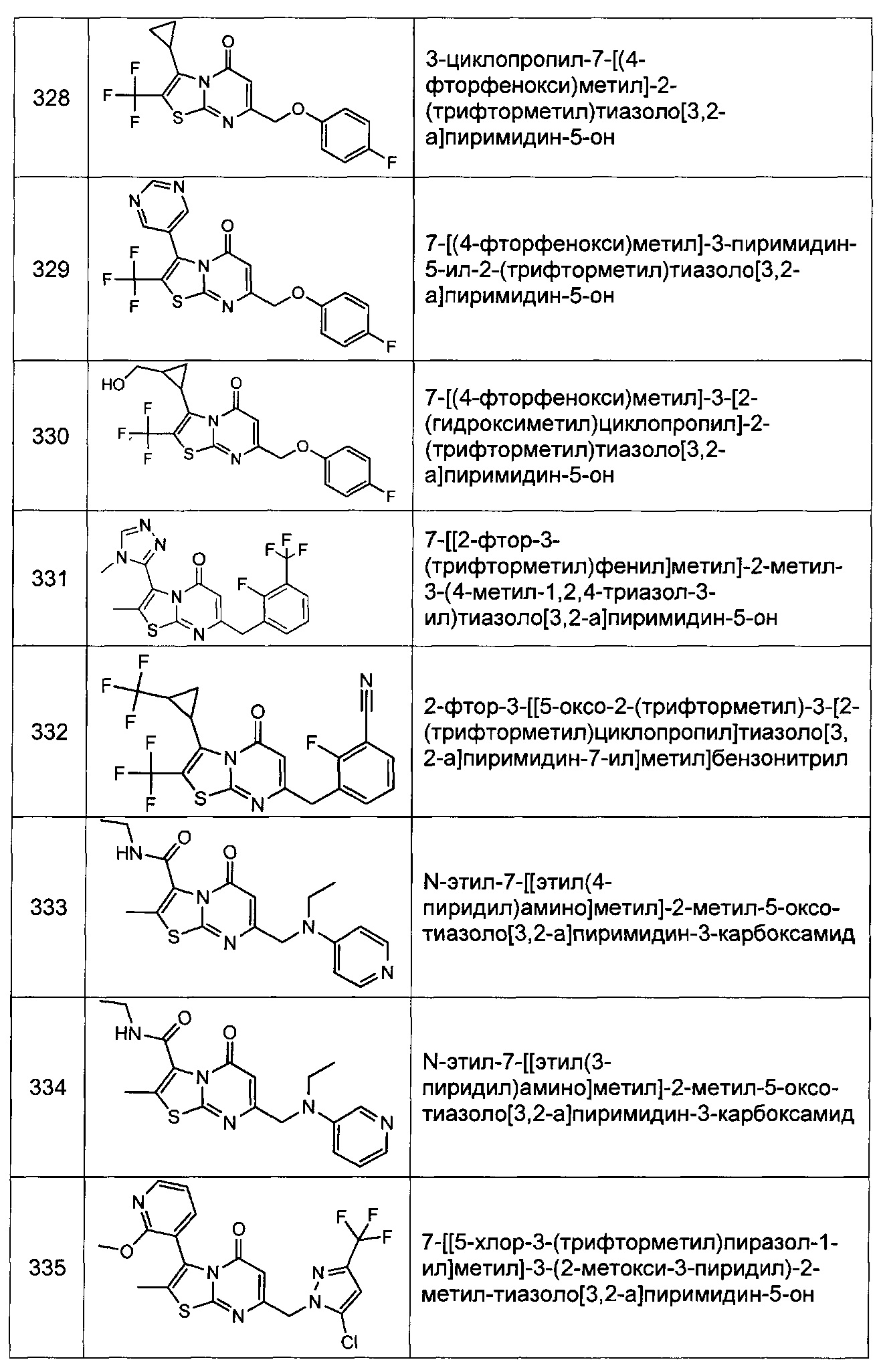
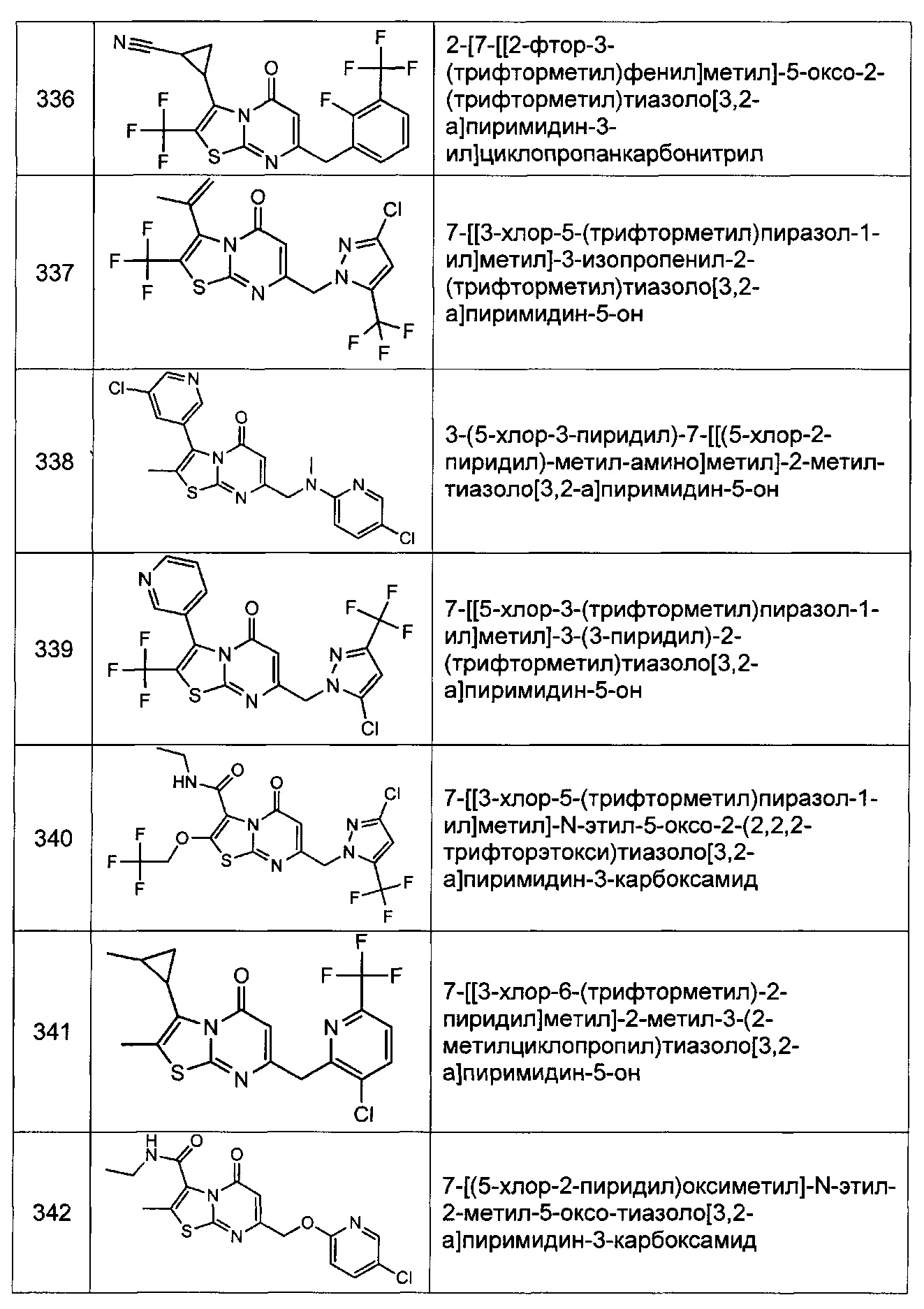
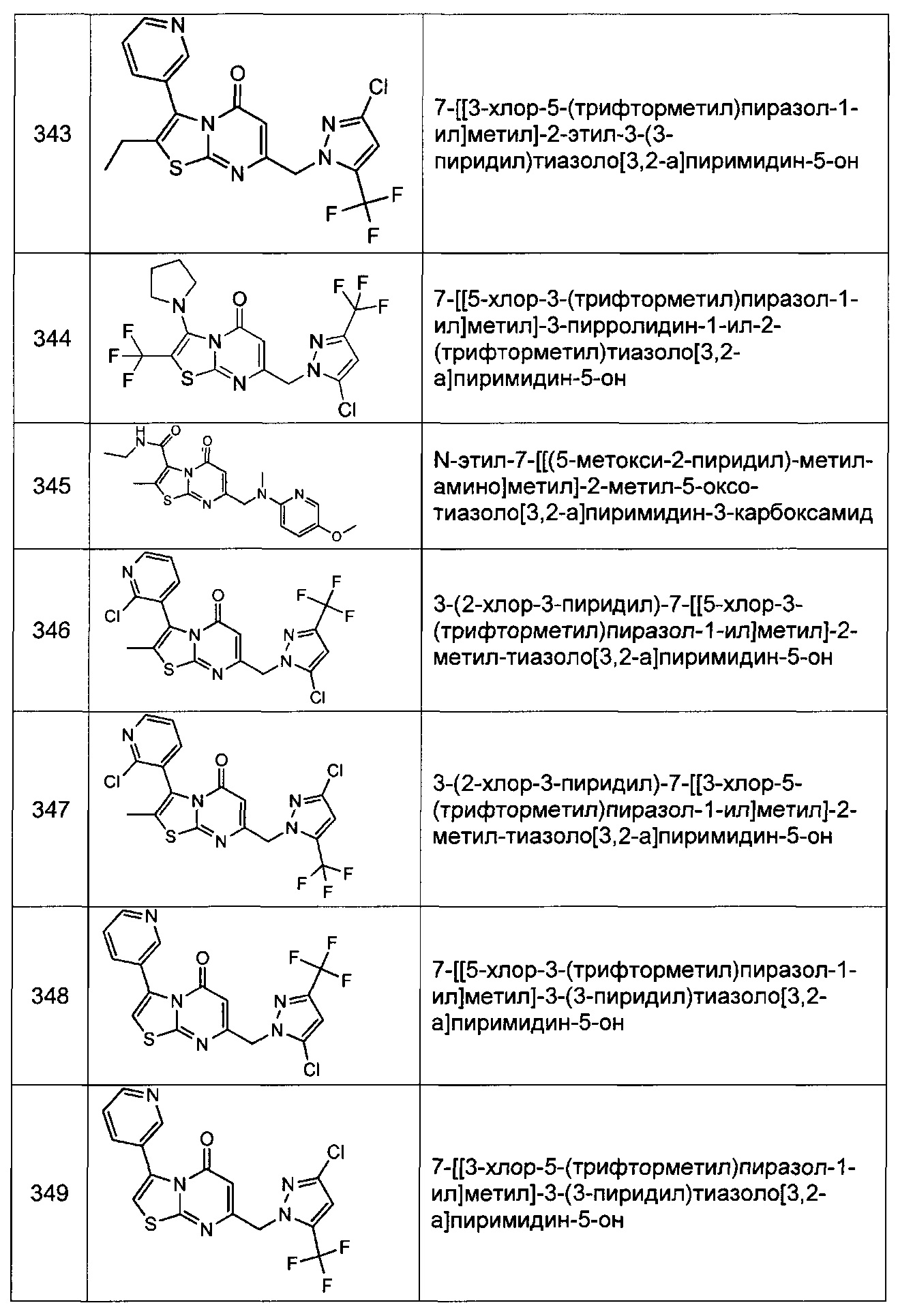
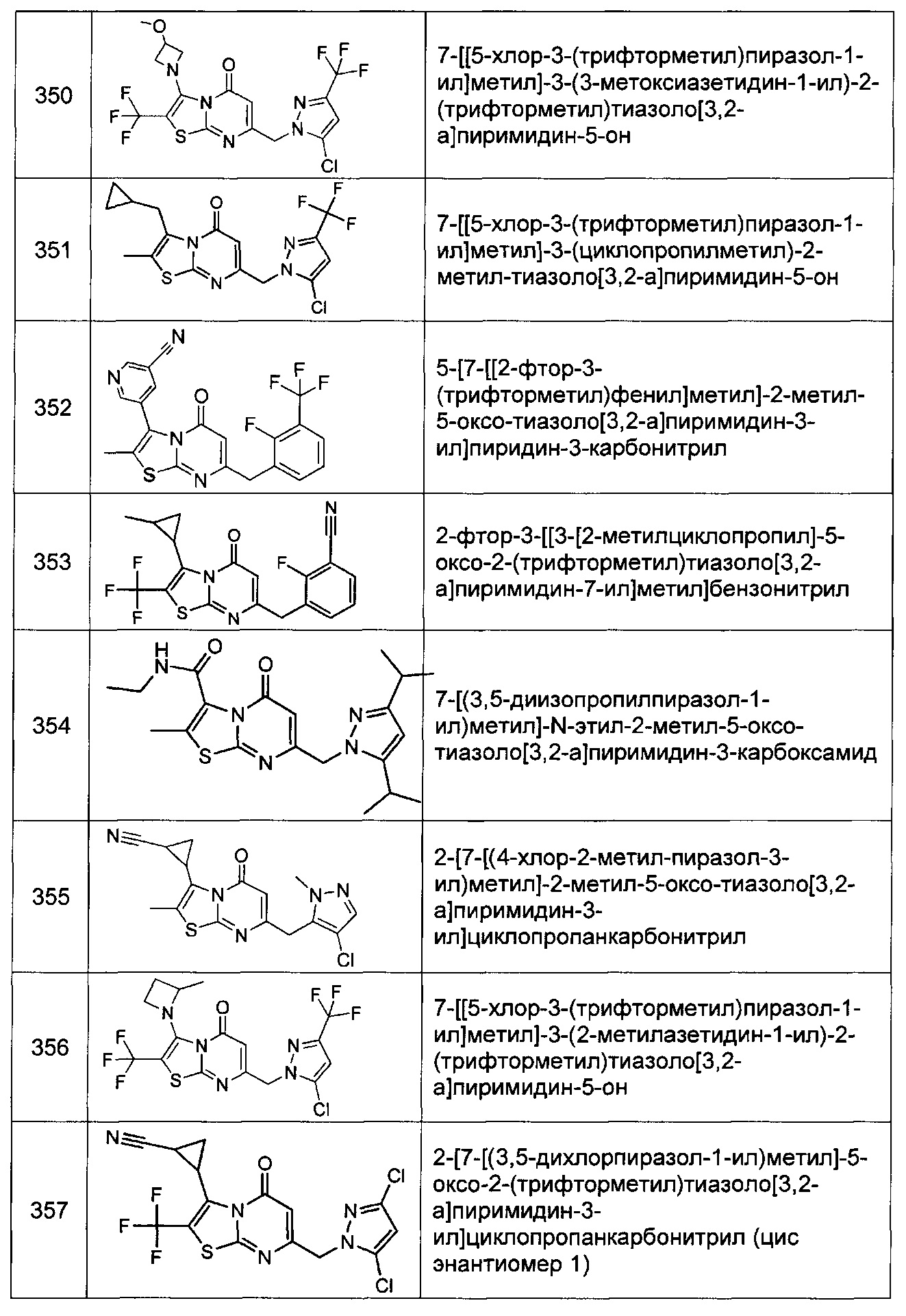
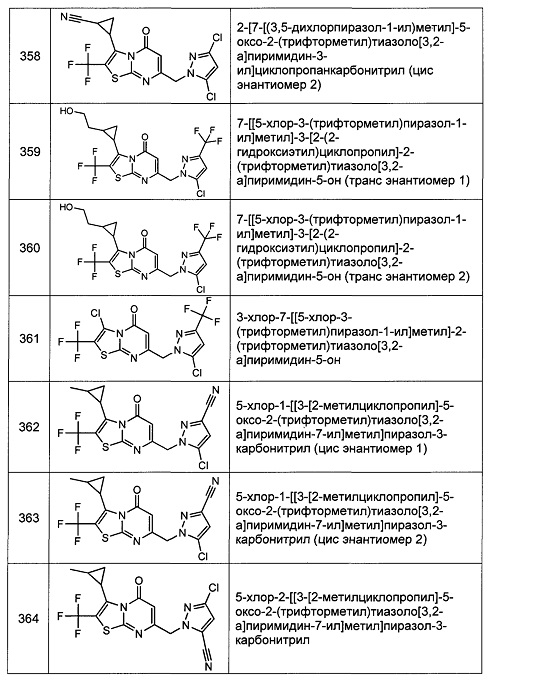
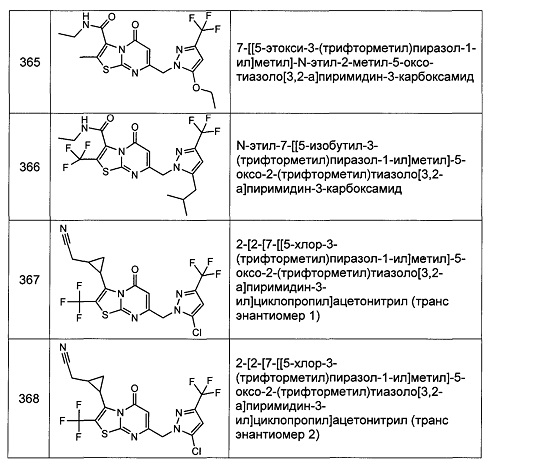
[0518] Необходимо понимать, что квалифицированный специалист будет способен получить соединения настоящего изобретения, используя известные в уровне техники способы вместе с общими способами синтеза, описанными здесь.
Анализ 1: Анализ на основе клеток
[0519] Клетки HEK стабильно трансфицированные тетрациклин индуцибельными hNR1 и hNR2A посеяли 384 луночные планшеты с прозрачным дном, покрытые поли-D-лизином (2.5×104 клеток на лунку) в минимально необходимой среде (MEM; без L-), включающей 7.5 мкг мл-1 доксициклина и 500 мкМ (+)-кетамина. Клетки инкубировали при 37°С в 5% СО2 в течение 24 ч. Для измерения изменений в цитозольном кальции посевную среду удалили и клетки инкубировали при 37°С в течение 60 мин с реагентом из набора для анализа кальция 1Х Becton Dickinson Calcium Assay Kit в сбалансированном солевом растворе Хэнкса (HBSS; без магния, включая 1.8 мМ кальций, 0.65 мг мл-1 пробенецид и 10 мкМ (+)-кетамин, рН 7.15) затем дали достигнуть комнатной температуры в течение 30 мин. Кривые концентрация-эффект для положительных аллостерических модуляторов (PAMs) строили посредством добавления различных концентраций (с 30 мкМ глицином и 300 нМ L-глутаматом (ЕС30)) в различные лунки в HBSS. Соединения добавили после 10 секундного считывания базовой линии и максимальный уровень относительных единиц флуоресценции (RFU) измеряли через период 5 мин. Ответы масштабировали относительно максимального ответа 100 мкМ L-глутамата (100%) и 0 мкМ L-глутамата (0%). Значения EC50 даны для соединений, достигающих плато максимального ответа, и макс % (EC50 (--)) только если плато не достигалось.
[0520] Четырехпараметрическое уравнение Хилла аппроксимировали к индивидуальным кривым концентрация-эффект:
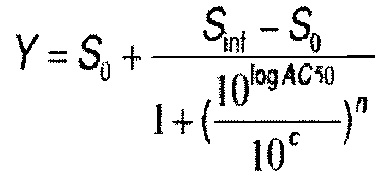
где Y, S0, Sinf, АС50, n и с являлись эффектом, нижней асимптотой, верхней асимптотой, расположение медианы, параметр наклона и концентрация соответственно.
[0521] Данные для соединений, протестированных в указанном анализе, показаны ниже в Таблице 2.
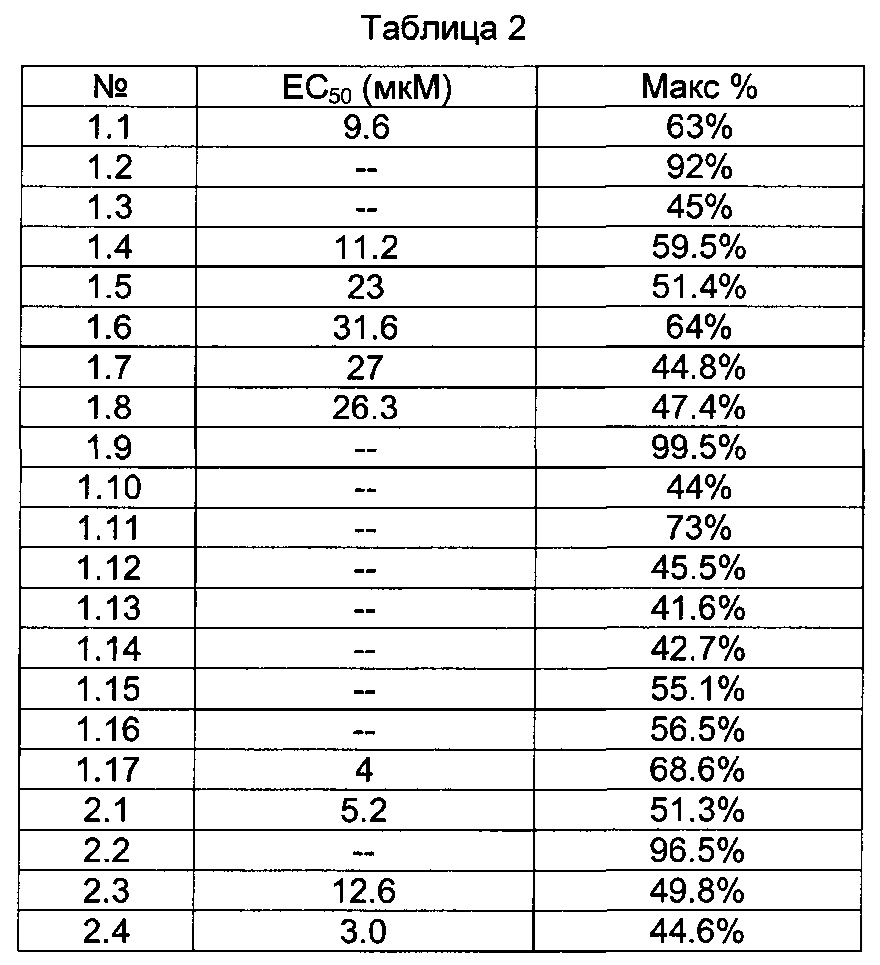
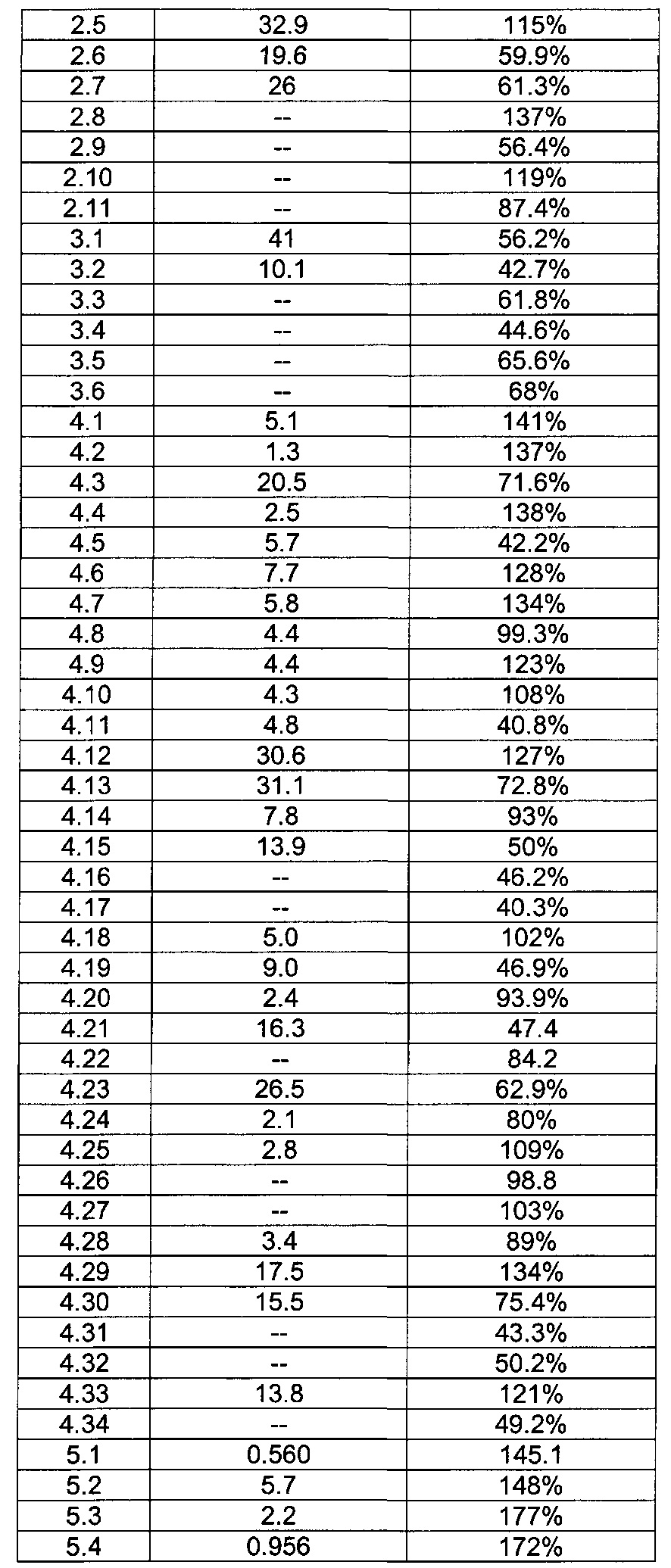
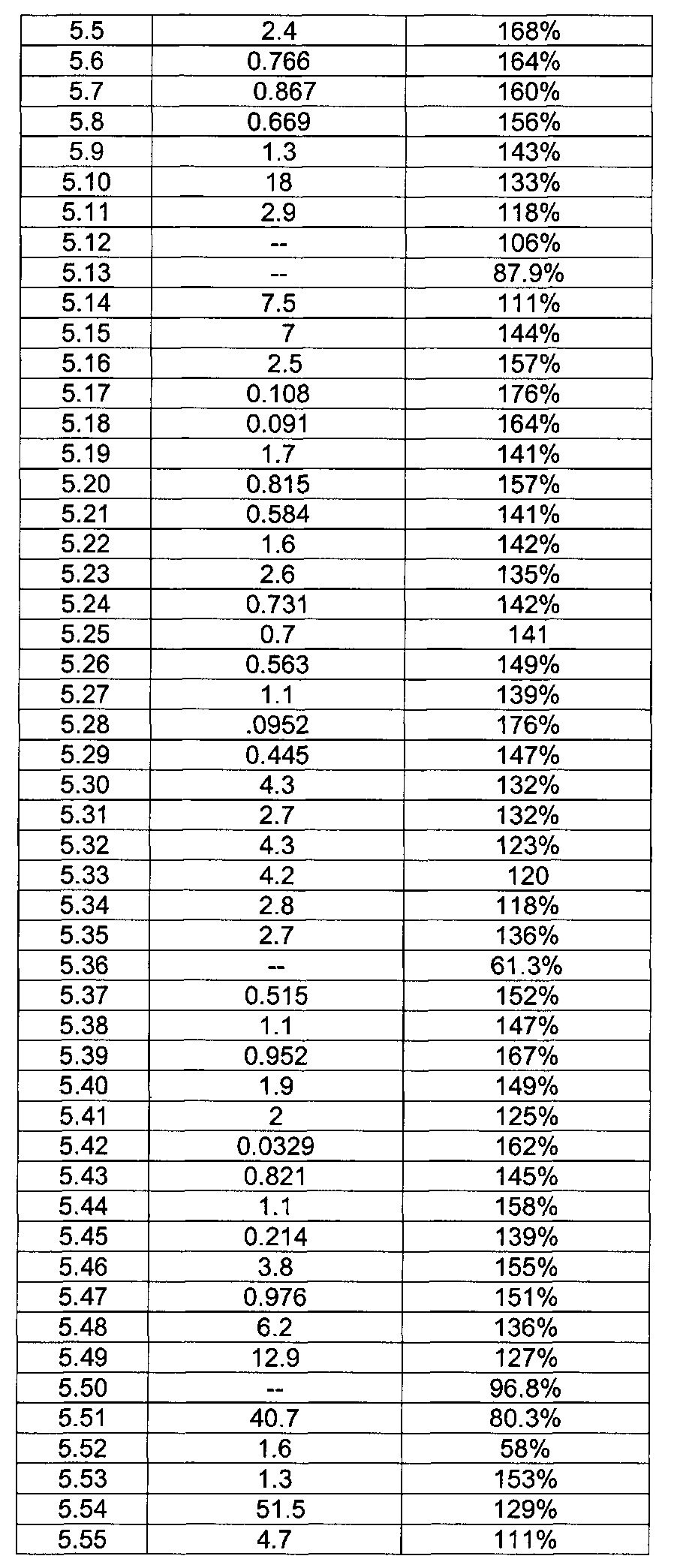
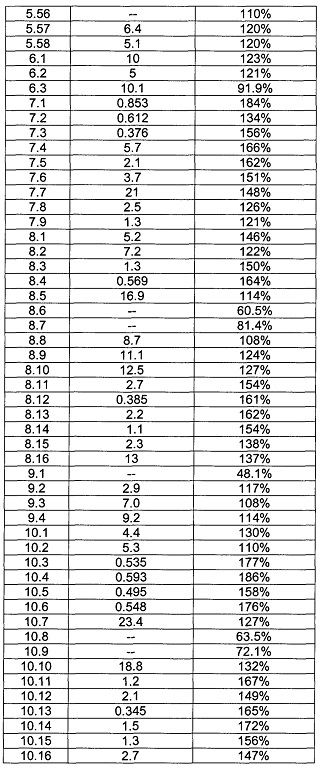
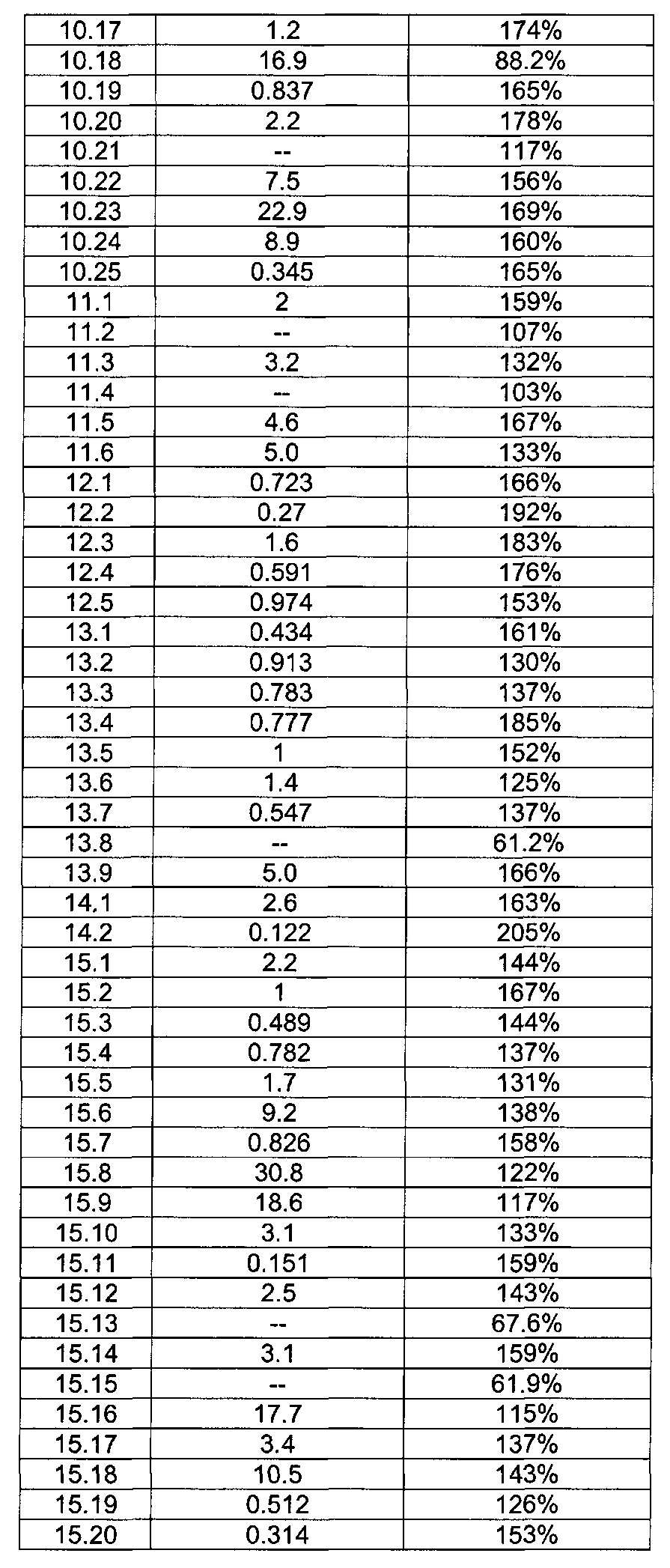
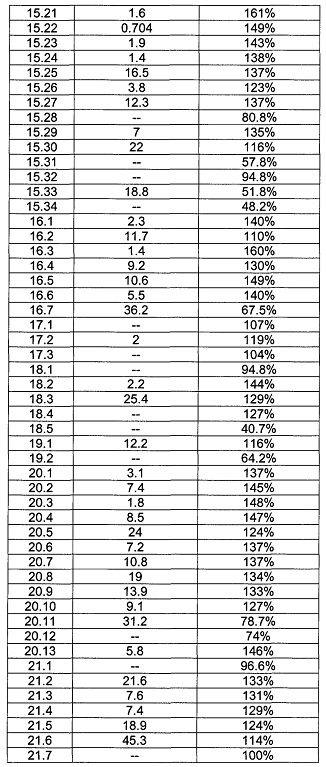
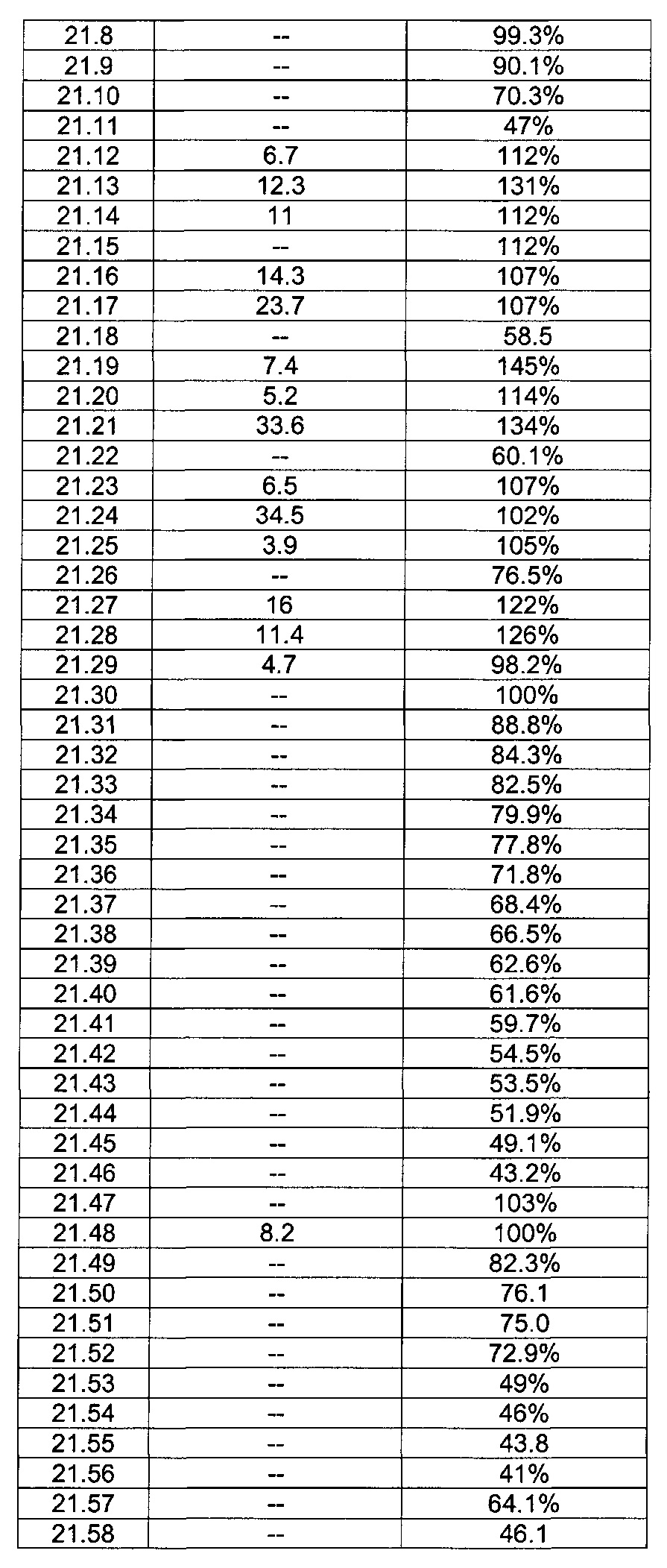
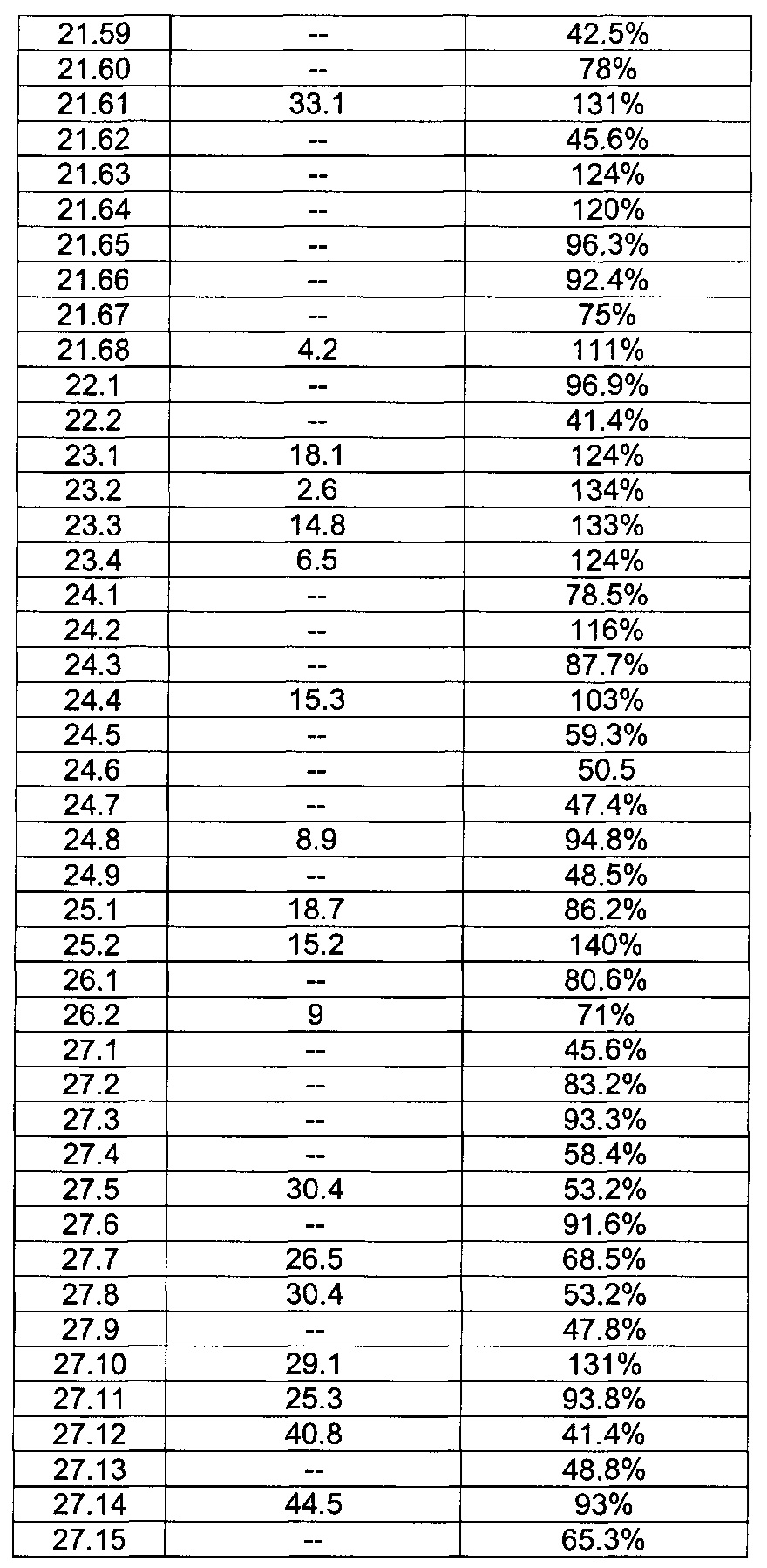
[0522] Дополнительные данные для соединений, протестированных в этом анализе, показаны в Таблице 3.
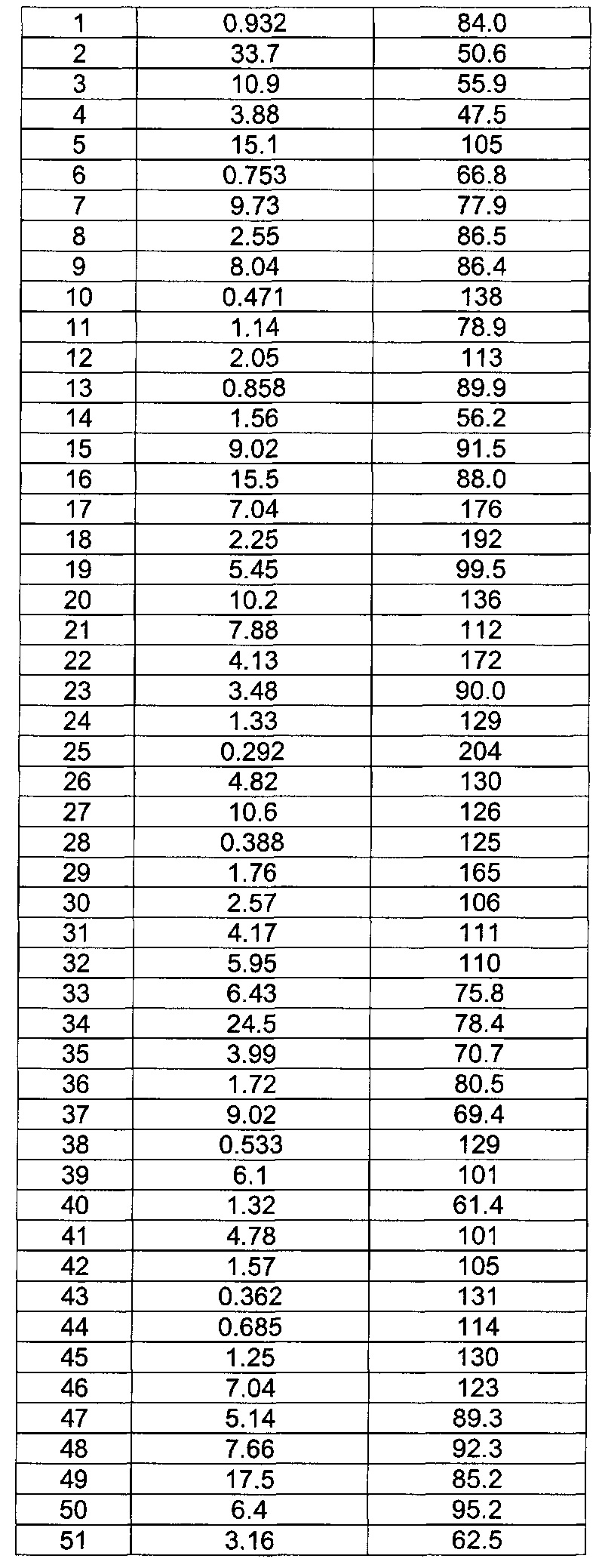
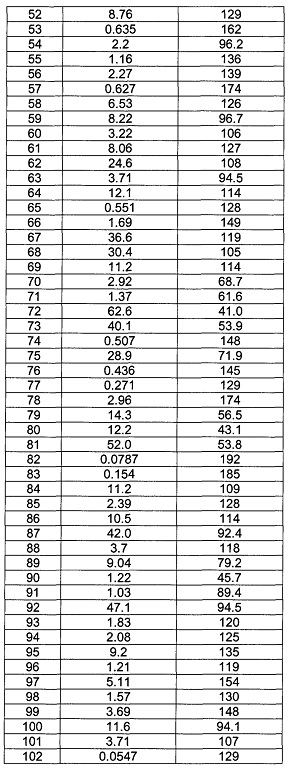
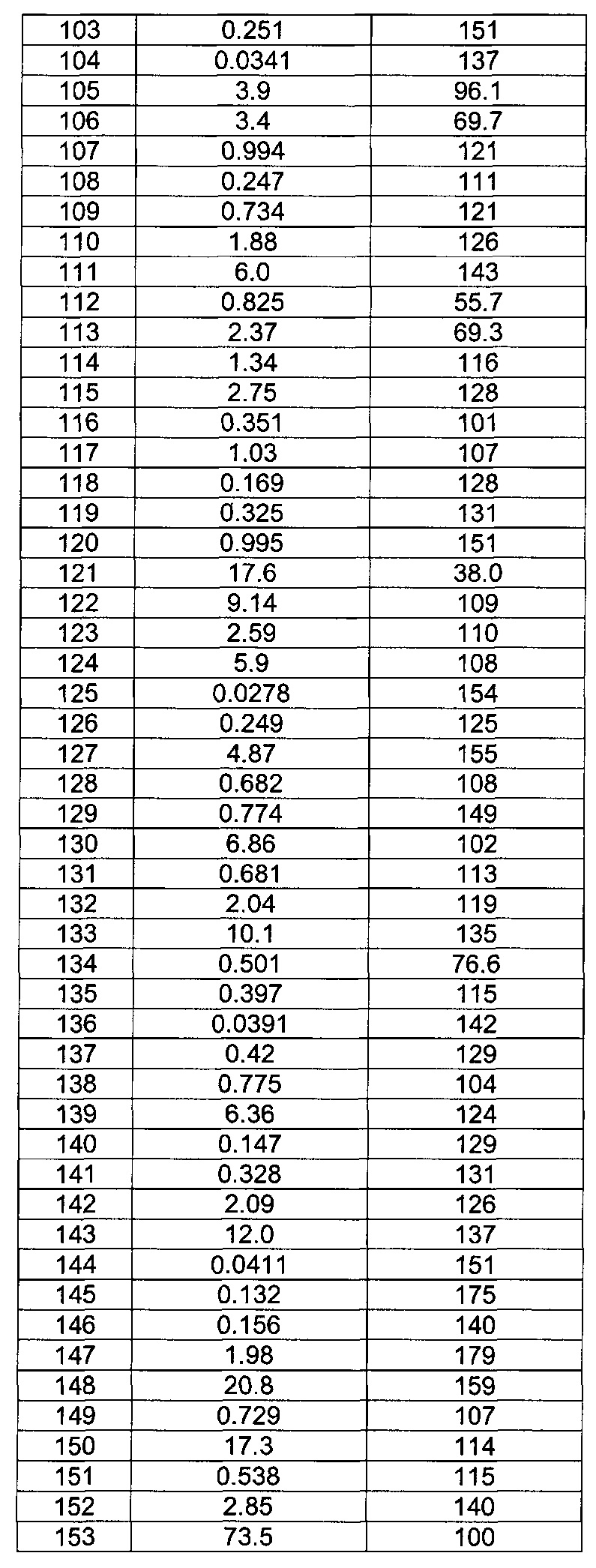
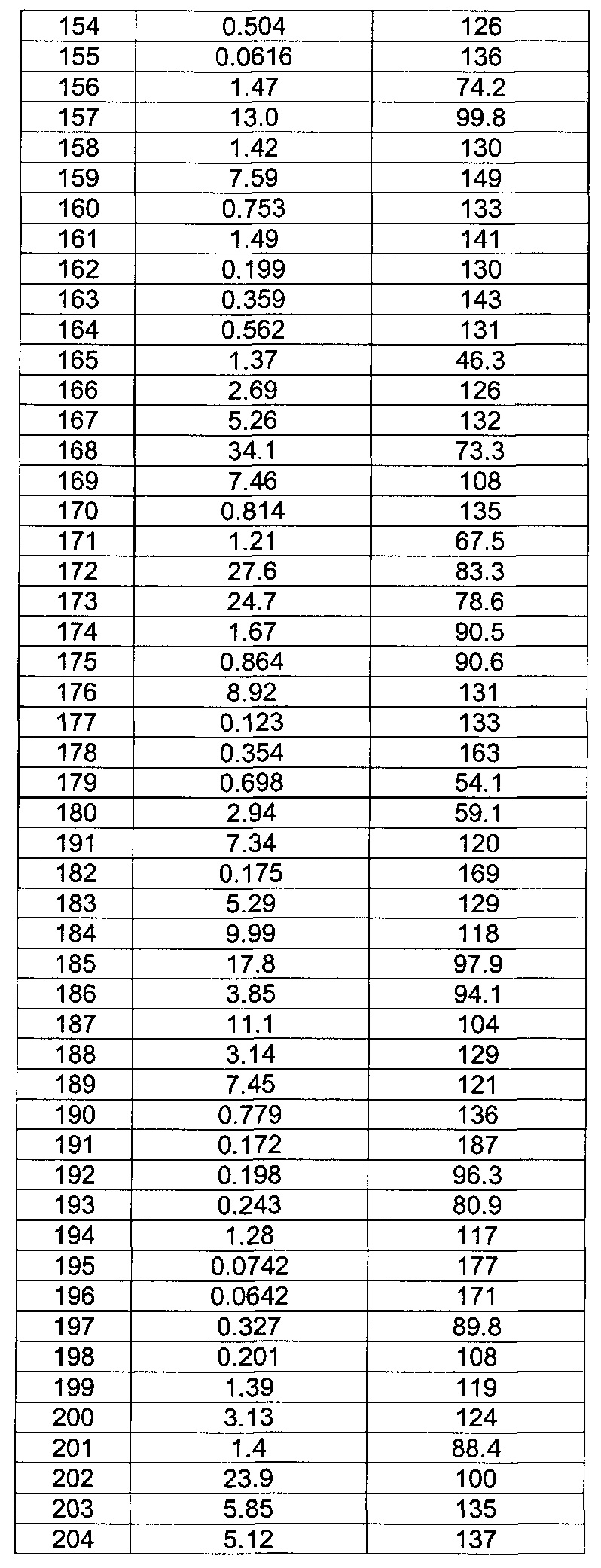
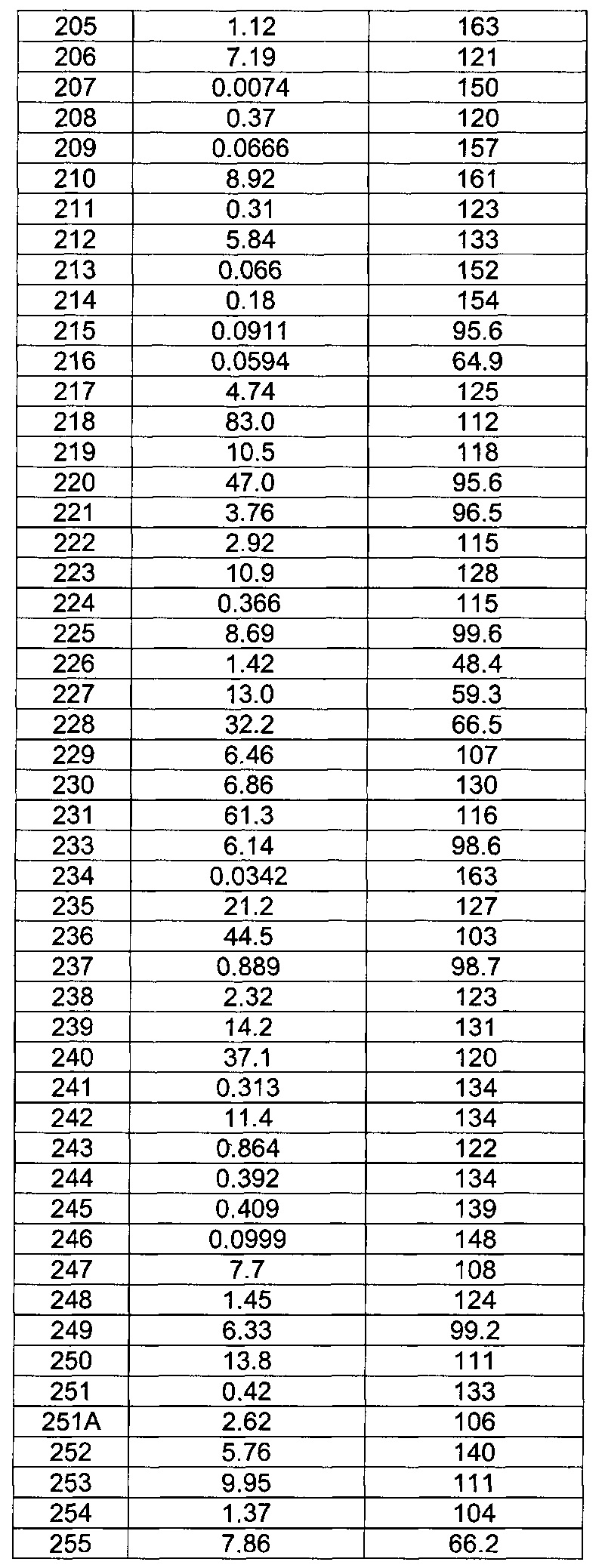
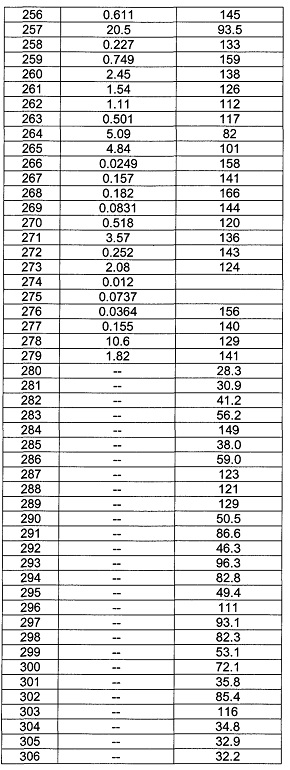
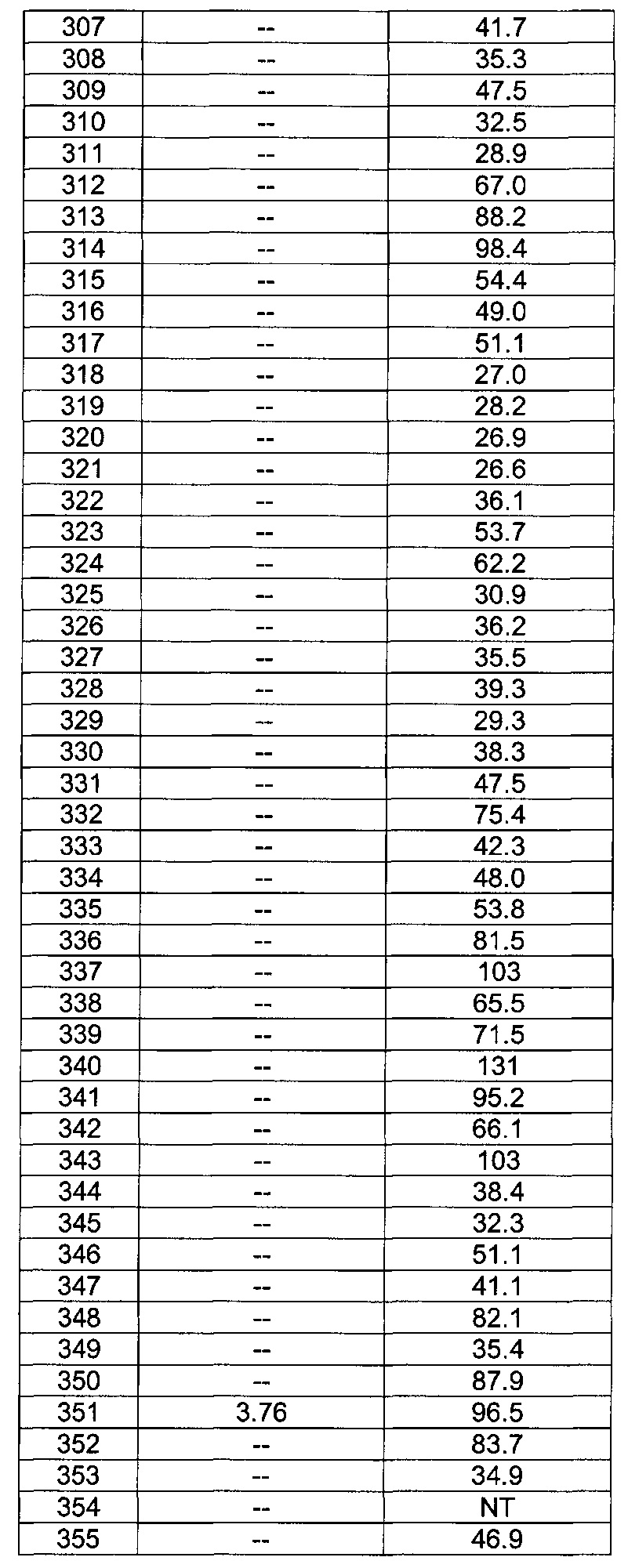
[0523] Несмотря на то, что настоящее изобретение было описано в сочетании с конкретными воплощениями, данными выше, множество их альтернатив, модификаций и других изменений очевидны для квалифицированных специалистов в уровне техники. Все такие альтернативы, модификации и изменения предназначены для включения в сущность и объем настоящего изобретения.