Результат интеллектуальной деятельности: ЖИВАЯ ОСЛАБЛЕННАЯ ГЕТЕРОЛОГИЧНАЯ ВАКЦИНА ОТ LEPTOSPIRA
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
Эта заявка испрашивает приоритет предварительной заявки США 62/239,136, зарегистрированной 8 октября 2015.
Область техники
Настоящее раскрытие имеет отношение к живым ослабленным вакцинам, которые обеспечивают гетерологичную защиту от инфекции Leptospira spirocheteсек. Настоящее изобретение также имеет отношение к реагентам и способам, обеспечивающим возможность их обнаружения, методам вакцинации, а также способам получения этих реагентов и вакцин.
Уровень техники
Лептоспироз представляет собой опасное для жизни заболевание, являющееся самой распространенной во всем мире болезнью, передаваемой от животного человеку, поражающей все виды млекопитающих, включая человека (B. Adler, 2015, Leptospira and Лептоспироз, vol. 387, B. Adler, Ed. Berlin, Heidelberg: Springer Berlin Heidelberg, pp. 1-9). Эту оставленную без внимания и новую инфекцию вызывает спирохета Leptospira, спиральная бактерия с характерными изогнутыми концами в виде крюков (Charon NW et al., 2002, Annu. Rev. Genet., vol. 36, no. 1, pp. 47-73). Инфекция одним из 10 патогенных видов, включая Leptospira interrogans, может приводить к широкому спектру симптомов от бессимптомоной инфекции до полиорганной недостаточности с уровнем смертности от 10 до 50%. Однако, имеется значительная нехватка понимания основных аспектов биологии и механизмов вирулентности патогенной Leptospira. Это во многом является следствием отсутствия достаточного и эффективного генетического инструментария в отношении этих медленно растущих бактерий. Таким образом, до сих пор установлено только ограниченное количество факторов вирулентности. Описанные механизмы вирулентности включают адгезию патогена и персистенцию в хозяине, повреждение ткани хозяина, почечную колонизацию и вход патогена и распространение в хозяине (Murray GL, 2015, Curr. Top. Microbiol. Imm мМunol., vol. 387, pp. 139-185).
Подвижность спирохет является уникальной, в том смысле, что они могут плыть в сильновязкой гелеобразной среде, которая замедляет или останавливает подвижность других перитрихиальных жгутиковых бактерий (C. Li et al., 2000, J. Mol. Microbiol. Biotechnol., vol. 2, no. 4, pp. 345-354). Эта подвижность обеспечивается двумя эндожгутиками, вставленными субтерминально в периплазму на каждом полюсе, тянущимися к середине клетки без перекрывания. Являются ли полюсы крюковидные или спиралеобразными, определяется направлением вращения жгутика. Вращение в направлении против часовой стрелки (CCW, если смотреть со стороны центра клетки) формирует спиралеобразные концы, тогда как вращение в направлении по часовой стрелке (CW) дает в результате крюковидные концы. Симметричное вращение жгутика не приводит к поступательной подвижности. Поступательное движение происходит только тогда, когда жгутики вращаются в противоположном направлении с помощью переднего конца в крюкообразной форме и заднего конца в спиралеобразной форме (Charon NW et al., 2002, выше).
Жгутики модельных систем Escherichia coli и Salmonella enterica в значительной степени изучены (Berg HC, 2003, Annu. Rev. Biochem., vol. 72, pp. 19-54; Macnab RM, 2003, Annu. Rev. Microbiol., vol. 57, pp. 77-100; Terashima H et al., 2008, Int. Rev. Cell Mol. Biol., vol. 270, pp. 39-85; СЕК. Kojima S et al., 2004, Int. Rev. Cytol., vol. 233, pp. 93-134; Sowa Y et al., 2008, Q. Rev. Biophyсек., vol. 41, no. 2, pp. 103-132). Обычно жгутики состоят из жгутиковой нити (филамента), крюка и мотора, который является составной частью базального тельца, причем их структура, по-видимому, является высоко консервативной в пределах Царства бактерий (Zhao X et al., 2014, Biochemistry (Mosc.), vol. 53, no. 27, pp. 4323-4333). Филаменты жгутика спирохет, однако, не состоят из одного полимера флагеллина, как у энтеробактерий, а содержат сложную структуру из нескольких субъединиц (Slamti L et al., 2011, J. Bacteriol., vol. 193, no. 22, pp. 6266-6275). Сайт-направленный или случайный мутагенез в Leptospira дает возможность исследования некоторых компонентов эндожгутиков, включая жгутиковые белки FlaA, FlaB (Picardeau M et al., 2001, Mol. Microbiol., vol. 40, no. 1, pp. 189-199; Lambert A et al., 2012, Infect. Imm мМun., vol. 80, no. 6, pp. 2019-2025), а также FliY, белок связанный со жгутиковым мотором и вероятно частью C-кольца (Zhao X et al., 2014, supra; Liao S et al., 2009, BMC Microbiol., vol. 9, no. 1, p. 253). Крио-электронная томография Leptospira spp. также обеспечивает представление о структуре эндожгутика (Zhao X et al., 2014, supra; Zhao X et al., 2013, PNAS, vol. 110, no. 35, pp. 14390-14395; Raddi G et al., 2012, J. Bacteriol., vol. 194, no. 6, pp. 1299-1306). Zhao и его сотрудники показали, что лептоспирозный жгутиковый мотор состоит из MS кольца (основа мотора), C-кольца, ответственного за переключение вращения мотора, стержня с L и P кольцами, соединяющего MS кольцо с крюком, уникальной структуры спирохет, называемой хомутом, окружающей MS-кольцо, сложного аппарата, отвечающего за жгутиковые белки III типа, включая субъединицы стержня, крюка и филамента, и наконец статора, который является генератором движущей силы. Считается, что C-кольцо состоит в своем центре из FliM в комплексе с FliN. Сигнальный белок хемотаксиса CheY-P (фосфорилированный CheY) связывается с FliM и вероятно FliN, приводя при прямом взаимодействии к конформационному изменению FliG, «перестраивая» взаимосвязь между FliG и статором, что обеспечивает возможность переключения направления вращения мотора или в направлении CW или CCW (Ahn DR et al., 2013, Int. J. Biol. Macromol., vol. 54, pp. 76-83; Y. Morimoto Y et al., 2014, Biomolecules, vol. 4, no. 1, pp. 217-234).
Первые бактериальные вакцины против лептоспироза были созданы более ста лет назад. На сегодняшний момент инактивированные цельноклеточные препараты остаются единственными лицензированными продуктами, предназначенными для использования в целях здоровья животных и человека. Они вызывают гуморальный иммунный ответ против основного иммунодоминантного бактериального антигена, липополисахарида (LPS). Его состав варьирует между серологическими вариантами, и отсюда вытекает узкий спектр серогруппспецифической защитной реакции. Однако, люди, а также животные (в частности, собаки) подвергаются воздействию множества серологических вариантов при наличии сильных временных и региональных изменений в эпидемиологии. Это является важной проблемой для производства вакцин в силу того, что имеет место длительное и затратное региональное развитие производства в соответствии с разновидностями и географическим положением.
В связи с этим существует острая необходимость в эффективной вакцине против широкого спектра инфекций Leptospira spirochetes у собак и кошек.
Раскрытие изобретения
Изобретение предоставляет композицию или вакцину, содержащую живые ослабленные Leptospira interroganсек. В частности, настоящее изобретение предоставляет рекомбинантные или ослабленные Leptospira interrogans, содержащие мутантный ген fliM, который является нефункциональным. Ген fliM рекомбинантных или ослабленных Leptospira interrogans может быть удален. Ген fliM может кодировать мутантный fliM белок, при этом FliM белок не транслируется, или может быть удален C-концевой участок fliM белка.
Настоящее изобретение имеет отношение к ослабленному штамму Leptospira interroganсек. В частности, изобретение предоставляет штаммы Leptospira interrogans, которые депонируются в CNCM под № CNCM I-5132 и CNCM I-5133, или любой потомок или потомство данных штаммов. У потомков или потомства депонированных штаммов ген fliM может быть полностью удален.
Настоящее изобретение показало неожиданное преимущество вакцинации с использованием живой ослабленной вакцины Leptospira interrogans для защиты животных от гомологичного и гетерологичного заражения Leptospira. Настоящее изобретение также неожиданно продемонстрировало, что перекрестный иммунитет может достигаться только при использовании штамма с ослабленной вирулентностью, непосредственно происходящего от полностью вирулентного изолята, но не при использовании авирулентного сапрофитного штамма.
Краткое описание чертежей
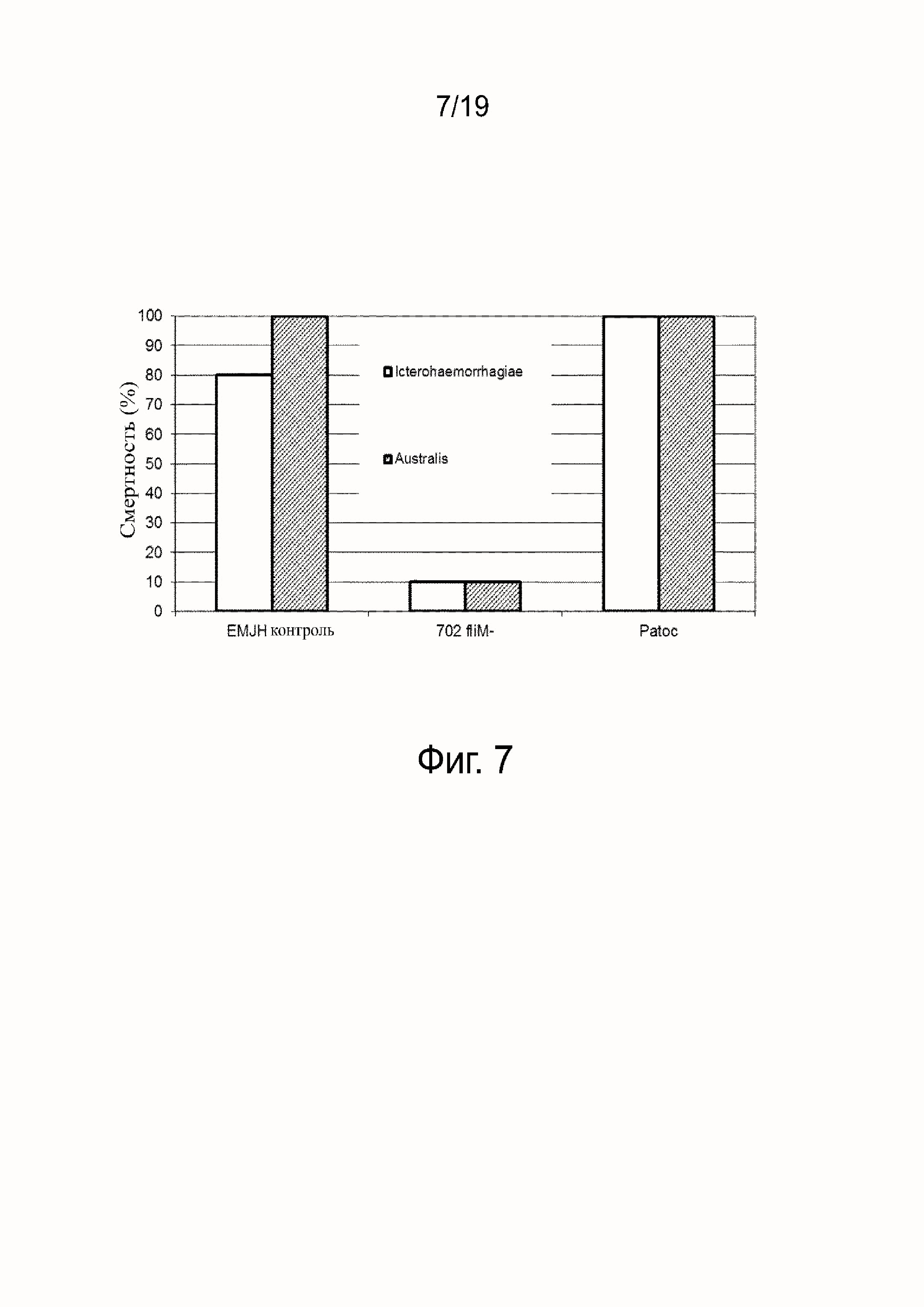
Фиг. 1A - L. interrrogans серогруппа australis мутантный штамм 702fliM-.
Фиг. 1B - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном.
Фиг. 1C - это штамм L. interrrogans серогруппа australis дикого типа.
Фиг. 1D - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0сек.
Фиг. 1E - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,1сек.
Фиг. 1F - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,2сек.
Фиг. 1G - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,3сек.
Фиг. 1H - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,4сек.
Фиг. 1I - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,5сек.
Фиг. 1J - L. interrrogans серогруппа australis мутантный штамм 702fliM-; временной интервал 0,6сек.
Фиг. 1K - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0сек.
Фиг. 1L - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,1сек.
Фиг. 1M - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,2сек.
Фиг. 1N - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,3сек.
Фиг. 1O - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,4сек.
Фиг. 1P - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,5сек.
Фиг. 1Q - L. interrrogans серогруппа australis мутантный штамм 702fliM-/+, восстановленный функциональным fliM геном; временной интервал 0,6сек.
Фиг. 1R - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0сек.
Фиг. 1S - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,1сек.
Фиг. 1T - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,2сек.
Фиг. 1U - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,3сек.
Фиг. 1V - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,4сек.
Фиг. 1W - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,5сек.
Фиг. 1X - L. interrrogans серогруппа australis штамм дикого типа; временной интервал 0,6сек.
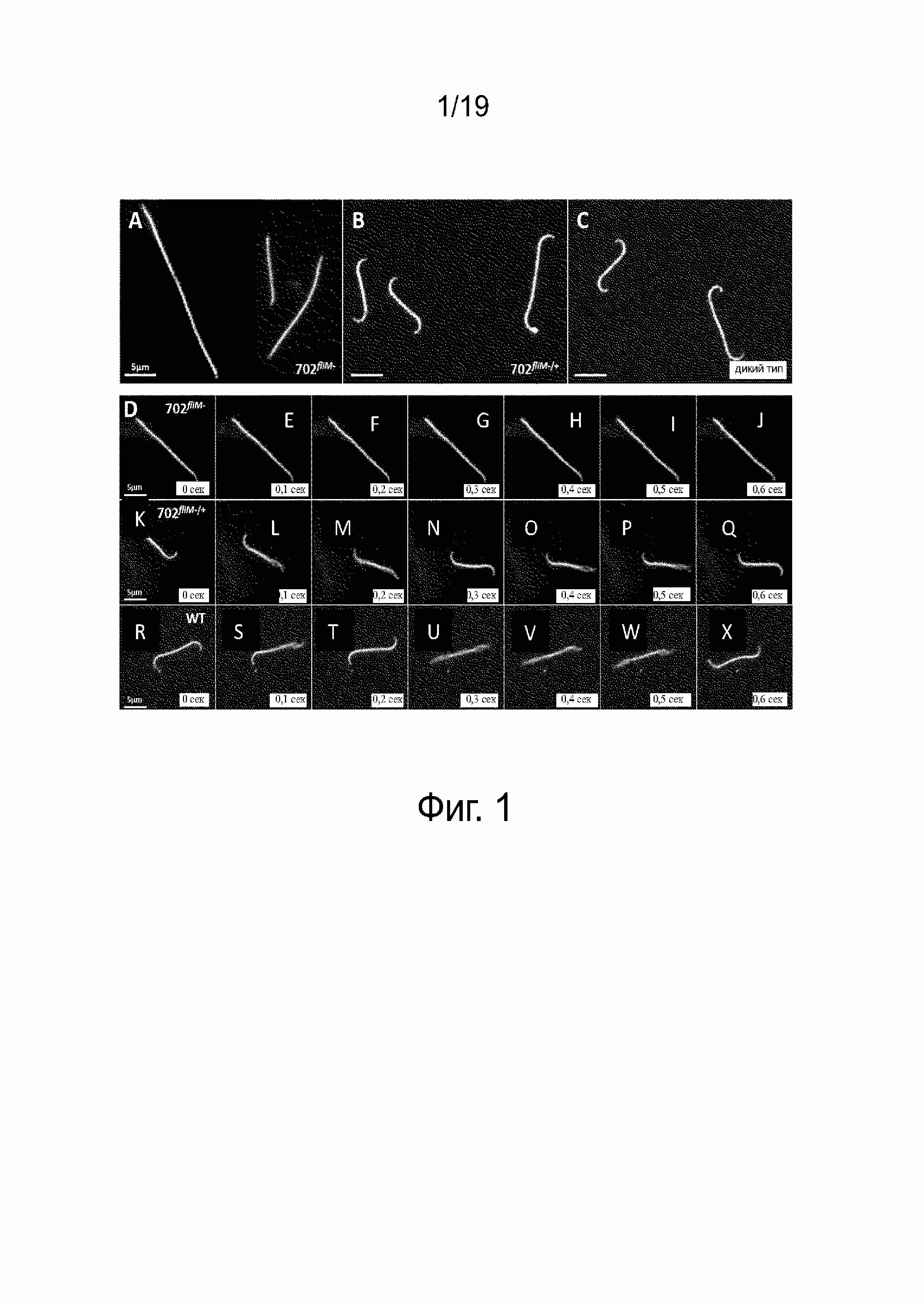
Фиг. 2A - Подвижность L. interrrogans серогруппа australis мутантного штамма 702fliM- после 10 дней инкубации.
Фиг. 2B - подвижность L. interrrogans серогруппа australis мутантного штамма 702fliM-/+, восстановленного функциональным fliM геном после 10 дней инкубации.
Фиг. 2C - Подвижность штамма дикого типа L. interrrogans серогруппа australis после 10 дней инкубации.
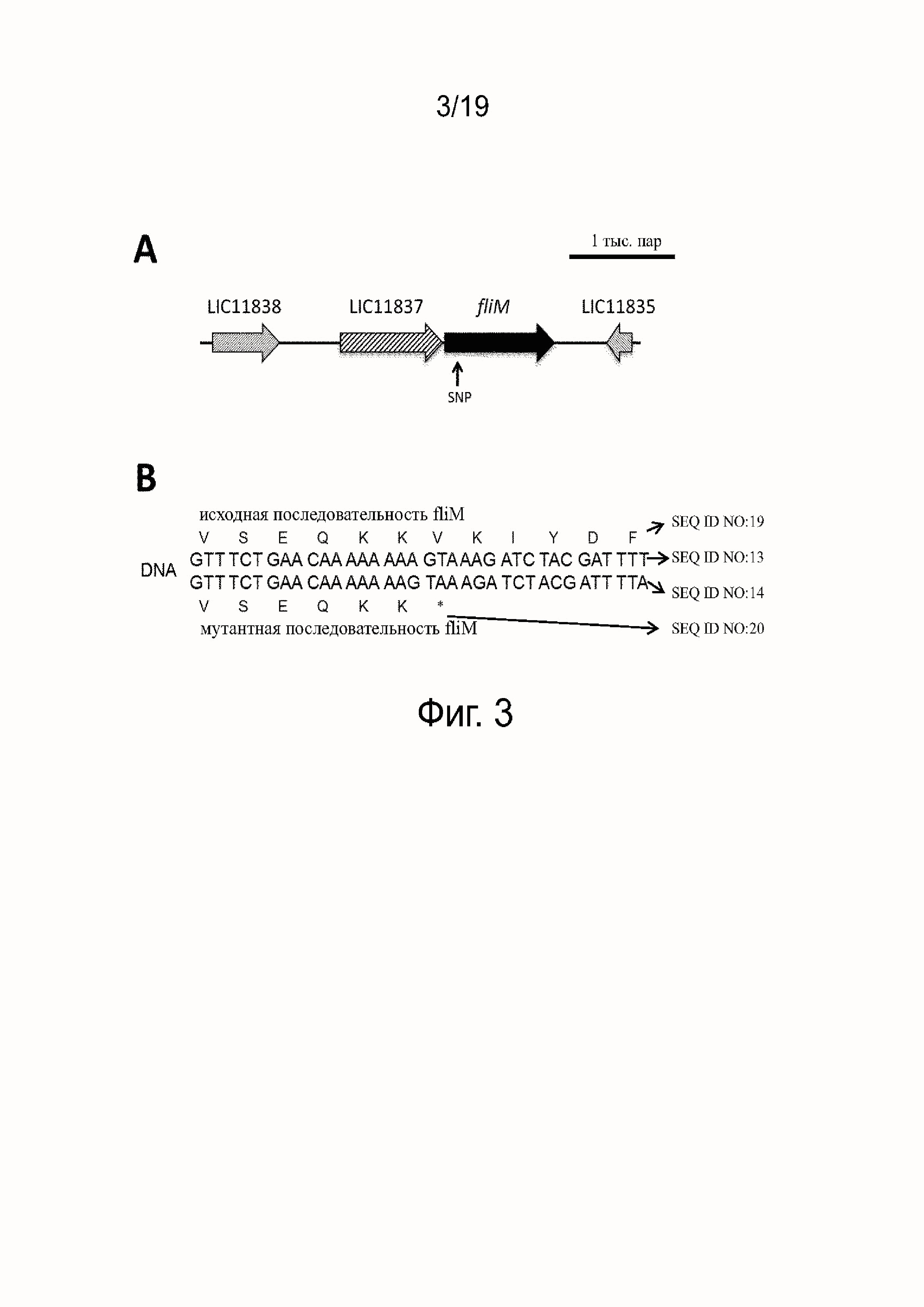
Фиг. 3A - это диаграмма, показывающая локализацию SNP L. interrrogans серогруппа australis мутантный штамм 702fliM-.
Фиг. 3B - это диаграмма, сравнивающая нуклеотидную последовательность L. interrrogans серогруппа australis штамма дикого типа с L. interrrogans серогруппа australis мутантным штаммом 702fliM-.
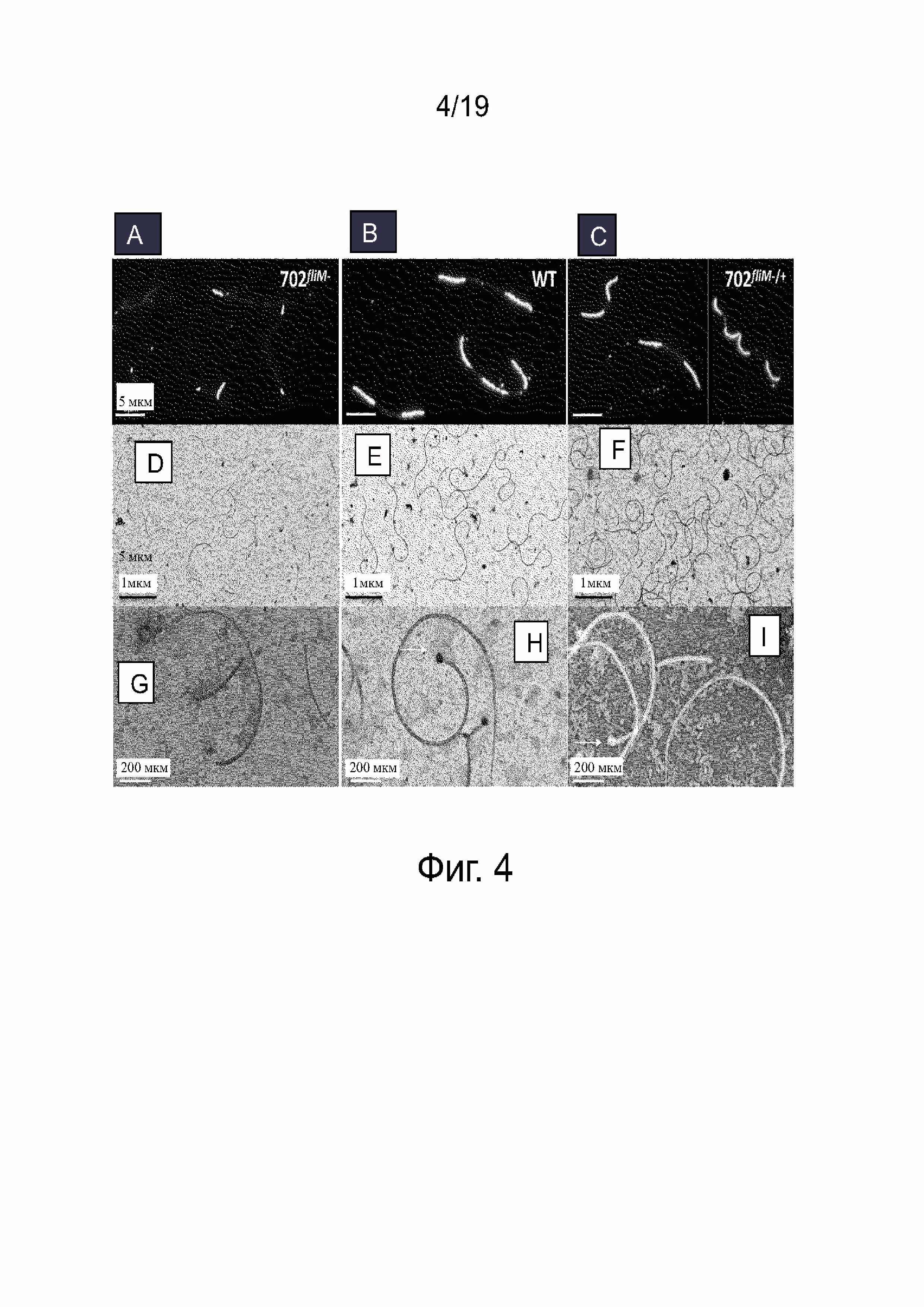
Фиг. 4A - это FlaB иммунофлуоресцентный анализ L. interrrogans серогруппа australis мутантный штамм 702fliM-.
Фиг. 4B - FlaB иммунофлуоресцентный анализ L. interrrogans серогруппа australis мутантный штамм 702fliM-/+.
Фиг. 4C - FlaB иммунофлуоресцентный анализ L. interrrogans серогруппа australis штамма дикого типа.
Фиг. 4D- это препарат жгутика после окрашивания уранилацетатом L. interrrogans серогруппа australis мутантного 702fliM-.
Фиг. 4E - это препарат жгутика после окрашивания уранилацетатом L. interrrogans серогруппа australis мутантного 702fliM-/+.
Фиг. 4F - это препарат жгутика после окрашивания уранилацетатом штамма дикого типа L. interrrogans серогруппа australis.
Фиг. 4G - это препарат жгутика после окрашивания уранилацетатом мутантного штамма L. interrrogans серогруппа australis 702fliM-, более сильное увеличение, чем 5D.
Фиг. 4H - это препарат жгутика после окрашивания уранилацетатом мутантного штамма L. interrrogans серогруппа australis 702fliM-/+, более сильное увеличение, чем 5E.
Фиг. 4I - это препарат жгутика после окрашивания уранилацетатом штамма дикого типа L. interrrogans серогруппа australis, более сильное увеличение, чем 5F.
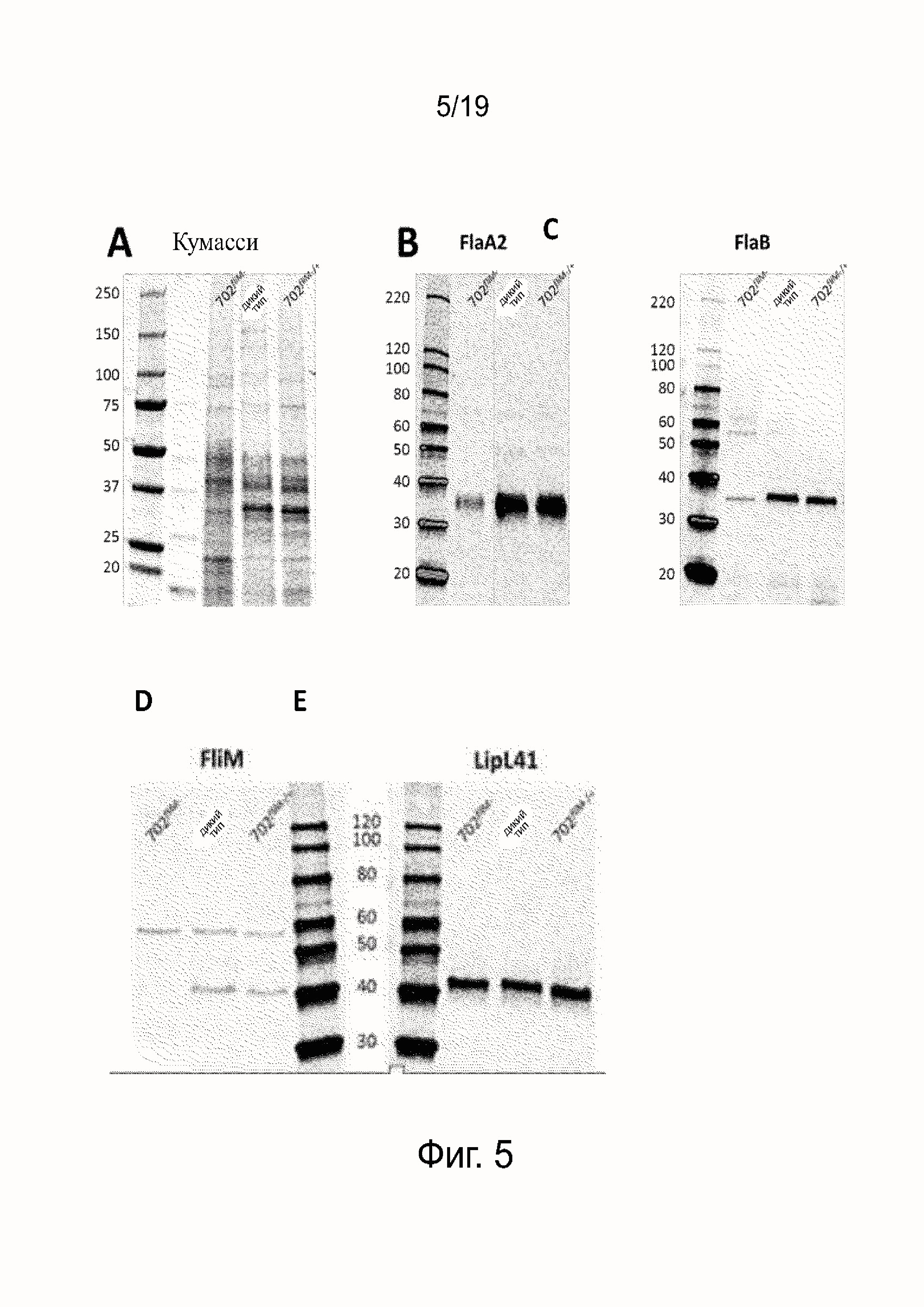
Фиг. 5A - это Кумасси-окрашивание очищенных флагеллярных белков L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ и штамма дикого типа L. interrrogans серогруппа australis.
Фиг. 5B - вестерн-блоттинг (с использованием FlaA2 антитела) очищенных флагеллярных белков L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ и штамма L. interrrogans серогруппа australis дикого типа.
Фиг. 5C - вестерн-блоттинг (с использованием FlaB антитела) очищенных флагеллярных белков L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ и штамма L. interrrogans серогруппа australis дикого типа.
Фиг. 5D - вестерн-блоттинг (с использованием FliM антитела) из цельноклеточного лизата L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ и штамма L. interrrogans серогруппа australis дикого типа.
Фиг. 5E - вестерн-блоттинг (с использованием LipL41 антитела) из цельноклеточного лизата L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ и штамма дикого типа L. interrrogans серогруппа autralis. Этот блот был выполнен для нормализации экспрессии белка.
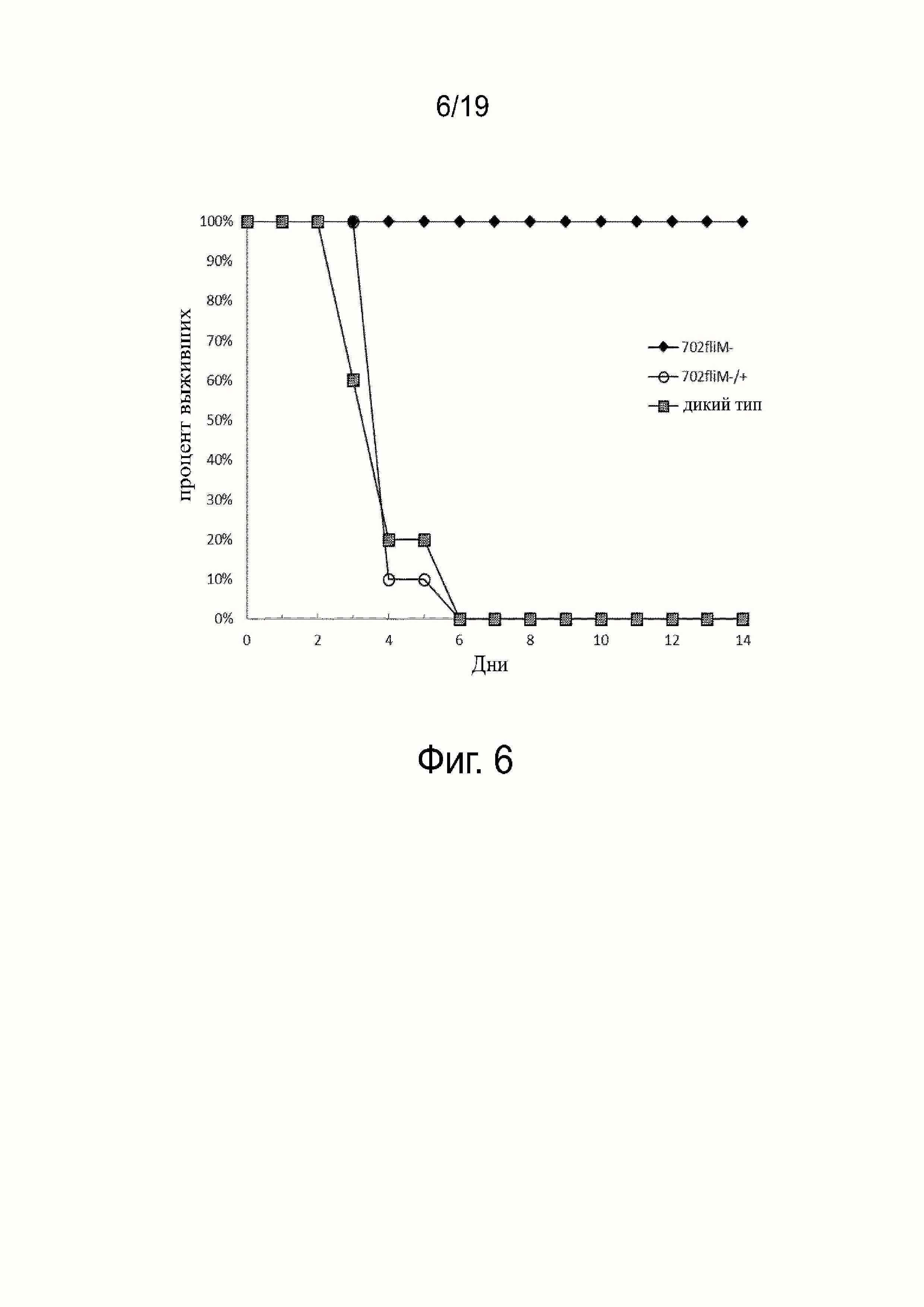
Фиг. 6 - график, демонстрирующий выживаемость хомяков после инъекции 108 одного из штаммов: L. interrrogans серогруппа australis мутантного штамма 702fliM-, L. interrrogans серогруппа australis мутантного штамма 702fliM-/+ или штамма дикого типа L. interrrogans серогруппа australis.
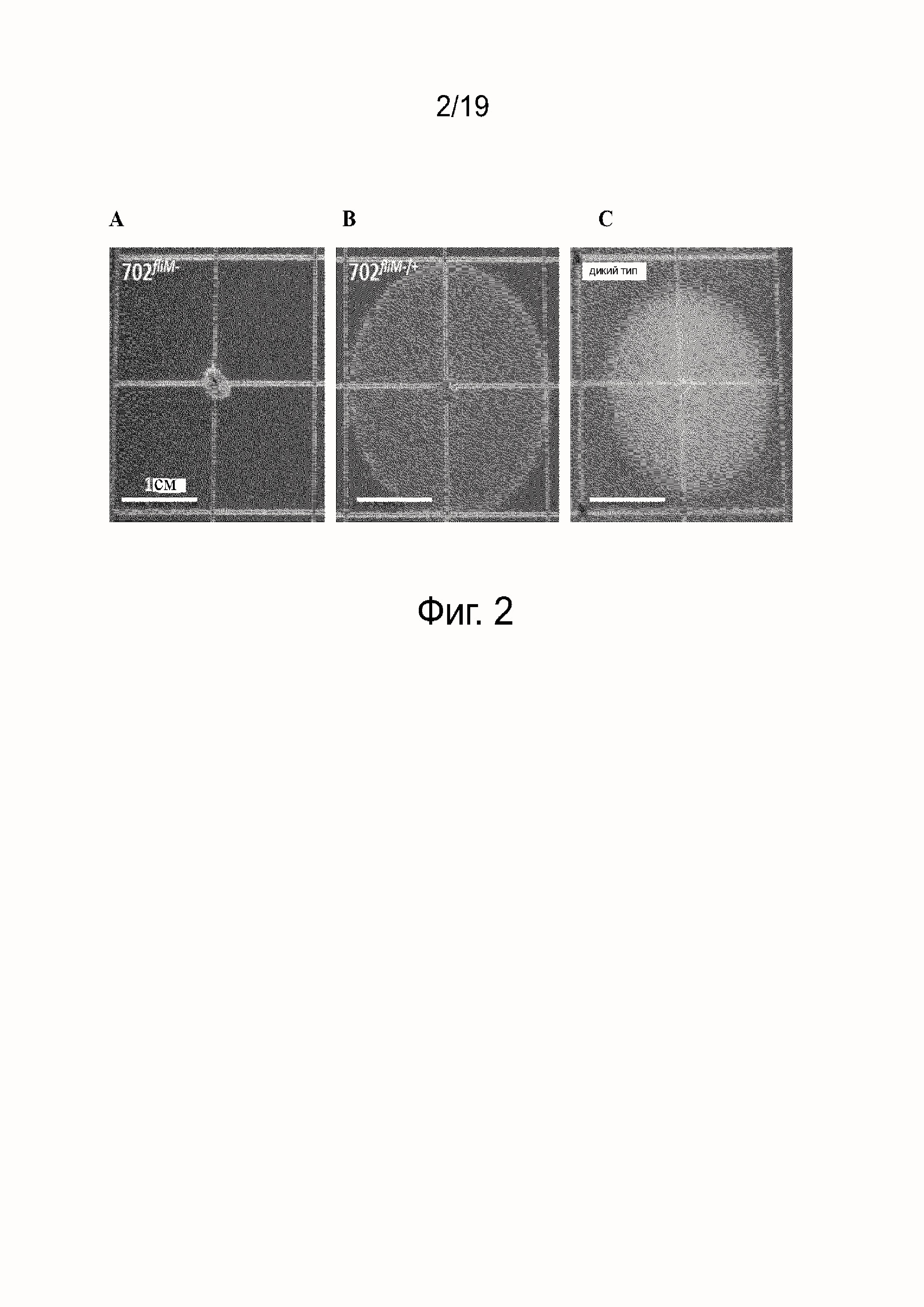
Фиг. 7 - это график, показывающий смертность хомяков, иммунизированных живым 702fliM- или Patoc или в отдельности культуральной средой и зараженных вирулентными штаммами L. interrrogans серогруппа Icterohaemorrhagiae (белые столбики) или Australis (заштрихованные столбики).
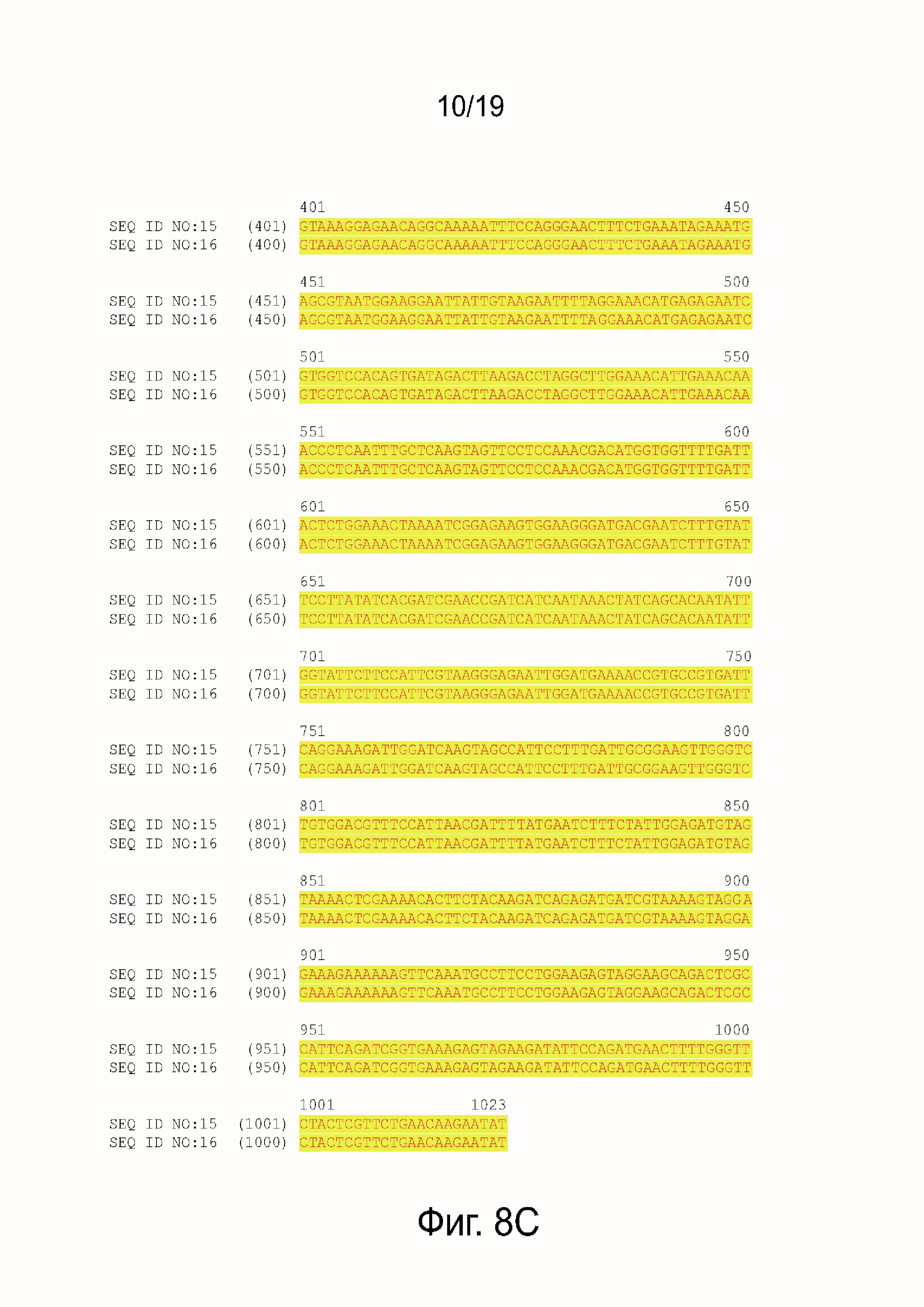
Фиг. 8A-8D показывают последовательности ДНК и белка и выравнивание последовательностей.
Фиг. 9 - это таблица, показывающая SEQ ID NOs, поставленные в соответствие с последовательностями ДНК и белка.
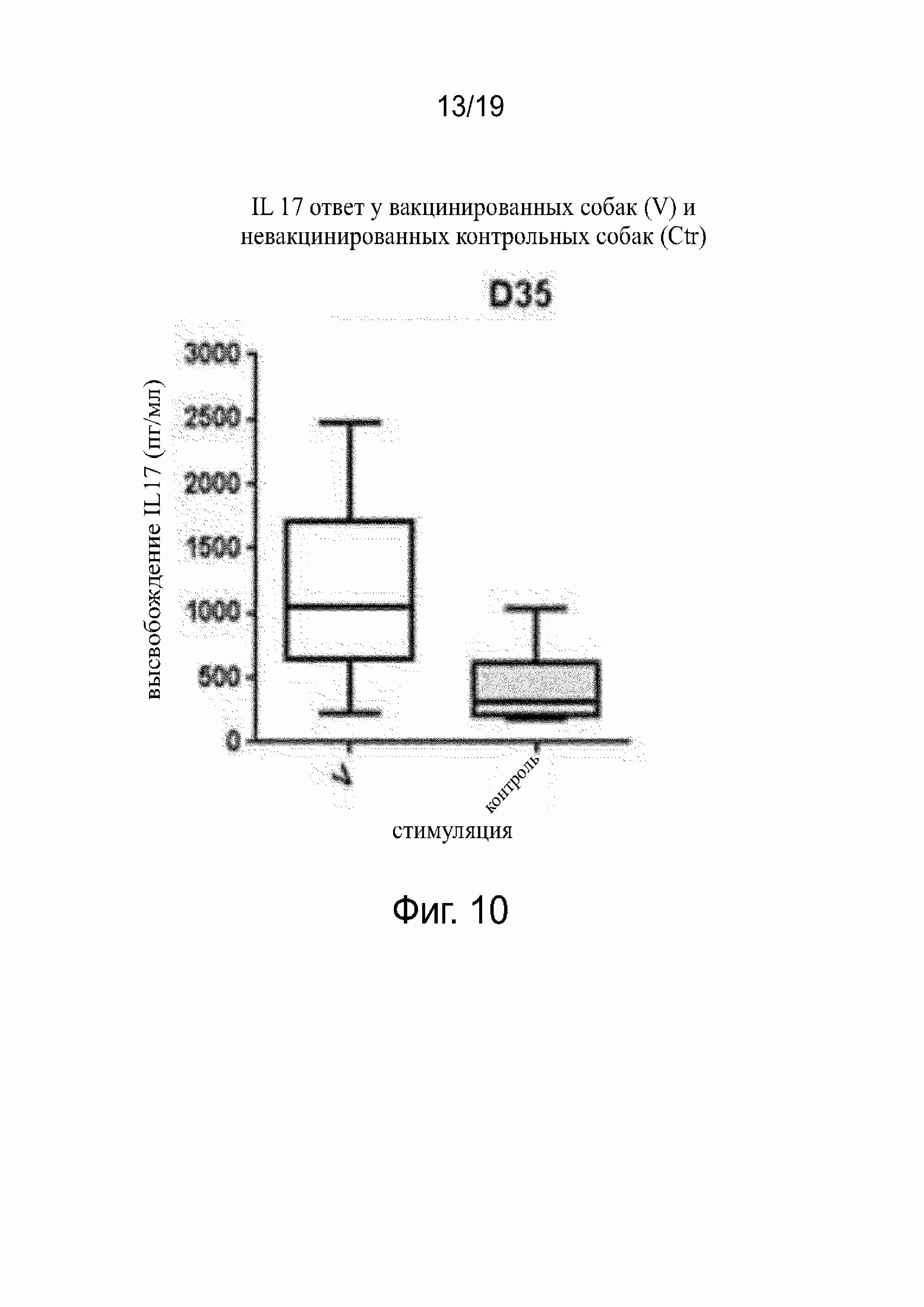
Фиг. 10 показывает Il17 ответ у вакцинированных и невакцинированных собак.
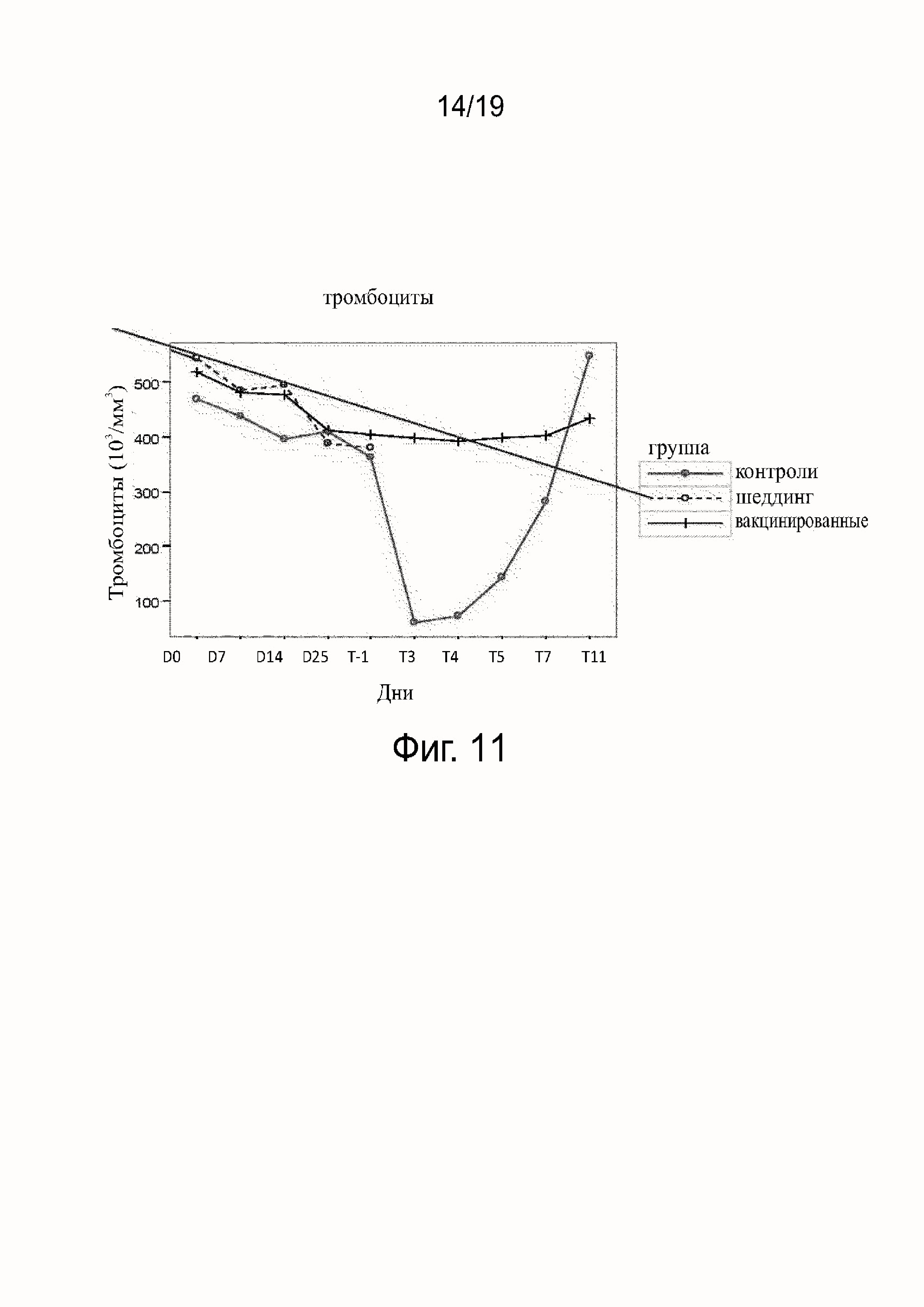
Фиг. 11 показывает содержание тромбоцитов у вакцинированных, невакцинированных и контрольных собак (шеддинг).
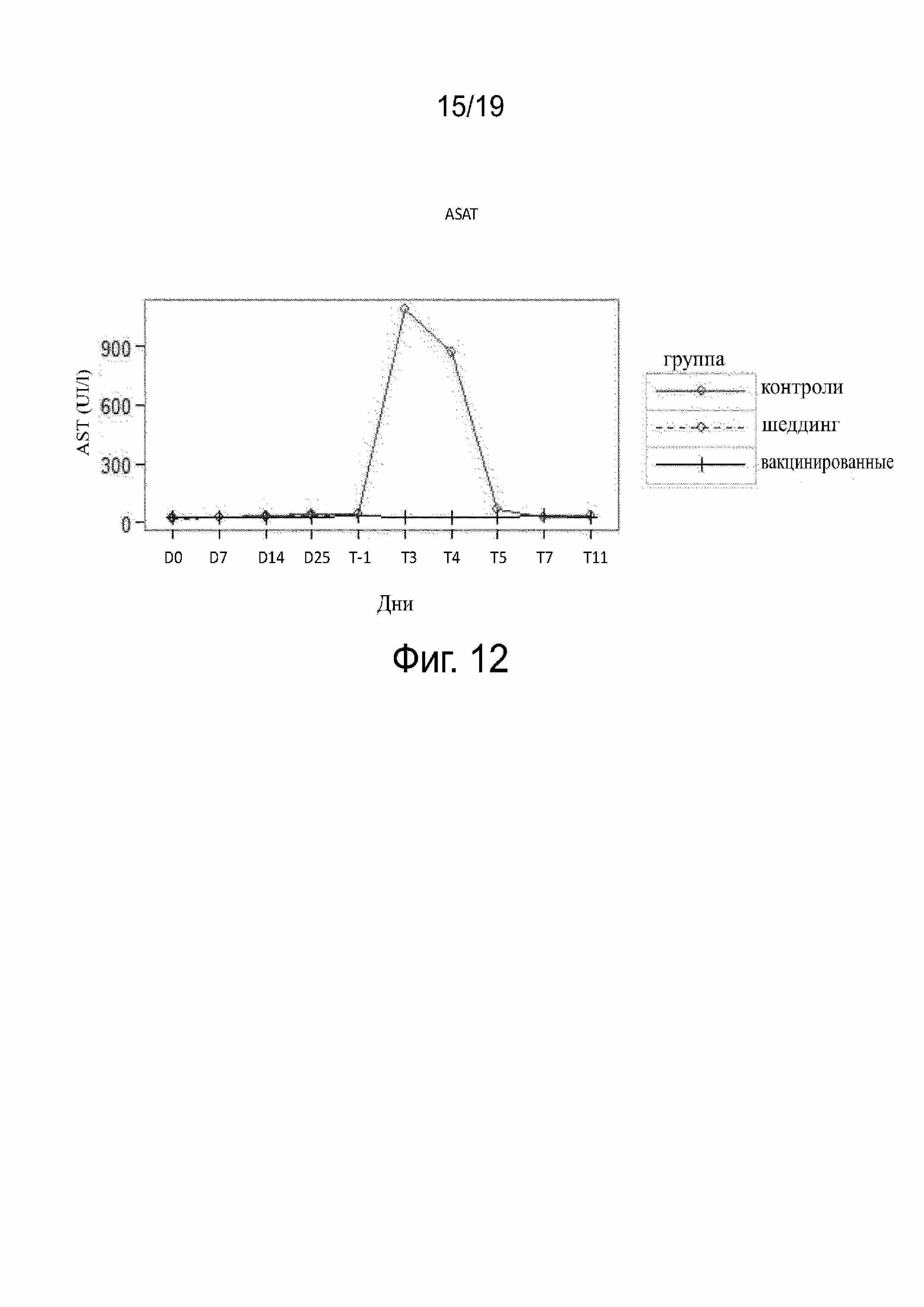
Фиг. 12 показывает ASAT, полученную у вакцинированных, невакцинированных и шеддинг контрольных собак.
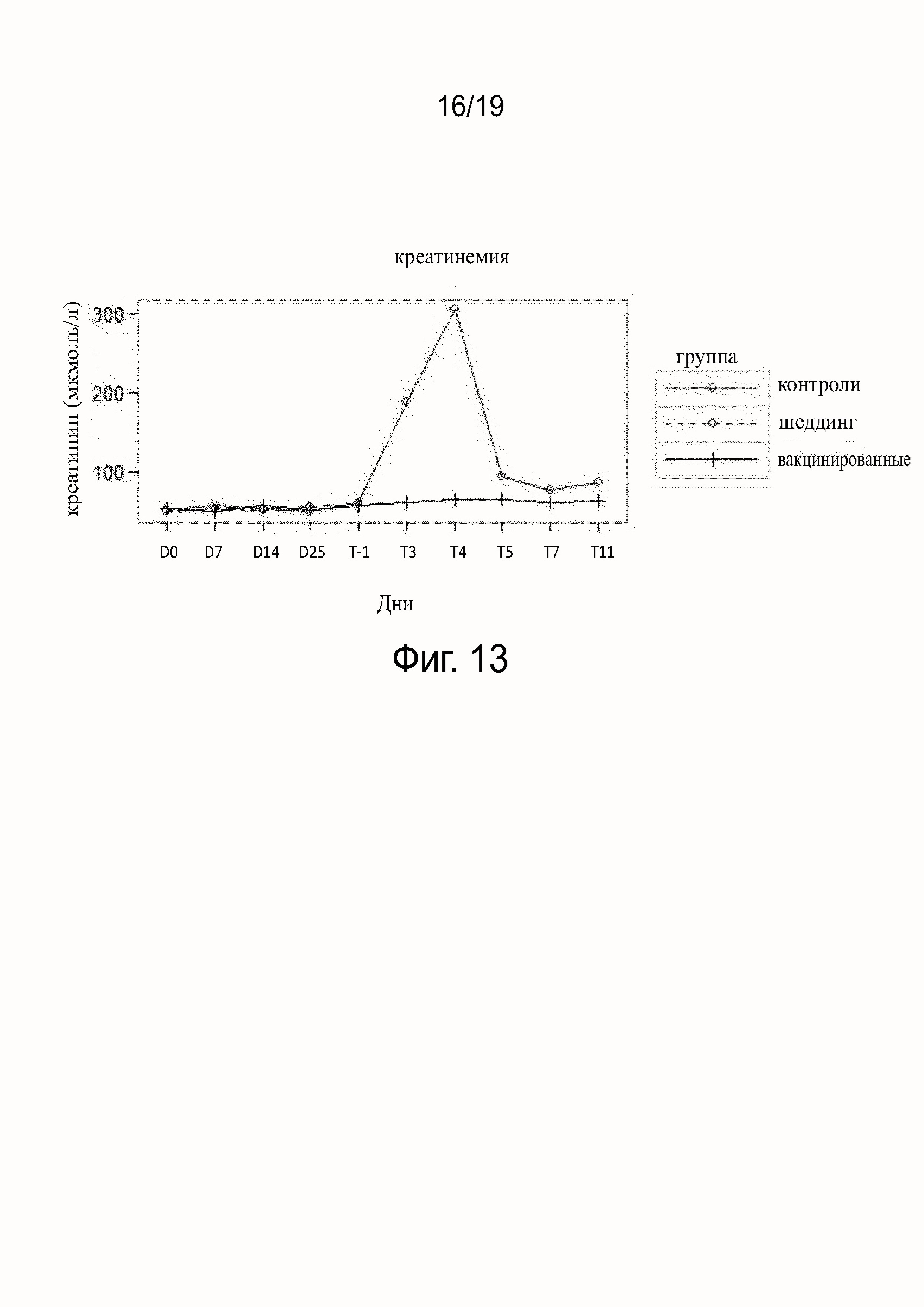
Фиг.13 показывает креатинемию, полученную у вакцинированных, невакцинированных и шеддинг контрольных собак.
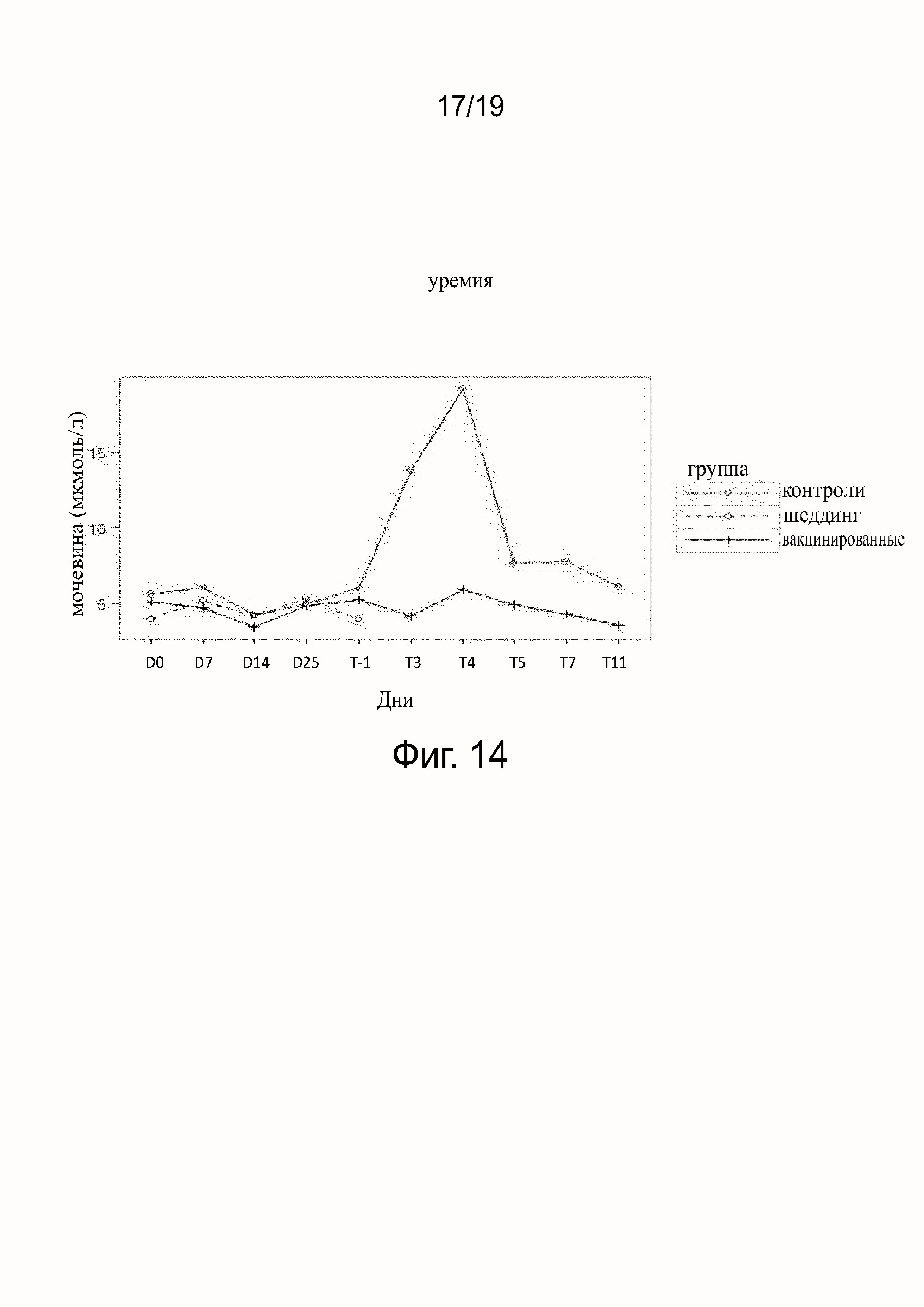
Фиг. 14 показывает уремию, полученную у вакцинированных, невакцинированных и шеддинг контрольных собак.
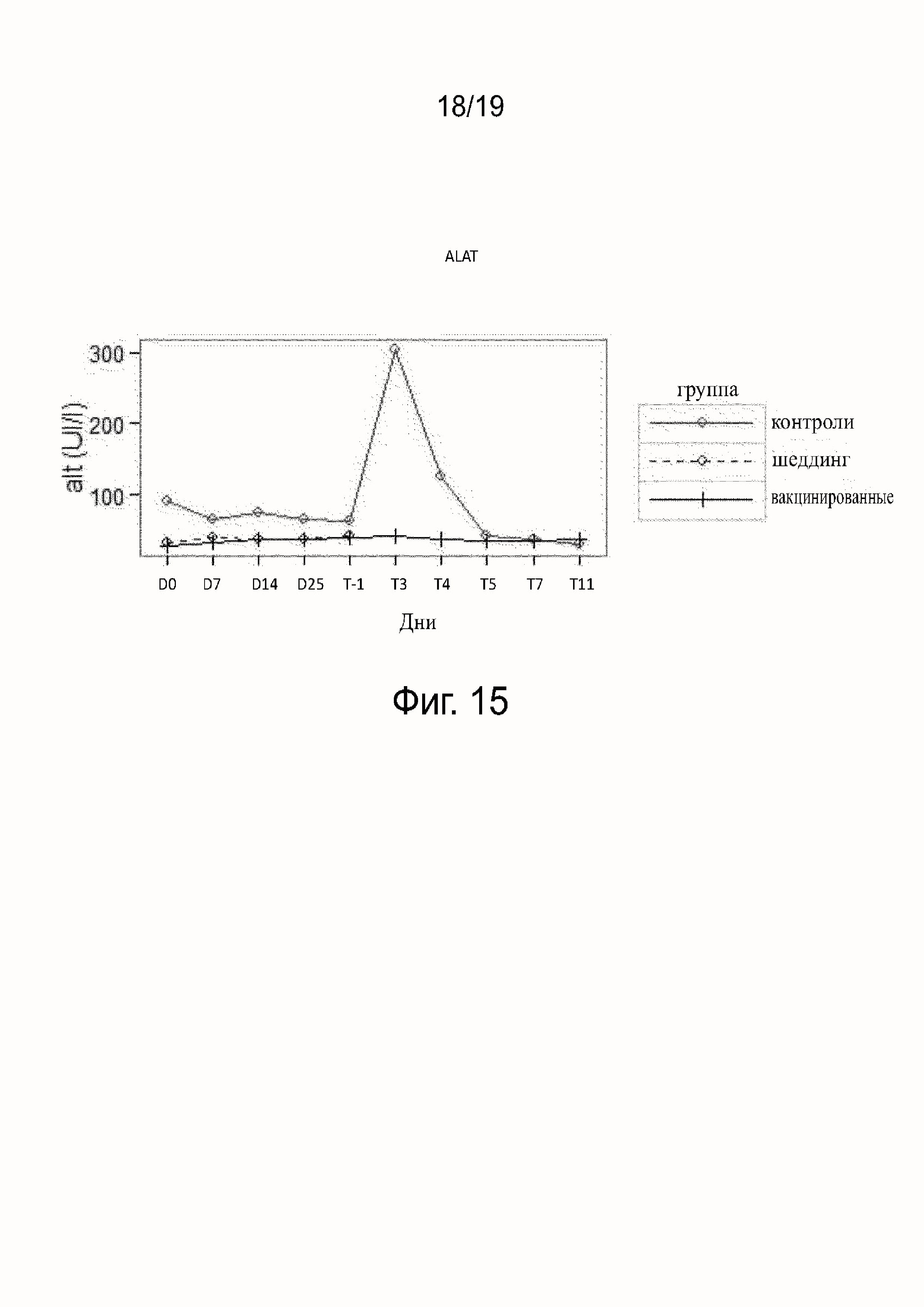
Фиг. 15 показывает ALAT, полученную у вакцинированных, невакцинированных и шеддинг контрольных собак.
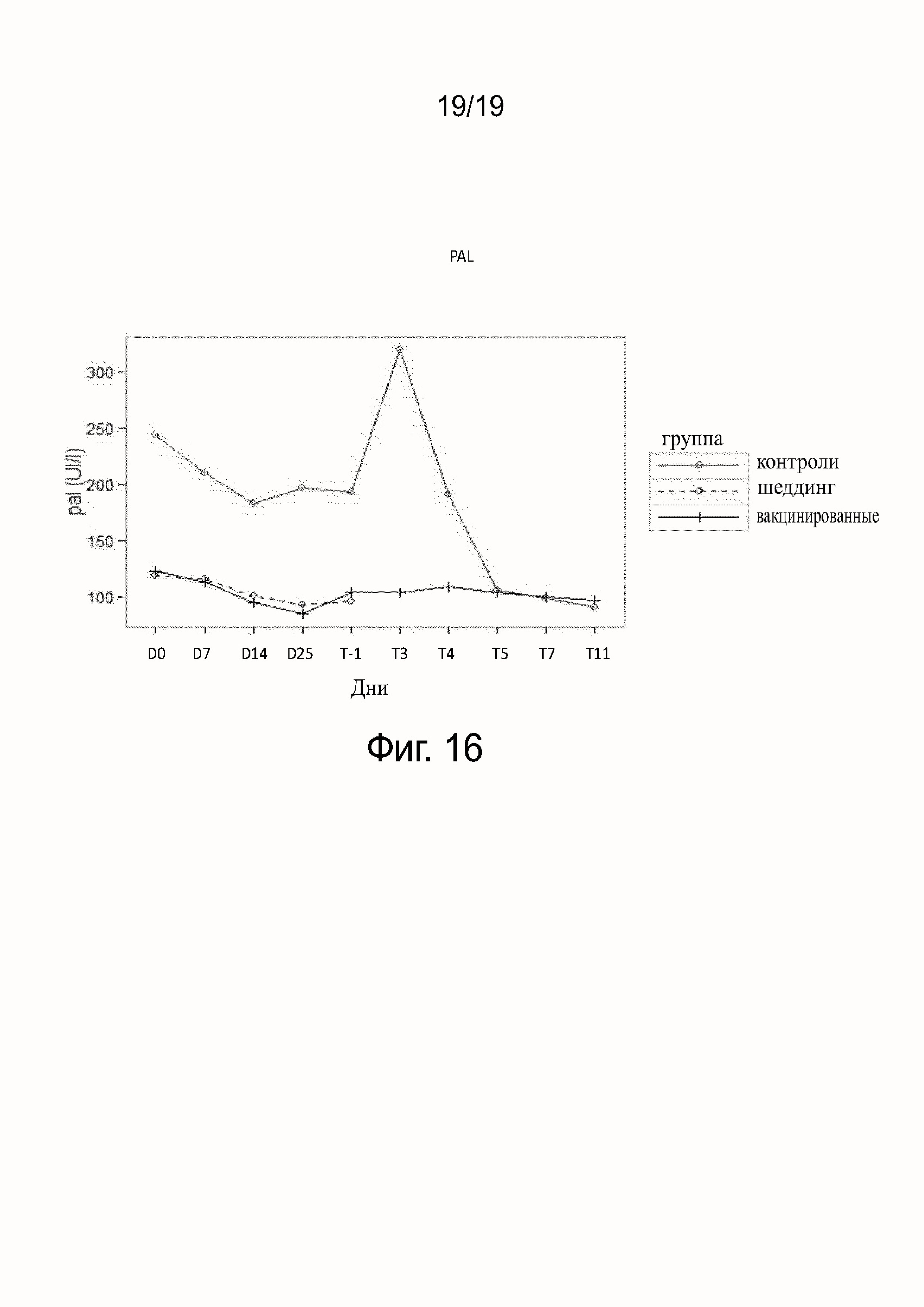
Фиг. 16 показывает PAL, полученный у вакцинированных, невакцинированных и контрольных собак (шеддинг).
Подробное описание изобретения
Следует отметить, что в этом раскрытии и, в частности, в пунктах формулы изобретения, такие термины как “содержит”, “состоящий из”, “содержащий” и тому подобные могут иметь значение, приписываемое им в законе США о патентах; например, они могут означать “включает”, “включающий”, “включая” и тому подобное; и что такие термины как “состоящий в основном из” и “состоит в основном из” имеют значение, приписываемое им в законе США о патентах, например, они допускают возможность неточного перечисления элементов, однако исключают элементы, которые обнаружены на предшествующем уровне техники или которые затрагивают основную или новую характерную черту изобретения.
Термины в единственном числе включают объекты во множественном числе, если контекст явно не диктует иначе. Аналогично, слово “или” включает “и”, если контекст явно не диктует иное. Слово “или” означает какой-либо один член из отдельного списка и также включает любую комбинацию из членов этого списка.
Использованный в описании термин “животное” включает всех млекопитающих, птиц и рыб. Животное, используемое в описании, может быть выбрано из группы, состоящей из семейств лошадиных (например, лошади), псовых (например, собаки, волки, лисы, койоты, шакалы), кошачьих (например, львы, тигры, домашние кошки, дикие кошки, другие большие кошки и другие кошачьи, включая гепардов и рысей), жвачных животных (например, крупный рогатый скот), свиньих (свиньи), овечьих (например, овцы, козы, ламы, бизоны), птиц (например, куры, утки, гуси, индюшки, перепелки, фазаны, попугаи, певчие птицы, соколы, вороны, африканские страусы, эму и казуары), приматов (например, древесные приматы, долгопяты, обезьяны, гиббоны и человекообразные обезьяны), людей и рыб. Термин “животное” также включает отдельное животное на всех стадиях развития, включая зародышевую и эмбриональную стадии.
Термин “нуклеиновая кислота”, “нуклеотид” и “полинуклеотид” используются взаимозаменяемым образом и относятся к РНК, ДНК, cDNA или cRNA и их производным, например, содержащим модифицированные остовы. Следует понимать, что изобретение предоставляет полинуклеотиды, содержащие последовательности, комплементарные последовательностям, описанным в данном документе. “Полинуклеотид”, рассматриваемый в настоящем изобретении, включает прямую цепь (от 5’ к 3’) и обратную комплементарную цепь (от 3’ к 5’). Полинуклеотиды согласно изобретению могут быть получены различными способами (например, путем химического синтеза, клонирования генов и т.д.) и могут принимать различные формы (например, линейную или разветвленную, одно или двухцепочечную или могут быть их гибридом, праймером, зондом и т.д.).
Термины “геномная ДНК” и “геном” используются взаимозаменяемым образом и относятся к наследственной генетической информации организма-хозяина. Геномная ДНК включает ДНК ядра (также называемую хромосомной ДНК), а также ДНК пластид (например, хлоропластов) и других клеточных органелл (например, митохондрий). Геномная ДНК или геном, рассматриваемый в настоящем изобретении, также относится к РНК вирусов. РНК может быть положительной цепью или отрицательной цепью РНК. Термин “геномная ДНК”, рассматриваемый в настоящем изобретении, включает геномную ДНК, содержащую последовательности, комплементарные последовательностям, описанным в данном документе. Термин “геномная ДНК” также относится к матричной РНК (mRNA), комплементарной ДНК (cDNA) и комплементарной РНК (cRNA).
Термин “ген” широко используется в отношении какого-либо сегмента полинуклеотида, связанного с биологической функцией. Таким образом, гены или полинуклеотиды включают интроны и экзоны, как в геномной последовательности, или только кодирующие последовательности, как в кДНК, такие как открытая рамка считывания (ORF), начиная со стартового кодона (кодона метионина) и заканчивая сигналом терминации (стоп-кодон). Гены и полинуклеотиды также могут включать участки, которые регулируют их экспрессию, например, инициацию транскрипции, трансляцию и терминацию транскрипции. Таким образом, также включаются промоторы и участки связывания рибосом (в общем, эти регуляторные элементы располагаются приблизительно между 60 и 250 нуклеотидами выше старт-кодона кодирующей последовательности или гена; Doree S M et al.; Pandher K et al.; Chung J Y et al.), терминаторы транскрипции (в большинстве случаев терминатор располагается в пределах приблизительно 50 нуклеотидов ниже стоп-кодона кодирующей последовательности или гена; Ward C K et al.). Ген или полинуклеотид также относится к фрагменту нуклеиновой кислоты, который экспрессирует мРНК или функциональную РНК, или кодирует специфический белок, и который включает регуляторные последовательности.
Термин “гетерологичная ДНК” при использовании в описании относится к ДНК, происходящей из другого организма, например, другого типа клеток или вида, отличного от реципиента. Термин также относится к ДНК или ее фрагменту в том же самом геноме ДНК хозяина, в котором гетерологичная ДНК вставлена в участок генома, отличающийся от ее первоначального положения.
Использованный в описании термин “антиген” или “иммуноген” означает субстанцию, которая вызывает специфический иммунный ответ в организме-хозяине. Антиген может включать целый организм, убитый, ослабленный или живой; субъединицу или часть организма; рекомбинантный вектор, содержащий вставку с иммуногенными свойствами; часть или фрагмент ДНК, способный индуцировать иммунный ответ после презентирования животному-хозяину; полипептид, эпитоп, гаптен или любую их комбинацию. Альтернативно, иммуноген или антиген может содержать токсин или антитоксин.
"Иммунный ответ" на композицию или вакцину - это развитие у хозяина клеточно-опосредованного и/или антитело-опосредованного (гуморального) иммунного ответа на композицию или вакцину, представляющую интерес. Обычно "иммунный ответ" включает, но не ограничивается этим, один или более из следующих эффектов: выработку антител, B-клеток, хелперных T-клеток и/или цитотоксических T-клеток, направленных специфически на антиген или антигены, включенные в композицию или вакцину, представляющую интерес. Предпочтительно, хозяин будет демонстрировать или терапевтический или защитный иммунный ответ, так что будет увеличиваться устойчивость к новой инфекции и/или будет уменьшаться клиническая тяжесть болезни. Такая защита будет проявляться или снижением, или отсутствием симптомов, обычно наблюдаемых у инфицированного хозяина, более коротким временем восстановления и/или пониженным титром вируса у инфицированного хозяина.
Термины “рекомбинантный” и “генетически модифицированный” используются взаимозаменяемым образом и относятся к любой модификации, изменению или инженерной модификации полинуклеотида или белка в его нативной форме или структуре, или любой модификации, изменению или инженерной модификации полинуклеотида или белка в его нативной форме в его собственной окружающей среде или близлежащей среде. Модификация, изменение или конструирование полинуклеотида или белка может включать, но не ограничивается этим, делецию одного или более нуклеотидов или аминокислот, делецию полного гена, оптимизацию кодонов гена, консервативную замену аминокислот, вставку одного или более гетерологичных полинуклеотидов.
“Выделенный” биологический компонент (такой как нуклеиновая кислота или белок или органелла) имеет отношение к компоненту, который практически отделен или очищен от других биологических компонентов в клетке организма, в котором компонент находится естественным образом, например, другой хромосомной и экстра-хромосомной ДНК и РНК, белков и органелл. Нуклеиновые кислоты и белки, которые “выделены”, включают нуклеиновые кислоты и белки, выделенные с помощью стандартных методов очистки. Термин также включает нуклеиновые кислоты и белки, полученные с помощью рекомбинантной технологии, а также химического синтеза.
В одном варианте осуществления настоящее изобретение предоставляет L. interrogans композицию или вакцину, включающую ослабленный или рекомбинантный штамм L. interrogans (LI), который содержит мутантный ген fliM (LIC11836). Термин “мутантный ген fliM” относится к гену fliM L. Interrogans, который изменен или сконструирован, что дает в результате нефункциональный fliM белок после экспрессии. Изменение или конструирование гена fliM включает мутацию или делецию сегмента гена fliM, который необходим для экспрессии функционального белка fliM. Изменение или конструирование гена fliM также включает мутацию или делецию одного или более нуклеотидов, необходимых для экспрессии функционального белка fliM. Термин “мутантный ген fliM” также включает делецию полного гена fliM L. interrogans, при которой fliM белок не экспрессируется.
Термин “композиция” включает какую-либо вакцину или иммунологическую композицию, которая после того, как введена хозяину, включая собак, кошек, лошадей и людей, вызывает иммунный ответ у хозяина и/или защищает хозяина от лейкоза, и/или может предотвратить внедрение паразита, и/или может предотвратить прогрессирование болезни у инфицированных субъектов, и/или которая может ограничить распространение паразитов во внутренние органы. Это может осуществляться после вакцинации согласно настоящему изобретению в результате индукции секреции цитокинов, а именно секреции IFN-гамма (например, можно использовать метод измерения секреции IFN-гамма с помощью иммуноанализа Quantikine® от R&D Systems Inc. (каталожный номер# CAIF00) (Djoba Siawaya JF et al.)).
В другом варианте осуществления настоящее изобретение предоставляет ослабленный или рекомбинантный L. interrogans, в котором ген fliM в нативном (дикого типа) L. interrogans геноме, кодирующий FliM белок, удален. В еще одном варианте осуществления настоящее изобретение предоставляет ослабленный или рекомбинантный L. Interrogans, в котором ген fliM является мутантным, с целью получения одного или больше преждевременных стоп-кодонов в гене. Термин “ген fliM” включает любой ген или полинуклеотид, который кодирует fliM L. interrogans, и его гомологи, фрагменты или варианты. Ген fliM может кодировать fliM белок, обладающий, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8% или 99.9% идентичностью последовательности с SEQ ID NO: 17, 18, 19 или 20 или ее варианта. Ген fliM, обладающий, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8% или 99.9% идентичностью последовательности с SEQ ID NO:17, 18, 19 или 20 также включается в настоящее изобретение. В другом аспекте настоящее изобретение предоставляет рекомбинантный L. interrogans, в котором ген fliM в нативном (дикого типа) L. interrogans геноме, кодирующий белок fliM изменен или сконструирован инженерным путем, что приводит к мутантному белку fliM.
В одном варианте осуществления изобретение предоставляет L. interrogans штаммы, депонированные в CNCM под номерами CNCM I-5132 и CNCM I-5133, или какого-либо родителя, потомка или потомство депонированных штаммов.
В одном варианте осуществления композиция или вакцина изобретения включает живой ослабленный штамм L. interrogans. Штаммы были депонированы в CNCM (Collection Nationale de Cultures de Micro-organismes) 1 сентября 2016 в соответствии с Будапештским договором и получили номер доступа CNCM I-5132 и CNCM I-5133. В другом варианте осуществления настоящее изобретение включает получение и выделение потомства или потомка штамма L. interrogans, который был депонирован в CNCM под учетными номерами CNCM I-5132 и CNCM I-5133. Изобретение, следовательно, распространяется на штаммы L. interrogans, которые происходят от депонированных штаммов в результате размножения или изменения в идентичной или дивергентной форме. Потомство или потомки CNCM I-5132 и CNCM I-5133 штаммов включают штамм L. interrogans, в котором ген fliM удален. Потомство или потомки могут содержать мутантный ген fliM, кодирующий белок FliM, обладающий, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8% или 99.9% идентичностью последовательности с последовательностью, установленной в SEQ ID NO: 17, 18, 19 или 20. Потомство или потомок может содержать полинуклеотид, обладающий, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%, 99.7%, 99.8% или 99.9% идентичностью последовательности с последовательностью, установленной в SEQ ID NO:13, 14, 15, или 16.
В одном варианте осуществления изобретение обеспечивает введение терапевтически эффективного количества вакцины или композиции для доставки антигена L. interrogans в клетку-мишень. Определение терапевтически эффективного количества является рутинным экспериментом для специалиста в данной области техники. В другом варианте осуществления вакцина или композиция содержит ослабленный штамм L. interrogans и носитель, адьювант, разбавитель или эксципиент, приемлемый фармацевтически или с точки зрения ветеринарии. В одном варианте осуществления носитель, разбавитель, адьювант, или эксципиент, приемлемый фармацевтически или с точки зрения ветеринарии, способствует трансфекции и/или улучшает сохранность вируса, бактерии или белка.
Фармацевтически или с точки зрения ветеринарии приемлемые носители, адьюванты, разбавители или эксципиенты хорошо известны специалисту в данной области техники. Например, фармацевтически или ветеринарно приемлемый носитель или разбавитель или эксципиент может быть 0,9% раствором NaCl (например, физраствором) или фосфатным буфером. Другие носители, адьюванты, разбавители или эксципиенты, приемлемые фармацевтически или с точки зрения ветеринарии, которые могут использоваться в методах данного изобретения, включают, но не ограничиваются этим, поли-(L-глутамат) или поливинилпирролидон. Носитель, адьювант, разбавитель или эксципиент, приемлемый фармацевтически или с точки зрения ветеринарии, может быть любым соединением или комбинацией соединений, способствующей введению вектора (или белка, экспрессируемого из вектора по изобретению in vitro); носитель, разбавитель, адьювант или эксципиент могут облегчать трансфекцию и/или улучшать сохранность вектора (или белка). Дозировки и объемы доз обсуждаются в общем описании, и также могут быть определены специалистом в данной области на основе чтения этого раскрытия в совокупности со знаниями в данной области техники, без ненужного экспериментирования.
Иммуногенные композиции и вакцины согласно изобретению могут содержать или включать в свой состав один или более адьювантов. Подходящими адьювантами для использования на практике настоящего изобретения являются (1) полимеры акриловой или метакриловой кислоты, полимеры малеинового ангидрида и производного алкенила, (2) иммуностимулирующие последовательности (ISS), такие как олигодезоксирибонуклеотидные последовательности, имеющие одну или более неметилированных CpG единиц (Klinman D. M. et al., Proc. Natl. Acad. Sci., USA, 1996, 93, 2879-2883; WO98/16247), (3) эмульсия масло-в-воде, такая как SPT эмульсия, описанная на стр. 147 в "Vaccine Design, The Subunit and Adjuvant Approach", опубликованной M. Powell, M. Newman, Plenum Press 1995, и эмульсия MF59, описанная на стр. 183 той же работы, (4) катионные липиды, содержащие соль четвертичного аммония, (5) цитокины, (6) гидроксид алюминия или фосфат алюминия или (7) сапонин, (8) диметилдиоктадецил бромид аммония (Vaccine Design p. 157), (9) Аридин (Vaccine Design p. 148), другие адьюванты, обсужденные в любом документе, цитированном и включенном путем отсылки в текущую заявку, или (8) любые их комбинации или смеси.
Эмульсия масло-в-воде (3) может быть основана на легком вазелиновом масле (типа из Европейской Фармакопеи), изопреноидном масле, таком как сквалан, сквален, масле, являющемся результатом олигомеризации алкенов, например, изобутена или децена, эфирах кислот или спиртов, имеющих неразветвленную алкильную группу, таких как растительные масла, этилолеат, пропиленгликоль, ди(каприлат/капрат), глицерин, три(каприлат/капрат) и пропиленгликоль диолеат, или сложных эфирах разветвленных жирных спиртов или кислот, в частности, сложных эфирах изостеариновой кислоты.
Масло используют в комбинации с эмульгирующими веществами для образования эмульсии. Эмульгаторы могут быть неионными поверхностно-активными веществами, такими как: сложные эфиры, с одной стороны, сорбитана, маннида (например, ангидроманнитол олеата), глицерина, полиглицерина или пропиленгликоля, и с другой стороны олеиновой, изостеариновой, рициновой или гидроксистеариновой кислот, указанные сложные эфиры являются необязательно этоксилированными, или блок-сополимерами полиоксипропилен-полиоксиэтилена, таким как Pluronic, например, L121. Некоторые из эмульсий, такие как TS6, TS7, TS8 и TS9 эмульсии, описаны в US 7,608,279 и US 7,371,395.
Полимеры акриловой и метакриловой кислоты (1) предпочтительно являются перекрестно-сшитыми, в частности, с полиалкениловыми эфирами сахаров или полиспиртов. Эти соединения известны под названием карбомер (Pharmeuropa vol. 8, No. 2, June 1996). Специалисты в данной области техники также могут обратиться к патенту США № 2,909,462, описывающему такие акриловые полимеры, перекрестно-сшитые с полигидроксилированным соединением, имеющим, по меньшей мере, 3 гидроксильные группы, предпочтительно не более 8, атомов водорода, по меньшей мере, трех гидроксилов являются замещенными ненасыщенными алифатическими радикалами, имеющими, по меньшей мере, 2 атома углерода. Предпочтительными являются радикалы, содержащие от 2 до 4 атомов углерода, например, винилы, аллилы и другие содержащие этиленовые двойные связи группы. Ненасыщенные радикалы могут сами содержать другие заместители, такие как метил. В частности, подходящими являются продукты, продаваемые на рынке под названием CARBOPOL™ (BF Goodrich, Ohio, USA). Они являются перекрестно-сшитыми с аллилсахарозой или с аллилпентаэритритолом. Из их числа можно упомянуть CARBOPOL™ 974P, 934P и 971 P.
Среди сополимеров малеинового ангидрида и производного алкенила предпочтительными являются сополимеры EMA™ (Monsanto), представляющие собой сополимеры малеинового ангидрида и этилена, являющиеся линейными или перекрестно-сшитыми, например перекрестно-сшитыми с дивиниловым эфиром.
Количественные отношения адьюванта, которые используются, хорошо известны и общедоступны для специалистов. Например, концентрация полимеров акриловой или метакриловой кислоты или сополимеров малеинового ангидрида и алкенила в конечной вакцинной композиции будет составлять от 0,01% до 1,5% вес/об, конкретнее от 0,05 до 1% вес/об, предпочтительно от 0,1 до 0,4% вес/об.
В одном варианте осуществления адьювант может включать TS6 (US7,371,395), LR2, LR3 и LR4 (US7,691,368), TSAP (US20110129494), TRIGEN™ (Newport Labs), синтетические дцРНК (например, поли-IC, поли-ICLC [HILTONOL®]) и MONTANIDE™ адьюванты (W/O, W/O/W, O/W, IMS и Gel; все от компании SEPPIC).
В еще одном варианте осуществления адьювант может включать интерлейкин-2 (IL-2), IL-12, интерферон α (IFNα), полиинозиновую и полицитидиновую кислоту и цитидин-фосфат-гуанозин олигодезоксинуклеотиды (CpG ODN), которые, как известно, значительно увеличивают CMI ответ на CIV вакцины (Vet. Imm мМuno. and Imm мМunopath. Vol. 129, Issues 1-2, 15 May 2009, Pages 1-13).
В специальном варианте осуществления фармацевтическая композиция вводится непосредственно in vivo. Преимущественно, фармацевтические и/или терапевтические композиции и/или составы согласно изобретению содержат или состоят в основном из или включают эффективное количество, предназначенное для получения терапевтического ответа, одного или более экспрессирующих векторов и/или полипептидов, как было сказано выше; при этом эффективное количество может быть определено, исходя из этого раскрытия, включая документы, рассматриваемые в этом описании, и знаний в данной области техники, без излишнего проведения экспериментов.
Композиция или вакцина может содержать дозу примерно от 102 до 1020, примерно от 103 до 1018, примерно от 104 до 1016, примерно от 105 до 1012 VLP (вирусоподобных частиц), полученных in vitro или in vivo из вирусного вектора, плазмиды или бакуловируса. Титр вирусного вектора может быть определен с помощью любого метода титрования вирусов, включая, но не ограничиваясь этим, FFA (Focus Forming Assay) или FFU (Focus Forming Unit), TCID50 (50% инфекционная доза в тканевой культуре), PFU (анализ бляшкообразующих единиц) и FAID50 (50% инфекционная доза флуоресцентных антител) и количество VLP, продуцированных in vitro, может быть определено с помощью метода гемагглютинации, ELISA и электронной микроскопии. Также могут применяться другие методы в зависимости от типа VLP.
Композиция или вакцина может содержать примерно от 102.0 до 1010.0 бактерий (например, количество leptpspires)/дозу. Композиция или вакцина может содержать эквивалентное количество бактерий в случае инактивированной/убитой композиции или вакцины. Объем дозировки может составлять в пределах примерно от 0,1 до 10 мл, в пределах примерно от 0,2 до 5 мл. По определению, объем одной дозы означает общий объем вакцины, введенной за один раз одному животному.
Настоящее изобретение предполагает, по меньшей мере, одно введение животному в эффективном количестве терапевтической композиции, изготовленной в соответствии с изобретением. Животное может быть самцом, самкой, беременной самкой и новорожденным. Это введение может осуществляться разными путями, включая, но не ограничиваясь этим, внутримышечную (IM), внутрикожную (ID) или подкожную (SC) инъекцию, или с помощью интраназального или перорального введения. Терапевтическая композиция согласно изобретению также может быть введена с помощью безыгольного инъектора (например, такого как Pigjet, Biojector или Vitajet аппарат (Bioject, Oreg., США)).
Композиция или вакцина вводится собаке или кошке. Вторичное введение может быть сделано при необходимости примерно через 2 - 11 недель после первого введения.
Жидкоструйные безыгольные инъекторы представляют собой устройства, осуществляющие инъекции определенного количества жидкости под высоким давлением через мелкое отверстие. В некотором варианте осуществления безыгольный инъектор представляет собой систему для чрескожной вакцинации DERMA-VAC NF.
Необязательно, введение может повторяться в виде бустерного (повторного) введения с подходящими интервалами, при необходимости или желании, например, примерно от 2 до 11 недель после первого введения. Бустерное введение также может повторяться каждые 6 месяцев или каждый год.
В одном варианте осуществления изобретения может использоваться «прайм-буст» режим, состоящий, по меньшей мере, из одного первичного введения и, по меньшей мере, одного бустерного введения с использованием, по меньшей мере, одного обычного полипептида, антигена, эпитопа или иммуногена. В большинстве случаев одна и та же композиция или вакцина используется как для первичного введения, так и для бустерного введения. Этот протокол введения называется “прайм-буст”. Однако для первичного введения и бустерного введения могут использоваться разные композиции или вакцины.
Другой целью является набор или комплект для вакцинации, содержащий, по меньшей мере, один флакон вакцины, содержащий вакцину настоящего изобретения, и функционально смонтированный для осуществления введения вакцины животному из семейства собачьих. Такой набор или комплект для вакцинации способен вызвать безвредный и защитный иммунный ответ против инфекции гриппа.
Далее изобретение будет описано с помощью следующих неограничивающих примеров.
Примеры
Создание ДНК вставок, плазмид и рекомбинантных вирусных векторов может осуществляться при помощи стандартных методов молекулярной биологии, описанных J. Sambrook et al. (Molecular Cloning: A Laboratory Manual, 4th edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 2014).
Пример 1. Выделение и идентификация мутанта L. Interrogans и исследование вакцинации на хомяках против гомологичного и гетерологичного заражения
Введение
Патогенные Leptospira являются высокоинвазивными спирохетами, вызывающими лептоспироз, наиболее распространенную по всему миру болезнь, передаваемую от животного человеку. Симптомы варьируют от хронической инфекции до полиорганной недостаточности со значительным уровнем смертности. Факторы вирулентности не особенно хорошо известны из-за отсутствия адекватных и эффективных генетических инструментов в отношении этих медленно растущих бактерий. Как известно, среди установленных решающих патогенных факторов подвижность является критической, поскольку она может сказываться на «входе» патогена и распространении в организме хозяина. Однако прямая связь между подвижностью и вирулентностью до сих пор еще не продемонстрирована у Leptospira. В этом исследовании мы выделили мутантный штамм L. interrogans, утративший и подвижность и вирулентность. Секвенирование полного генома позволило идентифицировать одиночную делецию в ген fliMе, разрывающую весь белок. FliM аннотируется как белок-переключатель жгутикового мотора и компонент C-кольца, центрального «узла» жгутикового мотора, регулирующего направление его движения. В этом исследовании мы подтвердили участие fliM в формировании и движении жгутика. Действительно, жгутик или отсутствовал у клетки или присутствовал на одной или обоих концах в укороченной форме, при этом вращательные движения концов клетки отсутствовали. Более короткий и нефункциональный жгутик вызывал потерю поступательного и непоступательного движения, а также морфологические дефекты: крюк и спиралевидные концы отсутствовали и наблюдались длинные цепи бактерий, показывающие дефекты деления. В дополнение к этому, наш штамм оказался неспособным вызвать инфекцию на модели хомячка даже при высокой инфекционной дозе (108 бактерий). Генетическая комплементация в trans с помощью репликативной плазмиды восстанавливала морфологию дикого типа, длину и вращение жгутика, подвижность и инфекционность. Следовательно, мы подтвердили функцию FliM у Leptospira как основную для структуры и вращения жгутика, и то и другое необходимо для поступательного движения. Кроме того, мы подтвердили, что отсутствие подвижности напрямую коррелирует с потерей инфекционности, подтверждая, что подвижность необходима для вирулентности.
Штаммы
Штаммы 702fliM-, 702fliM-/+ 733 и 732 Leptospira interrogans серогруппы Australis, также обозначенные как дикий тип (WT), L. interrogans серогруппы Icterohaemorrhagiae и L. biflexa серовара Patoc выращивали при 29°C в жидкой среде Ellinghausen-McCullough-Johnson-Harris при встряхивании или на EMJH агаровых планшетах (Difco). Штаммы Leptospira были идентифицированы по видам (16S rRNA), серогруппе (MAT с кроличьей антисывороткой) и уровням генотипа (MLVA). В случае необходимости в культуры добавляли спектиномицин до окончательной концентрации 50мкг/мл. Штаммы 702fliM- и 702fliM-/+ 733 были депонированы в CNCM (Collection Nationale de Cultures de Micro-organismes) 1 сентября 2016 под учетным номером CNCM I-5132 и CNCM I-5133, соответственно.
Геномика
ДНК выделяли с помощью набора QiaAmp DNA Blood Midi (Qiagen) для секвенирования полного генома и с помощью набора QiaAmp DNA Mini kit (Qiagen) для ПЦР амплификаций в соответствии с протоколами производителя. Геномные последовательности штаммов WT и 702fliM были установлены. Результаты секвенирования «монтировали» с помощью CLC Genomics Workbench 7 (CLCbio) и снабжали аннотацией Glier logarithm от компании GenostarSuite 4 (Genostar, Montbonnot Saint Martin, Франция). Полиморфизмы между этими двумя штаммами были установлены и проанализированы с помощью Genostar Suite 4 и подтверждены картированием результатов на установленных участках с помощью CLC Genomics Workbench 7.
ПЦР
ПЦР проводили, используя от 1 нг до 10 нг матрицы ДНК с 1U Phusion высококачественной ДНК-полимеразы (Thermo), 1X Phusion буфера, 200 мкМ каждого dNTP (Life), 0.5 мкМ каждого праймера в 5 0мкл воды, на амплификаторе Biometra TGradient. Использованные для этого анализа праймеры перечислены в таблице 1.
Таблица 1. Последовательности праймеров
|
Номера идентифицированных последовательностей следующие: SEQ ID NO:1 = PflgA, SEQ ID NO. 2 = FliMR2, SEQ ID NO:3 = CF109, SEQ ID NO:4 = CF099, SEQ ID NO:5 = CF108, SEQ ID NO:6 = CF103, SEQ ID NO:7 = flaB4F, SEQ ID NO:8 = flaB4R, SEQ ID NO:9 = rpoBF, SEQ ID NO:10 = rpoBR.
Генетическая комплементация
Кодирующая последовательность fliM (LIC11836) была амплифицирована из геномной ДНК штамма L. interrogans серовара Manilae L495 (100% идентичность последовательности с FliM штаммов Australis на аминокислотном уровне) с использованием праймеров FlimF (5′- CGACACATATGACAGAAATTTTAT -3′; SEQ ID NO:11) и FlimR2 (5′- TAACTTCAATTCTAATATTCTTGTTCAGAACG -3′; SEQ ID NO:12), которые вставлены в сайт рестрикции расщепления NdeI (подчеркнутые основания), и клонированы в вектор PCRII-TOPO (Invitrogen) в соответствии с инструкциями производителя. Кодирующая последовательность fliM затем была расщеплена NdeI и XhoHI, очищена и вставлена в аналогичные сайты рестрикции pCRPromFlgB для того, чтобы получить транскрипционное слияние между геном и промотором Borrelia burgdorferi flgB. Фрагмент ДНК, содержащий транскрипционное слияние, высвобождался путем EcoRI расщепления и был клонирован в соответствующий сайт репликативной плазмиды pMaORI (Pappas CJ et al., 2015, Appl. Environ. Microbiol., Feb. 2015), чтобы получить pCF036. Конструкция комплементации fliM была введена в штамм 702 путем слияния с E.coli β2163, несущей pCF036, как описано ранее (Pappas CJ et al., 2015, выше; Lambert A et al., 2014, FEMS Microbiol. Lett., p. fnu054). Планшеты инкубировали 5 недель, чтобы получить комплементированный штамм 702fliM-/+.
Анализ на планшетах с мягким агаром
Подвижность штамма Leptospira оценивали на EMJH планшетах с агаром 0.5% и 0.3% путем инокуляции 5мкл культур на фазе логарифмического роста (OD450nm приблизительно 0.3). Планшеты инкубировали при 29°C и проводили ежедневное наблюдение. Коротко, мягкие EMJH планшеты с 0.5% агаром, инокулированные 702fliM-, 702fliM-/+ и WT, наблюдали через 10 дней инкубации. 702fliM- не распространялись из точки их инокуляции (фиг. 2A), в противоположность 702fliM-/+ (фиг. 2B) и WT (фиг. 2C), которые образовывали круг 2,6 см и 2,2 см, соответственно. Показан один характерный планшет из трех экспериментов. Идентичные результаты наблюдались на трех 0.3% агаровых планшетах.
Микроскопия в темном поле
Leptospires исследовали с помощью микроскопии в темном поле, используя увеличение от x20 до x200 на микроскопе Olympus BX-53 139, снабженном камерой Hamamatsu Orca Flash2.8. Смотри фиг. 1A - 1X. Снимки были сделаны с помощью программного обеспечения CellSense (Olympus), а видео были сняты с помощью программного обеспечения MicroManager 1.4 (µМanager). Затем изображения были обработаны с использованием программного обеспечения ImageJ (ImageJ), при этом три изображения каждого штамма, содержащие приблизительно 80 бактерий использовали, чтобы вручную измерить длину бактерий с помощью ImageJ.
Трансмиссионная электронная микроскопия (TEM)
Коммерческая медная сетка 400 ячеек на кв. дюйм, покрытая углеродом, подвергнута тлеющему разряду непосредственно до использования. Образцы помещали в соприкосновении с сеткой в течение 10 мин. Затем «сетки» (подложки) с образцами фиксировали 2% глутаральдегидом в 0.1M какодилатном натриевом буфере в течение 10 минут и промывали 3 раза в течение 1 минуты в воде с целью соблюдения требований биобезопасности. Сетки высушивали и негативно окрашивали 4% уранил ацетатом в течение нескольких секунд. Образцы исследовали с помощью трансмиссионного электронного микроскопа (TEM) TECNAI T12 FEI, работающего при 120kV. Для измерения вручную длины жгутиков случайным образом выбирали 5 полей и анализировали с помощью программного обеспечения ImageJ.
Очистка рекомбинантного FliM и получение антисыворотки
Плазмиду, содержащую гибрид flgB-fliM, обработали NdeI и BamHI и клонировали в соответствующие сайты в pET28 векторе (EMD Biosciences). Полученная в результате плазмида pET28-(His)6FliM была введена в клетки E. coli BL21DE3. Экспрессию рекомбинантного белка индуцировали в 2L трансформированных клеток при OD600nm=0.7 добавлением 1 мМ изопропил β-D-1-тиогалактопиранозида (IPTG) на 4 часа при 37°C. FliM был нерастворим в используемых условиях роста и был выделен из телец включения следующим образом. Клетки собирали, и осадки ресуспендировали в буфере A (50 мМ NaH2PO4 pH 8.0, 300 мМ NaCl, 10 мМ имидазол, 10% глицерин) и лизировали ультразвуком в присутствии коктейля ингибиторов протеаз (полный мини, не содержащий EDTA, Roche) и 1 мМ фенил метилсульфонил фторида (PMSF). Нерастворимую фракцию, полученную после центрифугирования 60 мин при 40,000 x g при 4°C, ресуспендировали в буфере A, содержащем 1% Тритон X100, чтобы солюбилизировать мембранные белки. Тельца включения, полученные после 30 мин центрифугирования при 40,000 x g, солюбилизировали в буфере B (100 мМ NaH2PO4 pH 8.0, 8M мочевина, 10 мМ Tris pH 8.0, 200 мМ NaCl, 1 мМ PMSF, 0.1% Тритон X100), инкубировали в течение 1 часа при комнатной температуре при перемешивании и центрифугировали 30 мин при 4°C при 40,000 x g. Супернатан загрузили на никель-нитрилотриацетатную (Ni-NTA) смолу (Qiagen), уравновешенную буфером B. Поскольку рекомбинантный (His)6-FliM не мог быть элюирован из колонки с помощью общепринятых методов, использовали проточный метод, чтобы дополнительно очистить белок фильтрованием на отсекающей целлюлозной мембране 100 кДа (Amicon Ultra 100K, Merck Millipores). Проточную фракцию после фильтрования диализировали против C (50 мМ Tris pH 8.0, 150 мМ NaCl, 2 мМ 2M мочевина, 2 мМ DTT, 5 мМ EDTA) и концентрировали до 2.5 мг/мл.
Для получения поликлональной сыворотки двух кроликов иммунизировали 4 раза 2 мг очищенного белка FliM, сыворотку собирали на 38 день (Aldevron).
Получение препарата периплазматического жгутика
Протокол экстракции жгутиков был адаптирован из Lambert (2012, позже). Три отдельные культуры в середине фазы логарифмического роста при OD450nm приблизительно 0.3 (5x108 клеток/мл) (по 200 мл для каждого штамма) центрифугировали при 8000 x g 20мин при 4°C. Осадки промыли 22 мл PBS, а затем 24 мл раствора сахарозы (0.5 M сахароза, 0.15 M Tris pH 8). Клетки ресуспендировали в 12 мл раствора сахарозы и перемешивали на льду в течение 10 минут. Добавление 1.2 мл 10% Тритон X-1000 сопровождалось инкубацией 30 мин при комнатной температуре. Добавили по каплям 120 мкл 10 мг/мл лизоцима и инкубировали 5 минут на льду. Затем по каплям добавили 1.2 мл 20 мМ EDTA pH8. После 2 часов инкубации при комнатной температуре добавили 240 мкл 0.1 M MgSO4 и перемешивали 5 минут при комнатной температуре, затем добавили 240 мкл 0.1 M EDTA и вновь перемешивали при комнатной температуре 5 минут. Затем смеси центрифугировали при 17000 x g 15 мин при 4°C. Супернатанты смешивали с 1,6мл 20% полиэтиленгликоля 8000, заранее растворенного в 1 M NaCl, и инкубировали 30 мин на льду. Суспензии вновь центрифугировали при 24400 x g в течение 45 мин при 4°C. Осадки ресуспендировали в 2,5 мл воды и 100 мкл 1% азида натрия в PBS и поместили в 4°C на ночь. Затем смеси ультрацентрифугировали 45мин при 80000 x g при 4°C в ультрацентрифуге Beckman Optima MAX, используя ротор TLA 100.3. Препараты жгутиков ресуспендировали в соответствующем объеме воды в зависимости от OD культуры (приблизительно 800 мкл) и 100 мкл 1% азида натрия.
Белковые гели
Культуры Leptospira центрифугировали в течение 10 мин при 7000 x g, один раз промыли в PBS и затем нормализовали в PBS при 1 или 5 OD450nm единиц на миллилитр для получения цельноклеточных лизатов. Эти клеточные лизаты и препараты жгутиков смешивали с 3x лизирующим буфером, состоящим из 0,2 M Tris pH 8, 16% 2-меркаптоэтанола, 6% SDS, 30% глицерина и 0.06% бромфенолового синего, и кипятили при 100°C в течение 10 мин до нанесения на 4-20% геля TGX (SDS-PAGE, Biorad). 5 мкл маркеров длины, Precision Plus All Blue Standards (Biorad) и Magic Mark XP (Life) и разных объемов образцов разделяли при 150V - 200V в течение 30 мин - 1 часа. Окрашенные Кумасси гели три раза промывали дистиллированной водой в течение 5 мин, окрашивали в течение 1 часа Simply Blue (Invitrogen) и обесцвечивали на водяной бане в течение 1 часа. Вестерн-блоттинг проводили путем переноса белков из гелей на нитроцеллюлозные мембраны в течение 7минут при 25V и 1.3mA на гель с использованием системы переноса Transblot-Turbo (Biorad). Неспецифические сайты на мембранах блокировали после инкубации 1 час в буфере Odyssey (Li-Cor). Кроличьи первичные антитела анти-FlaB (LIC11531, 1:1000), FlaA2 (1:1000), FliM (1:100), LipL41 (1:100) разбавили в буфере Odyssey и инкубировали в течение 1 часа. Затем мембраны промыли 3 раза PBS + 0.1% Твин, и инкубировали со вторичными анти-кроличьими IgG (H&L) козьими антителами, конъюгированными с IRdye800® (Rockland), разбавленными 1:10000, в течение 45 минут в темноте. Было проведено три дополнительных промывки PBS + 0.1% Твин перед обнаружением с использованием визуализирующей системы Odyssey® при 800нм. Относительное определение приблизительного количества проводили путем измерения интенсивностей полос с помощью компьютерного программного обеспечения Odyssey® (Li-Cor).
Иммунофлуоресценция (IFA)
Протокол был адаптирован из Pinne и Haake (Pinne M et al., 2011, J. Viсек. Exp., no. 53). 5x108 leptospira промывали в PBS + 5 мМ MgCl2 и затем наносили на лунки 4-луночного слайда Lab-Tek® II CC² Slide (Nunc). Давали клеткам прикрепиться, инкубируя leptospires в течение 1 часа при 29°C. Жидкость удаляли осторожным отсасыванием, и клетки фиксировали и пермеабилизировали 1мл охлажденного до температуры льда 100% метанола в течение 20 мин при -20°C. Неспецифические сайты блокировали 1 мл PBS-BSA 2% в течение 1 часа. Затем инкубировали Leptospires с 200 мкл первичного FlaB антитела, разбавленного 1:100 в PBS-BSA 2%, в течение 1часа, затем 3 раза промывали 1 мл PBS. Добавили вторичные антитела CyTM3-конъюгированные AffiniPure козьи анти-кроличьи IgG (H+L, Jackson I мМunoResearch), разбавленные 1:100 в PBS-BSA 2%, и инкубировали в течение 1 часа. Клетки дважды промывали 1 мл PBS и один раз 1 мл воды. Камеры удалили, а слайды высушивали на воздухе в течение нескольких минут. Добавили каплю ProLong® Gold Antifade реагента, содержащего 4′,6′-диамидино-2-фенилиндол (DAPI) для контрастного окрашивания ДНК (Life Technologies), покрыли покровным стеклом и инкубировали в течение ночи в темноте. Слайды смотрели под флуоресцентным микроскопом Nikon Eclipse Ti-S (Nikon), снабженном камерой Digital Sigth DS-5Mc (Nikon), получали изображения с помощью Nikon NIS Elements F Package 4.0 (Nikon) и обработали их с помощью программного обеспечения ImageJ.
Анализ вирулентности
Самок золотистых сирийских хомяков в возрасте 6-7 недель инфицировали 108 Leptospira, введенных внутрибрюшинно. Продолжительность исследования была сначала установлена как 21 день, однако протокол был остановлен на 14 день в связи с быстрой смертью хомяков (смотри раздел Результаты). 2 группы по 5 хомяков инфицировали 702fliM- и WT и 1 группу из 10 хомяков инфицировали 702fliM-/+ (смотри фиг. 6).
Исследование иммунной защиты
Группы из двенадцати самок золотистых сирийских хомяков 4-недельного возраста вакцинировали внутрибрюшинным путем (IP) однократной дозой 106 живых L. interrogans серогруппа Australis 702fliM- или 108 живых сапрофитных L. biflexa серовар Patoc. В качестве контроля группу из 10 хомяков вакцинировали 1 мл EMJH. Через четырнадцать дней после иммунизации животных заражали путем IP вирулентным L. interroganсек. Половина группы получила 20 leptospires серогруппа Australis штамм 732, тогда как другую половину инокулировали 1000 leptospires Icterohaemorrhagiae. Эти сублетальные дозы были ранее определены как минимальное количество бактерий, необходимых для того, чтобы убить, по меньшей мере, 80% хомяков. За животными наблюдали в течение 21 дня после инфицирования. Умирающих хомяков подвергали эвтаназии с помощью внутрисердечной инъекции Dolethal. Смотри фиг. 7.
Учетные номера
Геномные последовательности L. interrogans штаммов 702 и 733 доступны в GenBank под учетными номерами NZ_LMXF00000000.1 и NZ_LMXK00000000.1, соответственно.
Результаты
Изолирование спонтанного неподвижного мутанта
Штамм L. interrogans серогруппы Australis 702 был выделен из крови собаки с острым лептоспирозом. Собака умерла от инфекции через несколько дней после взятия образца. Позитивная культура была несомненно клоновой с нетранслируемыми leptopires, что показано с помощью микроскопии в темном поле. Аналогично, после посева изолята на твердую среду EMJH все колонии были маленькими. Принимая во внимание, что этот неподвижный фенотип произошел от подвижного родительского штамма, ближайший филогенетический штамм был выбран из коллекции для дальнейшего фенотипического анализа.
Подвижный штамм 733, который также был выделен из больной собаки, посещавшей ту же самую клинику на 3 месяца позже, продемонстрировал те же самые молекулярные (16S rRNA и MLVA профили) и серологические (серогруппа Australis) характеристики, как неподвижный штамм 702. Более того, 702 и 733 показали сходные кинетические кривые роста клеток (не показано). Вместе взятые, эти данные показывают, что два штамма были очень близкими, таким образом, штамм 733 может рассматриваться как WT штамм, чтобы в следующих экспериментах сравнивать его с 702. Поэтому штамм 733 был назван WT.
Штамм 702 демонстрировал атипичную прямую морфологию при исследовании с помощью микроскопии в темном поле с отсутствием характерного крюка и спиралевидных концов, а также поступательной и непоступательной подвижности (фиг. 1A и 1D - 1J). Приблизительно 2% общей популяции продемонстрировало небольшой крюк на одном конце, обеспечивающий нерегулярные и медленные вращательные движения, но неспособный продвигать клетки вперед. Мы подтвердили это отсутствие подвижности 702 на планшетах с мягким агаром, потому что штамм не распространялся из места его инокуляции в противоположность WT (фиг. 2А). В дополнение к этому, данный штамм показал филаментную морфологию. Мы измерили длину клеток и сравнили с WT, используя различные изображения при x20 увеличении. Средняя длина WT составляла 9.4 мкм, как уже описано для типичных патогенных Leptospira и 16.5 мкМ для 702 (подсчитано 275 бактерий). Более того, распределение размеров клеток различалось между двумя штаммами: в WT 99% бактерий были короче, чем 15 мкм, и 1% имел длину между 15мкм и 30мкм, тогда как в неподвижном штамме 51% бактерий были короче, чем 15 мкм, 43% между 15 мкм и 30 мкм и 6% длиннее, чем 30 мкм, включая 2 бактерии по 70 мкм, что возможно показывает дефекты деления.
Одна спонтанная мутация аннулировала экспрессию FliM белка в неподвижном штамме
Были секвенированы полные геномы штаммов 702 и WT, чтобы установить мутацию(и), которые могли привести в результате к фенотипу с дефицитом движения в штамме 702. 50,272,184 прочтений и 10,974,264 прочтений было проанализировано для штаммов 702 и WT, соответственно, показывая глубину охвата 1000x и 200x, соответственно. Все прочтения были собраны в протяженные последовательности и аннотированы. Сравнительный анализ геномных последовательностей привел к идентификации двух полиморфизмов, одного DIP и одной нонсенс SNP. Эти две мутации вызывали появление преждевременного стоп-кодона на fliM (LIC11836) и LIC10453 генах. Однако, LIC10453, который кодирует гипотетический белок, также был сокращен на 50 аминокислот (при общем размере 364aa) в нисходящем направлении у двух других подвижных L. interrogans штаммов, доступных от MERIAL, что подтверждает, что этот ген не является необходимым для подвижности. В противоположность этому, было обнаружено, что fliM, аннотированный как белок-переключатель жгутикового мотора, является высоко-консервативным среди рода Leptospira, с идентичностью более чем 99% среди патогенных L. interrogans и L. borgpetersenii и 88% идентичностью с сапрофитным L. biflexa. Смотри фиг. 3B, fliM исходная последовательность (GTT TCT GAA CAA AAA GTA AAG ATC TAC GAT TTT; SEQ ID NO:13). Этот преждевременный стоп-кодон в fliM, который является результатом 1-нуклеотидной делеции 105bp ниже старт-кодона, затем с большой долей вероятности повлек за собой фенотип с дефицитом подвижности. Смотри фиг. 3B, fliM мутантная последовательность (GTT TCT GAA CAA AAA AAG TAA AGA TCT ACG ATT TTA; SEQ ID NO:14). Эта делеция была подтверждена ПЦР секвенированием после амплификации с праймерами CF109 (SEQ ID NO:3)-CF099 (SEQ ID NO:4). Полярного эффекта вследствие этой мутации не ожидалось, потому что не было в наличии генов ниже fliM (фиг. 3А). Чтобы дополнительно исследовать экспрессию FliM, мы получили поликлональные антитела к рекомбинантному FliM. Как ожидалось, экспрессия FliM не была обнаружена в цельноклеточных лизатах штамма 702 (фиг. 5D). Следовательно, мутация fliM вызывала отсутствие FliM экспрессии и вероятно была ответственна за потерю подвижности. Поэтому в дальнейшем мы назвали этот штамм 702fliM-.
Комплементация с использованием fliM восстанавливает типичную форму клетки, подвижность и вирулентность
Чтобы подтвердить, что мутация в fliM специфически вызывает потерю подвижности, мы дополнили штамм 702fliM- в trans репликативным вектором pMaORI, содержащим функциональный ген fliM под контролем конститутивного промотора (fliM является вторым геном предполагаемого оперона (фиг. 3A), препятствующего комплементации с использованием нативного fliM промотора). Экспрессия FliM была восстановлена в комплементированном штамме до уровня WT в соответствии с вестерн-блоттингом на 3 независимых культурах 702fliM-/+ (фиг. 5D). Исследование под микроскопом подтвердило восстановление подвижности и морфологии дикого типа с крюком и спиральными концами (фиг.1B и 1K - 1Q). «Расползание» бактерий в планшете с мягким агаром было сходно с WT (фиг.2B). Более того, не наблюдалось длинных филаментов и длина клеток была сравнима с WT: у 275 измеренных бактерий средняя длина была 10.9 мкм, включая 91% короче, чем 15 мкм, и 9% в пределах между 15 мкм и 30 мкм. Кинетика роста была сходна с 702fliM- и WT. Вместе взятые, эти данные доказывают, что trans комплементация успешно возвращает функциональный fliM в штамм 702fliM-, и что fliM необходим для формы клеток, подвижности и вирулентности.
Разрушение fliM вызывает дефект в сборке жгутика
Поскольку FliM является одним из компонентов мотора жгутика, мы далее исследовали цельность жгутика в мутантных, комплементированных и WT штаммах. Был проведен иммунофлуоресцентный анализ (IFA) с использованием антител к основному белку филамента FlaB (фиг.4A - 4C). Окрашивание WT штамма (фиг. 4B) показало присутствие FlaB белков от концов до середины клетки без перекрывания, что согласуется с предыдущими IFA экспериментами и описанием жгутика в Leptospira. Окрашивание комплементированного штамма 702fliM-/+ (фиг. 4C) было сходно с WT. Средняя длина FlaB окрашенного жгутика из этих двух штаммов составляла 3.5мкм. Однако, 702fliM- (фиг. 4A) показал или более короткий жгутик приблизительно 1.3мкм или отсутствие жгутика в 30% клеток. Для того, чтобы лучше охарактеризовать длину жгутика, очищенные жгутики из 3 штаммов исследовали под электронным микроскопом (фиг. 4D - 4I). В WT штаммах (фиг. 4E и 4H) мы наблюдали интактные спирально-свернутые жгутики со средним размером 3.2 мкм в длину, в соответствии с IFA экспериментом, и 20 мкм в диаметре. Исследуемые жгутики состояли из базального тела на одном конце и филамента диаметром 15 нм на другом конце, вероятно вследствие отсутствия оболочки (sheath), как уже было описано в предшествующих исследованиях leptospiral жгутика (14). Было отмечено небольшое количество поломанных жгутиков, вследствие хрупкости филаментов. В случае 702fliM- (фиг. 4D и 4G) все жгутики были значительно короче, средняя длина составляла 0,7 мкм. Это наблюдение было подтверждено на 3 партиях жгутиков, экстрагированных из 3 независимых культур, исключая тот факт, что эта короткость была вызвана только поломкой жгутиков.
Чтобы дополнительно охарактеризовать короткие филаменты на 702fliM-, очищенные жгутики исследовали с помощью электрофореза. Окрашивание Кумасси показало содержание различных жгутиковых белков 702fliM- по сравнению с WT и дополненными (комплементированными) штаммами (фиг.5A). В частности, мы отметили меньше белка с молекулярной массой около 30-40 кДа, соответствующей размеру описанных ранее жгутиковых белков (Liao, 2009, выше). Выработка двух основных белков филамента 30 кДа, FlaA2 (LIC10787) и FlaB (LIC11531), была исследована с помощью вестерн-блоттинга (фиг. 5B и 5C). Уровни белков FlaA2 (фиг. 5B) и FlaB (фиг. 5C) были приблизительно в 2,5 раза ниже в 702fliM- жгутиках по сравнению с WT и 702fliM-/+ штаммами, подтверждая аномально низкое количество жгутиковых белков, соответствующих более короткому филаменту. То же самое уменьшение экспрессии белков FlaA2 и FlaB было видно в цельноклеточных лизатах, но не при использовании qPCR, показывая, что содержание жгутиковых белков ниже в неподвижных штаммах, чем в WT, однако экспрессия генов не ухудшалась. Все вместе эти данные показывают, что разрушение fliM ведет к неполной сборке жгутика, и что эти короткие жгутики не способны обеспечивать подвижность.
Подвижность необходима для вирулентности
Чтобы исследовать роль подвижности в вирулентности, группы от пяти до десяти хомяков инфицировали внутрибрюшинным путем 108 штаммами 702fliM-, 702fliM-/+ или WT и контролировали в течение 14 дней. Тогда как все 702fliM- инфицированные хомяки выжили, те, которые получили WT и 702fliM-/+ умерли в течение 6 дней (фиг. 6). Эти результаты показывают, что неподвижные 702fliM- не являются вирулентными даже при высокой инфицирующей дозе, и что восстановление fliM и подвижность коррелирует с восстановлением вирулентности. Следовательно, подвижность является необходимой для вирулентности.
Живая 702fliM- вакцина защищает от гомологичного и гетерологичного заражения
Чтобы исследовать, может ли 702fliM- штамм представлять собой возможную живую кандидатную вакцину для собак, мы оценили защиту хомяков от гомологичного и гетерологичного заражения. Группы из 20 хомяков вакцинировали с помощью внутрибрюшинного введения однократной дозой 106 живых L. interrogans серогруппа Australis 702fliM- или 108 живых сапрофитных L. biflexa серовар Patoc или среды EMJH. Через четырнадцать дней после иммунизации животных заражали вирулентным L. interrogans Australis или Icterohaemorrhagiae серогруппа и контролировали в течение 21 дня.
В то время как от 80 до 100% животных, вакцинированных EMJH или Patoc, умерло, 90% 702fliM -вакцинированных хомяков выживало в обоих зараженных группах (смотри фиг. 7). Эти данные указывают, что живой неподвижный 702fliM- вирулентный ослабленный штамм серогруппа Australis, но не авирулентный Patoc, использованный в качестве живой вакцины, способен обеспечить перекрестный иммунитет от L. interrogans серовар icterohaemorrhagiae.
Обсуждение
Spirochetes являются высокоинвазивными бактериями, вероятно из-за их поразительно эффективной подвижности. У Leptospira поступательное движение клеток колеблется в пределах между 6 мкм/сек и 30 мкм/сек в зависимости от вязкости и обеспечивается только 2 жгутиками (Xu J, et al., 2015, Microbiol. Reсек., vol. 171, pp. 21-25; K. Takabe K, et al., 2013, Microbiol. I мМunol., vol. 57, no. 3, pp. 236-239; Cameron CE, 2015, Curr. Top. Microbiol. I мМunol., vol. 387, pp. 21-41). B. burgorferi плывет с похожей скоростью, но содержит от 7 до 11 перплазматических жгутиков, и Critispira имеет, по меньшей мере, 100 перплазматических жгутиков (Malawista SE et al., 2008, PLoS ONE, vol. 3, no. 2, p. e1633). Наличие 2 Leptospira жгутиков может объясняться более сложной структурой, обеспеченной большим числом генов, связанных с подвижностью. Тогда как 50 генов содержится в T. pallidium и B. burgorferi, приблизительно 90 генов присутствует в геноме Leptospira (A. L. T. O. do Nascimento ALTO et al., 2004, Braz. J. Med. Biol. Reсек., vol. 37, no. 4, pp. 459-477; M. Picardeau M et al., 2008, PLoS ONE, vol. 3, no. 2, p. e1607). Тем не менее, мы показали в этом исследовании, что делеция одного нуклеотида в одном из этих генов, fliM, может нарушить устойчивость всей жгутиковой структуры и подавить подвижность. Эта делеция была установлена путем полного секвенирования генома и сравнительной геномики штаммов 702fliM- и WT. Спонтанная делеция происходила в гомополимерном участке близко к началу ген fliM, препятствуя экспрессии белка. Комплементация функциональным fliM восстановила фенотип дикого типа, показывая, что только эта мутация была ответственна за дефекты 702fliM-. fliM аннотируется как белок-переключатель жгутикового мотора с гомологичным геном у других видов бактерий, однако до сих пор нет исследований, подтверждающих эту функцию, на Leptospira. Таким образом, ослабленный мутант, идентифицированный в этом исследовании, представляет огромный интерес.
Фенотипические исследования мутанта показали атипичную морфологию. Клеточные концы были уплотнены: мутантный штамм утратил крюк и спиралевидные концы. Основным признаком мутанта является потеря подвижности. Трансляционные сдвиги не наблюдались и только небольшая популяция (приблизит. 2%) демонстрировала медленные и единичные движения концов, не способные продвигать клетку вперед. Эти обнаружения указывают на нарушение жгутиков и вращение мотора. Мы дополнительно охарактеризовали жгутики и обнаружили, что они или отсутствовали или присутствовали в укороченной форме на одном или обоих концах нашего мутанта, лишенного fliM. Измерение их длины с помощью IFA и TEM показало уменьшенный размер в 2.5 - 4.5 раза по сравнению с WT, что согласуется с подобным уменьшением экспрессии белков филамента, обнаруженным на вестерн-блотах. Однако, при формировании жгутик демонстрировал типичный диаметр и изгиб по сравнению с WT и ранее опубликованными работами (Nauman RK et al., 1969, J. Bacteriol., vol. 98, no. 1, p. 264), что означает, что ядро и оболочка жгутика нарушаются не сразу. Затем fliM требуется для полной длины и вращения жгутика, и то и другое необходимо для поступательного движения.
Чтобы дополнительно охарактеризовать участие жгутика и подвижности в Leptospira патогенности, животную модель (хомяки) инфицировали мутантными штаммами. Эксперименты с инфицированием показали отсутствие вирулентности неподвижного штамма и восстановление полной инфекционности комплементированного штамма. В нашем документе мы впервые сообщаем, что показана прямая связь отсутствия подвижности и патогенности у Leptospira, без возможных полярных эффектов. Это открытие согласуется с идеей, что подвижность необходима для преодоления мембран слизистых оболочек, вход в ткани через поврежденную кожу, распространения в хозяине и проникновения в органы (Murray 2015, и позже).
702fliM- является невирулентным штаммом, который был выделен из больной собаки. Вероятно, животное было исходно инфицировано вирулентным штаммом, и точечная мутация происходила после изоляции с мутантным неподвижным штаммом, выросшим из WT популяции in vitro. Наоборот, штамм Patoc принадлежит к сапрофитному неинфекционному виду Leptospira. Неожиданно результаты показали, что перекрестная защита может достигаться только при использовании вирулентного ослабленного штамма, такого как 702fliM-, непосредственно происходящего от полностью вирулентного изолята, но не от авирулентного сапрофитного штамма.
В заключение, геномное секвенирование установило спонтанную точечную мутацию, ответственную за потерю подвижности, вероятно обеспечивающую селективное преимущество Leptospira в среде in vitro. Эта мутация в ген fliMе - которая происходит в ходе культивирования - дает в результате дестабилизацию C-кольца комплекса переключателя мотора, приводя к неполной сборке жгутика и дефектной регуляции движения, которые необходимы для поступательной подвижности. В дополнение к этому, кроме потери подвижности, неправильное формирование жгутика влияет на клеточную морфологию и деление. Дополнительно, с помощью генетической комплементации, мы подтвердили прямое участие подвижности в патогенности Leptospira, что дает знания о механизмах вирулентности этих зоонозных бактерий. Наконец, мы продемонстрировали, что неподвижный мутант, непосредственно происходящий от исходного вирулентного штамма, является подходящей перекрестной живой кандидатной вакциной, с характерными особенностями, которые нельзя найти при использовании авирулентного сапрофитного штамма.
Пример 2. Исследование безопасности и эффективности живой ослабленной L. interrogans вакцины при гомологичном заражении у собак
Цель исследования - оценить серологический ответ (иммуногенность), безопасность/способность к распространению и эффективность живой ослабленной L. interrogans вакцины на модели гомологичной вакцинации-заражения на собаках.
Исследование было разделено на две части: вакцинная фаза с D0 до D37, и фаза заражения (провокации) с Tpre (=D38) до T26 (=D69) с заражением на T0 (через 2 недели после второй вакцинации). Шестнадцать шестимесячных собак породы бигль из коммерческого источника случайным образом разбили на три группы, как показано в таблице 2, ниже. Собак в Группе A вакцинировали дважды подкожно с интервалом 25 дней на D0 и D25, используя 1 мл живой вакцины L. interrogans, содержащей около 5x107 lepo/мл ослабленного штамма 702fliM. Собаки в группах B (контрольная группа) и C (контрольная группа шеддинг) не были вакцинированы. Собаки из групп A и C были размещены вместе, чтобы установить потенциальный шеддинг вакцинного штамма. Собак из группы B разместили отдельно от двух других групп. У вакцинированных собак контролировали реакции в месте инъекции (припухлость, боль после пальпации), общее состояние (апатию, упадок сил) и температуру тела. Образцы крови собирали для проведения ELISA сыворотки (BS сухая пробирка), гематобиохимический анализ (BS Hep-Li и BS EDTA), qPCR анализ способности к распространению или исследования клеточного иммунитета (BS Hep-Na). Образцы мочевины собирали для qPCR анализов способности к распространению. Собак в группе C подвергали эвтаназии на D39 (T0) для анализа после смерти присутствия бактерий и повреждения тканей в печени и почках. Режим сбора образцов на фазе вакцинации детально показан в таблице 2.
На день D39 (T0) собак в группах A и B заражали с помощью внутрибрюшинного введения вирулентного штамма L. interrogans серогруппа Australis в дозе 5x109 lepo. Собаки из группы C не подвергались заражению, однако подверглись эвтаназии на D39. Во время периода после заражения собак ежедневно контролировали на предмет смертности, наличия клинических симптомов (общее состояние, обезвоживание, глазной симптом, рвота, диарея и кожно-слизистые симптомы), определяли температуру тела и взвешивали. Образцы крови собирали для проведения ELISA сыворотки (BS сухая пробирка), гематобиохимического анализа (BS Hep-Li и BS EDTA) и для qPCR анализа leptospiremia (BS Hep-Na). Мочу собирали для qPCR анализа leptospiruria. Печень и почки собирали после смерти для qPCR анализа на присутствие бактерий, а также на наличие повреждений тканей. Выжившие собаки в Группе A и B были подвергнуты эвтаназии на T26. Режим сбора образцов на фазе вакцинации детально показан в таблице 2.1.
Таблица 2. Дизайн эксперимента - вакцинная фаза
|
BS Hep-Li*: Кровь собирали в литий-гепаринизированные пробирки для биохимического анализа (мочевина, креатинин, ALT, AST, ALP).
BS Hep-Na**: Кровь в натрий-гепаринизированные пробирки для обнаружения leptospires с помощью qPCR и исследования клеточного иммунитета.
BS EDTA***: образцы, использованные для подсчета количества тромбоцитов.
Таблица 2.1. Дизайн эксперимента - фаза заражения
|
Результаты исследования способности к распространению/безопасности показаны в таблице 3 ниже. Результаты показывают, что не было обнаружено leptospiruria в группе вакцинированных собак (группа A) и у собак в группе шеддинг (группа C). Не наблюдалось местных или общих неблагоприятных побочных признаков после вакцинации у вакцинированных собак.
Таблица 3. Результаты исследования способности к распространению/безопасности
|
Результаты исследования клеточно-опосредованного иммунитета показаны на фиг. 10. Специфический ответ Leptospira IL-17 был установлен у вакцинированных собак через семь дней после второй инъекции вакцины. Других цитокинов (таких как IFNg, TNFa, IL-6, IL8, IL10) не было обнаружено в вакцинированной группе в in vitro PBMCs анализах повторного стимулирования.
Результаты эффективности показаны в таблице 4 ниже. Результаты продемонстрировали отличную защиту у вакцинированных собак (группа A) в том, что касается клинических признаков: ни одна из собак в группе A (0/8) не проявила каких-либо клинических признаков, и пять из шести собак в группе B (5/6) показали тяжелые клинические симптомы. Также, как видно из таблицы 4, не обнаружено leptospiruria у вакцинированных собак (группа A), при этом было только две собаки, которые были в небольшой степени положительными в один момент времени, и только одна собака в группе B, у которой не наблюдалось никаких клинических признаков была положительной по leptospiruria.
Таблица 4. Результаты по эффективности
|
Результаты исследования гематологических параметров (см. фиг. 11-16) показали, что в ходе фазы вакцинации не наблюдалось различий между контрольными (группа B), вакцинированными собаками (группа A) или собаками в группе шеддинг (группа C). После заражения значительное воздействие на гематологические параметры наблюдалось у контрольных (группа B), тогда как воздействия у вакцинированных собак (группа A) не наблюдалось. В контрольной группе (группа B) все собаки погибли после заражения, за исключением одной. У этой выжившей собаки (в группе B) параметры уремии и креатинемии были затронуты после T5, что показывает, что подверглись воздействию почки собаки, судя по leptospiruria.
Заражение было тяжелым и было признано действительным, так как пять из шести контрольных собак были клинически больны, что подтверждалось тяжелыми клиническими симптомами (слабость, кишечные и кожно-слизистые признаки) и изменением биологических параметров (мочевина, креатинин, AST, ALT, ALP и тромбоциты), собаки не были подвергнуты эвтаназии по этическим соображениям на день 3 или 4 после заражения. У этих собак имелся один или два положительных образца крови, положительные образцы почек и повреждения почек и печени.
После заражения все вакцинированные собаки оставались в хорошем общем состоянии без каких-либо клинических признаков или гипертермии. Не было отмечено изменения параметров крови. Leptospira не были обнаружены в крови или почках. Только у двух вакцинированных собак имелся незначительно положительный образец мочи, все образцы мочи оставались отрицательными у шести других вакцинированных собак. Не было обнаружено повреждения почек или печени у всех вакцинированных собак.
Защита от смертности, признаков болезни (клинические признаки, вес тела, ректальная температура, биологические параметры), инфекции, выделения бактерий, почечного носительства и повреждения почек была продемонстрирована у вакцинированных собак по сравнению с контрольными собаками.
Заключение
Результаты показали, что живая ослабленная вакцина L. interrogans, содержащая ослабленный 702fliM штамм, является безопасной в использовании. После введения животным у них отсутствовали какие-либо местные или общие симптомы, не было отмечено влияния на гематологические параметры. Признаки шеддинга отсутствуют после введения живой ослабленной вакцины животным. Живая ослабленная L. interrogans вакцина (штамм 702fliM) также предотвращала гибель, появление клинических симптомов болезни, заражение, выведение с мочой, почечное носительство и повреждение почек от заражения очень вирулентным L. interrogans серогруппа Australis, которое осуществлялось через две недели после 2-ой инъекции первичной вакцинации.
Пример 3. Исследование безопасности и эффективности живой ослабленной вакцины L. interrogans от гетерологичного заражения у собак
Цель исследования - оценить эффективность от гетерологичного заражения (возникновение иммунитета) живой ослабленной L. interrogans вакцины у собак.
Тринадцать шестимесячных собак породы биггль из коммерческого источника случайным образом разбили на две группы. Собак в Группе A вакцинировали дважды подкожно, на D0 и D28, используя 1 мл живой L. interrogans вакцины, содержащей 107 lepo/мл ослабленного штамма 702fliM. Собак в Группе B (контрольная группа) не вакцинировали.
На D42 (T0) каждую собаку в группах A и B заразили вирулентным штаммом L. interrrogans серогруппа Icterohaemorrhagiae в дозе 106 lepo/мл. Во время периода после заражения собак ежедневно контролировали смертность, клинические симптомы (общее состояние, обезвоживание, глазные симптомы, рвоту, диарею и кожно-слизистые признаки), температуру тела и вес. Кровь и мочу собирали регулярно на всем протяжении фазы вакцинации для серологического, гематобиохимического анализа и анализа leptospiremia и leptospiruria. Печень и почки собирали после смерти для анализа на присутствие бактерий, а также на наличие повреждения тканей. Выжившие собаки в Группе A и B подвергались эвтаназии на T28.
Результаты эффективности показывают, что общий клинический показатель (подсчет очков в баллах) значительно ниже у вакцинированных собак в сравнении с контрольными. Аналогично, счет общих биохимических и гематологических баллов, число положительных посевов крови на собаку (leptospiremia), число положительных посевов мочи на собаку (leptospiruria), число собак с положительным посевом почек и число собак с повреждениями почек были значительно ниже в вакцинированных группах при сравнении с контролями.
Заключение
Результаты показали, что живая ослабленная L. interrogans вакцина (штамм 702fliM) снижает смертность, клинические симптомы болезни, инфекцию, экскрецию с мочой, почечное носительство и повреждение почек после заражения гетерологичным вирулентным L. interrogans серогруппа Icterohaemorrhagiae, проведенного через 2 недели после второй инъекции первичной вакцинации, и обеспечивает перекрестную защиту от гетерологичного заражения.
Пример 4. Делеция гена fliM
Цель исследования заключается в получении рекомбинантного и ослабленного L. interrogans путем делеции FliM гена, кодирующего белок fliM (SEQ ID NO:17), из Leptospira interrogans генома.
Ген fliM, кодирующий белок fliM (SEQ ID NO:17), удалили из Leptospira interrogans путем использования двух последовательных стадий трансформации.
«Безмаркерная» система мутации для патогена L. interrogans формируется с помощью инструментов, обеспечивающих осуществление двух последовательных стадий трансформации. При первой гомологичной рекомбинации целевой ген fliM заменяется канамицин-резистентной кассетой с использованием аллельной системы обмена, как показано ранее для ligB (Croda, J., et al., 2008, Infect I мМun 76, 5826-5833). Для второй трансформации в качестве эффективного инструментального средства для вырезания ДНК-фрагментов, вставленных в бактериальную хромосому Leptospira interrogans, используется система рекомбиназы Flp, белка, который способствует как меж-, так и внутримолекулярной рекомбинации (Hoang, T. T., et al., 1998, Gene 212, 77-86).
Альтернативно, митохондриальная эндонуклеаза I-SceI S. cerevisiae может использоваться для получения «безмаркерной» делеции ген fliM из хромосомы Leptospira interrogans (Pósfai, G., et al., 1999, Nucleic Acids Res 27, 4409-4415)
Полученный рекомбинантный Leptospira interrogans, где ген fliM удален, является стабильным и надежным и используется в качестве живой ослабленной вакцины против гомологичного и гетерологичного заражений у собак, как описано в Примере 5.
Пример 5. Исследование безопасности и эффективности живой ослабленной вакцины L. interrogans от гомологичного и гетерологичного заражения у собак.
Целью исследования является оценка эффективности от гомологичного и гетерологичного заражения (возникновение иммунитета) живой ослабленной вакцины L. interrogans у собак. Живая ослабленная вакцина L. interrogans получена в Примере 4, где ген FliM, кодирующий белок fliM, удален.
Собак породы бигль, полученных от коммерческого источника, случайным образом разбили на две группы. Собак в Группе A вакцинировали дважды подкожно, на D0 и D28, 1 мл живой вакцины L. interrogans, содержащей 107 lepo/мл ослабленного штамма L. interroganсек. Собак в Группе B (контрольная группа) не вакцинировали.
В первом исследовании на D42 (T0) каждую собаку в группах A и B заразили вирулентным штаммом L. interrogans серогруппа Australis (гомологичное заражение). В другом исследовании на D42 (T0) каждую собаку в группах A и B заразили вирулентным штаммом L. interrrogans серогруппа Icterohaemorrhagiae (гетерологичное заражение). Во время периода после заражения собак ежедневно контролировали смертность, клинические симптомы (общее состояние, обезвоживание, глазные симптомы, рвоту, диарею и кожно-слизистые признаки), температуру тела и вес. Кровь и мочу собирали регулярно на всем протяжении фазы вакцинации для серологического, гематобиохимического анализа и анализа leptospiremia и leptospiruria. Печень и почки собирали после смерти для анализа на присутствие бактерий, а также на наличие повреждения тканей. Выжившие собаки в Группе A и B подвергались эвтаназии на T28.
Результаты эффективности показывают, что общий клинический показатель (подсчет очков в баллах) значительно ниже у вакцинированных собак в сравнении с контрольными. Аналогично, счет общих биохимических и гематологических баллов, число положительных посевов крови на собаку (leptospiremia), число положительных посевов мочи на собаку (leptospiruria), число собак с положительным посевом почек и число собак с повреждениями почек были значительно ниже в вакцинированных группах по сравнению с контролями.
Заключение
Результаты показали, что живая ослабленная L. interrogans вакцина (удален ген fliM) снижает смертность, клинические симптомы болезни, инфекцию, экскрецию с мочой, почечное носительство и повреждение почек после заражения гомологичным вирулентным L. interrogans серогруппа Australis и гетерологичным вирулентным L. interrogans серогруппа Icterohaemorrhagiae, осуществленным через 2 недели после второй инъекции первичной вакцинации, и обеспечивает защиту от гомологичного заражения и перекрестную защиту от гетерологичного заражения.