Результат интеллектуальной деятельности: Рекомбинантная плазмида pHis6-flagG-protE, обеспечивающая синтез рекомбинантного химерного белка, включающего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G S.typhii и используемого в качестве основы для вакцины против вируса клещевого энцефалита
Вид РИД
Изобретение
Изобретение относится к рекомбинантной плазмиде pHis6-flagG-protE со встроенными генами fliG и TBEVgp1, кодирующими гибридный рекомбинантный белок flagG-protE, индуцирующий иммунный ответ на вирус клещевого энцефалита, которая может стать основой для конструирования кандидатной рекомбинантной вакцины против вируса клещевого энцефалита (ВКЭ) с повышенной иммуногенностью. Изобретение может быть использовано в генной инженерии, биотехнологии и иммунологии.
Для иммунизации населения против клещевого энцефалита в России используют четыре типа инактивированных вакцин, производимых в России (штаммы 205 и Софьин), Австрии (Neudorfl) [1] и Германии (K23) [2]. На территории Китая c 1953 г. применяют оригинальную инактивированную вакцину против ВКЭ на основе штамма Zen-Zhang [3]. Производство вышеперечисленных вакцин основано на крупномасштабном культивировании высоковирулентных штаммов вируса клещевого энцефалита (ВКЭ). При таком крупномасштабном производстве крайне сложно обеспечить биобезопасность самого производства и окружающей среды. Это приводит к большому количеству негативных эффектов, связанных с организацией весьма опасного производства большого количества высокопатогенной вирусной биомассы. Данное обстоятельство обуславливает необходимость осуществлять проведение сложных и дорогостоящих инженерных решений для обеспечения всех аспектов биобезопасности, в том числе строго контроля за полнотой инактивации вируса при изготовлении конечной формы вакцины. Для инактивации ВКЭ используются высокоактивные химические соединения, например формалин, бета - пропиолактон и т.д. Их использование приводит к необратимой химической модификации вирусных молекул, что снижает их антигенность и иммуногенность, обеспечивает формирование иммунного ответа на разрушенные и модифицированные вирусные частицы, вызывает аллергизацию, а также целый ряд других негативных эффектов (реактогенность, сложные схемы иммунизации, недостаточная длительность иммунного ответа и т.д.) выявившихся при проведении массовой иммунизации населения.
Для преодоления этих недостатков актуально использовать искусственно созданные рекомбинантные вакцины, включающие только отдельные компоненты вирусов, например, иммуногены, индуцирующие синтез вируснейтрализующих антител, а также молекулярные адьюванты, усиливающие иммунные ответы. Основным иммуногеном, индуцирующим появление вируснейтрализующих антител, является гликопротеин Е вируса клещевого энцефалита [4]. Бактериальный флагеллин - перспективный и эффективный природный адъювант, усиливающий иммунный ответ против флавивирусов [5].
Наиболее близким аналогом (прототипом) к заявляемой плазмиде является рекомбинантная плазмида PGSDEI, кодирующая белок E вируса клещевого энцефалита (Патент РФ №2136754, МПК C12N 15/40, опубл. 10.09.1999 г.) [6]. Данная плазмида разработана для экспрессии в клетках E.coli штамма GSDE и наработки в них рекомбинантного белка.
Недостатками прототипа является то, что большая часть рекомбинантного белка представлена нерастворимыми тельцами включения и требует дополнительных этапов обработки лизатов для перевода вирусного белка Е в растворимую форму. Это говорит о том, что рекомбинантная молекула неспособна обеспечить правильную сборку и конформацию молекулы, типичную для исходной вирусной молекулы. Особенно это важно для поверхностных эпитопов белка Е, которые индуцируют образование вируснейтрализующих антител. Таким образом рекомбинантный белок, продуцируемый плазмидой-прототипом, не обеспечивает формирование полноценного противовирусного иммунитета.
Техническим результатом предлагаемого изобретения является создание рекомбинантной плазмиды, обеспечивающей продукцию рекомбинантного химерного белка без образования телец включения, содержащего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G Salmonella typhii в качестве адьюванта для конструирования кандидатной рекомбинантной вакцины против вируса клещевого энцефалита (ВКЭ) с более высокой иммуногенностью.
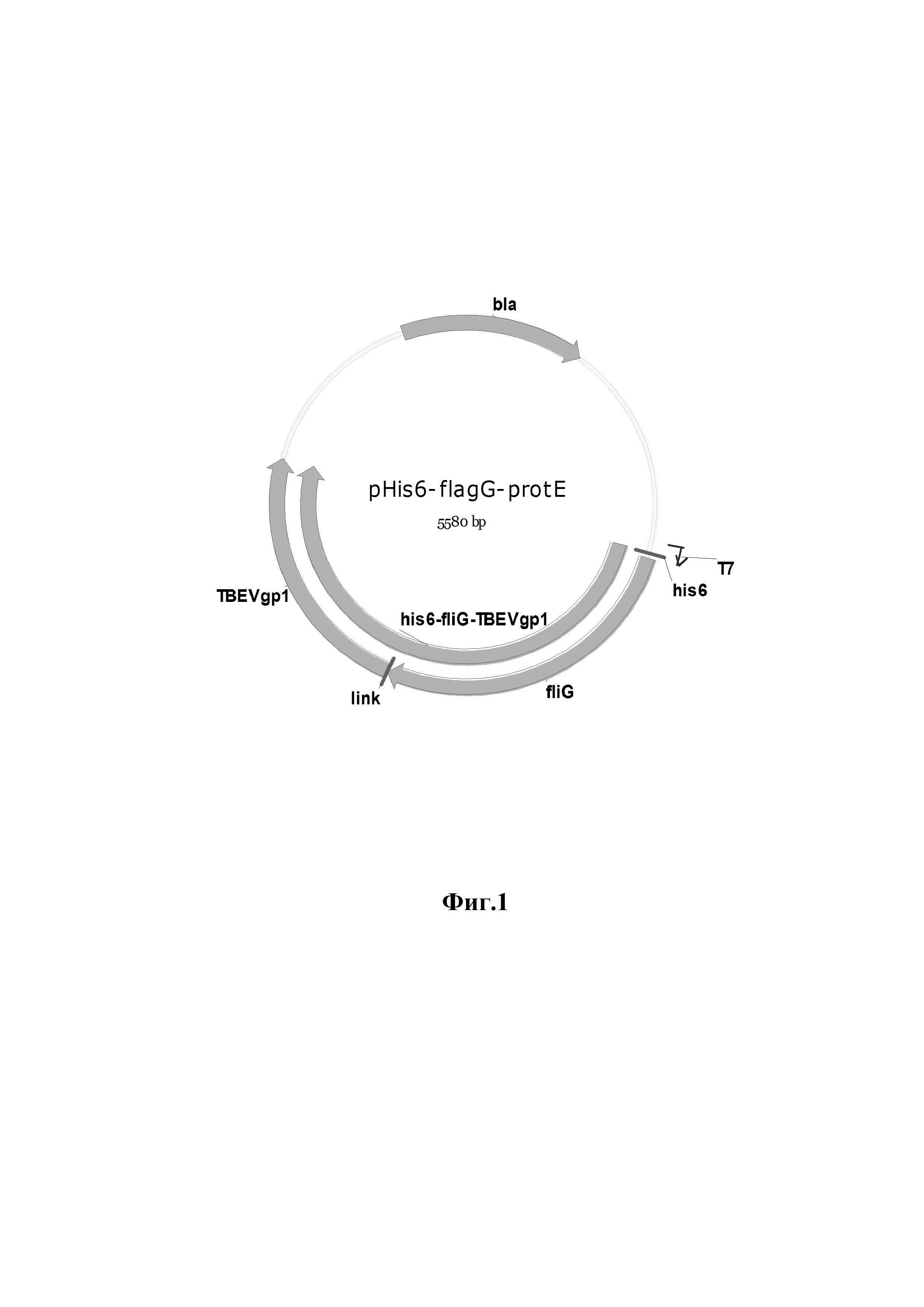
Указанный технический результат достигается конструированием рекомбинантной плазмиды pHis6-flagG-protE размером 5580 п.о., обеспечивающей синтез рекомбинантного химерного белка, имеющего аминокислотную последовательность (SEQ ID NO:2), включающего эпитопы гликопротеина Е вируса клещевого энцефалита и флагеллин G S.typhii и используемого в качестве основы для вакцины против вируса клещевого энцефалита, содержащая в соответствии с физической и генетической картой, представленной на фиг. 1, последовательно расположенные по направлению транскрипции BglII-HindIII фрагмент ДНК размером 2796 п.о., имеющий нуклеотидную последовательность (SEQ ID NO: 1), кодирующий химерный ген his6-fliG-TBEVgp1 (2796 п.о.), состоящий из гена TBEVgp1 вируса клещевого энцефалита (1236 п.о.) и гена fliG S.typhii (1518 п.о.); bla - ген устойчивости к ампициллину (861 п.о.); T7 - промотор фага T7 (18 п.о.); his6 - тег, кодирующий из 6 гистидинов (18 п.о.); link - шарнирная последовательность, кодирующая 3 аминокислоты «gly-ala-gly» (9 п.о.).
Отличием предлагаемой плазмиды от прототипа является наличие в ее составе генаfliGS.typhii, кодирующего протеин flagG, являющегося адьювантом и усиливающим иммунный ответ.
Гибридная молекула, несущая основные домены вирусного белка Е и флагеллина G, может стать основой для конструирования кандидатной рекомбинантной вакцины против ВКЭ с усиленной иммуногенностью и простотой производства без использования высокопатогенных вирусных штаммов.
Способ конструирования плазмиды заключается в синтезе полноразмерного гибридного гена, состоящего из двух отдельных генов fliG Salmonella typhii, кодирующего протеин flagG, и TBEVgp1, кодирующего гликопротеин protE вируса клещевого энцефалита в одной рамке трансляции, между которыми нет стоп-кодонов, но присутствует «шарнир» из трех аминокислотных остатков - «гли-ала-гли» для гибкой связи между доменами гибридного белка, а также заложен полигистидиновый тракт для аффинной очистки на колонке Ni-NTA. Сначала при помощи ПЦР получают химерный ген. Праймеры для ПЦР, специфичные к генам TBEVgp1 и fliG были разработаны так, чтобы они перекрывались друг с другом и, таким образом, позволяли синтезировать один непрерывный синтетический химерный ген из отдельных фрагментов ДНК. Внутренний праймер имеет на 5’конце взаимокомплементарную последовательность, позволяющую ввести «гли-ала-гли»-шарнир. В ограничивающие химерный ген олигонуклеотиды вводят сайты узнавания для эндонуклеаз рестрикции bglII и HindIII, позволяющие клонировать химерный ген в вектор pHis6.
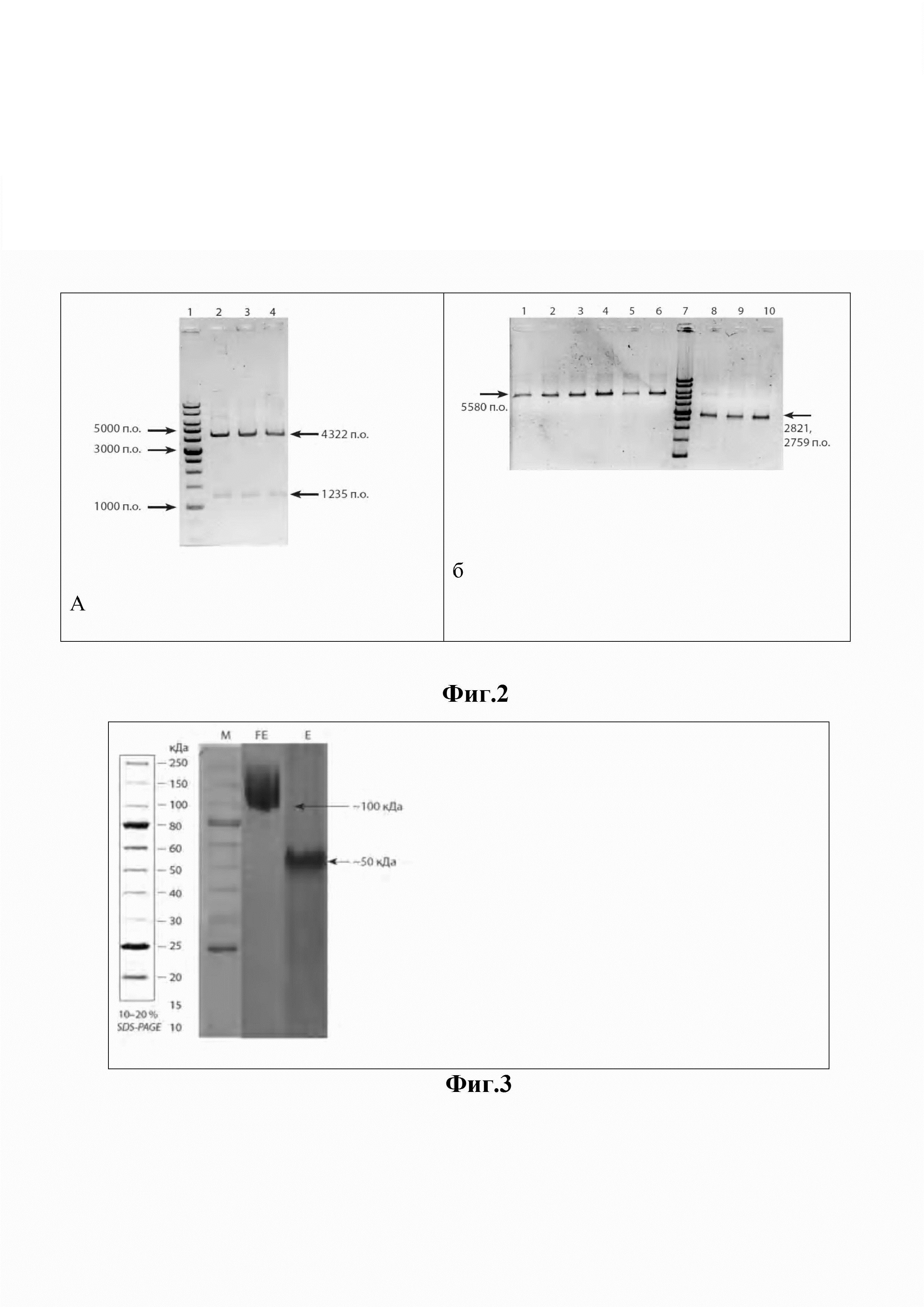
Изобретение иллюстрируется следующими фигурами. На фиг. 1 приведена физическая карта плазмиды pHis6-FlagG-protE, где BglII и HindIII - эндонуклеазы рестрикции; bla - ген устойчивости к ампициллину; T7 - промотор фага T7; his6 - тег из 6 гистидинов; link - последовательность, кодирующая 3 аминокислоты «гли-ала-гли»; fliG-TBEVgp1 - нуклеотидная последовательность химерного гена, кодирующая домены flagG и protE, соответственно (стрелками показано направление транскрипции) химерного гена, T7 - промотор фага T7; his6 - тег из шести гистидинов; link - последовательность, кодирующая три аминокислоты «гли-ала-гли». На фиг. 2 представлены результаты электрофоретического анализа клонов pHis6-flagG-protE, где на дорожках 2-4 (Фиг. 2а) размеры фрагментов, полученных с использованием рестриктазы VspI, соответствуют ожидаемым - 4 322 и 1 235 п.о.; на дорожках 1-3 (Фиг. 2б) размеры фрагментов, полученных с использованием рестриктазы EcoRI, соответствуют ожидаемым - 5580 п.о.; на дорожках 4-6 размеры фрагментов, полученных с использованием HindIII, соответствуют ожидаемым - 5580 п.о.; на дорожках 8-10 размеры фрагментов, полученных в результате совместного гидролиза EcoRI и HindIII, соответствуют ожидаемым - 2821 п.о. и 2759 п.о. На 1-й (фиг. 2а) и 7-й дорожках (фиг. 2б) - маркер молекулярных масс «1kb», «СибЭнзим», РФ (16 фрагментов: 10000, 8000, 6000, 5000, 4000, 3000×2, 2500, 2000, 1500, 1000×2, 750, 500×2, 250 п.о.). На фиг. 3 приведена электрофореграмма рекомбинантных белков flagG-protE и protE, где M - маркер молекулярных масс (15-250 кДа); FE-белок flagG-protE (100 кДа); E-белок protE (50 кДа). На фиг. 4 приведена нуклеотидная последовательность (SEQ ID NO: 1) ДНК, кодирующей белок flagG-protE, а на фиг. 5 - аминокислотная последовательность (SEQ ID NO: 1) белка flagG-protE.
Сущность изобретения поясняется следующими примерами конкретного выполнения изобретения.
Пример 1. Конструирование плазмиды pHis6-flagG-protE.
Для клонирования генов fliG и TBEVgp1 в составе вектора pHis6 были рассчитаны и синтезированы следующие праймеры:
Праймеры для реакции ПЦР гена fliG(размер ожидаемого ПЦР-продукта - 1518 п.о.):
U-BglII-flaG: 5‘ CCCAGATCTATGGCGCAGGTGATTAACACCA 3’
L-Bse3DI-link_fla:
5’ CCCGCAATGCCCCGCGCCGCGCAGCAGGCTCAGCACG 3’
Праймеры для реакции ПЦР гена TBEVgp1 (размер ожидаемого ПЦР-продукта - 1257 п.о.):
U-Bse3DI-E: 5’ CCCGCAATGGGTATGCCTCACGATGCACACATCTG 3’
L-HindIII-E: 5’ CCCAAGCTTATATGCCTTTCCTGGTTTT 3’
Используя эти праймеры и соответствующие матрицы ДНК (pGEM1-fliG, pGSDE1) были получены фрагменты ДНК, которые обработали рестриктазами BglII, Bse3DI (ген fliG) и Bse3DI, HindIII (ген гликопротеина Е - TBEVgp1). Вектор pHis6 обработали рестриктазами BglII и HindIII. Все три фрагмента ДНК были очищены при помощи «набора для очистки ДНК» («Цитокин», Санкт-Петербург) при их электрофоретическом разделении в 1% агарозном геле.
Фрагменты ДНК лигировали друг с другом а течение ночи при 4°С. В силу того, что была использована рестриктаза Bse3DI, образующая уникальные «липкие» концы, сшивка фрагментов ДНК fliG и TBEVgp1 произошла однозначно в заданной последовательности. Лигазную смесь использовали для трансформации клеток E. coli DH10B. По результатам рестрикционного анализа с участием эндонуклеаз рестрикции Vsp1, EcoRI и HindIII среди 24 независимо полученных клонов бактерий, устойчивых к ампициллину, выделено 8 клонов с ожидаемой для гена pHis6-flagG-protE картиной рестрикции (фиг. 2).
Сравнивая расчетные данные и данные электрофореза, можно сделать вывод, что все сайты рестрикции ДНК плазмид располагаются правильно и отобранные клоны содержат целевую плазмиду pHis6-flagG-protE, которая включает ген, кодирующий рекомбинантный гибридный белок flagG-protE (фиг. 1).
Пример 2. Наработка и выделение рекомбинантного белка flagG-protE.
Клетки E. coli BL21(DE3) трансформировали плазмидой pHis6-flagG-protE, засевали в ночь в 5 мл LB, содержащей ампициллин (50 мг/ мл). На следующий день инокулировали 1 мл ночной культуры в 100 мл LB с ампициллином (50 мкг/мл). Инкубировали на качалке в течение 2 ч при 37°С и 180 об/мин. Индукцию биосинтеза рекомбинантного белка проводили добавлением 1 мл раствора 100 мМ ИПТГ. Продолжали культивировать на протяжении 5 ч. Биомассу собирали центрифугированием: 4000 об/мин, 10 мин (центрифуга Avanti, ротор JLA-16-250, США).
Полученную биомассу ресуспендировали в 4 мл фосфатно-солевого буфера, содержащего 10 мМ имидазола и 8 М мочевину (pH 8.0), обрабатывали ультразвуком на ультразвуковой установке для лизиса клеток Cole-Parmer. Режим работы: мощность 35 Вт, 5 импульсов по 30 с промежуточным охлаждением во льду 1 мин. Лизат центрифугировали при 10000 об/мин в течение 10 мин, (центрифуга Eppendorf mini Spin plus, ротор f-45-12-11). Супернатант наносили на уравновешенную колонку с Ni-NTA-смолой (1 мл). После промывки связавшийся белок элюировали фосфатно-солевым буфером, содержащим 8 М мочевину и 250 мМ имидазола. Перед использованием белок переводили в фостфатно-солевой буфер диализом с одной сменой буфера. Концентрацию белка в растворе измеряли методом М. Бредфорд [7]. Для анализа препаратов рекомбинантных белков использовали их разделение в 12 % полиакриламидном денатурирующем электрофорезе по методике, описанной в работе [8].
Расчетные молекулярные массы flagG-protE (101275.08 Да) и protE (47832.62 Да) хорошо коррелируют с полученными в эксперименте. На электрофореграмме (фиг. 3) видно, что на дорожке FE белковая полоса имеет подвижность около 100 кДа, а на дорожке Е - около 50 кДа. Кроме того, белковые полосы не имеют видимых примесей, что свидетельствует о чистоте полученных препаратов flagG-protE и protE.
Секвенирование плазмиды pHis6-flagG-protE подтвердило отсутствие мутаций и правильность сборки конструкции. На фиг. 4 приведена определенная нуклеотидная последовательность ДНК (SEQ ID NO: 1), кодирующей белок flagG-protE, а на фиг. 5 представлена выведенная аминокислотная последовательность (SEQ ID NO: 2) рекомбинантного белка flagG-protE.
Пример 3. Оценка антигенности рекомбинантного белка flagG-protE.
Антигенные характеристики рекомбинатного белка flagG-protE оценивали по его способности к связыванию с моноклональными антителами (МКА) против ВКЭ в иммуноферментном анализе с панелью из восьми моноклональных антител, полученных к вирусному гликопротеину Е. Моноклональные антитела (МКА) против ВКЭ получали с использованием гибридов, описанных ранее [9-11]. В качестве контроля использовали рекомбинантныей белок protE, а также вирусные антигены прототипных штаммов трех основных генотипов ВКЭ (европейского, сибирского и дальневосточного).
Иммуноферментный анализ (ИФА) проводили по общепринятым методикам с применением инактивированных вирусных и рекомбинантных антигенов [12]. С этой целью в лунки полистироловых планшетов вносили по 100 мкл очищенного антигена в концентрации 5-10 мкг/мл и сорбировали при 4°C в течение ночи. Места неспецифического связывания насыщали 0.5 % раствором казеина в буфере ТСБ-Твин (0.145 М хлористого натрия, 20 мМ трис-HCl, 5 мМ PMSF (Sigma, США), содержащем 0.1 % Твин 20 (Serva, Германия), pH 7.4), в течение 1 часа при 37°С. Затем инкубировали с МКА в течение 1 часа при 37°С. Специфическое связывание выявляли антивидовыми меченными пероксидазой хрена антителами против IgG. В качестве хромогена использовали раствор О-фенилендиамина (1 мг/мл орто-фенилендиамина, 0.03 % перекиси водорода) в цитратно-фосфатном буфере (0.2 M лимонной кислоты, 0.5 M Na2HPO4, pH 5.0). Выдерживали 20 мин в темноте, останавливали реакцию добавлением 100 мкл 1 N HCl на лунку и измеряли оптическую плотность на спектрофотометре Uniscan (Финляндия) со светофильтром с максимумом пропускания 450 нм.
Результаты ИФА приведены в табл. 1, в которой представлено взаимодействие моноклональных антител с рекомбинантными белками protE и flagG-protE и вирусными антигенами прототипных штаммов трех основных генотипов ВКЭ (европейский, штамм Абсеттаров, KJ000002*; сибирский, штамм С11-13, MF043953*; дальневосточный, штаммы 205, JX498939* и 4072, KF951037*), где антиген сорбирован на плашку - 200 нг/лунку; МКА к белку Е ВКЭ взяты в разведении 1:300; значения оптической плотности соответствуют: «+» - от 0.3 до 0.8; «++» - от 0.8 до 1.5; «+++» - более 1.5; н.и. - не исследовали; * - номер полногеномной последовательности штамма ВКЭ в GenBank.
Использованный антиген был получен путем лизирования очищенного штамма ВКЭ [1] из музея вирусных штаммов Федерального бюджетного учреждения науки государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора после проведения полногеномного секвенирования.
По результатам анализа установлено, что панель из восьми моноклональных антител выявляла соответствующие эпитопы рекомбинантного белка protE. Это свидетельствует об антигенной структуре исследуемого рекомбинантного гибридного белка, схожей с антигенной структурой нативного вирусного белка Е ВКЭ. Гибридный белок flagG-protE проявляет свои антигенные свойства аналогично рекомбинантному protE и нативному белку Е вируса клещевого энцефалита, однако только пять видов МКА взаимодействовали с гибридным белком flagG-protE. МКА 4F6, 7F10 и 6B9 не узнавали эпитоп в гибридном белке при его наличии в составе белка protE. Идентичность аминокислотной последовательности фрагмента белка Е в двух рекомбинантных полипептидах позволяет предположить, что эпитопы для МКА 4F6, 7F10 и 6B9 сохраняются в гибридном белке и, по всей вероятности, прикрыты полипептидной цепью флагеллина.
Принципиально важно отметить, что МКА 13F6, EB1, E6B и 10Н10 взаимодействовали с гибридной рекомбинантной молекулой flagG-protE белка. МКА 13F6, EB1, E6B опознавали эпитопы домена III белка Е, расположенного между 273-429 а.о. Домен III флавивирусов обеспечивает индукцию вируснейтрализующих антител и рецепторное взаимодействие [13]. МКА 10Н10 распознают так называемый пептид слияния, расположенный в районе 98-113 а.о., который является высококонсервативным для большинства флавивирусов [2]. Этот район обеспечивает рецепторное взаимодействие вирусной частицы с ламининсвязывающим белком, участвует в процессе взаимодействия клеточных и вирусных мембран и формирует протективный иммунный ответ в организме [13]. Сохранность конформации эпитопов домена III и пептида слияния флавивирусов в составе гибридного белка позволяет предположить, что гибридный белок flagG-protE будет способен индуцировать образование вируснейтрализующих и антирецепторных антител и тем самым формировать полноценный противовирусный иммунитет, защищающий организм от развития инфекционного процесса. При этом флагеллин в составе гибридной молекулы будет дополнительно обладать сильными адъювантными свойствами, что сформирует выраженный и продолжительный противовирусный иммунитет. Эти свойства гибридного белка flagG-protE дают основание рассматривать его как весьма перспективный для создания кандидатной вакцины против клещевого энцефалита.
Пример 4. Оценка иммунногенности рекомбинантного белка flagG-protE на линии мышей BALB/c.
В эксперименте по иммунизации использовались 32 мыши линии BALB/c. Мыши разделены на 4 группы по 8 особей. Каждая группа содержалась в отдельной клетке. Корм и вода доступны без ограничений.
Первая группа - отрицательный контроль. Вводили физраствор с неполным адьювантом Фрейнда подкожно. Вторая группа - опыт. Иммунизация flagG-protE с неполным адьювантом Фрейнда подкожно. Третья группа - опыт. Иммунизация protE с неполным адьювантом Фрейнда подкожно. Четвертая группа - положительный контроль. Иммунизация официально применяемой вакциной против ВКЭ «Клещ-Э-ВАК». Вводили 0.5 мл подкожно (одна доза для иммунизации человека). Рекомбинантные белки вводили в дозе 6 мкг на иньекцию, что сравнимо с дозой вирусного антигена вакциной против ВКЭ «Клещ-Э-ВАК». Проведено три иммунизации (1, 22 и 42 дни), забор крови через 56 дней. Полученные сыворотки исследовали на взаимодействие с антигенами, использованными в эксперименте, в иммуноферментном анализе по схеме аналогичной схеме и приведенной в примере 3. В табл. 2 приведена иммуногенность рекомбинантного белка flagG-protE при трехкратной иммунизации мышей линии BALB/c.
Из таблицы 2 видно, что все полученные сыворотки содержат антивирусные антитела. Сыворотки, полученные при иммунизации коммерческой вакциной, имеют титр на вирусные белки от 1/2700 (один пул сывороток) до 1/8100 (остальные 3 пула сывороток). Кроме этого, эти сыворотки содержат антитела, которые опознают рекомбинантные антигены protE (1/2700 до 1/8100) и flagG-protE (1/300-1/8100).
Сыворотки, полученные на антиген flagG-protE, реагируют с вирусными белками КЭ в титре 1/2700, с белком protE в титре 1/72900. А на «свой» антиген flagG-protE в титре 1/656100.
Это позволяет сделать следующие выводы:
- антитела, образовавшиеся на «природный» инактивированный вирус в виде коммерческой вакцины одинаково реагируют как с вирусом, так и с рекомбинантными антигенами. Скорее всего, при вакцинации вакциной «Клещ-Э-ВАК» формируется титр антител, не превышающий каких-то определенных значений. Об этом говорит тот факт, что все антигены опознаются в примерно в равном титре и значения титра не превышают 1/8100;
- рекомбинатный антиген flagG-protE и protE формируют гораздо более высокий титр антител - до 1/656100;
- антитела, полученные при иммунизации мышей рекомбинантными антигенами, реагируют с нативным вирусом КЭ;
- использование flagG-protE в качестве кандидатной вакцины против ВКЭ имеет очень хорошие перспективы.
Таким образом, препарат flagG-protE, предложенный в качестве кандидатной вакцины против ВКЭ, обладает высокой иммуногенностью и способен индуцировать образование антивирусных антител в высоких титрах при использовании в дозах, сравнимых с дозами вирусного антигена в коммерческой вакцине «Клещ-Э-ВАК». Предлагаемый препарат flagG-protE может быть использован для формирования иммунитета против вируса клещевого энцефалита и конструирования рекомбинантных вакцин против одноименной вирусной инфекции.
Источники научно-технической и патентной информации
1. Leonova G.N., Ternovoi V.A., Pavlenko E.V., Maistrovskaya O.S., Protopopova E.V., Loktev V.B. Evaluation of vaccine Encepur® adult for induction human neutralizing antibodies against recent Far Eastern subtype strains of tick-borne encephalitis virus. Vaccine. 2007; 25(5): 895-901. DOI: https://doi.org/10.1016/j.vaccine.2006.09.014.
2. Morozova O.V., Bakhvalova V.N., Potapova O.F., Grishechkin A.E., Isaeva E.I., Aldarov K.V., Klinov D.V., Vorovich M.F. Evaluation of immune response and protective effect of four vaccines against the tick-borne encephalitis virus. Vaccine. 2014; 32(25): 3101-3106. DOI: 10.1016/j.vaccine.2014.02.046.
3. Yoshii K., Song J.Y., Park S.B., Yang J., Schmitt H.J. Tick-borne encephalitis in Japan, Republic of Korea and China. Emerg Microbes Infect. 2017; 6(9): e82. DOI: 10.1038/emi.2017.69.
4. Heinz F.X., Stiasny K. Flaviviruses and their antigenic structure. J ClinVirol. 2012; 55(4): 289-295. DOI: 10.1016/j.jcv.2012.08.024.
5. McDonald W.F., Huleatt J.W., Foellmer H.G., Hewitt D., Tang J., Desai P., Price A., Jacobs A., Takahashi V.N., Huang Y., Nakaar V., Alexopoulou L., Fikrig E., Powell T.J. A West Nile virus recombinant protein vaccine that coactivates innate and adaptive immunity. J Infect Dis. 2007; 195(11): 1607-1617.
6. Патент РФ №2136754, МПК C12N 15/40, опубл. 10.09.1999 г. (прототип).
7. Bradford M.M. A rapid and sensitive method for the quantation microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976; 72: 248-254.
8. Laemmli U.K. Cleavage of structural proteins during the assembly of thehead of bacteriophage T4. Nature. 1970; 227: 680-685.
9. Гайдамович С.Я., Локтев В.Б. и др. Моноклональные антитела, перекрестно реагирующие с ВКЭ и вирусом ВЭЛ. Вопросы вирусологии. 1990; 35(3): 221-225.
10. Протопопова Е.В., Локтев В.Б., Хусаинова А.Д., Коновалова С.Н. Получение и характеризация антиидиотипических антител, несущих на своей поверхности гемагглютинирующие паратопы ВКЭ. Вопросы вирусологии. 1996; 41(2): 50-63.
11. Романова Л.Ю., Гмыль Л.В, Локтев В.Б., Протопопова Е.В., Дживанян Т.И., Лашкевич В.А., Карганова Г.Г. Изменение антигенной структуры поверхностного гликопротеина Е вируса клещевого энцефалита при его адаптации к клещам и млекопитающим. Вопросы вирусологии. 2006; 51(6): 31-34.
12. Разумов И.А., Агапов Е.В., Перебоев А.В., Протопопова Е.В., Лебедева С.Д., Локтев В.Б. Изучение антигенной структуры гликопротеина Е2 вируса ВЭЛ с помощью крысиных моноклональных антител. Вопросы вирусологии. 1991; 36(1): 34-37.
13. Ershova А.S., Gra O.A., Lyaschuk A.M., Grunina T.M., Tkachuk A.P., Bartov M.S., Savina D.M., Sergienko O.V., Galushkina Z.M., Gudov V.P., Kozlovskaya L.I., Kholodiliv I.S., Gmyl L.V., Karganova G.G., Lunin V.G., Karyagina A.S., Gintsburg A.L. Recombinant domains III of Tisk-Borne Encephalitis Virus envelope protein in combination with dextran and CpGs induce immune response and partical protectiveness against TBE virus infection in mice. BMC Infect. Dis. 2016; 16(1): 544. DOI 10.1016/j. Vaccine. 2011.06.092.
Таблица 1.
|
Таблица 2.
|