Результат интеллектуальной деятельности: КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ ГЕНА TMPRSS6
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
Это предварительная заявка Соединенных Штатов 61/468830, поданная 29 марта 2011 г., и предварительная заявка Соединенных Штатов 61/568942, поданная 9 декабря 2011 г. Эти предшествующие заявки включены в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Это изобретение относится к специфическому ингибированию экспрессии гена TMPRSS6.
Известный уровень техники
TMPRSS6 (трансмембранная протеаза, серин 6) кодирует сериновую протеазу типа II и экспрессируется главным образом в печени. TMPRSS6 влияет на уровни железа в печени путем связывания и протеолитического расщепления активатора гепцидина и корецептора HJV (гемоювелина) BMP, который осуществляет негативную регуляцию уровней гепцидина.
TMPRSS6 состоит из короткого N-концевого внутрицитоплазматического хвоста, трансмембранного домена типа II, стволовой области, состоящей из двух внеклеточных доменов CUB (фактора комплемента C1s/C1r, эмбрионального фактора роста морского ежа и BMP (морфогенного белка кости)), трех доменов LDLR (рецепторов класса А липопротеидов низкой плотности) и С-концевого трипсиноподобного домена сериновой протеазы. Существуют также консенсусные сайты для N-гликозилирования во внеклеточном домене и сайт потенциального фосфорилирования в области внутрицитоплазматического хвоста.
Краткое изложение сущности изобретения
В настоящем изобретении описываются композиции и способы, которые влияют на расщепление транскриптов РНК гена TMPRSS6, опосредуемое индуцируемым РНК комплексом сайленсинга (RISC), например, в клетке или у млекопитающего. Описываются также композиции и способы лечения патологических состояний и заболеваний, вызываемых экспрессией гена TMPRSS6, таких как нарушение, характеризуемое избытком железа (например, талассемия, например, промежуточная β-талассемия или α-талассемия). Описываются также композиции и способы снижения или предотвращения поглощения или мобилизации железа, что тем самым облегчает избыточную нагрузку железом при определенных патологических состояниях. Описанные в настоящем документе способы и композиции обычно пригодны для лечения гемохроматоза (накопления железа в организме).
При применении в настоящем описании термин «iRNA» относится к агенту, который содержит РНК, в том виде, в котором термин определен в настоящем описании, и который опосредует направленное расщепление транскрипта РНК через путь индуцируемого РНК комплекса сайленсинга (RISC). В одном варианте осуществления iRNA, как описано в настоящем документе, ингибирует экспрессию TMPRSS6 в клетке или у млекопитающего. Альтернативно, в другом варианте осуществления iRNA позитивно регулирует экспрессию TMPRSS6 в клетке или у млекопитающего.
iRNA, включенные в композиции, охарактеризованные в настоящем документе, охватывают двухцепочечные РНК (dsRNA), имеющие цепь РНК (антисмысловую цепь), обладающую областью, которая составляет 30 нуклеотидов или менее, обычно 19-24 нуклеотида в длину, которая по существу комплементарна, по меньшей мере, части транскрипта мРНК гена TMPRSS6. В одном варианте осуществления dsRNA включает область, по меньшей мере, из 15 непрерывных нуклеотидов.
В одном варианте осуществления iRNA для ингибирования экспрессии гена TMPRSS6 включает, по меньшей мере, две последовательности, которые комплементарны друг другу. iRNA включает смысловую цепь, имеющую первую последовательность, и антисмысловую цепь, имеющую вторую последовательность. Антисмысловая цепь включает нуклеотидную последовательность, которая по существу комплементарна, по меньшей мере, части мРНК, кодирующей TMPRSS6, и область комплементарности состоит в длину из 30 нуклеотидов или менее и, по меньшей мере, из 15 нуклеотидов. Обычно iRNA имеет в длину от 19 до 24, например, от 19 до 21 нуклеотида. В некоторых вариантах осуществления iRNA имеет в длину от приблизительно 15 до приблизительно 25 нуклеотидов, а в других вариантах осуществления iRNA имеет в длину от приблизительно 25 до приблизительно 30 нуклеотидов. iRNA при контактировании с клеткой, экспрессирующей TMPRSS6, ингибирует экспрессию гена TMPRSS6, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40% или более, например, при тестировании описанным в настоящем документе методом. В одном варианте осуществления iRNA TMPRSS6 составлена в виде стабильной липидной частицы с нуклеиновой кислотой (SNALP).
В одном варианте осуществления iRNA, охарактеризованная в настоящем описании, включает первую последовательность dsRNA, которая выбрана из группы, состоящей из смысловых последовательностей таблиц 2, 3 или 4, и вторую последовательность, которая выбрана из группы, состоящей из соответствующих антисмысловых последовательностей таблиц 2, 3 или 4. Молекулы iRNA, охарактеризованные в настоящем описании, могут включать природные нуклеотиды или могут включать, по меньшей мере, один модифицированный нуклеотид, включая, но не ограничиваясь этим, 2'-O-метил-модифицированный нуклеотид, нуклеотид, имеющий 5’-фосфоротиоатную группу, и концевой нуклеотид, связанный с холестериловым производным. Альтернативно, модифицированный нуклеотид может быть выбран из группы 2'-дезокси-2'-фтор-модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, абазического нуклеотида, 2’-амино-модифицированного нуклеотида, 2’-алкил-модифицированного нуклеотида, морфолинонуклеотида, фосфорамидата и нуклеотида, включающего неприродное основание. Обычно такая модифицированная последовательность должна базироваться на первой последовательности указанной iRNA, выбранной из группы, состоящей из смысловых последовательностей таблиц 2, 3 или 4 и второй последовательности, выбранной из группы, состоящей из антисмысловых последовательностей таблиц 2, 3 или 4.
В одном варианте осуществления iRNA, охарактеризованная в настоящем описании, включает смысловую цепь dsRNA TMPRSS6, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO:111, SEQ ID NO:455, SEQ ID NO:109, SEQ ID NO:524, SEQ ID NO:89, SEQ ID NO:494, SEQ ID NO:445, SEQ ID NO:592, SEQ ID NO:47 и SEQ ID NO:540; и антисмысловую цепь, состоящую из последовательности, выбранной из группы, состоящей из SEQ ID NO:112, SEQ ID NO:456, SEQ ID NO:110, SEQ ID NO:525, SEQ ID NO:90, SEQ ID NO:495, SEQ ID NO:446, SEQ ID NO:593, SEQ ID NO:48 и SEQ ID NO:541.
В другом варианте осуществления композицию, содержащую dsRNA, направленную на TMPRSS6, вводят индивидууму, который имеет повышенные уровни железа, например, повышенные уровни железа в печени. Индивидуум, который имеет повышенные уровни железа, может быть идентифицирован как индивидуум, который имеет повышенные уровни железа в сыворотке (например, выше 350 мкг/мл, выше 500 мкг/мл или выше 1000 мкг/мл или более), повышенные уровни ферритина в сыворотке или уровень насыщения трансферрина выше 40%, выше 45%, выше 50%, выше 60% или более.
На перегрузку железом от слабой до умеренной указывают уровни ферритина в сыворотке 300-2500 мкг/л, тогда как уровни >2500 мкг/л связаны с повышенным риском заболеваний сердца. Сывороточный ферритин >1000 мкг/л, как показано, связан с неблагоприятными исходами как при первичной так и при вторичной перегрузке железом. Сывороточные уровни ферритина выше 200 мкг/л у женщин в пременопаузе и 300 мкг/л у мужчин и женщин в постменопаузе указывает на первичную перегрузку железом, обусловленную гемохроматозом, а уровни ферритина выше 1000 мкг/л обычно предполагают повреждение печени из-за перегрузки железом. Индивидуум, имеющий сывороточный уровень ферритина выше 300 мкг/л, 500 мкг/л, 1000 мкг/л, 1500 мкг/л, 2000 мкг/л, 2500 мкг/л или более, является кандидатом для лечения dsRNA, направленной на TMPRSS6.
В другом варианте осуществления композицию, содержащую dsRNA, направленную на TMPRSS6, вводят индивидууму, который имеет повышенные уровни трансферрина, например, уровни трансферрина выше 400 мг/дл, выше 500 мг/дл, выше 1000 мг/дл или более).
Уровни железа могут быть также измерены с помощью метода TIBC (суммарной железосвязывающей способности). В методе TIBC измеряют количество железа, которое должна нести кровь, если трансферрин был полностью насыщен. Так как трансферрин продуцируется печенью, метод TIBC может быть использован для мониторинга функции печени и питания. Индивидуум, имеющий величины TIBC выше 400 мкг/дл, выше 500 мкг/дл или выше 1000 мкг/дл или более, является кандидатом для лечения dsRNA, направленной на TMPRSS6.
В одном варианте осуществления введение dsRNA снижает уровни железа, например, в печени или в сыворотке, по меньшей мере, на 5%, например, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60% или более. В некоторых вариантах осуществления одно или более из уровней ферритина в сыворотке, уровней трансферрина в сыворотке, уровней насыщения трансферрина или величин TIBC снижается, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50% или, по меньшей мере, на 60% или более по сравнению с уровнями до лечения. В другом варианте осуществления снижение уровней железа, снижение уровней ферритина, снижение уровней трансферрина или насыщения трансферрина, или снижение величин TIBC поддерживается, по меньшей мере, в течение 5, 10, 20, 30 или 40 дней или более.
В одном варианте осуществления индивидуума выбирают, по меньшей мере, частично, на основе необходимости снижения уровней железа (в противоположность единственному выбору больного на основе того, кто, как оказывается, нуждается в этом).
В одном варианте осуществления iRNA, как описано в настоящем документе, направлена на РНК-транскрипт TMPRSS6 дикого типа, а в другом варианте осуществления iRNA направлена на мутантный транскрипт (например, РНК TMPRSS6, несущей аллельный вариант). Например, iRNA, охарактеризованная в изобретении, может быть направлена на полиморфный вариант, такой как при полиморфизме по единственному нуклеотиду (SNP) TMPRSS6. В другом варианте осуществления iRNA направлена как на транскрипт дикого типа, так и на мутантный транскрипт TMPRSS6. В еще одном варианте осуществления iRNA направлена на вариант транскрипта TMPRSS6.
В одном варианте осуществления iRNA, охарактеризованная в изобретении, направлена на некодирующую область РНК-транскрипта TMPRSS6, такую как 5'- или 3'-нетранслируемая область.
В одном варианте осуществления iRNA, охарактеризованная в изобретении, доставляется к печени, например, к гепатоцитам печени или к купферовым клеткам, например, к гипертрофированным купферовым клеткам.
В одном аспекте в вариантах осуществления, охарактеризованных в этом изобретении, предлагается клетка, содержащая, по меньшей мере, одну из iRNA, охарактеризованных в изобретении. Клетка обычно представляет собой клетку млекопитающего, такую как клетка человека.
В другом аспекте в вариантах осуществления, охарактеризованных в этом изобретении, предлагается фармацевтическая композиция для ингибирования экспрессии гена TMPRSS6 в организме, обычно у индивидуума, являющегося человеком. Композиция обычно включает одну или более iRNA, описанных в настоящем документе, и фармацевтически приемлемый носитель или носитель для доставки. В одном варианте осуществления композиция используется для лечения нарушения, которое обусловливает повышенные уровни железа, например, гемохроматоза. Например, композиция пригодна для лечения талассемии, такой как промежуточная β-талассемия.
В другом варианте осуществления фармацевтическую композицию составляют для введения по описанной в настоящем документе схеме дозирования, например, не более одного раза каждые два месяца, не более одного раза в месяц, не более двух раз в месяц, не более одного раза каждые четыре недели, не более одного раза каждые три недели, не более одного раза каждые две недели или не более одного раза каждую неделю. В другом варианте осуществления введение фармацевтической композиции может поддерживаться в течение месяца или более, например, одного, двух, трех или шести месяцев, или одного года, или пяти лет, или десяти лет или более, включая оставшуюся продолжительность жизни индивидуума.
В другом варианте осуществления композицию, содержащую iRNA, описанную в настоящем документе, например, dsRNA, направленную на TMPRSS6, вводят с терапевтическим агентом, не являющимся iRNA, таким как известный агент для лечения гемохроматоза или нарушения, которое вызывает гемохроматоз, такого как талассемия. Например, iRNA, охарактеризованную в изобретении, можно вводить с агентом для лечения β-талассемии, например, промежуточной β-талассемии, или другого нарушения, связанного с повышенными уровнями железа.
В другом варианте осуществления iRNA TMPRSS6 вводят больному и затем больному вводят агент, не являющийся iRNA (или наоборот). В другом варианте осуществления iRNA TMPRSS6 и агент, не являющийся iRNA, вводят в одно и то же время. В одном варианте осуществления агент представляет собой, например, агент, который влияет на уровни железа, такой как хелатирующий агент для железа (например, дезферриоксамин) или фолиевая кислота.
В другом аспекте в настоящем описании предлагается способ ингибирования экспрессии гена TMPRSS6 в клетке с помощью осуществления следующих стадий:
(a) введения в клетку двухцепочечной рибонуклеиновой кислоты (dsRNA), где dsRNA включает, по меньшей мере, две последовательности, которые комплементарны друг другу. dsRNA имеет смысловую цепь, обладающую первой последовательностью, и антисмысловую цепь, обладающую второй последовательностью; антисмысловая цепь имеет область комплементарности, которая по существу комплементарна, по меньшей мере, части мРНК, кодирующей TMPRSS6, и где область комплементарности составляет 30 нуклеотидов или менее, т.е. 15-30 нуклеотидов в длину и обычно 19-24 нуклеотида в длину, и где dsRNA при контактировании с клеткой, экспрессирующей TMPRSS6, ингибирует экспрессию гена TMPRSS6, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40% или более; и
(b) поддержания клетки, полученной на стадии (a), в течение времени, достаточного для достижения разрушения транскрипта мРНК гена TMPRSS6, тем самым ингибируя экспрессию гена TMPRSS6 в клетке.
В другом аспекте в изобретении предлагаются способы и композиции, пригодные для активации экспрессии гена TMPRSS6 в клетке или у млекопитающего.
В другом аспекте в изобретении предлагается способ модуляции экспрессии гена TMPRSS6 в клетке с помощью осуществления следующих стадий:
(a) введения в клетку двухцепочечной рибонуклеиновой кислоты (dsRNA), где dsRNA включает, по меньшей мере, две последовательности, которые комплементарны друг другу. dsRNA имеет смысловую цепь, обладающую первой последовательностью, и антисмысловую цепь, обладающую второй последовательностью; антисмысловая цепь имеет область комплементарности, которая по существу комплементарна, по меньшей мере, части мРНК, кодирующей TMPRSS6, и где область комплементарности составляет 30 нуклеотидов или менее, т.е. 15-30 нуклеотидов в длину и обычно 19-24 нуклеотида в длину, и где dsRNA при контактировании с клеткой, экспрессирующей TMPRSS6, модулирует экспрессию гена TMPRSS6, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40% или более; и
(b) поддержания клетки, полученной на стадии (a), в течение времени, достаточного для достижения разрушения или защиты транскрипта мРНК гена TMPRSS6, тем самым модулируя экспрессию гена TMPRSS6 в клетке.
В одном варианте осуществления способ подходит для ингибирования экспрессии гена в клетке печени, такой как гепатоцит или купферова клетка. В другом варианте осуществления способ подходит для активации экспрессии гена в клетке печени.
В других аспектах в изобретении предлагаются способы лечения, предотвращения, обратного развития или управления патологическими процессами, опосредуемыми экспрессией TMPRSS6, такими как нарушение, связанное с гемохроматозом. В одном варианте осуществления способ включает введение больному, нуждающемуся в таком лечении, предотвращении, обратном развитии или управлении, терапевтически или профилактически эффективного количества одной или более iRNA, охарактеризованных в изобретении. В одном варианте осуществления больной страдает талассемией, такой как промежуточная β-талассемия. В другом варианте осуществления введение iRNA, направленной на TMPRSS6, облегчает или ослабляет у больного тяжесть, по меньшей мере, одного симптома нарушения, опосредуемого TMPRSS6, такого как симптом, связанный с перегрузкой железом, например, боль суставов, боль в брюшной полости или слабость.
В одном аспекте в изобретении предлагается вектор для ингибирования экспрессии гена TMPRSS6 в клетке. В одном варианте осуществления вектор включает, по меньшей мере, одну регуляторную последовательность, оперативно связанную с нуклеотидной последовательностью, которая кодирует, по меньшей мере, одну цепь iRNA, как описано в настоящем документе.
В другом аспекте в изобретении предлагается клетка, содержащая вектор для ингибирования экспрессии гена TMPRSS6 в клетке. Вектор включает регуляторную последовательность, оперативно связанную с нуклеотидной последовательностью, которая кодирует, по меньшей мере, одну цепь одной из iRNA, как описано в настоящем документе.
В еще одном аспекте в изобретении предлагается композиция, содержащая iRNA в сочетании со второй iRNA, направленной на второй ген, вовлеченный в патологический процесс и пригодный для лечения заболевания, например, β-талассемии. Например, вторая iRNA может быть направлена на негативный регулятор гепцидина, такой как фактор, индуцируемый гипоксией, например, HIF-1a или HIF-2a; GDF15 или TWSG1. В одном варианте осуществления вторая iRNA направлена на ген, вовлеченный во второе заболевание, которое является результатом β-талассемии. Например, вторая iRNA может быть направлена на ген, вовлеченный в сахарный диабет, тромбоз или остеопению.
Подробности различных вариантов осуществления изобретения представлены ниже в описании. Другие особенности, цели и преимущества изобретения должны быть ясны из описания и фигур, а также из формулы изобретения.
Описание фигур
Фиг. 1 представляет собой последовательность мРНК TMPRSS6 человека (Ref. Seq. NM_153609.2, 01:56682967, дата регистрации 23 января 2011 г., SEQ ID NO:1).
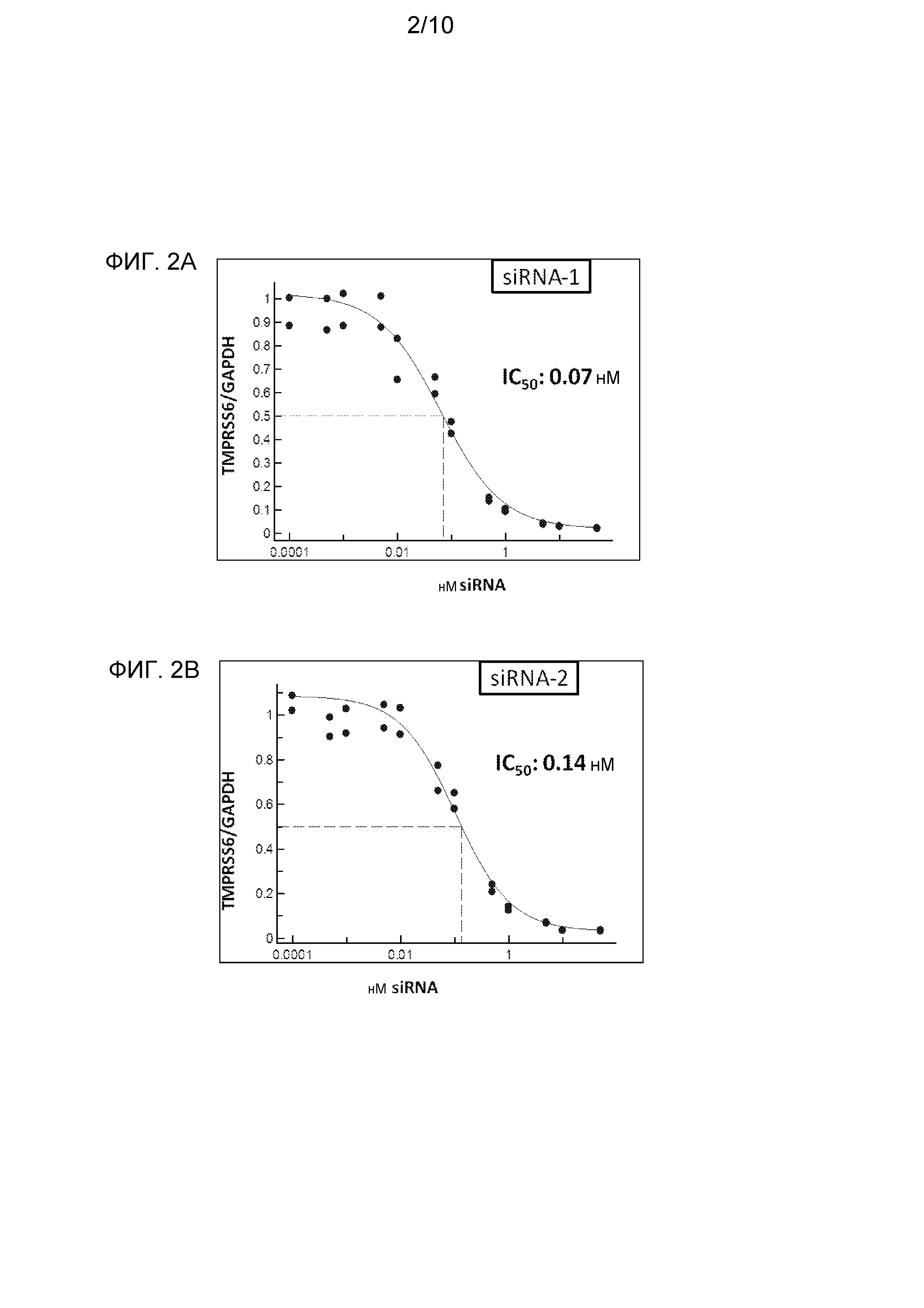
На фиг. 2A и 2B представлена эффективность двух химически модифицированных siRNA, направленных на TMPRSS6, в отношении снижения экспрессии гена TMPRSS6 в первичной культуре гепатоцитов мыши.
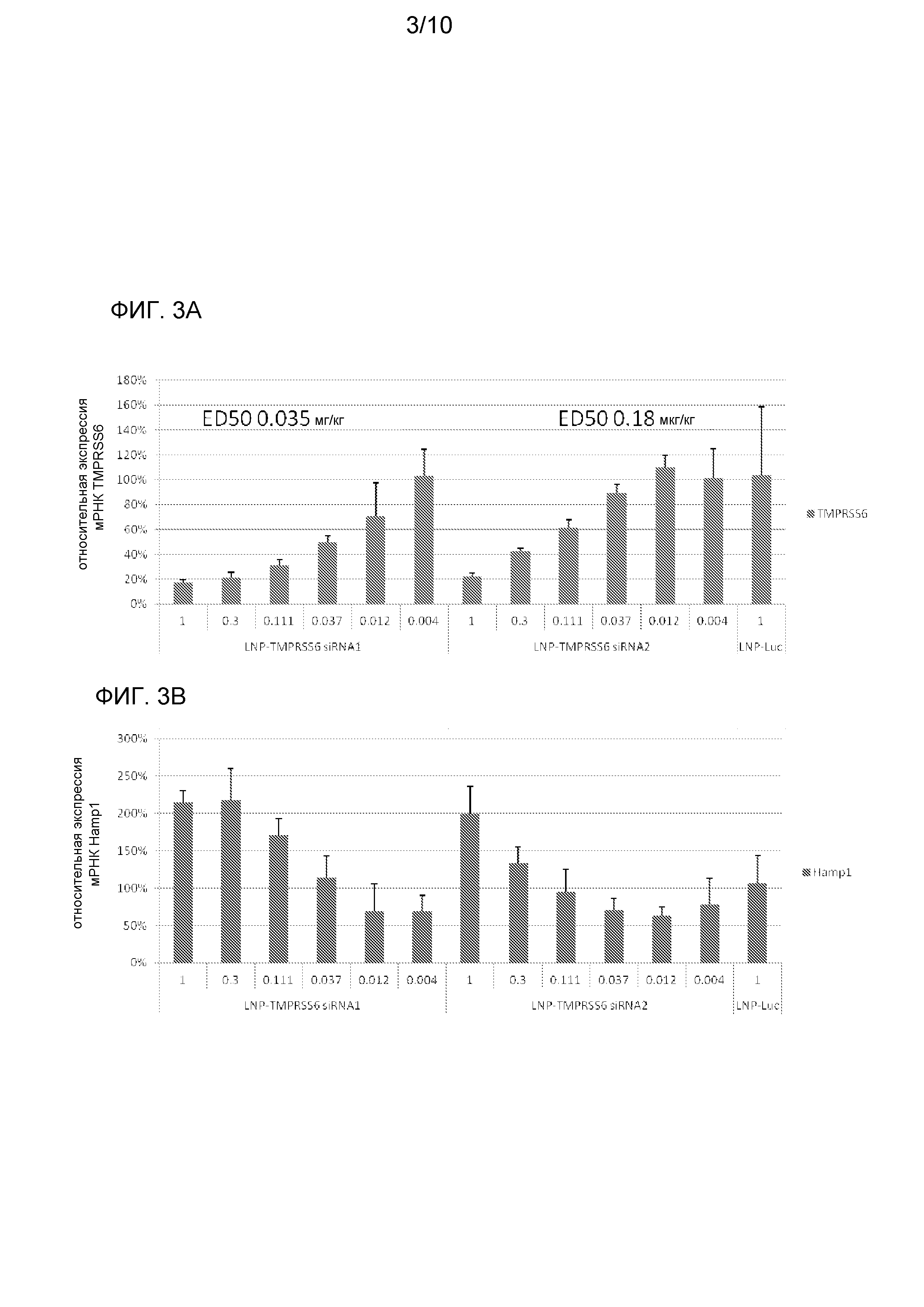
На фиг. 3A и 3B изображено влияние siRNA-1 LNP-TMPRSS6 (AD-46273) и siRNA-2 LNP-TMPRSS6 (AD-46286) на экспрессию генов TMPRSS6 и HAMP1, соответственно, у мышей WT C57BL/6.
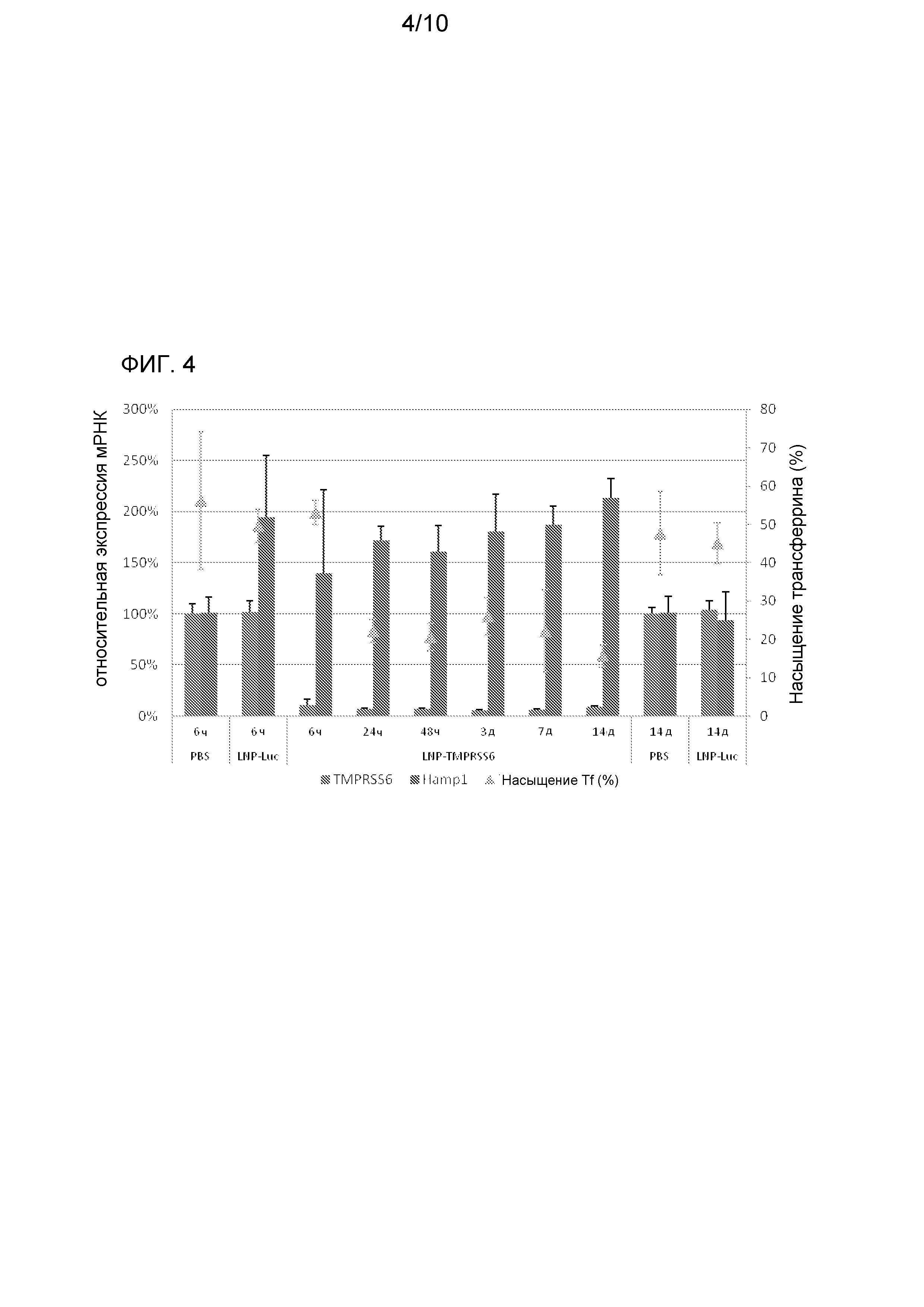
На фиг. 4 изображена продолжительность эффектов, опосредуемых siRNA TMPRSS6, на экспрессию гена TMPRSS6, экспрессию гена HAMP1 и на уровни железа в сыворотке мышей WT C57BL/6.
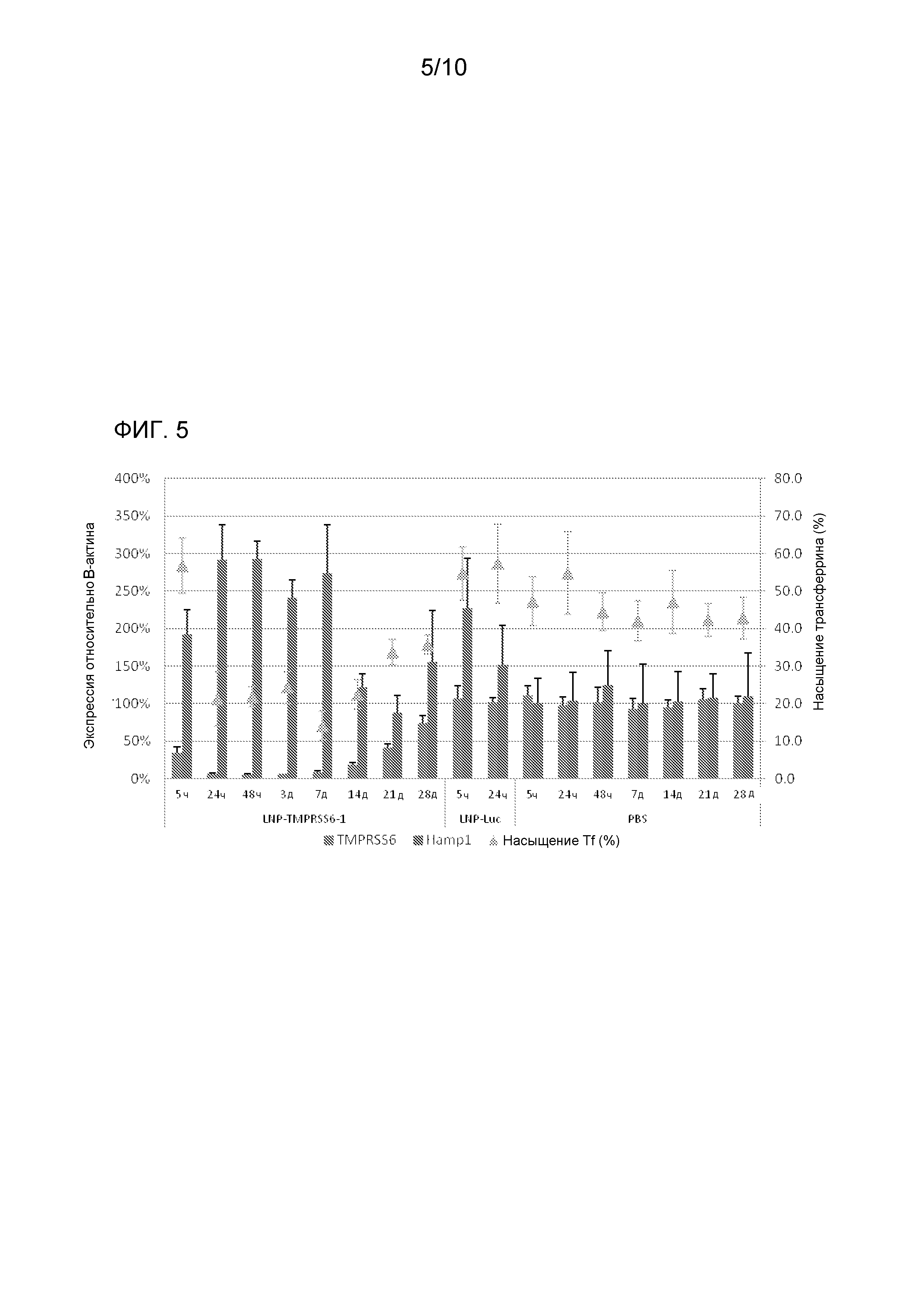
На фиг. 5 изображен уровень опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6, необходимый для поддержания опосредуемого siRNA TMPRSS6 действия на экспрессию гена HAMP1 и уровни железа в сыворотке у мышей WT C57BL/6.
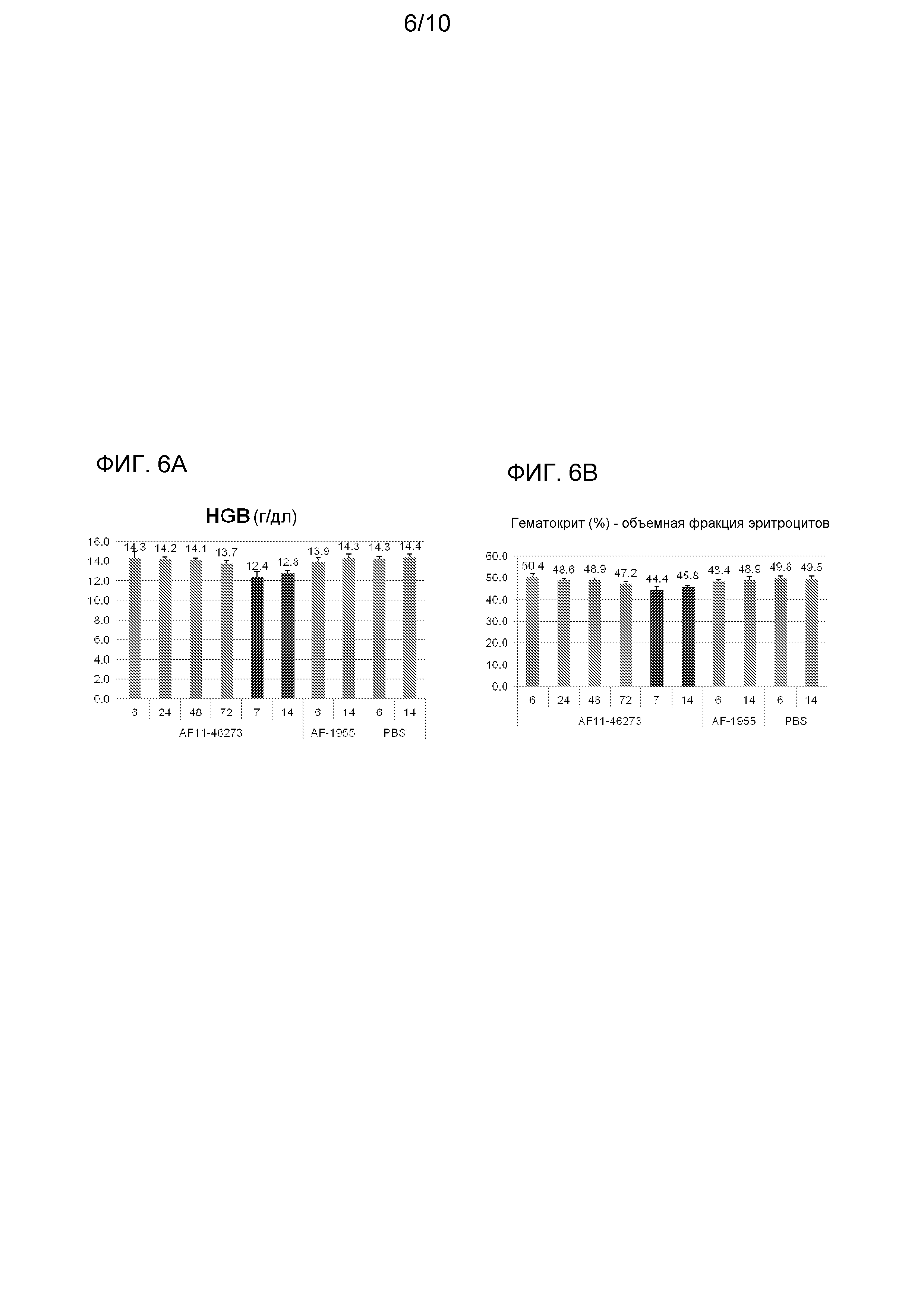
На фиг. 6A и 6B изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические параметры у мышей WT C57BL/6. На фиг. 6A изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гемоглобин (HBG) у мышей WT C57BL/6 через 6 часов, 24 часа, 48 часов, 72 часа, 7 дней и 14 дней после введения. На фиг. 6B изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематокрит у мышей WT C57BL/6 через 6 часов, 24 часа, 48 часов, 72 часа, 7 дней и 14 дней после введения.
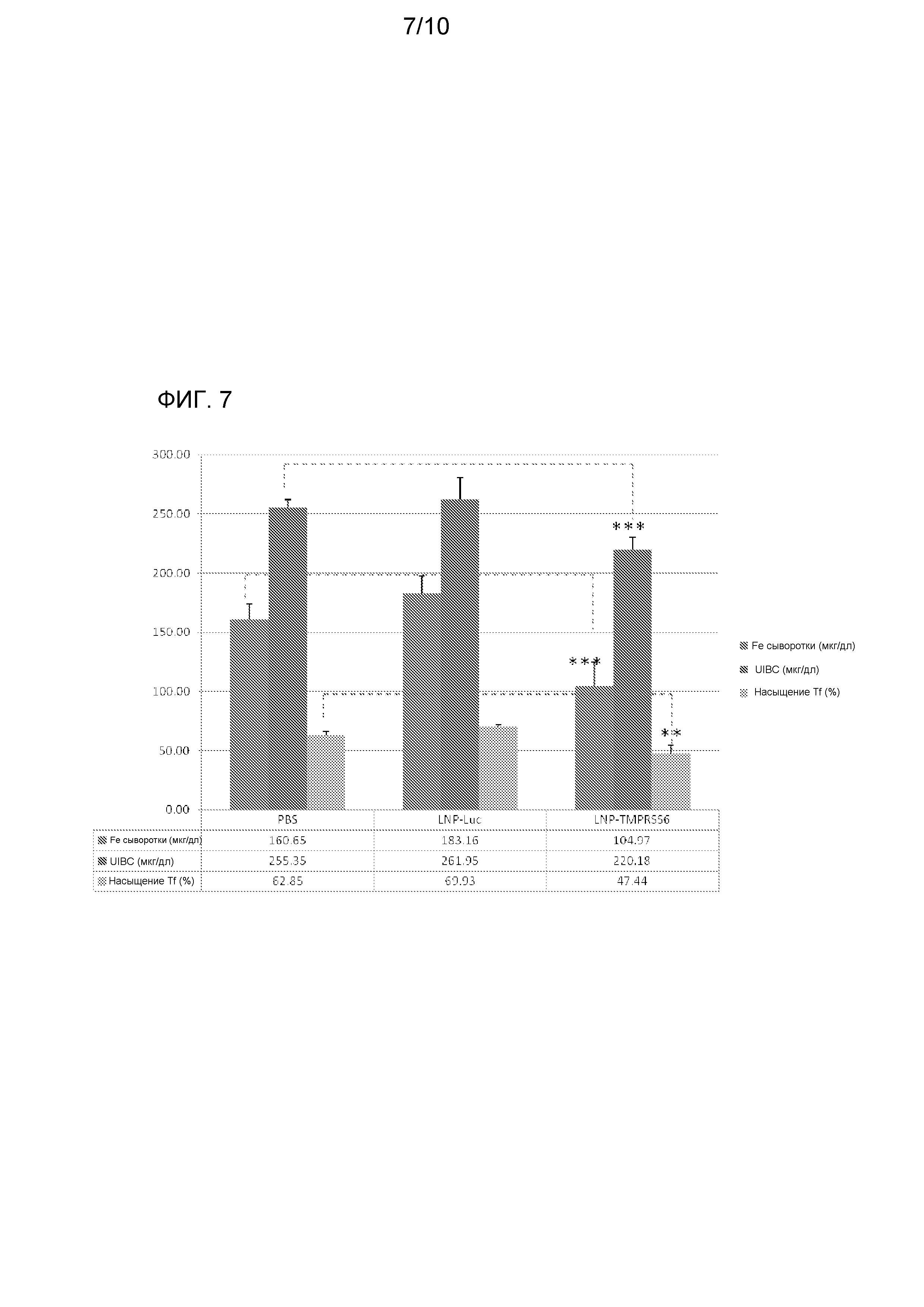
На фиг. 7 изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на показатели уровня железа в сыворотке у мышей с талассемией (Th3/+), включая уровни железа в сыворотке, уровни ненасыщенной железосвязывающей способности (UIBC) и уровни насыщения трансферрина.
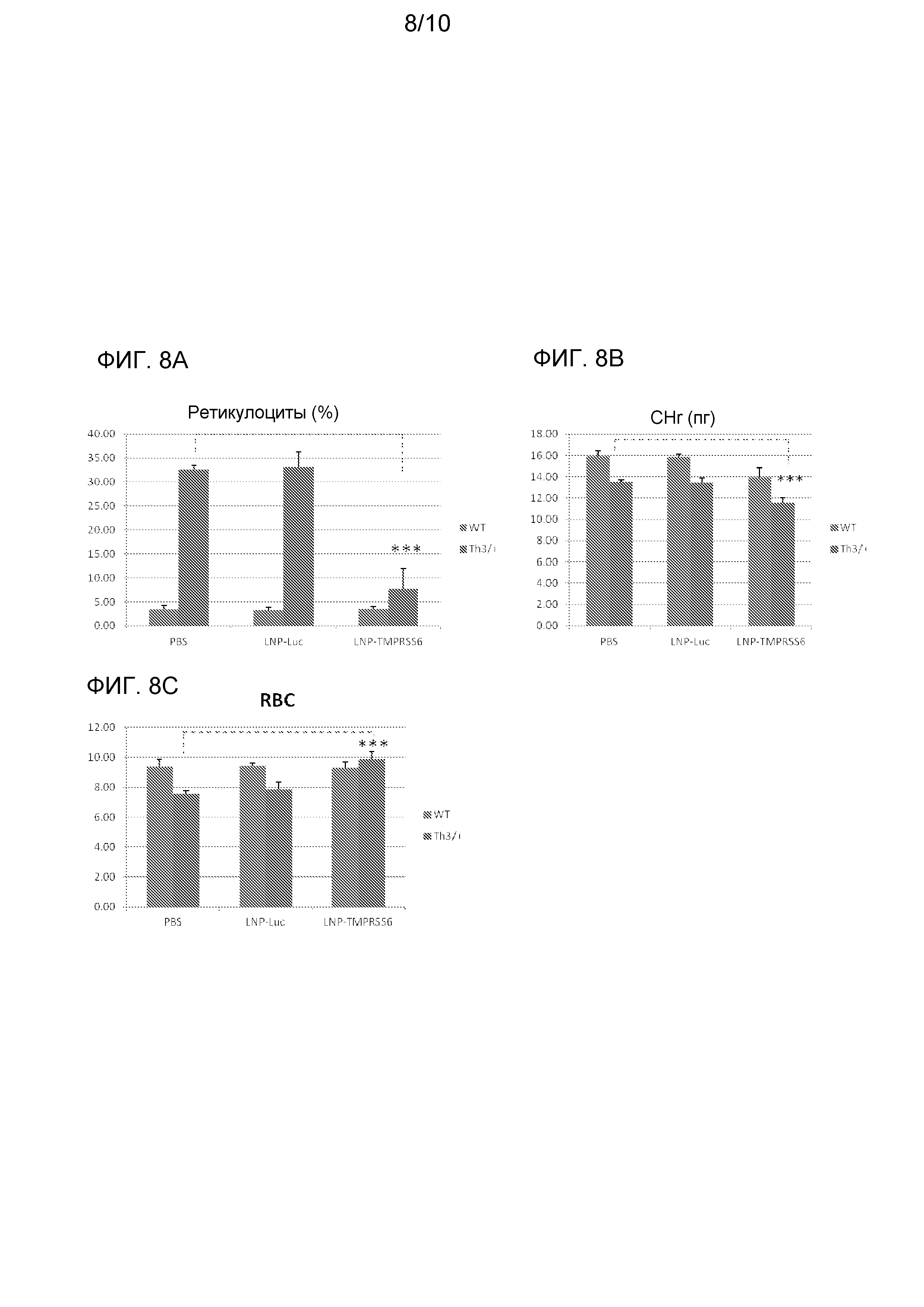
На фиг. с 8A до 8C изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на параметры ретикулоцитов и эритроцитов у мышей с талассемией (Th3/+). На фиг. 8A изображено действие на количество ретикулоцитов (%), на фиг. 8B изображено действие на содержание гемоглобина в ретикулоцитах (CHr), и на фиг. 8C изображено действие на количество зрелых эритроцитов.
На фиг. с 9A до 9D изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические параметры у мышей с талассемией (Th3/+). На фиг. 9A изображено действие на уровни гематокрита (HCT), на фиг. 9B изображено действие на гемоглобин (HGB), на фиг. 9C изображено действие на ширину распределения (RDW) эритроцитов (RBC), и на фиг. 9D изображено действие на среднюю величину эритроцитов (MCV).
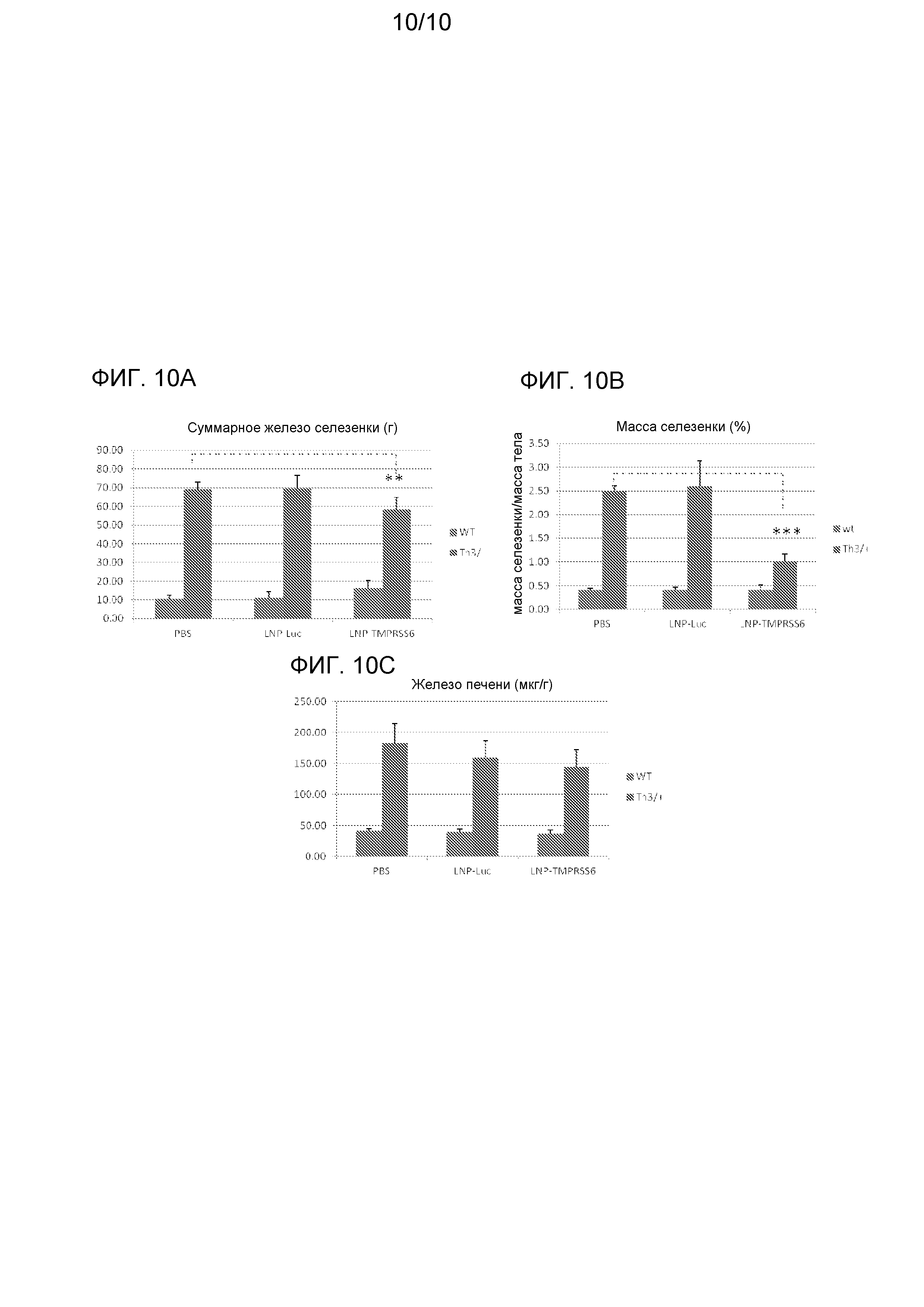
На фиг. с 10A до 10C изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на содержание железа в селезенке и печени мышей с талассемией (Th3/+). На фиг. 10A изображено действие на суммарное содержание железа в селезенке, на фиг. 10B изображено действие на массу селезенки и на фиг. 10C изображено действие опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на концентрацию железа в печени.
Подробное описание изобретения
В настоящем документе описываются iRNA и способы их использования для ингибирования экспрессии гена TMPRSS6 в клетке или у млекопитающего, где iRNA направлена на ген TMPRSS6. Предлагаются также композиции и способы лечения патологических состояний и заболеваний, вызываемых экспрессией гена TMPRSS6, таких как состояния, связанные с повышенными уровнями железа. iRNA управляет специфичной для последовательности деградацией мРНК с помощью процесса, известного как РНК-интерференция (RNAi). В альтернативном варианте осуществления iRNA активирует экспрессию гена TMPRSS6 в клетке или у млекопитающего, где iRNA направлена на ген TMPRSS6.
TMPRSS6 играет важную роль в гомеостазе железа в качестве ингибитора экспрессии гена HAMP. Ген HAMP кодирует печеночный гормон гепцидин, который является центральным регулятором гомеостаза железа. Гепцидин связывается с ферропортином (FPN1), белком-экспортером железа, который локализован главным образом на энтероцитах, осуществляющих всасывание, гепатоцитах и макрофагах. Связывание гепцидина с внеклеточным доменом ферропортина ведет к интернализации и деградации ферропортина, таким способом снижая всасывание пищевого железа из кишечника и высвобождение железа из макрофагов и гепатоцитов. Экспрессия гена HAMP может стимулироваться в ответ на железо через каскад передачи сигнала: морфогенный белок кости (BMP)/транскрипционный фактор «сыновья матерей против декапентаплегического транскрипта (SMAD)», опосредуемый корецептором BMP гемоювелином (HJV). Ключевая роль TMPRSS6 в регуляции HAMP заключается в ингибировании опосредуемой BMP позитивной регуляции HAMP. TMPRSS6 ингибирует опосредуемую BMP позитивную регуляцию HAMP путем расщепления корецептора BMP HJV, который существенен для опосредуемой BMP позитивной регуляции HAMP; предотвращая в результате этого сигнализацию BMP, транслокацию SMAD в ядро и транскрипционную активацию HAMP.
Ряд исследований на человеке и мыши подтвердил роль TMPRSS6 в регуляции HAMP и гомеостазе железа (Du et al. Science 2008, Vol. 320, pp1088-1092; Folgueras et al. Blood 2008, Vol. 112, pp2539-45). Исследования показали, что мутации TMPRSS6 с потерей функции могут вести к позитивной регуляции экспрессии гепцидина, вызывая наследуемую железодефицитную анемию, называемую рефрактерной к железу железодефицитной анемией (IRIDA) (Finberg. Seminars in Hematology 2009, Vol. 46, pp378-86), которая характеризуется повышенными уровнями гепцидина, гипохромной микроцитарной анемией, низким средним объемом эритроцитов (MCV), низким насыщением трансферрина, плохим всасыванием перорального железа и неполным ответом на парентеральное железо. Однако мутации с потерей функции позитивных регуляторов HAMP (например, BMP1, BMP4 и HFE), как показано, негативно регулируют экспрессию гепцидина и вызывают нарушения с перегрузкой железом (Milet et al. Am J Hum Gen 2007, Vol. 81, pp799-807; Finberg et al. Blood 2011, Vol. 117, pp4590-9). При первичных нарушениях с перегрузкой железом, в целом называемых наследственным гемохроматозом (HH), при анемиях, характеризуемых массированным неэффективным гемопоэзом и при перегрузке железом (вторичном гемохроматозе), таком как промежуточная β-талассемия (TI), уровни гепцидина являются низкими, несмотря на повышенные концентрации железа в сыворотке и запасы железа. В мышиной модели промежуточной β-талассемии показано, что потеря экспрессии TMPRSS6 ведет к повышенным уровням гепцидина (Finberg 2010 Oral Presentation: "TMPRSS6, an inhibitor of Hepatic BMP/Smad Signaling, is required for Hepcidin Suppression and Iron Loading in a Mouse Model of β-Thalassemia. American Society of Hematology Annual Meeting 2010, Abstract №: 164).
В настоящем изобретении описываются способы и композиции iRNA для модуляции экспрессии гена TMPRSS6. В определенных вариантах осуществления экспрессию TMPRSS6 снижают или ингибируют с использованием iRNA, специфичной для TMPRSS6, что тем самым приводит к повышению экспрессии HAMP и снижению уровней железа в сыворотке. Таким образом, ингибирование экспрессии или активности гена TMPRSS6 с использованием композиций iRNA, охарактеризованных в изобретении, может быть удобным подходом к лечению, направленному на снижение уровней железа у индивидуума. Такое ингибирование может быть пригодным для лечения нарушений, связанных с повышенными уровнями железа, такими как гемохроматоз или талассемия, например, β-талассемия.
iRNA композиций, описанных в настоящем документе, включают цепь РНК (антисмысловую цепь), имеющую область, которая состоит в длину из 30 нуклеотидов или менее, т.е. из 15-30 нуклеотидов в длину, обычно из 19-24 нуклеотидов в длину, причем область по существу комплементарна, по меньшей мере, части транскрипта мРНК гена TMPRSS6. Применение этих iRNA позволяет осуществлять направленное разрушение мРНК генов, которые вовлечены в патологии, связанные с экспрессией TMPRSS6 у млекопитающих. Очень низкие дозы iRNA TMPRSS6 в частности могут специфично и эффективно опосредовать RNAi, приводя к существенному ингибированию экспрессии гена TMPRSS6. Используя клеточные тест-системы, в настоящем изобретении продемонстрировано, что iRNA, направленные на TMPRSS6, могут специфично и эффективно опосредовать RNAi, приводя к существенному ингибированию экспрессии гена TMPRSS6. Таким образом, способы и композиции, включающие эти iRNA, пригодны для лечения патологических процессов, которые могут опосредоваться негативной регуляцией TMPRSS6, например, для лечения нарушения, которое вызывается повышенными уровнями железа, например, гемохроматоза или β-талассемии, например, промежуточной β-талассемии. В последующем подробном описании раскрывается каким образом получают и используют композиции, содержащие iRNA, для ингибирования экспрессии гена TMPRSS6, а также композиции и способы лечения заболеваний и нарушений, вызываемых экспрессией этого гена.
Варианты осуществления фармацевтических композиций, охарактеризованных в настоящем описании, также включают iRNA, имеющую антисмысловую цепь, включающую область, состоящую в длину из 30 нуклеотидов или менее, обычно из 19-24 нуклеотидов в длину, причем область по существу комплементарна, по меньшей мере, части транскрипта мРНК гена TMPRSS6, совместно с фармацевтически приемлемым носителем. Варианты осуществления композиций, охарактеризованных в изобретении, также включают iRNA, имеющую антисмысловую цепь, обладающую областью комплементарности, которая состоит в длину из 30 нуклеотидов или менее, обычно из 19-24 нуклеотидов в длину, и по существу комплементарна, по меньшей мере, части РНК-транскрипта гена TMPRSS6.
Соответственно, в некоторых аспектах в изобретении охарактеризованы фармацевтические композиции, содержащие iRNA TMPRSS6 и фармацевтически приемлемый носитель, способы использования композиций для ингибирования экспрессии гена TMPRSS6 и способы использования фармацевтических композиций для лечения заболеваний, вызываемых экспрессией гена TMPRSS6.
I. Определения
Для удобства ниже предлагается значение определенных терминов и выражений, используемых в описании, примерах и прилагаемой формуле изобретения. Если существует очевидное различие между использованием термина в других частях настоящего описания и его определением, предлагаемым в этом разделе, определение в этом разделе должно превалировать.
"G," "C," "A," "T" и "U", каждая обычно обозначает нуклеотид, который содержит в качестве основания гуанин, цитозин, аденин, тимидин и урацил, соответственно. Однако должно быть понятно, что термин «рибонуклеотид» или «нуклеотид» может также относиться к модифицированному нуклеотиду, как дополнительно подробно описано ниже, или к суррогатному замещающему компоненту. Специалист в данной области техники хорошо знает, что гуанин, цитозин, аденин и урацил могут быть замещены другими компонентами без существенного изменения свойства образовывать комплементарные пары нуклеотидов у олигонуклеотида, включающего нуклеотид, несущий такой компонент с замещением. Например, без ограничения, нуклеотид, включающий инозин в качестве своего основания, может образовывать комплементарную пару с нуклеотидами, содержащими аденин, цитозин или урацил. Следовательно, нуклеотиды, содержащие урацил, гуанин или аденин, могут быть заменены в нуклеотидных последовательностях dsRNA, охарактеризованных в настоящем описании, например, инозином. В другом примере аденин и цитозин в любом месте олигонуклеотида могут быть заменены на гуанин и урацил, соответственно, с образованием воббл-пары оснований G-U с мРНК-мишенью. Последовательности, содержащие такие замещенные компоненты, подходят для описанных в настоящем документе композиций и способов.
При применении в настоящем описании «трансмембранная протеаза, серин 6» (TMPRSS6) относится к конкретному полипептиду, экспрессируемому в клетке. TMPRSS6 также известен как матриптаза-2, трансмембранная протеаза, серин 6, IRIDA (рефрактерной к железу железодефицитной анемии), тип II трансмембранной сериновой протеазы 6 и связанная с мембраной мозаичная сериновая протеиназа матриптаза-2. TMPRSS6 представляет собой трансмембранный белок - сериновую протеазу типа II с приблизительно 899 аминокислотами в длину. TMPRSS6 содержит множественные домены, например, короткий эндодомен, трансмембранный домен, домен белка спермы морского ежа/энтеропептидазы/агрина (SEA), двух доменов фактора комплемента/эмбрионального фактора роста морского ежа/BMP (CUB), трех доменов класса LDL-R (LDLa) и трипсиноподобного домена сериновой протеазы с консервативной триадой His-Asp-Ser (HDS). Последовательность транскрипта мРНК TMPRSS6 человека может быть найдена в NM_153609.2 (SEQ ID NO:1) (фиг. 1).
При применении в настоящем описании термин «iRNA» относится к агенту, который содержит РНК в виде определяемого в настоящем описании термина и который опосредует направленное расщепление РНК-транскрипта по пути индуцируемого РНК комплекса сайленсинга (RISC). В одном варианте осуществления iRNA, как описано в настоящем документе, действует, ингибируя экспрессию TMPRSS6. Альтернативно, в другом варианте осуществления iRNA, как описано в настоящем документе, активирует экспрессию TMPRSS6.
При применении в настоящем описании «последовательность-мишень» обозначает непрерывную часть нуклеотидной последовательности молекулы мРНК, образованную в процессе транскрипции гена TMPRSS6, включая матричную РНК (мРНК), которая является РНК-продуктом процессинга первичного продукта транскрипции. Часть-мишень последовательности должна быть, по меньшей мере, достаточно длинной для того, чтобы служить в качестве субстрата для управляемого iRNA расщепления в этой части или около нее. Например, последовательность-мишень должна составлять обычно 9-36 нуклеотидов в длину, например, 15-30 нуклеотидов в длину, включая все поддиапазоны между ними. В качестве неограничивающих примеров, последовательность-мишень может составлять 15-30 нуклеотидов, 15-26 нуклеотидов, 15-23 нуклеотида, 15-22 нуклеотида, 15-21 нуклеотидов, 15-20 нуклеотидов, 15-19 нуклеотидов, 15-18 нуклеотидов, 15-17 нуклеотидов, 18-30 нуклеотидов, 18-26 нуклеотидов, 18-23 нуклеотида, 18-22 нуклеотида, 18-21 нуклеотидов, 18-20 нуклеотидов, 19-30 нуклеотидов, 19-26 нуклеотидов, 19-23 нуклеотида, 19-22 нуклеотида, 19-21 нуклеотидов, 19-20 нуклеотидов, 20-30 нуклеотидов, 20-26 нуклеотидов, 20-25 нуклеотидов, 20-24 нуклеотида, 20-23 нуклеотида, 20-22 нуклеотида, 20-21 нуклеотидов, 21-30 нуклеотидов, 21-26 нуклеотидов, 21-25 нуклеотидов, 21-24 нуклеотида, 21-23 нуклеотида или 21-22 нуклеотида.
При применении в настоящем описании термин «цепь, включающая последовательность», обозначает олигонуклеотид, включающий цепь нуклеотидов, которая описывается последовательностью при ссылке на использование стандартной номенклатуры нуклеотидов.
При применении в настоящем описании и, если не указано иначе, термин «комплементарная» при использовании для описания первой нуклеотидной последовательности по отношению ко второй нуклеотидной последовательности относится к способности олигонуклеотида или полинуклеотида, включающего первую нуклеотидную последовательность, гибридизоваться и образовывать дуплексную структуру при определенных условиях с олигонуклеотидом или полинуклеотидом, включающим вторую нуклеотидную последовательность, как должно быть понятно специалисту в данной области техники. Такие условия могут быть, например, жесткими условиями, где жесткие условия могут включать: 400 мМ NaCl, 40 мМ PIPES рН 6,4, 1 мМ ЭДТА, 50°С или 70°С в течение 12-16 часов с последующей отмывкой. Могут быть применены другие условия, такие как условия, сходные с физиологическими, с которыми можно столкнуться внутри организма. Специалист в данной области техники способен определить набор условий, наиболее подходящих для тестирования комплементарности двух последовательностей, в соответствии с конечным применением гибридизованных нуклеотидов.
Комплементарные последовательности в пределах iRNA, например, в пределах dsRNA, как описано в настоящем документе, включают спаривание оснований олигонуклеотида или полинуклеотида, включающего первую нуклеотидную последовательность, с олигонуклеотидом или полинуклеотидом, включающим вторую нуклеотидную последовательность, по всей длине одной или обеих нуклеотидных последовательностей. Такие последовательности могут обозначаться в настоящем описании как «полностью комплементарные» друг другу. Однако когда первая последовательность обозначается в настоящем описании как «по существу комплементарная» в отношении второй последовательности, две последовательности могут быть полностью комплементарными, или они могут образовывать при гибридизации одну пару или более, но обычно не более 5, 4, 3 или 2 ошибочно спаренных оснований у дуплекса до 30 пар оснований (п.о.) при сохранении способности к гибридизации в условиях, наиболее подходящих для их конечного применения, например, ингибирования экспрессии гена с помощью пути RISC. Однако когда два олигонуклеотида создаются для образования при гибридизации одного или более одноцепочечных липких концов, такие липкие концы не должны рассматриваться в качестве ошибочно спаренных в отношении определения комплементарности. Например, dsRNA, включающая один олигонуклеотид в 21 нуклеотид в длину и другой олигонуклеотид в 23 нуклеотида в длину, где более длинный олигонуклеотид включает последовательность из 21 нуклеотида, которая полностью комплементарна более короткому олигонуклеотиду, еще может рассматриваться как «полностью комплементарная» для описанных в настоящем документе целей.
«Комплементарные» последовательности при применении в настоящем описании могут также включать или полностью образовываться из пар оснований, образованных не по Уотсону-Крику, и/или пар оснований, образованных из неприродных и модифицированных нуклеотидов, до тех пор, пока выполняются указанные выше требования в отношении их способности к гибридизации. Такое спаривание оснований не по Уотсону-Крику включает, но не ограничивается этим, воббл-спаривание G:U или хугстиновское спаривание оснований.
Термины «комплементарное», «полностью комплементарное» и «по существу комплементарное» в настоящем описании могут использоваться в отношении спаривания оснований между смысловой цепью и антисмысловой цепью dsRNA или между антисмысловой цепью агента iRNA и последовательностью-мишенью, как должно быть понятно из контекста их использования.
При применении в настоящем описании полинуклеотид, который является «по существу комплементарным, по меньшей мере, части» матричной РНК (мРНК), обозначает полинуклеотид, который по существу комплементарен непрерывной части представляющей интерес мРНК (например, мРНК, кодирующей TMPRSS6). Например, полинуклеотид комплементарен, по меньшей мере, части мРНК TMPRSS6, если последовательность по существу комплементарна непрерывной части мРНК, кодирующей TMPRSS6.
Термин «двухцепочечная РНК» или «dsRNA» при применении в настоящем описании обозначает iRNA, которая включает молекулу РНК или комплекс молекул, имеющих область гибридизованного дуплекса, который включает две антипараллельные и по существу комплементарные цепи нуклеиновой кислоты, которые будут обозначаться как имеющие «смысловую» и «антисмысловую» ориентации в отношении РНК-мишени. Область дуплекса может иметь любую длину, которая позволяет осуществить специфичную деградацию желаемой РНК-мишени с помощью пути RISC, но обычно должна находиться в диапазоне от 9 до 36 пар оснований в длину, например, 15-30 пар оснований в длину. При рассмотрении дуплекса от 9 до 36 пар оснований дуплекс может быть любой длины в этом диапазоне, например, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 и в любом поддиапазоне между ними, включая, но не ограничиваясь этим, 15-30 пар оснований, 15-26 пар оснований, 15-23 пар оснований, 15-22 пар оснований, 15-21 пар оснований, 15-20 пар оснований, 15-19 пар оснований, 15-18 пар оснований, 15-17 пар оснований, 18-30 пар оснований, 18-26 пар оснований, 18-23 пар оснований, 18-22 пар оснований, 18-21 пар оснований, 18-20 пар оснований, 19-30 пар оснований, 19-26 пар оснований, 19-23 пар оснований, 19-22 пар оснований, 19-21 пар оснований, 19-20 пар оснований, 20-30 пар оснований, 20-26 пар оснований, 20-25 пар оснований, 20-24 пар оснований, 20-23 пар оснований, 20-22 пар оснований, 20-21 пар оснований, 21-30 пар оснований, 21-26 пар оснований, 21-25 пар оснований, 21-24 пар оснований, 21-23 пар оснований или 21-22 пар оснований. dsRNA, выработанные в клетке путем обработки дайсер-ферментом и сходными ферментами, обычно имеют диапазон длины 19-22 пары оснований. Одна цепь области дуплекса dsDNA включает последовательность, которая по существу комплементарна области РНК-мишени. Две цепи, образующие структуру дуплекса, могут происходить из одной молекулы РНК, имеющей, по меньшей мере, одну собственную комплементарную область, или из двух или более отдельных молекул РНК. Когда область дуплекса образуется из двух цепей одной молекулы, молекула может иметь область дуплекса, разделенную одноцепочечной последовательностью нуклеотидов (обозначаемую в настоящем описании как «петля шпильки») между 3'-концом одной цепи и 5'-концом соответственной другой цепи с образованием структуры дуплекса. Петля шпильки может включать, по меньшей мере, один неспаренный нуклеотид; в некоторых вариантах осуществления петля шпильки может включать, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, по меньшей мере, 6, по меньшей мере, 7, по меньшей мере, 8, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 20, по меньшей мере, 23 или более неспаренных нуклеотидов. Когда две по существу комплементарные цепи dsRNA составлены из отдельных молекул РНК, эти молекулы не требуют ковалентного связывания, но оно может быть осуществлено. Когда две цепи соединены ковалентно путем, отличным от петли шпильки, связывающая структура обозначается как «линкер». Термин «siRNA» используется в настоящем описании также для обозначения dsRNA, как описано выше.
Специалист в данной области техники должен понимать, что термин «молекула РНК» или «молекула рибонуклеиновой кислоты» охватывает не только молекулы РНК в том виде, в котором они экспрессируются или находятся в природе, но также аналоги и производные РНК, включающие один или более рибонуклеотидных/рибонуклеозидных аналогов или производных, как описано в настоящем документе или как известно в данной области техники. Строго говоря, «рибонуклеозид» включает нуклеозидное основание и сахар рибозу, а «рибонуклеотид» представляет собой рибонуклеозид с одним, двумя или тремя фосфатными остатками. Однако термины «рибонуклеозид» и «рибонуклеотид» могут рассматриваться как эквивалентные при использовании в настоящем описании. РНК может быть модифицирована по структуре нуклеотидного основания или по структуре рибозо-фосфатного остова, например, как описано ниже в настоящем документе. Однако молекулы, включающие рибонуклеозидные аналоги или производные, должны сохранять способность к формированию дуплекса. В качестве неограничивающих примеров, молекула РНК может также включать, по меньшей мере, один модифицированный рибонуклеозид, включая, но не ограничиваясь этим, 2'-О-метил-модифицированный нуклеозид, нуклеозид, включающий 5'-фосфоротиоатную группу, концевой нуклеозид, соединенный с холестериловым производным, или с бисдециламидной группой додекановой кислоты, блокированный нуклеозид, абазический нуклеозид, 2'-дезокси-2'-фтор-модифицированный нуклеозид, 2’-амино-модифицированный нуклеозид, 2’-алкил-модифицированный нуклеозид, морфолинонуклеозид, фосфорамидат или нуклеозид, включающий неприродное основание, или любое их сочетание. Альтернативно, молекула РНК может включать, по меньшей мере, два модифицированных рибонуклеозида, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, по меньшей мере, 6, по меньшей мере, 7, по меньшей мере, 8, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20 или более вплоть до полной длины молекулы dsRNA. Модификации не обязательно должны быть теми же самыми для каждого из такого множества модифицированных рибонуклеозидов в молекуле РНК. В одном варианте осуществления модифицированные РНК, предлагаемые для использования в описанных в настоящем документе способах и композициях, являются пептидными нуклеиновыми кислотами (PNA), которые обладают способностью образовывать требуемую дуплексную структуру и которые позволяют или опосредуют специфичную деградацию РНК-мишени с помощью пути RISC.
В одном аспекте модифицированный рибонуклеозид включает дезоксирибонуклеозид. В таком случае агент iRNA может включать один или более дезоксинуклеозидов, включая, например, липкий(ие) конец(концы) дезоксинуклеозида или один или более дезоксинуклеозидов в пределах двухцепочечной части dsRNA. Однако самоочевидно, что ни при каких условиях двухцепочечная молекула ДНК не охватывается термином «iRNA».
В одном аспекте агент РНК-интерференции включает одноцепочечную РНК, которая взаимодействует с последовательностью РНК-мишени, управляя расщеплением РНК-мишени. Не опираясь на теорию, длинная двухцепочечная РНК, введенная в растения и клетки беспозвоночных, расщепляется на siRNA с помощью эндонуклеазы типа III в качестве дайсер-фермента (Sharp et al., Genes Dev. 2001, 15:485). Дайсер-фермент, фермент, подобный рибонуклеазе-III, превращает dsRNA в короткие интерферирующие РНК из 19-23 оснований с характерными 3'-липкими концами из двух оснований (Bernstein, et al., (2001) Nature 409:363). siRNA затем включаются в индуцируемый РНК комплекс сайленсинга (RISC), где одна или более геликаз раскручивает дуплекс siRNA, позволяя комплементарной антисмысловой цепи руководить узнаванием мишени (Nykanen, et al., (2001) Cell 107:309). При связывании соответствующей мРНК-мишени одна или более эндонуклеаз в RISC расщепляет мишень с индукцией сайленсинга (Elbashir, et al., (2001) Genes Dev. 15:188). Таким образом, в одном аспекте изобретение относится к одноцепочечной РНК, которая стимулирует образование комплекса RISC с осуществлением сайленсинга гена-мишени.
При применении в настоящем описании термин «липкий конец нуклеотида» относится, по меньшей мере, к одному неспаренному нуклеотиду, который выдается из структуры дуплекса iRNA, например, dsRNA. Например, когда 3'-конец одной цепи dsRNA выступает за 5'-конец другой цепи или наоборот, это представляет собой липкий конец нуклеотидов. dsRNA может включать липкий конец, по меньшей мере, из одного нуклеотида; альтернативно, липкий конец может включать, по меньшей мере, два нуклеотида, по меньшей мере, три нуклеотида, по меньшей мере, четыре нуклеотида, по меньшей мере, пять нуклеотидов или более. Нуклеотидный липкий конец может включать или состоять из нуклеотидного/нуклеозидного аналога, включая дезоксинуклеотид/нуклеозид. Липкий(ие) конец(концы) могут быть на смысловой цепи, антисмысловой цепи или любом их сочетании. Более того, нуклеотид(ы) липкого конца могут присутствовать на 5'-конце, 3'-конце или на обоих концах либо антисмысловой, либо смысловой цепи dsRNA.
В одном варианте осуществления антисмысловая цепь dsRNA имеет липкий конец из 1-10 нуклеотидов на 3'-конце и/или на 5'-конце. В одном варианте осуществления смысловая цепь dsRNA имеет липкий конец из 1-10 нуклеотидов на 3'-конце и/или на 5'-конце. В другом варианте осуществления один или более нуклеотидов в липком конце заменены нуклеозидным тиофосфатом.
Термины «тупой» или «тупой конец» при применении в настоящем описании в отношении dsRNA обозначают, что не существует неспаренных нуклеотидов или нуклеотидных аналогов на данном концевом участке dsRNA, т.е. нет нуклеотидного липкого конца. Один или оба конца dsRNA могут быть тупыми. Когда оба конца dsRNA являются тупыми, dsRNA, как говорят, является тупоконечной. Для пояснения, «тупоконечная» dsRNA представляет собой dsRNA, которая является тупой на обоих концах, т.е. на любом конце нет нуклеотидного липкого конца молекулы. Чаще всего такая молекула должна быть двухцепочечной по всей своей полной длине.
Термин «антисмысловая цепь» или «управляющая цепь» относится к цепи iRNA, например, dsRNA, которая включает область, по существу комплементарную последовательности-мишени. При применении в настоящем описании термин «область комплементарности» относится к области в антисмысловой цепи, которая по существу комплементарна последовательности, например, последовательности-мишени, как определяется в настоящем описании. Когда область комплементарности не полностью комплементарна последовательности-мишени, ошибочно спаренные основания могут находиться во внутренних или концевых областях молекулы. Обычно наиболее толерантные ошибочно спаренные основания находятся в концевых областях, например, в пределах 5, 4, 3 или 2 нуклеотидов 5'- и/или 3'-конца.
Термин «смысловая цепь» или «сопровождающая цепь» при применении в настоящем описании относится к цепи iRNA, которая включает область, которая по существу комплементарна области антисмысловой цепи как определяемого в настоящем описании термина.
При применении в настоящем описании в одном варианте осуществления термин «SNALP» относится к стабильной частице нуклеиновая кислота-липид. SNALP представляет собой везикулу из липидов, покрывающих водную внутреннюю часть, включающую нуклеиновую кислоту, такую как iRNA, или плазмиду, с которой транскрибируется iRNA. SNALP описаны, например, в публикациях патентных заявок США №№ 20060240093, 20070135372 и в международной заявке № WO 2009082817. Примеры составов «SNALP» описаны в настоящем документе в другом месте.
«Введение в клетку» в отношении iRNA обозначает облегченный или эффективный захват или поглощение клеткой, как это понятно специалистам в данной области техники. Поглощение или захват iRNA может осуществляться без помощи диффузии или активных клеточных процессов, или с помощью вспомогательных агентов или устройств. Значение этого термина не ограничивается клетками in vitro; iRNA может быть также «введена в клетку», когда клетка является частью живого организма. В таком случае введение в клетку должно включать доставку в организм. Например, для доставки in vivo iRNA может быть введена в область ткани или введена системно. Доставка in vivo может также представлять собой β-глюкановую систему доставки, такую как система, описанная в патентах США №№ 5032401 и 5607677 и публикации США № 2005/0281781, которые включены тем самым в качестве ссылки в полном объеме. Введение в клетку in vitro включает методы, известные в данной области техники, такие как электропорация и липофекция. Дополнительные подходы описаны в настоящем документе ниже или известны в данной области техники.
При применении в настоящем описании термин «модулирование экспрессии» относится, по меньшей мере, к частичному «ингибированию» или к частичной «активации» экспрессии гена TMPRSS6 в клетке, обработанной композицией iRNA, как описано в настоящем документе, по сравнению с экспрессией TMPRSS6 в необработанной клетке.
Термины «активировать», «повышать», «позитивно регулировать экспрессию», «увеличивать экспрессию» и тому подобные, до тех пор пока они относятся к гену TMPRSS6, в настоящем описании относятся, по меньшей мере, к частичной активации экспрессии гена TMPRSS6, что проявляется в виде повышения количества мРНК TMPRSS6, которая может быть выделена или определена в первой клетке или группе клеток, в которых ген TMPRSS6 транскрибируется и которая или которые обработана или обработаны так, что экспрессия гена TMPRSS6 повышена по сравнению со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но которая или которые не обработана или не обработаны таким образом (контрольные клетки).
В одном варианте осуществления экспрессия гена TMPRSS6 активирована, по меньшей мере, приблизительно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% путем введения iRNA, как описано в настоящем документе. В некоторых вариантах осуществления ген активирован, по меньшей мере, приблизительно на 60%, 70% или 80% путем введения iRNA, охарактеризованной в изобретении. В некоторых вариантах осуществления экспрессия гена TMPRSS6 активирована, по меньшей мере, приблизительно на 85%, 90% или 95% или более путем введения iRNA, как описано в настоящем документе. В некоторых вариантах осуществления экспрессия гена TMPRSS6 повышена, по меньшей мере, в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 5 раз, по меньшей мере, в 10 раз, по меньшей мере, в 50 раз, по меньшей мере, в 100 раз, по меньшей мере, в 500 раз, по меньшей мере, в 1000 раз или более в клетках, обработанных iRNA, как описано в настоящем документе, по сравнению с экспрессией в необработанной клетке. Активация экспрессии с помощью малых dsRNA описана, например, у Li et al., 2006 Proc. Natl. Acad. Sci. U.S.A. 103: 17337-42, и в патентах США US20070111963 и US2005226848, каждый из которых включен в настоящее описание в качестве ссылки.
Термины «сайленсинг», «ингибирование экспрессии», «негативная регуляция экспрессии», «подавление экспрессии» и тому подобные, до тех пор, пока они относятся к гену TMPRSS6, в настоящем описании обозначают, по меньшей мере, частичное подавление экспрессии гена TMPRSS6, что проявляется в виде снижения количества мРНК TMPRSS6, которая может быть выделена или определена в первой клетке или группе клеток, в которых ген TMPRSS6 транскрибируется и которая или которые обработана или обработаны так, что экспрессия гена TMPRSS6 ингибируется по сравнению со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но которая или которые не обработана или не обработаны таким образом (контрольные клетки). Степень ингибирования обычно выражается в показателе

Альтернативно, степень ингибирования может быть дана в виде показателей снижения параметра, который функционально связан с экспрессией гена TMPRSS6, например, количества белка, кодируемого геном TMPRSS6, или количества клеток, проявляющих определенный фенотип, например, снижения уровней железа или поглощения железа. В принципе сайленсинг гена TMPRSS6 может быть определен в любой клетке, экспрессирующей TMPRSS6, либо конститутивно, либо в результате генной инженерии, и путем любого подходящего метода.
Например, в определенных случаях экспрессия гена TMPRSS6 подавлена, по меньшей мере, приблизительно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% путем введения iRNA, охарактеризованной в изобретении. В некоторых вариантах осуществления экспрессия гена TMPRSS6 подавлена, по меньшей мере, приблизительно на 60%, 70% или 80% путем введения iRNA, как описано в настоящем документе. В некоторых вариантах осуществления экспрессия гена TMPRSS6 подавлена, по меньшей мере, приблизительно на 85%, 90%, 95%, 98%, 99% или более путем введения iRNA, как описано в настоящем документе.
При применении в настоящем описании в контексте экспрессии TMPRSS6 термины «лечить», «лечение» и тому подобные относятся к ослаблению или облегчению патологических процессов, опосредуемых экспрессией TMPRSS6. В контексте настоящего изобретения в той мере, в которой оно относится к любому из других состояний, цитируемых в настоящем описании ниже (отличных от патологических процессов, опосредуемых экспрессией TMPRSS6), термины «лечить», «лечение» и тому подобные обозначают ослаблять или облегчать, по меньшей мере, один симптом, связанный с таким состоянием, или замедлять или обращать назад прогрессию или ожидаемую прогрессию такого состояния, например, замедлять прогрессию гемохроматоза, такого как β-талассемия.
Под «понижением» в контексте маркера заболевания или симптома обозначается статистически значимое снижение его уровня. Снижение может составлять, например, по меньшей мере, 10%, по меньшей мере, 20%, по меньшей мере, 30%, по меньшей мере, 40% или более и предпочтительно вызывать падение до уровня, приемлемого для диапазона нормы у индивидуума без такого заболевания.
При применении в настоящем описании выражения «терапевтически эффективное количество» и «профилактически эффективное количество» относится к количеству, которое обеспечивает терапевтическое преимущество при лечении, профилактике или управлении патологическими процессами, опосредуемыми экспрессией TMPRSS6, или явным симптомом патологического процесса, опосредуемого экспрессией TMPRSS6. Конкретное количество, которое является терапевтически эффективным, может быть легко определено обычным врачом и может варьироваться в зависимости от факторов, известных в данной области техники, таких как, например, тип патологических процессов, опосредуемых экспрессией TMPRSS6, история болезни пациента и возраст, стадия патологических процессов, опосредуемых экспрессией TMPRSS6, и введение других агентов, которые ингибируют патологические процессы, опосредуемые экспрессией TMPRSS6.
При применении в настоящем описании «фармацевтическая композиция» включает фармацевтически эффективное количество iRNA и фармакологически приемлемый носитель. При применении в настоящем описании «фармакологически эффективное количество», «терапевтически эффективное количество» или просто «эффективное количество» обозначает количество iRNA, эффективное для получения намеченного фармакологического, терапевтического или профилактического результата. Например, если данное клиническое лечение рассматривается как эффективное при снижении измеряемого параметра, связанного с заболеванием или нарушением, по меньшей мере, на 10%, то терапевтически эффективное количество лекарства для лечения этого заболевания или нарушения представляет собой количество, необходимое для индукции, по меньшей мере, 10% снижения этого параметра. Например, терапевтически эффективное количество iRNA, направленной на TMPRSS6, может снижать уровни белка TMPRSS6, по меньшей мере, на 10%.
При применении в настоящем описании термин «талассемия» обозначает наследуемое рецессивное заболевание крови. Мутация с потерей функции ведет к пониженной скорости синтеза или отсутствию синтеза одной из цепей глобина, которая входит в состав гемоглобина, и ведет к дефициту нормальных глобиновых белков. У больных талассемией возникает недостаточность продукции либо α-глобина (соответствует α-талассемии), β-глобина (соответствует β-талассемии) или в редких случаях δ-глобина. При α-талассемии избыток β-цепей образует нестабильные тетрамеры, которые характеризуются аномальными кривыми диссоциации кислорода. β-Талассемии могут быть малыми, большими или промежуточными.
Цепи β-глобина кодируются единственным геном, называемым геном HBB (гемоглобина β). Малая β-талассемия возникает у больных, несущих один мутантный аллель β-талассемии и один аллель дикого типа. Это состояние не влияет на уровни железа в крови, и больные не требуют лечения. Большая β-талассемия возникает, когда больные несут два нокаутных мутантных аллеля β-талассемии. У этих больных аккумулируется избыток железа, и избыток железа запасается главным образом в гипертрофированных клетках Купфера. Больных большой β-талассемией обычно лечат с помощью хронического переливания крови, хелирования железа, спленэктомии и аллогенной гемопоэтической трансплантации. Промежуточная β-талассемия возникает, когда больной несет один нокаутный аллель гена β-талассемии и один аллель с частичной потерей функции. У этих больных аккумулируется избыток железа, и избыток железа запасается главным образом в гепатоцитах. Больные с большой талассемией и промежуточной талассемией характеризуются анемией (гипоксией), которая ведет к повышению EPO (эритропоэтина) и в результате к существенному компенсаторному и неэффективному эритропоэзу (продукции эритроцитов стволовыми клетками костного мозга). У больных промежуточной талассемией иногда развивается гепатоспленомегалия, желтуха, остеопения, случаи тромбоза, язвы ног, легочная гипотензия, застойная сердечная недостаточность, сахарный диабет, дефицит гормона роста, гипотиреоз, гипопаратиреоз, гипогонадизм и деформации лица.
При применении в настоящем описании термин «гемохроматоз» обозначает нарушение, которое ведет к слишком большому всасыванию железа из желудочно-кишечного тракта. Гемохроматоз существует в двух формах: первичной и вторичной. Первичный гемохроматоз, наиболее обычное генетическое нарушение в Соединенных Штатах (поражающее по расчетам 1 из каждых от 200 до 300 американцев), обычно является результатом конкретного генетического нарушения, которое вызывает слишком большое всасывание железа. Вторичный или приобретенный гемохроматоз может быть вызван такими заболеваниями как талассемия или сидеробластная анемия. Вторичный гемохроматоз иногда развивается у больных гемолитической анемией и хроническим алкоголизмом. Симптомы гемохроматоза включают абдоминальную боль, суставную боль, утомляемость, отсутствие энергии, слабость, потемнение кожи (часто обозначаемой как «бронзовая») и потерю волос тела.
Термин «фармацевтически приемлемый носитель» относится к носителю для введения терапевтического агента. Такие носители включают, но не ограничиваются этим, физиологический раствор, декстрозу, воду, глицерин, этанол и их сочетание. Термин конкретно исключает среду клеточной культуры. Для лекарств, вводимых перорально, фармацевтически приемлемые носители включают, но не ограничиваются этим, фармацевтически приемлемые наполнители, такие как инертные разбавители, дезинтегрирующие агенты, связующие агенты, смазывающие агенты, подсластители, отдушки, окрашивающие агенты и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как кукурузный крахмал и альгиновая кислота подходят в качестве дезинтегрирующих агентов. Связующие агенты могут включать крахмал и желатин, тогда как смазывающий агент, если он присутствует, обычно должен представлять собой стеарат магния, стеариновую кислоту или тальк. Если это желательно, таблетки могут быть покрыты таким материалом как глицерилмоностеарат или глицерилдистеарат для замедления поглощения в желудочно-кишечном тракте. Агенты, включенные в лекарственные составы, дополнительно описываются в настоящем документе ниже.
При применении в настоящем описании «индивидуум» представляет собой млекопитающее, например, собаку, лошадь, кошку и других приматов, не являющихся человеком. В предпочтительном варианте осуществления индивидуум является человеком.
При применении в настоящем описании термин «LNPXX», где «XX» представляют собой цифры, также обозначается в настоящем описании как «AFXX». Например, LNP09 обозначается также как AF09 и LNP12 также известен или обозначается как AF12.
При применении в настоящем описании термин «включающий» или «включает» используется в отношении композиций, способов и их соответствующего(их) компонента(ов), которые существенны для изобретения, и еще открыты для включения неуточненных элементов, являются ли они существенными или нет.
При применении в настоящем описании термин «по существу состоящий из» относится к тем элементам, которые требуются для данного варианта осуществления. Термин дает право присутствия тем элементам, которые существенно не влияют на основную и новую или функциональную характеристику(и) того варианта осуществления, который охарактеризован в изобретении.
Термин «состоящий из» относится к композициям, способам и к их соответствующим компонентам, как описано в настоящем описании, которые исключают любой элемент, не цитируемый в этом описании или варианте осуществления.
II. Двухцепочечная рибонуклеиновая кислота (dsRNA)
В настоящем документе описываются агенты iRNA, которые модулируют экспрессию гена TMPRSS6. В одном варианте осуществления агент iRNA включает молекулы двухцепочечной рибонуклеиновой кислоты (dsRNA) для ингибирования экспрессии гена TMPRSS6 в клетке или у млекопитающего, например, у человека, имеющего повышенные уровни железа, такого как больной β-талассемией или гемохроматозом. dsRNA включает антисмысловую цепь, обладающую областью комплементарности, которая комплементарна, по меньшей мере, части мРНК, образованной при экспрессии гена TMPRSS6. Область комплементарности составляет в длину 30 нуклеотидов или менее, обычно 19-24 нуклеотида в длину, и dsRNA при контактировании с клеткой, экспрессирующей ген TMPRSS6, ингибирует экспрессию гена TMPRSS6, по меньшей мере, на 10% при тестировании, например, методом ПЦР или методом разветвленной ДНК-гибридизации (bDNA), или методом на уровне белка, таком как иммуноблоттинг. В одном варианте осуществления агент iRNA активирует экспрессию гена TMPRSS6 в клетке или у млекопитающего. Экспрессия гена TMPRSS6 в клеточной культуре, такой как клетки COS, клетки HeLa, первичная культура гепатоцитов, клетки HepG2, клетки первичной культуры, или в биологическом образце от индивидуума может быть определена путем измерения уровней мРНК TMPRSS6 с помощью метода bDNA или TaqMan®, или путем измерения уровней белка с помощью, например, иммунофлуоресцентного анализа с использованием, например, иммуноблоттинга или методов проточной цитометрии.
dsRNA включает две цепи РНК, которые являются комплементарными при гибридизации, с образованием дуплексной структуры в условиях, при которых должна использоваться dsRNA. Одна цепь dsRNA (антисмысловая цепь) включает область комплементарности, которая по существу комплементарна и обычно полностью комплементарна последовательности-мишени. Последовательность-мишень может происходить от последовательности мРНК, образованной при экспрессии гена TMPRSS6. Другая цепь (смысловая цепь) включает область, которая комплементарна антисмысловой цепи, так что две цепи гибридизуются и образуют дуплексную структуру при объединении в подходящих условиях. Обычно дуплексная структура состоит в длину из от 15 до 30 включительно, более обычно от 18 до 25 включительно, еще более обычно от 19 до 24 включительно и наиболее обычно от 19 до 21 пар оснований включительно. Сходно область комплементарности к последовательности-мишени состоит в длину из от 15 до 30 включительно, более обычно от 18 до 25 включительно, еще более обычно от 19 до 24 включительно и наиболее обычно от 19 до 21 нуклеотида включительно. В некоторых вариантах осуществления dsRNA имеет длину от 15 до 20 нуклеотидов включительно, и в других вариантах осуществления dsRNA имеет длину от 25 до 30 нуклеотидов включительно. Как должен знать специалист в данной области техники, область-мишень РНК-мишени для расщепления наиболее часто должна быть частью более крупной молекулы РНК, часто молекулы мРНК. Когда это уместно, «часть» мРНК-мишени представляет собой непрерывную последовательность мРНК-мишени достаточной длины для того, чтобы быть субстратом для направляемого RNAi расщепления (т.е. расщепления через путь RISC). dsRNA, имеющие настолько короткие дуплексы как 9 пар оснований, могут при некоторых условиях опосредовать управляемое RNAi расщепление РНК. Наиболее часто мишень должна составлять, по меньшей мере, 15 нуклеотидов в длину, предпочтительно 15-30 нуклеотидов в длину.
Специалист в данной области техники также должен знать, что область дуплекса является главной функциональной частью dsRNA, например, область дуплекса из от 9 до 36, например, 15-30 пар оснований. Таким образом, в одном варианте осуществления для размера, который становится преобразованным в функциональный дуплекс, например, из 15-30 пар оснований, направленно действующий на желаемую РНК для расщепления, молекула РНК или комплекс молекул РНК, имеющие область дуплекса, выше 30 пар оснований, представляют собой dsRNA. Таким образом, специалист в данной области техники должен знать, что в одном варианте осуществления miRNA представляет собой dsRNA. В другом варианте осуществления dsRNA не является природной miRNA. В другом варианте осуществления агент iRNA, пригодный для направленного действия на экспрессию TMPRSS6, не создается в клетке-мишени путем расщепления более крупной dsRNA.
dsRNA, как описано в настоящем документе, может дополнительно включать один или более одноцепочечных нуклеотидных липких концов. dsRNA может быть синтезирована с помощью стандартных методов, известных в данной области техники, как дополнительно обсуждается ниже, например, с использованием автоматического синтезатора ДНК, такого как имеющиеся в продаже, например, у Biosearch, Applied Biosystems, Inc. В одном варианте осуществления ген TMPRSS6 представляет собой ген TMPRSS6 человека. В другом варианте осуществления ген TMPRSS6 представляет собой ген TMPRSS6 мыши или крысы. Последовательность мРНК TMPRSS6 мыши может быть найдена в GenBank Accession № NM_027902 (01:125656151, дата записи 28 декабря 2010 г.). Последовательность мРНК TMPRSS6 крысы может быть найдена в GenBank Accession № NM_001130556.1 (GI:194474097, дата записи 17 января 2011 г.). В конкретных вариантах осуществления первая последовательность представляет собой смысловую цепь dsRNA, которая включает одну из смысловых последовательностей таблиц 2, 3 или 4, а вторая последовательность представляет собой антисмысловую цепь dsRNA, которая включает одну из антисмысловых последовательностей таблиц 2, 3 или 4. Альтернативные агенты dsRNA, которые направленно действуют в другом месте последовательности-мишени, предлагаемые в таблицах 2, 3 или 4, могут быть легко определены с использованием последовательности-мишени и примыкающей последовательности TMPRSS6.
В одном аспекте dsRNA должна включать, по меньшей мере, две нуклеотидные последовательности, смысловую и антисмысловую последовательность, где смысловая цепь выбрана из групп последовательностей, предлагаемых в таблицах 2, 3 или 4. В этом аспекте одна из двух последовательностей комплементарна другой из двух последовательностей, причем одна из последовательностей является по существу комплементарной последовательности мРНК, образованной при экспрессии гена TMPRSS6. По существу в этом аспекте dsRNA должна включать два олигонуклеотида, где один олигонуклеотид описывается как смысловая цепь в таблицах 2, 3 или 4, а второй олигонуклеотид описывается как соответствующая антисмысловая цепь смысловой цепи из таблиц 2, 3 или 4. Как описывается в настоящем документе в другом месте и как известно в данной области техники, комплементарные последовательности dsRNA могут также заключать в себе самокомплементарные области в одной молекуле нуклеиновой кислоты в противоположность существованию в виде отдельных олигонуклеотидов.
Специалист в данной области техники хорошо знает, что dsRNA, имеющие дуплексную структуру, состоящую из от 20 до 23, но особенно из 21 пары оснований, провозглашаются как особенно эффективные в плане индукции РНК-интерференции (Elbashir et al., EMBO 2001, 20:6877-6888). Однако другие авторы обнаружили, что более короткие или более длинные дуплексные структуры РНК также могут быть эффективными. В вариантах осуществления, описанных выше, благодаря природе олигонуклеотидных последовательностей, предлагаемых в таблицах 2, 3 или 4, dsRNA, описанные в настоящем документе, могут включать, по меньшей мере, одну цепь с длиной минимально из 21 нукл. Справедливо можно ожидать, что более короткие дуплексы, имеющие одну из последовательностей таблиц 2, 3 или 4 за вычетом только нескольких нуклеотидов на одном или обоих концах, могут быть сходно эффективными в сравнении с dsRNA, описанными выше. Следовательно, dsRNA, имеющие частичную последовательность, по меньшей мере, из 15, 16, 17, 18, 19, 20 или более непрерывных нуклеотидов из одной из последовательностей таблиц 2, 3 или 4, и отличающиеся по их способности ингибировать экспрессию гена TMPRSS6 не более чем на 5, 10, 15, 20, 25 или 30% ингибирования от dsRNA, включающей полную последовательность, охватываются настоящим изобретением.
Кроме того, РНК, предлагаемые в таблицах 2, 3 или 4, идентифицируют сайт в транскрипте TMPRSS6, который восприимчив к опосредуемому RISC расщеплению. По существу в настоящем изобретении дополнительно охарактеризованы iRNA, которые направлены на этот сайт внутри таких последовательностей. При применении в настоящем описании iRNA, как указано, направлена на определенный сайт внутри транскрипта РНК, если iRNA стимулирует расщепление транскрипта где-либо в пределах этого определенного сайта. Такая iRNA должна обычно включать, по меньшей мере, 15 непрерывных нуклеотидов из одной из последовательностей, предлагаемых в таблицах 2, 3 или 4, соединенных с дополнительными нуклеотидными последовательностями, взятыми из области, прилегающей к выбранной последовательности в гене TMPRSS6.
Несмотря на то, что последовательность-мишень состоит обычно из 15-30 нуклеотидов в длину, существуют разнообразные вариации в пригодности конкретных последовательностей в этом диапазоне для направленного расщепления любой данной РНК-мишени. Различные пакеты компьютерных программ и представленные в настоящем описании инструкции являются руководством для идентификации оптимальных последовательностей-мишеней для любого данного гена-мишени, но может быть также применен эмпирический подход, в котором «окно» или «шаблон» данного размера (в качестве неограничивающего примера, 21 нуклеотид) буквально или фигурально (включая, например, in silico) налагают на последовательность РНК-мишени для идентификации последовательностей в диапазоне размера, которые могут служить в качестве последовательностей-мишеней. С помощью продвижения последовательности «окна» постепенно на один нуклеотид выше или ниже исходной локализации последовательности-мишени, может быть идентифицирована следующая потенциальная последовательность-мишень до идентификации полного набора возможных последовательностей для любого данного выбранного размера мишени. С помощью этого процесса в соединении с систематическим синтезом и тестированием идентифицированных последовательностей (с использованием методов, описанных в настоящем документе, или известных в данной области техники) для идентификации тех последовательностей, которые работают оптимально, можно идентифицировать те последовательности РНК, которые при направленном действии агента iRNA, опосредуют наилучшее ингибирование экспрессии гена-мишени. Таким образом, несмотря на то, что последовательности, идентифицированные, например, в таблицах 2, 3 или 4, представляют собой эффективные последовательности-мишени, предполагается, что может быть достигнута дополнительная оптимизация эффективности ингибирования с помощью постепенного «прохода окна» на один нуклеотид выше или ниже данных последовательностей для идентификации последовательностей с равными или лучшими характеристиками ингибирования.
Кроме того, предполагается, что для любой последовательности, идентифицированной, например, в таблицах 2, 3 или 4, может быть достигнута дополнительная оптимизация с помощью систематического либо добавления, либо удаления нуклеотидов с созданием более длинных или более коротких последовательностей и тестирования этих созданных последовательностей с помощью прохода по РНК-мишени окна более длинного или более короткого размера вверх или вниз от этой точки. Более того, соединение этого подхода создания новых кандидатных мишеней с тестированием на эффективность iRNA, базирующихся на этих последовательностях-мишенях, в тесте на ингибирование, как известно в данной области техники или как описано в настоящем документе, может привести к дополнительному улучшению эффективности ингибирования. Кроме того, такие оптимизированные последовательности могут быть доведены, например, введением модифицированных нуклеотидов, как описано в настоящем документе или как известно в данной области техники, добавлением или изменениями в липком конце или другими модификациями, как известно в данной области техники и/или как обсуждается в настоящем документе, для дополнительной оптимизации молекулы как ингибитора экспрессии (например, повышения стабильности в сыворотке или периода полужизни в циркуляторном русле, повышения температурной устойчивости, увеличения трансмембранной доставки, направленной доставки к конкретному месту локализации или клеточному типу, повышения взаимодействия с ферментами пути сайленсинга, увеличения высвобождения из эндосом и т.д.).
iRNA, как описано в настоящем документе, может содержать одно или более ошибочно спаренных оснований с последовательностью-мишенью. В одном варианте осуществления iRNA, как описано в настоящем документе, содержит не более 3 ошибочно спаренных оснований. Если антисмысловая цепь iRNA содержит ошибочно спаренные основания с последовательностью-мишенью, предпочтительно, чтобы участок ошибочного спаривания не локализовался в центре области комплементарности. Если антисмысловая цепь iRNA содержит ошибочно спаренные основания с последовательностью-мишенью, предпочтительно, чтобы ошибочное спаривание было ограничено пределом последних 5 нуклеотидов, либо с 5'-, либо с 3'-конца области комплементарности. Например, для агента iRNA из 23 нуклеотидов с цепью РНК, которая комплементарна области гена TMPRSS6, цепь РНК обычно не содержит какого-либо ошибочно спаренного основания в пределах центральных 13 нуклеотидов. Способы, описанные в настоящем документе, или способы, известные в данной области техники, могут быть использованы для определения того, будет ли iRNA, содержащая ошибочно спаренное основание с последовательностью-мишенью, эффективна в ингибировании экспрессии гена TMPRSS6. Рассмотрение эффективности iRNA с ошибочно спаренными основаниями в отношении ингибирования экспрессии гена TMPRSS6 особенно важно, если известно, что конкретная область комплементарности гена TMPRSS6 имеет полиморфную вариабельность последовательности в популяции.
В одном варианте осуществления, по меньшей мере, один конец dsRNA имеет одноцепочечный нуклеотидный липкий конец из от 1 до 4, обычно от 1 до 2 нуклеотидов. Такие dsRNA, имеющие липкий конец, по меньшей мере, из одного нуклеотида, имеют неожиданно превосходные ингибиторные свойства относительно их аналогов с тупыми концами. В еще одном варианте осуществления РНК в iRNA, например, dsRNA химически модифицирована для повышения стабильности или других благоприятных характеристик. Нуклеиновые кислоты, охарактеризованные в изобретении, могут быть синтезированы и/или модифицированы с помощью методов, хорошо установленных в данной области техники, таких как методы, описанные в руководстве "Current protocols in nucleic acid chemistry," Beaucage, S.L. et al. (Edrs.), John Wiley & Sons, Inc., New York, NY, USA, включенном тем самым в настоящее описание в качестве ссылки. Модификации включают, например, (a) модификации концов, например, модификации 5'-конца (фосфорилирование, конъюгация, инвертированные связи и т.д.), модификации 3'-конца (конъюгация, нуклеотиды ДНК, инвертированные связи и т.д.), (b) модификации оснований, например, замену стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые образуют пары оснований с расширенным репертуаром партнеров, удаление оснований (абазические нуклеотиды) или конъюгацию оснований, (c) модификации сахаров (например, в 2’-положении или 4’-положении) или замену сахара, а также (d) модификации остова, включая модификацию или замену фосфодиэфирных связей. Конкретные примеры соединений РНК, пригодных для вариантов осуществления, описанных в настоящем документе, включают, но не ограничиваются этим, РНК, содержащие модифицированные остовы или неприродные межнуклеозидные связи. РНК, имеющие модифицированные остовы, включают, среди прочего, РНК, которые не имеют атома фосфора в остове. Для целей этого описания и, как иногда ссылаются в данной области техники, модифицированные РНК, которые не имеют атома фосфора в их межнуклеозидном остове, могут также рассматриваться как олигонуклеозиды. В конкретных вариантах осуществления модифицированная РНК должна иметь атом фосфора в межнуклеозидном остове.
Модифицированные остовы РНК включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метильные и другие алкильные фосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранофосфаты, имеющие нормальные 3'-5'-связи, их 2’-5’-соединенные аналоги и аналоги, имеющие инвертированную полярность, где прилегающие пары нуклеозидных единиц соединены от 3'-5' к 5'-3' или от 2'-5' к 5'-2'. Включаются также различные соли, смешанные соли и формы свободной кислоты.
Примеры патентов США, в которых представлено получение указанных выше фосфорсодержащих связей, включают, но не ограничиваются этим, патенты США №№ 3687808; 4469863; 4476301; 5023243; 5177195; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541316; 5550111; 5563253; 5571799; 5587361; 5625050; 6028188; 6124445; 6160109; 6169170; 6172209; 6239265; 6277603; 6326199; 6346614; 6444423; 6531590; 6534639; 6608035; 6683167; 6858715; 6867294; 6878805; 7015315; 7041816; 7273933; 7321029; и патент США RE39464, каждый из которых включен в настоящее описание в качестве ссылки.
Модифицированные остовы РНК, которые не включают в себя атом фосфора, имеют остовы, которые образуются короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными гетероатомами и алкильными или циклоалкильными межнуклеозидными связями, или одной или более короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают остовы, имеющие морфолиновые связи (образованные частично из части сахара нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетиловые и тиоформацетиловые остовы; метиленформацетиловые и тиоформацетиловые остовы; алкен-содержащие остовы; сульфаматные остовы; остовы метиленимино и метиленгидразино; сульфонатные и сульфонамидные остовы; амидные остовы; и другие, имеющие смешанные части компонентов N, O, S и CH2.
Примеры патентов США, в которых представлено получение указанных выше олигонуклеозидов, включают, но не ограничиваются этим, патенты США №№ 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 564562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437 и 5677439, каждый из которых включен в настоящее описание в качестве ссылки.
В других РНК-миметиках, подходящих или рассматриваемых для использования в iRNA, как сахар, так и межнуклеозидная связь, т.е. остов, нуклеотидных единиц замещены новыми группами. Единицы оснований поддерживаются для гибридизации с соответствующим соединением-мишенью нуклеиновой кислоты. Одно такое олигомерное соединение, РНК-миметик, которое, как показано, имеет отличные гибридизационные свойства, обозначается как пептидная нуклеиновая кислота (PNA). В соединениях PNA сахарный остов РНК заменен содержащим амид остовом, в частности, аминоэтилглициновым остовом. Основания нуклеиновой кислоты сохранены и связаны прямо или непрямо с аза-атомами азота амидной части остова. Примеры патентов США, в которых представлено получение соединений PNA, включают, но не ограничиваются этим, патенты США №№ 5539082; 5714331 и 5719262, каждый из которых включен в настоящее описание в качестве ссылки. Дополнительные указания на соединения PNA могут быть найдены, например, в Nielsen et al., Science, 1991, 254, 1497-1500.
Некоторые варианты осуществления, охарактеризованные в изобретении, включают РНК с фосфоротиоатными остовами и олигонуклеозиды с гетероатомными остовами и в частности --CH2--NH--CH2--, --CH2--N(CH3)—O--CH2-- [известный как метилен(метилимино) или MMI остов], --CH2--O--N(CH3)--CH2--, --CH2--N(CH3)--N(CH3)--CH2-- и --N(CH3)--CH2--CH2-- [где нативный фосфодиэфирный остов представлен как -O-P-O-CH2-] процитированного выше патента США № 5489677, и амидные остовы процитированного выше патента США № 5602240. В некоторых вариантах осуществления РНК, охарактеризованные в настоящем описании, имеют остовы структуры морфолино процитированного выше патента США № 5034506.
Модифицированные РНК могут также содержать одну или более замещенных частей сахаров. iRNA, например, dsRNA, охарактеризованные в настоящем описании, могут включать в положении 2' одно из следующего: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут быть замещены или не замещены от C1 до C10 алкилом или от C2 до C10 алкенилом и алкинилом. Примеры подходящих модификаций включают O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. В других вариантах осуществления dsRNA включают в положении 2' одно из следующего: от C1 до С10 низший алкил, замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, отщепляющую группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств iRNA или группу для улучшения фармакодинамических свойств iRNA и другие заместители, имеющие сходные свойства. В некоторых вариантах осуществления модификация включает 2'-метоксиэтокси(2'-O--CH2CH2OCH3, также известную как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78:486-504) т.е. алкокси-алкоксигруппу. Другим примером модификации является 2'-диметиламинооксиэтокси, т.е. O(CH2)2ON(CH3)2 группа, также известная как 2'-DMAOE, как описано в примерах настоящего документа ниже, и 2'-диметиламиноэтоксиэтокси (также известная в данной области техники как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2—O--CH2--N(CH2)2, также описанная в примерах настоящего документа ниже.
Другие модификации включают 2'-метокси(2'-OCH3), 2'-аминопропокси(2'-OCH2CH2CH2NH2) и 2'-фтор (2'-F). Сходные модификации могут быть также сделаны в других положениях РНК в iRNA, особенно в 3'-положении сахара на 3'-конце нуклеотида или в 2'-5'-связанных dsRNA и в 5'-положении 5'-конца нуклеотида. iRNA могут также иметь миметики сахаров, такие как циклобутиловые части вместо пентофуранозила сахара. Примеры патентов США, в которых представлено получение таких модифицированных структур сахаров, включают, но не ограничиваются этим, патенты США №№ 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633 и 5700920, некоторые из которых в большинстве случаев принадлежат рассматриваемой в данный момент заявке и каждый из которых включен в настоящее описание в качестве ссылки.
iRNA могут также включать модификации или замены нуклеотидных оснований (часто обозначаемых в данной области техники просто как «основания»). При применении в настоящем описании «немодифицированные» или «природные» нуклеотидные основания включают пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеотидные основания включают другие синтетические и природные нуклеотидные основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинилурацил и цитозин, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, особенно 5-бромо, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-дезазагуанин и 7-дезазааденин и 3-дезазагуанин и 3-дезазааденин. Дополнительные нуклеотидные основания включают основания, раскрытые в патенте США № 3687808, основания, раскрытые в Modified Nucleosides in Biochemistry, Biotechnology and Medicine, Herdewijn, P. ed. Wiley-VCH, 2008; основания, раскрытые в The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J. L, ed. John Wiley & Sons, 1990, основания, раскрытые в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и основания, раскрытые в Sanghvi, Y S., Chapter 15, dsRNA Research and Applications, pages 289-302, Crooke, S. T. and Lebleu, B., Ed., CRC Press, 1993. Некоторые из этих нуклеотидных оснований особенно пригодны для повышения связывающего сродства олигомерных соединений, охарактеризованных в изобретении. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и 0-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. 5-метилцитозиновые замены, как показано, повышают стабильность дуплекса нуклеиновых кислот на 0,6-1,2°С (Sanghvi, Y. S., Crooke, S. T. and Lebleu, B., Eds., dsRNA Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и являются примерами замен оснований особенно лучше в сочетании с 2'-O-метоксиэтильными модификациями сахаров.
Примеры патентов США, в которых представлено получение определенных из указанных выше модифицированных нуклеотидных оснований, а также других модифицированных нуклеотидных оснований, включают, но не ограничиваются этим, указанный выше патент США № 3687808, а также патенты США №№ 4845205; 513030; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5681941; 6015886; 6147200; 6166197; 6222025; 6235887; 6380368; 6528640; 6639062; 6617438; 7045610; 7427672 и 7495088, каждый из которых включен в настоящее описание в качестве ссылки, и патент США № 5750692, также включенный в настоящее описание в качестве ссылки.
РНК в iRNA можно также модифицировать для включения одной или более блокированных нуклеиновых кислот (LNA). Блокированная нуклеиновая кислота представляет собой нуклеотид, имеющий модифицированную рибозную часть, в которой часть рибозы включает добавочную связь, соединяющую 2'- и 4'-углероды. Эта структура эффективно «блокирует» рибозу в 3'-эндо-структурной конформации. Добавление блокированных нуклеиновых кислот к siRNA, как показано, повышает стабильность siRNA в сыворотке и снижает не относящиеся к мишени эффекты (Elmen, J. et al., (2005) Nucleic Acids Research 33(l):439-447; Mook, OR. et al., (2007) Mol Canc Ther 6(3):833-843; Grunweller, A. et al., (2003) Nucleic Acids Research 31(12):3185-3193).
Примеры патентов США, в которых представлено получение блокированных нуклеотидов нуклеиновой кислоты, включают, но не ограничиваются этим, следующие: патенты США №№ 6268490; 6670461; 6794499; 6998484; 7053207; 7084125 и 7399845, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
Другая модификация РНК в iRNA, охарактеризованных в изобретении, включает химическое присоединение к РНК одного или более лигандов, частей или конъюгатов, которые повышают активность, клеточное распределение, фармакокинетические свойства или клеточный захват iRNA. Такие части включают, но не ограничиваются этим, липидные части, такие как части холестерина (Letsinger et al., Proc. Natl. Acid. Sci. USA, 1989, 86: 6553-6556), холевой кислоты (Manoharan et al., Biorg. Med. Chem. Let., 1994, 4:1053-1060), тиоэфир, например, берил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660:306-309; Manoharan et al, Biorg. Med. Chem. Let., 1993, 3:2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20:533-538), алифатическую цепь, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J, 1991, 10: 1111-1118; Kabanov et al., FEBS Lett, 1990, 259:327-330; Svinarchuk et al., Biochimie, 1993, 75:49-54), фосфолипид, например, дигексадецил-rac-глицерин или 1,2-ди-O-гексадецил-rac-глицеро-3-фосфат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36:3651-3654; Shea et al., Nucl. Acids Res., 1990, 18:3777-3783), полиамин или цепь полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969-973), или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36:3651-3654), пальмитиловую часть (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229-237), или часть октадециламина или гексиламинокарбонилоксихолестерина (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277:923-937).
В одном варианте осуществления лиганд изменяет распределение, направленное действие или период жизни агента iRNA, в который он включен. В предпочтительных вариантах осуществления лиганд обеспечивает повышенное сродство к выбранной мишени, например, к молекуле, клетке или клеточному типу (например, к клетке печени, такой как гепатоцит), компартменту, например, компартменту клетки или органа, к ткани, органу или области организма, например, по сравнению с видами с отсутствием такого лиганда. Предпочтительные лиганды не должны принимать участия в спаривании дуплекса в дуплексной нуклеиновой кислоте.
Лиганды могут включать природное вещество, такое как белок (например, альбумин сыворотки человека (HSA), липопротеид низкой плотности (LDL) или глобин), углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин или гиалуроновая кислота) или липид. Лиганд может также представлять собой рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическую полиаминокислоту. Примеры полиаминокислот включают полиаминокислоту, такую как полилизин (PLL), поли-L-аспарагиновая кислота, поли-L-глутаминовая кислота, сополимер стирола-ангидрида малеиновой кислоты, сополимер поли(L-лактида-со-гликолида), сополимер дивинилового эфира-малеинового ангидрида, сополимер N-(2-гидроксипропил)метакриламида (HMPA), полиэтиленгликоль (ПЭГ), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловая кислота), полимеры N-изопропилакриламида или полифосфазин. Примеры полиаминов включают: полиэтиленимин, полилизин (PLL), спермин, спермидин, полиамин, псевдопептид-полиамин, пептидомиметический полиамин, дендримерный полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичную соль полиамина или α-спирализованный пептид.
Лиганды могут также включать направляющие группы, например, агент, направляющий на клетку или ткань, например, лектин, гликопротеин, липид или белок, например, антитело, которое связывается с определенным клеточным типом, таким как клетка почки. Направляющая группа может представлять собой тиреотропин, меланотропин, лектин, гликопротеин, белок A сурфактанта, углевод муцина, многовалентную лактозу, многовалентную галактозу, N- ацетилгалактозамин, N-ацетилглюкозамин, многовалентную маннозу, многовалентную фукозу, гликозилированные полиаминокислоты, многовалентную галактозу, трансферрин, бисфосфонат, полиглутамат, полиаспартат, липид, холестерин, стероид, желчную кислоту, фолат, витамин B12, витамин A, биотин или пептид RGD или пептидомиметик RGD.
Другие примеры лигандов включают красители, интеркалирующие агенты (например, акридины), поперечно сшивающие агенты (например, псорален, митомицин C), порфирины (TPPC4, тексафирин, сапфирин), полициклические ароматические углеводороды (например, феназин, дигидрофеназин), искусственные эндонуклеазы (например, EDTA), липофильные молекулы, например, холестерин, холевую кислоту, адамантануксусную кислоту, 1-пирен-масляную кислоту, дигидротестостерон, 1,3-бис-O-(гексадецил)глицерин, геранилоксигексильную группу, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, гептадецильную группу, пальмитиновую кислоту, миристиновую кислоту, O3-(олеоил)литохолевую кислоту, O3-(олеоил)холевую кислоту, диметокситритил или феноксазин) и пептидные конъюгаты (например, пептид Antennapedia, пептид Tat), алкилирующие агенты, фосфат, амино, меркапто, ПЭГ (например, ПЭГ-40K), MPEG, [MPEG]2, полиамино, алкил, замещенный алкил, меченные радиоактивностью маркеры, ферменты, гаптены (например, биотин), агенты, облегчающие транспорт/поглощение (например, аспирин, витамин E, фолиевую кислоту), синтетические рибонуклеазы (например, имидазол, бисимидазол, гистамин, имидазольные кластеры, акридин-имидазольные конъюгаты, Eu3+ комплексы тетраазамакроциклов), динитрофенил, HRP или AP.
Лиганды могут представлять собой белки, например, гликопротеины или пептиды, например, молекулы, имеющие специфическое сродство к колиганду или к антителам, например, к антителу, которое связывается со специфическим клеточным типом, таким как раковая клетка, эндотелиальная клетка или клетка кости. Лиганды могут также включать гормоны и рецепторы гормонов. Они могут также включать непептидные соединения, такие как липиды, лектины, углеводы, витамины, кофакторы, многовалентную лактозу, многовалентную галактозу, N-ацетилгалактозамин, N-ацетилглюкозамин, многовалентную маннозу или многовалентную фукозу. Лиганд может представлять собой, например, липополисахарид, активатор киназы p38 MAP или активатор NF-κB.
Лиганд может представлять собой вещество, например, лекарство, которое может повышать захват агента iRNA в клетку, например, путем нарушения клеточного цитоскелета, например, разрушая клеточные микротрубочки, микрофиламенты и/или промежуточные филаменты. Лекарство может представлять собой, например, таксон, винкристин, винбластин, цитохалазин, нокодазол, джаплакинолид, латрункулин A, фаллоидин, свинголид A, инданоцин или миосервин.
В некоторых вариантах осуществления лиганд, присоединенный к iRNA, как описано в настоящем документе, действует в качестве модулятора PK. При применении в настоящем описании «модулятор PK» обозначает модулятор фармакокинетики. Модуляторы PK включают липофилы, желчные кислоты, стероиды, аналоги фосфолипидов, пептиды, связывающие белок агенты, ПЭГ, витамины и т.д. Примеры модуляторов PK включают, но не ограничиваются этим, холестерин, жирные кислоты, холевую кислоту, литохолевую кислоту, диалкилглицериды, диацилглицерид, фосфолипиды, сфинголипиды, напроксен, ибупрофен, витамин Е, биотин и т.д. Олигонуклеотиды, которые включают ряд фосфоротиоатных связей, также как известно, связываются с сывороточным белком, таким образом, короткие олигонуклеотиды, например, олигонуклеотиды приблизительно из 5 оснований, 10 оснований, 15 оснований или 20 оснований, включающие в остове множественные фосфоротиоатные связи, также вносятся в настоящее изобретение в качестве лигандов (например, в качестве лигандов, модулирующих PK). Кроме того, аптамеры, которые связывают компоненты сыворотки (например, белки сыворотки), также подходят для использования в качестве лигандов, модулирующих PK, в вариантах осуществления, описанных в настоящем документе.
Для макромолекулярных лекарств и гидрофильных лекарственных молекул, которые не могут легко пересекать бислойные мембраны, захват в эндосомальные/лизосомальные компартменты клетки, как считается, является наибольшим препятствием для эффективной доставки к их месту действия. В последние годы разработан ряд подходов и стратегий, направленных на эту проблему. Для лизосомальных составов наиболее обычным является подход с использованием в составах сливающих липидов (Singh, R. S., Goncalves, C. et al. (2004). On the Gene Delivery Efficacies of pH- Sensitive Cationic Lipids via Endosomal Protonation. A Chemical Biology Investigation. Chem. Biol. 11, 713-723.). Другие компоненты, которые проявляют чувствительную к рН эндосомолитическую активность путем протонизации и/или индуцируемых рН конформационных изменений, включают заряженные полимеры и пептиды. Примеры могут быть найдены в Hoffman, A. S., Stayton, P. S. et al. (2002). Design of "smart" polymers that can direct intracellular drug delivery. Polymers Adv. Technol. 13, 992-999; Kakudo, Chaki, T., S. et al. (2004). Transferrin-Modified Liposomes Equipped with a pH-Sensitive Fusogenic Peptide: An Artificial Viral-like Delivery System. Biochemistry 436, 5618-5628; Yessine, M. A. and Leroux, J. C. (2004). Membrane-destabilizing polyanions: interaction with lipid bilayers and endosomal escape of biomacromolecules. Adv. Drug Deliv. Rev. 56, 999-1021; Oliveira, S., van Rooy, I. et al. (2007). Fusogenic peptides enhance endosomal escape improving iRNA-induced silencing of oncogenes. Int. J. Pharm. 331, 211-4. Они обычно используются в контексте систем доставки лекарств, таких как липосомы или липоплексы. Для доставки, опосредуемой фолатным рецептором, с использованием липосомных составов, например, в липосомы включают чувствительный к рН сливающий пептид и, как показано, это увеличивает активность путем улучшения высвобождения лекарства в процессе захвата лекарства (Turk, M. J., Reddy, J. A. et al. (2002). Characterization of a novel pH-sensitive peptide that enhances drug release from folate-targeted liposomes at endosomal pHs is described in Biochim. Biophys. Acta 1559, 56-68).
В определенных вариантах осуществления эндосомолитические компоненты по настоящему изобретению могут представлять собой полианионные пептиды или пептидомиметики, которые проявляют рН-зависимую мембранную активность и/или способность к слиянию. Пептидомиметик может представлять собой небольшую белковоподобную цепь, созданную для имитации пептида. Пептидомиметик можно получать в результате модификации существующего пептида для того, чтобы изменить свойства молекулы, или в результате синтеза пептидоподобной молекулы с использованием неприродных аминокислот или их аналогов. В определенных вариантах осуществления они имеют улучшенную стабильность и/или биологическую активность по сравнению с пептидом. В определенных вариантах осуществления эндосомолитический компонент обретает свою активную конформацию при эндосомальном рН (например, рН 5-6). «Активная конформация» представляет собой такую конформацию, при которой эндосомолитический компонент стимулирует лизис эндосомы и/или транспорт модульной композиции, охарактеризованной в изобретении, или любых ее компонентов (например, нуклеиновой кислоты) из эндосомы в цитоплазму клетки.
Можно провести скрининг библиотек соединений на их дифференциальную мембранную активность при рН эндосом относительно нейтрального рН с использованием метода гемолизиса. Обнадеживающие кандидаты, выделенные с помощью этого метода, могут быть использованы в качестве компонентов модульных композиций, охарактеризованных в изобретении. Метод идентификации эндосомолитического компонента для использования в композициях и способах по настоящему изобретению может включать: предоставление библиотеки соединений; введение в контакт клеток крови с членами библиотеки, где контролируется рН среды, в которой осуществляется контактирование; определение того, будут ли соединения индуцировать дифференциальный лизис клеток крови при низком рН (например, приблизительно рН 5-6) по сравнению с нейтральным рН (например, приблизительно рН 7-8).
Примеры эндосомолитических компонентов включают пептид GALA (Subbarao et al., Biochemistry, 1987, 26: 2964-2972), пептид EALA (Vogel et al., J. Am. Chem. Soc, 1996, 118: 1581-1586) и их производные (Turk et al., Biochem. Biophys. Acta, 2002, 1559: 56-68). В определенных вариантах осуществления эндосомолитический компонент может содержать химическую группу (например, аминокислоту), которая должна подвергаться изменению заряда или протонизации в ответ на изменение рН. Эндосомолитический компонент может быть линейным или разветвленным. Примеры первичных последовательностей эндосомолитических компонентов включают H2N-(AALEALAEALEALAEALEALAEAAAAGGC)-CO2H (SEQ ID NO:2); H2N-(AALAEALAEALAEALAEALAEALAAAAGGQ-CO2H (SEQ ID NO:3); и H2N- (ALEALAEALEALAEA)-CONH2 (SEQ ID NO:4).
В определенных вариантах осуществления в агент iRNA, охарактеризованный в изобретении, может быть включено более одного эндосомолитического компонента. В некоторых вариантах осуществления это должно влечь за собой включение более одного из тех же самых эндосомолитических компонентов в агент iRNA. В других вариантах осуществления это должно влечь за собой включение двух или более различных эндосомолитических компонентов в агент iRNA.
Эти эндосомолитические компоненты могут опосредовать утечку эндосом, например, путем изменения конформации при рН эндосом. В определенных вариантах осуществления эндосомолитические компоненты могут существовать в конформации случайного клубка при нейтральном рН и реорганизовываться в амфипатическую спираль при эндосомальном рН. Вследствие этого конформационного перехода эти пептиды могут встраиваться в липидную мембрану эндосомы, вызывая утечку эндосомальных компонентов в цитоплазму. Поскольку конформационный переход является зависимым от рН, эндосомолитические компоненты могут мало проявлять или не проявлять сливающей активности при циркуляции в крови (рН~7,4). При применении в настоящем описании «сливающая активность» определяется как такая активность, которая приводит к разрушению липидной мембраны эндосомолитическим компонентом. Одним примером сливающей активности является разрушение эндосомальной мембраны эндосомолитическим компонентом, приводящее к лизису эндосом и транспорту одного или более компонентов модульной композиции, охарактеризованной в изобретении (например, нуклеиновой кислоты), из эндосомы в цитоплазму.
В дополнение к методам гемолизиса, как описано в настоящем документе, подходящие эндосомолитические компоненты могут быть протестированы и идентифицированы специалистом в данной области техники с использованием других методов. Например, способность соединения отвечать, например, на изменение заряда в зависимости от рН окружения может быть протестирована с помощью общепринятых методов, например, теста на уровне клеток. В определенных вариантах осуществления тестируемое соединение смешивают или вводят в контакт с клеткой, и клетке дают возможность интернализовать тестируемое соединение, например, с помощью эндоцитоза. Затем может быть осуществлено получение эндосом из входивших в контакт клеток, и этот препарат эндосом сравнивают с препаратом эндосом из контрольных клеток. Изменение, например, снижение фракции эндосом из входившей в контакт клетки по сравнению с контрольной клеткой указывает на то, что тестируемое соединение может функционировать в качестве сливающего агента. Альтернативно, входившая в контакт клетка и контрольная клетка могут оцениваться, например, под микроскопом, например, под световым или электронным микроскопом, для определения различий в популяциях эндосом в этих клетках. Тестируемое соединение и/или эндосомы могут быть промечены, например, для количественной оценки эндосомальной утечки.
В методе другого типа агент iRNA, описанный в настоящем документе, создается с использованием одного или более протестированных или предполагаемых сливающих агентов. Агент iRNA может быть меченым для облегчения визуализации. Способность эндосомолитического компонента стимулировать утечку эндосом, как только агент iRNA захватывается клеткой, может быть оценена, например, с помощью получения препарата эндосом или путем микроскопических методов, которые дают возможность визуализации меченого агента iRNA в цитоплазме клетки. В других определенных вариантах осуществления ингибирование экспрессии гена или любой другой физиологический параметр может быть использован как заменяющий маркер утечки эндосом.
В других вариантах осуществления спектроскопия кругового дихроизма может быть использована для идентификации соединений, которые характеризуются зависимым от рН структурным переходом.
Может быть выполнен двухстадийный тест, где в первом тесте оценивается способность самого тестируемого соединения отвечать на изменения рН, а во втором тесте оценивается способность модульной композиции, которая включает тестируемое соединение, отвечать на изменения рН.
Конъюгаты липидов
В случае одного лиганда лиганд или конъюгат представляет собой липид или молекулу на основе липида. Такой липид или молекула на основе липида предпочтительно связывается с сывороточным белком, например, сывороточным альбумином человека (HSA). Связанный с HSA лиганд предоставляет возможность распределения конъюгата в ткани-мишени, например, ткани-мишени организма, не относящейся к почке. Например, ткань-мишень может представлять собой печень, включая паренхиматозные клетки печени. Другие молекулы, которые могут связываться с HSA, также могут быть использованы в качестве лигандов. Например, может быть использован непроксин или аспирин. Липид или лиганд на основе липида может (a) повышать устойчивость конъюгата к деградации, (b) повышать направленное действие или транспорт в клетку-мишень или клеточную мембрану, и/или (c) может быть использован для адаптирования связывания с сывороточным белком, например, HSA.
Лиганд на основе липида может быть использован для модуляции, например, контроля связывания конъюгата с тканью-мишенью. Например, липид или лиганд на основе липида, который связывается с HSA более сильно, менее вероятно будет направленно доставляться к почке и, следовательно, менее вероятно будет выведен из организма. Липид или лиганд на основе липида, который связывается с HSA менее сильно, может быть использован для направленной доставки конъюгата в почку.
В предпочтительном варианте осуществления лиганд на основе липида связывается с HSA. Предпочтительно, он связывается с HSA с достаточным сродством, так что конъюгат будет предпочтительно распределяться в ткани, не относящейся к почке. Однако предпочтительно, чтобы сродство не было настолько сильным, чтобы взаимодействие HSA-лиганд нельзя было обращать.
В другом предпочтительном варианте осуществления лиганд на основе липида связывается с HSA слабо или не связывается совсем, так что конъюгат будет предпочтительно распределяться в почке. Другие компоненты, которые направленно действуют на клетки почки, также могут быть использованы вместо или в дополнение к лиганду на основе липида.
В другом аспекте лиганд представляет собой компонент, например, витамин, который захватывается клеткой-мишенью, например, пролиферирующей клеткой. Это особенно пригодно для лечения нарушений, характеризуемых нежелательной клеточной пролиферацией, например, малигнизированного или немалигнизированного типа, например, раковых клеток. Примеры витаминов включают витамин A, E и K. Другие примеры витаминов включают витамин B, например, фолиевую кислоту, B12, рибофлавин, биотин, пиридоксаль или другие витамины или питательные вещества, захватываемые раковыми клетками. Включаются также HSA и липопротеид низкой плотности (LDL).
В другом аспекте лиганд представляет собой проникающий в клетку агент, предпочтительно спирализованный проникающий в клетку агент. Предпочтительно агент является амфипатическим. Примером агента является пептид, такой как tat или antennapedia. Если агент представляет собой пептид, он может быть модифицирован, включая пептидилмиметик, инвертомеры, непептидные или псевопептидные связи и использование D-аминокислот. Спирализованный агент предпочтительно представляет собой α-спирализованный агент, который предпочтительно имеет липофильную и липофобную фазу.
Пептиды, проникающие в клетку
Пептиды, подходящие для применения в настоящем изобретении, могут представлять собой природный пептид, например, пептид tat или antennapedia, синтетический пептид или пептидомиметик. Более того, пептид может представлять собой модифицированный пептид, например, пептид может включать непептидные или псевопептидные связи и D-аминокислоты. Пептидомиметик (также обозначаемый в настоящем описании как олигопептидомиметик) представляет собой молекулу, способную укладываться в определенную трехмерную структуру, сходную с природным пептидом. Присоединение пептида и пептидомиметиков к агентам iRNA может влиять на фармакокинетическое распределение iRNA, например, путем усиления узнавания и поглощения клеткой. Пептидная часть или часть пептидомиметика может составлять приблизительно 5-50 аминокислот в длину, например, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот в длину.
Пептид или пептидомиметик может представлять собой, например, пептид, проникающий в клетку, катионный пептид, амфипатический пептид или гидрофобный пептид (например, состоящий главным образом из Tyr, Trp или Phe). Пептидная часть может представлять собой дендримерный пептид, несвободный пептид или поперечно сшитый пептид. В другом альтернативном варианте пептидная часть может включать гидрофобную последовательность мембранной транслокации (MTS). Примером пептида, содержащего гидрофобную MTS, является RFGF, имеющий аминокислотную последовательность AAVALLPAVLLALLAP (SEQ ID NO:5). Аналог RFGF (например, аминокислотная последовательность AALLPVLLAAP (SEQ ID NO:6)), содержащий гидрофобную MTS, также может представлять собой направляющую часть. Пептидная часть может представлять собой пептид «для доставки», который может переносить крупные полярные молекулы, включая пептиды, олигонуклеотиды и белки, через клеточные мембраны. Например, последовательности из белка Tat ВИЧ (GRKKRRQRRRPPQ (SEQ ID NO:7)) и белка Antennapedia Drosophila (RQIKIWFQNRRMKWKK (SEQ ID NO: 8)), как обнаружено, способны функционировать в качестве пептидов для доставки. Пептид или пептидомиметик может кодироваться произвольной последовательностью ДНК, такой как идентифицированная для пептида из библиотеки фагового дисплея, или из комбинаторной библиотеки одна-гранула-одно-соединение (OBOC) (Lam et al., Nature, 354:82-84, 1991). Предпочтительно пептид или пептидомиметик, привязанный к липиду, представляет собой пептид, направленный на клетку, такой как аргинин-глицин-аспарагиновая кислота (RGD)-пептид или RGD-миметик. Пептидная часть может иметь диапазон длины от приблизительно 5 аминокислот до приблизительно 40 аминокислот. Пептидные части могут иметь структурную модификацию, такую как модификация для повышения стабильности или управляющая конформационными свойствами. Могут быть использованы любые структурные модификации, описанные ниже.
RGD-пептидная часть может быть использована для направленной доставки к опухолевой клетке, такой как эндотелиальная опухолевая клетка или опухолевая клетка рака молочной железы (Zitzmann et al., Cancer Res., 62:5139-43, 2002). RGD-пептид может облегчать направленную доставку агента dsRNA к опухолям других разнообразных тканей, включая легкое, почку, селезенку или печень (Aoki et al., Cancer Gene Therapy 8:783-787, 2001). Предпочтительно RGD-пептид должен облегчать направленную доставку агента iRNA к почке. RGD-пептид может быть линейным или циклическим и может быть модифицированным, например, гликозилированным или метилированным, для облегчения направленной доставки к конкретным тканям. Например, гликозилированный RGD-пептид может доставлять агент iRNA к опухолевой клетке, экспрессирующей αvβ3 (Haubner et al., Jour. Nucl. Med., 42:326-336, 2001).
Могут быть использованы пептиды, которые направлены на маркеры, которыми обогащены пролиферирующие клетки. Например, пептиды и пептидомиметики, содержащие RGD, могут направленно доставляться к раковым клеткам, в частности к клеткам, которые экспрессируют интегрин αvβ3. Таким образом, можно использовать RGD-пептиды, циклические пептиды, содержащие RGD, RGD-пептиды, которые включают D-аминокислоты, а также синтетические RGD-миметики. В дополнение к RGD можно использовать другие части, которые направленно действуют на лиганд интегрин αvβ3. В целом такие лиганды могут быть использованы для контроля клеточной пролиферации и ангиогенеза.
«Проникающий в клетку пептид» способен проникать в клетку, например, в микробную клетку, такую как бактериальная клетка или клетка гриба, или в клетку млекопитающего, такую как клетка человека. Проникающий в микробную клетку пептид может представлять собой, например, α-спирализованный линейный пептид (например, LL-37 или серопин P1), пептид, содержащий дисульфидную часть (например, α-дефенсин, β-дефенсин или бактенектин), или пептид, содержащий только одну или две доминирующих аминокислоты (например, PR-39 или индолицидин). Проникающий в клетку пептид может также включать сигнал ядерной транслокации (NLS). Например, проникающий в клетку пептид может представлять собой двухкомпонентный амфипатический пептид, такой как MPG, который происходит из гибридного пептидного домена gp41 ВИЧ-1 и NLS большого Т антигена SV40 (Simeoni et al., Nucl. Acids Res. 31:2717-2724, 2003).
Углеводные конъюгаты
В некоторых вариантах осуществления олигонуклеотиды iRNA, описанные в настоящем документе, дополнительно включают углеводные конъюгаты. Углеводные конъюгаты выгодны для доставки in vivo нуклеиновых кислот, а также композиций, которые подходят для терапевтического использования in vivo, как описано в настоящем документе. При применении в настоящем описании «углевод» обозначает соединение, которое представляет собой либо углевод per se, состоящий из одной или более моносахаридных единиц, имеющих, по меньшей мере, 6 углеродных атомов (которые могут быть линейными, разветвленными или циклическими) с атомом кислорода, азота или серы, связанным с каждым атомом углерода; либо соединение, имеющее в качестве своей части углеводную часть, состоящую из одной или более моносахаридных единиц, причем каждая имеет, по меньшей мере, шесть углеродных атомов (которые могут быть линейными, разветвленными или циклическими) с атомом кислорода, азота или серы, связанным с каждым атомом углерода. Примеры углеводов включают сахара (моно-, ди-, три- и олигосахариды, содержащие от приблизительно 4-9 моносахаридных единиц) и полисахариды, такие как крахмалы, гликоген, целлюлоза и полисахаридные камеди. Конкретные моносахариды включают C5 и выше (предпочтительно C5-C8) сахара; ди- и трисахариды включают сахара, имеющие две или три моносахаридных единицы (предпочтительно C5-C8).
В одном варианте осуществления углеводный конъюгат выбран из группы, состоящей из:
 Формула II
Формула II
 Формула III
Формула III
 Формула IV
Формула IV
 Формула V
Формула V
 Формула VI
Формула VI
 Формула VII
Формула VII
 Формула VIII
Формула VIII
 Формула IX
Формула IX
 Формула X
Формула X
 Формула XI
Формула XI
 Формула XII
Формула XII
 Формула XIII
Формула XIII
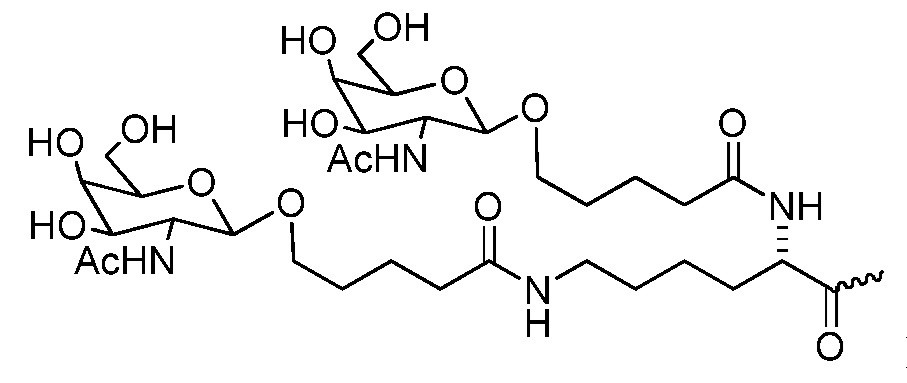 Формула XIV
Формула XIV
 Формула XV
Формула XV
 Формула XVI
Формула XVI
 Формула XVII
Формула XVII
 Формула XVIII
Формула XVIII
 Формула XIX
Формула XIX
 Формула XX
Формула XX
 Формула XXI
Формула XXI
 Формула XXII, т.е. формула II-формула XXII.
Формула XXII, т.е. формула II-формула XXII.
Другой пример углеводного конъюгата для использования в вариантах осуществления, описанных в настоящем документе, включает, но не ограничивается этим,

(Формула XXIII),
где один из X или Y представляет собой олигонуклеотид, другой представляет собой водород.
В некоторых вариантах осуществления углеводный конъюгат дополнительно включает другой лиганд, такой как, но не ограничиваясь этим, модулятор PK, эндосомолитический лиганд и проникающий в клетку пептид.
Линкеры
В некоторых вариантах осуществления конъюгаты, описанные в настоящем документе, могут быть присоединены к олигонуклеотиду iRNA с помощью различных линкеров, которые могут быть отщепляемыми или неотщепляемыми.
Термин «линкер» или «линкерная группа» обозначает органическую часть, которая соединяет две части соединения. Линкеры обычно включают прямую связь или атом, такой как кислород или сера, единицу, такую как NR8, C(O), C(O)NH, SO, SO2, SO2NH, или цепь атомов, такую как, но не ограничиваясь этим, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арилалкил, арилалкенил, арилалкинил, гетероарилалкил, гетероарилалкенил, гетероарилалкинил, гетероциклилалкил, гетероциклилалкенил, гетероциклилалкинил, арил, гетероарил, гетероциклил, циклоалкил, циклоалкенил, алкиларилалкил, алкиларилалкенил, алкиларилалкинил, алкениларилалкил, алкениларилалкенил, алкениларилалкинил, алкиниларилалкил, алкиниларилалкенил, алкиниларилалкинил, алкилгетероарилалкил, алкилгетероарилалкенил, алкилгетероарилалкинил, алкенилгетероарилалкил, алкенилгетероарилалкенил, алкенилгетероарилалкинил, алкинилгетероарилалкил, алкинилгетероарилалкенил, алкинилгетероарилалкинил, алкилгетероциклилалкил, алкилгетероциклилалкенил, алкилгетероциклилалкинил, алкенилгетероциклилалкил, алкенилгетероциклилалкенил, алкенилгетероциклилалкинил, алкинилгетероциклилалкил, алкинилгетероциклилалкенил, алкинилгетероциклилалкинил, алкиларил, алкениларил, алкиниларил, алкилгетероарил, алкенилгетероарил, алкинилгетероарил, где один или более метиленов могут быть прерваны или оканчиваться O, S, S(O), SO2, N(R8), C(O), замещенным или незамещенным арилом, замещенным или незамещенным гетероарилом, замещенным или незамещенный гетероциклическим соединением; где R8 представляет собой водород, ацил, алифатическое или замещенное алифатическое соединение. В одном варианте осуществления линкер находится между 1-24 атомами, предпочтительно между 4-24 атомами, предпочтительно между 6-18 атомами, более предпочтительно между 8-18 атомами и наиболее предпочтительно между 8-16 атомами.
Расщепляемая линкерная группа представляет собой группу, которая достаточно стабильна вне клетки, но которая расщепляется при входе в клетку-мишень с высвобождением двух частей линкера, удерживающихся вместе. В предпочтительном варианте осуществления расщепляемая линкерная группа расщепляется, по меньшей мере, в 10 раз или более, предпочтительно, по меньшей мере, в 100 раз быстрее в клетке-мишени или при первом исходном условии (которое может быть выбрано, например, для имитации или представления внутриклеточных условий), чем в крови индивидуума или при втором исходном условии (которое может быть выбрано, например, для имитации или представления условий, имеющихся в крови или сыворотке).
Расщепляемые линкерные группы чувствительны к расщепляющим агентам, например, к рН, окислительно-восстановительному потенциалу или присутствию вызывающих деградацию молекул. Обычно расщепляющие агенты более распространены или находятся на более высоком уровне или с более высокой активностью внутри клеток, чем в сыворотке или крови. Примеры таких вызывающих деградацию агентов включают: окислительно-восстановительные агенты, которые выбирают для конкретных субстратов или которые не имеют субстратной специфичности, включая, например, окислительные или восстановительные ферменты или восстанавливающие агенты, такие как меркаптаны, присутствующие в клетках, которые могут вызывать окислительно-восстановительный распад расщепляемой линкерной группы за счет восстановления; эндосомы или агенты, которые могут создать кислую среду, например, агенты, которые приводят к рН пять или ниже; ферменты, которые гидролизируют расщепляемую в кислых условиях линкерную группу или вызывают ее деградацию в результате действия как обычная кислота, пептидазы (которые могут быть специфичными для субстрата) и фосфатазы.
Расщепляемая линкерная группа, такая как дисульфидная связь, может быть чувствительна к рН. рН сыворотки человека составляет 7,4, тогда как средний внутриклеточный рН несколько ниже, находясь в диапазоне приблизительно 7,1-7,3. Эндосомы имеют более кислый рН в диапазоне 5,5-6,0, и лизосомы имеют еще более кислый рН приблизительно 5,0. Некоторые линкеры имеют расщепляемую линкерную группу, которая расщепляется при предпочтительном рН, вызывая тем самым высвобождение катионного липида от лиганда внутри клетки или в желаемом компартменте клетки.
Линкер может включать расщепляемую линкерную группу, которая расщепляется под действием конкретного фермента. Тип расщепляемой линкерной группы, включенной в линкер, может зависеть от клетки, являющейся мишенью. Например, лиганды, направленные на печень, могут быть соединены линкером с катионными липидами через линкер, который включает группу сложного эфира. Клетки печени богаты эстеразами и, следовательно, линкер будет расщепляться более эффективно в клетках печени, чем в клеточных типах, которые не обогащены эстеразами. Другие клеточные типы, богатые эстеразами, включают клетки легкого, коры почки и семенника.
Линкеры, которые содержат пептидные связи, могут быть использованы, когда клеточные типы, являющиеся мишенями, богаты пептидазами, как, например, клетки печени и синовиоциты.
В целом, пригодность кандидатной расщепляемой линкерной группы может быть оценена путем тестирования способности вызывающего деградацию агента (или условия) расщеплять кандидатную линкерную группу. Может быть также желательно тестирование кандидатной расщепляемой линкерной группы также на способность к устойчивости к расщеплению в крови или при контакте с другой тканью, не являющейся мишенью. Таким образом, можно определить относительную восприимчивость к расщеплению между первым и вторым состоянием, когда первое состояние выбирают как показатель расщепления в клетке-мишени, а второе состояние выбирают как показатель расщепления в других тканях или биологических жидкостях, например, в крови или сыворотке. Определения могут быть выполнены в бесклеточных системах, в клетках, в клеточной культуре, в органной или тканевой культуре или на целых животных. Может быть полезным выполнение первичных оценок в бесклеточной системе или в условиях культуры и подтверждение с помощью дальнейших оценок на целых животных. В предпочтительных вариантах осуществления пригодные кандидатные соединения расщепляются, по меньшей мере, в 2, 4, 10 или 100 раз быстрее в клетке (или в условиях in vitro, выбранных для имитации внутриклеточных условий) по сравнению с кровью или сывороткой (или с условиями in vitro, выбранными для имитации внеклеточных условий).
Линкерные группы, расщепляемые окислительно-восстановительным потенциалом
Одним классом расщепляемых линкерных групп являются линкерные группы, расщепляемые окислительно-восстановительным потенциалом, которые расщепляются при восстановлении или окислении. Примером расщепляемой при восстановлении линкерной группы является дисульфидная линкерная группа (-S-S-). Для определения того, является ли кандидатная расщепляемая линкерная группа походящей в качестве «расщепляемой при восстановлении линкерной группы» или, например, подходит для использования с конкретной частью iRNA и конкретным направляющим агентом, можно рассмотреть методы, описанные в настоящем документе. Например, кандидат может быть определен путем инкубации с дитиотреитолом (DTT) или с другим восстанавливающим агентом с использованием реагентов, известных в данной области техники, которые имитируют степень расщепления, которая должна наблюдаться в клетке, например, в клетке-мишени. Кандидаты могут быть также оценены в условиях, которые выбирают для имитации условий в крови или в сыворотке. В предпочтительном варианте осуществления кандидатные соединения расщепляются в крови самое большее на 10%. В предпочтительном варианте осуществления пригодные кандидатные соединения деградируют, по меньшей мере, в 2, 4, 10 или 100 раз быстрее в клетке (или в условиях in vitro, выбранных для имитации внутриклеточных условий) по сравнению с кровью (или с условиями in vitro, выбранными для имитации внеклеточных условий). Степень расщепления кандидатных соединений может быть определена с использованием стандартных методов кинетического анализа ферментов в условиях, выбранных для имитации внутриклеточных сред, при сравнении с условиями, выбранными для имитации внеклеточных сред.
Расщепляемые линкерные группы на основе фосфатов
Расщепляемые линкерные группы на основе фосфатов расщепляются агентами, которые разрушают или гидролизуют фосфатную группу. Примером агента, который расщепляет фосфатные группы в клетках, являются ферменты, такие как клеточные фосфатазы. Примерами расщепляемых линкерных групп на основе фосфатов являются -O-P(O)(ORk)-O-, -O-P(S)(ORk)-O-, -O-P(S)(SRk)-O-, -S-P(O)(ORk)-O-, -O-P(O)(ORk)-S-, -S-P(O)(ORk)-S-, -O-P(S)(ORk)-S-, -S-P(S)(ORk)-O-, -O-P(O)(Rk)-O-, -O-P(S)(Rk)-O-, -S-P(O)(Rk)-O-, -S-P(S)(Rk)-O-, -S-P(O)(Rk)-S-, -O-P(S)(Rk)-S-. В предпочтительных вариантах осуществления это -O-P(O)(OH)-O-, -O-P(S)(OH)-O-, -O-P(S)(SH)-O-, -S-P(O)(OH)-O-, -O-P(O)(OH)-S-, -S-P(O)(OH)-S-, -O-P(S)(OH)-S-, -S-P(S)(OH)-O-, -O-P(O)(H)-O-, -O-P(S)(H)-O-, -S-P(O)(H)-O-, -S-P(S)(H)-O-, -S-P(O)(H)-S-, -O-P(S)(H)-S-. В предпочтительном варианте осуществления это -O-P(O)(OH)-O-. Эти кандидаты могут быть определены с использованием методов, аналогичных, описанным выше.
Линкерные группы, расщепляемые в кислых условиях
Линкерные группы, расщепляемые в кислых условиях, представляют собой линкерные группы, которые расщепляются в условиях кислой среды. В предпочтительных вариантах осуществления линкерные группы, расщепляемые в кислых условиях, расщепляются в условиях кислой среды при рН приблизительно 6,5 или ниже (например, приблизительно 6,0, 5,5, 5,0 или ниже) или с помощью агентов, таких как ферменты, которые могут действовать в качестве обычной кислоты. В клетке специфический низкий рН органелл, таких как эндосомы и лизосомы, может обеспечить среду для расщепления линкерных групп, расщепляемых в кислых условиях. Примеры линкерных групп, расщепляемых в кислых условиях, включают, но не ограничиваются этим, гидразоны, сложные эфиры и сложные эфиры аминокислот. Группы, расщепляемые в кислых условиях, могут иметь общую формулу C=NN-, C(O)O или -OC(O). Предпочтительным вариантом осуществления является такой, когда углерод, присоединенный к кислороду сложного эфира (алкоксигруппа) представляет собой арильную группу, замещенную арильную группу или третичную алкильную группу, такую как диметилпентил или трет-бутил. Эти кандидаты могут быть определены с использованием методов, аналогичных, описанным выше.
Линкерные группы на основе сложных эфиров
Расщепляемые линкерные группы на основе сложных эфиров расщепляются в клетках ферментами, такими как эстеразы и амидазы. Примеры расщепляемых линкерных групп на основе сложных эфиров включают, но не ограничиваются этим, сложные эфиры алкиленовых, алкениленовых и алкиниленовых групп. Расщепляемые линкерные группы на основе сложных эфиров имеют общую формулу -C(O)O- или -OC(O)-. Эти кандидаты могут быть определены с использованием методов, аналогичных, описанным выше.
Расщепляемые группы на основе пептидов
Расщепляемые линкерные группы на основе пептидов расщепляются в клетках ферментами, такими как пептидазы и протеазы. Расщепляемые линкерные группы на основе пептидов представляют собой пептидные связи, образованные между аминокислотами с получением олигопептидов (например, дипептидов, трипептидов и т.д.) и полипептидов. Расщепляемые группы на основе пептидов не включают амидную группу (-C(O)NH-). Амидная группа может быть образована между любым алкиленом, алкениленом или алкинеленом. Пептидная связь представляет собой специфический тип амидной связи, образованной между аминокислотами, с получением пептидов и белков. Расщепляемая группа на основе пептидов обычно ограничивается пептидной связью (т.е. амидной связью), образованной между аминокислотами с получением пептидов и белков и не включает полной амидной функциональной группы. Расщепляемые линкерные группы на основе пептидов имеют общую формулу NHCHRAC(O)NHCHRBC(O)-, где RA и RB представляют собой группы R двух соседних аминокислот. Эти кандидаты могут быть определены с использованием методов, аналогичных, описанным выше.
Примеры углеводных конъюгатов с линкерами включают, но не ограничиваются этим,
 (Формула XXIV),
(Формула XXIV),
 (Формула XXV),
(Формула XXV),

(Формула XXVI),

(Формула XXVII),

(Формула XXVIII),

(Формула XXIX) и

(Формула XXX),
где один из X или Y представляет собой олигонуклеотид, другой представляет собой водород.
Примеры патентов США, в которых представлено получение конъюгатов РНК, включают, но не ограничиваются этим, патенты США №№ 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941; 6294664; 6320017; 6576752; 6783931; 6900297; 7037646; каждый из которых включен в настоящее описание в качестве ссылки.
Необязательно, чтобы все положения данного соединения были модифицированы одинаково, и фактически более одной указанной выше модификации может быть включено в одно соединение или даже в единственный нуклеотид в пределах iRNA. В настоящее изобретение включаются также соединения iRNA, которые представляют собой гибридные соединения. «Гибридные» соединения iRNA или «химеры» в контексте этого изобретения представляют собой соединения iRNA, предпочтительно dsRNA, которые содержат две или более химически отличных области, причем каждая состоит, по меньшей мере, из одной мономерной единицы, т.е. нуклеотида в случае соединения dsRNA. Эти iRNA обычно содержат, по меньшей мере, одну область, в которой РНК модифицирована так, чтобы придать iRNA повышенную устойчивость к разрушению нуклеазами, повышенный захват клетками и/или повышенное связывающее сродство к нуклеиновой кислоте-мишени. Дополнительная область iRNA может служить в качестве субстрата для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКаза H представляет собой клеточную эндонуклеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. Активация РНКазы H, следовательно, приводит к расщеплению РНК-мишени, тем самым существенно увеличивая эффективность ингибирования iRNA экспрессии гена. Следовательно, сравнимые результаты часто могут быть получены с более короткими iRNA, когда используются гибридные dsRNA, по сравнению с фосфоротиоатдезокси-dsRNA, гибридизующимися с теми же самыми областями-мишенями. Расщепление РНК-мишени обычно может быть определено с помощью гель-электрофореза и, если необходимо, методов, связанных с гибридизацией нуклеиновых кислот, известных в данной области техники.
В определенных случаях РНК в iRNA может быть модифицирована нелигандной группой. Ряд нелигандных молекул был конъюгирован с iRNA для того, чтобы повысить активность, распределение в клетке или клеточный захват iRNA, и методы осуществления таких конъюгаций доступны в научной литературе. Такие нелигандные части включают липидные части, такие как холестерин (Kubo, T. et al., Biochem. Biophys. Res. Comm., 2007, 365(1):54-61; Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86:6553), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Lett., 1994, 4:1053), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660:306; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3:2765), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20:533), алифатическую цепь, например, додекандиольные или ундецильные остатки (Saison-Behmoaras et al., EMBO J., 1991, 10:111; Kabanov et al., FEBS Lett, 1990, 259:327; Svinarchuk et al., Biochimie, 1993, 75:49), фосфолипид, например, дигексадецил-rac-глицерин или 1,2-ди-О-гексадецил-rac-глицеро-3-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36:3651; Shea et al., Nucl. Acids Res., 1990, 18:3777), полиамин или цепь полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969), или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36:3651), пальмитиловую часть (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229), или октадециламин или гексил-аминокарбонил-оксихолестериновую часть (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277:923). Примеры патентов Соединенных Штатов, в которых представлено получение таких конъюгатов РНК, перечислены выше. Типичные протоколы конъюгации включают синтез РНК, несущей аминолинкер в одном или более положений последовательности. Аминогруппу затем вводят в реакцию с молекулой, подвергающейся конъюгации, с использованием подходящих присоединяющих или активирующих реагентов. Реакция конъюгации может быть осуществлена либо с РНК, все еще связанной с твердой подложкой, либо после отщепления РНК, в фазе раствора. Очистка конъюгата РНК с помощью ВЭЖХ обычно дает чистый конъюгат.
Доставка iRNA
Доставка iRNA индивидууму может быть достигнута с помощью ряда различных путей. Доставка in vivo может быть осуществлена прямо путем введения композиции, включающей iRNA, например, dsRNA, индивидууму. Альтернативно, доставка может быть осуществлена непрямо с помощью введения одного или более векторов, которые кодируют и управляют экспрессией iRNA.
Прямая доставка композиции iRNA
В целом любой метод доставки молекулы нуклеиновой кислоты может быть адаптирован для использования с iRNA (смотри, например, Akhtar S. and Julian RL. (1992) Trends Cell. Biol. 2(5):139-144 и патент WO94/02595, которые включены в настоящее описание в качестве ссылки в полном объеме). Однако существует три фактора, которые важно рассматривать, для того, чтобы успешно доставить молекулу iRNA in vivo: (a) биологическую стабильность доставляемой молекулы, (2) предотвращение неспецифических эффектов и (3) аккумуляцию доставляемой молекулы в ткани-мишени. Неспецифические эффекты iRNA можно свести к минимуму с помощью местного введения, например, путем прямой инъекции или имплантации в ткань (в качестве неограничивающего примера, в опухоль) или местного введения препарата. Локальное введение в место лечения приводит к максимальной местной концентрации агента, ограничивает экспозицию агента с системными тканями, что в противном случае может привести к вредному действию агента или может разрушить агент, и позволяет использовать более низкую суммарную дозу вводимой молекулы iRNA. В нескольких исследованиях показан успешный нокдаун продуктов гена при местном введении iRNA. Например, внутриглазная доставка dsRNA VEGF с помощью введения в стекловидное тело у яванских макак (Tolentino, MJ., et al (2004) Retina 24: 132-138) и субретинальные инъекции у мышей (Reich, SJ., et al (2003) Mol. Vis. 9:210-216), как показано в обоих случаях, предотвращали неоваскуляризацию в экспериментальной модели дегенерации желтого пятна, связанной с возрастом. Кроме того, прямое внутриопухолевое введение dsRNA мышам снижает объем опухоли (Pille, J., et al (2005) Mol. Ther. 11:267-274) и может пролонгировать выживаемость у мышей, несущих опухоль (Kim, WJ., et al (2006) Mol. Ther. 14:343-350; Li, S., et al (2007) Mol. Ther. 15:515-523). РНК-интерференция, как также показано, успешна при местной доставке к ЦНС с помощью прямого введения (Dorn, G., et al. (2004) Nucleic Acids 32:e49; Tan, PH., et al (2005) Gene Ther. 12:59-66; Makimura, H., et al (2002) BMC Neurosci. 3:18; Shishkina, GT., et al (2004) Neuroscience 129:521-528; Thakker, ER., et al (2004) Proc. Natl. Acad. Sci. U.S.A. 101:17270-17275; Akaneya, Y., et al (2005) J. Neurophysiol. 93:594-602) и к легким путем интраназального введения (Howard, KA., et al (2006) Mol. Ther. 14:476-484; Zhang, X., et al (2004) J. Biol. Chem. 279:10677-10684; Bitko, V., et al (2005) Nat. Med. 11:50-55). Для системного введения iRNA для лечения заболевания РНК может быть модифицирована или альтернативно доставлена с использованием системы доставки лекарств; оба метода направлены на предотвращение быстрой деградации dsRNA эндо- и экзонуклеазами in vivo. Модификации РНК или фармацевтического носителя также могут давать возможность направленной доставки композиции iRNA к ткани-мишени и избегания нежелательных эффектов вне мишени. Молекулы iRNA могут быть модифицированы путем химической конъюгации с липофильными группами, такими как холестерин, для увеличения клеточного захвата и предотвращения деградации. Например, iRNA, направленную против ApoB, конъюгированную с липофильной холестериновой частью, вводили мышам системно, что привело к нокдауну мРНК apoB как в печени, так и в тощей кишке (Soutschek, J., et al (2004) Nature 432: 173-178). Конъюгация iRNA с аптамером, как показано, ингибирует рост опухоли и опосредует регрессию опухоли в мышиной модели рака простаты (McNamara, JO., et al (2006) Nat. Biotechnol. 24: 1005-1015). В альтернативном осуществлении iRNA может быть доставлена с использованием систем доставки лекарств, таких как наночастица, дендример, полимер, липосома или катионная система доставки. Положительно заряженные катионные системы доставки облегчают связывание молекулы iRNA (отрицательно заряженной) и также усиливают взаимодействия у отрицательно заряженной клеточной мембраны, создавая возможность эффективного захвата iRNA клеткой. Катионные липиды, дендримеры или полимеры могут либо связываться с iRNA, либо индуцировать образование везикулы или мицеллы (смотри, например, Kim SH., et al (2008) Journal of Controlled Release 129(2): 107-116), которые инкапсулируют iRNA. Образование везикул или мицелл дополнительно предотвращает деградацию iRNA при системном введении. Методы получения и введения комплексов катионы-iRNA хорошо освоены специалистами в данной области техники (смотри, например, Sorensen, DR., et al (2003) J. Mol. Biol 327:761-766; Verma, UN., et al (2003) Clin. Cancer Res. 9:1291-1300; Arnold, AS et al (2007) J. Hypertens. 25:197-205, которые включены в настоящее описание в качестве ссылки в полном объеме). Некоторые неограничивающие примеры систем доставки лекарств, пригодных для системной доставки iRNA, включают DOTAP (Sorensen, DR., et al (2003), выше; Verma, UN., et al (2003), выше), олигофектамин, «липидные частицы твердой нуклеиновой кислоты» (Zimmermann, TS., et al (2006) Nature 441: 111-114), кардиолипин (Chien, PY., et al (2005) Cancer Gene Ther. 12:321-328; Pal, A., et al (2005) Int J. Oncol. 26: 1087-1091), полиэтиленимин (Bonnet ME., et al (2008) Pharm. Res. Aug 16 Epub ahead of print; Aigner, A. (2006) J. Biomed. Biotechnol. 71659), пептиды Arg-Gly-Asp (ROD) (Liu, S. (2006) Mol. Pharm. 3:472-487) и полиамидоамины (Tomalia, DA., et al (2007) Biochem. Soc. Trans. 35:61-67; Yoo, H., et al (1999) Pharm. Res. 16: 1799-1804). В некоторых вариантах осуществления iRNA образует комплекс с циклодекстрином для системного введения. Методы введения и фармацевтические композиции iRNA и циклодекстринов могут быть найдены в патенте США № 7427605, который включен в настоящее описание в качестве ссылки в полном объеме.
Вектор, кодирующий iRNA
В другом аспекте iRNA, направленная на ген TMPRSS6, может экспрессироваться с транскрипционных единиц, вставленных в ДНК- или РНК-векторы (смотри, например, Couture, A, et al., TIG. (1996), 12:5-10; Skillern, A., et al., международную публикацию PCT № WO 00/22113, Conrad, публикацию PCT № WO 00/22114 и Conrad, патент США № 6054299). Экспрессия может быть временной (порядка от часов до недель) или поддерживаемой (от недель до месяцев или дольше) в зависимости от конкретного используемого конструкта и ткани или клеточного типа, являющихся мишенью. Эти трансгены могут быть введены в виде линейного конструкта, круговой плазмиды или вирусного вектора, который может быть интегрирующим или неинтегрирующим вектором. Трансген может быть также сконструирован с возможностью его наследования в виде внехромосомной плазмиды (Gassmann, et al., Proc. Natl. Acad. Sci. USA (1995) 92:1292).
Индивидуальная цепь или цепи iRNA могут транскрибироваться с промотора на экспрессионном векторе. Когда две отдельные цепи предназначены для экспрессии для создания, например, dsRNA, два отдельных экспрессионных вектора могут быть совместно введены (например, путем трансфекции или инфицирования) в клетку-мишень. Альтернативно, каждая индивидуальная цепь dsRNA может транскрибироваться промоторами, которые оба локализованы в одной и той же экспрессионной плазмиде. В одном варианте осуществления цепи dsRNA экспрессируются в виде обратных повторов полинуклеотидов, соединенных линкерной полинуклеотидной последовательностью, так что dsRNA имеет остов и петлевую структуру.
Экспрессионные векторы iRNA обычно представляют собой ДНК-плазмиды или вирусные векторы. Экспрессионные векторы, совместимые с эукариотными клетками, предпочтительно векторы, совместимые с клетками позвоночных, могут быть использованы для получения рекомбинантных конструктов для экспрессии iRNA, как описано в настоящем документе. Экспрессионные векторы для эукариотных клеток хорошо известны в данной области техники и доступны от ряда коммерческих источников. Обычно такие векторы предлагаются в виде содержащих подходящие сайты рестрикции для вставки сегмента желаемой нуклеиновой кислоты. Доставка экспрессионных векторов iRNA может быть системной, такой как внутривенное или внутримышечное введение, с помощью введения в клетки-мишени, выделенные от больного, с последующим повторным введением больному, или с помощью любого другого способа, который позволяет введение в желаемую клетку-мишень.
Экспрессионные плазмиды iRNA могут быть трансфицированы в клетки-мишени в виде комплекса с катионными липидными носителями (например, олигофектамином) или некатионными носителями на основе липидов (например, Transit-TKO™). Множественные липидные трансфекции для нокдаунов, опосредуемых iRNA, направленно действующих на различные области РНК-мишени в течение периода, составляющего неделю или более, также рассматриваются изобретением. Успешное введение векторов в клетки-хозяева может быть прослежено с использованием различных известных методов. Например, о временной трансфекции может сигнализировать репортер, такой как флуоресцентный маркер, такой как зеленый флуоресцентный белок (GFP). Стабильная трансфекция клеток ex vivo может быть гарантирована при использовании маркеров, которые предоставляют трансфицированной клетке устойчивость к конкретным факторам окружающей среды (например, к антибиотикам и лекарствам), такую как устойчивость к гигромицину B.
Вирусные векторные системы, которые могут использоваться в способах и композициях, описанных в настоящем документе, включают, но не ограничиваются этим, (a) аденовирусные векторы; (b) ретровирусные векторы, включая, но не ограничиваясь этим, лентивирусные векторы, вирус мышиного лейкоза Молони и т.д.; (c) адено-ассоциированные вирусные векторы; (d) векторы на основе вируса простого герпеса; (e) векторы SV40; (f) полиомные вирусные векторы; (g) папилломные вирусные векторы; (h) пикорнавирусные векторы; (i) поксвирусные векторы, такие как ортопоксвирусные, например, векторы на основе вируса коровьей оспы или оспы птиц, например, оспы канареек или оспы кур; и (j) векторы на основе зависимого от хелперов или «выпотрошенного» аденовируса. Могут быть выгодны также вирусы с дефектами репликации. Различные векторы должны или не должны быть включены в клеточный геном. Конструкты могут включать вирусные последовательности для трансфекции, если это желательно. Альтернативно, конструкт может быть включен в векторы, способные к эписомальной репликации, например, векторы EPV и EBV. Конструктам для рекомбинантной экспрессии iRNA обычно должны требоваться регуляторные элементы, например, промоторы, энхансеры и т.д. для обеспечения экспрессии iRNA в клетках-мишенях. Другие аспекты рассмотрения векторов и конструктов дополнительно описываются ниже.
Векторы, пригодные для доставки iRNA, должны включать регуляторные элементы (промотор, энхансер и т.д.), достаточные для экспрессии iRNA в желаемой клетке или ткани, являющейся мишенью. Регуляторные элементы могут быть выбраны для обеспечения либо конститутивной, либо регулируемой/индуцибельной экспрессии.
Экспрессия iRNA может строго регулироваться, например, с помощью использования индуцибельной регуляторной последовательности, которая чувствительна к определенным физиологическим регуляторам, например, к уровням глюкозы в циркуляторном русле или к гормонам (Docherty et al., 1994, FASEB J. 8:20-24). Такие индуцибельные экспрессионные системы, подходящие для контроля экспрессии dsRNA в клетках или у млекопитающего, включают, например, регуляцию экдизоном, эстрогеном, прогестероном, тетрациклином, химическими индукторами димеризации и изопропил-β-D1-тиогалактопиранозидом (IPTG). Специалист в данной области техники должен знать, как выбрать подходящую регуляторную/промоторную последовательность на основе предназначаемого использования трансгена iRNA.
В конкретном варианте осуществления могут быть использованы вирусные векторы, которые содержат последовательности нуклеиновой кислоты, кодирующие iRNA. Например, может быть использован ретровирусный вектор (смотри Miller et al., Meth. Enzymol. 217:581-599 (1993)). Эти ретровирусные векторы содержат компоненты, необходимые для корректной упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновой кислоты, кодирующие iRNA, клонируются в один или более векторов, которые облегчают доставку нуклеиновой кислоты больному. Более подробную информацию о ретровирусных векторах можно найти, например, в Boesen et al., Biotherapy 6:291-302 (1994), где описывается использование ретровирусного вектора для доставки гена mdr1 к гемопоэтическим стволовым клеткам для того, чтобы сделать стволовые клетки более устойчивыми к химиотерапии. Другие ссылки, иллюстрирующие использование ретровирусных векторов в генной терапии, включают: Clowes et al., J. Clin. Invest. 93:644-651 (1994); Kiem et al., Blood 83: 1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4:129-141 (1993); и Grossman and Wilson, Curr. Opin. in Genetics and Devel. 3:110-114 (1993). Лентивирусные векторы, рассматриваемые как использующиеся, включают, например, векторы на основе ВИЧ, описанные в патентах США №№ 6143520; 5665557 и 5981276, которые включены в настоящее описание в качестве ссылки.
Аденовирусы также рассматриваются как использующиеся для доставки iRNA. Аденовирусы являются особенно привлекательными носителями, например, для доставки генов в эпителий дыхательных путей. Аденовирусы в природе инфицируют эпителий дыхательных путей, где они вызывают умеренное заболевание. Другими мишенями систем доставки на основе аденовирусов являются печень, центральная нервная система, эндотелиальные клетки и мышца. Аденовирусы обладают преимуществом, будучи способными инфицировать неделящиеся клетки. Kozarsky and Wilson, Current Opinion in Genetics and Development 3:499-503 (1993) представили обзор генной терапии на основе аденовирусов. Bout et al., Human Gene Therapy 5:3-10 (1994) продемонстрировали использование аденовирусных векторов для переноса генов в эпителий дыхательных путей макак-резус. Другие случаи использования аденовирусов в генной терапии могут быть найдены у Rosenfeld et al., Science 252:431-434 (1991); Rosenfeld et al., Cell 68:143-155 (1992); Mastrangeli et al., J. Clin. Invest. 91:225-234 (1993); в публикации PCT W094/12649; и у Wang, et al., Gene Therapy 2:775-783 (1995). Подходящий вектор AV для экспрессии iRNA, охарактеризованной в изобретении, метод конструирования рекомбинантного вектора AV и метод доставки вектора в клетки-мишени описаны у Xia H et al. (2002), Nat. Biotech. 20:1006-1010.
Охватывается также использование аденоассоциированных вирусных векторов (AAV) (Walsh et al., Proc. Soc. Exp. Biol. Med. 204:289-300 (1993); патент США № 5436146). В одном варианте осуществления iRNA может быть экспрессирована в виде двух отдельных комплементарных одноцепочечных молекул РНК из рекомбинантного вектора AAV, имеющего, например, либо U6, либо H1 промоторы РНК или промотор цитомегаловируса (CMV). Подходящие векторы AAV для экспрессии dsRNA, охарактеризованной в изобретении, методы конструирования рекомбинантного вектора AV и методы доставки векторов в клетки-мишени описаны в Samulski R et al. (1987), J. Virol. 61:3096-3101; Fisher K J et al. (1996), J. Virol, 70:520-532; Samulski R et al. (1989), J. Virol. 63: 3822-3826; в патенте США № 5252479; в патенте США № 5139941; в международной патентной заявке № WO 94/13788; и в международной патентной заявке № WO 93/24641, полное раскрытие которых включено в настоящее описание в качестве ссылки.
Другие предпочтительные вирусные векторы представляют собой поксвирус, такой как вирус коровьей оспы, например, ослабленный вирус коровьей оспы, такой как модифицированный вирус Анкара (MVA) или NYVAC, вирус оспы птиц, такой как вирус оспы кур или оспы канареек.
Тропизм вирусных векторов может быть модифицирован путем псевдотипирования векторов с белками оболочки или другими поверхностными антигенами из других вирусов или путем замещения различных вирусных капсидных белков, что больше подходит. Например, лентивирусные векторы могут быть псевдотипированы с белками поверхности от вируса везикулярного стоматита (VSV), бешенства, лихорадки Эбола, вируса Мокола и тому подобного. Векторы AAV могут быть получены для направленного действия на различные клетки путем конструирования векторов для экспрессии различных серотипов капсидных белков; смотри, например, статью Rabinowitz J E et al. (2002), J Virol 76:791-801, полное раскрытие которой включено в настоящее описание в качестве ссылки.
Фармацевтический препарат вектора может включать вектор в приемлемом разведении или может включать матрикс с медленным высвобождением, в который заключен носитель для доставки гена. Альтернативно, когда полный вектор для доставки гена может быть получен интактным из рекомбинантных клеток, например, в случае ретровирусных векторов, фармацевтический препарат может включать одну или более клеток, которые продуцируют систему для доставки гена.
III. Фармацевтические композиции, содержащие iRNA
В одном варианте осуществления в настоящем изобретении предлагаются фармацевтические композиции, содержащие iRNA и фармацевтически приемлемый носитель. Фармацевтическая композиция, содержащая iRNA, пригодна для лечения заболевания или нарушения, связанного с экспрессией или активностью гена TMPRSS6, такого как патологические процессы, опосредуемые экспрессией TMPRSS6. Такие фармацевтические композиции составляют, основываясь на способе доставки. Одним примером являются композиции, которые составляют для системного введения с помощью парентеральной доставки, например, внутривенной (IV) доставки.
Фармацевтические композиции, охарактеризованные в настоящем изобретении, вводят в дозировках, достаточных для ингибирования экспрессии гена TMPRSS6. В целом, подходящая доза iRNA должна находиться в диапазоне от 0,01 до 200,0 миллиграмм на килограмм массы тела реципиента в день, обычно в диапазоне от 1 до 50 мг на килограмм массы тела в день. Например, dsRNA можно вводить в однократной дозе 0,05 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 3 мг/кг, 10 мг/кг, 20 мг/кг, 30 мг/кг, 40 мг/кг или 50 мг/кг. Фармацевтическую композицию можно вводить один раз в день или один раз в неделю, или один раз в месяц, или один раз через каждый месяц. Композицию альтернативно можно вводить два раза в неделю или два раза в месяц, или один раз каждые две, три или четыре недели. В некоторых вариантах осуществления iRNA вводят в виде двух, трех или более субдоз в подходящие интервалы в течение дня или даже используя непрерывную инфузию или доставку состава с контролируемым высвобождением. В этом случае iRNA, содержащаяся в каждой субдозе, должна быть, соответственно, в меньшем количестве для достижения суммарной суточной дозы. Единица лекарственной дозы может быть составлена для доставки в течение нескольких дней, например, с использованием обычного состава с поддерживаемым высвобождением, который дает поддерживаемое высвобождение iRNA в течение периода в несколько дней. Составы с поддерживаемым высвобождением хорошо известны в данной области техники и особенно пригодны для доставки агентов в конкретное место, например, они могут быть использованы с агентами по настоящему изобретению. В этом варианте осуществления единица лекарственной формы содержит соответствующее кратное число суточной дозы.
Влияние однократной дозы на уровни TMPRSS6 может продолжаться долго, так что последующие дозы вводят через интервалы не более чем в 3, 4 или 5 дней или через интервалы не более чем в 1, 2, 3 или 4 недели.
Специалист в данной области техники должен понимать, что определенные факторы могут влиять на дозировку и временные параметры, требуемые для эффективного лечения индивидуума, включая, но не ограничиваясь этим, тяжесть заболевания или нарушения, предшествующее лечение, общее состояние здоровья и/или возраст индивидуума и наличие других заболеваний. Более того, лечение индивидуума терапевтически эффективным количеством композиции может включать однократное лечение или серии терапевтических воздействий. Определение эффективных дозировок и периодов полужизни in vivo для индивидуальных iRNA, охватываемых изобретением, может быть осуществлено с использованием общепринятых методов или на основе тестирования in vivo с использованием подходящей животной модели, как описано в настоящем документе в другом месте.
За счет успехов в изучении генетики мышей создан ряд мышиных моделей для исследования различных заболеваний человека, таких как патологические процессы, опосредуемые экспрессией TMPRSS6. Такие модели могут быть использованы для тестирования iRNA in vivo, а также для определения терапевтически эффективной дозы. Подходящая мышиная модель представляет собой, например, мышь, содержащую трансген, экспрессирующий TMPRSS6 человека.
В настоящее изобретение включены также фармацевтические композиции и составы, которые включают соединения iRNA, охарактеризованные в изобретении. Фармацевтические композиции по настоящему изобретению можно вводить несколькими путями в зависимости от того, желательно ли местное или системное лечение и какова область, подвергаемая лечению. Введение может быть местным (например, с помощью чрескожного пластыря), легочным, например, с помощью ингаляции или вдувания порошков или аэрозолей, включая использование небулайзера; внутритрахеальным, интраназальным, эпидермальным и чрескожным, пероральным или парентеральным. Парентеральное введение включает внутривенное, внутриартериальное, подкожное, внутрибрюшинное или внутримышечное введение или инфузию; подкожное, например, через имплантированное устройство; или внутричерепное, например, с помощью внутрипаренхиматозного, внутриоболочечного или внутрижелудочкового введения.
iRNA может быть доставлена таким образом, чтобы направленно действовать на конкретную ткань, такую как печень (например, гепатоциты печени).
Фармацевтические композиции и составы для местного введения могут включать чрескожные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Традиционные фармацевтические носители на водной основе, в виде порошка или на масляной основе, загустители и тому подобное могут быть необходимы или желательны. Могут быть также пригодны покрытые презервативы, перчатки и тому подобное. Подходящие местные составы включают составы, в которых iRNA, охарактеризованные в изобретении, находятся в смеси с агентом для местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатирующие агенты и поверхностно-активные вещества. Подходящие липиды и липосомы включают нейтральные (например, диолеоилфосфатидилэтаноламин DOPE, димиристоилфосфатидилхолин DMPC, дистеароилфосфатидилхолин), отрицательно заряженные (например, димиристоилфосфатидилглицерин DMPG) и катионные (например, диолеоилтетраметиламинопропил DOTAP и диолеоилфосфатидилэтаноламин DOTMA). iRNA, охарактеризованные в изобретении, могут быть инкапсулированы в липосомы или могут образовывать комплексы с ними, в частности с катионными липосомами. Альтернативно, iRNA могут образовывать комплексы с липидами, в частности с катионными липидами. Подходящие жирные кислоты и сложные эфиры включают, но не ограничиваются этим, арахидоновую кислоту, олеиновую кислоту, эйкозаноевую кислоту, лауриловую кислоту, каприловую кислоту, каприновую кислоту, миристиловую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, акрилкарнитин, ацилхолин или C1-20 алкиловый эфир (например, изопропилмиристат IPM), моноглицерид, диглицерид или их фармацевтически приемлемую соль. Местные составы описаны подробно в патенте США № 6747014, который включен в настоящее описание в качестве ссылки.
Липосомные составы
Кроме микроэмульсий существует много организованных структур поверхностно-активных веществ, которые исследованы и используются для составов лекарств. Они включают монослои, мицеллы, бислои и везикулы. Везикулы, такие как липосомы, привлекают большой интерес из-за предоставляемой ими специфичности и продолжительности действия с точки зрения доставки лекарства. При применении в настоящем изобретении термин «липосома» обозначает везикулу, состоящую из амфифильных липидов, организованных в сферический бислой или бислои.
Липосомы представляют собой однослойные или многослойные везикулы, которые имеют мембрану, образованную из липофильного материала, с водной фазой внутри. Водная часть содержит композицию, предназначенную для доставки. Катионные липосомы обладают преимуществом, будучи способными сливаться с клеточной стенкой. Некатионные липосомы, хотя и не способны сливаться так эффективно с клеточной стенкой, захватываются макрофагами in vivo.
Для того чтобы пересечь интактную кожу млекопитающих, липидные везикулы должны пройти через серии тонких пор, каждая с диаметром менее 50 нм, под влиянием подходящего чрескожного градиента. Следовательно, желательно использовать липосому, которая является высоко деформируемой и способной проходить через такие тонкие поры.
Дополнительными преимуществами липосом является то, что: липосомы, получаемые из природных фосфолипидов, являются биосовместимыми и биодеградируемыми; липосомы могут включать широкий спектр лекарств, растворимых в воде и в липидах; липосомы в своих внутренних компартментах могут защищать инкапсулированные лекарства от метаболизма и деградации (Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Важными учитываемыми факторами в получении составов липосом являются липидный поверхностный заряд, размер везикул и объем воды липосом.
Липосомы удобны для переноса и доставки активных ингредиентов к месту действия. Поскольку липосомная мембрана структурно сходна с биологическими мембранами, когда липосомы наносят на ткань, липосомы начинают сливаться с клеточными мембранами и по мере прогрессирования слияния липосомы и клетки содержимое липосомы опустошается в клетку, где может действовать активный агент.
На составах липосом сфокусированы интенсивные исследования в отношении способа доставки многих лекарств. Существуют растущие доказательства того, что для местного введения липосомы имеют ряд преимуществ над другими составами. Такие преимущества включают пониженные побочные эффекты по сравнению с системным поглощением вводимого лекарства, повышенную аккумуляцию вводимого лекарства в желаемой мишени и способность к введению большого разнообразия лекарств, как гидрофильных, так и гидрофобных, в кожу.
В нескольких сообщениях подробно описывается способность липосом доставлять агенты, включая ДНК высокой молекулярной массы в кожу. Соединения, включая анальгетики, антитела, гормоны и ДНК высокой молекулярной массы, вводили в кожу. Большинство вариантов применения приводило к направленной доставке в верхний эпидермис.
Липосомы подразделяются на два обширных класса. Катионные липосомы представляют собой положительно заряженные липосомы, которые взаимодействуют с отрицательно заряженными молекулами ДНК, с образованием стабильного комплекса. Положительно заряженный комплекс ДНК/липосома связывается с отрицательно заряженной клеточной поверхностью и интернализуется в эндосому. Из-за кислого рН эндосомы липосомы разрушаются, высвобождая свое содержимое в клеточную цитоплазму (Wang et al., Biochem. Biophys. Res. Commun., 1987, 147, 980-985).
Липосомы, которые являются чувствительными к рН или отрицательно заряженными, захватывают нуклеиновые кислоты, не образуя комплексов с ними. Поскольку, как ДНК, так и липид, заряжены сходно, возникает отталкивание, а не образование комплекса. Тем не менее, некоторое количество ДНК захватывается в водное внутреннее содержимое липосом. Чувствительные к рН липосомы использовали для доставки нуклеиновых кислот, кодирующих ген тимидинкиназы, к монослоям клеток в культуре. Экспрессия экзогенного гена определялась в клетках-мишенях (Zhou et al., Journal of Controlled Release, 1992, 19, 269-274).
Один основной тип композиции липосом включает фосфолипиды, отличные от природного фосфатидилхолина. Композиции нейтральных липосом, например, могут быть образованы из димиристоилфосфатилхолина (DMCP) или дипальмитоилфосфатидилхолина (DPPC). Композиции анионных липосом обычно образованы из димиристоилфосфатидилглицерина, тогда как анионные способные к слиянию липосомы образуются в первую очередь из диолеоилфосфатидилэтаноламина (DOPE). Другой тип липосомной композиции образуется из фосфатидилхолина (PC), такого как, например, PC сои и PC яйца. Другой тип образуется из смесей фосфолипида и/или фосфатидилхолина, и/или холестерина.
В нескольких исследованиях оценена местная доставка липосомных составов лекарств в кожу. Нанесение липосом, содержащих интерферон, на кожу морских свинок приводило к снижению поражения кожи кожным герпесом, тогда как доставка интерферона другими способами (например, в виде раствора или эмульсии) была не эффективной (Weiner et al., Journal of Drug Targeting, 1992, 2, 405-410). Кроме того, в дополнительном исследовании протестирована эффективность интерферона, вводимого в виде части липосомного состава, по сравнению с введением интерферона с использованием водной системы и сделано заключение о том, что липосомный состав был лучше введения в воде (du Plessis et al., Antiviral Research, 1992, 18, 259-265).
Неионные липосомные системы также были исследованы для определения их применимости для доставки лекарств в кожу, в частности системы, включающие неионное поверхностно-активное вещество и холестерин. Неионные липосомные составы, включающие Novasome™ I (глицерилдилаурат/холестерин/полиоксиэтилен-10-стеариловый эфир) и Novasome™ II (глицерилдистеарат/холестерин/полиоксиэтилен-10-стеариловый эфир) использовали для доставки циклоспорина A в дерму кожи мыши. Результаты показали, что такие неионные липосомные системы были эффективны в облегчении отложения циклоспорина A в различных слоях кожи (Hu et al. S.T.P.Pharma. Sci., 1994, 4, 6, 466).
Липосомы включают также «стерически стабилизированные» липосомы, этот термин при использовании в настоящем описании обозначает липосомы, включающие один или более специализированных липидов, которые при включении в липосомы приводят к повышенному времени жизни в циркуляторном русле по сравнению с липосомами, не имеющими таких специализированных липидов. Примерами стерически стабилизированных липосом являются липосомы, в которых часть состава липидов, образующих везикулу липосомы, (A) включает один или более гликолипидов, таких как моносиалоганглиозид GM1, или (B) дериватизирована одним или более гидрофильными полимерами, такими как компонент полиэтиленгликоль (ПЭГ). Не опираясь на какую-либо конкретную теорию, в данной области техники считается, что, по меньшей мере, в отношении стерически стабилизированных липосом, содержащих ганглиозиды, сфингомиелин или дериватизированные ПЭГ липиды, увеличенное время полужизни в циркуляторном русле этих стерически стабилизированных липосом возникает из-за сниженного захвата в клетки ретикуло-эндотелиальной системы (RES) (Allen et al., FEBS Letters, 1987, 223, 42; Wu et al., Cancer Research, 1993, 53, 3765).
Различные липосомы, включающие один или более гликолипидов, известны в данной области техники. Papahadjopoulos et al. (Ann. N.Y. Acad. Sci., 1987, 507, 64) сообщали о способности моносиалоганглиозида GM1, сульфата галактоцереброзида и фосфатидилинозитола улучшать периоды полужизни липосом в крови. Эти данные были объяснены Gabizon et al. (Proc. Natl. Acad. Sci. U.S.A., 1988, 85, 6949). В патентах США № 4837028 и WO 88/04924, которые оба принадлежат Allen et al., раскрываются липосомы, содержащие (1) сфингомиелин и (2) ганглиозид GM1 или сложный эфир галактоцереброзидсульфата. В патенте США № 5543152 (Webb et al.) раскрыты липосомы, содержащие сфингомиелин. Липосомы, включающие 1,2-sn-димиристоилфосфатидилхолин, раскрыты в патенте WO 97/13499 (Lim et al).
Многие липосомы, включающие липиды, дериватизированные одним или более гидрофильными полимерами, и методы их получения известны в данной области техники. Sunamoto et al. (Bull. Chem. Soc. Jpn., 1980, 53, 2778) описали липосомы, включающие неионный детергент 2C1215G, который содержит часть ПЭГ. Illum et al. (FEBS Lett., 1984, 167, 79) отметили, что гидрофильное покрытие полистироловых частиц полимерными гликолями приводит к существенному увеличению периодов полужизни в крови. Синтетические фосфолипиды, модифицированные путем присоединения карбоксильных групп полиалкиленгликолей (например, ПЭГ), описаны Sears (патенты США №№ 4426330 и 4534899). Klibanov et al. (FEBS Lett., 1990, 268, 235) описали эксперименты, демонстрирующие, что липосомы, включающие фосфатидилэтаноламин (PE), дериватизированные ПЭГ или стеаратом ПЭГ, характеризуются существенным увеличением периодов полужизни в кровотоке. Blume et al. (Biochimica et Biophysica Acta, 1990, 1029, 91) расширили такие наблюдения в отношении других фосфолипидов, дериватизированных ПЭГ, например, DSPE-PEG, образованного из сочетания дистеароилфосфатидилэтаноламина (DSPE) и ПЭГ. Липосомы, имеющие ковалентно связанные части ПЭГ на своей внешней поверхности описаны в европейском патенте № EP 0445131 B1 и WO 90/04384, принадлежащих Fisher. Композиции липосом, содержащие 1-20 молярных процентов PE, дериватизированного ПЭГ, и методы их использования описаны Woodle et al. (патенты США №№ 5013556 и 5356633) и Martin et al. (патент США № 5213804 и европейский патент № EP 0 496 813 B1). Липосомы, включающие ряд других конъюгатов липид-полимер, раскрыты в патенте WO 91/05545 и патенте США № 5225212 (оба принадлежат Martin et al.) и в патенте WO 94/20073 (Zalipsky et al.). Липосомы, включающие модифицированные ПЭГ церамидные липиды, описаны в патенте WO 96/10391 (Choi et al). В патенте США № 5540935 (Miyazaki et al.) и патенте США № 5556948 (Tagawa et al.) описываются содержащие ПЭГ липосомы, которые могут быть дополнительно дериватизированы функциональными частями на их поверхности.
В данной области техники известен ряд липосом, включающих нуклеиновые кислоты. В патенте WO 96/40062, принадлежащем Thierry et al., раскрыты методы инкапсулирования в липосомы нуклеиновых кислот высокой молекулярной массы. В патенте США № 5264221, принадлежащем Tagawa et al., раскрыты липосомы, связанные с белком, и доказано, что такие липосомы могут включать dsRNA. В патенте США № 5665710, принадлежащем Rahman et al., описываются определенные методы инкапсулирования олигодезоксинуклеотидов в липосомы. В патенте WO 97/04787, принадлежащем Love et al., раскрыты липосомы, включающие dsRNA, направленные на ген raf.
Трансферсомы представляют собой еще один тип липосом, они являются высоко деформируемыми липидными агрегатами, которые являются привлекательными кандидатами носителей для доставки лекарств. Трансферсомы могут быть описаны как липидные капли, которые являются настолько высоко деформируемыми, что они легко способны проникать через поры, меньшего размера, чем сами капли. Трансферсомы способны адаптироваться к той среде, в которой они используются, например, они способны к собственной оптимизации (адаптируемости к форме пор в коже), к самовосстановлению, они часто достигают своих мишеней без фрагментации и часто являются самозагружающимися. Для получения трансферсом можно добавлять активаторы поверхности краев, обычно поверхностно-активные вещества, для стандартизации композиции липосом. Трансферсомы используют для доставки сывороточного альбумина к коже. Опосредованная трансферсомами доставка сывороточного альбумина, как показано, является эффективной для подкожного введения раствора, содержащего сывороточный альбумин.
Поверхностно-активные вещества находят широкое применение в составах, таких как эмульсии (включая микроэмульсии) и липосомы. Наиболее общим способом классификации и ранжирования свойств многих различных типов поверхностно-активных веществ, как природных, так и синтетических, является способ, использующий гидрофильный/липофильный баланс (HLB). Наиболее выгодный способ классификации различных поверхностно-активных веществ, используемых в составах, основывается на природе гидрофильной группы (также известной как «головка») (Rieger, in Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
Если молекула поверхностно-активного вещества не является ионизированной, она классифицируется как неионное поверхностно-активное вещество. Неионные поверхностно-активные вещества находят широкое применение в фармацевтических и косметических продуктах и подходят для использования в широком диапазоне величин рН. В целом, величины их HLB находятся в диапазоне от 2 до приблизительно 18 в зависимости от их структуры. Неионные поверхностно-активные вещества включают неионные сложные эфиры, такие как сложные эфиры этиленгликоля, сложные эфиры пропиленгликоля, глицериловые сложные эфиры, полиглицериловые сложные эфиры, сложные эфиры сорбитана, сложные эфиры сахарозы и этоксилированные сложные эфиры. Неионные алканоламиды и простые эфиры, такие как этоксилаты жирных спиртов, пропоксилированные спирты и этоксилированные/пропоксилированные блок-полимеры, также включают в этот класс. Полиоксиэтиленовые поверхностно-активные вещества являются наиболее популярными членами класса неионных поверхностно-активных веществ.
Если молекула поверхностно-активного вещества несет отрицательный заряд, когда она растворена или диспергирована в воде, поверхностно-активное вещество классифицируется как анионное. Анионные поверхностно-активные вещества включают карбоксилаты, такие как мыла, ациллактилаты, ациламиды аминокислот, сложные эфиры серной кислоты, такие как алкилсульфаты, этоксилированные алкилсульфаты, сульфонаты, такие как алкилбензолсульфонаты, ацилизетионаты, ацилтаураты и сульфосукцинаты и фосфаты. Наиболее важными членами класса анионных поверхностно-активных веществ являются алкилсульфаты и мыла.
Если молекула поверхностно-активного вещества несет положительный заряд, когда она растворена или диспергирована в воде, поверхностно-активное вещество классифицируется как катионное. Катионные поверхностно-активные вещества включают четвертичные соли аммония и этоксилированные амины. Четвертичные соли аммония представляют собой наиболее часто используемые члены этого класса.
Если молекула поверхностно-активного вещества обладает способностью нести либо положительный, либо отрицательный заряд, поверхностно-активное вещество классифицируется как амфотерное. Амфотерные поверхностно-активные вещества включают производные акриловой кислоты, замещенные алкиламиды, N-алкилбетаины и фосфатиды.
Использование поверхностно-активных веществ в лекарственных продуктах, составах и в эмульсиях описано в обзоре (Rieger, in Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
Липидные частицы, включающие нуклеиновые кислоты
В одном варианте осуществления dsRNA TMPRSS6, охарактеризованная в изобретении, полностью инкапсулирована в липидный состав, например, с образованием SPLP, pSPLP, SNALP или другой липидной частицы, содержащей нуклеиновую кислоту. При применении в настоящем описании термин «SNALP» относится к стабильной липидной частице, содержащей нуклеиновую кислоту, включая SPLP. При применении в настоящем описании термин «SPLP» относится к липидной частице, содержащей нуклеиновую кислоту, включающей плазмидную ДНК, инкапсулированную в липидную везикулу. SNALP и SPLP обычно содержат катионный липид, некатионный липид и липид, который предотвращает агрегацию частиц (например, конъюгат липид-ПЭГ). SNALP и SPLP весьма пригодны для системного применения, так как они имеют повышенный период полужизни в циркуляторном русле после внутривенного (i.v.) введения и аккумулируются в отдаленных местах (например, местах, физически отделенных от места введения). SPLP включают «pSPLP», которые включают инкапсулированный комплекс конденсирующий агент-нуклеиновая кислота, как показано в публикации PCT № WO 00/03683. Частицы по настоящему изобретению обычно имеют средний диаметр от приблизительно 50 нм до приблизительно 150 нм, более обычно от приблизительно 60 нм до приблизительно 130 нм, более обычно от приблизительно 70 нм до приблизительно 110 нм, наиболее обычно от приблизительно 70 нм до приблизительно 90 нм и по существу являются нетоксичными. Кроме того, нуклеиновые кислоты в случае присутствия в частицах нуклеиновая кислота-липид по настоящему изобретению в водном растворе устойчивы к деградации под действием нуклеазы. Частицы нуклеиновая кислота-липид и метод их получения раскрыты, например, в патентах США №№ 5976567; 5981501; 6534484; 6586410; 6815432 и публикации PCT № WO 96/40964.
В одном варианте осуществления отношение липида к лекарству (масс./масс. отношение) (например, отношение липида к dsRNA) должно быть в диапазоне от приблизительно 1:1 до приблизительно 50:1, от приблизительно 1:1 до приблизительно 25:1, от приблизительно 3:1 до приблизительно 15:1, от приблизительно 4:1 до приблизительно 10:1, от приблизительно 5:1 до приблизительно 9:1 или от приблизительно 6:1 до приблизительно 9:1.
Катионный липид может представлять собой, например, N,N-диолеил-N,N-диметиламмония хлорид (DODAC), N,N-дистеарил-N,N-диметиламмония бромид (DDAB), N-(I-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмония хлорид (DOTAP), N-(I-(2,3- диолеилокси)пропил)-N,N,N-триметиламмония хлорид (DOTMA), N,N-диметил-2,3-диолеилоксипропиламин (DODMA), 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA), 1,2-дилинолеилкарбамоилокси-3-диметиламинопропан (DLin-C-DAP), 1,2-дилинолеилокси-3- (диметиламино)ацетоксипропан (DLin-DAC), 1,2-дилинолеилокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), 1,2-дилинолеилокси-3-триметиламинопропана хлоридную соль (DLin-TMA.Cl), 1,2-дилинолеоил-3-триметиламинопропан хлоридную соль (DLin-TAP.Cl), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ) или 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандиол (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан (DLin-EG-DMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA), 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA) или их аналоги, (3aR,5s,6aS)-N,N-диметил-2,2-ди((9Z,12Z)-окктадека-9,12-денил)тетрагидро-3aH-циклопента[d][1,3]диоксол-5-амин (ALN100), (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноат (MC3), 1,1'-(2-(4-(2-((2-(бис(2-гидроксидодецил)амино)этил)(2-гидроксидодецил)амино)этил)пиперазин-1-ил)этилазанедиил)дидодекан-2-ол (Tech G1) или их смесь. Катионный липид может включать от приблизительно 20 моль.% до приблизительно 50 моль.% или приблизительно 40 моль.% суммарного липида, присутствующего в частице.
В другом варианте осуществления 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан может быть использован для получения наночастиц липид-siRNA. Синтез 2,2-дилинолеил-4- диметиламиноэтил-[1,3]-диоксолана описан в предварительной патентной заявке Соединенных Штатов номер 61/107998, поданной 23 октября 2008 г., которая включена в настоящее описание в качестве ссылки.
В одном варианте осуществления частица липид-siRNA включает 40% 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолана: 10% DSPC: 40% холестерина: 10% PEG-C-DOMG (молярный процент) с размером частицы 63,0±20 нм и отношением siRNA/липид 0,027.
Некатионный липид может представлять собой анионный липид или нейтральный липид, включая, но не ограничиваясь этим, дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), диолеоил-фосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), пальмитоилолеоилфосфатидилэтаноламин (POPE), диолеоил-фосфатидилэтаноламин 4-(N-малеимидометил)-циклогексан-1-карбоксилат (DOPE-mal), дипальмитоилфосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидилэтаноламин (DSPE), 16-O-монометил PE, 16-O-диметил PE, 18-1-транс PE, 1-стеароил-2-олеоил-фосфатидилэтаноламин (SOPE), холестерин или их смесь. Некатионный липид может составлять от приблизительно 5 моль.% до приблизительно 90 моль.%, приблизительно 10 моль.%, или приблизительно 58 моль.%, если включается холестерин, от суммарного липида, присутствующего в частице.
Конъюгированный липид, который ингибирует агрегацию частиц, может представлять собой, например, полиэтиленгликоль (ПЭГ)- липид, включая без ограничения, ПЭГ-диацилглицерин (DAG), ПЭГ-диалкилоксипропил (DAA), ПЭГ-фосфолипид, ПЭГ-церамид (Cer), или их смесь. Конъюгат ПЭГ-DAA может представлять собой, например, ПЭГ-дилаурилоксипропил (Ci2), ПЭГ-димиристилоксипропил (Ci4), ПЭГ-дипальмитилоксипропил (Ci6) или ПЭГ-дистеарилоксипропил (Ci8). Конъюгированный липид, который предотвращает агрегацию частиц, может составлять от 0 моль.% до приблизительно 20 моль.% или приблизительно 2 моль.% суммарного липида, присутствующего в частице.
В некоторых вариантах осуществления частица нуклеиновая кислота-липид дополнительно включает холестерин, составляющий, например, от приблизительно 10 моль.% до приблизительно 60 моль.% или приблизительно 48 моль.% от суммарного липида, присутствующего в частице.
LNP01
В одном варианте осуществления липидоид ND98.4HC1 (М.м. 1487) (смотри патентную заявку США № 12/056230, поданную 26.03.2008 г., которая включена в настоящее описание в качестве ссылки в полном объеме), холестерин (Sigma-Aldrich) и ПЭГ-церамид C16 (Avanti Polar Lipids) могут быть использованы для получения наночастиц липид-dsRNA (т.е. частиц LNP01). Маточные растворы каждого в этаноле могут быть получены следующим образом: ND98, 133 мг/мл; холестерин, 25 мг/мл, ПЭГ-церамид C16, 100 мг/мл. Маточные растворы ND98, холестерина и ПЭГ-церамида C16 могут быть затем объединены в молярном отношении 42:48:10. Объединенный липидный раствор может быть смешан с водной dsRNA (например, в ацетате натрия, pH 5), так что конечная концентрация этанола составляет приблизительно 35-45%, и конечная концентрация ацетата натрия составляет приблизительно 100-300 мМ. Наночастицы липид-dsRNA обычно образуются спонтанно при смешивании. В зависимости от желаемого распределения размеров частиц результирующая смесь наночастиц может быть продавлена через поликарбонатную мембрану (например, с ограничением 100 нм) с использованием, например, термического цилиндрического экструдера, такого как Lipex Extruder (Northern Lipids, Inc). В некоторых случаях стадия экструзии может быть исключена. Удаление этанола и одновременная замена буфера может быть осуществлена с помощью, например, диализа или фильтрации с отклоняющимся потоком. Буфер может быть заменен, например, физиологическим раствором, забуференным фосфатным буфером (PBS), при приблизительно рН 7, например, приблизительно рН 6,9, приблизительно рН 7,0, приблизительно рН 7,1, приблизительно рН 7,2, приблизительно рН 7,3 или приблизительно рН 7,4.

Формула I
Составы LNP01 описаны, например, в публикации международной патентной заявки № WO 2008/042973, которая включена в настоящее описание в качестве ссылки.
|
|
|
|
Составы, включающие SNALP (1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA)), описаны в международной публикации № WO2009/127060, зарегистрированной 15 апреля 2009 г., которая включена в настоящее описание в качестве ссылки.
Составы, включающие XTC, описаны, например, в предварительной заявке США с серийным № 61/148366, зарегистрированной 29 января 2009 г.; в предварительной заявке США с серийным № 61/156851, зарегистрированной 2 марта 2009 г.; в предварительной заявке США с серийным №, зарегистрированной 10 июня 2009 г.; в предварительной заявке США с серийным № 61/228373, зарегистрированной 24 июля 2009 г.; в предварительной заявке США с серийным № 61/239686, зарегистрированной 3 сентября 2009 г. и в международной заявке № PCT/US2010/022614, зарегистрированной 29 января 2010 г., которые включены в настоящее описание в качестве ссылки.
Составы, включающие MC3, описаны, например, в предварительной заявке США с серийным № 61/244834, зарегистрированной 22 сентября 2009 г., в предварительной заявке США с серийным № 61/185800, зарегистрированной 10 июня 2009 г. и в международной заявке № PCT/US10/28224, зарегистрированной 10 июня 2010 г., которые включены в настоящее описание в качестве ссылки.
Составы, включающие ALNY-100, описаны, например, в международной патентной заявке номер PCT/US09/63933, зарегистрированной 10 ноября 2009 г., которая включена в настоящее описание в качестве ссылки.
Составы, включающие C12-200, описаны в предварительной заявке США с серийным № 61/175770, зарегистрированной 5 мая 2009 г., и в международной заявке № PCT/US10/33777, зарегистрированной 5 мая 2010 г., которые включены в настоящее описание в качестве ссылки.
При применении в настоящем описании термин «LNPXX», где «XX» являются цифрами, также обозначается в настоящем описании как «AFXX». Например, LNP09 также обозначается как AF09, а LNP12 также известен или обозначается как AF12.
Синтез катионных липидов
Любое из соединений, например, катионных липидов и тому подобного, используемое в частицах нуклеиновая кислота-липид, охарактеризованных в изобретении, может быть получено с помощью известных методов органического синтеза, включая методы, описанные более подробно в примерах. Все заместители представляют собой определенное ниже, если не указано иначе.
«Алкил» обозначает линейную или разветвленную цепь нециклического или циклического, насыщенного алифатического углеводорода, содержащего от 1 до 24 углеродных атомов. Примеры насыщенных алкилов с линейной цепью включают метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и тому подобное; тогда как насыщенные алкилы с разветвленной цепью включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил и тому подобное. Примеры насыщенных циклических алкилов включают циклопропил, циклобутил, циклопентил, циклогексил и тому подобное; тогда как ненасыщенные циклические алкилы включают циклопентенил и циклогексенил и тому подобное.
«Алкенил» обозначает алкил, как определено выше, содержащий, по меньшей мере, одну двойную связь между соседними атомами углерода. Алкенилы включают как цис-, так и транс-изомеры. Примеры алкенилов с линейной и разветвленной цепью включают этиленил, пропиленил, 1-бутенил, 2-бутенил, изобутенил, 1-пентенил, 2-пентинил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил и тому подобное.
«Алкинил» обозначает любой алкил или алкенил, как определено выше, который дополнительно содержит, по меньшей мере, одну тройную связь между соседними атомами углерода. Примеры алкинилов с линейной и разветвленной цепью включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил и тому подобное.
«Ацил» обозначает любой алкил, алкенил или алкинил, в котором углерод в точке присоединения замещен оксогруппой, как определено ниже. Например, -C(=O)алкил, -C(=O)алкенил и -C(=O)алкинил являются ацильными группами.
«Гетероцикл» обозначает от 5- до 7-членное моноциклическое или от 7- до 10-членное бициклическое, гетероциклическое кольцо, которое является либо насыщенным, ненасыщенным, либо ароматическим, и которое содержит 1 или 2 гетероатома, независимо выбранных из азота, кислорода и серы, и где гетероатомы азот и сера необязательно могут быть окислены, и гетероатом азот необязательно может быть четвертичным, включая бициклические кольца, в которых любой из указанных выше гетероциклов соединен с бензольным кольцом. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Гетероциклы включают гетероарилы, как определено ниже. Гетероциклы включают морфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперизинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное.
Термины «необязательно замещенный алкил», «необязательно замещенный алкенил», «необязательно замещенный алкинил», «необязательно замещенный ацил» и «необязательно замещенный гетероцикл» обозначают, что при замещении, по меньшей мере, один атом водорода замещен заместителем. В случае замещения оксогруппой (=O) замещены два атома водорода. В этом смысле заместители включают оксо, галоген, гетероцикл, CN, -ORx, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy, где n равно 0, 1 или 2, Rx и Ry являются одинаковыми или различаются и независимо представляют собой водород, алкил или гетероцикл, и каждый указанный алкильный или гетероциклический заместитель может быть дополнительно замещен одним или более из оксо, галогена, -OH, -CN, алкила, -ORx, гетероцикла, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy.
«Галоген» обозначает фтор, хлор, бром и йод.
В некоторых вариантах осуществления методы, охарактеризованные в изобретении, могут требовать использования защитных групп. Методология защитных групп хорошо известна специалистам в данной области техники (смотри, например, Protective Groups in Organic Synthesis, Green, T.W. et al., Wiley-Interscience, New York City, 1999). Вкратце, защитные группы в контексте этого изобретения представляют собой любую группу, которая снижает или уничтожает нежелательную реактивность функциональной группы. Защитная группа может быть добавлена к функциональной группе для маскирования ее реактивности в течение определенных реакций и затем удалена для открытия исходной функциональной группы. В некоторых вариантах осуществления используется «спиртовая защитная группа». «Спиртовая защитная группа» представляет собой любую группу, которая снижает или уничтожает нежелательную реактивность спиртовой функциональной группы. Защитные группы могут быть добавлены и удалены с использованием методов, хорошо известных в данной области техники.
Синтез соединения формулы A
В некоторых вариантах осуществления частицы нуклеиновая кислота-липид, охарактеризованные в настоящем изобретении, составляют с использованием катионного липида формулы A:
 ,
,
где R1 и R2 независимо представляют собой алкил, алкенил или алкинил, каждый может быть необязательно замещен, и R3 и R4 независимо представляют собой низший алкил, или R3 и R4 могут быть взяты вместе с образованием необязательно замещенного гетероциклического кольца. В некоторых вариантах осуществления катионный липид представляет собой XTC (2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан). В целом липид формулы A, представленный выше, может быть получен следуя схемам реакций 1 или 2, где все заместители представляют собой определенное выше, если не указано иначе.
Схема 1

Липид A, где R1 и R2 независимо представляют собой алкил, алкенил или алкинил, каждый может быть необязательно замещен, и R3 и R4 независимо представляют собой низший алкил, или R3 и R4 могут быть взяты вместе с образованием необязательно замещенного гетероциклического кольца, может быть получен в соответствии со схемой 1. Кетон 1 и бромид 2 могут быть приобретены или получены в соответствии с методами, известными специалистам в данной области техники. Реакция 1 и 2 дает кеталь 3. Обработка кеталя 3 амином 4 дает липиды формулы A. Липиды формулы A можно перевести в соответствующую аммонийную соль с помощью органической соли формулы 5, где X представляет собой анионный противоион, выбранный из галогена, гидроксида, фосфата, сульфата или тому подобного.
Схема 2

Альтернативно, исходное вещество для кетона 1 может быть получено в соответствии со схемой 2. Реагент 6 Гриньяра и цианид 7 могут быть приобретены или получены в соответствии с методами, известными специалистам в данной области техники. Реакция 6 и 7 дает кетон 1. Превращение кетона 1 в соответствующие липиды формулы A происходит как описано на схеме 1.
Синтез MC3
Получение DLin-M-C3-DMA (т.е. (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноата) происходило следующим образом. Раствор (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ола (0,53 г), гидрохлорида 4-N,N-диметиламиномасляной кислоты (0,51 г), 4-N,N-диметиламинопиридина (0,61 г) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (0,53 г) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Раствор промывали разведенной хлористоводородной кислотой затем разведенным водным бикарбонатом натрия. Органические фракции сушили над безводным сульфатом магния, фильтровали и растворитель удаляли на роторном вакуумной испарителе. Остаток пропускали через колонку силикагеля (20 г) с использованием 1-5% градиента элюции метанол/дихлорметан. Фракции, содержащие очищенный продукт, объединяли, и растворитель удаляли с выходом бесцветного масла (0,54 г).
Синтез ALNY-100
Синтез кеталя 519 [ALNY-100] осуществляли с использованием следующей схемы 3:

Синтез соединения 515
К перемешиваемой суспензии LiAlH4 (3,74 г, 0,09852 моль) в 200 мл безводного ТГФ в двугорлой RBF (1 л) медленно добавляли раствор соединения 514 (l0 г, 0,04926 моль) в 70 мл ТГФ при 0°С в атмосфере азота. После окончательного добавления реакционную смесь нагревали до комнатной температуры и затем нагревали с обратным холодильником в течение 4 час. Прохождение реакции отслеживали с помощью TLC. После завершения реакции (по TLC) смесь охлаждали до 0°С и гасили путем осторожного добавления насыщенного раствора Na2SO4. Реакционную смесь перемешивали в течение 4 час. при комнатной температуре и отфильтровывали. Остаток промывали ТГФ. Фильтрат и смывы смешивали и разводили 400 мл диоксана и 26 мл конц. HCl и перемешивали в течение 20 минут при комнатной температуре. Летучие соединения отделяли под вакуумом с получением гидрохлоридной соли соединения 515 в виде белого твердого вещества. Выход: 7,12 г, 1H-ЯМР (ДМСО, 400 МГц): δ=9,34 (широкий, 2H), 5,68 (с, 2H), 3,74 (м, 1H), 2,66-2,60 (м, 2H), 2,50-2,45 (м, 5H).
Синтез соединения 516
К перемешиваемому раствору соединения 515 в 100 мл сухого DCM в 250 мл двугорлой RBF добавляли NEt3 (37,2 мл, 0,2669 моль) и охлаждали до 0°С в атмосфере азота. После медленного добавления N-(бензилоксикарбонилокси)сукцинимида (20 г, 0,08007 моль) в 50 мл сухого DCM, реакционной смеси давали нагреться до комнатной температуры. После завершения реакции (2-3 часа по TLC) смесь непрерывно промывали раствором 1н HCl (1×100 мл) и насыщали раствором NaHCO3 (1×50 мл). Органический слой затем высушивали над безводн. Na2SO4, и растворитель выпаривали с получением сырого вещества, которое очищали с помощью хроматографии на колонке силикагеля с получением соединения 516 в виде клейкой массы. Выход: 11 г (89%). 1H-ЯМР (CDCl3, 400 МГц): δ=7,36-7,27(м, 5H), 5,69 (с, 2H), 5,12 (с, 2H), 4,96 (шир., 1H) 2,74 (с, 3H), 2,60(м, 2H), 2,30-2,25(м, 2H). ЖХ-МС [M+H] -232,3 (96,94%).
Синтез соединений 517A и 517B
Циклопентен 516 (5 г, 0,02164 моль) растворяли в растворе 220 мл ацетона и воды (10:1) в одногорлой 500 мл RBF, и к нему добавляли N-метилморфолин-N-оксид (7,6 г, 0,06492 моль), затем 4,2 мл 7,6% раствора OsO4 (0,275 г, 0,00108 моль) в трет-бутаноле при комнатной температуре. После завершения реакции (~3 часа), смесь гасили добавлением твердого Na2SO3, и полученную смесь перемешивали в течение 1,5 час при комнатной температуре. Реакционную смесь разводили DCM (300 мл) и промывали водой (2×100 мл) затем насыщенным раствором NaHCO3 (1×50 мл), водой (1×30 мл) и наконец, физиологическим раствором (1×50 мл). Органическую фазу сушили над безводн. Na2SO4, и растворитель удаляли под вакуумом. Очистка сырого вещества с помощью хроматографии на колонке силикагеля дала смесь диастереомеров, которые разделяли препаративной ВЭЖХ.
Выход: 6 г сырого вещества
517A - пик-1 (белое твердое вещество) 5,13 г (96%). 1H-ЯМР (ДМСО, 400 МГц): δ=7,39-7,31(м, 5H), 5,04(с, 2H), 4,78-4,73 (м, 1H), 4,48-4,47(д, 2H), 3,94-3,93(м, 2H), 2,71(с, 3H), 1,72- 1,67(м, 4H). ХЖ-МС - [M+H]-266,3, [M+NH4+]-283,5 присутствует, ВЭЖХ-97,86%.
Стереохимия подтверждена рентгеновским анализом.
Синтез соединения 518
Используя метод, аналогичный описанному для синтеза соединения 505, получали соединение 518 (1,2 г, 41%) в виде бесцветного масла. 1H-ЯМР (CDCl3, 400 МГц): δ=7,35-7,33 (м, 4H), 7,30-7,27 (м, 1H), 5,37-5,27 (м, 8H), 5,12 (с, 2H), 4,75 (м, 1H), 4,58-4,57 (м, 2H), 2,78-2,74 (м, 7H), 2,06-2,00 (м, 8H), 1,96-1,91 (м, 2H), 1,62 (м, 4H), 1,48 (м, 2H), 1,37-1,25 (шир. м, 36H), 0,87 (м, 6H). ВЭЖХ-98,65%.
Общий метод синтеза соединения 519
Раствор соединения 518 (1 экв.) в гексане (15 мл) добавляли по каплям к охлажденному на льду раствору LAH в ТГФ (1 M, 2 экв.). После окончания добавления смесь нагревали при 40°С в течение 0,5 час затем опять охлаждали в ледяной бане. Смесь осторожно гидролизовали насыщенным водным Na2SO4, затем фильтровали через целит и восстанавливали до масла. Колоночная хроматография дала чистое соединение 519 (1,3 г, 68%), которое было получено в виде бесцветного масла. 13C ЯМР=130,2, 130,1 (×2), 127,9 (×3), 112,3, 79,3, 64,4, 44,7, 38,3, 35,4, 31,5, 29,9 (×2), 29,7, 29,6 (×2), 29,5 (×3), 29,3 (×2), 27,2 (×3), 25,6, 24,5, 23,3, 226, 14,1; Электроспрей МС (+ve): Молекулярная масса C44H80NO2 (M+H)+ Рассчитан. 654,6, Найденн. 654,6.
Составы, полученные либо стандартным методом, либо методом без экструзии, могут быть охарактеризованы сходным образом. Например, составы обычно характеризуются при визуальном осмотре. Они должны быть беловатыми полупрозрачными растворами, свободными от агрегатов или осадка. Размер частиц и распределение размеров частиц липидных наночастиц могут быть измерены с помощью рассеяния света с использованием, например, Malvern Zetasizer Nano ZS (Malvern, USA). Размер частиц должен составлять приблизительно 20-300 нм, например, 40-100 нм. Распределение размеров частиц должно быть унимодальным. Суммарная концентрация dsRNA в составе, а также в захваченной фракции, определяется с использованием метода исключения красителя. Образец dsRNA состава может быть проинкубирован с красителем, связывающимся с РНК, таким как Ribogreen (Molecular Probes), в присутствии или в отсутствие поверхностно-активного вещества, разрушающего состав, например, 0,5% тритона X-100. Суммарная dsRNA в составе может быть определена по сигналу образца, содержащего поверхностно-активное вещество, относительно стандартной кривой. Захваченную фракцию определяют вычитанием содержания «свободной» dsRNA (при измерении по сигналу в отсутствие поверхностно-активного вещества) из суммарного содержания dsRNA. Процент захваченной dsRNA обычно >85%. Для состава SNALP размер частиц составляет, по меньшей мере, 30 нм, по меньшей мере, 40 нм, по меньшей мере, 50 нм, по меньшей мере, 60 нм, по меньшей мере, 70 нм, по меньшей мере, 80 нм, по меньшей мере, 90 нм, по меньшей мере, 100 нм, по меньшей мере, 110 нм и, по меньшей мере, 120 нм. Подходящий диапазон обычно составляет от приблизительно, по меньшей мере, 50 нм до приблизительно, по меньшей мере, 110 нм, от приблизительно, по меньшей мере, 60 нм до приблизительно, по меньшей мере, 100 нм или от приблизительно, по меньшей мере, 80 нм до приблизительно, по меньшей мере, 90 нм.
Композиции и составы для перорального введения включают порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в воде или в неводных средах, капсулы, желатинизированные капсулы, саше, таблетки или минитаблетки. Могут быть желательными загустители, отдушки, разбавители, эмульгаторы, диспергирующие агенты или связующие агенты. В некоторых вариантах осуществления пероральными составами являются те, в которых dsRNA, охарактеризованные в изобретении, вводят в сочетании с одним или более поверхностно-активными веществами и хелаторами, увеличивающими проникновение. Подходящие поверхностно-активные вещества включают жирные кислоты и/или их сложные эфиры или соли, желчные кислоты и/или их соли. Подходящие желчные кислоты/соли включают хенодезоксихолевую кислоту (CDCA) и урсодезоксихенодезоксихолевую кислоту (UDCA), холевую кислоту, дегидрохолевую кислоту, дезоксихолевую кислоту, глухолевую кислоту, глихолевую кислоту, гликодезоксихолевую кислоту, таурохолевую кислоту, тауродезоксихолевую кислоту, тауро-24,25-дигидрофузидат натрия и гликодигидрофузидат натрия. Подходящие жирные кислоты включают арахидоновую кислоту, ундекановую кислоту, олеиновую кислоту, лауриловую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или моноглицерид, диглицерид или их фармацевтически приемлемую соль (например, натриевую). В некоторых вариантах осуществления используются сочетания агентов, усиливающих проникновение, например, жирных кислот/солей в сочетании с желчными кислотами/солями. Одним примером сочетания является натриевая соль лауриловой кислоты, каприловой кислоты и UDCA. Дополнительные агенты, усиливающие проникновение, включают полиоксиэтилен-9-лауриловый эфир, полиоксиэтилен-20-цетиловый эфир. DsRNA, охарактеризованные в изобретении, могут быть доставлены перорально в гранулированной форме, включая частицы, высушиваемые при распылении, или комплексированные с образованием микро- или наночастиц. Агенты, комплексирующие dsRNA, включают полиаминокислоты; полиимины; полиакрилаты; полиалкилакрилаты, полиоксэтаны, полиалкилцианоакрилаты; катионизированные желатины, альбумины, крахмалы, акрилаты, полиэтиленгликоли (ПЭГ) и крахмалы; полиалкилцианоакрилаты; ДЭАЭ-дериватизированные полиимины, поллуланы, целлюлозы и крахмалы. Подходящие комплексирующие агенты включают хитозан, N-триметилхитозан, поли-L-лизин, полигистидин, полиорнитин, полиспермины, протамин, поливинилпиридин, политиодиэтиламинометилэтилен P(TDAE), полиаминостирол (например, п-амино), поли(метилцианоакрилат), поли(этилцианоакрилат), поли(бутилцианоакрилат), поли(изобутилцианоакрилат), поли(изогексилцианоакрилат), ДЭАЭ-метакрилат, ДЭАЭ-гексилакрилат, ДЭАЭ-акриламид, ДЭАЭ-альбумин и ДЭАЭ-декстран, полиметакрилат, полигексилакрилат, поли(D,L-молочную кислоту), поли(DL-молочную-со-гликолевую кислоту (PLGA), альгинат и полиэтиленгликоль (ПЭГ). Пероральные составы для dsRNA и их получение подробно описаны в патенте США 6887906, публ. США № 20030027780 и в патенте США № 6747014, каждый из которых включен в настоящее описание в качестве ссылки.
Композиции и составы для парентерального, внутрипаренхиматозного (в мозг), внутриоболочечного, внутрижелудочкового или внутрипеченочного введения могут включать стерильные водные растворы, которые могут также содержать буферы, разбавители и другие подходящие добавки, такие как, но не ограничиваясь этим, агенты, усиливающие проникновение, вещества носителей и другие фармацевтически приемлемые носители или наполнители.
Фармацевтические композиции по настоящему изобретению включают, но не ограничиваются этим, растворы, эмульсии и содержащие липосомы составы. Эти композиции могут быть получены из разнообразных компонентов, которые включают, но не ограничиваются этим, предварительно образованные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества. Особенно предпочтительными являются составы, которые направлены на печень, при лечении заболеваний печени, таких как карцинома печени.
Фармацевтические композиции по настоящему изобретению, которые легко могут быть представлены в единицах лекарственной формы, могут быть получены в соответствии с общепринятыми методами, хорошо известными в фармацевтической промышленности. Такие методы включают стадию осуществления объединения активных ингредиентов с фармацевтическим(ими) носителем(ями) или наполнителем(ями). В целом, составы получают путем выполнения однородного и тщательного объединения активных ингредиентов с жидкими носителями или мелкодисперсными твердыми носителями или с обоими и затем, если это необходимо, придания формы продукту.
Композиции по настоящему изобретению могут быть составлены в виде любой из многих возможных лекарственных форм, таких как, но не ограничиваясь этим, таблетки, капсулы, желатинизированные капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции по настоящему изобретению могут также составляться в виде суспензий в водной, неводной или смешанной средах. Водные суспензии могут дополнительно содержать вещества, которые повышают вязкость суспензии, включая, например, натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
Дополнительные составы
Эмульсии
Композиции по настоящему изобретению могут быть получены и составлены в виде эмульсий. Эмульсии обычно представляют собой гетерогенные системы одной жидкости, диспергированной в другой в виде капель, обычно превышающих 0,1 мкм в диаметре (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто представляют собой двухфазные системы, включающие две несмешиваемые жидкие фазы, тщательно смешанные и диспергированные друг в друге. В целом эмульсии могут быть либо вариантом вода-в-масле (w/o), либо вариантом масло-в-воде (o/w). Когда водная фаза тонко разделена или диспергирована в виде мелких капель в основной масляной фазе, полученную композицию называют эмульсией воды-в-масле (w/o). Альтернативно, когда масляная фаза тонко разделена или диспергирована в виде мелких капель в основной водной фазе, полученную композицию называют эмульсией масла-в-воде (o/w). Эмульсии могут содержать дополнительные компоненты в дополнение к диспергированным фазам и активное лекарство, которое может присутствовать либо в виде раствора в водной фазе, раствора в масляной фазе, либо само по себе в виде отдельной фазы. Фармацевтические наполнители, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты, также по необходимости могут присутствовать в эмульсиях. Фармацевтические эмульсии могут также представлять собой множественные эмульсии, которые включают более двух фаз, так как, например, в случае эмульсий масло-в-воде-в-масле (o/w/o) и вода-в-масле-в-воде (w/o/w). Такие сложные составы часто дают определенные преимущества, которых нет у простых двойных эмульсий. Множественные эмульсии, в которых индивидуальные масляные капли эмульсии o/w охватывают мелкие водные капли, составляют эмульсию w/o/w. Подобно этому, система масляных капель, заключенная в глобулы воды, стабилизированные в непрерывной масляной фазе, дает эмульсию o/w/o.
Эмульсии характеризуются маленькой термодинамической стабильностью или ее отсутствием. Часто диспергированная или дискретная фаза эмульсии хорошо диспергирована во внешней или непрерывной фазе и поддерживается в этой форме посредством эмульгаторов или вязкости состава. Каждая из фаз эмульсии может быть полутвердой или твердой, как это имеет место в случае основ мазей типа эмульсий и в случае кремов. В других средствах для стабилизации эмульсий привлекается использование эмульгаторов, которые могут быть включены в любую фазу эмульсии. Эмульгаторы в широком смысле могут быть разделены на четыре категории: синтетические поверхностно-активные вещества, природные эмульгаторы, абсорбирующие основы и мелкодисперсные твердые вещества (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Синтетические сурфактанты, также известные как поверхностно-активные агенты, нашли широкое применение в составе эмульсий и обзорно описаны в литературе (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества обычно являются амфифильными и включают гидрофильную и гидрофобную часть. Отношение гидрофильной части к гидрофобной части поверхностно-активного вещества обозначается как гидрофильный/гидрофобный баланс (HLB) и является ценным инструментом классификации и выбора поверхностно-активных веществ при получении составов. Поверхностно-активные вещества могут быть подразделены на различные классы на основе природы их гидрофильной группы: неионные, анионные, катионные и амфотерные (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
Природные эмульгаторы, используемые в составах эмульсий, включают ланолин, пчелиный воск, фосфатиды, лектин и гуммиарабик. Абсорбирующие основы, такие как безводный ланолин и гидрофильный вазелин, обладают гидрофильными свойствами, так что они могут впитывать воду с образованием w/o эмульсий, все еще сохраняя их полутвердую консистенцию. Мелкодисперсные твердые вещества также используются в качестве хороших эмульгаторов особенно в сочетании с поверхностно-активными веществами и в вязких препаратах. Они включают полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, ненабухающие клеи, такие как бентонит, аттапулгит, гекторит, каолин, монтмориллонит, коллоидный силикат алюминия и коллоидный силикат алюминия-магния, пигменты и неполярные твердые вещества, такие как глицерилтристеарат.
Широкое разнообразие неэмульгирующих веществ также включается в составы эмульсий, и они вносят вклад в свойства эмульсий. Они включают жиры, масла, воски, жирные кислоты, жирные спирты, сложные эфиры жирных кислот, увлажнители, гидрофильные коллоиды, консерванты и антиоксиданты (Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Гидрофильные коллоиды или гидроколлоиды включают природные камеди и синтетические полимеры, такие как полисахариды (например, гуммиарабик, агар, альгиновую кислоту, каррагенин, гуаровую камедь, камедь карайи и трагакант), производные целлюлозы (например, карбоксиметилцеллюлозу и карбоксипропилцеллюлозу), и синтетические полимеры (например, карбомеры, простые эфиры целлюлозы и полимеры карбоксивинила). Они диспергируются или набухают в воде с образованием коллоидных растворов, которые стабилизируют эмульсии путем образования сильных межфазных пленок вокруг капель диспергированной фазы и с помощью повышения вязкости внешней фазы.
Так как эмульсии часто содержат ряд ингредиентов, таких как углеводы, белки, стерины и фосфатиды, которые могут легко поддерживать рост микробов, эти составы часто включают консерванты. Обычно используемые консерванты, включаемые в составы эмульсий, включают метилпарабен, пропилпарабен, четвертичные аммонийные соли, хлорид бензалкония, сложные эфиры п-гидроксибензойной кислоты и борную кислоту. Антиоксиданты также обычно добавляют к составам эмульсий для предотвращения разрушения состава. Используемые антиоксиданты могут представлять собой ловушки свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированный гидроксианизол, бутилированный гидрокситолуол, или восстанавливающие агенты, такие как аскорбиновая кислота и метабисульфит натрия, и синергисты антиоксидантов, такие как лимонная кислота, винная кислота и лецитин.
Применение эмульсионных составов дерматологическим, пероральным и парентеральным путем и методы их получения обзорно описываются в литературе (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Эмульсионные составы для пероральной доставки очень широко используются из-за легкости их составления, а также эффективности с позиции всасывания и биодоступности (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Слабительные на минерально-масляной основе, растворимые в масле витамины и препараты высокожирных пищевых продуктов находятся среди веществ, которые обычно вводят перорально в виде эмульсий o/w.
В одном варианте осуществления настоящего изобретения композиции iRNA и нуклеиновых кислот составляют в виде микроэмульсий. Микроэмульсия может быть определена как система воды, масла и амфифильного агента, который представляет собой единственный необязательно изотропный и термодинамически стабильный жидкий раствор (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Обычно микроэмульсии представляют собой системы, которые получают сначала путем диспергирования масла в водном растворе поверхностно-активного вещества и затем добавления достаточного количества четвертого компонента, обычно спирта с промежуточной длиной цепи, с образованием прозрачной системы. Следовательно, микроэмульсии также описываются как термодинамически стабильные, изотропически прозрачные дисперсии двух несмешиваемых жидкостей, которые стабилизированы межфазными пленками поверхностно-активных молекул (Leung and Shah, in: Controlled Release of Drugs: Polymers and Aggregate Systems, Rosoff, M., Ed., 1989, VCH Publishers, New York, pages 185-215). Микроэмульсии обычно получают путем объединения от трех до пяти компонентов, которые включают масло, воду, поверхностно-активное вещество, вторичное поверхностно-активное вещество и электролит. Является ли микроэмульсия эмульсией типа воды-в-масле (w/o) или масла-в-воде (o/w) зависит от свойств масла и используемого поверхностно-активного вещества и от структуры и геометрической упаковки полярных головок и углеводородных хвостов поверхностно-активных молекул (Schott, in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 271).
Интенсивно исследован феноменологический подход, использующий фазовые диаграммы, и это привело к всестороннему знанию специалистом в данной области техники того, как составлять микроэмульсии (смотри, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335). По сравнению с традиционными эмульсиями микроэмульсии предоставляют преимущества для не растворимых в воде лекарств в составе термодинамически стабильных капель, которые образуются спонтанно.
Поверхностно-активные вещества в препарате микроэмульсий включают, но не ограничиваются этим, ионные поверхностно-активные вещества, неионные поверхностно-активные вещества, Brij 96, полиоксиэтиленолеиловые эфиры, сложные эфиры полиглицерина и жирных кислот, тетраглицеринмонолаурат (ML310), тетраглицеринмоноолеат (MO310), гексаглицеринмоноолеат (PO310), гексаглицеринпентаолеат (PO500), декаглицеринмонокапрат (MCA750), декаглицеринмоноолеат (MO750), декаглицеринсеквиолеат (SO750), декаглицериндекаолеат (DAO750), по одиночке или в сочетании с вторичными поверхностно-активными веществами. Вторичное поверхностно-активное вещество, обычно спирт с короткой цепью, такой как этанол, 1-пропанол и 1-бутанол, служит для повышения межфазовой текучести путем проникновения в пленку поверхностно-активного вещества и последующего создания неупорядочной пленки из-за свободного объема, создаваемого между молекулами поверхностно-активного вещества. Микроэмульсии могут, однако, быть получены без использования вторичных поверхностно-активных веществ, и безалкогольные самоэмульгирующиеся системы известны в данной области техники. Водная фаза обычно может представлять собой, но не ограничиваться этим, воду, водный раствор лекарства, глицерин, ПЭГ300, ПЭГ400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляная фаза может включать, но не ограничиваться этим, такие вещества как Captex 300, Captex 355, Capmul MCM, сложные эфиры жирных кислот, моно-, ди- и триглицериды со средней цепью (C8-C12), полиоксиэтилированные сложные эфиры глицерина и жирных кислот, жирные спирты, полигликолизированные глицериды, насыщенные полигликолизированные C8-C10 глицериды, растительные масла и силиконовое масло.
Микроэмульсии представляют особый интерес с точки зрения солюбилизации лекарств и повышения всасывания лекарств. Микроэмульсии на основе липидов (как o/w, так и w/o), как предполагается, повышают пероральную биодоступность лекарств, включая пептиды (смотри, например, патенты №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Микроэмульсии предоставляют преимущества в отношении улучшенной солюбилизации лекарства, защиты лекарства от ферментативного гидролиза, возможного повышения всасывания лекарства, благодаря индуцируемым поверхностно-активным веществом изменениям текучести и проницаемости мембран, легкости получения, легкости перорального введения по сравнению с твердыми лекарственными формами, улучшенной клинической эффективности и пониженной токсичности (смотри, например, патенты США №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться спонтанно, когда их компоненты соединяют вместе при температуре окружающей среды. Это может быть особенно выгодным, когда составляются термолабильные лекарства, пептиды или iRNA. Микроэмульсии эффективны также при чрескожной доставке активных компонентов, как при косметическом, так и при фармацевтическом применении. Ожидается, что композиции и составы микроэмульсий по настоящему изобретению должны облегчать системное всасывание iRNA и нуклеиновых кислот из желудочно-кишечного тракта, а также улучшать местный клеточный захват iRNA и нуклеиновых кислот.
Микроэмульсии по настоящему изобретению могут также содержать дополнительные компоненты и добавки, такие как моностеарат сорбитана (Grill 3), лабразол и агенты, усиливающие проницаемость, для улучшения свойств состава и повышения поглощения iRNA и нуклеиновых кислот по настоящему изобретению. Агенты, усиливающие проницаемость, используемые в микроэмульсиях по настоящему изобретению, могут быть классифицированы как принадлежащие к одному из пяти широких категорий - поверхностно-активные вещества, жирные кислоты, соли желчных кислот, хелатирующие агенты и агенты, не являющиеся хелатирующими и не являющиеся поверхностно-активными веществами (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92). Каждый из этих классов обсуждался выше.
Агенты, усиливающие проницаемость
В одном варианте осуществления в настоящем изобретении применяются различные агенты, усиливающие проницаемость, для воздействия на эффективную доставку нуклеиновых кислот, особенно iRNA, в кожу животных. Большинство лекарств присутствует в растворе как в ионизированной, так и в неионизированной форме. Однако только растворимые в липидах или липофильные лекарства легко проходят через клеточные мембраны. Было раскрыто, что даже нелипофильные лекарства могут пересекать клеточные мембраны, если мембрана, которую надо пересечь, обработана агентом, усиливающим проницаемость. Кроме поддержки диффузии нелипофильных лекарств через клеточные мембраны агенты, усиливающие проницаемость, также повышают проницаемость липофильных лекарств.
Агенты, усиливающие проницаемость, могут классифицироваться как принадлежащие к одной из пяти широких категорий, т.е. к поверхностно-активным веществам, жирным кислотам, солям желчных кислот, хелатирующим агентам и агентам, не являющимся хелатирующими и не являющимся поверхностно-активными веществами (смотри, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из упомянутых выше классов описывается ниже более подробно.
Поверхностно-активные вещества: в плане настоящего изобретения поверхностно-активные вещества (или «поверхностно-активные агенты») представляют собой химические компоненты, которые при растворении в водном растворе снижают поверхностное натяжение раствора или межфазовое натяжение между водным раствором и другой жидкостью, в результате чего всасывание iRNA через слизистую оболочку усиливается. В дополнение к солям желчных кислот и жирным кислотам эти агенты, усиливающие проницаемость, включают, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир) (смотри, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и перфторированные эмульсии, такие как FC-43. Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Жирные кислоты: различные жирные кислоты и их производные, которые действуют как агенты, усиливающие проницаемость, включают, например, олеиновую кислоту, лауриловую кислоту, каприловую кислоту (н-деканоевую кислоту), миристиловую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линолеиновую кислоту, дикапрат, трикапрат, моноолеин (1-моноолеоил-rac-глицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, глицерин-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитины, ацилхолины, их C1-20-алкиловые сложные эфиры (например, метиловый, изопропиловый и трет-бутиловый) и их моно- и диглицериды (т.е. олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и т.д.) (смотри, например, Touitou, E., et al. Enhancement in Drug Delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; El Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Соли желчных кислот: физиологическая роль желчи включает облегчение диспергирования и всасывания липидов и жирорастворимых витаминов (смотри, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Brunton, Chapter 38 in: Goodman & Oilman's The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp. 934-935). Различные природные соли желчных кислот и их синтетические производные действуют в качестве агентов, усиливающих проницаемость. Таким образом, термин «соли желчных кислот» включает любой из природных компонентов желчи, а также любые их синтетические производные. Подходящие соли желчных кислот включают, например, холевую кислоту (или ее фармацевтически приемлемую натриевую соль, холат натрия), дегидрохолевую кислоту (дегидрохолат натрия), дезоксихолевую кислоту (дезоксихолат натрия), глюколиевую кислоту (глюколат натрия), гликолевую кислоту (гликохолат натрия), гликодезоксихолевую кислоту (гликодезоксихолат натрия), таурохолевую кислоту (таурохолат натрия), тауродезоксихолевую кислоту (тауродезоксихолат натрия), хенодезоксихолевую кислоту (хенодезоксихолат натрия), урсодезоксихолевую кислоту (UDCA), тауро-24,25-дигидрофузидат натрия (STDHF), гликодигидрофузидат натрия и полиоксиэтилен-9-лауриловый эфир (POE) (смотри, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Хелатирующие агенты: хелатирующие агенты при применении в плане настоящего изобретения могут быть определены как соединения, которые удаляют ионы металлов из раствора путем образования комплексов с ними, в результате чего всасывание iRNA через слизистую оболочку повышается. В отношении их использования в настоящем изобретении в качестве агентов, усиливающих проницаемость, хелатирующие агенты имеют дополнительное преимущество, служа также ингибиторами ДНКаз, так как наиболее охарактеризованные нуклеазы ДНК требуют двухвалентного иона металла для катализа и, следовательно, ингибируются хелатирующими агентами (Jarrett, J. Chromatogr., 1993, 618, 315-339). Подходящие хелатирующие агенты включают, но не ограничиваются этим, динатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА), лимонную кислоту, салицилаты (например, салицилат натрия, 5-метоксисалицилат и гомованилат натрия), N-ацильные производные коллагена, лаурет-9 и N-аминоацильные производные β-дикетонов (енаминов) (смотри, например, Katdare, A. et al., Excipient development for pharmaceutical, biotechnology, and drug delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel., 1990, 14, 43-51).
Агенты, не являющиеся хелатирующими и не являющиеся поверхностно-активными веществами: при применении в настоящем описании соединения, усиливающие проницаемость, не являющиеся хелатирующими и не являющиеся поверхностно-активными веществами, могут быть определены как соединения, которые проявляют незначительную активность в качестве хелатирующих агентов или в качестве поверхностно-активных веществ, но, тем не менее, повышают всасывание iRNA через слизистую оболочку пищеварительного тракта (смотри, например, Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Этот класс агентов, усиливающих проницаемость, включает, например, ненасыщенные циклические производные мочевины, производные 1-алкил- и 1-алкенилазациклоалканона (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92); и нестероидные противовоспалительные агенты, такие как диклофенак натрия, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
К фармацевтическим и другим композициям по настоящему изобретению также могут быть добавлены агенты, которые усиливают захват iRNA на клеточном уровне. Например, катионные липиды, такие как липофектин (Junichi et al., патент США № 5705188), катионные производные глицерина и поликатионные молекулы, такие как полилизин (Lollo et al., заявка PCT WO 97/30731), как известно, повышают клеточный захват dsRNA. Примеры имеющихся в продаже реагентов для трансфекции включают среди прочих, например, липофектамин™ (Invitrogen; Carlsbad, CA), липофектамин 2000™ (Invitrogen; Carlsbad, CA), 293фектин™ (Invitrogen; Carlsbad, CA), целлфектин™ (Invitrogen; Carlsbad, CA), DMRIE-C™ (Invitrogen; Carlsbad, CA), FreeStyle™ MAX (Invitrogen; Carlsbad, CA), липофектамин™ 2000 CD (Invitrogen; Carlsbad, CA), липофектамин™ (Invitrogen; Carlsbad, CA), RNAiMAX (Invitrogen; Carlsbad, CA), олигофектамин™ (Invitrogen; Carlsbad, CA), оптифект™ (Invitrogen; Carlsbad, CA), реагент для трансфекции X-tremeGENE Q2 (Roche; Grenzacherstrasse, Switzerland), липосомный реагент для трансфекции DOTAP (Grenzacherstrasse, Switzerland), липосомный реагент для трансфекции DOSPER (Grenzacherstrasse, Switzerland), или фуген (Grenzacherstrasse, Switzerland), реагент трансфектам® (Promega; Madison, WI), реагент для трансфекции TransFast™ (Promega; Madison, WI), реагент Tfx™-20 (Promega; Madison, WI), реагент Tfx™-50 (Promega; Madison, WI), DreamFect™ (OZ Biosciences; Marseille, France), EcoTransfect (OZ Biosciences; Marseille, France), реагент для трансфекции TransPassa D1 (New England Biolabs; Ipswich, MA, USA), LyoVec™/LipoGen™ (Invivogen; San Diego, CA, USA), реагент для трансфекции PerFectin (Genlantis; San Diego, CA, USA), реагент для трансфекции NeuroPORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции GenePORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции GenePORTER 2 (Genlantis; San Diego, CA, USA), реагент для трансфекции цитофектин (Genlantis; San Diego, CA, USA), реагент для трансфекции BaculoPORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции TroganPORTER™ (Genlantis; San Diego, CA, USA), RiboFect (Bioline; Taunton, MA, USA), PlasFect (Bioline; Taunton, MA, USA), UniFECTOR (B-Bridge International; Mountain View, CA, USA), SureFECTOR (B-Bridge International; Mountain View, CA, USA) или HiFectTM (B-Bridge International, Mountain View, CA, USA).
Для повышения проникновения вводимых нуклеиновых кислот могут быть использованы другие агенты, включая гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
Носители
Определенные композиции по настоящему изобретению включают в состав также соединения-носители. При применении в настоящем описании «соединение-носитель» или «носитель» может обозначать нуклеиновую кислоту или ее аналог, который является инертным (т.е. не обладает биологической активностью per se), но узнается как нуклеиновая кислота процессами in vivo, которые снижают биодоступность нуклеиновой кислоты, обладающей биологической активностью, например, путем деградации биологически активной нуклеиновой кислоты или стимуляции ее удаления из циркуляторного русла. Совместное введение нуклеиновой кислоты и соединения-носителя, обычно с избытком последнего вещества, может приводить к существенному снижению количества нуклеиновой кислоты, открываемой в печени, почке или в другой структуре вне циркуляторного русла, очевидно, из-за конкуренции между соединением-носителем и нуклеиновой кислотой за общий рецептор. Например, открываемость частично фосфоротиоатной dsRNA в печеночной ткани может быть снижена, когда ее вводят совместно с полиинозиновой кислотой, декстран-сульфатом, полицитидиновой кислотой или 4-ацетамидо-4'-изотиоциано-стильбен-2,2'-дисульфоновой кислотой (Miyao et al., DsRNA Res. Dev., 1995, 5, 115-121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177-183).
Наполнители
В отличие от соединения-носителя «фармацевтический носитель» или «наполнитель» представляет собой фармацевтически приемлемый растворитель, суспендирующий агент или любой другой фармакологически инертный носитель для доставки одной или более нуклеиновых кислот животному. Наполнитель может представлять собой жидкость или твердое вещество, и его выбирают, имея в виду планируемый способ его введения, так чтобы обеспечить желаемый объем, консистенцию и т.д. при объединении с нуклеиновой кислотой и другими компонентами данной фармацевтической композиции. Типичные фармацевтические носители включают, но не ограничиваются этим, связующие агенты (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т.д.); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты или гидрофосфат кальция и т.д.); смазывающие агенты (например, стеарат магния, тальк, кремнезем, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.); дезинтегрирующие агенты (например, крахмал, крахмал-гликолят натрия и т.д.); и увлажняющие агенты (например, лаурилсульфат натрия и т.д.).
Фармацевтически приемлемые органические или неорганические наполнители, подходящие для непарентерального введения, которые пагубно не взаимодействуют с нуклеиновыми кислотами, также могут быть использованы для составления композиций по настоящему изобретению. Подходящие фармацевтически приемлемые носители включают, но не ограничиваются этим, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Составы для местного введения нуклеиновых кислот могут включать стерильные и нестерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидких или твердых масляных основаниях. Растворы могут также содержать буферы, разбавители и другие подходящие добавки. Могут быть использованы фармацевтически приемлемые органические или неорганические наполнители, подходящие для непарентерального введения, которые пагубно не взаимодействуют с нуклеиновыми кислотами.
Подходящие фармацевтически приемлемые наполнители включают, но не ограничиваются этим, воду, солевые растворы, спирт, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Другие компоненты
Композиции по настоящему изобретению могут дополнительно содержать другие вспомогательные компоненты, обычно находящиеся в фармацевтических композициях, на уровнях их использования, установленных в данной области техники. Таким образом, например, композиции могут содержать дополнительные, совместимые, фармацевтически активные вещества, такие как, например, противозудные агенты, вяжущие агенты, местные анестетики или противовоспалительные агенты, или могут содержать дополнительные вещества, полезные для физического составления различных лекарственных форм композиций по настоящему изобретению, такие как красители, отдушки, консерванты, антиоксиданты, замутняющие агенты, загустители и стабилизаторы. Однако такие вещества при добавлении не должны чрезмерно вмешиваться в биологическую активность компонентов композиций по настоящему изобретению. Составы могут быть стерилизованы и, если это желательно, смешаны со вспомогательными агентами, например, со смазывающими агентами, консервантами, стабилизаторами, увлажняющими агентами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красителями, отдушками и/или ароматизирующими веществами и тому подобным, что отрицательно не влияет на взаимодействие с нуклеиновой(ыми) кислотой(ами) состава.
Водные суспензии могут содержать вещества, которые повышают вязкость суспензии, включая, например, натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
В некоторых вариантах осуществления фармацевтические композиции, охарактеризованные в изобретении, включают (a) одно или более соединений iRNA и (b) один или более антицитокиновых биологических агентов, которые функционируют с помощью механизма, не связанного с RNAi. Примеры таких биологических агентов включают биологические агенты, которые направлены на IL1β (например, анакинра), IL6 (например, тоцилизумаб) или TNF (например, этанерсепт, инфликсимаб, адлимумаб или сертолизумаб).
Токсичность и терапевтическая эффективность таких соединений могут быть определены с помощью стандартных фармацевтических методов в клеточных культурах или у экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Отношение доз токсического и терапевтического эффектов представляет собой терапевтический индекс, и он может быть выражен как отношение LD50/ED50. Соединения, которые проявляют высокие терапевтические индексы, являются предпочтительными.
Данные, полученные в тестах с клеточными культурами и в исследованиях на животных, могут быть использованы для составления диапазона дозировок для применения у человека. Дозировка композиций, охарактеризованных в настоящем описании, обычно лежит в пределах диапазона циркулирующих концентраций, что включает ED50 с низкой токсичностью или ее отсутствием. Дозировка может варьироваться в пределах этого диапазона в зависимости от используемой единицы лекарственной формы и применяемого пути введения. Для любого соединения, используемого в методах, охарактеризованных в изобретении, терапевтически эффективная доза может быть определена первоначально из методов с использованием клеточных культур. Доза может быть составлена с использованием животных моделей для достижения диапазона концентрации соединения в циркулирующей плазме или, когда это подходит, полипептидного продукта последовательности-мишени (например, достижения пониженной концентрации полипептида), что включает IC50 (т.е. концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование симптомов) при определении в клеточной культуре. Такая информация может быть использована для более точного определения пригодных доз у человека. Уровни в плазме могут быть измерены, например, с помощью высокоэффективной жидкостной хроматографии.
В дополнение к их введению, обсуждемому выше, iRNA, описанные в настоящем документе, можно вводить в сочетании с другими известными агентами, эффективными при лечении патологических процессов, опосредуемых экспрессией TMPRSS6. В любом случае врач, осуществляющий введение, может подогнать количество и временные интервалы введения iRNA на основе результатов, наблюдаемых при использовании стандартных измерений эффективности, известных в данной области техники, или описанных в настоящем документе.
Способы лечения заболеваний, вызываемых экспрессией гена TMPRSS6
Изобретение относится, в частности, к использованию iRNA, направленной на TMPRSS6, и к композициям, содержащим, по меньшей мере, одну такую iRNA, для лечения нарушения или заболевания, опосредуемого TMPRSS6. Например, композицию, содержащую iRNA, направленную на ген TMPRSS6, используют для лечения нарушения, связанного с повышенными уровнями железа, такого как талассемия (например, промежуточная β-талассемия или α-талассемия), первичный гемохроматоз, вторичный гемохроматоз, тяжелый ювенильный гемохроматоз, сидеробластная анемия, гемолитическая анемия, дизэритропоэтическая анемия или серповидноклеточная анемия. В одном варианте осуществления iRNA TMPRSS6 используют для лечения гемоглобинопатии. iRNA TMPRSS6, охарактеризованные в изобретении, могут также использоваться для лечения повышенных уровней железа, обусловленных другими состояниями, такими как хронический алкоголизм.
При талассемиях костный мозг синтезирует недостаточные количества цепи гемоглобина; это в свою очередь снижает продукцию эритроцитов и вызывает анемию. Может быть затронута либо α-, либо β-цепь, но β-талассемии являются более обычными; новорожденные дети здоровы, так как их организм все еще продуцирует HbF, который не имеет β-цепей; в течение первых нескольких месяцев жизни костный мозг переключается на продукцию HbA, и симптомы начинают появляться.
β-талассемии возникают в результате мутации либо неэкспрессирующегося (β0), либо экспрессирующегося на низком уровне (β+) аллелей гена HBB. β-талассемии варьируются по тяжести в зависимости от генотипа и включают малую/особую β-талассемию (β/β0 или β/β+), промежуточную β-талассемию (β0/β+) и большую β-талассемию (β0/β0 или (β+/β+).
При промежуточной талассемии (TI) обычно присутствует небольшой гемолиз, тогда как большая β-талассемия (TM) обычно сопровождается обширным гемолизом, который вызывает, например, анемию и спленомегалию; и высокий неэффективный гемопоэз, вызывающий стимуляцию костного мозга (изменения скелета, остеопению), повышенный синтез эритропоэтина, гепатоспленомегалию, употребление препаратов железа (мегабластная анемия) и высокий уровень мочевой кислоты в крови. iRNA, охарактеризованные в изобретении, например, iRNA TMPRSS6, лучше подходят для лечения перегрузки железом, которая обычно сопровождает талассемии, которые больше похожи на TI (например, при лечении индивидуумов, имеющих генотип β0/β+, β/β0 или β/β+).
Симптомы β-талассемий включают также, например, осложнение, обусловленное лечением, например, перегрузку железом, которая вызывает эндокринопатии, фиброз печени и фиброз сердца. Введение агента iRNA, который направлен на TMPRSS6, может быть эффективным для лечения одного или более из этих симптомов.
α-талассемии возникают в результате мутации либо неэкспрессирующегося (α0), либо экспрессирующегося на низком уровне (α+) аллелей генов HBA1 или HBA2. α-талассемии варьируются по тяжести в зависимости от генотипа и включают особую талассемию (-α/αα), Hb Барта и водянку плода (α0/α0), малую α-талассемию (--/αα), (-α/-α) и болезнь HbH (--/-α). Продуцируется меньше цепей α-глобина, что приводит к избытку β-цепей у взрослых и избытку γ-цепей у новорожденных. Избыток β-цепей образует нестабильные тетрамеры (называемые гемоглобином H или HbH из 4 бета-цепей), которые имеют аномальные кривые диссоциации кислорода. Введение агента iRNA, который направлен на TMPRSS6, может быть эффективным для лечения перегрузки железом у индивидуума, который страдает α-талассемией.
Симптомы гемохроматоза включают, например, боль в брюшной полости, боль суставов, утомляемость, отсутствие энергии, слабость, потемнение кожи (часто обозначаемое как «бронзовая» кожа) и потерю волос тела. Введение агента iRNA, который направлен на TMPRSS6, может быть эффективным для лечения одного или более из этих симптомов.
Другие симптомы, связанные с перегрузкой железом, включают повышенный риск заболевания печени (цирроза, рака), сердечный приступ или сердечную недостаточность, сахарный диабет, остеоартрит, остеопороз, метаболический синдром, гипотиреоз, гипогонадизм и в некоторых случаях преждевременную смерть. Нарушение регуляции железа, приводящее к его перегрузке, может также ускорить такие нейродегенеративные заболевания, как болезнь Альцгеймера, Паркинсона, Хантингтона, эпилепсию и множественный склероз. Введением iRNA, которая направлена на TMPRSS6, например, iRNA, описанной в таблицах 2, 3 или 4, можно лечить один или более из этих симптомов, или предотвращать развитие или прогрессию заболевания или нарушения, которое усугубляется при повышенных уровнях железа.
Изобретение дополнительно относится к применению iRNA или ее фармацевтической композиции, например, для лечения нарушения, связанного с повышенными уровнями железа, в сочетании с другими фармацевтическими агентами и/или другими терапевтическими методами, например, известными фармацевтическими агентами и/или известными терапевтическими методами, такими как, например, применяемые в настоящее время для лечения этих нарушений. Например, в определенных вариантах осуществления iRNA, направленную на TMPRSS6, вводят в сочетании, например, с хелаторами железа (например, дезферроксамином), фолиевой кислотой, переливанием крови, флеботомией, агентами для лечения язвы, агентами для повышения уровней фетального гемоглобина (например, гидроксимочевиной), агентами для контролирования инфекций (например, антибиотиками и противовирусными препаратами), агентами для лечения тромботического состояния, или со стволовыми клетками, или трансплантатом костного мозга. Для трансплантата стволовых клеток можно использовать стволовые клетки из пупочного канатика, такие как от родственника, например, от брата или сестры. Примеры хелаторов железа включают дезферроксамин, деферазирокс (Exjade), деферопрон, витамин Е, масло зародышей пшеницы, токоферсолан и индикаксантин.
iRNA и дополнительный терапевтический агент можно вводить в одной и той же композиции, например, парентерально, или дополнительный терапевтический агент можно вводить как часть отдельной композиции или с помощью другого метода, описанного в настоящем документе. Введение iRNA TMPRSS6 и дополнительного терапевтического агента может происходить в одно и то же время или в различные периоды времени и в любом порядке.
В изобретении характеризуется метод введения агента iRNA, направленного на TMPRSS6, больному, страдающему заболеванием или нарушением, опосредуемым экспрессией TMPRSS6, таким как нарушение, связанное с повышенными уровнями железа. Введение dsRNA может снижать уровни железа, снижать уровни ферритина и/или снижать уровни насыщения трансферрина. Например, введение dsRNA может снижать уровни железа в сыворотке и/или снижать уровни ферритина в сыворотке. Уровни насыщения трансферрина могут быть снижены на 5%, 10%, 15%, 20%, 25% или более. Уровни насыщения трансферрина могут быть снижены ниже 50%, ниже 45%, ниже 40%, ниже 35%, ниже 35% или ниже. Насыщение трансферрина является мерой количества железа, связанного с трансферрином сыворотки, и соответствует отношению железа сыворотки к суммарной связывающей способности для железа.
Под «снижением» в этом контексте подразумевается статистически достоверное снижение такого уровня. Снижение может составлять, например, по меньшей мере, 10%, по меньшей мере, 20%, по меньшей мере, 30%, по меньшей мере, 40% или более и предпочтительно представляет собой снижение до уровня, приемлемого как лежащего в пределах диапазона нормального уровня для индивидуума без такого нарушения.
Эффективность лечения или профилактики заболевания может быть оценена, например, с помощью измерения прогрессии заболевания, ремиссии заболевания, тяжести симптомов, снижения боли, качества жизни, дозы лекарства, требуемой для поддержания лечебного эффекта, уровня маркера заболевания или любого другого измеряемого параметра, подходящего для данного заболевания, подвергаемого лечению, или для заболевания, на которое направлена профилактика. Вполне в пределах способности специалиста в данной области техники прослеживать эффективность лечения или профилактики путем измерения любого одного из таких параметров или любого сочетания параметров. Например, могут прослеживаться уровни насыщения трансферрина или ферритин сыворотки для оценки эффективности данного режима лечения.
Методы определения уровня железа обычно выполняются на образце крови больного. В методе измерения уровня железа измеряют количество железа в сыворотке крови, которое переносится белком трансферрином. В тесте TIBC (суммарной железосвязывающей способности) измеряют количество железа, которое кровь должна нести, если трансферрин полностью насыщен. Так как трансферрин продуцируется печенью, TIBC может быть использован для прослеживания функции печени и питания. Трансферриновый тест представляет собой прямое измерение уровней трансферрина (также называемого сидерофилином) в крови. Насыщающий уровень трансферрина может быть рассчитан путем деления уровня железа в сыворотке на TIBC. В ферритиновом тесте измеряют уровень в крови белка, который запасает железо для более позднего использования организмом.
Лечение iRNA, описанное в настоящем документе, может быть использовано для лечения индивидуумов, имеющих повышенные уровни железа, на что могут указывать повышенные уровни железа в сыворотке, например, измеренные уровни железа выше 350 мкг/дл, выше 350 мкг/дл, выше 500 мкг/дл, выше 1000 мкг/дл или более. В одном варианте осуществления повышенные уровни железа в сыворотке составляют, например, выше 15, 20, 25 или 30 мг/г сухой массы.
Лечение iRNA, описанное в настоящем документе, может быть использовано для лечения индивидуумов, имеющих повышенные уровни железа, на что могут указывать повышенные уровни ферритина в сыворотке, например, измеренные уровни ферритина выше 300 мкг/л, выше 500 мкг/л, выше 1000 мкг/л, выше 1500 мкг/л, выше 2000 мкг/л, выше 2500 мкг/л или 3000 мкг/л или более.
Лечение iRNA, описанное в настоящем документе, может быть использовано для лечения индивидуумов, имеющих повышенные уровни железа, на что могут указывать повышенные уровни трансферрина в сыворотке, например, измеренные уровни трансферрина выше 400 мг/дл, выше 500 мг/дл, выше 1000 мг/дл или более.
Лечение iRNA, описанное в настоящем документе, может быть использовано для лечения индивидуумов, имеющих умеренно повышенные уровни железа, на что могут указывать умеренно повышенные уровни насыщения трансферрина, например, уровни насыщения 40%, 45% или 50% или более. Кроме того, описанное в настоящем документе лечение можно также использовать для профилактики повышенных уровней железа у индивидуумов, имеющих только минорное повышение насыщения трансферрина. Специалист в данной области техники легко может проследить уровни насыщения трансферрина у индивидуумов, получающих лечение iRNA, как описано в настоящем документе, и провести анализ на снижение уровней насыщения трансферрина, по меньшей мере, на 5% или 10%.
Лечение iRNA, описанное в настоящем документе, может быть использовано для лечения индивидуумов, имеющих повышенные уровни железа, на что может указывать величина TIBC выше 400 мкг/дл, выше 500 мкг/дл, выше 1000 мкг/дл или более.
В некоторых вариантах осуществления индивидуумы, нуждающиеся в лечении siRNA TMPRSS6, имеют пониженные уровни гематокрита, пониженные уровни гемоглобина, повышенную ширину распределения эритроцитов, повышенное количество ретикулоцитов, пониженное количество зрелых эритроцитов, повышенную ненасыщенную железосвязывающую способность, пониженный неэффективный эритропоэз, пониженный экстрамедуллярный гемопоэз и/или пониженные уровни экспрессии HAMP1.
За больным можно дополнительно следить с помощью метода определения уровня сахара (глюкозы) крови или уровня α-фетопротеина, с помощью эхокардиограммы (например, для проверки функции сердца), электрокардиограммы (ЭКГ) (например, для наблюдения за электрической активностью сердца), с помощью методов визуализации (таких как КТ-сканирование, МРТ и ультразвук) и тестов на функции печени. Избыток окрашивания на железо или концентрации железа могут быть измерены в образцах биопсии печени или для подтверждения степени повреждения печени, например, стадии заболевания печени.
Эффект лечения или профилактики является очевидным, когда наблюдается статистически достоверное улучшение одного или более показателей заболевания или когда отсутствует ухудшение или развитие симптомов, которые в противном случае должны ожидаться. В качестве примера, благоприятное изменение, по меньшей мере, на 10% измеряемого показателя заболевания и предпочтительно, по меньшей мере, на 20%, 30%, 40%, 50% или более может быть показателем эффективности лечения. Эффективность для данного лекарства iRNA или состава этого лекарства с iRNA может быть также оценена с использованием экспериментальной животной модели для данного заболевания, как известно в данной области техники. При использовании экспериментальной животной модели эффективность лечения доказывается, когда наблюдается статистически значимое снижение маркера или симптома.
Альтернативно, эффективность может быть измерена по снижению тяжести заболевания при определении специалистом в области диагностики на основе шкалы клинически принятой градации тяжести заболевания.
Больным можно вводить терапевтическое количество iRNA, такое как 0,01 мг/кг, 0,05 мг/кг, 0,1 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 1,5 мг/кг, 2,0 мг/кг или 2,5 мг/кг dsRNA. iRNA можно вводить с помощью внутривенной инфузии в течение периода времени, такого как в течение периода в 5 минут, 10 минут, 15 минут, 20 минут или 25 минут. Введение повторяют, например, регулярно, например, каждые две недели (т.е. раз в две недели), через один месяц, два месяца, три месяца, четыре месяца или дольше. После первоначальной схемы лечения лечение можно осуществлять на основе более редкого введения. Например, после введения каждые две недели в течение трех месяцев, введение можно повторять один раз в месяц в течение шести месяцев или года, или дольше. Введение iRNA может снижать уровни TMPRSS6, например, в клетке, ткани, крови, моче или другой части организма больного, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90% или более.
Перед введением полной дозы iRNA больным можно вводить меньшую дозу, такую как 5% инфузионной реакции, и прослеживать побочные эффекты, такие как аллергическая реакция или ухудшение симптомов. В другом варианте у больного можно прослеживать нежелательные иммуномодуляторные эффекты, такие как повышенные уровни цитокинов (например, TNF-α или INF-α).
Многие нарушения, связанные с повышенными уровнями железа, являются наследуемыми. Следовательно, больной, нуждающийся в лечении iRNA TMPRSS6, может быть идентифицирован по семейному анамнезу. Работник здравоохранения, такой как врач, медицинская сестра или член семьи могут взять семейный анамнез перед назначением или введением dsRNA TMPRSS6. Больному может быть также проведен ДНК-тест для идентификации мутации гена TMPRSS6 перед введением больному dsRNA TMPRSS6. Например, диагноз наследуемого гемохроматоза может быть подтвержден с помощью идентификации двух мутаций гена HFE (гемохроматоза) C282Y и H63D, в соответствии с поступлением в GenBank № CAB07442.1 (GI: 1890180, дата записи 23 октября 2008 г.).
Благодаря ингибиторным эффектам на экспрессию TMPRSS6, композиция по изобретению или фармацевтическая композиция, полученная из нее, может повышать качество жизни.
Методы модуляции экспрессии гена TMPRSS6
В еще одном аспекте в изобретении предлагается метод модуляции (например, ингибирования или активации) экспрессии гена TMPRSS6 у млекопитающего.
В одном варианте осуществления метод включает введение композиции, охарактеризованной в изобретении, млекопитающему так, что экспрессия гена-мишени TMPRSS6 снижается, например, на продолжительное время, например, по меньшей мере, на два, три, четыре дня или более, например, на одну неделю, две недели, три недели или четыре недели или более. Влияние снижения экспрессии гена-мишени TMPRSS6 предпочтительно приводит к снижению всасывания и/или мобилизации железа в организме. Сниженное всасывание или мобилизация железа может проявляться наблюдаемым снижением уровней ферритина в сыворотке, уровней железа в сыворотке или в печени и/или уровней насыщения трансферрина сыворотки. В некоторых вариантах осуществления одно или более из уровней ферритина в сыворотке, уровней железа в сыворотке или в печени или уровней насыщения трансферрина сыворотки снижается, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50% или, по меньшей мере, на 60% или более по сравнению с уровнями до лечения. В некоторых вариантах осуществления уровни ферритина в сыворотке снижаются, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50% или, по меньшей мере, на 60% или более по сравнению с уровнями до лечения.
В другом варианте осуществления метод включает введение композиции, как описано в настоящем документе, млекопитающему так, что экспрессия гена-мишени TMPRSS6 повышается, например, по меньшей мере, на 10% по сравнению с животным до лечения. В некоторых вариантах осуществления активация TMPRSS6 возникает на продолжительное время, например, по меньшей мере, на два, три, четыре дня или более, например, на одну неделю, две недели, три недели, четыре недели или более. Не опираясь на теорию, iRNA может активировать экспрессию TMPRSS6 путем стабилизации транскрипта мРНК TMPRSS6, взаимодействия с промотором в геноме и/или ингибирования ингибитора экспрессии TMPRSS6.
iRNA, пригодные для способов и композиций, охарактеризованных в изобретении, специфично направлены на РНК (первичные или после процессинга) гена-мишени TMPRSS6. Композиции и способы ингибирования экспрессии этих генов TMPRSS6 с использованием iRNA могут быть получены и осуществлены, как описано в настоящем документе в другом месте.
В одном варианте осуществления способ включает введение композиции, содержащей iRNA, где iRNA включает нуклеотидную последовательность, которая комплементарна, по меньшей мере, части транскрипта РНК гена TMPRSS6 млекопитающего, подвергаемого лечению. Когда организм, который подвержен лечению, представляет собой организм млекопитающего, такого как человек, композицию можно вводить любым способом, известным в данной области техники, включая, но не ограничиваясь этим, пероральный, внутрибрюшинный или парентеральный пути, включая внутричерепное (например, внутрижелудочковое, внутрипаренхиматозное и внутриоболочечное), внутривенное, внутримышечное, подкожное, чрескожное, воздушным путем (аэрозольное), назальное, ректальное и местное (включая защечное и подъязычное) введение. В определенных вариантах осуществления композиции вводят с помощью внутривенной инфузии или инъекции.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, что и обычно понимаемое специалистом в той области техники, к которой принадлежит это изобретение. Хотя методы и материалы, сходные или эквивалентные описанным в настоящем документе, могут быть использованы на практике или при тестировании iRNA и в методах, охарактеризованных в изобретении, подходящие методы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем описании, включены в качестве ссылки в полном объеме. В случае конфликта настоящее описание, включая определения, должно служить для контроля. Кроме того, материалы, методы и примеры являются только иллюстративными и не предназначены быть лимитирующими.
Примеры
Пример 1. Синтез интерферирующей РНК (iRNA)
Источник реагентов
Когда источник реагента конкретно не дан в настоящем описании, такой реагент может быть получен от любого поставщика реагентов для молекулярной биологии с качеством/чистотой, стандартной для применения в молекулярной биологии.
Синтез олигонуклеотидов
Заявители использовали несколько различных методов для получения молекул iRNA, описанных в настоящем документе. В этом примере описывается один подход, который был использован. Специалист в данной области техники может использовать любой метод, известный в данной области техники для получения iRNA, как описано в настоящем документе.
Олигонуклеотиды синтезируют на синтезаторе AKTAoligopilot. Для синтеза олигонуклеотидов использовали имеющуюся в продаже стеклянную твердую подложку с контролируемым размером пор (dT-CPG, 500Å, Prime Synthesis) и фосфорамидиты РНК со стандартными защитными группами, 5'-O-диметокситретил-N6-бензоил-2'-трет-бутилдиметилсилил-аденозин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидитом, 5'-O-диметокситретил-N4-ацетил-2'-трет-бутилдиметилсилил-цитидин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидитом, 5'-O-диметокситретил-N2-изобутил-2'-трет-бутилдиметилсилил-гуанозин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидитом и 5'-O-диметокситретил-2'-трет-бутилдиметилсилил-уридин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидитом (Pierce Nucleic Acids Technologies). 2'-F-фосфорамидиты 5'-O-диметокситретил-N4-ацетил-2'-фторцитидин-3'-O-N,N'-диизопропил-2-цианоэтил-фосфорамидит и 5'-O-диметокситретил-2'-фторуридин-3'-O-N,N'-диизопропил-2-цианоэтил-фосфорамидит покупали у (Promega). Все фосфорамидиты использовали в концентрации 0,2 М в ацетонитриле (CH3CN) за исключением гуанозина, который использовали в концентрации 0,2 М в 10% THF/ANC (об./об.). Использовали время присоединения/рециклизации 16 минут. Активатор представлял собой 5-этилтиотетразол (0,75 М, American
International Chemicals); для PO-окисления использовали йод/воду/пиридин и для PS-окисления PADS (2%) в 2,6-лутидине/ACN (1:1 об./об.).
3'-лиганд-конъюгированные цепи синтезируют с использованием твердой подложки, содержащей соответствующий лиганд. Например, введение единицы холестерина в последовательность осуществляют из фосфорамидита гидроксипролинол-холестерина. Холестерин привязывают к транс-4-гидроксипролинолу через 6-аминогексаноатную связь с получением гидроксипролинол-холестериновой части. iRNA, меченные на 5'-конце Cy-3 и Cy-5.5 (флуорофором), синтезируют из соответствующего Quasar-570 (Cy-3) фосфорамидита, приобретаемого у Biosearch Technologies. Конъюгация лигандов с 5'-концом и/или во внутреннем положении достигается путем использования защищенного соответствующим образом строительного блока лиганд-фосфорамидит. В течение 15 минут происходит присоединение 0,1 М раствора фосфорамидита в безводном CH3CN в присутствии 5-(этилтио)-1H-тетразольного активатора к олигонуклеотиду, связанному с твердой подложкой. Окисление межнуклеотидного фосфита до фосфата осуществляется с использованием йодной воды, как сообщалось (1) или путем обработки трет-бутилгидропероксидом/ацетонитрилом/водой (10:87:3) с 10-минутным временем ожидания окисления конъюгированного олигонуклеотида. Фосфоротиоат вводят путем окисления фосфита до фосфоротиоата с помощью использования реагента переноса серы, такого как DDTT (приобретаемый у AM Chemicals), PADS и/или реагент Beaucage. Холестерин-фосфорамидит синтезируют в лаборатории и используют в концентрации 0,1 М в дихлорметане. Время присоединения для холестерин-фосфорамидита составляет 16 минут.
Снятие защиты I (снятие защиты нуклеотидных оснований)
После окончания синтеза подложку переносят в 100-миллилитровую стеклянную колбу (VWR). Олигонуклеотид отщепляют от подложки с одновременным снятием защиты основания и фосфатных групп с помощью 80 мл смеси этанольного аммиака [аммиак:этанол (3:1)] в течение 6,5 час при 55°С. Колбу быстро охлаждают на льду и затем смесь этанол-аммиак фильтруют в новую 250-миллилитровую колбу. CPG отмывают 2×40 мл порциями этанол/вода (1:1 об./об.). Объем смеси затем снижают до ~30 мл с помощью роторного испарителя. Смесь затем охлаждают на сухом льду и высушивают под вакуумом на скоростном вакуумном испарителе.
Снятие защиты II (удаление группы 2'-TBDMS)
Высушенный осадок ресуспендируют в 26 мл триэтиламина, триэтиламинтригидрофторида (TEA·3HF) или пиридина-HF и ДМСО (3:4:6) и нагревают при 60°С в течение 90 минут для удаления групп трет-бутилдиметилсилила (TBDMS) в положении 2'. Реакцию затем гасят 50 мл 20 мМ цетата натрия и рН доводят до 6,5. Олигонуклеотид хранят в морозильнике до очистки.
Анализ
Олигонуклеотиды анализируют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) до очистки, и выбор буфера и колонки зависит от природы последовательности и/или от конъюгированного лиганда.
Очистка ВЭЖХ
Олигонуклеотиды, конъюгированные с лигандом, очищают с помощью препаративной ВЭЖХ с обращенной фазой. Неконъюгированные олигонуклеотиды очищают с помощью анионообменной ВЭЖХ на колонке TSK геля, забитой в лаборатории. Буферы представляют собой 20 мМ фосфат натрия (pH 8,5) в 10% CH3CN (буфер A) и 20 мМ фосфат натрия (pH 8,5) в 10% CH3CN и 1 М NaBr (буфер B). Фракции, содержащие полноразмерные олигонуклеотиды, объединяют, обессоливают и лиофилизуют. Приблизительно 0,15 ОП обессоленных олигонуклеотидов разводят в воде до 150 мкл и затем пипетируют в специальные сосуды для CGE и ЖХ/МС анализа. Соединения затем анализируют с помощью LC-ESMS и CGE.
Получение iRNA
Для обычного получения iRNA эквимолярные количества смысловой и антисмысловой цепи нагревают в 1×PBS при 95°С в течение 5 мин и медленно охлаждают до комнатной температуры. Сохранность дуплекса подтверждают с помощью анализа ВЭЖХ.
Последовательности нуклеиновой кислоты представлены ниже с использованием стандартной номенклатуры и конкретных аббревиатур таблицы 1.
|
|
Пример 2. Конструкция siRNA TMPRSS6
Транскрипты
siRNA, направленные на TMPRSS6, были сконструированы и синтезированы. В конструкте использовали транскрипт NM_153609.2 (SEQ ID NO: 1, фиг. 1) из коллекции NCBI Refseq.
Дуплексы siRNA конструировали со 100% идентичностью гену TMPRSS6.
Суммарно было сконструировано 655 смысловых и 655 антисмысловых олигонуклеотидов siRNA гена TMPRSS6 человека. Олигонуклеотиды представлены в таблице 2. Дополнительные смысловые и антисмысловые олигонуклеотиды siRNA TMPRSS6 человека представлены в таблице 3. Смысловые и антисмысловые олигонуклеотиды siRNA TMPRSS6 человека с модификациями представлены в таблице 4.
Таблица 2
Последовательности смысловой и антисмысловой
цепей dsRNA TMPRSS6 человека





Таблица 3
Немодифицированные последовательности смысловой и антисмысловой цепей dsRNA TMPRSS6 человека


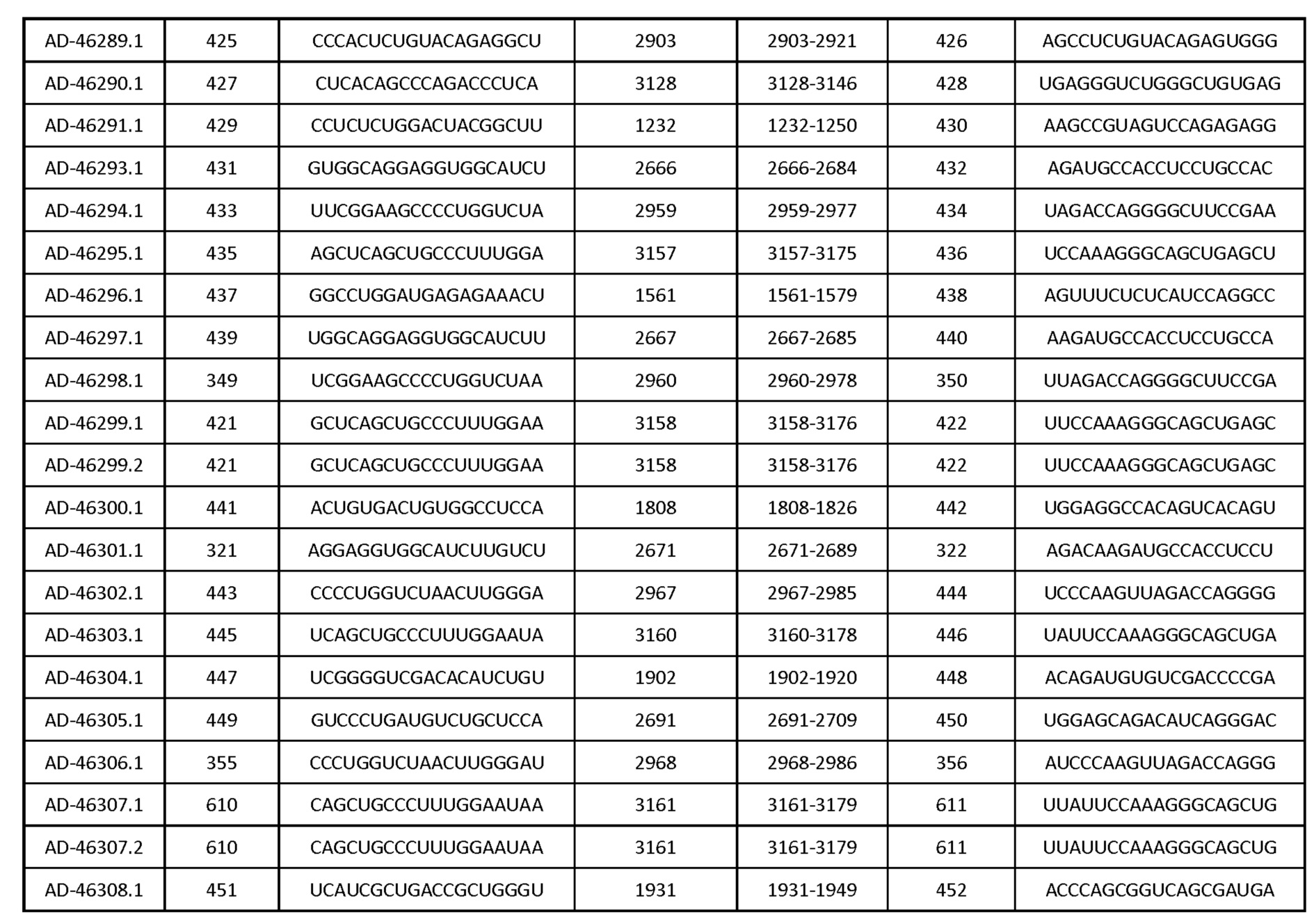
Таблица 4
Модифицированные последовательности смысловой и антисмысловой цепей dsRNA TMPRSS6 человека



Синтез последовательностей TMPRSS6
Последовательности iRNA TMPRSS6 могут быть синтезированы на синтезаторе MerMade 192 в масштабе 1 мкмоль.
Может быть использована эндолайтная химия, как подробно описано ниже.
Все пиримидины (цитозин и уридин) в смысловой цепи содержали 2'-O-метилированные основания (2'-O-метил C и 2'-O-метил U).
В смысловой цепи пиримидины, примыкающие к рибонуклеозиду A (в сторону 5'-положения), могут быть замещены их соответствующими 2-O-метилированными нуклеозидами.
Может быть введено расширение двух оснований dTsdT на 3'-конце как смысловой, так и антисмысловой последовательности.
Файл последовательности может быть превращен в текстовой файл, чтобы сделать его совместимым для загрузки в компьютерную программу синтеза MerMade 192.
Синтез, расщепление и снятие защиты
Для синтеза последовательностей TMPRSS6 используют олигонуклеотидный синтез на твердой подложке с применением фосфороамидитной химии.
Синтез указанных выше последовательностей может быть осуществлен в масштабе 1 мкм в 96-луночных планшетах. Растворы амидита могут быть получены в концентрации 0,1 М и этилтиотетразол (0,6 М в ацетонитриле) может быть использован в качестве активатора.
Синтезированные последовательности могут быть расщеплены и обработаны для снятия защиты в 96-луночных планшетах с использованием метиламина на первой стадии и фторидного реагента на второй стадии. Неочищенные последовательности можно преципитировать с использованием смеси ацетон:этанол (80:20), и осадки ресуспендировать в 0,02 М натрий-ацетатном буфере. Образцы от каждой последовательности могут быть проанализированы с помощью ЖХ-МС для подтверждения идентичности и в УФ для количественной оценки. Выбранный набор образцов можно также проанализировать с помощью IEX хроматографии для определения чистоты.
Очистка и обессоливание
Все последовательности могут быть очищены в анализаторной системе очистки AKTA с использованием колонки 15Q Source. Введение и сбор образцов можно осуществлять в 96-луночных (лунка объемом 1,8 мл) планшетах. В элюенте может быть собран единичный пик, соответствующий полноразмерной последовательности. Очищенные последовательности могут быть обессолены на колонке сефадекса G25 при использовании системы очистки AKTA. Обессоленные последовательности TMPRSS6 могут быть проанализированы на концентрацию (по измерению в УФ при A260) и чистоту (с помощью ионообменной ВЭЖХ). Одиночные цепи затем могут быть посланы для отжига.
Пример 3. Скрининг дуплексов siRNA TMPRSS6 на активность в отношении нокдауна TMPRSS6 in vitro
Проводили скрининг дуплексов siRNA TMPRSS6 на их способность вызывать нокдаун экспрессии TMPRSS6 in vitro. Оценивали с помощью скрининга действия единственной дозы, скрининга ответа на дозу и на выживаемость клеток-хозяев.
Скрининг in vitro:
Клеточная культура и трансфекции для исследований действия единственной дозы и ответа на дозу
Перед отделением от планшета с помощью трипсинизации клетки HeLa или Hep3B (ATCC, Manassas, VA) выращивали примерно до конфлюэнтности при 37°С в атмосфере 5% CO2 в X (ATCC), дополненной 10% FBS, стрептомицином и глутамином (ATCC). Трансфекцию осуществляли путем добавления 14,8 мкл Opti-MEM плюс 0,2 мкл липофектамина RNAiMax на лунку (Invitrogen, Carlsbad CA. cat # 13778-150) к 5 мкл дуплексов siRNA на лунку в 96-луночном планшете и инкубации при комнатной температуре в течение 15 минут. 80 мкл полных ростовых сред без антибиотика, содержащих ~2×104 клеток HeLa или Hep3B, затем добавляли к смеси siRNA. Клетки инкубировали в течение либо 24, либо 120 часов перед очисткой РНК. Эксперименты с единственной дозой осуществляли при конечной концентрации дуплексов 10 нМ и 0,1 нМ, а эксперименты с ответом на дозу выполняли при конечной концентрации дуплексов 10, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005, 0,00001 нМ.
Выделение суммарной РНК с использованием набора для выделения мРНК DYNABEADS® (Invitrogen, part #: 610-12):
Клетки собирали и лизировали в 150 мкл лизирующего/связывающего буфера, затем перемешивали в течение 5 минут при 850 об/мин с использованием Eppendorf® Thermomixer (скорость смешивания была одинаковой в течение всего периода). Десять микролитров магнитных шариков и 80 мкл смеси в лизирующем/связывающем буфере добавляли к планшету с круглодонными лунками и перемешивали 1 минуту. Магнитные шарики удерживали путем использования магнитного штатива, и супернатант удаляли, не тревожа шарики. После удаления супернатанта лизированные клетки добавляли к остающимся шарикам и смешивали в течение 5 минут. После удаления супернатанта магнитные шарики промывали два раза 150 мкл буфера А для промывки и перемешивали в течение одной минуты. Шарики опять удерживали и супернатант удаляли. Шарики затем промывали 150 мкл буфера B для промывки, удерживали и супернатант удаляли. После этого шарики промывали 150 мкл элюирующего буфера, удерживали и супернатант удаляли. Шарикам затем давали высохнуть в течение двух минут. После высушивания добавляли 50 мкл элюирующего буфера и смешивали в течение пяти минут при 70°С. Шарики удерживали на магните в течение пяти минут. 40 мкл супернатанта удаляли и добавляли к другому 96-луночному планшету.
Синтез кДНК с использованием набора ABI для получения кДНК высокой емкости обратной транскрипцией (Applied Biosystems, Foster City, CA, Cat #4368813):
Мастер-микс 2 мкл 10Х буфера, 0,8 мкл 25Х dNTP, 2 мкл случайных праймеров, 1 мкл обратной транскриптазы, 1 мкл ингибитора РНКазы и 3,2 мкл H2O на реакцию добавляли в 10 мкл суммарной РНК. кДНК получали с использованием термоциклера (Hercules, CA) Bio-Rad C-1000 или S-1000 с прохождением следующих стадий: 25°С 10 мин, 37°С 120 мин, 85°С 5 сек, 4°С поддерживание.
ПЦР в реальном времени
2 мкл кДНК добавляли к мастер-микс, содержащему 0,5 мкл зонда GAPDH TaqMan (Applied Biosystems Cat #4326317E), 0,5 мкл зонда TMPRSS6 TaqMan (Applied Biosystems cat # Hs00542184_m1) и 5 мкл зонда мастер-микс Lightcycler 480 (Roche Cat #04887301001) на лунку в 50 384-луночных планшетов (Roche cat # 04887301001). ПЦР в реальном времени осуществляли в системе для ПЦР в реальном времени ABI 7900HT (Applied Biosystems) с использованием теста ∆∆Ct(RQ). Каждый дуплекс тестировали в двух независимых трансфекциях и каждую трансфекцию тестировали в двух параллельных опытах, если в суммарных таблицах не указано иначе.
Для расчета относительной кратности изменения данные ПЦР в реальном времени анализировали с использованием метода ∆∆Ct и нормализовали на клетки, трансфицированные 10 нМ AD-1955, или на клетки при имитации трансфекции. IC50s рассчитывали с использованием модели подгонки по 4 параметрам с применением XLFit и нормализовали на клетки, трансфицированные AD-1955 в том же диапазоне доз, или на их собственную самую низкую дозу.
Скрининг выживаемости. Перед отделением от планшета с помощью трипсинизации клетки HeLa или Hep3B (ATCC, Manassas, VA) выращивали примерно до конфлюэнтности при 37°С в атмосфере 5% CO2 в X (ATCC), дополненной 10% FBS, стрептомицином и глутамином (ATCC). Выживаемость клеток измеряли на 3 и 5 день в клетках HeLa или Hep3B после трансфекции 100, 10, 1, 0,1, 0,01 и 0,0001 нМ siRNA. Клетки высаживали с плотностью 2,5×103-5×103 клеток на лунку в 96-луночные планшеты. Каждую siRNA оценивали в трех параллельных опытах и данные усредняли. siRNA, направленные на PLK1 и AD-19200, включали в качестве положительных контролей на потерю жизнеспособности и AD-1955 включали как отрицательный контроль. Использование PLK1 и AD19200 приводит к зависимой от дозы потере жизнеспособности. Для измерения жизнеспособности 20 мкл CellTiter Blue (Promega) добавляли к каждой лунке 96-луночных планшетов после 3 и 5 дней и инкубировали при 37°С в течение 2 часов. Планшеты затем считывали на спектрофотометре (Molecular Devices) при 560возб./590испуск. Выживаемость выражали как среднюю величину единиц света при трех повторных трансфекциях ± стандартное отклонение.
Нокдаун in vitro экспрессии TMPRSS6 дуплексами siRNA TMPRSS6
В таблице 5 представлены данные, показывающие нокдаун TMPRSS6 в клетках Hep3B, трансфицированных siRNA, направленными на TMPRSS6. Данные выражены как фракция мессенджера TMPRSS6, оставшаяся в клетках, трансфицированных siRNA, направленными на TMPRSS6, относительно клеток, трансфицированных отрицательным контролем siRNA, AD-1955. Клетки, которые не обрабатывали («наивные» клетки), служили в качестве второго отрицательного контроля. Все siRNA тестировали, по меньшей мере, два раза, и реакции qPCR также осуществляли в двух параллелях. Эксперименты с единственной дозой осуществляли при конечной концентрации дуплекса siRNA 10 нМ и 0,1 нМ.
Таблица 5
Экспрессия TMPRSS6 при скрининге с единственной
дозой in vitro



IC50 выбранных дуплексов siRNA TMPRSS6 в in vitro скрининге зависимости эффекта от дозы
В таблице 6 представлены величины IC50 выбранных дуплексов siRNA TMPRSS6, определенные с помощью in vitro скрининга зависимости эффекта от дозы. Дуплексы siRNA TMPRSS6, которые были эффективными в скрининге с единственной дозой 10 нМ и 0,1 нМ (таблица 5), тестировали на активность в отношении нокдауна TMPRSS6 в тесте зависимости эффекта от дозы на 1 и 5 дни после трансфекции клеток Hep3B. Эксперименты по зависимости эффекта от дозы проводили при конечной концентрации дуплекса siRNA 10, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005, 0,00001 нМ. Для нормализации нокдаун TMPRSS6 измеряли относительно контроля, не являющегося мишенью, AD-1955, или величины, полученной при самой низкой концентрации siRNA для каждого тестируемого дуплекса.
Таблица 6
IC50 выбранных дуплексов siRNA TMPRSS6 в in vitro
скрининге зависимости эффекта от дозы

Скрининг выживаемости in vitro клеточных линий HeLa и HEP3B, трансфицированных дуплексами siRNA TMPRSS6
В таблице 7 представлены данные по выживаемости клеточных линий HeLa и HEP3B, трансфицированных дуплексами siRNA TMPRSS6. Данные по выживаемости выражены как среднее нескорректированных единиц, где более низкие величины представляют собой более низкую выживаемость. Ошибка выражена как стандартное отклонение из трех параллельных трансфекций.
|
|
|
|
|
Пример 4. Отбор главного дуплекса siRNA TMPRSS6
С целью отбора конкретных siRNA TMPRSS6 для использования в дальнейших экспериментах in vivo проводили скрининг химически модифицированных siRNA на сайленсинг активности гена TMPRSS6 путем трансфекции клеток гепатомы человека HEP3B. Для оценки in vivo выбрали две крайне эффективные siRNA с минимальным предсказанным потенциалом действия вне мишени и с реактивностью у многих видов, включая яванскую макаку, крысу и мышь. Эффективность двух выбранных siRNA TMPRSS6 была также подтверждена в первичной культуре гепатоцитов мыши, где siRNA-1 (AD-46273) TMPRSS6 и siRNA-2 (AD-46286) TMPRSS6 проявляли сильную активность в отношении сайленсинга гена TMPRSS6, причем siRNA-1 (AD-46273) TMPRSS6 продемонстрировала IC50, равную 70 пМ (фиг. 2A) и siRNA-2 (AD-46286) TMPRSS6 продемонстрировала IC50, равную 140 пМ (фиг. 2B).
Пример 5. Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 у мышей WT C57BL/6
Влияние siRNA TMPRSS6 на TMPRSS6 и экспрессию мРНК HAMP1 у мышей WT C57BL/6
Для того чтобы оценить эффект siRNA-1 (AD-46273) LNP-TMPRSS6 и siRNA-2 (AD-46286) LNP-TMPRSS6 in vivo, самкам мышей WT C57BL/6 восьминедельного возраста через хвостовую вену делали IV инъекцию 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или siRNA-2 (AD-46286) LNP-TMPRSS6, или LNP-AD-19551 (siRNA, направленной на ген люциферазу, не относящийся к млекопитающим). siRNA TMPRSS6 составляли с LNP11 (MC3). Мышей забивали через 24 часа после введения, и печени удаляли, быстро замораживали и растирали в порошок. Небольшое количество (~20 мг) порошка печени разрушали в лизирующем буфере и использовали для анализа мРНК с помощью TaqMan®. Суммарно использовали по пять мышей на группу. Данные выражали как отношение в процентах LNP-Luc контроля и мРНК-мишени TMPRSS6 к мРНК B-актина. Как показано на фиг. 3A, наблюдалось специфическое и зависимое от дозы ингибирование экспрессии печеночной мРНК TMPRSS6 под действием siRNA-1 (AD-46273) LNP-TMPRSS6 и siRNA-2 (AD-46286) LNP-TMPRSS6 (данные представлены как среднее ± стандартное отклонение) с ED50 0,035 мг/кг и ED50 0,18 мг/кг, соответственно. Как показано на фиг. 3B, наблюдалось также зависимое от дозы ингибирование экспрессии мРНК HAMP1 печени под действием siRNA-1 (AD-46273) LNP-TMPRSS6 и siRNA-2 (AD-46286) LNP-TMPRSS6.
Продолжительность опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 и экспрессии гена HAMP1 у мышей WT C57BL/6
Для того чтобы оценить продолжительность опосредуемого siRNA TMPRSS6 нокдауна TMPRSS6 и экспрессию гена HAMP1, мышам WT C57BL/6 восьминедельного возраста через хвостовую вену делали однократную IV инъекцию дозы 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc (LNP-AD-1955) или PBS; все агенты siRNA доставлялись в виде составов с LNP11. Мышей забивали через 6 часов, 24 часа, 48 часов, 3 дня, 7 дней и 14 дней. Уровень экспрессии мРНК TMPRSS6 и HAMP1 в печени анализировали с использованием метода TaqMan® и нормализовали на B-актин. Использовали по пять мышей на группу и данные на фиг. 4 представляли как среднее ± стандартное отклонение. Как показано на фиг. 4, однократная доза 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 вызывала нокдаун экспрессии мРНК TMPRSS6 уже через шесть часов после введения и снижала экспрессию мРНК TMPRSS6 приблизительно на 90% от контроля LNP-Luc или контроля PBS с продолжительностью в течение двухнедельного периода времени. Экспрессия гена HAMP1 повышалась, начиная с 24 часов после введения, и поддерживалась в течение двухнедельного периода времени с максимальным увеличением 200% от контроля на 14 день после введения (фиг. 4). Кроме того, определяли уровни железа в сыворотке как процент насыщения трансферрина (Tf) с использованием Olympus AU 400. Уровень насыщения трансферрина рассчитывали как отношение железа сыворотки к суммарной железосвязывающей способности (TIBC) и выражали как процент насыщения трансферрина. Процент насыщения трансферрина снижался приблизительно на 50%, начиная с 24 часов после введения, и поддерживался в течение двухнедельного периода времени, указывая на то, что циркулирующие в сыворотке уровни железа снижены (фиг. 4). Уровень сайленсинга TMPRSS6, опосредуемый siRNA TMPRSS6, необходимый для поддержания эффектов, опосредуемых siRNA TMPRSS6, влияет на экспрессию гена HAMP1 и уровни железа в сыворотке мышей WT C57BL/6.
Для того чтобы оценить уровень опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6, необходимого для поддержания опосредуемых siRNA TMPRSS6 эффектов на экспрессию гена HAMP1 и уровни железа в сыворотке мышей WT C57BL/6, мышам WT C57BL/6 вводили 0,3 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc, или PBS; все агенты siRNA доставлялись в виде составов с LNP11. Мышей забивали через 5 часов, 24 часа, 48 часов, 3 дня, 7 дней, 14 дней, 21 день и 28 дней после введения. Уровень экспрессии мРНК TMPRSS6 и HAMP1 анализировали с использованием метода TaqMan® и нормализовали на B-актин. Использовали по пять мышей на группу, и данные представляли на фиг. 5 как среднее ± стандартное отклонение. Как показано на фиг. 5, максимальное снижение экспрессии гена TMPRSS6 на 90% достигалось через 24 часа после введения и поддерживалось до третьего дня после введения. На седьмой день после введения экспрессия гена TMPRSS6 была снижена приблизительно на 85%; экспрессия гена HAMP1 была индуцирована приблизительно на 250% от контроля; и насыщение трансферрина (%) было снижено приблизительно на 50% (фиг. 5). На 21 день после введения экспрессия гена TMPRSS6 была снижена приблизительно на 40%; экспрессия гена HAMP1 нормализовалась; и уровни железа в сыворотке, измеренные по насыщению трансферрина (%), начали возвращаться к нормальными величинам (фиг. 5). В заключение, максимальный нокдаун экспрессии мРНК TMPRSS6 достигался через 24 часа после введения и возвращался приблизительно к 50% от нормальных уровней экспрессии через 3 недели после введения; уровни мРНК гепцидина повышались уже через 24 часа и поддерживались до семи дней после введения; уровни гепцидина возвращались к контрольным уровням на четырнадцатый день после введения; и насыщение трансферрина как показатель циркулирующих уровней железа снижался на 50% от контрольных уровней уже через 24 часа после введения и нормализовался к четвертой неделе. Таким образом, данные, представленные на фиг. 5, показывают, что более чем 50% сайленсинг TMPRSS6 требуется для поддержания опосредуемых siRNA-1 (AD-46273) LNP-TMPRSS6 эффектов на экспрессию гена HAMP1 и уровни железа в сыворотке.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические параметры у мышей WT C57BL/6
Для того чтобы оценить влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические параметры, включая гемоглобин (HGB) и гематокрит; мышам WT C57BL/6 вводили однократную дозу 1 мг/кг siRNA-1 (AD-46273) TMPRSS6 или контроля LNP-Luc или PBS; и затем забивали в различные временные точки до двух недель после введения. Гематологические параметры, включая гемоглобин (HGB), гематокрит, средний объем эритроцитов (MCV), средний гемоглобин эритроцитов (MCH), среднюю концентрацию гемоглобина эритроцитов (MCHC) и содержание гемоглобина в ретикулоцитах (Chr) определяли с использованием анализатора Advia 120. Как показано на фиг. 6A и 6B, сайленсинг TMPRSS6 у мышей Th3/+ приводил к снижению HGB (фиг. 6A) и снижению гематокрита (фиг. 6B) у мышей WT C57BL/6. Наблюдался сходный эффект на средний объем эритроцитов (MCV), средний гемоглобин эритроцитов (MCH), среднюю концентрацию гемоглобина эритроцитов (MCHC) и содержание гемоглобина в ретикулоцитах (Chr).
Пример 6. Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 у мышей с талассемией (Th3/+)
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на показатели уровней железа в сыворотке у мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на показатели, касающиеся железа сыворотки, включая уровни железа, ненасыщенную железосвязывающую способность (UIBC) и насыщение Tf, у мышей с талассемией (Th3/+), шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc или PBS, и мышей забивали через две недели после введения. Использовали по пять мышей на группу, и данные представляли на фиг. 7 как среднее ± стандартное отклонение, причем ** обозначали величину P<0,01 и *** обозначали величину P<0,001. Как показано на фиг. 7, сайленсинг TMPRSS6 у мышей Th3/+ приводил к существенному снижению железа сыворотки, UIBC, и насыщения Tf по сравнению с контрольной группой PBS.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на показатели ретикулоцитов и эритроцитов у мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на показатели ретикулоцитов и эритроцитов, включая количество ретикулоцитов, содержание гемоглобина в ретикулоцитах (CHr) и количество эритроцитов (RBC), у мышей с талассемией (Th3/+) шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc, или PBS, и мышей забивали через две недели после введения. Показатели ретикулоцитов и эритроцитов, включая количество ретикулоцитов, содержание гемоглобина в ретикулоцитах (CHr) и количество эритроцитов (RBC), оценивали с использованием анализатора Advia 120. Использовали по пять мышей на группу, и данные представляли на фиг. 8A-8C как среднее ± стандартное отклонение, причем ** обозначали величину P<0,01 и *** обозначали величину P<0,001. Как показано на фиг. 8A и 8B, соответственно, сайленсинг TMPRSS6 у мышей Th3/+ приводил к существенному снижению количества ретикулоцитов, а также содержания гемоглобина в ретикулоцитах (Chr). Кроме того, сайленсинг TMPRSS6 у мышей Th3/+ приводил к существенному росту количества зрелых эритроцитов (RBC) (фиг. 8C), демонстрируя существенное исправление неэффективного эритропоэза, экстрамедуллярного гемопоэза и продукции эритроцитов.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические показатели у мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на гематологические показатели, включая гематокрит (HCT), гемоглобин (HGB), ширину распределения эритроцитов (RDW) и среднюю величину эритроцитов (MCV), у мышей с талассемией (Th3/+) шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc или PBS, и мышей забивали через две недели после введения. Гематологические показатели, включая гематокрит (HCT), гемоглобин (HGB), ширину распределения эритроцитов (RDW) и среднюю величину эритроцитов (MCV); оценивали с использованием анализатора Advia 120. Использовали по пять мышей на группу, и данные представляли на фиг. 9 как среднее ± стандартное отклонение, причем ** обозначали величину P<0,01 и *** обозначали величину P<0,001. Сайленсинг TMPRSS6 у мышей Th3/+ приводил к существенному увеличению HCT (фиг. 9A), существенному росту HGB (фиг. 9B), существенному снижению RDW (фиг. 9C) и существенному снижению MCV (фиг. 9D). Данные, представленные на фиг. 9, иллюстрируют нормализацию фенотипа β-талассемии по этим гематологическим параметрам после введения siRNA-1 (AD-46273) LNP-TMPRSS6.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на морфологию периферической крови у мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на морфологию периферической крови у мышей с талассемией (Th3/+) шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc, и мышей забивали через две недели после введения. Окрашивание по Май-Грюнвальду-Гимзе при увеличении 10Х показало заметное снижение полихромазии у мышей Th3/+, получавших siRNA TMPRSS6, по сравнению с контролем, характерное снижение количества ретикулоцитов, а также общую тенденцию к нормализации морфологии зрелых эритроцитов. Окрашивание по Май-Грюнвальду-Гимзе при увеличении 10Х показало также, что у животного WT siRNA TMPRSS6 индуцировала легкий анизоцитоз по сравнению с контрольным животным WT.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на архитектонику селезенки у мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на архитектонику селезенки у мышей с талассемией (Th3/+) шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc, или PBS, и мышей забивали через две недели после введения. Окрашивание гематоксилином и эозином (H&E) при увеличении 10Х показало, что мыши Th3/+, получавшие siRNA TMPRSS6, по сравнению с контролем характеризовались нормализацией архитектоники селезенки, включая снижение синусоидального экстрамедуллярного эритропоэза и повторное появление узлов белой пульпы селезенки.
Влияние опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на содержание железа в селезенке и печени мышей с талассемией (Th3/+)
Для оценки влияния опосредуемого siRNA TMPRSS6 сайленсинга TMPRSS6 на содержание железа в селезенке и печени мышей с талассемией (Th3/+) шестинедельным мышам Th3/+ вводили через хвостовую вену 1 мг/кг siRNA-1 (AD-46273) LNP-TMPRSS6 или контроля LNP-Luc или PBS, и мышей забивали через две недели после введения. Использовали по пять мышей на группу, и данные представляли на фиг. 10A-10C как среднее ± стандартное отклонение, причем ** обозначали величину P<0,01 и *** обозначали величину P<0,001. Сайленсинг TMPRSS6 у мышей Th3/+ приводил к существенному снижению содержания железа в селезенке и массы селезенки (фиг 10A и фиг. 10B, соответственно), указывая на нормализацию экстрамедулярного гемопоэза. Наблюдалась также тенденция к снижению содержания железа в печени, но она была статистически не достоверной (фиг. 10C).
Представленные выше результаты показывают, что сайленсинг TMPRSS6 в результате системного введения состава siRNA повышает экспрессию HAMP до уровней, достаточных для улучшения фенотипа в мышиной модели промежуточной β-талассемии. Следовательно, разработаны siRNA LNP-TMPRSS6 для наследственных нарушений с перегрузкой железом, характеризуемых аномально низкими уровнями гепцидина (например, для промежуточной β-талассемии и наследственного гемохроматоза).
Эквиваленты
Специалисты в данной области техники должны знать или могут выяснить с использованием не более чем обычных экспериментов многие эквиваленты конкретных вариантов осуществления изобретения, описанного в настоящем документе. Такие эквиваленты предназначаются для охвата последующей формулой изобретения.