Результат интеллектуальной деятельности: Способ прогнозирования эффективности лечения больных острыми миелобластными лейкозами противоопухолевыми препаратами даунорубицином и цитозин-арабинозидом
Вид РИД
Изобретение
Изобретение относится к онкогематологии.
Из уровня техники известен ряд способов прогнозирования эффективности лечения онкологических больных, в частности следующий.
Способ прогнозирования чувствительности к химиотерапии у больных с лимфопролиферативными заболеваниями по патенту РФ №2593020 состоит в том, что в сыворотке крови пациента до начала лечения определяют содержание тимидинкиназы-1 (TK-1) и β2-микроглобулина (β2-МГ), а после первого курса химиотерапии (XT) - активность TK-1. Если активность ТК-1 до начала лечения <150,0 ДЕд/л или уровень β2-МГ до начала лечения <2200,0 мкг/л, то в результате 6-8 курсов XT достигается полная или частичная ремиссия. Если активность ТК-1 после 1 курса XT возрастает более, чем в 4 раза относительно исходного уровня, то в результате 6-8 курсов XT достигается полная или частичная ремиссия.
В данном способе чувствительность к химиотерапии прогнозируется на основании 2-х параметров (TK-1 и β2-МГ), которые косвенно отражают стадию заболевания, агрессивность его течения, т.е. в определенной мере отражают состояние организма. Данный способ прогнозирования чувствительности больного к химиотерапии не учитывает саму предстоящую терапию, не позволяет оценить чувствительность опухолевых клеток к конкретному цитостатическому препарату и выбрать наиболее рациональные схемы лечения.
Чувствительность опухолевых клеток к цитостатическим препаратам может определяться различными способами.
Дифференцированное окрашивание клеток на цитотоксичность (differential staining cytotoxicity assay - DiSC) с целью определения их лекарственной восприимчивости основано на неодинаковой инкорпорации гематоксилин-эозина в нормальные и трансформированные живые клетки, а также нигрозина (fastgreen-Nigrosin) в погибшие. Лекарственная восприимчивость оценивается по соотношению количества живых клеток в лунках планшета с клетками, обработанными цитостатическими препаратами, и количества живых клеток в необработанных контрольных лунках, которое должно составлять не менее 80% жизнеспособных клеток (Иншаков А.Н. Фармакодинамическое моделирование чувствительности опухолевых клеток хронического лимфолейкоза и множественной миеломы к химиопрепаратам in vitro: автореф. дис. канд. мед. наук: 14.01.12 // Рос. онкол. науч. центр им. Н.Н. Блохина РАМН. - М., 2012; 26 с; Bosanquet AG. Correlations between therapeutic response of leukaemias and in-vitro drug-sensitivity assay. Lancet: 1991; 337 (8743): 711-14).
В данном методе анализируется морфология клетки с помощью оптической микроскопии. Основными ограничениями DiSC-анализа являются его трудоемкость и субъективность, обусловленная квалификацией персонала, производящего окраску мазков и подсчет клеток под микроскопом.
В статье «Разработка принципов создания диагностического набора для определения лекарственной чувствительности лейкозных клеток» А.И. Свирновского, Т.Ф. Сергиенко, В.В. Пасюкова и др. («Проблемы здоровья и экологии», 2011, №3) для доклинической диагностики лекарственной чувствительности опухолевых клеток кроветворной ткани использован МТТ тест. Химиопрепараты использовали в концентрации, близкой к терапевтической в крови или готовили ряд разведений препаратов для определения концентрации, при которой погибает 50% опухолевых клеток (IC50). Чувствительность опухолевых клеток к цитостатическим препаратам определяли с помощью МТТ-теста, для чего 96-луночный планшет с анализируемыми концентрациями цитостатического препарата и клетками в питательной среде инкубировали в течение 44 часов, затем в каждую лунку планшета добавляли по 20 мкл раствора МТТ. Через 4 часа инкубации с МТТ во все лунки добавляли равный объем солюбилизирующей смеси с додецилсульфатом натрия. Закрытый планшет переносили в холодильник на 20-25 мин до осаждения пены в тестируемых лунках, затем на спектрофотометре на длине волны 540 нм определяли оптическую плотность в лунках и процент жизнеспособных клеток.
Для МТТ-анализа пригодны, в основном, адгезионные культуры [Ross D.D., Thompson B.W., Ordez J.V., Joneckis С.С. Improvement of flow-cytometric detection of multidrug-resistant cells by cell-volume normalization of intracellular daunorubicin content. Cytometry: 1989; 10(2): 185-91].
Обычно при выполнении МТТ-теста перед добавлением в лунки планшета раствора ДМСО или SDS для растворения кристаллов формазана, из лунок планшета отбирают среду, что усложняет и удлиняет методику, а в случае суспензионных культур приводит к потере части клеток, что может искажать результаты теста.
Кроме того, DMSO и SDS являются токсичными не только для человека, выполняющего тест, но и для самих клеток, могут вызвать гибель части клеток в контрольных лунках (в отсутствие цитостатических препаратов) и в опытных, что также может искажать результаты теста (Цитотоксичность додецилсульфата натрия в отношении кератиноцитов линии НаСаТ: сравнительный анализ различных методов оценки жизнеспособности клеток/ Русанов А.Л., Лузгина Н.Г., Лисица А.В.// Бюллетень экспериментальной биологии и медицины, 2017. - N 2.-С. 256-260).
Известна статья «Прогностическое значение определения чувствительности бластных клеток детей с острым лимфобластным лейкозом к химиопрепаратам in vitro /Кузнецова С.С, Иншаков А.Н., Маякова С.А., Шишкин Ю.В., Барышников А.Ю // Российский биотерапевтический журнал, 2004 (https://cyberleninka.ru/article/n/prognosticheskoe-znachenit-opredeleniea-chuvstvitelnosti-blastnyh-kletok-detey-s-ostrym-limfoblastnym-leykozom-k-himiopreparatam-in).
У 35 детей с острым лимфобластным лейкозом (ОЛЛ) в возрасте от 1 года до 17 лет определялась чувствительность бластных клеток к 7 химиопрепаратам (преднизолону, винкристину, рубомицину, доксорубицину, цитарабину, пуринетолу и вепезиду) in vitro двумя методами: МТТ-тестом и DISC-методом. Выявлялась корреляционная зависимость между степенью чувствительности бластов in vitro и группами прогноза, возрастом, полом и инициальным количеством лейкоцитов в периферической крови, сроками выхода пациентов в ремиссию. При сопоставлении групп детей с ОЛЛ по доле эффективных препаратов in vitro с достижением ремиссии на 33-й день от начала терапии получены статистически достоверные различия (р=0,008). Все пациенты, у которых доля эффективных препаратов составила более 40%, достигли ремиссии.
Данная работа касается острого лимфобластного лейкоза, в ней использован МТТ-тест, недостатки которого отмечены выше.
Раскрытие изобретения
Сущность предлагаемого способа прогнозирования эффективности лечения больного острым миелобластным лейкозом (далее ОМЛ) противоопухолевыми препаратами даунорубицином и цитозин-арабинозидом (далее цитарабином) состоит в следующем.
У больного берут пробу крови, если у него наблюдается гиперлейкоцитоз, или костного мозга, если отсутствует гиперлейкоцитоз, выделяют опухолевые (лейкозные) клетки, культивируют их в лунках планшета с каждым цитостатическим препаратом (даунорубицином, цитарабином) в отдельности, используя ряд концентраций цитостатического препарата, позволяющий определить ту его концентрацию, при которой in vitro выживает 50% лейкозных клеток данного пациента (IC50), добавляют раствор WST-1 (Water Soluble Tetrazolium), измеряют на спектрофотометре оптическую плотность в каждой лунке, определяют относительную плотность живых клеток в лунках.
Определяют IC50 для даунорубицина и цитарабина. При значении IC50 даунорубицина у обследуемого пациента, попадающем в области значений 0,014-0,25 мкМ/л; от болеее 0,25 до 0,5, включая 0,5 мкМ/л; более 0,5 мкМ/л устанавливают соответственно высокую (1 балл), среднюю (2 балла) или низкую (3 балла) чувствительность опухолевых клеток пациента к даунорубицину in vitro.
При значении IC50 цитарабина у обследуемого пациента, попадающем в области значений 0,3-1,5 мкМ/л; от более 1,5 до 8, включая 8 мкМ/л; более 8 мкМ/л устанавливают соответственно высокую (1 балл), среднюю (2 балла) или низкую (3 балла) чувствительность опухолевых клеток пациента к цитарабину in vitro.
Если опухолевые клетки пациента in vitro:
 характеризуются низкой чувствительностью к даунорубицину и цитарабину, прогнозируют очень высокую вероятность резистентности пациента к лечению данными препаратами;
характеризуются низкой чувствительностью к даунорубицину и цитарабину, прогнозируют очень высокую вероятность резистентности пациента к лечению данными препаратами;
 характеризуются низкой чувствительностью к цитарабину, прогнозируют очень высокую вероятность резистентности пациента к монотерапии цитарабином (монотерапия цитарабином применяется в случае высокой коморбидности пациента, наличии у него заболеваний, исключающих прием даунорубицина);
характеризуются низкой чувствительностью к цитарабину, прогнозируют очень высокую вероятность резистентности пациента к монотерапии цитарабином (монотерапия цитарабином применяется в случае высокой коморбидности пациента, наличии у него заболеваний, исключающих прием даунорубицина);
 высокочувствительны к даунорубицину, при этом высоко-, средне- или низкочувствительны к цитарабину, прогнозируют высокую вероятность ремиссии или ремиссии с последующим ранним (в течение первых двенадцати месяцев) рецидивом при лечении двумя данными препаратами;
высокочувствительны к даунорубицину, при этом высоко-, средне- или низкочувствительны к цитарабину, прогнозируют высокую вероятность ремиссии или ремиссии с последующим ранним (в течение первых двенадцати месяцев) рецидивом при лечении двумя данными препаратами;
 высокочувствительны к даунорубицину и цитарабину, прогнозируют примерно 50%-ную вероятность ремиссии у пациента при лечении его двумя данными препаратами или только цитарабином.
высокочувствительны к даунорубицину и цитарабину, прогнозируют примерно 50%-ную вероятность ремиссии у пациента при лечении его двумя данными препаратами или только цитарабином.
Опухолевые клетки выделяют из пробы крови или костного мозга путем центрифугирования через LSM (Lymphocyte Separation Medium), затем в течение суток их культивируют в СО2-инкубаторе перед внесением в лунки планшета.
В каждую лунку планшета помещают 50-200 тысяч опухолевых клеток для культивирования их с цитостатическим препаратом.
Для определения IC50 опухолевые клетки культивируют со следующими концентрациями даунорубицина (мкМ/л): 0; 0,05; 0,1; 0,2; 0,4; 0,6; 1; 2 и (отдельно) со следующими концентрациями цитарабина (мкМ/л): 0; 0,001; 0,01; 0,2; 0,8; 4,1; 40,8; 82 в течение 48-72 часов.
Раствор WST-1 добавляют в лунки планшета, содержащие 150 мкл среды, в объеме 10 мкл исходного раствора WST-1 с концентрацией 0,5 мг/мл и культивируют с WST-1 в течение 2-3 часов.
IC50 определяют путем построения в прямоугольной системе координат графика зависимости процента выживших клеток в лунках от концентрации цитостатического препарата в этих лунках или с помощью программы OriginPro 7.5.
Техническими результатами предлагаемого способа являются следующие:
1) предлагаемый способ так же, как и аналог по патенту РФ №2593020, включает исследование некоторых параметров организма (в аналоге это тимидинкиназа-1 и β2-микроглобулин, в предлагаемом способе - опухолевые клетки), в определенной мере отражающих стадию и агрессивность течения заболевания, но, в отличие от указанного аналога, предлагаемый способ позволяет прогнозировать эффективность лечения на основе проверки до начала лечения эффективности предполагаемых для лечения препаратов полихимиотерапии (ПХТ), дает возможность оценить чувствительность опухолевых клеток пациента к цитостатическим препаратам, входящим в стандартные схемы лечения ОМЛ, и таким образом до начала лечения выбрать более эффективный препарат (препараты);
2) предлагаемый способ по сравнению со способами, использующими МТТ-тест, менее трудоемок, требует меньше времени для его осуществления;
3) результаты исследования чувствительности опухолевых клеток, выполненного при помощи WST-1 теста, по сравнению с теми, что выполнены при помощи МТТ-теста, являются более точными и достоверными, т.к.:
- на суспензионных культурах, к которым относятся лейкозные клетки, не теряется часть клеток, вследствие таких необходимых при выполнении МТТ-теста манипуляций, как отбор среды с клетками из лунок, ее центрифугирование, ресуспендирование клеток, перенос их обратно в планшет перед добавлением в лунки ДМСО или додецилсульфата;
- не погибает часть клеток под воздействием токсичных ДМСО или додецилсульфата, используемых при выполнении МТТ-теста;
4) вероятность резистентности пациента к лечению даунорубицином и цитарабином при низкой чувствительности in vitro его опухолевых клеток к указанным препаратам является очень высокой и составляет в исследованной группе 100%;
5) вероятность резистентности пациента к монотерапии цитарабином при низкой чувствительности in vitro его опухолевых клеток к цитарабину является очень высокой и составляет в исследованной группе 100%;
6) высокая, средняя и низкая чувствительность клеток in vitro к цитостатическому препарату (цитостатическим препаратам) совпадает соответственно с ремиссией, ремиссией с ранним рецидивом и с резистентностью пациента к лечению данным цитостатическим препаратом (цитостатическими препаратами) у 64,5% пациентов;
7) предлагаемый способ позволяет сделать в два раза более точный прогноз относительно результата лечения пациента на основании выявленной in vitro низкой чувствительности опухолевых клеток пациента к даунорубицину и цитарабину, чем на основании выявленной in vitro высокой чувствительности его опухолевых клеток к указанным препаратам. Низкая чувствительность опухолевых клеток к тем цитостатическим препаратам (препарату), которые (который) получал пациент, совпадает с резистентностью пациента к терапии этими препаратами (этим препаратом) в обследованной группе в 84,2% случаев, а высокая чувствительность опухолевых клеток с ремиссией у пациента - в 42,9% случаев.
Иллюстративный материал
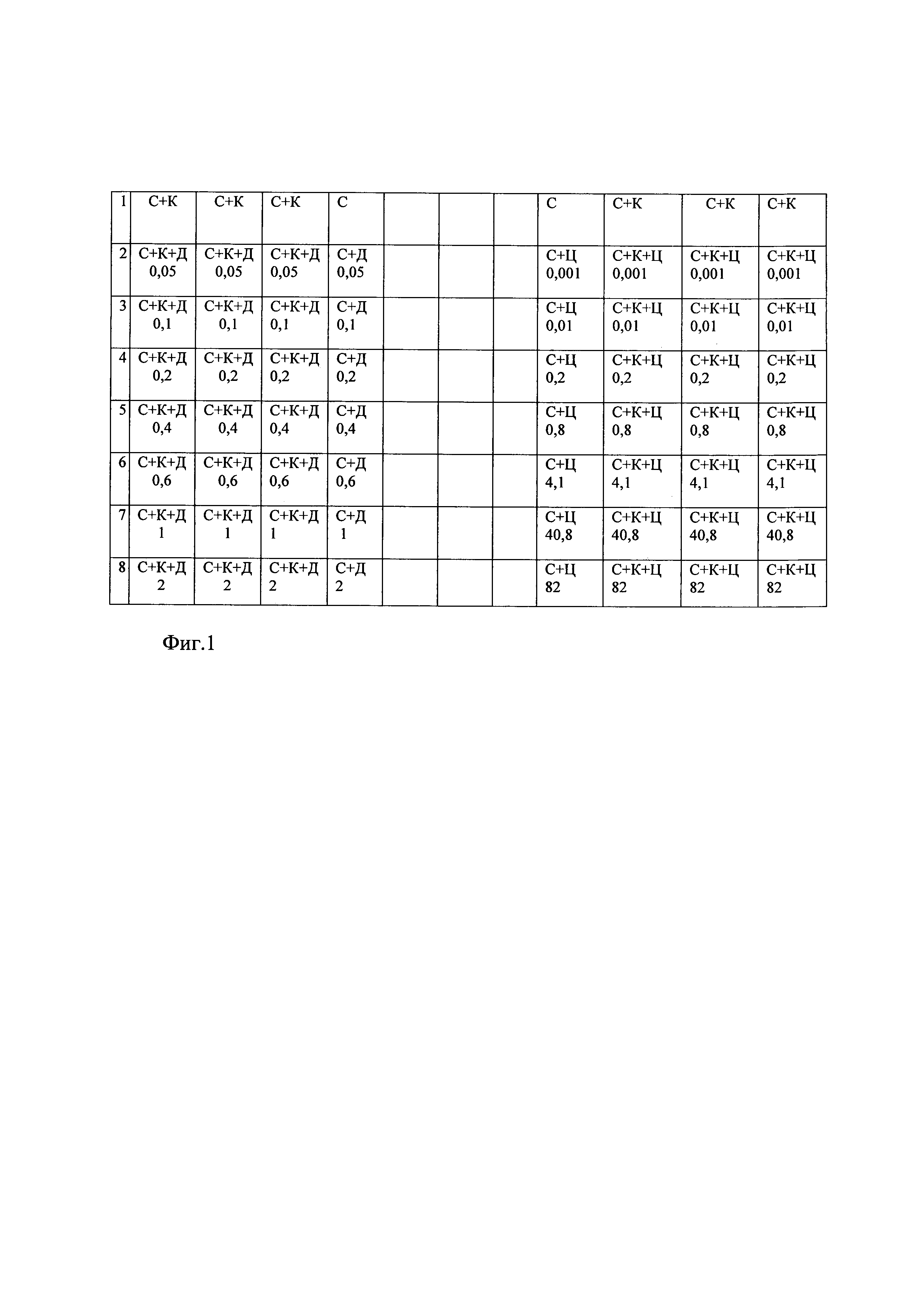
Фиг. 1. Пример схемы размещения контрольных и опытных лунок в 96-луночном планшете. Обозначения: цифрами 1-8 обозначены номера 12-луночных рядов в планшете (на схеме они горизонтальные); К - клетки, например, 100 тысяч в лунке; С - среда питательная, например, 150 мкл в лунке; Д - даунорубицин в следующих концентрациях от 1-го до 8-го ряда лунок соответственно (мкМоль/л): 0; 0,05; 0,1; 0,2; 0,4; 0,6; 1; 2; Ц-цитарабин в следующих концентрациях от 1-го до 8-го ряда лунок соответственно (мкМоль/л): 0; 0,001; 0,01; 0,2; 0,8; 4,1; 40,8; 82. Одна и та же концентрация каждого цитостатического препарата присутствует в трех опытных и одной контрольной лунках.
Пример осуществления изобретения
У пациента с подтвержденным диагнозом ОМЛ берут пробу крови, если у пациента наблюдается гиперлейкоцитоз, или костного мозга, если у него отсутствует гиперлейкоцитоз. Если объем пробы костного мозга не достаточен, то берут дополнительно пробу крови.
Пробу крови (5 мл), костного мозга (3 мл) забирают в пробирки с ЭДТА. Образцы крови и костного мозга обрабатывают сразу или в течение нескольких часов после сбора.
Забирают из пробы 800 мкл крови или костного мозга, добавляют 4,2 мл 0,9% раствора хлористого натрия.
Опухолевые клетки выделяют следующим образом.
На дно центрифужной пробирки помещают 2 мл LSM, сверху наслаивают 5 мл суспензии клеток в 0,9% растворе хлористого натрия и центрифугируют при 800g в течение 20 мин при температуре 21°С.
Отбирают полученную фракцию опухолевых клеток, переносят ее в другую пробирку, содержащую 2 мл 0,9% раствора хлористого натрия, ресуспендируют.
Суспензию клеток центрифугируют в течение 10 минут при 680g. Сливают надосадочную жидкость, к осадку добавляют 1 мл модифицированной по Пскову питательной среды Дульбекко (Iscove's Modified Dulbecco's Medium, IMDM), дополненной 10% эмбриональной бычьей сывороткой, клетки ресуспендируют.
Помещают в камеру Горяева 7,5 мкл полученной клеточной суспензии, определяют концентрацию и количество живых клеток в суспензии.
Взвесь клеток в объеме 1 мл помещают в чашку Петри, содержащую 3 мл среды IMDM, дополненной 10% эмбриональной бычьей сывороткой (FBS), 1% раствором антибиотика (10000 мкг / мл стрептомицина, 10000 ME / мл пенициллина), 25 мкг / мл антимикотика амфотерицина и в течение суток культивируют в СО2-инкубаторе при 37°С в увлажненной атмосфере, содержащей 5% СО2.
Получают, условно называемую, исходную взвесь (суспензию) клеток. Определяют концентрацию живых клеток в исходной суспензии и готовят рабочую суспензию клеток для раскапывания в лунки планшета.
Используют 96-луночные планшеты.
Вносят клетки в лунки планшета по 50-200 тысяч клеток, например, по 100 тысяч клеток в 75 мкл питательной среды в лунку. Цитостатический препарат вносят в лунку планшета в 75 мкл среды; в одной и той же концентрации его вносят в три опытные лунки. Каждый цитостатический препарат в опыте используют в семи различных концентрациях. На фиг. 1 показана схема 96-луночного планшета, на которой приведен пример расположения опытных (содержащих клетки, питательную среду и цитостатический препарат) и контрольных лунок. Лунки первого контроля содержат клетки (100 тыс.) и питательную среду - 150 мкл, лунки второго контроля - только 150 мкл среды.
Высаженные на планшет клетки инкубируют в течение 48-72 ч. в присутствии вышеуказанных концентраций даунорубицина и цитарабина в среде IMDM в присутствии 10% эмбриональной бычьей сыворотки при 37°С в атмосфере 5%-го CO2.
По окончании инкубации в опытные и контрольные лунки планшета в стерильных условиях раскапывают раствор WST-1в концентрации 0.5 мг/мл по 10 мкл в лунку. Планшеты снова помещают в СО2-инкубатор на 2-3 часа.
После инкубации клеток с раствором WST-1 измеряют на многоканальном спектрофотометре оптическую плотность в каждой лунке планшета, определяя разность поглощения на длинах волн 620 и 450 нм.
После определения относительной плотности живых клеток (относительно плотности живых клеток в контрольных лунках без цитостатического препарата, содержащих только среду и клетки) во 2-8-й лунках с различными концентрациями цитостатического препарата строят график зависимости процента живых клеток в лунках от концентрации цитостатического препарата в данных лунках в прямоугольной системе координат и определяют среднее значение IC50 - концентрации цитостатического препарата, при которой выживает 50% лейкозных клеток.
IC50 можно определить также с помощью программы Origin (OriginPro 7.5). Вносят в программу значения концентрации цитостатического препарата в лунках, процент живых клеток в лунках с разными концентрациями цитостатического препарата и аппроксимируют зависимость процента живых клеток от концентрации цитостатического препарата экспоненциальной функцией.
Полученное среднее значение IC50 для обследуемого пациента сравнивают с разработанной авторами шкалой высокой, средней и низкой чувствительности опухолевых клеток больных ОМЛ к данному цитостатическому препарату.
Значения IC50, соответствующие высокой, средней или низкой чувствительности даунорубицина и цитарабина, а также соответствующий им прогноз указаны выше, а также приведены ниже.
Общая характеристика группы обследованных больных ОМЛ
Группу обследованных составили 53 пациента Городского гематологического центра города Новосибирска с диагнозом "Острый миелобластый лейкоз" (ОМЛ).
Средний возраст пациентов составил 51,23±14,5 лет. Распределение по полу было следующим: мужчины - 25 пациентов (48,15%), женщины - 28 пациенток (51,85%).
Обязательный комплекс обследования больных включал сбор жалоб, анамнеза, объективный осмотр, лабораторные методы: общий анализ крови и мочи, биохимические тесты (общий белок, АЛТ, ACT, протромбиновый индекс, тимоловая проба), в том числе С-реактивный белок, фибриноген, лактатдегидрогеназа и щелочная фосфатаза для определения биохимической активности опухолевого процесса. Всем пациентам проводилась компьютерная томография малого таза, забрюшинного пространства, брюшной полости, грудной клетки, исследование пунктата костного мозга с подсчетом миелограммы, иммунофенотипирование опухолевых клеток методом проточной цитофлуорометрии, кариотипирование методом метафазных пластинок, а также молекулярно-цитогенетическое исследование клеток FISH-методом. Диагноз острого лейкоза был установлен на основании цитологического исследования костного мозга с иммунофенотипированием опухолевых клеток методом проточной цитофлуорометрии с использованием широкой панели моноклональных антител к кластерам дифференцировки гемопоэтических клеток.
У всех больных была произведена оценка уровня лейкоцитоза, определен первичный/вторичный лейкоз, наличие экстрамедуллярных поражений, цитогенетических мутаций.
Гепаринизированные образцы периферической крови или костного мозга брали во время диагностики перед химиотерапией и обрабатывали либо сразу, либо после хранения в 10%-ном диметилсульфоксиде в жидком азоте.
Показатели гемограммы больных до начала лечения показали, что у 42 больных из 53-х были обнаружены бласты в периферической крови. Среднее их содержание составило 55,69±29,26% по отношению к лейкоцитам. У остальных 11 больных бласты были только в костном мозге.
Анализ особенностей миелограммы показал, что среднее содержание бластных элементов у 53-х пациентов составило 58,92±30,04% по отношению ко всем клеткам костного мозга.
У всех 53-х пациентов содержание 6 ластов в костном мозге превышало 20% по отношению ко всем клеткам костного мозга.
При наличии определенной совокупности признаков определялся прогноз для каждого пациента на основании известной из уровня техники информации; данные представлены в таблицах 1 и 2.
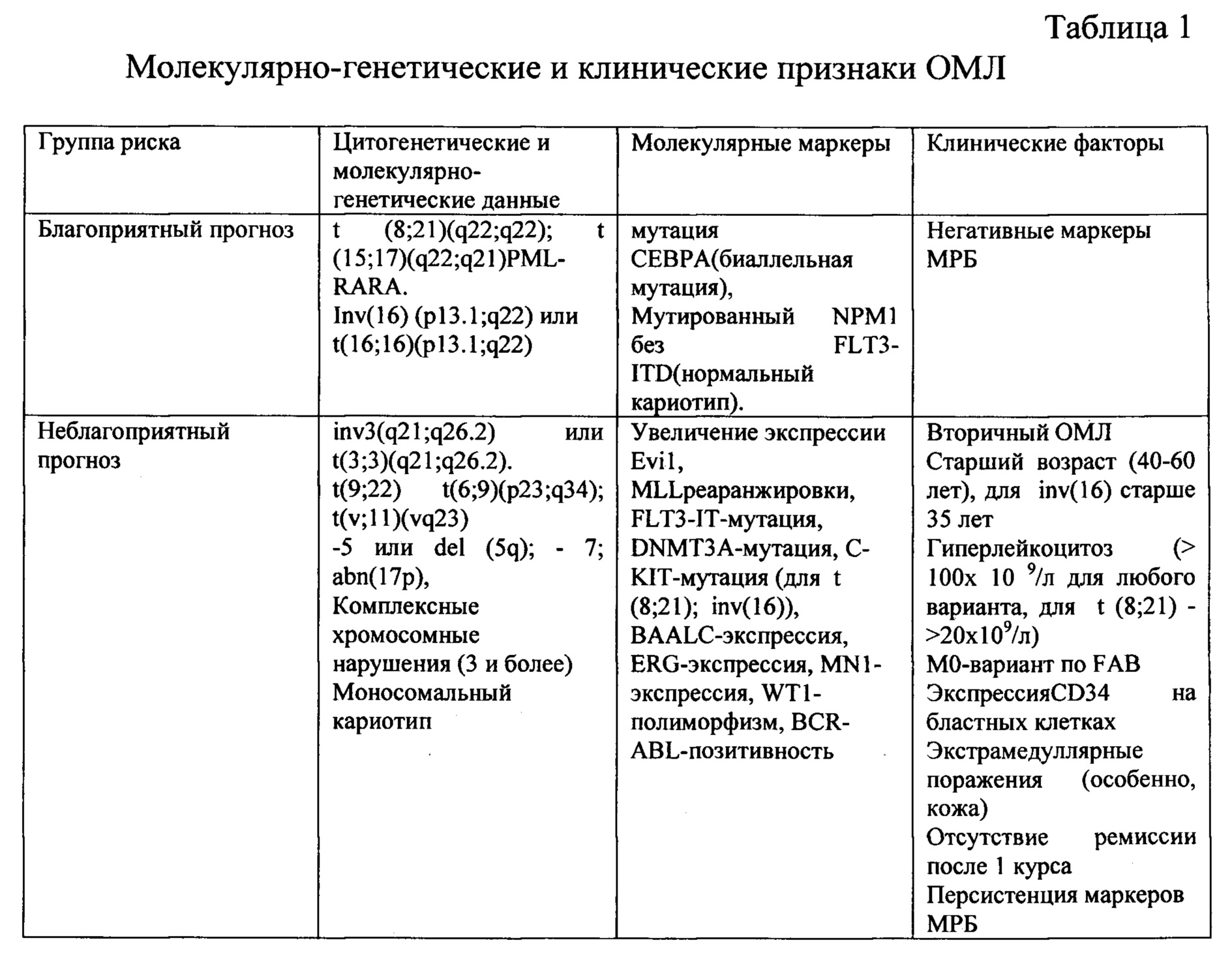

У 10 пациентов из 53-х (18,87%) определялся благоприятный прогноз, у 43-х пациентов (81,13%) - неблагоприятный.
Сбор образцов периферической крови и костного мозга
Периферическая кровь у пациентов с лейкемией была получена в BD Vacutainer путем пункции периферической вены (BD, Franklin Lakes, NJ, USA). Образцы костного мозга собирали в стеклянные пробирки с ЭДТА или гепарином путем прокола иглой для стернальной пункции или аспирации / биопсии подвздошного гребня с помощью иглы Джамшиди.
Выделение клеток и культивирование
Образцы крови и костного мозга обрабатывали сразу или в течение нескольких часов после сбора. Критерии для бластных клеток больных ОМЛ были основаны на соответствующих цитологических и фенотипических характеристиках.
Лейкозные клетки были выделены из периферической крови и костного мозга пациентов с помощью LSM с последующим центрифугированием (MP Biomedicals, США) в соответствии с инструкциями производителя. После выделения клетки культивировали в питательной среде IMDM, дополненной 10% эмбриональной бычьей сывороткой (FBS), 1% раствором антибиотика (10000 мкг/мл стрептомицина, 10000 МЕ/мл пенициллина) и антимикотиком амфотерицином 25 мкг/мл (ICN, Германия), при 37°С в увлажненной атмосфере с 5% СО2.
Клетки культивировали в чашках Петри в течение суток для адаптации к условиям in vitro. Затем высаживали в 96-луночный планшет в определенной концентрации (0.5×105-2×105 на лунку) и инкубировали с цитостатическим препаратом (опыт) или без цитостатического препарата (контроль) в течение 48-72 часов.
Оценка чувствительности лейкозных клеток к цитостатическим препаратам (даунорубицину и цитарабину) с использованием WST-1-теста
Даунорубицин (5 мг, TEVA, Израиль), цитарабин (100 мг / мл, TEVA, Израиль) хранили в соответствии с рекомендациями производителя и разводили в нужных концентрациях только перед использованием.
После инкубации с указанными химиотерапевтическими лекарственными препаратами добавляли раствор WST-1 (Roche, Швейцария) в концентрации 0,5 мг/мл в соответствии с инструкцией к реактиву, и клетки дополнительно инкубировали в течение 2-3 часов.
Абсорбцию измеряли спектрофотометрически с использованием Multiscan RC (Labsystems, Finland) при длинах волн 450 и 620 нм. IC50 рассчитывали по трем независимым измерениям оптической плотности в трех лунках с одной и той же концентрацией цитостатического препарата. Значение различий было проанализировано с использованием t-критерия Стьюдента. Для каждого пациента были определены значения IC50 для даунорубицина и цитарабина.
Для оценки чувствительности опухолевых клеток пациентов к цитостатическим препаратам in vitro была разработана шкала на основе определения IC50 и IC75 у группы больных, относительно которых было заранее известно, что они высокочувствительны к конкретному препарату.
Опухолевые клетки пациента оценивали как высоко-, средне- или низкочувствительные к цитостатическому препарату, если значение IC50 цитостатического препарата у данного пациента попадало в следующие диапазоны шкалы:
для цитарабина: 1 балл (высокая чувствительность) - 0,3-1,5 мкМоль/л; 2 балла (средняя чувствительность) – от более 1,5 до 8, включая 8 мкМоль/л; 3 балла (низкая чувствительность) - более 8 мкМоль/л;
для даунорубицина: 1 балл (высокая чувствительность) - 0,014-0,25 мкМоль/л; 2 балла (средняя чувствительность) - от более 0,25 до 5, включая 0,5 мкМоль/л, 3 балла (низкая чувствительность) - более 0,5 мкМоль/л.
После постановки диагноза пациентам назначался курс лечения в Городском гематологическом центре города Новосибирска. Результаты WST-теста и результаты клинических и параклинических исследований оценивали в совокупности.
Часть пациентов, прошедших 1-2 курса ПХТ, в связи с высокой коморбидностью получала только один цитостатический препарат - цитарабин в рамках протоколов ПХТ МДД21 и МДЦ 28 (доза цитарабина 10 мг/м 2 раза в сутки); другие пациенты получали 2 цитостатических препарата в рамках протокола ПХТ «7+3» (даунорубицин в дозе 60 мг/м и цитарабин в дозе 200 мг/м2).
Был проведен сравнительный анализ уровня IC50 для цитостатических препаратов у пациентов до начала лечения с результатами лечения пациентов (клинико-гематологическим ответом) после 1-2 курсов ПХТ. Клинико-гематологический ответ оценивали по количеству бластов в костном мозге или на основе следующей разработанной шкалы эффективности лечения:
1 балл - полная клинико-гематологическая ремиссия (ПКГР): доля бластных клеток в миелограмме снижается до уровня менее 5%, отсутствуют внекостномозговые лейкемические очаги поражения, в периферической крови отсутствуют бластные клетки, в костном мозге отсутствуют бластные клетки с палочками Ауэра, количество собственных тромбоцитов у пациента (т.е. не приобретенных в результате гемотрансфузий) равно или больше 100 тыс./мкл, количество собственных гранулоцитов - больше или равно 1 тыс./мкл;
2 балла - ремиссия с последующим ранним (в течение первых двенадцати месяцев) рецидивом, доля бластов в костном мозге после 1-2 курсов ПХТ от 5 до 20%;
3 балла - рецидив с последующей резистентностью; первичная резистентность - нет эффекта (ПКГР) на индукционных курсах; доля бластов после 1-2 курсов ПХТ в костном мозге больше 20%.
Ниже в таблице 3 представлены данные для 31 больного из обследованных 53-х, для которых имелись все данные из следующих: IC50 даунорубицина и цитарабина, если пациент получал оба препарата; IC50 цитарабина, если пациент получал только этот препарат; ответ на терапию даунорубицином и цитарабином или только цитарабином; цитостатические препараты, которые получал данный больной.

Примечания:
* ответ на терапию указан в % бластов в миелограмме после 1-2 курсов лечения и/или согласно вышеприведенной классификации в баллах (в скобках);
** крестиком отмечены препараты, которые получал пациент.
Приведенные в таблице 3 данные показывают следующее.
Благоприятный результат лечения (ремиссия, 1 балл) наступил у 7 пациентов из 31 (22,6%). Результат лечения, оцениваемый в 2 и 3 балла, наблюдался у 5 (16,1%) и 19 (61,3%) больных соответственно, что в сумме составило 24 (77,4%) пациента. Полученные результаты близки к прогнозу, полученному на основании молекулярно-генетических и клинических признаков, приведенных в табл. 2.
В обследованной группе 21 пациент из 31-го получали даунорубицин и цитарабин. Из них у 8 человек опухолевые клетки были in vitro низкочувствительными и к даунорубицину, и к цитарабину. Все 8 человек (100%) оказались резистентными к лечению данными препаратами (р=0,0029).
В обследованной группе 10 больных получали цитарабин (без даунорубицина). У 8 из них опухолевые клетки были in vitro низкочувствительными к цитарабину, лечение цитарабином оказалось неэффективным (3 балла) у всех 8 человек, т.е. в 100% случаев (р=0,0297). В одном из двух других случаев опухолевые клетки оказались in vitro высокочувствительными к цитарабину, в другом - среднечувствительными к нему. В обоих случаях лечение цитарабином оказалось эффективным, у пациентов наступила ремиссия.
В обследованной группе высокочувствительными in vitro к даунорубицину оказались опухолевые клетки у 10 пациентов, которые получали оба препарата. При этом опухолевые клетки у них были высоко, средне- или низкочувствительны к цитарабину. Из указанных 10 пациентов у 5 наблюдалась ремиссия, еще у 3х - ремиссия с ранним рецидивом. Таким образом, у 8 человек из 10 (80%) наблюдалась ремиссия или ремиссия с последующим ранним (в течение первых 12 месяцев) рецидивом при лечении двумя данными препаратами.
В обследованной группе высокочувствительными in vitro к даунорубицину и к цитарабину оказались опухолевые клетки у 6 человек. Из них у 3-х пациентов (50%), получавших оба препарата или только цитарабин, наступила ремиссия.
Чувствительность клеток к цитостатическим препаратам (препарату), которые (который) получал пациент, оцененная в баллах, совпадает с результатом лечения, оцененным в баллах (см. ниже) в исследованной группе у 64,5% пациентов.
Низкая чувствительность опухолевых клеток к цитостатическим препаратам (препарату), которые (который) получал пациент, совпадает с резистентностью пациента к лечению в обследованной группе в 84.2% случаев (у 16 человек из 19, у которых результат лечения оценивался 3-мя баллами), а высокая чувствительность к препаратам (препарату), которые (который) получал пациент, с ремиссией - в 42,9% случаев (у 3-х человек из 7-и, у которых наступила ремиссия).