Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ PICHIA PASTORIS X3351 - ПРОДУЦЕНТ ВАКЦИННОГО БЕЛКА gp 51 ВИРУСА ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА
Вид РИД
Изобретение
Область техники, к которой относится изобретение.
Изобретение включает штамм Pichia pastoris Х3351 - продуцент поверхностного антигена (gp 51) возбудителя лейкоза крупного рогатого скота и плазмида pFLDα 51 с целевой генетической вставкой.
Изобретение относится к биотехнологии и ветеринарии и касается получения штамма дрожжей Pichia pastoris Х3351 - продуцента поверхностного антигена (gp 51) ВЛ КРС с помощью рекомбинантной плазмиды, кодирующей ген этого поверхностного антигена. Штамм позволяет получать специфичный антиген gp 51 для вакцинопрофилактики и серологической диагностики лейкоза КРС.
Уровень техники.
В настоящее время известно достаточно много методов получения поверхностных антигенов возбудителя лейкоза крупного рогатого скота. Известен способ осаждения циркулирующих иммунных комплексов сыворотки крови больных лейкозом животных с последующей их диссоциацией и экстрагированием белковых компонентов ВЛ КРС. При этом сыворотку крови от больных лейкозом коров смешивают раствором ПЭГ-6000 в 0,1 М боратном буфере до 3% конечной концентрации; перемешивают, центрифугируют, отделяют осадок и растворяют в 5-кратном объеме 3% раствора ПЭГ-6000 в боратном буфере, центрифугируют; полученный осадок, содержащий компоненты вируса, растворяют в 3-кратном объеме дистиллированной воды и выдерживают, перемешивая, после чего пробу смешивают равным объемом насыщенного раствора сульфата аммония, перемешивают и центрифугируют; надосадочную жидкость отделяют и диализируют, фильтруют и концентрируют. Способ позволяет получать специфичный и стабильный антиген ВЛ КРС для серологической диагностики инфекции, который позволяет определять широкий спектр антител при инфекционном процессе (RU 2564007C1, опубл. 27.09.2015).
Известен способ получения пептидных фрагментов gp51, индуцирующих образование антител, которые защищают от ВЛ КРС, включающих пептидные последовательности, которые воспроизводят всю или часть последовательности фрагмента гликопротеина gp 51 оболочки вируса ВЛКРС, который несет по меньшей мере один из эпитопов (F, G, Н), ответственных за биологическую активность вируса. Применяется для подготовки или поиска антител, для диагностики и подготовки вакцин (US 5239056 (А), опубл. 24.08.1993).
Известно изобретение, рекомбинантного вируса, содержащего ген поверхностного антигена вируса бычьей лейкемии, включенного в ген вируса осповакцины и способный экспрессировать поверхностный антиген вируса бычьей лейкемии. Способ получения рекомбинантного вируса, включает стадии (1) введения ДНК, содержащей ген гемагглютининового гена осповакцины, в клонирующий вектор, (2) введение гена поверхностного антигена вируса бычьей лейкемии и промотор для гена в клонирующий вектор, (3) включение гена поверхностного антигена вируса бычьей лейкемии вместе с его промотором в геном вируса осповакцины путем гомологичной рекомбинации между геном гемагглютинина в клонирующем векторе и геном гемагглютинина в геноме осповакцины. Описан и способ иммунизации млекопитающих против вируса коровьего лейкоза, который включает инокуляцию млекопитающих рекомбинантным вирусом (WO 8806182 (А1), опубл. 25.08.1988).
Как правило, при создании вакцинных препаратов используют поверхностные белки (антигены) вирусной оболочки ВЛ КРС (gp 51 и gp 30). Данные белки выделяются из природных вирусов или получаются методом рекомбинантного синтеза с использованием генетических конструкций, кодирующих эти поверхностные антигены. В этих конструкциях гены антигенов экспрессируются под контролем сильных промоторов. Эти конструкции обеспечивают получение высокого уровня экспрессии целевого продукта. Также для синтеза поверхностных антигенов ВЛ КРС применяются зараженные культуры клеток (FLK и др.), но они требуют использования для роста клеток сложных и дорогостоящих питательных сред и технологически сложных методов.
Наиболее близким к заявленному рекомбинантному штамму является рекомбинантный штамм Bacillus subtilis 168 со вставкой в геном генов вируса бычьей лейкемии, которые имеют ослабленный фенотип и содержат комбинацию специфических мутаций. В результате получены векторы, позволяющие получать вакцины, в частности вакцины, подходящие для профилактического лечения связанных с ВЛ КРС заболеваний у животных (МХ2015011064(A), МКИ А61К 39/21, А01К 67/027, С07К 16/04, С07К 16/08, C12N 7/00, опубл. 01.03.2016, прототип).
Вышеуказанный штамм В. subtilis получали путем последовательного осуществления следующих действий. Гены АmyЕ и Lys-A Bacillus subtilis вводили в плазмиду pBLV6073GPDX. Для этого фрагмент гена AmyE-F был амплифицирован методом полимеразной цепной реакции (ПЦР) и вставлен в сайт Pci I pBLV6073GPDX. Другой фрагмент AmyEB был амплифицирован методом ПЦР. Ген Lys-A также был амплифицирован методом ПЦР. Две последние вставки гены AmyEB и Lys-A были совместно амплифицированы и вставлены в сайт Sal I pBLV6073GPDX.
Трансформируемые известной плазмидой клетки бактериального штамма Bacillus subtilis 168 являются продуцентом антигенов tax/rex, R3/G4, mir, env,pol, gag ВЛКРС.
Данный рекомбинантный штамм, полученный способом, описанным в патенте, позволяет обеспечить получение поверхностного антигена ВЛ КРС. Однако кроме поверхностного антигена экспрессируемый участок гена содержит и другие белки ВЛ КРС, которые мало эффективны в качестве иммунных антигенов. Их синтез снижает рентабельность промышленного производства. Поэтому трансформированный штамм недостаточно эффективен. Кроме того, некоторые поверхностные антигены ВЛКРС являются гликозилированными белками, в частности gp 51. Бактериальный штамм Bacillus subtilis 168 не обладает способностью гликозилировать белки. Поэтому синтезируемые описанным штаммом Bacillus subtilis 168 поверхностные антигены не являются полными структурными аналогами белков природного ВЛКРС, что снижает специфичность иммунитета при вакцинировании животных.
Раскрытие сущности изобретения.
При создании заявленного штамма Pichia pastoris Х3351 - продуцента поверхностного антигена (gp 51) (ВЛ КРС) была поставлена задача создания стабильного, более эффективного микробиологического дрожжевого продуцента, обеспечивающего синтез рекомбинантного поверхностного антигена вируса, с последующим созданием на его основе высоко иммуногенной вакцины, лишенной побочных эффектов. Данная задача решена за счет достижения эффекта повышенного синтеза рекомбинантного поверхностного антигена ВЛ КРС gp 51.
Поставленная в изобретении задача, с достижением упомянутого выше результата, решена следующим образом.
Была разработана целевая генетическая вставка, представляющая собой нуклеотидную последовательность гена gp 51 возбудителя лейкоза крупного рогатого скота. Данная нуклеотидная последовательность была оптимизирована под кодон дрожжей Pichia pastoris. К 3'- концу нуклеотидной последовательности был добавлен стопкодон ТАА. Затем к 5'- и 3'- концам были добавлены сайты узнавания рестриктазы Sac II. Затем был осуществлен синтез целевой генетической вставки (SEQ ID NO 1) с использованием ДНК-синтезатора ASM-800.

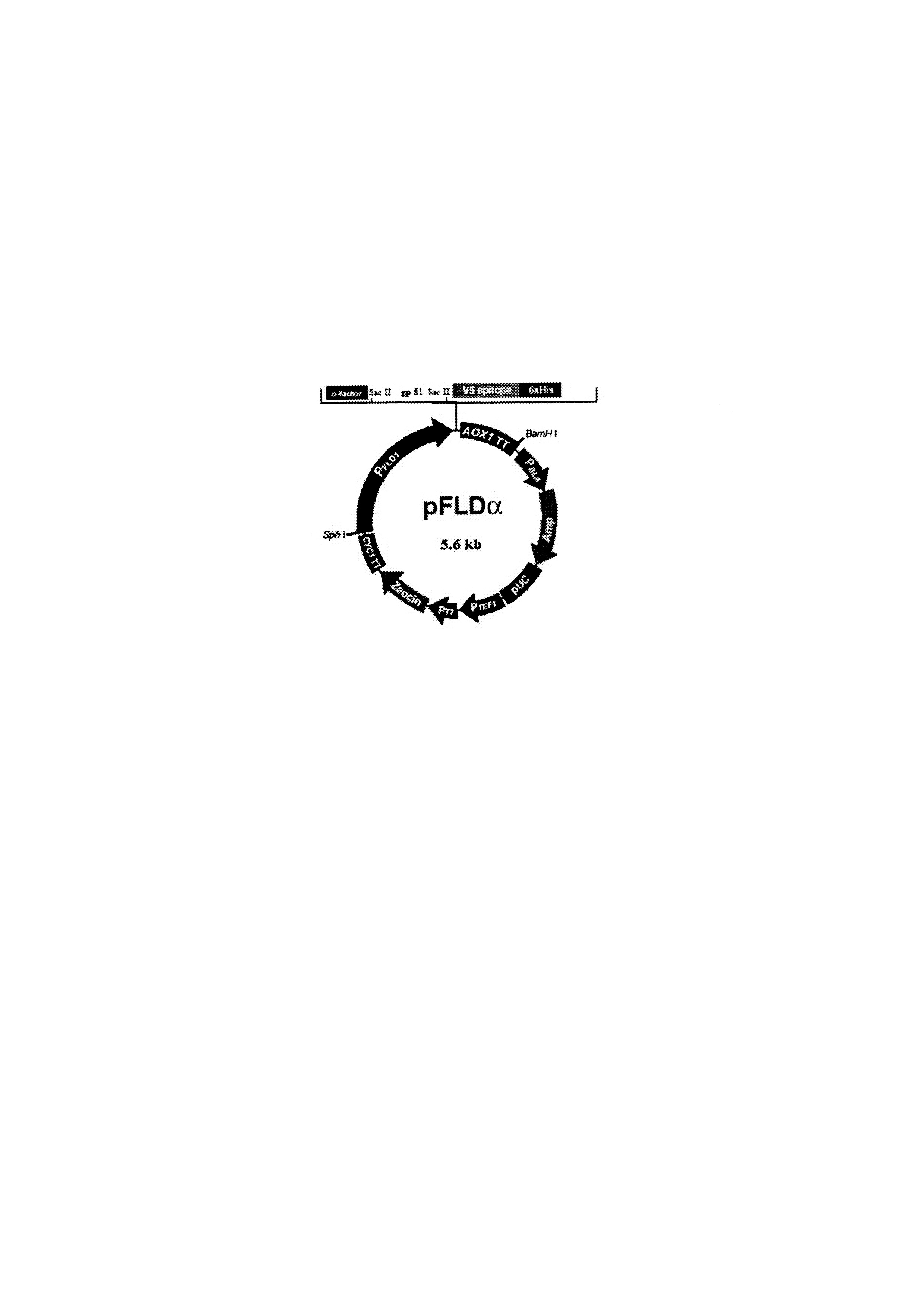
В качестве трансформирующего вектора для переноса целевой генетической вставки в геном дрожжей нами была выбрана «челночная» плазмида pFLDα. Мы обработали синтезированный участок ДНК эндонуклеазой рестрикции Sac II. Также данной рестриктазой был обработана плазмида pFLDα. После мы выполнили сшивку обработанной эндонуклеазой рестрикции Sac II целевой генетической вставки по «липким» концам с разрезанной той же рестриктазой плазмидой pFLDα с использованием лигазы Т4. Таким образом, была получена рекомбинантная плазмида pFLDα 51, несущая целевую генетическую вставку - ген gp 51 ВЛ КРС (фигура).
Была выполнена трансфекция рекомбинантной плазмиды pFLDα 51 в компетентные клетки Е. coli. После накопления достаточного количества плазмидного материала, плазмида pFLDα 51 была выделена и «расшита» рестриктазой Nsi I. Далее была выполнена электропорация «расшитой» плазмиды pFLDα 51 в геном штамма дрожжей X 33 Pichia pastoris. Наличие целевой генетической вставки в геноме выше указанных дрожжей было доказано методом секвенирования по Сэнгеру с использованием ДНК-анализатора ABI 3500. Таким образом, был получен штамм дрожжей Pichia pastoris Х3351.
Рекомбинантный штамм дрожжей Х3351 был подращен на среде MGA. Затем перенесен на основные среды MMAs (с метанолом) и MGMa (с метиламином). В течение всего срока культивирования с суточным интервалом отбирались определенные аликвоты культуральной жидкости. После данные аликвоты были исследованы методом вертикального электрофореза в 12% ПААГ. В аликвотах, отобранных на 4-е и 5-е сутки, методом вертикального электрофореза установлено наличие белка весом 30 кДа. После прохождения всего срока культивирования культуральная жидкость была очищена центрифугированием и затем с использованием аффинной хроматографии из нее был выделен белок - гликопротеин gp 51 ВЛКРС. Наличие и идентификация гликопротеина gp 51 установлено методами вертикального электрофореза в ПААГ. Методом ИФА подтверждена антигенная специфичность гликопротеина gp 51 ВЛКРС.
Рекомбинантный штамм Pichia pastoris Х3351 депонирован в Всероссийской коллекции промышленных микроорганизмов (регистрационный номер ВКПМ: Y-4332, 26.06.2017).
Осуществление изобретения.
Пример 1. Получения рекомбинантного штамма дрожжей Pichia pastoris Х3351.
1.1 Синтез оптимизированной молекулы ДНК гена gp 51, кодирующего поверхностные белки вируса лейкоза крупного рогатого скота.
Синтез целевой генетической вставки выполнен с использованием ДНК-синтезатора ASM-800 производства ООО «БИОССЕТ» согласно следующему протоколу:
1. «Верхнюю» цепь ДНК фрагмента разделили на участки по 65-80 «букв» (нуклеотидов) (обозначение «Т», от «тор»).
2. К местам стыков олиго нуклеотидов прописали комплементарные нуклеотидные подставки, по 15-17 «букв» залипания на каждый олигонуклеотид, в результате образуются 30-35 членные нижние олигонуклеотиды (обозначение «В» - от «bottom»).
3. Далее «Т» и «В»-олигонуклеотиды просинтезировали с помощью ДНК-синтезатора.
4. Далее, сделали смесь «Т» олигонуклеотидов (кроме первого), по 2 мкМ каждый в 1x Т4 лигазном буфере с АТР, и фосфолировали стандартно в 20 мкл. Киназу инактивировали нагреванием.
5. Параллельно сделали микс «В» (все «В»-олигонуклеотиды + первый Т-олигонуклеотид, также по 2 мкМ в 1х Т4-лигазном буфере).
6. Смешали равные объемы смесей «В» и «Т» (по 5-10 мкл). Прогрели при 95°С в течение 1 мин, дали пассивно остыть до комнатной температуры. Далее, развели смесь еще в 5 раз (1х Т4-лигазный буфер, конечная концетрация олигонуклеотидов 200 нМ каждый) и оставили лигироваться на ночь (+14°С). После полученную смесь развели в 5-10 раз.
7. 1 мкл разведенной смеси взяли на проведение ПЦР с концевыми праймерами, объем реакции 50 мкл.
1.2 Добавка сайтов узнавания эндонуклеазы.
К оптимизированной нуклеотидной последовательности гена белка gp 51 к 5'-концу и к 3'-концу были добавлены сайты узнавания эндонуклеазы Sac II.
1.3 Трансфекция плазмиды pFLD α 51 в дрожжевой штамм продуцента.
После синтеза целевой нуклеотидной последовательности гена гликопротеина gp 51 действовали по следующему алгоритму:
1. Плазмида pFLDα и синтезированная генетическая вставка гена gp 51 по отдельности были обработаны рестриктазой Sac II производства BioLab, Великобритания.
2. Затем плазмида и генетическая вставка были «сшиты» с использованием лигазы Т4 производства СибЭнзим, Россия, получена плазмида pFLDα 51.
3. Модифицированная плазмида была выделена с использованием набора MiniPrep производства Invirogen, США;
4. Затем, чтобы накопить в достаточном количестве модифицированную плазмиду pFLDα она методом химической трансформации была внедрена в химически компетентные клетки Е. coli;
5. Чтобы отобрать клетки Е. coli, несущие модифицированную плазмиду, модифицированный штамм был высеян на среду с ампициллином. В результате были отобраны единичные колонии, растущие на среде с ампициллином;
6. Далее модифицированная плазмида была выделена с помощью набора MiniPrep производства Invitrogen, США;
7. Модифицированная плазмида была обработана («расшита») рестриктазой Nsi I и путем электропорации была введена в геном дрожжей Pichia pastoris Х-33. Контроль наличия генетической вставки нуклеотидной последовательности гена gp 51 был определен методом секвенирования по Сэнгеру с использованием ДНК-анализатора ABI 3500;
8. Затем дрожжи были посеяны на среду YPDS с антибиотиком зеоцином для отбора колоний дрожжей, несущих целевую генетическую вставку (отбор колоний рекомбинантных дрожжей осуществлялся по устойчивости к зеоцину, т.к. модифицированные дрожжи содержат в своем геноме ген устойчивости к данному антибиотику).
9. Дрожжи, выросшие на данной селективной среде - рекомбинантный штамм дрожжей Pichia pastoris Х3351.
10. Выросшие колонии дрожжей пересеивали на жидкую среду MGAs, культивировали в течение 6 часов до достижения оптической плотности среды OD600=4;
11. Затем дрожжи были пересеяны на основные среды для экспрессии - MMAs (с метанолом). Отбор проб от надосадочной культуральной жидкости осуществлялся каждые сутки в течение всего срока культивирования, который составил 5 суток;
12. Отобранные пробы были проанализированы на наличие белка gp 51 методом вертикального электрофореза в ПААГ с концентрацией 10%. Наличие искомого белка gp 51 в культуральной жидкости подтверждается полосой на уровне 30 кДА в ПААГ;
13. Надосадочная культуральная жидкость после культивирования была отобрана и очищена от клеточного дебриса центрифугированием при 3000 об/мин в течение 5 мин;
14. Далее из культуральной среды методом аффинной хроматографии с использованием набора реагентов ProBond ™ Purification System производства ThermoFisher Scientific был выделен целевой белок gp 51 ВЛ КРС;
15. Далее проведена проверка антигенной специфичности полученного рекомбинантного белка gp 51 ВЛ КРС методом иммуноферментного анализа с использованием положительных контрольных сывороток.
Рекомбинантный штамм дрожжей Pichia pastoris Х3351 - продуцент поверхностного антигена (gp 51) возбудителя лейкоза крупного рогатого скота (ВЛ КРС), депонированный в Всероссийской коллекции промышленных микроорганизмов под номером Y 4332.