Результат интеллектуальной деятельности: СПОСОБ ПОВЫШЕНИЯ ЧАСТОТЫ ОБРАЗОВАНИЯ ДВУНИТЕВЫХ РАЗРЫВОВ ДНК В КЛЕТКАХ ЧЕЛОВЕКА ПРИ ДЕЙСТВИИ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ В УСЛОВИЯХ ВЛИЯНИЯ РАДИОМОДИФИКАТОРОВ
Вид РИД
Изобретение
Область изобретения. Изобретение относится к исследованиям, касающимся повышения эффективности радиационной терапии. Изобретение применимо к методам дистанционной или контактной (внутриполостной) лучевой терапии и радионуклидной терапии злокачественных новообразований, использующим различные излучения, такие как рентгеновские лучи, γ-излучение, нейтронное излучение, пучки заряженных частиц, излучение от распада радионуклидных источников.
Уровень изобретения. Россия занимает пятое место в мире по смертности онкологических больных и лидирует по числу больных раком на 100 тыс. населения. В среднем в России, как и во всем мире, отмечается рост заболеваемости раком на 1,5% в год. По данным медицинской статистики, в настоящее время 500 тыс.россиян ежегодно заболевают различными формами рака, до 300 тыс. в год умирают. На программу борьбы с онкологическими заболеваниями из федерального бюджета до 2024 г. будет выделено 900 млрд. рублей.
При лечении раковых заболеваний (злокачественных опухолей) применяют хирургические методы, химиотерапию, иммунологические методы и ионизирующее излучение. В качестве ионизирующего излучения при радиационной терапии применяются как электромагнитные излучения (гамма-кванты и рентгеновские лучи), так и корпускулярные виды излучений (электроны, нейтроны, протоны, тяжелые ионы). Использование гамма-квантов и рентгеновского излучения является наиболее доступным по стоимости методом лучевой терапии. Более перспективный метод адронной терапии онкологических заболеваний является значительно более дорогим, поскольку требует создания специализированных ускорителей заряженных частиц (особенно это относится к углеродной терапии рака). Сегодня в РФ обеспечивается только 60% потребности в радиотерапии, поэтому повышение ее эффективности является первоочередной задачей. Длительное фракционированное лечение с использованием только облучения (в настоящее время в клинической практике суммарная доза облучения составляет от 40 до 60 Гр) затруднено из-за различных побочных реакций. Для усиления противоопухолевого лучевого эффекта в качестве одного из методов используется комбинированное применение химиотерапевтических лекарственных средств и облучения, что делает результаты этого лечения более эффективным по сравнению с раздельным применением радиационного фактора и химиотерапевтических препаратов. В последние годы ведутся активные поиски различных радиосенсибилизирующих агентов: ингибиторов, препятствующих делению клеток и их диссеминированию, сенсибилизаторов, повышающих клеточную радиочувствительность и обусловливающих уменьшение суммарной дозы облучения на опухоль.
При прохождении ионизирующего излучения через чувствительные мишени клеток формируется широкий спектр нарушений структуры дезоксирибонуклеиновой кислоты (ДНК). Эти повреждения формируются либо за счет прямого разрушения ковалентных связей молекулы ДНК, либо непрямого действия образующихся свободных водных радикалов. Наиболее тяжелыми нарушениями, приводящими к клеточной гибели, являются одновременные нарушения целостности двух цепочек ДНК - двунитевые разрывы (ДР) [1, 2]. Двунитевые разрывы образуются либо в результате прямого разрыва двух комплементарных участков - прямые ДР (ПДР), вследствие передачи энергии локальному участку ДНК, приводящей к нарушению ее целостности, либо формируются из других повреждений как «издержки репарации» в процессе работы репарационных ферментов. Этот тип повреждений относится к разряду энзиматических ДР (ЭДР) [3, 4]. При действии редкоионизирующих излучений выход однонитевых разрывов (ОР) и ДР ДНК соотносится как 10:1. С возрастанием линейной передачи энергии (ЛПЭ) наблюдаются изменения в спектре индуцируемых повреждений ДНК клеток. При малых значениях ЛПЭ в большей степени формируются повреждения оснований и однонитевые разрывы ДНК. ОР ДНК эффективно репарируются клетками. Двойные разрывы ДНК лежат в основе формирования хромосомных аберраций и обусловливают гибель клеток.
Радиосенсибилизирующие агенты по механизму их действия разделяются на 2 группы: а) усиливающие первичные радиационные повреждения ДНК; б) ингибирующие процессы пострадиационного восстановления. Например, цисплатин является радиосенсибилизатором 1-й группы, обусловливающим формирование сшивок ДНК-белок, ДНК-ДНК. Примером применения сенсибилизатора 2-ой группы может служить комбинация лучевой терапии с предварительным введением 5-фторурацила. При радиотерапевтическом использовании этот агент нарушает синтез ДНК и вызывает образование структурно несовершенной РНК, угнетая клеточное деление. Он подавляет синтез рибонуклеиновой кислоты, путем включения 5-фторуридина трифосфата в ее структуру, вместо уридина трифосфата. Это приводит к нарушению процессинга рибонуклеиновой кислоты и синтеза белка. Применение 5-фторурацила при лучевой терапии в пред- и послеоперационный период, является распространенным методом [5-7], например, является стандартным приемом лечения рака прямой кишки II-III стадии. Данный метод (сочетание радиотерапии с введением радиомодификатора 5-фторурацила) является прототипом настоящего изобретения [8]. Однако эффективность комбинированного применения 5-фторурацила и ионизирующего излучения сравнительно невысока. Например, указывается [9], что "комбинирование лучевой терапии с химиотерапией … в большинстве случаев незначительно улучшает безрецидивную и общую выживаемость у больных с распространенными формами рака шейки матки". Поэтому поиск эффективных сенсибилизаторов в настоящее время активно продолжается.
Раскрытие изобретения. Таким образом, задачей настоящего изобретения является применение усиливающего агента для радиотерапевтических методов лечения опухолевых заболеваний, направленное на повышение частоты образования двунитевых разрывов ДНК в клетках человека. Как следствие, это позволит повысить эффективность радиационного воздействия на опухолевые клетки, уменьшить локальную терапевтическую дозу облучения и снизить неблагоприятные побочные лучевые реакции. Настоящее изобретение предлагает в качестве усиливающего агента для повышения частоты образования двунитевых разрывов ДНК в клетках человека ингибитор репарации ДНК 1-β-D-арабино-фуранозилцитозин в комбинации с дополняющим агентом гидроксимочевиной, которые вводятся перед облучением.
1-β-D-арабинофуранозилцитозин (АраЦ) является официнальным препаратом (торговые названия цитозар, алексан, цитарабин, цитостадин, цитарабин-ЛЭНС, цитастадин, цитозар НоваМедика) и используется в клинике при лечении острых и хронических лейкозов. АраЦ (русское название цитарабин) является синтетическим нуклеозидом, содержащим арабинозу в углеводной части молекулы. Химическое название - 4-Амино-1-бета-В-арабинофуранозил-2(1Н)-пиримидинон. Структурная формула АраЦ (цитарабина):

Механизм действия АраЦ (цитарабина) связан со встраиванием его активного метаболита арабинозидцитозин трифосфата в концевое звено молекулы ДНК во время ее синтеза в процессе репликации, что ведет к нарушению репликативных процессов. В связи с этим, цитарабин активен только по отношению к клеткам, находящимся в фазе синтеза ДНК (S-фазе) клеточного цикла. АраЦ (цитарабин) также блокирует активность ДНК полимеразы α, и в меньшей степени β ведущих репаративный синтез ДНК, вследствие чего происходит длительная фиксация однонитевых разрывов ДНК, возникающих в результате облучения. Невосстанавливаемые ОР ДНК являются сайтами формирования двунитевых разрывов ДНК в результате атаки участков нитей, оппозитных нерепарированным ОР, эндонуклеазами типа S1. Таким образом, в присутствии АраЦ (цитарабина) при действии ионизирующих излучений в отличие от других радиосенсибилизаторов (например, 5-фторурацила) происходит трансформация однонитевых разрывов ДНК в двунитевые разрывы, приводящие к клеточной гибели.
Гидроксимочевина (ГМ) является ингибитором рибонуклеотидредуктазы и влияет на внутриклеточный пул нуклеотидов, в частности, цитозина и снижает его [10]. В комбинации с АраЦ (цитарабином) может рассматриваться как дополняющий агент, усиливающий действие АраЦ (цитарабина). Структурная формула гидроксимочевины:
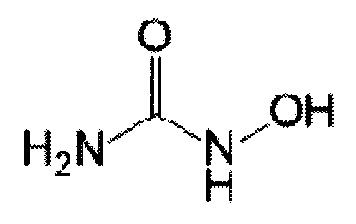
Гидроксимочевина также является официнальным препаратом и используется в клинике при терапии опухолей головы и шеи, при меланоме кожи, раке толстой и прямой кишки, при раке шейки матки, раке почки и предстательной железы. Таким образом, не существует препятствий к практическому применению АраЦ (цитарабина) и ГМ в сочетании с лучевой терапией.
Для подтверждения возможности использования изобретения было исследовано модифицирующее действие АраЦ (цитарабина). Экспериментально установлено, что в клетках, облученных редко- и плотноионизирующим излучениями, в условиях влияния АраЦ (цитарабина) и гидроксимочевины, в разной степени модифицируется выход ДР ДНК в пострадиационный период [11]. Так, при γ-облучении в условиях их влияния выход ДР ДНК значительно возрастал в ходе пострадиационной инкубации лимфоцитов и клеток человека в культуре. В то же время при облучении клеток ускоренными тяжелыми ионами модифицирующее действие агента было много меньшим или отсутствовало.
Эффективность модифицирующего влияния АраЦ (цитарабина) + ГМ была установлена при исследовании частоты образования ДР ДНК в различных клетках человека, облученных терапевтическим пучком протонов в пике Брегга без введения модифицирующих агентов и при предварительном их введении перед облучением. Экспериментальные исследования были выполнены на пучке протонов №1 Медико-технического комплекса на фазотроне Лаборатории ядерных проблем Объединенного института ядерных исследований, г. Дубна. Терапевтический протонный пучок формируется замедлением выведенного пучка фазотрона с энергией 660 МэВ до энергии 150-200 МэВ с помощью углеродного деградера с последующим коллимированием пучка и магнитным анализом. В ходе экспериментов пучок протонов с энергией 170 МэВ создавал равномерное поле облучения размером 10×10 см. Затем с помощью поглотителя и гребенчатого фильтра в зоне облучения формировался модифицирован-ный пик Брегга шириной до 2 см (в воде и биологической ткани) на уровне 90% максимальной дозы. В спектре ЛПЭ вклад в поглощенную дозу протонов с низкой ЛПЭ (2-25 кэВ/мкм) составлял ~67%, с ЛПЭ 25-50 кэВ/мкм ~23% и с высокой ЛПЭ (50-100 кэВ/мкм) ~10%. Мощность дозы при облучении составляла около 1,5 Гр/мин. Таким образом, в эксперименте полностью моделировалось облучение глубокозалегающих локальных новообразований у пациента.
Нормальные фибробласты кожи человека (NHDF 22873, Lonza, CC-2509) культивировали в среде IMDM (Sigma-Aldrich, Германия) с добавлением 10%-ной эмбриональной телячьей сыворотки (Sigma-Aldrich, Германия) и 1%-ного раствора гентамицин-глутамина (Sigma-Aldrich, Германия) в пластиковых флаконах с площадью поверхности роста 25 см2 (Corning, США) при 37°С и 5%-м содержанием СО2 в атмосфере. Для всех экспериментов использовали клетки на 9-12-м пассаже. За 16-18 ч до облучения 300 мкл клеточной суспензии наносили на покровные стекла диаметром 14 мм и толщиной 0,17 мм, размещенных в пластиковых чашках Петри диаметром 35 мм (MatTekCorporation, P35G-0.170-14-C, США). После 2-часовой инкубации к прикрепившимся клеткам добавляли 3,5 мл среды для культивирования. За 1 ч до облучения в культуральную среду фибробластов добавляли АраЦ (Sigma-Aldrich, Германия) и ГМ (Sigma-Aldrich, Германия) в конечной концентрации 20 мкМ и 2 мМ, соответственно, после чего клетки инкубировали в термостате при 37°С в течение 1 ч.
В экспериментах на медицинском пучке протонов протонный пучок перед пересечением монослоя клеток, проходил через стеклянное дно чашки Петри (MatTekCorporation, P35G0.170-14-C, США) толщиной 170 мкм под углом 10°, т.е. через 980 мкм стекла с ρ=2,58 г/см3. Спектр энергии замедленных протонов в пике Брегга в этом случае простирался от 0 до ~44 МэВ.
Для количественной оценки частоты образования ДР ДНК в отдельных ядрах клеток и их визуализации при действии излучений в обычных условиях и в присутствии АраЦ (цитарабина) + ГМ, был использован иммуноцитохимический метод определения γН2АХ/53 ВР1 фокусов. Метод ДНК-фокусов основан на использовании меченных флуоресцентными красителями отдельных ферментов, участвующих в репарации ДР ДНК. При использовании конфокального микроскопа в ядрах клеток можно регистрировать флуоресцирующие ДНК-фокусы, отражающие сайты формирования ДР ДНК. Этот метод позволяет изучать не только количественные стороны формирования и элиминации радиационно-индуцированных фокусов (РИФ), поскольку выход фокусов пропорционален числу ДР, но и проводить анализ структуры комплексных повреждений ДНК. В результате исследований было показано, что введение АраЦ (цитарабина) + ГМ перед облучением протонами приводит к резкому увеличению частоты образования ДР в пострадиационный период.
Облучение клеток человека (фибробластов кожи и клеток глиобластомы) в отсутствии и присутствии АраЦ (цитарабина) + ГМ проводилось также на пучке ядер бора-11 на циклотроне У400М Лаборатории ядерных реакций ОИЯИ. Ядра бора (В-11) с энергией 8 МэВ/нуклон (ЛПЭ = 139 кэВ/мкм) при мощности дозы ~2 Гр/мин облучали монослои клеток в чашках Петри диаметром 14 мм. Облучение образцов производилось на установке "Геном-М" в дозе 1 Гр. Этот эксперимент фактически воспроизводил условия облучения клеток человека в пике Брегга при углеродной терапии из-за близости физических характеристик В-11 и С-12.
Аналогичные эксперименты были проведены при облучении клеток гамма-квантами Со-60 на медицинской облучательной установке "Рокус-М". Увеличение числа ДР ДНК в присутствии АраЦ (цитарабина) и ГМ при γ-облучении, как было показано нами ранее [12], сопровождается более чем двукратным возрастанием радиочувствительности клеток китайского хомяка в культуре, оцениваемой по их выживаемости.
Полученные результаты хорошо демонстрируются фигурами 1-3.
Описание фигур:
На фигуре 1 представлены изображения индивидуальных γН2АХ/53 ВР1 фокусов в ядрах клеток человека в различное время после облучения протонами и ускоренными ионами бора в дозах 0,6 Гр и 1 Гр, соответственно, без модификаторов и в присутствии АраЦ (цитарабин) + ГМ. Повреждения ДНК видны как светлые точки. Стрелками на изображениях показаны комплексные повреждения, включающие множественные ДР ДНК, формируемые в виде «треков» по ходу заряженной частицы. Ясно видно, что спустя 24 ч после облучения количество повреждений ДНК при протонном облучении с предварительным введением АраЦ (цитарабина) + ГМ намного больше числа повреждений, формируемых в результате облучения протонами и ядрами без введения радиомодификаторов.
На фигуре 2 показана кинетика формирования и элиминации γН2АХ/53 ВР1 фокусов в ядрах клеток человека при облучении протонами в пике Брэгга в присутствии и отсутствии радиомодификаторов АраЦ (цитарабина) + ГМ. По оси ординат отложено количество фокусов на одну клетку. По оси абсцисс - время после облучения. Слева представлены результаты для дозы облучения 0,6 Гр, справа - для дозы 1,25 Гр.
Из фигуры 2 видно, что без АраЦ (цитарабин) + ГМ наибольшее количество фокусов (25 и 35 на клетку, соответственно) формируется через 1 ч после облучения. Через 24 ч их количество снижается до минимума (~5 на клетку). Совершенно иной тип кинетики формирования γН2АХ/53 ВР1 фокусов наблюдается при облучении клеток протонами в присутствии АраЦ (цитарабина) + ГМ. В течение 24 ч пострадиационной инкубации клеток происходит не уменьшение количества РИФ, а их резкое возрастание до 65 на клетку.
На фигуре 3 показано сравнение кинетики формирования и элиминации γН2АХ/53 ВР1 фокусов в ядрах клеток человека при облучении протонами и ядрами бора-11 в пике Брэгга в присутствии и отсутствии радиомодификаторов АраЦ (цитарабина) + ГМ. По оси ординат отложено количество фокусов на одну клетку. По оси абсцисс - время после облучения. Выход γН2АХ/53 ВР1 фокусов в отсутствии радиомодификаторов АраЦ (цитарабин) + ГМ при облучении ядрами бора-11 в пике Брегга выше, как и следует ожидать, чем при облучении протонами в пике Брегга при сравнимых дозах (45 и 35 на клетку соответственно спустя 1 ч после облучения и ~20 и 5 фокусов на клетку, соответственно, спустя 24 ч после облучения). Однако введение АраЦ + Гм делает облучение протонами существенно более эффективным в сравнении с облучением ядрами в пострадиационный период (до 65 на клетку через 24 ч после облучения).
Таким образом, применение АраЦ (цитарабина) + ГМ перед облучением может приводить к увеличению числа летальных повреждений ДНК в опухолевых клетках в пострадиационный период, т.е. к повышению эффективности лучевой терапии. Этот эффект проявляется не только при лучевой терапии, но будет проявляться также и при радионуклидной терапии, когда (перорально, внутривенно, внутриполостным или внутритканевым способом) вводятся радиофармпрепараты, воздействующие непосредственно на патологические очаги, поскольку механизм повреждающего действия излучения на цепочки ДНК во всех случаях одинаков. Суммируя, можно полагать, что комбинированное применение использованных официнальных препаратов с облучением редкоионизирующими излучениями является перспективным для использования в клинике.
Литература
1. Sachs R.K., Chen A.M., Brenner D.J. Review: proximity effects in the production of chromosome aberrations by ionizing radiation. // Int. J. Radiat. Biol. 1997. Vol. 71. № LP. 1-19.
2. Jackson S.P., Bartek J. The DNA-damage response in human biology and disease // Nature. 2009. Vol. 461. №7267. P. 1071-1078.
3. Kowalczykowski S.C. Initiation of genetic recombination and recombination-dependent replication. // Trends Biochem. Sci. 2000. Vol. 25. №4. P. 156-165.
4. Yokoya A., Cunniffe S.M.T., Watanabe R., Kobayashi K., O'Neill P. Induction of DNA Strand Breaks, Base Lesions and Clustered Damage Sites in Hydrated Plasmid DNA Films by Ultrasoft X Rays around the Phosphorus K Edge // Radiat. Res. 2009. Vol. 172. №3. P. 296-305.
5. Гладилина А.И. Радиосенсибилизация в лучевой терапии злокачественных новообразований. Эффективная фармакотерапия. Онкология, гематология и радиология №1 (2011), стр. 46-53.
6. Minsky B.D., Neuberg D., Kelsen D.P. et al. Final report of Intergroup Trial 0122 (ECOG PE-289, RTOG 90-12): Phase II trial of neoadjuvant chemotherapy plus concurrent chemotherapy and high-dose radiation for squamous cell carcinoma of the esophagus. Int J Radiat Oncol Biol Phys, 1999. - v. 43, №.3. - p. 517-523
7. Rich T.A., Shepard R.C., Mosley S.T. et al. Four decades of continuing innovation with f1 uorouracil: current and future approaches to fluorouracil chemoradiation therapy // J. Clin. Oncol. 2004. Vol. 22. P. 2214-2232.
8. Заявка на изобретение РФ №2017104909 от 17.07.2015, Бейкер Ч. «Лечение рака и комбинацией лучевой терапии, наночастиц оксида церия и химиотерапевтического средства»
9. Сравнение эффективности трех программ химиолучевого лечения рака шейки матки II-IV клинической стадии. Добренький, Алексей Михайлович, Российский научный центр рентгенорадиологии, Москва 2004 г. Диссертация кандидата медицинских наук.
10.  A. et al. Hydroxyurea arrests DNA replication by a mechanism that preserves basal dNTP pools. // J. Biol. Chem. American Society for Biochemistry and Molecular Biology, 2004. Vol. 279, №1. P. 223-230.
A. et al. Hydroxyurea arrests DNA replication by a mechanism that preserves basal dNTP pools. // J. Biol. Chem. American Society for Biochemistry and Molecular Biology, 2004. Vol. 279, №1. P. 223-230.
11. Борейко A.B., Чаусов B.H., Красавин E.A., Равначка И., Стукова С.И. Влияние ингибиторов синтеза ДНК на индукцию и репарацию двунитевых разрывов ДНК в лимфоцитах человека при действии излучений с разной ЛПЭ // Письма в ЭЧАЯ. 2011. Т. 4. №167. С. 670-678.
12. Красавин Е.А. Проблема ОБЭ и репарация ДНК. Москва: Энергоатомиздат, 1989.
Способ повышения частоты образования двунитевых разрывов ДНК в клетках человека при действии ионизирующих излучений в условиях влияния радиомодификаторов, отличающийся тем, что в качестве ингибиторов репарации ДНК перед облучением применяют комбинацию из официнальных препаратов 1-β-D-арабинофуранозилцитозина и гидроксимочевины.



