АНТИМИКРОБНЫЙ ПЕПТИД И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Изобретение относится к области биохимии и медицины. Более конкретно, настоящее изобретение относится к области антимикробных пептидов и к противодействию бактериальным, вирусным, грибковым и паразитарным инфекциям.
Антимикробные пептиды (АМП) являются неотъемлемым компонентом защитной системы организмов в природе и обеспечивают защиту от инвазивных патогенов. Они демонстрируют сильную антимикробную активность против грамположительных и грамотрицательных бактерий, грибков, паразитов и вирусов. Малые АМП (обычно длиною примерно 15-40 аминокислот) действуют главным образом путем нарушения структуры или функции клеточных мембран клеток микроорганизмов, они не действуют целенаправленно на определенные единичные молекулярные структуры. Таким образом, в отличие от традиционных антибиотиков они являются эффективными независимо от метаболической активности бактерий. АМП человека, такие как дефенсины и кателицидин (LL-37), присутствуют в лейкоцитах и секретируются различными эпителиальными тканями в коже и слизистых поверхностях. В дополнении к своей антимикробной активности АМП являются важными эффекторными молекулами в процессе воспаления, активации иммунитета и заживления ран. АМП сильно различаются по последовательности и вторичной структуре, но имеют некоторые общие свойства. Они обычно являются катионными, амфипатическими и оказывают свое микробицидное воздействие посредством нарушения целостности бактериальной мембраны. Взаимодействие АМП с анионной поверхностью мембраны целевых микробов приводит к пермеабилизации мембраны, клеточному лизису и смерти. Общепринято, что цитоплазматическая мембрана является основной мишенью большинства АМП, тем самым накопление пептида в мембране приводит к повышению проницаемости и потери барьерной функции, что ведет к утечке цитоплазматических компонентов и клеточной смерти.
Традиционные антибиотики убивают бактерии путем связывания с такими мишенями, как эпитоп на клеточной стенке, или мишенями среди бактериальных белков и относящимися к синтезу ДНК или РНК. Патогенные бактерии развивают устойчивость быстрее с помощью изменения мишеней антибиотиков, так что антибиотики больше не могут связываться с этими мишенями. Главное преимущество АМП по сравнению с традиционными антибиотиками состоит в том, что развитие устойчивости затруднено. Одной из причин этого является то, что АМП не воздействуют целенаправленно на определенные единичные молекулярные структуры (эпитопы) как традиционные антибиотики, но действуют на клеточную мембрану, убивая микроорганизмы. АМП являются особенно полезными при противодействии так называемым инфекциям, связанным с образованием биопленок, которые представляют собой прикрепленные к поверхности клеточные агломераты микроорганизмов, по большей части бактерий, но также и грибков. Биопленки вносят значительный вклад в устойчивость бактерий к традиционным антибиотикам. Биопленки связаны с различными патологическими состояниями у человека, такими как муковисцидоз, колонизация имплантированных медицинских изделий и образование зубного налета и ран. Противодействие инфекции, связанной с образованием биопленок, с помощью традиционных антибиотиков является кроме того недостаточным по целому ряду причин, включая стимуляцию высвобождения провоспалительных микробных соединений, недостаточное проникновение через биопленки и инактивацию или расщепление в крови в результате необходимого систематического введения. Другие преимущества АМП по сравнению с традиционными антибиотиками включают быстронаступающее уничтожение, факт того, что они биоразлагаемы, что уменьшает текущее беспокойство об остаточных антибиотиках в окружающей среде, и демонстрируют сопутствующую противовоспалительную активность.
Из потенциального пула сотен природных и искусственных пептидов относительно малое количество достигло этапа клинических испытаний. Примерами являются пептид магаинин, омиганан, ОР-145, новексатин и литиксар. Только два АМП, даптомицин и DPK-060, находятся сейчас на этапе клинических исследований. В случае ОР-145, который также называется Р60.4Ас (Peptides, 2006; 27:649-60), клинические испытания были проведены до фазы II. ОР-145 является пептидом из 24 аминокислот, производным от эндогенного антимикробного пептида человека кателицидина LL-37. ОР-145 разрабатывали как нейтрализующий эндотоксины антимикробный пептид для местного лечения хронического среднего отита. Кроме того, что он является антимикробным пептидом, ОР-145 нейтрализует липополисахариды.
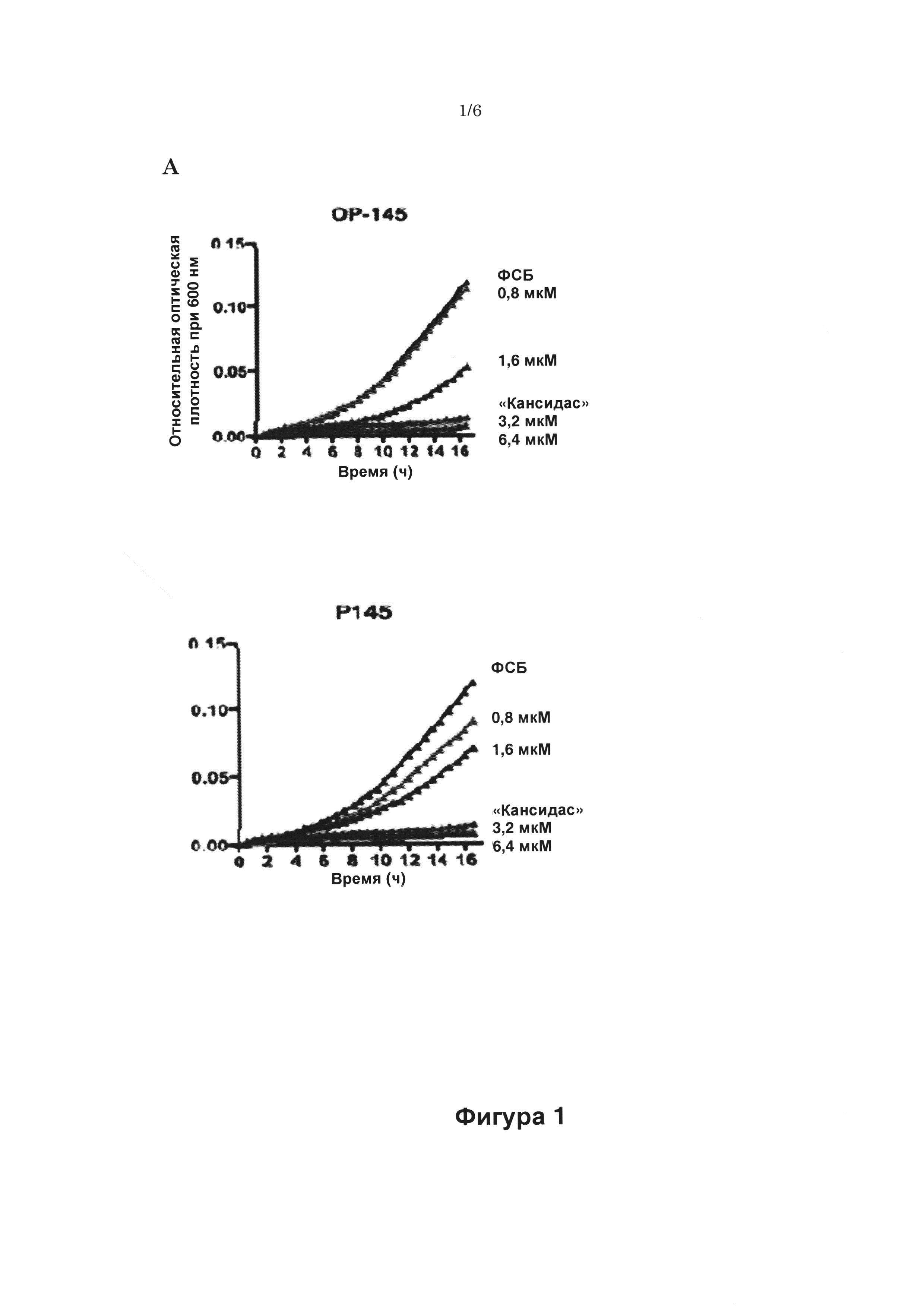
Известные в настоящее время АМП, включая ОР-145, все еще имеют некоторое количество недостатков. Например, различные бактерии, такие как P. aeruginosa, Е. faecalis, Proteus mirabilis, Streptococcus pyogenes и S. aureus, все секретируют протеазы, которые расщепляют несколько антимикробных пептидов, таких как кателицидин LL-37. Таким образом, устойчивые к действию протеаз антимикробные пептиды имеют преимущество с терапевтической точки зрения. Кроме того, с учетом потенциального литического воздействия, а также других свойств АМП, которые могут быть направленны не только против бактериальных мембран, но также на мембраны млекопитающих, одна из задач при конструировании новых пептидов заключается в разработке АМП с высокой специфичностью против микроорганизмов, таких как бактериальные или грибковые клетки, по сравнению со специфичностью к клеточным мембранам инфицированного пациента, то есть с высоким терапевтическим индексом (минимальная гемолитическая концентрация/минимальная антимикробная активность; МГК/МАА). Другой важный недостаток известных АМП, включая ОР-145, заключается в том, что на их активность сильно влияет присутствие компонентов плазмы. Например, в случае ОР-145 летальная концентрация ЛК99.9 (самая низкая концентрация пептида, убивающая ≥99,9% бактерий) в фосфатно-буферном растворе (ФСБ) составляет 1,6 мкМ, тогда как ЛК99,9 в ФСБ/плазма (1:1) составляет примерно 200 мкМ. Это особенно является недостатком для АМП, которые вводят системным образом.
За значительно более низкую активность АМП в присутствии плазмы могут быть ответственны несколько механизмов, таких как инактивация пептида компонентами плазмы, например, ферментативное расщепление или недоступность пептида из-за неспецифического связывания с компонентами плазмы. АМП, устойчивые к воздействию ! компонентов плазмы, не только важны, так как они являются потенциальными средствами | систематической терапии, но также важны для лечения, например, инфицированных ран и инфекции и воспаления, связанных с присутствием медицинского имплантата. В частности, при инфекции глубоких тканей может присутствовать высокая протеолитическая активность, которая может привести к инактивации АМП, которые не являются устойчивыми к протеолизу. Отделяемое из хронических ран содержит избыток протеаз и имплантированные материалы быстро покрываются компонентами плазмы из жидкостей организма-хозяина. Как хронические раны, так и медицинские имплантаты часто связаны с образованием микробных биопленок. В частности, при лечении связанных с образованием биопленок инфекций антибиотики по большей части вводят системно, и, следовательно, они подвержены к ферментативному расщеплению в крови и окружающих тканях. Таким образом, из-за чувствительности к компонентам плазмы применимость многих АМП, включая ОР-145, будет ограничиваться, например, вариантами местного введения. Таким образом, существует явная потребность в альтернативных АМП, которые устойчивы к воздействию компонентов плазмы, особенно в качестве потенциальных средств системной терапии и/или терапевтических средств, эффективных против биопленочных инфекций, связанных, например, с хроническими ранами и медицинскими имплантатами.
Целью настоящего изобретения является обеспечение новых сильнодействующих антимикробных пептидов, которые преодолеют недостатки традиционных антибиотиков и которые имеют улучшенные свойства по сравнению с известными антимикробными пептидами, в частности, потому что они являются устойчивыми к воздействию компонентов плазмы. Дополнительной целью настоящего изобретения является обеспечение антимикробных пептидов, которые являются неаллергенными при введении млекопитающим, таким как человек, которые имеют высокую специфичность против патогенных микроорганизмов и имеют особенно высокую антимикробную активность против патогенных микроорганизмов при инфекциях, связанных с образованием биопленок. Пептиды и полипептиды согласно настоящему изобретению проявляют сильную антимикробную активность широкого спектра против как микроорганизмов в биопленках, так и микроорганизмов, не организованных в биопленки, оказывают быстрое антимикробное действие и их можно применять в качестве терапевтических, профилактических или диагностических средств. Пептиды или полипептиды согласно настоящему изобретению сконструированы с целью преодолеть проблемы ограниченного времени сохранения эффективности и ограниченной применимости пептидов, потому что они сохраняют свою антимикробную активность в крови, плазме и сыворотке в присутствии компонентов указанных жидкостей.
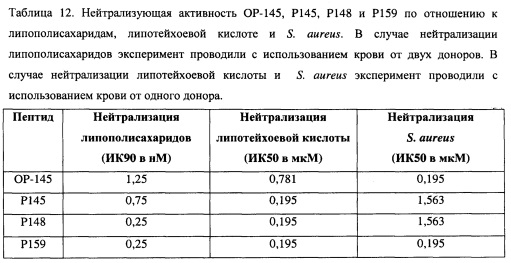
Авторы настоящего изобретения обнаружили, что пептиды Р139-Р163, которые основаны на последовательности LKKLYKRLVKILKRWWRYLKRPVR, являются высокоэффективными против (обладающих лекарственной устойчивостью) грамположительных бактерий (например, Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных бактерий (например, Pseudomonas aeruginosa), а также против грибков (Candida albicans и Aspergillus niger), см. Таблицы 2-4 и 11, Фиг. 1 и 2. Таким образом, пептиды проявляют антимикробную активность широкого спектра. Все пептиды являются высоко активными, как подтверждено их низкими значениями ингибирующей концентрации ИК99,9, которые в ФСБ сравнимы со значениями ОР-145. Важно, обнаружили, что все пептиды были эффективнее ОР-145 в присутствии плазмы. Большинство пептидов даже оказывало значительно более сильное действие с активностью в присутствии плазмы выше до 16 раз, чем у ОР-145 (Таблицы 2-4). Как показано в Таблице 2, ОР-145 имеет ИК99,9 в присутствии 50% плазмы, равную 204,8 мкМ. Р148 и Р159 имеют ИК99,9 в присутствии плазмы, равную 12,8 мкМ (16-кратное увеличение). Р140, Р141, Р144, Р145, Р150, Р151, Р152, Р153, Р158, Р160, Р161, Р162 и Р163 имеют ИК99,9 в присутствии плазмы, равную 25,6 мкМ (8-кратное увеличение). Р139, Р142, Р143, Р146, Р147, Р154, Р156 и Р157 имеют ИК99,9 в присутствии плазмы, равную 51,2 мкМ (4-кратное увеличение), и Р149 и Р155 имеют ИК99,9 в присутствии плазмы, равную 102,4 мкМ (2-кратное увеличение).
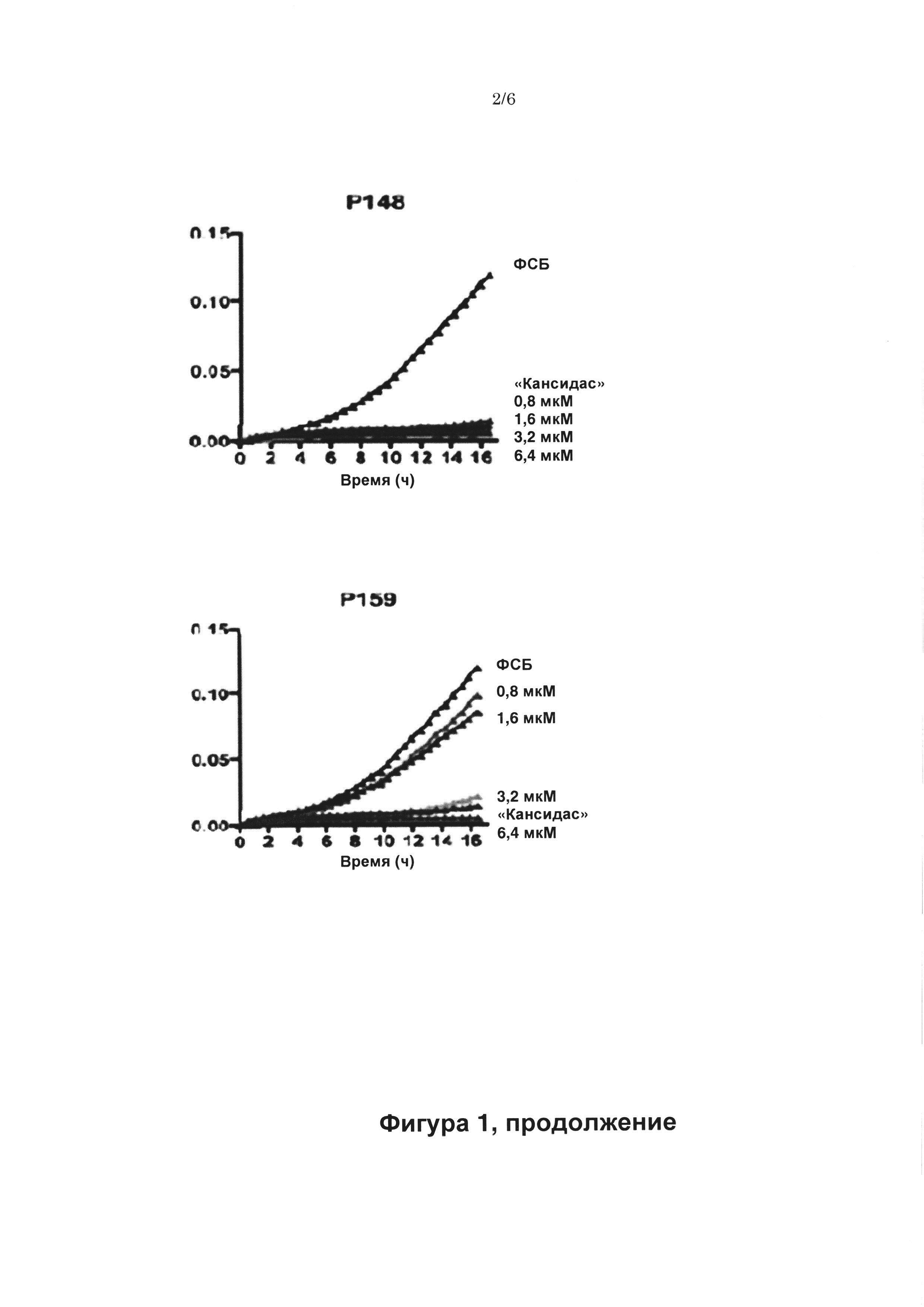
Было обнаружено, что пептиды Р145, Р148 и Р159 эффективны против бактериальных культур как в середине логарифмической фазы роста, так и в стационарной фазе роста (см. таблицы 2-4). Дополнительно, Р145, Р148 и Р159 способны ингибировать образование биопленок бактериями S. aureus (см. Фиг. 3). Кроме того,, Р145, Р148 и Р159 имеют наглядную иммуномодуляторную активность, так как нейтрализуют относящиеся к эндотоксинам липотейхоевую кислоту и липополисахариды, таким образом, снижая провоспалительный ответ (Таблица 12).
Дополнительно было обнаружено, что более короткие варианты Р148, имеющие по меньшей мере 16 аминокислот в составе, обладают антимикробной активностью в ФСБ, сравнимой с антимикробной активностью Р148 (см. таблицу 5). Важно, что в присутствии плазмы антимикробная активность у этих более коротких вариантов также сохраняется. Более короткий вариант Р148, имеющий 14 аминокислот в составе, обладает сниженной антимикробной активностью по сравнению с Р148, но все еще в 5 раз сильнее, чем ОР-145, в присутствии плазмы.
Следовательно, полипептид согласно настоящему изобретению обладает высокой антимикробной активностью против микроорганизмов, находящихся в биопленках или нет, как в присутствии, так и в отсутствии плазмы, с оптимальной противоспалительной (нейтрализующей соединения микроорганизмов) активностью, о чем свидетельствует нейтрализующая активность по отношению к липополисахаридам и липотейхоевой кислоте.
Воздействие антимикробных пептидов согласно настоящему изобретению на биопленочные инфекции является тройным: пептиды предотвратят образование биопленок и диспергируют оставшиеся биопленки, убьют бактерии, грибки или другие микроорганизмы в месте и поблизости от места высвобождения и будут управлять иммунным ответом посредством нейтрализации провоспалительных микробных эндотоксинов, таких как липотейхоевая кислота, пептидогликан и липополисахариды и активации макрофагов для усиления их фагоцитарной и микробицидной активности. Данный иммунный контроль необходим для предотвращения того, чтобы ткань, окружающая имплантаты, стала новой нишей для патогенов.
Соответственно, согласно настоящему изобретению предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью и обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях реализации может иметь:
- одну или несколько следующих аминокислотных замен:
 замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
 замену аминокислоты R и/или К на положительно заряженную аминокислоту;
замену аминокислоты R и/или К на положительно заряженную аминокислоту;
- одну или несколько замен аминокислоты на соответствующую D-аминокислоту;
- одну или несколько замен аминокислоты на соответствующую неприродную аминокислоту; и/или
- ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности.
Дополнительно предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью и обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях,
указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях реализации имеет:
- одну или несколько следующих аминокислотных замен:
 замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
 замену аминокислоты R и/или К на аминокислоту А или положительно заряженную аминокислоту;
замену аминокислоты R и/или К на аминокислоту А или положительно заряженную аминокислоту;
- одну или несколько замен аминокислоты на соответствующую D-аминокислоту;
- одну или несколько замен аминокислоты на соответствующую неприродную аминокислоту; и/или
- ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности.
В аминокислотных последовательностях или их вариантах, как определено в настоящей заявке, аминокислоты обозначены однобуквенными символами. Эти однобуквенные символы и трехбуквенные символы хорошо известны специалистам в данной области техники и имеют следующее значение: A (Ala) - аланин, С (Cys) -цистеин, D (Asp) - аспарагиновая кислота, Е (Glu) - глутаминовая кислота, F (Phe) фенилаланин, G (Gly) - глицин, Н (His) - гистидин, I (Не) - изолейцин, К (Lys) - лизин, L (Leu) - лейцин, М (Met) - метионин, N (Asn) - аспарагин, Р (Pro) - пролин, Q (Gin) - глутамин, R (Arg) - аргинин, S (Ser) - серии, Т (Thr) - треонин, V (Val) - валин, W (Trp) - триптофан, Y (Tyr) - тирозин. Используемый в настоящей заявке термин «положительно заряженная аминокислота» относится к аминокислоте, которая имеет положительный заряд при физиологических рН, то есть при рН 7,3-7,4.
Полипептид согласно настоящему изобретению обладает антимикробной активностью, предпочтительно антибактериальной, противовирусной и/или противогрибковой активностью, более предпочтительно антибактериальной и/или противогрибковой активностью. Кроме того, полипептид согласно настоящему изобретению предпочтительно обладает и антимикробной, и противовоспалительной активностью. Термин «антимикробная активность» полипептида, используемый в настоящей заявке, относится к противодействию росту или пролиферации по меньшей мере одного микроба, например, бактерии, вируса и/или грибка, и включает ингибирование, снижение или прекращение роста или пролиферации, а также убийство микроба. Микроб (микроорганизм) представляет собой организм, который имеет микроскопические размеры, то есть обычно слишком мал, чтобы было видно невооруженным человеческим глазом. Микробы очень разнообразны, они включают бактерии, вирусы, грибы, археи, простейших и микроскопические водоросли. Аналогично термины «антибактериальная активность», «противовирусная активность», «противогрибковая активность» и «противопаразитарная активность», используемые в настоящей заявке, относятся к противодействию росту или пролиферации соответственно бактерии, вируса, грибка и паразита в целом и включают ингибирование, снижение или предотвращение роста или пролиферации, а также убийство такового микроорганизма. Антимикробную активность, например, выражена в виде ингибирующей концентрации (ИК) или летальной концентрации (ЛК). Обозначения ИКх или ЛКх, используемые в настоящей заявке, относятся к самой низкой концентрации пептида, которая убивает по меньшей мере х% микробов после 2 часов. Например, обозначения ИК99,9 и ЛК99,9 относятся к самой низкой концентрации пептида, которая убивает ≥99,9% микробов. Антимикробная, антибактериальная, противовирусная, противогрибковая и противопаразитарная активность может быть измерена с помощью способов, известных в данной области техники.
Один из таких способов подробно описан в разделе «Примеры» настоящей заявки и включает анализ in vitro для определения антимикробной активности. В данном способе микробы, например, бактерии или грибки, инкубируют, например, в течение 1-2 часов с различными концентрациями полипептида согласно настоящему изобретению, где после этого смесь микробов с полипептидом инкубируют в или на подходящей культуральной среде, чтобы установить число выживших и/или убитых микробов по сравнению с образцом микробов, который не инкубировали с полипептидом, который дополнительно обрабатывали тем же способом.
Анализы вирусного бляшкообразования могут быть использованы для оценки противовирусной активности полипептида согласно настоящему изобретению. Вкратце, вирусный инокулят подвергают действию полипептида перед инфицированием монослоя пермиссивных клеток. После стандартного периода времени определяют титр вируса в клеточных экстрактах с использованием множественных разведений этих экстрактов инфицируемыми свежими монослоями клеток и количественного определения их воздействий на монослой клеток.
Для оценки противопаразитарной активности, полипептид согласно настоящему изобретению и паразита инкубируют в течение стандартного периода времени. После этого метаболическая активность паразитов может быть проанализирована напрямую, например, с помощью анализа на основе 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиумбромида (МТТ-тест), или паразитов переносят в клетки млекопитающих и после инкубации оценивают с помощью микроскопии размножение паразитов в данных клетках.
Термин «противовоспалительная активность» полипептида, используемый в настоящей заявке, относится к ингибированию, снижению или предотвращению воспалительной реакции у субъекта, который был инфицирован микробами, например, бактериями, вирусами, грибками и/или паразитами. Противовоспалительная активность полипептидов согласно настоящему изобретению достигается путем ингибирования, снижения или предотвращения высвобождения провоспалительных микробных соединений, таких как липотейхоевая кислота, пептидогликан и/или липополисахариды. Противовоспалительная активность может быть измерена с помощью способов, известных в данной области техники. Примерами подобных способов является анализ нейтрализации липополисахаридов и анализ нейтрализации липотейхоевой кислоты, как описано в разделе «Примеры» данной заявки. В подобном способе полипептид согласно настоящему изобретению смешивают с фиксированной концентрацией липополисахаридов или липотейхоевой кислоты, например, 500 нг/мл липополисахаридов или 2 мг/мл липотейхоевой кислоты, и инкубируют в течение 30 мин. После этого данные смеси добавляли в разбавленную свежую человеческую цельную кровь и спустя 20 часов измеряли уровень цитокинов (например, интерлейкина-8 (ИЛ-8) для липотейхоевой кислоты и интерлейкина-12р40 (ИЛ-12р40) для липополисахаридов) в образце крови с помощью твердофазного иммуноферментного анализа (ELISA).
Полипептиды согласно настоящему изобретению устойчивы к воздействию плазмы, также называемой плазмой крови, предпочтительно к воздействию плазмы человека. Термин «плазма» или «плазма крови», используемый в настоящей заявке, имеет общеизвестное значение, используемое в данной области техники. Термин относится к жидкой части крови, из которой удалены эритроциты, лейкоциты и тромбоциты, указанная часть содержит белки, гормоны и другие органические соединения и неорганические соединения, такие как электролиты. Термин «устойчивый к воздействию плазмы», используемый в настоящей заявке, определяется как обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, предпочтительно плазмы человека, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях. Предпочтительно указанная активность против по меньшей мере одного вида микроорганизмов является по меньшей мере в 1,5 раза выше, чем активность ОР-145, более предпочтительно по меньшей мере в 2 раза выше, более предпочтительно по меньшей мере в 4 раза выше, более предпочтительно по меньшей мере в 5 раз выше активности ОР-145. Особенно предпочтительные полипептиды обладают антимикробной активностью против по меньшей мере одного вида микроорганизмов, которая по меньшей мере в 16 раз выше в присутствии 50% плазмы, чем антимикробная активность ОР-145.
В случае «в присутствии 50% плазмы», это означает, что антимикробную активность измеряют, когда полипептид или ОР-145 инкубируют с микробами в жидкости, такой как ФСБ с добавлением плазмы, предпочтительно плазмы человека, с конечной концентрацией 50%. В случае «одинаковые условия реакции», это означает, что условия, при которых определяют антимикробную, антибактериальную, противовирусную, противогрибковую и/или противопаразитарную активность полипептида согласно настоящему изобретению, являются такими же, как условия, при которых определяют антимикробную, антибактериальную, противовирусную, » противогрибковую и/или противопаразитарную активность ОР-145. Подобные условия включают (но не ограничиваются этим) буфер, в котором инкубируют полипептид и микробы, идентичность микробных видов, концентрации микробов, времени и температуры инкубации и источника используемой плазмы.
ОР-145 имеет последовательность JIGKEFKRIVERIKRFLRELVRPLRB, где J - ацетил и В - амид. Специалист вполне способен синтезировать ОР-145, чтобы иметь возможность сравнить антимикробную активность ОР-145 с антимикробной активностью других пептидов, используя широко применяемые способы твердофазного синтеза или рекомбинантные способы, описанные более подробно ниже в настоящей заявке. Кроме того, ацетилирование и амидирование являются стандартными техниками, используемыми в данной области техники, таким образом, специалист способен провести ацетилирование N-конца и амидирование С-конца пептидной цепи ОР-145.
Как подробно описано в настоящей заявке антимикробная, антибактериальная, противовирусная, противогрибковая и/или противопаразитарная активность in vitro предпочтительно выражена в виде ИК99,9 или ИК50. Обозначения «ИК99.9» и «ИК50», используемые в настоящей заявке, относятся к самой низкой концентрации пептида, которая убивает соответственно по меньшей мере 99,9% или 50% микробов в течение заданного периода времени, например, 2 часов. Предпочтительно, полипептиды согласно настоящему изобретению имеют ИК99,9 in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, которая составляет по большей мере 75% от ИК99,9 ОР-145 при определении в одинаковых условиях. ИК99,9 in vitro полипептида согласно настоящему изобретению против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы составляет предпочтительно по большей мере 70% от ИК99.9 ОР-145 при определении в одинаковых условиях, более предпочтительно по большей мере 60%, более предпочтительно по большей мере 50%, более предпочтительно по большей мере 40%, более предпочтительно по большей мере 30%, более предпочтительно по большей мере 20%, наиболее предпочтительно по большей мере 10%. Особенно предпочтительные полипептиды имеют ИК99,9 in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, которая составляет по большей мере 10% от ИК99,9 ОР-145 при определении в одинаковых условиях.
Полипептиды согласно настоящему изобретению предпочтительно имеют ИК99,9 in vitro, равной по большей мере 150 мкМ после 2 часов при 37°С против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы. Указанную ИК99,9 предпочтительно определяют в соответствии со способом определения антимикробной активности, как описано в настоящей заявке в разделе «Примеры». Указанный способ, описанный в разделе «Примеры», для определения антимикробной активности против микробов, не связанных с образованием биопленок, включает смешивание 50 мкл раствора полипептида в ФСБ с добавлением плазмы человека с конечной концентрацией 50% и 20 мкл бактериальной суспензии с концентрацией 5×106 колониеобразующих единиц (КОЕ) на мл ФСБ в лунке. После инкубации этой смеси в течение 2 часов при 37°С в условиях встряхивания образец используют для оценки количества бактерий. Самая низкая концентрация пептида, при которой убиты 99,9% бактерий, называется ингибирующей концентрацией 99,9 (ИК99,9). Количество бактерий может быть определено путем ручного подсчета КОЕ. Для определения антибактериальной активности, например, используют концентрацию 1×106 КОЕ/мл бактерий, для определения противогрибковой активности, например, используют концентрацию 1×105 клеток/мл.
Для определения активности против биопленок, указанный способ, описанный в разделе «Примеры», включает определение ИК50 после инкубации полипептида в течение 24 часов при 37°С с 1×108 КОЕ/мл штамма S. aureus JAR060131 в подобранной для образования биопленок среде ВМ2 в 96-луночных полипропиленовых планшетах, покрытых плазмой путем инкубации в течение ночи с 20% плазмой при 4°С, удаления планктонных бактерий четырьмя промывками ФСБ и окрашивания биопленок кристаллическим фиолетовым. После солюбилизации с этанолом определяют оптическую плотность при 590 нм в качестве меры массы биопленки.
Полипептиды согласно настоящему изобретению предпочтительно имеют ИК99,9 in vitro, равной по большей мере 100 мкМ, в присутствии 50% плазмы,, более предпочтительно по большей мере 80 мкМ, более предпочтительно по большей мере 51,2 мкМ, более предпочтительно по большей мере 30 мкМ. Предпочтительные полипептиды согласно настоящему изобретению имеют ИК99,9, как определено в настоящей заявке, равной по большей мере 25,6 мкМ. Особенно предпочтительны полипептиды, демонстрирующие ИК99,9 in vitro в присутствии 50% плазмы против по меньшей мере одного вида микроорганизмов, равной по большей мере 12,8 мкМ.
Указанный по меньшей мере один вид микроорганизмов является, например, видом бактерий, таким как S. aureus, S. epidermidis, P. aeruginosa, видом грибков, таким как С. albicans и A. niger, видом паразитов, таким как Plasmodium falciparum и Toxoplasma gondii, или видом вирусов, таким как вирус гепатита А, вирус гепатита С, вирус гриппа типа А и т.д. Предпочтительно, полипептид согласно настоящему изобретению имеет ИК99,9 in vitro, равную по большей мере 105 мкМ, против по меньшей мере одного вида бактерий или грибков в присутствии 50% плазмы, предпочтительно против S. aureus, S. epidermidis, P. aeruginosa, С. albicans и A. niger, наиболее предпочтительно полипептид согласно настоящему изобретению имеет ИК99.9 in vitro в присутствии 50% плазмы, равной по большей мере 105 мкМ против по меньшей мере S. aureus, наиболее предпочтительно против штамма S. aureus JAR, описанного в Campoccia et al. (Int J Artif Organs. 2008 Sep; 31(9):841-7). Предпочтительные полипептиды согласно настоящему изобретению имеют ИК99,9, как описано в настоящей заявке, против S. aureus, равной по большей мере 25,6 мкМ, более предпочтительно по большей мере 12,8 мкМ.
Предпочтительный вариант последовательности имеет не более одной замены аминокислоты на аминокислоту А. Это может быть любая аминокислота, например аминокислота в любом из аминокислотных положений от 1 до 24. Как показано в таблицах 6-8, полипептиды, где одна аминокислота заменена на аланин, сохраняют по меньшей мере часть своей антимикробной активности, тогда как для некоторых имеющих аланиновую замену полипептидов активность даже повышена.
Согласно настоящему изобретению также предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности,
указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью и обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro в присутствии 50% плазмы, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях реализации имеет:
- одну или несколько следующих аминокислотных замен:
 замену аминокислоты К на положительно заряженную аминокислоту, предпочтительно на аминокислоту R, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
замену аминокислоты К на положительно заряженную аминокислоту, предпочтительно на аминокислоту R, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
 замену аминокислоты R на положительно заряженную аминокислоту, предпочтительно на аминокислоту К, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
замену аминокислоты R на положительно заряженную аминокислоту, предпочтительно на аминокислоту К, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
 замену аминокислоты L на аминокислоту V, I или W;
замену аминокислоты L на аминокислоту V, I или W;
 замену аминокислоты Y на аминокислоту W или Q;
замену аминокислоты Y на аминокислоту W или Q;
 замену аминокислоты V на аминокислоту F или А;
замену аминокислоты V на аминокислоту F или А;
 замену аминокислоты I на аминокислоту L;
замену аминокислоты I на аминокислоту L;
 замену аминокислоты W на аминокислоту F, Y, L или I;
замену аминокислоты W на аминокислоту F, Y, L или I;
- одну или несколько замен аминокислот на соответствующую D-аминокислоту;
- одну или несколько замен аминокислот на соответствующую неприродную аминокислоту; и/или
- ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности.
Согласно настоящему изобретению также предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью и обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro в присутствии 50% плазмы, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях реализации имеет:
- одну или несколько следующих аминокислотных замен:
 замену аминокислоты К на аминокислоту А или положительно заряженную аминокислоту, предпочтительно на аминокислоту A, R, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
замену аминокислоты К на аминокислоту А или положительно заряженную аминокислоту, предпочтительно на аминокислоту A, R, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
 замену аминокислоты R на аминокислоту А или положительно заряженную аминокислоту, предпочтительно на аминокислоту А, К, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
замену аминокислоты R на аминокислоту А или положительно заряженную аминокислоту, предпочтительно на аминокислоту А, К, гемолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту;
 замену аминокислоты L на аминокислоту А, V, I или W;
замену аминокислоты L на аминокислоту А, V, I или W;
 замену аминокислоты Y на аминокислоту A, W или Q;
замену аминокислоты Y на аминокислоту A, W или Q;
 замену аминокислоты V на аминокислоту F или А;
замену аминокислоты V на аминокислоту F или А;
 замену аминокислоты I на аминокислоту А или L;
замену аминокислоты I на аминокислоту А или L;
 замену аминокислоты W на аминокислоту A, F, Y, L или I;
замену аминокислоты W на аминокислоту A, F, Y, L или I;
- одну или несколько замен аминокислот на соответствующую D-аминокислоту;
- одну или несколько замен аминокислот на соответствующую неприродную аминокислоту; и/или
- ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности.
Подобный предпочтительный вариант последовательности дополнительно предпочтительно имеет по большей мере одну замену аминокислоты на аминокислоту А. Это может быть любая аминокислота, таким образом, аминокислота в любом из аминокислотных положений от 1 до 24 может быть заменена на аминокислоту А.
Вариант аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR, используемый в настоящей заявке, имеет длину по меньшей мере в 14 аминокислот и предпочтительно одну или несколько следующих аминокислотных замен:
- замену аминокислоты К на положительно заряженную аминокислоту, предпочтительно на аминокислоту R, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, более предпочтительно на аминокислоту R;
- замену аминокислоты R на положительно заряженную аминокислоту, предпочтительно на аминокислоту К, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, более предпочтительно на аминокислоту К;
- замену аминокислоты L на аминокислоту V, I или W;
- замену аминокислоты Y на аминокислоту W или Q;
- замену аминокислоты V на аминокислоту F или А;
- замену аминокислоты I на аминокислоту L;
- замену аминокислоты W на аминокислоту F, Y, L или I;
- замена одной или нескольких аминокислот на соответствующие D-аминокислоты;
- замену одной или нескольких аминокислот на соответствующие неприродные аминокислоты. Предпочтительно, указанный вариант последовательности имеет до 14 указанных замен, более предпочтительно до 10 указанных замен, например, до 9, до 8, до 7, до 6, до 5, до 4, до 3, до 2 или до 1 указанной замены.
Предпочтительно, указанный вариант последовательности в некоторых случаях имеет одну или несколько следующих аминокислотных замен:
- замену аминокислоты К в аминокислотном положении 2 на аминокислоту R;
- замену аминокислоты К в аминокислотном положении 3 на аминокислоту R;
- замену аминокислоты L в аминокислотном положении 4 на аминокислоту V;
- замену аминокислоты Y в аминокислотном положении 5 на аминокислоту W;
- замену аминокислоты L в аминокислотном положении 8 на аминокислоту V;
- замену аминокислоты V в аминокислотном положении 9 на аминокислоту F или А;
- замену аминокислоты К в аминокислотном положении 10 на аминокислоту R;
- замену аминокислоты I в аминокислотном положении 11 на аминокислоту L;
- замену аминокислоты L в аминокислотном положении 12 на аминокислоту I или W;
- замену аминокислоты W в аминокислотном положении 15 на аминокислоту F, Y, L или I;
- замену аминокислоты W в аминокислотном положении 16 на аминокислоту F, Y, L или I;
- замену аминокислоты Y в аминокислотном положении 18 на аминокислоту Q;
- замену аминокислоты К в аминокислотном положении 20 на аминокислоту R;
- замену аминокислоты R в аминокислотном положении 21 на аминокислоту К;
- замену одной или нескольких аминокислот на соответствующую D-аминокислоту.
В данной заявке нумерация положений аминокислот является следующей: L1K2K3L4Y5K6R7L8V9K10I11L12K13R14W15W16R17Y18L19K20R21P22V23R24. Указанный вариант дополнительно предпочтительно имеет в некоторых случаях одну или несколько, более предпочтительно по большей мере одну, замен аминокислоты на аминокислоту А. Это может быть любая аминокислота, таким образом, аминокислота в любом из аминокислотных положений от 1 до 24 может быть заменена на аминокислоту А.
Предпочтительно, вариант последовательности, как определено в настоящей заявке, имеет до 15 указанных аминокислотных замен, более предпочтительно до 10 указанных аминокислотных замен, например, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 указанных замен. Кроме того, вариант последовательно, как определено в настоящей заявке, предпочтительно включает по меньшей мере аминокислотную последовательность KRLVKILKRWWRYL, то есть аминокислоты в положениях 6-19, которая в некоторых случаях может иметь одну или несколько указанных аминокислотных замен.
Следовательно, предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или включающий вариант указанной аминокислотной последовательности,
указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью и обладает антимикробной, антибактериальной, противовирусной, противогрибковой и/или противопаразитарной активностью in vitro против по меньшей мере одного вида микроорганизмов в присутствии 50% плазмы, которая по меньшей мере в 1,3 раза выше, чем активность ОР-145, при определении в одинаковых условиях,
указанный вариант последовательности, имеет по меньшей мере аминокислотную последовательность KRLVKILKRWWRYL, которая в некоторых случаях может содержать:
- до 10 следующих аминокислотных замен:
 замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы;
 замену аминокислоты R и/или К на аминокислоту А или положительно заряженную аминокислоту;
замену аминокислоты R и/или К на аминокислоту А или положительно заряженную аминокислоту;
- одну или несколько замен аминокислот на соответствующую D-аминокислоту;
- одну или несколько замен аминокислот на соответствующую неприродную аминокислоту; и/или
- ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности.
Вариант последовательности, который имеет по меньшей мере одну из указанных аминокислотных замен, дополнительно предпочтителен.
Предпочтительный полипептид согласно настоящему изобретению включает аминокислотную последовательность пептидов Р139, Р140, Р141, Р142, Р143, Р144, Р145, Р146, Р147, Р148, Р149, Р150, Р151, Р152, Р153, Р154, Р155, Р156, Р157, Р158, Р159, Р160, Р161, Р162 или Р163, как представлено в таблице 1, потому что данные пептиды обладают высокой антимикробной активностью в ФСБ и обладают повышенной антимикробной активностью в присутствии плазмы по сравнению с пептидом ОР-145. Предпочтительно, указанный полипептид включает аминокислотную последовательность пептидов Р139, Р140, Р141, Р142, Р145, Р146, Р147, Р148, Р150, Р151, Р152, Р153, Р154, Р156, Р157, Р158, Р159, Р160, Р161, Р162 или Р163, как представлено в таблице 1, потому что данные пептиды обладают повышенной по меньшей мере в 4 раза активностью в присутствии плазмы в сравнении с ОР-145. Более предпочтительно, указанный полипептид включает аминокислотную последовательность пептидов Р140, Р141, Р145, Р148, Р150, Р151, Р152, Р153, Р158, Р159, Р160, Р161, Р162 или Р163, как представлено в таблице 1, потому что данные пептиды обладают повышенной по меньшей мере в 8 раз активностью в присутствии плазмы в сравнении с ОР-145.
Особенно предпочтительный полипептид согласно настоящему изобретению включает аминокислотную последовательность LKRLYKRLAKLIKRLYRYLKKPVR, которая является аминокислотной последовательностью пептида Р145, или вариант указанной аминокислотной последовательности, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот и в некоторых случаях имеет одну или несколько замен аминокислот на соответствующую D-аминокислоту и/или на соответствующую неприродную аминокислоту и/или в некоторых случаях имеет ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности, более предпочтительно указанный полипептид включает по меньшей мере аминокислоты в положениях 14-19 аминокислотной последовательности LKRLYKRLAKLIKRLYRYLKKPVR, наиболее предпочтительно указанный полипептид включает аминокислотную последовательность LKRLYKRLAKLIKRLYRYLKKPVR. Подобный полипептид является особенно предпочтительным, потому что пептид Р145 обладает сильной антимикробной активностью широкого спектра как в присутствии, так и в отсутствии сыворотки и противовоспалительными свойствами.
Другой особенно предпочтительный полипептид согласно настоящему изобретению включает аминокислотную последовательность
LKRVWKRVFKLLKRYWRQLKKPVR, которая является аминокислотной последовательностью пептида Р148, или вариант указанной аминокислотной последовательности, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот и в некоторых случаях имеет одну или несколько замен аминокислоты на соответствующую D-аминокислоту и/или на соответствующую неприродную аминокислоту и/или в некоторых случаях имеет ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности, более предпочтительно указанный полипептид включает по меньшей мере аминокислоты в положениях 14-19 аминокислотной последовательности LKRVWKRVFKLLKRYWRQLKKPVR, наиболее предпочтительно указанный полипептид включает аминокислотную последовательность LKRVWKRVFKLLKRYWRQLKKPVR, RVWKRVFKLLKRYWRQLKKPVR, LKRVWKRVFKLLKRYWRQLKKP, RVWKRVFKLLKRYWRQLKK, WKRVFKLLKRYWRQLKKPVR, LKRVWKRVFKLLKRYWRQLK, VWKRVFKLLKRYWRQLKK, WKRVFKLLKRYWRQLK, KRVFKLLKRYWRQL. Данные последовательности являются аминокислотными последовательностями пептидов Р148, Р325, Р326, Р327, Р328, Р329, РЗЗО, Р331 и Р332. Подобный полипептид является особенно предпочтительным, потому что пептид Р148 обладает сильной антимикробной активностью широкого спектра как в присутствии, так и в отсутствии сыворотки и противовоспалительными свойствами, а пептиды Р325, Р326, Р327, Р328, Р329, Р330, Р331 и Р332 сохраняют активность пептида Р148.
Другой особенно предпочтительный полипептид согласно настоящему изобретению включает аминокислотную последовательность LKRLYKRVFRLLKRYYRQLRRPVR, которая является аминокислотной последовательностью пептида Р159, или вариант указанной аминокислотной последовательности, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях имеющий одну или несколько замен аминокислоты на соответствующую D-аминокислоту и/или на соответствующую неприродную аминокислоту и/или необязательно имеет ретро-инвертированную последовательность из по меньшей мере 14 последовательных аминокислот из указанной аминокислотной последовательности, более предпочтительно указанный полипептид включает по меньшей мере аминокислоты в положениях 14-19 аминокислотной последовательности LKRLYKRVFRLLKRYYRQLRRPVR, наиболее предпочтительно указанный полипептид включает аминокислотную последовательность LKRLYKRVFRLLKRYYRQLRRPVR. Подобный полипептид является особенно предпочтительным, потому что пептид Р159 обладает сильной антимикробной активностью широкого спектра как в присутствии, так и в отсутствии сыворотки и противовоспалительными свойствами.
Дополнительный предпочтительный полипептид согласно настоящему изобретению включает аминокислотную последовательность пептидов Р246, Р247, Р248, Р249, Р250, Р251, Р252, Р253, Р254, Р255, Р256, Р257, Р258, Р259, Р260, Р261, Р262, Р263, Р264, Р265, Р266, Р267, Р268, Р269, Р270, Р271, Р272, Р273, Р274, Р275,Р276, Р277, Р278, Р279, Р280, Р281, Р282, Р283, Р284, Р285, Р286, Р287, Р288, Р289, Р290, Р291, Р292, Р293, Р294, Р295, Р296, Р297, Р298, Р299, Р300, Р301, Р302, РЗОЗ, Р304, Р305, Р306, Р307, Р308, Р309, Р310, Р311, Р312, Р313, Р314, Р315, Р316 или Р317, как представлено в Таблице 6, 7 и 8, потому что данные пептиды обладают высокой антимикробной активностью в ФСБ и обладают повышенной антимикробной активностью в присутствии плазмы по сравнению с пептидом ОР-145. Полипептиды, имеющие подобную аминокислотную последовательность, являются вариантами полипептидов Р145, Р148 или Р159, где одна аминокислота заменена на аминокислоту А. Особенно предпочтительные полипептиды согласно настоящему изобретению имеют аминокислотную последовательность пептида Р276, варианта пептида Р148, где аминокислота R в положении 7 заменена на аминокислоту А.
Предпочтительный полипептид, согласно настоящему изобретению, имеет аминокислотную последовательность полипептида, выбранную из Таблицы 1, 2, 5, 6, 7, 8, 9 и/или 10. Полипептид согласно настоящему изобретению более предпочтительно включает аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или ее вариант, который имеет летальную концентрацию 99,9 (ЛК99,9) в 50% плазме, равной по большей мере 102,4 мкМ, выбранной из Таблиц 2 или 5-10. В одном из вариантов реализации представлен полипептид, который имеет ЛК99,9 в 50% плазмы, равной по большей мере 51,2 мкМ, выбранной из Таблиц 2 или 5-10, более предпочтительно равной по большей мере 51,2 мкМ.
Альтернативно или дополнительно к заменам аминокислоты на другую аминокислоту, как описано выше, вариант аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR, как определено в настоящей заявке, может содержать одну ли несколько замен L-аминокислоты на ее соответствующую D-аминокислоту или на D-аминокислоту, соответствующую L-аминокислоте, которая присутствует в указанной аминокислотной последовательности после одной или нескольких аминокислотных замен, обозначенных выше. Аминокислоты, обозначенные в настоящей заявке символом в виде одной заглавной буквой, например, А - аланин, являются теми L-аминокислотами, традиционно обнаруживаемыми во встречающихся в природе белках. Термин «соответствующая D-аминокислота», используемый в настоящей заявке, определяется как D-аминокислотная противоположность L-аминокислоты. Например, соответствующей D-аминокислотой аланина (А) является D-аланин (а), соответствующей D-аминокислотой аргинина (R) является D-аргинин (r), соответствующей D-аминокислотой аспарагина (N) является D-аспарагин (n) и т.д. Все L-аминокислоты в варианте последовательности, как определено в настоящей заявке, могут быть заменены на свои соответствующие D-аминокислоты. Следовательно, предложен полипептид согласно настоящему изобретению, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой, противопаразитарной и/или противовоспалительной активностью, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и необязательно имеет:
- одну или несколько следующих аминокислотных замен:
 замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы, или на соответствующую D-аминокислоту аминокислоты L, V, F, A, I, W, Y или Q;
замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы, или на соответствующую D-аминокислоту аминокислоты L, V, F, A, I, W, Y или Q;
 замену аминокислоты R на положительно заряженную аминокислоту, предпочтительно на аминокислоту К, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, или на соответствующую D-аминокислоту аминокислоты К или R;
замену аминокислоты R на положительно заряженную аминокислоту, предпочтительно на аминокислоту К, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, или на соответствующую D-аминокислоту аминокислоты К или R;
 замену аминокислоты К на положительно заряженную аминокислоту, предпочтительно на аминокислоту R, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, или на соответствующую D-аминокислоту аминокислоты R или К;
замену аминокислоты К на положительно заряженную аминокислоту, предпочтительно на аминокислоту R, гомолизин, гомоаргинин, орнитин, диаминобутановую кислоту и диаминопропионовую кислоту, или на соответствующую D-аминокислоту аминокислоты R или К;
- одну или несколько замен аминокислоты на соответствующую D-аминокислоту. Подобный вариант последовательности может дополнительно иметь замену одной или нескольких аминокислот, предпочтительно по большей мере одной аминокислоты, выбранной из аминокислот К и R, замененных на аминокислоту А или на соответствующую D-аминокислоту. Предпочтительно, указанный вариант последовательности необязательно имеет одну или несколько следующих аминокислотных замен:
 замену аминокислоты К на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
замену аминокислоты К на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
 замену аминокислоты R на аминокислоту К или на соответствующую D-аминокислоту аминокислоты К;
замену аминокислоты R на аминокислоту К или на соответствующую D-аминокислоту аминокислоты К;
 замену аминокислоты L на аминокислоту V, I или W или на соответствующую D-аминокислоту аминокислоты V, I или W;
замену аминокислоты L на аминокислоту V, I или W или на соответствующую D-аминокислоту аминокислоты V, I или W;
 замену аминокислоты Y на аминокислоту W или Q или на соответствующую D-аминокислоту аминокислоты W или Q;
замену аминокислоты Y на аминокислоту W или Q или на соответствующую D-аминокислоту аминокислоты W или Q;
• замену аминокислоты V на аминокислоту F или А или на соответствующую D-аминокислоту аминокислоты F или А;
 замену аминокислоты I на аминокислоту L или на соответствующую D-аминокислоту аминокислоты L;
замену аминокислоты I на аминокислоту L или на соответствующую D-аминокислоту аминокислоты L;
 замену аминокислоты W на аминокислоту F, Y, L или I или на соответствующую D-аминокислоту аминокислоты F, Y, L или I;
замену аминокислоты W на аминокислоту F, Y, L или I или на соответствующую D-аминокислоту аминокислоты F, Y, L или I;
- одну или несколько замен аминокислоты на соответствующую D-аминокислоту.
Более предпочтительно, указанный вариант последовательности необязательно имеет одну или несколько следующих аминокислотных замен:
- замену аминокислоты К в аминокислотном положении 2 на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
- замену аминокислоты К в аминокислотном положении 3 на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
- замену аминокислоты L в аминокислотном положении 4 на аминокислоту V или на соответствующую D-аминокислоту аминокислоты V;
- замену аминокислоты Y в аминокислотном положении 5 на аминокислоту W или на соответствующую D-аминокислоту аминокислоты W;
- замену аминокислоты L в аминокислотном положении 8 на аминокислоту V или на соответствующую D-аминокислоту аминокислоты V;
- замену аминокислоты V в аминокислотном положении 9 на аминокислоту F или А или на соответствующую D-аминокислоту аминокислоты F или А;
- замену аминокислоты К в аминокислотном положении 10 на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
- замену аминокислоты I в аминокислотном положении 11 на аминокислоту L или на соответствующую D-аминокислоту аминокислоты L;
- замену аминокислоты L в аминокислотном положении 12 на аминокислоту I или W или на соответствующую D-аминокислоту аминокислоты I или W;
- замену аминокислоты W в аминокислотном положении 15 на аминокислоту F, Y, L или I или на соответствующую D-аминокислоту аминокислоты F, Y, L или I;
- замену аминокислоты W в аминокислотном положении 16 на аминокислоту F, Y, L или I или на соответствующую D-аминокислоту аминокислоты F, Y, L или I;
- замену аминокислоты Y в аминокислотном положении 18 на аминокислоту Q или на соответствующую D-аминокислоту аминокислоты Q;
- замену аминокислоты К в аминокислотном положении 20 на аминокислоту R или на соответствующую D-аминокислоту аминокислоты R;
- замену аминокислоты R в аминокислотном положении 21 на аминокислоту К или на соответствующую D-аминокислоту аминокислоты К;
- замену аминокислоты на соответствующую D-аминокислоту.
Вариант аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR, как определен в настоящей заявке, может содержать до 24 замен L-аминокислоты на ее соответствующую D-аминокислоту. Следовательно, вариант последовательности может полностью состоять из D-аминокислот. Например, вариант последовательности может содержать 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 5, 4, 3, 2 или 1 замену L-аминокислоты на ее соответствующую D-аминокислоту. Предпочтительно, указанный вариант последовательности, имеет одну или несколько замен L-аминокислоты на ее соответствующую D-аминокислоту, включает по меньшей мере 14 аминокислот из аминокислотной последовательности пептидов Р139, Р140, Р141, Р142, Р143, Р144, Р145, Р146, Р147, Р148, Р149, Р150, Р151, Р152, Р153, Р154, Р155, Р156, Р157, Р158, Р159, Р160, Р161, Р162 или Р163, как представлено в Таблице 1. Более предпочтительно, полипептид согласно настоящему изобретению, необязательно включает одну или несколько замен L-аминокислоты на ее соответствующую D-аминокислоту, включает аминокислотную последовательность пептида Р145, Р148 или Р159. В одном из вариантов реализации вариант последовательности, как определено в настоящей заявке, содержит одну замену аминокислоты на соответствующую D-аминокислоту. Положение D-аминокислоты в аминокислотной последовательности не имеет значения. В другом варианте реализации вариант последовательности содержит замену всех L-аминокислот на их соответствующие D-аминокислоты. Вариант последовательности, как определено в настоящей заявке, может дополнительно быть ретро-инвертированным пептидом из по меньшей мере 14 последовательных аминокислот из аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR или из аминокислотной последовательности одного из пептидов Р139-Р163, предпочтительно Р145, Р148 или Р159. Предпочтительно, указанный вариант последовательности является ретро-инвертированным пептидом полноразмерной указанной аминокислотной последовательности, предпочтительно аминокислотной последовательности одного из пептидов Р139-Р163, более предпочтительно Р145, Р148 или Р159. Ретро-инвертированный пептид является пептидом, состоящим из D-аминокислот в последовательности, обратной исходной аминокислотной последовательности. Например, предпочтительным вариантом последовательности согласно настоящему изобретению является ретро-инвертированный пептид аминокислотной последовательности пептида Р145, Р148 или Р159, то есть имеет последовательность соответственно rvpkklyrylrkilkalrkylrkl, rvpkklqrwyrkllkfvrkwvrkl или rvprrlqryyrkllrfvrkylrkl или имеет в составе по меньшей мере 14 аминокислот из одной из указанных последовательностей
Вариант аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR, как определено в настоящей заявке, может включать до 5 замен аминокислоты на неприродную аминокислоту или замен аминокислоты, которая представлена в указанной аминокислотной последовательности после одной или нескольких аминокислотных замен, обозначенных выше, на неприродную аминокислоту. Термин «неприродные аминокислоты», используемый в настоящей заявке, относится к некодируемым генетически аминокислотам, независимо от того, встречаются они в природе или нет. Неприродные аминокислоты, которые могут быть присутствовать в варианте аминокислотной последовательности, как определено в настоящей заявке, включают: β-аминокислоты; п-ацил-L-фенилаланин; N-ацетиллизин; О-4-аллил-L-тирозин; 2-аминоадипиновая кислоту; 3-аминоадипиновая кислоту; бета-аланин; 4-трет-бутил-2-азидоянтарная кислота; бета-аминопропионовую кислоту; 2-аминобутановую кислоту; 4-аминобутановую кислоту; 2, 4-диаминобутановую кислоту; 6-аминокапроновую кислоту; 2-аминогептановую кислоту; 2-аминоизобутановую кислоту; 3-аминоизобутановую кислоту; 2-аминопимелиновую кислоту; п-аминофенилаланин; 2,3-диаминобутановую кислоту; 2,3-диаминопропионовую кислоту; 2,2'-диаминопимелиновую кислоту; п-амино-L-фенилаланин; п-азидо-L-фенилаланин; D-аллилглицин; п-бензоил-L-фенилаланин; 3-бензотиенилаланин; п-бромфенилаланин; трет-бутилаланин; трет-бутилглицин; 4-хлорфенилаланин; циклогексилаланин; цистеиновую кислоту; D-цитруллин; тио-L-цитруллин; десмозин; эпсилон-аминокапроновую кислоту; N-этилглицин; N-этиласпарагин; 2-фторфенилаланин; 3-фторфенилаланин; 4-фторфенилаланин; гомоаргинин; гомоцистеин; гомосерин; гидроксилизин; алло-гидроксилизин; метиловый эфир 3-(3-метил-4-нитробензил)-L-гистидина; изодесмозин; алло-изолейцин; изопропил-L-фенилаланин; 3-метил-фенилаланин; N-метилглицин; N-метилизо лейцин; 6-N-метиллизин; О-метил-L-тирозин; N-метилвалин; метионина сульфоксид; 2-нафтилаланин; L-3-(2-нафтил)аланин; изосерин; 3-фенилсерин; норвалин; норлейцин; 5,5,5-трифтор-DL-лейцин; орнитин; 3-хлортирозин; N5-карбамоилорнитин; пеницилламин; фенилглицин; пиперидиновую кислоту; пиридилаланин; 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту; бета-2-тиенилаланин; γ-карбокси-DL-глутаминовую кислоту; 4-фтор-DL-глутаминовую кислоту; D-тироксин; алло-треонин; 5-гидрокситриптофан; 5-метокситриптофан; 5-фтортриптофан; 3-фторвалин.
Предпочтительно, природная аминокислота из указанной последовательности заменена на соответствующую неприродную аминокислоту. Используемый в настоящей заявке термин «соответствующая неприродная аминокислота» относится к неприродной аминокислоте, которая является производной от исходной природной аминокислоты. Например, природная аминокислота заменена на соответствующую β-аминокислоту. У β-аминокислот их аминогруппа связана с β-углеродом, а не с α-углеродом, как у природных аминокислот. Например, α-аланин заменен на β-аланин и т.д. Другими примерами замены природной аминокислоты на неприродную аминокислоту, которая является производной от указанной природной аминокислоты, являются следующие примеры. Алании, например, заменен на бета-аланин, трет-бутилаланин, 2-нафтилаланин; L-3-(2-нафтил)аланин, 2-аминоизобутановую кислоту. Аргинин, например, заменен на гомоаргинин, орнитин, NS-карбамоилорнитин, 3-аминопропионовую кислоту. Аспарагин, например, заменен на N-этиласпарагин. Аспарагиновая кислота, например, заменена на 4-трет-бутил-2-азидоянтарную кислоту. Цистеин, например, заменен на цистеиновую кислоту, гомоцистеин. Глутаминовая кислота, например, заменена на γ-карбокси-DL-глутаминовую кислоту, 4-фтор-DL-глутаминовую кислоту. Глутамин, например, заменен на D-цитруллин, тио-L-цитруллин. Глицин, например, заменен на N-метилглицин, трет-бутилглицин, N-метилглицин, D-аллилглицин. Гистидин, например, заменен на метиловый эфир 3-(3-метил-4-нитробензил)-L-гистидина. Изолейцин, например, заменен на изодесмозин, N-метилизолейцин, алло-изолейцин. Лейцин, например, заменен на норлейцин, десмозин, 5,5,5-трифторлейцин. Лизин, например, заменен на 6-N-метиллизин, 2-аминогептановую кислоту, N-ацетиллизин, гидроксилизин, алло-гидроксилизин. Метионин, например, заменен на метионина сульфоксид. Фенилаланин, например, заменен на п-амино-L-фенилаланин, 3-бензотиенилаланин, п-бромфенилаланин, п-ацил-L-фенилаланин, 2-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин. Пролин, например, заменен на 3-гидроксипролин, 4-гидроксипролин, 1-ацетил-4-гидрокси-L-пролин. Серии, например, заменен на гомосерин, изосерин, 3-фенилсерин. Треонин, например, заменен на D-тироксин, алло-треонин. Триптофан, например, заменен на 5-гидрокситриптофан, 5-метокситриптофан, 5-фтортриптофан. Тирозин, например, заменен на О-метил-L-тирозин, O-4-аллил-L-тирозин, 3-хлортирозин. Валин, например, заменен на норвалин, N-метилвалин, 3-фторвалин.
Следовательно, предложен полипептид согласно настоящему изобретению, включающий аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой, противопаразитарной и/или противовоспалительной активностью, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях имеет:
- одну или несколько следующих аминокислотных замен:
 замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы, или на соответствующую неприродную аминокислоту аминокислоты L, V, F, A, I, W, Y или Q;
замену одной или нескольких аминокислот, выбранных из группы аминокислот L, V, F, A, I, W, Y или Q, на другую аминокислоту, выбранную из указанной группы, или на соответствующую неприродную аминокислоту аминокислоты L, V, F, A, I, W, Y или Q;
 замену аминокислоты R на аминокислоту К или на соответствующую неприродную аминокислоту аминокислоты К;
замену аминокислоты R на аминокислоту К или на соответствующую неприродную аминокислоту аминокислоты К;
 замену аминокислоты К на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты К;
замену аминокислоты К на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты К;
- одну или несколько замен аминокислоты на соответствующую D-аминокислоту.
Подобный вариант последовательности может дополнительно содержать замену одной или нескольких аминокислот, предпочтительно по большей мере одной аминокислоты, выбранной из аминокислот К и R, замененных на соответствующую неприродную аминокислоту А. Предпочтительно, указанный вариант последовательности в некоторых случаях имеет одну или несколько следующих аминокислотных замен:
 замену аминокислоты К на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
замену аминокислоты К на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
 замену аминокислоты R на аминокислоту К или на соответствующую неприродную аминокислоту аминокислоты К;
замену аминокислоты R на аминокислоту К или на соответствующую неприродную аминокислоту аминокислоты К;
 замену аминокислоты L на аминокислоту V, I или W или на соответствующую неприродную аминокислоту аминокислоты V, I или W;
замену аминокислоты L на аминокислоту V, I или W или на соответствующую неприродную аминокислоту аминокислоты V, I или W;
 замену аминокислоты Y на аминокислоту W или Q или на соответствующую неприродную аминокислоту аминокислоты W или Q;
замену аминокислоты Y на аминокислоту W или Q или на соответствующую неприродную аминокислоту аминокислоты W или Q;
 замену аминокислоты V на аминокислоту F или А или на соответствующую неприродную аминокислоту аминокислоты F или А;
замену аминокислоты V на аминокислоту F или А или на соответствующую неприродную аминокислоту аминокислоты F или А;
 замену аминокислоты I на аминокислоту L или на соответствующую неприродную аминокислоту аминокислоты L;
замену аминокислоты I на аминокислоту L или на соответствующую неприродную аминокислоту аминокислоты L;
• замену аминокислоты W на аминокислоту F, Y, L или I или на соответствующую неприродную аминокислоту аминокислоты F, Y, L или I;
- одну или несколько замен аминокислот на соответствующую неприродную аминокислоту.
Более предпочтительно, указанный вариант последовательности необязательно имеет одну или несколько следующих аминокислотных замен:
- замену аминокислоты К в аминокислотном положении 2 на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
- замену аминокислоты К в аминокислотном положении 3 на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
- замену аминокислоты L в аминокислотном положении 4 на аминокислоту V или на соответствующую неприродную аминокислоту аминокислоты V;
- замену аминокислоты Y в аминокислотном положении 5 на аминокислоту W или на соответствующую неприродную аминокислоту аминокислоты W;
- замену аминокислоты L в аминокислотном положении 8 на аминокислоту V или на соответствующую неприродную аминокислоту аминокислоты V;
- замену аминокислоты V в аминокислотном положении 9 на аминокислоту F или А или на соответствующую неприродную аминокислоту аминокислоты F или А;
- замену аминокислоты К в аминокислотном положении 10 на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
- замену аминокислоты I в аминокислотном положении 11 на аминокислоту L или на соответствующую неприродную аминокислоту аминокислоты L;
- замену аминокислоты L в аминокислотном положении 12 на аминокислоту I или W или на соответствующую неприродную аминокислоту аминокислоты I или W;
- замену аминокислоты W в аминокислотном положении 15 на аминокислоту F, Y, L или I или на соответствующую неприродную аминокислоту аминокислоты F, Y, L или I;
- замену аминокислоты W в аминокислотном положении 16 на аминокислоту F, Y, L или I или на соответствующую неприродную аминокислоту аминокислоты F, Y, L или I;
- замену аминокислоты Y в аминокислотном положении 18 на аминокислоту Q или на соответствующую неприродную аминокислоту аминокислоты Q;
- замену аминокислоты К в аминокислотном положении 20 на аминокислоту R или на соответствующую неприродную аминокислоту аминокислоты R;
- замену аминокислоты R в аминокислотном положении 21 на аминокислоту К или на соответствующую неприродную аминокислоту аминокислоты К;
- замену аминокислоты на соответствующую D-аминокислоту.
Полипептид согласно настоящему изобретению может состоять из аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR или варианта данной последовательности, как определено в настоящей заявке. Используемый в настоящей заявке термин «полипептид» относится к пептидам, полипептидам и пептидомиметикам, которые включают множество аминокислот. Термины «полипептид» и «пептид» используются взаимозаменяемо. Самый короткий полипептид согласно настоящему изобретению, у которого было показано, что он обладает антимикробной активностью, имеет длину, равную 14 аминокислотам. Однако аминокислотная последовательность или ее вариант могут быть частью большего полипептида, то есть полипептида, который был удлинен с N-конца и/или С-конца на одну или несколько дополнительных аминокислот. Аминокислотная последовательность полипептида согласно настоящему изобретению или ее вариант может быть модифицирована на N-конце и/или С-конце, предпочтительно посредством включения в состав N-концевой и/или С-концевой элонгирующей группы. Альтернативно, указанная аминокислотная последовательность или ее вариант удлинены на N-конце и/или С-конце. Таким образом, полипептид согласно настоящему изобретению включает по меньшей мере 14 аминокислот и может включать до 1000 аминокислот. Однако предпочтительны более короткие полипептиды, чтобы удерживать производственные расходы на как можно более низком уровне. Предпочтительно, полипептид согласно настоящему изобретению имеет длину, равную 14-200 аминокислотам, более предпочтительно 14-100 аминокислотам, более предпочтительно 14-50 аминокислотам. Например, полипептид согласно настоящему изобретению включает от 14 до 24 аминокислот, то есть 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислоты. Предпочтительно указанный полипептид включает по меньшей мере 16 аминокислот, например, 16-200, 16-100 или 16-50 аминокислот. Указанный полипептид предпочтительно имеет 14-24 аминокислоты в составе. Подобный полипептид, имеющий 14-24 аминокислоты в составе, может дополнительно иметь N-концевую и/или С-концевую модификацию, такую как N-концевая модификация, выбранная из группы, состоящей из ацетил-, гексаноил-, деканоил-, мири стоил-, NH-(CH2-CH2-O)11-CO- и пропионил-остатка, и/или такую как С-концевая модификация, выбранная из группы, состоящей из амид-, NH-(CH2-CH2-O)11-СО-амид-остатка и одной или двух аминогексаноиловых групп. В одном из вариантов реализации полипептид согласно настоящему изобретению состоит из аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR или ее варианта, как определено в настоящей заявке, предпочтительно состоящего из аминокислотной последовательности пептида Р145, Р148 или Р159, как представлено в Таблице 1, или по меньшей мере из их 14 аминокислот, необязательно имеющего N-концевую и/или С-концевую модификацию, предпочтительно включающий N-концевую и/или С-концевую удлинняющую (элонгирующую) группу.
Используемый в настоящей заявке термин «пептидомиметик» относится к соединению, содержащему непептидные структурные элементы, такое соединение имитирует антимикробные, антибактериальные, противовирусные, противогрибковые, противопаразитарные и/или противовоспалительные свойства полипептида согласно настоящему изобретению. Следовательно, полипептид согласно настоящему изобретению может включать непептидные структурные элементы. Подобные непептидные структурные элементы могут присутствовать в аминокислотной последовательности полипептида согласно настоящему изобретению как результат замены или модификации одной или нескольких аминокислот указанной последовательности. Альтернативно, полипептид согласно настоящему изобретению может включать непептидные структурные элементы вне аминокислотной последовательности LKKLYKRLVKILKRWWRYLKRPVR или в ее варианте, как определено в настоящей заявке, то есть в необязательных N-концевых и/или С-концевых элонгирующих группах. Непептидный структурный элемент в пептидомиметике является, как правило, модификацией одной или нескольких существующих аминокислот. Предпочтительные пептидомиметики получают путем структурной модификации полипептидов согласно настоящему изобретению, например, с использованием неприродных аминокислот, таких как определены выше в настоящей заявке, конформационных ограничений, циклизации полипептида, изостерической замены или других модификаций. Аминокислотная последовательность полипептида согласно настоящему изобретению, таким образом, необязательно включает одну или несколько модификаций. Подобный полипептид может быть модифицирован в ходе естественных процессов, таких как посттрансляционный процессинг, или с помощью приемов химической модификации. Модификации могут быть введены в любое место на указанном полипептиде, включая в полипептидный остов, боковые цепи аминокислот и N-конец или С-конец. Одиночный полипептид может содержать множество видов модификаций или несколько модификаций одного вида. Модификации включают ацетилирование, амидирование, ацилирование, фосфорилирование, метилирование, деметилирование, АДФ-рибозилирование, образование дисульфидных связей, убиквитинирование, гамма-карбоксилирование, гликозилирование, гидроксилирование, йодирование, окисление, пэгилирование и сульфатирование. Дополнительно полипептид согласно настоящему изобретению может быть снабжен меткой, такой как биотин, флуоресцеин или флавин, липид или производное липида, сахарная группа. Полипептид согласно настоящему изобретения может дополнительно быть снабжен фрагментом для направленного воздействия.
В предпочтительном варианте реализации полипептид согласно настоящему изобретению является модифицированным на N-конце и/или С-конце. Полипептид согласно настоящему изобретению, таким образом, предпочтительно включает N-концевую и/или С-концевую удлинняющую группу. N-концевые и/или С-концевые элонгирующие группы, которые могут быть использованы в полипептиде согласно настоящему изобретению, хорошо известны в данной области техники. Предпочтительными примерами N-концевой модификации являются ацетил-, гексаноил-, деканоил-, миристоил-, NH-(CH2-CH2-O)11-CO- и пропионил-остаток. Предпочтительными примерами С-концевой модификации являются амид-, NH-(CH2-CH2-O)11-СО-амид-остаток и одна или две аминогексаноиловые группы. Однако другие N-концевые или С-концевые элонгирующие группы, которые известны специалисту в данной области техники, также приведут к созданию активных соединений. В одном из вариантов реализации указанный полипептид включает N-концевой ацетил-, гексаноил-, деканоил-, миристоил-, NH-(CH2-CH2-O)11-CO- или пропионил-остаток и С-концевой амид-, NH-(СН2-СН2-О)11-СО-амид-остаток и одну или две аминогексаноиловые группы. В одном из вариантов реализации предложен полипептид согласно настоящему изобретению, где N-конец ацетилирован и С-конец амидирован.
Таким образом, согласно настоящему изобретению предложен выделенный или рекомбинантный полипептид, включающий аминокислотную последовательность LKKXYKRLVKILKRWWRYLKRPVR или вариант указанной аминокислотной последовательности, указанный полипептид, обладает антимикробной, антибактериальной, противовирусной, противогрибковой, противопаразитарной и/или противовоспалительной активностью, указанный вариант последовательности, имеет по меньшей мере 14 аминокислот в составе и в некоторых случаях имеет одну или несколько, предпочтительно до 10, следующих аминокислотных замен:
- замену аминокислоты К в аминокислотном положении 2 на аминокислоту R;
- замену аминокислоты К в аминокислотном положении 3 на аминокислоту R;
- замену аминокислоты L в аминокислотном положении 4 на аминокислоту V;
- замену аминокислоты Y в аминокислотном положении 5 на аминокислоту W;
- замену аминокислоты L в аминокислотном положении 8 на аминокислоту V;
- замену аминокислоты V в аминокислотном положении 9 на аминокислоту F или А;
- замену аминокислоты К в аминокислотном положении 10 на аминокислоту R;
- замену аминокислоты I в аминокислотном положении 11 на аминокислоту L;
- замену аминокислоты L в аминокислотном положении 12 на аминокислоту I или W;
- замену аминокислоты W в аминокислотном положении 15 на аминокислоту F, Y, L или I;
- замену аминокислоты W в аминокислотном положении 16 на аминокислоту F, Y, L или I;
- замену аминокислоты Y в аминокислотном положении 18 на аминокислоту Q;
- замену аминокислоты К в аминокислотном положении 20 на аминокислоту R;
- замену аминокислоты R в аминокислотном положении 21 на аминокислоту К; и/или
- замену одной или нескольких аминокислот на соответствующие D-аминокислоты, при этом указанная аминокислотная последовательность или указанный ее вариант включает N-концевую и/или С-концевую элонгирующую группу, предпочтительно включающую N-концевой ацетил-, гексаноил-, деканоил-, миристоил-, NH-(CH2-CH2-O)11-СО- или пропионил-остаток и С-концевой амид-, NH-(CH2-CH2-O)11-СО-амид-остаток и одну или две аминогексаноиловые группы. Специалисту в данной области техники будет понятно, что другие N-концевые или С-концевые элонгирующие группы также приведут к созданию активных соединений. В настоящей заявке нумерация аминокислот является следующей: L1K2K3L4Y5K6R7L8V9K10I11L12K13R14W15W16R17Y18L19K20R21P22V23R24. Указанный полипептид предпочтительно включает аминокислотную последовательность пептида Р145, Р148 или Р159, как представлено в Таблице 1, или по меньшей мере 14 аминокислот из этой последовательности. Указанный полипептид предпочтительно имеет 14-24 аминокислот в составе.
В предпочтительном варианте реализации полипептид согласно настоящему изобретению включает гидрофобный фрагмент.Добавление гидрофобных групп к катионным (поли)пептидам улучшает их способность нейтрализовать микробный эндотоксин микроорганизмов и взаимодействовать с микробными мембранами и, таким образом, улучшает их способность уничтожать микробы, например, патогены.
Как описано выше в настоящей заявке, полипептид согласно настоящему изобретению может быть модифицирован с помощью приемов химической модификации, известных в данной области техники. Модификации полипептидов согласно настоящему изобретению могут быть введены в процессе или в конце синтеза полипептида. Например, когда полипептид синтезируют с использованием способа твердофазного синтеза, может быть проведено N-концевое ацетилирование в конце синтеза путем вступления в реакцию аминокислотной последовательности, которая все еще связана со смолой, с уксусной кислотой. В качестве другого примера С-концевое амидирование, например, проводят с использованием специального типа смолы при твердофазном пептидном синтезе, такого как коммерчески доступная смола Tentagel SAM (ex Rapp, Тюбинген, Германия). Эти смолы включают химическую ручку, от которой освобождаются амидированные (поли)пептиды в процессе расщепления. Эти и другие способы модификации "? полипептидов известны любому специалисту в данной области техники.
В предпочтительном варианте реализации полипептид согласно настоящему изобретению включает проникающий в клетку пептид. Подобный проникающий в клетку пептид является пептидной последовательностью, которая при связывании с антимикробным пептидом согласно настоящему изобретению облегчает эффективный перенос полипептида через клеточные мембраны. Любой проникающий в клетку пептид, известный в данной области техники, может быть использован в полипептиде согласно настоящему изобретению. Примеры проникающих в клетку полипептидов включают полиаргинин, белок-трансактиватор транскрипции (ТАТ), белок Tat вируса иммунодефицита человека (ВИЧ-Tat), R9-TAT, Рер-1, Рер-7, пенетратин, транспортан, Antp, Rev, белок оболочки герпесвируса кошек, буфорин II, модельный амфипатический пептид (MAP), фактор роста фибробластов Капоши (К-ФГФ), Ku70, SynBl, HN-1, транспортан 10 (ТР10), pVEC, бис-гуанидий-спермидин-холестерол (BGSC) и бис-гуанидий-трен-холестерин (BGTC), но не ограничиваются ими.
Полипептид согласно настоящему изобретению предпочтительно является полипептидом, который не встречается как таковой в природе. То есть полипептид согласно настоящему изобретению предпочтительно является не встречающимся в природе полипептидом. Термин «не встречающийся в природе», используемый в настоящей заявке, означает, что полипептид не обнаруживают в природе в данной форме, предпочтительно, что аминокислотную последовательность полипептида не обнаруживают в природе.
Предложен также мультимер полипептида согласно настоящему изобретению, включающий до 6 полипептидов, включающих аминокислотную последовательность LKKLYKRLVKILKRWWRYLKRPVR или ее вариант, как определено в настоящей заявке, предпочтительно включающий аминокислотную последовательность пептида Р145, Р148 и Р159 или по меньшей мере 14 аминокислот из нее. Указанный мультимер может включать до 6 полипептидных мономеров, имеющих одинаковую аминокислотную последовательность, или до 6 полипептидных мономеров, из которых два или более полипептидных мономера имеют разную аминокислотную последовательность. В предпочтительном варианте реализации мультимер согласно настоящему изобретению включает до 6 полипептидов согласно настоящему изобретению, имеющих одинаковую аминокислотную последовательность.
Согласно настоящему изобретению также предложены соли полипептидов. Подобные соли включают соли присоединения кислоты и соли присоединения основания, но не ограничиваются ими. Используемый в настоящей заявке термин «фармацевтически приемлемая соль» полипептида относится к соли, которая сохраняет требуемую антимикробную, антибактериальную, противогрибковую, противовирусную, противопаразитарную и/или противовоспалительную активность полипептида и подходит для введения людям или животным. Способы приготовления солей полипептидов известны в данной области техники и главным образом включают смешивание полипептида с фармацевтически приемлемой кислотой или основанием, например, путем вступления в реакцию свободных кислых или свободных основных форм продукта с одним или несколькими эквивалентами подходящей кислоты или основания в растворителе или среде, в которой эта соль нерастворима, или в растворителе, таком как вода, который потом удаляют высушиванием в вакууме или с помощью лиофилизации, или путем обмена катионов существующей соли на другой катион на подходящей ионообменной смоле. Примеры фармацевтически приемлемых кислот и оснований включают органические и неорганические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, молочная кислота, гликолевая кислота, щавелевая кислота, пировиноградная кислота, янтарная кислота, малеиновая кислота, малоновая кислота, трифторуксусная кислота, коричная кислота, серная кислота, соляная кислота, бромистоводородная кислота, азотная кислота, хлорная кислота, фосфорная кислота и тиоциановая кислота, которые образуют аммонийные соли со свободными аминогруппами полипептидов, и основания, которые образуют соли карбоновых кислот со свободными карбоксильными группами полипептидов, такие как этиламин, метиламин, диметиламин, триэтиламин, изопропиламин, диизопропиламин и другие моно-, ди- и триалкиламины и арильные амины.
Полипептиды согласно настоящему изобретению могут быть приготовлены различными способами. Например, полипептид может быть синтезирован с помощью широко используемых способов твердофазного синтеза, например, способов, который включает защиту трет-бутоксикарбонилом (t-BOC) или 9-флуоренилметоксикарбонилом (FMOC) альфа-аминогрупп, которые хорошо известны в данной области техники. В настоящей заявке аминокислоты последовательно добавляют к растущей цепи аминокислот.Подобные методики, например, описаны в Merrifield (1963), J. Am. Chem. Soc. 85: 2149-2156; и Atherton et al, "Solid Phase Peptide Synthesis," IRL Press, London, (1989). Методики твердофазного синтеза особенно пригодны для синтеза полипептидов относительно короткой длины, таких как полипептиды с длиной до примерно 70 аминокислот, при крупномасштабном производстве.
Альтернативно, полипептид согласно настоящему изобретению может быть приготовлен с использованием рекомбинантных способов, хорошо известных в данной области техники, при которых нуклеотидную последовательность, кодирующую полипептид, экспрессируют в клетках-хозяевах. Таким образом, согласно изобретению предложен способ получения полипептида согласно настоящему изобретению, включающий:
- обеспечение молекулой нуклеиновой кислоты, включающей последовательность нуклеиновой кислоты, кодирующую полипептид согласно настоящему изобретению;
- трансформацию клетки-хозяина указанной молекулой нуклеиновой кислоты;
- культивирование указанной клетки-хозяина в условиях, которые позволяют осуществить экспрессию указанного полипептида;
- сбор указанного полипептида из указанных клеток;
- необязательно осуществление N-концевой или С-концевой модификации указанного полипептида, например, путем добавления N-концевой и/или С-концевой элонгирующей группы.
Согласно изобретению дополнительно предложена молекула нуклеиновой кислоты, включающая последовательность нуклеиновой кислоты, кодирующую полипептид согласно настоящему изобретению, которая в настоящей заявке обозначается также как молекула нуклеиновой кислоты согласно настоящему изобретению. Используемая в настоящей заявке молекула нуклеиновой кислоты или последовательность нуклеиновой кислоты согласно настоящему изобретению включает цепь нуклеотидов, предпочтительно ДНК и/или РНК.
Дополнительно предложен вектор, включающий молекулу последовательности нуклеиновой кислоты согласно настоящему изобретению. Термин «вектор», используемый в настоящей заявке, относится к молекуле нуклеиновой кислоты, такой как плазмида, бактериофаг или вирус животного, способный вводить гетерологичную последовательность нуклеиновой кислоты в клетку-хозяина. Вектор согласно настоящему изобретению позволяет проводить экспрессию или выработку полипептида согласно настоящему изобретению, кодируемого гетерологичной последовательностью нуклеиновой кислоты, в клетке-хозяине. Вектор, применяемый в соответствии с настоящим изобретением, например, получен из вируса животного, примеры которого включают вирус осповакцины (включая аттенуированные производные, такие как модифицированный вирус осповакцины Анкара (MVA)), вирус ньюкаслской болезни, аденовирус или ретровирус, но не ограничиваются ими. Вектор согласно настоящему изобретению предпочтительно включает экспрессионную кассету, включающую промотор, который подходит для инициации транскрипции полипептида согласно. настоящему изобретению в выбранных клетках-хозяевах. Примеры подходящих промоторов для экспрессии полипептидов согласно настоящему изобретению в эукариотических клетках-хозяевах включают (но не ограничиваются ими) промотор бета-актина, иммуноглобулиновый промотор, промотор 5S РНК или полученные из вирусов промоторы, такие как промоторы цитомегаловируса (CMV), вируса саркомы Рауса (RSV) и вируса обезьян 40 (SV40), для клеток-хозяев млекопитающих.
Предложена дополнительно рекомбинантная клетка-хозяин, включающая молекулу нуклеиновой кислоты и/или вектор согласно настоящему изобретению. Клетка-хозяин является клеткой, трансформированной или способной к трансформации с помощью молекулы нуклеиновой кислоты, такой как вектор согласно настоящему изобретению. Термин «трансформация» относится к введению чужеродной нуклеиновой кислоты в клетку-реципиент.Трансформация клетки-хозяина может привести к временной экспрессии рекомбинантного белка указанной клеткой, что означает, что рекомбинантный... белок экспрессируется только в течение определенного периода времени. Альтернативно, трансформация клетки-реципиента может привести к стабильной экспрессии, что означает, что нуклеиновую кислоту вводят в геном клетки, и, таким образом, она передается следующему поколению клеток. Дополнительно, может быть достигнута индуцируемая экспрессия рекомбинантного белка. Система индуцируемой экспрессии требует наличия или отсутствия молекулы, которая позволяет проводить экспрессию последовательности нуклеиновой кислоты, кодирующей полипептид согласно настоящему изобретению. Примеры систем индуцируемой экспрессии включают (но не ограничиваются ими) системы экспрессии Tet-On и Tet-Off, индуцируемую гормонами систему экспрессии генов, такую как, например, индуцируемая экдизоном система экспрессии генов, индуцируемую арабинозом систему экспрессии генов и индуцируемую систему экспрессии дрозофилы, использующую вектор pMT/BiP (Invitrogen), который включает индуцируемый промотор металлотионеина. Клетка-хозяин, применяемая в способе для приготовления полипептида согласно настоящему изобретению, является, например, грамположительным прокариотом, грамотрицательным прокариотом или эукариотом. Предпочтительно, указанная клетка-хозяин является эукариотической клеткой, такой как клетка растений, клетка дрожжей, клетка млекопитающего или клетка насекомого, наиболее предпочтительно клетка насекомого или клетка млекопитающего. Примеры подходящих клеток-хозяев включат клетки растений, такие как клетки кукурузы, клетки риса, клетки ряски, клетки табака (такие как клетки BY-2 или NT-1) и клетки картофеля. Примерами клеток дрожжей являются клетки дрожжей Saccharomyces и Pichia. Примерами клеток насекомых являются клетки Spodoptera frugiperda, такие как, клетки Tn5, SF-9 и SF-21, и клетки дрозофилы, такие как клетки дрозофилы Schneider 2 (S2). Примеры клеток млекопитающих, которые подходят для экспрессии полипептида согласно настоящему изобретению, включают клетки почки африканской зеленой обезьяны (Vero), клетки почки новорожденного хомяка (такие как ВНК-21), клетки сетчатки человека (например, клетки PerC6), клетки почки эмбриона человека (такие как клетки НЕК293), клетки Мадин-Дарби почки собаки (MDCK), фибробласты эмбриона курицы (CEF), клетки почки эмбриона курицы (клетки СЕК), полученные из бластодермы эмбриональные стволовые клетки (например, ЕВ14), фибробласты эмбриона мыши (например, клетки 3Т3), клетки яичника китайского хомячка (СНО) и производные этих типов клеток, но не ограничиваются ими.
Способ согласно настоящему изобретению предпочтительно дополнительно включает этап сбора, очистки и/или выделения полипептидов согласно настоящему изобретению. Полученные полипептиды согласно настоящему изобретению предпочтительно применяют при терапии человека, необязательно после дополнительных этапов очистки, выделения или обработки, например, очистки с использованием гель-электрофореза или хроматографических способов.
Полипептид согласно настоящему изобретению проявляет ряд активностей, которые могут быть с успехом использованы при применении как в терапии, так и не в терапии. В частности полипептиды согласно настоящему изобретению полезны при противодействии различным микробным инфекциям, таким как бактериальные инфекции, грибковые инфекции, вирусные инфекции и при противодействии паразитарным инфекциям. Таким образом, предложены фармацевтические композиции, включающие полипептид согласно настоящему изобретению или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество. Также предложены фармацевтические композиции, включающие молекулу нуклеиновой кислоты или вектор согласно настоящему изобретению и по меньшей мере один фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество.
Согласно настоящему изобретению дополнительно предложен полипептид согласно настоящему изобретению для применения в качестве лекарственного средства. Дополнительно предложена молекула нуклеиновой кислоты, включающая последовательность нуклеиновой кислоты, кодирующую полипептид согласно настоящему изобретению, для применения в качестве лекарственного средства. Указанное лекарственное средство может быть терапевтическим или профилактическим средством.
В одном из вариантов реализации согласно настоящему изобретению предложен способ лечения субъекта, болеющего или имеющего риск заболеть бактериальной, грибковой, вирусной и/или паразитарной инфекцией, включающий введение указанному субъекту терапевтически эффективного количества полипептида согласно настоящему изобретению, фармацевтической композиции согласно настоящему изобретению или молекулы нуклеиновой кислоты согласно настоящему изобретению. Также предложен способ приготовления лекарственного средства для лечения субъекта, инфицированного микробом, или для профилактики микробной инфекции. В предпочтительном варианте реализации указанный микроб является бактерией, грибком, вирусом или паразитом. Дополнительно предложен полипептид и/или молекула нуклеиновой кислоты для применения согласно настоящему изобретению при предотвращении или лечении микробной, бактериальной, грибковой, вирусной и/или паразитарной инфекции или состояния, наступившего в результате микробной, бактериальной, грибковой, вирусной и/или паразитарной инфекции.
Используемый в настоящей заявке термин «субъект» относится к человеку или животному. Субъекты включают млекопитающих, таких как люди, свиньи, хорьки, тюлени, кролики, кошки, собаки, коровы и лошади, и птиц, таких как курицы, утки, гуси и индейки, но не ограничиваются ими. В предпочтительном варианте реализации настоящего изобретения субъектом является млекопитающее. В особенно предпочтительном варианте реализации субъектом является человек.
Согласно настоящему изобретению также предложен способ ингибирования роста микроба, например, бактерии, вируса, грибка, или паразита, включающий осуществление контакта указанного микроба или паразита с полипептидом или фармацевтической композицией согласно настоящему изобретению. Указанное контактирование можно осуществлять in vivo и in vitro.
Полипептиды и фармацевтические композиции согласно настоящему изобретению являются эффективными при лечении разнообразных микробных инфекций, таких как различные вирусные, бактериальные и грибковые инфекции. Например, полипептиды и фармацевтические композиции являются эффективными при лечении инфекций, вызванных грамотрицательными и грамположительными бактериями. Примеры патогенных бактерий, которые могут вызывать инфекции у людей или животных, поддающиеся лечению полипептидами и композициями согласно настоящему изобретению, включают бактерии рода листерий, бактерии рода эшерихий, хламидии, риккетсиозные бактерии, микобактерии, стафилококки, стрептококки, пневмококки, менингококки, бактерии рода клебсиеллы, псевдомонады, бактерии рода легионелл, дифтерийные, сальмонеллезные палочки, холерный вибрион, столбнячную палочку, бактерии рода клостридий, бактерии рода бацилл, бактерии рода иерсиний и бактерии рода лептоспира, но не ограничиваются ими.
Примеры патогенных вирусов, которые могут вызывать инфекции у людей или животных, поддающиеся лечению полипептидами и композициями согласно настоящему изобретению, включают гепатиты А, В или С, вирус герпеса (например, вирус ветряной оспы (VZV), вирус простого герпеса 1 типа (HSV-I), вирус герпеса человека 6 типа (HHV-6,) вирус простого герпеса 2 типа (HSV-II), цитомегаловирус (CMV), вирус Эпштейна-Барр), аденовирус, вирус гриппа, флавивирусы, эховирус, риновирус, вирус Коксаки, коронавирус, респираторно-синцитиальный вирус (RSV), ротавирус, вирус кори, вирус краснухи, парвовирус, вирус осповакцины, Т-лимфотропный вирус человека (HTLV), вирус денге, папилломавирус, полиовирус, вирус бешенства и вирус иммунодефицита человека (ВИЧ; например, 1 и 2 типа), но не ограничиваются ими.
Примеры патогенных грибков, которые могут вызывать инфекции у людей или животных, поддающиеся лечению полипептидами и композициями согласно настоящему изобретению, включают грибки рода кандида (например, Candida albicans, Candida krusei, Candida glabrata, Candida tropicalis), рода аспергилл (например, Aspergillus fumigatus, Aspergillus niger), Cryptococcus neoformans, Histoplasma capsulatum, мукоровые грибы, Blastomyces dermatitidis, Paracoccidioides brasiliensis и Coccidioides immitis, но не ограничиваются ими.
Примеры патогенных паразитов, которые могут вызывать инфекции у людей или животных, поддающиеся лечению полипептидами и композициями согласно настоящему изобретению, включают Entamoeba histolytica, паразитов рода плазмодий (например, Plasmodium falciparum, Plasmodium vivax), паразитов рода энтамеб, паразитов рода лямблий, Balantidium coli, паразитов рода акантомеб, вид криптоспоридий, Pneumocystis carinii, Babesia microti, паразиты рода трипаносом (например, Trypanosoma brucei, Trypanosoma cruzi), паразиты рода лейшманий (например, Leishmania donovani) и Toxoplasma gondii, но не ограничиваются ими.
В предпочтительном варианте реализации полипептиды и фармацевтические композиции согласно настоящему изобретению являются эффективными при лечении инфекций, вызванных метициллин-резистентным золотистым стафилококком Staphylococcus aureus (МРЗС) и (нерезистентным) 5. aureus, Staphylococcus epidermidis, грамотрицательной бактерией Pseudomonas aeruginosa и видами грибов Candida albicans и Aspergillus niger.
Композиции, содержащие полипептиды, могут быть введены при профилактическом и/или терапевтическом лечении. При терапевтическом применении полипептиды или композиции вводят субъекту, предпочтительно человеку, уже страдающему от заболевания, в количестве, достаточном для противодействия симптомам инфекции или состоянию, возникшему в результате инфекции и ее осложнений. При профилактическом применении полипептиды или композиции вводят субъекту, например, человеку или животному, имеющему риск заболевания микробной или паразитарной инфекцией, в количестве, достаточном для предотвращения инфекции или по меньшей мере для остановки развития инфекции. Полипептид, как правило, представлен в фармацевтической композиции согласно настоящему изобретению в терапевтическом количестве, которое является количеством, достаточным для излечения состояния или заболевания, особенно симптомов, связанных с микробной или паразитарной инфекцией. Типичные дозы приема полипептида согласно настоящему изобретению или комбинаций по меньшей мере двух полипептидов находятся между 0,01 и 10 мг полипептида на кг массы тела в зависимости от размера полипептида.
Полипептиды и фармацевтические композиции согласно настоящему изобретению подходят для широкого круга разнообразных применений. Например, они могут быть использованы для местного применения, например, при лечении или предотвращении кожных инфекций, раневых инфекций и инфекций мочевыводящих путей. Как было ранее подробно описано в настоящей заявке, полипептиды согласно настоящему изобретению способны предотвращать образование биопленок и диспергировать существующие биопленки, убивать бактерии, грибки или другие микробы в месте и вокруг места образования биопленки, и модулировать иммунные ответы путем нейтрализации провоспалительных микробных эндотоксинов. Бактериальные биопленки могут отсрочить заживление кожных ран и снизить местную антибактериальную эффективность традиционных антибиотиков при заживлении или лечении инфицированных кожных ран, кожных инфекций или инфекций мочевыводящих путей. Таким образом, согласно настоящему изобретению предложен полипептид, фармацевтическая композиция и/или молекула нуклеиновой кислоты согласно настоящему изобретению для применения при лечении или предотвращении кожной инфекции, раневой инфекции и/или инфекций мочевыводящих путей. Также предложен полипептид, фармацевтическая композиция и/или молекула нуклеиновой кислоты согласно настоящему изобретению для применения при заживлении ран. Дополнительно предложено применение полипептида, фармацевтической композиции и/или молекулы нуклеиновой кислоты согласно настоящему изобретению при производстве фармацевтической композиции для лечения или предотвращении кожной инфекции, раневой инфекции, инфекции мочевыводящих путей и/или при заживлении ран. Согласно настоящему изобретению дополнительно предложен способ лечения субъекта, страдающего от кожной инфекции, раневой инфекций и/или инфекции мочевыводящих путей, включающий введение указанному субъекту терапевтически эффективного количества полипептида согласно настоящему изобретению, фармацевтической композиции согласно настоящему изобретению или молекулы нуклеиновой кислоты согласно настоящему изобретению.
Полипептиды согласно настоящему изобретению можно дополнительно успешно использовать в качестве консерванта для материалов, подверженных микробной, например, бактериальной, вирусной, грибковой, паразитарной, инфекции. Подобные материалы могут быть пропитаны или покрыты или накрыты полипептидом согласно настоящему изобретению. Как было ранее подробно описано в настоящей заявке, полипептиды согласно настоящему изобретению сохраняют антимикробную активность в крови, плазме и сыворотке и в присутствии компонентов, таких как компоненты плазмы. Таким образом, полипептиды и фармацевтическая композиция согласно настоящему изобретению являются особенно подходящими для систематического введения и для лечения и/или предотвращения инфекции, связанной с имплантатами и медицинскими изделиями. Термин «медицинские изделия», используемый в настоящей заявке, относится к любому типу медицинских изделий, которые могут быть использованы в теле человека или животного, и включает медицинские инструменты, медицинские приспособления, протезы, такие как искусственные суставы, включая тазобедренные суставы и коленные суставы, и зубные протезы, грудные имплантаты, имплантируемые изделия, такие как водители ритма сердца, сердечные клапаны, стенты, катетеры, ушные вентиляционные трубки, шины, винты для медицинских устройств и раневые или тканевые повязки, но не ограничиваются ими. Имплантаты и медицинские изделия часто связаны с возникновением микробной инфекцией, в частности биопленочных инфекций, которым успешно противодействуют полипептиды согласно настоящему изобретению, как показано в разделе «Примеры». Дополнительно, имплантаты и медицинские устройства в целом быстро покрываются компонентами плазмы из жидкостей организма носителей после имплантации. Поскольку полипептиды согласно настоящему изобретению проявляют антимикробную активность в присутствии компонентов плазмы, как показано в разделе «Примеры», микробная инфекция имплантатов и/или медицинский изделий эффективно лечится и/или предотвращается полипептидом согласно настоящему изобретению. Таким образом, предложено применение полипептида согласно настоящему изобретению в качестве консерванта для имплантата и/или медицинского изделия. Также предложен полипептид согласно настоящему изобретению для применения при предотвращении и/или лечении микробной инфекции, предпочтительно бактериальной инфекции, имплантата и/или медицинских изделий.
Полипептид согласно настоящему изобретению преимущественно включен в носитель, обеспечивающий контролируемое высвобождение и/или направленную доставку. Используемый в настоящей заявке термин «контролируемое высвобождение» относится к высвобождению полипептида согласно настоящему изобретению зависимым от времени образом. В одном из вариантов реализации контролируемое высвобождение относится к медленному высвобождению. Используемый в настоящей заявке термин «направленная доставка» относится к высвобождению полипептида согласно настоящему изобретению сайт-направленным образом. Применение носителя, обеспечивающего контролируемое высвобождение, имеет преимущество в том, что можно избежать частого введения, такого как введение путем инъекции, полипептида согласно настоящему изобретению. Применение носителя, обеспечивающего направленную доставку, имеет преимущество в том, что полипептид согласно настоящему изобретению эффективно доставляется к и/или задерживается в требуемом месте тела субъекта, таком как очаг воспаления или очаг инфекции. Предпочтительно полипептид согласно настоящему изобретению направлен к месту, инфицированному микроорганизмами, включая бактерии, грибки, вирусы или паразитов. Носители, обеспечивающие контролируемое высвобождение и/или направленную доставку, хорошо известны в данной области техники. Не устанавливающими ограничений примерами носителей, обеспечивающими контролируемое высвобождение и/или направленную доставку, являются наночастицы, микрочастицы, нанокапсулы, микрокапсулы, липосомы, микросферы, гидрогели, полимеры, липидные комплексы, сывороточный альбумин, антитела, циклодекстрины и декстраны. Контролируемое высвобождение обеспечивается, например, путем введения полипептида согласно настоящему изобретению в состав поверхности или на поверхность подобного носителя. Носители состоят из материалов, образующих частицы, которые захватывают полипептид согласно настоящему изобретению и медленно деградируют или растворяются в подходящей среде, такой как водная, кислая или щелочная среда или жидкости организма, и таким образом высвобождают полипептид. Направленная доставка, например, достигается путем обеспечения носителя с нацеленными группами на его поверхности. Примерами подобных носителей, включающих нацеленные группы, являются функционализованные антителами носители, носители, имеющие сайт-специфический лиганд, и носители с положительными или отрицательным зарядом поверхности. Предпочтительными частицами для контролируемого высвобождения и/или направленной доставки являются наночастицы, то есть частицы в диапазоне от примерно 1 до 500 нм в диаметре, предпочтительно до примерно 200 нм в диаметре, и липосомы, необязательно обеспеченные нацеленными группами. Таким образом, согласно настоящему изобретению предложены носитель, обеспечивающий контролируемое высвобождение, включающий полипептид согласно настоящему изобретению, и фармацевтические композиции, включающие подобный носитель, обеспечивающий контролируемое высвобождение. Предложены также носитель, обеспечивающий направленную доставку, включающий полипептид согласно настоящему изобретению, и фармацевтическая композиция, включающая подобный носитель, обеспечивающий направленную доставку,. Подобный носитель предпочтительно выбран из группы, состоящей из наночастиц, микрочастиц, нанокапсул, микрокапсул, липосом, микросфер, гидрогелей, полимеров, липидных комплексов, сывороточного альбумина, антител, циклодекстринов и декстранов.
Предпочтительные носители, обеспечивающие направленную доставку и/или контролируемое высвобождение, состоят из биодеградируемого материала. Термин «биодеградируемый», используемый в настоящей заявке, относится к молекулам, которые деградируют в физиологических условиях. Это включает молекулы, которые расщепляются гидролитически, и молекулы, которые требует ферментативного расщепления. Подходящие биодеградируемые материалы включают биодеградируемые полимеры и природные биодеградируемые материалы, такие как ПМК (полимолочная кислота), ПГК (полигликолевая кислота), поликапролактон (ПКЛ), полиэтиленоксид (ПЭО), полидиоксанон (ПДО), поликапролактон (ПКЛ), полипропиленфумарат, полимеры, производных от лактонов, таких как лактид, гликолид и капролактон, карбонаты, такие как триметиленкарбонат и тетраметиленкарбонат, диоксаноны, этиленгликоль, этиленоксид сложного полиэфирамида (ПЭА), сложные эфирамиды, γ-гидроксивалерат, β-гидроксипропионат, α-гидроксикислоту, гидроксибутераты, гидроксиалканоаты, полиимидкарбонаты, полиуретаны, полиангидриды и их комбинации, полисахариды, такие как гиалуроновая кислота, хитозан и целлюлоза, и белки, такие как желатин и коллаген, но не ограничиваются ими.
Дополнительно предложено покрытие, предпочтительно для имплантатов и/или медицинских изделий, включающее полипептид согласно настоящему изобретению. В одном из вариантов реализации подобное покрытие обеспечивает контролируемое высвобождение полипептида согласно настоящему изобретению. Подобное покрытие, обеспечивающие контролируемое высвобождение, для медицинских изделий предпочтительно включает биодеградируемый материал, так что высвобождение полипептида согласно настоящему изобретению достигается посредством деградации материала покрытия. Таким образом, также предложено покрытие, обеспечивающее контролируемое высвобождение, включающее полипептид согласно настоящему изобретению. Дополнительно предложено медицинское изделие, включающее подобное покрытие, включающее полипептид согласно настоящему изобретению и биодеградируемый материал. Дополнительно предложен имплантат, включающий подобное покрытие, включающее полипептид согласно настоящему изобретению и биодеградируемый материал. Биодеградируемое покрытие в соответствии с настоящим изобретением включает биодеградируемый материал, как определено выше. В частности, подобное биодеградируемое покрытие включает материал, выбранный из группы, состоящей из ПМК (полимолочная кислота), ПГК (полигликолевая кислота), поликапролактона (ПКЛ), полиэтиленоксида (ПЭО), полидиоксанона (ПДО), поликапролактона (ПКЛ), полипропиленфумарата, полимеров, производных от лактонов, таких как лактид, гликолид и капролактон, карбонатов, таких как триметиленкарбонат и тетраметиленкарбонат, диоксанонов, этиленгликоля, этиленоксида сложного полиэфирамида (ПЭА), сложных эфирамидов, γ-гидроксивалерата, β-гидроксипропионата, α-гидроксикислоты, гидроксибутератов, гидроксиалканоатов, полиимидкарбонатов, полиуретанов, полиангидридов и их комбинации, полисахаридов, таких как гиалуроновая кислота, хитозан и целлюлоза, и белков, таких как желатин и коллаген. Дополнительно предложен способ предотвращения и/или лечения микробной инфекции, предпочтительно бактериальной инфекции, имплантата и/или медицинского изделия, включающий обеспечение указанного имплантата и/или медицинского изделия покрытием, включающим полипептид согласно настоящему изобретению, и имплантацию указанного имплантата или медицинского изделия субъекту.
Полипептиды и фармацевтические композиции также пригодны в качестве противовоспалительных средств, так как они нейтрализуют провоспалительные микробные эндотоксины, такие как липотейхоевая кислота, пептидогликан и липополисахариды, таким образом, ингибируя, снижая или предотвращая инфлюкс нейтрофилов, макрофагов/моноцитов и лимфоцитов и высвобождение провоспалительных микробных соединений инфицированным субъектом. Таким образом, также предложен способ ингибирования высвобождения провоспалительных соединений, включающий контактирование клетки, способной высвободить провоспалительные соединения, с полипептидом согласно настоящему изобретению. Подобное контактирование может быть проведено in vivo и in vitro. Дополнительно предложен полипептид согласно настоящему изобретению для применения в качестве противоспалительного средства.
Несмотря на то, что полипептиды согласно настоящему изобретению являются сильными антимикробными средствами, они могут быть скомбинированы с известными антимикробными средствами, такими как традиционные противоинфекционные средства, например, антибиотики, противовирусные средства и противогрибковые средства или другие антимикробные пептиды, и антителами и химическими веществами, например, сенсибилизаторами, наночастицами. Подобная комбинация может привести к повышенной антимикробной активности или расширить спектр действия. Полипептиды согласно настоящему изобретению могут, например, быть скомбинированы с пенициллинами, цефалоспоринами, макролидами, фторхинолонами, сульфонамидами, тетрациклинами и/или аминогликозидами для лечения бактериальных инфекций. Для терапии вирусных инфекций полипептиды могут быть скомбинированы с противовирусными нуклеозидными аналогами, такими как ацикловир, ганцикловир, зидовудин («Азидотимидин» (АЗТ)) или диданозин, или с ингибиторами нейраминидазы, такими как осельтамивир, перамивир или занамивир. Для лечения грибковых инфекций полипептиды и композиции согласно настоящему изобретению могут быть скомбинированы с полиеновыми противогрибковыми средствами, имидазолами, триазолами, аллиламинами, эхинокандинами, циклопироксом, флуцитозином и/или гризеофульвином. Таким образом, согласно настоящему изобретению предложена фармацевтическая композиция, которая содержит полипептид согласно настоящему изобретению и дополнительное антимикробное средство, такое как антибиотик или антимикробный пептид, предпочтительно выбранный из группы, состоящей из пенициллинов, цефалоспоринов, карбапенемов и мупироцинов.
Фармацевтические композиции согласно настоящему изобретению содержат по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Примеры подходящих носителей, например, включают гемоцианин моллюска фиссуреллы (KLH), сывороточный альбумин (например, бычий сывороточный альбумин (БСА) или кроличий сывороточный альбумин (КСА)) и овальбумин. В предпочтительном варианте реализации указанный подходящий носитель является раствором, например, солевым раствором. Примеры вспомогательных веществ, которые могут быть включены в таблетки, капсулы и тому подобное, следующие: связывающее вещество, такое как трагакант, аравийская камедь, кукурузный крахмал или желатин; вспомогательное вещество, такое как микрокристаллическая целлюлоза; разрыхляющее вещество, такое как кукурузный крахмал, прежелатинизированный крахмал, альгиновая кислота и тому подобное; смазывающее вещество, такое как магния стеарат; подсластитель, такой как сахароза, лактоза или сахарин; вкусовая добавка, такая как мята, масло грушанки или вишня. Если формой единицы дозирования является капсула, она может содержать, кроме материалов упомянутого выше типа, жидкий носитель, такой как жирное масло. Другие разнообразные материалы могут быть представлены в качестве покрытий или для иного способа модификации физической формы единицы дозирования. Например, таблетки могут быть покрыты шеллаком, сахаром или тем и другим. Сироп или эликсир может содержать активное соединение, сахарозу в качестве подсластителя, метилпарабены и пропилпарабены в качестве консервантов, краситель и вкусовую добавку, такую как вкус вишни или апельсина. Фармацевтическая композиция согласно настоящему изобретению предпочтительно подходит для применения человеком.
Фармацевтические композиции, описанные в настоящей заявке, можно вводить множеством различных способов. Примеры включают введение фармацевтической композиции, включающей полипептид согласно настоящему изобретению и содержащей фармацевтически приемлемый переносчик, посредством перорального, интраназального, ректального, местного, интраперитонеального, внутривенного, внутримышечного, подкожного, субдермального, трансдермального, интратекального и интракраниального способов введения. В случае перорального введения активный ингредиент может быть введен в твердой форме дозирования, такой как капсулы, таблетки и порошки, или в жидкой форме, такой как эликсиры, сиропы и суспензии.
Стерильные композиции для инъекции могут быть приготовлены согласно традиционной фармацевтической практике путем растворения или суспендирования полипептида согласно настоящему изобретению в носителе для инъекции, таком как вода или встречающееся в природе растительное масло, как кунжутное масло, кокосовое масло, арахисовое масло, хлопковое масло и т.д., или синтетический жирный носитель, как этилолеат или тому подобное. Буферы, консерванты, антиоксиданты и тому подобное также могут быть включены в состав.
Композиции для местного применения также могут быть приготовлены согласно традиционной фармацевтической практике. Термин «местное применение», используемый в настоящей заявке, относится к введению на поверхность организма, такую как кожа или слизистые оболочки, с целью местного лечения состояний, возникающих в результате микробных или паразитарных инфекций. Примеры лекарственных форм для местного применения включают крем, гель, мазь, лосьон, пену, суспензию, спрей, аэрозоль, порошковый аэрозоль, но не ограничиваются ими. Лекарственные средства для местного применения могут быть накожными, что означает, что их применяют напрямую на коже. Лекарственные средства для местного применения могут быть также ингаляционными, например, для применения на слизистом эпителии дыхательного пути, или их применяют на поверхности тканей, отличных от кожи, такие как глазные капли, вводимые в конъюнктиву, или ушные капли, помещаемые в ухо. Указанная фармацевтическая композиция, приготовленная для местного применения, предпочтительно включает по меньшей мере одно фармацевтическое вспомогательное вещество, подходящее для местного применения, такое как эмульгатор, разбавитель, увлажнитель, консервант, регулятор рН и/или воду.
Полипептид согласно настоящему изобретению также особенно подходит для диагностического применения. Полипептиды можно применять для обнаружения микробной инфекции, например, путем обнаружения микробных токсинов, например, бактериальных токсинов, включая липополисахариды, липотейхоевую кислоты и пептидогликан, присутствующих в физиологических образцах, таких как кровь, плазма, слизь, раневой экссудат и моча. Дополнительно полипептиды могут быть применены для определения количества микробных токсинов в подобных образцах. Таким образом, предложена молекула нуклеиновой кислоты полипептида согласно настоящему изобретению для применения в качестве диагностического средства. Дополнительно предложено применение полипептида согласно настоящему изобретению для обнаружения микробного токсина, предпочтительно бактериального или грибкового токсина, в физиологическом образце, таком как кровь, плазма, слизь, раневой экссудат и образец мочи. Как описано выше, полипептид согласно настоящему изобретению может быть соединен с подходящим фрагментом, таким как биотин, флуоресцентная метка, поглощающим в ближней инфракрасной области красителем или радиоактивным изотопом. Подобные меченые полипептиды могут быть применены в способе обнаружения микробных инфекций, таких как бактериальные инфекции, потому что они мигрируют к месту микробной инфекции. Применяя детектор, подходящий для использованной метки, прикрепленной к полипептиду, возможно обнаружить инфекционные очаги. Таким образом, согласно настоящему изобретению также предложены способы обнаружения микробных инфекций, таких как бактериальные инфекции. Способ, как правило, включает введение меченого полипептида субъекту, который инфицирован микробным организмом или который подозревают в том, что он им инфицирован. Поскольку меченый полипептид способен взаимодействовать с организмом-возбудителем инфекции, он накапливается в очаге инфекции. С целью обнаружения микробных токсинов в физиологическом образце способ включает введение меченого полипептида в физиологический образец субъекта, который инфицирован микробным организмом или который подозревают в том, что он им инфицирован. Возможно обнаружить накопление полипептида в очаге инфекции или в образце с использованием различных детекторов, которые являются чувствительными к метке, „. прикрепленной к полипептиду.
Другое полезное применение полипептидов согласно настоящему изобретению состоит в консервации пищевых продуктов. Таким образом, также предложено применение полипептида согласно настоящему изобретению в качестве пищевого консерванта. Патогенные или вызывающие порчу микроорганизмы главным образом разрушают термической обработкой пищевых продуктов, подвергая их температурам в диапазоне от 60 до 100°С. Подобная обработка может оказывать нежелательные эффекты на пищевой продукт, такие как нежелательные органолептические эффекты. Применение полипептида согласно настоящему изобретению в качестве консерванта в пищевых продуктах может иметь своим результатом увеличенный срок хранения и/или повышенную безопасность пищевого продукта.
Патогенные микроорганизмы в пищевых продуктах могут вызывать инфекции или интоксикации субъектов и включают бактерии, такие как Campylobacter jejuni, Salmonella typhi, Salmonella paratyphi и поп-typhi Salmonella species, Staphylococcus aureus, Escherichia coli, Listeria monocytogenes, Shigella и Clostridium Botulinum, вирусы, такие как вируса рода ротавирусов и рода норовирусов, паразитов, таких как Taenia solium, Taenia saginata и Trichinella spiralis и плесени. Порча пищевых продуктов относится к изменению вида, консистенции, вкуса и/или запаха пищевых продуктов и может быть вызвана бактериями, такими как бактерии родов лактобактерйй, лейконосток, псевдомонад, микрококков, флавобактерий, серратия, энтеробактерий и стрептококков, грибами, такими как грибы родов аспергилл, фузариум и кладоспорий, и дрожжами.
Изобретение будет объяснено более детально в следующих не налагающих ограничений примерах.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Кривые роста A. niger, культивированного в ФСБ в присутствии 5 мкМ препарата «Кансидас» или 0,8-6,4 мкМ указанных пептидов. Значения выражены в виде оптической плотности при 600 нм относительно оптической плотности в 0 часов. Световые микрофотографии роста грибка в ФСБ после 16 часов инкубации. Характерные световые микрофотографии трипликатов.
Фигура 2: Световая микрофотография роста A. niger в 25% плазме после 16 часов инкубации с ФСБ, препаратом «Кансидас», ОР-145 или указанными пептидами. Характерные световые микрофотографии трипликатов.
Фигура 3: Ингибирование образования биопленок штамма S. aureus JAR060131 при различных концентрациях (в мкМ). Результаты выражены в виде среднего процента массы биопленки относительно необработанного образца (0) ± среднеквадратичное отклонения трех параллельных экспериментов. А, образование биопленок в непокрытых лунках. В, образование биопленок в покрытых плазмой лунках.
ПРИМЕРЫ
Материалы и методы
Синтез антимикробного пептида
Искусственные пептиды готовили с помощью стандартной Fmoc-химии (9-флуоренилметоксикарбонил (Fmoc)) с использованием предварительно нагруженных смол Tentagel, бензотриазол-1-илокси-трис-пирролидино-фосфония гексафторфосфата/N-метилморфолина (PyBop/NMM) для активации in situ и 20% пиперидина в N-метилпирролидоне для удаления Fmoc. [Hiemstra HS et al. Proc Natl Acad Sci USA, 94, 10313-10318 (1997)]. Реакции соединения проводили в течение 60 минут с 6-кратным избытком ацилирующих агентов. После конечной стадии удаления Fmoc пептиды отщепляли раствором трифторуксусной кислотой (ТФУ) в воде 19:1 (об./об.), содержащим дополнительные скавенжеры, когда аминокислота С (триэтилсилан) или аминокислота W (этантиол) присутствовали в пептидной последовательности. Пептиды выделяли преципитацией раствором простого эфира и пентана 1:1 (об./об.) и проводили выделение продукта центрифугированием. После воздушной сушки при температуре 40°С пептиды растворяли в растворе уксусной кислоты в воде 1:10 (об./об.) и лиофилизировали. Пептиды проверяли на чистоту с использованием сверхэффективной жидкостной хроматографии с масс-спектрометрией (Acquity, Waters) и на интактность с использованием времяпролетной МАЛДИ масс-спектрометрии (Microflex, Bruker), показывающей ожидаемые молекулярные массы.
Бактериальные штаммы
Клинический изолят метициллин-резистентного золотистого стафилококка Staphylococcus aureus (МРЗС), штамм LUH14616, был любезно предоставлен доктором С. Крус, Медицинский центр Маастрихтского университета, Маастрихт, Нидерланды (см. Croes S ВМС Microbiol. 2009;9:229. doi: 10.1186/1471-2180-9-229).
Штамм S. aureus JAR описан в Campoccia et al. (Int J Artif Organs. 2008 Sep;31(9):841-7).
Штамм Staphylococcus epidermidis RP62a описан в Infect. Immun.2008; 75: 1129-1136.
Штамм Pseudomonas aeruginosa PAO1 описан в Nucl. Acids Res 2011; 39, Suppl. 1: D596-D60.
Бактерии хранили при -80°C перед использованием. Инокуляты бактерий, находящихся в середине логарифмической фазы роста, готовили путем инкубации бактериальных колоний, выделенных из чашек с кровяным агаром, на среде трипсинового соевого бульона (Becton Dickinson, Le Pont de Clax, France) в течение 2,5 часов и затем разбавляли до необходимой концентрации. Бактерии штамма S. aureus JAR060131 в стационарной фазе роста получали от 18-20 часовых культур.
Определение антибактериальной активности
Пептиды инкубировали с 1х106 КОЕ/мл культуры, находящейся в середине логарифмического роста, штаммов S. aureus JAR060131, метициллин-резистентного золотистого стафилококка Staphylococcus aureus (МРЗС) LUH14616, Staphylococcus epidermidis RP62a и Pseudomonas aeruginosa PAO1 в ФСБ без или с добавлением смешанной человеческой плазмы от нескольких доноров (Sanquin, Амстердам, Нидерланды) с конечной концентрацией 50%. Антимикробная активность выражена в виде 99,9% летальной концентрации (ЛК99,9), то есть самой низкой концентрация пептида, которая убивает ≥99,9% бактерий после 2 часов инкубации при 37°С в условиях встряхивания.
Для оценки антимикробной активности пептидов по отношению к бактериям в стационарной фазе роста пептиды инкубировали в условиях, описанных выше, с 1х106 КОЕ/мл бактериями S. aureus JAR060131, находящимися в стационарной фазе роста, полученными от 18-20 часовых культур.
Определение противогрибковой активности
Пептиды инкубировали с 1х105 клетками/мл культуры, находящейся в середине логарифмической фазы роста, штамма Candida albicans Y-O1 без или с добавлением смешанной плазмы человека с конечной концентрацией 50%. Антимикробная активность выражена в виде 99% летальной концентрации (ЛК99), то есть самой низкой концентрация пептида, при которой ≥99% клеток были убиты после 2 часов инкубации при 37°С в условиях встряхивания.
Воздействие пептидов на рост грибков оценивали, используя грибок Aspergillus niger. Пептиды инкубировали с 7,5х104 спорами/мл штамма A. niger PagsA-lux в ФСБ без или с добавлением смешанной человеческой плазмы с конечной концентрацией 25%. В качестве положительного контроля споры обрабатывали противогрибковым каспофунгином (лекарственный препарат «Кансидас»). Измеряли поглощение в течение времени и в 16 часов, рост грибка визуализировали с помощью световой микроскопии.
Определение активности против биопленок
Пептиды инкубировали с 1х108 КОЕ/мл S. aureus JAR060131 в подобранной для образования биопленок среде ВМ2 в 96-луночных полипропиленовых планшетах, как описано в Antimicrob Agents Chemother 2012; 56: 2696-2704. После 24 часов инкубации при 37°С удаляли планктонные бактерии четырьмя промывками ФСБ и окрашивали биопленки кристаллическим фиолетовым. После солюбилизации с этанолом определяли оптическую плотность при 590 нм в качестве меры массы биопленки. Активность против биопленок выражена в виде 50% ингибирующей концентрации (ИК50), то есть самой низкой концентрации полипептида, которая приводит к ≥50% снижению массы биопленки.
Для оценки активности пептидов против биопленок в присутствии плазмы 96-луночные полипропиленовые планшеты покрывали плазмой путем инкубации в течение ночи с 20% плазмой при 4°С. Лунки промывали один раз стерильной водой и инокулировали S. aureus и пептидами, как описано выше.
Иммуномодуляторная активность: нейтрализация липополисахаридов и липотейхоевой кислоты
Пептиды предварительно инкубировали с 500 нг/мл липополисахаридов (штамм Е. coli 054) или 2 мг/мл липотейхоевой кислоты (S. aureus, без эндотоксинов) или с 1х109 КОЕ/мл убитых ультрафиолетом бактерий S. aureus JAR060131 в течение 30 мин при 37°С. Разбавленную цельную человеческую кровь стимулировали смесями пептид-липополисахарид/липотейхоевая кислота/S. aureus в течение 20 часов при 37°С. Уровни ИЛ-12р40 и ИЛ-8 в супернатантах определяли с использованием ELISA. Активность по нейтрализации липополисахаридов и липотейхоевой кислоты выражена в виде 50% или 90% ингибирующей концентрации (ИК50 и ИК90), то есть самой низкой концентрации, которая привела к ≥50% или ≥90% снижению выработки ИЛ-12р40 или ИЛ-8, индуцируемой липополисахаридом/липотейхоевой кислотой/S. aureus.
Результаты
Идентификация 25 пептидов, производных от ОР-145
Новые пептиды, которые являются антимикробными пептидами и которые меньше подвержены воздействию компонентов плазмы по сравнению с ОР-145, идентифицировали на основе компьютерного прогноза.
Предполагается, что ОР-145 принимает амфипатическую спиральную структуру. При такой структуре пептид сворачивается в α-спираль, которая содержит заряженные группы на одной стороне спирали и гидрофобные группы на другой стороне. Авторам настоящего изобретения известно по результатам предыдущих исследований, в которых применялись пептиды с аминокислотными заменами, что введение заряженных групп, которые оказываются на гидрофобной части спирали, или введение гидрофобных групп, которые оказываются на заряженной стороне спирали, приводит к созданию соединений со сниженной антибактериальной активностью.
Таким образом, авторы настоящего изобретения решили, что вновь разработанные пептиды должны по прогнозам сворачиваться в амфипатическую спираль. На основе последовательности ОР-145 авторы настоящего изобретения разработали нижеследующий мотив для аминокислотной замены. Авторы настоящего изобретения сосредоточились на заменах, которые приводят к созданию пептидов, которые значительно отличаются от ОР-145, минимизируя структурное сходство с ОР-145 и максимизируя вероятность, что связывание с компонентами плазмы, влияющее на антимикробную активность, минимизировано.
Компьютерный прогноз показал, что нижеследующий мотив приведет к созданию пептидов с амфипатической спиралью.

Нижеследующие 25 пептидов были выбраны на основе данного мотива (J=ацетил, В=амид).

Данные пептиды проверяли на их антибактериальную активность в отсутствии и в присутствии плазмы (Таблица 2).
На основе полученных результатов пептиды Р145, Р148 и Р159 выбрали в качестве значительно улучшенных пептидов по сравнению с ОР-145.
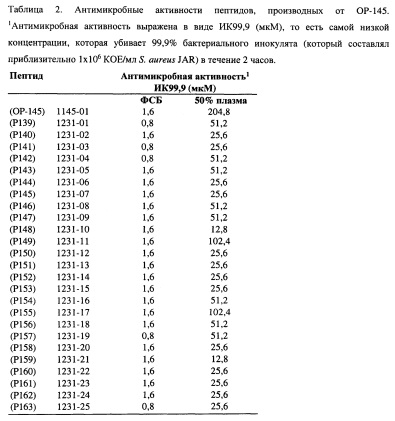
Антимикробная активность Р145, Р148 и Р159 против различных бактерий
В ФСБ пептиды Р145, Р148 и Р159 имели одинаковую антимикробную активность против всех бактериальных видов, находящихся в середине логарифмической фазы роста культуры, как и ОР-145 (Таблица 3). В присутствии 50% плазмы Р145, Р148 и Р159 показали повышенную бактерицидную активность против S. aureus JAR060131 (в 11-16 раз), МРЗС LUH14616 (в 21-26 раз), S. epidermidis RP62a (в 43 раза) и P. aeruginosa PAO1 (в более 11-21 раза) по сравнению с ОР-145.
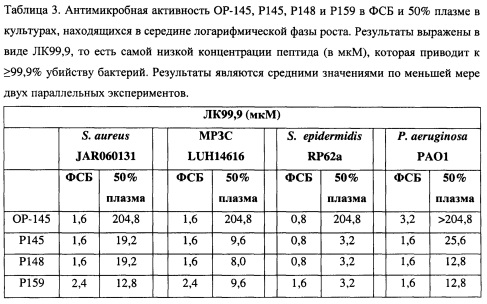
ОР-145, Р145, Р148 и Р159 показали схожую антимикробную активность против штамма S. aureus JAR060131, находящегося в стационарной фазе роста, (Таблица 4) в сравнении с бактериями в логарифмической фазе. Таким образом, в присутствии 50% плазмы Р145, Р148 и Р159 показали более высокую бактерицидную активность против S. aureus JAR060131, чем ОР-145.

Антимикробная активность вариантов Р148 с разной длиной последовательности
Делеция 4 аминокислот на С-конце и N-конце Р148 не влияет на антимикробную активность против S. aureus JAR060131 (Таблица 5). Удаление 5 аминокислот на С-конце и N-конце снижает антимикробную активность по сравнению с Р148, но активность все равно в 5 раз выше по сравнению с ОР-145.
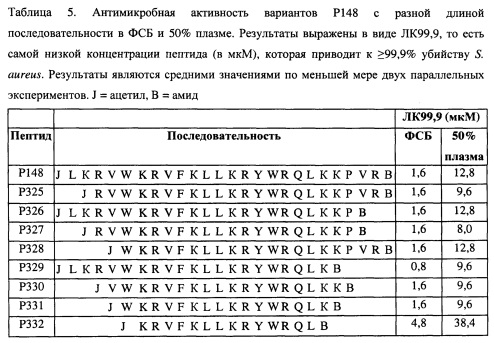
Антимикробная активность Р145, Р148 и Р159 со множеством аланиновых замен
Замена одной аминокислоты пептидов Р145, Р148 и Р159 и двух аминокислот пептида Р148 на аланин не влияет на антимикробную активность против S. aureus JAR060131 (Таблицы 6-9).

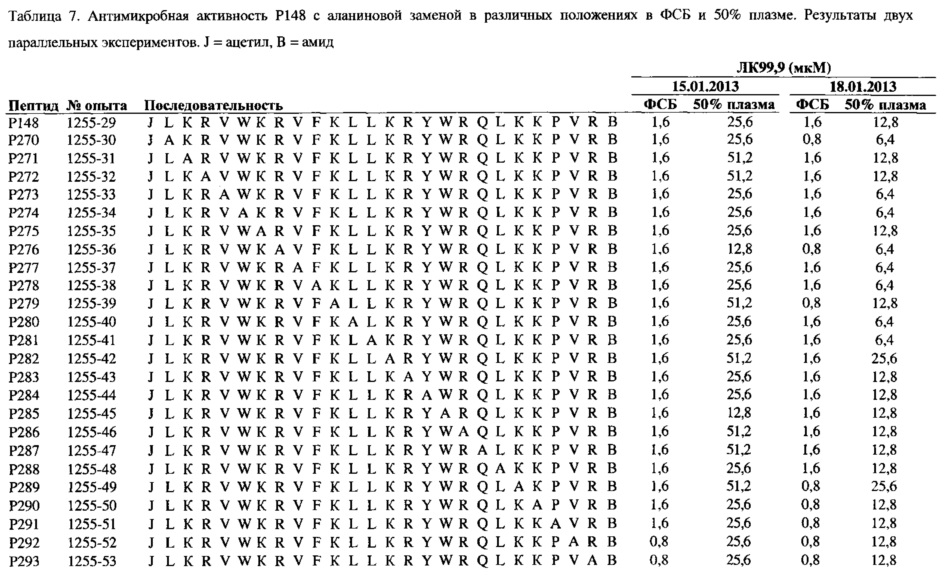
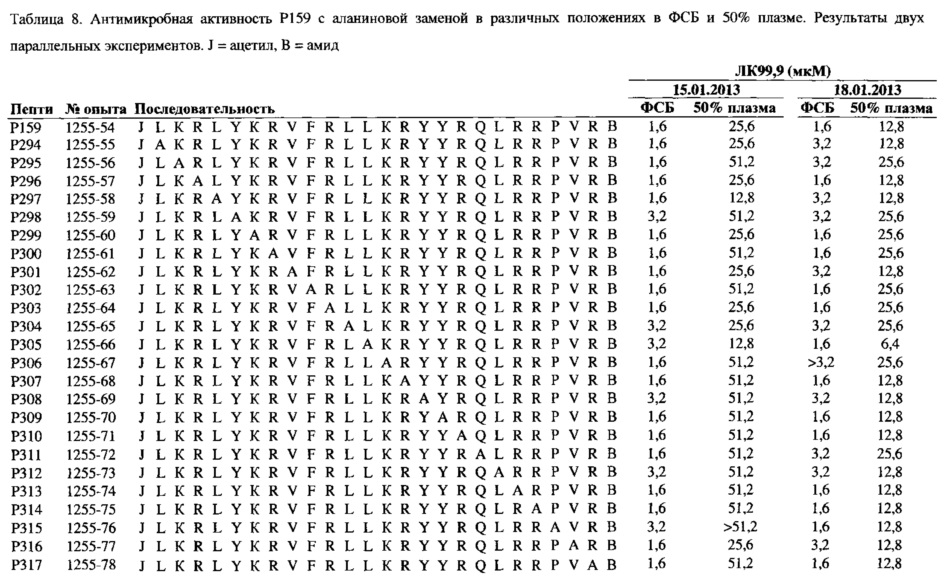

Антимикробная активность вариантов Р148 с заменами на положительно заряженные аминокислоты
Варианты Р148, где лизин или аргинин заменен на положительно заряженную аминокислоту, сохраняют антимикробную активность против S. aureus как в ФСБ, так и в присутствии 50% плазмы (Таблица 10).


Противогрибковая активность P145, P148 и P159
ОР-145 не продемонстрировал противогрибковую активность против С. albicans Y-O1 в ФСБ при концентрации 51,2 мкМ (Таблица 11). Р145, Р148 и Р159 убили 99% клеток С. albicans при концентрациях в диапазоне от 12,8 мкМ (для Р159) до 38,4 мкМ (для Р148). В 50% плазме противогрибковая активность проявлялась при концентрации 204,8 мкМ для Р145, Р148 и Р159. При данной концентрации не наблюдали противогрибковую активность у ОР-145.

ОР-145 ингибировал рост A. niger на >99,9% при концентрациях 3,2 мкМ (Фиг. 1). Р145 показал схожую противогрибковую активность, как ОР-145, при этом Р148 имел противогрибковую активность выше в 4 раза, ингибируя рост грибка уже при концентрации 0,8 мкМ. Р159 имел противогрибковую активность меньше в 2 раза по сравнению с ОР-145. Так как плазма влияла на значения оптической плотности, противогрибковую активность пептидов в присутствии плазмы оценивали только на основе световых микрофотографий. В присутствии 25% плазмы рост грибка ингибировали 204,8 мкМ ОР-145 (Фиг. 2). Р145, Р148 и Р159 ингибировали рост при 102,4 мкМ.
Активность Р145, Р148 и Р159 против биопленок
ОР-145 показал ≥50% ингибирование образования биопленок при концентрации 3,2 мкМ (Фиг. 3А). Значение ИК50 для Р145 составило 6,4 мкМ и для Р148 и Р159 составило 12,8 мкМ. Максимальное ингибирование образования биопленок составило приблизительно 75%. Стоит отметить, что в подобранной для образования биопленок среде ВМ2 данные пептиды не демонстрировали антимикробную активность до концентрации 51,2 мкМ. В покрытых плазмой лунках 3,2 мкМ ОР-145 и Р159 ингибировали образование биопленок на 50%, при этом для Р145 и Р148 требовалась концентрация в два раза больше, чтобы ингибировать образование биопленок на 50% (Фиг. 3В). Максимальное ингибирование образования биопленок в присутствии плазмы находилось в диапазоне от 61% (для Р148) до 82% (для Р159).
Иммуномодуляторная активность: нейтрализация липополисахаридов и липотейхоевой кислоты пептидами Р145, Р148 и Р159
Значения ИК50 и ИК90 для ОР-145 составили соответственно 0,15 нМ и 1,25 нМ. Р148 ингибировал на >50% выработку ИЛ-12р40, индуцированную липополисахаридами, уже при концентрации 0,3 нМ и Р159 при концентрации 0,05 нМ. Девяностопроцентное ингибирование выработки ИЛ-12р40, индуцированной липополисахаридами, достигали с концентрацией 0,25 нМ для Р148 и Р159 и 0,75 нМ для Р145 (Таблица 11). Способность пептидов нейтрализовывать липотейхоевую кислоту оценивали путем измерения ингибирования выработки клетками крови ИЛ-8, индуцированной липотейхоевой кислотой. При конечной концентрации 0,781 мкМ ОР-145 ингибировал >50% выработки ИЛ-8, индуцированной 5 мкг/мл липотейхоевой кислоты (Таблица 11). Р145, Р148 и Р159 обладали в 4 раза большей способностью нейтрализовывать липотейхоевую кислоту. Пептиды также предварительно инкубировали с убитыми ультрафиолетом бактериями штамма S. aureus JAR060131. Инкубация с 0,195 мкМ ОР-145 привела к >50% снижению выработки ИЛ-8, индуцированной S. aureus JAR (Таблица 12). Р159 обладал схожей с ОР-145 нейтрализующей активностью, при этом концентрация Р145 и Р148 для ингибирования на >50% выработки ИЛ-8, индуцированной S. aureus, требовалась в 8 раз больше (Таблица 12).