Результат интеллектуальной деятельности: КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ ИЛИ ИХ КОМПОНЕНТЫ, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ ЗАБОЛЕВАНИЙ КОЖИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей пробиотические бактерии, для лечения патологий, ассоциированных с изменениями иммунной системы. В частности, настоящее изобретение относится к применению выбранных пробиотических бактерий для приготовления композиции для лечения аллергий, таких как атопический дерматит.
Уровень техники
Атопический дерматит (АтД) - заболевание, которым страдает до пятой части населения земного шара. В первую очередь заболевание поражает детей раннего возраста [1-4]. Влияние атопического дерматита на качество жизни детей сравнимо, а в некоторых случаях и более выражено, чем при других хронических заболеваниях, и, в целом, субъективно воспринимается, как более изнурительное [5]. Значительной проблемой является то, что атопический дерматит зачастую выступает первым этапом в развитии так называемого «атопического марша». У 40% детей с АтД к 4 годам развивается астма или аллергический ринит. Помимо аллергических проявлений, аллергический ринит, в частности, прочно ассоциирован с развитием инфекционного среднего отита (у 79% со средним отитом имеется аллергический ринит) [6-9]. Важнейшим фактором АтД является нарушение кожных барьеров, связанное с трансэпидермальной потерей воды (TEWL) и колонизацией S. aureus, и положительно коррелирующей с сенсибилизацией аэроаллергенами [10-14]. Основой кожного барьера является внешний, роговой слой эпидермиса, который в норме содержит липиды и естественный увлажняющий фактор (NMF), предотвращающие потерю влаги и задерживающие воду в эпидермисе. Липиды представлены эфирами холестерина, свободными жирными кислотами (пальмитиновая, стеариновая, олеиновая и линоленовая кислоты), церамидами и холестерином. Недостаточность этого барьера и последующее увеличение трансэпидермальной потери влаги у новорожденных - надежный предиктор развития АтД [15-17]. Данное нарушение во многом обусловлено генетическим факторами и является многостадийным. Происходит уменьшение количества различных фракций церамидов (в частности, 1 и 3); увеличивается уровень свободного холестерина и уменьшение количества длинноцепочечных СЖК; нарушается формирование ламеллярных телец и гранул, нарушение их секреции (вследствие повышения активности рецептора, активируемого протеазами (PAR2)); часто имеется генетически детерминированное повышение активности ферментов (деацетилазы сфингомиелина), снижение продукции церамидов; мутации гена филаггрина, приводят к нарушению ороговения, снижению содержания NMF и увеличению рН. Повышение активности сериновых протеаз, а также мутации гена антипротеазы LEKTI и других ведут к усилению десквамации эпидермиса [18-24].
Все вышеописанное отражено в рекомендациях всех ведущих международных дерматологических и аллергологических ассоциаций, указывающих на необходимость базовой терапии с обязательным использованием эмолентов (увлажняющих средств) при ведении пациентов с АтД. Примерами являются Консенсусные рекомендации PRACTALL Европейской Академии Аллергологии и Клинической Иммунологии и Американской Академии Аллергии, Астмы и Иммунологии; рекомендации по лечению атопического дерматита Американской Академии Дерматологии; указания по лечению атопического дерматита Немецкого Общества Дерматологов S2-Leitlinie; рекомендации британского Национального Института Клинического Совершенства NICE, и т.д.
Однако, мероприятия по увлажнению кожи больных являются лишь средством лечения и в лучшем случае третичной профилактики атопического дерматита. Эффективных средств первичной профилактики, то есть средств, предотвращающих дебют заболевания, до настоящего момента не существовало, а у лекарственных средств, применяемых для профилактики и лечения АтД, к тому же имеются противопоказания и побочные эффекты, которые ограничивают их применение. При этом известны следующие факты:
- педиатрическими ассоциациями рекомендуется мыть кожу здоровых новорожденных и младенцев без использования мыла и активно увлажнять [25] кожу;
- раннее увлажнение может снизить риск развития АтД в два раза [26-28].
Арсенал увлажняющих средств, тем не менее, на настоящий день представлен в основном тремя категориями компонентов:
1. Гигроскопичные вещества (глицерин, пропилен гликоль, молочная кислота, мочевина, аминокислоты и т.д.);
2. Гидрофильные пленкообразующие вещества (гиалуроновая кислота, хитозан)
3. Гидрофобные пленкообразующие вещества (вазелин, ланолин, силиконовые масла и т.д.)
4. Эссенциальные липиды (церамиды, холестерин, свободные жирные кислоты)
Таким образом, сохраняется потребность в средствах, не имеющих ограничений, основанных на применении лекарственных средств и способов лечения, и которое можно применять для всех категорий пациентов. В частности, сохраняется потребность в лечении, которое может способствовать борьбе с началом аллергий и развитием воспалений кожи и/или для уменьшения беспокоящих симптомов, таких как покраснение кожи, зуд и экзема.
При разработке нефармацевтических увлажняющих средств не учитывается тот факт, что в основе атопического дерматита лежит не только трансдермальная потеря влаги, но и «неправильный» ответ иммунной системы, обусловленный во многом эволюционно «непривычными» гигиеническими условиями, в которых существует современное человечество в развитых странах [29-30]. Об избыточности гигиены говорят и результаты современных исследований, демонстрирующие, что применение про- и пребиотиков, раннее введение прикорма потенциальными аллергенами, ранний контакт с животными, жизнь в сельских условиях являются факторами профилактики АтД [31-36]. Это обусловлено контактом иммунной системы с непатогенными бактериями, настраивающими иммунные ответы должным образом. Однако эффективность существующих пре- и пробиотиков невысока. Возможным способом улучшения эффективности пробиотиков является использование их лизатов - то есть компонентов бактерий, полученных после разрушения клеточной стенки бактерий. Так, есть данные о местном применении лизатов V. filiformis для лечения АтД, но не для профилактики [37].
Известен патент, US 20160008412 A1, описывающий применение пробиотических бактерий и их лизатов для лечения заболеваний кожи. Однако авторы патента используют лакто-, бифидо- и пропионибактерии Lactobacillus acidophilus, Lactobacillus salivarius, Bifidobacterium lactis and Propionibacterium jensenii для лечения заболеваний, связанных с нарушением плотных контактов между клетками. Иммуномодулирующей функции, которая бы препятствовала развитию заболеваний кожи, данные композиции не имеют.
Также описано применение пробиотиков для первичной профилактики атопических заболеваний (US 7112322 В2). Патент описывание назначение живых пробиотических бактерий не ребенку или пациенту, а беременным женщинам в дозе от 1×108 до 1×1010 КОЕ в течение двух недель до родов с последующим применением пробиотиков у новорожденного в такой же дозировке в течение 2 месяцев, при этом пробиотические бактерии выбраны из Lactobacillus casei spp. rhamnosus АТСС 53103 и Bifidobacterium lactis Bb-12. В этом патенте типы микроорганизмов, механизм действия и путь введения отличаются от заявляемого.
Описан метод лечения атопического дерматита с использованием симбиотиков (US 20090169531 A1). Суть метода заключается в применении лекарственного средства или пищевой добавки, содержащей бактерии Lactobacillus rhamnosus в живом состоянии и лактозу, способную ферментироваться указанными бактериями. В этом патенте типы микроорганизмов, механизм действия и путь введения также отличаются от заявляемого.
Существует патент на композицию, содержащую пробиотические бактерии для лечения иммунных заболеваний (US 8734783 В2), где метод лечения заключается в пероральном применении композиции, содержащей бактерии Lactobacillus salivarius LS01 (DSM 22775) и Bifidobacterium breve BR03 (DSM 16604), что приводит к улучшению течения атопического дерматита. В этом патенте типы микроорганизмов, механизм действия и путь введения отличаются от заявляемого.
Описана косметическая композиция для местного применения (US 4464362 А) с целью восстановления ДНК в клетках кожи, подвергающихся воздействию ультрафиолетового облучения. Данная композиция содержит инактивированные культуры бактерий, выбранных из родов: Bifidobacterium, Actinomycetaceae, Propionibacteriaceae, Lactobacillaceae и коринеформные бактерий. В этом патенте типы микроорганизмов и механизм действия отличаются от заявляемого.
Описано применение лизатов бактерий рода Bifidobacterium в составе косметической композиции для лечения чувствительной кожи (US 20090068160 A1). Также описано косметическое использование лизата бифидобактерий и/или его фракций для лечения сухости кожи и ассоциированных заболеваний рогового слоя кожи (US 20090060962 A1), в составе средства патентом также заявлена возможность использования микроорганизмов, выбранных из группы Ascomycetes (грибки), таких, как Saccharomyces, Yarrowia, Kluyveromyces, Torulaspora, Schizosaccharomyces pombe, Debaromyces, Candida, Pichia, Aspergillus и Penicillium, и бактерий родов Bifidobacterium, Bacteroides, Fusobacterium, Melissococcus, Propionibacterium, Enterococcus, Lactococcus, Staphylococcus, Peptostreptococcus, Bacillus, Pediococcus, Micrococcus, Leuconostoc, Weissella, Aerococcus, Oenococcus, Lactobacillus, и их смесей. В этом патенте типы микроорганизмов и механизм действия отличаются от заявляемого.
Запатентована композиция эмолента для профилактики атопического дерматита (US 20110065806 A1). Профилактика состоит в обработке кожей композицией, состоящей из смеси глицерина и жидкого парафина в виде эмульсии «масло в воде» или «вода в масле». В этом патенте не содержатся продукты микроорганизмов и эффективность его ниже, чем способ и композиция, заявляемые в настоящей заявке.
Известен метод применения лизатов бактерий рода Vitreoscilla с целью профилактики или лечения гиперсеборейных состояний кожи скальпа (US 20150125412 A1). Этим же патентом защищена композиция для применения в косметологии и/или дерматологии, содержащая хотя бы один лизат бактерий рода Vitreoscilla. Тип микроорганизмов и механизм действия значительно отличаются от заявляемого.
Запатентована композиция, содержащая пробиотические бактерии для применения в лечении иммунных расстройств (RU 2605293 С2). Данная композиция содержит культуру пробиотических бактерий Lactobacillus salivarius (LS01) DSM 22775, Для применения в профилактическом и/или терапевтическом лечении патологий, выбранных из группы, состоящей из аллергий, атопии, аллергического ринита, пищевой гиперчувствительности, атопического дерматита, экземы, астмы или иммунодефицитов. Зависимым пунктом формулы патента является композиция, где указанная бактериальная культура представлена в указанной композиции в форме живых бактерий, мертвых бактерий или клеточных компонентов, клеточных экстрактов или их лизатов. Последний пункт формулы предусматривает лишь пероральное применение композиции. Таким образом, в этом патенте типы микроорганизмов, механизм действия и путь введения отличаются от заявляемого.
Известен способ применения пробиотической бактерии или ее лизата (RU (11) 2014 145 534 (13) А), где пробиотическая бактерия является штаммом Lactobacillus rhamnosus, штаммом Lactobacillus reuteri или штаммом Bifidobacterium longum. Способ лечения с применением этих штаммов включает восстановление или регенерацию кожного барьера при различных патологических состояниях, а также для лечения инфекций. Способ применения предусматривает введение бактерии или лизата в кожу. То есть типы микроорганизмов, механизм действия и путь введения отличаются от заявляемого настоящей заявкой.
Описана иммуногенная композиция для модуляции иммунной системы и ее применение, способ лечения и предотвращения заболеваний, способ индукции регенерации клеток и способ восстановления иммунного ответа (RU 2013143400А). Иммуногенная композиция содержит терапевтически эффективное количество двух или более природных или синтетических антигенных агентов, включающих патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP; от англ. "danger-associated molecular patterns"), выбранных из группы, состоящей из следующих агентов: (А) антигенных агентов с молекулярными паттернами, ассоциированными с бактериями; (В) антигенных агентов с молекулярными паттернами, ассоциированными с вирусами; (С) антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами; (D) антигенных агентов с молекулярными паттернами, ассоциированными с простейшими; (Е) антигенных агентов с молекулярными паттернами, ассоциированными с многоклеточными паразитами/или (F) антигенных агентов с молекулярными паттернами, ассоциированными с прионами; и один или более физиологически приемлемых носителей, наполнителей, разбавителей или растворителей. При этом иммуногенная композиция для модуляции иммунной системы отличается тем, что антигенные агенты выбраны из по меньшей мере четырех из групп (А), (В), (С), (D), (Е) и (F). Антигенные агенты с молекулярными паттернами, ассоциированными с бактериями, выбраны из антигенных агентов с молекулярными паттернами, ассоциированными с бактериями, принадлежат к следующим родам: Staphylococcus, Streptococcus, Enterococcus, Corynebacterium, Bacillus, Listeria, Clostridium, Mycobacterium, Actinomyces, Nocardia, Escherichia, Proteus, Klebsiella, Serratia, Enterobacter, Salmonella, Shigella, Pseudomonas, Burkholderia, Stenotrophomonas, Acinetobacter, Vibrio, Campylobacter, Helicobacter, Bacteroides, Neisseria, Moraxella, Haemophilus, Bordetella, Brucella, Francisella, Pasteurella, Yersinia, Legionella, Gardnerella, Treponema, Leptospira, Borrella, Mycoplasma, Rickettsia и Chlamydia. Антигенные агенты с молекулярными паттернами, ассоциированными с вирусами, выбраны из антигенных агентов с молекулярными паттернами, ассоциированными с вирусами, принадлежат к следующим семействам: Adenoviridae, Arenaviridae, Bunyaviridae, Coronaviridae, Filoviridae, Flaviviridae, Hepadnaviridae, Deltavirus, Caliciviridae, Herpesviridae, Orthomyxoviridae, papovaviridae, Paramyxoviridae, Parvoviridae, Picornaviridae, Poliovirus, Poxyviridae, Reoviridae, Retroviridae, Rhabdoviridae и Togaviridae. Антигенные агенты с молекулярными паттернами, ассоциированными с грибами и дрожжами, выбраны из антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами, принадлежат к следующим родам: Sporothrix, Aspergillus, Blastomyces, Candida, Coccidioides, Cryptococcus, Histoplasma и Pneumocystis. Антигенные агенты с молекулярными паттернами, ассоциированными с простейшими, принадлежат к следующим родам: Criptosporidiu, Ciclospora, Entamoeba, Naegleria, Giardia, Leishmania, Plasmodium, Toxoplasma, Trichomonas, Trypanosoma, Microsporidia и Isospora. Антигенные агенты с молекулярными паттернами, ассоциированными с гельминтами, выбраны из антигенных агентов с молекулярными паттернами, ассоциированными со следующими гельминтами: трематодами, цестодами и нематодами. Кроме того предусмотрено, что антигенные агенты могут имитировать молекулы белков, полисахаридов и/или липидов и обладать ферментативной активностью. Антигенные агенты, имеющие происхождение от агентов, выбранных из: дорназы, леведурина, оидиомицина, производного очищенного белка бациллы Коха (PPD; от англ. "purified protein derivative"), прионов, стрептокиназ, стрептококкового токсоида, дифтерийного токсоида, столбнячного токсоида, исходного туберкулина Коха, инактивированных лизатов следующих организмов: Ascaris lumbricoides, Aspergillus spp., Aspergillus flavus, Aspergillus fumigatus, Aspergillus terreus, Candida spp., Candida albicans, Candida glabrata, Candida parapsilosis, Chlamydia spp., Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia trachomatis, Cryptosporidium spp., Dermatophytes, Entamoeba hystolitica, Enterobius vermicularis, Enterococcus faecalis, Epidermophyton floccosum, Escherichia coli, Giardia lamblia, Haemophilus influenzae, Microsporum canis, Mycobacterium spp., Mycobacterium bovis, Mycobacterium leprae, Mycobacterium tuberculosis, Neisseria gonorrhoeae, папилломавируса человека, полиовируса, Proteus spp., Proteus mirabilis, Proteus penerii, Proteus vulgaris, Salmonella spp., Salmonella bongori, Salmonella enterica, Serratia spp., Serratia liquefaciens, Serratia marcencens, Shigella spp., Shigella flexneri, Shigella sonnei, Staphylococcus spp., Staphylococcus aureus, Staphylococcus epidermidis, Strongyloides stercoralis, Streptococcus spp., Streptococcus bovis, Streptococcus viridans, Streptococcus equinus, Streptococcus pneumoniae, Streptococcus pyogenes, Toxoplasma gondii, Trichomonas vaginalis, trichophytin, Trichophyton spp., Trichophyton rubrum, Trichophyton tonsurans, Trichophyton mentagrophytes, вируса желтой лихорадки, вируса гепатита В, вируса краснухи, вируса ветряной оспы, вируса оспы, вируса паротита, вируса кори, герпетического вируса и вируса осповакцины, либо их синтетических аналогов, представляющих патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), ассоциированные с данными антигенными агентами. Иммуногенная композиция при этом предусматривает введение людям или животным пероральным, внутрикожным, парентеральным, подкожным, внутривенным, внутримышечным путем, а также через слизистую оболочку носа и/или полости рта, но не накожным способом, поскольку имеет механизм действия принципиально отличный от описываемого данной заявкой.
Известно применение бактериальных экстрактов против респираторных расстройств (RU (11) 2456007 (13) С2), при этом иммуностимулирующий экстракт состоит из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis. Также известна композиция, содержащая пробиотические бактерии для применения в лечении патологий, ассоциированных с изменениями иммунной системы (RU (11) 2012140052 (13) А). Композиция включает в себя по меньшей мере одну культуру пробиотических бактерий, выбранную из группы, включающей следующие бактериальные культуры: Lactobacillus salivarius (LS01) DSM 22775, Bifidobacterium breve (BR03) DSM 16604, Lactobacillus pentosus (LPS01) DSM 21980, Streptococcus thermophilus (FP4) DSM 18616, Lactobacillus casei ssp.rhamnosus (LR04) DSM 16605, Lactobacillus acidophilus (LA02) DSM 21717.
Известен патент RU (11) 2009136577 (13) A - бактериальный экстракт против респираторных расстройств и способ его получения. Экстракт состоит из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, где во время приготовления указанного экстракта один или более бактериальных штаммов лизируют при рН более чем 12 и экстракт обрабатывают с тем, чтобы удалить нуклеиновые кислоты.
Таким образом, в настоящее время уровень техники не предусматривает изготовление и применение композиции для применения в профилактическом и/или терапевтическом лечении заболеваний кожи человека и млекопитающих животных, ассоциированных с увеличением трансдермальной потери влаги и изменениями иммунной системы (в частности, для первичной профилактики атопического дерматита) и содержащая лизат хотя бы одной бактерии, выбранной из Mycobacterium spp и Staphylococcus spp, механизм которых был бы основан на стимуляции иммунной системы антигенами бактерий, характерных для сельской местности, присутствие которых ассоциировано со снижением риска заболеваний, возникающих в результате изменения иммунной системы и/или трансдермальной потери влаги, в частности, атопического дерматита.
Раскрытие изобретения
Авторы настоящего изобретения обнаружили, что топическое применение увлажняющих средств, содержащих лизаты (экстракты) и компоненты среды культивирования микроорганизмов из типов Firmicutes, Proteobacteria, Actinobacteria, Ascomycota, Basidiomycota, в частности бактерий Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis - то есть естественных бактерий, как правило, в больших количествах присутствующих в окружающей среде сельской местности, эффективны при предупреждении и/или при лечении состояний кожи и заболеваний кожи и, в частности, при предупреждении и/или лечении атопического дерматита и/или для оздоровления кожи.
Следовательно, настоящее изобретение обеспечивает композицию для топического (местного) применения на кожу человека или млекопитающих животных, включающую лизат (экстракт) хотя бы одной бактерии из числа Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis в сочетании или без сочетания с компонентами среды, в которой культивировались бактерии из числа Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis, для применения с целью предупреждения и/или лечения состояний кожи и заболеваний кожи, предпочтительно атопического дерматита.
До этого было известно, что Mycobacterium vaccae является представителем «деревенской микрофлоры», и живые бактерии при подкожном введении значительно улучшают течение АтД у детей и взрослых, при этом у детей младшего возраста эффект М. vaccae более выражен. На животных моделях было продемонстрировано, что вакцинация М. vaccae улучшает выживаемость при меланоме, защищает от развития астмы [38-45] и способствует перестройке иммунного ответа на Th1-тип [60]. Кроме того, известно, что представители здоровой микрофлоры кожи - S. epidermidis и S. hominis продуцируют бактериоцины и защищают кожу от колонизации S. aureus (золотистым стафилококком) и их количество часто снижено на коже людей с атопическим дерматитом [46]. Однако применение живых микроорганизмов не всегда безопасно, к тому же сроки годности продукции, содержащей живые пробиотики, очень малы.
Авторы настоящего изобретения предложили решение этих проблем путем отбора специфических пробиотических бактериальных штаммов после интенсивной научно-исследовательской деятельности. Объектом настоящего изобретения является композиция, содержащая лизат и/или продукты метаболизма и жизнедеятельности по меньшей мере одной из пробиотических бактерий Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis, как заявлено в формуле изобретения. Кроме того, объект настоящего изобретения относится к применению лизатов и/или продуктов метаболизма и жизнедеятельности по меньшей мере одной из пробиотических бактерий Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis, как заявлено в формуле изобретения. Другие предпочтительные воплощения настоящего изобретения изложены в следующем подробном описании посредством не ограничивающих объем настоящего изобретения примеров.
Задача настоящего изобретения заключалась в отборе лизатов специфических бактериальных штаммов с целью оценки возможности первичной, вторичной, третичной профилактики и лечения пациентов с атопическим дерматитом и с целью определения их влияния на клинические и иммунологические параметры.
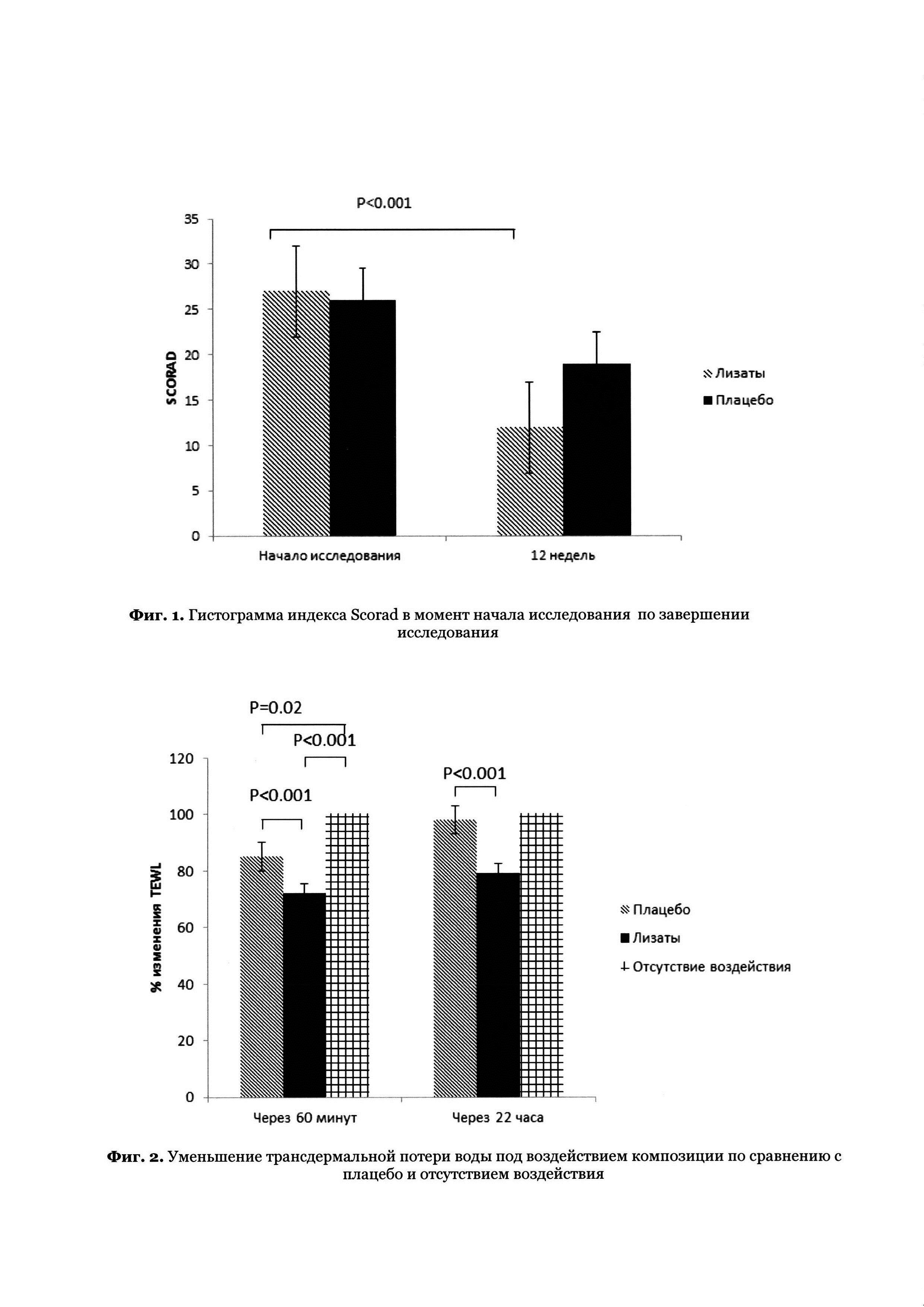
Диагноз атопического дерматита устанавливали с применением общепринятых критериев, а тяжесть заболевания в исследовании оценивали, используя стандартизированный индекс тяжести для атопического дерматита - Индекс SCORAD (Индекс оценки атопического дерматита). Указанный индекс известен специалистам в данной области техники.
Обнаружено, что лизаты и продукты метаболизма бактерий Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis штаммов, перечисленных ниже, и продукты их метаболизма обладают выраженным иммуномодулирующим действием при топическом (местном) применении на кожу и, таким образом, полезны для лечения патологий кожи, ассоциированных с изменениями иммунной системы.
Культуры Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis депонированы в немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen -GmbH, (DSMZ)) в Германии в соответствии с Будапештским соглашением под идентификационными номерами DSM 43292, DSM 43516, DSM 43229, DSM 43514, DSM 43515, DSM 31013; DSM 30936, DSM 30918, DSM 30568, DSM 30637, DSM 30934, DSM 30780, DSM 30916, DSM 30906, DSM 30971, DSM 30591, DSM 31011, DSM 30647, DSM 30556, DSM 30905, DSM 30883, DSM 30804, DSM 1798, DSM 4851, DSM 3270, DSM 8913, DSM 3269, DSM 28764, DSM 18857, DSM 28765, DSM 30804, DSM 20042, DSM 28319, DSM 20044, DSM 20041; DSM 30988, DSM 30991, DSM 30990, DSM 20330, DSM 30894, DSM 30900, DSM 30549, DSM 20328, DSM 15614, DSM 30574, DSM 30984, DSM 30903, DSM 30940, DSM 30667, DSM 30576, DSM 30986, DSM 100547, DSM 30970, DSM 30900, DSM 30565, DSM 30515. Специалист в данной области примет во внимание, что данным списком не ограничиваются возможные варианты осуществления данного изобретения и могут быть использованы и иные штаммы, помимо перечисленных в данном документе
В контексте настоящего изобретения перечисленные выше культуры пробиотических бактерий могут находиться в форме живых бактерий, мертвых бактерий или клеточных компонентов, клеточных экстрактов или их лизатов, компонентов культуральной среды, в которой происходило культивирование перечисленных выше бактерий.
Осуществление изобретения
Как применено в этом документе, следующие термины имеют следующие значения.
Термин «лизат» означает материал, полученный после разрушения одного или более бактериальных штаммов. В некоторых случаях экстракт получают только из одного штамма, в то время как в других случаях экстракт представляет собой смесь экстрактов из нескольких различных штаммов.
Термин «кожное заболевание» означает атопический дерматит и другие связанные заболевания кожи. Экзема представляет собой атопический дерматит.
Термин «предупреждение и/или лечение заболеваний кожи» означает предупреждение и снижение частоты и/или возникновения и/или тяжести и/или длительности заболеваний кожи, т.е. атопического дерматита и других связанных заболеваний кожи, в особенности атопического дерматита. Термин «возникновения» связан с количеством случаев любых кожных заболеваний. Частота связана с количеством случаев одного и того же кожного заболевания. Данное предупреждение охватывает снижение частоты и/или тяжести указанных заболеваний кожи в более позднем возрасте. Термин «в более позднем возрасте» охватывает влияние после завершения вмешательства. Влияние «в более позднем возрасте» предпочтительно может быть от 2-х до 4 недель, от 2-х до 12-ти месяцев или лет (например, до 2, 5, 10 лет) после завершения указанного вмешательства.
Термин «состояния кожи» означает состояния, когда кожа предрасположена к избыточной трансдермальной потере влаги (TEWL), раздражена, закупорена или воспалена. Состояния кожи могут вызвать симптомы заболеваний кожи, такие как покраснение, отек, жжение и зуд.
Термин «предупреждение и/или лечение состояний кожи» означает оздоровление кожи и/или предупреждение обезвоживание кожи и/или повышение гидратации кожи и/или уменьшение кожной сыпи, шероховатости и/или сухости кожи. Данное предупреждение дополнительно охватывает установление фенотипа, видимого или скрытого, сопровождающего снижение частоты, возникновения, тяжести и/или длительности указанных состояний кожи в более позднем возрасте.
Термин «повышение оральной толерантности к аллергенам» означает снижение чувствительности к аллергенам при пероральном приеме.
Термин «гипоаллергенная питательная композиция» означает питательную композицию, которая с низкой вероятностью может вызывать аллергические реакции.
Термин «пребиотик» означает неперевариваемые углеводы, которые благотворно влияют на хозяина путем избирательной стимуляции роста и/или активности полезных для здоровья бактерий, таких как бифидобактерии в толстом кишечнике человека [47].
Термин «пробиотик» означает микробные клеточные препараты или компоненты микробных клеток или продукты метаболизма микробных клеток, которые благотворно влияют на здоровье или общее самочувствие организма-хозяина [48].
«Аллергия» представляет собой аллергию, которая была установлена врачом и которую можно лечить при возникновении в этом потребности или в течение более продолжительного времени.
Выражение "иммуномодулирующая композиция" означает, что композиция способна модулировать иммунную систему в том смысле, что способна стимулировать/вызывать несколько ответов иммунной системы, например, продукцию специфических цитокинов.
Все проценты даны по массе, если не указано иное.
Композиция в соответствии с изобретением предпочтительно представляет собой гипоаллергенную композицию.
Указанная композиция содержит, по меньшей мере, один пробиотик или бактериальный лизат на основе бактерий из числа Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis. Это означает, что композиция в соответствии с изобретением содержит пробиотик на основе Mycobacterium vaccae или Staphylococcus epidermidis или Staphylococcus hominis или сочетание двух или более вышеперечисленных пробиотиков и/или их компонентов. Пробиотик может быть получен путем культивирования бактерий в питательных средах, и их дальнейшего полного или частичного разрушения физическими (например, ультразвуком), химическими (например, щелочью) или биологическими (например, бактериофагами) методами и дальнейшей модификации с целью сохранения и дальнейшего применения (например, л иофил изация).
Предпочтительно, композиция в соответствии с изобретением содержит продукты от 103 до 1012 КОЕ пробиотического бактериального штамма, более предпочтительно, от 107 до 1012 КОЕ, на г сухой массы композиции или от 0,01 до 10 г лиофилизированного продукта на 100 г сухой массы композиции.
Композиция изобретения может дополнительно включать, по меньшей мере, один пребиотик, такой как диетические волокна с пребиотической активностью, такие как фруктоолигосахариды (FOS), инулин и частично гидролизованную гуаровую камедь (PHGG), обычно в количестве от 0,1 до 10% от массы композиции.
В соответствии с предпочтительными вариантами осуществления обеспечиваются композиции и способы, направленные на применение местного состава, который содержит (а) по меньшей мере, один пробиотик или бактериальный лизат на основе бактерий из числа Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis; и (b) формообразующее или наполнитель для местного применения, где местный состав доставляет и удерживает пробиотик на коже и, таким образом, лечат состояние кожи.
В предпочтительном воплощении настоящее изобретение содержит или, альтернативно, состоит из пробиотика или бактериального лизата на основе бактерий Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis для приготовления композиции, способной предупреждать, уменьшать и/или лечить патологии, ассоциированные с изменениями иммунной системы, такие как аллергии, атопия, аллергический ринит, пищевая гиперчувствительность, атопический дерматит, экзема, астма и иммунодефициты.
Способ доставки местного состава, содержащего пробиотики или бактериальные лизаты, может изменяться, но, как правило, включает применение состава данного изобретения на область кожи, склонной к или затронутой состоянием кожи, таким как повреждение кожи, связанное с трансдермальной потерей влаги и изменениями иммунной системы, например, при риске развития атопического дерматита, при атопическом дерматите, увеличенной толщине кожи, потере эластичности кожи и уменьшении содержания коллагена и/или сухой коже.
Пробиотики или бактериальные лизаты по настоящему изобретению можно рассматривать как "активные ингредиенты", которые могут быть смешаны в соответствующих пропорциях с физиологически и/или фармацевтически приемлемыми эксципиентами. Для усиления своей активности действующие начала могут быть введены системно, преимущественно перорально, в форме композиции в твердом состоянии, приготовленной в соответствии со способами, известными специалистам в данной области техники. В предпочтительном воплощении композиции находятся в форме лиофилизатов, порошков, гранул, таблеток, мягких желатиновых капсул или суспензий. Композиции по настоящему изобретению могут представлять собой фармацевтические, диетические, пищевые или нутрицевтические композиции.
Композиции по настоящему изобретению, которые содержат выбранные пробиотики или бактериальные лизаты, полезны в качестве иммуномодулирующих композиций, способных модулировать иммунную систему.
Таким образом, композиции по настоящему изобретению можно эффективно применять для профилактического и/или терапевтического лечения патологий, ассоциированных с изменениями иммунной системы, в частности для профилактического и/или терапевтического лечения аллергий, атопии, аллергического ринита, пищевой гиперчувствительности, атопического дерматита, экземы, астмы или иммунодефицитов. Предпочтительно, композиции по настоящему изобретению можно эффективно применять для профилактического и/или терапевтического лечения атопического дерматита.
Предпочтительно применение людьми с кожей, склонной к или затронутой состоянием кожи склонными к пациентами, страдающими атопическим дерматитом АД, композиции, содержащей пробиотик или лизат на основе бактерий из числа Mycobacterium vaccae, Staphylococcus epidermidis и Staphylococcus hominis, приводит к снижению частоты состояний кожи, а в случае атопического дерматита вызывает снижение индекса Scorad (меньшее значение Scorad указывает на более хорошее качество жизни).
Варианты осуществления данного изобретения, таким образом, относятся к фармацевтическим или целебным косметическим ("космецевтическим") препаратам, которые можно применять для предупреждения, оказания помощи или лечения различных состояний кожи и, в частности, состояний кожи, которые связаны с трансдермальной потерей влаги и изменениями иммунной системы, например, при риске развития атопического дерматита, при атопическом дерматите, увеличенной толщине кожи, потере эластичности кожи и уменьшении содержания коллагена и/или сухой коже. Специалист в данной области примет во внимание, что следующие примеры являются лишь показательными относительно состояний кожи, включающие состояния кожи, которые возникают в результате трансдермальной потерей влаги и изменениями иммунной системы в коже субъекта, и что состояния кожи, отличные от перечисленных в данном документе, можно лечить согласно вариантам осуществления данного изобретения.
Специалист в данной области примет во внимание, что эти и связанные варианты осуществления данного изобретения можно применять для предупреждения или лечения состояний кожи, нарушений, осложнений, заболеваний, инфекций или иных, помимо перечисленных в данном документе.
Местные составы
Как отмечено выше, варианты осуществления, описанные в данном документе, относятся к местным составам описанных композиций, составам, которые содержат пробиотики или бактериальные лизаты в фармацевтически приемлемом носителе, формообразующем или разбавителе и в терапевтическом количестве, как раскрыто в данном документе, при нанесении местно на животное, предпочтительно на млекопитающее, и наиболее предпочтительно на человека.
Местное нанесение пробиотиков или бактериальных лизатов, описанных в данном документе, в чистой форме или в соответствующей фармацевтической композиции можно осуществить любыми общепринятыми методами местного нанесения средств для подобных применений. Местное применение или нанесение композиции означает, в предпочтительных вариантах осуществления, непосредственный контакт композиции (например, местного состава) с кожей субъекта, подвергающегося лечению, которое может быть в одном или более локализованных или широко распространенных участках кожи и которое может в целом относиться к контакту местного состава с интактным роговым слоем или эпидермисом, но не обязательно должно так ограничиваться; например, определенные варианты осуществления рассматривают как местное применение нанесения местного состава, описанного в данном документе, на раненную, стертую или пораженную кожу, или кожу субъекта, подвергающегося хирургической операции, так, чтобы контакт местного состава мог происходить не только с роговым слоем или эпидермисом, но также со слоями зернистых клеток, осистых клеток и/или базальных клеток кожи, и/или с дермальными или нижележащими тканями, например, что может сопровождать определенные виды заживления раны или лечения раны, или другие коррекции кожной ткани.
Местные составы (например, косметические и фармацевтические композиции) данного изобретения можно получить сочетанием описанных пробиотиков или бактериальных лизатов с соответствующим фармацевтически приемлемым носителем, разбавителем или формообразующим для применения при приготовлении местного состава, и можно составить в препараты в твердой, полутвердой, гелевой, кремовой, коллоидной, суспензионной или жидкой, или других местно наносимых формах, таких как порошки, гранулы, мази, растворы, промывки, гели, кремы, лосьоны, пасты, пластыри, лекарственные вещества в вязком носителе, биоклеи, микросферные суспензии, аэрозоли, пены для ванн, шампуни, массажные масла, очищающая вода, очищающие и увлажняющие салфетки.
Местные составы, описанные в данном документе, доставляют эффективное количество пробиотиков и бактериальных лизатов к коже и удерживают их там в течение неопределенного времени.
Композиции, которые будут наноситься на кожу субъекта или пациента, могут в определенных вариантах осуществления принимать форму одной или более единиц дозировки, где, например, капсула, наполненная жидкостью, или ампула может содержать одну единицу дозировки, и контейнер местного состава, как описано в данном документе, в форме аэрозоля может содержать множество единиц дозировки. Существующие способы получения таких форм дозировки известны или будут очевидны специалистам данной области техники; например, см. The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). В соответствии с данными идеями композиция, которая подлежит нанесению, будет в любом случае содержать терапевтически эффективное количество пробиотиков и бактериальных лизатов для лечения состояния кожи, которые связаны с трансдермальной потерей влаги и изменениями иммунной системы.
Как отмечено выше, данные местные составы могут принимать любую из широкого разнообразия форм и включают, например, кремы, лосьоны, растворы, спреи, гели, мази, пасты или подобное, и/или могут быть приготовлены так, чтобы содержать липосомы, мицеллы и/или микросферы. Например, кремы, как хорошо известно в настоящих уровнях техники фармацевтического и косметического состава, являются вязкими жидкостями или полутвердыми эмульсиями, или масло-в-воде, или вода-в-масле. Основы для крема являются водосмываемыми и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза, также называемая "внутренняя" фаза, обычно включает вазелин и жирный спирт, такой как цетиловый или стеариловый спирт. Обычно, водная фаза, хотя и не обязательно, превышает масляную фазу в объеме и, как правило, содержит увлажнитель. Эмульгатор в кремовом составе, как правило, является неионным, анионным, катионным или амфотерным поверхностно-активным веществом.
Лосьоны, которые предпочтительны для доставки косметических средств, являются препаратами, подлежащими нанесению на поверхность кожи без растирания, и типично являются жидкими или полужидкими препаратами, в которых твердые частицы, включая активное средство, присутствуют в водной или спиртовой основе. Лосьоны обычно являются суспензиями твердых веществ и предпочтительно содержат жидкую масляную эмульсию типа масло-в-воде. В данном документе лосьоны являются предпочтительными составами для лечения больших участков тела из-за простоты применения более жидкой композиции. Обычно является предпочтительным, чтобы нерастворимое вещество в лосьоне было тонкоизмельченным. Лосьоны, как правило, будут содержать суспендирующие средства для получения лучших дисперсий, а также соединения, пригодные для локализации и удерживания активного средства при контакте с кожей, например, метилцеллюлозу, натрий карбоксиметилцеллюлозу или подобное.
Растворами являются гомогенные смеси, полученные растворением одного или более химических веществ (растворенных веществ) в жидкости так, чтобы молекулы растворенного вещества диспергировались среди молекул растворителя. Раствор может содержать другие фармацевтически приемлемые и/или косметически приемлемые химикаты для буферизации, стабилизации или сохранения растворенного вещества. Общими примерами растворителей, применяемых для приготовления растворов, являются этанол, вода, пропиленгликоль или любые другие фармацевтически приемлемые и/или косметически приемлемые наполнители.
Гелями являются полутвердые системы суспензионного типа. Однофазные гели содержат органические макромолекулы, в основном распределенные однородно по жидкости-носителю, который типично является водным, но также, предпочтительно, содержит спирт и, факультативно, масло. Предпочтительные "органические макромолекулы," т.е., гелеобразующие средства, могут быть химически сшитыми полимерами, такими как, например, сшитые полимеры акриловой кислоты, семейством полимеров "карбомер", например, карбоксиполиалкиленами, которые можно коммерчески получить под торговым названием Carbopol®. Также предпочтительными в определенных вариантах осуществления могут быть гидрофильные полимеры, такие как полиэтиленоксиды, сополимеры полиоксиэтилена-полиоксипропилена и поливиниловый спирт; целлюлозные полимеры, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы и метилцеллюлоза; камеди, такие как трагакантовая и ксантановая камедь; альгинат натрия; и желатин. Для получения однородного геля можно добавить диспергирующие средства, такие как спирт или глицерин, или гелеобразующее средство можно диспергировать измельчением в порошок, механическим смешиванием или перемешиванием, или их сочетаниями.
Мази, как также хорошо известно в данной области техники, являются полутвердыми препаратами, которые типично основаны на вазелине или других производных нефти. Специфическая мазевая основа, которую необходимо применять, как будет отмечено специалистами в настоящем уровне техники, является такой, которая будет обеспечивать ряд необходимых характеристик, например, смягчение или подобное. Как и с другими носителями или наполнителями мазевая основа должна быть инертной, стабильной, нераздражающей и не сенсибилизирующей. Мазевые основы можно сгруппировать в четыре класса: маслянистые основы; эмульгируемые основы; эмульсионные основы; и водорастворимые основы [49]. Маслянистые мазевые основы включают, например, растительные масла, жиры, полученные из животных, и полутвердые углеводороды, полученные из нефти. Эмульгируемые мазевые основы, также известные как абсорбирующие мазевые основы, содержат немного или не содержат воды и включают, например, гидроксистеаринсульфат, безводный ланолин и гидрофильный вазелин. Эмульсионные мазевые основы являются или эмульсиями вода-в-масле (В/Ж), или эмульсиями масло-в-воде (М/В) и включают, например, цетиловый спирт, глицерил моностеарат, ланолин и стеариновую кислоту. Предпочтительные водорастворимые мазевые основы получают из полиэтиленгликолей различного молекулярного веса.
Пасты являются полутвердыми формами дозировки, в которых активное средство суспендировано в подходящей основе. В зависимости от природы основы пасты делят на жирные пасты или изготовленные из однофазных водных гелей. Основой в жирной пасте обычно является вазелин или гидрофильный вазелин, или подобное. Пасты, изготовленные из однофазных водных гелей, обычно включают карбоксиметилцеллюлозу или подобное в качестве основы.
Составы можно также приготовить с липосомами, мицеллами и микросферами. Липосомами являются микроскопические везикулы, имеющие одну (однослойные) или множество (многослойные) липидных стенок, содержащих липидный бислой, и, в настоящем контексте, они могут инкапсулировать и/или адсорбировать в их липидные мембранные поверхности один или более компонентов описанных здесь местных составов, таких как антиоксидантные соединения или определенные носители или формообразующие. Липосомальные препараты в данном документе включают катионные (положительно заряженные), анионные (отрицательно заряженные) и нейтральные препараты. Катионные липосомы являются легкодоступными. Например, N[1-2,3-диолеилокси)пропил]-N,N,N-триэтиламмонийные (DOTMA) липосомы доступны под торговым названием Lipofectin® (GIBCO BRL, Grand Island, N.Y.). Аналогично, анионные и нейтральные липосомы также легкодоступны, например, от Avanti Polar Lipids (Birmingham, AL), или могут быть легко получены с помощью легкодоступных материалов. Такие материалы включают фосфатидилхолин, холестерин, фосфатидилэтаноламин, диолеилфосфатидилхолин (DOPC), диолеилфосфатидилглицерин (DOPG) и диолеилфосфатидилэтаноламин (DOPE), среди прочего. Эти материалы можно также смешать с DOTMA в соответствующих соотношениях. Способы получения липосом с помощью этих материалов хорошо известны в настоящем уровне техники.
Мицеллы известны в настоящем уровне техники как содержащие молекулы поверхностно-активного вещества, расположенные так, что их полярные концевые группы образуют внешнюю сферическую оболочку, тогда как гидрофобные углеводородные цепи ориентированы к центру сферы, образуя ядро. Мицеллы формируются в водном растворе, содержащем поверхностно-активное вещество при достаточно высокой концентрации так, чтобы мицеллы образовывались природным путем. Поверхностно-активные вещества, пригодные для образования мицелл, включают, но без ограничений, лаурат калия, октансульфонат натрия, декансульфонат натрия, додекансульфонат натрия, лаурилсульфат натрия, докузат натрия, децилтриметиламмония бромид, додецилтриметиламмония бромид, тетрадецилтриметиламмония бромид, тетрадецилтриметиламмония хлорид, додецилтриаммония хлорид, полиоксил-8 додециловый эфир, полиоксил-12 додециловый эфир, ноноксинол ю и ноноксинол 30.
Микросферы, подобным образом, могут быть включены в описываемые в данный момент местные составы. Подобно липосомам и мицеллам, микросферы в основном инкапсулируют один или более компонентов данных составов. Они обычно, но не обязательно, образованы из липидов, предпочтительно заряженных липидов, таких как фосфолипиды. Получение липидных микросфер хорошо известно в данной области техники.
Различные добавки, как известно специалистам данной области техники, также можно включить в местные составы. Например, растворители, включая относительно небольшие количества спирта, можно применять для растворения определенных компонентов состава. Примеры растворителей включают, но без ограничений, эфиры, такие как моноэтиловый эфир диэтиленгликоля (коммерчески доступен как Transcutol®) и монометиловый эфир диэтиленгликоля; поверхностно-активные вещества, такие как лаурат натрия, лаурилсульфат натрия, цетилтриметиламмония бромид, бензалкония хлорид, Poloxamer® (231, 182, 184), Tween® (20, 40, 60, 80) и лецитин; спирты, такие как этанол, пропанол, октанол, бензиловый спирт и подобное; полиэтиленгликоль и его сложные эфиры, такие как полиэтиленгликоля монолаурат (PEGML); амиды и другие азотистые соединения, такие как мочевина, диметилацетамид (DMA), диметилформамид (DMF), 2-пирролидон, 1-метил-2-пирролидон, этаноламин, диэтаноламин и триэтаноламин; терпены; алканоны; и органические кислоты, в особенности лимонную кислоту и сукциновую кислоту. Azone® и сульфоксиды, такие как DMSO и C10MSO, также можно применять, но они менее предпочтительны.
Наиболее предпочтительными усилителями проникновения в кожу являются липофильные со-усилители, которые типично называются "пластифицирующие" усилители, т.е., усилители, имеющие молекулярный вес в диапазоне от приблизительно 150 до 1000 дальтон, водную растворимость менее чем приблизительно 1 вес. %, предпочтительно менее чем приблизительно 0,5 вес. % и наиболее предпочтительно менее чем приблизительно 0,2 вес. %. Параметр растворимости Гильдебранда пластифицирующих усилителей находится в диапазоне от приблизительно 2,5 до приблизительно 10, предпочтительно в диапазоне от приблизительно 5 до приблизительно 10. Предпочтительными липофильными усилителями являются жирные сложные эфиры, жирные спирты и жирные эфиры. Примеры специфических и наиболее предпочтительных сложных эфиров жирных кислот включают метиллаурат, этилолеат, монолаурат пропиленгликоля, дилаурат пропиленглицерина, монолаурат глицерина, моноолеат глицерина, изопропил н-деканоат и октилдодецилмиристат.Жирные спирты включают, например, стеариловый спирт и олеиловый спирт, в то время как жирные эфиры включают соединения, где диол или триол, предпочтительно С2-С4 алкандиол или триол, замещены одним или двумя заместителями жирного эфира. Дополнительные усилители проникновения в кожу будут известны специалистам в области техники местной доставки лекарственного средства и/или описаны в соответствующей литературе [50].
Различные другие добавки могут быть включены в местные составы согласно определенным вариантам осуществления данного изобретения, дополнительно к определенным выше. Они включают, но без ограничений, антиоксиданты, вяжущие средства, ароматизирующие средства, консерванты, смягчители, пигменты, красители, увлажнители, диспергаторы и солнцезащитные средства, а также другие классы материалов, присутствие которых может быть желательно в косметических, медицинских или других целях. Типичные примеры факультативных добавок для включения в составы данного изобретения являются следующими: консерванты, такие как сорбат; растворители, такие как изопропанол и пропиленгликоль; вяжущие средства, такие как ментол и этанол; смягчители, такие как полиалкиленметилглюкозиды; увлажнители, такие как глицерин; эмульгаторы, такие как глицерина стеарат, ПЭГ-100 стеарат, полиглицерил-3 гидроксилауриловый эфир и полисорбат 60; сорбит и другие полигидроксиспирты, такие как полиэтиленгликоль; средства от солнечного ожога, такие как октилметоксилциннамат (коммерчески доступен как Parsol МСХ) и бутилметоксибензоилметан (доступен под торговым названием Parsol 1789); антиоксиданты, такие как аскорбиновая кислота (витамин С), α-токоферол (витамин Е), β-токоферол, γ-токоферол, δ-токоферол, ε-токоферол, ζ1-токоферол, ζ2-токоферол, η-токоферол и ретинол (витамин А); эфирные масла, церамиды, незаменимые жирные кислоты, минеральные масла, растительные масла (например, соевое масло, пальмовое масло, жидкая фракция масла ши, подсолнечное масло), животные жиры (например, пергидросквален), синтетические масла, силиконовые масла или воски (например, циклометикон и диметикон), фторированные масла (обычно перфторполиэфиры), жирные спирты (например, цетиловый спирт) и воски (например, пчелиный воск, карнаубский воск и парафиновый воск); модификаторы ощущения кожи; и загустители и поверхностно-активные вещества, такие как разбухающие глины и поперечно сшитые карбоксиполиалкилены, которые коммерчески можно получить под торговым названием Carbopol®.
Другие добавки включают полезные средства, такие как материалы, которые кондиционируют кожу (в частности, верхние слои кожи в роговом слое эпидермиса) и сохраняют ее мягкой посредством замедления снижения у нее содержания воды и/или защищают кожу. Такие кондиционирующие и увлажняющие средства включают, в качестве примера, пирролидинкарбоновую кислоту и аминокислоты; органические противомикробные средства, такие как 2,4,4'-трихлор-2-гидроксидифениловый эфир (триклозан) и бензойная кислота; противовоспалительные средства, такие как ацетилсалициловая кислота и глицирретиновая кислота; противосеборейные средства, такие как ретиноевая кислота; сосудорасширяющие средства, такие как никотиновая кислота; ингибиторы меланогенеза, такие как койевая кислота; и их смеси. Могут присутствовать другие преимущественно включенные косметически активные средства, например, α-гидроксикислоты, α-кетокислоты, полимерные гидроксикислоты, увлажнители, коллаген, экстракты из морских водорослей и антиоксиданты, такие как аскорбиновая кислота (витамин С), α-токоферол (витамин Е) или другие токоферолы, такие как описанные выше, и ретинол (витамин А), и/или их косметически приемлемые соли, сложные эфиры, амиды или другие производные. Дополнительные косметические средства включают те, что способны улучшать снабжение кожной ткани кислородом. Можно также включить солнцезащитные средства.
Другие варианты осуществления могут включать разнообразие неканцерогенных, нераздражающих заживляющих материалов, которые облегчают лечение составами данного изобретения. Такие заживляющие материалы могут включать питательные вещества, минералы, витамины, электролиты, ферменты, травы, экстракты растений, железистые или животные экстракты, или безопасные терапевтические средства, которые можно добавить к составу для облегчения заживления кожных нарушений. Количества этих различных добавок такие, как обычно применяют в косметической области, и варьируют в диапазоне, например, от приблизительно 0,01% до приблизительно 20% общего веса местного состава.
Составы данного изобретения могут также включать обычные добавки, такие как замутнители, ароматизирующие, красящие, гелеобразующие средства, загущающие средства, стабилизаторы, поверхностно-активные вещества и подобное. Можно также добавить другие средства, такие как противомикробные средства, для предупреждения порчи при хранении, т.е., для ингибирования роста микробов, таких как дрожжи и плесени. Подходящие противомикробные средства типично выбирают из метиловых и пропиловых сложных эфиров п-гидроксибензойной кислоты (например, метил- и пропилпарабен), бензоата натрия, сорбиновой кислоты, имидомочевины и их сочетаний. Составы могут также содержать смягчающие раздражение добавки для минимизации или устранения возможности раздражения кожи или повреждения кожи, возникающие из-за химической частицы, которую необходимо ввести, или других компонентов композиции. Подходящие смягчающие раздражение добавки включают, например: α-токоферол; ингибиторы моноаминоксидазы, в частности, фениловые спирты, такие как 2-фенил-1-этанол; глицерин; салицилаты; аскорбаты; ионофоры, такие как монензин; амфифильные амины; аммония хлорид; N-ацетилцистеин; капсаицин; и хлорохин. Смягчающая раздражение добавка, если присутствует, может быть включена в местный состав в концентрации, эффективной для смягчения раздражения или повреждения кожи, типично представляя не более чем приблизительно 20 вес. %, более типично не более чем приблизительно 5 вес. %, состава.
Местные составы могут также содержать, дополнительно к митохондриально нацеленным антиоксидантным соединениям, описанным в данном документе (например, mitoQ-C10 мезилат), терапевтически эффективное количество одного или более дополнительных фармакологически активных средств, подходящих для местного нанесения. Такие средства могут включать ассиметричный ламеллярный агрегат, состоящий из фосфолипидов и фторуглерода с загруженным кислородом или смеси фторуглеродных соединений, которые способны улучшать поставку кислорода в кожную ткань.
Подходящие фармакологически активные средства, которые могут быть включены в данные местные составы и, таким образом, местно применяться, включают, но без ограничений, следующее: средства, улучшающие или устраняющие пигментированные или непигментированные возрастные пятна, кератозы и морщины; противомикробные средства; противобактериальные средства; противозудные и противоксеротические средства; противовоспалительные средства; местные анестетики и анальгетики; кортикостероиды; ретиноиды (например, ретиноевая кислота; витамины; гормоны; и антиметаболиты). Некоторые примеры местных фармакологически активных средств включают ацикловир, амфотерицин, хлоргексидин, клотримазол, кетоконазол, эконазол, миконазол, метронидазол, миноциклин, нистатин, неомицин, канамицин, фенитоин, сложные эфиры парааминобензойной кислоты, октилметоксициннамат, октилсалицилат, оксибензон, диоксибензон, токоферол, токоферилацетат, сульфид селения, цинк-пиритион, дифенгидрамин, прамоксин, лидокаин, прокаин, эритромицин, тетрациклин, клиндамицин, кротамитон, гидрохинон и его монометиловые и бензиловые эфиры, напроксен, ибупрофен, кромолин, ретиноевую кислоту, ретинол, ретинилпальмитат, ретинилацетат, каменноугольную смолу, гризеофульвин, эстрадиол, гидрокортизон, гидрокортизона 21-ацетат, гидрокортизона 17-валерат, гидрокортизона 17-бутират, прогестерон, бетаметазона валерат, бетаметазона дипропионат, триамцинолона ацетонид, флуоцинонид, клобетазола пропионат, миноксидил, дипиридамол, дифенилгидантоин, бензоилпероксид и 5-фторурацил.
Фармакологически приемлемый носитель может быть также включен в местный состав определенных данных вариантов осуществления и может быть любым носителем, обычно применяемым в данной области техники. Примеры включают воду, низшие спирты, высшие спирты, многоатомные спирты, моносахариды, дисахариды, полисахариды, углеводородные масла, жиры и масла, воски, жирные кислоты, силиконовые масла, неионные поверхностно-активные вещества, ионные поверхностно-активные вещества, силиконосодержащие поверхностно-активные вещества и смеси на водной основе, и смеси на эмульсионной основе таких носителей.
Варианты осуществления данного изобретения могут применяться косметически, фармацевтически или и то, и другое одновременно. Косметические и фармацевтические применения могут включать такие продукты, как аэрозоли, детские продукты, масла для ванн, пена для ванн, моющие средства, продукты декоративной косметики, кондиционеры, маскирующие кремы, кремы, дезодоранты, дезинфектанты, капли, макияж для глаз и лица, лак для ногтей, крем-основа, гели, гигиеническая губная помада, блеск для губ, помада, маски, молочко, увлажняющие крема, ночной крем, мази, масла, парфюмерные изделия, пластыри (включая трансдермальные пластыри), порошки, шампуни, гели или лосьоны для бритья, полезные для кожи крема и лосьоны, мыла, губки, спреи, тонирующие средства, тоники, салфетки и подобное. Специалист в данной области оценит, что варианты осуществления данного изобретения не ограничены примерами, приведенными в данном документе.
Варианты осуществления местного состава данного изобретения можно регулярно наносить на любую область кожи, требующей лечения, с частотой и в количестве, необходимом для достижения желаемых результатов. Частота лечения зависит от природы состояния кожи, степени поражения или повреждения кожи, ответной реакции кожи пользователя, эффективности активных ингредиентов в конкретном варианте осуществления, эффективности наполнителя, применяемого для доставки активных ингредиентов в соответствующий слой кожи, легкости, с которой формула удаляется физическим контактом с одеждой или ее удаление потом или другими внутренними или внешними жидкостями, и удобства для образа жизни пользователя.
Типичные концентрации активных веществ, таких как новая лечебная композиция, описанная в данном документе, могут находиться в диапазоне, например, от приблизительно 0,001-30% по весу от общего веса композиции до приблизительно 0,01-5,0%, и более предпочтительно до приблизительно 0,1-3,0%. В качестве одного характерного примера, композиции данного изобретения можно применять на кожу с дозой, равной от приблизительно 1,0 мг/кв. см кожи до приблизительно 20,0 мг/кв. см кожи. Характерные примеры местных составов включают, но без ограничений, аэрозоли, спирты, безводные основы (такие как помады и пудры), водные растворы, кремы, эмульсии (включая эмульсии или вода-в-масле, или масло-вводе), жиры, пены, гели, водно-спиртовые растворы, липосомы, лосьоны, микроэмульсии, мази, масла, органические растворители, полиолы, полимеры, порошки, соли, силиконовые производные и воски. Местные составы могут включать, например, хелатирующие средства, кондиционирующие средства, смягчители, формообразующие, увлажнители, защитные средства, загущающие средства или УФ-абсорбирующие средства. Специалист в данной области оценит, что составы, отличные от перечисленных, можно применять в вариантах осуществления данного изобретения.
Хелатирующие средства факультативно могут быть включены в местные составы и могут быть выбраны из любого средства, которое подходит для применения в косметической композиции, и могут включать любое природное или синтетическое химическое вещество, обладающее способностью связывать двухвалентные катионные металлы, такие как Са2+, Мп2+ или Mg+. Примеры хелатирующих средств включают, но без ограничений, ЭДТА, динатрий ЭДТА, ЭГТА, лимонную кислоту и дикарбоновые кислоты.
Кондиционирующие средства также факультативно могут быть включены в местные составы. Примеры средств, кондиционирующих кожу, включают, но без ограничений, ацетилцистеин, N-ацетилдигидросфингозин, сополимер акрилатов/бегенилакрилата/диметиконакрилата, аденозин, аденозинциклофосфат, аденозинфосфат, аденозинтрифосфат, аланин, альбумин, экстракт водрослей, аллантоин и производные, экстракты алоэ барбаденского, алюминия РСА (пирролидонкарбоновая кислота), амилоглюкозидазу, арбутин, аргинин, азулен, бромелаин, порошок пахты, бутиленгликоль, кофеин, глюконат кальция, капсаицин, карбоцистеин, карнозин, бета-каротин, казеин, каталазу, цефалины, церамиды, цветочный экстракт ромашки аптечной (лекарственной), холекальциферол, холестериловые сложные эфиры, кокосовый бетаин, коэнзим А, модифицированный кукурузный крахмал, кристаллины, циклоэтоксиметикон, цистеин ДНК, цитохром С, дарутозид, декстрана сульфат, сополиолы диметикона, диметилсиланола гиалуронат, ДНК, эластин, эластиновые аминокислоты, эпидермальный фактор роста, эргокальциферол, эргостерол, этилгексил РСА, фибронектин, фолиевую кислоту, желатин, глиадин, бета-глюкан, глюкозу, глицин, гликоген, гликолипиды, гликопротеины, гликозаминогликаны, гликосфинголипиды, пероксидазу хрена, гидрогенизированные белки, гидролизованные белки, масло жожоба, кератин, кератиновые аминокислоты и кинетин, лактоферрин, ланостерин, лаурил РСА, лецитин, линолеиновую кислоту, линоленовую кислоту, липазу, лизин, лизоцим, солодовый экстракт, мальтодекстрин, меланин, метионин, минеральные соли, ниацин, ниацинамид, овсяные аминокислоты, оризанол, пальмитоил гидролизованные белки, панкреатин, папаин, ПЭГ (полиэтиленгликоль), пепсин, фосфолипиды, фитостерины, плацентарные ферменты, плацентарные липиды, пиридоксаль 5-фосфат, кверцетин, резорцинацетат, рибофлавин, РНК, эстракт лизата сахаромицетов, аминокислоты шелка, сфинголипиды, стеарамидопропил бетаин, стеарилпальмитат, токоферол, токоферилацетат, токофериллинолеат, убихинон, масло из семян vitis vinifera (виноград), пшеничные аминокислоты, кстантановую камедь и глюконат цинка. Средства, кондиционирующие кожу, помимо перечисленных выше, можно сочетать с раскрытой композицией или препаратом, обеспеченным таким образом, что может быть легко оценено специалистом в данной области техники.
Местные составы могут также факультативно включать один или более смягчителей, примеры которых включают, но без ограничений, ацетилированный ланолин, ацетилированный ланолиновый спирт, кроссполимер акрилатов/С10-30 алкилакрилата, сополимер акрилатов, аланин, экстракт водрослей, экстракт или гель алоэ барбаденского, экстракт алтея лекарственного, алюминия крахмала октенилсукцинат, алюминия стеарат, косточковое абрикосовое масло (primus armeniaca), аргинин, аргинина аспартат, экстракт арники горной, аскорбиновую кислоту, аскорбилпальмитат, аспарагиновую кислоту, масло авокадо (persea gratissima), сульфат бария, барьерные сфинголипиды, бутиловый спирт, пчелиный воск, бегениловый спирт, бета-ситостерин, ВНТ (бутилокситолуол), экстракт березовой коры (betula alba), экстракт бурачника (borago officinalis), 2-бром-2-нитропропан-1,3-диол, экстракт иглицы колючей (ruscus aculeatus), бутиленгликоль, экстракт календулы лекарственной, масло календулы лекарственной, канделильский воск (euphorbia cerifera), масло канолы, каприловый/каприновый триглицерид, кардамонное масло (elettaria cardamomum), карнаубский воск (copernicia cerifera), каррагенан (chondrus crispus), морковное масло (daucus carota sativa), касторовое масло (ricinus communis), церамиды, церезин, цетеарет-5, цетеарет-12, цетеарет-20, цетеарилоктаноат, цетет-20, цетет-24, цетилацетат, цетилоктаноат, цетилпальмитат, масло обыкновенной ромашки (anthemis nobilis), холестерин, сложные эфиры холестерина, холестерила гидроксистеарат, лимонную кислоту, масло шалфея (salvia sclarea), какао-масло (theobroma cacao), кокосовый каприлат/капрат, кокосовое масло (cocos nucifera), коллаген, коллагенновые аминокислоты, кукурузное масло (zea mays), жирные кислоты, децилолеат, декстрин, диазолидинилмочевину, диметикон сополиол, диметиконол, диоктиладипат, диоктилсукцинат, дипентаэритритил гексакаприлат/гексакапрат, DMDM-гидантоин (диметилолдиметилгидантоин), ДНК, эритритол, этоксидигликоль, этиллинолеат, масло эвкалипта шаровидного, масло энотеры (oenothera biennis), жирные кислоты, фруктозу, желатин, масло герани пятнистой, глюкозамин, глутамат глюкозы, глутаминовую кислоту, глицерет-26, глицерин, глицерол, глицерил дистеарат, глицерил гидроксистеарат, глицерил лаурат, глицерил линолеат, глицерил миристат, глицерил олеат, глицерил стеарат, глицерил стеарат SE, глицин, гликольстеарат, гликольстеарат SE, гликозаминогликаны, масло из семян винограда (vitis vinifera), масло лесного ореха (corylus americana), масло лесного ореха (corylus avellana), гексиленгликоль, мед, гиалуроновую кислоту, гибридное сафлоровое масло (carthamus tinctorius), гидрогенизированное касторовое масло, гидрогенизированные глицериды жирных кислот кокосового масла, гидрогенизированное кокосовое масло, гидрогенизированный ланолин, гидрогенизированный лецитин, гидрогенизированный пальмовый глицерид, гидрогенизированное пальмоядровое масло, гидрогенизированное соевое масло, гидрогенизированный жирный глицерид, гидрогенизированное растительное масло, гидролизованный коллаген, гидролизованный эластин, гидролизованные гликозаминогликаны, гидролизованный кератин, гидролизованный соевый белок, гидроксилированный ланолин, гидроксипролин, имидазолидинилмочевину, йодопропинилбутилкарбамат, изоцетилстеарат, изоцетилстеароилстеарат, изодецилолеат, изопропил изостеарат, изопропилланолат, изопропилмиристат, изопропилпальмитат, изопропилстеарат, изостеарамид ДЭА (диэтаноламин), изостеариновую кислоту, изостеарил лактат, изостеарил неопентаноат, жасминовое масло (jasminum officinale), масло жожоба (buxus chinensis), келп, масло орехов лакового дерева (aleurites moluccana), амид молочной кислоты МЕА, ланет-16, ланет-ю ацетат, ланолин, ланолиновую кислоту, ланолиновый спирт, ланолиновое масло, ланолиновый воск, лавандовое масло (lavandula angustifolia), лецитин, лимонное масло (citrus medica limonum), линолевую кислоту, линоленовую кислоту, масло орехов macadamia ternifolia, стеарат магния, сульфат магния, мальтит, масло ромашки лекарственной (chamomilla recutita), метилглюкозы сесквистеарат, метилсиланол РСА, микрокристаллический воск, минеральное масло, норковое масло, масло mortierella, миристиллактат, миристилмиристат, миристилпропионат, неопентенилгликоля дикаприлат/дикапрат, октилдодеканол, октилдодецилмиристат, октилдодецилстеароилстеарат, октилгидроксистеарат, октилпальмитат, октилсалицилат, октилстеарат, олеиновую кислоту, оливковое масло (olea europaea), апельсиновое масло (citrus aurantium dulcis), пальмовое масло (elaeis guineensis), пальмитиновую кислоту, пантетин, пантенол, пантенил этиловый эфир, парафин, РСА, масло из персиковых косточек (primus persica), масло земляного ореха (arachis hypogaea), ПЭГ-8 C12 18 сложный эфир, ПЭГ-15 кокамин, ПЭГ-150 дистеарат, ПЭГ-60 глицерилизостеарат, ПЭГ-5 глицерилстеарат, ПЭГ-30 глицерилстеарат, ПЭГ-7 гидрогенизированное касторовое масло, ПЭГ-40 гидрогенизированное касторовое масло, ПЭГ-60 гидрогенизированное касторовое масло, ПЭГ-20 метилглюкозы сесквистеарат, ПЭГ-40 сорбитан перолеат, ПЭГ-5 соевый стерол, ПЭГ-10 соевый стерол, ПЭГ-2 стеарат, ПЭГ-8 стеарат, ПЭГ-20 стеарат, ПЭГ-32 стеарат, ПЭГ-40 стеарат, ПЭГ-50 стеарат, ПЭГ-100 стеарат, ПЭГ-150 стеарат, пентадекалактон, масло мяты перечной (mentha piperita), вазелин, фосфолипиды, конденсат полиаминосахара, полиглицерил-з диизостеарат, поликватерниум-24, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, полисорбат 85, миристат калия, пальмитат калия, сорбат калия, стеарат калия, пропиленгликоль, пропиленгликоль дикаприлат/дикапрат, пропиленгликоль диоктаноат, пропиленгликоль дипеларгонат, пропиленгликоль лаурат, пропиленгликоль стеарат, пропиленгликоль стеарат SE, PVP (поливинилпирролидон), пиридоксин дипальмитат, кватерний-15, кватерний-18 гекторит, кватерний-22, ретинол, ретинилпальмитат, масло из рисовых отрубей (oryza sativa), РНК, розмариновое масло (rosmarinus officinalis), розовое масло, сафлоровое масло (carthamus tinctorius), масло шалфея (salvia officinalis), салициловую кислоту, масло сандалового дерева (santalum album), серии, сывороточный белок, сезамовое масло (sesamum indicum), масло ши (butyrospermum parkii), шелковый порошок, хондроитинсульфат натрия, натриевую ДНК, гиалуронат натрия, лактат натрия, пальмитат натрия, натрия РСА, полиглутамат натрия, стеарат натрия, растворимый коллаген, сорбиновую кислоту, сорбитан лаурат, сорбитан олеат, сорбитан пальмитат, сорбитан сесквиолеат, сорбитан стеарат, сорбит, соевое масло (glycine soja), сфинголипиды, сквалан, сквален, амид стеариновой кислоты МЕА-стеарат, стеариновую кислоту, стеароксидиметикон, стеарокситриметилсилан, стеариловый спирт, стеарилглицирретинат, стеарилгептаноат, стеарилстеарат, подсолнечное масло (helianthus annuus), масло сладкого миндаля (primus amygdalus dulcis), синтетический пчелиный воск, токоферол, токоферилацетат, токофериллинолеат, трибегенин, тридецилнеопентаноат, тридецилстеарат, триэтаноламин, тристеарин, мочевину, растительное масло, воду, воски, масло зародышей пшеницы (triticum vulgare) и масло иланг-иланга (cananga odorata).
В некоторых вариантах осуществления местный состав может содержать подходящее формообразующее, которое типично должно иметь высокое сродство с кожей, хорошо переноситься, быть устойчивым и давать такую консистенцию, которая позволяет легкое использование. Подходящие местные формообразующие и наполнители могут отбираться обычным путем для конкретного применения специалистами в данной области техники и в особенности на основании одного из многих стандартных текстов в данной области техники [51]. Факультативно один или более увлажнителей также включены в местный состав. Примеры увлажнителей включают, но без ограничений, аминокислоты, хондроитинсульфат, диглицерин, эритритол, фруктозу, глюкозу, глицерин, глицерол, гликоль, 1,2,6-гексантриол, мед, гиалуроновую кислоту, гидрогенизованный мед, гидрогенизованный гидролизат крахмала, инозит, лактит, мальтит, мальтозу, маннит, природный фактор увлажнения, ПЭГ-15 бутандиол, полиглицерил сорбит, соли пирролидонкарбоновой кислоты, калия РСА, пропиленгликоль, натрия глюкуронат, натрия РСА, сорбит, сахарозу, трегалозу, мочевину и ксилит.
В определенных вариантах осуществления рассматривают местные составы, содержащие одно или более дополнительное средство для защиты кожи. Примеры средств для защиты кожи могут включать, но без ограничений, экстракт водрослей, аллантоин, гидроксид алюминия, сульфат алюминия, бетаин, экстракт из листьев чайного куста, цереброзиды, диметикон, глюкуронолактон, глицерин, каолин, ланолин, солодовый экстракт, минеральное масло, вазелин, глюконат калия и тальк. Специалист в данной области техники легко оценит, что защитные средства кожи, отличные от перечисленных выше можно также сочетать с раскрытой композицией данного изобретения или препаратом, обеспеченным таким образом.
Поверхностно-активные вещества можно также по желанию включить в определенные местные составы, рассматриваемые в данном документе, и можно выбрать из любых природных или синтетических поверхностно-активных веществ, подходящих для применения в косметических композициях, такие как катионные, анионные, цвиттерионные или неионные поверхностно-активные вещества или их смеси [52]. Примеры катионных поверхностно-активных веществ могут включать, но без ограничений, DMDAO (додецилдиметиламиноксид) или другие аминоксиды, длинноцепочечные первичные амины, диамины и полиамины, и их соли, четвертичные аммониевые соли, полиоксиэтилированные длинноцепочечные амины и четвертичные полиоксиэтилированные длинноцепочечные амины. Примеры анионных поверхностно-активных веществ могут включать, но без ограничений, SDS (додецилсульфат натрия); соли карбоновых кислот (например, мыла); соли сульфоновых кислот, соли серной кислоты, сложные эфиры фосфорной и полифосфорной кислот; алкилфосфаты; моноалкилфосфат (MAP); и соли перфторкарбоновых кислот. Примеры цвитер-ионных поверхностно-активных веществ могут включать, но без ограничений, кокамидопропилгидроксисультаин (CAPHS) и другие, которые являются рН-чувствительными и требуют повышенного внимания при разработке соответствующего рН формулы (т.е., алкиламинопропионовые кислоты, имидазолинкарбоксилаты и бетаины) или такие, которые не являются рН-чувствительными (например, сульфобетаины, сультаины). Примеры неионных поверхностно-активных веществ могут включать, но без ограничений, алкилфенолэтоксилаты, этоксилаты спиртов, полиоксиэтиленированные полиоксипропиленгликоли, полиоксиэтиленированные меркаптаны, сложные эфиры длинноцепочечных карбоновых кислот, алканоламиды, третичные ацетиленовые гликоли, полиоксиэтиленированные силиконы, N-алкилпирролидоны и алкилполигликозидазы. Любое сочетание поверхностно-активных веществ является приемлемым. Определенные варианты осуществления могут включать, по меньшей мере, одно анионное и одно катионное поверхностно-активное вещество или, по меньшей мере, одно катионное и одно цвиттер-ионное поверхностно-активное вещество, которое совместимо, т.е., не образует комплексы, которые при смешивании существенно оседают.
Примеры уплотняющих средств, которые также могут присутствовать в определенных местных составах, включают, но без ограничений, сополимер акриламидов, агарозу, амилопектин, бентонит, альгинат кальция, кальция карбоксиметилцеллюлозу, карбомер, карбоксиметилхитин, целлюлозную камедь, декстрин, желатин, гидрогенизированный жир, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропиловый крахмал, альгинат магния, метилцеллюлозу, микрокристаллическую целлюлозу, пектин, различные ПЭГи, полиакриловую кислоту, полиметакриловую кислоту, поливиниловый спирт, различные ППГи (полипропиленгликоль), сополимер акрилатов натрия, каррагенан натрия, ксантановую камедь и дрожжевой бета-глюкан. Уплотняющие средства, отличные от перечисленных выше, могут также применяться в вариантах осуществления данного изобретения.
Согласно с определенными вариантами осуществления, рассматриваемыми в данном документе, местный состав для применения при лечении состояния кожи, которое возникает в результате продуцирования АФК в коже, может содержать одно или более солнцезащитных или УФ-абсорбирующих средств. В случае, где являются желательными свойства абсорбирования ультрафиолетового света (УФА и УФВ), такие средства могут включать, например, бензофенон, бензофенон-1, бензофенон-2, бензофенон-3, бензофенон-4, бензофенон-5, бензофенон-6, бензофенон-7, бензофенон-8, бензофенон-9, бензофенон-10, бензофенон-11, бензофенон-12, бензилсалицилат, бутил ПАБК (пара-аминобензойная кислота), циннаматные сложные эфиры, циноксат, ДЭА-метоксициннамат, диизопропилметилциннамат, этилдигидроксипропил ПАБК, этилдиизопропилциннамат, этилметоксициннамат, этил ПАБК, этилуроканат, глицерил октаноат диметоксициннамат, глицерил ПАБК, гликоль салицилат, гомосалат, изоамил-п-метоксициннамат, оксиды титана, цинка, циркония, кремния, марганца и церия, ПАБК, сложные эфиры ПАБК, Parsol 1789 и изопропилбензил салицилат и их смеси. Специалист в данной области техники оценит, что в данном изобретении можно применять солнцезащитные и УФ-абсорбирующие или защитные средства, отличные от перечисленных.
Местные составы, раскрытые в данном документе, типично являются эффективными при значениях рН от приблизительно 2,5 до приблизительно 10,0. Предпочтительно, рН композиции находится в точно или приблизительно следующих диапазонах рН: от приблизительно рН 5,5 до приблизительно рН 8,5, от приблизительно рН 5 до приблизительно рН 10, от приблизительно рН 5 до приблизительно рН 9, от приблизительно рН 5 до приблизительно рН 8, от приблизительно рН 3 до приблизительно рН 10, от приблизительно рН 3 до приблизительно рН 9, от приблизительно рН 3 до приблизительно рН 8 и от приблизительно рН 3 до приблизительно рН 8,5. Наиболее предпочтительно рН составляет от приблизительно рН 7 до приблизительно рН 8. Специалист в данной области техники может добавить соответствующие рН-регулирующие ингредиенты к композициям данного изобретения для регулировки рН до приемлемого диапазона.
Применение
Крем, лосьон, гель, мазь, пасту или подобное можно распределить по пораженной поверхности и слегка втереть. Раствор можно применять таким же образом, но более типично его будут применять при помощи пипетки, тампона или подобного, и осторожно применять к пораженным областям. Режим применения будет зависеть от ряда факторов, которые можно легко определить, такие как тяжесть состояния и его ответная реакция на начальное лечение, но будет обычно включать одно или более применений в день на постоянной основе. Рядовой специалист данной области техники может легко определить оптимальное количество состава, которое необходимо нанести, методики нанесения и частоты повторения. В основном, рассматривается, что составы данного изобретения будут применяться в диапазоне от одного или двух раз в неделю до одного, двух или трех раз в день.
Как также обсуждалось выше, местные составы, применимые в данном документе (например, фармацевтическая и/или косметическая композиции), таким образом, также содержат фармацевтически приемлемый носитель, включая любой подходящий разбавитель или формообразующее, которое включает любое фармацевтическое средство, которое само по себе не вредит субъекту, получающему композицию, и которое может наноситься без неспецифической токсичности. Фармацевтически приемлемые носители включают, но без ограничений, жидкости, такие как воду, соляной раствор, глицерин и этанол, и подобное, и могут также включать усилители вязкости (например, смолу бальзамической пихты) или пленкообразователи, такие как коллоидные или нитроцеллюлозные растворы. Полное обсуждение фармацевтически приемлемых носителей, разбавителей и других формообразующих представлено в [57, текущее издание].
В случае, когда местный состав находится в форме капсулы, наполненной гелем или жидкостью, например, желатиновой капсулы, он может содержать, в дополнение к материалам вышеописанного типа, жидкий носитель, такой как полиэтиленгликоль или масло. Жидкие фармацевтические и косметические композиции данного изобретения, независимо от того, будут ли они растворами, суспензиями или другой подобной формой, могут включать одно или более из следующего: стерильные разбавители, такие как вода для инъекции, соляной раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический хлорид натрия, нелетучие масла, такие как синтетические моно или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; противобактериальные средства, такие как бензиловый спирт или метилпарабен; дополнительные антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты и средства регулирования тонуса, такие как хлорид натрия или декстроза.
Для местного нанесения носитель может, соответственно, включать раствор, эмульсию, мазь или гелевую основу. Основание, например, может включать одно или более из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы, и стабилизаторы. Уплотняющие средства могут присутствовать в фармацевтической или косметической композиции для местного нанесения. Если предназначается для трансдермального нанесения, композиция может включать трансдермальный пластырь или устройство ионтофореза. Местные составы могут содержать компоненты данного изобретения в концентрации от приблизительно 0,1 до приблизительно 10 % вес/объем (вес на единицу объема). Местный состав можно обеспечить в форме крема, лосьона, раствора, спрея, геля, мази, пасты или подобного, и/или может содержать липосомы, мицеллы, микросферы и/или другие элементы доставки микрочастиц или наночастиц.
Местный состав может включать средство, которое связывается с антиоксидантным соединением и тем самым содействует его доставке к фибробластам и кератиноцитам кожи. Подходящие средства, которые могут действовать в этом качестве, включают клатрирующие средства, такие как циклодекстрины; другие средства могут включать белок или липосому.
Местный состав данного изобретения может быть также обеспечен в форме единиц дозировки, которые можно наносить как аэрозоль. Выражение аэрозоль применяют для обозначения разнообразных систем в диапазоне от таковых с коллоидной природой до систем, состоящих из герметизированных упаковок. Доставку можно осуществлять при помощи разжиженного или сжатого газа, или при помощи подходящей насосной системы, которая распределяет активные ингредиенты. Аэрозоли соединений данного изобретения могут быть доставлены в однофазных, двухфазных или трехфазных системах для доставки активного ингредиента(-ов). Доставка аэрозоля включает необходимые контейнер, активаторы, клапаны, субконтейнеры и подобное, которые все вместе могут формировать набор. Специалист в данной области техники без лишнего экспериментирования может определить предпочтительные аэрозоли для доставки местных составов на кожу.
Местные составы можно получить методикой, хорошо известной в фармацевтической области техники. Например, фармацевтическую композицию, предназначенную для нанесения на кожу в виде спрея, промывки или средства для ополаскивания, можно приготовить объединением пробиотика или бактериального лизата, как описано в данном документе, со стерильной, дистиллированной водой так, чтобы сформировать раствор. Поверхностно-активное вещество можно добавить для облегчения формирования однородного раствора или суспензии. Поверхностно-активные вещества являются соединениями, которые нековалентно взаимодействуют с активным компонентом так, чтобы облегчить растворение или гомогенное суспензирование соединения в водной системе доставки.
Пробиотики или бактериальные лизаты для применения в местных составах наносят в терапевтически эффективном количестве, которое будет изменяться в зависимости от разнообразных факторов, включая активность использованного конкретного пробиотика или бактериального лизата; метаболическую устойчивость и продолжительность действия соединения; возраст, вес тела, общее состояние здоровья, пол, тип кожи и питание субъекта; метод и время нанесения; скорость выведения; сочетание лекарственных средств; тяжесть конкретного состояния кожи; и терапию, которой подвергается субъект. В целом, терапевтически эффективная ежедневная доза составляет (для 70 кг млекопитающего) от приблизительно 0,001 мг/кг (т.е., 0,07 мг) до приблизительно 100 мг/кг (т.е., 7,0 г); предпочтительно терапевтически эффективная ежедневная доза составляет (для 70 кг млекопитающего) от приблизительно 0,01 мг/кг (т.е., 7 мг) до приблизительно 50 мг/кг (т.е., 3,5 г); более предпочтительно терапевтически эффективная ежедневная доза составляет (для 70 кг млекопитающего) от приблизительно 1 мг/кг (т.е., 70 мг) до приблизительно 25 мг/кг (т.е., 1,75 г).
Диапазоны эффективных доз, приведенные в данном документе, не следует истолковывать как ограничивающие и представляют собой предпочтительные диапазоны доз. Однако наиболее предпочтительной дозой будет приспособленная для отдельного субъекта, как понятно и возможно для определения специалистом соответствующей области техники [53-58].
При желании общую дозу, необходимую для каждого лечения, можно наносить многократными дозами или за одну дозу в течение дня. В определенных предпочтительных вариантах осуществления рассматривают однократное применение местного состава в день. Обычно, и в отдельных вариантах осуществления, лечение можно начинать небольшими дозами, которые являются меньшими, чем оптимальная доза соединения. Впоследствии дозировку увеличивают небольшими прибавками до достижения оптимального эффекта в этих условиях.
Местный состав можно наносить отдельно или в сочетании с другими лечениями и/или фармацевтическими препаратами, направленными на состояние кожи, связанное с трансдермальной потерей влаги и изменениями иммунной системы или направленными на другие связанные симптомы или этиологические факторы. Например, и как также отмечено выше, местный состав может дополнительно включать ретиноевую кислоту. В качестве другого примера, местный состав может включать антиоксидантные соединения, имеющие различные антиоксидантные части (например, хинон или хинол, такой как митохинол, и витамин Е (токоферол)). Например, предполагается, что MitoQ® (митохинон/митохинол) способен к регенерации сниженного витамина Е (токоферол) так, чтобы включение в состав как MitoQ, так и витамина Е (или в виде антиоксидантной части митохондриально нацеленного антиоксидантного соединения, или в виде неконъюгированного антиоксиданта) могло рассматриваться как преимущественное обеспечение восстанавливаемого источника антиоксидантного потенциала согласно такому иллюстративному варианту осуществления; аналогично, включение в местный состав других сочетаний антиоксидантных частей, посредством чего один антиоксидант может регенерировать другой, находится в пределах связанных вариантов осуществления, которые рассматриваются в данный момент.
Реципиентами местных составов, описанных в данном документе, может быть любое позвоночное животное, такое как млекопитающие. Среди млекопитающих предпочтительными реципиентами являются млекопитающие отрядов приматы (включая людей, человекообразных обезьян и остальных обезьян), Arteriodactyla (включая лошадей, коз, коров, овец, свиней), Rodenta (включая мышей, крыс, кроликов и хомяков) и Carnivora (включая кошек и собак). Среди птиц предпочтительными реципиентами являются индюки, курицы и другие члены того же отряда. Наиболее предпочтительными реципиентами являются люди.
Для местных применений предпочтительно наносить эффективное количество фармацевтической или косметической композиции, включающей пробиотик или бактериальный лизат согласно данному изобретению, на целевую область, например, пораженные поверхности кожи, участки кожи с повышенным риском и подобное. Это количество будет, в основном, варьировать в диапазоне от приблизительно 0,0001 мг до приблизительно 1 г соединения данного изобретения на применение, в зависимости от участка, который нужно лечить, тяжести симптомов и природы применяемого местного наполнителя. Предпочтительным местным препаратом является крем-лосьон, где от приблизительно 0,001 до приблизительно 50 мг активного ингредиента применяют на кубический сантиметр основы. Фармацевтическую композицию можно составить в виде трансдермальных композиций или устройств трансдермальной доставки ("пластыри"). Такие композиции включают, например, основу, резервуар для активного соединения, контрольную мембрану, прокладочный материал и контактный клей. Такие трансдермальные пластыри можно применять, по желанию, для обеспечения непрерывной пульсирующей или по требованию доставки соединений данного изобретения.
Композиции данного изобретения можно составить так, чтобы обеспечить быстрое, непрерывное или длительное высвобождение активного ингредиента после нанесения пациенту процедурами применения, известными в настоящем уровне техники. Системы доставки лекарственных средств с контролируемым высвобождением включают осмотические насосные системы и системы растворения, содержащие резервуары, покрытые полимером, или матричные составы лекарственное средство-полимер. Примеры систем контролированного высвобождения представлены в патентах США №№3845770 и 4326525 и в [59].
Самый подходящий путь будет зависеть от природы и тяжести состояния, которое нужно лечить. Специалисты в настоящем уровне техники также знакомы с определением способов местного нанесения (спреи, кремы, открытое применение, окклюзионная повязка, пропитки, промывания и т.д.), форм дозировки, подходящих фармацевтических формообразующих и других веществ, относящихся к доставке соединений субъекту в случае их необходимости.
Литература
1. Nutten S. Atopic Dermatitis: Global Epidemiology and Risk Factors. Ann Nutr Metab 2015; 66(suppl 1):8-16.
2. Chaplin S. Guide to treatments used for atopic dermatitis in adults. Prescriber, 2016. DOI: 10.1002/psb.1505.
3. Bieber T. Atopic dermatitis. N Engl J Med. 20085358:1483-1494
4. Connelly D. Atopic dermatitis: emerging and current treatments. The Pharmaceutical Journal, 20175298(7898). DOI: 10.1211/PJ.2017. 20202373.
5. Beattie PE & Lewis-Jones MS. A comparative study of impairment of quality of life in children with skin disease and children with other chronic childhood diseases. Br J Dermatol 2006; 155:145-151.
6. Barnetson RS & Rogers M. Childhood atopic eczema. BMJ 2002; 324:1376-1379.
7. Weinberg EG. The atopic march. Curr Allergy Clin Immunol 2005; 18:4-5.
8. Sasai K, Furukawa S, Muto T, Baba M, Yabuta K, Fukuwatari Y. Early detection of specific IgE antibody against house dust mite in children at risk of allergic disease. J Pediatr 1996; 128: 834-40.
9. ETAC Study group.Allergic factors associated with the development of asthma and the influence of cetirizine in a double-blind, randomised, placebo-controlled trial: first results of ETAC. Early Treatment of the Atopic Child. Pediatr Allergy Immunol. 1998;9:116-24.
10. Laudanska H, Reduta T, Szmitkowska D. Evaluation of skin barrier function in allergic contact dermatitis and atopic dermatitis using method of the continuous TEWL measurement. Rocz Akad Med Bialymst. 2003;48:123-7.
11. Berents TL, Carlsen KCL, Mowinckel P. et al. Transepidermal water loss in infancy associated with atopic eczema at 2 years: a population-based cohort study. Br J Dermatol. 2016. DOI: io.mi/bjd.15157.
12. Simpson EL, Irvine AD, Eichenfield L. et al. Update on Epidemiology, Diagnosis, and Disease Course of Atopic Dermatitis. Semin Cutan Med Surg. 2016 Jun; 35(5 Suppl):S84-8.
13. Lindh JD, Bradley M. Clinical Effectiveness of Moisturizers in Atopic Dermatitis and Related Disorders: A Systematic Review. Am J Clin Dermatol. 2015 Oct; 16(5):341-59.
14. De Marchi F. Correlation of skin barrier impairment in atopic dermatitis with aeroallergen sensitization. Allergy Asthma Proc. 2015 Nov-Dec; 36(6):e127-33.
15. Cau L, Pendaries V, Lhuillier E. et al. Lowering relative humidity level increases epidermal protein deimination and drives human filaggrin breakdown. J Dermatol Sci. 2017 Мау;86(2):106-113.
16. Moore DJ, Rawlings AV. The chemistry, function & (patho)physiology of stratum corneum barrier ceramides. Int J Cosmet Sci. 2017 Mar 24. doi: io.mi/ics.12399.
17. Kelleher M. et al. Skin barrier dysfunction measured by transepidermal water loss at 2 days and 2 months predates and predicts atopic dermatitis at 1 year. J Allergy Clin Immunol. 2015 Apr;135(4):930-5.e1.
18. van Smeden J, Bouwstra JA. Stratum Corneum Lipids: Their Role for the Skin Barrier Function in Healthy Subjects and Atopic Dermatitis Patients. Curr Probl Dermatol. 2016;49:8-26.
19. Borodzicz S, Rudnicka L, Mirowska-Guzel D. et al. The role of epidermal sphingolipids in dermatologic diseases. Lipids Health Dis. 2016515:13.
20. Wallmeyer L, Lehnen D, Eger N. et al.
21. Fartasch Acta Derm Venereol Suppl (Stockh) 1992
22. Hara J Invest Dermatol 2000
23. Hachem JP et al. J Invest Dermatol 2006
24. Elias M. Curr Allerg Asthma Rep 2009
25. Blume-Peytavi U. et al. Recommendations from a European Roundtable Meeting on Best Practice Healthy Infant Skin Care. Pediatr Dermatol. 2016 Мау; 33(3):311-21
26. Simpson EL. A pilot study of emollient therapy for the primary prevention of atopic dermatitis. J Am Acad Dermatol. 2010 Oct; 63(4):587-93.
27. Simpson EL. et al. Emollient enhancement of the skin barrier from birth offers effective atopic dermatitis prevention. J Allergy Clin Immunol. 2014 Oct; 134(4):818-23.
28. Horimukai K, Morita K, Narita M, Kondo M, et al. Application of moisturizer to neonates prevents development of atopic dermatitis. J Allergy Clin Immunol 2014:134: 824-30.
29. Barnard E, Li H. Shaping of cutaneous function by encounters with commensals. J Physiol. 2017 Jan 15;595(2):437-450.
30. Biedermenn T. Regulation of T Cell Immunity in Atopic Dermatitis by Microbes: The Yin and Yang of Cutaneous Inflammation. Front Immunol. 2015; 6: 353.
31. Van Bever HP. OPINION: Primary prevention of allergy - Will it soon become a reality? Pediatr Allergy Immunol. 2016 Feb; 27(1):6-12
32. Seite S et al. Clinical efficacy of emollients in atopic dermatitis patients -relationship with the skin microbiota modification. Clin Cosmet Investig Dermatol. 2017 Jan 12510:25-33
33. Seite S., Bieber T. Barrier function and microbiotic dysbiosis in atopic dermatitis. Clin Cosmet Investig Dermatol. 20155 8: 479-483.
34. Erika von Mutius & Donata Vercelli. Farm living: effects on childhood asthma and allergy. Nature Reviews Immunology 10, 861-868 (December 2010)
35. Xu F. et al. Prevalence of Childhood Atopic Dermatitis: An Urban and Rural Community-Based Study in Shanghai, China. PloS, http: //dx.doi.org/10.1371/journal.pone.0036174
36. Nutten S. Atopic Dermatitis: Global Epidemiology and Risk Factors. Ann Nutr Metab 2015; 66(suppl 1):8-16
37. Gueniche A, Knaudt B, Schuck E, et al. Effects of non-pathogenic gram-negative bacterium Vitreoscilla filiformis lysate on atopic dermatitis: a prospective, randomized, double-blind, placebocontrolled clinical study. Br J Dermatol 2008: 159: 1357-63.
38. Arkwright PD, David TJ. Intradermal administration of a killed Mycobacterium vaccae suspension (SRL 172) is associated with improvement in atopic dermatitis in children with moderate-to-severe disease. J Allergy Clin Immunol. 2001 Mar; 107(3):531-4.
39. Davies MG, Symons C, Shaw S. et al. An open study to assess the efficacy clinically and immunologically of M. vaccae vaccine in patients with atopic dermatitis. J Dermatolog Treat. 2006;17(2):74-7.
40. Cananzi FC, Mudan S, Dunne M. et al. Long-term survival and outcome of patients originally given Mycobacterium vaccae for metastatic malignant melanoma. Hum Vaccin Immunother. 2013 Nov; 9(11):2427-33.
41. Dunstan JA, Brothers S, Bauer J. et al. The effects of Mycobacteria vaccae derivative on allergen-specific responses in children with atopic dermatitis. Clin Exp Immunol. 2011 Jun; 164(3):321-9
42. Arkwright PD, David TJ. Effect of Mycobacterium vaccae on atopic dermatitis in children of different ages. Br J Dermatol. 2003 Nov; 149(5): 1029-34.
43. Berth-Jones J, Arkwright PD, Marasovic D. et al. Killed Mycobacterium vaccae suspension in children with moderate-to-severe atopic dermatitis: a randomized, double-blind, placebo-controlled trial. Clin Exp Allergy. 2006 Sep; 36(9):1115-21.
44. Brothers S, Asher MI, Jaksic M. et al. Effect of a Mycobacterium vaccae derivative on paediatric atopic dermatitis: a randomized, controlled trial. Clin Exp Dermatol. 2009 Oct; 34(7):770-5.
45. Li C, Jiang X, Luo M. et al. Mycobacterium vaccae Nebulization Can Protect against Asthma in Balb/c Mice by Regulating Th9 Expression. PLoS One. 2016 Aug 12;11(8):e0161164
46. Nakatsuji Т., Chen TH., Narala S., et al. Antimicrobials from human skin commensal bacteria protect against Staphylococcus aureus and are deficient in atopic dermatitis. Science Translational Medicine, 2017;9(378):eaah4680. DOI: 10.1126/scitranslmed.aah4680
47. Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr. 1995; 125:1401-12.
48. Salminen S, Ouwehand A. Benno Y. et al. «Probiotics: how should they be defined Trends Food Sci. Technol. 1999:10 107-10.
49. Remington: The Science and Practice of Pharmacy, 19th Ed. (Easton, Pa.: Mack Publishing Co., 1995), на стр. 1399-1404
50. Percutaneous Penetration Enhancers, eds. Smith et al. (CRC Press, 1995)
51. Remington's Pharmaceutical Sciences, том 18, Mack Publishing Co., Easton, Pa. (1990), глава 87.
52. Rosen, M., "Surfactants and Interfacial Phenomena," Second Edition, John Wiley & Sons, New York, 1988, глава l, страница 431
53. Berkow et al., eds., The Merck Manual, 16th edition, Merck and Co., Rahway, N.J., 1992
54. Goodman et al., eds., Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th edition, Pergamon Press, Inc., Elmsford, N.Y., (2001)
55. Avery's Drug Treatment: Principles and Practice of Clinical Pharmacology and Therapeutics, 3rd edition, ADIS Press, Ltd., Williams and Wilkins, Baltimore, MD. (1987)
56. Ebadi, Pharmacology, Little, Brown and Co., Boston, (1985)
57. Osolci al., eds., Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Co., Easton, PA (1990)
58. Katzung, Basic and Clinical Pharmacology, Appleton and Lange, Norwalk, CT(1992)
59. P.J. Kuzma et al., Regional Anesthesia 22 (6); 543-551 (1997)
60. Zhang L, Jiang Y, Cui Z et al. Mycobacterium vaccae induces a strong Thi response that subsequently declines in C57BL/6 mice. J Vet Sci. 2016 Dec 30;17(4):505-513.
61. Hadley EA, Smillie FI, Turner MA. et al. Effect of Mycobacterium vaccae on cytokine responses in children with atopic dermatitis. Clin Exp Immunol. 2005 Apr; 140(1):101-8.
62. Dalbeth N, Yeoman S, Dockerty JL et al. A randomised placebo controlled trial of delipidated, deglycolipidated Mycobacterium vaccae as immunotherapy for psoriatic arthritis. Ann PJieum Dis. 2004 Jun;63(6):718-22.
63. Camporota L, Corkhill A, Long H et al. The effects of Mycobacterium vaccae on allergen-induced airway responses in atopic asthma. Eur Respir J. 2003 Feb; 21(2):287-93.
64. Kobayashi T, Glatz M, Horiuchi К et al. Dysbiosis and Staphylococcus aureus Colonization Drives Inflammation in Atopic Dermatitis. Immunity. 2015 Apr 21;42(4):756-66.
65. Gueniche A, Dahel K, Bastien P. et al. Vitreoscilla filiformis bacterial extract to improve the efficacy of emollient used in atopic dermatitis symptoms. Journal of the European Academy of Dermatology and Venereology 22(6): 746-7.
66. Two AM, Nakatsuji T, Kotol PF et al. The Cutaneous Microbiome and Aspects of Skin Antimicrobial Defense System Resist Acute Treatment with Topical Skin Cleansers. J Invest Dermatol. 2016 Oct; 136(10):1950-4.
Экспериментальная часть
Заявитель тестировал все вышеупомянутые штаммы.
Следующие примеры представлены в качестве иллюстрации и не для ограничения.
Пример 1
Средство с бактериальными экстрактами для местного применения
Указанные компоненты объединяют для получения местного крема для лечения состояний кожи, которые связаны с трансдермальной потерей влаги и изменениями иммунной системы. 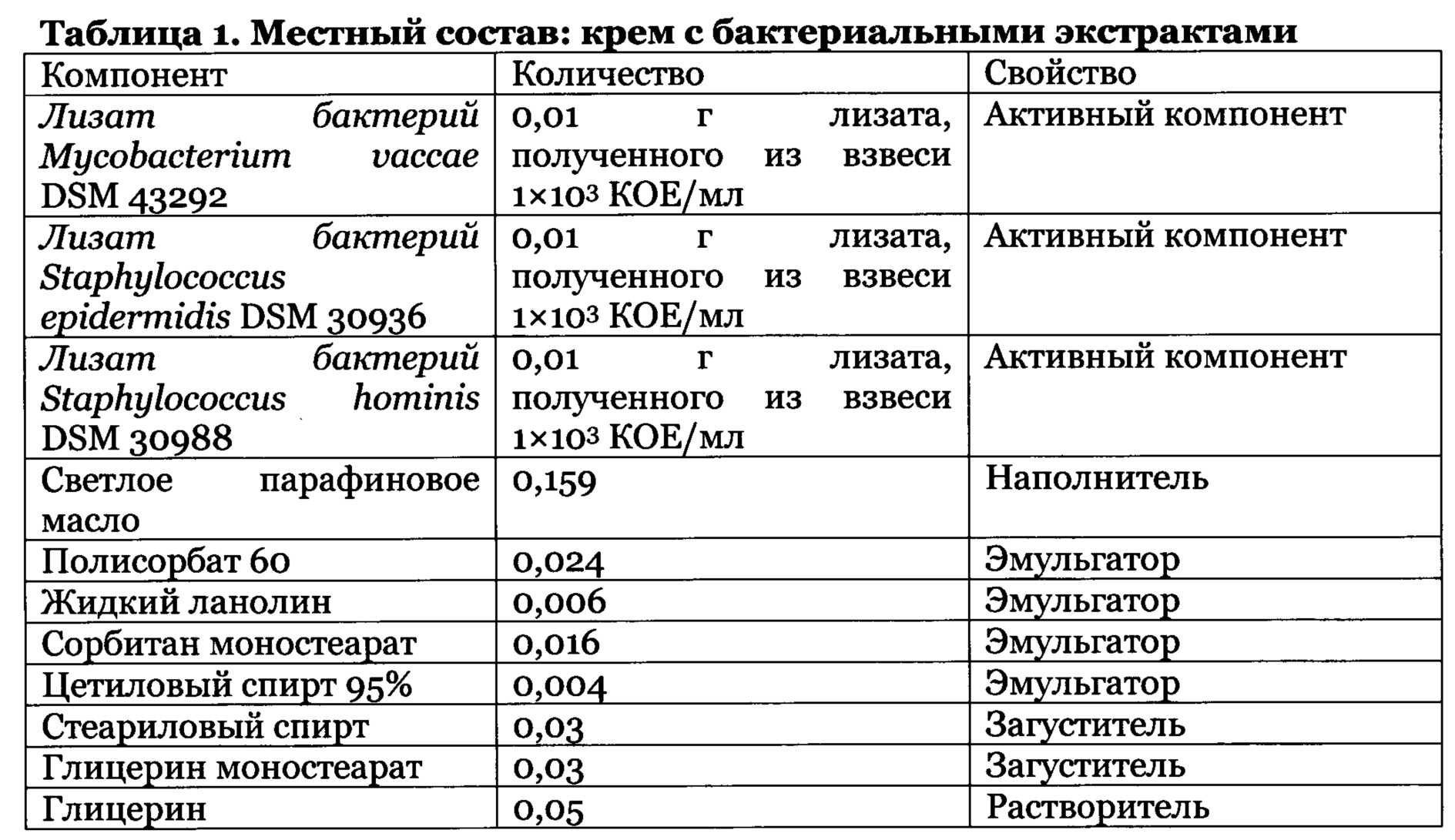
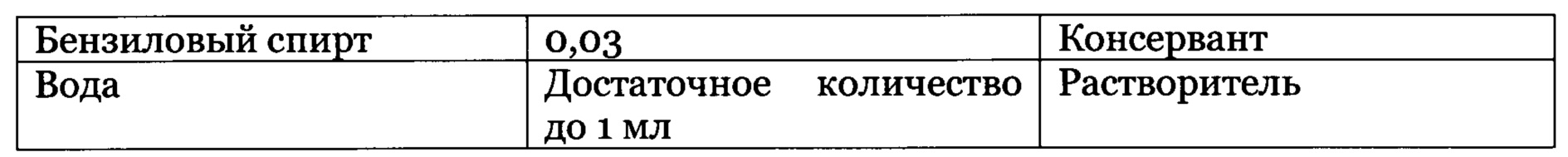
Пример 2
Средство с бактериальными экстрактами для местного применения
Указанные компоненты объединяют для получения местного крема для лечения состояний кожи, которые связаны с трансдермальной потерей влаги и изменениями иммунной системы.
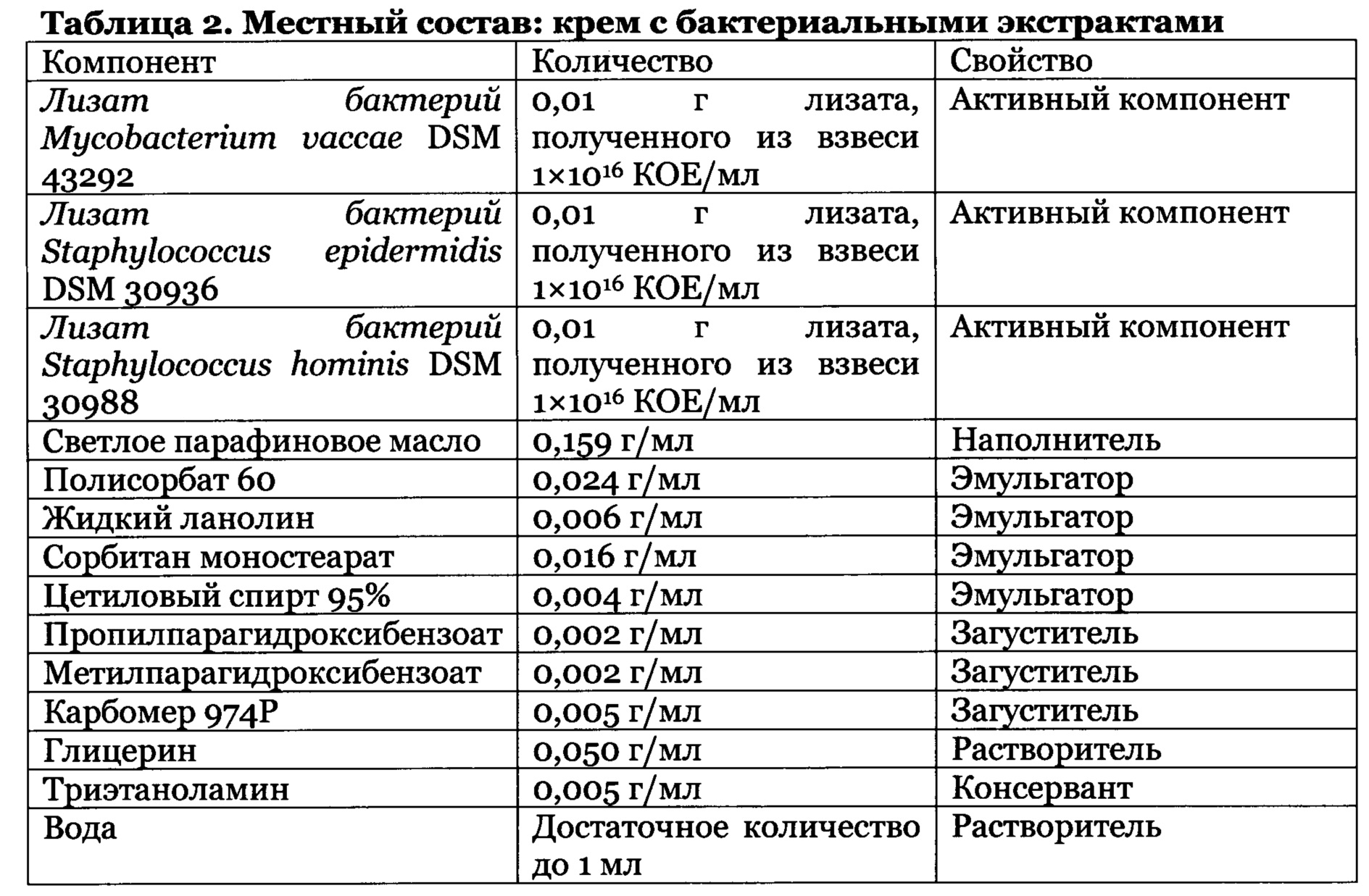
Пример 3
Применение крема с бактериальными экстрактами для местного применения при лечении атопического дерматита
Первое клиническое исследование проводили для тестирования композиции, содержащей лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988.
Группу из 60 пациентов (мужчин и женщин, в возрасте от 18 до 55 лет), страдающих от умеренного/тяжелого АД, произвольным образом разделяли (1:1) на две группы.
Диагноз умеренного/тяжелого АтД оценивали с использованием стандартизированного индекса тяжести АтД (индекс SCORAD - индекс оценки атопического дерматита). Указанный индекс известен специалистам в данной области техники. Исследование проводилось на протяжении 12 месяцев.
Ни один из пациентов не менял свою диету, и всех попросили не употреблять ферментированные продукты, содержащие живые микроорганизмы, во время клинического исследования. Пациентов, которые страдали аллергическим заболеванием в активной форме (респираторным или кожным) или инфекционным заболеванием во время беременности или кормления грудью, исключили из данного исследования. Пациентов, которые получили лечение пробиотиками, антибиотиками или иммуномодуляторами в течение шести месяцев до регистрации или которые получали лечение пероральными стероидами за месяц до регистрации, исключили из данного исследования. Все пациенты дали свое согласие об информированности во время регистрации.
Группу 1 (30 человек) лечили композицией, содержащей лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988, в массе 0,03 г. Пациенты наносили крем, произведенный по рецептуре, как в таблице 1, дважды в день.
Группу 2 (30 человек) лечили плацебо, представляющим собой крем, произведенный по рецептуре, как в таблице 1, применяемый дважды в день.
Опросник по симптомам и качеству жизни
Диагностические критерии для АД были установлены в соответствии с недавно опубликованным клиническим руководством. Клиническую тяжесть оценивали с использованием индекса SCORAD, разработанного Европейской рабочей группой по атопическому дерматиту. В ходе исследования для измерения варьирования симптомов, связанных с патологией, все зарегистрированные пациенты заполнили специфический опросник DLQI (дерматологический индекс качества жизни). Оценку SCORAD осуществляли в начале, конце и спустя два месяца после приостановки лечения оператором, который не знал, в какую группу включен пациент.DLQI заполнялся пациентами во время регистрации и на 12 неделе.
Разделение плазмы и мононуклеарных клеток периферической крови (РВМС)
Для разделения плазмы и мононуклеарных клеток периферической крови (РВМС) образцы периферической венозной крови отбирали у всех исследуемых субъектов во время регистрации, после 3 месяцев лечения и спустя 2 месяца после приостановки терапии. Плазму хранили до времени анализа, тогда как РВМС отделяли путем центрифугирования в градиенте плотности. Жизнеспособность клеток определяли с использованием счетчика клеток Adam-MC.
Стимуляция РВМС
РВМС инкубировали в течение 18 часов в присутствии или в отсутствие липополисахаридной (LPS) бактериальной стимуляции. Анализ цитокинов, индуцированных аллергенным стимулом, осуществляли путем проточной цитометрии с добавлением брефельдина А в качестве ингибитора клеточного транспорта в течение последних часов культуры.
Иммунофенотипирование клеток
Процент активированных CD8+Т-лимфоцитов рассчитывали непосредственно на образцах периферической венозной крови путем цитофлуориметрического анализа с использованием моноклональных антител (mAb), конъюгированных с флуорохромами (CD8, CD38, CD45RO). После инкубации с mAb эритроциты лизировали, и клетки фиксировали и анализировали при помощи проточного цитометра FC500 (Beckman Coulter).
Анализ субпопуляций лимфоцитов
Идентификацию различных субпопуляций Т лимфоцитов осуществляли на не стимулированных культурах РВМС и культурах РМВС, стимулированных в течение 18 часов LPS во все моменты (базовый, 3ms и 3+2ms). Маркировку клеток осуществляли путем одновременного использования комбинаций флуоресцентных антител, способных к распознаванию молекул на поверхности клеток и на внутриклеточных компонентах. Конкретно, Т-хелперные лимфоциты 1 типа (Th1) идентифицировали как CD4+/IFN-γ+/Tbet+; Т-хелперные лимфоциты 2 типа (Th2) как CD4+/IL-4+/GATA3+; Т-хелперные лимфоциты 17 типа (Th17) как CD4+/IL-17+/RORγT+и, наконец, регуляторные Т-хелперы (Treg) как CD4+/CD25+/FOXP3+/IL-10+/TGF-β+.
Оценка экспрессии toll-подобных рецепторов (TLR) на регуляторных Т-лимфоцитах
Анализ осуществляли на не стимулированных РВМС в соответствии с протоколом, предложенным производителем mAb. Конкретно, необходимы следующие mAb: CD4, CD25, FOXP3, TLR-4, TLR-2.
Все данные для 6о пациентов тщательно собирали и анализировали.
На Фиг. 1 показана гистограмма индекса Scorad в момент начала исследования по по завершении исследования.
Полученные результаты демонстрируют, что применение 30 пациентами из группы 1 пробиотической композиции, содержащей лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988, имеющей концентрацию 3×109 КОЕ, приводил к снижению индекса Scorad у пациентов, пораженных АтД (меньшее значение Scorad указывает на более хорошее качество жизни).
DLQI продемонстрировал улучшение у пациентов, которых лечили композицией, содержащей лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988. В группе пациентов, которым вводили плацебо, никакое значимое различие не обнаружено с точки зрения SCORAD или DLQI (Таблица 2). 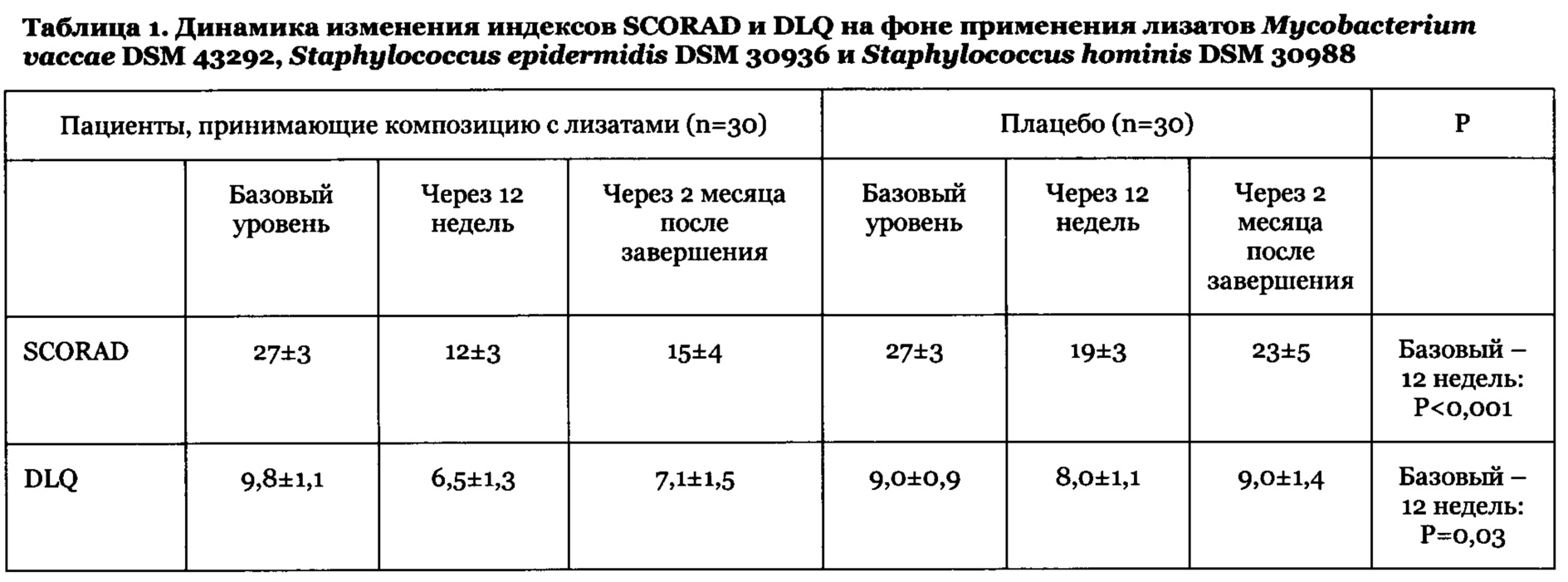
Активированные Т лимфоциты
Количество активированных CD8+Т-клеток анализировали, оценивая экспрессию CD38 и CD45. Прогрессирующее снижение наблюдали в указанных клетках во время периода исследования у пациентов, которых лечили композицией (Таблица 2). Значимые изменения не обнаружены в плацебо группе.

Регуляторные Т-клетки (Treq)
Регуляторные Т-клетки оценивали как в отсутствие стимуляции, так и после стимуляции LPS. После лечения смесью процент не стимулированных Treg лимфоцитов был значительно повышен (Таблица 3 и Таблица 4). Аналогичные результаты получены в результате анализа после стимуляции LPS.


Экспрессия Toll-подобных рецепторов на регуляторных Т лимфоцитах
Экспрессию Toll-подобных рецепторов 2 (TLR-2) и 4 (TLR-4) оценивали непосредственно в периферической венозной крови. Как показано в Таблице 5 и Таблице 6, экспрессия обеих молекул на Treg лимфоцитах значительно увеличивалась после лечения лизатами. 


Субпопуляции лимфоцитов Th1, Th2 и Th17
Субпопуляции лимфоцитов Th1, Tb.2 и Th17 оценивали в отсутствие стимуляции и после стимуляции LPS в обеих группах, подвергающихся анализу: процент субпопуляции Th1, идентифицированной на основе экспрессии молекул CD4 и Tbet и секреции цитокина IFN-γ, был значительно выше у субъектов, которых лечили композицией, содержащей лизаты.
Процент субпопуляции клеток Th2, идентифицированных на основе экспрессии молекул CD4 и GATA3 и секреции цитокина IL-4 был значительно, снижен во время применения композиции, содержащей лизаты, но после прекращения лечения вновь повышался.
Процент субпопуляции клеток Th17, идентифицированных на основе экспрессии молекул CD4 и RORγT и секреции цитокина IL-17, был снижен у пациентов, которых лечили композицией, содержащей лизаты, после 12 недель лечения. Спустя два месяца после прекращения лечения значимые различия обнаружены между двумя группами, подвергающимися анализу в отношении субпопуляций лимфоцитов Th2 и Th17 (р=0,008 и р=0,0031 соответственно). Значимые различия не обнаружены в клеточных популяциях Th1, Th2 и Th17 у субъектов в группе плацебо.
Соотношения Th1/Th2 и Th17/Treq
После 12 недель применения композиции, содержащей лизаты, значимое увеличение обнаружено в соотношении Th1/Th2 (р=0,028). Этот эффект исчезает после прекращения лечения (р=0,002). Напротив, в этой группе соотношение Th17/Treg прогрессивно уменьшалось, и этот результат также обнаружен спустя 2 месяца после прекращения лечения (р=0,029). Во время исследования субъекты из контрольной группы (плацебо), не продемонстрировали какого-либо значимого различия в соотношениях Th1/Th2 и Th17/Treg. Соотношение Th17/Treg значительно выше в группе плацебо по сравнению с группой, получавшей композицию с лизатами, после 12 недель лечения (р=0,037).
Корреляции
У пациентов, которым вводили пробиотики, в конце лечения обнаружена отрицательная корреляция между SCORAD и процентом Treg лимфоцитов после стимуляции LPS (р=0,020) и между процентом активированных CD8+ Т-лимфоцитов и клеток ТМ, стимулированных LPS (р=0,046).
Значимая положительная корреляция обнаружена между концентрацией LPS в плазме крови и процентом не стимулированных клеток Th2 (p=0,016), между концентрацией LPS в плазме крови и процентом клеток Th17, стимулированных LPS (р=0,04), и между процентом активированных CD8+ Т-лимфоцитов и клеток Th7, стимулированных LPS (p=0,037).
Кроме того, введение указанной пробиотической композиции в течение 16 недель было способно блокировать секрецию рассматриваемого цитокина, IL-4, среднее значение которого сравнимо со значением, полученным в момент регистрации. Напротив, введение плацебо не было способно блокировать высвобождение цитокина IL-4, уровень которого значительно увеличивался после 16 недель лечения (развитие заболевания).
Пример 4
Доклинические исследования
Доклинические исследования in vitro, в которых сравнивали иммуномодулирующие способности тестируемых бактериальных штаммов, показали, что культура лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988 демонстрируют превосходную способность индуцировать продукцию цитокинов 1 типа.
Кроме того, все лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988 тестировали в отношении их способности индуцировать синтез IL-12 мононуклеарными клетками периферической крови (РВМС) в исследовании in vivo. IL-12 представляет собой цитокин Th1-типа и является ключевым элементом в лечении аллергий и других атопических патологий.
В качестве примера приведены данные в отношении Mycobacterium vaccae DSM 43292, тестированные на РВМС: Th-1 (пг/мл)=1,754; Th-2 (пг/мл)=326; Th1/Th2=5,38.
Пример 5
Применение крема с бактериальными экстрактами для местного применения с целью предотвращения трансдермальной потери влаги
В исследовании принимало участие 10 мужчин и 10 женщин в возрасте от 18 до 55 лет с фототипами кожи 2 из. Исключали прием горячих напитков в течение часа перед исследованием, а также использование потенциальных ирритантов (например, скрабов) в течение 48 часов перед исследованием. Исключались прием противовоспалительных препаратов и воздействие выраженного ультрафиолетового облучения в течение трех недель, предшествующих исследованию.
Изучали участок кожи на внутренней стороне предплечья. Использовали композицию, как в примере 1, а в качестве контроля - аналогичную композицию, не содержащую бактериальные лизаты. Продукты наносили на кожу при помощи камер Финна в количестве 500 мкл в рандомизированном порядке. Через пять часов камеры удаляли и спустя еще 6о минут (включая период акклиматизации в помещении) производили измерения. Также производили оценку TEWL спустя 22 часа после удаления камеры. Результаты исследования представлены на Фиг. 2 и свидетельствуют об уменьшении трансдермальной потери воды после воздействия исследуемой композиции.
Пример 6
Применение крема с бактериальными экстрактами для местного применения с целью профилактики атопического дерматита Клиническое исследование проводили для тестирования крема, содержащего лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988 в концентрации 0,00001 г/г композиции.
Группу из 90 пациентов (детей в возрасте от 1 недели до 1 месяца), предрасположенных к АтД (имеющих хотя бы одного близкого родственника (мать, отец, сиблинг), страдающего аллергическим заболеванием), произвольным образом разделяли (1:1) на две группы.
Исследование проводилось на протяжении 12 месяцев.
Исследуемым группы 1 (30 человек) ежедневно после гигиенических процедур наносили на кожу композицию, содержащую лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988, в массе 0,03 г. Исследуемым группы 2 (30 человек) ежедневно после гигиенических процедур наносили на кожу композицию, не содержащую лизаты, а в остальном аналогичную рецептуре, как в таблице 1. Исследуемым группы 3 (30 человек) не назначали дополнительных мероприятий.
По истечении 12 месяцев у пациентов из группы 1 у семи исследуемых появились симптомы и признаки АтД, в отличие от группы 2, где симптомы и признаки АтД появились у 15 человек. Из группы 3 у 21 человека появились симптомы и признаки АтД.
Таким образом, ежедневное применение композиции, содержащей лизаты Mycobacterium vaccae DSM 43292, Staphylococcus epidermidis DSM 30936 и Staphylococcus hominis DSM 30988, значительно снижало риск заболевания АтД к 12 месяцам жизни.
Различные варианты осуществления, описанные выше, можно сочетать для обеспечения дополнительных вариантов осуществления. Аспекты данного изобретения можно модифицировать, при необходимости, для использования идей различных патентов, заявок и публикаций для обеспечения дополнительных вариантов осуществления. Эти и другие изменения можно сделать в вариантах осуществления в свете вышеописанного детального описания. В целом, в следующей формуле изобретения используемые выражения не следует истолковывать для ограничения формулы изобретения до специфических вариантов осуществления, раскрытых в описании и формуле изобретения, но должны истолковываться как включающие все возможные варианты осуществления наряду с полным объемом эквивалентов, на которые распространяется право такой формулы изобретения. Соответственно, данная формула изобретения не ограничивается раскрытием.