Результат интеллектуальной деятельности: Лиганды транслокаторного белка TSPO, обладающие антидепрессивной и ноотропной активностью
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к фармакологии, и касается применения N-бензил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамида (ГМЛ-1) и N-бутил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамида (ГМЛ-3), представляющих собой гетероциклические лиганды транслокаторного белка TSPO [Середенин С.Б., Мокров Г.В., Гудашева Т.А., Деева О.А., Ярков С.А., Яркова М.А., Жердев В.П., Алексеев К.В., Дурнев А.Д., Незнамов Г.Г. Патент РФ №2572076], в качестве средств, обладающих антидепрессивной и ноотропной активностями. Эти виды активности были выявлены в дополнение к анксиолитическому действию соединений ГМЛ-1 и ГМЛ-3, которое было описано в патенте РФ №2572076. Вещества ГМЛ-1 и ГМЛ-3 могут применяться для лечения депрессии, тревоги, нарушения когнитивных функций и комплексных психических и неврологических заболеваний.
По данным ВОЗ, депрессией страдают 4-5% населения земного шара, а к 2030 году депрессии могут выйти на первое место по распространенности среди других заболеваний [1. Бюллетень ВОЗ. 10 фактов о глобальном бремени болезней, 2008. http://www.who.int/features/factfiles/global_burden/ru/index.html; 2. N. Sartorius, Med. Res., 2001, 1, 20-21.]. Уже в настоящее время в экономически развитых странах эндогенными и психогенными депрессивными расстройствами страдают около 20% психических больных [F. Angelucci, et al., Progr. Brain Res., 2004, 146, 151-165].
Высокая частота депрессий и их негативное влияние на качество жизни было показано у больных с различными патологиями, включая сердечнососудистые, онкологические, вирусные и кожные заболевания, заболевания желудочно-кишечного тракта. Кроме того, большую проблему представляет сочетание депрессии с соматическими заболеваниями, особенно у пожилых людей. Наконец, депрессия является одной из основных причин суицида [Н. Wittchen, et al., Eur. Neuropsychopharmacol, 2011, 21 (9), 655-679].
Несмотря на то, что на настоящий момент имеется широкий ряд нейропсихотропных препаратов различных химических групп, проблема лечения депрессии далеко не решена. При курсовой терапии назначение большинства современных антидепрессантов в адекватных терапевтически дозах только у 65-75% больных приводит к положительному клиническому эффекту. Кроме того, антидепрессанты обладают рядом существенных недостатков: недостаточной широтой и устойчивостью терапевтического эффекта, длительным латентным периодом действия, высокой вероятностью развития побочных эффектов, риском токсических эффектов при передозировке [1. N. Sartorius, et al., Int. J. Neuropsychopharmacol., 2007, 10, S1-S207. 2. M.J. Millan, Pharmacol. Ther., 2006, 110, 135-370. 3. G.I. Papakostas, J. Clin. Psychiatry, 2008, 69, 8-13.]. В связи с этим важнейшей задачей остается создание новых оригинальных антидепрессантов с высокой эффективностью, низкой токсичностью и минимумом побочных эффектов. Особо актуальным является создание психотропных препаратов, обладающих поливалентным действием, в частности, сочетающих антидепрессивную активность с анксиолитической активностью и со способностью положительно влиять на интеллектуально-мнестические функции пациента.
Перспективным подходом к созданию новых препаратов, обладающих широким спектром нейропсихотропной активности, в том числе, антидепрессивной, анксиолитической и ноотропной, является использование новых лигандов трансклокаторного белка TSPO. В организме TSPO представлен на мембране митохондрий стероидпродуцирующих тканей центральной и периферической нервной системы [V. Papadopolous, et al., Trends Pharmacol. Sci., 2006, 27, 402-409]. Одной из ключевых ролей TSPO в ЦНС является его вовлеченность в биосинтез нейростероидов [Е. Da Pozzo, et al., Curr. Mol. Med., 2012, 12, 426-442]. TSPO активирует транспортировку хлористерина с внешней на внутреннюю мембрану митохондрий, что является лимитирующей стадией синтеза нейростероидов [D.М. Stocco, Annu. Rev. Physiol., 2001, 63, 193-213].
Нейростероиды являются положительными аллостерическими модуляторами ГАМКA-рецептора, который играет важнейшую роль в патофизиологии депрессивных, тревожных и прочих нейрональных расстройств [R. Rupprecht, et al., Trends Neurosci., 1999, 22, 410-416]. Так как TSPO играет важнейшую роль в регуляции синтеза нейростероидов, лиганды этого рецептора могут являться эффективными нейропсихотропными препаратами, например, антидепрессантами, анксиолитиками, ноотропами, или препаратами комплексного действия [R. Rupprecht, et al., Nat. Rev. Drug Disc., 2010, 9, 971-988].
В качестве примера лиганда TSPO, обладающего анксиолитической и антидепрессивной активности, можно привести соединение YL-IPA08 (N-ethyl-N-(2-pyridinylmethyl)-2-(3,4-ichlorophenyl)-7-methylimidazo[1,2-a]-pyridine-3-acetamide hydrochloride) [L.-M. Zhang, et al., Neuropharmacology, 2014, 81, 116-125].
При изучении серии лигандов транслокаторного белка TSPO в ряду 1-арилпирроло[1,2-а]пиразин-3-карбоксамидов в качестве наиболее активных соединений проявили себя N-бензил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамид (ГМЛ-1) и N-бутил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-3), синтез которых осуществлялся следующим образом:
Получение N-бензил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамида (ГМЛ-1).
1.1. N-бензил-N-метилакриламид.
К раствору 150 ммоль (18.18 г) метилбензиламина и 195 ммоль (19.69 г) триэтиламина в 60 мл сухого хлористого метилена при перемешивании прикапывали раствор 150 ммоль (13.58 г) хлорангидрида акриловой кислоты в 40 мл сухого хлористого метилена в течение 30 минут при температуре -5°С, после чего перемешивали реакционную массу в течение часа при комнатной температуре и прибавляли 70 мл воды. Органический раствор отделяли, а водный промывали 60 мл хлористого метилена. Объединенные органические растворы промывали последовательно 50 мл 10%-ной соляной кислоты, 50 мл 5%-ного раствора гидроксида натрия и 50 мл воды, профильтровывали через бумажный фильтр и упаривали досуха, получая 17.53 г продукта в виде светло-желтого масла (выход 67%). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.98, 2.99 (два с, 3 Н, СН3); 4.58, 4.67 (два с, 2 Н, СН2); 5.69 (м, 1 Н, Н(3а)); 6.37 (м, 1 Н, Н(3b)); 6.59 (м, 1 Н, Н(2а)); 7.12-7.38 (м, 5 Н, Ph).
1.2. N-бензил-2,3-дибром-N-метилпропанамид.
К раствору 44 ммоль (7.71 г) N-бензил-N-метилакриламида в 100 мл сухого хлористого метилена прикапывали 45 ммоль (7.19 г) брома при перемешивании при 0°С в течение 20 минут. Реакционную массу перемешивали при комнатной температуру в течении 2 часов, промывали раствором 5 г Na2S2O4 в 60 мл воды и 2 раза по 40 мл воды, профильтровывали через бумажный фильтр и упаривали досуха, получая 12.24 г продукта в виде желтого масла (выход 83%). Спектр ЯМР lH (CDCl3, δ, м.д.): 2.99, 3.02 (два с, 3 Н, СН3); 3.68 (м, 1 Н, Н(3а)); 4.22 (м, 1 Н, Н(3b)); 4.38-4.84 (м, 3 Н, Н(2), CH2Ph); 7.15-7.43 (м, 5 Н, Ph).
1.3. 2-азидо-N-бензил-N-метилакриламид.
К суспензии 44 ммоль (2.86 г) азида натрия в 50 мл сухого ДМФА прибавляли раствор 20 ммоль (6.70 г) N-бензил-2,3-ди6ром-N-метилпропанамида в 30 мл сухого ДМФА при температуре 75°С. Реакционную смесь перемешивали при температуре 75°С в течение 25 минут, после чего охлаждали до комнатной температуры и разбавляли 350 мл воды. Продукт экстрагировали 3 раза по 100 мл диэтилового эфира, объединенные эфирные растворы промывали 80 мл воды, профильтровывали через бумажный фильтр и упаривали досуха. Остаток хроматографировали на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:3). Нужные фракции упаривали досуха, получая 3.37 г продукта в виде желтого масла (выход 78%). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.90, 2.98 (два с, 3 Н, СН3); 4.62 (с, 2 Н, СН2); 5.08 (м, 2 Н, СН2=); 7.10-7.43 (м, 5 Н, Ph).
1.4. (1H-Пиррол-2-ил)фенилметанон был получен по литературной методике [J. White, et al., J. Org. Chem., 1977, 42, 4248-4251].
1.5. N-бензил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-1).
К раствору 2 ммоль (0.43 г) 2-азидо-N-бензил-N-метилакриламида в 6 мл сухого ДМФА прибавляли 2.2 ммоль (0.72 г) карбоната цезия и 2 ммоль (0.34 г) (N-пиррол-2-ил)фенилметанона, и реакционную массу перемешивали при комнатной температуре в течение двух суток. Полученную смесь разбавляли 30 мл воды, и продукт экстрагировали 4 раза по 20 мл этилацетата. Объединенные этилацетатные растворы промывали 20 мл воды, профильтровывали через бумажный фильтр и упаривали досуха. Остаток хроматографировали на колонке с силикагелем, используя в качестве элюента смесь этилацетата с гексаном сначала (1:3), затем (2:3). Фракции с продуктом упаривали досуха, остаток растворяли в 4 мл этанола и оставляли при -4°С на ночь. Выпавший осадок отфильтровывали, получая 0.41 г продукта в виде светло-желтых кристаллов (выход 61%). Т. пл. 101-103°С. Найдено (%): С, 77.63; Н, 5.65; N, 12.47. C22H19N3O. Вычислено (%): С, 77.40; Н, 5.61; N, 12.31. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 3.06, 3.29 (два с, 3 Н, СН3); 4.76, 5.03 (два с, 2 Н, СН2); 6.73 (м, 1 Н, Н(8)); 6.95 (м, 1 Н, Н(7)); 7.26-8.02 (м, 11 Н, 2 Ph, Н(6)); 8.52 (с, 1 Н, Н(4)).
Получение N-бутил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамида (ГМЛ-3).
2.1. N-бутил-N-метил акрил амид.
Получали в соответствии с пунктом 1.1. Примера 1 из метилбутиламина и акрилоилхлорида. Выход 80%. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0.90 (т, 3 Н, СН2СН3, 3J=7.3); 1.29 (м, 2 Н, СН2СН3); 1.51 (м, 2 Н, СН2СН2СН3); 2.95, 3.01 (два с, 3 Н, NCH3); 3.30, 3.39 (два т, 2 Н, NCH2, 3J=7.4); 5.62 (м, 1 Н, Н(3а)); 6.28 (м, 1 Н, Н(3b)); 6.53 (м, 1 Н, Н(2а)).
2.2. N-бутил-2,3-дибром-N-метилпропанамид.
Получали в соответствии с пунктом 1.2. Примера 1 из N-бутил-N-метилакриламида. Выход 81%. Спектр ЯМР lH (CDCl3, δ, м.д., J/Гц): 0.91, 0.95 (два т, 3 Н, СН2СН3, 3J=7.3); 1.33, 1.53 (два м, 2 Н, СН2СН3); 1.62, 3.18 (два м, 2 Н, СН2СН2СН3); 2.99, 3.05 (два с, 3 Н, NCH3); 3.42 (м, 2 Н, NCH2); 3.65 (м, 1 Н, Н(3а)); 4.14 (м, 1 Н, Н(3b)); 4.62 (м, 1 Н, Н(2)).
2.3. 2-азидо-N-бутил-N-метилакриламид.
Получали в соответствии с пунктом 1.3. Примера 1 из N-бутил-2,3-дибром-N-метилпропанамида. Выход 79%. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0.92 (т, 3 Н, СН2СН3, 3J=7.3); 1.30 (м, 2 Н, СН2СН3); 1.55 (м, 2 Н, СН2СН2СН3); 2.94, 3.05 (два с, 3 Н, NCH3); 3.39 (т, 2 Н, NCH2, 3J=7.3); 4.95, 5.02 (оба м, по 1 Н, СН2=).
2.4. N-бутил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамид (ГМЛ-3).
Получали в соответствии с пунктом 1.5 Примера 1 из 2-азидо-N-бутил-N-метилакриламида и (1H-пиррол-2-ил)фенилметанона. Выход 57% (светло-желтые кристаллы). Т. пл. 85-87°С. Найдено (%): С, 74.21; Н, 6.70; N, 13.50. C19H21N3O. Вычислено (%): С, 74.24; Н, 6.89; N, 13.67. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 0.81, 0.97 (два т, 3 Н, СН2СН3, 3J=7.3); 1.19, 1.39 (два м, 2 Н, СН2СН3); 1.67 (м, 2 Н, СН2СН2СН3); 3.11, 3.32 (два с, 3 Н, NCH3); 3.54, 3.69 (два т, 2 Н, NCH2, 3J=7.4); 6.90-7.05 (м, 2 Н, Н(7), Н(8)); 7.40-8.05 (м, 6 Н, Ph, Н(6)); 8.41 (с, 1 Н, Н(4)).
Известно, что соединения ГМЛ-1 и ГМЛ-3, благодаря высокой аффинности к транслокаторному белку TSPO, обладают анксиолитической активностью [1. С.Б. Середенин и др., патент РФ №2572076; 2. G.V. Mokrov, et al., Bioorg. & Med. Chem., 2015, 23, 3368-3378].
Поскольку согласно литературным данным для некоторых лигандов транслокаторного белка TSPO помимо анксиолитической активности известны другие виды нейропсихотропной активности, включая антидепрессивную и ноотропную активности [1. L.М. Zhang, et al., Neuropharmacology, 2014, 81, 116-125; 2. A. Kita, et al., Br. J. Pharmacol, 2004, 142, 1059-1072; 3. R. Rupprecht, et al., Nat. Rev. Drug Discovery, 2010, 9, 971-988], была изучена антидепрессивная активность соединений ГМЛ-1 и ГМЛ-3 и ноотропная активность соединения ГМЛ-1. Эффекты соединений во всех случаях изучали при внутрибрюшинном введении.
Технический результат.
У соединения ГМЛ-1 была выявлена антидепрессивная активность при субхроническом введении в дозе 0,50 мг/кг, сопоставимая с активностью препарата сравнения амитриптилина в дозе 7,00 мг/кг, и ноотропная активность в диапазоне доз от 0,05 до 5,00 мг/кг. У соединения ГМЛ-3 была выявлена антидепрессивная активность как при субхроническом введении (в дозе 0,50 мг/кг), так и при остром введении (в диапазоне доз от 0,50 до 5,00 мг/кг), сопоставимая с активностью амитриптилина в дозе 7,00 мг/кг. При этом доказано, что активность соединения ГМЛ-3 обусловлена взаимодействием с транслокаторным белком TSPO. Это было подтверждено путем совместного введения ГМЛ-3 с селективным блокатором TSPO - соединением РКП 195, при котором происходила полная блокировка антидепрессивного эффекта ГМЛ-3.
Полученные данные позволяют предложить применение соединений ГМЛ-1 и ГМЛ-3 в качестве антидепрессантов с ноотропным компонентом действия.
Пример 1. Изучение антидепрессивной активности соединений ГМЛ-1 и ГМЛ-3.
Антидепрессивную активность соединений ГМЛ-1 и ГМЛ-3 изучали в тесте «подвешивание за хвост» [L. Steru, et al., Psychopharmacology, 1985, 85, 367-370]. Этот тест является стандартным методом оценки депрессивного поведения грызунов. Эксперимент проводился на беспородных мышах-самцах CD-1 массой 20-24 г (НЛП «Питомник лабораторных животных ФИБХ РАН). Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°С и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 [1993] и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%. Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов. В качестве препарата сравнения использовали антидепрессант амитриптилин в дозе 7,00 мг/кг.
Соединения ГМЛ-1 и ГМЛ-3 и амитриптилин готовились в виде суспензии с Твин-80 и дистиллированной водой и вводились однократной внутрибрюшинной (в/бр) инъекцией за 30 мин до начала тестирования.
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни).
В работе использовали установку фирмы PanLab (камера 51 см ×25 см ×15 см, разделенная на три отсека), позволяющую обеспечить стандартные условия выполнения теста одновременно для трех животных. Животное подвешивали за хвост, после чего датчики-преобразователи в течение 6 минут регистрировали суммарное время неподвижности мыши, пытающейся избежать подвешивания. Снижение длительности иммобилизации у животных опытных групп по сравнению с контролем расценивалось как наличие антидепрессивных свойств у вещества.
1.1. Антидепрессивная активность соединений ГМЛ-1 и ГМЛ-3 при остром введении.
Соединения ГМЛ-1 и ГМЛ-3 исследовали в дозах 0,10; 0,50; 1,00 и 5,00 мг/кг, введение проводили однократно, в/бр, за 30 минут до эксперимента (таблицы 1, 2). Соединение ГМЛ-1 в дозах 0,50; 1,00 и 5,00 мг/кг достоверно не оказывало влияние на время неподвижности мышей CD-1. Соединение ГМЛ-3 в дозах 0,50; 1,00 и 5,00 мг/кг статистически значимо снижало время неподвижности мышей CD-1. Антидепрессивный эффект ГМЛ-3 в этих дозах был сопоставим с активностью препарата сравнения амитриптилина в дозе 7,00 мг/кг. Наибольший эффект соединения ГМЛ-3 достигался в дозе 0,50 мг/кг. В качестве отрицательного контроля в исследовании использовали диазепам в дозе 1,00 мг/кг, который вводили в/бр за 30 минут до эксперимента. Это соединение не снижало время неподвижности мышей CD-1.
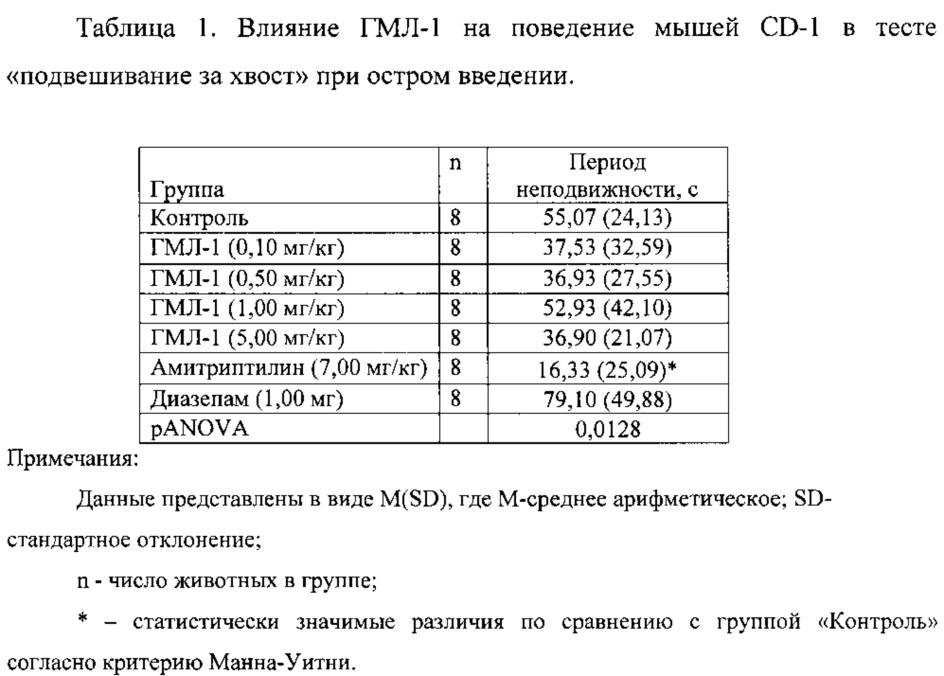
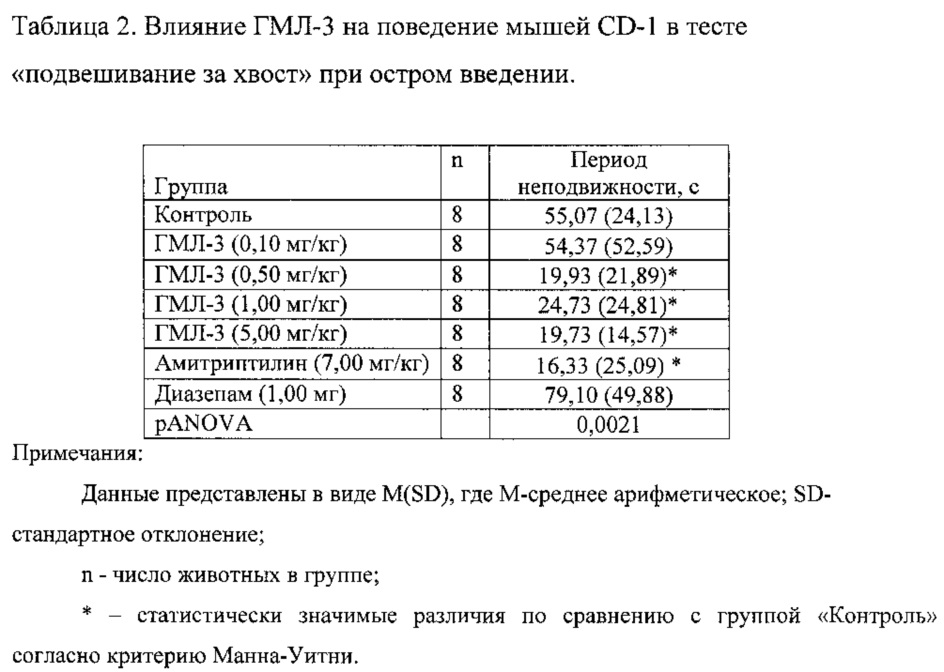
Таким образом, в тесте «подвешивание за хвост» показано, что соединение ГМЛ-3 оказывает достоверный антидепрессивный эффект в диапазоне доз 0,50-5,00 мг/кг при остром введении.
1.2. Антидепрессивная активность соединений ГМЛ-1 и ГМЛ-3 при субхроническом введении.
Соединения ГМЛ-1 и ГМЛ-3 исследовали в дозах 0,50 мг/кг, введение проводили в течение пяти дней, в/бр, каждый раз за 30 минут до эксперимента. Соединения ГМЛ-1 и ГМЛ-3 статистически значимо снижали время неподвижности мышей CD-1 (таблица 3). Антидепрессивный эффект ГМЛ-1 и ГМЛ-3 был сопоставим с активностью препарата сравнения амитриптилина в дозе 7,00 мг/кг.
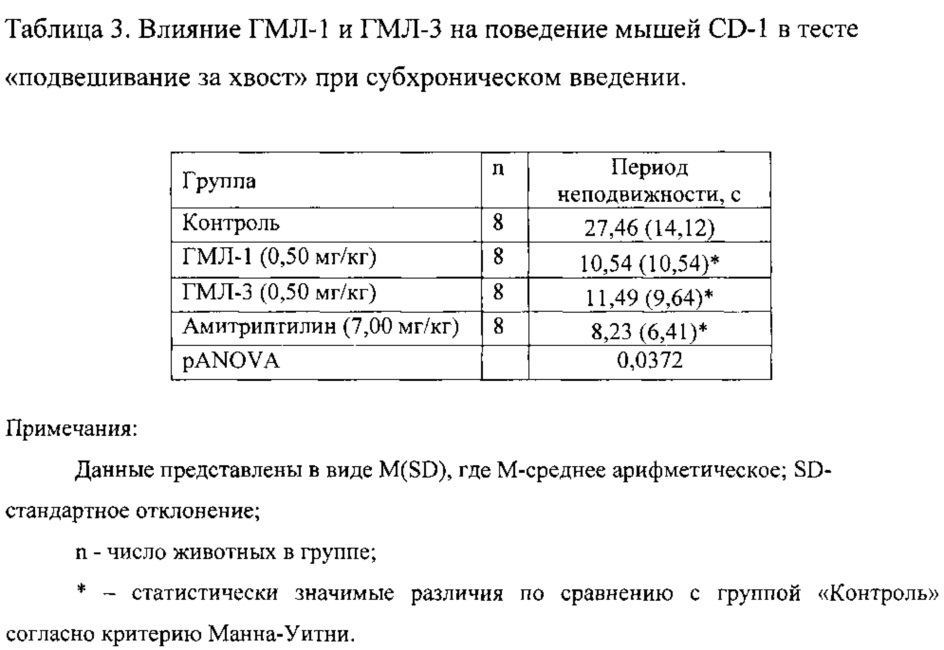
Таким образом, в тесте «подвешивание за хвост» показано, что соединения ГМЛ-1 и ГМЛ-3 оказывают достоверный антидепрессивный эффект в дозе 0,50 мг/кг при субхроническом введении.
Пример 2. Влияние специфического ингибитора TSPO (18 kDa) РК11195 на антидепрессивный эффект соединения ГМЛ-3.
Вещество РK11195 (N-бутан-2-ил-1-(2-хлорфенил)-N-метилизохинолин-3-карбоксамид) является специфическим ингибитором, связывающимся с рецепторным участком TSPO, и при совместном введении с лигандами TSPO (18 kDa) блокирует их эффекты [1. A. Kita, et al., Br. J. Pharmacol., 2004, 142, 1059-1072; 2. G. Le Fur, et al., Life Set, 1983, 32(16), 1849-1856].
С целью изучения зависимости антидепрессивного эффекта соединения ГМЛ-3 от взаимодействия с сайтом связывания TSPO использовали соединения ГМЛ-3 в дозе 0,50 мг/кг и субстанцию РK11195 (Sigma-Aldrich, USA) в дозе 10,00 мг/кг. Все вещества готовились в виде суспензии с Твин-80 и дистиллированной водой и вводились однократной в/бр инъекцией.
Эксперимент выполнен на беспородных мышах-самцах CD-1 массой 20-24 г. Поведение животных оценивали в тесте «подвешивание за хвост».
Эксперимент выполнялся по следующей схеме: беспородные мыши-самцы CD-1 были разделены на 4 группы по 8 особей в каждой. Группа 1 являлась контрольной, мышам в/бр вводилась дистиллированная вода из расчета 0,10 мл на 10 г веса (контрольная инъекция, КИ), через 30 мин проводилась повторная аналогичная инъекция и через 30 мин поведение животных оценивали в тесте «подвешивание за хвост». Мышам группы 2 в/бр вводилось суспензия РK11195 в дозе 10,00 мг/кг, через 30 мин - дистиллированная вода и через 30 мин поведение животных оценивали в тесте «подвешивание за хвост». Мышам группы 3 в/бр вводилась дистиллированная вода, через 30 мин суспензия ГМЛ-3 в дозе 0,5 мг/кг и через 30 мин поведение животных оценивали в тесте «подвешивание за хвост». Мышам группы 4 в/бр вводилась суспензия РКП 195 в дозе 10,00 мг/кг, через 30 мин суспензия ГМЛ-3 в дозе 0,50 мг/кг и через 30 мин поведение животных оценивали в тесте «подвешивание за хвост».
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни).
Соединение ГМЛ-3 в дозе 0,50 мг/кг вызывало выраженный антидепрессивный эффект у мышей CD-1, статистически значимо снижая время неподвижности по сравнению с контрольной группой 1. Предварительное введение РK11195 в дозе 10,00 мг/кг (Группа 4) блокировало антидепрессивный эффект ГМЛ-3, увеличивая время неподвижности животных в сравнении с группой 3 (таблица 4).

Результаты эксперимента демонстрируют зависимость антидепрессивного эффекта соединения ГМЛ-3 от взаимодействия с рецепторным участком TSPO.
Пример 3. Изучение ноотропной активности соединения ГМЛ-1.
Ноотропную активность соединения ГМЛ-1 изучали в тесте «распознавание нового объекта» в условиях скополаминовой амнезии путем изучения влияния ГМЛ-1 при однократном введении на рабочую память крыс [R. Verloes, et al., Psychopharmacology, 1988, 95(2), 226-30.]. Опыты проводили на беспородных крысах-самцах массой 280-340 г (НИИ «Питомник лабораторных животных ФИБХ РАН). Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°С и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 10 крыс в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 [1993] и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%. Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов.
ГМЛ-1 вводили в дозах 0,05; 0,10 и 0,50 мг/кг, (в/бр); растирали с Твин-80 и разводили дистиллированной водой. В эксперименте использовали следующие группы: 1. контрольная группа; 2. группа «скополамин»; 3. группа «ГМЛ-1 (0,05 мг/кг) + скополамин»; 4. группа «ГМЛ-1 (0,10 мг/кг) + скополамин»; 5. группа «ГМЛ-1 (0,50 мг/кг) + скополамин». В каждой группе использовали по 10 животных. Амнезию у крыс моделировали с помощью скополамина (0,20 мг/кг, п/к). ГМЛ-1 вводили за 1 ч до скополамина. Через 30 минут после введения скополамина проводили тест распознавания нового объекта. Контрольным животным вместо скополамина вводили физиологический раствор и вместо ГМЛ-1 дистиллированную воду с Твин-80. Группе «скополамин» вводили вместо ГМЛ-1 дистиллированную воду с Твин-80.
Перед началом эксперимента каждую крысу сажали в клетку Т4 с опилками, идентичную ее домашней клетке, и давали ей 5 мин для адаптации. В фазу ознакомления в два ближайших угла клетки помещали два одинаковых незнакомых для крысы объекта (герметично закрытые жестяные банки с жидкостью, объемом 0,33 л, оранжевого цвета). В течение 4 мин регистрировали время исследования крысой каждого объекта. Затем объекты убирали. Перерыв между фазой ознакомления и тестом - 3 мин. При проведении теста в те же углы клетки помещали новую пару объектов, в которой один объект был идентичен объектам, предъявлявшимся в фазе ознакомления, а второй был незнакомым (стеклянная банка с жидкостью, герметично закрытая металлической крышкой, объемом 0,33 л, зеленого цвета). В течение 4 мин регистрировали время исследования знакомого и нового объектов. Позиции знакомого и нового объектов (правый и левый угол) меняли от животного к животному. Перед каждым тестом объекты протирали спиртом для уничтожения меток, оставленных предыдущим животным. Исследованием считали обнюхивание, когда нос животного находился на расстоянии не более 2 см от объекта.
Межгрупповые различия оценивали с помощью U теста Манна-Уитни с поправкой Бонферрони. Для оценки рабочей памяти крыс использовали коэффициент дискриминации (КД), который рассчитывали по формуле:
КД=(а-б)/(а+б), где а - время исследования нового объекта во время теста (с), а б - время исследования знакомого объекта во время теста (с). Этот коэффициент отражает рабочую память крыс. Значение КД может быть от -1 до +1. Чем оно больше, тем лучше животное различает новый и знакомый объекты.
Данные представлены в виде медиан.
Показано, что контрольные животные значительно больше времени исследовали новый объект, чем знакомый. Введение скополамина заметно нарушало способность животных к распознаванию объектов, что выражалось в снижении времени исследования нового объекта по отношению к суммарному времени исследования нового и знакомого объектов во время теста. ГМЛ-1 статистически достоверно противодействовал скополаминовой амнезии во всех исследованных дозах (таблица 5).
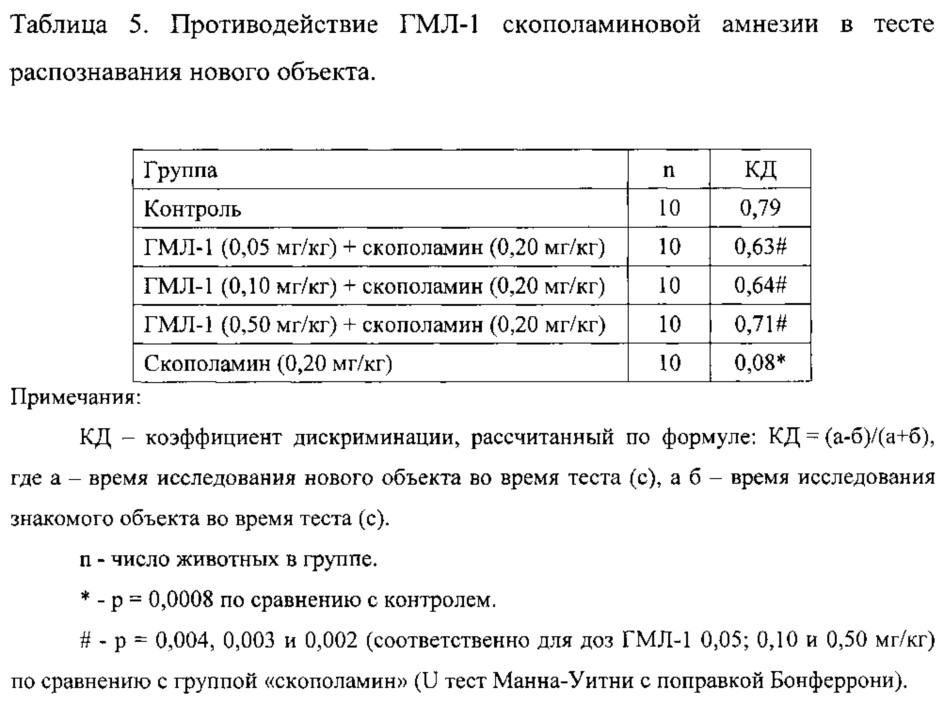
Таким образом, лиганд транслокаторного протеина ГМЛ-1 в диапазоне доз 0,05-0,50 мг/кг, в/б при введении за 1 ч до повреждения статистически достоверно противодействует нарушению рабочей памяти у крыс, индуцированному скополамином, в тесте распознавания нового объекта.

