СОСТАВЫ ТВЕРДЫХ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ АНТАГОНИСТА ОРЕКСИНОВОГО РЕЦЕПТОРА
Вид РИД
Изобретение
Уровень техники изобретения
Орексины (гипокретины) содержат два нейропептида, производимых гипоталамусом: орексин A (OX-A) (33-аминокислотный пептид) и орексин B (OX-B) (28-аминокислотный пептид) (Sakurai T. et al., Cell, 1998, 92, 573-585). Обнаружено, что орексины стимулируют потребление пищи у крыс, давая основание для предположения о физиологической роли этих пептидов в качестве посредников в центральном механизме обратной связи, регулирующем пищевое поведение (Sakurai T. et al., Cell, 1998, 92, 573-585). Орексины регулируют состояния сна и бодрствования, открывая потенциально новые терапевтические подходы к наркологическим или страдающим бессонницей пациентам (Chemelli R.M. et al., Cell, 1999, 98, 437-451). Также указано, что орексины играют роль в возбуждении, удовлетворении, обучении и памяти (Harris, et al., Trends Neurosci., 2006, 29 (10), 571-577). Два орексиновых рецептора были клонированы и охарактеризованы у млекопитающих. Они принадлежат к суперсемейству рецепторов, сопряженных с G-белком (Sakurai T. et al., Cell, 1998, 92, 573-585): рецептор орексин-1 (OX или OX1R) селективен по отношению к OX-A и рецептор орексин-2 (ОX2 или OX2R) способен связывать OX-A, а также OX-B. Считается, что физиологические действия, в которых, как предполагается, участвуют орексины, экспрессируются через один или как OX 1 рецептор, так и OX 2 рецептор как два подтипа орексиновых рецептора.
Орексиновые рецепторы обнаружены в млекопитающем мозге, и в научной литературе высказывается предположение о том, что они могут быть причастны к различным патологиям, таким как депрессия; тревожность; зависимости; обсессивно-компульсивное расстройство; аффективный невроз; депрессивный невроз; тревожный невроз; дистимическое расстройство; поведенческое расстройство; расстройство настроения; сексуальная дисфункция; психосексуальная дисфункция; сексуальное расстройство; шизофрения; маниакальная депрессия; делирий; деменция; умственная отсталость тяжелой степени и дискинезия, такая как болезнь Хантингтона и синдром Туретта; расстройства пищевого поведения, такие как анорексия, булимия, кахексия и ожирение; аддиктивное пищевое поведение; пищевое поведение с перееданием/самоочищением; сердечно-сосудистые заболевания; диабет; расстройства аппетита/вкуса; рвота, тошнота; астма; злокачественная опухоль; болезнь Паркинсона; синдром Иценко-Кушинга/заболевание; базофильная аденома; пролактинома; гиперпролактинемия; опухоль/аденома гипофиза; заболевания гипоталамуса; воспалительное заболевание кишечника; дискинезия желудка; язвы желудка; синдром Фрэлиха; болезни аденогипофиза; заболевание гипофиза; гипофункция аденоoгипофиза; гиперфункция аденогипофиза; гипоталамический гипогонадизм; синдром Каллманна (аносмия, гипосмия); функциональная или психогенная аменорея; гипопитуитаризм; гипоталамический гипотиреоз; гипоталамическо-адреналиновая дисфункция; идиопатическая гиперпролактинемия; гипоталамические расстройства дефицита гормона роста; идиопатический дефицит гормона роста; карликовость; гигантизм; акромегалия; нарушенные биологические и суточные ритмы; нарушения сна, связанные с заболеваниями, такими как неврологические расстройства, нейропатическая боль и синдром беспокойных ног; сердечные и легочные заболевания, острая и застойная сердечная недостаточность; гипотензия; гипертензия; задержка мочеиспускания; остеопороз; стенокардия; инфаркт миокарда; ишемический или геморрагический инсульт; субарахноидальное кровоизлияние; язвы; аллергии; доброкачественная гипертрофия предстательной железы; хроническая почечная недостаточность; заболевание почек; нарушенная толерантность к глюкозе; мигрень; гипералгезия; боль; повышенная или гипертрофированная чувствительность к боли, такая как гипералгезия, каузалгия и аллодиния; острая боль; ожоговая боль; атипичная лицевая боль; нейропатическая боль; позвоночная боль; комплексный региональный болевой синдром I и II; артритическая боль; боль при спортивных травмах; боль, связанная с инфекцией, например, ВИЧ, боль после химиотерапии; боль после инсульта; послеоперационная боль; невралгия; тошнота, рвота; состояния, связанные с висцеральной болью, такие как синдром раздраженного кишечника и ангина; мигрень; недержание мочи, например, неотложное недержание мочи; переносимость наркотиков или синдром отмены наркотиков; расстройства сна; приступы апноэ во сне; нарколепсия; бессонница; парасомния; синдром десинхронизации физиологических циклов после трансмеридиональных перелетов; и нейродегенеративные расстройства, включая назологические формы, такие как комплекс расторможенности-деменции-паркинсонизма-амиотрофии; паллидо-понто-нигральная дегенерация; эпилепсия; судорожные расстройства и другие заболевания, связанные с общей орексиновой дисфункцией.
Соединение по формуле I:
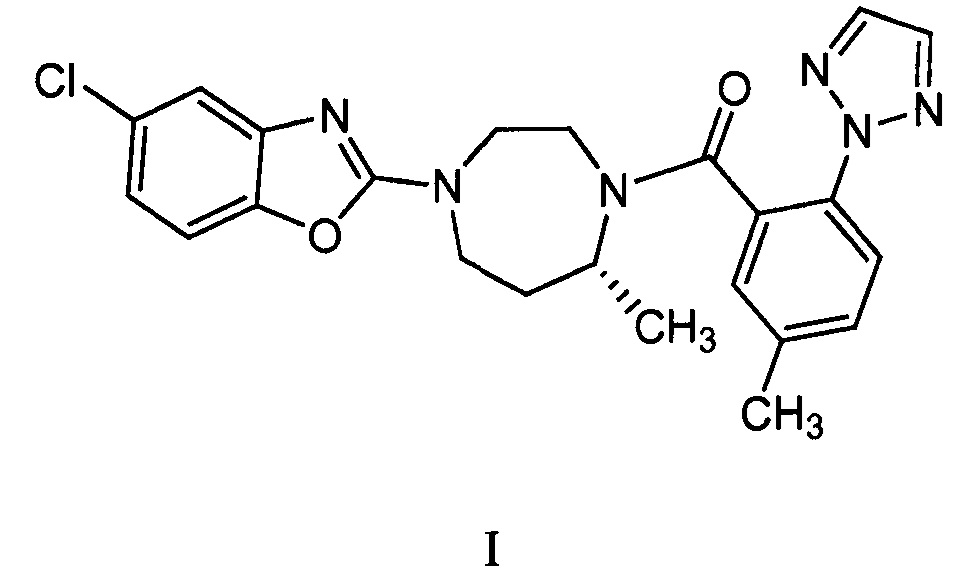
5-хлор-2-{(5R)-5-метил-4-[5-метил-2-(2H-1,2,3-триазол-2-ил)бензоил]-1,4-диазепан-1-ил}-1,3-бензоксазол (также называемый «суворексантом») описан в качестве антагониста орексиновых рецепторов в патенте США 7951797, публикации патентной заявки США 2008/0132490, патентной публикации PCT WO 2008/069997, Cox et al., J. Med. Chem. 2010, 53, 5320-5332, Strotman et al., JACS, 2011, 133(21), 8362-8371, Baxter et al., Org. Process Res. & Dev., 2011, 15(2) 367-375. Это соединение может называться, например, «5-хлор-2-{(5R)-5-метил-4-[5-метил-2-(2H-1,2,3-триазол-2-ил)бензоил]-1,4-диазепан-1-ил}-1,3-бензоксазолом», «[(R)-4-(5-хлор-бензооксазол-2-ил)-7-метил-[1,4]диазепан-1-ил]-(5-метил-2-[1,2,3]триазол-2-илфенил)метаноном» или «[(7R)-4-(5-хлор-1,3-бензоксазол-2-ил)-7-метил-1,4-диазепан-1-ил] [5-метил-2-(2H-1,2,3-триазол-2-ил)фенил]метаноном».
Сущность изобретения
Настоящее изобретение относится к фармацевтической композиции, содержащей соединение суворексанта или его фармацевтически приемлемую соль, полимер, повышающий концентрацию, и необязательно фармацевтически приемлемое поверхностно-активное вещество.
Краткое описание чертежей
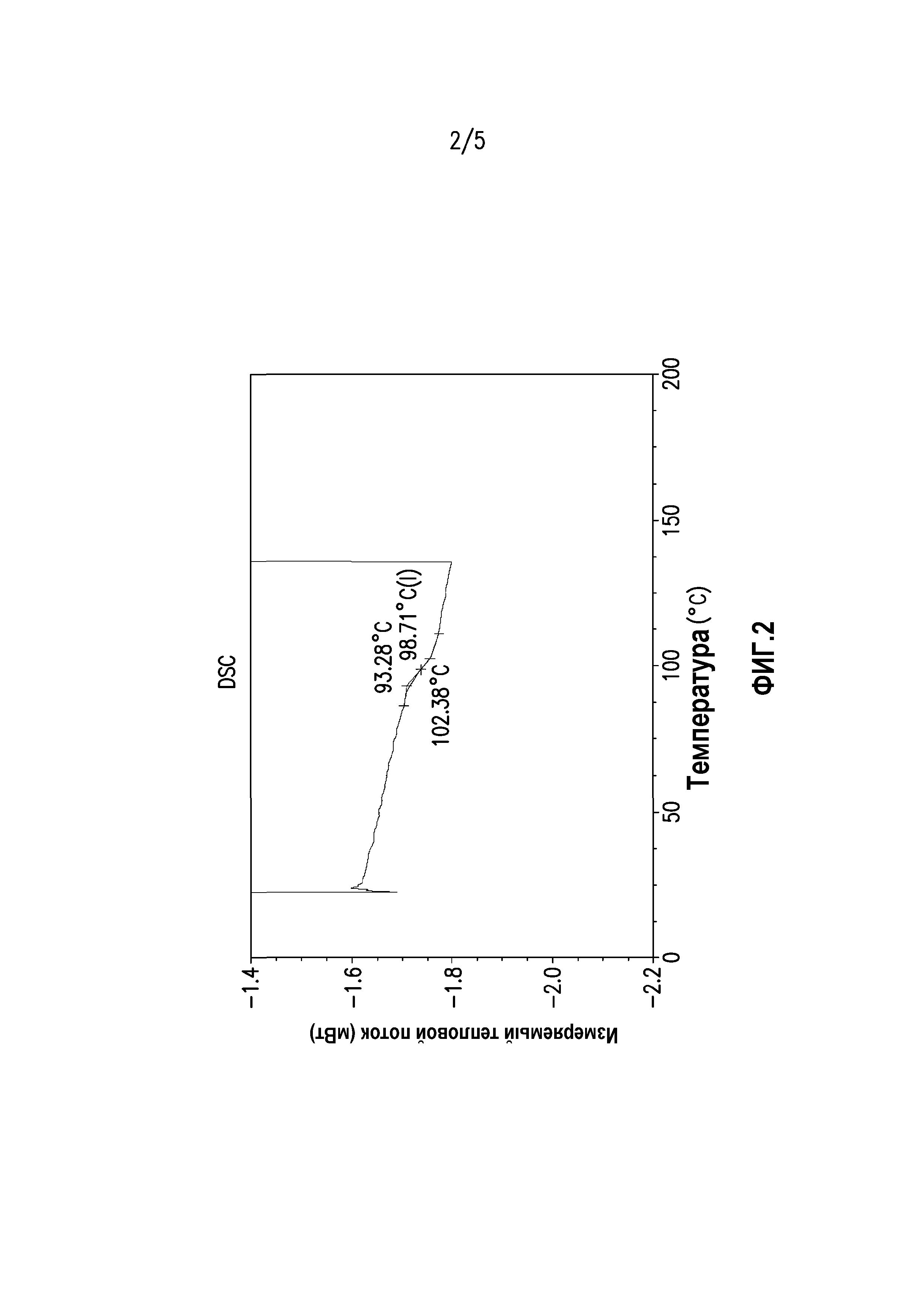
На фиг. 1 показана порошковая рентгеновская дифрактограмма состава суворексанта, полученного экструзией горячего расплава.
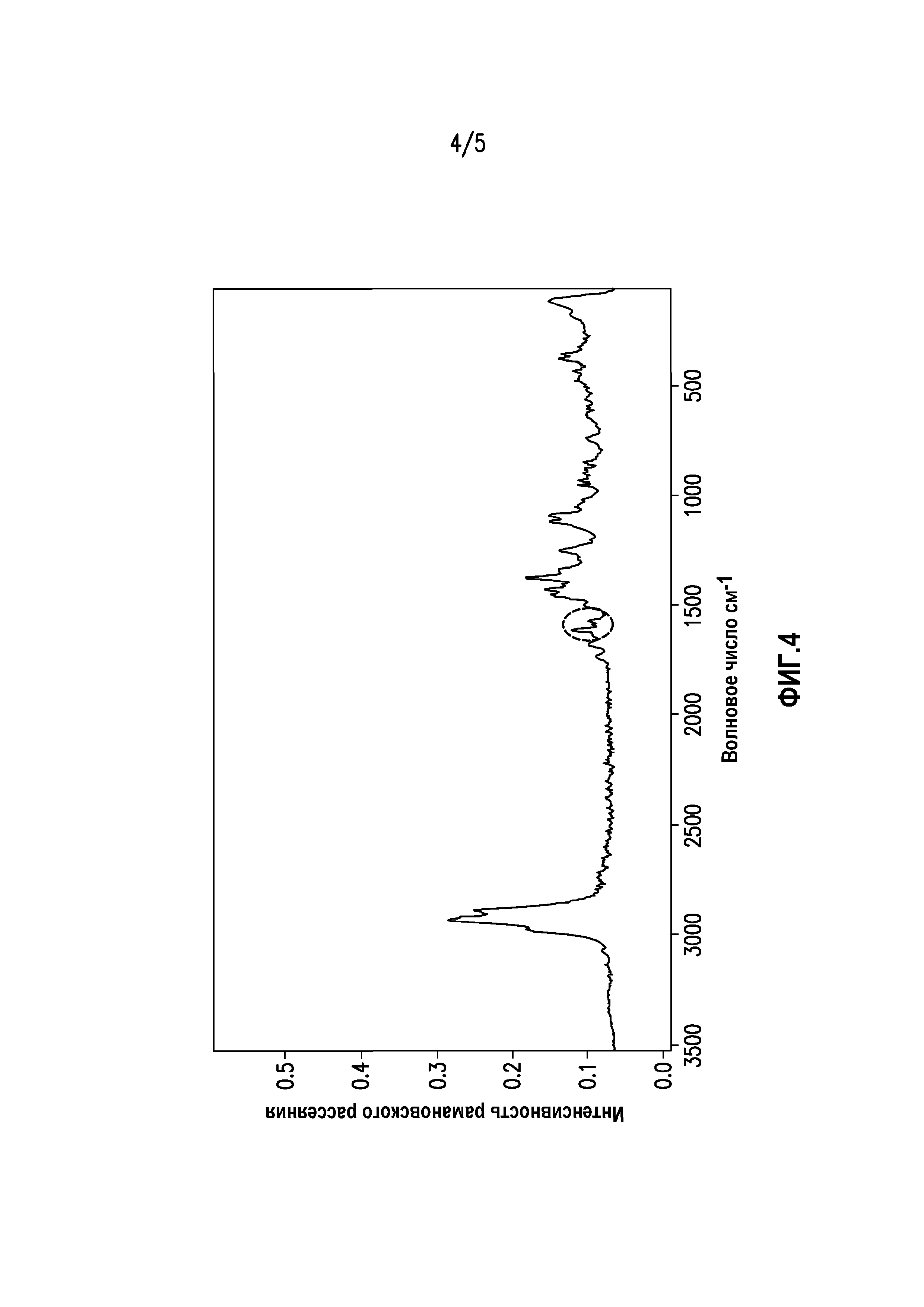
На фиг. 2 показана термограмма модулированной дифференциальной сканирующей калориметрии состава суворексанта, полученного экструзией горячего расплава.
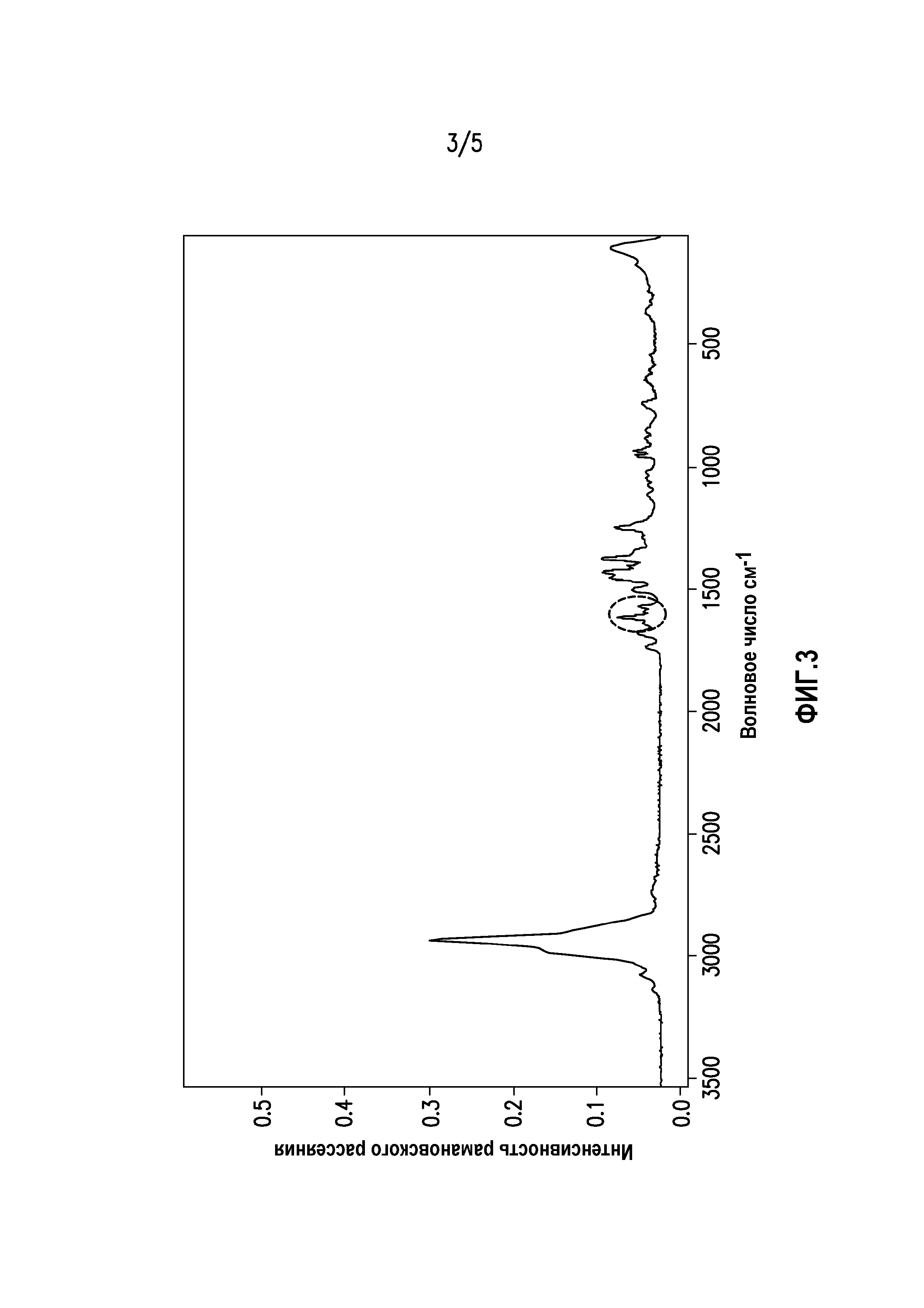
На фиг. 3 показана спектрограмма рамановского рассеяния экструдата горячего расплава суворексанта.
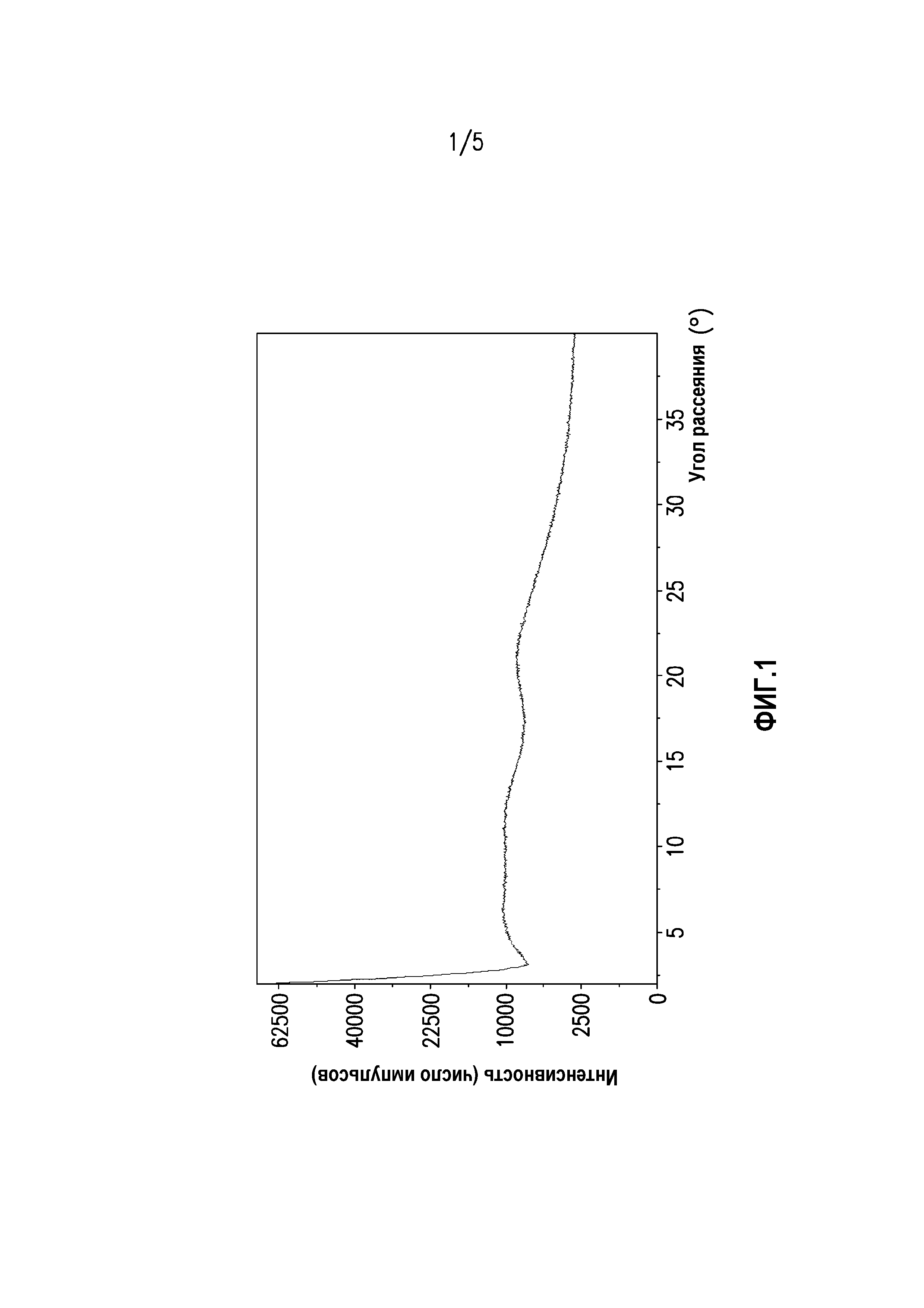
На фиг. 4 показана спектрограмма рамановского рассеяния таблетированной лекарственной формы, содержащей экструдат горячего расплава суворексанта.
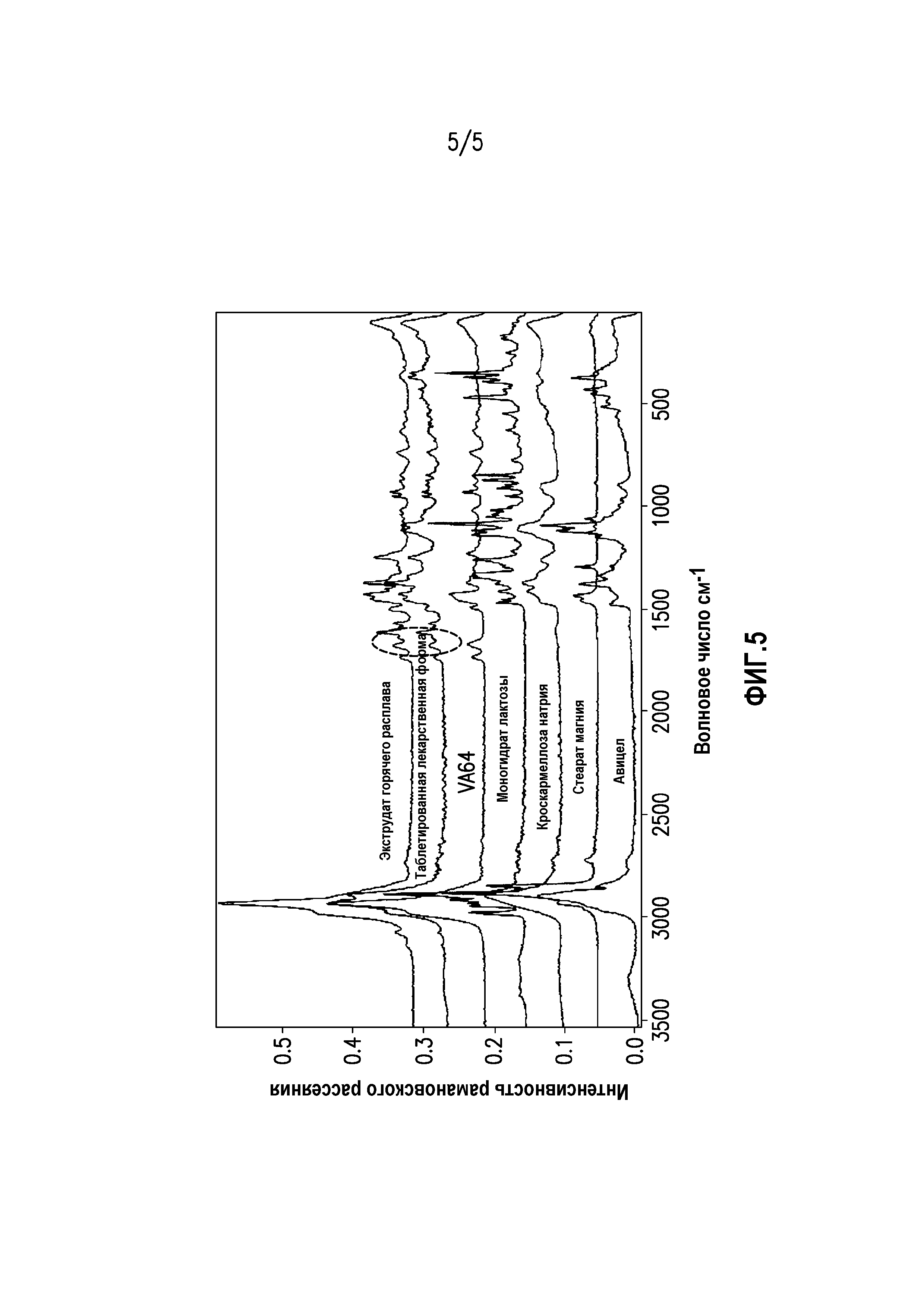
На фиг. 5 показана спектрограмма рамановского рассеяния экструдата горячего расплава суворексанта с наложенной спектрограммой рамановского рассеяния таблетированной лекарственной формы, содержащей экструдат горячего расплава суворексанта, а также с наложенной спектрограммой рамановского рассеяния отдельных эксципиентов в такой таблетированной лекарственной форме, содержащей экструдат горячего расплава суворексанта.
Подробное описание изобретения
Настоящее изобретение относится к фармацевтической композиции, содержащей:
(1) суворексант или его фармацевтически приемлемую соль;
(2) полимер, повышающий концентрацию, где полимер повышает биодоступность суворексанта и является водорастворимым и легкодиспергируемым в воде; и
(3) необязательно одно или несколько поверхностно-активных веществ.
Полимер, повышающий концентрацию, является полимером, образующим аморфную дисперсию с суворексантом, которая нерастворима или почти полностью нерастворима в воде посредством (a) растворения суворексанта или (b) взаимодействия с суворексантом таким образом, что суворексант не образует кристаллы или кристаллические домены в полимере. Полимер, повышающий концентрацию, растворяется в воде или легко диспергируется в воде так, что при помещении полимера в воду или водную среду (например, сок желудочно-кишечного тракта или имитацию желудочно-кишечного сока) растворимость и/или биодоступность суворексанта повышается по сравнению с растворимостью или биодоступностью в отсутствие полимера.
Один класс полимеров, пригодных для использования в настоящем изобретении, содержит нейтральные нецеллюлозные полимеры. Иллюстративные полимеры включают: виниловые полимеры и сополимеры, имеющие заместителей, являющихся гидрокси, алкилом, ацилокси и циклическими амидами. Они включают поливиниловые спирты, имеющие, по меньшей мере, часть своих повторяющихся единиц в негидролизованной(винилацетат) форме (например, поливиниловые спирт-сополимеры поливинилацетата); поливинилпирролидинон; сополимеры поливинилового спирта с полиэтиленом и сополимеры поливинилпирролидинон-поливинилацетата. Класс нецеллюлозных неионных полимеров содержит поливинилпирролидинон и сополимеры поливинилпирролидинона, такие как сополимеры поливинилпирролидинон-поливинилацетата, доступные в качестве полимеров и сополимеров Kollidon или полимеров и сополимеров Plasdone. Типичным сополимером является коповидон. Эти сополимеры часто продают под товарными знаками Kollidon VA64 или Plasdone S630. Типичным сополимером является привитой сополимер поливинил капролактам-поливинилацетат-полиэтиленгликоль. Этот сополимер часто продают под товарным знаком Soluplus.
Другой класс полимеров, пригодный для использования в настоящем изобретении, содержит ионизируемые нецеллюлозные полимеры. Иллюстративные полимеры включают: полимеры винила, функционализированные карбоновой кислотой, такие как полиметакрилаты, функционализированные карбоновой кислотой, и полиакрилаты, функционализированные карбоновой кислотой. Этот сополимер часто продают под товарным знаком EUDRAGITS, от Rohm Tech Inc., город Мейден, штат Массачутетс; амин-функционализированные полиакрилаты и полиметакрилаты; белки и крахмалы, функционализированные карбоновой кислотой, такие как гликолят крахмала.
Полимеры, повышающие концентрацию, могут также быть нецеллюлозными полимерами, которые амфифильны и являются сополимерами относительно гидрофильного и относительно гидрофобного мономера. Примеры включают ранее упомянутые сополимеры акрилата и метакрилата (EUDRAGITS). Другим примером амфифильных полимеров являются блок-сополимеры оксида этилена (или гликоля) и оксида пропилена (или гликоля), где единицы олигомера поли(пропиленгликоля) относительно гидрофобны и единицы поли(этиленгликоля) относительно гидрофильны. Эти полимеры часто продают под товарным знаком Полоксамер.
Класс полимеров содержит ионизируемые и нейтральные целлюлозные полимеры с, по меньшей мере, одним заместителем, связанным сложноэфирной и/или простой эфирной связью, в котором полимер имеет степень замещения, по меньшей мере, 0,1 для каждого заместителя. В номенклатуре, используемой в настоящем документе, заместители, связанные простой эфирной связью, перечисляются до «целлюлозы» как молекула, прикрепленная к целлюлозной основе простой эфирной связью; например, «целлюлоза этилбензойной кислоты» имеет заместители этоксибензойной кислоты на целлюлозной основе. Аналогично заместители, связанные сложноэфирной связью, перечисляются после «целлюлозы» как карбоксилат; например, «фталат целлюлозы» имеет одну карбоновую кислоту каждой молекулы фталата, прикрепленной к полимеру сложноэфирной связью, при этом другая группа карбоновой кислоты фталатной группы остается как группа свободной группой карбоновой кислоты.
Также следует отметить, что название полимера, такое как «ацетат-фталат целлюлозы» относится к любому семейству целлюлозных полимеров, имеющих ацетатные и фталатные группы, прикрепленные сложноэфирной связью к значительной части гидроксильных групп целлюлозных полимеров. Обычно степень замещения каждой замещающей группы может варьироваться от 0,1 до 2,9 при условии соответствия других критериев полимера. «Степень замещения» относится к среднему количеству трех замещенных гидроксилов на повторяющуюся единицу сахарида на целлюлозной цепи. Например, если все гидроксилы целлюлозной цепи замещены фталатом, степень замещения фталатом равна 3.
Также в рамки каждого типа семейства полимеров включают целлюлозные полимеры, имеющие дополнительных заместителей, добавляемых в относительно небольших количествах, которые по существу не изменяют функциональность полимера.
Амфифильные целлюлозные полимеры можно получать посредством замещения целлюлозы на любом или всех 3 гидроксильных заместителях, присутствующих на каждой повторяющейся единице сахарида, по меньшей мере, одним относительно гидрофобным заместителем. Гидрофобным заместителем по существу может быть любой заместитель, который при замещении при достаточно высоком уровне или степени замещения может воспроизводить целлюлозный полимер, по существу не растворимый в воде. Гидрофильные области полимера могут быть или теми частями, которые являются относительно незамещенными, так как незамещенные гидроксилы сами по себе являются относительно гидрофильными, или теми областями, которые замещены гидрофильными заместителями. Примеры гидрофобных заместителей включают алкильные группы, связанные простой эфирной связью, такие как метил, этил, пропил, бутил и т.д.; или алкильные группы, связанные сложноэфирной связью, такие как ацетат, пропионат, бутират и т.д.; и арильные группы, связанные простой эфирной и/или сложноэфирной связью, такие как фенил, бензоат или фенилaт. Гидрофильные группы включают неионизируемые группы, связанные простой эфирной или сложноэфирной связью, такие как гидроксиалкильные заместители гидроксиэтил, гидроксипропил и алкильные простые эфирные группы, такие как этоксиэтокси или метоксиэтокси. Гидрофильные заместители включают те, которые являются ионизируемыми группами, связанными простой эфирной или сложноэфирной связью, такие как карбоновые кислоты, тиокарбоновые кислоты, замещенные фенокси группы, амины, фосфаты или сульфонаты.
Один класс целлюлозных полимеров содержит нейтральные полимеры, то есть полимеры являются по существу неионизируемыми в водном растворе. Такие полимеры содержат неионизируемые заместители, которые могут быть связанными или простой эфирной или сложноэфирной связью. Иллюстративные неионизируемые заместители, связанные простой эфирной связью, включают: алкильные группы, такие как метил, этил, пропил, бутил, и т.д.; гидроксиалкильные группы, такие как гидроксиметил, гидроксиэтил, гидроксипропил и т.д.; и арильные группы, такие как фенил. Иллюстративные неионизируемые группы, связанные сложноэфирной связью, включают: алкильные группы, такие как ацетат, пропионат, бутират и т.д.; и арильные группы, такие как фенилaт. Однако при включении арильных групп полимеру может потребоваться включить достаточное количество гидрофильного заместителя, чтобы полимер обладал, по меньшей мере, некоторой растворимостью в воде при любом физиологически соответствующем pH от 1 до 8.
Иллюстративные неионизируемые полимеры, которые можно использовать в качестве полимера, включают: ацетат гидроксипропилметилцеллюлозы, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиэтилметилцеллюлозу, ацетат гидроксиэтилцеллюлозы и гидроксиэтилэтилцеллюлозу.
Вариантом осуществления нейтральных целлюлозных полимеров являются те, которые амфифильны. Иллюстративные полимеры включают гидроксипропилметилцеллюлозу и ацетат гидроксипропилцеллюлозы, где целлюлозные повторяющиеся единицы, которые имеют относительно высокое количество метиловых или ацетатных заместителей по отношению к незамещенным гидроксильным или гидроксипропиловым заместителям, составляют гидрофобные по отношению к другим повторяющимся единицам на полимере участки.
Вариант осуществления целлюлозных полимеров содержит полимеры, которые являются, по меньшей мере, частично ионизируемыми при физиологически соответствующем pH и включают, по меньшей мере, один ионизируемый заместитель, который может быть связанным или простой эфирной или сложноэфирной связью. Иллюстративные ионизируемые заместители, связанные простой эфирной связью, включают: карбоновые кислоты, такие как уксусная кислота, пропионовая кислота, бензойная кислота, салициловая кислота, алкоксибензойные кислоты, такие как этоксибензойная кислота или пропоксибензойная кислота, различные изомеры алкоксифталевой кислоты, такие как этоксифталевая кислота и этоксиизофталевая кислота, различные изомеры алкоксиникотиновой кислоты, такие как этоксиникотиновая кислота, и различные изомеры пиколиновой кислоты, такие как этоксипиколиновая кислота и т.д.; тиокарбоновые кислоты, такие как 5 тиоуксусная кислота; замещенные фенокси группы, такие как гидроксифенокси и т.д.; амины, такие как аминоэтокси, диэтиламиноэтокси, триметиламиноэтокси и т.д.; фосфаты, такие как фосфат этокси и сульфонаты, такие как сульфонат этокси. Иллюстративные ионизируемые заместители, связанные сложноэфирной связью, включают: карбоновые кислоты, такие как сукцинат, цитрат, фталат, терефталат, изофталат, тримеллитат и различные изомеры пиридиндикарбоновой кислоты и т.д.; тиокарбоновые кислоты, такие как тиосукцинат; замещенные фенокси группы, такие как аминосалициловая кислота; амины, такие как природные или синтетические аминокислоты, такие как аланин или фенилаланин; фосфаты, такие как ацетил фосфат; и сульфонаты, такие как ацетил сульфонат. Для того чтобы полимеры, замещенные ароматической группой, обладали требующейся растворимостью в воде, необходимо прикрепление достаточного количества гидрофильных групп, таких как гидроксипропильная или функциональные группы карбоновой кислоты, к полимеру для приведения полимера в растворимое состояние, по меньшей мере, при значении pH, при котором происходит ионизация ионизируемых групп. В некоторых случаях ароматическая группа сама может быть ионизируемой, такой как фталатные или тримеллитатные заместители.
Иллюстративные целлюлозные полимеры, которые, по меньшей мере, частично ионизируются при физиологически соответствующем pH, включают: ацетат-сукцинат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилцеллюлозы, сукцинат гидроксиэтилметилцеллюлозы, ацетат-сукцинат гидроксиэтилцеллюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксиэтилметилцеллюлозы, ацетат-фталат гидроксиэтилметилцеллюлозы, карбоксиэтилцеллюлозу, карбоксиметилцеллюлозу, ацетат-фталат целлюлозы, ацетат-фталат метилцеллюлозы, ацетат-фталат этилцеллюлозы, ацетат-фталат гидроксипропилцеллюлозы, ацетат-фталат гидроксипропилметилцеллюлозы, ацетат-фталат-сукцинат гидроксипропилцеллюлозы, ацетат-сукцинат-фталат гидроксипропилметилцеллюлозы, фталат-сукцинат гидроксипропилметилцеллюлозы, пропионат-фталат целлюлозы, бутират-фталат гидроксипропилцеллюлозы, ацетат-тримеллитат целлюлозы, ацетат-тримеллитат метилцеллюлозы, ацетат-тримеллитат этилцеллюлозы, ацетат-тримеллитат гидроксипропилцеллюлозы, ацетат-тримеллитат гидроксипропилметилцеллюлозы, сукцинат ацетат-тримеллитат гидроксипропилцеллюлозы, пропионат-тримеллитат целлюлозы, бутират-тримеллитат целлюлозы, ацетат-терефталат целлюлозы, ацетат-изофталат целлюлозы, ацетат-пиридиндикарбоксилат целлюлозы, ацетат (салициловая кислота)целлюлозы, ацетат (салициловая кислота)гидроксипропил целлюлозы, ацетат (этилбензойная кислота)целлюлозы, ацетат(этилбензойная кислота) гидроксипропилцеллюлозы, ацетат этил(фталевая кислота)целлюлозы, ацетат этил(никотиновая кислота)целлюлозы и ацетат этил(пиколиновая кислота)целлюлозы.
Иллюстративные целлюлозные полимеры, соответствующие определению амфифильности, имеющие гидрофильные и гидрофобные области, включают полимеры, такие как ацетат-фталат целлюлозы и ацетат-тримеллитат целлюлозы, где целлюлозные повторяющиеся единицы, имеющие одного или нескольких ацетатных заместителей, являются гидрофобными по отношению к тем, которые не имеют ацетатных заместителей или имеют одного или более ионизированных фталатных или тримеллитатных заместителей.
Подгруппой целлюлозных ионогенных полимеров являются те, которые имеют как ароматический функциональный заместитель карбоновой кислоты, так и алкилaтный заместитель, и таким образом, являются амфифильными. Иллюстративные полимеры включают ацетат-фталат целлюлозы, ацетат-фталат метилцеллюлозы, ацетат-фталат этилцеллюлозы, ацетат-фталат гидроксипропилцеллюлозы, фталат гидроксилпропилметилцеллюлозы, ацетат-фталат гидроксипропилметилцеллюлозы, ацетат-фталат-сукцинат гидроксипропилцеллюлозы, пропионат-фталат целлюлозы, бутират-фталат гидроксипропилцеллюлозы, ацетат-тримеллитат целлюлозы, ацетат-тримеллитат метилцеллюлозы, ацетат-тримеллитат этилцеллюлозы, ацетат-тримеллитат гидроксипропилцеллюлозы, ацетат-тримеллитат гидроксипропилметилцеллюлозы, ацетат-тримеллитат-сукцинат гидроксипропилцеллюлозы, пропионат-тримеллитат целлюлозы, бутират-тримеллитат целлюлозы, ацетат-терефталат целлюлозы, ацетат-изофталат целлюлозы, ацетат-пиридиндикарбоксилат целлюлозы, ацетат(салициловая кислота)целлюлозы, ацетат (салициловая кислота) гидроксипропил целлюлозы, ацетат (этилбензойная кислота)целлюлозы, ацетат (этилбензойная кислота)гидроксипропилцеллюлозы, ацетат этил(фталевая кислота)целлюлозы, ацетат этил(никотиновая кислота)целлюлозы и ацетат этил(пиколиновая кислота)целлюлозы.
Другой подгруппой целлюлозных ионизируемых полимеров являются те, которые имеют неароматический карбоксилатный заместитель. Иллюстративные полимеры включают ацетат-сукцинат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилцеллюлозы, ацетат-сукцинат гидроксиэтилметилцеллюлозы, сукцинат гидроксиэтилметилцеллюлозы и ацетат-сукцинат гидроксиэтилцеллюлозы.
Как перечислено выше, большое число полимеров можно использовать для образования аморфных дисперсий суворексанта. В одном из вариантов осуществления настоящего изобретения полимер, повышающий концентрацию, содержит целлюлозный полимер, являющийся водорастворимым в своем неионизированном состоянии и также водорастворимым в своем ионизированном состоянии. Конкретным подклассом таких полимеров являются так называемые «кишечнорастворимые» полимеры, которые включают, например, определенные виды ацетат-фталата гидроксипропилметилцеллюлозы и ацетат-тримеллитата целлюлозы. В дисперсиях, образованных от таких полимеров, обычно проявляется большое повышение максимальной концентрации лекарственного средства в тестах на растворимость по сравнению с теми, которые предназначены для контроля лекарственного средства кристаллической формы. Кроме того, также применимы некишечнорастворимые виды таких полимеров и тесно связанные целлюлозные полимеры.
В одном из вариантов осуществления настоящего изобретения полимер, повышающий концентрацию, содержит ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMCAS), фталат гидроксипропилметилцеллюлозы (HPMCP), ацетат-фталат целлюлозы (CAP), ацетат-тримеллитат целлюлозы (CAT), ацетат-фталат метилцеллюлозы, ацетат-фталат гидроксипропилцеллюлозы, ацетат-терефталат целлюлозы и ацетат-изофталат целлюлозы.
В одном из вариантов осуществления настоящего изобретения полимер, повышающий концентрацию выбран из группы, состоящей из ацетат-сукцината гидроксипропилметилцеллюлозы (HPMCAS), фталата гидроксипропилметилцеллюлозы (HPMCP), ацетат-фталата целлюлозы (CAP), ацетат-тримеллитата целлюлозы (CAT), ацетат-фталата метилцеллюлозы, ацетат-фталата гидроксипропилцеллюлозы, ацетат-терефталата целлюлозы, ацетат-изофталата целлюлозы, поливинилпирролидинона, сополимеров винил пирролидинона/винилацетата и сополимеров акрилата и метакрилата.
В одном из вариантов осуществления настоящего изобретения полимером, повышающим концентрацию, является ацетат-сукцинат гидроксипропилметилцеллюлозы (HPMCAS) или сополимер винил пирролидинона/винилацетата.
В одном из вариантов осуществления настоящего изобретения полимером, повышающим концентрацию, является полимер, нечувствительный к pH. Термин «нечувствительный к pH» означает полимер, не имеющий существенной разницы в растворимости между pH желудка (pH 1-4) и pH кишечника (pH 5-8). Типичные нечувствительные к pH полимеры включают: сополимер винил пирролидинона/винилацетата, сополимер поливинил пирролидинона/винилацетата, гидроксипропилметилцеллюлозу, гидроксипропил целлюлозу, этилцеллюлозу, поливинил пирролидинон, сополимер метакрилата, полиэтиленоксид, сополимеры (полоксамеры) полиоксипропилена/полиоксиэтилена и полиэтиленгликоль. В одном из вариантов осуществления настоящего изобретения полимером, повышающим концентрацию, является сополимер винил пирролидинонавинилацетата или сополимер поливинил пирролидинона/винилацетата.
В одном из вариантов осуществления настоящего изобретения полимером, повышающим концентрацию, является сополимер винил пирролидинона/винилацетата. В одном из вариантов осуществления настоящего изобретения полимером, повышающим концентрацию, является сополимер поливинил пирролидинона/винилацетата.
Когда смешивают конкретные полимеры, пригодные для использования в композициях по настоящему изобретению, также могут быть подходящими смеси таких полимеров. Таким образом, подразумевается, что термин «полимер» включает смеси полимеров в дополнение к единичному виду полимера.
Фармацевтическая композиция по настоящему изобретению необязательно содержит одно или несколько поверхностно-активных веществ, которые могут быть ионногенными или неионногенными поверхностно-активными веществами. Поверхностно-активные вещества могут повышать скорость растворения, способствуя смачиванию, таким образом повышая максимальную концентрацию растворенного лекарственного средства. Поверхностно-активные вещества могут также облегчать обработку дисперсии. Поверхностно-активные вещества могут также стабилизировать аморфные дисперсии посредством ингибирования кристаллизации или осаждения лекарственного средства путем взаимодействия с растворенным лекарственным средством с помощью таких механизмов, как комплексообразование, образование комплексов включения, образование мицеллы и адсорбции к поверхности твердого лекарственного средства. Подходящие поверхностно-активные вещества включают катионные, анионные и неионногенные поверхностно-активные вещества. Они включают, например, жирные кислоты и алкилсульфонаты; катионные поверхностно-активные вещества, такие как хлорид бензалкония (Hyamine 1622, доступный от Lonza, Inc., город Фэр Лон, штат Нью-Джерси); анионные поверхностно-активные вещества, такие как диоктилсульфосукцинат натрия (докузат натрия, доступный от Mallinckrodt Spec. Chem., город Сент-Луис, штат Миссури) и лаурилсульфат натрия (додецилсульфат натрия); сорбитановые сложные эфиры жирных кислот (серия SPAN поверхностно-активных веществ); витамин E TPGS; полиэтиленсорбитановые сложные эфиры жирных кислот (серия Tween поверхностно-активных веществ, доступных от ICI Americas Inc., город Уитмингтон, штат Дэлавер); касторовые масла полиоксиэтилена и гидрогенизированные касторовые масла, такие как Cremophor RH-40 и Cremopher EL; Liposorb P-20, доступные от Lipochem Inc., город Патерсон, штат Нью-Джерси; Capmul POE-O, доступные от Abitec Corp., город Джейнсвилл, штат Висконсин), и природные поверхностно-активные вещества, такие как таурохолевокислый натрий, 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин, лецитин и другие фосфолипиды и моно- и диглицериды.
Фармацевтическая композиция по настоящему изобретению может необязательно содержать другие эксципиенты, такие как один или несколько дезинтегрантов, разбавителей или смазочных средств. Типичные дезинтегранты могут включать кроскармеллозу натрия, крахмалгликолят натрия, кросповидон и крахмал. Типичные, способствующие скольжению средства могут включать диоксид силикона и тальк. Типичные смазочные средства могут включать стеарат магния, стеариновую кислоту и стеарилфумарат натрия. Типичные разбавители могут включать микрокристаллическую целлюлозу, лактозу и маннит.
Вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей полимер, повышающий концентрацию, и 4-40% суворексанта или его фармацевтически приемлемую соль. Вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей полимер, повышающий концентрацию, и 6-20% суворексанта или его фармацевтически приемлемую соль. Вариант осуществления настоящего изобретения относится к фармацевтической композиции, содержащей полимер, повышающий концентрацию, и 8-15% суворексанта или его фармацевтически приемлемую соль. В одном из вариантов осуществления настоящего изобретения составы коповидона с суворексантом и необязательно поверхностно-активным веществом могут содержать 4%-40% суворексанта и 0-10% поверхностно-активного вещества, где недостающий объем состава представлен коповидоном. В одном из вариантов осуществления настоящего изобретения составы Kollidon VA64 с суворексантом и необязательно поверхностно-активным веществом могут содержать 4%-40% суворексанта и 0-10% поверхностно-активного вещества, где недостающий объем состава представлен Kollidon VA64. В одном из вариантов осуществления настоящего изобретения составы Plasdone S630 с суворексантом и необязательно поверхностно-активным веществом могут содержать 4%-40% суворексанта и 0-10% поверхностно-активного вещества, где недостающий объем состава представлен Plasdone S630. В одном из вариантов осуществления настоящего изобретения составы Soluplus с суворексантом и необязательно поверхностно-активным веществом могут содержать 4%-40% суворексанта и 0-10% поверхностно-активного вещества, где недостающий объем состава представлен Soluplus. В одном из вариантов осуществления настоящего изобретения составы HPMCAS с суворексантом и необязательно поверхностно-активным веществом могут содержать 4%-40% суворексанта и 0-10% поверхностно-активного вещества, где недостающий объем состава представлен HPMCAS.
Фармацевтические композиции по настоящему изобретению получают посредством процессов, являющихся подходящими для образования соединением (лекарственным средством) дисперсии (также обозначаемой как аморфная дисперсия) в полимере таким образом, что лекарственное средство, как правило, является аморфным или растворяется в полимере или компоненте композиции, таком как поверхностно-активное вещество. Дисперсии являются стабильными, и лекарственное средство не образует кристаллы или другие нерастворимые частицы. Такие способы включают способы растворения, такие как сушка распылением, покрытие распылением, лиофилизация и испарение сорастворителя в вакууме или посредством нагрева раствора полимера и лекарственного средства. Такие способы также включают способы, которые смешивают твердое лекарственное средство с полимером в расплавленном состоянии, такие как экструзия горячего расплава, и способы смешивания твердого нерасплавленного полимера и лекарственного средства при нагреве и давлении для образования дисперсии.
Другой аспект настоящего изобретения относится к способу получения композиции, содержащей суворексант или его фармацевтически приемлемую соль, молекулярно диспергированный в или растворенный в полимере, повышающем концентрацию. В некоторых вариантах осуществления предпочтительным является выбор полимера, используемого в композиции по изобретению, из тех полимеров, повышающих концентрацию, которые обеспечивают следующие свойства: (i) суворексант растворим в полимере; (ii) суворексант образует раствор или дисперсию, который ведет себя как эвтектическая смесь с температурой плавления ниже температуры плавления суворексанта; (iii) при смешивании суворексанта с выбранным(и) полимером(ами) и его нагреве он проявляет себя как флюсующее вещество для способствования плавлению полимера и способствования растворению суворексанта в полимере. В некоторых вариантах осуществления способ получения композиции по изобретению содержит: (i) образование смеси суворексанта и выбранного полимера; (ii) образование расплавленной дисперсии посредством нагревания смеси с температурой выше приблизительно 60°C и ниже приблизительно 200°C, при необязательном перемешивании расплавленной дисперсии; (iii) охлаждение дисперсии, полученной на стадии (ii) для образования твердого вещества; и (iv) необязательно образование массы, имеющей определенную форму, из дисперсии либо до, либо одновременно со стадией охлаждения (iii).
Процессы для получения фармацевтических композиций суворексанта полимером, повышающим концентрацию, включают (a) экструзию горячего расплава и (b) сушку распылением. В одном из вариантов осуществления настоящего изобретения полимерами для применения в этих процессах являются поливинилпирролидинон, сополимеры поливинилпирролидинон-поливинилацетата (например, коповидон), HPC, HPMCAS, HPMC, HPMCP, CAP и CAT. В одном из вариантов осуществления настоящего изобретения полимерами для применения в экструзии горячего расплава являются поливинилпирролидинон и сополимеры поливинилпирролидинон-поливинилацетата (коповидон, такой как Kollidon VA64 или Plasdone S630). В одном из вариантов осуществления настоящего изобретения полимером для применения в экструзии горячего расплава является коповидон. В одном из вариантов осуществления настоящего изобретения полимером для применения в экструзии горячего расплава является Kollidon VA64. В одном из вариантов осуществления настоящего изобретения полимером для применения в экструзии горячего расплава является Plasdone S630. В одном из вариантов осуществления настоящего изобретения полимером для применения в экструзии горячего расплава является Soluplus. В одном из вариантов осуществления настоящего изобретения полимеры для сушки распылением включают HPC, HPMCAS, HPMC, HPMCP, CAP и CAT. В одном из вариантов осуществления настоящего изобретения полимером для сушки распылением является HPMCAS.
Оба этих процесса хорошо известны в данной области. При сушке распылением полимер, активное соединение и необязательно другие ингредиенты, такие как поверхностно-активные вещества, растворяют в растворителе и затем распыляют через сопло в виде тонкой струи в камеру, где растворитель быстро испаряется с получением тонкодисперсных частиц, содержащих полимер, лекарственное средство и необязательно другие ингредиенты. Растворитель является любым растворителем, в котором все из компонентов композиции являются растворимыми и легко испаряются в распылительной сушилке. Также возможно применение растворителя в получении фармацевтических композиций. Иллюстративными растворителями являются ацетон, метанол и этанол. Метанол и ацетон являются предпочтительными. При экструзии горячего расплава полимер, лекарственное средство и необязательно поверхностно-активные вещества смешивают в процессе влажного гранулирования или другом процессе смешивания, а затем смесь полимера, лекарственного средства и поверхностно-активного вещества закладывают в камеру экструдера, предпочтительно двухшнекового экструдера, для получения лучшего смешивания, и затем тщательно расплавляют и смешивают с образованием аморфной дисперсии. В одном из вариантов осуществления настоящего изобретения может применяться химическое или физическое вспенивание аморфной дисперсии. Аморфная дисперсия, которую подвергли вспениванию, может обладать улучшенными характеристиками измельчения и обеспечивать более быстрое растворение на увеличенной площади поверхности.
В соответствии с настоящим изобретением расплав можно получать на подходящем устройстве, в котором смесь суворексанта и полимера можно нагревать и необязательно перемешивать. Отвердевание можно проводить только охлаждением расплава любыми подходящими способами и в любом подходящем контейнере. После получения твердого вещества его можно дополнительно механически обработать для обеспечения подходящей формы для включения в состав лекарственного средства, например, таблетки или капсулы.
Следует понимать, что другие способы получения расплава, его затвердевание и образование частиц подходящего размера из твердого вещества можно применять без отступления от объема изобретения. Например, подходящим способом композиции по изобретению можно получать с использованием экструдера. При использовании экструдера для получения композиций по изобретению подходящим способом материал можно вносить в экструдер или в состоянии до офлюсования, которое представляет сухую смесь, или в офлюсованном состоянии, которое представляет расплавленное, пластичное или полутвердое состояние, достигаемое после применения нагревания смеси в достаточной мере для растворения суворексанта в полимере, необязательно при получении офлюсованной шихты можно применять смешивание во время нагревания для содействия достижению однородности офлюсованного материала.
При подаче материала в экструдер в офлюсованном состоянии выбирают такую продолжительность обработки в экструдере, которая достаточна для обеспечения гомогенности композиции, и температуру предпочтительно поддерживать в экструдере на таком уровне, который достаточен для обеспечения сохранения пластичности материала для экструдивания его подходящим способом с получением формованного экструдата. При внесении материала в экструдер в состоянии до офлюсования составные части экструдера, например, цилиндры и любая смесительная камера, присутствие в оборудовании, будут поддерживаться при температуре, достаточной для содействия достижению офлюсования смеси. При выборе температуры для применения при обработке композиции также будет учитываться то, что смешивание, возникающее внутри экструзионного оборудования, например, в цилиндрах смесительной камеры, также способствует локализованному офлюсованию смеси посредством передачи сдвигового напряжения, индуцирующего нагревание в смеси. Дополнительно следует понимать, температура оборудования и продолжительность обработки будут выбраны для сведения к минимуму количества времени нахождения смеси в экструдере в условиях нагревания и/или сдвигового напряжения, чтобы свести к минимуму количество суворексанта, разложившегося во время образования композиции, как указано выше. Как правило, экструзионные процессы, при которых применяется нагревание экструдированного материала, называются «процессами горячего расплава/экструзии». При получении композиций по настоящему изобретению с использованием экструзионного оборудования получаемый, таким образом, экструдат может быть любой подходящей формы, например, лентовидной, цилиндрической, решетчатой и т. п. При желании экструдат можно подвергнуть дополнительной обработке, например, с помощью измельчения композиции в форме частиц.
В альтернативном варианте осуществления настоящее изобретение относится к аморфной форме соединения суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к изолированной аморфной форме соединения суворексанта. В одном из вариантов осуществления настоящего изобретения фармацевтическую композицию суворексанта и полимера, повышающего концентрацию, получают в соответствии с любым известным процессом, приводящим к присутствию, по меньшей мере, большой части суворексанта в аморфном состоянии относительно других морфологических форм суворексанта. Эти процессы включают механические процессы, такие как измельчение и экструзия; процессы плавления, такие как высокотемпературное сплавление, экструзия горячего расплава, модифицированное растворителем расплавление и процессы затвердевания расплава; и процессы с применением растворителя, включая процессы осаждения нерастворителем, покрытие распылением и сушка распылением. Хотя дисперсии по настоящему изобретению можно получить с помощью любых из этих процессов, в одном из вариантов осуществления изобретения суворексант в фармацевтической композиции является по существу аморфным и по существу равномерно распределен на всем протяжении полимера.
В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 40% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 50% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 60% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 70% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 80% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 90% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 95% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 98% масс. аморфной формы относительно других морфологических форм суворексанта. В альтернативном варианте осуществления настоящее изобретение относится к суворексанту в форме, содержащей, по меньшей мере, приблизительно 99% масс. аморфной формы относительно других морфологических форм суворексанта. Относительное количество кристаллического и аморфного суворексанта можно определять с помощью нескольких аналитических способов, включая дифференциальную сканирующую калориметрию (DSC), порошковую рентгеновскую дифракцию (XRPD) и рамановскую спектроскопию.
Аморфную форму соединения суворексанта получали посредством растворения образца суворексанта в ацетоне с последующим удалением ацетона. В частности, аморфную форму соединения суворексанта получали посредством растворения образца суворексанта в ацетоне, нагревания раствора до 60°C с последующим удалением ацетона на роторном испарителе. Полученное в результате твердое вещество сушили в течение ночи в вакуумном сушильном шкафу при 40°C для удаления любых остатков растворителя. Термограмма и дифрактограмма полученного в результате материала указали на то, что он является аморфным.
Вариант осуществления настоящего изобретения относится к процессу получения аморфной формы соединения суворексанта, который содержит растворение образца суворексанта в ацетоне с последующим удалением ацетона.
Аморфная форма соединения суворексанта может иметь преимущества относительно других морфологических форм суворексанта, такие как лучшая растворимость и/или более высокая скорость растворения, чем у кристаллических форм соединения, что может повышать биодоступность соединения, может способствовать более быстрому началу терапевтического действия, может снижать изменчивость терапевтического ответа среди индивидуумов и может уменьшать любое влияние приема пищи.
Исследования с помощью порошковой рентгеновской дифракции широко используются для характеризации молекулярных структур, степени кристалличности и полиморфизма. Порошковую рентгеновскую дифрактограмму получали на рентгенодифракционной системе Philips Analytical X'Pert PRO с консолью PW3040/60. В качестве источника была использована керамическая рентгеновская трубка Сu LEF с К-альфа излучением PW3373/00.
Данные ДСК получали с использованием TA Instruments DSC 2910 или аналогичных контрольно-измерительных приборов. Образец массой от 2 до 6 мг взвешивали на лотке и лоток загибали. Этот лоток помещали в положение образца в калоритмической ячейке. Пустую чашку весов помещали в исходное положение. Калоритмическую ячейку закрывали и поток азота проходил через ячейку. Программу нагрева устанавливали для нагревания образца при скорости нагревания 10°C/мин до температуры приблизительно 200°C. После завершения испытания данные анализировали с использованием аналитической программы ДСК в системном программном обеспечении. Наблюдаемые эндотермы интегрировали между показателями исходной температуры, которые были выше и ниже температурного диапазона, в пределах которого наблюдают эндотерму. В отчете представлены данные начальной температуры, пиковой температуры и энтальпии.
Рамановская спектроскопия широко применяется для определения композиции и морфологического характера исследуемых образцов. Фурье-Раман спектры (Фурье-спектры рамановского рассеяния) собирали в диапазоне 50-4000 см-1 с помощью системы Bruker IFS 66v/S вместе с приставкой рамановского раcсеяния FRA106/S. Сигнал усредняли в течение 5-10 минут при разрешении 4 см-1 и мощности лазера 300-500 мВт. Образцы подносили к лазеру с использованием вращающейся платформы, которую вращали во время измерения для обеспечения образцов большого объема.
На фиг. 1 показана порошковая рентгеновская дифрактограмма состава суворексанта, полученного экструзией горячего расплава. Порошковая рентгеновская дифрактограмма указывает на отсутствие четких отражений указывает на отсутствие кристалличности.
На фиг. 2 показана термограмма модулированной дифференциальной сканирующей калориметрии состава суворексанта, полученного экструзией горячего расплава. Как отмечено на термограмме, в составах при экструзии горячего расплава соединение суворексанта присутствует в аморфной форме, характеризующейся единой температурой перехода. На этом образце показана единая температура перехода, составляющая приблизительно 99°C.
На фиг. 3 показана спектрограмма рамановского рассеяния экструдата горячего расплава суворексанта. Как отмечено на спектрограмме, экструдат горячего расплава суворексанта в аморфной форме характеризуется пиком рамановского рассеяния 1614 см-1. Экструдат горячего расплава суворексанта в аморфной форме также характеризуется пиком рамановского рассеяния 1590 см-1. Возможен также вариант, когда экструдат горячего расплава суворексанта в аморфной форме характеризуется пиком рамановского рассеяния 1571 см-1.
На фиг. 4 показана спектрограмма рамановского рассеяния таблетированной лекарственной формы, содержащей экструдат горячего расплава суворексанта. Как отмечено на спектрограмме, таблетированная лекарственная форма, содержащая экструдат горячего расплава суворексанта в аморфной форме, характеризуется пиком рамановского рассеяния 1614 см-1. Таблетированная лекарственная форма, содержащая экструдат горячего расплава суворексанта в аморфной форме, также характеризуется пиком рамановского рассеяния 1590 см-1. Возможен также вариант, когда таблетированная лекарственная форма, содержащая экструдат горячего расплава суворексанта в аморфной форме, характеризуется пиком рамановского рассеяния 1571 см-1. Как альтернативный вариант, таблетированная лекарственная форма, содержащая экструдат горячего расплава суворексанта в аморфной форме, характеризуется пиками рамановского рассеяния 1614 см-1, 1590 см-1 и 1571 см-1.
На фиг. 5 показана спектрограмма рамановского рассеяния экструдата горячего расплава суворексанта с наложенной спектрограммой рамановского рассеяния таблетированной лекарственной формы, содержащей экструдат горячего расплава суворексанта, а также с наложенной спектрограммой рамановского рассеяния отдельных эксципиентов в такой таблетированной лекарственной форме, содержащей экструдат горячего расплава суворексанта.
В описании суворексант обладает активностью антагонизации рецептора орексин-1 (OX1) человека, где Ki составляет 0,55 нМ и антагонизации рецептора орексин-2 (OX2) человека с Ki составляет 0,35 нМ. Относительно стандартных фармацевтических составов суворексанта настоящее изобретение может иметь преимущества, такие как обеспечение лучшей растворимости суворексанта и/или более высокой скорости растворения, чем у стандартных составов соединения, что может повышать биодоступность соединения, может способствовать более быстрому началу терапевтического действия, может снижать изменчивость терапевтического ответа среди индивидуумов и может уменьшать любое влияние приема пищи.
Композиции, содержащие полимер, повышающий концентрацию, повышают концентрацию суворексанта в водной среде, такой как вода, сок желудочно-кишечного тракта или имитация желудочно-кишечного сока, полученного для in vitro лабораторных тестов относительно контрольной композиции, содержащей эквивалентное количество суворексанта без полимера. После введения композиции в водную среду композиция, содержащая полимер, повышающий концентрацию, и суворексант, обеспечивает более высокую максимальную водную концентрацию суворексанта относительно контрольной композиции с той же концентрацией суворексанта, но без полимера, повышающего концентрацию. Инертный наполнитель можно использовать вместо полимера с целью контроля поддержания одной и той же концентрации суворексанта, как в композиции, содержащей полимер. В одном из вариантов осуществления настоящего изобретения полимер повышает максимальную концентрацию суворексанта в водном растворе, по меньшей мере, на 25%. В одном из вариантов осуществления настоящего изобретения полимер повышает максимальную концентрацию суворексанта в водном растворе, по меньшей мере, на 50%. В одном из вариантов осуществления настоящего изобретения полимер повышает максимальную концентрацию суворексанта в водном растворе, по меньшей мере, в два раза относительно контрольной композиции. В одном из вариантов осуществления настоящего изобретения полимер повышает максимальную концентрацию суворексанта в водном растворе, по меньшей мере, в 5 раз по сравнению с контрольной композиции. В одном из вариантов осуществления настоящего изобретения повышение полимером максимальной концентрации суворексанта в водном растворе является, по меньшей мере, 10-кратным. Такое значительное повышение концентрации может потребоваться с целью достижения суворексантом эффективного уровня в крови посредством перорального введения дозы. Такие водные растворы, как правило, являются пересыщенными растворами в отношении суворексанта.
В in vivo фармакокинетических измерениях, в которых концентрацию суворексанта измеряют как функцию времени в крови или сыворотке после введения состава подопытному животному, композиции по настоящему изобретению показывают область под кривой зависимости концентрации от времени (AUC) и максимальную концентрацию Cmax, которая выше, чем у контрольной композиции, содержащей эквивалентное количество соединения без полимера, повышающего концентрацию. В одном из вариантов осуществления настоящего изобретения область под кривой зависимости концентрации от времени (AUC) является, по меньшей мере, на 25% больше, чем у контрольной композиции. В одном из вариантов осуществления настоящего изобретения AUC является, по меньшей мере, на 50% больше, чем у контрольной композиции, содержащей такое же количество лекарственного средства, но без полимера. В одном из вариантов осуществления настоящего изобретения область под AUC увеличена, по меньшей мере, в два раза по сравнению с контрольной композицией, содержащей такое же количество лекарственного средства, но без полимера. В одном из вариантов осуществления настоящего изобретения область под AUC увеличена, по меньшей мере, в 5 раз по сравнению с контрольной композицией, содержащей такое же количество лекарственного средства, но без полимера. В одном из вариантов осуществления настоящего изобретения увеличение области под AUC является, по меньшей мере, 10-кратным по сравнению с контрольной композицией, содержащей такое же количество лекарственного средства, но без полимера. В одном из вариантов осуществления настоящего изобретения увеличение области под AUC является, по меньшей мере, 15-кратным по сравнению с контрольной композицией, содержащей такое же количество лекарственного средства, но без полимера. В одном из вариантов осуществления настоящего изобретения увеличение области под AUC является, по меньшей мере, 20-кратным по сравнению с контрольной композицией, содержащей такое же количество лекарственного средства, но без полимера.
В одном из вариантов осуществления настоящего изобретения Cmax повышается, по меньшей мере, на 25% относительно контрольной композиции без полимера, повышающего концентрацию, после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения Cmax повышается, по меньшей мере, на 50% относительно контрольной композиции без полимера, повышающего концентрацию, после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является, по меньшей мере, двукратным относительно контрольной композиции без полимера после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является, по меньшей мере, 5-кратным относительно контрольной композиции без полимера после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является также, по меньшей мере, 10-кратным по сравнению с концентрацией лекарственного средства контрольной композиции без полимера после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является также, по меньшей мере, 20-кратным по сравнению с концентрацией лекарственного средства контрольной композиции без полимера после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является также, по меньшей мере, 30-кратным по сравнению с концентрацией лекарственного средства контрольной композиции без полимера после ее введения подопытному животному или пациенту. В одном из вариантов осуществления настоящего изобретения повышение Cmax является также, по меньшей мере, 40-кратным по сравнению с концентрацией лекарственного средства контрольной композиции без полимера после ее введения подопытному животному или пациенту.
Фармацевтические композиции по настоящему изобретению показывают повышенную in vivo биодоступность по сравнению с составами без полимера, повышающего концентрацию. Соединение суворексанта абсорбируется быстрее после перорального введения этих составов. AUC лекарственного средства и максимальная концентрация лекарственного средства в крови или сыворотке повышаются при введении составов пациенту.
В in vivo фармакокинетических измерениях, в которых концентрацию суворексанта измеряют как функцию времени в крови или сыворотке после введения состава подопытному животному или человеку-пациенту при совместном введении с пищей (такой как пища с высоким содержанием жиров), композиции по настоящему изобретению, в которых использован полимер, повышающий концентрацию, являющийся нечувствительным к pH полимером, могут показывать время до пиковой концентрации (Tmax), которое меньше, чем композиции, содержащей эквивалентное количество соединения с использованием полимера, повышающего концентрацию, не являющегося нечувствительным к pH полимером. Соответственно, применение полимера, повышающего концентрацию, являющегося нечувствительным к pH полимером, может способствовать уменьшению влияния приема пищи, которая иначе задерживает Tmax при введении состава суворексанта с пищей (такой как пища с высоким содержанием жиров).
Пероральное введение фармацевтической композиции по настоящему изобретению удивительным образом снижает влияние приема пищи, то есть пероральное введение состава, содержащего композицию по изобретению, обеспечивает, по существу, такое же воздействие суворексанта и меньшую изменчивость биодоступности среди круга пациентов независимо от введения состава с пищей или при воздержании от пищи. Кроме того, при сравнении результатов перорального введения состава, содержащего композицию по изобретению, с теми, которые получены после введения эквивалентного количества суворексанта в форме общепринятого состава, или с приемом пищи или при воздержании от приема пищи, композиция по изобретению приводит к повышенной биодоступности с более низким уровнем изменчивости биодоступности среди круга индивидуумов и более высоким уровнем воздействия (AUC) у здоровых добровольцев, которым его вводят. Кроме того, считается, что схожие результаты достигаются у пациентов, которым вводят состав, содержащий композицию по изобретению.
Термин «фармацевтически приемлемые соли» относится к солям, полученным от фармацевтически приемлемых нетоксических оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли, полученные от неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и т. п. Конкретные варианты осуществления включают соли аммония, кальция, магния, калия и натрия. Соли в твердой форме могут существовать в более чем одной кристаллической структуре и могут также быть в форме гидратов. Соли, полученные из фармацевтически приемлемых органических нетоксических оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилен-диамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т. п. Когда соединение, используемое в настоящем изобретении, является основным, соли можно получать из фармацевтически приемлемых нетоксических кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и т.п. Конкретные варианты осуществления включают лимонную, бромистоводородную, соляную, малеиновую, фосфорную, серную, фумаровую и винную кислоты. Следует понимать, что в рамках изобретения ссылки на суворексант означают также включение фармацевтически приемлемых солей.
Примером осуществления изобретения является применение составов, описанных в примерах и в настоящем документе. Суворексант или его фармацевтически приемлемая соль пригодны в способе вызывания антагонизма активности орексинового рецептора у пациента, такого как млекопитающее, нуждающееся в таком ингибировании, содержащем введение эффективного количества соединения. Настоящее изобретение относится к применению составов суворексанта или его фармацевтически приемлемой соли как антагонистов активности орексинового рецептора. В дополнение к приматам, в особенности людям, возможно лечение различных других млекопитающих в соответствии со способом по настоящему изобретению.
Индивидуумом, которому проводится лечение по настоящим способам, как правило, является млекопитающее, такое как человек, мужского или женского пола. Термин «терапевтически эффективное количество» означает количество соединения для индивидуума, которое вызовет биологический или лекарственный ответ ткани, системы, животного или человека, которого добивается научный работник, ветеринар, врач или другой клиницист. Установлено, что специалист в данной области может воздействовать на неврологические и психические расстройства посредством лечения пациента, в настоящее время страдающего расстройствами, или посредством профилактического лечения пациент, страдающего расстройствами, эффективным количеством соединения по настоящему изобретению. В рамках изобретения термины «лечение» и «лечения» относятся ко всем процессам, в которых может происходить замедление, прерывание, торможение, контролирование или прекращение прогрессирования неврологических и психических расстройств, описываемых в настоящем документе, но необязательно указывает на полное устранение всех симптомов расстройства, а также профилактическая терапия упомянутых состояний, в особенности у пациента, имеющего предрасположенность к такому заболеванию или расстройству. Следует понимать, что термины «введение» и/или «введения» соединения означают обеспечение соединения по изобретению или пролекарственного средства соединения по изобретению нуждающемуся в этом индивидууму.
Подразумевается, что термин «композиция» в рамках изобретения включает продукт, содержащий точно определенные ингредиенты в точно определенных количествах, а также любой продукт, который получают в результате, прямо или косвенно, из комбинации точно определенных ингредиентов в точно определенных количествах. Подразумевается, что такой термин по отношению к фармацевтической композиции включает продукт, содержащий активный(ые) ингредиент(ы) и инертный(ые) ингредиент(ы), которые составляют носитель, а также любой продукт, который получают в результате, прямо или косвенно, из комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или из диссоциации одного или нескольких ингредиентов, или из других типов реакций или взаимодействий одного или нескольких ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению включают любую композицию, полученную посредством смешивания соединения по настоящему изобретению и фармацевтически приемлемого носителя. Под «фармацевтически приемлемым» подразумевают, что носитель, разбавитель или эксципиент должен быть совместим с другими ингредиентами состава и не оказывать неблагоприятное воздействие на их реципиент.
В научной литературе затронуты орексиновые рецепторы в широком спектре биологических функций. Это дало основание сделать предположение о потенциальной роли этих рецепторов в различных патологических процессах у людей или других особей. В соответствии с настоящим изобретением составы суворексанта или его фармацевтически приемлемой соли могут быть применимы в лечении, профилактике, улучшении состояния, контроле или снижении риска возникновения неврологических и психических расстройств, связанных с орексиновыми рецепторами. В соответствии с настоящим изобретением составы суворексанта или его фармацевтически приемлемой соли могут обеспечивать способы: профилактики и лечения расстройств сна и нарушений сна; лечения бессонницы; улучшения качества сна; усиления поддержания сна; увеличение фазы сна с быстрым движением глаз; увеличение 2 фазы сна; уменьшение фрагментации режима сна; лечения бессонницы; улучшения когнитивности; повышения способности сохранения в памяти; лечения или контроля ожирения; лечения или контроля депрессии; у пациента-млекопитающего, нуждающегося в этом, содержащие введение пациенту терапевтически эффективного количества суворексанта или их фармацевтически приемлемой соли в составе по настоящему изобретению.
В соответствии с настоящим изобретением составы суворексанта или его фармацевтически приемлемой соли могут быть пригодны в способе профилактики, лечения, контроля, улучшения состояния или снижения риска возникновения заболеваний, расстройства и состояний, отмеченных в настоящем документе. Дозировка активного ингредиента в композициях по настоящему изобретению может варьироваться, однако необходимо, чтобы количество активного ингредиента было таким, которое подходит для получения лекарственной формы. Активный ингредиент можно вводить пациентам (животным и человеку) при необходимости такого лечения в дозировках, которые обеспечат оптимальную фармацевтическую эффективность. Выбранная дозировка зависит от требуемого терапевтического эффекта, от способа введения и от длительности лечения. Доза будет варьироваться от пациента к пациенту в зависимости от природы и степени тяжести заболевания, массы тела пациента, особой диеты, которую затем соблюдает пациент, сопутствующего лекарственного лечения и других факторов, которые примут во внимание специалисты в данной области. Как правило, уровни дозирования от 0,0001 до 10 мг/кг массы тела ежедневно вводят пациенту, например, людям и пожилым людям, для получения эффективного антагонизма орексиновых рецепторов. Диапазон доз обычно составит приблизительно от 0,5 мг до 1,0 г на пациента в сутки, которые можно вводить однократно или многократно. В одном из вариантов осуществления диапазон доз составит приблизительно от 0,5 мг до 500 мг на пациента в сутки, в другом варианте осуществления приблизительно от 0,5 мг до 200 мг на пациента в сутки и в еще одном варианте осуществления приблизительно от 5 мг до 50 мг на пациента в сутки.
Фармацевтические композиции по настоящему изобретению могут быть представлены в составе твердой дозированной лекарственной формы, таком как содержащий приблизительно 0,5 мг до 500 мг активного ингредиента или содержащая приблизительно 1 мг до 250 мг активного ингредиента. Фармацевтическая композиция может быть представлена в составе твердой дозированной лекарственной формы, содержащем приблизительно 1 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 40 мг, 50 мг или 100 мг активного ингредиента. В конкретных вариантах осуществления фармацевтическая композиция может быть представлена в составе твердой дозированной лекарственной формы, содержащем приблизительно 10 мг, 15 мг, 20 мг, 30 мг или 40 мг активного ингредиента. Для перорального введения композиции могут быть представлены в форме таблеток, содержащих от 1,0 до 1000 миллиграммов активного ингредиента, например, 1,5, 10, 15, 20, 25, 50, 75, 100, 150, 200, 250, 300, 400, 500, 600, 750, 800, 900 и 1000 миллиграммов активного ингредиента для симптоматической корректировки дозировки пациенту, подлежащему лечению. Соединение можно вводить по схеме лечения от 1 до 4 раз в сутки, например, один или два раза в сутки. В одном из вариантов осуществления настоящего изобретения соединение можно вводить по схеме лечения один раз в сутки в вечернее время, такое как перед сном.
Суворексант или его фармацевтически приемлемую соль, используемые в настоящем изобретении, можно использовать в комбинации с одним или несколькими другими лекарственными средствами для лечения, профилактики, контроля, улучшения состояния или снижения риска возникновения заболеваний или состояний, для которых могут быть применимы соединения по настоящему изобретению или другие лекарственные средства, где совместная комбинация лекарственных средств более безопасна или более эффективна, чем лекарственное средство по отдельности. Такое(ие) лекарственное(ие) средство(а) можно вводить, путем и в количестве, широко используемых для этого, одновременно или последовательно с соединением по настоящему изобретению. При использовании соединения по настоящему изобретению одновременно с одним или несколькими другими лекарственными средствами предполагается фармацевтическая композиция в стандартной лекарственной форме, содержащей такие другие лекарственные средства и соединение по настоящему изобретению. Однако комбинированное лечение может также включать лечение, в котором соединение по настоящему изобретению и одно или несколько других лекарственных средств вводят в различных перекрывающих друг друга режимах. Также предусмотрено, что при использовании в комбинации с одним или нескольким другими активными ингредиентами соединения по настоящему изобретению и другие активные ингредиенты можно использовать в пониженных дозировках, чем при использовании по отдельности. Таким образом, фармацевтические композиции по настоящему изобретению включают такие, которые содержат один или несколько других активных ингредиентов в дополнение к соединению по настоящему изобретению. Вышеуказанные комбинации включают комбинации соединения по настоящему изобретению не только с одним другим активным соединением, но также с двумя или более другими активными соединениями.
Аналогично суворексант или его фармацевтически приемлемую соль, используемые в настоящем изобретении, можно использовать в комбинации с другими лекарственными средствами, которые используют для профилактики, лечения, контроля, улучшения состояния или снижения риска возникновения заболеваний или состояний, для которых пригодны соединения по настоящему изобретению. Такие другие лекарственные средства можно вводить, путем и в количестве, широко используемом для этого, одновременно или последовательно с соединением по настоящему изобретению. При использовании суворексанта или его фармацевтически приемлемой соли одновременно с одним или несколькими другими лекарственными средствами предполагается фармацевтическая композиция, содержащая такие другие лекарственные средства в дополнение к соединению по настоящему изобретению. Такие фармацевтические композиции получают без излишнего экспериментирования согласно способам, описываемым в настоящем документе и известным в данной области. Таким образом, фармацевтические композиции по настоящему изобретению включают такие, которые также содержат один или несколько других активных ингредиентов в дополнение к соединению по настоящему изобретению.
Массовое отношение суворексанта или его фармацевтически приемлемой соли ко второму активному ингредиенту может варьироваться и будет зависеть от эффективной дозы каждого ингредиента. Как правило, будет использоваться эффективная доза каждого. Таким образом, например, при комбинации соединения по настоящему изобретению с другим агентом, массовое отношение соединения по настоящему изобретению к другому агенту обычно будет варьироваться приблизительно от 1000:1 до приблизительно 1:1000, такому как приблизительно 200:1 до приблизительно 1:200. Комбинации соединения по настоящему изобретению с другими активными ингредиентами будут также находиться в рамках указанного выше диапазона, но в каждом случае должна использоваться эффективная доза каждого активного ингредиента. В таких комбинациях соединение по настоящему изобретению и другие активные агенты можно вводить раздельно или совместно. Кроме того, введение одного элемента может предшествовать, происходить одновременно или следовать за введением другого(их) агента(ов).
Фармацевтические композиции по настоящему изобретению могут быть подходящим способом представлены в стандартной лекарственной форме, и их можно получать любым из способов, хорошо известных в данной области фармакологии. Все способы включают стадию приведения активного ингредиента с носителем, который составляет один или несколько сопутствующих ингредиентов. Как правило, фармацевтические композиции получают посредством равномерного и тщательного приведения активного ингредиента в комбинацию с жидким носителем или высокодисперсным твердым носителем или и тем, и другим, а затем, при необходимости, формование продукта в необходимую лекарственную форму. В фармацевтической композиции соединение активного начала включают в количестве, достаточном для произведения желаемого действия на течение или состояние заболеваний. В рамках изобретения подразумевается, что термин «композиция» включает продукт, содержащий точно определенные ингредиенты в точно определенных количествах, а также любой продукт, который получают в результате, прямо или косвенно, из комбинации точно определенных ингредиентов в точно определенных количествах.
Фармацевтические композиции, предназначенные для перорального применения, можно получать согласно способам, описываемым в настоящем документе, и другому способу, известному в области техники для получения фармацевтических композиций. Такие композиции могут также содержать одно или несколько веществ, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов с целью обеспечения фармацевтически изящных и приятных на вкус препаратов. Таблетки могут содержать активный ингредиент в смеси с нетоксическими фармацевтически приемлемыми эксципиентами, которые являются подходящими для получения таблеток. Этими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновая кислота; связывающие средства, например, крахмал, желатин или гуммиарабик, и смазки, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть не покрыты или они могут быть покрыты известными способами для замедления растворения и абсорбции в желудочно-кишечном тракте и, следовательно, обеспечения длительного действия в течение более долгого периода времени. Композиции для перорального применения могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешивают с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешивают с водой или масляной средой, например, арахисовым маслом, парафиновым маслом или оливковым маслом. Водные суспензии содержат активные материалы в смеси с эксципиентами, подходящими для получения водных суспензий. Диспергируемые порошки и гранулы, подходящие для получения водной суспензии посредством добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим агентом или смачивающим средством, суспендирующим средством и одним или несколькими консервантами.
Несколько способов получения фармацевтических составов по настоящему изобретению проиллюстрировано в следующих примерах. В некоторых случаях порядок проведения указанных выше примеров может варьироваться с целью способствования эффективности процесса или желаемых свойств состава. Следующие примеры представлены с целью по возможности более полного понимания изобретения. Эти примеры носят исключительно иллюстративный характер, и их не следует рассматривать в качестве какого-либо ограничения изобретения.
ПРИМЕРЫ
Ниже представлены примеры получения фармацевтических составов. Биодоступность определяют in vivo посредством дозирования экспериментальных составов и/или других составов суворексанта собакам породы бигль при дозировке 5 мг/кг суворексанта, а затем измерения количества суворексант в сыворотке или крови как функции времени. Сравнение проводят с другими составами, содержащими такое же количество и такую же концентрацию суворексанта, такими как твердый состав с общепринятыми эксципиентами. Растворение составов в воде или имитации желудочного сока можно наблюдать и измерять для определения концентрации и скорости растворения суворексанта в жидкости с использованием составов по настоящему изобретению или других составов, включая составы с общепринятыми эксципиентами в качестве контрольных для определения улучшения растворимости с использованием составов по настоящему изобретению.
Пример 1
Получение составов посредством сушки распылением
Состав 1
Высушенные распылением составы содержали: суворексант (10-20% масс./масс.); необязательно поверхностно-активное вещество, такое как (1) 2-4% SDS (додецилсульфат натрия), (2) 2,5% витамин E TPGS, (3) 2% Tween 80, (4) 2% Span 80 или (5) 2% Cremophor EL, или смесь двух или более этих поверхностно-активных веществ; и недостающий объем состава представлен либо HPMCAS-L, HPMCAS-M, либо HPMCAS-H (приобретенным как AQOAT от Shin Etsu). Компоненты растворяли или суспендировали в системе растворителей, таких как ацетон, метанол и смеси органических растворителей с водой (0,5-18%) масс./об. твердых веществ), а затем сушили распылением, как описано ниже.
Получение раствора
Суворексант, необязательно поверхностно-активное вещество или поверхностно-активные вещества, и полимер смешивали с ацетоном, метанолом или смесями органических растворителей с водой следующим образом, с выходом раствора (который может быть структурированной суспензией). Лекарственное средство, поверхностно-активное вещество и полимер растворяли в растворителе. Полимер медленно растворяли и добавляли к растворителю в течение длительного периода времени с интенсивным перемешиванием, таким как с использованием мешалки или магнитной мешалки и пластины для смешивания. Полученный в результате раствор/суспензию перемешивали в течение, по меньшей мере, дополнительных 60 минут перед сушкой распылением.
Процесс сушки распылением 1
Сушку распылением проводили в распылительной сушилке Niro SD Micro. Подогретый сухой азот и раствор состава вносили одновременно в двухлоточную форсунку, а затем разряжали в виде спрея в сушильной камере вместе с дополнительным подогретым газом, что привело к быстрому испарению с образованием частиц. Высушенные частицы переносили рабочим газом в циклон, а затем в камеру рукавного фильтра для сбора. Проводили регулирование и наблюдение за тремя скоростями процесса: 1) скоростью подачи раствора, 2) скоростью потока рабочего азота и 3) скоростью потока распыляющего азота. Скорость подачи раствора контролировали с помощью внешнего перистальтического насоса, и она составляет -5-20 мл/мин в лабораторном масштабе. Скорость распыляющего азота и скорость рабочего азота составляли 2-3 кг/час для распыляющего азота и 20-30 кг/час для рабочего азота. Намеченная температура рабочего газа на выходе из сушильной камеры была несколько ниже температуры кипения системы растворителей, хотя показанные температуры в диапазоне 30 до 70°C соответствовали требованиям, и температуру во всасывающей камере (на выходе из форсунки) корректировали для получения необходимой температуры на выходе. Заданная температура на входе обычно составляла 80-90°C. Уровень оставшегося растворителя в продукте, как правило, был ниже (<1% масс./масс.).
Процесс сушки распылением 2 аналогичен процессу 1, за исключением того, что сушку распылением проводили в расширенной камерной распылительной сушилке Niro PSD-1, оборудованной двухлоточной форсункой с отверстием 1 мм. Проводили регулирование и наблюдение за следующими условиями: скоростью подачи состава раствора (2-7,6 кг/час), скоростью потока рабочего газа (35-38 мм H2O), отношением распыления (соотношение скорости потока распыляющего газа к скорости подачи) (0,9-2,8), давлением распыления (0,25-1,5 бар), температурой газа на выходе (43-70°C) и температурой газа на входе (61-134°C).
Обработка после сушки распылением
При обработке более мелкого масштаба сбор материала осуществлялся в двух областях, циклоне и камерах рукавного фильтра. Типичный средний размер частиц в результате процесса 1 сушки распылением варьировался от 1 до 30 мкм, с измерением отдельных частиц от <1 мкм до >100 мкм, согласно отобранных образцам из циклонного сборочного участка. Большинство частиц в рукавном фильтре были 1 мкм или менее, хотя частицы были в высокой степени агломерированными. В условиях процесса 2 сушки частицы собирали только из циклонной сборочной камеры, и типичный средний размер частиц был намного крупнее, как правило, от 5 до 70 мкм.
Из высушенных распылением частиц получали гранулы следующим образом. Частицы смешивали в подходящем смесителе (V или Bohle) с микрокристаллической целлюлозой, такой как авицел (наполнитель), лактоза (наполнитель), кроскармеллоза натрия (дезинтегрант), коллоидный диоксид кремния (способствующее скольжению средство) и стеарат магния (смазочное средство). Затем смешанные порошки уплотняли катком в гранулы, подвергли дополнительной смазке и поместили в капсулы.
Состав, полученный, как описано выше, содержащий 10% (масс./масс.) суворексанта, 40% HPMCAS-LF, 42,5% моногидрата лактозы, 6% кроскармеллозы натрия, 0,5% коллоидного диоксида кремния и 1% стеарата магния переносили в капсулы, при этом каждая капсула содержала 50 мг суворексанта. Фармакокинетический профиль этой композиции тестировали в группе из 3 собак породы бигль, воздерживавшихся от приема пищи, с помощью введения однократной дозы 1 мг/кг. Фармакокинетические измерения суворексанта в крови в течение 24-часового периода указаны ниже: AUCo-24 составляет 52,3±19,1 мкM×час; Cmax составляет 6,95±2,23 мкM и Tmax составляет 1,0 час с диапазоном 1,0-2,0 часа.
Для сравнения состав, содержащий суворексант без полимера или процесса сушки распылением, получали и тестировали следующим образом. Состав без полимера содержал 25% суворексанта, 3% кроскармеллозы натрия, 1% стеарата магния, 35,5% микрокристаллической целлюлозы и 35,5% лактозы, и его получали посредством уплотнения катком и спрессования в таблетки. Фармакокинетический профиль этой композиции измеряли введением однократной дозы 5 мг/кг группе из 3 собак породы бигль, воздерживавшихся от приема пищи, а затем измерения количества суворексанта в крови собак в течение периода, составившего, по меньшей мере, 24 часа. Фармакокинетические данные указаны ниже: AUC0-24 составляет 3,04±1,40 мкМ×час, Cmax составляет 0,34±0,10 мкМ и Tmax составляет 2,0 час с диапазоном 1,0-2,0 часа. Фармакокинетика для «общепринятого» состава не была такой же, как для полимерных составов.
Пример 2
Получение составов экструзией горячего расплава
Следующие два состава получали посредством экструзии горячего расплава. Количество выражено в % по массе. KollidonVA64 является сополимером поливинилпирролидинона и поливинилацетата с соотношением с сомономером приблизительно 1,2:1. Он также известен как коповидон. Он обладает температурой стеклования (Tg) приблизительно 110°C.
(1) суворексант, 20%; Kollidon VA64, 80%.
(2) суворексант, 20%; HPMCAS-LG, 80%
Состав 1
Состав 1 получали посредством смешивания двух компонентов, а затем введения смеси в двухшнековый экструдер. Смесь получали посредством объединения полимера KollidonVA64 и суворексанта при комнатной температуре в бункерном смесителе Bohle, оборудованном 2 литровым бункером.
Смесь перед экструзией вносили в двухшнековый экструдер горячего расплава Thermo Prism 16 мм с соотношением длины к диаметру 40:1. В цилиндре экструдера было 10 температурных зон под номерами 1-10, с зоной 1 на входной стороне цилиндра и зоной 10 прямо перед мундштуком. Зону 1 не нагревали, и в ней не проводили измерение температуры. В каждой из зон 2-10 проводили контроль температуры и измеряли температуру каждой из этих зон. Температуру в мундштуке не контролировали, но ее можно измерить. Подачу осуществляли в зону 2 через питающее отверстие. Шнеки были сконструированы таким образом, чтобы смешивание проходило через зоны 4 и 5. Смешивание завершилось сразу после вентиляционного отверстия. Перед экструзией смесь подавали в загрузочное окно экструдера при приблизительно 10 г/мин из двухшнекового весового дозатора K-Tron. Скорость вращения шнеков составляла 100 об/мин. Профиль заданных температур в экструдере для зон 2-10 составлял: зоны 2-5 - 20°C; зоны 6-10 - 130°C. Истинными температурами в этих зонах были: зона 2 - 22-23°C; зона 4 - 80°C; зоны 6-10 - 180°C. В зоне 10 температура изначально была установлена на 190°C во избежание давления во время запуска, а затем заданную температуру понижали до 180°C после начала экструзии. Температура расплавленного продукта на выходе из мундштука составляла 200°C. Не отмечалось ощутимого нарастания давления в мундштуке. Экструдат был чистым и внешне гомогенным. Затем твердый экструдированный полимер перемалывали с использованием мельницы Fitz Mill с конфигурацией ножей в переднем положении, с экраном 1722-0033 при 7500 об/мин.
При альтернативной методике состав получали посредством смешивания двух компонентов, а затем подачи смеси в двухшнековый экструдер. Смесь получали посредством объединения полимера коповидона и суворексанта при комнатной температуре в бункерном смесителе. Смесь перед экструзией подавали в двухшнековый экструдер с соотношением длины к диаметру 40/1. Экструдер состоял из 12 температурных зон под номерами 1-12, с зоной 1 на входной стороне цилиндра и зоной 10 в конце секций цилиндра, где зоной 11 был адаптер для изменения режима потока к одному отверстию и зоной 12 был адаптер мундштука. В зоне 1 поддерживалась низкая температура посредством охлаждения воды. В каждой из зон 2-12 проводили контроль температуры и измеряли температуру каждой из этих зон. Подачу производили в Zone 2 через боковой двухшнековый податчик. Шнеки были разработаны таким образом, чтобы уплотнение расплавом образовалось в зоне 3, давая возможность отводить влагу в зоне 4. Смешивание происходило в зонах 6 и 7, давая возможность отводить влагу также в зоне 8. Смесь перед экструзией подавали в загрузочное окно экструдера из двухшнекового весового дозатора. Скорость вращения шнеков составляла 300 об/мин. Профиль заданных температур в экструдере для зон 2-12 составлял: зона 2-42°C; зона 3 - 100°C; зона 4 - 130°C, зоны 5-12 - 180°C. Температура расплавленного продукта на выходе из мундштука составляла 185°C. Не отмечалось ощутимого нарастания давления в мундштуке. Экструдат был чистым и внешне гомогенным. Экструдированный материал подавали через вальцы противоположного вращения, охлажденные до 10-12°C, для доведения расплава до его температуры стеклования и образования хрупкого листа стекла, который подавали на дробилку крупного дробления и размельчали на мелкие куски. Затем экструдат измельчали с использованием ударной дробилки с молотковым устройством с экраном 0,84 мм при окружной скорости вальцов 40-45 м/с.
Состав 2
Состав 2 получали с использованием той же методики, которую использовали для состава 1. Экструзию проводили при тех же общих условиях, как при экструзии состава 1. Единственное изменение заключалось в том, что температуру зон 6-10 установили до 140°C, и в зоне 10 ее изначально установили на 150°C перед понижением до 140°C. Температура расплавленного экструдата при выходе из мундштука составляла 140°C. Давление в мундштуке было низким. Экструдат измельчали с использованием того же способа, который использовали для состава 1.
Пример 3
Получение таблетированных лекарственных форм посредством экструзии горячего расплава
Композиция состава для получения таблеток, содержащих 8% суворексанта, представлена в следующей таблице. В соответствии с настоящим изобретением композиции могут варьироваться более широко.
|
|
Ниже приведен типовой диапазон количества компонентов, которые можно использовать, и их функции: суворексант (API), 0,5-40%; 5-30% коповидон (стабилизирующий полимер), 0,25-40%; микрокристаллическая целлюлоза (наполнитель), 5-95%; лактоза (наполнитель), 5-95%; кроскармеллоза натрия (дезинтегрант), 1-10%; стеарат магния (смазочное средство). Типовой диапазон количества суворексанта и коповидона составляет 1-40% и 5-90% соответственно.
В одном из вариантов осуществления настоящего изобретения заместители можно использовать вместо полимеров и эксципиентов. Например, при использовании торгового наименования или торговой марки можно также использовать те же материалы с другим торговым наименованием или торговой маркой: стабилизирующий полимер - Eudragits (сополимеры акрилата-метакрилата), PVP, HPC, HPMC, HPMCP, HPMCAS, CAS, CAP и CAT; поверхностно-активные вещества - SDS, Cremophor (различные виды), полисорбаты (различные виды), Solutol, Gelucires, Spans (различные виды), PEG; наполнители - дифосфат кальция, окремнелая микрокристаллическая целлюлоза, крахмал, маннит; дезинтегранты - кросповидон, крахмалгликолят натрия, силикат кальция, крахмал; необязательные красители - красный железоокислый пигмент, желтый железоокислый пигмент, черный железоокислый пигмент, диоксид титана, FD&C Blue #2 и необязательное покрытие - Opadry I, Opadry II, Opadry II HP.
|
|
Составы в выше приведенной таблице получали посредством экструзии горячего расплава с соблюдением следующей процедуры. Суворексант вносили с использованием двухшнекового порошкового питателя Ktron K20 в зоне 1 цилиндра экструдера через верхнее загрузочное окно секции цилиндра (2 кг/час). Полимер (Kollidon VA64) вносили с использованием Ktron K20 двухшнекового порошкового питателя в зоне 2 цилиндра экструдера через боковой двухшнековый податчик Leistritz с верхним вентиляционным отверстием в секции цилиндра (8 Кг/час).
Вентиляционный канал (или два вентиляционных канала) располагались в зонах цилиндра 7, 8 и/или 9. Они имели вентиляционное сообщение с окружающей средой для удаления водяного пара. Остальные секции цилиндра были закрыты. Все питатели помещают на датчик напряжения для непрерывного контроля изменений массы. Температура в цилиндре поддерживалась на уровне комнатной температуре в зоне 1, и в зонах 3 или 4 температура составляла приблизительно 130°C. Зоны 5-10 нагревали до приблизительно 180°C.
Экструзионную головку с 4 отверстиями использовали для экструдирования материала на охлажденном роликовом блоке производства ThermoElectron. На охлажденном роликовом блоке использовали холодную воду для получения хрупкого листа экструдата, который затем крошили на частицы «дробилкой крупного дробления» (в сущности представлявшей собой ротор с перпендикулярными колышками, которые ударяли по хрупкому листу, перемещаемому к ротору).
Частицы из дробилки крупного дробления перемалывали с использованием мельницы Fitz Mill перед переработкой для выделения и очистки конечного продукта/таблетирования. Затем измельченный экструдат смешивали в подходящем смесителе (V или Tote) с микрокристаллической целлюлозой (например, авицелом) (наполнитель), лактозой (наполнитель) и кроскармеллозой натрия (дезинтегрант). Затем смесь смазывали стеаратом магния. Смазанную смесь спрессовывали в таблетки. Спрессованные таблетки могут необязательно быть покрыты.
Фармакокинетический профиль этой композиции суворексанта тестировали посредством введения однократной дозы состава, которая составляла 5 мг/кг, группам из 3 собак породы бигль, воздерживавшихся от приема пищи, и измерения концентрации суворексанта в крови в течение периода, составлявшего, по меньшей мере, 24 часа. Фармакокинетические измерения суворексанта указаны ниже: AUCO-24 (мкM-час) 2,82±0,493; Cmax (мкM) 0,587±0,182; Tmax (час) 1,0 (0,5-2,0).
Фармакокинетический профиль этой композиции суворексанта также тестировали посредством введения однократной дозы состава здоровым людям мужского пола. В этом исследовании данная композиция суворексанта способствовала уменьшению влияния приема пищи при введении состава суворексанта с пищей (такой как пища с высоким содержанием жиров). В первый период лечения этого клинического исследования однократную дозу этой композиции суворексанта (40 мг) вводили перорально 7 индивидуумам натощак (спустя 8 часов воздержания от приема пищи), и однократную дозу этой композиции суворексанта (40 мг) вводили перорально 7 различным индивидуумам после завтрака с высоким содержанием жиров. Во второй период лечения этого клинического исследования 7 индивидуумов в каждой группе лечения переходили в другую группу и получали другое лечение.
Как показано в следующей таблице, AUCo-oo и Cmax для данной композиции суворексант оставались неизменными после введения завтрака с высоким содержанием жиров по сравнению с введением натощак. Введенное с пищей/натощак GMR и 90% доверительных интервалов для AUCo-inf составляли 0,98 (0,90, 1,07). Введенное с пищей/натощак GMR и 90% доверительных интервалов для Cmax составляли 1,09 (0,90, 1,33). Срединное Tmax составляло 3,0 часов после завтрака с высоким содержанием жиров и 2,0 часов при введении натощак. Средний, кажущийся конечным период t1/2 при введении после завтрака с высоким содержанием жиров в основном оставался без изменений по сравнению с введением натощак, со значениями t1/2 11,8 и 10,9 часов соответственно.
|
В то время как изобретение описано и проиллюстрировано со ссылкой на определенные конкретные варианты его осуществления, специалистам в данной области будет понятно то, что возможно произведение различных адаптаций, изменений, модификаций, замен, удалений или добавлений методик и протоколов без отступления от существа и объема изобретения.