СОЕДИНЕНИЯ - ПРОИЗВОДНЫЕ СУЛЬФАМАТА ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ИЛИ СМЯГЧЕНИИ БОЛИ
Вид РИД
Изобретение
[Область техники]
Настоящее изобретение относится к соединениям - производным сульфамата и к композиции для лечения и/или смягчения боли, содержащей указанные соединения - производные сульфамата или их фармацевтически приемлемую соль в качестве активного ингредиента. Более точно, настоящее изобретение относится к фармацевтической композиции для лечения и смягчения боли, содержащей соединение - производное сульфамата и/или его фармацевтически приемлемую соль в качестве активного ингредиента. Кроме того, настоящее изобретение относится к способу для лечения или смягчения боли, включающий введение соединения - производного сульфамата в фармацевтически эффективном количестве субъекту, нуждающемуся в лечении или смягчении боли.
[Предшествующий уровень техники]
Боль является одной из наиболее распространенных причин у пациента для обращения за медицинской помощью и, в результате, боль является причиной потери огромного числа рабочих дней в году.
Боль это неприятное чувство, часто вызванные интенсивными или повреждающими раздражителями, такими как удар пальцем ноги о твердый предмет, ожог пальца, попадание спирта на разрез, и ушиб локтевой кости. Международная ассоциация по изучению боли широко использует следующее определение боли: "Боль это неприятное сенсорное и эмоциональное переживание, связанное с фактическом или потенциальным повреждением тканей, или описывается в терминах такого повреждения". Боль побуждает индивида избегать повреждающих ситуаций, чтобы защитить поврежденную часть тела в то время когда он ее лечит, а также чтобы избегать подобных ситуаций в будущем. Большая часть боли смягчается сразу же после того, как удаляется стимул, вызывающий боль, и участок тела заживает, но иногда боль сохраняется, несмотря на удаление стимула и явного исцеления тела; и иногда боль возникает при отсутствии каких-либо обнаруживаемых раздражителей, повреждений или болезни.
Боль является наиболее распространенной причиной для консультации у врача. Это основной симптом во многих заболеваниях, и она может существенно ухудшать качество жизни человека и его общего функционирования. Психологические факторы, такие как социальная поддержка, гипнотическое внушение, радостное возбуждение, или отвлечение могут существенно модулировать интенсивность боли или неприятные ощущения от нее.
В 1994, в ответ на необходимость наличия более полезной системы для описания хронической боли Международная ассоциация по изучению боли (International Association for the Study Pain, IASP) классифицировала боль согласно конкретными характеристиками: (1) область тела, в которой присутствует боль (например, живот, нижние конечности), (2) система, чья дисфункция может быть причиной боли (например, нервная система, желудочно-кишечный тракт), (3) продолжительность и картина возникновения, (4) интенсивность и время с момента начала заболевания, и (5) этиология.
Эта система была подвергнута критике Клиффордом Дж. Вульфом (Clifford J. Woolf) и другими как неадекватная для руководства исследованиями и лечения. Согласно тезисами Вульфа, есть три класса боли: ноцицептивная боль (см. ниже), воспалительная боль, которая связана с повреждением ткани и инфильтрацией иммунных клеток, и патологическая боль, которая является болезненным состоянием, вызванным повреждением нервной системы или нарушением ее функции (дисфункциональная боль, синдром раздраженного кишечника, напряжение типа головной боли и т.д.).
При ноцицептивной боли, раздражение чувствительных нервных окончаний, называемых ноцицепторами, вызывает болевые ощущения. Такая боль часто возникает после травмы или хирургического вмешательства. Эти болевые сигналы передаются ноцицепторами в мозг. Часто боль является локализованной, постоянной и имеет ноющее или пульсирующее свойство. После того, как повреждение ткани излечивается боль обычно ослабевает. Лечение с помощью опиоидов может ослаблять ноцицептивную боль. Психогенная боль представляет собой болевое расстройство, которое связана с психологическими факторами. Некоторые типы психических или эмоциональных проблем могут вызвать боль. Они также могут увеличить или продлить боль. Боль в желудке является одним из наиболее распространенных видов психогенной боли. Люди с этим болевым расстройством на самом деле имеют реальную боль. Диагноз ставят, когда все физические причины боли исключены.
Нейропатическая боль вызывается нарушениями в нервах, спинном мозге или головном мозге и является хроническим типом доброкачественной боли с предполагаемой распространенностью у более 1% населения. Оптимизация облегчения боли у этих больных имеет решающее значение в оказании помощи пациенту по восстановлению контроля над его или ее жизнью. Наиболее частой причиной невропатической боли является травма или дисфункция нервов. Травма или дисфункция периферических нервов или нервов, следующих от спинного мозга, приводит к отсутствию ингибирования нервных импульсов в спинном мозге, которое в результате приводит к боли. Нейропатическая боль также может быть обусловлена рецепторами центральной нервной системы, а не периферийной, в условиях, когда присутствует повреждение спинного мозга и рассеянный склероз.
Поэтому невропатическую боль можно разделить на дополнительные два класса: периферическую невропатическую боль и центральную нейропатическую боль в зависимости от того, какая система задействована: периферическая или центральная нервная система.
Недостаточное лечение боли широко распространено во всех хирургических отделениях, палатах интенсивной терапии, отделениях экстренной медицинской помощи, общей практики, при работе со всеми формами хронической боли и при уходе в конце жизни. Это пренебрежительное отношение распространяется на все возрасты, от новорожденных до ослабленных пожилых людей. Африканцы и латиноамериканцы чаще чем другие страдают без необходимости в руках врача; и лечению боли у женщин, скорее всего, уделяется меньшее внимание, чем у мужчин.
Поэтому существует необходимость в разработке терапевтических мер для лечения или смягчения боли.
[Описание]
[Техническая проблема]
Недостаточное лечение боли широко распространено во всех хирургических отделениях, палатах интенсивной терапии, отделениях экстренной медицинской помощи, общей практики, при работе со всеми формами хронической боли и при уходе в конце жизни. Это пренебрежительное отношение распространяется на все возрасты, от новорожденных до ослабленных пожилых людей. Африканцы и латиноамериканцы чаще чем другие страдают без необходимости в руках врача; и лечению боли у женщин, скорее всего, уделяется меньшее внимание, чем у мужчин.
[Техническое решение]
Настоящее изобретение относится к соединениям - производным сульфамата и к композициям для лечения и/или смягчения боли, содержащим соединения - производные сульфамата или их фармацевтически приемлемую соль в качестве активного ингредиента.
[Положительные результаты]
Целью настоящего изобретения является создание новых соединений - производных сульфамата или их фармацевтически приемлемой соли.
Другой целью настоящего изобретения является создание фармацевтической композиции для лечения и смягчения боли, содержащей указанное соединение - производное сульфамата и/или его фармацевтически приемлемую соль в качестве активного ингредиента.
Еще одной целью настоящего изобретения является создание способа для лечения или смягчения боли, включающего введение соединения - производного сульфамата в фармацевтически эффективном количестве субъекту, нуждающемуся в лечении или смягчении боли.
[Наилучший способ осуществления изобретения]
Авторы настоящего изобретения провели интенсивные исследования для разработки нового препарат против боли с высокой активностью и низкой токсичностью, который может быть эффективным способом для лечения боли. В результате, авторы настоящего изобретения обнаружили, что соединения - производные сульфамата, представленные ниже на формуле 1 или 1', обеспечивают чрезвычайно высокий уровень активности против боли со значительно меньшими побочными эффектами.
Соответственно, целью настоящего изобретения является создание нового соединения - производного сульфамата или его фармацевтически приемлемой соли.
Еще одной целью настоящего изобретения является создание фармацевтической композиции для лечения и смягчения боли, содержащей указанное соединение - производное сульфамата и/или его фармацевтически приемлемую соль в качестве активного ингредиента.
Другой целью настоящего изобретения является создание способа лечения или смягчения боли, включающего введение соединения - производного сульфамата в фармацевтически эффективном количестве субъекту, нуждающемуся в лечении или смягчении боли.
[Варианты осуществления изобретения]
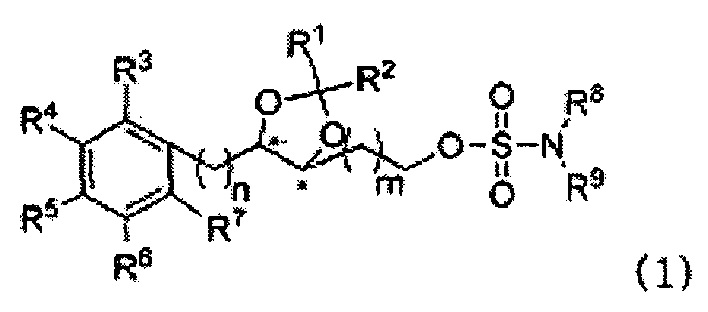
В одном аспекте настоящего изобретения обеспечивается соединение, представленное на следующей формуле 1, или его фармацевтически приемлемая соль:
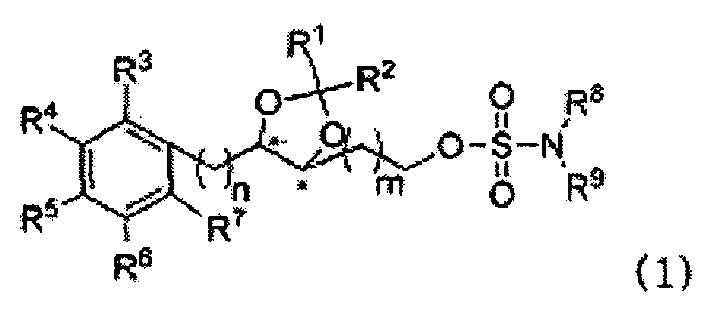
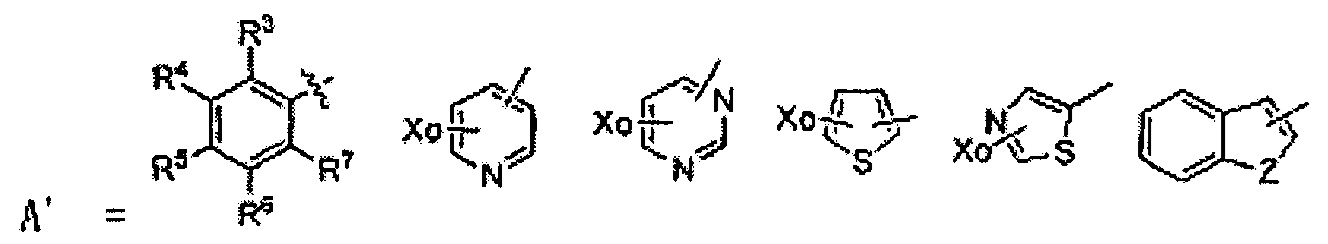
где R1 и R2 каждый, независимо, выбран из группы, содержащей водород, C1-C5 алкильную группу, C2-C5 алкенильную и С6-С10 арильную группу, R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-C12 циклоалкильную группу, или R1 и R2 связаны и они вместе с атомом кислорода, к которому они присоединены, образуют карбонильную группу; R3, R4, R5, R6 и R7 каждый, независимо, выбран из группы, содержащей водород, гидроксил, C1-C5 алкокси, С1-С5 алкил, С2-С5 алкенил, С6-C10 арил, C1-C5 алкоксикарбонил, карбоксил, C2-C5 ацил, C1-С5 алкилтио, циано, нитро, амин, C1-C5 алкиламин и галоген; R8 и R9 каждый, независимо, представляет собой водород или C1-С3 алкильную группу; пит каждый, независимо, является целым числом в диапазоне 0-4.
Согласно конкретным вариантом осуществления настоящего изобретения, R1 и R2 каждый, независимо, выбран из группы, содержащей водород, C1-С3 алкил и фенил, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-С6 циклоалкильную группу.
Согласно конкретным вариантом осуществления настоящего изобретения, R8 и R9 каждый, независимо, представляет собой водород или метил.
В предпочтительном варианте согласно настоящему изобретению, тип каждый, независимо, является целым числом в диапазоне 0-2.
В более предпочтительном варианте согласно настоящему изобретению, тип каждый, независимо, является целым числом в диапазоне 0-1.
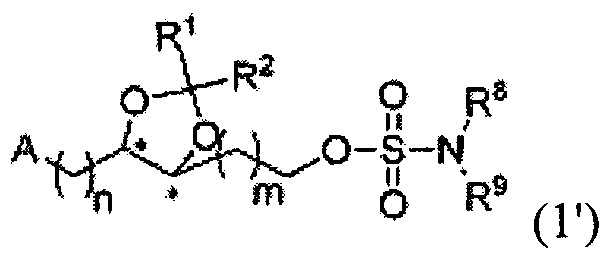
В другом аспекте настоящего изобретения, обеспечивается соединение, представленное на следующей формуле, или его фармацевтически приемлемая соль:
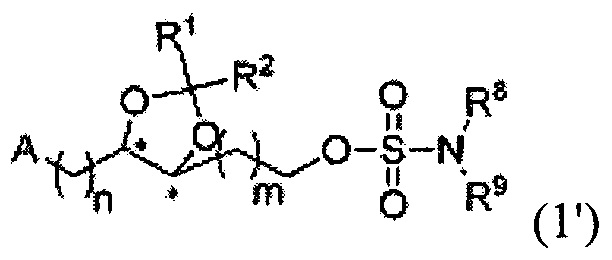
где R1 и R2 каждый независимо, выбран из группы, содержащей водород, C1-C5 алкил, С2-С5 алкенил и С6-С10 арил, R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-С12 циклоалкильную группу, или R1 и R2 связаны и они вместе с атомом кислорода, к которому они присоединены, образуют карбонильную группу; А является гетероциклической частицей, необязательно содержащей один или несколько заместителей, выбранных из группы, содержащей водород, гидроксил, C1-C5 алкокси, C1-C5 алкил, C2-C5 алкенил, С6-С10 арил, C1-C5 алкоксикарбонил, карбоксил, C2-C5 ацил, C1-C5 алкилтио, циано, нитро, амин, C1-C5 алкиламин и галоген, R8 и R9 каждый, независимо, представляет собой водород или C1-С3 алкил; и n и m каждый, независимо, является целым числом в диапазоне 0-4.
Согласно конкретным вариантом осуществления настоящего изобретения, R1 и R2 каждый, независимо, выбран из группы, содержащей водород, C1-С3 алкил и фенил, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-С6 циклоалкильную группу.
В предпочтительном варианте согласно настоящему изобретению, А является гетероциклической частицей, представляющей собой С3-С10 гетероциклическую группу.
Согласно конкретным вариантом осуществления настоящего изобретения, R8 и R9 каждый, независимо, представляет собой водород или метил.
В предпочтительном варианте согласно настоящему изобретению, n и m каждый независимо является целым числом в диапазоне 0-2.
В более предпочтительном варианте согласно настоящему изобретению, n и m каждый независимо является целым числом в диапазоне 0-1.
Конкретные примеры заместителей, представленные А, в химической формуле включают в себя следующие:

где Х каждый, независимо, выбран из группы, содержащей галоген, нитро, амин и C1-C5 алкил; o является целым числом в диапазоне 0-4; и Z выбран из S, О или NH.
В предпочтительном варианте согласно настоящему изобретению, о является целым числом в диапазоне 0-2.
В более предпочтительном варианте согласно настоящему изобретению, о является целым числом в диапазоне 0-1.
Термин "алкил", использующийся в настоящем описании, относится к насыщенной углеводородной группе с линейной или разветвленной цепью, например, метил, этил, пропил, бутил, изобутил, трет-бутил и пентил.
"С1-С5 алкильная группа", использующаяся в настоящем описании, относится к алкильной группе с количеством атомом углерода в диапазоне 1-5.
Термин "алкенил", использующийся в настоящем описании, если не указано иное, включает в себя алкильную частицу, содержащую по меньшей мере одну двойную связь углерод-углерод, где алкил определен выше.
Термин "алкокси", использующийся в настоящем описании, если не указано иное, включает O-алкильные группы, где алкил определен выше.
Термин "алкилтио", использующийся в настоящем описании, если не указано иное, включает S-алкильные группы, где алкил определен выше.
Термин "алкоксикарбонил", использующийся в настоящем описании, если не указано иное, включает -С(O)O-алкильные группы, где алкил определен выше.
Термин "ацил", использующийся в настоящем описании, если не указано иное, включает -С(O)-алкильные группы, где алкил определен выше.
Термин "арил" или "арильная группа", использующийся в настоящем описании, относится к полностью или частично ненасыщенным моноциклическим или полициклическим кольцам углерода с ароматичностью. Арильной группой согласно настоящему изобретению предпочтительно являются моноарил или биарил, такой как фенил или нафтил. Указанный арильный радикал может необязательно содержать один или несколько заместителей, таких как гидрокси, меркапто, гало, алкил, фенил, алкокси, галоалкил, нитро, циано, диалкиламино, аминоалкил, ацил и алкоксикарбонил, указанные в настоящем описании.
Термин "циклоалкил" или "циклоалкильная группа", использующийся в настоящем описании, относится к моноциклическим или полициклическим насыщенным кольцам, содержащим атомы углерода и водорода.
Термин "гетероциклический" или "гетероциклическая группа", использующийся в настоящем описании, если не указано иное, означает ароматическую и неароматическую гетероциклические группы (включая насыщенные гетероциклические группы), содержащие один ли несколько гетероатомов, каждый из которых выбран из О, S и N, где каждое кольцо гетероциклической группы содержит от 4 до 10 атомов. Неароматические гетероциклические группы могут содержать кольца только с 4-мя атомами, но ароматические гетероциклические кольца должны иметь по меньшей мере 5 атомов. Гетероциклические группы согласно настоящему изобретению, если не указано иное, могут содержать одно кольцо или более чем одно кольцо, то есть они могут быть моноциклическими или полициклическими, например бициклическими (и могут включать неароматическое и/или ароматическое кольца).
Согласно более конкретным вариантом осуществления изобретения, указанное соединение выбрано из группы, включающей:
(1) (5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(2) (5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(3) (5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(4) (3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(5) (3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(6) (5-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(7) (5-(2-фенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(8) (5-(2-фторфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(9) (5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(10)(3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(11) (3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(12)(5-(2-фторфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(13) (5-(2-йодфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(14) (5-(2-йодфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(15) (5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(16) (3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(17) (3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(18) (5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(19) (5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(20) (5-(2,4-дихлорфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(21) (5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(22) (3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(23) (3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(24) (5-(2,4-дихлорфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(25) (5-(2,6-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(26) (5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(27) (5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(28) (3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(29) (3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(30) (5-(2,6-дихлорфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(31) (5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(32) (5-(2-аминофенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(33) (5-(2-аминофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(34) (3-(2-аминофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(35) (3-(2-аминофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(36) (5-(2-аминофенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(37) (5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(38) (5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(39) (5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(40) (3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(41) (3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(42) (5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(43) (5-(2-нитрофенил)-2-оксо-1,3-диоксолан-4-ил)метилсульфамат;
(44) (5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(45) (5-(2-метилфенил)-2-метил-1,3-диоксолан-4-ил)метилсульфамат;
(46) (5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат
(47) (3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат
(48) (3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(49) (5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-ил)метилсульфамат;
(50) (5-(2-метиламинофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилметилсульфамат;
(51) (5-фенил-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(52) (5-фенил-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(53) (3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(54) (3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(55) 2-(5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этилсульфамат;
(56) 2-(5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилсульфамат;
(57) 2-(3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилсульфамат;
(58) 2-(3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилсульфамат;
(59) (5-бензил-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(60) (5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(61) (3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(62) (3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(63) 2-(5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этилсульфамат;
(64) 2-(5-фенил-2,2-диэтил-1,3-диоксолан-4-ил)этилсульфамат;
(65) 2-(3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилсульфамат;
(66) 2-(3-фенил-1,4-диоксаспиро [4,5] декан-2-ил)этилсульфамат;
(67) 2-(5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этилсульфамат;
(68) 2-(5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилсульфамат;
(69) 2-(3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилсульфамат;
(70) 2-(3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилсульфамат;
(71) (5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(72) (5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)метилсульфамат;
(73) (3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)метилсульфамат;
(74) (3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)метилсульфамат;
(75) 2-(5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этилсульфамат;
(76) 2-(5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)этилсульфамат;
(77) 2-(3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилсульфамат;
(78) 2-(3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этилсульфамат;
(79) (5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(80) (5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(81) (2,2-диметил-5-(4-метилтиазол-5-ил)-1,3-диоксолан-4-ил)метилсульфамат;
(82) (2,2-диметил-5-(2-хлор-4-метилтиазол-5-ил)-1,3-диоксолан-4-ил)метилсульфамат;
(83) (2,2-диметил-5-(тиофен-3-ил)-1,3-диоксолан-4-ил)метилсульфамат;
(84) (2,2-диметил-5-(5-хлортиофен-2-ил)-1,3-диоксолан-4-ил)метилсульфамат;
(85) (5-(3-хлорпиридин-4-ил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(86) (5-(4-хлорпиридин-3-ил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат;
(87) (2,2-диметил-5-(пиримидин-5-ил)-1,3-диоксолан-4-ил)метилсульфамат и
(88) (2,2-диметил-5-(2-хлорпиримидин-5-ил)-1,3-диоксолан-4-ил)метилсульфамат.
Согласно конкретным примером осуществления настоящего изобретения, указанное соединение находится в форме рацемата, энантиомера, диастереомера, смеси энантиомеров или смеси диастереомеров.
Как видно из Примеров, авторы настоящего изобретения синтезировали соединения различной стереохимии и исследовали их обезболивающую активность посредством многоцентровых экспериментов.
Термин "энантиомер", использующийся в настоящем описании, относится к одному из двух стереомеров, которые являются зеркальными отражениями друг друга и которые не совмещаются дуг с другом вследствие существования одного или нескольких хиральных углеродов. Согласно конкретным вариантом осуществления настоящего изобретения, указанным энантиомером согласно настоящему изобретению является энантиомер, в котором хиральные углероды C4 и C5 отличаются стереоконфигурацией.
Термин "диастереомер", использующийся в настоящем описании, относится к стереомерам, которые не являются энантиомерами, что случается, когда два или более стереомеров соединения имеют различные конфигурации одного или нескольких (но не всех) эквивалентных хиральных центров, которые не являются зеркальными отражениями друг друга.
Термин "рацемат", использующийся в настоящем описании, относится к смеси, содержащей одинаковые количества двух энантиомеров различной стереоконфигурации и не обладающей оптической активностью.
Специалисту в данной области из приведенных ниже примеров очевидно, что соединения согласно настоящему изобретению не ограничены соединениями с определенной стереохимией.
Согласно конкретным вариантом осуществления настоящего изобретения, фармацевтически приемлемую соль получают посредством реакции указанного соединения неорганической кислотой, органической кислотой, аминокислотой, сульфоновой кислотой, ионом щелочного металла или ионом аммония.
Фармацевтически приемлемыми солями согласно настоящему изобретению являются соли, которые могут быть получены с использованием методов, известных в уровне техники, например соли с неорганическими кислотами, такими как соляная кислота, бромноватая кислота, серная кислота, бисульфат натрия, фосфат, нитрат и карбонат; и соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, янтарная кислота, бензойная кислота, лимонная кислота, малеиновая кислота, малоновая кислота, винная кислота, глюконовая кислота, молочная кислота, гентизиновая кислота, фумаровая кислота, лактобионовая кислота, салициловая кислота, и трифторуксусная кислота, ацетилсалициловая кислота (аспирин); или соли с аминокислотами, такими как глицин, аланин, валин, изолейцин, серии, цистеин, цистин, аспарагиновая кислота, глютамин, лизин, аргинин, тирозин, и пролин; соли сульфоновой кислоты, такие как метансульфонат, этансульфонат, бензолсульфонат и толуолсульфонат; соли металлов путем реакции с ионом щелочного металла, таким как калий и натрий; или соли с ионом аммония, но не ограничиваются ими.
В другом аспекте настоящего изобретения обеспечивается способ контроля боли, включающий введение фармацевтически эффективного количества указанного соединения согласно настоящему изобретению или его фармацевтически приемлемой соли субъекту, нуждающемуся в этом.
Термин «фармацевтически эффективное количество", использующийся в настоящем описании, относится к количеству, достаточному для демонстрации и достижения эффективности и активности для предотвращения, смягчения, лечения заболевания, ассоциированного с болью.
Фармацевтическая композиция согласно настоящему изобретению включает фармацевтически приемлемый носитель в дополнение к ингредиенту с активным соединением.
Фармацевтически приемлемый носитель, содержащийся в указанной фармацевтической композиции согласно настоящему изобретению, который обычно используется в фармацевтических композициях, включает лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, культивируемый каучук, фосфат калия, аргинаты, желатин, силикат калия, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сиропы, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, и минеральные масла, но не ограничивается ими. Фармацевтическая композиция согласно настоящему изобретению может дополнительно включать в себя смазывающее вещество, увлажнитель, подсластитель, вкусовой агент, эмульгатор, суспендирующий агент и консервант. Подробности относительно подходящих фармацевтически приемлемых носителей и композиций можно найти в Remington's Pharmaceutical Sciences (19-е издание, 1995).
Указанная фармацевтическая композиция согласно настоящему изобретению может вводиться орально или парэнтерально, и конкретно может вводиться парэнтерально. В ходе парэнтерального введения она может вводиться внутривенно, подкожно, внутримышечно, внутрибрюшинно, трансдермально или внутрисуставно. Если говорить более конкретно, то ее вводят внутримышечно или внутрибрюшинно.
Указанное соединение или его фармацевтически приемлемая соль имеет отношение к боли, где боль является одной или несколькими болями, выбранными из группы, содержащей ноцицептивную боль, психогенную боль, воспалительную боль и патологическую боль. Более конкретно, боль является одной или несколькими болями, выбранными из группы, содержащей невропатическую боль, боль при раке, послеоперационную боль, боль тройничного нерва, идиопатическую боль, диабетическую невропатическую боль и мигрень.
Подходящая дозировка фармацевтической композиции согласно настоящему изобретению может варьироваться в зависимости от фармацевтических методов составления композиции, методов введения, возраста пациента, массы тела, пола, патогенного состояния, диеты, времени введения, пути введения, скорости выведения и чувствительности используемой фармацевтической композиции. Предпочтительно, фармацевтическая композиция согласно настоящему изобретению может вводиться в суточной дозе 0,001-10000 мг/кг (вес тела).
Согласно обычными методами, известными специалистам в данной области техники, фармацевтическая композиция согласно настоящему изобретению может быть составлена с использованием фармацевтически приемлемого носителя и/или переносчика, как описано выше, с получением нескольких форм, включая форму с единичной дозой и форму с множественной дозой. Не ограничивающиеся каким-либо образом примеры композиций включают раствор, суспензию или эмульсию в масле или водной среде, эликсир, порошок, гранулу, таблетку и капсулу, но не ограничиваются только ими, и могут дополнительно содержать диспергирующий агент или стабилизатор.
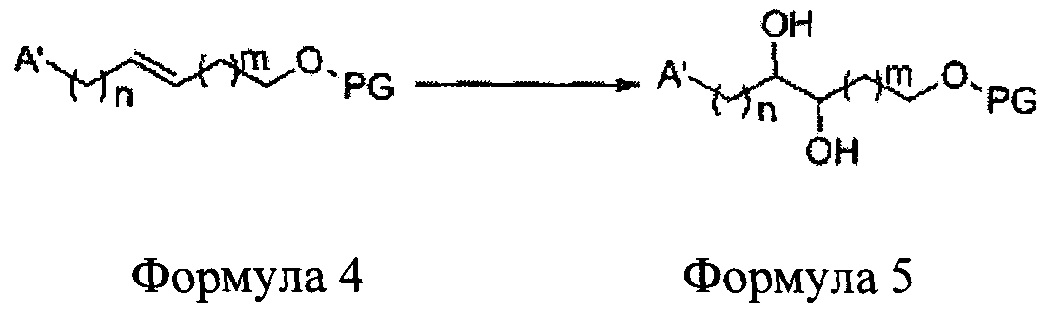
Соединение - производное сульфамата согласно настоящему изобретению может быть получено по следующей схеме реакции.
[Схема реакции 1] Синтез спирта

Спирт формулы 3 синтезируют посредством реакции восстановления с использованием восстанавливающего агента, включающего LiAlH4 (литий алюминий гидрид), NaBH4 (боргидрид натрия), Zn(BH4)2 (боргидрид цинка), NaH (гидрид натрия), KH (гидрид калия), AlH3 (гидрид алюминия) и NaOMe (метоксид натрия), но не ограничиваясь ими, в основных условиях из карбоксиловой кислоты формулы 2.
[Схема реакции 2] Синтез защищенного спирта
 , PG = Защитная группа
, PG = Защитная группа
ОН спирта формулы 3 защищают защитной группой, включающей TMS (триметилсилил), TES (триэтилсилил), TIPS (триизопропилсилил), TBDMS (трет-бутилдиметилсилил), TBDPS (трет-бутилдифенилсилил), Piv (пивалоил), MOM (Метоксиметил), ацетил, бензоил, и тритил (трифенилметил), но не ограничиваясь ими, в основных условиях для применения в следующей реакции.
[Схема реакции 3] Синтез защищенного диола
 , PG = Защитная группа
, PG = Защитная группа
Асимметрическим катализатором дигидроксилирования может быть один или несколько катализаторов, выбранных из группы, содержащей хиральный лиганд (например, (DHQD)2PHAL, (DHQ)2PHAL, и т.д.), осмиевый катализатор (например, OsO4, K2OsO2(OH)4, и т.д.), K2CO3, K3Fe(CN)6, N-метилморфолиноксид (NMO), метансульфонамид (CH3SO2NH2), и подобные им. Например, Асимметрический катализатор дигидроксилирования может включать AD-mix-α (K2OsO2(OH)4(cat), K2CO3, K3Fe(CN)6, (DHQ)2PHAL(cat)) и метансульфонамид (CH3SO2NH2), или OsO4 и N-метилморфолиноксид, но не ограничиваются ими.
[Схема реакции 4] Синтез соединения диоксолан-спирт
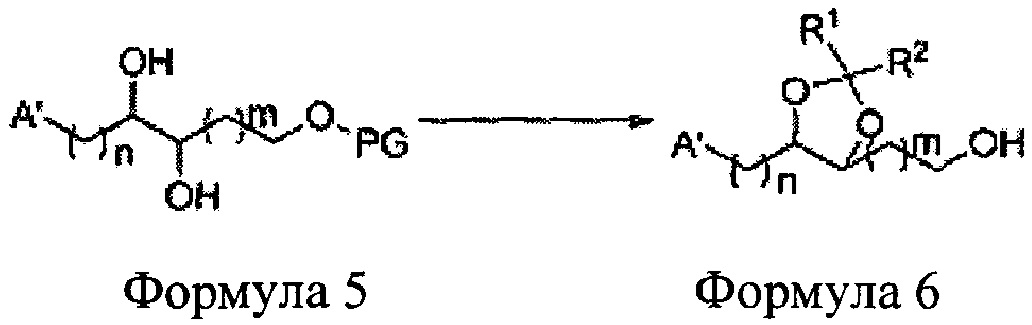
Диол формулы 5 вводят в реакцию с кетоном (таким как ацетон, 3-пентанон, циклопентанон или циклогексанон), алкоксисоединением (таким как диметоксипропан, диэтоксиэтан или метоксипропен) или альдегидом (таким как бензальдегид, циклопентанкарбоксальдегид или циклогексанкарбоксальдегид) в кислых условиях, например, в растворе с растворенной кислотой, такой как p-TsOH (р-толуолсульфоновая кислота), H2SO4 (серная кислота), HNO3 (азотная кислота), с последующим удалением защитной группы с получением диоксолан-спирта формулы 6. Но хотя мы описали несколько примеров кетонов, алкоксисоединений, альдегидов и кислот для вышеуказанной реакции, они не ограничиваются ими и могут быть соответствующим образом выбраны в зависимости от поставленной цели.
[Схема реакции 5] Синтез сложных эфиров

Сложный эфир формулы 7, содержащий R, выбранный из группы, содержащей линейный или разветвленный C1-C10 алкил, или циклический С3-С10 алкил, аллил и бензил синтезируют посредством реакции этерификации в кислых условиях из карбоксиловой кислоты формулы 2.
[Схема реакции 6] Синтез соединения сложный эфир-диол
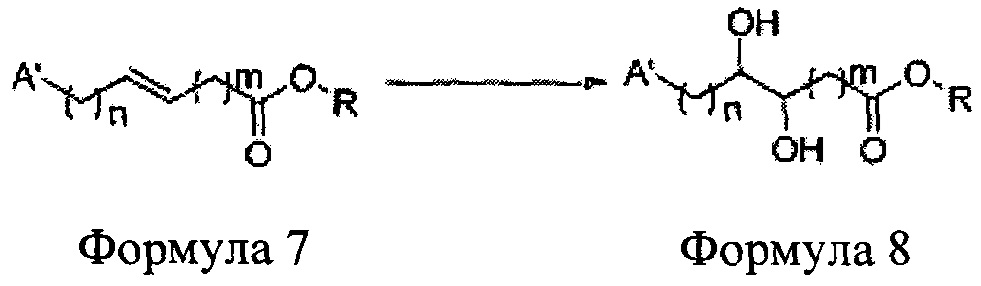
Катализатором асимметричного гидроксилирования может быть один или несколько катализаторов, выбранных из группы, содержащей хиральный лиганд (например, (DHQD)2PHAL, (DHQ)2PHAL, и т.д.), осмиевый катализатор (например, OsO4, K2OsO2(OH)4, и т.д.), K2CO3, K3Fe(CN)6, N-метилморфолиноксид (NMO), метансульфонамид (CH3SO2NH9), и подобные им. Например, катализатор асимметричного гидроксилирования может включать AD-mix-α (K2OsO2(OH)4(cat), K2CO3, K3Fe(CN)6, (DHQ)2PHAL(cat)) и метансульфонамид (CH3SO2NH2), или OsO4 и N-метилморфолиноксид (NMO), но не органичиваются ими.
[Схема реакции 7] Синтез соединения диоксолан-сложный эфир
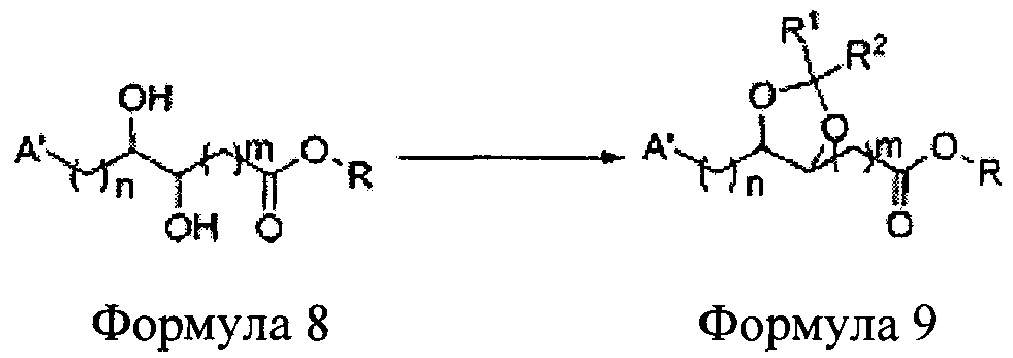
Диол формулы 8 вводят в реакцию с кетоном (таким как ацетон, 3-пентанон, циклопентанон, или циклогексанон), алкоксид-соединением, таким как диметоксипропан, диэтоксиэтане, 3-метоксипент-2-ен, 1-метоксициклопент-1-ен, 1-метоксициклогекс-1-ен или метоксипропен), или альдегидом (таким как бензальдегид, циклопентанкарбоксальдегид, или циклогексанкарбоксальдегид) в кислых условиях, Например, в растворе с растворенной кислотой, такой как p-TsOH (р-толуолсульфоновая кислота), H2SO4 (серная кислота), HNO3 (Азотная кислота) с получением диоксолан-сложного эфира формулы 9. Но хотя мы описали несколько примеров кетонов, алкоксисоединений, альдегидов и кислот для вышеуказанной реакции, они не ограничиваются ими и могут быть соответствующим образом выбраны в зависимости от поставленной цели.
[Схема реакции 8] Синтез соединения диоксолан-спирт
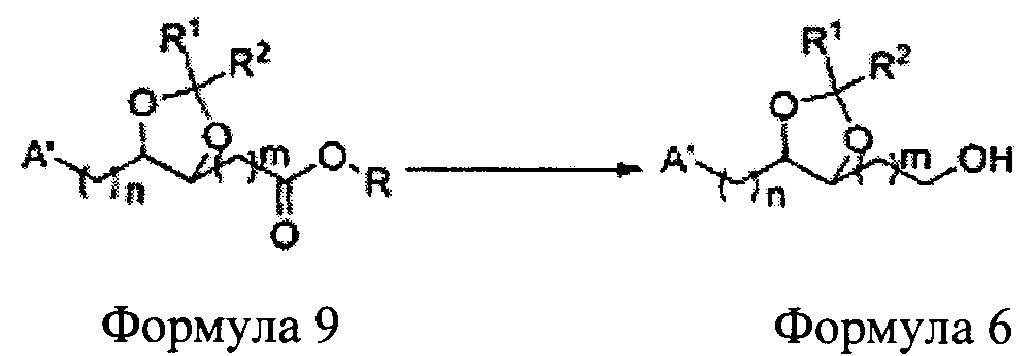
Соединение диоксолан-спирт формулы 6 синтезируют посредством реакции восстановления с использованием восстанавливающего агента, включающего LiAlH4 (литий алюминий гидрид), NaBH4 (боргидрид натрия), Zn(BH4)2 (боргидрид цинка), NaH (гидрид натрия), KH (гидрид калия), AlH3 (гидрид алюминия), и NaOMe (метоксид натрия) в основных условиях из соединения диоксолан-сложный эфир формулы 9.
[Схема реакции 9] Синтез сульфамата
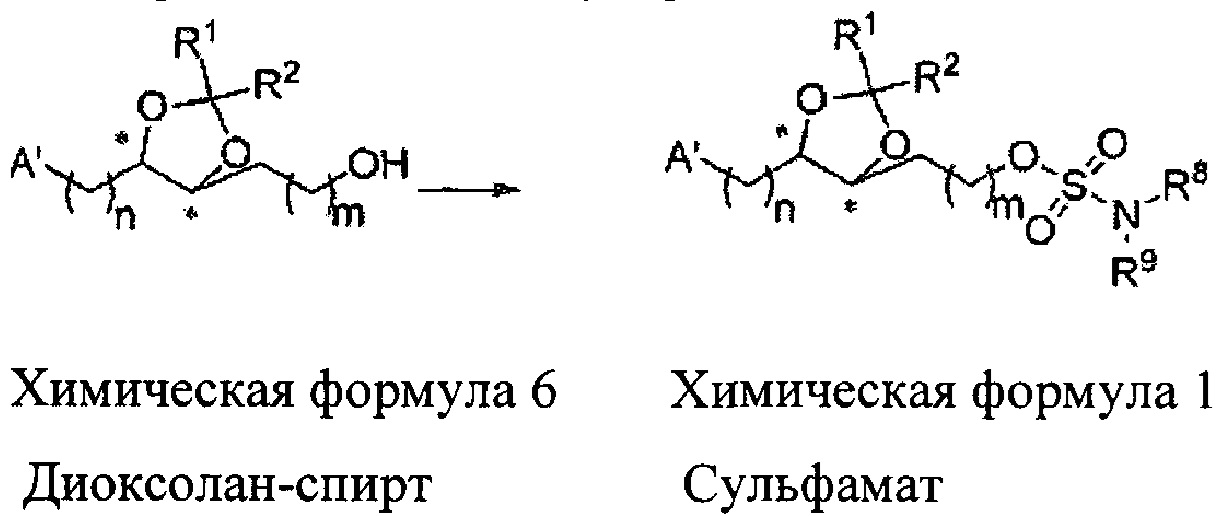
Диоксолан-спирт формулы 6 вводят в реакцию с сульфамидом или сульфамоилхлоридом в основных условиях с использованием основания, включающего пиридин, пиперидин и пиперазин, но не ограничиваясь ими, для получения сульфамата 1 или 1'.
[Схема реакции 10] Синтез соединения диоксолан-спирт
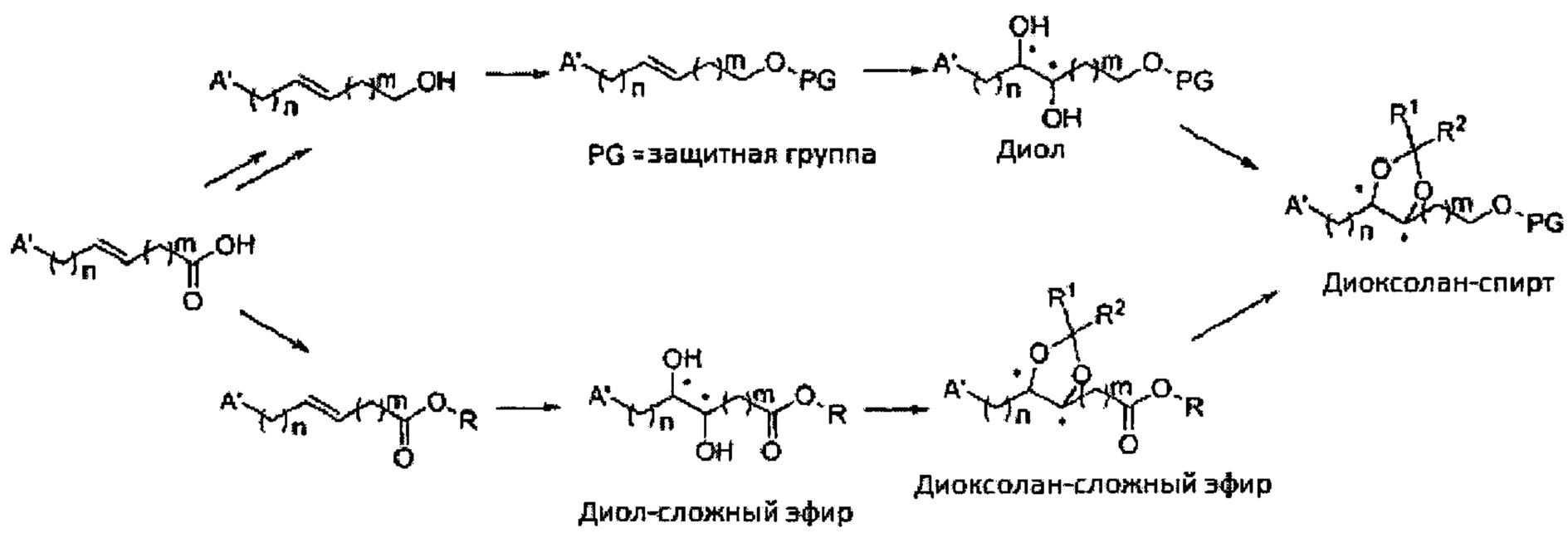
Диоксолан-спирт, используемый в синтезе сульфаматов, синтезируют посредством дигидроксилирования, конденсации и реакции удаления защитной группы.
Примеры
Пример получения 1: (Е)-3-(2-хлорфенил)проп-2-ен-1-ол
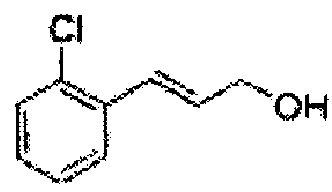
В 100 мл круглодонную колбу добавляли 2-хлоркоричную кислоту (5 г, 7,3 ммоль) и ТГФ (20 мл) и реакционную смесь охлаждали до 0°С. Добавляли триэтиламин (4,2 мл, 30,1 ммоль) и этилхлорформиат (2,88 мл, 30,1 ммоль). В ходе помешивания из реакционной смеси выпадал осадок в виде белого твердого вещества. Через 2 часа реакционную смесь отфильтровывали с ТГФ (белое твердое вещество + желтый раствор).
Указанный желтый раствор добавляли по каплям к боргидриду натрия (2,68 г, 142,3 ммоль) в Н2О при 0°С и перемешивали в течение 2 часов, реакцию останавливали 1N раствором HCl. Реакционную смесь экстрагировали EtOAc и промывали Н2О. Объединенные органические экстракты осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали под вакуумом. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (2,96 г, 60-70%).
1Н ЯМР (400 МГц, CDCl3) δ 1,67 (s, 1Н), 4,39 (t, J=4,0, 2H), 6,37 (dt J=5,6, 16,0, 1H), 7,03 (d, J=16,0, 1H), 7,18~7,38 (m, 4H).
Пример получения 2: (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензол
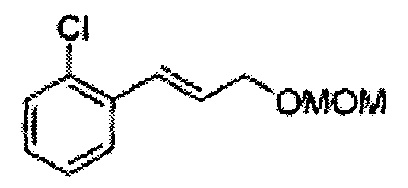
В 250 мл круглодонную колбу добавляли (Е)-3-(2-хлорфенил)проп-2-ен-1-ол (2,96 г, 17,5 ммоль. Пример получения 1) и дихлорметан (17,5 мл) и реакционную смесь охлаждали до 0°С. Добавляли диизопропилэтиламин (6,1 мл, 35,1 ммоль) и перемешивали при 0°С. Метилхлорметиловый эфир (2,77 мл, 35,1 ммоль) добавляли по каплям и перемешивали в течение ночи. Реакцию останавливали 1N раствором NaOH, экстрагировали дихлорметаном. Объединенные органические экстракты осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали под вакуумом. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (3,43 г, 85-95%).
1Н ЯМР (400 МГц, CDCl3): δ 3,44 (s, 3Н), 4,30 (dd, J=8,0, 1,6, 1H), 4,73 (s, 2H), 6,30 (1H, dt, J=6,0, 16), 7,04 (d, J=16,0, 1H), 7,20~7,57 (m, 4H).
Пример получения 3: (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диол
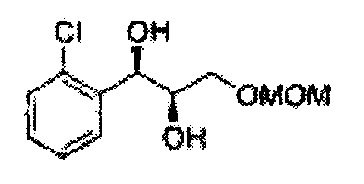
В 250 мл круглодонную колбу, оснащенную магнитной мешалкой, добавляли 80 мл трет-бутилового спирта, 80 мл воды и K3Fe(CN)6 (15,93 г, 48,3 ммоль), K2CO3 (6,7 г, 48,3 ммоль), (DHQD)2-PHAL (0,12 г, 0,16 ммоль), K2OsO2(OH), (11,8 мг, 0,03 ммоль) и метансульфонамид (1,53 г, 16,1 ммоль). Перемешивали при 0°С. (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензол (3,43 г, 16,1 ммоль. Пример получения 2) добавляли сразу же, и указанную смесь перемешивали энергично при 0°С в течение ночи. Пока указанную смесь перемешивали при 0°С, добавляли твердый сульфит натрия (Na2SO3, 24,4 г, 193,5 ммоль) и оставляли нагреваться указанную смесь до комнатной температуры. В реакционную смесь добавляли этилацетат и после разделения слоев водную фазу экстрагировали органическим растворителем. Объединенные органические слои промывали 2 N КОН. Объединенные органические экстракты осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали под вакуумом. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (3,31 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1Н), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69~3,77 (m, 2H), 3,96~3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 1H).
Пример получения 4: (1S,2S)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диол
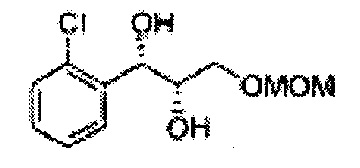
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (DHQ)2-PHAL вместо (DHQD)2-PHAL. 3,1 г (75-90%).
1Н ЯМР (400 МГц, CDCl3): δ 3,09 (d, J=5,6, 1H), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H)
Пример получения 5: 1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диол
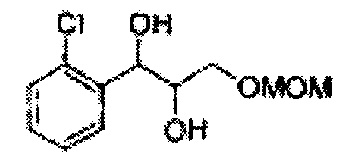
(Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензол (9,11 г, Пример получения 2) растворяли в 45 мл смеси ацетон/t-BuOH/H2O (5:1:1 V/V). При комнатной температуре добавляли N-метилморфолин-N-оксид (7,51 г) и OsO4 (0,54 г) и перемешивали в течение 2-3 часов. Когда реакция заканчивалась, полученный продукт промывали водой и метиленхлоридом (МС). Затем, органический слой обезвоживали безводным сульфатом магния (MgSO4), отфильтровывали, и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (7,42 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1H), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H)
Пример получения 6: ((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
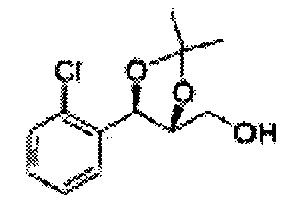
К (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диолу (3,31 г, 13,4 ммоль, Пример получения 3) добавляли дихлорметан, охлажденный до 0°С. Добавляли 2,2-диметоксипропан (3,3 мл, 26,8 ммоль) и р-толуолсульфоновую кислоту (2 г, 10, 7 ммоль) и перемешивали при комнатной температуре в течение 5 часов. Реакцию останавливали Н2О, экстрагировали ДХМ, и промывали H2O. Органический слой осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,05 г, 30-40%).
1H ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3H), 1,63 (s, 3H), 1,95~1,98 (m, 1H), 3,88~3,89 (m, 1H), 3,90~3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25~7,66 (m, 4H)
Пример получения 7: ((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
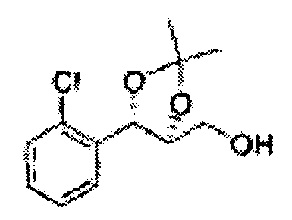
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали (1S,2S)-1-(2-хлорфенил)-3- (метоксиметокси)пропан-1,2-диол (Пример получения 4) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (1,1 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3H), 1,64 (s, 3H), 1,98 (m, 1H), 3,76~3,83 (m, 1H), 3,88~3,90 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25~7,66 (m, 4H)
Пример получения 8: (5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
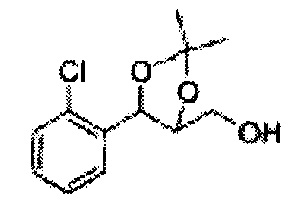
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали 1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диол (Пример получения 5) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (2,1 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3Н), 1,63 (s, 3Н), 1,95~1,98 (m, 1H), 3,88~3,89 (m, 1H), 3,90~3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25~7,66 (m, 4H)
Пример получения 9: (Е)-3-(2-фторфенил)-акриловая кислота
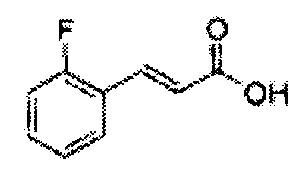
Пиперидин (247 мг, 2,90 ммоль) добавляли к перемешиваемому раствору малоновой кислоты (3,1 г, 29,00 ммоль) и 2-фторальдегида (3 г, 24,17 ммоль) в пиридине при комнатной температуре в атмосфере азота. Указанный раствор охлаждали до комнатной температуры, затем реакцию останавливали раствором HCl. Осадок обрабатывали ЭА и H2O. Органический слой отделяли и водный слой экстрагировали дополнительно ЭА. Объединенные экстракты промывали соляным раствором. Органический слой осушали над Na2SO4, отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (3,66 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 6,60 (d, J=16,0, 1H), 7,24-7,50 (m, 3Н), 7,66 (d, J=16,0, 1H), 7,84 (t, J=8,0, 1H).
Пример получения 10: (Е)-3-(2-фторфенил)-проп-2-ен-1-ол
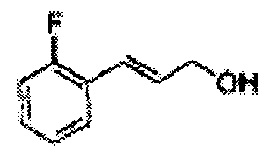
Осуществляли по существу такой же способ, какой описан в Примере получения 1, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-фторфенил)-акриловую кислоту (Пример получения 9) вместо 2-хлоркоричной кислоты (1,6 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,67 (s, 1H), 4,39 (t, J=4,0, 2H), 6,34-6,41 (m, 1H), 7,00-7,38 (m, 4H).
Пример получения 11: (Е)-1-фтор-2-(3-(метоксиметокси)проп-1-енил)бензол
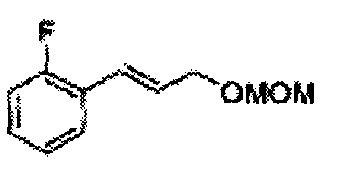
Осуществляли по существу такой же способ, какой описан в Примере получения 2, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-фторфенил)-проп-2-ен-1-ол (Пример получения 10) вместо (Е)-3-(2-хлорфенил)-проп-2-ен-1-ола (Пример получения 1) (2,23 г, 85-95%).
1Н ЯМР (400 МГц, CDCl3) δ 3,44 (s, 3Н), 4,30 (dd, J=1,6, 8,0, 1H), 4,73 (s, 2H), 6,27-6,37 (m, 1H), 7,02-7,57 (m, 4H).
Пример получения 12: (1К,2К)-1-(2-фторфенил)-3-(метоксиметокси)пропан-1,2-диол
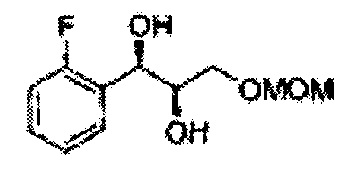
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-1-фтор-2-(3-(метоксиметокси)проп-1-енил)бензол (Пример получения 11) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (2,13 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1H), 3,27 (d, J=4,4, 1H), 3,41 (s, 3Н), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H)
Пример получения 13: ((4R,5R)-5-(2-фторфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
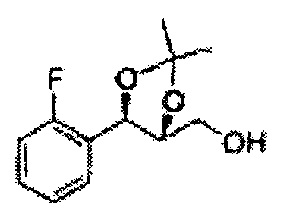
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали (1R,2R)-1-(2-фторфенил)-3-(метоксиметокси)пропан-1,2-диол (Пример получения 12) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (1,73 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3Н), 1,63 (s, 3Н), 1,95-1,98 (m, 1H), 3,88-3,89 (m, 1H), 3,90-3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25-7,66 (m, 4H)
Пример получения 14: (1S,2S)-1-(2-фторфенил)-3-(метоксиметокси)пропан-1,2-диол
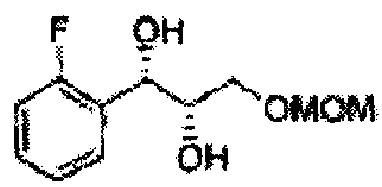
Осуществляли по существу такой же способ, какой описан в Примере получения 4, за исключением того, что для получения целевого соединения использовали (Е)-1-фтор-2-(3-(метоксиметокси)проп-1-енил)бензол (Пример получения 11) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (2,13 г, 75-90%).
1H ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1Н), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H)
Пример получения 15: ((4S,5S)-5-(2-фторфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
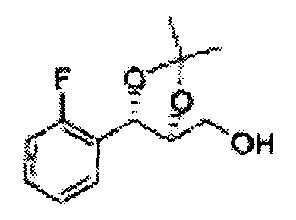
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали (1S,2S)-1-(2-фторфенил)-3-(метоксиметокси)пропан-1,2-диол (Пример получения 14) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (1,73 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3H), 1,63 (S, 3H), 1,95-1,98 (m, 1H), 3,88-3,89 (m, 1H), 3,90-3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25-7,66 (m, 4H)
Пример получения 16: 2-йодбензолальдегид
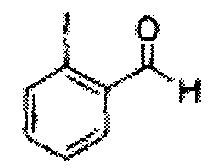
В колбе растворяли 2-йодбензиловый спирт (4 г, 17,09 ммоль) в дихлорметане (МС, 85 мл), а затем туда добавляли оксид марганца (MnO2, 14,86 г, 170,92 ммоль). Полученный продукт реакции перемешивали с обратным холодильником. Когда реакция заканчивалась, полученный продукт реакции охлаждали до комнатной температуры, а затем отфильтровывали и концентрировали с использованием целита для получения целевого соединения (8,6 г, выход 75-90%).
1H ЯМР (400 МГц, CDCl3) δ 7,30-7,99 (m, 4H), 10,10 (s, 1H)
Пример получения 17: (Е)-3-(2-йодфенил)-акриловая кислота
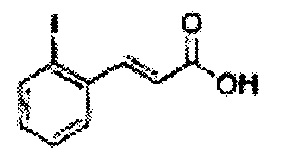
Осуществляли по существу такой же способ, какой описан в Примере получения 9, за исключением того, что для получения целевого соединения использовали 2-йодбензолальдегид (Пример получения 16) вместо 2-фторальдегида (2,06 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 6,60 (d, J=16,0, 1Н), 7,24-7,50 (m, 3H), 7,66 (d, J=16,0, 1H), 7,84 (t, J=8,0, 1H)
Пример получения 18: (Е)-3-(2-йодфенил)-проп-2-ен-1-ол.
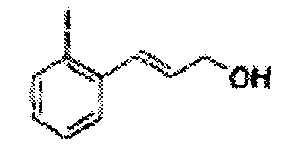
Осуществляли по существу такой же способ, какой описан в Примере получения 1, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-йодфенил)-акриловую кислоту (Пример получения 17) вместо 2-хлоркоричной кислоты (1,08 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,67 (s, 1H), 4,39 (t, J=4,0, 2H), 6,34-6,41 (m, 1H), 7,00-7,38 (m, 4H)
Пример получения 19: (Е)-1-йод-2-(3-(метоксиметокси)проп-1-енил)бензол
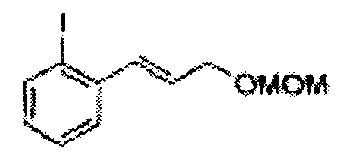
Осуществляли по существу такой же способ, какой описан в Примере получения 2, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-йодфенил)-проп-2-ен-1-ол (Пример получения 18) вместо (Е)-3-(2-хлорфенил)-проп-2-ен-1-ола (Пример получения 1) (1,37 г, 85-95%).
1H ЯМР (400 МГц, CDCl3) δ 3,44 (s, 3H), 4,30 (dd, J=8,0, 1,6, 1H), 4,73 (s, 2H), 6,27-6,34 (m, 1H), 7,02-7,57 (m, 4H).
Пример получения 20: (1R,2R)-1-(2-йодфенил)-3-(метоксиметокси)пропан-1,2-диол
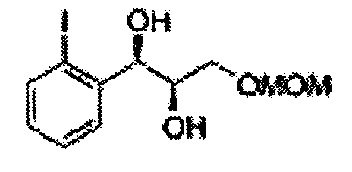
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-1-йод-2-(3-(метоксиметокси)проп-1-енил)бензол (Пример получения 19) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензол (Пример получения 2) (1,32 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1H), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H).
Пример получения 21: ((4R,5R)-5-(2-йодфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
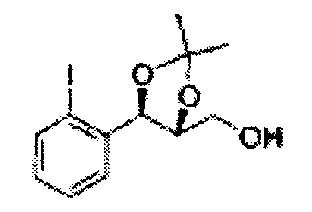
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали (1R,2R)-1-(2-йодфенил)-3-(метоксиметокси)пропан-1,2-диол (Пример получения 20) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (1,33 г, 30-40%).
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3H), 1,63 (s, 3H), 1,95-1,98 (m, 1H), 3,88-3,89 (m, 1H), 3,90-3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25-7,66 (m, 4H)
Пример получения 22: (1S,2S)-1-(2-йодфенил)-3-(метоксиметокси)пропан-1,2-диол
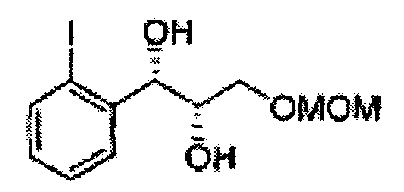
Осуществляли по существу такой же способ, какой описан в Примере получения 4, за исключением того, что для получения целевого соединения использовали (Е)-1-йод-2-(3-(метоксиметокси)проп-1-енил)бензол (Пример получения 19) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (1,32 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ 3,09 (d, J=5,6, 1H), 3,27 (d, J=4,4, 1H), 3,41 (s, 3H), 3,69-3,77 (m, 2H), 3,96-3,99 (m, 1H), 4,69 (s, 2H), 5,19 (t, J=4,4, 1H), 7,23-7,61 (m, 4H)
Пример получения 23: ((4S,5S)-5-(2-йодфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
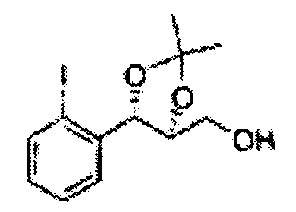
Осуществляли по существу такой же способ, какой описан в Примере получения 6, за исключением того, что для получения целевого соединения использовали (1S,2S)-1-(2-йодфенил)-3-(метоксиметокси)пропан-1,2-диол (Пример получения 22) вместо (1R,2R)-1-(2-хлорфенил)-3-(метоксиметокси)пропан-1,2-диола (Пример получения 3) (1,33 г, 30-40).
1H ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3H), 1,63 (s, 3H), 1,95-1,98 (m, 1H), 3,88-3,89 (m, 1H), 3,90-3,96 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25-7,66 (m, 4H).
Пример получения 24: (Е)-Метил-3-(2-хлорфенил)акрилат
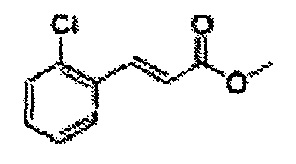
В 250 мл круглодонную колбу добавляли 2-хлоркоричную кислоту (25 г, 136,9 ммоль) и МеОН (56 мл). Добавляли по каплям POCl3 (1,27 мл, 13,6 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение 3-4 часов. Реакционную смесь охлаждали до комнатной температуры, реакцию останавливали 1N Раствором NaOH. Указанную смесь экстрагировали EtOAc и промывали H2O. Водный слой дополнительно экстрагировали EtOAc. Объединенные органические слои осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали под вакуумом (26,98 г, 85-97%)
1H ЯМР (400 МГц, CDCl3) δ 3,84 (s, 3Н), 6,45 (d, J=16,0, 1H), 7,28-7,65 (m, 4H), 8,12 (d, J=16,0, 1H).
Пример получения 25: (2R,3S)-метил-3-(2-хлорфенил)дигидроксипропаноат
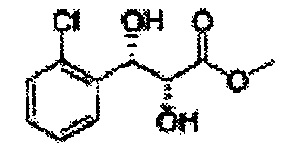
В 1000 мл круглодонную колбу, оснащенную магнитной мешалкой, добавляли 362 мл трет-бутилового спирта, 362 мл воды, K3Fe(CN)6 (135,53 г, 411,63 ммоль), K2CO3 (56,89 г, 411,63 ммоль), (DHQ)2PHAL (1,06 г, 1,37 ммоль), K2OsO2(OH)4, (0,1 г, 0,27 ммоль), и метансульфонамид (13,05 г, 137,21 ммоль) и перемешивали при 0°С. (Е)-Метил-3-(2-хлорфенил)акрилат (26,98 г, Пример получения 24) добавляли сразу же и указанную смесь перемешивали энергично при 0°С в течение ночи. Пока указанную смесь перемешивали при 0°С, добавляли твердый сульфит натрия (Na2SO3, 24,4 г, 193,5 ммоль), EtOAc и воду и оставляли указанную смесь нагреваться до комнатной температуры и перемешивали. После разделения слоя, водный слой добавляли к EtOAc, и водный слой отделяли. Объединенные органические слои дважды промывали 0,3М раствором H2SO4/Na2SO4 (H2SO4 76 мл, H2O 2 л, Na2SO4 360 г). После отделения органического слоя, органический слой промывали Н2О. После отделения указанного слоя, органический слой осушали над безводным MgSO4, отфильтровывали и концентрировали под вакуумом. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (24,42 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3) δ 7,62-7,26 (4H, m), 5,51 (1H, dd, J=7,2, 2,4), 4,50 (1H, dd, J=5,6, 2,4), 3,86 (3H, s), 3,13 (1H, d, J=6,0), 2,79 (1H, d, J=7,2)
Пример получения 26: (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
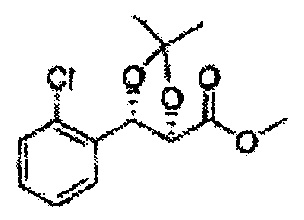
Дихлорметан (ДХМ) добавляли к (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноату (24,4 г, Пример получения 25) и охлаждали до 0°С. Добавляли 2,2-диметоксипропан (26 мл, 211,77 ммоль) и р-толуолсульфоновую кислоту (2 г, 10,58 ммоль) и перемешивали при комнатной температуре. Реакцию останавливали Н2О, экстрагировали ДХМ, промывали H2O, осушали над безводным сульфатом магния, отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (23,6 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,63 (s, 3Н), 1,65 (s, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,62 (d, J=7,6, 1H), 7,28-7,64 (m, 4H)
Пример получения 27: ((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол

Раствор ЛАГ (LiAlH4 3,31 г, 87,25 ммоль) в ТГФ добавляли по каплям к раствору (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилату (23,6 г, Пример получения 26) в ТГФ при 0°С и указанную смесь перемешивали при комнатной температуре. Реакцию останавливали H2O при 0°С, отфильтровывали на целите с EtOAc, промывали EtOAc, осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (21,13 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3) δ 1,57 (s, 3Н), 1,64 (s, 3Н), 1,98 (m, 1H), 3,76-3,83 (m, 1H), 3,88-3,90 (m, 2H), 5,41 (d, J=8,4, 1H), 7,25-7,66 (m, 4H)
Пример получения 28: (Е)-метил-3-(2,4-дихлорфенил)акрилат
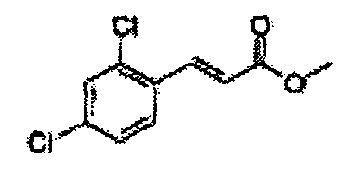
Осуществляли по существу такой же способ, какой описан в Примере получения 24, за исключением того, что для получения целевого соединения использовали 2,4-дихлоркоричную кислоту вместо 2-хлоркоричной кислоты (9,7 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ 3,84 (S, 3Н), 6,44 (d, J=16, 1Н), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,55 (d, J=8,4, 1H), 8,04 (d, J=16, 1H).
Пример получения 29: (2R,3S)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат
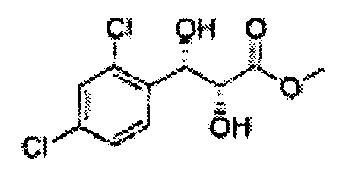
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2,4-дихлорфенил)акрилат (Пример получения 28) вместо (Е)-метил-3-(2-хлорфенил)акрилата (Пример получения 24) (3,8 г, 60-80%)
1Н ЯМР (400 МГц, CDCl3): δ 3,11 (s, 1H), 3,88 (s, 3Н), 4,42 (d, J=2,4, H), 5,43 (d, J=2,0, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,55 (d, J=8,4, 1H).
Пример получения 30: (4R,5S)-метил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
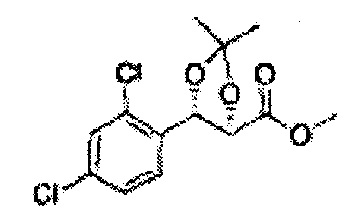
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 29) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (3,5 г, 60-80%)
1H ЯМР (400 МГц, CDCl3): δ 1,59 (s, 3Н). 1,63 (d, J=8,8, 3Н), 3,78 (s, 3Н), 4,25 (d, J=7,6, 1H), 5,56 (d, J=8,0, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,56 (d, J=8,4, 1H).
Пример получения 31: ((4S,5S)-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
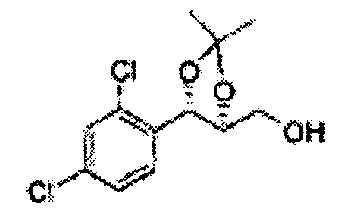
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 30) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,56 (s, 3Н), 1,62 (d, J=4,8, 6H), 1,97 (dd, J=7,6, J=7,2, 1H), 3,75-3,80 (m, 1H), 3,82-3,86 (m, 1H), 3,89-3,94 (m, 1H), 5,36 (d, J=8,4, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,56 (d, J=8,4, 1H).
Пример получения 32: (Е)-этил-3-(2,6-дихлорфенил)акрилат
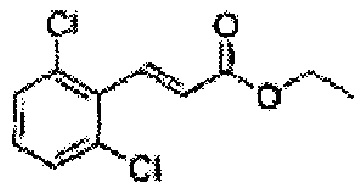
К перемешиваемому раствору 2,6-дихлорбензальдегида (5,0 г, 28,56 ммоль) в ТГФ добавляли триэтилфосфонацетат (6,4 г, 28,56 ммоль) при 0°С. Реакционную смесь добавляли в t-BuOK (3,2 г, 28,56 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение 10 часов, затем реакцию останавливали 1N HCl, разбавляли эфиром, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали на хроматографической колонке с SiO2 (4,3 г, 40-60%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (t, J=3,6, 3Н), 4,31 (q, J=3,7, 2H), 6,61 (d, J=16, 1H), 7,21 (t, J=4,2, 1H), 7,38 (d, J=5,2, 1H), 7,81 (d, J=16, 1H).
Пример получения 33: (2R,3S)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат
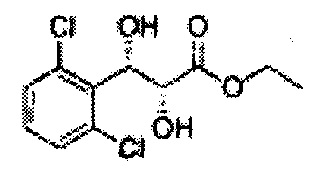
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2,6-дихлорфенил)акрилат (Пример получения 32) вместо (Е)-Метил-3-(2-хлорфенил)акрилата (Пример получения 24) (3,9 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): s 1,21 (t, J=7,2, 3Н), 3,22 (s; 1H), 3,69 (s, 1H), 4,20-4,28 (m, 1H), 4,70 (d, J=5,2, 1H), 5,62 (d, J=5,6, 1H), 7,19-7,36 (m, 3Н).
Пример получения 34: (4R,5S)-этил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
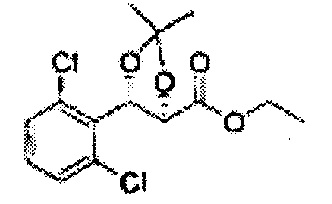
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 29) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (4,1 г, 60-90%).
1Н ЯМР (400 МГц, CDCl3) δ 1,26 (t, J=7,2, 3Н), 1,58 (s, 3Н), 1,70 (s, 3Н), 3,77 (s, 3H), 4,24 (q, J=7,2, 1H), 4,95 (q, J=4,4, 1H), 5,95 (q, J=3,0, 1H), 7,20-7,39 (m, 3Н).
Пример получения 35: ((4S,5S)-5-(2,6-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
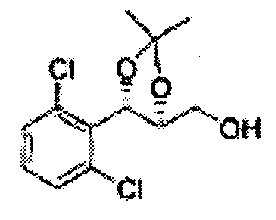
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-этил-5-(2,6-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 33) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,55 (s, 3Н), 1,68 (s, 3Н), 3,66 (q, J=5,5, 1H), 3,85 (q, J=5,1, 1H), 4,56-4,61 (m, H), 5,78 (d, J=9,2, 1H), 7,19-7,37 (m, 3Н).
Пример получения 36: (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат
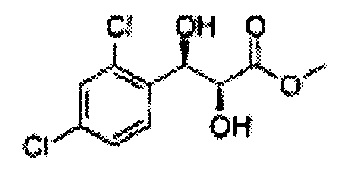
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2,4-дихлорфенил)акрилат (Пример получения 28) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (2,4 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3): δ 3,11 (s, 1H), 3,88 (s, 3Н), 4,42 (d, J=2,4, 1H), 5,43 (d, J=2,0, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,55 (d, J=8,4, 1H).
Пример получения 37: (4S,5R)-метил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат

Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 36) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (3,2 г, 60-80%)
1Н ЯМР (400 МГц, CDCl3): δ 1,59 (s, 3Н), 1,63 (d, J=8,8, 3Н), 3,78 (s, 3Н), 4,25 (d, J=7,6, 1H), 5,56 (d, J=8,0, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,56 (d, J=8,4, 1H).
Пример получения 38: ((4R,5R)-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
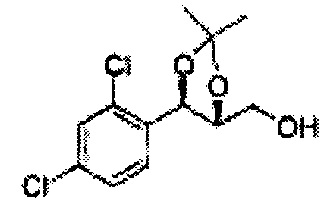
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 37) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,56 (s, 3Н), 1,62 (d, J=4,8, 6H), 1,97 (dd, J=7,6, J=7,2, 1H), 3,75-3,80 (m, 1H), 3,82-3,86 (m, 1H), 3,89-3,94 (m, 1H), 5,36 (d, J=8,4, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,56 (d, J=8,4, 1H).
Пример получения 39: (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат
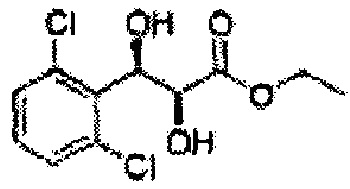
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2,6-дихлорфенил)акрилат (Пример получения 32) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (2,8 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3): δ 3,11 (s, 1H), 3,88 (s, 3Н), 4,42 (d, J=2,4, 1H), 5,43 (d, J=2,0, 1H), 7,28-7,33 (m, 1H), 7,41 (d, J=2,0, 1H), 7,55 (d, J=8,4, 1H). 1H ЯМР (400 МГц, CDCl3): δ=1,21 (t, J=7,2, 3H), 3,22 (s, 1H), 3,69 (s, 1H), 4,20-4,28 (m, 1H), 4,70 (d, J=5,2, 1H), 5,62 (d, J=5,6, 1H). 7,19-7,36 (m, 3H).
Пример получения 40: (4S,5R)-этил-5-(2,4-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
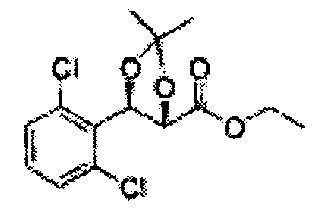
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 39) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (4,1 г, 60-90%)
1Н ЯМР (400 МГц, CDCl3): δ 1,26 (t, J=7,2, 3H), 1,58 (s, 3H), 1,70 (s, 3H), 3,77 (S, 3H), 4,24 (q, J=7,2, 1H), 4,95 (q, J=4,4, 1H), 5,95 (q, J=3,0, 1H), 7,20-7,39 (m, 3H).
Пример получения 41: ((4R,5R)-5-(2,6-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
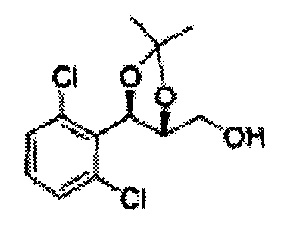
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-этил-5-(2,6-дихлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 40) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (5,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3) δ 1,55 (s, 3H), 1,68 (s, 3H), 3,66 (q, J=5,5, 1H), 3,85 (q, J=5,1, 1H), 4,56-4,61 (m, 1H), 5,78 (d, J=9,2, 1H), 7,19-7,37 (m, 3H).
Пример получения 42: (Е)-3-(2-нитрофенил)-акриловая кислота
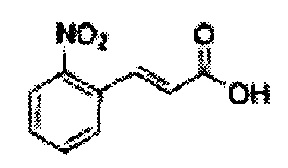
Осуществляли по существу такой же способ, какой описан в Примере получения 9, за исключением того, что для получения целевого соединения использовали 2-нитробензолальдегид вместо 2-фторальдегида (2,06 г, 70-90%)
1Н ЯМР (400 МГц, ДМСО) δ 6,52 (d, J=15,6, 1H), 7,65 (t, J=8,1, 1H), 7,75 (t, J=7,4, 1H), 7,83 (d, J=15,8, 1H), 7,92 (dd, J=7,6, 1,1, 1H), 8,05 (dd, J=8,1, 1,2, 1H)
Пример получения 43: (Е)-метил-3-(2-нитрофенил)акрилат
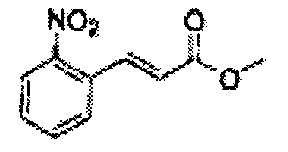
Осуществляли по существу такой же способ, какой описан в Примере получения 24, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-нитрофенил)-акриловую кислоту (Пример получения 42) вместо 2-хлоркоричной кислоты (15,8 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3) δ 3,80 (s, 3Н), 6,34 (d, J=15,9 Гц, 1H), 7,49-7,68 (m, 4H), 8,01 (d, J=7,9 Гц, 1H), 8,08 (d, J=15,9, 1H).
Пример получения 44: (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат
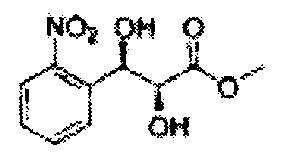
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-нитрофенил)акрилат (Пример получения 43) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (12,5 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3): δ=4,31 (s, 3Н), 5,44 (m, 4H), 5,89 (s, 1H), 7,53-7,90 (m, 4H).
Пример получения 45: (4S,5R)-метил-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
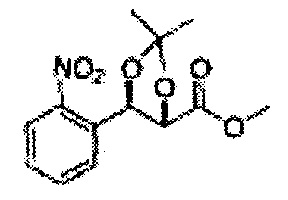
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 44) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (11 г, 60-80%)
1Н ЯМР (400 МГц, CDCl3): δ 1,38 (s, 3Н), 1,40 (s, 3Н), 3,75 (s, 3Н), 4,49 (d, J=7,4, 1H), 5,25 (d, 7,4, 1H), 7,48-7,77 (m, 3Н, 8,08 (m, 1H)
Пример получения 46: ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
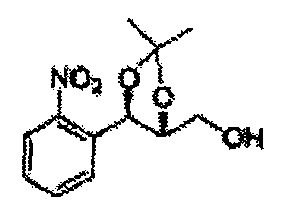
Осуществляли по существу такой же способ, какой описан в Примере получения 27 за исключением того, что (4S,5R)-метил-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 45) использовали вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (13,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,38 (s, 3Н), 1,40 (s, 3Н), 3,89 (d, J=4,1, 2H), 4,26 (dt, J=7,0, 4,1, 1H), 5,26 (d, J=7,0, 1H), 7,55-7,86 (m, 3Н), 8,08 (m, 1H).
Пример получения 47: ((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
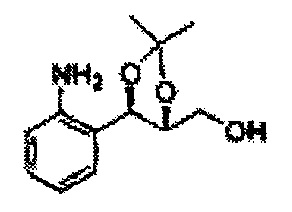
К перемешиваемому раствору ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46, 14 г) в EtOAc добавляли Pd(OH)2 (20 вес.%, 2,8 г) в атмосфере водорода (баллон). Указанную смесь перемешивали в течение 6 часов, затем полученную смесь отфильтровывали через целит и концентрировали при пониженном давлении. Неочищенный продукт очищали на хроматографической колонке с SiO2 для получения целевого соединения (7,5 г, 65-85).
1Н ЯМР (400 МГц, CDCl3): δ 1,39 (s, 3Н), 1,40 (s, 3Н), 3,88 (d, J=4,27, 2H), 3,99 (dt, J=7,02, J=4,30, 1H), 4,74 (d, J=7,02, 1H), 6,65-6,72 (m, 2H), 6,98 (m, 1H), 7,25 (m, 1H).
Пример получения 48: (2R,3S)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат
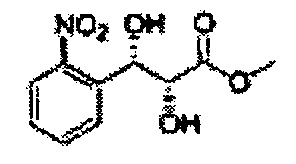
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-нитрофенил)акрилат (Пример получения 43) вместо (Е)-метил-3-(2-хлорфенил)акрилата (Пример получения 24) (21,7 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): δ 4,31 (s, 3Н), 5,44 (m, 4H), 5,89 (s, 1H), 7,53-7,90 (m, 4H).
Пример получения 49: (4R,5S)-метил-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
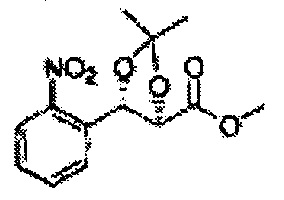
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 48) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (21 г, 60-90%).
1Н ЯМР (400 МГц, CDCl3): δ 1,38 (s, 3Н), 1,40 (s, 3Н), 3,75 (s, 3Н), 4,49 (d, J=7,4, 1H), 5,25 (d, J=7,4, 1H), 7,48-7,77 (m, 3Н, 8,08 (m, 1H)
Пример получения 50: ((4S,5S)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
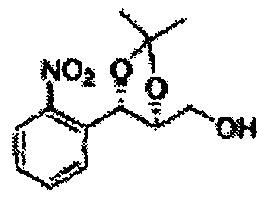
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 48) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (14 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 61,38 (s, 3Н), 1,40 (s, 3Н), 3,89 (d, J=4,1, 2H), 4,26 (dt, J=7,0, 4,1, 1H), 5,26 (d, J=7,0, 1H), 7,55-7,86 (m, 3Н), 8,08 (m, 1H).
Пример получения 51: ((4S,5S)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
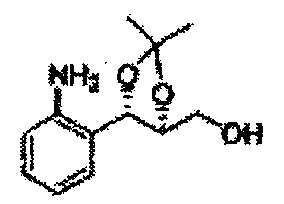
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали (4S,5S)-метил-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 50) вместо (4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (11 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 51,38 (s, 3Н), 1,40 (s, 3Н), 3,89 (d, J=4,1, 2H), 4,26 (dt, J=7,0, 4,1, 1H), 5,26 (d, J=7,0, 1H), 7,55-7,86 (m, 3Н), 8,08 (m, 1H).
Пример получения 52: (Е)-3-о-толилакриловая кислота

Осуществляли по существу такой же способ, какой описан в Примере получения 9, за исключением того, что для получения целевого соединения использовали 2-метилбензолальдегид вместо 2-фторальдегида для получения целевого соединения (1,5 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ 2,48 (s, 3Н), 6,16 (d, J=15,1, 1H), 7,00-7,10 (m, 1H), 7,21-7,26 (m, 3Н), 8,04 (d, J=15,1, 1H), 11,0 (s, 1H).
Пример получения 53: (Е)-Метил-3-о-толилакрилат
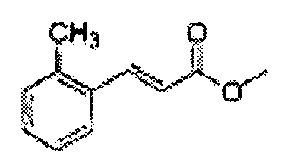
Осуществляли по существу такой же способ, какой описан в Примере получения 24, за исключением того, что для получения целевого соединения использовали (Е)-3-о-толилакриловую кислоту (Пример получения 52) вместо 2-хлоркоричной кислоты (1,5 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3) δ 2,48 (s, 3Н), 3,77 (s, 3Н), 6,14 (d, J=15,1, 1H), 7,00-7,10 (m, 1H), 7,21-7,26 (m, 3Н), 8,07 (d, J=15,1, 1H).
Пример получения 54: (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат
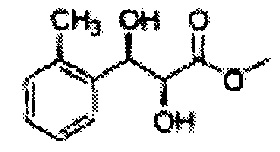
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-о-толилакрилат (Пример получения 53) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (1,3 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3): δ 2,34 (s, 3Н), 2,80 (s, 1H), 3,65 (s, 1H), 3,68 (s, 3Н), 4,52 (d, J=7,0, 1H), 5,22 (d, J=7,0, 1H), 7,19-7,39 (m, 4H).
Пример получения 55: (4S,5R)-метил-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
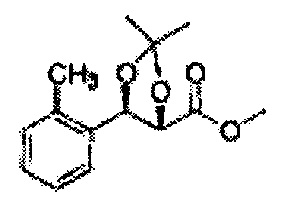
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат (Пример получения 54) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (1,7 г, 60-80)
1Н ЯМР (400 МГц, CDCl3): δ 1,27 (s, 6H), 2,34 (s, 3Н), 3,68 (s, 3Н), 5,11 (d, J=7,0, 1H), 5,81 (d, J=7,0, 1H), 7,19-7,26 (m, 3Н), 7,37-7,39 (m, 1H).
Пример получения 56: ((4R,5R)-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
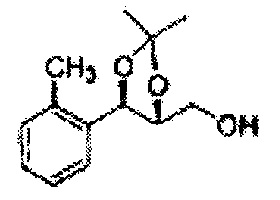
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 55) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,27 (s, 6H), 2,34 (s, 3Н), 3,52-3,60 (m, 2H), 3,65 (s, 1H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,26 (m, 3Н), 7,37-7,39 (m, 1H).
Пример получения 57: (2R,3S)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат
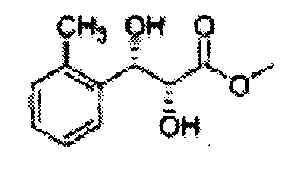
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-о-толилакрилат (Пример получения 53) вместо (Е)-метил-3-(2-хлорфенил)акрилата (Пример получения 24) (1,7 г, 60-80%)
1H ЯМР (400 МГц, CDCl3): δ 2,34 (s, 3Н), 2,80 (s, 1H), 3,65 (s, 1H), 3,68 (s, 3Н), 4,52 (d, J=7,0, 1H), 5,22 (d, J=7,0, 1H), 7,19-7,39 (m, 4H).
Пример получения 58: (4R,5S)-метил-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
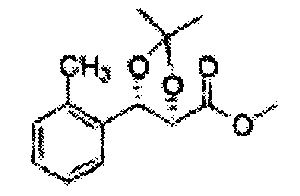
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат (Пример получения 57) вместо (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (1,9 г, 60-90%)
1Н ЯМР (400 МГц, CDCl3): δ 1,27 (s, 6Н), 2,34 (s. 3Н), 3,68 (s, 3Н), 5,11 (d, J=7,0, 1H), 5,81 (d, J=7,0, 1H), 7,19-7,26 (m, 3Н), 7,37-7,39 (m, 1H).
Пример получения 59: ((4S,5S)-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
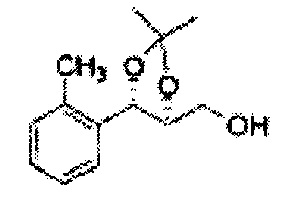
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-метилфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 58) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,27 (s, 6Н), 2,34 (s, 3Н), 3,52-3,60 (m, 2H), 3,65 (s, 1H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,26 (m, 3Н), 7,37-7,39 (m, 1H).
Пример получения 60: ((4S,5R)-метил-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
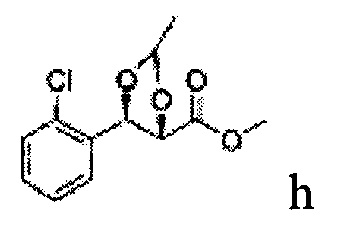
Дихлорметан (МС) добавляли к 2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноату (Пример получения 433) при комнатной температуре. 1,1-Диэтоксиэтан (8 мл) и р-толуолсульфоновую кислоту (0,27 г) добавляли и перемешивали при комнатной температуре. Реакцию останавливали Н2О, экстрагировали МС, промывали H2O, осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (3,6 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3H), 3,78 (s, 3H), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,28-7,64 (m, 4H)
Пример получения 61: ((4R,5R)-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-ил)метанол
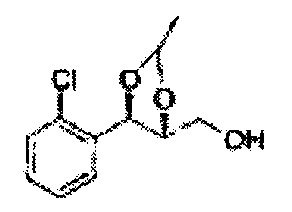
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 60) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,26 (m, 3H), 7,37-7,39 (m, 1H).
Пример получения 62: ((4R,5S)-метил-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
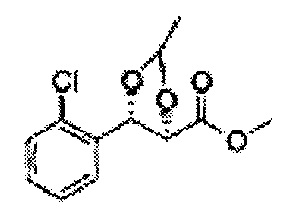
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноат (Пример получения 25) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 54) (2,1 г, 70-95).
1Н ЯМР (400 МГц, CDCl3): δ 1,36 (d, J=6,4, 3H), 3,78 (s, 3H), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,28-7,64 (m, 4H)
Пример получения 63: ((4S,5S)-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-ил)метанол
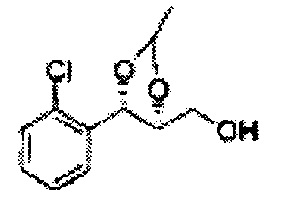
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-хлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 62) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,26 (m, 3H), 7,37-7,39 (m, 1H).
Пример получения 64: (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
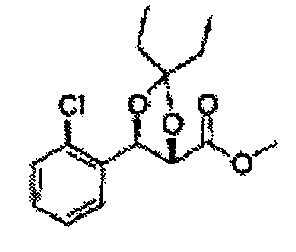
3-пентанон добавляли к (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноату (Пример получения 433) при комнатной температуре. Серную кислоту (H2SO4) добавляли и перемешивали при комнатной температуре. Реакцию останавливали H2O, экстрагировали ЕА, промывали Н2О, осушали над безводным сульфатом натрия (Na2SO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,6 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6H), 1,59 (m, 4H), 3,67 (s, 3H), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,22-7,60 (m, 4H)
Пример получения 65: ((4R,5R)-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
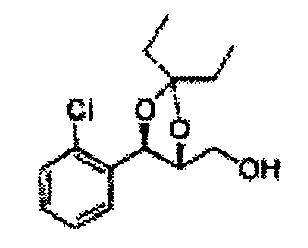
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 64) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (2,0 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6H), 1,59 (m, 4H), 3,66 (d, J=8,0, 2H), 5,09 (d, J=7,6, 1H), 5,88 (d, J=7,6, 1H), 7,26-7,62 (m, 4H).
Пример получения 66: (4R,5S)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат.
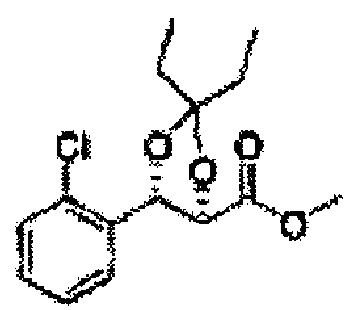
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноат (Пример получения 25) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 54) (1,4 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,22-7,60 (m, 4Н)
Пример получения 67: ((4S,5S)-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
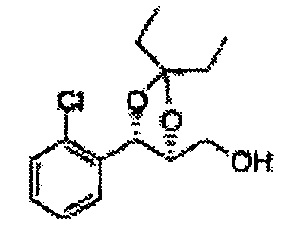
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 66) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (2,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,66 (d, J=8,0, 2H), 5,09 (d, J=7,6, 1H), 5,88 (d, J=7,6, 1H), 7,26-7,62 (m, 4Н).
Пример получения 68: (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
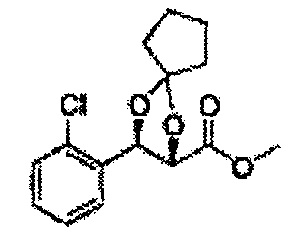
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4Н), 1,82-1,86 (m, 1H), 1,91-2,00 (m, 3Н), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,39-7,61 (m, 4Н)
Пример получения 69: ((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
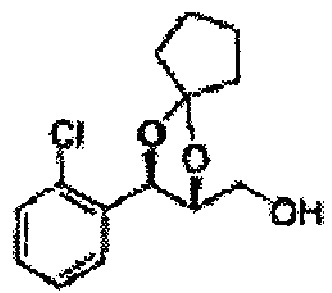
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 68) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,7 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 1Н), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1Н), 7,34-7,58 (m, 4Н)
Пример получения 70: (2R,3S)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
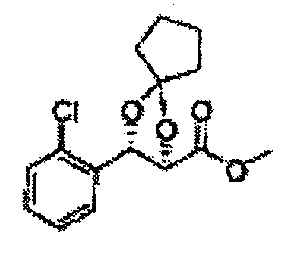
Осуществляли по существу такой же способ, какой описан в Примере получения 68, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноат (Пример получения 25) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (1,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4Н), 1,82-1,86 (m, 1Н), 1,91-2,00 (m, 3H), 3,68 (s 3H), 4,40 (d, J=7,2, 1Н), 5,39 (d, J=7,2, 1Н), 7,39-7,61 (m, 4Н)
Пример получения 71: ((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
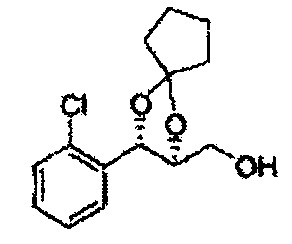
Осуществляли по существу такой же способ, какой описан в Примере получения 69, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 70) вместо (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 68) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 1Н), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1Н), 7,34-7,58 (m, 4Н)
Пример получения 72: (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
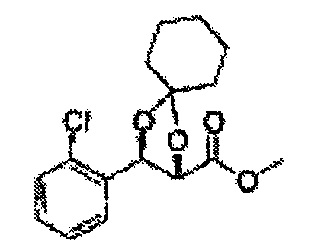
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали циклогексанон вместо 3-пентанона (1,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н). 3,79 (s, 3Н), 4,33 (d, J=8,0, 1Н), 5,85 (d, J=8,0, 1H), 7,35-7,63 (m, 4Н)
Пример получения 73: ((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
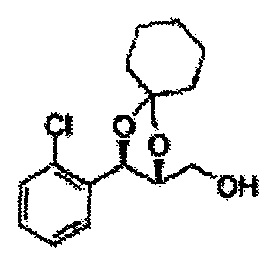
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 72) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,48-7,87 (m, 4Н)
Пример получения 74: (2R,3S)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
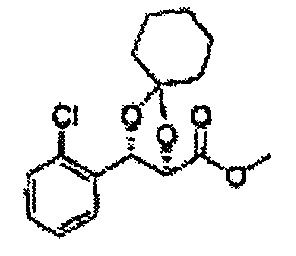
Осуществляли по существу такой же способ, какой описан в Примере получения 72, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноат (Пример получения 25) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,1 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н). 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,35-7,63 (m, 4Н)
Пример получения 75: ((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
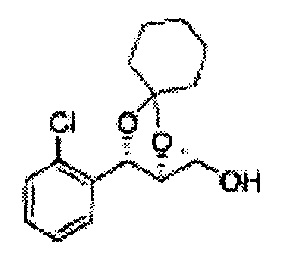
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 74) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,6 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,48-7,87 (m, 4H)
Пример получения 76: (4S,5R)-метил-5-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
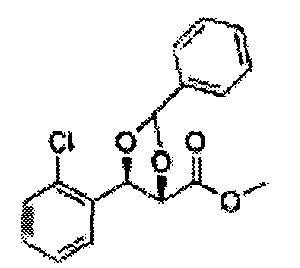
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали бензальдегид вместо 3-пентанона (1,1 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,35-7,63 (m, 4H)
Пример получения 77: ((4R,5R)-5-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
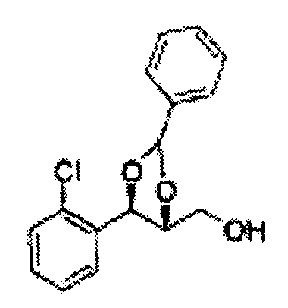
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 76) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,48-7,87 (m, 4H)
Пример получения 78: (4R,5S)-метил-5-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
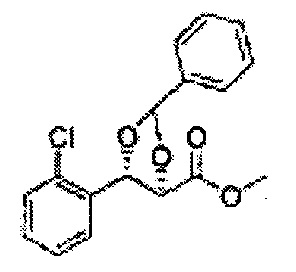
Осуществляли по существу такой же способ, какой описан в Примере получения 66, за исключением того, что для получения целевого соединения использовали бензальдегид вместо 3-пентанона (1,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1Н), 5,85 (d, J=8,0, 1Н), 7,35-7,63 (m, 4Н)
Пример получения 79: ((4S,5S)-5-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
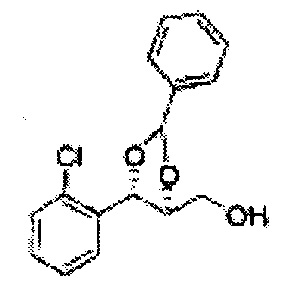
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 78) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,48-7,87 (m, 4H)
Пример получения 80: (Е)-метил-3-(2-фторфенил)акрилат
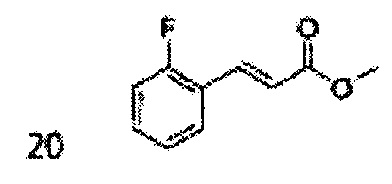
Осуществляли по существу такой же способ, какой описан в Примере получения 24, за исключением того, что для получения целевого соединения использовали (Е)-3(2-фторфенил)-акриловую кислоту (Пример получения 9) вместо 2-хлоркоричной кислоты для получения целевого соединения (6,98 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ 3,84 (s, 3Н), 6,45 (d, J=16,0, 1H), 7,24-7,62 (m, 4H), 8,12 (d, J=16,0, 1H)
Пример получения 81: (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат
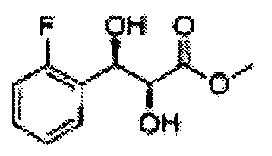
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-фторфенил)акрилат (Пример получения 80) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (7,5 г, 75-90).
1H ЯМР (400 МГц, CDCl3): δ=4,31 (s, 3Н), 5,44 (m, 4Н), 5,89 (s, 1Н), 7,32-7,70 (m, 4H).
Пример получения 82: (2R,3S)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат
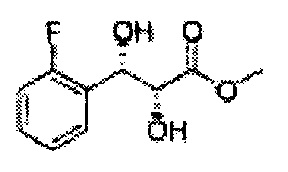
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-фторфенил)акрилат (Пример получения 80) вместо (Е)-метил-3-(2-хлорфенил)акрилата(Пример получения 24) (7,2 г, 60-80%)
1Н ЯМР (400 МГц, CDCl3): δ=4,31 (s, 3Н), 5,44 (m, 4H), 5,89 (s, 1H), 7,32-7,70 (m, 4H).
Пример получения 83: ((4S,5R)-метил-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-карбоксилат
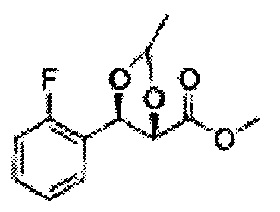
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 81) вместо ((2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (3,1 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1Н), 5,07 (m, 1Н), 5,62 (d, J=7,6, H), 7,29-7,67 (m, 4H)
Пример получения 84: ((4R,5R)-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-ил)метанол
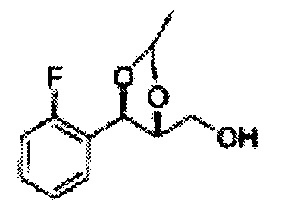
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 83) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н). 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,39 (m, 4H).
Пример получения 85: ((4R,5S)-метил-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-карбоксилат
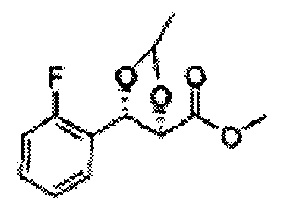
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 82) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,9 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,29-7,69 (m, 4H)
Пример получения 86: ((4S,5S)-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-ил)метанол
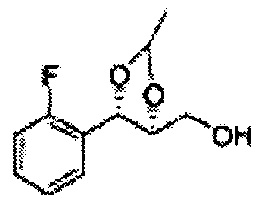
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-фторфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 85) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (3,8 г, 70-95%)
1Н ЯМР (400 МГц, С CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,19-7,4,2 (m, 4H).
Пример получения 87: (4S,5R)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
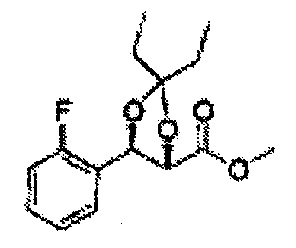
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 81) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,1 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,20-7,61 (m, 4Н)
Пример получения 88: ((4R,5R)-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
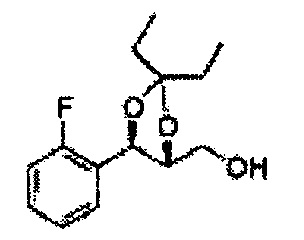
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 87) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (2,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,66 (d, J=8,0, 2H), 5,09 (d, J=7,6, 1H), 5,88 (d, J=7,6, 1H), 7,23-7,60 (m, 4Н).
Пример получения 89: (4R,5S)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
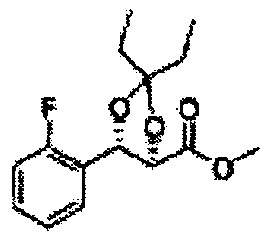
Осуществляли по существу такой же способ, какой описан в Примере получения 87, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 82) вместо (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноата (Пример получения 81) (2,3 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,20-7,61 (m, 4Н)
Пример получения 90: ((4S,5S)-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
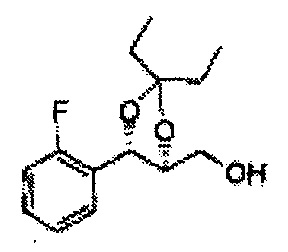
Осуществляли по существу такой же способ, какой описан в Примере получения 88, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 89) вместо (4S,5R)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 87) (2,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6H), 1,59 (m, 4H), 3,66 (d, J=8,0, 2H), 5,09 (d, J=7,6, 1H), 5,88 (d, J=7,6, 1H), 7,23-7,62 (m, 4H)
Пример получения 91: (2S,3R)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
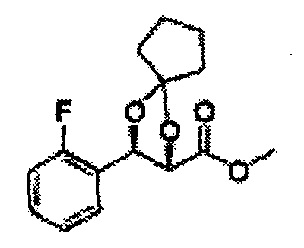
Осуществляли по существу такой же способ, какой описан в Примере получения 87, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,1 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4H), 1,82-1,86 (m, 1H), 1,91-2,00 (m, 3Н), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,33-7,62 (m, 4H)
Пример получения 92: ((2R,3R)-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
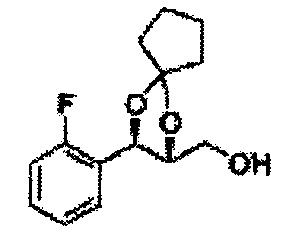
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 91) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,9 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 1Н), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1Н), 7,32-7,57 (m, 4Н)
Пример получения 93: (2R,3S)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
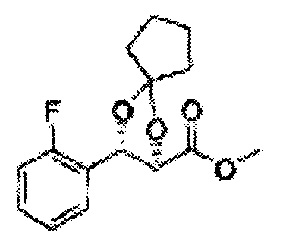
Осуществляли по существу такой же способ, какой описан в Примере получения 91, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 82) вместо (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноата (Пример получения 81) (1,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4Н), 1,82-1,86 (m, 1Н), 1,91-2,00 (m, 3Н), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1Н), 5,39 (d, J=7,2, 1Н), 7,39-7,61 (m, 4Н)
Пример получения 94: ((2R,3R)-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
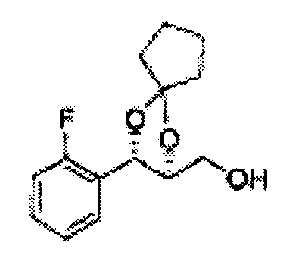
Осуществляли по существу такой же способ, какой описан в Примере получения 88, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 93) вместо (4S,5R)-метил-5-(2-фторфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 87) (1,2 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 1Н), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1Н), 7,38-7,63 (m, 4Н)
Пример получения 95: (2S,3R)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
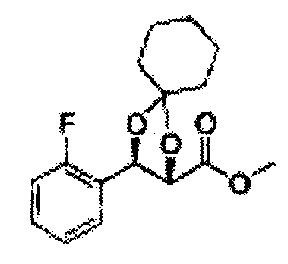
Осуществляли по существу такой же способ, какой описан в Примере получения 91, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,7 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1Н), 5,85 (d, J=8,0, 1Н), 7,37-7,63 (m, 4Н)
Пример получения 96: ((2R,3R)-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
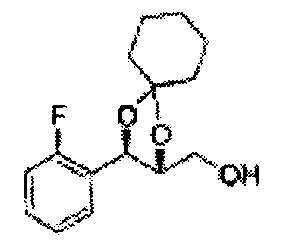
Осуществляли по существу такой же способ, какой описан в Примере получения 73, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 95) вместо (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 72) (1,4 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,42-7,89 (m, 4H)
Пример получения 97: (2R,3S)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
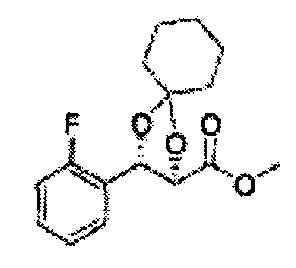
Осуществляли по существу такой же способ, какой описан в Примере получения 95, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноат (Пример получения 82) вместо (2S,3R)-метил-3-(2-фторфенил)-2,3-дигидроксипропаноата (Пример получения 81) (1,8 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,32-7,64 (m, 4H)
Пример получения 98: ((2S,3S)-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
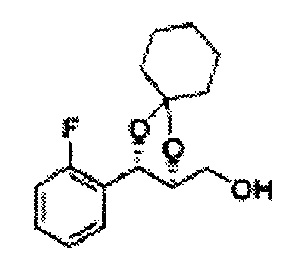
Осуществляли по существу такой же способ, какой описан в Примере получения 96, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 97) вместо (2S,3R)-метил-3-(2-фторфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 95) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,33-7,67 (m, 4H)
Пример получения 99: (4S,5R)-метил-5-(2-фторфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
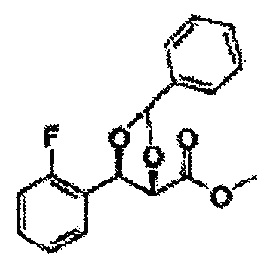
Осуществляли по существу такой же способ, какой описан в Примере получения 87, за исключением того, что для получения целевого соединения использовали бензальдегид вместо 3-пентанона (1,6 г, 50-70%).
1H ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,83 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,33-7,64 (m, 4H)
Пример получения 100: ((4R,5R)-5-(2-фторфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
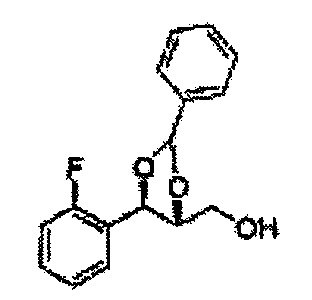
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-фторфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 99) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,43-7,85 (m, 4H)
Пример получения 101: (4R,5S)-метил-5-(2-фторфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
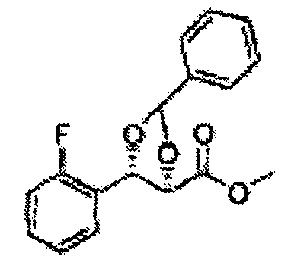
Осуществляли по существу такой же способ, какой описан в Примере получения 89, за исключением того, что для получения целевого соединения использовали бензальдегид вместо 3-пентанона (1,7 г, 50-70%).
1H ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0,1Н), 5,85 (d, J=8,0, 1H), 7,33-7,64 (m, 4H)
Пример получения 102: ((4S,5S)-5-(2-фторфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
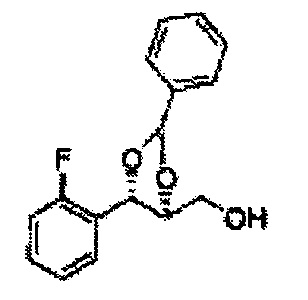
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-фторфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 101) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,1 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,43-7,85 (m, 4H)
Пример получения 103: (Е)-метил-3-(2-йодфенил)акрилат
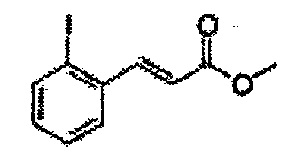
Осуществляли по существу такой же способ, какой описан в Примере получения 24, за исключением того, что для получения целевого соединения использовали (Е)-3-(2-йодфенил)-акриловую кислоту (Пример получения 17) вместо 2-хлоркоричной кислоты (3,2 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ 3,84 (s, 3Н), 6,45 (d, J=16,0, 1H), 7,01-7,35 (m, 4H), 8,09 (d, J=16,0, 1H)
Пример получения 104: (2S,3R)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат
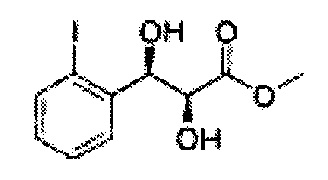
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-йодфенил)акрилат (Пример получения 103) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (3,2 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ=4,31 (s, 3Н), 5,44 (m, 4H), 5,89 (s, 1H), 7,30-7,71 (m, 4H).
Пример получения 105: (2R,3S)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат
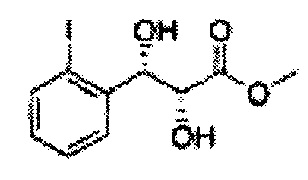
Осуществляли по существу такой же способ, какой описан в Примере получения 25, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-йодфенил)акрилат (Пример получения 103) вместо (Е)-метил-3-(2-хлорфенил)акрилата (Пример получения 24) (3,1 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): δ=4,31 (s, 3Н), 5,44 (m, 4H), 5,89 (s, 1H), 7,31-7,72 (m, 4H).
Пример получения 106: ((4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилат
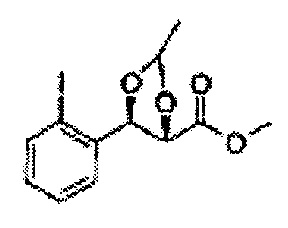
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат (Пример получения 104) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,7 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,29-7,70 (m, 4H)
Пример получения 107: ((4R,5R)-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-ил)метанол
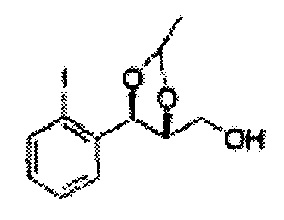
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 106) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (2,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17-7,41 (m, 4H).
Пример получения 108: ((4R,5S)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилат
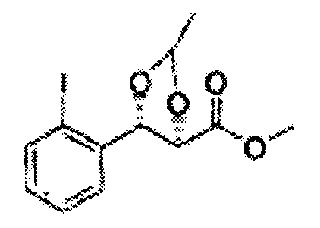
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат (Пример получения 104) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,4 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,29-7,70 (m, 4H)
Пример получения 109: ((4S,5S)-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-ил)метанол
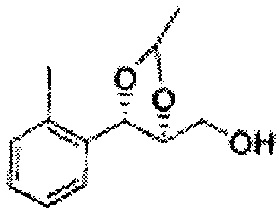
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 108) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,9 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17-7,41 (m, 4H)
Пример получения 110: (4S,5R)-метил-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
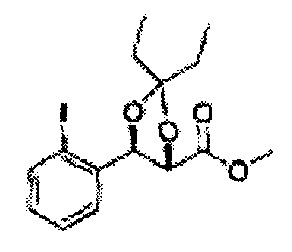
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат (Пример получения 104) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,6 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,23-7,65 (m, 4Н)
Пример получения 111: ((4R,5R)-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
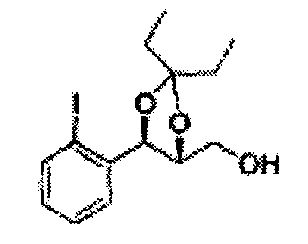
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 110) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (2,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17-7,41 (m, 4Н)
Пример получения 112: (4R,5S)-метил-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
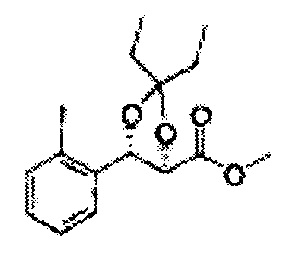
Осуществляли по существу такой же способ, какой описан в Примере получения 110, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноат (Пример получения 105) вместо (2S,3R)-метил-3-(2-йодфенил)-2,3-дигидроксипропаноата (Пример получения 104) (2,3 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3H), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,20-7,61 (m, 4H)
Пример получения 113: ((4S,5S)-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
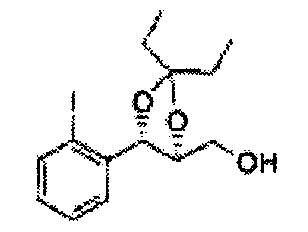
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-йодфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 112) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н). 4,36 (dd, J=7;0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17-7,41 (m, 4H)
Пример получения 114: (2S,3R)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
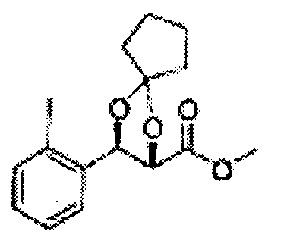
Осуществляли по существу такой же способ, какой описан в Примере получения 110, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,7 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4H), 1,82-1,86 (m, 1H), 1,91-2,00 (m, 3Н), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,19-7,44 (m, 4H)
Пример получения 115: ((2R,2R)-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
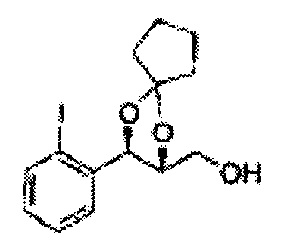
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 114) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (2,1 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 1H), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1H), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,20-7,45 (m, 4H)
Пример получения 116: (2R,3S)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
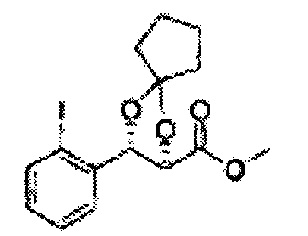
Осуществляли по существу такой же способ, какой описан в Примере получения 112, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,9 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4Н), 1,82-1,86 (m, 1Н), 1,91-2,00 (m, 3H), 3,68 (s, 3H), 4,40 (d, J=7,2, 1Н), 5,39 (d, J=7,2, 1Н), 7,19-7,44 (m, 4Н)
Пример получения 117: ((2S,2S)-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
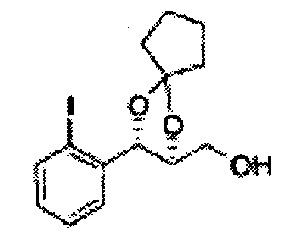
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 116) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 1Н), 3,52-3,65 (m, 2Н), 3,82-3,86 (m, 1Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1Н), 7,20-7,45 (m, 4Н)
Пример получения 118: (2S,3R)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
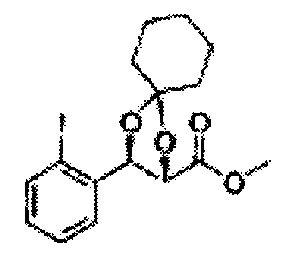
Осуществляли по существу такой же способ, какой описан в Примере получения 114, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,9 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3H), 4,33 (d, J=8,0, 1Н), 5,85 (d, J=8,0, 1Н), 7,17-7.3 (m, 4Н)
Пример получения 119: ((2R,3R)-3-(2-йодфенил)-1,4-диоксаспиро[4,5]-декан-2-ил)метанол
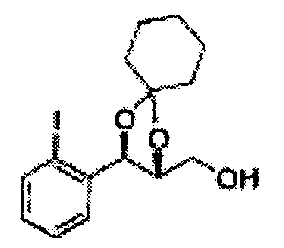
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 118) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,19-7,49 (m, 4H)
Пример получения 120: (2R,3S)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
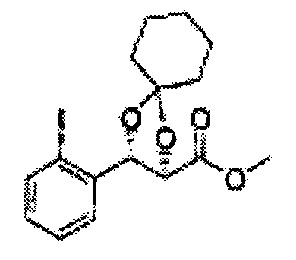
Осуществляли по существу такой же способ, какой описан в Примере получения 116, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,3 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) 51,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1Н), 7,17-7,43 (m, 4Н)
Пример получения 121: ((2S,3S)-3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
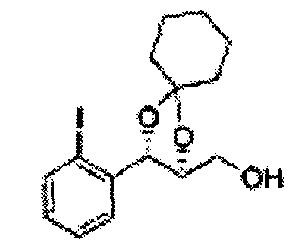
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-йодфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 120) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,19-7,49 (m, 4H)
Пример получения 122: (4S,5R)-метил-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
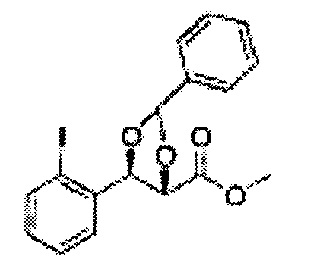
Осуществляли по существу такой же способ, какой описан в Примере получения 118, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) 63,67 (s, 3Н), 5,11 (d, J=8,0, 1H), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-7,57 (m, 9H)
Пример получения 123: ((4R,5R)-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
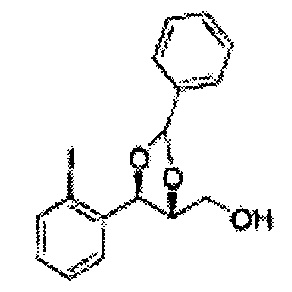
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 122) вместо (4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,4 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 3,66 (d, J=7,6, 2Н), 4,36 (m, 1H), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 6,94-7,59 (m, 9H)
Пример получения 124: (4R,5S)-метил-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
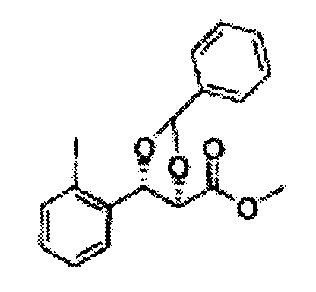
Осуществляли по существу такой же способ, какой описан в Примере получения 120, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (2,1 г, 50-70).
1Н ЯМР (400 МГц, ДМСО) 53,67 (s, 3Н), 5,11 (d, J=8,0, 1Н), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-7,57 (m, 9H)
Пример получения 125: ((4S,5S)-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
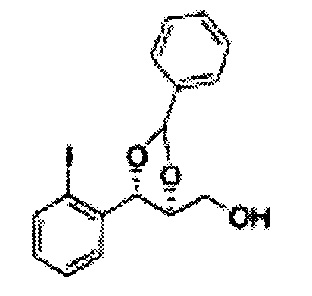
Осуществляли по существу такой же способ, какой описан в Примере получения 107, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-йодфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 124) вместо C4S,5R)-метил-5-(2-йодфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 106) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 3,66 (d, J=7,6, 2H), 4,36 (m, 1H), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 6,94-7,59 (m, 9H)
Пример получения 126: ((4S,5R)-метил-5-(2,4-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
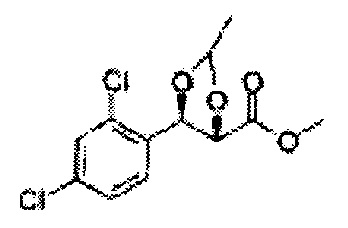
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 36) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (0,9 г, 70-95).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,07-7,21 (m, 3Н)
Пример получения 127: ((4R,5R)-5-(2,4-дихлорфенил)-2-метилдиоксолан-4-ил)метанол
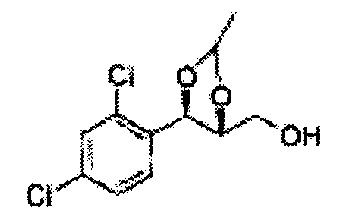
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали ((4S,5R)-метил-5-(2,4-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 126) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (0,7 г, 70-95)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,08-7,39 (m, 3Н).
Пример получения 128: ((4R,5S)-метил-5-(2,4-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
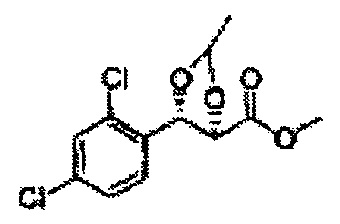
Осуществляли по существу такой же способ, какой описан в Примере получения 126, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 29) вместо (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 36) (1,9 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6,1H), 7,07-7,21 (m, 3Н).
Пример получения 129: ((4S,5S)-5-(2,4-дихлорфенил)-2-метилдиоксолан-4-ил)метанол
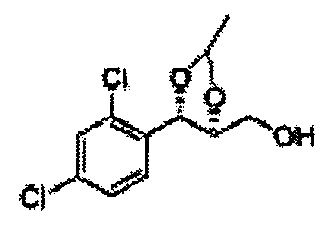
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2,4-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 128) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,08-7,39 (m, 3Н).
Пример получения 130: (4S,5R)-метил-5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
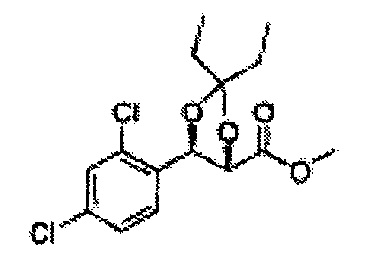
Осуществляли по существу такой же способ, какой описан в Примере получения 64, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 36) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,2 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6,1H), 5,81 (d, J=7,6, 1H), 7,12-7,37 (m, 3Н)
Пример получения 131: ((4R,5R)-5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
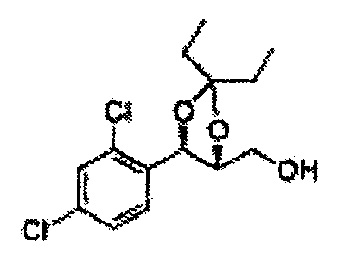
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 130) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0. 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,08-7,39 (m, 3Н).
Пример получения 132: (4R,5S)-метил-5-(2,4-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
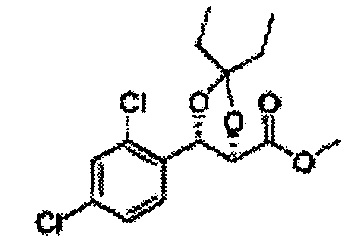
Осуществляли по существу такой же способ, какой описан в Примере получения 130, за исключением того, что для получения целевого соединения использовали (2R,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 29) вместо (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 36) (2,1 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,12-7,37 (m, 3Н)
Пример получения 133: ((4S,5S)-5-(2,4-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
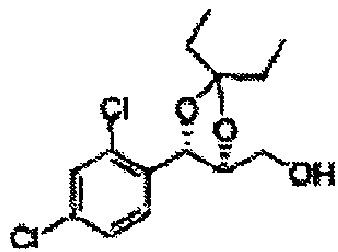
Осуществляли по существу такой же способ, какой описан в Примере получения 131, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 132) вместо ((4S,5)-метил-5-(2,4-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 130) (1,2 г, 70-95%).
1H ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,08-7,39 (m, 3Н).
Пример получения 134: (2S,3R)-метил-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
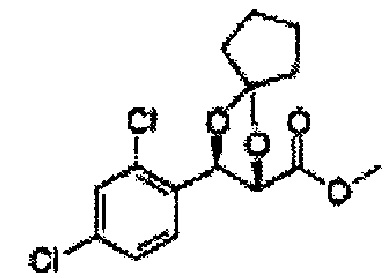
Осуществляли по существу такой же способ, какой описан в Примере получения 131, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4Н), 1,82-1,86 (m, 1H), 1,91-2,00 (m, 3Н), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,03-7,36 (m, 3Н)
Пример получения 135: ((2R,3R)-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
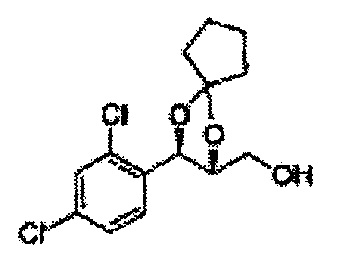
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 134) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 1H), 3,52-3,65 (m, 2H), 3,82-3,86 (m, 1H), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,02-7,37 (m, 3H)
Пример получения 136: (2R,3S)-метил-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
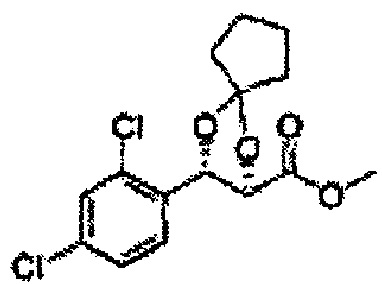
Осуществляли по существу такой же способ, какой описан в Примере получения 132, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4H), 1,82-1,86 (m, 1H), 1,91-2,00 (m, 3H), 3,68 (s, 3H), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,03-7,36 (m, 3H)
Пример получения 137: ((2S,3S)-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
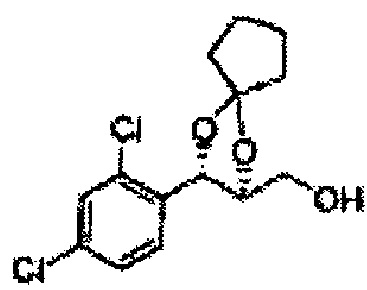
Осуществляли по существу такой же способ, какой описан в Примере получения 135, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 136) вместо (2S,3R)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 134) (1,2 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 1H), 3,52-3,65 (m, 2H), 3,82-3,86 (m, 1H), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,02-7,37 (m, 3H)
Пример получения 138: (2S,3R)-метил-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
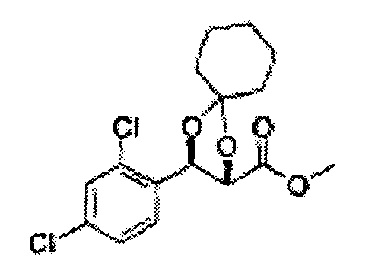
Осуществляли по существу такой же способ, какой описан в Примере получения 134, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,8 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1Н), 5,85 (d, J=8,0, 1H), 7,07-7,41 (m, 3Н)
Пример получения 139: ((2R,3R)-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
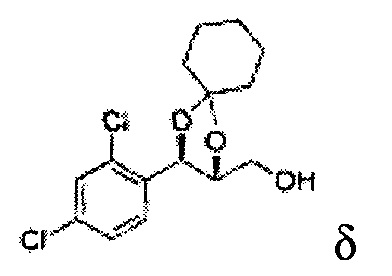
Осуществляли по существу такой же способ, какой описан в Примере получения 73, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 138) вместо (2S,3R)-метил-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 72) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,04-7,40 (m, 3Н)
Пример получения 140: (2R,3S)-метил-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
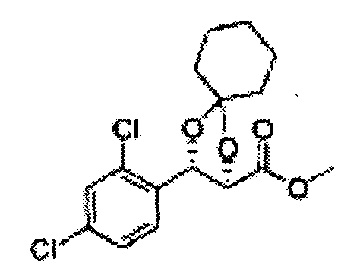
Осуществляли по существу такой же способ, какой описан в Примере получения 136, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,6 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,07-7,41 (m, 3Н)
Пример получения 141: ((2S,3S)-3-(2,4-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
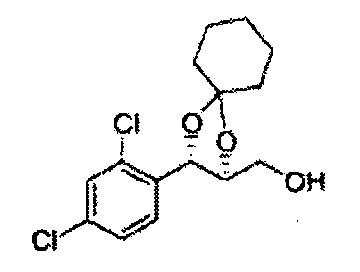
Осуществляли по существу такой же способ, какой описан в Примере получения 139, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 140) вместо (2S,3R)-метил-3-(2,4-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 138) (1,2 г, 70-95)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,04-7,40 (m, 3H)
Пример получения 142: (4S,5R)-метил-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
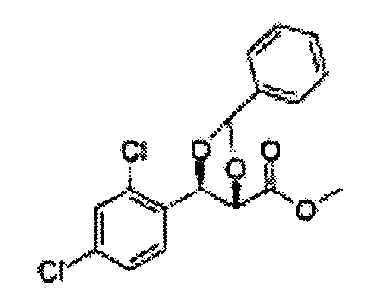
Осуществляли по существу такой же способ, какой описан в Примере получения 138, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3H), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,03-7,41 (m, 3H)
Пример получения 143: ((4R,5R)-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
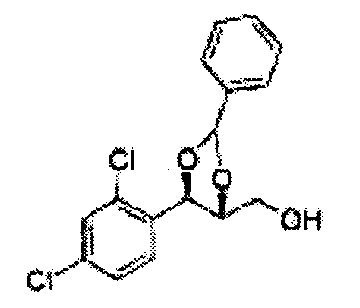
Осуществляли по существу такой же способ, какой описан в Примере получения 65, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 142) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 64) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,04-7,42 (m, 3H)
Пример получения 144: (4R,5S)-метил-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
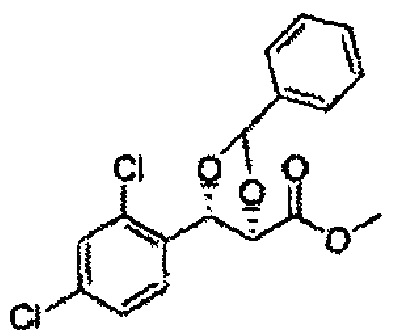
Осуществляли по существу такой же способ, какой описан в Примере получения 140, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,6 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3H), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,03-7,41 (m, 3Н)
Пример получения 145: ((4S,5S)-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
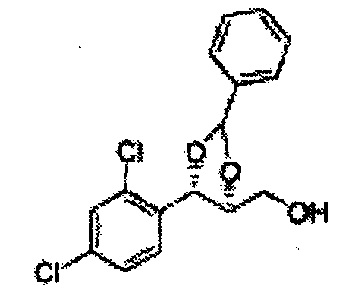
Осуществляли по существу такой же способ, какой описан в Примере получения 143, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 144) вместо (2S,3R)-метил-3-(2,4-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 142) (1,2 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,04-7,42 (m, 3H)
Пример получения 146: ((4S,5R)-этал-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
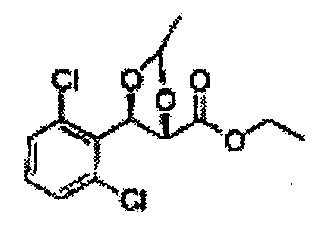
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 39) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (1,7 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3H), 3,78 (s, 3H), 4,15 (m, 2H), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,17-7,36 (m, 3H)
Пример получения 147: ((4R,5R)-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-ил)метанол
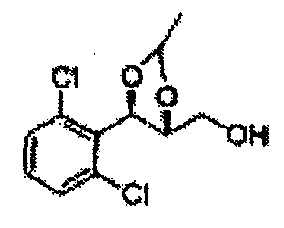
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали ((4S,5R)-этил-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 146) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,2 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,18-7,39 (m, 3H).
Пример получения 148: ((4R,5S)-этил-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат
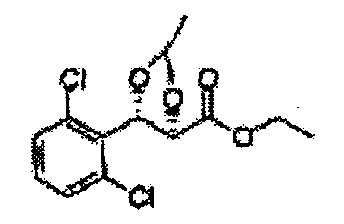
Осуществляли по существу такой же способ, какой описан в Примере получения 146, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 33) вместо (2S,3R)-метил-3-(2,4-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 39) (1,8 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3H), 3,78 (s, 3H), 4,15 (m, 2H). 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,17-7,36 (m, 3H).
Пример получения 149' ((4S,5S)-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-ил)метанол
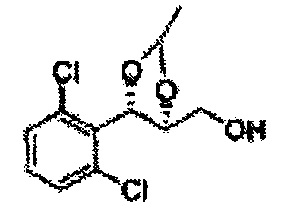
Осуществляли по существу такой же способ, какой описан в Примере получения 147, за исключением того, что для получения целевого соединения использовали ((4R,5S)-этил-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 148) вместо ((4S,5R)-этил-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 146) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,18-7,39 (m, 3Н).
Пример получения 150' (4S,5R)-этил-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
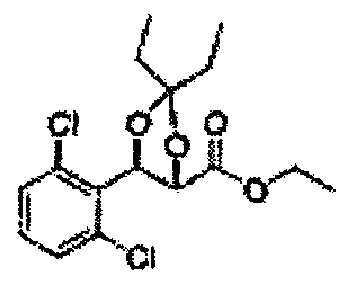
Осуществляли по существу такой же способ, какой описан в Примере получения 130, за исключением того, что для получения целевого соединения использовали (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 39) вместо (2S,3R)-метил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 36) (1,8 г, 60-85%).
1H ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6H), 1,30 (t, J=8,0, 3Н), 1,59 (m. 4H), 4,12 (m, 2Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,08-7,26 (m, 3Н)
Пример получения 151: ((4R,5R)-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
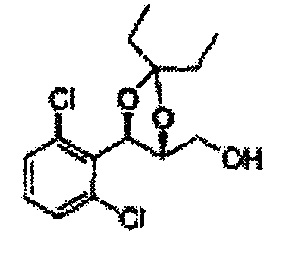
Осуществляли по существу такой же способ, какой описан в Примере получения 147, за исключением того, что для получения целевого соединения использовали (4S,5R)-этил-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 150) вместо ((s,5R)-этил-5-(2,6-дихлорфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 146) (1,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,07-7,29 (m, 3H).
Пример получения 152: (4К,5S)-этил-5-(2,6-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
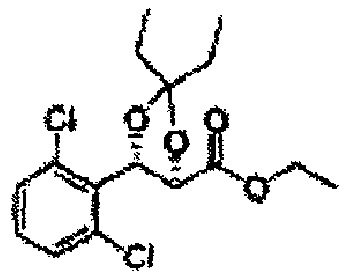
Осуществляли по существу такой же способ, какой описан в Примере получения 150, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноат (Пример получения 33) вместо (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 39) (2,5 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,30 (t, J=8,0, 3H), 1,59 (m, 4Н), 4,12 (m, 2Н), 5.11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,08-7,26 (m, 3H)
Пример получения 153: ((4S,5S)-5-(2,6-хлорфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
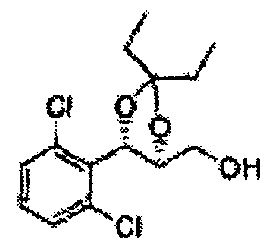
Осуществляли по существу такой же способ, какой описан в Примере получения 151, за исключением того, что для получения целевого соединения использовали (4R,5S)-этил-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 152) вместо (4S,5R)-этил-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 150) (2,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,07-7,29 (m, 3H).
Пример получения 154: (2S,3R)-этил-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
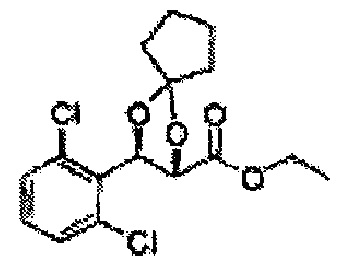
Осуществляли по существу такой же способ, какой описан в Примере получения 150, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,1 г, 70-95%).
1H ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,8 Гц, 3Н), 1,69-1,71 (m, 4H), 1,73-1,86 (m, 4H), 4,07-4,14 (m, 2Н), 5,11 (d, J=7,2, 1H), 5,81 (d, J=7,2, 1H), 7,07-7,31 (m, 3Н)
Пример получения 155 ((2R,3R)-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
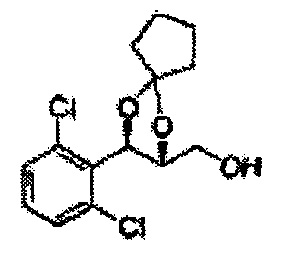
Осуществляли по существу такой же способ, какой описан в Примере получения 151, за исключением того, что для получения целевого соединения использовали (2S,3R)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 154) вместо (4S,5)-этил-5-(2,6-дихлорфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 150) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 4H), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,08-7,32 (m, 3Н)
Пример получения 156: (2R,3S)-этил-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
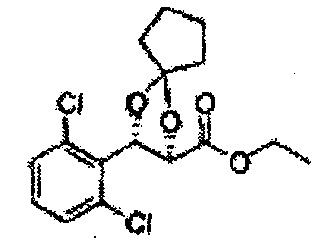
Осуществляли по существу такой же способ, какой описан в Примере получения 152, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,8 Гц, 3Н), 1,69-1,71 (m, 4H), 1,73-1,86 (m, 4H), 4,07-4,14 (m, 2Н), 5,11 (d, J=7,2, 1H), 5,81 (d, J=7,2, 1H), 7,07-7,31 (m, 3Н)
Пример получения 157: ((2S,3S)-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
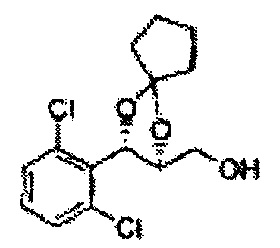
Осуществляли по существу такой же способ, какой описан в Примере получения 155, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 156) вместо (2S,3R)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 154) (2,0 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4Н), 1,83-1,94 (m, 4Н), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1H). 7,08-7,32 (m, 3H)
Пример получения 158: (2S,3R)-этил-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
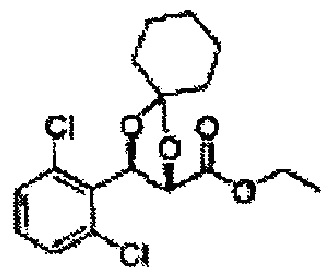
Осуществляли по существу такой же способ, какой описан в Примере получения 154, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,6, 3H), 1,61-1,69 (m, 10H), 4,08-4,18 (d, 2Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,07-7,31 (m, 3H)
Пример получения 159: ((2R,3R)-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
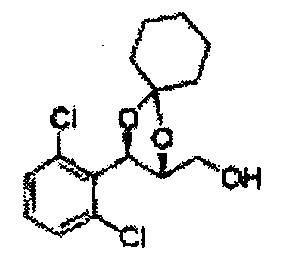
Осуществляли по существу такой же способ, какой описан в Примере получения 155, за исключением того, что для получения целевого соединения использовали (2S,3R)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 158) вместо (2S,3R)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 154) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,05-7,30 (m, 3H)
Пример получения 160: (2R,3S)-этил-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
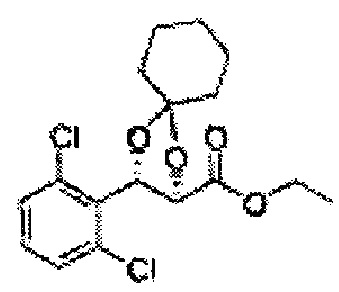
Осуществляли по существу такой же способ, какой описан в Примере получения 156, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,9 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,6, 3H), 1,61-1,69 (m, 10H), 4,08-4,18 (d, 2Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,07-7,31 (m, 3H)
Пример получения 161: ((2S,3S)-3-(2,6-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
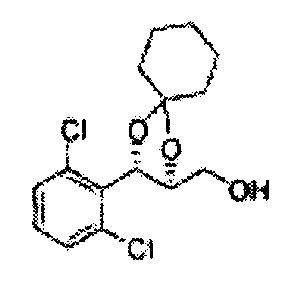
Осуществляли по существу такой же способ, какой описан в Примере получения 159, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 160) вместо (2S,3R)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 158) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,05-7,30 (m, 3H)
Пример получения 162: (4S,5R)-этил-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат

Осуществляли по существу такой же способ, какой описан в Примере получения 158, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (2,0 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,6, 3Н), 4,08-4,18 (d. 2H), 5,13 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 6,18 (s, 1H), 7,03-7,22 (m, 8H)
Пример получения 163: ((4R,5R)-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
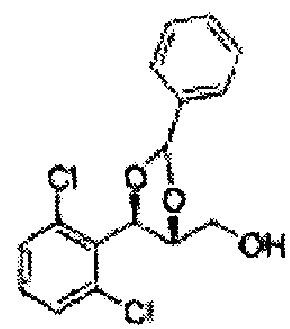
Осуществляли по существу такой же способ, какой описан в Примере получения 159, за исключением того, что для получения целевого соединения использовали (4S,5R)-этил-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 162) вместо (2S,RS)-этил-3-(2,6-дихлорфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 158) (1,6 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 3,50-3,79 (m, 2H), 5,13 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 6,18 (s, 1H), 7,03-7,22 (m, 8H)
Пример получения 164: (4R,5S)-этил-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
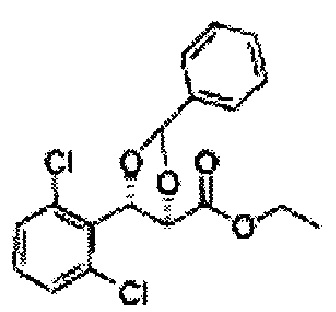
Осуществляли по существу такой же способ, какой описан в Примере получения 160, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,8 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 1,30 (t, J=7,6, 3Н), 4,08-4,18 (d. 2H), 5,13 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 6,18 (s, 1H), 7,03-7,22 (m, 8H)
Пример получения 165: ((4S,5S)-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
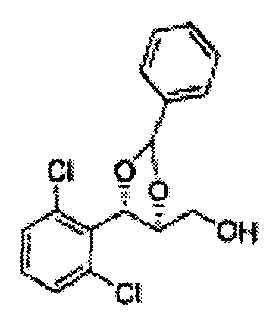
Осуществляли по существу такой же способ, какой описан в Примере получения 163, за исключением того, что для получения целевого соединения использовали (4R,5S)-этил-5-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 164) вместо (2S,3R)-этил-3-(2,6-хлорфенил)-2-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 162) (1,4 г.70-95%)
1H ЯМР (400 МГц, ДМСО): δ 3,50-3,79 (m, 2Н), 5,13 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 6,18 (s, 1H), 7,03-7,22 (m, 8H)
Пример получения 166: ((4S,5R)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилат
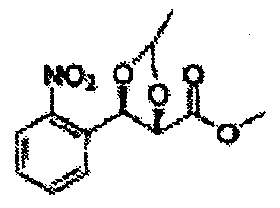
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 44) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,3 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, J=7,6, 1H), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,45-8,12 (m. 4H)
Пример получения 167: ((4R,5R)-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-ил)метанол
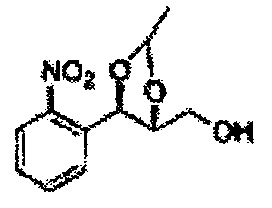
Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 166) вместо (4R,5S)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (1,9 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,47-8.11 (m, 4H).
Пример получения 168: ((4R,5S)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилат
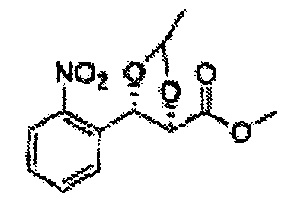
Осуществляли по существу такой же способ, какой описан в Примере получения 160, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 48) вместо (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноата (Пример получения 44) (2,0 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3Н), 3,78 (s, 3Н), 4,30 (d, 7-7,6, 1Н), 5,07 (m, 1H), 5,62 (d, J=7,6, 1H), 7,45-8,12 (m, 4H)
Пример получения 169' ((4S,5S)-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 167, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 168) вместо (4S,5R)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 166) (1,6 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,47-8,11 (m, 4H).
Пример получения 170: (4S,5R)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
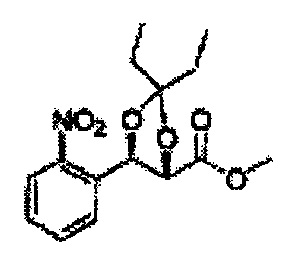
Осуществляли по существу такой же способ, какой описан в Примере получения 150, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 44) вместо (2S,3R)-этил-3-(2,6-дихлорфенил)-2,3-дигидроксипропаноата (Пример получения 39) (2,4 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6H), 1,59 (m, 4H), 3,67 (s, 3Н), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,43-8,10 (m, 4H)
Пример получения 171: ((4R,5R)-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 167, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 170) вместо (4S,5R)-метил-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 166) (1,9 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,37-8,09 (m, 4Н)
Пример получения 172: (4R,5S)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
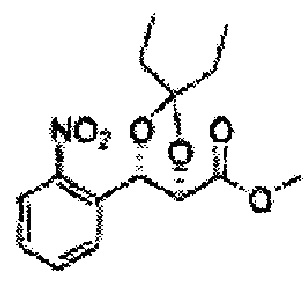
Осуществляли по существу такой же способ, какой описан в Примере получения 170, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноат (Пример получения 48) вместо (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноата (Пример получения 44) (2,5 г, 60-85%).
1H ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6Н), 1,59 (m, 4Н), 3,67 (s, 3H), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,43-8,10 (m, 4Н)
Пример получения 173: ((4S,5S)-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
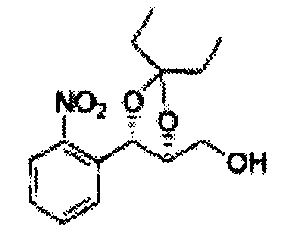
Осуществляли по существу такой же способ, какой описан в Примере получения 171, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 172) вместо (4S,5R)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 170) (2.0 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6H), 1,59 (m, 4H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,37-8,09 (m, 4H)
Пример получения 174: (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
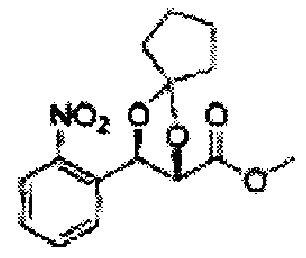
Осуществляли по существу такой же способ, какой описан в Примере получения 170, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4H), 1,82-1,86 (m, 4H), 3,68 (s, 3H), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,44-8,06 (m, 4H)
Пример получения 175: ((2R,3R)-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
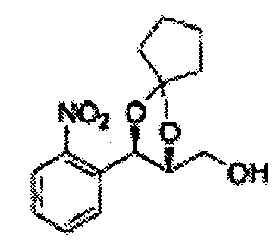
Осуществляли по существу такой же способ, какой описан в Примере получения 171, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 174) вместо (4S,5R)-метил-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 170) (2,1 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 4H), 3,52-3,65 (m, 2H), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,46-8,09 (m, 4H)
Пример получения 176: (2R,3S)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
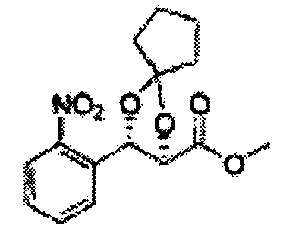
Осуществляли по существу такой же способ, какой описан в Примере получения 172, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,9 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,69-1,71 (m, 4H), 1,82-1,86 (m, 4H), 3,68 (s, 3Н), 4,40 (d, J=7,2, 1H), 5,39 (d, J=7,2, 1H), 7,44-8,06 (m, 4H)
Пример получения 177: ((2S,3S)-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 175, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 176) вместо (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 174) (2,0 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,60-1,72 (m, 4H), 1,83-1,94 (m, 4H), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,46-8,09 (m, 4H)
Пример получения 178: (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
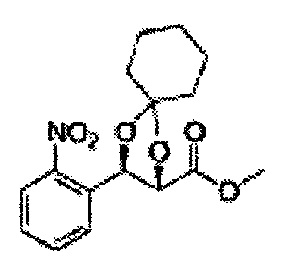
Осуществляли по существу такой же способ, какой описан в Примере получения 174, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,7 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,45-8,12 (m, 4H)
Пример получения 179: ((2R,3R)-3-(2-нитрофенил-1,4-диоксаспиро[4,5]декан-2-ил)метанол
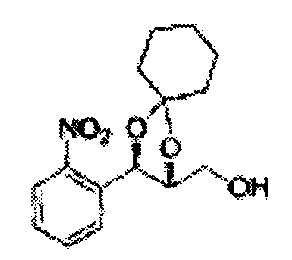
Осуществляли по существу такой же способ, какой описан в Примере получения 175, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 178) вместо (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 174) (1,4 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,46-8,09 (m, 4H)
Пример получения 180: (2R,3S)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
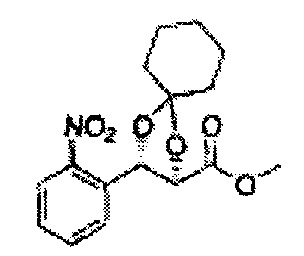
Осуществляли по существу такой же способ, какой описан в Примере получения 176, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,45-8,12 (m, 4H)
Пример получения 181: ((2S,3S)-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
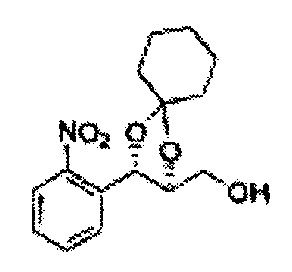
Осуществляли по существу такой же способ, какой описан в Примере получения 179, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 180) вместо (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 178) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,19-7,49 (m, 4H)
Пример получения 182: (4S,5R)-метил-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилат
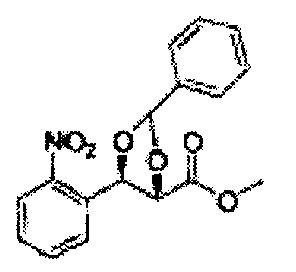
Осуществляли по существу такой же способ, какой описан в Примере получения 178, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) 63,67 (s, 3Н), 5,11 (d, J=8,0, 1Н), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-8,12 (m, 9H)
Пример получения 183: ((4R,5R)-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-ил)метанол
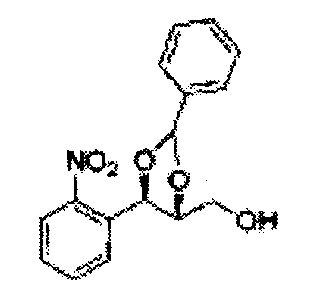
Осуществляли по существу такой же способ, какой описан в Примере получения 179, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 182) вместо (2S,3R)-метил-3-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 174) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 3,66 (d. J=7,6, 2H), 4,36 (m, 1H). 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 7,06-8,14 (m, 9H)
Пример получения 184: (4R,5S)-метил-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилат
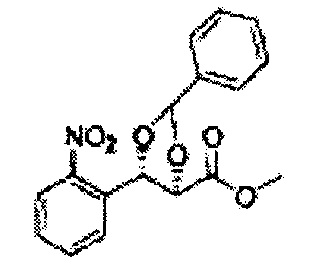
Осуществляли по существу такой же способ, какой описан в Примере получения 180 за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,8 г, 50-70%).
1H ЯМР (400 МГц, ДМСО): 63,67 (s, 3Н), 5,11 (d, J=8,0, 1H), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-8,12 (m, 9H)
Пример получения 185: ((4S,5S)-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 18,3, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 184) вместо (2S,3R)-метил-3-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 182) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 3,66 (d, J=7,6, 2Н). 4,36 (m, 1Н), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 7,06-8,14 (m, 9H)
Пример получения 186: (4S,5R)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилат
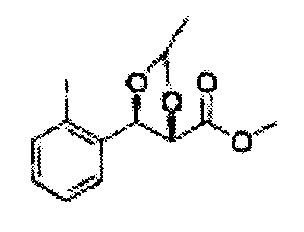
Осуществляли по существу такой же способ, какой описан в Примере получения 60, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат (Пример получения 54) вместо (2S,8R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 433) (2,1 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3) δ 1,36 (d, J=6,4, 3H), 2,35 (s, 3H), 3,68 (s, 3H), 5,07 (m, 1H), 5,11 (d, J=7,6, 1H), 5,82 (d, J=7,6, 1H), 7,19-7,39 (m, 4H)
Пример получения 187: ((4R,5R)-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-ил)метанол
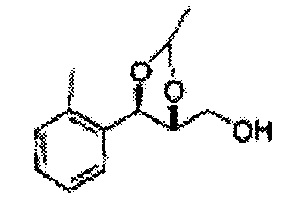
Осуществляли по существу такой же способ, какой описан в Примере получения 185, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 186) вместо (2R,3S)-метил-3-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 184) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17-7,41 (m, 4H).
Пример получения 188: (4R,5S)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилат
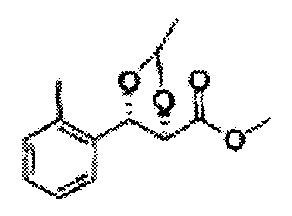
Осуществляли по существу такой же способ, какой описан в Примере получения 186, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат (Пример получения 57) вместо (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноата (Пример получения 54) (1,8 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3): δ 1,36 (d, J=6,4, 3Н), 2,35 (s, 3Н), 3,68 (s, 3Н), 5,07 (m, 1H), 5,11 (d, J=7,6, 1H), 5,82 (d, J=7,6, 1H), 7,19-7,39 (m, 4H)
Пример получения 189: ((4S,5S)-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-ил)метанол
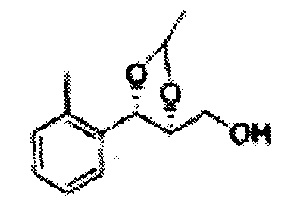
Осуществляли по существу такой же способ, какой описан в Примере получения 187, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилат (Пример получения 188) вместо (4S,5R)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 186) (1,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,17 7,41 (m, 4H).
Пример получения 190: (4S,5R)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
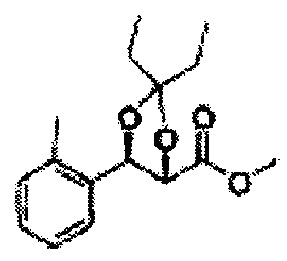
Осуществляли по существу такой же способ, какой описан в Примере получения 170, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноат (Пример получения 54) вместо (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноата (Пример получения 44) (2,1 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6H), 1,59 (m, 4H), 2,33 (s, 1H), 3,67 (s, 3H), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,00-7,17 (m, 4H)
Пример получения 191: ((4R,5R)-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
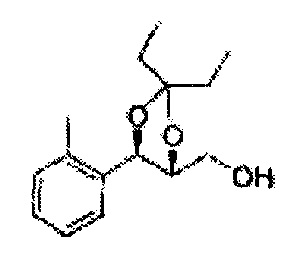
Осуществляли по существу такой же способ, какой описан в Примере получения 187, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 190) вместо (4S,5R)-метил-5-(2-метилфенил)-2-метил-1,3-диоксолан-4-карбоксилата (Пример получения 186) (1,7 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6H), 1,59 (m, 4H), 2,37 (s, 3H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,15-7,39 (m, 4H)
Пример получения 192: (4R,5S)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
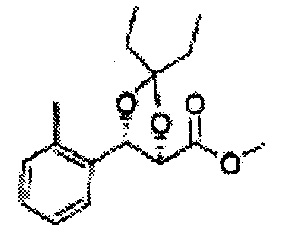
Осуществляли по существу такой же способ, какой описан в Примере получения 190, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-метилфенил)-2,8-дигидроксипропаноат (Пример получения 57) вместо (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноата (Пример получения 54) (2,2 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3) δ 0,96 (m, 6H), 1,59 (m, 4H), 2,33 (s, 1H), 3,67 (s, 3H), 5,11 (d, J=7,6, 1H), 5,81 (d, J=7,6, 1H), 7,00-7,17 (m, 4H)
Пример получения 193: ((4S,5S)-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
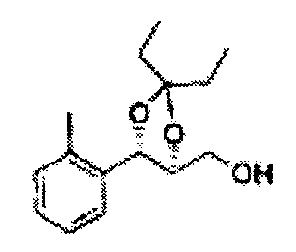
Осуществляли по существу такой же способ, какой описан в Примере получения 191, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 192) вместо (4S,5R)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 190) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4Н), 2,37 (s, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1Н), 5,17 (d, J=7,0, 1H), 7,15-7,39 (m, 4Н)
Пример получения 194' (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
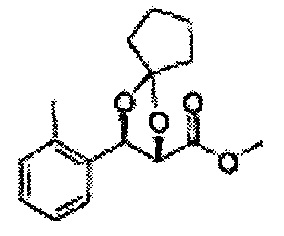
Осуществляли по существу такой же способ, какой описан в Примере получения 190, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,1 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,49-1,57 (m, 4Н). 1,72-1,81 (m, 4Н), 2,35 (s, 3Н), 3,68 (s, 3Н). 5,14 (d, J=7,2, 1H), 5,89 (d, J=7,2. 1H), 7,02-7,25 (m, 4Н)
Пример получения 195: ((2R,3R)-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
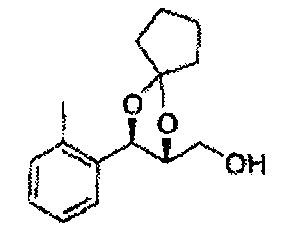
Осуществляли по существу такой же способ, какой описан в Примере получения 191, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 194) вместо (4S,5R)-метил-5-(2-метилфенил)-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 190) (1,6 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 1,49-1,57 (m, 4Н), 1,72-1,81 (m, 4Н), 2,35 (s, 3Н), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,02-7,25 (m, 4Н)
Пример получения 196: (2R,3S)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
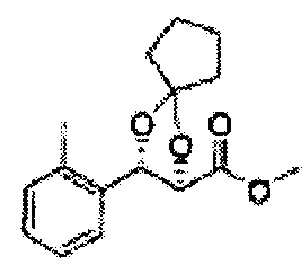
Осуществляли по существу такой же способ, какой описан в Примере получения 192, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,5 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО): δ 1,49-1,57 (m, 4Н), 1,72-1,81 (m, 411), 2,35 (s, 3H), 3,68 (s, 3Н), 5,14 (d, J=7,2, 1H), 5,89 (d, J=7,2, 1H), 7,02-7,25 (m, 4Н)
Пример получения 197: ((2S,3S)-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 195, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 196) вместо (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 194) (2,0 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,49-1,57 (m, 4Н), 1,72-1,81 (m, 4Н), 2,35 (s, 3H), 3,52-3,65 (m, 2H), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,02-7,25 (m, 4Н)
Пример получения 198: (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
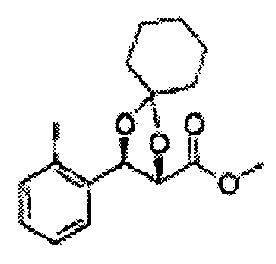
Осуществляли по существу такой же способ, какой описан в Примере получения 194, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,8 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 2,34 (s, 3Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,01-7,30 (m, 4Н)
Пример получения 199: ((2R,3R)-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
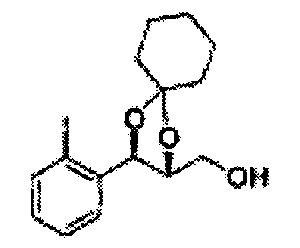
Осуществляли по существу такой же способ, какой описан в Примере получения 195, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 198) вместо (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 194) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н), 2,33 (s, 3Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1Н), 5,43 (d, J=7,6, 1H), 7,02-7,28 (m, 4H)
Пример получения 200: (2R,3S)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
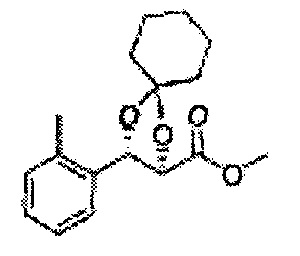
Осуществляли по существу такой же способ, какой описан в Примере получения 196, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,2 г, 70-95%).
1Н ЯМР (400 МГц, ДМСО) δ 1,61-1,69 (m, 10Н), 2,34 (s, 3Н), 3,79 (s, 3Н), 4,33 (d, J=8,0, 1H), 5,85 (d, J=8,0, 1H), 7,01-7,30 (m, 4H)
Пример получения 201: ((2S,3S)-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
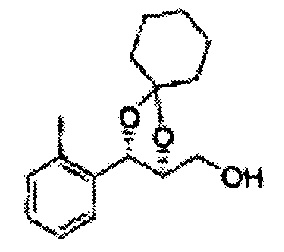
Осуществляли по существу такой же способ, какой описан в Примере получения 199, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 200) вместо (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 198) (1,5 г, 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 1,63-1,75 (m, 10Н). 2,33 (s. 3Н), 3,52-3,81 (m, 2Н), 3,95 (t, J=8,0, 1Н), 5,43 (d, J=7,6, 1H), 7,02-7,28 (m, 4H)
Пример получения 202: (4S,5R)-метил-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
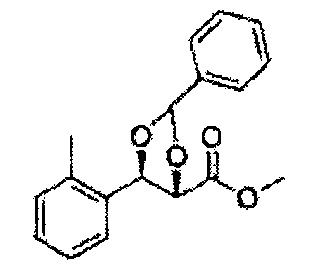
Осуществляли по существу такой же способ, какой описан в Примере получения 198, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (2,2 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО) δ 2,33 (s, 3Н), 3,67 (s, 3Н), 5,11 (d, J=8,0, 1H), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-7,32 (m, 9H)
Пример получения 203: ((4R,5R)-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
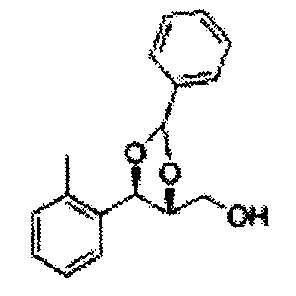
Осуществляли по существу такой же способ, какой описан в Примере получения 199, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 202) вместо (2S,3R)-метил-3-(2-метилфенил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 198) (1,6 г. 70-95%)
1Н ЯМР (400 МГц, ДМСО): δ 2,32 (s, 3Н), 3,66 (d, J=7,6, 2Н), 4,36 (m, 1H), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 6,99-7,33 (m, 9H)
Пример получения 204: (4R,5S)-метил-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-карбоксилат
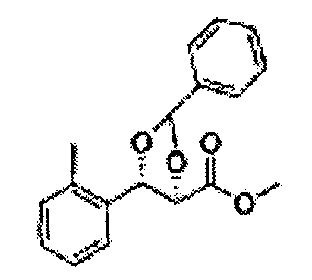
Осуществляли по существу такой же способ, какой описан в Примере получения 200, за исключением того, что для получения целевого соединения использовали бензальдегид вместо циклогексанона (1,9 г, 50-70).
1Н ЯМР (400 МГц, ДМСО) δ 2,33 (s, 3Н), 3,67 (s, 3Н), 5,11 (d, J=8,0, 1Н), 5,81 (d, J=8,0, 1H), 6,18 (s, 1H), 6,96-7,32 (m, 9H)
Пример получения 205: ((4S,5S)-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-ил)метанол
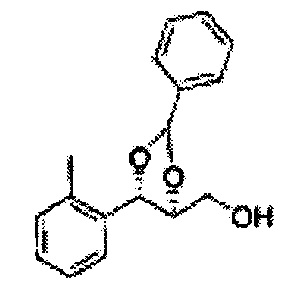
Осуществляли по существу такой же способ, какой описан в Примере получения 203, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 204) вместо (4-S,5R)-метил-5-(2-метилфенил)-2-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 202) (1,3 г, 70-95%)
1H ЯМР (400 МГц, ДМСО): δ 2,32 (s, 3Н), 3,66 (d, J=7,6, 2Н), 4,36 (m, 1H), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 6,99-7,33 (m, 9H)
Пример получения 206: ((4R,5R)-5-(2-аминофенил)-2-метил-1,3-диоксолан-4-ил)метанол
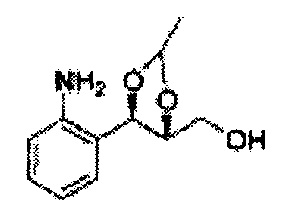
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4R,5R)-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-ил)метанол (Пример получения 167) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,5 г, 65-85%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3Н), 3,62-3,70 (m, 2Н), 4,36 (dd, J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,57-8,08 (m, 4H).
Пример получения 207: ((4S,5S)-5-(2-аминофенил)-2-метил-1,3-диоксолан-4-ил)метанол.
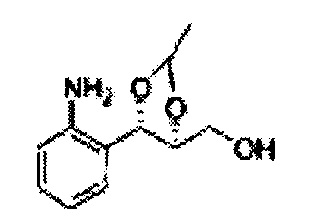
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-2-метил-1,3-диоксолан-4-ил)метанол (Пример получения 169) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,1 г, 65-85%)
1Н ЯМР (400 МГц, CDCl3): δ 1,37 (d, J=6,0, 3H), 3,62-3,70 (m, 2H), J=7,0, J=7,0, 1H), 5,06 (m, 1H), 5,17 (d, J=7,0, 1H), 7,57-8,08 (m, 4H)
Пример получения 208: ((4R,5R)-5-(2-аминофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
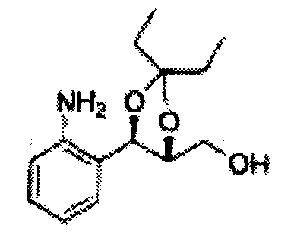
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4R,5R)-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол (Пример получения 171) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,5 г, 65-85%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,55-8,09 (m, 4H)
Пример получения 209: ((4S,5S)-5-(2-аминофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
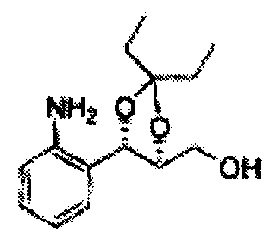
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол (Пример получения 173) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,4 г, 65-85%)
1Н ЯМР (400 МГц, CDCl3): δ 0,96 (m, 6Н), 1,59 (m, 4H), 3,62-3,70 (m, 2H), 4,36 (dd, J=7,0, J=7,0, 1H), 5,17 (d, J=7,0, 1H), 7,55-8,09 (m, 4H)
Пример получения 210: ((2R,3R)-3-(2-аминофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
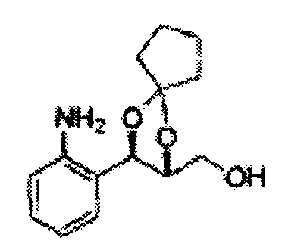
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4R,5R)-5-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол (Пример получения 175) вместо С(4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,7 г, 65-85%)
1Н ЯМР (400 МГц, ДМСО): δ 1,62-1,73 (m, 4Н), 1,82-1,95 (m, 4Н), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1Н), 5,12 (d, J=7,6, 1H), 7,56-8,11 (m, 4Н)
Пример получения 211: ((2S,3S)-3-(2-аминофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
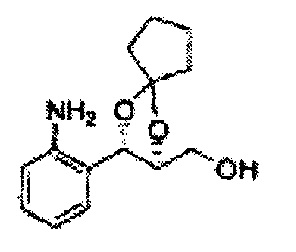
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол (Пример получения 177) вместо ((4,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,6 г, 65-85%)
1Н ЯМР (400 МГц, ДМСО): δ 1,62-1,73 (m, 4Н), 1,82-1,95 (m, 4Н), 3,52-3,65 (m, 2Н), 4,90 (t, J=5,2, 1H), 5,12 (d, J=7,6, 1H), 7,56-8,11 (m, 4Н)
Пример получения 212: ((2R,3R)-3-(2-аминофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
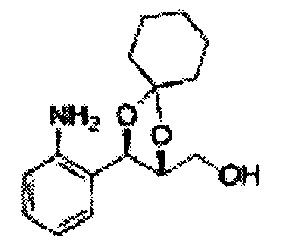
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4R,5R)-5-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол (Пример получения 179) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,1 г, 65-85%)
1Н ЯМР (400 МГц, ДМСО): δ 1,61-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,49-8,12 (m, 4H)
Пример получения 213: ((2S,3S)-3-(2-аминофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
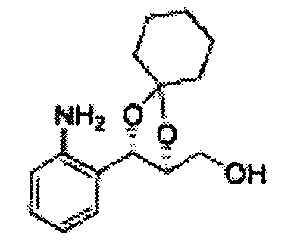
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол (Пример получения 181) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,0 г, 65-85%)
1H ЯМР (400 МГц, ДМСО): δ 1,61-1,75 (m, 10Н), 3,52-3,81 (m, 2H), 3,95 (t, J=8,0, 1H), 5,43 (d, J=7,6, 1H), 7,49-8,12 (m, 4H)
Пример получения 214: ((4R,5R)-5-(2-аминофенил)-2-фенил-1,3-диоксолан-4-ил)метанол
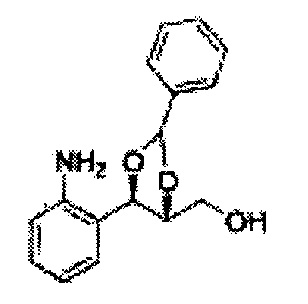
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4R,5R)-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-ил)метанол (Пример получения 183) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 46) (1,2 г, 65-85%)
1Н ЯМР (400 МГц, ДМСО): δ 3,66 (d, J=7,6, 2H), 4,36 (m, 1H), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 7,06-8,14 (m, 9H)
Пример получения 215: ((4S,5S)-5-(2-аминофенил)-2-фенил-1,3-диоксолан-4-ил)метанол
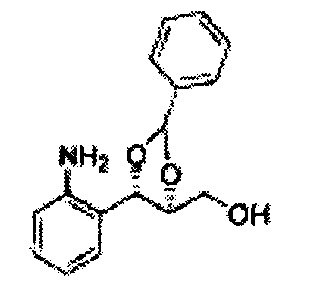
Осуществляли по существу такой же способ, какой описан в Примере получения 47, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-2-фенил-1,3-диоксолан-4-ил)метанол (Пример получения 185) вместо ((4R,5R)-5-(2-нитрофенил-2-диметил-1,3-диоксолан-4-ил)метанол (Пример получения 46) (0,9 г, 65-85%)
1H ЯМР (400 МГц, ДМСО): δ 3,66 (d, J=7,6, 2Н), 4,36 (m, 1Н), 5,17 (d, J=8,0, 1H), 6,18 (s, 1H), 7,06-8,14 (m, 9H)
Пример получения 216: (Е)-метилциннамат

В круглодонную колбу добавляли транс-коричную кислоту (7 г, 47,25 ммоль) и МеОН (70 мл). POCl3 (0,43 мл, 4,73 ммоль) добавляли по каплям. Реакционную смесь перемешивали с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, реакцию останавливали 1N раствором NaOH. Указанную смесь экстрагировали EtOAc и промывали Н2О. Водный слой затем экстрагировали EtOAc. Объединенные органические слои осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали под вакуумом (7,1 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): 63,81 (s, 3Н), 6,42 (d, J=15,9, 1H). 7,37-7,39 (m, 3Н), 7,50-7,53 (m, 2H), 7,67 (d, J=15,9, 1H)
Пример получения 217: (2S,3R)-метил-3-фенил-2,3-дигидроксипропаноат

Осуществляли по существу такой же способ, какой описан в Примере получения 36, за исключением того, что для получения целевого соединения использовали (Е)-метил циннамат (Пример получения 216) вместо (Е)-метил-3-(2,4-дихлорфенил)акрилата (Пример получения 28) (6,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 2,70 (bs, 1H), 3,08 (bs, 1H), 3,82 (s, 3Н), 4,38 (d, J=2,9, 1H), 5,03 (d, J=2,9, 1H), 7,30-7,42 (m, 5H)
Пример получения 218: (4S,5R)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилат
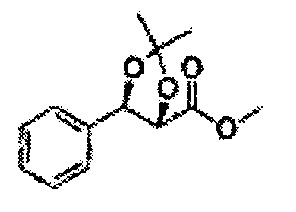
Осуществляли по существу такой же способ, какой описан в Примере получения 45, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 217) вместо (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноата (Пример получения 44) (5,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,56 (s, 3Н), 1,61 (s, 3Н), 3,79 (s, 3Н), 4,36 (d, 1=7,8, 1Н), 5,17 (d, J=7.8, 1H). 7,31-7,40 (m, 5H)
Пример получения 219: ((4R,5R)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)метанол
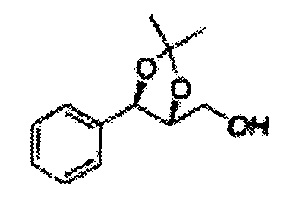
Осуществляли по существу такой же способ, какой описан в Примере получения 46, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 218) вместо (4S,5R)-метил-5-(2-нитрофенил)-1,3-диоксолан-4-карбоксилата (Пример получения 45) (4,4 г, 70-95)
1Н ЯМР (400 МГц, CDCl3): δ 1,41 (s, 3Н), 1,46 (s, 3Н), 2,79 (bs, 1Н), 3,48-3,52 (m, 1Н), 3,68-3,76 (m, 2H), 4,76 (d, J=8,8, 1Н), 7,18-7,28 (m, 5H)
Пример получения 220: (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноат
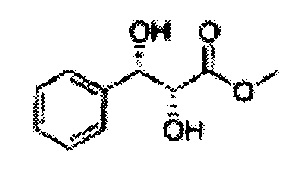
Осуществляли по существу такой же способ, какой описан в Примере получения 30, за исключением того, что для получения целевого соединения использовали (Е)-метилциннамат (Пример получения 216) вместо (Е)-метил-3-(2,4-дихлорфенил)акрилата (Пример получения 28) (8,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCL3): δ 2,70 (bs, 1Н), 3,08 (bs, 1Н), 3,82 (s, 3Н), 4,38 (d, J=2,9, 1Н), 5,03 (d, J=2,9, 1Н), 7,30-7,42 (m, 5H)
Пример получения 221: (4R,5S)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилат
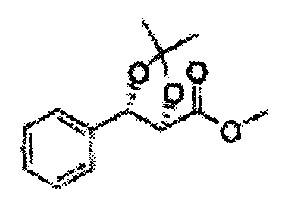
Осуществляли по существу такой же способ, какой описан в Примере получения 45, за исключением того, что использовали (2S,3R)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 217) вместо (2S,3R)-метил-3-(2-нитрофенил)-2,3-дигидроксипропаноата (Пример получения 44) (5,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ 1,56 (s, 3Н), 1,61 (s, 3Н), 3,79 (s, 3Н), 4,36 (d, J=7,8, 1H), 5,17 (d, J=7,8, 1H), 7,31-7,40 (m, 5H)
Пример получения 222: ((4S,5S)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)метанол
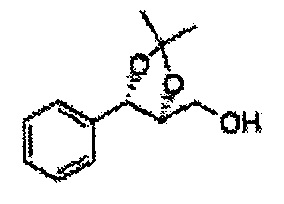
Осуществляли по существу такой же способ, какой описан в Примере получения 46, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 221) вместо (4S,5R)-метил-5-(2-нитрофенил)-1,3-диоксолан-4-карбоксилата (Пример получения 45) (6,5 г, 70-95%)
1H ЯМР (400 МГц, CDCL3): δ 1,41 (s, 3Н), 1,46 (s, 3Н), 2,79 (bs, 1H), 3,48-3,52 (m, 1H), 3,68-3,76 (m, 2H), 4,76 (d, J=8,8, 1H), 7,18-7,28 (m, 5H)
Пример получения 223: (4S,5R)-метил-2,2-диэтил-5-фенил-1,3-диоксолан-4-карбоксилат
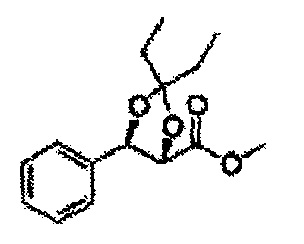
Осуществляли по существу такой же способ, какой описан в Примере получения 190, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 217) вместо (2S,3R)-метил-3-(2-метилфенил)-2,3-дигидроксипропаноата (Пример получения 54) (1,9 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,01 (t, J=7,4, 1H), 1,06 (t, 1=7,6, 3Н), 1,78-1,90 (m, 4H), 3,78 (s, 3Н), 5,12 (d, J=8,4, 1H), 7,32-7,45 (m, 5H)
Пример получения 224: ((4R,5R)-5-фенил-2,2-диэтил-1,3-диоксолан-4-ил)метанол
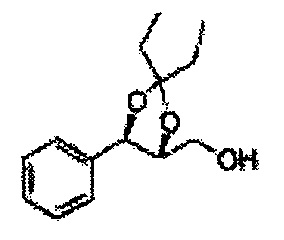
Осуществляли по существу такой же способ, какой описан в Примере получения 219, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-2,2-диэтил-5-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 223) вместо (4S,5R)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 218) (1,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,00 (t, J=7,6, 1Н), 1,06 (t, J=7,4, 1H), 1,74-1,90 (m, 4H), 3,64 (ddd, J=3,4, J=8,4, J=12,1, 1H), 3,84-3,91 (m, 2H), 4,89 (d, J=8,8, 1H), 7,30-7,43 (m, 5H)
Пример получения 225: (4R,5S)-метил-2,2-диэтил-5-фенил-1,3-диоксолан-4-карбоксилат

Осуществляли по существу такой же способ, какой описан в Примере получения 223, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 220) вместо (2S,3R)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 217) (5,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,01 (t, J=7,4, 1H), 1,06 (t, J=7,6, 3H), 1,78-1,90 (m, 4H), 3,78 (s, 3H), 5,12 (d, J=8,4, 1H), 7,32-7,45 (m, 5H)
Пример получения 226: ((4S,5S)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)метанол
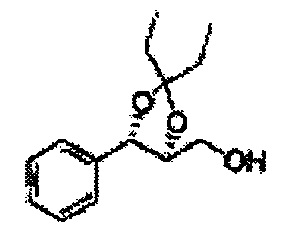
Осуществляли по существу такой же способ, какой описан в Примере получения 224, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилат (Пример получения 225) вместо (4S,5R)-метил-2,2-диметил-5-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 218) (6,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1.00 (t, J=7,6, 1H), 1,06 (t, 1=7,4, 1H), 1,74-1,90 (m, 4H), 3,64 (ddd, J=3,4, J=8,4, J=12,1, 1H), 3,84-3,91 (m, 2H), 4,89 (d, J=8,8, 1H), 7,30-7,43 (m, 5H)
Пример получения 227: (2S,3R)-метил-3-фенил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
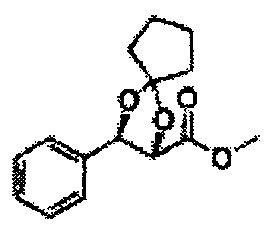
Осуществляли по существу такой же способ, какой описан в Примере получения 223, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (0,9 г, 50-75%)
1H ЯМР (400 МГц, CDCl3): δ=1,71-1,80 (m, 4Н), 1,87-1,94 (m, 1Н), 2,00-2,08 (m, 3H), 3,79 (s, 3H), 4,35 (d, J=7,2, 1Н), 5,08 (d, J=7,2, 1Н), 7,32-7,45 (m, 5H)
Пример получения 228: ((2R,3R)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
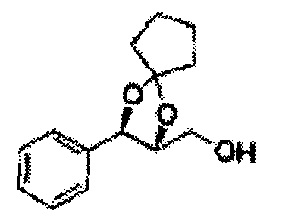
Осуществляли по существу такой же способ, какой описан в Примере получения 224, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-фенил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 227) вместо (4S,5R)-метил-2,2-диэтил-5-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 223) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,69-1,82 (m, 4Н), 1,85-2,03 (m, 4Н), 3,66 (ddd, J=3,7, 8,1, 12,1, 1Н), 3,83-3,90 (m, 2H), 4,84 (d, J=8,4, 1Н), 7,26-7,41 (m, 5H)
Пример получения 229: (2R,3S)-метил-3-фенил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
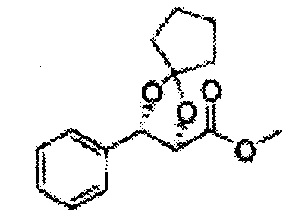
Осуществляли по существу такой же способ, какой описан в Примере получения 225, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (0,8 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=1,71-1,80 (m, 4Н), 1,87-1,94 (m, 1Н), 2,00-2,08 (m, 3H), 3,79 (s, 3H), 4,35 (d, J=7,2, 1Н), 5,08 (d, J=7,2, 1Н), 7,32-7,45 (m, 5H)
Пример получения 230: ((2S,3S)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
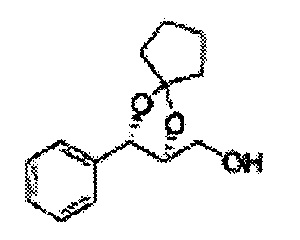
Осуществляли по существу такой же способ, какой описан в Примере получения 228, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-фенил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 229) вместо (2S,3R)-метил-3-фенил-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 227) (0,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,69-1,82 (m, 4Н), 1,85-2,03 (m, 4H), 3,66 (ddd, J=3,7, 8,1, 12,1, 1H), 3,83-3,90 (m, 2H), 4,84 (d, J=8,4, 1H), 7,26-7,41 (m, 5H)
Пример получения 231: (2S,3R)-метил 3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилат
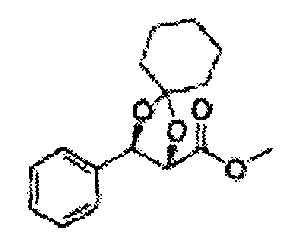
Осуществляли по существу такой же способ, какой описан в Примере получения 227, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанон для получения целевого соединения (1,4 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41-1,49 (m, 2H), 1,58-1,76 (m, 4H), 1,79-1,90 (m, 4H), 3,78 (s, 3H), 4,36 (d, J=7,6, 1H), 5,16 (d, J=7,2, 1H), 7,31-7,44 (m, 5H)
Пример получения 232: ((2R,3R)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)метанол
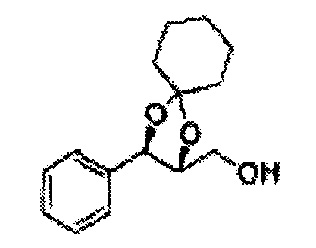
Осуществляли по существу такой же способ, какой описан в Примере получения 224, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил 3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 231) вместо (4S,5R)-метил-2,2-диэтил-5-фенил-1,3-диоксолан-4-карбоксилата (Пример получения 223) (1,0 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,41-1,50 (m, 2H), 1,61-1,89 (m, 8H), 3,60-3,66 (m, 1H), 3,85-3,90 (m, 2H), 4,91 (d, J=8,4, 1H), 7,30-7,42 (m, 5H)
Пример получения 233: (2R,3S)-метил-3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилат
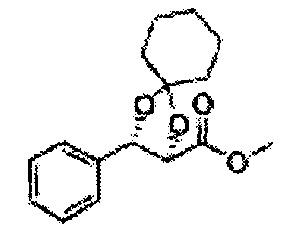
Осуществляли по существу такой же способ, какой описан в Примере получения 229, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,2 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41-1,49 (m, 2H), 1,58-1,76 (m, 4H), 1,79-1,90 (m, 4H), 3,78 (s, 3H), 4,36 (d, J=7,6, 1H), 5,16 (d, J=7,2, 1H), 7,31-7,44 (m, 5H)
Пример получения 234: ((2S,3S)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)метанол
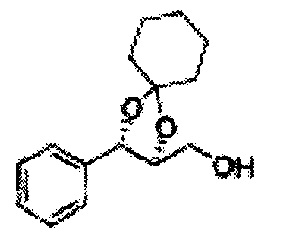
Осуществляли по существу такой же способ, какой описан в Примере получения 232, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 233) вместо (2S,3R)-метил-3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 231) (0,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41-1,50 (m, 2Н), 1,61-1,89 (m, 8Н), 3,60-3,66 (m, 1Н), 3,85-3,90 (m, 2Н), 4,91 (d, J=8,4, 1Н). 7,30-7,42 (m, 5Н)
Пример получения 235: (Е)-5-фенилпент-3-еновая кислота
Раствор малоновой кислоты (17,06 г, 163,96 ммоль) в ДМСО (65 мл) обрабатывали раствором АсОН (0,1 мл, 1,49 ммоль) и пиперидина (0,15 мл, 1,49 ммоль) в ДМСО (4 мл). Реакционный раствор нагревали до 65°С и добавляли по каплям гидроциннамальдегид (10 г, 74,53 ммоль) в течение 1,5 часов. После окончания добавления реакционную смесь перемешивали в течение дополнительных 2 часов при 65°С. The раствор охлаждали до комнатной температуры, выливали в H2O и экстрагировали Et2O. Объединенные органические экстракты промывали 5% водным KHSO4 и соляным раствором, осушали над MgSO4, и упаривали досуха. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (10,4 г, 75-90%)
1Н ЯМР (400 МГц, CDCl3): δ=3,19 (d, J=6,9, 2Н), 3,46 (d, J=6,9, 2Н), 5,69-5,78 (m, 1Н), 5,83-5,91 (m, 1Н), 7,01-7,56 (m, 5Н), 11,79 (s, 1Н)
Пример получения 236: (Е)-5-фенилпент-3-ен-1-ол

К перемешиваемому раствору ЛАГ (LiAlH4, 3,3 г, 86,73 ммоль) в ТГФ (66 мл) добавляли по каплям раствор (Е)-5-фенилпент-3-еновой кислоты (Пример получения 235, 11,0 г, 57,82 ммоль) в ТГФ(44 мл) при 0°С затем перемешивали при комнатной температуре в течение 1 часа. Реакцию останавливали Н2О при 0°С, отфильтровывали через целит, промывали EtOAc, осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (7,2 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ=1,40 (bs, 1Н), 2,31 (q, J=6,3, 2H), 3,37 (d, J=6,8, 2H), 3,66 (t, J=6,4, 2H), 5,49 (dt, J=4,9, 11,0, 1Н), 5,73 (dt, J=4,8, 10,9, 1Н), 7,17-7,31 (m, 5H)
Пример получения 237: (Е)-трет-бутилдиметил(5-фенилпент-3-енилокси)силан

К перемешиваемому раствору (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236, 6,3 г, 38,83 ммоль) в CH2Cl2 добавляли имидазол (3,4 г, 50,48 ммоль) и TBDMS-Cl (7,6 г, 50,48 ммоль) при 0°С, затем перемешивали в течение 1 часа при комнатной температуре. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (10,6 г, 80-98%)
1Н ЯМР (400 МГц, CDCl3): δ=0,00 (s, 6Н), 0,84 (s, 9H), 2,21 (ddd, J-6,8, 13,6, 0,8, 2H), 3,29 (d, J=6,8, 2H), 3,59 (t, J=6,8, 2H), 5,41-5,49 (m, 1Н), 5,56-5,63 (m, 1Н), 7,13-7,26 (m, 5H)
Пример получения 238: (Е)-5-фенилпент-3-енилпивалат
К перемешиваемому раствору (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236, 3,8 г, 23,42 ммоль) в CH2Cl2 (40 мл) добавляли пиридин (2,3 мл, 28,1 ммоль) и пивалоилхлорид (3,5 мл, 28,1 ммоль) при 0°С в атмосфере N2. Указанную смесь перемешивали в течение 14 часов. Полученную смесь разбавляли CH2Cl2, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (5,5 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,17 (s, 9H), 2,36 (q, J=6,7, 2H), 3,34 (d, 1=6,8, 2H), 4,09 (t, J=6,8, 2H), 5,45-5,51 (m, 1Н), 5,64-5,69 (m, 1Н), 7,16-7,21 (m, 3H), 7,26-7,30 (m, 2H)
Пример получения 239: (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-фенилпентан-2,3-диол

Осуществляли по существу такой же способ, какой описан в Примере получения 217, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил (5-фенилпент-3-енилокси)силан (Пример получения 237) вместо (Е)-метилциннамата (Пример получения 216) (8,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,00 (s, 6H), 0,82 (s, 9H), 1,57-1,62 (m, 1H), 1,73-1,80 (m, 1H), 2,51 (d, J=6,0, 1H), 2,77 (dq, J=6,9, 14,9, 2H), 3,50 (d, J=3,6, 1H), 3,59-3,62 (m, 1H), 3,66 (dq, J=3,1, 5,4, 1H), 3,72-3,82 (m, 2H), 7,12-7,25 (m, 5H)
Пример получения 240: (2-((4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан
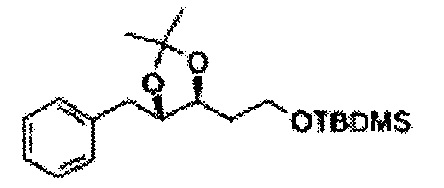
Осуществляли по существу такой же способ, какой описан в Примере получения 218, за исключением того, что для получения целевого соединения использовали (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-фенил пентан-2,3-диол (Пример получения 239) вместо (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноат (Пример получения 217) (9,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,00 (s, 6H), 0,85 (s, 9H), 1,29 (s, 3H), 1,34 (s, 3H), 1,52-1,58 (m, 2H), 2,87 (dq, J=5,5, 14,2, 2H), 3,64-3,69 (m, 2H), 3,80-3,88 (m, 2H), 7,18-7,27 (m, 5H)
Пример получения 241: 2-((4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этанол
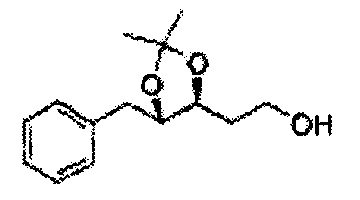
К перемешиваемому раствору (2-((4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилана (Пример получения 240, 11,5 г, 32,80 ммоль) в ТГФ (115 мл) медленно добавляли тетрабутилфторид аммония (TBAF, 1,0М в ТГФ, 48,8 мл, 48,8 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение 5 часов. Полученную смесь разбавляли EtOAc, промывали водой, осушали над безводным сульфатом магния, отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (7,3 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,38 (s, 3H), 1,40 (s, 3H), 1,50-1,63 (m, 2H), 2,29 (t, J=5,4, 1H), 2,82 (dd, J=5,8, 13,8, 1H), 3,01 (dd, J=6,4, 14,0, 1H), 3,72 (q, J=5,5, 2H), 3,86 (dt, J=3,2, 8,4, 1H), 3,92-3,97(m, 1H), 7,22-7,32 (m, 5H)
Пример получения 242: (2R,3R)-5-(трет-бутилдиметилсилилокси)-1-фенилпентан-2,3-диол
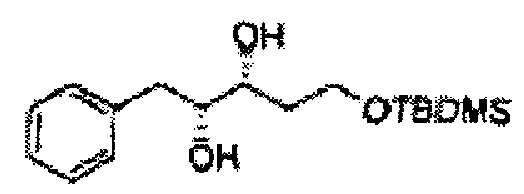
Осуществляли по существу такой же способ, какой описан в Примере получения 220, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил (5-фенилпент-3-енилокси)силан (Пример получения 237) вместо (Е)-метилциннамата (Пример получения 216) (10,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,00 (s, 6H), 0,82 (s, 9H), 1,57-1,62 (m, 1H), 1,73-1,80 (m, 1H), 2,51 (d, J=6,0, 1H), 2,77 (dq, J=6,9, 14,9, 2H), 3,50 (d, J=3,6. 1H), 3,59-3,62 (m, 1H). 3,66 (dq, J=3,1, 5,4, 1H), 3,72-3,82 (m, 2H), 7,12-7,25 (m, 5H)
Пример получения 243: (2-((4R,5R)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан
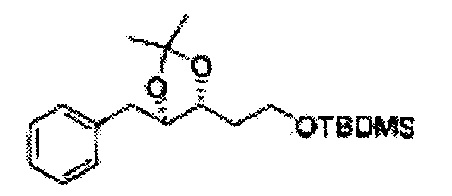
Осуществляли по существу такой же способ, какой описан в Примере получения 221, за исключением того, что для получения целевого соединения использовали (2R,3R)-5-(трет-бутилдиметилсилилокси)-1-фенилпентан-2,3-диол (Пример получения 242) вместо (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноата (Пример получения 217) (11,5 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=0,00 (s, 6H), 0,85 (s, 9H), 1,29 (s, 3Н), 1,34 (s, 3Н), 1,52-1,58 (m, 2H), 2,87 (dq, 1=5,5, 14,2, 2H), 3,64-3,69 (m, 2H), 3,80-3,88 (m, 2H), 7,18-7,27 (m, 5H)
Пример получения 244: 2-((4R,5R)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этанол
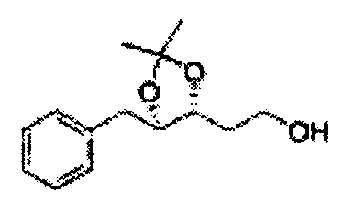
Осуществляли по существу такой же способ, какой описан в Примере получения 241, за исключением того, что для получения целевого соединения использовали (2-((4R,5R)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан (Пример получения 243) вместо (2-((4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилана (Пример получения 240) (7,4 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3) δ=1,38 (s, 3Н), 1,40 (s, 3Н), 1,50-1,63 (m, 2H), 2,29 (t, J=5,4, 1H), 2,82 (dd, J=5,8, 13,8, 1H), 3,01 (dd, J=6,4, 14,0, 1H), 3,72 (q, J=5,5, 2H), 3,86 (dt, J=3,2, 8,4, 1H), 3,92-3,97 (m, 1H), 7,22-7,32 (m, 5H)
Пример получения 245: (3S,4S)-3,4-дигидрокси-5-фенилпентилпивалат
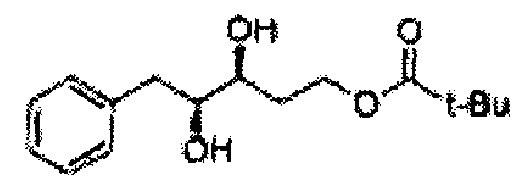
Осуществляли по существу такой же способ, какой описан в Примере получения 239, за исключением того, что для получения целевого соединения использовали (Е)-5-фенилпент-3-енилпивалат (Пример получения 238) вместо (Е)-трет-бутилдиметил (5-фенилпент-3-енилокси)силана (Пример получения 237) (5,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,16 (s, 9H), 1,83-1,88 (m, 2H), 2,08 (d, J=4,8, 1H), 2,67 (d, 1=5,2, 1H), 2,80 (dd, J=8,0, 13,6, 1H), 2,92 (dd, J=5,2, 13,6, 1H), 3,50-3,55 (m, 1H), 3,66-3,71 (m, 1H), 4,09-4,19 (m, 1H), 4,35-4,41 (m, 1H), 7,22-7,25 (m, 3H), 7,29-7,33 (m, 2H)
Пример получения 246: (2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат
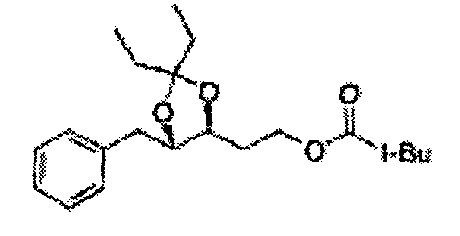
Осуществляли по существу такой же способ, какой описан в Примере получения 223, за исключением того, что для получения целевого соединения использовали (3S,4S)-3,4-дигидрокси-5-фенилпентилпивалат (Пример получения 245) вместо (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноата (Пример получения 217) (0,9 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,76 (q, J=7,6, 2H), 1,84-1,90 (m, 2H), 2,00-2,07 (m, 2H), 3,85 (dt, J=3,7, 8,5, 1H), 4,14-4,27 (m, 2H), 5,17 (d, J=8,4, 1H), 7,22-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,64 (dd, J=1,4, 7,8, 1H)
Пример получения 247: 2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этанол
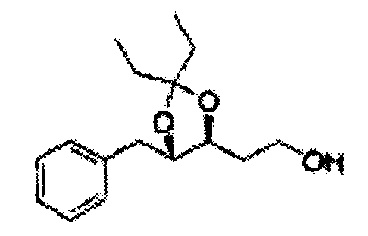
К перемешиваемому раствору (2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 246, 1,0 г, 2,87 ммоль) в МеОН (10 мл) добавляли NaOMe (0,47 г, 8,61 ммоль) и затем нагревали до 45°С. Указанную смесь перемешивали в течение 14 часов. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали, и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (0,7 г, 80-95%);
1Н ЯМР (400 МГц, CDCl3): δ=0,89 (t, J=7,4, 6H), 1,44-1,50 (m, 1H), 1,54-1,66 (m, 5H), 2,37 (t, J=5,6, 1H), 2,80 (dd, J=5,6, 14,0, 1H), 3,03 (dd, J=6,4, 14,0, 1H), 3,72 (q, J=5,5, 2H), 3,80-3,85 (m, 1H), 3,89-3,94 (m, 1H), 7,21-7,24 (m, 3H), 7,28-7,31 (m, 2H).
Пример получения 248: (3R,4R)-3,4-дигидрокси-5-фенилпентилпивалат
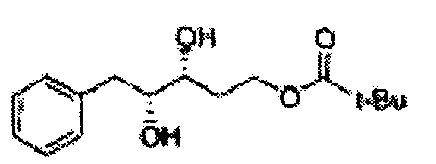
Осуществляли по существу такой же способ, какой описан в Примере получения 242, за исключением того, что для получения целевого соединения использовали (Е)-5-фенилпент-3-енилпивалат (Пример получения 238) вместо (Е)-трет-бутилдиметил(5-фенилпент-3-енилокси)силана (Пример получения 237) (4,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,16 (s, 9H), 1,83-1,88 (m, 2H), 2,08 (d, J=4,8, 1H), 2,67 (d, J=5,2, 1H), 2,80 (dd, J=8,0. 13,6, 1H), 2,92 (dd, J=5,2, 13,6, 1H), 3,50-3,55 (m, 1H), 3,66-3,71 (m, 1H), 4,09-4,19 (m, 1H), 4,35-4,41 (m, 1H), 7,22-7,25 (m, 3H), 7,29-7,33 (m, 2H)
Пример получения 249: (2-((4R,5R)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат
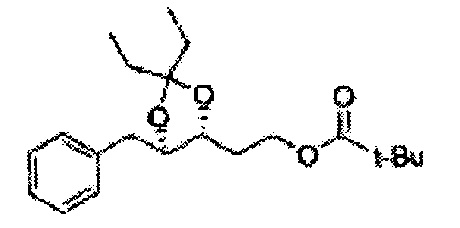
Осуществляли по существу такой же способ, какой описан в Примере получения 246, за исключением того, что для получения целевого соединения использовали (3R,4R)-3,4-дигидрокси-5-фенилпентилпивалат (Пример получения 248) вместо (3S,4S)-3,4-дигидрокси-5-фенилпентилпивалата (Пример получения 245) (1,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,76 (q, J=7,6, 2H), 1,84-1,90 (m, 2H), 2,00-2,07 (m, 2H), 3,85 (dt, J=3,7, 8,5, 1H), 4,14-4,27 (m, 2H), 5,17 (d, J=8,4, 1H), 7,22-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,64 (dd, 1=1,4, 7,8, 1H)
Пример получения 250: 2-((4R,5R)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этанол
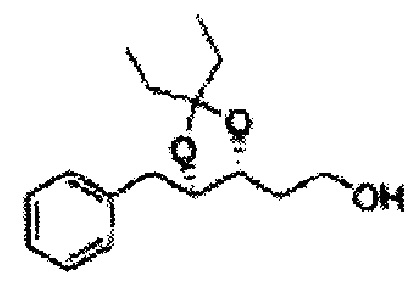
Осуществляли по существу такой же способ, какой описан в Примере получения 247, за исключением того, что для получения целевого соединения использовали (2-((4R,5R)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 249) вместо (2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 246) (0,9 г, 80-95%)
1H ЯМР (400 МГц, CDCl3): δ=0,89 (t, J=7,4, 6Н), 1,44-1,50 (m, 1H), 1,54-1,66 (m, 5H), 2,37 (t, J=5,6, 1H), 2,80 (dd, J=5,6, 14,0, 1H), 3,08 (dd, J=6,4, 14,0, 1H), 3,72 (q, J=5,5, 2H), 3,80-3,85 (m, 1H), 3,89-3,94 (m, 1H), 7,21-7,24 (m, 3H), 7,28-7,31 (m, 2H)
Пример получения 251: 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат

Осуществляли по существу такой же способ, какой описан в Примере получения 246, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,2 г, 60-85%)
1H ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9H), 1,53-1,80 (m, 10Н), 2,81 (dd, 1=6,0, 13,6, 1H), 3,00 (dd, J=6,4, 14,0, 1H), 3,75-3,80 (m, 1H), 3,84-3,89 (m, 1H), 4,05-4,16 (m, 2H), 7,20-7,24 (m, 3H), 7,27-7,31 (m, 2H)
Пример получения 252: 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
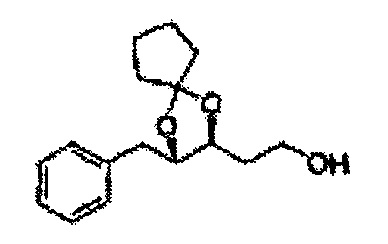
Осуществляли по существу такой же способ, какой описан в Примере получения 247, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 251) вместо (2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 246) (0,7 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,44-1,51 (m, 1H), 1,56-1,60 (m, 1H), 1,63-1,70 (m, 4Н), 1,72-1,81 (m, 4Н), 2,26 (t, J=5,4, 1H), 2,80 (dd, J=6,0, 14,0, 1H), 3,03 (dd, J=6,4, 14,0, 1H), 3,71 (q, J=5,5, 2H), 3,81-3,92 (m, 2H), 7,22-7,24 (m, 3H), 7,28-7,32 (m, 2H)
Пример получения 253: 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
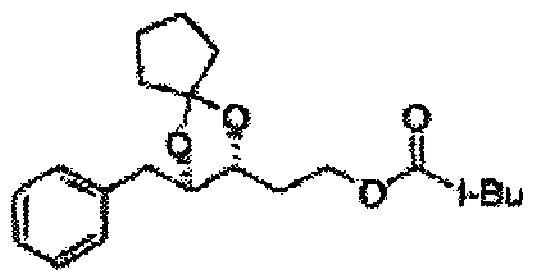
Осуществляли по существу такой же способ, какой описан в Примере получения 249, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,7 г, 60-85%)
1H ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9Н), 1,53-1,80 (m, 10Н), 2,81 (dd, J=6,0, 13,6, 1H), 3,00 (dd, J=6,4, 14,0, 1H), 3,75-3,80 (m, 1H), 3,84-3,89 (m. 1H), 4,05-4,16 (m, 2H), 7,20-7,24 (m, 3H), 7,27-7,31 (m, 2H)
Пример получения 254: 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
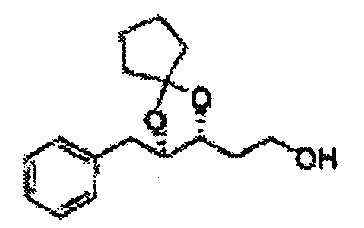
Осуществляли по существу такой же способ, какой описан в Примере получения 252, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 253) вместо 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 251) (0,8 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,44-1,51 (m, 1H), 1,56-1,60 (m, 1H), 1,63-1,70 (m, 4Н), 1,72-1,81 (m, 4Н), 2,26 (t, J=5,4, 1H), 2,80 (dd, J=6,0, 14,0, 1H), 3,03 (dd, J=6,4, 14,0, 1H), 3,71 (q, J=5,5, 2H), 3,81-3,92 (m, 2H), 7,22-7,24 (m, 3H), 7,28-7,32 (m, 2H)
Пример получения 255: 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
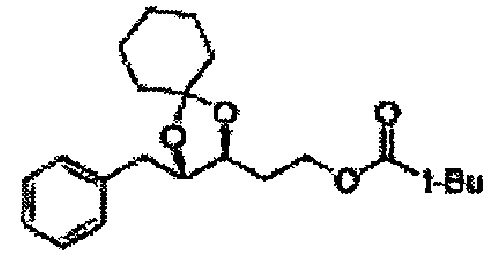
Осуществляли по существу такой же способ, какой описан в Примере получения 251, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,4 г, 60-85)
1Н ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9Н), 1,53-1,60 (m, 10Н), 1,61-1,66 (m, 2H), 2,83 (dd, J=5,6. 14,0, 1H), 2,98 (dd, J=6,0, 14,0, 1H), 3,78 (dt, J=3,5, 8,2, 1H), 3,86-3,91 (m, 1H), 4,11-4,15 (m, 2H), 7,20-7,31 (m, 5H)
Пример получения 256: 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этанол
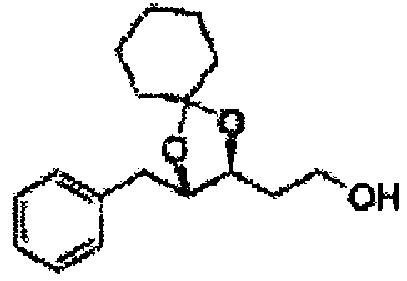
Осуществляли по существу такой же способ, какой описан в Примере получения 254, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 255) вместо 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 253) (1,0 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,34-1,43 (m, 2H), 1,48-1,61 (m, 10Н), 2,42 (t, J=5,6, 1H), 2,81 (dd, J=5,6, 14,0, 1H), 3,02 (dd, J=6,2, 13,8, 1H), 3,72 (q, J=5,5, 2H), 3,82-3,87 (m, 1H), 3,91-3,96 (m, 1H), 7,21-7,31 (m, 5H)
Пример получения 257: 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
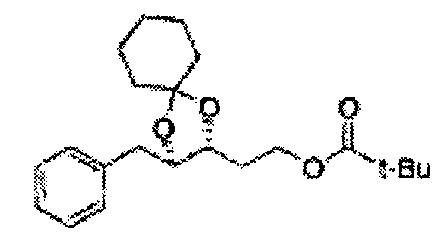
Осуществляли по существу такой же способ, какой описан в Примере получения 253, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,6 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): s=1,18 (s, 9H), 1,53-1,60 (m, 10Н), 1,61-1,66 (m, 2H), 2,83 (dd, J=5,6, 14,0, 1H), 2,98 (dd, J=6,0, 14,0, 1H), 3,78 (dt, J=3,5, 8,2, 1H), 3,86-3,91 (m, 1H), 4,11-4,15 (m, 2H), 7,20-7,31 (m, 5H)
Пример получения 258: 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этанол
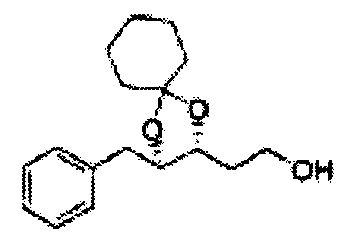
Осуществляли по существу такой же способ, какой описан в Примере получения 256, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 257) вместо 2-((2S,3S)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалата (Пример получения 255) (1,1 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,34-1,43 (m, 2H), 1,48-1,61 (m, 10Н), 2,42 (t, J=5,6, 1H), 2,81 (dd, J=5,6, 14,0, 1H), 3,02 (dd, J=6,2, 13,8, 1H), 3,72 (q, J=5,5, 2H), 3,82-3,87 (m, 1H), 3,91-3,96 (m, 1H), 7,21-7,31 (m, 5H)
Пример получения 259: (Е)-метил-4-фенилбут-2-еноат
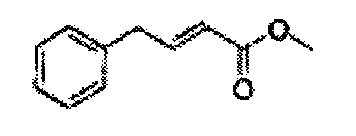
К раствору фенилацетальдегида (5,0 г, 41,61 ммоль) в толуоле (500 мл) добавляли метил(трифенилфосфоранилиден)ацетат (13,9 г, 41,61 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение 3 часов. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали, и концентрировали при пониженном давлении. К неочищенному продукту добавляли эфир/гексан (=1:1, об/об) при 0°С затем перемешивали в течение 30 минут. Фильтрат концентрировали, затем очищали на колонке с силикагелем для получения целевого соединения (5,9 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ=3,47 (d, J=6,8, 2Н), 3,67 (s, 3Н), 5,79 (d, J=15,4, 1H), 7,06 (dt, J=15,4, 6,8, 1H), 7,28-7,12 (m, 5H)
Пример получения 260: (2R,3S)-метил-2,3-дигидрокси-4-фенилбутаноат

Осуществляли по существу такой же способ, какой описан в Примере получения 245, за исключением того, что для получения целевого соединения использовали (Е)-метил-4-фенилбут-2-еноат (Пример получения 259) вместо (Е)-5-фенилпент-3-енилпивалата (Пример получения 238) (3,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=2,96 (ddd, J=7,3, 13,5, 17,1, 2Н), 3,10 (d, J=5,2, 1H), 3,80 (s, 3Н), 4,08 (dd, J=1,4, 5,4, 1H), 7,23-7,34 (m, 5H)
Пример получения 261: (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилат
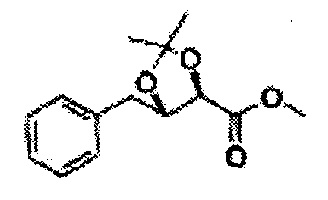
Осуществляли по существу такой же способ, какой описан в Примере получения 240, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-2,3-дигидрокси-4-фенилбутаноат (Пример получения 260) вместо (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-фенилпентан-2,3-диола (Пример получения 239) (3,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,42 (s, 3Н), 1,43 (s, 3Н), 3,01 (dd, J=6,8, 14,4, 1Н), 3,12 (dd, J=4,4, 14,4, 1Н), 3,72 (s, 3Н), 4,19 (d, J=7,6, 1Н), 4,40 (ddd, J=4,4, 7,0, 7,8, 1Н), 7,22-7,33 (m, 5H)
Пример получения 262: ((4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)метанол
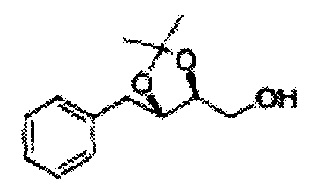
Осуществляли по существу такой же способ, какой описан в Примере получения 234, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 261) вместо (4S,5R)-метил-3-фенил-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 233) (2,3 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41 (s, 6Н), 1,79 (q, J=4,3, 1Н), 2,83 (dd, J=6,2, 13,8, 1Н), 3,07 (dd, J=6,4, 14,0, 1Н), 3,29 (ddd, J=4,7, 7,5, 12,1, 1Н), 3,54 (ddd, J=2,8, 5,2, 12,0, 1Н), 3,83 (ddd, J=3,9. 3,9, 7,1, 1Н), 4,15 (q, J=7,1, 1Н), 7,22-7,32 (m, 5H)
Пример получения 263: (4R,5S)-метил-5-бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилат

К перемешиваемому раствору (2R,3S)-метил 2,3-дигидрокси-4-фенилбутаноата (Пример получения 260, 2,0 г, 9,51 ммоль) в 3-пентаноне (5 мл, 47,55 ммоль) добавляли каталитическое количество H2SO4 (0,051 мл, 0,951 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение 20 часов. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали, и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,2 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=0,85 (t, J=6,0, 3Н), 0,92 (t, J=7,6, 3Н), 1,66 (dq, J=7,6, 14,7, 4H), 3,01 (dd, J=6,6, 14,2, 1Н), 3,10 (dd, J=4,4, 14,4, 1Н), 3,71 (s, 3Н), 4,17 (d, J=8,4, 1Н), 4,32-4,37 (m, 1Н), 7,23-7,32 (m, 5H)
Пример получения 264: ((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)метанол
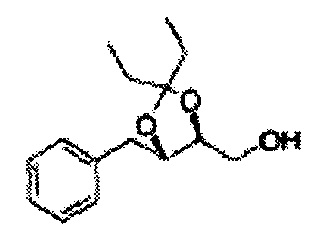
Осуществляли по существу такой же способ, какой описан в Примере получения 262, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 263) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 261) (0,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,91 (dt, J=1,9, 7,5, 6H), 1,61-1,68 (m, 4H), 1,77 (t, J=6,2, 1H), 2,81 (dd, J=6,4, 14,0, 1H), 3,09 (dd, J=6,2, 13,8, 1H), 3,24-3,30 (m, 1H), 3,49-3,54 (m, 1H), 3,78-3,82 (m, 1H), 4,08-4,13 (m, 1H), 7,21-7,32 (m, 5H)
Пример получения 265: (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
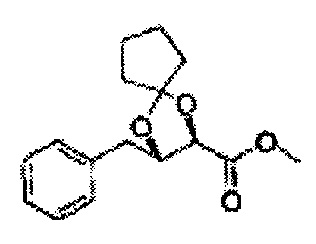
Осуществляли по существу такой же способ, какой описан в Примере получения 263, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,3 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,61-1,79 (m, 5H), 1,85-1,92 (m, 3Н), 3,00-3,11 (m, 2H), 3,70 (s, 3H), 4,17 (d, J=7,2, 1H), 4,32 (dt, J=4,9, 7,0, 1H), 7,21-7,33 (m, 5H)
Пример получения 266: ((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
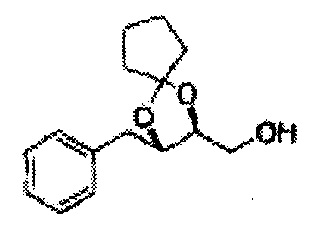
Осуществляли по существу такой же способ, какой описан в Примере получения 264, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил 3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 265) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 263) (0,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,57-1,88 (m, 8H), 2,82 (dd, J=6,6, 13,8, 1H), 3,08 (dd, J=6,4, 14,0, 1H), 3,27-3,33 (m, 1H), 3,47-3,52 (m, 1H), 3,79-3,83 (m, 1H), 4,07 (q, J=6,8, 1H), 7,21-7,32 (m, 5H)
Пример получения 267: (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,5]декан-2-карбоксилат
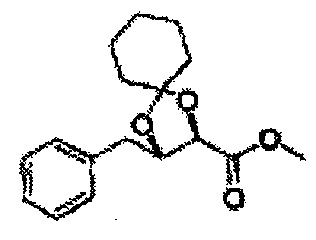
Осуществляли по существу такой же способ, какой описан в Примере получения 265, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,5 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,54-1,74 (m, 10Н), 2,99-3,12 (m, 2H), 3,70 (s, 3H), 4,18 (d, J=7,6, 1H), 4,36-4,41 (m, 1H), 7,21-7,32 (m, 5H)
Пример получения 268: ((2S,3S)-3-бензил-1,4-диоксаспиро[4,4]декан-2-ил)метанол
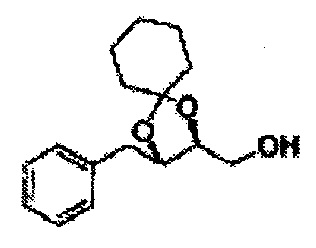
Осуществляли по существу такой же способ, какой описан в Примере получения 266, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 267) вместо (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 265) (0,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,53-1,65 (m, 10Н), 2,82 (dd, 3=6,2, 13,8, 1H), 3,07 (dd, J=6,4, 13,6, 1H), 3,24-3,30 (m, 1H), 3,52-3,56 (m, 1H), 3,80-3,84 (m, 1H), 4,10-4,15 (m, 1H), 7,21-7,31 (m, 5H)
Пример получения 269: (2S,3R)-метил-2,3-дигидрокси-4-фенилбутаноат
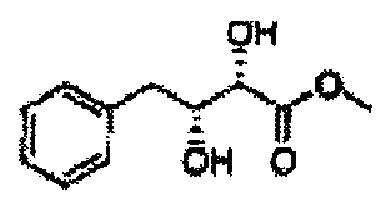
Осуществляли по существу такой же способ, какой описан в Примере получения 242, за исключением того, что для получения целевого соединения использовали (Е)-метил-4-фенилбут-2-еноат (Пример получения 259) вместо (Е)-трет-бутилдиметил(5-фенил пент-3-енилокси)силана (Пример получения 237) (3,5 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=2,96 (ddd, J=7,3, 13,5, 17,1, 2H), 3,10 (d, J=5,2, 1H), 3,80 (s, 3H), 4,08 (dd, 3=1 A, 5,4, 1H), 7,23-7,34 (m, 5H)
Пример получения 270: (4S,5R)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилат
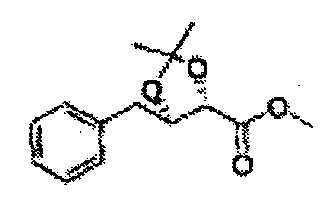
Осуществляли по существу такой же способ, какой описан в Примере получения 261, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-2,3-дигидрокси-4-фенилбутаноат (Пример получения 269) вместо (2R,3S)-метил-2,3-дигидрокси-4-фенилбутаноата (Пример получения 260) (3,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41 (s, 6Н), 1,79 (q, J=4,3, 1Н), 2,83 (dd, J=6,2, 13,8, 1H), 3,07 (dd, J=6,4, 14,0, 1H), 3,29 (ddd, J=4,7, 7,5, 12,1, 1H), 3,54 (ddd, J=2,8, 5,2, 12,0, 1H), 3,83 (ddd, J=3,9, 3,9, 7,1, 1H), 4,15 (q, J=7,1, 1H), 7,22-7,32 (m, 5H)
Пример получения 271: ((4R,5R)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)метанол
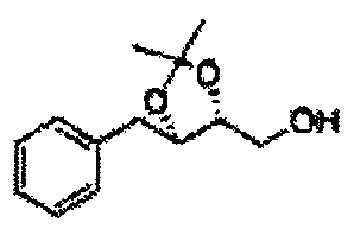
Осуществляли по существу такой же способ, какой описан в Примере получения 262, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 270) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 261) (2,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,41 (s, 6Н), 1,79 (q, 1=4,3, 1H), 2,83 (dd, J=6,2, 13,8, 1H), 3,07 (dd, J=6,4, 14,0, 1H), 3,29 (ddd, J=4,7, 7,5, 12,1. 1H), 3,54 (ddd, J=2,8, 5,2, 12,0, 1H), 3,83 (ddd, J=3,9, 3,9, 7,1, 1H), 4,15 (q, J=7,1, 1H), 7,22-7,32 (m, 5H)
Пример получения 272: (4S,5R)-метил-5-бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилат
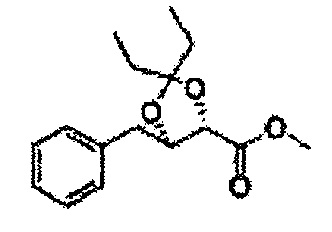
Осуществляли по существу такой же способ, какой описан в Примере получения 263, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-2,3-дигидрокси-4-фенилбутаноат (Пример получения 269) вместо (2,3-дигидрокси-4-фенилбутаноата (Пример получения 260) (1,5 г. 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=0,85 (t, J=6,0, 3Н), 0,92 (t, J=7,6, 3Н), 1,66 (dq, J=7,6, 14,7, 4H), 3,01 (dd, J=6,6, 14,2. 1H), 3,10 (dd, J=4,4, 14,4, 1H), 3,71 (s, 3Н), 4,17 (d, J=8,4. 1H), 4,32-4,37 (m, 1H), 7,23-7,32 (m, 5H)
Пример получения 273: ((4R,5R)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)метанол
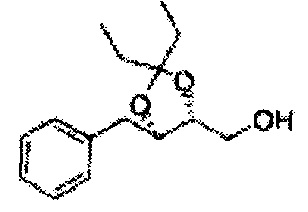
Осуществляли по существу такой же способ, какой описан в Примере получения 264, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 272) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 263) (1,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,91 (dt, J=1,9, 7,5, 6H), 1,61-1,68 (m, 4H), 1,77 (t, J=6,2, 1H), 2,81 (dd, J=6,4, 14,0, 1H), 3,09 (dd, J=6,2, 13,8, 1H), 3,24-3,30 (m, 1H), 3,49-3,54 (m, 1H), 3,78-3,82 (m, 1H), 4,08-4,13 (m, 1H), 7,21-7,32 (m, 5H)
Пример получения 274: (2S,3R)-метил-3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
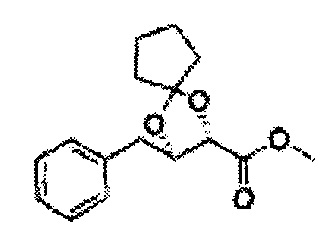
Осуществляли по существу такой же способ, какой описан в Примере получения 272, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,2 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,61-1,79 (m, 5H), 1,85-1,92 (m, 3Н), 3,00-3,11 (m, 2H), 3,70 (s, 3H), 4,17 (d, J=7,2, 1H), 4,32 (dt, J=4,9, 7,0, 1H), 7,21-7,33 (m, 5H)
Пример получения 275: ((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
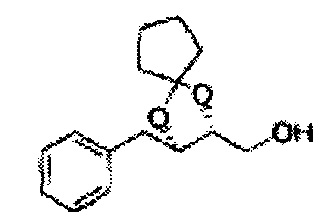
Осуществляли по существу такой же способ, какой описан в Примере получения 266, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 274) вместо (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 265) (1,1 г, 70-95%)
1Н ЯМР (400 МГц, CDCL3) δ=1.57-1.88 (m, 8Н), 2,82 (dd, J=6,6, 13,8, 1Н), 3,08 (dd, J=6,4, 14,0, 1Н), 3,27-3,33 (m, 1Н), 3,47-8,52 (m, 1Н), 3,79-3,83 (m, 1Н), 4,07 (q, J=6,8, 1Н), 7,21-7,32 (m, 5H)
Пример получения 276: (2S,3R)-метил-3-бензил-1,4-диоксаспиро[4,5]декан-2-карбоксилат
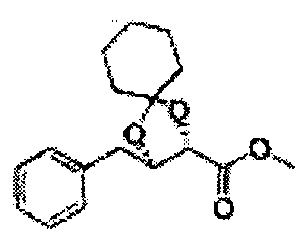
Осуществляли по существу такой же способ, какой описан в Примере получения 274, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,4 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,54-1,14 (m, 10Н), 2,99-3,12 (m, 2H), 3,70 (s, 3Н), 4,18 (d, J=7,6, 1Н), 4,36-4,41 (m, 1Н), 7,21-7,32 (m, 5H)
Пример получения 277: ((2R,3R)-3-бензил-1,4-диоксаспиро[4,4]нонан-2-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 268, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-бензил-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 276) вместо (2R,3S)-метил-3-бензил-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 267) (1,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,53-1,65 (m, 10Н), 2,82 (dd, J=6,2, 13,8, 1Н), 3,07 (dd, J=6,4, 13,6, 1Н), 3,24-3,30 (m, 1Н), 3,52-3,56 (m, 1Н), 3,80-3,84 (m, 1Н), 4,10-4,15 (m, 1Н), 7,21-7,31 (m, 5H)
Пример получения 278: (Е)-4-фенилбут-3-еновой кислоты
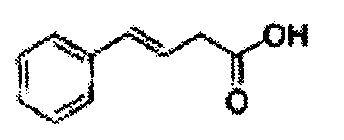
К перемешиваемому раствору 2-фенилацетальдегида (5,0 г, 32,3 ммоль) и малоновой кислоты (4,0 г, 38,8 ммоль) в пиридине (25,0 мл) добавляли каталитическое количество пиперидина (0,64 мл, 6,46 ммоль), затем нагревали с обратным холодильником. Через 3 часа полученную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К неочищенному продукту медленно добавляли 2N HCl. Белый осадок отфильтровывали и осушали под вакуумом для получения целевого соединения (3,5 г, 55-80%)
1Н ЯМР (400 МГц, CDCl3): δ=3,39 (d, J=8,8, 2Н), 6,31 (td, J=7,9, 14,8, 1H), 6,94 (d, J=16, 1H), 7,17-7,45 (m, 3H), 7,56-7,59 (m, 1H)
Пример получения 279: (Е)-4-фенилбут-3-ен-1-ол

К перемешиваемому раствору Zn(BH4)2 (40,0 мл, 20,0 ммоль) в ТГФ (40 мл) добавляли по каплям раствор (Е)-4-фенилбут-3-еновой кислоты (Пример получения 278, 2,0 г, 10,0 ммоль) в ТГФ(5 мл) при 0°С, затем нагревали с обратным холодильником в течение 0,5 часа. Реакцию останавливали H2O при 0°С, отфильтровывали через целит, промывали EtOAc, осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,0 г, 50-75%)
1H ЯМР (400 МГц, CDCl3: δ=2,55 (ddd, J=4,1, 11,9, 21,5, 2Н), 3,82 (t, 1=5,8, 2Н), 6,24 (td, J=7,2, 15,7, 1H), 6,87 (d, J=14,8, 1H), 7,12-7,25 (m, 3H), 7,36 (dd, J=1,2, 8,0, 1H), 7,52 (dd, J=1,6, 9,2, 1H)
Пример получения 280: (Е)-трет-бутилдиметил (4-фенилбут-3-енилокси)силан
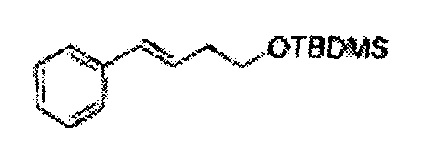
Осуществляли по существу такой же способ, какой описан в Примере получения 237, за исключением того, что для получения целевого соединения использовали (Е)-4-фенилбут-3-ен-1-ол (Пример получения 279) вместо (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236) (1,7 г, 80-98%)
1Н ЯМР (400 МГц, CDCl3): δ=0,07 (s, 3H), 0,10 (s, 3H), 0,92 (d, J=6,4, 9H), 2,51 (q, J=4,5, 2Н), 3,78 (t, J=6,6, 2Н), 6,26 (td, J=7,2, 15,7, 1H), 6,84 (d, J=15,6, 1H), 7,13-7,24 (m, 3H), 7,36 (dd, J=5,6, 12,4, 1H), 7,53 (dd, J=1,4, 7,8, 1H)
Пример получения 281: (Е)-4-фенилбут-3-енилпивалат

Осуществляли по существу такой же способ, какой описан в Примере получения 238, за исключением того, что для получения целевого соединения использовали (Е)-4-фенилбут-3-ен-1-ол (Пример получения 279) вместо (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236) (10,8 г, 75-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,22 (s, 9Н), 2,57 (ddd, J=1,3, 6,7, 13,5, 2H), 4,22 (t, J=6,6, 2H), 6,19 (td, J=7,0, 16,0, 1H), 6,49 (d, J=16,0, 1H), 7,23-7,26 (m, 1H), 7,31-7,41 (m, 4H)
Пример получения 282: (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диол
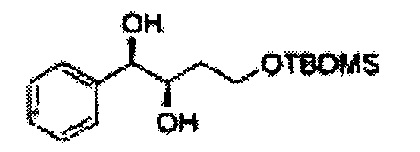
Осуществляли по существу такой же способ, какой описан в Примере получения 239, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил(4-фенилбут-3-енилокси)силан (Пример получения 280) вместо (Е)-трет-бутилдиметил(5-фенилпент-3-енилокси)силана (Пример получения 237) (0,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,10 (s, 3Н), 0,11 (s, 3H), 0,92 (s, 9Н), 1,69-1,70 (m, 1H), 1,93-2,07 (m, 1H), 3,51 (d, J=4,8, 1H), 3,86 (d, J=3,2, 1H), 3,87 (dd, J=3,2, 9,2, 1H), 3,91-3,96 (m, 1H), 4,01-4,06 (m, 1H), 5,05 (t, J=4,6, 1H), 7,22-7,26 (m, 1H), 7,31-7,37 (m, 2H), 7,59 (dd, J=1,2, 7,6, 1H)
Пример получения 283: (3R,4R)-3,4-дигидрокси-4-фенилбутилпивалат
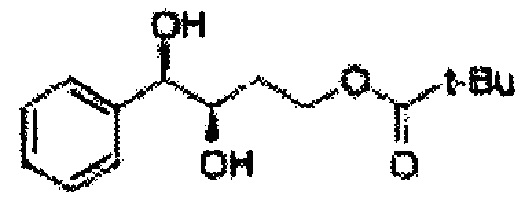
Осуществляли по существу такой же способ, какой описан в Примере получения 282, за исключением того, что для получения целевого соединения использовали (Е)-4-фенилбут-3-енилпивалат (Пример получения 281) вместо (Е)-трет-бутилдиметил(4-фенилбут-3-енилокси)силана (Пример получения 280) (8,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9Н), 1,65-1,74 (m, 2H), 2,83 (d, 1=2,4, 1H), 2,96 (d, J=3,2, 1H), 3,74-3,79 (m, 1H), 4,10-4,17 (m, 1H), 4,33 (ddd, 1=4,0, 7,2, 12,6, 1H), 4,49 (d, J=5,6, 1H), 7,31-7,41 (m, 5H)
Пример получения 284: трет-бутил (2-((4R,5)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан
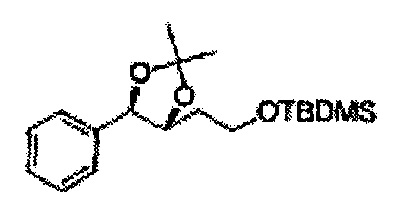
Осуществляли по существу такой же способ, какой описан в Примере получения 218, за исключением того, что для получения целевого соединения использовали (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диол (Пример получения 282) вместо (2R,3S)-метил-3-фенил-2,3-дигидроксипропаноата (Пример получения 217) (1,6 г, 70-95)
1Н ЯМР (400 МГц, CDCl3): δ=0,02 (s, 3Н), 0,07 (s, 3Н), 0,86 (s, 9H), 1,50 (s, 3Н), 1,58 (s, 3Н), 1,82-1,99 (m, 2Н), 3,68-3,78 (m, 2Н), 3,95 (dt, J=3,3, 8,7, 1Н), 5,16 (d, J=8,4, 1H), 7,21-7,27 (m, 1H), 7,31-7,38 (m, 2Н), 7,60 (dd, J=1,6, 7,6, 1H)
Пример получения 285: 2-((4R,5R)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этанол
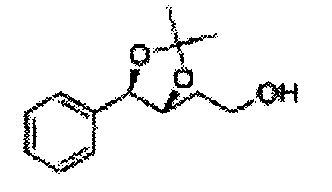
Осуществляли по существу такой же способ, какой описан в Примере получения 244, за исключением того, что для получения целевого соединения использовали трет-бутил(2-((4R,5)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан (Пример получения 284) вместо (2-((4R,5R)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилана (Пример получения 243) (1,4 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3): δ=1,56 (s, 3Н), 1,62 (s, 3Н), 1,92-2,04 (m, 2Н), 2,26 (q, J=3,7, 1H), 3,75-3,90 (m, 2Н), 3,94 (td, J=3,9, 8,5, 1H), 5,23 (d, J=15,6, 1H), 7,22-7,27 (m, 1H), 7,33-7,39 (m, 2H), 7,62 (dd, J=1,6, 7,6, 1H)
Пример получения 286: (1S,2S)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диол
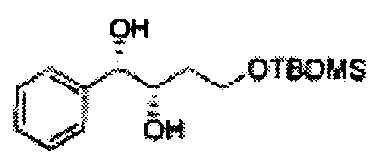
Осуществляли по существу такой же способ, какой описан в Примере получения 242, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил(4-фенилбут-3-енилокси)силан (Пример получения 280) вместо (Е)-трет-бутилдиметил(5-фенилпент-3-енилокси)силана (Пример получения 237) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,10 (s, 3Н), 0,11 (s, 3Н), 0,92 (s, 9H), 1,69-1,70 (m, 1H), 1,93-2,07 (m, 1H), 3,51 (d, J=4,8, 1H), 3,86 (d, J=3,2, 1H), 3,87 (dd, J=3,2, 9,2, 1H), 3,91-3,96 (m, 1H), 4,01-4,06 (m, 1H), 5,05 (t, J=4,6, 1H), 7,22-7,26 (m, 1H), 7,31-7,37 (m, 2Н), 7,59 (dd, J=1,2, 7,6, 1H)
Пример получения 287: (3S,4S)-3,4-дигидрокси-4-фенилбутилпивалат
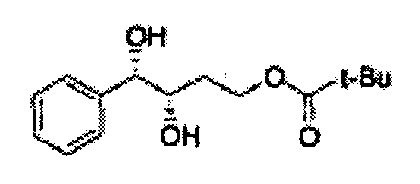
Осуществляли по существу такой же способ, какой описан в Примере получения 286, за исключением того, что для получения целевого соединения использовали (Е)-4-фенилбут-3-енилпивалат (Пример получения 281) вместо (Е)-трет-бутилдиметил(4-фенилбут-3-енилокси)силана (Пример получения 280) (10,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9Н), 1,65-1,74 (m, 2Н), 2,83 (d, 1=2,4, 1Н), 2,96 (d, J=3,2, 1H), 3,74-3,79 (m, 1Н), 4,10-4,17 (m, 1Н), 4,33 (ddd, J=4,0, 7,2, 12,6, 1Н), 4,49 (d, J=5,6, 1Н), 7,31-7,41 (m, 5H)
Пример получения 288: трет-бутил(2-((4S,5S)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан
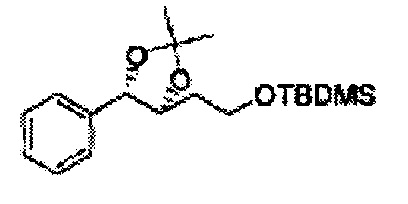
Осуществляли по существу такой же способ, какой описан в Примере получения 284, за исключением того, что для получения целевого соединения использовали (1S,2S)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диол (Пример получения 286) вместо (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диола (Пример получения 282) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,02 (s, 3Н), 0,07 (s, 3Н), 0,86 (s, 9Н), 1,50 (s, 3Н), 1,58 (s, 3Н), 1,82-1,99 (m, 2Н), 3,68-3,78 (m, 2Н), 3,95 (dt, J=3,3, 8,7, 1Н), 5,16 (d, J=8,4, 1Н), 7,21-7,27 (m, 1Н), 7,31-7,38 (m, 2Н), 7,60 (dd, J=1,6, 7,6, 1Н)
Пример получения 289: 2-((4S,5S)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этанол
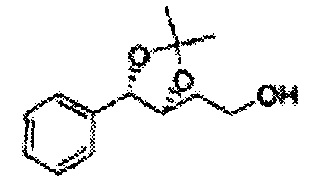
Осуществляли по существу такой же способ, какой описан в Примере получения 285, за исключением того, что для получения целевого соединения использовали трет-бутил(2-((4S,5S)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан (Пример получения 288) вместо трет-бутил(2-((4R,5)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилана (Пример получения 284) (0,4 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,56 (s, 3Н). 1,62 (s, 3Н), 1,92-2,04 (m, 2H), 2,26 (q, J=3,7, 1H), 3,75-3,90 (m, 2H), 3,94 (td, 1=3,9, 8,5, 1H), 5,23 (d, J=15,6, 1H), 7,22-7,27 (m, 1H), 7,33-7,39 (m, 2H), 7,62 (dd, J=1,6, 7,6, 1H)
Пример получения 290: 2-((4R,5R)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат
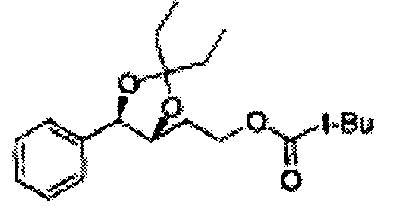
Осуществляли по существу такой же способ, какой описан в Примере получения 264, за исключением того, что для получения целевого соединения использовали (3R,4R)-3,4-дигидрокси-4-фенилбутилпивалат (Пример получения 283) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 263) (1,8 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,00 (t, J=7,4, 3Н), 1,08 (t, J=7,6, 3Н), 1,14 (s, 9H), 1,76 (q, J=7,5, 2H), 1,81-1,89 (m, 2H), 1,91-1,98 (m, 2H), 3,87 (td, J=5,8, 8,8, 1H), 4,13-4,18 (m, 1H), 4,22-4,28 (m, 1H), 4,58 (d, J=8,8, 1H), 7,31-7,43 (m, 5H)
Пример получения 291: 2-((4R,5R)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат
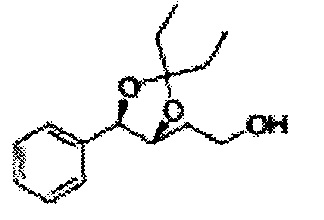
Осуществляли по существу такой же способ, какой описан в Примере получения 258, за исключением того, что для получения целевого соединения использовали 2-((4R,5R)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 290) вместо 2-((2R,3R)-3-бензил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалата (Пример получения 257) (0,9 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,01 (t, J=7,4, 3Н), 1,07 (t, J=7,6, 3Н), 1,79 (q, J=7,5, 2H), 1,83-1,90 (m, 4H), 2,38 (q, J=3,7, 1H), 3,75-3,87 (m, 2H), 3,90-3,95 (m, 1H), 4,63 (d, 1=8,8, 1H), 7,32-7,43 (m, 5H)
Пример получения 292: 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
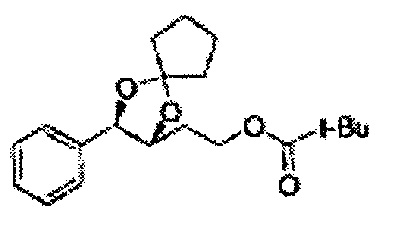
Осуществляли по существу такой же способ, какой описан в Примере получения 290, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,8 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,14 (s, 9Н), 1,67-1,83 (m, 4Н), 1,88-2,07 (m, 6Н), 3,84 (td, J=6,0, 8,4, 1H), 4,13 (td, J=7,0, 11,1, 1H), 4,24 (td, 1=6,4, 11,2, 1H), 4,55 (d, J=8,4, 1H), 7,31-7,39 (m, 5H)
Пример получения 293: 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
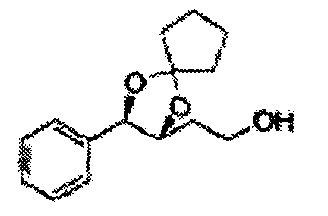
Осуществляли по существу такой же способ, какой описан в Примере получения 291, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 292) вместо 2-((4S,5S)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 290) (0,9 г. 80-95%)
1Н ЯМР (400 МГц, CDCl3): s=1,71-1,81 (m, 4Н), 1,87-2,07 (m, 6Н), 2,27 (q, 1=3,7, 1H), 3,79-3,85 (m. 2H), 3,89-3,92 (m, 1H), 4,59 (d, J=8,4, 1H), 7,32-7,41 (m, 5H)
Пример получения 294: 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
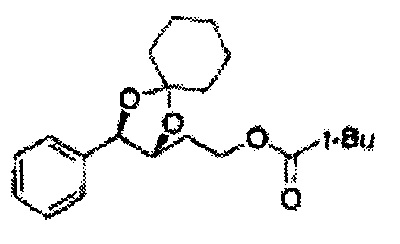
Осуществляли по существу такой же способ, какой описан в Примере получения 292, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,0 г, 60-85%).
1Н ЯМР (400 МГц, CDCl3): δ=1,14 (s, 9Н), 1,67-1,83 (m, 4Н), 1,88-2,07 (m, 6Н), 3,84 (td, J=6,0, 8,4, 1H), 4,10-4,17 (m, 1H), 4,21-4,27 (m, 1H), 4,55 (d, J=8,4, 1H), 7,31-7,39 (m, 5H)
Пример получения 295: 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этанол
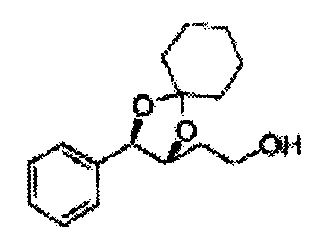
Осуществляли по существу такой же способ, какой описан в Примере получения 293, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 294) вместо 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 292) (1,2 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,71-1,83 (m, 4H), 1,87-2,05 (m, 6H), 2,27 (q, J=3,7, 1H), 3,79-3,85 (m, 2H), 3,86-3,91 (m, 1H), 4,59 (d, J=8,4, 1H), 7,32-7,41 (m, 5H)
Пример получения 296: 2-((4S,5S)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат
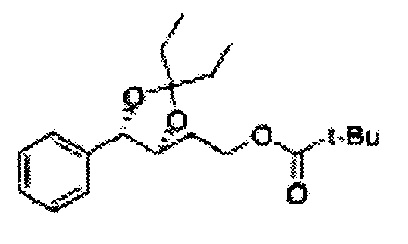
Осуществляли по существу такой же способ, какой описан в Примере получения 290, за исключением того, что для получения целевого соединения использовали (3S,4S)-3,4-дигидрокси-4-фенилбутилпивалат (Пример получения 287) вместо (3R,4R)-3,4-дигидрокси-4-фенилбутилпивалата (Пример получения 283) (2,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1.00 (t, J=7,4, 3Н), 1,08 (t, J=7,6, 3Н), 1,14 (s, 9H), 1,76 (q, J=7,5, 2H), 1,81-1,89 (m, 2H), 1,91-1,98 (m, 2H), 3,87 (td, J=5,8, 8,8, 1H), 4,13-4,18 (m, 1H), 4,22-4,28 (m, 1H), 4,58 (d, 1=8,8, 1H), 7,31-7,43 (m, 5H)
Пример получения 297: 2-((4S,5S)-2(2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат
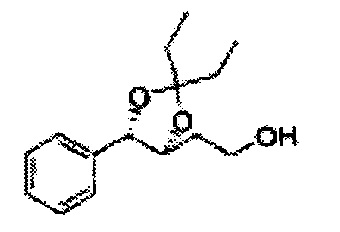
Осуществляли по существу такой же способ, какой описан в Примере получения 295, за исключением того, что для получения целевого соединения использовали 2-((4S,5S)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 296) вместо 2-((2R,3R)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалата (Пример получения 294) (0,7 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,01 (t, J=7,4, 3Н), 1,07 (t, t=7,6, 3Н), 1,79 (q, 1=7,5, 2H), 1,83-1,90 (m, 4H), 2,38 (q, J=3,7, 1H), 3,75-3,87 (m, 2H), 3,90-3,95 (m, 1H), 4,63 (d, J=8,8, 1H), 7,32-7,43 (m, 5H)
Пример получения 298: 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
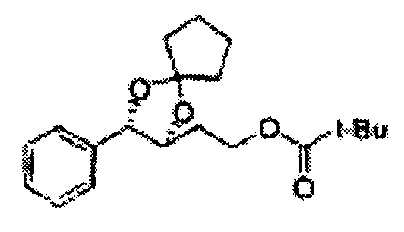
Осуществляли по существу такой же способ, какой описан в Примере получения 296, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (2,4 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,14 (s, 9Н), 1,67-1,83 (m, 4Н), 1,88-2,07 (m, 6Н), 3,84 (td, J=6,0, 8,4, 1Н), 4,13 (td, J=7,0, 11,1, 1H), 4,24 (td, J=6,4, 11,2, 1H), 4,55 (d, J=8,4, 1H), 7,31-7,39 (m, 5H)
Пример получения 299: 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этанол

Осуществляли по существу такой же способ, какой описан в Примере получения 297, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 298) вместо 2-((4S,5S)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 296) (0,7 г, 80-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,71-1,81 (m, 4Н), 1,87-2,07 (m, 6Н), 2,27 (q, J=3,7, 1H), 3,79-3,85 (m, 2Н), 3,89-3,92 (m, 1H), 4,59 (d, J=8,4, 1H), 7,32-7,41 (m, 5H)
Пример получения 300: 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
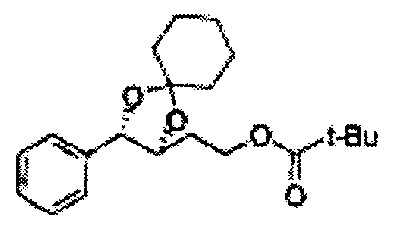
Осуществляли по существу такой же способ, какой описан в Примере получения 298, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (2,4 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,14 (s, 9Н), 1,67-1,83 (m, 4Н), 1,88-2,07 (m, 6Н), 3,84 (td, J=6,0, 8,4, 1H), 4,10-4,17 (m, 1H), 4,21-4,27 (m, 1H), 4,55 (d, J=8,4, 1H), 7,31-7,39 (m, 5H)
Пример получения 301: 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этанол
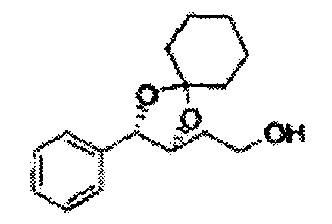
Осуществляли по существу такой же способ, какой описан в Примере получения 299, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 300) вместо 2-((2S,3S)-3-фенил-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 298) (1,2 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,71-1,83 (m, 4H), 1,87-2,05 (m, 6H), 2,27 (q, J=3,7, 1H), 3,79-3,85 (m, 2H), 3,86-3,91 (m, 1H), 4,59 (d, J=8,4, 1H), 7,32-7,41 (m, 5H)
Пример получения 302: (Е)-5-(2-хлорфенил)пент-3-еновая кислота
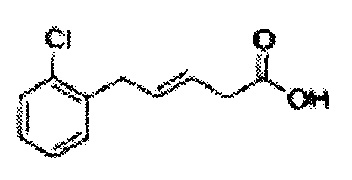
Осуществляли по существу такой же способ, какой описан в Примере получения 235, за исключением того, что для получения целевого соединения использовали 3-(2-хлорфенил)пропанол вместо гидроциннамальдегида (6,1 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ=3,15 (dd, J=0,8, 6,8, 2H), 3,53 (d, J=6,4, 2H), 5,61-5,69 (m, 1H), 5,75-5,82 (m, 1H), 7,16-7,28 (m, 3H), 7,36-7,38 (m, 1H)
Пример получения 303: (Е)-5-(2-хлорфенил)пент-3-ен-1-ол

Осуществляли по существу такой же способ, какой описан в Примере получения 236, за исключением того, что для получения целевого соединения использовали (Е)-5-(2-хлорфенил)пент-3-еновую кислоту (Пример получения 302) вместо (Е)-5-фенилпент-3-еновой кислоты (Пример получения 235) (4,6 г, 70-90%)
1Н ЯМР (400 МГц, CDCl3): δ=2,33 (dq, J=1,0, 6,5, 2H), 3,50 (dd, J=1,8, 5,0, 2H), 3,67 (q, J=6,0, 2H), 5,45-5,53 (m, 1H), 5,70-5,77 (m, 1H), 7,15-7,37 (m, 4H)
Пример получения 304: (Е)-трет-бутил(5-(2-хлорфенил)пент-3-енилокси)диметилсилан
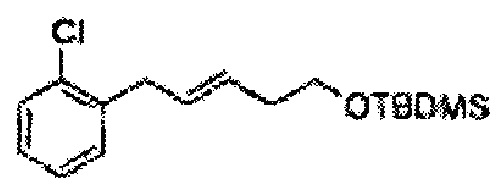
Осуществляли по существу такой же способ, какой описан в Примере получения 237, за исключением того, что для получения целевого соединения использовали (Е)-5-(2-хлорфенил)пент-3-ен-1-ол (Пример получения 303) вместо (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236) (4,9 г, 75-95%)
1Н ЯМР (400 МГц, CDCl3) δ=0,60 (s, 6H), 0,90 (s, 9Н), 2,28 (dq, J=1,0, 6,7, 2H), 3,47 (d, J=6,4, 2H), 3,65 (t, J=6,8, 2H), 5,49-5,56 (m, 1H), 5,62-5,70 (m, 1H), 7,14-7,36 (m, 4H)
Пример получения 305: (Е)-5-(2-хлорфенил)пент-3-енилпивалат

Осуществляли по существу такой же способ, какой описан в Примере получения 238, за исключением того, что для получения целевого соединения использовали (Е)-5-(2-хлорфенил)пент-3-ен-1-ол (Пример получения 303) вместо (Е)-5-фенилпент-3-ен-1-ола (Пример получения 236) (7,2 г, 75-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,18 (s, 9Н), 2,36 (q, J=6,7, 2Н), 3,45 (d, 1=6,4, 2H), 4,08 (t, J=6,6, 2H), 5,43-5,50 (m, 1H), 5,63-5,70 (m, 1H), 7,12-7,35 (m, 4H)
Пример получения 306: (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)пентан-2,3-диол
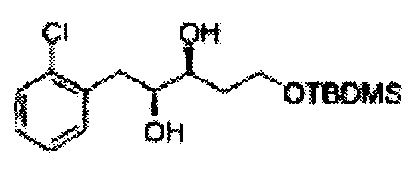
Осуществляли по существу такой же способ, какой описан в Примере получения 239, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутил(5-(2-хлорфенил)пент-3-енилокси)диметилсилан (Пример получения 304) вместо (Е)-трет-бутилдиметил(5-фенилпент-3-енилокси)силана (Пример получения 237) (2,8 г, 90%)
1Н ЯМР (400 МГц, CDCl3): δ=0,11 (s, 6H), 0,92 (s, 9Н), 1,68-1,77 (m, 1H), 1,87-1,96 (m, 1H), 2,64 (d, 1=6,0, 1H), 2,93 (dd, J=8,2, 13,4, 1H), 3,07 (dd, J=4,8, 13,6, 1H), 3,68 (d, J=3,2, 1H), 3,76-3,96 (m, 4H), 7,17-7,25 (m, 2H), 7,35-7,39 (m, 2H)
Пример получения 307: (2-(4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан
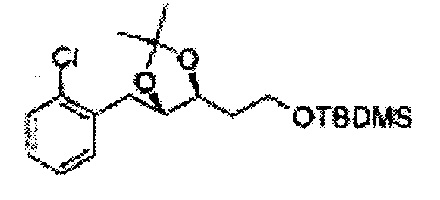
Осуществляли по существу такой же способ, какой описан в Примере получения 240, за исключением того, что для получения целевого соединения использовали (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)пентан-2,3-диол (Пример получения 306) вместо (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-фенил пентан-2,3-диол (Пример получения 239) (3,6 г, 75-90%)
1Н ЯМР (400 МГц, CDCl3): δ=0,06 (s, 6Н), 0,91 (s, 9H), 1,39 (s, 3Н), 1,40 (s, 3Н), 1,69 (q, J=6,5, 2Н), 3,05 (dq, J=5,8, 15,1, 2H), 3,70-3,80 (m, 2H), 3,86-3,93 (m, 1H), 3,97-4,02 (m, 1H), 7,17-7,25 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 308: 2-((4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
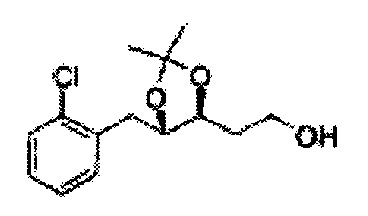
Осуществляли по существу такой же способ, какой описан в Примере получения 241, за исключением того, что для получения целевого соединения использовали (2-(4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан (Пример получения 307) вместо (2-(4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилана (Пример получения 240) (3,2 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,38 (s, 3Н), 1,40 (s, 3Н), 1,50-1,63 (m, 2H), 2,29 (t, J=5,4, 1H), 2,82 (dd, J=5,8, 13,8, 1H), 3,01 (dd, J=6,4, 14,0, 1H), 3,72 (q, J=5,5, 2H), 3,86 (dt, J=3,2, 8,4, 1H), 3,92-3,97 (m, 1H), 7,17-7,25 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 309: (2R,3R)-5-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)пентан-2,3-диол
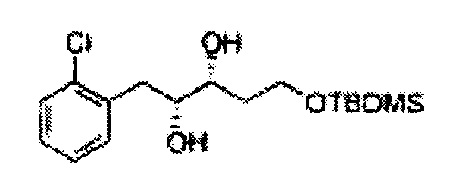
Осуществляли по существу такой же способ, какой описан в Примере получения 242, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутил (5-(2-хлорфенил)пент-3-енилокси)диметилсилан (Пример получения 304) вместо (Е)-трет-бутилдиметил (5-фенилпент-3-енилокси)силана (Пример получения 237) (4,4 г, 90%)
1Н ЯМР (400 МГц, CDCl3): δ=0,11 (s, 6Н). 0,92 (s, 9H), 1,68-1,77 (m, 1H), 1,87-1,96 (m, 1H), 2,64 (d, J=6,0, 1H), 2,93 (dd, J=8,2, 13,4, 1H), 3,07 (dd, J=4,8. 13,6, 1H), 3,68 (d, J=3,2, 1H), 3,76-3,96 (m, 4H), 7,17-7,25 (m, 2H), 7,35-7,39 (m, 2H)
Пример получения 310: (2-(4R,5)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан
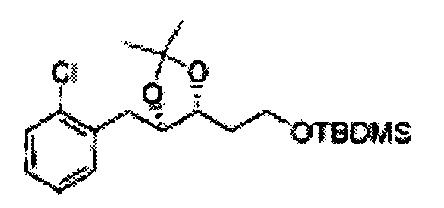
Осуществляли по существу такой же способ, какой описан в Примере получения 307, за исключением того, что для получения целевого соединения использовали (2R,3R)-5-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)пентан-2,3-диол (Пример получения 309) вместо (2S,3S)-5-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)пентан-2,3-диола (Пример получения 306) (4,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,06 (s, 6H), 0,91 (s, 9H), 1,39 (s, 3Н), 1,40 (s, 3Н), 1,69 (q, J=6,5, 2H), 3,05 (dq, J=5,8, 15,1, 2H), 3,70-3,80 (m, 2H), 3,86-3,93 (m, 1H), 3,97-4,02 (m, 1H), 7,17-7,25 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 311: 2-((4R,5R)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
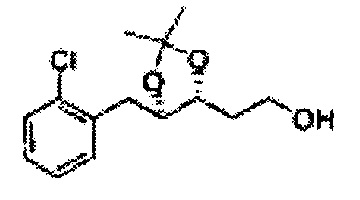
Осуществляли по существу такой же способ, какой описан в Примере получения 241, за исключением того, что для получения целевого соединения использовали (2-(4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилан (Пример получения 307) вместо (2-(4S,5S)-5-бензил-2,2-диметил-1,3-диоксолан-4-ил)этокси)(трет-бутил)диметилсилана (Пример получения 240) (3,0 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,38 (s, 3Н), 1,40 (s, 3Н), 1,50-1,63 (m. 2H), 2,29 (t, J=5,4, 1H), 2,82 (dd, J=5,8, 13,8, 1H), 3,01 (dd, J=6,4, 14,0, 1H), 3,72 (q, 1=5,5, 2H), 3,86 (dt, J=3,2, 8,4, 1H), 3,92-3,97 (m, 1H), 7,17-7,25 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 312: (3S,4S)-3,4-дигидрокси-5-(2-хлорфенил)пентилпивалат
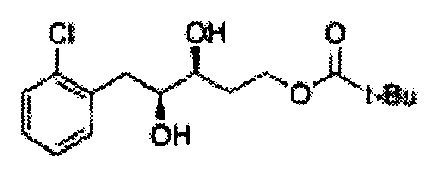
Осуществляли по существу такой же способ, какой описан в Примере получения 306, за исключением того, что для получения целевого соединения использовали (Е)-5-(2-хлорфенил)пент-3-енилпивалат (Пример получения 305) вместо (Е)-трет-бутил(5-(2-хлорфенил)пент-3-енилокси)диметилсилан (Пример получения 304) (6,0 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,16 (s, 9H), 1,85-1,91 (m, 2H), 2,17 (d, J=6,0, 1H), 2,73 (d, J=5,2, 1H), 2,91 (dd, J=8,4, 13,6, 1H), 3,08 (dd, J=5,6, 13,6, 1H), 3,52-3,55 (m, 1H), 3,77-3,80 (m, 1H), 4,11-4,19 (m, 1H), 4,37-4,41 (m, 1H), 7,18-7,23 (m, 2H), 7,31 (dd, J=2,2, 7,0, 1H), 7,36 (dd, J=1,8, 7,4, 1H)
Пример получения 313: 2-((4S,5S)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат
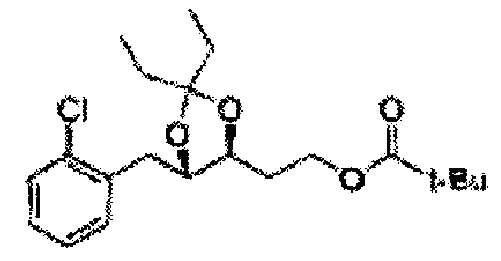
Осуществляли по существу такой же способ, какой описан в Примере получения 246, за исключением того, что для получения целевого соединения использовали (3S,4S)-3,4-дигидрокси-5-(2-хлорфенил)пентилпивалат (Пример получения 312) вместо (3S,4S)-3,4-дигидрокси-5-фенилпентилпивалат (Пример получения 245) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,90 (t, J=7,4, 6H), 1,21 (s, 9H), 1,58-1,66 (m, 4H), 1,70-1,77 (m, 2Н), 3,06 (d, J=5,6, 2H), 3,81-3,86 (m, 1H), 3,94-3,99 (m, 1H), 4,15-4,25 (m, 2H), 7,18-7,24 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 314 2-((4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
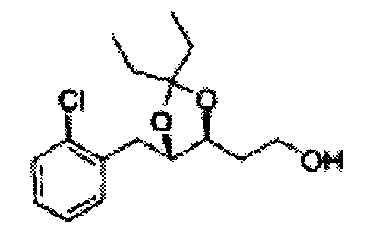
Осуществляли по существу такой же способ, какой описан в Примере получения 247, за исключением того, что для получения целевого соединения использовали 2-((4S,5S)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 313) вместо 2-((4S,5S)-5-бензил-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 246) (0,9 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3): δ=0,91 (dt, J=2,5, 7,5, 6Н), 1,46-1,79 (m, 6H), 2,42 (t, J=5,6, 1H), 3,01-3,12 (m, 2H), 3,79 (q, J=5,6. 2H), 3,88-3,93 (m, 1H), 3,98-4,06 (m, 1H), 7,18-7,25 (m, 2H), 7,35-7,39 (m, 2H)
Пример получения 315: (3R,4R)-3,4-дигидрокси-5-(2-хлорфенил)пентилпивалат
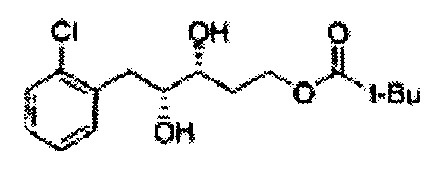
Осуществляли по существу такой же способ, какой описан в Примере получения 309, за исключением того, что для получения целевого соединения использовали (Е)-5-(2-хлорфенил)пент-3-енилпивалат (Пример получения 305) вместо (Е)-трет-бутил(5-(2-хлорфенил)пент-3-енилокси)диметилсилана (Пример получения 304) (4,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,11 (s, 6Н), 0,92 (s, 9Н), 1,68-1,77 (m, 1Н), 1,87-1,96 (m, 1Н), 2,64 (d, J=6,0, 1Н), 2,93 (dd, J=8,2, 13,4, 1Н), 3,07 (dd, J=4,8, 13,6, 1Н), 3,68 (d, J=3,2, 1Н), 3,76-3,96 (m, 4H), 7,17-7,25 (m, 2H), 7,35-7,39 (m, 2H)
Пример получения 316: 2-((4R,5R)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат
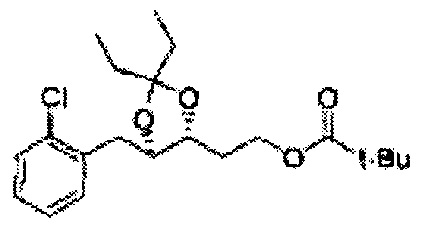
Осуществляли по существу такой же способ, какой описан в Примере получения 313, за исключением того, что для получения целевого соединения использовали (3R,4R)-3,4-дигидрокси-5-(2-хлорфенил)пентилпивалат (Пример получения 315) вместо (3S,4S)-3,4-дигидрокси-5-(2-хлорфенил)пентилпивалата (Пример получения 312) (1,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,90 (t, J=7,4, 6Н), 1,21 (s, 9Н), 1,58-1,66 (m, 4H), 1,70-1,77 (m, 2H), 3,06 (d, J=5,6, 2H), 3,81-3,86 (m, 1Н), 3,94-3,99 (m, 1Н), 4,15-4,25 (m, 2H), 7,18-7,24 (m, 2H), 7,36-7,38 (m, 2H)
Пример получения 317: 2-((4R,5R)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
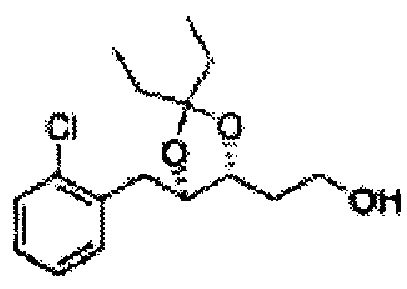
Осуществляли по существу такой же способ, какой описан в Примере получения 314, за исключением того, что для получения целевого соединения использовали 2-((4R,5R)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 316) вместо 2-((4S,5S)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалатА (Пример получения 313) (0,9 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,91 (dt, J=2,5, 7,5, 6Н), 1,4-6-1,79 (m, 6Н). 2,42 (t, J=5,6, 1Н), 3,01-3,12 (m, 2H), 3,79 (q, 1=5,6, 2H), 3,88-3,93 (m, 1Н), 3,98-4,06 (m, 1Н), 7,18-7,25 (m, 2H), 7,35-7,39 (m, 2H)
Пример получения 318: 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
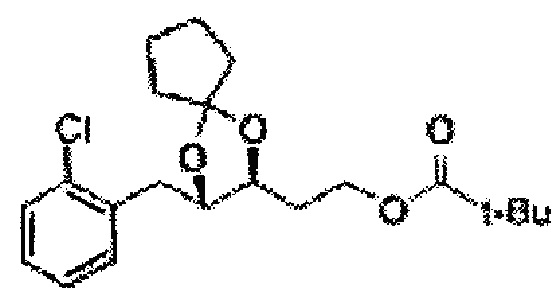
Осуществляли по существу такой же способ, какой описан в Примере получения 313, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,2 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,21 (s, 9H), 1,64-1,74 (m, 5H), 1,75-1,88 (m, 5H), 3,03-3,11 (m, 2Н), 3,81-3,86 (m, 1Н), 3,97 (q, J=6,5, 1H), 4,12-4,22 (m, 2H), 7,18-7,25 (m, 2H), 7,34-7,39 (m, 2H)
Пример получения 319: 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
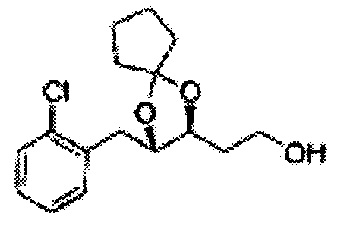
Осуществляли по существу такой же способ, какой описан в Примере получения 317, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 318) вместо 2-((4R,5R)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 316) (0,7 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,62-1,74 (m, 6Н), 1,75-1,88 (m, 4Н), 2,28 (t, J=5,6, 1H), 3,03-3,12 (m, 2H), 3,78 (q, J=5,6, 1H), 3,88-3,95 (m, 1H), 3,97-4,06 (m, 1H), 7,18-7,26 (m, 2H), 7,34-7,39 (m, 2H)
Пример получения 320: 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
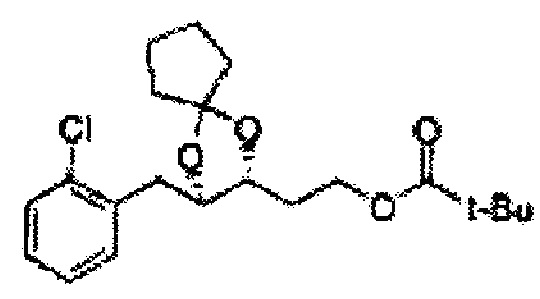
Осуществляли по существу такой же способ, какой описан в Примере получения 316, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (1,4 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,21 (s, 9H), 1,64-1,74 (m, 5H), 1,75-1,88 (m, 5H), 3,03-3,11 (m, 2H), 3,81-3,86 (m, 1H), 3,97 (q, J=6,5, 1H), 4,12-4,22 (m, 2H), 7,1,8-7,25 (m, 2H), 7,34-7,39 (m, 2H)
Пример получения 321: 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
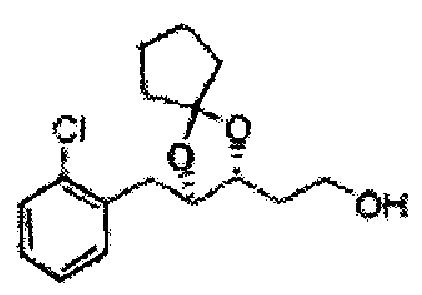
Осуществляли по существу такой же способ, какой описан в Примере получения 319, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 320) вместо 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 318) для получения целевого соединения. (0,8 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,62-1,74 (m, 6H), 1,75-1,88 (m, 4H), 2,28 (t, J=5,6, 1H), 3,03-3,12 (m, 2H), 3,78 (q, J=5,6, 1H). 3,88-3,95 (m, 1H), 3,97-4,06 (m, 1H), 7,18-7,26 (m, 2H), 7,34-7,39 (m, 2H)
Пример получения 322: 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
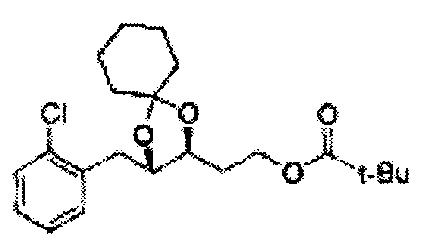
Осуществляли по существу такой же способ, какой описан в Примере получения 318, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,1 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,21 (s, 9H), 1,58-1,61 (m, 8Н), 1,77 (q, J=6,8, 2H), 3,07 (d, J=6,0, 2H), 3,81-3,88 (m, 1H), 3,96-4,01 (m, 1H), 4,16-4,22 (m, 2H), 7,17-7,25 (m, 2H), 7,36-7,39 (m, 2H)
Пример получения 323: 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этанол
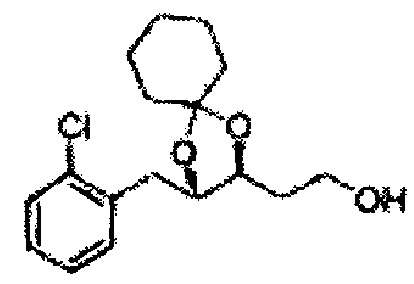
Осуществляли по существу такой же способ, какой описан в Примере получения 321, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 322) вместо 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 320) (0,7 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,51-1,64 (m, 8Н), 1,65-1,74 (m, 2Н), 2,59-2,63 (m, 1Н), 3,06 (d, J=6,0, 2Н), 3,76-3,78 (m, 2Н), 3,89-3,94 (m, 1Н), 3,99-4,04 (m, 1Н), 7,16-7,24 (m, 2Н), 7,35-7,38 (m, 2Н)
Пример получения 324: 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
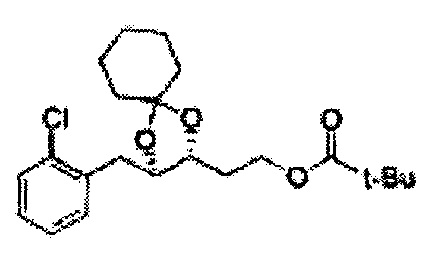
Осуществляли по существу такой же способ, какой описан в Примере получения 320, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,5 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,21 (s, 9Н), 1,58-1,61 (m, 8Н), 1,77 (q, 1=6,8, 2Н), 3,07 (d, J=6,0, 2Н), 3,81-3,88 (m, 1Н), 3,96-4,01 (m, 1Н), 4,16-4,22 (m, 2Н), 7,17-7,25 (m, 2Н), 7,36-7,39 (m, 2Н)
Пример получения 325: 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этанол
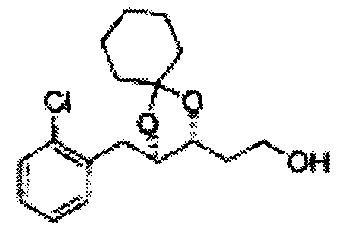
Осуществляли по существу такой же способ, какой описан в Примере получения 323, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 324) вместо 2-((2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалата (Пример получения 322) (0,9 г, 80-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,51-1,64 (m, 8Н), 1,65-1,74 (m, 2Н), 2,59-2,63 (m, 1Н), 3,06 (d, J=6,0, 2Н), 3,76-3,78 (m, 2Н), 3,89-3,94 (m, 1Н), 3,99-4,04 (m, 1Н), 7,16-7,24 (m, 2Н), 7,35-7,38 (m, 2Н)
Пример получения 326: (Е)-метил-4-(2-хлорфенил)бут-2-еноат
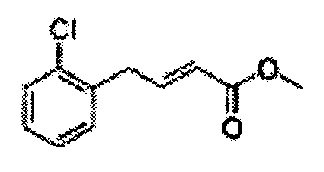
Осуществляли по существу такой же способ, какой описан в Примере получения 259, за исключением того, что для получения целевого соединения использовали 2-хлорфенилацетальдегид вместо фенилацетальдегида (5,0 г, 65-85%)
1Н ЯМР (400 МГц, CDCl3): δ=3,47 (d, J=6,8, 2H), 3,67 (s, 3Н), 5,79 (d, J=15,4, 1H), 7,06 (dt, J=15,4, 6,8, 1H), 7,12-7,28 (m, 4H)
Пример получения 327: (2R,3S)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноат
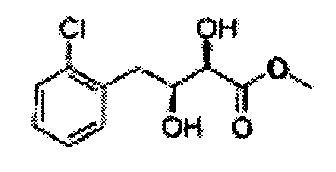
Осуществляли по существу такой же способ, какой описан в Примере получения 260, за исключением того, что для получения целевого соединения использовали (Е)-метил-4-(2-хлорфенил)бут-2-еноат (Пример получения 326) вместо (Е)-метил-4-фенилбут-2-еноата (Пример получения 259) (3,0 г, 70-95%)
1Н ЯМР (00 МГц, CDCl3): δ=3,08-3,17 (m, 2H), 3,84 (s, 3Н), 4,12 (dd, J=1,6, 5,2, 1H), 4,28-4,34 (m, 1H), 7,20-7,27 (m, 2H), 7,33-7,36 (m, 1H), 7,39-7,41 (m, 1H)
Пример получения 328: (4R,5S)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
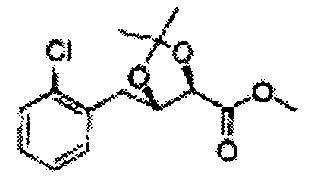
Осуществляли по существу такой же способ, какой описан в Примере получения 261, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-4-(2-хлорфенил)2,3-дигидроксибутаноат (Пример получения 327) вместо (2R,3S)-метил-2,3-дигидрокси-4-фенилбутаноата (Пример получения 260) (0,6 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,45 (s, 3Н), 1,49 (s, 3Н), 3,11 (dd, J=7,6, 14,4, 1H), 3,35 (dd, J=4,4, 14,4, 1H), 3,74 (s, 3Н), 4,30 (d, J=7,6, 1H), 4,50 (dt, J=4,0, 7,6, 1H), 7,19-7,26 (m, 2H), 7,36-7,40 (m, 2H)
Пример получения 329: ((4S,5S)-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
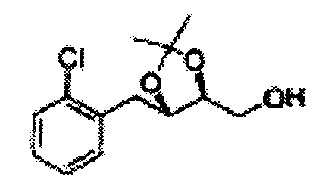
Осуществляли по существу такой же способ, какой описан в Примере получения 262, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 328) вместо (4R,5S)-метил-5-бензил-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 261) (0,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,43 (s, 6Н), 1,83 (q, J=4,3, 1Н), 3,06-3,17 (m, 2H), 3,45 (ddd, J=4,6, 7,4, 12,0, 1Н), 3,68 (ddd, J=3,2, 5,2, 12,0, 1Н), 3,91 (ddd, J=3,3, 4,7, 8,0, 1Н), 4,22-4,27 (m, 1Н), 7,20-7,26 (m, 2H), 7,35-7,40 (m, 2H)
Пример получения 330: (4R,5S)-метил-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-карбоксилат
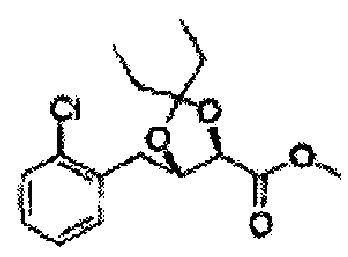
Осуществляли по существу такой же способ, какой описан в Примере получения 263, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноат (Пример получения 327) вместо (2R,3S)-метил-2,3-дигидрокси-4-фенилбутаноата (Пример получения 260) (0,8 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=0,93 (t, J=7,4, 6Н), 1,67-1,74 (m, 4H), 3,10 (dd, J=8,0, 14,4, 1Н), 3,35 (dd, J=4,0, 14,4, 1Н), 3,73 (s, 3H), 4,27 (d, J=8,4, 1Н), 4,42-4,47 (m, 1Н), 7,18-7,26 (m, 2H), 7,37-7,40 (m, 2H)
Пример получения 331: ((4S,5S)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
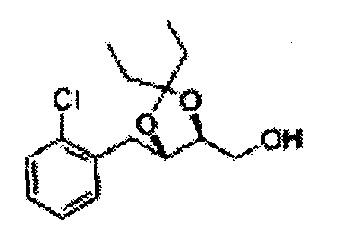
Осуществляли по существу такой же способ, какой описан в Примере получения 329, за исключением того, что для получения целевого соединения использовали (4R,5S)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 330) вместо (4R,5S)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 328) (0,6 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=0,93 (dt, J=2,1, 7,5, 6H), 1,62-1,70 (m, 4H), 1,83 (q, J=4,3, 1H), 3,11 (ddd, J=6,0, 14,2, 28,0, 2H), 3,44 (ddd, J=4,8, 7,2, 12,0, 1H), 3,64-3,69 (m, 1H), 3,88 (ddd, J=3,3, 4,9, 8,3, 1H), 4,18-4,24 (m, 1H), 7,19-7,26 (m, 2H), 7,36-7,39 (m, 2H)
Пример получения 332: (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
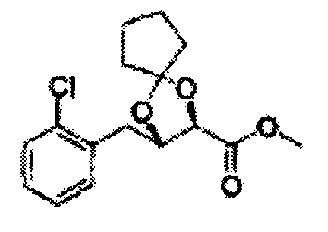
Осуществляли по существу такой же способ, какой описан в Примере получения 330, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона для получения целевого соединения (0,8 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,65-1,80 (m, 5H), 1,89-2,00 (m, 3Н), 3,13 (dd, J=7,8, 14,2, 1H), 3,32 (dd. J=4,6, 14,2, 1H), 3,72 (s, 3Н), 4,28 (d, J=7,2, 1H), 4,41-4,46 (m, 1H), 7,19-7,26 (m, 2H), 7,35-7,40 (m, 2H)
Пример получения 333: (2S,3S)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
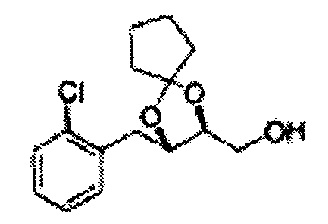
Осуществляли по существу такой же способ, какой описан в Примере получения 331, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 332) вместо (4R,5S)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 330) (0,6 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,69-1,74 (m, 3Н), 1,77-1,85 (m, 5H), 3,11 (ddd, J=6,3, 14,1, 31,3, 2H), 3,42-3,48 (m, 1H), 3,61-3,66 (111, 1H), 3,87-3,91 (m, 1H), 4,19 (q, J=6,8, 1H), 7,19-7,26 (m, 2H), 7,34-7,40 (m, 2H)
Пример получения 334: (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
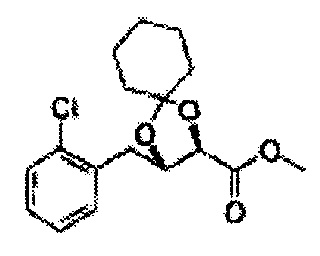
Осуществляли по существу такой же способ, какой описан в Примере получения 332, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (0,5 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,54-1,77 (m, 10Н), 3,12 (dd, J=7,6, 14,4, 1H), 3,32 (dd, J=4,4, 14,4, 1H), 3,72 (s, 3H), 4,30 (d, J=7,6, 1H), 4,46-4,51 (m, 1H), 7,18-7,26 (m, 2H), 7,37-7,39 (m, 2H)
Пример получения 335: ((2S,3S)-3-(-2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 333, за исключением того, что для получения целевого соединения использовали (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,5.⎪декан-2-карбоксилат (Пример получения 334) вместо (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 332) (0,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,38-1,45 (m, 2H), 1,58-1,63 (m, 8H), 1,84 (q, J=4,3, 1H), 3,11 (ddd, J=7,9, 15,9, 22,1, 2H), 3,43 (ddd, J=4,6, 7,6, 12,1, 1H), 3,66-3,71 (m, 1H), 3,88-3,92 (m, 1H), 4,21-4,26 (m, 1H), 7,18-7,26 (m, 2H), 7,37-7,39 (m, 2H)
Пример получения 336: (2S,3R)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноат
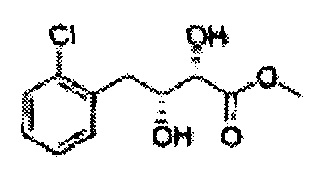
Осуществляли по существу такой же способ, какой описан в Примере получения 269, за исключением того, что для получения целевого соединения использовали (Е)-метил-4-(2-хлорфенил)бут-2-еноат (Пример получения 326) вместо (Е)-метил-4-фенилбут-2-еноата (Пример получения 259) (3,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=3,08-3,17 (m, 2H), 3,84 (s, 3H), 4,12 (dd. J=1,6, 5,2, 1H), 4,28-4,34 (m, 1H), 7,20-7,27 (m, 2H), 7,33-7,36 (m, 1H), 7,39-7,41 (m, 1H)
Пример получения 337: (4S,5R)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
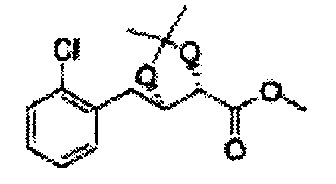
Осуществляли по существу такой же способ, какой описан в Примере получения 328, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноат (Пример получения 336) вместо (2R,3S)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноата (Пример получения 327) (3,4 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,41 (s, 6Н), 1,79 (q, J=4,3, 1Н), 2,83 (dd, J=6,2, 13,8, 1H), 3,07 (dd, J=6,4, 14,0, 1H), 3,29 (ddd, J=4,7, 7,5, 12,1, 1H), 3,54 (ddd, J=2,8, 5,2, 12,0, 1H), 3,83 (ddd, J=3,9, 3,9, 7,1, 1H), 4,15 (q, J=7,1, 1H), 7,22-7,32 (m, 5H)
Пример получения 338: ((4R,5R)-5-(-2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
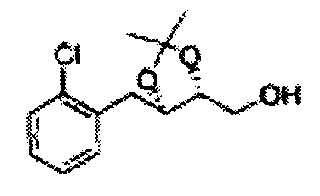
Осуществляли по существу такой же способ, какой описан в Примере получения 335, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 337) вместо (2R,3S)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-карбоксилата (Пример получения 334) (2,7 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3): δ=1,41 (s, 6H), 1,79 (q, J=4,3, 1H), 2,83 (dd, J=6,2, 13,8, 1H), 3,07 (dd, J=6,4, 14,0, 1H), 3,29 (ddd, J=4,7, 7,5, 12,1, 1H), 3,54 (ddd, J=2,8, 5,2, 12,0, 1H), 3,83 (ddd, 1=3,9, 3,9, 7,1, 1H), 4,15 (q, J=7,1, 1H), 7,22-7,32 (m, 5H)
Пример получения 339: (4S,5R)-метил-(5-2-хлор)бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилат
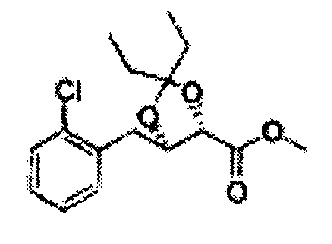
Осуществляли по существу такой же способ, какой описан в Примере получения 330, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-2,3-дигидрокси-4-фенилбутаноат (Пример получения 336) вместо (2R,3S)-метил-4-(2-хлорфенил)-2,3-дигидроксибутаноата (Пример получения 327) (0,6 г, 50-75%)
1Н ЯМР (400 МГц, CDCl3): δ=0,93 (t, J=7,4, 6H), 1,67-1,74 (m, 4H), 3,10 (dd, J=8,0, 14,4, 1H), 3,35 (dd, J=4,0, 14,4, 1H), 3,73 (s, 3H), 4,27 (d, J=8,4, 1H), 4,42-4,47 (m, 1H), 7,18-7,26 (m, 2H), 7,37-7,40 (m, 2H)
Пример получения 340: ((4R,5R)-5-(2-хлорбензил)-2,2-диэтил-1,3-диоксолан-4-ил)метанол
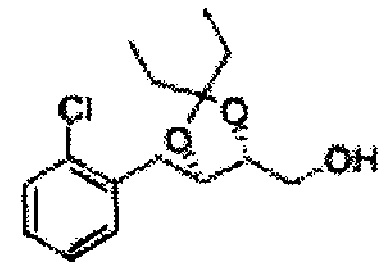
Осуществляли по существу такой же способ, какой описан в Примере получения 338, за исключением того, что для получения целевого соединения использовали (4S,5R)-метил-(5-2-хлор)бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилат (Пример получения 339) вместо (4S,5R)-метил-5-(2-хлорбензил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 337) (0,5 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,93 (dt, J=2,1, 7,5, 6H), 1,62-1,70 (m, 4H), 1,83 (q, J=4,3, 1H), 3,11 (ddd, J=6,0, 14,2, 28,0, 2H), 3,44 (ddd, J=4,8, 7,2, 12,0, 1H), 3,64-3,69 (m, 1H), 3,88 (ddd, J=3,3, 4,9, 8,3, H), 4,18-4,24 (m, 1H), 7,19-7,26 (m, 2H), 7,36-7,39 (m, 2H)
Пример получения 341: (2S,3R)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат
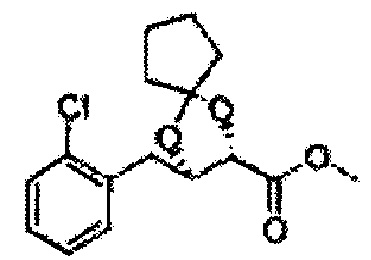
Осуществляли по существу такой же способ, какой описан в Примере получения 339, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона для получения целевого соединения (0,5 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,65-1,80 (m, 5H), 1,89-2,00 (m, 3H), 3,13 (dd, J=7,8, 14,2, 1H), 3,32 (dd, J=4,6, 14,2, 1H), 3,72 (s, 3H), 4,28 (d, J=7,2, 1H), 4,41-4,46 (m, 1H), 7,19-7,26 (m, 2H), 7,35-7,40 (m, 2H)
Пример получения 342: ((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-ил)метанол
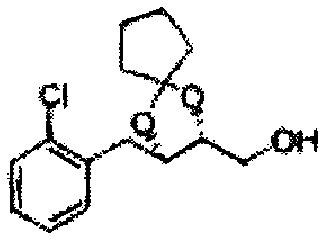
Осуществляли по существу такой же способ, какой описан в Примере получения 340, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилат (Пример получения 341) вместо (4S,5)-метил-(5-2-chlprp)бензил-2,2-диэтил-1,3-диоксолан-4-карбоксилата (Пример получения 339) (0,4 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,69-1,74 (m. 3Н), 1,77-1,85 (m, 5H), 3,11 (ddd, J=6,3, 14,1, 31,3, 2H), 3,42-3,48 (m. 1Н), 3,61-3,66 (111, 1H), 3,87-3,91 (m, 1H), 4,19 (q, J=6,8, 1H), 7,19-7,26 (m, 2H), 7,34-7,40 (m, 2H)
Пример получения 343: (2S,3R)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат
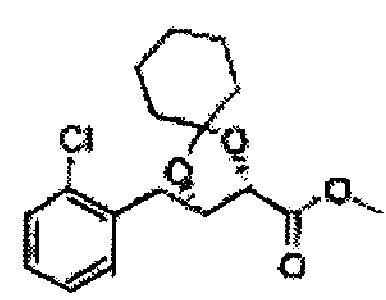
Осуществляли по существу такой же способ, какой описан в Примере 341, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (0,9 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,54-1,77 (m, 10Н), 3,12 (dd, J=7,6, 14,4, 1H), 3,32 (dd, J=4,4, 14,4, 1H), 3,72 (s, 3Н), 4,30 (d, J=7,6, 1H), 4,46-4,51 (m, 1H), 7,18-7,26 (m, 2H), 7,37-7,39 (m, 2H)
Пример получения 344: ((2R,3R)-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-ил)метанол
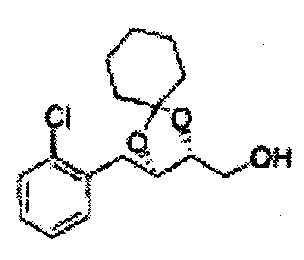
Осуществляли по существу такой же способ, какой описан в Примере получения 342, за исключением того, что для получения целевого соединения использовали (2S,3R)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,5]декан-2-карбоксилат (Пример получения 343) вместо (2S,3R)-метил-3-(2-хлорбензил)-1,4-диоксаспиро[4,4]нонан-2-карбоксилата (Пример получения 341) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,38-1,45 (m, 2H), 1,58-1,63 (m, 8H), 1,84 (q, J=4,3, 1H), 3,11 (ddd, J=7,9, 15,9, 22,1, 2H), 3,43 (ddd, J=4,6, 7,6, 12,1, 1H), 3,66-3,71 (m, 1H), 3,88-3,92 (m, 1H), 4,21-4,26 (m, 1H), 7,18-7,26 (m, 2H), 7,37-7,39 (m, 2H)
Пример получения 345: (Е)-4-(2-хлорфенил)бут-3-еновой кислоты

Осуществляли по существу такой же способ, какой описан в Примере получения 278, за исключением того, что для получения целевого соединения использовали 2-(2-хлорфенил)ацетальдегид вместо фенил ацетальдегид для получения целевого соединения (4,0 г, 55-80%)
1Н ЯМР (400 МГц, CDCl3): δ=3,39 (d, J=8,8, 2Н), 6,31 (td, J=7,9, 14,8, 1H), 6,94 (d, J=16. 1H), 7,17-7,45 (m, 3H), 7,56-7,59 (m, 1H)
Пример получения 346: (Е)-4-(2-хлорфенил)бут-3-ен-1-ол

Осуществляли по существу такой же способ, какой описан в Примере получения 279, за исключением того, что для получения целевого соединения использовали (Е)-4-(2-хлорфенил)бут-3-еновую кислоту (Пример получения 345) вместо (Е)-4-фенилбут-3-еновой кислоты (Пример получения 278) (1,2 г, 55-80%)
1Н ЯМР (400 МГц, CDCl3) δ=2,55 (ddd, J=4,1, 11,9, 21,5, 2Н), 3,82 (t, J=5,8, 2Н), 6,24 (td, J=7,2, 15,7, 1H), 6,87 (d, J=14,8, 1H), 7,12-7,25 (m, 3H), 7,36 (dd, J=1,2, 8,0, 1H), 7,52 (dd, J=1,6, 9,2, 1H)
Пример получения 347: (Е)-трет-бутилдиметил (4-(2-хлорфенил)бут-3-енилокси)силан
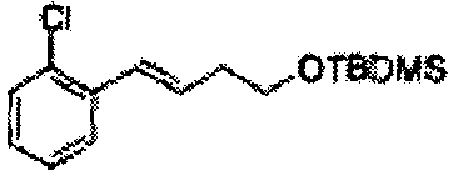
Осуществляли по существу такой же способ, какой описан в Примере получения 280, за исключением того, что для получения целевого соединения использовали (Е)-4-(2-хлорфенил)бут-3-ен-1-ол (Пример получения 346) вместо (Е)-4-фенилбут-3-ен-1-ола (Пример получения 279) (1,1 г, 80-98%)
1Н ЯМР (400 МГц, CDCl3): δ=0,07 (s, 3H), 0,10 (s, 3H), 0,92 (d, J=6,4, 9H), 2,51 (q, J=4,5, 2Н), 3,78 (t, J=6,6, 2Н), 6,26 (td, J=7,2, 15,7, 1H), 6,84(d, J=15,6, 1H), 7,13-7,24 (m, 3H), 7,36 (dd, J=5,6, 12,4, 1H), 7,53 (dd, J=1,4, 7,8, 1H)
Пример получения 348: (Е)-4-(2-хлорфенил)бут-3-енилпивалат
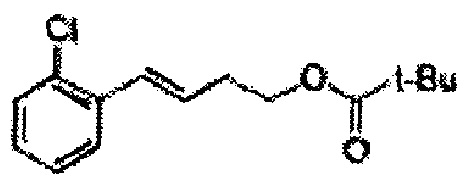
Осуществляли по существу такой же способ, какой описан в Примере получения 281, за исключением того, что для получения целевого соединения использовали (Е)-4-(2-хлорфенил)бут-3-ен-1-ол (Пример получения 346) вместо (Е)-4-фенилбут-3-ен-1-ола (Пример получения 279) (3,5 г, 75-95)
1Н ЯМР (400 МГц, CDCl3): δ=1,21 (s, 9H), 2,55-2,64 (m, 2H), 4,24 (t, J=6,4, 2H), 6,18 (td, J=7,9, 14,8, 1H), 6,86 (d, J=16,0, 1H), 7,22-7,26 (m, 2H), 7,38 (dd, J=3,6, 10,8, 1H), 7,51 (dd, J=1,6, 7,6, 1H)
Пример получения 349: (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)бутан-1,2-диол
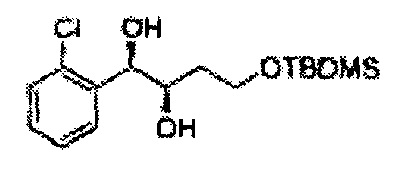
Осуществляли по существу такой же способ, какой описан в Примере получения 282, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил (4-2-хлорфенил)бут-3-енилокси)силан (Пример получения 347) вместо (Е)-трет-бутилдиметил (5-фенилпент-3-енилокси)силана (Пример получения 237) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3) δ=0,10 (s, 3Н), 0,11 (s, 3Н), 0,92 (s, 9H), 1,69-1,70 (m, 1H), 1,93-2,07 (m, 1H), 3,51 (d, J=4,8, 1H), 3,86 (d, 1=3,2, 1H), 3,87 (dd, J=3,2, 9,2, 1H), 3,91-3,96 (m, 1H), 4,01-4,06 (m, 1H), 5,05 (t, J=4,6, 1H), 7,22-7,26 (m, 1H), 7,31-7,37 (m, 2H), 7,59 (dd, J=1,2, 7,6, 1H)
Пример получения 350: (3R,4R)-3,4-дигидрокси-4-(2-хлорфенил)бутилпивалат
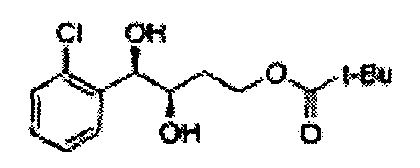
Осуществляли по существу такой же способ, какой описан в Примере получения 349, за исключением того, что для получения целевого соединения использовали (Е)-4-(2-хлорфенил)бут-3-енилпивалат (Пример получения 348) вместо (Е)-трет-бутилдиметил(4-2-хлорфенил)бут-3-енилокси)силана (Пример получения 347) (3,2 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,19 (s, 9H), 1,76-1,84 (m, 1H), 1,90-1,98 (m, 1H), 2,70 (d, J=4,4, 1H), 2,86 (d, J=5,2, 1H), 3,84-3,90 (m, 1H), 4,14-4,21 (m, 1H), 4,35-4,41 (m, 1H), 5,05 (t, J=5,0, 1H), 7,23-7,39 (m, 3Н), 7,54 (dd, J=1,6, 7,6, 1H)
Пример получения 351: трет-бутил (2-((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан
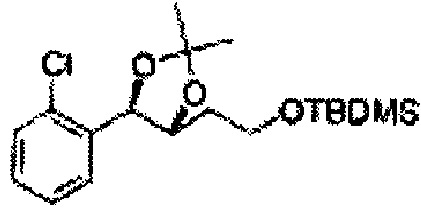
Осуществляли по существу такой же способ, какой описан в Примере получения 284, за исключением того, что для получения целевого соединения использовали (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)бутан-1,2-диол (Пример получения 349) вместо (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-фенилбутан-1,2-диола (Пример получения 282)(0,8 г, 70-95)
1Н ЯМР (400 МГц, CDCl3): δ=0,02 (s, 3Н), 0,07 (s, 3Н), 0,86 (s, 9H), 1,50 (s, 3Н), 1,58 (s, 3Н), 1,82-1,99 (m, 2Н), 3,68-3,78 (m, 2Н), 3,95 (dt, J=3,3, 8,7, 1H), 5,16 (d, J=8,4. 1H), 7,21-7,27 (m, 1H), 7,31-7,38 (m, 2Н), 7,60 (dd, J=1,6, 7,6, 1H)
Пример получения 352: 2-((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
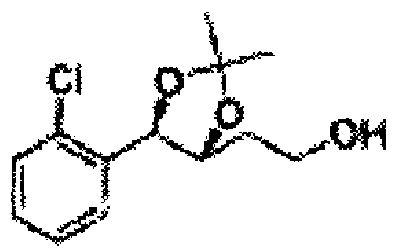
Осуществляли по существу такой же способ, какой описан в Примере получения 285 за исключением того, что для получения целевого соединения использовали трет-бутил(2-((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан (Пример получения 351) вместо трет-бутил (2-((4К,5К)-5-фенил-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилана (Пример получения 284) (0,7 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,56 (s, 3Н), 1,62 (s, 3Н), 1,92-2,04 (m, 2Н), 2,26 (q, J=3,7, 1H), 3,75-3,90 (m, 2Н), 3,94 (td, J=3,9, 8,5, 1H), 5,23 (d, J=15,6, 1H), 7,22-7,27 (m, 1H), 7,33-7,39 (m, 2H), 7,62 (dd, J=1,6, 7,6, 1H)
Пример получения 353: (1S,2S)-4-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)бутан-1,2-диол
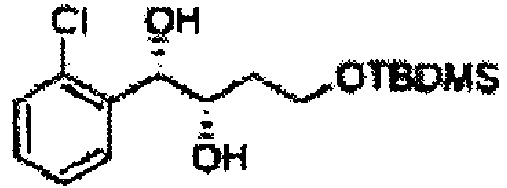
Осуществляли по существу такой же способ, какой описан в Примере получения 286, за исключением того, что для получения целевого соединения использовали (Е)-трет-бутилдиметил (4-(2-хлорфенил.)бут-3-енилокси)силан (Пример получения 347) вместо (Е)-трет-бутилдиметил(4-фенилбут-3-енилокси)силан (Пример получения 280) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3) δ=1,19 (s, 9Н), 1,76-1,84 (m, 1Н), 1,90-1,98 (m, 1H), 2,70 (d, J=4,4, 1H), 2,86 (d, J=5,2, 1H), 3,84-3,90 (m, 1H), 4,14-4,21 (m, 1H), 4,35-4,41 (m, 1H), 5,05 (t, J=5,0, 1H), 7,23-7,39 (m, 3H), 7,54 (dd, J=1,6, 7,6, 1H)
Пример получения 354: (3S,4S)-3,4-дигидрокси-4-(2-хлорфенил)бутилпивалат
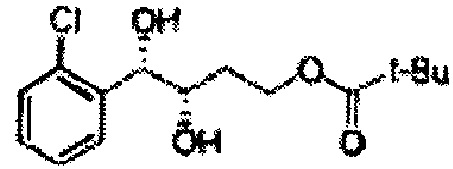
Осуществляли по существу такой же способ, какой описан в Примере получения 353, за исключением того, что для получения целевого соединения использовали (Е)-4-(2-хлорфенил)бут-3-енилпивалат (Пример получения 348) вместо ((Е)-трет-бутилдиметил (4-(2-хлорфенил)бут-3-енилокси)силана (Пример получения 347) (3,0 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,19 (s, 9Н), 1,76-1,84 (m, 1H), 1,90-1,98 (m, 1H), 2,70 (d, J=4,4, 1H), 2,86 (d, J=5,2, 1H), 3,84-3,90 (m, 1H), 4,14-4,21 (m, 1H), 4,35-4,41 (m, 1H), 5,05 (t, J=5,0, 1H), 7,23-7,39 (m, 3H), 7,54 (dd, J=1,6, 7,6, 1H)
Пример получения 355: трет-бутил(2-((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан
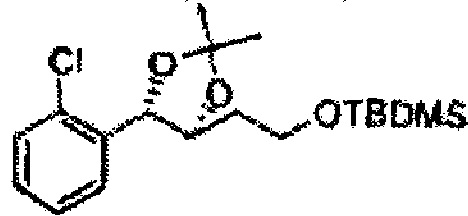
Осуществляли по существу такой же способ, какой описан в Примере получения 351, за исключением того, что для получения целевого соединения использовали (1S,2S)-4-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)бутан-1,2-диол (Пример получения 353) вместо (1R,2R)-4-(трет-бутилдиметилсилилокси)-1-(2-хлорфенил)бутан-1,2-диола (Пример получения 349) (0,7 г, 70-95%)
1Н ЯМР (400 МГц, CDCl3): δ=0,02 (s, 3H), 0,07 (s, 3H), 0,86 (s, 9Н), 1,50 (s, 3H), 1,58 (s, 3H), 1,82-1,99 (m, 2H), 3,68-3,78 (m, 2H), 3,95 (dt, J=3,3, 8,7, 1H), 5,16 (d. J=8,4, 1H), 7,21-7,27 (m, 1H), 7,31-7,38 (m, 2H), 7,60 (dd, J=1,6, 7,6, 1H)
Пример получения 356: 2-((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этанол
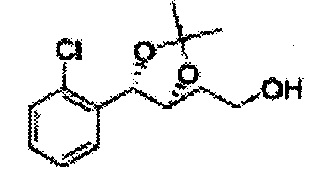
Осуществляли по существу такой же способ, какой описан в Примере получения 352, за исключением того, что для получения целевого соединения использовали трет-бутил (2-((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилан (Пример получения 355) вместо трет-бутил (2-((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)этокси)диметилсилана (Пример получения 351) (0,3 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3): δ=1,56 (s, 3Н), 1,62 (s, 3Н), 1,92-2,04 (m, 2Н), 2,26 (q, J=3,7, 1Н), 3,75-3,90 (m, 2Н), 3,94 (td, J=3,9, 8,5, 1Н), 5,23 (d, J=15,6, 1Н), 7,22-7,27 (m, 1Н), 7,33-7,39 (m, 2H), 7,62 (dd, J=1,6, 7,6, 1H)
Пример получения 357: 2-((4R,5R)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалат
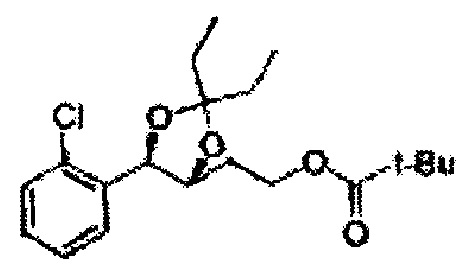
Осуществляли по существу такой же способ, какой описан в Примере получения 290, за исключением того, что для получения целевого соединения использовали (3R,4R)-3,4-дигидрокси-4-(2-хлорфенил)бутилпивалат (Пример получения 350) вместо (3R,4R)-3,4-дигидрокси-4-фенилбутилпивалата (Пример получения 283) (0,8 г, 70-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,76 (q, J=7,6, 2Н), 1,84-1,90 (m, 2Н), 2,00-2,07 (m, 2Н), 3,85 (dt, J=3,7, 8,5, 1Н), 4,14-4,27 (m, 2Н), 5,17 (d, J=8,4, 1Н), 7,22-7,28 (m, 1Н), 7,32-7,38 (m, 2Н), 7,64 (dd, J=1,4, 7,8, 1Н)
Пример получения 358: 2-((4R,5R)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалат
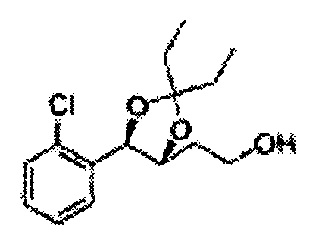
Осуществляли по существу такой же способ, какой описан в Примере получения 291, за исключением того, что для получения целевого соединения использовали 2-((4R,5R)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалат (Пример получения 357) вместо 2-((4R,5R)-2,2-диэтил-5-фенил-1,3-диоксолан-4-ил)этилпивалата (Пример получения 290) (0,6 г, 80-95%)
1H ЯМР (400 МГц, CDCl3): δ=1,02 (1, J=7,4, 3Н), 1,08 (t, J=7,4, 3Н), 1,80 (q, 1=7,5, 2Н), 1,86-1,91 (m, 2Н), 1,96-2,00 (m, 2Н), 2,37 (q, J=3,7, 1H), 3,76-3,95 (m, 3Н), 5,23 (d, J=8,4, 1H), 7,25-7,27 (m, 1H), 7,32-7,39 (m, 2Н), 7,65 (dd, J=1,8, 7,8, 1H)
Пример получения 359: 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
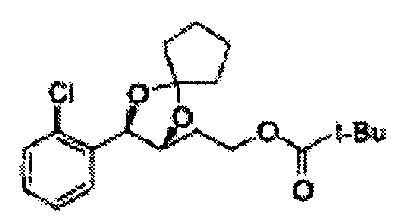
Осуществляли по существу такой же способ, какой описан в Примере получения 357, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (0,8 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,17 (s, 9H), 1,58-2,02 (m, 10Н). 3,86 (ddd, J=3,8, 8,2, 8,2, 1H), 4,11-4,28 (m, 2Н). 5,13 (d, J=8,0, 1H), 7,20-7,39 (m, 3Н), 7,58 (dd, J=1,6, 8,0, 1H)
Пример получения 360: 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этанол

Осуществляли по существу такой же способ, какой описан в Примере получения 358, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 359) вместо 2-((4R,5R)-2,2-диэтил-5-(2-хлорфенил-1,3-диоксолан-4-ил)этилпивалат (Пример получения 357) (0,5 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,72-1,90 (m, 4H), 1,93-1,98 (m, 6H), 2,28 (q, J=3,7, 1H), 3,76-3,93 (m, 3Н), 5,18 (d, J=8,0, 1H), 7,24-7,29 (m, 1H), 7,32-7,38 (m, 2Н), 7,60 (dd, J=1,8, 7,8, 1H)
Пример получения 361: 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат
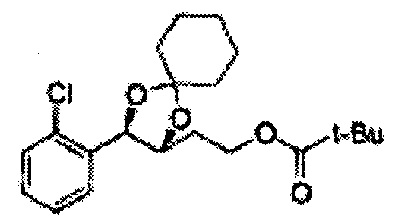
Осуществляли по существу такой же способ, какой описан в Примере получения 359, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (1,0 г, 60-85%)
1Н ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,70-1,94 (m, 10Н), 2,06-2,09 (m, 2H), 3,86 (dt, J=3,5, 8,5, 1H), 4,16-4,26 (m, 2H), 5,18 (d, J=8,4, 1H), 7,22-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,61 (dd, J=1,4, 7,8, 1H)
Пример получения 362: 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этанол
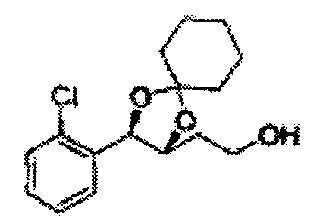
Осуществляли по существу такой же способ, какой описан в Примере получения 360, за исключением того, что для получения целевого соединения использовали 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 361) вместо 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 359) (0,6 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,42-1,50 (m, 2H), 1,63-1,77 (m, 5H), 1,82-1,89 (m, 5H), 2,41 (q, J=3,9, 1H), 3,78-3,96 (m, 3H), 5,25 (d, J=8,4, 1H). 7,21-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,63 (dd, J=1,4, 7,8, 1H)
Пример получения 363: 2-((4S,5S)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалат
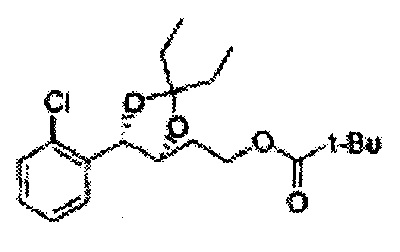
Осуществляли по существу такой же способ, какой описан в Примере получения 357, за исключением того, что для получения целевого соединения использовали (3S,4S)-3,4-дигидрокси-4-(2-хлорфенил)бутилпивалат (Пример получения 354) вместо (3R,4R)-3,4-дигидрокси-4-(2-хлорфенил)бутилпивалата (Пример получения 850) (0,7 г, 70-95%).
1Н ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,76 (q, J=7,6, 2H), 1,84-1,90 (m, 2H), 2,00-2,07 (m, 2H), 3,85 (dt, J=3,7, 8,5, 1H), 4,14-4,27 (m, 2H), 5,17 (d, J=8,4, 1H), 7,22-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,64 (dd, J=1,4, 7,8, 1H)
Пример получения 364: 2-((4S,5S)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этанол
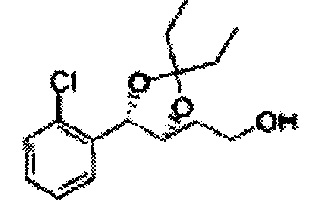
Осуществляли по существу такой же способ, какой описан в Примере получения 358, за исключением того, что для получения целевого соединения использовали 2-((4S,5S)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалат (Пример получения 363) вместо 2-((4R,5R)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалата (Пример получения 357) (0,5 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,02 (t, J=7,4, 3Н), 1,08 (t, J=7,4, 3H), 1,80 (q, J=7,5, 2H), 1,86-1,91 (m, 2H), 1,96-2,00 (m, 2H), 2,37 (q, J=3,7. 1H), 3,76-3,95 (m, 3H), 5,23 (d, J=8,4, 1H), 7,25-7,27 (m, 1H), 7,32-7,39 (m, 2H), 7,65 (dd, J=1,8, 7,8, 1H)
Пример получения 365: 2-((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат
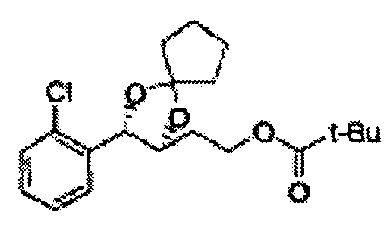
Осуществляли по существу такой же способ, какой описан в Примере получения 363, за исключением того, что для получения целевого соединения использовали циклопентанон вместо 3-пентанона (0,6 г, 60-85%)
1H ЯМР (400 МГц, CDCl3): δ=1,17 (s, 9H), 1,58-2,02 (m, 10Н), 3,86 (ddd, J=3,8, 8,2, 8,2, 1H), 4,11-4,28 (m, 2H), 5,13 (d, J=8,0, 1H), 7,20-7,39 (m, 3H), 7,58 (dd, J=1,6, 8,0, 1H)
Пример получения 366: 2-((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этанол
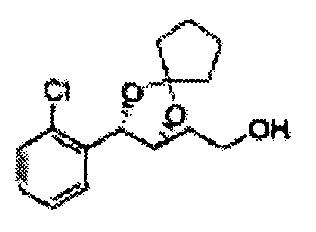
Осуществляли по существу такой же способ, какой описан в Примере получения 364, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалат (Пример получения 365) вместо 2-((4S,5S)-2,2-диэтил-5-(2-хлорфенил)-1,3-диоксолан-4-ил)этилпивалата (Пример получения 363) (0,4 г, 80-95%)
1Н ЯМР (400 МГц, CDCl3): δ=1,72-1,90 (m, 4Н), 1,93-1,98 (m, 6H), 2,28 (q, J=3,7, 1H), 3,76-3,93 (m, 3H), 5,18 (d, J=8,0, 1H), 7,24-7,29 (m, 1H), 7,32-7,38 (m, 2H), 7,60 (dd, J=1,8, 7,8, 1H)
Пример получения 367: 2-((2S,3S)-3-(2-хлорфенил.)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат

Осуществляли по существу такой же способ, какой описан в Примере получения 366, за исключением того, что для получения целевого соединения использовали циклогексанон вместо циклопентанона (0,7 г, 60-85)
1Н ЯМР (400 МГц, CDCl3): δ=1,15 (s, 9H), 1,70-1,94 (m, 10Н), 2,06-2,09 (m, 2H), 3,86 (dt, J=3,5, 8,5, 1H), 4,16-4,26 (m, 2H), 5,18 (d, J=8,4, 1H), 7,22-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,61 (dd, J=1,4, 7,8, 1H)
Пример получения 368: 2-((2R,3R)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этанол
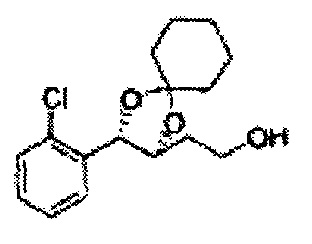
Осуществляли по существу такой же способ, какой описан в Примере получения 366, за исключением того, что для получения целевого соединения использовали 2-((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,5]декан-2-ил)этилпивалат (Пример получения 367) вместо 2-((2S,3S)-3-(2-хлорфенил)-1,4-диоксаспиро[4,4]нонан-2-ил)этилпивалата (Пример получения 365) (0,4 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3): δ=1,42-1,50 (m, 2H), 1,63-1,77 (m, 5H), 1,82-1,89 (m, 5H), 2,41 (q, J=3,9, 1H), 3,78-3,96 (m, 3H), 5,25 (d, J=8,4, 1H), 7,21-7,28 (m, 1H), 7,32-7,38 (m, 2H), 7,63 (dd, J=1,4, 7,8, 1H)
Пример получения 369: (Е)-1-(3(бензилокси)проп-1-енил)2-хлорбензол
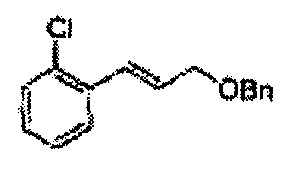
К раствору (Е)-3-(2-хлорфенил)проп-2-ен-1-ола (Пример получения 1, 5,3 г, 31,6 ммоль) в ТГФ последовательно добавляли NaH (60% в минеральном масле, 0,91 г, 37,7 ммоль) и бензилбромид (4,12 мл, 34,8 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали Н2О при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и разделяли. Объединенные органические слои промывали H2O, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (4,94 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ=7,57 (dd, J=7,76, 2, 1H), 7,42-7,13 (m. 3Н), 7,05 (d, J=16, 1H), 6,37-6,30 (m, 1H), 4,62 (s, 2H), 4,26 (dd, J=6, 1,6, 2H).
Пример получения 370: (±)-2-(бензилоксиметил)-3-(2-хлорфенил)оксиран
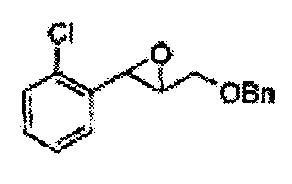
К раствору (Е)-1-(3-(бензилокси)проп-1-енил)-2-хлорбензол (Пример получения 369, 4,94 г, 22 ммоль) в CH2Cl2 (110 мл) добавляли 3-хлорпероксибензойную кислоту (70-75%, 8 г, 33 ммоль) порциями при 0°С. Указанную смесь перемешивали в течение 18 часов при комнатной температуре. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали Н2О при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали насыщенным NaHCO3, H2O, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (4,3 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3) δ 7,42-7,24 (m, 9H), 4,68 (d, J=14,8, 2H), 4,18 (d, J=2 Гц, 1H), 3,96 (dd, J=11,6, 2,8 Гц, 1H), 3,69-3,64 (m, 1H), 3,14 (qt, J=2,4 Гц, 1Н)
Пример получения 371: (±)-3-(бензилокси)-1-(2-хлорфенил)-2-гидроксипропил и (±)-3-(бензилокси)-1-(2-хлорфенил)-1-гидроксипропан-2-илацетат
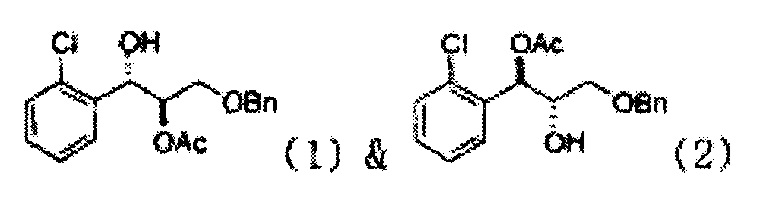
К раствору (±)-2-(бензилоксиметил)-3-(2-хлорфенил)оксирана (Пример получения 370, 4,3 г, 15,6 ммоль) в уксусной кислоте (78 мл) добавляли нитрат церия и аммония (1,71 г, 3,1 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение часов при комнатной температуре. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали насыщенным NaHCO3 до pH7 при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали H2O, затем осушали над MgSO4 и упаривали при пониженном давлении Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1) (1,2 г, 23%), (2) (1,8 г, 34%).
(1) 1H ЯМР (400 МГц, CDCl3) δ=7,55-7,22 (m, 9H), 5,41 (t, J=5 Гц, 1Н), 5.33-5,29 (m, 1H), 4,61-4,47 (m, 2H), 3,70-3,63 (m, 2H, -ОН), 2,09 (s, 3H).
(2) 1Н ЯМР (400 МГц, CDCl3) δ=7,46-7,24 (m, 9H), 6,31 (d, J=5,6 Гц, 1H), 4,55 (d, J=9,6 Гц, 2H), 4,24-4,22 (m, 1H), 3,67-3,55 (m, 2H), 2,52 (d, J=5,2 Гц, -ОН), 2,10 (s, 3H).
Пример получения 372: (±)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диол (смесь анти)
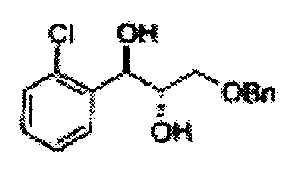
К раствору (±)-3-(бензилокси)-1-(2-хлорфенил)-2-гидроксипропил и (±)-3-(бензилокси)-1-(2-хлорфенил)-1-гидроксипропан-2-илацетата (Пример получения 371,3 г, 8,9 ммоль) в МеОН (36 мл) и H2O (4 мл) добавляли K2CO3 (3,69 г, 26,7 ммоль) при 0°С. Указанную смесь перемешивали в течение 1,5 часов при 0°С. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали H2O при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали H2O, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (2,4 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3) δ=7,50 (dd, J=7,6, 1,2 Гц, 1H), 7,35-7,19 (m, 8H), 5,28 (t, 7=4,8 Гц, 1H), 4,46 (d, J=6 Гц, 2H), 4,18-4,13 (m, 1H), 3,55-3,42 (m, 3H, -ОН), 3,02 (d, J=5,2 Гц, -ОН).
Пример получения 373: (±)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан
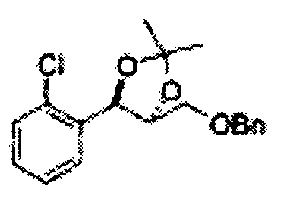
К раствору (±)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диола (Пример получения 372, 2,4 г, 8,2 ммоль) в CH2Cl2 (40 мл) последовательно добавляли р-толуолсульфонилхлорид (15,2 г, 0,08 ммоль), и 2,2-диметоксипропан (8,4 мл, 9,84 ммоль) при 0°С. Указанную смесь перемешивали в течение 1,5 часов при комнатной температуре. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали H2O, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали Н2О, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (2,2 г, 75-90%).
1Н ЯМР (400 МГц, CDCl3) δ=7,61 (dd, J=7,4, 1,6 Гц, 1Н), 7,35-7,16 (m, 8H), 5,63 (d, J=6,8, 1H), 4,83-4,78 (m, 1Н). 4,26 (d, J=12 Гц, 2H), 3,14-3,06 (m, 2H), 1,66 (s, 3H), 1,53 (s, 3H).
Пример получения 374: 5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол (смесь SR и RS)
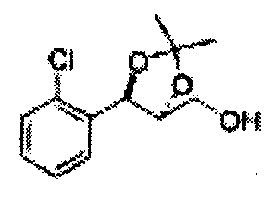
К раствору (±)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолана (Пример получения 375, 2,2 г, 6,6 ммоль) в EtOAc (33 мл) добавляли 10% Pd/C на углероде (0,11 г) при комнатной температуре. Указанную смесь перемешивали в течение 1 часа при комнатной температуре в атмосфере H2 (газ). ТСХ показала полное израсходование исходных веществ. Реакционную смесь отфильтровывали через прокладку с целитом, затем упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,5 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3) δ=7,61 (dd, J=7,4. 1,6, 1Н), 7,35-7,16 (m, 8H), 5,63 (d, J=6,8 Гц, 1Н), 4,83-4,78 (m, 1Н), 4,26 (d, J=12, 2H), 3,14-3,06 (m, 2H), 1,66 (s, 3H), 1,53 (s, 3H).
Пример получения 375: (2R,3R)-2-(бензилоксиметил)-3-(2-хлорфенил)оксиран
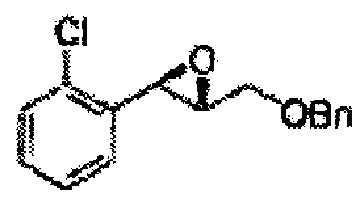
К раствору (Е)-1-(3-(бензилокси)проп-1-енил)-2-хлорбензола (Пример получения 369, 4,16 г, 18,58 ммоль) и 1,2:4,5-ди-O-изопропилиден-β-D-эритро-2,3-гексодиуло-2,6-пиранозы (5,76 г, 22,30 ммоль) в ACN-DMM (3:1, об/об) (185 мл) добавляли буфер (0,2М K2CO3-АСОН в 4× 10М водном ЭДТА, буфер pH=8,0) (185 мл) и Bu4NHSO4 (0,26 г, 0,75 ммоль). Затем указанную смесь охлаждали до 0°С, раствор оксона (15,76 г, 25,64 ммоль) в 4×104 М водном ЭДТА (100 мл) и раствор K2CO3 (13,6 г, 98,47 ммоль) в Н2О (100 мл) добавляли по каплям раздельно в промежутком в 3,5 часа с помощью шприцевого насоса при 0°С. Реакционную смесь перемешивали в течение 14 часов при 0°С. Реакцию останавливали Н2О, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали Н2О, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (2,9 г, 50-65%).
1Н ЯМР (400 МГц, CDCl3) δ=3,14 (qt, J=2,4 Гц, 1H), 3,69-3,64 (m, 1H), 3,96 (dd, J=11,6, 2,8 Гц, 1H), 4,18 (d, 3=2 Гц, 1H), 4,68 (d, J=14,8, 2H), 7,42-7,24 (m, 9H),
Пример получения 376: (1S,2R)-3-(бензилокси)-1-(2-хлорфенил)-2-гидроксипропилацетат
К раствору (2R,3R)-2-(бензилоксиметил)-3-(2-хлорфенил)оксирана (Пример получения 375, 2,9 г, 10,55 ммоль) в Уксусной кислоте (55 мл) добавляли Нитрат церия и аммония (1,15 г, 2,11 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение 18 часов при комнатной температуре. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали насыщенным NaHCO3 до pH7 при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали Н2О, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,2 г, 30-50%),
1Н ЯМР (400 МГц, CDCl3) δ=2,10 (s, 3Н), 2,52 (d, J=5,2 Гц, -ОН), 3,67-3,55 (m, 2H), 4,24-4,22 (m, 1H), 4,55 (d, J=9,6 Гц, 2H), 6,31 (d, J=5,6 Гц, 1H), 7,46-7,24 (m, 9H).
Пример получения 377: (1S,2R)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диол
К раствору (1S,2R)-3-(бензилокси)-1-(2-хлорфенил)-2-гидроксипропилацетата (Пример получения 376, 1,2 г, 3,58 ммоль) в МеОН (16,2 мл) и H2O (1,8 мл) добавляли K2CO3 (1,48 г, 10,74 ммоль) при 0°С. Указанную смесь перемешивали в течение 1,5 часов при 0°С. ТСХ показала полное израсходование исходных веществ. Реакцию останавливали Н2О при 0°С, затем экстрагировали EtOAc. Водный слой экстрагировали EtOAc и отделяли. Объединенные органические слои промывали H2O, затем осушали над MgSO4 и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,0 г, 80-100%).
1Н ЯМР (400 МГц, CDCl3) δ=3,02 (d, J=5,2 Гц, 1H), 3,55-3,42 (m, 3Н, -ОН), 4,18-4,13 (m, 1H), 4,46 (d, J=6 Гц, 2H), 5,28 (t, J=4,8 Гц, 1H), 7,35-7,19 (m, 8H), 7,50 (dd, J=7,6, 1,2 Гц, 1H).
Пример получения 378: (4R,5S)-4-(бензилоксиметил)-5-(2-хлорфенил)-1,3-диоксолан
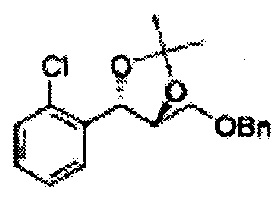
Осуществляли по существу такой же способ, какой описан в Примере получения 373, за исключением того, что для получения целевого соединения использовали (1S,2R)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диол (Пример получения 377) вместо (±)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диола (Пример получения 372) (0,77 г, 80-100%).
1Н ЯМР (400 МГц, CDCl3): δ=1,53 (s, 3Н), 1,66 (s, 3H), 3,14-3,06 (m, 2H), 4,26 (d, J=12 Гц, 2H), 4,83-4,78 (m, 1H), 5,63 (d, J=6,8, 1H), 7,35-7,16 (m, 8H), 7,61 (dd, J=7,4, 1,6 Гц, 1Н).
Пример получения 379: ((4R,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
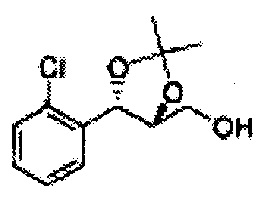
Осуществляли по существу такой же способ, какой описан в Примере получения 374, за исключением того, что для получения целевого соединения использовали ((4R,5S)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан (Пример получения 378) вместо (±)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолана (Пример получения 373) (0,58 г, 80-100%).
1Н ЯМР (400 МГц, CDCl3) δ=1,66 (s, 3Н), 1,53 (s, 3Н), 3,14-3,06 (m, 2H), 4,26 (d, J=12, 2H), 4,83-4,78 (m, 1H), 5,63 (d, J=6,8 Гц, 1H), 7,35-7,16 (m, 8H), 7,61 (dd, J=7,4, 1,6, 1H).
Пример получения 380: (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилат
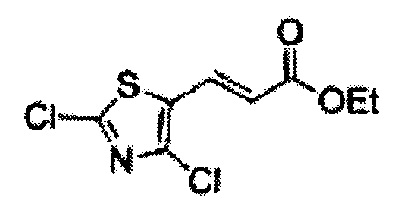
К перемешиваемому раствору 2,4-дихлортиазол-5-карбальдегида (5,0 г, 27,5 ммоль) в ТГФ (200 мл) добавляли триэтилфосфонацетат (6,6 мл, 32,9 ммоль) и гидроксид лития (0,79 мл, 32,9 ммоль), 4А молекулярные сита 5 г при комнатной температуре в атмосфере N2. Указанную смесь перемешивали в течение 3 часов. Полученную смесь разбавляли EtOAc, промывали водой, осушали над безводным сульфатом магния (MgSO4), отфильтровывали, и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (6,1 г, 80-95%)
1Н ЯМР (400 МГц, ДМСО): δ=1,22 (q, J=12,5, 3Н), 4,23 (q, J=7,0, 2H), 6,54 (d, J=16, 1H), 7,54 (d, J=16, 1H).
Пример получения 381: (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноат
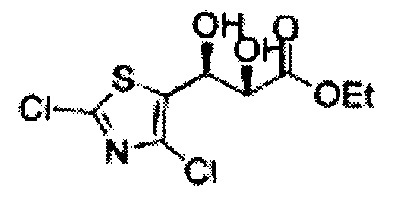
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилат (Пример получения 380) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (3,94 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,22 (q, J=12,5, 3Н), 4,18 (q, J=7,0, 2H), 4,20 (dd, J=2,4, J=7,6, 1H), 5,19 (dd, J=2,6, J=5,8, 1H), 6,03 (d, 3=7,6, 1H), 6,37 (d, J=5,6, 1H).
Пример получения 382: (4S,5S)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
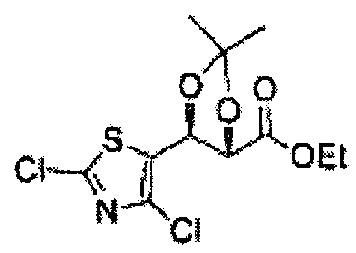
Осуществляли по существу такой же способ, какой описан в Примере получения 26, за исключением того, что для получения целевого соединения использовали (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 381) вместо (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноата (Пример получения 25) (0,13 г, 65-80%)
1Н ЯМР (400 МГц, ДМСО): δ=1,20 (t, J=7,2, 3Н), 1,42 (s, 3Н), 1,49 (s, 3Н), 4,18 (m, 2H), 4,66 (d, J=6,8, 1H), 5,44 (d, J=6,8, 1H).
Пример получения 383: ((4R,5S)-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 27, за исключением того, что для получения целевого соединения использовали (4S,5S)-этил_5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 382) вместо (4S,5R)-метил-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 26) (0,05 г, 50-70%)
1Н ЯМР (400 МГц, ДМСО): δ=1,42 (d, J=6,0, 6Н), 3,59 (m, 1Н), 3,67 (m, 1H), 3,97 (m, 1H), 5,04 (t, J=5,4, 1H), 5,10 (d, J=8,4, 1H).
Пример получения 384: (2R,3R)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноат
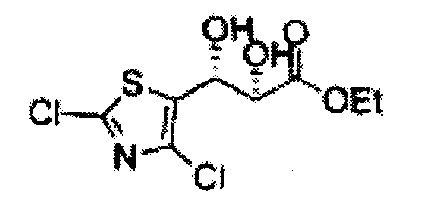
Осуществляли по существу такой же способ, какой описан в Примере получения 381, за исключением того, что для получения целевого соединения использовали (DHQ)2-PHAL вместо (DHQD)2-PHAL (3,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,22 (q, J=12,5, 3Н). 4,18 (q, J=7,0, 2H), 4,20 (dd, J=2,4, J=7,6, 1H), 5,19 (dd, J=2,6. J=5,8, 1H), 6,03 (d, 3=7,6, 1H), 6,37 (d, J=5,6, 1H).
Пример получения 385: (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
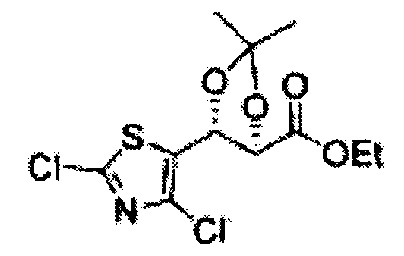
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2R,3R)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 384) вместо (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (0,13 г, 65-80%).
1Н ЯМР (400 МГц, ДМСО): δ=1,20 (t, J=7,2, 3Н), 1,42 (s, 3Н), 1,49 (s, 3Н), 4,18 (m, 2H), 4,66 (d, J=6,8, 1H), 5,44 (d, J=6,8, 1H).
Пример получения 386: ((4S,5R)-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
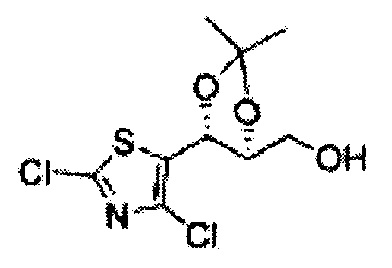
Осуществляли по существу такой же способ, какой описан в Примере получения 388, за исключением того, что для получения целевого соединения использовали (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 385) вместо (4S,5S)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 382) (0,05 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,42 (d, J=6,0, 6Н), 3,59 (m, 1Н), 3,67 (m, 1H), 3,97 (m, 1H), 5,04 (t, J=5,4, 1H), 5,10 (d, J=8,4, 1H).
Пример получения 387: (Е)-этил-3-(2-хлортиазол-5-ил)акрилат
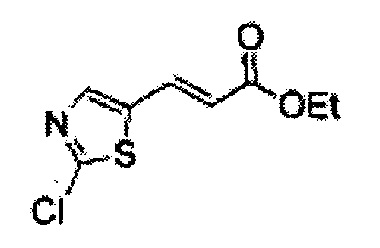
Осуществляли по существу такой же способ, какой описан в Примере получения 380, за исключением того, что для получения целевого соединения использовали 2-хлортиазол-5-карбальдегид вместо 2,4-дихлортиазол-5-карбальдегида (4,7 г, 80-95%)
1Н ЯМР (400 МГц, ДМСО): δ=1,25 (t, J=7,0, 3Н), 4,19 (q, J=7,2, 2H), 6,40 (d, J=16, 1H), 7,81 (d, J=16, 1H), 8,11 (s, 1H)
Пример получения 388: (2S,3S)-этил-3-(2-хлортиазол-5-ил)-2,3-дигидроксипропаноат
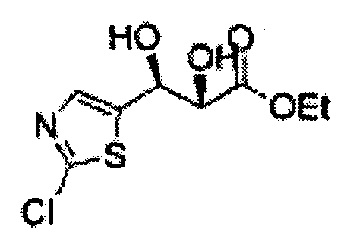
Осуществляли по существу такой же способ, какой описан в Примере получения 381, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2-хлортиазол-5-ил)акрилат (Пример получения 387) вместо (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилата (Пример получения 380) (4,1 г, 50-70).
1Н ЯМР (400 МГц, ДМСО): δ=1,20 (t, J=7,0, 3Н), 4,12 (q, J=7,2, 2H), 5,18 (d, J=1,6, 1H), 5,87 (s, 1H), 6,12 (s, 1H), 7,63 (s, 1H).
Пример получения 389: (4S,5S)-этил-5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
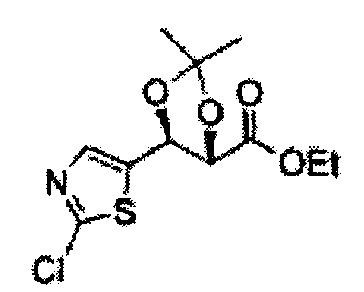
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2S,3S)-этил-3-(2-хлортиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 388) вместо (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (1,0 г, 65-80%).
1Н ЯМР (400 МГц, ДМСО): δ=1,44 (d, J=16,8, 3Н), 4,18 (m, 2Н), 4,62 (d, J=7,6, 1Н), 5,50 (d, J=7,2, 1Н), 7,74 (s, 1Н).
Пример получения 390: (4R,5S)-5-(2-хлортиазол-5-ил)2,2-диметил-1,3-диоксолан-4-ил)метанол
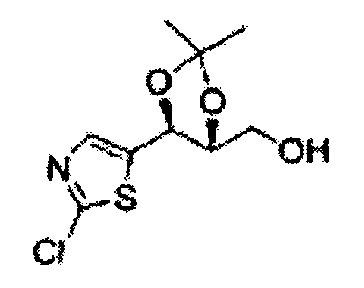
Осуществляли по существу такой же способ, какой описан в Примере получения 386, за исключением того, что для получения целевого соединения использовали (4S,5S)-этил-5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 389) вместо (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 385) (0,84 г, 70-90%).
1Н ЯМР (400 МГц, ДМСО): δ=1,40 (d, J=2,0, 6H), 3,59 (q, J=4,7, 2Н), 3,94 (m, 1Н), 5,06 (t, J=6,6, 1Н), 5,09 (d, J=0,8, 1Н), 7,69 (s, 1Н).
Пример получения 391: (2R,3R)-этил-3-(2-хлортиазол-5-ил)-2,3-дигидроксипропаноат
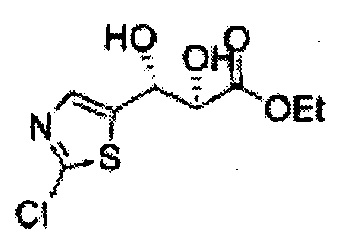
Осуществляли по существу такой же способ, какой описан в Примере получения 384, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2-хлортиазол-5-ил)акрилат (Пример получения 387) вместо (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилата (Пример получения 380) (3,9 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,20 (t, J=7,0, 3Н), 4,12 (q, J=7,2, 2Н), 5,18 (d, J=1,6, 1Н), 5,87 (s, 1Н), 6,12 (s, 1Н), 7,63 (s, 1Н).
Пример получения 392: (4R,5R)-этил-5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат

Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2R,3R)-этил-3-(2-хлортиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 391) вместо (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (0,73 г, 65-80%).
1Н ЯМР (400 МГц, ДМСО): δ=1,44 (d, J=16,8, 3Н), 4,18 (m, 2H), 4,62 (d, J=7,6, H), 5,50 (d, J=7,2, 1H), 7,74 (s, 1H).
Пример получения 393: (4S,5R)-5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 386, за исключением того, что для получения целевого соединения использовали (4R,5R)-этил-5-(2-хлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 392) вместо (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 385) (0,60 г, 70-90%).
1H ЯМР (400 МГц, ДМСО): δ=1,40 (d, J=2,0, 6H), 3,59 (q, J=4,7, 2H), 3,94 (m, 1H), 5,06 (t, J=6,6, 1H), 5,09 (d, J=0,8, 1H), 7,69 (s, 1H).
Пример получения 394: (Е)-этил-3-(4-метилтиазол-5-ил)акрилат
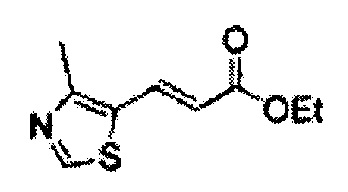
Осуществляли по существу такой же способ, какой описан в Примере получения 380, за исключением того, что для получения целевого соединения использовали 4-метилтиазол-5-карбальдегид вместо 2,4-дихлортиазол-5-карбальдегида (15 г, 80-95%)
1Н ЯМР (400 МГц, ДМСО): δ=1,25 (t, J=7,0, 311), 1,45 (s 3Н), 4,19 (q, J=7,0, 2H), 6,12 (d, J=16, 1H), 7,77 (d, J=16, 1H), 9,09 (s, 1H).
Пример получения 395: (2S,3S)-этил-3-(4-метилтиазол-5-ил)-2,3-дигидроксипропаноат
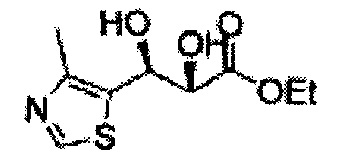
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(4-метилтиазол-5-)акрилат (Пример получения 394) вместо (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилата (Пример получения 381) (4,0 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,11 (t, J=7,0, 3Н), 1,43 (s, 3Н), 4,04 (m, 2Н), 5,11 (t, J=3,8, 1H), 5,70 (d, J=20,7, 1H), 5,92 (d, J=4,0, 1H), 6,81 (s, 1H), 8,86 (s, 1H).
Пример получения 396: (4S,5S)-этил-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
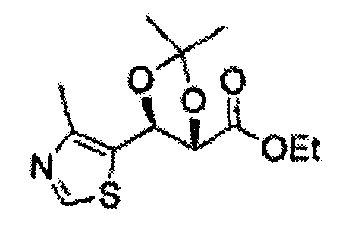
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2S,3S)-этил-3-(4-метилтиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 395) вместо (2S,3S)-этил 3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (2,6 г, 55-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,17 (t, J=3,6, 3Н), 1,43 (s, 3Н), 1,49 (s, 3Н), 2,34 (s, 3Н), 4,17 (q, J=7,0 2Н), 4,40 (d, J=14,0, 1H), 5,53 (d, J=7,2, 1H), 9,01 (s, 1H).
Пример получения 397: (4R,5S)-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
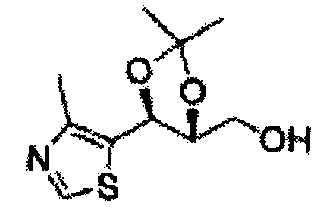
Осуществляли по существу такой же способ, какой описан в Примере получения 386, за исключением того, что для получения целевого соединения использовали (4S,5S)-этил-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 396) вместо (4R,5)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 385) (1,7 г, 70-90%).
1Н ЯМР (400 МГц, ДМСО): δ=1,42 (d, J=7,6, 6H), 2,36 (s, 3Н), 3,58 (m; 2Н), 3,80 (d, J=3,2, 1H), 5,02 (t, J=5,4, 1H), 5,17 (d, J=8,4, 1H), 8,98 (s, 1H).
Пример получения 398: (2R,3R)-этил-3-(4-метилтиазол-5-дигидроксипропаноат
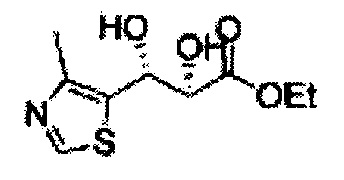
Осуществляли по существу такой же способ, какой описан в Примере получения 384, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(4-метилтиазол-5-ил)акрилат (Пример получения 394) вместо (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилата (Пример получения 380) (6,0 г, 50-70%).
1Н ЯМР (400 МГц, ДМСО): δ=1,11 (t, J=7,0, 3Н), 1,43 (s, 3Н), 4,04 (m, 2Н), 5,11 (t, J=3,8, 1H), 5,70 (d, J=20,7, 1H), 5,92 (d, J=4,0, 1H), 6,81 (s, 1H), 8,86 (s, 1H).
Пример получения 399: (4R,5R)-этил-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
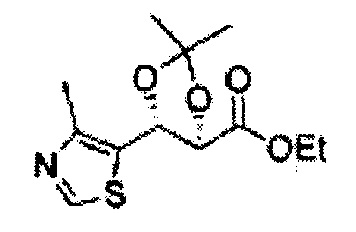
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2R,3R)-этил-3-(4-метилтиазол-5-ил)-2,3-дигидроксипропаноат (Пример получения 398) вместо (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (5,0 г, 65-80%).
1Н ЯМР (400 МГц, ДМСО): δ=1,17 (t, J=3,6, 3Н), 1,43 (s, 3Н), 1,49 (s, 3Н), 2,34 (s, 3Н), 4,17 (q, J=7,0 2Н), 4,40 (d, J=14,0, 1H), 5,53 (d, 1=7,2, 1H), 9,01 (s, 1H).
Пример получения 400: (4S,5R)-5-(4-метилтиазол-5-ил)2,2-диметил-1,3-диоксолан-4-ил)метанол
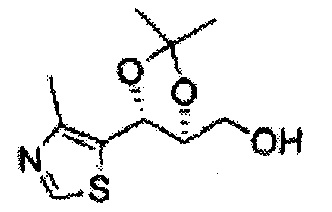
Осуществляли по существу такой же способ, какой описан в Примере получения 386, за исключением того, что для получения целевого соединения использовали (4R,5R)-этил-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 399) вместо (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1.3-диоксолан-4-карбоксилата (Пример получения 385) (4,1 г, 70-90%).
1Н ЯМР (400 МГц, ДМСО): δ=1,42 (d, J=7,6, 6H), 2,36 (s, 3Н), 3,58 (m, 2H), 3,80 (d, J=3,2, 1Н), 5,02 (t, J=5,4, 1H), 5,17 (d, J=8,4, 1H), 8,98 (s, 1H).
Пример получения 401: (4R,5S)-этил-5-(2-хлор-4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
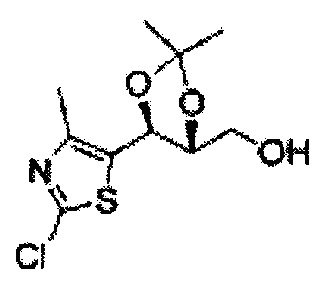
К перемешиваемому раствору (4R,5S)-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 397, 3,1 г, 14,3 ммоль) в ТГФ (20 мл) добавляли н-бутиллитий (14,3 мл, 35,7 ммоль) и CCl4 (4,1 мл, 42,8 ммоль) при -78°С. Указанную смесь перемешивали в течение 0,5 часа. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (2,8 г, 70-90%)
1Н ЯМР (400 МГц, ДМСО): δ=1,40 (d, J=5,6, 6H), 2,28 (s, 3Н), 3,58 (m, 2H), 3,80 (m, 1H), 5,06 (m, 1H), 5,13 (d, J=8,4, 1H).
Пример получения 402: (4S,5R)-этил-5-(2-хлор-4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
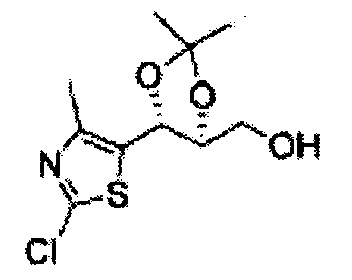
Осуществляли по существу такой же способ, какой описан в Примере получения 401, за исключением того, что для получения целевого соединения использовали (4S,5R)-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол (Пример получения 400) вместо (4R,5S)-5-(4-метилтиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанола (Пример получения 397) (1,5 г, 70-90%).
1Н ЯМР (400 МГц, ДМСО): δ=1,40 (d, J=5,6, 6H), 2,28 (s, 3Н), 3,58 (m, 2H), 3,80 (m, 1H), 5,06 (m, 1H), 5,13 (d, J=8,4, 1H).
Пример получения 403: (Е)-этил-3-(тиофен-3-ил)акрилат
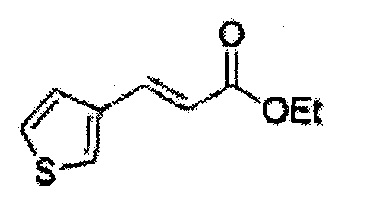
К перемешиваемому раствору триэтилфосфонацетата (5,36 мл, 26,7 ммоль) в ТГФ (40 мл) добавляли t-BuOK (3 г, 26,7 ммоль) по каплям при комнатной температуре и перемешивали при этой температуре в течение 30 минут. Затем тиофен-3-карбальдегид (3 г, 26,7 ммоль) добавляли и перемешивали при 90°С и перемешивали при этой температуре в течение 30 минут. Реакцию останавливали 1М раствором HCl. Полученную смесь экстрагировали из воды этилацетатом. Объединенные органические слои осушали (Na2SO4), отфильтровывали и концентрировали. Осадок очищали на колонке с силикагелем для получения целевого соединения (3,9 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,34 (t, J=7,2, 3Н), 4,26 (q, J=7,2, 2H), 6,31 (d, J=15,6, 1H), 6,89 (d, J=4, 1H), 7,69 (s, 1H), 7,73 (d, J=4, 1H), 7,80 (d, J=15,6, 1H)
Пример получения 404: (2R,3S)-этил-2,3-дигидрокси-3-(тиофен-3-ил)пропаноат
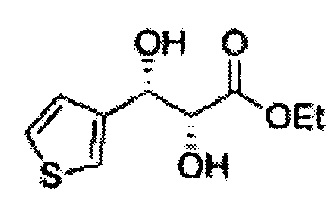
Осуществляли по существу такой же способ, какой описан в Примере получения 384, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(тиофен-3-ил)акрилат (Пример получения 403) вместо (Е)-этил-3-(2,4-дихлортиазол-5-ил)акрилата (Пример получения 380) (6,0 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): δ=1,34 (t, J=7,2, 3Н), 4,26 (q, J=7,2, 2H), 4,65 (d, J=5,5, 1H), 5,13 (d, J=5,5, 1H), 6,93 (dd, J=6,09, J=1,32, 1H), 7,47 (dd, J=6,09, J=1,73, 1H), 7,88 (dd, J=1,73, J=1,32, 1H)
Пример получения 405: (4R,5S)-этил-2,2-диметил-5-(тиофен-3-диоксолан-4-карбоксилат
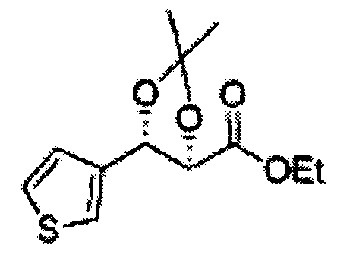
Осуществляли по существу такой же способ, какой описан в Примере получения 382, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-2,3-дигидрокси-3-(тиофен-3-ил)пропаноат (Пример получения 404) вместо (2S,3S)-этил-3-(2,4-дихлортиазол-5-ил)-2,3-дигидроксипропаноата (Пример получения 381) (3,0 г, 65-80%).
1Н ЯМР (400 МГц, CDCl3): δ=1,18 (t, J=7,1, 3H), 1,41 (s, 3H), 1,43 (s, 3H), 4,16 (q, J=7,1, 2H), 4,21 (d, J=7,0, 1H). 4,94 (d, J=7,0, 1H) 6,95 (dd, J=6,0, J=1,3, 1H), 7,48 (dd, J=6,0, J=l,7, 1H), 7,90 (dd. J=1,7, J=1,3, 1H)
Пример получения 406: ((4S,5S)-2,2-диметил-5-(тиофен-3-ил)-1,3-диоксолан-4-ил)метанол
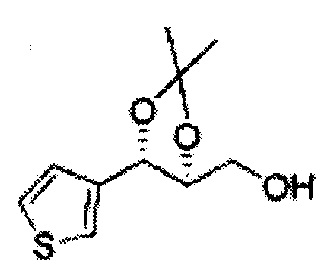
Осуществляли по существу такой же способ, какой описан в Примере получения 386, за исключением того, что для получения целевого соединения использовали (4R,5R)-этил-2,2-диметил-5-(тиофен-3-ил)-1,3-диоксолан-4-карбоксилат (Пример получения 405) вместо (4R,5R)-этил-5-(2,4-дихлортиазол-5-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 385) (2,2 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,39 (s, 3H). 1,42 (s, 3H), 3,47-3,6 (m, 2H) 3,84-3,88 (m, 1H) 4,82 (d, J=7,0, 1H), 6,93 (dd, J=6,1, J=1,3, 1H), 7,47 (dd, J=6,1, J=1б7, 1H,), 7,89 (dd, J=1,7, J=1,3, 1H)
Пример получения 407: (Е)-этил-3-(5-хлортиофен-2-ил)акрилат
Осуществляли по существу такой же способ, какой описан в Примере получения 403, за исключением того, что для получения целевого соединения использовали 5-хлортиофен-2-карбальдегид вместо тиофен-3-карбальдегида (4,0 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,36 (t, J=7,2, 3H), 4,20 (q, J=7,2, 2H), 6,13 (d, J=15,6, 1H), 6,89 (d, J=4, 1H), 7,65 (d, J=15,6, 1H), 7,83 (d, J=4,2, 1H)
Пример получения 408: (2R,3S)-этил-2,3-дигидрокси-3-(5-хлортиофенил)пропаноат
Осуществляли по существу такой же способ, какой описан в Примере получения 404, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(5-хлортиофен-2-ил)акрилат (Пример получения 407) вместо (Е)-этил-3-(тиофен-3-ил)акрилата (Пример получения 403) (2,8 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): δ 1,34 (t, J=7,2, 3Н), 2,76 (d, J=8,4, 1Н), 3,32 (d, J=5,6, 1H), 4,33 (q, J=7,2 2H), 4,4 (dd, J=2,4, J=5,2 1H), 5,16 (dd, J=2, J=8, 1H), 6,82 (d, J=4, 1H), 6,88 (dd, J=0,8 J=3,6, 1H)
Пример получения 409: (4R,5S)-этил-2,2-диметил-5-(5-хлортиофен-2-ил)-1,3-диоксолан-4-карбоксилат
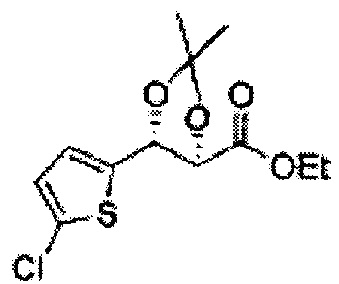
Осуществляли по существу такой же способ, какой описан в Примере получения 405, за исключением того, что для получения целевого соединения использовали (2R,3S)-этил-2,3-дигидрокси-3-(5-хлортиофен-2-ил)пропаноат (Пример получения 408) вместо (2R,3S)-этил-2,3-дигидрокси-3-(тиофен-3-ил)пропаноата (Пример получения 404) (0,85 г, 65-80%).
1H ЯМР (400 МГц, CDCl3): δ-1,31 (t, J=7,2 3Н), 1,54 (s, 3Н), 1,58 (s, 3Н), 4,29-4,36 (m, 2H), 4,42 (d, J=7,2 1H), 5,29 (d, J=7,2 1H), 6,81 (q, J=4 1H), 6,88 (d, J=3,2 1H)
Пример получения 410: ((4S,5S)-2,2-диметил-5-(5-хлортиофен-2-ил)-1,3-диоксолан-4-ил)метанол
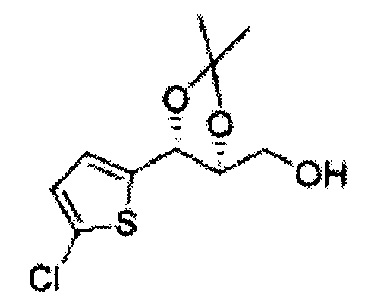
Осуществляли по существу такой же способ, какой описан в Примере получения 406, за исключением того, что для получения целевого соединения использовали (4R,5R)-этил-2,2-диметил-5-(5-хлортиофен-2-ил)-1,3-диоксолан-4-карбоксилат (Пример получения 409) вместо (4R,5R)-этил-2,2-диметил-5-(тиофен-3-ил)-1,3-диоксолан-4-карбоксилата (Пример получения 405) (0,8 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,39 (s, 3Н), 1,42 (s, 3Н), 3,54-3,79 (m, 2H,) 4,28-4,42 (m, 1H), 5,17 (d, J=7,2, 1H), 6,47 (d, J=6,1, 1H,), 6,51 (d, J=6,1, 1H)
Пример получения 411: 3-хлоризоникотинальдегид
В 250 мл круглодонную колбу с 3-хлорпиридином (1 г, 8,80 ммоль) в ТГФ (20 мл) по каплям добавляли диизопропиламид лития (LDA) (11 мл, 22,02 ммоль) при -78°С и перемешивали при той же температуре в течение 1-2 часов. Затем добавляли ДМФ (822 мкл, 10,56 ммоль) и перемешивали при комнатной температуре в течение 1 часа. ЕА (этилацетат) и воду добавляли к реакционной смеси, а после разделения слоев, водную фазу экстрагировали органическим растворителем. Объединенные органические экстракты осушали над безводным сульфатом натрия (Na2SO4), отфильтровывали и концентрировали под вакуумом. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (0,33 г, 30-65%)
1Н ЯМР (400 МГц, CDCl3) δ=7,73 (d, J=8,0, 1H) 8,71 (d, J=4,0, 1H) 8,81 (s, 1H) 10,52 (s, 1H)
Пример получения 412: (Е)-этил-3-(3-хлорпиридин-4-ил)акрилат
3-Хлоризоникотинальдегид (Пример получения 411, 0,54 г, 3,79 ммоль) растворяли в бензоле при комнатной температуре, добавляли триэтилфосфоацетат (753 мкл, 3,79 ммоль) и трет-бутоксид калия (468 мг, 4,17 ммоль) и перемешивали. Когда реакция заканчивалась, полученный продукт промывали водой и этилацетатом (ЕА). Затем, органический слой обезвоживали безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (0,57 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ=1,40 (t, J=12, 3Н) 4,13 (q, J=6,6, 2H) 6,61 (d, J=16,0, 1H) 7,46 (d, J=16,0, 1H) 7,97 (d, J=8,0, 1H) 8,51 (d, J=4,0, 1H) 8,66 (s, 1H).
Пример получения 413: Этил-3-(3-хлорпиридин-4-ил)-2,3-дигидроксипропаноат
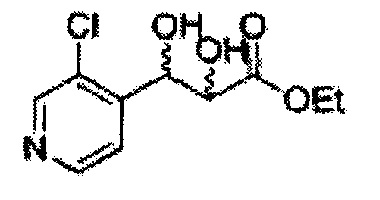
(Е)-Этил-3-(3-хлорпиридин-4-ил)акрилат (Пример получения 412, 0,57 г, 2,69 ммоль) растворяли в смеси ацетон (11,4 мл)/вода (2,3 мл)/t-BuOH (2,3 мл). К нему добавляли NMO (0,47 г, 4,03 ммоль), тетроксид осмия (13,6 мг, 0,05 ммоль) и перемешивали при 40°С. Когда реакция заканчивалась, полученный продукт промывали водой и этилацетатом (ЕА). Затем органический слой обезвоживали безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (0,44 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3) δ=1,28 (t, J=12,0, 3H) 4,15 (q, J=6,6, 2H) 4,26 (d, J=4,0, 1H) 5,24 (d, J=4,0, 1H) 5,44 (brs, 1H) 5,98 (brs, 1H) 7,59(d, J=8,0, 1H) 8,52 (d, J=4,0, 1H) 8,56 (s, 1H)
Пример получения 414: Этил 5-(3-хлорпиридин-4-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
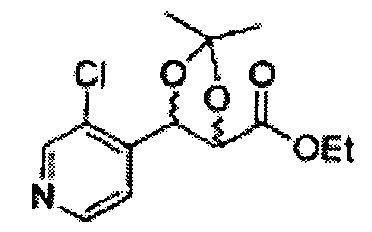
Осуществляли по существу такой же способ, какой описан в Примере получения 405, за исключением того, что для получения целевого соединения использовали этил-3-(3-хлорпиридин-4-ил)-2,3-дигидроксипропаноат (Пример получения 413) вместо (2R,3S)-этил-2,3-дигидрокси-3-(тиофен-3-ил)пропаноата (Пример получения 404) (5,26 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 1,28 (t, J=12,0, 3H) 1,61 (s, 3H) 1,65 (s, 3H) 4,23 (q, J=6,0 2H) 4,38 (d, J=7,2 1H) 5,67 (d, J=8,0, 1H) 7,55 (d, J=8,0, 1H) 8,56 (d, J=4,0, 1H) 8,57 (s, 1H)
Пример получения 415: (5-(3-хлорпиридин-4-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол

Осуществляли по существу такой же способ, какой описан в Примере получения 406, за исключением того, что для получения целевого соединения использовали этил-5-(3-хлорпиридин-4-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 414) вместо (4R,5R)-этил-2,2-диметил-5-(тиофен-3-ил)-1,3-диоксолан-4-карбоксилата (Пример получения 405) (0,18 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ=1,56 (s, 3H), 1,59 (s, 3H), 3,79-3,67 (m, 1H), 3,85 (dd, J=8,0, 6,0, 1H), 4,06-3,90 (m, 1H), 4,14 (dd, J=8,0, 6,0, 1H), 5,37 (d, J=8,0, 1H), 7,57(d, J=6,0, 1H), 8,57 (d, J=12, 2H)
Пример получения 416: 4-хлоризоникотинальдегид
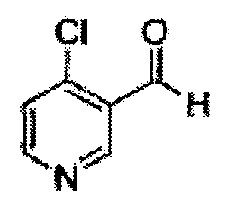
Осуществляли по существу такой же способ, какой описан в Примере получения 411, за исключением того, что для получения целевого соединения использовали этил 4-хлорпиридин вместо 3-хлорпиридина (3,0 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3): δ=7,45 (d, J=5,2, 1Н), 8,70 (d, J=5,2, 1H), 9,06 (s, 1H), 10,52 (s, 1H)
Пример получения 417: (Е)-этил-3-(4-хлорпиридин-3-ил)акрилат
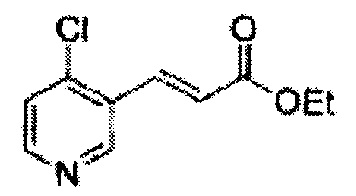
Осуществляли по существу такой же способ, какой описан в Примере получения 412, за исключением того, что для получения целевого соединения использовали этил-4-хлорникотинальдегид (Пример получения 416) вместо 3-хлоризоникотинальдегида (Пример получения 411) (4,0 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,37 (t, J=7,0, 3Н), 4,33 (q, J=6,6, 2H), 6,57 (d, J=16,4, 1H), 7,39 (d, J=5,2, 1H), 7,98 (d, J=16,0, 1H), 8,49 (d, J=5,2, 1H), 8,82 (s, 1H)
Пример получения 418: Этил-3-(4-хлорпиридин-3-ил)-2,3-дигидроксипропаноат
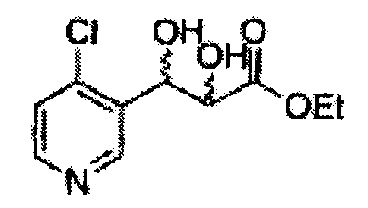
Осуществляли по существу такой же способ, какой описан в Примере получения 413, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(4-хлорпиридин-3-ил)акрилат (Пример получения 417) вместо (Е)-этил-3-(3-хлорпиридин-4-ил)акрилата (Пример получения 412) (2,4 г, 60-80%).
1Н ЯМР (400 МГц, CDCl3) δ=1,34 (t, J=7,2, 3Н), 4,35 (q, J=7,0, 2H), 4,45 (d, J=2,4, 1H), 5,49 (d, J=2,0, 1H), 7,32 (d, J=5,2, 1H), 8,46 (d, J=4,4, 1H), 8,79 (s, 1H)
Пример получения 419: Этил-5-(4-хлорпиридин-3-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат
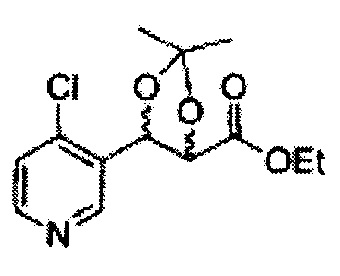
Осуществляли по существу такой же способ, какой описан в Примере получения 414, за исключением того, что для получения целевого соединения использовали этил-3-(4-хлорпиридин-3-ил)-2,3-дигидроксипропаноат (Пример получения 418) вместо этил-3-(3-хлорпиридин-4-ил)-2,3-дигидроксипропаноата (Пример получения 413) (1,3 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,25 (t, J=7,2 3Н), 1,59 (s, 3Н), 1,64 (s, 3Н); 4,22 (q, J=8,27 2H), 4,37 (d, J=7,6, 1H), 5,56 (d, J=7,6, 1H), 7,31 (d, J=5,2, 1H), 8,48 (d, J=5,2, 1H), 8,78 (s, 1H)
Пример получения 420: (5-(4-хлорпиридин-3-ил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
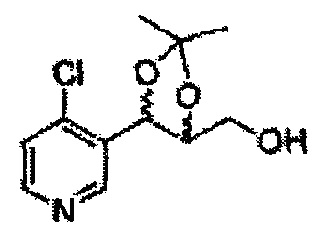
Осуществляли по существу такой же способ, какой описан в Примере получения 415, за исключением того, что для получения целевого соединения использовали этил-5-(4-хлорпиридин-3-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилат (Пример получения 419) вместо этил-5-(3-хлорпиридин-4-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 414) (0,8 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3): δ=1,56 (s, 3Н), 1,63 (s, 3Н), 1,64 (s, 3Н), 3,73-3,77 (m, 1H), 3,95-3,99 (m, 1H) 5,39 (d, J=8,4, 1H), 7,32 (d, J=5,6, 1H), 8,46 (d, J=5,2, 1H), 8,82 (s, 1H)
Пример получения 421: (Е)-этил-3-(пиримидин-5-ил)акрилат
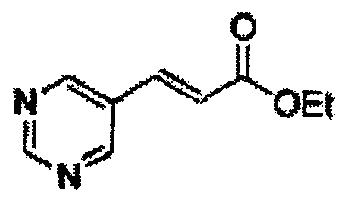
К 5-бромпиримидину (5 г, 31,4 ммоль) в ДМФ (75 мл) добавляли этилакрилат (9,5 мл, 94,4 ммоль) при комнатной температуре. Добавляли диизопропиламин (7,5 мл, 42,8 ммоль), триметилфосфат (0,19 мл, 1,6 ммоль), Pd(Pac)2 (0,18 г, 0,78 ммоль). Реакционную смесь нагревали при 110С в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и реакцию останавливали Н2О, затем экстрагировали ЕА (этилацетат). Водный слой экстрагировали ЕА и отделяли. Объединенные органические слои промывали H2O, затем осушали над безводным сульфатом магния (MgSO4) и упаривали при пониженном давлении. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (3,9 г, 70-90%).
1H ЯМР (400 МГц, CDCl3) δ 1,38 (t, J=6,8, 3Н), 4,29-4,35 (m, 1H), 6,61 (d, J=17,2, 1H), 7,63 (d, J=16,4, 1H), 8,90 (s, 2H), 9,22 (s, 1H).
Пример получения 422: Этил-3-(пиримидин-5-ил)-2,3-дигидроксипропаноат
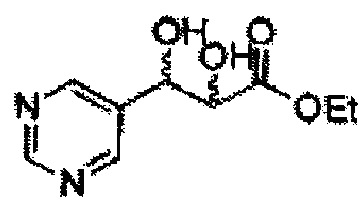
Осуществляли по существу такой же способ, какой описан в Примере получения 418, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(пиримидин-5-ил)акрилат (Пример получения 421) вместо (Е)-этил-3-(4-хлорпиридин-3-ил)акрилата (Пример получения 417) (1,6 г, 40-60%).
1Н ЯМР (400 МГц, CDCl3) δ 1,07-1,39 (m, 3Н), 4,16-4,34 (m, 2H), 4,39 (s, 1H), 4,69 (s, 1H), 5,04 (s, 1H), 5,10 (s, 1H), 8,98 (s, 2H), 9,01 (s, 1H).
Пример получения 423: Этил-2,2-диметил-5-(пиримидин-5-ил)-1,3-диоксолан-4-карбоксилат
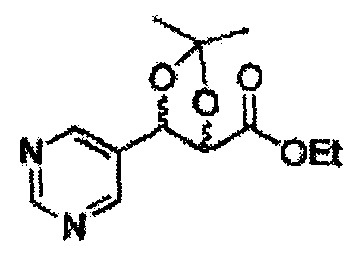
Осуществляли по существу такой же способ, какой описан в Примере получения 419, за исключением того, что для получения целевого соединения использовали этил-3-(пиримидин-5-ил)-2,3-дигидроксипропаноат (Пример получения 422) вместо этил-3-(4-хлорпиридин-3-ил)-2,3-дигидроксипропаноата (Пример получения 418) (0,97 г, 40-60%).
1Н ЯМР (400 МГц, CDCl3) δ 1,30 (t, J=,7,2, 3Н), 1,55 (s, 3Н), 1,61 (s, 3Н), 4,25-4,32 (m, 1H), 4,35 (d, J=8,0, 1H), 5,18 (d, J=7,6, 1H), 8,82 (s, 2H), 9,20 (s, 1H).
Пример получения 424: (2,2-диметил-5-(пиримидин-5-ил)-1,3-диоксолан-4-ил)метанол
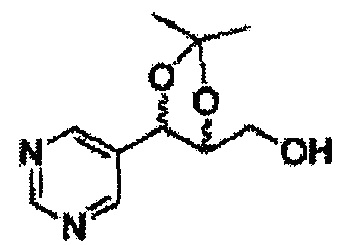
Осуществляли по существу такой же способ, какой описан в Примере получения 420, за исключением того, что для получения целевого соединения использовали этил-2,2-диметил-5-(пиримидин-5-ил)-1,3-диоксолан-4-карбоксилат (Пример получения 423) вместо этил-5-(4-хлорпиридин-3-ил)-2,2-диметил-1,3-диоксолан-4-карбоксилата (Пример получения 419) (0,65 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 1,53 (s, 3Н), 1,56 (s, 3Н), 2,75 (s, -ОН), 3,68-3,73 (m, 1H), 3,69-3,64 (m, 1H), 3,89-3,93 (m, 2H), 5,0 (d, J=8,4, 1H), 8,79 (s, 2H), 9,18 (s, 1H).
Пример получения 425: (Е)-этил-3-(2-хлорпиримидин-5-ил)акрилат
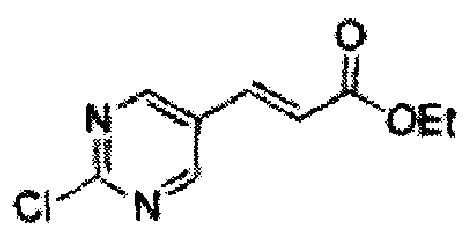
Осуществляли по существу такой же способ, какой описан в Примере получения 421, за исключением того, что для получения целевого соединения использовали 2-хлор-5-бромпиримидин вместо 5-бромпиримидина (9,7 г, 50-70%).
1H ЯМР (400 МГц, CDCl3) δ 1,37 (t, /=6,8, 3Н), 4,32 (qt, J=7,2, 2H), 6,59 (d, J=16,4, 1H), 7,60 (d, J=16,4, 1H), 8,77 (s, 2H).
Пример получения 426: Этил 3-(2-хлорпиримидин-5-ил)-2,3-дигидроксипропаноат
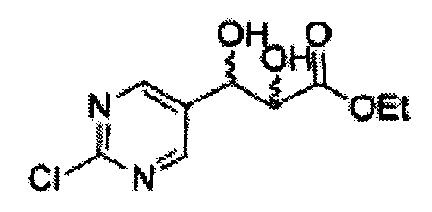
Осуществляли по существу такой же способ, какой описан в Примере получения 422, за исключением того, что для получения целевого соединения использовали (Е)-этил-3-(2-хлорпиримидин-5-ил)акрилат (Пример получения 425) вместо (Е)-этил-3-(пиримидин-5-ил)акрилата (Пример получения 421) (2,1 г, 40-60%).
1Н ЯМР (400 МГц, CDCl3) δ 1,33-1,37 (m, 3Н), 2,97 (d, J=7,2, 1H), 3,31 (d, J=18,4, 1H), 4,34-4,55 (m, 3Н), 5,10 (d, J=7,2, 1H), 8,72 (s, 2H).
Пример получения 427: Этил-2,2-диметил-5-(2-хлорпиримидин-5-ил)-1,3-диоксолан-4-карбоксилат
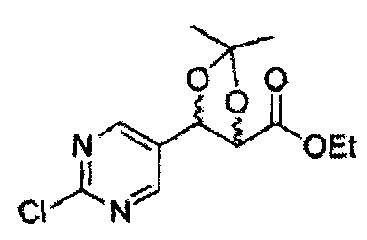
Осуществляли по существу такой же способ, какой описан в Примере получения 423, за исключением того, что для получения целевого соединения использовали этил-3-(2-хлорпиримидин-5-ил)-2,3-дигидроксипропаноат (Пример получения 426) вместо этил-3-(пиримидин-5-ил)-2,3-дигидроксипропаноата (Пример получения 422) (0,98 г, 40-60%).
1Н ЯМР (400 МГц, CDCl3) δ 1,32 (t, J=7,2 3Н), 1,55 (s, 3Н), 1,60 (s, 3Н), 4,27-4,34 (m, 3Н), 5,19 (d, J=7,6, 1H), 8,71 (s, 2H).
Пример получения 428: (2,2-диметил-5-(2-хлорпиримидин-5-ил)-1,3-диоксолан-4-ил)метанол
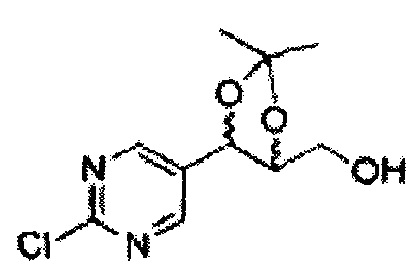
Осуществляли по существу такой же способ, какой описан в Примере получения 424, за исключением того, что для получения целевого соединения использовали этил-2,2-диметил-5-(2-хлорпиримидин-5-ил)-1,3-диоксолан-4-карбоксилат (Пример получения 427) вместо этил-2,2-диметил-5-(пиримидин-5-ил)-1,3-диоксолан-4-карбоксилата (Пример получения 423) (0,71 г, 70-90%).
1Н ЯМР (400 МГц, CDCl3) δ 1,54 (s, 3Н), 1,56 (s, 3H), 2,21 (s, -ОН), 3,71-3,76 (m, 1H), 3,69-3,64 (m, 1H), 3,88-3,96 (m, 2H), 5,02 (d, J=8,0, 1H), 8,68 (s, 2H).
Пример получения 429: (1R,2S)-3-(бензилокси)-1-(2-хлорфенил)-1-гидроксипропан-2-илацетат
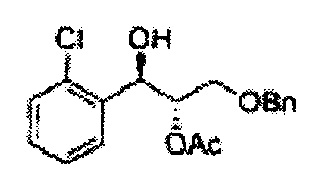
Для получения целевого соединения ацетат региоизомера отделяли и очищали посредством хроматографии на колонке с силикагелем как описано в Примере получения 376 (0,42 г, выход 10-30%)
1Н ЯМР (400 МГц, CDCl3) δ 2,09 (s, 3Н), 3,63-3,70 (m, 2H), 4,47-4,61 (m, 2H), 5,29-5,33 (m, 1H), 5,41 (t, J=5,0 Гц, 1H), 7,22-7,55 (m, 9H).
Пример получения 430: (1R,2S)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диол
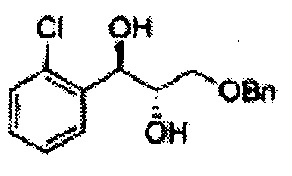
Осуществляли по существу такой же способ, какой описан в Примере получения 377, за исключением того, что для получения целевого соединения использовали (1R,2S)-3-(бензилокси)-1-(2-хлорфенил)-1-гидроксипропан-2-ил ацетат (Пример получения 429) вместо (1S,2R)-3-(бензилокси)-1-(2-хлорфенил)-2-гидроксипропилацетата (Пример получения 376) (0,31 г, 80-95%).
1Н ЯМР (400 МГц, CDCl3): δ 3,02 (d, J=5,2 Гц, 1H), 3,55-3,42 (m, 3Н, -ОН), 4,18-4,13 (m, 1H), 4,46 (d, J=6 Гц, 2H), 5,28 (t, J=4,8 Гц, 1H). 7,35-7,19 (m, 8H), 7,50 (dd, J=7,6, 1,2 Гц, 1H).
Пример получения 431: (4S,5R)-4-(бензилоксиметил)-5-(2-хлорфенил)-1,3-диоксолан
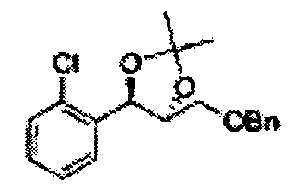
Осуществляли по существу такой же способ, какой описан в Примере получения 373, за исключением того, что для получения целевого соединения использовали (1R,2S)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диол (Пример получения 430) вместо (±)-3-(бензилокси)-1-(2-хлорфенил)пропан-1,2-диола (Пример получения 372) (0,84 г, 80-100%).
1H ЯМР (400 МГц, CDCl3) 61,53 (s, 3Н), 1,66 (s, 3H), 3,14-3,06 (m, 2H), 4,26 (d, J=12 Гц, 2H), 4,83-4,78 (m, 1H). 5,63 (d, J=6,8, 1H), 7,35-7,16 (m, 8H), 7,61 (dd, J=7,4, 1,6 Гц, 1Н).
Пример получения 432: ((4S,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
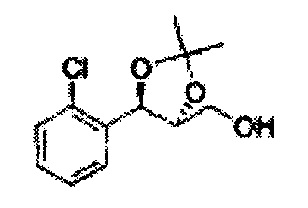
Осуществляли по существу такой же способ, какой описан в Примере получения 374, за исключением того, что для получения целевого соединения использовали ((4S,5R)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан (Пример получения 431) вместо (±)-4-(бензилоксиметил)-5-(2-хлорфенил)-2,2-диметил-1,3 диоксолан (Пример получения 373) (0,82 г, 80-100%).
1Н ЯМР (400 МГц, CDCl3): δ 1,66 (s, 3Н), 1,53 (s, 3Н), 3,14-3,06 (m, 2H), 4,26 (d, J=12, 2H), 4,83-4,78 (m, 1H), 5,63 (d, J=6,8 Гц, 1H), 7,35-7,16 (m, 8H), 7,61 (dd, J=7,4, 1,6, 1H).
Пример получения 433: (2S,3R)-метил-3-(2-хлорфенил)-2,3-дигидроксипропаноат
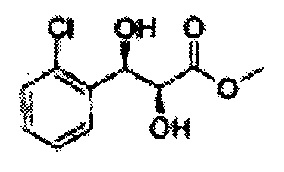
Осуществляли по существу такой же способ, какой описан в Примере получения 3, за исключением того, что для получения целевого соединения использовали (Е)-метил-3-(2-хлорфенил)акрилат (Пример получения 24) вместо (Е)-1-хлор-2-(3-(метоксиметокси)проп-1-енил)бензола (Пример получения 2) (14,2 г, 70-90)
1Н ЯМР (400 МГц, CDCl3) δ 2,79 (d, J=7,2, 1H), 3,13 (d, J=6,0, 1H), 3,86 (s, 3Н), 4,50 (dd, J=5,6, 2,4, 1H), 5,51 (dd, J=7,2, 2,4, 1H), 7,62-7,26 (m, 41)
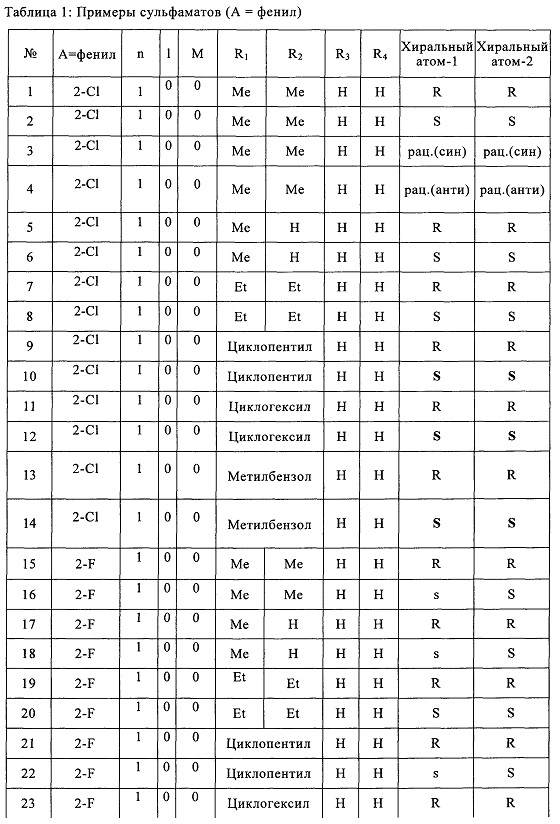
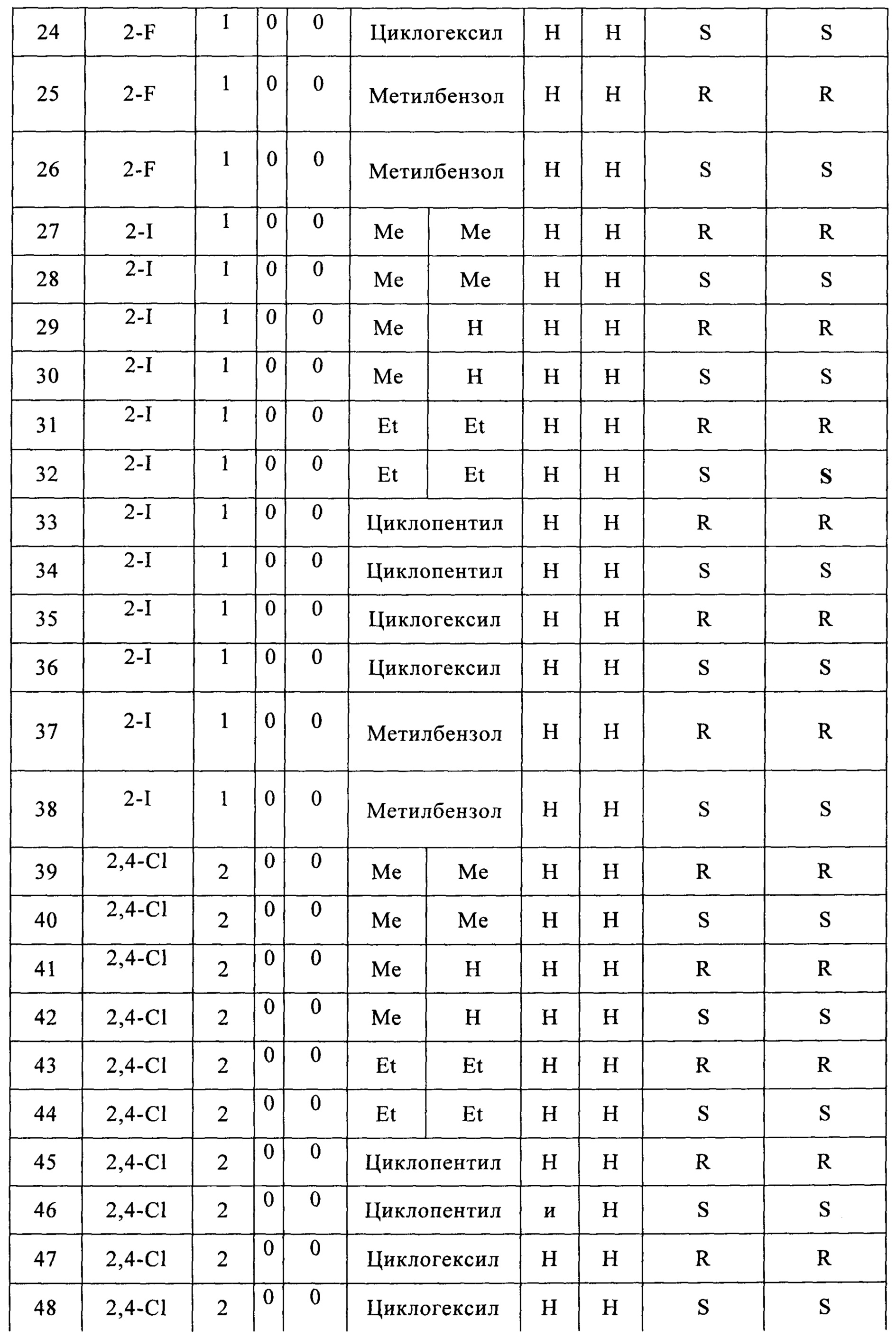
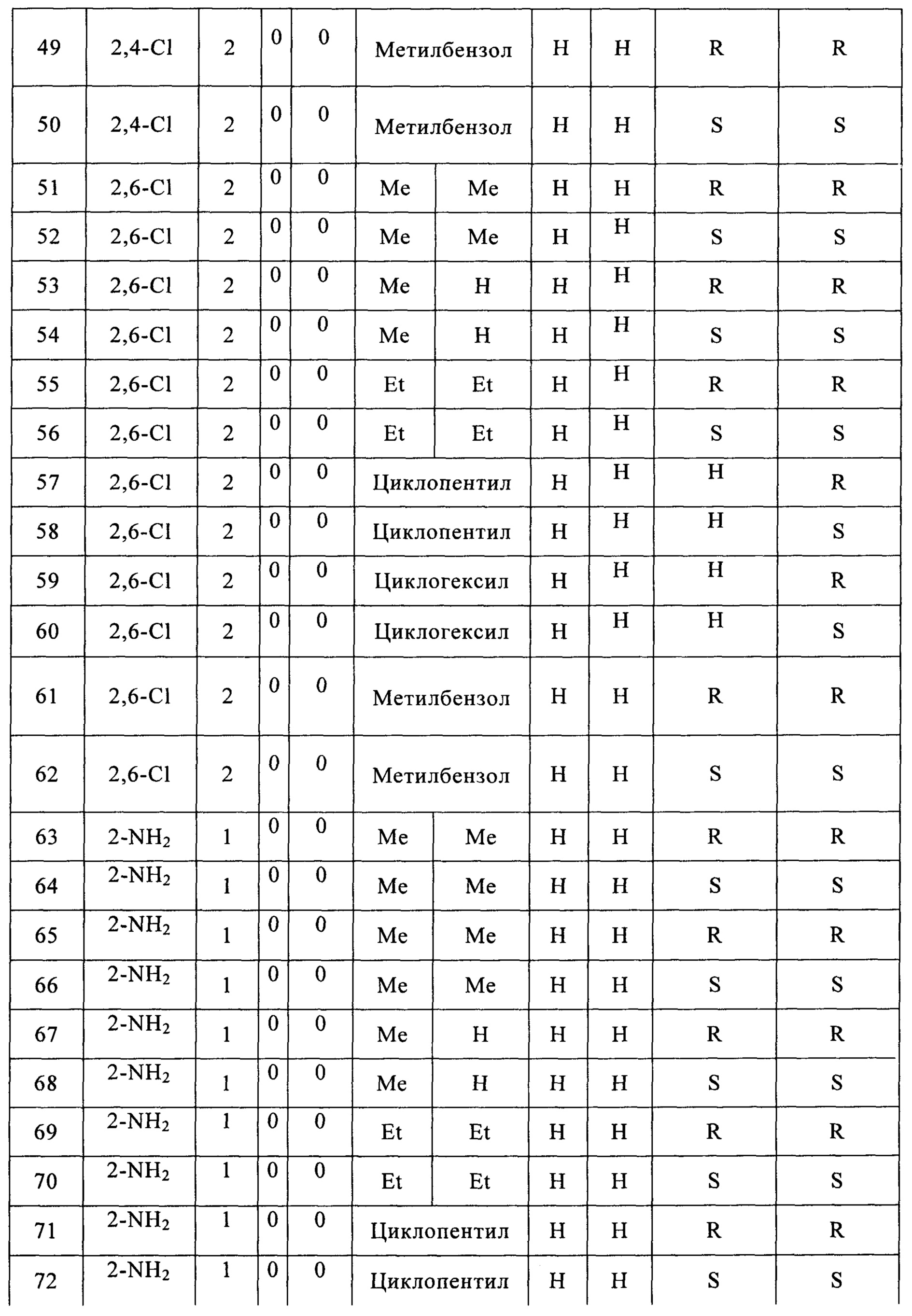

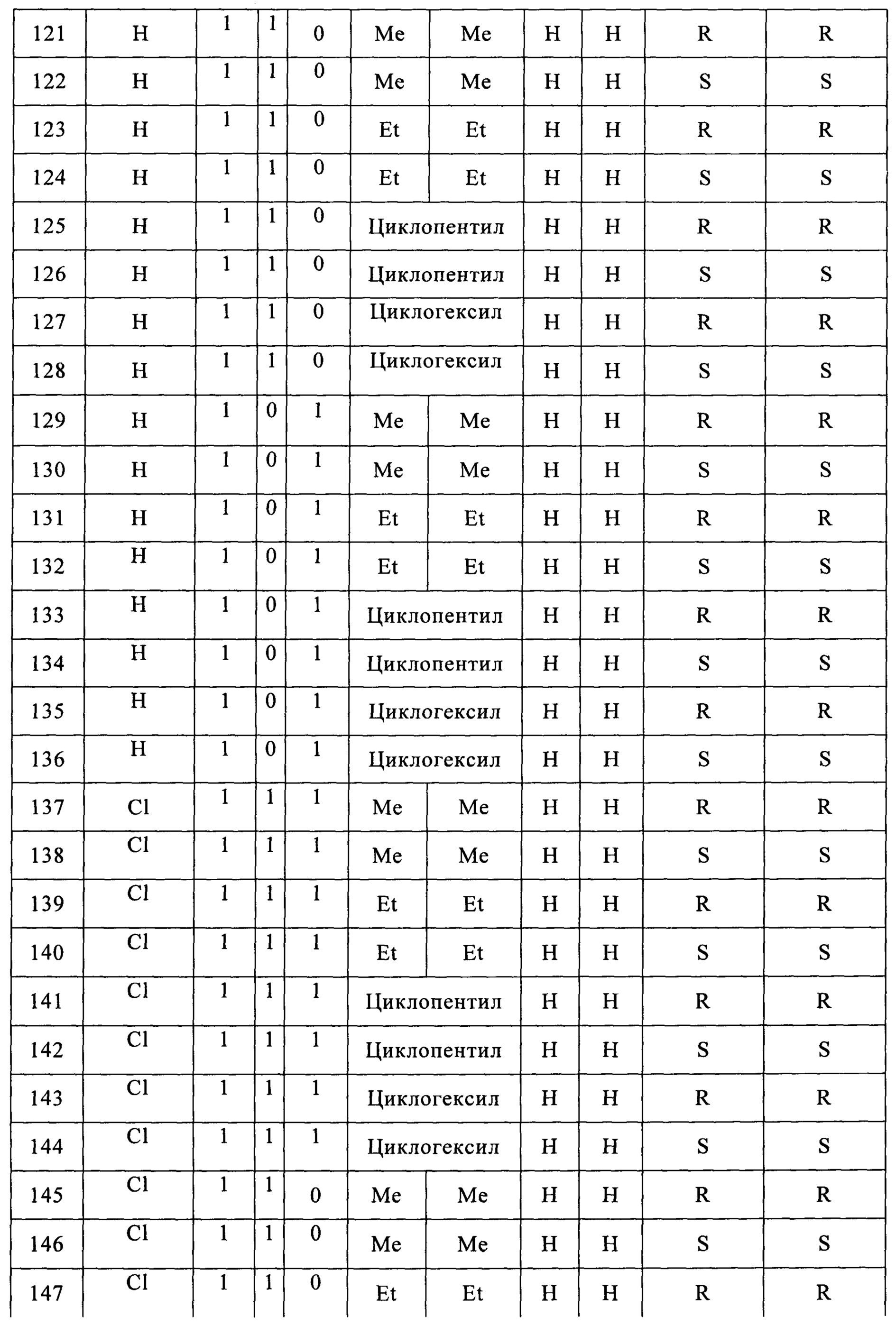
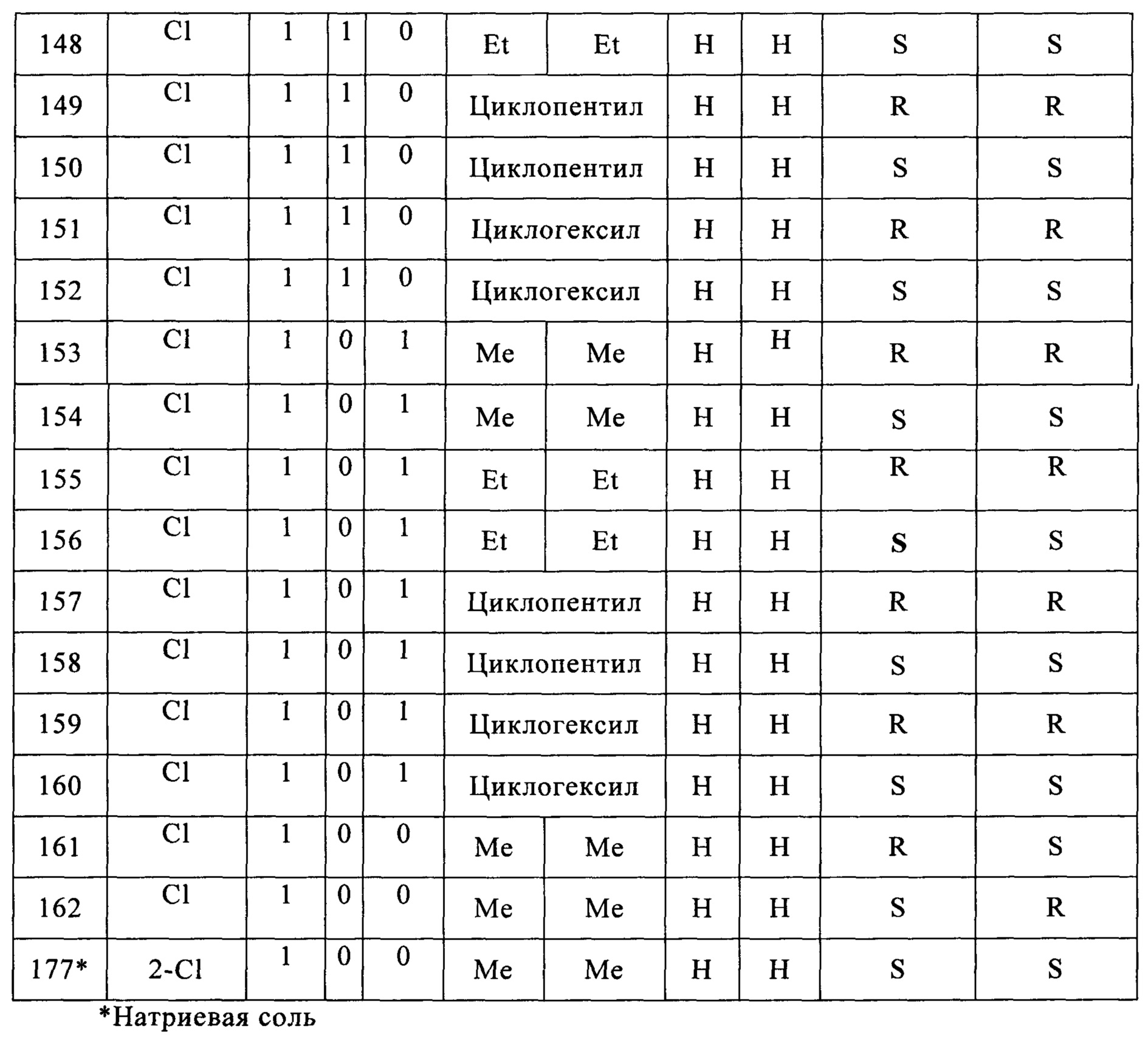
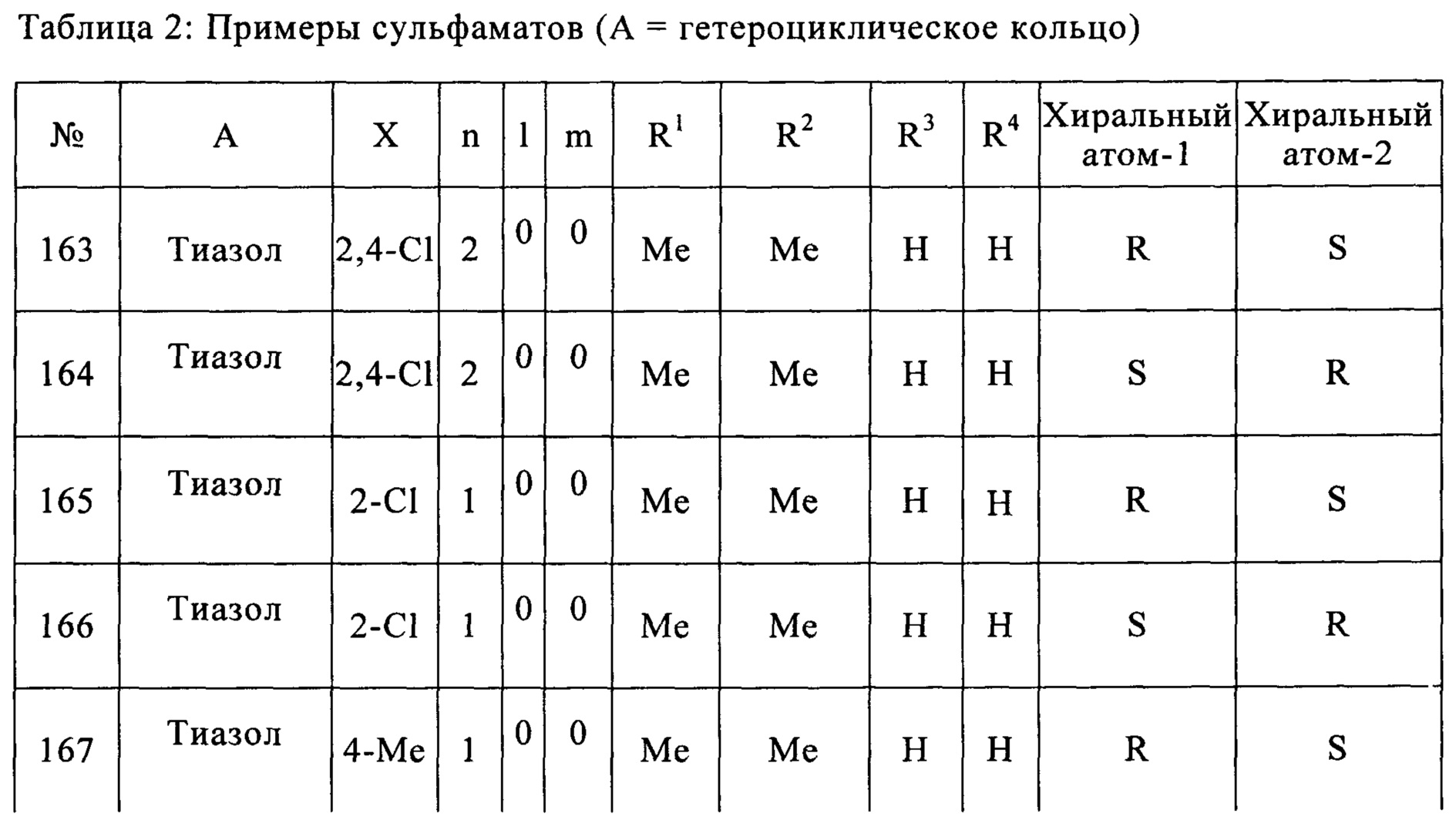
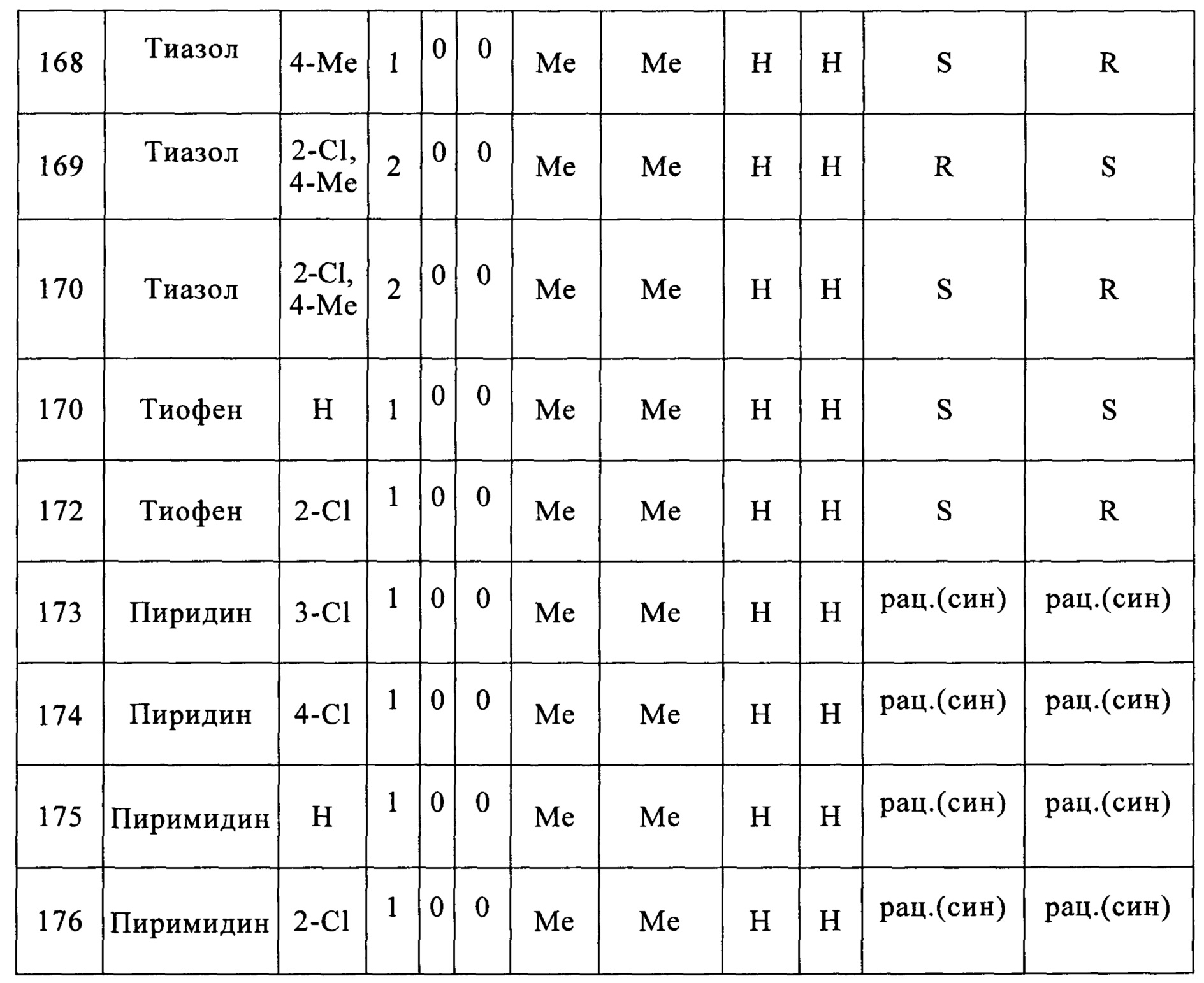
Пример 1-1: ((4,5)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат
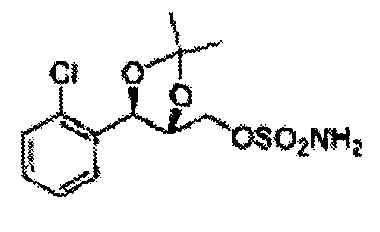
В 100 мл колбу добавляли ацетонитрил (2,26 мл, 43,2 ммоль) и охлаждали до 0°С. Добавляли по каплям хлорсульфонилизоцианат (1,5 мл, 17,3 ммоль), и муравьиную кислоту (0,65 мл, 17,3 ммоль) и перемешивали при комнатной температуре в течение 6 часов. Медленно добавляли ((4,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол (Пример получения 6, 1,05 г, 4,3 ммоль) в N,N-диметилацетамиде (13,2 мл, 142,7 ммоль) при 0 С и перемешивали при комнатной температуре в течение 1 часа. Реакцию останавливали Н2О, экстрагировали EtOAc, и промывали Н2О. Органический слой осушали над безводным сульфатом магния (MgSO4), отфильтровывали и концентрировали. Неочищенное соединение очищали на колонке с силикагелем для получения целевого соединения (1,00 g, 50-80%).
1Н ЯМР (400 МГц, CDCl3): δ 1,57 (s, 3Н), 1,63 (s, 3Н), 4,11-4,10 (m, 1H), 4,53-4,42 (m, 2H), 4,88 (s, 2H), 5,37 (d, J=8,4, 1H), 7,28-7,56 (m, 4H)
Пример 1-2: ((4R,5)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат
В 100 мл круглодонную колбу добавляли ((4R,5R)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метанол (Пример получения 6, 10,0 г, 41,2 ммоль), 50 мл толуола, 7,92 г (82,4 ммоль) сульфамида и 13,0 г (165 ммоль) пиридина при комнатной температуре. Указанную смесь нагревали с обратным холодильником в течение 1,5 часов (температура бани 135°С). Реакционную смесь охлаждали до комнатной температуры, затем раствор экстрагировали 27,5 мл (82,4 ммоль) 3N раствора NaOH. Водный слой промывали 50 мл толуола. К указанной смеси добавляли 50 мл метанола и 35 мл воды, затем подкисляли до pH,0 путем медленного добавления уксусной кислоту для получения целевого соединения (9,9 г 60-80%).
Согласно способу, описанному в Примере 1, получали следующие соединения из Примеров 2-64, 67-88, 91-102, 105-176:
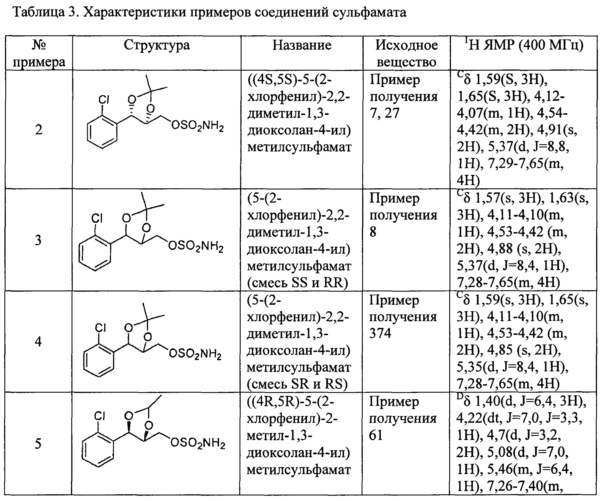
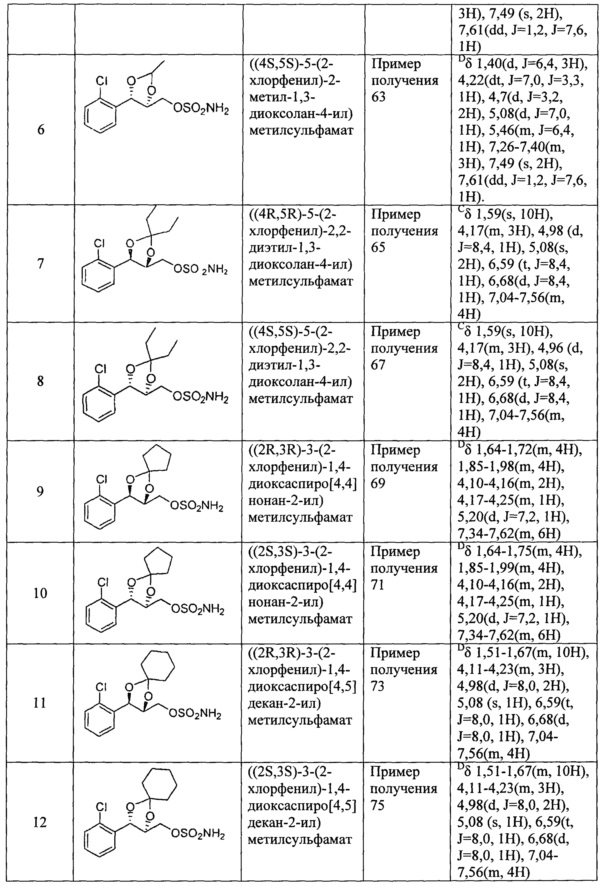
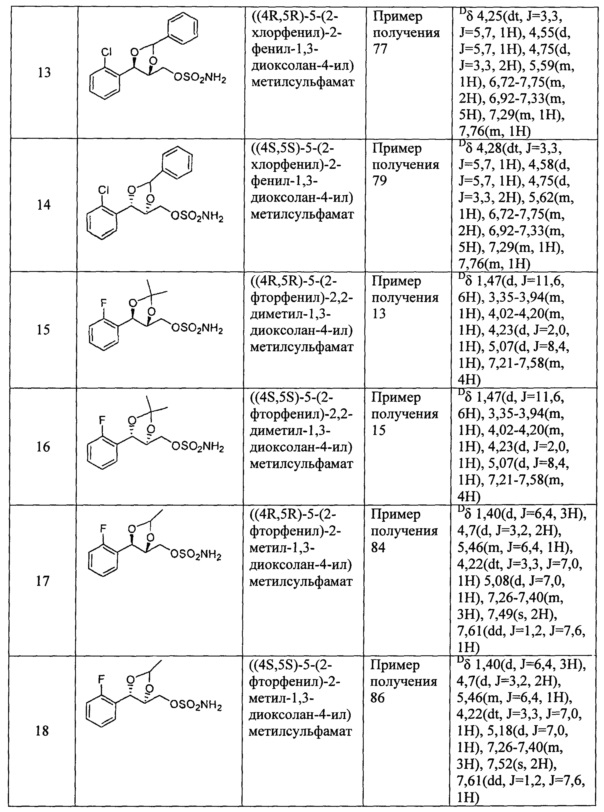
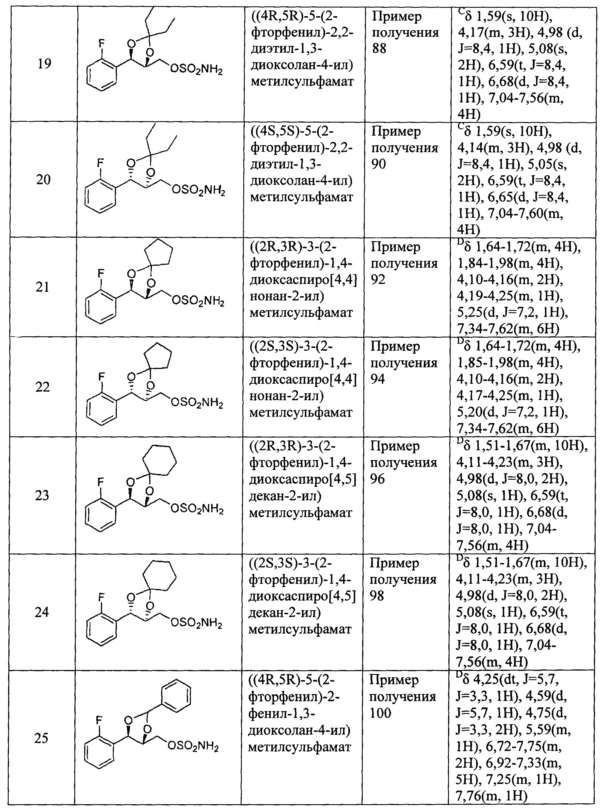
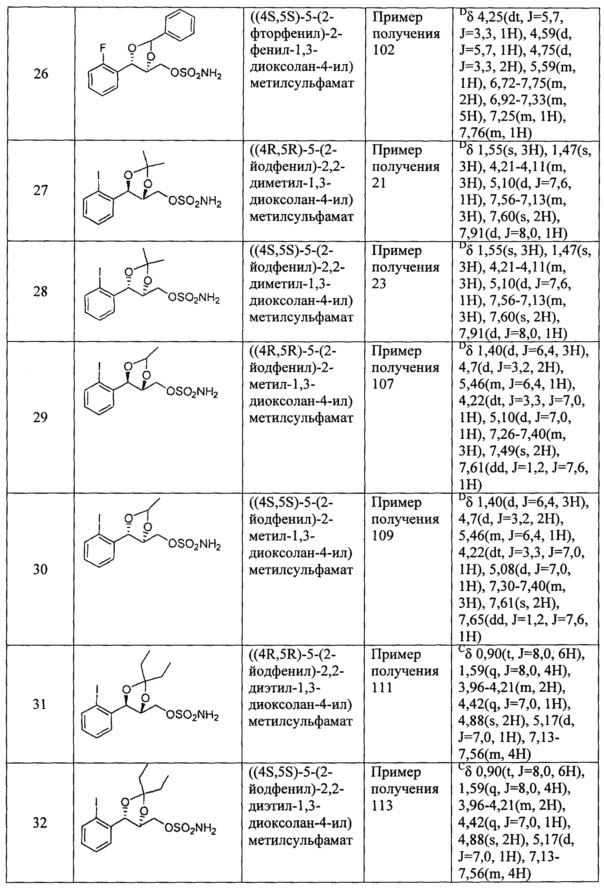
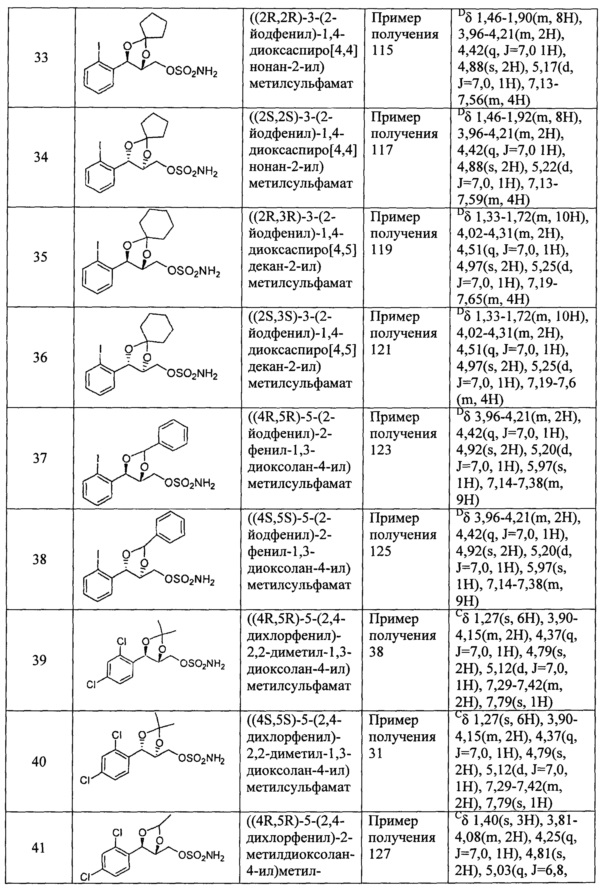
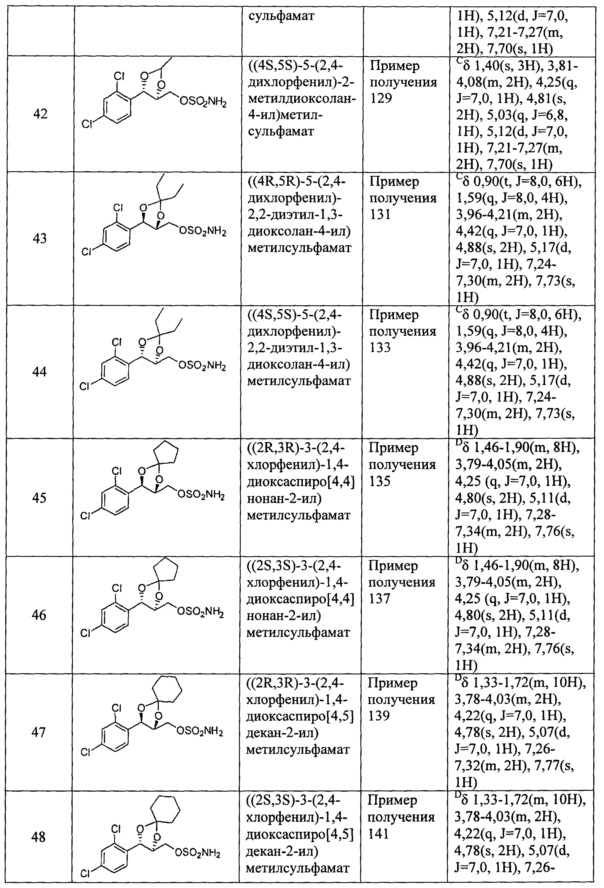
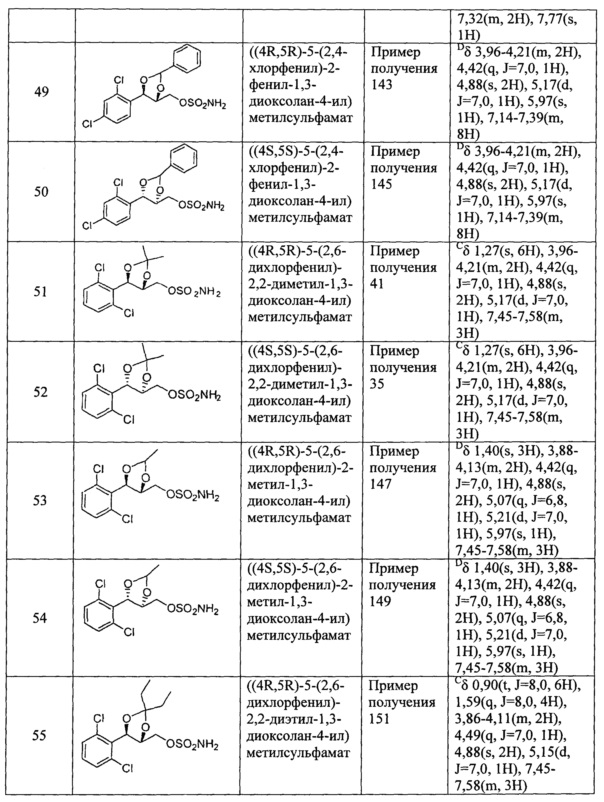
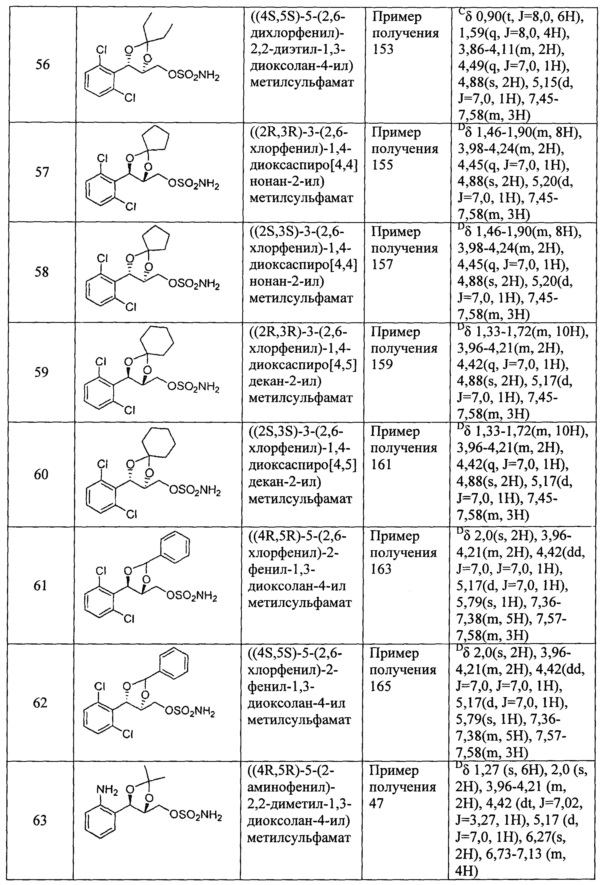
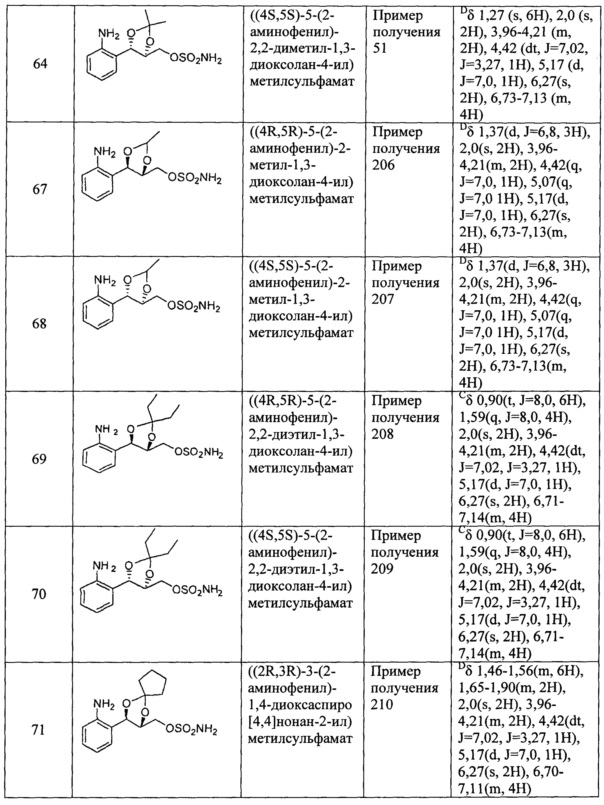
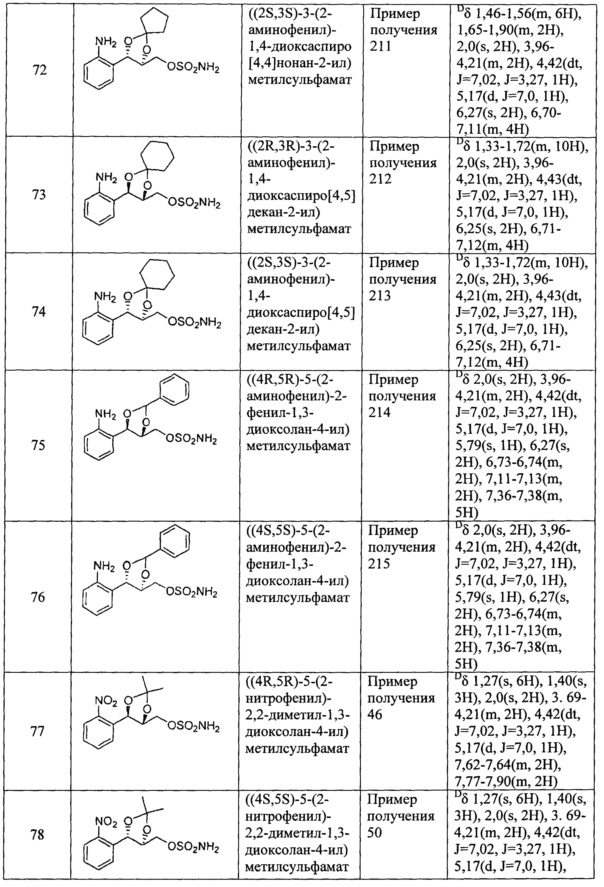
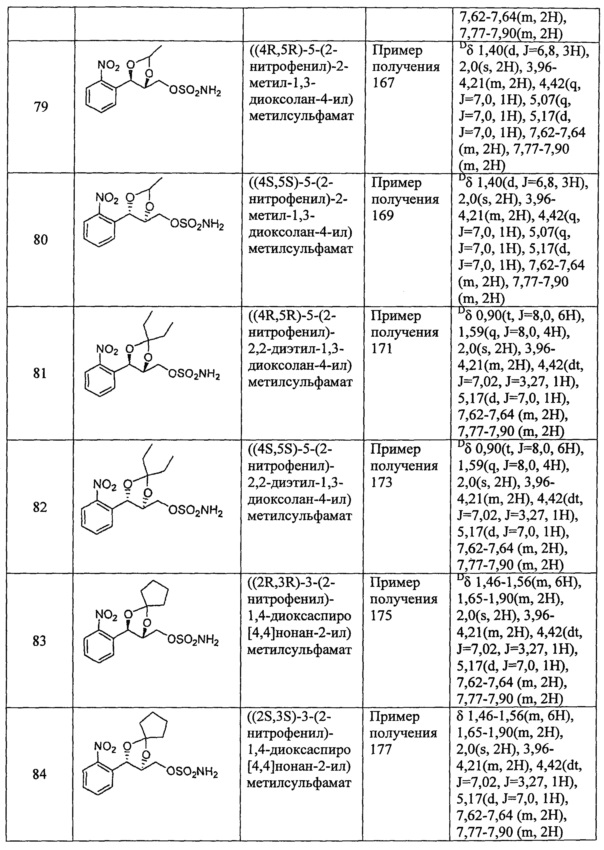
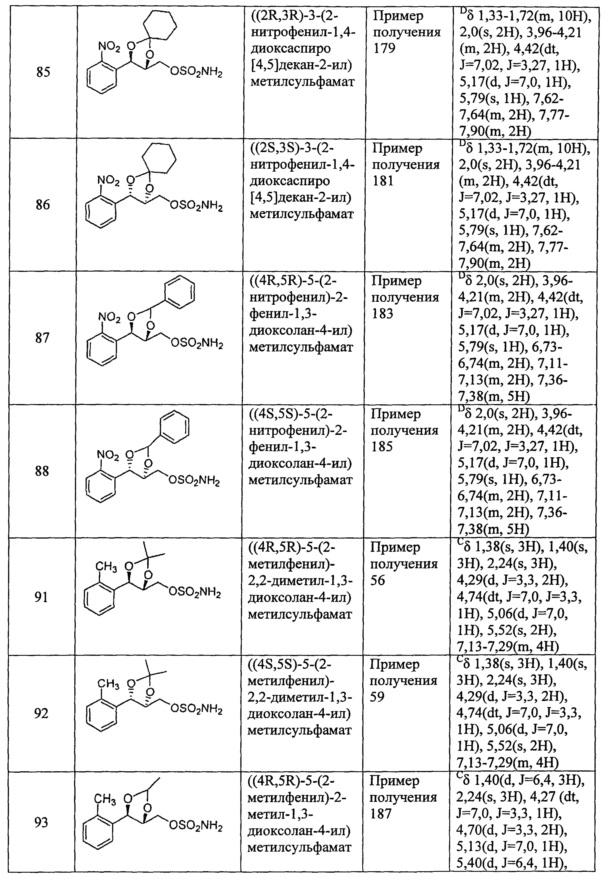
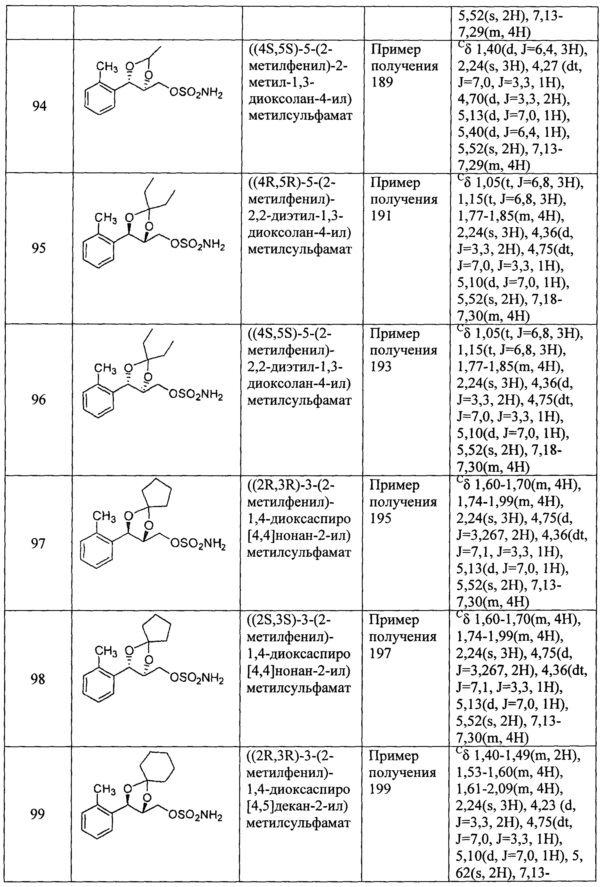
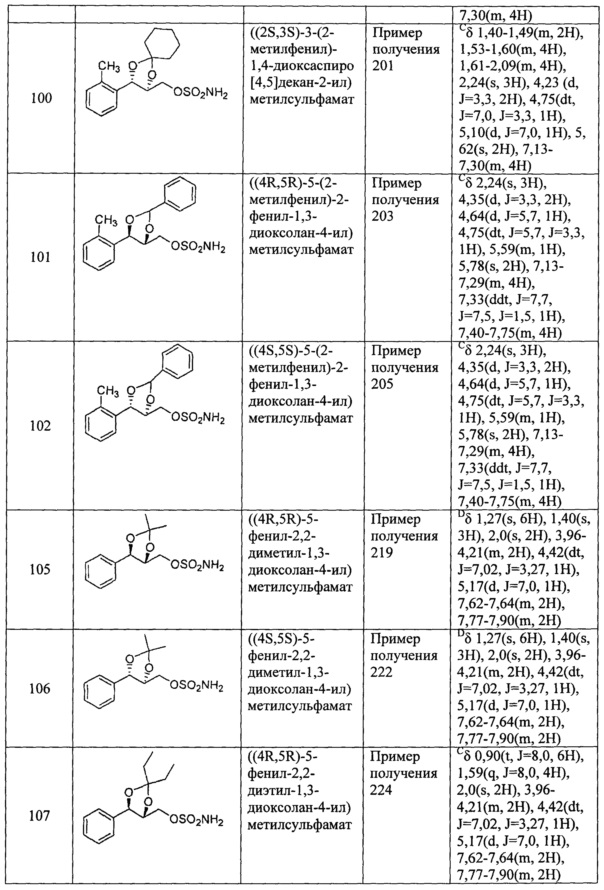
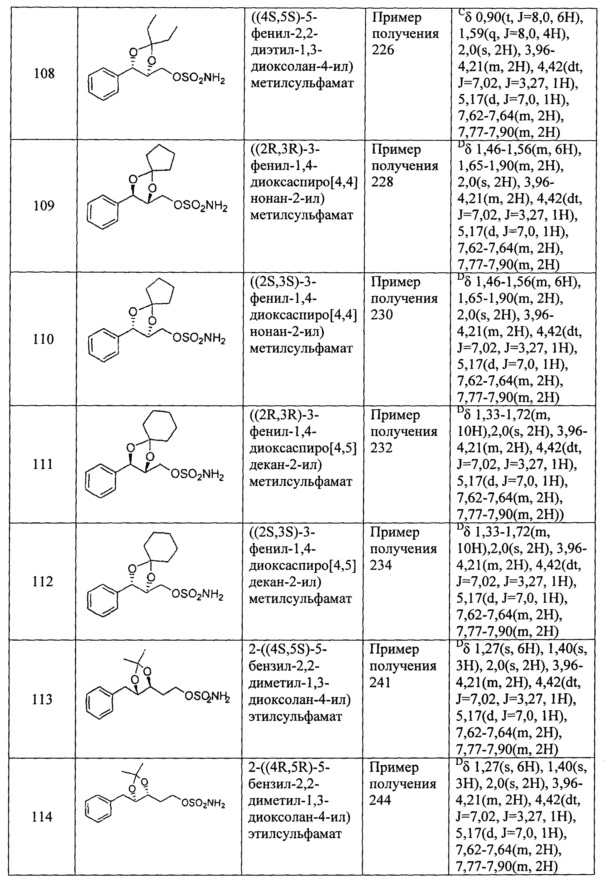
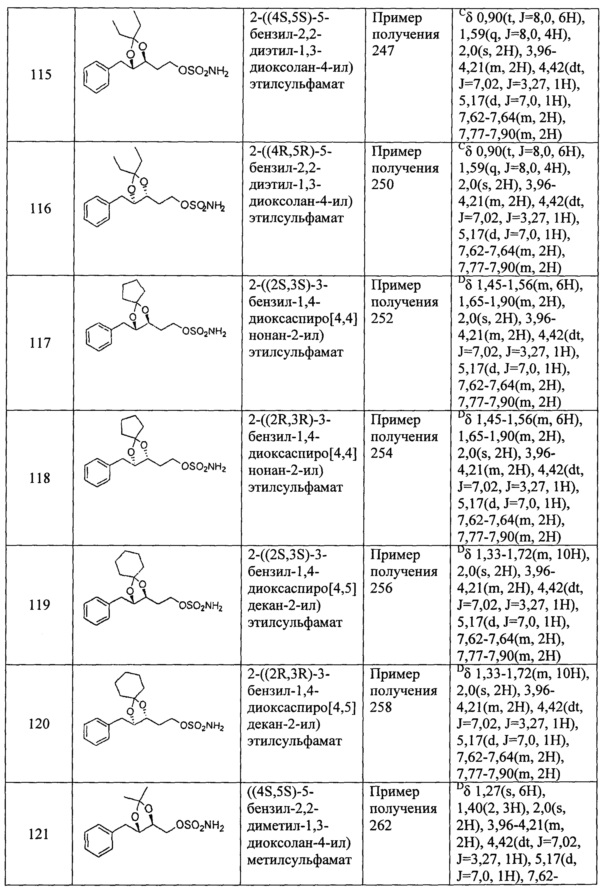
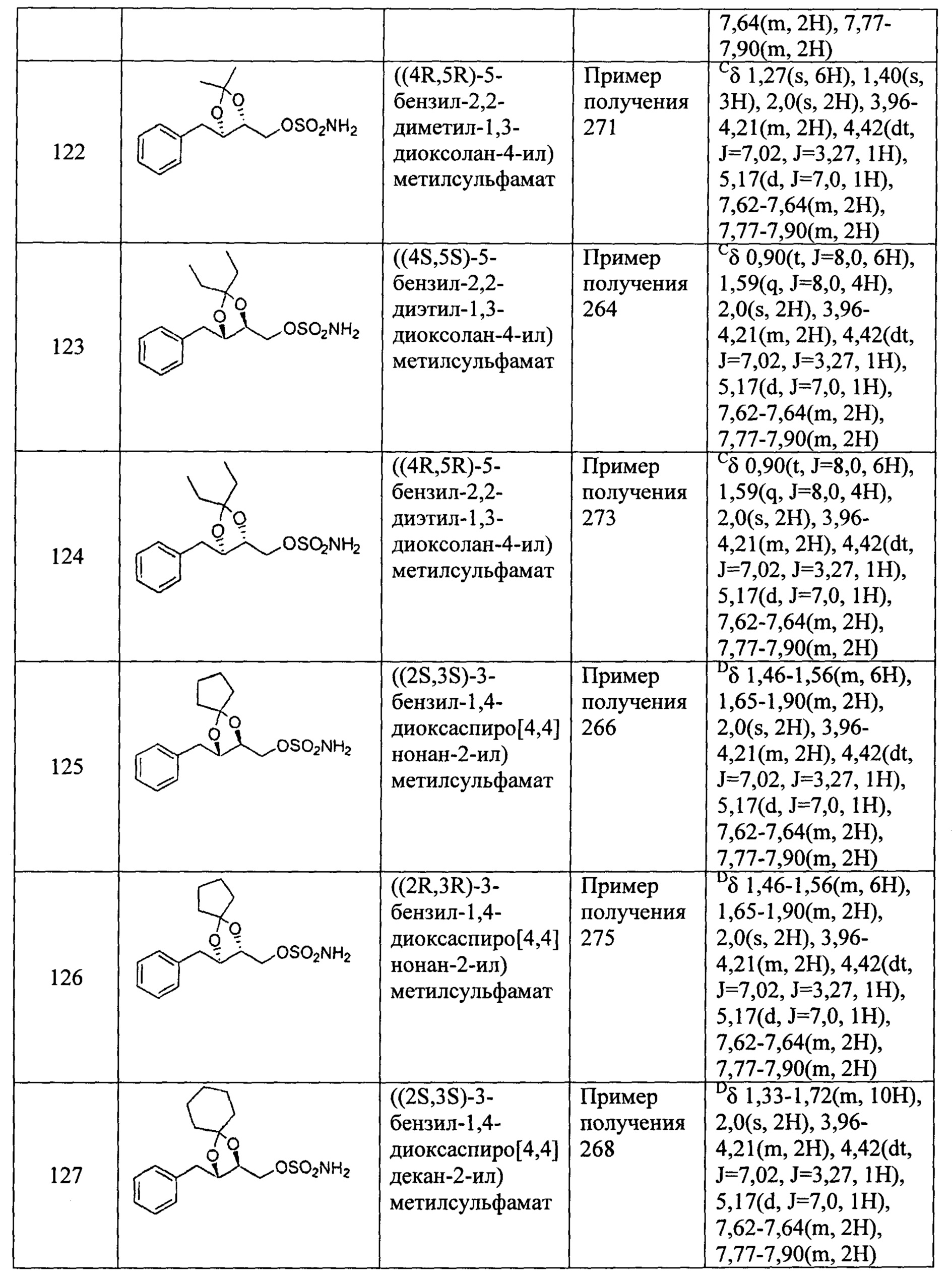
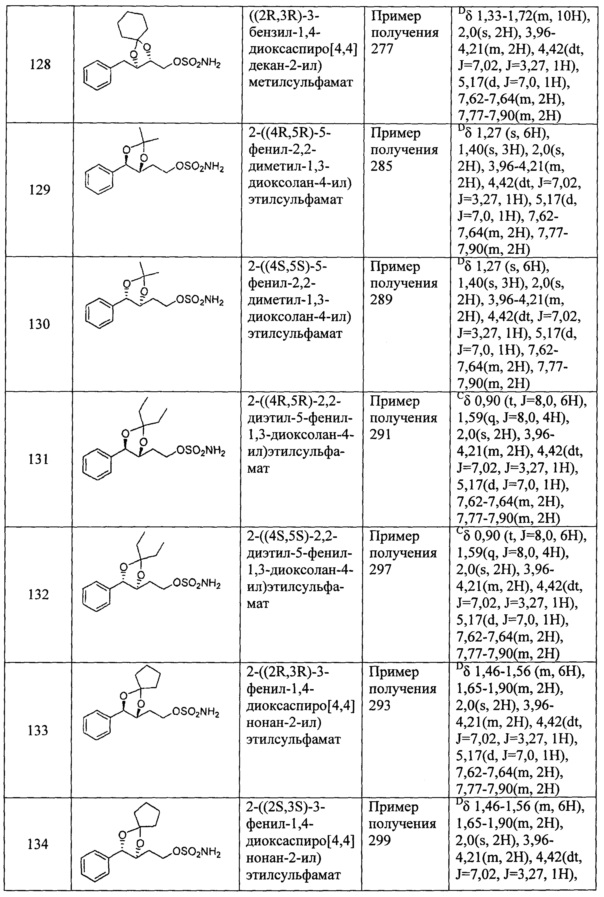
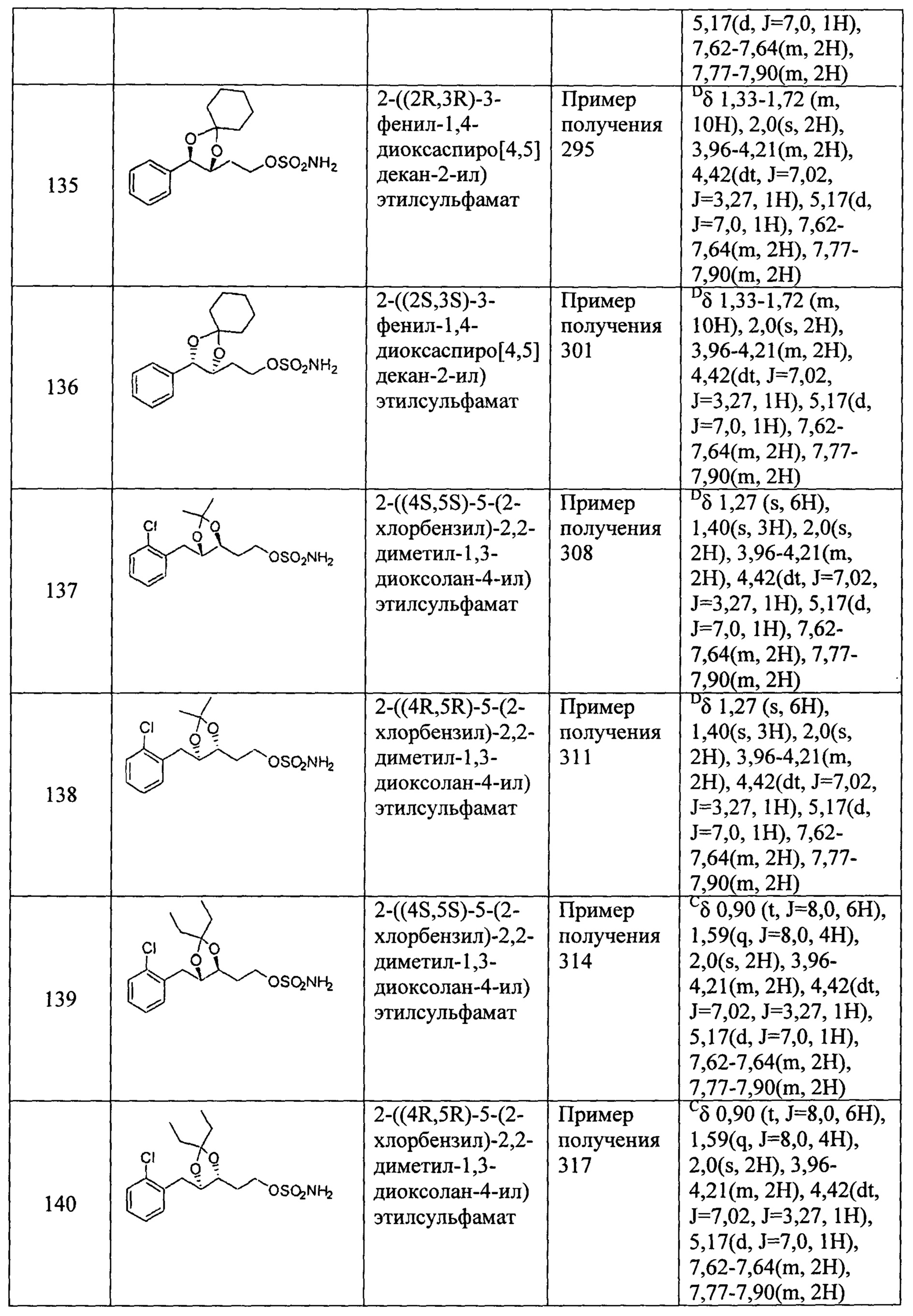
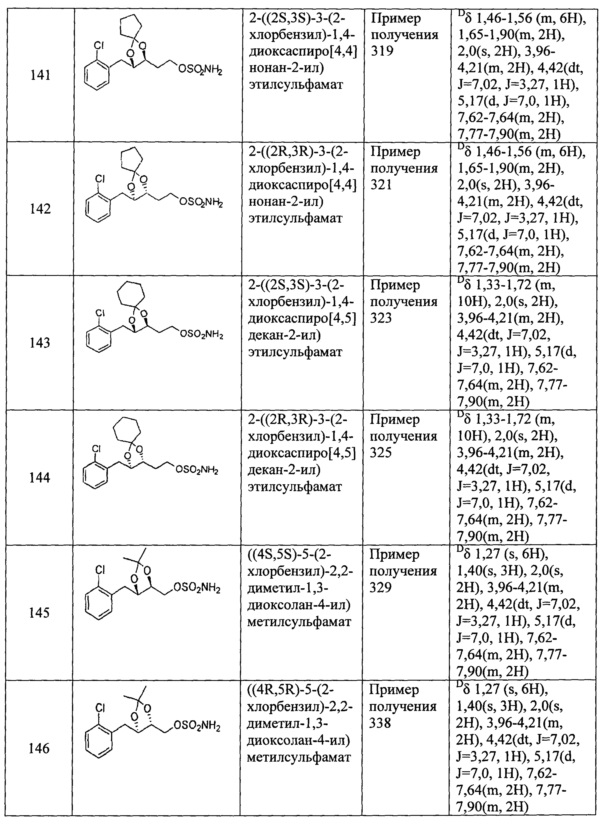
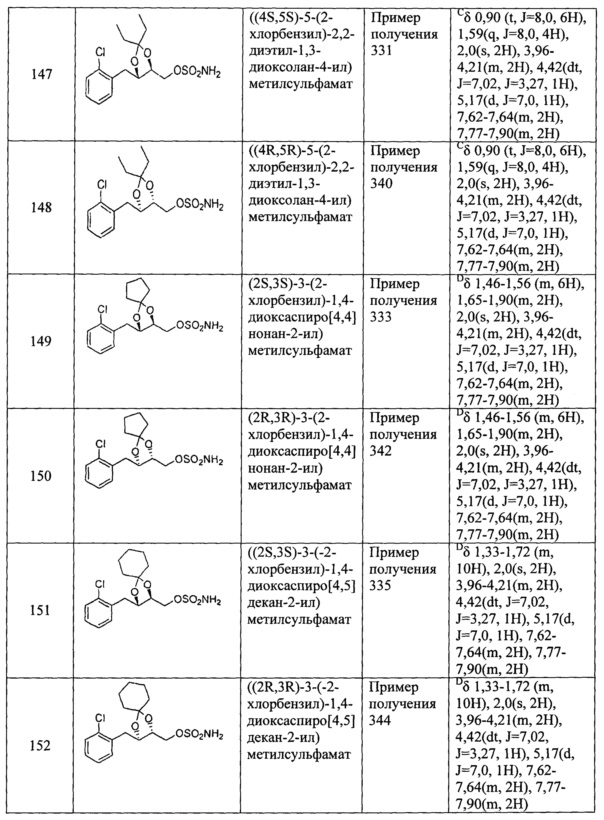
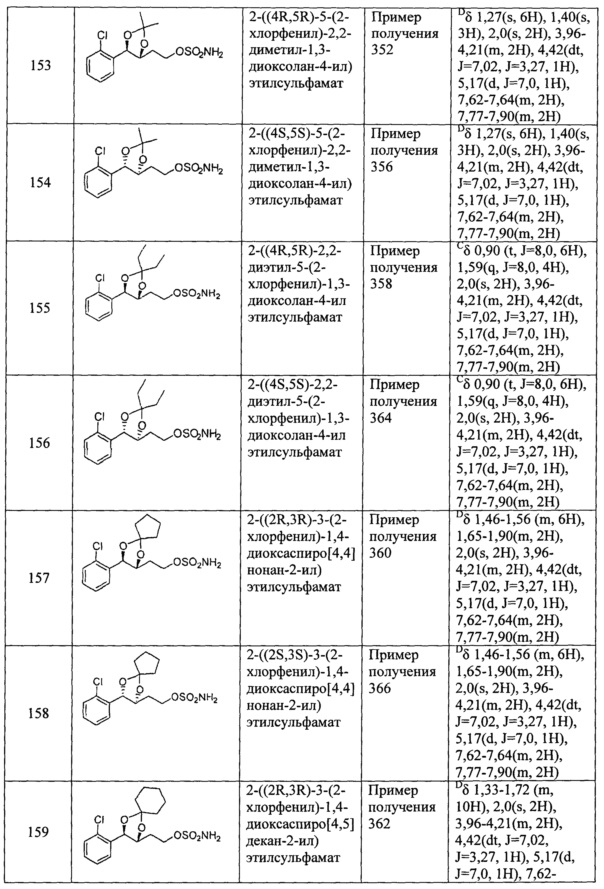
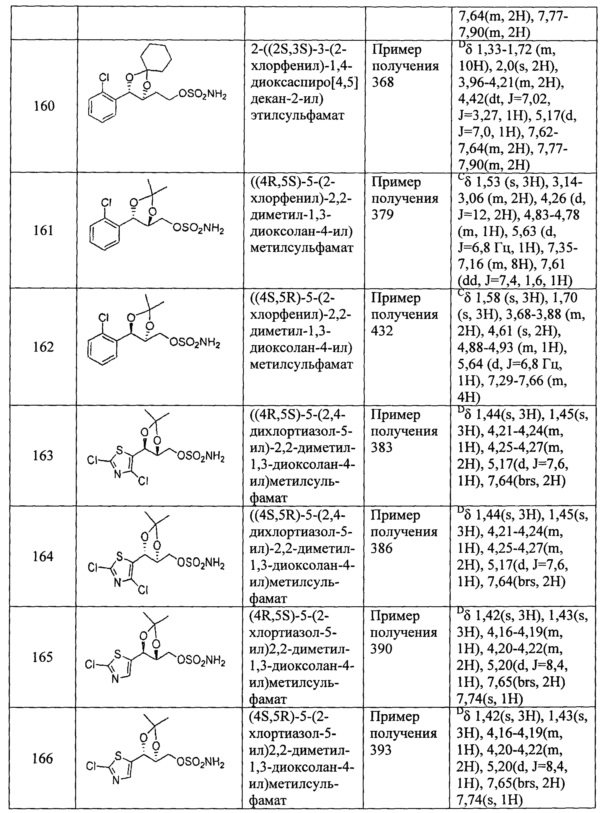
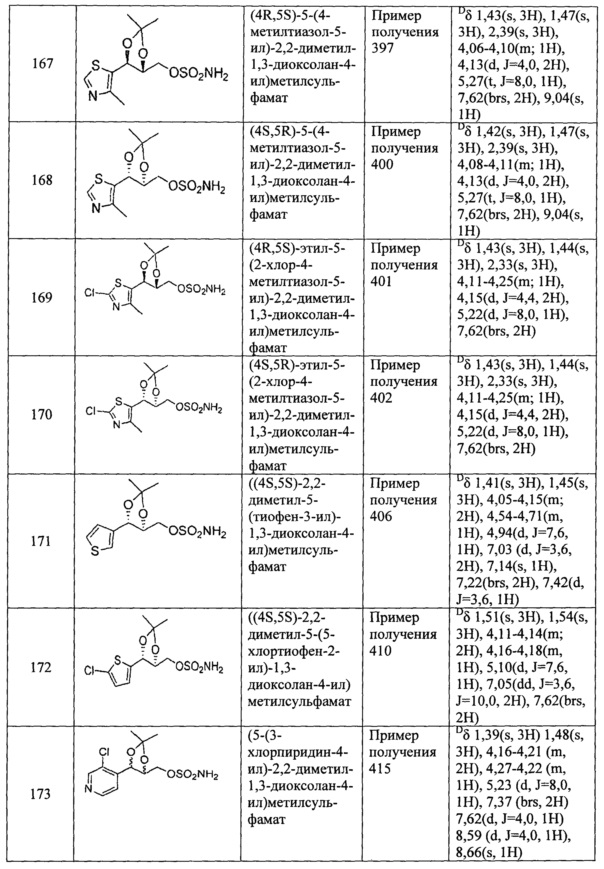
Пример 65: ((((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфонил)амид натрия
К перемешиваемому раствору ((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 63, 5,5 г) в дистиллированной воде (55 мл) добавляли 1N NaOH (23 мл), а затем нагревали. Через 30 минут полученную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Неочищенный продукт в ЕА (этилацетат, 16,5 мл) медленно добавляли к эфиру (200 мл) при низкой температуре. Осадок отфильтровывали, промывали гексаном и осушали под вакуумом для получения целевого соединения (4,7 г, 65-85%)
1Н ЯМР (400 МГц, ДМСО) δ 1,42 (s, 3Н), 1,46 (s, 3Н), 3,79-3,81 (m, 211), 3,99-4,00 (m, 1Н), 4,94 (d, J=8,4, 1Н), 6,59-7,16 (m, 4Н).
Пример 66: ((((4S,5S)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфонил)амид натрия
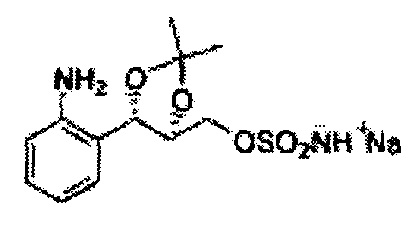
Осуществляли по существу такой же способ, какой описан в Примере 65, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат (Пример 64) вместо ((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 63) (4,23 г, 65-85%).
1Н ЯМР(400 МГц, ДМСО) δ 1,42 (s, 3Н), 1,46 (s, 3Н), 3,79-3,81 (m, 2Н), 3,99-4.00 (m, 1Н), 4,94 (d, J=8,4, 1Н), 6,59-7;16 (m, 4Н).
Пример 89: ((4R,5R)-5-(2-нитрофенил)-2-охо-1,3-диоксолан-4-ил)металсульфамат
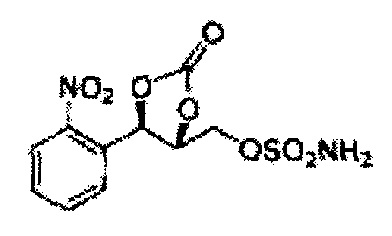
К перемешиваемому раствору ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 77, 5,2 г, 16 ммоль) в EtOAc (50 мл) добавляли 3N HCl (24,6 мл, 80.0 ммоль) при комнатной температуре. Указанную смесь перемешивали в течение 5 часов. Полученную смесь разбавляли EtOAc, промывали насыщенным. NaHCO3, осушали над MgSO4, отфильтровывали, и концентрировали при пониженном давлении. Неочищенный продукт перемешивали в ТГФ (35 мл) добавляли СДИ (2,91 г, 17,9 ммоль) при комнатной температуре. Указанную смесь перемешивали для 1Н. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на солонке с SiO2 для получения целевого соединения (2,6 г, 60-80%)
1Н ЯМР (400 МГц, CDCl3) δ 2,0 (s, 2Н), 4,08-4,33 (m, 2Н), 4,72 (dt, J=7,02, J=3,27, 1Н), 5,47 (d, J=7,0, 1Н), 7,62-7,64 (m, 2Н), 7,77-7,90 (m, 2Н)
Пример 90: ((4S,5S)-5-(2-нитрофенил)-2-оксо-1,3-диоксолан-4-ил)метилсульфамат
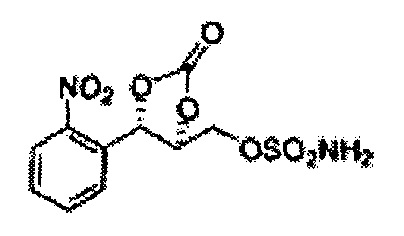
Осуществляли по существу такой же способ, какой описан в Примере 89, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-нитрофенил)-2,2-диметил-4,3-диоксолан-4-ил)метилсульфамат(Пример 78) вместо ((4R,5R)-5-(2-нитрофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 77) (0,9 г, 50-80)
1Н ЯМР(400 МГц, CDCl3) δ 2,0 (s, 2Н), 4,08-4,33 (m, 2Н), 4,72 (dt, J=7,02, J=3,27, 1Н), 5,47 (d, J=7,0, 1Н), 7,62-7,64 (m, 2Н), 7,77-7,90 (m, 2Н),
Пример 103: ((4R,5R)-5-(2-метиламинофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилметилсульфамат
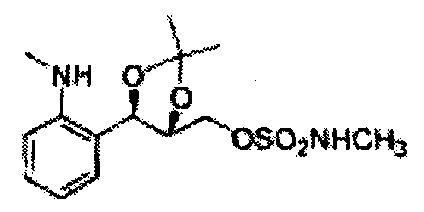
К перемешиваемому раствору ((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 63, 0,68 г, 2,25 ммоль) и бензотриазола (0,27 г, 2,25 ммоль) в EtOH (10 мл) медленно добавляли формальдегид (10 вес. % в Н2О, 0,62 мл, 2,25 ммоль) и NaBH4 (0,085 г, 2,25 ммоль) при 0°С. Полученную смесь разбавляли EtOAc, промывали водой, осушали над MgSO4, отфильтровывали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на солонке с SiO2 для получения целевого соединения (0,3 г, 30-50%)
1Н ЯМР(400 МГц, CDCl3): δ 1,40 (s, 6Н), 2,62 (s, 3Н), 2,96 (s, 3Н), 4,25 (dt, J=7,0, J=3,3, 1H), 4,75 (d, J=3,3, 2H), 4,84 (d, J=7,0, 1H), 6,99-7,20 (m, 4H)
Пример 104: ((4S,5S)-5-(2-метиламинофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилметилсульфамат
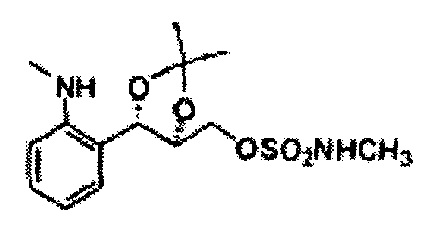
Осуществляли по существу такой же способ, какой описан в Примере 103, за исключением того, что для получения целевого соединения использовали ((4S,5S)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамат (Пример 64) вместо ((4R,5R)-5-(2-аминофенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 63) (0,5 г, 50-80%)
1H ЯМР (400 МГц, CDCl3) δ 1,40 (s, 6Н), 2,62 (s, 3Н), 2,96 (s, 3Н), 4,25 (dt, J=7,0, J=3,3, 1H), 4,75 (d, J=3,3, 2H), 4,84 (d, J=7,0, 1H), 6,99-7,20 (m, 4H)
Пример 177: ((((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метокси)сульфонил)амид натрия
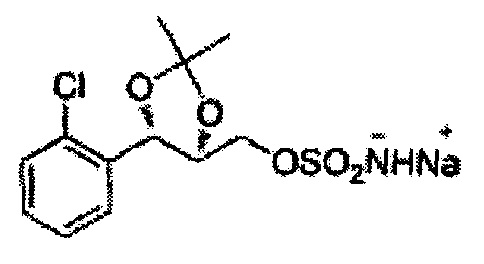
К перемешиваемому раствору ((4S,5S)-5-(2-хлорфенил)-2,2-диметил-1,3-диоксолан-4-ил)метилсульфамата (Пример 2, 5,0 г, 15,5 ммоль) в смеси МТБЭ и изопропилового спирта (50 мл, 3:1, об/об) добавляли 6N водный раствор NaOH (2,5 мл, 14,2 ммоль) при комнатной температуре, затем перемешивали в течение 1 часа при 0°С. Из полученной смеси удаляли растворитель. К концентрированному остатку добавляли смесь H2O и изопропилового спирта (15 мл, 1:2, об/об) при комнатной температуре, затем перемешивали в течение 30 минут. В указанную смесь добавляли МТБЭ (75 мл), затем перемешивали в течение 1 часа при 0°С. Твердый продукт отфильтровывали и сушили на воздухе для получения целевого соединения (4,76 г, 70-90%).
Содержание воды.: 1,54%, температуры плавления: первая -67,6-67,7 С, вторая - 126,9 С
1Н ЯМР (400 МГц, ДМСО-d6) δ 1,43 (s, 3Н), 1,50 (s, 3H), 3,77 (dd, J=7,2, 11,2, 1H), 3,87 (dd, J=2,8, 11,2, 1H), 3,99-4,03 (m, 1H), 5,09 (d, J=8,4, 1H), 7,35-7,47 (m, 3Н), 7,61 (dd, J=1,8, 7,4, 1H)
Экспериментальный Пример 1: Оценка антиаллодинической активности на модели воспалительной боли, индуцированной полным адъювантом Фрейнда (Complete Freund's Adjuvant, CFA).
Самцам крыс линии Спраг Доули (200-220 г, Nara Bio, Корея) давали возможность привыкнуть к обстановке перед хирургическим вмешательством в течение 1 недели со свободным доступом к еде и воде в течение всего эксперимента. Поддерживали комнатную температуру и влажность при 24±2°С и 50+10%, соответственно.
Воспалительную боль, индуцированную CFA, вызывали по методике Nagakura и др. (2003) и Gregory P. и др. (2010) с небольшими модификациями. В левую подошву вводили посредством инъекции CFA (Sigma, США) в объеме 100 мл под газовой анестезией изофлураном и NO2 с соотношением потоков 4:4. Крысам из группы плацебо контроля инъецировали 10 мкл солевого раствора, а крысы из группы с наполнителем (несущей средой) были идентичны крысам из модели с инфузией CFA, за исключением того, что им вводили наполнитель.
Оценивали тактильную чувствительность (механическую аллодинию) с использованием мононитей фон Фрея перед и после обработки и использовали пороговое значение отдергивания для животных менее 4 г.Через одну неделю после хирургического вмешательства проверяли животных, которым ввели CFA (n=4-6), животных из плацебо контроля (n=12) и животных, которым ввели наполнитель, (n=17) проверяли на чувствительность с использованием мононитей фон Фрея в 3-х повторах каждое животное. Всех животных помещали в камеру из нержавеющей стали и давали им возможность привыкнуть в течение 30 минут в боксе для экспериментов. Тактильную чувствительность задней лапы с той же стороны измеряли с помощью метода подъема и опускания (Dixon, 1980) с использованием семи мононитей фон Фрея (0,4, 1, 2, 4, 6, 8, и 15 г) в 3-х повторах. За тестом на тактильную чувствительность следовал метод Dixon (Dixon, 1980). 50% значение порогового значения отдергивания лапы рассчитывали с использованием следующей формулы: [Xth]log=[vFr]log+ky, где [vFr] является последнего использованного усилия фон Фрея, k - 0,2249, являющийся средним интервалом (в логарифмических единицах) между мононитями фон Фрея и у является значением, которое зависит от характера ответных отдергиваний (Dixon, 1980). Если животное не отвечало на самое большое усилие нити фон Фрея (15 г), к лапе прикладывали усилие 18,4 г.
Антиаллодинический эффект соединений из Примеров оценивали при дозировке 10, 30 и 60 мг/кг (n=4-6), введенной внутрибрюшинно в объеме 5 мкл/г массы тела в наполнителе 30% (об/об) ПЭГ. Тест проводили во время пиковой эффективности (0,5 часа) после введения соединения.
Рассчитывали относительные значения, сравненные с плацебо контролем (% по отношению к контролю) и показанные в Таблице 4, которая демонстрирует антиаллодинический эффект указанных соединений из Примеров на модели боли, индуцированной CFA, на крысах.




Экспериментальный Пример 2: Оценка антиаллодинической активности на модели Чанга (Chung).
Самцам крыс линии Спраг Доули (200-220 г. Orient Bio, Корея) давали возможность привыкнуть к обстановке перед хирургическим вмешательством в течение 1 недели со свободным доступом к еде и воде в течение всего эксперимента. Поддерживали комнатную температуру и влажность при 24±2°С и 50+10%, соответственно. Невропатическую хирургическую модель (SNL, Spinal nerve ligation, перевязка спинных нервов) получали как описано в Kim и Chung (1992). Вкратце, животных подвергали газовой анестезии изофлураном и NO2 с соотношением потоков 4:4. Левые люмбальные спинные нервы L5 и L6 отделяли и крепко перевязывали шелковой ниткой 4-0. Рану обрабатывали раствором антибиотика гентомицина (4 мг/кг, 4 мкл/г массы тела), и мышцы в ране сшивали с помощью нити Cat Cut Chrom 4/0, а кожу сшивали нитью Dafilon 4/0. Плацебо контроли готовили таким же образом как у животных с открытыми спинными нервами, нервы L5 и L6 не перевязывали. Но контроля с носителем были идентичны в модели SNL за исключением того, что им вводили наполнитель.
Оценивали тактильную чувствительность (механическую аллодинию) с использованием мононитей фон Фрея перед и после обработки и использовали пороговое значение отдергивания для животных менее 4 г. Через одну неделю после хирургического вмешательства проверяли животных, которым ввели CFA (n=4-6), животных из плацебо контроля (n=4-10) и животных, которым ввели наполнитель, (n=4-13) проверяли на чувствительность с использованием мононитей фон Фрея в 3-х повторах каждое животное. Всех животных помещали в камеру из нержавеющей стали и давали им возможность привыкнуть в течение 30 минут в боксе для экспериментов. Тактильную чувствительность задней лапы с той же стороны измеряли с помощью метода подъема и опускания (Dixon, 1980) с использованием семи мононитей фон Фрея (0,4, 1, 2, 4, 6, 8, и 15 г) в 3-х повторах. За тестом на тактильную чувствительность следовал метод Dixon (Dixon, 1980). 50% значение порогового значения отдергивания лапы рассчитывали с использованием следующей формулы: [Xth]log=[vFr]log+ky, где [vFr] является последнего использованного усилия фон Фрея, k - 0,2249, являющийся средним интервалом (в логарифмических единицах) между мононитями фон Фрея и у является значением, которое зависит от характера ответных отдергиваний (Dixon, 1980). Если животное не отвечало на самое большое усилие нити фон Фрея (15 г), к лапе прикладывали усилие 18,4 г.
Всех животных не кормили 18 часов перед введением соединений. Антиаллодинический эффект соединений из Примеров оценивали при различной дозировке (n=5-6), введенной орально в объеме 5 мкл/г массы тела в наполнителе 30% (об/об) ПЭГ 400 или 20% (об/об) Твин 80 или солевого раствора. Тест проводили во время пиковой эффективности (1 час) после введения соединения.
Рассчитывали относительные значения, сравненные с плацебо контролем (% по отношению к контролю), показанные в Таблице 5, которая демонстрирует антиаллодинический эффект указанных соединений из Примеров на модели боли SNL на крысах.
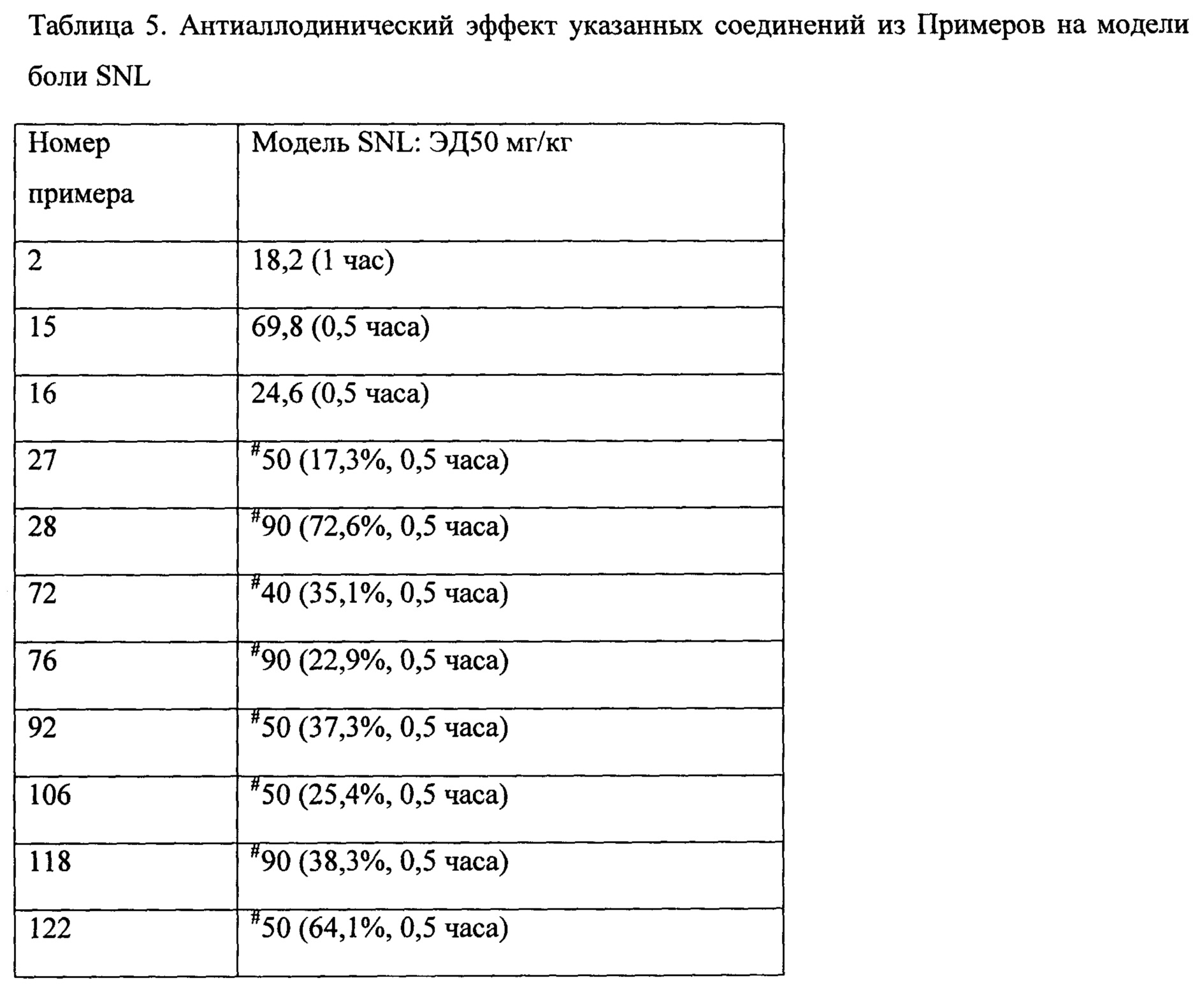
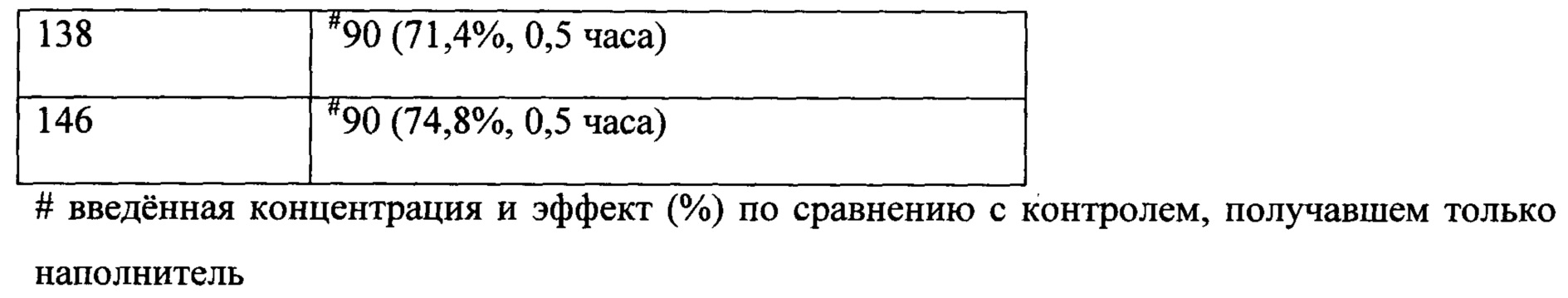
Экспериментальный Пример 3: Тест корчей
Для изучения эффекта ослабления боли соединениями - производными сульфамата проводили тест корчей в модели общей боли на животных со ссылкой на Fischer, L.G. и др. (2008).
Мышах ICR (самцы, 24-28 г; Orient Bio, Корея) давали возможность привыкнуть к обстановке перед тестом в течение 1 часа. Животных не кормили 2 часа перед введением соединений. Соединения вводили орально при дозировке 20 мг/кг, 10 мкл/г массы тела (n=3-5/на группу). Все соединения растворяли в носителе 30% (об/об) PEG 400 или 20% (об/об) Твин 80. Контрольную группу обрабатывали носителем без соединений.
Через 1 час после введения соединений в мышей инъецировали 0,6% уксусную кислоту в дозировке 10 мкл/г массы тела. Животным давали возможность привыкнуть к обстановке в клетке в течение 5 минут. Через 5 минут после привыкания подсчитывали количество корчей (внутрибрюшинных спазмов) в течение 15 минут со ссылкой на Korzeniewska-Rybicka, I. и др. (1998) и сравнивали с контролем.
Рассчитывали относительные значения, сравненные с контролем (% по отношению к контролю), показанные в Таблице 6


Экспериментальный Пример 4: Оценка антиаллодинической активности на модели боли, индуцированной оперативным вмешательством.
Использовали самцов крыс линии Спраг Доули (Orient Bio, Корея) весом 300-320 г общей численностью 201 крыса (подробности в Таблице 7). Крысам давали привыкнуть к обстановке в течение по меньшей мере 3-х дней до хирургии со свободным доступом к еде и воде. Поддерживали комнатную температуру и влажность при 24±2°С и 50+10%, соответственно. Применяли способ хирургии модели боли, индуцированной оперативным вмешательством, описанный Brennan и др. (1996). Сначала крыс с аллодинией (пороговое значение меньше 8 г) исключали из предварительного теста фон Фрея. В ходе постоперационной хирургии крыс подвергали анестезии посредством газовой анестезии с 2% изофлюраном. Крыс укладывали мордой вниз на пластинку с постоянной температурой 37°С для предотвращения гипотермии. Ипсилатеральную плоскую поверхность (левая сторона) задней лапы подготавливали для создания стерильных условиях 10% раствором повидона и йода. Делали продольное рассечение (1 см) (Фиг. 2-А) ножом (номер 11) через кожу и оболочку мышц ипсилатеральной плоской поверхности (левая сторона) задней лапы, начиная от 0,5 см ниже проксимального края пятки и продолжая по направлению к пальцам. Плантарные мышцы крысы приподнимали и рассекали в продольном направлении (Фиг. 2-В). После остановки кровотечения посредством мягкого надавливания кожу сшивали 2-мя матрасными швами (4-0 Dafilon) (Фиг. 2-С). Место раны накрывали марлей с 10% раствором повидона с йодом и делали инъекцию антибиотика (гентамицин, 8 мг/кг, внутрибрюшинно). Швы удаляли под анестезией галотана приблизительно через 30 часов, в конце послеоперационного дня 1.
Через 2-3 дня восстановления крыс с хорошим ответом (пороговое значение менее 4 г) отбирали для предварительного теста фон Фрея. Согласно этому ответу были сформированы три группы, где у каждой группы были одинаковые средние ответы:
Группа 1, после операции, получавшие лекарство; Группа 2, после операции, получавшие носитель; Группа 3, не после операции, получавшие носитель. В этом исследовании Группа 3 была группой плацебо (положительного) контроля. Группу 2 использовали для проверки возможной неудачи с общей пост-операционной болью.
Для измерения эффективности пороговому значению группы С присваивали значение 100% эффективности, и эффективности рассчитывали в виде процента пороговых значений группы А по сравнению с группой С (для каждого отличного уровня дозы). На основании этих значений эффективности рассчитывали ЭД50 с использованием логарифмического приближения. Если не получали четкое значение ЭД50, отмечали процент эффективности при наивысшей испытанной дозе или дозе большей, чем самая высокая испытанная доза.
Для теста пороговой боли всех животных помещали в камеру из нержавеющей стали и давали им возможность привыкнуть в течение 30 минут в боксе для экспериментов. Тактильную чувствительность задней лапы с той же стороны измеряли с помощью метода подъема и опускания (Dixon, 1980) с использованием семи мононитей фон Фрея (0,4, 1, 2, 4, 6, 8, и 15 г) в 3-х повторах, 50% значение порогового значения отдергивания лапы рассчитывали с использованием следующей формулы: [Xth]log=[vFr]log+ky, где [vFr] является последнего использованного усилия фон Фрея, k - 0,2249, являющийся средним интервалом (в логарифмических единицах) между мононитями фон Фрея и у является значением, которое зависит от характера ответных отдергиваний (Dixon, 1980). Если животное не отвечало на самое большое усилие нити фон Фрея (15 г), к лапе прикладывали усилие 18,4 г.
Препараты растворяли в 30% PEG400 для примера 2, в 0,9% физиологическом растворе для Прегабалина, в, 20% Tween 80 для Тайленола, в 0,9% солевом растворе для Топирамата. Эти носители были выбраны в зависимости от растворимости соединений. Делали внутрибрюшинные инъекции (5 мкл/г) для всех препаратов.
Рассчитывали относительные значения по сравнению с плацебо (% контроля), показанные в Таблице 8, которые показывают антиаллодинический эффект указанных соединений из Примеров в модели боли, индуцированной оперативным вмешательством, на крысах.
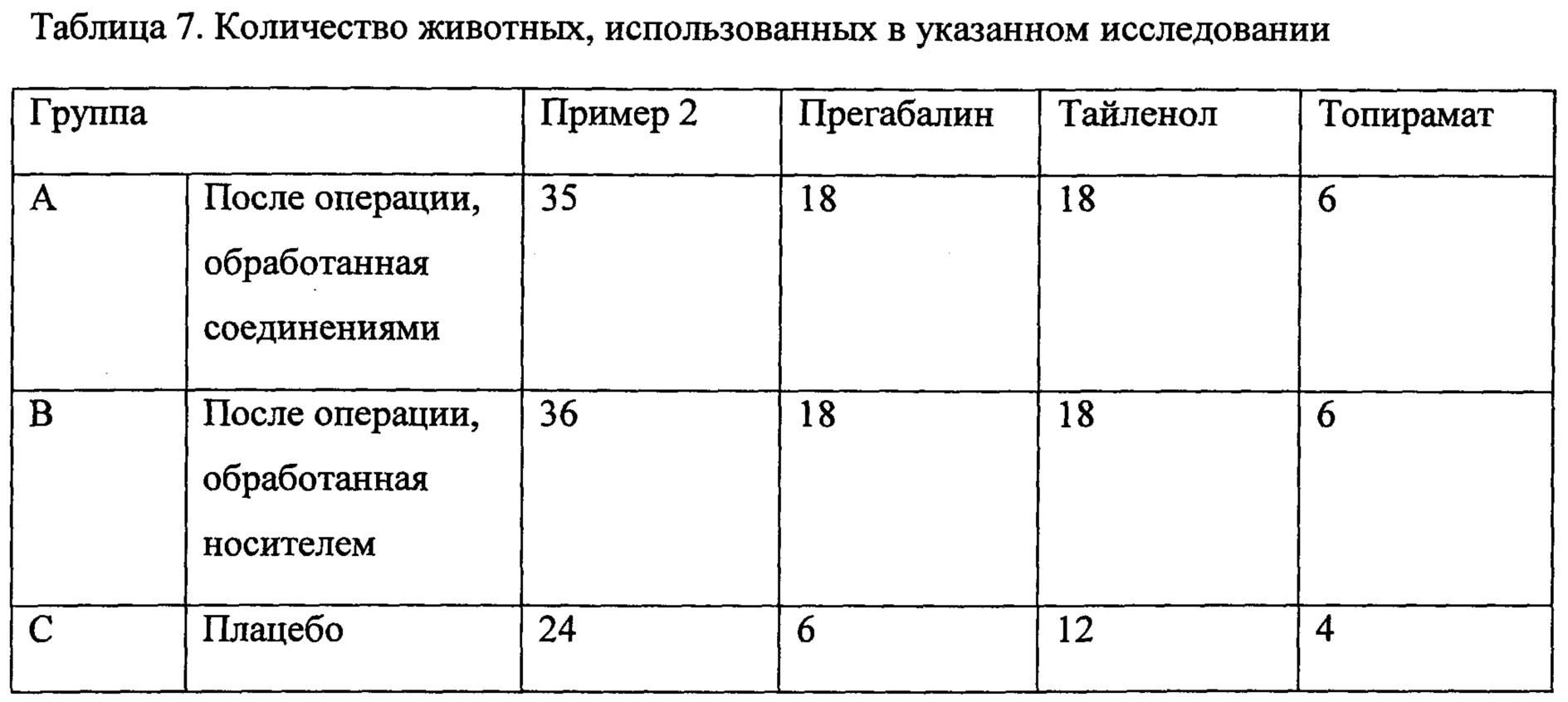
Полный экспериментальный график изображен на Фиг.1 и более подробные процедуры описаны в следующих разделах.

Экспериментальный Пример 5: Оценка антиаллодинической активности на модели диабетической боли, индуцированной стрептозотоцином (STZ).
Самцам крыс линии Спраг Доули (200-220 г, Nara Bio, Корея) давали возможность привыкнуть к обстановке перед хирургическим вмешательством в течение 1 недели со свободным доступом к еде и воде в течение всего эксперимента. Поддерживали комнатную температуру и влажность при 24±2°С и 50+10%, соответственно.
Использовали модель диабетической боли, индуцированной STZ, в соответствии с модифицированным методом Rakieten и др. (1963) и Bertrtand Aubel и др. (2004). Всех животных не кормили в течение от 4 до 6 часов перед инъекцией STZ. STZ (Sigma, США) растворяли в 20 мМ натрий-цитратном буфере, pH 5,5 (Sigma, США) и вводили крысам внутрибрюшинно при дозировке 75 мг/кг, 4 мкл/г массы тела. Крысам из плацебо контроля вводили такой же объем 20 мМ натрий-цитратного буфера, pH 5,5 а контроль с носителем был идентичен модели STZ, за исключением того, что вводили носитель. Крысы получали воду с 10% сахарозой в течение 2 дней с последующей внезапной гипогликемией. Спустя 3 дня индукцию диабета проверяли посредством измерения уровня глюкозы в крови из хвостовой вены с помощью глюкозометра (Life Scan One Touch Ultra, США). Если уровень глюкозы в крови был не больше 300 мг/дл чрез 72 часов, таких крыс исключали из диабетической группы.
Оценивали тактильную чувствительность (механическую аллодинию) с использованием мононитей фон Фрея перед и после обработки и использовали пороговое значение отдергивания для животных менее 4 г. Через одну неделю после хирургического вмешательства проверяли животных с диабетом (n=6), животных из плацебо контроля (n=12) и животных, которым ввели наполнитель, (n=18) проверяли на чувствительность с использованием мононитей фон Фрея в 3-х повторах каждое животное. Всех животных помещали в камеру из нержавеющей стали и давали им возможность привыкнуть в течение 30 минут в боксе для экспериментов. Тактильную чувствительность задней лапы с той же стороны измеряли с помощью метода подъема и опускания (Dixon, 1980) с использованием семи мононитей фон Фрея (0,4, 1, 2, 4, 6, 8, и 15 г) в 3-х повторах. За тестом на тактильную чувствительность следовал метод Dixon (Dixon, 1980). 50% значение порогового значения отдергивания лапы рассчитывали с использованием следующей формулы: [Xth]log=[vFr]log+ky, где [vFr] является последнего использованного усилия фон Фрея, k - 0,2249, являющийся средним интервалом (в логарифмических единицах) между мононитями фон Фрея и у является значением, которое зависит от характера ответных отдергиваний (Dixon, 1980). Если животное не отвечало на самое большое усилие нити фон Фрея (15 г), к лапе прикладывали усилие 18,4 г.
Антиаллодинический эффект соединений из Примеров оценивали при дозировке 10, 30 и 60 мг/кг (n=6), введенной внутрибрюшинно в объеме 5 мкл/г массы тела в наполнителе 30% (об/об) ПЭГ. Тест проводили во время пиковой эффективности (0,5 часа) после введения соединения.
Рассчитывали относительные значения, сравненные с плацебо контролем (% по отношению к контролю) и показанные в Таблице 9, которая демонстрирует антиаллодинический эффект указанных соединений из Примеров на модели боли, индуцированной STZ, на крысах.

Экспериментальный Пример 6: Тест с горячей пластиной
Для проверки обезболивающего эффекта производных сульфамата проводили тест с горячей пластиной в общей модели боли на животных со ссылкой на Current Protocols in Neuroscience; Behavioral Neuroscience Unit 8,9.
Мышам ICR (самцы, 30-35 г.Orient Bio, Корея) давали возможность привыкнуть к обстановке перед тестом в течение 1 часа. Животных не кормили 2 часа перед введением соединений. Соединения вводили орально в дозировке 150 мг/кг, 10 мкл/г массы тела (группа n=7-10). Все соединения растворяли в носителе 30% (об/об) ПЭГ 400 или 20% (об/об) Твин 80. Контрольная группа получала носитель без соединений.
Через 0,5 часа после введения соединений мышей помещали на горячую пластину предварительно нагретую до 55±1°С (Hu, X. и др., 2008), а затем измеряли время задержки отдергивания (время отключения: 30 сек) до того момента, когда каждая мышь убирала лапу от пластины, встряхивалась, лизала лапу или заднюю ногу, или отпрыгивала от пластины. Относительные величины, рассчитанные по сравнению с контрольной, (% контроля) показаны в Таблице 10.


Экспериментальный Пример 7: Оценка антиаллодинической активности на модели боли, индуцированной винкристином.
Самцам крыс линии Спраг Доули (300-320 г, Nara Bio, Корея) давали возможность привыкнуть к обстановке перед хирургическим вмешательством в течение 1 недели со свободным доступом к еде и воде в течение всего эксперимента. Поддерживали комнатную температуру и влажность при 24±2°С и 50+10%, соответственно.
Тест с винкристином проводили в соответствии с процедурой Natsuko и др. (2001) с минимальными модификациями. Винкристин вводили посредством внутривенной инфузии непрерывно в течение 14 дней с использованием мини-осмотического насоса следующим образом. Раствор сульфата винкристина (Hospira, Австралия) разбавляли 0,9% физиологическим раствором до 30 мкг/кг в конечной дозе. Насосы (Alzet Model 2002, США) заполняли раствором винкристина и приводили в готовность инкубацией при 37°С в течение 4-х часов перед началом инфузии. Вкратце, животное подвергали газовой анестезии с изофлураном и NO2 с соотношением потоков 4:4. Катетер, изготовленный из ПЭ-60 трубки, вставляли в наружную яремную вену крысы. Плацебо контроль готовили таким же образом, как и с наружной яремной веной, но внешнюю яремную вену не надрезали, а группа, получавшая носитель, была идентична модели с введением винкристина за исключением того, что вводили только носитель.
Оценивали тактильную чувствительность (механическую аллодинию) с использованием мононитей фон Фрея перед и после обработки и использовали пороговое значение отдергивания для животных менее 4 г. Через одну неделю после хирургического вмешательства проверяли животных, которым ввели винкристин (n=6), животных из плацебо контроля (n=12) и животных, которым ввели наполнитель, (n=18) проверяли на чувствительность с использованием мононитей фон Фрея в 3-х повторах каждое животное. Всех животных помещали в камеру из нержавеющей стали и давали им возможность привыкнуть в течение 30 минут в боксе для экспериментов. Тактильную чувствительность задней лапы с той же стороны измеряли с помощью метода подъема и опускания (Dixon, 1980) с использованием семи мононитей фон Фрея (0,4, 1, 2, 4, 6, 8, и 15 г) в 3-х повторах. За тестом на тактильную чувствительность следовал метод Dixon (Dixon, 1980). 50% значение порогового значения отдергивания лапы рассчитывали с использованием следующей формулы: [Xth]log=[vFr]log+ky, где [vFr] является последнего использованного усилия фон Фрея, k - 0,2249, являющийся средним интервалом (в логарифмических единицах) между мононитями фон Фрея и у является значением, которое зависит от характера ответных отдергиваний (Dixon, 1980). Если животное не отвечало на самое большое усилие нити фон Фрея (15 г), к лапе прикладывали усилие 18,4 г.
Антиаллодинический эффект соединений из Примеров оценивали при дозировке 1, 5 и 10 мг/кг (n=6), введенной внутрибрюшинно в объеме 5 мкл/г массы тела в наполнителе 30% (об/об) ПЭГ. Тест проводили во время пиковой эффективности (0,5 часа) после введения соединения.
Рассчитывали относительные значения, сравненные с плацебо контролем (% по отношению к контролю) и показанные в Таблице 11, которая демонстрирует антиаллодинический эффект указанных соединений из Примеров на модели боли, индуцированной винкристином, на крысах.

Экспериментальный Пример 8: Тест с отдергиванием хвоста
Для проверки обезболивающего эффекта производных сульфамата проводили тест с отдергиванием хвоста в общей модели боли на животных со ссылкой на Current Protocols in Neuroscience; Behavioral Neuroscience Unit 8,9.
Мышам ICR (самцы, 30-35 г. Orient Bio, Корея) давали возможность привыкнуть к обстановке перед тестом в течение 1 часа. Животных не кормили 2 часа перед введением соединений. Соединения вводили орально в дозировке 150 мг/кг, 10 мкл/г массы тела (группа n=7-10). Все соединения растворяли в носителе 30% (об/об) ПЭГ 400 или 20% (об/об) Твин 80. Контрольная группа получала носитель без соединений.
После введения соединений хвост мышей помещали в измеритель отдергивания хвоста при аналгезии. Во избежание повреждения тканей, максимальное время воздействия на болевые раздражители ограничивали 15 секундами. Время задержки отдергивания измеряли как время до момента когда каждая мышь отвечала на стимул. Рассчитывали относительные величины по отношению к контролю (% контроля).
Рассчитывали относительные значения по отношению к плацебо, показанные в Таблице 12, которые показывают эффект соединений из Примеров в тесте с отдергиванием хвоста на мышах.

[Статистический анализ]
Полученные результаты приведены в виде средней величины ± среднее квадратичное отклонение. Различие между группами статистически анализировали с помощью ANOVA, и затем, дополнительно проверяли с помощью теста Даннета или теста Бонферрони. Если р было меньше 0,05, определяли, что различие между группами было статистически значимым.