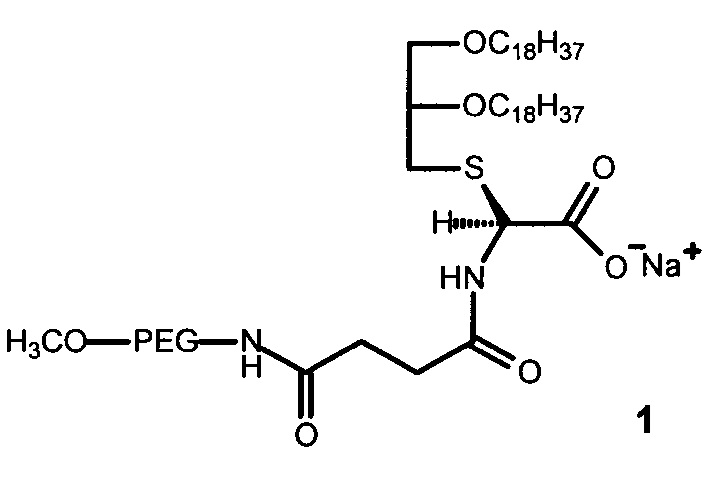
Результат интеллектуальной деятельности: НОВЫЙ ПОЛИЭТИЛЕНГЛИКОЛЬСОДЕРЖАЩИЙ ГЛИЦЕРОЛИПИД
Вид РИД
Изобретение
Изобретение относится к области химии, биотехнологии, медицины и химико-фармацевтической промышленности. Более конкретно, предложены новый полиэтиленгликоль-содержащий глицеролипид определенного строения, конъюгат на его основе с апконвертирующими наночастицами и способ получения такого конъюгата.
Среди разработанных на сегодняшний день липидных производных наиболее широко распространены 1,2-диолеолоил-sn-глицеро-3-фосфоэтаноламин-N-[амино(полиэтиленгликоль)-2000] (аммониевая соль) (DOPE-PEG) и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[амино(полиэтиленгликоль)-2000] (аммониевая соль) (DSPE-PEG), благодаря таким преимуществам, как неиммуногенность, низкая токсичность, возможность крупномасштабного производства [Yang Li et al. Self-Assembled Nanoparticles Based on Amphiphilic Anticancer Drug-Phospholipid Complex for Targeted Drug Delivery and Intracellular Dual-Controlled Release / ACS Applied Materials & Interfaces, 2015, V. 7, N. 32, pp. 17573-17581; Michela Pisani et al. Metal cation induced cubic phase in poly(ethylene glycol)-functionalized dioleoylphosphatidylethanolamine aqueous dispersions / The Journal of Physical Chemistry B, 2008, V. 112, N. 17, pp. 5276-5278].
Однако за счет того, что длиноцепные заместители в 1 и 2 положении DOPE-PEG и DSPE-PEG присоединены через сложноэфирную связь, они быстро расщепляются в организме эстеразами. Кроме того, синтез глицерофосфолипидов отличается более сложной методикой по сравнению с синтезом глицеролипида на основе цистеина вместо фосфорной группы.
Из уровня техники известно, что использование полиэтиленгликоль содержащих липидов приводит к минимизации неспецифического клиренса в тканях ретикулоэндотелиальной системы, что увеличивает время удержания в кровотоке [Mark Kastantin et al. Effect of the Lipid Chain Melting Transition on the Stability of DSPE-PEG (2000) Micelles / Langmuir, 2009, V. 25, N. 13, pp. 7279-7286; Suk J.S. et al. PEGylation as a strategy for improving nanoparticle-based drug and gene delivery / Advanced Drug Delivery Reviews, 2016, V. 99, pp. 28-51]. В некоторых случаях использование полиэтиленгликоля (ПЭГ) уменьшает агрегацию эритроцитов и/или гемолиз [Eliyahu Н. et al. Lipoplex-induced hemagglutination: potential involvement in intravenous gene delivery / Gene therapy, 2002, V. 9, pp. 850-858].
Задача настоящего изобретения состояла в расширении арсенала полиэтиленгликоль-содержащих глицеролипидов, которые, в том числе, могли бы образовывать комплексы с апконвертирующими наночастицами.
Технический результат заключается в получении нового полиэтиленгликоль-содержащего глицеролипида и конъюгата на его основе с апконвертирующими наночастицами. Дополнительно технический результат заключается в придании биосовместимости и в обеспечении солюбилизации гидрофобных апконвертирующих наночастиц в биологических средах, а также в увеличении времени циркуляции в кровотоке.
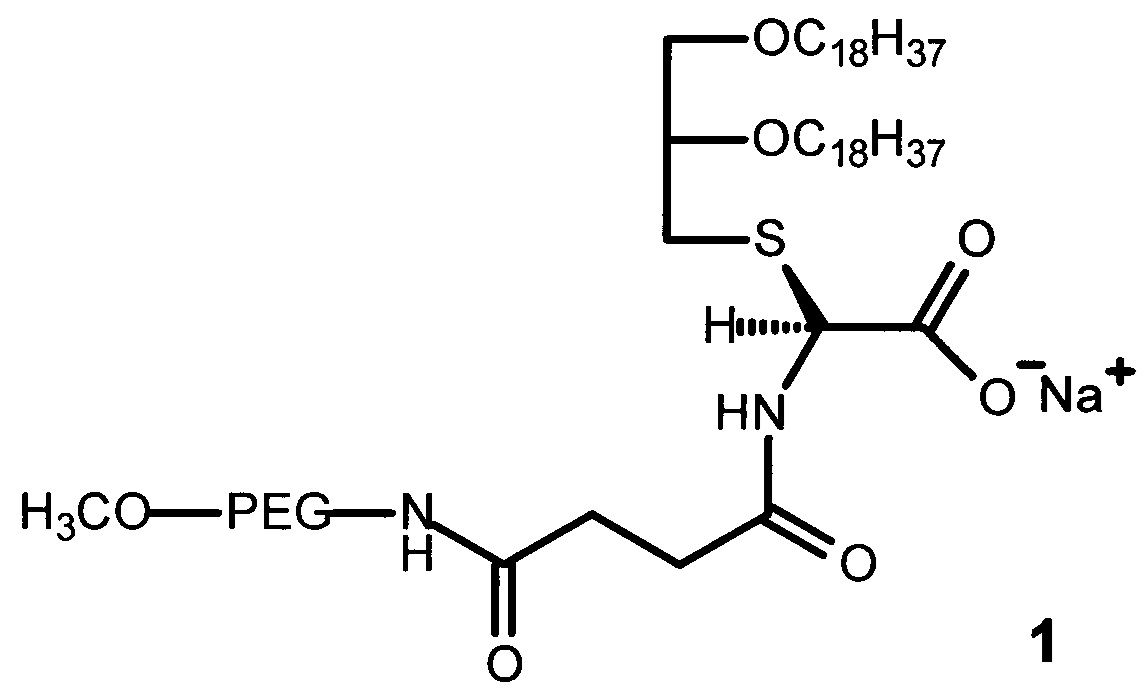
Технический результат достигается ПЭГ-содержащим глицеролипидом, имеющим строение формулы (1):
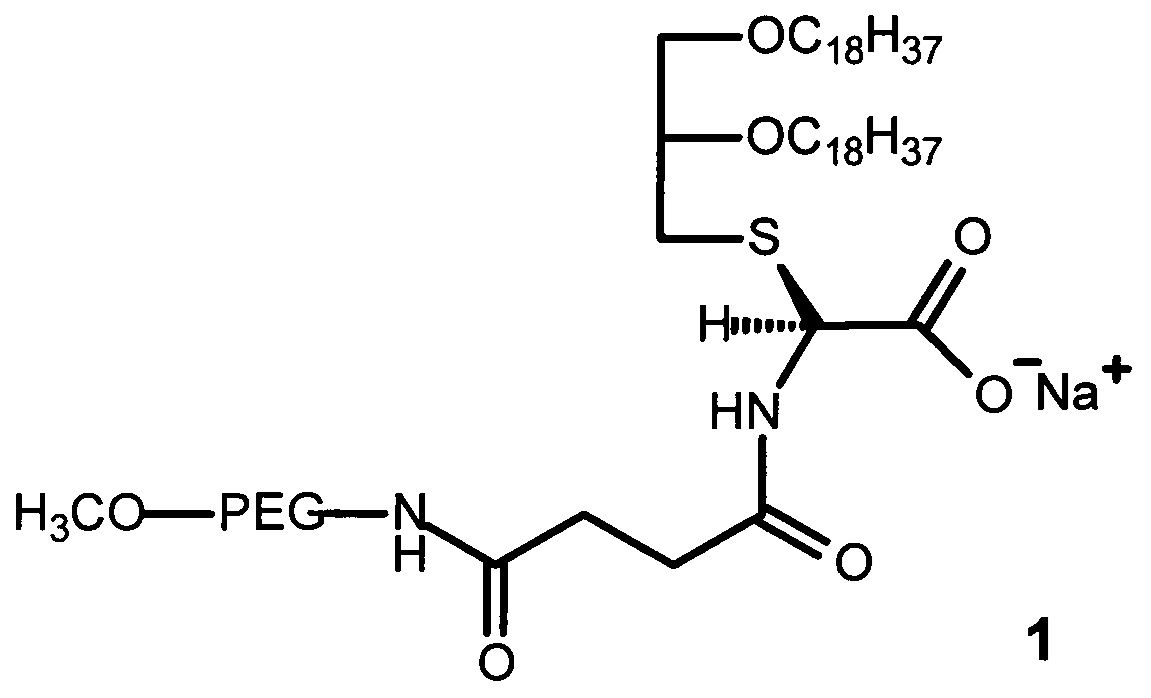
где PEG - цепь полиэтиленгликоля с молекулярной массой от 750 до 2000 Да.
Структура ПЭГ-содержащего глицеролипида (1) включает:
- остаток глицерина с двумя жирными углеводородными хвостами с длиной цепи C18 для взаимодействия с остатками олеиновой кислоты на поверхности апконвертирующих наночастиц с образованием конъюгатов ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами; и
- остаток полиэтиленгликоля различной молекулярной массы (от 750 до 2000 Да), необходимый для солюбилизации гидрофобных апконвертирующих наночастиц в биологических средах и образования устойчивых дисперсий в водных средах, а также для защиты комплексов глицеролипид-апконвертирующие наночастицы от воздействия сыворотки крови и увеличения времени циркуляции в кровотоке.
Для присоединения ПЭГ к глицерину в качестве линкера используют янтарный ангидрид. В качестве аминокислоты использовали цистеин. Заряженная карбоксильная группа в остатке цистеина способствует предотвращению агрегации конъюгатов ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами.
Технический результат также достигается конъюгатом ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4, покрытыми остатками олеиновой кислоты
Кроме того, технический результат достигается способом получения предложенного конъюгата, согласно которому к суспензии апконвертирующих наночастиц в гексане добавляют раствор ПЭГ-содержащего глицеролипида в хлороформе, затем полученную смесь упаривают досуха и сушат в вакууме в течение 1-3 ч.
В качестве исходного соединения в синтезе ПЭГ-содержащего глицеролипида (1) использовали 1,2-изопропилиденглицерин (2), из которого при взаимодействии с бензилбромидом в N,N-диметилформамиде (ДМФА) был получен 1,2-изопропилиден-3-бензилглицерин (3). Удаление изопропилиденовой защиты в условиях кислотного гидролиза приводило к образованию 1-бензилглицерина (4), который в дальнейшем алкилировали октадецилбромидом в присутствии гидрида натрия в ДМФА с образованием 1,2-диоктадецил-3-бензилглицерина (5). Соединение (5) гидрировали в присутствии Pd/C в смеси растворителей тетрагидрофуран/метанол (ТГФ/МеОН), с образованием 1,2-диоктадецилглицерина (6). 1,2-диоктадецилглицерин растворяли в хлористом метилене, добавляли трифенилфосфин и N-бромсукцинимид, в результате получали 1,2-диоктадецил-3-бромглицерин (7) [Wenyan Wu et al. Structure-Activity relationship in Toll-like receptor-2 agonistic diacyithioglycerol lipopeptides / Journal of Medicinal Chemistry, 2010, V. 53, pp. 3198-3213]. Следующим этапом было присоединение аминокислоты к липидной части. В качестве аминокислоты использовали N-Boc-цистеин. Его алкилировали по атому серы с использованием хемоселективной реакции в ДМФА в присутствии триэтиламина и йодида калия, который добавляли в каталитических количествах и использовали как реагент для образования йодпроизводного 1,2-диоктадецилглицерина in situ, с получением соединения (9). Далее Вос-защиту удаляли 4М раствором хлороводорода в метаноле с образованием соединения со свободной аминогруппой (10), которую далее ацилировали янтарным ангидридом. Реакцию проводили в хлороформе в присутствии диизопропилэтиламина в качестве основания. В результате получали продукт со свободной карбоксильной группой (11) с количественным выходом. Для активации карбоксильной группы в соединении (11) для реакции с ПЭГ использовали N-гидроксисукцинимид в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC). На последней стадии проводили присоединение ПЭГ к активированному производному (12) в присутствии диизопропилэтиламина с образованием целевого соединения (1).
Растворители и реагенты Sigma-Aldrich. Хлористый метилен и триэтиламин кипятили над гидридом кальция и перегоняли перед реакцией. Пиридин кипятили над гидроксидом калия и перегоняли перед реакцией.
Колоночную хроматографию осуществляли на силикагеле Silicagel 60 (0,040-0,063 мм и 0,063-0,200 мм, Merck). Обнаружение пятен на хроматограммах проводили раствором фосформолибденовая кислота/церий (IV) сульфат с последующим прогреванием и с помощью УФ-лампы (254 нм).
Спектры 1Н-ЯМР и 13С-ЯМР регистрировали на приборе Bruker DPX 300 с использованием CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги 1Н-ЯМР приведены относительно остаточного сигнала CHCl3 (δН 7.26 м.д.). Химические сдвиги 13С-ЯМР приведены относительно центрального сигнала растворителя (δC 77.0 м.д. для растворов в CDCl3). Масс-спектры были получены на спектрометре Ultraflex II Bruker Daltonics методом MALDI TOF.
Далее осуществляли получение конъюгата ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4. Для этого к суспензии апконвертирующих наночастиц в гексане добавляли раствор ПЭГ-содержащего глицеролипида (1) в хлороформе, затем полученную смесь упаривают досуха и сушат в вакууме в течение 1-3 ч.
Для изучения времени удержания целевого конъюгата ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4 в кровотоке использовали клетки SK-BR-3 и применяли 5% раствор исследуемого конъюгата в 0,9% растворе хлорида натрия. Далее проводилась серия экспериментов на лабораторных животных. Использовали модель черных мышей с введением наркоза золетил-рометара по 0,2 мл внутрибрюшинно, в количестве 3 шт.
Сопоставительный анализ заявляемого соединения с известными и широко используемыми DOPE-PEG и DSPE-PEG показал, что ПЭГ-содержащий глицеролипид (1) обладает следующими преимуществами:
1) увеличение времени удержания заявленного конъюгата ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4 в кровотоке по сравнению с коммерчески доступными прототипами с 15 мин до 30 мин;
2) полученный конъюгат ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4 не требует сложной процедуры приготовления;
3) предлагаемый конъюгат ПЭГ-содержащего глицеролипида с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4 стабилен при хранении как в сухом виде, так и в виде водных формуляций.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез ПЭГ-содержащего глицеролипида (1), молекулярная масса ПЭГ 2000 Да.
К суспензии гидрида натрия (6 г, 0.14 моль) в N,N-диметилформамиде (150 мл) прикапывали 1,2-изопропилиденглицерин (2) (18.1 г, 0.14 моль) в N,N-диметилформамиде (10 мл) в течение 30 мин при охлаждении. Затем в течение 15 мин прикапывали бензилбромид (24 г, 0.14 моль), перемешивали еще 10 мин. Полученный раствор отфильтровывали, упаривали. Осадок соединения (3) растворяли в хлористом метилене (100 мл), промывали водой (50 мл) и упаривали. Остаток перегоняли в вакууме при 0,1 мм.рт.ст. (tкип=90°С). Получили 24.5 г (80%) 1,2-изопропилиден-3-бензилглицерина (3).
К раствору 1,2-изопропилиден-3-бензилглицерина (3) (10 г, 44.8 ммоль) в 80% водном метаноле (20 мл) добавляли смолу Dowex 50wx2 в Н+ форме (2 г) и перемешивали при кипячении 2 часа. Затем раствор отфильтровывали, промывали гексаном (200 мл), осушали над сульфатом натрия и упаривали. Остаток соединения (4) растворяли в хлороформе (30 мл) и выдерживали 2 суток над молекулярными ситами 3А, отфильтровывали, упаривали и сушили в вакууме масляного насоса в течение 3 ч. Получили 7.6 г (92%) 1-бензилглицерина (4).
К раствору 1-бензилглицерина (4) (188 мг, 1.03 ммоль) в N,N-диметилформамиде (5 мл) добавляли гидрид натрия (124 мг, 1.1 ммоль) и перемешивали в течение 15 мин. Затем добавляли октадецилбромид (824 мг, 1.03 ммоль) и перемешивали сутки. Избыток гидрида натрия нейтрализовали метанолом (2 мл). Полученный раствор растворяли в хлористом метилене (50 мл), промывали водой (50 мл). Осушали над сульфатом натрия и упаривали. Продукт очищали методом колоночной хроматографии, элюируя системой гексан/этилацетат. После чего перекристаллизовывали из изопропанола. Получили 319 мг (45%) 1,2-диоктадецил-3-бензилглицерина (5).
К раствору соединения (5) (8 г, 0.012 моль) в смеси ТГФ (100 мл) и метанола (10 мл), добавляли 10%-й палладий на угле (500 мг) и гидрировали при атмосферном давлении до поглощения необходимого объема водорода. Осадок отфильтровывали, раствор упаривали. Остаток растворяли в хлористом метилене (80 мл) и промывали водой (50 мл). Осушали над сульфатом натрия и упаривали. Продукт (6) перекристаллизовывали из гексана. Получили 4.94 г (71%) 1,2-диоктадецилглицерина (6).
К раствору соединения (6) (800 мг, 1.35 ммоль) в хлористом метилене (50 мл) добавляли трифенилфосфин (1.065 г, 4.05 ммоль) и перемешивали при охлаждении 10 мин. Затем при охлаждении к смеси добавляли N-бромсукцинимид (721 мг, 4.05 ммоль) и перемешивали 3 часа при комнатной температуре. Полученное соединение промывали водой (50 мл), осушали над сульфатом натрия и упаривали. От примесей трифенилфосфиноксида соединение (7) очищали переосаждением из гексана. Получили 797 мг (90%) 1,2-диоктадецил-3-бромглицерина (7).
К раствору метилового эфира цистеина (5 г, 29 ммоль) в ТГФ (40 мл) добавляли триэтиламин (5.8 г, 58 ммоль). Перемешивали при охлаждении в атмосфере аргона 10 мин и прикапывали раствор Вос-ангидрида (6.3 г, 29 ммоль) в ТГФ (10 мл). Затем реакционную смесь перемешивали 2 часа при комнатной температуре. Полученное соединение экстрагировали этилацетатом (100 мл), осушали над сульфатом натрия и упаривали. Получили 7 г (97%) метилового эфира N-трет-бутоксикарбонилцистеина (8).
К раствору соединения (7) (2.25 г, 3.41 ммоль) в N,N-диметилформамиде (30 мл) добавляли диизопропилэтиламин (3.7 г, 27.28 ммоль), метиловый эфир трет-бутоксицистеина (6.8 г, 27.28 ммоль) и каталитическое количество йодистого калия. Затем перемешивали 4 часа при нагревании до 80°С. Полученное соединение экстрагировали хлороформом (200 мл) и промывали 2 раза водой (2×20 мл) и 1 раз растровом разбавленной HCl, осушали над сульфатом натрия, упаривали. Продукт очищали методом колоночной хроматографии, элюируя системой гексан/этилацетат. Получили 2.5 г (90%) 1,2-диоктадецил-глицеро-S-(O-метил-N-трет-бутокси)-цистеина (9).
К раствору соединения (9) (2 г, 2.46 ммоль) в хлористом метилене (20 мл) добавляли HCl/МеОН (2 г, 28 ммоль). Перемешивали 12 часов при комнатной температуре. Полученное соединение упаривали и переосаждали из диэтилового эфира (40 мл). Получили 1.76 г (92%) гидрохлорида 1,2-диоктадецил-глицеро-S-(O-метил)-цистеина (10).
К раствору соединения (10) (200 мг, 0.28 ммоль) в хлористом метилене (5 мл) добавляли диизопропилэтиламин (15 мг, 0.7 ммоль) и янтарный ангидрид (12.5 мг, 0.7 ммоль). Перемешивали 12 часов при комнатной температуре. Полученное соединение промывали 2 раза водой (2×10 мл) и 1 раз растровом разбавленной HCl, осушали над сульфатом натрия, упаривали. В дальнейшем использовали без дополнительной очистки. Получили 200 мг (88%) 1,2-диоктадецил-глицеро-S-(O-метил-N-бутандионкарбокси)-цистеина (11).
К раствору соединения (11) (100 мг, 0.12 ммоль) в хлористом метилене (5 мл) добавляли N-гидроксисукцинимид (16 мг, 0.13 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимид (26 мг, 0.13 ммоль). Перемешивали 12 часов при комнатной температуре. Полученный продукт промывали водой (5 мл), осушали над сульфатом натрия и упаривали. В дальнейшем использовали без дополнительной очистки. Получили 101 мг (90%) 1,2-диоктадецил-глицеро-S-(O-метил-N-бутандионкарбокси)-сукцинимидоцистеина (12).
К раствору соединения (12) 100 мг (0.11 ммоль) в хлористом метелене добавляли диизопропилэтиламин (30 мг, 0.22 ммоль) и амино-метокси-ПЭГ2000 (440 мг, 0.22 ммоль). Перемешивали 24 часа при комнатной температуре. Полученные продукты промывали 2 раза водой (2×10 мл) и 1 раз растровом разбавленной HCl, осушали над сульфатом натрия и упаривали. Продукт очищали методом колоночной хроматографии, элюируя системой хлороформ/метанол. Получили 213 мг (69%) 1,2-диоктадецил-глицеро-S-(O-метил-N-бутандионкарбокси-N-метокси)-ПЭГ-цистеина (13).
К раствору соединения (13) (100 мг, 0.03 ммоль) в ТГФ (2,5 мл) добавляли раствор гидроксида лития (27.5 мг, 1.14 ммоль) в воде (1 мл). Перемешивали 2 часа при комнатной температуре. Полученный продукт подкисляли раствором соляной кислоты до рН 4 и экстрагировали хлористым метиленом, осушали над сульфатом натрия и упаривали. Продукт очищали переосаждением из диэтилового эфира. Получили 95 мг (96%) 1,2-диоктадецил-глицеро-S-(N-бутандионкарбокси-N-метокси)-ПЭГ-цистеина (14).
К раствору соединения (14) (100 мг, 0.03 ммоль) в смеси МеОН/H2O (2 мл/2 мл) добавляли раствор гидрокарбоната натрия (20 мг, 0.24 ммоль) в воде (1,5 мл). Перемешивали и досуха упаривали. Полученный продукт сушили в вакууме масляного насоса 30 мин. Продукт растворяли в хлороформе (5 мл) и упаривали. Продукт очищали переосаждением из диэтилового эфира. Получили 99 мг (99%) натриевой соли 1,2-диоктадецил-глицеро-S-(N-бутандионкарбокси-N-метокси)-ПЭГ-цистеина (1).
Соединение 14: 1Н-ЯМР, (δ, м.д.): 7.05 (м, 1Н, N-H), 6.36 (с, 1H, ПЭГ-N-H), 4.74 (дк, J=11.0, 5.6 Гц, 1Н, HN-C-H), 3.96-3.22 (м, 192Н, глицерин-Н-О, O-СН2-октадецил, ПЭГ-Н, ПЭГ-О-СН3), 3.04-2.98 (м, 2Н, HS-CH2), 2.88-2.46 (м, 6Н, СН2-СООН, глицерин-СН2-S), 1.69-1.45 (м, 4Н, O-СН2-СН2-октадецил), 1.26 (с, 60Н, октадецил-Н), 0.86 (т, J=6.7 Гц, 6Н, СН3).
Пример 2. Синтез ПЭГ-содержащего глицеролипида (1), молекулярная масса ПЭГ 1500 Да.
ПЭГ-содержащий глицеролипид (1) с молекулярной массой ПЭГ 1500 Да получали в соответствии с аналогичной процедурой, которая подробно изложена в примере 1, за исключением в том, что вместо амино-метокси-ПЭГ2000 использовали амино-гидрокси-ПЭГ1500. Получили 120 мг (39%) натриевой соли 1,2-диоктадецил-глицеро-S-(N-бутандионкарбокси-N-метокси)-ПЭГ-цистеина (1).
1Н-ЯМР, (δ, м.д.): 7.05 (м, 1Н, N-H), 6.36 (с, 1Н, ПЭГ-N-H), 4.74 (дк, J=11.0, 5.6 Гц, 1Н, HN-C-H), 3.96-3.22 (м, 147Н, глицерин-Н-О, О-СН2-октадецил, ПЭГ-Н, ПЭГ-О-СН3), 3.04-2.98 (м, 2Н, HS-CH2), 2.88-2.46 (м, 6Н, СН2-СООН, глицерин-CH2-S), 1.69-1.45 (м, 4Н, O-СН2-СН2-октадецил), 1.26 (с, 60Н, октадецил-Н), 0.86 (т, J=6.7 Гц, 6Н, СН3).
Пример 3. Синтез ПЭГ-содержащего глицеролипида (1), молекулярная масса ПЭГ 750 Да.
ПЭГ-содержащий глицеролипид (1) с молекулярной массой ПЭГ 750 Да получали в соответствии с аналогичной процедурой, которая подробно изложена в примере 1, за исключением в том, что вместо амино-метокси-ПЭГ2000 использовали амино-гидрокси-ПЭГ750. Получили 90 мг (37%) натриевой соли 1,2-диоктадецил-глицеро-S-(N-бутандионкарбокси-N-метокси)-ПЭГ-цистеина (1).
1Н-ЯМР, (δ, м.д.): 7.05 (м, 1Н, N-H), 6.36 (с, 1H, ПЭГ-N-H), 4.74 (дк, J=11.0, 5.6 Гц, 1H, HN-C-H), 3.96-3.22 (м, 74Н, глицерин-Н-О, O-СН2-октадецил, ПЭГ-Н, ПЭГ-О-СН3), 3.04-2.98 (м, 2Н, HS-CH2), 2.88-2.46 (м, 6Н, СН2-СООН, глицерин-CH2-S), 1.69-1.45 (м, 4Н, O-СН2-СН2-октадецил), 1.26 (с, 60Н, октадецил-Н), 0.86 (т, J=6.7 Гц, 6Н, СН3).
Для создания конъюгатов на основе ПЭГ-содержащего глицеролипида (1) использовали апконвертирующие наночастицы со структурой ядро-оболочка NaYF4:Yb3+:Er3+/NaYF4 или NaYF4:Yb3+:Tm3+/NaYF4, полученные методом высокотемпературного разложения прекурсоров в высокипящих гидрофобных растворителях, методика синтеза таких наночастиц описана в уровне техники [Khaydukov E.V. et al. Riboflavin photoactivation by apconvertion nanoparticles for cancer treatment / Scientific Reports, 2016, V. 6, 35103; Nechaev A.V. et al. Natural Chlorins Octadecylamides - Upconversion Nanoparticles Complexes for the Study of Energy Transfer Process / Macroheterocycles, 2016, V. 9, pp. 361-365]. В данных работах получены монодисперсные гидрофобные наночастицы со средним размером 60 нм, покрытые остатками олеиновой кислоты. Наночастицы обладают антистоксовой фотолюминисценцией при возбуждении на длине волны 975 нм.
Пример 4. Синтез конъюгата ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4.
16 мг ПЭГ-содержащего глицеролипида (1) растворяли в 2 мл хлороформа и смешивали с 4 мг апконветирующих наночастиц NaYF4:Yb3+:Er3+/NaYF4, диспергированных в 4 мл гексана (концентрация наночастиц 1 мг/мл). Полученную смесь медленно упаривали до образования тонкой пленки и сушили в вакууме масляного насоса 2 часа.
Полученный конъюгат ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 суспендировали в 5 мл воды и фильтровали через шприцевой фильтр с размерами пор 0,2 мкм с последующим центрифугированием в течение 1 часа при 6000 об/мин, а затем диспергированием в 2 мл 0,9% раствора хлорида натрия с образованием устойчивой дисперсии.
Пример 5. Синтез конъюгата ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Tm3+/NaYF4.
Конъюгат ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Tm3+/NaYF4 получали в соответствии с аналогичной процедурой, которая подробно изложена в примере 4, за исключением в том, что вместо апконвертирующих наночастиц NaYF4:Yb3+:Er3+/NaYF4 использовали наночастицы NaYF4:Yb3+:Tm3+/NaYF4.
На фиг. 1 представлены фотографии 5% растворов полученных конъюгатов в 0,9% растворе хлорида натрия: фиг. 1а - раствор конъюгата ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3: Er3+/NaYF4; фиг. 1б - раствор конъюгата ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Tm3+/NaYF4.
Пример 6. Анализ на время циркуляции в кровотоке.
Для исследования времени циркуляции конъюгата ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 в кровотоке проводилась серия экспериментов на лабораторных животных. Использовали модель черных мышей с введением наркоза золетил-рометара по 0,2 мл внутрибрюшинно, в количестве 3 шт. Вводили конъюгат ПЭГ-содержащего глицеролипида (1) с апконвертирующими наночастицами NaYF4:Yb3+:Er3+/NaYF4 в 0,9% растворе хлорида натрия по 0,15 мл внутривенно (в ретроорбитальный синус). Забор крови осуществляли из хвостовой вены через 1, 3, 5, 10, 30, 60, 120, 180 мин и 1 сутки с подрезанием хвоста. Каждый образец крови исследовался на апконверсионном люминесцентном микроскопе (с детекцией отдельных наночастиц) в четырех случайных местах. Получали соответствующие фотографии и вручную подсчитывали количество наночастиц. На фиг. 2 выборочно представлены микрофотографии образцов крови с люминесцентного микроскопа, качественно демонстрирующие изменение концентрации наночастиц с течением времени.
С помощью оригинальных имиджинговых систем, разработанных во ФНИЦ «Кристаллография и фотоника» РАН, наблюдался апконверсионный сигнал в кровеносной системе малого животного до 30 мин.
Таким образом, приведенные примеры однозначно указывают на то, что ПЭГ-содержащий глицеролипид (1) обладает способностью солюбилизировать гидрофобные апконвертирующие наночастицы в биологических средах, а также защищает полученные конъюгаты ПЭГ-содержащий глицеролипид-апконвертирующие наночастицы от воздействия сыворотки крови, что приводит к увеличению времени циркуляции в кровотоке по сравнению с коммерчески доступными производными.