Результат интеллектуальной деятельности: Способ калибровки объема раствора для микроинъекции в предовуляторные ооциты мыши
Вид РИД
Изобретение
Изобретение относится к биотехнологии, конкретно, к способу количественных микроинъекций растворов в широком диапазоне объемов в предовуляторные ооциты мыши, который может быть использован для микроинъекцирования других крупных одиночных клеток, включая ооциты разных млекопитающих.
Предовуляторные (GV, germinal vesicle) ооциты млекопитающих относятся к ключевым объектам биологии развития, поскольку именно они в решающей степени определяют качество оплодотворенных яйцеклеток и способность зародышей к развитию (Blanco et al., Developmental competence of in vivo and in vitro matured oocytes: A review // Biotechnology and Molecular Biology Review - 2011. - V. 6. - P. 155-165; Gilbert et al., Oocyte developmental competence and embryo quality: distinction and new perspectives // Anim. Reprod. - 2015.- V. 12. - P. 397-407).
Экспериментальные исследования предовуляторных ооцитов млекопитающих часто проводятся на GV ооцитах мыши, как модельной системе, и включают микроинъекции в ооциты различных растворов и содержащихся в них сигнальных молекул таких, как плазмидные ДНК (Jo et al., Tropomodulin-3 is essential in asymmetric division during mouse oocyte maturation. // Sci. Rep. - 2016. - V. 6. - P. 29204), интерферирующие РНК (Svoboda and Stein, RNAi experiments in mouse oocytes and early embryos. // Cold Spring Harb. Protoc. - 2009. - doi:10.1101/pdb.top56) или другие активные метаболиты (Nakano Н., Kubo Н. Study of the in vitro maturation of mouse oocytes induced by microinjection of maturation promoting factor (MPF). // J. Assist. Reprod. Genet.- 2000. - V. 17. - V. 67-73), которые самостоятельно не способны проникать внутрь живых клеток.
При этом объемы инъецируемых растворов не должны превышать 1-5% общего объема ооцита, чтобы избежать травматичного набухания ооцитов, вызываемых микроинъекциями (Jaffe and Terasaki, Quantitative microinjection of oocytes, eggs, and embryos. // Methods Cell Biol. - 2004. - V. 74. - P. 219-242). Поскольку все ооциты имеют правильную сферическую форму, их объем рассчитывается по формуле объема шара (4/3π(D/2)3, где D - диаметр ооцита), что для GV ооцитов мыши, имеющих диаметр 70-75 мкм (Griffin et al., Comparative analysis of follicle morphology and oocyte diameter in four mammalian species (mouse, hamster, pig, and human). // J. Exp. Clin. Assist. Reprod. - 2006. -V. 3. - P. 2), составляет 180-220 пл (Пример 1). С учетом цитированных данных (Jaffe and Terasaki, 2004; Griffin et al., 2006) этот пример показывает, что в ооциты мыши допустимо инъецировать не более 2-10 пл растворов. Однако соблюдение данного условия представляет серьезную проблему, поскольку известные способы калибровки объемов инъецируемых растворов достаточно трудоемки и могут изменяться в зависимости от типа инъекционной системы и используемых капилляров. Так, ближайший аналог настоящего изобретения основан на предварительной, т.е. до проведения микроинъекций, калибровке инъецирующих капилляров (называемых также микропипетками) в зависимости от продолжительности инъекционного процесса или величины давления, создаваемого в капилляре. При этом калибровка может производиться путем измерения объемов капель среды, выпускаемых из инъецирующего капилляра в полимер полидиметилсилоксан (Eroglu et al., Quantitative microinjection of trehalose into mouse oocytes and zygotes, and its effect on development. // Cryobiology. - 2003. - V. 46. - P. 121-134), либо - воды в минеральное масло (Chow et al., Single cell transfection through precise microinjection with quantitatively controlled injection volumes. // Sci. Rep. - 2016. - V. 6. - P. 24127). При таких способах калибровки принимается, что капли, выпущенные в инертную среду, имеют сферическую форму, что позволяет рассчитывать объемы капель, исходя из их диаметров, измеряемых микроскопически. В подавляющем большинстве случаев для микроинъекций используют самодельные капилляры, имеющие коническую форму (Kline D. Quantitative microinjection of mouse oocytes and eggs. // Methods Mol. Biol. - 2009. - V. 518. - P. 135-156; Nakagawa and FitzHarris, Quantitative microinjection of Morpholino antisense oligonucleotides into mouse oocytes to examine gene function in meiosis-I. // Methods Mol. Biol. - 2016. - V. 1457. - P. 217-230), для изготовления которых необходимы специальное оборудование и квалификация, а замена одного капилляра (в случае его поломки или засорения) на другой капилляр потребует построения новой калибровочной кривой или проведения дополнительных оценочных микроинъекций (Nakagawa and FitzHarris, 2016). В отдельных случаях для более тонкой регулировки давления в инъецирующем капилляре в него набирают каплю ртути (mercury) (Jaffe et al., Microinjection of follicle-enclosed mouse oocytes. // Methods Mol. Biol. - 2009. - V. 518. - P. 157-173), что небезопасно для здоровья оператора и окружающей среды, поскольку пары ртути чрезвычайно ядовиты (Bernhoft RA. Mercury toxicity and treatment: a review of the literature. // J. Environ. Public Health. - 2012. - V. 2012. - P. 460508).
Задачей настоящего изобретения является создание простого способа калибровки объемов растворов, инъецируемых в GV ооциты мыши, в диапазоне от 1 до 10 пл. Поставленная задача решается за счет использования инъецирующих капилляров с практически параллельными стенками, внутренний диаметр которых известен и гарантируется фирмой-производителем. В данном изобретении используют инъекционные капилляры фирмы ТРС (Австралия), каталожный номер LICR-TA35, с внутренним диаметром, равным 5 мкм. Внешний диаметр этих капилляров составляет 6,5 мкм, что значительно меньше диаметра ооцита (70-75 мкм) (Фигура 1).
Параллельные стенки таких капилляров позволяют применять для расчета объема (V) раствора, находящегося внутри капилляра, формулу цилиндра:
V=πr2H=π(D/2)2Н,
где V - объем раствора внутри инъецирующего капилляра (в мкм3 или пл), π=3,14, D - внутренний диаметр капилляра (в нашем случае - 5 мкм), r - внутренний радиус капилляра (в нашем случае - 2,5 мкм), Н - расстояние между границами раствора в инъецирующем капилляре (в мкм). В данной формуле при инъекциях заданного объема растворов единственной переменной величиной является расстояние (Н, в мкм), которое можно вычислить по формуле, взяв за основу формулу объема цилиндра (см. выше):
Н=V/πr2=V/π(D/2)2,
где Н - расстояние между границами раствора в инъецирующем капилляре (в мкм), V - требуемый объем инъецируемого раствора (в мкм3 или пл), π=3,14; D - внутренний диаметр капилляра (в нашем случае - 5 мкм), r - внутренний радиус капилляра (в нашем случае - 2,5 мкм). По этой же формуле можно рассчитать величину Н, изменяя значения числителя в соответствии с объемом, нужным для микроинъекций (Пример 2).
В предлагаемом изобретении используют микроинъекционную систему, основными компонентами которой являются инвертированный световой микроскоп Axio Observer Z1 ("Carl Zeiss", Германия), механический микроинъектор Narishiga IM-9B ("Narishiga", Япония), цветная CCD камера Axiocam 105 color ("Carl Zeiss") и компьютер, оснащенный программой ZEN2012 ("Carl Zeiss"). Программа ZEN2012 позволяет наблюдать ооциты и инъецирующий капилляр на мониторе компьютера в реальном времени и наносить на изображения капилляра линейные метки, откалиброванные в микрометрах. Общий вид микроинъекционной системы иллюстрирует фигура 2.
Фигуры 3-6 иллюстрируют последовательные этапы микроинъекций в GV ооциты мыши стандартного фосфатно-солевого буфера (ФСБ, 2,7 мМ KCl, 140 мМ NaCl, 8,1 мМ Na2HPO4, 1,5 мМ KH2PO4) в объеме 1 пл (фиг. 3), 2,5 пл (фиг. 4), 5 пл (фиг. 5), 10 пл (фиг. 6). Выбор буфера ФСБ для микроинъекций объясняется тем, что ранее он успешно использовался в качестве растворителя при инъекциях антител в соматические клетки (Fomproix et al., Effects of anti-fibrillarin antibodies on building of functional nucleoli at the end of mitosis. // J. Cell Sci. - 1998. - V. 111. - P. 359-372). В наших условиях ФСБ не проявлял токсичности при инъекциях в GV ооциты мыши (Пример 3).
Таким образом, предлагаемый способ калибровки объемов растворов для микроинъекций в предовуляторные ооциты мыши не требует построения калибровочных кривых и осуществляется в процессе микроинъекций в реальном времени. Данный способ может быть применен в любых механических микроинъекционных системах, которые оснащены CCD камерой и программным обеспечением, позволяющим наносить графические метки на изображения ооцитов. В данном способе не предусмотрены особые требования к удерживающему капилляру.
Предлагаемое изобретение иллюстрируют следующие примеры:
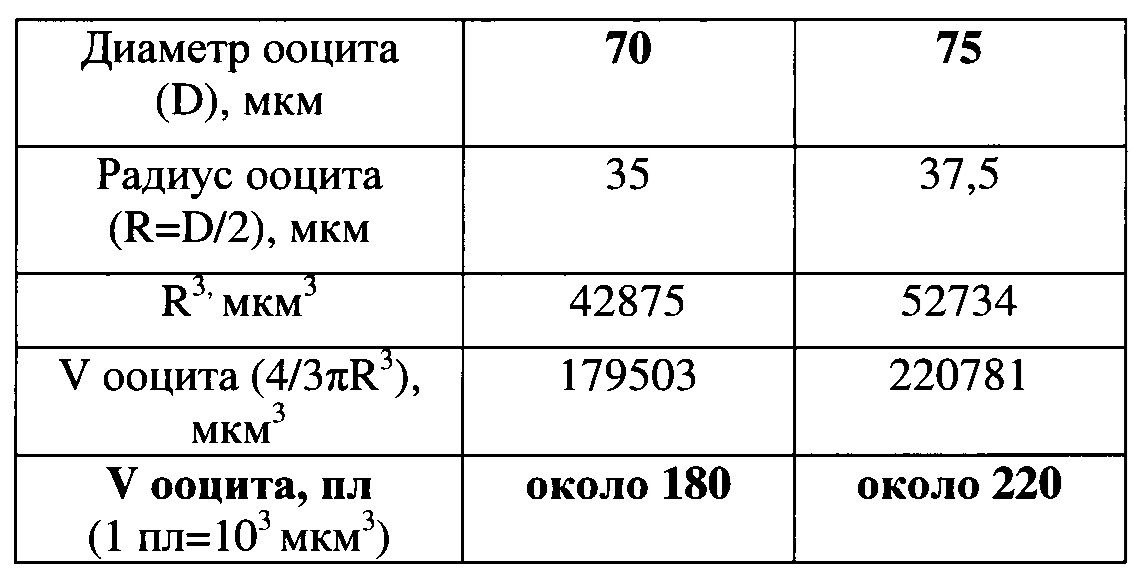
Пример 1.
Расчет объемов предовуляторных ооцитов мыши диаметром 70 и 75 мкм, произведенный по формуле объема шара V=4/3πR3, где V - объем ооцита (в мкм3 и пиколитрах, пл), π=3,14, D и R - диаметр и радиус ооцита соответственно (в мкм).
Пример 2.
Значения величины Н (расстояние между границами раствора в инъецирующем капилляре, фиг. 1) при микроинъекциях в ооциты мыши растворов в диапазоне объемов от 1 до 10 пл. Расчет производят по формуле цилиндра H=V/π(D/2)2, где V - объем в пиколитрах (пл), π=3,14, D - внутренний диаметр инъецирующего капилляра (мкм)

Пример 3.
Условия гормональной стимуляции животных, выделения ооцитов, микроинъекций буфера ФСБ и культивирования инъецированных ооцитов in vitro.
Самок гибридов мышей (CBA×C57B1)Fl 6-8-недельного возраста получают из питомника лабораторных животных «Столбовая» Федерального государственного бюджетного учреждения науки Научный центр биомедицинских технологий Федерального медико-биологического агентства и содержат в условиях, обеспечивающих свободный доступ к питьевой воде и стандартному корму. Все манипуляции с животными производят в соответствии с Правилами внутреннего распорядка ИБХ РАН по содержанию и использованию лабораторных животных и Правилами лабораторной практики в Российской Федерации (Приказ Министерства Здравоохранения РФ №267 от 19.06.2003).
Стимуляцию ооцитов к мейотическому созреванию производят по стандартной методике (Klein, 2009) путем внутрибрюшинного введения 10 ME гонадотропина сыворотки жеребой кобылы «Фоллимаг»® (ЗАО «Мосагроген», Россия). Через 48 час животных забивают, а извлеченные яичники помещают в буфер ФСБ, где от яичников отделяют жировую ткань и проверяют ампулу на наличие в ней спонтанно овулировавших ооцитов (не выявили ни в одном эксперименте). Выделение GV ооцитов проводят путем пунктирования яичников препаровальными иглами в среде М2, содержащей 100 мкг/мл дбцАМФ (dbcAMP, дибутирил-циклический аденозинмонофосфат), который добавляют для предотвращения спонтанного созревания ооцитов in vitro. Отделение ооцитов от окружающих кумулусных клеток производят механически путем пипетирования. Для микроинъекций отбирают GV ооциты, свободные от клеток кумулуса и имеющие диаметр 70-75 мкм.
Микроинъекции производят в стерильных пластиковых чашках Петри диаметром 35 мм, на дно которых помещают каплю раствора ФСБ и каплю среды М2 с дбцАМФ (капли объемом около 40 мкл) и полностью покрывают капли парафиновым маслом, чтобы не допустить их испарения. В каплю со средой М2 помещают 5-7 ооцитов. Микроинъекции производят при комнатной температуре и стандартном освещении. Микроинъекция одного ооцита занимает не более 2 мин. Всего нами было инъецировано: 1 пл ФСБ - 15 ооцитов, 2,5 пл ФСБ - 15 ооцитов, 5 пл ФСБ - 32 ооцита, 10 пл ФСБ - 37 ооцитов.
Для оценки возможной травматичности микроинъекций ооциты инкубируют в среде αМЕМ с добавлением 5%-ов эмбриональной бычьей сыворотки, 2 мМ L-глутамина, 5 мМ таурина, 36 мг/мл пирувата натрия в атмосфере 5% CO2 в течение 24 час при 37°С (Belli et al., Time-lapse dynamics of the mouse oocyte chromatin organisation during meiotic resumption // Biomed. Res. Int. - 2014. - V. 2014. - Article ID 207357).
Все реагенты, использованные для культивирования ооцитов, приобретают у фирмы "Merk" (Германия).
Полученные результаты показывают, что ооциты, инъецированные 1-10 пл ФСБ, способны развиваться до стадии зрелой яйцеклетки (или МП ооцита), так что во всех группах доля МП ооцитов составляет около 60%. Доля травмированных и погибших ооцитов во всех группах не превышает 30-40%, что меньше значений (примерно 50%), известных из литературы (Jaffe et al., 2009).
Предлагаемое изобретение иллюстрируют следующие графические материалы: Фиг. 1. - Схематичное изображение инъекционного капилляра фирмы ТРС (Австралия, каталожный номер LICR-TA35) с внутренним диаметром 5 мкм и внешним диаметром 6,5 мкм. На изображение нанесены положения границ инъецируемых растворов (менисков) в капилляре.
Фиг. 2. - Общий вид микроинъекционной системы, использованной в изобретении.
Система включает световой инвертированный микроскоп Axio Observer Z1 ([1]), микроинъектор Narishiga IM-9B, где ([2а]) - гидравлический поршень и ([2б]) - пневматический поршень, цветную CCD камеру Axiocam 105 color ([3]) и компьютер ([4]), оснащенный программой ZEN2012 ("Carl Zeiss"). Инъецирующий и удерживающий (холдер) капилляры в данной системе располагаются слева и справа от оператора, хотя их положение не является критичным и может быть изменено по желанию оператора. Микроскоп оборудован объективом A-Plan 10×/0.25 (числовая апертура) и конденсором Хоффмана для модуляционного (рельефного) контраста ("Carl Zeiss").
Фиг. 3. - Последовательные этапы микроинъекции 1 пл буфера ФСБ в цитоплазму GVooцитa мыши. Данный объем раствора соответствует отрезку Н (Distance), длиной 50 мкм (μm) (см. Таблицу в Примере 2). Масштабная линия - 50 μm.
а - заполнение инъецирующего капилляра раствором, б - введение капилляра в цитоплазму ооцита, в - микроинъекция раствора, г - отведение ооцита от капилляра.
Фиг. 4. - Последовательные этапы микроинъекции 2,5 пл буфера ФСБ в цитоплазму GVооцита мыши. Данный объем раствора соответствует отрезку Н (Distance), длиной 127 мкм (μm) (Пример 2). Масштабная линия - 50 μm.
а - заполнение инъецирующего капилляра раствором, б - введение капилляра в цитоплазму ооцита, в - микроинъекция раствора, г - отведение ооцита от капилляра.
Фиг. 5. - Последовательные этапы микроинъекции 5 пл буфера ФСБ в цитоплазму GV-ооцита мыши. Данный объем раствора соответствует длине отрезка Н (Distance), равной 255 мкм (μm) (Пример 2). Масштабная линия - 50 μm.
а - заполнение инъецирующего капилляра раствором, б - введение капилляра в цитоплазму ооцита, в - микроинъекция раствора, г - отведение ооцита от капилляра. Фиг. 6. - Последовательные этапы микроинъекции 10 пл буфера ФСБ в цитоплазму GVооцита мыши. Данный объем раствора соответствует длине отрезка Н (Distance), равной 510 мкм (μm) (Пример 2). Масштабная линия - 50 μm.
а - заполнение инъецирующего капилляра раствором, б - введение капилляра в цитоплазму ооцита, в - микроинъекция раствора, г - отведение ооцита от капилляра.
Список использованных сокращений:
μm и мкм - микрометр, 10-3 мм;
мкм3 - кубический микрометр;
пл - пиколитр, 1 пл равен 103 кубических микрометров (мкм3);
GV - предовуляторный (germinal vesicle) ооцит, ооцит в составе Граафова пузырька;
ME - международная единица определения активности гормонов.






