Результат интеллектуальной деятельности: Радиофармацевтический препарат для терапии первичной гепатоцеллюлярной карциномы и метастатических образований в печень, а также состав и способ его получения
Вид РИД
Изобретение
В качестве изобретения будет рассмотрен состав и способ получения полипептидных макромолекул диаметром 20-40 мкм, меченных изотопами рения в терапевтических целях.
Значительное число научных работ было посвящено решению проблемы терапии гепатоцеллюлярной карциномы (ГЦК). При отсутствии возможности проведения хирургического вмешательства в качестве альтернативы используется метод контактной лучевой терапии источниками ионизирующего излучения (радионуклидная терапия - РНТ). Положительный эффект метода достигается за счет трансартериальной радиоэмболизации (ТАРЭ) капилляров печени, питающих опухолевые клетки. ТАРЭ осуществляется полимерными макромолекулами, содержащими источники ионизирующего излучения. Таким образом, синергетический эффект снижения поступления питательных веществ в опухолевые клетки вместе с локальным воздействием ионизирующего излучения приводит к замедлению роста, а затем к деструкции злокачественных образований в печени. Дополнительно стоит отметить, что преимущества РНТ перед хирургическим вмешательством заключается в подавлении болевого синдрома, уменьшении потребления анальгетиков, а также в улучшении дальнейшего качества жизни и уменьшении времени реабилитации [1].
В настоящее время в целях терапии ГЦК исследована эффективность применения полимерных макромолекул из различных материалов, меченных достаточно широким спектром бета-излучающих радионуклидов (198Au, 131I, 32Р, 90Y, 206Bi, 35S), однако наибольшее распространение получили методики радиоэмболизации с применением 131I-липиодола и стеклянных микросфер (TheraSphere®) или смолы (SIR-Spheres®), меченных 90Y [2-5].
Стоит отметить, что изотопы рения, особенно 188Re, в качестве действующего вещества для РНТ в составе ТАРЭ при ГЦК обладают рядом преимуществ по сравнению с изотопами 90Y и 131I. По сравнению с 188Re РФП на основе изотопа 90Y обладают более высокой стоимостью одной терапевтической дозы, большей трудоемкостью процесса получения микросфер на основе стеклянной матрицы, лучевая нагрузка на здоровые ткани пациента за счет ядерно-физических характеристик 90Y выше, а также изотоп 90Y является чистым β- эмиттером, что в отличие от 188Re не дает возможности наблюдать биораспределение изотопа в теле пациента с помощью гамма-камеры. По сравнению с 188Re изотоп 131I не обладает такими же способностями к комплексообразованию, что снижает перечень возможных носителей радионуклида, а также является долгоживущим радионуклидом, что, в свою очередь, повышает дозовую нагрузку на здоровые органы пациента.
Известен способ получения микросфер для радиотерапии ГЦК на основе изотопа 90Y, в котором защищается метод формирования микросфер в виде стеклянных частиц сплавлением оксидов кремния, иттрия и алюминия [6]. Микросферы обрабатывают щавелевой кислотой с концентрацией 0,1-0,2 М, или соляной кислотой с концентрацией 0,2-1,5 М, или плавиковой кислотой с концентрацией 0,01-0,05 М, или смесью соляной и плавиковой кислот в соотношении, соответственно, от 10:1 до 20:1, или смесью соляной, плавиковой и щавелевой кислот в соотношении, соответственно, от 10:1:1 до 20:1:1. После кислотной обработки проводят промывание суспензии, как минимум, два раза водой для инъекций и, как минимум, два раза спиртом. Далее проводят облучение микросфер тепловыми нейтронами в реакторе при температуре от 20 до 60°C до получения толщины обработанного слоя от 10 до 100 нм. Технический результат изобретения заключается в сохранении высокой удельной активности микросфер при их использовании в течение длительного времени.
Недостатки этого метода связаны в основном с наличием высокотемпературных процессов и необходимостью реакторного облучения при формировании РФП, что обусловлено трудоемкостью процесса и сказывается на стоимости производства. Также высокая плотность микросфер способствует их осаждению в кровеносном русле, не достигая целевой точки радиоэмболизации, что приводит к неоправданным лучевым нагрузкам на здоровые ткани и органы. Кроме того, может происходить эффект выщелачивания в организм ионов металлов с поверхности стеклянных микросфер.
Известен способ, в котором в качестве носителя действующего вещества в составе РФП выступают микросферы альбумина человека диаметром от 20 до 40 мкм [7]. Способ включает эмульгирование раствора альбумина в растительном масле, дальнейшую тепловую обработку эмульсии и ее фильтрацию. При этом стабильный изотоп Pd и радионуклид 103Pd в виде хлористого палладия в 0,1 М растворе соляной кислоты смешивают с микросферами альбумина. Полученную смесь обрабатывают ультразвуком до получения гомогенной суспензии, после чего ее выдерживают при комнатной температуре в течение 18-24 часов. Микросферы выделяют из смеси центрифугированием с последующим восстановлением гидросульфитом натрия. Используют фракцию микросфер с диаметром 20-40 микрон. Изобретение позволяет получить микросферы альбумина с высокой удельной активностью.
Также известны способы получения липиодола, меченного изотопами 131I [8], 90Y [9] и 188Re [10]. Однако масло семян опийного мака в качестве носителя радионуклидов в целях радиоэмболизации при ГЦК обладает рядом недостатков. Во-первых, вероятность его статичного расположения вблизи опухоли меньше, чем для твердых микросфер. Во-вторых, удержание изотопов молекулами липиодола хуже, нежели стеклянными либо полипептидными микросферами.
Микросферы альбумина человека являются оптимальными объектами для транспортной доставки радионуклидов терапевтического либо диагностического назначения к злокачественной опухоли. Они биодеградируемы и не являются чужеродными организму человека.
Известен способ приготовления суспензии микросфер альбумина человека, меченых изотопами 99mTc, 188Re или 186Re с помощью поэтапного смешения содержимого четырех флаконов [11]. Во флаконе «А», согласно формуле изобретения, содержится хлорид олова двухводного (SnCl2⋅2H2O) массой от 2,5 до 10 мг в водном растворе соляной, уксусной либо фосфорной кислоты. Во флаконе «В» содержится стабилизатор соли олова - лимонная кислота массой от 10 до 30 мг. В флаконе «С» содержатся МСА человека от 10 до 60 мкм, подлежащие мечению, массой от 2 до 3 мг. Флакон «D», в свою очередь, содержит стабилизатор pH до величины 6-8, в качестве которого может быть использован едкий натр, аммиак, натрий-фосфатный буфер, трис-буфер. Реакция мечения МСА проходит под воздействием микроволнового излучения и протекает в течение нескольких минут.
Недостатком данного способа является количество флаконов, а именно четыре, что приводит к увеличению потерь активности действующего вещества либо одного из вспомогательных компонентов. Дополнительно стоит отметить, что восстановитель - SnCl2⋅2H2O находится в подкисленном водном растворе во флаконе «А», что в свою очередь может отразиться на результате мечения изотопом полипептидной молекулы, так как реакционный объем, и как следствие концентрация радионуклида в реакционной смеси прямо пропорциональна выходу реакции мечения.
Также известен способ приготовления микросфер [12], меченых 188Re, основанный на суспендировании частиц биополимера либо органического полимера в растворе с pH от 1 до 3, содержащем водорастворимую соль олова двухвалентного и соль 188Re с активностью от 1000 МБк до 60000 МБк; нагреванием раствора в течение 45-70 минут в диапазоне температур от 80 до 100°C. В формуле изобретения защищается как состав, так и способ приготовления конечного РФП. Все производные поделены на три контейнера, во флаконе «А» содержится водорастворимая соль двухвалентного олова и комплексообразователь для стабилизации этой соли (2,5-дигидроксибензойная кислота; аскорбиновая кислота; лимонная кислота; малоновая кислота; глюконовая кислота; молочная кислота; гидроксиизомасляная кислота; уксусная кислота; винная кислота; янтарная кислота; соли указанных кислот, либо глюкопентонатов), флакон «В» включает в себя частицы биополимера либо органического синтетического полимера диаметром от 10 до 30 мкм, во флаконе «С» содержится вещество для увеличения pH раствора, а именно: цитрат, ацетат или тартрат в кристаллической форме либо в водном растворе, обеспечивая величину pH продукта от 5 до 8,5.
Основными недостатками данного способа являются: во-первых, время нагрева, недостаточное для достижения значения выхода реакции мечения более 95%, во-вторых, использование диаметра полимерных микрочастиц от 10 до 30 мкм, что может быть недостаточным для радиоэмболизации более крупных капилляров, что в свою очередь приведет к увеличению необоснованной лучевой нагрузки на здоровые ткани организма.
Задачей настоящего изобретения является создание суспензии полипептидных макромолекул, меченных изотопами 188Re или 186Re для целей ядерной медицины, при этом устраняя вышеизложенные недостатки уже имеющихся в мировой практике разработок.
В качестве первого объекта изобретения будет рассмотрен состав набора для приготовления суспензии полипептидных биодеградабельных микрочастиц. Набор для приготовления РФП состоит из трех флаконов из дрота для лекарственных средств вместимостью 10 мл, герметично укупоренные резиновыми пробками и обжатые алюминиевыми колпачками. На каждый из флаконов набора нанесена этикетка с обозначением номера.. В каждом флаконе реагенты находятся в лиофилизированной форме (таблица 1). Содержимое каждого флакона стерильно.
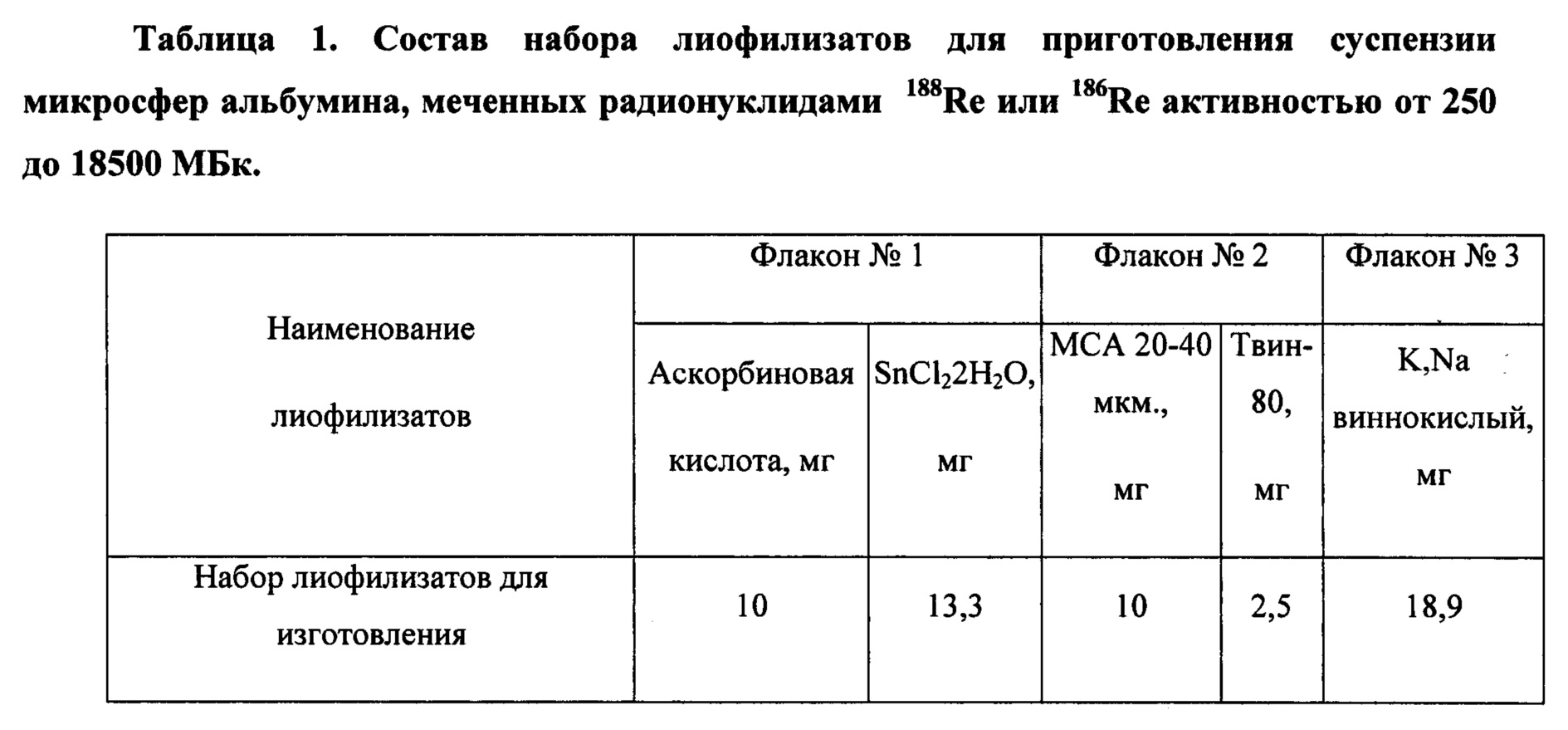
Во флаконе №1 содержится стерильный лиофилизат смеси восстановителя - хлорида олова (SnCl2⋅2H2O) и антиоксиданта - аскорбиновой кислоты (C6H8O6). Олово дихлорид 2х-водный является восстановителем рения до более низкого валентного состояния, так как рений в высшем окисленном состоянии (степень окисления +7) не образует комплекса с носителем (микросферы альбумина), а аскорбиновая кислота необходима для предотвращения радикальных реакций.
Во флаконе №2 содержится стерильный лиофилизат смеси носителя атомов радионуклида - микросфер альбумина человека диаметром от 20 до 40 мкм и эмульгатора - полисорбата - 80 (C64Н124O26). МСА представляют собой сферические монолитные частицы с зеркальной поверхностью, плотность их составляет 1,26±0,12 г/см3. В 10 мг МСА содержится 561 000±53 400 шт., средний радиус МСА (~ 30 мкм). Tween-80 в составе компонентов для приготовления суспензии используется для улучшения смачиваемости микросфер альбумина, так как их поверхность обладает гидрофобными свойствами.
Во флаконе №3 содержится стерильный лиофилизат трансхелатора и стабилизатора pH. Для этих целей используется соль тартрат-Na,K (Na,K -виннокислый), который является лигандом, образующим комплекс 188Re или 186Re с низкой константой стабильности с последующим перелигандирующим свойством. Кроме этого, калий-натрий виннокислый является реагентом, поддерживающим буфферность реакционной смеси и выполняющий роль стабилизатора pH.
Методика получения лиофилизатов согласно таблице 1 приведена ниже, все операции проводятся в асептических условиях в ламинарном шкафу.
Флакон №1
В круглодонную колбу с двумя горловинами емкостью 250 мл, снабженную магнитной мешалкой, помещают 100 мл воды для инъекций, добавляют 1000 мг аскорбиновой кислоты, перемешивают до полного растворения, затем добавляют 1330 мг двухлористого олова двухводного, тщательно перемешивают в течение 5 минут. Полученный раствор фильтруют под вакуумом через ацетат-целлюлозный стерилизующий фильтр с размером пор 0,22 мкм. Фильтрованный раствор расфасовывают автоматической пипеткой с номиналом 100-1000 мкл во флаконы вместимостью 10 мл по 1 мл в каждый (всего 100 флаконов). Весь процесс проводят в токе аргона. Затем флаконы помещают в камеру сублиматора на полку, охлажденную до минус 20°C. В камере создают давление 0,1-0,2 мм. рт.ст.с помощью вакуумного насоса. При этих условиях проводят лиофильную сушку в течение 43 ч, после этого камеру заполняют сухим аргоном до атмосферного давления. Затем флаконы удаляют из камеры, укупоривают резиновыми пробками и вальцуют алюминиевыми колпачками (. Режим лиофилизации подробно представлен далее.
Флакон №2
В круглодонную колбу с двумя горловинами емкостью 250 мл, снабженную магнитной мешалкой, помещают 250 мг твина-80 и 100 мл воды для инъекций, тщательно перемешивают, добавляют 1000 мг МСА с размерами 20-40 мкм (предварительно выдержанные в сухожаровом шкафу при 120°C в течение 1 ч), перемешивают в течение 10 мин. Полученный раствор расфасовывают автоматической пипеткой с номиналом 100-1000 мкл во флаконы вместимостью 10 мл по 1 мл в каждый (всего 100 флаконов). Весь процесс проводят в токе аргона. Затем флаконы помещают в камеру сублиматора на полку, охлажденную до минус 20°C. В камере создают давление 0,1- 0,2 мм. рт. ст. с помощью вакуумного насоса. При этих условиях проводят лиофильную сушку в течение 47 ч, после этого камеру заполняют сухим аргоном до атмосферного давления. Затем флаконы удаляют из камеры, укупоривают резиновыми пробками и вальцуют алюминиевыми колпачками. Режим лиофилизации подробно представлен далее.
Флакон №3
В круглодонную колбу с двумя горловинами емкостью 250 мл, снабженную магнитной мешалкой, помещают 100 мл воды для инъекций, добавляют 1890 мг K,Na виннокислого, тщательно перемешивают до полного растворения. Полученный раствор фильтруют под вакуумом через ацетат-целлюлозный стерилизующий фильтр с размером пор 0,22 мкм. Фильтрованный раствор расфасовывают автоматической пипеткой с номиналом 100-1000 мкл во флаконы вместимостью 10 мл по 1 мл в каждый (всего 100 флаконов). Весь процесс проводят в токе аргона. Затем флаконы помещают в камеру сублиматора на полку, охлажденную до минус 20°C. В камере создают давление 0,1-0,2 мм. рт. ст. с помощью вакуумного насоса. При этих условиях проводят лиофильную сушку в течение 47 ч, после этого камеру заполняют сухим аргоном до атмосферного давления. Затем флаконы удаляют из камеры, укупоривают резиновыми пробками и вальцуют алюминиевыми колпачками. Режим лиофилизации подробно представлен далее.
Методика лиофильной сушки реагентов.
Перед расфасовкой растворов компонентов для получения набора лиофилизатов включают сублимационную установку и охлаждают полки до минус 30°C. Флаконы с расфасованными растворами устанавливают на охлажденные полки, закрывают герметично двери сублимационной камеры и продолжают замораживание растворов во флаконах в течение 30 мин. После этого включают конденсер, доводят температуру конденсера до 50-55°C, включают вакуумный насос. После достижения вакуума 0,3 мм. рт. ст. отключают охлаждение полок и проводят лиофильную сушку в таком режиме (плавающий режим). В плавающем режиме через 20 ч вакуум в сублимационной камере достигает 4⋅10-3 мм. рт. ст.Температура полок постепенно повышается до минус 12°C через 1 ч после начала сушки, через 3 ч температура полок повышается до минус 8°C, через 10 ч - до 0°C, через 20 ч до плюс 10°C, через 40 ч температура в камере повышается до плюс 24-27°C. При температуре плюс 24-27°C проводят сушку в течение 4 ч. Суммарная длительность сушки составляет 44 ч. После этого отключают вакуумный насос, открывают штуцер сублимационной камеры и через силиконовый шланг заполняют сублимационную камеру аргоном до атмосферного давления, фильтруя аргон через фильтр с размером пор 0,22 мкм. После этого открывают дверь сублимационной камеры, которая находится в стерильном помещении, удаляют поддоны с флаконами из камеры, быстро закрывают флаконы резиновыми пробками и обжимают алюминиевыми колпачками. На флаконы наклеивают этикетки, помещают их в холодильник и хранят при температуре плюс 2-8°C.
В качестве второго объекта изобретения будет рассмотрен способ приготовления суспензии полипептидных биодеградабельных микрочастиц, позволяющий получать инъекционную форму РФП непосредственно в медицинских учреждениях. В качестве действующего вещества, как уже отмечалось выше, используются изотопы 186Re, 188Re в форме перренат ионов в изотоническом растворе 0,9% NaCl. Изотоп 188Re возможно получать в медицинских учреждениях из радионуклидного генератора.
Все операции проводятся в асептических условиях в ламинарном радиохимическом шкафу.
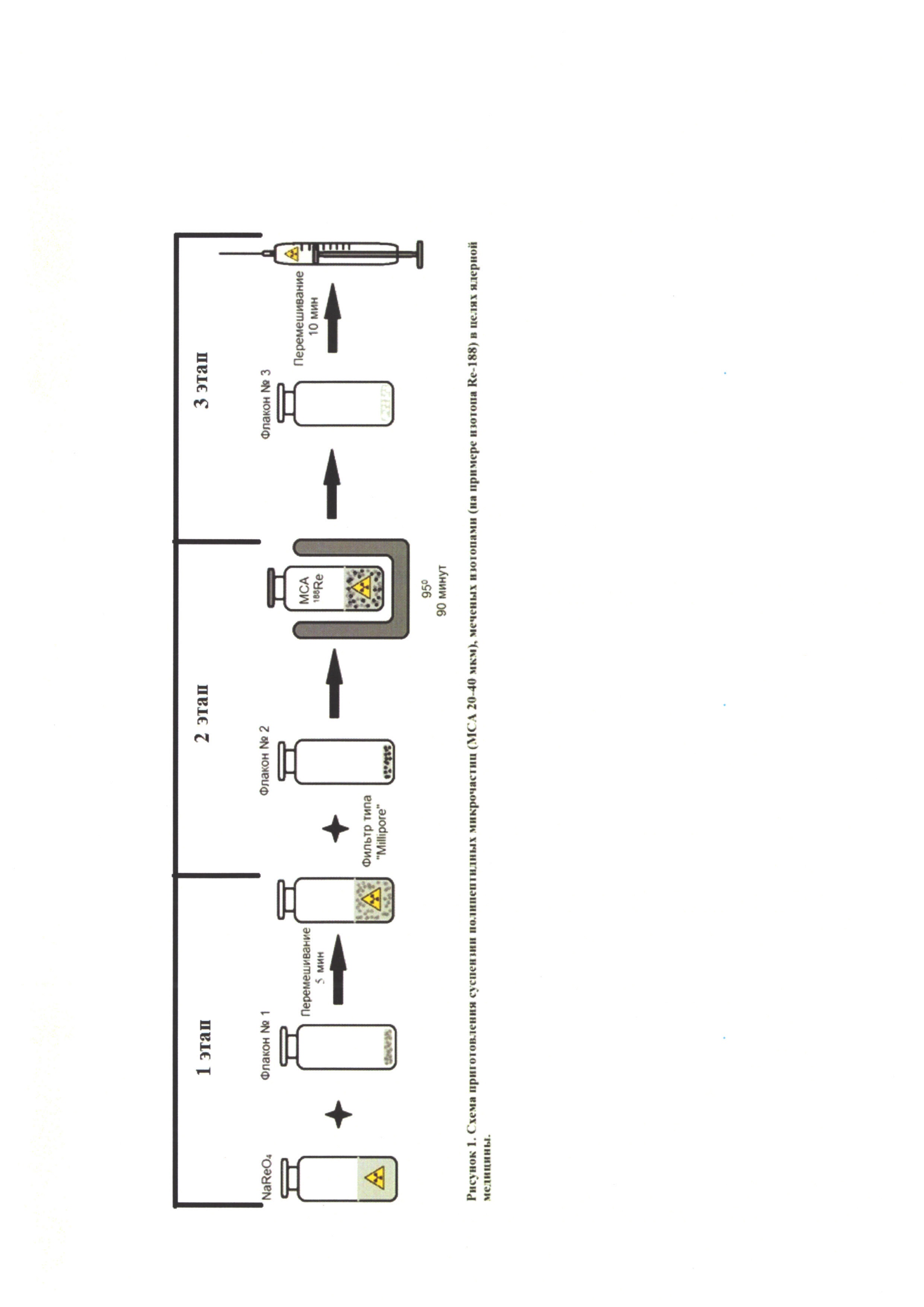
Способ приготовления, описанный ниже, состоит из трех этапов (рисунок 1):
Этап №1
Изотонический раствор натрия перрената (186Re, 188Re) объемом от 1 до 5 мл и активностью от 100 МБк/флакон до 18500 МБк/флакон через прокол резиновой пробки переносится одноразовым стерильным шприцем в флакон со стерильным лиофилизатом №1, который затем устанавливается в шейкер с частотой вращения 100-150 об/мин на 5 минут. В результате, во флаконе №1 образуется раствор с величиной pH от 1,5 до 2,5.
Этап №2
По завершении предыдущего этапа образовавшийся во флаконе №1 раствор, прокалывая резиновую пробку, отбирают одноразовым стерильным шприцем. Как только весь раствор собран, на шприц одевают мембранный фильтр с диаметром пор 0,22 мкм и вносят содержимое шприца через прокол резиновой пробки во флакон со стерильным лиофилизатом №2, обеспечивая таким образом дополнительную стерилизацию методом фильтрования раствора, попадающего во флакон №2. Затем флакон №2 помещают в печку, где нагревают при температуре 90-99°C в течение 1,5 часов, периодически перемешивая содержимое флакона. В результате во флаконе №2 образуется суспензия микросфер альбумина, меченных изотопом рения на 60-80%, с величиной рН раствора от 1,5 до 2,5.
Этап №3
По завершении предыдущего этапа флакон №2 достают из печки и оставляют остывать при комнатной температуре на 15-20 минут. Затем остывшую суспензию прокалывая резиновую пробку, отбирают стерильным одноразовым шприцем и переносят во флакон со стерильным лиофилизатом №3, который помещают в шейкер на 10 мин. при частоте оборотов 100 об/мин. После перемешивания образуется суспензия микросфер альбумина, меченых изотопом рения минимум на 95%, с величиной pH надосадочной жидкости от 2,5 до 3,5. Содержимое флакона №3 представляет собой готовую инъекционную форму РФП.
В качестве третьего объекта изобретения рассматривается возможность использования суспензии микросфер альбумина, меченных изотопами
188Re, в медицинских целях в качестве радиофармацевтических препаратов терапевтического назначения. Микросферы альбумина благодаря своим размерам имеют возможность депонировать в капиллярах, питающих опухоль, в непосредственной близости от злокачественных клеток. МСА, меченные изотопами 186Re и 188Re, были исследованы на лабораторных животных с искусственно созданной моделью патологии печени. Целью исследования было выявление терапевтического эффекта полученного РФП.
В ходе выполнения работы было изучено терапевтическое действие РФП по критериям: торможение роста опухоли, сравнение продолжительности жизни животных-опухоленосителей, изменение их качества жизни. Полученные результаты показали улучшение общего состояния животных (сохранение двигательной активности, уровня потребления корма и воды, функций пищеварения), и, как следствие, улучшение качества жизни. Продолжительность жизни животных с имплантированными опухолями печени после введения им исследуемого РФП увеличилась в среднем на 15% по сравнению с животными, оставшимися без лечения. Отмечено торможение роста опухоли в среднем на 9,49%, отсутствие метастазирования первичной опухоли в группе крыс с проведением терапии РФП (МСА 20-40 мкм, меченные 188Re). Изученный радиофармацевтический препарат отвечает заявленным критериям терапевтического действия как радиофармацевтический лекарственный препарат для внутриартериальной радионуклидной терапии гепатоцеллюлярной карциномы и метастатических поражений.
Литература:
[1] P. Smith, R. Krohn, G. Hermanson, A. Mallia, F. Gartner, M. Provenzano, Measurement of protein using bicinchoninic acid. // Analytical Biochemistry, Vol. 150, 1985, 76-85.
[2] J.I. Bilbao, M.F. Reiser, Liver radioembolization with 90Y microspheres // Berlin Springer, 2008. 162-167.
[3] R.T. Hoffmann, P.M. Paprottka, A. Schon, F. Bamberg, A. Haug, Durr, E.M. Rauch В., С.T. Trumm, T.F. Jakobs, Т.К. Helmberger, M.F. Reiser, F.T. Kolligs, Transarterial hepatic yttrium-90 radioembolization in patients with unresectable intrahepatic cholangiocarcinoma: factors associated with prolonged survival // Cardiovasc. Intervent Radiol, Vol. 35, No. 1, 2012, 105-116.
[4] J.L. Raoul, M. Messner, E. Boucher, J.F. Bretagne, J.P. Campion, K. Boudjema, Preoperative treatment of hepatocellular carcinoma with intra-arterial injection of 131I-labelled lipiodol // Br. J. Surg., Vol. 90, No. 11, 2003, 1379-1383.
[5] K. Memon, R.J. Lewandowski, A. Riaz, R. Salem, Yttrium 90 microspheres for the treatment of hepatocellular carcinoma // Recent Results Cancer Res. Vol. 190, 2013, 207-224.
[6] В.В. Каныгин, О.Б. Егоров, Способ получения микросфер для радиотерапии, патент РФ №2485059 (2011).
[7] В.М. Петриев, В.К. Ширяев, Л.А. Смахтин, В.Г. Скворцов, Б.Л. Жуйков, Способ получения меченых радионуклидом микросфер, патент РФ №2359702 (2007).
[8] Н. Ahmadzadehfar, A. Sabet, K. Wilhelm, Н. J. Biersack, J. Risse, Iodine-131-Lipiodol therapy in hepatic tumours // Methods, Vol. 55, 2011, 246-252.
[9] M. Chen, S. Wang, B. Shieh, L. Sheen, R. Tsay, G. Ting, W. Lin, Novel preparation of Y-90 Lipiodol by using of conjugating technique, патент TW №334438 (1998).
[10] H. Нуарэ, Э. Гарин, H. Лепаръер, В. Ардиссон, Композиция для лечения рака печени у людей на основе рения-188 и способ получения такой композиции, патент РФ №2543342 (2011).
[11] S. Chen, С. Li, Т. Lee, С. Chang, Kit and method for quickly preparing radio-isotope labeled human serum albumin microspheres, патент US №2016058897 (2016).
[12] G. Wunderlich, A. Drews, Method and kit for the production of particles labelled with rhenium-188, патент US 2008219923 (2008).