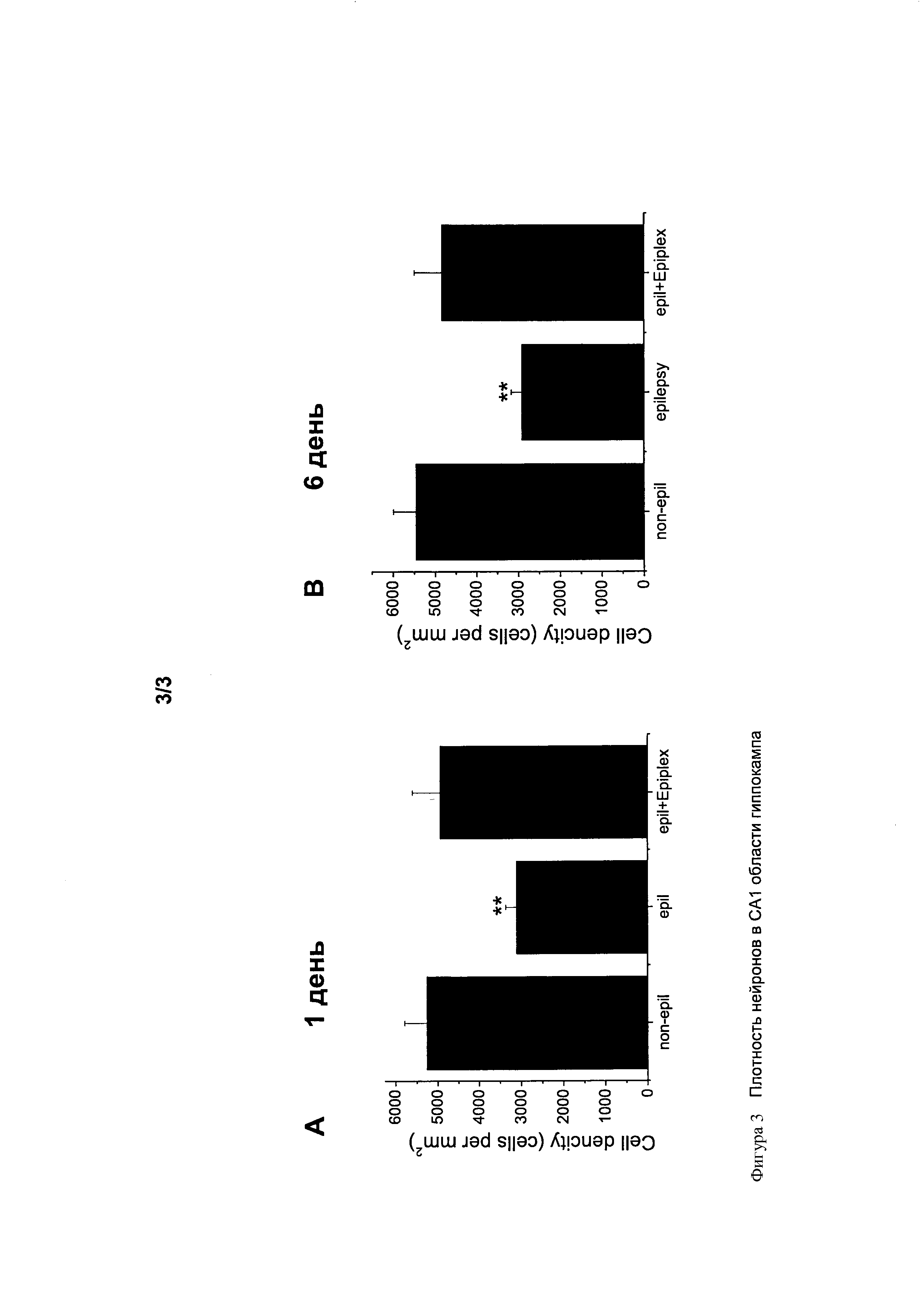
СНИЖЕНИЕ КОЛИЧЕСТВА ЭПИЛЕПТИЧЕСКИХ ПРИПАДКОВ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к лекарственным композициям, которые используются для снижения частоты и тяжести эпилептических припадков, а также их использованием.
Предпосылки создания изобретения
Эпилепсия является распространенным и разнообразным набором хронических неврологических заболеваний, характеризующихся припадками [1][2]. Для постановления диагноза «эпилепсия» необходимо, чтобы припадки возникали спонтанно. Некоторые определения понятия эпилепсия требуют, чтобы приступы были повторяющимися и неспровоцированными, [1][3][4], но другие определения требуют, чтобы возник одиночный припадок в сочетании с изменениями головного мозга, которые увеличивают вероятность будущих приступов. [5]
Определенные эпилептические синдромы требуют конкретные провоцирующие факторы или триггеры для возникновения эпилептического припадка. Их называют рефлекторной эпилепсией. Например, у пациентов с первичной эпилепсией чтения припадки вызываются на фоне чтения. [16] Фотосенситивная эпилепсия может ограничиваться припадками, вызванными мигающими огнями. Другие провоцирующие факторы могут вызвать эпилептический припадок у пациентов, которые в противном случае были бы подвержены спонтанным припадкам. Например, дети с пикнолепсией могут быть подвержены к гипервентиляции легких. Фактически, вспышки света и гипервентиляция являются активаторами, которые используются в клинической ЭЭГ для того, чтобы вызвать эпилептический припадок для помощи в диагностике. Наконец, остальные провоцирующие факторы могут способствовать возникновению, в отличие от непременного побуждения припадка у восприимчивых лиц. Эмоциональный стресс, недосыпание, сам сон, тепловой стресс, алкоголь и лихорадочные заболевания являются примерами провоцирующих факторов приведенными больными эпилепсией. Стоит отметить, что степень влияния различных провоцирующих факторов варьируется в зависимости от вида эпилептического синдрома. Так же у женщин больных эпилепсией менструальный цикл может повлиять на частоту возникновения припадков. Катамениальная эпилепсия - это термин, обозначающий припадки, связанные с менструальным циклом. [18] Тем не менее, в большинстве случаев причина не выявляется; однако, факторы, которые ассоциированы с заболеванием включают в себя: травмы головного мозга, инсульты, рак головного мозга, и злоупотребление наркотиками и алкоголем, помимо прочего. [6]
Эпилепсия, как правило, контролируется, но не излечивается, для этой цели используются антиэпилептические препараты (АЭП). Основой терапии АЭП являются противосудорожные препараты. Зачастую, противосудорожная терапия является пожизненной и может привести к серьезным последствиям, влияющим на качество жизни. Выбор противосудорожного препарата, а также их эффективность разнится в зависимости от эпилептического синдрома. Механизмы действия, эффективность по отношению к определенным эпилептическим синдромам, а также побочные эффекты отличаются в зависимости от выбранного противосудорожного препарата.
В настоящее время существует 20 препаратов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (США) (FDA) для использования при лечении эпилептических припадков в США: Карбамазепин (Тегретол), Дикалия клоразепат (Транксен), Клоназепам (Клонопин), Этосуксимид (Заронтин), Фелбамат (Фелбатол), Фосфенитоин (Церебикс), Габапентин (Нейронтин), Лакосомид (Вимпат), Ламотриджин (Ламиктал), Леветирацетам (Кеппра), Окскарбазепин (Трилептал), Фенобарбитал (Люминал), Фенитоин (Дилантин), Прегабалин (Лирика), Примидон (Мисолин), Тиагабин (Габитрил), Топирамат (Топамакс), натриевая соль вальпроевой кислоты (Депакот), Вальпроевая кислота (Депакин), и Зонисамид (Зонегран). Другие лекарственные препараты, которые еще не одобренные FDA включают в себя Клобазам (Фризиум), Вигабатрин (Сабрил), Ретигабин, Бриварацетам, Селетрацетам, Ацетазоламид (Диамокс), прогестерон, адренокортикотропный гормон (АКТГ, Актар), кортикостероидные гормоны (Преднизон), и бромид.
Другие препараты обычно используются, чтобы остановить эпилептический припадок или прервать серийные судорожные приступы, к ним относятся Диазепам (Валиум, Диастат) и Лоразепам (Ативан). К лекарствам используемым при рефрактерном эпилептическом статусе относят Паральдегид (Парал), Мидазолам (Версед), а также Пентобарбитал (Нембутал).
Основная цель, стоящая перед пациентами, - это уменьшение или полное отсутствие припадков и минимальное количество побочных эффектов. Многие больные успешно добиваются такого результата за счет монотерапии - использование одного противосудорожного препарата. Однако, некоторым пациентам необходимо назначение двух или более противосудорожных препаратов, несмотря на повышенный риск в возникновении побочных эффектов. Несмотря на это, примерно у 20% больных эпилепсией возникают эпилептические припадки на фоне подходящей противосудорожной терапии [10][11] и, примерно 88% больных отмечали возникновение как минимум одного побочного эффекта (а именно на перепады настроения, сонливость, или шаткость походки). [51]
Если эпилепсия человека не может быть взята под контроль после адекватного испытания двух или трех (мнения экспертов разнятся) разных препаратов, то эпилепсия такого человека считается неподвластной медикаментозной терапии. Исследование пациентов с ранее нелеченой эпилепсией показали, что 47% из них добились контроля над припадками, используя первый препарат.14% больных добились такого результата с использованием второго или третьего препарата. Еще 3% пришли к этому результату с использованием двух препаратов одновременно. [55] Тем не менее, у свыше 30% людей страдающих эпилепсией нет контроля над эпилептическими припадками даже с наиболее подходящей терапией.
Соответственно, существует постоянная потребность в новых методах лечения нацеленных на уменьшение частоты и тяжести приступов у больных эпилепсией, особенно у тех, кто оказался устойчивым к текущим АЭП.
Раскрытие сущности изобретения
Авторы настоящего изобретения обнаружили комплекс активных соединений, которые понижают количество эпилептических припадков в (естественных условиях), которые определенны в in vivo модели эпилепсии и, кроме того, облегчают последствия припадков, в случае их возникновения. Другим преимуществом изобретенной лекарственной композиции является то, что ее можно создавать с использованием соединений, которые уже присутствуют в организме человека в виде метаболитов и/или теми веществами, которые не являются ядовитыми для организма человека. Таким образом, изобретенная композиция минует проблемы связанные с побочными эффектами многих часто назначаемых антиэпилептических препаратов ("АЭП").
Составляющие компоненты изобретенной композиции относятся к промежуточным продуктам метаболизма Цикла Лимонной Кислоты (цикла Кребса) и аскорбата (витамин С). Не желая быть связанными теоритическими постулатами, авторы полагают, что эта смесь метаболитов и восстановительного вещества помогает восстанавливать клеточный энергетический запас и тем самым заблаговременно препятствовать негативному воздействию нейрональной гипервозбудимости.
Композиция
В соответствии с этим, один из аспектов данного изобретения связан с лекарственным препаратом в состав которого входят один или более из нижеперечисленных компонентов, а также фармацевтически приемлемый носитель, разбавитель или наполнитель:
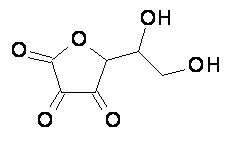
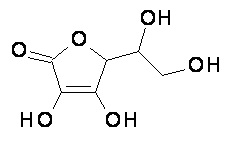
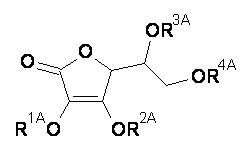
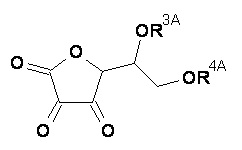
(А) композиция формулы (A-I) или (А-II):


или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
где:
-R1A означает Н либо R1AA независимо друг от друга;
-R2A означает Н либо R2AA независимо друг от друга;
-R3A означает Н либо R3AA независимо друг от друга;
-R4A означает Н либо R4AA независимо друг от друга;
-R1AA означает R1AAA либо C(O)R1AAAA независимо друг от друга;
-R2AA означает R2AAA либо C(O)R2AAAA независимо друг от друга;
-R3AA означает R3AAA либо C(O)R3AAAA независимо друг от друга;
-R4AA означает R3AAA либо C(O)R4AAAA независимо друг от друга;
-R1AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2ААА линейная или разветвленная насыщенная C1-6 алкильная группа;
-R3AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R4AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R1AAAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2AAAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R3AAAA линейная или разветвленная насыщенная C7-20 алкильная группа, либо линейная или разветвленная C7-20 алкенильная группа имеющая от 1 до 3 углерод-углеродных ненасыщенных связей; и
-R4AAAA линейная или разветвленная насыщенная C7-20 алкильная группа, либо линейная или разветвленная C7-20 алкенильная группа имеющая от 1 до 3 углерод-углеродных ненасыщенных связей;
(B) композиция формулы (B-I):

или фармацевтически приемлемая соль, гидрат или сольват вышеупомянутого; где:
R1B линейная или разветвленная насыщенная C1-6 алкильная группа;
R2B означает Н или R2BB независимо друг от друга; и
R2BB линейная или разветвленная насыщенная C1-6 алкильная группа;
(C) композиция формулы (C-I):

или фармацевтически приемлемая соль, гидрат или сольват вышеупомянутого;
где:
-R1C означает Н либо R1CC независимо друг от друга;
-R2C означает Н либо R2CC независимо друг от друга;
-R1CC линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2CC линейная или разветвленная насыщенная C1-6 алкильная группа; и
и
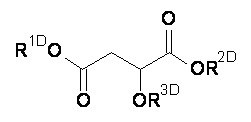
(D) композиция формулы (D-I):

или фармацевтически приемлемая соль, гидрат или сольват вышеупомянутого;
где:
-R1D означает Н либо R1DD независимо друг от друга;
-R2D означает Н либо R2DD независимо друг от друга;
-R3D означает Н либо R3DD независимо друг от друга;
-R1DD линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2DD линейная или разветвленная насыщенная C1-6 алкильная группа; и
-R3DD линейная или разветвленная насыщенная C1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компонент (А), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компонент (В), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компонент (С), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компонент (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонента (А), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонента (В), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонента (С), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонента (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А) и (В), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А) и (В), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А) и (С), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А) и (С), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (В) и (С), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (В) и (С), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (В) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (В) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (С) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (С) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А), (В) и (С), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А), (В) и (С), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А), (В) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А), (В) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А), (С) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А), (С) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (В), (С) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (В), (С) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство содержит в своем составе компоненты (А), (В), (С) и (D), а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство по существу состоит из компонентов (А), (В), (С) и (D), а также из фармацевтически приемлемого носителя, разбавителя или наполнителя.
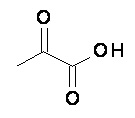
Компонент (А)
Компонент (А) относится к аскорбиновой кислоте либо к дегидроаскорбиновой кислоте, которые имеют следующее строение, соответственно:


Точнее говоря, компонент (А) это композиция формулы (A-I) или (А-II):


или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого; где:
-R1A означает Н либо R1AA независимо друг от друга;
-R2A означает Н либо R2AA независимо друг от друга;
-R3A означает Н либо R3AA независимо друг от друга;
-R4A означает Н либо R4AA независимо друг от друга;
-R1AA означает R1AAA либо C(O)R1AAAA независимо друг от друга;
-R2AA означает R2AAA либо C(O)R2AAAA независимо друг от друга;
-R3AA означает R3AAA либо C(O)R3AAAA независимо друг от друга;
-R4AA означает R3AAA либо C(O)R4AAAA независимо друг от друга;
-R1AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R3AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R4AAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R1АААА линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2AAAA линейная или разветвленная насыщенная C1-6 алкильная группа;
-R3AAAA линейная или разветвленная насыщенная С7-20 алкильная группа, либо линейная или разветвленная C7-20 алкенильная группа имеющая от 1 до 3 углерод-углеродных ненасыщенных связей; и
-R4AAAA линейная или разветвленная насыщенная C7-20 алкильная группа, либо линейная или разветвленная C7-20 алкенильная группа имеющая от 1 до 3 углерод-углеродных ненасыщенных связей;
В одном из вариантов осуществления настоящего изобретения, компонент (А) это композиция формулы (A-I), или его таутомер, или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В одном из вариантов осуществления настоящего изобретения, компонент (А) это композиция формулы (А-II), или его таутомер, или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
Следует отметить, что, когда R1A и/или R2A композиции формулы (A-I) являются водородом, то композиции формулы (A-I) могут быть представлены в различных таутомерных формах. Например, когда R1A является водородом, композиция (A-I) может взаимопревращаться между следующими таутомерами:
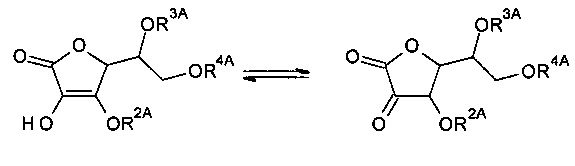
Аналогичным образом, когда R2A является водородом, композиция (A-I) может взаимопревращаться между следующими таутомерами:
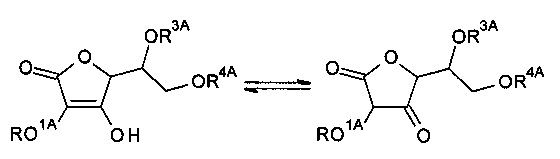
Если не указано иначе, то ссылка на один таутомер подразумевает ссылку на все таутомеры.
Кроме того, обратите внимание, композиции формул (A-I) и (А-II) имеют по меньшей мере два хиральных центра, в частности атомы углерода, отмеченные звездочкой (*) в следующих формулах. Каждый из атомов углерода в этих положениях может находиться либо в (R) либо в (S) конфигурации. Если не указано иначе, то ссылка на один энантиомер/диастереомер подразумевает ссылку на энантиомеры, а также все диастереомеры.


В одном из вариантов осуществления настоящего изобретения, компонент (А) это композиция формулы (А-Iа):

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В одном из вариантов осуществления настоящего изобретения, компонент (А) это композиция формулы (А-IIа):

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
R1A
В одном из вариантов осуществления настоящего изобретения, R1A это Н.
В одном из вариантов осуществления настоящего изобретения, R1A это R1AA.
R2A
В одном из вариантов осуществления настоящего изобретения, R2A это Н.
В одном из вариантов осуществления настоящего изобретения, R2A это R2AA.
R3A
В одном из вариантов осуществления настоящего изобретения, R3A это Н.
В одном из вариантов осуществления настоящего изобретения, R3A это R3AA.
R1AA
В одном из вариантов осуществления настоящего изобретения, R1AA это R1ААА.
В одном из вариантов осуществления настоящего изобретения, R1AA это C(O)R1AAAA
R2АА
В одном из вариантов осуществления настоящего изобретения, R2AA это R2AAA.
В одном из вариантов осуществления настоящего изобретения, R2AA это C(O)R2AAAA.
R3AA
В одном из вариантов осуществления настоящего изобретения, R3AA это R3AAA.
В одном из вариантов осуществления настоящего изобретения, R3AA это C(O)R3AAAA.
R4АА
В одном из вариантов осуществления настоящего изобретения, R4AA это R4AAA.
В одном из вариантов осуществления настоящего изобретения, R4AA это C(O)R4AAAA.
R1AAA
В одном из вариантов осуществления настоящего изобретения, R1AAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R1AAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R1AAA это -Me либо -Et.
R2AAA
В одном из вариантов осуществления настоящего изобретения, R2AAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R2AAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R2AAA это -Me либо -Et.
R3ААА
В одном из вариантов осуществления настоящего изобретения, R3AAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R3AAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R3AAA это -Me либо -Et.
R4AAA
В одном из вариантов осуществления настоящего изобретения, R4AAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R4AAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R4AAA это -Me либо -Et.
R1AAAA
В одном из вариантов осуществления настоящего изобретения, R1AAAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R1AAAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R1AAAA это -Me либо -Et.
R2AAAA
В одном из вариантов осуществления настоящего изобретения, R2AAAA это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R2AAAA это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R2AAAA это -Me либо -Et.
R3АААА
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная или разветвленная насыщенная C7-20 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная насыщенная C7-20 группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA разветвленная насыщенная C7-20 группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная или разветвленная насыщенная C13-20 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная насыщенная C13-20 группа.
В одном из вариантов осуществления настоящего изобретения, R3АААА разветвленная насыщенная С13-20 группа.
В одном из вариантов осуществления настоящего изобретения, R3АААА линейная или разветвленная насыщенная C15-17 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная насыщенная С15-17 группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA разветвленная насыщенная C15-17 группа.
В одном из вариантов осуществления настоящего изобретения, R3AAAA это С15 алкил, такой как С15H31, например, линейная С15H31 алкильная цепь.
В одном из вариантов осуществления настоящего изобретения, R3AAAA это С17 алкил, такой как С17Н35, например, линейная С17Н35 алкильная цепь.
В одном из вариантов осуществления настоящего изобретения, R3AAAA линейная или разветвленная C7-20 алкенильная группа, имеющая от 1 до 3 углерод-углеродных ненасыщенных связей.
R4АААA
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная или разветвленная насыщенная C7-20 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная насыщенная C7-20 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA разветвленная насыщенная С7-20 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная или разветвленная насыщенная С13-20 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная насыщенная С13-20 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA разветвленная насыщенная С13-20 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная или разветвленная насыщенная С15-17 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная насыщенная С15-17 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA разветвленная насыщенная С15-17 группа.
В одном из вариантов осуществления настоящего изобретения, R4AAAA это С15 алкил, такой как С15H31, например, линейная С15H31 алкильная цепь.
В одном из вариантов осуществления настоящего изобретения, R4AAAA это С17 алкил, такой как С17Н35, например, линейная С17Н35 алкильная цепь.
В одном из вариантов осуществления настоящего изобретения, R4AAAA линейная или разветвленная C7-20 алкенильная группа имеющая от 1 до 3 углерод-углеродных ненасыщенных связей.
R1A, R2A, R3A и R4A
В предпочтительном варианте осуществления настоящего изобретения, компонент (А) это композиция формулы (А-III):

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В одном из вариантов осуществления настоящего изобретения, компонент (А) это L-аскорбиновая кислота:
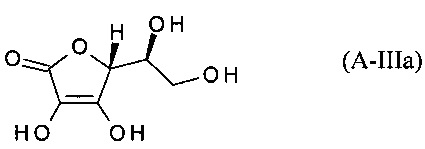
или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В еще одном из вариантов осуществления настоящего изобретения, компонент (А) это L-аскорбиновая кислота:

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В еще одном из предпочтенных вариантов осуществления настоящего изобретения, компонент (А) это композиция формулы (A-IV):

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В одном из вариантов осуществления настоящего изобретения, компонент (А) это L-дегидроаскорбиновая кислота:

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
В еще одном из вариантов осуществления настоящего изобретения, компонент (А) это D-дегидроаскорбиновая кислота:

или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
Соли
В одном из вариантов осуществления настоящего изобретения, компонент (А) это фармацевтически приемлемая соль композиция формулы (A-I), (А-II), (A-Ia), (A-IIb), (А-III), (A-IV), (А-IIIа), (A-IVa), (А-IIIb) либо (A-IVb), как описано ниже.
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R1A это М1А где М1А является катионом металла, например, катион металла выбранный из Na+, K+, Са2+, Mg2+, Cr2+, Mn2+, Fe2+, Zn2+, и Мо3+.
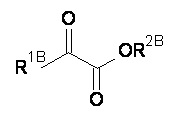
Компонент (В)
Компонент (В) это композиция формулы (B-I):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
где:
R1B линейная или разветвленная насыщенная C1-6 алкильная группа;
R2B означает Н либо R2BB независимо друг от друга; и
R2BB линейная или разветвленная насыщенная C1-6 алкильная группа.
R1B
В одном из вариантов осуществления настоящего изобретения, R1B линейная или разветвленная насыщенная C1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R1B это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R1B это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R1B это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R1B это -Me.
R2B
В одном из вариантов осуществления настоящего изобретения, R2B является водородом.
В одном из вариантов осуществления настоящего изобретения, R2B это R2BB.
R2BB
В одном из вариантов осуществления настоящего изобретения, R2BB линейная насыщенная C1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R2BB это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R2BB это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R2BB это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R2BB это -Me.
R1B и R2B
В предпочтительном варианте осуществления настоящего изобретения, R1B является метилом и R2B является водородом; то есть, компонент (В) является пировиноградной кислотой:

Соли
В одном из вариантов осуществления настоящего изобретения, компонент (В) это фармацевтически приемлемая соль композиции формулы (B-I) либо (В-II), как описано ниже.
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R2B это М2B, где М2B является фармацевтически приемлемым катионом. Например, R2B может быть М2В где М2В является неорганическим катионом, таким как Na+, K+, Са2+, Mg2+, или Al3+, либо органическим катионом, таким как: ион аммония (т.е.  ), замещенный ион аммония (например, NH3R+,
), замещенный ион аммония (например, NH3R+,  ,
, 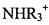 ,
, 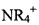 ), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
В одном из вариантов осуществления настоящего изобретения, компонент (В) это фармацевтически приемлемая соль пировиноградной кислоты, такая как пируват натрия, пируват кальция, пируват магния, либо креатин пируват.
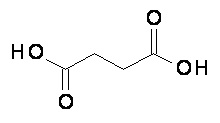
Компонент (С)
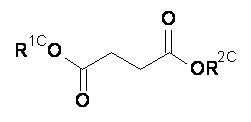
Компонент (С) относится к янтарной кислоте, которая имеет следующую структуру:

Точнее говоря, компонент (С) это композиция формулы (C-I):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
где:
1СС
-R1С означает Н либо R1СС независимо друг от друга;
-R2C означает Н либо R2CC независимо друг от друга;
-R1CC линейная или разветвленная насыщенная C1-6 алкильная группа; и
-R2CC линейная или разветвленная насыщенная C1-6 алкильная группа.
R1C
В одном из вариантов осуществления настоящего изобретения, R1C это Н.
В одном из вариантов осуществления настоящего изобретения, R1C это R1CС.
R2C
В одном из вариантов осуществления настоящего изобретения, R2C это Н.
В одном из вариантов осуществления настоящего изобретения, R2C это R2CC.
R1СС
В одном из вариантов осуществления настоящего изобретения, R1CC линейная насыщенная
С1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R1СС это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R1CC это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R1CC это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R1CC это -Me.
R2CC
В одном из вариантов осуществления настоящего изобретения, R2CC линейная насыщенная
С1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R2CC это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R2CC это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R2CC это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R2CC это -Me.
Соли
В одном из вариантов осуществления настоящего изобретения, компонент (С) это фармацевтически приемлемая соль композиция формулы (C-I) либо (С-II), как описано ниже.
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R1C это М1C, где М1C является фармацевтически приемлемым катионом. Например, R1C может быть М1C где М1C является неорганическим катионом, таким как Na+, K+, Са2+, Mg2+, или Al3+, либо органическим катионом, таким как: ион аммония (т.е. 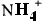 ), замещенный ион аммония (например, NH3R+,
), замещенный ион аммония (например, NH3R+, 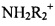 ,
, 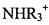 ,
, 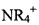 ), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R2C это М2C, где М2C является фармацевтически приемлемым катионом. Например, R2C может быть М2C где М2C является неорганическим катионом, таким как Na+, K+, Са+, Mg2+, или Al3+, либо органическим катионом, таким как: ион аммония (т.е. 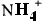 ), замещенный ион аммония (например, NH3R+,
), замещенный ион аммония (например, NH3R+, 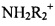 ,
, 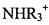 ,
, 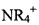 ), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
), или креатин (т.е. 2-[карбамимидоил(метил)амино] уксусная кислота).
Компонент (D)
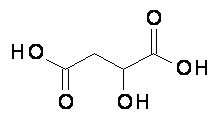
Компонент (D) относится к яблочной кислоте, которая имеет следующую структуру:

Точнее говоря, компонент (D) это композиция формулы (D-I):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
где:
-R1D означает Н либо R1DD независимо друг от друга;
-R2D означает Н либо R2DD независимо друг от друга;
-R3D означает Н либо R3DD независимо друг от друга;
-R1DD линейная или разветвленная насыщенная C1-6 алкильная группа;
-R2DD линейная или разветвленная насыщенная С1-6 алкильная группа;
-R3DD линейная или разветвленная насыщенная C1-6 алкильная группа.
Кроме того, обратите внимание, композиция формулы (D-I) имеет по меньшей мере один хиральный центр, а именно, атом углерода к которому прикреплено -OR3D. Атом углерода в этих положениях может находиться либо в (R) либо в (S) конфигурации. Если не указано иначе, то ссылка на один энантиомер/диастереомер подразумевает ссылку на энантиомеры, а также все диастереомеры.
В одном из вариантов осуществления настоящего изобретения, компонент (D) это композиция формулы (D-Ia):

В одном из вариантов осуществления настоящего изобретения, компонент (D) это композиция формулы (D-Ib):
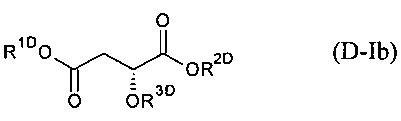
R1D
В одном из вариантов осуществления настоящего изобретения, R1D это Н.
В одном из вариантов осуществления настоящего изобретения, R1D это R1DD.
R2D
В одном из вариантов осуществления настоящего изобретения, R2D это Н.
В одном из вариантов осуществления настоящего изобретения, R2D это R2DD.
R3D
В одном из вариантов осуществления настоящего изобретения, R3D это Н.
В одном из вариантов осуществления настоящего изобретения, R3D это R3DD.
R1DD
В одном из вариантов осуществления настоящего изобретения, R1DD линейная насыщенная
С1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R1DD это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R1DD это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R1DD это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R1DD это -Me.
R2DD
В одном из вариантов осуществления настоящего изобретения, R2DD линейная насыщенная C1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R2DD это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R2DD это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R2DD это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R2DD это -Me.
R3DD
В одном из вариантов осуществления настоящего изобретения, R3DD линейная насыщенная C1-6 алкильная группа.
В одном из вариантов осуществления настоящего изобретения, R3DD это -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, либо -tBu.
В одном из вариантов осуществления настоящего изобретения, R3DD это -Me, -Et, -nPr, -iPr.
В одном из вариантов осуществления настоящего изобретения, R3DD это -Me либо -Et.
В одном из вариантов осуществления настоящего изобретения, R3DD это -Me.
Соли
В одном из вариантов осуществления настоящего изобретения, компонент (D) это фармацевтически приемлемая соль композиции формулы (D-I), (D-Ia), (D-Ib) либо (D-II), как описано ниже.
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R1D это М1D, где М1D является фармацевтически приемлемым катионом. Например, R1D может быть M1D где М1D является неорганическим катионом, таким как Na+, K+, Са2+, Mg2+, или Al3+, либо органическим катионом, таким как: ион аммония (т.е. 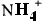 ), замещенный ион аммония (например, NH3R+,
), замещенный ион аммония (например, NH3R+, 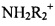 ,
, 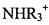 ,
, 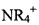 ), или креатин (т.е. 2-[карбамимидоил(метил)амино]уксусная кислота).
), или креатин (т.е. 2-[карбамимидоил(метил)амино]уксусная кислота).
Особенно подходящие фармацевтически приемлемые соли включают соединения, где R2D это М2D, где М2D является фармацевтически приемлемым катионом. Например, R2D может быть M2D где M2D является неорганическим катионом, таким как Na+, K+, Са2+, Mg2+,или Al3+, либо органическим катионом, таким как: ион аммония (т.е. 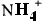 ), замещенный ион аммония (например, NH3R+,
), замещенный ион аммония (например, NH3R+, 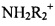 ,
, 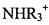 ,
, 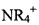 ), или креатин (т.е. 2-[карбамимидоил(метил)амино]уксусная кислота).
), или креатин (т.е. 2-[карбамимидоил(метил)амино]уксусная кислота).
Комбинации (А), (В), (С) и (D)
В особенно предпочтительном варианте осуществления настоящего изобретения, лекарственное средство содержит в своем составе два или более из следующих компонентов, а также фармацевтически приемлемый носитель, разбавитель или наполнитель.
(A) композиция формулы (А-III) или (A-IV):


или его таутомер;
или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
(B) композиция формулы (В-II):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого;
(C) композиция формулы (С-II):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого; и
(D) композиция формулы (D-II):

или фармацевтически приемлемая соль, гидрат или сольват любого из вышеупомянутого.
Количество Компонентов
Соответствующим образом, композиция состоит из 0.8-1.2 массового процента компонента (А), где массовый процент будучи по отношению к общему количеству компонентов (А), (В), (С) и (D) в композиции. Например, композиция может состоять из 0.9-1.1 массового процента компонента (А), как например 0.95-1.05 массового процента.
Соответствующим образом, композиция состоит из 26-40 массового процента компонента (В), где массовый процент будучи по отношению к общему количеству компонентов (А), (В), (С) и (D) в композиции. Например, композиция может состоять из 28-38 массового процента компонента (В), как например 30-36 либо 32-34 массового процента.
Соответствующим образом, композиция состоит из 26-40 массового процента компонента (С), где массовый процент будучи по отношению к общему количеству компонентов (А), (В), (С) и (D) в композиции. Например, композиция может состоять из 28-38 массового процента компонента (С), как например 30-36 либо 32-34 массового процента.
Соответствующим образом, композиция состоит из 26-40 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (А), (В), (С) и (D) в композиции. Например, композиция может состоять из 28-38 массового процента компонента (D), как например 30-36 либо 32-34 массового процента.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 26-40 массового процента компонента (В), 26-40 массового процента компонента (С), и 26-40 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (А), (В), (С) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В), (С) и (D) с молярным соотношением 2-3:150-230:110-170:100-150 (A:B:C:D).
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В), (С) и (D) с молярным соотношением 2:150:110:100 (A:B:C:D).
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 39.5-59.5 массового процента компонента (В), 39.5-59.5 массового процента компонента (С), где массовый процент, будучи по отношению к общему количеству компонентов (А), (В) и (С) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 39.5-59.5 массового процента компонента (В), 39.5-59.5 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (А), (В) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 39.5-59.5 массового процента компонента (С), 39.5-59.5 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (А), (С) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 39.5-59.5 массового процента компонента (В), 39.5-59.5 массового процента компонента (С), где массовый процент, будучи по отношению к общему количеству компонентов (А), (В) и (С) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 26-40 массового процента компонента (В), 26-40 массового процента компонента (С), 26-40 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (В), (С) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В) и (С) с молярным соотношением 2-3:230-340:170-250
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В) и (С) с приблизительным молярным соотношением 2:230:170
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В) и (D) с молярным соотношением 2-3:230-340:150-225
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (В) и (D) с приблизительным молярным соотношением 2:230:150
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (С) и (D) с молярным соотношением 2-3:170-250:150-225
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А), (С) и (D) с приблизительным молярным соотношением 2:170:150
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В), (С) и (D) с молярным соотношением 150-230:110-170:100-150
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В), (С) и (D) с приблизительным молярным соотношением 150:110:100.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 98.8-99.2 массового процента компонента (В), где массовый процент, будучи по отношению к общему количеству компонентов (А) и (В) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 98.8-99.2 массового процента компонента (С), где массовый процент, будучи по отношению к общему количеству компонентов (А) и (С) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 0.8-1.2 массового процента компонента (А), 98.8-99.2 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (А) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 40-60 массового процента компонента (В), 40-60 массового процента компонента (С), где массовый процент, будучи по отношению к общему количеству компонентов (В) и (С) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 40-60 массового процента компонента (В), 40-60 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (В) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из 40-60 массового процента компонента (С), 40-60 массового процента компонента (D), где массовый процент, будучи по отношению к общему количеству компонентов (С) и (D) в композиции.
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (В) с молярным соотношением 1-1.5:281-282
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (В) с приблизительным молярным соотношением 1:281
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (С) с молярным соотношением 1-1.5:209-210
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (С) с приблизительным молярным соотношением 1:209
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (D) с молярным соотношением 1-1.5:184-185
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (А) и (D) с приблизительным молярным соотношением 1:184
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В) и (С) с молярным соотношением 230-340:170-250
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В) и (С) с приблизительным молярным соотношением 230:170
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В) и (D) с молярным соотношением 230-340:150-225
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (В) и (D) с приблизительным молярным соотношением 230-150
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (С) и (D) с молярным соотношением 170-250:150-225
В одном из вариантов осуществления настоящего изобретения, композиция состоит из компонентов (С) и (D) с приблизительным молярным соотношением 170:150
Общий химический синтез
Большинство составных формул (A-I), (B-I), (C-I) и (D-I) согласно настоящему описанию могут быть получены из коммерческих источников. Остальные составные формул (A-I), (B-I), (C-I) и (D-I) могут быть получены с использованием традиционных способов, известных в данной области, или путем адаптации обычных методов, известных в данной области обычными способами.
Изомеры
Некоторые соединения могут существовать в одной или нескольких определенных геометрических, оптических, энантиомерных, диастереоизомерных, эпимерных, атропических, стереоизомерных, таутомерных, конформационых, или аномерных форм, в том числе, но не ограничиваясь перечисленным, cis- и trans-формы; Е- и Z-формы; с-, t-, и r-формы; эндо- и экзо-формы; R-, S-, и мезо-формы; D- и L-формы; d- и l-формы; (+) и (-) формы; кето-, энол-, и энолат-формы; syn- и anti-формы; синклинальные- и антиклинальная-формы; α- и β-формы; осевые и экваториальная формы; лодка- (boat-), стул- (chair-), изгиб- (twist-), конверт- (envelope-), и полустул- (halfchair-) формы; и их комбинации, в дальнейшем совместно именуемые "изомерами" (или "изомерными формами").
Ссылка на класс структур вполне может включать в себя структурно изомерные формы, попадающие в пределах этого класса (например, C1-6 алкил включает в себя n-пропил и iso-пропил; бутил включает в себя n-, iso-, sec-, и tert-бутил). Однако ссылка на конкретную группу или заместительную модель не предполагает учет других структурных (или органических изомеров), которые различаются между собой относительно типу атомных связей, а не по их положению в пространстве. Например, ссылка на метокси группу, - OCH3, не должна рассматриваться как ссылка на его структурный изомер, гидроксиметильную группу, -CH2OH. Вышеуказанное исключение не распространяется на таутомерные формы, упомянутые выше.
Следует отметить, что подразумевающимися под термином "изомер" являются соединения с одним или несколькими изотопными замещениями. К примеру, Н может быть в любой изотопной форме, в том числе 1Н, 2Н (D), и 3Н (Т); С может быть в любой изотопной форме, в том числе 12С, 13С, и 14С; О может быть в любой изотопной форме, в том числе 16O и 18О; и тому подобное.
Если не указано иначе, ссылка на конкретное соединение включает в себя все такие изомерные формы, включая смеси (например, рацемические смеси) такового. Способы получения (например, асимметричный синтез) и разделения (например, фракционной кристаллизацией и хроматографическими средствами) таких изомерных форм, либо известны в данной области либо могут быть легко получены путем адаптации методов описанными в данном документе, или известными методами, известным образом.
Соли
Целесообразно или даже желательно подготовить, очистить и/или обработать соответствующую соль соединений формул (A-I), (А-II), (A-Ia), (A-IIb), (А-III), (A-IV), (А-IIIа), (A-IVa), (A-IIIb), (A-IVb), (B-I), (B-II), (C-I), (C-II), (D-I), (D-Ia), (D-Ib) либо (D-II), например, фармацевтически приемлемую соль. Примеры фармацевтически приемлемых солей описываются в Berge et al., 1977, "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19.
Например, если соединение является анионным или имеет функциональную группу, которая может быть анионной {например., -СООН может быть -COO-), тогда можно будет составить соль с подходящим катионом. Примерами подходящих неорганических катионов являются, но не ограничиваются перечисленным, ионы щелочных металлов, таких как Na+ и K+, щелочноземельных катионов, таких как Са2+ и Mg2+, и других катионов, таких как Al3+. Примерами подходящих органических катионов являются, но не ограничиваются перечисленным, ионы аммония (т.е. 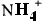 ), замещенные ион аммония (например, NH3R+,
), замещенные ион аммония (например, NH3R+, 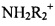 ,
, 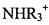 ,
, 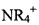 ). Примерами некоторых подходящих замещенных ионов аммония являются те, которые были получены из: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером распространенного иона четвертичного аммония является is
). Примерами некоторых подходящих замещенных ионов аммония являются те, которые были получены из: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером распространенного иона четвертичного аммония является is 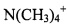 .
.
Если не указано иначе, ссылка на конкретное соединение также включает их солевые формы.
Сольваты и гидраты
Целесообразно или даже желательно подготовить, очистить и/или обработать соответствующие сольваты соединений формул (A-I), (А-II), (A-Ia), (A-IIb), (А-III), (A-IV), (А-IIIа), (A-IVa), (A-IIIb), (A-IVb), (B-I), (B-II), (C-I), (C-II), (D-I), (D-Ia), (D-Ib) либо (D-II), либо фармацевтически приемлемые соли вышеуказанного. Понятие «сольват» именуемое в настоящем документе, в общепринятом значении, будет использоваться для обозначения комплекса: раствор (например, композиции, соли композиций) и растворитель. Если в качестве растворителя используется вода, то сольват будет условно называться гидратом, например, моногидрат, дигидрат, тригидрат и т.д.
Если не указано иначе, ссылка на конкретное соединение также включает их сольватные и гидратные формы.
Химически защищенные Формы
Целесообразно или даже желательно подготовить, очистить и/или обработать соединения формул (A-I), (А-II), (A-Ia), (A-IIb), (А-III), (A-IV), (А-IIIа), (A-IVa), (A-IIIb), (A-IVb), (B-I), (B-II), (C-I), (C-II), (D-I), (D-Ia), (D-Ib) либо (D-II), либо фармацевтически приемлемые соли вышеуказанного в химически защищенной форме. Понятие «химически защищенная форма» именуемое в настоящем документе, в общепринятом химическом значении, будет использоваться по отношению к соединению, в котором одна или более реакционноспособная функциональная группа защищена от нежелательных химических реакций при определенных условиях (например, pH, температура, радиация, растворитель, и тому подобное). На практике, хорошо известные химические методы используются для обратимого приведения в нереакционноспособное состояние функциональную группу, которая иначе была бы реакционноспособна, при определенных условиях. В химически защищенной форме одна или более реакционноспособная функциональная группа находятся в форме защищенной или защитной группы (также известная как замаскированная или маскирующая группа, либо блокированная или блокирующая группа). Защищая реакционноспособную функциональную группу, реакции с участием других незащищенных реакционноспособных функциональных групп могут быть выполнены, не влияя на защищенную группу; защитная группа может быть удалена, как правило, на последующем этапе, без существенного влияния на остальную часть молекулы. Дополнительную информацию можно получить в Protective Groups in Organic Synthesis (Т. Green and P. Wuts; 4th Edition; John Wiley and Sons, 2006).
Широкое разнообразие таких "защитных", "блокирующих", или "маскирующих" методов широко используются и хорошо известны в области органического синтеза. Например, соединение, которое имеет две неэквивалентные реакционноспособные функциональные группы, обе из которых были бы реактивными в определенных условиях, могут быть модифицированы для того, чтобы превратить одну из функциональных групп в «защищенную» и, следовательно, в нереакционноспособную, в заданных условиях; таким образом, будучи защищенным, соединение можно использовать в качестве реагента, которое, фактически, имеет только одну реакционноспособную функциональную группу. После того, как желаемая реакция (с участием другой функциональной группы) завершена, защищенную группу можно "лишить защиты" для того, чтобы вернуть ее в исходное функциональное состояние.
Например, гидроксильная группа может быть защищена в виде эфира (-OR) или сложного эфира (-OC(=O)R), например, как: t-бутиловый эфир; бензильный, бензогидрильный (дифенилметил), или тритильный (трифенилметил) эфир; триметилсилиловый или t-бутилдиметилсилиловый эфир; или сложный ацетильный эфир (-ОС(=O)СН3, -ОАс).
Например, альдегидная или кетоновая группа может быть защищена в виде ацеталя (R-CH(OR)2) или кеталя (R2C(OR)2), соответственно, в которых карбонильная группа (>С=O) преобразована в диэфир (>C(OR)2), в результате реакции с, например, первичным спиртом. Альдегидная или кетоновая группа легко регенерируется путем гидролиза с использованием большого количества воды в присутствии кислоты.
Например, группа карбоновой кислоты может быть защищена в виде сложного эфира, например, в виде: сложного С1-7алкильного эфира (например, сложный метиловый эфир; сложный t-бутиловый эфир); сложного С1-7галогеналкильного эфира (например, сложный тригалоидалкильный эфир); сложного триС1-7алкилсилил1-7алкильного эфира; или сложного С5-20арилС1-7алкильного эфира (например, сложный бензиловый эфир, сложный нитробензильный эфир); или в виде амида, например, в виде метилового амида.
Пролекарства
Целесообразно или даже желательно подготовить, очистить и/или обработать соединения формул (A-I), (А-II), (A-Ia), (A-IIb), (А-III), (A-IV), (А-IIIа), (A-IVa), (A-IIIb), (A-IVb), (B-I), (B-II), (C-I), (C-II), (D-I), (D-Ia), (D-Ib) либо (D-II), либо фармацевтически приемлемые соли вышеуказанного в виде пролекарства. Понятие «пролекарство» именуемое в настоящем документе относится к соединению, которое, когда метаболизируется (например, в условиях in vivo), производит требуемое активное соединение. Как правило, пролекарство является неактивным, или менее активным, чем требуемое активное соединение, но может способствовать более эффективным обработке, введения средства, а также влиять на метаболические свойства соединения.
Например, некоторые пролекарства представляют собой сложные эфиры активного соединения (например, физиологически приемлемый метаболически неустойчивый сложный эфир). В ходе обмена веществ, эфирная группа (-С(=O)OR) расщепляется с образованием активного лекарственного средства. Такие сложные эфиры могут быть получены путем эстерификации, например, любой из карбоксильных групп (-С(=O)ОН) в исходном соединении, с, в случае необходимости, предварительной защитой любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим "лишением защиты", если потребуется.
Лекарственные формы
Хоть это и допустимо, вводить лекарственное средство, описанное в этом документе, в чистом виде, но все же предпочтительнее вводить его в виде лекарственного средства, вместе с одним или несколькими другими фармацевтически приемлемыми ингредиентами, которые хорошо известны специалистам в данной области, в том числе, но не ограничиваясь ими, фармацевтически приемлемые носители, разбавители, формообразующие, вспомогательные вещества, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, смачивающие агенты), дезодораторы, красители, вкусовые агенты, и подслащивающие агенты. Препарат может дополнительно включать другие действующие вещества, например, другие терапевтические или профилактические средства.
Таким образом, настоящее изобретение далее предоставляет лекарственные препараты, как было выше упомянуто, и способы получения лекарственного препарата, состоящего из смеси двух или более компонентов (А), (В), (С) и (D), согласно настоящему описанию, в сочетании с одним или несколькими фармацевтически приемлемыми ингредиентами, которые хорошо известны специалистам в этой области техники, например, носителями, разбавителями, наполнителями и т.д. Будучи произведенные в виде дискретных единицах (например, таблетки и т.д.), каждая единица будет содержать заранее определенное количество (дозу) соединения.
Термин "фармацевтически приемлемый", в данном описании, относится к соединениям, ингредиентам, материалам, композициям, лекарственным формам и т.д., которые, в пределах медицинских показаний, подходят для использования в контакте с тканями субъекта исследования (например, человека) без излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумных соотношением польза/риск. Каждый носитель, разбавитель, наполнитель и т.д., также должен быть "приемлемыми" в смысле совместимости по отношению к другим ингредиентам композиции.
Подходящие носители, разбавители, наполнители и т.п., можно найти в установившейся фармацевтической литературе, например в, Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; and Handbook of Pharmaceutical Excipients, 5th edition, 2005.
Препараты могут быть приготовлены любыми, хорошо известными в области фармации, методами. Такие методы включает в себя шаг соединения компонентов (А), (В), (С) и/либо (D) с носителем, который представляет собой один или несколько вспомогательных ингредиентов. В целом, препараты получают путем равномерного и тщательного перемешивания двух или более компонентов, выбранных из (А), (В), (С) и (D) с носителями (например, жидкие носители, тонко измельченные твердые носители, и т.д.), а затем приданием формы полученному продукту, в случае необходимости.
Препарат можно синтезировать в целях обеспечения быстрого или медленного высвобождения; немедленного, отсроченного, назначенного на определенное время или замедленного высвобождения; или комбинацию вышеперечисленного.
Препараты могут подходящим образом быть в форме жидкостей, растворов (например, водный раствор, неводный), суспензий (например, водный раствор, неводный), эмульсии (например, масло-в-воде, вода-в-масле), эликсиров, сиропов, лекарственной каши, жидкостей для полоскания рта, капель, таблеток (в том числе, например, таблетки, покрытые оболочкой), гранул, порошков, таблеток для рассасывания, пастилки, капсул (включая, например, твердые и мягкие желатиновые капсулы), крахмальной облатки, драже, ампул, пилюль, суппозиториев, вагинальных суппозиториев, настойки, геля, пасты, мази, крема, лосьона, масла, пены, спрея, или аэрозоля.
В одном варианте осуществления лекарственный препарат представляет собой раствор композиции в воде. В таком варианте осуществления изобретения нижний предел количества фармацевтической композиции в воде может быть 1 мг/л, 10 мг/л, 30 мг/л, 50 мг/л, 100 мг/л, 500 мг/л, 1 г/л, 2 г/л или 5 г/л. В таком варианте осуществления изобретения верхний предел количества фармацевтической композиции в воде может быть 50 мг/л, 100 мг/л, 500 мг/л, 1 г/л, 2 г/л, 5 г/л или 10 г/л.
Препараты могут подходящим образом быть представлены в виде пластыря, лейкопластыря, бинта, повязки или тому подобное, что пропитано одним или несколькими соединениями, а также, в необязательном порядке, один или несколько других фармацевтически приемлемых ингредиентов, включая, например, энхансеры проникновения, проникания и поглощения. Лекарственные препараты также могут быть, подходящим образом, представлены в виде депо или резервуара.
Компоненты (А), (В), (С) и/либо (D) могут быть растворены в, подвешены в, или смешаны с одним или несколькими другими фармацевтически приемлемыми ингредиентами. Компоненты (А), (В), (С) и/либо (D) могут быть представлены в виде липосом или других микрочастиц, которые разработаны с целью прикрепления компонентов (А), (В), (С) и/либо (D) к, например, элементам крови или к одному или нескольким органам.
Лекарственные формы, подходящие для перорального приема (например, путем приема внутрь) включают жидкости, растворы (например, водный раствор, неводный), суспензии (например, водный раствор, неводный), эмульсии (например, масло-в-воде, вода-в-масле), эликсиры, сиропы, лекарственной каши, таблеток, гранул, порошков, капсул, крахмальных облаток, драже, ампул, пилюль.
Лекарственные формы, подходящие для введения буккально включают жидкости для полоскания рта, леденцы, пастилки, а также пластырь, лейкопластырей, хранилищ и резервуаров. Леденцы, как правило, содержат компоненты (А), (В), (С) и/или (D) с вкусовыми добавками, как правило, сахароза и аравийская камедь или трагакантовая камедь. Пастилки, как правило, включают в себя компоненты (А), (В), (С) и/или (D) в инертной матрице, такой как желатин и глицерин, или сахароза и аравийская камедь. Жидкости для полоскания рта, как правило, включают соединение в приемлемом жидком носителе.
Лекарственные формы, подходящие для подъязычного применения, включают таблетки, леденцы, пастилки, капсулы и таблетки.
Лекарственные формы, подходящие для чресслизистого перорального введения, включают жидкости, растворы (например, водные, неводные), суспензии (например, водный раствор, неводный), эмульсии (например, масло-в-воде, вода-в-масле), жидкости для полоскания рта, леденцы, пастилки, а также пластыри, депо и резервуары.
Лекарственные формы, подходящие для чресслизистого, не оральным путем, введения включают жидкости, растворы (например, водные, неводные), суспензии (например, водный раствор, неводный), эмульсии (например, масло-в-воде, вода-в-масле), суппозитории, пессарии, гели, пасты, мази, кремы, лосьоны, масла, а также лейкопластыри, депо и резервуары.
Таблетки могут быть изготовлены обычными способами, например, прессованием или формованием, при необходимости с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием, в подходящем устройстве, компоненты (А), (В), (С) и/или (D) в сыпучей форме, такой как порошок или гранулы, при необходимости смешанной с одним или несколькими связующими веществами (например, повидон, желатин, аравийска камедь, сорбит, трагакантовая камедь, гидроксипропилметилцеллюлоза); наполнителями или разбавителями (например, лактоза, микрокристаллическая целлюлоза, гидрофосфат кальция); смазывающими веществами (например, стеарат магния, тальк, диоксид кремния); разрыхлителями (например, натрий гликолат крахмала, перекрестно-сшитый повидон, перекрестно-сшитый натрий карбоксиметилцеллюлоза); поверхностно-активными или диспергирующими или смачивающими агентами (например, лаурилсульфат натрия); консервантами (например, метил-п-гидроксибензоат, пропил-п-гидроксибензоат, сорбиновая кислота); ароматизаторами, усилителями вкуса и подсластителями. Формованные таблетки могут быть изготовлены при помощи формования в подходящем устройстве смесь порошкообразных компонентов (А), (В), (С) и/или (D), увлажненных инертным жидким разбавителем. Таблетки могут быть, при необходимости покрыты либо выбранены и могут быть приготовлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение компонентов (А), (В), (С) и/или (D), с помощью, например, гидроксипропилметилцеллюлозы в различных пропорциях, чтобы обеспечить желаемый профиль высвобождения. Таблетки могут быть снабжены покрытием, например, для того, чтобы воздействовать на высвобождение, например, энтеросолюбильное покрытие, для обеспечения высвобождения в всех частях кишечника, за исключением желудка.
Мази, как правило, получают из компонентов (А), (В), (С) и/или (D) и парафиновой или водорастворимой мазевой основы.
Кремы, как правило, получают из компонентов (А), (В), (С) и/или (D) и кремовой основы типа масло-в-воде. При желании, водный компонент кремовой основы может включать, например, по меньшей мере, около 30% многоатомного спирта в весовом отношении многоатомного спирта, т.е. спирт, имеющий две или более гидроксильные группы такие как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль, а также смеси вышеперечисленного. Препараты для местного применения могут, по желанию включать соединение, которое увеличивает поглощение либо проникновение компонентов (А), (В), (С) и/или (D), через кожу или через другие пораженные участки. Примеры таких энхансеров дермального проникновения включают диметилсульфоксид и родственные аналоги. 1
Эмульсии, как правило, получают из компонентов (А), (В), (С) и/или (D), и масляной фазы, которая по мере необходимости может содержать лишь только вещество, способствующее эмульгированию (иначе известное как эмульгатор), или оно может содержать смесь по меньшей мере, одного эмульгатора с жиром или маслом, или,одновременно как и с жиром так и с маслом. Предпочтительно, чтобы гидрофильный эмульгатор прилагался вместе с липофильным эмульгатором, который действует в качестве стабилизатора. Также желательно включать как и масло, так и жир. Вместе эмульгатор(ы) с или без стабилизатора(ов) образуют так называемый эмульгирующий воск, а воск вместе с маслом и/или жиром образует так называемую эмульгирующую основу мази, которая образует масляную дисперсную фазу крема.
Подходящие эмульгаторы и стабилизаторы эмульсий, включать в себя Tween 60, Span 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для композиции основан на достижении желаемых косметических свойств, поскольку растворимость компонентов (А), (В), (С) и/или (D) большинства масел, которые будут использоваться в композиции эмульсии может быть очень низкой. Таким образом, крем должен, предпочтительно, быть нежирным, не оставляющим пятен и отмывающимся продуктом с соответствующей консистенцией во избежание утечки из тюбиков и других контейнеров. Прямо- или разветвленно-цепные, моно- или двухосновные алкиловые сложные эфиры, такие как ди-изоадипат, изоцетил стеарат, пропиленгликолевый двухзамещенный сложный эфир жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексил пальмитат или смесь разветвленно-цепных сложных эфиров, известных как Crodamol САР могут быть использованы, три последних сложных эфира являются предпочтительными. Они могут быть использованы индивидуально или в сочетании в зависимости от требуемых свойств. В качестве альтернативы, могут быть использованы липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла.
Лекарственные формы, подходящие для интраназального введения, где носителем является жидкость, включают в себя, например, назальный спрей, капли в нос, или в аэрозольной форме с использованием небулайзера, включающей водные или масляные растворы компонентов (А), (В), (С) и/или (D).
Лекарственные формы, подходящие для интраназального введения, где носителем является твердое вещество, включают в себя, например, те, которые представленны в виде крупного порошка, имеющего размер частиц, например, в диапазоне примерно от 20 до 500 микрон, который вводится в порядке, в котором лекарство для вдыхания через нос должно приниматься внутрь, то есть путем быстрого вдоха через носовой проход из контейнера с порошком, подносимого близко к носу.
Лекарственные формы, подходящие для введения в легкие (например, путем ингаляции или инсуффляционной терапией) включают те, которые представлены в виде аэрозольного спрея из герметичной упаковки, с использованием подходящего пропеллента, такого как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или других подходящих газов.
Лекарственные формы, подходящие для введения в глаза, включают глазные капли, в которых компоненты (А), (В), (С) и/или (D) растворены или суспендированы в подходящем носителе, особенно водного растворителя для соединения.
Лекарственные формы, подходящие для ректального введения, могут быть представлены в виде суппозиториев с подходящей основой, содержащей, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы, например, масло какао или салицилат; или в виде раствора или суспензии для лечения клизмой.
Препараты, подходящие для внутривагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к компонентам (А), (В), (С) и/или (D), такие носители, которые считаются в данной области техники приемлемыми.
Лекарственные формы, подходящие для парентерального применения (например, путем инъекции), включают в себя водные или неводные изотонические апирогенные, стерильные жидкости (например, растворы, суспензии), в котором компоненты (А), (В), (С) и/или (D) растворены, суспендированы или предоставляются иным образом (например, в липосоме или другой микрочастице). Такие жидкости могут дополнительно содержать и другие фармацевтически приемлемые ингредиенты, такие как антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатические агенты, суспендирующие агенты, загустители и растворенные вещества, которые делают препарат изотоничным плазме крови (или другой соответствующей биологической жидкости) предполагаемого реципиента. Примеры наполнителей включают в себя, например, воду, спирты, полиолы, глицерин, растительные масла и тому подобное. Примерами подходящих изотонических носителей для использования в таких композициях, являются раствор натрия хлорида для инъекций, раствор Рингера, либо раствор Рингера с лактатом для инъекций. Как правило, концентрация компонентов (А), (В), (С) и/или (D) в жидкости составляет от, приблизительно 1 нг/мл до, примерно 10 мкг/мл, например, примерно от 10 нг/мл до около 1 мкг/мл. Препараты могут быть представлены в разово-дозовой или в многодозовой герметично закрытой таре, например, ампулах и флаконах, и могут храниться в высушенном при замораживании (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекции, непосредственно перед использованием. Импровизированные растворы и суспензии для инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток.
Дозировка
Специалист в данной области техники должен знать, что приемлемые дозы фармацевтических композиций настоящего изобретения, могут варьировать от пациента к пациенту. Определение оптимальной дозы, как правило, включает сопоставление уровня терапевтического эффекта по отношении к любому риску или разрушительным побочным эффектам. Выбранный уровень дозировки будет зависеть от ряда факторов в том числе, но не ограничиваясь этим, активности компонентов лекарственного средства, способа введения, время введения, скорости выведения компонентов лекарства, продолжительности лечения, других лекарственных средств, соединений и/или материалов использованных совместно, тяжести состояния, а также от вида, пола, возраста, веса, состояния, здоровья, и предварительного анамнеза пациента. Количество фармацевтической композиции и ее способа введения, в конечном счете будет по усмотрению врача, ветеринара или клинициста, хотя обычно дозировка подбирается для достижения локальной концентрации на месте действия, которая приводит к достижению желаемого эффекта, не вызывая существенных опасных или вредных побочных эффектов.
Введение может быть осуществлено в виде одной дозы, непрерывно или периодически (например, в виде разделенных доз через определенные промежутки времени) на протяжении всего курса лечения. Методы определения наиболее эффективных средств и дозировок вводимых композиций хорошо известны специалистам в данной области и будут отличаться в зависимости от применяемого средства в качестве терапии, самой цели терапии, клетки-мишени(ей) подлежащих лечению, и лечимого больного. Разовое или многократное введение может быть реализовано, где дозы и алгоритм лечения выбираются лечащим врачом, ветеринаром, или врачом.
Как правило, подходящая доза фармацевтической композиции находится в диапазоне примерно от 0,01 мг/кг до около 250 мг/кг от массы тела в день, или в любом другом диапазоне в этих пределах. Предпочтительный диапазон составляет приблизительно от 0,1 до около 100,0 мг/кг от массы тела в день, или в любом другом диапазоне в этих пределах; оптимальнее выбирать диапазон, от примерно 0,5 мг/кг до около 50 мг/кг, или в любом другом диапазоне в этих пределах; еще более оптимальнее диапазон, от примерно 1,0 до примерно 30,0 мг/кг массы тела в день, или в любом другом диапазоне в этих пределах. Лекарственное средство можно принимать по схеме от 1 до 4 раз в день. В случае, когда компонент представлен в композиции в виде соли, сложного эфира, пролекарства, или тому подобным, количество вводимого препарата рассчитывается на основе исходного соединения, и таким образом, фактический использованный вес увеличивается пропорционально.
Использование в медицине
Фармацевтические композиции и препараты, описанные в настоящем документе, могут быть использованы, например, в различных методах лечения расстройств (например, эпилепсии или расстройств, связанных с эпилепсией), в соответствии с характером препарата.
Использование в терапевтических методах
Другой аспект настоящего изобретения относится к фармацевтической композиции или препарату, которые описаны в настоящем документе, для применения в методах лечения человеческого или животного организма терапией, например, для использования метода лечения расстройств (например, эпилепсии или расстройств, связанных с эпилепсией), как описано в настоящем документе.
С одной стороны, метод лечения является методом лечения эпилепсии или расстройств, связанных с эпилепсией. В некоторых инстанциях подвергнутые лечению человек или животное могут являться больными фармакорезистентной эпилепсией. В некоторых инстанциях метод включает в себя этап определения, если подвергнутые лечению человек или животное могут являться больными фармакорезистентной эпилепсией.
Использование в производстве лекарственных средств
Другой аспект настоящего изобретения относится к применению фармацевтической композиции, описанной в настоящем документе, в производстве лекарственного препарата, описанного в настоящем документе, для лечения расстройства (например, эпилепсии или расстройств, связанных с эпилепсией), которое описано в настоящем документе.
В одном из вариантов осуществления настоящего изобретения, лекарственное средство включает фармацевтическую композицию, которая описана в настоящем документе.
Методы лечения
Другой аспект настоящего изобретения относится к способу лечения, например, расстройства (например, эпилепсии или расстройств, связанных с эпилепсией), которое описано в настоящем документе, заключающегося в введении пациенту, нуждающегося в таком лечении, терапевтически эффективного количества фармацевтической композиции или препарата, которые описаны в настоящем документе.
С одной стороны, метод лечения является методом лечения эпилепсии или расстройств, связанных с эпилепсией. В некоторых инстанциях подвергнутые лечению человек или животное могут являться больными фармакорезистентной эпилепсией. В некоторых инстанциях метод включает в себя этап определения, если подвергнутые лечению человек или животное могут являться больными фармакорезистентной эпилепсией.
Эпилепсия и схожие расстройства
Используемые в настоящем документе, если не указано иначе, термины "эпилепсия и схожие расстройства" или "эпилепсия или схожее расстройство" означает любое расстройство, в котором субъект (предпочтительно взрослый человек, ребенок или младенец) испытывает один или несколько припадков и/или тремор. К подходящим примерам относят, но ими не ограничиваются, эпилепсию (в том числе, но не ограничиваясь этим, локализационно-обусловленные эпилепсии, генерализованные эпилепсии, эпилепсии, имеющие признаки генерализованных и парциальных приступов, и тому подобное), приступы, связанные с синдромом Леннокса-Гасто, приступы как осложнение заболевания или состояния (например, приступы, связанные с энцефалопатией, фенилкетонурия, болезнь несовершеннолетних Гоше, прогрессирующая миоклоническая эпилепсия Люндборга, инсульт, черепно-мозговая травма, стресс, гормональные изменения, употребление наркотиков или наркотическая абстиненция, употребление алкоголя или алкогольная абстиненция, недосып, лихорадка, инфекции и т.п.), эссенциальный тремор, синдром беспокойных конечностей, и тому подобное.
Предпочтительно, выбирать расстройство из следующих: эпилепсия (независимо от типа, основной причины или происхождения), эссенциальный тремор или синдром беспокойных конечностей, более предпочтительно выбирать из следующих: эпилепсия (независимо от типа, основной причины или происхождения) или эссенциальный тремор.
Термин "субъект", вышеупомянутый, означает животное, предпочтительно млекопитающее, наиболее предпочтительно - взрослый человек, ребенок или младенец, который был объектом лечения, наблюдения или эксперимента.
Эпилептический припадок
"Эпилептический припадок" это массивное нарушение электрических связей между нейронами в головном мозге, что приводит к временному, синхронизированному высвобождению излишней энергии. Повторяющаяся потеря энергии приводит к истощению и исчерпыванию клеточных ресурсов, которые вызывают гибель клеток и на протяжении болезни приводит к когнитивными нарушениями (слабоумию). Есть множество различных классификаций эпилептических припадков. Основное отличие, которое определяет различные виды припадков, по уровню их судорожной активности, заключается в том, что они носят либо парциальный (созначный с фокальным), либо генерализованный характер.
Парциальными припадками являются те, в которых судорожная активность ограничивается отдельными участками коры головного мозга. Если сознание полностью сохраняется во время приступа, клинические проявления считаются относительно легкими и, в таком случае, приступ будет называться простым фокальным приступом. Если сознание нарушается, то в таком случае, приступ будет называться сложным фокальным приступом. Еще одна дополнительная подгруппа включает в себя приступы, которые поначалу проявляются в виде парциальных припадков, которые затем распространяются диффузно по всей коре головного мозга, известные как вторично-генерализованные парциальные приступы.
Генерализованные приступы диффузно охватывают области мозга одновременно в двустороннем (симметричном) порядке. Абсанс или малые эпилептические припадки характеризуются внезапными, краткими потерями сознания без потери ортостатической контроля. Атипичные абсансные припадки обычно характеризуются более длительным сроком потери сознания, менее острым началом и прекращением, а также более выраженными моторными симптомами, которые включает фокальные и латеральные свойства. Генерализованные тонико-клонические или большие эпилептические припадки, основной тип генерализованных припадков, характеризуются внезапным, острым началом. Начальная фаза приступа это, как правило, тоническое сокращение мышц, нарушение дыхания, заметное повышение тонуса симпатической нервной системы приводящее к увеличению частоты сердечных сокращений, артериального давления и размера зрачка. Через 10-20 сек, тоническая фаза приступа, как правило, переходит в клоническую фазу, в результате наложения периода миорелаксации на тоническое сокращение мышц. Периоды релаксации постепенно увеличиваются до момента окончания иктальной фазы, которая обычно длится не более 1 мин. Постиктальная фаза характеризуется невосприимчивостью, мышечной вялостью, и чрезмерное слюноотделением, что может привести к жесткому дыханию и частичной обструкции дыхательных путей. Атонические приступы характеризуются внезапной потерей постурального мышечного тонуса длительностью 1-2 сек. Сознание на короткое время нарушается, но обычно не бывает послеприпадочной спутанности. Миоклонические припадки характеризуются внезапным и кратким сокращением мышц, которые могут охватывать одну сторону тела или все тело.
Таким образом, в одних случаях "припадком" является парциальный припадок, такой как простой фокальным приступ, сложный фокальный приступ, либо вторично-генерализованный парциальный приступ.В других случаях "припадком" является генерализованный или большой припадок, такой как абсансный припадок, миоклонический припадок, клонический припадок, тонический припадок, тонико-клонический припадок, либо атонический припадок.
Поскольку припадки являются характерным аспектом эпилепсии, они могут в целях настоящего изобретения быть рассмотрены как симптом эпилепсии, или "расстройство, связанное с эпилепсией".
Лечение
Термин "лечение", используемый в данном документе применительно лечению заболевания, относится в общем к лечению и терапии, независимо, человека либо животного (например, в ветеринарии), в которых достигается некий желаемый терапевтический эффект, например, угнетение прогрессирования заболевания, и включает снижение скорости прогрессирования, подавление темпа прогрессирования, облегчения симптомов заболевания, улучшения состояния и излечение этого состояния. Лечение с профилактической целью (т.е. профилактика) также включено. Например, использование пациентами, у которых еще не развилось заболевание, но которые подвержены риску его развития, охватываются термином "лечение".
Например, лечение рака включает профилактику рака, снижения заболеваемости раком, снижения риска возникновения деменции на фоне рака, облегчение симптомов рака и т.д.
Термин "терапевтически эффективное количество" используемый в данном документе, относится к такому количеству соединения, или материала, композиции или лекарственной формы, содержащей соединение, которое является эффективным для достижения некого желаемого терапевтического эффекта, соразмерного с резонным соотношением пользы/риска, при назначении в соответствии с заданным режимом лечения.
Термин "предотвращать", используемый в данном документе, относится к профилактическому лечению или лечению, которое предотвращает один или несколько симптомов или состояний заболевания, расстройства или состояний, описанных в настоящем документе. Профилактическое лечение может быть начато, например, до ("первичная профилактика") или после ("вторичная профилактика") события, которое предшествует началу заболевания, расстройства или состояния. Профилактическое лечение, которое включает введение композиции, описанной в настоящем документе. Назначенные дозы могут быть изменены в ходе профилактического лечения.
В некоторых случаях, лечение эпилепсии и родственных ей нарушений подразумевает собой снижение частоты и/или тяжести припадков, испытываемых индивидом. Например, в некоторых случаях частота приступов у индивида получающего лечение (как измерено в течение, например, одного года), может быть снижено до менее чем 80% от частоты приступов до начала лечения композициями настоящего изобретения. В некоторых случаях частота приступов (как измерено в течение, например, одного года), может быть снижено до менее чем 70%, 60%, 50%, 40%, 30%, 20% или менее 10% от частоты приступов до начала лечения композициями настоящего изобретения. Тяжесть приступа может быть измерена, например, путем измерения уровня гибели нейронов после приступа; например, путем измерения уровня гибели нейронов в СА1 области гиппокампа либо на 1 день, либо через 6 дней после приступа.
Таким образом, в некоторых случаях композиции настоящего изобретения используются в методах сокращения частоты приступов, или для уменьшения гибели нейронов (например, уменьшение гибели нейронов в СА1 области гиппокампа).
Комплексные терапии
Термин "лечение" включает в себя комбинированные лечения и терапии, в которых объединены два или более типа лечения или терапии, например, в последовательном порядке или назначаемые одновременно. Например, фармацевтические композиции, описанные в данном документе, могут также быть использованы в комбинированной терапии, например, в сочетании с другими препаратами, например, антиэпилептическими препаратами (АЭП'ми) или противосудорожными препаратами (в контексте настоящего документа, относятся к веществу способному лечить, ингибировать или предотвращать эпилептическую активность или иктогенез, когда вещество вводят субъекту или пациенту). Примерами лечения и терапии включают в себя, но не ограничиваются ими, химиотерапию (введения активных веществ, в том числе, например, лекарств, антител (например, как в иммунотерапии), пролекарства (например, как в фотодинамической терапии, GDEPT, ADEPT, и т.д.); хирургию; лучевую терапию; фотодинамическую терапию; генную терапию, а также контролируемые диеты.
В некоторых случаях, фармацевтические композиции или препараты, описанные в данном документе назначаются вместе с одним или более противосудорожным препаратом и/или антиэпилептическим препаратом.
Конкретное сочетание будет по усмотрению врача, который будет подбирать дозировку, опираясь на свои общие познаниям и схемы применения, известные квалифицированному специалисту. Вещества (то есть, фармацевтический препарат, описанный в настоящем документе, а также одно или несколько других веществ), могут быть введены одновременно или последовательно, и могут быть введены в индивидуально варьируемых режимах дозирования и различными способами введения. Например, при последовательном введении, вещества могут быть введены через короткие временные интервалы (например, через каждые 5-10 мин) или через более длительные интервалы (например, 1, 2, 3, 4 или более часов между введением, или, при необходимости, на более долгие периоды между введением), где точная схема приема лекарственного средства должна быть соизмерима со свойствами терапевтического вещества(в).
Вещества (то есть, фармацевтический препарат, описанный здесь, а также одно или несколько других веществ) могут быть составлены друг с другом в одной лекарственной форме, или в качестве альтернативы, отдельные вещества могут быть составлены отдельно и представлены вместе в виде набора, при необходимости, с инструкцией по их применению.
Противосудорожное и/или антиэпилептическое вещество
Подходящими примерами противосудорожного и/или антиэпилептического вещества включают в себя, но не ограничиваются ими:
a. Антагонисты АМРА, такие как АМР-397, Е-2007, NS-1209, талампанел, и тому подобное;
b. Бензодиазепины, такие как диазепам, лоразепам, клоназепам, клобазам, и тому подобное;
c. Барбитураты, такие как фенобарбитал, амобарбитал, метилфенобарбитал, примидон, и тому подобное;
d. Вальпроаты, такие как вальпроевая кислота, натриевая соль вальпроевой кислоты, вальпромид, и тому подобное;
e. ГАМК агенты, такие как габапентин, прегабалин, вигабатрин, лозигамон, ретигабин, руфинамид, SPD-421 (DP-VPA), Т-2000, ХР-13512, и тому подобное;
f. Производные иминостильбена, такие как карбамазепин, окскарбазепин, и тому подобное;
g. Производные гидантоина, такие как фенитоин натрия, мефенитоин, фосфенитоин натрия и тому подобное;
h. антагонисты NMDA, такие как харкосерамид, и тому подобное;
i. Блокаторы натриевых каналов, такие как BIA-2093, С0-1 02862, ламотригин, и тому подобное;
j. Сукцинимиды, такие как метосуксимид, этосуксимид, и тому подобное; а также
k. АЭПы, такие как ацетазоламид, клометиазол эдизилат, зонисамид, фелбамат, топирамат, тиагабин, леветирацетам, бриварацетам, GSK-362115, GSK-406725, ICA-69673, КБД производное конопли, изовалерамид (NPS-1776), каризбамат, сафинамид, селетрацетам, соретолид, стирипентол, валроцемид, (2S)-(-)-N-(6-хлор-2,3-дигидро-бензо[1,4]диоксин-2-илметил)-сульфамид, и тому подобное.
Другими примерами АЭПов являются бриварацетам, каризбамат, карбамазепин, клобазам, клоназепам, этосуксимид, фелбамат, габапентин, лакозамид, ламотриджин, леветирацетам, окскарбазепин, фенобарбитал, фенитоин, прегабалин, примидон, ретигабин, руфинамид, сафинамид, селетрацетам, тампанел, тиагабин, топирамат, вальпроат, вигабатрин, зонисамид, (2S)-(-)-N-(6-хлор-2,3-дигидро-бензо[1,4]диоксин-2-илметил)-сульфамид, бензодиазепины, барбитураты и седативно-гипнотические средства.
Фармакорезистентный больной эпилепсией
Используемое в данном документе понятие "фармакорезистентный больной эпилепсией" подразумевает собой больного эпилепсией или расстройством, связанным с эпилепсией, приступы которого не купируются ни одним из двух, как минимум, различных антиэпилептических препаратов (например, ни одним из двух, как минимум, из АЭПов перечисленных выше). В некоторых случаях, приступы фармакорезистентного больного не купируются ни одним из трех, как минимум, различных антиэпилептических препаратов (например, ни одним из трех, как минимум, из АЭПов перечисленных выше).
Другие применения
Фармацевтические композиции и препараты, описанные в данном документе, также могут быть использованы в качестве добавок для культивирования клеток.
Фармацевтические композиции и препараты, описанные в данном документе, также могут быть использованы в качестве составной части in vitro анализа, например, для того, чтобы определить, будет ли польза от лечения препаратом у потенциального больного.
Фармацевтические композиции и препараты, описанные в данном документе, также могут быть использованы в качестве стандарта, например в анализе, с целью выявления, характеристики, и/или оценки других фармацевтических препаратов.
Наборы
Другой аспект настоящего изобретения относится к набору, содержащему (а) фармацевтическую композицию, или препарат, описанные в данном документе, желательно предоставляемое в подходящем контейнере и/или с подходящей упаковкой; и (б) инструкции по применению, например, с письменными инструкциями о том, как вводить фармацевтическую композицию или препарат и т.д.
В случае необходимости, набор может, по необходимости, включать подходящие реагенты (например, буферы, растворители) и устройства (например, трубки, шприцы) для сборки и использования (например, введения).
Письменные инструкции могут также включать в себя перечень показаний для которых назначение действующего вещества является соответствующим лечением.
Способы применения
Фармацевтическая композиция или препарат могут быть введены пациенту любым подходящим методом введения, будь то энтерально/парентерально либо местно (т.е. на месте желаемого действия).
Пути введения включают, но не ограничиваются ими, пероральный (например, через рот); буккальный; подъязычный; трансдермальный (в том числе, например, с помощью патча, пластыря и т.д.); трансмукозный (в том числе, например, с помощью патча, пластыря и т.д.); интраназальный (например, с помощью назального спрея, капель или за счет распылителя или устройства доставки сухого порошка); ранссклеральный (например, с помощью глазных капель); пульмональный (например, путем ингаляционной или инсуффляционной терапии с использованием, например, аэрозоля, например, через рот или через нос); ректально (например, с помощью суппозиториев или клизм); вагинально (например, с помощью пессария); парентерально, например, путем инъекции (например, инфузия), в том числе подкожном, внутрикожным, внутримышечным, внутривенным, внутриартериальным, внутрисердечным, интратекальным, интраспинальным, интракапсулярным, подкапсульным, интраорбитальным, внутрибрюшинным, внутритрахеальным, подэпидермисным, внутрисуставным, субарахноидальным и надчревным путями; путем имплантации депо или резервуара, например, подкожно или внутримышечно.
В предпочтительном варианте осуществления, фармацевтическую композицию или препарат вводят парентерально, например, путем внутривенной инфузии.
Объект исследования/пациент
Объектом исследования/пациентом может представлять собой: хордовых, позвоночных, млекопитающего, плацентарного млекопитающего, сумчатые (например, кенгуру, вомбаты), грызуны (например, морская свинка, хомяк, крыса, мышь), мышиные (например, мышь), зайцеобразные (например, кролик), птичий (например, птица), собачьи (например, собака), кошачий (например, кошки), лошадиные (например, лошадь), свиньи (например, свинья), овечий (например, овцы), крупный рогатый скот (например, коровы), примат, обезьяний (например, обезьяна или человекообразная обезьяна), обезьяны (например, мартышка, бабуин), человекообразная обезьяна (например, горилл, шимпанзе, орангутан, гиббон), или человек. Кроме того, исследование может проводиться над объектом исследования/пациентом на любом его этапе развития, например, на эмбриональном этапе.
В предпочтительном варианте осуществления, объект исследования/пациент это человек.
Рисунки
Фиг. 1. In-vitro модель эпилепсии.
A. Низкий уровень магния, без предварительного лечения препаратом EPIPLEX;
B. Низкий уровень магния, с предварительным лечением препаратом EPIPLEX;
C. 4-АР без предварительного лечения препаратом EPIPLEX;
D. 4-АР с предварительным лечением препаратом EPIPLEX;
На каждой из иллюстраций A-D, на левой части иллюстрации изображена флуоресценция красителем Хехст (все клетки), а на правой части иллюстрации изображена флуоресценция пропидийиодидом (нежизнеспособные клетки)
Фиг. 2. Плотность нейронов в СА1 области гиппокампа после острого эпизода пилокарпин/литий индуцированного эпилептического статуса. На иллюстрациях изображено окрашивание флуоресцентным красителем Хехст (нейрональные клеточные ядра)
A. Животное, не использовавшееся ранее в опытах;
B. Контрольное животное, после эпилептического статуса;
C. Животное с предварительным лечением препаратом EPIPLEX, после эпилептического статуса.
Фиг. 3. Плотность нейронов в СА1 области гиппокампа после острого эпизода пилокарпин/литий индуцированного эпилептического статуса.
A. Плотность клеток через 1 день после эпилептического статуса.
B. Плотность клеток через 6 дней после эпилептического статуса.
Метки столбцов:
"non-epil" = Животное, не использовавшееся ранее в опытах;
"epil" = Контрольное животное, после эпилептического статуса;
C. "epil + epiplex" = Животное, с предварительным лечением препаратом EPIPLEX, после эпилептического статуса.
Материалы и методы
Анализ жизнеспособности клеток
Для оценки гибели клеток, культуру первичных нейронов окрасили одновременно 20 мкМ пропидийиодида (который не окрашивает жизнеспособные клетки, но прокрашивает красным цветом нежизнеспособные клетки после нарушения целостности их мембраны) и 4,5 мкМ Hoechst 33342 (Molecular Probes, Eugene; маркирует ядра синим цветом, для подсчета общего количества клеток). Каждый эксперимент был проделан, по крайней мере на 3-4 разных покровных стеклах полученных на независимых культурах клеток. От трех до четырех участков на каждом покровном стекле были сфотографированы и проанализированы. Статистический анализ был проведен по регионам.
Пилокарпин/литиевая модель генерализованной эпилепсии
Инъекции лития/пилокарпина достоверно вызывают эпилептический статус у находящихся в сознании лабораторных крыс. Эпилептический статус характеризуется генерализованными припадками и связан с высокой летальностью, так же как с гибелью нейрональных клеток в СА1 области гиппокампа. Воздействие тестируемого соединения на поврежденные нейроны головного мозга, вследствие пагубного воздействия эпилептических припадков, были оценены на 1-й и 6 день после провоцирования эпилептического статуса.
Примеры
Пример 1: Epiplex уменьшает внутриклеточные колебания кальция в in-vitro модели эпилепсии
Культура первичных нейронов может быть использована в качестве in-vitro модели эпилепсии (см, например, Buck et al., Sagratella et al., Leite et al.). В этой модели, реакция клеток аналогичная той при эпилептическом припадке вызывается путем замены нормальной инкубационной среды (в остальном идентичной) 'средой с низким содержанием магния'. Сразу после помещения нейронов в среду с низким содержанием магния, наблюдаются высоко-амплитудные колебания цитозольного кальция. Подобные цитозольные колебания кальция наблюдаются при применении 100 мкМ 4-аминопиридина (4-АР) к культивируемым нейронам.
Для того чтобы оценить влияние препарата EPIPLEX на данную клеточную модель эпилепсии, культуры первичных нейронов были инкубированы с препаратом EPIPLEX (100 мкМ; 0,8-1,2 массового % аскорбиновой кислоты, 26-40 массового % пирувата натрия, 26-40 массового % сукцината и 26-40 массового % D-малата) в течение 20 мин перед введением культуры либо в среду с низким содержанием магния, либо 4-АР.
Было отмечено, что препарат EPIPLEX обладает двумя значительными свойствами. Во-первых, предварительное лечение препаратом EPIPLEX существенно снижает амплитуду и частоту колебаний кальция, вызываемых либо низким магнием или 4-АР. Во-вторых, предварительное лечение препаратом EPIPLEX значительно снижало уровень нейрональной клеточной смерти, наблюдаемое после припадка, измеренная по количеству клеток, прокрашенных флуоресценцией пропидийиодидом (см рисунок 1).
Пример 2: Epiplex уменьшает высокую летальность и уровень гибели нейрональных клеток в in vivo модели судорожного эпилептического статуса вызванная литием/пилокарпином
Для того чтобы оценить влияние препарата EPIPLEX на данную модель эпилепсии in vivo, были отобраны две группы животных, по 7 в каждой, для последующих испытаний. Одной группе добавляли 5 г/л препарата EPIPLEX (0,8-1,2 массового % аскорбиновой кислоты, 26-40 массового % пирувата натрия, 26-40 массового % сукцината и 26-40 массового % D-малата) в питьевую воду на протяжении 24 ч до начала терапии литием/пилокарпином.
Было отмечено, что препарат EPIPLEX обладает двумя значительными свойствами. Во-первых, группа получавшая препарат EPIPLEX продемонстрировала значительное снижение смертности, где все 7 животных остались в живых после эпизода острого эпилептического статуса. В контрольной группе (т.е. без препарата EPIPLEX) только 3 из 7 животных остались в живых после эпизода острого эпилептического статуса (статистически значимо p<0.05).
Во-вторых, в контрольной группе (т.е. без препарата EPIPLEX) эпизод острого эпилептического статуса привел к существенной гибели нейрональных клеток в СА1 области гиппокампа (снижение плотности клеток на 33% и 38% при оценке на 1й и 6 дни после СЭ, соответственно; p<0.001), схожей с гибелью нейрональных клеток у людей больных гиппокампальный склероз. Для сравнения, группа животных, получающих препарат EPIPLEX перед эпизодом острого эпилептического статуса не показала значительной потери нейрональных клеток в СА1 области гиппокампа. Нейрональная плотность в СА1 области этих животных на препарате EPIPLEX вследствие острого эпилептического статуса не отличалась от таковых в гиппокампе животных, не использовавшихся ранее в опытах (p>0.05).
Литература
Buck et al. 1978, "Preliminary report on the magnesium deficient rat as a model of epilepsy", Lab Anim Sci. 1978 Dec; 28 (6): 680-5.
Sagratella et al. 1987, "Effects of ketamine and (+)cyclazocine on 4-aminopyridine and 'magnesium free' epileptogenic activity in hippocampal slices of rats", Neuropharmacology. 1987 Aug; 26 (8): 1181-4.
Leite JP et al. 1990, "Spontaneous recurrent seizures in rats: an experimental model of partial epilepsy", Neurosci Biobehav Rev. 1990 Winter; 14 (4): 511-7.
Pereira MB et al. 2007, "Study pharmacologic of the GABAergic and glutamatergic drugs on seizures and status epilepticus induced by pilocarpine in adult Wistar rats", Neuroscience Letters, Volume 419, Issue 3, 4 June, Pages 253-257