Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СИЛИБИН
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к области лекарственных препаратов для применения в медицине, и в частности к фармацевтической композиции, которая содержит силибин, для лечения болезни печени.
Уровень техники
В 1960–1980-х годах фармацевты Западной Германии во главе с Г. Вагнером выделили активный ингредиент из плода расторопши пятнистой, названный силимарином, который представляет собой новый класc флавоноидов с заместителями С-9, то есть флавонолигнаны, конденсированные с дигидрофлавонолом и производным фенилпропаноида. Силибин (силибинин) является одним из основных составляющих компонентов силимарина. Фармакологические и токсикологические исследования показали, что силибин оказывает защитное и стабилизирующее действие на мембрану гепатоцитов, способствуя восстановлению гепатоцитов и улучшая функцию печени. Силибин обладает разными уровнями защитного и лечебного эффектов в отношении разных типов повреждения печени, которые вызываются «печеночными ядами», такими как тетрахлорид углерода, тиоацетамид, гидроксихолин, фаллоидин, мукронатин и т. д. Также силибин может использоваться для лечения острого и хронического гепатита, раннего цирроза печени, жировой дистрофии печени, токсической или медикаментозной гепатопатии.
Силибин плохо растворяется в воде и стандартных органических растворителях, плохо всасывается при пероральном применении, что является причиной его низкой биологической доступности и, таким образом, оказывает отрицательное влияние на его клиническую эффективность. Для улучшения его биологической доступности отечественные и иностранные фармацевты провели значительный объем работ. Способами улучшения всасывания плохо растворимых лекарственных средств обычно являются сверхтонкий помол, высаливание и добавление совместного растворителя и т.д. На протяжении последних лет исследования показали, что растворение и биологическая доступность в значительной степени улучшаются при использовании способов составления с включением соединения циклодекстрина, составления в твердую дисперсию, в синтетический фосфолипидный комплекс и составление в разные лекарственные формы.
С позиции твердого препарата фосфолипидный комплекс является более специфической твердой дисперсией, которая имеет постоянную точку плавления, представляющей собой молекулярное соединение (комплекс) с более стабильными химическими свойствами, и отличается от соединения на основе лекарственного средства и фосфолипида, при этом такие соединения варьируются по типам фосфолипидов и соотношениям лекарственного средства и фосфолипида, а молекула фосфолипида может быть связана с разным количеством молекул лекарственного средства. На основе спектроскопических характеристик комплекса сделали заключение, что это лекарственное средство характеризуется сильным взаимодействием с полярными группами фосфолипида, что подавляет свободное вращение одиночных цепей в молекуле, тогда как две длинных цепи жирных кислот фосфолипида не принимают участия в реакции с образованием комплекса и могут сдвигать и обертывать полярные части фосфолипида с образованием липофильной поверхности, вследствие чего этот комплекс демонстрирует высокую растворимость в липидах. Этот комплекс изменяет физико-химические свойства лекарственного средства, и таким образом повышается растворимость лекарственных средств в липидах и уменьшается растворимость лекарственных средств в воде, что способствует связыванию молекул лекарственного средства с мембранами клеток с улучшением всасывания и повышением биологической доступности лекарственного средства.
Чай пуэр является уникальным и известным чаем из провинции Юньнань. Эта местность характеризуется умеренным климатом, обильными осадками и сильными туманами. Провинция Юньнань является местом выращивания крупнолистового чая пуэр, который классифицируют на две группы по его переработке: неферментированный чай пуэр, полученный путем прямой переработки в конечный продукт, и ферментированный чай пуэр, полученный путем переработки после искусственно ускоренной ферментации, при этом его классифицируют на рассыпной чай и прессованный чай; также в настоящее время для конечного продукта используют процесс естественного созревания, вследствие чего его уникальные качества улучшаются.
Чай пуэр представляет собой единственный постферментированный чай, в котором вещества, вредные для человеческого организма, такие как теофиллин, полифенолы чая, разрушаются в ходе длительного процесса ферментации, поэтому данный продукт мягкий, не оказывает стимулирующего действия на организм, а также может активизировать метаболизм, ускорять пищеварение и расщепление жиров и токсинов в организме. При проблемах в современном обществе, связанных с ожирением и высокими уровнями триглицеридов, чай пуэр может смягчать отрицательные последствия за счет выведения токсинов, придания чувства насыщения, оказания противовоспалительного эффекта, снижения уровня холестерина, выведения жиров и снижения избыточной массы тела. Современные технологии демонстрируют, что чай пуэр может корригировать инсулинорезистентность, регулировать уровни липидов и лептина в крови и т. д., и может блокировать накопление жира клетками паренхимы печени, которое до некоторой степени обусловлено инсулинорезистентностью.
Неалкогольная жировая дистрофия печени (NAFLD) представляет собой повреждение печение, индуцированное метаболическим стрессом, которое тесно связано с инсулинорезистентностью и генетической предрасположенностью, при этом патологические изменения при ней аналогичны таковым при алкогольной жировой дистрофии печени. NAFLD представляет собой клинико-патологический синдром, который характеризуется избыточным отложением и накоплением жира в гепатоцитах в печеночных долях, но без злоупотребления алкоголем в анамнезе. NAFLD демонстрирует разные степени повреждения печени, от простой жировой дистрофии при отсутствии воспаления до тяжелой воспалительной реакции в виде сильного фиброза и даже цирроза, при этом преимущественно выделяют 3 типа: простую жировую дистрофию печени, стеатогепатит, жировой цирроз.
Лечение неалкогольной жировой дистрофии печени:
1. Предупреждение возникновения основного заболевания или связанных с ним факторов риска. 2. Основное лечение: корригирование рационального потребления калорий и рациона, умеренные занятия физическими упражнениями в аэробном режиме, корригирование неправильного образа жизни и вредных привычек. 3. Исключение усугубления повреждения печени: предупреждение резкого снижения массы тела, злоупотребления лекарственными средствами и других факторов, которые могут индуцировать обострение болезни печени. 4. Снижение веса тела: требуется от всех пациентов с NAFLD, у которых имеется избыточная масса тела, висцеральное ожирение и быстрый набор массы за короткий период времени, с изменением образа жизни для контроля массы тела и уменьшения окружности талии. Основное лечение в течение 6 месяцев, снижение массы тела <0,45 кг в месяц или индекс массы тела (BMI) >27 кг/м2 в комбинации с отклонением от нормы более чем двух из таких показателей, как уровень липидов в крови, уровень глюкозы в крови, кровяное давления и другие, можно рассматривать как показание к добавлению сибутрамина или орлистата и других лекарственных средств для лечения ожирения, при этом снижение массы тела за неделю не должно превышать 1,2 кг (для детей не превышать 0,5 кг за неделю); а BMI 40 кг/м2 или BMI >35 кг/м2 в сочетании с синдромом апноэ во время сна и другими заболеваниями, связанными с ожирением, можно рассматривать как показание для процедуры шунтирования проксимальной части желудка для похудения (II-1, II-2, II-3, III). 5. Лекарственное средство, повышающее чувствительность к инсулину: в сочетании с диабетом 2-го типа, нарушенной толерантностью к глюкозе, повышенным уровнем глюкозы в плазме крови натощак и висцеральным ожирением можно рассматривать как показание к применению метформина и тиазолидиндионов с целью корригирования инсулинорезистентности и контроля уровня глюкозы в крови (II-1, II-2, II-3). 6. Гиполипидемические средства: дислипидемия в течение основного лечения и (или) применение фармацевтических средств для снижения массы тела и гипогликемических фармацевтических средств на протяжении более 3-6 месяцев, что по-прежнему сочетается с гиперлипидемией или гиперлипидемией с более чем 2 факторами риска, следует рассматривать как показание к добавлению фибратов, статинов или пробукола и других гиполипидемических лекарственных средств (II-1, II-2, II-3). 7. Лекарственные средства для лечения болезней печени: при NAFLD, ассоциированной с нарушением функции печени, метаболический синдром, неэффективность 3-6-месячного основного лечения и биопсия печени, демонстрирующая NASH и постепенное прогрессирование заболевания, можно использовать вспомогательное медикаментозное лечение заболевания печени с использованием антиоксидантных, противовоспалительных, противофиброзных и родственных им лекарственных средств (II-1, II-2, II-3, III), таких как полиенфосфатидилхолин, витамин Е, силимарин и урсодезоксихолевая кислота, которые могут быть рационально подобраны в соответствии с эффективностью лекарственных средств, активностью заболевания и стадией заболевания, но при этом нельзя одновременно применять много лекарственных средств. 8. Пересадка печени: перед трансплантацией печени необходимо провести проверку в отношении наличия, главным образом, болезни печени в терминальной стадии, связанной с NASH, и криптогенного цирроза печени, а также метаболического состояния (III). BMI >40 кг/м2 является противопоказанием для пересадки печени (III).
Вышеуказанные виды лечения не использовали в сочетании, как например, комбинацию гипогликемических средств и средств для лечения болезней печени, или комбинацию гиполипидемических средств и средств для лечения болезней печени. Таким образом, необходим безотлагательный поиск фармацевтического средства с разнообразными лечебно-профилактическими свойствами.
Краткое описание настоящего изобретения
Настоящее изобретение предусматривает фармацевтическую композицию. Она оказывает надлежащий лечебный эффект при неалкогольной жировой дистрофии печени, при этом комбинация из трех компонентов также характеризуется синергическим эффектом при лечении неалкогольной жировой дистрофии печени.
Настоящее изобретение предусматривает способ получения фармацевтической композиции.
Настоящее изобретение также предусматривает применение данной фармацевтической композиции.
Настоящее изобретение осуществляют с помощью следующих технических решений:
фармацевтическую композицию по настоящему изобретению получают из следующих видов лекарственного сырья при соотношении по массе:
8,75-60 частей силибина,
15-65 частей фосфолипида,
25-200 частей экстракта чая пуэр.
Предпочтительно фармацевтическую композицию по настоящему изобретению получают из следующих видов лекарственного сырья при соотношении по массе:
8,75-60 частей силибина,
15-65 частей фосфолипида,
25-150 частей экстракта чая пуэр.
Предпочтительно фармацевтическую композицию по настоящему изобретению получают из следующих видов лекарственного сырья при соотношении по массе:
25-40 частей силибина,
30-50 частей фосфолипида,
80-120 частей экстракта чая пуэр.
Наиболее предпочтительно фармацевтическую композицию по настоящему изобретению получают из следующих видов лекарственного сырья при соотношении по массе:
35 частей силибина,
42 части фосфолипида,
100 частей экстракта чая пуэр.
Фосфолипид в соответствии с настоящим изобретением представляет собой соевый лецитин или фосфолипид на основе фосфатидилхолина, и предпочтительно представляет собой соевый фосфолипид.
Оба описанные силибин и фосфолипид – известны из предшествующего уровня техники или являются коммерчески доступными. С целью лучшего проявления эффективности настоящего изобретения силибин по настоящему изобретению предпочтительно получают путем растворения силимарина в 80% этаноле, фильтрования и трехкратного промывания осадка 95% этанолом с последующим сбором осадка. Осадок растворяют в безводном этаноле, фильтруют и в фильтрат добавляют некоторое количество воды для отделения осадка, при этом осадок собирают путем фильтрации, высушивают при пониженном давлении, измельчают в порошок и перемешивают.
Действие фосфолипида в настоящем изобретении заключается в обеспечении растворения и всасывания фармацевтических средств. Силибин представляет собой фармацевтическое средство, которое плохо растворяется и характеризуется низкой проницаемостью, при этом его растворимость может улучшаться после объединения с фосфолипидом с образованием фосфолипидного комплекса, что повышает биологическую доступность данного фармацевтического средства.
Экстракт чая пуэр является коммерчески доступным, предпочтительно под названием эссенция чая пуэр DEEPURE®. Его также можно получить в соответствии с предшествующим уровнем техники. С целью лучшего проявления эффективности настоящего изобретения эссенцию чая пуэр или экстракт чая пуэр предпочтительно получают в соответствии со способами, изложенными в патентах (публикация № CN101961061A, CN101961061B, CN101961425A, CN101961425B, CN101961060A, CN101961059A, CN101961059B).
Например, указанную эссенцию чая пуэр получают следующим образом:
стадия 1: листья чая пуэр отваривают в 6-12-кратном объеме воды 2-4 раза, каждый раз по 0,5-2 часа; раствор экстракта фильтруют и фильтрат концентрируют при пониженном давлении и при температуре ≤70°C до соотношения массы чайных листьев:объема концентрата = 1:2-1:3;
стадия 2: концентрат центрифугируют с помощью центрифуги, центрифугат концентрируют при пониженном давлении до плотности 1,1-1,25 при 45-65°C, концентрированную пасту подвергают высушиванию распылением или высушиванию под воздействием микроволнового излучения с получением конечного продукта.
Предпочтительно данные стадии осуществляют следующим образом:
стадия 1: листья чая пуэр отваривают в 6-12-кратном объеме бурно кипящей воды 3 раза, каждый раз по 0,5-2 часа; раствор экстракта фильтруют и фильтрат концентрируют при пониженном давлении и при температуре ≤70°C до соотношения массы чайных листьев:объема концентрата = 1:2-1:3;
стадия 2: концентрат центрифугируют с помощью трехколонной центрифуги периодического действия, полученный центрифугат центрифугируют на центрифуге с трубчатым ротором, а затем центрифугат концентрируют при пониженном давлении до плотности 1,1-1,25 при 45-65°C, концентрированную пасту подвергают высушиванию распылением или высушиванию под воздействием микроволнового излучения с получением конечного продукта;
при этом параметры для центрифуги с трубчатым ротором следующие: скорость центрифугирования: 15000-19000 об./мин; параметры высушивания распылением: температура на входе: 140-190°C, температура на выходе: 75-95°C.
Наиболее предпочтительно эти стадии осуществляют следующим образом:
листья чая пуэр отваривают в бурно кипящей воде 3 раза, первый раз кипятят 1,5 ч, добавляют 10 объемов воды; второй раз кипятят 1,5 ч, добавляют 8 объемов воды; третий раз кипятят 1 ч, добавляют 8 объемов воды, раствор экстракта фильтруют и фильтрат концентрируют при пониженном давлении и при температуре ≤70°C до соотношения массы чайных листьев:объема концентрата = 1:2-1:3, с помощью трехколонной центрифуги периодического действия, полученный центрифугат центрифугируют на центрифуге с трубчатым ротором, а затем центрифугат концентрируют при пониженном давлении до плотности 1,1-1,25 при 45-65℃, концентрированную пасту подвергают высушиванию распылением или высушиванию под воздействием микроволнового излучения с получением конечного продукта.
При этом параметры для центрифуги с трубчатым ротором следующие: скорость центрифугирования: 15000-19000 об./мин; параметры высушивания распылением: температура на входе: 140-190°C, температура на выходе: 75-95°C.
Вышеупомянутые композиции получают при определенных соотношениях компонентов по массе, и эти значения можно увеличивать или уменьшать согласно соответствующим соотношениям в ходе производственных процессов, таких как крупномасштабное производство, которое может выражаться в единицах измерения кг или т (тонна); мелкомасштабное производство, которое может быть в единицах измерения г. Массу можно увеличивать или уменьшать, но соотношение по весу видов лекарственного сырья оставляют без изменения.
Вышеуказанные соотношения по массе получены с помощью научного скрининга для определенных пациентов, таких как пациенты с тяжелыми или умеренными симптомами, страдающие ожирением или худощавые пациенты, при этом соотношение количеств компонентов в композиции могут быть соответствующим образом откорректированы, увеличены или уменьшены не более чем на 10%, причем эффективность практически не изменяется.
Любые фармацевтически приемлемые лекарственные формы могут быть составлены в виде фармацевтического препарата, при этом лекарственные формы выбраны из таблетки, таблетки, покрытой сахарной оболочкой, таблетки, покрытой пленочной оболочкой, таблетки, покрытой кишечнорастворимой оболочкой, капсулы, твердой капсулы, мягкой капсулы, жидкости для перорального приема, средства для перорального приема, гранулы, пилюли, порошка, пасты, лиофилизированного препарата, суспензии, раствора, инъекционного раствора, суппозитория, мази, пластыря, крема, спрея, трансдермальной терапевтической системы. Предпочтительными являются препараты для перорального приема, а в оптимальном варианте предпочтительными являются таблетка, капсула, гранула.
Некоторые фармацевтические приемлемые носители могут быть добавлены в фармацевтические композиции по настоящему изобретению, если в этом существует необходимость, фармацевтические препараты могут быть получены с использованием общепринятых методик составления галеновых лекарственных форм, таких как смешивание фармацевтически активных веществ с фармацевтически приемлемыми носителями. Фармацевтические приемлемые носители выбраны из маннита, сорбита, сорбиновой кислоты или ее калиевой соли, метабисульфита натрия, бисульфита натрия, тиосульфата натрия, гидрохлорида цистеина, меркаптоуксусной кислоты, метионина, витамина А, витамина С, витамина Е, витамина D, азона, динатриевой соли EDTA, динатрий-кальциевой соли EDTA, карбоната, ацетата, фосфата одновалентного щелочного металла или их водного раствора, хлористоводородной кислоты, уксусной кислоты, серной кислоты, фосфорной кислоты, аминокислоты, хлорида натрия, хлорида калия, лактата натрия, ксилита, мальтозы, глюкозы, фруктозы, декстрана, глицина, крахмала, сахарозы, лактозы, маннита, производного диоксида кремния, целлюлозы и ее производного, альгината, желатина, поливинилпирролидона, глицерина, пропиленгликоля, этанола, Tween 60-80, Span-80, пчелиного воска, ланолина, вазелинового масла, цетилового спирта, сложных эфиров галловой кислоты, агара, триэтаноламина, основной аминокислоты, мочевины, аллантоина, карбоната кальция, бикарбоната кальция, поверхностно-активного вещества, полиэтиленгликоля, циклодекстрина, бета-циклодекстрина, фосфолипидного соединения, каолина, талька, стеарата кальция, стеарата магния и т. д. Предпочтительными являются носители, выбранные из одного или более из микрокристаллической целлюлозы, лактозы, крахмала, натриевой соли карбоксиметилцеллюлозы, гидроксипропилцеллюлозы с низкой степенью замещения, талька.
При составлении фармацевтической композиции по настоящему изобретению в лекарственный препарат единичная доза этого лекарственного препарата может содержать 0,1-1000 мг фармацевтически активного вещества по настоящему изобретению, а остальными составляющими компонентами являются фармацевтически приемлемые носители. Фармацевтически приемлемые носители могут составлять 0,1-99,9% по массе от общей массы препарата. Предпочтительно фармацевтически приемлемые носители могут составлять 40-70% по массе от общей массы препарата.
Частоту применения и дозировку фармацевтических композиций или препаратов по настоящему изобретению определяют в соответствии с состоянием пациентов в ходе применения.
Совокупная скорость растворения препаратов, содержащих фармацевтическую композицию по настоящему изобретению, таких как таблетки, капсулы, гранулы и так далее, составляет не менее 60% при растворении in vitro в течение 2 ч, а при растворении in vitro в течение 30 минут показатель растворения составляет более 15% или равен этому значению, при этом условия растворения следующие: суспензионный способ, скорость вращения 100 об./мин и температура 37ºС, средой высвобождения является: 1000 мл раствора хлористоводородной кислоты с показателем pH 1,2, дозировка: 1 капсула/1 таблетка/1 пакетик гранул.
Настоящее изобретение также предусматривает способ получения фармацевтической композиции по настоящему изобретению, при этом данный способ получения предусматривает следующие стадии:
1) отбор заданного количества сырья для последующего применения;
2) получение раствора комплекса на основе силибина: отвешивают заданное количество силибина и фосфолипида, их растворяют в безводном этаноле, затем концентрируют до определенного объема и извлекают с помощью этанола для последующего применения;
3) грануляция: отвешивают заданное количество экстракта чая пуэр в качестве исходного материала, отбирают раствор комплекса на основе силибина, полученный на стадии 2, в качестве подаваемой жидкости, и получают гранулы с помощью способа грануляции распылением в псевдоожиженном слое, которые представляют собой фармацевтическую композицию по настоящему изобретению.
Настоящее изобретение также включает стадию получения 4, предусматривающую отбор фармацевтической композиции, полученной на стадии 3, и фармацевтически приемлемых носителей, при этом фармацевтически приемлемые носители получают в соответствии со стандартным способом получения.
Предпочтительно способ получения фармацевтической композиции по настоящему изобретению предусматривает следующие стадии:
1) отбор заданного количества сырья для последующего применения;
2) получение раствора комплекса на основе силибина: отвешивают заданное количество силибина и фосфолипида и их растворяют в безводном этаноле, нагревают с обратным холодильником для осветления раствора, и продолжают нагревать в течение некоторого периода времени, затем прозрачный раствор концентрируют при пониженном давлении до определенного объема с получением раствора комплекса на основе силибина для последующего применения;
3) грануляция: отвешивают заданное количество экстракта чая пуэр в качестве исходного материала, отбирают раствор комплекса на основе силибина, полученный на стадии 2, в качестве подаваемой жидкости, получают гранулы с помощью способа грануляции распылением в псевдоожиженном слое и после полного распыления раствора комплекса высушивают с получением гранул фармацевтической композиции для последующего применения;
4) получение: отбирают гранулы, полученные на стадии 3, и фармацевтически приемлемые носители с получением стандартного препарата.
При этом время нагревания, описанное для стадии 2, составляет 0,5-1,5 часа, объем концентрированного раствора составляет 5% - 20% от исходного объема, а температура концентрирования при пониженном давлении составляет 60-80°C.
При этом параметры для псевдоожиженного слоя на стадии 3 являются следующими: температура материалов составляет 40-65°C, и такие параметры, как частота вращения вентилятора, температура воздуха на впуске и частота подачи регулируют с тем, чтоб поддерживать материалы в надлежащем ожиженном состоянии в ходе осуществления способа грануляции, и при этом после завершения грануляции гранулы сушат в течение 10-60 минут, при этом температура высушивания составляет 55-65°C.
Чай пуэр может корригировать инсулинорезистентность, регулировать уровни липидов и лептина в крови и оказывать другие эффекты, он может блокировать накопление жира в клетках паренхимы печени, которое до некоторой степени обусловлено инсулинорезистентностью, в сочетании с высокой способностью силибина к захвату свободных радикалов и к предупреждению оксидативного стресса, при этом оба данных компонента предпочтительно обладают лечебно-профилактическим эффектом в отношении NAFLD (неалкогольной жировой дистрофии печени).
Далее полезные эффекты настоящего изобретения будут описаны с помощью экспериментальных примеров.
Экспериментальный пример 1. Эксперимент по исследованию растворения in vitro
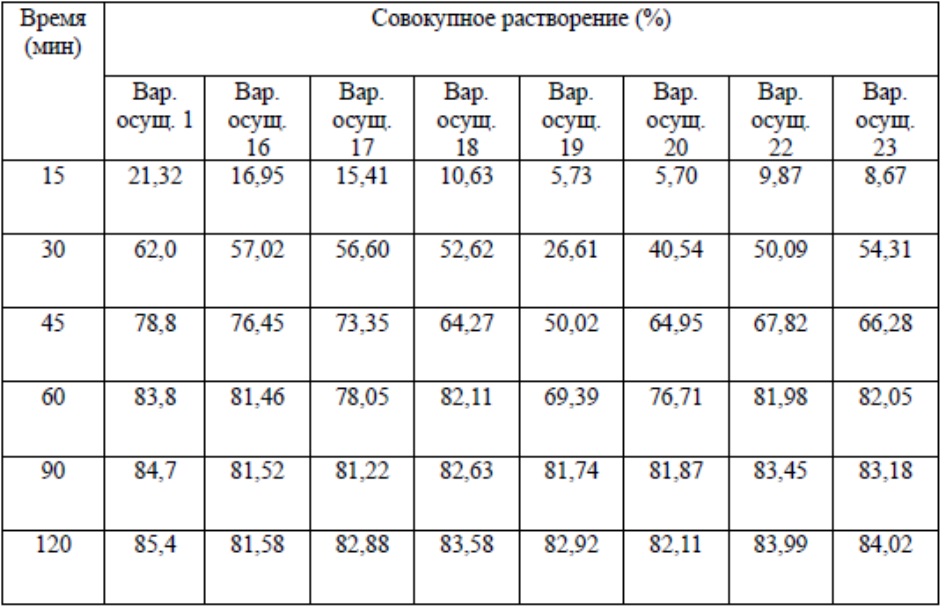
Растворение композиций на основе силибина-фосфолипида-чая пуэр, полученных в вариантах осуществления 16-20, определяли в следующих условиях: выбор способов растворения основывался на свойствах основного компонента силибина в данных композициях, который в качестве лекарственного препарата обладает низкой растворимостью и низкой проницаемостью, при этом он относится к четвертой категории согласно биофармацевтической классификации лекарственных средств (BCS), а его растворение и всасывание являются стадиями, лимитирующими скорость процесса, но вместе с тем всасывание данного фармацевтического препарата зависит от растворения, при этом стадия растворения силибина в основном осуществляется в желудке, стадия всасывания в основном осуществляется в тонком кишечнике. Таким образом, определение растворения этого фармацевтического препарата in vitro вносит вклад в оценку показателя всасывания in vivo и последующую оценку эффективности. Как результат, следующий способ растворения выбирали для оценки данной композиции: суспензионный способ, скорость вращения 100 об./мин при температуре 37°C, а среда для высвобождения представляет собой 1000 мл раствора хлористоводородной кислоты с показателем pH 1,2, дозировка: 1 капсула/1 таблетка/1 пакетик гранул. Временные точки отбора образцов: 15, 30, 45, 60, 90, 120 мин. Определяли совокупную растворимость. Результаты показаны в таблице 1 ниже.
Таблица 1. Итоговые результаты исследования растворения лекарственного препарата на основе силибина-фосфолипида-чая пуэр, полученного согласно различным ранее описанным способам (n=6)
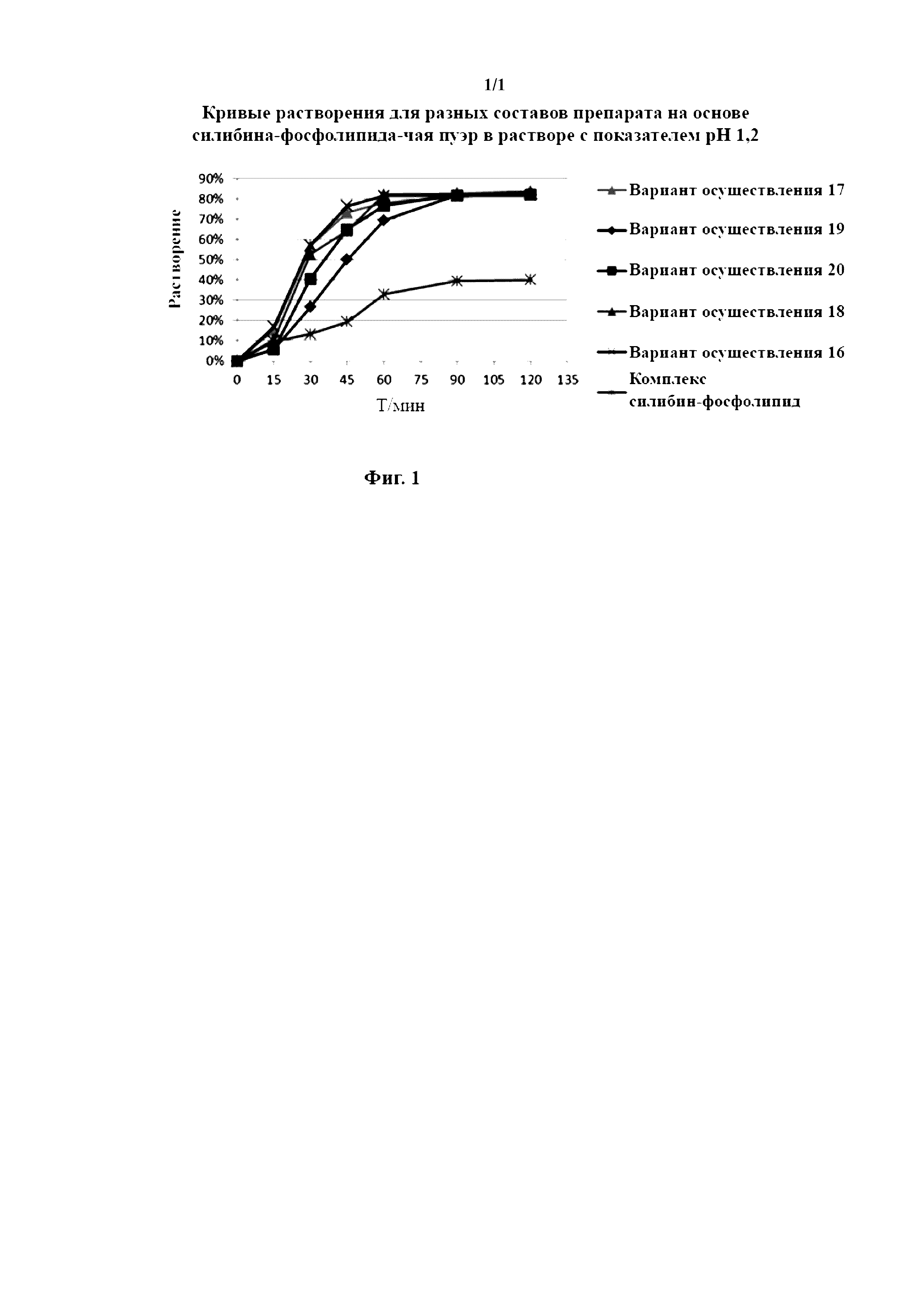
Растворение эталонного препарата (коммерческое название: Shui Lin Jia, продукт компании Tasly Pharmaceutical Co., Ltd.) определяли и сравнивали с композицией на основе силибина-фосфолипида-чая пуэр, полученной в вариантах осуществления 16-20, и результаты показаны на фигуре 1.
Из данных, приведенных в таблице 1 и на кривой на фигуре 1, можно увидеть, что высвобождение in vitro композиции на основе силибина-фосфолипида-чая пуэр, полученной с помощью способа получения по настоящему изобретению, является значительно лучшим, чем высвобождение эталонного препарата Shui Lin Jia, который представляет собой комплекс силибина-фосфолипида, при этом, как ни странно, совокупное растворение этой композиции в растворе хлористоводородной кислоты с показателем pH 1,2 через 2 часа достигало более 80%, то есть это свидетельствует о практически полном растворении с увеличением в два раза по сравнению с растворением эталонного состава, при этом решаются проблемы низкой растворимости и низкой биологической доступности силибина, которые всегда существовали, что дает основание для проведения в будущем исследований с подбором дозы и безопасности и эффективности композиции на основе силибина in vivo.
Объединенные данные теста растворения in vitro и фармакологические исследования in vivo демонстрируют, что настоящее изобретение дополнительно улучшает растворимость этого фармацевтического средства за счет объединения комплекса силибин-фосфолипид с чаем пуэр, продолжая улучшать всасывание данного фармацевтического средства путем улучшения совместимости данного фармацевтического средства и биологической мембраны как результат комбинации силибина и фосфолипида, при улучшении двух аспектов в виде растворимости и всасывания улучшается биологическая доступность основного компонента силибина.
Экспериментальный пример 2. Оценка фармакодинамики in vivo
1. Экспериментальные животные
80 мышей класса SPF (свободных от патогенной микрофлоры) и самцов 6-недельного возраста C57 BL/6J, дефицитных по лептину (ob/ob), 10 мышей класса SPF и 6-недельных самцов C57 BL/6J (ob/m), предоставленных Beijing Huafukang Bioscience Co., Inc., содержали в барьерном отделении для животных центра фармакологических и токсикологических исследований института Tasly при температуре 20°C - 25°C, относительной влажности 60%, по 5 мышей в каждой клетке, при времени освещения 12 часов, при регулярном и достаточном кормлении, причем мышам ob/ob скармливали рацион c высоким содержанием жиров (HFD, D12492), мышам C57 BL/6J скармливали стандартный рацион, при этом оба типа рационов были предоставлены компанией Beijing Huafukang Bioscience Co., Inc., и со свободным доступом к воде, ежедневной заменой подстилки.
2. Испытуемые вещества
Комплекс силибин-фосфолипид, предоставленный компанией Tasly Pharmaceutical Co., Ltd., номер партии 500902031 (полученный в соответствии со стадией 1, варианта осуществления 1 по настоящему изобретения); экстракт чая пуэр, коричневый порошок, предоставленный компанией Tasly Pharmaceutical Co., Ltd., номер партии Z001 PE(2014)C06(H) для защиты от света хранили при комнатной температуре в шкафу для образцов в комнате для испытаний Института фармакологии.
3. Экспериментальные методики
3.1 Экспериментальный подбор доз и разделение на группы
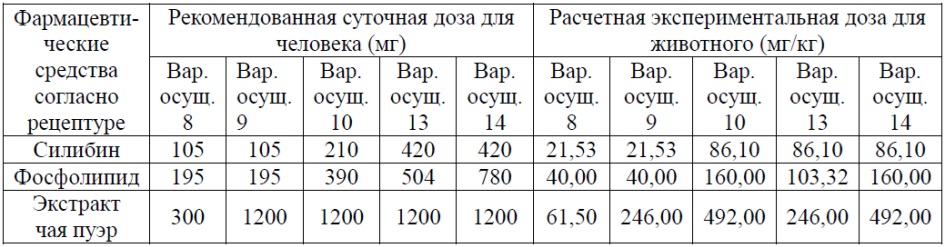
Дозу комплекса силибин-фосфолипид для введения экспериментальным животным рассчитывали в соответствии с суточной дозой для людей, составляющей 3 г (содержит 420 мг силибина, 504 мг соевого фосфолипида); дозу для введения экспериментальным животным экстракта чая пуэр рассчитывали в соответствии с суточной дозой для людей, составляющей 1,2 г; в таблице 2 показаны пять разных по соотношению составляющих компонентов композиций и подобранные экспериментальные дозы, причем доза для экспериментальных животных установлена на уровне клинически эквивалентной дозы соответствующих тестируемых веществ согласно следующей формуле для расчета:
экспериментальная доза для животного = рекомендованная доза для человека/60кг*12,3
Таблица 2. Вводимая доза различных композиций
3.2 Введение испытуемых веществ
После 1-недельного периода кормления с целью адаптации 80 мышей ob/ob 6-недельного возраста случайным образом разделяли на 8 групп: модельная группа, группа c назначением комплекса силибин-фосфолипид, группа c назначением экстракта чая пуэр, группа c назначением варианта осуществления 8, группа c назначением варианта осуществления 9, группа c назначением варианта осуществления 10, группа c назначением варианта осуществления 13, группа c назначением варианта осуществления 14, по 10 мышей в каждой группе. Еще 10 мышей C57BL/6J 6-недельного возраста составляли нормальную группу. Нормальной группе мышей скармливали стандартный рацион, а модельной группе и группе с назначением препарата скармливали богатый жирами рацион (HFD, D12492). Кроме того, мышам в разных группах введения лекарственного средства задавали соответствующие дозы лекарственных средств путем внутрижелудочного введения, при этом дозы пяти композиций показаны в таблице 2, а нормальной группе и модельной группе задавали такое же количество дистиллированной воды, путем внутрижелудочного введения на протяжении 6 недель.
Мыши имели свободный доступ к рациону и воде на протяжении эксперимента, при этом каждую неделю их взвешивали и дозы корригировали в соответствии с массой тела. После последнего введения мышей подвергали голоданию на протяжении 12 часов, но сохраняли доступ к воде, измеряли массу тела, извлекали глазные яблоки мышей для забора крови, а затем их убивали путем перелома шеи и быстро отбирали печень, промывали ее физиологическим раствором, промокали фильтровальной бумагой и после взвешивания хранили в морозильной камере при -20°C.
3.3 Определение показателей и методики
3.3.1 Общее наблюдение
Показатели массы тела мышей в каждой группе измеряли еженедельно в ходе эксперимента.
3.3.2 Расчет печеночного индекса и общая оценка морфологии печени
После окончания эксперимента печень взвешивали и рассчитывали печеночный индекс, печеночный индекс (%)= масса сырой печени/масса тела*100%.
3.3.3 Определение биохимических показателей сыворотки крови
Кровь отбирали у всех мышей путем извлечения глазных яблок и центрифугировали при 3000 об./мин в течение 15 минут, сыворотку крови отделяли и переносили в пробирки эппендорф и хранили в морозилке при -20°C для последующего использования. Содержание глютамино-щавелевоуксусной трансаминазы (AST), глутамат-пируватной трансаминазы (ALT), общего холестерина (TC), холестерина липопротеинов низкой плотности (LDL-C) в сыворотке крови измеряли с помощью автоматического биохимического анализатора 7020.
3.3.4 Индекс инсулинорезистентности
Уровень инсулина натощак (FINS) в сыворотке крови определяли с использованием набора для ИФА и индекс инсулинорезистентности рассчитывали по формуле.
Homa-IR (индекс инсулинорезистентности)= 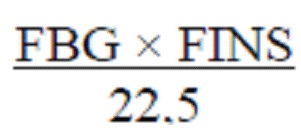
3.3.5 Гистопатологическое исследование печени
Замороженные срезы получали из замороженной ткани печени, и степень стеатоза печени определяли путем окрашивания масляным красным (oil red O). Стадии процесса окрашивания c использованием масляного красного O: получали замороженные срезы → промывали дистиллированной водой в достаточном объеме → окрашивали разведенным раствором масляного красного O в темноте на протяжении 10-15 минут → удаляли 6 мл насыщенного раствора масляного красного O, добавляли 4 мл дистиллированной воды, оставляли на 5-10 минут и удаляли с помощью фильтровальной бумаги для последующего использования → просветляли ткани в 60% этаноле → промывали водой →ядра клеток окрашивали гематоксилином → покрывали нейтральной средой для микроскопии → проводили микроскопическое исследование.
3.4 Обработка данных
Статистическое программное обеспечение SPSS 15.0 использовали для анализа, при этом данные выражали в виде среднего значения ± стандартное отклонение, а t-критерий использовали для анализа присутствия или отсутствия различия между двумя группами до и после обработки, причем различие является статистически значимым при P<0,05.
4. Результаты экспериментов
4.1 Эффекты каждого испытуемого вещества в отношении массы тела
Массу тела мышей в каждой группе измеряли еженедельно в ходе эксперимента и изучали эффекты каждого испытуемого вещества в отношении массы тела мышей с неалкогольной жировой дистрофией печени. Как показано в таблице 3, масса тела мышей в нормальной группе увеличивалась медленно, а масса тела мышей в модельной группе увеличивалась быстрее. После 6 недель введения, за исключением группы с назначением комплекса силибин-фосфолипид, в остальных группы прибавка в массе тела мышей подавлялась в различной степени (P<0,01), при этом значимое различие между группами отсутствовало.
Таблица 3. Эффекты каждого испытуемого вещества в отношении массы тела мышей (г, n=10, 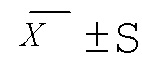 )
)
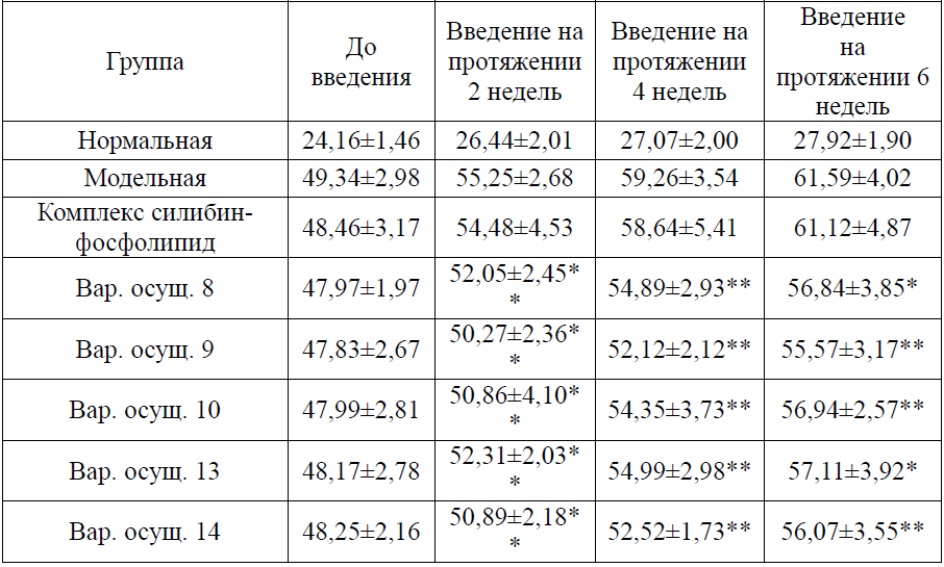
*по сравнению с модельной группой P<0,05; **по сравнению с модельной группой P<0,01.
4.2 Эффекты каждого испытуемого вещества в отношении печеночного индекса
Как показано в таблице 4, масса тела, масса сырой печени и печеночный индекс мышей в модельной группе значимо увеличивались (P<0,01) по сравнению с мышами в нормальной группе, при этом каждое испытуемое вещество может значимо уменьшать массу сырой печени и печеночный индекс у мышей (P<0,01).
Таблица 4. Эффекты каждого испытуемого вещества в отношении печеночного индекса у мышей
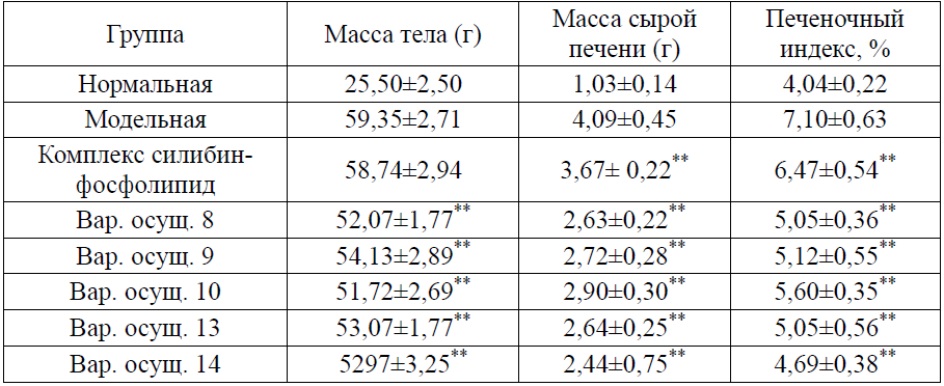
*по сравнению с модельной группой P<0,05; **по сравнению с модельной группой P<0,01.
4.3 Эффекты каждого испытуемого вещества в отношении уровня липидов в крови, функции печени и индекса инсулинорезистентности.
Как показано в таблице 5, уровни сывороточных TC, LDL, ALT, AST и индекс инсулинорезистентности значимо увеличены у мышиной модели неалкогольной жировой дистрофии печени по сравнению с нормальной группой (P<0,05). Комплекс силибин-фосфолипид демонстрирует отсутствие значимого улучшения при чрезмерно повышенном индексе (P>0,05). Композиции согласно каждому варианту осуществления могут в разной степени корригировать патологическое повышение уровня липидов крови, функцию печени и индекса инсулинорезистентности, при этом данный эффект выражен лучше, чем при использовании этих двух препаратов по отдельности; причем при использовании вариантов осуществления 18-20 уровни сывороточных TC, LDL, ALT, AST и индекс инсулинорезистентности значимо снижались (P<0,05); при использовании варианта осуществления 16 уровень сывороточного ТС и индекс инсулинорезистентности могут снижаться (P<0,05), но уровни сывороточных LDL, ALT и AST значимо не снижались (P>0,05); при использовании варианта осуществления 17 уровни сывороточных TC, ALT и индекс инсулинорезистентности могут снижаться (P<0,05), но уровни LDL и AST значимо не улучшались (P>0,05).
Таблица 5. Эффекты каждого испытуемого вещества в отношении уровня липидов в крови, функции печени и индекса инсулинорезистентности
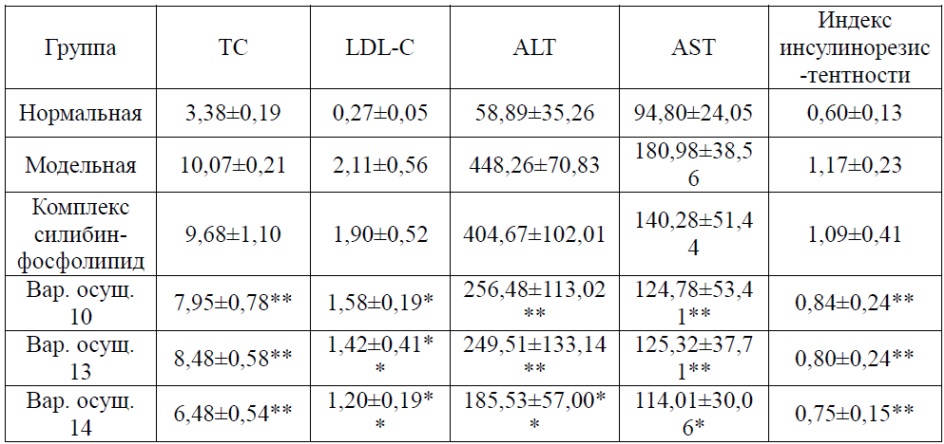
*по сравнению с модельной группой P<0,05; **по сравнению с модельной группой P<0,01.
4.4 Эффекты каждого испытуемого вещества в отношении патологического состояния печени у мышей
Окрашивание с помощью масляного красного O: при исследовании с помощью световой микроскопии замороженных срезов из тканей печени, окрашенных масляным красным О, в соответствии с размером и количеством красных частиц в гепатоцитах патологическое состояние печени классифицировали на легкий, умеренный и тяжелый типы. Легкий означает, что 1/3-2/3 красных гранул выявляют на единицу площади под световым микроскопом, что оценивают в 1 балл; умеренный означает, что более 2/3 гепатоцитов содержат красные частицы, что оценивают в 2 балла; тяжелый означает, что практически все гепатоциты содержат красные частицы, что оценивают в 3 балла; отсутствие стеатоза оценивают в 0 баллов.
Как показано в таблице 6, стеатоз встречается практически во всех гепатоцитах в тканях печени модельной группы и балл показателя патологии достоверно увеличен по сравнению с нормальной группой (P<0,01); при этом отсутствовало значимое улучшение балла показателя патологии печени при использовании комплекса силибин-фосфолипид или экстракта чая пуэр по отдельности (P>0,05); комбинация этих двух средств может корригировать течение стеатоза печени в различной степени и данный эффект лучше эффекта, наблюдаемого при использовании этих двух средств по отдельности; причем средства согласно вариантам осуществления 16, 18, 19 и 20 могут значимо снижать балл показателя патологии (P<0,05); комбинация 17 проявляет тенденцию к снижению балла показателя патологии (P>0,05).
Таблица 6. Эффекты каждого испытуемого вещества в отношении патологического состояния печени у мышей
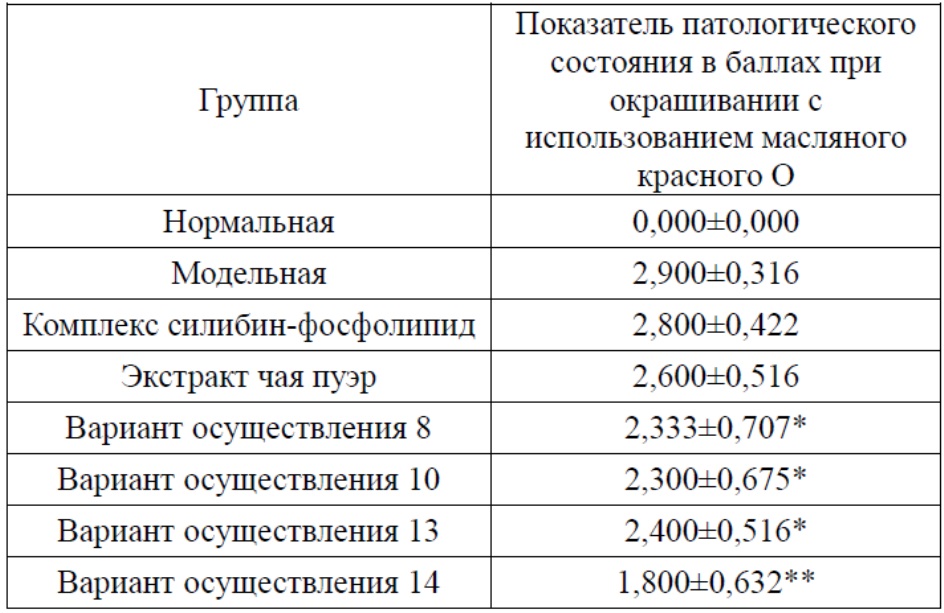
*по сравнению с модельной группой P<0,05; **по сравнению с модельной группой P<0,01.
5. Выводы, полученные на основе экспериментов
Вышеприведенные результаты экспериментов демонстрируют, что масса тела, печеночный индекс, уровни липидов в крови, ALT, AST и индекс инсулинорезистентности значимо увеличивались у мышей модельной группы с неалкогольной жировой дистрофией печени по сравнению с мышами контрольной группы, и в тканях печени присутствовал тяжелый стеатоз. Чай пуэр может корригировать инсулинорезистентность, регулировать уровни липидов крови в сочетании с высокой способностью силибина к захвату свободных радикалов и к предупреждению оксидативного стресса, при этом использование в комбинации данных двух средств значимо улучшало течение стеатоза печени, и этот эффект был выражен лучше, чем эффект при их использовании по отдельности, то есть они обладают синергическим эффектом.
Краткое описание графических материалов
На фигуре 1 представлена кривая высвобождения in vitro, где каждый образец представляет собой следующее: эталонный препарат Shui Lin Jia, Shui Lin Jia без чая пуэр и композиции на основе силибина-фосфолипида-чая пуэр, полученные в вариантах осуществления 16-20.
Подробное описание настоящего изобретения
Далее подробное описание настоящего изобретения будет описано более подробно со ссылкой на варианты осуществления и экспериментальные примеры, чтобы более четко описать преимущества и характеристики настоящего изобретения. Однако эти варианты осуществления являются только иллюстративными и не предназначены для ограничения объема настоящего изобретения. Специалистам в данной области техники будет понятно, что различные модификации и замены могут быть сделаны в элементах и формах настоящего изобретения без отклонения от сущности и объема настоящего изобретения, но такие модификации и замены подпадают под объем настоящее изобретение. Настоящее изобретение дополнительно иллюстрируется следующими конкретными вариантами осуществления, но не предназначено для ограничения настоящего изобретения.
Вариант осуществления 1
Отбирали 26,25 г силибина, 45 г соевого фосфолипида, 75 г экстракта чая пуэр.
1) Получали раствор комплекса на основе силибина: отвешивали заданное количества силибина и соевого фосфолипида и их растворяли в безводном этаноле, нагревали с обратным холодильником для осветления раствора и продолжали нагревать в течение 1 ч, затем концентрировали при пониженном давлении и повторно извлекали с помощью этанола с получением 15% от исходного объема для последующего применения;
2) грануляция: отвешивали заданное количество экстракта чая пуэр в качестве исходного материала, отбирали раствор комплекса на основе силибина, полученный на стадии 1, в качестве подаваемой жидкости, получали гранулы с помощью способа грануляции распылением в псевдоожиженном слое, устанавливали температуру материалов на уровне 40°C, высушивали при 60°C в течение 20 мин, после полного распыления раствора комплекса, гранулы расфасовывали в пакеты с получением 1000 пакетов гранул.
Вариант осуществления 2
Отбирали 180 г силибина, 195 г соевого фосфолипида, 450 г экстракта чая пуэр.
1) Получали раствор комплекса на основе силибина: отвешивали заданное количества силибина и соевого фосфолипида и их растворяли в безводном этаноле, нагревали с обратным холодильником для осветления раствора и продолжали нагревать в течение 1,5 ч, затем концентрировали при пониженном давлении и повторно извлекали с помощью этанола с получением 20% от исходного объема для последующего применения;
2) грануляция: отвешивали заданное количество экстракта чая пуэр в качестве исходного материала, отбирали раствор комплекса на основе силибина, полученный на стадии 1, в качестве подаваемой жидкости, получали гранулы с помощью способа грануляции распылением в псевдоожиженном слое, устанавливали температуру материалов на уровне 65°C, высушивали при 65°C в течение 60 мин, после полного распыления раствора комплекса, гранулы расфасовывали в пакеты с получением 1000 пакетов гранул.
Вариант осуществления 3
Отбирали 26,25 г силибина, 195 г фосфолипида сои, 450 г экстракта чая пуэр.
1) Получали раствор комплекса на основе силибина: отвешивали заданное количества силибина и соевого фосфолипида и их растворяли в безводном этаноле, нагревали с обратным холодильником для осветления раствора и продолжали нагревать в течение 0,5 часа, затем концентрировали при пониженном давлении и повторно извлекали с помощью этанола с получением 5% от исходного объема для последующего применения;
2) грануляция: отвешивали заданное количество экстракта чая пуэр в качестве исходного материала, отбирали раствор комплекса на основе силибина, полученный на стадии 1, в качестве подаваемой жидкости, получали гранулы с помощью способа грануляции распылением в псевдоожиженном слое, устанавливали температуру материалов на уровне 50°C, высушивали при 55°C в течение 10 мин, после полного распыления раствора комплекса, гранулы расфасовывали в пакеты с получением 1000 пакетов гранул.
Вариант осуществления 4
Отбирали 26,25 г силибина, 195 г соевого фосфолипида, 75 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 5
Отбирали 180 г силибина, 45 г соевого фосфолипида, 75 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 6
Отбирали 180 г силибина, 45 г соевого фосфолипида, 450 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 7
Отбирали 180 г силибина, 195 г соевого фосфолипида, 75 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 8
Отбирали 26,25 г силибина, 48,75 г соевого фосфолипида, 75 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 9
Отбирали 26,25 г силибина, 48,75 г соевого фосфолипида, 300 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 10
Отбирали 52,5 г силибина, 97,5 г соевого фосфолипида, 300 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 11
Отбирали 75 г силибина, 90 г соевого фосфолипида, 240 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 12
Отбирали 90 г силибина, 108 г соевого фосфолипида, 270 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 13
Отбирали 105 г силибина, 126 г соевого фосфолипида, 300 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 14
Отбирали 105 г силибина, 195 г соевого фосфолипида, 300 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 15
Отбирали 120 г силибина, 150 г соевого фосфолипида, 360 г экстракта чая пуэр и получали 1000 пакетов гранул согласно cпособу варианта осуществления 1.
Вариант осуществления 16
Отбирали гранулы, полученные в варианте осуществления 8, добавляли 494 г микрокристаллической целлюлозы и 56 г натриевой соли карбоксиметилкрахмала, равномерно перемешивали, заключали в капсулы № 0 c с получением 1000 капсул.
Вариант осуществления 17
Отбирали гранулы, полученные в варианте осуществления 9, добавляли 269 г микрокристаллической целлюлозы и 56 г натриевой соли карбоксиметилкрахмала, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 18
Отбирали гранулы, полученные в варианте осуществления 10, добавляли 194 г микрокристаллической целлюлозы и 56 г натриевой соли карбоксиметилкрахмала, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 19
Отбирали гранулы, полученные в варианте осуществления 13, добавляли 169 г микрокристаллической целлюлозы, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 20
Отбирали гранулы, полученные в варианте осуществления 14, добавляли 44 г микрокристаллической целлюлозы и 56 г натриевой соли карбоксиметилкрахмала, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 21
Отбирали гранулы, полученные в варианте осуществления 8, добавляли 400 г лактозы, 94 г крахмала и 56 г натриевой соли карбоксиметилкрахмала, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 22
Отбирали гранулы, полученные в варианте осуществления 13, добавляли 80 г лактозы, 10 г талька и 79 г гидроксипропилцеллюлозы с низкой степенью замещения, равномерно перемешивали, заключали в капсулы № 0 с получением 1000 капсул.
Вариант осуществления 23
Отбирали гранулы, полученные в варианте осуществления 13, добавляли 169 г микрокристаллической целлюлозы, равномерно перемешивали, и осуществляли таблетирование с получением 1000 таблеток.