БИОМАРКЕРЫ ДЛЯ ТУБЕРКУЛЕЗА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области биомаркеров заболевания. В одном из аспектов изобретение относится к способам детекции или диагностики туберкулеза у субъекта с использованием таких биомаркеров.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
Туберкулез является основной проблемой здравоохранения в развивающихся странах из-за перенаселения, плохой инфраструктуры и высокой частоты инфекции ВИЧ [1]. Одним из основных препятствий для уменьшения переноса ТВ является отсутствие точных диагностических тестов для применения в клиниках для первичной медицинской помощи, в которых при осмотре большинства пациентов с ТВ (60%) еще не могут обеспечить лабораторно подтвержденный диагноз ТВ [2]. Без своевременного и точного диагноза, перенос происходит с частотой 15 близких контактов в год на пациента [3].
Современные диагностические тесты для ТВ требуют детекции бактерий в образцах мокроты. Однако для них показана значительная изменчивость в чувствительности и специфичности, особенно для ВИЧ-положительных субъектов из-за непродуктивной или олигобациллярной мокроты. Современный золотой стандарт диагностического теста, культура мокроты, занимает много времени, дорог, подвержен контаминации и требует инфраструктуры. Новые тесты на молекулярной основе, такие как GeneXpert®, обеспечивают быструю детекцию ТВ и устойчивости к рифампицину в хорошо оборудованных лабораториях, но являются дорогими, требуют инфраструктуры и теряют чувствительность у субъектов с отрицательным мазком мокроты (включая детей и ВИЧ-положительных).
Быстрые тесты на основе микрожидкостных устройств (иммунохроматографические анализы на тест-полосках) являются многообещающими для диагностики ТВ. Они просты в использовании, дешевы, обеспечивают ответ в течение нескольких минут, не требуют специализированного оборудования и стабильны при комнатной температуре; что делает их идеальными для применения в условиях высокой нагрузки ТВ, ограниченности ресурсов. Иммунохроматографические анализы на тест-полосках детектируют маркеры в образце жидкости организма; где моча и кровь являются наиболее распространенными. До настоящего времени, однако, такой тест не разработан для ТВ из-за утраты чувствительности, связанной с маркерами и/или типом образца.
Низкая чувствительность современных анализов высвобождения IFN-γ на основе крови (IGRA) [4] может быть обусловлена миграцией специфических для ТВ клеток из крови в легкое в ходе активного ТВ, поскольку значительно более высокие уровни клеточных и растворимых иммунных маркеров хозяина присутствуют в плевральной жидкости по сравнению с кровью тех же самых субъектов [5]. Анализы приводили к 96% правильной классификации ТВ или других респираторных заболеваний независимо от статуса ВИЧ [5]. Кроме того, анализы не требовали стимуляции антигеном, с высокими уровнями маркеров, присутствующими непосредственно ex-vivo. Антигены Mtb значительно меняются в соответствии со стадией инфекции, что позволяет предполагать, что независимый от антигенов тест может увеличивать специфичность.
Несмотря на доверие к сбору образцов мокроты для диагностики ТВ посредством микробиологии, диагностический потенциал растворимой фракции (т.е. биомаркеров хозяина) не оценивали, как наблюдали для других респираторных заболеваний, таких как астма [6], кистозный фиброз [7] и хроническое обструктивное заболевание легких (COPD) [7].
Таким образом, еще существует необходимость в улучшенных способах детекции туберкулеза у субъектов. В частности, существует необходимость в способе, который является точным, но быстрым, недорогим и пригодным для использования по месту оказания медицинской помощи (т.е. не в лабораторных условиях).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к способу детекции туберкулеза у субъекта, включающего в себя (a) определение уровня одного или нескольких биомаркеров иммунной системы хозяина в образце мокроты, полученном от субъекта; и (b) сравнение уровней биомаркеров в образце мокроты с одним или несколькими эталонными значениями; где уровни биомаркеров в образце мокроты по сравнению с эталонными значениями являются показателем присутствия или отсутствия туберкулеза у субъекта.
В одном из вариантов осуществления биомаркеры содержат растворимые белки. Например, биомаркеры могут содержать один или несколько цитокинов, хемокинов и/или факторов роста.
В одном из вариантов осуществления биомаркеры содержат один или несколько цитокинов Th2. Предпочтительно, уменьшенный уровень цитокина(цитокинов) Th2 по сравнению с эталонным значением(значениями) является показателем присутствия туберкулеза у субъекта. В одном из вариантов осуществления цитокины Th2 содержат интерлейкин-10 (IL-10) и/или интерлейкин-13 (IL-13).
В другом варианте осуществления биомаркеры содержат один или несколько цитокинов, выбранных из антагониста рецептора интерлейкина-1 (IL-1Ra), интерлейкина-15 (IL-15), гранулоцитарного колониестимулирующего фактора (G-CSF) и фактора роста эндотелия сосудов (VEGF). Предпочтительно, уменьшенный уровень IL-1Ra, IL-15, G-CSF и/или VEGF по сравнению с эталонными значениями является показателем присутствия туберкулеза у субъекта.
В другом варианте осуществления биомаркер содержит фактор роста фибробластов (FGF). Предпочтительно, увеличенный уровень FGF по сравнению с эталонным значением является показателем присутствия туберкулеза у субъекта.
В другом варианте осуществления биомаркеры дополнительно содержат один или несколько цитокинов Th1. Предпочтительно, уменьшенный уровень цитокина(цитокинов) Th1 по сравнению с эталонным значением(значениями) является показателем присутствия туберкулеза у субъекта. В одном из вариантов осуществления цитокин Th1 содержит IFN-γ.
В другом варианте осуществления биомаркеры выбраны из группы, состоящей из IL-1Ra, IL-10, IL-13, IL-15, FGF, G-CSF, VEGF и IFN-γ. Предпочтительно, биомаркеры содержат IL-13, FGF и/или IFN-γ.
В одном из вариантов осуществления подозревают, что субъект страдает заболеванием легких (или респираторным нарушением), и для субъекта показаны один или несколько симптомов, выбранных из хронического кашля, боли в груди и лихорадки. Предпочтительно, уровни биомаркеров в образце мокроты по сравнению с эталонными значениями являются показателем того, страдает ли субъект туберкулезом или другим респираторным заболеванием (например, пневмонией, астмой или хроническим обструктивным заболеванием легких), т.е. уровни биомаркеров позволяют отличать туберкулез от других респираторных заболеваний (например, пневмонии, астмы или хронического обструктивного заболевания легких) у субъекта.
В одном из вариантов осуществления эталонное значение содержит уровень биомаркера в образце мокроты от субъекта, не страдающего туберкулезом. Таким образом, уровни биомаркеров в образце мокроты предпочтительно сравнивают с соответствующими уровнями биомаркеров (для каждого конкретного биомаркера) в контрольных образцах. В одном из вариантов осуществления контрольные образцы могут включать в себя образцы от субъектов, страдающих другими заболеваниями легких (или респираторными нарушениями), например, такими как пневмония.
В одном из вариантов осуществления уровни биомаркеров определяют посредством иммунологического анализа (например, каждый биомаркер детектируют с использованием антитела или его фрагмента). Предпочтительно, уровни биомаркеров определяют с использованием анализа ELISA. В одном из вариантов осуществления детекцию проводят с использованием иммунохроматографического анализа. В другом варианте осуществления уровни биомаркеров детектируют с использованием мультиплексного анализа цитокинов, например, с использованием микросфер Luminex™.
В дополнительном аспекте настоящее изобретение относится к способу лечения субъекта, предположительно страдающего заболеванием легких, включающему в себя (a) определение способом, как определено выше, являются ли уровни биомаркеров в образце мокроты от субъекта показателем присутствия или отсутствия туберкулеза у субъекта; и (b) если уровни биомаркеров в образце мокроты являются показателем присутствия туберкулеза, лечение субъекта от туберкулеза.
В одном из вариантов осуществления лечение от туберкулеза включает в себя введение терапевтически эффективного количества противотуберкулезного средства субъекту. Предпочтительно лечение включает в себя введение изониазида, рифампицина, этамбутола и/или пиразинамида субъекту. В другом предпочтительном варианте осуществления лечение от туберкулеза проводят в течение по меньшей мере 2 месяцев, по меньшей мере 4 месяцев или по меньшей мере 6 месяцев.
В другом варианте осуществления, если уровни биомаркеров в образце мокроты являются показателем отсутствия туберкулеза, способ включает в себя лечение субъекта от другого респираторного состояния, например, пневмонии, астмы или хронического обструктивного заболевания легких. Например, лечение от пневмонии может включать в себя введение амоксициллина, доксициклина, кларитромицина, азитромицина и/или эритромицина субъекту.
В дополнительном аспекте, настоящее изобретение относится к устройству для иммунохроматографического анализа для детекции туберкулез у субъекта, где устройство содержит один или несколько реагентов, подходящих для детекции одного или нескольких биомаркеров иммунной системы хозяина в образце мокроты, полученном от субъекта.
В одном из вариантов осуществления устройство содержит одно или несколько антител, которые специфически связывают один или несколько биомаркеров иммунной системы хозяина. Предпочтительно, антитела связывают один или несколько цитокинов, хемокинов и/или факторов роста. Более предпочтительно, антитела специфически связывают один или несколько из IL-1Ra, IL-10, IL-13, IL-15, FGF, G-CSF, VEGF и IFN-γ. Наиболее предпочтительно, антитела связывают IL-13, FGF и/или IFN-γ.
В одном из вариантов осуществления устройство содержит меченое антитело (например, антитело, меченное поддающейся детекции группой, такой как флуоресцентная метка или радиоактивная метка) и иммобилизованное антитело (например, антитело, иммобилизованное на твердой фазе). Предпочтительно, каждое из меченого и иммобилизованного антитела связывают различные эпитопы на биомаркере, т.е. так, что антитела не конкурируют за связывание с биомаркером. Таким образом, меченые и иммобилизованные антитела, как правило, являются способными одновременно связывать биомаркер.
Предпочтительно, иммобилизованное антитело является иммобилизованным на материале хроматографического носителя. Материал хроматографического носителя, как правило, представляет собой капиллярно-активный материал, который, например, позволяет миграцию жидкого компонента образца мокроты.
В предпочтительном варианте осуществления устройство находится в форме тестовой полоски или тестовой полоски, которую погружают в образец, например, хроматографической тестовой полоски. Контакт образца с тестовой полоской может, в одном из вариантов осуществления, позволять миграцию жидкости в образце по направлению к иммобилизованному антителу. В некоторых вариантах осуществления меченое антитело депонировано на материале хроматографического носителя, и предпочтительно, также мигрирует по направлению к иммобилизованному антителу после нанесения образца на тестовую полоску. В предпочтительном варианте осуществления меченое антитело и биомаркер формируют комплекс, который связывается посредством иммобилизованного антитела в тестовой области хроматографической полоски. На присутствие туберкулеза у субъекта предпочтительно указывает видимый сигнал (например, измерение окраски) в тестовой области устройства после контакта устройства с образцом мокроты.
В следующем аспекте настоящее изобретение относится к применению устройства для иммунохроматографического анализа, как описано выше, для детекции туберкулеза у субъекта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
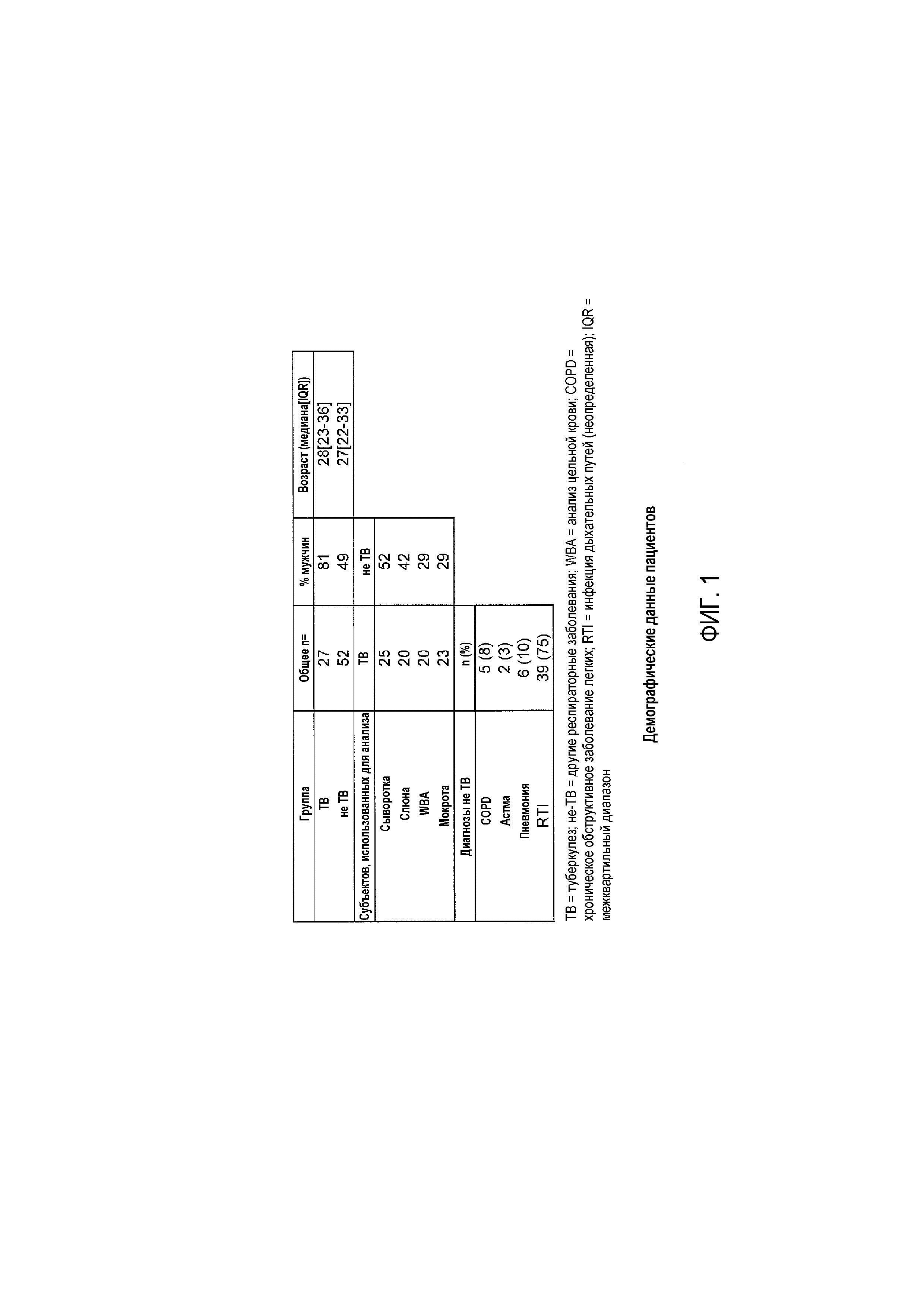
Фигура 1: Демографические данные пациентов. ТВ=туберкулез; не-TB=другие респираторные заболевания; WBA=анализ цельной крови; COPD=хроническое обструктивное заболевание легких; RTI=инфекция дыхательных путей (неопределенная); IQR=межквартильный диапазон.
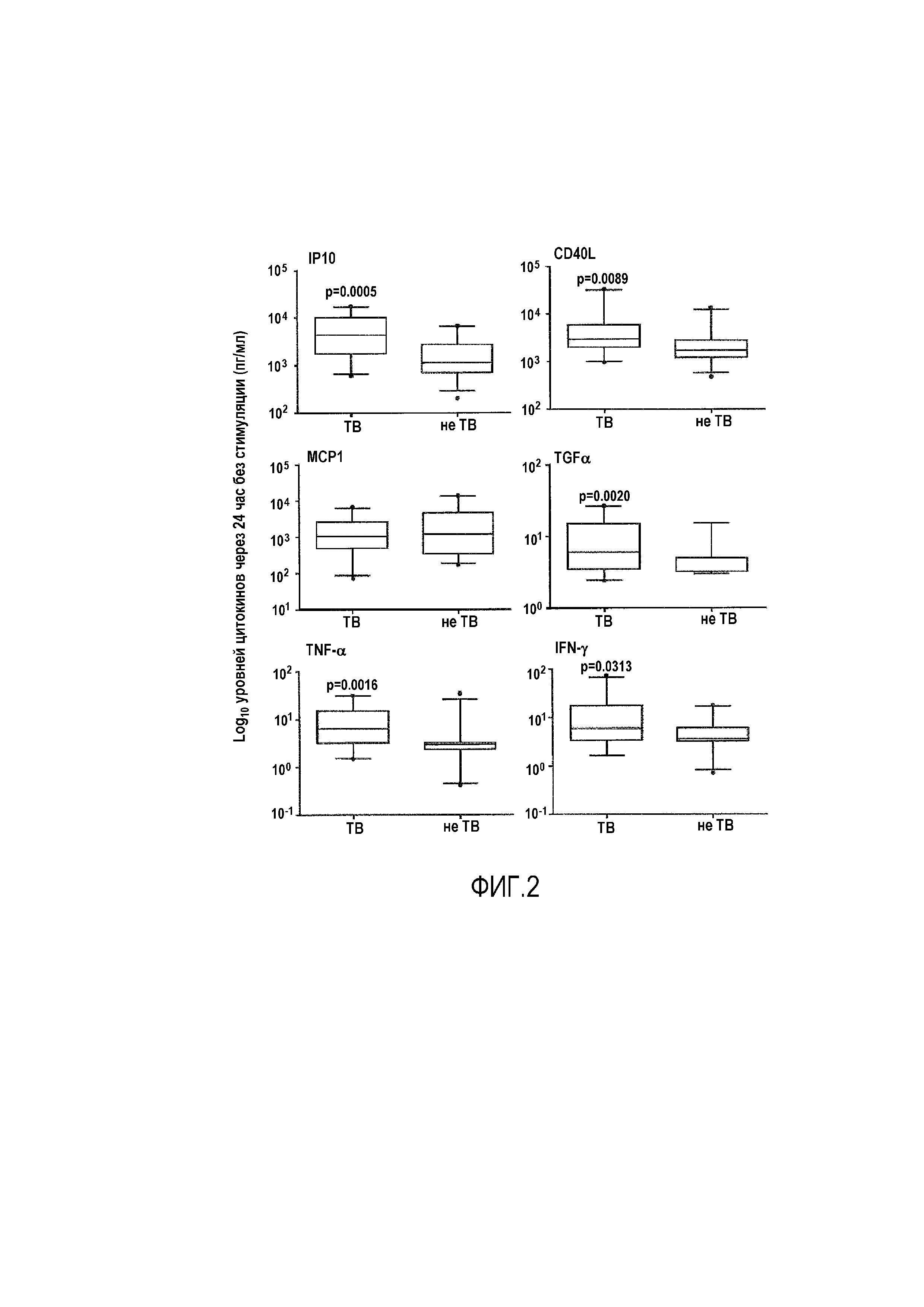
Фигура 2: Уровни цитокинов после 24 час инкубации без стимуляции антигеном (контроль Nil). Анализ 20 ТВ и 26 не-TB (других респираторных нарушений) по уровню цитокинов после 24 часов инкубации. Прямоугольниками показан межквартильный диапазон; линией показана медиана; планками показан диапазон 5-95%, и точками показаны выпавшие данные. Данные анализировали с использованием U-критерия Манна-Уитни для сравнения ТВ и не-TB. Значения p ≤0,035 считали значимыми, и они указаны.
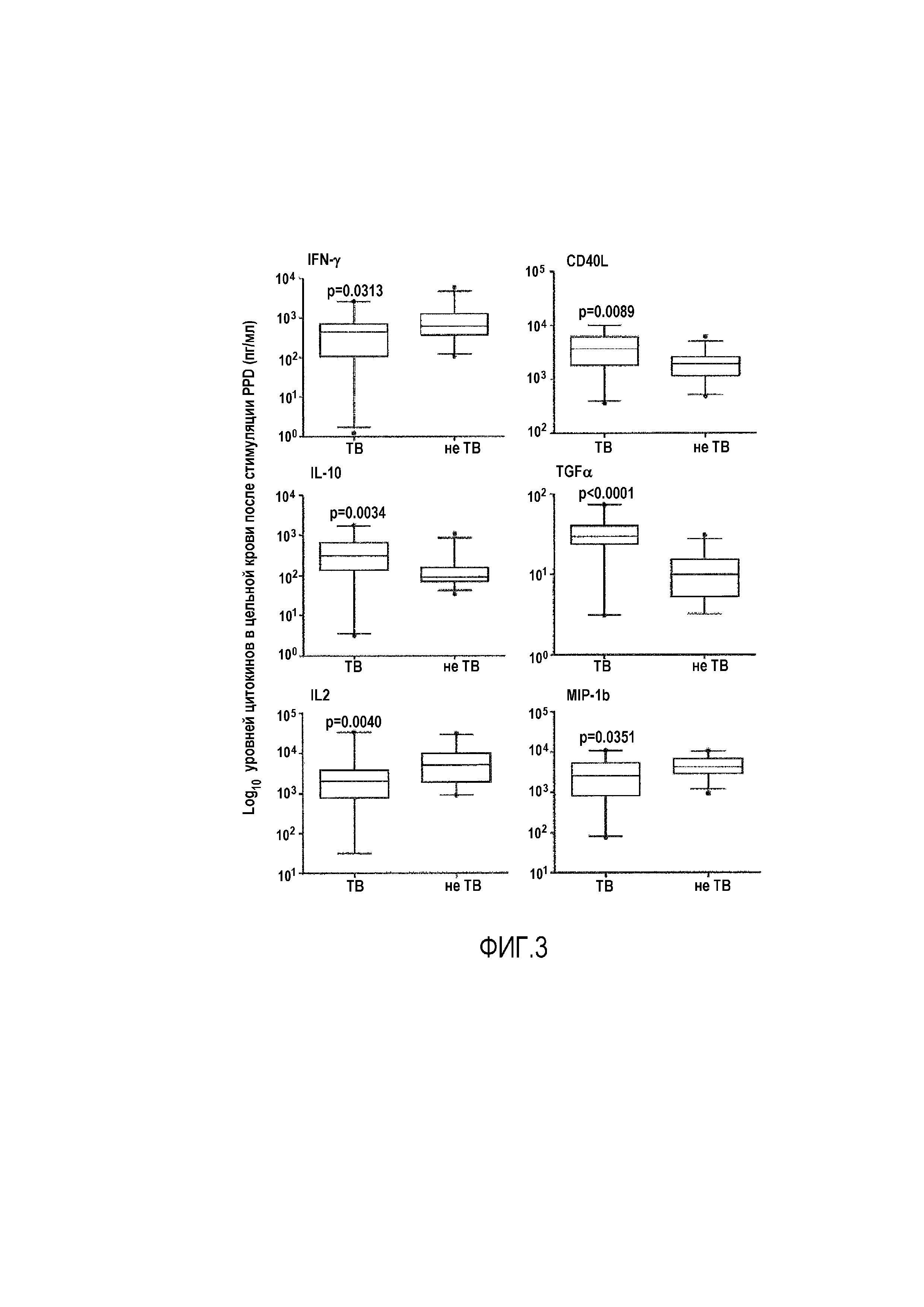
Фигура 3: Уровни цитокинов после 24 час инкубации с PPD. Анализ 20 ТВ и 26 не-TB (другие респираторные нарушения) по уровням цитокинов после 24 часов инкубации с PPD. Прямоугольниками показан межквартильный диапазон; линией показана медиана; планками показан диапазон 5-95%, и точками показаны выпавшие данные. Данные анализировали с использованием U-критерия Манна-Уитни для сравнения ТВ и не-TB. Значения p ≤0,035 считали значимыми, и они указаны.
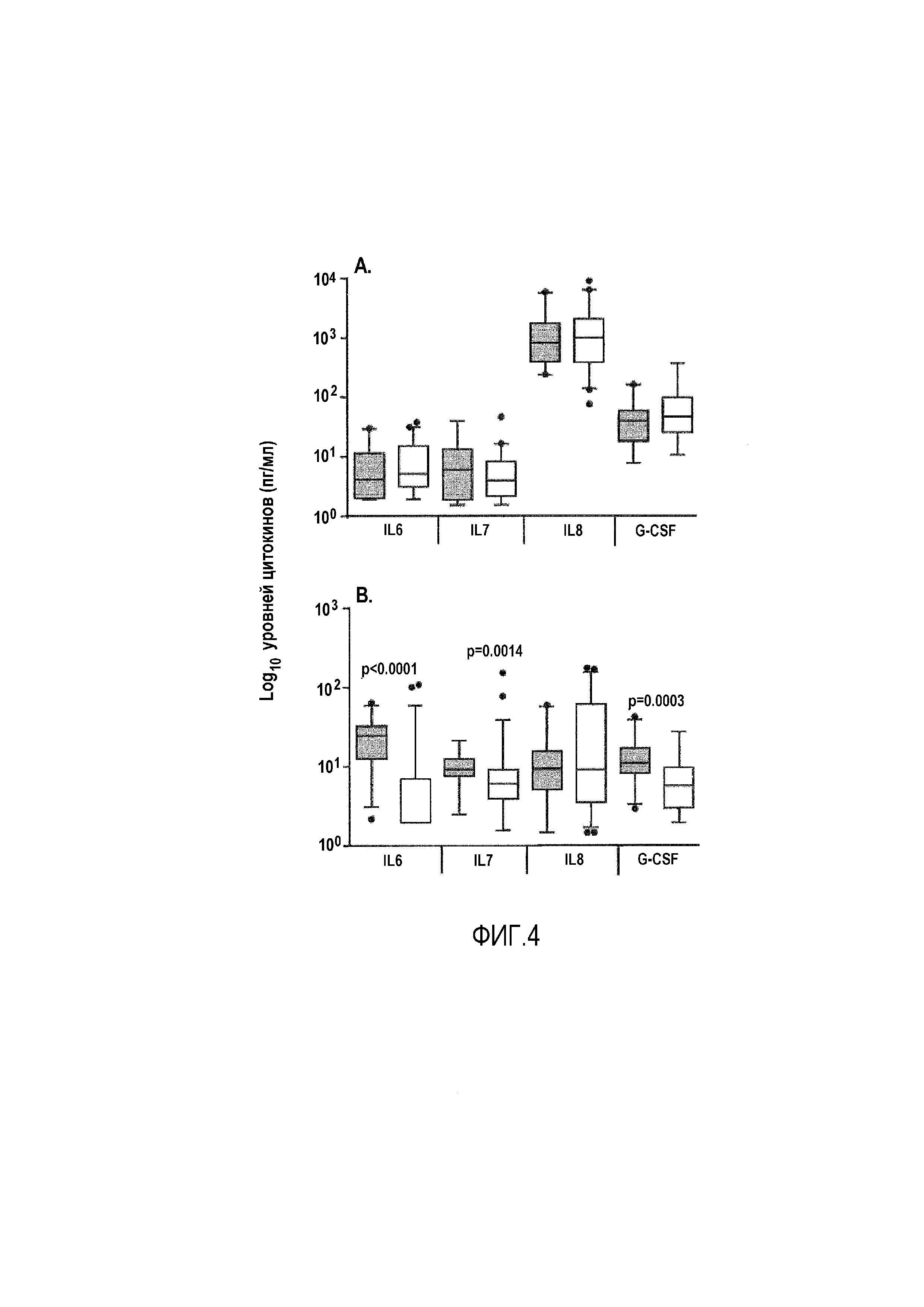
Фигура 4: Уровни цитокинов ex vivo в сыворотке и слюне. A: Анализ ex vivo слюны от 20 ТВ (серый) и 42 не-TB (белый) субъектов. B: Анализ ex vivo сыворотки от 25 ТВ (серый) и 52 не-TB (белый) субъектов. Прямоугольниками показан межквартильный диапазон; линией показана медиана; планками показан диапазон 5-95%, и точками показаны выпавшие данные. Данные анализировали с использованием U-критерия Манна-Уитни для сравнения ТВ и не-TB. Значения p ≤0,035 считали значимыми, и они указаны.
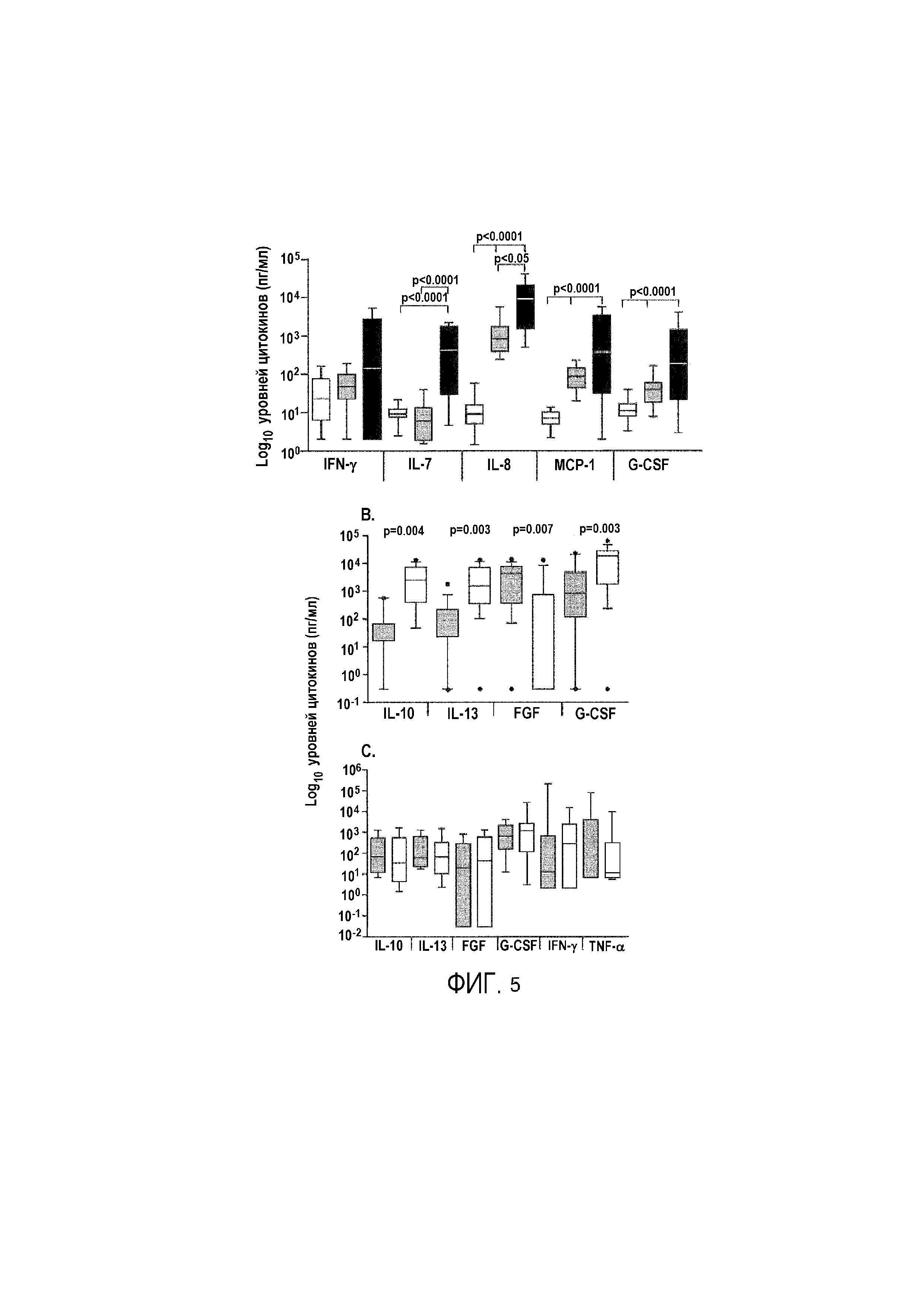
Фигура 5: В мокроте показаны высокие уровни цитокинов непосредственно ex vivo. A: Сравнение уровней цитокинов в сыворотке (белый), слюне (серый) и мокроте (черный) от пациентов с ТВ (n=25, 20 и 23, соответственно). Следует отметить, что показанные значения не корректированы на разведение цитокинов мокроты в ходе расщепления. B: Анализ ex vivo уровней цитокинов в мокроте от ТВ (n=23) и не-TB (n=29) субъектов. Прямоугольниками показан межквартильный диапазон; линией показана медиана; планками показан диапазон 5-95% и точками показаны выпавшие данные. Данные анализировали с использованием U-критерия Манна-Уитни для сравнения ТВ и не-TB. Значения p ≤0,035 считали значимыми, и они указаны.
Фигура 6: Тепловая карта уровней цитокинов в мокроте ex vivo. Указаны медианные значения (красный=высокий, синий=низкий) для субъектов с ТВ (n=23) и субъектов с другими респираторными нарушениями (не-TB; n=29).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому способу детекции туберкулеза у субъекта. Вместо попыток детекции туберкулезных антигенов (которые являются динамичными и меняются в зависимости от состояния, присутствующего количества, штамма и вирулентности бактерий), в способе преимущественно используют биомаркеры хозяина, обеспечивающие профиль белков, специфический для туберкулеза. На этот профиль не влияет штамм микобактерии, лежащий в основе инфекции, что делает способ более широко применимым, чем существующие способы на основе антигенов. Кроме того, способ можно использовать, чтобы отличать туберкулез от других состояний легких, таких как пневмония. Поскольку способ осуществляют на образцах мокроты, но без необходимости стимуляции антигенами или культивирования, способ является быстрым, и его можно осуществлять не в лабораторных условиях. Таким образом, способ можно осуществлять без использования игл или отбора образцов крови, без необходимости способов расширенной диагностики и без необходимости инфраструктуры, такой как медицинские учреждения, электричество и т.д. Это является особенно важным для облегчения использования способа в развивающихся странах.
Детекция туберкулеза
В одном из аспектов настоящее изобретение относится к способу детекции туберкулеза у субъекта. Под «детекцией туберкулеза», как правило, понимают, что способ можно использовать для определения того, страдает ли субъект туберкулезом. Таким образом, в конкретных вариантах осуществления способ можно использовать для диагностики туберкулеза; скрининга популяции пациентов по присутствию туберкулеза; детекции активной туберкулезной инфекции; детекции инфекции легких микобактериями (например, Mycobacterium tuberculosis); и/или мониторирования прогрессирования туберкулезной инфекции у субъекта.
Туберкулез (ТВ) представляет собой хроническое инфекционное заболевание, которое в основном, вызвано инфекцией микобактерией, такой как Mycobacterium tuberculosis. В одном из вариантов осуществления детекция ТВ означает детекцию инфекции бактерией из комплекса Mycobacterium tuberculosis. Комплекс Mycobacterium tuberculosis состоит из M. tuberculosis в буквальном смысле, M. africanum, M. Beijing и других. Другие виды микобактерий, которые могут являться ассоциированными с туберкулезом, в некоторых случаях включают в себя Mycobacterium bovis, Mycobacterium canetti и Mycobacterium microti. Только приблизительно у 10% субъектов, инфицированных такими микобактериями, как правило, развивается активный (т.е. симптоматический) туберкулез. Активная туберкулезная инфекция, как правило, поражает преимущественно легкие, приводя к таким симптомам, как боль в груди, лихорадка и хронический кашель с образованием мокроты. Могут возникать также внелегочные симптомы, например, в центральной нервной и лимфатической системах. Таким образом, настоящий способ, как правило, используют для детекции активной туберкулезной инфекции, например, при которой для субъекта показаны один или несколько вышеуказанных симптомов.
Настоящий способ также можно использовать, чтобы отличать туберкулез от других заболеваний легких или респираторных нарушений, в частности, пневмонии. Способ также можно использовать, чтобы отличать туберкулез от неинфекционных заболеваний легких, таких как хроническое обструктивное заболевание легких (COPD) и астма.
Пневмония представляет собой воспалительное состояние легких, как правило, вызванное инфекцией вирусами или бактериями. Симптомы пневмонии также могут включать кашель, потерю массы, боль в груди и лихорадку. Таким образом, во многих случаях трудно отличить пневмонию от туберкулеза без проведения рентгеновского исследования субъекта. Однако пневмония и туберкулез, как правило, требуют лечения с помощью достаточно различных схем лечения, и последствия неправильной диагностики могут быть очень серьезными. Например, также как к уменьшенной терапевтической эффективности для индивидуального субъекта, неточный диагноз может приводить к увеличенному переносу заболевания и увеличенной устойчивости к лекарственному средству с течением времени. Настоящее изобретение, таким образом, в одном из аспектов относится к улучшенному способу определения того, страдает ли субъект, предположительно страдающий заболеванием легких (например, обладающий одним или несколькими симптомами, показательными для туберкулеза и/или пневмонии), туберкулезом или другим заболеванием легких, таким как пневмония.
Субъект
В одном из вариантов осуществления субъект представляет собой человека. Однако, способ по настоящему изобретению не является ограниченным человеком, и его также можно осуществлять, например, для не относящихся к человеку млекопитающих. В предпочтительном варианте осуществления субъект представляет собой взрослого человека, хотя в некоторых вариантах осуществления способ можно осуществлять для ребенка или младенца.
Как правило, субъект предположительно страдает заболеванием легких. Таким образом, субъект может обладать одним или несколькими симптомами, ассоциированными с заболеванием легких, например, хроническим кашлем (как правило с образованием мокроты), болью в груди, затруднением дыхания, лихорадкой и/или потерей массы тела.
Образец
В вариантах осуществления настоящего изобретения биомаркеры детектируют в образце мокроты, полученной от субъекта. Мокрота (или слизь) представляет собой густую, вязкую жидкость, происходящую из легких. Образец мокроты, как правило, выходит из легких при кашле. Мокроту следует отличать от слюны, которая значительно более жидкая и происходит из ротовой полости, а не из легких.
Субъекты, предположительно страдающие заболеванием легких, таким как туберкулез, как правило, выделяют значительное количество мокроты, которое можно анализировать с использованием способа, описываемого в настоящем документе. Способы получения образцов мокроты от субъектов хорошо известны. Например, в некоторых случаях субъекта можно проинструктировать сделать одно или два глубоких дыхания, а затем кашлять, пока он не будет способен откашлять густой, вязкий образец мокроты.
При необходимости, можно предпринимать дополнительные шаги, чтобы помочь субъекту предоставить образец мокроты. Вдыхание горячего влажного воздуха может разжижать слизь дыхательных путей, что облегчает откашливание образца мокроты. Например, субъект может вдыхать туман (например, полученный посредством ручного струйного распылителя или ультразвукового распылителя), содержащий 3-15% раствор соли в течение 5-15 минут перед кашлем.
Биомаркеры иммунной системы хозяина
В вариантах осуществления настоящего изобретения детектируют один или несколько биомаркеров иммунной системы хозяина. Под «биомаркерами хозяина», как правило, понимают, что биомаркеры получены от самого субъекта (а не, например, из патогена, инфицировавшего субъекта). Например, биомаркеры хозяина могут быть кодированы геномом субъекта, а не генетическим материалом возбудителя инфекции. Как правило, биомаркеры хозяина, таким образом, представляют собой человеческие белковые биомаркеры.
Под «биомаркерами иммунной системы», как правило, понимают, что биомаркеры экспрессируются в иммунной системе субъекта. Например, биомаркеры можно выражать посредством клеток иммунной системы (например, лейкоцитов, таких как лимфоциты, нейтрофилы или макрофаги), или биомаркеры могут оказывать биологическое действие на клетки иммунной системы. В предпочтительном варианте осуществления один или несколько биомаркеров представляют собой иммуномодуляторы.
Как правило, биомаркеры представляют собой растворимые белки или пептиды. Например, биомаркеры могут представлять собой сигнальные молекулы, секретируемые клетками иммунной системы, и/или связывающиеся с рецепторами клеточной поверхности на клетках иммунной системы.
В предпочтительных вариантах осуществления биомаркеры содержат один или несколько цитокинов, хемокинов и/или факторов роста. Цитокины представляют собой группу передающих сигналы молекул (как правило, белков или пептидов), которые, как правило, оказывают иммуномодулирующие эффекты, часто посредством связывания с рецепторами на клетках иммунной системы (например, лейкоцитах). Примеры подгрупп цитокинов включают в себя лимфокины, интерлейкины и интерфероны.
Ответы T-клеток-помощников общепринятым образом классифицируют как Th1 или Th2, где Th1 классическим образом ассоциируют с опосредованными клетками (например, цитотоксическими T-клетками и макрофагами) ответами против внутриклеточных патогенов, а Th2 с гуморальными (например, продукцией секретируемых антител В-клетками) ответами против внеклеточных патогенов. Ответы Th1 и Th2, как правило, ассоциированы с конкретными цитокинами, которые можно классифицировать соответственно.
В одном из вариантов осуществления один или несколько биомаркеров представляет собой цитокин Th2. Как показано в настоящем документе, уровни цитокинов Th2 уменьшены в образцах мокроты от субъектов с туберкулезом, по сравнению с субъектами, не страдающими ТВ. Таким образом, цитокин Th2 предпочтительно представляет собой интерлейкин-4, интерлейкин-10, или интерлейкин-13. Более предпочтительно, один или несколько биомаркеров содержит IL-10 или IL-13. В таких вариантах осуществления уменьшенный уровень одного или нескольких цитокинов Th2 по сравнению с эталонными значениями, как правило, является показателем присутствия туберкулеза у субъекта.
Альтернативно, в некоторых вариантах осуществления один или несколько биомаркеров представляет собой цитокин Th1. Цитокины Th1 включают в себя, например, интерферон-γ. Даже несмотря на то, что в некоторых случаях уровни конкретных цитокинов Th1 могут не иметь статистически значимых различий между ТВ и не-TB пациентами, как показано в примерах, цитокины Th1, такие как IFN-γ, могут обладать диагностическим потенциалом при использовании в комбинации с дополнительными биомаркерами. Таким образом, в предпочтительном варианте осуществления, когда один или несколько биомаркеров представляет собой цитокин Th1, определяют по меньшей мере один дополнительный биомаркер иммунной системы хозяина (например, цитокин Th2 и/или фактор роста). В таких вариантах осуществления уменьшенный уровень одного или нескольких цитокинов Th1 (например, IFN-γ) по сравнению с эталонными значениями, как правило, является показателем присутствия туберкулеза у субъекта.
В дополнение к упомянутым выше, различные другие цитокины можно использовать в конкретных вариантах осуществления настоящего изобретения. Например, дополнительные цитокины включают в себя IL-1B, IL-2, IL-7, IL-8, IL-9, IL-12, IL-17 и TNF-α. Особенно предпочтительные цитокины включают в себя антагонист рецептора интерлейкина-1 (IL-1Ra), интерлейкин-15, фактор роста эндотелия сосудов (VEGF) и гранулоцитарный колониестимулирующий фактор (G-CSF). Уменьшенный уровень таких цитокинов по сравнению с эталонными значениями, как правило, является показателем присутствия туберкулеза у субъекта.
Хемокины представляют собой передающие сигнал молекулы, опосредующие хемоатракцию (хемотаксис) между клетками. Хемокины, как правило, ответственны за рекрутирование клеток, таких как лейкоциты (например, нейтрофилы, моноциты/макрофаги или лимфоциты), в участки воспаления, например, посредством связывания с рецепторами клеточной поверхности на таких клетках. Хемокины, как правило, представляют собой растворимые белки или пептиды, и их можно в некоторых случаях классифицировать как подгруппу цитокинов. Примеры хемокинов включают в себя хемотаксический белок-1 моноцитов (MCP-1), воспалительный белок-1α макрофагов (MIP-1α), воспалительный белок-1β макрофагов (MIP-1β), индуцируемый интерфероном гамма белок 10 (IP-10), RANTES (регулируемый при активации, экспрессируемый и секретируемый нормальными T-клетками) и эотаксин.
Факторы роста представляют собой передающие сигналы молекулы, которые, как правило, способны стимулировать рост, пролиферацию и/или дифференцировку клеток, включая ангиогенез. Некоторые агенты, классифицированные как цитокины, также можно рассматривать как являющиеся факторами роста и наоборот, например, VEGF, G-CSF и GM-CSF. Факторы роста, как правило, представляют собой белки или пептиды, или стероиды. В вариантах осуществления настоящего изобретения один или несколько биомаркеров содержит фактор роста фибробластов (FGF). Как правило, увеличенный уровень такого фактора роста в образце мокроты по сравнению с эталонным значением является показателем присутствия туберкулеза у субъекта.
Комбинации биомаркеров
В предпочтительных вариантах осуществления уровни множества (например, 2, 3, 4, 5, 6 или более) маркеров иммунной системы хозяина определяют в образце мокроты.
В одном из вариантов осуществления способ включает в себя определение уровней по меньшей мере одного цитокина Th2 и по меньшей мере одного фактора роста. В другом варианте осуществления способ включает в себя определение уровней по меньшей мере одного цитокина Th1 и по меньшей мере одного цитокина Th2. Предпочтительно, способ включает в себя определение уровней по меньшей мере одного цитокина Th1, по меньшей мере одного цитокина Th2 и по меньшей мере одного фактора роста.
В особенно предпочтительном варианте осуществления биомаркеры выбраны из группы, состоящей из IL-1Ra, IL-10, IL-13, IL-15, FGF, G-CSF, VEGF и/или IFN-γ. Более предпочтительно, биомаркеры содержат IL-13, FGF и/или IFN-γ. Например, в конкретных вариантах осуществления биомаркеры могут содержать (i) IL-13 и FGF; (ii) IL-13 и IFN-γ; (iii) FGF и IFN-γ; или (iv) IL-13, FGF и IFN-γ.
Определение уровней биомаркеров
По настоящему способу, уровни биомаркеров определяют в образце мокроты от субъекта. Количество конкретного биомаркера в образце можно измерять любым подходящим способом. Например, способы детекции белковых биомаркеров могут включать в себя использование антитела, связывающей молекулы, рецептора или их фрагмента, которые избирательно связываются с белком. Антитела, которые связываются с биомаркерами, описываемыми в настоящем документе, известны, или их можно получать известными в данной области способами, включая иммунизацию животного и сбор сыворотки (для получения поликлональных антител) или клеток селезенки (для получения гибридом посредством слияния с иммортализованными линиями клеток, что приводит к получению моноклональных антител). Аминокислотные последовательности биомаркеров, описываемых в настоящем документе, являются известными и доступными из публично доступных баз данных, и их можно использовать для получения подходящих иммуногенов для продукции антител. Молекулы для детекции, такие как антитела, можно, необязательно, связывать с твердой подложкой, например, такой как пластиковая поверхность или бусины, или массив. Подходящие форматы тестов для детекции уровней белков включают в себя, в качестве неограничивающих примеров, иммунологический анализ, такой как твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA), Вестерн-блоттинг, массивы антител, мультиплексные анализы цитокинов и иммунопреципитация.
В предпочтительном варианте осуществления биомаркеры можно детектировать с использованием мультиплексного анализа цитокинов, например, с использованием микросфер Luminex™. Например, антитела, специфически связывающиеся с каждым цитокиновым биомаркером, можно присоединять к микросферам, например, к микросферам Luminex™, разработанным для использования вместе с устройством Luminex™. Большое количество (например, вплоть до 100) различных типов микросфер можно смешивать и анализировать вместе. В одном из вариантов осуществления способ осуществляют в одном реакционном сосуде. Каждую популяцию микросфер можно отличать по ее уникальному профилю или цвету флуоресценции.
В формате типичного мультиплексного анализа цитокинов, различные типы бусин содержат антитела к различным цитокиновым биомаркерам. Обеспечивают инкубацию аликвоты бусин с небольшим объемом тестируемого образца мокроты. Затем бусины промывают для удаления не связавшегося образца. Затем добавляют антитело для детекции, конъюгированное с поддающимся детекции маркером (например, биотином, поддающимся детекции посредством добавления стрептавидина-фикоэритрина). Затем образец анализируют, например, в проточном анализаторе, посредством разделения различных типов бусин и детекции присутствия маркера. Интенсивность сигнала от каждой бусины сравнивают с интенсивностью сигнала от бусины - отрицательного контроля, включенной в препарат, для определения того, является ли бусина положительной или отрицательной для каждого цитокина.
В другом варианте осуществления биомаркеры можно детектировать с использованием массива антител. Массив антител, как правило, содержит массив молекул иммуноглобулинов или их функциональных производных или эквивалентов, иммобилизованных на отдельных областях твердой подложки, так что различные отдельные области обладают специфичностью для различных биомаркеров. Профиль связывания иммобилизованных иммуноглобулинов с их соответствующими антигенами является показателем присутствия конкретных биомаркеров в образце. Подходящие массивы антител описаны, например, в Chang (1983) J. Immunol. Methods 65, 217 223 и WO00/39580.
Альтернативно, уровень белка биомаркера можно определять посредством масс-спектрометрии. Масс-спектрометрия позволяет детекцию и количественную оценку аналита посредством его молекулярной массы. Можно использовать любой подходящий способ ионизации в области масс-спектрометрии, известный в данной области, включая в качестве неограничивающих примеров электронный удар (EI), химическую ионизацию (CI), ионизацию полем (FDI), ионизацию распылением в электрическом поле (ESI), ионизацию лазерной десорбцией (LDI), ионизацию лазерной десорбцией с использованием матрицы (MALDI) и усиленную поверхностью ионизацию лазерной десорбцией (SELDI). Можно использовать любой подходящий масс-спектрометрический способ детекции, например, квадрупольную масс-спектрометрию (QMS), масс-спектрометрию с преобразованием Фурье (FT-MS) и времяпролетную масс-спектрометрию (TOF-MS).
Иммунохроматографический анализ
В особенно предпочтительном варианте осуществления уровень биомаркера детектируют с использованием иммунохроматографического анализа. Иммунохроматографические анализы являются особенно подходящими для одностадийного исследования по месту лечения (РОСТ) и обеспечивают чувствительные и быстрые способы детекции молекул-мишеней. Иммунохроматографические анализы можно использовать в сэндвич-формате или в формате конкурентного теста. Как правило, высокомолекулярные аналиты с несколькими доступными эпитопами можно анализировать в сэндвич-формате, в то время как меньшие молекулы, представляющие только отдельный доступный эпитоп, можно детектировать посредством конкурентного анализа.
Подходящие устройства для иммунохроматографического анализа описаны, например, в US 2005/0175992 и US 2007/0059682. Как правило, устройство для иммунохроматографического анализа может быть представлено в форме тестовой полоски или тестовой полоски, которую погружают в образец. Устройство может быть изготовлено из материала хроматографического носителя, так что жидкость в образце мигрирует в сторону от зоны нанесения к зоне реагента. Как правило, молекулы аналита затем встречают меченое антитело, специфическое для аналита, и формируют комплекс аналит-антитело. Этот комплекс затем продолжает мигрировать дальше в сторону к зоне тестовой линии, на которой (например, в формате сэндвич-анализа) следующее антитело иммобилизовано на материале хроматографического носителя. Это второе (иммобилизованное) антитело, как правило, связывается с отличным эпитопом на аналите по сравнению с первым (меченым) антителом. Присутствие аналита в образце, таким образом, детектируют посредством визуализации сигнала (например, изменения окраски) в зоне тестовой линии, обусловленной связыванием комплекса меченое антитело-аналит посредством иммобилизованного антитела. В некоторых случаях, дополнительное антитело, которое связывается с меченым антителом как в присутствии, так и в отсутствие аналита (например, антитело против иммуноглобулина, связывающееся с Fc-областями меченого антитела), может быть иммобилизовано в зоне контрольной линии, которая также присутствует на тестовой полоске. Если тест функционирует правильно, сигнал должен быть визуализирован в зоне контрольной линии, независимо от того, присутствует аналит в образце или нет.
В альтернативных вариантах осуществления биомаркеры можно детектировать посредством конкурентного иммунохроматографического анализа. В таком формате анализа, образец, как правило, сначала встречает меченый аналит или его аналог (вместо меченого антитела, как в формате сэндвич-анализа, обсуждаемом выше). Аналит, происходящий из образца, затем мигрирует вместе с меченым аналитом к тестовой линии, где иммобилизованы антитела против аналита. Немеченый аналит в образце конкурирует с меченым аналитом за связывание с антителом, так что отсутствие видимой полосы на тестовой линии является показателем присутствия аналита в образце. Этот формат анализа можно использовать, например, когда является желательным предоставлять положительный видимый сигнал в качестве показателя присутствия ТВ, например, когда биомаркер представляет собой цитокин Th2, количество которого уменьшено в образцах мокроты от субъектов с заболеванием.
Антитела
В способах детекции, описываемых в настоящем документе, предпочтительно, используют одно или несколько антител, которые связываются с биомаркерами иммунной системы хозяина, описываемыми в настоящем документе. Подходящие антитела являются коммерчески доступными, или их можно получать с использованием известных способов.
Антитела содержат молекулы иммуноглобулинов. Молекулы иммуноглобулинов представляют собой в самом широком смысле члены суперсемейства иммуноглобулинов, семейства полипептидов, обладающих иммуноглобулиновыми характеристиками сворачивания молекул антител, которые содержат два β-листа и, как правило, консервативную дисульфидную связь. Антитела, как используют в настоящем документе, относятся к полноразмерным антителам или фрагментам антител, способным связывать избранный биомаркер-мишень, и включают в себя Fv, ScFv, F(ab') и F(ab')2, моноклональные и поликлональные антитела, сконструированные антитела, включая химерные, CDR-привитые и гуманизированные антитела, и искусственно отобранные антитела, полученные с использованием фагового дисплея или альтернативных способов.
Антитела можно получать из сыворотки животных, или, в случае моноклональных антител или их фрагментов, продуцировать в культуре клеток. Технологию рекомбинантных ДНК можно использовать для получения антител в соответствии с разработанными способами, в культуре клеток бактерий, дрожжей, насекомых или предпочтительно, млекопитающих. Выбранная система культуры клеток предпочтительно секретирует продукт антитела.
Выращивание клеток гибридомы или клеток-хозяев млекопитающих in vitro проводят в подходящих средах для культивирования, которые представляют собой общепринятые стандартные среды для культивирования, например, модифицированную Дульбекко среду Игла (DMEM) или среду RPMI 1640, необязательно, дополненные сывороткой млекопитающих, например, эмбриональной телячьей сывороткой, или микроэлементами и поддерживающими рост добавками, например, фидерными клетками, такими как нормальные клетки перитонеального экссудата мыши, клетки селезенки, макрофаги костного мозга, 2-аминоэтанолом, инсулином, трансферрином, липопротеином низкой плотности, олеиновой кислотой или т.п. Среда для культивирования может являться свободной от сыворотки или продуктов животного происхождения, такой как среда химически определенного состава, чтобы минимизировать контаминацию животного происхождения. Размножение клеток-хозяев, представляющих собой бактериальные клетки или клетки дрожжей, подобным образом проводят в подходящих средах для культивирования, известных в данной области, например, в случае бактерий, в среде LB, NZCYM, NZYM, NZM, Terrific Broth, SOB, SOC, 2 x YT или минимальной среде M9, и в случае дрожжей, в среде YPD, YEPD, минимальной среде или полной минимальной среде с исключением компонентов.
Клетки насекомых можно культивировать в бессывороточной среде, которая дешевле и безопаснее по сравнению с содержащей сыворотку средой. Рекомбинантный бакуловирус можно использовать в качестве экспрессирующего вектора и конструкции, используемой для трансфекции линии клеток хозяина, которые могут представлять собой любые из ряда линий клеток чешуекрылых, в частности, Spodoptera frugiperda Sf9, как известно в данной области. Обзоры экспрессии рекомбинантных белков в клетках-хозяевах насекомых представлены в Altmann et al. (1999), Glycoconj J 1999, 16, 109-23 и Kost and Condreay (1999), Curr Opin Biotechnol, 10, 428-33.
Продукция in vitro обеспечивает относительно чистые препараты антител и позволяет масштабирование для получения больших количеств желательных антител. Способы культивирования бактериальных клеток, дрожжей, клеток насекомых и млекопитающих известны в данной области и включают в себя культивирование в гомогенной суспензии, например, в аэролифтном реакторе или в реакторе с непрерывным перемешиванием, или в иммобилизованной или связанной культуре клеток, например, в полых волокнах, микрокапсулах, на агарозных микробусинах или керамических картриджах.
Большие количества желательных антител можно также получать посредством размножения клеток млекопитающих in vivo. Для этой цели клетки гибридомы, продуцирующие желательные антитела, инъецируют гистосовместимым млекопитающим, чтобы вызвать рост продуцирующих антитела опухолей. Необязательно, животных примируют с помощью углеводородов, особенно минеральных масел, таких как пристан (тетраметил-пентадекан), перед инъекцией. Через одну-три недели антитела выделяют из жидкостей организма этих млекопитающих. Например, клетки гибридомы, полученные посредством слияния подходящих клеток миеломы с продуцирующими антитела клетками селезенки от мышей Balb/c, или трансфицированные клетки, происходящие из линии клеток гибридомы Sp2/0, продуцирующие желательные антитела, инъецируют интраперитонеально мышам Balb/c, необязательно, предварительно обработанным пристаном, и через одну-две недели у животных отбирают асцитную жидкость.
Указанные выше и другие способы обсуждают, например, в Kohler and Milstein, (1975) Nature 256:495-497; US 4376110; Harlow and Lane, Antibodies: a Laboratory Manual, (1988) Cold Spring Harbor, содержание которых включено в настоящий документ посредством ссылки. Способы получения рекомбинантных молекул антител описаны в вышеуказанных ссылках, а также, например, в EP 0623679; EP 0368684 и EP 0436597, содержание которых включено в настоящий документ посредством ссылки.
Проводят скрининг супернатантов культур клеток по желательным антителам, предпочтительно, посредством иммунофлуоресцентного окрашивания клеток, экспрессирующих желательную мишень, посредством иммуноблоттинга, посредством иммуноферментного анализа, например, сэндвич-анализа или дот-анализа, или радиоиммунологического анализа.
Для выделения антител, иммуноглобулины в культуральных супернатантах или в асцитной жидкости можно концентрировать, например, посредством осаждения сульфатом аммония, диализа против гигроскопичного материала, такого как полиэтиленгликоль, фильтрации через селективные мембраны или т.п. Если необходимо и/или желательно, антитела очищают общепринятыми способами хроматографии, например, гель-фильтрацией, ионообменной хроматографией, хроматографией на DEAE-целлюлозе и/или иммуноаффинной хроматографией, например, аффинной хроматографией с белком, содержащим мишень, или с белком-A.
Антитела, полученные указанными выше способами, можно клонировать посредством выделения нуклеиновой кислоты из клеток, в соответствии с общепринятыми способами. Целесообразно, можно выделять нуклеиновые кислоты вариабельных доменов антител и использовать для конструирования фрагментов антител, таких как scFv.
В способах, описанных в настоящем документе, можно использовать рекомбинантные нуклеиновые кислоты, содержащие вставку, кодирующую вариабельный домен тяжелой цепи и/или вариабельный домен легкой цепи антител. По определению такие нуклеиновые кислоты содержат кодирующие одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, состоящие из кодирующей нуклеиновой кислоты и из комплементарной ей нуклеинов кислоты, или собственно эти комплементарные (одноцепочечные) нуклеиновые кислоты.
Антитела можно, кроме того, получать посредством мутагенеза генов антител для получения искусственных репертуаров антител. Этот способ позволяет получение библиотек антител; библиотеки антител являются также коммерчески доступными. Таким образом, искусственные репертуары иммуноглобулинов, предпочтительно, искусственные репертуары ScFv, можно использовать в качестве источника иммуноглобулинов.
Выделенные или клонированные антитела можно соединять с другими молекулами, например, средствами ассоциации нуклеиновой кислоты или белка посредством химического связывания, с использованием способов, известных в данной области (например, Harlow and Lane, Antibodies: a Laboratory Manual, (1988) Cold Spring Harbor, и Maniatis, Т., Fritsch, E. F. and Sambrook, J. (1991), Molecular Cloning: A Laboratory Manual. Cold Spring Harbor, New York, Cold Spring Harbor Laboratory Press). Такие способы можно использовать для получения меченых антител или для иммобилизации антитела на твердой фазе.
В некоторых вариантах осуществления (например, включающих в себя иммунохроматографические анализы) антитело может являться меченым. Как правило, меченое антитело способно производить поддающийся детекции сигнал. Сигнал может представлять собой, например, получение ферментативной активности, такой как протеазная активность, транскрипционная активность или индуцирующая люминесценцию активность. Предпочтительно, однако, сигнал представляет собой испускание или поглощение электромагнитного излучения, например, света. Более предпочтительно, сигнал представляет собой видимый сигнал, например, сигнал поддается детекции невооруженным глазом. Сигнал может представлять собой, например, изменение окраски, которое имеет место, когда присутствует меченое антитело.
Способы конъюгации видимых или флуоресцентных меток с различными молекулами, включая пептиды, полипептиды и антитела, хорошо известны в данной области. В определенных вариантах осуществления может являться желательным включать спейсерные средства между антителом и меткой. Спейсерные средства могут содержать линкеры или спейсеры, представляющие собой полимеры различной длины (длину которых можно контролировать посредством контроля степени полимеризации). Многочисленные спейсеры и линкеры известны в данной области, и специалисту в данной области известно, как их выбирать и использовать, в зависимости от применения. Специалисту в данной области известно также, какую длину спейсера использовать.
Сравнение с эталонными значениями
В вариантах осуществления настоящего изобретения уровни биомаркеров в образце мокроты сравнивают с одним или несколькими эталонными значениями. Эталонное значение может представлять собой, например, предварительное измерение уровня биомаркера, присутствующего в образце мокроты от нормального субъекта, т.е. субъекта, не страдающего туберкулезом. В некоторых вариантах осуществления эталонное значение можно получать для субъекта (или популяции субъектов), страдающего заболеванием легких, отличным от туберкулеза, например, пневмонией. Эталонное значение может, например, быть основано на среднем или медианном уровне биомаркера в контрольной популяции субъектов, например, 5, 10, 100, 1000 или более субъектов (которые могут являться либо совпадающими по возрасту и/или полу, либо не совпадающими с тестируемым субъектом), для которых не показаны симптомы туберкулеза. Предпочтительно, уровень биомаркера в тестируемом образце отличается по меньшей мере на 1%, 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30% или по меньшей мере на 50% по сравнению с контрольным значением.
Контрольное значение можно определять с использованием соответствующих способов определения уровня липидов в тестируем образце, например, с использованием одного или несколько образцов, полученных от контрольной популяции субъектов. Например, в некоторых вариантах осуществления уровни биомаркеров в контрольных образцах можно определять в параллельных анализах с тестируемыми образцами. В альтернативных вариантах осуществления контрольное значение может являться предварительно определенным, или может являться рассчитанным или экстраполированным, без необходимости проводить соответствующее определение в контрольном образце относительно каждого полученного тестируемого образца.
В случае иммунохроматографических анализов, присутствие или отсутствие биомаркера в образце, как правило, можно определять по присутствию или отсутствию видимого сигнала (например, изменения окраски) на тестовой линии на устройстве для иммунохроматографического анализа, т.е. результат в норме можно определять невооруженным глазом. Специалисту в данной области понятно, что устройства для иммунохроматографического анализа можно использовать также для определения того, является ли уровень конкретного биомаркера выше или ниже конкретного порогового значения (которое может соответствовать эталонному значению, как описано в настоящем документе). Пороговое и эталонное значения, в общем, можно определять с использованием различных статистических способов, включая анализ рабочей характеристической кривой, как описано в примерах ниже.
Например, конфигурацию и условия анализа, и относительные количества меченых, иммобилизованных и контрольных антител можно выбирать так, что силу видимого сигнала на тестовой линии можно сравнивать с видимым сигналом на контрольной линии, чтобы получать показатели того, составляет ли уровень биомаркера выше или ниже эталонного значения. Альтернативно, иммунохроматографический анализ на тест-полосках можно проводить для образца от субъекта параллельно с отдельным (контрольным) тестом для образца от субъекта, как известно, не страдающего туберкулезом. Контроль также может представлять собой образец, не происходящий от пациента, но содержащий определенное количество биомаркера. В любом случае, сравнение результатов для тестовой полоски с контрольной полоской может обеспечивать показатели уровня биомаркеров в образце мокроты от субъекта по сравнению с эталонным значением.
В другом альтернативном варианте осуществления, сигнал на устройстве для иммунохроматографического анализа можно оценивать количественно для обеспечения более точного показателя уровня биомаркеров. Например, можно определять интенсивность сигнала на тестовой линии для количественной оценки количества аналита в образце. Можно использовать ручные диагностические устройства, такие как считыватели для тестовых полосок, например, для освещения тестовой линии и измерения специфической длины волны света, показательной для метки. Алгоритмы обработки изображений могут быть включены в такие считыватели для корреляции сигнала с концентрациями аналитов.
Лечение заболевания легких
В дополнительном аспекте, настоящее изобретение относится к способу лечения субъекта, предположительно страдающего заболеванием легких или респираторным нарушением. Как правило, способ включает в себя стадию осуществления способа детекции, как описано выше, и лечения субъекта на основании его результатов. В частности, если уровни биомаркеров в образце мокроты являются показателем присутствия туберкулеза у субъекта, способ как правило, включает в себя стадию введения терапевтически эффективного количества противотуберкулезного лекарственного средства (например, содержащего одно или несколько лекарственных средств) субъекту. Как правило, такое лечение ТВ продолжают в течение длительного периода времени, например, по меньшей мере 1 месяц, по меньшей мере 2 месяца, по меньшей мере 3 месяца, по меньшей мере 4 месяца или по меньшей мере 6 месяца.
В дополнительных вариантах осуществления, если уровни биомаркеров в образце мокроты являются показателем отсутствия туберкулеза у субъекта, способ может включать в себя стадию проведения альтернативной терапии заболевания легких у субъекта. Альтернативная терапия может представлять собой лечение, например, пневмонии, астмы или хронического обструктивного заболевания легких. Например, в некоторых вариантах осуществления, субъекту можно вводить лекарственное средство против пневмонии. Обычно такое лечение заболеваний легких, отличных от ТВ, может являться более кратковременным, чем лечение ТВ. Таким образом, в таких вариантах осуществления, лечение можно продолжать в течение вплоть до 1 недели, вплоть до 2 недель, вплоть до 3 недель или вплоть до 1 месяца.
Лекарственные средства и протоколы, которые можно использовать для лечения туберкулеза, хорошо известны специалисту в данной области. Например, терапия против туберкулеза может включать в себя введение одного или нескольких средств, выбранных из изониазида, рифампицина, этамбутола и/или пиразинамида. Как правило, активную инфекцию ТВ лечат с использованием двух или более лекарственных средств в комбинации. Лечение предпочтительно проводят в течение по меньшей мере 6 месяцев, хотя его можно разделить на начальный период интенсивного лечения с последующим длительным продолжающим периодом. Таким образом, стандартное кратковременное лечение активной инфекции ТВ представляет собой изониазид, рифампицин, пиразинамид и этамбутол в течение двух месяцев, с последующими только изониазидом и рифампицином в течение следующих четырех месяцев. В случае неудачи такой терапии первой линии, в некоторых случаях можно использовать терапию второй линии. Лекарственные средства второй линии могут включать в себя аминогликозиды (например, амикацин, канамицин); фторхинолоны (например, ципрофлоксацин, левофлоксацин, моксифлоксацин); тиоамиды (например, этионамид, протионамид); циклосерин (например, клозерин); теризидон, капреомицин, виомицин или энвиомицин.
В отличие от этого, лекарственные средства, используемые для лечения пневмонии (в частности, бактериальной пневмонии), обычно представляют собой антибиотики широкого спектра. Например, подходящие антибиотические средства включают в себя амоксициллин, доксициклин, кларитромицин, макролиды (такие как азитромицин или эритромицин). В некоторых случаях цефалоспорины, карбапенемы и ванкомицин также можно использовать, например, вводить внутривенно, и использовать в комбинации, особенно в случае внутрибольничных инфекций. Как правило, лечение можно проводить например, в течение 3-5 суток, 7-10 суток или вплоть до 2 недель.
Лекарственное средство можно вводить субъекту с использованием множества способов. Например, средство можно вводить системно, что включает в себя инъекцию, включая внутримышечную или внутривенную, перорально, сублингвально, трансдермально, подкожно или интраназально. Предпочтительно, средство вводят перорально. Концентрация и количество лекарственного средства, подлежащего введению, как правило, меняются в зависимости от характера заболевания, типа вводимого средства, способа введения, и возраста и состояния здоровья субъекта.
Лекарственное средство можно составлять в фармацевтической композиции, например, в форме твердого вещества или таблетки, или в жидкой форме, например, вместе с фармацевтически приемлемым разбавителем. Композиции могут общепринятым образом содержать фармацевтически приемлемые количества разбавителей, наполнителей и других подходящих носителей. Подходящие носители и составы описаны, например, в Remington’s Pharmaceutical Sciences (Remington’s Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., USA 1985).
Наборы
В следующих вариантах осуществления настоящее изобретение относится к набору, пригодному для осуществления способа, как описано выше. В частности, набор может содержать реагенты, пригодные для детекции биомаркеров, описанных выше, например, одного или нескольких биомаркеров иммунной системы хозяина, или комбинации биомаркеров, как определено в настоящем документе. Как правило реагенты могут содержать антитела, которые специфически связываются с биомаркерами или с комбинацией биомаркеров, как определено в настоящем документе. Например, набор может содержать одно, два, три или четыре различных антитела, каждое из которых связывается с отличным биомаркером, выбранным из определенных выше.
Такие наборы могут, необязательно, кроме того, содержать один или несколько дополнительных компонентов, например, реагентов, пригодных для проведения анализа ELISA с использованием антител, которые связываются с биомаркерами. Например, наборы могут содержать антитела для связывания и детекции каждого биомаркера, вторичные антитела, реагенты для детекции, твердые фазы (например, реакционные планшеты или бусины), стандарты (например, известные концентрации каждого биомаркера в форме рекомбинантных белков) а также буферы, пригодные для проведения любой стадии способа ELISA. Наборы могут, кроме того, содержать флаконы, контейнеры и другие упаковочные материалы для хранения вышеуказанных реагентов, а также инструкции для осуществления способа, как определено в настоящем документе.
В особенно предпочтительных вариантах осуществления набор находится в форме устройства для иммунохроматографического анализа или содержит его. Такое устройство может содержать одно или несколько антител, которые специфически связываются с биомаркером или комбинацией биомаркеров иммунной системы хозяина, как описано в настоящем документе. Подходящие антитела являются коммерчески доступными, или их можно получать с использованием известных способов.
Изобретение в настоящее время описано в качестве примера только в отношении следующих конкретных вариантов осуществления.
ПРИМЕРЫ
В настоящем исследовании несколько типов образцов анализировали для определения оптимальной комбинации жидкостей и биомаркеров для диагностики ТВ. Уровни биомаркеров хозяина в мокроте значительно превышали уровни в крови, подвергнутой стимуляции антигеном, и обеспечивали на 96% правильную классификацию ТВ, вне зависимости от мазка или статуса ВИЧ. Таким образом настоящее изобретение относится к тесту, позволяющему «внелабораторную» детекцию ТВ. Преимущества этого очевидны: при 10 миллионах новых диагнозов каждый год, но только 16% подтвержденных в лаборатории, возможность быстрой детекции ТВ может значительно уменьшить нагрузку ТВ.
Методы
Субъекты:
Субъектов последовательно привлекали из амбулаторной клиники и отделения Medical Research Council Unit, Fajara, The Gambia. Все субъекты являлись взрослыми (≥18 лет), с присутствием кашля, длившегося более 2 недель, плюс один другой клинический симптом (т.е. потеря массы, лихорадка), позволяющий предполагать ТВ. Критерии исключения включали в себя предшествующее лечение ТВ или сопутствующие заболевания, такие как малярия. После подписания информированного согласия всех субъектов подвергали полной гематологической, микробиологической, биохимической оценке и оценке симптомов. Проводили тестирование ВИЧ, и образцы мокроты, слюны, сыворотки и гепаринизированной крови собирали для иммунологических оценок. Клинические симптомы (опросник, медицинский осмотр), рентген грудной клетки и микробиологические анализы (мазка и культуры мокроты) использовали для классификации пациентов на две группы: с подтвержденным культивированием ТВ и с другими респираторными заболеваниями (фигура 1). Культивирование мокроты проводили с использованием жидкой культуры (BACTEC™, Becton-Dickinson, USA), и присутствие комплекса Mycobacterium tuberculosis (MTBC) подтверждали с использованием тестов на ТВ Capilia rapid (Taun Laboratories, Japan). Этическое одобрение получали от правительства Гамбии / объединенного этического комитета MRC.
Микробиологическое подтверждение
Образцы мокроты анализировали посредством красителя Циля-Нильсена (ZN) с использованием микроскопии LED. Аликвоту подвергали деконтаминации и культивировали (BACTEC™, Becton-Dickinson, USA). Положительные культуры подтверждали посредством теста на ТВ Capilia rapid (Tauns, Japan) и хранили в глицерине при -70°C.
Сполиготипирование
Сохраненные изоляты выращивали в среде Миддлбрука 7H9 с добавкой OADC (олеиновая кислота, альбумин, декстроза и каталаза) для выделения ДНК. 10 нг ДНК использовали для анализа сполиготипа с помощью коммерчески доступных мембран (Isogen Biosciences, The Netherlands). Пленки для сполиготипирования сканировали и классифицировали с использованием программного обеспечения, разработанного в Matlab (Mathworks, USA), с последующим редактированием и подтверждением вручную. Каждую картину сполиготипирования классифицировали по двоичному коду, и результат вводили в базу данных Microsoft Access (Redmond, USA). Для изолятов, которые невозможно было надежно классифицировать как M. tuberculosis или M. africanum только на основании анализа сполиготипа, оценивали присутствие или отсутствие определяющих линии полиморфизмов длинных последовательностей RD702 и TbD1, как описано ранее.
Мультиплексные анализы цитокинов
Подготовка образцов
Сыворотку и слюну разделяли на аликвоты и замораживали при -20°C, пока они не потребуются. Мокроту расщепляли в течение 15 минут при комнатной температуре с помощью 0,1% дитиотреитола (DTT). Добавляли равный объем фосфатно-солевого буфера (PBS), образцы центрифугировали (600 gmax, 5 мин), и супернатант собирали и хранили при -20°C. В случае гепаринизированной крови, авторы настоящего изобретения использовали 450 мкл неразведенной крови на лунку 24-луночного планшета. Кровь стимулировали с помощью очищенного белкового производного (PPD) (10 пг/мл; Statens Serum Institute, Denmark), ESAT-6/CFP-10 (EC; 10 пг/мл) и двух антигенов состояния покоя, Rv0081 и Rv2029 (оба при 10 мкг/мл). После 24 час инкубации (37°C, 5% CO2), супернатанты собирали и хранили при -20°C до анализа.
Мультиплексный анализ продукции цитокинов
Образцы анализировали с использованием либо изготовленного на заказ 13-плексного (стимулированная кровь), либо 27-плексного Bio-Plex (сыворотка, слюна и мокрота) наборов предварительно смешанных цитокинов/хемокинов по инструкциям производителя (Bio-Rad, Belgium). После предварительного смачивания планшета для фильтрования, 50 мкл суспензии бусин добавляли в каждую лунку и промывали дважды. Затем добавляли 50 мкл образцов и стандартов, и инкубировали в течение 1 часа при 300 об./мин. Планшет промывали 3 раза, затем добавляли 50 мкл антитела для детекции, и планшет инкубировали в течение 30 мин при 300 об./мин. После промывки, 25 мкл стрептавидина-PE добавляли в каждую лунку и инкубировали в течение 10 мин. Планшет снова промывали, и содержимое ресуспендировали в 125 мкл буфера для анализа, герметично закрывали, перемешивали и немедленно считывали в анализаторе Bio-plex с использованием программного обеспечения Bioplex manager (версии 4.0). Контроль качества использовали для каждого планшета для контроля изменчивости между анализами.
Статистический анализ
Из значений для аналитов, измеренных для антигенспецифических образцов (анализ только цельной крови), вычитали фон (результаты без стимуляции). Значения для слюны, сыворотки и мокроты все получены для нестимулированных образцов и таким образом, не требовали вычитания фона. ТВ и не-TB субъектов сравнивали с использованием U-критерия Манна-Уитни. Проводили анализы логистической регрессии и рабочей характеристической кривой, и корректировали по возрасту и полу. Совпадающие мокроту и стимулированные антигеном культуры анализировали с использованием критерия Фридмана с последующим тестом Данна для множественных сравнений. Графики получали с использованием Graphpad Prism версии 6.0 (программное обеспечение MacKiev, USA) и статистического анализа с помощью SPSSv20 (IBM, USA). Значения P ≤0,035 рассматривали как значимые для расчета уровня ложноположительных результатов (FDR).
Результаты
Демографические характеристики субъектов
Всего авторы настоящего изобретения анализировали 52 не-TB субъектов и 27 субъектов с подтвержденным ТВ (фигура 1). Не присутствовало различий в медиане возраста между ТВ и не-TB субъектами, но группа ТВ обладала значимо более высокой долей мужчин по сравнению с группой не-TB (81% по сравнению 49%). Это совпадает с эпидемиологией ТВ в Гамбии, и поэтому все результаты корректировали по полу и возрасту. Из группы не-TB, окончательные диагнозы были основаны на клинической оценке и ответе на лечение, где у 13/52 субъектов диагностировано хроническое обструктивное заболевание легких (COPD; n=5), астма (n=2), пневмония (n=6), и остальные сгруппированы в общие инфекции дыхательных путей (RTI; без подтвержденного диагноза). Количество субъектов менялось для каждого типа образца из-за доступности образцов (фигура 1): 20 ТВ и 26 не-TB субъектов использовали для анализа цельной крови со стимуляцией антигеном (WBA); 25 ТВ и 52 не-TB субъектов для анализа сыворотки; 20 ТВ и 42 не-TB субъектов для анализа слюны, и 23 ТВ и 29 не-TB субъектов для анализа мокроты.
Классификация ТВ с использованием культуральных супернатантов цельной крови после 24-часовой стимуляции антигеном
Авторы настоящего изобретения анализировали профили цитокинов у ТВ и не-TB субъектов после стимуляции в течение ночи с помощью Nil (без антигена), EC, PPD, Rv0081 и Rv2029. Профили сравнивали для стимуляции антигеном (Ag), Ag-Nil и Nil для каждого цитокина. Уровни IP10 и MCP-1 являлись высокими в обеих группах после всех стимуляций (средние значения 7522 пг/мл и 6547 пг/мл соответственно), в то время как уровни TGF-α, EGF и VEGF являлись низкими (средние значения 9 пг/мл, 26 пг/мл и 23 пг/мл, соответственно). Существовал ряд аналитов, уровень которых был значимо выше у субъектов с подтвержденным ТВ по сравнению с не-TB в культурах Nil, включая IP10, CD40L, TGF-α, TNF-α и IFN-γ (p=0,0005, p=0,0089, p=0,0020, p=0,0016 и p=0,0313 соответственно; фиг. 2). После стимуляции антигеном, большинство различий наблюдали до вычитания фона, с уровнями CD40L и TGF-α, значимо более высокими у субъектов с ТВ по сравнению с не-TB субъектами, вне зависимости от используемого антигена. После вычитания фона, большинство различий наблюдали в культурах после стимуляции PPD, с более высокими уровнями CD40L, IL-10 и TGF-α у субъектов с ТВ по сравнению с не-TB субъектами (p=0,0089, p=0,0034 и p<0,0001, соответственно), но с более низкими уровнями IFN-γ, IL-2 и MIP-1β (p=0,0313, p=0,0040 и p=0,0351 соответственно; фиг. 3). Авторы настоящего изобретения проводили анализы логистической регрессии для определения оптимальной комбинации антиген-биомаркер для диагноза ТВ: после стимуляции PPD, наилучшим классификатором являлся TGF-α с AUC 0,86 [95%CI 0,73-1,0], чувствительностью 96,2% [95%CI 80,4-99,9], специфичностью 80,0% [95%CI 56,3-94,3] и отношением правдоподобия 4,8. После стимуляции EC, уровни TGF-α приводили к 84,6% чувствительности [95%CI 65,1-95,6] и 80% специфичности [95%CI 56,3-94,3]. Наилучшей классификации достигали после стимуляции PPD, где с комбинацией CD40L, TGF-α и IL10 получали на 89% правильную классификацию ТВ или не-TB (данные не показаны). Важно, что не присутствовало различий в иммунных профилях хозяина для субъектов с ТВ, инфицированных различными штаммами Mtb (M. tuberculosis или M. africanum), после стимуляции любым из антигенов (данные не показаны).
Анализ ex vivo уровней цитокинов в слюне и плазме:
Главным фактором для эффективного диагностического теста в развивающихся странах является время до постановки диагноза. Авторы настоящего изобретения, таким образом, желали оценить уровни цитокинов в жидкостях организма непосредственно ex vivo. В слюне показаны более высокие уровни цитокинов, чем в сыворотке, но не наблюдали различий между ТВ и не-TB субъектами для какого-либо анализированного цитокина (фиг. 4A). Сыворотка обладала относительно низкими уровнями всех цитокинов, где MIP-1β детектировали на самом высоком уровне (86 пг/мл) у субъектов с ТВ. Однако, присутствовали значимо более высокие уровни IL-6, IL7 и G-CSF в сыворотке от субъектов с ТВ по сравнению с не-TB субъектами (p<0,0001, p=0,0014 и p=0,0003, соответственно; фиг. 4B).
В мокроте показаны высокие уровни цитокинов непосредственно ex vivo:
Авторы настоящего изобретения анализировали уровни цитокинов ex vivo в растворимой фракции расщепленной мокроты и обнаружили неожиданно высокие уровни без необходимости стимуляции антигеном по сравнению как со слюной, так и с сывороткой. Авторы настоящего изобретения проводили перекрестный анализ уровней цитокинов ex vivo у субъектов, обладающих подтвержденным ТВ (фиг. 5A). Уровни всех из IL-4, IL-5, IL-10, IL-13, IL-7, IL-8, IL-12(p70) и MIP-1β были значимо выше в мокроте по сравнению как со слюной, так и с сывороткой (проиллюстрированы на фиг. 5A посредством IL-7 и IL-8), в то время как уровни IL-13, IL-17, G-CSF, GM-CSF, MCP-1 и TNF-α были значимо выше как в слюне, так и в мокроте, по сравнению с сывороткой (проиллюстрированы на фиг. 5A посредством G-CSF и MCP-1). IL-6 являлся единственным цитокином с более низким уровнем в слюне по сравнению как с сывороткой (p<0,01), так и с мокротой (p<0,0001), без различий между сывороткой и мокротой (данные не показаны), без наблюдаемых различий в уровнях IFN-γ между тремя типами образцов (фиг. 5A).
Затем авторы настоящего изобретения сравнивали уровни цитокинов в мокроте от ТВ и не-TB субъектов (фиг. 6 и фиг. 5B). Интересно, что авторы настоящего изобретения не обнаружили значимых различий в уровнях провоспалительных цитокинов (т.е. TNF-α, IFN-γ, IP-10; данные не показаны), однако значимо более низкие уровни IL-10 (p=0,004), IL-13 (p=0,003) и IL-15 (p=0,022) обнаружены в мокроте от субъектов с ТВ по сравнению с не-TB субъектами (фиг. 6 и фиг. 5B). Кроме того, уровни естественных цитокинов IL-1Ra, G-CSF и VEGF все были значимо более низкими (p=0,005, p=0,004, p=0,030, соответственно), в то время как уровень FGF был значимо более высоким у субъектов с ТВ по сравнению с не-TB субъектами (медиана 287 пг/мл при ТВ по сравнению с 2,2 пг/мл у не-TB субъектов; p=0,007; фиг. 6 и Фиг. 5B). Только с уровнями FGF получали на 74% правильную классификацию (чувствительность 78% [95%CI 56-93] и специфичность 67% [95%CI 47-83]) ТВ. Логистическая регрессия показала, что с комбинацией IL-13, FGF и IFN-γ получали на 96% правильную классификацию для ТВ и на 85% для не-TB (в общем 90%). Важно, что не наблюдали отличий у субъектов с сопутствующей инфекцией ВИЧ, как наблюдали ранее при анализе плевральной жидкости [5].
Микробиологическое подтверждение ТВ проводят для 2-3 образцов на пациента, с изменением времени сбора образцов (3 образца в пределах 24 час является стандартом в MRC). Существует изменчивость результатов анализа мазка для различных образцов, и таким образом, авторы настоящего изобретения желали определить уровни цитокинов в нескольких образцах мокроты, полученных от одного и того же субъекта (n=15). Авторы настоящего изобретения не обнаружили различий в уровнях какого-либо из анализированных цитокинов (фиг. 5C).
Обсуждение
Наряду с высокой чувствительностью и специфичностью, важным критерием разработки диагностики ТВ на месте оказания медицинской помощи на основе тестовых полосок является время до получения результатов. Прекращение наблюдения или отказ от медицинской помощи является главной проблемой оказания медицинской помощи в условиях ограниченности ресурсов; таким образом, является настоятельной необходимостью, чтобы пациенты могли получать диагноз и соответствующую помощь в пределах нескольких часов от их подвергания тестированию на ТВ [2]. Современные диагностические тесты на основе происходящих из крови иммунных факторов хозяина требуют по меньшей мере 24 часов на обработку образца, и даже тогда уровни часто являются слишком низкими для дальнейшего проведения быстрого теста. Насколько известно авторам настоящего изобретения, они являются первой группой, исследующей уровни цитокинов в мокроте в качестве нового инструмента для диагностики ТВ. Авторы настоящего изобретения обнаружили необычайно высокие уровни цитокинов в мокроте ex vivo с минимальной необходимой подготовкой образца; комбинация FGF, IL-13 и IFN-γ обеспечивала на 96% правильную классификацию ТВ у субъектов с проявлением сходных симптомов (т.е. продолжительностью кашля >2 недель). Эти обнаружения позволили разработку быстрого теста для ТВ на месте оказания медицинской помощи.
Авторы настоящего изобретения ранее показали, что чувствительность и специфичность для ТВ значительно повышались посредством анализа образцов из участка инфекции по сравнению с кровью [5]. Это обусловлено миграцией эффекторных CD4+ T-клеток в легкие из крови в ходе заболевания ТВ, приводящей к фактическому отсутствию этих клеток в крови, однако, к преобладающей и высоко активированной популяции в легких [5]. Эти клетки являются ответственными за продукцию IFN-γ и других цитокинов, необходимых для борьбы с инфекцией, и таким образом, напрямую коррелируют с увеличенными уровнями растворимых факторов, присутствующих в образцах, происходящих из легких, по сравнению с кровью. Мокроту общепринятым образом используют для микробиологической детекции Mtb. Ее можно легко получать, и на уровни цитокинов, по-видимому, не влияет сопутствующая инфекция ВИЧ, что делает ее идеальным типом образца для разработки теста на ТВ. Кроме того, не присутствовало влияния штамма инфекции, и воспроизводимость являлась высокой для различных образцов мокроты от одного и того же субъекта.
Уровни IL-4, IL-5, IL-10, IL-13, IL-7, IL-8 и MIP-1b все были значимо выше в мокроте по сравнению как со слюной, так и с сывороткой, в то время как уровни IL-1b, IL-17, G-CSF, GM-CSF, MCP-1 и TNF-α все были значимо ниже в сыворотке по сравнению со слюной и мокротой, с отсутствием различий между слюной и мокротой. Эти обнаружения иллюстрируют различия в иммунных подгруппах, отвечающих местно, по сравнению с периферией. Например, увеличенные уровни естественных и Th17 цитокинов наблюдали в слюне и мокроте по сравнению с кровью, что указывает на увеличение ассоциированного со слизистыми оболочками иммунитета в этих участках. Интересно, что не наблюдали различий в уровнях цитокинов Th1 между типами образцов ex vivo, и также не присутствовало значимых различий в уровнях IFN-γ, IP-10 и TNF-α ex vivo в мокроте от субъектов с ТВ по сравнению с субъектами с другими респираторными нарушениями. И наоборот, уровни цитокинов Th2, IL-10 и IL-13 все были значимо ниже при ТВ по сравнению с не-TB; что указывает на смещение в сторону ответов Th1 у субъектов с ТВ, которое может приводить к увеличению иммунной патологии. G-CSF является необходимым для рекрутирования нейтрофилов, и обнаружено, что его уровень значимо ниже в мокроте от субъектов с ТВ по сравнению с не-TB субъектами. Это интересно, поскольку нейтрофилы являются главным компонентом защитного иммунного ответа на ТВ [8], и показано, что введение G-CSF увеличивает ответ на терапию ТВ [9]. В то время как уровни большинства факторов были ниже при ТВ по сравнению с не-TB, уровень FGF был значимо выше. Путь передачи сигналов фактора роста фибробластов (FGF) является неотъемлемой частью патогенеза многих заболеваний дыхательных путей, и роста и развития нормального легкого [10]. Интересно, что инфицированные Mtb фибробласты теряют свою способность к представлению антигена, что позволяет предполагать, что Mtb может ускользать от иммунологического надзора T-помощников посредством инфекции фибробластов, таким образом, приводя к персистенции бактерий [11].
Требования к разработке диагностики, определенные по рекомендациям FIND (Foundation for Innovative New Diagnostics), включают в себя по меньшей мере 75% и в идеале >95% чувствительность (включая 100% положительных при культивировании образцов). Авторы настоящего изобретения анализировали только субъектов с подтвержденным в культуре ТВ, и из них, только 3 обладали отрицательным мазком (14%), так что сложно на этой стадии определять чувствительность у субъектов с отрицательным мазком. Однако, на 96% правильная классификация ТВ с использованием комбинации FGF, IL-13 и IFN-γ из мокроты значительно превышает результаты опубликованных в настоящее время тестов на основе крови, выдыхаемого воздуха или мочи. Авторы настоящего изобретения ограничили свой анализ 27 цитокинами/хемокинами, но с увеличением количества аналитов, доступных для детекции, вероятно, можно определить маркеры, обеспечивающие >95% специфичности и чувствительности. В заключение, авторы настоящего изобретения показали, что использование мокроты вместо крови значительно увеличивает диагностическую точность тестов на ТВ на иммунной основе и уменьшает время до получения результатов. Эти обнаружения являются многообещающими для будущей разработки быстрого диагностического иммунохроматографического теста на ТВ, который является пригодным для применения в условиях ограниченности ресурсов.
Сущность
Туберкулез (ТВ) является важной проблемой здравоохранения в развивающихся странах с 9 миллионами новых случаев и 1,4 миллиона смертей ежегодно. Одним из основных препятствий для уменьшения нагрузки ТВ является отсутствие быстрого и точного диагностического теста для применения в поликлиниках с минимальной инфраструктурой. Авторы настоящего изобретения анализировали образцы от пациентов с проявлениями симптомов, позволяющих предполагать ТВ, но до подтверждения. После клинической и микробиологической оценки, у них затем диагностировали ТВ или другие респираторные заболевания (не-TB). Авторы настоящего изобретения оценивали биомаркеры хозяина в мокроте, слюне, сыворотке и в стимулированных антигеном культурах цельной крови для определения оптимального типа образца и комбинации биомаркеров для диагностики ТВ. При стимуляции цельной крови в течение ночи с помощью ESAT-6/CFP-10 (EC) или PPD получали высокие уровни цитокинов; после стимуляции PPD, наилучшим классификатором являлся TGF-α с AUC 0,86 [95%CI 0,73-1,0], чувствительностью 96,2% [95%CI 80,4-99,9], специфичностью 80,0% [95%CI 56,3-94,3] и отношением правдоподобия 4,8. После стимуляции EC, уровни TGF-α приводили к 84,6% чувствительности [95%CI 65,1-95,6] и 80% специфичности [95%CI 56,3-94,3]. Наилучшей классификации достигали после стимуляции PPD с получением для комбинации CD40L, TGF-α и IL10 на 89% правильной классификации ТВ или не-TB. Однако, 24 часов стимуляции не является идеальным для «быстрого» диагностического теста. Слюна ex vivo обладала значимо более высокими уровнями цитокинов по сравнению с сывороткой ex vivo, но не могла позволить дискриминацию между группами пациентов. Уровни в сыворотке IL7, IL-8 и G-CSF все были значимо выше у субъектов с ТВ по сравнению с не-TB субъектами (p<0,0001, p=0,0014 и p=0,0003 соответственно). Авторы настоящего изобретения анализировали также уровни цитокинов в растворимой фракции мокроты; которую используют для общепринятых микробиологических анализов, и которую можно получать от большинства взрослых пациентов с ТВ легких. Не наблюдали значимых отличий в уровнях провоспалительных цитокинов (IFN-γ, IP-10, TNF-α), однако значимо более низкие уровни цитокинов Th2 (IL-10 (p=0,0004), IL-13 (p=0,0003) и IL-15 (p=0,0221) и естественных цитокинов (IL-1ra (p=0,0005), VEGF (0,0301) и G-CSF (p=0,0041)), и более высокий уровень FGF (p=0,007) наблюдали в мокроте от субъектов с ТВ по сравнению с не-TB субъектами. Комбинация IL-13, FGF и IFN-γ обеспечивала на 96% правильную классификацию для ТВ и 85% для не-TB (в общем 90%), вне зависимости от статуса ВИЧ. Настоящее изобретение, таким образом, относится к быстрому тесту на ТВ на месте оказания медицинской помощи.
Ссылки:
1. WHO Global Tuberculosis Report 2012. WHO fact sheet number 104. Available at: http://www.who.int/tb/publications/factsheet_global.pdf.
2. Batz H-G, Cook GS, Reid SD. Towards lab-free ТВ diagnostics. WHO-TDR 2011. Accessed at: http://www.stoptb.org/wg/tb_hiv/assets/documents/MSF_Stop%20TB_Imperial_TAG_TowardsLabF reeTBDX_July%2011_Web2.pdf
3. WHO tuberculosis fact sheet number 104. March, 2012. Accessed at http://www.who.int/mediacentre/factsheets/fsl04/en/
4. WHO diagnostics evaluation series. Laboratory-based evaluation of 19 commercially available rapid diagnostic tests for tuberculosis. 2008. Accessed at: http://www.who.int/tdr/publications/documents/diagnostic-evaluation-2.pdf
5. Sutherland JS, Garba D, Fombah AE, Mendy-Gomez A, Mendy FS, Antonio M, Townend J, Ideh RC, Corrah T, Ota MO. Highly accurate diagnosis of pleural tuberculosis by immunological analysis of the pleural effusion. PLoS One 2012;7:e30324.
6. Dente FL, Camevali S, Bartoli ML, Cianchetti S, Bacci E, Di Franco A, Vagaggini B, Paggiaro P. Profiles of proinflammatory cytokines in sputum from different groups of severe asthmatic patients. Ann Allergy Asthma Immunol 2006;97:312-320.
7. Eickmeier O, Huebner M, Herrmann E, Zissler U, Rosewich M, Baer PC, Buhl R, Schmitt-Grohé S, Zielen S, Schubert R. Sputum biomarker profiles in cystic fibrosis (CF) and chronic obstructive pulmonary disease (COPD) and association between pulmonary function. Cytokine 2010;50:152-157
8. Yang CT, Cambier CJ, Davis JM, Hall CJ, Crosier PS, Ramakrishnan L. Neutrophils exert protection in the early tuberculous granuloma by oxidative killing of mycobacteria phagocytosed from infected macrophages. Cell Host Microbe 2012;12:301-312.
9. Cormican U, Schey S, Milburn HJ. G-CSF enables completion of tuberculosis therapy associated with iatrogenic neutropenia. Eur Respir J 2004;23:649-650.
10. Dosanjh A. The fibroblast growth factor pathway and its role in the pathogenesis of lung disease. J Interferon Cytokine Res 2012;32:111-114.
11. Mariotti S, Sargentini V, Pardini M, Giannoni F, De Spirito M, Gagliardi MC, Greco E, Teloni R, Fraziano M, Nisini R. Mycobacterium tuberculosis may escape helper T cell recognition by infecting human fibroblasts. Hum Immunol 2013;74:722-729.
Содержание всех ссылок, описываемых в настоящем документе, включено посредством ссылки. Хотя изобретение описано посредством примера, следует понимать, что варианты и модификации можно осуществлять без отклонения от объема изобретения, как определено в формуле изобретения. Кроме того, когда существуют известные эквиваленты конкретных признаков, такие эквиваленты включены, как если бы они были конкретно включены посредством ссылки, в это описание. Дополнительные преимущества и признаки настоящего изобретения очевидны из фигур и неограничивающих примеров.