Результат интеллектуальной деятельности: Использование сигнальных пептидов митохондриальной локализации для увеличения уровня гетерологической экспрессии белков в P.pastoris и S.cerevisiae
Вид РИД
Изобретение
Настоящее изобретение относится к области биотехнологии и молекулярной биологии и может быть использовано для увеличения уровня выхода рекомбинантных белков и изменения качества их фолдинга при их экспрессии с использованием штаммов-продуцентов на основе дрожжей, в частности P. pastoris и S. cerevisiae.
Штаммы-продуценты на основе прокариотического организма бактерии E. coli часто не пригодны для гетерологической экспрессии белков, которым требуются посттрансляционные модификации, эукариотические шапероны и процессинг для образования биологически активного состояния. Белки эукариотических организмов как правило имеют более сложную структуру, чем у прокариотических. Правильный фолдинг и процессинг является необходимым условием для их функционирования. Для синтеза сложных белков используют системы экспрессии, созданные на основе многоклеточных эукариотических организмов (культуры клеток млекопитающих, трансгенные растения и животные), которые позволяют получать гетерологичные белки. Существенным недостатком этих систем является достаточная сложность работы с такими культурами клеток, особенные требования к стерильности, аэрации биомассы, механическая непрочность клеток, дороговизна и трудоемкость получения трансгенных растений и животных, при недостаточном выходе целевых белков. Для рекомбинантного синтеза некоторых белков достаточно использовать штаммы-продуценты на основе дрожжей, такие как S. cerevisiae и P. pastoris. Данные штаммы-продуценты имеют ряд преимуществ. У дрожжей так же подробно как у E. coli изучены процессы метаболизма, при работе с ними используются стандартные методы генетической инженерии, дрожжи легко культивировать на относительно дешевых субстратах, все это делает возможным масштабирование процесса культивирования штаммов-продуцентов на основе дрожжей. Применение данной системы экспрессии позволяет сочетать простоту бактериальных систем экспрессии и возможности пострансляционных модификаций и фолдинга рекомбинантных белков [1]. Еще одни достоинством этой системы гетерологичной экспрессии является возможность осуществления процессинга целевого рекомбинантного белка. Использование лидерных пептидов в слитной полипептидной цепи с целевыми белками позволяет задать их направления их транспорта и процессинга внутри клетки штамма продуцента [2]. Например, данный подход необходим для белков со сложной структурой, а также для различных ферментов, обладающих токсичностью внутри клетки, в последнем случае используются секреторные лидерные пептиды направляющие рекомбинантные белки из цитоплазмы в культуральную жидкость. Культуральная жидкость после культивирования P. pastoris, содержит относительно небольшое количество собственных белков штамма-продуцента, поэтому секретированный целевой белок можно достаточно легко очистить от примесных белков и компонентов питательной среды. Так же возможно использовать для экспрессии не секреторные сигнальные пептиды, а сигналы внутриклеточной локализации. В значительной степени изучены сигнальные пептиды митохондриальной локализации. На данный момент известно 3 варианта встраивания белков во внутреннюю мембрану митохондрий [3]: 1) путь через белковый комплекс TIM22 («TIM22 pathway»): используется для некоторых белков, имеющих мотивы распознавания внутри своей структуры или последовательности иминокислотных остатков. Этот путь не задействует лидерные пептиды. 2) Путь остановки транспорта («Stop transfer pathway»): присущ белкам с одной трансмембранной спиралью. Данные белки экспрессируются с лидерной последовательностью, которая удаляется комплексом протеаз сразу после встраивания во внутреннюю мембрану митохондрий. 3) Консервативная сортировка («Conservative sorting))): белки транслируются с лидерным сигнальным пептидом, транспортируются в митохондриальный матрикс, затем сигнальный пептид отщепляется митондриальной пептидазой [4] и белок претерпевает фолдинг и, если это мембранный белок, встраивается в мембрану при помощи фермента Oxa1 [6]. Данный способ используется преимущественно для белков, кодируемых митохондриальной ДНК, а также для белков, кодируемых ядерными генами, но имеющих прокариотические аналоги [6], например, субъединица 9 F0F1 ATPase N. crassa, Oxa1, Сох18/Оха2, Mrs2.
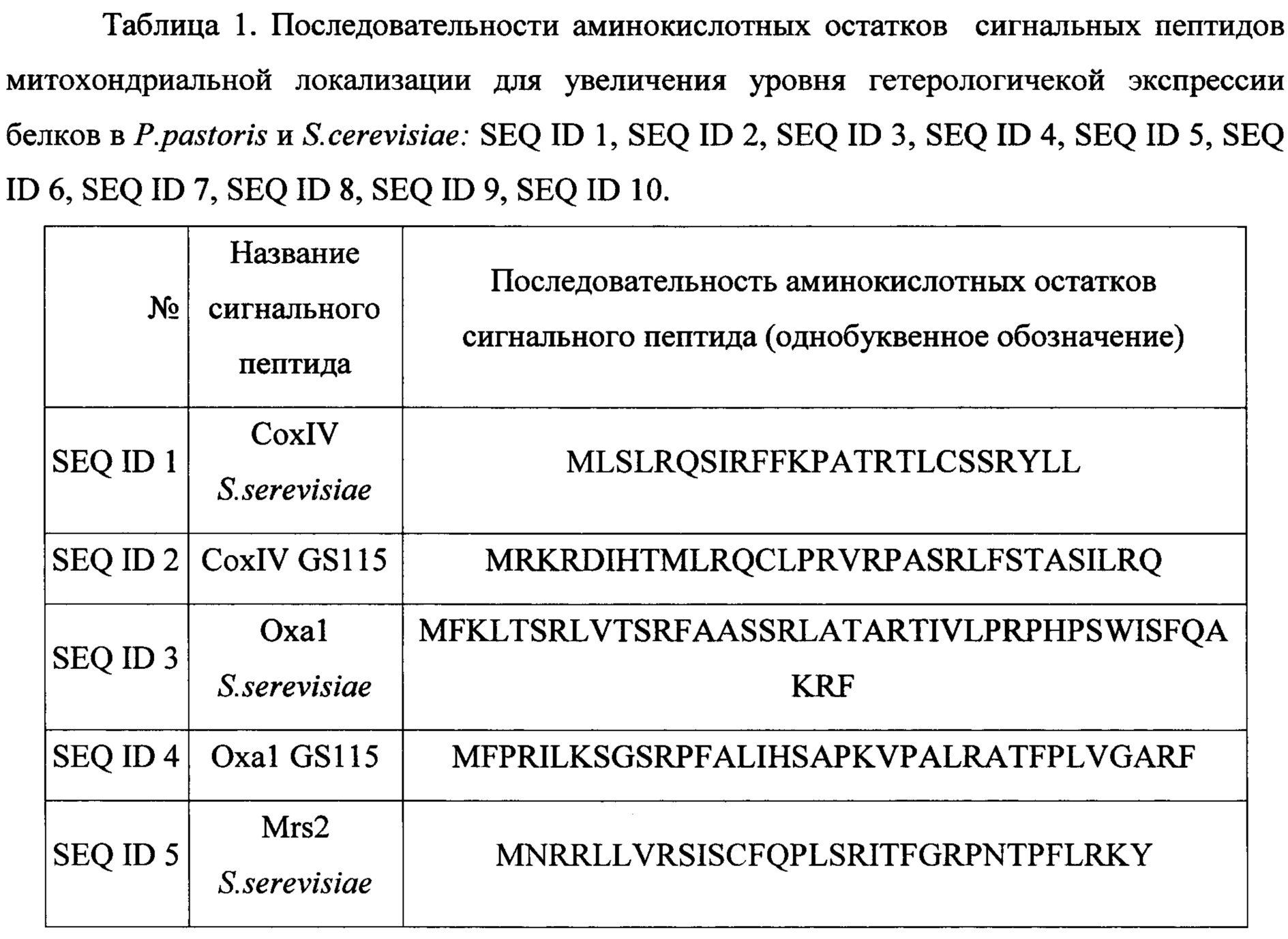
Решение задачи увеличения уровня экспрессии генов рекомбинантных белков при использовании штаммов-продуцентов на основе дрожжей актуально с момента разработки технологии их культивирования. Предлагаемый нами способ увеличения уровня экспрессии генов целевых рекомбинантных белков заключается в добавлении на 5"-конец генов, кодирующих данные рекомбинантные белки, - генов, кодирующих последовательности лидерных пептидов митохондриальной локализации (при сохранении рамки считывания). Аминокислотные последовательности данных лидерных пептидов представлены в таблице 1. Таким образом, при экспрессии генов целевых рекомбинантных белков с генами, кодирующими лидерные пептиды, целевые рекомбинантные белки будут нести на своем N-конце пептиды митохондриальной локализации в слитной полипептидной цепи. Данные сигнальные пептиды будут приводить к транспорту целевых полипептидов (белков) в митохондрии (в некоторых случаях через эндоплазматический ретикулум, в зависимости от выбранного сигнального пептида), что приведет: 1) к задействованию митохондриальных пептидаз в специфическом гидролизе слитной последовательности аминокислотных остатков после сигнальных пептидов, 2) процессингу целевых полипептидов в соответствии с выбранным сигнальным пептидом, при этом отличном от процессинга, которому подвергается целевой полипептид без сигнального пептида, 3) участию в фолдинге целевых полипептидов шаперонов (митохондриальных и эндоплазматического ретикулума) соответствующих данному сигнальному пептиду. Процессы 2 и 3, вызванные использованием сигнальных пептидов, для некоторых рекомбинантных белков приводят к увеличению общего уровня их экспрессии, то есть приводят к увеличению их количества содержащегося в цитоплазме и мембранах клеток штамма-продуцента. Это вероятно обусловлено изменениями в процессах внутриклеточного процессинга полипептидов (2) и фолдинга (3) происходящими при наличии пептидов митохондриальной локализации на N-конце белков.

При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующем примере, используются хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [7].
Пример 1. Выбор сигнальных лидерных пептидов.
Были проанализированы аминокислотные последовательности белков, имеющих митохондриальную локализацию, а также для белков, кодируемых ядерными генами, но имеющих прокариотические аналоги. Их последовательности и идентификационные номера в базе данных белков приведены в Таблица 2. Данные последовательности аминокислотных остатков построены автоматически по кДНК белков, соответствуют последовательности мРНК белков, согласно принципам формирования базы данных. Таким образом, последовательности аминокислотных остатков белков содержат полную последовательность незрелых белков до их посттрансляционного процессинга и модификаций. В частности, данные последовательности аминокислотных остатков включают в себя последовательности лидерных сигнальных пептидов. Данные лидерные пептиды и были выбраны для использования.




Источники информации.
1. J.M. Cregg, Higgins D.R. 1995. Production of foreign proteins in the yeast Pichia pastoris. // Canadian J. Botany Supp.73, 5981-5987.
2. Герасимов A.C., Шульга A.A., Зейналов O.A., Скрябин К.Г. Синтез гетерологичных рецепторов, связанных с G-белком, в клетках метилотрофных дрожжей P. pastoris. Доклады Академии Наук. Т.441 (5), с. 1-4, 2011. Pichia pastoris. Nat Biotechnol. 27: 561-566, 2009
3. Mossmann, D., Meisinger, C,  F. N. 2012. Processing of mitochondrial presequences. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 1819(9), 1098-1106.
F. N. 2012. Processing of mitochondrial presequences. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 1819(9), 1098-1106.
4.  F.N., Wortelkamp, S., Zahedi, R.P., Becker, D., Leidhold, C., Gevaert, K., … & Meisinger, C. 2009. Global analysis of the mitochondrial N-proteome identifies a processing peptidase critical for protein stability. Cell, 139(2), 428-439.
F.N., Wortelkamp, S., Zahedi, R.P., Becker, D., Leidhold, C., Gevaert, K., … & Meisinger, C. 2009. Global analysis of the mitochondrial N-proteome identifies a processing peptidase critical for protein stability. Cell, 139(2), 428-439.
5. Stuart, Rosemary A. 2002. Insertion of proteins into the inner membrane of mitochondria: the role of the Oxal complex. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research 1592.1: 79-87.
6. Rojo, E.E., Stuart, R.A., & Neupert, W. (1995). Conservative sorting of F0-ATPase subunit 9: export from matrix requires delta pH across inner membrane and matrix ATP. The EMBO journal, 14(14), 3445.
7. Ausubel F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A., and Struhl, K. (1997) Current Protocols in Molecular Biology, John Wiley and Sons, New York.
Использование одного из сигнальных пептидов SEQ ID 1, SEQ ID 2, SEQ ID 3, SEQ ID 4, SEQ ID 5, SEQ ID 6, SEQ ID 7, SEQ ID 8, SEQ ID 9, SEQ ID 10 для гетерологической экспрессии в слитной полипептидной цепи с рекомбинантным белком в штаммах-продуцентах на основе P.pastoris и S. cerevisiae для увеличения уровня экспрессии рекомбинантных белков.







