Результат интеллектуальной деятельности: Пероральный препарат с замедленным высвобождением
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к пероральному препарату с замедленным высвобождением, содержащему цилостазол.
Уровень техники
Цилостазол представляет собой 6-[4-(1-циклогексил-1Н-тетразол-5-ил)-бутокси]-3,4-дигидро-2(1Н)-хинолинон, который является соединением на основе хинолинона, представленным приведенной ниже формулой 1, и относится к ингибиторам внутриклеточной цАМФ ФДЭФДЭ типа III (циклической АМФ фосфодиэстеразы типа III)
Химическая формула 1
Цилостазол играет роль в подавлении коагуляции крови, стимуляции центрального кровообращения, противовоспалительном и противоязвенном воздействиях, снижении кровяного давления, профилактике и лечении астмы и ишемического инсульта и улучшении мозгового кровообращения путем подавления коагуляции тромбоцитов и расширения артерий посредством ингибирования активности ФДЭ при всасывании в организм. Поэтому цилостазол широко применяют в качестве тромболитического агента, улучшающего мозговое кровообращение агента, противовоспалительного лекарственного средства, противоопухолевого средства, гипотензивного агента и противоастматического средства.
Традиционные препараты цилостазола принимают перорально два раза в день, и их недостаток состоит в том, что они характеризуются низкой комплаентностью и вызывают побочные эффекты, такие как головная боль, тяжесть в голове и тахикардия, при резком росте концентрации лекарственного средства в крови при приеме перорально. Цилостазол является плохо растворимым лекарственным средством, имеющим растворимость в воде 1 мкг/мл или менее, и было показано, что цилостазол всасывается главным образом в верхних отделах желудочно-кишечного тракта, и его всасывание уменьшается по мере его продвижения в нижние отделы кишечника. Поэтому считают, что препарат цилостазола с обычным регулируемым высвобождением имеет низкую биодоступность. Соответственно, были предприняты попытки разработать препарат цилостазола с замедленным или регулируемым высвобождением, который не имеет вышеописанных проблем.
Более подробно, в опубликованной международной патентной заявке WO 97/48382 описан препарат цилостазола с замедленным высвобождением в виде нескольких единиц, включая по меньшей мере 2 мини-таблетки, приготовленные с использованием гидроксипропилметилцеллюлозы в качестве основной матрицы. Эту таблетку матричного типа с замедленным высвобождением можно легко приготовить с использованием обычной технологии приготовления препаратов и оборудования. Однако, как только структура матрицы разрушается, происходит быстрое высвобождение лекарственного средства, вызывающее транзиторное повышение концентрации лекарственного средства в крови. Кроме того, плохо растворимые лекарственные средства, такие как цилостазол, могут не полностью растворяться даже после разрушения структуры матрицы, что приводит к проблемам неэкономного расходования. Более того, они имеют низкие скорости начального высвобождения из-за характеристик структуры матрицы, что становится недостатком, когда требуется быстрое высвобождение. Таким образом, трудно получить преимущество в качестве препарата с замедленным высвобождением. Чтобы решить эти проблемы, в опубликованной международной патентной заявке WO 00/57881 и опубликованной патентной заявке US 2002/0058066 предложен препарат, содержащий внешний слой и сердцевину, где внешний слой медленно высвобождает лекарственное средство в верхнем отделе желудочно-кишечного тракта (тонком кишечнике), а сердцевина разрушается и быстро высвобождает лекарственное средство в нижнем отделе тонкого кишечника и толстой кишке. Однако этот препарат имеет проблемы в том, что быстрое высвобождение лекарственного средства в нижнем отделе тонкого кишечника и толстой кишке может вызывать раздражение и повреждение слизистого слоя толстой кишки, а в толстой кишке, где содержание воды является относительно низким, может происходить неравномерное растворение плохо растворимого лекарственного средства, что приводит к неравномерной скорости всасывания и неравномерному соотношению всасывания; причем способ получения этого препарата является очень сложным, поскольку он состоит из сердцевины с быстрым высвобождением и внешнего слоя, окружающего сердцевину, и большой объем таблетки снижает комплаентность лекарственного средства.
Соответственно, необходимо разработать препарат с замедленным высвобождением для уменьшения побочных эффектов, вызываемые высокой скоростью растворения традиционных препаратов цилостазола сразу после приема. Однако в случае разрабатываемых препаратов с замедленным высвобождением все еще трудно регулировать высвобождение лекарственного средства. Таким образом, существует потребность в разработке препарата цилостазола с замедленным высвобождением, который просто задерживает высвобождение лекарственного средства, а также имеет стабильную скорость растворения при однократном ежедневном приеме.
Техническая задача
Соответственно, изобретатели настоящего изобретения предприняли много усилий, чтобы решить проблемы препарата с замедленным высвобождением из плохо растворимого цилостазола, и в результате они обнаружили, что, когда цилостазол изготавливают в виде таблетки с матрицей с замедленным высвобождением, используя смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент, используют цилостазол, имеющий средний размер частиц в специфическом диапазоне, и используют гранулы, полученные посредством мокрого гранулирования с точным регулированием количества растворителя этанола, для получения препарата с замедленным высвобождением, имеющего надлежащую начальную скорость растворения и профиль растворения, обеспечивающий возможность эффективного поддержания концентрации лекарственного средства в организме, посредством чего реализуют настоящее изобретение.
Техническое решение
Для решения проблем обычных таблеток цилостазола с замедленным высвобождением в настоящем изобретении предложен препарат с замедленным высвобождением, имеющий надлежащую начальную скорость растворения и профиль растворения, обеспечивающий возможность эффективного поддержания концентрации лекарственного средства в организме.
Преимущества изобретения
Пероральный препарат с замедленным высвобождением согласно настоящему изобретению имеет надлежащую начальную скорость растворения и профиль растворения, обеспечивающий возможность эффективного поддержания концентрации лекарственного средства в организме, снижая при этом возможность возникновения побочных эффектов при поддержании эффективности цилостазола даже при однократном ежедневном приеме, а также повышая комплаентность лекарственного средства.
Краткое описание чертежей
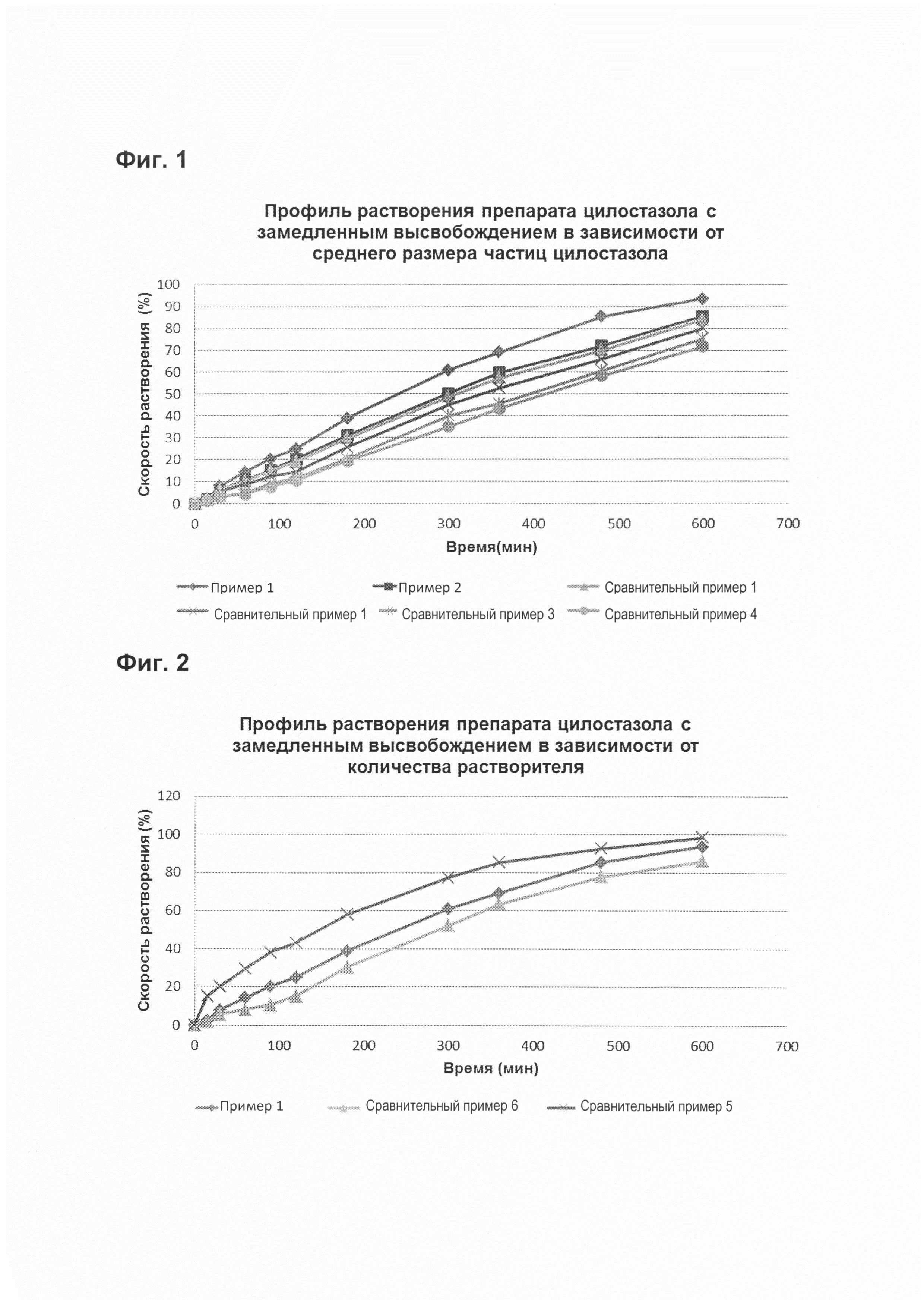
На Фиг. 1 показан профиль растворения препарата цилостазола с замедленным высвобождением в зависимости от среднего размера частиц цилостазола, и
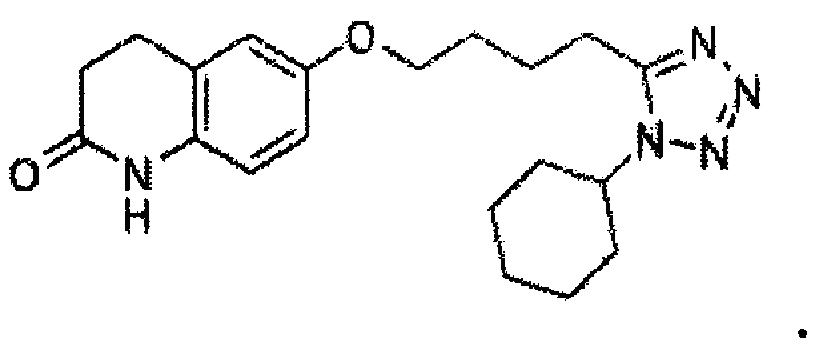
на Фиг. 2 показан профиль растворения препарата с цилостазола замедленным высвобождением в зависимости от количества растворителя этанола.
Наилучший вариант реализации изобретения
Для достижения вышеуказанной цели, в одном из аспектов изобретения предложен пероральный препарат с замедленным высвобождением, который получают посредством формования композиции, содержащей цилостазол в качестве активного ингредиента, смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент, отличающийся тем, что пероральный препарат с замедленным высвобождением имеет приведенный ниже профиль растворения, когда его подвергают тесту на растворение согласно второму методу теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки) (37±0,5°С, 0,5% раствор лаурилсульфата натрия, 50 об/мин):
1) от 20% до 30% от общей массы цилостазола высвобождается к моменту времени, составляющему 2 часа после начала теста;
2) от 50% до 70% от общей массы цилостазола высвобождается к моменту времени, составляющему 5 часов после начала теста, и
3) по меньшей мере 85% от общей массы цилостазола высвобождается к моменту времени, составляющему 10 часов после начала теста.
В препарате с замедленным высвобождением согласно настоящему изобретению композиция может представлять собой гранулу, которая получена посредством мокрого гранулирования с использованием растворителя этанола.
Растворитель этанол можно использовать в количестве от 40 масс. ч. до 75 масс. ч. на 100 масс. ч. цилостазола.
Согласно настоящему изобретению, активный ингредиент цилостазол может иметь средний размер частиц 12 мкм или менее.
В настоящем изобретении гидрофильный полимер, используемый в качестве носителя с замедленным высвобождением, может представлять собой один или более полимеров, выбранных из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, полиэтиленоксида, каррагинана, натуральной камеди, гуаровой камеди, трагаканта, арабской камеди, камеди бобов рожкового дерева, ксантановой камеди, альгината, поливинилового спирта и поливиниллпирролидона.
Гидрофильный полимер может иметь вязкость от 50000 сП до 150000 сП.
Солюбилизирующий агент, используемый согласно настоящему изобретению, может представлять собой одно или более соединений, выбранных из группы, состоящей из лаурилсульфата натрия, полисорбата 80, олеоилмакроголглицерида, линолеоилмакроголглицерида и каприлокапроилполиоксилглицерида.
Препарат с замедленным высвобождением согласно настоящему изобретению может включать от 10 масс. ч. до 30 масс. ч. гидрофильного полимера, от 3 масс. ч. до 10 масс. ч. карбомера и от 5 масс. ч. до 20 масс. ч. солюбилизирующего агента, в пересчете на 100 масс. ч. цилостазола.
Препарат с замедленным высвобождением согласно настоящему изобретению может дополнительно включать наполнитель, связывающее вещество и смазывающее вещество.
Более конкретно, препарат с замедленным высвобождением может включать от 30 масс. ч. до 70 масс. ч. наполнителя, от 1 масс. ч. до 10 масс. ч. связывающего вещества и от 2 масс. ч. до 10 масс. ч. смазывающего вещества, в пересчете на 100 масс. ч. цилостазола.
Наполнитель, используемый согласно настоящему изобретению, может представлять собой один или более наполнителей, выбранных из группы, состоящей из микрокристаллической целлюлозы, крахмала, лактозы, маннита, сорбита и коллоидного диоксида кремния.
Связывающее вещество, используемое согласно настоящему изобретению, может представлять собой одно или более связывающих веществ, выбранных из группы, состоящей из поливинилпирролидона, сополимера винилпирролидона/винильного производного, а также крахмала.
Смазывающее вещество, используемое согласно настоящему изобретению, может представлять собой одно или более смазывающих веществ, выбранных из группы, состоящей из стеарата магния, талька и аморфного диоксида кремния.
В другом аспекте настоящего изобретения предложен пероральный препарат с замедленным высвобождением, который получают посредством формования композиции, содержащей 100 масс. ч. цилостазола в качестве активного ингредиента, смесь гидроксипропилметилцеллюлозы в количестве от 10 масс. ч. до 30 масс. ч. и карбомера в количестве от 3 масс. ч. до 10 масс. ч. в качестве носителя с замедленным высвобождением, от 5 масс. ч. до 20 масс. ч. солюбилизирующего агента, от 30 масс. ч. до 70 масс. ч. наполнителя, от 1 масс. ч. до 10 масс. ч. связывающего вещества и от 2 масс. ч. до 10 масс. ч. смазывающего вещества, отличающийся тем, что пероральный препарат с замедленным высвобождением имеет приведенный ниже профиль растворения, когда его подвергают тесту на растворение согласно второму методу теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки) (37±0,5°С, 0,5% раствор лаурилсульфата натрия, 50 об/мин):
1) от 20% до 30% от общей массы цилостазола высвобождается к моменту времени, составляющему 2 часа после начала теста;
2) от 50% до 70% от общей массы цилостазола высвобождается к моменту времени, составляющему 5 часов после начала теста, и
3) по меньшей мере 85% от общей массы цилостазола высвобождается к моменту времени, составляющему 10 часов после начала теста.
В препарате с замедленным высвобождением композиция может представлять собой гранулу, которая получена мокрым гранулированием с использованием растворителя этанола.
Более конкретно, растворитель этанол можно использовать в количестве от 40 масс. ч. до 70 масс, ч., в пересчете на 100 масс. ч. цилостазола.
Кроме того, цилостазол может иметь средний размер частиц 12 мкм или менее.
Более конкретно, солюбилизирующий агент может представлять собой лаурилсульфат натрия, наполнитель может представлять собой смесь микрокристаллической целлюлозы и коллоидного диоксида кремния, связывающее вещество может представлять собой поливинилпирролидон, а смазывающее вещество может представлять собой стеарат магния.
Способ реализации изобретения
Согласно конкретному воплощению изобретения, предложен пероральный препарат с замедленным высвобождением, который получают посредством формования композиции, содержащей цилостазол в качестве активного ингредиента, смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент, отличающийся тем, что пероральный препарат с замедленным высвобождением имеет приведенный ниже профиль растворения, когда его подвергают тесту на растворение согласно второму методу теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки) (37±0,5°С, 0,5% раствор лаурилсульфата натрия, 50 об/мин):
1) от 20% до 30% от общей массы цилостазола высвобождается к моменту времени, составляющему 2 часа после начала теста;
2) от 50% до 70% от общей массы цилостазола высвобождается к моменту времени, составляющему 5 часов после начала теста, и
3) по меньшей мере 85% от общей массы цилостазола высвобождается к моменту времени, составляющему 10 часов после начала теста.
В препарате с замедленным высвобождением согласно изобретению можно использовать смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент для смешивания цилостазолаа в форме таблетки с матрицей с замедленным высвобождением, где используют цилостазол, имеющий средний размер частиц в специфическом диапазоне, и используют гранулы, полученные посредством мокрого гранулирования, при точном регулировании количества растворителя этанола, благодаря чему препарат с замедленным высвобождением имеет надлежащую начальную скорость растворения и профиль растворения, обеспечивающий возможность эффективного поддержания концентрации лекарственного средства в организме.
Профиль растворения препарата с замедленным высвобождением согласно настоящему изобретению представляет собой профиль растворения в моменты времени 2 часа, 5 часов и 10 часов, который получен посредством подходящего in-vitro теста на растворение. Подходящий тест на растворение можно проводить при температуре растворения 37±0,5°С с использованием 0,5%-ного раствора лаурилсульфата натрия в качестве среды теста на растворение при скорости вращения 50 об/мин согласно второму методу теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки), и его можно модифицировать известным специалистам путем.
Более конкретно, из препарата с замедленным высвобождением согласно настоящему изобретению от 20% до 30% от общей массы цилостазола высвобождается к моменту времени, составляющему 2 часа после начала теста, от 50% до 70% от общей массы цилостазола высвобождается к моменту времени, составляющему 5 часов после начала теста, и по меньшей мере 85% от общей массы цилостазола высвобождается к моменту времени, составляющему 10 часов после начала теста.
Если препарат с замедленным высвобождением удовлетворяет такому профилю растворения, он проявляет надлежащую начальную скорость растворения, и таким образом, частота возникновения побочных эффектов может быть снижена без отсрочки эффективности воздействия, при этом концентрацию лекарственного средства в организме можно поддерживать в течение заранее заданного времени. Таким образом, эффективность воздействия цилостазола можно поддерживать даже при однократном ежедневном приеме, что приводит к повышению комплаентности лекарственного средства.
Согласно настоящему изобретению, активный ингредиент цилостазол может иметь средний размер частиц 12 мкм или менее. Если средний размер частиц больше 12 мкм, начальная скорость растворения заметно снижается, что приводит к отсроченному высвобождению лекарственного средства. Таким образом, трудно поддерживать эффективную концентрацию лекарственного средства в крови. Нижний предел не ограничен особым образом, но предпочтительно он составляет 5 мкм.
Согласно воплощению настоящего изобретения, когда использовали цилостазол, имеющий средний размер частиц в пределах вышеуказанного диапазона, препарат имел следующий профиль растворения: от 20% до 30% от общей массы цилостазола высвобождалось к моменту времени, составляющему 2 часа после начала теста, от 50% до 70% от общей массы цилостазола высвобождалось к моменту времени, составляющему 5 часов после начала теста и по меньшей мере 85% от общей массы цилостазола высвобождалось к моменту времени, составляющему 10 часов после начала теста (Фиг. 1, экспериментальный пример 1).
Согласно настоящему изобретению, композицию, содержащую цилостазол в качестве активного ингредиента, смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент, можно гранулировать посредством мокрого гранулирования и затем формовать. Предпочтительно, композиция может представлять собой гранулу, полученную посредством мокрого гранулирования с использованием растворителя этанола.
Для достижения цели настоящего изобретения растворитель этанол можно использовать в количестве от 40 масс. ч. до 75 масс. ч., в пересчете на 100 масс. ч. цилостазола. Если количество растворителя этанола составляет менее 40 масс, ч., образуется много мелкого порошка от гранулы, при этом гранулированные частицы становятся непрочными, а текучесть является плохой и при таблетировании происходит образование небольшой «шапочки», так что снижается эффективность производства, и после таблетирования твердость является низкой, а начальная скорость растворения высокой. Таким образом, проблема состоит в том, что продукт не соответствует требованиям скорости растворения через 2 часа и 5 часов. Если количество растворителя этанола составляет более 75 масс, ч., получаемые гранулы являются слишком влажными для того, чтобы иметь хорошую текучесть, и частицы являются прочными, а после таблетирования твердость является слишком высокой, а начальная скорость растворения становится низкой. Таким образом, проблема состоит в том, что продукт не отвечает требованию скорости растворения через 2 часа.
Согласно воплощению настоящего изобретения, когда использовали гранулы, полученные с использованием этанола в количестве, удовлетворяющем вышеуказанному диапазону, получали текучесть, подходящую для таблетирования, и таблетка имела твердость от 11 кг/см2 до 13 кг/см2 после таблетирования, так что получали продукт удовлетворительной твердости, а профиль растворения тоже был улучшен (Таблица 4, Фиг. 2, экспериментальные примеры 2 и 3).
В настоящем изобретении в качестве носителя с замедленным высвобождением используют смесь гидрофильного полимера и карбомера. Карбомер находится в кислотных условиях в желудке в состоянии золя, так что высвобождение лекарственного препарата может поддерживаться с помощью гидрофильного полимера. Карбомер находится в состоянии гидрогеля в тонком кишечнике в щелочных условиях, так что высвобождение лекарственного препарата можно регулировать. Когда карбомер используют совместно с гидрофильным полимером, карбомер служит для надежного образования матрицы в таблетке, поддерживая форму матрицы из-за разбухания таблетки и предотвращая истирание таблетки, что обеспечивает возможность поддерживания постоянной скорости растворения.
В настоящем изобретении гидрофильный полимер, используемый в качестве носителя с замедленным высвобождением, может представлять собой один или более полимеров, выбранных из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, полиэтиленоксида, каррагинана, натуральной камеди, гуаровой камеди, трагаканта, арабской камеди, камеди бобов рожкового дерева, ксантановой камеди, альгината, поливинилового спирта и поливиниллпирролидона, но не ограничивается указанным. Например, гидрофильный полимер может представлять собой гидроксипропилметилцеллюлозу.
Гидрофильный полимер может иметь вязкость от 50000 сП до 150000 сП и предпочтительно от 80000 сП до 120000 сП. Если вязкость составляет менее 50000 сП, требуется большое количество гидрофильного полимера, что приводит к увеличению размера таблетки. Если вязкость превышает 150000 сП, активный ингредиент может быть неоднородно перемешан в нем. Хотя при одинаковой вязкости, можно использовать продукт, имеющий подходящую однородность частиц, прекрасную диспергируемость и пригодное физическое состояние.
В настоящем изобретении можно использовать в качестве носителя с замедленным высвобождением от 10 масс. ч. до 30 масс. ч. гидрофильного полимера и от 3 масс. ч. до 10 масс. ч. карбомера, в пересчете на 100 масс. ч. цилостазола. В данной заявке, если массовое отношение карбомера к гидрофильному полимеру составляет менее 1:1, могут возникнуть трудности с образованием матрицы в таблетке, и таким образом задержка высвобождения лекарственного средства может действовать не надлежащим образом. Если массовое отношение превышает 10:1, скорость растворения цилостазола в щелочных условиях может снижаться, и цилостазол и гидрофильный полимер могут не смешиваться однородно.
Солюбилизирующий агент, используемый согласно настоящему изобретению, представляет собой компонент, который способствует растворению плохо растворимого лекарственного средства цилостазола, и он может представлять собой одно или более веществ, выбранных из группы, состоящей из лаурилсульфата натрия, полисорбата 80, олеоилмакроголглицерида, линолеоилмакроголглицерида и каприлокапроилполиоксилглицерида, но не ограничивается указанным. Например, солюбилизирующий агент может представлять собой лаурилсульфат натрия.
Содержание солюбилизирующего агента может составлять от 5 масс. ч. до 20 масс. ч., в пересчете на 100 масс. ч. цилостазола. Если содержание ниже вышеуказанного диапазона, лекарственное средство не достигает критической мицеллярной концентрации для снижения скорости растворения, и таким образом трудно получить удовлетворительное фармакологическое воздействие. Напротив, если содержание превышает вышеуказанный диапазон, концентрация высвобожденного лекарственного средства может снижаться, снижая всасывание лекарственного средства.
Препарат с замедленным высвобождением согласно настоящему изобретению может включать от 10 масс. ч. до 30 масс. ч. гидрофильного полимера, от 3 масс. ч. до 10 масс. ч. карбомера, от 5 масс. ч. до 20 масс. ч. солюбилизирующего агента, в пересчете на 100 масс. ч. цилостазола.
Препарат с замедленным высвобождением согласно настоящему изобретению может дополнительно включать наполнитель, связывающее вещество и смазывающее вещество.
Если препарат с замедленным высвобождением согласно настоящему изобретению может дополнительно включать наполнитель, связывающее вещество и смазывающее вещество, он может включать от 30 масс. ч. до 70 масс. ч. наполнителя, от 1 масс. ч. до 10 масс. ч. связывающего вещества, от 2 до 10 масс. ч. смазывающего вещества, в пересчете на 100 масс. ч. цилостазола, но не ограничиваясь указанным.
Наполнитель, используемый согласно настоящему изобретению, может представлять собой одно или более веществ, выбранных из группы, состоящей из микрокристаллической целлюлозы, крахмала, лактозы, маннита, сорбита и коллоидного диоксида кремния, но не ограничивается указанным. Например, наполнитель может представлять собой смесь микрокристаллической целлюлозы и коллоидного диоксида кремния.
Связывающее вещество, используемое согласно настоящему изобретению, может представлять собой одно или более веществ, выбранных из группы, состоящей из поливинилпирролидона, сополимера винилпирролидона/винилового производного и крахмала, но не ограничивается указанным. Например, связывающее вещество может представлять собой поливинилпирролидон, такой как Povidone K-30.
Смазывающее вещество, используемое согласно настоящему изобретению, может представлять собой одно или более веществ, выбранных из группы, состоящей из стеарата магния, талька и аморфного диоксида кремния, но не ограничено указанным. Например, смазывающее вещество может представлять собой стеарат магния.
Согласно другому конкретному воплощению настоящего изобретения, предложен пероральный препарат с замедленным высвобождением, полученный посредством формования композиции, содержащей 100 масс. ч. цилостазола в качестве активного ингредиента, смесь из гидроксипропилметилцеллюлозы в количестве от 10 масс. ч. до 30 масс. ч. и карбомера в количестве от 3 масс. ч. до 10 масс. ч. в качестве носителя с замедленным высвобождением, от 5 масс. ч. до 20 масс. ч. солюбилизирующего агента, от 30 масс. ч. до 70 масс. ч. наполнителя, от 1 масс. ч. до 10 масс. ч. связывающего вещества и от 2 масс. ч. до 10 масс. ч. смазывающего вещества, отличающийся тем, что пероральный препарат с замедленным высвобождением имеет приведенный ниже профиль растворения, когда его подвергают тесту на растворение согласно второму методу теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки) (37±0,5°С, 0,5% раствор лаурилсульфата натрия, 50 об/мин):
1) от 20% до 30% от общей массы цилостазола высвобождается к моменту времени, составляющему 2 часа после начала теста;
2) от 50% до 70% от общей массы цилостазола высвобождается к моменту времени, составляющему 5 часов после начала теста, и
3) по меньшей мере 85% от общей массы цилостазола высвобождается к моменту времени, составляющему 10 часов после начала теста.
В конкретном воплощении композиция может представлять собой гранулу, которая получена посредством мокрого гранулирования с использованием растворителя этанола.
Более конкретно, растворитель этанол можно использовать в количестве от 40 масс. ч. до 75 масс. ч., в пересчете на 100 масс. ч цилостазола.
Кроме того, цилостазол может иметь средний размер частиц 12 мкм или менее.
Более конкретно, солюбилизирующий агент может представлять собой лаурилсульфат натрия, наполнитель может представлять собой смесь микрокристаллической целлюлозы и коллоидного диоксида кремния, связывающее вещество может представлять собой поливинилпирролидон, и смазывающее вещество может представлять собой стеарат магния.
Препарат с замедленным высвобождением согласно настоящему изобретению может быть приготовлен посредством традиционного способа, такого как гранулирование, смешивание и формование прессованием. Более конкретно, препарат с замедленным высвобождением согласно настоящему изобретению может быть приготовлен посредством способа мокрого гранулирования. Цилостазол в качестве активного ингредиента и вспомогательные вещества смешивают в достаточной степени, а затем смесь гидрофильного полимера и карбомера в качестве носителя с замедленным высвобождением и солюбилизирующий агент перемешивают друг с другом до однородности в смесителе для порошков. К смеси добавляют этанол для получения мокрых гранул. Количество используемого этанола может составлять от 40 масс. ч. до 75 масс. ч., в пересчете на 100 масс. ч цилостазола. Если необходимо небольшое количество носителя с замедленным высвобождением растворяют в воде или в смешанном растворителе, содержащем спирт, и используют для гранулирования порошка. Полученные гранулы высушивают в достаточной степени в печи при 60°С и размалывают до однородности. Далее добавляют стеарат магния для формования препарата и осуществляют таблетирование с использованием роторной таблеточной машины.
Ниже в данной заявке подробно со ссылками на примеры, сравнительные примеры и экспериментальные примеры описаны содержание и эффект настоящего изобретения. Однако нижеследующие примеры, сравнительные примеры и экспериментальные примеры приведены только в целях иллюстрации, и область защиты настоящего изобретения не ограничена ими.
Примеры 1 и 2 и сравнительные примеры 1-4. Приготовление состава с замедленным высвобождением цилостазола посредством варьирования размера частиц цилостазола
Пример 1
Согласно соотношению компонентов в смеси, приведенному в таблице 1, цилостазол, имеющий средний размер частиц 8,61 мкм, в качестве активного ингредиента и соответствующие вспомогательные вещества перемешивали в достаточной смеси. Затем гидроксипропилметилцеллюлозу также добавляли к смеси в качестве гидрофильного полимера, и смесь перемешивали до однородности в смесителе для порошков. После этого получали мокрые гранулы, используя этанол. При мокром гранулировании использовали 55 масс. ч. этанола, в пересчете на 100 масс. ч. цилостазола. Полученные гранулы высушивали в достаточной степени в печи при 60°С и размалывали до однородности. К смеси дополнительно добавляли стеарат магния для формования препарата, и осуществляли таблетирование с использованием роторной таблеточной машины для получения таблеток, содержащих 200 мг цилостазола на таблетку.

Пример 2
Препарат цилостазола с замедленным высвобождением получали тем же способом, как в примере 1, за исключением того, что использовали цилостазол, имеющий средний размер частиц 11,42 мкм.
Сравнительные примеры 1-4
Препарат цилостазола с замедленным высвобождением получали тем же способом, как в примере 1, за исключением того, что использовали цилостазол, имеющий средний размер частиц 12,81 мкм, 13,85 мкм, 15,43 мкм или 15,65 мкм.
Средний размер частиц цилостазола, используемого в примерах 1 и 2 и сравнительных примерах 1-4, приведен в таблице 2.

Сравнительные примеры 5 и 6. Получение препаратов цилостазола с замедленным высвобождением посредством варьирования количества растворителя этанола
Препарат цилостазола с замедленным высвобождением получали тем же способом, как в примере 1, за исключением того, что при мокром гранулировании использовали 35 масс. ч. или 80 масс. ч. этанола, в пересчете на 100 масс. ч. цилостазола.
Количество растворителя этанола, используемое в примере 1 и сравнительных примерах 5 и 6, представлено в таблице 3.

Экспериментальный пример 1. Тест на растворение препаратов цилостазола с замедленным высвобождением, полученных путем варьирования размеров частиц цилостазола
Для оценки скоростей растворения препаратов цилостазола с замедленным высвобождением, полученных путем варьирования среднего размера частиц цилостазола в примерах 1 и 2 и сравнительных примерах 1-4, проводили тест на растворение.
Тест на растворение проводили с использованием 900 мл раствора лаурилсульфата натрия (0,5%) в качестве среды теста на растворение при скорости вращения 50 об/мин и температуре растворения 37±0,5°С, в соответствии со вторым методом теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки). Каждые 5 мл среды растворения отбирали в заданные моменты времени, составляющие 0, 15, 30, 60, 90, 120, 180, 300, 360, 480 и 600 минут после начала теста на растворение и фильтровали с использованием 0,45 мкм мембранного фильтра. Полученные растворы использовали в качестве тестовых растворов. Поглощение (At и As) тестовых и стандартных растворов при 257 нм определяли с использованием УФ спектрофотометра (Shimadzu, Япония). Результаты теста на растворение представлены на Фиг. 1.
Как показано на Фиг. 1, когда использовали цилостазол со средним размером частиц 12 мкм или менее в примерах 1 и 2, препараты показывали профиль растворения, при котором от 20% до 30% от общей массы цилостазола высвобождалось в момент времени, составляющий 2 часа после начала теста, от 50% до 70% от общей массы цилостазола высвобождалось в момент времени, составляющий 5 часов после начала теста и по меньшей мере 85% от общей массы цилостазола высвобождалось в момент времени, составляющий 10 часов после начала теста. Напротив, когда использовали цилостазол со средним размером частиц более 12 мкм в сравнительных примерах 1-4, скорость растворения составляла менее 20% в момент времени, составляющий 2 часа, менее 50% в момент времени, составляющий 5 часов после начала теста и менее 85% в момент времени, составляющий 10 часов после начала теста, при этом их начальная скорость растворения была низкой и концентрация лекарственного средства в организме не поддерживалась эффективно во времени, что показывает, что эти препараты не подходят в качестве препаратов с замедленным высвобождением.
Экспериментальный пример 2. Тест на растворение препаратов цилостазола с замедленным высвобождением, полученных путем варьирования количества растворителя этанола
Для оценки скоростей растворения препаратов цилостазола с замедленным высвобождением, полученных путем варьирования количества растворителя этанола в примере 1 и сравнительных примерах 5 и 6, проводили тест на растворение.
Тест на растворение проводили с использованием 900 мл раствора лаурилсульфата натрия (0,5%) в качестве среды испытания на растворение при скорости вращения 50 об/мин и температуре растворения 37±0,5°С, в соответствии со вторым методом теста «Растворение» Корейской фармакопеи (метод с использованием лопастной мешалки). Каждые 5 мл среды растворения отбирали в заданные моменты времени, составляющие 0, 15, 30, 60, 90, 120, 180, 300, 360, 480 и 600 минут после начала теста на растворение и фильтровали с использованием 0,45 мкм мембранного фильтра. Полученные растворы использовали в качестве тестовых растворов. Поглощение (At и As) тестовых и стандартных растворов при 257 нм определяли с использованием УФ спектрофотометра (Shimadzu, Япония). Результаты теста на растворение представлены на Фиг. 2.
Как показано на Фиг. 2, пример 1 показывал профиль растворения, при котором от 20% до 30% от общей массы цилостазола высвобождалось в момент времени, составляющий 2 часа после начала теста, от 50% до 70% от общей массы цилостазола высвобождалось в момент времени, составляющий 5 часов после начала теста и по меньшей мере 85% от общей массы цилостазола высвобождалось в момент времени, составляющий 10 часов после начала теста. Напротив, сравнительный пример 5 показал скорость растворения более 30% в момент времени 2 часа и более 70% в момент времени 5 часов, что указывает на слишком высокую начальную скорость растворения и высокий риск побочных эффектов. Сравнительный пример 6 показал скорость растворения менее 20% в момент времени 2 часа и более 70% в момент времени 5 часов, что указывает на то, что начальное растворение препарата вряд ли происходило, и этот препарат не подходит для получения надлежащей эффективности.
Сравнительный пример 3. Определение физических свойств препаратов с замедленным высвобождением, полученных путем варьирования количества этанола при гранулировании
Для оценки физических свойств препаратов цилостазола с замедленным высвобождением, полученных путем варьирования количества растворителя этанола в примере 1 и сравнительных примерах 5 и 6, определяли угол естественного откоса гранул, полученных мокрым гранулированием, и твердость таблеток.
Для определения угла естественного откоса гранулы, полученные мокрым гранулированием, пропускали через воронку, и непосредственно измеряли угол естественного откоса (Θ), который представляет собой угол линии ребра осевших гранул.
При определении твердости измеряли твердость каждой из 10 таблеток, используя прибор для определения твердости ERWEKA.
Результаты измерений угла естественного откоса и твердости представлены в таблице 4.

Как показано в таблице 4, пример 1 показал угол естественного откоса, составляющий от 39° до 42°, что указывает на то, что текучесть является подходящей для таблетирования, и показал твердость таблетки после таблетирования, составляющую от 11 кг/см2 до 13 кг/см2, что указывает на то, что можно получить продукт удовлетворительной твердости. Напротив, в сравнительном примере 5 гранулы показали низкую твердость, создавая большое количество мелкого порошка, при этом частицы были непрочными, а гранулы показали угол естественного откоса от 50° до 55° или выше, что указывает на то, что текучесть не подходит для таблетирования. Кроме того, после таблетирования наблюдали низкую твердость (от 5 кг/см2 до 8 кг/см2) и образование небольшой «шапочки».
В сравнительном примере 6 избыточное количество этанола вводили при гранулировании, так что паста для гранулирования становилась слишком жидкой, и полученные гранулы были слишком твердыми, так что таблетки после таблетирования имели высокую твердость от 18 кг/см2 до 20 кг/см2. Поэтому активный ингредиент не высвобождался легко, причем гранулы показывали угол естественного откоса 57° или выше, что указывает на то, что текучесть не подходит для таблетирования.