Результат интеллектуальной деятельности: СОСТАВ, СОДЕРЖАЩИЙ ЧАСТИЦЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к пероральным композициям для доставки биоактивных агентов в желудочно-кишечный тракт.
УРОВЕНЬ ТЕХНИКИ
В области пероральной доставки лекарственных средств имеется интерес к разработке гастроретентивных (удерживаемых в желудке) лекарственных форм биоактивных веществ. Вещества, обладающие биоактивностью, как правило, представляют собой синтетические соединения, так называемые небольшие молекулы. Часто для минимизации побочных эффектов и обеспечения максимальной эффективности требуется медленное высвобождение указанных синтетических соединений из соответствующих лекарственных форм после перорального введения. Для указанной задачи лекарственные вещества можно заключать в матрицы, содержащие липиды. Вследствие гидрофобной природы липидных компонентов указанного состава липофильное или амфифильное биоактивное вещество может высвобождаться в полости желудочно-кишечного тракта более медленно по сравнению со стандартной матрицей, используемой в таблетках, содержащей вспомогательные вещества, имеющие высокую растворимость в воде. Вследствие того факта, что высвобождение из матрицы с замедленным высвобождением может происходить вплоть до шести или восьми часов, при том что обычное время опорожнения желудка ограничивается всего двумя часами, существует необходимость в придании гастроретентивных свойств указанному составу с замедленным высвобождением для максимизации эффективного периода доставки лекарственного средства. Удерживание в желудке может быть обеспечено путем придания составу мукоадгезивных свойств. Мукоадгезивная система для доставки в желудок связывается со слизистой оболочкой стенок желудка и тем самым продлевает время удерживания системы и обеспечивает более продолжительный период высвобождения. В уровне техники описана комбинация мукоадгезивных свойств и липидной матрицы с замедленным высвобождением. В заявке на патент США №2006/0134144 подробно описаны мукоадгезивные композиции для увеличения растворимости нерастворимых лекарственных средств. В этом случае фармацевтические соединения вводят в состав совместно с моноглицеридами и маслами. В публикации WO 03/037355, Reckitt Benckiser Healthcare, упомянуты полиакрилатные композиции для применения для защиты слизистой. Помимо мукоадгезивного полимера указанные композиции содержат витамины и масло. В Европейском патенте ЕР 0580861, выданном Nippon Shinyaku Company, заявлена капсула с замедленным высвобождением для обеспечения адгезии в желудочно-кишечном тракте. Твердые капсулы заполняли лекарственным веществом, адгезивным полимером и полимерными наполнителями и жидким парафином. В патенте США №5571533, выданном Recordati, описаны мукоадгезивные композиции с контролируемым высвобождением для перорального введения лекарственного вещества фуросемида. В указанном патенте на фуросемид-липидные гранулы наносили покрытие из мукоадгезивных полимеров. В патенте США №6368635, выданном Takeda Chemical Industries, описаны матрицы, обладающие адгезией к слизистой оболочке желудочно-кишечного тракта. Высокоплавкий триглицерид смешивали с лекарственным веществом и полимером на основе акриловой кислоты и получали лекарственные формы, имеющие мукоадгезивные свойства. В последних исследованиях в области борьбы с ожирением было показано, что триглицериды или соответствующие продукты их разложения в пищеварительной системе, свободные жирные кислоты, могут сами по себе действовать как биоактивные вещества. Например, документально подтверждено, что инфузия лауриновой кислоты или олеиновой кислоты в двенадцатиперстную кишку с применением зонда для искусственного кормления обеспечивает сильно выраженное чувство сытости. Следовательно, существует необходимость в обеспечении составов свободных жирных кислот с замедленным высвобождением.
В публикации WO 2011/136975 А1 описаны способ и система для отображения информации о желудочном бандаже и, более конкретно, специфической информации о желудочном бандаже, которая позволяет регулировать желудочный бандаж. Регулировка желудочного бандажа может быть основана на нескольких видах данных. Указанные данные могут включать данные о чувстве сытости.
Альтернативные неинвазивные подходы для лечения ожирения могут обеспечивать чувство сытости или ощущение насыщения или удовлетворения за счет применения разнообразных съедобных композиций, таких как гелеобразующие системы или определенные питательные композиции.
Если в случае бандажирования желудка информация о чувстве сытости может быть важна для медработников при исследовании эффективности устройства, то в случае неинвазивных композиций, обеспечивающих чувство сытости, собранная и отображенная информация о чувстве сытости может быть полезной в качестве обоснования введения композиции, обеспечивающей чувство сытости, и для обеспечения лучшего соблюдения пациентом схемы лечения.
Указанную информацию о чувстве сытости традиционно собирают в виде рукописных документов или печатных данных, занесенных в электронные таблицы или формы на компьютере. Более предпочтительно указанные данные о чувстве сытости можно собирать в реальном времени при помощи приложения в виде программного обеспечения, используемого на компьютере или мобильном устройстве, таком как смартфон, или на носимом «умном» устройстве.
Задачей настоящего изобретения является обеспечение эффективного способа доставки жирных кислот и липидов на основе жирных кислот в желудочно-кишечный тракт. Дополнительной задачей является обеспечение средств для доставки указанных жирных кислот и липидов к конкретным участкам желудочно-кишечного тракта, таким как желудок или двенадцатиперстная кишка. Дополнительной задачей является обеспечение композиций, лекарственных форм и/или составов, подходящих для пероральной доставки жирных кислот и липидов на основе жирных кислот. Дополнительной задачей является обеспечение способа лечения ожирения, который повышает приверженность к терапии и мотивирует пациента соблюдать предписанный режима введения.
Дополнительные задачи станут понятны при изучении подробного описания, включая примеры, и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту в изобретении предложена съедобная частица, имеющая ситовый диаметр в диапазоне от 0,05 до 3 мм, содержащая набухающий в воде или водорастворимый полимерный компонент, первый липидный компонент и необязательно аминокислоту, витамин и/или питательный микроэлемент. Первый липидный компонент содержит средне- или длинноцепочечную жирную кислоту. Частица дополнительно характеризуется тем, что набухающий в воде или водорастворимый полимерный компонент заключен внутри и/или покрыт оболочкой липидного компонента.
Первый липидный компонент, внутри которого заключен или которым покрыт набухающий в воде или водорастворимый полимерный компонент, может представлять собой активное ядро съедобной частицы. Частица может содержать дополнительный слой покрытия, содержащего второй липидный компонент и/или гидрофильный компонент. Необязательно слой покрытия по существу не содержит набухающего в воде или водорастворимого полимерного компонента.
В качестве альтернативы съедобная частица может содержать инертное ядро, например, состоящее из инертного материала, и первый липидный компонент, внутри которого заключен или которым покрыт набухающий в воде или водорастворимый полимерный компонент, где указанный липидный компонент может быть выполнен в качестве покрытия, покрывающего инертное ядро. Кроме того, частица может дополнительно содержать второй липидный компонент и/или гидрофильный компонент. Необязательно второй слой покрытия по существу не содержит набухающего в воде или водорастворимого полимерного компонента.
Предпочтительно первый липидный компонент содержит по меньшей мере одну средне- или длинноцепочечную жирную кислоту, имеющую температуру плавления в диапазоне ниже 37°С, как таковую или в гидратированной форме.
Согласно дополнительному аспекту в изобретении предложены композиции для перорального введения, содержащие съедобные частицы или полученные из указанных частиц, такие как бутыли, саше, бумажные трубочки, капсулы или таблетки или другие лекарственные формы.
Согласно дополнительному аспекту в изобретении предложено применение частиц и композиций на основе частиц для предотвращения и/или лечения ожирения или заболевания или состояния, связанного с ожирением. Кроме того, предложено применение для подавления аппетита, обеспечения чувства сытости и/или снижения массы тела.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту в изобретении предложена съедобная частица, имеющая ситовый диаметр в диапазоне от 0,05 до 3 мм, содержащая набухающий в воде или водорастворимый полимерный компонент, первый липидный компонент и необязательно аминокислоту, витамин и/или питательный микроэлемент. Первый липидный компонент содержит средне- или длинноцепочечную жирную кислоту. Частица дополнительно характеризуется тем, что набухающий в воде или водорастворимый полимерный компонент заключен внутри и/или покрыт оболочкой липидного компонента.
Во избежание неясности следует понимать, что наличие аминокислоты, витамина и/или питательного микроэлемента в частицах согласно настоящему изобретению (и/или в смесях для получения указанных частиц) является необязательным для всех вариантов реализации, если явным образом не указано иное. Это означает, что при использовании в настоящем описании перечни, включающие аминокислоту, витамин и/или питательный микроэлемент, относятся к конкретным вариантам реализации, в которых присутствуют указанные необязательные аминокислоты, витамины и/или питательные микроэлементы, но при этом не исключают те варианты реализации, в которых указанные необязательные компоненты отсутствуют.
Кроме того, включение аминокислоты, витамина и/или питательного микроэлемента в состав частиц согласно настоящему изобретению не зависит от включения других компонентов; т.е. частицы могут не содержать всех указанных компонентов, содержать только один, два или три из четырех или могут содержать все четыре указанных компонента.
Также следует понимать, что при использовании в настоящем описании формы единственного числа или отличительные признаки, описанные в единственном числе, не исключают совокупность соответствующих отличительных признаков. Если явным образом не указано или не описано иное, выражения, такие как «аминокислота», «витамин», «питательный микроэлемент», «полимер» и т.д., выбраны исключительно для простоты и включают одну(-ин) или более аминокислот, витаминов, питательных микроэлементов, полимеров и т.д.; например, в виде комбинаций или смесей двух или более соответствующих компонентов.
Авторы настоящего изобретения обнаружили, что съедобные частицы, такие как определено в настоящем описании, и в частности пероральные композиции, содержащие совокупность указанных частиц или полученные из них, могут эффективно вызывать чувство сытости или подавлять аппетит, и, таким образом, их можно применять для предотвращения или лечения ожирения или состояний, связанных с ожирением; например, при применении съедобных частиц, таких как определено в настоящем описании, и/или композиций, содержащих множество указанных частиц или полученных из них, для снижения массы тела. Не желая быть связанными конкретной теорией, авторы настоящего изобретения полагают, что при пероральном введении жирная кислота или сложный эфир жирной кислоты, содержащиеся в частице, более эффективно доставляются к слизистой оболочке желудочно-кишечного тракта, такой как слизистая желудка или двенадцатиперстной кишки, при применении набухающего в воде или водорастворимого полимерного компонента, что можно использовать для обеспечения продленного или усиленного иным образом взаимодействия вещества на основе жирной кислоты с целевыми структурами в слизистой. Кроме того, набухающий в воде или водорастворимый полимерный компонент можно использовать для обеспечения продленного или усиленного иным образом взаимодействия аминокислоты, витамина и/или питательного микроэлемента (если они присутствуют) с целевыми структурами в слизистой.
Вероятно, что набухающий в воде или водорастворимый полимерный компонент продлевает физическую целостность частицы после приема внутрь по сравнению с липидной частицей, не содержащей набухающий в воде или водорастворимый полимерный компонент. Продление целостности частицы, содержащей липид, может приводить к ускоренной эвакуации частиц из желудка и, таким образом, к ускоренному взаимодействию доставляемых с использованием указанной частицы жирных кислот или сложных эфиров жирных кислот со слизистой кишечника. Продление целостности частицы, содержащей липид, также может обеспечивать доставку жирных кислот или сложных эфиров жирных кислот в более удаленные участки тонкого кишечника, такие как тощая кишка или подвздошная кишка.
Вероятно, что набухающий в воде или водорастворимый полимерный компонент повышает переваримость липидного компонента, который в иных случаях имеет ограниченную переваримость, такого как твердый жир, например, тристеарин. В опубликованном исследовании питания крыс было показано, что тристеарин (Dynasan® 118, температура плавления в диапазоне 72-75°С) имеет энергетическую ценность только 3 ккал/г, что соответствует истинной переваримости только 0,15 г стеариновой кислоты/г стеарина независимо от употребляемого количества. Вероятно, что набухающий в воде или водорастворимый полимерный компонент усиливает смачиваемость поверхности частицы и/или повышает доступ воды и желчных кислот и усиливает последующую эмульгацию и опосредованный липазой гидролиз липида.
Вероятно, что набухающий в воде или водорастворимый полимерный компонент обеспечивает частицу, обладающую мукоадгезивными свойствами, в частности в комбинации с продлением целостности частицы.
При использовании в настоящем описании съедобная частица представляет собой частицу, которая по существу подходит для употребления внутрь или перорального введения. Частица, которую с учетом композиции, размера и морфологии, можно применять в качестве компонента пищи или компонента фармацевтической композиции для перорального применения, представляет собой пример съедобной частицы.
Частица имеет ситовый диаметр от примерно 0,05 мм до примерно 3 мм, это означает, что она будет проходить через сито, имеющее размер ячеек или отверстий, составляющий примерно 3 мм, но не через сито, имеющее размер ячеек или отверстий, составляющий примерно 0,05 мм или менее. Частица также может иметь диаметр в диапазоне от примерно 0,1 мм до примерно 2,5 мм или от примерно 0,1 мм до примерно 2 мм, например, примерно 0,25±0,20 мм, примерно 0,5±0,25 мм, примерно 1,0±0,25 мм, примерно 1,5±0,25 мм или примерно 2,0±0,25 мм, соответственно. Следует понимать, что в случае композиции, содержащей совокупность частиц согласно настоящему изобретению, указанные размеры частиц характеризуют предпочтительные среднемассовые ситовые диаметры съедобных частиц.
Набухающий в воде или водорастворимый полимерный компонент представляет собой гидрофильный или амфифильный полимерный материал, который может растворяться или набухать в водной среде. Материал может содержать мукоадгезивное соединение или смесь мукоадгезивных соединений или может придавать мукоадгезивность частице. Если указанный материал представляет собой смесь, то он также может содержать один или более компонентов, которые сами по себе не набухают в воде или не являются мукоадгезивными, если при этом смесь сохраняет набухаемость в воде.
При использовании в настоящем описании набухание в воде или в водной среде, как правило, обозначает увеличение объема твердого объекта, вызванное процессом включения или диффузии воды, сопровождаемое гидратацией, т.е. смачиванием и поглощением влаги.
Водорастворимый полимерный компонент представляет собой гидрофильный или амфифильный полимер, имеющий растворимость в воде, составляющую по меньшей мере 1 мг/л.
Продление целостности частицы представляет собой продление периода времени при инкубации in vivo или при симуляции условий in vivo, в течение которого не происходит уменьшение объема или массы или расплавление на капли основной части (более 50%) частиц. Целостность частиц может быть легко определена путем визуальной оценки невооруженным глазом или при помощи микроскопа или другой технологии визуализации, включая микроскопическую визуализацию, и последующей компьютерной обработки изображения.
Мукоадгезивность представляет собой способность прилипать к слизистой или мембране слизистой оболочки. Для определения мукоадгезивности доступны разнообразные традиционные способы, такие как измерение прочности на разрыв, эллипсометрия или измерения текучести (D. Ivarsson et al., Colloids Surf В Biointerfaces, vol. 92, стр. 353-359, 2012). Даже если указанные способы и не позволяют получать абсолютные значения мукоадгезивности, как таковой, они указывают на наличие и относительную величину мукоадгезивности материала.
Для определения мукоадгезивности согласно настоящему изобретению предпочтительно применяют модифицированный способ стекающей жидкой пленки (описанный помимо прочего в Mucoadhesive drug delivery systems, Carvalho F.C. et al., Brazilian Journal of Pharmaceutical Sciences 46 (2010)). Согласно указанному способу выбранную слизистую мембрану (например, из желудка свиньи) помещают в чашку Петри совместно с искусственным желудочным соком при температуре, установленной на 37°С. Чашку Петри помещают на рабочую поверхность, которую наклоняют вверх и вниз относительно горизонтальной оси. Способ наклонного перемещения и объем буфера выбирают таким образом, чтобы небольшие волны буфера непрерывно протекали по поверхности слизистой ткани. В способе стекающей жидкой пленки схожее перемешивание обеспечивают за счет прокачивания буфера по поверхности слизистой ткани, расположенной под углом 45°. Количество частиц, сохранившихся на слизистой мембране в течение конкретного периода времени, можно оценивать количественно при помощи различных способов. Например, можно проводить подсчет частиц необязательно с использованием увеличительного стекла или микроскопа, или их можно собирать, сушить, а затем проводить гравиметрический анализ.
В контексте настоящего изобретения набухающий в воде или водорастворимый полимерный компонент может иметь или индуцировать мукоадгезивную прочность, достаточную для того, чтобы обеспечивать прикрепление к слизистой мембране при контакте с указанной мембраной и обеспечивать прикрепление частицы или ее компонента в течение значительно более продолжительного периода времени по сравнению с материалом, который не является мукоадгезивным, таким как твердый триглицерид или липофильный полимер, например, политетрафторэтилен. В одном предпочтительном варианте реализации набухающий в воде или водорастворимый полимерный компонент содержит мукоадгезивный полимер. В частности, он может содержать по меньшей мере один полимерный материал, выбранный из поли(карбоксилатов), хитозана, простых эфиров целлюлозы и ксантановой камеди.
В дополнительном предпочтительном варианте реализации набухающий в воде или водорастворимый полимерный компонент представляет собой растительное волокно. В контексте настоящего изобретения растительное волокно включает отдельные индивидуальные компоненты растительных волокон или их производные, а также их смеси. Например, подходящий набухающий в воде или водорастворимый полимерный компонент представляет собой оболочку семян подорожника или волокна оболочки семян подорожника, также называемые шелухой семян подорожника или просто оболочкой подорожника. Оболочка семян подорожника представляет собой оболочку семян подорожника индийского, также известного как овальный подорожник (Desert Indianwheat) или яйцевидный подорожник (Blond Psyllium). Основным компонентом оболочки семян подорожника являются растворимые, но непереваримые полисахаридные волокна, которые имеют высокую степень набухания в воде. Как известно, подорожник является источником диетических волокон, а также мягким слабительным или размягчителем стула.
При использовании поли(карбоксилата) его предпочтительно выбирают из поли(акриловой кислоты), поли(метакриловой кислоты), сополимеров акриловой и метакриловой кислоты и поли(гидроксиэтилметакриловой кислоты) или из альгиновой кислоты или пектина или карбоксиметилцеллюлозы. Простой эфир целлюлозы предпочтительно выбран из гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы (также известной как гипролоза), гидроксипропилметилцеллюлозы (также известной как гипромеллоза) и метилцеллюлозы. При использовании ионного полимера, такого как поли(карбоксилат) и/или карбоксиметилцеллюлоза, он может быть частично или полностью нейтрализован, предпочтительно в виде натриевой или калиевой соли, наиболее предпочтительно в виде натриевой соли. Кроме того, полимерный материал может быть по меньшей мере частично поперечно-сшитым.
В дополнительном предпочтительном варианте реализации мукоадгезивный полимер представляет собой сополимер акриловой кислоты и метакриловой кислоты или акриловой или метакриловой кислоты и малеиновой кислоты. Сополимер может быть поперечно-сшитым с небольшими количествами простого полиэфира полиалкенила. Указанные сополимеры имеют высокую гидрофильность и могут поглощать большие количества воды, что приводит к набуханию.
Особенно эффективными при реализации настоящего изобретения являются, например, карбомеры. Карбомерные каучуки представляют собой высокомолекулярные, поперечно-сшитые полимеры на кислой основе. Коммерческие варианты карбомеров реализуются, например, как Carbopol®, Noveon®, Pemulen®, Polygel®, Synthalen®, Acritamer® или Tego Carbomer®. Большинство указанных торговых марок включают различные сорта карбомеров.
Например, серия полимеров Carbopol® включает гомополимеры, сополимеры, интерполимеры, представленные Carbopol® Aqua SF-1 (акрилатный сополимер, акрилатный сополимер с низкой степенью поперечной сшивки), Carbopol® Aqua SF-2 (акрилатный сшитый полимер-4), Carbopol® Aqua СС (сшитый полиакрилатный полимер-1), Carbopol® 934 (карбомер, акрилатный гомополимер, поперечно-сшитый с простыми аллильными эфирами сахарозы), Carbopol® 940 (карбомер), Carbopol® 941 (карбомер), Carbopol® 971P (карбомер с низкой степенью поперечной сшивки с аллилпентаэритритом), Carbopol® 71G (свободнотекучая форма Carbopol® 971P в виде гранул для применения в составах, получаемых методом прямого прессования), Carbopol® 974Р (карбомер, с высокой степенью поперечной сшивки), Carbopol® 980 (карбомер), Carbopol® 980 (карбомер), Carbopol® 981 (карбомер, поперечносшитый с аллилпентаэритритом), Carbopol® 1342 (акрилаты/С 10-30 алкилакрилатный сшитый полимер, сополимер акриловой кислоты и С10-С30 алкилакрилата, поперечно сшитый с аллилпентаэритритом), Carbopol® 1382 (акрилаты/С10-30 алкилакрилатный сшитый полимер, сополимер акриловой кислоты и С10-С30 алкилакрилата, поперечно сшитый с аллилпентаэритритом), Carbopol® 2984 (карбомер), Carbopol® 5984 (карбомер), Carbopol® Ultrez 10 (карбомер), Carbopol® Ultrez 20 (акрилаты/ С10-30 алкилакрилатный сшитый полимер), Carbopol® Ultrez 21 (акрилаты/ С10-30 алкилакрилатный сшитый полимер), Carbopol® Ultrez 30 (карбомер), Carbopol® ETD 2001, Carbopol® ETD 2020 (акрилаты/ С10-30 алкилакрилатный сшитый полимер, интерполимер, содержащий блок-сополимер полиэтиленгликоля и сложного эфира длинноцепочечной алкановой кислоты), Carbopol® ETD 2050 (карбомер).
Среди указанных выше сортов полимеров, одобренных для фармацевтического применения, предпочтительными являются те, что удовлетворяют фармакопейным статьям, таким как статья «Карбомер» Европейской фармакопеи (Ph. Eur. 8) или статьям Фармакопеи США/Национального формуляра (USP-NF), озаглавленным «Карбомер 910», «Карбомер 934», «Карбомер 934Р», «Карбомер 940», «Карбомер 941», «Гомополимерный карбомер», «Сополимерный карбомер», «Интерполимерный карбомер» или «Карбомер 1342».
Кроме того, особенно эффективными являются поликарбофилы (USP-NF), которые представляют собой высокомолекулярные полимеры акриловой кислоты, поперечно-сшитые с дивинилгликолем. Они обеспечивают превосходные биоадгезивные свойства. Примером предпочтительного сорта поликарбофилов является NOVEON® АА-1.
Необязательно набухающий в воде или водорастворимый полимерный компонент содержит по меньшей мере один полисахарид, одобренный для перорального применения в качестве вспомогательного вещества или пищевой добавки или ингредиента пищи. По меньшей мере один полисахарид может быть выбран из групп катионных полисахаридов, анионных полисахаридов и неионных полисахаридов.
Подходящие катионные полисахариды включают, но не ограничиваются ими, хитозан, полисахариды, модифицированные при помощи четвертичных аммонийных групп (например, катионную гуаровую камедь, катионную целлюлозу, катионную гидроксиэтилцеллюлозу и катионный крахмал), их производные или смеси двух или более указанных полисахаридов.
В качестве альтернативы катионный полисахарид представляет собой полимерный материал, содержащий основные аминогруппы, по меньшей мере часть которых является протонированными в нейтральной среде. Катионный полисахарид может быть обеспечен или включен в состав в виде свободного основания, количественно протонированной солевой формы или любой смеси двух указанных форм.
Форма «свободного основания» относится к полимеру, такому как полиглюкозамин (хитозан), содержащему боковые цепи аминогрупп в основной форме, например, -NH2. «Солевая форма» относится к полимеру, такому как полиглюкозамин (хитозан), содержащему боковые цепи аминогрупп в солевой форме, например, -NH3+Cl- в случае хлоридных солей аммонийных групп. Следует понимать, что солевая форма может относиться к смесям солей, например, солевая форма может содержать смеси различных солей, такие как -NH3+Cl- и -NH3+СН3-СОО-. «Какая-либо смесь двух форм» относится к полимерному материалу, содержащему аминогруппы, где часть аминогрупп присутствует в основной форме, например, -NH2 в случае первичных аминогрупп, и часть указанных боковых цепей присутствует в солевой форме, например, -NH3+Сl-. Например, указанную смесь можно называть неполной хлоридной солью хитозана.
«Хитозан» для задач настоящего изобретения определен как хитозан, выделенный из грибков или полученный путем деацетилирования хитина, где средняя степень деацетилирования предпочтительно составляет более чем примерно 75%, более чем примерно 80%, более чем примерно 90% или более чем примерно 95%, соответственно. Степень деацетилирования относится к относительному содержанию деацетилированных аминогрупп в хитине. Особенно предпочтительный хитозан представляет собой хитозан, полученный из грибковой биомассы, выбранной из группы, состоящей из Candida Guillermondii, Aspergillus niger, Aspergillus terreus и их комбинаций, хитозан, содержащий материал со степенью деацетилирования N-ацетильных групп в хитине более 85 процентов и имеющий вязкость менее 25 сантипуаз (мПа⋅с) при 25°С в 1-процентной водной уксусной кислоте.
Подходящие анионные полисахариды включают, но не ограничиваются ими, сульфатированные гликозаминогликаны, включая гепараны, гепарансульфаты, гепарины, альгинаты; альгинаты пропиленгликоля; каррагинаны; сульфат целлюлозы; карбоксиметилцеллюлозу; фукоидан; галактаны, содержащие глюкуроновую кислоту или галактуроновую кислоту; хондроитины или сульфаты хондроитина; геллановую камедь; гиалуронаны и гиалуроновые кислоты; модифицированные крахмалы, такие как октенилсукцинаты крахмала или фосфаты монокрахмала, окисленные крахмалы или карбоксиметилированные крахмалы; пектиновые кислоты, пектины, включая амидированные пектины, гомогалактуронаны, замещенные галактуронаны, рамногалактуронаны, их сложные метиловые и этиловые эфиры; порфираны; сульфатированные галактаны; трагакант или камедь карайи; ксантановые камеди и ксиланы.
Одним из особенно эффективных поликарбоксилатных полисахаридов является альгиновая кислота. Альгиновая кислота представляет собой линейный сополимер, содержащий гомополимерные блоки остатков (1-4)-связанного β-D-маннуроната (М) и его С-5 эпимера α-L-глюкуроната (G), соответственно, ковалентно связанные друг с другому в виде различных последовательностей или блоков. Мономеры могут присутствовать в виде гомополимерных блоков соединенных последовательно G-остатков (G-блоки), соединенных последовательно М-остатков (М-блоки) или чередующихся М- и G-остатков (MG-блоки).
Анионный полисахарид можно включать в состав в виде свободной кислоты или нейтрализованной солевой формы кислоты или в виде смеси двух указанных форм, т.е. частично нейтрализованной соли. Форма «свободной кислоты» относится к полимерному материалу, содержащему кислотные группы в неионизованной, протонированной кислотной форме, например, -СООН или -SO4H2. «Солевая форма» относится к полимерному материалу, кислотные группы которого находятся в ионизированной или солевой форме, например, -COO-Na+ в случае натриевых солей карбоксилатов или -SO42-Na2+ в случае натриевых солей сульфатов. Следует понимать, что солевая форма может относиться к смесям солей, например, солевая форма может содержать смеси -COO-Na+ и -СОО-K+ или -СОО-Са2+-СОО-. «Какая-либо смесь двух форм» относится к полимерному материалу, содержащему кислотные группы, где часть указанных групп присутствует в неионизированной кислотной форме, например, -СООН в случае карбоновых кислот, и другая часть кислотных групп присутствует в ионизированной солевой форме, например, -COO-Na+ в случае натриевых солей карбоновых кислот. Например, указанную смесь можно называть неполной натриевой солью альгиновой кислоты.
Предпочтительно анионный полисахарид представляет собой анионное пищевое волокно. Пищевое волокно для задач настоящего изобретения представляет собой полимерный углевод, содержащий десять или более мономерных звеньев, которые не поддаются гидролизу под действием эндогенных ферментов в тонком кишечнике человека. Они, как правило, представляют собой полимерные углеводы, полученные из пищевого сырья посредством физических, ферментных или химических превращений, или синтетические полимерные углеводы.
Предпочтительно анионный полисахарид представляет собой альгиновую кислоту, карбоксиметилцеллюлозу, гиалуронан, альгинат натрия, альгинат пропиленгликоля, каррагинан, геллановую камедь, пектин, трагакант или ксантановую камедь. Особенно предпочтительно по меньшей мере один анионный полисахарид представляет собой карбоксиметилцеллюлозу, альгинат натрия или альгинат пропиленгликоля, пектин, ксантановую камедь или гиалуронан. Необязательно применяют комбинацию анионных полисахаридов, таких как альгинат натрия и ксантан или альгинат натрия и пектин.
Пектиновые полисахариды (пектины) обогащены галактуроновой кислотой. В рамках группы пектинов были выявлены и охарактеризованы несколько различных полисахаридов. Гомогалактуронаны представляют собой линейные цепи α-(1-4)-связанной D-галактуроновой кислоты. Замещенные галактуронаны характеризуются наличием боковых сахаридных остатков (таких как D-ксилоза или D-апиоза в случае ксилогалактуронана и апиогалактуронана, соответственно), прикрепленных к остову из остатков D-галактуроновой кислоты. Пектин рамногалактуронан I (RG-I) содержит остов повторяющихся дисахаридных звеньев: (1,4)-α-D-галактуроновая кислота-(1,2)-α-L-рамноза-(1). Множество остатков рамнозы могут содержать боковые группы различных нейтральных сахаров. Нейтральные сахара, главным образом, представляют собой D-галактозу, L-арабинозу и D-ксилозу, где типы и доли нейтральных сахаров могут быть различными в зависимости от природы пектина. Другим структурным типом пектина является рамногалактуронан II (RG-II). Выделенный пектин, как правило, имеет молекулярную массу 60-130000 г/моль в зависимости от происхождения и условий экстракции. В природном пектине примерно 80 процентов карбоксильных групп галактуроновой кислоты этерифицированы метанолом. Указанное значение снижается в различной степени при экстракции пектина. Отношение этерифицированных остатков галактуроновой кислоты к неэтерифицированным определяет поведение пектина при применении в качестве пищевой добавки. По этой причине пектины разделяют на высоко- и низкоэтерифицированные пектины (короткие НМ и LM-пектины), в которых этерифицировано более или менее половины от всех остатков галактуроновой кислоты. Звенья неэтерифицированной галактуроновой кислоты могут представлять собой свободные кислоты (группы карбоновой кислоты) или соли с натрием, калием или кальцием. Соли частично этерифицированных пектинов называют пектинатами; если степень этерификации составляет менее 5 процентов, то соли называют пектатами; нерастворимая кислота соответствует пектиновой кислоте. Амидированный пектин представляет собой модифицированную форму пектина. В указанном соединении некоторую часть остатков галактуроновой кислоты превращают с использованием аммиака в амид карбоновой кислоты. Наиболее предпочтительными пектинами являются высокоэтерифицированные пектины.
Подходящие неионные полисахариды включают, но не ограничиваются ими, агарозы; амилопектины; амилозы; арабиноксиланы; бета-глюканы, включая каллозу, курдлан, хризоламинарин или лейкозин, ламинарии, лентинан, лихенин, плевран, шизофиллан, зимосан; капсуланы; целлюлозы, включая гемицеллюлозы, сложные эфиры целлюлозы, такие как ацетат целлюлозы, триацетат целлюлозы, пропионат целлюлозы, ацетат-пропионат целлюлозы и ацетат-бутират целлюлозы; простые эфиры целлюлозы, такие как метилцеллюлоза, гидроксиэтилметилцеллюлоза, гидроксипропилметилцеллюлоза (гипромеллоза), гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза (гипролоза), гидроксиэтилгидроксипропилцеллюлоза, метилэтилцеллюлоза или алкоксигидроксиэтилгидроксипропилцеллюлоза, где алкоксигруппа является неразветвленной или разветвленной и содержит от 2 до 8 атомов углерода; хитины; циклодекстрины; декстраны; декстрины (например, коммерчески доступные как Nutriose® или Benefiber®); галактоглюкоманнаны; галактоманнаны, включая камедь пажитника, гуаровую камедь, камедь тары, камедь бобов рожкового дерева или камедь рожкового дерева; глюкоманнаны, включая конжаковую камедь; фруктаны, включая инулин, леван, синистрин или флеин; мальтодекстрины; гликогены; пуллуланы; крахмалы, включая резистентные крахмалы, модифицированные крахмалы, такие как ацетилированный крахмал, гидроксипропилированный крахмал или гидроксиэтилкрахмал; полидекстрозы; велановую камедь и ксилогликаны.
Предпочтительно неионный полисахарид представляет собой неионное пищевое волокно. Предпочтительно неионный полисахарид выбран из группы, состоящей из бета-глюканов, простых эфиров целлюлозы, гуаровых камедей, галактоманнанов, глюкоманнанов, инулинов и декстринов. Предпочтительно неионный полисахарид представляет собой гидроксипропилметилцеллюлозу (гипромеллозу) или камедь бобов рожкового дерева или бета-глюкан овса или ячменя или конжаковую камедь или резистентный декстрин. Особенно предпочтительными неионными полисахаридами являются гидроксипропилметилцеллюлоза (гипромеллоза), гидроксипропилцеллюлоза, бета-глюкан овса или ячменя и резистентный декстрин крахмала.
Резистентные декстрины представляют собой короткоцепочечные полимеры глюкозы, не имеющие сладкого вкуса, которые обладают относительной устойчивостью к гидролитическому действию пищеварительных ферментов человека. Их можно получать, например, из пшеницы (NUTPJOSE® группы FB или Benefiber®) или кукурузного крахмала (NUTRIOSE® группы FM), при помощи высококонтролируемого способа декстринизации и последующей стадии хроматографического фракционирования. На стадии декстринизации проводят гидролиз крахмала и последующую реполимеризацию, и происходит превращение крахмала в волокно: помимо типичных для крахмала α-1,4 и α-1,6 перевариваемых связей образуются неперевариваемые гликозидные связи, такие как β-1,2 или β-1,3, которые не расщепляются ферментами в пищеварительном тракте.
Необязательно набухающий в воде или водорастворимый полимерный компонент согласно настоящему изобретению содержит более одного полисахарида. В частности, предпочтительно выбирают анионный полисахарид и неионный полисахарид, в частности комбинацию ксантановой камеди и гидроксипропилметилцеллюлозы (гипромеллозы).
Необязательно набухающий в воде или водорастворимый полимерный компонент согласно настоящему изобретению содержит синтетический набухающий в воде или водорастворимый полимерный материал, такой как поливиниловый спирт, поливинилацетат, полиэтиленгликоли (ПЭГ), полипропиленгликоли (ППГ) или поливинилпирролидоны (ПВП). Указанный полимер может быть линейным, разветвленным или поперечно-сшитым, например, как в случае кросповидона (поперечно-сшитого поливинилпирролидона) или ПЭГ гидрогеля.
Необязательно набухающий в воде или водорастворимый полимерный компонент содержит тиолированный полимер, такой как хитозан-4-тиобутиламидин, конъюгат хитозан-тиогликолевая кислота, конъюгат хитозан-цистеин, конъюгат хитозана и глутатиона, конъюгат поликарбофил-цистеин, конъюгат полиакриловая кислота-цистеин, конъюгат карбоксиметилцеллюлоза-цистеин или любые смеси или комбинации двух или более указанных полимеров.
Первый липидный компонент содержит средне- или длинноцепочечную жирную кислоту. Жирная кислота согласно настоящему описанию может относиться к свободной жирной кислоте, частично или полностью нейтрализованной жирной кислоте, т.е. к соли жирной кислоты, такой как натриевая, калиевая или кальциевая соль, или к этерифицированной жирной кислоте. Этерифицированная жирная кислота в качестве остатка спирта может содержать глицерин, таким образом, этерифицированная жирная кислота представляет собой моно-, ди- или триглицерид. Ацильная цепь жирной кислоты может быть насыщенной или ненасыщенной.
Под среднецепочечной жирной кислотой понимают жирную кислоту, ацильный остаток которой содержит от 6 до 12 атомов углерода, при этом длинноцепочечная жирная кислота обозначает жирную кислоту, ацильный остаток которой содержит от 13 до 21 атома углерода. Предпочтительными среднецепочечными жирными кислотами являются каприловая кислота, каприновая кислота и лауриновая кислота, включая их сложные эфиры и соли, в частности моно-, ди- и триглицериды и натриевые, калиевые и кальциевые соли. Если рассматривать ди- и триглицериды, то они также могут содержать остатки различных жирных кислот, присоединенные к молекуле глицерида. Примеры предпочтительных длинноцепочечных жирных кислот включают миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, арахидиновую кислоту, бегеновую кислоту, миристолеиновую кислоту, пальмитолеиновую кислоту, сапиеновую кислоту, олеиновую кислоту, линолевую кислоту и линоленовую кислоту и соответствующие соли и глицериды.
В одном из предпочтительных вариантов реализации первый липидный компонент содержит один или более неполных глицеридов средне- или длинноцепочечной жирной кислоты, в частности моноглицеридов средне- или длинноцепочечной жирной кислоты. Например, моноолеин или монолаурин особенно подходят для реализации изобретения при использовании по отдельности или в комбинации друг с другом. При использовании в настоящем описании моноглицерид, такой как моноолеин или монолаурин, можно включать в виде по существу чистого соединения или в виде смеси моно- и диглицеридов или даже моно-, ди- и триглицеридов различных жирных кислот, но с повышенным содержанием («обогащенный моноглицерид») конкретного моноглицеридного соединения. Например, можно применять моноолеин, содержащий по меньшей мере примерно 40% (или по меньшей мере примерно 50% или 60%, или 70%, или 80%, или 90%) данного моноглицерида олеиновой кислоты.
Безусловно, первый липидный компонент может представлять собой смесь, содержащую две или более жирных кислот и/или сложных эфиров или солей жирных кислот. Например, компонент может содержать одну или более жирных кислот, которые могут быть частично или полностью нейтрализованными, в комбинации с одним или более глицеридами, такими как триглицериды.
Ингредиент(-ы) первого липидного компонента может(-гут) представлять собой природные, синтетические или полусинтетические материалы. Например, можно применять масло какао, которое само по себе представляет собой смесь различных липидных компонентов, большая часть которых представляет собой соединения на основе жирных кислот, такие как определено в настоящем описании. Другим предпочтительным ингредиентом первого липидного компонента является пальмовый стеарин или пальмоядровый стеарин. Пальмовый стеарин представляет собой твердую фракцию пальмового масла, которую получают путем неполной кристаллизации при контролируемой температуре.
В одном из вариантов реализации первый липидный компонент содержит одну или более свободных жирных кислот. Например, в состав липидного компонента может входить свободная олеиновая кислота или лауриновая кислота. Другими предпочтительными свободными жирными кислотами являются смеси ненасыщенных жирных кислот, таких как так называемые омега-жирные кислоты или сопряженные линолевые кислоты. Сопряженные линолевые кислоты (СЛК) представляют собой семейство изомеров линолевой кислоты. Сопряженные линолевые кислоты включают транс-жирную кислоту и цис-жирную кислоту, так как двойные связи в СЛК являются сопряженными и разделены простой связью. Различные марки СЛК реализуются на рынке в качестве пищевых добавок (Tonalin®, BASF, и Clarinol®, Stepan). Омега-3-жирные кислоты представляют собой полиненасыщенные жирные кислоты (ПНЖК), содержащие двойную связь (С=С) при третьем атоме углерода, начиная с конца углеродной цепи. Примерами омега-3-жирных кислот являются α-линоленовая кислота (ALA) (присутствует в растительных маслах), эйкозапентаеновая кислота (ЕРА) и докозагексаеновая кислота (DHA) (обе распространены в рыбьем жире). Если первый липидный компонент содержит ненасыщенную жирную кислоту, то он также может содержать антиоксидант, такой как витамин Е или его производное.
В одном из предпочтительных вариантов реализации средне- или длинноцепочечная жирная кислота, включенная в состав первого липидного компонента, как таковое in vitro или в гидратированной форме in vivo имеет температуру плавления в диапазоне ниже 37°С. При использовании в настоящем описании понимают, что температура плавления находится в диапазоне ниже 37°С, если нижний (но необязательно верхний) предел диапазона находится ниже 37°С. Другими словами, соединение, имеющее температуру плавления в диапазоне от 35°С до 38°, является примером материала согласно настоящему изобретению с температурой плавления в диапазоне ниже 37°С. Другими словами, согласно указанному варианту реализации по меньшей мере некоторая часть материала на основе жирной кислоты, входящего в состав липидного компонента, будет плавиться при физиологической температуре в организме человека. Кроме того, диапазон температуры плавления липидного компонента может быть включен в указанный диапазон, если липидный компонент может подвергаться гидратации, и температура плавления в гидратированном состоянии в диапазоне ниже 37°С. Указанное поведение некоторых липидов также описано как «плавление при гидратации».
Согласно дополнительному предпочтительному варианту первый липидный компонент содержит средне- или длинноцепочечную жирную кислоту, имеющую температуру плавления в диапазоне или нижний предел диапазона плавления от примерно 10°С до 37°С или от примерно 25°С до 37°С, соответственно.
Авторы настоящего изобретения неожиданно обнаружили, что частицы, содержащие набухающий в воде или водорастворимый полимерный компонент, заключенный внутри или покрытый оболочкой липидного компонента, содержащего указанное(-ые) соединение(-ия) на основе жирной кислоты с низкой температурой плавления, могут дольше сохранять целостность. Вероятно, что мукоадгезивные свойства, придаваемые частицам, зависят от природы полимерного компонента. Вероятно, что указанные эффекты по отдельности или в комбинации также вносят вклад или связаны с увеличением времени удерживания частиц в желудке, повышенной биодоступностью липида(-ов) и появлением чувства сытости, связанного с введением частиц.
Кроме того, авторы настоящего изобретения неожиданно обнаружили, что частицы, содержащие набухающий в воде или водорастворимый полимерный компонент, заключенный внутри или покрытый оболочкой липидного компонента, содержащего указанное(-ые) соединение(-ия) на основе жирной кислоты с низкой температурой плавления, могут образовывать вязкую эмульсию в желудочно-кишечном тракте. Вероятно, что указанный эффект также вносит вклад или связан с увеличением времени удерживания частиц в желудке и появлением чувства сытости, связанного с введением частиц.
Необязательно первый липидный компонент может содержать один или более дополнительных ингредиентов, которые могут иметь полностью различные диапазоны температуры плавления. Например, в качестве первого липидного компонента можно применять смесь олеиновой кислоты, имеющей температуру плавления в диапазоне от 13°С до 14°С, и твердого жира (т.е. смеси триглицеридов), имеющего температуру плавления в диапазоне от 42°С до 45°С. В качестве альтернативы твердому жиру в указанной смеси можно применять миристиновую кислоту (Тпл от 54°С до 55°С) или лауриновую кислоту (Тпл от 43°С до 44°С). Объединение жирной кислоты с солью жирной кислоты в выбранном отношении для регулировки диапазона плавления в пределах желаемых оптимальных значений может быть эффективным.
В одном из предпочтительных вариантов реализации соединение на основе жирной кислоты, входящее в состав первого липидного компонента, как таковое in vitro или в гидратированном состоянии in vivo имеет температуру плавления в диапазоне выше 37°С. При использовании в настоящем описании понимают, что температура плавления находится в диапазоне выше 37°С, если верхний предел диапазона составляет более 37°С. Другими словами соединение, имеющее температуру плавления в диапазоне от 40°С до 44°С, является примером материала согласно настоящему изобретению с температурой плавления в диапазоне выше 37°С. Кроме того, диапазон температуры плавления липидного компонента может быть включен в указанный диапазон, если липидный компонент может подвергаться гидратации, и температура плавления в гидратированном состоянии находится в диапазоне выше 37°С. Особенно предпочтительно первый липидный компонент, имеющий температуру плавления в диапазоне выше 37°С, представляет собой фракционированный, но негидрогенизированный пальмовый стеарин или пальмоядровый стеарин. Пальмовый стеарин представляет собой твердую фракцию пальмового масла, которую получают путем неполной кристаллизации при контролируемой температуре. Примером предпочтительного продукта товарного качества является Prifex® 300 производства Sime Darby Unimills.
Согласно настоящему изобретению набухающий в воде или водорастворимый полимерный компонент заключен внутри и/или покрыт оболочкой липидного компонента. При использовании в настоящем описании термин «заключенный» означает, что набухающий в воде или водорастворимый полимерный компонент в значительной степени распределен внутри липидного компонента в виде отдельных молекул, коллоида или твердой суспензии. Липидный компонент образует непрерывную фазу, в которой содержится несплошная и диспергированная фаза набухающего в воде или водорастворимого полимерного компонента. Во избежание неясности указанное определение не исключает случаев, при которых некоторое количество материала, представляющего собой набухающий в воде или водорастворимый полимерный компонент, - как правило, небольшая доля, - не полностью заключено внутри, но располагается на внешней поверхности липидного компонента.
Как правило, «заключенный внутри» в контексте настоящего изобретения также означает, что липидный компонент и набухающий в воде или водорастворимый полимерный компонент смешаны настолько однородно, что пористость полученной композиции липид-полимер в значительной степени понижена по сравнению с частицами, полученными из набухающего в воде или водорастворимого полимера, как такового, например, при получении путем вальцевания или агломерации. Пористость частиц можно определять при помощи порометрии, аналитического способа, используемого для определения различных количественных характеристик пористой природы материала, таких как диаметр пор, общий объем пор и площадь поверхности. Указанная техника включает нагнетание несмачивающей жидкости под высоким давлением внутрь материала с применением порометра.
Термин «покрытый оболочкой» означает, что частица, содержащая набухающий в воде или водорастворимый полимерный компонент, по существу окружена слоем липидного материала, представляющего собой первый липидный компонент. На практике в зависимости от способа получения в некоторой степени могут присутствовать обе указанные формы («заключенная внутри» или «покрытая оболочкой»).
В одном из предпочтительных вариантов реализации частица согласно настоящему изобретению может быть выполнена таким образом, чтобы иметь активное ядро и покрытие, нанесенное на ядро, причем активное ядро содержит первый липидный компонент, внутри которого заключен или которым покрыт набухающий в воде или водорастворимый полимерный компонент, при этом покрытие содержит второй липидный компонент и/или гидрофильный компонент. Покрытие может по существу не содержать набухающего в воде или водорастворимого полимерного компонента.
Указанный вариант реализации является особенно эффективным за счет того, что покрытие позволяет эффективно проводить пероральное введение в отсутствие взаимодействия набухающего в воде или водорастворимого полимерного компонента со слизистой оболочкой рта или пищевода при приеме внутрь, так как покрытие выступает в качестве защитного слоя. Покрытие также обеспечивает защиту от агломерации и спекания при производстве, хранении и перевозке и способствует достижению приемлемого срока хранения.
Другими словами, в указанной группе вариантов реализации активное ядро может быть покрыто физиологически неактивной оболочкой, такой как оболочка в виде полимерной пленки или липидного покрытия. Оболочка в виде полимерной пленки, которая получена на основе гидрофильного компонента, может не содержать липида или может содержать некоторое относительно низкое количество липида, например, в качестве пластификатора. Липидное покрытие может состоять исключительно из второго липидного компонента или может содержать некоторое количество гидрофильного компонента, например, в качестве ускорителя распадения.
Покрытие может быть выполнено с обеспечением возможности его быстрого распада, чтобы активное ядро частицы быстро высвобождалось после проглатывания. Предпочтительно второй липидный компонент, т.е. компонент, включенный в состав покрытия частицы, содержит один или более липидов, имеющих температуру плавления или диапазон температуры плавления ниже чем примерно 37°С, что определено выше, например, температура плавления находится в диапазоне от примерно 25°С до примерно 37°С. Композиция второго липидного компонента необязательно может быть такой же, что и у первого липидного компонента. В качестве альтернативы композиции могут быть различными.
Как было указано выше, покрытие частицы согласно указанному варианту реализации может содержать гидрофильный компонент. Указанный гидрофильный материал может быть заключен внутри или диспергирован внутри второго липидного материала и может действовать как ускоритель распада слоя покрытия. Ускорение распада может быть обеспечено при помощи различных механизмов в зависимости от выбора гидрофильного компонента. Например, разрыхлитель, такой как, например, кросповидон, кроскармеллоза, низкозамещенная гипромеллоза или даже ионообменные смолы, может обеспечивать быстрый захват воды, увеличение объема и тем самым вызывает разрушение покрытия. С другой стороны, ненабухающие вспомогательные вещества, имеющие высокую растворимость в воде, такие как сахара или сахарные спирты, могут действовать, главным образом, как порообразующие агенты, в результате указанного действия быстро создаются каналы, в которые поступает вода, что также способствует распадению. Необязательно гидрофильный компонент содержит смесь гидрофильных соединений. Предпочтительно гидрофильный компонент отличается от набухающего в воде или водорастворимого полимерного компонента и не имеет мукоадгезивность, либо имеет низкую мукоадгезивность.
Если покрытие содержит только гидрофильный компонент, но не липидный компонент, то гидрофильный компонент предпочтительно представляет собой пленкообразующий агент, такой как водорастворимый полимер. Примеры возможных подходящих пленкообразующих полимеров включают метилцеллюлозу, гипролозу, гипромеллозу, поливиниловый спирт, повидон, поливинилацетат, (мет)акрилатный сополимер и т.д. Необязательно композиция может содержать дополнительные ингредиенты, такие как один или более пластификаторов, агентов, модифицирующих рН, порообразующих агентов, красителей, подсластителей, вкусоароматических добавок, агентов, препятствующих слеживанию, или диспергирующих добавок.
В указанной группе вариантов реализации, где частица согласно настоящему изобретению содержит активное ядро, содержащее первый липидный компонент, внутри которого заключен или которым покрыт набухающий в воде или водорастворимый полимерный компонент, окруженное покрытием, активное ядро предпочтительно должно составлять по меньшей мере 50% по массе от общей массы частицы. Необязательно масса активного ядра составляет по меньшей мере примерно 60% или даже по меньшей мере примерно 70% от общей массы частицы.
В родственном варианте реализации частица согласно настоящему изобретению содержит инертное ядро, первое покрытие, нанесенное на инертное ядро, и второе покрытие, нанесенное на первое покрытие. В указанном случае первое покрытие содержит набухающий в воде или водорастворимый полимерный компонент и первый липидный компонент, второе покрытие содержит второй липидный компонент и необязательно гидрофильный компонент, и второе покрытие также по существу не содержит набухающий в воде или водорастворимый полимерный компонент. Гидрофильный компонент может быть выбран, как описано выше. Как и в обсуждаемом ранее варианте реализации первый липидный компонент, внутри которого заключен или которым покрыт набухающий в воде или водорастворимый полимерный компонент, окружен слоем покрытия, содержащим второй липидный компонент. Разница заключается в том, что первый липидный компонент и набухающий в воде или водорастворимый полимерный компонент не образуют ядро частицы, а только слой на поверхности инертного ядра, имеющего другой состав.
Инертное ядро может состоять из фармакологически инертного материала, такого как сахароза, крахмал или микрокристаллическая целлюлоза. Конкретные примеры подходящих инертных ядер включают сферические частицы на основе микрокристаллической целлюлозы со средним диаметром порядка 100 или 200 мкм, которые, например, коммерчески доступны как Cellets® 100 или Cellets® 200; мелкозернистые частицы крахмала и сахара схожего диаметра; или кристаллы сахара схожего диаметра, например, получаемые при просеивании.
Для описания композиции и дополнительных необязательных отличительных признаков липидных компонентов, набухающего в воде или водорастворимого полимерного компонента и гидрофильного компонента следует обратиться к приведенному выше обсуждению.
В контексте указанного варианта реализации инертное ядро предпочтительно не должно составлять более чем примерно 70% по массе от общей массы частицы. Более предпочтительно масса ядра составляет не более чем примерно 60% или не более чем примерно 50% от общей массы частицы. В других вариантах реализации масса ядра составляет от примерно 10% до примерно 50% или от примерно 10% до примерно 40% или от примерно 15% до примерно 35% от общей массы частицы.
Как уже обсуждалось, ключевым отличительным признаком настоящего изобретения является то, что набухающий в воде или водорастворимый полимерный компонент заключен внутри или покрыт оболочкой первого липидного компонента, что вероятно влияет на улучшение и/или продление взаимодействия жирной кислоты с мишенью в слизистой желудочно-кишечного тракта. Целевая структура, например, может быть представлена рецепторами, сопряженными с G-белком (GPCR), задействованными при распознавании липидов в кишечнике, такими как GPR120.
В некоторых вариантах реализации указанный факт также может приводить к повышению биодоступности первого липидного компонента. Это также может приводить к повышению биодоступности аминокислоты, витамина и/или питательного микроэлемента, если они присутствуют. В указанном контексте биодоступность следует рассматривать в широком смысле, включая доступность, например, первого липидного компонента или биологически активных ингредиентов первого липидного компонента в целевом биологическом участке, таком как слизистая желудка или кишечника, с точки зрения уровня и/или продолжительности доступности.
Необязательно частица может дополнительно содержать аминокислоты, витамин, питательный микроэлемент или любые их комбинации.
Согласно настоящему описанию аминокислота представляет собой органическое соединение, содержащее аминогруппу и карбоксильную группу, главным образом, имеющее общую структуру NH2-CHR-COOH, где R представляет собой боковую цепь, которая является специфической для каждой аминокислоты. Необязательно карбоксильная группа является частично или полностью нейтрализованной. Аминокислота может быть обеспечена в L-форме, D-форме или в виде рацемата. В предпочтительном варианте реализации аминокислота представляет собой протеиногенную аминокислоту, т.е. аминокислоту, которая может быть предшественником белка и может встраиваться в белок при его трансляции или биосинтезе. Протеиногенные L-аминокислоты, выявленные в настоящее время, представляют собой L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин, L-глутаминовую кислоту, L-глутамин, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин, L-валин, L-селенцистеин, L-пирролизин и N-формил-L-метионин. В другом варианте реализации аминокислота выбрана из группы 20 аминокислот, определяющих генетический код, состоящей из L-аланина, L-аргинина, L-аспарагина, L-аспарагиновой кислоты, L-цистеина, L-глутаминовой кислоты, L-глутамина, глицина, L-гистидина, L-изолейцина, L-лейцина, L-лизина, L-метионина, L-фенилаланина, L-пролина, L-серина, L-треонина, L-триптофана, L-тирозина и L-валина.
В другом предпочтительном варианте реализации аминокислота выбрана из группы так называемых незаменимых аминокислот, состоящей из аминокислот, которые организм человека не может синтезировать, т.е. из L-гистидина, L-изолейцина, L-лейцина, L-лизина, L-метионина, L-фенилаланина, L-треонина, L-триптофана и L-валина.
В дополнительном предпочтительном варианте реализации аминокислота выбрана из группы, состоящей из L-изолейцина, L-валина, L-тирозина, L-метионина, L-лизина, L-аргинина, L-цистеина, L-фенилаланина, L-глутамата, L-глутамина, L-лейцина и L-триптофана. Среди указанных аминокислот особенно предпочтительной является группа, состоящая из L-фенилаланина, L-лейцина, L-глутамина, L-глутамата и L-триптофана. В другом предпочтительном варианте реализации аминокислота представляет собой L-триптофан.
Необязательно частица содержит две или более аминокислот. Указанная смесь или комбинация аминокислот предпочтительно должна содержать по меньшей мере одну аминокислоту, такую как описано выше, т.е. протеиногенную аминокислоту или аминокислоту, выбранную из группы аминокислот, определяющих генетический код, или из незаменимых аминокислот или из группы, аминокислот, состоящей из L-изолейцина, L-валина, L-тирозина, L-метионина, L-лизина, L-аргинина, L-цистеина, L-фенилаланина, L-глутамата, L-глутамина, L-лейцина и L-триптофана. Особенно предпочтительные частицы, включающие смеси или комбинации аминокислот, содержат по меньшей мере одну аминокислоту, выбранную из группы, состоящей из L-фенилаланина, L-лейцина, L-глутамина, L-глутамата и L-триптофана. В частности, L-триптофан является предпочтительным ингредиентом комбинации двух или более аминокислот.
Предпочтительными также являются смеси или комбинации аминокислот, в которых по меньшей мере две аминокислоты являются членами одной из предпочтительных групп, таких как определено ранее. Кроме того, в частицах согласно настоящему изобретению можно применять смеси или комбинации аминокислот, в которых по существу все включенные аминокислоты являются членами одной из предпочтительных групп, таких как определено выше.
При использовании в настоящем описании витамины представляют собой жизненно-важные питательные вещества, требующиеся в небольших количествах, которые, например, человек (или другие организмы), как правило, не может синтезировать в достаточных количествах и которые, таким образом, необходимо принимать с пищей. Термин «витамин» является условным и зависит от конкретного организма; например, аскорбиновая кислота представляет собой витамин для человека, но при этом многие другие животные могут сами синтезировать его. Витамины представляют собой органические соединения, классифицированные на основании биологической и химической активности, но не структуры. Каждый витамин относится к группе витамеров, все из которых имеют биологическую активность конкретного витамина и могут превращаться в активную форму витамина в организме и которые объединены друг с другом в группы, обозначенные при помощи родовых идентификаторов, представляющих собой буквы алфавита, такие как «витамин А». Общеизвестные витамины являются предпочтительными для настоящего изобретения (родственный(-ые) витамер(-ы) указан(-ы) в скобках): витамин А (ретинол, ретиналь и каротиноиды, включая бета-каротин, криптоксантин, лютеин, ликопен, зеаксантин), витамин В1 (тиамин), витамин В2 (рибофлавин), витамин ВЗ (ниацин, ниацинамид), витамин В5 (пантотеновая кислота), витамин В6 (пиридоксин, пиридоксамин, пиридоксаль), витамин В7 (биотин), витамин В8 (эрг-адениловая кислота), витамин В9 (фолиевая кислота, фолиновая кислота), витамин В12 (цианокобаламин, гидроксикобаламин, метилкобаламин), витамин С (аскорбиновая кислота), витамин D (холекальциферол (D3), эргокальциферол (D2)), витамин Е (токоферолы, токотриенолы), витамин K (филлохинон, менахиноны). Витамины согласно настоящему изобретению могут быть обеспечены в качестве полусинтетических добавок и добавок, полученных из синтетических источников, и/или добавок природного происхождения; например, в виде растительных экстрактов.
При использовании в настоящем описании термин «питательные микроэлементы» относится к питательным элементам, требуемым человеку и/или другим организмам в небольших количествах для разнообразных физиологических функций, надлежащего роста и развития; включая, например, пищевые микроминералы или следовые элементы, количество которых в общем случае составляет менее 100 мг/день (в противоположность макроминералам). Микроминералы или следовые элементы включают по меньшей мере бор, кобальт, хром, кальций, медь, фторид, йод, железо, магний, марганец, молибден, селен, цинк. Питательные микроэлементы также включают фитохимические агенты, такие как терпеноиды или полифенольные соединения, а также витамины (т.е. некоторые соединения могут быть отнесены к категориям витаминов и питательных микроэлементов).
Предпочтительные питательные микроэлементы согласно настоящему изобретению могут быть выбраны из органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, яблочная кислота, холин и таурин; и следовых минералов, таких как соли бора, кобальта, хрома, кальция, меди, фторида, йода, железа, магния, марганца, молибдена, селена, цинка, натрия, калия, фосфора или хлорида; и холестерина.
Необязательные компоненты, т.е. аминокислоту, витамин и/или питательный микроэлемент, можно включать в состав частиц согласно настоящему изобретению при помощи различных способов. Например, гидрофильные соединения, такие как аминокислоты, водорастворимые витамины и водорастворимые питательные микроэлементы, можно вводить в виде смеси с водорастворимым или набухающим в воде полимером, при этом липофильные соединения можно вводить в виде смеси с первым и/или вторым липидным компонентом.
Для дополнительного усиления благоприятного действия частицы массовое отношение первого липидного компонента к набухающему в воде или водорастворимому полимерному компоненту предпочтительно должно находиться в диапазоне от примерно 0,1 до примерно 10. В некоторых вариантах реализации массовое отношение составляет от примерно 0,1 до примерно 5, от примерно 0,1 до примерно 3, от примерно 0,1 до примерно 2 или от примерно 0,1 до примерно 1. В дополнительных вариантах реализации указанное массовое отношение составляет от примерно 0,2 до примерно 1,5, от примерно 0,25 до примерно 1,2, от примерно 0,25 до примерно 1,0, например, примерно 0,3, примерно 0,5, примерно 0,75 или примерно 1, соответственно. Особенно предпочтительно массовое отношение составляет от примерно 0,5 до примерно 5 или от примерно 0,75 до примерно 4 или от примерно 1 до примерно 3, соответственно.
Авторы настоящего изобретения обнаружили, что действие свободных или этерифицированных жирных кислот, вызывающее чувство сытости, усиливается в случае доставки в виде частицы согласно настоящему изобретению и позволяет подавлять аппетит и обеспечивает способ предотвращения и/или лечения ожирения даже без фармакологического вмешательства с применением синтетического лекарственного средства. Таким образом, в предпочтительном варианте реализации указанная частица также не содержит синтетическое лекарственное вещество. Другими словами, частица может по существу состоять из набухающего в воде или водорастворимого полимерного компонента и первого липидного компонента и необязательно из второго липидного компонента, аминокислоты, витамина и/или питательного микроэлемента и необязательно из одного или более фармакологически инертных вспомогательных веществ, таких как гидрофильный компонент или инертный материал ядра.
Частица согласно настоящему изобретению может иметь форму гранулы, пеллеты или мини-таблетки. Более предпочтительно частица представляет собой гранулу и/или пеллету.
При использовании в настоящем описании гранула относится к агломерированной частице, полученной из совокупности более мелких основных частиц. Агломерация или гранулирование для получения гранулы может включать применение техник сухого, влажного гранулирования или гранулирования из расплава.
Пеллету при использовании в настоящем описании определяют как частицу, имеющую относительно сферическую или сфероидальную форму. При получении при помощи способа агломерации драже является частным типом гранулы. Тем не менее, пеллеты (т.е. сферические или сфероидальные частицы) также можно получать при помощи способов, отличных от агломерации. Во избежание неясности степень сферичности пеллеты может быть различной согласно различным техническим аспектам. В контексте настоящего изобретения сферичность драже находится в типовом диапазоне для пеллет, применяемых в фармацевтических составах для перорального применения.
Мини-таблетка, которую также часто называют микро-таблеткой, представляет собой стандартную форму, полученную путем прессования или сжатия порошка или гранул. Как правило, прессование проводят при помощи таблеточных прессов с использованием пуансонов.
Мини-таблетки, таблетки или капсулы, содержащие частицы согласно настоящему изобретению, предпочтительно получают и обрабатывают таким образом, чтобы они быстро распадались после перорального введения. При использовании в настоящем описании распад определяют как существенное физическое изменение морфологии мини-таблетки, таблетки или капсулы, такое как разрушение или отделение покрытия таблетки, растворение капсулы или распад таблетки или мини-таблетки для высвобождения частиц или пеллет или гранул согласно настоящему изобретению. Для определения характеристик распада указанной таблетки, мини-таблетки или капсулы можно использовать микроскоп. Что касается устройства, гидродинамических условий и температуры, то можно использовать способ <701>, описанный в Фармакопее США 29 (USP29), с тем исключением, что в качестве среды для исследования можно применять воду, и можно регулировать размер ячеек или отверстий проволочного сита с учетом ситового диаметра таблетки, мини-таблетки или капсулы. При исследовании согласно указанному способу мини-таблетки или таблетки или капсулы, содержащие частицы согласно настоящему изобретению, предпочтительно распадаются в течение не более чем примерно 15 минут. Более предпочтительно они распадаются в течение примерно 10 минут или менее. Согласно другому варианту реализации они распадаются в течение примерно 8 минут или менее или в течение примерно 5 минут или менее, соответственно.
Частицы согласно настоящему изобретению можно получать при помощи способа, включающего стадию обработки смеси, содержащей первый липидный компонент, набухающий в воде или водорастворимый полимерный компонент и необязательно аминокислоту, витамин и/или питательный микроэлемент, путем (a) экструзии смеси с применением шнекового экструдера; (b) кристаллизации распылением смеси необязательно с применением техники разрушения струи; (с) гранулирования из расплава смеси; (d) прессования смеси в мини-таблетки; (е) впрыскивания расплава смеси в жидкую среду; или (f) нанесения покрытия из указанной смеси на инертные ядра методом распыления.
Смесь, содержащую первый липидный компонент, набухающий в воде или водорастворимый полимерный компонент и необязательно аминокислоту, витамин и/или питательный микроэлемент, можно получать при помощи традиционных средств, таких как смешение или перемешивание с высоким сдвиговым усилием. Необязательно смесь получают при помощи того же оборудования, которое также применяют для последующей стадии, на которой получают частицы. Например, для получения расплава, применяемого затем для кристаллизации распылением, гранулирования из расплава или впрыскивания расплава, получение сухой предварительной смеси перед плавлением компонентов расплава может не требоваться, но вместо этого смешение и плавление можно осуществлять одновременно на одной стадии. Таким образом, смесь, которую обрабатывают согласно описанным выше стадиям (a)-(f), следует рассматривать в широком смысле как включающую любую форму объединения материалов, требуемых для получения частиц.
В одном из вариантов реализации смесь экструдируют с применением шнекового экструдера. Необязательно для проведения стадии экструзии применяют двухшнековый экструдер. Экструдер должен иметь сито с размером отверстий, подходящим для получения экструдата соответствующего диаметра, например, 0,5 мм или 1,0 мм. Скорость шнеков можно выбирать с учетом емкости экструдера и технологических характеристик смеси. Например, можно выбирать скорость шнеков в диапазоне от примерно 20 до примерно 100 об/мин.
Предпочтительно стадию экструзии проводят без использования растворителя и при относительно низкой температуре, например, ниже чем примерно 35°С или ниже чем примерно 30°С, например, при комнатной температуре. Также стадию экструзии предпочтительно проводят при температуре ниже нижнего предела диапазона температуры плавления компонента смеси, имеющего самую низкую температуру плавления.
Предпочтительно ингредиенты, применяемые для получения частиц путем экструзии, смешивают или перемешивают перед подачей в экструдер.
Как отмечалось выше, ингредиенты также можно смешивать с применением того же оборудования, которое используют на стадии экструзии. Таким образом, предпочтительно ингредиенты, применяемые для получения экструдированных частиц, обеспечивают в экструдере путем совместного введения с применением соответствующего подающего оборудования и необязательно повторно используют в экструдере (например, посредством внутренних обходных петель) до получения однородной смеси, которая подготовлена для последующей экструзии.
После стадии экструзии экструдату можно придавать сферическую форму для получения практически сферических частиц. Для указанной задачи можно применять любой традиционный сферонизатор. Предпочтительно следует устанавливать температуру рубашки сферонизатора ниже нижнего предела диапазона температуры плавления компонента смеси, имеющего самую низкую температуру плавления. Скорость пластин для сферонизации можно устанавливать в диапазоне от примерно 200 до примерно 2000 об/мин, например, от примерно 500 до примерно 1500 об/мин. Затем можно проводить просеивание для отбора частиц продукта с оптимальным размером.
В конкретном варианте реализации частицы получают из смеси путем отверждения указанной смеси распылением. Указанный способ также можно называть охлаждением распылением или распылительным охлаждением. В указанном способе жидкий расплав распыляют в виде спрея из мелкодисперсных капель примерно сферической формы внутри камеры для охлаждения распылением. В указанной камере происходит взаимодействие капель с потоком воздуха или газа, который является достаточно холодным для отверждения капель. Поток воздуха или газа может иметь направление, совпадающее, частично совпадающее или противоположное направлению потока.
Для более эффективного образования капель соответствующего размера и формы можно применять нагреваемую вращающуюся форсунку распылителя или фонтанную форсунку. В контексте настоящего изобретения высокоскоростная вращающаяся форсунка является одним из предпочтительных типов форсунок для получения частиц.
Необязательно однородность распыляемых капель может быть дополнительно увеличена за счет применения техники разрушения струи, такой как получение капель электростатическим способом, разрезание струи, возбуждение струи или фокусировка потока. В общем случае разрушение струи относится к нарушению струи жидкости/газа под влиянием сил, воздействующих на струю.
При получении капель электростатическим способом применяют форсунку, оборудованную электродом, при помощи которого подают электрический заряд на распыляемый расплав. При разрезании струи распыляемый поток направляют через режущее устройство, схожее, например, с вращающимся диском, имеющим отверстия определенного размера. Возбуждение струи обозначает возбуждение распыляемого расплава ультразвуковыми волнами, которое приводит к вибрации и способствует разделению капель.
Фокусировку потока обеспечивают путем приложения объединенных гидродинамических сил со специфической геометрией, которое можно осуществлять с применением камеры, стойкой к давлению, в которой нагнетают давление путем непрерывной фокусировки источника текучей среды. Внутри камеры сфокусированный поток текучей среды впрыскивают через капиллярную подающую трубку, один из концов которой расположен напротив небольшого отверстия, соединяющего камеру с внешней окружающей средой. Сфокусированный поток текучей среды выдавливает мениск текучей среды в заостренный наконечник с образованием микроструи, выходящей из камеры через отверстие. Нестабильность капилляра приводит к разрушению стационарной струи на гомогенные капли.
В другом конкретном варианте реализации частицы получают путем впрыскивания расплавленной смеси в жидкость. Жидкость можно охлаждать до температуры ниже комнатной температуры или предпочтительно значительно ниже нижнего предела диапазона температуры плавления ингредиента липидного компонента, имеющего самую низкую температуру плавления. Жидкость следует выбирать с учетом состава данной смеси, но также следует обращать внимание на безопасность и физиологическую переносимость. Во многих случаях подходящей жидкостью является этанол.
В другом варианте реализации частицы можно получать путем агломерации расплава или гранулирования расплава. В контексте настоящего изобретения агломерацию и гранулирование можно использовать взаимозаменяемо. Для указанной задачи компоненты смеси перемешивают или смешивают и агломерируют или гранулируют в оборудовании подходящего типа, таком как нагреваемый гранулятор, смеситель с высоким сдвиговым усилием/гранулятор или гранулятор с псевдоожиженным слоем. В зависимости от типа оборудования гранулирование можно проводить путем нагревания смеси до температуры, при которой по меньшей мере один из ее компонентов размягчается или плавится, при непрерывном перемешивании или смешении. В традиционном грануляторе это может приводить к образованию более крупных агломератов, которые затем пропускают через сито для получения частиц желаемого размера. При использовании оборудования с псевдоожиженным слоем смесь полностью можно переводить в текучее состояние и осторожно нагревать до температуры плавления ингредиента, имеющего самую низкую температуру плавления. В качестве альтернативы ингредиент, самые низкие температуры плавления, можно расплавлять и распылять на псевдоожиженную порошковую смесь, содержащую оставшиеся ингредиенты.
Необязательно расплавленные гранулы можно дополнительно обрабатывать и прессовать в мини-таблетки. Для указанной задачи гранулы предпочтительно сначала смешивают с одним или более наполнителями/связывающими веществами таблеток для увеличения пластичности смеси. Кроме того, перед прессованием также можно добавлять традиционные вспомогательные вещества для улучшения текучести гранул и снижения их слипания. Таблетирование можно проводить с использованием любого традиционного пресса для получения фармацевтических таблеток, такого как эксцентриковый пресс или вращающийся пресс. Необязательно пресс может быть оборудован инструментом с несколькими пуансонами, таким образом, при каждой операции прессования получают совокупность мини-таблеток. Предпочтительными являются пуансоны с очень низким диаметром таблеток, например, от примерно 1 мм до примерно 3 мм, например, примерно 1,5 мм.
В дополнительном варианте реализации частицы получают путем нанесения распылением покрытия смеси, содержащей первый липидный компонент и набухающий в воде или водорастворимый полимерный компонент, на инертные ядра. При использовании в настоящем описании инертное ядро представляет собой частицу, полученную из физиологически приемлемого материала, который подходит для нанесения покрытия и сам по себе по существу не вносит вклад в физиологическое действие частиц согласно настоящему изобретению, т.е. не вызывает чувство сытости. Примеры подходящих ядер включают кристаллы соответствующего размера и формы, такие как кристаллы сахара (сахарозы). В одном из предпочтительных вариантов реализации на сферические зерна или мелкозернистые частицы, полученные из сахара, крахмала, целлюлозы, в частности из микрокристаллической целлюлозы (например, Cellets®), наносят распылением покрытие, включающее смесь.
Нанесение распылением покрытий на инертные ядра можно проводить, например, в устройстве с псевдоожиженным слоем. Смесь первого липидного компонента и набухающего в воде или водорастворимого полимерного компонента можно расплавлять и распылять на псевдоожиженные частицы ядра. Необязательно в указанную смесь также можно добавлять аминокислоту, витамин и/или питательный микроэлемент, если их используют. В качестве альтернативы водную или органическую дисперсию (или суспензию, которую определяют как подтип дисперсии) смеси распыляют на псевдоожиженные ядра таким образом, чтобы при испарении воды или растворителя происходило образование покрытия из смеси первого липидного компонента и набухающего в воде или водорастворимого полимерного компонента и необязательно аминокислоты, витамина и/или питательного микроэлемента на частицах инертных ядер.
Как и в случае всех других способов, указанных выше, можно применять последующую стадию разделения полученных частиц с использованием сита для достижения однородного распределения частиц по размерам.
Для получения частиц согласно настоящему изобретению, которые содержат дополнительное покрытие (или второе покрытие, нанесенное на первое покрытие), содержащее второй липидный компонент и/или гидрофильный компонент, но не набухающий в воде или водорастворимый полимерный компонент, указанное второе покрытие также можно наносить при помощи традиционных фармацевтических способов нанесения покрытия распылением. В одном из предпочтительных вариантов реализации для указанной задачи применяют нанесение покрытия в псевдоожиженном слое, где используют псевдоожиженные частицы согласно настоящему изобретению, полученные согласно приведенному выше описанию, в качестве активных ядер, на которые распыляют расплав или дисперсию/суспензию второго липидного компонента или раствор или дисперсию/суспензию гидрофильного компонента. При использовании одновременно второго липидного компонента и гидрофильного компонента их можно наносить совместно в виде дисперсии/суспензии в воде или растворителе или в виде расплава липида, в котором диспергирован гидрофильный компонент.
Согласно дополнительному аспекту настоящего изобретения предложена съедобная частица, которую можно получать при помощи способа, такого как описано выше.
Согласно дополнительному аспекту в изобретении предложена твердая композиция для перорального введения, содержащая совокупность частиц, таких как описано выше, или полученная из совокупности частиц, например, путем прессования частиц в таблетки. Если частицы не прессуют в таблетки, то ими теоретически можно наполнять капсулы, саше, бумажные трубочки или контейнеры (например, бутыли из стекла или других материалов). В одном из предпочтительных вариантов реализации саше, бумажные трубочки или контейнеры наполняют гранулами таким образом, чтобы однократная доза содержалась в одной первичной упаковке. Необязательно композиция может содержать частицы совместно с одним или более дополнительными неактивными ингредиентами.
Если частицы, как таковые, предназначены для проглатывания, то они предпочтительно имеют среднемассовый ситовый диаметр в диапазоне от примерно 0,1 мм до примерно 3 мм. Значения среднемассового ситового диаметра в диапазоне от примерно 0,5 мм до примерно 3 мм или от примерно 0,75 мм до примерно 2,5 мм или от примерно 1 мм до примерно 2 мм также являются предпочтительными. В других предпочтительных вариантах реализации среднемассовый ситовый диаметр может находиться в диапазоне от примерно 0,1 мм до примерно 0,4 мм, от примерно 0,2 мм до примерно 0,5 мм или от примерно 0,2 мм до примерно 0,4 мм, соответственно.
Обеспечение и пероральное введение частиц в виде саше, бумажных пакетиков или контейнеров также является эффективным по той причине, что введение относительно большого количества композиции в виде однократной дозы является предпочтительным. В одном из предпочтительных вариантов реализации однократная доза содержит по меньшей мере примерно 2 г композиции и более предпочтительно по меньшей мере примерно 3 г композиции. В другом варианте реализации однократная доза содержит от примерно 3 г до примерно 20 г композиции. В дополнительных вариантах реализации количество композиции, содержащейся в однократной дозе, составляет от примерно 4 г до примерно 15 г или от примерно 5 г до примерно 12 г или от примерно 5 г до примерно 10 г, соответственно. Также предпочтительно композиция должна иметь высокое содержание частиц согласно настоящему изобретению, такое как по меньшей мере примерно 50% или по меньшей мере примерно 60% или по меньшей мере примерно 70% или по меньшей мере примерно 80% по массе. Особенно предпочтительно содержание частиц в композиции составляет по меньшей мере примерно 90% или по меньшей мере примерно 95% или по меньшей мере примерно 98%, например, примерно 100% по массе.
Для введения композицию можно суспендировать в жидком или полутвердом носителе. Жидкость может представлять собой даже воду или фруктовый сок или молочный напиток или любую другую съедобную, предпочтительно негазированную, жидкость. Она необязательно может быть обеспечена совместно с композицией в составе одного набора. Контролирование природы и количества жидкости является эффективным и делает введение более воспроизводимым. Готовая к употреблению питьевая суспензия, например, может иметь объем в диапазоне от примерно 30 мл до примерно 300 мл или от примерно 50 мл до примерно 200 мл.
В предпочтительном варианте реализации композицию согласно настоящему изобретению вводят в виде питьевой суспензии. Было обнаружено, что питьевая суспензия согласно настоящему изобретению подходит для введения больших количеств, таких как 1 г или более, композиции при сохранении хороших питейных и вкусовых качеств. Питейность указанной питьевой композиции согласно настоящему изобретению можно оценивать при помощи способов, применяемых для определения текучести влажных гранулированных материалов. В частности, можно проводить динамические измерения угла естественного откоса с использованием устройства с вращающимся барабаном, где барабан в целом или его дно и крышка являются проницаемыми или полупроницаемыми. Указанные устройства коммерчески доступны, например в Mercury Scientific, USA (порошковый анализатор Revolution), и APTIS, Belgium (порошковый реометр GranuDruM). В подходящих экспериментальных установках для динамического измерения угла естественного откоса влажного гранулированного материала, содержащего водную жидкость, барабан предпочтительно изготовлен из ПТФЭ (Teflon®) или содержит покрытие ПТФЭ или схожего антиадгезивного материала и заполнен до половины объема суспензией порошка или частиц. После размещения крышки и дна барабана вдоль горизонтальной оси и повторяющегося постукивания для равномерного распределения содержимого барабана суспензия образует горизонтальный мениск с нулевым углом. Это можно наблюдать визуально и определять при помощи стандартных способов измерения углов. Вращение барабана относительно горизонтальной оси может приводить к смещению мениска порошковой суспензии на определенный угол, после чего мениск суспензии восстанавливает свое положение практически до нулевого угла. Смещение мениска относительно горизонтального уровня можно повторять несколько раз, и можно вычислять среднее значение динамического угла естественного откоса.
Предпочтительно питьевая суспензия содержит совокупность частиц согласно настоящему изобретению и по меньшей мере одну водную жидкость, и суммарный объем частиц и по меньшей мере одной водной жидкости составляет 100 об. %. Соответственно, в настоящем изобретении предложена питьевая суспензия, содержащая от 50 до 75 об. % частиц согласно настоящему изобретению; и от 25 до 50 об. % по меньшей мере одной водной жидкости; где объем фракций указан в пересчете на общий объем питьевой суспензии. Предпочтительно динамический угол естественного откоса питьевой суспензии составляет менее чем примерно 30°.
В дополнительном предпочтительном варианте реализации количества частиц и жидкости выбирают таким образом, чтобы получать плотно упакованную питьевую суспензию за счет выравнивания уровня частиц, которыми наполняют контейнер подходящего размера, и уровня водной жидкости в том же контейнере, содержащем осажденные частицы. Другими словами, количество жидкости выбирают таким образом, чтобы мениск жидкости располагался примерно там же, где и верхняя граница осажденных частиц.
По меньшей мере одна водная жидкость может дополнительно содержать спирт, вкусоароматические добавки, красители, консерванты, вещества, увеличивающие вязкость, медикаментозные добавки или смеси двух или более указанных агентов. Подходящими вкусоароматическими добавками являются лимонная кислота, яблочная кислота, фосфорная кислота, винная кислота, природные и синтетические душистые вещества, подсластители, например, моносахариды, дисахариды, многоатомные спирты; включая арабит, эритрит, глицерин, изомальт, лактит, мальтит, маннит, сорбит или ксилит; или заменители сахара, включая цикламат, сахарин, стевию, сукралозу и/или аспартам. Дополнительными подходящими вкусоароматическими добавками являются фруктовые и/или овощные соки. Красителями, подходящими для применения в составе водной жидкости, являются, например, очаровательный красный АС, антоцианин, азорубин, бетанин, бриллиантовый синий FCF, каротин, хинолиновый желтый WS, понсо 4R, зеленый S, патентованный синий V и тартразин, как таковые или в виде соответствующих алюминиевых лаков. Подходящими консервантами являются витамины А, Е или С, ретинилпальмитат, цистеин, метионин, лимонная кислота, цитрат натрия, применяемые в количествах от 0,001 до 0,1% по массе в пересчете на массу жидкости.
Количество первого липидного компонента, который является ключевым ингредиентом композиции, предпочтительно должно составлять по меньшей мере примерно 1 г на однократную дозу или на упаковку. В другом варианте реализации однократная доза содержит по меньшей мере примерно 2 г первого липидного компонента, например, примерно 3 г или примерно 4 г. В дополнительном предпочтительном варианте реализации содержание первого липидного компонента в однократной дозе составляет по меньшей мере примерно 5 г.
Количество аминокислоты (или общее количество аминокислот, если применяют смесь или комбинацию аминокислот) может составлять примерно 0,05 г или более на однократную дозу или на упаковку. В другом варианте реализации однократная доза содержит по меньшей мере примерно 0,1 г или по меньшей мере примерно 0,2 г или по меньшей мере примерно 0,5 г аминокислоты(-от), соответственно. В дополнительных вариантах реализации содержание аминокислоты(-от) в однократной дозе составляет от 0,5 г до примерно 5 г или от примерно 0,5 г до примерно 3 г.
В одном из вариантов реализации компоненты частиц выбирают таким образом, чтобы динамический угол естественного откоса суспензии, полученной путем суспендирования композиции в воде в массовом отношении 1, составлял менее 30°.
Как уже отмечалось, частицы и композиции согласно настоящему изобретению можно применять для подавления аппетита, в частности у субъекта-человека, и для обеспечения чувства сытости.
Не желая быть связанными конкретной теорией, авторы настоящего изобретения полагают, что действие в отношении подавления аппетита по меньшей мере отчасти определяется жирной кислотой, содержащейся в первом липидном компоненте, которая при приеме внутрь взаимодействует с физиологическими мишенями, расположенными в слизистой желудочно-кишечного тракта, например, желудка и/или двенадцатиперстной кишки, и тем самым активирует один или более сигнальных каскадов, которые в конечном итоге вызывают ощущение сытости или снижение аппетита или голода. Вероятно, что одной из мишеней, на которые воздействует жирная кислота, являются грелиновые клетки (или грелиновые рецепторы), которые в большом количестве присутствуют в желудке и двенадцатиперстной кишке.
Аминокислота, если присутствует, также может вносить вклад в действие в отношении подавления аппетита, которое может быть вызвано стимуляцией хемосенсоров в проксимальном отделе желудочно-кишечного тракта, что в свою очередь запускает секрецию CCK и глюкагона.
Авторы настоящего изобретения обнаружили, что набухающий в воде или водорастворимый полимерный компонент усиливает действие жирной кислоты вероятно за счет свойств набухания и/или мукоадгезивности, которые влияют на продление прикрепления частиц (или их компонентов) к слизистой оболочке желудка или двенадцатиперстной кишки и обеспечивают усиление взаимодействия жирной кислоты и целевой структуры. Безусловно, и другие свойства частиц также могут влиять или вносить вклад в продление времени удерживания в желудке, например, выбранный размер частиц или низкая плотность, обусловленная высоким содержанием липида. В любом случае, авторы настоящего изобретения обнаружили, что пероральное введение частиц добровольцам вызывало чувство сытости и впоследствии субъекты отмечали понижение аппетита и меньше питались после введения композиции, содержащей частицы, такие как описано в настоящей заявке. Указанный эффект согласовывался с данными, полученными у животных, в которых было показано, что применение композиции приводит к потере массы тела или к снижению массы тела у исследуемых животных.
Частицы и/или композиции согласно настоящему изобретению, таким образом, можно применять для клинических задач или в качестве пищевых добавок для предотвращения и/или лечения ожирения и избыточного веса, а также для предотвращения и/или лечения заболеваний или состояний, связанных с ожирением; например, за счет употребления внутрь частиц, таких как определено в настоящем описании, и/или композиций, содержащих или полученных из совокупности указанных частиц, для снижения массы тела.
Другими словами, согласно одному из аспектов настоящего изобретения предложен способ предотвращения и/или лечения ожирения и избыточного веса, а также предотвращения и/или лечения заболеваний или состояний, связанных с ожирением, для подавления аппетита, снижения массы тела и/или обеспечения чувства сытости, включающий стадию перорального введения частиц согласно настоящему изобретению и/или композиций, содержащих или полученных из совокупности указанных частиц. Необязательно указанный способ включает пероральное введение частиц и/или композиций по меньшей мере один раз в день в течение по меньшей мере одной недели.
Другими словами, согласно одному из аспектов настоящего изобретения предложено применение частиц согласно настоящему изобретению и/или композиций, содержащих или полученных из совокупности указанных частиц, для получения лекарственных средств для предотвращения и/или лечения ожирения и избыточного веса, а также для предотвращения и/или лечения заболеваний или состояний, связанных с ожирением, для подавления аппетита, снижения массы тела и/или обеспечения чувства сытости. Необязательно указанное применение включает пероральное введение частиц и/или композиций по меньшей мере один раз в день в течение по меньшей мере одной недели.
При использовании в настоящем описании ожирение представляет собой медицинское состояние, при котором избыточный жир накопился в организме в такой степени, что может оказывать нежелательное действие на здоровье. Под избыточным весом понимают пограничное состояние, характеризующееся индексом массы тела (ИМТ) от 25 до 30. Если ИМТ составляет более 30, то состояние классифицируют как ожирение.
В одном из вариантов реализации частицы и/или композиции вводят субъектом с нормальным весом или избыточным весом, набирающих вес со временем или подверженных иным образом риску развития ожирения. В указанном случае терапевтической задачей является прекращение или ограничение набора веса и предотвращение развития ожирения. Другой задачей может являться снижение риска развития у субъекта заболевания или состояния, связанного с ожирением или вызванного им.
В дополнительном варианте реализации частицы и/или композиции вводят пациентам с ожирением для лечения или снижения тяжести ожирения. И снова терапевтическое применение может быть направлено на снижение риска развития заболевания или состояния, связанного с ожирением или вызванного им.
В настоящее время большое число заболеваний и состояний рассматривают как связанные с ожирением или вызванные им, даже если механизм, посредством которого они связаны с ожирением, не во всех случаях выявлен до конца. В частности, указанные заболевания и состояния включают без ограничений сахарный диабет 2 типа, артериальную гипертензию, метаболический синдром, инсулинорезистентность, гиперхолестеринемию, гипертриглицеридемию, остеоартрит, обструктивное апноэ сна, ишемическую болезнь сердца, инфаркт миокарда, застойную сердечную недостаточность, инсульт, подагру и поясничную боль. Предотвращение и/или снижение риска развития любого из указанных состояний включено в объем терапевтического применения согласно настоящему изобретению.
Кроме того, терапевтическое применение предпочтительно включает пероральное введение по меньшей мере один раз в день частиц и/или композиций согласно настоящему изобретению в течение по меньшей мере одной недели. Следует понимать, что в указанном контексте выражение «терапевтическое применение» также включает превентивное или профилактическое применение. В дополнительном предпочтительном варианте реализации частицы и/или композиции вводят субъекту-человеку в течение по меньшей мере примерно 2 недель или по меньшей мере примерно 4 недель или по меньшей мере примерно 6 недель или по меньшей мере примерно 2 месяцев, соответственно. Режим введения, включающий введение один или два раза в день, также является предпочтительным.
Время введения следует выбирать таким образом, чтобы максимизировать чувство сытости, и снизить количество пищи, потребляемой субъектом, который подвергается лечению, после введения частиц и/или композиций согласно настоящему изобретению. Например, дозу композиции можно эффективно вводить перед основным приемом пищи, например, перед обедом и/или перед ужином для снижения количества пищи, употребляемой в течение любого из указанных приемов пищи. Что касается точного определения времени, то введение дозы за 5-120 минут перед соответствующим приемом пищи, в частности от примерно 10 до примерно 120 минут перед приемом пищи или от примерно 15 до примерно 90 минут перед приемом пищи, например, от примерно 30 до примерно 60 минут перед приемом пищи, является предпочтительным.
В одном из особенно предпочтительных вариантов реализации дозу, содержащую по меньшей мере примерно 5 г первого липидного компонента, вводят субъекту-человеку по меньшей мере один раз в день от примерно 15 до примерно 90 минут перед приемом пищи в течение по меньшей мере 4 недель для предотвращения и/или лечения ожирения или связанного с ним заболевания.
Также подразумевается, что частицы и/или композиции согласно настоящему изобретению применяют в комбинации с применением устройства для сбора, хранения и/или отображения информации, связанной с соблюдением субъектом схемы терапии и/или эффективностью терапии. При использовании в настоящем описании информация, связанная с соблюдением субъектом схемы терапии, может включать, например, информацию о введении дозы в течение определенного периода времени (например, в течение календарного дня) или о времени введения каждой дозы. Устройство предпочтительно представлять собой программируемое электронное устройство, такое как компьютер, в частности микрокомпьютер, и наиболее предпочтительно портативный микрокомпьютер, такой как мобильный телефон («смартфон»), или носимое устройство, такое как «умные» часы, электронный напульсник и т.д. Информация может поступать в устройство автоматически при помощи датчика, или пользователь, такой как субъект или пациент, лечащий врач, медсестра или лицо, осуществляющее уход, может вводить ее вручную и сохранять для последующего анализа или отображения. Например, пациент может периодически отслеживать фактическое соблюдение или приверженность к схеме терапии.
Устройство может быть запрограммировано для обеспечения сигнала обратной связи или напоминания для пользователя в случае несоблюдения или недостаточной приверженности к терапии. Сигнал обратной связи может быть оптическим, осязаемым (например, вибрация) или акустическим.
Информация, связанная с эффективностью терапии, может включать, например, массу субъекта, уровень голода или аппетита, количество основных приемов пищи и перекусов или тип или количество пищи, съедаемой в любой конкретный период времени (например, за календарный день), или даже физиологические данные, такие как концентрация глюкозы в крови или кровяное давление. В зависимости от типа информация, связанная с эффективностью терапии, может быть автоматически внесена на устройство или введена вручную пользователем. Информация, связанная с ощущением сытости или голода, может быть эффективно введена пользователем или пациентом вручную, при этом физиологические параметры, такие как уровень глюкозы в крови или кровяное давление, можно получать при помощи соответствующих измерительных устройств, применяемых для определения указанных параметров. В последнем случае перенос данных, кодирующих информацию, получаемых при помощи измерительного устройства, на устройство для хранения и/или отображения информации предпочтительно осуществляют на основе беспроводных технологий.
Более подробно, сбор информации может быть инициирован пользователем, или устройство может быть запрограммировано при помощи приложения (т.е. программного обеспечения), которое создает напоминание для пользователя о необходимости ввода информации о чувстве сытости. Предпочтительно сбор информации происходит с регулярными временными интервалами, такими как 15- или 30-минутные интервалы. В одном из вариантов реализации сбор информации проводят в течение 12, 16 или 18 часов в день. В другом варианте реализации сбор информации проводят в течение нескольких периодов, например, от 1 до 3 часов в течение дня, например, три раза по 3 часа. Предпочтительно указанные периоды времени включают время приема пищи, такие как завтрак, обед и ужин. Предпочтительно пользователи в данный период сбора информации могут не обращаться к полученным ранее рейтингам чувства сытости при получении информации в реальном времени.
Сбор информации можно проводить следующим образом. Пользователь открывает приложение программного обеспечения, после чего на цветном сенсорном дисплее появляется изображение, включающее информацию о чувстве сытости, полученное при помощи визуальных аналоговых шкал для оценки сытости. Указанные шкалы и индексы были подробно описаны ранее (Flint A, Raben A, Blundell JE, Astrup A. Reproducibility, power and validity of visual analogue scales in assessment of appetite sensations in single test meal studies. Int J Obes Relat Metab Disord 2000; 24:38-48). Вкратце, визуальная аналоговая шкала (ВАШ) состоит из горизонтальной неструктурированной 10 см линии, у каждого конца которой представлены слова, описывающие крайние степени («совсем нет» или «в высшей степени») вариантов ответа на вопрос «Насколько вы сыты прямо сейчас?» по «однополярной» шкале. Для подтверждения надежных и достоверных результатов участники оценивают свое чувство сытости настолько точно, насколько это возможно, и они не могут обращаться к созданным ранее рейтингам при заполнении ВАШ.
На экране с информацией о чувстве сытости может быть изображен вопрос 1 «насколько вы голодны?» совместно с неструктурированной шкалой с ползунком, с одного конца которой указан вариант «я совсем не голоден», а с другого конца указан вариант «очень голоден». Приложение ждет, когда пользователь коснется шкалы с ползунком в каком-либо одном положении. После прикосновения к шкале может появляться ползунок, и пользователь может регулировать его положение. Приложение определяет положение ползунка после того, как пользователь удаляет палец от символа ползунка, получает данные о позиционировании ползунка и использует их для дополнительной обработки.
Дополнительные потенциально эффективные варианты реализации могут быть легко получены на основании предложенного выше описания и последующих примеров.
ПРИМЕРЫ
Пример 1: Получение частиц путем кристаллизации распылением
Частицы, в которых набухающий в воде или водорастворимый полимерный компонент заключен внутри липидного компонента, можно получать путем кристаллизации распылением при помощи следующего способа. Плавили 250 г каприновой кислоты. В расплав добавляли 100,0 г гомополимерного карбомера типа A NF и 50,0 г капрата натрия и смешивали для получения вязкой суспензии. При непрерывном нагревании суспензию подавали в нагретую вращающуюся форсунку колонны для кристаллизации распылением. В колонну непрерывно вводили холодный воздух, что обеспечивало отверждение получаемых капель. Затем твердые частицы пропускали через соответствующие сита для удаления частиц с избыточным и недостаточным размером и получения частиц согласно настоящему изобретению. Необязательно продукт можно дополнительно обрабатывать, например, путем нанесения покрытия на частицы.
Пример 2: Получение частиц путем кристаллизации распылением
Аналогично можно получать частицы из поликарбофила и смеси жирных кислот. Например, плавили 240,0 г лауриновой кислоты и 60,0 г каприновой кислоты и вводили в расплав 100,0 г поликарбофила (USP) с получением вязкой суспензии липида. При непрерывном нагревании суспензию подавали в нагретую вращающуюся форсунку колонны для кристаллизации распылением. Снова в колонну непрерывно вводили холодный воздух, что обеспечивало отверждение получаемых капель. Затем твердые частицы пропускали через соответствующие сита для удаления частиц с избыточным и недостаточным размером и получения частиц согласно настоящему изобретению.
Пример 3: Получение частиц путем кристаллизации распылением с использованием техник разрушения струи
В качестве одного из вариантов реализации примера 1 можно применять колонну для кристаллизации распылением, оборудованную средствами для распыления с разрушением струи и получения монодисперсных частиц соответствующего размера, например, для получения капель электростатическим способом, разрезания струи, возбуждения струи или фокусировки потока.
Смешивали и плавили 200,0 г твердого жира EP/NF (например, Suppocire® А) и 400,0 г миристата натрия. В расплав добавляли 100,0 г гомополимерного карбомера типа В NF и перемешивали для получения вязкой суспензии. При непрерывном нагревании суспензию подавали в форсунку колонны для кристаллизации распылением, оборудованной средствами для возбуждения струи. Устанавливали параметры вибрационного возбуждения для обеспечения частиц с размером порядка 200 мкм. В колонну непрерывно подавали холодный воздух для отверждения получаемых капель. В качестве конечного продукта собирали однородные отвержденные частицы.
Пример 4: Получение частиц путем впрыскивания расплава
Смешивали и плавили 150,0 г смеси твердого жира EP/NF и глицерилмоноолеата (тип 40) EP/NF (например, Ovicure® WL 2944) и 200,0 г лаурата натрия. В расплав добавляли 90,0 г интерполимерного карбомера типа A NF и перемешивали для получения вязкой суспензии. При непрерывном нагревании суспензию подавали в форсунку элементарного микроструйного устройства, при прохождении через которое образовывались капли, которые впрыскивали в охлажденный абсолютный этанол для получения частиц с размером порядка 250 мкм. Собирали отвержденные частицы и тщательно сушили для получения конечного продукта.
Пример 5: Получение частиц путем холодной экструзии без использования растворителя
Однородную смесь 250,0 г отвержденного пальмового масла, 50,0 г олеата натрия и 110,0 г карбомера 941 NF получали с использованием V-образного смесителя. Смесь подавали при помощи гравиметрического устройства подачи порошков типа KT20 (K-Tron) в отверстие для ввода порошка двухшнекового экструдера Leistritz NANO 16® и экструдировали в первых сегментах экструдера при температуре в диапазоне от 25°С до 30°С. Конечный сегмент охлаждали до 20°С. При помощи указанного способа получали короткие стержни с длиной примерно 0,8-1,5 мм. Затем стержням придавали сферическую форму на оборудовании Caleva® MBS 120, где устанавливали температуру водной рубашки на 30-35°С, конечный продукт получали в виде по существу сферических частиц.
Пример 6: Нанесение покрытия кристаллов сахара путем гранулирования расплава
Получали предварительную смесь 200,0 г миристиновой кислоты, 75,0 г олеата натрия, 100,0 г карбомера 941 NF и 250,0 г кристаллов сахарозы (средний размер частиц 200-250 мкм). Предварительную смесь вводили в планетарный смеситель, оборудованный нагревательной рубашкой. При непрерывной эксплуатации смесителя температуру медленно повышали до полного расплавления фазы липида. Снова при непрерывной эксплуатации смесителя понижали температуру до комнатной. Полученную отвержденную массу пропускали через сито для разрушения или удаления частиц с избыточным размером с получением конечного продукта.
Пример 7: Нанесение покрытия органического раствора липидов на мелкозернистые частицы
Получали предварительную смесь 200,0 г миристиновой кислоты, 75,0 г олеата натрия и 100,0 г карбомера 941 NF и диспергировали в абсолютном этаноле. Вводили 275,0 г сахарных сфер EP/NF (мелкозернистые частицы) во взрывоупорном оборудовании с псевдоожиженным слоем, содержащем колонну Вюрстера, предварительно нагретом до 50-55°С. Затем медленно распыляли дисперсию на предварительно нагретые сахарные сферы, оставляли для выпаривания этанола, учитывая критические пределы взрываемости смесей воздух-этанол. После завершения сахарные сферы с покрытием охлаждали до комнатной температуры и продували холодным воздухом до тех пор, пока количество остаточных растворителей не попадало в пределы приемлемого диапазона, с получением конечного продукта.
Пример 8: Нанесение покрытия водной суспензии на мелкозернистые частицы
Получали предварительную смесь 300,0 г миристиновой кислоты и 100,0 г карбомера 941 NF и диспергировали в деминерализованной воде (q.s.). Аналогично предыдущему примеру 275,0 г сахарных сфер EP/NF (мелкозернистые частицы) вводили в оборудование с псевдоожиженным слоем, содержащее колонну Вюрстера, предварительно нагретое примерно до 50-55°С. Затем суспензию медленно распыляли на предварительно нагретые сахарные сферы для испарения воды. После завершения сахарные сферы с покрытием охлаждали до комнатной температуры и продували холодным воздухом до тех пор, пока количество воды не попадало в пределы приемлемого диапазона, с получением конечного продукта.
Пример 9: Прессование мини-таблеток из расплава гранулята
Частицы согласно настоящему изобретению также можно получать в виде мини-таблеток предпочтительно имеющих небольшой диаметр, такой как 1,5 мм. Например, смешивали 300,0 г лауриновой кислоты, 50,0 г лаурата натрия, 100,0 г микрокристаллической целлюлозы (например, Avicel® РН101) и 100,0 г карбомера 941 NF с получением предварительной смеси, которую затем вводили в нагретый планетарный смеситель с рубашкой и агломерировали с получением гранулированного материала. Затем расплав гранулята просеивали через соответствующее сито, оборудованное ножами для получения мелкодисперсного гранулированного материала. Полученный гранулированный материал затем смешивали с 75,0 г микрокристаллической целлюлозы (например, Avicel® PH101). Полученную смесь прессовали на эксцентриковом таблеточном прессе с несколькими пуансонами с получением двояковыпуклых таблеток конечного продукта с диаметром 1,5 мм и толщиной примерно 2 мм. В указанном примере микрокристаллическую целлюлозу также можно заменять на лактозу (например, на моногидрат лактозы NF) или дигидрат гидрофосфата кальция (Евр. фармакоп.).
Пример 10: Нанесение пленочного покрытия на основе гипромеллозы на активные ядра
На активные ядра, полученные согласно примерам 1-9, можно наносить покрытие при помощи следующего способа. Водный раствор полимера (А) получали путем растворения 5,0 г гипромеллозы типа 2910 (например, Pharmacoat® 603) в 90,0 мл деминерализованной воды. Отдельно получали дисперсию пигмента (В) путем диспергирования 2,0 г диоксида титана (например, диоксида титана «Anatas») и 1,0 г пигмента в 15,0 мл деминерализованной воды, которую затем гомогенизировали с использованием гомогенизатора с большим сдвиговым усилием. Затем получали дисперсию покрытия (С) путем смешения раствора полимера (А) и дисперсии пигмента (В) при непрерывном перемешивании.
На следующей стадии 1000 г активных ядер, полученных согласно любому из примеров 1-9, переводили в текучее состояние в устройстве гранулирования с псевдоожиженным слоем, оборудованном колонной Вюрстера, при температуре 25-30°С. 100 мл дисперсии покрытия (С) медленно распыляли на активные ядра, поддерживая температуру слоя 25-30°С путем регулировки температуры подводимого воздуха и скорости распыления. Активные ядра с покрытием полностью сушили при указанной температуре в псевдоожиженном слое и затем охлаждали до комнатной температуры в псевдоожиженном слое.
В результате можно получать частицы с покрытием, оболочка которых быстро распадается при приеме внутрь.
Следует отметить, что раствор полимера (А) также можно получать путем растворения 5,0 г гипромеллозы типа 2910 (например, Pharmacoat® 603) в смеси 45,0 мл этанола и 55,0 мл деминерализованной воды. В указанном варианте испарение растворителя в процессе нанесения покрытия распылением будет происходить быстрее.
В качестве альтернативы дисперсию покрытия также можно получать путем дополнительного введения пластификатора, поверхностно-активного вещества и небольшого количества этилцеллюлозы. В указанном случае раствор полимера (А) можно получать путем растворения 5,0 г гипромеллозы типа 2910 (например, Pharmacoat® 603) и 0,5 г триацетина (триацетат глицерина) в 50,0 мл деминерализованной воды. Кроме того, 0,25 г лаурилсульфата натрия растворяли в 2,5 мл деминерализованной воды с получением раствора поверхностно-активного вещества (А'). Дисперсию пигмента (В) получали путем диспергирования и гомогенизации 2,5 г талька, 3,0 г диоксида титана и 0,2 мг красящего пигмента в 20,0 мл деминерализованной воды. Затем получали дисперсию покрытия (С) путем смешения раствора полимера (А), раствора поверхностно-активного вещества (А'), дисперсии пигмента (В) и 5,0 г дисперсии этилцеллюлозы (соответствует 1,5 г сухого вещества). Процедуру нанесения покрытия, как таковую, проводили согласно приведенному выше описанию.
Пример 11: Получение композиции, содержащей частицы с покрытием
Композицию, содержащую частицы согласно настоящему изобретению, которыми можно легко наполнять бумажные трубочки или сашеты, можно получать путем осторожного перемешивания 1005 г активных ядер с покрытием, полученных согласно примеру 10, совместно с 0,5 г гидрофобного коллоидного оксида кремния (NF) (например, AEROSIL® R 972) во вращающемся барабане. Вместо гидрофобного коллоидного оксида кремния также можно использовать такое же количество коллоидного диоксида кремния стандартного сорта (например, AEROSIL® 200). В указанной композиции оксид кремния выступает в качестве агента, препятствующего спеканию.
Пример 12: Нанесение покрытия смеси липидного компонента и гидрофильного компонента на активные ядра
Дисперсию покрытия получали путем растворения 5,0 г гипромеллозы типа 2910 (например, Pharmacoat® 603) и диспергирования 2,0 г лауроилполиоксил-32-глицеридов NF (например, Gelucire® 44/14) в смеси 45,0 мл этанола и 55 мл деминерализованной воды. Затем наносили покрытие 105 мл дисперсии на 1000 г активных ядер, полученных согласно любому из примеров 1-9, при помощи того же оборудования и способа, что описаны в примере 10. Получали частицы с покрытием согласно настоящему изобретению, оболочка которых быстро распадалась после перорального введения.
В качестве альтернативы лауроилполиоксил-32-глицеридам NF можно применять схожие количества стеароилполиоксил-32-глицеридов NF (например, Gelucire® 50/13) или каприлокапроилполиоксил-8-глицеридов NF (например, Labrasol®).
Пример 13: Нанесение пленочного покрытия на основе повидона на активные ядра
Раствор покрытия можно получать путем растворения 5,0 г повидона K30 и 1,0 г полиэтиленгликоля 4000 (в качестве альтернативы полиэтиленгликоля 1000) в смеси 60 мл этанола и 40 мл деминерализованной воды. Затем 100,0 мл раствора распыляли на 1000 г активных ядер, полученных согласно любому из примеров 1-9, при помощи того же оборудования и способа, что описаны в примере 10. При помощи способа получали частицы, покрытие которых быстро высвобождало активное ядро после перорального введения.
Пример 14: Нанесение пленочного покрытия на основе этилцеллюлозы на активные ядра
Раствор покрытия можно получать путем растворения 4,0 г этилцеллюлозы NF (например, ETHOCEL® 10 FP) и 1,0 г полиэтиленгликоля 4000 в смеси 25 мл ацетона, 35 мл этанола и 40 мл деминерализованной воды. Затем 100,0 мл раствора распыляли на 1000 г активных ядер, полученных согласно любому из примеров 1-9, при помощи того же оборудования и способа, что описаны в примере 10, учитывая критический предел взрываемости смесей воздух-ацетон-этанол. При помощи способа получали частицы, покрытие которых быстро высвобождало активное ядро после перорального введения.
Пример 15: Нанесение покрытия на основе фосфолипидов на активные ядра
В указанном примере покрытие содержало липидный компонент в комбинации с гидрофильным компонентом. Суспензию покрытия получали путем диспергирования 10,0 г частично гидрогенизированного соевого лецитина (например, Lipoid S75-35 или Lipoid S-PC-35) в деминерализованной воде (q.s.) путем гомогенизации с высоким сдвиговым усилием, затем добавляли небольшое количество (q.s.) системы покрытия с немедленным высвобождением (например, Opadry®), содержащей водорастворимый полимер покрытия, пластификатор и пигмент. Затем 100,0 мл дисперсии распыляли на 1000 г активных ядер, полученных согласно любому из примеров 1-9, при помощи того же оборудования и способа, что описаны в примере 10. При помощи способа получали частицы, покрытие которых быстро высвобождало активное ядро после перорального введения.
Для получения частиц с покрытием с пониженной слипаемостью часть частично гидрогенизированного соевого лецитина можно заменять на полностью гидрогенизированный лецитин (например, Lipoid S75-3) или совместно с 10,0 г частично гидрогенизированного соевого лецитина можно добавлять 2,0 г полностью гидрогенизированного лецитина.
Пример 16: Нанесение покрытия смеси лецитина и мальтодекстрина на активные ядра
10,0 г порошковой смеси лецитина и мальтодекстрина (например, Soluthin®) диспергировали в 95 мл деминерализованной воды при комнатной температуре. 1000 г ядер, полученных согласно любому из примеров 1-9, переводили в текучее состояние в устройстве с псевдоожиженным слоем при температуре от 20 до 30°С. Затем медленно распыляли 100,0 мл дисперсии на активные ядра при помощи способа распыления «сверху», поддерживая температуру подложки 20-30°С, путем регулировки температуры входящего воздуха и скорости распыления. Ядра с покрытием полностью сушили при указанной температуре в псевдоожиженном слое и затем охлаждали до комнатной температуры в псевдоожиженном слое. Снова получали частицы, покрытие которых быстро высвобождало активное ядро после перорального введения.
Пример 17: Нанесение покрытия сложного эфира сахарозы на активные ядра
Получали прозрачный раствор путем растворения 15,0 г лаурата сахарозы L-1695 в 90,0 мл деминерализованной воды при комнатной температуре. 1000 г активных ядер, полученных согласно любому из примеров 1-9, переводили в текучее состояние и наносили покрытие при помощи способа, схожего с тем, что описан в примере 16, с получением частиц с покрытием, имеющих схожие свойства, связанные с характеристиками высвобождения.
В качестве альтернативы лаурату сахарозы L-1695 можно применять лаурат сахарозы L-1570 необязательно в виде лаурата сахарозы LWA-1570, готового к использованию раствора 40% L-1570 в 4% этанола и 56% воды. Например, 30,0 г лаурата сахарозы LWA-1570 можно разбавлять 110,0 мл деминерализованной воды и 20 мл этанола. 150 мл полученного раствора покрытия можно применять для нанесения покрытия на 1000 г ядер.
Пример 18: Нанесение покрытия привитого сополимера этиленгликоля/винилового спирта на активные ядра
Частицы с покрытием согласно настоящему изобретению также можно получать с применением привитого сополимера этиленгликоля/винилового спирта в качестве агента для нанесения покрытия с немедленным высвобождением. Например, раствор полимера можно получать из 24,0 г Kollicoat®, диспергированного в 96 мл деминерализованной воды и растворенного при перемешивании. Отдельно получали суспензию пигмента путем диспергирования 4,5 г талька, 1,5 г красного оксида железа и 3,9 г диоксида титана в 11,0 мл деминерализованной воды, затем гомогенизировали при помощи гомогенизатора с большим сдвиговым усилием. Затем получали дисперсию покрытия путем смешения 100,0 мл раствора полимера с 20,0 г суспензии пигмента. 1000 г активных ядер, полученных согласно любому из примеров 1-9, переводили в текучее состояние и наносили покрытие при помощи способа, схожего с тем, что описан в примере 16, с получением частиц с покрытием, имеющих схожие свойства, связанные с характеристиками высвобождения. На протяжении всего способа нанесения покрытия суспензию покрытия непрерывно перемешивали для предотвращения седиментации.
Пример 19: Получение частиц путем криоизмельчения
300 г твердого жира (твердый свиной жир производства Caelo, Germany) переводили в расплав при 50°С. При помощи шпателя в липид вводили 200 г Carbopol® 971G (Lubrizol). Вязкой массой наполняли пластиковый пакет и охлаждали до -18°С в морозильной камере. Замороженный материал разбивали молотком и измельчали в порошок при помощи кухонного блендера (Bosch, ProfiMIXX, Germany). После сушки в вакууме при 25°С для удаления остаточных количеств конденсированной воды полученные частицы разделяли, пропуская через несколько проволочных сит (VWR International, Germany), для получения классифицированного порошка с размером менее 0,5 мм.
Пример 20: Получение частиц путем криоизмельчения
500 г твердого жира (Witepsol® W35 производства NRC, Germany) переводили в расплав при 50°С. При помощи шпателя в липид вводили 250 г Carbopol® 971G (Lubrizol). Вязкой массой наполняли пластиковый пакет и охлаждали до -18°С в морозильной камере. Замороженный материал разбивали молотком и измельчали в порошок при помощи ультрацентробежной мельницы (ZM 200, Retsch, Germany). Для измельчения материал предварительно охлаждали в сухом льду и в течение двух минут перемешивали при скорости вращения 18000 раз/минуту. Материал превращали в частицы с диаметром (D90) 0,2 мм с количественным выходом. Перед разделением частицы сушили в вакууме при 25°С для удаления остаточных количеств конденсированной воды, если указанную процедуру считали необходимой.
Пример 21: Получение частиц путем гранулирования в псевдоожиженном слое
400 г классифицированного порошка, полученного в примере 19, помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1 производства Innojet, Germany), оборудованное резервуаром для продукта IPC3. Порошок переводили в текучее состояние при 32°С при помощи потока воздуха с расходом 50 м3/ч. Материал гранулировали в течение 30 минут и разделяли, пропуская через несколько проволочных сит, с получением 240 г частиц с размером от 0,5 до 1,0 мм и 64 г частиц с размером более 1,0 мм.
Пример 22: Исследования животных
A. Общие способы
Животным (крысам), которых выдерживали в клетках в стандартных условиях размещения животных (по два животных в клетке или в отдельных клетках), предоставляли неограниченный доступ к корму и воде. Корм для животных был обеспечен в виде пеллеты, которые размещали в специальных подставках для пеллет, или крема или гранулированного порошка в контейнере, размещенном внутри клетки.
В начале и после завершения экспериментов определяли массу тела. Употребление пищи отмечали каждый день за исключением выходных. Эксперименты проводили в соответствии с законодательством Германии в области защиты животных.
Корм для грызунов приобретали в ssniff®  GmbH, Germany, поли(акриловую кислоту) (РАА, Carbopol® 971 Р NF) получали в Lubrizol Corporation, USA. Измельченные стружки масла какао (Caelo 633 В) приобретали в Caesar & Lorentz, Germany. Твердый жир (Witepsol®) приобретали в NRC, Germany. Все значения содержания в процентах указаны как содержание в процентах (масс./масс.), если конкретно не указано иное.
GmbH, Germany, поли(акриловую кислоту) (РАА, Carbopol® 971 Р NF) получали в Lubrizol Corporation, USA. Измельченные стружки масла какао (Caelo 633 В) приобретали в Caesar & Lorentz, Germany. Твердый жир (Witepsol®) приобретали в NRC, Germany. Все значения содержания в процентах указаны как содержание в процентах (масс./масс.), если конкретно не указано иное.
B. Стандартный корм в виде пеллет, содержащего 5% жира - сравнительный образец нормального приема пищи и прироста массы
Двенадцати самцам крыс линии Вистар, имеющим среднюю массу тела 319±7 г, давали экспериментальный корм, представленный в виде пеллет, в течение семи дней. Смесь состояла из стандартного корма для грызунов (ssniff® EF R/M Control, 5%), где содержание жира в конечной смеси составляло 5%.
В стандартный корм добавляли воду с получением пасты, которую экструдировали и разрезали на пеллеты (1 см ×3 см) при помощи кухонного комбайна (Kitchen Aid Classic, USA). Пеллеты сушили при 25°С в течение ночи.
После завершения эксперимента вычисляли количество употребленной пищи, энергетическую ценность пищи и изменение массы тела (± СКО). Животные набирали 5,0±1,9% массы тела, среднее количество пищи, употребляемой за день, составляло 24,3±2,7 г, что соответствовало среднему количеству метаболической энергии, составляющему 374±40,8 кДж, потребляемому одним животным в день.
C. Композиция корма в виде пеллеты/ масла какао, содержащая 11,6% жира - стандартный образец приема пищи с отрегулированной энергетической ценностью
Шести самцам крыс линии Вистар, имеющим среднюю массу тела 324±6 г, давали экспериментальный корм, представленный в виде пеллеты, в течение шести дней.
Смесь состояла из стандартного корма (ssniff® EF R/M Control, 5%) и масла какао (7,5% относительно массы стандартного корма), в конечной смеси общее содержание жира в целом составляло примерно 11,6% (включая масло какао), и содержание масла какао составляло примерно 7,0%. Масло какао плавили и смешивали со стандартным кормом. Добавляли воду для получения пасты, которую экструдировали и разрезали на пеллеты (1 см ×3 см) при помощи кухонного комбайна (Kitchen Aid, USA). Пеллеты сушили при 25°С в течение ночи.
После завершения эксперимента вычисляли количество употребленной пищи, энергетическую ценность пищи и изменение массы тела (± СКО). Животные набирали 3,8±1,3% массы тела, среднее количество пищи, употребляемой за день, составляло 22,5±2,0 г, что соответствовало среднему количеству метаболической энергии, составляющему 382,2±33,7 кДж, потребляемому одним животным в день.
D. Композиция корма в виде крема или пасты, содержащая 50% жира, количество которой было ограничено 10 г/день на одно животное - стандартный образец потери массы тела, вызванной ограничением энергии, поступающей с пищей
Четырем самцам крыс линии Вистар, имеющим среднюю массу тела 329±7 г, давали экспериментальный корм, представленный в виде смеси кремовой пастообразной текстуры, в течение пяти дней. Экспериментальный корм представлял собой композицию корма с высоким содержанием жира, содержащую 50% жира относительно массы конечной смеси, которую получали путем смешения трех стандартных кормов, которые приобретали в ssniff®, а именно 'EF R/M Control, 5%', 'EF R/M с 30% жира' и 'EFR/Mc 80% жира', в массовом отношении 10:45:45, соответственно.
Количество употребляемого корма было ограничено 10 г в день, что соответствовало среднему потребляемому количеству метаболической энергии 236 кДж в день. После завершения эксперимента оценивали изменение массы тела (± СКО). Убыль массы тела у животных составляла 3,6±0,6%.
E. Композиция корма в виде пеллет, содержащая 4,5% жира и 9,1% полимеров - пример потери массы тела, вызванной приемом полимера, связанной с пониженным усвоением
Шести самцам крыс линии Вистар, имеющим среднюю массу тела 301,4±9,2 г, давали экспериментальный корм, представленный в виде пеллет, в течение семи дней. Смесь состояла из стандартного корма (ssniff® EF R/M Control, 5%) и содержала всего 10% полимеров (относительно массы стандартного корма; в частности 6,2% Carbopol® 971 NF, 1,5% Kollicoat® МАЕ 100Р, Sigma Aldrich, USA, и 2,3% хитозана из панцирей краба, Sigma Aldrich, USA). Из указанной смеси получали композицию корма в виде пеллет, имеющую содержание жира примерно 4,5% и общее содержание полимеров 9,1% относительно массы конечной смеси (в частности примерно 5,6% Carbopol®, примерно 1,4% Kollicoat® и примерно 2,1% хитозана).
Стандартный корм смешивали с порошками полимеров. Добавляли воду для получения пасты, которую экструдировали и разрезали на пеллеты (1 см ×3 см) при помощи кухонного комбайна (Kitchen Aid, USA). Пеллеты сушили при 25°С в течение ночи.
После завершения эксперимента вычисляли количество употребленной пищи, энергетическую ценность пищи и изменение массы тела (± СКО). Животные теряли 3,9±4,6% массы тела, среднее количество пищи, употребляемой за день, составляло 18,1±2,1 г, что соответствовало среднему количеству метаболической энергии, составляющему 253±29 кДж потребляемому одним животным в день.
F. Композиция корма в виде пеллет, содержащая 4,7% жира и 5,7% полимера - пример потери массы тела, вызванной приемом полимера, связанной с пониженным усвоением
Шести самцам крыс линии Вистар, имеющим среднюю массу тела 317±14,5 г, давали экспериментальный корм, представленный в виде пеллет, в течение семи дней. Смесь состояла из стандартного корма (ssniff® EF R/M Control, 5%) и 6% Carbopol® 971 NF (относительно массы стандартного корма), получали композицию корма в виде пеллет, имеющую содержание жира 4,7% и содержание Carbopol® примерно 5,7% относительно массы конечной смеси.
Стандартный корм смешивали с порошком полимера, добавляли воду для получения пасты, которую экструдировали и разрезали на пеллеты (1 см ×3 см) при помощи кухонного комбайна (Kitchen Aid, USA). Пеллеты сушили при 25°С в течение ночи.
После завершения эксперимента вычисляли количество употребленной пищи, энергетическую ценность пищи и изменение массы тела (± СКО). Животные теряли 1,8±2,3% массы тела, среднее количество пищи, употребляемой за день, составляло 18,4±5,3 г, что соответствовало среднему количеству метаболической энергии, составляющему 267±77 кДж потребляемому одним животным в день.
G. Порошковая композиция корма в виде пеллет/Witepsol®, содержащая 11,0% жира и 5,3% полимера - пример потери массы тела, вызванной приемом полимера, связанной с пониженным усвоением
Шести самцам крыс линии Вистар, имеющим среднюю массу тела 307±8 г, давали экспериментальный корм, представленный в виде порошка, в течение пяти дней. Смесь состояла из стандартного корма (ssniff® EF R/M Control, 5%) и Witepsol® W25 (7,5% относительно массы стандартного корма) и 6% Carbopol® 971 NF (относительно массы стандартного корма), что давало среднее содержание всех жиров примерно 11,0% (включая Witepsol®), содержание Witepsol® примерно 6,6% и содержание Carbopol® примерно 5,3% относительно массы конечной смеси.
Расплав Witepsol® смешивали с порошком полимера, переносили в пакет с застежкой и охлаждали до -18°С в морозильной камере. Материал разбивали молотком и измельчали в гранулят при помощи кухонного блендера (ProfiMIXX, Bosch, Germany). Добавляли стандартный корм и смешивали с гранулятом с получением корма в виде порошка.
После завершения эксперимента вычисляли количество употребленной пищи, энергетическую ценность пищи и изменение массы тела (± СКО). Животные теряли 2,4±1,8% массы тела, среднее количество пищи, употребляемой за день, составляло 15,1±0,8 г, что соответствовало среднему количеству метаболической энергии, составляющему 245±13 кДж потребляемому одним животным в день.
Пример 23: Исследование дыхания у здоровых добровольцев
Оценку периода полувыведения из желудочно-кишечного тракта и биодоступности свободных жирных кислот проводили при помощи исследования дыхания с использованием 13С-октановой кислоты. Меченный субстрат октановой кислоты быстро поглощается в кишечнике и подвергается метаболизму в печени с получением 13СO2, который удаляется при выдохе, что, таким образом, отражает захват октановой кислоты в желудочно-кишечном тракте после выведения ее из желудка. В начале эксперимента у субъекта брали контрольный образец выдыхаемого воздуха. Затем субъект употреблял гранулят липида в качестве контрольного образца или гранулят липида, содержащий полимеры, в качестве исследуемого образца.
Гранулят получали путем плавления липида при 50°С и добавления 100 мг 13С октановой кислоты (Campro Scientific, The Netherlands) и, в случае исследуемых образцов, введения полимера. Затем смесь переносили в пакет с застежкой и охлаждали до -18°С в морозильной камере. Материал разбивали молотком, измельчали до гранулята в кухонном блендере (Bosch, Germany), сушили в вакууме при 25°С и разделяли, пропуская через несколько проволочных сит (VWR International, Germany), с получением гранулята с размером частиц менее 1,3 мм и более 0,5 мм.
Для приема образца внутрь замороженный гранулят смешивали со 100 г холодного йогурта (фруктовый, примерно 100 калорий), затем смесь употребляли в течение одной-двух минут. После приема образцов внутрь субъект выдыхал через наконечник для рта, и образец воздуха в конце выдоха собирали в 300 мл пакет из фольги в различные моменты времени. Образцы выдыхаемого воздуха собирали в течение 410 минут. В течение указанного периода времени субъекты выпивали 0,5-1,0 л воды со скоростью примерно один стакан в час, через 180 минут субъекты съедали легкий ланч, в качестве физических упражнений субъекты выполняли повседневную работу.
После завершения сбора пакетов с выдыхаемым воздухом проводили анализ при помощи анализатора выдыхаемого воздуха FANci2, функционирующего на основе недисперсионной инфракрасной спектроскопии (Fischer Analysen Instrumente GmbH, Germany). Содержание 13C в выдыхаемом воздухе выражали как относительное изменение ( ) по сравнению с универсальным стандартом (углерод из известняка Pee Dee Belemnite). Обогащение 13С определяли как разницу между содержанием 13С в выдыхаемом воздухе перед приемом образца внутрь и содержанием 13С в определенный момент времени после употребления образца внутрь и выражали как изменение относительно исходного уровня (DOB («delta over basal»),
) по сравнению с универсальным стандартом (углерод из известняка Pee Dee Belemnite). Обогащение 13С определяли как разницу между содержанием 13С в выдыхаемом воздухе перед приемом образца внутрь и содержанием 13С в определенный момент времени после употребления образца внутрь и выражали как изменение относительно исходного уровня (DOB («delta over basal»),  ). При помощи программного обеспечения анализатора выдыхаемого воздуха (FANci, версия 2.12.42.14 02/14) значения суммарной дозы в процентах (cPDR, соответствует биодоступности) и времени достижения половинного значения cPDR (HLF, соответствует периоду полувыведения из желудочно-кишечного тракта) заносили в протокол.
). При помощи программного обеспечения анализатора выдыхаемого воздуха (FANci, версия 2.12.42.14 02/14) значения суммарной дозы в процентах (cPDR, соответствует биодоступности) и времени достижения половинного значения cPDR (HLF, соответствует периоду полувыведения из желудочно-кишечного тракта) заносили в протокол.
Вводили несколько исследуемых композиций, содержащих частицы согласно настоящему изобретению. Как показано ниже в таблице, было установлено, что частицы обеспечивали увеличение биодоступности (исследуемые композиции 1, 2, 4, 5 и 6) или увеличение периода полувыведения из желудочно-кишечного тракта (исследуемая композиция 3).
Твердый жир (Witepsol®) приобретали в NRC, Germany. Масло какао приобретали в местном продуктовом магазине. Лаурат натрия и лауриновую кислоту, микрокристаллическую целлюлозу и различные сорта ГПЦ приобретали в Sigma-Aldrich, USA. ГПМЦ (Metolose® 90SH) получали в Harke, Germany, ксантан (Xantan Texturas) получали в Solegraells Guzman, Spain. Carbopol® приобретали в Lubrizol, USA. Моноолеат глицерина и монолаурат глицерина получали в TCI, Belgium.
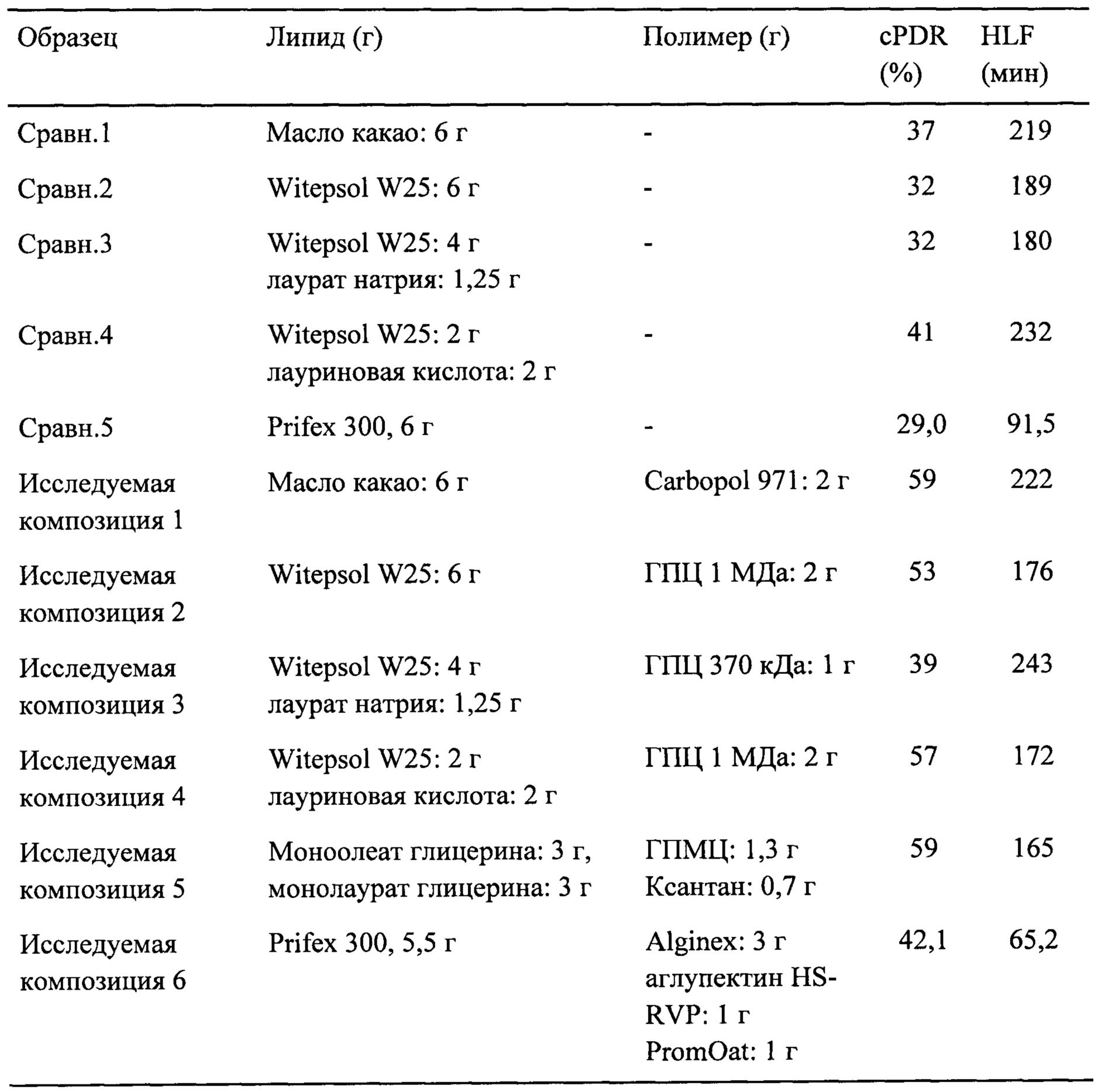
Пример 24: Исследование мукоадгезивности и целостности частиц in vitro
Альгинат натрия средней вязкости (альгинат №1), альгиновую кислоту, лаурат натрия и лауриновую кислоту, микрокристаллическую целлюлозу (МКЦ), гидроксипропилцеллюлозу (ГПЦ) и карбоксиметилцеллюлозу (КМЦ) различных сортов, аравийскую камедь, хитозан и соли кальция получали в Sigma-Aldrich, USA. Альгинат №3 получали в Dragonspice, Germany. Альгинат №4 (Satialgine® S 1600) получали в Cargill, France. Альгинат №5 (Manucol DH) получали в IMCD, Germany. Альгинат №6 (Protanal® LF) и альгинат №7 (Protanal® PH) получали в FMC, UK. Альгинат №8 (Alginex® НН) и альгинат №9 (Algin LZ-2) получали в Kimica, Japan. Различные сорта Carbopol® получали в Lubrizol, USA. Ксантан (Texturas Xantan), геллановую камедь (Texturas gellan), альгинат №2 (Texturas Algin) получали в Solegraells Guzman, Spain. ГПМЦ (Metolose® 90SH) получали в Harke, Germany. Различные сорта подорожника (99%; 100 меш) и гуаровую камедь получали в Caremoli, Germany. Камедь рожкового дерева получали в Werz, Germany. Кокосовую муку получали в Noble House, Belgium. Яблочный пектин, низкоэтерифицированный яблочный пектин и лизолецитин получали в Dragonspice, Germany. Пектин №1 (Pektin Classic AU202) получали в Herbstreith & Fox, Germany. Пектин №2 (Aglupectin® HS-RVP) и камедь тары (AgluMix® 01) получали в Silva Extracts, Italy. Различные сорта пектина с низким содержанием метоксила, амидированного пектина с низким содержанием метоксила, быстро желирующего пектина с высоким содержанием метоксила и медленно желирующего пектина с высоким содержанием ментоксила получали в Modernist Pantry, USA. Бета-глюкан (порошковое содержимое биокапсул с бета-глюканом Hafer) получали в Raab Vitalfood, Germany. Бета-глюкан PromOat® получали в Tate&Lyle, Sweden. Порошок какао с низким содержанием жиров получали в Naturata, Germany. Порошок какао с высоким содержанием жиров получали в Cebe, Germany. Инулин получали в Spinnrad, Germany. Резистентный декстрин Benefiber® (также известный как Benefiber® Nutriose®) получали в Novartis, UK.
Различные сорта жира Witespol® получали в NRC, Germany. Твердый жир Gelucire® 43/01 получали в  , France. Моноглицериды получали в TCI, Belgium. Масло какао приобретали в местном супермаркете. Пальмовый жир получали в Peter
, France. Моноглицериды получали в TCI, Belgium. Масло какао приобретали в местном супермаркете. Пальмовый жир получали в Peter  , Germany. Пальмовый стеарин, масло омега-3-концентрат и порошок 67 омега-3-концентрат получали в Bressmer, Germany. Пальмовый стеарин IP и пальмовый стеарин MB получали в Henry Lamotte, Germany. Кокосовое масло и различные сорта кокосового жира получали в Dr. Goerg, Germany. Масло ши №1 получали в Gustav Hees, Germany. Масло ши №2 получали в Cremer Oleo, Germany. Соевый лецитин №1 (сорт порошка) получали в Caelo, Germany. Соевый лецитин №2 (Texturas Lecite) получали в Solegraells Guzman, Spain. Какао-массу получали в Homborg, Germany. Желтый и белый пчелиный воск получали в Heinrich Klenk, Germany. Конъюгированную линолевую кислоту (Tonalin®) получали в BASF, Germany. Пальмовый стеарин Prifex® 300 получали в Unimills, The Netherlands. Омега-3-жирные кислоты (Omega-3 1400) получали в Queisser Pharma, Germany. Сафлоровое масло получали в
, Germany. Пальмовый стеарин, масло омега-3-концентрат и порошок 67 омега-3-концентрат получали в Bressmer, Germany. Пальмовый стеарин IP и пальмовый стеарин MB получали в Henry Lamotte, Germany. Кокосовое масло и различные сорта кокосового жира получали в Dr. Goerg, Germany. Масло ши №1 получали в Gustav Hees, Germany. Масло ши №2 получали в Cremer Oleo, Germany. Соевый лецитин №1 (сорт порошка) получали в Caelo, Germany. Соевый лецитин №2 (Texturas Lecite) получали в Solegraells Guzman, Spain. Какао-массу получали в Homborg, Germany. Желтый и белый пчелиный воск получали в Heinrich Klenk, Germany. Конъюгированную линолевую кислоту (Tonalin®) получали в BASF, Germany. Пальмовый стеарин Prifex® 300 получали в Unimills, The Netherlands. Омега-3-жирные кислоты (Omega-3 1400) получали в Queisser Pharma, Germany. Сафлоровое масло получали в  , Germany.
, Germany.
Гранулы получали путем плавления одного липида при 50°С и необязательно добавления других липидных компонентов и нескольких кристаллов масляного красного О (Sigma Aldrich, USA) с получением гомогенного расплава или суспензии. В случае исследуемых образцов вводили полимер(-ы) путем механического перемешивания. Каждую композицию переносили в пакет с застежкой и охлаждали до -18°С в морозильной камере. Материал сначала разбивали молотком, измельчали до гранулята в кухонном блендере (Bosch ProfiMIXX, Germany), необязательно сушили в вакууме при 25°С и затем разделяли, пропуская через несколько проволочных сит (VWR International, Germany), с получением гранулята с размером частиц менее 2,0 мм и более 1,3 мм. Свежий желудок свиньи (приобретенный у местного мясника) разрезали на куски 3 см ×3 см и помещали на дно стеклянной чашки Петри (диаметр 10 см). В чашку Петри добавляли 22 мл искусственного желудочного сока для имитации условий натощак (FaSSGF). FaSSGF получали путем растворения 1 г NaCl (Sigma-Aldrich) в 450 мл воды, добавления 30 мг порошка ИКС (biorelevant.com), регулировки рН до 2,0 при помощи 0,1 н. HCl (Sigma-Aldrich) и добавления воды до конечного объема 500 мл. Накрывали чашку Петри и помещали в шейкер для чашек Петри (ST5 производства CAT, Germany), в котором устанавливали угол наклона 12°С и скорость 50 встряхиваний/минуту. Шейкер помещали в печь, нагретую до 37°С. Через 30 минут к содержимому чашки Петри добавляли 350 мг гранулята, не прерывая перемешивание. Через 5 минут образцы удаляли из печи и кусок желудка свиньи трижды промывали водой (по 3 мл). Материал, прикрепленный к поверхности желудка, удаляли при помощи шпателя, переносили в мерную чашку и сушили до постоянной массы (электронный измеритель влаги MLB 50-3N, Kern & Sohn, Germany). Отмечали сухую массу мукоадгезивного материала и вычисляли как долю в процентах от исходной массы гранулята, таким образом, связывание являлось мерой мукоадгезивности. Чашку Петри, содержащую оставшийся несвязанный материал, перемешивали при 37°С в течение еще 15 минут, по результатам визуальной оценки целостность частицы классифицировали как «низкую» (полное разрушение или разрушение по меньшей мере 50% частиц) или «высокую» (разрушение менее чем 50% частиц) или «среднюю» (разрушение менее чем 50%, но видимое выделение небольших количеств порошка из частиц).
В результаты было показано, что определенные исследуемые композиции, содержащие частицы согласно настоящему изобретению, обеспечивали по существу повышенное связывание со слизистой и/или высокую целостность частиц, что показано ниже в таблице.
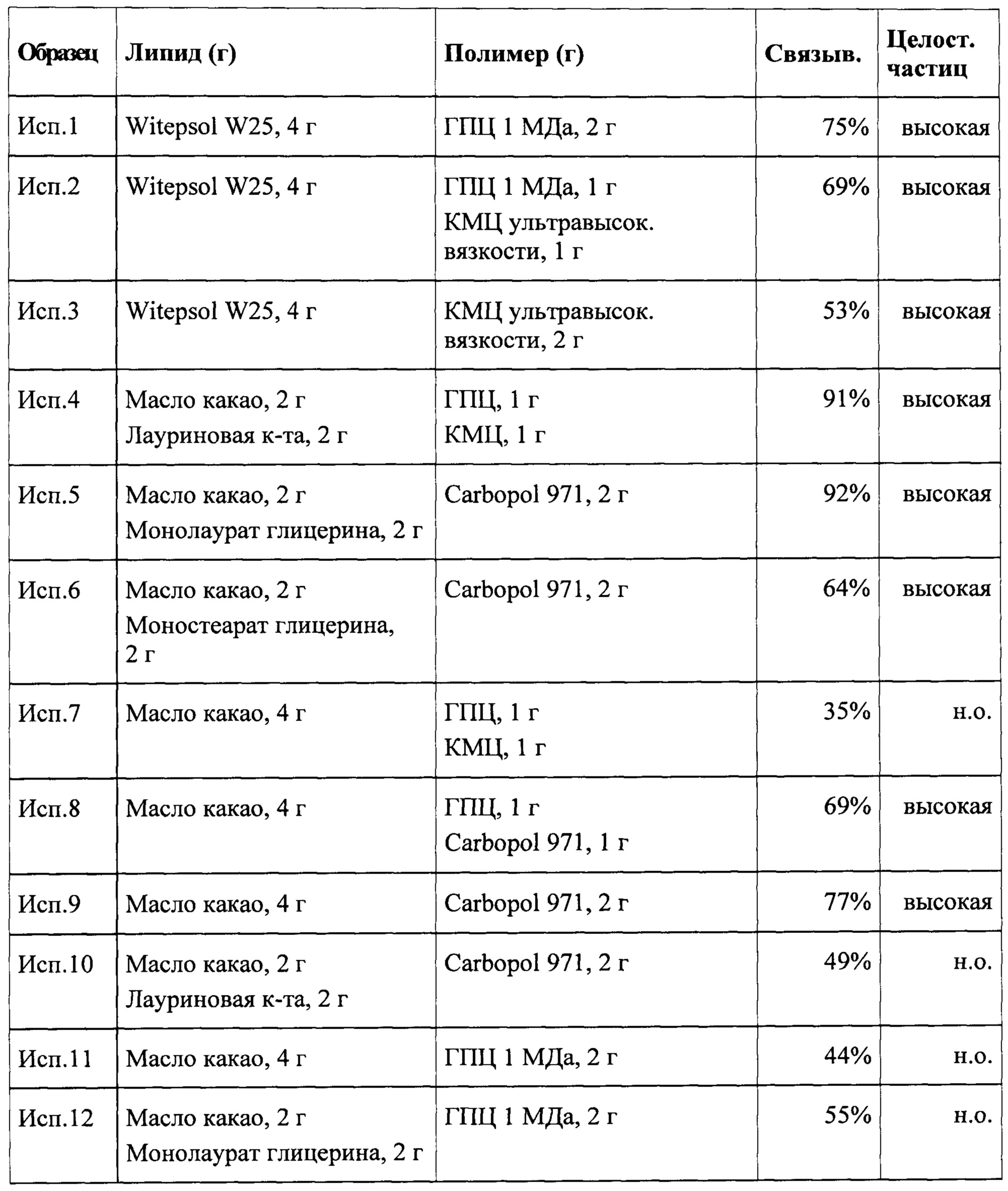
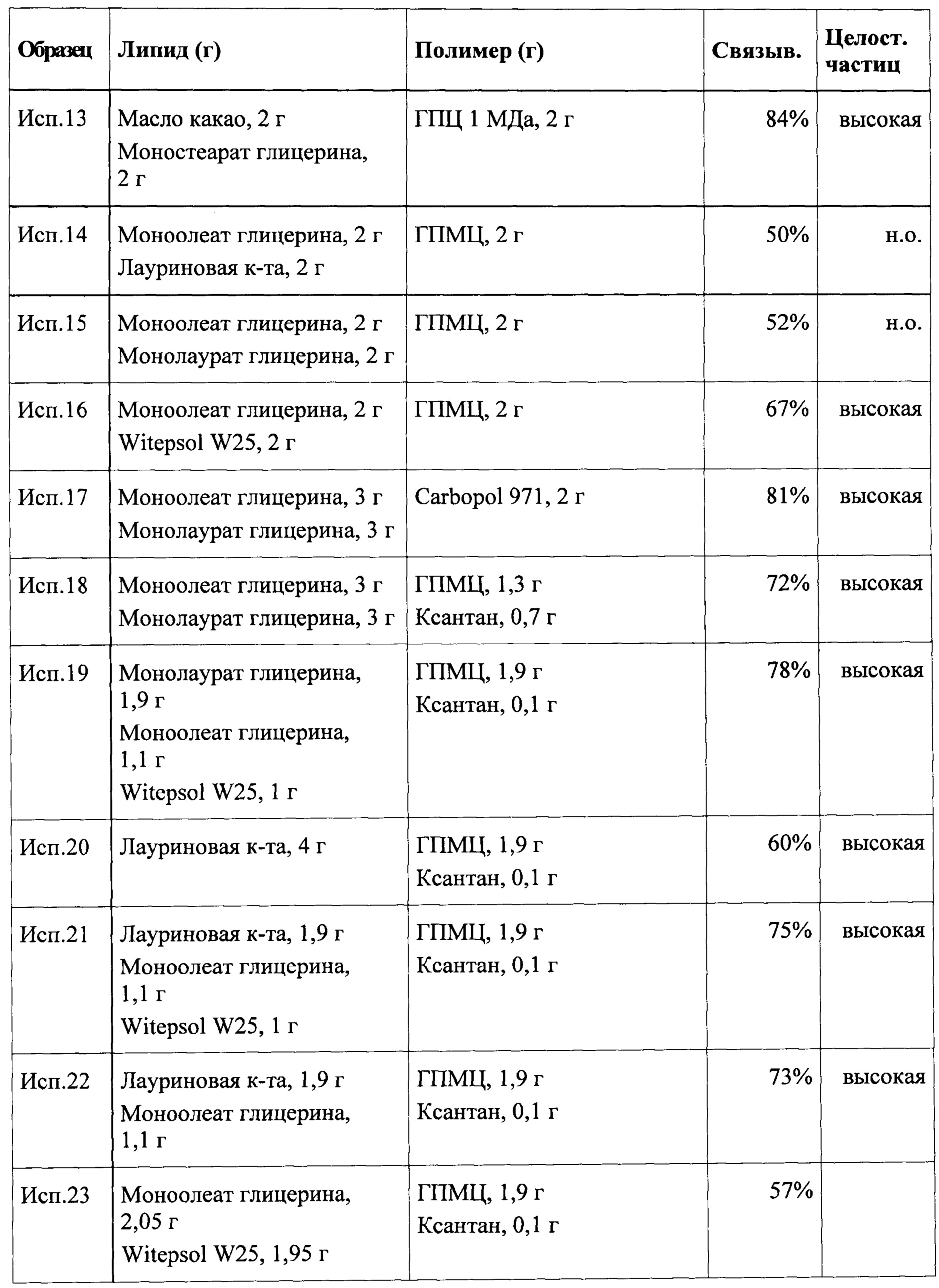
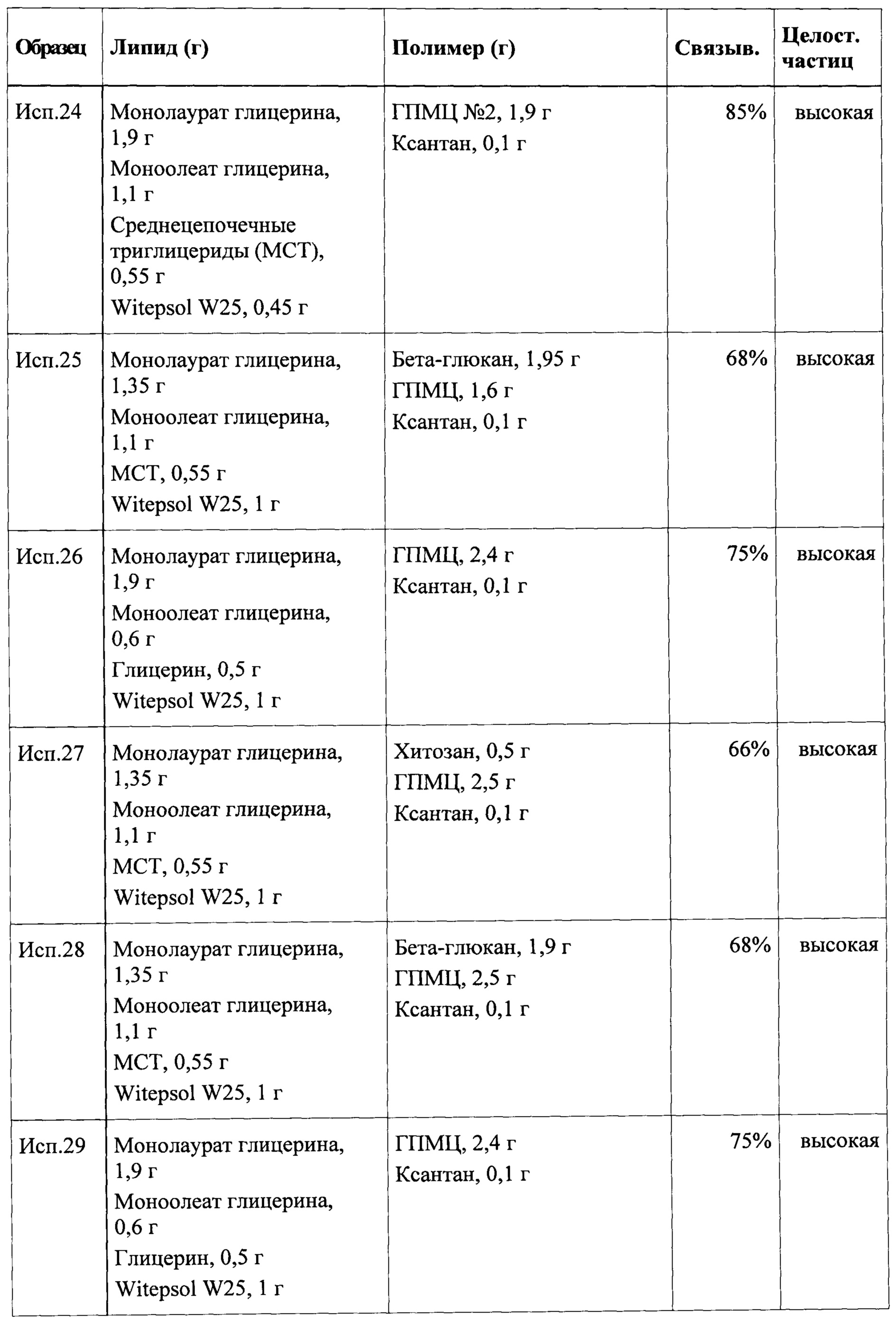
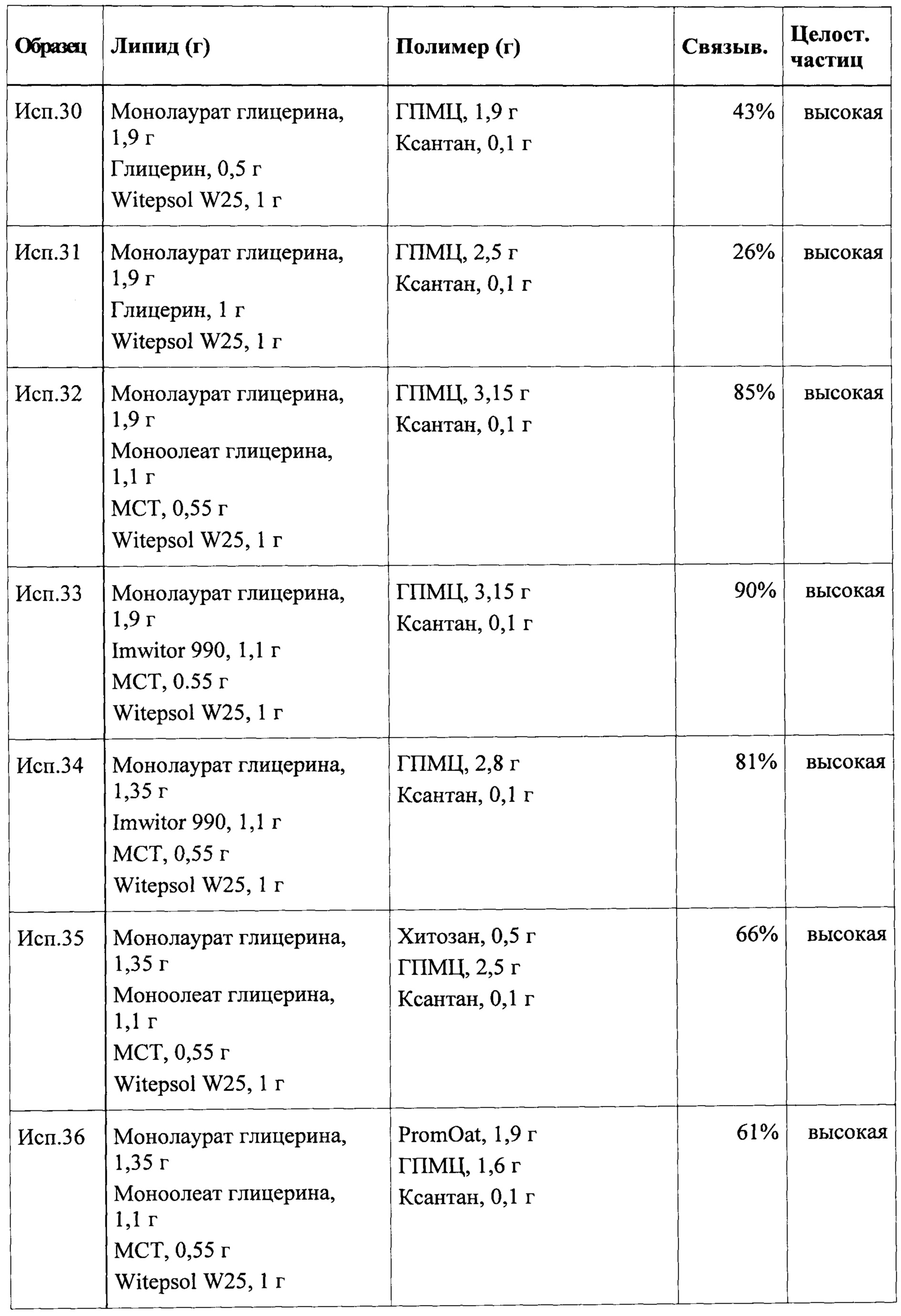
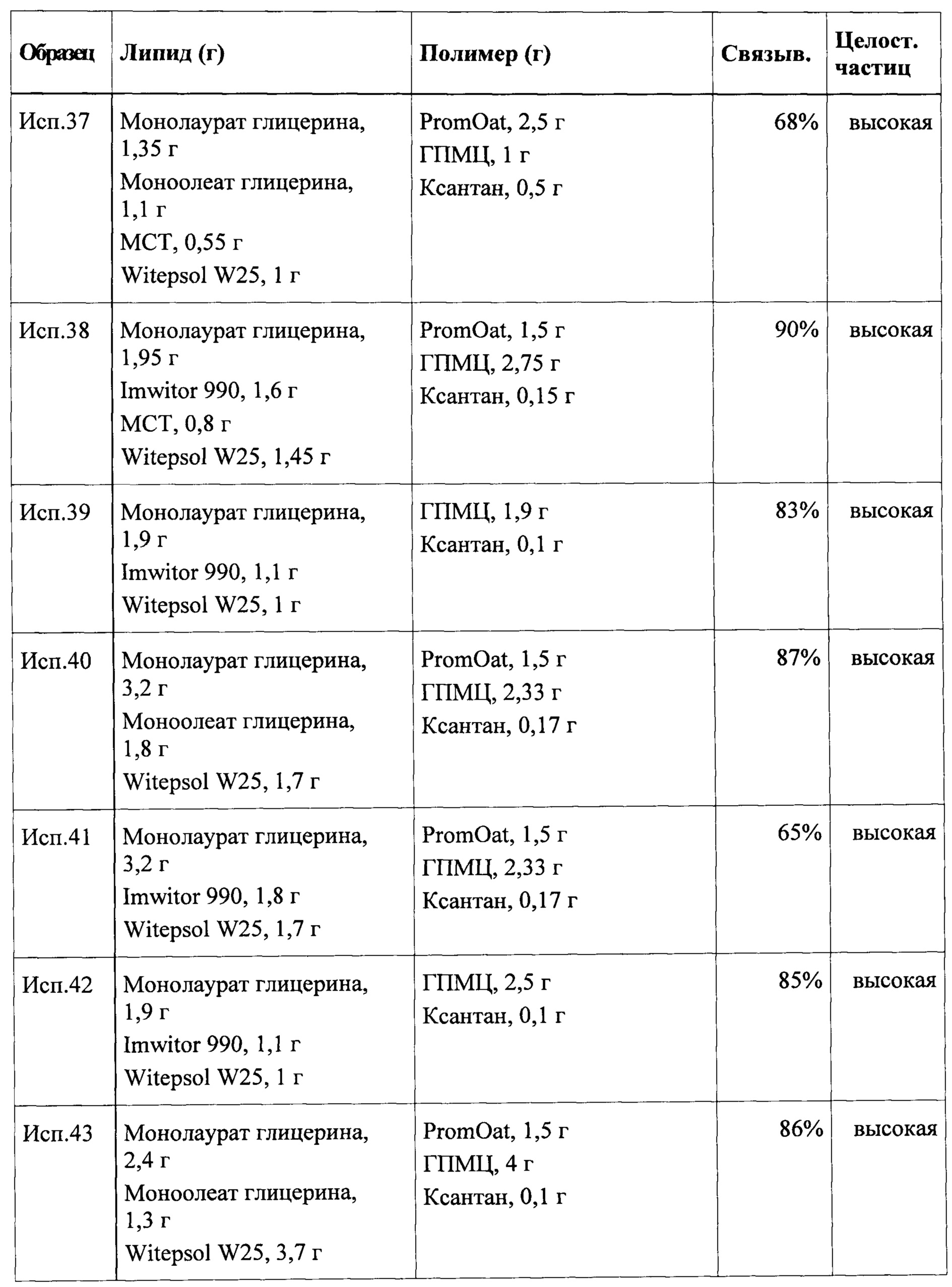
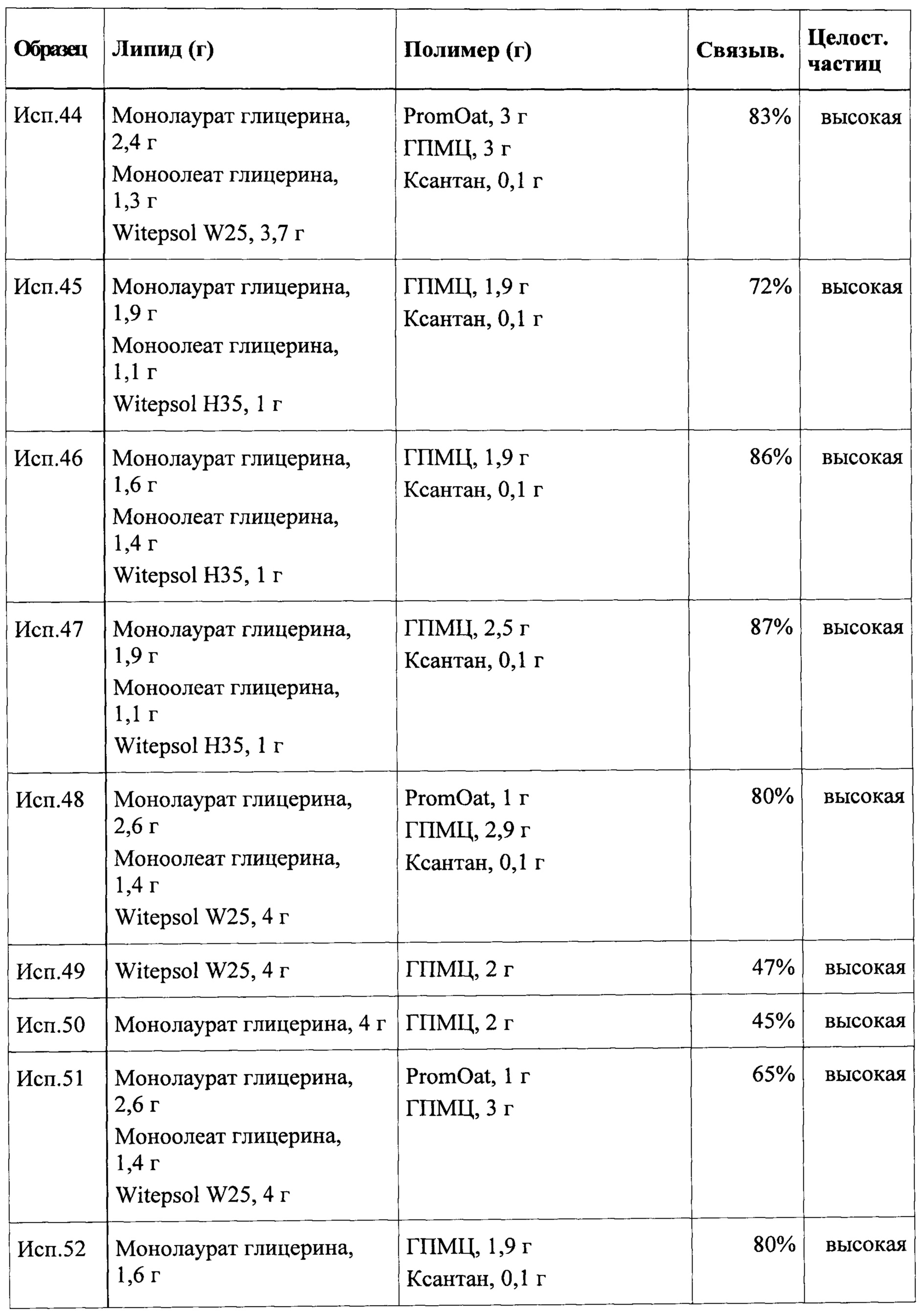
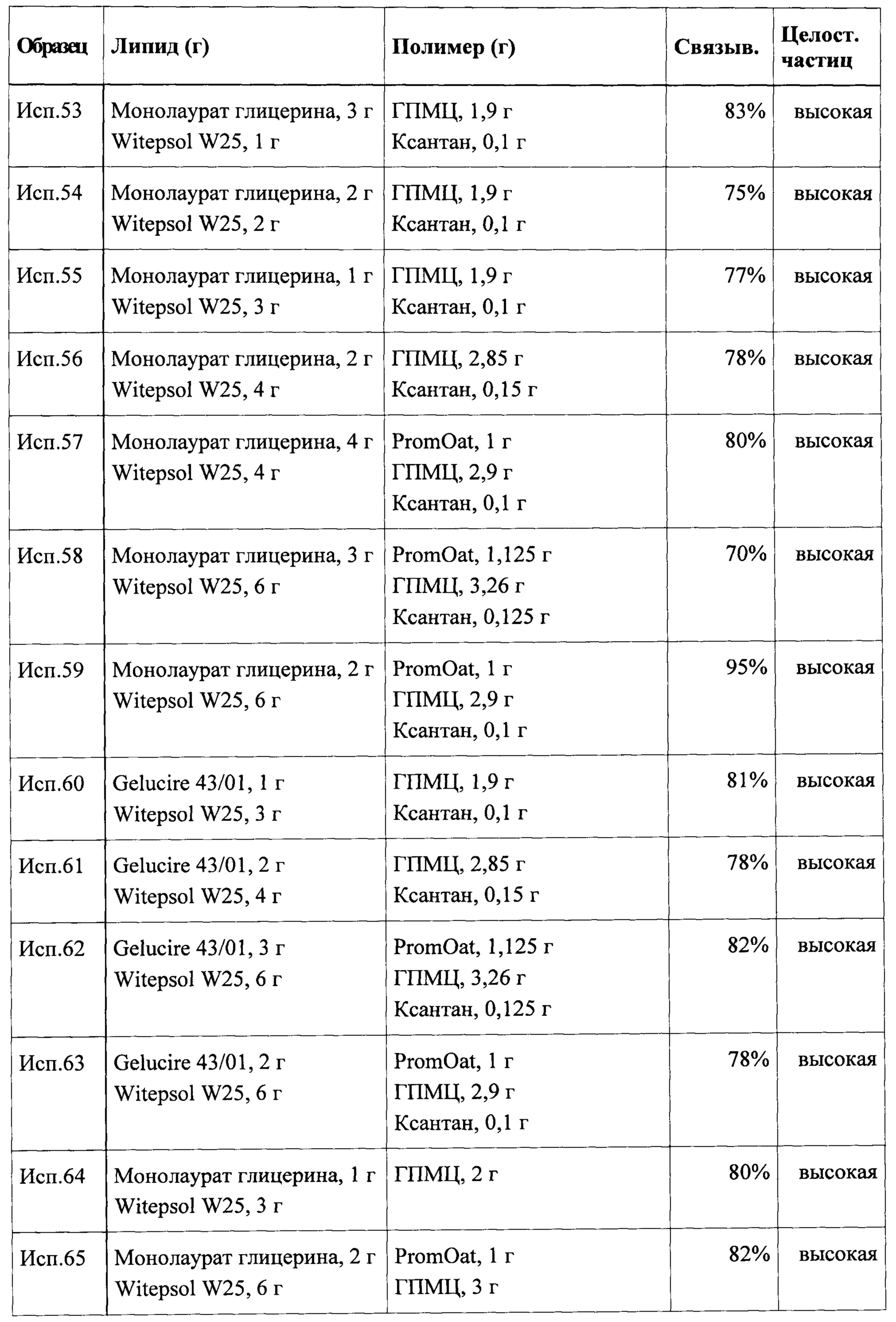
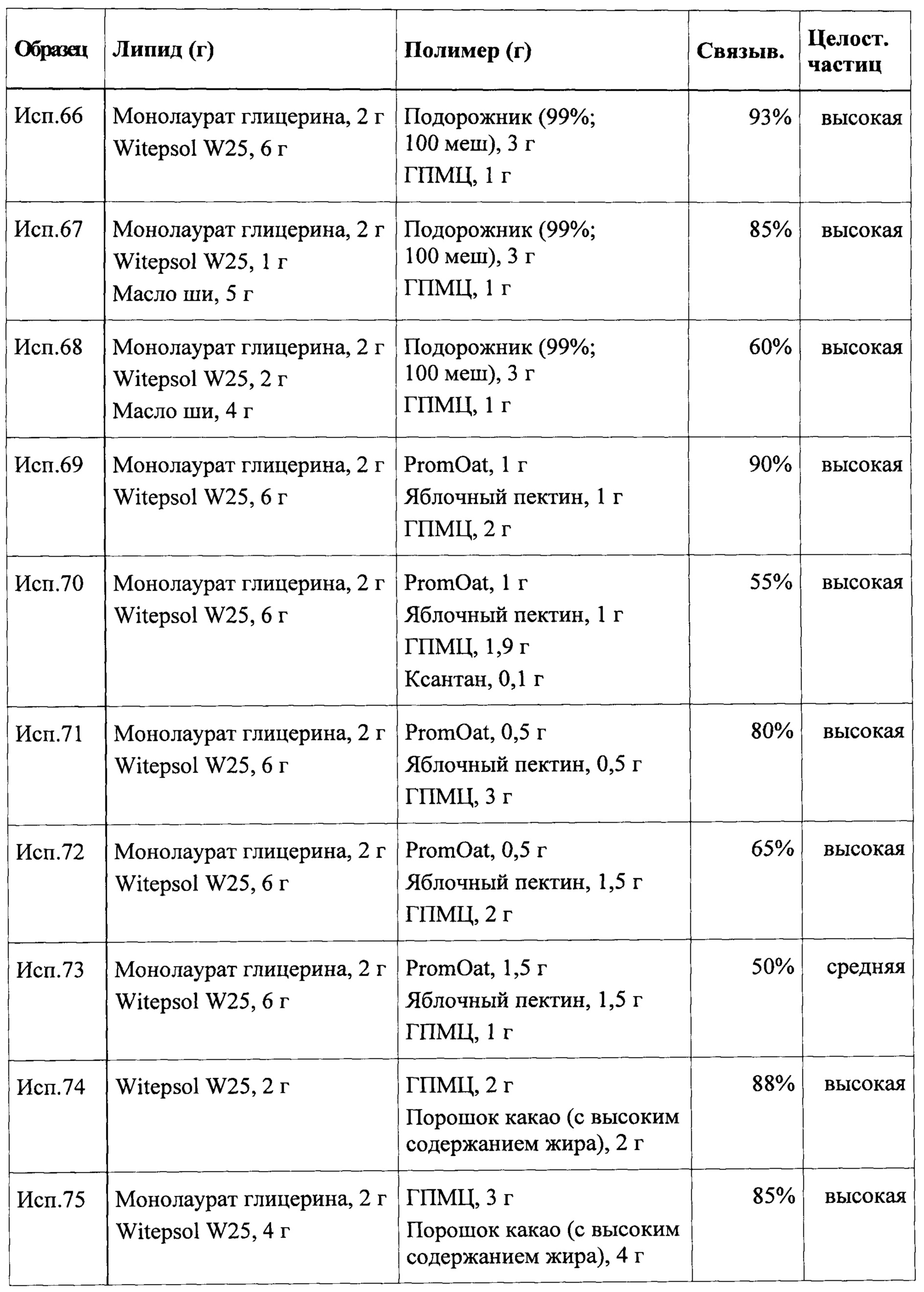
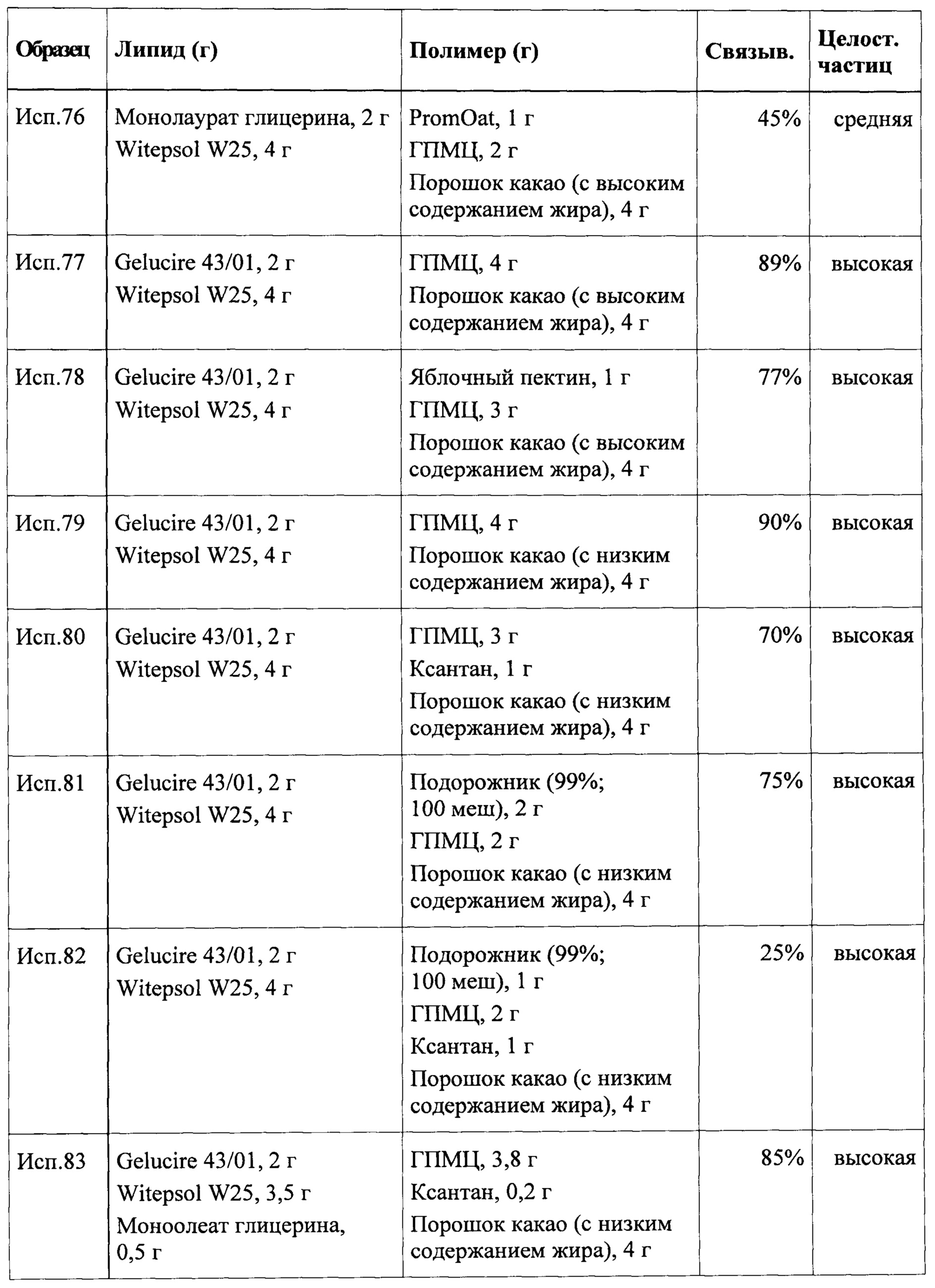
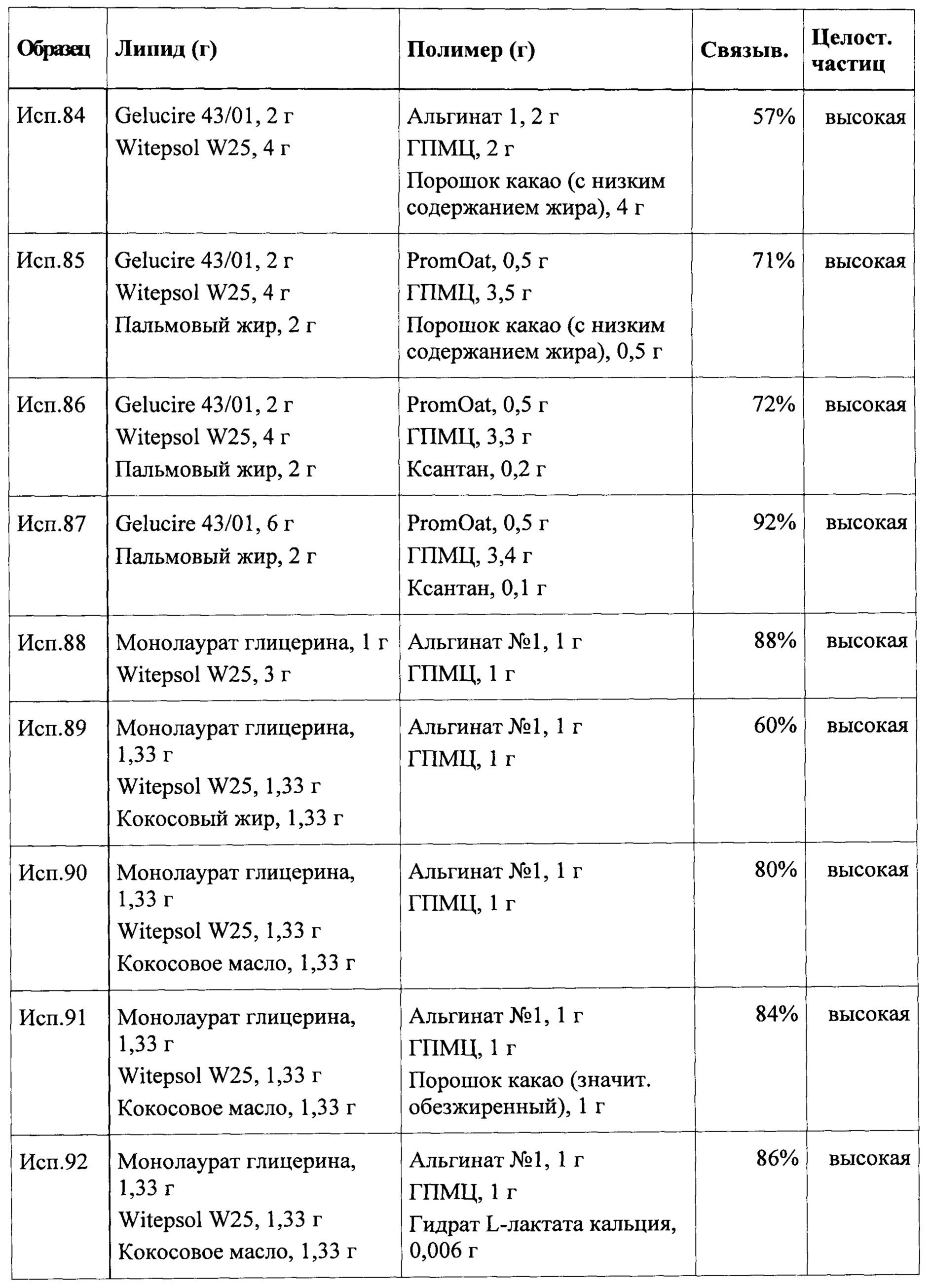
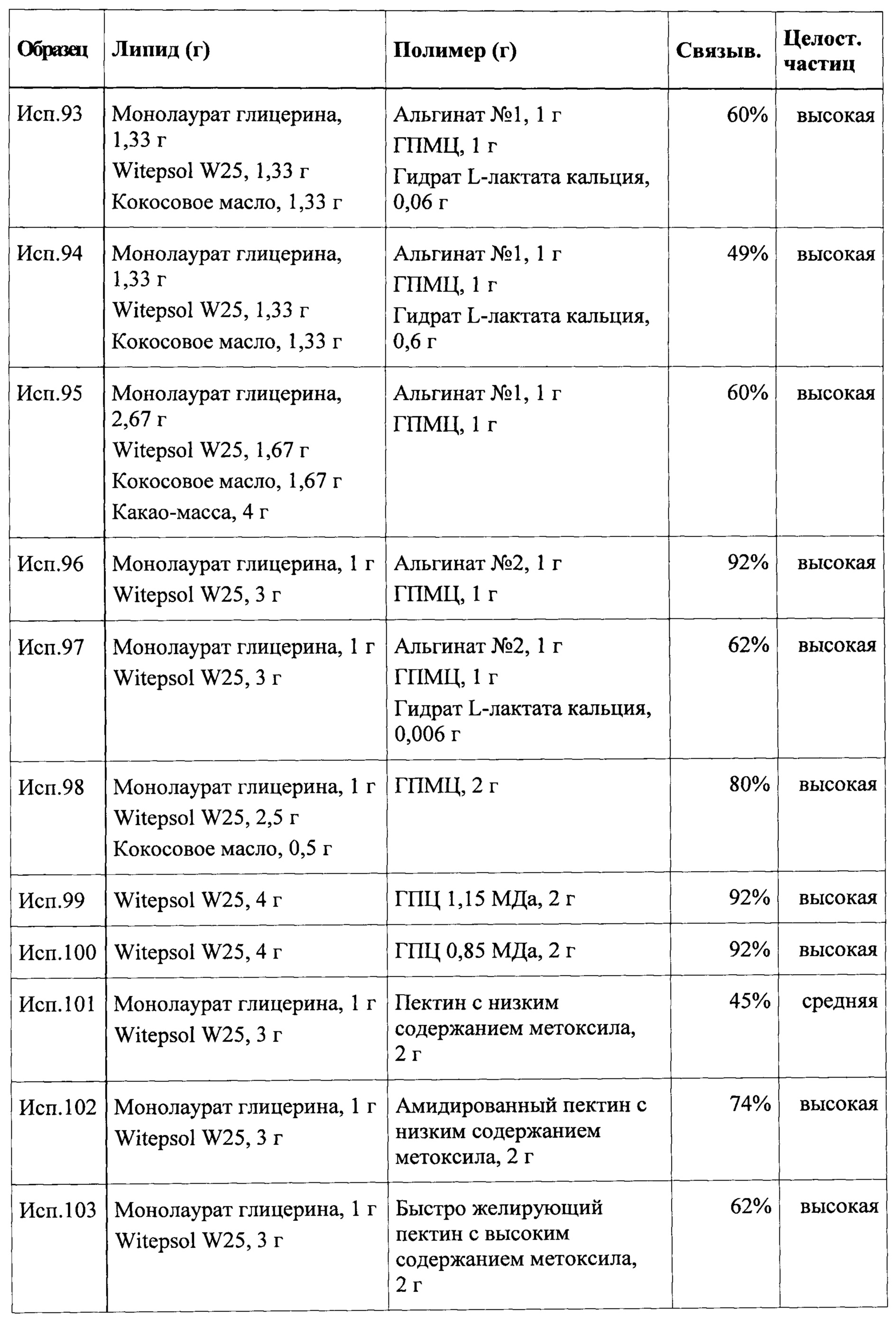
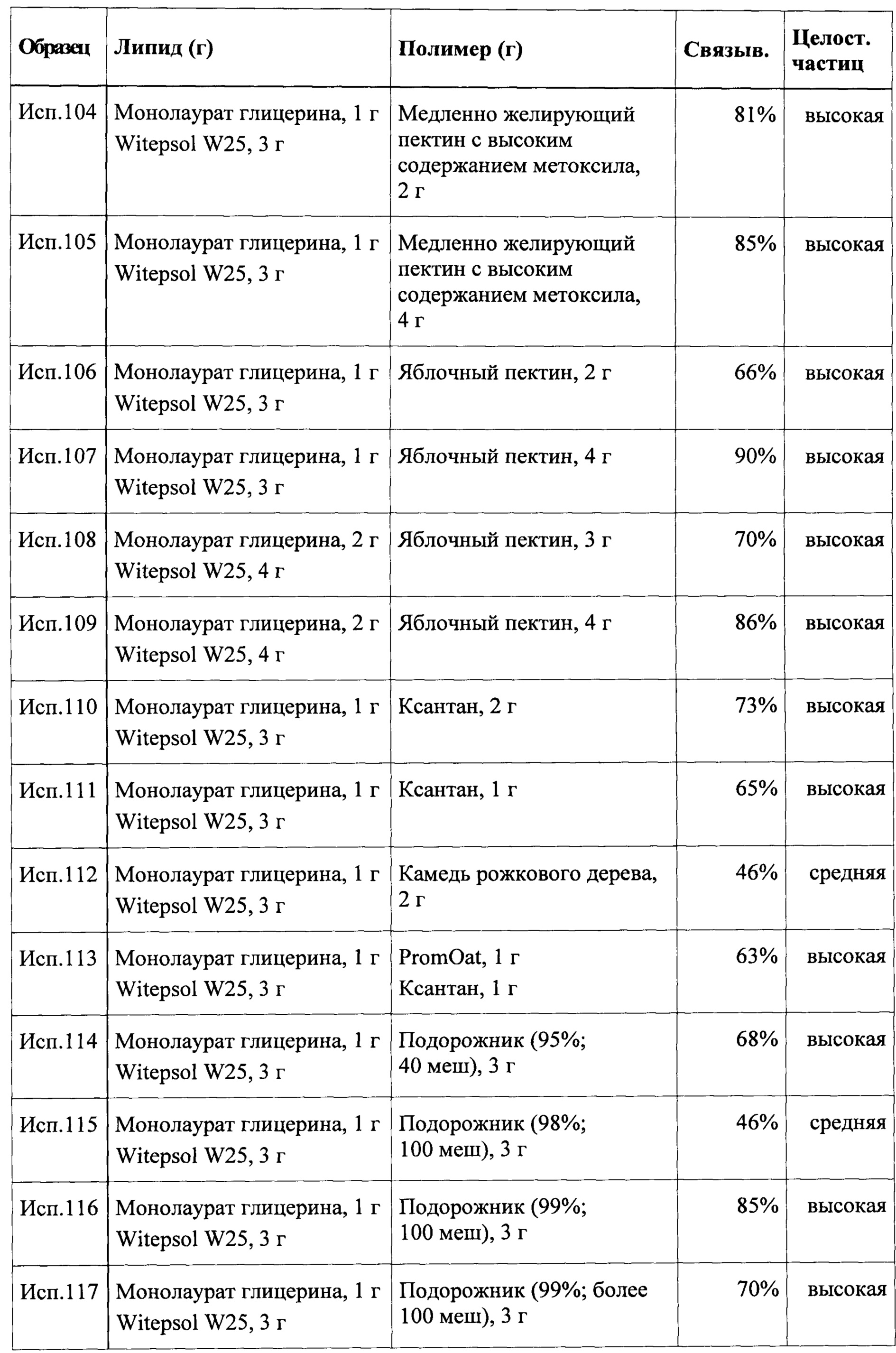
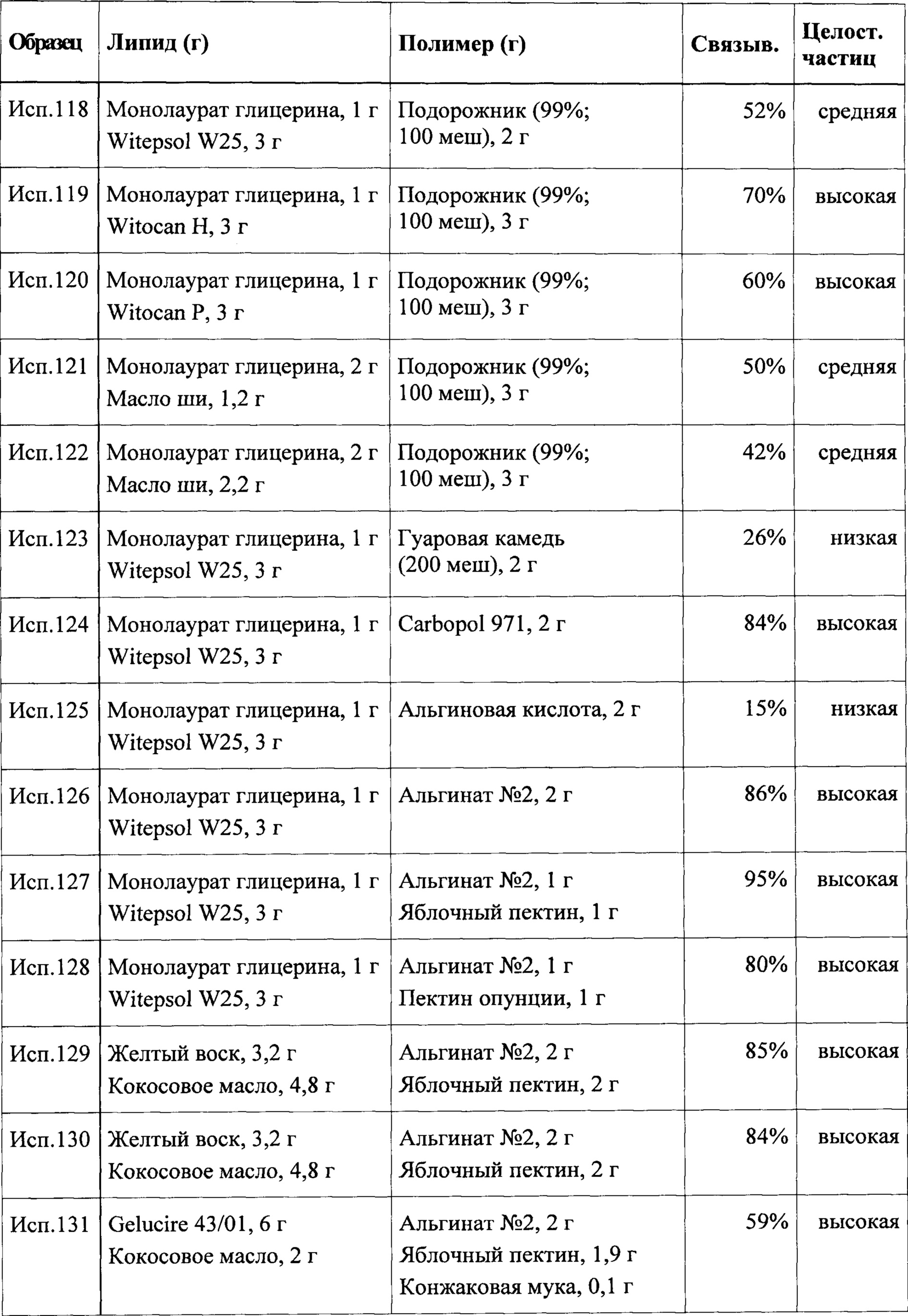
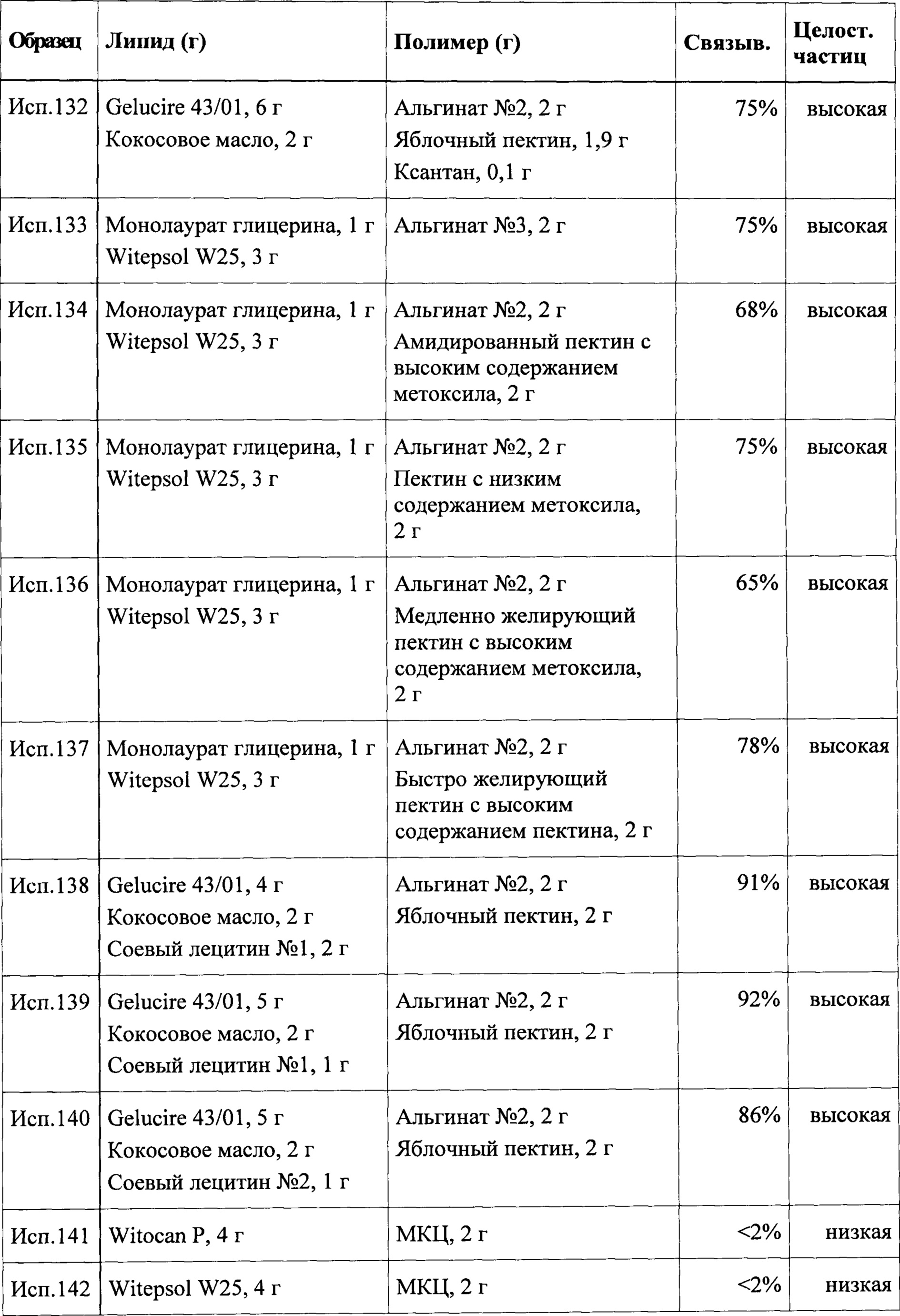
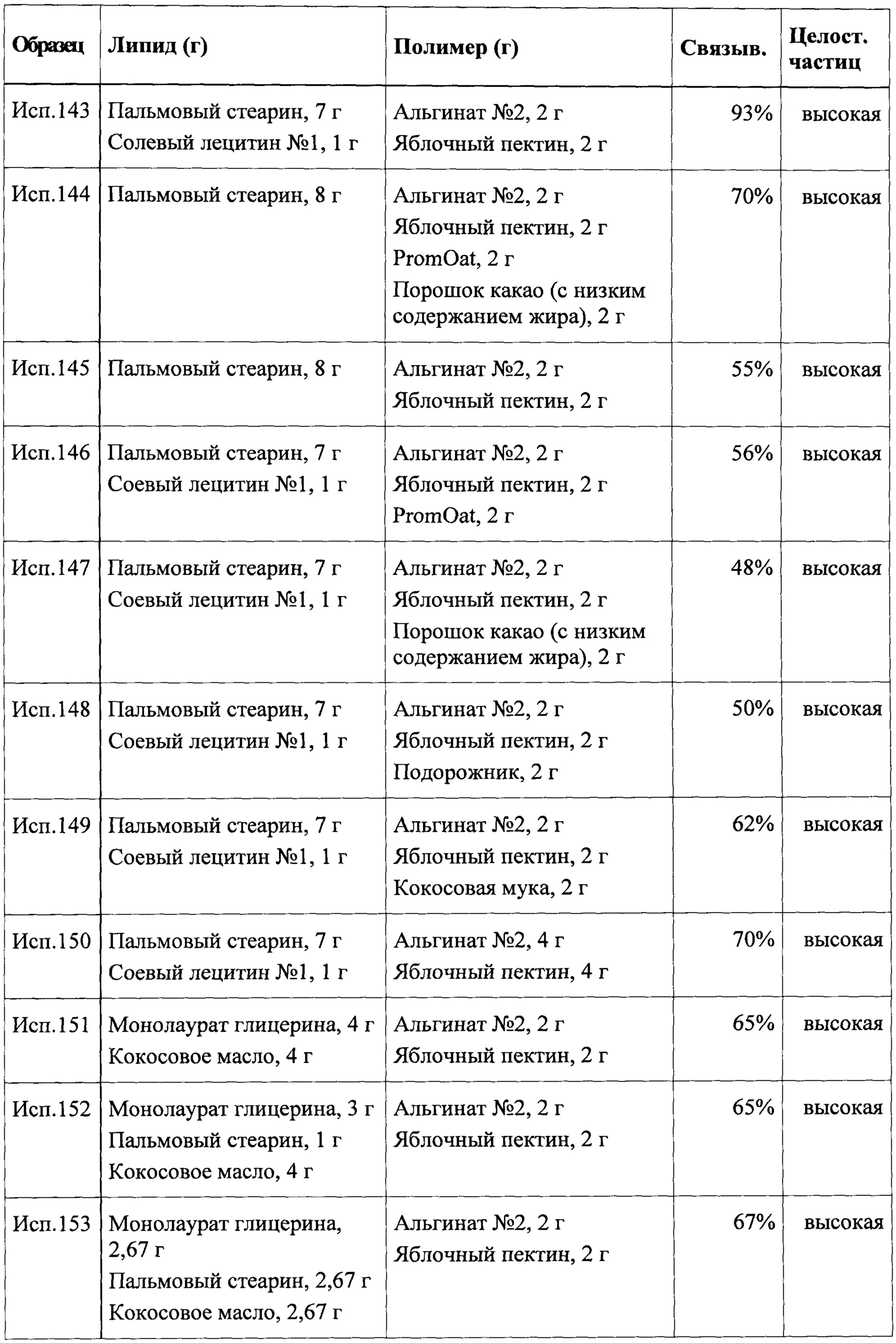
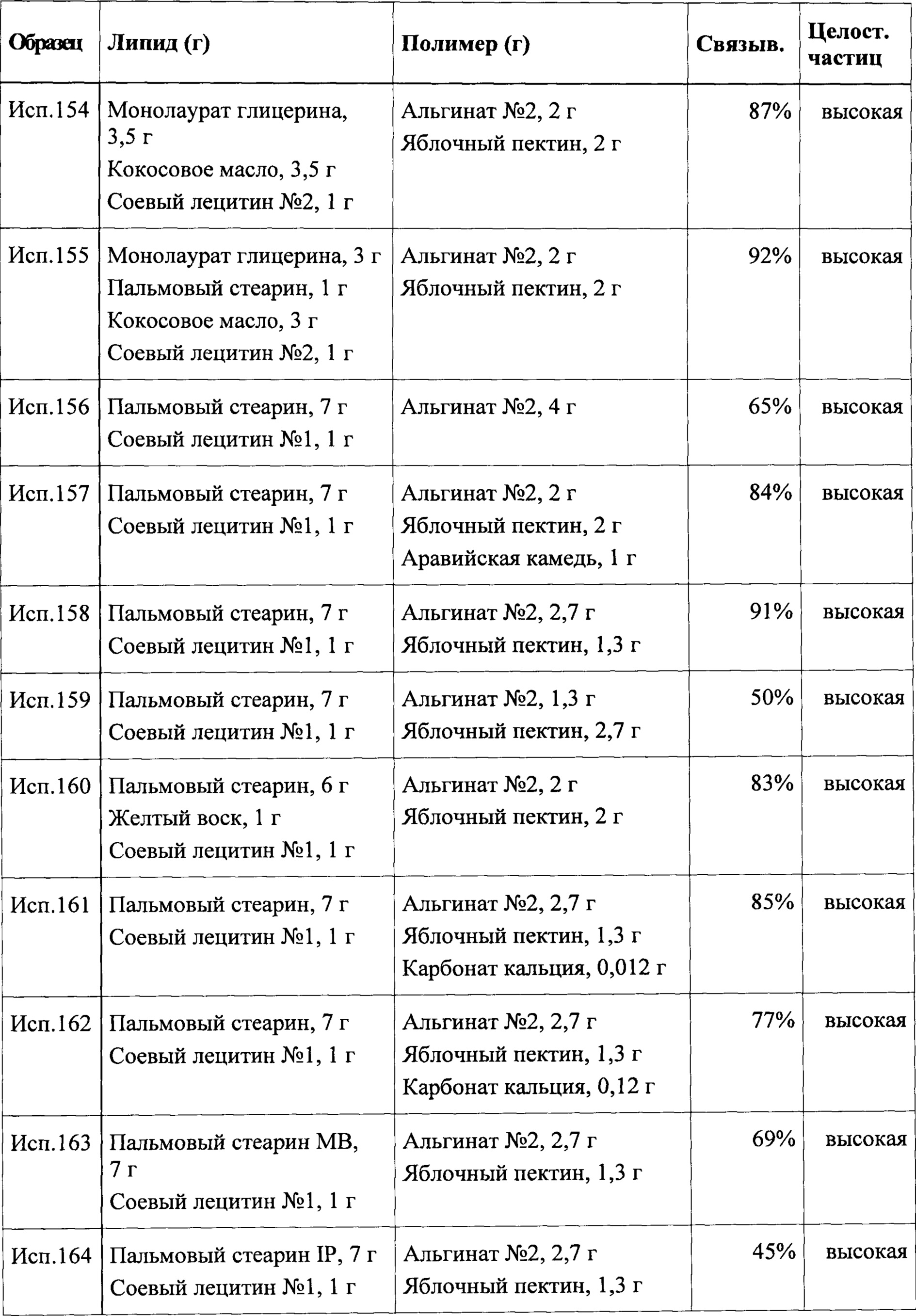
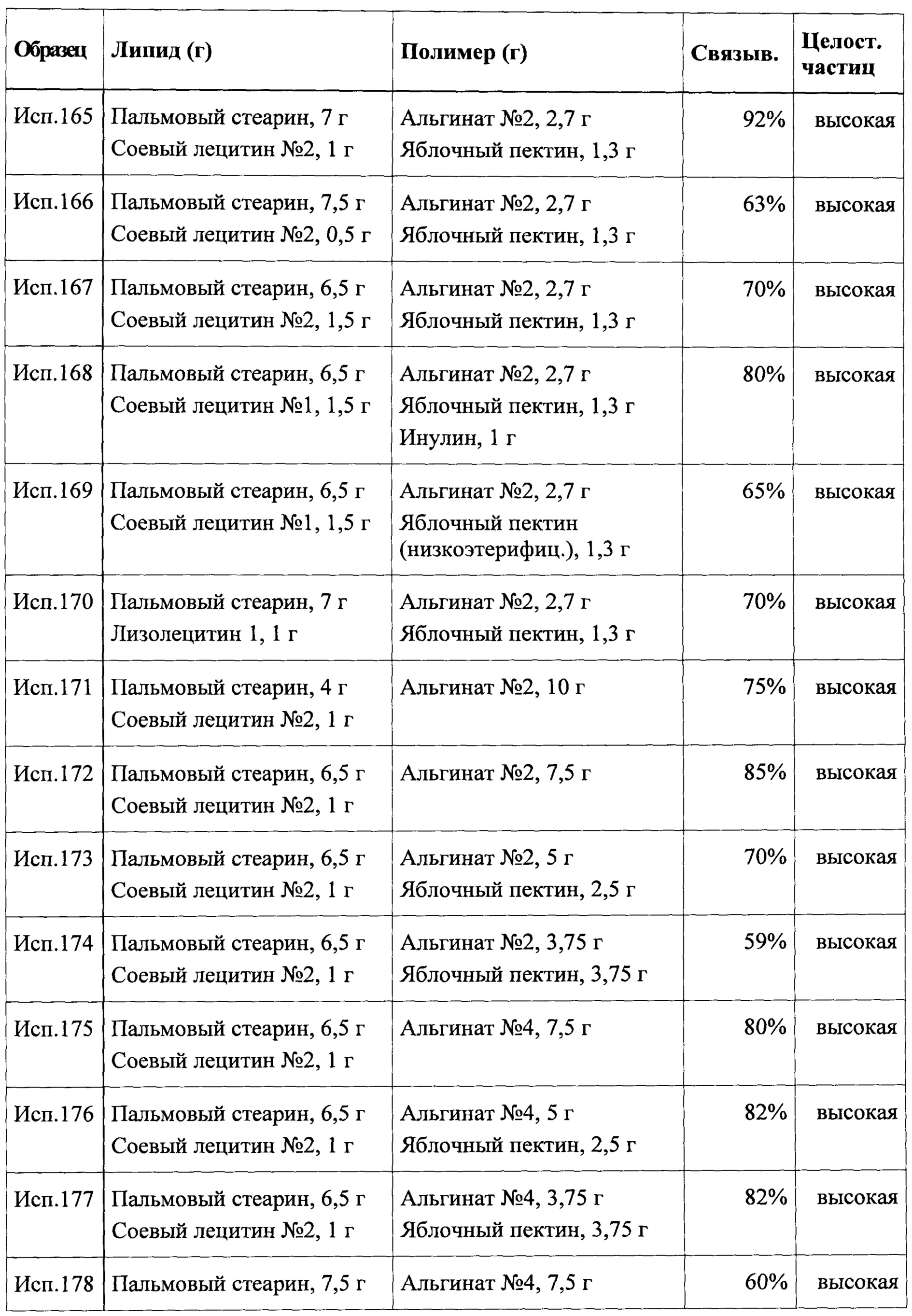
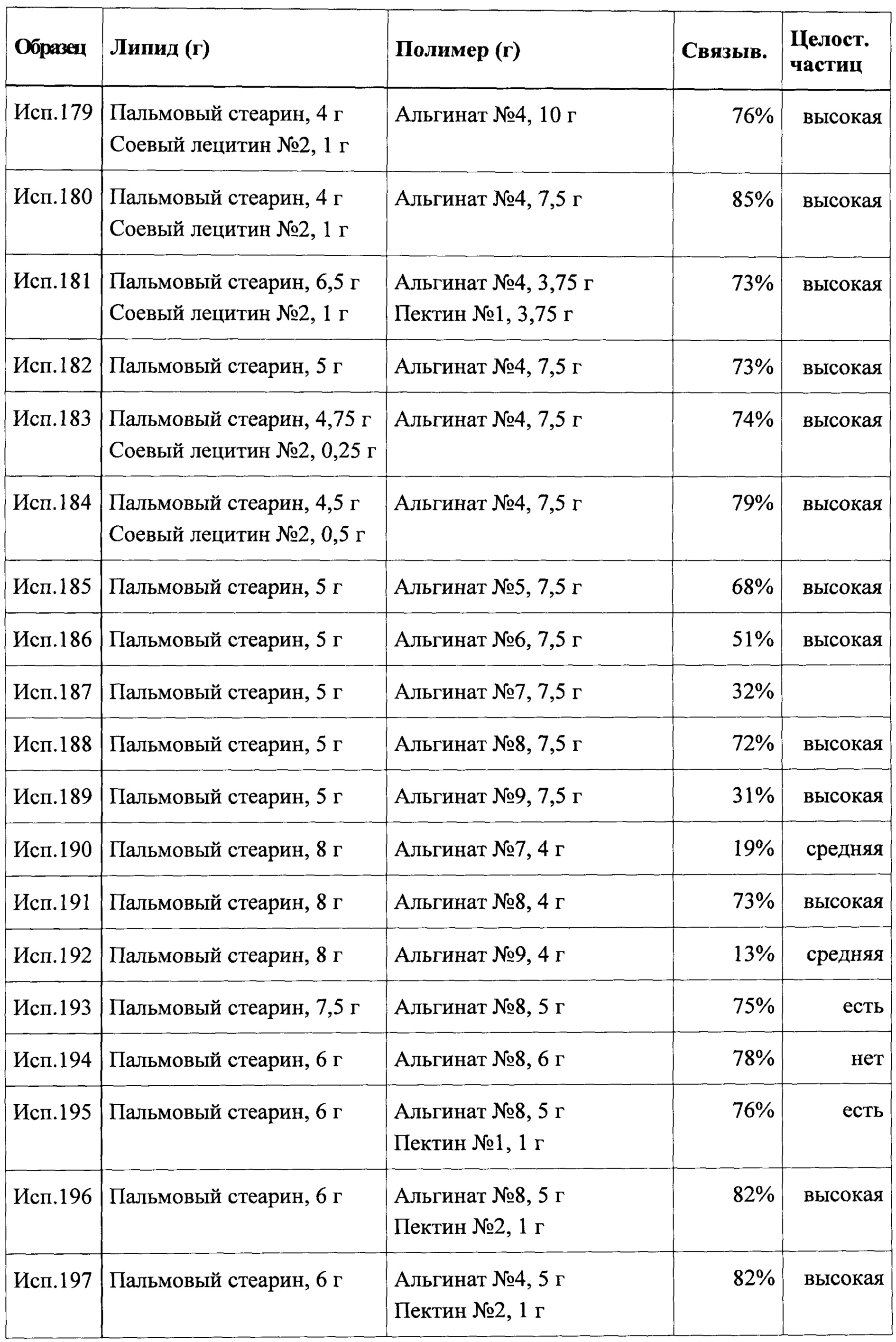
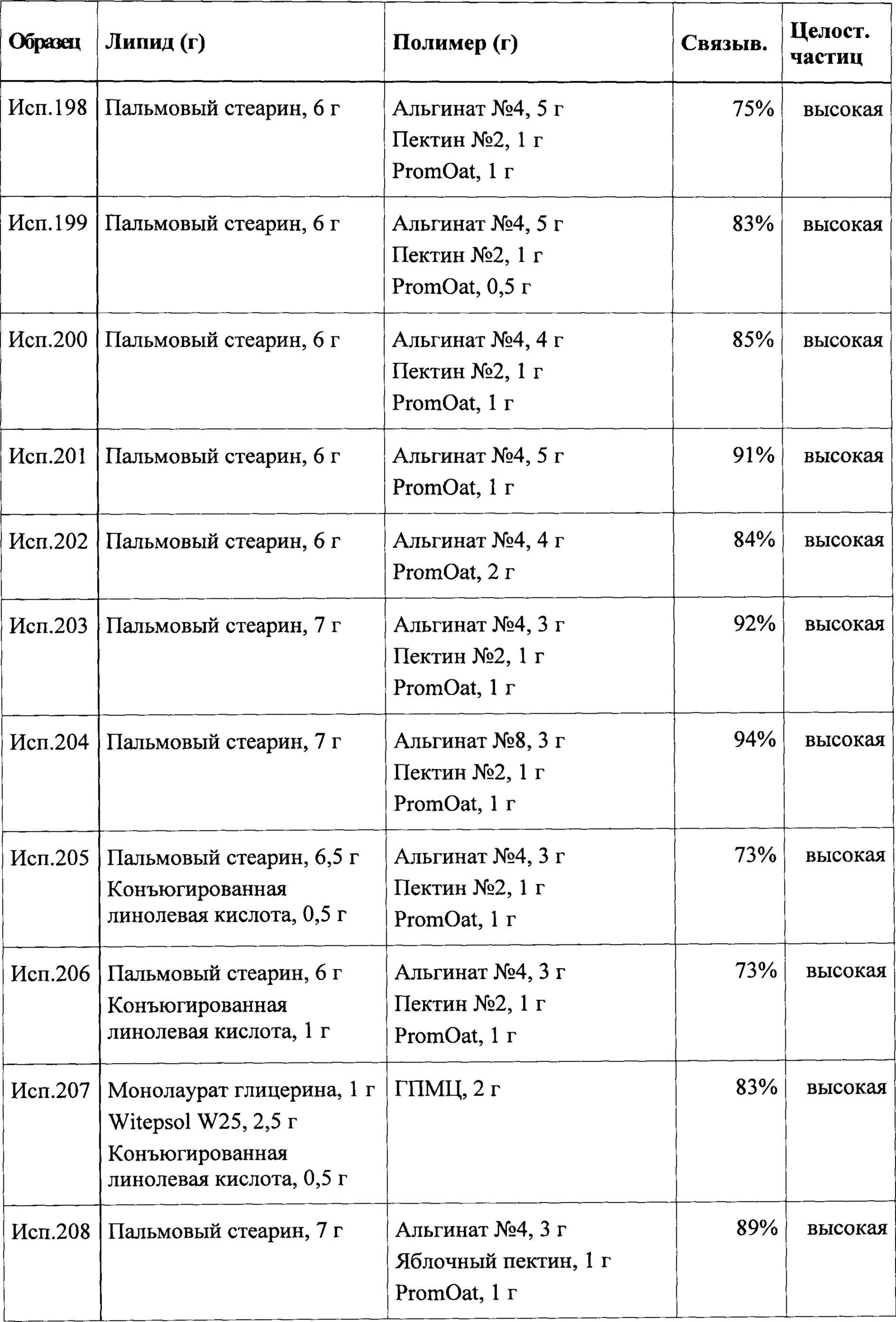
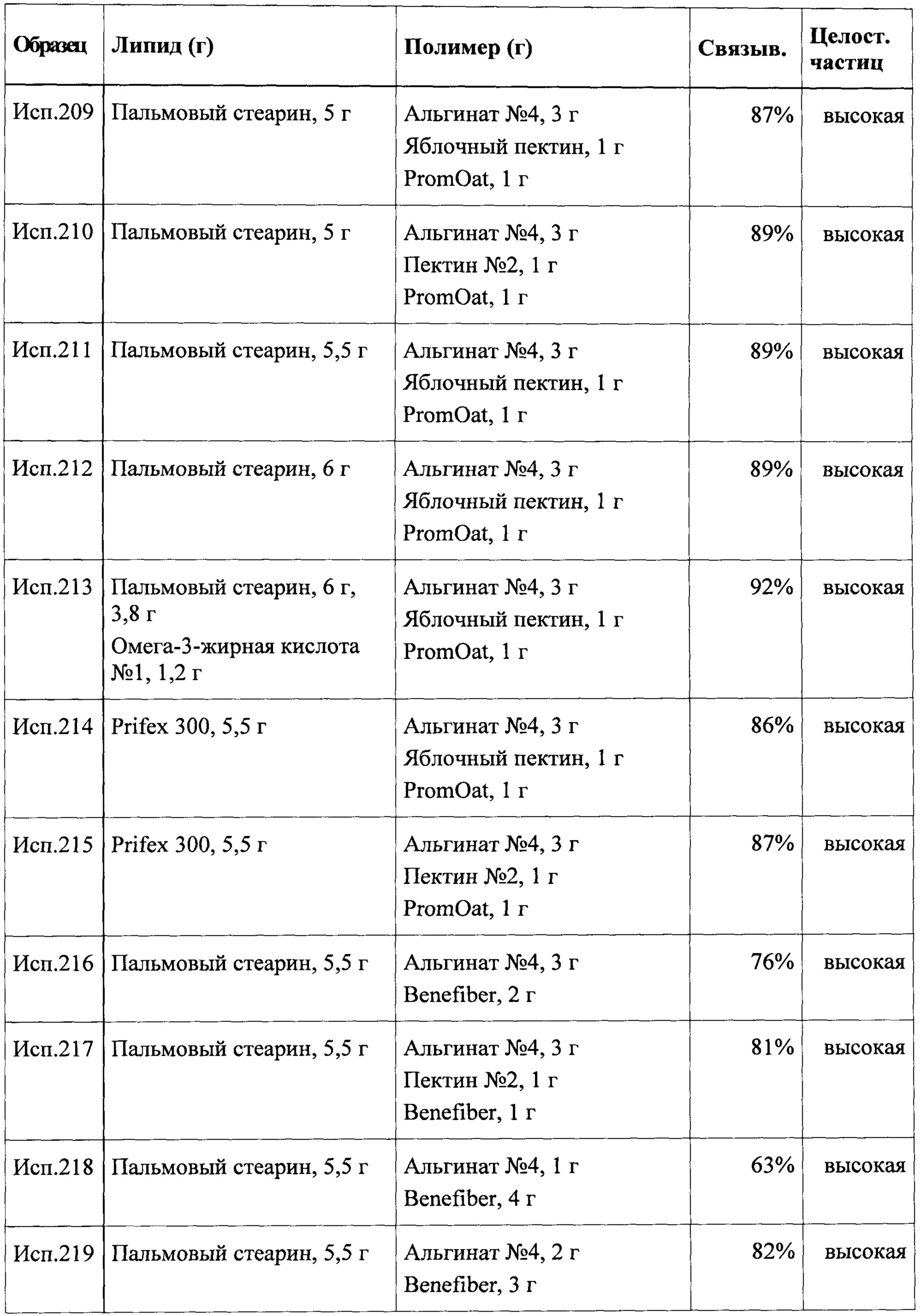
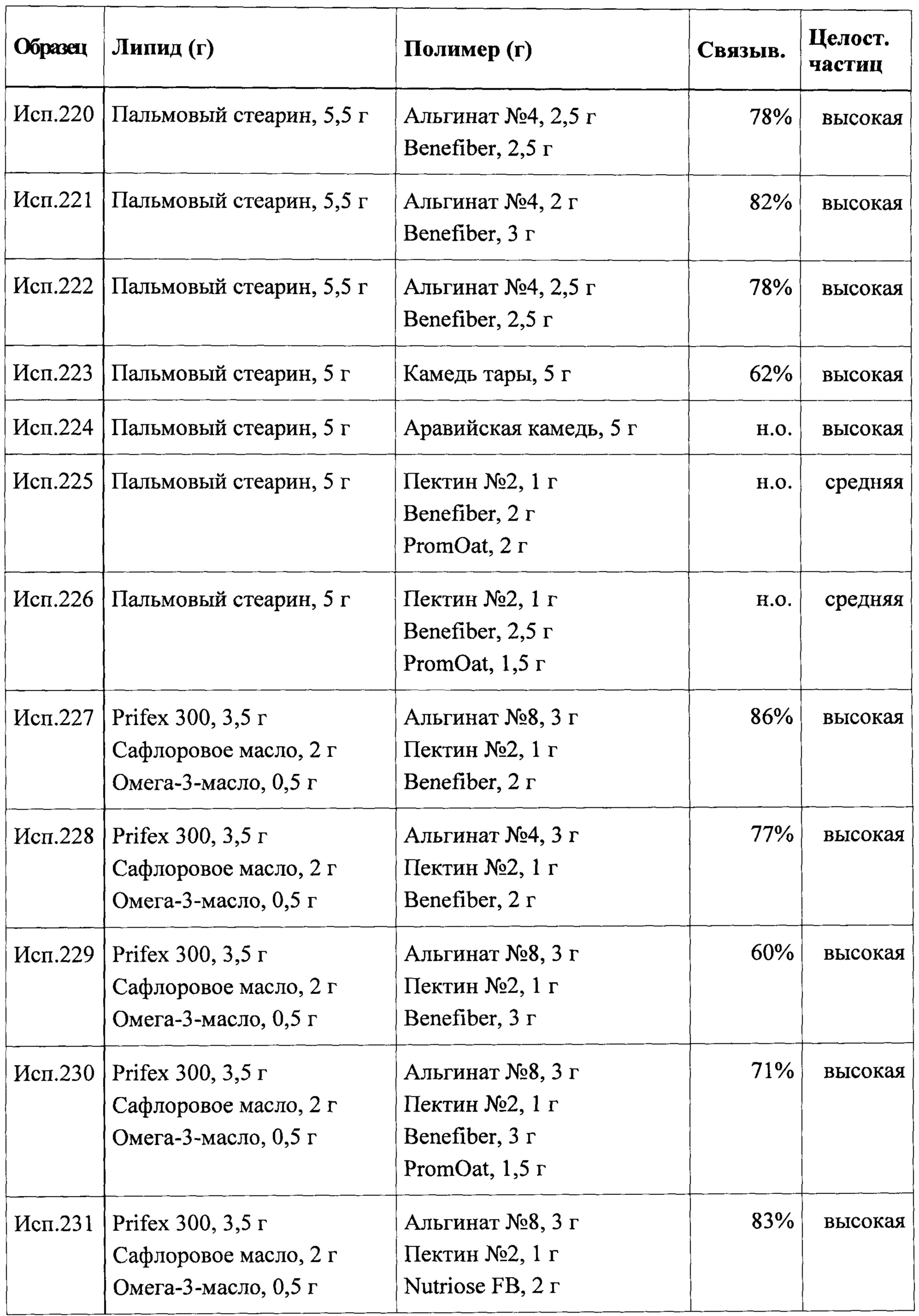

Пример 25: Получение предварительной смеси путем гранулирования с высоким сдвиговым усилием
4,5 кг твердого жира (Witepsol® W25, Cremer Oleo), 1,5 кг монолаурата глицерина (Mosselman, Belgium) и 3,0 кг ГПМЦ (Metolose 60SH, Shin Etsu, Japan) вводили в смеситель Ploughshare ( , Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 80 об/мин повышали температуру до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание и при этом останавливали нагревание и добавляли 2 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда после выпаривания диоксида углерода и использовали в качестве предварительной смеси в экспериментах с использованием экструзии. Когда процесс считали завершенным, полученные частицы гранулята сушили в вакууме при 25°С для удаления остаточной конденсированной воды; например, перед классификацией частиц.
, Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 80 об/мин повышали температуру до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание и при этом останавливали нагревание и добавляли 2 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда после выпаривания диоксида углерода и использовали в качестве предварительной смеси в экспериментах с использованием экструзии. Когда процесс считали завершенным, полученные частицы гранулята сушили в вакууме при 25°С для удаления остаточной конденсированной воды; например, перед классификацией частиц.
Пример 26: Получение предварительной смеси путем гранулирования с высоким сдвиговым усилием
3,0 кг твердого жира (Witepsol® W25, Cremer Oleo), 1,0 кг монолаурата глицерина (Mosselman, Belgium) вводили в смеситель Ploughshare ( , Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 80 об/мин повышали температуру до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 3,0 кг оболочек семян подорожника (Carepsyllium, Caremoli, Germany) и через 5 минут 2 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда после выпаривания диоксида углерода и использовали в качестве предварительной смеси в эксперименте с использованием экструзии 29. Когда процесс считали завершенным, полученные частицы гранулята сушили в вакууме при 25°С для удаления остаточной конденсированной воды; например, перед классификацией частиц.
, Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 80 об/мин повышали температуру до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 3,0 кг оболочек семян подорожника (Carepsyllium, Caremoli, Germany) и через 5 минут 2 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда после выпаривания диоксида углерода и использовали в качестве предварительной смеси в эксперименте с использованием экструзии 29. Когда процесс считали завершенным, полученные частицы гранулята сушили в вакууме при 25°С для удаления остаточной конденсированной воды; например, перед классификацией частиц.
Пример 27: Получение гранулята путем грануляции с высоким сдвиговым усилием
750 г твердого жира (Witepsol® W25, Cremer Oleo), 250 г монолаурата глицерина (Mosselman, Belgium) и 500 г ГПМЦ (Metolose® 60SH, Shin Etsu, Japan) вводили в смеситель Ploughshare ( , Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 200 об/мин повышали температуру в сосуде до 54°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 1 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда, необязательно сушили в вакууме при 25°С и пропускали через несколько проволочных сит (1,0 мм (меш 18) и 2,0 мм (меш 10) и 3,15 мм, VWR, Germany) с получением продукта. Получали материал, 51% (масс./масс.) которого составляла фракция частиц с размером 1,0-3,15 мм.
, Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 200 об/мин повышали температуру в сосуде до 54°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 1 кг колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда, необязательно сушили в вакууме при 25°С и пропускали через несколько проволочных сит (1,0 мм (меш 18) и 2,0 мм (меш 10) и 3,15 мм, VWR, Germany) с получением продукта. Получали материал, 51% (масс./масс.) которого составляла фракция частиц с размером 1,0-3,15 мм.
Пример 28: Получение гранулята путем грануляции с высоким сдвиговым усилием
900 г альгината (Satialgine®, Cargill, Germany), 60 г соевого лецитина (порошковый, Golden Peanut, Germany) и 540 г пальмового стеарина (пальмовый стеарин 54, Bressmer, Germany) вводили в смеситель Ploughshare ( , Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 200 об/мин повышали температуру в сосуде до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 440 г колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда, необязательно сушили в вакууме при 25°С и пропускали через несколько проволочных сит (1,0 мм (меш 18) и 2,0 мм (меш 10) и 3,15 мм, VWR, Germany) с получением продукта. Получали материал, 48% (масс./масс.) которого составляла фракция частиц с размером 1,0-3,15 мм.
, Germany), оборудованный нагревательной рубашкой. При непрерывном перемешивании при 200 об/мин повышали температуру в сосуде до 60°С до полного расплавления липидных компонентов. Продолжали перемешивание, при этом останавливали нагревание и добавляли 440 г колотого сухого льда в течение 5 минут. Полученный гранулят удаляли из сосуда, необязательно сушили в вакууме при 25°С и пропускали через несколько проволочных сит (1,0 мм (меш 18) и 2,0 мм (меш 10) и 3,15 мм, VWR, Germany) с получением продукта. Получали материал, 48% (масс./масс.) которого составляла фракция частиц с размером 1,0-3,15 мм.
Пример 29: Получение частиц путем экструзии
Предварительную смесь, полученную согласно протоколу эксперимента 26, содержащую 300 г твердого жира (Witepsol® W25, Cremer Oleo, Germany), 100 г монолаурата глицерина (Mosselman, Belgium) и 300 г оболочек семян подорожника (Carepsyllium, Caremoli, Germany), подавали при помощи волюметрической системы дозирования (Dosimex DO-50, Gabler, Germany) через отверстие для ввода порошка в двухшнековый экструдер (Extruder DE-40/10, Gabler, Germany) и экструдировали при температуре в диапазоне 30-35°С с получением нитей с диаметром 1,0 мм. Экструдированные нити нарезали на гранулы при помощи вращающихся ножей. Затем гранулам придавали округлую форму в сферонизаторе (Spheronizer 250, Gabler, Germany) с получением частиц с диаметром примерно 1 мм.
Пример 30: Получение частиц путем экструзии
Расплавленную предварительную смесь 187,5 г твердого жира (Witepsol® W25, Cremer Oleo, Germany), 356,25 г монолаурата глицерина (Mosselman, Belgium) и 206,25 г моноолеата глицерина (Mosselman, Belgium) получали в лабораторном стакане на разогретой плитке (при 80°С), оборудованной верхнеприводной мешалкой, и подавали при помощи перистальтического насоса (Masterflex®, Thermo Fisher, Germany) в одно из входных отверстий двухшнекового экструдера (Pharma 11 НМЕ, Thermo Fisher, Germany). Одновременно с этим порошковую предварительную смесь 256,25 г ГПМЦ (Metolose® 60SH, Shin Etsu, Japan) и 18,75 г ксантана (Xanthan FF, Jungbunzlauer, Switzerland) подавали при помощи волюметрической системы дозирования (Volumetric Single Screw Feeder, Thermo Fisher, Germany) через отверстие для ввода порошка в экструдер и экструдировали смесь при температуре в диапазоне 30-35°С с получением нитей с диаметром 1,5 мм, которые затем разрушали и придавали полученным частицам округлую форму в сферонизаторе (Caleva MBS 120, Thermo Fisher, Germany) с получением гранулята с диаметром примерно 1-2 мм.
Пример 31: Нанесение покрытия из смеси липида и эмульгатора на ядра
600 г гранулята, полученного согласно одному из примеров 27-30, помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1, Innojet, Germany, оборудованное резервуваром для продукта IPC3) и переводили в текучее состояние при температуре слоя 20°С с расходом воздуха 90 кубических метров/час. 105,0 г Dynasan® 115 и 45,0 г полисорбата 65 плавили в лабораторном стакане на горячей плитке (при 80°С), оборудованной верхнеприводной мешалкой. Горячий расплав распыляли на гранулят с использованием перистальтического насоса при помощи способа распыления «сверху» при скорости распыления 6,5 г/мин. В различные моменты времени собирали образцы с различным количеством покрытия, соответствующим 10, 15, 20 и 25% (масс./масс.).
Пример 32: Нанесение покрытия из смеси липида и гидроколлоида на ядра
600 г гранулята, полученного согласно одному из примеров 27-30, помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1, Innojet, Germany, оборудованное резервуваром для продукта IPC3) и переводили в текучее состояние при температуре слоя 20°С с расходом воздуха 90 кубических метров/час. 135 г Dynasan® 116 и 15 г гуаровой камеди (Careguar, Caremoli, Germany) нагревали на горячей плитке (при 80°С), оборудованной механической мешалкой. Горячий расплав распыляли на гранулят с использованием перистальтического насоса при помощи способа распыления «сверху» при скорости распыления 6,5 г/мин. В различные моменты времени собирали образцы с различным количеством покрытия, соответствующим 15 и 25% (масс./масс.).
Пример 33: Исследование мукоадгезивности гранулята с покрытием
На частицы гранулята, полученного согласно эксперименту 30, наносили покрытия различной толщины согласно экспериментальному способу 31, и проводили исследование мукоадгезивности согласно протоколу, описанному выше, с тем исключением, что кинетику связывания определяли до 30 минут.
Связывание образца гранулята, содержащего 10% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 6 минут. Связывание образца гранулята, содержащего 15% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 9 минут. Связывание образца гранулята, содержащего 20% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 12 минут. Связывание образца гранулята, содержащего 25% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 25 минут.
Пример 34: Исследование мукоадгезивности гранулята с покрытием
На частицы гранулята, полученного согласно эксперименту 30, наносили покрытия различной толщины согласно экспериментальному способу 32, и проводили исследование мукоадгезивности согласно протоколу, описанному выше, с тем исключением, что кинетику связывания определяли до 30 минут.
Связывание образца гранулята, содержащего 15% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 14 минут. Связывание образца гранулята, содержащего 20% (масс./масс.) покрытия, в желудке свиньи достигало максимума через 25 минут.
Пример 35: Получение гранулята путем экструзии
Предварительную смесь, полученную согласно протоколу эксперимента 26, содержащую 224 г пальмового стеарина (пальмовый стеарин 54, Juchem, Germany), 96 г альгината (Satialgine®, Cargill, France) 32 г пектина (Aglupectin® HS-RVP, Silvateam, Italy) и 32 г бета-глюкана овса (PromOat®, Tate & Lyle, Sweden), подавали при помощи волюметрической системы дозирования (Dosimex DO-50, Gabler, Germany) через отверстие для ввода порошка в двухшнековый экструдер (Extruder DE-40/10, Gabler, Germany, эксплуатируемый при 7 об/мин) и экструдировали при температуре в диапазоне 10-12°С с получением нитей с диаметром 1,5 мм. Экструдированные нити нарезали на гранулы с длиной 0,8-2,5 мм при помощи вращающихся ножей (рабочая скорость 100 об/мин). Предварительную смесь с количественным выходом превращали в экструдат в течение менее чем 5 минут.
Пример 36: 10 кг партия гранулята с покрытием
Предварительную смесь получали путем плавления 8,25 кг пальмового стеарина (пальмовый стеарин 54, Bressmer, Germany) в кастрюле на индукционной плите. Когда температура расплава достигала 60°С, вводили 4,5 кг альгината натрия (Satialgine®, Cargill, France), 1,5 г препарата из волокон овса (PromOat®, Tate&Lyle, Sweden) и 1,5 кг пектина (Pektin HV, Golden Peanut, Germany) при помощи ложки. Смесь переносили в виде нескольких аликвот в пластиковые пакеты с застежкой и охлаждали до комнатной температуры с получением твердых пластин. Пластины липид-полимер дополнительно охлаждали в морозильной камере, установленной на -18°С, и затем измельчали с получением частиц с размером примерно 5 мм и менее при помощи блендера (Vitamix®, Vita-Mix Corp., USA). Полученную предварительную смесь подавали при помощи волюметрической системы дозирования (Dosimex DO-50, Gabler, Germany) через отверстие для ввода порошка в двухшнековый экструдер (Extruder DE-40/10, Gabler, Germany, эксплуатируемый при 10 об/мин) и экструдировали при температуре в диапазоне 10-12°С с получением нитей с диаметром 1,5 мм. Экструдированные нити нарезали на гранулы с длиной 0,8-2,5 мм при помощи вращающихся ножей (рабочая скорость 100 об/мин). Предварительную смесь с количественным выходом превращали в экструдат в течение менее чем 5 минут. Экструдат переносили в пластиковые пакеты аликвотами по 990 г и хранили при -18°С. В каждый пакет добавляли 9,9 г порошка PromOat® и тщательно перемешивали с экструдатом. Затем гранулы необязательно сушили в вакууме при 25°С и проводили классификацию с использованием проволочных сит 2 мм (меш 10) и 1,0 мм (меш 18). Перемешивали классифицированные гранулы и разделяли на аликвоты по 600 г. Аликвоты помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1, Innojet, Germany, оборудованное резервуаром для продукта IPC3) и переводили в текучее состояние при температуре слоя 20°С с расходом воздуха 80 кубических метров/час. 120 г Dynasan® 115 плавили в лабораторном стакане на горячей плитке (при 90°С), оборудованной верхнеприводной мешалкой. Горячий расплав количественно распыляли на гранулят с использованием перистальтического насоса при помощи способа распыления «сверху» при скорости распыления 6,5 г/мин. Объединяли аликвоты и получали всего 10 кг гранулята с покрытием, который хранили в пластиковом контейнере.
Пример 37: Гранулят с покрытием
Получали четырнадцать кг предварительной смеси в виде семи партий по 2 кг в каждой. Для каждой партии 0,9 кг пальмового стеарина (Prifex® 300, Unimills, The Netherlands) и 0,1 кг льняного масла (manako BIO  human, Makana, Germany) переводили в расплав в кастрюле на индукционной плитке. Когда температура расплава достигала 60°С, вводили 0,3 кг альгината натрия (Alginex®, Kimica, Japan), 0,1 кг препарата из волокон овса (PromOat®, Tate&Lyle, Sweden) и 0,1 кг пектина (Aglupectin® HS-RVP, Silva, Italy) при помощи ложки. Смесь переносили в виде нескольких аликвот в пластиковые пакеты с застежкой и охлаждали до комнатной температуры с получением твердых пластин. Пластины липид-полимер дополнительно охлаждали в морозильной камере, установленной на -18°С, и затем измельчали с получением частиц с размером примерно 5 мм и менее при помощи блендера (Vitamix® Professional 750, Vita-Mix Corp., USA). Полученную предварительную смесь подавали при помощи волюметрической системы дозирования (Dosimex DO-50, Gabler, Germany) через отверстие для ввода порошка в двухшнековый экструдер (Extruder DE-40/10, Gabler, Germany, эксплуатируемый при 10 об/мин) и экструдировали при температуре в диапазоне порядка 30°С с получением нитей с диаметром 1,0 мм. Экструдированные нити нарезали на гранулы с длиной 0,8-2,5 мм при помощи вращающихся ножей (рабочая скорость 100 об/мин). Экструдат переносили в пластиковые пакеты в виде нескольких аликвот и хранили при -18°С. Затем гранулы необязательно сушили в вакууме при 25°С и проводили классификацию при помощи проволочных сит (Atechnik, Germany) 2 мм (меш 10) и 1,0 мм (меш 18). Материал, удерживавшийся на сите 2 мм, измельчали при помощи домашнего блендера (MK55300, Siemens, Germany) и повторно классифицировали при помощи нескольких проволочных сит. Выход классифицированных гранул с размером в диапазоне 1-2 мм после их объединения составлял 9,0 кг, их разделяли на аликвоты по 600 г. Партии (одна аликвота на цикл, пятнадцать циклов) помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1, Innojet, Germany, оборудованное резервуаром для продукта IPC3) и переводили в текучее состояние при температуре слоя 20°С с расходом воздуха 65 м3/ч. В каждом цикле 120 г пальмового стеарина (Prifex® 300, Unimills, The Netherlands) плавили в лабораторном стакане на горячей плитке (при 100°С), оборудованной верхнеприводной мешалкой. Горячий расплав количественно распыляли на гранулят с использованием перистальтического насоса при помощи способа распыления «сверху» при скорости распыления 6,5 г/мин. Объединяли партии и получали всего 10,67 кг гранулята с покрытием, который хранили в пластиковом контейнере.
human, Makana, Germany) переводили в расплав в кастрюле на индукционной плитке. Когда температура расплава достигала 60°С, вводили 0,3 кг альгината натрия (Alginex®, Kimica, Japan), 0,1 кг препарата из волокон овса (PromOat®, Tate&Lyle, Sweden) и 0,1 кг пектина (Aglupectin® HS-RVP, Silva, Italy) при помощи ложки. Смесь переносили в виде нескольких аликвот в пластиковые пакеты с застежкой и охлаждали до комнатной температуры с получением твердых пластин. Пластины липид-полимер дополнительно охлаждали в морозильной камере, установленной на -18°С, и затем измельчали с получением частиц с размером примерно 5 мм и менее при помощи блендера (Vitamix® Professional 750, Vita-Mix Corp., USA). Полученную предварительную смесь подавали при помощи волюметрической системы дозирования (Dosimex DO-50, Gabler, Germany) через отверстие для ввода порошка в двухшнековый экструдер (Extruder DE-40/10, Gabler, Germany, эксплуатируемый при 10 об/мин) и экструдировали при температуре в диапазоне порядка 30°С с получением нитей с диаметром 1,0 мм. Экструдированные нити нарезали на гранулы с длиной 0,8-2,5 мм при помощи вращающихся ножей (рабочая скорость 100 об/мин). Экструдат переносили в пластиковые пакеты в виде нескольких аликвот и хранили при -18°С. Затем гранулы необязательно сушили в вакууме при 25°С и проводили классификацию при помощи проволочных сит (Atechnik, Germany) 2 мм (меш 10) и 1,0 мм (меш 18). Материал, удерживавшийся на сите 2 мм, измельчали при помощи домашнего блендера (MK55300, Siemens, Germany) и повторно классифицировали при помощи нескольких проволочных сит. Выход классифицированных гранул с размером в диапазоне 1-2 мм после их объединения составлял 9,0 кг, их разделяли на аликвоты по 600 г. Партии (одна аликвота на цикл, пятнадцать циклов) помещали в устройство с псевдоожиженным слоем (Ventilus V-2.5/1, Innojet, Germany, оборудованное резервуаром для продукта IPC3) и переводили в текучее состояние при температуре слоя 20°С с расходом воздуха 65 м3/ч. В каждом цикле 120 г пальмового стеарина (Prifex® 300, Unimills, The Netherlands) плавили в лабораторном стакане на горячей плитке (при 100°С), оборудованной верхнеприводной мешалкой. Горячий расплав количественно распыляли на гранулят с использованием перистальтического насоса при помощи способа распыления «сверху» при скорости распыления 6,5 г/мин. Объединяли партии и получали всего 10,67 кг гранулята с покрытием, который хранили в пластиковом контейнере.
Пример 38: Получение гранул, содержащих триптофан
Гранулы получали путем плавления 2 г монолаурата глицерина (Mosselman, Belgium) и 2 г моноолеата глицерина 40 (TCI, Belgium) при 55°С. При помощи механического перемешивания вводили L-триптофан (1 г, TCI, Belgium), гидроксипропилметилцеллюлозу (Metolose® 90SH-100000SR, Harke, Germany) и ксантановую камедь (0,5 г, Solegraells, Spain). Композицию переносили в пакет с застежкой и охлаждали до -18°С в морозильной камере. Сначала материал разбивали молотком, измельчали в гранулят при помощи кухонного блендера (Bosch ProfiMIXX, Germany), необязательно сушили в вакууме при 25°С и затем классифицировали, пропуская через несколько проволочных сит (VWR International, Germany), с получением гранул с размером менее 1,0 мм и более 0,5 мм.
200 мг образца гранул, содержащих триптофан, суспендировали в 22 мл искусственного желудочного сока для имитации условий натощак (FaSSGF) при 37°С и перемешивали (шейкер ST5 производства CAT, Germany). FaSSGF получали путем растворения 1 г NaCl (Sigma-Aldrich) в 450 мл воды, добавления 30 мг порошка ИКС (biorelevant.com), регулировки рН до 2,0 при помощи 0,1 н. HCl (Sigma-Aldrich) и добавления воды до конечного объема 500 мл. Отбирали аликвоты надосадочной жидкости с 15-минутными интервалами и определяли концентрацию триптофана путем измерения поглощения при длине волны 280 нм с использованием устройства NanoDrop® 2000 (Thermo Scientific, USA). Высвобождение триптофана происходило согласно кинетике первого порядка, и период полувысвобождения составлял 20 минут.
200 мг образца гранул, содержащих триптофан, суспендировали в 22 мл искусственного желудочного сока для имитации условий натощак (FaSSGF) при 37°С и перемешивали (шейкер ST5 производства CAT, Germany). FaSSGF получали путем растворения 0,21 г пеллеты NaOH (Sigma-Aldrich), 3,09 г NaCl (Sigma-Aldrich) и 1,98 г моногидрата дигидрофосфата натрия (Sigma-Aldrich) в 450 мл воды, добавления 1,12 г порошка ИКС (biorelevant.com), регулировки рН до 6,5 и добавления воды до конечного объема 500 мл. Отбирали аликвоты надосадочной жидкости с 15-минутными интервалами и определяли концентрацию триптофана путем измерения поглощения при длине волны 280 нм с использованием устройства NanoDrop® 2000 (Thermo Scientific, USA). Высвобождение триптофана происходило согласно кинетике первого порядка, и период полувысвобождения составлял 15 минут.
Контроль триптофана
30 мг порошка триптофана суспендировали в 22 мл FaSSGF при 37°С и перемешивали (шейкер ST5 производства CAT, Germany). Отбирали аликвоты с 5-минутными интервалами и количественно определяли концентрацию триптофана путем измерения поглощения при длине волны 280 нм с использованием устройства NanoDrop® 2000 (Thermo Scientific, USA). Количественное растворение триптофана происходило через 10 минут.

