Результат интеллектуальной деятельности: БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к новым бициклическим гетероциклическим соединениям, к фармацевтическим композициям, включающим указанные соединения, и применению указанных соединений в лечении заболеваний, например, рака.
УРОВЕНЬ ТЕХНИКИ
Семейство IAP
Семейство белков ингибиторов апоптоза (IAP) включает 8 членов, XIAP, cIAP1, cIAP2, NAIP, ILP2, ML-IAP, сурвивин и BRUCE (также известный как apollon). Было показано, что члены семейства IAP ингибируют апоптоз через свою способность непосредственно ингибировать членов каспазного семейства апоптотических ферментов, несмотря на то, что точная роль всех 8 членов должна все еще полностью не определена. Общим структурным признаком всех членов семейства IAP являются цинк-связывающая складка из ~70 аминокислот, называемая доменом повтора бакуловирусного IAP (BIR), присутствующая в одной - трех копиях.
Множество взаимодействий между IAP и другими белками опосредуются через поверхностную борозду на домене BIR. Домены BIR могут быть классифицированы по их пептид-связывающей специфичности. Существует три типа доменов BIR; домены типа III (способный к связыванию каспазных (и каспазаподобных) пептидов со специфичностью для пролина в третьем положении (P3) (например, XIAP BIR3), домены типа II (как домены типа III, но с отсутствующей специфичностью для пролина, например, XIAP BIR2) и домены типа 1 (которые не связываются с каспазами или подобными пептидами, например, XIAP BIR1) (Eckelman et al. Cell Death and Differentiation 2008; 15: 920-928). BIRs являются маленькими (~70 аминокислот), Zn-координируемыми доменами, и множество белков используют свой N-конец для взаимодействия с бороздами доменов BIR. Антагонисты BIR предотвращают связывание каспаз с BIRs, и, следовательно, приводят к повышенной активности каспазы, таким образом, вызывая аутоубиквитинилирование и протеасомальную деградацию IAP.
IAP суперэкспрессируются при многих случаях рака, включая случаи рака почек, меланому, рака толстой кишки, легкого, молочной железы, яичника и предстательной железы (Tamm et al., Clin. Cancer Research 2000; 6(5): 1796-803), и участвуют в росте, патогенезе и резистентности опухоли к химио- и лучевой терапии (Tamm 2000).
XIAP
XIAP является белком размером 57 кДа с тремя доменами BIR, второй и третий из которых связывают каспазы и цинковый палец типа RING (лигаза E3). XIAP связывает несколько белков в дополнение к каспазам, включая субстраты лигирования, такие как TAK1 и кофактор TAB1, MURR1, участвующий в гомеостазе меди (Burstein et al., EMBO 2004; 23: 244-254), эндогенные ингибиторы, такие как второй митохондриальный активатор каспаз (SMAC), и таковые с менее ясной функцией, такие как MAGE-D1, NRAGE (Jordan et al., J. Biol. Chem. 2001; 276: 39985-39989).
Домен BIR3 связывает и ингибирует каспазу 9, апикальную каспазу в митохондриальном пути активации каспазы. Борозда на поверхности домена BIR3 взаимодействует с N-концом малой субъединицы каспазы 9, захватывая каспазу-9 в ее неактивной мономерной форме с некомпетентным каталитическим сайтом (Shiozaki et al., Mol. Cell 2003; 11: 519-527).
В дополнение к связыванию каспазы, XIAP также ингибирует апоптоз через другие механизмы. XIAP формирует комплекс с киназой TAK1 и ее кофактором TAB1, что приводит к активации JNK и путей трансдукции сигнала MAPK, что в свою очередь приводит к активации NF-κB (Sanna et al., Mol Cell Biol 2002; 22: 1754-1766). XIAP также активирует NF-κB путем промотирования транслокации NF-κB в ядро и деградации IκB (Hofer-Warbinek et al., J. Biol. Chem. 2000; 275: 22064-22068, Levkau et al., Circ. Res. 2001; 88: 282-290).
Клетки, трансфицированные XIAP, могут блокировать программируемую гибель клеток в ответ на множество апоптотических стимулов (Duckett et al., EMBO 1996; 15: 2685-2694, Duckett et al., MCB 1998; 18: 608-615, Bratton, Lewis, Butterworth, Duckett and Cohen, Cell Death and Differentiation 2002; 9: 881-892).
XIAP повсеместно экспрессируется во всех нормальных тканях, но он патологически увеличен при многих случаях острой и хронической лейкемии, раке предстательной железы, легкого, почек и других типах опухолей (Byrd et al., 2002; Ferreira et al., 2001; Hofmann et al., 2002; Krajewska et al., 2003; Schimmer et al., 2003; Tamm et al., 2000). При de novo остром миелоидном лейкозе (AML) экспрессия XIAP коррелирует с миеломоноцитарными французско-американско-британскими (FAB) подтипами M4/M5 (P <0,05) и экспрессией моноцитарных маркеров во взрывах AML. Кроме того, было обнаружено, что XIAP суперэкспрессируется в нормальных моноцитах, но не выявляется в гранулоцитах. При AML экспрессия XIAP была значительно ниже у пациентов с благоприятной, но не с промежуточной или плохой цитогенетикой (n=74; P<0,05) (Tamm et al., Hematol. J. 2004; 5(6): 489-95).
Суперэкспрессия делает клетки резистентными к мультиагентной терапии и ассоциируется с плохим клиническим исходом заболевания, включая AML, рак почек, меланому (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803) и рак легких (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
XIAP транслируется кэп-независимым механизмом инициации трансляции, опосредуемым уникальной последовательностью участка внутренней посадки рибосомы (IRES), расположенной в его 5'-нетранслируемых областях. Это позволяет мРНК XIAP активно транслироваться в условиях клеточного стресса, когда клеточный синтез белка по большей части ингибируется. Повышающая регуляция трансляции XIAP в ответ на стресс увеличивает резистентность к вызванной облучением гибели клеток (Holcik et al., Oncogene 2000; 19: 4174-4177).
Ингибирование XIAP было исследовано in vitro несколькими методами, включая сайленсинг РНК, генный нокаут, миметики пептидного лиганда и антагонисты малой молекулы, и было показано, что оно промотирует апоптоз при монотерапии и сенсибилизирует к химиотерапии многие типы опухоли, включая опухоли мочевого пузыря (Kunze et al., 2008; 28 (4B): 2259-63). Мыши с нокаутом по XIAP рождаются с ожидаемой Менделевской частотой без очевидных физических или гистологических дефектов и имеют нормальные продолжительности жизни (Harlin et al., Mol. Cell Biol. 2001; 21(10): 3604-3608). Это показывает, что отсутствие активности XIAP не токсично в нормальных тканях и предлагает терапевтическое окно в отношении опухолевых клеток. Дальнейшие исследования показали, что XIAP является критическим дискриминатором между апоптозом в клетках типа 1 и типа 2, включая гепатоциты, и поэтому должен использоваться с осторожностью у пациентов с состояниями печени в анамнезе (Jost et al., Nature, 2009, 460, 1035-1041). Было отмечено, что уровни cIAP1 и cIAP2 положительно регулируются у мышей с нокаутом по XIAP и могут защитить от патологии через компенсационный механизм, что позволяет предположить, что для функционального нокаута может требоваться пан-ингибирование. Точно так же мыши с нокаутом по cIAP1 и cIAP2 так же не проявляют симптомов (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56). В то время как отсутствие любого из IAP не приводит к явному фенотипу у мышей, делеция cIAP1 с cIAP2 или XIAP приводит к средней эмбриональной летальности (Moulin, EMBO J., 2012).
Эндогенные антагонисты IAP, такие как SMAC, использовались для утверждения членов этой семейства в качестве мишеней терапевтических агентов. Пептиды SMAC хемосенсибилизировали опухолевые клетки, и в комбинации с препаратами платины и связанным с Фактором Некроза Опухоли-α апоптоз-индуцирующим лигандом (TRAIL) в ксенотрансплантатах, приводили к задержке роста опухоли (Fulda et al., Nat. Med. 2002; 808-815; Yang et al., Cancer Res. 2003; 63: 831-837).
Натуральный продукт, эмбеллин, был идентифицирован как связывающийся на поверхностной борозде домена BIR3 XIAP с аффинностью, подобной натуральному пептиду SMAC. Эмбеллин индуцирует апоптоз в клеточных линиях in vitro и приводит к задержке роста опухоли ксенотрансплантатов (Nikolovska-Coleska et al., J. Med. Chem. 2004; 47(10): 2430-2440; Chitra et al., Chemotherapy 1994; 40: 109-113).
XIAP антисмысловые олигонуклеотиды разрабатывались как терапевтические агенты для лечения солидных опухолей и гематологических злокачественных образований. Было показано, что эти антисмысловые олигонуклеотиды снижают уровни экспрессии белка на ~70%, индуцируют апоптоз и сенсибилизируют клетки к химиотерапии in vitro и задерживают рост опухоли in vivo. Один из этих агентов, AEG351156, был изучен в клинических испытаниях (Hu et al., Clin. Cancer Res. 2003; 9: 2826-2836; Cummings et al., Br. J. Cancer 2005; 92: 532-538).
Разработанные малые молекулы-антагонисты XIAP включают пептидомиметики, а также синтетические агенты. Пептидомиметики предназначаются для домена BIR3, имитируя разрушение SMAC связывания каспазы-9 с XIAP, демонстрируют индукцию апоптоза во множестве линий опухолевых клеток в качестве единственного агента, а также как хемосенсибилизаторы, и далее исследуются клинически (Oost et al., J. Med. Chem. 2004; 47: 4417-4426; Sun et al., Bioorg. Med. Chem. Lett. 2005; 15: 793-797).
Синтетические малые молекулы-антагонисты доменов BIR3 и BIR2 также демонстрируют протовоопухолевую активность в нескольких различных моделях, включая индукцию апоптоза окрашиванием аннексином-V и IC50<10 мкМ против более чем одной трети панели клеточной линии NCI60. Антагонисты XIAP также индуцировали дозозависимую гибель клеток первичной культуры клеток лейкемии в 5 из 5 клеточных линий хронического лимфолейкоза и в 4 из 5 клеточных линий острого миелоидного лейкоза (Schimmer et al., Cancer Cell 2004; 5: 25-35; Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Высокие уровни белка XIAP в линиях опухолевых клеток коррелировали обратно пропорционально с чувствительностью к некоторым лекарственным средствам против рака, в частности, к цитарабину и другим нуклеозидам (Tamm et al., Clin. Cancer Research 2000; 6: 1796-1803). Ингибирование XIAP потенцирует TRAIL-индуцированную противоопухолевую активность в двух преклинических моделях рака поджелудочной железы in vivo (Vogler 2008). Исследования экспрессии гена и трансфекции позволяют предположить, что увеличенная экспрессия супрессора апоптоза XIAP играет важную роль в резистентности к аноикозу и в выживании циркулирующих человеческих клеток рака предстательной железы, таким образом промотируя метастазирование. Было обнаружено, что малые молекулы-антагонисты оказывали в этих моделях антиметастатическое действие (Berezovskaya et al., Cancer Res. 2005; 65(6): 2378-86).
Также было обнаружено, что XIAP участвует в других проводящих путях, связанных с раком и другими заболеваниями, и они могут также подвергаться лечению агентами, предназначенными для XIAP. E3 лигазная активность домена пальца RING XIAP может связываться как с TAB1, так и с расположенным выше рецептором BMP (тип 1), что позволяет предпоожить, что XIAP может участвовать в опосредуемом TGF-β сигнальном пути (Yamaguchi et al., EMBO 1999; 179-187). Было показано, что суперэкспрессия киназы фокальной адгезии (FAK) приводит к положительно регулируемой экспрессии XIAP (Sonoda et al., J. Biol. Chem. 2000; 275: 16309-16315). Лигазы E3 являются привлекательными терапевтическими мишенями, и были разработаны молекулы, нацеливаемые на эту активность в других белках, такие как MDM2 (Vassilev et al., Science 2004; 303: 844-848). Прямое или непрямое ингибирование активности лигазы XIAP может также быть полезным в лечении рака и других заболеваний. Разрегулированный апоптотический сигнальный путь, который может быть следствием ингибирования функции IAP в контроле программируемой гибели клеток, также участвует во многих заболеваниях, включая нарушения, связанные с аккумуляцией клеток (например, рак, аутоиммунитет, воспаление и рестеноз), или нарушения, в которых чрезмерный уровень апоптоза приводит к потере клеток (например, инсульт, сердечная недостаточность, нейродегенерация, такая как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, СПИД, ишемия (инсульт, инфаркт миокарда) и остеопороз).
XIAP является важным апоптотическим регулятором в экспериментальном аутоиммунном энцефаломиелите и потенциальной фармакологической мишенью для лечения аутоиммунных заболеваний, таких как рассеянный склероз (MS) (Moore et al., 2004; 203(1): 79-93). Антисмысловой нокдаун XIAP обращает паралич в животных моделях MS, что позволяет предположить, что лечение, предназначенное для XIAP и, возможно, других IAP, может быть полезно в лечении MS (Hebb et al., Curr. Drug Disc. Tech. 2008; 5(1): 75-7).
cIAP1, cIAP-2, XIAP и сурвивин суперэкспрессируются в злокачественной плевральной мезотелиоме и ответственны за значительную степень резистентности культивируемых клеток мезотелиомы к цисплатину. Уровни циркуляции TNF-α значительно выше у пациентов с мезотелиомой до хирургического уменьшения объема опухоли по сравнению с пациентами после хирургии. TNF-α увеличивает содержания мРНК и белка IAP-1, IAP-2 и XIAP (Gordon et al., 2007). Повышающая регуляция NF-κB играет важную роль в выживании мезотелиом в ответ на воспалительные эффекты, вызванные действием волокон асбеста (Sartore-Bianchi et al., 2007). Антагонисты IAP имеют потенциал для изменения эффекта провыживания TNF-α.
Способность клеточных линий положительно регулировать экспрессию TNF альфа в достаточной степени, чтобы действовать аутокринным образом и убить клетки после истощения cIAP 1 и 2, считается важной для активности IAP (Cancer Nature Reviews (2010), 10 (8), 561-74, Gryd-Hansen, M). In vivo, однако, некоторые типы опухоли окружены сетью провоспалительных цитокинов, и следовательно, эти опухолевые клетки, которые после истощения cIAP1/2 переключаются на убийство клеток апоптозом, могут быть переключены на апоптоз действием TNF альфа (или другими цитокиновыми агонистами Рецептора смерти), уже продуцированного окружающими клетками в микросреде опухоли, такими как связанные с опухолью макрофаги, или самими опухолевыми клетками. Некоторые типы опухолей, такие как опухоли молочной железы, яичника и меланома, показывают этот «воспалительный фенотип», который мог потенциально может быть мишенью для антагонистов IAP.
cIAP1 и cIAP2
Клеточные IAP (cIAP) 1 и 2 являются тесно связанными членами семейства IAP с тремя доменами BIR, доменом RING и доменом рекрутирования каспазы (CARD). Функциональный ядерный экспортный сигнал существует в домене CARD cIAP1, который, по-видимому, важен для клеточной дифференцировки (Plenchette et al., Blood 2004; 104: 2035-2043). Наличие этого домена CARD уникально для cIAP1 и cIAP2 в семействе белков IAP. Эти два гена находятся в тандеме на хромосоме 11q22, и учитывая их высокую степень подобия, считаются возникшими в результате дупликации гена.
cIAP1, как XIAP и сурвивин, широко экспрессируется в линиях опухолевых клеток и, как было обнаружено, экспрессируется с высокими уровнями при раке ободочной и прямой кишки, в частности, а также раке легкого, яичника, почек, ЦНС и молочной железы (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Экспрессия cIAP2 обычно более ограничена и, как считается, регулируется конститутивным убиквитинилированием и деградацией cIAP1 (Conze et al., Mol. Biol. Cell 2005; 25(8): 3348-56; Mahoney et al., PNAS 2008; 105: 11778-11783). Анализ иммуногистохимии и вестерн-блотинг идентифицировали cIAP1 и cIAP2 как потенциальные онкогены, поскольку оба суперэкспрессируются при множественных заболеваниях раком легких с или без более высокого числа копий (Dai et al., Human Mol. Genetics 2003; 12(7): 791-801). Уровень экспрессии cIAP1, по-видимому, играет важную роль на низших стадиях аденокарциномы (Hofmann et al., J. Cancer Res. Clin. Oncology 2002; 128(10): 554-60).
Увеличенные уровни cIAP1 и cIAP2 и уменьшенные уровни эндогенных ингибиторов связаны с хеморезистентностью, как было показано для XIAP. Было обнаружено, что суперэкспрессия cIAP коррелирует in vitro с резистентностью к ДНК-алкилирующим агентам, таким как карбоплатин, цисплатин и ингибитор топоизомеразы VP-16 (Tamm et al., Clin. Cancer Res. 2000; 6: 1796-1803). Было обнаружено, что уровни cIAP1 и сурвивина были высокими в раковых клетках щитовидной железы после лечения доксорубицином и цисплатином. Клетки, резистентные к химиотерапии, такой как терапия таксолом, показывали уменьшенную экспрессию SMAC и высвобождали минимальные количества этого белка из митохондрии. Было обнаружено, что даун-регуляция cIAP1 и сурвивина увеличивала цитотоксичность цисплатина и доксорубицина, тогда как суперэкспрессия SMAC улучшала эффективность таксола. Однако сайленсинг cIAP1 и сурвивина путем интерференции РНК восстанавливал чувствительность к доксорубицину и цисплатину (Tirrò et al.; Cancer Res. 2006; 66(8): 4263-72).
Миметики SMAC, такие как LBW242, как первоначально считалось, прежде всего нацелены XIAP. Однако исследования показали, что cIAP1 нацеливался для деградации путем аутоубиквитинилирования в клетках (Yang et al., J. Biol. Chem. 2004; 279(17): 16963-16970), и, возможно, в результате способствовал апоптотическим эффектам. Было обнаружено, что siРНК cIAP1 и индукция (или стимуляция) фактора некроза опухоли (TNF) - альфа действуют синергически и делают клеточные линии более чувствительными (Gaither et al. Cancer Res. 2007; 67 (24): 11493-11498).
Было продемонстрировано, что cIAP1 и cIAP2 являются критическими регуляторами сигнального пути NF-Bκ, участвующего в широком диапазоне биологических процессов, в частности, во врожденном и приобретенном иммунитете, а также в пролиферации и выживании. Дерегуляция пути NF-Bκ связана с воспалением и раковыми образованиями, включая гепатит и неспецифический язвенный колит, гастрит, гепатоцеллюлярный рак, рак ободочной и прямой кишки и рак желудка, а также ангиогенез и метастазирование (Shen et al., Apoptosis 2009; 14: 348-363).
В связывании лиганда рецептор TNF (TNF-R) рекрутирует TNFR-ассоциированный домен смерти (TRADD) и взаимодействующий с рецептором белок (RIP) 1. TRAF2 и cIAP1/cIAP2 затем рекрутируются для формирования большого мембранного комплекса. RIP1 убиквитинируется, и эти цепочки полиубиквитина служат состыковывающимся местом для даунстрим киназ, приводя к сигнальным эффектам пути NF-κB (Ea et al., Mol. Cell 2006; 22: 245-257; Wu et al., Nat. Cell Biol. 2006; 8: 398-406). Полные роли являются сложными, и их еще предстоит полностью определить, но cIAP1 и cIAP2 идентифицируются как ключевые компоненты регуляции TNF альфа опосредованных сигналов NF-κB, а также конститутивных (лиганднезависимых/классических) сигналов NF-κB (Varfolomeev et al., Cell 2007; 131(4): 669-81). Было показано, что cIAP1 и cIAP2 связывают TRAF2, адаптерный белок, функционирующий как в классических, так и в альтернативных NF-κB сигнальных путях, а также сигнальном пути MAPK (Rothe et al., Cell 2005; 83: 1243-1252). cIAP1 и cIAP2 непосредственно нацеливают RIP1 для убиквитинилирования in vitro (Betrand et al., Mol. Cell 2008; 30: 689-700).
TNF альфа регулирует множество клеточных функций, включая апоптоз, воспаление, иммунный ответ и рост и дифференцировку клеток (Trace et al., Annu. Rev. Med. 1994; 45: 491-503), и терапевтические антагонисты IAP могут иметь преимущество при состояниях, при которых эти функции затронуты.
Продукция TNF альфа отмечается во многих злокачественных опухолях и является одним из ключевых факторов связанного с раком воспаления, стимулирующего развитие и/или прогрессию опухоли. cIAP защищают раковые клетки от летальных эффектов TNF альфа.
NAIP
NAIP был первым открытым IAP (Roy et al., Cell 1995; 80: 167-178). NAIP является уникальным среди IAP, в том, что он имеет нуклеотидсвязывающий домен и домен олигомеризации, а также богатые лейцином повторы, которые подобны содержащимся в белках, обычно участвующих во врожденном иммунитете. Существуют признаки того, что NAIP может также суперэкспрессироваться при некоторых случаях рака, включая рак молочной железы и пищевода (Nemoto et al., Exp. Mol. Pathol. 2004; 76(3): 253-9), а также MS (Choi et al., J. Korean Med. 2007; 22 Suppl: S17-23; Hebb et al., Mult. Sclerosis 2008; 14(5): 577-94).
ML-IAP
Ингибитор меланомы белка апоптоза (ML-IAP) содержит единственный BIR и звено пальца RING. ML-IAP является сильным ингибитором апоптоза, индуцируемого рецепторами смерти и химиотерапевтическими агентами, вероятно функционируя как прямой ингибитор даунстрим эффекторных каспаз (Vucic et al., Curr. Biol. 2000; 10(21): 1359-66). ML-IAP также известен как содержащий повтор бакуловирусного IAP белок 7 (BIRC7), почечный ингибитор белка апоптоза (KIAP), белок пальца RING 50 (RNF50) и Livin. Домен BIR ML-IAP обладает эволюционно консервативной складкой, необходимой для антиапоптозной активности. Было обнаружено, что большинство клеточных линий меланомы экспрессирует высокие уровни ML-IAP, в отличие от первичных меланоцитов, экспрессирующих недетектируемые уровни. Эти клетки меланомы были значительно более устойчивыми к лекарственному апоптозу. Суперэкспрессия ML-IAP делает клетки меланомы резистентными к апоптотическим стимулам, и таким образом, потенциально способствует патогенезу этого злокачественного образования.
ILP-2
ILP-2, также известный как BIRC8, имеет единственный домен BIR и домен RING. ILP-2 экспрессируется только в яичке в нормальных клетках и связывается с каспазой 9 (Richter et al., Mol. Cell. Biol. 2001; 21: 4292-301).
Сурвивин
Сурвивин, также известный как BIRC5, ингибирует как каспазу 3, так и каспазу 7, но его первичная функция состоит в регуляции прогресса митоза, а не в регуляции апоптоза. Сурвивин промотирует формирование микроканальцев в митотическом веретене, противодействуя апоптозу во время клеточного цикла. Ингибирование апоптоза сурвивином является прогностическим для плохого исхода при раке ободочной и прямой кишки (Kawasaki et al., Cancer Res. 1998; 58(22): 5071-5074) и раке желудка стадии III (Song et al., Japanese J. Clin. Oncol. 2009; 39(5): 290-296).
BRUCE
BRUCE (содержащий повтор BIR убиквитин-конъюгирующий фермент) является периферическим мембранным белком в сети транс-Гольджи с единственным доменом BIR, наиболее сходным с таковым сурвивина. BRUCE ингибируется тремя механизмами: (i) связывание SMAC, (ii) протеаза HtrA2 и (iii) опосредуемое каспазой расщепление. Кроме того, BRUCE действует как лигаза убиквитина E2/E3 через убиквитин-конъюгирующий (UBC) домен.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям формулы (I). Настоящее изобретение относится к соединениям, которые могут быть использованы в терапии, в частности, в лечении рака. Соединения формулы (I) могут быть антагонистами белков семейства IAP (IAP), и особенно XIAP и/или cIAP (такой как cIAP1 и/или cIAP2) и могут быть использованы в лечении IAP-опосредованных состояний.
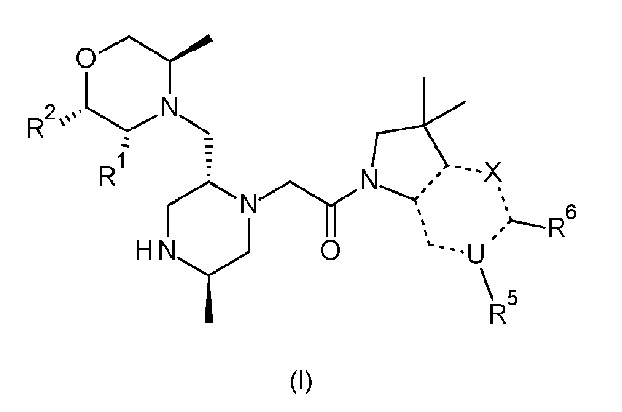
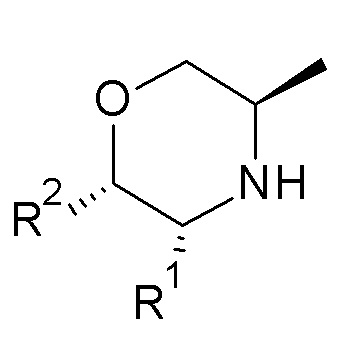
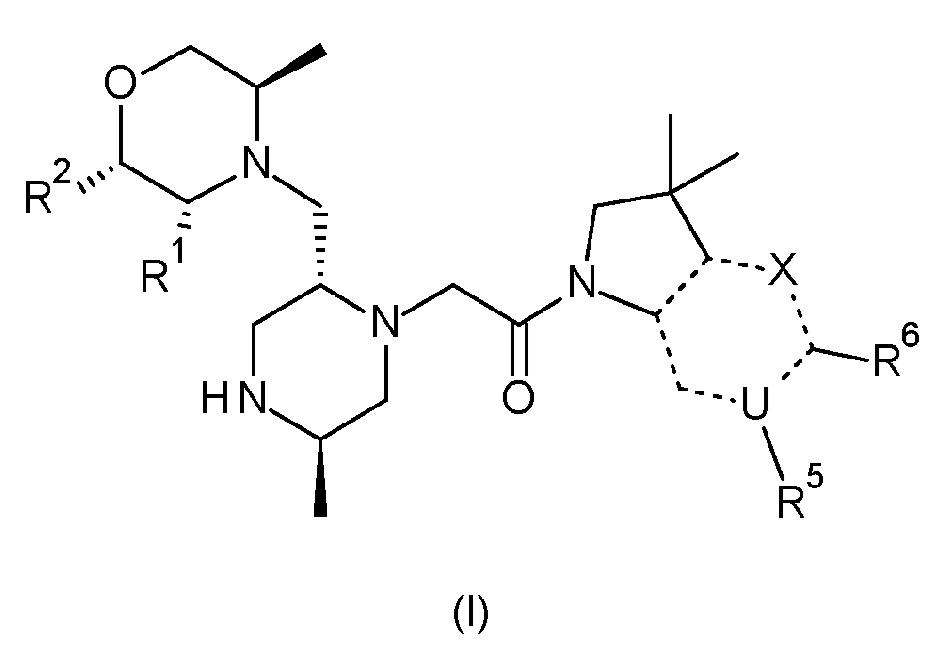
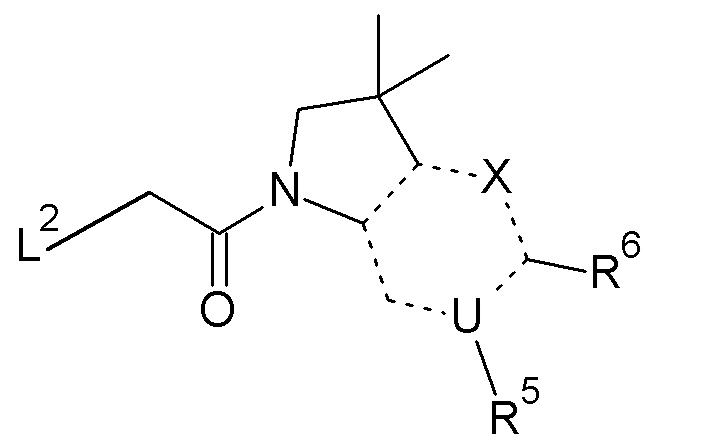
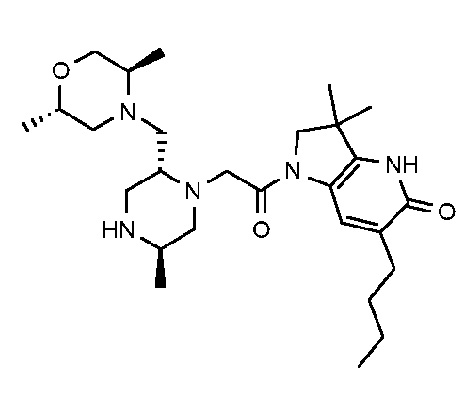
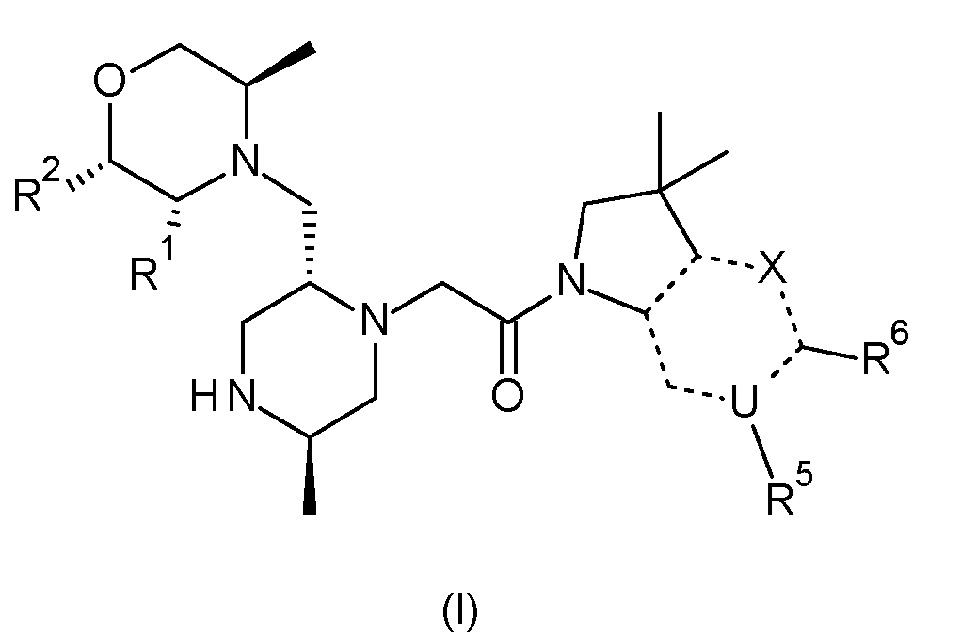
Согласно первому аспекту, изобретение относится к соединению формулы (I):
или его таутомерной или стереохимически изомерной форме, фармацевтически приемлемой соли или сольвату;
в которой
X обозначает CR4, N или NR3;
причем
- когда X обозначает CR4, тогда U обозначает азот, и R6 обозначает оксо; или
- когда X обозначает N, тогда U обозначает углерод, и R6 обозначает гидроксиметил или -CH(ORx)CH2ORz; или
- когда X обозначает NR3, тогда U обозначает углерод, и R6 обозначает оксо;
пунктирная связь (-------) обозначает одинарную или двойную связь, причем по меньшей мере две из указанных пунктирных связей обозначают двойную связь;
R1 и R2 независимо обозначают водород или метил;
R3 обозначает водород, метил или -NH2;
R4 обозначает водород, метил, гидроксиметил, -NH2 или фтор;
R5 обозначает незамещенный н-бутил, или бензил, замещенный на фенильной группе одним или двумя атомами фтора; и
Rx и Rz независимо обозначают водород или метил.
В другом аспекте изобретение относится к соединению формулы (I) для применения в профилактике или лечении заболевания или состояния, как описано здесь, к фармацевтическим композициям, включающим соединение формулы (I), и к способам синтеза соединения формулы (I).
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: 1H ЯМР Примера 39. Образец получали в ДМСО-D6 и калибровали к недейтерированному остатку ДМСО растворителя при δ=2,50 миллионных долях. Содержащийся внутренний референсный стандарт (TCNB) присутствует как синглет при δ=8,5 частей на миллион.
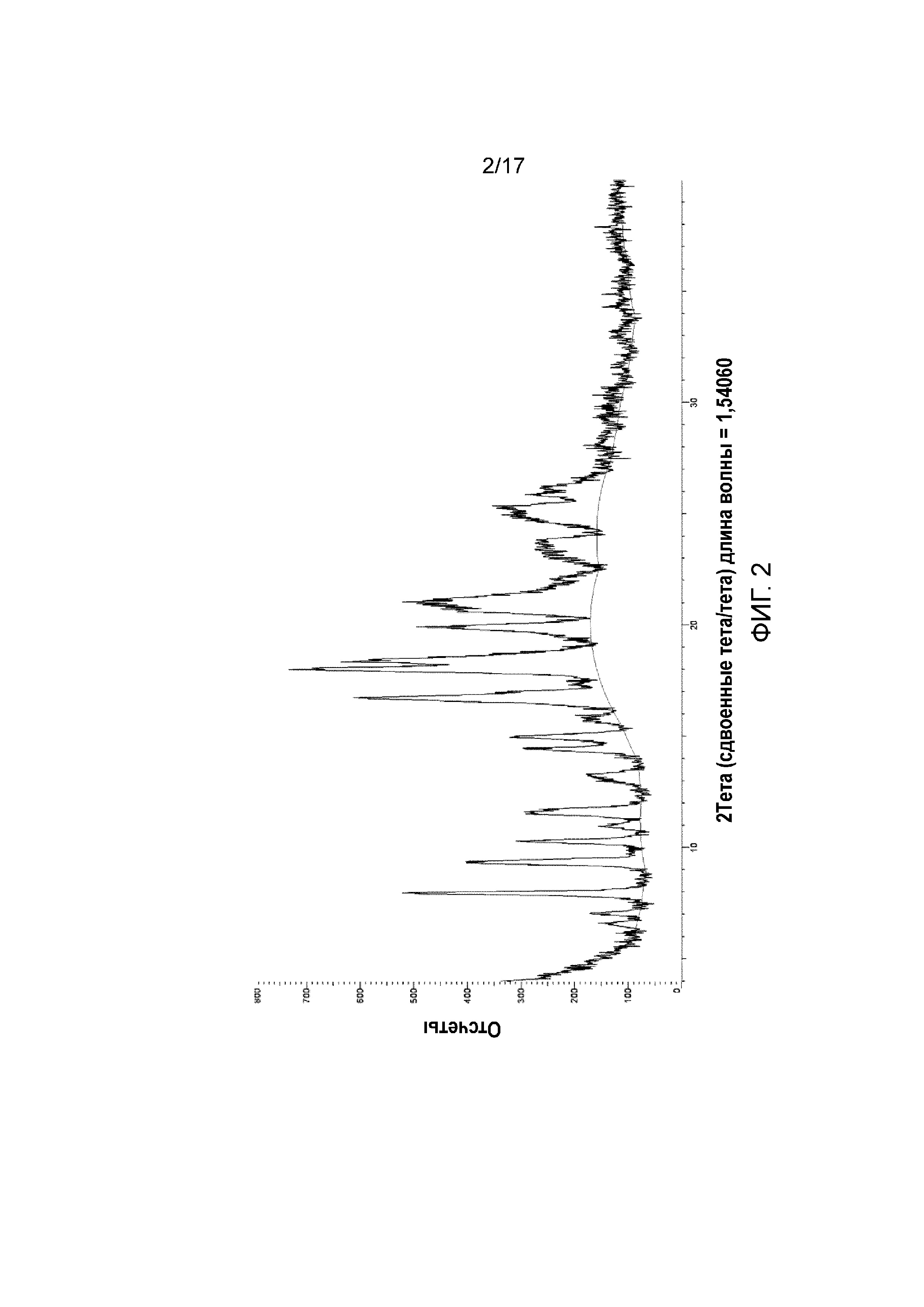
Фигура 2: XRPD примера 39.
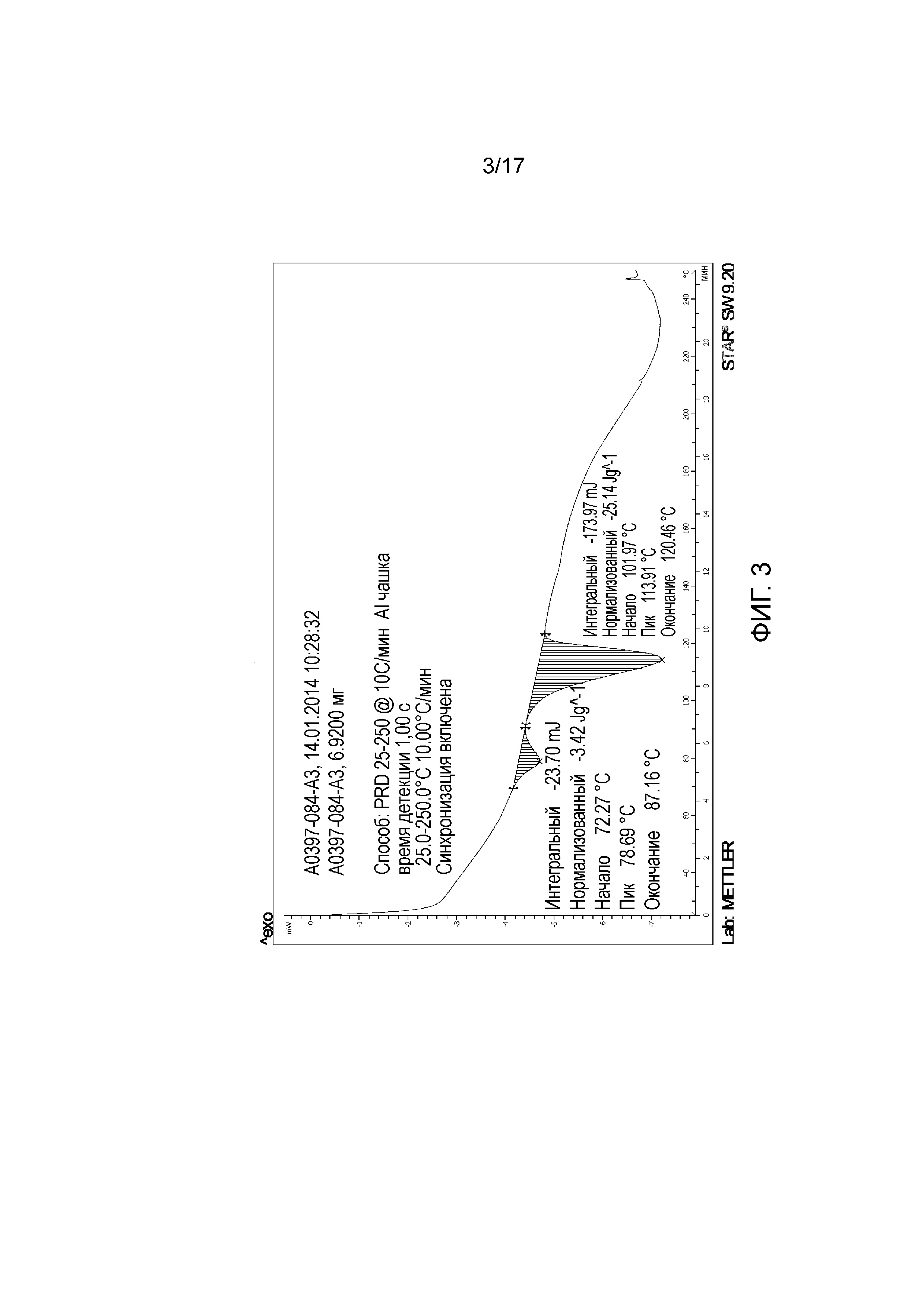
Фигура 3: DSC примера 39.
Фигура 4: 1H ЯМР Примера 40. Образец получали в ДМСО-D6 и калибровали к недейтерированному остатку ДМСО растворителя при δ=2,50 миллионных долях. Содержащийся внутренний референсный стандарт (TCNB) присутствует как синглет при δ=8,5 частей на миллион.
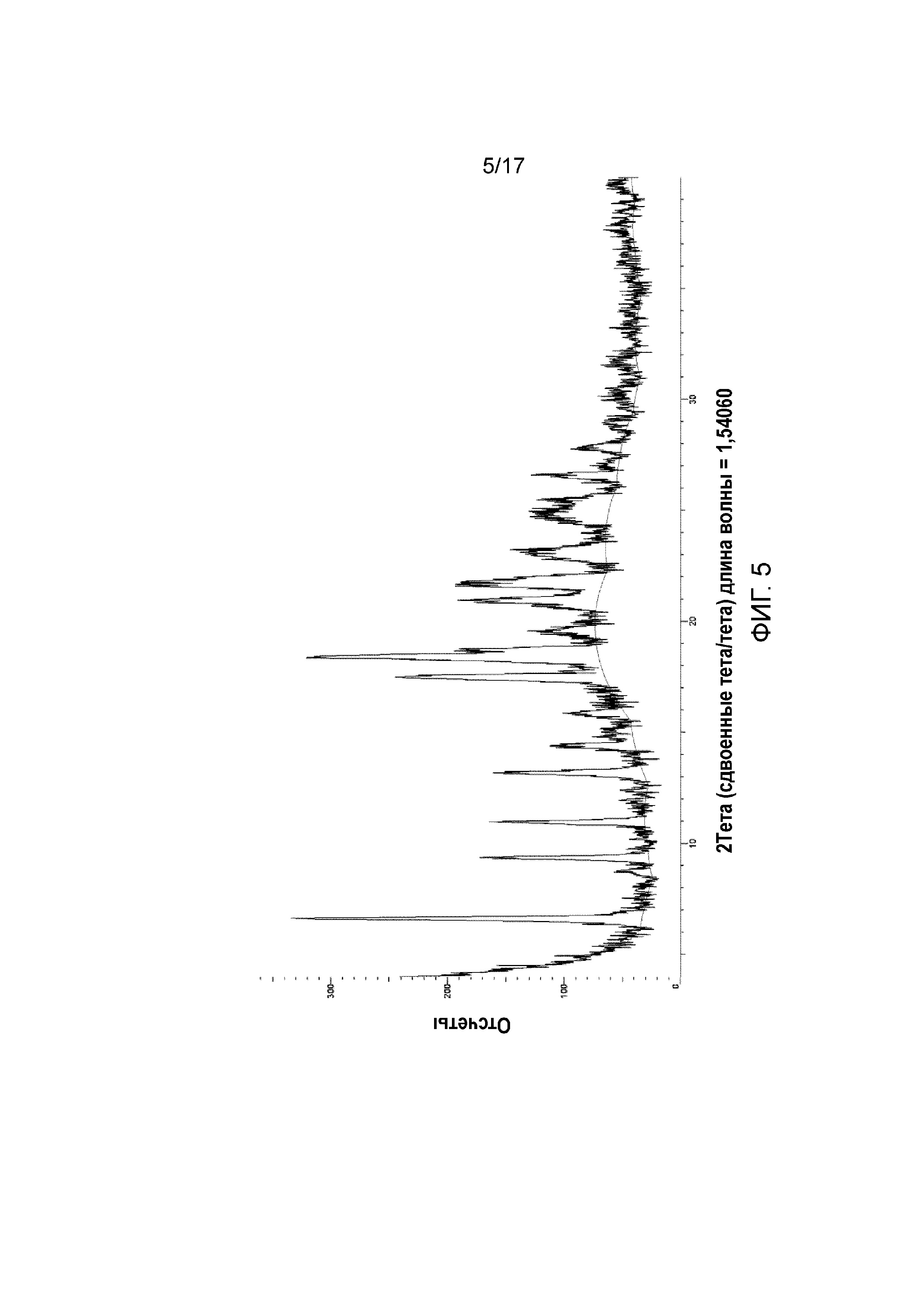
Фигура 5: XRPD примера 40.
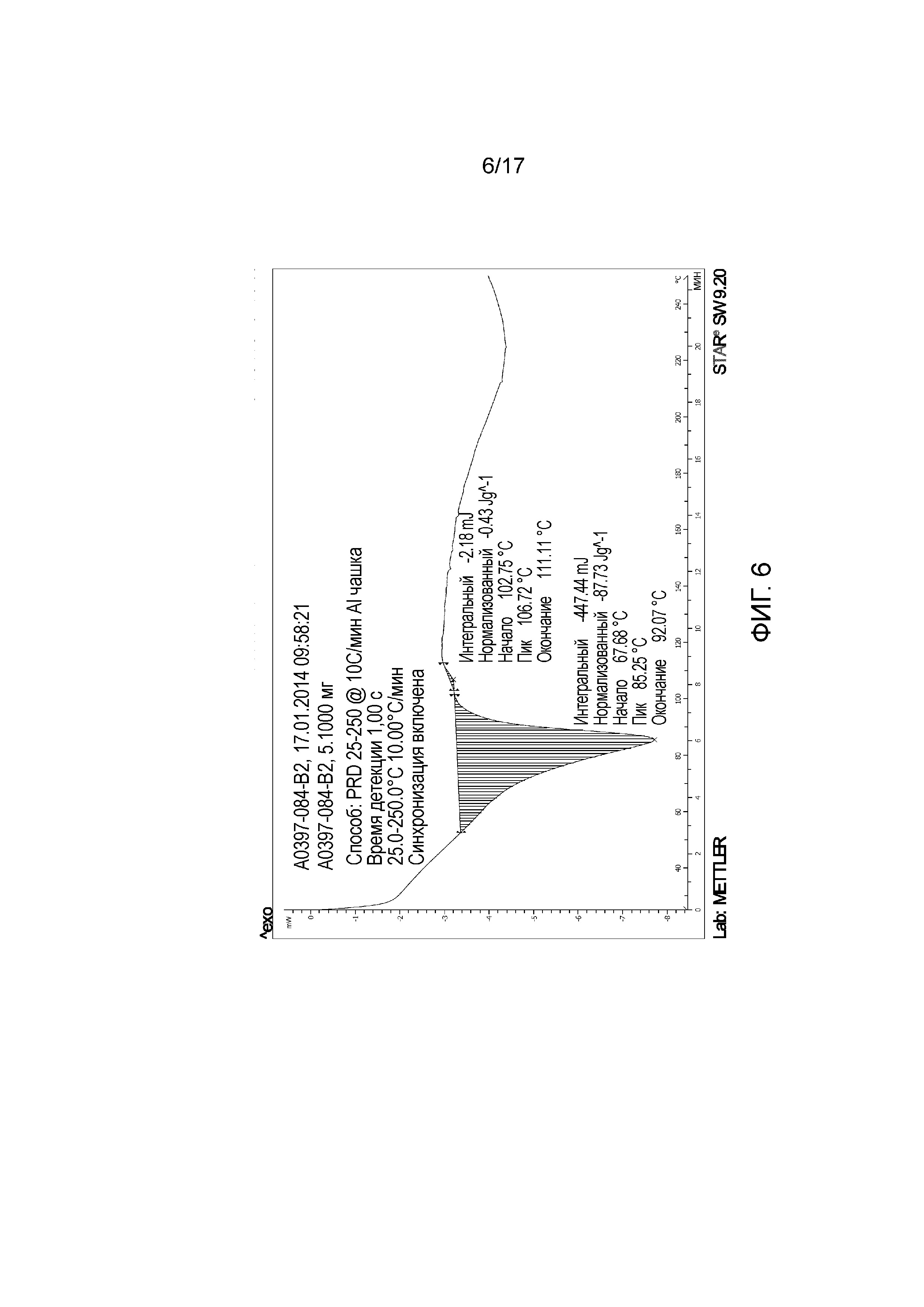
Фигура 6: DSC примера 40.
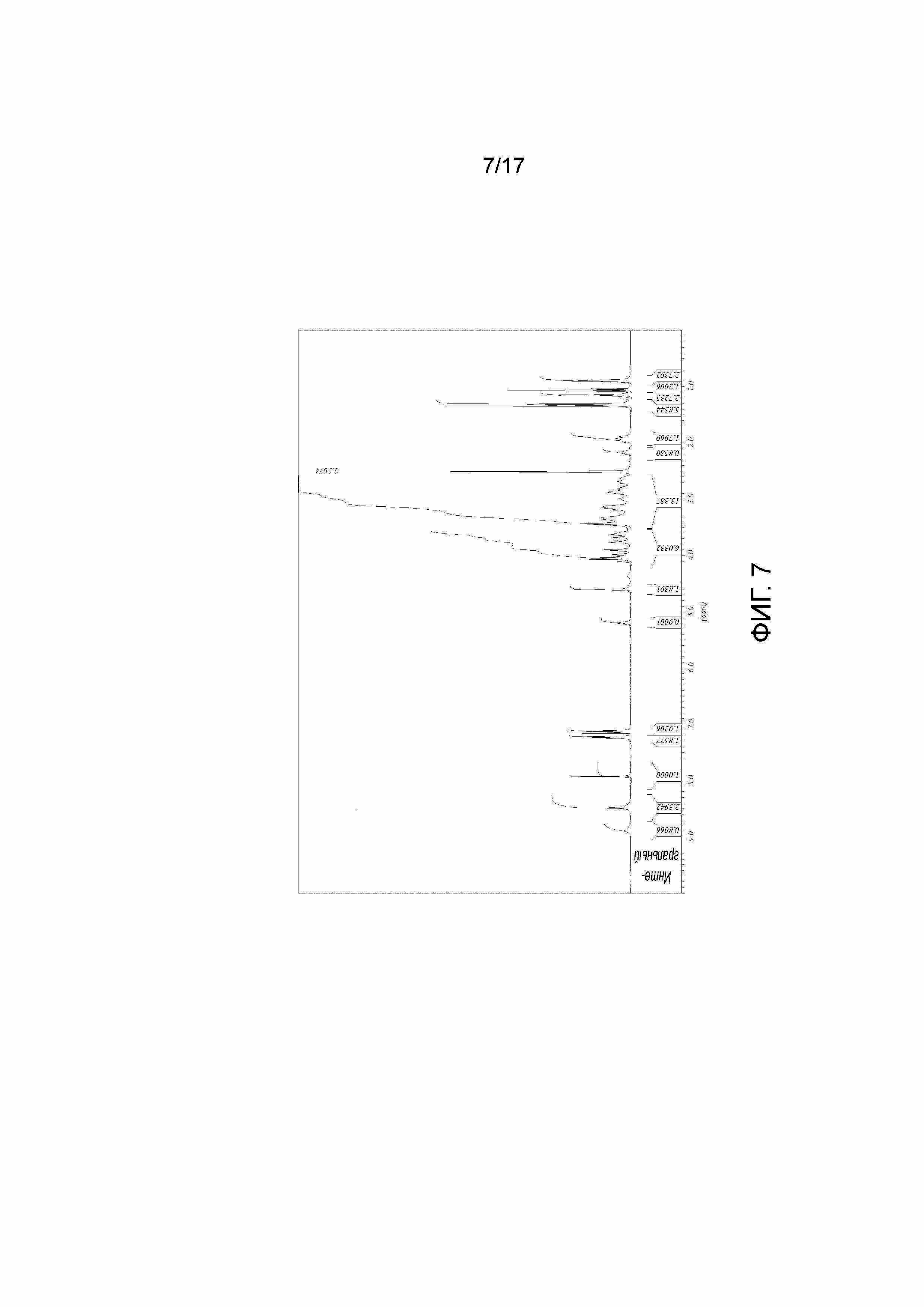
Фигура 7: 1H ЯМР Примера 41. Образец получали в ДМСО-D6 и калибровали к недейтерированному остатку ДМСО растворителя при 2,50 миллионных долях.
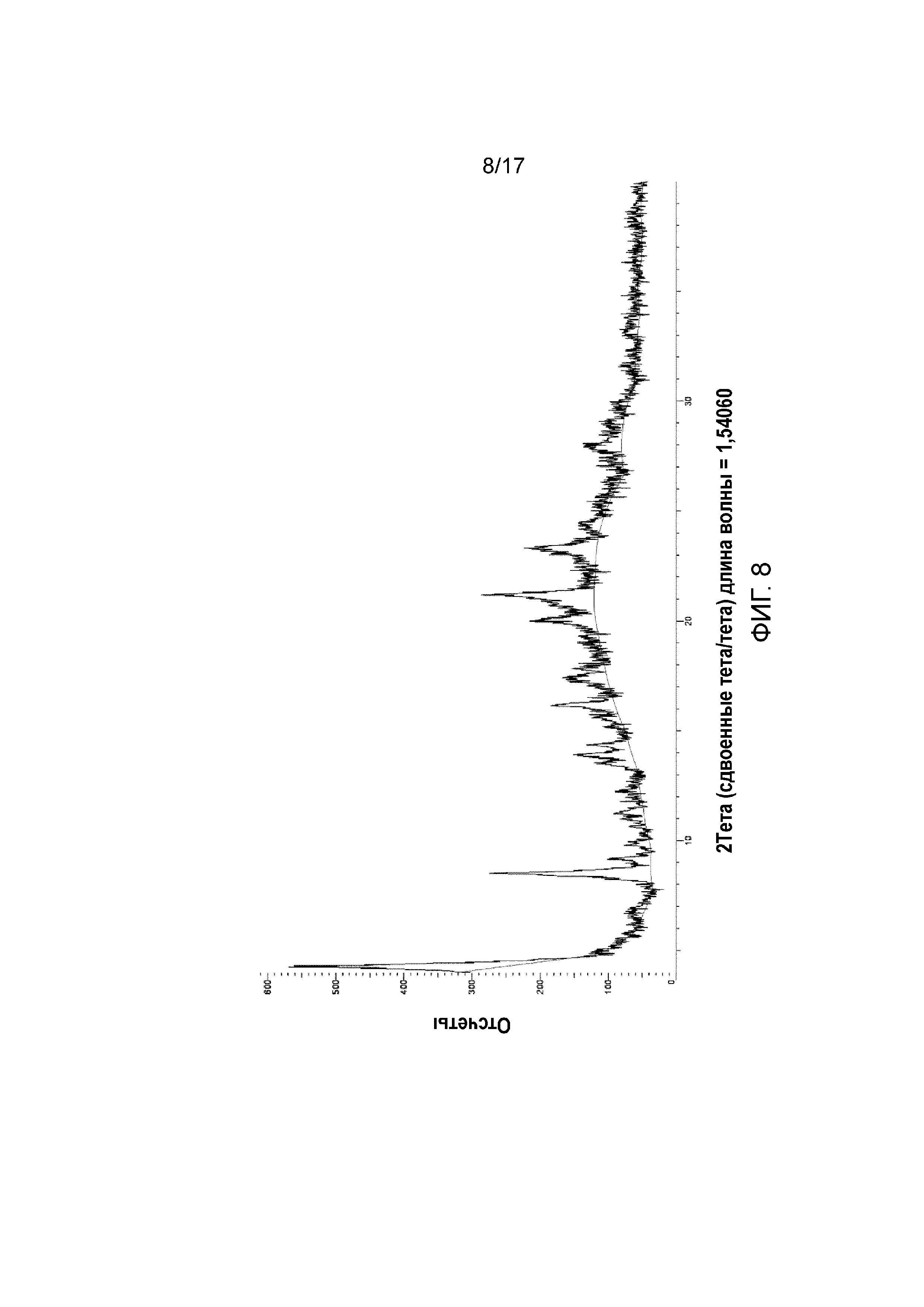
Фигура 8: XRPD примера 41.
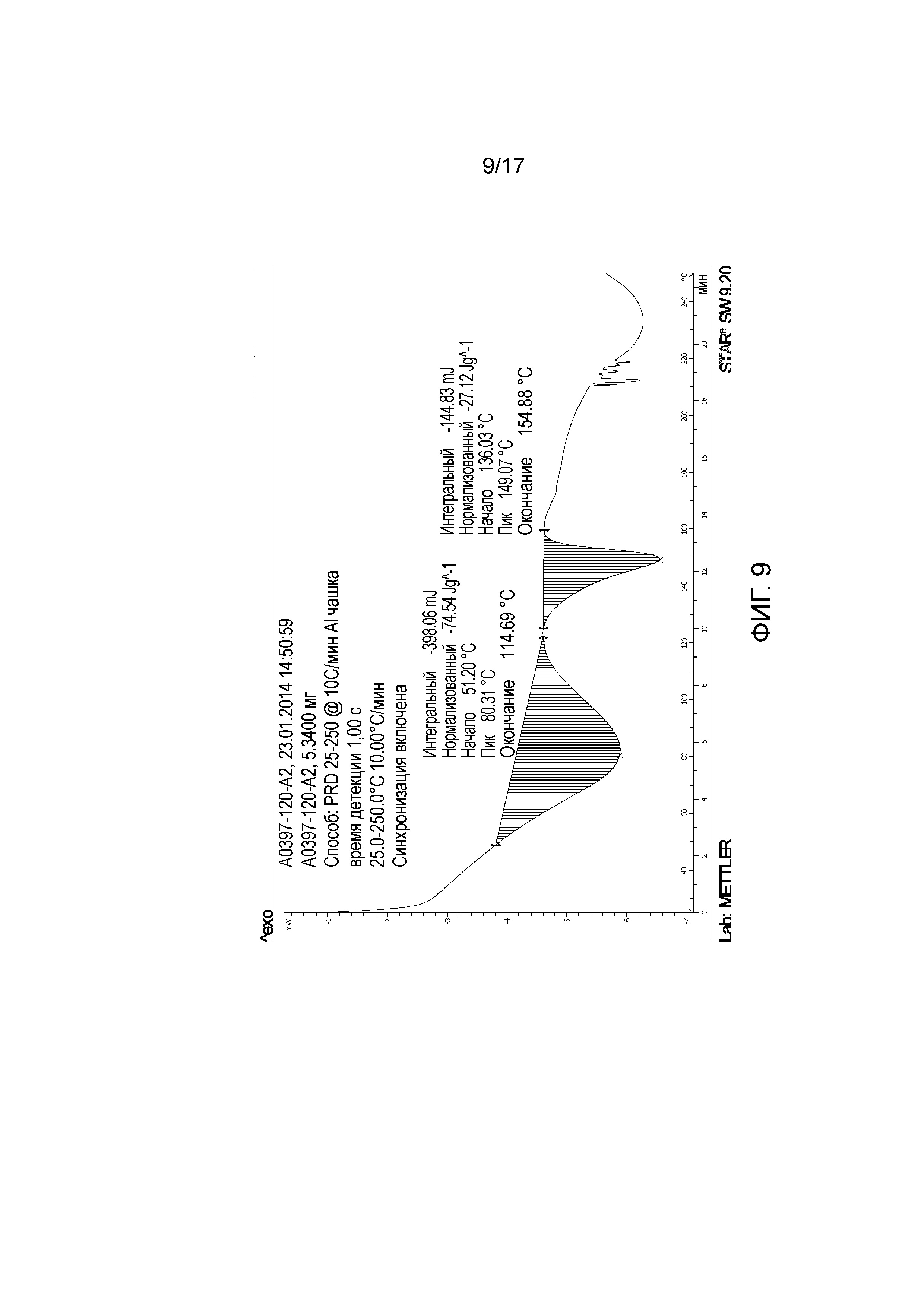
Фигура 9: DSC примера 41.
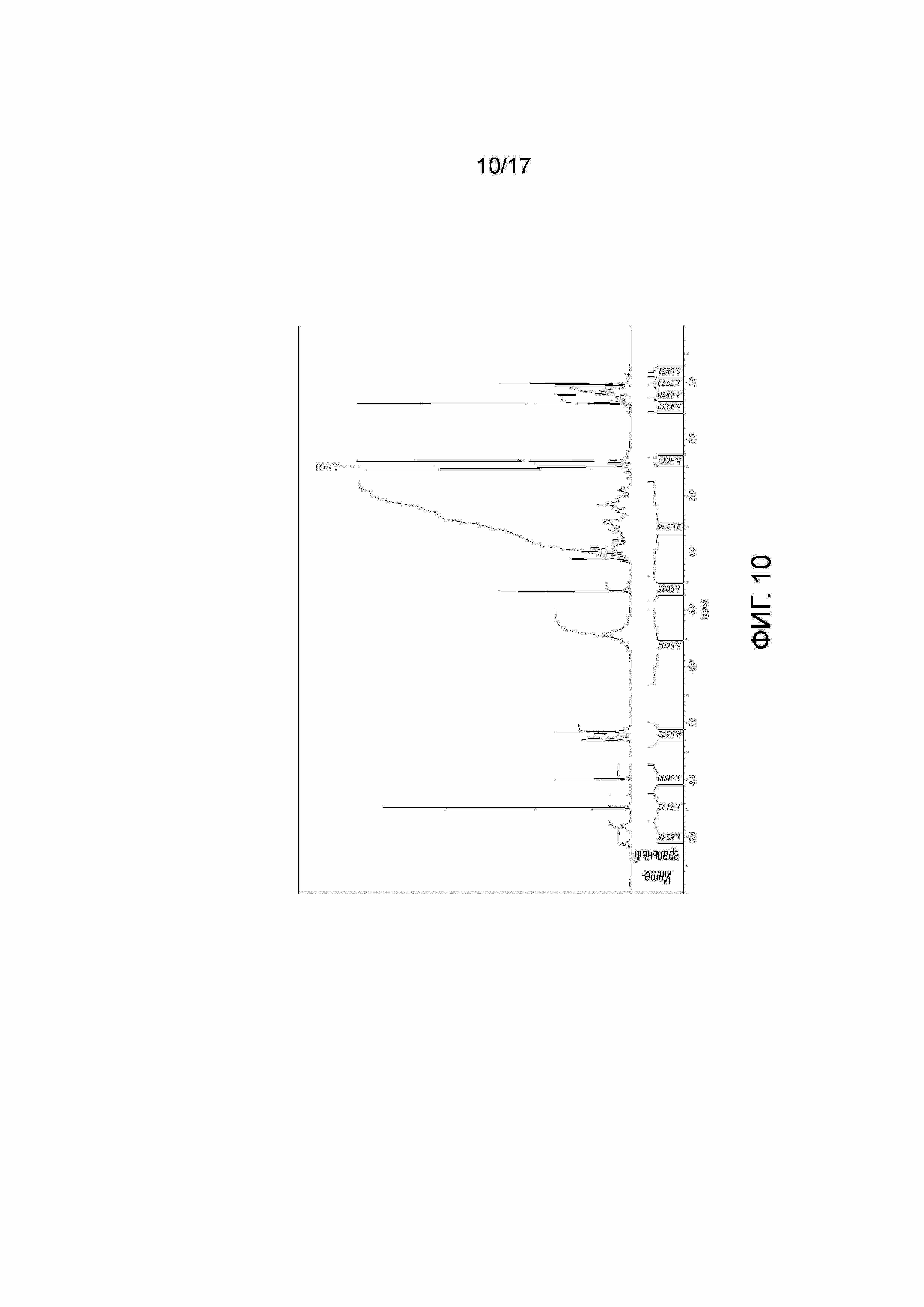
Фигура 10: 1H ЯМР Примера 42. Образец получали в ДМСО-D6 и калибровали к недейтерированному остатку ДМСО растворителя при 2,50 миллионных долях.
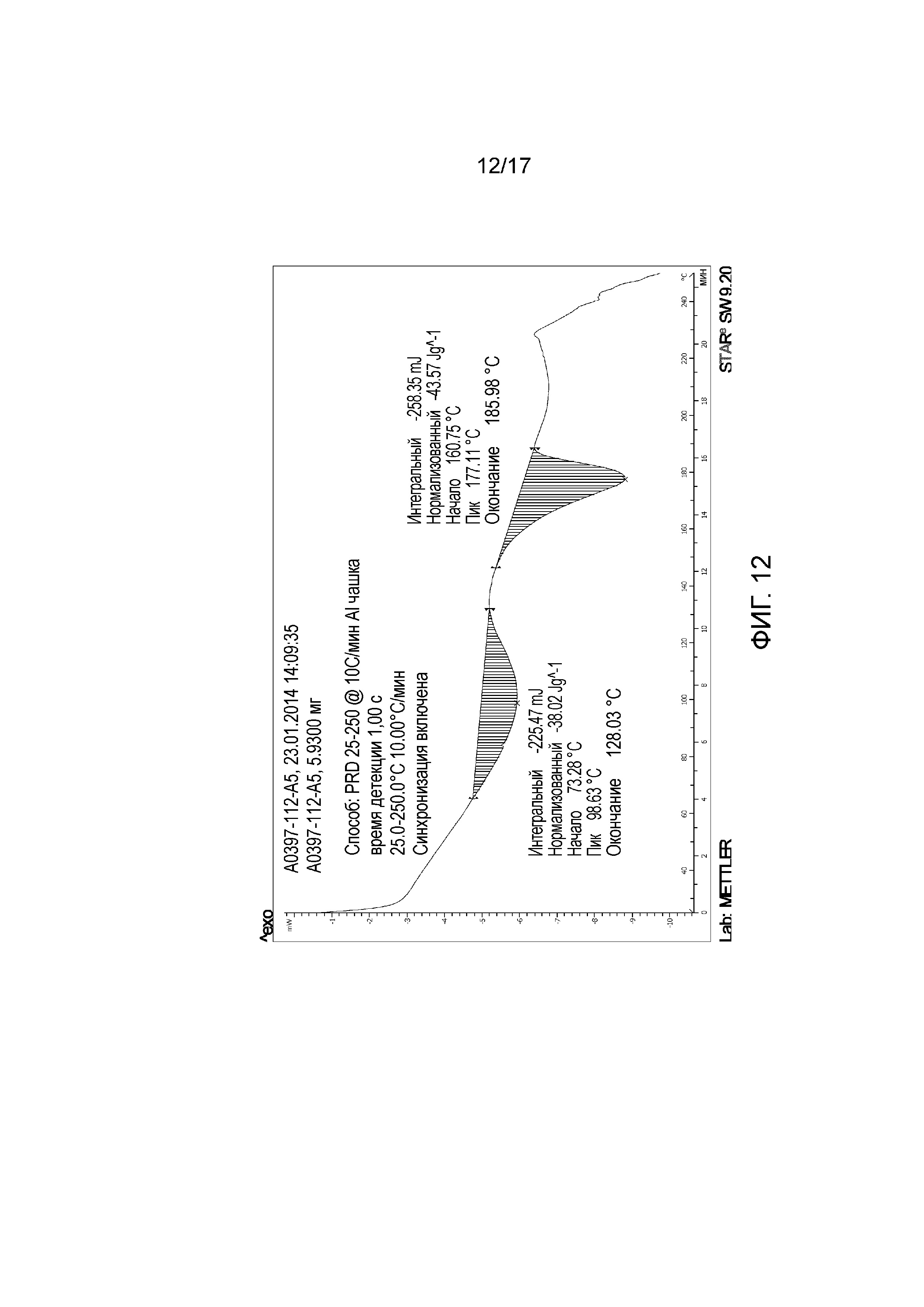
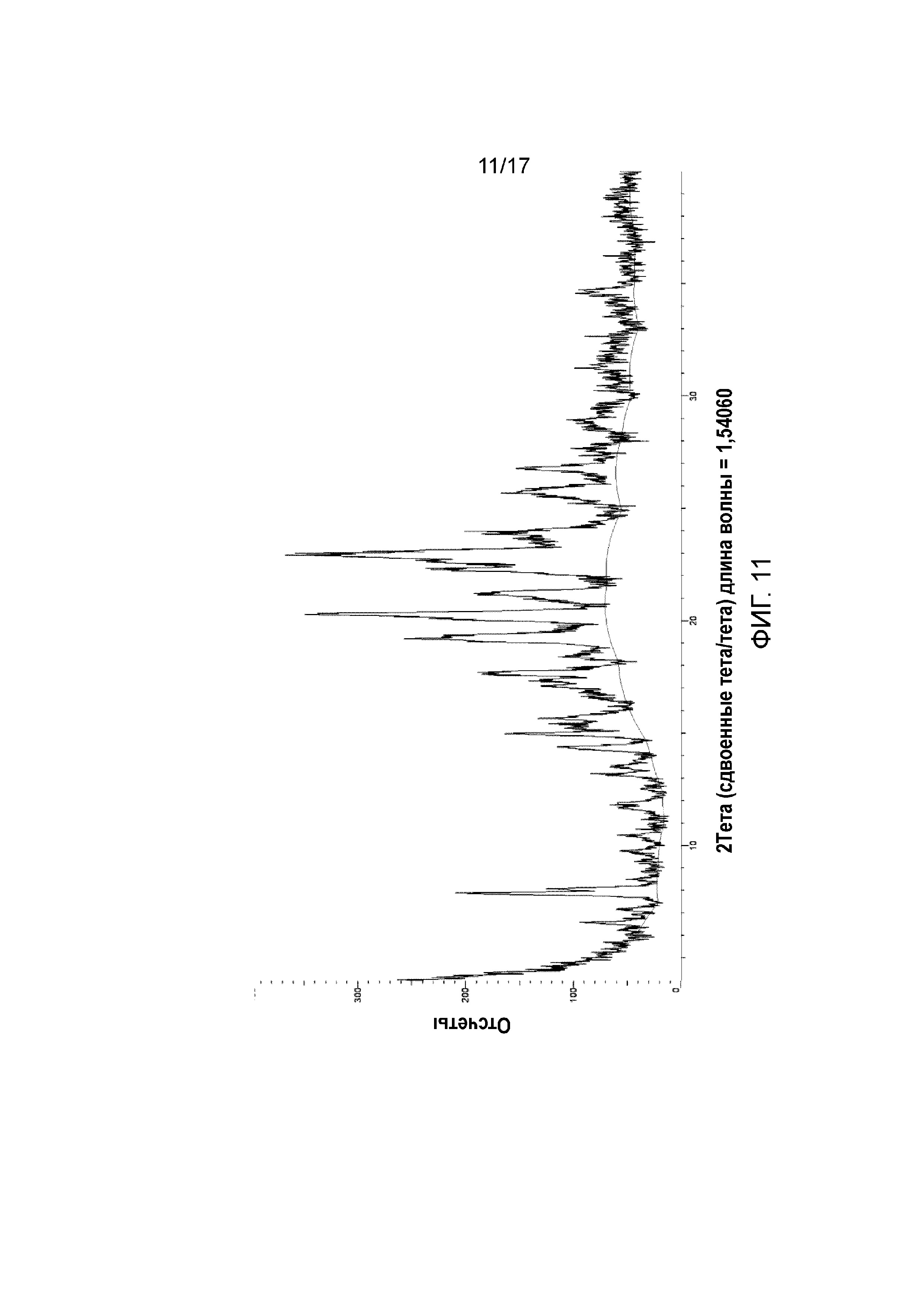
Фигура 11: XRPD примера 42.
Фигура 12: DSC примера 42.
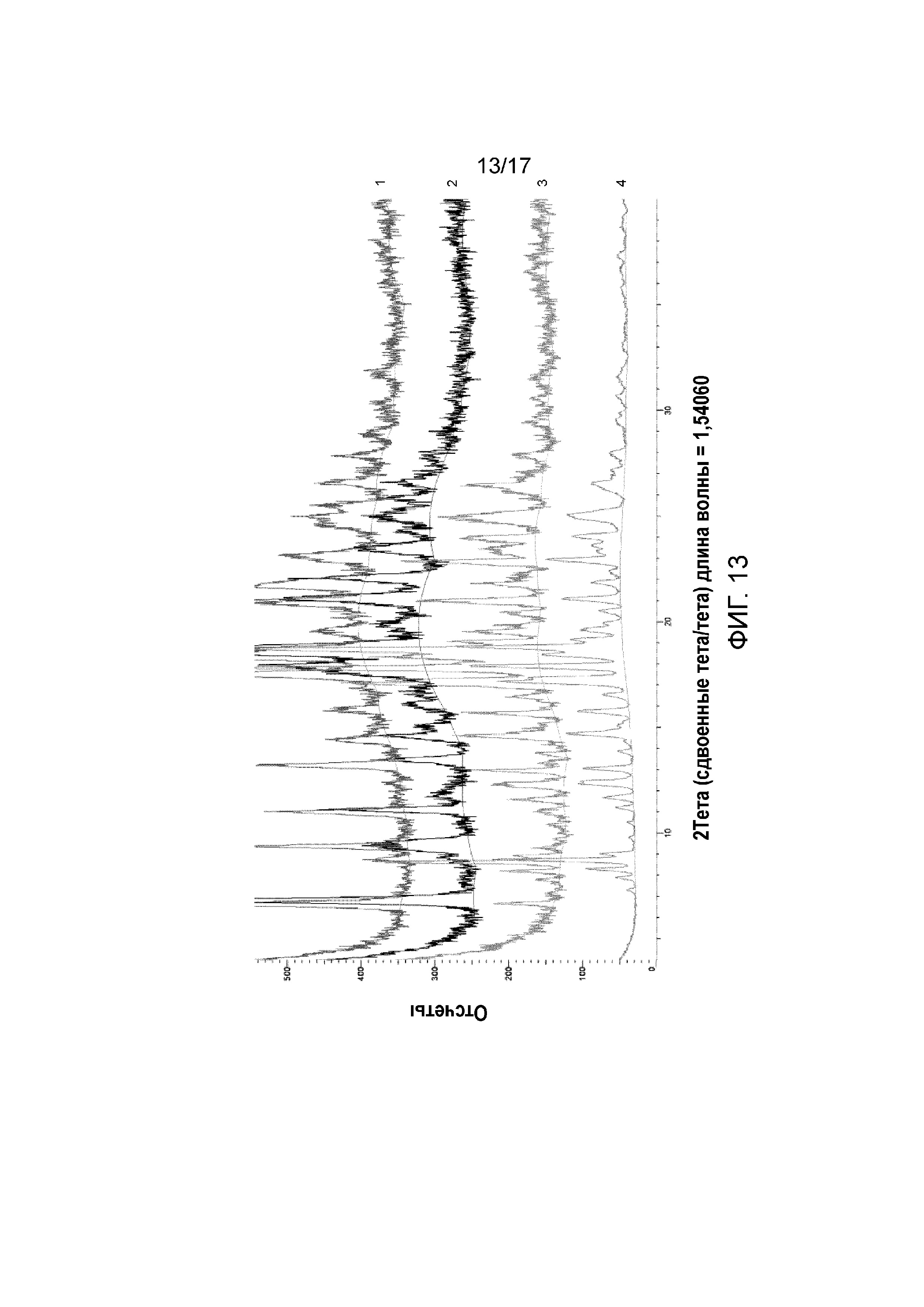
Фигура 13: XRPD L-(+)-лактат Форма B (дифрактограмма, обозначенная 1), продукт Примера 40, реакционная смесь в t=0 ч (дифрактограмма, обозначенная 2), после 4 дней (дифрактограмма, обозначенная 3) по сравнению с L-(+)-лактатом Форма C (дифрактограмма, обозначенная 4), Пример 43.
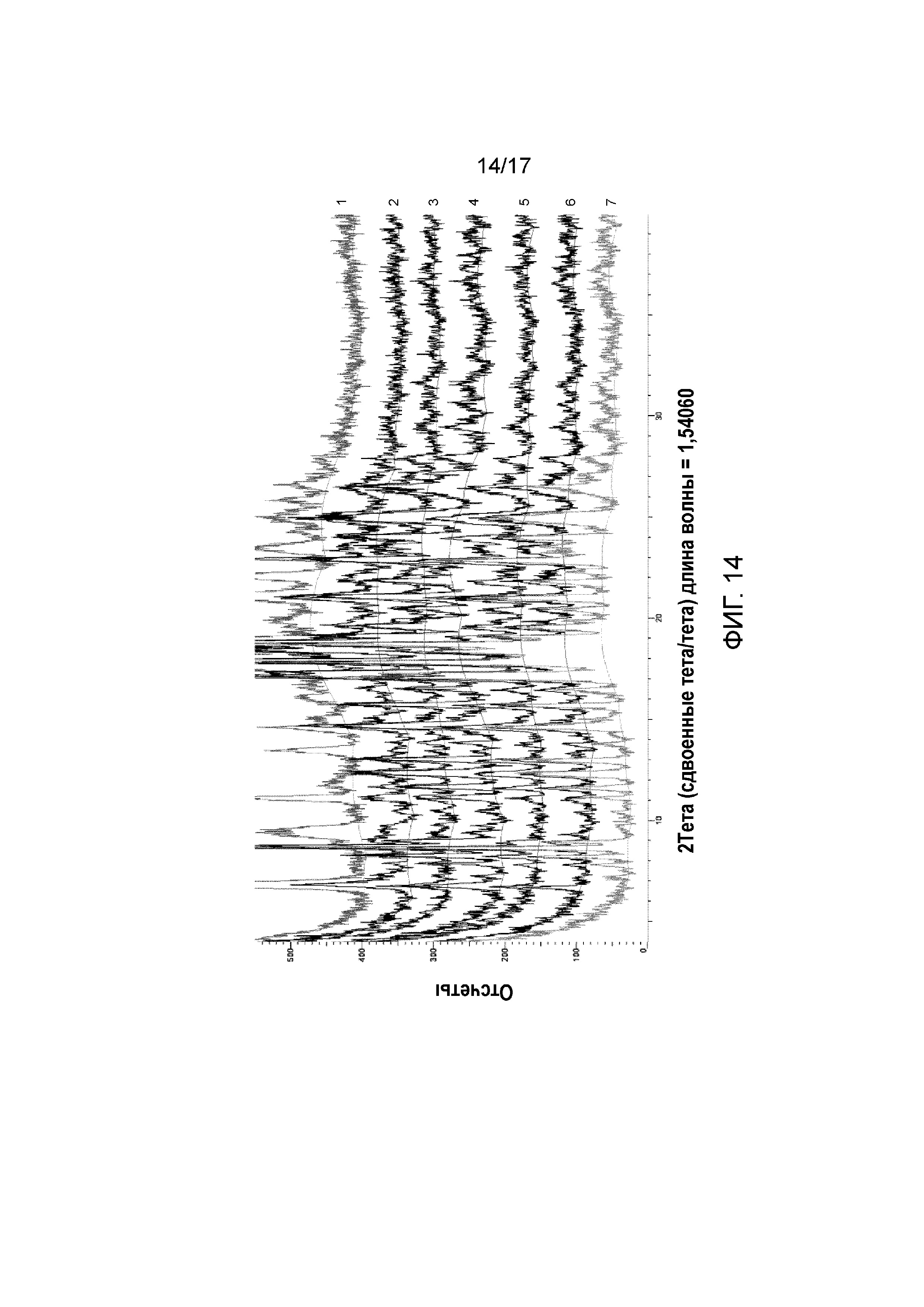
Фигура 14: XRPD Примера 43 изоструктурный с Формой B в t=0 ч (дифрактограмма, обозначенная 1), прогрессе реакционных смесей (дифрактограммы, обозначенные 2-6), взаимное превращение, полностью завершенное после нагревания в течение t=5 дней с получением Формы C (дифрактограмма, обозначенная 7).
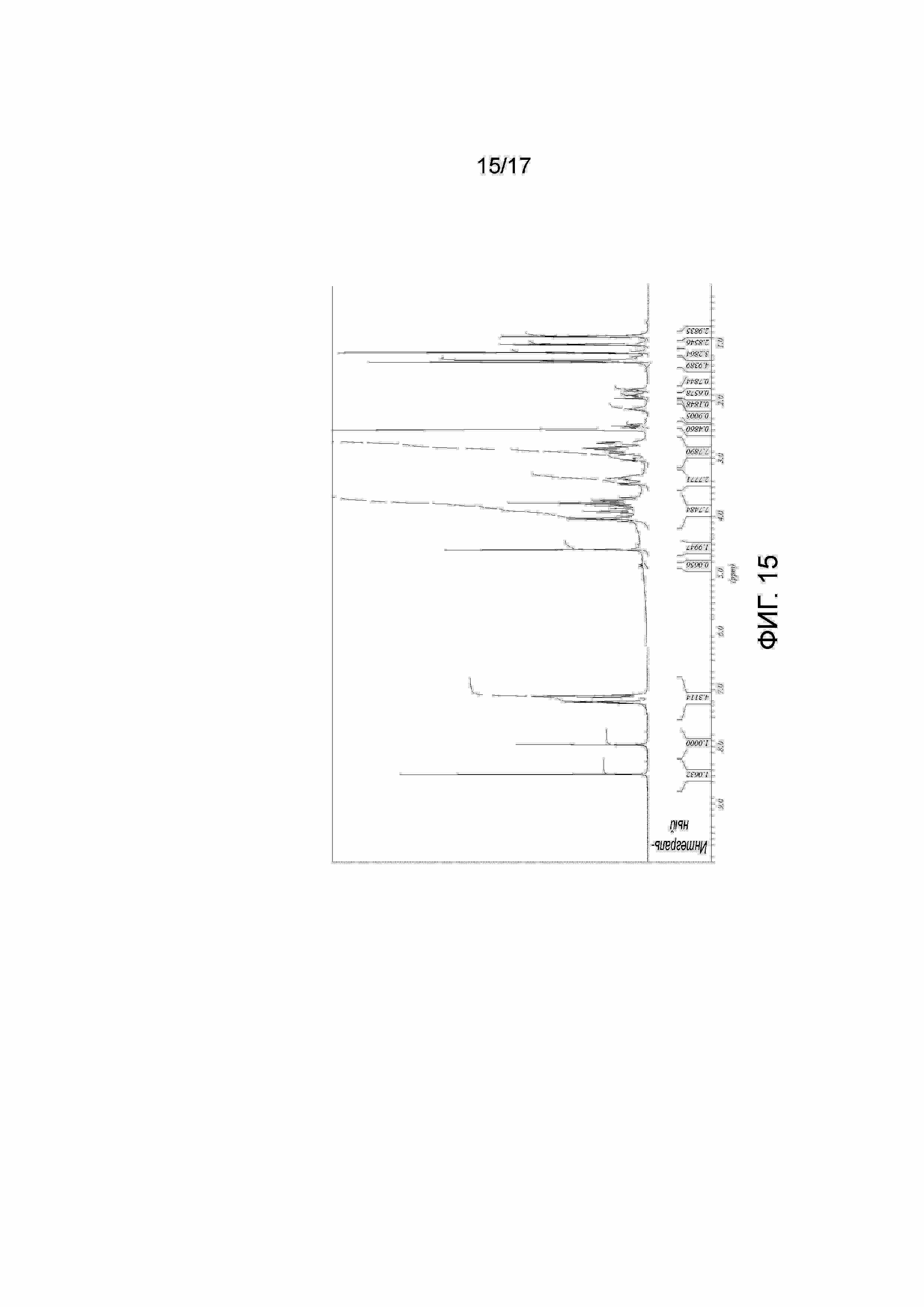
Фигура 15: 1H ЯМР Примера 43. Образец получали в ДМСО-D6 и калибровали к недейтерированному остатку ДМСО растворителя при δ=2,50 миллионных долях. Содержащийся внутренний референсный стандарт (TCNB) присутствует как синглет при δ=8,5 частей на миллион.
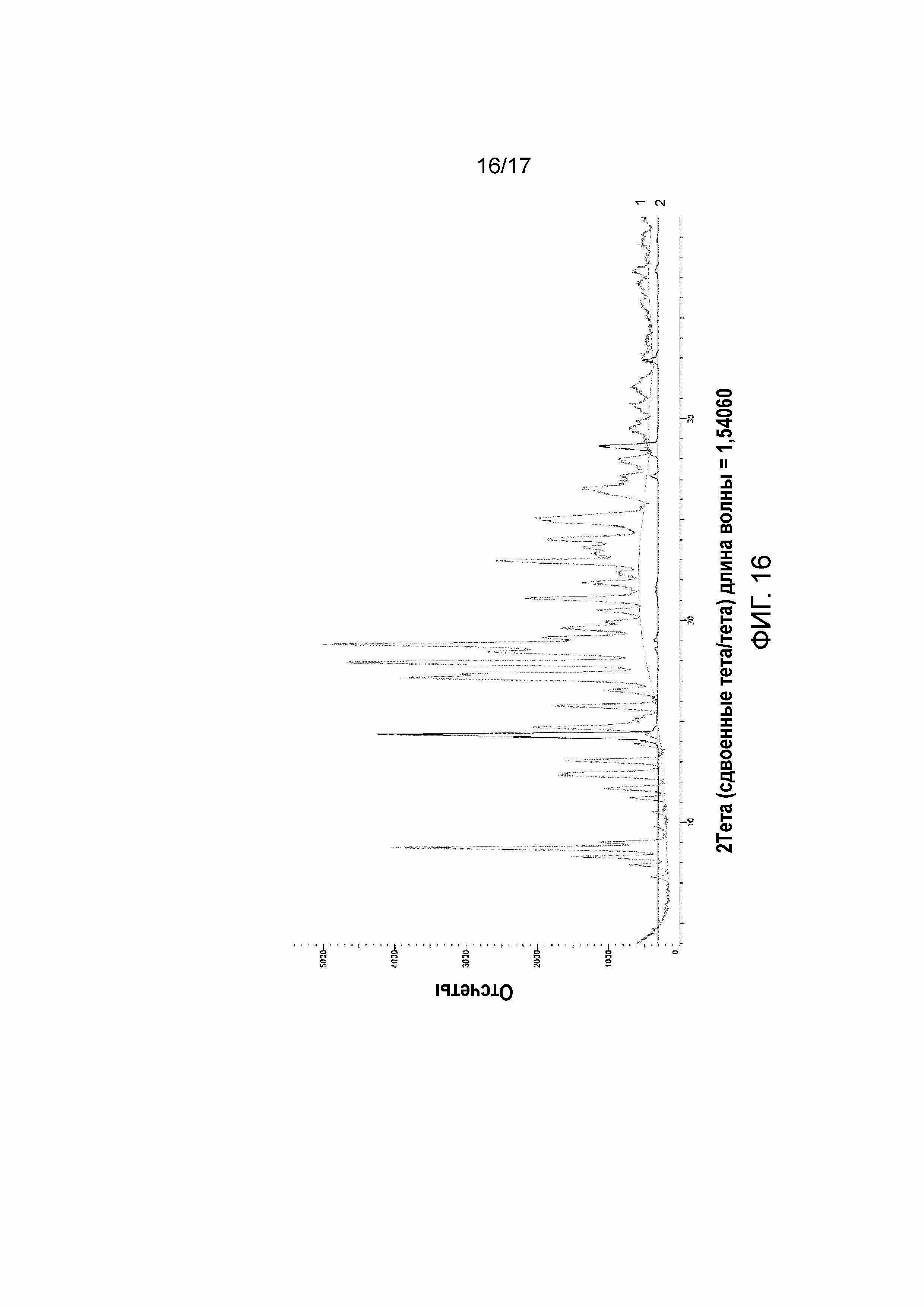
Фигура 16: XRPD Примера 43 (дифрактограмма, обозначенная 1), перекрытый безводной L-(+)-молочной кислотой (дифрактограмма, обозначенная 2).
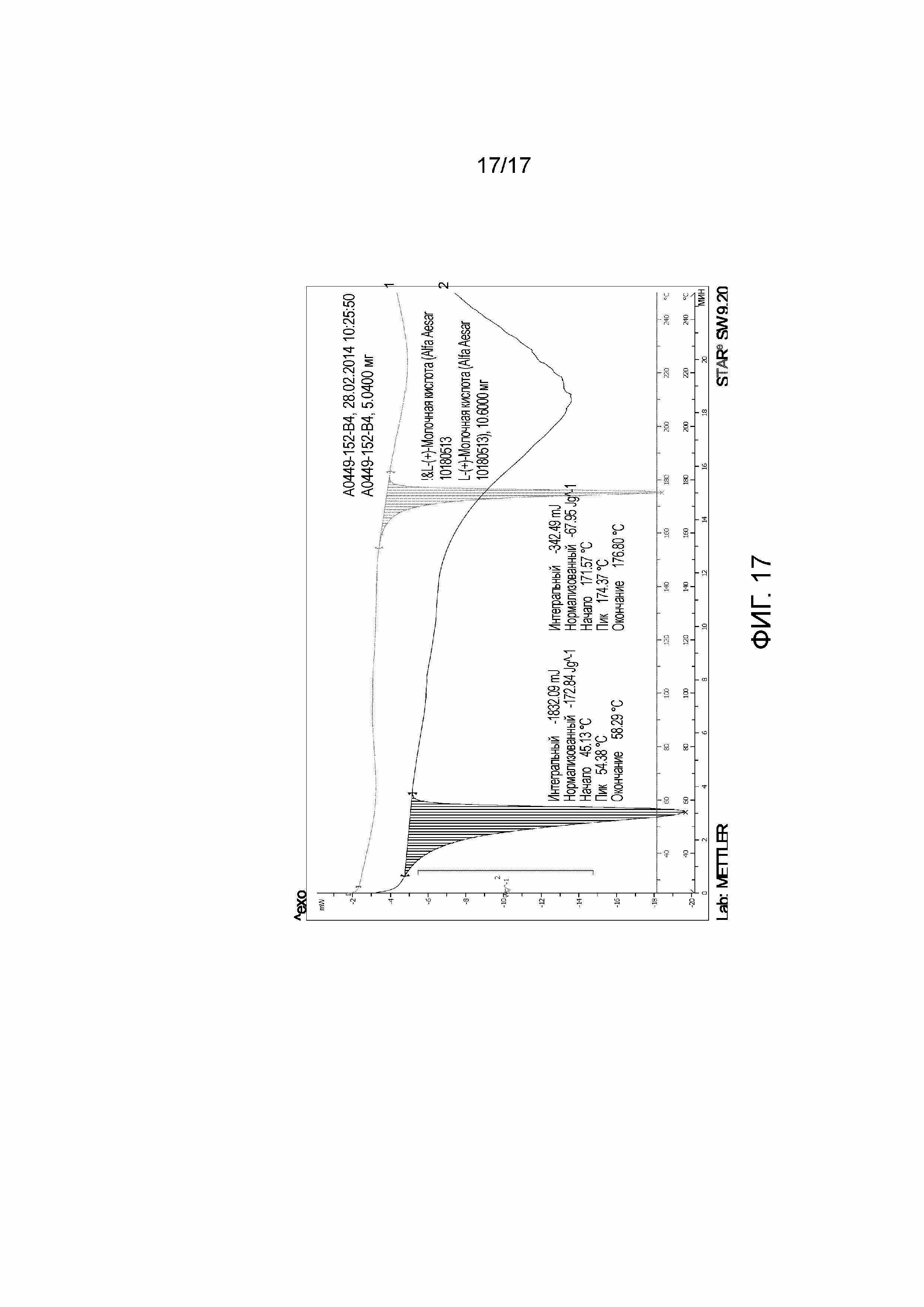
Фигура 17: DSC Примера 43 (термограмма, обозначенная 1), перекрытый безводной L-(+)-молочной кислотой (термограмма, обозначенная 2).
ОПРЕДЕЛЕНИЯ
Если в контексте не указано иное, ссылки на формулу (I) во всех разделах этого документа (включая применение, способы и другие аспекты изобретения) включают ссылки на все другие подформулы, подгруппы, предпочтения, варианты осуществления и примеры, как определено здесь.
Под «IAP» понимают любого из членов семейства IAP XIAP, cIAP (cIAP1 и/или cIAP2), NAIP, ILP2, ML-IAP, сурвивина и/или BRUCE, в частности, XIAP, cIAP1, cIAP2, ML-IAP, более конкретно XIAP, cIAP1 и/или cIAP2, наиболее конкретно XIAP и/или cIAP1. В частности, подразумевают домены BIR IAP, в частности, домены BIR XIAP, cIAP1 или cIAP2.
Под ʺодним или более членами семейства IAPʺ понимают любого из членов семейства IAP, в частности, XIAP, cIAP1 и/или cIAP2, более конкретно XIAP и/или cIAP1.
«Потенциал» является мерой активности лекарственного средства, выраженной с точки зрения количества, необходимого для оказания влияния данной интенсивности. Очень сильнодействующее лекарственное средство вызывает больший ответ в низких концентрациях. Потенциал пропорционален сродству и эффективности. Сродство является способностью лекарственного средства связываться с рецептором. Эффективность является отношением между занятием рецептора и способностью инициировать ответ на молекулярном, клеточном, тканевом или системном уровне.
Термин «антагонист» относится к типу лиганда рецептора или лекарственного средства, блокирующего или ослабляющего опосредуемые агонистом биологические ответы. Антагонисты имеют сродство, но не имеют агонистической эффективности в отношении их родственных рецепторов, и связывание будет разрывать взаимодействие и ингибировать функцию любого лиганда (например, эндогенных лигандов или субстратов, агониста или обратного агониста) на рецепторах. Антагонизм может проявляться непосредственно или опосредованно и может быть опосредован любым механизмом и на любом физиологическом уровне. Примером опосредованного антагонизма является опосредованный антагонизм cIAP в результате убиквинирования cIAP, приводящий к его деградации. В результате антагонизм лигандов может, при различных обстоятельствах, проявляться функционально различными способами. Антагонисты опосредуют свои эффекты путем связывания с активным центром или с аллостерическими сайтами на рецепторах, или они могут взаимодействовать в уникальных связывающих сайтах, обычно не участвующих в регуляции биологической активности рецептора. Антагонистическая активность может быть обратимой или необратимой в зависимости от долговечности комплекса антагонист-рецептор, которая, в свою очередь, зависит от природы связывания антагониста с рецептором.
Термин «лечение», в рамках изобретения в контексте лечения состояния, т.е. статуса, нарушения или заболевания, обычно относится к лечению и терапии в отношении как человека, так и животного (например, в ветеринарных применениях), в рамках которого достигается некоторый желаемый терапевтический эффект, например, ингибирование прогресса состояния и сокращение уровня прогресса, остановка в уровне прогресса, улучшение состояния, уменьшение или облегчение по меньшей мере одного симптома, связанного с или вызванного подвергаемым лечению состоянием, и излечение состояния. Например, лечение может быть уменьшением одного или нескольких симптомов нарушения или полное устранение нарушения.
Термин «профилактика» (т.е. использование соединения в качестве профилактической меры), в рамках изобретения в контексте лечения состояния, т.е. статуса, нарушения или заболевания, обычно относится к профилактике или предупреждению в отношении как человека, так и животного (например, в ветеринарных применениях), в рамках которых достигается некоторый желаемый профилактический эффект, например, предотвращение возникновения заболевания или защита от заболевания. Профилактика включает полное и общее блокирование всех симптомов нарушения в течение неопределенного срока времени, простое замедление начала одного или нескольких симптомов заболевания или обеспечение меньшей вероятности возникновения заболевания.
Ссылки на профилактику или лечение болезненного статуса или состояния, такого как рак, включают облегчение рака или уменьшение заболеваемости раком.
В рамках изобретения, термин «опосредованный», используемый, например, в сочетании с IAP, как описано здесь (и применительно, например, к различным физиологическим процессам, заболеваниям, статусам, состояниям, терапиям, лечениям или вмешательствам), предназначен для ограниченного употребления, так, чтобы различные процессы, заболевания, статусы, состояния, лечения и вмешательства, к которым применяется этот термин, были такими, в которых белок играет биологическую роль. В случаях, когда этот термин используется применительно к заболеванию, статусу или состоянию, биологическая роль, которую играет белок, может быть прямой или косвенной и может быть необходимой и/или достаточной для проявления симптомов заболевания, статуса или состояния (или его этиологии или прогрессии). Таким образом, функция белка (и в частности, аберрантные уровни функции, например, супер- или недостаточная экспрессия) не должна обязательно быть ближайшей причиной заболевания, статуса или состояния: скорее это подразумевает, что опосредованные заболевания, статусы или состояния включают такие, которые имеют многофакторные этиологии, и объединяют прогрессии, в которых только частично участвует рассматриваемый белок. В случаях, когда этот термин используется применительно к лечению, профилактике или вмешательству, роль, которую играет белок, может быть прямой или косвенной и может быть необходимой и/или достаточной для операции лечения, профилактики или результата вмешательства. Таким образом, болезненный статус или состояние, опосредуемое белком, включают развитие резистентности к любому определенному лекарственному средству против рака или лечению рака.
Комбинации по изобретению могут оказывать терапевтически эффективное влияние относительно терапевтического эффекта отдельных соединений/агентов при раздельном введении.
Термин «эффективный» включает выгодные эффекты, такие как аддитивность, синергизм, уменьшенные побочные эффекты, уменьшенная токсичность, увеличенное время до прогрессии заболевания, увеличенное время выживания, сенсибилизация или ресенсибилизация одного агента к другому или улучшенный уровень ответа. Предпочтительно, эффективный эффект может допускать более низкие дозы каждого или любого компонента, вводимого пациенту, таким образом уменьшая токсичность химиотерапии, при оказании и/или поддержании того же терапевтического эффекта. «Синергический» эффект в настоящем контексте относится к терапевтическому эффекту, оказываемому комбинацией, который больше, чем сумма терапевтических эффектов агентов комбинации при индивидуальном использовании. «Аддитивный» эффект в настоящем контексте относится к терапевтическому эффекту, оказываемому комбинацией, который больше, чем терапевтический эффект любого из агентов комбинации при индивидуальном использовании. Термин «уровень ответа» в рамках изобретения относится, в случае солидной опухоли, к степени сокращения размера опухоли в установленный срок, например, 12 недель. Таким образом, например, 50%-й уровень ответа означает сокращение размера опухоли на 50%. Ссылки, приводимые здесь, на ʺклинический ответʺ относятся к уровню ответа 50% или больше. ʺЧастичный ответʺ определяется здесь как составляющий менее 50%.
В рамках изобретения, термин «комбинация», применительно к двум или более соединений и/или агентов, предназначен для определения материала, в котором ассоциированы эти два или более агентов. Термины «комбинированный» и «комбинирование» в этом контексте должны интерпретироваться соответственно.
Ассоциация этих двух или более соединений/агентов в комбинации может быть физической или нефизической. Примеры физически ассоциированных комбинированных соединений/агентов включают:
- композиции (например, унитарные составы), включающие эти два или более соединений/агентов в смеси (например, в одной и той же унифицированной дозе);
- композиции, включающие материал, в котором эти два или более соединений/агентов химически/физико-химически связаны (например, перекрестным связыванием, молекулярной агломерацией или связыванием с общей группой носителя);
- композиции, включающие материал, в котором эти два или более соединений/агентов химически/физико-химически совместно упакованы (например, расположены на поверхности или внутри липидных везикул, частиц (например, микро- или наночастиц) или капелек эмульсии);
- фармацевтические наборы, фармацевтические упаковки или пользовательские упаковки, в которых эти два или более соединений/агентов совместно упакованы или совместно представлены (например, как часть множества унифицированных доз).
Примеры нефизически ассоциированных комбинированных соединений/агентов включают:
- материал (например, неунитарный состав), включающий по меньшей мере одно из этих двух или более соединений/агентов вместе с инструкциями по экстемпоральной ассоциации этого по меньшей мере одного соединения для формирования физической ассоциации этих двух или более соединений/агентов;
- материал (например, неунитарный состав), включающий по меньшей мере одно из этих двух или более соединений/агентов вместе с инструкциями по комбинированной терапии этими двумя или более соединениями/агентами;
- материал, включающий по меньшей мере одно из этих двух или более соединений/агентов вместе с инструкциями по введению популяции пациентов, которой был(и) введен(ы) другой(ие) из этих двух или более соединений/агентов;
- материал, включающий по меньшей мере одно из этих двух или более соединений/агентов в количестве или в форме, специфично адаптированном(ой) для использования в комбинации с другим(и) из этих двух или более соединений/агентов.
В рамках изобретения, термин «комбинированная терапия» предназначен для определения терапий, включающих использование комбинации двух или более соединений/агентов (как определено выше). Таким образом ссылки на «комбинированную терапию», «комбинации» и использование соединений/агентов ʺв комбинацииʺ в этой заявке могут относиться к соединениям/агентам, вводимым как часть одного и того же полного режима лечения. Также позология каждого из этих двух или более соединений/агентов может отличаться: каждое может вводиться одновременно или в разное время. Поэтому понятно, что соединения/агенты комбинации могут быть введены последовательно (например, до или после) или одновременно, в одном и том же фармацевтическом составе (т.е. совместно) или в разных фармацевтических составах (т.е. раздельно). Одновременное введение в одном и том же составе рассматривается как унитарный состав, тогда как одновременно в разных фармацевтических составах рассматривается как неунитарный состав. Позологии каждого из этих двух или более соединений/агентов в комбинированной терапии могут также отличаться в зависимости от пути введения.
В рамках изобретения, термин ʺфармацевтический наборʺ определяет множество одной или более унифицированных доз фармацевтической композиции вместе со средствами для дозирования (например, измерительные средства) и/или средствами доставки (например, ингалятор или шприц), в случае необходимости содержащимися в общей внешней упаковке. В фармацевтических наборах, включающих комбинацию двух или более соединений/агентов, отдельные соединения/агенты могут быть унитарными или неунитарными составами. Унифицированная доза(дозы) может содержаться в блистерной упаковке. Фармацевтический набор может дополнительно включать инструкции по использованию.
В рамках изобретения, термин ʺфармацевтическая упаковкаʺ определяет множество одной или более унифицированных доз фармацевтической композиции, в случае необходимости содержащихся в общей внешней упаковке. В фармацевтических упаковках, включающих комбинацию двух или более соединений/агентов, отдельные соединения/агенты могут быть унитарными или неунитарными составами. Унифицированная доза(дозыы) может содержаться в блистерной упаковке. Фармацевтическая упаковка может дополнительно включать инструкции по использованию.
Термин «н-бутил» в рамках изобретения относится к линейной алкильной группе, содержащей 4 атома углерода.
Термин «оксо» в рамках изобретения относится к группе =O.
Пунктирная связь (-------) обозначает одинарную или двойную связь, как требуется для заполнения валентностей атомов, связываемых этой связью. Понято, что в некоторых случаях соединение имеет ароматический характер. Пунктирная связь (-------) обозначает одинарную или двойную связь, таким образом, что кольцо, содержащее X и U, содержат по меньшей мере две двойных связи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Из формулы (I) будет понято, что соединения по изобретению могут быть представлены следующим образом:
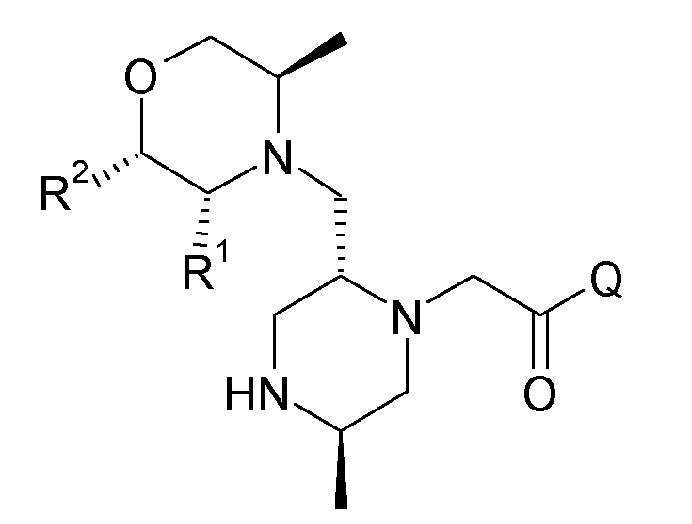
где Q обозначает любой из A, B или C, представленных ниже:
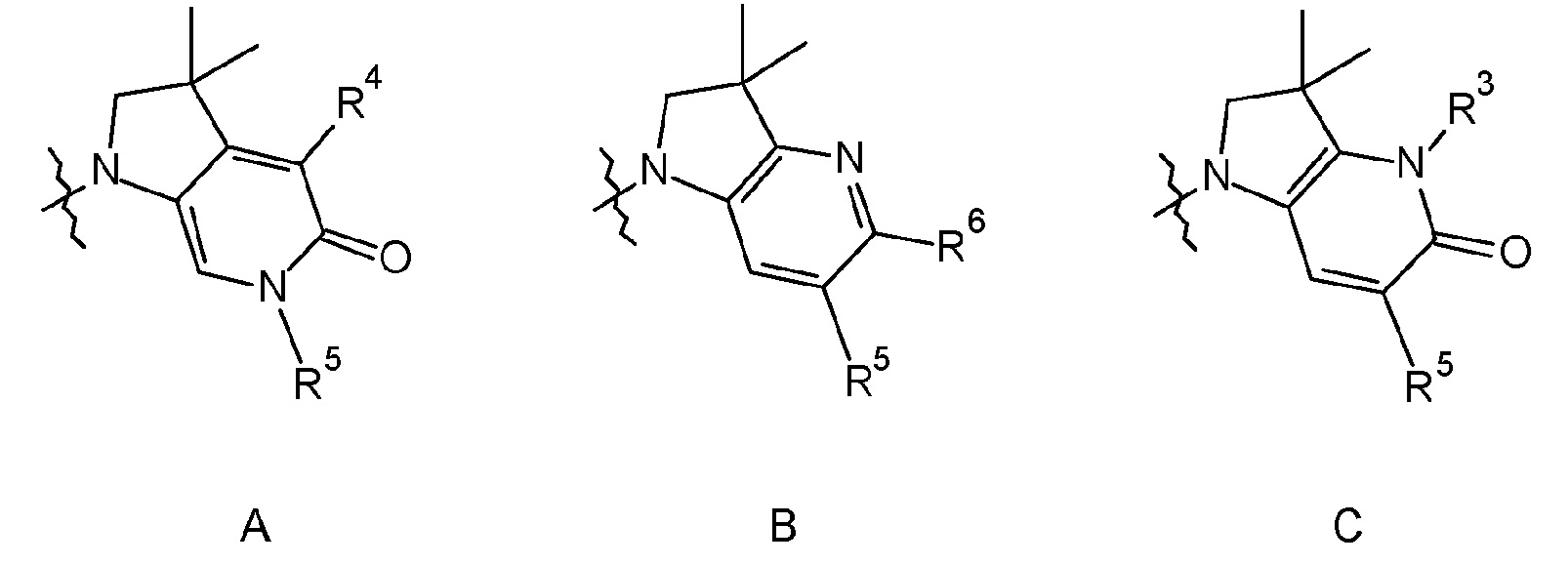
В одном варианте осуществления Q обозначает A. В одном варианте осуществления Q обозначает B. В одном варианте осуществления Q обозначает C.
В одном варианте осуществления, X обозначает CR4 или N. В альтернативном варианте осуществления, X обозначает CR4 или NR3. В альтернативном варианте осуществления, X обозначает N или NR3. В другом варианте осуществления, X обозначает CR4. В другом альтернативном варианте осуществления, X обозначает N. В другом альтернативном варианте осуществления, X обозначает NR3.
В одном варианте осуществления, один из R1 и R2 обозначает водород, и другой обозначает метил, или R1 и R2, оба, обозначают водород. В одном варианте осуществления, один из R1 и R2 обозначает водород, и другой обозначает метил. В другом варианте осуществления R1 обозначает метил, и R2 обозначает водород. В альтернативном варианте осуществления R1 обозначает водород, и R2 обозначает метил. В другом альтернативном варианте осуществления R1 и R2 оба обозначают водород.
В одном варианте осуществления R3 обозначает водород или метил. В альтернативном варианте осуществления R3 обозначает водород или -NH2. В другом альтернативном варианте осуществления R3 обозначает метил или -NH2. В другом варианте осуществления R3 обозначает водород. В другом альтернативном варианте осуществления R3 обозначает метил. В другом альтернативном варианте осуществления R3 обозначает -NH2.
В одном варианте осуществления R4 обозначает водород или метил. В другом варианте осуществления R4 обозначает водород. В альтернативном варианте осуществления R4 обозначает метил.
В одном варианте осуществления R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В одном варианте осуществления R5 обозначает незамещенный н-бутил. В альтернативном варианте осуществления R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора. В другом варианте осуществления R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В другом варианте осуществления R5 обозначает бензил, замещенный одним атомом фтора в положении 2, 3 или 4 фенильной группы (т.е. обозначает 2-фторбензил, 3-фторбензил или 4-фторбензил). В другом варианте осуществления R5 обозначает бензил, замещенный одним атомом фтора в положении 4 фенильной группы (т.е. обозначает 4-фторбензил). В другом варианте осуществления R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,3, 3,4 или 2,4 фенильной группы (т.е. обозначает 2,3-дифторбензил, 3,4-дифторбензил или 2,4-дифторбензил). В другом варианте осуществления R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е. обозначает 2,4-дифторбензил).
В другом варианте осуществления R5 обозначает незамещенный н-бутил, 4-фторфенил или 2,4-дифторфенил. В другом варианте осуществления R5 обозначает 4-фторфенил.
В одном варианте осуществления R6 обозначает гидроксиметил или -CH(ORx)CH2ORz. В одном варианте осуществления R6 обозначает гидроксиметил.
В одном варианте осуществления R6 обозначает -CH(ORx)CH2ORz. В одном варианте осуществления, один из Rx и Rz обозначает водород, и другой обозначает метил, или Rx и Rz оба обозначают водород. В другом варианте осуществления Rx обозначает метил, и Rz обозначает водород. В альтернативном варианте осуществления Rx обозначает водород, и Rz обозначает метил. В другом альтернативном варианте осуществления Rx и Rz оба обозначают водород. В другом варианте осуществления Rx обозначает водород или метил, и Rz обозначает водород. В другом альтернативном варианте осуществления Rx и Rz оба обозначают метил.
В одном варианте осуществления R6 обозначает гидроксиметил, -CH(OH)CH2OH, -CH(OMe)CH2OH или -CH(OH)CH2OMe. В другом варианте осуществления R6 обозначает гидроксиметил, -CH(OH)CH2OH или -CH(OMe)CH2OH. В другом варианте осуществления R6 обозначает гидроксиметил.
В одном варианте осуществления R6 обозначает оксо (т.е. =O).
Подформулы
В одном варианте осуществления соединение представляет собой соединение формулы (I), в которой:
X обозначает CR4, N или NR3;
причем
- когда X обозначает CR4, тогда U обозначает азот, и R6 обозначает оксо; или
- когда X обозначает N, тогда U обозначает углерод, и R6 обозначает гидроксиметил или -CH(ORx)CH2ORz; или
- когда X обозначает NR3, тогда U обозначает углерод, и R6 обозначает оксо;
пунктирная связь (-------) обозначает одинарную или двойную связь, причем по меньшей мере две из указанных пунктирных связей обозначают двойную связь;
один из R1 и R2 обозначает водород, и другой обозначает метил, или R1 и R2 оба обозначают водород;
R3 обозначает водород, метил или -NH2;
R4 обозначает водород или метил;
R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы; и
один из Rx и Rz обозначает водород, и другой обозначает метил, или Rx и Rz оба обозначают водород.
В другом варианте осуществления соединение представляет собой соединение формулы (I), в которой:
X обозначает CR4, N или NR3;
причем
- когда X обозначает CR4, тогда U обозначает азот, и R6 обозначает оксо; или
- когда X обозначает N, тогда U обозначает углерод, и R6 обозначает гидроксиметил или -CH(ORx)CH2ORz; или
- когда X обозначает NR3, тогда U обозначает углерод, и R6 обозначает оксо;
пунктирная связь (-------) обозначает одинарную или двойную связь, причем по меньшей мере две из указанных пунктирных связей обозначают двойную связь;
один из R1 и R2 обозначает водород, и другой обозначает метил, или R1 и R2 оба обозначают водород;
R3 обозначает водород, метил или -NH2;
R4 обозначает водород или метил;
R5 обозначает незамещенный н-бутил 4-фторбензил или 2,4-фторбензил;
Rx обозначает водород или метил; и
Rz обозначает водород.
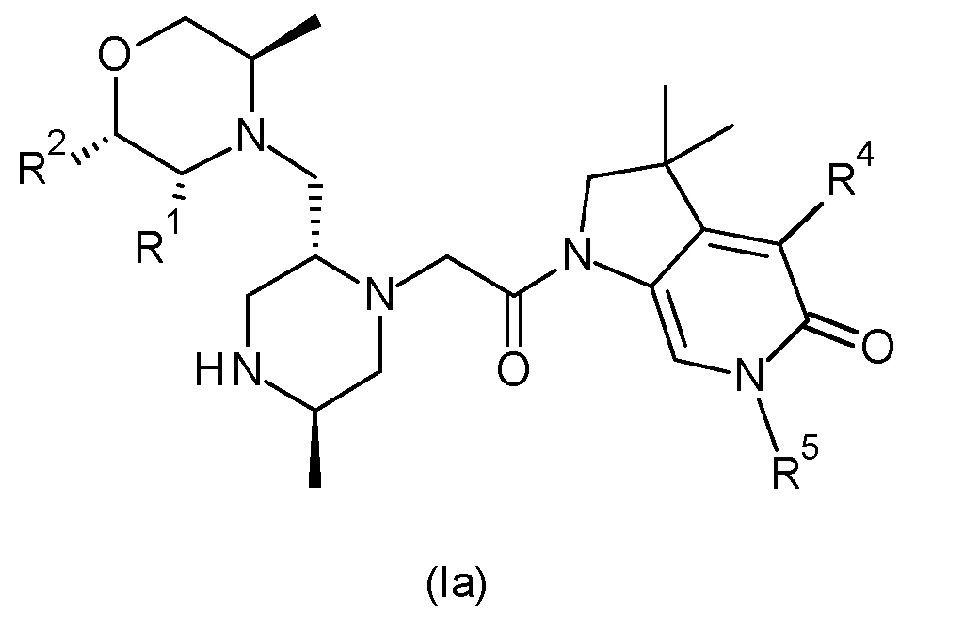
В одном варианте осуществления соединение формулы (I) представляет собой соединение формулы (Ia):
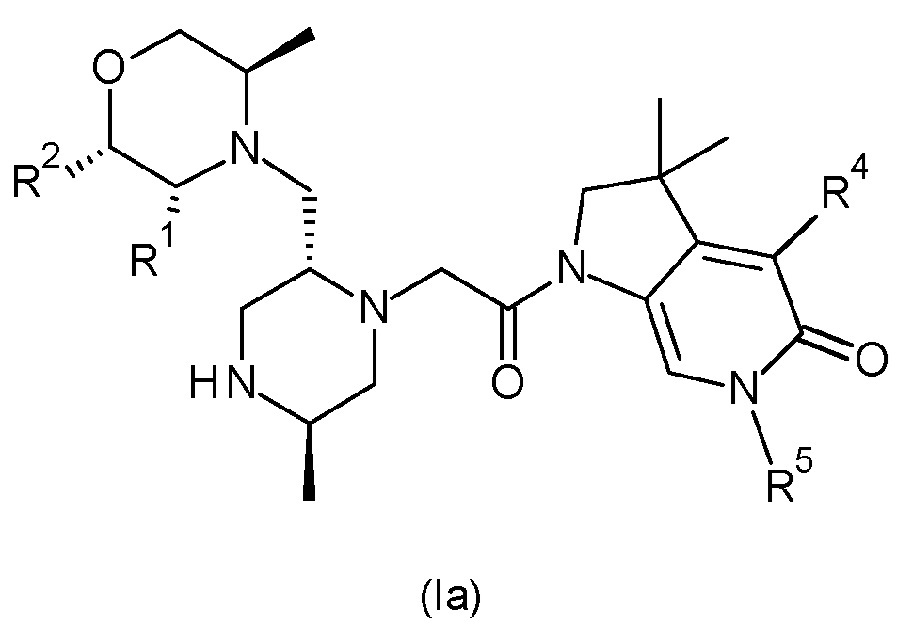
или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват; в которой R1, R2, R4 и R5 имеют значения, определенные в любом из вариантов осуществления.
В одном варианте соединения формулы (Ia), один из R1 и R2 обозначает водород, и другой обозначает метил, или R1 и R2 оба обозначают водород. В другом варианте соединения формулы (Ia) R1 обозначает водород, и R2 обозначает метил, или R1 и R2 оба обозначают водород.
В другом варианте соединения формулы (Ia) R1 обозначает метил, и R2 обозначает водород. В альтернативном варианте осуществления соединения формулы (Ia) R1 обозначает водород, и R2 обозначает метил.
В одном варианте соединения формулы (Ia) R4 обозначает водород или метил.
В одном варианте соединения формулы (Ia) R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В одном варианте соединения формулы (Ia) R5 обозначает незамещенный н-бутил. В альтернативном варианте соединения формулы (Ia) R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора. В другом варианте соединения формулы (Ia) R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В другом варианте соединения формулы (Ia) R5 обозначает бензил, замещенный одним атомом фтора в положении 4 фенильной группы (т.е. обозначает 4-фторбензил). В другом варианте соединения формулы (Ia) R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е. обозначает 2,4-дифторбензил).
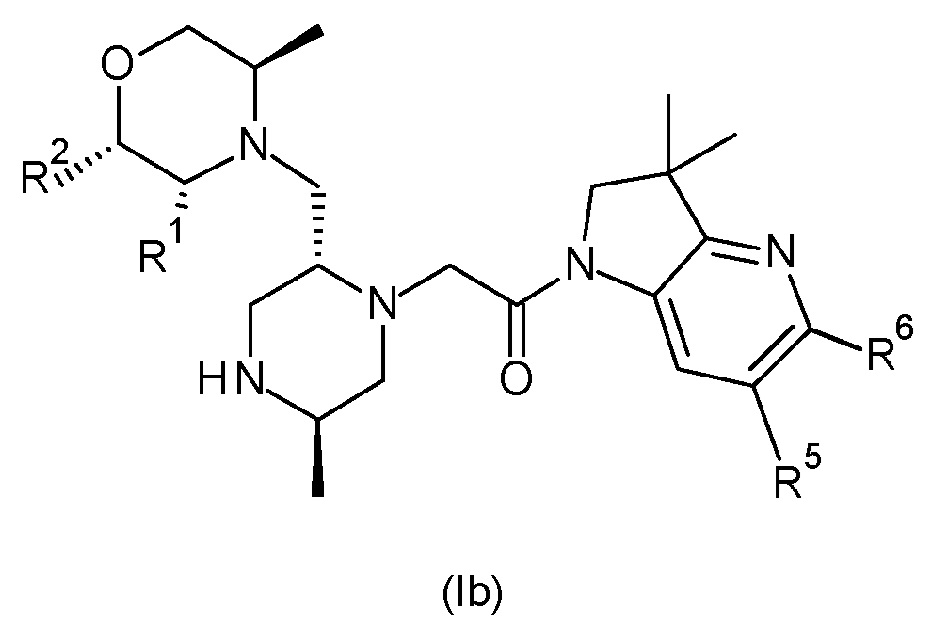
В одном варианте осуществления соединение формулы (I) представляет собой соединение формулы (Ib):
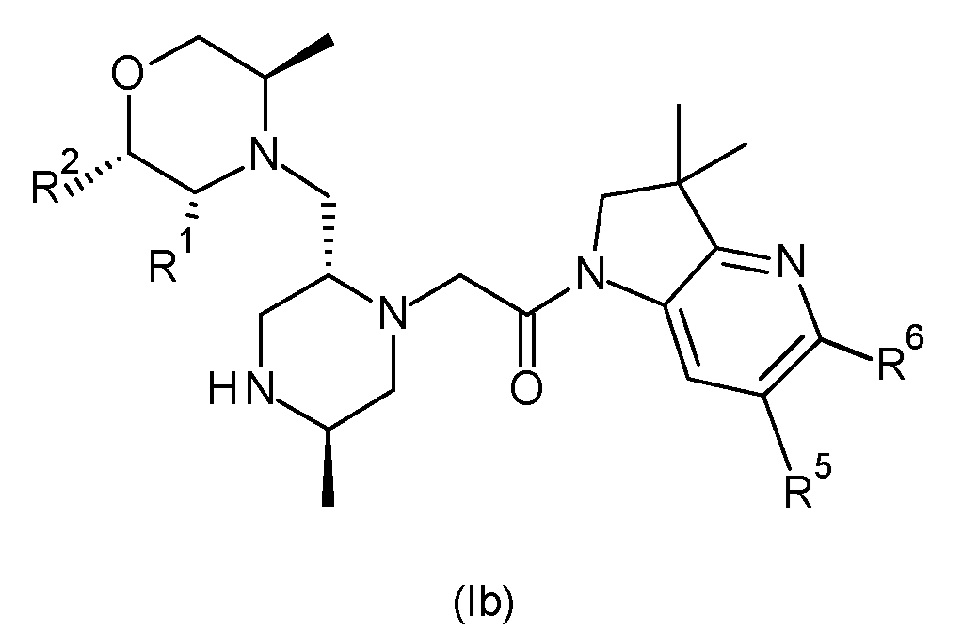
или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват; в которой R1, R2, R5, R6, Rx и Rz имеют значения, определенные в любом из вариантов осуществления. В одном варианте осуществления R6 обозначает гидроксиметил или -CH(ORx)CH2ORz.
В одном варианте соединения формулы (Ib) R1 обозначает метил, и R2 обозначает водород, или R1 и R2 оба обозначают водород.
В другом варианте соединения формулы (Ib) R1 и R2 оба обозначают водород.
В одном варианте соединения формулы (Ib) R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В одном варианте соединения формулы (Ib) R5 обозначает незамещенный н-бутил. В альтернативном варианте соединения формулы (Ib) R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора. В другом варианте соединения формулы (Ib) R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В другом варианте соединения формулы (Ib) R5 обозначает бензил, замещенный одним атомом фтора в положении 2, 3 или 4 фенильной группы (т.е. обозначает 2-фторбензил, 3-фторбензил или 4-фторбензил). В другом варианте соединения формулы (Ib) R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е. обозначает 2,4-дифторбензил). В другом варианте соединения формулы (Ib) R5 обозначает бензил, замещенный одним атомом фтора в положении 4 фенильной группы (т.е. обозначает 4-фторбензил).
В одном варианте соединения формулы (Ib) R6 обозначает гидроксиметил, -CH(OH)CH2OH, -CH(OMe)CH2OH или -CH(OH)CH2OMe.
В другом варианте соединения формулы (Ib) R6 обозначает гидроксиметил, -CH(OH)CH2OH или -CH(OMe)CH2OH.
В другом варианте соединения формулы (Ib) R6 обозначает гидроксиметил.
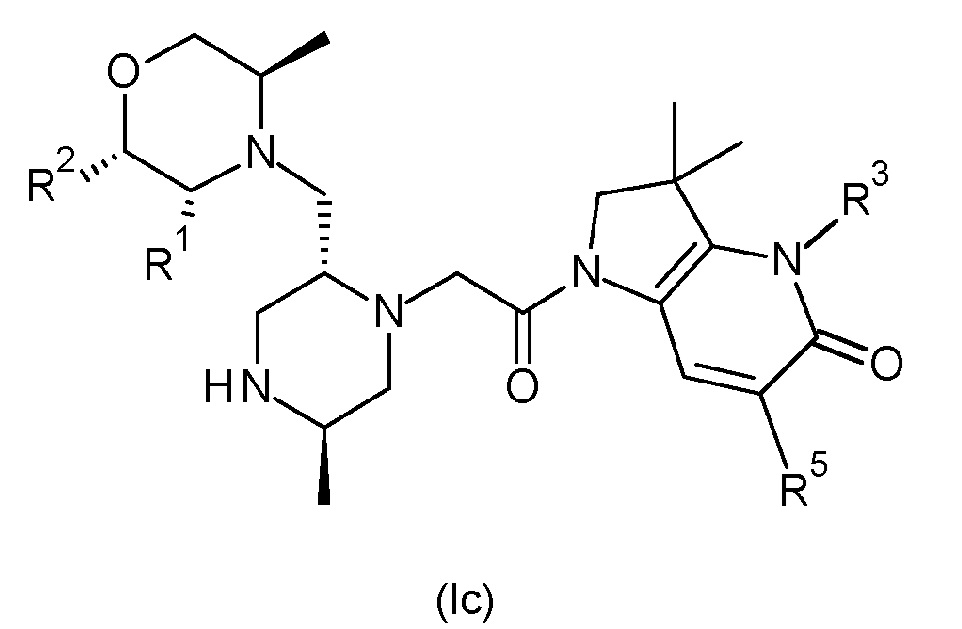
В одном варианте осуществления соединение формулы (I) представляет собой соединение формулы (Ic):
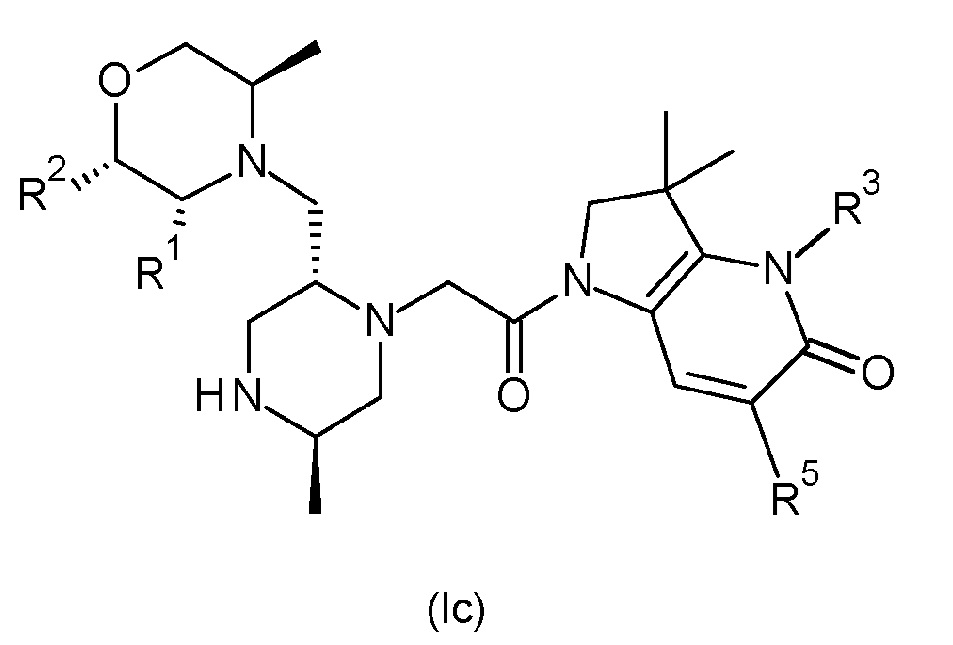
или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват; в которой R1, R2, R3 и R5 имеют значения, определенные в любом из вариантов осуществления.
В одном варианте соединения формулы (Ic), один из R1 и R2 обозначает водород, и другой обозначает метил, или R1 и R2 оба обозначают водород. В другом варианте соединения формулы (Ic) R1 обозначает метил, и R2 обозначает водород, или R1 и R2 оба обозначают водород.
В одном варианте соединения формулы (Ic) R3 обозначает водород или метил. В альтернативном варианте соединения формулы (Ic) R3 обозначает водород или -NH2. В другом альтернативном варианте соединения формулы (Ic) R3 обозначает метил или -NH2. В другом варианте соединения формулы (Ic) R3 обозначает водород. В другом альтернативном варианте соединения формулы (Ic) R3 обозначает метил. В другом альтернативном варианте соединения формулы (Ic) R3 обозначает -NH2.
В одном варианте осуществления соединения формулы (Ic) R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В одном варианте соединения формулы (Ic) R5 обозначает незамещенный н-бутил. В альтернативном варианте соединения формулы (Ic) R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора. В другом варианте соединения формулы (Ic) R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В другом варианте соединения формулы (Ic) R5 обозначает бензил, замещенный одним атомом фтора в положениях 2 или 4 фенильной группы (т.е. обозначает 2-фторбензил или 4-фторбензил). В другом варианте соединения формулы (Ic) R5 обозначает бензил, замещенный одним атомом фтора в положении 4 фенильной группы (т.е. обозначает 4-фторбензил). В другом варианте соединения формулы (Ic) R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е. обозначает 2,4-дифторбензил).
В одном варианте осуществления соединение формулы (I) представляет собой соединение формулы (Id):
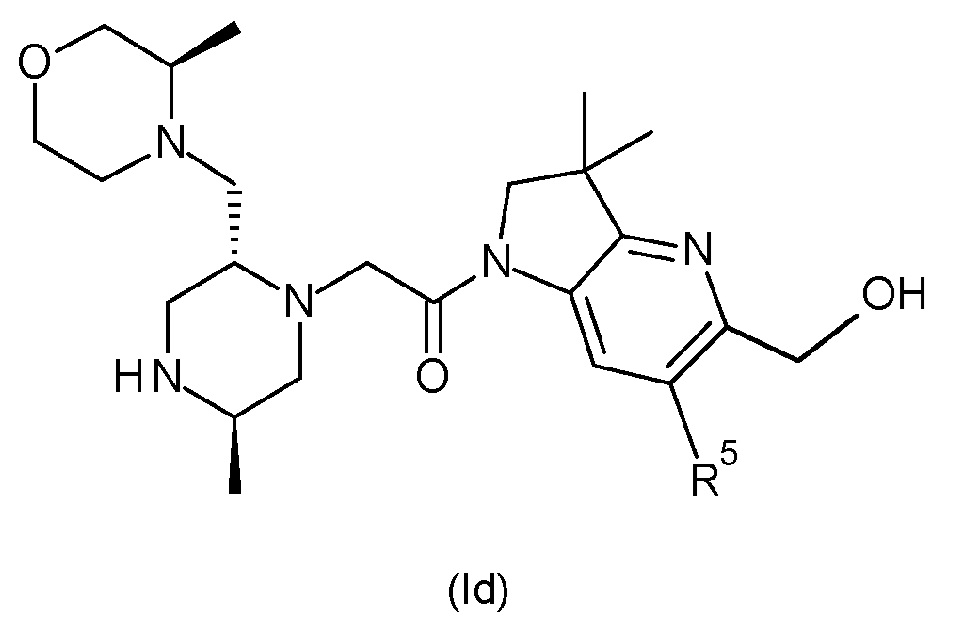
или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват; в которой R5 имеет значения, определенные в любом из вариантов осуществления.
В одном варианте соединения формулы (Id) R5 обозначает незамещенный н-бутил или бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В одном варианте соединения формулы (Id) R5 обозначает незамещенный н-бутил. В альтернативном варианте соединения формулы (Id) R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора. В другом варианте соединения формулы (Id) R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы. В другом варианте соединения формулы (Id) R5 обозначает бензил, замещенный одним атомом фтора в положении 2, 3 или 4 фенильной группы (т.е. обозначает 2-фторбензил, 3-фторбензил или 4-фторбензил). В другом варианте соединения формулы (Id) R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е. обозначает 2,4-дифторбензил). В другом варианте соединения формулы (Id) R5 обозначает бензил, замещенный одним атомом фтора в положении 4 фенильной группы (т.е. обозначает 4-фторбензил).
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib) или (Ic), в которой R1 обозначает метил, и R2 обозначает водород.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib) или (Ic), в которой R1 и R2 оба обозначают водород.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib) или (Ic), в которой R1 обозначает водород, и R2 обозначает метил.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает незамещенный н-бутил.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный на фенильной группе одним или двумя атомами фтора.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный на фенильной группе двумя атомами фтора, например, 2,3 дизамещенный, 2,4 дизамещенный, 2,5 дизамещенный, 3,5 дизамещенный, 2,6 дизамещенный или 3,4 дизамещенный.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный одним или двумя атомами фтора в положении 2, 3 и/или 4 фенильной группы.
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный одним атомом фтора в положении 2, 3 или 4 фенильной группы (т.е. обозначает 2-фторбензил, 3-фторбензил или 4-фторбензил).
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,3, 3,4 или 2,4 фенильной группы (т.е. обозначает 2,3-дифторбензил, 3,4-дифторбензил или 2,4-дифторбензил).
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает бензил, замещенный двумя атомами фтора в положениях 2,4 фенильной группы (т.е., обозначает 2,4-дифторбензил).
В одном варианте осуществления соединение формулы (I) является соединением формулы (I), (Ia), (Ib), (Ic) или (Id), в которой R5 обозначает 2,4-дифторбензил или 4-фторбензил.
В одном варианте осуществления изобретение относится к соединению формулы (I), включая свободное основание соединения из Примеров 1-37 или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват.
В одном варианте осуществления изобретение относится к соединению формулы (I), которое является свободным основанием соединения из Примеров 1-37 или его таутомерной или стереохимически изомерной формой, фармацевтически приемлемой солью или сольватом.
В одном варианте осуществления изобретение относится к соединению формулы (I), включая соединение из Примеров 1-37 или его таутомерную или стереохимически изомерную форму или сольват.
В другом варианте осуществления соединение выбрано из свободного основания из Примеров 1-34 или его таутомерной или стереохимически изомерной формы, фармацевтически приемлемой соли или сольвата.
В другом варианте осуществления изобретение относится к соединению формулы (I), включая соединение, выбранное из следующих соединений:
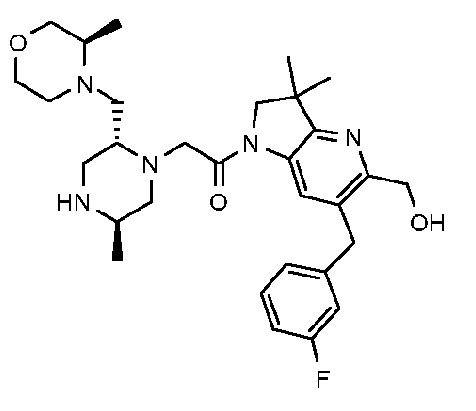
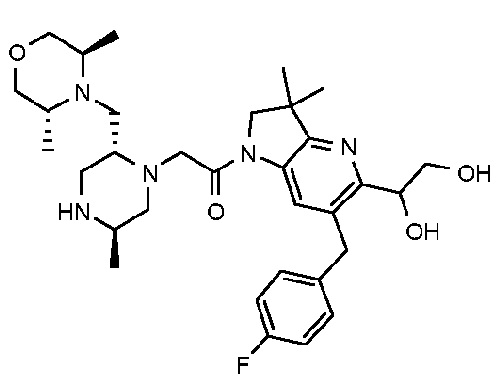
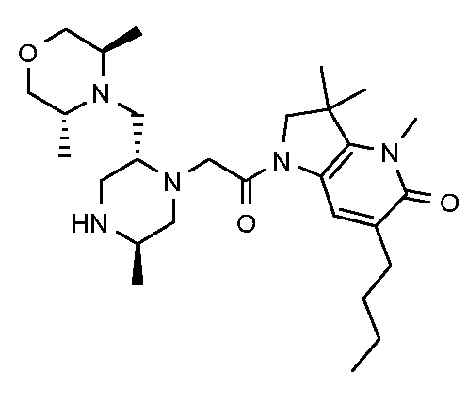
1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он;
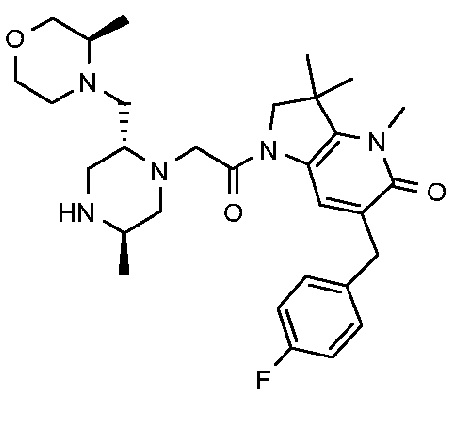
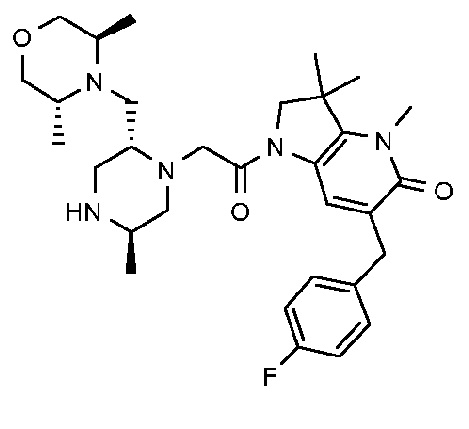
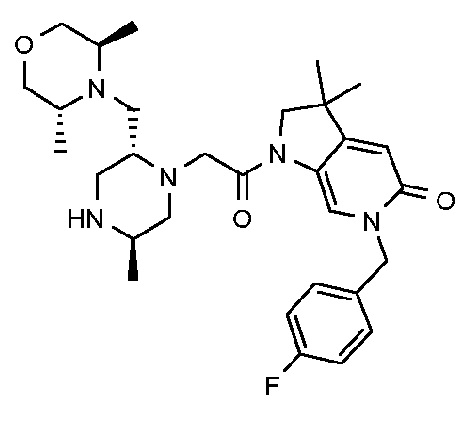
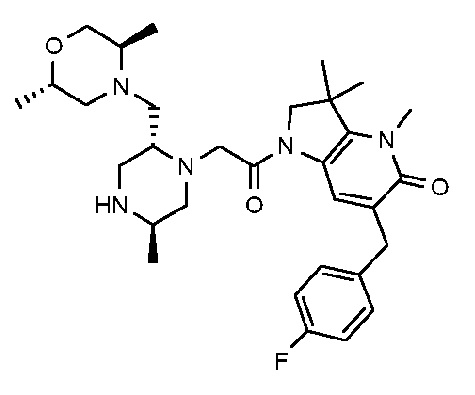
6-[(4-фторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
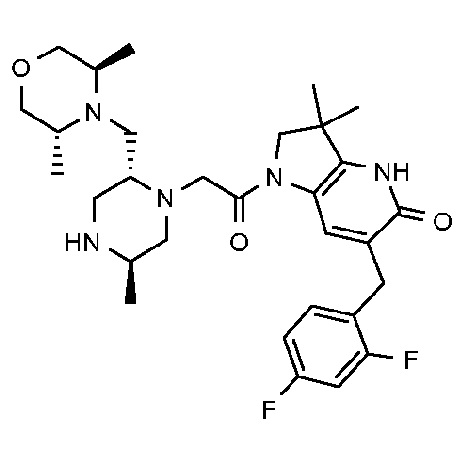
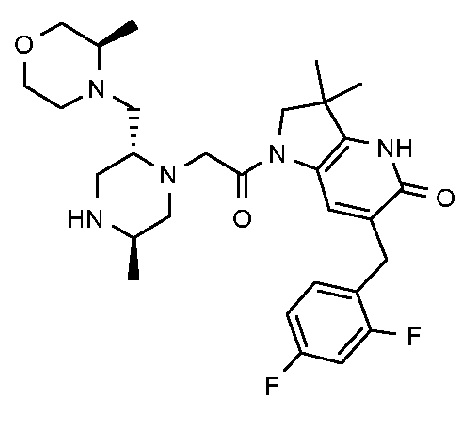
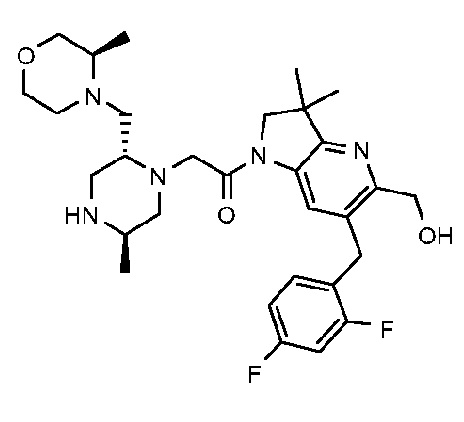
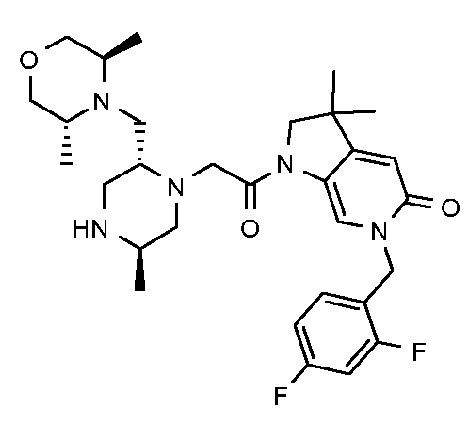
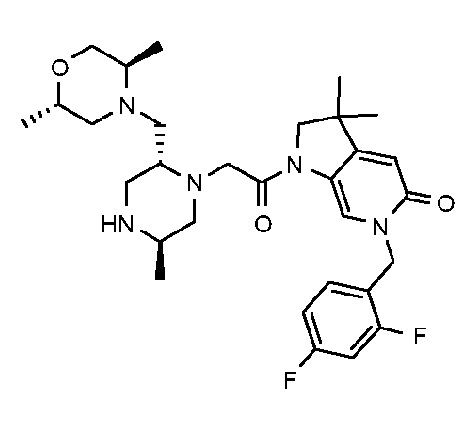
6-[(2,4-дифторфенил)метил]-3,3-диметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
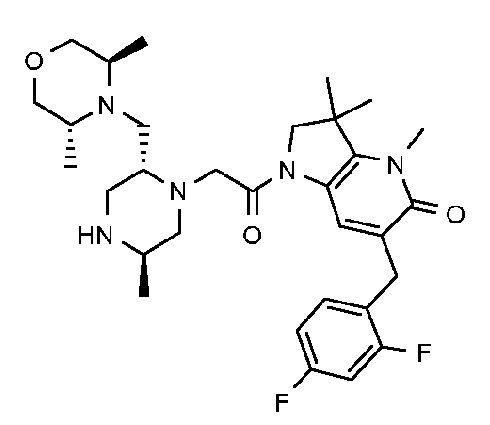
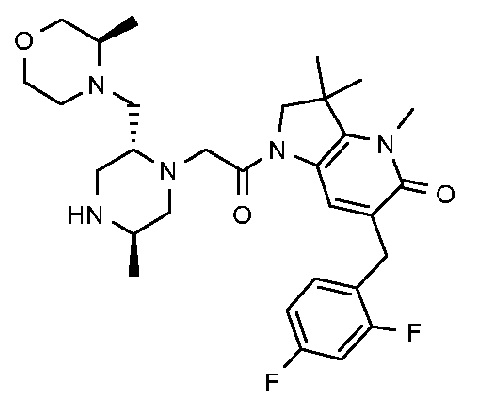
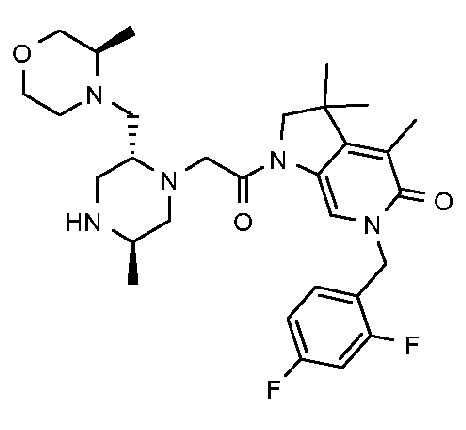
6-[(2,4-дифторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
1-[5-((R или S)-1,2-дигидроксиэтил)-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]этан-1-он;
6-[(2,4-дифторфенил)метил]-1-{2-[(2R,5R)-2-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-5-он;
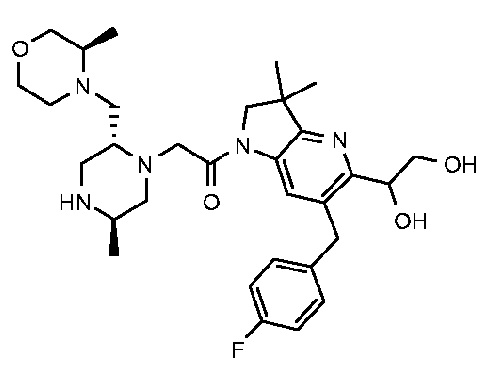
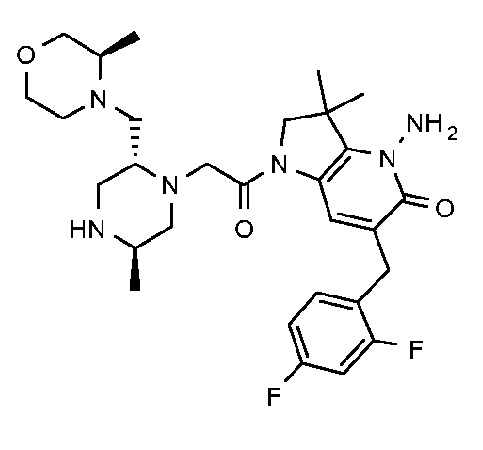
4-амино-6-[(4-фторфенил)метил]-3,3-диметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
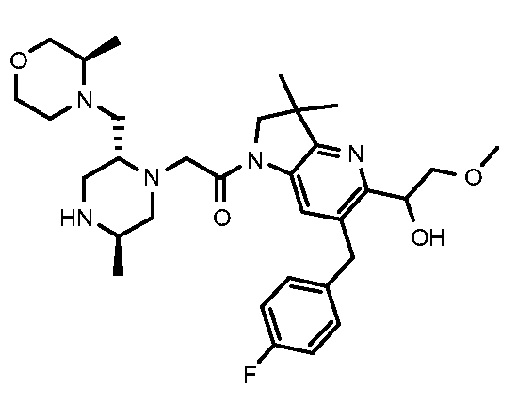
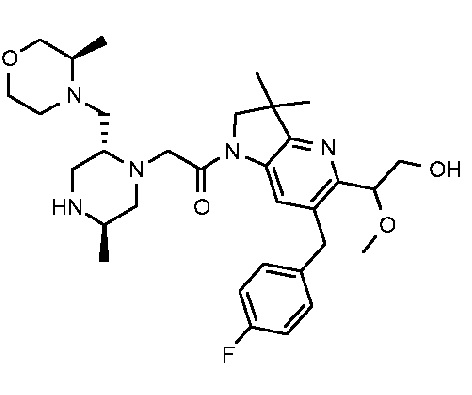
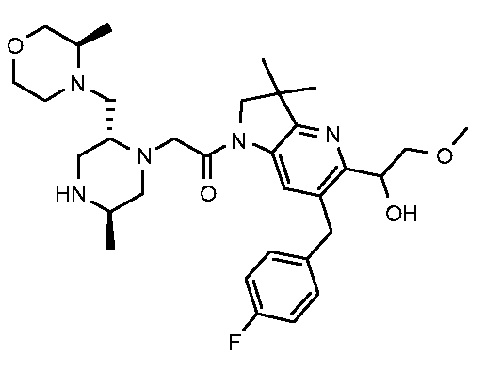
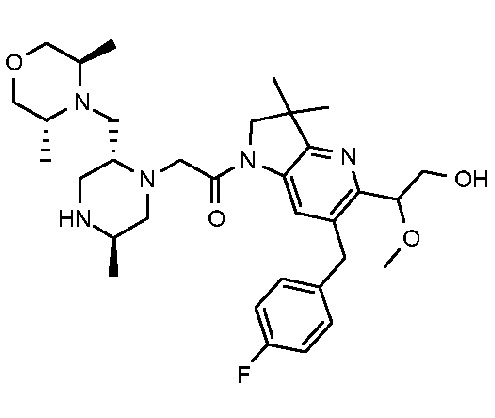
1-{6-[(4-фторфенил)метил]-5-((R или S)-2-гидрокси-1-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он;
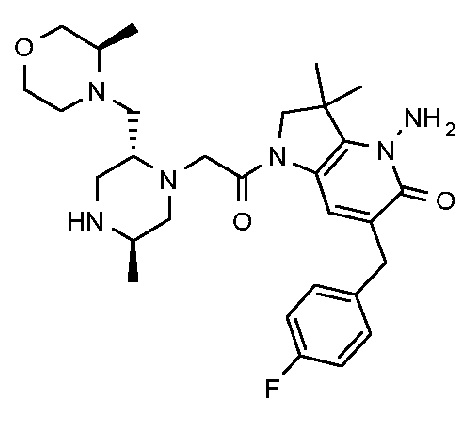
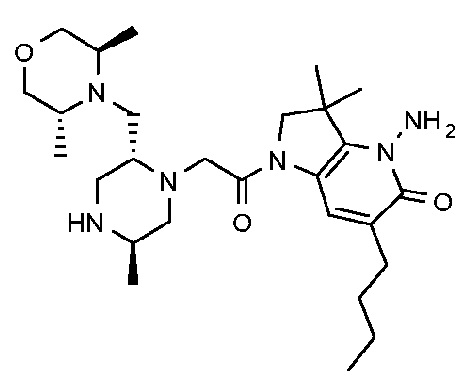
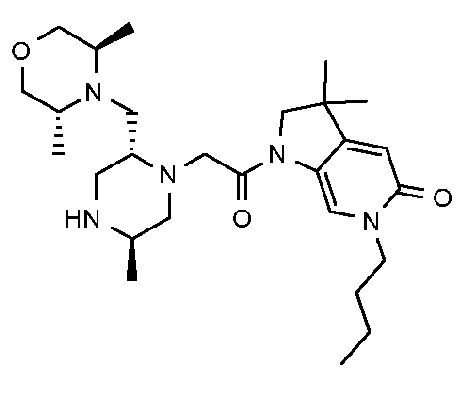
4-амино-6-бутил-1-{2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
6-[(2,4-дифторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-5-он;
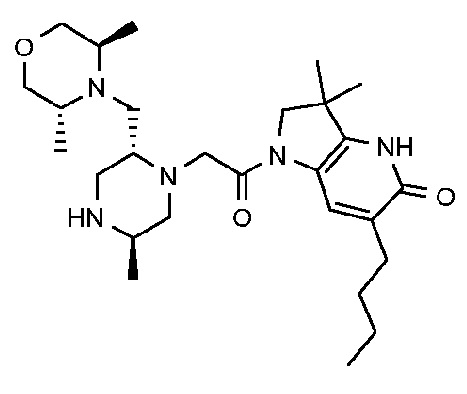
6-бутил-1-{2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он; и
6-бутил-1-{2-[(2R,5R)-2-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он;
или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват.
В другом варианте осуществления изобретение относится к соединению, выбранному из следующих соединений:
1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он дигидрохлорид (E2);
6-[(4-фторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E6);
6-[(2,4-дифторфенил)метил]-3,3-диметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E8);
6-[(2,4-дифторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E19);
1-[5-((R или S)-1,2-дигидроксиэтил)-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]этан-1-он дигидрохлорид (E21);
6-[(2,4-дифторфенил)метил]-1-{2-[(2R,5R)-2-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-5-он дигидрохлорид (E22);
4-амино-6-[(4-фторфенил)метил]-3,3-диметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E24);
1-{6-[(4-фторфенил)метил]-5-((R или S)-2-гидрокси-1-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он тригидрохлорид (E27);
4-амино-6-бутил-1-{2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E30);
6-[(2,4-дифторфенил)метил]-3,3,4-триметил-1-{2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]ацетил}-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-5-он дигидрохлорид (E31);
6-бутил-1-{2-[(2R,5R)-2-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E32) и
6-бутил-1-{2-[(2R,5R)-2-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-5-метилпиперазин-1-ил]ацетил}-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он дигидрохлорид (E37)
или к его таутомерной или стереохимически изомерной форме или сольвату.
В другом варианте осуществления соединение выбрано из свободного основания из Примеров 2, 6, 19, 21, 22, 24, 27, 30, 31 и 32, или его таутомерной или стереохимически изомерной формы, фармацевтически приемлемой соли или сольвата.
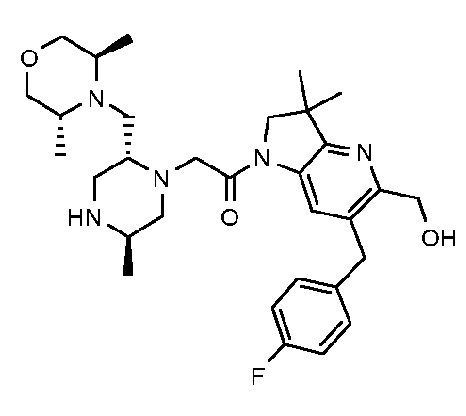
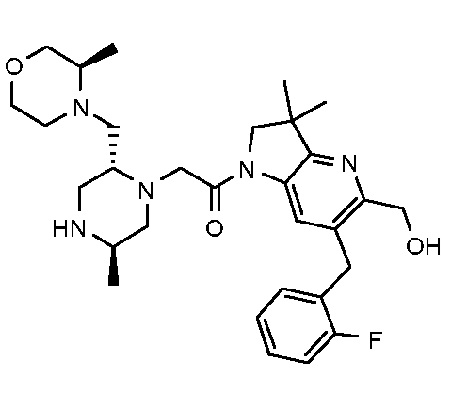
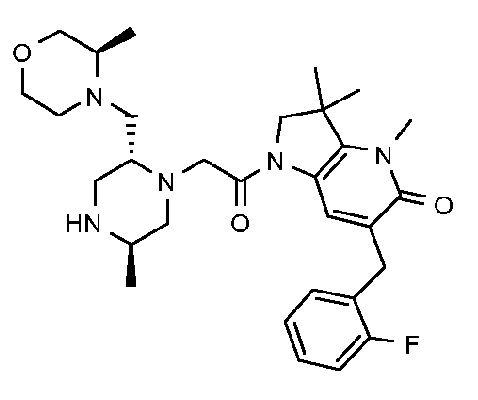
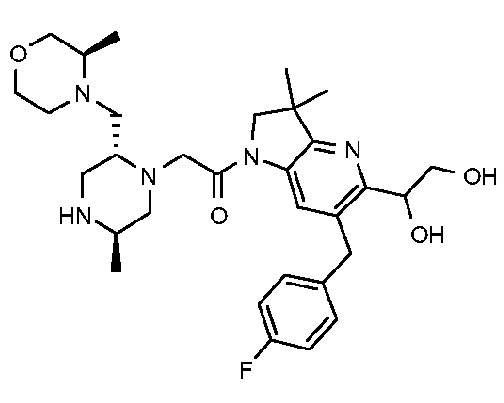
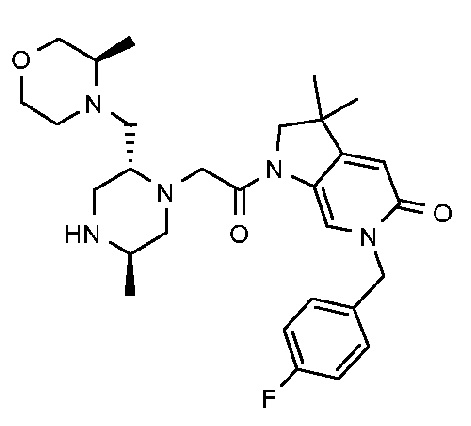
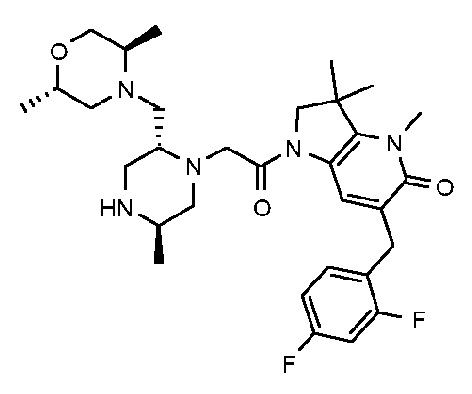
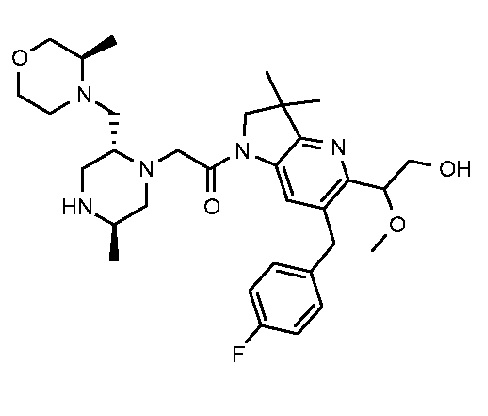
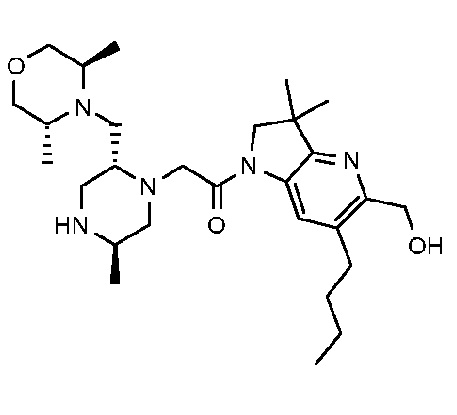
В другом варианте осуществления изобретение относится к соединению формулы (I), включая 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он или его таутомерную или стереохимически изомерную форму, фармацевтически приемлемую соль или сольват.
В другом варианте осуществления изобретение относится к соединению формулы (I), включая 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он гидрохлоридную соль или ее таутомерную или стереохимически изомерную форму или сольват.
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он дигидрохлориду (E2).
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он лактатной соли или ее таутомерной или стереохимически изомерной форме или сольвату.
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактатной соли или ее таутомерной или стереохимически изомерной форме или сольвату.
В другом варианте осуществления соединение выбрано из Примеров 38-42.
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактату (Форма A) (E39).
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактату (Форма B) (E40).
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактату (Форма C) (E43).
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфатной соли или ее таутомерной или стереохимически изомерной форме или сольвату.
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфату (Форма F) (E41).
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилатной соли или ее таутомерной или стереохимически изомерной форме или сольвату.
В другом варианте осуществления изобретение относится к 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилату (Форма B) (E42).
В другом варианте осуществления выбранное соединение отличается от соединения из Примера 35 или его таутомерной или стереохимически изомерной формы, фармацевтически приемлемой соли или сольвата.
В другом варианте осуществления выбранное соединение отличается от соединения из Примера 2 или его таутомерной или стереохимически изомерной формы, фармацевтически приемлемой соли или сольвата.
Для предотвращения сомнения следует понимать, что каждое общее и частное предпочтение, вариант осуществления и пример для одного заместителя могут быть скомбинированы с каждым общим и частным предпочтением, вариантом осуществления и примером для одного или более, в частности, всех других заместителей, как определено здесь, и что все такие варианты осуществления охватываются этой заявкой.
СОЛИ, СОЛЬВАТЫ, ТАУТОМЕРЫ, ИЗОМЕРЫ, N-ОКСИДЫ, СЛОЖНЫЕ ЭФИРЫ, ПРОЛЕКАРСТВА И ИЗОТОПЫ
Ссылка на соединение формулы (I) и ее подгрупп также включает его ионные формы, соли, сольваты, изомеры (включая геометрические и стереохимические изомеры), таутомеры, N-оксиды, сложные эфиры, пролекарства, изотопы и защищенные формы, например, как обсуждено ниже; в частности, соли или таутомеры или изомеры или N-оксиды или сольваты; и более конкретно, соли или таутомеры или N-оксиды или сольваты, еще более конкретно соли или таутомеры или сольваты.
Соли
Многие соединения формулы (I) могут существовать в форме солей, например, солей присоединения с кислотой или, в некоторых случаях, солей с органическими и неорганическими основаниями, таких как карбоксилатные, сульфонатные и фосфатные соли. Все такие соли находятся в рамках этого изобретения, и ссылки на соединения формулы (I) включают солевые формы соединений.
Соли согласно настоящему изобретению могут быть синтезированы из родительского соединения, содержащего основную или кислую группу, стандартными химическими способами, такими как способы, описанные в Pharmaceutical Salts: Properties, Selection, and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, издание в твердом переплете, 388 страниц, август 2002. Обычно такие соли могут быть получены путем реакции форм свободной кислоты или основания этих соединений с подходящими основанием или кислотой в воде или в органическом растворителе, или в смеси обоих; обычно используются неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Соли присоединения с кислотой (моно- или ди-соли) могут быть сформированы с большим разнообразием кислот, как неорганических, так и органических. Примеры солей присоединения с кислотой включают моно- или ди-соли, сформированные с кислотой, выбранной из группы, состоящей из уксусной, 2,2-дихлоруксусной, адипиновой, альгиновой, аскорбиновой (например, L-аскорбиновой), L-аспарагиновой, бензолсульфоновой, бензойной, 4-ацетамидобензойной, бутеновой, (+) камфорной, камфорсульфоновой, (+)-(1S)-камфор-10-сульфоновой, каприновой, капроновой, каприловой, коричной, лимонной, цикламиновой, додецилсерной, этан-1,2-дисульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, муравьиной, фумаровой, галактаровой, гентизиновой, глюкогептоновой, D-глюконовой, глюкуроновой (например, D-глюкуроновой), глутаминовой (например, L-глутаминовой), α-оксоглутаровой, гликолевой, гиппуровой, галогеноводородных кислот (например, бромоводородной, хлороводородной, йодоводородной), изэтиновой, молочной (например, (+)-L-молочной, (±)-DL-молочной), лактобионовой, малеиновой, яблочной, (-)-L-яблочной, малоновой, (±)-DL-миндальной, метансульфоновой, нафталин-2-сульфоновой, нафталин-1,5-дисульфоновой, 1-гидрокси-2-нафтойной, никотиновой, азотной, олеиновой, оротовой, щавелевой, пальмитиновой, памовой, фосфорной, пропионовой, пировиноградной, L-пироглутаминовой, салициловой, 4-аминосалициловой, себациновой, стеариновой, янтарной, серной, дубильной, (+)-L-винной, тиоциановой, п-толуолсульфоновой, ундециленовой и валериановой кислот, а также ацилированные аминокислоты и катионообменные смолы.
Одна частная группа солей состоит из солей, сформированных из уксусной, соляной, йодоводородной, фосфорной, азотной, серной, лимонной, молочной, янтарной, малеиновой, яблочной, изэтиновой, фумаровой, бензолсульфоновой, толуолсульфоновой, метансульфоновой (мезилат), этансульфоновой, нафталинсульфоновой, валерьяновой, уксусной, пропионовой, бутеновой, малоновой, глюкуроновой и лактобионовой кислот. Одна особая подгруппа солей состоит из солей, сформированных из соляной, молочной (например, (+)-L-молочной, (-)-D-молочной или (±)-DL-молочной), серной и метансульфоновой (мезилат) кислот. Одна особая подгруппа солей состоит из солей, сформированных из молочной (например, (+)-L-молочной, (-)-D-молочной или (±)-DL-молочной), серной и метансульфоновой (мезилат) кислот. Одна особая подгруппа солей состоит из солей, сформированных из молочной (например, (+)-L-молочной, (-)-D-молочной или (±)-DL-молочной) и серной кислот. Одна частная соль является хлороводородной солью. Одна другая частная соль является лактатной солью (такой как соединение из Примеров 39, 40 и 43). Одна другая частная соль является сульфатной солью (такой как соединение Примера 41). Одна другая частная соль является мезилатной солью (такой как соединение Примера 42). Одна частная соль является лактатной солью (такой как соединение Примеров 39, 40 и 43, в частности, соединение Примера 43), например, L-(+)-лактатной солью.
Если соединение является анионным или имеет функциональную группу, которая может быть анионной (например, -COOH может быть -COO-), то соль можно формировать с органическим или неорганическим основанием, генерируя подходящий катион. Примеры подходящих неорганических катионов включают, но не ограничены ими, ионы щелочного металла, такие как Li+, Na+ и K+, катионы щелочноземельного металла, такие как Ca2+ и Mg2+, и другие катионы такой как Al3+ или Zn+. Примеры подходящих органических катионов включают, но не ограничены ими, ион аммония (т.е. NH4+) и ионы замещенного аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами некоторых подходящих ионов замещенного аммония являются полученные из: метиламина, этиламина, диэтиламина, пропиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером обычного иона четвертичного аммония является N(CH3)4+.
Если соединения формулы (I) содержат функциональную аминогруппу, они могут образовывать соли четвертичного аммония, например, реакцией с алкилирующим агентом согласно способам, известным специалисту. Такие четвертичные аммониевые основания находятся в рамках формулы (I).
Соединения по изобретению могут существовать как моно- ди-или три-соли, в частности моно- или ди-соли, в зависимости от pKa кислоты, из которой сформирована соль.
Солевые формы соединений по изобретению являются, как правило, фармацевтически приемлемыми солями, и примеры фармацевтически приемлемых солей обсуждаются в Berge et al., 1977, "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19. Однако соли, которые не являются фармацевтически приемлемыми, могут также быть получены в качестве промежуточных форм, которые могут затем превращаться в фармацевтически приемлемые соли. Такие не-фармацевтически приемлемые солевые формы, которые могут быть использованы, например, в очистке или разделении соединений по изобретению, также являются частью изобретения.
В одном варианте осуществления изобретение относится к фармацевтической композиции, включающей раствор (например, водный раствор), содержащий соединение формулы (I) и ее подгрупп и примеров, как описано здесь, в форме соли в концентрации более 10 мг/мл, как правило, более 15 мг/мл, и в частности, более 20 мг/мл.
N-оксиды
Соединения формулы (I), содержащие функциональную аминогруппу, могут также образовывать N-оксиды. Ссылка здесь на соединение формулы (I), содержащее функциональную аминогруппу, также включает N-оксид.
Если соединение содержит несколько функциональных аминогрупп, один или больше чем один атом азота может быть окислен для формирования N-оксида. Частными примерами N-оксидов являются N-оксиды третичного амина или атом азота азотсодержащего гетероцикла.
N-оксиды могут быть сформированы обработкой соответствующего амина окисляющим агентом, таким как пероксид водорода или надкислота (например, пероксикарбоновая кислота), см., например, Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience, страницы. Более конкретно, N-оксиды могут быть получены с использованием процедуры, описанной L. W. Deady (Syn. Comm. 1977, 7, 509-514), в котором аминосоединение реагирует с м-хлорпероксибензойной кислотой (MCPBA), например, в инертном растворителе, таком как дихлорметан.
Геометрические изомеры и таутомеры
Соединения формулы (I) могут существовать во многих различных геометрических изомерных и таутомерных формах, и ссылки на соединения формулы (I) включают все такие формы. Для предотвращения сомнения, если соединение может существовать в одной из нескольких геометрических изомерных или таутомерных форм и только одна специфично описана или показана, все другие, тем не менее, охватываются формулой (I).
Например, в соединениях формулы (I) фенильное кольцо соединений, когда X обозначает NH, и U обозначает углерод, может существовать в таутомерной форме, как проиллюстрировано ниже. Для простоты общая формула (I) иллюстрирует одну форму 1, но эта формула должна приниматься в качестве охватывающий и таутомерные формы (1 и 2).
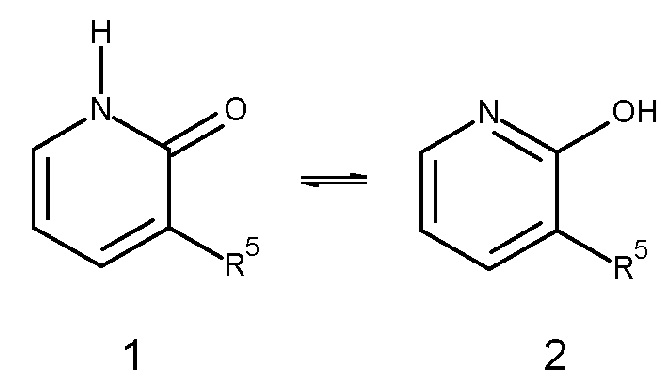
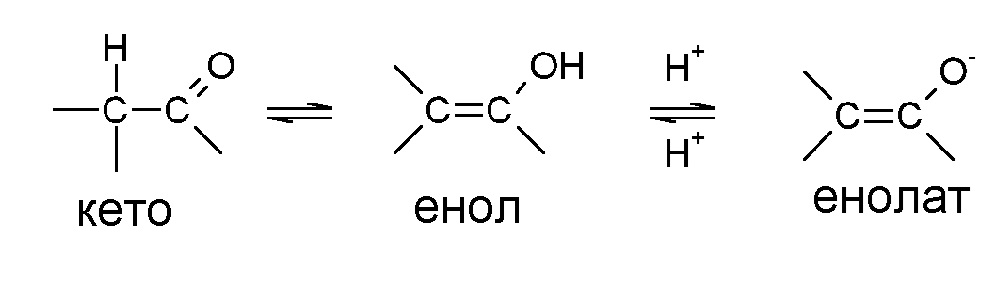
Другие примеры таутомерных форм включают, например, кето-, енольные и енолатные формы, как, например, в следующих таутомерных парах: кетон/енол (проиллюстрированный ниже), имин/енамин, амид/имино спирт, амидин/ендиамин, нитрозо/оксим, тиокетон/ентиол и нитро/аци-нитро.
Стереоизомеры
Если не упомянуто или не указано иное, химическое обозначение соединений обозначает смесь всех возможных стереохимически изомерных форм.
Стереоцентры иллюстрируются обычным образом, например, с помощью «штрихованных» или «клиновидных» линий.

Вос-N-метилаланин (S)-(+)-2-гидрокси-2-фенилпропионовая кислота
Если соединение описано как смесь двух диастереоизомеров/эпимеров, конфигурация стереоцентра не уточняется и обозначается прямыми линиями.
Если не упомянуто или не указано иное, когда соединения формулы (I) содержат один или несколько хиральных центров и могут существовать в форме двух или более оптических изомеров, ссылки на соединения формулы (I) включают все его оптические изомерные формы (например, энантиомеры, эпимеры и диастереоизомеры), либо как отдельные оптические изомеры, либо как смеси (например, рацемические смеси) двух или более оптических изомеров, если из контекста не следует иное.
Оптические изомеры могут быть охарактеризованы и идентифицированы их оптической активностью (т.е. как+и - изомеры, или d и l изомеры), или они могут быть охарактеризованы с точки зрения их абсолютной стереохимии с помощью номенклатуры ʺR и Sʺ, разработанной Кана, Ингольда и Прелога, см. Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, Нью-Йорк, 1992, страницы 109-114, и см. также Кан, Ингольд и Прелог, Angew. Chem. Int. Ed. Engl., 1966, 5, 385-415.
Оптические изомеры могут быть разделены множеством методов, включая хиральную хроматографию (хроматография на хиральной подложке), и такие методы известны специалисту.
Как альтернатива хиральной хроматографии, оптические изомеры могут быть разделены путем формирования диастереоизомерных солей с хиральными кислотами, такими как (+)-винная кислота, (-)-пироглутаминовая кислота, (-)-ди-толуоил-L-винная кислота, (+)-миндальная кислота, (-)-яблочная кислота и (-)-камфорсульфоновая кислота, разделением диастереоизомеров предпочтительной кристаллизацией и затем разделением солей для получения отдельного энантиомера свободного основания.
Дополнительно энантиомерное разделение может быть осуществлено путем ковалентного связывания энантиомерно чистого хирального вспомогательного элемента с соединением и затем выполнения диастереоизомерного разделения с помощью стандартных способов, таких как хроматография. После этого осуществляют расщепление вышеупомянутой ковалентной связи для генерации соответствующего энантиомерно чистого продукта.
Если соединения формулы (I) существуют как две или более оптических изомерных формы, один энантиомер в паре энантиомеров может показывать преимущества перед другим энантиомером, например, с точки зрения биологической активности. Таким образом, при некоторых обстоятельствах, может быть желательно использовать в качестве терапевтического агента только один из пары энантиомеров или только один из множества диастереоизомеров. Соответственно, изобретение относится к композициям, содержащим соединение формулы (I), имеющее один или более хиральных центров, в которой по меньшей мере 55% (например, по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%) соединения формулы (I) присутствуют как единственный оптический изомер (например, энантиомер или диастереоизомер). В одном общем варианте осуществления 99% или более (например, по существу все) общего количества соединения формулы (I) могут присутствовать как единственный оптический изомер (например, энантиомер или диастереоизомер).
Соединения, включающие двойные связи, могут иметь E (entgegen) или Z (zusammen) стереохимию по указанной двойной связи. Заместители на двухвалентных циклических или (частично) насыщенных радикалах могут иметь цис- или транс-конфигурацию. Термины цис и транс, когда они используется в настоящем описании, используются в соответствии с номенклатурой Chemical Abstracts (J. Org. Chem. 1970, 35 (9), 2849-2867) и относятся к положению заместителей на кольцевой группе.
Особенно интересны такие соединения формулы (I), которые являются стереохимически чистыми. Когда соединение формулы (I), например, определяется как R, это означает, что соединение по существу не содержит изомера S. Если соединение формулы (I), например, определяется как E, это означает, что соединение по существу не содержит изомера Z. Термины цис, транс, R, S, E и Z известны специалисту.
Изотопные вариации
Настоящее изобретение включает все фармацевтически приемлемые изотопно меченные соединения по изобретению, т.е. соединения формулы (I), в которых один или более атомов заменены атомами, имеющими то же атомное число, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно встречающихся в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H (D) и 3H (T), углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I, 125I и 131I, азота, такие как 13N и 15N, кислорода, такой как 15O, 17O и 18O, фосфор, такой как 32P, и серы, такие как 35S.
Некоторые изотопно меченные соединения формулы (I), например, такие, которые включают радиоактивный изотоп, могут быть использованы в исследованиях распределения лекарственного средства и/или субстрата в ткани. Соединения формулы (I) могут также иметь ценные диагностические свойства, в силу которых они могут использоваться для детекции или идентификации формирования комплекса между меченным соединением и другими молекулами, пептидами, белками, ферментами или рецепторами. В способах детекции или идентификации могут использоваться соединения, меченные такими агентами как радиоизотопы, ферменты, флуоресцентные вещества, светящиеся вещества (например, люминол, производные люминола, люциферин, экворин и люцифераза) и т.д. Радиоактивные изотопы тритий, т.е. 3H (T), и углерод 14, т.е. 14C, особенно полезны с этой целью ввиду простоты их инкорпорации и доступных средств обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H (D), может предоставить определенные терапевтические преимущества вследствие большей метаболической стабильности, например, увеличенного периода полужизни in vivo или уменьшенных требований к дозировке, и следовательно, может использоваться при некоторых обстоятельствах.
Замещение позитрон-эмитирующими изотопами, такими как 11C, 18F, 15O и 13N, может быть использовано в исследованиях позитронной эмиссионной томографии (PET) для исследования занятия мишени.
Изотопно меченные соединения формулы (I) могут обычно быть получены стандартными методами, известными специалисту, или способами, аналогичными описанным в сопровождающих Примерах и Примерах получения с помощью подходящих изотопно меченных реагентов вместо ранее используемого немеченного реагента.
Сложные эфиры
Сложные эфиры, такие как сложные эфиры карбоновой кислоты, сложные ацилокси эфиры и фосфатные сложные эфиры соединений формулы (I), имеющих группу карбоновой кислоты или гидроксильную группу, также охвачены Формулой (I). Примерами сложных эфиров являются соединения, содержащие группу -С(=O)OR, в которой R является эфирным заместителем, например, C1-7 алкильной группой, C3-12 гетероциклильной группой или C5-12 арильной группой, в частности, C1-6 алкильной группой. Частные примеры сложноэфирных групп включают, но не ограничены ими -C(=O)OCH3, -C(=O)OCH2CH3, C(=O)OC(CH3)3 и -C(=O)OPh. Примеры ацилокси (обратный сложный эфир) групп представлены -OC(=O)R, в которой R является ацилокси заместителем, например, C1-6 алкильной группой, C3-12 гетероциклильной группой или C5-12 арильной группой, в частности, C1-6 алкильной группой. Частные примеры ацилоксигрупп включают, но не ограничены ими, OC(=O)CH3 (ацетокси), OC(=O)CH2CH3, OC(=O)C(CH3)3, OC(=O)Ph и OC(=O)CH2Ph. Примерами фосфатных сложных эфиров являются полученные из фосфорной кислоты.
В одном варианте осуществления изобретения формула (I) включает сложные эфиры соединений формулы (I), имеющие группу карбоновой кислоты или гидроксильную группу. В другом варианте осуществления изобретения формула (I) не включает сложные эфиры соединений формулы (I), имеющие группу карбоновой кислоты или гидроксильную группу.
Сольваты и кристаллические формы
Также формулой (I) охвачены любые полиморфные формы соединений и сольваты, такие как гидраты, алкоголяты и т.п.
Соединения по изобретению могут образовывать сольваты, например, с водой (т.е. гидраты) или обычными органическими растворителями. В рамках изобретения, термин «сольват» означает физическую ассоциацию соединений согласно настоящему изобретению с одной или более молекулами растворителя. Эта физическая ассоциация включает различные степени образования ионных и ковалентных связей, включая водородную связь. В некоторых случаях сольват будет способен к выделению, например, когда одна или более молекул растворителя будут включены в кристаллическую решетку кристаллического твердого соединения. Термин «сольват» обозначает как фазу раствора, так и способные к выделению сольваты. Неограничивающие примеры подходящих сольватов включают соединения по изобретению в комбинации с водой, изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой или этаноламином и т.п. Соединения по изобретению могут проявлять свои биологические действия, пока они находятся в растворе.
Сольваты известны в области фармацевтической химии. Они могут быть важны для процессов получения вещества (например, в отношении их очистки), хранения вещества (например, его стабильность) и простоты обработки вещества и часто формируются как часть стадии выделения или очистки химического синтеза. Специалист может определить посредством стандартных и давно используемых методов, сформировались ли гидрат или другой сольват в условиях выделения или в условиях очистки, используемых для получения данного соединения. Примеры таких методов включают термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), рентгеновскую кристаллографию (например, монокристаллическую рентгеновскую кристаллографию или рентгеновскую порошковую дифрактометрию) и ЯМР твердого тела (SS-ЯМР, также известный как Magic Angle Spinning ЯМР или MAS-ЯМР). Такие методы являются также частью стандартного набора аналитических инструментов специалиста в области химии, как ЯМР, ИК, ВЭЖХ и МС.
Альтернативно, специалист может сознательно сформировать сольват с помощью условий кристаллизации, включающих количество растворителя, необходимое для определенного сольвата. После этого стандартные методы, описанные выше, могут использоваться для того, чтобы установить, сформировались ли сольваты.
В одном варианте осуществления соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она имеет <10% сольватов (например, не более, чем любое из следующих количеств 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5, 0,1, 0,05 или 0,01%), например, гидратов, алкоголятов, изопропилацетата, метилацетата или алканов, таких как гептаны.
В одном варианте осуществления соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она является безводной. В другом варианте осуществления, безводная соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она содержит не более, чем 5% (например, не более, чем любое из следующих количеств 4, 3, 2, 1, 0,5, 0,1, 0,05 или 0,01%), по массе, воды.
В одном варианте осуществления соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она содержит единственную кристаллическую форму и не больше, чем 5% (например, не более, чем любое из следующих количеств 4, 3, 2, 1, 0,5, 0,1, 0,05 или 0,01%), по массе, других кристаллических форм.
В одном варианте осуществления соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она является кристаллической.
В одном варианте осуществления соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она является аморфной.
Кроме того, соединения согласно настоящему изобретению могут иметь один или несколько полиморфов или аморфных кристаллических форм, и такие формы включены в рамки изобретения.
Указание «полиморфов» относится к существованию более чем одной кристаллической структуры соединения формулы (I). Способность химического соединения кристаллизоваться более чем в одной кристаллической модификации может иметь влияние на свойства указанных соединений, такие как физико-химические свойства, срок хранения, растворимость, свойства составления, токсичность, биодоступность, гигроскопичность и свойства обработки. Кроме того, терапевтическое действие фармацевтического соединения может быть изменено полиморфизмом молекулы лекарственного средства.
В одном варианте осуществления соединение формулы (I) включает полиморфную форму 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она или ее соль.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму соли 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата. Это соединение может быть получено, как определено здесь в Примере 39.
В другом варианте осуществления, 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат характеризуется спектром 1H ЯМР, изображенным на Фигуре 1.
Рентгеновская порошковая структура соединения характеризуется параметрами угла преломления (2θ) и межплоскостного расстояния (d) спектра дифракции рентгеновских лучей. Они связаны уравнением Брэгга, nλ=2d Sin θ, (где n=1; λ=используемая длина волны катода; d=межплоскостное расстояние; и θ=угол преломления). В рамках изобретения, межплоскостные расстояния, угол преломления и полная структура важны для идентификации кристалла в рентгеновской порошковой дифрактометрии, вследствии характеристик данных. Относительная интенсивность не должна строго интерпретироваться, так как она может варьировать в зависимости от направления роста кристаллов, размеров частиц и условий измерения. Кроме того, углы преломления обычно означают таковые, совпадающие в диапазоне 2θ±0,2°. Пики означают главные пики и включают пики, не больше, чем средние под углами преломления, отличными от указанных выше.
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой, установленной рентгеновской порошковой дифрактометрией (XRPD), имеющей пики при 6,5±0,5°, 7,1±0,5°, 7,9±0,5°, 9,3±0,5°, 10,2±0,5°, 11,0 ± 0,5°, 11,6±0,5°, 13,3 ± 0,5°, 14,4 ± 0,5°, 15,0 ± 0,5°, 16,7 ± 0,5°, 18,0±0,5°, 18,4±0,5°, 20,0±0,5°, 21,0±0,5°, 23,4±0,5°, 25,2±0,5° и 26,1±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,5 ± 0,2°, 7,1 ± 0,2°, 7,9 ± 0,2°, 9,3 ± 0,2°, 10,2 ± 0,2°, 11,0 ± 0,2°, 11,6 ± 0,2°, 13,3 ± 0,2°, 14,4 ± 0,2°, 15,0 ± 0,2°, 16,7 ± 0,2°, 18,0 ± 0,2°, 18,4 ± 0,2°, 20,0 ± 0,2°, 21,0 ± 0,2°, 23,4 ± 0,2°, 25,2 ± 0,2° и 26,1 ± 0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,5±0,1°, 7,1±0,1°, 7,9±0,1°, 9,3±0,1°, 10,2±0,1°, 11,0±0,1°, 11,6±0,1°, 13,3±0,1°, 14,4 ± 0,1°, 15,0±0,1°, 16,7±0,1°, 18,0±0,1°, 18,4±0,1°, 20,0±0,1°, 21,0±0,1°, 23,4±0,1°, 25,2±0,1° и 26,1± 0,1°(2θ, 1d.p).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,5°, 7,1°, 7,9°, 9,3°, 10,2°, 11,0°, 11,6°, 13,3°, 14,4°, 15,0°, 16,7°, 18,0°, 18,4°, 20,0°, 21,0°, 23,4°, 25,2° и 26,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, по существу как показано на Фигуре 2.
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 2, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность, как пики, показанные на Фигуре 2.
Специалисту будет понятно, что ссылки на «интенсивность» пиков относительно XRPD относятся здесь к относительным интенсивностям с учетом нормализации фонового шума и других таких параметров.
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков при углах преломления (2θ) и интенсивностях, как показанные в структуре XRPD на Фигуре 2.
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,59 ± 0,5Å, 12,44±0,5Å, 11,19±0,5Å, 9,50±0,5Å, 8,67±0,5Å, 8,04±0,5Å, 7,62±0,5Å, 6,65±0,5Å, 6,15±0,5Å, 5,90±0,5Å, 5,31±0,5Å, 4,93±0,5Å, 4,82±0,5Å, 4,44±0,5Å, 4,23±0,5Å, 3,80±0,5Å, 3,53±0,5Å и 3,41±0,5Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,59±0,2Å, 12,44±0,2Å, 11,19±0,2Å, 9,50±0,2Å, 8,67±0,2Å, 8,04±0,2Å, 7,62±0,2Å, 6,65±0,2Å, 6,15±0,2Å, 5,90±0,2Å, 5,31±0,2Å, 4,93±0,2Å, 4,82±0,2Å, 4,44±0,2Å, 4,23±0,2Å, 3,80±0,2Å, 3,53±0,2Å и 3,41±0,2Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,59±0,1Å, 12,44±0,1Å, 11,19±0,1Å, 9,50±0,1Å, 8,67±0,1Å, 8,04±0,1Å, 7,62±0,1Å, 6,65±0,1Å, 6,15±0,1Å, 5,90±0,1Å, 5,31±0,1Å, 4,93±0,1Å, 4,82±0,1Å, 4,44±0,1Å, 4,23±0,1Å, 3,80±0,1Å, 3,53±0,1Å и 3,41±0,1Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,59Å, 12,44Å, 11,19Å, 9,50Å, 8,67Å, 8,04Å, 7,62Å, 6,65Å, 6,15Å, 5,90Å, 5,31Å, 4,93Å, 4,82Å, 4,44Å, 4,23Å, 3,80Å, 3,53Å и 3,41Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется температурами пика DSC 78,69°C±0,5°C и/или 113,91°C±0,5°C (такими как 78,69°C±0,2°C и/или 113,91°C±0,2°C, в частности, 78,69°C±0,1°C и/или 113,91°C±0,1°C, более конкретно, 78,69°C и/или 113,91°C).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется исходными температурами DSC 72,3°C±0,5°C (эндотермичность, широкий) и/или 102°C±0,5°C (эндотермичность, широкий) (такими как 72,3°C±0,2°C и/или 102°C±0,2°C, в частности, 72,3°C±0,1°C и/или 102°C±0,1°C, более конкретно, 72,3°C и/или 102°C).
В другом варианте осуществления, полиморфная форма А 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется термограммой DSC, как изображено на Фигуре 3.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата. Это соединение может быть получено, как определено здесь в Примере 40.
В другом варианте осуществления, 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат характеризуется спектром 1H ЯМР, изображенным на Фигуре 4.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,6±0,5°, 9,4±0,5°, 11,0±0,5°, 13,2±0,5°, 14,3±0,5°, 15,8±0,5°, 17,4±0,5°, 18,4±0,5°, 19,1±0,5°, 20,9±0,5°, 21,8±0,5°, 23,1±0,5°, 24,9±0,5°, 26,7±0,5° и 27,8±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,6±0,2°, 9,4±0,2°, 11,0±0,2°, 13,2±0,2°, 14,3±0,2°, 15,8±0,2°, 17,4±0,2°, 18,4±0,2°, 19,1±0,2°, 20,9±0,2°, 21,8±0,2°, 23,1±0,2°, 24,9±0,2°, 26,7±0,2° и 27,8±0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,6±0,1°, 9,4±0,1°, 11,0±0,1°, 13,2±0,1°, 14,3±0,1°, 15,8±0,1°, 17,4±0,1°, 18,4±0,1°, 19,1±0,1°, 20,9±0,1°, 21,8±0,1°, 23,1±0,1°, 24,9±0,1°, 26,7±0,1° и 27,8±0,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 6,6°, 9,4°, 11,0°, 13,2°, 14,3°, 15,8°, 17,4°, 18,4°, 19,1°, 20,9°, 21,8°, 23,1°, 24,9°, 26,7° и 27,8° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, по существу как показано на Фигуре 5.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 5, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность, как пики, показанные на Фигуре 5.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков при углах преломления (2θ) и интенсивностях, как показанные в структуре XRPD на Фигуре 5.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,39±0,5Å, 9,40±0,5Å, 8,04±0,5Å, 6,70±0,5Å, 6,19±0,5Å, 5,61±0,5Å, 5,09±0,5Å, 4,82±0,5Å, 4,64±0,5Å, 4,25±0,5Å, 4,07±0,5Å, 3,85±0,5Å, 3,57±0,5Å, 3,34±0,5Å и 3,21±0,5Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,39±0,2Å, 9,40±0,2Å, 8,04±0,2Å, 6,70±0,2Å, 6,19±0,2Å, 5,61±0,2Å, 5,09±0,2Å, 4,82±0,2Å, 4,64±0,2Å, 4,25±0,2Å, 4,07±0,2Å, 3,85±0,2Å, 3,57±0,2Å, 3,34±0,2Å и 3,21±0,2Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,39±0,1Å, 9,40±0,1Å, 8,04±0,1Å, 6,70±0,1Å, 6,19±0,1Å, 5,61±0,1Å, 5,09±0,1Å, 4,82±0,1Å, 4,64±0,1Å, 4,25±0,1Å, 4,07±0,1Å, 3,85±0,1Å, 3,57±0,1Å, 3,34±0,1Å и 3,21±0,1Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 13,39Å, 9,40Å, 8,04Å, 6,70Å, 6,19Å, 5,61Å, 5,09Å, 4,82Å, 4,64Å, 4,25Å, 4,07Å, 3,85Å, 3,57Å, 3,34Å и 3,21Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется температурами пика DSC 85,25°C±0,5°C и/или 106,72°C±0,5°C (такими как 85,25°C±0,2°C и/или 106,72°C±0,2°C, в частности, 85,25°C±0,1°C и/или 106,72°C±0,1°C, более конкретно, 85,25°C и/или 106,72°C).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется исходными температурами DSC 68°C ± 0,5°C (большая эндотермичность, широкий) и/или 102°C±0,5°C (очень маленькая эндотермичность, широкий) (такими как 68°C±0,2°C и/или 102°C±0,2°C, в частности, 68°C±0,1°C и/или 102°C±0,1°C, более конкретно, 68°C и/или 102°C).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется термограммой DSC, как изображено на Фигуре 6.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата. Это соединение может быть получено, как определено здесь в Примере 41.
В другом варианте осуществления, 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфат характеризуется спектром 1H ЯМР, изображенным на Фигуре 7.
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется структурой XRPD, имеющей пики при 8,5±0,5°, 13,5±0,5°, 13,9±0,5°, 14,3±0,5°, 16,2±0,5°, 17,3±0,5°, 20,1±0,5°, 21,3±0,5°, 23,3±0,5°, 24,4±0,5° и 27,9±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется структурой XRPD, имеющей пики при 8,5±0,2°, 13,5±0,2°, 13,9±0,2°, 14,3±0,2°, 16,2±0,2°, 17,3±0,2°, 20,1±0,2°, 21,3±0,2°, 23,3±0,2°, 24,4±0,2° и 27,9±0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется структурой XRPD, имеющей пики при 8,5 ± 0,1°, 13,5±0,1°, 13,9±0,1°, 14,3±0,1°, 16,2±0,1°, 17,3±0,1°, 20,1±0,1°, 21,3±0,1°, 23,3±0,1°, 24,4±0,1° и 27,9±0,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется структурой XRPD, имеющей пики при 8,5°, 13,5°, 13,9°, 14,3°, 16,2°, 17,3°, 20,1°, 21,3°, 23,3°, 24,4° и 27,9° (2θ, 1d.p).
В другом варианте осуществления полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется структурой XRPD, по существу как показано на Фигуре 8.
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется наличием пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 8, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность как пики, показанные на Фигуре 8.
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется наличием главных пиков при углах преломления (2θ) и интенсивностях, как показано в структуре XRPD на Фигуре 8.
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется значениями межплоскостного расстояния (d) 10,40±0,5Å, 6,56±0,5Å, 6,37±0,5Å, 6,19±0,5Å, 5,47±0,5Å, 5,12±0,5Å, 4,42±0,5Å, 4,17±0,5Å, 3,82±0,5Å, 3,65±0,5Å и 3,20±0,5Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется значениями межплоскостного расстояния (d) 10,40±0,2Å, 6,56±0,2Å, 6,37±0,2Å, 6,19±0,2Å, 5,47±0,2Å, 5,12±0,2Å, 4,42±0,2Å, 4,17±0,2Å, 3,82±0,2Å, 3,65±0,2Å и 3,20±0,2Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется значениями межплоскостного расстояния (d) 10,40±0,1Å, 6,56±0,1Å, 6,37±0,1Å, 6,19±0,1Å, 5,47±0,1Å, 5,12±0,1Å, 4,42±0,1Å, 4,17±0,1Å, 3,82±0,1Å, 3,65±0,1Å и 3,20±0,1Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется значениями межплоскостного расстояния (d) 10,40Å, 6,56Å, 6,37Å, 6,19Å, 5,47Å, 5,12Å, 4,42Å, 4,17Å, 3,82Å, 3,65Å и 3,20Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется температурами пика DSC 80,31°C±0,5°C и/или 149,07°C±0,5°C (такими как 80,31°C±0,2°C и/или 149,07°C±0,2°C, в частности, 80,31°C±0,1°C и/или 149,07°C±0,1°C, более конкретно, 80,31°C и/или 149,07°C).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется исходными температурами DSC 51,2°C±0,5°C (эндотермичность, широкий) и/или 136°C±0,5°C (эндотермичность, широкий) (такими как 51,2°C±0,2°C и/или 136°C±0,2°C, в частности, 51,2°C±0,1°C и/или 136°C±0,1°C, более конкретно, 51,2°C и/или 136°C).
В другом варианте осуществления, полиморфная форма F 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфата характеризуется термограммой DSC, как изображено на Фигуре 9.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата. Это соединение может быть получено, как определено здесь в Примере 42.
В другом варианте осуществления, 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилат характеризуется спектром 1H ЯМР, изображенным на Фигуре 10.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется структурой XRPD, имеющей пики при 6,6±0,5°, 8,0±0,5°, 11,8±0,5°, 13,2±0,5°, 14,3±0,5°, 15,0±0,5°, 15,6±0,5°, 17,1±0,5°, 17,4±0,5°, 17,7±0,5°, 19,2±0,5°, 20,3±0,5°, 21,2±0,5°, 22,3±0,5°, 23,0±0,5°, 24,0±0,5°, 25,8±0,5°, 26,8±0,5° и 28,9±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется структурой XRPD, имеющей пики при 6,6 ± 0,2°, 8,0 ± 0,2°, 11,8 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 15,0 ± 0,2°, 15,6 ± 0,2°, 17,1 ± 0,2°, 17,4 ± 0,2°, 17,7 ± 0,2°, 19,2 ± 0,2°, 20,3 ± 0,2°, 21,2 ± 0,2°, 22,3 ± 0,2°, 23,0 ± 0,2°, 24,0 ± 0,2°, 25,8 ± 0,2°, 26,8 ± 0,2° и 28,9 ± 0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется структурой XRPD, имеющей пики при 6,6±0,1°, 8,0±0,1°, 11,8±0,1°, 13,2±0,1°, 14,3±0,1°, 15,0±0,1°, 15,6±0,1°, 17,1±0,1°, 17,4±0,1°, 17,7±0,1°, 19,2±0,1°, 20,3±0,1°, 21,2±0,1°, 22,3±0,1°, 23,0±0,1°, 24,0±0,1°, 25,8±0,1°, 26,8±0,1° и 28,9±0,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется структурой XRPD, имеющей пики при 6,6°, 8,0°, 11,8°, 13,2°, 14,3°, 15,0°, 15,6°, 17,1°, 17,4°, 17,7°, 19,2°, 20,3°, 21,2°, 22,3°, 23,0°, 24,0°, 25,8°, 26,8° и 28,9° (2θ, 1d.p).
В другом варианте осуществления полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется Структурой XRPD, по существу как показано на Фигуре 11.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется наличием пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 11, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность как пики, показанные на Фигуре 11.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется наличием главных пиков при углах преломления (2θ) и интенсивностях, как показанные в структуре XRPD на Фигуре 11.
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется значениями межплоскостного расстояния (d) 13,39±0,5Å, 11,05±0,5Å, 7,50±0,5Å, 6,70±0,5Å, 6,19±0,5Å, 5,90±0,5Å, 5,68±0,5Å, 5,18±0,5Å, 5,09±0,5Å, 5,01±0,5Å, 4,62±0,5Å, 4,37±0,5Å, 4,19±0,5Å, 3,98±0,5Å, 3,86±0,5Å, 3,71±0,5Å, 3,45±0,5Å, 3,32±0,5Å и 3,09±0,5Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется значениями межплоскостного расстояния (d) 13,39±0,2Å, 11,05±0,2Å, 7,50±0,2Å, 6,70±0,2Å, 6,19±0,2Å, 5,90±0,2Å, 5,68±0,2Å, 5,18±0,2Å, 5,09±0,2Å, 5,01±0,2Å, 4,62±0,2Å, 4,37±0,2Å, 4,19±0,2Å, 3,98±0,2Å, 3,86±0,2Å, 3,71±0,2Å, 3,45±0,2Å, 3,32±0,2Å и 3,09±0,2Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется значениями межплоскостного расстояния (d) 13,39±0,1Å, 11,05±0,1Å, 7,50±0,1Å, 6,70±0,1Å, 6,19±0,1Å, 5,90±0,1Å, 5,68±0,1Å, 5,18±0,1Å, 5,09±0,1Å, 5,01±0,1Å, 4,62±0,1Å, 4,37±0,1Å, 4,19±0,1Å, 3,98±0,1Å, 3,86±0,1Å, 3,71±0,1Å, 3,45±0,1Å, 3,32±0,1Å и 3,09±0,1Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется значениями межплоскостного расстояния (d) 13,39Å, 11,05Å, 7,50Å, 6,70Å, 6,19Å, 5,90Å, 5,68Å, 5,18Å, 5,09Å, 5,01Å, 4,62Å, 4,37Å, 4,19Å, 3,98Å, 3,86Å, 3,71Å, 3,45Å, 3,32Å и 3,09Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется температурами пика DSC 98,63°C±0,5°C и/или 177,11°C±0,5°C (такими как 98,63°C ± 0,2°C и/или 177,11°C±0,2°C, в частности, 98,63°C±0,1°C и/или 177,11°C±0,1°C, более конкретно, 98,63°C и/или 177,11°C).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется исходными температурами DSC 73,3°C±0,5°C (эндотермичность, широкий) и/или 160,8°C±0,5°C (эндотермичность, широкий) (такими как 73,3°C±0,2°C и/или 160,8°C±0,2°C, в частности, 73,3°C±0,1°C и/или 160,8°C±0,1°C, более конкретно, 73,3°C и/или 160,8°C).
В другом варианте осуществления, полиморфная форма B 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилата характеризуется термограммой DSC, как изображено на Фигуре 12.
В другом варианте осуществления соединение формулы (I) включает полиморфную форму C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата. Это соединение может быть получено, как определено здесь в Примере 43.
В другом варианте осуществления, 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат характеризуется спектром 1H ЯМР, изображенным на Фигуре 15.
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 7,4±0,5°, 7,9±0,5°, 8,3±0,5°, 8,7±0,5°, 9,0±0,5°, 10,4±0,5°, 11,2±0,5°, 11,6±0,5°, 12,3±0,5°, 13,1±0,5°, 13,9±0,5°, 14,7±0,5°, 15,8±0,5°, 16,5±0,5°, 17,1±0,5°, 17,9±0,5°, 18,4±0,5°, 18,9±0,5°, 19,6±0,5°, 20,4±0,5°, 21,0±0,5°, 21,8±0,5°, 22,9±0,5°, 23,3±0,5°, 23,6±0,5°, 24,0±0,5°, 24,9±0,5° и 26,4±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 7,4±0,2°, 7,9±0,2°, 8,3±0,2°, 8,7±0,2°, 9,0±0,2°, 10,4±0,2°, 11,2±0,2°, 11,6±0,2°, 12,3±0,2°, 13,1±0,2°, 13,9±0,2°, 14,7±0,2°, 15,8±0,2°, 16,5±0,2°, 17,1±0,2°, 17,9±0,2°, 18,4±0,2°, 18,9±0,2°, 19,6±0,2°, 20,4±0,2°, 21,0±0,2°, 21,8±0,2°, 22,9±0,2°, 23,3±0,2°, 23,6±0,2°, 24,0±0,2°, 24,9±0,2° и 26,4±0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 7,4±0,1°, 7,9±0,1°, 8,3±0,1°, 8,7±0,1°, 9,0±0,1°, 10,4±0,1°, 11,2±0,1°, 11,6±0,1°, 12,3±0,1°, 13,1±0,1°, 13,9±0,1°, 14,7±0,1°, 15,8±0,1°, 16,5±0,1°, 17,1±0,1°, 17,9±0,1°, 18,4±0,1°, 18,9±0,1°, 19,6±0,1°, 20,4±0,1°, 21,0±0,1°, 21,8±0,1°, 22,9±0,1°, 23,3±0,1°, 23,6±0,1°, 24,0±0,1°, 24,9±0,1° и 26,4±0,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, имеющей пики при 7,4°, 7,9°, 8,3°, 8,7°, 9,0°, 10,4°, 11,2°, 11,6°, 12,3°, 13,1°, 13,9°, 14,7°, 15,8°, 16,5°, 17,1°, 17,9°, 18,4°, 18,9°, 19,6°, 20,4°, 21,0°, 21,8°, 22,9°, 23,3°, 23,6°, 24,0°, 24,9° и 26,4° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется структурой XRPD, по существу как показано на Фигуре 16, помеченной как 1.
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 16, помеченной как 1, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность, как пики, показанные на Фигуре 16, помеченные как 1.
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков при углах преломления (2θ) и интенсивностях, как показанные в структуре XRPD на Фигуре 16, помеченной как 1.
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков, как измерено XRPD при 8,7±0,5°, 17,1±0,5°, 17,9±0,5° и 18,9±0,5° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков, как измерено XRPD при 8,7±0,2°, 17,1±0,2°, 17,9±0,2° и 18,9±0,2° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков, как измерено XRPD при 8,7±0,1°, 17,1±0,1°, 17,9±0,1° и 18,9±0,1° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется наличием главных пиков, как измерено XRPD при 8,7°, 17,1°, 17,9° и 18,9° (2θ, 1d.p).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 11,94±0,5Å, 11,19±0,5Å, 10,65±0,5Å, 10,16±0,5Å, 9,82±0,5Å, 8,50±0,5Å, 7,90±0,5Å, 7,62±0,5Å, 7,19±0,5Å, 6,75±0,5Å, 6,37±0,5Å, 6,02±0,5Å, 5,61±0,5Å, 5,37±0,5Å, 5,18±0,5Å, 4,95±0,5Å, 4,82±0,5Å, 4,69±0,5Å, 4,53±0,5Å, 4,35±0,5Å, 4,23±0,5Å, 4,07±0,5Å, 3,88±0,5Å, 3,82±0,5Å, 3,77±0,5Å, 3,71±0,5Å, 3,57±0,5Å и 3,37±0,5Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 11,94±0,2Å, 11,19±0,2Å, 10,65±0,2Å, 10,16±0,2Å, 9,82±0,2Å, 8,50±0,2Å, 7,90±0,2Å, 7,62±0,2Å, 7,19±0,2Å, 6,75±0,2Å, 6,37±0,2Å, 6,02±0,2Å, 5,61±0,2Å, 5,37±0,2Å, 5,18±0,2Å, 4,95±0,2Å, 4,82±0,2Å, 4,69±0,2Å, 4,53±0,2Å, 4,35±0,2Å, 4,23±0,2Å, 4,07±0,2Å, 3,88±0,2Å, 3,82±0,2Å, 3,77±0,2Å, 3,71±0,2Å, 3,57±0,2Å и 3,37±0,2Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 11,94±0,1Å, 11,19±0,1Å, 10,65±0,1Å, 10,16±0,1Å, 9,82±0,1Å, 8,50±0,1Å, 7,90±0,1Å, 7,62±0,1Å, 7,19±0,1Å, 6,75±0,1Å, 6,37±0,1Å, 6,02±0,1Å, 5,61±0,1Å, 5,37±0,1Å, 5,18±0,1Å, 4,95±0,1Å, 4,82±0,1Å, 4,69±0,1Å, 4,53±0,1Å, 4,35±0,1Å, 4,23±0,1Å, 4,07±0,1Å, 3,88±0,1Å, 3,82±0,1Å, 3,77±0,1Å, 3,71±0,1Å, 3,57±0,1Å и 3,37±0,1Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется значениями межплоскостного расстояния (d) 11,94Å, 11,19Å, 10,65Å, 10,16Å, 9,82Å, 8,50Å, 7,90Å, 7,62Å, 7,19Å, 6,75Å, 6,37Å, 6,02Å, 5,61Å, 5,37Å, 5,18Å, 4,95Å, 4,82Å, 4,69Å, 4,53Å, 4,35Å, 4,23Å, 4,07Å, 3,88Å, 3,82Å, 3,77Å, 3,71Å, 3,57Å и 3,37Å (d, 2d.p.).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется температурой пика DSC 174,37°C ± 0,5°C (такой как 174,37°C ± 0,2°C, в частности, 174,37°C ± 0,1°C, более конкретно, 174,37°C).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется исходной температурой DSC 171,6°C±0,5°C (эндотермичность, острый) (такой как 171,6°C±0,2°C, в частности, 171,6°C±0,1°C, более конкретно, 171,6°C).
В другом варианте осуществления, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата характеризуется термограммой DSC, как изображено на Фигуре 17, помеченной как 1.
В одном варианте осуществления, лактатная (например, L-(+)-лактат) соль 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она, которая является кристаллической и характеризуется одним или более (в любой комбинации) или всеми следующими параметрами:
(a) спектр 1H ЯМР, изображенный на Фигуре 15; и/или
(b) структура XRPD, имеющая пики при 7,4±0,5°, 7,9±0,5°, 8,3±0,5°, 8,7±0,5°, 9,0±0,5°, 10,4±0,5°, 11,2±0,5°, 11,6±0,5°, 12,3±0,5°, 13,1±0,5°, 13,9±0,5°, 14,7±0,5°, 15,8±0,5°, 16,5±0,5°, 17,1±0,5°, 17,9±0,5°, 18,4±0,5°, 18,9±0,5°, 19,6±0,5°, 20,4±0,5°, 21,0±0,5°, 21,8±0,5°, 22,9±0,5°, 23,3±0,5°, 23,6±0,5°, 24,0±0,5°, 24,9±0,5° и 26,4±0,5° (2θ, 1d.p); и/или
(c) структура XRPD, по существу как показано на Фигуре 16, помеченная как 1; и/или
(d) наличие пиков при тех же углах преломления (2θ) структуры XRPD, показанной на Фигуре 16, помеченной как 1, и причем, в некоторых случаях, пики имеют ту же относительную интенсивность, как пики, показанные на Фигуре 16, помеченные как 1; и/или
(e) наличие главных пиков при углах преломления (2θ) и интенсивностях, как показанные в структуре XRPD на Фигуре 16, помеченной как 1; и/или
(f) наличие главных пиков, как измерено XRPD при 8,7±0,5°, 17,1±0,5°, 17,9±0,5° и 18,9±0,5° (2θ, 1d.p); и/или
(g) значения межплоскостного расстояния (d) 11,94±0,5 Å, 11,19±0,5 Å, 10,65±0,5 Å, 10,16±0,5 Å, 9,82±0,5 Å, 8,50±0,5 Å, 7,90±0,5 Å, 7,62±0,5 Å, 7,19±0,5 Å, 6,75±0,5 Å, 6,37±0,5 Å, 6,02±0,5 Å, 5,61±0,5 Å, 5,37±0,5 Å, 5,18±0,5 Å, 4,95±0,5 Å, 4,82±0,5 Å, 4,69±0,5 Å, 4,53±0,5 Å, 4,35±0,5 Å, 4,23±0,5 Å, 4,07±0,5 Å, 3,88±0,5 Å, 3,82±0,5 Å, 3,77±0,5 Å, 3,71±0,5 Å, 3,57±0,5 Å и 3,37±0,5 Å (d, 2d.p.); и/или
(h) температура пика DSC 174,37°C±0,5°C (такая как 174,37°C±0,2°C, в частности, 174,37°C±0,1°C, более конкретно, 174,37°C); и/или
(i) исходная температура DSC 171,6°C±0,5°C (эндотермичность, острый) (такая как 171,6°C±0,2°C, в частности, 171,6°C±0,1°C, более конкретно, 171,6°C); и/или
(j) термограмма DSC, как изображенная на Фигуре 17, помеченная как 1.
В частности, полиморфная форма C 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата обеспечивает преимущества в отношении стабильности и кристалличности.
Комплексы
Формула (I) также включает комплексы (например, комплексы включения или клатраты с такими соединениями, как циклодекстрины, или комплексы с металлами) соединений. Комплексы включения, клатраты и комплексы с металлами могут быть сформированы посредством способов, известных специалисту.
Пролекарства
Также формулой (I) охвачены любые пролекарства соединений формулы (I). Под «пролекарственным средствами» понимают, например, любое соединение, превращающееся in vivo в биологически активное соединение формулы (I).
Например, некоторые пролекарства являются сложными эфирами активного соединения (например, физиологически приемлемым метаболически лабильным сложным эфиром). Во время метаболизма сложноэфирная группа (-C(=O)OR) отщепляется для получения активного лекарственного средства. Такие сложные эфиры могут быть образованы этерификацией, например, любой из групп карбоновой кислоты (-C(=O)OH) в родительском соединении, с, если это необходимо, предшествующей защитой любых других реакционно-способных групп, присутствующих в родительском соединении, при необходимости с последующим удалением защитных групп.
Примеры таких метаболически лабильных сложных эфиров включают таковые формулы -C(=O)OR, в которой R обозначает:
C1-7алкил (например, Me, Et, -nPr, -iPr, -nBu, -sBu, -iBu, tBu);
C1-7аминоалкил (например, аминоэтил; 2-(N,N-диэтиламино)этил; 2-(4-морфолинo)этил); и
ацилокси-C1-7алкил (например, ацилоксиметил; ацилоксиэтил; пивалоилоксиметил; ацетоксиметил; 1-ацетоксиэтил; 1-(1-метокси-1-метил)этил-карбонилоксиэтил; 1-(бензоилокси)этил; изопропокси-карбонилоксиметил; 1-изопропокси-карбонилоксиэтил; циклогексил-карбонилоксиметил; 1-циклогексил-карбонилоксиэтил; циклогексилокси-карбонилоксиметил; 1-циклогексилокси-карбонилоксиэтил; (4-тетрагидропиранилокси) карбонилоксиметил; 1-(4-тетрагидропиранилокси)карбонилоксиэтил; (4-тетрагидропиранил)карбонилоксиметил; и 1-(4-тетрагидропиранил)карбонилоксиэтил).
Кроме того, некоторые пролекарства ферментативно активируются для получения активного соединения или соединения, после дальнейшей химической реакции дающего активное соединение (например, как в антигеннаправленной ферментной пролекарственной терапии (ADEPT), геннаправленной ферментной пролекарственной терапии (GDEPT) и лиганднаправленной ферментной пролекарственной терапии (LIDEPT) и т.д.). Например, пролекарство может быть производным сахара или другим гликозидным конъюгатом, или может быть производным эфира аминокислоты. В одном варианте осуществления формула (I) не включает пролекарства соединений формулы (I).
Преимущества соединений по изобретению
Соединения формулы (I) могут иметь много преимуществ перед соединениями, известными из уровня техники.
Соединения по изобретению могут иметь преимущество в одном или более следующих аспектов:
Более высокая селективность в отношении IKr (hERG) ионных каналов сердца;
Более высокая метаболическая стабильность;
Более низкая P450-ингибирующая активность;
Более высокая пероральная биодоступность; и/или
Более высокая эффективность in vivo.
Более высокая селективность в отношении IKr (hERG) ионных каналов сердца
В конце 1990-х множество лекарственных средств, апробированных FDA США, были отозваны из продажи в США, когда было обнаружено, что они вовлечены в случаи смерти, вызванной нарушением функции сердца. Впоследствии было обнаружено, что побочным эффектом этих лекарственных средств было развитие аритмий, вызванных блокированием каналов hERG в сердечных клетках. Канал hERG является одной из семейства калиевых ионных каналов, первый член которого был идентифицирован в конце 1980-х у мутанта плодовой мушки Drosophila melanogaster (см. Jan, L.Y. and Jan, Y.N. (1990). A Superfamily of Ion Channels. Nature, 345(6277):672). Биофизические свойства hERG калиевых ионных каналов описаны Sanguinetti, M.C., Jiang, C., Curran, M.E., and Keating, M.T. (1995). A Mechanistic Link Between an Inherited and an Acquired Cardiac Arrhythmia: HERG encodes the Ikr potassium channel. Cell, 81:299-307, и Trudeau, M.C., Warmke, J.W., Ganetzky, B., and Robertson, G.A. (1995). HERG, a Human Inward Rectifier in the Voltage-Gated Potassium Channel Family. Science, 269:92-95. Поэтому устранение блокировки активности hERG остается важным фактором, принимаемым во внимание в разработке любого нового лекарственного средства.
Было обнаружено, что многие соединений формулы (I) имеют сниженную hERG активность и/или хорошее разделение между активностью IAP и hERG активностью (большее «терапевтическое окно»). Одним способом измерения hERG активности является способ электрофизиологии фиксации потенциала. Альтернативные методы для измерения функциональной hERG активности включают hERG-связывающие тесты, в которыж могут использоваться коммерчески доступные мембраны, изолированные от клеток, стабильно экспрессирующих канал hERG, или коммерчески доступные клеточные линии, экспрессирующие канал hERG.
Многие соединения формулы (I) имеют улучшенный индекс кардиологической безопасности (Cardiac Safety Index, CSI) [CSI=hERG IC50/Cmax (несвязанный)] (Shultz et al, J. Med. Chem., 2011; Redfern et al., Cardiovasc. Res., 2003). Это может быть следствием увеличения hERG IC50 или сокращения Cmax, требуемого для эффективности (вследствие лучшего потенциала IAP и/или PK).
Некоторые соединения формулы (I) имеют сниженную активность в отношении блокировки ионного канала hERG. Некоторые соединения формулы (I) имеют средние значения IC50 против hERG, которые больше, чем в 30 раз, или больше, чем в 40 раз, или больше, чем в 50 раз превосходят значения IC50 соединений в тестах пролиферации клеток. Некоторые соединения формулы (I) имеют средние значения IC50 против hERG, которые составляют более 10 мкМ, более конкретно, более 20 мкМ и более предпочтительно более 30 мкМ. Некоторые соединения по изобретению имеют средние значения IC50 против hERG, которые составляют более 40 мкМ или показывают % ингибирования, репрезентативный для такого IC50, в концентрациях 10, 30 или 300 мкМ. Некоторые соединения по изобретению имеют средний CSI выше, чем минимальное рекомендуемое значение (30 раз).
Как видно из данных, представленных в Таблице 1, все соединения из Примеров 1-34 имеют более низкую hERG активность, чем соединение из Примера 259 (также 262 и 263) WO 2012/143726. В частности, соединения из Примеров 1-2, 11 и 34 по изобретению продемонстрировали IC50 ≥ 40 мкМ против hERG, тогда как соединение из Примера 259 (также 262 и 263) WO 2012/143726 показывает 42% ингибирования hERG при 10 мкМ. Поэтому более высокая селективность по отношению к hERG является главным преимуществом соединений по изобретению по сравнению раскрытыми в уровне техники антагонистическими соединениями IAP, в частности, раскрытыми в WO 2012/143726.
Более высокая метаболическая стабильность
Соединения формулы (I) могут иметь выгодные свойства ADMET, например, лучшую метаболическую стабильность (например, как определяется с микросомами печени мыши), лучший профиль P450 и/или благоприятный клиренс (например, низкий клиренс). Эти признаки могут дать преимущество большего количества лекарственного средства, доступного в большом круге кровообращения для достижения соответствующего места действия для проявления его терапевтического эффекта. Увеличенные концентрации лекарственного средства для проявления фармакологического действия на опухоли потенциально приводят к улучшенной эффективности, таким образом, позволяя вводить уменьшенные дозировки. Таким образом, соединения формулы (I) должны демонстрировать уменьшенные требования к дозировке и должны легче составляться и вводиться. Кроме того, соединение может иметь меньший оборот P450 (например, 3A4).
Более низкая P450 ингибирующая активность
Многие соединения формулы (I) имеют преимущество в том, что они имеют различную чувствительность к ферментам P450. Например, некоторые соединения формулы (I) имеют значения IC50 более 10 мкМ против каждого из ферментов цитохрома P450 1A2, 2C9, 2C19, 3A4 и 2D6 (в частности, 3A4). Кроме того, в частности, соединения не являются ингибиторами P450.
Более высокая пероральная биодоступность
Потенциально соединения по изобретению имеют физико-химические свойства, подходящие для пероральной доставки (пероральное содержание или AUC). В частности, соединения формулы (I) могут демонстрировать улучшенную пероральную биодоступность. Пероральная биодоступность может быть определена как отношение (F) плазменного содержания соединения, введенного пероральным путем, к плазменному содержанию соединения, когда его вводят внутривенным (i.v.) путем, выраженное в процентах.
Соединения, имеющие пероральную биодоступность (значение F, % F) более 30%, более конкретно, более 40%, особенно предпочтительны тем, что они могут быть вводиться перорально, а не парентерально, или в дополнение к парентеральному введению.
Более высокая эффективность in vivo
В результате увеличенного потенциала против XIAP и/или cIAP, соединения по изобретению могут иметь увеличенную эффективность in vivo в линиях раковых клеток и на in vivo моделях.
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ФОРМУЛЫ (I)
В этом разделе, как во всех других разделах этой заявки, если из контекста не следует иное, ссылки на формулу (I) также включают все другие подгруппы и примеры, как определено здесь.
Соединения формулы (I) могут быть получены в соответствии со способами синтеза, известными специалисту.
Согласно другому аспекту, изобретение относится к способу получения соединения формулы (I), как определено выше, включающему:
(a) (i) введение соединения формулы (II):
в которой R5, R6, U и X имеют значения, определенные выше для соединений формулы (I), L1 обозначает подходящую уходящую группу, такую как атом галогена (например, хлор), и P1 обозначает водород или подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, в реакцию с соединением формулы (III):
или его в случае необходимости защищенным производным; в которой R1 и R2 имеют значения, определенные выше для соединений формулы (I), с последующей реакцией удаления защитной группы, подходящей для удаления защитной группы P1 и любых других защитных групп в случае необходимости; или
(ii) введение соединения формулы (IV):
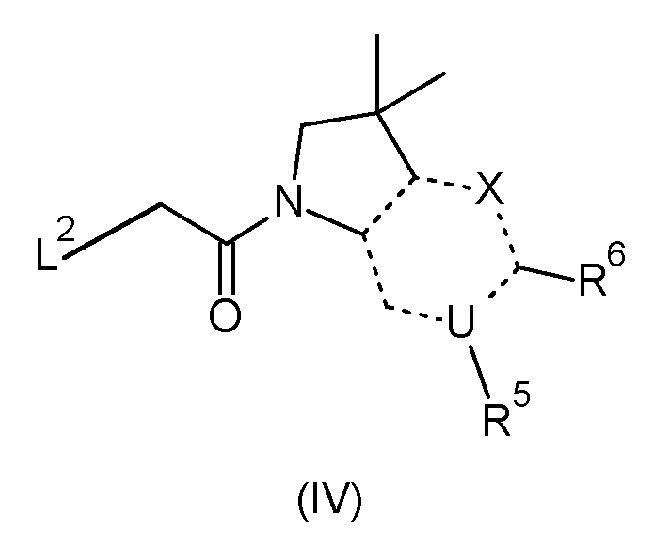
в которой R5, R6, X и U имеют значения, определенные выше для соединений формулы (I), и L2 обозначает подходящую уходящую группу, такую как галоген (например, хлор), в реакцию с соединением формулы (V):
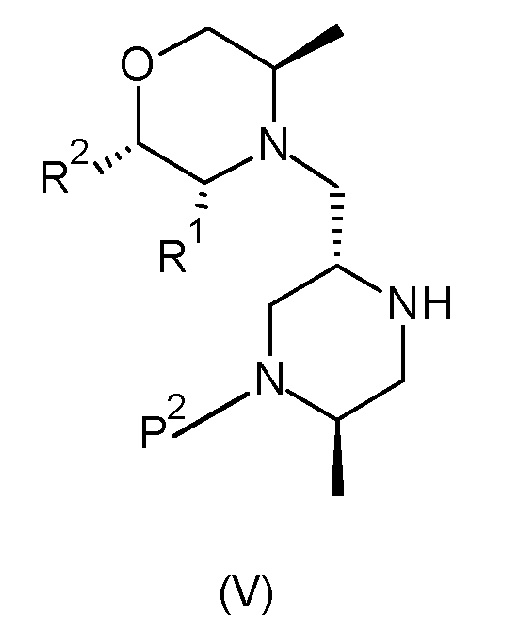
или его в случае необходимости защищенным производным; причем R1 и R2 имеют значения, определенные выше для соединений формулы (I), и P2 обозначает водород или подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, с последующей реакцией удаления защитной группы, подходящей для удаления защитной группы P2 и любых других защитных групп в слуяае необходимости; и/или
(b) удаление защитной группы защищенного производного соединения формулы (I); и/или
(c) взаимное превращение соединения формулы (I) или его защищенного производного в другое соединение формулы (I) или его защищенное производное; и
(d) дополнительное формирование фармацевтически приемлемой соли соединения формулы (I).
Процесс (a) (i), как правило, включает реакцию соединения формулы (II) с соединением формулы (III), в случае необходимости в присутствии подходящей добавки, такой как йодид калия, и подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ацетонитрил. Такой процесс может быть осуществлен при температуре среды или при повышенной температуре, например, 70°C.
Процесс (a) (ii), как правило, включает реакцию соединения формулы (IV) с соединением формулы (V), в случае необходимости в присутствии подходящей добавки, такой как йодид калия, и подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ацетонитрил.
Процесс (b), как правило, включает любую подходящую реакцию удаления защитной группы, условия которой будут зависеть от природы защитной группы. Когда защитная группа представляет собой tBoc, такая реакция удаления защитной группы, как правило, включает использование подходящей кислоты в подходящем растворителе. Например, кислота может предпочтительно включать трифторуксусную кислоту или хлорид водорода, и растворитель может предпочтительно включать дихлорметан, этилацетат, 1,4-диоксан, метанол или воду. В случае необходимости, может использоваться смесь растворителей, например, водный раствор метанола или этилацетат/1,4-диоксан.
Следует понимать, что, когда защитная группа обозначает tBoc, удаление защитной группы с использованием подходящей кислоты, как описано выше, может генерировать соединение формулы (I) в форме фармацевтически приемлемой соли, которая может быть выделена непосредственно. Также соединение формулы (I) может быть выделено как свободное основание с помощью способов, известных в данной области техники, и после этого в случае необходимости преобразовано в фармацевтически приемлемую соль согласно процессу (d).
Процесс (c), как правило, включает процедуры взаимного превращения, известные специалисту в данной области. Например, в соединениях формулы (I), первый заместитель может быть превращен способами, известными специалисту в данной области, во второй, альтернативный заместитель. Широкий диапазон известных взаимных преобразований функциональной группы известен специалисту в данной области для превращения соединения предшественника в соединение формулы I, и они описаны в Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, 1992. Например, возможные катализируемые металлом присоединения функциональных групп, такие как с использованием реактивов органо-олова (реакция Стилле), реактивов Гриньяра и реакции с азотными нуклеофилами, описаны в 'Palladium Reagents and Catalysts' [Jiro Tsuji, Wiley, ISBN 0-470-85032-9] and Handbook of OrganoPalladium Chemistry for Organic Synthesis [Volume 1, Edited by Ei-ichi Negishi, Wiley, ISBN 0-471-31506-0].
Процесс (d) может быть осуществлен путем обработки соединения формулы (I) в форме свободного основания, растворенного в подходящем растворителе, стехиометрическим количеством или избытком фармацевтически приемлемой органической или неорганической кислоты, затем выделением полученной соли способами, известными в данной области техники, например, выпариванием растворителя или кристаллизацией.
При необходимости за реакциями, ранее описанными в процессах (a), (b) и (c), следуют или предшествуют им одна или более реакций, известных специалисту в данной области, и их проводят в адекватном порядке для достижения необходимых замещений на R1, R2 и R6, определенных выше, для получения других соединений формулы (I). Неограничивающие примеры таких реакций, условия которых могут быть найдены в литературе, включают:
защиту реакционоспособных функциональных групп,
удаление защитных групп реакционоспособных функциональных групп,
галогенирование,
дегалогенирование,
деалкилирование,
алкилирование и арилирование амина, анилина, спирта и фенола,
реакция Мицунобу гидроксильных групп,
реакции циклоприсоединения на подходящих группах,
востановление нитро, сложных эфиров, циано, альдегидов,
катализируемые переходным металлом реакции сочетания,
ацилирование,
сульфонилирование/введение сульфонильных групп,
омыление/гидролиз сложноэфирных групп,
амидирование или переэтерификация сложноэфирных групп,
этерификация или амидирование карбоксильных групп,
обмен галогена,
нуклеофильное замещение амином, тиолом или спиртом,
восстановительное аминирование,
формирование оксима на карбонильных и гидроксиламино-группах,
S-окисление,
N-окисление,
солеобразование.
Соединения формулы (II) могут быть получены из соединений формулы (IV) в соответствии со следующей Схемой 1:
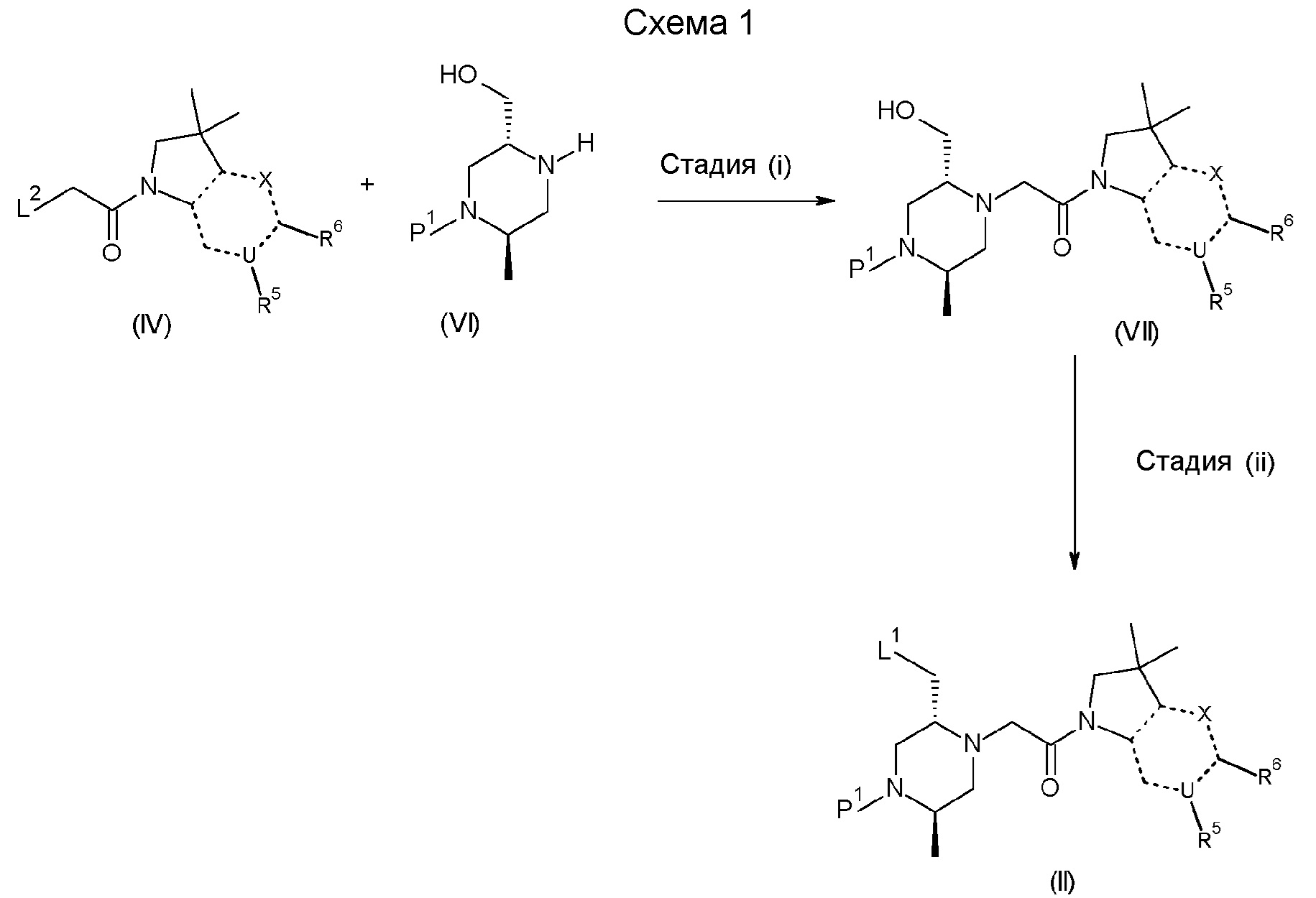
в которой X, U, R5, R6, L1, L2 и P1 имеют значения, определенные выше.
Стадия (i) Схемы 1, как правило, включает реакцию соединений формул (IV) и (VI), в случае необходимости в присутствии подходящей добавки, такой как йодид калия, и подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ацетонитрил.
Когда L1 обозначает хлор, стадия (ii) Схемы 1, как правило, включает реакцию соединения формулы (VII) с реактивом, способным к преобразованию гидроксильной группы в подходящую уходящую группу, например, метилсульфонил хлорид, в присутствии основания, такого как триэтиламин.
Соединения формулы (IV), где X обозначает N, U обозначает углерод, и R6 обозначает гидроксиметил, могут быть получены в соответствии со следующей Схемой 2:
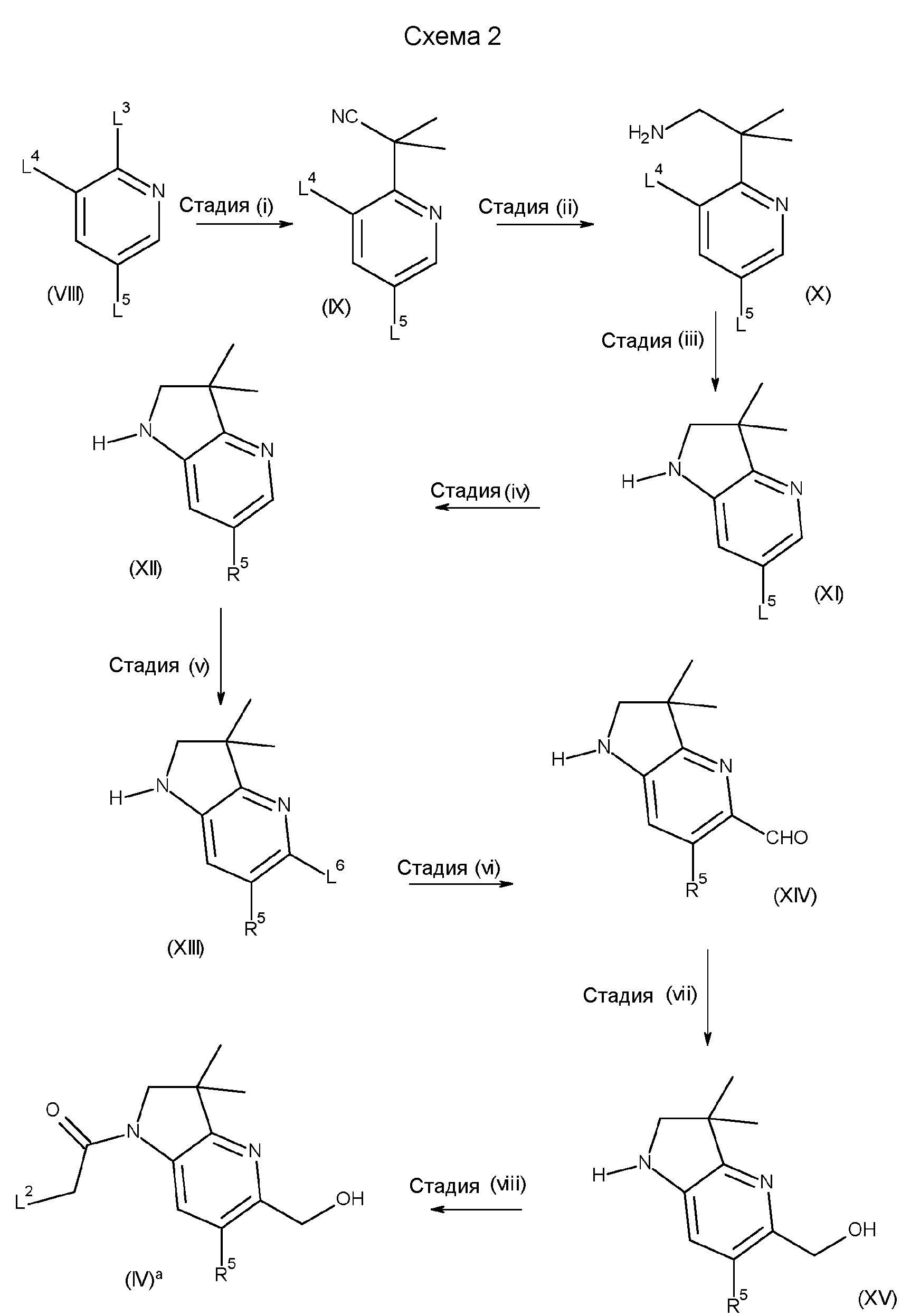
в которой L3, L4, L5 и L6 обозначают подходящие уходящие группы, такие как, атом галогена (т.е., фтор, бром или хлор), и R5 и L2 имеют значения, определенные выше.
Когда L3 и L4 оба обозначают фтор, стадия (i) Схемы 2, как правило, включает реакцию соединения формулы (VIII) с основанием, таким как натрий бис(триметилсилил)амид, в присутствии тетрагидрофурана и изобутиронитрила в подходящем растворителе, таком как толуол. Пример такой реакции показан здесь в Примере получения 11.
Стадия (ii) Схемы 2 включает реакцию с подходящим восстанавливающим агентом и как правило включает реакцию соединения формулы (IX) с комплексом боран-тетрагидрофуран в присутствии подходящего растворителя, такого как тетрагидрофуран. Пример такой реакции показан здесь в Примере получения 12. Стадия (ii) Схемы 2 может также, как правило, включать реакцию соединения формулы (IX) с гексагидратом хлорида никеля (II) с последующим добавлением боргидрида натрия. Пример такой реакции показан здесь в Примере получения 12, альтернативная процедура.
Стадия (iii) Схемы 2, как правило, включает циклизацию соединения формулы (X) с помощью подходящего основания, например, карбоната калия, и подходящего растворителя, такого как NMP. Пример такой реакции показан здесь в Примере получения 13.
Стадия (iv) Схемы 2, как правило, включает реакцию соединения формулы (XI) с соединением формулы R5-M, в которой R5 имеет значения, определенные выше, и M обозначает остаток металлоорганических соединений, таким образом, что R5-M обозначает нуклеофильный металлоорганический реагент, такой как галогенид органоцинка. Стадия (iv), как правило, также включает использование бромида лития, катализатора, такого как [1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден](3-хлорпиридил)палладий (II) дихлорид, в подходящей системе растворителей, например, тетрагидрофуране и NMP. Пример такой реакции показан здесь в Примере получения 15.
Стадия (v) Схемы 2, как правило, включает галогенирование соединения формулы (XII), например, с помощью N-бромсукцинимида в диметилформамиде. Пример такой реакции показан здесь в Примере получения 16.
Стадия (vi) Схемы 2 включает литиирование и реакцию с подходящим электрофилом для введения формильной группы, и как правило, включает реакцию соединения формулы (XIII) с MeLi в THF с последущим добавлением tBuLi в гексане, с последущим добавлением диметилформамида. Пример такой реакции показан здесь в Примере получения 17.
Стадия (vii) Схемы 2 включает восстановление формильной группы подходящим восстанавливающим агентом, и как правило, включает реакцию соединения формулы (XIV) с боргидридом натрия в метаноле. Пример такой реакции показан здесь в Примере получения 17.
Когда L2 обозначает галоген, такой как хлор, стадия (viii) Схемы 2, как правило, включает реакцию соединения формулы (XV) с галогенацетил галогенидом, таким как хлорацетил хлорид в MeCN, с последующим добавлением карбоната калия в метаноле. Пример такой реакции показан здесь в Примере получения 18. Также соединения формулы (XIII) могут быть преобразованы в соединения формулы (XV) согласно последовательности, аналогичной описанной в Примерах получения 25-29 включительно.
Следует понимать, что соединения формулы (XV), где R6 обозначает CH(ORx)CH2ORz, могут быть получены аналогично Схеме 2, выше, путем изменения стадий, начиная со стадии (v) Схемы 2. Примеры подходящих последовательностей реакций показаны здесь в Примерах получения 38-42.
Соединения, где X обозначает NR3, U обозначают углерод, и R6 обозначает =O, могут быть синтезированы с помощью взаимных преобразований функциональной группы на подходящих промежуточных соединениях Схемы 2 или их защищенных производных, например, как продемонстрировано в Примерах получения 22-24, 30-35 и 50.
Также следует понимать, что соединения формулы (IV), где R5 обозначает незамещенную н-бутильную или альтернативно замещенную бензильную группу, могут быть получены аналогично Схеме 2, выше, путем изменения металлоорганического реактива, используемого на стадии (iv) Схемы 2. Пример такой реакции показан здесь в Примерах получения 15 А, 15B и 15C.
Соединения, где X обозначает CR4, U обозначают азот, и R6 обозначает оксо, могут быть синтезированы с помощью последовательностей, аналогичных описанным в Примерах получения 43-49 и 51-58.
Соединения формулы (V) или их в случае необходимости защищенные производные могут быть получены в соответствии со следующей Схемой 3:
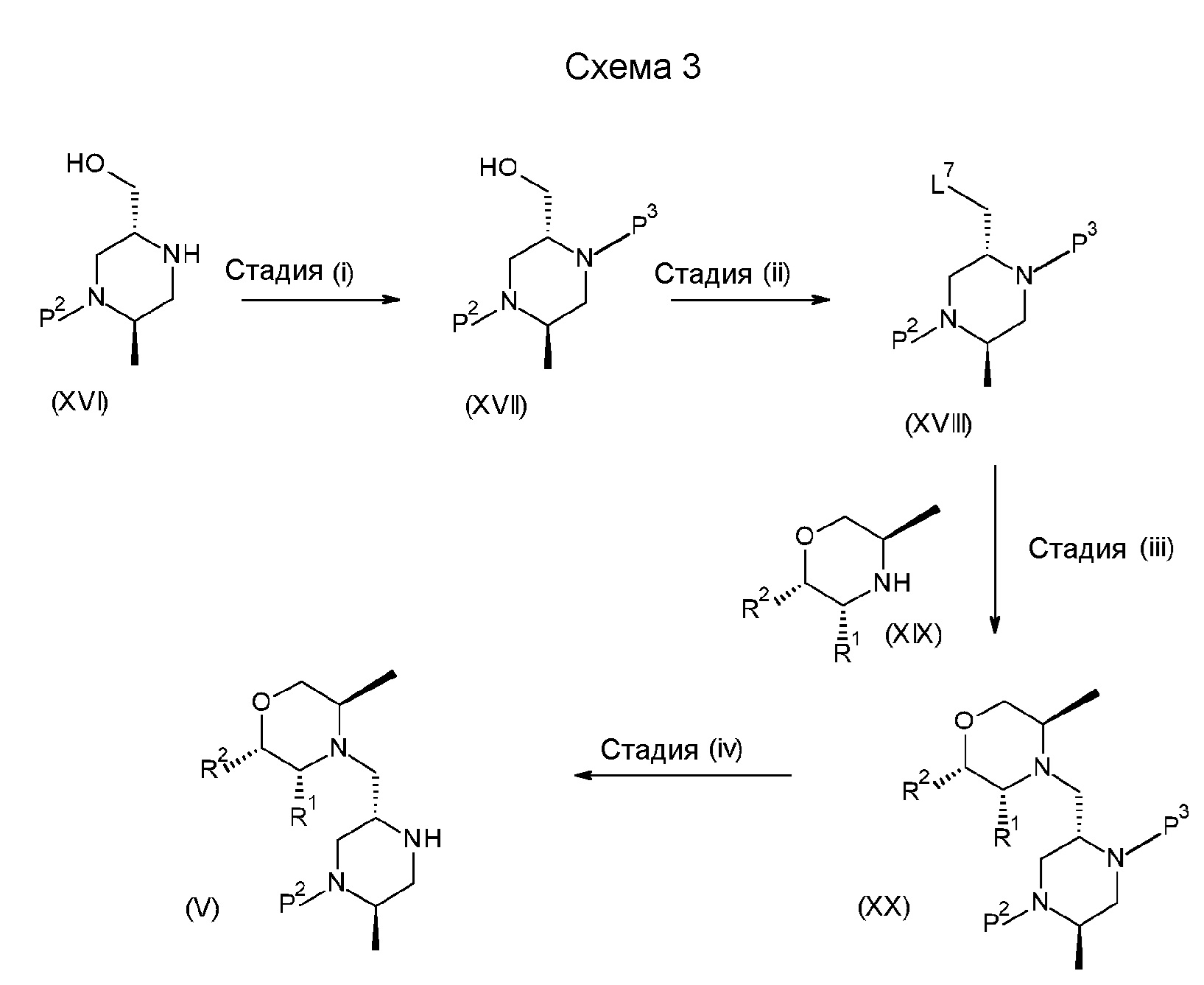
в которой R1, R2 и P2 имеют значения, определенные выше для соединений формулы (V), L7 обозначает подходящую уходящую группу, такую как атом галогена (например, хлор), и P3 обозначает подходящую защитную группу, такую как бензил.
Когда P3 обозначает бензил, стадия (i) Схемы 3, как правило, включает реакцию соединения формулы (XVI) с бензальдегидом в присутствии подходящего восстанавливающего агента, такого как триацетоксиборгидрид натрия и 1,2-дихлорэтан. Пример такой реакции показан здесь в Примере получения 5.
Когда L7 обозначает хлор, стадия (ii) Схемы 3, как правило, включает реакцию соединения формулы (XVII) с метансульфонил хлоридом в присутствии триэтиламина и дихлорметана. Пример такой реакции показан здесь в Примере получения 6.
Стадия (iii) Схемы 3, как правило, включает реакцию соединений формул (XVIII) и (XIX) в присутствии основания, такого как карбонат калия, добавки, такой как йодид калия, в подходящем растворителе, таком как ацетонитрил. Пример такой реакции показан здесь в Примере получения 7.
Стадия (iv) Схемы 3, как правило, включает реакцию удаления защитной группы. Например, когда P3 обозначает бензил, стадия (iv), как правило, включает гидрирование соединения формулы (XX) в присутствии подходящего катализатора, такого как палладий на углероде, в подходящей системе растворителей, такой как этанол или смесь уксусной кислоты и этанола. Пример такой реакции показан здесь в Примере получения 8.
Альтернативно, соединения формулы (I) могут быть синтезированы путем реакции соединения формулы (XXI):
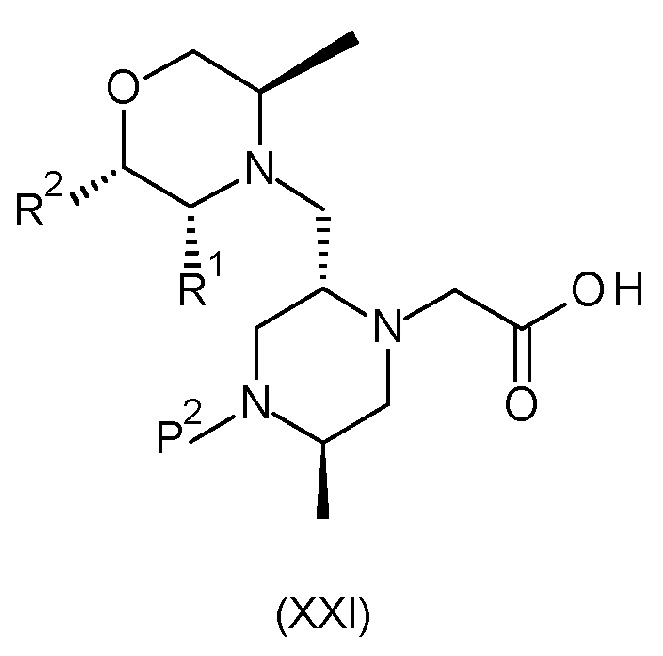
или его в случае необходимости защищенного производного, в которой R1 и R2 имеют значения, определенные выше для соединений формулы (I), и P2 обозначает подходящую защитную группу, такую как трет-бутилоксикарбонильная (tBoc) группа, с соединением формулы (XXII):
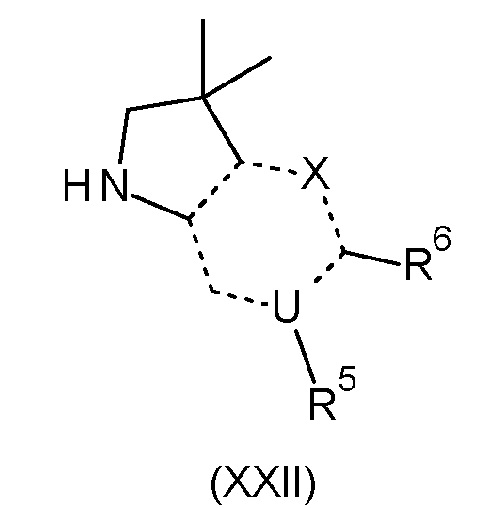
в которой X, U, R5 и R6 имеют значения, определенные выше, с последующей реакцией удаления защитной группы, подходящей для удаления защитной группы P2 и любых дополнительных защитных групп.
Один пример подходящего соединения формулы (XXII) включает соединение формулы (XV), как определено выше.
Эта реакция, как правило, включает реакцию соединения формулы (XXI) с соединением формулы (XXII), таким как соединение формулы (XV), в подходящем растворителе и при подходящей температуре, например, температуре среды, в присутствии подходящего основания и реактива, способного к активации группы карбоновой кислоты, присутствующей в соединении формулы (XXI). Подходящий растворитель должен быть инертным к используемым реактивам, например, дихлорметаном. Примерами подходящих оснований являются триэтиламин и N,N-диизопропилэтиламин (диPEA). Примерами подходящих реактивов активации являются бром-трис-пирролидино-фосфоний гексафторфосфат (PyBrop), O-бензотриазол-N,N,N',N'-тетраметил-уроний-гексафтор-фосфат (HBTU), 1,1'-карбонилдиимидазол, 1-этил-3-(3'-диметиламинопропил)-карбодиимид гидрохлорид (EDC) и 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат) (HATU). Этот процесс может в случае необходимости быть осуществлен в присутствии каталитического или стехиометрического количества подходящего co-активирующего реагента, такого как 1-гидроксибензотриазол (HOBt) или 1-гидроксиазабензотриазол (HOAt).
Соединения формулы (XXI) или их в случае необходимости защищенные производные могут быть получены из соединений формулы (V) или их в случае необходимости защищенных производных, как определено выше, способами, известными в данной области техники, например, реакцией с эфиром моногалогенуксусной кислоты, таким как бензил бромацетат, в присутствии подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ацетонитрил; и последующим гидролизом эфира (или в случае необходимости гидрогенолизом в случае сложного бензилового эфира). Соединения формулы (I) могут быть получены согласно последовательности, аналогичной описанным в Примерах получения 1-5.
Соединения формулы (XXII) могут быть получены при помощи последовательностей, аналогичных описанным в Схеме 2 или следующих примерах получения: 38-42; 22-24, 30-35 и 50; или 43-49 и 51-58.
Следует понимать, что некоторые соединения, например, соединения формул (I), (II), (III), (V), (VI), (VII), (XVI), (XVII), (XVIII), (XIX), (XX), (XXI) и (XXII), могут существовать в различных диастереомерных и/или энантиомерных формах и что в способах их получения могут использоваться энантиомерно чистые синтетические предшественники.
Альтернативно, могут использоваться рацемические предшественники, и смеси диастереоизомеров, полученные в этих способах, могут быть разделены способами, известными специалисту в данной области, например, с помощью нехиральной или хиральной препаративной хроматографии или разделения с помощью диастереомерных производных: например, кристаллизацией соли, полученной с энантиомерно чистой кислотой, такой как L-винная кислота; или энантиомерным разделением диастереомерного производного, сформированного путем ковалентного связывания энантиомерно чистого хирального вспомогательного соединения с соединением, с последующим разделением с помощью стандартных способов, таких как хиральная хроматография. Вышеупомянутая ковалентная связь затем расщепляется для генерации подходящего энантиомерно чистого продукта.
Требуемые промежуточные соединения, например, соединения формулы (III), (VI), (VIII), R5-M, (XVI) и (XIX) являются коммерчески доступными, известными из литературы, полученными способами, аналогичными описанным в литературе, или полученными способами, аналогичными описанным в примере экспериментальных процедур ниже. Другие соединения могут быть получены взаимным превращением функциональных группы R1, R2, R5 и R6 с использованием способов, известных в данной области техники.
В другом варианте осуществления изобретение относится к новому промежуточному соединению. В одном варианте осуществления изобретение относится к новому промежуточному соединению формулы (II) или (IV), или (V), или (VII), или (XX). В альтернативном варианте осуществления изобретение относится к новому промежуточному соединению формулы (XXI) или (XXII).
Защитные группы
Во многих реакциях, описанных выше, может быть необходимо защитить одну или более групп для препятствования реакции в нежелательном месте в молекуле. Примеры защитных групп и способы защиты и снятия защиты функциональных групп могут быть найдены в Protective Groups in Organic Synthesis (T. Green and P. Wuts; 3rd Edition; John Wiley and Sons, 1999).
В частности, группы R1 и R2 могут быть синтезированы в защищенных формах, и защитные группы могут быть удалены для получения соединения формулы (I).
Гидроксильная группа может быть защищена, например, как простой эфир (-OR) или сложный эфир (-OC(=O)R), например, как: трет-бутиловый эфир; тетрагидропираниловый (THP) эфир; бензиловый, бензгидриловый (дифенилметиловый) или тритиловый (трифенилметиловый) эфир; триметилсилиловый или трет-бутилдиметилсилиловый эфир; или сложный ацетиловый эфир (-OC(=O)CH3).
Альдегидная или кетонная группа могут быть защищены, например, как ацеталь (R-CH(OR)2) или кеталь (R2C(OR)2), соответственно, в которых карбонильную группу (>C=O) обрабатывают, например, первичным спиртом. Альдегидная или кетонная группа легко регенерируются гидролизом с помощью большого избытка воды в присутствии кислоты.
Аминогруппа может быть защищена, например, как амид (-NRCO-R) или карбамат (-NRCO-OR), например, как: метил амид (-NHCOCH3); бензил карбамат (-NHCO-OCH2C6H5, -NH-Cbz или NH-Z); как трет-бутил карбамат (-NHCOOC(CH3)3, -NH-Boc); 2-бифенил-2-пропилкарбамат (-NHCO-OC(CH3)2C6H4C6H5, -NH-Bpoc), как 9-флуоренилметил карбамат (-NH-Fmoc), как 6-нитровератрил карбамат (-NH-Nvoc), как 2-триметилсилилэтил карбамат (-NH-Teoc), как 2,2,2-трихлорэтил карбамат (-NH-Troc), как аллил карбамат (-NH-Alloc) или как 2(-фенилсульфонил)этил карбамат (-NH-Psec).
Например, в соединениях формулы II, которые содержат аминогруппу, аминогруппа может быть защищена посредством защитной группы, как определено выше, причем одна определенная группа является трет-бутилоксикарбонильной (Вос) группой, в то время как вводят дополнительные функциональные группы. Если не требуется последующая модификация аминогруппы, защитную группу можно вводить через последовательность реакций с получением N-защищенной формы соединения формулы (I), которая может затем подвергаться удалению защитной группы стандартными методами (например, обработкой кислотой в случае группы Вос) с получением соединения формулы (I).
Другие защитные группы для аминов, таких как циклические амины и гетероциклические группы N-H, включают толуолсульфонильную (тозильную) и метансульфонильную (метилсульфонильную) группы, бензильные группы, такие как п-метоксибензильная (PMB) группа и тетрагидропиранильная (THP) группа.
Группа карбоновой кислоты может быть защищена как сложный эфир, например, как: сложный C1-7 алкиловый эфир (например, сложный метиловый эфир; сложный трет-бутиловый эфир); сложный C1-7 галогеналкиловый эфир (например, сложный C1-7 тригалогеналкиловый эфир); сложный триC1-7 алкилсилил-C1-7алкиловый эфир; или сложный C5-20 арил-C1-7 алкиловый эфир (например, сложный бензиловый эфир; сложный нитробензиловый эфир; сложный п-метоксибензиловый эфир. Тиоловая группа может быть защищена, например, как тиоэфир (SR), например, как: бензиловый тиоэфир; ацетамидометиловый эфир (-S-CH2NHC(=O)CH3).
Выделение и очистка соединений по изобретению
Соединения по изобретению могут быть выделены и очищены согласно стандартным методам, известным специалисту в данной области, и примеры таких способов включают хроматографические методы, такие как колоночная хроматография (например, флэш-хроматография) и ВЭЖХ. Одним особенно полезным методом очистки соединений является препаративная жидкостная хроматография с помощью масс-спектрометрии в качестве средства обнаружения очищенных соединений, выходящих из хроматографической колонки.
Препаративный LC-MS является стандартным и эффективным способом, используемым для очистки маленьких органических молекул, таких как соединения, описанные здесь. Способы жидкостной хроматографии (LC) и масс-спектрометрии (MS) могут варьировать для обеспечения лучшего разделения сырых материалов и улучшенного обнаружения образцов MS. Оптимизация способа препаративной градиентной LC включает варьирование колонок, летучих элюентов и модификаторов и градиентов. Эти способы известны в области оптимизации способов препаративной LC-MS, как и их использование для очистки соединений. Такие способы описаны в Rosentreter U, Huber U.; Optimal fraction collecting in preparative LC/MS; J Comb Chem.; 2004; 6(2), 159-64 и Leister W, Strauss K, Wisnoski D, Zhao Z, Lindsley C., Development of a custom high-throughput preparative liquid chromatography/mass spectrometer platform for the preparative purification and analytical analysis of compound libraries; J Comb Chem.; 2003; 5(3); 322-9. Пример такой системы для очистки соединений препаративной LC-MS описан ниже в разделе В качестве примера этой заявки (под заголовком ʺСистема очистки масс-направленной LC-MSʺ).
Способы перекристаллизации соединений формулы (I) и их солей могут быть осуществлены способами, известными специалисту - см., например, (P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Handbook of Pharmaceutical Salts: Properties, Selection, and Use, Chapter 8, Publisher Wiley-VCH). Продукты, полученные из органической реакции, редко бывают чистыми, когда их выделяют непосредственно из реакционной смеси. Если соединение (или его соль) является твердым, оно может быть очищено и/или кристаллизовано перекристаллизацией из подходящего растворителя. Хороший растворитель для перекристаллизации должен растворять умеренное количество вещества, которое подвергают очистке, при повышенных температурах, но только небольшое количество вещества при более низкой температуре. Он должен легко растворять примеси при низких температурах или не растворять вообще. Наконец, растворитель должен быть легко удаляем из очищенного продукта. Это обычно означает, что он имеет относительно низкую температуру кипения, и специалисту в данной области известны растворители для перекристаллизации определенного вещества или, если эта информация не доступна, он может протестировать несколько растворителей. Для получения хорошего выхода очищенного материала используется минимальное количество горячего растворителя для растворения всего нечистого материала. На практике используется на 3-5% больше растворителя, чем необходимо, таким образом, раствор является ненасыщенным. Если нечистое соединение содержит примесь, которая нерастворима в растворителе, она может затем быть удалена фильтрацией, после чего раствору дают кристаллизоваться. Кроме того, если нечистое соединение содержит следы окрашенного материала, который не является нативным для соединения, их можно удалить, добавив небольшое количество обесцвечивающего вещества, например, активированного угля, к горячему раствору, фильтруя его и затем позволив ему кристаллизоваться. Обычно кристаллизация происходит спонтанно после охлаждения раствора. Если этого не происходит, кристаллизация может быть индуцирована путем охлаждения раствора ниже комнатной температуры или путем добавления одного кристалла чистого материала (затравочный кристалл). Перекристаллизация может также быть выполнена, и/или выход оптимизирован, при помощи антирастворителя или совместного растворителя. В этом случае соединение растворяют в подходящем растворителе при повышенной температуре, фильтруют, и затем дополнительный растворитель, в котором требуемое соединение имеет низкую растворимость, добавляют для облегчения кристаллизации. Кристаллы затем, как правило, выделяют с помощью вакуумной фильтрации, промывают и затем высушивают, например, в термостате или сушкой.
Другие примеры способов очистки включают сублимацию, включающую стадию нагревания под вакуумом, например, с помощью «холодного пальца», и кристаллизацию из расплава (Crystallization Technology Handbook 2nd Edition, edited by A. Mersmann, 2001).
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Соединения по изобретению, их подгруппы и примеры являются антагонистами ингибитора белка апоптоза (IAP), которые могут быть использованы в профилактике или лечении болезненных статусов или состояний, описанных здесь. Кроме того, соединения по изобретению и их подгруппы могут быть использованы в профилактике или лечении заболеваний или состояния, опосредуемых IAP. Ссылки на предотвращение или профилактику или лечение болезненного статуса или состояния, такого как рак, включают облегчение или снижение заболеваемости раком.
Таким образом, например, предусматривается, что соединения по изобретению могут быть использованы в облегчении или снижении заболеваемости раком.
Соединения согласно настоящему изобретению могут быть использованы для лечения взрослой популяции. Соединения согласно настоящему изобретению могут быть использованы для лечения педиатрической популяции.
Более конкретно, соединения формулы (I) и ее подгрупп являются антагонистами IAP. Например, соединения по изобретению имеют сродство к XIAP, cIAP1 и/или cIAP2, и в частности, IAP, выбранных из XIAP и cIAP1.
Некоторые соединения являются соединениями, имеющими сродство к одному или более IAP, выбранных из XIAP, cIAP1 и cIAP2. Некоторые соединения по изобретению являются такими, которые имеют значения IC50 менее 0,1 мкМ.
Антагонистические соединения формулы (I) способны связываться с IAP и демонстрировать потенциал в отношении IAP. В одном варианте осуществления антагонистические соединения формулы (I) демонстрируют селективность в отношении одного или более IAP по сравнению с другими членами семейства IAP и могут быть способны связываться с и/или демонстрировать сродство к XIAP и/или cIAP предпочтительным образом по отношению к связыванию с и/или демонстрации сродства к другим членам семейства IAP.
Кроме того, многие соединения по изобретению демонстрируют селективность в отношении XIAP по сравнению с cIAP или наоборот, селективность в отношении cIAP по сравнению с XIAP (в частности, cIAP1), и такие соединения составляют один вариант осуществления изобретения. В частности, соединения по изобретению мошут иметь по меньшей мере в 10 раз большее сродство к одному или более членов семейства IAP, в частности, XIAP, cIAP1 и/или cIAP2, чем к другим членам семейства IAP. Это может быть определено с помощью способов, описанных здесь. В другом варианте осуществления соединения по изобретению могут иметь эквивалентное сродство к XIAP, cIAP1 и/или cIAP2, в частности, эквивалентное сродство (т.е. меньше, чем 10-кратное различие в сродстве) к XIAP и cIAP1.
Активность против XIAP и cIAP1 может быть особенно предпочтительной. Антагонизм по отношению к XIAP и cIAP1 с эквипотентностью должно позволить запускать апоптоз через активацию каспазы-8 и осуществлять переключение от сигнального пути провыживания NF-κB к апоптозу; и мощный антагонизм XIAP обеспечивает достижение апоптоза, прежде чем какой-либо механизм внутренней резистентности успевает активироваться для блокировки этого процесса. После истощения cIAP1 через аутоубиквитинилирование и протеасомальную деградацию временно активируется сигнальный путь NF-κB, ответственный за экспрессию TNF альфа в чувствительных клеточных линиях - это также ответственно за активацию антиапоптических факторов, таких как cIAP2 и c-FLIP. Следовательно, существует потребность в мощном антагонизме XIAP, чтобы потенцировать активацию эффекторной каспазы и гибель клеток, вместо усиления cIAP2-опосредованной резистентности. Обычно считается, что токсичность, возникающая при введении этих соединений in vivo, является результатом временной индукции сигнального пути NF-κB и проистекающей из этого повышающей регуляции провоспалительных цитокинов, опосредуемой исключительно антагонизмом cIAP1/2. Поэтому двойной потенциал должна обеспечить достижение терапевтического окна до достижения ограничивающей дозу токсичности.
Функция IAP в контроле программируемой гибели клеток также участвует во многих заболеваниях, включая нарушения, связанные с аккумуляцией клеток (например, рак, аутоиммунные нарушения, воспаление и рестеноз), нарушения, в которых избыточный апоптоз приводит к потери клеток (например, инсульт, сердечная недостаточность, нейродегенерация, такая как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, боковой амиотрофический склероз, СПИД, ишемия (инсульт, инфаркт миокарда) и остеопороз, или лечение аутоиммунных заболеваний, таких как рассеянный склероз (MS).
Поэтому также предусматривается, что соединения по изобретению могут быть использованы в лечении других состояний, таких как воспаление (например, артрит, включая ревматоидный артрит), гепатит, неспецифический язвенный колит, гастрит, аутоиммунитет, рестеноз, инсульт, сердечная недостаточность, нейродегенеративные состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, миотоническая дистрофия и боковой амиотрофический склероз, СПИД, ишемия, такая как травматическое повреждение головного мозга, повреждение спинного мозга, мозговая ишемия, повреждение, вызванное мозговой ишемией/реперфузией (I/R), повреждение, вызванное острой и хронической ишемией ЦНС, инсульт или инфаркт миокарда, дегенеративные заболевания скелетно-мышечной системы, такие как остеопороз, аутоиммунные заболевания, такие как рассеянный склероз (MS) и диабет Типа 1, и болезни глаз, такие как сетчаточная дегенерация, которые являются следствием потери контроля программируемой гибели клеток. В одном варианте осуществления соединения по изобретению могут быть использованы в лечении вирусных инфекций, таких как вирус герпеса, вирус оспы, вирус Эпштейн-Барра, вирус Синдбис, аденовирус, ВИЧ, ВПЧ, гепатита, например, гепатита B (HBV) или гепатита С (HCV) и HCMV или при микобактериальных инфекциях, таких как туберкулез (TB).
В результате их сродства к IAP, соединения будут полезны в обеспечении средства контроля программируемой гибели клеток. Поэтому ожидается, что соединения могут оказаться полезными в лечении или профилактике пролиферативных нарушений, таких как раковые образования. Кроме того, соединения по изобретению могут быть полезными в лечении заболеваний, в которых имеет место нарушение, связанное с аккумуляцией клеток, или в которых избыточный апоптоз приводит к потери клеток.
Примеры раковых образований (и их доброкачественных аналогов), которые могут быть подвергнуты лечению (или ингибироваться), включают, но не ограничены ими, опухоли эпителиального происхождения (аденомы и случаи рака различных типов, включая аденокарциномы, плоскоклеточный рак, переходно-клеточные раковые образования и другие случаи рака), такие как случаи рака мочевого пузыря и мочевых путей, молочной железы, желудочно-кишечного тракта (включая пищевод, желудок, тонкий кишечник, толстый кишечник, прямую кишку и анус), печени (гепатоцеллюлярный рак), желчного пузыря и желчной системы, экзокринной поджелудочной железы, почки, легкого (например, аденокарциномы, мелкоклеточный рак легкого, немелкоклеточный рак легкого, бронхиоальвеолярный рак и мезотелиому), головы и шеи (например, раковые образования в языке, полости рта, гортани, глотке, носоглотке, миндалине, слюнных железах, полости носа и околоносовых пазухах), яичника, маточных труб, брюшины, влагалища, вульвы, полового члена, шейки матки, миометрия, эндометрия, щитовидной железы (например, фолликулярный рак щитовидной железы), надпочечника, предстательной железы, кожи и придатков (например, меланома, базально-клеточный рак, плоскоклеточный рак, кератоакантома, диспластическое родимое пятно); гематологические злокачественные образования (т.е. лейкозы, лимфомы) и предраковые гематологические нарушения и пограничные со злокачественным образованием нарушения, включая гематологические злокачественные образования и родственные состояния лимфоидного происхождения (например, острый лимфолейкоз [ALL], хронический лимфолейкоз [CLL], В-клеточные лимфомы, такие как диффузная крупноклеточная В-клеточная лимфома [DLBCL], фолликулярная лимфома, лимфома Беркитта, мантийноклеточная лимфома, Т-клеточные лимфомы и лейкемия, лимфомы естественных клеток-киллеров [NK], лимфома Ходжкина, волосатоклеточная лейкемия, моноклональная гаммопатия неясного значения, плазмоцитомы, множественная миелома и посттрансплантационные лимфопролиферативные нарушения), и гематологические злокачественные образования и родственные состояния миелоидного происхождения (например, острый миелогенный лейкоз [AML], хронический миелогенный лейкоз [CML], хронический миеломоноцитарный лейкоз [CMML], гиперэозинофильный синдром, миелопролиферативные нарушения, такие как истинная полицитемия, эссенциальная тромбоцитемия и первичный миелофиброз, миелопролиферативный синдром, миелодиспластический синдром и промиелоцитарный лейкоз); опухоли мезенхимального происхождения, например, саркомы мягких тканей, кости или хряща, такие как остеосаркомы, фибросаркомы, хондросаркомы, рабдомиосаркома, лейомиосаркомы, липосаркомы, ангиосаркомы, саркома Капоши, саркома Юинга, синовиальные саркомы, эпителиоидные саркомы, желудочно-кишечные стромальные опухоли, доброкачественные и злокачественные гитиоцитомы и возвышающаяся дерматофибросаркома; опухоли центральной или периферической нервной системы (например, астроцитомы, глиомы и глиобластомы, менингиомы, эпендимомы, шишковидные опухоли и шванномы); эндокринные опухоли (например, гипофизарные опухоли, опухоли надпочечников, опухоли островковых клеток, опухоли паращитовидной железы, карциноиды и медуллярный рак щитовидной железы); глазные и придаточные опухоли (например, ретинобластома); опухоли зародышевых клеток и трофобластические опухоли (например, тератомы, семиномы, дисгерминомы, хорионаденомы и хориокарциномы); и педиатрические и эмбриональные опухоли (например, медуллобластома, нейробластома, опухоль Вильямса и примитивные нейроэктодермальные опухоли); или синдромы, врожденные или иные, которые делают пациента склонным к развитию злокачественных образований (например, пигментная ксеродерма).
Рост клеток является близко контролируемой функцией. Рак, состояние аномального роста клеток, развивается, когда клетки бесконтрольно делятся (увеличение численности), бесконтрольно растут (увеличение в размерах) и/или подвергаются сокращенной гибели клеток за счет апоптоза (программируемая гибель клеток), некроза или аноикоза. В одном варианте осуществления аномальный рост клеток выбран из бесконтрольной пролиферации клеток, чрезмерного роста клеток или сниженной программируемой гибели клеток. В частности, состояние или заболевание, связанное с аномальным ростом клеток, представляет собой рак. Таким образом, в фармацевтических композициях, применениях или способах по изобретению для лечения заболевания или состояния, включающего аномальный рост клеток (т.е. бесконтрольный и/или быстрый рост клеток), заболевание или состояние, включающее аномальный рост клеток, в одном варианте осуществления представляет собой рак.
В одном варианте осуществления гематологические злокачественные образования представляют собой лейкоз. В другом варианте осуществления гематологические злокачественные образования представляют собой лимфому.
В одном варианте осуществления заболевание, подвергаемое лечению, представляют собой лейкоз, такой как острый и хронический лейкоз, острый миелоидный лейкоз (AML) и хронический лимфолейкозом (CLL). В одном варианте осуществления лейкоз представляет собой рефрактерный DLBCL.
В одном варианте осуществления лимфома является лимфомой MALT. В одном варианте осуществления лейкоз представляет собой AML.
В одном варианте осуществления гематологическое злокачественное образование является множественной миеломой.
Многие заболевания характеризуются постоянным и нерегулируемым ангиогенезом. Хронические пролиферативные заболевания часто сопровождаются глубоким ангиогенезом, который может способствовать или поддерживать воспалительное и/или пролиферативное состояние или который приводит к деструкции ткани посредством инвазивной пролиферации кровеносных сосудов. Было обнаружено, что рост и метастазирование опухоли зависят от ангиогенеза. Соединения по изобретению могут поэтому быть использованы в предотвращении и разрыве инициации ангиогенеза опухоли. В частности, соединения по изобретению могут быть использованы в лечении метастаза и метастатических раковых образований.
Метастаз или метастатическое заболевание являются распространением заболевания от одного органа или части к другому несмежному органу или части. Раковые образования, которые могут быть подвергнуты лечению соединениями по изобретению, включают первичные опухоли (т.е. раковые клетки на месте происхождения), локальную инвазию (раковые клетки, проникающие и инфильтрирующие окружающие нормальные ткани в ограниченном районе) и метастатические (или вторичные) опухоли т.е. опухоли, сформировавшиеся из злокачественных клеток, циркулирующих через кровоток (гематогенное распространение) или через лимфатические сосуды, или через полости тела (трансцеломические) к другим местам и тканям в теле.
Определенные раковые образования включают гепатоцеллюлярный рак, меланому, рак пищевода, почек, толстой кишки, колоректальный, легкого, например, мезотелиому или аденокарциному легкого, молочной железы, мочевого пузыря, желудочно-кишечного тракта, яичника и предстательной железы.
Определенные раковые образования включают рак почек, меланому, толстой кишки, легкого, молочной железы, яичника и предстательной железы. В одном варианте осуществления рак выбран из меланомы, рака толстой кишки, молочной железы и яичника. В одном варианте осуществления рак является меланомой. В одном варианте осуществления рак является воспалительным раком молочной железы.
В одном варианте осуществления рак является раком легких, например, мезотелиомой, включая злокачественную перитонеальную мезотелиому или злокачественную плевральную мезотелиому.
В одном варианте осуществления рак является раком молочной железы, в частности, трижды негативным (трижды -ve) раком молочной железы.
В одном варианте осуществления рак является раком ободочной и прямой кишки.
Следующий аспект изобретения включает соединение по изобретению для применения в профилактике или лечении рака у пациента, выбранного из субпопуляции, обладающей раковыми образованиями с высоким воспалительным компонентом. Такие раковые образования также известны как «воспалительный фенотип» и включают опухоли с повышенными сигналами цитокинов (например, TNF). В одном варианте осуществления рак является воспалительной опухолью, например, меланомой, раком толстой кишки, молочной железы и яичника, в частности, меланомой.
В одном варианте осуществления меланома является ras мутантной меланомой.
Некоторые раковые образования не поддаются лечению определенными лекарственными средствами. Это может быть следствием типа опухоли (наиболее распространенные эпителиальные злокачественные образования являются неотъемлемо хеморезистентными), или резистентность может возникнуть спонтанно, в то время как заболевание прогрессирует или в результате лечения. В этом отношении, ссылки на мезотелиому включает мезотелиому с резистентностью к топоизомеразным ядам, алкилирующим агентам, антитубулинам, антифолатам, соединениям платины и радиационной терапии, в частности, резистентную к цисплатину мезотелиому. Так же ссылки на множественную миелому включают чувствительную к бортезомибу множественную миелому или рефрактерную множественную миелому, и ссылки на хронический миелогенный лейкоз включают иматиниб-чувствительный хронический миелогенный лейкоз и рефрактерный хронический миелогенный лейкоз.
Раковые образования могут быть раковыми образованиями, которые чувствительны к антагонизму одного или более IAP, выбранного из XIAP, cIAP1, cIAP2, NAIP, ILP2, ML-IAP, сурвивина и BRUCE, более конкретно, XIAP, cIAP1, cIAP2, ML-IAP, наиболее предпочтительно XIAP.
Далее предусматривается, что соединения по изобретению, и в частности, соединения, имеющие сродство к IAP, будут особенно полезны в лечении или профилактике рака типа связанного с или характеризующегося наличием повышенных уровней IAP или амплификацией 11q22, например, раковые заболевания, упомянутые в этом контексте во вводном разделе этой заявки.
Повышенные уровни IAP вследствие суперэкспрессии IAP обнаруживаются при многих случаях рака и связаны с неблагоприятным прогнозом. Кроме того, раковые заболевания с амплификацией 11q22 могут также быть чувствительны к антагонисту IAP. Повышенные уровни IAP и амплификация 11q22 могут быть идентифицированы методами, обрисованными здесь в общих чертах. Является ли конкретный рак чувствительным к функции IAP, может быть определено способом, как изложено в разделе, озаглавленном ʺСпособы диагностикиʺ.
Следующий аспект относится к применению соединения для получения лекарственного средства для лечения заболевания или состояния, как описано здесь, в частности, рака.
Соединения могут также быть использованы в лечении роста опухоли, патогенеза, резистентности к химио- и лучевой терапии путем сенсибилизации клеток к химиотерапии и как антиметастатический агент.
Терапевтические противораковые вмешательства всех типов обязательно увеличивают стрессы, которым подвергаются опухолевые клетки-мишени. При смягчении вредных эффектов таких стрессов IAP непосредственно участвуют в эффекте резистентности к лекарствам против рака и схемам лечения. Таким образом, антагонисты IAP представляют собой класс химиотерапевтических средств с потенциалом для: (i) сенсибилизации злокачественных клеток к лекарственным средствам и/или лечениям против рака; (ii) облегчение или ослабление уровня резистентности к лекарственным средствам и/или лечениям против рака; (iii) обращения резистентности к лекарственным средствам и/или лечениям против рака; (iv) потенцирования активности лекарственных средств и/или лечений против рака; (v) задержки или предотвращения развития резистентности к лекарственным средствам и/или лечениям против рака.
В результате их сродства к IAP, соединения могут быть использованы в качестве средства контроля программируемой гибели клеток. Поэтому также предусматривается, что соединения по изобретению могут быть использованы в лечении других состояний, таких как воспалительные заболевания, такие как гепатит, неспецифический язвенный колит и гастрит; нейродегенеративные состояния, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, миотоническая дистрофия и боковой амиотрофический склероз; СПИД, ишемия, такая как рестеноз, травматическое повреждение головного мозга, повреждение спинного мозга, мозговая ишемия, повреждения, вызванные мозговой ишемией/реперфузией (I/R), повреждения, вызванные острой и хронической ишемией ЦНС, инсульт или инфаркт миокарда; дегенеративные заболевания скелетно-мышечной системы, такие как остеопороз; аутоиммунные заболевания, такие как рассеянный склероз (MS) и диабет Типа 1, и болезни глаз, такие как сетчаточная дегенерация.
Сродство соединений по изобретению как антагонистов IAP может быть измерено с помощью биологических и биофизических тестов, описанных здесь в примерах, и уровень сродства, показанной данным соединением, может быть определен с точки зрения значения IC50. некоторые соединения согласно настоящему изобретению являются соединениями, имеющими значение IC50 менее 1 мкМ, более конкретно, менее 0,1 мкМ.
В одном варианте осуществления изобретение относится к соединению для применения в лечении заболевания или состояния, опосредуемого IAP (например, XIAP и/или cIAP, например, cIAP1). В другом варианте осуществления изобретение относится к соединению для применения в лечении заболевания или состояния, суперэкспрессирующего IAP (например, XIAP и/или cIAP, например, cIAP1).
В одном варианте осуществления изобретение относится к соединению для применения в лечении заболевания или состояния, опосредуемого IAP, причем соединение является антагонистом IAP, имеющим IC50 менее 50 мкм по меньшей мере в одном тесте (например, смещающее связывание) против IAP. В частности, IAP является XIAP, cIAP1 и/или cIAP2. В другом варианте осуществления заболевание или состояние, опосредуемое IAP, представляет собой рак, характеризующийся суперэкспрессией по меньшей мере одного IAP и/или амплификацией 11q22.
В одном варианте осуществления изобретение относится к соединению для применения в лечении заболевания или состояния, опосредуемого IAP, причем соединение имеет IC50 менее 10 мкм против по меньшей мере одного IAP в тесте (например, смещающее связывание) против IAP.
Следующий аспект относится к применению соединения для получения лекарственного средства для лечения заболевания или состояния, опосредуемого IAP, причем соединение является антагонистом IAP, имеющим IC50 менее 50 мкм против по меньшей мере одного IAP в тесте (например, смещающее связывание).
СПОСОБЫ ДИАГНОСТИКИ
До введения соединения формулы (I) пациент может быть скринирован, чтобы определить, является ли заболевание или состояние, которым пациент страдает или может страдать, таким, которое может быть подвергнуто лечению соединением, имеющим сродство к IAP. Термин «пациент» включает человека и животных.
Например, биологический образец, взятый от пациента, может быть проанализирован для того, чтобы определить, является ли состояние или заболевание, такое как рак, которым пациент страдает или может страдать, таким, которое характеризуется генетической аномалией или патологической экспрессией белка, приводящей к повышающей регуляции уровней IAP или к сенсибилизации пути к нормальной функции IAP или к повышающей регуляции биохимического пути вниз от активации IAP.
Примеры таких патологий, приводящих к активации или сенсибилизации IAP, потере или ингибированию апоптотических путей, повышающей регуляции рецепторов или лигандов, цитогенетическим аберрациям или присутствию мутантных вариантов рецепторов или лигандов. Опухоли с повышающей регуляцией IAP, в частности, суперэкспрессией IAP, могут быть особенно чувствительны к антагонистам IAP. Например, суперэкспрессия XIAP и cIAP была идентифицирована в ряде форм рака, обсуждаемых в разделе Уровень техники.
Амплификация хромосомы 11q22 была обнаружена в клеточных линиях и первичных опухолях от плоскоклеточного рака пищевода (Imoto et al., 2001) и шейки матки (Imoto et al., 2002), а также в первичных клеточных линиях рака легкого (Dai et al., 2003). Анализ методами иммуногистохимии и вестерн-блоттинга идентифицировал cIAP1 и cIAP2 как потенциальные онкогены в этой области, поскольку оба суперэкспрессируются при раке, при котором происходит эта редкая амплификация.
Термин «повышающая регуляция» включает увеличенную экспрессию или суперэкспрессию, включая амплификацию гена (т.е. множественные копии гена), цитогенетическую аберрацию и увеличенную экспрессию в силу транскрипционного эффекта. Таким образом, пациент может быть подвергнут диагностическому анализу для детекции маркера, характеристического для повышающей регуляции IAP. Термин «диагностика» включает скрининг. Под маркером понимают генетические маркеры, включая, например, измерение композиции ДНК для идентификации наличия мутаций IAP или амплификации 11q22. Термин «маркер» также включает маркеры, которые являются характеристическими для повышающей регуляции IAP, включая уровни белка, состояние белка и уровни мРНК вышеупомянутых белков.
Диагностические анализы и скрининг, как правило, проводят на биологическом образце (т.е., ткани тела или жидкостях организма), выбранном из образцов биопсии опухоли, образцов крови (изоляция и обогащение опухолевых клеток), спинномозговой жидкости, плазмы, сыворотки, слюны, биопсий стула, мокроты, анализа хромосом, плевральной жидкости, перитонеальной жидкости, буккальных проб, биопсий кожи или мочи.
Способы идентификации и анализа цитогенетической аберрации, амплификации гена, мутаций и повышающей регуляции белков известны специалисту в данной области. Методы проверки могут включать, но не ограничены ими, стандартные методы, такие как полимеразная цепная реакция с обратной транскриптазой (RT-ПЦР) или гибридизация in situ, такая как флюоресцентная гибридизация in situ (FISH).
При скрининге методом RT-ПЦР уровень мРНК в опухоли оценивают путем создания кДНК-копии мРНК с последующей амплификацией кДНК посредством ПЦР. Способы амплификации посредством ПЦР, выбор праймеров и условия амплификации известны специалисту в данной области. Манипуляции с нуклеиновой кислотой и ПЦР проводят стандартными методами, как описано, например, в Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc., или Innis, M.A. et al., eds. (1990) PCR Protocols: a guide to methods and applications, Academic Press, Сан-Диего. Реакции и манипуляции, включающие нуклеиновокислотные методы, также описаны в Sambrook et al., (2001), 3rd Ed, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press. Альтернативно может использоваться коммерчески доступный набор для RT-ПЦР (например, Roche Molecular Biochemicals) или методология, представленная в патентах США 4,666,828; 4,683,202; 4,801,531; 5,192,659, 5,272,057, 5,882,864, и 6,218,529 и включенная в настоящее описание ссылкой.
Примером метода гибридизации in situ для оценки экспрессии мРНК является флюоресцентная гибридизация in situ (FISH) (см. Angerer (1987) Meth. Enzymol., 152: 649).
Обычно гибридизация in situ включает следующие основные стадии: (1) фиксация ткани, предназначенной для анализа; (2) предгибридизационная обработка образца для увеличения доступности целевой нуклеиновой кислоты и уменьшения неспецифического связывания; (3) гибридизация смеси нуклеиновых кислот с нуклеиновой кислотой в биологической структуре или ткани; (4) постгибридизационная промывка для удаления фрагментов нуклеиновой кислоты, не связавшихся в гибридизации, и (5) детекция гибридизированных фрагментов нуклеиновой кислоты. Зонды, используемые в таких исследованиях, как правило, метят, например, радиоизотопами или флуоресцентными репортерами. Определенные зонды являются достаточно длинными, например, имеют длину от приблизительно 50, 100 или 200 нуклеотидов до приблизительно 1000 или более нуклеотидов, для обеспечения специфической гибридизации с целевой нуклеиновой кислотой(ами) в строгих условиях. Стандартные методы для выполнения FISH описаны в Ausubel, F.M. et al., eds. (2004) Current Protocols in Molecular Biology, John Wiley & Sons Inc and Fluorescence In Situ Hybridization: Technical Overview by John M. S. Bartlett in Molecular Diagnosis of Cancer, Methods and Protocols, 2nd ed.; ISBN: 1-59259-760-2; March 2004, pps. 077-088; Series: Methods in Molecular Medicine.
Способы для профилирования экспрессии гена описаны в (DePrimo et al. (2003), BMC Cancer, 3:3). Кратко, протокол является следующим: двухспиральную кДНК синтезируют от общей РНК, используя олигомер (dT)24 для примирования синтеза первой цепочки кДНК с последующим синтезом второй цепочки кДНК с рандомными гексамерными праймерами. Двухспиральную кДНК используют в качестве шаблона для in vitro транскрипции кРНК с использованием биотинилированных рибонуклеотидов. кРНК химически фрагментируется согласно протоколам, описанным Affymetrix (Санта-Клара, Калифорния, США) и затем быстро гибридизуется на Human Genome Arrays.
Также белковые продукты, экспрессированные от мРНК, могут быть протестированы иммуногистохимическим анализом образцов опухоли, твердофазным иммуноферментным анализом с планшетами для микротитрования, Вестерн-блоттингом, 2-мерным электрофорезом в SDS-полиакриламидном геле, ELISA, потоковой цитометрией и другими способами, известными в области детекции специфических белков. Способы детекции включают использование сайтспецифических антител. Специалисту понятно, что все такие известные методы детекции повышающей регуляции IAP, детекции вариантов или мутантов IAP или детекции амплификации 11q22 могут быть использованы в данном случае.
Патологические уровни белков, таких как IAP, могут быть измерены с помощью стандартных белковых тестов, например, тестов, описанных здесь. Повышенные уровни или суперэкспрессия могут также быть обнаружены в образце ткани, например, ткани опухоли, путем измерения уровней белка с помощью теста, такого как тест от Chemicon International. Представляющий интерес белок может быть иммунопреципитирован из лизата образца, и его уровни могут быть измерены.
Альтернативные методы измерения суперэкспрессии или повышения IAP, включая их изоформы, включают измерение плотности микрососудов. Она может, например, быть измерена с помощью способов, описанных Orre and Rogers (Int J Cancer (1999), 84(2), 101-8). Способы тестирования также включают использование маркеров.
Поэтому все эти методы могут также использоваться для идентификации опухолей, особенно подходящих для лечения соединениями по изобретению.
Поэтому в следующем аспекте изобретение включает применение соединения согласно изобретению для получения лекарственного средства для лечения или профилактики болезненного статуса или состояния у пациента, который был подвергнут скринингу и определен как страдающий или подвергающийся риску страдания заболеванием или состоянием, которое может быть подвергнуто лечению соединением, имеющим сродство к IAP (т.е. антагонистом IAP).
Другой вариант осуществления относится к способу лечения пациента, имеющего, или подвергающегося риску его развития, заболевание или состояние, описанное здесь (например, рак), включающему введение эффективного количества соединения формулы (I).
Другой аспект изобретения включает соединение по изобретению для применения в профилактике или лечении рака у пациента, выбранного из субпопуляции, обладающей суперэкспрессией одного или более членов семейства IAP (например, cIAP и/или XIAP).
Другой аспект изобретения включает соединение по изобретению для применения в профилактике или лечении рака у пациента, выбранного как имеющий цитогенетическую аберрацию, приводящую к суперэкспрессии IAP, например, пациента, выбранного как имеющий амплификацию 11q22.
Определение с помощью МРТ нормализации сосудов (например, использование МРТ с градиентным эхо, спиновым эхо и контрастным усилением для измерения объема крови, относительного размера сосудов и проницаемости сосудов) в комбинации с циркулирующими биомаркерами может также использоваться для идентификации для лечения соединением по изобретению.
Таким образом, следующим аспектом изобретения является способ диагностики и лечения болезненного статуса или состояния, опосредуемого IAP, который включает (i) скрининг пациента для того, чтобы определить, является ли заболевание или состояние, которым пациент страдает или может страдать, таким, которое может быть подвергнуто лечению соединением, имеющим сродство к IAP; и (ii), когда показано, что заболевание или состояние, которым страдает пациент, является таким, последующее введение пациенту соединения формулы (I) и ее подгрупп или примеров, как определено здесь.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Хотя активное соединение может быть введено индивидуально, предпочтительно представить его как фармацевтическую композицию (например, состав). В одном варианте осуществления она представляет собой стерильную фармацевтическую композицию.
Таким образом, настоящее изобретение также относится к фармацевтическим композициям, как определено выше, и способам получения фармацевтической композиции, включающей (например, в смеси) по меньшей мере одно соединение формулы (I) (и ее подгруппы, как определено здесь) вместе с одним или более фармацевтически приемлемыми эксципиентами и в случае необходимости другими терапевтическими или профилактическими агентами, как описано здесь.
Фармацевтически приемлемый эксципиент(ы) может быть выбран из, например, носителей (например, твердый, жидкий или полутвердый носитель), адъювантов, разбавителей, наполнителей или агентов для увеличения объема, гранулирующих агентов, агентов для создания покрытия, контролирующих высвобождение агентов, связующих, разрыхлителей, лубрикантов, консервантов, антиоксидантов, буферных агентов, суспендирующих агентов, загустителей, ароматизаторов, подсластителей, маскирующих вкус агентов, стабилизаторов или любых других эксципиентов, обычно используемых в фармацевтических композициях. Примеры эксципиентов для различных типов фармацевтических композиций приведены более подробно ниже.
Термин ʺфармацевтически приемлемыйʺ, в рамках изобретения, относится к соединениям, материалам, композициям и/или лекарственным формам, которые являются, в рамках здравого медицинского суждения, подходящими для использования в контакте с тканями пациента (например, человека) без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или трудностей, соразмерными с обоснованным отношением преимущества/риска. Каждый носитель, эксципиент и т.д. должен также быть «приемлемым» в смысле того, чтобы быть совместимым с другими ингредиентами состава.
Фармацевтические композиции, содержащие соединения формулы (I), могут быть составлены в соответствии с известными методами, см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Истон, Пенсильвания, США.
Фармацевтические композиции могут быть в любой форме, подходящей для перорального, парентерального, местного, внутриносового, эндобронхиального, подъязычного, глазного, ушного, ректального, интравагинального или чрескожного введения. Если композиции предназначены для парентерального введения, они могут быть составлены для внутривенного, внутримышечного, внутрибрюшинного, подкожного введения или для прямой доставки в целевой орган или ткань инъекцией, вливанием или другими средствами доставки. Доставка может осуществляться болюсным вливанием, краткосрочным вливанием или долгосрочным вливанием и может осуществляться путем пассивной доставки или посредством использования подходящего инфузионного насоса или шприцевого насоса.
Фармацевтические составы, адаптированные для парентерального введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, бактериостаты, совместные растворители, поверхностно-активные вещества, смеси органических растворителей, агенты комплексообразования циклодекстрина, эмульгаторы (для формирования и стабилизации составов в форме эмульсии), липосомные компоненты для формирования липосом, желируемые полимеры для формирования полимерных гелей, защитные агенты для лиофилизации и комбинации агентов для, среди прочего, стабилизации активного ингредиента в растворимой форме и придания составу изотоничности с кровью намеченного реципиента. Фармацевтические составы для парентерального введения могут также принимать форму водных и неводных стерильных суспензий, которые могут включать суспендирующие агенты и загустители (R. G. Strickly, Solubilizing Excipients in oral and injectable formulations, Pharmaceutical Research, Vol 21(2) 2004, p 201-230).
Составы могут быть представлены в унифицированной дозе или мультидозовых контейнерах, например, изолированных ампулах, пузырьках и предварительно заполненных шприцах, и могут быть сохранены в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. В одном варианте осуществления состав находится в качестве активного фармацевтического ингредиента в бутылке для последующего восстановления с помощью подходящего разбавителя.
Фармацевтический состав может быть получен путем лиофилизации соединения формулы (I) или ее подгрупп. Лиофилизация относится к процедуре высушивания композиции сублимацией. Высушивание сублимацией и лиофилизация поэтому используются здесь в качестве синонимов.
Экстемпоральные растворы и суспензии для инъекции могут быть получены из стерильных порошков, гранул и таблеток.
Фармацевтические композиции согласно настоящему изобретению для парентеральной инъекции могут также включать фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные инъецируемые растворы или дисперсии непосредственно перед использованием.
Примеры подходящих водных и неводных основ, разбавителей, растворителей или носителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), карбоксиметилцеллюлозу и подходящие смеси этих веществ, растительные масла (такие как подсолнечное масло, сафлоровое масло, кукурузное масло или оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Свойственная текучесть может поддерживаться, например, при помощи загустителей или материалов покрытия, таких как лецитин, поддержанием требуемого размера частиц в случае дисперсии и при помощи сурфактантов.
Композиции согласно настоящему изобретению могут также содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Профилактика действия микроорганизмов может быть обеспечена включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Может также быть желательно включать агенты для регулировки тоничности, таких как сахара, хлорид натрия и т.п. Пролонгированная абсорбция инъецируемой лекарственной формы может быть обеспечена включением агентов, задерживающих абсорбцию, таких как моностеарат алюминия и желатин.
В одном частном варианте осуществления изобретения фармацевтическая композиция находится в форме, подходящей для внутривенного введения, например, инъекцией или вливанием. Для внутривенного введения раствор может дозироваться как таковой или может быть введен в мешок для вливания (содержащий фармацевтически приемлемый эксципиент, такой как 0,9% солевой раствор или 5% раствор декстрозы) перед введением.
В другом частном варианте осуществления фармацевтическая композиция находится в форме, подходящей для подкожного (s.c.) введения.
Фармацевтические лекарственные формы, подходящие для перорального введения, включают таблетки (покрытые или непокрытые), капсулы (с твердой или мягкой оболочкой), каплеты, пилюли, таблетки для рассасывания, сиропы, растворы, порошки, гранулы, эликсиры и суспензии, сублингвальные таблетки, пластинки или пластыри, такие как щечные пластыри.
Таким образом, композиции таблетки могут содержать разовую дозу активного соединения вместе с инертным разбавителем или носителем, таким как сахар или сахарный спирт, например; лактоза, сахароза, сорбит или маннит; и/или разбавитель несахарной природы, такой как карбонат натрия, фосфат кальция, карбонат кальция или целлюлоза или ее производное, такое как микрокристаллическая целлюлоза (MCC), метилцеллюлоза, этилцеллюлоза, гидроксипропил метилцеллюлоза, и крахмал, такой как кукурузный крахмал. Таблетки могут также содержать такие стандартные ингредиенты как связующие и гранулирующие агенты, такие как поливинилпирролидон, разрыхлители (например, набухающие поперечно-сшитые полимеры, такие как поперечно-сшитая карбоксиметилцеллюлоза), смазывающие вещества (например, стеараты), консерванты (например, парабены), антиоксиданты (например, BHT), буферные вещества (например, фосфатные или цитратные буферы) и шипучие агенты, такие как смеси цитрата/бикарбоната. Такие эксципиенты известны и не нуждаются в подробном обсуждении здесь.
Таблетки могут быть разработаны таким образом, чтобы либо высвобождать лекарственное средство при контакте с жидкостями желудка (таблетки с быстрым высвобождением), либо высвобождать контролируемым образом (таблетки контролируемого высвобождения) в течение пролонгированного периода времени или в определенном отделе ЖКТ.
Составы в форме капсул могут быть твердыми желатиновыми или мягкими желатиновыми и могут содержать активный компонент в твердой, полутвердой или жидкой форме. Желатиновые капсулы могут быть сформированы из животного желатина или его синтетических растительных эквивалентов.
Твердые лекарственные формы (например; таблетки, капсулы и т.д.) могут быть покрытыми или не покрытыми. Покрытия могут действовать либо как защитная пленка (например, полимер, воск или лак), либо как механизм контроля высвобождения лекарственного средства, либо в идентификационных или эстетических целях. Покрытие (например, полимер типа Eudragit™) может быть разработано для высвобождения активного компонента в желаемом месте в желудочно-кишечном тракте. Таким образом, покрытие может быть выбрано так, чтобы деградировать в определенных условиях pH в желудочно-кишечном тракте, таким образом селективно высвобождая соединение в желудке или в подвздошной кишке, двенадцатиперстной кишке, тонкой или толстой кишке.
Вместо покрытия, или в дополнение к нему, лекарственное средство может быть представлено в твердом матриксе, включающем агент контроля высвобождения, например, агент задержки высвобождения, который может быть адаптирован для высвобождения соединения контролируемым образом в желудочно-кишечном тракте. Альтернативно, лекарственное средство может быть представлено в полимерном покрытии, например, полимерном покрытии из полиметакрилата, которое может быть адаптировано для селективного высвобождения соединения в условиях варьирующей кислотности или щелочности в желудочно-кишечном тракте. Также материал матрикса или задерживающее высвобождение покрытие могут принимать форму эродируемого полимера (например, полимера на основе малеинового ангидрида), который по существу постоянно эродирует по мере того, как лекарственная форма проходит через желудочно-кишечный тракт. В другой альтернативе покрытие может быть разработано для разложения под действием микробов в пищеварительном тракте. Как дальнейшая альтернатива, активное соединение может быть составлено в системе доставки, обеспечивающей осмотический контроль высвобождения соединения. Составы осмотического высвобождение и другие составы отсроченного высвобождения или замедленного высвобождения (например, составы на основе ионообменных смол) могут быть получены в соответствии со способами, известными специалисту в данной области техники.
Соединение формулы (I) может быть составлено с носителем и введено в форме наночастиц, причем увеличенная площадь поверхности наночастиц способствует их абсорбции. Кроме того, наночастицы обеспечивают возможность прямого проникновения в клетку. Системы доставки лекарственных средств в форме наночастиц описаны в ʺNanoparticle Technology for Drug Deliveryʺ издательства Ram B Gupta and Uday B. Kompella, Informa Healthcare, ISBN 9781574448573, опубликовано 13 марта 2006. Наночастицы для доставки лекарственных средств также описаны в J. Control. Release, 2003, 91 (1-2), 167-172, и в Sinha et al., Mol. Cancer Ther. August 1, (2006) 5, 1909.
Фармацевтические композиции, как правило, включают от приблизительно 1% (вес./вес.) до приблизительно 95% (вес./вес.) активного ингредиента и от 99% (вес./вес.) до 5% (вес./вес.) фармацевтически приемлемого эксципиента или комбинации эксципиентов. В частности, композиции включают от приблизительно 20% (вес./вес.) до приблизительно 90%, % (вес./вес.) активного ингредиента и от 80% (вес./вес.) до 10% фармацевтически приемлемого эксципиента или комбинации эксципиентов. Фармацевтические композиции включают от приблизительно 1% до приблизительно 95%, в частности, от приблизительно 20% до приблизительно 90%, активного ингредиента. Фармацевтические композиции согласно изобретению могут быть, например, в форме разовой дозы, например, в форме ампул, пузырьков, суппозиториев, предварительно заполненных шприцев, драже, таблеток или капсул.
Фармацевтически приемлемый эксципиент(ы) может быть выбран согласно желаемой физической форме состава и может, например, быть выбран из разбавителей (например, твердых разбавителей, таких как наполнители или агенты для увеличения объема; и жидких разбавителей, таких как растворители и совместные растворители), разрыхлителей, буферных агентов, лубрикантов, агентов для повышения текучести, контролирующих высвобождение (например, высвобождение замедленные или задерживающиеся полимеры или воски) агентов, связующих, гранулирующих агентов, пигментов, пластификаторов, антиоксидантов, консервантов, ароматизаторов, маскирующих вкус агентов, агентов регулировки тоничности и агентов для создания покрытия.
Специалист имеет опыт по выбору соответствующих количеств ингредиентов для использования в составах. Например, таблетки и капсулы, как правило, содержат 0-20% разрыхлителей, 0-5% лубрикантов, 0-5% агентов для повышения текучести и/или 0-99% (вес./вес.) наполнителей/или агентов увеличения объема (в зависимости от дозы лекарственного средства). Они могут также содержать 0-10% (вес./вес.) полимерных связующих, 0-5% (вес./вес.) антиоксидантов, 0-5% (вес./вес.) пигментов. Таблетки замедленного высвобождения, кроме того, содержат 0-99% (вес./вес.) контролирующих высвобождение (например, задерживающих) полимеров (в зависимости от дозы). Пленочные оболочки таблетки или капсулы, как правило, содержат 0-10% (вес./вес.) полимеров, 0-3% (вес./вес.) пигментов и/или 0-2% (вес./вес.) пластификаторов.
Парентеральные составы, как правило, содержат 0-20% (вес./вес.) буферов, 0-50% (вес./вес.) совместных растворителей и/или 0-99% (вес./вес.) воды для инъекции (WFI) (в зависимости от дозы и если они высушены замораживание). Составы для внутримышечных депо могут также содержать 0-99% (вес./вес.) масла.
Фармацевтические композиции для перорального введения могут быть получены путем комбинации активного ингредиента с твердыми носителями, при желании грануляции полученной смеси и обработки смеси, при желании или необходимости, после добавления подходящих эксципиентов, в таблетки, ядра драже или капсулы. Они также могут быть включены в полимерный или восковой матрикс, позволяющий активным ингредиентам диффундировать или высвобождаться в отмеренных количествах.
Соединения по изобретению могут также быть составлены в форме твердых дисперсий. Твердые дисперсии представляют собой гомогенные чрезвычайно тонкодисперсные фазы двух или более твердых веществ. Твердые растворы (молекулярные дисперсные системы), один тип твердой дисперсии, известны как используемые в фармацевтической технологии (см. (Chiou and Riegelman, J. Pharm. Sci., 60, 1281-1300 (1971)) и могут быть использованы для увеличения скоростей растворения и увеличения биодоступности лекарственных средств с низкой водорастворимостью.
Это изобретение также относится к твердым лекарственным формам, включающим твердый раствор, описанный выше. Твердые лекарственные формы включают таблетки, капсулы, жевательные таблетки и дисперсивные или шипучие таблетки. Известные эксципиенты могут быть смешаны с твердым раствором для получения желаемой лекарственные формы. Например, капсула может содержать твердый раствор, смешанный с (a) разрыхлителем и лубрикантом или (b) разрыхлителем, лубрикантом и сурфактантом. Кроме того, капсула может содержать агент для увеличения объема, такой как лактоза или микрокристаллическая целлюлоза. Таблетка может содержать твердый раствор, смешанный с по меньшей мере одним разрыхлителем, лубрикантом, сурфактантом, агентом для увеличения объема и глидантом. Жевательная таблетка может содержать твердый раствор, смешанный с агентом для увеличения объема, лубрикантом и при желании дополнительным подсластителем (таким как искусственный подсластитель) и подходящими ароматизаторами. Твердые растворы могут также быть сформированы путем распыления растворов лекарственного средства и подходящего полимера на поверхность инертных носителей, таких как сахарные бусинки ('non-pareils'). Эти бусинки могут впоследствии быть заполнены в капсулы или прессованы в таблетки.
Фармацевтические составы могут быть представлены пациенту в ʺупаковках для пациентаʺ, содержащих весь курс лечения в единственной упаковке, обычно блистерной упаковке. Упаковки для пациента имеют преимущество перед традиционными назначениями, где фармацевт выделяет назначенные пациенту фармацевтические средства из оптовой поставки, причем у пациента всегда есть доступ к вкладышу, содержащемуся в упаковке для пациента, обычно отсутствующему в назначениях для пациента. Включение вкладыша в упаковку, как было показано, улучшало комплаенс пациента по отношению к инструкциям врача.
Композиции для местного применения и назальной доставки включают мази, кремы, спреи, пластыри, гели, жидкие капли и вставки (например, внутриглазные вставки). Такие композиции могут быть составлены в соответствии с известными способами.
Примеры составов для ректального или интравагинального введения включают пессарии и суппозитории, которые могут быть, например, сформированы из имеющего форму пластичного или воскового материала, содержащего активное соединение. Растворы активного соединения могут также использоваться для ректального введения.
Композиции для введения ингаляцией могут принимать форму ингаляционных порошковых композиций или жидких или порошковых спреев и могут вводиться в стандартной форме с помощью порошковых ингаляторов или аэрозольных устройств. Такие устройства являются известными. Для введения ингаляцией порошкообразные составы как правило включают активное соединение вместе с инертным твердым измельченным в порошок разбавителем, таким как лактоза.
Соединения формулы (I) обычно представлены в стандартной лекарственной форме, и как таковые, как правило, содержат количество соединения, достаточное для обеспечения желаемого уровня биологической активности. Например, состав может содержать от 1 нанограмма до 2 граммов активного ингредиента, например, от 1 нанограмма до 2 миллиграммов активного ингредиента. В этих диапазонах частные поддиапазоны соединения составляют от 0,1 миллиграмма до 2 граммов активного ингредиента (чаще от 10 миллиграммов до 1 грамма, например, от 50 миллиграммов до 500 миллиграммов) или от 1 микрограмма до 20 миллиграммов (например, от 1 микрограмма до 10 миллиграммов, например, от 0,1 миллиграмма до 2 миллиграммов активного ингредиента).
Для пероральных композиций стандартная лекарственная форма может содержать от 1 миллиграмма до 2 граммов, как правило от 10 миллиграммов до 1 грамма, например, от 50 миллиграммов до 1 грамма, например, от 100 миллиграммов до 1 грамма, активного соединения.
Активное соединение вводят пациенту (например, человеку или животным) в количестве, достаточном для достижения желаемого терапевтического эффекта.
СПОСОБЫ ЛЕЧЕНИЯ
Соединения формулы (I) и ее подгрупп, как определено здесь, могут быть использованы в профилактике или лечении ряда болезненных статусов или состояний, опосредуемых IAP. Таким образом, согласно другому аспекту, изобретение относится к способу лечения болезненного статуса или состояния, опосредуемого IAP, таким как XIAP и/или cIAP (например, рака), который включает введение пациенту соединения формулы (I), как описано здесь. Согласно другому аспекту, изобретение относится к способу лечения болезненного статуса или состояния (например, рака), при котором имеет место суперэкспрессия IAP, такого как XIAP и/или cIAP, включающему введение пациенту соединения формулы (I), как описано здесь. Примеры таких болезненных статусов и состояний приведены выше, и в частности, включают рак.
Соединения обычно вводят пациенту, например, человеку или животному, в частности, человеку.
Соединения, как правило, вводят в количествах, которые являются терапевтически или профилактически полезными и которые обычно являются нетоксичными. Однако в некоторых ситуациях (например, в случае опасных для жизни заболеваний) преимущества введения соединения формулы (I) могут перевесить недостатки любых токсичных эффектов или побочных эффектов, когда можно считать желательным вводить соединения в количествах, связанных с определенной степенью токсичности.
Соединения могут вводиться в течение длительного времени для поддержания полезных терапевтических эффектов или могут вводиться только в течение короткого периода. Альтернативно, они могут вводиться в непрерывном режиме или в режиме, обеспечивающем периодическое введение (например, пульсирующий режим).
Типичная суточная доза соединения формулы (I) может быть в диапазоне от 100 пикограммов до 100 миллиграммов на килограмм массы тела, как правило, от 5 нанограммов до 25 миллиграммов на килограмм массы тела, и чаще от 10 нанограммов до 15 миллиграммов на килограмм (например, от 10 нанограммов до 10 миллиграммов, и как правило, от 1 микрограмма на килограмм до 20 миллиграммов на килограмм, например, от 1 микрограмма до 10 миллиграммов на килограмм) на килограмм массы тела, несмотря на то, что при необходимости могут быть введены более высокие или более низкие дозы. Соединение формулы (I) может вводиться ежедневно или на повторной основе каждые 2 или 3, или 4, или 5, или 6, или 7, или 10 или 14, или 21, или 28 дней, например.
Соединения по изобретению могут вводиться перорально в диапазоне доз, например, 1-1 500 мг, 2-800 мг, или 5-500 мг, например, 2-200 мг или 10-1 000 мг, причем частные примеры доз включают 10, 20, 50 и 80 мг. Соединение может вводиться один раз или несколько раз в сутки. Соединение может вводиться постоянно (т.е. приниматься каждый день без перерыва в течение курса лечения). Также соединение может вводиться периодически (т.е. приниматься постоянно в течение установленного срока, такого как неделя, затем отменяться на период, такой как неделя, и затем приниматься постоянно в течение другого периода, такого как неделя и т.д. в течение всего курса лечения). Примеры режимов лечения, при которых используют периодическое введение, включают режимы, в которых введение осуществляют циклами: одна неделя приема, одна неделя отмены; или две недели приема, одна неделя отмены; или три недели приема, одна неделя отмены; или две недели приема, две недели отмены; или четыре недели приема, две недели отмены; или одна неделя приема, три недели отмены - в течение одного или более циклов, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более циклов.
В одной частной схеме введения пациент получает вливание соединения формулы (I) в течение периодов продолжительностью в один час ежедневно в течение максимум десяти дней, в частности, до пяти дней, в течение одной недели, и лечение повторяют с желаемым интервалом, таким как две - четыре недели, в частности, каждые три недели.
Более конкретно, пациент может получать вливание соединения формулы (I) в течение периодов продолжительностью в один час ежедневно в течение 5 дней, и лечение повторяют каждые три недели.
В другой частной схеме введения пациент получает вливание в течение от 30 минут до 1 часа с последующими поддерживающими вливаниями переменной продолжительности, например, 1-5 часов, например, 3 часа.
В другой частной схеме введения пациент получает непрерывное вливание сроком от 12 часов до 5 дней, в частности, непрерывное вливание от 24 часов до 72 часов.
В другой частной схеме введения пациенту дают соединение перорально один раз в неделю.
В другой частной схеме введения пациенту дают соединение перорально один раз в день в течение от 7 до 28 дней, например, 7, 14 или 28 дней.
В другой частной схеме введения пациенту дают соединение перорально один раз в день в течение 1 дня, 2 дней, 3 дней, 5 дней или 1 недели, с последующим необходимым количеством выходных для завершения одно- или двухнедельного цикла.
В другой частной схеме введения пациенту дают соединение перорально один раз в день в течение 2 недель с последующими 2 неделями отмены.
В другой частной схеме введения пациенту дают соединение перорально один раз в день в течение 2 недель с последующей 1 неделей отмены.
В другой частной схеме введения пациенту дают соединение перорально один раз в день в течение 1 недели с последующей 1 неделей отмены.
В конечном счете, однако, количество вводимого соединения и тип используемой композиции будет соразмерно с природой подвергаемого лечению болезненного или физиологического состояния и будет определяться на усмотрение врача.
Было обнаружено, что антагонисты IAP могут использоваться в качестве единственного агента или в комбинации с другими противораковыми агентами. Например, это может быть полезно для комбинации антагониста, индуцирующего апоптоз, с другим агентом, действующим через отличный механизм, для регулирования роста клеток, для устранения, таким образом, двух из характерных признаков развития рака. Эксперименты по комбинации могут быть осуществлены, например, как описано в Chou TC, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regulat 1984;22: 27-55.
Соединения, определенные здесь, могут вводиться как единственный терапевтический агент, или они могут вводиться в комбинированной терапии с одним или более других соединений (или терапий) для лечения определенного болезненного состояния, например, неопластического заболевания, такого как рак, как определено выше. Для лечения вышеупомянутых состояний соединения по изобретению могут предпочтительно использоваться в комбинации с одним или более другими лекарственными средствами, более конкретно, с другими противораковыми агентами или адъювантами (поддерживающими агентами в терапии) в терапии рака. Примеры других терапевтических агентов или методов лечения, которые могут быть назначены вместе (или параллельно или в различных временных интервалах) с соединениями формулы (I), включают, но не ограничены ими:
- ингибиторы топоизомеразы I;
- антиметаболиты;
- агенты нацеливания тубулина;
- ДНК-связующее и ингибиторы топоизомеразы II;
- алкилирующие агенты;
- моноклональные антитела;
- антигормоны;
- ингибиторы трансдукции сигналов;
- ингибиторы протеасомы;
- ингибиторы ДНК метилтрансферазы;
- цитокины и ретиноиды;
- терапии с нацеливанием хроматина;
- лучевую терапию; и
- другие терапевтические или профилактические агенты.
Частные примеры противораковых агентов или адъювантов (или их солей) включают, но не ограничены ими, любой из агентов, выбранных из групп (i)-(xlvi), и в случае необходимости группы (xlvii), приведенных ниже:
Соединения платины, например, цисплатин (в случае необходимости в комбинации с амифостином), карбоплатин или оксалиплатин;
Таксановые соединения, например, паклитаксел, связанные частицы паклитаксел-белок (AbraxaneTM), доцетаксел, кабазитаксел или ларотаксел;
Ингибиторы топоизомеразы I, например, соединения камптотецина, например, камптотецин, иринотекан (CPT11), SN-38 или топотекан;
Ингибиторы топоизомеразы II, например, противоопухолевые эпиподофиллотоксины или производные подофиллотоксина, например, этопозид или тенипозид;
Алкалоиды барвинка, например, винбластин, винкристин, липосомальный винкристин (Onco-TCS), винорелбин, виндезин, винфлунин или винвесир;
Нуклеозидные производные, например, 5-фтороурацил (5-FU, в случае необходимости в комбинации с лейковорином), гемцитабин, капецитабин, тегафур, UFT, S1, кладрибин, цитарабин (Ara-C, цитозин арабинозид), флударабин, клофарабин или неларабин;
Антиметаболиты, например, клофарабин, аминоптерин или метотрексат, азацитидин, цитарабин, флоксуридин, пентостатин, тиогуанин, тиопурин, 6-меркаптопурин или гидроксимочевина (гидроксикарбамид);
Алкилирующие агенты, такие как азотистый иприт или нитрозомочевина, например, циклофосфамид, хлорамбуцил, кармустин (BCNU), бендамустин, тиотепа, мелфалан, треосульфан, ломустин (CCNU), алтретамин, бусульфан, дакарбазин, эстрамустин, фотемустин, ифосфамид (в случае необходимости в комбинации с месна), пипоброман, прокарбазин, стрептозоцин, темозоломид, урацил, меклоретамин, метилциклогексилхлорэтилнитрозомочевина или нимустин (ACNU);
Антрациклины, антрацендионы и родственные лекарственные средства, например, даунорубицин, доксорубицин (в случае необходимости в комбинации с дексразоксаном), липосомальные составы доксорубицина (например, Caelyx™, Myocet™, Doxil™), идарубицин, митоксантрон, эпирубицин, амсакрин или валрубицин;
Эпотилоны, например, иксабепилон, патупилон, BMS-310705, KOS-862 и ZK-EPO, эпотилон A, эпотилон B, дезоксиэпотилон B (также известный как эпотилон D или KOS-862), аза-эпотилон B (также известный как BMS-247550), аулималид, изолаулималид или луэтеробин;
Ингибиторы ДНК метилтрансферазы, например, темозоломид, азацитидин или децитабин или SGI-110;
Антифолаты, например, метотрексат, динатрий пеметрексед или ралтитрексед;
Цитотоксические антибиотики, например, антиномицин D, блеомицин, митомицин C, дактиномицин, карминомицин, дауномицин, левамизол, пликамицин или митрамицин;
Тубулинсвязывающие вещества, например, комбрестатин, колхицины или нокодазол;
Ингибиторы трансдукции сигналов, такие как ингибиторы киназы (например, ингибиторы EGFR (рецептор эпителиального фактора роста), ингибиторы VEGFR (рецептор фактора роста эндотелия сосудов), ингибиторы PDGFR (рецептор фактора роста тромбоцитов), MTKI (многоцелевые ингибиторы киназы), ингибиторы Raf, ингибиторы mTOR, например, иматиниб мезилат, эрлотиниб, гефитиниб, дасатиниб, лапатиниб, довотиниб, акситиниб, нилотиниб, вандетаниб, ваталиниб, пазопаниб, сорафениб, сунитиниб, темсиролимус, эверолимус (RAD 001), вемурафениб (PLX4032/RG7204), дабрафениб, энкорафениб или ингибитор киназы IκB, такой как SAR-113945, бардоксолон, BMS-066, BMS-345541, IMD-0354, IMD-2560 или IMD-1041 или ингибиторы MEK, такие как селуметиниб (AZD6244) и траметиниб (GSK121120212);
Ингибиторы аврора киназы, например, AT9283, барасертиб (AZD1152), TAK-901, MK0457 (VX680), ценисертиб (R-763), данусертиб (PHA-739358), алисертиб (MLN 8237) или MP-470;
Ингибиторы CDK, например, AT7519, росковитин, селициклиб, алвоцидиб (флавопиридол), динациклиб (SCH-727965), 7-гидрокси-стауроспорин (UCN-01), JNJ-7706621, BMS-387032 (также известный как SNS-032), PHA533533, PD332991, ZK-304709 или AZD-5438;
Ингибиторы PKA/B и ингибиторы пути PKB (akt), например, ингибиторы AKT, такие как KRХ-0401 (перифосин/NSC 639966), ипатасертиб (GDC-0068; RG-7440), афуресертиб (GSK-2110183; 2110183), MK-2206, MK-8156, AT13148, AZD-5363, трицирибин фосфат (VQD-002; трицирибин фосфат моногидрат (API 2; TCN-P; TCN-PM; VD-0002), RX-0201, NL-71-101, SR-13668, PX-316, AT13148, AZ-5363, Семафор, SF1126 или энзастаурин HCl (LY317615) или ингибиторы MTOR, такие как аналоги рапамицина, такие как RAD 001 (эверолимус), CCI 779 (темсиролимус), AP23573 и ридафоролимус, сиролимус (первоначально известный как рапамицин), AP23841 и AP23573, ингибиторы кальмомодулина, например, CBP-501 (ингибиторы транслокации семейства forkhead), энзастаурин HCl (LY317615) или ингибиторы PI3K, такие как дактолизиб (BEZ235), бупарлизиб (BKM-120; NVP-BKM-120), BYL719, копанлизиб (BAY-80-6946), ZSTK-474, CUDC-907, апитолизиб (GDC-0980; RG-7422), пиктилизиб (пиктрелизиб, GDC-0941, RG-7321), GDC-0032, GDC-0068, GSK-2636771, иделализиб (ранее CAL-101, GS 1101, GS-1101), MLN1117 (INK1117), MLN0128 (INK128), IPI-145 (INK1197), LY-3023414, ипатасертиб, афуресертиб, MK-2206, MK-8156, LY-3023414, LY294002, SF1126 или PI-103 или сонолизиб (PX 866);
Ингибиторы Hsp90, например, AT13387, хербимицин, гелдамицин (GA), 17-аллиламино-17-десметоксигелданамицин (17-AAG), например, NSC 330507, Kos-953 и CNF-1010, 17-диметиламиноэтиламино-17-дeметоксигелданамицин гидрохлорид (17-DMAG), например, NSC 707545 и Kos-1022, NVP-AUY922 (VER-52296), NVP-BEP800, CNF-2024 (BIIB-021 пероральный пурин), ганетеспиб (STA 9090), SNX-5422 (SC-102112) или IPI-504;
Моноклональные антитела (неконъюгированные или конъюгированные с радиоизотопами, токсинами или другими веществами), производные антител и родственные агенты, такие как анти-CD, анти-VEGFR, анти-HER2, анти-CTLA4, анти-PD-1 или анти-EGFR антитела, например, ритуксимаб (CD20), офатумумаб (CD20), ибритумомаб тиуксетан (CD20), GA101 (CD20), тозитумомаб (CD20), эпратузумаб (CD22), линтузумаб (CD33), гемтузумаб озогамицин (CD33), алемтузумаб (CD52), галиксимаб (CD80), трастузумаб (антитело HER2), пертузумаб (HER2), трастузумаб-DM1 (HER2), эртумаксомаб (HER2 и CD3), цетуксимаб (EGFR), панитумумаб (EGFR), нецитумумаб (EGFR), нимотузумаб (EGFR), бевацизумаб (VEGF), катумаксумаб (EpCAM и CD3), абаговомаб (CA125), фарлетузумаб (рецептор фолата), элотузумаб (CS1), деносумаб (лиганд RANK), фигитумумаб (IGF1R), CP751,871 (IGF1R), мапатумумаб (рецептор TRAIL), metMAB (met), митумомаб (ганглиозид GD3), наптумомаб эстафенатокс (5T4), силтуксимаб (IL6), или иммуномодулирующие агенты, такие как CTLA-4 блокирующие антитела и/или антитела к PD-1 и PD-L1 и/или PD-L2, например, ипилимумаб (CTLA4), MK-3475 (пембролизумаб, ранее ламбролизумаб, анти-PD-1), ниволумаб (анти-PD-1), BMS-936559 (анти-PD-L1), MPDL320A, AMP-514 или MEDI4736 (анти-PD-L1), или тремелимумаб (ранее тицилимумаб, CP-675,206, анти-CTLA-4);
Антагонисты рецептора эстрогена или селективные модуляторы рецептора эстрогена (SERMs) или ингибиторы синтеза эстрогена, например, тамоксифен, фулвестрант, торемифен, дролоксифен, фаслодекс или ралоксифен;
Ингибиторы ароматазы и родственные лекарственные средства, такие как эксеместан, анастрозол, летразол, тестолактон аминоглутетимид, митотан или ворозол;
Антиандрогены (т.е. антагонисты рецептора андрогена) и родственные агенты, например, бикалутамид, нилутамид, флутамид, ципротерон или кетоконазол;
Гормоны и их аналоги, такие как медроксипрогестерон, диэтилстилбэстрол (также известный как диэтилстилбоэстрол) или октреотид;
Стероиды, например, дромостанолон пропионат, мегестрол ацетат, нандролон (деканоат, фенпропионат), флуоксиместрон или госсипол,
Стероидный ингибитор 17-альфа- гидроксилаза-17,20-лиазы цитохрома P450 (CYP17), например, абиратерон;
Агонисты или антагонисты гонадотропин-высвобождающего гормона (GnRAs), например, абареликс, госерелин ацетат, гистрелин ацетат, лейпролид ацетат, трипторелин, бусерелин или деслорелин;
Глюкокортикоиды, например, преднизон, преднизолон, дексаметазон;
Дифференцирующие агенты, такие как ретиноиды, рексиноиды, витамин D или ретиноевая кислота, и агенты, блокирующие метаболизм ретиноевой кислоты (RAMBA), например, аккутан, алитретиноин, бексаротен или третиноин;
Ингибиторы фарнезилтрансферазы, например, типифарниб;
Терапии, нацеленные на хроматин, такие как ингибиторы гистон деацетилазы (HDAC), например, панобиностат, ресминостат, абексиностат, вориностат, ромидепсин, белиностат, энтиностат, квизиностат, прациностат, тефиностат, моцетиностат, гивиностат, CUDC-907, CUDC-101, ACY-1215, MGCD-290, EVP-0334, RG-2833, 4SC-202, ромидепсин, AR-42 (Ohio State University), CG-200745, вальпроевая кислота, CKD-581, бутират натрия, субероиланилид гидроксамидная кислота (SAHA), депсипептид (FR 901228), дациностат (NVP-LAQ824), R306465/JNJ-16241199, JNJ-26481585, трихостатин A, хламидоцин, A-173, JNJ-MGCD-0103, PXD-101 или апицидин;
Ингибиторы протеасомы, например, бортезомиб, карфилзомиб, деланзомиб (CEP 18770), иксазомиб (MLN 9708), опрозомиб (ONX-0912) или маризомиб;
Фотодинамические лекарственные средства, например, порфимер натрий или темопорфин;
Противораковые агенты полученные из морских организмов, такие как трабектидин;
Меченные изотопом лекарственные средства для радиоиммунотерапии, например, с испускающим бета-частицы изотопом (например, Йод-131, Итрий-90) или испускающим альфа-частицы изотопом (например, Висмут-213 или Актиний-225), например, ибритумомаб или Йодтозитумомаб;
Ингибиторы теломеразы, например, теломестатин;
Ингибиторы матриксной металлопротеиназы, например, батимастат, маримастат, приностат или метастат;
Рекомбинантные интерфероны (такие как интерферон-γ и интерферон α) и интерлейкины (например, интерлейкин 2), например, алдеслейкин, денилейкин дифтитокс, интерферон альфа 2a, интерферон альфа 2b или пэг-интерферон альфа 2b;
Селективные модуляторы иммунного ответа, например, талидомид или леналидомид;
Терапевтические вакцины, такие как сипулейцел-T (Provenge) или OncoVex;
Цитокин-активирующие агенты включают пицибанил, ромуртид, сизофиран, вирулизин или тимозин;
Триоксид мышьяка;
Ингибиторы рецепторов, связанных с G-белком (GPCR), например, атрасентан;
Ферменты, такие как L-аспарагиназа, пэгаспаргаза, расбуриказа или пэгадемаза;
Ингибиторы репарации ДНК, такие как ингибиторы PARP, например, олапариб, велапариб, инипариб, INO-1001, AG-014699 или ONO-2231;
Агонисты рецептора смерти (например, рецептора TNF-связанного апоптоз-индуцирующего лиганда (TRAIL)), такие как мапатумумаб (ранее HGS-ETR1), конатумумаб (ранее AMG 655), PRO95780, лексатумумаб, дуланермин, CS-1008, апомаб или рекомбинантные лиганды TRAIL, такие как рекомбинантный человеческий лиганд TRAIL/Apo2;
Профилактические агенты (добавки); т.е. агенты, уменьшающие или облегчающие некоторые побочные эффекты, связанные с агентами химиотерапии, например
противорвотные агенты,
агенты, предотвращающие или уменьшающие продолжительность связанной с химиотерапией нейтропении и предотвращающие осложнения, являющиеся результатом сниженных уровней тромбоцитов, эритроцитов или лейкоцитов, например, интерлейкин-11 (например, опрелвекин), эритропоэтин (EPO) и его аналоги (например, дарбепоэтин альфа), аналоги колониестимулирующего фактора, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (например, сарграмостим) и гранулоцитарный колониестимулирующий фактор (G-CSF) и его аналоги (например, филграстим, пэгфилграстим),
агенты, ингибирующие резорбцию костей, такие как деносумаб или бисфосфонаты, например, золедронат, золедроновая кислота, памидронат и ибандронат,
агенты, подавляющие воспалительные реакции, такие как дексаметазон, преднизон и преднизолон,
агенты, используемые для уменьшения уровней гормона роста и IGF-I (и других гормонов) в крови у пациентов с акромегалией или другими редкими гормонопродуцирующими опухолями, такие как синтетические формы гормона соматостатина, например, октреотид ацетат,
антидот к лекарственным средствам, уменьшающим уровни фолиевой кислоты, такие как лейковорин или фолиновая кислота,
агенты для уменьшения боли, например, опиаты, такие как морфий, диаморфин и фентанил,
нестероидные противовоспалительные лекарственные средства (NSAID), такие как ингибиторы COX-2, например, целекоксиб, эторикоксиб и лумиракоксиб,
агенты для лечения воспаления слизистой оболочки, например, палифермин,
агенты для лечения побочных эффектов, включая анорексию, кахексию, отек или тромбоэмолические эпизоды, такие как мегестрол ацетат.
В одном варианте осуществления противораковое средство выбрано из рекомбинантных интерферонов (таких как интерферон-γ и интерферон α) и интерлейкинов (например, интерлейкина 2), например, алдеслейкина, денилейкин дифтитокса, интерферона альфа 2a, интерферона альфа 2b или пэгинтерферона альфа 2b; интерферона-α2 (500 мк/мл), в частности, интерферон-β; и ингибиторов трансдукции сигналов, таких как ингибиторы киназы (например, ингибиторов EGFR (рецептор фактора роста эпителия), ингибиторов VEGFR (рецептор фактора роста эндотелия сосудов), ингибиторов PDGFR (рецептор фактора роста тромбоцитов), MTKI (многоцелевые ингибиторы киназы), Raf ингибиторов ВВС, mTOR ингибиторов, например, иматиниб мезилата, эрлотиниба, гефитиниба, дасатиниба, лапатиниба, довотиниба, акситиниба, нилотиниба, вандетаниба, ваталиниба, пазопаниба, сорафениба, сунитиниба, темсиролимуса, эверолимуса (RAD 001), вемурафениба (PLX4032/RG7204), дабрафениба, енкорафениба или ингибитора киназы IκB, такого как SAR-113945, бардоксолона, BMS-066, BMS-345541, IMD-0354, IMD-2560 или IMD-1041, или ингибиторов MEK, таких как селуметиниб (AZD6244) и траметиниб (GSK121120212), в частности, Raf ингибиторов (например, вемурафениба) или ингибиторов MEK (например, траметиниба).
Каждое из соединений, присутствующих в комбинациях по изобретению, можно вводить согласно индивидуально варьирующимся схемам введения и через различные пути. Также позология каждого из этих двух или более агентов может отличаться: каждый может вводиться одновременно или в разное время. Специалисту в данной области хорошо известны, на основании его общих знаний, режимы введения и комбинированная терапия для использования. Например, соединение по изобретению можно использовать в комбинации с одним или более другими агентами, вводимыми согласно их обычному режиму комбинации. Примеры стандартных режимов комбинации приведены ниже.
Таксановое соединение предпочтительно вводят в дозировке от 50 до 400 мг на квадратный метр (мг/м2) площади поверхности, например, от 75 до 250 мг/м2, в частности, для паклитаксела - в дозировке приблизительно от 175 до 250 мг/м2 и для доцетаксела -приблизительно от 75 до 150 мг/м2 за курс лечения.
Соединение камптотецина предпочтительно вводят в дозировке от 0,1 до 400 мг на квадратный метр (мг/м2) площади поверхности, например, от 1 до 300 мг/м2, в частности, для иринотекана - в дозировке приблизительно от 100 до 350 мг/м2 и для топотекана - приблизительно от 1 до 2 мг/м2 за курс лечения.
Противоопухолевое производное подофиллотоксина предпочтительно вводят в дозировке от 30 до 300 мг на квадратный метр (мг/м2) площади поверхности, например, от 50 до 250мг/м2, в частности, для этопозида - в дозировке приблизительно от 35 до 100 мг/м2 и для тенипозида - приблизительно от 50 до 250 мг/м2 за курс лечения.
Протовоопухолевый алкалоид барвинка предпочтительно вводят в дозировке от 2 до 30 мг на квадратный метр (мг/м2) площади поверхности, в частности, для винбластина - в дозировке приблизительно от 3 до 12 мг/м2, для винкристина - в дозировке приблизительно от 1 до 2 мг/м2, и для винорелбина - в дозировке приблизительно от 10 до 30 мг/м2 за курс лечения.
Протовоопухолевое производное нуклеозида предпочтительно вводят в дозировке от 200 до 2500 мг на квадратный метр (мг/м2) площади поверхности, например, от 700 до 1500 мг/м2, в частности, для 5-FU - в дозировке от 200 до 500 мг/м2, для гемцитабина - в дозировке приблизительно от 800 до 1200 мг/м2 и для капецитабина - приблизительно от 1000 до 2500 мг/м2 за курс лечения.
Алкилирующие агенты, такие как азотистый иприт или нитрозомочевина, предпочтительно вводят в дозировке от 100 до 500 мг на квадратный метр (мг/м2) площади поверхности, например, от 120 до 200 мг/м2, в частности, для циклофосфамида - в дозировке приблизительно от 100 до 500 мг/м2, для хлорамбуцила - в дозировке приблизительно от 0,1 до 0,2 мг/кг, для кармустина - в дозировке приблизительно от 150 до 200 мг/м2, и для ломустина - в дозировке приблизительно от 100 до 150 мг/м2 за курс лечения.
Протовоопухолевое производное антрациклина предпочтительно вводят в дозировке от 10 до 75 мг на квадратный метр (мг/м2) площади поверхности, например, от 15 до 60 мг/м2, в частности, для доксорубицина - в дозировке приблизительно от 40 до 75 мг/м2, для даунорубицина - в дозировке приблизительно от 25 до 45мг/м2, и для идарубицина - в дозировке приблизительно от 10 до 15 мг/м2 за курс лечения.
Антиэстрогенный агент предпочтительно вводят в суточной дозировке приблизительно от 1 до 100 мг в зависимости от конкретного агента и подвергаемого лечению состояния. Тамоксифен предпочтительно вводят перорально в дозировке от 5 до 50 мг, в частности, от 10 до 20 мг два раза в сутки, продолжая терапию в течение достаточного количества времени для достижения и поддержания терапевтического эффекта. Торемифен предпочтительно вводят перорально в дозировке приблизительно 60 мг один раз в сутки, продолжая терапию в течение достаточного количества времени для достижения и поддержания терапевтического эффекта. Анастрозол предпочтительно вводят перорально в дозировке приблизительно 1 мг один раз в сутки. Дролоксифен предпочтительно вводят перорально в дозировке приблизительно от 20 до 100 мг один раз в сутки. Ралоксифен предпочтительно вводят перорально в дозировке приблизительно 60 мг один раз в сутки. Эксеместан предпочтительно вводят перорально в дозировке приблизительно 25 мг один раз в сутки.
Антитела предпочтительно вводят в дозировке приблизительно от 1 до 5 мг на квадратный метр (мг/м2) площади поверхности, или, в ином случае, в дозировках, известных в данной области техники. Трастузумаб предпочтительно вводят в дозировке от 1 до 5 мг на квадратный метр (мг/м2) площади поверхности, в частности, от 2 до 4 мг/м2 за курс лечения.
Если соединение формулы (I) вводят в комбинированной терапии с одним, двумя, тремя, четырьмя или более других терапевтических агентов (в частности, одним или двумя, более конкретно, одним), соединения могут вводиться одновременно или последовательно. В последнем случае два или более соединений вводят в течение периода времени и в количестве и таким образом, которые достаточны для обеспечения достижения выгодного или синергического эффекта. При последовательном введении, они могут вводиться в близко расположенных интервалах (например, в течение 5-10 минут) или в более длинных интервалах (например, на расстоянии 1, 2, 3, 4 или более часов, или, при необходимости, с еще более длинными промежутками), причем точный режим введения должен быть соразмерным со свойствами терапевтического агента(ов). Эти дозировки могут вводиться, например, один раз, два раза или более за курс лечения, который может быть повторен, например, каждые 7, 14, 21 или 28 дней.
В одном варианте осуществления изобретение относится к соединению формулы (I) для получения лекарственного средства для применения в терапии, причем указанное соединение используется в комбинации с одним, двумя, тремя или четырьмя другими терапевтическими агентами. В другом варианте осуществления изобретение относится к лекарственному средству для лечения рака, включающему соединение формулы (I), причем указанное лекарственное средство используется в комбинации с одним, двумя, тремя или четырьмя другими терапевтическими агентами. Изобретение также относится к применению соединения формулы (I) для получения лекарственного средства для усиления или потенцирования степени ответа у пациента, страдающего раком, где пациент получает лечение с одним, двумя, тремя или четырьмя другими терапевтическими агентами.
Следует понимать, что конкретный способ и порядок введения и соответствующие количества и режимы введения для каждого компонента комбинации будут зависеть от конкретного другого лекарственного средства и вводимого соединения согласно настоящему изобретению, их пути введения, конкретной подвергаемой лечению опухоли и конкретного получающего лечение хозяина. Оптимальный способ и порядок введения и количество и режим введения могут быть легко определены специалистом с помощью стандартных способов и ввиду информации, изложенной здесь.
Весовое соотношение соединения согласно настоящему изобретению и одного или более другого противоракового агента(ов), когда их вводят в форме комбинации, может быть определено специалистом в данной области техники. Указанное соотношение и точная дозировка и частота введения зависят от конкретного соединения согласно изобретению и другого используемого противоракового агента(ов), конкретного подвергаемого лечению состояния, серьезности подвергаемого лечению состояния, возраста, массы тела, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также других лекарственных средств, которые может принимать человек, как известно специалисту в данной области техники. Кроме того, очевидно, что эффективная суточноая доза может быть уменьшена или увеличена в зависимости от реакции пациента и/или в зависимости от оценки врача, прописывающего соединения согласно настоящему изобретению. Конкретное весовое соотношение для соединения формулы (I) и другого противоракового агента может варьировать от 1/10 до 10/1, более конкретно, от 1/5 до 5/1, еще более конкретно, от 1/3 до 3/1.
Соединения по изобретению могут также быть введены в сочетании с нехимиотерапевтическими лечениями, такими как лучевая терапия, фотодинамическая терапия, генотерапия; хирургия и конктролируемые диеты.
Соединения согласно настоящему изобретению также имеют терапевтические применения в сенсибилизации опухолевых клеток для лучевой терапии и химиотерапии. Следовательно, соединения согласно настоящему изобретению могут использоваться в качестве «радиосенсибилизаторов» и/или «хемосенсибилизаторов» или могут быть введены в сочетании с другим «радиосенсибилизатором» и/или «хемосенсибилизатором». В одном варианте осуществления соединение по изобретению предназначено для использования в качестве хемосенсибилизатора.
Термин «радиосенсибилизатор» определяется как молекула, вводимая пациентам в терапевтически эффективных количествах для увеличения чувствительности клеток к ионизирующему облучению и/или для промотирования лечения заболеваний, которые поддаются лечению ионизирующим облучением.
Термин «хемосенсибилизатор» определяется как молекула, вводимая пациентам в терапевтически эффективных количествах для увеличения чувствительности клеток к химиотерапии и/или для промотирования лечения заболеваний, которые поддаются лечению химиотерапией.
В одном варианте осуществления соединение по изобретению вводят с «радиосенсибилизатором» и/или «хемосенсибилизатором». В одном варианте осуществления соединение по изобретению ввожят с «иммунным сенсибилизатором».
Термин ʺиммунный сенсибилизаторʺ определяется как молекула, вводимая пациентам в терапевтически эффективных количествах для увеличения чувствительности клеток к антагонисту IAP, например, путем промотирования или усиления иммунного ответа, например, путем триггерного запуска высвобождения TNF.
Во многих протоколах лечения рака в настоящее время используют радиосенсибилизаторы в сочетании с рентгеновским облучением. Примеры рентгенактивируемых радиосенсибилизаторов, включают, но не ограничены ими, следующее: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин C, RSU 1069, SR 4233, EO9, RB 6145, никотинамид, 5-бромдезоксиуридин (BUdR), 5-йоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин (FudR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные.
Фотодинамическая терапия (PDT) рака использует видимый свет в качестве радиационного активатора сенсибилизирующего агента. Примеры фотодинамических радиосенсибилизаторов включают следующие, но не ограничены ими: производные гематопорфирина, фотофрин, производные бензопорфирина, этиопорфирин олова, феоборбид-a, бактериохлорофилл-a, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и производные.
Радиосенсибилизаторы могут быть введены в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но не ограничиваясь ими: соединения по изобретению; соединения, вызывающие инкорпорацию радиосенсибилизаторов в клетки-мишени; соединения, контролирующие поток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические агенты, действующие на опухоль с дополнительным облучением или без дополнительного облучения; или другие терапевтически эффективные соединения для лечения рака или других заболеваний.
Хемосенсибилизаторы могут быть введены в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но не ограничиваясь ими: соединения по изобретению; соединения, вызывающие инкорпорацию хемосенсибилизаторов в клетки-мишени; соединения, контролирующие поток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические агенты, действующие на опухоль, или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Кальциевые антагонисты, например, верапамил, найдены полезными в комбинации с антибластомными средствами для установления хемочувствительности в опухолевых клетках, резистентных к обычным химиотерапевтическим веществам, и потенцирования эффективности таких соединений в чувствительных к лекарственному средству злокачественных образованиях.
Примеры иммунных сенсибилизаторов включают следующие, но не ограничены ими: иммуномодулирующие агенты, например, моноклональные антитела, такие как антитела иммунных контрольных точек [например, CTLA-4 блокирующие антитела и/или антитела к PD 1 и PD-L1 и/или PD-L2, например, ипилимумаб (CTLA4), MK-3475 (пембролизумаб, ранее ламбролизумаб, анти-PD-1), ниволумаб (анти-PD-1), BMS-936559 (анти-PD-L1), MPDL320A, AMP-514 или MEDI4736 (анти-PD-L1) или тремелимумаб (ранее тицилимумаб, CP-675,206, анти-CTLA-4)]; или ингибиторы трансдукции сигналов; или цитокины (такие как рекомбинантные интерфероны); или онколитические вирусы; или иммунные адъюванты (например, BCG).
Иммунные сенсибилизаторы могут вводиться в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но не ограничиваясь ими: соединения по изобретению; соединения, вызывающие инкорпорацию иммунных сенсибилизаторов в клетки-мишени; соединения, контролирующие поток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; терапевтические агенты, действующие на опухоль, или другие терапевтически эффективные соединения для лечения рака или другого заболевания.
Для использования в комбинированной терапии с другим химиотерапевтическим агентом, соединение формулы (I) и один, два, три, четыре или более других терапевтических агентов могут быть, например, составлены вместе в лекарственной форме, содержащей два, три, четыре или более терапевтических агентов, т.е., в единой фармацевтической композиции, содержащей все агенты. В альтернативном варианте осуществления отдельные терапевтические агенты могут быть составлены отдельно и представлены вместе в форме набора, в случае необходимости с инструкциями по их использованию.
В одном варианте осуществления изобретение относится к комбинации соединения формулы (I) с один или более (например, 1 или 2) другими терапевтическими агентами (например, противораковыми агентами, как описано выше). В другом варианте осуществления изобретение относится к комбинации антагониста IAP, как описано здесь, и ингибитора пути PI3K/AKT, выбранного из: апитолисиба, бупарлисиба, копанлисиба, пиктилисиба, ZSTK-474, CUDC-907, GSK-2636771, LY-3023414, ипатасертиба, афуресертиба, MK-2206, MK-8156, иделалисиба, BEZ235 (дактолисиб), BYL719, GDC-0980, GDC-0941, GDC-0032 и GDC-0068.
В другом варианте осуществления изобретение относится к соединению формулы (I) в комбинации с одним или более (например, 1 или 2) другими терапевтическими агентами (например, противораковыми агентами) для применения в терапии, такой как профилактика или лечение рака.
В одном варианте осуществления фармацевтическая композиция включает соединение формулы (I) вместе с фармацевтически приемлемым носителем и в случае необходимости одним или более терапевтическими агентами.
В другом варианте осуществления изобретение относится к применению комбинации согласно изобретению в получении фармацевтической композиции для ингибирования роста опухолевых клеток.
В другом варианте осуществления изобретение относится к продукту, содержащему соединение формулы (I) и один или более противораковых агентов в форме комбинированного препарата для одновременного, раздельного или последовательного применения в лечении пациентов, страдающих раком.
ПРИМЕРЫ
Изобретение будет теперь проиллюстрировано, но не ограничено, частными вариантами осуществления, описанными в следующих примерах. Соединения были названы с помощью пакета автоматизированного присвоения названий, такого как AutoNom (MDL), или упоминаются под названиями, данными им химическим поставщиком.
Следующие процедуры синтеза представлены для иллюстрации используемых способов; для данного получения или стадии используемый предшественник может не обязательно происходить из отдельной партии, синтезируемой согласно стадии в данном описании. В примерах используются следующие аббревиатуры.
|
Данные ЯМР: Если не указано, спектры 1H ЯМР регистрировали при 25°C на спектрометре Bruker Avance I, настроенном на 400 МГц. Данные были обработаны и проанализированы с использованием программного обеспечения Topspin 2.1. Для данных ЯМР, где число установленных протонов меньше, чем теоретическое число протонов в молекуле, предполагается, что очевидно недостающий сигнал(ы) затенен пиками растворителя и/или воды. Кроме того, где спектры были получены в протонных ЯМР растворителях, происходит обмен протонов NH и/или OH с растворителем, и следовательно, такие сигналы обычно не наблюдаются.
Аналитические и препаративные системы LC-MS
Аналитическая система LC-MS и описание способа
В следующих примерах соединения охарактеризовывались масс-спектроскопией с помощью систем и операционных условий, изложенных ниже. Где атомы с различными изотопами присутствуют и указана единственная масса, масса, указанная для соединения, является моноизотопной массой (т.е. 35Cl; 79Br и т.д.).
Система LC-MS Waters Platform:
Система ВЭЖХ: Waters 2795
Масс-спектрометрический детектор: Micromass Platform LC
Детектор PDA: Waters 2996 PDA
• Условия Platform MS:
Капиллярное напряжение: 3,6 кВ (3,40 кВ при отрицательном ES)
Напряжение конуса: 30 В
Исходная температура: 120°C
Диапазон сканирования: 125-800 а. е. м.
Способ ионизации: положительное электрораспыление или
отрицательное электрораспыление или
положительное и отрицательное электрораспыление
Система LC-MS Waters Fractionlynx:
Система ВЭЖХ: автоматический дозатор 2767 - насос бинарного градиента 2525
Масс-спектрометрический детектор: Waters ZQ
Детектор PDA: Waters 2996 PDA
• условия Fractionlynx MS:
Капиллярное напряжение: 3,5 кВ (3,25 кВ при отрицательном ES)
Напряжение конуса: 40 В (25 В при отрицательном ES)
Исходная температура: 120°C
Диапазон сканирования: 125-800 а. е. м.
Способ ионизации: положительное электрораспыление или
отрицательное электрораспыление или
положительное и отрицательное электрораспыление
Система LC-MS Agilent 1200SL-6140 - RAPID:
Система ВЭЖХ: Agilent 1200 серия SL
Масс-спектрометрический детектор: одноквадрупольный Agilent 6140
Второй детектор: Agilent 1200 MWD SL
• условия Agilent MS:
Капиллярное напряжение: 4000 В при пол. ES (3500 В при отрицательном ES)
Фрагментор/Усилитель: 100
Усилитель: 1
Поток осушающего газа: 7,0 л/мин
Температура газа: 345°C
Давление небулайзера: 35 фунтов на квадратный дюйм
Диапазон сканирования: 125-800 а. е. м.
Способ ионизации: Электрораспыление с переключением положительное-отрицательное
Препаративная система LC-MS и описание способа
Препаративная LC-MS является стандартным и эффективным способом, используемым для очистки маленьких органических молекул, таких как соединения, описанные здесь. Способы жидкостной хроматографии (LC) и масс-спектрометрии (MS) могут варьировать для обеспечения лучшего разделения сырых материалов и улучшенной детекции образцов с помощью MS. Оптимизация способа препаративной градиентной LC включает варьирование колонками, летучими элюентами и модификаторами и градиентами. Способы известны в области оптимизации препаративных способов LC-MS и затем использования их для очистки соединений. Такие способы описаны в Rosentreter U, Huber U.; Optimal fraction collecting in preparative LC/MS; J Comb Chem.; 2004; 6(2), 159-64 и Leister W, Strauss K, Wisnoski D, Zhao Z, Lindsley C., Development of a custom high-throughput preparative liquid chromatography/mass spectrometer platform for the preparative purification and analytical analysis of compound libraries; J Comb Chem.; 2003; 5(3); 322-9.
Несколько систем для очистки соединений с помощью препаративной LC-MS описаны ниже, хотя для специалиста в данной области будет очевидна возможность использования систем и способов, альтернативных описанным. На основании информации, приведенной здесь, или с использованием альтернативных хроматографических систем, специалист в данной области может очистить соединения, описанные здесь, препаративной LC-MS.
Система Waters Fractionlynx:
• Аппаратные средства:
автодозатор с двойной петлей/коллектор фракций 2767
препаративный насос 2525
CFO (органайзер жидкостных колонок) для выбора колонки
RMA (менеджер реагентов Waters) для подкачивающего насоса
Масс-спектрометр Waters ZQ
Матричный светодиодный детектор Waters 2996
Масс-спектрометр Waters ZQ
• Условия Waters МS:
Капиллярное напряжение: 3,5 кВ (3,2 кВ при отрицательном ES)
Напряжение конуса: 25 В
Исходная температура: 120°C
Диапазон сканирования: 125-800 а. е. м.
Способ ионизации: положительное электрораспыление или
отрицательное электрораспыление
Препаративная система LC-MS AGILENT 1100:
Аппаратные средства:
Автоматический дозатор: 1100 серия ʺprepALSʺ
Насос: 1100 серия «PrepPump» для препаративного поточного градиента и 1100 серия «QuatPump» для перекачки модификатора в препаративном потоке
УФ-детектор: 1100 серия ʺMWDʺ Multi Wavelength Detector
Детектор MS: 1100 серия ʺLC-MSD VLʺ
Коллектор фракций: 2 x ʺPrep-FCʺ
Подкачивающий насос: ʺWaters RMAʺ
Agilent Active Splitter
• Условия Agilent MS:
Капиллярное напряжение: 4000 В (3500 В при отрицательном ES)
Фрагментор/Усилитель: 150/1
Поток осушающего газа: 12,0 л/мин
Температура газа: 350°C
Давление небулайзера: 50 фунтов на квадратный дюйм
Диапазон сканирования: 125-800 а. е. м.
Способ ионизации: положительное электрораспыление или отрицательное электрораспыление
• Колонки:
Ряд коммерчески доступных колонок - как ахиральных, так и хиральных - может использоваться таким образом, что, в сочетании с изменениями в мобильной фазе, органическом модификаторе и pH, они обеспечивают самое большое покрытие с точки зрения широкого диапазона селективности. Все колонки использовались в соответствии с рекомендуемыми производителями операционными условиями. Как правило, использовались колонки с частицами 5 микронов, где это возможно. Например, колонки от Waters (включая, но не ограничиваясь ими, XBridge™ Prep OBD™ C18 и Phenyl, Atlantis® Prep T3 OBD™ и Sunfire™ Prep OBD C18 5 мкм 19×100 мм), Phenomenex (включая, но не ограничиваясь ими, Synergy MAX-RP and LUX™ Cellulose-2), Astec (колонки Chirobiotic™, включая, но не ограничиваясь ими, V, V2 и T2) и Diacel® (включая, но не ограничиваясь ей, Chiralpak® AD-H) были доступны для скрининга.
• Элюенты:
Элюент мобильной фазы был выбран в сочетании с рекомендуемыми производителями колонки ограничениями стационарной фазы для оптимизации производительности разделения на колонке.
• Способы:
Ахиральная препаративная хроматография
Соединения, описанные в примерах, подвергали очистке ВЭЖХ, где это указано, с помощью способов, разработанных в соответствии с рекомендациями, как описано в Snyder L. R., Dolan J. W., High-Performance Gradient Elution The Practical Application of the Linear-Solvent-Strength Model, Wiley, Hoboken, 2007.
Хиральная препаративная хроматография
Препаративные разделения с помощью хиральных стационарных фаз (CSPs) являются естественным методом для разделения энантиомерных смесей. Равным образом, они могут использоваться для разделения диастереомеров и ахиральных молекул. Способы известны в области оптимизации препаративных хиральных разделений на CSPs и последующего их использования для очистки соединений. Такие способы описаны в Beesley T. E., Scott R.P.W.; Chiral Chromatography; Wiley, Chichester, 1998.
Значения стехиометрии солей или содержания кислоты в соединениях по изобретению представляют собой таковые полученные экспериментально и могут варьировать в зависимости от используемого способа анализа. В случае, если никакая солевая форма не указана, соединение было получено в форме свободного основания.
Пример получения 1: метиловый эфир (R)-2-(S)-2-Бензилоксикарбониламино-3-гидрокси-пропионил-амино)-пропионовой кислоты
Диизопропилэтиламин (375 мл) добавляли по каплям к охлажденной смеси гидрохлорида метилового эфира (R)-2-амино-пропионовой кислоты (100 г, 0,716 моль), EDC (165 г, 0,86 моль), карбобензилокси-L-серина (171,4 г, 0,716 моль) и DCM (3,6 л). Полученную смесь перемешивали в атмосфере азота при температуре среды в течение 16 ч. После удаления растворителя в вакууме при 40°C остаток разбавляли насыщенным раствором карбоната натрия (1 л), водой (1 л) и экстрагировали EtOAc (2 л, 2×1 л). Объединенные органические фазы промывали 2М соляной кислоты (1 л), насыщенным солевым раствором (1 л), высушивали над сульфатом магния и концентрировали в вакууме в 40 °C, получая целевое соединение (172 г) в форме бесцветного твердого вещества. 1H ЯМР (Me-d3-OD): 7,44-7,28 (6H, m), 5,13 (2H, s), 4,46 (1H, d), 4,43 (1H, d), 4,25 (1H, t), 3,82-3,68 (5H, m), 1,39 (3H, d).
Пример получения 2: (3S,6R)-3-Гидроксиметил-6-метил-пиперазин-2,5-дион
К метиловому эфиру (R)-2-(S)-2-бензилоксикарбониламино-3-гидрокси-пропионил-амино)-пропионовой кислоты (который может быть получен, как описано в Примере получения 1) (172 г, 0,53 моль) добавляли 10%-й палладий на углероде (8,6 г), MeOH (530 мл) и циклогексен (344 мл) в атмосфере азота. Смесь нагревали с обратным холодильником в течение 17 ч. Добавляли MeOH (500 мл), и нагревание с обратным холодильником продолжали в течение 1 ч. Горячую реакционную смесь фильтровали через слой целита, осадок после фильтрации промывали горячим MeOH (2×500 мл). Объединенные фильтраты концентрировали. Полученное твердое вещество суспендировали в 2-бутаноне (400 мл), и петролейный эфир (400 мл) постепенно добавляли за 10 минут. После перемешивания в течение 30 минут твердые вещества отфильтровывали, осадок после фильтрации промывали смесью 2:1 петролейный эфир/2-бутанон (300 мл). Осадок после фильтрации высушивали в вакууме при 40°C, получая целевое соединение (68,3 г) в форме твердого вещества грязно-белого цвета. 1H ЯМР (ДМСО-D6): 8,08 (1H, s), 7,90 (1H, s), 5,11 (1H, t), 3,92 (1H, q), 3,80-3,71 (1H, m), 3,71-3,60 (1H, m), 3,58-3,47 (1H, m), 1,24 (3H, d).
Пример получения 3: ((2R,5R)-5-Метил-пиперазин-2-ил)-метанол гидрохлорид
К (3S,6R)-3-гидроксиметил-6-метил-пиперазин-2,5-диону (который может быть получен, как описано в Примере получения 2) (34 г, 0,215 моль) добавляли раствор борана в THF (1 М, 1,6 л, 1,6 моль) и смесь нагревали до 70°C в течение 18 ч. Раствор охлаждали на льду, затем постепенно добавляли MeOH (425 мл), затем 5М соляной кислоты (113 мл). Смесь нагревали до 70°C в течение 2 ч и затем охлаждали до температуры среды. Полученное твердое вещество отфильтровывали, осадок после фильтрации промывали THF (200 мл) и высушивали в вакууме при 40°C, получая целевое соединение (39,3 г) в форме бесцветного твердого вещества. 1H ЯМР (ДМСО-D6): 9,79 (3H, s), 5,59 (1H, s), 3,76-3,40 (5H, m), 3,19-2,94 (2H, m), 1,28 (3H, d).
Пример получения 4: трет-бутиловый эфир (2R,5R)-5-Гидроксиметил-2-метил-пиперазин-1-карбоновой кислоты
К ((2R,5R)-5-метил-пиперазин-2-ил)-метанол гидрохлориду (который может быть получен, как описано в Примере получения 3) (20 г, 119 ммоль) в MeOH (96 мл) при 0°C (ванна со льдом) добавляли триэтиламин (48,7 мл, 357 ммоль). Трет-бутил бикарбонат (61 г, 280 ммоль) в MeOH (145 мл) добавляли за 30 минут. Температуру реакции поддерживали <10°C в течение 1 ч, нагревали до температуры среды в течение 1 ч и затем нагревали до 50°C в течение 18 ч. Реакционную смесь концентрировали, и остаток растворяли в этаноле (397 мл). Добавляли раствор NaOH (23,8 г, 595 ммоль) в воде (397 мл), и реакционную смесь нагревали до 100°C в течение 18 ч, затем охлаждали до температуры среды. Смесь нейтрализовали 1M HCl (~300 мл) до pH 9 (с использованием pH-метра), затем экстрагировали хлороформом (3×700 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток повторно растворяли в MeOH и концентрировали, затем высушивали в вакууме при 40°C, получая целевое соединение (21 г, 75%) в форме бесцветного твердого вещества. 1H ЯМР (Me-d3-OD): 4,20-4,07 (1H, m), 3,79 (1H, dd), 3,71-3,58 (2H, m), 3,54 (1H, dd), 3,24 (1H, dd), 3,18-3,01 (1H, m), 3,01-2,89 (1H, m), 2,55 (1H, dd), 1,48 (9H, s), 1,25 (3H, s).
Пример получения 5: трет-бутиловый эфир (2R,5R)-4-Бензил-5-гидроксиметил-2-метил-пиперазин-1-карбоновой кислоты
Смесь трет-бутилового эфира (2R,5R)-5-гидроксиметил-2-метил-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 4) (3,48 г, 15,1 ммоль), бензальдегида (1,76 г, 16,6 ммоль), натрий триацетоксиборгидрида (3,84 г, 18,1 ммоль) и 1,2-дихлорэтана (30 мл) перемешивали при 20°C в течение 18 ч, затем разделяли между насыщенным водным раствором NaHCO3 (150 мл) и DCM (3×50 мл). Объединенные органические экстракты высушивали (Na2SO4), затем упаривали в вакууме с получением масла. Хроматография (SiO2, 0-30% EtOAc в петролейном эфире) дала целевое соединение (4,588 г, 74%) в форме бесцветного твердого вещества. MS: [M+H]+=321.
Пример получения 6: трет-бутиловый эфир (2R,5R)-4-Бензил-5-хлорметил-2-метил-пиперазин-1-карбоновой кислоты
Метансульфонил хлорид (570 мкл, 7,35 ммоль) при 0°C добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-гидроксиметил-2-метил-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 5) (1,9 г, 6,12 ммоль), содержащему TEA (2,6 мл, 18,4 ммоль) в DCM (30 мл). Раствор перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь разделяли между водным раствором NH4Cl и DCM. Органическую фазу собирали, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (30% EtOAc в петролейном эфире) дала целевое соединение (1,6 г) в форме твердого вещества белого цвета. MS: [M+H]+=339.
Пример получения 7: трет-бутиловый эфир (2R,5S)-4-Бензил-2-метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты
K2CO3 (81,6 г, 591 ммоль) и KI (73,6 г, 443 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метил-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 6) (50 г, 147,9 ммоль) в ацетонитриле (400 мл), с последующим добавлением (R)-3-метилморфолин гидрохлорида (26,4 г, 192 ммоль). Реакционную смесь перемешивали при 70°C в течение 18 ч. Твердое вещество затем удаляли фильтрацией, и растворитель удаляли в вакууме. Сырой материал очищали хроматографией с использованием слоя диоксида кремния (20% EtOAc в петролейном эфире), получая целевое соединение (41,3 г) в форме твердого вещества белого цвета. MS: [M+H]+=404.
Пример получения 8: Трет-бутиловый эфир (2R,5S)-2-Метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты
Палладий на углероде (10%) (33 г) и уксусную кислоту (220 мл) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензил-2-метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 7) (41,3 г, 102 ммоль) в EtOH (300 мл). Смесь перемешивали под H2 (1 атмосфера) при комнатной температуре в течение 18 ч. Затем реакционную смесь фильтровали через слой Целита для удаления катализатора, и растворитель удаляли в вакууме. Сырой материал разделяли между насыщенным водным раствором NaHCO3 и DCM, и продукт экстрагировали DCM (3x). Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме, получая целевое соединение (30,5 г) в форме бледно-желтого масла. 1H ЯМР (400 МГц, CDCl3): 4,43-3,87 (1H, m), 3,78 (1H, d), 3,73-3,55 (3H, m), 3,32 (1H, dd), 3,22 (1H, dd), 3,16-2,93 (3H, m), 2,93-2,72 (1H, m), 2,55-2,35 (2H, m), 2,35-2,15 (2H, m), 1,89 (1H, dd), 1,45 (9H, s), 1,26 (3H, d), 0,96 (3H, d).
Альтернативная процедура:
В плотно закупоренную 10 л фланцевую колбу, снабженную магнитной мешалкой, добавляли трет-бутиловый эфир (2R,5S)-4-бензил-2-метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты (500 г, 1,24 моль, 1,0 экв.) (который может быть получен, как описано в Примере получения 7) и этанол (Сток, 5 л). Колбу помещали в атмосферу азота, и 10%-й Pd/C (Aldrich, 50 г, 0,124 моль, 0,1 экв.) добавляли в форме пасты в этаноле. Колбу несколько раз очищали насосом Divac и помещали в атмосферу водорода с использованием 4 баллонов. Реакционную смесь нагревали до 30°C в течение ночи, после чего ЯМР подтвердил полное потребление исходного материала. Реакционную смесь охлаждали до комнатной температуры и фильтровали через слой целита в атмосфере азота. Фильтраты упаривали досуха с получением целевого продукта в форме бесцветного масла.
1H ЯМР (MeOD): 1,00 (3H, d), 1,25 (3H, d), 1,48 (9H, s), 2,08-2,14 (1H, m), 2,28-2,35 (1H, m), 2,42-2,48 (1H, m), 2,49-2,55 (1H, dd), 2,80-3,06 (4H, m), 3,22-3,28 (2H, m), 3,61-3,78 (4H, m), 4,12-4,16 (1H, m).
13C ЯМР (MeOD): 14,6, 15,7, 28,8, 40,8, 44,8, 48,3, 50,3, 53,2, 54,3, 57,5, 68,5, 73,9, 81,1, 157,0.
Пример получения 9: трет-бутиловый эфир (2R,5S)-4-Бензил-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты
K2CO3 (2,7 г, 19,5 ммоль) и KI (1,83 г, 11,05 ммоль) добавляли к раствору трет-бутилового эфира (2R,5R)-4-бензил-5-хлорметил-2-метил-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 6) (2,2 г, 6,5 ммоль) в ацетонитриле (30 мл) с последующим добавлением (3R,5R)-3,5-диметилморфолина (0,80 г, 7,0 ммоль). Реакционную смесь перемешивали при 70°C в течение 18 ч. Твердое вещество затем удаляли фильтрацией, и растворитель удаляли в вакууме. Остаток разделяли между водой и дихлорметаном. Органическую фазу высушивали, фильтровали и растворитель выпаривали. Сырой материал очищали хроматографией на силикагеле (0-40% EtOAc в петролейном эфире) получая целевое соединение (2,56 г, 94%) в форме твердого вещества белого цвета. MS: [M+H]+=418.
Пример получения 10: трет-бутиловый эфир (2R,5S)-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты
Палладий на углероде (10%) (1,6 г) и уксусную кислоту (10 мл) добавляли к раствору трет-бутилового эфира (2R,5S)-4-бензил-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 9) (2,5 г, 6,0 ммоль) в EtOH (70 мл). Смесь перемешивали под H2 (1 атмосфера) при комнатной температуре в течение 3 ч. Затем реакционную смесь фильтровали через слой Целита для удаления катализатора, и растворитель удаляли в вакууме. Сырой материал разделяли между насыщенным водным раствором NaHCO3 и DCM, и продукт экстрагировали DCM (3x). Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме, получая целевое соединение (1,53 г, 78%) в форме бледно-желтого масла. 1H ЯМР (400 МГц, CDCl3): 4,16 (1H, s), 3,79-3,59 (3H, m), 3,44-3,19 (3H, m), 3,08 (1H, dd), 2,99-2,69 (4H, m), 2,52 (1H, dd), 2,29 (1H, dd), 1,47 (9H, s), 1,27 (3H, d), 1,00 (6H, d).
Следующее соединение получали, осуществляя процедуру, аналогичную описанной в Примерах получения 9 и 10:
10 А: трет-бутиловый эфир (2R,5S)-5-((2S,5R)-2,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты, MS: [M+H]+=328.
Пример получения 11: 2-(5-хлор-3-фтор-пиридин-2-ил)-2-метил-пропионитрил
Раствор бис(триметилсилил)амида натрия (610 мл, 40% в тетрагидрофуране, 1,326 моль) добавляли к охлажденному на льду раствору 5-хлор-2,3-дифторпиридина (198,2 г, 1,326 моль) и нитрилизомасляной кислоты (238 мл, 2,65 моль) в толуоле (2 л). Смесь перемешивали в атмосфере азота при комнантной температуре в течение ночи перед добавлением насыщенного водного раствора хлорида аммония (1 л). Фазы разделяли, и водную фазу экстрагировали этилацетатом (2×1 л). Объединенные органические экстракты высушивали (MgSO4) и концентрировали в вакууме при 40 °C, получая целевое соединение (259,8 г, 95%) 1H ЯМР (400 МГц, ДМСО-d6): 8,57 (1H, dd), 8,24 (1H, dd), 1,74 (6H, уширенный).
Пример получения 12: 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропиламин
Комплекс боран-тетрагидрофуран (1 М, 1,37 л, 1,365 моль) добавляли к охлажденному раствору 2-(5-хлор-3-фтор-пиридин-2-ил)-2-метил-пропионитрила (который может быть получен, как описано в Примере получения 11) (135,6 г, 0,683 моль) в тетрагидрофуране (670 мл). Смесь перемешивали в атмосфере азота при комнатной температуре в течение ночи, после чего охлаждали на льду. Смесь гасили добавлением 5 М соляной кислоты (335 мл). Полученную смесь подщелачивали 40%-м водным раствором гидроксида калия (460 мл), и фазы разделяли. Основную водную фазу экстрагировали этилацетатом (2×670 мл), и объединенные органические экстракты промывали солевым раствором (670 мл), высушивали (MgSO4) и концентрировали в вакууме при 40°C, получая целевое соединение (102,9 г, 74%) 1H ЯМР (400 МГц, ДМСО-D6): 8,44 (1H, t), 7,95 (1H, dd), 2,85 (2H, d), 1,29 (6H, d).
Пример получения 12, альтернативная процедура: 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропиламин
В 10 л фланцевую колбу добавляли 2-(5-хлор-3-фтор-пиридин-2-ил)-2-метил-пропионитрил (который может быть получен, как описано в Примере получения 11) (200 г, 1,00 моль), гексагидрат хлорида никеля (II) (239,4 г, 1,00 моль) и этанол (3,0 л). Полученный зеленый раствор охлаждали до 0°C с использованием ванны сухой лед/ацетон в атмосфере азота. Боргидрид натрия (114,3 г, 3,02 моль) добавляли частями с такой скоростью, чтобы температура реакции оставалась ниже 6°C (дополнительное время=1¾ ч), получая черную суспензию. Как только добавление было завершено, холодную ванну заменяли ванной лед/вода, затем реакционной смеси давали нагреться до комнатной температуры в течение ночи. Реакционную смесь охлаждали до 0-4°C в ванне со льдом. 25%-й водный раствор аммиака (2680 мл) добавляли из капельной воронки, таким образом, чтобы температура реакции оставалась ниже 10°C (дополнительное время=1 ч). Как только добавление было завершено, перемешивание продолжали при приблизительно 0°C в течение 30 минут, затем смесь фильтровали через целит, и остатки промывали этанолом (2×750 мл). (Внимание! Не позволяйте фильтру высыхать. Общее время фильтрации приблизительно 2 ч). Бледно-желтый/коричневый фильтрат переносили на большой ротационный испаритель и концентрировали, пока весь этанол не был удален. Полученное зеленое масло переносили в 5 л делительную воронку и добавляли 25% водный раствор аммиака, пока масло не стало желтым (200 мл). Масло отделяли, и водную фазу экстрагировали толуолом (2×300 мл). Объединенные органические экстракты промывали смесью 1:1 25% водный раствор аммиака/солевой раствор (300 мл), высушивали над сульфатом натрия, фильтровали и концентрировали на ротационном испарителе (температура ванны до 70°C) с получением сырого продукта в форме желтого масла (161 г), данные, соответствующие данным выше. Это масло использовали на следующей стадии без очистки.
Пример получения 13: 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Смесь 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропиламина (который может быть получен, как описано в Примере получения 12 и Примере получения 12, альтернативная процедура) (33 г, 0,163 моль), карбоната калия (122 г, 0,884 моль) и NMP (100 мл) нагревали до 150°C в течение 4 часов. Охлажденную смесь разбавляли водой (330 мл) и экстрагировали толуолом (3×300 мл), объединенные органические экстракты промывали солевым раствором (160 мл), высушивали (MgSO4) и концентрировали в вакууме при 40°C с получением сырого материала (24,8 г). Хроматография на силикагеле с элюированием 5-30% этилацетат/петролейный эфир дала целевое соединение (21 г, 71%) 1H ЯМР (400 МГц, ДМСО-D6): 7,61 (1H, d), 6,75 (1H, d), 6,06 (1H, s ушир.), 3,31 (2H, s), 1,21 (6H, s).
Пример получения 14: трет-бутиловый эфир 6-хлор-3,3-диметил-2,3-дигидропирроло[3,2-b]пиридин-1-карбоновой кислоты
Ди-трет-бутилдикарбонат (3,7 г, 17,1 ммоль) добавляли к смеси 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (который может быть получен, как описано в Примере получения 13) (2,6 г, 14,2 ммоль), тетрагидрофурана (26 мл) и 2М гидроксида натрия (11,4 мл, 22,8 ммоль) при перемешивании в течение 2 дней. Бифазную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические экстракты высушивали (MgSO4) и концентрировали в вакууме при 40°C с получением сырого материала (6,02 г). Хроматография на силикагеле с элюированием 5-30% этилацетат/петролейный эфир дала целевое соединение (2,23 г, 55%); 1H ЯМР (400 МГц, ДМСО-D6): 8,11 (1H, d), 7,85 (1H, s ушир.), 3,77 (2H, s), 1,52 (9H, s), 1,28 (6H, s).
Пример получения 15: 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Раствор хлорида 4-фторбензилцинка (2 л 0,5 М раствора в THF, 1 моль) добавляли к дегазированной смеси 6-хлор-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (который может быть получен, как описано в Примере получения 13) (91,3 г, 0,5 моль), бромида лития (130,3 г, 1,5 моль) и [1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден](3-хлорпиридил)палладий (II) дихлорида (6,8 г, 0,01 моль) в THF (685 мл) и NMP (910 мл) при 20°C с экзотермой. Полученную темную смесь перемешивали в атмосфере азота при комнатной температуре в течение 18 ч. Реакционную смесь гасили 2,5% водным раствором лимонной кислоты (900 мл) и экстрагировали толуолом (2×900 мл). Объединенные органические фазы промывали водой (3×900 мл), солевым раствором (900 мл), высушивали над MgSO4, фильтровали и концентрировали в вакууме. Полученное твердое вещество суспендировали в петролейном эфире (450 мл) и толуоле (100 мл). После перемешивания в течение 30 минут твердые вещества отфильтровывали, осадок после фильтрации промывали петролейный эфиром (2×90 мл). Осадок после фильтрации высушивали в вакууме при 40 °C, получая целевое соединение (107,3 г) в форме твердого вещества серого цвета. 1H ЯМР (ДМСО-D6): 7,60 (1H, d), 7,30-7,22 (2H, m), 7,15-7,06 (2H, m), 6,53 (1H, d), 5,64 (1H, s), 3,78 (2H, s), 3,22 (2H, d), 1,19 (6H, s).
Следующие соединения были получены подобо описанному в Примере получения 15:
15 А: трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-карбоксилат, MS: [M+H]+=357.
15B: 6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=257.
15C: 6-бутил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=205.
15D: 6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=257.
15E: 6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Пример получения 16: 5-Бром-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Раствор 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (который может быть получен, как описано в Примере получения 15) (88,5 г, 0,345 моль) в DMF (1,67 л) охлаждали до -5°C. Твердый N-бромсукцинимид (61,5 г, 0,345 моль) добавляли частями с экзотермой. Смесь перемешивали в течение 1 ч, нагревая до комнатной температуры. Воду (2,66 л) добавляли с экзотермой, и полученную смесь перемешивали в течение 18 ч при комнатной температуре, твердые вещества отфильтровывали, и осадок после фильтрации промывали водой (270 мл). Осадок после фильтрации растворяли в THF (1,5 л), сушили над MgSO4, фильтровали и концентрировали в вакууме, получая целевое соединение (109,7 г) в форме твердого вещества желтого цвета. 1H ЯМР (ДМСО-D6): 7,29-7,20 (2H, m), 7,20-7,03 (2H, m), 6,64 (1H, s), 5,88 (1H, s), 3,89 (2H, s), 3,26 (2H, d), 1,20 (6H, s).
Следующие соединения были получены подобно Примеру получения 16:
16 А: 5-Бром-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=335, 337.
16B: 5-Бром-6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=335, 337.
16C: 5-Бром-6-Бутил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин, MS: [M+H]+=283, 285.
16D: 5-Бром-6-(2,4-дифторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин
Пример получения 17: [6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанол
К 5-бром-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридину (который может быть получен, как описано в Примере получения 16) (22,8 г, 68,2 ммоль) в THF (300 мл), охлажденному до -78°C, добавляли MeLi (1,6 М в Et2O; 51,1 мл, 91,8 ммоль) за 15 минут. Трет-бутиллитий (1,7 М в гексане; 96 мл, 164 ммоль) добавляли за 30 минут. Через 15 минут добавляли DMF (26 мл), и смесь перемешивали при -78°C в течение еще 50 минут. Добавляли насыщенный водный раствор NH4Cl (450 мл), и смесь перемешивали в течение 10 минут при комнатной температуре. Органический слой отделяли, и водный слой экстрагировали EtOAc (2×150 мл). Объединенные органические фракции промывали солевым раствором (200 мл), высушивали (MgSO4) и упаривали с получением 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-карбальдегида в форме твердого вещества желтого цвета, которое использовали без дальнейшей очистки. MS: m/z=285 (M+H+)+. Этот продукт (~ 68 ммоль) суспендировали в MeOH (250 мл) и охлаждали в ванне со льдом. NaBH4 (3,4 г, 81,8 ммоль) добавляли частями за 5 минут. Охлаждение удаляли, и смесь перемешивали в течение еще 20 минут. Смесь охлаждали в ванне со льдом, с последующим осторожным добавлением 10%-го водного раствора KHSO4 за 10 минут (осторожно: вспенивание). После перемешивания в течение 5 минут при комнатной температуре, смесь повторно охлаждали с помощью ванны со льдом. Смесь подщелачивали добавлением 50%-го водного NaOH (~ 18 мл) и затем концентрировали в вакууме до объема ~ одной трети. Полученную водную смесь экстрагировали CH2Cl2 (1×200 мл, 2×100 мл), и объединенные слои CH2Cl2 высушивали (MgSO4). Раствор CH2Cl2 концентрировали в вакууме до ~ 30 мл и затем разбавляли толуолом (70 мл) для инициирования кристаллизации продукта. Сбор с помощью фильтрации дал продукт в форме бесцветного кристаллического твердого вещества (10,6 г). Второй выход (2,1 г) был собран из фильтрата. Фильтрат концентрировали, и оставшийся материал очищали хроматографией SiO2 (элюируя смесью 25-50% EtOAc/гексаны) с получением третьей партии материала (2,1 г); что дает целевое соединение с общим выходом 14,8 г (76% за 2 стадии), MS: [M+H]+=287.
Альтернативная процедура включает последующую перекристаллизацию из изопропилового спирта.
Следующее соединение было получено подобно Примеру получения 17:
(6-бутил-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил)-метанол, MS: [M+H]+=235.
Пример получения 18: 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он
К охлажденной (~ 5 °C) суспензии [6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанола (который может быть получен, как описано в Примере получения 17) (11,8 г, 41,3 ммоль) в MeCN (175 мл) добавляли хлорацетил хлорид (6,9 мл, 86,7 ммоль). Охлаждение удаляли, и смесь перемешивали в течение 30 минут при комнатной температуре. Смесь затем упаривали в вакууме и растворяли в MeOH (200 мл). Добавляли раствор K2CO3 (12 г в H2O на 100 мл), и смесь перемешивали при комнатной температуре в течение 20 минут, после чего смесь концентрировали в вакууме до объема ~ одной четверти. Водную смесь экстрагировали CH2Cl2 (1×100 мл, 2×30 мл), и объединенные слои CH2Cl2 высушивали (MgSO4). Упаривание в вакууме дало продукт в форме бесцветного кристаллического твердого вещества (12,1 г, ~ 100%), MS: [M+H]+=363.
Следующие соединения были получены согласно способу, аналогичному или подобному таковому из Примера получения 18:
18А: 1-(2-Хлорацетил)-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=349.
18B: 2-Хлор-1-{6-[(2-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, MS: [M+H]+=363.
18C: 1-(2-Хлорацетил)-6-[(4-фторфенил)метил]-3,3,4-триметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=363.
18D: 1-(2-Хлорацетил)-6-[(2,4-фторфенил)метил]-3,3-диметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=367.
18E: 1-(2-Хлорацетил)-6-[(2-фторфенил)метил]-3,3,4-триметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=363.
18F: 2-Хлор-1-{6-[(2,4-дифторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, MS: [M+H]+ =381.
18G: 2-Хлор-1-[5-6-(1,2-дигидроксиэтил) [(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]этан-1-он, MS: [M+H]+=393.
18-й: 2-Хлор-1-{6-[(3-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, MS: [M+H]+=363.
18I: 1-(2-Хлор-ацетил)-6-(4-фторбензил)-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он, MS: [M+H]+=349.
18 Дж: 1-(2-Хлор-ацетил)-6-(2,4-дифтор-бензил)-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он, MS: [M+H]+=367.
18K: 2-Хлор-1-[5-((R или S)-1,2-дигидроксиэтил)-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]этан-1-он, от более медленно элюирующего предшественника. MS: [M+H]+=393.
18L: 1-(2-Хлорацетил)-6-[(2,4-фторфенил)метил]-3,3,4-триметил-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=381.
18M: 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(R или S)-1-гидрокси-2-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, от более быстро элюирующего предшественника, MS: [M+H]+=407.
18 Н: 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(R или S)-1-метокси-2-гидроксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, от более быстро элюирующего предшественника, MS: [M+H]+=407.
18O: 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(R или S)-1-гидрокси-2-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, от более медленно элюирующего предшественника, MS: [M+H]+=407.
18P: 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(R или S)-1-метокси-2-гидроксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он, от более медленно элюирующего предшественника, MS: [M+H]+=407.
18Q: 1-(2-Хлор-ацетил)-6-(2,4-дифтор-бензил)-3,3,4-триметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он, MS: [M+H]+=381.
18R: 6-бутил-1-(2-хлор-ацетил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=297.
18: 1-[6-бутил-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-хлорэтан-1-он, MS: [M+H]+=311.
18T: 6-бутил-1-(2-хлор-ацетил)-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он, MS: [M+H]+=297.
Пример получения 19: трет-бутил(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат
Трет-бутиловый эфир (2R,5S)-2-Метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 8) (15,5 г, 46,4 ммоль), KI (12,8 г, 77,4 ммоль) и K2CO3 (21,4 г, 155 ммоль) перемешивали в MeCN (70 мл) и охлаждали в ванне со льдом. 2-Хлор-1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}этан-1-он (который может быть получен, как описано в Примере получения 18) (14,0 г, 38,7 ммоль) затем добавляли как раствор в MeCN (100 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали в вакууме до объема ~ одной четверти. Смесь разделяли между EtOAc (150 мл) и H2O (150 мл), и затем водный слой экстрагировали дополнительным количеством EtOAc (1×75 мл). Объединенные слои EtOAc промывали 10%-м водным раствором KH2PO4 (4×100 мл) и затем солевым раствором (70 мл). Органический слой высушивали (MgSO4) и упаривали с получением продукта в форме бесцветного твердого вещества (25,8 г, 98%), MS: [M+H]+=640.
Следующие соединения были получены согласно способу, аналогичному таковому из Примера получения 19:
трет-бутил(2R,5S)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=654.
трет-бутил(2R,5S)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил(2R,5S)-4-(2-{6-[(2-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=626.
трет-бутил(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=658.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=644.
трет-бутил(2R,5S)-4-(2-{6-[(2-фторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил(2R,5S)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=654.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, 1H ЯМР (400 МГц, Me-d3-OD): 8,12 (1H, s), 7,27-7,16 (1H, m), 7,06-6,86 (2H, m), 4,76 (2H, s), 4,17 (1H, s), 4,10-4,07 (2H, m), 3,99 (1H, d), 3,74-3,49 (5H, m), 3,30-3,22 (2H, m), 2,97-2,77 (4H, m), 2,59-2,43 (2H, m), 2,43-2,32 (1H, m), 2,32-2,21 (1H, m), 1,47 (9H, s), 1,43 (6H, s), 1,22 (3H, d), 1,00 (3H, d).
трет-бутил(2R,5S)-4-{2-[5-6-(1,2-дигидроксиэтил)[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат MS: [M+H]+=670; хиральная ВЭЖХ (гептан/этанол, 80:20, 0,2% DEA, колонка chiralPAk-IC) дала более быстро элюирующий диастереоизомер A, MS: [M+H]+=670 и более медленно элюирующий диастереоизомер B, MS: [M+H]+=670.
трет-бутил(2R,5S)-4-(2-{6-[(3-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил(2R,5S)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=640.
трет-бутил (2R,5S)-4-(2-{6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=626.
трет-бутил(2R,5S)-5-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=654.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=658.
трет-бутил(2R,5S)-4-{2-[5-((R или S)-1,2-дигидроксиэтил)-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=684.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-5-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=658.
трет-бутил(2R,5S)-4-(2-{4-амино-6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}- 2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=659.
трет-бутил(2R,5S)-4-(2-{4-амино-6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=641.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=672.
трет-бутил(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-((R или S)-1-гидрокси-2-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат (из более быстро элюирующего изомера), MS: [M+H]+=684.
трет-бутил (2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-((R или S)-1-гидрокси-2-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат (из более медленно элюирующего изомера), MS: [M+H]+=684.
трет-бутил (2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-((R или S)-1-метокси-2-гидроксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат (из более быстро элюирующего изомера), MS: [M+H]+=684.
трет-бутил(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-((R или S)-1-метокси-2-гидроксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат (из более медленно элюирующего изомера), MS: [M+H]+=684.
трет-бутил(2R,5S)-4-(2-{4-амино-6-бутил-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=603.
трет-бутил(2R,5S)-4-(2-{6-[(2,4-дифторфенил)метил]-3,3,4-триметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилат, MS: [M+H]+=658.
трет-бутил(2R,5S)-4-(2-{6-бутил-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=588.
трет-бутил(2R,5S)-4-(2-{6-бутил-3,3,4-триметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=602.
трет-бутил(2R,5S)-4-{2-[6-бутил-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил]-2-оксоэтил}-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=602.
трет-бутил(2R,5S)-4-(2-{6-бутил-3,3-диметил-5-оксо-1H,2H,3H,5H,6H-пирроло[2,3-c]пиридин-1-ил}-2-оксоэтил)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=588.
трет-бутил(2R,5S)-5-{[(3R,5R)-3,5-диметилморфолин-4-ил]метил}-4-(2-{6-[(4-фторфенил)метил]-5-((R или S)-2-гидрокси-1-метоксиэтил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}- 2-оксоэтил)-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=698.
трет-бутил(2R,5S)-4-(2-{6-бутил-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-5-{[(2S,5R)-2,5-диметилморфолин-4-ил]метил}-2-метилпиперазин-1-карбоксилат, MS: [M+H]+=588.
Пример получения 20: трет-бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифтор-бензил)-3,3,4-триметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-ил]-2-оксо-этил}-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифтор-бензил)-3,3-диметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-ил]-2-оксо-этил}-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты (146 мг, 0,22 ммоль) растворяли в DMF (3 мл). Добавляли гидрид натрия (60%, 11 мг, 0,27 ммоль), и реакционную смесь перемешивали в течение 30 минут. Добавляли йодметан (0,017 мл, 0,27 ммоль), и реакционную смесь перемешивали в течение 30 минут при комнатной температуре, после чего разделяли между водой (10 мл) и EtOAc (2×10 мл). Органические фракции промывали солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией, элюируя 0-10% MeOH в EtOAc и затем препаративной ВЭЖХ, получая целевое соединение (17,6 мг). MS: [M+H]+=672.
Пример получения 21: трет-бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифтор-бензил)-3,3,4-триметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-ил]-2-оксо-этил}-2-метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир (2R,5S)-4-{2-[6-(2,4-дифтор-бензил)-3,3-диметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-ил]-2-оксо-этил}-2-метил-5-(R)-3-метил-морфолин-4-илметил)-пиперазин-1-карбоновой кислоты (670 мг, 1,04 ммоль) растворяли в THF (20 мл). Добавляли трет-бутоксид лития (170 мг, 2,08 ммоль), затем йодметан (0,16 мл, 2,60 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, после чего разделяли между водой (30 мл) и EtOAc (2×30 мл). Органические фракции промывали солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией, элюируя 0-10% MeOH в DCM, получая целевое соединение (350 мг). MS: [M+H]+=658.
Следующее соединение получали аналогично Примеру получения 21:
21А: трет-бутиловый эфир (2R,5S)-4-[2-(6-бутил-3,3,4-триметил-5-оксо-2,3,4,5-тетрагидропирроло[3,2-b]пиридин-1-ил)-2-оксо-этил]-5-((3R,5R)-3,5-диметил-морфолин-4-илметил)-2-метил-пиперазин-1-карбоновой кислоты, MS: [M+H]+=602.
Пример получения 22: трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-4-окси-1H,2H,3H-пирроло[3,2-b]пиридин-1-карбоксилат
К перемешиваемому раствору трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-карбоксилата (который может быть получен, как описано в Примере получения 15А) (3,88 г, 10,9 ммоль) в DCM (30 мл) при температуре среды добавляли частями за 0,1 ч 3-хлорпербензойную кислоту (77%, 2,7 г, 12,0 ммоль). Смесь перемешивали в течение 3 ч, затем разделяли между насыщенным водным раствором NaHCO3 (150 мл) и DCM (3×30 мл). Объединенные органические экстракты высушивали (Na2SO4) и упаривали в вакууме. Остаток кристаллизовали из смеси простой эфир - петролейный эфир, получая целевое соединение (2,62 г). 1H ЯМР (400 МГц, Me-d3-OD): 7,74 (1H, s), 7,35-7,24 (2H, m), 7,13-7,02 (2H, m), 3,96 (2H, s), 3,79 (2H, s), 1,57 (6H, s), 1,53 (9H, s).
Пример получения 23: трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-карбоксилат
Смесь трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-4-окси-1H,2H,3H-пирроло[3,2-b]пиридин-1-карбоксилата (который может быть получен, как описано в Примере получения 22) (0,6 г, 1,6 ммоль) и уксусного ангидрида (4 мл) нагревали при 105°C в течение 2 ч, затем при 140°C в течение 3 ч, затем охлаждали, конечный раствор вливали в воду со льдом (~100 г). Полученное бесцветное твердое вещество собирали фильтрацией, затем суспендировали в метаноле (15 мл). Добавляли водный раствор NaOH (1 М, 1,8 мл), и смесь перемешивали в течение 0,25 ч. Раствор концентрировали до 12 мл в вакууме, затем разбавляли водой (20 мл), и полученное твердое вещество собирали фильтрацией, получая целевое соединение (0,6 г). MS: [M+H]+=373.
Следующее соединение получали подобно Примеру получения 23:
23А: трет-бутил-6-[(2-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-карбоксилат
Пример получения 24: 6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин
Смесь трет-бутил-6-[(4-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-карбоксилата (который может быть получен, как описано в Примере получения 23) (0,6 г, 1,6 ммоль), метанола (20 мл) и 5М водного раствора HCl (20 мл) нагревали с обратным холодильником в течение 16 ч, охлаждали, затем обрабатывали водой. Полученное твердое вещество собирали фильтрацией, получая целевое соединение (0,255 г). MS: [M+H]+=273.
Пример получения 25: 1-[5-Бром-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
К раствору 5-бром-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (который может быть получен, как описано в Примере получения 16А) (4,5 г, 13,43 ммоль) в толуоле (50 мл) добавляли ацетилхлорид (1,05 мл, 14,78 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный раствор NaHCO3 (50 мл), и продукт экстрагировали EtOAc (2x40 мл). Органическую фазу промывали солевым раствором, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (4,99 г). MS: [M+H]+=377.
Следующее соединение получали подобно описанному в Примере получения 25:
25А: 1-[5-Бром-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон, MS: [M+H]+=377.
Пример получения 26: 1-[6-(3-фторбензил)-3,3,5-триметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
К дегазированному раствору 1-[5-бром-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанона (который может быть получен, как описано в Примере получения 25) (4,9 г, 13,0 ммоль), LiBr (3,35 г, 39,0 ммоль) и [1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден](3-хлорпиридил)палладия (II) добавляли дихлорид (180 мг, 0,26 ммоль) в THF (30 мл) и NMP (30 мл), хлорид метилцинка (2M в THF, 10 мл, 20 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду (20 мл) и 5%-й водный раствор лимонной кислоты (3 мл), и продукт экстрагировали толуолом - EtOAc (1:1, 2x40 мл). Органическую фазу промывали солевым раствором, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (4,05 г). MS: [M+H]+=313.
Пример получения 27: 1-[6-(3-фторбензил)-3,3,5-триметил-4-окси-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
К раствору 1-[6-(3-фторбензил)-3,3,5-триметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанона (который может быть получен, как описано в Примере получения 26) (4,05 г, 13,0 ммоль) в DCM (50 мл) добавляли м-хлор-пербензойную кислоту (77%, 4,4 г, 19,5 ммоль) в небольших частях, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли Na2S2O3 (10%, 50 мл) и перемешивали в течение 30 минут. Продукт экстрагировали DCM (3x40 мл), объединенные органические слои промывали 1M NaOH, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (4,22 г). MS: [M+H]+=329.
Пример получения 28: 1-ацетил-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-илметиловый эфир уксусной кислоты
Раствор 1-[6-(3-фторбензил)-3,3,5-триметил-4-окси-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанона (который может быть получен, как описано в Примере получения 27) (4,22 г, 12,86 ммоль) в уксусном ангидриде (25 мл) нагревали при 110°C в течение 2 ч. Реакционную смесь охлаждали, выливали на лед и перемешивали в течение 2 ч. Смесь нейтрализовали Na2CO3, и продукт экстрагировали DCM (3x30 мл). Органическую фазу высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя смесью петролейный эфир - EtOAc 0-50%, получая целевое соединение (3,49 г). MS: [M+H]+=371.
Пример получения 29: [6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанол
Раствор 1-ацетил-6-(3-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-илметилового эфира уксусной кислоты (который может быть получен, как описано в Примере получения 28) (3,49 г, 9,43 ммоль) и NaOH (6,0 г, 150 ммоль) в EtOH (60 мл) и воде (60 мл) нагревали с обратным холодильником в течение ночи. EtOH выпаривали, pH доводили до pH=8 с использованием 5M HCl, и продукт экстрагировали DCM (3x30 мл). Органическую фазу высушивали, фильтровали и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя смесью петролейный эфир - EtOAc 0-100%, получая целевое соединение (2,04 г). MS: [M+H]+=287.
Следующие соединения были получены с помощью последовательности, подобной описанной в Примерах получения 25-29, включительно:
[6-(2-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанол, [M+H]+=287.
[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанол, [M+H]+=287.
[6-(2,4-дифтор-бензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-метанол, 1H ЯМР (400 МГц, Me-d3-OD): 7,22-7,12 (1H, m), 7,00-6,82 (2H, m), 6,67-6,59 (1H, m), 4,72-4,61 (2H, m), 4,04 (2H, s), 1,34 (6H, s).
Пример получения 30: 1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
К раствору 6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридина (который может быть получен, как описано в Примере получения 15) (10,1 г, 39 ммоль) в MeCN (130 мл) при ~ 10 °C добавляли ацетилхлорид (3,6 мл, 51 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и затем упаривали в вакууме. Остаток разделяли между CH2Cl2 и 1н. водным раствором NaOH. Слой CH2Cl2 высушивали (MgSO4) и упаривали, получая целевое соединение (12,3 г) в форме кристаллического твердого вещества. MS: m/z=299 (M+H +) +.
Пример получения 31: 1-[6-(4-фторбензил)-3,3-диметил-4-окси-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (который может быть получен, как описано в Примере получения 30) (12,2 г, 41 ммоль) и mCPBA (77%, 12 г, ~ 53 ммоль) растворяли в CH2Cl2 (150 мл) и перемешивали в течение 3 часов. Затем добавляли 20%-й водный раствор Na2S2O3, и смесь перемешивали в течение 25 минут. Водный слой экстрагировали другой партией CH2Cl2, и затем объединенные слои CH2Cl2 промывали 2×1н. водным раствором NaOH. Органический слой высушивали (MgSO4) и упаривали в вакууме, получая целевое соединение (12 г) в форме кристаллического твердого вещества желтого цвета. MS: m/z=315 (M+H +) +.
Пример получения 32: 1-ацетил-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-иловый эфир уксусной кислоты
1-[6-(4-фторбензил)-3,3-диметил-4-окси-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (который может быть получен, как описано в Примере получения 31) (11,55 г, 37 ммоль) нагревали в Ac2O (70 мл) в течение 5 часов. Смесь затем охлаждали и вливали в смесь лед/вода (500 г). Смесь перемешивали в течение 1 часа, и полученный осадок собирали фильтрацией, получая целевое соединение (12. 1 г, 92%) в форме твердого вещества серого цвета. MS: m/z=357 (M+H +) +.
Пример получения 33: 1-Ацетил-6-(4-фторбензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он
1-ацетил-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-иловый эфир уксусной кислоты (который может быть получен, как описано в Примере получения 32) (6 г, 19 ммоль) суспендировали в EtOH (60 мл) и обрабатывали 2н. водным раствором NaOH (42 мл). Смесь перемешивали в течение ночи и затем подкисляли 5н. водным раствором HCl. Продукт экстрагировали CH2Cl2, и органический слой высушивали (MgSO4). Очистка хроматографией SiO2 (с элюированием смесью 50-100% EtOAc/гексаны) дала твердое вещество желтого цвета. Это твердое вещество растирали с толуолом, и твердое вещество собирали, получая целевое соединение (2,4 г, 44%). MS: m/z=315 (M+H +)+.
Следующие соединения были получены подобно описанному в Примерах получения 30-33:
1-Ацетил-6-(2,4-дифтор-бензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=333.
1-Ацетил-6-бутил-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=263.
Пример получения 34: 1-Ацетил-6-(4-фторбензил)-3,3,4-триметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он
К смеси 1-ацетил-6-(4-фторбензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-она (который может быть получен, как описано в Примере получения 33) (3,1 г, 9,9 ммоль) и K2CO3 (2,7 г, 20 ммоль) в DMF (30 мл) при ~ 0°C добавляли йодметан (0,74 мл, 11,9 ммоль). Смесь перемешивали при комнатной температуре в течение 5 ч, после чего смесь разделяли между EtOAc и водой. Слой EtOAc промывали солевым раствором и высушивали (MgSO4). Очистка хроматографией SiO2 (с элюированием смесью 0-10% MeOH/EtOAc) дала целевое соединение (960 мг, 29%) в форме бесцветного кристаллического твердого вещества. MS: [M+H]+=329.
Пример получения 35: 6-(4-фторбензил)-3,3,4-триметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он
1-Ацетил-6-(4-фторбензил)-3,3,4-триметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он (который может быть получен, как описано в Примере получения 34) (960 мг, 2,9 ммоль) растворяли в смеси EtOH (10 мл) и 5н. водного раствора HCl (10 мл) и нагревали при 95°C в течение 1 часа в атмосфере N2. Смесь затем охлаждали и концентрировали в вакууме. Добавляли лед и конц. водный раствор NH3, и полученную водную смесь экстрагировали CH2Cl2. Раствор CH2Cl2 высушивали (MgSO4) и упаривали, получая целевое соединение, которое немедленно использовали. MS: [M+H]+=287.
Следующее соединение получали подобно описанному в Примерах получения 30-35:
6-(2,4-дифтор-бензил)-3,3,4-триметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=269.
Следующие соединения были получены подобно описанному в Примере получения 35:
6-(4-фторбензил)-3,3,-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=273.
6-бутил-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=221.
6-[(2,4-дифторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин, MS: [M+H]+=291.
Пример получения 36: трет-бутиловый эфир 6-(2-фторбензил)-3,3,4-триметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-карбоновой кислоты
Получен из трет-бутил-6-[(2-фторфенил)метил]-3,3-диметил-5-оксо-1H,2H,3H,4H,5H-пирроло[3,2-b]пиридин-1-карбоксилата с использованием способа, подобного описанному в Примере получения 34. MS: [M+H]+=387.
Пример получения 37: 6-(2-фторбензил)-3,3,4-триметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он
Получен из трет-бутилового эфира 6-(2-фторбензил)-3,3,4-триметил-5-оксо-2,3,4,5-тетрагидро-пирроло[3,2-b]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 36) с использованием способа, подобного описанному в Примере получения 24. MS: [M+H]+=287.
Пример получения 38: 1-[6-(4-фторбензил)-3,3-диметил-5-винил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
1-[5-Бром-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (который может быть получен, как описано в Примере получения 25 А) (7,64 г, 20,27 ммоль), трибутилвинилолово (6,22 мл, 21,28 ммоль) и бис(три-трет-бутилфосфин)палладий (0) (0,104 г, 0,20 ммоль) растворяли в толуоле (39 мл). После дегазации азотом, реакционную смесь нагревали до 85°C в течение 2 ч. Реакционную смесь концентрировали в вакууме, и сырой продукт очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, этилацетат/петролейный эфир 40-60 °C), получая целевое соединение (3,64 г). MS: [M+H]+=325.
Пример получения 39: (RS)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон
К 1-[6-(4-фторбензил)-3,3-диметил-5-винил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанону (который может быть получен, как описано в Примере получения 38) (3,64 г, 11,23 ммоль) в ацетоне (76 мл) и воде (8,5 мл) добавляли водный раствор гидроксида натрия (2,5 М, 13,48 мл, 11,23 ммоль), и реакционную смесь охлаждали (ванна со льдом) до 0 °C. Перманганат калия (1,78 г, 11,23 молекулярных масс) добавляли к реакционной смеси и перемешивали в течение 1 ч. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 20 ч. Добавляли дополнительный перманганат калия (1,77 г, 33,7 ммоль), и через 1 ч реакционную смесь фильтровали через целит, промывали ацетоном и водой. Фильтрат концентрировали с получением водной смеси, которую экстрагировали этилацетатом (3x). Объединенные органические фракции высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Сырой продукт очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, этилацетат/петролейный эфир 40-60 °C), получая целевое соединение (1,5 г). MS: [M+H]+=359.
Хиральная очистка
(RS)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (который может быть получен, как описано в Примере получения 39) (1,5 г) очищали хиральной препаративной ВЭЖХ (ChiralPAK AD-H, гептан/этанол), получая 39А (R или S)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (быстро выходящий изомер) (0,5 г) и 39B (R или S)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (медленнее выходящий изомер) (0,6 г).
Пример получения 40: (RS)-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-этан-1,2-диол
(RS)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (который может быть получен, как описано в Примере получения 39) (0,250 мг, 0,70 ммоль) растворяли в этаноле (4,37 мл) и воде (4,37 мл). Добавляли гидроксид натрия (0,447 г, 11,2 ммоль), и реакционную смесь нагревали с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры реакционную смесь концентрировали. Добавляли воду, и водный слой экстрагировали этилацетатом (3x). Объединенные органические экстракты высушивали над сульфатом натрия, фильтровали и концентрировали, получая целевое соединение, (171 мг). MS: [M+H]+=317.
Следующие соединения были получены подобно описанному в Примере получения 40:
40А: (R или S)-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-этан-1,2-диол, из более медленно элюирующего изомера 39B. MS: [M+H]+=317.
40B: (R или S)-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-метоксиэтанол, из более быстро элюирующего предшественника, MS: [M+H]+=331.
40C: (R или S)-1-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-метоксиэтанол, из более медленно элюирующего предшественника, MS: [M+H]+=331.
40D: (R или S)-2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-метоксиэтанол из более быстро элюирующего предшественника, MS: [M+H]+=331.
40E: (R или S)-2-[6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-метоксиэтанол из более медленно элюирующего предшественника, MS: [M+H]+=331.
Пример получения 41: 2-[1-ацетил-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-гидроксиэтиловый эфир (RS)-метансульфоновой кислоты
К (RS)-1-[5-(1,2-дигидроксиэтил)-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанону (который может быть получен, как описано в Примере получения 39) (1,48 г, 4,13 моль) в дихлорметане (20,7 мл), охлажденному до 0 °C, добавляли триэтиламин (0,502 г, 4,96 ммоль) и метан сульфонил хлорид (0,34 мл, 4,34 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь выливали в воду и экстрагировали DCM (3x). Объединенные органические экстракты высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Сырой продукт очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, этилацетат/петролейный эфир 40-60 oC), получая целевое соединение (1,25 г) MS: [M+H]+=437.
Пример получения 42: 1-[6-(4-фторбензил)-5-(1-гидрокси-2-метоксиэтил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (42 А) и 1-[6-(4-фторбензил)-5-(2-гидрокси-1-метоксиэтил)-3,3-диметил-2,3-дигидро-пирроло[3,2-b]пиридин-1-ил]-этанон (42B)
К 2-[1-ацетил-6-(4-фторбензил)-3,3-диметил-2,3-дигидро-1H-пирроло[3,2-b]пиридин-5-ил]-2-гидроксиэтиловому эфиру (RS)-метансульфоновой кислоты (который может быть получен, как описано в Примере получения 41) (1,24 г, 2,84 ммоль) в метаноле (9,48 мл) добавляли метоксид натрия (25%) в метаноле (1,23 мл, 5,69 ммоль). После перемешивания в течение 6 ч добавляли дополнительный метоксид натрия (25%) в метаноле (1,23 мл). Смесь перемешивали в течение 18 ч, затем добавляли метоксид натрия (25%) в метаноле (1,23 мл). После перемешивания в течение еще 22 ч добавляли воду, и реакционную смесь экстрагировали этилацетатом (3x). Объединенные органические экстракты концентрировали в вакууме, и сырой продукт очищали колоночной хроматографией на силикагеле (градиентное элюирование, 0-100%, этилацетат/петролейный эфир 40-60°C), с получением, отдельно, двух целевых соединений в форме рацемических смесей. Хиральное разделение ВЭЖХ осуществляли следующим образом:
42А: колонка ADH, 80/20 гептан этанол, 0,2% DEA дало более быстро элюирующий 42A1 и более медленно элюирующийся 42A2
42B: колонка LUX 2, 80/20 гептан этанол, 0,2% DEA дало более быстро элюирующийся 42B1 [1H ЯМР (400 МГц, Me-d3-OD): 8,18 (1H, s), 7,19 (2H, dd), 7,03 (2H, t), 4,66 (1H, dd), 4,21-4,05 (2H, m), 4,05-3,82 (3H, m), 3,63 (1H, dd), 3,13 (3H, s), 2,24 (3H, s), 1,42 (6H, s)] и более медленное элюирующий 42B2
Пример получения 43: трет-бутиловый эфир (6-метокси-4-метилпиридин-3-ил)-карбаминовой кислоты
К раствору 5-амино-2-метокси-4-пиколина (5,0 г, 36,2 ммоль) в THF (80 мл) и насыщенном водном растворе Na2CO3 (20 мл) добавляли ди-трет-бутил бикарбонат (7,9 г, 36,2 ммоль), и реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали, экстрагировали DCM, промывали солевым раствором, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (8,8 г). MS: [M+H]+=239.
Пример получения 44: (5-трет-бутоксикарбониламино-2-метокси-пиридин-4-ил)-уксусная кислота
К раствору трет-бутилового эфира (6-метокси-4-метилпиридин-3-ил)-карбаминовой кислоты (который может быть получен, как описано в Примере получения 43) (2,8 г, 11,9 ммоль) в THF (100 мл) при -78°C добавляли втор-бутиллитий (1,4 М в циклогексане, 28 мл, 39,3 ммоль). Реакционную смесь перемешивали в течение 10 минут, затем газообразный CO2 барботировали в нее через канюлю в течение 1 ч. Реакционную смесь оставляли нагреваться до комнатной температуры, гасили 2н. HCl. рH доводили до pH=4 с использованием 1н. NaOH, и продукт экстрагировали EtOAc. Органический слой промывали солевым раствором, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (4,4 г). MS: [M+H]+=283.
Пример получения 45: трет-бутиловый эфир 5-метокси-2-оксо-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь (5-трет-бутоксикарбониламино-2-метокси-пиридин-4-ил)-уксусной кислоты (которая может быть получена, как описано в Примере получения 44) (3,4 г, 11,9 ммоль), диизопропилэтил амина (4,6 мл, 26,18 ммоль), EDC (2,5 г, 13,09 ммоль) и HOAt (1,78 г, 13,09 ммоль) в DCM (50 мл) перемешивали в течение 3 ч. Реакционную смесь промывали насыщенным NaHCO3, водой, солевым раствором, затем высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя 0-50% петролейный эфир - EtOAc, получая целевое соединение (2,2 г). MS: [M+H]+=265.
Пример получения 46: трет-бутиловый эфир 5-метокси-3,3-диметил-2-оксо-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 5-метокси-2-оксо-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 45) (1,94 г, 7,35 ммоль), K2CO3 (2,33 г, 18,57 ммоль) и йодметана (1,14 мл, 18,57 ммоль) в ацетоне (25 мл) нагревали с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали, растворитель выпаривали, остаток разделяли между водой и DCM. Органическую фазу высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя 0-20% петролейный эфир - EtOAc, получая целевое соединение (1,47 г). MS: [M+H]+=293.
Пример получения 47: трет-бутиловый эфир 6-(4-фторбензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 5-метокси-3,3-диметил-2-оксо-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 46) (1,43 г, 4,9 ммоль), NaI (1,47 г, 9,8 ммоль) и 4-фторбензил бромида (0,67 мл, 5,4 ммоль) в ацетонитриле (50 мл) нагревали с обратным холодильником в течение 5 ч, перемешивали при комнатной температуре в течение ночи и снова нагревали с обратным холодильником в течение еще 6 ч. Реакционную смесь охлаждали, вливали в 10%-й водный раствор Na2S2O3, экстрагировали DCM, органическую фазу высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя 0-100% петролейный эфир - EtOAc, получая целевое соединение (910 мг). MS: [M+H]+=387.
Следующее соединение получали, осуществляя процедуру, аналогичную описанной в Примере получения 47:
47А: трет-бутиловый эфир 6-(2,4-дифтор-бензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты, MS: [M+H]+=405.
Пример получения 48: 6-(4-фторбензил)-3,3-диметил-1,6-дигидро-3H-пирроло[2,3-c]пиридин-2,5-дион
Раствор трет-бутилового эфира 6-(4-фторбензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 47) (910 мг, 2,36 ммоль) в TFA (5 мл) и DCM (5 мл) перемешивали в течение 1 ч. Растворитель выпаривали, остаток разделяли между DCM и насыщенным раствором NaHCO3, органическую фазу высушивали, растворитель выпаривали, получая целевое соединение (0,67 г). MS: [M+H]+=287.
Пример получения 49: 6-(4-фторбензил)-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он
К раствору 6-(4-фторбензил)-3,3-диметил-1,6-дигидро-3H-пирроло[2,3-c]пиридин-2,5-диона (который может быть получен, как описано в Примере получения 48) (526 мг, 1,84 ммоль) в THF (30 мл) добавляли раствор BH3.Me2S (2M, 9,7 мл, 18,4 ммоль), и смесь нагревали с обратным холодильником в течение 3 ч. Охлажденный, MeOH (10 мл) добавляли тщательно и нагревали с обратным холодильником в течение 2 ч. Растворитель выпаривали, остаток разделяли между DCM и насыщенным раствором NaHCO3. Органическую фазу высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (494 мг). Использовали без очистки. MS: [M+H]+=273.
Следующее соединение получали, осуществляя процедуру, аналогичную описанной в Примере получения 49:
49А: 6-(2,4-дифтор-бензил)-3,3,4-триметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он,
MS: [M+H]+=305.
Следующее соединение получали, осуществляя процедуру, аналогичную описанной в Примерах получения 47-49, включительно:
49B: 6-(2,4-дифтор-бензил)-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он, MS: [M+H]+=291.
Пример получения 50: 4-амино-1-(2-хлор-ацетил)-6-(2,4-дифтор-бензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он
К раствору 1-(2-хлор-ацетил)-6-(2,4-дифтор-бензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-она (который может быть получен, как описано в Примере получения 18D) (117 мг, 0,32 ммоль) в DMF (2 мл) добавляли карбонат калия (88 мг, 0,64 ммоль)) и O-(2,4-динитрофенил)гидроксиламин (95 мг, 0,48 ммоль). Полученную смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли водный раствор 1М гидроксид натрия (5 мл), и смесь экстрагировали EtOAc (2×10 мл). Органические фракции промывали водой, высушивали над MgSO4 и концентрировали. Остаток очищали колоночной хроматографией, элюируя 20-65% EtOAc в петролейном эфире, получая целевое соединение (79 мг) в форме твердого вещества оранжевого цвета. MS: [M+H]+=382.
Следующие соединения получали, осуществляя процедуру, аналогичную описанной в Примере получения 50:
50А: 4-амино-1-(2-хлор-ацетил)-6-(4-фторбензил)-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=364.
50B: 4-амино-1-(2-хлор-ацетил)-6-бутил-3,3-диметил-1,2,3,4-тетрагидро-пирроло[3,2-b]пиридин-5-он, MS: [M+H]+=312.
Пример получения 51: трет-бутиловый эфир 4-Бром-6-(2,4-дифтор-бензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
N-бромсукцинимид (529 мг, 2,97 ммоль) добавляли к раствору трет-бутилового эфира 6-(2,4-дифтор-бензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 47А) (1,0 г, 2,47 ммоль) в DMF. Раствор перемешивали в течение 1,5 часов при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли воду, и продукт экстрагировали DCM (3x). Органические фазы собирали, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией, получая 1,1 г целевого соединения в форме твердого вещества желтого цвета. MS: [M+H]+=484.
Пример получения 52: 6-(2,4-дифтор-бензил)-3,3,4-триметил-1,6-дигидро-3H-пирроло[2,3-c]пиридин-2,5-дион
Раствор Me2Zn в гептане (1M, 5,8 мл, 5,8 ммоль) медленно добавляли к раствору трет-бутилового эфира 4-бром-6-(2,4-дифтор-бензил)-3,3-диметил-2,5-диоксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 51) (935 мг, 1,93 ммоль) и Pd(dppf)2Cl2 (282 мг, 0,38 ммоль) в диоксане (10 мл). Реакционную смесь перемешивали при 70°C в атмосфере N2 в изолированном сосуде в течение 1 часа. Затем добавляли вторую аликвоту Me2Zn (5,8 мл, 5,8 ммоль), и перемешивание продолжали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, гасили насыщ. NaHCO3 и экстрагировали DCM. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали флэш-хроматографией с получением 200 мг целевого соединения в форме полутвердого вещества желтого цвета. MS: [M+H]+=319.
Пример получения 53: 5-метокси-3,3-диметил-1,3-дигидро-пирроло[2,3-c]пиридин-2-он
Получен из трет-бутилового эфира 5-метокси-3,3-диметил-2-оксо-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты с использованием процедуры, подобной описанной в Примере получения 48. MS: [M+H]+=193.
Пример получения 54: 5-метокси-3,3-диметил-2,3-дигидро-1H-пирроло[2,3-c]пиридин
К раствору 5-метокси-3,3-диметил-1,3-дигидро-пирроло[2,3-c]пиридин-2-она (который может быть получен, как описано в Примере получения 53) (2,8 г, 14,6 ммоль) в THF (60 мл) добавляли раствор BH3.THF (1M, 150 мл, 150 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Аккуратно добавляли MeOH (50 мл) и нагревали с обратным холодильником в течение 1 ч. Растворитель выпаривали, остаток разделяли между DCM и насыщенным раствором NaHCO3. Органическую фазу высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя 0-60% петролейный эфир - EtOAc, получая целевое соединение (2,27 г). MS: [M+H]+=179.
Пример получения 55: трет-бутиловый эфир 5-метокси-3,3-диметил-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
К раствору 5-метокси-3,3-диметил-2,3-дигидро-1H-пирроло[2,3-c]пиридина (который может быть получен, как описано в Примере получения 54) (534 мг, 3,0 ммоль) в THF (10 мл) и насыщенном водном растворе Na2CO3 (4 мл), добавляли ди-трет-бутил бикарбонат (780 мг, 3,6 ммоль), и реакционную смесь перемешивали в течение ночи, затем разбавляли водой, экстрагировали EtOAc, промывали солевым раствором, высушивали, фильтровали, и растворитель выпаривали, получая целевое соединение (760 мг). MS: [M+H]+=279.
Пример получения 56: трет-бутиловый эфир 6-(E)-бут-2-енил)-3,3-диметил-5-оксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 5-метокси-3,3-диметил-2,3-дигидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 55) (760 мг, 2,7 ммоль), NaI (410 мг, 2,7 ммоль) и бутилен бромида (0,33 мл, 3,24 ммоль) в ацетонитриле (25 мл) нагревали с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали, выливали на 10% Na2S2O3, экстрагировали DCM, органическую фазу высушивали, фильтровали, и растворитель выпаривали. Сырой продукт очищали на силикагеле, элюируя 0-70% петролейный эфир - EtOAc, получая целевое соединение (433 мг). MS: [M+H]+=319.
Пример получения 57: трет-бутиловый эфир 6-бутил-3,3-диметил-5-оксо-2,3,5,6 тетрагидро пирроло[2,3-c]пиридин-1-карбоновой кислоты
Смесь трет-бутилового эфира 6-(E)-бут-2-енил)-3,3-диметил-5-оксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (который может быть получен, как описано в Примере получения 56) (433 мг, 1,36 ммоль) и Pd/C (10%, 100 мг) в EtOH (15 мл) гидрировали в течение 1 ч. Катализатор отфильтровывали, фильтрат упаривали, и остаток очищали на силикагеле, элюируя 0-50% петролейный эфир - EtOAc, получая целевое соединение (387 мг). MS: [M+H]+=321.
Пример получения 58: 6-бутил-3,3-диметил-1,2,3,6-тетрагидро-пирроло[2,3-c]пиридин-5-он
Раствор трет-бутилового эфира 6-бутил-3,3-диметил-5-оксо-2,3,5,6-тетрагидро-пирроло[2,3-c]пиридин-1-карбоновой кислоты (380 мг, 1,19 ммоль) в TFA (5 мл) и DCM (5 мл) перемешивали в течение 1 ч. Растворитель выпаривали, остаток разделяли между DCM и насыщенным раствором NaHCO3, органическую фазу высушивали, растворитель выпаривали, и остаток очищали на силикагеле, элюируя 0-100% петролейный эфир - EtOAc, получая целевое соединение (170 мг). MS: [M+H]+=221.
ПРИМЕРЫ 1-37
Следующая процедура является иллюстративной для получения соединений Примеров 1-37, перечисленных в таблице, приведенной ниже.
Смесь трет-бутил-(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилата (0,47 г), этилацетата (10 мл) и HCl-диоксана (4 М; 10 мл) перемешивали при 20°C в течение 18 ч, и полученное твердое вещество собирали фильтрацией с получением 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он дигидрохлорида (Пример 2, 0,43 г).
Следующими способами, подобными и/или аналогичными описанному выше, соединения, указанные в таблице, приведенной ниже, получали из соответствующих N-Вос защищенных производных с любыми значительными изменениями, указанными ниже. Предшественники для N-Вос защищенных производных идентифицируются (номером примера получения или названием) в таблице, приведенной ниже. Целевые соединения либо выделяли непосредственно в форме свободного основания или подходящей соли без дальнейшей очистки, либо очищали, например, с использованием масс-направленной препаративной ВЭЖХ, кристаллизации или растирания.
1H ЯМР генерировали при 400 МГц в Me-d3-OD, если не указано иное.
|
Пример 38: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он (свободное основание)
1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он дигидрохлорид (1,00 г, 1,0 экв., 1,00 вес.) (который может быть получен, как описано в Примере 2) заполняли в круглодонную колбу, растворяли в воде (10,0 мл, 10,0 об., 10,00 вес.) и перемешивали в атмосфере азота при температуре от 18 до 23°C, получая раствор соломенного цвета (pH=4,73, T=19,3°C). К водному раствору добавляли этилацетат (10,0 мл, 10,0 об.), и бифазную смесь перемешивали при температуре от 18 до 23°C в течение 5 минут. Слои разделяли, и водный слой (pH=4,58, 19,6°C) возвращали в колбу. Добавляли (осторожно) гидрокарбонат натрия (388,2 мг, 3×1,05 экв., 0,4 вес.) и наблюдали вспенивание. Смесь перемешивали в течение 20 минут (pH=7,51, 18,2°C), добавляли дихлорметан (5,0 мл, 5,0 об.), и смесь перемешивали в тех же условиях в течение еще 5 минут. Слои разделяли, слой дихлорметана сохраняли, и водный слой (pH=7,66, T=17,7°C) возвращали в колбу. Проводили две дальнейшие экстракции дихлорметаном (2×5,0 мл, 2×5,0 об.) (pH=8,25, T=18,5°C и pH=8,47, T=18,3°C), и объединенные органические слои высушивали над сульфатом натрия (1,0 г, 1,0 вес.), фильтровали и концентрировали досуха при пониженном давлении при 40°C (400 мбар). Концентрат затем высушивали при 40°C (<20 мбар) за 2 часа с получением белой пены (850,2 мг, 102%, 100% корр. для тестов входа и выхода вес./вес.), 94,3% вес./вес. osfb (против TCNB), который содержал этилацетат (3,4% вес./вес.) и дихлорметан (0,8% вес./вес.).
Пример 39: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат (форма A),
Свободное основание 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (500,0 мг, 1,0 вес.) (которое может быть получено, как описано в Примере 38) заполняли в сосуд на 25 мл и растворяли в этаноле (1,0 мл, 2,0 об.). Добавляли L-(+)-молочную кислоту (106,2 мг, 1,0 экв.), и содержимое сосуда перемешивали в течение 1 часа при температуре от 18 до 23°C, получая желтый раствор. По истечении этого времени TBME (9,0 мл, 18,0 об.) заполняли в сосуд, и смесь перемешивали при температуре от 18 до 23°C. Прогресс кристаллизации соли мониторили с помощью XRPD. Лактатная соль осталась в растворе после перемешивания в течение 16 часов при температуре от 18 до 23°C. По истечении этого времени раствор концентрировали до приблизительно ¼ первоначального объема и добавляли TBME (9,0 мл, 18,0 об.), получая липкий твердый и прозрачный супернатант, который превращался в тонкодисперсную суспензию после обработки ультразвуком и дальнейшего перемешивания (приблизительно 20 часов при температуре от 18 до 23°C). Твердое вещество выделяли фильтрацией, высушивали под током азота, получая 365 мг твердого вещества белого цвета, идентифицированного как Форма B XRPD. Твердое вещество высушивали в термостате при температуре от 40 до 45°C в течение 67 часов с получением твердого вещества белого цвета (325 мг, 56%.), 98,8% вес./вес. oasfb (против TCNB), который содержал TBME (1,0% вес./вес.) и воду (0,6% вес./вес.) и было показано XRPD как Форма. Подробные данные о характеристике (1H ЯМР, XRPD и DSC) для Примера 39 показаны на Фигурах 1-3.
Пример 40: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат (форма B)
Реакцию осуществляли согласно процедуре, описанной в Примере 39, но без высушивания в печи, с получением твердого вещества белого цвета (529,1 мг, 90%), 96,1% вес./вес. oasfb (против TCNB), который содержал TBME (5,9% вес./вес.) и воду (3,8% вес./вес.) и было показано XRPD как Форма B. Также использовалась альтернативная Примеру 40 процедура, которую осуществляли без использования этанола. Подробные данные о характеристике (1H ЯМР, XRPD и DSC) для Примера 40 показаны на Фигурах 4-6.
Пример 41: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он сульфат (Форма F)
Свободное основание 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (500,0 мг, 1,0 вес.) (который может быть получен, как описано в Примере 38) заполняли в сосуд на 10 мл и растворяли в этаноле (1,0 мл, 2,0 об.). Раствор серной кислоты (103,2 мг, 1,0 экв.) в этаноле (4,0 мл, 8,0 об.) добавляли за 10 минут при перемешивании при температуре от 18 до 23°C с получением прозрачного геля. Содержимое сосуда перемешивали в течение 1 часа при той же температуре, за это время гель растворялся, давая желтый раствор. Перемешивание продолжалив течение 16 часов, и при этом образовывалась белая суспензия. Прогресс кристаллизации соли проверяли с использованием XRPD. Затем добавляли этанол (2,0 мл, 4,0 об.) для корректной мобилизации суспензии, и продукт отделяли фильтрацией и высушивали под током азота, получая твердое вещество белого цвета (465,2 мг, 79%), 94,9% вес./вес. oasfb (против TCNB), которое содержало этанол (2,9% вес./вес.) и воду (3,6% вес./вес.) и было показано XRPD как Форма F. Подробные данные о характеристике (1H ЯМР, XRPD и DSC) для Примера 41 показаны на Фигурах 7-9.
Пример 42: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он мезилат (Форма B)
Свободное основание 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (500,0 мг, 1,0 вес.) (который может быть получен, как описано в Примере 38) заполняли в сосуд на 25 мл и растворяли в 2-пропаноле (2,5 мл, 5,0 об.). Добавляли метансульфоновую кислоту (276,0 мг, 3,0 экв.) (наблюдали слабую экзотермическую реакцию), и полученную маслянисто-липкую смесь перемешивали в течение 1 часа при температуре от 18 до 23°C. н-Гептан (10,0 мл, 20,0 об.) медленно добавляли за 10 минут с получением белой суспензии и небольшого количества липкого твердого вещества. Прогресс кристаллизации соли проверяли с помощью XRPD. Соль не кристаллизовалась в умеренных условиях (перемешивание при температуре от 18 до 23°C в течение 3 дней), поэтому температуру повышали до 40-45°C, получая липкое твердое вещество и прозрачный супернатант. Эту смесь охлаждали до температуры от 18 до 23°C, мобилизовали лопаткой и обрабатывали ультразвуком в течение 20 минут с получением белой суспензии, содержащей некоторое количество липких твердых веществ. Суспензию перемешивали в течение 20 часов при той же температуре, фильтровали и высушивали под потоком азота с получением твердого вещества бежевого цвета (402,9 мг, 63%) 99,0% вес./вес. oasfb (против TCNB), которое содержало 2-пропанол (2,3% вес./вес.), н-гептан (0,2% вес./вес.), воду (1,9% вес./вес.) и было показано XRPD как Форма B. Подробные данные о характеристике (1H ЯМР, XRPD и DSC) для Примера 42 показаны на Фигурах 10-12.
Пример 43: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат (форма C)
Первая партия
Свободное основание 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (10,0 г, корр.) (который может быть получен, как описано в Примере 38) растворяли в изопропилацетате (80,0 мл, 8,0 об.) с получением бледно-желтого раствора. Твердую безводную L-(+)-молочную кислоту (1,67 г, 1,0 экв.) заполняли в одной части в ту же колбу, и небольшое количество смолы замечали в основании колбы. Смесь затем быстро перемешивали для мобилизации смолы, и в растворе спонтанно образовывались ядра, и твердое вещество осаждалось. Образец твердого осадка анализировали XRPD и обнаруживали, что он соответствует Форме В (12,0 об.). Добавляли н-гептан, и смесь перемешивали при 40°C в атмосфере азота в течение 4 дней, чтобы продемонстрировать, что смесь преобразуется в Форму C, прогресс чего проверяли с помощью XRPD (фигура 13). Температуру смеси повышали до 55°C, и перемешивание продолжали в течение 24 ч для завершения превращения (фигура 14). Продукт отделяли фильтрацией (быстрой <0,5 минуты), промывали смесью изопропилацетат/н-гептан (2,0/3,0, об./об., 5,0 об.) и высушивали под током азота в течение 20 ч, получая целевое соединение в форме белого порошка (8,89 г, 79%), 91,6% вес./вес. (osfb), Форма C, т.пл. 172°C.
Вторая партия
Свободное основание 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (10,0 г, корр.) (который может быть получен, как описано в Примере 38) растворяли в изопропилацетате (60,0 мл, 6,0 об.) с получением бледно-желтого раствора. К которому добавляли безводную L-(+)-молочную кислоту (1,67 г, 1,0 экв.), растворенную в изопропилацетате (10,0 мл, 1,0 об.). Осуществляли промывку изопропилацетатом (10,0 мл, 1,0 об.), и смесь перемешивали при 18-23°C с получением бледно-желтого раствора.
н-Гептан (120 мл, 12,0 об.) добавляли по каплям за 40 минут, и смола образовывалась в нижней части колбы. После перемешивания в течение 1 ч 40 минут внешний вид смеси улучшился, но смола все еще присутствовала на дне колбы.
Смесь перемешивали в течение 16 ч при 18-23°C, за это время смола мобилизовалась и образовывалась зернистая, тонкодисперсная суспензия. Суспензию фильтровали в атмосфере азота (быстрая фильтрация), и осадок после фильтрации собирали и анализирован XRPD (Форма C). Осадок после фильтрации промывали смесью изопропилацетат/н-гептан (2,0/3,0, об/об, 5,0 об.), собирали и анализировали XRPD (Форма C), и оставляли для высушивания на фильтре под потоком азота на 16 ч. Продукт состоял из слегка грязно-белого порошкообразного твердого вещества (11,36 г, 91% корр.) Формы C, 94,3% вес./вес. (oasfb), Форма C, т.пл. 172°C, и содержал изопропилацетат (1,0 вес.%).
Подробные данные о характеристике (1H ЯМР, XRPD и DSC) для Примера 43 показаны на Фигурах 15-17.
Пример 44: 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактат (форма C)
Стадия 1
К раствору трет-бутил-(2R,5S)-4-(2-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-оксоэтил)-2-метил-5-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-карбоксилата (1,0 вес.) (который может быть получен, как описано в Примере получения 19) в метаноле (10 об.), охлажденному до <10°C медленно добавляли 4M HCl в 1,4-диоксане (3 об.) с последующей промывкой метанолом (0,5 об.). Смесь нагревали до температуры от 15 до 25°C и перемешивали при этой температуре в течение по меньшей мере 12 ч. Реакционную смесь затем нагревали до температуры от 30 до 40°C и перемешивали, пока реакция не была завершена по результатам ВЭЖХ (как правило, >2 ч. По завершении реакционный раствор концентрировали досуха при температуре до 40°C. Остаток растворяли в очищенной воде (8 об.) и промывали этилацетатом (2×4 об.). рH водной фазы доводили до pH 12-13 с использованием 4M NaOH (как требуется), после чего экстрагировали этилацетатом (3×5 об.). Объединенные органические фазы промывали раствором хлорида натрия (5 об.) и высушивали над сульфатом магния (1,0 вес.) в течение по меньшей мере 10 минут. Твердое вещество удаляли фильтрацией, и остаток после фильтрации промывали этилацетатом (2×2 об.). Фильтраты концентрировали на ротационном испарителе при температуре до 40°C, полученный концентрат растворяли в метилацетате (5 об.), и раствор концентрировали как описано выше для получения свободного основания 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она.
Стадия 2
К раствору свободного основания 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-она (1,0 вес.) (который может быть получен, как описано на Стадии 1) в метилацетате (3 об.) добавляли раствор L-(+)-молочной кислоты (0,085 вес.) в метилацетате (0,75 об.). Затем заполняли затравочную массу 1-{6-[(4-фторфенил)метил]-5-(гидроксиметил)-3,3-диметил-1H,2H,3H-пирроло[3,2-b]пиридин-1-ил}-2-[(2R,5R)-5-метил-2-{[(3R)-3-метилморфолин-4-ил]метил}пиперазин-1-ил]этан-1-он L-(+)-лактата (Форма C) (0,01 вес.) в метилацетате (0,08 об.), после чего добавляли раствор L-(+)-молочной кислоты (0,085 вес.) в метилацетате (0,75 об.) и промывали метилацетатом (0,5 об.). Суспензию перемешивали в течение приблизительно 30 минут, после чего добавляли н-гептана (12,0 об.) по меньшей мере за 1 ч, поддерживая температуру от 15 до 25°C. Смесь поддерживали при температуре от 15 до 25°C и перемешивали в течение по меньшей мере 2 ч. Твердое вещество удаляли фильтрацией, и остаток после фильтрации промывали смесью 2:3 метилацетат/н-гептан (5 об.). Материал высушивали на фильтре до состояния, пригодного для обработки, и затем высушивали в термостате при температуре до 80°C, пока содержание метилацетата не составило ≤0,5% вес./вес., получая целевое соединение в форме твердого вещества цвета от грязно-белого до бежевого.
Пример 45: примеры фармацевтических составов
(i) Состав таблетки
Композицию таблетки, содержащую соединение формулы (I), получали путем смешивания соответствующего количества соединения (например, 50-250 мг) с подходящим разбавителем, разрыхлителем, агентом для прессования и/или глидантом. Одна возможная таблетка включает 50 мг соединения с 197 мг лактозы (BP) в качестве разбавителя и 3 мг стеарата магния в качестве лубриканта, и ее прессуют для формирования таблетки известным образом. Прессованная таблетка может быть покрытой пленкой.
(ii) Состав капсулы
Состав капсулы получают путем смешивания 100-250 мг соединения формулы (I) с эквивалентным количеством лактозы и заполнения полученной смеси в стандартные твердые желатиновые капсулы. Подходящий разрыхлитель и/или глидант могут быть включены в соответствующих количествах, если требуется.
(iii) Инъецируемый состав I
Парентеральная композиция для введения инъекцией может быть получена путем растворения соединения формулы (I) (например, в солевой форме) в воде, содержащей 10%-й пропиленгликоль, с получением концентрации активного соединения 1,5 вес.%. Раствору затем придают изотоничность, стерилизуют фильтрацией или конечной стерилизацией, заполняют в ампулу или пузырек, или предварительно заполненный шприц и закупоривают.
(iv) Инъецируемый состав II
Парентеральную композицию для инъекции получают путем растворения в воде соединения формулы (I) (например, в солевой форме) (2 мг/мл) и маннита (50 мг/мл), стерилизующей фильтрации раствора или конечной стерилизации и заполнения в закупориваемые пузырьки или ампулы на 1 мл или предварительно заполненный шприц.
(v) Инъецируемый состав III
Состав для внутривенной доставки инъекцией или вливанием может быть получен путем растворения соединения формулы (I) (например, в солевой форме) в воде в количестве 20 мг/мл и затем придания изотоничности. Пузырек затем изолируют и стерилизуют путем автоклавирования или заполняют в ампулу или пузырек или предварительно заполненный шприц, стерилизуют фильтрацией и закупоривают.
(vi) Инъецируемый состав IV
Состав для внутривенной доставки инъекцией или вливанием может быть получен путем растворения соединения формулы (I) (например, в солевой форме) в воде, содержащей буфер (например, 0,2 М ацетата pH 4,6) в количестве 20 мг/мл. Пузырек, ампулу или предварительно заполненный шприц затем закупоривают и стерилизуют путем автоклавирования или стерилизуют фильтрацией и закупоривают.
(vii) Состав для подкожной или внутримышечной инъекции
Композицию для подкожного введения получают путем смешивания соединения формулы (I) с кукурузным маслом фармацевтического качества с получением концентрации 5-50 мг/мл. Композицию стерилизуют и заполняют в подходящий контейнер.
(viii) Лиофилизированный состав I
Аликвоты составленного соединения формулы (I) помещают в пузырьки на 50 мл и лиофилизируют. Во время лиофилизации композиции замораживают с использованием одностадийного протокола замораживания при (-45°C). Температуру повышают до -10°C для отжига, затем понижают для замораживания при -45°C, с последующим первичным высушиванием при +25°C в течение приблизительно 3400 минут, с последующим вторичным высушиванием с увеличенными стадиями, если температура до 50°C. Давление во время первичного и вторичного высушивания устанавливают равным 80 миллиторр.
(ix) Лиофилизированный состав II
Аликвоты составленного соединения формулы (I) или его соли, как определено здесь, помещают в пузырьки на 50 мл и лиофилизируют. Во время лиофилизации композиции замораживают с использованием одностадийного протокола замораживания при (-45°C). Температуру повышают до -10°C для отжига, затем понижают для замораживания при -45°C, с последующим первичным высушиванием при +25°C в течение приблизительно 3400 минут, с последующим вторичным высушиванием с увеличенными стадиями, если температура до 50°C. Давление во время первичного и вторичного высушивания устанавливают равным 80 миллиторр.
(x) Лиофилизированный состав для использования при внутривенном введении III
Забуференный водный раствор получают путем растворения соединения формулы (I) в буфере. Забуференный раствор заполняют, с фильтрацией для удаления частиц, в контейнер (такой как стеклянный пузырек Типа 1), который затем частично закупоривают (например, посредством пробки Fluorotec). Если соединение и состав достаточно стабильны, состав стерилизуют путем автоклавирования при 121°C в течение подходящего промежутка времени. Если состав не стабилен для автоклавирования, он может стерилизоваться с помощью подходящего фильтра и заполняться в стерильных условиях в стерильные пузырьки. Раствор высушивают замораживанием с использованием подходящего цикла. По завершении цикла высушивания при температуре ниже нуля градусов пузырьки снова заполняют азотом для приведения к атмосферному давлению, закупоривают и запаивают (например, алюминиевой крышкой). Для внутривенного введения высушенное замораживанием твердое вещество может быть восстановлено с фармацевтически приемлемым разбавителем, таким как 0,9% солевой раствор или 5% декстроза. Раствор может вводиться как есть или может быть дополнительно разбавлен в инфузионном мешке (содержащем фармацевтически приемлемый разбавитель, такой как 0,9% солевой раствор или 5% декстроза) перед введением.
(xi) Активный фармацевтический ингредиент в бутылке
Композицию для перорального введения получали путем заполнения бутылки или пузырька соединением формулы (I). Композицию затем восстанавливали с подходящим разбавителем, например, водой, фруктовым соком или коммерчески доступным носителем, таким как OraSweet или Syrspend. Ресуспендированный осадок может быть распределен в дозирующие колпачки или спринцовки для полости рта для введения.
Биологические тесты
Экспрессия и очистка доменов XIAP, cIAP-1 и cIAP-2 BIR3
Рекомбинантный домен BIR3 человеческого XIAP (остатки 252-350), слитый с His-tag, человеческий cIAP-1 (остатки 267-363), слитый с GST-tag, и человеческий cIAP-2 (остатки 244-337), слитый с His-tag, суперэкспрессировали из клеток Escherichia coli, выращенных в среде TB. Белок выделяли из лизатов с помощью афинной хроматографии Ni-NTA (XIAP/cIAP-2) или глютатион сефаразной 4B афинной хроматографии (cIAP-1). Аффинные маркеры для XIAP и cIAP-1 расщепляли тромбином в 25 мМ HEPES pH 7,5, 100 мМ NaCl, 50 мкМ Zn(OAc)2 и 1 мМ Ca(OAc)2 с последующей очисткой доменов BIR3 эксклюзионной хроматографией. His-tag не расщепляли для cIAP-2, и белок не концентрировали выше 3 мг/мл из-за агрегации, индуцируемой ковалентной самоолигомеризацией. Очищенный белок сохраняли в 25 мM Tris pH 7.5, 100 мM NaCl при -80°C.
Тесты конкуретного смещения связывания XIAP, cIAP-1 и cIAP-2 in vitro
Модифицированные пептиды SMAC и соединения проверяли на их способность смещать флуоресцентный радиоактивный индикатор от XIAP, cIAP-1 или cIAP-2. Домены BIR3 cIAP-1, cIAP-2 и XIAP инкубировали с тестируемыми соединениями или пептидами на основе SMAC и их соответствующими пептидными зондами (Peptide Protein Research) в тестовом буфере (50 мМ Hepes pH 7,5, 0.025% Tween-20, 0.01% BSA и 1 мM DTT). Положительные контроли состояли из белков BIR3 и радиоактивного индикатора (отсутствие ингибирования), и отрицательные контроли содержали только радиоактивный индикатор (100%-е ингибирование). Образцы инкубировали при комнатной температуре в течение 1 часа (XIAP и cIAP-2) или 3 часов (cIAP-1), после чего считывали в BMG Pherastar в режиме поляризации флуоресценции (FP 485 нм, 520 нм, 520 нм). Значения IC50 определяли на основании точек доза-ответ с помощью нелинейного анализа методом наименьших квадратов.
Конечные условия для тестов XIAP, cIAP-1 и cIAP-2
|
Антипролиферативная активность
Ингибирование роста клеток измеряли с использованием теста Alamar Blue (Nociari, M. M, Shalev, A., Benias, P., Russo, C. Journal of Immunological Methods 1998, 213, 157-167). Этот способ основывается на способности жизнеспособных клеток восстанавливать диазорезорцин до его флуоресцентного продукта резоруфина. Для каждого теста на пролиферацию клетки высевали на 96-луночные планшеты и оставляли для восстановления в течение 16 часов до добавления ингибирующих соединений (в 0,1% об./об. ДМСО) в течение еще 72 часов. В конце инкубационного периода добавляли 10% (об./об.) Alamar Blue и инкубировали в течение еще 6 часов до определения флуоресцентного продукта при 535 нМ облучения/590 нМ эмиссии.
Антипролиферативная активность соединений по изобретению могжет быть определена путем измерения способности соединений ингибировать рост в 3 линиях раковых клеток:
• EVSA-T (человеческий рак молочной железы) DSMZ кат. no. ACC 433
• MDA-MB-231 (человеческий рак молочной железы) ECACC кат. no. 92020424
• HCT116 (человеческий рак толстой кишки) кат. no. 91091005 91091005 (нечувствительная клеточная линия, используемая в качестве контроля для неспецифической цитотоксичности)
В тесте с помощью клеточной линии EVSA-T Примеры 1-34 имеют EC50 меньше, чем 0,01 мкМ. В частности Примеры 1-3, 5-8, 10-14, 16, 18-25, 27-28 и 30-32 имеют EC50 меньше, чем 0,001 мкМ. В тесте с помощью клеточной линии MDA-MB-231, Примеры 1-34 имеют EC50 меньше, чем 0,1 мкМ. В частности, Примеры 1-8, 10-14 и 18-32 имеют EC50 меньше, чем 0,01 мкМ. Более конкретно, Примеры 7-8 имеют EC50 меньше, чем 0,001 мкМ. Данные для соединений по изобретению в этих тестах приведены в Таблице 1.
Индукция апоптоза
В таблице, приведенной ниже, показана чувствительность группы девяти человеческих клеточных линий меланомы, оцененных на индукцию апоптоза в присутствии 1 нг/мл TNF-α, добавленного в то же время, что и Пример в количестве 1 мкМ 2 в течение 24 часов. Диапазон чувствительности наблюдали с 3 клеточными линиями (SK-MEL-24, WM-266-4 и WM-115), оказавшимися наименее чувствительными (<20% клеток, подвергшихся апоптозу через 24 ч). В таблице детализирован процент общих клеток, положительных в отношении активности по расщеплению каспазы-3 после 24-часовой обработки 1 мкМ Примера 2 плюс 1 нг/мл TNF-α на основании цитометрии с помощью флуорогенного субстрата каспазы-3 (NucView488 - Biotium).
|
Протокол теста MSD иммунопреципитации (IP) HEK293-XIAP-каспазы-9
Стабильные клетки HEK293-XIAP-каспазы-9 высевали в планшеты с 96 лунками [200 мкл/лунка в 1×106 клеток/мл в культивируемой полной среде (DMEM+10% FBS+0,5 мг/мл генетицина (Invitrogen)] и оставляли на ночь при 37°C для восстановления. Соединения добавляли в продублированные лунки в 0,1% ДМСО в течение 2 ч при 37°C. Клетки лизировали в 50 мкл 1 x лизирующего буфера MSD (1% Triton X-100 в 20 мM Tris.Cl (pH 7,6), 150 мM NaCl, включающего ингибиторы протеазы) в течение 20 минут, взбалтывая при комнатной температуре. Планшеты MSD с высоким связыванием стрептавидина (L15SB-2) покрывали биотинилированным антителом анти-FLAG M2 (Sigma F9291) в 25 мкл/лунка с разбавлением антитела в PBS 5 мкг/мл в течение 1 ч, при взбалтывании; с последующим блокированием в течение 1 ч с использованием 150 мкл 3% BSA/TBST. Лизат клеток (25 мкл) добавляли к покрытым анти-FLAG планшетам MSD с 96 лунками и помещали на аппарат для встряхивания на 4 ч при комнатной температуре. После промывки 4 раза с использованием 150 мкл TBST (20 мM Tris.Cl (pH 7,6), 150 мM NaCl, 0,1% Tween-20), анти-Каспаза-9 [CST#9505] разбавленный до 5 мкл/мл в блокирующем буфере MSD (3% BSA/TBST), добавляли на ночь 4° C. После промывки планшетов 4 раза х 150 мкл TBST, метку анти-кролик-сульфо (MSD cat no. R32AB-1), разбавленную до 2 мкг/мл в блокирующем буфере MSD, добавляли на 2 часа при комнатной температуре. Планшеты промывали 4 раза х 150 мкл TBST и добавляли 150 мкл/лунка 1 x буфер считывания MSD (R92TC-2), после чего каждый планшет считывали.
Значения EC50 определяли на основании точек доза-ответ с помощью нелинейного анализа наименьших квадратов. Примеры 1-37 имеют EC50 меньше, чем 0,1 мкМ. В частности, Примеры 1-13, 15, 18-25, 27-28, 30-34 и 36-37 имеют EC50 меньше, чем 0,01 мкМ. Более конкретно, Примеры 10, 12, 23-24 и 31 имеют EC50 меньше чем 0,001 мкМ. Данные для соединений по изобретению в этом тесте приведены в Таблице 1.
Протокол деградации cIAP1 в тесте MSD в клетках MDA-MB-231
Клетки MDA-MB-231 высаживали в планшеты с 96 лунками [200 мкл/лунка в 4×105 клеток/мл в культивируемой полной среде (DMEM+10% FBS) и оставляли на ночь при 37°C для восстановления. Соединения добавляли в продублированные лунки в 0,1% ДМСО в течение 2 ч при 37°C. Клетки лизировали в 50 мкл 1 x лизирующего буфера MSD (1% Triton X-100 в 20 мM Tris.Cl (pH 7,6), 150 мM NaCl, включающего ингибиторы протеазы) в течение 20 минут, взбалтывая при комнатной температуре. Планшеты MSD с высоким связыванием стрептавидина (L15SB-2) покрывали биотинилированным антителом анти-cIAP1 (R&D Systems cat no. AF8181 - биотинилировано в лаборатории) в 25 мкл/лунка с разбавлением антитела в PBS 5 мкг/мл в течение 1 ч, при взбалтывании; с последующим блокированием в течение 1 ч с использованием 150 мкл 3% BSA/TBST. Лизат клеток (25 мкл) добавляли к планшету MSD с 96 лунками, покрытому анти-cIAP1, и помещали на ночь при 4°C. После промывки 4 раза с использованием 150 мкл TBST (20 мM Tris.Cl (pH 7,6), 150 мM NaCl, 0,1% Tween-20), антитело для детекции метки анти-cIAP1-сульфо (R&D Systems cat no. AF8181 - сульфо-меченное в лаборатории), разбавленное до 6 мкг/мл в блокирующем буфере MSD, добавляли в течение 2 часов при комнатной температуре. Планшеты промывали 4 раза х 150 мкл TBST и добавляли 150 мкл/лунка 1 x буфер считывания MSD (R92TC-2), после чего каждый планшет считывали.
Значения EC50 определяли на основании точек доза-ответ с помощью нелинейного анализа наименьших квадратов. Примеры 1-37 имеют EC50 меньше, чем 0,01 мкМ. В частности, Примеры 1-8, 10-14, 16, 18-27, 30-34 и 37 имеют EC50 меньше, чем 0,001 мкМ. Более конкретно, Пример 7 имеет EC50 меньше, чем 0,0001 мкМ. Данные для соединений по изобретению в этом тесте приведены в Таблице 1.
Протокол теста фиксации потенциала популяции (PPC)
Ингибирование каналов hERG измеряли автоматизированным тестом фиксации потенциала в клетках CHO K1, стабильно трансфицированных ионным каналом hERG. Измерения PPC проводили с помощью инструмента IonWorks Quattro (Molecular Devices Corporation, Юнион-Сити, Калифорния) с использованием 384-луночных планшетов PatchPlate (Molecular Devices Corporation) с 64 апертурами на лунку. Каждую концентрацию тестируемого соединения проверяли в двух лунках. Амфотерицин B использовался для получения электрического доступа к внутренней среде клетки в конечной концентрации 200 мкг/мл. Ток родственного человеческому ether-à-gogo гена (hERG) измеряли с предварительным импульсом до +40 мВ (2 с) от исходного потенциала -80 мВ, с последующим переходом к -50 мВ (2 с), чтобы вызвать деактивирующий следовой ток перед возвращением к исходному потенциалу в течение 1 с. Соединения инкубировали в течение 600 с между пред- и пост-считыванием соединений. Используемый внешний записывающий раствор представлял собой 130 мМ Na глюконата, 20 мМ NaCl, 4 мМ KCl, 1 мМ MgCl2, 1,8 мМ CaCl2, 10 мМ Hepes, 5 мМ глюкозы, pH до 7,3 с помощью NaOH. Все данные отфильтровывали по степени наполнения, падению наполнения и амплитуде тока. Максимальная амплитуда тока 3-го импульса следового тока была вычислена до (Пре-) и после (Пост-) добавления соединения, и количество блока оценивали путем деления Пост-амплитуды тока на Пре-амплитуду тока. Данные, полученные с использованием этого теста, представлены в Таблице 1.
Протокол теста ручной фиксации потенциала (MPC)
Ингибирование каналов hERG измеряли ручным тестом Фиксации потенциала в клетках HEK293, стабильно трансфицированных ионным каналом hERG. Усилитель HEKA EPC10 и программное обеспечение PatchMaster использовали для сбора и анализа данных для этого проекта.
Клетки высевали на покровное стекло, монтировали на инвертированный микроскоп и постоянно смачивали в контрольном растворе (137 мМ NaCl, 4 мМ KCl, 1 мМ MgCl2, 1,8 мМ CaCl2, 10 мМ Hepes, 10 мМ Глюкозы, pH 7,35).
После того, как клетки электронно фиксировали и оставляли для уравновешивания, применяли протокол импульса. Протокол импульса включал переход от исходного потенциала -80 мВ до +40 мВ в течение 4 с для инактивации каналов hERG, затем напряжение на мембране снова снижали до -50 мВ в течение 4 с для индукции следового тока до возвращения к исходному потенциалу. Эту последовательность повторяли с межимпульсным интервалом 20 с. Протокол напряжения был применен в течение эксперимента, начиная до лекарственного средства (контроль 0,33% ДМСО) и после аккумулятивных добавлений возрастающих концентраций соединений. Вызванные амплитуды максимального тока постоянно мониторили в течение эксперимента.
Тестируемые соединения наносили в течение 5 минут или пока динамическое равновесие не было достигнуто, в зависимости от того, что наступало ранее, после чего измеряли эффект соединения. Пиковый следовой ток измеряли до и после каждого добавления соединения. Результаты для отдельных клеток нормализовали к их соответствующему носителю в качестве контроля, и результаты усредняли. Каждую концентрацию соединения измеряли в двойном экземпляре. 0,1 мкМ цисаприда использовали в качестве референсного ингибитора.
|
Если не указано иное, данные, приведенные выше, представляют собой результат единственного эксперимента. Если была получена больше чем одна точка данных, в таблице выше показано среднее число (например, среднегеометрическое или среднее арифметическое) этих точек данных (n) до 2 значимых цифр.
Протокол комбинации для апоптоза
Клеточные линии меланомы высевали в двойных лунках планшетов с 24 лунками в количестве 0,5×106 клеток/мл за день до обработки, чтобы обеспечить их адгезию. После инкубации клеток с соединением(ями) с или без 1 нг/мл TNF-α (R&D Systems) в течение 24 ч в инкубаторе CO2 при 37°C, клетки собирали трипсинизацией. Осадок клеток из планшета с 24 лунками повторно суспендировали в 100 мкл буфера FACS (PBS+1% эмбриональной бычьей сыворотки). Реактив NucView488 (Biotium) добавляли в конечной концентрации 2 мкМ. Планшет инкубировали в темноте в течение 30 минут, после чего измеряли флуоресцентно окрашенные клетки в цитометре Guava easyCyte HT (Millipore). Окрашивание при расщеплении каспазы-3 регистрировали в канале FL1 с неокрашенными и контрольными лунками ДМСО, используемыми для получения популяций окрашенных и неокрашенных клеток.
В Таблице 2 показан % увеличения апоптоза, наблюдаемый в SK-MEL-28 или в A375 с указанной комбинацией агентов, включенных в Пример 2, плюс 1 нг/мл TNF-α в течение 24 ч в культуре. Никакого увеличения апоптоза не наблюдалось в этих временных рамках с агентом комбинации, показанным в первом столбце таблицы, при индивидуальном использовании (с или без TNF-α) - данные не показаны.
|
Протокол комбинации для пролиферации клеток
Эффект соединения формулы (I) (Соединение I) в комбиниции с противораковым агентом (Соединение II) может быть оценен с помощью следующего метода. Клетки от линий клеток человека (например, MDA-MB-231 и EVSA-T) высевали на планшеты для культуры тканей с 96 лунками в концентрации 2,5×103, 6,0×103 или 4,0×103 клетки/лунки соответственно. Клеткам давали восстановиться в течение 48 часов до добавления соединения(й) или носителя в качестве контроля (0,35% ДМСО) следующим образом:
Соединения добавляли конкуррентно в течение 96 часов. После инкубации соединений в течение в общей сложности 96 часов, клетки фиксировали ледяной 10% (вес./об.) трихлоруксусной кислотой в течение 1 часа на льду и затем промывали четыре раза dH2О с помощью моечной машины для планшетов (Labsystems Wellwash Ascent) и высушивали воздухом. Клетки затем окрашивали 0,4% (вес./об.) Сульфородамином B (Sigma) в 1%-й уксусной кислоте в течение 20 минут при комнатной температуре и затем промывали четыре раза 1% (об./об.) уксусной кислотой и высушивали воздухом перед добавлением 10 мМ буфера Tris для растворения красителя. Колориметрический продукт определяли количественно путем считывания в Abs490nm на спектрофотометре для считывания планшетов Wallac Victor2 (1420 multilabel counter, Perkin Elmer Life Sciences). Определяли IC50 для Соединения II в присутствии переменных доз Соединения I. Синергизм был определен, когда IC50 снижалась в присутствии субэффективных доз Соединения I. Аддитивность была определена, когда ответ для Соединения II и Соединения I вместе приводил к эффекту, эквивалентному сумме двух соединений индивидуально. Антагонистические эффекты были определены как такие, которые заставляют IC50 повышаться, т.е. такие, где ответ на два соединения был меньше, чем сумма эффектов двух соединений при индивидуальном применении.