Результат интеллектуальной деятельности: СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ЭНДОГЕННОГО ГИПЕРКОРТИЦИЗМА
Вид РИД
Изобретение
Область техники
Изобретение относится к медицине, а именно, к эндокринологии и может быть использовано в клинической практике для диагностики эндогенного гиперкортицизма.
Уровень техники
Эндогенный гиперкортицизм (ЭГ) - эндокринное заболевание, обусловленное повышенной продукцией кортизола органической природы, т.е. вследствие адренокортикотропин (АКТГ)-, кортиколиберин (КРГ)- или кортизол-секретирующей опухоли различной локализации [Дедов И.И.: Клиническая нейроэндокринология, М. УП Принт. 2011. 343 стр.]. Избыточная секреция кортизола приводит к развитию осложнений со стороны углеводного обмена (нарушение толерантности к глюкозе, сахарный диабет), сердечно-сосудистой системы (артериальная гипертензия, кардиомиопатия), скелетно-мышечной системы (остеопороз, стероидная саркопения), системы гемостаза (гипо- и гиперкоагуляция), а также к развитию психических нарушений от депрессивного расстройства и неврозов до стероидного психоза. Пятилетняя выживаемость при недиагностированном ЭГ составляет 50% [Plotz CM, Knowlton AI, Ragan С. The natural history of Cushing's syndrome. Am J. Med. l952; 13:597-614], что делает эту патологию наиболее тяжелой в структуре всех эндокринных заболеваний. Среди причин ЭГ наиболее частой является доброкачественная опухоль гипофиза (80-85% случаев) - болезнь Иценко-Кушинга (БИК), более редко встречаются кортикостеромы надпочечников (10-20%) и АКТГ - эктопированный синдром (5-10%) [Nieman LK, Biller ВМ, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Clin Endocrinol Metab. 2008; 93:1526-1540. doi: 10.1210/jc.2008-0125]. Распространенность БИК составляет 39,1 случаев на миллион, заболеваемость 1,2-2,4 случая на миллион [Etxabe J, Vazquez JA. Morbidity and mortality in Cushing's disease: an epidemiological approach. Clin. Endocrinol. (Oxf.). 1994; 40(4):479-484. doi: 10.1111/j.1365-2265.1994.tb02486.x.], кортикостеромы надпочечника и АКТГ - эктопированный синдром встречаются реже. При классическом варианте течения ЭГ можно наблюдать яркую и характерную клиническую картину: перераспределение подкожно-жировой клетчатки (ПЖК) с преимущественным ее отложением в области передней брюшной стенки, лунообразное лицо, избыточное отложение ПЖК в области шейного отдела позвоночника (так называемый «климактерический горбик»), образование гематом при незначительной травме и без видимой травмы, появление специфического покраснения в области щек (матронизм), и багровых стрий в области передней брюшной стенки, плеч, предплечий, а также на нижних конечностях [Nieman LK, Biller ВМ, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Clin Endocrinol Metab. 2008; 93:1526-1540. doi: 10.1210/jc.2008-0125]. Несмотря на описанную яркую клиническую картину изменений внешности, далеко не всегда диагноз ЭГ устанавливается своевременно из-за неспецифичности многих симптомов, так, например, классические стрии и матронизм, по данным Российского исследования, встречаются лишь в 50% случаев преимущественно у лиц молодого возраста [Белая Ж.Е., Рожинская Л.Я., Драгунова Н.В., Дзеранова Л.К., Марова Е.И., Арапова С.Д., Молитвословова Н.Н., Зенкова Т.С., Мельниченко Г.А., Дедов И.И. "Метаболические осложнения эндогенного гиперкортицизма. Выбор пациентов для скрининга." Ж. Ожирение и Метаболизм, 2013, №1, стр. 29-34]. Среди лабораторных исследований и проб в целях диагностики ЭГ в первую очередь используются определение кортизола в слюне и в крови собранной в 23:00 с целью выявления нарушений циркадности; кортизола в сыворотке крови, взятой утром после приема 1 мг дексаметазона накануне в 23:00, а также широко распространен анализ суточной мочи на кортизол [Belaya ZE, Iljin AV, Melnichenko GA, Rozhinskaya LY, Dragunova NV, Dzeranova LK, Butrova SA, Troshina EA, Dedov II.: Diagnostic performance of late-night salivary cortisol measured by automated electrochemiluminescence immunoassay in obese and overweight patients referred to exclude Cushing's syndrome.// Endocrine, 2012, Vol.41, pp. 494-500. DOI 10.1007/sl2020-012-9658-3]. Тем не менее, диагностика ЭГ является объективно сложной для амбулаторных врачей, так как определение кортизола крови и АКТГ утром неинформативно [Мельниченко Г.А., Дедов И.И., Белая Ж.Е., Рожинская Л.Я., Вагапова Г.Р., Волкова Н.И., Григорьев А.Ю., Гринева Е.Н., Марова Е.И., Мкртумян A.M., Трунин Ю.Ю., Черебилло В.Ю. Болезнь Иценко-Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения. Ж. Проблемы Эндокринологии, 2015, Т 61, №2, 55-77, Nieman LK, Biller ВМ, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Clin Endocrinol Metab. 2008; 93:1526-1540. doi: 10.1210/jc.2008-0125], сбор суточной мочи на свободный кортизол сопряжен с ошибками пациента, а определения кортизола в сыворотке крови в вечерние часы требует госпитализации больного [Марова Е.И., Арапова С.Д., Белая Ж.Е. и др. Болезнь Иценко-Кушинга: клиника, диагностика, лечение. Москва. 2012; стр 64]. Анализ слюны на свободный кортизол собранной в 23:00 доказал свою эффективность для диагностики эндогенного гиперкортицизма и вошел в американские [Nieman LK, Biller ВМ, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Clin Endocrinol Metab. 2008; 93:1526-1540. doi: 10.1210/jc.2008-0125], европейские и российские клинические рекомендации [Белая Ж.Е., Рожинская Л.Я. «Болезнь Иценко-Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения» 2014 г.]. Этот метод исследования также отличается рядом технических преимуществ: пациент может выполнить сбор слюны самостоятельно, в домашних условиях, методика безболезненная, что минимизирует вероятность стресса; слюна содержит свободный, стабильный при комнатной температуре до 7 дней кортизол, что делает возможным дистанционное проведение анализа (отправление материала по почте); уровень кортизола в слюне не зависит от содержания кортизол-связывающего глобулина, что дает возможность проводить анализ в группе пациентов, принимающих заместительную гормональную/менопаузальную терапию, а также данный анализ имеет преимущество перед определением свободного кортизола в суточной моче, так как количество слюны не влияет на результат [Valassi Е, Franz Н, Brue Т, Feelders RA, Netea-Maier R,. Diagnostic tests for Cushing's syndrome differ from published guidelines: data from ERCUSYN. European Journal of Endocrinology 176:5, стр. 613-624]. Раннее для определения кортизола в слюне, собранной в 23:00, был разработан референсный интервал - 0.5-9.4 ммоль/л [Белая Ж.Е. Ранняя диагностика эндогенного гиперкортицизма. Канонический Wnt сигнальный путь и изменение костного метаболизма при глюкокортикоидном остеопорозе. Автореферат диссертации на соискание степени доктора медицинских наук, 2013, 49 стр.]. Одного теста недостаточно для установления ЭГ, поэтому рекомендуется обязательное дополнительное проведение малой пробы с дексаметазоном (которую также называют ночной подавляющий тест с дексаметазоном или пробой с 1 мг дексаметазона) или сбор суточной мочи на свободный кортизол. Малая проба с дексаметазоном (МИД) проводится следующим образом: в 23:00 пациент принимает 1 мг дексаметазона, на следующее утром в интервале 8-9 утра натощак сдает анализ крови на кортизол. Полученный уровень кортизола в крови менее 50 нмоль/л свидетельствует в пользу отсутствия эндогенного гиперкортицизма, в то время как более высокие значения кортизола в ходе МПД, напротив, расцениваются как наличие заболевания. По современным клиническим рекомендациям, в первую очередь пациенту с подозрением на ЭГ проводится исследование кортизола в слюне в 23:00 и МПД с определением кортизола в крови. До настоящего времени не существует разработанной точки разделения для проведения МПД по слюне. Разработка подобной точки разделения для кортизола в слюне, собранной утром после 1 мг дексаметазона, позволила бы сделать первый этап диагностики ЭГ полностью неинвазивным. Следует также учитывать, что существует вариабельность референтного интервала для различных методов определения кортизола как в крови, так и в слюне, особенно для масс-спектрометрии и иммуноферментного (ИФА) или электрохемилюминисцентного анализа (ЭХЛА), поэтому и точка разделения на фоне МПД, очевидно, должна различаться.
Ранее были проведены и опубликованы исследования слюны в рамках МПД, тем не менее, в этих исследованиях использовались другие методы измерения кортизола слюны. Как было упомянуто ранее, чувствительность разных методов исследования кортизола слюны отличается и, соответственно, будут отличаться и точки разделения. В одной из работ, были исследованы уровень кортизола слюны вечером, кортизола суточной мочи, а также кортизола слюны и крови утром в ходе МПД. Кортизол слюны был измерен при помощи жидкостной хроматографии и тандем масс-спектрометрии. В исследовании участвовали 99 человек: 21 с эндогенным гиперкортицизмом, 78 с эукортицизмом. Была определена точка разделения для кортизола слюны 0,85 нмоль/л [CM Ng, ТК Lam, YC Au Yeung, СН Choi, YP Iu, CC Shek, SC Tiu. Clinical utility of late-night and post-overnight dexamethasone suppression salivary cortisone for the investigation of Cushing's syndrome. Hong Kong Med J 2017; 23:570-8, DOI: 10.12809/hkmj 176240]. Тем не менее, в данной работе не было когорты пациентов с ожирением, тогда как известно, что у пациентов с ожирением зачастую наблюдаются ложноположительные результаты МПД вследствие функционального гиперкортицизма. В другой работе также были исследованы кортизол суточной мочи, кортизол в слюне и в крови в ходе МПД. В исследовании участвовало 27 человек с синдромом Кушинга и 64 человека в группе контроля. Исследование кортизола слюны проводилось при помощи радиоиммунологического анализа, была выработана точка разделения для кортизола слюны 1,9 нмоль/л, при этом чувствительность составила 100%, специфичность 94% [Zina Barrou, Dominique Guiban, Amel Maroufi, Claudine Fournier, Marie-Annick  Jean-Pierre Luton and Pierre Thomopoulos. Overnight dexamethasone suppression test: comparison of plasma and salivary cortisol measurement for the screening of Cushing's syndrome. Eur J Endocrinol January 1, 1996 134 93-96; doi: 10.1530/eje.0.1340093]. Тем не менее, и в данном исследовании не было когорты пациентов с ожирением. Существует ограничение самих методов исследования, а именно радиоиммунный анализ сопряжен с лучевой нагрузкой и, в настоящее время, редко используется, а метод масс-спектрометрии достаточно дорогостоящий. Оба метода предполагают предварительное накапливание биологических образцов для максимального использования диагностического набора. ЭХЛА проводится на автоматическом анализаторе и позволяет быстро получить результат у индивидуального пациента при определении кортизола как в крови, так и в слюне.
Jean-Pierre Luton and Pierre Thomopoulos. Overnight dexamethasone suppression test: comparison of plasma and salivary cortisol measurement for the screening of Cushing's syndrome. Eur J Endocrinol January 1, 1996 134 93-96; doi: 10.1530/eje.0.1340093]. Тем не менее, и в данном исследовании не было когорты пациентов с ожирением. Существует ограничение самих методов исследования, а именно радиоиммунный анализ сопряжен с лучевой нагрузкой и, в настоящее время, редко используется, а метод масс-спектрометрии достаточно дорогостоящий. Оба метода предполагают предварительное накапливание биологических образцов для максимального использования диагностического набора. ЭХЛА проводится на автоматическом анализаторе и позволяет быстро получить результат у индивидуального пациента при определении кортизола как в крови, так и в слюне.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа неинвазивной диагностики эндогенного гиперкортицизма.
Поставленная задача решается заявляемым способом, включающим забор слюны с последующим определением концентрации кортизола и степени подавления его уровня на фоне проведения пробы с дексаметазоном, при этом слюну отбирают вечером в 23:00±30 минут, с последующим приемом 1 мг дексаметазона, через 9-10 часов проводят повторный забор слюны с определением концентрации кортизола, при этом определение кортизола осуществляют электрохемилюминисцентным методом, в случае содержания кортизола в вечерней пробе слюны менее 9,4 нмоль/л и в утренней пробе слюны после дексаметазона менее 12,0 нмоль/л делают вывод об отсутствии гиперкортицизма, в случае содержания кортизола в вечерней пробе слюны равной или более 9,4 нмоль/л и в утренней пробе слюны равной или более 12,0 нмоль/л делают вывод о присутствии гиперкортицизма, в остальных случаях требуется проведение дополнительного исследования. При этом для сбора пробы слюны рекомендуется использовать систему Salivette Sarstedt. Исследование кортизола в слюне проводят на анализаторах, пригодных для проведения электрохемилюминесцентного анализа со стандартными наборами для определения кортизола. Предпочтительно использовать автоматический анализатор Cobas е 601 фирмы F. Hoffmann-La Roche Ltd., также возможно использование автоматических анализаторов Elecsys 1010 и 2010, Cobas е411 фирмы F. Hoffmann-La Roche Ltd. Предпочтительно в качестве набора для определения кортизола использовать диагностический набор Cortisol кат. №11875116 122.
Техническим результатом заявляемого изобретения является разработка способа неинвазивной диагностики эндогенного гиперкортицизма с высокой степенью специфичности более (90%) при сохранении чувствительности, особенно для пациентов с ожирением.
Краткое описание чертежей
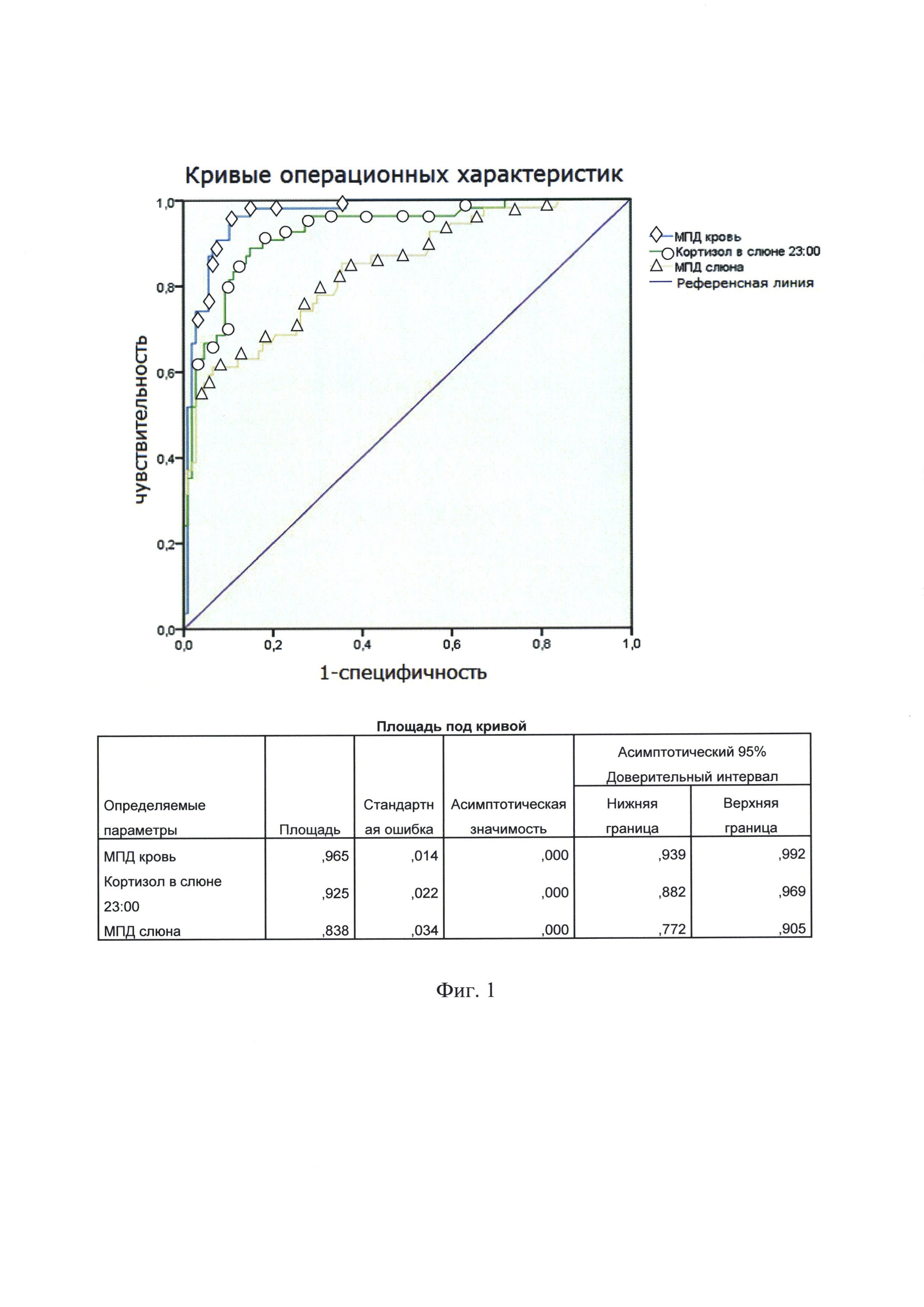
На фиг. 1 представлены кривые операционных характеристик для трех методов диагностики. Площади под кривыми операционных характеристик для определения кортизола в слюне в 23:00, кортизола в крови и в слюне в ходе МПД, где  - МПД
- МПД
кровь,  - кортизол в слюне 23:00,
- кортизол в слюне 23:00,  - МПД слюна,
- МПД слюна,  референсная линия.
референсная линия.
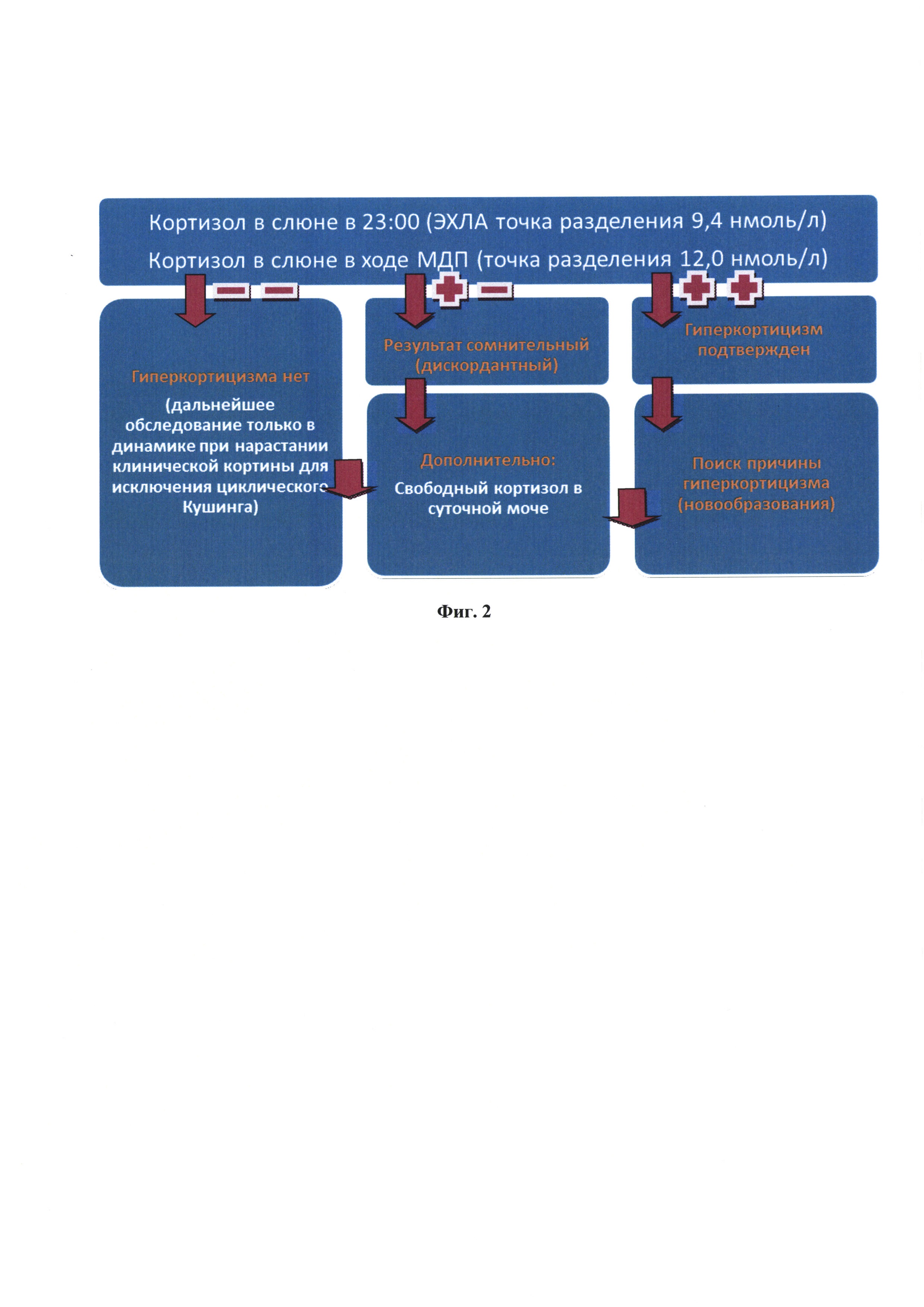
На фиг. 2 представлена общая схема диагностики эндогенного гиперкортицизма.
Осуществление изобретения
Для осуществления способа неинвазивной диагностики эндогенного гиперкортицизма, проводят забор слюны и определение кортизола в слюне пациента отобранной вечером ориентировочно в интервале 22:30-23:30. При этом за час до исследования исключались прием пищи, курение и чистка зубов, при которой возможна травматизация и кровоточивость десен. С последующим приемом дексаметазона 1 мг (2 таблетки). Через 9-10 часов пациент повторно сдает материал слюны, соблюдая вышеизложенные условия, с последующим определением концентрации кортизола (ориентировочно на следующий день в 08:00±30 мин). Определение концентрации (содержания) кортизола в слюне проводят электрохемилюминесцентным методом (ЭХЛА) на анализаторе Cobas е 601 фирмы F. Hoffmann-La Roche Ltd стандартными наборами для определения кортизола (диагностический набор Cortisol кат. №11875116 122). Или аналогичных по характеристикам (Elecsys 1010 и 2010, Cobas е411 фирмы F. Hoffmann-La Roche Ltd.). Минимальное содержание слюны, необходимое для проведения анализа - 120 мкл. Образцы подвергаются центрифугированию 5 минут при 2000 оборотов и жидкий остаток образца слюны анализируется сразу или может быть сохранен в холодильнике (в среднем +8°С) до 7 дней или может быть заморожен для отсроченного проведения теста.
Для решения поставленной задачи было проведено когортное проспективное исследование с участием 164 человек (132 женщины и 32 мужчины), из них 54 с верифицированным диагнозом эндогенный гиперкортицизм, 56 с ожирением (ИМТ более 30 кг/м2) и 54 - здоровые добровольцы. Возрастная категория от 17 лет до 77 лет (средний возраст 38,83 года, возрастная медиана составила 34 года). Общая характеристика пациентов, включенных в исследование, сведена в таблице 1.
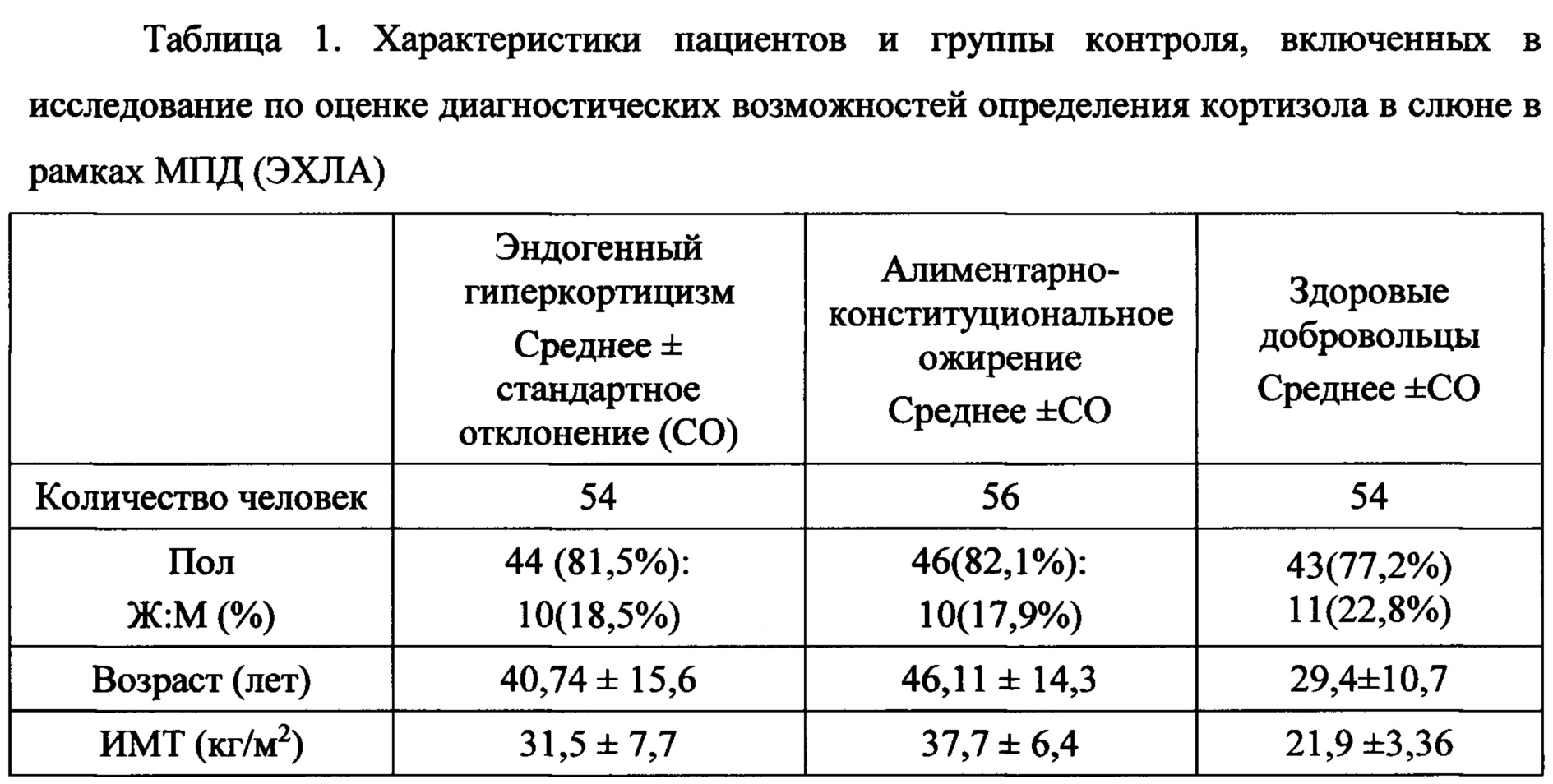
Ж - женщины, М- мужчины
Всем пациентам было выполнено исследование кортизола слюны вечером в 23:00, при этом за час до исследования исключались прием пищи, курение и чистка зубов, при которой возможна травматизация и кровоточивость десен. Забор слюны осуществлялся при помощи системы для сбора слюны Salivette Sarstedt. После сдачи материала вечерней слюны, пациент принимал 1 мг (2 таблетки) дексаметазона. На следующий день в 08:00 пациент повторно сдавал материал слюны, соблюдая вышеизложенные условия, и венозную кровь для определения кортизола в обеих биологических жидкостях (слюне и крови). Исследование кортизола в сыворотке крови и слюне было проведено электрохемилюминесцентным методом (ЭХЛА) на анализаторе Cobas е 601 фирмы F. Hoffinann-La Roche Ltd стандартными наборами для определения кортизола (диагностический набор Cortisol кат. №11875116 122).
Референтный интервал кортизола в слюне в ходе МПД, рассчитанный по данным 54 добровольцев составил 0,5-12,7 нмоль/л (5-95 процентили). Минимальный уровень свободного кортизола в слюне, который удалось определить методом ЭХЛА - 0,5 нмоль/л (лабораторная чувствительность метода). Максимальный уровень кортизола слюны в рамках МПД у здоровых добровольцев - 29,6 ммоль/л. Максимальный уровень вечернего кортизола в слюне у здоровых добровольцев - 20,4 нмоль/л.
По результатам исследования было выполнено сравнение чувствительности и специфичности кортизола слюны в ходе МПД по сравнению с кортизолом крови и кортизолом слюны, собранной в 23:00. Данные были проанализирована при помощи статистической программы IBM SPSS Statistics 23, выполнен ROC-анализ.
При сравнении площадей под кривой операционных характеристик (AUC) были получены следующие результаты: для кортизола слюны в ходе МПД - 0,838, (95% ДИ 0,772-0,905), для кортизола в крови в ходе МПД - 0,965, (95% ДИ 0,939-0,992) и кортизола слюны, собранной в 23:00 - 0,925, (95% ДИ 0,882-0,969). Были проанализированы оптимальные точки разделения (cut-off) для кортизола в слюне в ходе МПД. Исходя из наибольшей суммы чувствительности и специфичности для разных когорт: для когорты «ожирение+ЭГ» значение кортизола в слюне в ходе МПД составило 12,1 нмоль/л (чувствительность = 60%, специфичность = 92,9%), для когорты «Контроль+ЭГ» значение составило 12,6 нмоль/л (чувствительность = 58,2%, специфичность = 96,2%), для всех когорт точка разделения составила 12,2 нмоль/л (чувствительность = 60,7%, специфичность 93,4%). Учитывая незначительную вариабельность значений точки разделения для разных когорт пациентов, для удобства, было выбрано значение 12,0 нмоль/л. На фиг. 1 представлены кривые операционных характеристик для трех методов диагностики.
При анализе полученных данных отмечена относительно невысокая чувствительность метода определения кортизола в слюне в ходе МПД при очень высокой специфичности. Определение кортизола в крови в ходе МПД наоборот характеризуется высокой чувствительностью, но низкой специфичностью. Данные о диагностических возможностях определения кортизола в слюне в ходе малой пробы с дексаметазоном сведены в таблице 2. 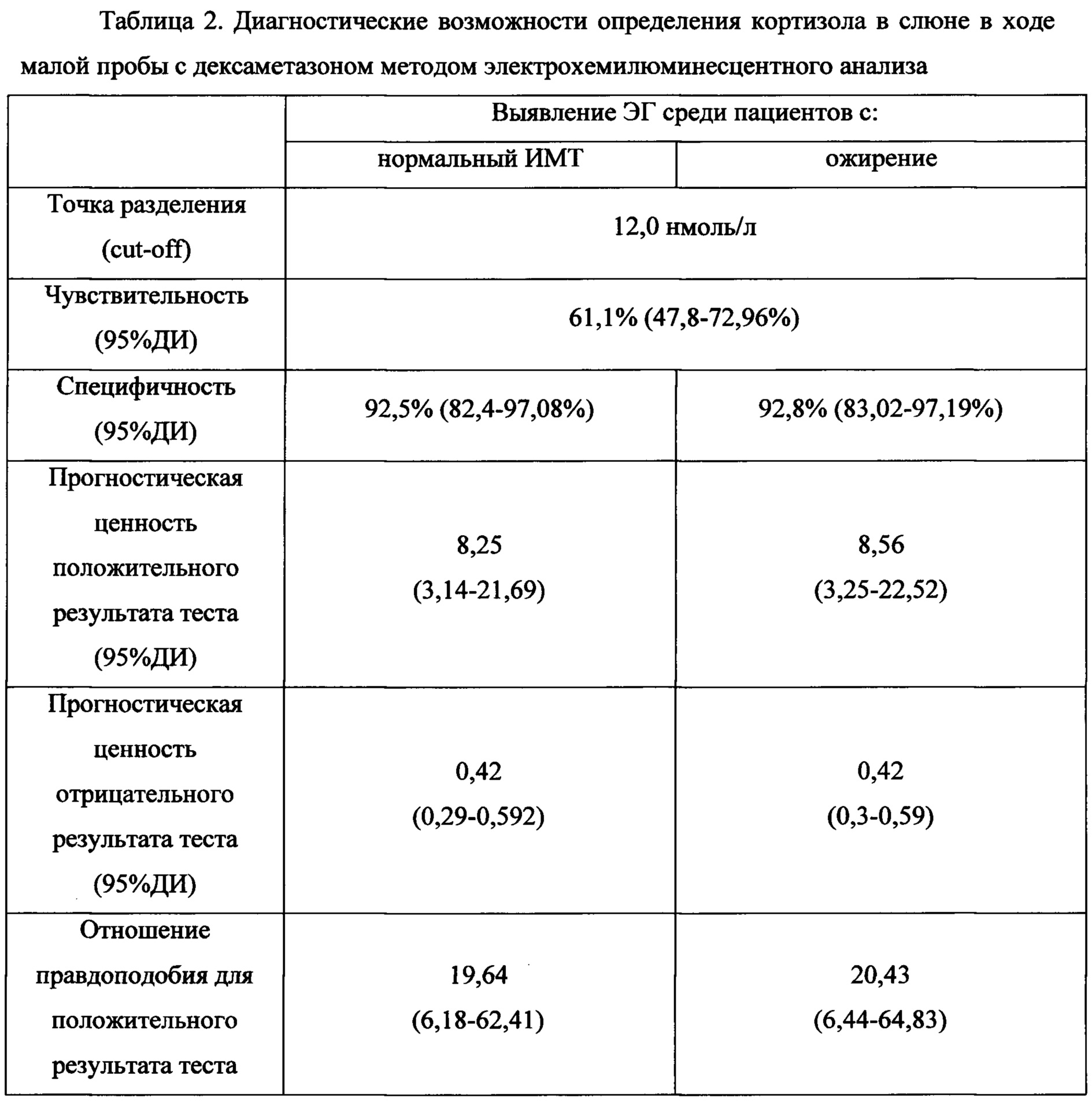
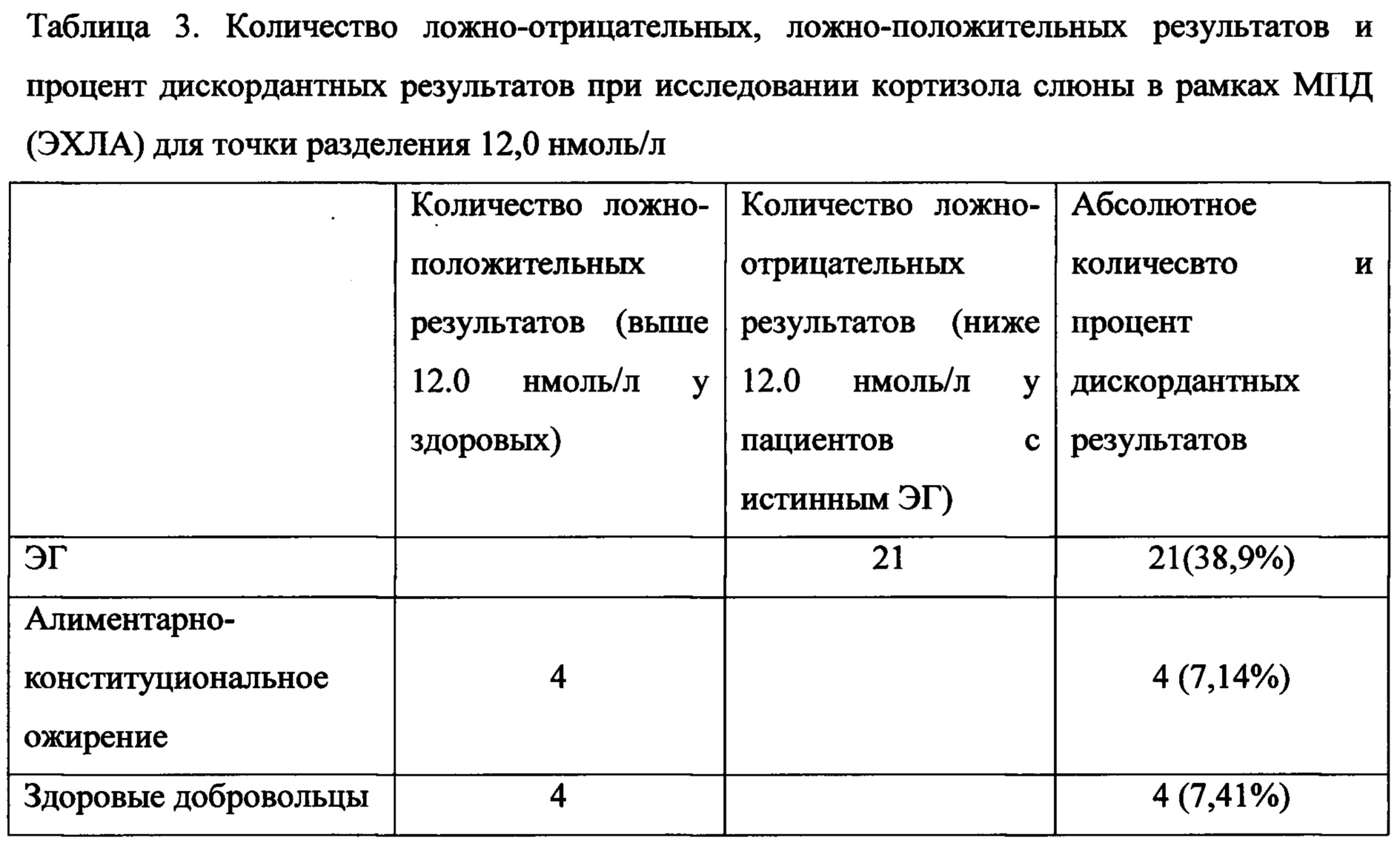
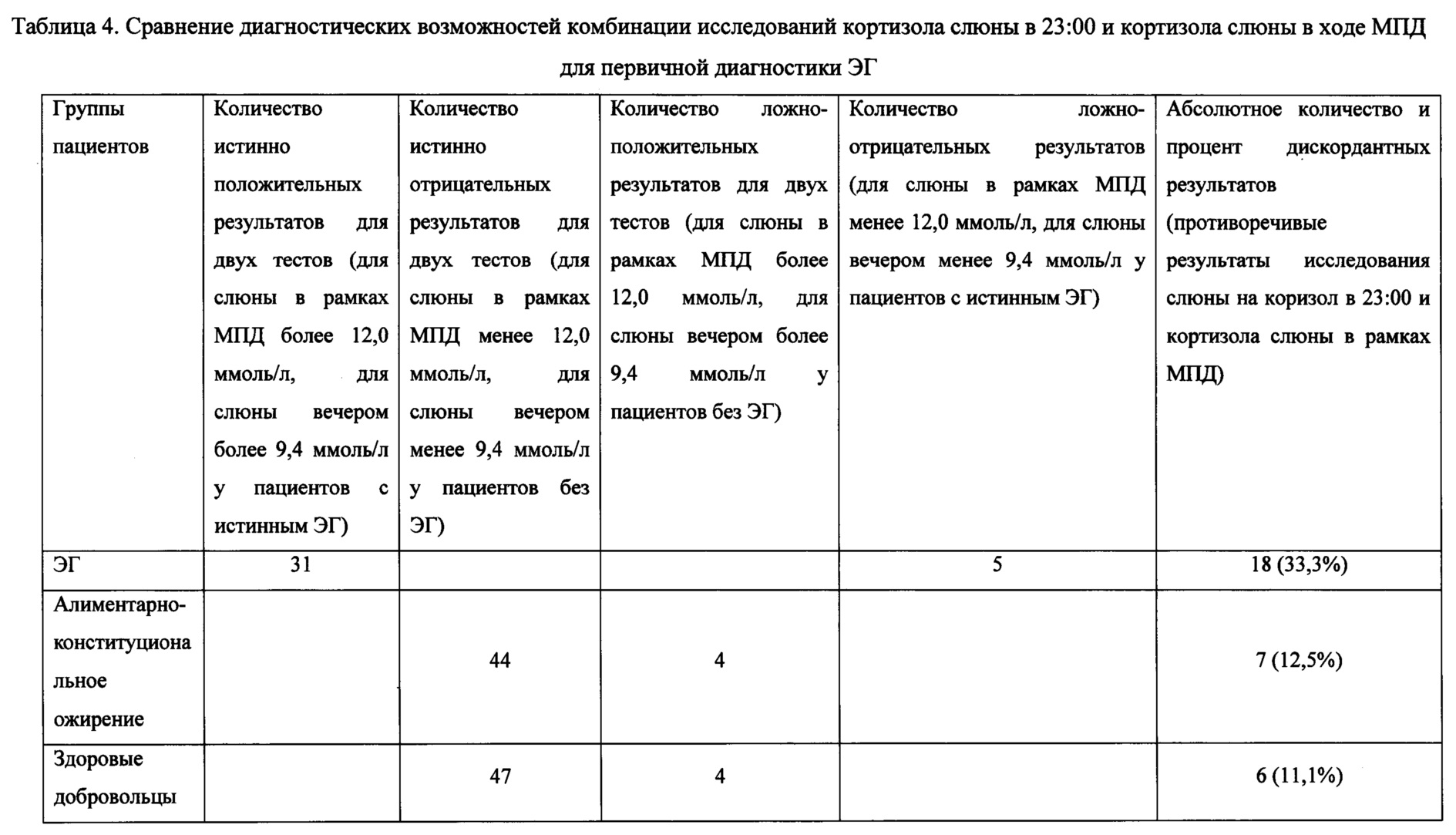
По итогам анализа полученных данных (табл. 2 и 3), можно сделать вывод о возможности использования слюны в рамках малой пробы с дексаметазоном, при этом точкой разделения следует выбрать 12,0 нмоль/л. В данной работе впервые был определен референсный интервал для кортизола слюны в рамках МПД для ЭХЛА. Для диагностики ЭГ этот метод необходимо дополнять исследованием слюны на кортизол, собранной в 23:00. При дискордантных результатах слюны вечером и слюны в рамках МПД, в качестве следующего этапа диагностики ЭГ следует провести анализ на кортизол суточной мочи. Данный алгоритм диагностики ЭГ сделает ее полностью неинвазивной и удобной для амбулаторных врачей. Количественные характеристики диагностических возможности комбинации двух неинвазивных тестов сведены в Таблице 4. Таким образом, для однонаправленной комбинации двух неинвазивных тестов определения кортизола в слюне с целью выявления пациентов с ЭГ среди пациентов с ожирением чувствительность составляет 86.1% (95%ДИ 71.3-93.9), специфичность 91.7% (95%ДИ 80.5-96.7); с общим количеством дискордантных результатов - 25, то есть 22.7% из 110 обследованных с ожирением и клинической картиной ЭГ будут нуждаться в проведении дополнительного исследования. Эти данные позволяют рекомендовать комбинацию двух неинвазивных тестов в качестве метода скрининга среди пациентов с ожирением и подозрением на ЭГ.
Исходя из полученных результатов, предлагается ввести в клиническую практику новый, полностью неинвазивный, алгоритм диагностики ЭГ (фиг. 2).
Ниже представлено более детальное описание заявляемого способа, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
Клинический пример №1
У пациентки Э. 34 лет, с морбидным ожирением (ИМТ 44 кг/м2) проводилось исключение ЭГ. Было выполнено исследование вечерней слюны (в 23:00) на кортизол - 2,23 нмоль/л (менее 9,4 нмоль/л), исследование кортизола слюны в рамках МПД - 2,1 нмоль/л (менее 12,0 нмоль/л, проба положительна). Результаты данной комбинации исследований полностью исключают ЭГ. Тем не менее, при исследовании кортизола крови в ходе МПД у данной пациентки отсутствует подавление кортизола ниже 50 нмоль/л (1700 нмоль/л). В качестве дополнительного исследования выполнен сбор суточной мочи на кортизол (264,5 нмоль/сут), что полностью исключает ЭГ. Таким образом, при классической комбинации методов первичной диагностики ЭГ (исследований кортизола слюны в 23:00 и крови в ходе МПД) у пациентки Э. полученные дискордантные данные не позволяют исключить ЭГ и вынуждают клинициста проводить дополнительный диагностический поиск (исследование суточной мочи на кортизол, исследование кортизола крови в 23:00). Тогда как при изначальной комбинации исследований кортизола слюны, собранной в 23:00 и кортизола слюны в ходе МПД, диагноз ЭГ исключается сразу и не приводит к дополнительным расходам на уточняющие методы исследования, ускоряет диагностику ЭГ и минимизируется дискомфорт пациента за счет полностью неинвазивных диагностических исследований.
Клинический пример №2
У пациентки М., 70 лет, с ожирением II степени (ИМТ 37 кг/м2), проводилось исключение ЭГ. Результаты проведенных исследований: кортизол слюны, собранной в 23:00 - 4,0 нмоль/л (менее 9,4 нмоль/л), кортизол слюны в ходе МПД - 11,3 нмоль/л (менее 12,0 нмоль/л), кортизол крови в ходе МПД - 314 нмоль/л (при норме менее 50 нмоль/л), кортизол суточной мочи - 130,5 нмоль/сут (60-413 нмоль/сут). Таким образом, наблюдается дискордантность результатов при классической комбинации исследований кортизола слюны в 23:00 и кортизола крови в ходе МПД, что привело к необходимости в проведении дополнительных исследований (сбор суточной мочи на кортизол). Тогда как при комбинации исследований кортизола слюны в 23:00 и кортизола слюны в ходе МПД диагноз ЭГ исключается сразу.
Клинический пример №3
У пациентки К., 56 лет проводилось исключение ЭГ. Данные проведенного обследования: кортизол слюны, собранной в 23:00 - 8,8 нмоль/л (менее 9,4 нмоль/л), кортизол слюны в ходе МПД - 6,6 нмоль/л (менее 12,0 нмоль/л), кортизол крови в ходе МПД - 110,7 нмоль/л (при норме менее 50 нмоль/л), кортизол суточной мочи - 101,0 нмоль/сут (60-413 нмоль/сут). В данном случае в очередной раз наблюдается преимущество комбинации исследований кортизола слюны в 23:00 и кортизола слюны в ходе МПД перед классической комбинацией с исследованием крови в рамках МПД, так как в первом случае нет дискордантности результатов исследований и диагноз ЭГ исключается сразу.
Клинический пример №4
Пациентка И. (45 лет) находилась в отделении нейроэндокринологии и остеопатии ФГБУ НМИЦ Эндокринологии МЗ РФ с диагнозом «Пролактин-секретирующая аденома гипофиза». Также у пациентки имелось Ожирение II степени (ИМТ 36,6 кг/м2). В целях исключения смешанной секреции аденомы гипофиза у пациентки с ожирением было проведено гормональное исследование: кортизол слюны, собранной в 23:00 - 2,75 нмоль/л, кортизол крови утром в ходе МПД - 28,47 нмоль/л, кортизол слюны утром в ходе МПД - 0,5 нмоль/л. Полученные данные однозначно исключают ЭГ.
Клинический пример №5
Пациентка М. (39 лет) находилась в отделении нейроэндокринологии и остеопатий по поводу подозрения на Болезнь Иценко-Кушинга (АКТГ-зависимый ЭГ). Для подтверждения диагноза было проведено гормональное исследование: кортизол слюны, собранной в 23:00 - 11,33 нмоль/л, кортизол крови утром в ходе МПД - 540 нмоль/л, кортизол слюны утром в ходе МПД - 12,98 нмоль/л. Результаты проведенных исследований подтвердили наличие ЭГ, по результатам МРТ гипофиза выявлена аденома размерами 7.5×9×8.5 мм, пациентке было рекомендовано нейрохирургиченское лечение Болезни Иценко-Кушинга.
Во всех приведенных клинических случаях наблюдается преимущество исследования слюны на кортизол в ходе МПД перед исследованием крови на кортизол в ходе МПД. Данные преимущества связаны, в первую очередь, с высокой специфичностью исследования слюны на кортизол в рамках МПД (92,5%, тогда как специфичность исследования крови на кортизол в рамках МПД 80%). Необходимо обратить внимание на факт включения пациентов с ожирением, то есть с клиническими проявлениями функционального гиперкортицизма.