СПОСОБ ЭКСТРАКЦИИ КАРБОНОВЫХ КИСЛОТ, ПРОДУЦИРУЕМЫХ ПРИ АНАЭРОБНОЙ ФЕРМЕНТАЦИИ ИСХОДЯ ИЗ СБРАЖИВАЕМОЙ БИОМАССЫ
Вид РИД
Изобретение
Настоящее изобретение относится к способу экстракции карбоновых кислот, продуцируемых при анаэробной ферментации исходя из сбраживаемой биомассы. Способ предпочтительно предназначен для экстракции карбоновых кислот из жидкой фазы.
Под сбраживаемой биомассой в данном случае понимают органический субстрат преимущественно непищевого назначения, получаемый исходя из отходов, субпродуктов и попутных продуктов, образованных органическими веществами, то есть биомассу, образующуюся вследствие активности человека бытового, промышленного, сельскохозяйственного, лесохозяйственного, аквакультурного, агропромышленного или животноводческого направления. В порядке неограничительных примеров в качестве органического субстрата можно назвать навоз, органическую фракцию бытового мусора, попутные продукты скотобоен, целлюлозные или лигноцеллюлозные остатки, происходящие из агропромышленности, такие как остатки, образующиеся при переработке сахарного тростника (багасса), подсолнечника или сои.
Под анаэробной ферментацией понимают ферментацию, осуществляемую в анаэробных условиях микроорганизмами, эукариотами или прокариотами, такими как бактерии, грибы, водоросли или дрожжи.
Среди метаболитов ферментации карбоновые кислоты представляют собой метаболиты ферментации, называемые предшественниками, при этом, разумеется, другие метаболиты ферментации также называют предшественниками. В качестве неограничительных примеров могут быть названы уксусная, пропионовая, масляная, валериановая, капроновая, гептановая, октановая, нонановая и фенилуксусная кислоты. Эти предшественники позволяют впоследствии получать соединения, которые представляют больший интерес в энергетическом и/или химическом аспекте, при этом, разумеется, речь идет об органических соединениях. В качестве соединений, представляющих интерес в энергетическом и/или химическом аспекте, можно назвать, например, соединения, содержащие углеродную цепь, такие как кислоты, углеводороды, метан, сложные эфиры, спирты, амиды, полимеры.
В дальнейшем описание будет относиться к карбоновым кислотам, при этом, разумеется, настоящее изобретение относится к экстракции метаболитов ферментации в общем случае. Карбоновые кислоты, предпочтительно летучие жирные кислоты или AGV, могут быть превращены, например, в кетоны, алканы, спирты, алкены. Понятно, что в результате такой ферментации образуются также другие метаболиты, отличающиеся от карбоновых кислот, при этом в более или менее значительном количестве. В числе других метаболитов можно назвать сложные эфиры, газы, молочную кислоту, спирты, водород и диоксид углерода. В то же время известно, что продуцирование карбоновых кислот, происходящее при анаэробной ферментации, вызывает подкисление среды, вредящее микроорганизмам. Подкисление среды, вызывающее ингибирование микроорганизмов, то есть замедление и даже остановку ферментации, обуславливает необходимость работать в периодическом режиме. В силу этого карбоновые кислоты экстрагируют во время разных стадий после ферментации в течение заданного времени. Таким образом, такая экстракция не позволяет осуществлять быстрое и непрерывное продуцирование соединений, называемых предшественниками, при этом выход не является оптимальным. К тому же, способ экстракции в периодическом режиме ведет к расходованию культуры микроорганизмов и образованию отходов, являющихся малоприемлемыми или неприемлемыми для дальнейшей переработки. Представляет интерес осуществление оптимальной экстракции карбоновых кислот, продуцируемых при анаэробной ферментации без ингибирования микроорганизмов. Из WO-A-2011/063391 известен способ экстракции заданного метаболита, в данном случае бутанол, экстрагирующим сольвентом, содержащим карбоновую кислоту. Сольвент представляет собой сольвент, имеющийся в торговой сети. Из FR-A-2 591 505 известен также способ обработки воды, позволяющий экстрагировать органические соединения, в числе которых амины, аминокислоты и фенолы, используя в качестве сольвента органический сольвент, в данном случае жидкую и несмешивающуюся с водой карбоновую кислоту, для получения органической и водной фракций. Оказалось, что эти способы неприемлемы для экстракции метаболитов, таких как карбоновые кислоты, продуцируемые в непрерывном режиме при ферментации.
Настоящее изобретение более предпочтительно направлено на устранение этих недостатков за счет разработки способа экстракции, позволяющего в непрерывном режиме биологически совместимым, равномерным и управляемым образом, с образованием минимального количества отходов, неприемлемых для дальнейшей переработки, и без ингибирования микроорганизмов получать различные метаболиты ферментации, называемые предшественниками и получаемые анаэробной ферментацией.
В связи с этим, целью настоящего изобретения является способ экстракции карбоновых кислот с числом атомов углерода от одного до девяти, продуцируемых микроорганизмами в реакторе ферментации при анаэробной ферментации исходя из сбраживаемой биомассы, причем указанная экстракция представляет собой экстракцию типа "жидкость-жидкость", а способ отличается тем, что он включает в себя по меньшей мере следующие стадии, на которых:
a) выбирают эндогенный экстрагирующий сольвент по меньшей мере из одной из карбоновых кислот, продуцируемых во время анаэробной ферментации, так чтобы число атомов углерода в молекуле сольвента превышало или было равно числу атомов углерода в молекуле экстрагируемой карбоновой кислоты, имеющей плотность меньше плотности воды и температуру кипения, превышающую 70°C в нормальных условиях по давлению;
b) выбранный экстрагирующий сольвент приводят в контакт с ферментируемой средой вне реактора ферментации без прерывания ферментации;
c) отделяют метаболиты ферментации от экстрагирующего сольвента по меньшей мере одной перегонкой;
d) собирают и хранят или используют метаболиты ферментации, полученные на стадии c).
Такой способ позволяет в непрерывном режиме экстрагировать метаболиты ферментации, сохраняя продуцирующую способность микроорганизмов, содержащихся в биореакторе.
Термин "эндогенный" следует понимать в смысле обозначения соединения или смеси соединений, которые получают, но не в исключительном порядке, анаэробной ферментацией. Иными словами, эндогенный сольвент может быть получен другими путями, которые приводят к получению соединения, которое если не идентично, то подобно соединению, продуцируемому во время анаэробной ферментации независимо от продуцируемого количества.
Стадия экстракции позволяет не только отбирать в непрерывном режиме соединения, продуцируемые в реакторе ферментации, но также и сохранять микроорганизмы, ответственные за это продуцирование, причем экстракцию осуществляют эндогенным сольвентом в условиях, которые не являются летальными для сообщества микроорганизмов, то есть в биологически приемлемых условиях экстракции. Таким образом, устраняются проблемы, связанные с накоплением предшественников в реакторе ферментации, например подкисление ферментируемой среды вследствие накопления продуцируемых карбоновых кислот, являющихся вредными для микроорганизмов. При этом поддерживается высокий уровень активности микроорганизмов, близкий к исходному уровню, в течение всего цикла ферментации.
Согласно предпочтительным, но не обязательным вариантам настоящего изобретения такой способ может отличаться одной или несколькими из следующих характеристик:
- на стадии a) эндогенный экстрагирующий сольвент представляет собой карбоновую кислоту по меньшей мере с четырьмя атомами углерода;
- после стадии c) и перед стадией d) на дополнительной стадии e) карбоновые кислоты перегонкой отделяют от воды органической фракции, полученной на стадии c);
- экстрагирующий сольвент представляет собой карбоновую кислоту с числом атомов углерода от четырех до девяти;
- экстрагирующий сольвент представляет собой карбоновую кислоту с семью или восемью атомами углерода;
- экстрагирующий сольвент выбирают из гептановой, октановой или нонановой кислоты;
- дополнительная стадия f) декантации между стадиями c) и d) обеспечивает первое разделение органической и водной фракций;
- во время приведения в контакт ферментируемой среды и экстрагирующего сольвента вне реактора ферментируемую среду отбирают в непрерывном режиме;
- во время приведения в контакт ферментируемой среды и экстрагирующего сольвента вне реактора ферментируемую среду отбирают периодически;
- после стадий b) и c) по меньшей мере часть жидкой фракции, выходящей после экстракции, снова подают в реактор ферментации и вводят в ферментируемую среду.
Настоящее изобретение относится также к установке для осуществления способа соответственно одной из указанных ранее характеристик, отличающейся тем, что она включает в себя по меньшей мере:
- реактор ферментации;
- устройство для экстракции, приемлемое для обеспечения приведения в контакт ферментируемой среды и экстрагирующего сольвента;
- по меньшей мере одно устройство для перегонки.
Согласно предпочтительным, но не обязательным вариантам настоящего изобретения такая установка может отличаться одной или несколькими из следующих характеристик:
- установка включает в себя также по меньшей мере два устройства для перегонки и по меньшей мере одно устройство для декантации.
Настоящее изобретение может быть понято лучше, а другие его преимущества могут проявиться более ясно при чтении описания нескольких вариантов осуществления настоящего изобретения, приведенных в качестве неограничительных примеров со ссылкой на прилагаемые чертежи, на которых:
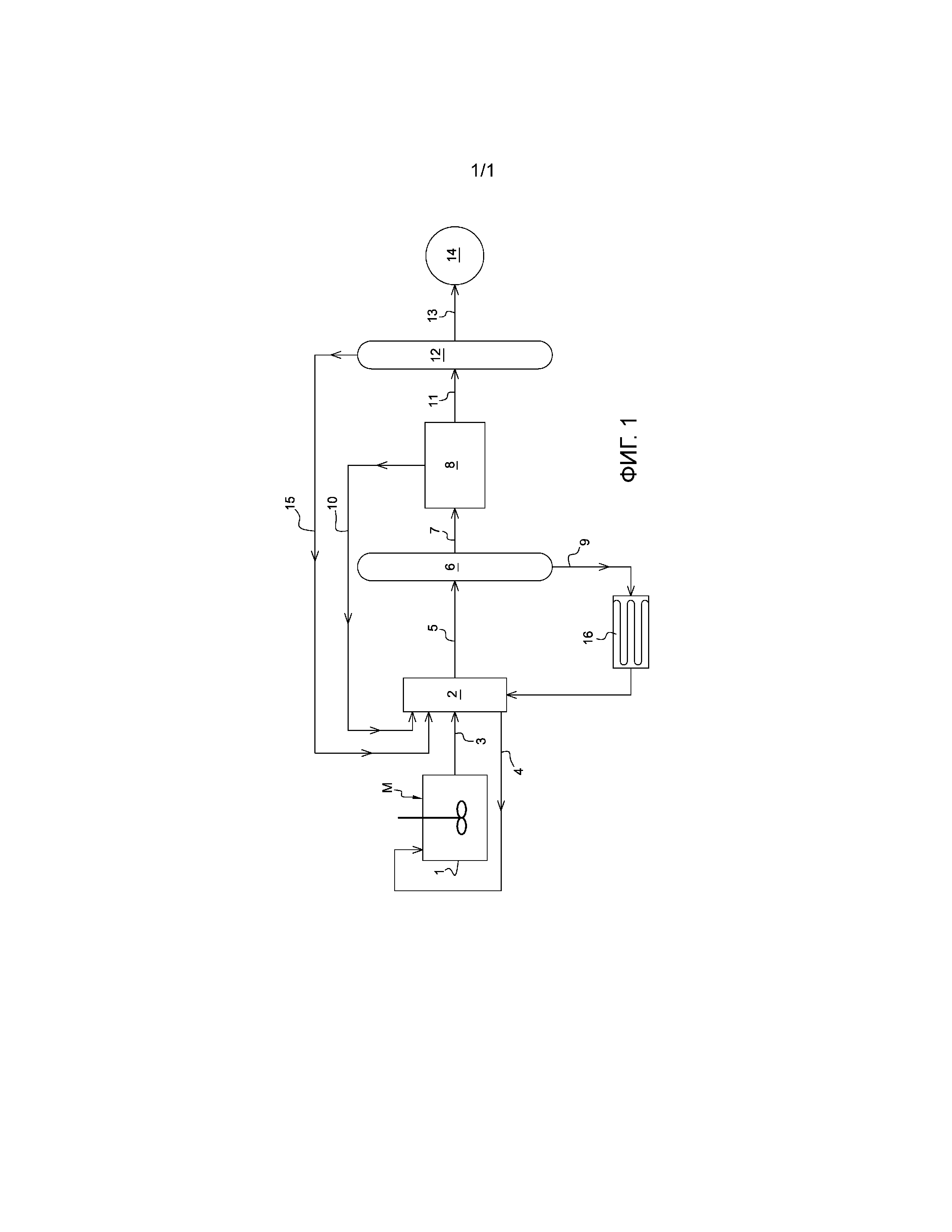
- на фиг. 1 показана упрощенная схема, представляющая вариант осуществления способа по настоящему изобретению с двумя устройствами для перегонки и одним устройством для декантации.
Различные стадии способа описаны согласно фиг. 1, при этом, разумеется, стадии, известные по существу, не изложены подробно. Следует отметить, что на фиг. 1 поясняется способ с двумя устройствами для перегонки, то есть вариант осуществления, который представляет экономически эффективное решение в случае установок с типовыми размерами. Установка с одним устройством для перегонки является технически возможной и даже предпочтительной, но для обеспечения экономической эффективности требуется установка с более значительными размерами, такими как размеры установок, находящихся на нефтеперерабатывающих предприятиях.
В то же время, далее в качестве примера будет описана экстракция карбоновых кислот, при этом, разумеется, эндогенными карбоновыми кислотами могут быть экстрагированы другие метаболиты ферментации.
При этом субстрат S, используемый для анаэробной ферментации, преимущественно представляет собой необработанный субстрат, то есть субстрат, который не подвергался какой-либо предварительной физико-химической или ферментативной обработке. Субстрат S преобладающим образом состоит из сбраживаемой биомассы. В качестве неограничительных примеров можно назвать сельскохозяйственные или растительные отходы (солома, багасса, кукурузная гуща, трава, древесина, остатки от покоса травы), отходы бумажной промышленности (картон, бумага), пищевые отходы, отходы скотобоен, органические компоненты бытового мусора, стоки животноводческих ферм (навоз, навозная жижа, помет), водоросли, отходы аквакультуры, отходы от лесохозяйственной деятельности или также сбраживаемые попутные продукты производства косметических средств. Некоторые субстраты содержат органические соединения, такие как органические кислоты, влияние которых на процесс ферментации будет отсутствовать или окажется второстепенным. Более того, эти соединения могут содержаться в ферментируемой среде и могут участвовать, например, в продуцировании заданных конечных органических соединений.
Субстрат S вводят в реактор ферментации 1, известный по существу и масштабированный для требуемой производительности, так чтобы она соответствовала лабораторному масштабу, принятому для осуществления испытаний, или промышленному масштабу в случае производства. Иными словами, реактор ферментации 1 или биореактор имеет объем, варьирующий от нескольких литров до нескольких сотен кубических метров в зависимости от потребностей.
Микроорганизмы преимущественно вводят в начальный момент в реактор ферментации 1 в количестве, достаточном для начала ферментации. Микроорганизмы преимущественно вводят в форме конгломерата, отмеченного стрелкой M. Под термином "конгломерат" понимают смесь или микст микроорганизмов, эукариотов и прокариотов, при этом в данном случае речь идет о бактериях, дрожжах, грибах или водорослях. Эти микроорганизмы происходят в основном из природных экосистем, преимущественно, но не в исключительном порядке из анаэробных экосистем, таких как приводимые в порядке неограничительных примеров анаэробные зоны водных сред, такие как бескислородные зоны некоторых озер, почвы, болота, активный ил очистных сооружений, рубцы жвачных животных или кишечники термитов. Следует принимать во внимание то обстоятельство, что качественное и количественное распределение разных типов и видов микроорганизмов в конгломерате M не является точно известным и, как правило, может изменяться в широких пределах. Оказалось, что это качественное и количественное разнообразие неожиданным образом обуславливает устойчивость и приспособляемость микроорганизмов, что позволяет обеспечить оптимальное использование субстратов независимо от их состава и в переменных условиях ферментации.
В то же время, в силу того, что субстрат S используют в первичном виде, то есть его не стерилизуют или, в более общем случае, не освобождают от микроорганизмов, которые он содержит перед его введением в биореактор 1, оказалось, что эндемичные микроорганизмы субстрата S фактически включаются в конгломерат M или по меньшей мере ассоциируются в биореакторе 1 с указанным конгломератом.
Конгломерат микроорганизмов M, ассоциированный с микроорганизмами, которые могут содержаться в субстрате 1, обеспечивает ферментацию субстрата S, при этом без прибавления таких веществ, как ферменты. В то же время, ферментация протекает в анаэробных условиях и более точно тогда, когда редокс-потенциал составляет меньше -200 мВ и преимущественно находится в интервале от -550 до -200 мВ, а значение pH составляет меньше 8 и предпочтительно находится в интервале от 4 до 7. Ферментация преимущественно ограничивается продуцированием метаболитов ферментации, называемых предшественниками, а именно карбоновых кислот. Так, например, индуцируется реакция, подобная феномену ацидоза, встречающегося у жвачных животных, при этом продуцирование метана приближается к нулю. Метан в общем случае представляет собой один из конечных метаболитов ферментации, получаемых во время анаэробной ферментации микроорганизмами, происходящими из природных экосистем.
Ферментация в первый период ведет к образованию карбоновых кислот с числом атомов углерода от одного до девяти и в основном от двух до четырех атомов углерода, таких как уксусная, пропионовая и масляная кислоты. Также образуются карбоновые кислоты с более длинными цепями, то есть с числом атомов углерода больше четырех, такие как валериановая, капроновая, гептановая, октановая или нонановая кислота. Продолжая ферментацию и/или увеличивая количество микроорганизмов в биореакторе 1, в случае необходимости селективными микроорганизмами можно благоприятствовать продуцированию карбоновых кислот с более длинными углеродными цепями, то есть с числом атомов углерода больше четырех.
Иными словами, метаболиты, продуцируемые в достаточном количестве во время ферментации, в основном представляют собой карбоновые кислоты с числом атомов углерода от двух до шести. В дальнейшем описании экстракция будет относиться в основном к экстракции карбоновых кислот, при этом, разумеется, способ может быть осуществлен в случае других карбоновых кислот или других метаболитов ферментации, продуцируемых во время ферментации других типов.
Ферментация предпочтительно может быть осуществлена в непрерывном режиме, в периодическом режиме или партиями или также прерывисто-непрерывным способом или с периодической подпиткой в одном или в нескольких реакторах ферментации 1, соединенных последовательно.
Во всех случаях ферментацию производят для обеспечения продуцирования карбоновых кислот в жидкой фазе. Таким образом, легко понять, что ферментируемая среда содержит твердую фракцию, включающую, по меньшей мере в начальный момент, твердую фракцию субстрата S, а также твердую фракцию конгломерата микроорганизмов M.
Жидкая фракция ферментируемой среды содержит соединения, продуцируемые во время ферментации, или метаболиты ферментации, а также жидкую фракцию субстрата S по меньшей мере в начале ферментации.
Продолжительность ферментации изменяется, в частности, в зависимости от субстрата S, содержащихся микроорганизмов M и условий ферментации. Как правило, период ферментации составляет от 1 до 7 суток и предпочтительно от 2 до 4 суток. Концентрация метаболитов, получаемая в ферментируемой среде по окончании этого периода, варьирует, но в случае карбоновых кислот обычно составляет от 10 до 20 г/л в зависимости от карбоновых кислот, при этом, разумеется, в некоторых условиях она может превышать 35 г/л, например может составлять около 50 г/л. В конце стадии ферментации ферментируемая среда имеет кислую реакцию при значении pH, которое находится в общем случае в интервале от 4 до 6, в силу присутствия в ферментируемой среде карбоновых кислот.
Когда при продуцировании заданных метаболитов, например карбоновых кислот, посредством ферментации субстрата S достигается заданное количество, в общем случае в стадии стабильного режима ферментации, начинают стадию экстракции соединений.
Предпочтительно, но не обязательно, заданное количество карбоновых кислот соответствует замедлению роста микроорганизмов и, следовательно, находится вблизи порога ингибирования микроорганизмов, которое связано с подкислением ферментируемой среды карбоновыми кислотами.
Экстракция представляет собой экстракцию типа "жидкость-жидкость". Экстрагирующий сольвент представляет собой эндогенный сольвент, то есть сольвент, выбранный по меньшей мере из одного из соединений, продуцируемых во время ферментации. Понятно, что сольвент может представлять собой смесь нескольких соединений, продуцируемых во время ферментации. В данном случае эндогенный сольвент выбирают из карбоновых кислот, составляющих часть метаболитов ферментации.
Действительно, в отличие от других органических сольвентов карбоновые кислоты образуются во время ферментации. Применение такого эндогенного сольвента имеет несколько преимуществ.
Прежде всего, таким образом гарантируется отсутствие соединений, отличающихся от соединений, образующихся при ферментации: то есть отсутствует органический сольвент, в отношении которого есть риск обнаружить его следы в конечном продукте.
С карбоновыми кислотами можно, в частности, экстрагировать не только карбоновые кислоты, но также другие метаболиты, такие как спирты, амины, аминокислоты и ароматические соединения, такие как фениловые кислоты. К тому же, при экстракции типа "жидкость-жидкость" неизбежны потери сольвента. Они происходят во время хранения, во время перегонки и даже во время ферментации, если сольвент является приемлемым для потребления микроорганизмами. Следовательно, требуется осуществлять добавку сольвента, что вызывает затраты и связано с дополнительными ограничениями в отношении транспортировки и окружающей среды.
За счет использования эндогенного сольвента, образующегося во время анаэробной ферментации, такого как карбоновая кислота, этот вариант позволяет компенсировать, по меньшей мере частично, потери сольвента.
В то же время, такой эндогенный сольвент позволяет избегать любой риск нежелательной и/или неконтролируемой реакции сольвента с летучими жирными кислотами, продуцируемыми во время ферментации, и не только с ними, но в более общем случае и с соединениями, образующимися при ферментации.
Наконец, применение карбоновой кислоты в качестве сольвента вносит свой вклад в снижение значения pH водной фракции во время экстракции.
Карбоновые кислоты, которые продуцируются во время ферментации, используются в качестве сольвента и могут содержаться в ферментируемой среде, представляют собой, в качестве примера и не в исключительном порядке, кислоты с числом атомов углерода от четырех до девяти.
Во всех случаях следует выбирать карбоновую кислоту так, чтобы число атомов углерода в ее молекуле превышало или было равно числу атомов углерода в молекуле экстрагируемого метаболита.
Неограничительные примеры таких кислот, продуцируемых во время ферментации, представлены в приведенной далее таблице 1.
В таблице 1 приведены значения плотности при комнатной температуре, то есть приблизительно при 20°C.
Таблица 1
|
Более конкретно, заявителем, исходя из осуществленных испытаний, установлено, что карбоновые кислоты с числом атомов углерода от шести до девяти и предпочтительно с семью или восемью атомами углерода представляют собой особенно предпочтительные эндогенные сольвенты. Иными словами, исходя из карбоновых кислот, указанных в таблице 1 неограничительным образом и в качестве примеров, заявителем в качестве эндогенного сольвента приняты капроновая, гептановая и октановая кислоты. В качестве варианта, могут быть использованы изомеры этих кислот.
Соединения, то есть в данном случае метаболиты ферментации, предпочтительно экстрагируют по отдельности или по меньшей мере экстрагируют группами соединений исходя из жидкой фракции ферментируемой среды, что обеспечивает, кроме того, более высокие выходы и легкость получения специфических соединений исходя из этих экстрагированных соединений.
Во всех случаях, содержащиеся метаболиты по меньшей мере частично экстрагируют в таких условиях, что экстракция не разрушает и не ингибирует микроорганизмы M или по меньшей мере оказывает такое действие в масштабах, которые не изменяют ощутимым образом продолжение ферментации микроорганизмами M, содержащимися в ферментируемой среде. Иными словами, сольвент не является губительным для сообщества микроорганизмов. Следовательно, экстракция не вызывает ни эффекта вмешательства, ни эффекта деградации как в отношении ферментируемой среды, так и в отношении ферментативных способностей микроорганизмов M, которые содержатся в ней. Следовательно, экстракция осуществляется в таких условиях, что она является биологически совместимой.
Когда из ферментируемой среды экстрагируют такие соединения, как карбоновые кислоты, то фактически уменьшают подкисление ферментируемой среды этими кислотами. Таким образом, ферментация и, следовательно, продуцирование метаболитов продолжаются в условиях, аналогичных начальным условиям, причем ферментируемая среда остается слабокислой.
При этом, как преимущество, обнаружилось, что жидкая фракция, остающаяся после экстракции, может содержать живые и, следовательно, потенциально активные микроорганизмы M. Поскольку в этой жидкой фракции содержится меньше карбоновых кислот, чем в начальный момент, то значение pH жидкой фракции соответствует менее кислой реакции. Таким образом, ее можно снова вводить в реактор ферментации 1. Таким образом, благодаря экстракции кислых соединений не только уменьшается феномен ацидоза и/или стабилизируется значение pH ферментируемой среды в ходе ферментации, но в некоторой мере осуществляется также повторный засев среды микроорганизмами M, обеспечивающими ферментацию, причем без значительного снижения значения pH ферментируемой среды.
Такое решение позволяет оптимизировать выход ферментации и осуществлять ферментацию в непрерывном режиме, при этом уменьшая продолжительность ферментации с тенденцией снижения образования отходов до нуля.
Экстракцию осуществляют в непрерывном режиме или при последовательном осуществлении экстракции, например, через каждые 12 часов. Иными словами, можно продолжать ферментацию и при этом экстрагировать продуцируемые метаболиты как по мере их продуцирования, так и в постоянном режиме. После экстракции метаболиты очищают и/или перерабатывают в другие продукты, такие как алканы, алкены, амиды, амины, сложные эфиры, полимеры, известными по существу химическими способами, такими как, например, перегонка, синтез, электросинтез, амидирование или полимеризация.
Более конкретно, ферментированную смесь подают в верхнюю часть экстракционной колонны 2 согласно стрелке 3. В колонну 2 предварительно вводят эндогенный сольвент, то есть кислоту или смесь карбоновых кислот. Как было указано ранее, эндогенный сольвент предпочтительно представляет собой карбоновую кислоту с семью или восемью атомами углеродов. Однако в общем случае количество, полученное при ферментации, является недостаточным для обеспечения экстракции большинства других полученных карбоновых кислот. Следовательно, необходимо вводить такие карбоновые кислоты, происходящие из другого источника, отличающегося от осуществляемой ферментации. Речь может идти, например, о карбоновых кислотах, экстрагированных ранее и хранящихся для этого применения, или также кислоты предпочтительно биологического происхождения, поступающие из коммерческого источника.
Противоточная циркуляция или перемешивание, осуществляемые по существу известными средствами, обеспечивает приведение в контакт карбоновых кислот и сольвента. Во время первой стадии карбоновые кислоты или по меньшей мере их часть переходят в сольвент.
Ферментированную смесь, фактически свободную от карбоновых кислот, cобирают в нижней части экстракционной колонны 2 и предпочтительно снова вводят в ферментер 1 согласно стрелке 4. В тех случаях, когда сольвент представляет собой одну из карбоновых кислот, содержащихся в ферментированной смеси, невозможно какое-либо загрязнение сольвентом, вредящее продолжению ферментации вследствие его повторного введения в ферментируемую смесь.
Сольвент с содержащимися в нем карбоновыми кислотами cобирают в верхней части экстракционной колонны 2 и согласно стрелке 5 подают в первую дистилляционную колонну 6. Сольвент и экстрагированные карбоновые кислоты образуют по меньшей мере одну органическую фракцию, способную смешиваться по меньшей мере частично с водой. В данном случае можно напомнить, что описываемый и поясняемый пример соответствует варианту осуществления, в котором работают более чем с одной дистилляционной колонной, а именно с двумя колоннами. Такой вариант осуществления представляет собой вариант, который может иметь место в случае установок средних размеров.
Перегонку осуществляют при температурах, позволяющих селективно отбирать карбоновые кислоты, температура кипения которых меньше, чем у сольвента.
Карбоновые кислоты и воду, выходящую после экстракции, cобирают после перегонки в верхней части колонны 6. Этот поток согласно стрелке 7 охлаждают и направляют в декантатор 8.
Сольвент, который cобирают в нижней части колонны 6, является более тяжелым, чем экстрагированные карбоновые кислоты. Сольвент перенаправляют согласно стрелке 9 в экстракционную колонну 2. Таким образом, сольвент используют повторно, уменьшая потери и ограничивая потребность во внешней подаче эндогенного сольвент.
После декантации водную фракцию отбирают и направляют согласно стрелке 10 в экстракционную колонну 2.
Таким образом, основные карбоновые кислоты органической фракции, отбираемой из нижней части декантатора 8, представляют собой смесь разных карбоновых кислот и в случае необходимости воды в пропорциях, требующих в некоторых случаях дополнительной обработки. Иными словами, за исключением крупных установок, таких как установки, находящиеся на нефтеперерабатывающих предприятиях, для оптимизации соотношения "эффективность/стоимость" может быть резонным осуществлять дополнительную перегонку, как показано на фиг. 1. С этой целью этого карбоновые кислоты направляют согласно стрелке 11 во вторую дистилляционную колонну 12. Таким образом, в дистилляционную колонну 12 вводят раствор, который в основном содержит только органическую фракцию.
После второй перегонки карбоновые кислоты cобирают в нижней части колонны 12, причем их температуры кипения превышают температуру кипения воды, и согласно стрелке 13 направляют в узел 14 сбора и хранения. В случае, когда имеются два устройства для перегонки, представляет интерес размещение по меньшей мере одного устройства для декантации. В одном из вариантов по меньшей мере часть отобранных карбоновых кислот в очищенном виде или в виде смеси направляют непосредственно в устройство, позволяющее синтезировать конечные соединения. Воду, собранную после второй перегонки, согласно стрелке 15 предпочтительно направляют в экстракционную колонну. В то же время, как показано в варианте осуществления, показанном на фиг. 1, в случае неочищенных карбоновых кислот представляет интерес осуществление второго разделения по меньшей мере одной перегонкой для отбора продуктов, которые являются чистыми или по меньшей мере приемлемыми для применения. Таким образом, последовательными перегонками можно отделить любую кислоту. Эти перегонки могут быть осуществлены в одном устройстве для перегонки, если оно имеет соответствующую конструкцию и достаточный размер. На практике, в общем случае речь идет о дистилляционных колоннах, таких как колонны, находящиеся в промышленных установках типа нефтеперерабатывающих предприятий.
В зависимости от условий перегонки предпочтительно следует предусмотреть по меньшей мере один теплообменник 16 для охлаждения сольвента. Рекуперированное таким образом тепло предпочтительно используют для подогрева сольвента, выходящего из верхней части экстракционной колонны, перед его подачей в дистилляционную колонну 6. Таким образом можно уменьшить потребление энергии, необходимое для первой перегонки, причем значительным образом. Понятно, что для этих разных тепловых потоков предусматривают по меньшей мере два теплообменника или только один.
В других вариантах осуществления число и/или размеры различных устройств отличаются от описанных ранее. В частности, можно предусматривать несколько установок, работающих параллельно.
Аналогичным образом, специалисты в данной области техники могут сами выбирать устройства управления и безопасности, традиционно применяемые в установках экстракции и/или перегонки.
Заявителем были проведены испытания согласно различным вариантам осуществления для случая экстракции карбоновых кислот.
Испытание 1. Экстракция гептановой кислотой
Карбоновые кислоты получали в ходе ферментации, которую осуществляли с субстратом, содержавшим фракцию сбраживаемого бытового мусора с концентрацией 50 г/л по сухому веществу (MS). Отбирали 50 мл ферментируемой среды, то есть жидкой фракции. Значение pH этой пробы составляло 4,3. Затем из этих 50 мл осуществляли экстракцию гептановой кислотой в объемном соотношении 1/1. Полученный выход экстракции составил 37%.
Заявителем установлено, что в таких же условиях испытаний получают идентичный выход, используя вместо гептановой кислоты октановую.
Заявителем были проведены также сравнительные испытания по ферментации согласно различным вариантам осуществления с целью оценки влияния присутствия экстрагирующих сольвентов в ферментируемой среде на выход ферментации.
Испытание 2. Сравнение ферментации, осуществляемой в присутствии и в отсутствии гептановой кислоты
Были проведены в течение 160 ч два параллельных испытания по ферментации остатков от покоса газонной травы в нестерильных условиях с концентрацией 25 г/л по сухому веществу в анаэробном биореакторе вместимостью 2 л, работавшем в мезофильном режиме (38°C). В первом испытании после внесения оптимизированной смеси анаэробных микроорганизмов прибавляли начальное количество гептановой кислоты с дозой 2,8 г/л. Присутствие гептановой кислоты позволяет определить степень биологической совместимости экстракции, осуществляемой с сольвентом этого типа. На практике, культуральная среда, вновь вводимая в биореактор после экстракции, может содержать экстрагирующий сольвент от следового количества до количества, определяемого пределом растворимости. Второе испытание по ферментации, выполненное фактически как контрольное, осуществляли параллельно в таких же условиях за исключением прибавления гептановой кислоты.
В ходе этих испытаний по ферментации осуществляли контроль метаболитов в жидкой и газовой фазах. В конце ферментации полученные выходы в расчете на продуцирование летучих жирных кислот составили 0,33 г AGV/г сухого вещества в случае испытания с прибавлением гептановой кислоты и 0,39 г AGV/г сухого вещества в случае контрольной ферментации. Таким образом, установлено, что присутствие сольвента оказывает отрицательное действие в легкой степени, составляющей около 15% в расчете на продуцирование летучих жирных кислот, при сохранении при этом высокого выхода в 30%, что представляет собой как бы то ни было достаточно приемлемое значение в качестве рабочей характеристики.
Присутствие гептановой кислоты в биореакторе обуславливает такое же течение метаболизма, как и в случае избыточного накопления в ферментируемой среде летучих жирных кислот. Уменьшение начальной концентрации гептановой кислоты или выбор в качестве сольвента карбоновой кислоты, имеющей растворимость в культуральной среде меньше, чем у гептановой кислоты, будет позволять достигать значений выхода, эквивалентных значениям, полученным с контрольным образцом культуры.
Для доказательства этого вывода заявителем осуществлено описанное далее испытание.
Испытание 3. Сравнение ферментации, осуществляемой в присутствии и в отсутствии октановой кислоты
Воспроизводили испытание 2 в тех же самых условиях культивирования, но исходя из 50 г/л по сухому веществу пищевых отходов и сравнивая в этот раз значения выходов, полученных во время ферментации с начальным прибавлением 0,7 г/л октановой кислоты, относительно испытания по контрольной ферментации, в случае которой она отсутствует.
В конце ферментации выход составил 0,3 г AGV/г сухого вещества в случае культуры с октановой кислотой и 0,31 г AGV/г сухого вещества в случае контрольной ферментации.
Таким образом, выходы являются эквивалентными, из чего следует вывод, что присутствие октановой кислоты в случае ее максимального растворенного количества, не нарушает ход ферментации.
Осуществление такого способа обуславливает не только наличие в установке по меньшей мере одного реактора ферментации 1, но также и по меньшей мере одной экстракционной колонны 2 и по меньшей мере одной и предпочтительно двух дистилляционных колонн 6 и 12, а также по меньшей мере одного декантатора 8 и в предпочтительном варианте осуществления по меньшей мере одного теплообменника 16. Эти устройства по существу известны, а их число и размеры адаптируют к типу производства.
Такая установка предпочтительно включает в себя также по меньшей мере один узел хранения продуктов, поступающих после экстракции. Средства управления и регулирования, такие как чувствительные элементы для измерения температуры, pH и/или редокс-потенциалов, также предусматривают. При этом контроль активности микроорганизмов осуществляют известными по существу способами, например аналитическим контролем продуцирования газообразных и жидких метаболитов, контролем цитометрией в потоке, способами молекулярной биологии, такими как молекулярные отпечатки или биочипы.