Результат интеллектуальной деятельности: КОВАЛЕНТНО СВЯЗАННЫЕ КОНЪЮГАТЫ ХЕЛИКАР-АНТИТЕЛО ПРОТИВ ХЕЛИКАРА И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
В данном документе описываются (ковалентные) комплексы, содержащие аминокислотную последовательность мотива хеликар и антитело против хеликара, при этом аминокислотная последовательность мотива хеликар присутствует в или конъюгирована с грузом, при этом элемент, содержащий аминокислотную последовательность мотива хеликар и антитело против хеликара ковалентно связаны друг с другом посредством одной связи. Также описаны способы получения ковалентных комплексов и их применения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Главными препятствиями для терапевтического применения полипепидов являются их ограниченная растворимость, стабильность in vivo, короткий период полувыведения в сыворотке и быстрый клиренс из кровотока.
Описаны разные подходы для решения данной проблемы. Однако ни одна из данных технологий не предоставляет надежной и универсальной платформы, которая обеспечивает фармакокинетическую (PK) модуляцию без столкновения с рисками иммуногенности или потенциальной потери биологической активности.
Одним подходом для улучшения PK/стабильности и биофизических характеристик терапевтических полипептидов является их слияние с веществами, которые стабилизируют полипептид, поддерживают его в растворе и продлевают его период полувыведения. Примерами таких соединений являются человеческий сывороточный альбумин или области Fc человеческого иммуноглобулина. Данный подход применим ко многим линейным полипептидам, которые состоят из остатков встречающихся в природе аминокислот, и которые переносят модификации либо на С-, либо на N-конце без потери их биологической активности. Полипептиды, которые являются циклическими, сшитыми, содержат неприродные аминокислотные остатки или дополнительные модификации, не могут быть продуцированы рекомбинантно в виде слитых полипептидов. Однако такие полипептиды могут представлять собой желательный выбор для терапевтических применений, так как они часто превосходят «нормальные» линейные полипетиды в показателях стабильности к протеазам, активности и специфичности.
Один подход для улучшения PK/стабильности и биофизических характеристик терапевтических полипептидов, который также можно применять к полипептидам, которые являются циклическими, сшитыми или содержат неприродные структуры, представляет собой химическое или ферментативное конъюгирование с полимерами, например, посредством ПЭГилирования (ПЭГ - полиэтиленгликоль) или ГЭКилирования (ГЭК - гидроксиэтилкрахмал). Однако такие модификации часто приводят к значительному уменьшению биологической активности полипептида и, при определенных обстоятельствах, могут быть причиной проблем безопасности или токсичности.
Главным недостатком большинства существущих технологий химического связывания для стабилизации или модуляции PK терапевтических полипептидов является их сложность. Наряду со стадией химического связывания, данные способы во многих случаях приводят к смеси полипептидных производных, которые присоединяются к соединению, модулирующему PK, с неопределенными стехиометриями и/или в неопределенных положениях. Дополнительно используемые в настоящее время технологии модификации полипептидов часто приводят к сильно сниженной биологической активности или даже к полной потере биологической активности терапевтического полипептида. Кроме того, сложно прогнозировать фармакологические свойства и/или возможные пути деградации химических конъюгатов.
Элемент хеликар состоит из 12-мерного пептида из аминокислот, образующих α-спираль. Структурные элементы данного пептида описаны в Nygaard et al., также описывающей антитело против хеликара и структуру комплекса с 12-мерным пептидом, частью дрожжевого белка с лейциновой молнией, названного GCN4. Часть антитела в виде Fv подверглась созреванию аффинности с использованием методики фагового дисплея до аффинности 25 пМ (Zahnd, С., et al., J. Biol. Chem. 279 (2004) 18870-18877).
В Metz, S., et al. (Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8424) описаны биспецифичные, связывающиеся с дигоксигенином антитела для целевой доставки груза. Модуляция PK гаптенилированных пептидов через нековалентное комплексообразование с антителом описана Hoffmann, Е., et al. (J. Contr. Rel. 171 (2013) 48-56). В WO 2012/093068 описана фармацевтическая композиция комплекса антитела против dig (дигоксигенин) и дигоксигенина, который конъюгирован с пептидом. Направленная эволюция in vitro и кристаллографический анализ пептидсвязывающего одноцепочечного фрагмента антитела (scFV) с низкой пикомолярной аффинностью описываются в Zahnd, С., et al. (J. Biol. Chem. 279 (2004) 18870-18877). В Hanes, J., et al. (Proc. Natl. Acad. Sci. USA 95 (1998) 14130-14135) описано то, что рибосомальный дисплей эффективно отбирает и вырабатывает in vitro высокоаффинные антитела из иммунных библиотек.
В US 5804371 описаны пептиды, меченные гаптеном, и их применение в иммунологическом способе выявления. Decarie A., et al. (Peptides 15 (1994) 511-518) описаны пептид, меченный дигоксигенином (брадикинин), и его применение для хемилюминоферментативного иммуноанализа брадикинина в воспаленных тканях.
В WO 2004/065569 описаны мультифункциональные антитела.
В WO 2014/006124 описаны ковалентные комплексы гаптен-антитело против гаптена.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Обнаружили, что образование комплекса, опосредованного хеликаром, можно использовать для ковалентного конъюгирования полипептидов, содержащих аминокислотную последовательность мотива хеликар либо на одном из концов, либо внутри полипептидной последовательности. В случае вставки аминокислотная последовательность 12-мерного мотива хеликар либо вставлена внутри последовательности полипептида, либо существующий спиральный мотив модифицирован для включения важных аминокислот, которые участвуют в распознавании антителом против хеликара.
Обнаружили, что посредством ковалентного конъюгирования соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против хеликара можно добиться стабилизации, улучшения PK (фармакокинетический) свойств соединения или, в случае биспецифичного антитела, дополнительного нацеливания.
Один аспект, как описано в данном документе, представляет собой конъюгат, содержащий соединение, содержащее аминокислотную последовательность мотива хеликар, и антитело, которое специфично связывается с аминокислотной последовательностью мотива хеликар, характеризуемый ковалентной связью между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела против хеликара, при этом CDR2 определяется согласно Kabat.
Обнаружили, что в конъюгатах и способах, как описано в данном документе, можно использовать любое соединение при дериватизации аминокислотной последовательностью мотива хеликар, которая содержит функциональный остаток для образования ковалентной связи между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела. Расположение данной функциональной группы в аминокислотной последовательности мотива хеликар имеет то преимущество, что отсутствует необходимость в реконструкции синтеза и положения функциональной группы в CDR2 антитела при замене соединения, дериватизированного мотивом хеликар.
Один аспект, как описано в данном документе, представляет собой конъюгат, содержащий соединение, содержащее аминокислотную последовательность мотива хеликар, и антитело, которое специфично связывается с аминокислотной последовательностью мотива хеликар соединения, содержащего аминокислотную последовательность мотива хеликар (антитело против аминокислотной последовательности мотива хеликар), характеризуемый ковалентной связью между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела, при этом CDR2 определяется согласно Kabat.
В одном воплощении CDR2 представляет собой CDR2 легкой цепи.
В одном воплощении аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARLKK (SEQ ID NO: 01) или ее вариант с одним аминокислотным остатком, замененным на цистеин. В одном воплощении аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARLKK (SEQ ID NO: 01), где один аминокислотный остаток из трех С-концевых аминокислотных остатков заменен на цистеин. В одном воплощении аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARCKK (SEQ ID NO: 02) или AHLENEVARLCK (SEQ ID NO: 03).
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, содержит аминокислотную последовательность мотива хеликар, возможно линкер и груз.
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, представляет собой полипептид, содержащий аминокислотную последовательность мотива хеликар, либо слитую с одним их его концов, либо находящуюся внутри последовательности полипептида. В данном воплощении груз представляет собой полипептид.
Одним аспектом, как описано в данном документе, является конъюгат, содержащий i) соединение, содержащее аминокислотную последовательность мотива хеликар, выбранную из группы, состоящей из SEQ ID NO: 01, варианта SEQ ID NO: 01, где один аминокислотный остаток был заменен на цистеин, SEQ ID NO: 02 и SEQ ID NO: 03, и ii) антитело, которое специфично связывается с аминокислотной последовательностью мотива хеликар, где конъюгат содержит ковалентную связь между аминокислотной последовательностью мотива хеликар и аминокислотным остатком в CDR2 антитела против хеликара, при этом CDR2 определяется согласно Kabat.
В одном воплощении CDR2 представляет собой CDR2 легкой цепи.
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, содержит аминокислотную последовательность мотива хеликар, возможно линкер и груз.
В одном воплощении всех аспектов ковалентная связь образуется между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела.
В одном воплощении ковалентная связь образуется между функциональной группой в соединении, содержащем аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела.
В одном воплощении функциональная группа находится в аминокислотной последовательности мотива хеликар.
В одном воплощении ковалентная связь образуется между остатком цистеина в CDR2 легкой цепи антитела и функциональной группой в соединении, содержащем аминокислотную последовательность мотива хеликар.
В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 или в положении 51 согласно нумерации вариабельного домена легкой цепи по Kabat.
В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
В одном воплощении всех аспектов ковалентная связь представляет собой дисульфидную связь.
В одном воплощении всех аспектов ковалентная связь представляет собой дисульфидную связь между остатком цистеина в аминокислотной последовательности мотива хеликар и остатком цистеина в CDR2 легкой цепи антитела против хеликара. В одном воплощении аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность SEQ ID NO: 02.
В одном воплощении всех аспектов антитело представляет собой биспецифичное антитело, содержащее первый функционал связывания с антигеном, не являющимся хеликаром, и второй функционал связывания с аминокислотной последовательностью мотива хеликар. В одном воплощении антиген (не являющимся хеликаром) представляет собой антиген поверхности клетки. В одном воплощении антиген поверхности клетки представляет собой антиген, ассоциированный с опухолью. В одном воплощении одна тяжелая цепь биспецифичного антитела содержит мутацию, формирующую впадину, и соответствующая другая цепь содержит мутацию, формирующую выступ. В одном воплощении одна тяжелая цепь биспецифичного антитела содержит мутации T366S, L368A и Y407V, и соответствующая другая цепь содержит мутацию T366W. В одном воплощении одна тяжелая цепь биспецифичного антитела дополнительно содержит мутацию S354C, и соответствующая другая цепь содержит мутацию Y349C.
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело, с которым на одном или обоих С-концах тяжелых цепей были слиты scFv или dsscFv, или scFab, или dsscFab, или их комбинация, либо непосредственно, либо через пептидный линкер.
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело. В одном воплощении одна тяжелая цепь биспецифичного антитела содержит мутацию, формирующую впадину, и соответствующая другая цепь содержит мутацию, формирующую выступ.
В одном воплощении груз выбран из связывающей группировки, метящей группировки и биологически активной группировки.
В одном воплощении антитело представляет собой полноразмерное антитело.
В одном воплощении антитело представляет собой гуманизированное или человеческое антитело.
В одном воплощении константная область антитела принадлежит к подклассу IgG1 или к подклассу IgG4.
В одном воплощении антитело имеет константную область подкласса IgG1 с аланином в положении 234 и 235 и с глицином в положении 329 с нумерацией согласно индексу ЕС (Европейсткий Союз) по Kabat.
В одном воплощении антитело имеет константную область подкласса IgG4 с пролином в положении 228, глутаминовой кислотой в положении 235 и глицином в положении 329 с нумерацией согласно индексу ЕС по Kabat.
В одном воплощении антитело представляет собой фрагмент антитела. В одном воплощении данный фрагмент представляет собой Fab или (Fab)2.
В одном воплощении всех аспектов конъюгат содержит точно одну ковалентную связь на CDR2 легкой цепи.
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, содержит реакционноспособную группу, которая может образовать ковалентную связь с тиольной группой остатка цистеина в CDR2 антитела. В одном воплощении реакционноспособная группа представляет собой тиол, малеимид или галогенацетил.
В одном воплощении всех аспектов ковалентная связь представляет собой дисульфидную связь. В одном воплощении дисульфидная связь образуется без добавления окислительно-восстановительно активного агента.
В одном воплощении конъюгат содержит терапевтическую или выявляемую группировку. В одном воплощении терапевтическая или выявляемая группировка ковалентно конъюгирована с аминокислотной последовательностью мотива хеликар, или аминокислотная последовательность мотива хеликар включена в терапевтическую или выявляемую группировку.
В одном воплощении аминокислотная последовательностью мотива хеликар конъюгирована с полипептидом, состоящим из 5-500 аминокислотных остатков. В одном воплощении данный полипептид содержит 10-450 аминокислотных остатков. В одном воплощении полипептид содержит 12-450 аминокислотных остатков. В одном воплощении полипептид содержит 15-400 аминокислотных остатков.
В одном воплощении аминокислотная последовательность мотива хеликар конъюгирована с выявляемой меткой.
В одном воплощении аминокислотная последовательность мотива хеликар конъюгирована с полипептидом или с выявляемой меткой, или с грузом через линкер. В одном воплощении линкер представляет собой непептидный линкер. В одном воплощении линкер представляет собой пептидный линкер.
Одним аспектом, как описано в данном документе, является антитело против хеликара, которое имеет в легкой цепи остаток цистеина в CDR2, при этом CDR определяются согласно Kabat.
В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 или в положении 51 согласно нумерации вариабельного домена легкой цепи по Kabat.
В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
В одном воплощении антитело имеет точно в одном вариабельном домене легкой цепи остаток цистеина в положении 55 или в положении 51 согласно нумерации вариабельного домена легкой цепи по Kabat.
В одном воплощении всех аспектов антитело представляет собой гуманизированное или человеческое антитело.
В одном воплощении антитело представляет собой полноразмерное антитело или Fab, или scFv, или scFv, конъюгированный с областью Fc.
В одном воплощении цистеин образует дисульфидную связь с изолированным остатком цистеина или с изолированным остатком гомоцистеина.
Одним аспектом, как описано в данном документе, является иммуноконъюгат, содержащий конъюгат, как описано в данном документе, и цитотоксический агент.
Одним аспектом, как описано в данном документе, является фармацевтическая композиция, содержащая конъюгат, как описано в данном документе, и фармацевтически приемлемый носитель.
Конъюгат, как описано в данном документе, предназначен для применения в качестве лекарственного средства.
Конъюгат, как описано в данном документе, предназначен для лечения рака.
Конъюгат, как описано в данном документе, предназначен для лечения диабета.
Конъюгат, как описано в данном документе, предназначен для лечения ожирения.
Конъюгат, как описано в данном документе, предназначен для лечения воспалительного заболевания.
Конъюгат, как описано в данном документе, предназначен для лечения метаболического заболевания.
Конъюгат, как описано в данном документе, предназначен для лечения вирусного заболевания.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, в изготовлении лекарственного средства.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, в качестве диагностического агента.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, содержащего терапевтический полипептид, для увеличения стабильности терапевтического полипептида.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, содержащего терапевтический полипептид, для увеличения активности терапевтического полипептида.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, содержащего терапевтический полипептид, для увеличения периода полувыведения in vivo терапевтического полипептида.
Одним аспектом, как описано в данном документе, является применение конъюгата, как описано в данном документе, в лечении заболевания.
Одним аспектом, как описано в данном документе, является способ лечения индивида, имеющего заболевание, включающий введение индивиду эффективного количества конъюгата, как описано в данном документе.
Одним аспектом, как описано в данном документе, является способ лечения заболевания у индивида, включающий введение индивиду эффективного количества конъюгата, как описано в данном документе.
В одном воплощении заболевание представляет собой рак.
В одном воплощении заболевание представляет собой диабет.
В одном воплощении заболевание представляет собой ожирение.
Одним аспектом, как описано в данном документе, является способ получения конъюгата, как описано в данном документе, содержащего комбинацию антитела против хеликара, содержащего первую реакционноспособную группу, и соединения, содержащего аминокислотную последовательность мотива хеликар, содержащего вторую реакционноспособную группу, при этом атом альфа-углерода аминокислотного остатка, который несет первую реакционноспособную группу, находится примерно в 10-11 ангстремах от атома соединения, содержащего аминокислотную последовательность мотива хеликар.
Одним аспектом, как описано в данном документе, является способ получения конъюгата, как описано в данном документе, включающий следующие стадии:
- объединение в растворе антитела против хеликара, которое специфично связывается с аминокислотной последовательностью мотива хеликар, и которое содержит первую реакционноспособную группу на одном аминокислотном остатке в CDR2, с соединением, содержащим аминокислотную последовательность мотива хеликар, содержащим вторую реакционноспособную группу, где соединение, содержащее аминокислотную последовательность мотива хеликар, содержит груз, такой как пептид, состоящий из 5-500 аминокислот, или выявляемую метку, и
- выделение конъюгата из раствора.
Одним аспектом, как описано в данном документе, является способ получения антитела против хеликара для образования конъюгата, как описано в данном документе, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую антитело против хеликара, и
- выделение антитела против хеликара из клетки или среды для культивирования,
где в антителе против хеликара остаток в CDR2 легкой цепи мутирован до цистеина, которое имеет в структуре нековалентного комплекса антитела против хеликара и соединения, содержащего аминокислотную последовательность мотива хеликар, определенной рентгеноструктурным анализом, расстояние 10-11 ангстрем между атомом альфа-углерода аминокислотного остатка в CDR2 антитела и атомом соединения, содержащего аминокислотную последовательность мотива хеликар, между которыми должна образоваться ковалентная связь.
Одним аспектом, как описано в данном документе, является способ идентификации положения в CDR2 антитела против хеликара, которое может быть мутировано до цистеина для образования ковалентной связи между данным остатком в CDR2 антитела и связанным соединением, содержащим аминокислотную последовательность мотива хеликар, включающий следующие стадии:
- предоставление кристаллической структуры нековалентного комплекса антитела против хеликара и соединения, содержащего аминокислотную последовательность мотива хеликар, и
- идентификация аминокислотного остатка в CDR2 антитела против хеликара и в соединении, содержащем аминокислотную последовательность мотива хеликар, с расстоянием от 10 до 11 ангстрем между атомами альфа-углерода аминокислотного остатка в CDR2 антитела и атомом в соединении, содержащем аминокислотную последовательность мотива хеликар,
где идентифицированное положение представляет собой положение в CDR2 антитела, которое может быть мутировано до цистеина для образования ковалентной связи между остатком в CDR2 антитела и связанным соединением, содержащим аминокислотную последовательность мотива хеликар.
Одним аспектом, как описано в данном документе, является биспецифичное антитело против хеликара для целевой доставки соединения, содержащего аминокислотную последовательность мотива хеликар, в клетку-мишень, где данное биспецифичное антитело содержит первый функционал (сайт) связывания, который специфично связывается с соединением, содержащим аминокислотную последовательность мотива хеликар, и второй функционал связывания, который специфично связывается с маркером поверхности клетки клетки-мишени.
Одним аспектом, как описано в данном документе, является применение комплекса, состоящего из соединения, содержащего аминокислотную последовательность мотива хеликар, и антитела, которое имеет первый функционал связывания, который специфично связывается с аминокислотной последовательностью мотива хеликар, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, для доставки соединения, содержащего аминокислотную последовательность мотива хеликар, в мозг.
В одном воплощении рецептор гематоэнцефалического барьера выбран из группы, состоящей из рецептора трансферрина (TfR), рецептора инсулина, рецептора инсулиноподобного фактора роста (рецептор IGF), белка 8, родственного рецептору липопротеина низкой плотности (LRP8), белка 1, родственного рецептору липопротеина низкой плотности (LRP1), и фактора роста, подобного гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело, содержащее два сайта связывания.
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело, с которым были слиты один или два scFv или scFab, и которое содержит три или четыре сайта связывания.
В одном воплощении биспецифичное антитело представляет собой фрагмент антитела. В одном воплощении фрагмент антитела выбран из F(ab')2 и диател.
В одном воплощении биспецифичное антитело представляет собой гуманизированное или человеческое антитело.
В одном воплощении биспецифичное антитело не имеет эффекторной функции. В одном воплощении биспецифичное антитело не имеет функциональной области Fc. В одном воплощении биспецифичное антитело не имеет области Fc. В одном воплощении биспецифичное антитело имеет область Fc человеческого подкласса IgG1 с мутациями L234A, L235A и P329G, где положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat). В одном воплощении биспецифичное антитело имеет область Fc человеческого подкласса IgG4 с мутациями S228P, L235E и P329G, где положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat). В одном воплощении биспецифичное антитело содержит:
а) один сайт связывания для соединения, содержащего аминокислотную последовательность мотива хеликар, и один сайт связывания для рецептора гематоэнцефалического барьера или
б) два сайта связывания для соединения, содержащего аминокислотную последовательность мотива хеликар, и один сайт связывания для рецептора гематоэнцефалического барьера, или
в) один сайт связывания для соединения, содержащего аминокислотную последовательность мотива хеликар, и два сайта связывания для рецептора гематоэнцефалического барьера, или
г) два сайта связывания для соединения, содержащего аминокислотную последовательность мотива хеликар, и два сайта связывания для рецептора гематоэнцефалического барьера.
В случаях б) и в) предыдущего воплощения одна тяжелая цепь биспецифичного антитела содержит мутацию, создающую впадину, и соответствующая другая цепь содержит мутацию, создающую выступ.
В одном предпочтительном воплощении биспецифичное антитело содержит два сайта связывания для соединения, содержащего аминокислотную последовательность мотива хеликар, и один или два сайта связывания для рецептора гематоэнцефалического барьера.
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, содержит линкер между гаптеном и грузом. В одном воплощении линкер представляет собой пептидный линкер. В одном воплощении линкер представляет собой химический линкер (непептидный линкер).
Обнаружили, что посредством ковалентного связывания соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против соединения, содержащего аминокислотную последовательность мотива хеликар, может достигаться стабилизация и улучшение PK свойств соединения.
В одном воплощении каждый из биспецифичного антитела и соединения, содержащего аминокислотную последовательность мотива хеликар, содержит функциональную группу, посредством которой при связывании соединения, содержащего аминокислотную последовательность мотива хеликар, биспецифичным антителом образуется ковалентная связь между соединением, содержащим аминокислотную последовательность мотива хеликар, и биспецифичным антителом.
В одном воплощении биспецифичное антитело содержит функциональную группу на аминокислотном остатке в CDR2 антитела, при этом CDR2 определяется согласно Kabat. В одном воплощении функциональная группа на аминокислотном остатке в CDR2 антитела представляет собой тиольную группу. В одном воплощении биспецифичное антитело содержит аминокислотный остаток цистеина в CDR2 антитела.
В одном воплощении всех аспектов соединение, содержащее аминокислотную последовательность мотива хеликар, содержит функциональную группу в аминокислотной последовательности мотива хеликар или, при его наличии, в линкере между аминокислотной последовательностью мотива хеликар и соединением. В одном воплощении функциональная группа представляет собой тиол или малеимид, или галогенацетил. В одном воплощении функциональная группа в аминокислотной последовательности мотива хеликар, или, при его наличии, в линкере представляет собой тиольную группу.
В одном воплощении всех аспектов ковалентная связь образуется между остатком цистеина в CDR2 антитела и тиольной группой в соединении, содержащем аминокислотную последовательность мотива хеликар. В одном воплощении ковалентная связь представляет собой дисульфидную связь. В одном воплощении ковалентная связь представляет собой дисульфидную связь, и она образуется без добавления окислительно-восстановительно активных агентов.
В одном воплощении всех аспектов CDR2 представляет собой CDR2 легкой цепи. В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 51, или в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat. В одном предпочтительном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
Обнаружили, что можно использовать любое соединение в соединении, содержащем аминокислотную последовательность мотива хеликар, при дериватизации цистеином аминокислотной последовательности хеликара, содержащей функциональную группу для образования ковалентной дисульфидной связи между соединением, содержащим аминокислотную последовательность мотива хеликар, и остатком цистеина в CDR2 легкой цепи антитела. Нахождение остатка цистеина (тиольной функциональной группы) в аминокислотной последовательности мотива хеликар имеет то преимущество, что отсутствует необходимость реконструировать синтез и положение остатка цистеина в CDR2 легкой цепи антитела при изменении груза.
В одном воплощении всех аспектов образуется точно одна ковалентная связь на CDR2 легкой цепи.
В одном воплощении всех аспектов соединение выбрано из связывающей группировки, метящей группировки и биологически активной группировки.
В одном воплощении всех аспектов биологически активная группировка выбрана из группы, содержащей антитела, полипептиды, природные лиганды одной или более чем одной мишени ЦНС (центральная нервная система), модифицированные версии природных лигандов одной или более чем одной мишени ЦНС, аптамеры, ингибирующие нуклеиновые кислоты (т.е. малые интерферирующие РНК (миРНК) и короткие шпилечные РНК (кшРНК)), запертые нуклеиновые кислоты (ЗНК), рибозимы и маленькие молекулы или активные фрагменты любого из вышеупомянутых.
В одном воплощении всех аспектов соединение представляет собой нуклеиновую кислоту или производное нуклеиновой кислоты. В одном воплощении нуклеиновая кислота представляет собой иРНК (интерферирующая РНК) или ЗНК.
В одном воплощении всех аспектов соединение представляет собой полипептид.
В одном воплощении соединение представляет собой маленькую молекулу (неполипептидную биологически активную группировку).
В одном воплощении биологически активная группировка представляет собой полипептид. В одном воплощении полипептид состоит из 5-500 аминокислотных остатков. В одном воплощении полипептид содержит 10-450 аминокислотных остатков. В одном воплощении полипептид содержит 15-400 аминокислотных остатков. В одном воплощении полипептид содержит 18-350 аминокислотных остатков.
В одном воплощении биспецифичное антитело содержит первый функционал связывания, который специфично связывается с соединением, содержащим аминокислотную последовательность мотива хеликар (функционал связывания против аминокислотную последовательность мотива хеликар), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR), или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении биспецифичное антитело имеет два функционала связывания, которые специфично связываются с соединением, содержащим аминокислотную последовательность мотива хеликар (два функционала связывания против аминокислотную последовательность мотива хеликар), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина), или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
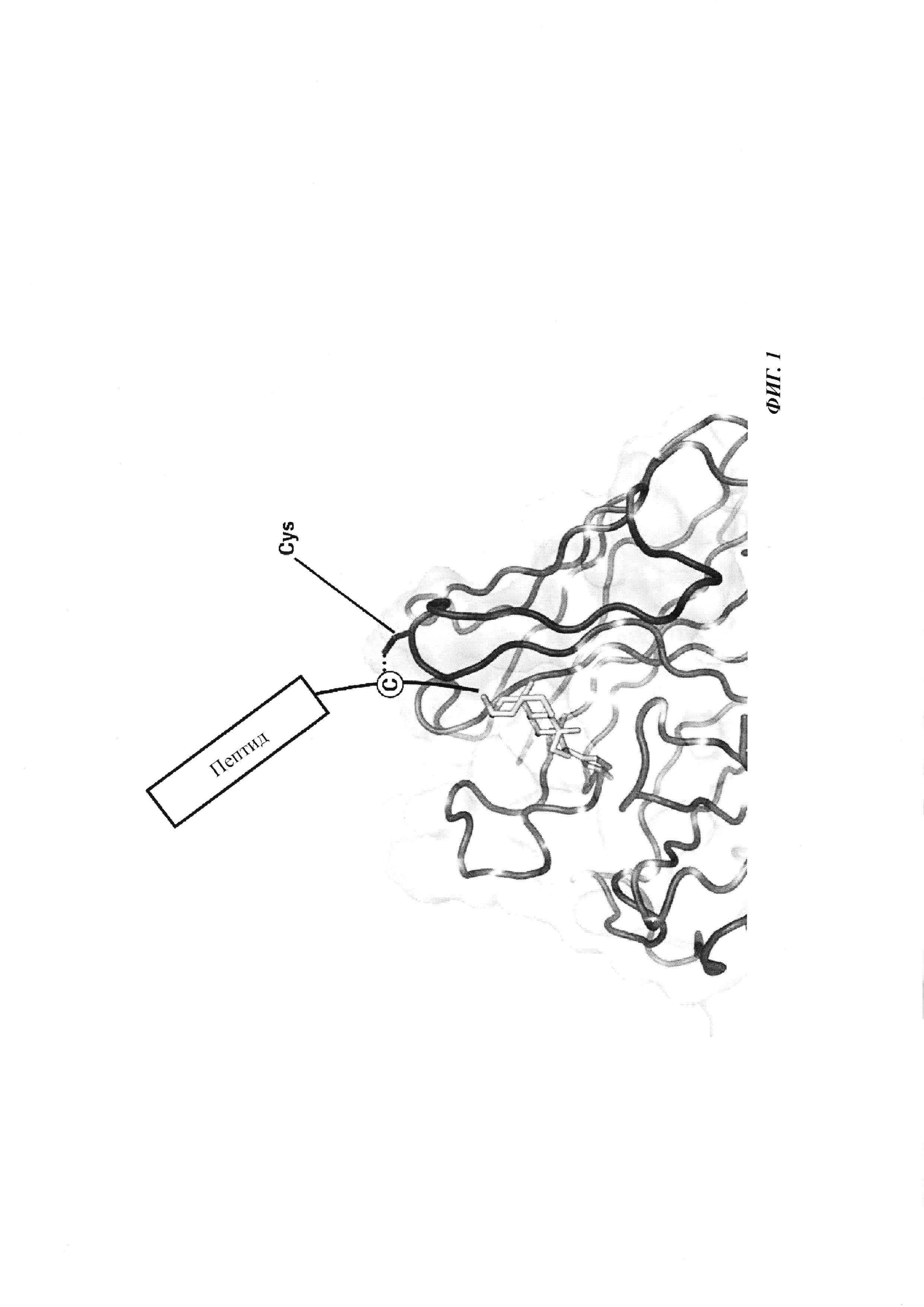
Фиг. 1: введение SH функциональных групп в гаптен, а также в антитело в подходящих положениях обеспечивает образование между антителом и гаптеном ковалентной связи, приводящей к формированию конъюгата.
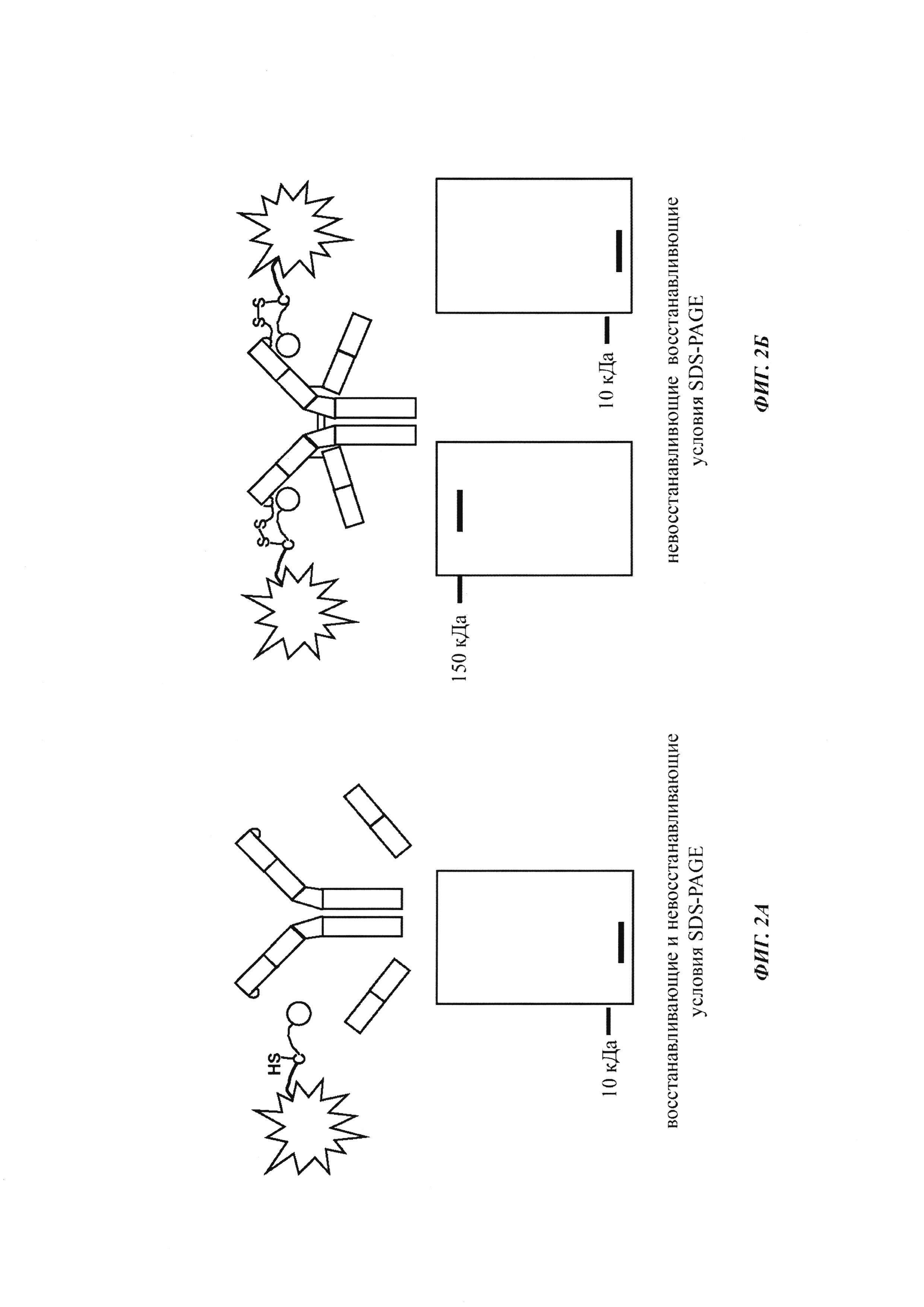
Фиг. 2: схема картины полос автофлуоресценции при проведении SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (без дополнительного окрашивания геля SDS-PAGE):
А: если не образуется ковалентная связь между антителом и конъюгатом гаптен-флуорофор как при восстанавливающих, так и при невосстанавливающих условиях можно выявить одну автофлуоресцирующую полосу при молекулярной массе свободного конъюгата гаптен-флуорофор.
Б: если образуется ковалентная связь между антителом и конъюгатом гаптен-флуорофор при невосстанавливающих условиях можно выявить одну автофлуоресцирующую полосу при объединенной молекулярной массе антитела и конъюгата гаптен-флуорофор. При восстанавливающих условиях дисульфидные мостики в конъюгате антитела и конъюгата гаптен-флуорофор (гаптенилированное соединение) расщепляются и можно выявить одну автофлуоресцирующую полосу при молекулярной массе свободного конъюгата гаптен-флуорофор.
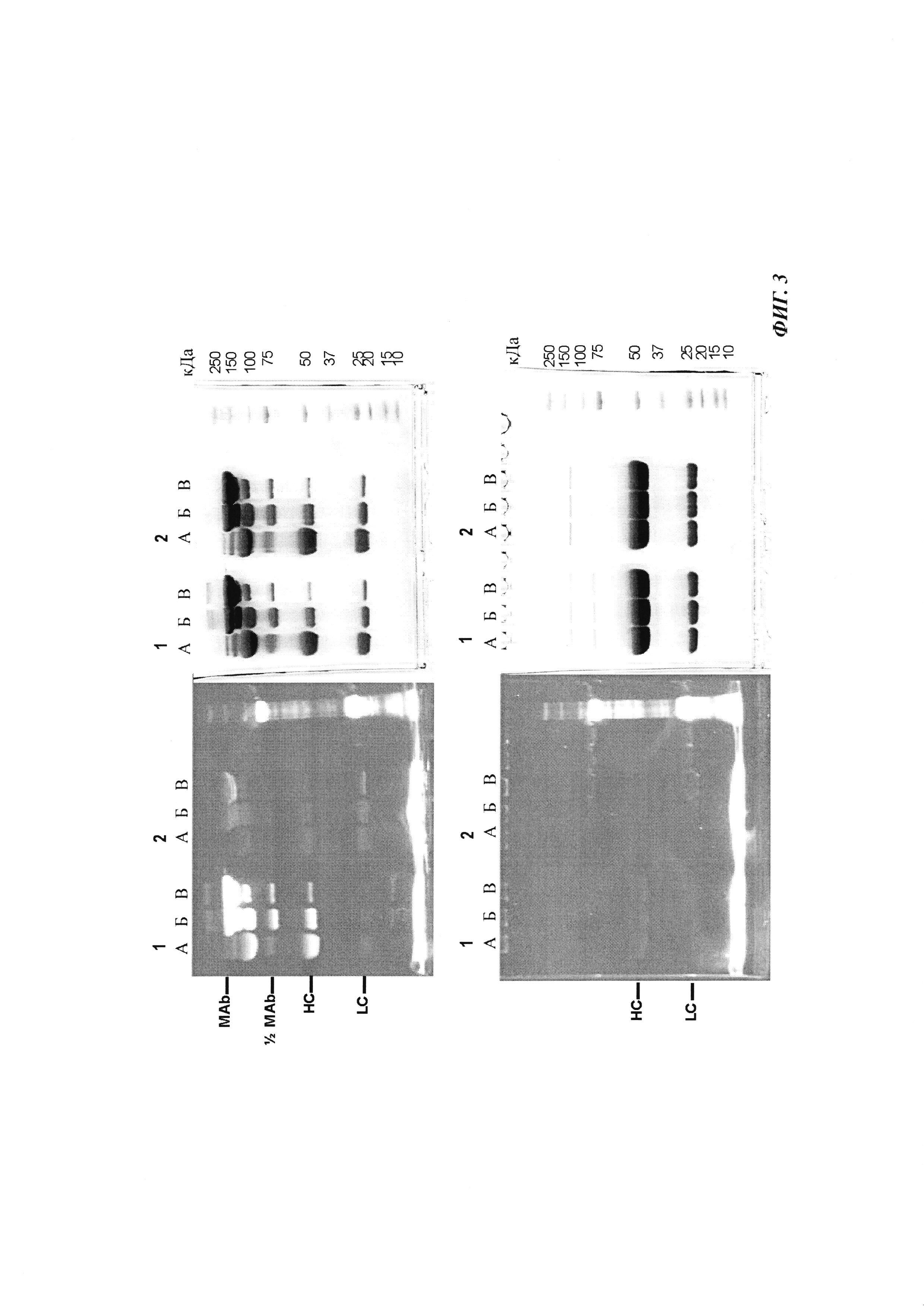
Фиг. 3: образование конъюгата гаптенсвязывающих антител с мутацией Cys с конъюгатами гаптен-Cys-флуоресцентная метка (гаптенилированное соединение) в присутствии окислительно-восстановительно активных агентов: окисляющего агента (глутатиона дисульфид, GSSG) и восстанавливающего агента (дитиотрейтол, DTE): образование комплекса антителом и последующее ковалентное связывание в определенных положениях выявляется посредством флуоресцентных сигналов в анализах SDS-PAGE. Анализы SDS-PAGE при невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в Примере 5. Ковалентно связанные с антителом гаптены выявляются при невосстанавливающих условиях в виде связанных с белком в подходящих положениях сигналов большего размера. Данные сигналы отделяются от белка при восстановлении и видны при восстанавливающих условиях в виде маленьких соединений.
Слева: флуоресцентное изображение
Справа: окрашивание кумасси синим
Ряд 1: антитело против дигоксигенина с мутацией 52bC
Ряд 2: антитело против дигоксигенина с остатком дикого типа в положении 52b
(A) ковалентное связывание с использованием 3 мМ DTE и 10 мМ GSSG;
(Б) ковалентное связывание с использованием 0,3 мМ DTE и 1 мМ GSSG;
(B) ковалентное связывание с использованием 0,03 мМ DTE и 0,1 мМ GSSG.
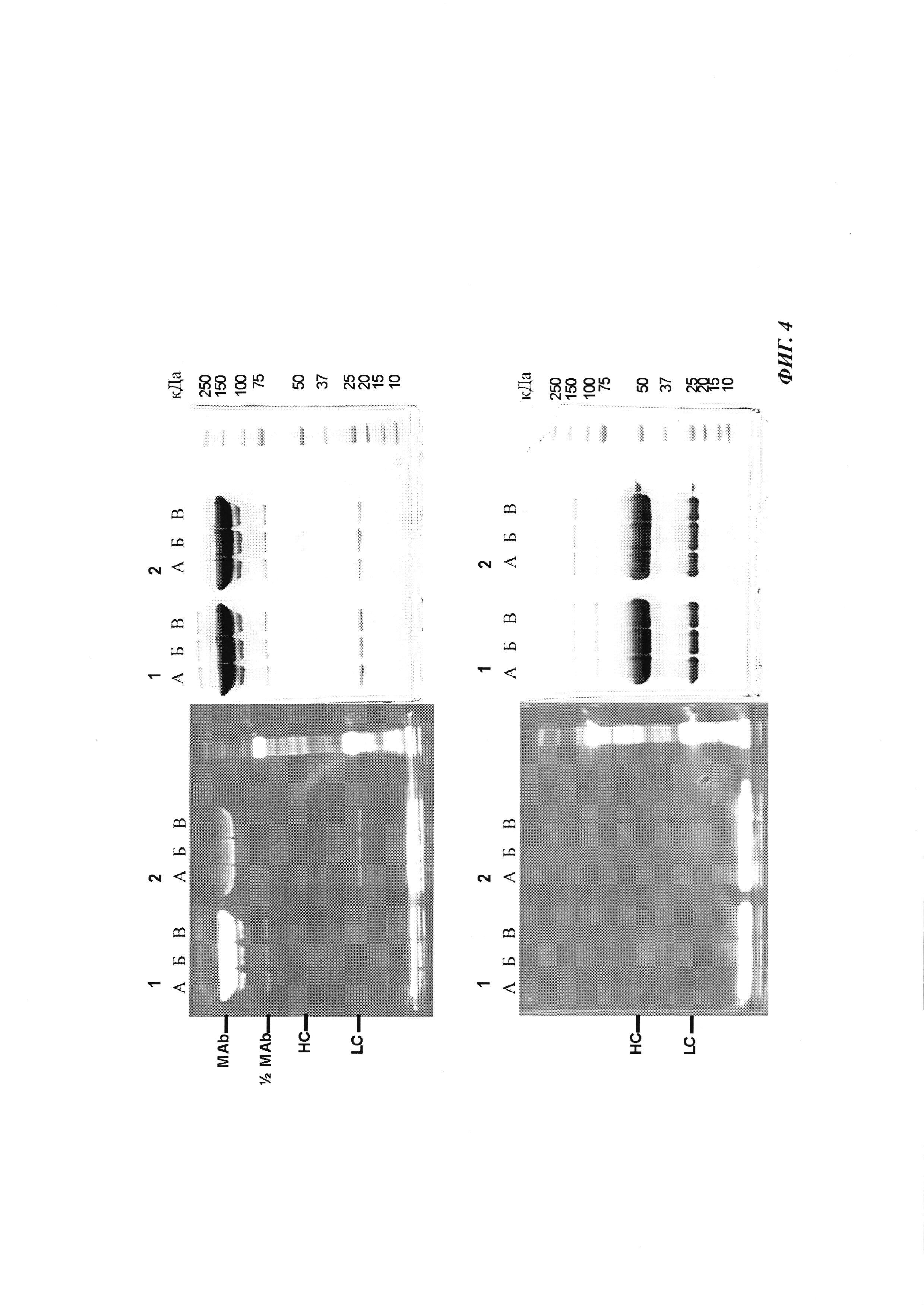
Фиг. 4: образование комплекса гаптенсвязывающих антител с мутацией Cys с конъюгатами гаптен-Cys-флуоресцентная метка в присутствии только окислителя (глутатиона дисульфид, GSSG), но в отсутствие восстановителей или в отсутствие обоих: образование комплекса антителом и последующее ковалентное связывание в определенных положениях выявляется в анализах SDS-PAGE по флуоресцентным сигналам. Анализы SDS-PAGE при невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в Примере 4. Ковалентно связанные с антителом гаптены выявляются при невосстанавливающих условиях в виде связанных с белком в подходящих положениях сигналов большего размера. Данные сигналы отделяются от белка при восстановлении и видны при восстанавливающих условиях в виде маленьких соединений.
Слева: флуоресцентное изображение
Справа: окрашивание кумасси синим
Ряд 1: антитело против дигоксигенина с мутацией 52bC
Ряд 2: антитело против дигоксигенина с остатком дикого типа в положении 52b
(A) без добавок
(Б) ковалентное связывание с 1 мМ GSSG;
(B) ковалентное связывание с 0,1 мМ GSSG.
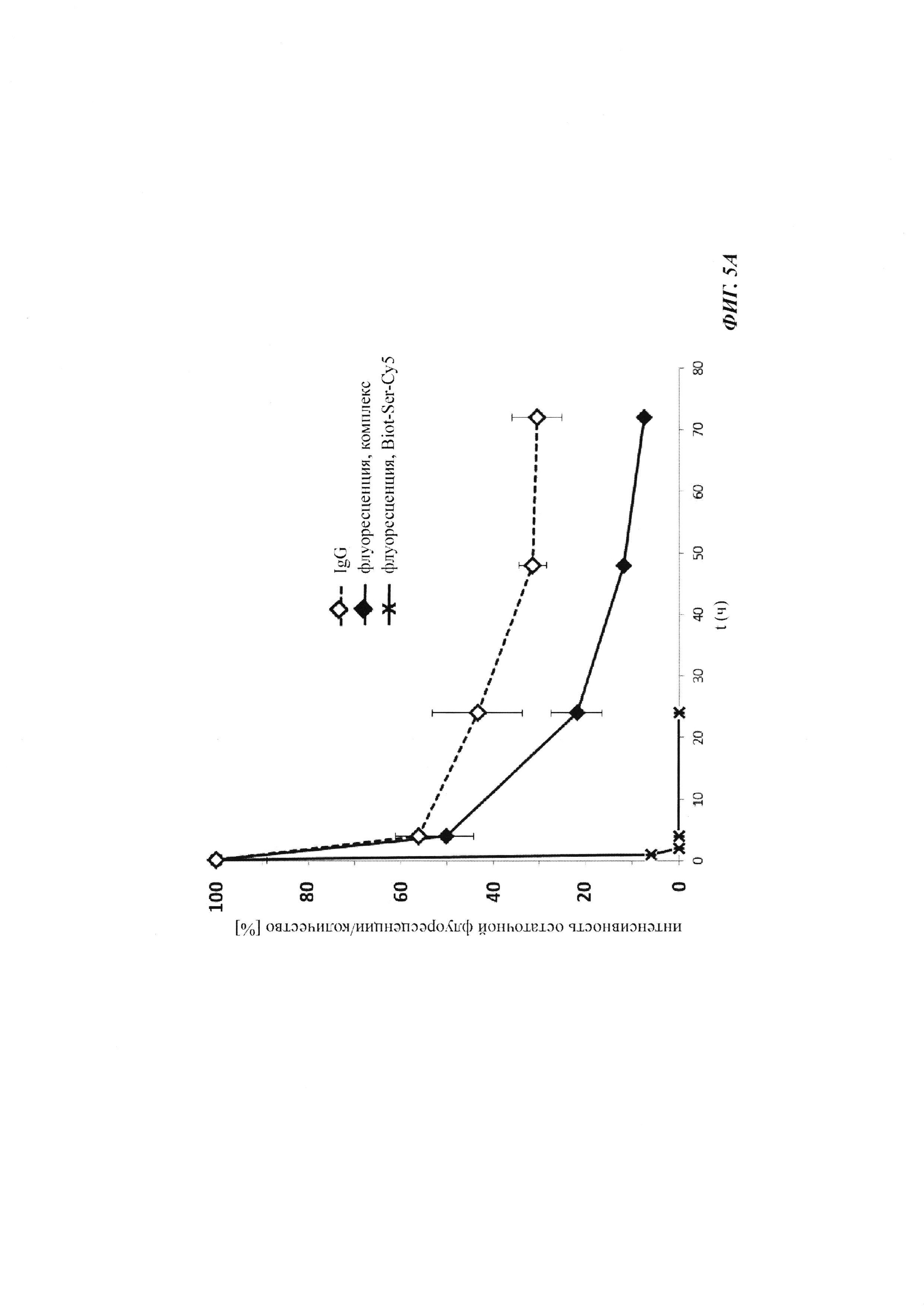
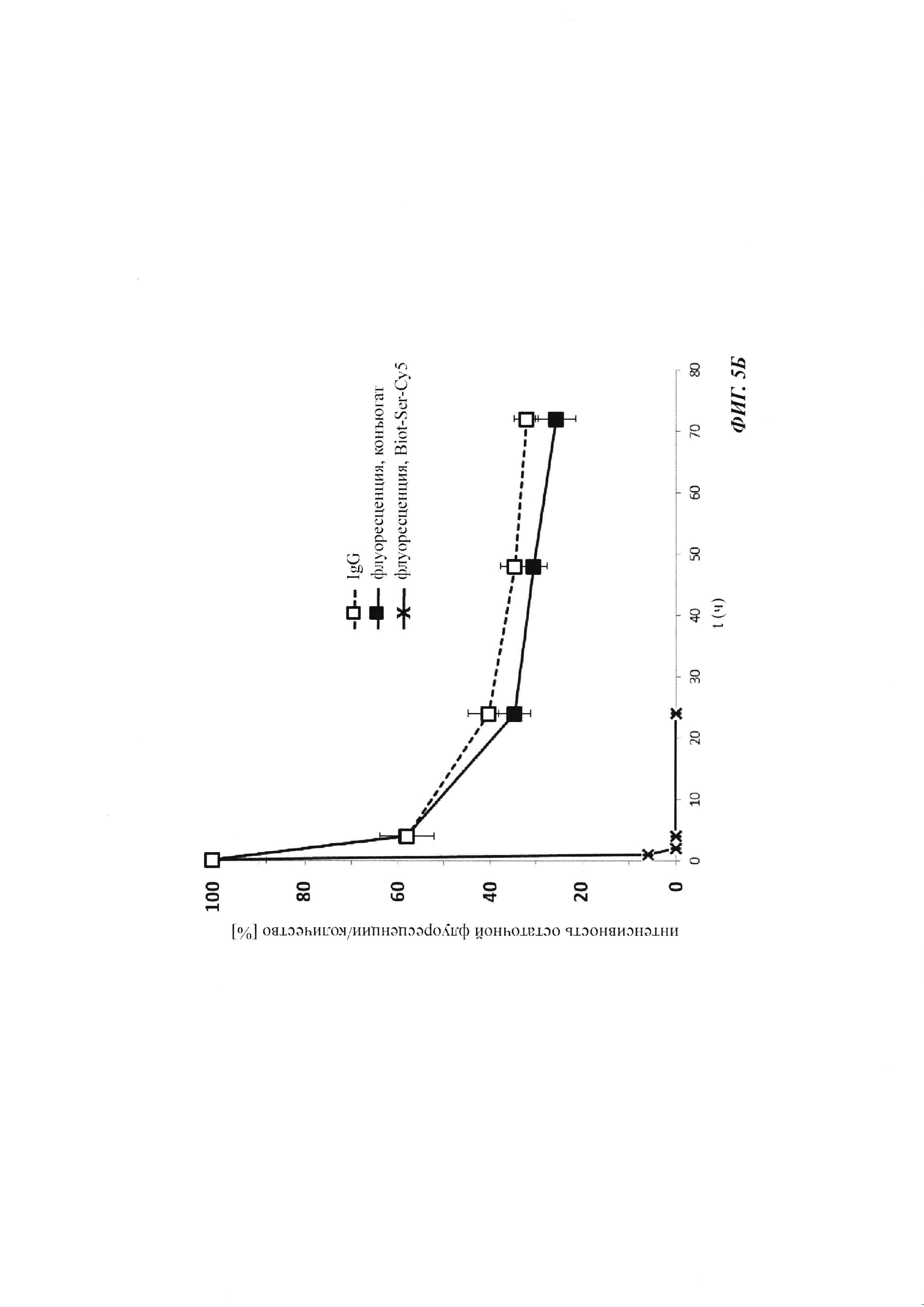
Фиг. 5: результаты PK исследования в крови in vivo с ковалентными конъюгатами и нековалентными комплексами по сравнению с не образующим комплекс антигеном/гаптеном; показаны относительная интенсивность остаточной флуоресценции (%, закрашенные метки) опосредованной Су-5 флуоресценции нековалентных комплексов биотин-Cy5 (Фиг. 5А) и ковалентных (связанных SS-мостиком) конъюгатов (Фиг. 6Б), а также не образующего комплекс биотин-Ser-Cy5 (звездочка); флуоресцентный сигнал в момент времени t, равный 0,08 ч, был принят за 100%; дополнительно показано относительное остаточное количество человеческого IgG в образцах мышиной сыворотки (незакрашенные метки); концентрация IgG в сыворотке (мг/мл) в t, равное 0,08 ч, была принята за 100%.
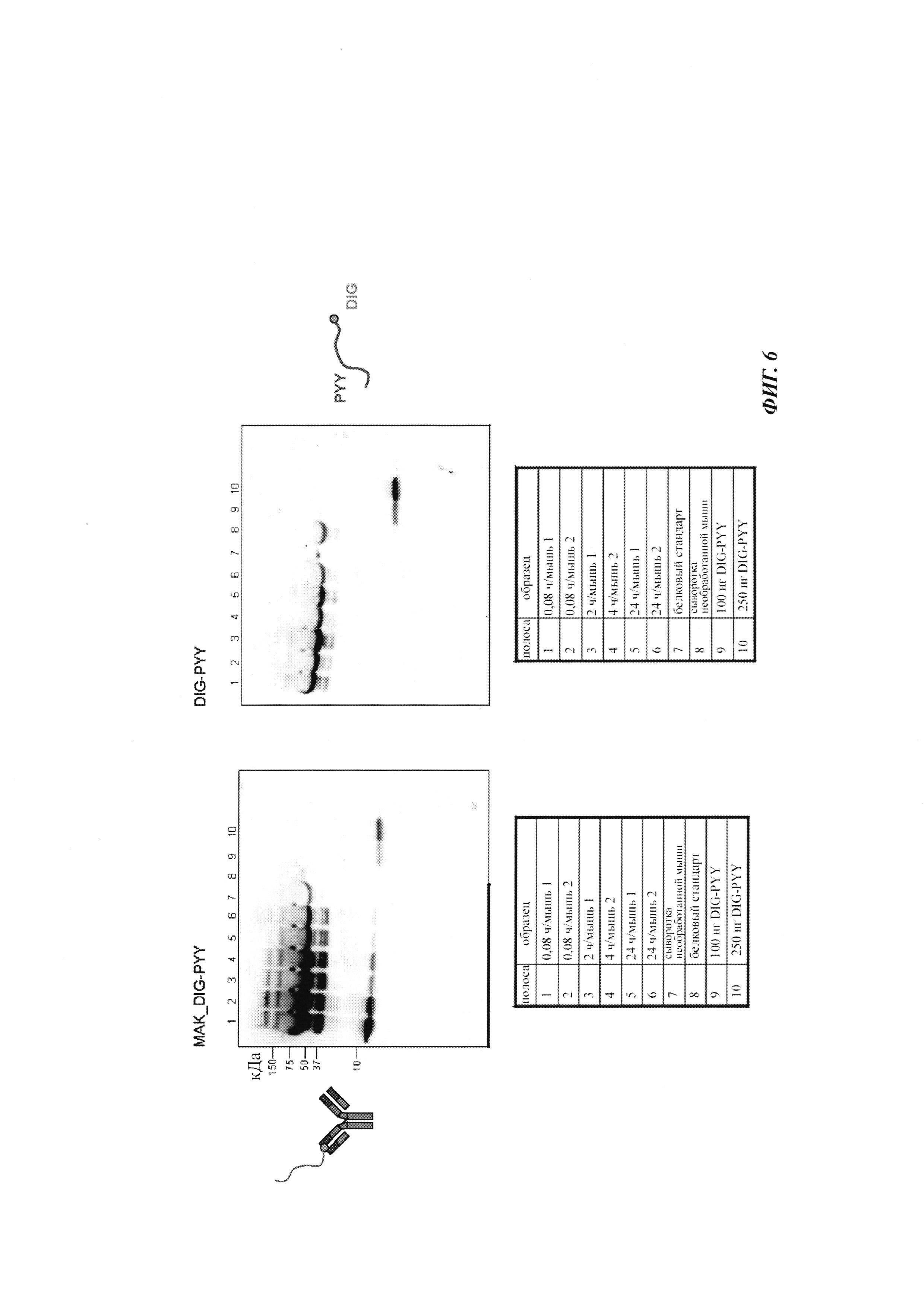
Фиг. 6: определение посредством вестерн-блоттинга количества дигоксигенилированного полипептида PYY в сыворотке мышей.
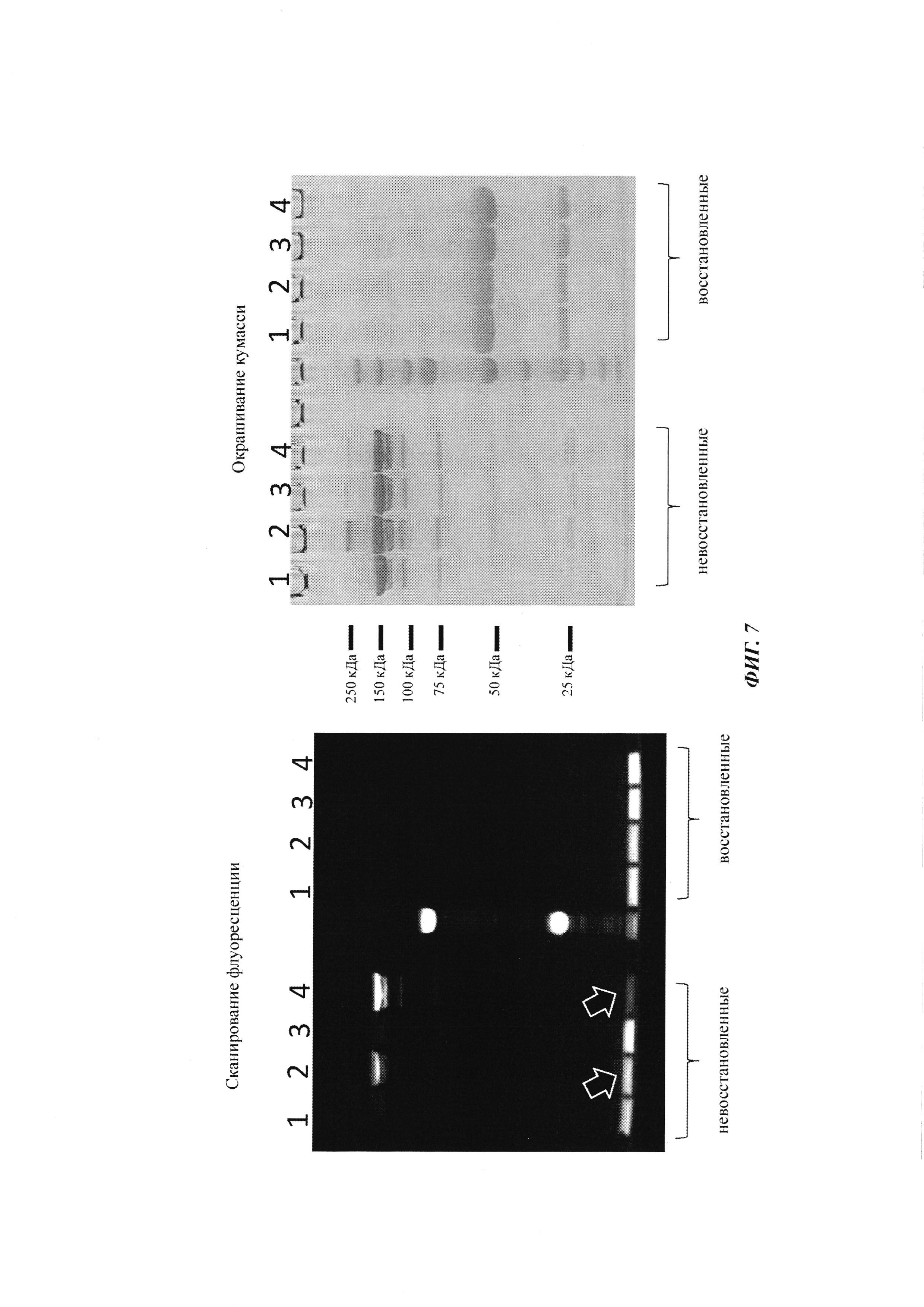
Фиг. 7: анализ управляемого аффинностью комплексообразования гаптенилированных соединений с антителами против гаптена.
На образование комплекса антителом и последующее ковалентное связывание в определенных положениях указывают флуоресцентные сигналы в анализах SDS-PAGE, которые проводили, как описано в Примере 11.
Слева: флуоресцентное изображение с невосстановленными (левая сторона геля) и восстановленными (правая сторона геля) образцами.
Справа: окрашивание кумасси синим.
1: гуманизированное антитело против дигоксигенина плюс биотин-Cys-Cy5
2: гуманизированное антитело против дигоксигенина VH52bC плюс биотин-Cys-Cy5
3: гуманизированное антитело против биотина плюс биотин-Cys-Cy5
4: гуманизированное антитело против биотина VH53C плюс биотин-Cys-Cy5
Белые стрелки отмечают избыток (несвязанного) биотин-Cys-Cy5, который значительно выше при использовании антитела против дигоксигенина VH52bC, так как движущей силой реакции конъюгирования в данном случае не является аффинность.
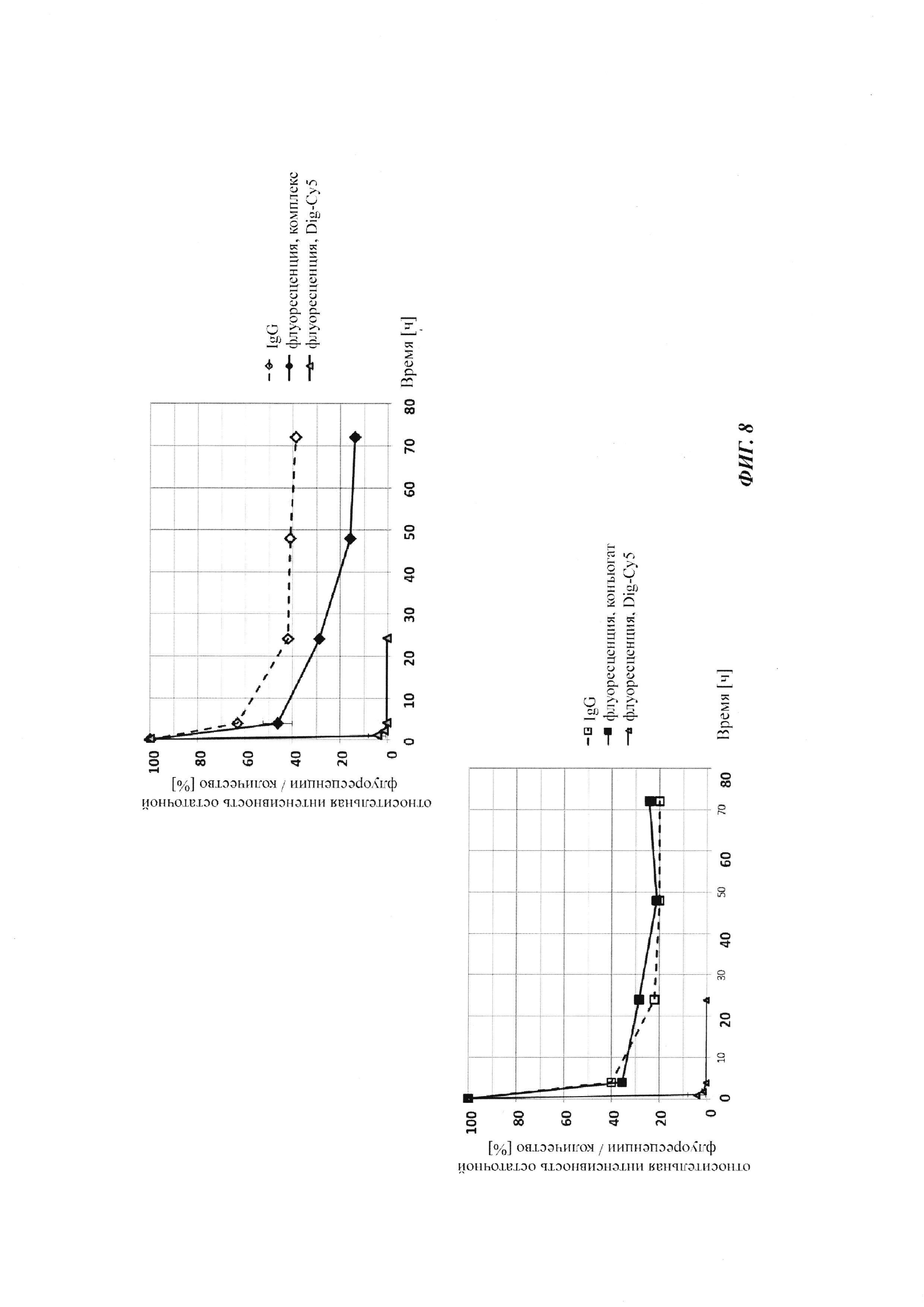
Фиг. 8: относительная интенсивность остаточной флуоресценции (%) опосредованной Cy5 флуоресценции нековалентных комплексов Dig-Cy5, ковалентных (связанных дисульфидными мостиками) конъюгатов, а также некомплексированного Dig-Cy5; флуоресцентный сигнал в момент времени t, равный 0,08 ч, принимали за 100%; дополнительно, показано относительное остаточное количество человеческого IgG в образцах мышиной сыворотки; концентрация IgG в сыворотке (мг/мл) в t, равное 0,08 ч, была принята за 100%.
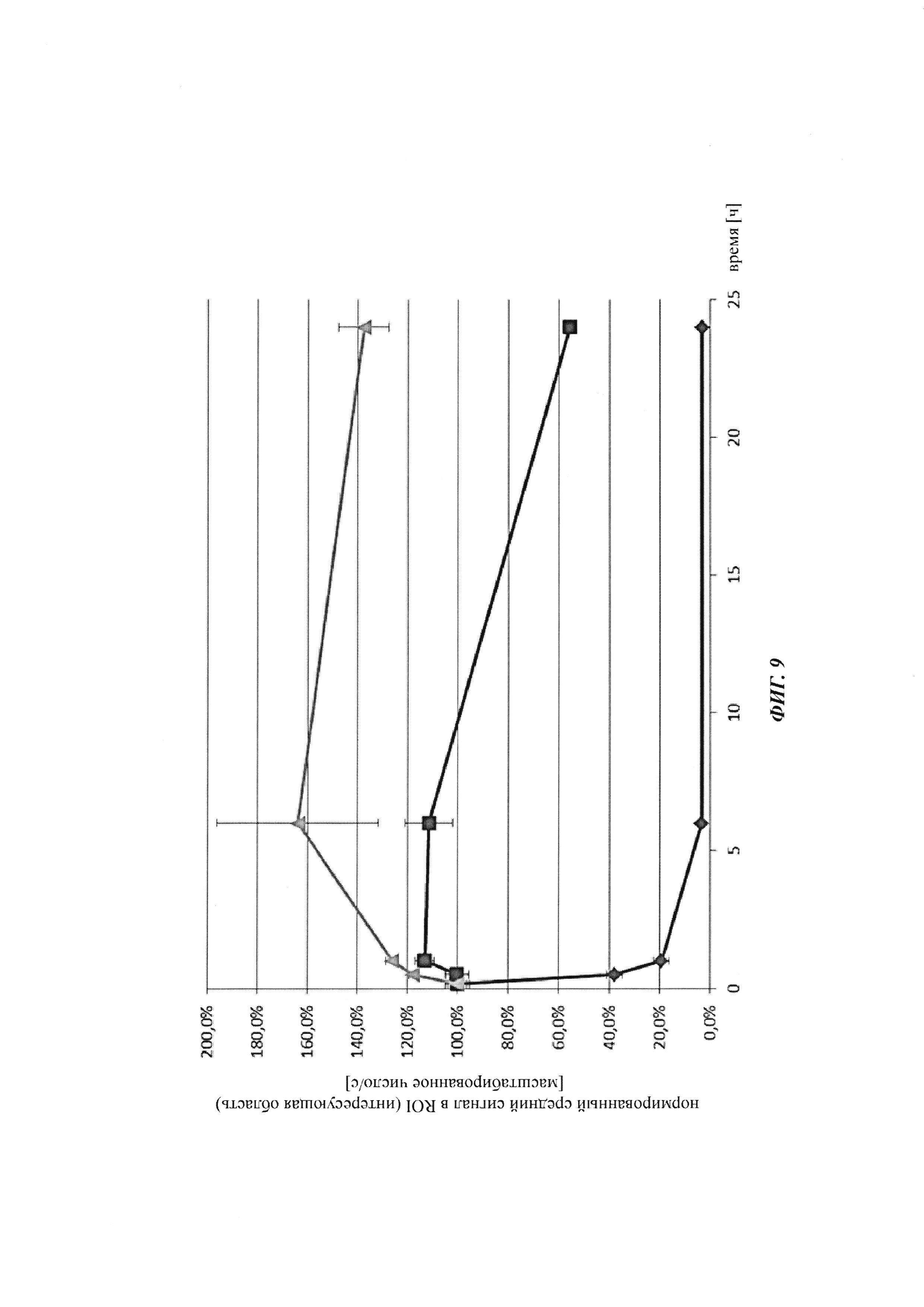
Фиг. 9: фармакокинетику при in vivo-подобных условиях опосредованной Cy5 флуоресценции биотин-Cy5 нековалентных комплексов и ковалентных (связанных дисульфидными мостиками) конъюгатов, а также некомплексированного биотин-Cy5 определяли посредством неинвазивной визуализации глаза; закрашенный ромб: биотин-Cy5; закрашенный квадрат: биотин-Cy5 плюс антитело против биотина (комплекс); треугольник: конъюгат Cy5-биотин-антитело против биотина.
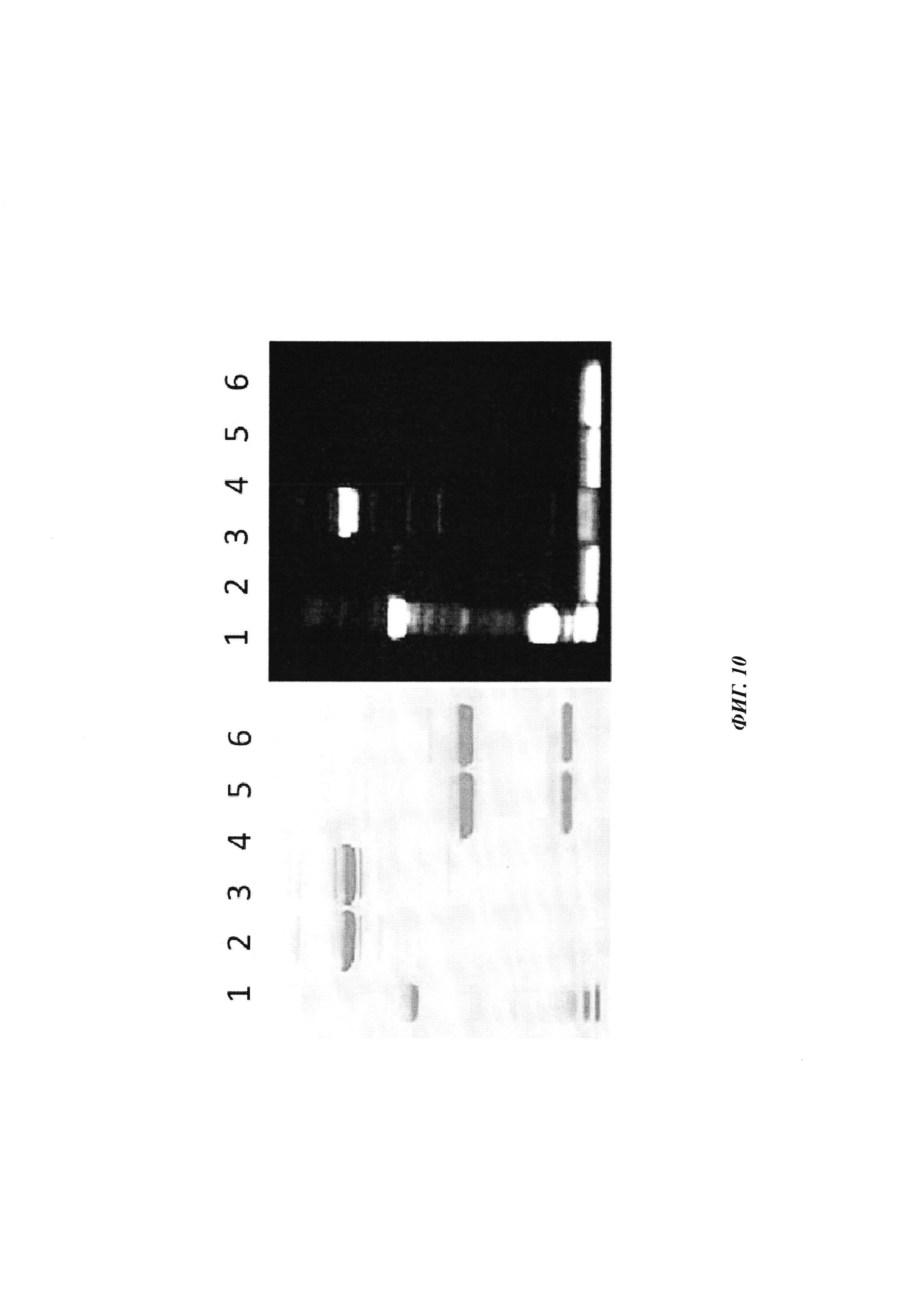
Фиг. 10: образование ковалентных комплексов между антителами, связывающимися с биотином, и биотин-Cys-Cy5 продемонстрировано посредством SDS-PAGE при невосстанавливающих и восстанавливающих условиях; реакцию связывания проводили в мышиной сыворотке при 37°С в течение 1 ч. Cy5 является связанным с Н-цепью только при невосстанавливающих условиях в образцах, которые содержали биотин-Cys-Cy5 и антитело с мутацией Cys; данные ковалентные конъюгаты разрушаются при восстановлении (правые полосы); полосы 1: маркер молекулярной массы; 2-3 - невосстанавливающие - 2: антитело против биотина (без мутации Cys) плюс биотин-Cys-Cy5 (комплекс); 3: антитело против биотина-Cys плюс биотин-Cys-Cy5 (конъюгат); 4-5 - восстанавливающие - 5: антитело против биотина (без мутации Cys) плюс биотин-Cys-Cy5 (комплекс); 6: антитело против биотина-Cys плюс биотин-Cys-Cy5 (конъюгат).
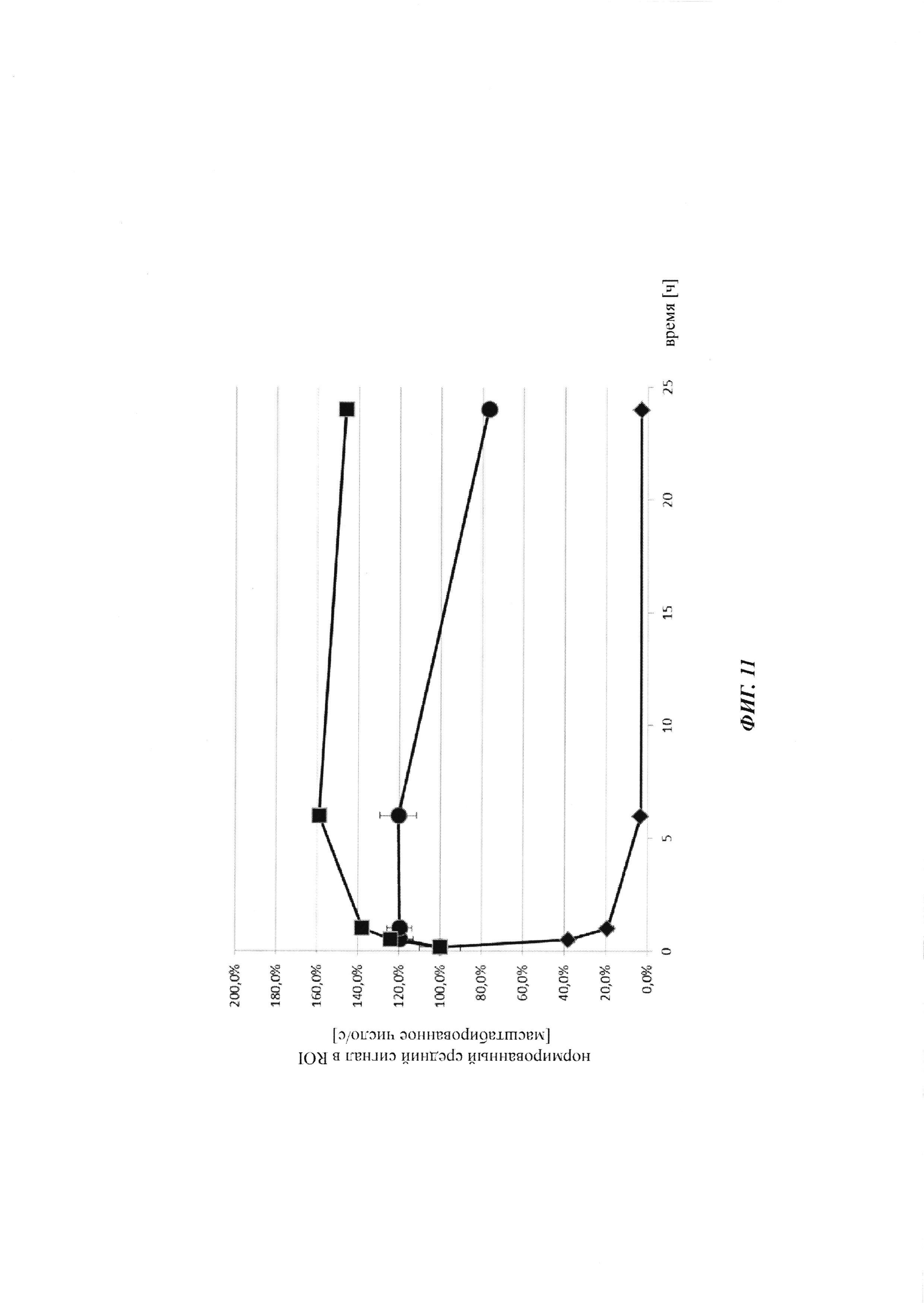
Фиг. 11: фармакокинетику in vivo опосредованной Cy5 флуоресценции биотин-Cy5 нековалентных комплексов и ковалентных (связанных дисульфидным мостиком) конъюгатов, а также некомплексированного биотин-Cy5 определяли посредством неинвазивной визуализации глаза; закрашенный ромб: биотин-Cy5, закрашенный круг: биотин-Cy5, введенный через 24 часа после введения антитела против биотина (образование комплекса in vivo); закрашенный квадрат: биотин-Cys-Cy5, введенный через 24 часа после введения антитела против биотина-Cys (образование конъюгата in vivo).
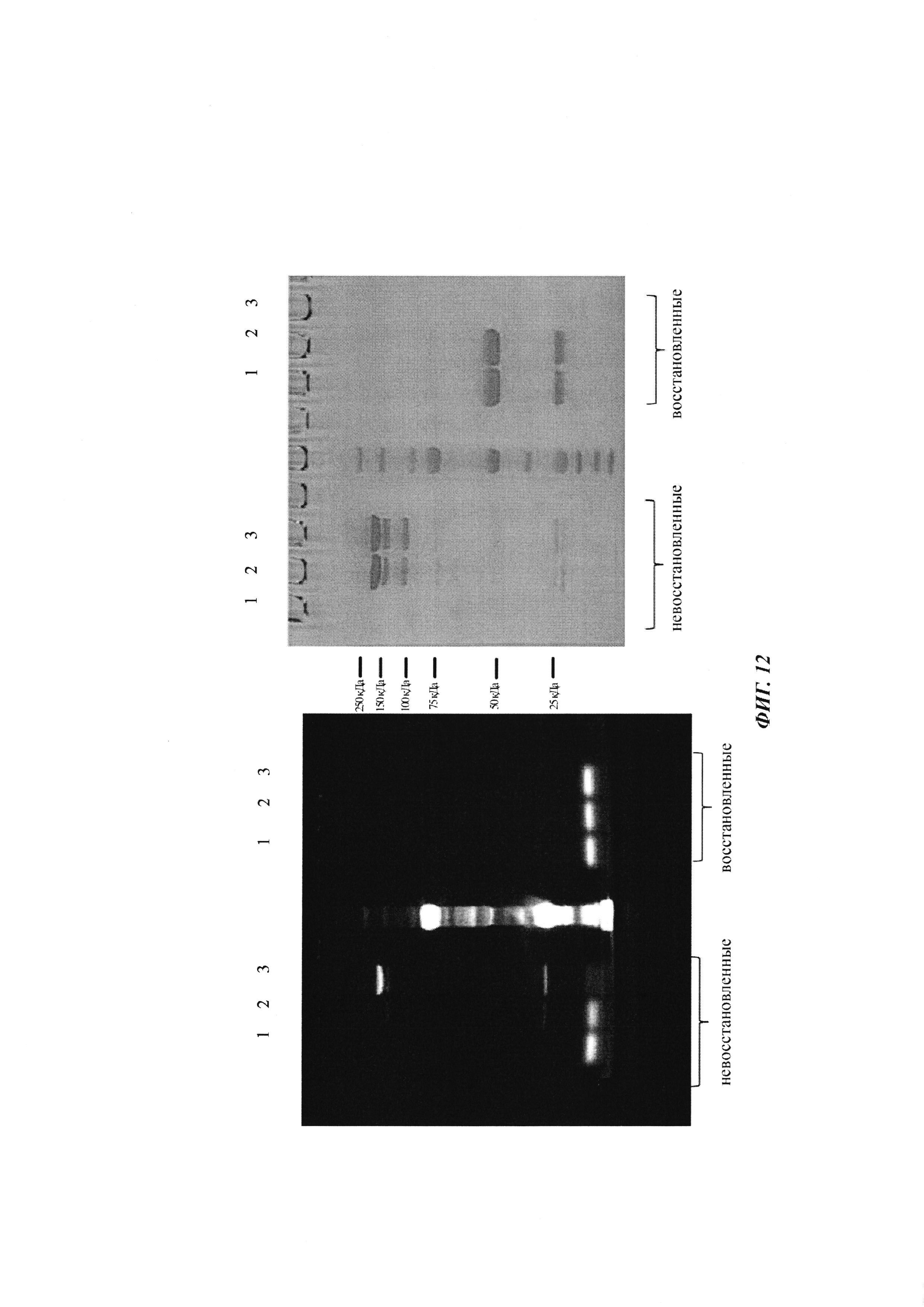
Фиг. 12: гель SDS-PAGE связывания антитела 0155 с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином с использованием 2,5-кратного молярного избытка формы ковалентного комплекса 0156 на основе соединения, содержащего аминокислотную последовательность мотива хеликар; 1 - вариант 2 аминокислотной последовательности мотива хеликар с цистеином; 2 - антитело 0019; 3 - антитело 0155.
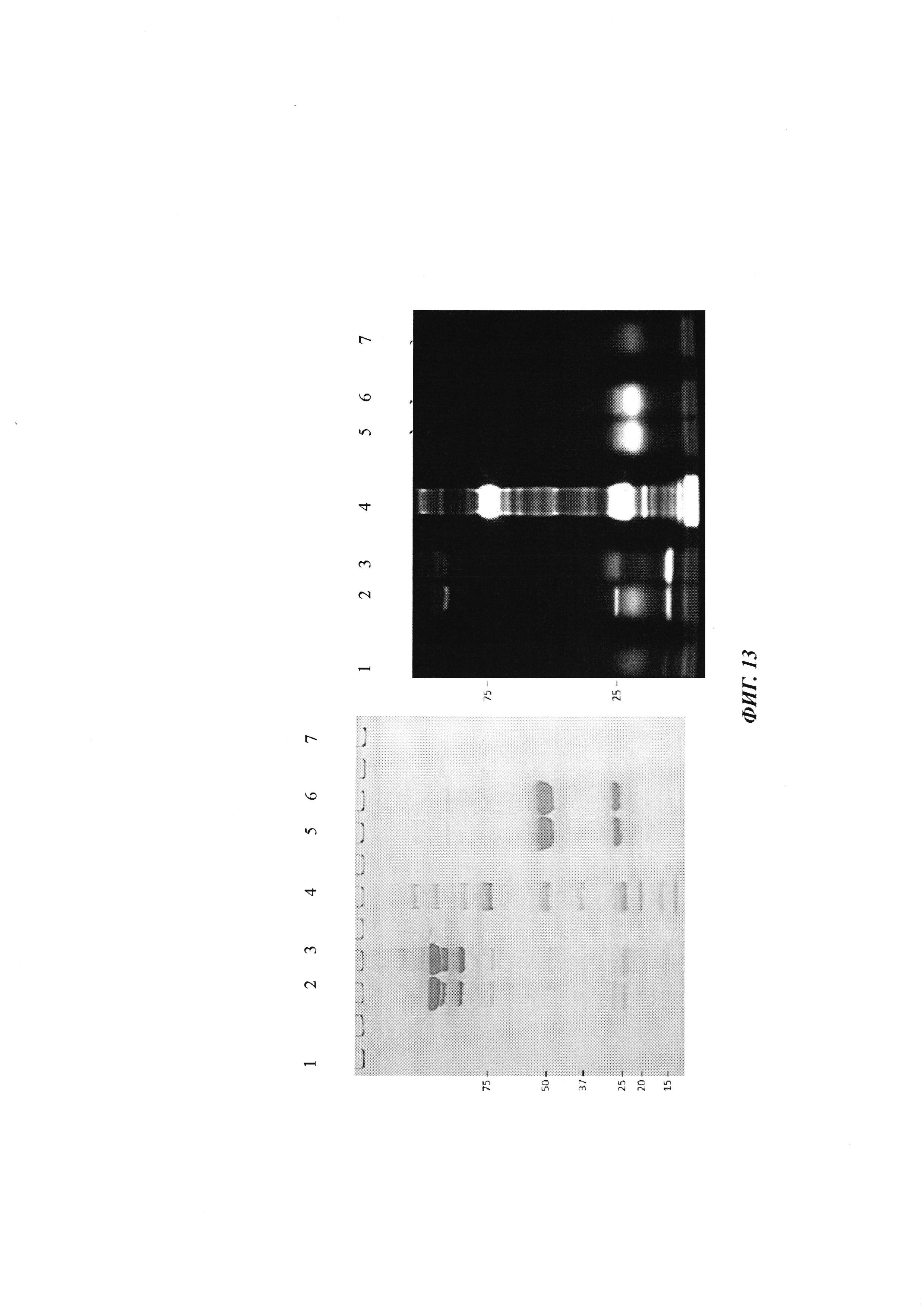
Фиг. 13: гель SDS-PAGE связывания антитела 0157 с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином; 1 - вариант 1 аминокислотной последовательности мотива хеликар с цистеином (окисленный); 2 - контрольное связывание (окисленный); 3 - ковалентный конъюгат (окисленный); 4 - маркер молекулярной массы; 5 - ковалентный конъюгат (восстановленный); 6 - контрольное связывание (восстановленный); 7 - вариант 1 аминокислотной последовательности мотива хеликар с цистеином (восстановленный).
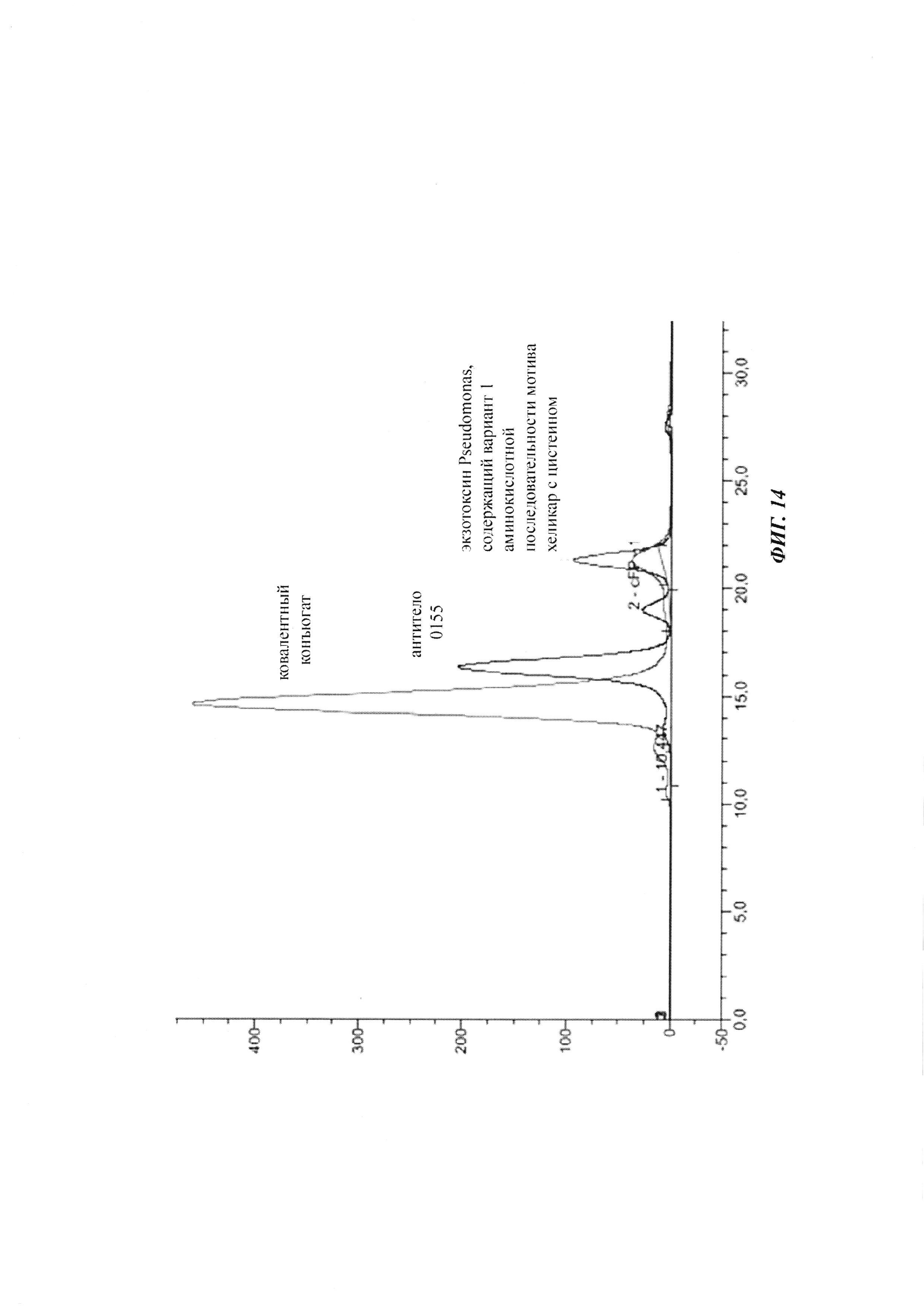
Фиг. 14: хроматограмма SEC антитела 0155, молекулы экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина, содержащей вариант 1 аминокислотной последовательности мотива хеликар с цистеином SEQ ID NO: 28, и их ковалентного конъюгата.
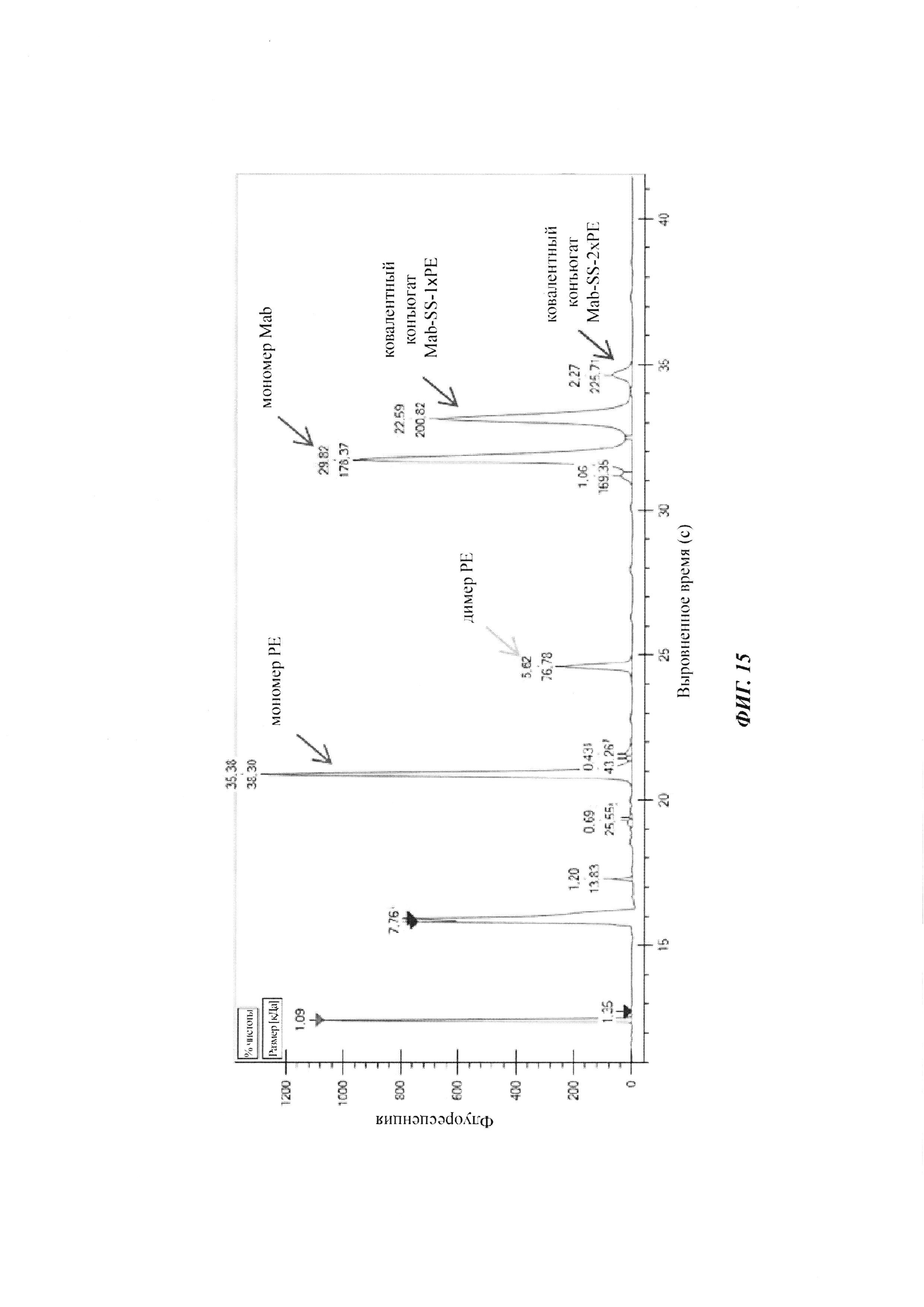
Фиг. 15: анализ эффективности конъюгирования посредством SDS-CE (капиллярный электрофорез с додецилсульфатом натрия), Caliper, для невосстановленных образцов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Термин «акцепторный человеческий каркас» для целей данного документа представляет собой каркас, содержащий аминокислотную последовательность каркаса вариабельного домена легкой цепи (VL) или каркаса вариабельного домена тяжелой цепи (VH), происходящий из каркаса человеческого иммуноглобулина или человеческого консенсусного каркаса, как определено ниже. Акцепторный человеческий каркас, «происходящий из» каркаса человеческого иммуноглобулина или человеческого консенсусного каркаса, может содержать одинаковую аминокислотную последовательность, или он может содержать замены аминокислотной последовательности. В некоторых воплощениях число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых воплощениях акцепторный человеческий каркас VL является идентичным по последовательности последовательности каркаса VL человеческого иммуноглобулина или последовательности человеческого консенсусного каркаса.
Термин «аминокислота» обозначает группу карбокси-α-аминокислот либо встречающихся в природе, т.е. которые непосредственно или в виде предшественника могут кодироваться нуклеиновой кислотой, либо не встречающихся в природе. Индивидуальные встречающиеся в природе аминокислоты кодируются нуклеиновыми кислотами, состоящими из трех нуклеотидов - так называемых кодонов или триплетов оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном. Это известно как «вырожденность генетического кода». Термин «аминокислота» в том виде, в котором он используется в пределах данной заявки, обозначает встречающиеся в природе карбокси-α-аминокислоты, включающие следующие: аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (Arg, R), аспарагин (Asn, N), аспарагиновая кислота (Asp, D), цистеин (Cys, С), глутамин (Gln, Q), глутаминовая кислота (Glu, Е), глицин (Gly, G), гистидин (His, Н), изолейцин (IIе, I), лейцин (Leu, L), лизин (Lys, K), метионин (Met, М), фенилаланин (Phe, F), пролин (Pro, Р), серии (Ser, S), треонин (Thr, Т), триптофан (Trp, W), тирозин (Tyr, Y) и валин (Val, V). Примеры аминокислот, не встречающихся в природе, включают Aad (альфа-аминоадипиновая кислота), Abu (аминомасляная кислота), Ach (альфа-аминоциклогексан-карбоновая кислота), Аср (альфа-аминоциклопентан-карбоновая кислота), Асрс (1-аминоциклопропан-1-карбоновая кислота), Aib (альфа-аминоизомасляная кислота), Aic (2-аминоиндан-2-карбоновая кислота; также именуемая 2-2-Aic), 1-1-Aic (1-аминоиндан-1-карбоновая кислота), (2-аминоиндан-2-карбоновая кислота), аллилглицин (аллилGlу), аллоизолейцин (allo-Ile), Asu (альфа-аминосубериновая кислота, 2-аминооктандиовая кислота), Bip (4-фенил-фенилаланин-карбоновая кислота), BnHP ((2S,4R)-4-гидроксипролин), Cha (бета-циклогексилаланин), Cit (цитруллин), циклогексилглицин (Chg), циклопентилаланин, бета-циклопропилаланин, Dab (1,4-диаминомасляная кислота), Dap (1,3-диаминопропионовая кислота), п-(3,3-дифенилаланин-карбоновая кислота), 3,3-дифенилаланин, ди-н-пропилглицин (Dpg), 2-фурилаланин, гомоциклогексилаланин (HoCha), гомоцитруллин (HoCit), гомоциклолейцин, гомолейцин (HoLeu), гомоаргинин (HoArg), гомосерин (HoSer), гидроксипролин, Lys(Ac), (1) Nal (1-нафтилаланин), (2) Nal (2-нафтилаланин), 4-МеО-Арс (1-амино-4-(4-метоксифенил)-циклогексан-1-карбоновая кислота), нор-лейцин (Nle), Nva (норвалин), оматин, 3-Pal (альфа-амино-3-пиридилаланин-карбоновая кислота), 4-Pal (альфа-амино-4-пиридилаланин-карбоновая кислота), 3,4,5,F3-Phe (3,4,5-трифтор-фенилаланин), 2,3,4,5,6,F5-Phe (2,3,4,5,6-пентафтор-фенилаланин), Pqa (4-оксо-6-(1-пиперазинил)-3(4Н)-хиназолин-уксусная кислота (CAS 889958-08-1)), пиридилаланин, хинолилаланин, саркозин (Sar), тиазолилаланин, тиенилаланин, Tic (альфа-амино-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота), Tic(OH), Tle (трет-бутилглицин) и Tyr(Ме), но не ограничиваются ими.
Термин «вариант аминокислотной последовательности» относится к полипептидам, имеющим аминокислотные последовательности, которые в некоторой степени отличаются от полипептида с нативной последовательностью. Обычно варианты аминокислотной последовательности будут обладать по меньшей мере примерно 70%-ной идентичностью последовательности с полипептидом с нативной последовательностью. В одном воплощении вариант имеет примерно 80% или более идентичности последовательности с полипептидом с нативной последовательностью. В одном воплощении вариант имеет примерно 90% или более идентичности последовательности с полипептидом с нативной последовательностью. В одном воплощении вариант имеет примерно 95% или более идентичности последовательности с полипептидом с нативной последовательностью. В одном воплощении вариант имеет примерно 98% или более идентичности последовательности с полипептидом с нативной последовательностью. Варианты аминокислотной последовательности обладают заменами, делециями и/или вставками в определенных положениях в пределах аминокислотной последовательности нативной аминокислотной последовательности. Аминокислоты обозначаются традиционными названиями, однобуквенными и трехбуквенными кодами.
Термин «антитело» используется в данном документе в самом широком смысле и охватывает разные структуры антител, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, но не ограничивается ими, при условии, что они демонстрируют желательную антигенсвязывающую активность.
Термин «фрагмент антитела» обозначает молекулу, отличную от интактного антитела, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, молекулы одноцепочечных антител (например, scFv) и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
Термин «биотин», сокращенно «BI», обозначает 5-[(3aS,4S,6aR)-2-оксогексагидро-1Н-тиено[3,4-d]имидазол-4-ил]пентановую кислоту. Биотин также известен как витамин Н или кофермент R.
Термин «биспецифичные антитела» обозначает антитела, которые имеют две разные специфичности связывания (антигена/хеликара). В одном воплощении биспецифичные антитела, как описано в данном документе, являются специфичными в отношении двух разных антигенов, т.е. соединения, содержащего аминокислотную последовательность мотива хеликар, и антигена, не содержащего аминокислотную последовательность мотива хеликар.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, тогда как остальная тяжелая и/или легкая цепь происходит из другого источника или вида.
«Класс» антитела относится к типу константного домена или константной области, которыми обладает его тяжелая цепь. Существуют пять главных классов антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
Термин «цитотоксический агент» в том виде, как он используется в данном документе, относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клеток. Цитотоксические агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты; и разные противоопухолевые или противораковые агенты, раскрытые ниже, но не ограничиваются ими.
Термин «дигоксигенин», кратко «DIG», обозначает 3-[(3S,5R,8R,9S,10S,12R,13S,14S,17R)-3,12,14-тригидрокси-10,13-диметил-1,2,3,4,5,6,7,8,9,11,12,15,16,17-тетрадекагидро-циклопента[а]-фенантрен-17-ил]-2Н-фуран-5-он (номер CAS 1672-46-4). Дигоксигенин (DIG) представляет собой стероид, обнаруженный исключительно в цветках и листьях растений Digitalis purpurea, Digitalis orientalis и Digitalis Ianata (наперстянка) (Polya, G., Biochemical targets of plant bioactive compounds, CRC Press, New York (2003) p. 847).
Термин «эффективное количество» агента, например, фармацевтической композиции, обозначает количество, эффективное в дозировках и в течение периодов времени, необходимых для достижения желательного терапевтического или профилактического результата.
Расщепление антител папаином продуцирует два идентичных антигенсвязывающим фрагмента, именуемых фрагментами «Fab», причем каждый имеет один антигенсвязывающий сайт, и остаточный фрагмент «Fc», название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и все еще способен к поперечному связыванию антигена.
Фрагмент Fab также содержит константный домен легкй цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбокси конце домена СН1 тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. Fab'-SH представляет собой используемое в данном документе обозначение для Fab', в котором остаток(тки) цистеина константных доменов несет(сут) по меньшей мере одну свободную тиольную группу. Фрагменты антитела F(ab')2 исходно продуцировались в виде пар фрагментов Fab', которые имеют между ними цистеины шарнирной области. Также известны другие продукты химического связывания фрагментов антитела.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полные сайт распознавания антигена и антигенсвязывающий сайт. Данная область состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в тесной, нековалентной ассоциации. Именно в данной конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с определением антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть гипервариабельных областей придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные в отношении антигена) имеет способность распознавать и связываться с антигеном, хотя и с меньшей аффинностью, чем полный связывающий сайт.
Термин «область Fc» в данном документе используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Данный термин включает области Fc с нативной последовательностью и варианты областей Fc. В одном воплощении область Fc тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или может отсутствовать. Если в данном документе не определено иначе, нумерация аминокислотных остатков в области Fc или в константной области осуществляется согласно системе нумерации ЕС, также именуемой индекс ЕС, как описано в Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Термин «флуоресцеин», кратко «FLUO», обозначает 6-гидрокси-9-(2-карбоксифенил)-(3Н)-ксантен-3-он, альтернативно - 2-(6-гидрокси-3-оксо-(3Н)-ксантен-9-ил)-бензойную кислоту. Флуоресцеин также известен как резорцинолфталеин, C.I. 45350, растворитель желтый 94, D&С желтый №7, ангиофлур, японский желтый 201 или мыльный желтый.
Термин «каркас», кратко «FR», обозначает аминокислотные остатки вариабельного домена тяжелой и легкой цепи, отличные от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в следующей последовательности в VH (или в VL): FR1-Н1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термин «свободная аминокислота цистеин» обозначает остаток аминокислоты цистеин, который был создан путем генетической модификации в родительском антителе, имеет тиольную функциональную группу (SH), и не образует пару в виде внутримолекулярного дисульфидного мостика. Тем не менее, свободная аминокислота цистеин может образовать пару в виде внутримолекулярного дисульфидного мостика, например, с глутатионом.
Термин «полноразмерное антитело» обозначает антитело, имеющее структуру, по существу аналогичную структуре нативного антитела, или имеющее тяжелые цепи, которые содержат область Fc, как определено в данном документе. Нативные антитела IgG представляют собой гетеротетрамерные гликопротеины массой примерно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидным мостиком. От N-до С-конца каждая тяжелая цепь имеет вариабельную область (VH), также именуемую вариабельный тяжелый домен или вариабельный домен тяжелой цепи, с последующими тремя константными доменами (СН1, СН2 и СН3). Аналогично, от N- до С-конца каждая легкая цепь имеет вариабельную область (VL), также именуемую вариабельный легкий домен или вариабельный домен легкой цепи, с последующим константным легким (CL) доменом. Легкая цепь антитела может быть приписана к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
«Полноразмерное антитело» представляет собой антитело, содержащее домен VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи - СН1, СН2 и СН3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, человеческие константные домены с нативной последовательностью) или вариантом его аминокислотной последовательности. Полноразмерное антитело может иметь одну или более чем одну «эффекторную функцию», которая относится к тем биологическим активностям, которые присущи константной области Fc (области Fc с нативной последовательностью или варианту аминокислотной последовательности области Fc) антитела. Примеры эффекторных функций антитела включают связывание C1q; комплементзависимую цитотоксичность; связывание с рецептором Fc; антителозависимую клеточную цитотоксичность (ADCC); фагоцитоз и понижающую регуляцию рецепторов поверхности клетки, таких как рецептор В-клеток и BCR.
Термин «гаптен» обозначает маленькую молекулу, которая может вызывать иммунный ответ только при присоединении к большому носителю, такому как белок. Типичными гаптенами являются анилин, о-, м- и п-аминобензойная кислота, хинон, гистамин-сукцинил-глицин (HSG), гидралазин, галотан, иридий-DTPA (диэтилентриаминпентауксусная кислота), флуоресцеин, биотин, дигоксигенин, теофиллин и динитрофенол. В одном воплощении гаптен представляет собой биотин или дигоксигенин, или теофиллин, или карборан, или бромдезоксиуридин.
Термин «аминокислотная последовательность мотива хеликар» обозначает аминокислотную последовательность, которая имеет аминокислотную последовательность SEQ ID NO: 01 или ее вариант, которая специфично связывается антителом против хеликара, которое имеет вариабельный домен тяжелой цепи SEQ ID NO: 04 и вариабельный домен легкой цепи SEQ ID NO: 05.
Термин «аминокислотная последовательность мотива хеликар, которая конъюгирована с» или «соединение, содержащее аминокислотную последовательность мотива хеликар» обозначает аминокислотную последовательность мотива хеликар, которая ковалентно связана с другой группировкой, такой как полипептид или метка. Активированное производное аминокислотной последовательность мотива хеликар можно использовать в качестве исходного вещества для образования таких конъюгатов. В одном воплощении линкер содержит: а) одну или более чем одну (в одном воплощении - от трех до шести) метилен-карбокси-метильную группу (-CH2-С(O-) и/или б) от 1 до 10 (в одном воплощении - от 1 до 5) аминокислотных остатков (в одном воплощении выбранных из глицина, серина, глутамата, β-аланина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты или лизина), и/или в) одно или более чем одно (в одном воплощении - одно или два) соединение, имеющее структурную формулу NH2-[(CH2)nO]xCH2-CH2-COOH, в котором n равно 2 или 3, и х равен 1-10, в одном воплощении - 1-7. Последний элемент приводит (по меньшей мере частично) к образованию линкера (части) формулы -NH-[(CH2)nO]xCH2-CH2-С(O)-. Одним примером такого соединения является, например, 12-амино-4,7,10-триоксадодекановая кислота (приводит к образованию TEG (триэтиленгликоль) линкера). В одном воплощении линкер дополнительно содержит малеимидную группу. Линкер имеет стабилизирующий и солюбилизирующий эффект, так как он содержит заряды и/или может образовать водородные мостики. Кроме того, он может стерически облегчать связывание антитела против хеликара с соединением, содержащим аминокислотную последовательность мотива хеликар. В одном воплощении линкер локализован на боковой цепи аминокислоты аминокислотной последовательности мотива хеликар (например, конъюгирован с боковой цепью лизина или цистеина через амино или тиольную группу). В одном воплощении линкер локализован на аминоконце или на карбоксильном конце аминокислотной последовательности хеликара. Положение линкера на конъюгированном соединении (грузе) типично выбрано в области, где биологическая активность груза не подвергается влиянию. Следовательно, положение присоединения линкера зависит от природы груза и релевантных структурных элементов, которые отвечают за биологическую активность. Биологическую активность груза, к которому присоединена аминокислотная последовательность мотива хеликар, можно тестировать в анализе in vitro.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичную трансформированную клетку и потомство, происходящее от нее, безотносительно от числа пассажей. Потомство может не быть полностью идентичным родительской клетке по составу нуклеиновых кислот, но может содержать мутации. В данный документ включено мутантное потомство, которое имеет такую же функцию или биологическую активность, что и полученная в результате скрининга или отбора на них исходно трансформированная клетка.
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком или человеческой клеткой, или полученного из источника, не являющегося человеческим, в котором используются репертуары человеческих антител или другие последовательности, кодирующие человеческое антитело. Данное определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
Термин «гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR, не являющихся человеческими, и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет по существу содержать все или по меньшей мере один и типично два вариабельных домена, в которых все или по существу все HVR (например, CDR) соответствуют HVR антитела, не являющегося человеческим, и все или по существу все FR соответствуют FR человеческого антитела. Гуманизированное антитело возможно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Термин «гуманизированная форма» антитела, например, антитела, не являющегося человеческим, относится к антителу, которое подверглось гуманизации.
Термин «гипервариабельная область» или «HVR» в том виде, в котором он используется в данном документе, относится к каждой из областей вариабельного домена антитела, которая является гипервариабельной по последовательности («области, определяющие комплементарность», или CDR) и/или образует структурно определенные петли («гипервариабельные петли»), и/или содержит остатки, контактирующие с антигеном («контакты с антигеном»). В общем, антитела содержат шесть HVR: три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3).
Описанные в данном документе HVR включают:
(а) гипервариабельные петли, встречающиеся в области аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia, С. and Lesk, А.М., J. Mol. Biol. 196 (1987) 901-917);
(б) CDR, встречающиеся в области аминокислотных остатков 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (Н1), 50-65 (Н2) и 95-102 (Н3) (Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242);
(в) контакты с антигеном, встречающиеся в области аминокислотных остатков 27c-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (Н1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(г) комбинации (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (Н1), 26-35b (Н1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
«Индивид» или «субъект» представляет собой млекопитающее. Млекопитающие включают домашних животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, человек и приматы, не являющиеся человеком, такие как обезьяны), кроликов и грызунов (например, мыши и крысы), но не ограничиваются ими. В некоторых воплощениях индивид или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его природного окружения. В некоторых воплощениях антитело очищено до более чем 95%-ной или 99%-ной чистоты при определении, например, электрофоретическими (например, SDS-PAGE, изоэлектрофокусировка (IEF), капиллярный электрофорез) или хроматографическими (например, ионообменная ВЭЖХ (высокоэффективная жидкостная хроматография) или ВЭЖХ с обращенной фазой) способами. Относительно обзора способов оценки чистоты антитела, см., например, Flatman, S. et al., J. Chrom. В 848 (2007) 79-87.
«Выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которую отделили от компонента ее природного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но данная молекула нуклеиновой кислоты присутствует внехромосомно или в участке хромосомы, который отличается от ее природной хромосомной локализации.
Термин «моноклональное антитело» в том виде, в котором он используется в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, содержащиеся в популяции, являются идентичными и/или связываются с тем же самым эпитопом, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающие во время получения препарата моноклонального антитела, причем такие варианты обычно присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые типично включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, модификатор «моноклональное» указывает характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, подлежащие применению согласно настоящему изобретению, можно получать целым рядом способов, включающих способ гибридомы, способы генной инженерии, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов человеческих иммуноглобулинов, но не ограничивающихся ими, причем такие способы и другие типичные способы получения моноклональных антител описываются в данном документе.
Термин «моноспецифичное антитело» обозначает антитело, которое имеет один или более чем один сайт связывания, каждый из которых имеет одинаковую специфичность связывания, т.е. связывается с тем же самым антигеном или аминокислотной последовательностью мотива хеликар.
Термин «голое антитело» относится к антителу, которое не конъюгировано с гетерологичной группировкой (например, с цитотоксической группировкой) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
Термин «листок-вкладыш в упаковке» используется для названия инструкций, традиционно включаемых в имеющиеся в продаже упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждения относительно применения таких терапевтических продуктов.
«Родительское антитело» представляет собой антитело, содержащее аминокислотную последовательность, в которой один или более чем один аминокислотный остаток заменяется одним или более чем одним остатком цистеина. Родительское антитело может содержать природную последовательность или последовательность дикого типа. Родительское антитело может иметь предсуществующие модификации аминокислотной последовательности (такие как присоединения, делеции и/или замены) относительно других природных, дикого типа или модифицированных форм антитела. Родительское антитело специфично связывается с аминокислотной последовательностью мотива хеликар. Родительское антитело также может быть дополнительно направлено против интересующего антигена-мишени, например, важного с биологической точки зрения полипептида. Также рассматриваются антитела, направленные против неполипептидных антигенов.
Термин «груз» обозначает любую молекулу или комбинацию молекул, активность которых желательно доставлять в клетку и/или чтобы она локализовалась в клетке. Грузы включают метки, цитотоксины (например, экзотоксин Pseudomonas, рицин, абрин, дифтерийный токсин и тому подобное), ферменты, факторы роста, транскрипционные факторы, лекарственные средства, радиоактивные изотопы, лиганды, антитела, липосомы, наночастицы, вирусные частицы, цитокины и тому подобное, но не ограничваются ими.
«Химиотерапевтический агент» представляет собой химическое соединение, полезное в лечении ракового заболевания. Примеры химиотерапевтических агентов включают следующие: алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламиламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; противоадреналиновые средства, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); циклофосфамид; тиотепа; таксаны, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ) и доцетаксел (TAXOTERE®, Rh6ne-Poulenc Rorer, Antony, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-М; ингибитор топоизомеразы 35 - RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота, эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше. Также в данное определение включены противогормональные агенты, которые действуют, регулируя или ингибируя действие гормона на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше.
Термин «антиангиогенный агент» относится к соединению, которое блокирует, или в некоторой степени препятствует развитию кровеносных сосудов. Антиангиогенный агент может, например, представлять собой маленькую молекулу или антитело, которое связывается с фактором роста или рецептором фактора роста, участвующих в стимуляции ангиогенеза. В одном воплощении антиангиогенный фактор представляет собой антитело, которое связывается с фактором роста эндотелия сосудов (VEGF).
Термин «цитокин» является общим термином для белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Включенными среди цитокинов являются гормон роста, такой как человеческий гормон роста, N-метионил-человеческий гормон роста и коровий гормон роста; паратгормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-а и -Р; мюллерова ингибирующая субстанция; мышиный пептид, ассоциированный с гонадотропином; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-p; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-a и TGF-p; инсулиноподобный фактор роста-I и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-а, -Р и -у; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (GCSF); интерлейкины (IL), такие как IL-I, IL-Ia, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-α или TNF-P; и другие полипептидные факторы, включающие LIF (фактор, ингибирующий лейкоз) и наборный лиганд (KL). Термин «цитокин» в том виде, в котором он используется в данном документе, включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с природной последовательностью.
Термин «fMLP» обозначает трипептид, состоящий из N-формилметионина, лейцина и фенилаланина. В одном воплощении эффекторная группировка представляет собой fMLP или его производное.
Термин «пролекарство» относится к предшественнику или к форме производного фармацевтически активного вещества, которые являются менее цитотоксичными для опухолевых клеток по сравнению с родительским лекарственным средством и способными к ферментативной активации или превращению в более активную родительскую форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, Vol. 14, 615th Meeting Belfast (1986) pp. 375-382 и Stella, et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt, et al., (eds.), pp. 247-267, Humana Press (1985). Пролекарства, которые могут быть использованы в качестве эффекторной группировки, включают фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептид-содержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, b-лактам-содержащие пролекарства, возможно замещенные феноксиацетамид-содержащие пролекарства или возможно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие пролекарства на основе 5-фторуридина, которые могут быть превращены в более активное свободное цитотоксическое лекарственное средство, но не ограничиваются ими. Примеры цитотоксических лекарственных средств, которые могут быть дериватизированы до формы пролекарства для применения в данном изобретении, включают те химиотерапевтические агенты, которые описаны в данном документе, но не ограничиваются ими.
Термин «цитотоксическая группировка» относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клеток. Цитотоксические агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты; и разные противоопухолевые или противораковые агенты, раскрытые в данном документе, но не ограничиваются ими.
«Процент (%) идентичности аминокислотной последовательности» по отношению к эталонной полипептидной последовательности определяется как процентная доля аминокислотных остатков в последовательности-кандидате, которые являются идентичными аминокислотным остаткам в эталонной полипептидной последовательности, после выравнивания данных последовательностей и введения, при необходимости, пробелов для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены как часть идентичности последовательности. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может достигаться разными способами, которые находятся в пределах квалификации в данной области, например, с использованием общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для указанных в данном документе целей значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Автором компьютерной программы для сравнения последовательностей ALIGN-2 является Genentech, Inc., и исходный код с пользовательской документацией был подан в Бюро регистрации авторских прав США, Washington D.C., 20559, где он зарегестрирован под регистрационным №авторских прав США TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть компилирована из исходного кода. Программа ALIGN-2 должна быть компилирована для применения на операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей заданы программой ALIGN-2 и не изменяются.
В ситуациях, когда ALIGN-2 используется для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А относительно, при сравнении или против данной аминокислотной последовательности Б (что, в качестве альтернативы, может быть выражено как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности относительно, при сравнении или против данной аминокислотной последовательности Б) рассчитывется следующим образом:
100 умножить на отношение X/Y,
где X равен числу аминокислотных остатков, подсчитанных программой для выравнивания последовательностей ALIGN-2 как идентичные соответствия, в выравнивании данной программой А и Б, и где Y равен общему числу аминокислотных остатков в Б. Будет понятно, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, % идентичности аминокислотной последовательности А с Б не будет равен % идентичности аминокислотной последовательности Б с А. Если конкретно не утверждается иное, все значения % идентичности аминокислотных последовательностей, использованные в данном документе, получают, как описано в непосредственно предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
Термин «фармацевтическая композиция» относится к препарату, который находится в такой форме, чтобы обеспечивать эффективную биологическую активность содержащегося в нем активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому вводилась бы композиция.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
«Полипептид» представляет собой полимер, состоящий из аминокислот, связанных пептидными связями, независимо от того, продуцируется ли он в природе или синтетически. Полипептиды из менее чем примерно 20 аминокислотных остатков могут называться «пептидами», тогда как молекулы, состоящие из двух или более чем двух полипептидов или содержащие один полипептид из более чем 100 аминокислотных остатков, могут называться «белками». Полипептид также может содержать неаминокислотные компоненты, такие как углеводные группы, ионы металлов или сложные эфиры карбоновой кислоты. Неаминокислотные компоненты могут быть добавлены клеткой, в которой экспрессируется полипептид, и могут варьировать, в зависимости от типа клетки. Полипептиды определяются в данном документе в терминах структуры их аминокислотного остова или кодирующей их нуклеиновой кислоты. Присоединения, такие как углеводные группы, обычно не определяются, но, тем не менее, могут присутствовать.
Все полипептидные последовательности написаны согласно общепринятому соглашению, при этом альфа-N-концевой аминокислотный остаток находится слева, и альфа-С-концевой аминокислотный остаток находится справа. Термин «N-конец» в том виде, как он используется в данном документе, относится к свободной альфа-аминогруппе аминокислоты в полипептиде, и термин «С-конец» относится к свободному концу в виде α-карбоксильной группы аминокислоты в полипептиде. Фраза «полипептид, который N-терминирован группой», относится к полипептиду, несущему группу на азоте альфа-аминогруппы N-концевого аминокислотного остатка. Фраза «аминокислота, которая N-терминирована группой», относится к аминокислоте, несущей группу на азоте альфа-аминогруппы.
Если не указано иное посредством префикса «D», например, D-Ala или N-Me-D-Ile, или не написано в формате строчных букв, например, a, i, l (D версии Ala, Ile, Leu), стереохимией альфа-углерода аминокислот и аминоацильных остатков в полипептидах, описанных в данном описании изобретения и приложенной формуле изобретения, является природная «L» конфигурация. Обозначения Кана-Ингольда-Прелога «R» и «S» используются для определения стереохимии хиральных центров в определенных ацильных заместителях на N-конце полипептидов. Подразумевается, что обозначение «R, S» указывает рацемическую смесь двух энантиомерных форм. Данная номенклатура следует номенклатуре, описанной в Cahn, R.S., et al., Angew. Chem. Int. Ed. Engl. 5 (1966) 385-415.
Термин «одноцепочечный Fv», кратко «scFv», обозначает фрагмент антитела, который содержит домены VH и VL антитела, где данные домены присутствуют в одной полипептидной цепи. В одном воплощении полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv желательной структуры для связывания антигена. Относительно обзора scFv, см. Plueckthun, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore (Eds), Springer-Verlag, New York, pp. 269-315(1994).
Термин «теофиллин», кратко «ТНЕО», обозначает 1,3-диметил-7Н-пурин-2,6-дион. Теофиллин также известен как диметилксантин.
Термин «лечение» (и его грамматические вариации, такие как «лечить» или «проведение лечения») обозначает клиническое вмешательство в попытке изменить естественный ход заболеания у индивида, которого лечат, и его можно проводить либо для профилактики, либо на протяжении хода клинической патологии. Желательные эффекты лечения включают предупреждение появления или рецидива заболевания, облегчение симптомов, уменьшение каких-либо прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, уменьшение скорости прогрессирования заболевания, уменьшение интенсивности или временное облегчение болезненного состояния и ремиссию или улучшенный прогноз, но не органичиваются ими. В некоторых воплощениях антитела по изобретению используют для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин «х-валентное», например, «одновалентное» или «двухвалентное», или «трехвалентное», или «четырехвалентное», обозначает присутствие определенного числа сайтов связывания, т.е. «х», в молекуле антитела. Термины «двухвалентное», «четырехвалентное» или «шестивалентное», как таковые, обозначают присутствие в молекуле антитела двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания соответственно. Биспецифичные антитела, как описано в данном документе, являются по меньшей мере «двухвалентными» и могут быть «трехвалентными» или «многовалентными» (например, «четырехвалентными» или «шестивалентными»). В одном воплощении биспецифичное антитело, как описано в данном документе, является двухвалентным, трехвалентным или четырехвалентным. В одном воплощении биспецифичное антитело является двухвалентным. В одном воплощении биспецифичное антитело является трехвалентным. В одном воплощении биспецифичное антитело является четырехвалентным.
В некоторых аспектах и воплощениях антитела, как описано в данном документе, имеют два или более чем два сайта связывания и являются биспецифичными. То есть, антитела могут быть биспецифичными даже в случаях, когда имеются более чем два сайта связывания (т.е., данное антитело является трехвалентным или многовалентным). Термин «биспецифичные антитела» включает, например, многовалентные одноцепочечные антитела, диатела и триатела, а также антитела, имеющие структуру константного домена полноразмерных антител, с которыми связаны дополнительные антигенсвязывающие сайты (например, одноцепочечный Fv, домен VH и/или домен VL, Fab или (Fab)2) через один или более чем один пептидный линкер. Антитела могут быть полноразмерными из одного вида или химерными, или гуманизированными. Для антитела с более чем двумя антигенсвязывающими сайтами некоторые сайты связывания могут быть идентичными, при условии, что данный белок имеет сайты связывания в отношении двух разных антигенов. То есть, в то время как первый сайт связывания является специфичным в отношении аминокислотной последовательности мотива хеликар, второй сайт связывания является специфичным в отношении антигена, не являющегося аминокислотной последовательностью мотива хеликар, и наоборот.
Термин «вариабельная область» обозначает домен тяжелой или легкой цепи антитела, который участвует в связывании антитела с его антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела обычно имеют аналогичные структуры, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt, T.J. et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), страница 91). Один домен VH или VL может быть достаточным для придания специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных доменов VL или VH соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628).
Термин «вектор» обозначает молекулу нуклеиновой кислоты, способную размножать другую нуклеиновую кислоту, с которой он связан. Данный термин включает вектор в виде самореплицируемой структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они связаны функциональным образом. Такие векторы называются в данном документе «экспрессионные векторы».
II. Конъюгаты, описанные в данном документе
В одном аспекте изобретение основано на открытии того, что ковалентный конъюгат, содержащий соединение, содержащее аминокислотную последовательность мотива хеликар, и антитело против аминокислотной последовательность мотива хеликар, которое специфично связывается с аминокислотной последовательностью мотива хеликар, может быть получен посредством образования ковалентной связи между правильно размещенной функциональной группой в аминокислотной последовательности мотива хеликар и функциональной группой в вариабельном домене антитела, особенно в CDR2 антитела, при этом CDR2 определяется согласно нумерации вариабельного домена согласно Kabat.
В одном воплощении соединение, содержащее аминокислотную последовательность мотива хеликар, представляет собой конъюгат, содержащий аминокислотную последовательность мотива хеликар, линкер и груз.
В некоторых воплощениях функциональная группа может содержать электронодефицитные двойные связи или тиол. В одном воплощении функциональная группа представляет собой малеимид или цистеин.
Поскольку конъюгаты, как описано в данном документе, можно использовать в качестве терапевтического агента у людей, в данном документе также предложен гуманизированный вариант описанного выше антитела, которое специфично связывается с аминокислотной последовательностью мотива хеликар.
Ковалентные конъюгаты соединения, содержащего аминокислотную последовательность мотива хеликар, и антитела против аминокислотной последовательности мотива хеликар могут придавать соединению, содержащему аминокислотную последовательность мотива хеликар, благоприятные биофизические характеристики и улучшенные PK свойства. Кроме того, в случае применения биспецифичного антитела, конъюгаты можно использовать для нацеливания соединения, содержащего аминокислотную последовательность мотива хеликар, на клетки, которые демонстрируют антиген, который распознается вторым функционалом связывания биспецифичного антитела. Такие конъюгаты состоят из одного функционала связывания против аминокислотной последовательности мотива хеликар и одного дополнительного функционала связывания антигена (не являющегося аминокислотной последовательностью мотива хеликар). Стехиометрическое отношение антитела к полипептиду, содержащему аминокислотную последовательность мотива хеликар, зависит от формата биспецифичного антитела и может составлять 1:1, 1:2, 2:1, 2:2, 2:4 и 4:2 (антитело : полипептид, содержащий аминокислотную последовательность мотива хеликар).
Желательно, чтобы биологически активное соединение в соединении, содержащем аминокислотную последовательность мотива хеликар, сохраняло хорошую биологическую активность, несмотря на конъюгирование с аминокислотной последовательностью мотива хеликар, а также конъюгирование с антителом. Также желательно (в случае биспецифичных нацеливающих модулей), чтобы сайт связывания мишени на поверхности клетки биспецифичного антитела сохранял его специфичность связывания и аффинность в присутствии ковалентно конъюгированного соединения, содержащего мотив хеликар.
Реакционноспособная группа в аминокислотной последовательности мотива хеликар может представлять собой любую реакционноспособную группу, такую как, например, малеимид, например, N-этилмалеимид (NEM), йодацетамид, пиридилдисульфид или другой реакционноспособный партнер по конъюгированию (см., например, Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55 и 643-671).
Реакционноспособная группа на антителе ограничивается группами, которые могут быть получены селективно, т.е. специфично в отношении положения. Следовательно, она ограничивается группами боковой цепи аминокислотных остатков цистеина, серина, аспарагина, глутамина, тирозина, лизина, аргинина, аспарагиновой кислоты и глутаминовой кислоты.
Для образования ковалентного конъюгата между антителом против аминокислотной последовательности мотива хеликар и соединением, содержащим аминокислотную последовательность мотива хеликар, оба должны быть модифицированы введением реакционноспособной группы. При связывании аминокислотной последовательности мотива хеликар антителом против аминокислотной последовательности мотива хеликар две реакционноспособные группы оказываются совсем рядом друг с другом, обеспечивая образование ковалентной связи. В одном воплощении модификация представляет собой введение в каждое из соединений тиольной функциональной группы. В одном воплощении тиольное соединение представляет собой остаток цистеина.
Положение, подлежащее мутации, должно одновременно удовлетворять двум требованиям: (i) связываемые положения должны находится поблизости от связывающей области для использования эффекта расположения аминокислотной последовательности мотива хеликар для направленного связывания, (ii) мутация и связываемое положение должны располагаться таким образом, чтобы не было влияния на само связывание аминокислотной последовательности мотива хеликар. Данные требования для нахождения подходящего положения являются фактически «противоречащими» друг другу, так как требование (i) лучше всего выполняется положением, близким к сайту связывания, тогда как требование (ii) наиболее безопасно достигается удаленными положениями от сайта связывания.
Несмотря на эти фактически взаимоисключающие требования, было идентифицировано положение, в котором можно осуществлять мутацию без воздействия на расположение аминокислотной последовательности мотива хеликар, и которое, тем не менее, одновременно обеспечивает направленное ковалентное связывание.
Одно положение расположено в положении VL55 согласно нумерации вариабельного домена легкой цепи по Kabat.
Одно положение расположено в положении VL51 согласно нумерации вариабельного домена легкой цепи по Kabat.
Данные положения применимы к антителу против аминокислотной последовательности мотива хеликар и, таким образом, каждый раз не требуется начинать с нуля получение нового ковалентного конъюгата, который необходимо сделать. Лишь аминокислотная последовательность мотива хеликар должна быть введена в конъюгат с грузом.
Антитела, модифицированные, как описано в данном документе, сохраняют связывающую способность в отношении аминокислотной последовательности мотива хеликар их аналогов - родительских антител (т.е. антител дикого типа). Таким образом, модифицированное антитело способно к связыванию, в одном воплощении оно способно к специфичному связыванию с аминокислотной последовательностью мотива хеликар.
Термины «функционал связывания» или «антитело, которое связывается с» обозначают то, что молекула, содержащая функционал связывания, или антитело могут специфично образовать комплекс с другой молекулой. Связывание может быть выявлено анализом in vitro, как, например, в анализе плазмонного резонанса (BIAcore, GE-Healthcare, Уппсала, Швеция). Аффинность образования комплекса определяется по показателям ka (константа скорости для ассоциации соединений с образованием комплекса), kD (константа диссоциации, диссоциации комплекса) и KD (kD/ka). Связывание или специфичное связывание означает аффинность связывания (KD) примерно 10-7 М или менее, в одном воплощении - от примерно 10-8 М до примерно 10-13 М, в одном воплощении - от примерно 10-9 М до примерно 10-13 М. Таким образом, антитело, которое связывается с аминокислотной последовательностью мотива хеликар с образованием комплекса, как описано в данном документе, специфично связывается с аминокислотной последовательностью мотива хеликар с аффинностью связывания (KD) примерно 10-8 моль/л или менее, в одном воплощении - от примерно 10-8 моль/л до примерно 10-13 моль/л.
Обнаружили, что образование ковалентной связи между антителом против аминокислотной последовательности мотива хеликар, модифицированным цистеином, и соединением, содержащим аминокислотную последовательность мотива хеликар, модифицированным цистеином, несущим остаток цистеина в аминокислотной последовательности мотива хеликар, происходит при связывании антитела с аминокислотной последовательностью мотива хеликар без необходимости добавления восстановителей и/или окислителей, если образующаяся связь представляет собой дисульфидную связь. Таким образом, дисульфидный мостик между двумя соединениями образуется спонтанно при образовании нековалентного комплекса. Следовательно, для способа образования ковалентного комплекса, как описано в данном документе, просто требуется смешивание двух соединений. Единственной предпосылкой для образования дисульфидной связи является правильная ориентация двух соединений по отношению друг к другу.
Генетически модифицированные антитела, как описано в данном документе, могут сайтспецифично и эффективно ковалентно конъюгировать (связываться) с аминокислотной последовательностью мотива хеликар, содержащей реакционноспособную группу.
Замена аминокислотного остатка в положении VL55 или VL51 соответственно (согласно схеме нумерации по Kabat) на остаток Cys приводила к производным антитела против аминокислотной последовательности мотива хеликар с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO: 06 и SEQ ID NO: 07.
Один аспект, как описано в данном документе, представляет собой антитело против аминокислотной последовательности мотива хеликар, которое представляет собой гуманизированное антитело. В одном воплощении антитело против аминокислотной последовательности мотива хеликар содержит гуманизированный вариабельный домен тяжелой цепи, происходящий из вариабельного домена тяжелой цепи, который имеет аминокислотную последовательность SEQ ID NO: 04, и гуманизированный вариабельный домен легкой цепи, происходящий из вариабельного домена легкой цепи, который имеет аминокислотную последовательность SEQ ID NO: 05.
Один аспект, как описано в данном документе, представляет собой антитело против аминокислотной последовательности мотива хеликар, которое представляет собой гуманизированное антитело. В одном воплощении антитело против аминокислотной последовательности мотива хеликар содержит гуманизированный вариабельный домен тяжелой цепи, происходящий из вариабельного домена тяжелой цепи, который имеет аминокислотную последовательность SEQ ID NO: 04, и гуманизированный вариабельный домен легкой цепи, происходящий из вариабельного домена легкой цепи, который имеет аминокислотную последовательность SEQ ID NO: 06.
Один аспект, как описано в данном документе, представляет собой антитело против аминокислотной последовательности мотива хеликар, которое представляет собой гуманизированное антитело. В одном воплощении антитело против аминокислотной последовательности мотива хеликар содержит гуманизированный вариабельный домен тяжелой цепи, происходящий из вариабельного домена тяжелой цепи, который имеет аминокислотную последовательность SEQ ID NO: 04, и гуманизированный вариабельный домен легкой цепи, происходящий из вариабельного домена легкой цепи, который имеет аминокислотную последовательность SEQ ID NO: 07.
Один аспект, как описано в данном документе, представляет собой антитело против аминокислотной последовательности мотива хеликар, которое содержит такие же CDR, как и в вариабельном домене SEQ ID NO: 04 для тяжелой цепи и такие же, как и в любом из вариабельных доменов SEQ ID NO: 05 или SEQ ID NO: 06, или SEQ ID NO: 07 для вариабельного домена легкой цепи, и дополнительно содержит акцепторный человеческий каркас, например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас.
Один аспект, как описано в данном документе, представляет собой антитело против аминокислотной последовательности мотива хеликар, которое содержит такие же гипервариабельные петли, как и в вариабельном домене SEQ ID NO: 04 для тяжелой цепи и такие же, как и в любом из вариабельных доменов SEQ ID NO: 05 или SEQ ID NO: 06, или SEQ ID NO: 07 для вариабельного домена легкой цепи, и дополнительно содержит акцепторный человеческий каркас, например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас.
Например, PYY был модифицирован так, чтобы он содержал аминокислотную последовательность мотива хеликар и комплексировался антителом против аминокислотной последовательности мотива хеликар для того, чтобы получить преимущество фармакокинетических свойств антитела и избежать собственной нестабильности PYY.
Структурное исследование пептида PYY3-36 (Nygaard, R., et al., Biochem. 45 (2006) 8350-8357; SEQ ID NO: 211) выявляет спиральный мотив (аминокислотная последовательность хеликар-подобного мотива) для центральных аминокислот.
Поскольку N-концевой изолейцин и модифицированный С-конец были описаны как важные для функциональной активности пептида, центральную спираль модифицировали для того, чтобы она отображала аминокислоты в аминокислотной последовательности мотива хеликар.

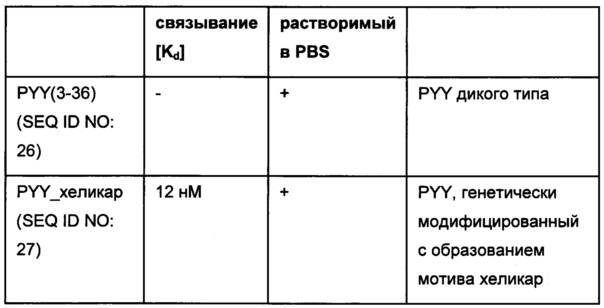
Полное антитело IgG1 0019 против аминокислотной последовательности мотива хеликар и модифицированный пептид PYY - PYY_хеликар получали in vitro посредством введения небольшого избытка пептида в раствор антитела. Образовался комплекс 0052. Стехиометрия данного комплекса, определенная посредством аналитических экспериментов SEC-MALLS, составляет 1,6 пептидов, комплексированных на одном двухвалентном антителе.
Антитело 0019, PYY(3-36) дикого типа, PYY_хеликар и комплекс 0052 тестировали на их эффект на семейство рецептора Y2.
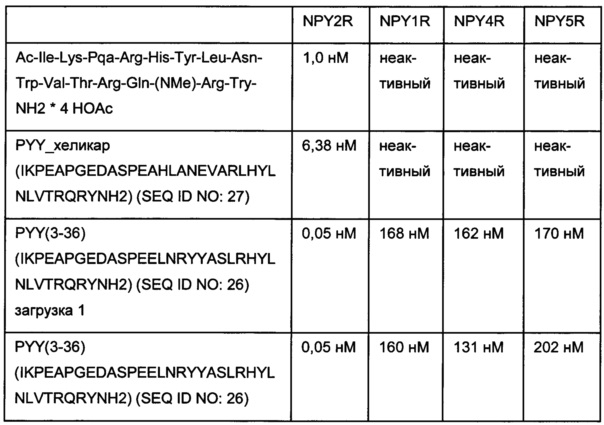
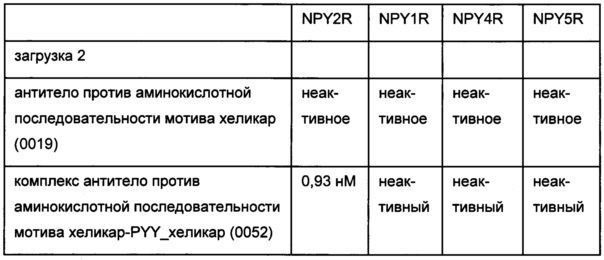
Как было продемонстрировано (Hoffmann, Е., et al., J. Cont. Rel. 171 (2013) 48-56.), пептиды, комплексированные антителом, имеют пролонгированный период полувыведения in vivo. Кроме того и неожиданно, данный комплекс демонстрирует немного лучшую аффинность в отношении рецептора NPY2R по сравнению с некомплексированным пептидом; антитело стабилизирует полипептид и презентирует пептид в его фиксированной биологически активной конформации.
Для того чтобы увеличить стабильность комплекса между антителом против аминокислотной последовательности мотива хеликар и соединением, содержащим аминокислотную последовательность мотива хеликар in vitro и in vivo, использовали образование дисульфидного мостика при связывании.
Первой стадией является стадия специфичного распознавания (высокоаффинное взаимодействие), т.е. образование комплекса соединение, содержащее аминокислотную последовательность мотива хеликар-антитело против аминокислотной последовательности мотива хеликар. После этого на второй стадии следует спонтанная перетасовка дисульфидного мостика с образованием ковалентного комплекса с улучшенной стабильностью.
Поскольку 12-мерный пептид (аминокислотная последовательность мотива хеликар) является относительно жестким соединением (по меньшей мере при комплексировании специфичным антителом против аминокислотной последовательности мотива хеликар), обнаружили, что необходимо использовать специфичную для структуры конструкцию дисульфидного мостика. Поскольку образование комплекса и осуществляемое позднее ковалентное связывание происходят между двумя соединениями, продуцированными рекомбинантно, искусственные остатки цистеина, введенные для образования ковалентной дисульфидной связи, не обязательно продуцируются в виде свободных остатков цистеина, но экспрессируются в восстановленной форме, т.е. конъюгированными со свободной аминокислотой цистеином или гомоцистеином.
Критически важным является положение в аминокислотной последовательности вариабельного домена антитела против аминокислотной последовательности мотива хеликар, куда вводится искусственный свободный остаток цистеина. Неэкспонированный цистеин в аминокислотной последовательности вариабельного домена антитела имеет большую вероятность экспрессии в форме свободного цистеина (не конъюгированного), тогда как экспонированный остаток цистеина, близкий к карману связывания, может отменить связывание 12-мерного пептида (аминокислотная последовательность мотива хеликар) из-за стерического препятствия, индуцированного конъюгированием цистеина с дополнительной группировкой, подобной свободному цистеину.
Для того чтобы идентифицировать подходящее положение, которое создает минимальный риск стерического препятствия и сильного уменьшения аффинности, тестировали разные положения для введения искусственного остатка цистеина в аминокислотную последовательность мотива хеликар. Остаток цистеина был введен на С-конце 12 мера (аминокислотная последовательность мотива хеликар) для того, чтобы иметь главную часть паратопа неизменной. Пептиды синтезировали и сливали с флуоресцентным мотивом.
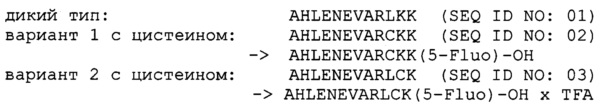
На антителе делали структурную конструкцию для обеспечения образования дисульфидного для обоих сконструированных пептидов, включающих каждый цистеин в отличном 3D (трехмерном) окружении.
12-мерный спиральный пептид AHLENEVARLKK (аминокислотная последовательность мотива хеликар) моделируется в VH и доменах VH. Остатки L10 и K11 идентифицируются как возможное положение на С-конце пептида, а в вариабельном домене легкой цепи идентифицируются положения N55 и G51 согласно нумерации легкой цепи по Kabat.
Двухвалентное антитело 0155 (N55C) связывали с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином. На геле SDS-PAGE (денатурирующие условия, см. Фиг. 12) флуоресценция видна только на антителе 0155; при восстанавливающих условиях виден только маленький пептид.
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против аминокислотной последовательности мотива хеликар было успешным.
Связывание антитела 0157 (G51C) с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином не приводило к ожидаемому ковалентному комплексу. Флуоресценция не видна в ожидаемой полосе, но видна на контроле, который должен быть негативным в данном эксперименте (см. Фиг. 13).
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом 0157 против аминокислотной последовательности мотива хеликар не было успешным. Не желая быть связанными данной теорией, предполагается, что в этом случае цистеинилирование антитела происходит слишком глубоко в кармане связывания для того, чтобы обеспечивать эффективное связывание флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, и доставлять нуклеофильную тиольную группу в подходящее положение для атаки С51.
Методология на основе хеликара становится особенно привлекательной при рассмотрении образования ковалентного комплекса с рекомбинантно продуцированным полипептидом, содержащим аминокислотную последовательность мотива хеликар.
Поскольку конъюгирование антитела 0155, содержащего мутацию VL-N55C, с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 02) работало значительно лучше по сравнению с альтернативой (G51C на VL с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARCKK; SEQ ID NO: 03)), дополнительно исследовали конъюгирование 0155 с полипептидом, содержащим вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Данный полипептид содержал вариант 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 02), слитой с N-концом.
Антитело 0155 ковалентно конъюгируют с молекулой экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина SEQ ID NO: 28, содержащей вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Хроматограмма SEC показана на Фиг. 14. Эффективность конъюгирования анализируется посредством SDS-CE (капиллярный электрофорез с додецилсульфатом натрия), Caliper, для невосстановленных образцов (см. Фиг. 15).
В заключение, моноклональное антитело против аминокислотной последовательности мотива хеликар может быть использовано для комплексирования пептидов, маленьких молекул с пептидным линкером и рекомбинантных белков посредством высокоаффинного распознавания аминокислотной последовательности 12-мерного мотива хеликар. Пептиды с предрасположенностью к сворачиванию в виде спирали могут быть модифицированы для имитации исходной аминокислотной последовательности AHLENEVARLKK (SEQ ID NO: 01) 12-мерного мотива хеликар, и затем становятся способными к комплексообразованию с моноклональным антителом против аминокислотной последовательности мотива хеликар. Помимо высокоаффинного комплексообразования, создается возможность ковалентного конъюгирования с цистеиновым вариантом SEQ ID NO: 01, содержащим цистеин, и модифицированным антителом против аминокислотной последовательности мотива хеликар, содержащим цистеин в CDR, посредством образования стабильной дисульфидной связи. Рекомбинантные белки, экспрессируемые другой системой, могут быть конъюгированы in vitro позднее без участия конкретных условий реакции, но посредством спонтанной перетасовки дисульфидных мостиков.
Аффинность антитела
В некоторых воплощениях само антитело против аминокислотной последовательности мотива хеликар, как описано в данном документе, или антитело против аминокислотной последовательности мотива хеликар в комплексе, как описано в данном документе, имеет константу диссоциации (Kd) меньшую или равную 1 мкМ, меньшую или равную 100 нМ, меньшую или равную примерно 10 нМ (например, примерно 10-6 М или менее, например, от примерно 10-6 М до примерно 10-13 М, например, от примерно 10-8 М до примерно 10-10 М).
В одном воплощении Kd измеряется посредством анализа связывания радиоактивно меченого антигена (RIA), проведенного с Fab версией интересующего антитела и его антигеном, как описано в следующем анализе. Аффинность Fab в отношении антигена при связывании в растворе измеряется посредством уравновешивания Fab с минимальной концентрацией антигена, меченного 125I, в присутствии серии титрования немеченого антигена, затем захвата связанного антигена с использованием планшета, покрытого антителом против Fab (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Для создания условий для данного анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл захватывающего антитела против Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6) и затем блокируют 2% (масс/об.) бычьего сывороточного альбумина в PBS (фосфатно-солевой буферный раствор) в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620) 100 пМ или 26 пМ [125I]-антиген смешивают с серийными разведениями интересующего Fab (например, согласно с оценкой антитела против VEGF, Fab-12 в Presta, L.G. et al., Cancer Res. 57 (1997) 4593-4599). Интересующий Fab затем инкубируют в течение ночи; однако, инкубация может продолжаться в течение более длительного периода (например, примерно 65 часов) для обеспечения того, что достигается равновесие. Затем смеси переносят в планшет для захвата для инкубации при комнатной температуре (например, в течение одного часа). Раствор затем удаляют, и планшет восемь раз промывают 0,1%-ным полисорбатом 20 (TWEEN-20®) в PBS. При высыхании планшетов добавляют 150 мкл/лунку сцинтиллянта (MICROSCINT-20™; Packard), и осуществляют счет на планшетах на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Для применения в конкурентных анализах связывания выбирают концентрации каждого Fab, которые дают меньшее чем или равное 20% от максимального связывания.
Согласно другому воплощению Kd измеряют с использованием анализов поверхностного плазмонного резонанса, используя BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с применением чипов СМ5 с иммобилизированным антигеном при ~ 10 единицах ответа (RU). Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активируют N-этил-N'-(3-диметиламинопропил)-карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (примерно 0,2 мкМ) до инъекции при скорости тока 5 мкл/минуту с достижением приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена инъецируют 1 М этаноламин для блокирования непрореагировавших групп. Для измерений кинетики инъецируют двухкратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS с поверхностно-активным веществом (PBST) - 0,05%-ный полисорбат 20 (TWEEN-20™) при 25°С при скорости тока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с использованием простой модели связывания Лангмюра один к одному (BIACORE® Evaluation Software, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесная константа диссоциации (Kd) рассчитывается как отношение koff/kon. См., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881. Если скорость ассоциации превышает 106 М-1 с-1 при определении приведенным выше анализом повехностного плазмонного резонанса, тогда скорость ассоциации может быть определена с использованием методики гашения флуоресценции, в которой измеряется увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение - 295 нм; испускание - 340 нм, 16 нм полоса пропускания) 20 нМ антитела против антигена (в форме Fab) в PBS, рН 7,2, при 25°С в присутствии возрастающих концентраций антигена при измерении на спектрометре, таком как спектрофотометр, оснащенный устройством для остановки струи (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) с кюветой с перемешиванием.
Фрагменты антитела
В некоторых воплощениях предложенное в данном документе антитело против аминокислотной последовательности мотива хеликар или находящееся в конъюгате, как описано в данном документе, представляет собой фрагмент антитела против аминокислотной последовательности мотива хеликар. Фрагменты антитела включают фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, и другие фрагменты, описанные ниже, но не ограничиваются ими. Для обзора определенных фрагментов антител, см. Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Для обзора фрагментов scFv, см., например, Plueckthun, A., In; The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185 и патенты США №5571894 и 5587458. Для обсуждения фрагментов Fab и F(ab')2, содержащих остатки эпитопа, связывающегося с рецептором спасения, и имеющих повышенный период полувыведения in vivo, см. US 5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифичными. См., например, ЕР 0404097; WO 1993/01161; Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134 и Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Триатела и тетратела также описаны в Hudson, P.J. et al., Nat. Med. 9 (20039 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, МА; см., например, US 6248516).
Фрагменты антител можно получать разными методиками, включающими протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е. coli или фагом), как описано в данном документе, но не ограничивающимися ими.
Химерные и гуманизированные антитела
В некоторых воплощениях антитело против аминокислотной последовательности мотива хеликар, предложенное в данном документе, или антитело против аминокислотной последовательности мотива хеликар в конъюгате, как описано в данном документе, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US 4816567 и Morrison, S.L. et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855). В одном примере химерное антитело содержит вариабельную область, не являющуюся человеческой (например, вариабельную область, происходящую от мыши, крысы, хомяка, кролика или примата, не являющегося человеком, такого как обезьяна), и человеческую константную область. В другом примере химерное антитело представляет собой антитело с «переключением класса», в котором был изменен класс или подкласс от класса или подласса родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Типично антитело, не являющееся человеческим, гуманизируют для уменьшения иммуногенности у людей при сохранении специфичности и аффинности родительского антитела, не являющегося человеческим. Обычно гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части), происходят из антитела, не являющегося человеческим, и FR (или их части) происходят из последовательностей человеческого антитела. Гуманизированное антитело возможно также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками из антитела, не являющегося человеческим (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Обзор гуманизированных антител и способов их получения приводится, например, в Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, и они дополнительно описываются, например, в Riechmann, I. et al., Nature 332 (1988) 323-329; Queen, С. et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; патентах США №5821337, 7527791, 6982321 и 7087409; Kashmiri, S.V. et al., Methods 36 (2005) 25-34 (описывающей пересадку SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывающей изменение поверхности вариабельного домена); Dall'Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывающей «перетасовку FR»), Osbourn, J. et al., Methods 36 (2005) 61-68 и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывающих подход «управляемой селекции» в отношении перетасовки FR).
Человеческие каркасные области, которые можно использовать для гуманизации, включают каркасные области, выбранные с использованием способа «наилучшей аппроксимации» (см., например, Sims, M.J. et al., J. Immunol. 151 (1993) 2296-2308; каркасные области, происходящие из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter, P. et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289 и Presta, L.G. et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (подвергнувшиеся соматическому мутагенезу) каркасные области или человеческие каркасные области зародышевой линии (см., например, Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633) и каркасные области, полученные в результате скрининга библиотек FR (см., например, Васа, М. et al., J. Biol. Chem. 272 (1997) 10678-10684 и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618), но не ограничиваются ими.
Антитела, происходящие из библиотеки
Антитела против аминокислотной последовательности мотива хеликар по изобретению или антитела против аминокислотной последовательности мотива хеликар в конъюгате, как описано в данном документе, могут быть выделены посредством скрининга комбинаторных библиотек на антитела с желательной активностью или активностями. Например, в данной области известно множество способов получения библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желательными характеристиками связывания. Обзор таких способов приводится, например, в Hoogenboom, H.R. et al., Methods in Molecular Biology 178 (2001) 1-37, и они дополнительно описаны, например, в McCafferty, J. et al., Nature 348 (1990) 552-554; Clackson, T. et al., Nature 352 (1991) 624-628; Marks, J.D. et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, A., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S. et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V. et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472 и Lee, C.V. et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых способах фагового дисплея репертуары генов VH и VL по отдельности клонируют полимеразной цепной реакцией (ПЦР) и случайным образом рекомбинируют в фаговые библиотеки, которые затем можно подвергать скринингу на антигенсвязывающий фаг, как описано в Winter, G. et al., Ann. Rev. Immunol. 12 (1994) 433-455. Фаг типично подвергает дисплею фрагменты антитела либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки из иммунизированных источников дают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. В качестве альтернативы, может быть клонирован нативный репертуар (например, от человека) с предоставлением одного источника антител к широкому диапазону не своих, а также своих антигенов без какой-либо иммунизации, как описано Griffiths, A.D. et al., EMBO J. 12 (1993) 725-734. Наконец, библиотеки наивных также можно получать синтетически посредством клонирования не подвергавшихся реаранжировке сегментов V-гена из стволовых клеток, и используя ПЦР-праймеры, содержащие случайную последовательность, для кодирования сильно вариабельных областей CDR3 и для осуществления реаранжировки in vitro, как описано Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: патент US 5750373, US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936 и US 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в данном документе человеческими антителами или фрагментами человеческих антител.
Форматы антител
Описанные выше антитела против аминокислотной последовательности мотива хеликар и фрагменты антител против аминокислотной последовательности мотива хеликар можно объединять разными способами с получением разных форматов антител.
Например, один или более чем один фрагмент scFv антитела можно сливать с С-концом одной или более чем одной полипептидной цепи полного антитела. Фрагмент scFv антитела в особенности может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один или более чем один фрагмент Fab антитела может быть слит с С-концом одной или более чем одной полипептидной цепи полного антитела. Фрагмент Fab антитела в особенности может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один scFv и один фрагмент Fab антитела может быть слит с N-концами области Fc антитела.
Например, один scFv или фрагмент Fab антитела может быть слит с N-концом области Fc антитела, и один scFv или фрагмент Fab антитела может быть слит с С-концом соответствующей другой цепи области Fc антитела.
Мультиспецифичные антитела
Разработали широкий спектр форматов рекомбинантных антител, например, четырехвалентные биспецифичные антитела, посредством слияния, например, формата антитела IgG и одноцепочечных доменов (см., например, Coloma, M.J., et al., Nature Biotech 15 (1997) 159-163; WO 01/077342 и Morrison, S.L., Nature Biotech 25 (2007) 1233-1234).
Также были разработаны несколько других форматов, в которых больше не сохраняется базовая структура антитела (IgA, IgD, IgE, IgG или IgM), такие как диа-, триа- или тетратела, минитела, несколько одноцепочечных форматов (scFv, бис-scFv), которые способны к связыванию с двумя или более чем двумя антигенами (Holliger, P., et al., Nature Biotech 23 (2005) 1126-1136; Fischer, N.,  , O., Pathobiology 74 (2007) 3-14; Shen, J., et al., Journal of Immunological Methods 318 (2007) 65-74; Wu, C, et al., Nature Biotech. 25 (2007) 1290-1297).
, O., Pathobiology 74 (2007) 3-14; Shen, J., et al., Journal of Immunological Methods 318 (2007) 65-74; Wu, C, et al., Nature Biotech. 25 (2007) 1290-1297).
Во всех таких форматах используются линкеры либо для слияния базовой структуры антитела (IgA, IgD, IgE, IgG или IgM) с другим связывающим белком (например, с scFv), либо для слияния, например, двух фрагментов Fab или scFv (Fischer, N. and  , О., Pathobiology 74 (2007) 3-14). Следует учитывать, что может быть желательным сохранение эффекторных функций, таких как, например, комплементзависимая цитотоксичность (CDC) или антителозависимая клеточная цитотоксичность (ADCC), которые опосредованы связыванием с рецептором Fc, посредством поддержания высокой степени сходства с антителами, встречающимися в природе.
, О., Pathobiology 74 (2007) 3-14). Следует учитывать, что может быть желательным сохранение эффекторных функций, таких как, например, комплементзависимая цитотоксичность (CDC) или антителозависимая клеточная цитотоксичность (ADCC), которые опосредованы связыванием с рецептором Fc, посредством поддержания высокой степени сходства с антителами, встречающимися в природе.
В WO 2007/024715 описаны иммуноглобулины с двойным вариабельным доменом в виде генетически модифицированных многовалентных и мультиспецифичных белков. Способ получения биологически активных димеров антител описан в US 6897044. Многовалентная конструкция на основе FV антитела, имеющая по меньшей мере четыре вариабельных домена, которые связаны друг с другом посредством пептидных линкеров, описана в US 7129330. Димерные и мультимерные антигенсвязывающие структуры описаны в US 2005/0079170. Трех- или четырехвалентный моноспецифичный антигенсвязывающий белок, содержащий три или четыре фрагмента Fab, ковалентно связанных друг с другом посредством соединительной структуры, который не является природным иммуноглобулином, описан в US 6511663. В WO 2006/020258 описаны четырехвалентные биспецифичные антитела, которые могут эффективно экспрессироваться в прокариотических и эукариотических клетках, и которые являются полезными в терапевтических и диагностических способах. Способ разделения или предпочтительного проведения синтеза димеров, которые связаны посредством по меньшей мере одной межцепочечной дисульфидной связи, из димеров, которые не связаны посредством по меньшей мере одной межцепочечной дисульфидной связи, из смеси, содержащей два типа полипептидных димеров, описан в US 2005/0163782. Биспецифичные четырехвалентные рецепторы описаны в US 5959083. Генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами описаны в WO 2001/077342.
Мультиспецифичные и многовалентные антигенсвязывающие полипептиды описаны в WO 97/001580. В WO 92/004053 описаны гомоконъюгаты, типично полученные из моноклональных антител класса IgG, которые связываются с одинаковой антигенной детерминантой и являются ковалентно связанными посредством синтетического поперечного связывания. Олигомерные моноклональные антитела с высокой авидностью в отношении антигена описаны в WO 91/06305, при этом секретируются олигомеры, типично класса IgG, имеющие два или более чем два мономера иммуноглобулина, совместно ассоциированные с образованием четырехвалентных или шестивалентных молекул IgG. В US 6350860 описаны антитела, происходящие от овцы, и конструкции генетически модифицированных антител, которые можно использовать для лечения заболеваний, при которых активность интерферона-гамма является патогенной. В US 2005/0100543 описаны нацеливаемые конструкции, которые представляют собой многовалентные носители биспецифичных антител, т.е. каждая молекула нацеливаемой конструкции может служить в качестве носителя двух или более чем двух биспецифичных антител. Генетически модифицированные биспецифичные четырехвалентные антитела описаны в WO 95/009917. В WO 2007/109254 описаны стабилизированные связывающие молекулы, которые состоят из или содержат стабилизированный scFv.
В некоторых воплощениях предложенное в данном документе антитело против аминокислотной последовательности мотива хеликар или антитело против аминокислотной последовательности мотива хеликар в конъюгате, как описано в данном документе, представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных сайтов. В некоторых воплощениях одна из специфичностей связывания направлена на аминокислотную последовательность мотива хеликар, а другая - на любой другой (не являющийся аминокислотной последовательностью мотива хеликар) антиген. Биспецифичные антитела также можно использовать для помещения цитотоксических агентов в клетки. Биспецифичные антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики получения мультиспецифичных антител включают рекомбинантную соэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, имеющих разные специфичности (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829 и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и инженерию «выступ во впадину» (см., например, патент США №5731168), но не ограничиваются ими. Мультиспецифичные антитела также можно получать посредством инженерии эффектов электростатического наведения для получения гетеродимерных молекул на основе Fc антитела (WO 2009/089004); поперечного связывания двух или более чем двух антител или фрагментов (см., например, патент США №4676980 и Brennan, М. et al., Science 229 (1985) 81-83); с использованием лейциновых молний для получения биспецифичных антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553; с использованием технологии «диатела» для получения биспецифичных фрагментов антитела (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); с использованием димеров на основе одноцепочечной Fv (scFv) (см., например, Gruber, М et al., J. Immunol. 152 (1994) 5368-5374) и получения триспецифичных антител, как описано, например, в Tutt, А. et al., J. Immunol. 147 (1991) 60-69).
В одном воплощении домены СН3 тяжелых цепей биспецифичного антитела изменяют посредством технологии «выступ во впадину», которая подробно описана с использованием нескольких примеров, например, в WO 96/027011, WO 98/050431, Ridgway J.В., et al., Protein Eng. 9 (1996) 617-621, Merchant, A.M., et al., Nat Biotechnol 16 (1998) 677-681. В данном способе взаимодействующие поверхности двух доменов СН3 изменяют для усиления гетеродимеризации обеих тяжелых цепей, содержащих эти два домена СН3. Каждый из двух доменов СН3 (из двух тяжелых цепей) может представлять собой «выступ», тогда как другой представляет собой «впадину». Введение дисульфидного мостика стабилизирует гетеродимеры (Merchant, А.М, et al., Nature Biotech 16 (1998) 677-681, Atwell, S., et al. J. Mol. Biol. 270 (1997) 26-35) и увеличивает выход.
В одном воплощении всех аспектов биспецифичное антитело характеризуется тем, что:
- каждый из домена СН3 одной тяжелой цепи и домена СН3 другой тяжелой цепи встречаются на поверхности контакта, которая содержит исходную поверхность контакта между доменами СН3 антитела,
где указанную поверхность контакта изменяют для стимуляции образования биспецифичного антитела, где данное изменение характеризуется тем, что
а) домен СН3 одной тяжелой цепи изменен,
таким образом, что в пределах исходной поверхности контакта домена СН3 одной тяжелой цепи, которая встречается с исходной поверхностью контакта домена СН3 другой тяжелой цепи в пределах биспецифичного антитела,
аминокислотный остаток заменяется аминокислотным остатком, имеющим больший объем боковой цепи, генерируя, посредством этого, выступ в пределах поверхности контакта домена СН3 одной тяжелой цепи, который позиционируется во впадину в пределах поверхности контакта домена СН3 другой тяжелой цепи
и
б) домен СН3 другой тяжелой цепи изменен,
таким образом, что в пределах исходной поверхности контакта второго домена СН3, которая встречается с исходной поверхностью контакта первого домена СН3 в пределах биспецифичного антитела,
аминокислотный остаток заменяется аминокислотным остатком, имеющим меньший объем боковой цепи, генерируя, посредством этого, впадину в пределах поверхности контакта второго домена СН3, в пределах которой позиционируется выступ в пределах поверхности контакта первого домена СН3.
Таким образом, биспецифичные антитела, как описано в данном документе, в одном воплощении характеризуются тем, что
- каждый из домена СН3 первой тяжелой цепи полноразмерного антитела и домена СН3 второй тяжелой цепи полноразмерного антитела встречаются на поверхности контакта, которая содержит изменение исходной поверхности контакта между доменами СН3 антитела,
где i) в домене СН3 первой тяжелой цепи
аминокислотный остаток заменяется аминокислотным остатком, имеющим больший объем боковой цепи, генерируя, посредством этого, выступ в пределах поверхности контакта домена СН3 одной тяжелой цепи, который позиционируется во впадине в пределах поверхности контакта домена СН3 другой тяжелой цепи,
и где ii) в домене СН3 второй тяжелой цепи
аминокислотный остаток заменяется аминокислотным остатком, имеющим меньший объем боковой цепи, генерируя, посредством этого, впадину в пределах поверхности контакта второго домена СН3, в пределах которой позиционируется выступ в пределах поверхности контакта первого домена СН3.
В одном воплощении аминокислотный остаток, имеющий больший объем боковой цепи, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
В одном воплощении аминокислотный остаток, имеющий меньший объем боковой цепи, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном воплощении оба домена СН3 дополнительно изменяются посредством введения цистеина (С) в качестве аминокислоты в соответствующих положениях каждого домена СН3 таким образом, что может быть образован дисульфидный мостик между обоими доменами СН3.
В одном воплощении биспецифичное антитело содержит мутацию T366W в домене СН3 «цепи с выступом» и мутации T366S, L368A, Y407V в домене СН3 «цепи со впадиной». Также можно использовать дополнительный межцепочечный дисульфидный мостик между доменами СН3 (Merchant, A.M., et al., Nature Biotech. 16 (1998) 677-681), например, посредством введения в домен СН3 «цепи с выступом» мутации Y349C и в домен СН3 «цепи со впадиной» мутации Е356С или мутации S354C (нумерация согласно индексу ЕС по Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов СН3 и мутации Е356С, T366S, L368A, Y407V в другом из двух доменов СН3. В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов СН3 (дополнительную мутацию Y349C в одном домене СН3 и дополнительную мутацию Е356С или S354C в другом домене СН3, образующую межцепочечный диульфидный мостик) (нумерация согласно индексу ЕС по Kabat); (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991))). Альтернативно или дополнительно можно использовать другие технологии «выступ во впадину», как описано в ЕР 1870459 А1. Таким образом, другим примером биспецифичного антитела является антитело с мутациями R409D, K370E в домене СН3 «цепи с выступом» и с мутациями D399K, E357K в домене СН3 «цепи со впадиной» (нумерация согласно индексу ЕС по Kabat; (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
В одном воплощении биспецифичное антитело содержит мутацию T366W в домене СН3 «цепи с выступом» и мутации T366S, L368A, Y407V в домене СН3 «цепи со впадиной», и дополнительно мутации R409D, K370E в домене СН3 «цепи с выступом» и мутации D399K, E357K в домене СН3 «цепи со впадиной».
В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A, Y407V в других двух доменах СН3, или биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов СН3, и дополнительно мутации R409D, K370E в домене СН3 «цепи с выступом» и мутации D399K, E357K в домене СН3 «цепи со впадиной». Такие мутации, дающие выступ и впадину в домене СН3, типично используются в константных областях человеческой тяжелой цепи SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10 или SEQ ID NO: 11 (аллотипы человеческого подкласса IgG1 (кавказский и афроамериканский или мутанты L234A/L235A и L234A/L235A/P329G), SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 14 (человеческий подкласс IgG4 или мутанты S228P, L235E и S228P/L235E/P329G) (нумерация согласно индексу ЕС по Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD(1991).
В одном воплощении биспецифичное антитело содержит константные области человеческой тяжелой цепи SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10 или SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 14, дополнительно включающие такие мутации, дающие «выступ» и «впадину» в домене СН3 (например, мутации Y349C, T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов СН3) (нумерация согласно индексу ЕС по Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
В одном воплощении биспецифичное антитело содержит константные области человеческой легкой цепи SEQ ID NO: 15 или SEQ ID NO: 16.
В данный документ также включены генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами, включая «антитела-осьминоги» (см., например, US 2006/0025576).
Описанное в данном документе антитело или фрагмент также включает "Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с аминокислотной последовательностью мотива хеликар, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Описанное в данном документе антитело или фрагмент также включает мультиспецифичные антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном воплощении первая специфичность связывания биспецифичного антитела направлена на аминокислотную последовательность мотива хеликар, и вторая специфичность связывания - на антиген, не являющийся аминокислотной последовательностью мотива хеликар. В одном воплощении антиген, не являющийся аминокислотной последовательностью мотива хеликар, выбран из следующих: маркеры лейкоцитов - CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD11a,b,c, CD13, CD14, CD18, CD19, CD22, CD23, CD27 и его лиганд, CD28 и его лиганды В7.1, В7.2, В7.3, CD29 и его лиганд, CD30 и его лиганд, CD40 и его лиганд gp39, CD44, CD45 и изоформы, CD56, CD58, CD69, CD72, CTLA-4, LFA-1 и TCR; антигены гистосовместимости, МНС (главный комплекс гистосовместимости) класса I или II, антигены Льюиса Y, SLex, SLey, SLea и SLeb; интегрины, VLA-1, VLA-2, VLA-3, VLA-4, VLA-5, VLA-6, αVβ3 и LFA-1, Мас-1 и pI50,95, αVβ1, gpIIbIIIa, αR β3, α6β4, αVβ5, αVβ6 и αV 62 7; селектины, L-селектин, Р-селектин и Е-селектин и их противорецепторы VCAM-1, ICAM-1, ICAM-2 и LFA-3; интерлейкины - IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14 и IL-15; рецептор интерлейкина, выбранный из группы, состоящей из IL-1R, IL-2R, IL-3R, IL-4R, IL-5R, IL-6R, IL-7R, IL-8R, IL-9R, IL-10R, IL-11R, IL-12R, IL-13R, IL-14R и IL-15R; хемокин, выбранный из группы, состоящей из PF4, RANTES, MIP1α, МСР1, NAP-2, Groα, Groβ, and IL-8; фактор роста, выбранный из группы, состоящей из TNF-альфа (фактор некроза опухолей-альфа), TGF-бета (трансформирующий фактор роста-бета), TSH (тиреотропный гормон), VEGF (фактор роста эндотелия сосудов)/VPF (фактор сосудистой проницаемости), VEGFA, VEGFB, VEGF111, VEGF121, VEGF165, VEGF189, VEGF206, PTHrP, семейство EGF (эпидермальный фактор роста), семейство PDGF (фактор роста тромбоцитов), эндотелии, фиброзин (FSF-1), человеческий ламинин и гастринвысвобождающий пептид (GRP), PLGF (плацентарный фактор роста), HGH (гормон роста человека), HGHR (рецептор гормона роста человека); рецептор фактора роста, выбранный из группы, состоящей из следующих: TNFальфаR, RGFбетаR, TSHR, VEGFR/VPFR, EGFR, PTHrPR, семейство PDGFR, EPO-R, GCSF-R (рецептор гранулоцитарного колониестимулирующего фактора) и другие гематопоэтические рецепторы; рецептор интерферона, выбранный из группы, состоящей из IFNCαR, IFNβR и IFNλR; Ig и его рецептор, выбранный из группы, состоящей из IgE, FcγRI и FcγRII; антиген опухоли, выбранный из группы, состоящей из her2-neu, муцина, СЕА (карцино-эмбриональный антиген) и эндосиалина; аллерген, выбранный из группы, состоящей из антигена пылевых клещей, антигенов Iol р1 (злака) и урушиола; вирусный полипептид, выбранный из группы, состоящей из гликопротеинов В, Н и gCIII CMV (цитомегаловирус), гликопротеинов оболочки HIV-1 (вирус иммунодефицита человека-1), гликопротеинов оболочки RSV (вирус саркомы Рауса), гликопротеинов оболочки HSV (вирус простого герпеса), гликопротеинов оболочки HPV (вирус папилломы человека), антигенов поверхности вирусов из семейства вируса гепатита; токсин, выбранный из группы, состоящей из эндотоксина псевдомонады и остеопонтина/уропонтина, змеиного яда, яда паука и пчелиного яда конотоксина; фактор крови, выбранный из группы, состоящей из C3b комплемента, С4а комплемента, C4b-9 комплемента, фактора Rh, фибриногена, фибрина и ингибитора роста, ассоциированного с миелином; и фермент, выбранный из группы, состоящей из полипептида переноса сложного эфира холестерина, мембраносвязанных металлопротеаз матрикса и декарбоксилазы глутаминовой кислоты (GAD).
Варианты антитела
В некоторых воплощениях рассматриваются варианты аминокислотных последовательностей антител, предложенных в данном документе. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела против аминокислотной последовательности мотива хеликар. Варианты аминокислотной последовательности антитела могут быть получены посредством введения подходящих модификаций в нуклеотидную последовательность, кодирующую антитело, или посредством пептидного синтеза. Такие модификации включают, например, делеции из и/или вставки в, и/или замены остатков в пределах аминокислотных последовательностей антитела. Можно делать любую комбинацию делеции, вставки и замены для получения конечной конструкции, при условии, что конечная конструкция обладает желательными характеристиками, например, связыванием антигена.
а) Варианты с заменой, вставкой и делецией
В некоторых воплощениях предложены варианты антитела, имеющие одну или более чем одну аминокислотную замену. Интересующие сайты для мутагенеза посредством замен включают HVR и FR. В интересующее антитело можно вводить аминокислотные замены и продукты подвергать скринингу на желательную активность, например, сохраненное/улучшенное связывание антигена, пониженную иммуногенность или улучшенные ADCC или CDC.
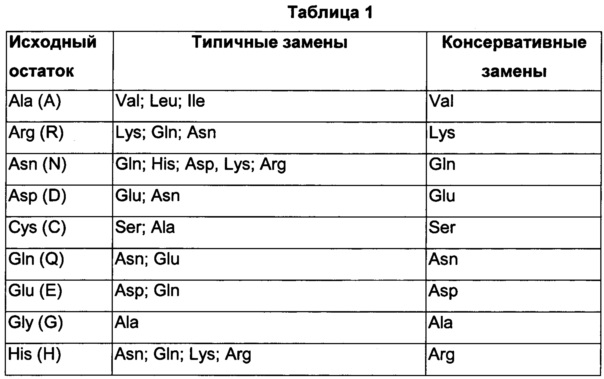
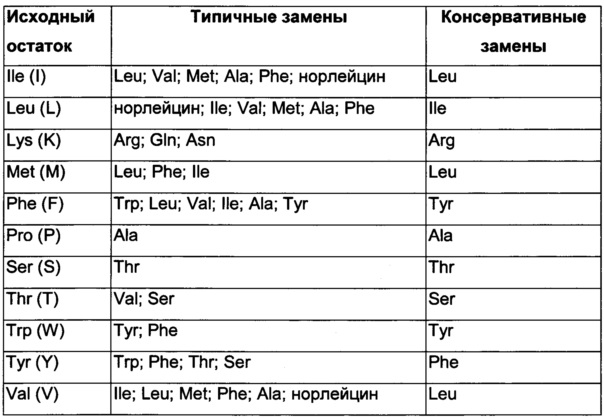
Аминокислоты можно группировать согласно общим свойствам боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены будут влечь за собой замену члена одного из данных классов на другой класс.
Один тип варианта с заменой включает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). В общем, образующийся вариант(ты), отобранный для дальнейшего исследования, будет иметь модификации (например, улучшения) определенных биологических свойств (например, повышенная аффинность, пониженная иммуногенность) относительно родительского антитела и/или будет иметь по существу сохраненные определенные биологические свойства родительского антитела. Типичным вариантом с заменой является антитело с созревшей аффинностью, которое можно с удобством получать, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как методики, описанные в данном документе. Вкратце, один или более чем один остаток HVR мутируют, и варианты антител подвергают фаговому дисплею и скринингу на конкретную биологическую активность (например, аффинность связывания).
В HVR можно делать изменения (например, замены), например, для улучшения аффинности антитела. Такие изменения можно делать в «горячих точках» HVR, т.е. остатках, кодируемых кодонами, которые на протяжении процесса соматического созревания подвергаются мутации с высокой частотой (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или SDR (a-CDR), причем образующийся вариант VH или VL тестируется на аффинность связывания. Созревание аффинности посредством конструирования и повторного отбора из вторичных библиотек выло описано, например, в Hoogenboom, H.R. et al. в Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности разнообразие вводится в вариабельные гены, выбранные для созревания, любым из целого ряда способов (например, ПЦР, склонная к ошибкам, перетасовка цепи или мутагенез, управляемый олигонуклеотидом). Затем создают вторичную библиотеку. Данную библиотеку затем подверают скринингу для идентификации любых вариантов антитела с желательной аффинностью. Другой способ введения разнообразия включает подходы, направленные на HVR, в которых рандомизируются несколько остатков HVR (например, 4-6 остатков за один раз). Остатки HVR, участвующие в связывании антигена, можно специфично идентифицировать, например, с использованием мутагенеза на основе аланинового сканирования или моделирования. Мишенью часто являются, в частности, CDR3 тяжелой цепи и CDR3 легкой цепи.
В некоторых воплощениях замены, вставки или делеции могут встречаться в пределах одной или более чем одной HVR, при условии, что такие изменения по существу не уменьшают способность антитела к связыванию антигена. Например, в HVR можно делать консервативные изменения (например, консервативные замены, как приведено в данном документе), которые по существу не уменьшают аффинность связывания. Такие изменения могут находиться вне «горячих точек» HVR или SDR. В некоторых воплощениях предложеных выше вариантов последовательностей VH и VL каждая HVR является либо неизменной, либо содержит не более чем одну, две или три аминокислотные замены.
Полезный способ идентификации остатков или областей антитела, которые могут служить мишенью для мутагенеза, называется «мутагенез на основе аланинового сканирования», как описано Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В данном способе идентифицируют остаток или группу остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения того, подвергается ли влиянию взаимодействие антитела с антигеном. Дополнительные замены можно вводить в положениях аминокислот, демонстрирующих функциональную чувствительность к исходным заменам. В качестве альтернативы или дополнительно, определяют кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут служить в качестве мишени или упраздняться в качестве кандидатов для замены. Варианты можно подвергать скринингу для определения того, имеют ли они желательные свойства.
Вставки аминокислотной последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более чем сто остатков, а также вставки внутри последовательности одного или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие варианты молекулы антитела со вставкой включают слияние с N- или С-концом антитела фермента (например, для ADEPT (опосредованная антителами терапия с использованием ферментов и пролекарств)) или полипептида, который увеличивает период полувыведения антитела в сыворотке.
б) Варианты по гликозилированию
В некоторых воплощениях антитело, предложенное в данном документе, или содержащееся в конъюгате, как описано в данном документе, изменяют для увеличения или уменьшения степени, в которой гликозилировано антитело. Добавление или удаление сайтов гликозилирования к антителу можно с удобством осуществлять посредством изменения аминокислотной последовательности таким образом, что создается или удаляется один или более чем один сайт гликозилирования.
Когда антитело содержит область Fc, может быть изменен углевод, присоединенный к ней. Нативные антитела, продуцируемые клетками млекопитающих, типично содержат разветвленный двухантенный олигосахарид, который обычно присоединяется N-связью к Asn297 домена СН2 области Fc. См., например, Wright, A. and Morrison, S.L., TIBTECH 15 (1997) 26-32. Данный олигосахарид может включать разные углеводы, например, маннозу, N-ацетилглюкозамин (ClcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» двухантенной олигосахаридной структуры. В некоторых воплощениях в антителе по изобретению могут быть сделаны модификации олигосахарида для того, чтобы создать варианты антитела с определенными улучшенными свойствами.
В одном воплощении предложены варианты антитела, имеющие структуру углевода, в которой отсутствует фукоза, присоединенная (прямо или опосредованно) к области Fc. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется посредством расчета среднего количества фукозы в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, присоединенных к Asn297 (например, сложных, гибридных структур и структур с высоким содержанием маннозы), при измерении посредством масс-спектрометрии MALDI-TOF (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из матрицы), как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в положении 297 области Fc (нумерация ЕС остатков области Fc); однако, Asn297 также может находиться примено в плюс/минус 3 аминокислотах выше или ниже положения 297, т.е. между положениями 294 и 300, из-за небольших вариаций последовательности в антителах. Такие варианты по фукозилированию могут иметь улучшенную функцию ADCC. См., например, US 2003/0157108; US 2004/0093621. Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» вариантам антител включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают клетки СНО (яичники китайского хомяка) Lec13, дефицитные по фукозилированию белка (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108 и WO 2004/056312, особенно в Примере 3), и нокаутные линии клеток, такие как нокаутные клетки СНО по гену альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688 и WO 2003/085107).
Дополнительно предложены варианты антител с разделенными надвое олигосахаридами, например, в которых двухантенный олигосахарид, присоединенный к области Fc антитела, разделен надвое посредством ClcNAc. Такие варианты антител могут иметь пониженное фукозилирование и/или улучшенную функцию ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878; патенте США №6602684 и US 2005/0123546. Также предложены варианты антител с по меньшей мере одним галактозным остатком в олигосахариде, присоединенном к области Fc. Такие варианты антител могут иметь улучшенную функцию CDC. Такие варианты антител описаны, например, в WO 1997/30087; WO 1998/58964 и WO 1999/22764.
в) Варианты области Fc
В некоторых воплощениях в область Fc антитела, предложенного в данном документе, могут быть введены одна или более чем одна аминокислотная модификация, генерируя, посредством этого, вариант области Fc. Вариант области Fc может содержать последовательность человеческой области Fc (например, области Fc человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или более чем одном положении аминокислоты.
В некоторых воплощениях в данном изобретении рассматривается вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для применений, в которых важным является период полувыведения антитела in vivo, тем не менее, определенные эффекторные функции (такие как опосредованные комплементом и ADCC) не требуются или являются вредными. Можно проводить анализы цитотоксичности in vitro и/или in vivo для подтверждения уменьшения/устранения антивностей CDC и/или ADCC. Например, для того, чтобы убедиться, что антитело не имеет связывания с FcγR (следовательно, вероятно, не имеет активности ADCC), но сохраняет способность к связыванию с FcRn, можно проводить анализы связывания с рецептором Fc (FcR). Первичные клетки, опосредующие ADCC - клетки NK (природный киллер), экспрессируют только FcRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках обобщена в Таблице 3 на странице 464 Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. Неограничивающие примеры анализов in vitro для оценки активности ADCC интересующей молекулы описаны в патенте США №5500362 (см., например, Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063 и Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); патент США №5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166 (1987) 1351-1361). В качестве альтернативы, можно использовать нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Полезные эффекторные клетки для таких анализов включают одноядерные клетки периферической крови (РВМС) и клетки-природные киллеры (NK). В качестве альтернативы или дополнительно, активность ADCC интересующей молекулы можно оценивать in vivo, например, в такой животной модели, как модель, раскрытая в Clynes, R. et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Также можно проводить анализы связывания C1q для подтверждения того, что антитело не способно связываться с C1q и, следовательно, не имеет активности CDC. См., например, ELISA связывания C1q и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно проводить анализ CDC (см., например, Gazzano-Santoro, Н. et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S. et al., Blood 101 (2003) 1045-1052 и Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Определения связывания с FcRn и клиренса/периода полувыведения in vivo также можно проводить с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int. Immunol. 18 (2006: 1759-1769).
Антитела с ослабленной эффекторной функцией включают антитела с заменой одного или более чем одного остатка области Fc 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие мутанты Fc включают мутантов Fc с заменами в двух или более чем двух положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый мутант Fc «DANA» с заменой остатков 265 и 297 на аланин (патент США №7332581).
Описаны определенные варианты антител с улучшенным или ослабленным связыванием с FcR. (См., например, патент США №6737056; WO 2004/056312 и Shields, R.L. et al.. J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит область Fc с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в положениях 298, 333 и/или 334 области Fc (нумерация остатков ЕС).
В некоторых воплощениях в области Fc делают изменения, которые приводят к измененным (т.е. либо улучшенному, либо ослабленному) связыванию C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в патенте США №6194551, WO 99/51642 и Idusogie, Е.Е. et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с увеличенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG в плод (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593 и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описаны в US 2005/0014934. Данные антитела содержат область Fc с одной или более чем одной заменой в ней, которая улучшает связывание области Fc с FcRn. Такие варианты Fc включают варианты с заменами в одном или более чем одном остатке области Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 области Fc (патент США №7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821; и WO 94/29351 относительно других примеров вариантов области Fc.
г) Варианты антител с модификацией цистеином
В некоторых воплощениях может быть желательным создание антител с модификацией цистеином, например, «тиоMAb», в которых один или более чем один остаток антитела заменен остатком цистеина. В конкретных воплощениях замененные остатки встречаются в доступных сайтах антитела. Посредством замены данных остатков цистеином в доступных сайтах антитела, посредством этого, размещаются реакционноспособные тиольные группы, и их можно использовать для конъюгирования антитела с другими группировками, такими как лекарственные группировки или группировки линкер-лекарственное средство, для создания иммуноконъюгата, как дополнительно описано в данном документе. В некоторых воплощениях любой один или более чем один из следующих остатков может быть заменен цистеином: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация ЕС) тяжелой цепи и S400 (нумерация ЕС) области Fc тяжелой цепи. Антитела с модификацией цистеином можно получать, как описано, например, в патенте США №7521541.
д) Производные антител
В некоторых воплощениях предложенное в данном документе антитело может быть дополнительно модифицировано для того, чтобы оно содержало дополнительные небелковые группировки, которые известны в данной области и легко доступны. Группировки, подходящие для дериватизации антитела включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1, 3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры), декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. Полиэтиленгликоля пропиональдегид может иметь преимущества в изготовлении из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать и, если присоединен более чем один полимер, они могут быть одинаковыми или разными молекулами. В общем, число и/или тип полимеров, используемых для дериватизации, может быть определено на основе соображений, включающих конкретные свойства или функции антитела, подлежающие улучшению, то, будет ли производное антитела использоваться в терапии при определенных условиях и т.д., но не ограничиваясь ими.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которые можно селективно нагревать посредством воздействия радиации. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Радиация может иметь любую длину волны и включает длины волн, которые не причиняют вреда обычным клеткам, но которые нагревают небелковую группировку до температуры, при которой умерщвляются клетки, расположенные рядом с конъюгатом антитело-небелковая группировка, но не ограничивается ими.
Соединения, содержащие аминокислотную последовательность мотива хеликар
Аминокислотная последовательность мотива хеликар в конъюгате, как описано в данном документе, может быть конъюгирована с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофорами, такими как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или детектируемой меткой или агентом, модифицирующим клиренс, таким как разные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводом, или липофильным агентом. Такой конъюгат обозначают как соединение, содержащее мотив хеликар. Конъюгирование может осуществляться либо непосредственно, либо через промежуточный линкер.
а) Терапевтический агент
Терапевтическим агентом (лекарственным средством) конъюгата может быть любое соединение, группировка или группа, которая имеет цитотоксический или цитостатический эффект. Лекарственные группировки включают: (i) химиотерапевтические агенты, которые могут функционировать в качестве ингибиторов микротрубочек, ингибиторов митоза, ингибиторов топоизомеразы или интеркаляторов ДНК; (ii) белковые токсины, которые могут функционировать ферментативно; и (iii) радиоизотопы.
Типичные терапевтические агенты включают майтансиноид, ауристатин, доластатин, трихотецен, СС1065, калихеамицин и другие энедииновые антибиотики, таксан, антрациклин и стереоизомеры, изостеры, их аналоги и производные, но не ограничиваются ими.
Белковые токсины включают цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина (Vitetta et al (1987) Science, 238: 1098), цепь А абрина, цепь А модессина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-5), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (WO 93/21232).
Терапевтические радиоизотопы включают 32Р, 33Р, 90Y, 1251, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212B, 212Pb и радиоактивные изотопы Lu.
Радиоизотопные или другие метки могут быть включены известными способами (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57; "Monoclonal Antibodies in Immunoscintigraphy" Chatal, CRC Press 1989). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгирования радионуклида с комплексом (WO 94/11026).
б) Метки
Соединение, содержащее аминокислотную последовательность мотива хеликар может представлять собой соединение, содержащее аминокислотную последовательность мотива хеликар, содержащее дополнительную метящую группировку. Можно использовать любую метящую группировку, которую можно ковалентно присоединять к аминокислотной последовательности мотива хеликар (см., например, Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, Fla.). Метка может функционировать для: (i) предоставления выявляемого сигнала; (ii) взаимодействия со второй меткой для модификации выявляемого сигнала, предоставленного первой или второй меткой, например, для получения FRET (резонансный перенос энергии флуоресценции); (iii) воздействия на подвижность, например, электрофоретическую подвижность или проницаемость клетки посредством заряда, гидрофобности, формы или других физических параметров, или (iv) предоставления захватывающей группировки, например, для модуляции ионного комплексообразования.
Конъюгаты, содержащие аминокислотную последовательность мотива хеликар и содержащие метку, как описано в данном документе, могут быть полезными в диагностических анализах, например, для выявления экспрессии интересующего антигена в конкретных клетках, тканях или сыворотке. Для диагностических применений будет использоваться биспецифичное антитело, в котором первый функционал связывания связывается с мишенью, и второй функционал связывания связывается с меткой, содержащей аминокислотную последовательность мотива хеликар. Аминокислотная последовательность мотива хеликар типично будет помечена выявляемой группировкой. Доступны многочисленные метки, которые обычно можно группировать в следующие категории:
(а) Радиоизотопы (радионуклиды), такие как 3H, 11C, 14C, 18F, 32Р, 35S, 64Cu, 68Gn, 86Y, 89Zr, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 131Bi. Конъюгаты, меченные радиоизотопом, являются полезными в экспериментах по визуализации с нацеливанием на рецептор. Аминокислотную последовательность мотива хеликар можно метить реактивами-лигандами, которые связываются, хелатируют или иным образом формируют комплекс с радиоизотопным металлом с использованием методик, описанных в Current Protocols in Immunology, (1991) Тома 1 и 2, Coligen et al, Ed. Wiley-lnterscience, New York, N.Y., Pubs. Хелатирующие лиганды, которые могут формировать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и ТЕТА (Macrocyclics, Dallas, Тех.). Радионуклиды могут быть нацелены через комплексообразование с комплексом, как описано в данном документе (Wu et al, Nature Biotechnology 23(9) (2005) 1137-1146). Визуализация рецептора-мишени с использованием комплексов, меченных радионуклидом, может давать маркер активации пути посредством выявления и количественного измерения постепенного накопления комплексов или соответствующих терапевтических антител в опухолевой ткани (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210).
Комплексы металл-хелат подходят в качестве меток для экспериментов по визуализации (US 2010/0111856; US 5342606; US 5428155; US 5316757; US 5480990; US 5462725; US 5428139; US 5385893; US 5739294; US 5750660; US 5834456; Hnatowich et al, J. Immunol. Methods 65 (1983) 147-157; Meares et al, Anal. Biochem. 142 (1984) 68-78; Mirzadeh et al, Bioconjugate Chem. 1 (1990) 59-65; Meares et al, J. Cancer (1990), Suppl. 10:21-26; Izard et al, Bioconjugate Chem. 3 (1992) 346-350; Nikula et al, Nucl. Med. Biol. 22 (1995) 387-90; Camera et al, Nucl. Med. Biol. 20 (1993) 955-62; Kukis et al, J. Nucl. Med. 39 (1998) 2105-2110; Verel et al., J. Nucl. Med. 44 (2003) 1663-1670; Camera et al, J. Nucl. Med. 21 (1994) 640-646; Ruegg et al, Cancer Res. 50 (1990) 4221-4226; Verel et al, J. Nucl. Med. 44 (2003) 1663-1670; Lee et al, Cancer Res. 61 (2001) 4474-4482; Mitchell, et al, J. Nucl. Med. 44 (2003) 1105-1112; Kobayashi et al Bioconjugate Chem. 10 (1999) 103-111; Miederer et al, J. Nucl. Med. 45 (2004) 129-137; DeNardo et al, Clinical Cancer Research 4 (1998) 2483-90; Blend et al, Cancer Biotherapy & Radiopharmaceuticals 18 (2003) 355-363; Nikula et al J. Nucl. Med. 40 (1999) 166-76; Kobayashi et al, J. Nucl. Med. 39 (1998) 829-36; Mardirossian et al, Nucl. Med. Biol. 20 (1993) 65-74; Roselli et al, Cancer Biotherapy & Radiopharmaceuticals, 14 (1999) 209-20).
(б) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), разные типы флуоресцеина, включающие FITC (флуоресцеинизотиоцианат), 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; разные типы родамина, включающие TAMRA; дансил; лиссамин; цианины; фикоэритрины; техасский красный и их аналоги. Флуоресцентные метки могут быть конъюгированы с аминокислотной последовательностью мотива хеликар с использованием методик, раскрытых, например, выше в Current Protocols in Immunology. Флуоресцентные красители и реактивы на основе флуоресцентной метки включают красители и реактивы, которые имеются в продаже у Invitrogen/Molecular Probes (Eugene, Oregon, США) и Pierce Biotechnology, Inc. (Rockford, III.).
Выявляемые метки, такие как флуоресцентные красители и хемилюминисцентные красители (Briggs et al "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1 (1997) 1051-1058), дают выявляемый сигнал и обычно являются применимыми для мечения, особенно со следующими свойствами: (i) меченый конъюгат должен давать очень сильный сигнал со слабым фоном таким образом, что могут быть чувствительно выявлены маленькие количества конъюгата как в бесклеточных анализах, так и в анализах на основе клеток; и (ii) меченый конъюгат должен быть фотостабильным так, что флуоресцентный сигнал можно наблюдать, отслеживать и записывать без значимого фотообесцвечивания. Для применений, включающих связывание на поверхности клетки меченых конъюгатов с мембранами или поверхностями клеток, особенно живых клеток, метки должны (iii) иметь хорошую растворимость в воде для достижения эффективной концентрации конъюгата и чувствительности выявления и (iv) быть нетоксчными для живых клеток так, чтобы не нарушать нормальные метаболические процессы клеток или вызывать преждевременную гибель клеток.
(в) Доступны или раскрыты разные ферментативно-субстратные метки (см., например, US 4275149). Фермент обычно катализирует химическое изменение хромогенного субстрата, которое может быть измерено с использованием разных методик. Например, фермент может катализировать изменение окрашивания субстрата, которое можно измерять спектрофотометрически. В качестве альтернативы, фермент может изменять флуоресценцию или хемилюминисценцию субстрата. Хемилюминисцентный субстрат становится элетронно возбужденным посредством химической реакции и может затем испускать свет, который можно измерять (например, с использованием хемилюминометра), или передает энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, люцифераза светляка и бактериальная люцифераза; US 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (АР), 3-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), оксидазы гетероциклических соединений (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и тому подобные. Методики конъюгирования ферментов с полипептидами описаны в O'Sullivan et al "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed. by J. Langone & IT Van Vunakis), Academic Press, New York, 73 (1981) 147-166.
Примеры фермент-субстратных комбинаций (US 4275149; US 4318980) включают, например:
(i) пероксидазу хрена (HRP) с пероксидом водорода в качестве субстрата, где пероксидаза окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидина гидрохлорид (ТМВ));
(ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
(iii) 3-D-галактозидазу (3-D-Gal) с хромогенным субстратом (например, п-нитрофенил-(3-D-галактозидом) или флуорогенным субстратом 4-метилумбеллиферил-(3-D-галактозидом).
Меченый конъюгат, как описано в данном документе, может использоваться в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (Zola, Monoclonal Antibodies: A Manual of Techniques (1987) pp. 147-158, CRC Press, Inc.).
Меченые конъюгаты, как описано в данном документе, являются полезными в качестве биомаркеров для визуализации и зондов при использовании в разных способах и методиках биомедицинской и молекулярной визуализации, таких как: (i) MPT (магнитно-резонансная томография); (ii) микроКТ (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) PET (позитронная эмиссионная томография) Tinianow, J. et al Nuclear Medicine and Biology, 37(3) (2010) 289-297; Chen et al, Bioconjugate Chem. 15 (2004) 41-49; US 2010/0111856; (v) биолюминисценция; (vi) флуоресценция и (vii) ультразвук. Иммуносцинтиграфия представляет собой методику визуализации, в которой конъюгаты, меченные радиоактивными веществами, вводятся пациенту-животному или человеку, и получают изображение сайтов в организме, где локализуется конъюгат (US 6528624). Биомаркеры для визуализации можно объективно измерять и оценивать в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут быть нескольких типов: маркеры типа 0 представляют собой маркеры естественной истории заболевания, и они линейно коррелируют с известными клиническими показателями, например, оценка посредством МРТ синовиального воспаления при ревматоидном артрите; маркеры типа I запечатлевают эффект вмешательства в соответствии с механизмом действия, даже если данный механизм может быть несвязанным с ожидаемым клиническим результатом; маркеры типа II функционируют как имитация ожидаемых результатов, когда изменение в или сигнал от биомаркера прогнозирует клиническую пользу для «подтверждения» целевого ответа, как, например, измеренная эрозия кости при ревматоидном артрите, определенная КТ. Биомаркеры для визуализации, таким образом, могут давать фармакодинамическую (PD) терапевтическую информацию по: (i) экспрессии белка-мишени, (ii) связыванию терапевтического средства с белком-мишенью, т.е. селективности, и (iii) фармакодинамическим данным - клиренсу и периоду полувыведения. Преимущества биомаркеров для визуализации in vivo по отношению к лабораторным биомаркерам включают: неинвазивную обработку, поддающуюся количественному измерению оценку всего организма, повторное дозирование и оценку, т.е. во многие моменты времени, и потенциально переносимые эффекты от доклинических (на маленьких животных) на клинические (на человеке) результаты. Для некоторых применений биовизуализация подменяет или минимизирует число экспериментов на животных в доклинических исследованиях.
Способы мечения пептидов хорошо известны. См. Haugland (2003) Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley (1992) Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T.S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R.L. and Noyes, С.M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGruyter, Berlin and New York и Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); DeLeon-Rodriguez et al, Chem. Eur. J. 10 (2004) 1149-1155; Lewis et al, Bioconjugate Chem. 12 (2001) 320-324; Li et al, Bioconjugate Chem. 13 (2002) 110-115; Mier et al Bioconjugate Chem. 16(2005)240-237.
Конъюгаты антител
Антитело в конъюгате, как описано в данном документе, может быть дополнительно конъюгировано, если оно само по себе не является одной из молекул, с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофорами, такими как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или выявляемой меткой, или агентом, модифицирующим клиренс, таким как разные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводным или липофильным агентом.
Иммуноконъюгаты
Согласно изобретению также предложены иммуноконъюгаты, содержащие антитело, как описано в данном документе, или конъюгат, как описано в данном документе, конъюгированные с одним или более чем одним цитотоксическим агентом, таким как химиотерапевтические агенты или лекарственные средства, агенты, ингибирующие рост, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, или их фрагменты) или радиоактивные изотопы.
В одном воплощении иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более чем одним лекарственным средством, включающим майтансиноид (см. US 5208020, US 5416064 и ЕР 0425235 В1); ауристатин, такой как монометилауристатиновые лекарственные группировки DE и DF (ММАЕ и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производное (см. US 5712374, US 5714586, US 5739116, US 5767285, US 5770701, US 5770710, US 5773001 и US 5877296; Hinman, L.M. et al., Cancer Res. 53 (1993) 3336-3342 и Lode, H.N. et al., Cancer Res. 58 (1998) 2925-2928); антрациклин, такой как дауномицин или доксорубицин (см. Kratz, F. et al., Curr. Med. Chem. 13 (2006) 477-523; Jeffrey, S.C. et al., Bioorg. Med. Chem. Lett. 16 (2006) 358-362; Torgov, M.Y. et al., Bioconjug. Chem. 16 (2005) 717-721; Nagy, A. et al., Proc. Natl. Acad. Sci. USA 97 (2000) 829-834; Dubowchik, G.M. et al., Bioorg. & Med. Chem. Letters 12 (2002) 1529-1532; King, H.D. et al., J. Med. Chem. 45 (2002) 4336-4343 и патент США №6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен и СС1065, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, или комплекс, как описано в данном документе, конъюгированные с ферментативно активным токсином или его фрагментом, включающим цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модессина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, РАРМ и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, или комплекс, как описано в данном документе, конъюгированные с радиоактивным атомом с образованием радиоконъюгата. Для получения радиоконъюгатов доступно множество радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При использовании радиоконъюгата для выявления он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99m или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография, МРТ), такую как опять-таки йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента можно получать с использованием целого ряда бифункциональных связывающих агентов для белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)-гександиамин), производные бис-диазония (такие как бис-(п-диазониябензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгирования радиоактивного нуклеотида с антителом. См. WO 94/11026. Линкер может быть «расщепляемым линкером», облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; патент США №5208020).
Иммуноконъюгаты или ADC прямо рассматриваются в данном документе, но не ограничиваются такими конъюгатами, которые получены с поперечно связывающими реактивами, включающими BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые имеются в продаже (например, у Pierce Biotechnology, Inc., Rockford, IL, США), но не ограничивающимися ими.
Линкер
Термин «линкер» обозначает бифункциональную или мультифункциональную группировку, которую можно использовать для конъюгирования (связывания) антитела или аминокислотной последовательности мотива хеликар с другими соединениями, такими как выявляемые метки или лекарственные средства. Конъюгаты аминокислотной последовательности мотива хеликар могут быть с удобством получены с использованием линкера, имеющего реакционноспособную функциональную группу для связывания с другим соединением и с аминокислотной последовательностью мотива хеликар.
В одном воплощении линкер имеет реакционноспособный сайт, который имеет электрофильную группу, которая реагирует с нуклеофильной группой, присутствующей на аминокислотной последовательности мотива хеликар или на антителе, или на другом соединении. Тиольная группа цистеина, например, реагирует с электрофильной группой на линкере и образует ковалентную связь с линкером. Полезные электрофильные группы включают другую тиольную, малеимидную и галогенацетамидную группы (см., например, способ конъюгирования на стр. 766 Klussman et al, Bioconjugate Chemistry 15(4) (2004) 765-773), но не ограничиваются ими.
Примеры функциональных групп, реагирующих с тиолом, включают тиол, малеимид, альфа-галогенацетил, активированные сложные эфиры, такие как сложные эфиры сукцинимида, 4-нитрофениловые сложные эфиры, пентафторфениловые сложные эфиры, тетрафторфениловые сложные эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты, но не ограничиваются ими.
Линкер может содержать аминокислотные остатки, которые связывают антиген (аминокислотную последовательность мотива хеликар) с грузом. Аминокислотные остатки могут образовать дипептидное, трипептидное, тетрапептидное, пентапептидное, гексапептидное, гептапептидное, октапептидное, нонапептидное, декапептидное, ундекапептидное или додекапептидное звено. Аминокислотные остатки включают аминокислотные остатки, встречающиеся в природе, а также не встречающиеся в природе аминокислотные аналоги, такие как, например, цитруллин или β-аминокислоты, такие как, например, β-аланин, или ϖ-аминокислоты, такие как 4-аминомасляная кислота.
В другом воплощении линкер имеет реакционноспособную функциональную группу, которая имеет нуклеофильную группу, которая реагирует с электрофильной группой, присутствующей на аминокислотной последовательности мотива хеликар или на антителе (антителе против аминокислотной последовательности мотива хеликар). Полезные электрофильные группы включают карбонильные группы альдегидов и кетонов, но не ограничиваются ими. Гетероатом нуклеофильной группы линкера может реагировать с электрофильной группой на аминокислотной последовательности мотива хеликар или антителе и образовать ковалентную связь с антигеном (аминокислотной последовательностью мотива хеликар) или антителом. Полезные нуклеофильные группы на линкере включают гидразидную, оксимовую, амино, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную, но не ограничиваются ими. Электрофильная группа на антигене (аминокислотной последовательности мотива хеликар) дает удобный сайт для присоединения к линкеру.
Типично линкеры пептидного типа можно получать путем образования пептидной связи между двумя или более чем двумя аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, согласно способу синтеза в жидкой фазе (Е. Schroder and K. Lubke "The Peptides", volume 1 (1965) 76-136, Academic Press), который хорошо известен в области химии пептидов.
В другом воплощении линкер может быть замещен группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (SO3-) или аммоний, или полимер, такой как ПЭГ, может увеличивать растворимость реактива в воде и облегчать реакцию связывания линкерного реактива с антигеном (аминокислотной последовательностью мотива хеликар) или лекарственной группировкой, или облегчать реакцию связывания, в зависимости от используемого пути синтеза.
Конъюгаты, содержащие лекарственное средство или метку, как описано в данном документе, прямо предусматривают комплексы, полученные со следующими линкерными реактивами: ВМРЕО, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включая бис-малеимидные реактивы: DTME, ВМВ, BMDB, ВМН, ВМОЕ, ВМ(РЕО)3 и ВМ(РЕО)4, которые имеются в продаже у Pierce Biotechnology, Inc., но не ограничиваются ими. Бис-малеимидные реактивы обеспечивают последовательное или одновременное присоединение, например, тиольной группы к тиолсодержащей лекарственной группировке, метке или линкерному промежуточному соединению. Другие функциональные группы, помимо малеимида, которые реагируют, например, с тиольной группой, включают йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат.
Типичный линкер включает валин-цитруллиновый (val-cit или vc) дипептидный линкерный реактив, имеющий малеимидную ширилку и пара-аминобензилкарбамоильный (РАВ) самораспадающийся спейсер, и phe-lys(Mtr) дипептидный линкерный реактив, имеющий малеимидную ширилку и п-аминобензильный самораспадающийся спейсер.
Тиольные группы цистеина являются нуклеофильными и способными к реакции с образованием ковалентных связей с электрофильными группами на линкерных реактивах и соединениях, содержащих мотив хеликар, включающих: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и хлорангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы; и (iv) дисульфиды, включающие пиридилдисульфиды, образующиеся посредством сульфидного обмена. Нуклеофильные группы на соединении, содержащем мотив хеликар, включают аминогруппу, тиольную, гидроксильную, гидразидную, оксимовую, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные к реакции с образованием ковалентных связей с электрофильными группами на линкерных группировках и линкерных реактивах, но не ограничиваются ими.
III. Нуклеиновая кислота
ДНК, кодирующую аминокислотную последовательность антитела, как описано в данном документе, соединений или части соединений, содержащихся в конъюгате, как описано в данном документе, можно получать множеством способов, известных в данной области. Данные способы включают получение сайтнаправленным (или опосредованным олигонуклеотидами) мутагенезом, ПЦР-мутагенезом и кассетным мутагенезом полученной ранее ДНК, кодирующей полипептид, но не ограничиваются ими.
Варианты рекомбинантных антител также можно конструировать посредством манипулирования с рестрикционным фрагментом или посредством ПЦР с перекрывающимися праймерами с использованием синтетических олигонуклеотидов. Мутагенные праймеры кодируют замену(ны) на кодоны цистеина. Для получения ДНК, кодирующей такие генетически модифицированные антитела, можно использовать стандартные методики мутагенеза. Общее руководство можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989 и Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-lnterscience, New York, N.Y., 1993.
IV. Экспрессия и очистка
Антитела можно получать с использованием способов и композиций генной инженерии, например, как описано в US 4816567. В одном воплощении предложена выделенная нуклеиновая кислота, кодирующая антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионные векторы), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клетка Y0, NS0, Sp20). В одном воплощении предложен способ получения антитела, как описано в данном документе, где данный способ влючает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как приведено выше, при подходящих условиях для экспрессии антитела, и возможно выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела, как описано в данном документе, выделяют нуклеиновую кислоту, кодирующую антитело, например, как описано выше, и вставляют в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием традиционных методик (например, посредством применения олигонуклеотидных зондов, которые способны к специфичному связыванию с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела можно продуцировать в бактериях, в частности, когда не нужны гликозилирование и эффекторная функция Fc. Относительно экспрессии фрагментов и полипептидов антитела в бактериях см., например, US 5648237, US 5789199 и US 5840523. (См. также Charlton, K.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, описывающую экспрессию фрагментов антитела в Е. coli.). После экспрессии антитело можно выделять из пасты бактериальных клеток в растворимой фракции и можно дополнительно очищать.
Помимо прокариот, подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитело, являются эукариотические микробы, такие как нитчатые грибки или дрожжи, включая штаммы грибков и дрожжей, пути гликозилирования которых были «гуманизированы», приводя к продукции антитела с частично или полностью человеческой картиной гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414 и Li, Н. et al., Nat. Biotech. 24 (2006)210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также происходят из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также можно использовать в качестве хозяев. См., например, патенты США №5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для продуцирования антител в трансгенных растениях).
Клетки позвоночных также можно использовать в качестве хозяев. Например, могут быть полезными линии клеток млекопитающих, которые адаптированы для роста в суспензии. Другими примерами полезных линий клеток-хозяев млекопитающих являются линия CV1 почки обезьяны, трансформированная SV40 (COS-7); линия эмбриональной почки человека (293 или клетки 293, как описано, например, Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почки новорожденного хомяка (ВНК); мышиные клетки Сертоли (клетки ТМ4, как описано, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени серой крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5 и клетки FS4. Другие полезные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включая клетки СНО DHFR" (негативные по дегидрофолатредуктазе) (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Для обзора определенных линий клеток-хозяев млекопитающих, полезных для продукции антител, см., например, Yazaki, P. and Wu, А.М., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
V. Способы и композиции для диагностики и выявления
В некоторых воплощениях любое из антител, особенно биспецифичных антител и конъюгатов, как описано в данном документе, является полезным для выявления присутствия одной или более чем одной молекулы-мишени в биологическом образце. Термин «выявление» в том виде, в котором он используется в данном документе, охватывает количественное или качественное выявление. В одном воплощении биологический образец содержит клетку или ткань.
В одном воплощении предложено антитело или конъюгат, как описано в данном документе, для применения в способе диагностики или выявления. В некоторых воплощениях способ включает приведение в контакт биологического образца с антителом или конъюгатом, как описано в данном документе, при пермиссивных условиях для связывания антитела или конъюгата с мишенью и выявление того, образуется ли комплекс между антителом или конъюгатом и мишенью. Такое способ может представлять собой способ in vitro или in vivo.
В некоторых воплощениях предложены меченые антитела или конъюгаты. Метки включают метки или группировки, которые выявляются непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминисцентные и радиоактивные метки), а также такие группировки, как ферменты или лиганды, которые выявляются опосредованно, например, посредством ферментативной реакции или молекулярного взаимодействия, но не ограничиваются ими. Типичные метки включают радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат дегидрогеназу, оксидазы гетероциклических соединений, такие как уриказа и ксантиноксидаза, связанные с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное, но не ограничиваются ими.
VI. Фармацевтические композиции
Фармацевтические композиции антитела или конъюгата, как описано в данном документе, получают смешиванием такого антитела или конъюгата, имеющего желательную степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают: буферы, такие как фосфатный, цитратный или на основе других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок) и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ), но не ограничиваются ими. Типичные фармацевтически приемлемые носители в данном документе дополнительно включают агенты для диспергирования лекарственного средства в интерстициальном пространстве, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, человеческие растворимые гиалуронидазные гликопротеины РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGPs и способы применения, включающие rhuPH20, описаны в публикациях патентов США №2005/0260186 и 2006/0104968. В одном аспекте sHASEGP объединяют с одной или более чем одной дополнительной гликозаминогликаназой, такой как хондроитиназа.
Типичные лиофилизированные композиции антитела описаны в US 6267958. Водные композиции антитела включают композиции, описанные в US 6171586 и WO 2006/044908, причем последние композиции включают гистидин-ацетатаный буфер.
Описанная в данном документе композиция также может содержать более чем один активный ингредиент, по мере необходимости для конкретного показания, которое лечат, предпочтительно активные ингредиенты с дополнительными активностями, которые не оказывают неблагоприятного влияния друг на друга. Такие активные ингредиенты подходящим образом присутствуют в комбинации в количествах, которые являются эффективными для намеченной цели.
Активные ингредиенты могут быть захвачены в микрокапсулы, полученные, например, посредством методик коацервации или полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело или конъюгат, которые находятся в виде формованных предметов, например, пленок или микрокапсул.
Композиции, подлежащие для введения in vivo, обычно являются стерильными. Стерильность может легко достигаться, например, фильтрованием через мембраны для стерилизующей фильтрации.
VII. Терапевтичекие способы и композиции
Любое из описанных в данном документе антител или конъюгатов можно использовать в терапевтических способах.
В одном аспекте предложено антитело или конъюгат, как описано в данном документе, для применения в качестве лекарственного средства. В других аспектах предложено антитело или конъюгат, как описано в данном документе, для применения в лечении заболевания. В некоторых воплощениях предложено антитело или конъюгат, как описано в данном документе, для применения в способе лечения. В некоторых воплощениях согласно изобретению предложено антитело или конъюгат, как описано в данном документе, для применения в способе лечения индивида, включающем введение индивиду эффективного количества антитела или конъюгата, как описано в данном документе. В одном таком воплощении способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может представлять собой человека.
В другом аспекте согласно изобретению предложено применение антитела или конъюгата, как описано в данном документе, в изготовлении или получении лекарственного средства. В одном воплощении лекарственное средство служит для лечения заболевания. В другом воплощении лекарственное средство служит для применения в способе лечения заболевания, включающем введение индивиду, имеющему заболевание, эффективного количества лекарственного средства. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может быть человеком.
В другом аспекте согласно изобретению предложен способ лечения заболевания. В одном воплощении данный способ включает введение индивиду, имеющему такое заболевание, эффективного количества антитела или конъюгата, как описано в данном документе. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может быть человеком.
В другом аспекте согласно изобретению предложены фармацевтические композиции, содержащие любое из антител или конъюгатов, как описано в данном документе, например, для применения в любом из приведенных выше терпевтических способов. В одном воплощении фармацевтическая композиция содержит любое из антител или конъюгатов, как описано в данном документе, и фармацевтически приемлемый носитель. В другом воплощении фармацевтическая композиция содержит любое из антител или конъюгатов, как описано в данном документе, и по меньшей мере один дополнительный терапевтический агент, например, как описано ниже.
Антитела и конъюгаты, как описано в данном документе, можно использовать в терапии либо одни, либо в комбинации с другими агентами. Например, антитело и конъюгат, как описано в данном документе, можно вводить совместно с по меньшей мере одним дополнительным терапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, охватывают комбинированное введение (когда два или более чем два терапевтических агента включают в ту же самую или в отдельные композиции) и раздельное введение, причем в данном случае введение антитела по изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта. Антитела и конъюгаты, как описано в данном документе, также можно использовать в комбинации с лучевой терапией.
Антитело или конъюгат, как описано в данном документе (и любой дополнительный терапевтический агент), можно вводить любыми подходящими способами, включая парентеральное, внутрилегочное и интраназальное введение, и, если это желательно для местного лечения, введение в область поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может осуществляться любым подходящим путем, например, посредством инъекций, таких как внутривенные или подкожные инъекции, отчасти в зависимости от того, является ли введение кратковременным или хроническим. В данном документе рассматриваются разные схемы дозирования, включающие однократные или многократные введения на протяжении разных моментов времени, болюсное введение и импульсную инфузию, но не ограничивающиеся ими.
Антитела или конъюгаты, как описано в данном документе, были бы приготовлены, дозированы и введены способом, согласующимся с надлежащей медицинской практикой. В данном контексте факторы для рассмотрения включают конкретное расстройство, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние индивидуального пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело или конъюгат не должны, но возможно готовятся с одним или более чем одним агентом, используемым в настоящее время для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других агентов зависит от количетва антитела или конъюгата, присутствующих в композиции, типа расстройства или лечения и других факторов, обсуждавшихся выше. Их обычно используют в таких же дозировках и с использованием таких же путей введения, которые описаны в данном документе, или примерно от 1 до 99% от дозировок, описанных в данном документе, или в любой дозировке и любым путем, который эмпирически/клинически определен как подходящий.
Для предупреждения или лечения заболевания подходящая дозировка антитела или конъюгата, как описано в данном документе (при использовании одного или в комбинации с одним или более чем одним другим дополнительным терапевтическим агентом), будет зависеть от типа заболевания, подлежащего лечению, типа антитела или конъюгата, тяжести и хода заболевания, того, вводится ли антитело или конъюгат для предупредительных или терапевтических целей, предыдущей терапии, клинической истории пациента, ответа на антитело или конъюгат и решения лечащего врача. Антитело или конъюгат подходящим образом вводятся пациенту за один раз или на протяжении серии обработок. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5 мг/кг - 10 мг/кг) антитела или конъюгата могут составлять исходную подходящую дозировку для введения пациенту, например, независимо от того, посредством одного или более чем одного раздельного введения или посредством непрерывной инфузии. Одна типичная ежесуточная дозировка может варьировать от примерно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений на протяжении некольких суток или более, в зависимости от состояния, лечение обычно сохраняли бы, пока не происходило бы желательное подавление симптомов заболевания. Одна типичная дозировка антитела или конъюгата находилась бы в интервале от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту можно вводить одну или более чем одну дозу примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любую комбинацию). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от примерно двух до примерно двадцати или, например, примерно шесть доз антитела). Может вводиться исходная более высокая ударная доза, с последующей одной или более чем одной меньшей дозой. Однако могут быть полезными другие схемы дозировки. Прогресс данной терапии легко отслеживать традиционными методиками и анализами.
Понятно, что любые из приведенных выше композиций или терапевтических способов можно получать(осуществлять) с использованием иммуноконъюгата по изобретению вместо или помимо антитела или конъюгата, как описано в данном документе.
VIII. Изделия
В другом аспекте изобретения предложено изделие, содержащее полезные материалы для лечения, предупреждения и/или диагностики расстройств, описанных выше. Данное изделие содержит контейнер и этикетку или листок-вкладыш в упаковке на или ассоциированные с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки с в.в. (внутривенный) раствором и т.д. Контейнеры могут быть образованы из целого ряда материалов, таких как стекло или пластмасса. Данный контейнер содержит композицию, которая сама по себе или объединенная с другой композицией является эффективной для лечения, предупреждения и/или диагностики состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок с внутривенным раствором или флакон, имеющий крышку, проницаемую подкожной инъекционной иглой). По меньшей мере один активный агент в композиции представляет собой антитело или комплекс, как описано в данном документе. На этикетке или листке-вкладыше в упаковке указано, что композиция используется для лечения выбранного состояния. Кроме того, изделие может содержать (а) первый контейнер с композицией, содержащейся в нем, где данная композиция содержит антитело или комплекс, как описано в данном документе; и (б) второй контейнер с композицией, содержащейся в нем, где данная композиция содержит дополнительный цитотоксический или иной терапевтический агент. Изделие в данном воплощении изобретения может дополнительно содержать листок-вкладыш в упаковке, указывающий, что композиции можно использовать для лечения конкретного состояния. Альтернативно или дополнительно изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно включать другие материалы, желательные с коммерческой или пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любое из приведенных выше изделий может включать иммуноконъюгат по изобретению, вместо или помимо антитела или конъюгата, как описано в данном документе.
IX. Конкретные воплощения
1. Конъюгат, содержащий соединение, содержащее аминокислотную последовательность мотива хеликар, и антитело, которое специфично связывается с аминокислотной последовательностью мотива хеликар, характеризующийся ковалентной связью между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела против хеликара, при этом CDR2 определяется согласно Kabat.
2. Конъюгат, содержащий соединение, содержащее аминокислотную последовательность мотива хеликар, и антитело, которое специфично связывается с аминокислотной последовательностью мотива хеликар соединения, содержащего аминокислотную последовательность мотива хеликар (антитело против аминокислотной последовательности мотива хеликар), характеризующийся ковалентной связью между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела, при этом CDR2 определяется согласно Kabat.
3. Конъюгат по любому из пп. 1-2, характеризующийся тем, что CDR2 представляет собой CDR2 легкой цепи.
4. Конъюгат по любому из пп. 1-3, характеризующийся тем, что аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARLKK (SEQ ID NO: 01) или ее вариант с одним аминокислотным остатком, замененным на цистеин.
5. Конъюгат по любому из пп. 1-4, характеризующийся тем, что аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARLKK (SEQ ID NO: 01), в которой один аминокислотный остаток из трех С-концевых аминокислотных остатков заменен на цистеин.
6. Конъюгат по любому из пп. 1-5, характеризующийся тем, что аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность AHLENEVARCKK (SEQ ID NO: 02) или AHLENEVARLCK (SEQ ID NO: 03).
7. Конъюгат по любому из пп. 1-6, характеризующийся тем, что соединение, содержащее аминокислотную последовательность мотива хеликар, содержит аминокислотную последовательность мотива хеликар, возмжно линкер и груз.
8. Конъюгат по любому из пп. 1-7, характеризующийся тем, что соединение, содержащее аминокислотную последовательность мотива хеликар, представляет собой полипептид, содержащий аминокислотную последовательность мотива хеликар либо слитую с одним из его концов, либо находящуюся внутри последовательности полипептида.
9. Конъюгат по любому из пп. 1-8, характеризующийся тем, что ковалентная связь образуется между соединением, содержащим аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела.
10. Конъюгат по любому из пп. 1-9, характеризующийся тем, что ковалентная связь образуется между функциональной группой в соединении, содержащем аминокислотную последовательность мотива хеликар, и аминокислотным остатком в CDR2 антитела.
11. Конъюгат по любому из пп. 1-10, характеризующийся тем, что функциональная группа находится в аминокислотной последовательности мотива хеликар.
12. Конъюгат по любому из пп. 1-11, характеризующийся тем, что ковалентная связь образуется между остатком цистеина в CDR2 легкой цепи антитела и функциональной группой в соединении, содержащем аминокислотную последовательность мотива хеликар.
13. Конъюгат по п. 12, характеризующийся тем, что остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 или в положении 51 согласно нумерации вариабельного домена легкой цепи по Kabat.
14. Конъюгат по любому из пп. 12-13, характеризующийся тем, что остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
15. Конъюгат по любому из пп. 1-14, характеризующийся тем, что ковалентная связь представляет собой дисульфидную связь.
16. Конъюгат по п. 15, характеризующийся тем, что дисульфидная связь образуется между остатком цистеина в аминокислотной последовательности мотива хеликар и остатком цистеина в CDR2 легкой цепи антитела против хеликара.
17. Конъюгат по любому из пп. 1-16, характеризующийся тем, что аминокислотная последовательность мотива хеликар имеет аминокислотную последовательность SEQ ID NO: 02.
18. Конъюгат по любому из пп. 1-17, характеризующийся тем, что антитело представляет собой биспецифичное антитело, содержащее первый функционал связывания в отношении антигена, не являющегося хеликаром, и второй функционал связывания в отношении аминокислотной последовательности мотива хеликар.
19. Конъюгат по п. 18, характеризующийся тем, что антиген (не являющийся хеликаром) представляет собой антиген поверхности клетки.
20. Конъюгат по п. 19, характеризующийся тем, что антиген поверхности клетки представляет собой антиген, ассоциированный с опухолью.
21. Конъюгат по любому из пп. 18-20, характеризующийся тем, что биспецифичное антитело представляет собой полноразмерное антитело, с которым на одном или обоих С-концах тяжелой цепи был слит scFv или dsscFv, или scFab, или dsscFab, или их комбинация, либо непосредственно, либо через пептидный линкер.
22. Конъюгат по любому из пп. 18-21, характеризующийся тем, что биспецифичное антитело представляет собой полноразмерное антитело.
23. Конъюгат по любому из пп. 18-22, характеризующийся тем, что одна тяжелая цепь биспецифичного антитела содержит мутацию, формирующую впадину, и соответствующая другая цепь содержит мутацию, формирующую выступ.
24. Конъюгат по любому из пп. 7-23, характеризующийся тем, что груз выбран из связывающей группировки, метящей группировки и биологически активной группировки.
25. Конъюгат по любому из пп. 1-24, характеризующийся тем, что антитело представляет собой полноразмерное антитело.
26. Конъюгат по любому из пп. 1-25, характеризующийся тем, что антитело представляет собой гуманизированное или человеческое антитело.
27. Конъюгат по любому из пп. 1-26, характеризующийся тем, что константная область антитела принадлежит к подклассу IgG1 или к подклассу IgG4.
28. Конъюгат по любому из пп. 1-27, характеризующийся тем, что антитело имеет константную область подкласса IgG1 с аланином в положении 234 и 235 и с глицином в положении 329 с нумерацией согласно индексу ЕС по Kabat.
29. Конъюгат по любому из пп. 1-27, характеризующийся тем, что антитело имеет константную область подкласса IgG4 с пролином в положении 228, глутаминовой кислотой в положении 235 и глицином в положении 329 с нумерацией согласно индексу ЕС по Kabat.
30. Конъюгат по любому из пп. 1-24, характеризующийся тем, что в данном воплощении антитело представляет собой фрагмент антитела.
31. Конъюгат по п. 30, характеризующийся тем, что фрагмент представляет собой Fab или (Fab)2.
32. Конъюгат по любому из пп. 1-31, характеризующийся тем, что конъюгат содержит точно одну ковалентную связь на CDR2 легкой цепи.
33. Конъюгат по любому из пп. 1-32, характеризующийся тем, что соединение, содержащее аминокислотную последовательность мотива хеликар, содержит реакционноспособную группу, которая может образовать ковалентную связь с тиольной группой остатка цистеина в CDR2 антитела.
34. Конъюгат по любому из пп. 1-33, характеризующийся тем, что реакционноспособная группа представляет собой тиол или малеимид, или галогенацетил.
35. Конъюгат по любому из пп. 1-34, характеризующийся тем, что ковалентная связь представляет собой дисульфидную связь.
36. Конъюгат по п. 35, характеризующийся тем, что дисульфидная связь образуется без добавления окислительно-восстановительно активного агента.
37. Конъюгат по любому из пп. 1-36, характеризующийся тем, что конъюгат содержит терапевтическую или выявляемую группировку.
38. Конъюгат по п. 37, характеризующийся тем, что терапевтическая или выявляемая группировка ковалентно конъюгирована с аминокислотной последовательностью мотива хеликар, или аминокислотная последовательность мотива хеликар включена в терапевтическую или выявляемую группировку.
39. Конъюгат по любому из пп. 1-38, характеризующийся тем, что аминокислотная последовательность мотива хеликар конъюгирована с полипептидом, состоящим из 5-500 аминокислотных остатков.
40. Конъюгат по п. 39, характеризующийся тем, что полипептид содержит 10-450 аминокислотных остатков.
41. Конъюгат по любому из пп. 39-40, характеризующийся тем, что полипептид содержит 12-450 аминокислотных остатков.
42. Конъюгат по любому из пп. 39-41, характеризующийся тем, что полипептид содержит 15-400 аминокислотных остатков.
43. Конъюгат по любому из пп. 1-42, характеризующийся тем, что аминокислотная последовательность мотива хеликар конъюгирована с выявляемой меткой.
44. Конъюгат по любому из пп. 1-43, характеризующийся тем, что аминокислотная последовательность мотива хеликар конъюгирована с полипептидом или с выявляемой меткой, или с грузом через линер.
45. Конъюгат по п. 44, характеризующийся тем, что линкер представляет собой непептидный линкер.
46. Конъюгат по п. 44, характеризующийся тем, что линкер представляет собой пептидный линкер.
47. Антитело против хеликара, которое имеет в легкой цепи остаток цистеина в CDR2, при этом CDR2 определяется согласно Kabat.
48. Антитело против хеликара по п. 47, характеризующееся тем, что остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 или в положении 51 согласно нумерации вариабельного домена легкой цепи по Kabat.
49. Антитело против хеликара по любому из пп. 47-48, характеризующееся тем, что остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
50. Антитело против хеликара по любому из пп. 47-49, характеризующееся тем, что антитело имеет остаток цистеина точно в одном вариабельном домене тяжелой цепи в положении 55 или в положении 51.
51. Антитело против хеликара по любому из пп. 47-50, характеризующееся тем, что антитело представляет собой гуманизированное или человеческое антитело.
52. Антитело против хеликара по любому из пп. 47-51, характеризующееся тем, что антитело представляет собой полноразмерное антитело или Fab, или scFv, или scFv, конъюгированный с областью Fc.
53. Антитело против хеликара по любому из пп. 47-52, характеризующееся тем, что цистеин образует дисульфидную связь с изолированным остатком цистеина или с изолированным остатком гомоцистеина.
54. Иммуноконъюгат, содержащий конъюгат по любому из пп. 1-46 и цитотоксический агент.
55. Фармацевтическая композиция, содержащая конъюгат по любому из пп. 1-46 и фармацевтически приемлемый носитель.
56. Конъюгат по любому из пп. 1-46 для применения в качестве лекарственного средства.
57. Конъюгат по любому из пп. 1-46 для лечения рака.
58. Конъюгат по любому из пп. 1-46 для лечения диабета.
59. Конъюгат по любому из пп. 1-46 для лечения ожирения.
60. Конъюгат по любому из пп. 1-46 для лечения воспалителого заболевания.
61. Конъюгат по любому из пп. 1-46 для лечения метаболического заболевания.
62. Конъюгат по любому из пп. 1-46 для лечения вирусного заболевания.
63. Применение конъюгата по любому из пп. 1-46 в изготовлении лекарственного средства.
64. Применение конъюгата по любому из пп. 1-46 в качестве диагностического агента.
65. Применение конъюгата по любому из пп. 1-46, содержащего терапевтический полипептид, для увеличения стабильности терапевтического полипептида.
66. Применение конъюгата по любому из пп. 1-46, содержащего терапевтический полипептид, для увеличения активности терапевтического полипептида.
67. Применение конъюгата по любому из пп. 1-46, содержащего терапевтический полипептид, для увеличения периода полувыведения терапевтического полипептида in vivo.
68. Применение конъюгата по любому из пп. 1-46 в лечении заболевания.
69. Способ лечения индивида, имеющего заболевание, включающий введение индивиду эффективного количества конъюгата по любому из пп. 1-46.
70. Способ лечения заболевания у индивида, включающий введение индивиду эффективного количества конъюгата по любому из пп. 1-46.
71. Способ по любому из пп. 68-70, характеризующийся тем, что заболевание представляет собой рак.
72. Способ по любому из пп. 68-70, характеризующийся тем, что заболевание представляет собой диабет.
73. Способ по любому из пп. 68-70, характеризующийся тем, что заболевание представляет собой ожирение.
74. Способ получения конъюгата по любому из пп. 1-46, включающий объединение антитела против хеликара, содержащего первую реакционноспособную группу, и соединения, содержащего аминокислотную последовательность мотива хеликар, которое имеет вторую реакционноспособную группу, при этом атом альфа-углерода аминокислотного остатка, который несет первую реакционноспособную группу, находится примерно в 10-11 ангстремах от атома соединения, содержащего аминокислотную последовательность мотива хеликар, с которым слит линкер.
75. Способ получения конъюгата по любому из пп. 1-46, включающий следующие стадии:
- объединение в растворе антитела против хеликара, которое специфично связывается с аминокислотной последовательностью мотива хеликар и содержит реакционноспособную группу на одном аминокислотном остатке в CDR2, с соединением, содержащим аминокислотную последовательность мотива хеликар, содержащим реакционноспособную группу, где соединение, содержащее аминокислотную последовательность мотива хеликар, содержит груз, такой как пептид, состоящий из 5-500 аминокислотных остатков, или выявляемую метку, и
- выделение данного конъюгата из раствора.
76. Способ получения антитела против хеликара для образования конъюгата по любому из пп. 1-46, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую антитело против хеликара, и
- выделение антитела против хеликара из клетки или из культуральной среды,
где в антителе против хеликара остаток в CDR2 легкой цепи мутирован до цистеина, которое в структуре нековалентного комплекса антитела против хеликара и соединения, содержащего аминокислотную последовательность мотива хеликар, определенной посредством рентгеноструктурного анализа, имеет расстояние от 10 до 11 ангстрем между атомом альфа-углерода аминокислотного остатка в CDR2 антитела и атомом соединения, содержащего аминокислотную последовательность мотива хеликар, между которыми должна образоваться ковалентная связь.
77. Способ идентификации положения в CDR2 антитела против хеликара, которое можно мутировать до цистеина для образования ковалентной связи между остатком в CDR2 антитела и связанным соединением, содержащим аминокислотную последовательность мотива хеликар, включающий следующие стадии:
- предоставление кристаллической структуры нековалентного комплекса антитела против хеликара и соединения, содержащего аминокислотную последовательность мотива хеликар, и
- идентификация аминокислотного остатка в CDR2 антитела против хеликара и в соединении, содержащем аминокислотную последовательность мотива хеликар, с расстоянием от 10 до 11 ангстрем между атомами альфа-углерода аминокислотного остатка в CDR2 антитела и атомом в соединении, содержащем аминокислотную последовательность мотива хеликар,
где идентифицированное положение представляет собой положение в CDR2 антитела, которое можно мутировать до цистеина для образования ковалентной связи между остатком в CDR2 антитела и связанным соединением, содержащим аминокислотную последовательность мотива хеликар.
78. Биспецифичное антитело против хеликара для целевой доставки соединения, содержащего аминокислотную последовательность мотива хеликар, в клетку-мишень, где биспецифичное антитело содержит первый сайт связывания, который специфично связывается с соединением, содержащим аминокислотную последовательность мотива хеликар, и второй функционал связывания, который специфично связывается с маркером клеточной поверхности клетки-мишени.
Раскрытие всех ссылок, процитированных в данном документе, включено посредством этого при помощи ссылки.
Следующие примеры, графические материалы и последовательности приведены для помощи в понимании настоящего изобретения, истинный объем которого изложен в приложенной формуле изобретения. Понятно, что в изложенных методиках могут быть сделаны модификации без отступления от сущности изобретения.
ПРИМЕРЫ
Относительно аминокислотных последовательностей, синтеза и очистки антител против гаптена и гаптенилированных соединений в том виде, в котором они используются в приведенных ниже примерах, пожалуйста, см. WO 2014/006124.
Пример 1
Связывание рекомбинантного гуманизированного антитела против биотина с соединением, меченным биотином (гаптенилированным соединением)
Для того чтобы определить, приводили ли процедура гуманизации и последующее введение цистеиновых мутаций к производным, которые сохраняли полную активность связывания, проводили следующие эксперименты.
Свойства связывания производных рекомбинантного антитела против биотина анализировали методикой биослойной интерферометрии (BLI) с использованием прибора Octet QK (Fortebio Inc.). Данная система хорошо устоялась для исследования взаимодействий молекул. Методика BLI основана на измерении картины интерференции белого света, отраженного от поверхности кончика биосенсора и внутреннего эталона. Связывание молекул с кончиком биосенсора приводит к сдвигу картины интерференции, который можно измерить. Для анализа того, уменьшила ли процедура гуманизации, описанная выше, способность антитела против биотина связываться с биотином, непосредственно сравнивали свойства химерных и гуманизированных версий антитела по их способности к связыванию с биотинилированным белком. Исследования связывания проводили путем захвата антитела против биотина на биосенсорах для захвата с антителом против Fc человеческого IgG (АНС) (Fortebio Inc.). Сначала биосенсоры инкубировали в растворе антитела с концентрацией 0,5 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, в течение 1 мин. Затем биосенсоры инкубировали в течение 1 мин в 1× PBS, рН 7,4, для достижения стабильного фона. Связывание измеряли путем инкубирования биосенсоров, покрытых антителом, в растворе, содержащем биотинилированный белок с концентрацией 0,06 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, в течение 5 мин. Диссоциацию отслеживали в течение 5 мин в 1× PBS, рН 7,4. Полученные в результате кривые связывания для химерного и гуманизированного антител против биотина сравнивали непосредственно.
Гуманизированная версия антитела демонстрировала равное или даже лучшее связывание с биотинилированным антигеном, чем химерное антитело. То же самое верно для гуманизированного антитела с мутацией Cys в положении VH53 по Kabat. Биотинилированный белок демонстрировал остаточное неспецифичное связывание с биосенсорами, которое было пониженным при покрытии биосенсоров герцептином, который не связывается с биотином. Таким образом, функциональность антитела против биотина сохранялась у его гуманизированного варианта (который определяется последовательностями, описанными в SEQ ID NO: 19 и 20, SEQ ID NO: 21 и 22).
Поверхностный плазмонный резонанс
Измерение поверхностного плазмонного резонанса проводили на приборе BIAcore® Т200 (GE Healthcare Biosciences АВ, Швеция) при 25°С.Примерно 4300 резонансных единиц (RU) захватывающей системы (10 мкг/мл захватывающего антитела против человеческого антитела (Fc IgG) из набора для захвата человеческого антитела, BR-1008-39, GE Healthcare Biosciences АВ, Швеция) захватывали на чипе СМ3 (GE Healthcare, BR-1005-36) при рН 5,0 посредством применения стандартного набора для аминного связывания, поставленного GE Healthcare (BR-1000-50). Подвижным буфером для аминного связывания был HBS-N (10 мМ HEPES, рН 7,4, 150 мМ NaCl, GE Healthcare, BR-1006-70). Подвижным буфером и буфером для разведения для следующего анализа связывания был PBS-T (10 мМ фосфатно-солевой буферный раствор, включающий 0,05% Tween 20), рН 7,4. Гуманизированное антитело против биотина захватывали посредством инъецирования 2 нМ раствора в течение 60 с при скорости тока 5 мкл/мин. Биотинилированную миРНК разводили PBS-T в концентрациях 0,14-100 нМ (серии разведения 1:3). Связывание измеряли посредством инъецирования каждой концентрации в течение 180 с при скорости тока 30 мкл/мин, время диссоциации - 600 с. Поверхность регенерировали 30 с промывкой 3 М раствором MgCl2 при скорости тока 5 мкл/мин. Данные оценивали с использованием программы BIAevaluation (GE Healthcare Biosciences АВ, Швеция). Общие различия индекса преломления корректировали посредством вычитания ответа, полученного от поверхности с антителом против Fc человеческого IgG. Также вычитали пустые инъекции (двойной контроль). Для расчета KD и кинетических параметров использовали модель Лангмюра 1:1.
Анализ кинетики связывания посредством поверхностного плазмонного резонанса (SPR) проводили для гуманизированного антитела против биотина SEQ ID NO: 19 и 20 и гуманизированного антитела против биотина VH53C SEQ ID NO: 21 и 22. Антитела против биотина в концентрации 2 нМ захватывали антителом против Fc человеческого IgG, которое было связано с сенсорным чипом СМ3. Записывали связывание биотинилированных миРНК (Mw: 13868 Да) в концентрациях 0,41; 1,23; 3,7; 11,1; 33,3; 100 и 300 нМ. Измерения проводили в двойных повторностях. Расчетная KD для гуманизированного антитела против биотина и гуманизированного антитела против биотина VH53C составляла 0,633 нМ и 0,654 нМ соответственно.
Пример 2
Получение нековалентных комплексов гаптенилированных соединений с антителами против гаптена
Общий способ:
Получение комплексов антител против гаптена с гаптенилированными соединениями (гаптены, конъюгированные с грузом) должно приводить к определенным комплексам, и следует убедиться, что соединение (груз) в данных комплексах сохраняет его активность. Для получения комплексов гаптенилированных соединений с соответствущим антителом против гаптена гаптенилированное соединение растворяли в H2O до конечной концентрации 1 мг/мл. Антитело концентрировали до конечной концентрации 1 мг/мл (4,85 мкМ) в 20 мМ гистидиновом буфере, 140 мМ NaCl, рН 6,0. Гаптенилированный груз и антитело смешивали в молярном отношении 2:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 15 минут при RT (комнатная температура).
В качестве альтернативы, гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антитело концентрировали до конечной концентрации 10 мг/мл в 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Гаптенилированное соединение и антитело смешивали в моляном отношении 2,5:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 60 минут при RT и 350 об./мин.
Типичный способ образования комплексов гаптенилированных флуоресцентных красителей и антител против гаптена - нековалентный комплекс дигоксигенин-Cy5
В качестве компонентов - антител использовали гуманизированное и мышиное антитело против дигоксигенина или биспецифичные производные антитела против дигоксигенина. Для получения комплексов дигоксигенилированного Cy5 с антителами против дигоксигенина конъюгат Cy5-дигоксигенин растворяли в PBS до конечной концентрации 0,5 мг/мл. Антитело использовали в концентрации 1 мг/мл (примерно 5 мкМ) в буфере, состоящем из 20 мМ гистидина и 140 мМ NaCl, рН 6. Дигоксигенилированный Cy5 и антитело смешивали в молярном отношении 2:1 (дигоксигенилированный Cy5 к антителу). Данная процедура приводила к гомогенному препарату комплексов определенного состава.
Реакцию комплексообразования можно отслеживать посредством определения флуоресценции (650/667 нм) флуорофора, ассоциированного с антителом, на гель-фильтрационной колонке. Результаты данных экспериментов демонстрируют то, что комплексообразование происходит только если антитело содержит функционалы связывания с дигоксигенином. Антитела без функционалов связывания с дигоксигенином не связываются с конъюгатом дигоксигенин-Cy5. Усиленный сигнал можно наблюдать для двухвалентных антител против дигоксигенина до отношения конъюгата дигоксигенин-Cy5 к антителу 2:1. Затем флуоресцентные сигналы, зависимые от состава, достигают плато.
Типичный способ образования комплексов гаптенилированных флуоресцентных красителей и антител против гаптена - комплекс биотин-Cy5 / химерное антитело против биотина (человеческого подкласса IgG)
Для получения комплексов Cy5, дериватизированного биотином (биотин-Cys-Cy5), содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10,1 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали посредством SDS-PAGE, как описано в Примере За. Выявление флуоресценции проводили, как описано в Примере 3а.
Типичный способ образования конъюгатов биотинилированных флуоресцентных красителей и антител против биотина - биотин-Ser-Cy5 / гуманизированное антитело против биотина:
Для получения комплексов Cy5, дериватизированного биотином (биотин-Ser-Cy5), содержащих остаток серина в линкере, 0,61 мг биотин-Ser-Cy5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, до концентрации 10 мг/мл. 18,5 мг гуманизированного антитела против биотина использовали в концентрации 10 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Ser-Cy5 и антитело смешивали в молярном отношении 2,5:1 (биотин-Ser-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образец затем подвергали гель-фильтрации с использованием колонки препаративного класса для высокой загрузки Superdex 200 16/60 (GE Healthcare) со скоростью тока 1,5 мл/мин и 20 мМ гистидином, 140 мМ NaCl, рН 6,0, в качестве подвижной фазы. Фракции пика отбирали и анализировали SDS-PAGE на чистоту. Отношение красителя к антителу рассчитывали посредством (1) измерения поглощения образцов при длине волны 280 нм (белок) и 650 нм (Cy5); (2) с использованием формулы: А650 меченного белка/ε(Cy5)*концентрацию белка (М) = моли красителя на моль белка, где ε(Cy5) равно 25000 М-1 см-1, А650 комплекса равно 47,0, и концентрация белка составляет 86,67 мкМ. Полученное в результате отношение красителя к молекуле антитела составляло 2,17, что указывает на то, что все паратопы антитела насыщаются молекулами биотин-Cy5.
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс дигоксигенин-PYY(3-36) / антитело против дигоксигенина
Для получения нековалентных комплексов дигоксигенилированных полипептидов с антителом против дигоксигенина антитело, полученное из мышиной гибридомы (лиофилизат из 10 мМ KPO4, 70 мМ NaCl; рН 7,5), растворяли в 12 мл воды и диализировали против раствора, содержащего 20 мМ гистидин, 140 мМ NaCl, рН 6,0, с получением 300 мг (2×10-6 моль) в 11 мл буфера (концентрация составляет 27,3 мг/мл). Конъюгат дигоксигенин-PYY(3-36) (11,57 мг, 4×10-6 моль, 2 экв.) добавляли 4 порциями по 2,85 мг в пределах 1 ч и инкубировали в течение еще одного часа при комнатной температуре. После завершения реакции комплексообразования комплексы очищали гель-фильтрацией посредством колонки Superdex 200 26/60 GL (320 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, при скорости тока 2,5 мл/мин. Элюированный комплекс собирали в 4 мл фракциях, объединяли и стерилизовали через 0,2 мкм фильтр с получением 234 мг комплекса в концентрации 14,3 мг/мл. Аналогичным образом для получения комплексов гуманизированного антитела против дигоксигенина антитело доводили до концентрации 10,6 мг/мл (9,81 мг, 6,5×10-8 моль в 0,93 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. 0,57 мг, составляющих 1,97×10-7, составляющих 3,03 экв. дигоксигенилированного полипептида (DIG-PYY), добавляли в раствор антитела в виде лиофилизата. Полипептид и антитело инкубировали в течение 1,5 ч при комнатной температуре. Избыток полипептида удаляли гель-фильтрацией посредством колонки Superose 6 10/300 GL в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, при скорости тока 0,5 мл/мин. Элюированный комплекс собирали в 0,5 мл фракциях, объединяли и стерилизовали через 0,2 мкм фильтр с получением 4,7 мг комплекса в концентрации 1,86 мг/мл.
Образующийся комплекс гаптенилированный полипептид-антитело против гаптена определяли в качестве мономерной IgG-подобной молекулы через появление одиночного пика в гель-фильтрации. Образующийся комплекс определяли как мономерную IgG-подобную молекулу, несущую два дигоксигенин-PYY производных на молекулу антитела. Определенный состав данных пептидных комплексов был подтвержден гель-фильтрацией, которая также показала отсутствие агрегатов белка. Определенный состав (и отношение полипептида к белку 2:1) данных биспецифичных пептидных комплексов был дополнительно подтвержден SEC-MALLS (гель-фильтрация с детектированием рассеивания лазерного излучения с кратными углами). Для анализа SEC-MALLS 100-500 мкг соответствующего образца наносили на гель-фильтрационную колонку Superdex 200 10/300 GL со скоростью тока 0,25-0,5 мл/мин с 1×PBS, рН 7,4, в качестве подвижной фазы. Рассеяние света выявляли с использованием детектора Wyatt MiniDawn TREOS/QELS, индекс преломления измеряли с использованием детектора Wyatt Optilab rEX. Полученные данные анализировали с использованием программы ASTRA (версия 5.3.4.14). Результаты анализов SEC-MALLS дают информацию о массе, радиусе и размере комплекса. Эти данные затем сравнивали с данными для соответствующего некомплексированного антитела. Результаты данных экспериментов демонстрируют то, что экспонирование дигоксигенилированного-PYY с антителом против дигоксигенина приводит к образованию комплексов, которые содержат два производных дигоксигенин-PYY на одну молекулу антитела. Таким образом, дигоксигенилированный PYY может образовать комплекс с антителом против дигоксигенина в определенных сайтах (область связывания) и с определенной стехиометрией.
Характеризация данного комплекса посредством исследований поверхностного плазмонного резонанса дала дополнительное доказательство того, что реакция комплексообразования генерировала определенные и полностью комплектованные молекулы. Антитело против дигоксигенина может связываться с чипом SPR, что приводит к усилениям сигнала. Последующее добавление конъюгата дигоксигенин-PYY приводит к дополнительным усилениям сигнала, пока все сайты связывания не оказываются полностью занятыми. При данных условиях добавление дополнительного дигоксигенин-PYY не усиливает дополнительно сигнал. Это указывает на то, что реакция комплексообразования является специфичной, и что сигналы не вызваны неспецифичным прилипанием дигоксигенилированного полипептида.
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY-PEG3-Cys-β-Ala-Biot / химерное антитело против биотина
Для получения нековалентных комплексов биотинилированный-PYY-полипептид, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY-PEG3-Cys-β-Ala-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-β-Ala-Biot и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY-PEG3-Cys-β-Ala-Biot к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Образующийся комплекс определяли как мономерную IgG-подобную молекулу посредством появления одного пика в гель-фильтрации (95% мономера). Образующийся комплекс дополнительно анализировали SDS-PAGE и последующим анализом вестерн-блоттингом. 10 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 35 мин при 200 В и 120 мА. Молекулы, которые были разделены на полиакриламидном геле, переносили на PVDF мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25В и 160 мА. Мембрану блокировали в 1% (масс/об.) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при RT. Мембрану промывали 3× в течение 5 мин в 1× PBST и затем инкубировали с конъюгатом стрептавидин-POD (пероксидаза) (2900 U/мл, Roche), который использовали в разведении 1:2000. Выявление стрептавидин-POD, связавшегося с биотином на мембране, проводили с использованием субстрата для вестерн-блоттинга Lumi-Light (Roche).
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY-PEG3-Cys-PEG2-Biot / химерное антитело против биотина
Для получения нековалентных комплексов биотинилированный-PYY-полипептид, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY-PEG3-Cys-PEG2-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-PEG2-Biot и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY-PEG3-Cys-PEG2-Biot к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Полученный в результате комплекс определяли посредством гель-фильтрации как 63% мономерной IgG-подобной молекулы и 37% димерных растворимых агрегетов. Полученный в результате комплекс дополнительно анализировали SDS-PAGE и последующим анализом вестерн-блоттингом. 10 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 35 мин при 200 В и 120 мА. Молекулы, которые были разделены на полиакриламидном геле, переносили на PVDF мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25В и 160 мА. Мембрану блокировали в 1% (масс/об.) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при RT. Мембрану промывали 3× в течение 5 мин в 1× PBST и затем инкубировали с конъюгатом стрептавидин-POD (2900 U/мл, Roche), который использовали в разведении 1:2000. Выявление стрептавидин-POD, связавшегося с биотином на мембране, проводили с использованием субстрата для вестерн-блоттинга Lumi-Light (Roche).
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY(PEG3-Cys-PEG2-5-Fluo) / химерное антитело против Флуоресцеина
Для получения нековалентных комплексов флуоресцеина, конъюгированного с полипептидом PYY, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-5-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 9,99 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-5-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-5-Fluo) к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Полученный в результате комплекс определяли посредством гель-фильтрации как 76% мономерной IgG-подобной молекулы и 24% димерных растворимых агрегетов. Полученный в результате комплекс дополнительно анализировали SDS-PAGE и последующим выявлением флуоресценции, связанной с флуоресцеином, в полиакриламидном геле. 8 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Флуоресценцию, связанную с флуоресцеином, записывали с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм.
Пример 3
Получение определенных ковалентных конъюгатов гаптенилированных красителей или полипептидов с антителом против гаптена VH52bC/VH53C в присутствии окислительно-восстановительных агентов
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Ahx-Cy5/антитело против дигоксигенина VH52bC
Получение ковалентных конъюгатов антител против гаптена и гаптенилированных флуоресцентных красителей, содержащих цистеиновый линкер, приводит к определенным конъюгатам, где дисульфидный мостик образуется в специфическом положении между VH52bC в CDR2 антитела против гаптена и цистеином в линкере между гаптеном и флуоресцентным красителем. Реакцию конъюгирования проводили в присутствии окислительно-восстановительных реактивов. Dig-Cys-Ahx-Cy5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. Солюбилизацию облегчали посредством добавления по каплям 10% (об./об.) уксусной кислоты. Конечную концентрацию доводили до 0,4 мг/мл. Антитело против дигоксигенина VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, доводили до концентрации 10 мг/мл. Антитело против дигоксигенина использовали в качестве контроля и обрабатывали тем же самым способом, что и антитело против дигоксигенина VH52bC. 4,7 нмоль каждого антитела смешивали с 2,5 молярными эквивалентами Dig-Cys-Ahx-Cy5. Это достигалось добавлением 11,7 нмоль данного вещества 4 порциями (по 2,9 нмоль каждая) каждые 15 мин. Между этими добавлениями образцы инкубировали при 25°С при аккуратном встряхивании. После добавления последней порции 0,64 нмоль каждого комплекса антитело-Dig-Cys-Ahx-Cy5 переносили в буфер, содержащий следующие окислительно-восстановительные реактивы: 3 мМ DTE (дитиотрейтол) плюс 10 мМ GSSG (окисленный глутатион), 3 мМ DTE плюс 1 мМ GSSG и 0,03 мМ DTE плюс 0,1 мМ GSSG. Все образцы инкубировали в данных условиях в течение 15 мин. После инкубации образцы делили пополам (по 0,34 нмоль каждый) и готовили для гель-электрофореза с SDS. Для этого добавляли 4× буфер для образца LDS (Invitrogen). Для каждого образца также получали восстановленную версию посредством добавления 10× восстановителя для образца NuPAGE (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин перед электрофорезом на 4-12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Флуоресценцию в геле, связанную с Cy5, выявляли с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После выявления флуоресценции гель окрашивали SimplyBlue SafeStain (Invitrogen). Гели показаны на Фиг. 3.
Сайт-специфичное образование дисульфидной связи было показано для антитела против дигоксигенина VH52bC (Фиг. 8, гели сверху, полосы 1 А-В) с низким сигналом фоновой флуоресценции при использовании антитела против дигоксигенина без цистеина в CDR2 (полосы 2 А-В). Фоновые сигналы в контрольных реакциях можно объяснить связыванием Dig-Cys-Ahx-Cy5 с цистеинами, которые обычно участвуют в образовании межцепочечных дисульфидных связей антитела. Возрастающие количества окислительно-восстановительных реактивов значительно уменьшают число дисульфидных мостиков, которые соединяют тяжелые и легкие цепи антитела, продуцируя, главным образом, ¾ антитела (минус 1× LC), димеры НС (минус 2× LC) и ½ антитела (1× НС плюс 1× LC). В нижней части геля можно выявить флуоресценцию Dig-Cys-Ahx-Cy5, который не был ковалентно связан с антителом. Гели внизу Фиг. 8 показывают то, что при восстановлении образцов связанная с Cy5 флуоресценция не выявляется около тяжелой и легкой цепей антитела, указывая на то, что ковалентная связь, в самом деле, образовалась посредством дисульфидного мостика. Окрашивания каждого геля кумасси показывают то, что общее количество белка в каждой полосе было равным.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Cy5/антитело против дигоксигенина VH52bC
Dig-Cys-Cy5 растворяли в 8,3 мМ HCl, 10% (об./об.) DMF до конечной концентрации 3,25 мг/мл. Антитело против дигоксигенина VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, доводили до концентрации 15 мг/мл. Антитело против дигоксигенина использовали в качестве контроля и обрабатывали таким же способом, что и антитело против дигоксигенина VH52bC. 13,3 нмоль каждого антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5 в конечной концентрации антитела 10 мг/мл в присутствии 1 мМ GSH (восстановленный глутатион) и 5 мМ GSSG (окисленный глутатион). Это достигалось добавлением 26,6 нмоль данного вещества 2 порциями каждые 5 мин. Между этими добавлениями образцы инкубировали при RT при аккуратном перемешивании. После добавления последней порции образцы инкубировали в течение 1 ч при RT. Эффективность реакции связывания оценивали посредством SDS-PAGE и последующей записи флуоресцентного сигнала, связанного с Cy5. 5, 10 и 20 мкг каждого образца готовили для SDS-PAGE. Для этого добавляли 4× буфер для образца LDS (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин перед электрофорезом на 4-12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Флуоресценцию в геле, связанную с Cy5, выявляли с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После выявления флуоресценции гель окрашивали SimplyBlue SafeStain (Invitrogen).
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - PEG3-PYY(PEG3-Cys-4Abu-Dig) / гуманизированное антитело против дигоксигенина VH52bC
Для получения конъюгатов дериватизированного дигоксигенином полипептида PYY, содержащих цистеинилированный линкер, 1,4 мг PEG3-PYY(PEG3-Cys-4Abu-Dig) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10 мг/мл (примерно 68 мкМ) в буфере, состоящем из 5 мМ Tris-HCl, 1 мМ EDTA, 1 мМ GSH, 5 мМ GSSG, рН 8,2. PEG3-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном отношении 2:1 (PEG3-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 мин при RT, перемешивали при 100 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 43% выявленного соединения идентифицировали как антитело, связанное с 2 молекулами полипептида, 46% представляло собой антитело, связанное с 1 полипептидной молекулой, и 11% было идентифицировано как несвязанное антитело.
Пример 4
Получение определенных ковалентных конъюгатов гаптенилированных красителей и полипептидов с антителом против гаптена VH52bC/VH53C в отсутствие окислительно-восстановительных агентов
Для получения связанных дисульфидом ковалентных конъюгатов антитело против гаптена/гаптенилированный полипептид или гаптенилированный краситель необходимо (i) связать гаптен (например, дигоксигенин, флуоресцеин, биотин или теофиллин) через подходящие линкеры, содержащие реакционноспособную группу (такую как, например цистеин, малеимид), с полипептидом или красителем, которые позволяют экспонировать полипептид над поверхностью антитела и, следовательно, сохранять его активность, и (ii) создать ковалентные сайт-специфичные конъюгаты гаптенилированных полипептидов с антителом против гаптена с цистеиновой мутацией (антитело VH52bC/VH53C), в которых сохраняется биологическая активность полипептида, и (iii) провести реакцию в отсутствие восстановителя для того, чтобы избежать восстановления межцепочечных дисульфидных мостиков антитела.
Общий способ:
Получение конъюгатов антител против гаптена с гаптенилированными соединениями должно приводить к конъюгатам с определенной стехиометрией, и следует убедиться, что соединение в данных коньюгатах сохраняет его активность. Для получения конъюгатов гаптенилированных соединений с соответствущим антителом против гаптена гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антитело против гаптена VH52bC/VH53C доводили до концентрации 10 мг/мл в 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Гаптенилированное соединение и антитело против гаптена VH52bC/VH53C смешивали в молярном отношении 2,5:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 60 минут при RT и 350 об./мин.
Полипептид, конъюгированный с гаптеном через линкер, содержащий цистеин, далее называется гаптен-Cys-полипептид или полипептид-Cys-гаптен. Данный полипептид может иметь либо свободный N-конец, либо кэппированный N-конец, например, с ацетильной группой (Ас-полипептид-Cys-гаптен) или с остатком ПЭГ (ПЭГ-полипептид-Cys-гаптен).
Флуоресцентный краситель, конъюгированный с гаптеном через линкер, содержащий цистеин, далее называется краситель-Cys-гаптен или гаптен-Cys-краситель.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Ahs-Cy5/антитело против дигоксигенина VH52bC
Образцы готовили точно так же, как описано в Примере 3а, с тем различием, что комплексы антитело-Dig-Cys-Ahs-Cy5 переносили в буфер, либо не содержащий окислительно-восстановительных соединений, либо содержащий 0,1 мМ GSSG (окисленный глутатион) или 1 мМ GSSG. Полученные в результате сканированные на флуоресценцию и окрашенные кумасси полиакриламидные гели показаны на Фиг. 4. При всех трех условиях продемонстрирована аналогичная специфичность в отношении сайтспецифичного образования дисульфидных связей (Фиг. 4, верхние гели, полосы 1 А-В) с низким уровнем фоновых реакций (Фиг. 4, полосы 2 А-В). Это подтверждает то, что образование дисульфидной связи может осуществляться без необходимости в восстановителях. Это значительно стабилизирует антитело/уменьшает разрушение антитела, так как по сравнению с Примером 3 выявляются только остаточные количества ¾ антител (минус 1× LC), димеров НС (минус 2× LC) и ½ антител (1× НС плюс 1× LC).
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Cy5/антитело против дигоксигенина VH52bC
Образцы готовили точно так же, как описано в Примере 3b, с тем различием, что 13,3 нмоль антитела смешивали с 2 молярными эквивалентами Pig-Cys-Cy5 при конечной концентрации антитела 10 мг/мл в отсутствие окислительно-восстановительных реактивов.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - биотин-Cys-Cy5/ химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против биотина VH53C использовали в концентрации 9,7 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Полученный в результате конъюгат анализировали посредством SDS-PAGE, как описано в Примере 3а. Выявление флуоресценции проводили, как описано в Примере 3а.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - биотин-Cys-Cy5/ гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг гуманизированного антитела против биотина VH53C использовали в концентрации 7,4 мг/мл (примерно 51 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Полученный в результате конъюгат анализировали SDS-PAGE, как описано в Примере 3а. Выявление флуоресценции проводили, как описано в Примере 3а.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-4Abu-Diq)/ гуманизированное антитело против дигоксигенина YH52bC
Для получения конъюгатов дериватизированного дигоксигенином полипептида PYY, содержащих цистеинилированный линкер, 2,4 мг Ac-PYY(PEG3-Cys-4Abu-Dig) растворяли в 20% ацетате до концентрации 5 мг/мл. 10 мг гуманизированного антитела против дигоксигенина VH52bC (68,4 нмоль) использовали в концентрации 19,5 мг/мл (примерно 133 мкМ) в буфере, состоящем из 20 мМ гистидина, 140 мМ NaCl, рН 6,0. Ac-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном отношении 2:1 (Ac-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 мин при RT, перемешивая при 100 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 7,4% выявленного соединения было идентифицировано как антитело, связанное с 2 пептидными молекулами, 40% представляло собой антитело, связанное с 1 пептидной молекулой, и 52% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-βAIa-Biot)/химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антитела против биотина VH53C использовали в концентрации 9,7 мг/мл (примерно 67 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-βAla-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-βAla-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 87,7% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида, 12,3% было идентифицировано как антитело, связанное с 1 молекулой пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Biot)/химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антитела против биотина VH53C использовали в концентрации 9,9 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 100% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-βAla-Biot)/гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,06 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антитела против биотина VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-βAla-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-βAla-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 62,2% выявленного соединения было идентифицировано как антитело, связанное с 2 пептидными молекулами, 33,9% было идентифицировано как антитело, связанное с 1 пептидной молекулой, и 3,9% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Biot)/гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,08 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антитела против биотина VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 71,4% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида, 26% было идентифицировано как антитело, связанное с 1 молекулой пептида, и 2,5% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ас-PYY(PEG3-Cy5-PEG2-Fluo)/антитело против флуоресцеина YH52bC
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против флуоресцеина VH52bC использовали в концентрации 9,3 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Fluo) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 95% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида, 5% было идентифицировано как антитело, связанное с 1 молекулой пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Fluo)/антитело против флуоресцеина VH28C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против флуоресцеина VH28C использовали в концентрации 9,5 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Fluo) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 100% выявленного соединения было идентифицировано как антитело, связанное с двумя молекулами пептида.
Пример 5
Получение ковалентных комплексов теофиллин-антитело против теофиллина
Для оценки образования ковалентных комплексов антитела, в которых используется теофиллин и антитела, связывающиеся с теофилином, в качестве системы распознавания гаптена, получали теофиллин-Cys-Cy5 в качестве флуоресцентного груза, в общем, применяя методики синтеза и очистки, которые были описаны для дигоксигенин-Cys-Cy5 или биотин-Cys-Cy5, за исключением того, что гаптен был заменен, по сравнению с теофиллином. Для демонстрации образования ковалентного дисульфида, получали антитела, связывающиеся с теофиллином, которые содержали сконструированный Cys в положении 54 или 55 вариабельной области тяжелой цепи (антитело против теофиллина-Cys). Данные производные антител комплексировали с теофиллин-Cys-Cy5 и затем подвергали SDS-PAGE при невосстанавливающих и восстанавливающих условиях, как описано в Примере 4. При невосстанавливающих условиях связанное с дисульфидом антитело против теофиллина, комплексированное с Cy5, выявляли в геле по его флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в Примере 4. Ковалентные комплексы формировались как следствие простой реакции загрузки, таким же образом, как и дисульфиды, конорые наблюдали при использовании дигоксигенина, флуоресцеина или биотина в качестве гаптена. Данные комплексы диссоциировали, как и ожидалось, при восстановлении, т.е высвобождали груз из Н-цепи только при восстановлении дисульфида.
Пример 6
Получение ковалентных комплексов гаптен-антитело при условиях, подобных условиям in vivo, и доказательство направленного образования дисульфида in vivo
Для оценки образования ковалентных комплексов гаптен-антитело при условиях, подобных условиям in vivo, антитела против биотина-Cys инкубировали при 37°С в мышиной сыворотке с биотин-Cys-Cy5 в течение 60 мин. Затем захватывали антитело из мышиной сыворотки посредством белка А. Затем захваченные антитела подвергали SDS-PAGE при невосстанавливающих и восстанавливающих условиях, как описано в Примере 4. Связанное с дисульфидом антитело, комплексированное с Cy5, выявляли в геле по его флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в Примере 4. Фиг. 10 демонстрирует то, что в сыворотке при 37°С образуются ковалентные комплексы между антителом, т.е. при условиях, которые имеют сходство с условиями in vivo. Данные комплексы диссоциируют, как и ожидалось, при восстановлении, т.е. груз высвобождается от Н-цепи только при восстановлении дисульфида (Фиг. 10). Наблюдение того, что при позиционировании гаптена даже в присутствии сыворотки может образоваться направленная дисульфидная связь между антителом и грузом является неожиданным, так как сыворотка содержит большое количество белков, пептидов и других соединений (которые могут препятствовать реакциям образования дисульфида). Наблюдение того, что при позиционировании гаптена может образоваться направленная дисульфидная связь между антителом и грузом в сыворотке при 37°С также открывает возможность применения данной системы модуляции PK в преднацеливающей ситуации: раздельное применение антитела и гаптен-груза, с последующей сборкой комплексов антитела и последующим образованием дисульфида in vivo.
Для дальнейшей оценки потенциала применений «преднацеливания» in vivo определяли фармакокинетику биотин-Cy5 при условиях преднацеливания посредством неинвазивной оптической методики визуализации глаза животных, как описано в Примере 10. В данных экспериментах присутствие Cy5 определяли неинвазивно посредством оптической визуализации глаза животных, что выявляло флуоресценцию Cy5 в капиллярах. Значения опосредованной Cy5 флуоресценции, которая была выявлена в глазе мышей через 10 мин после инъекции биотин-Cy5, были приняты за значение 100%, и значения флуоресценции, измеренные в последующие моменты времени, были выражены относительно них. В данном эксперименте 1 мг антитела (либо антитела против биотина, либо антитела против биотина-Cys (Cys мутант антитела против биотина)) применяли за 24 часа до инъекции биотин-Cy5 и начала визуализации глаза. Контрольной группе не давали предварительную инъекцию антитела против биотина.
Результаты данных экспериментов показаны на Фиг. 11: инъекция биотин-Cy5 животным, которые не получали предварительно инъецированного антитела, устранялась с низким периодом полувыведения в сыворотке и низкими уровнями воздействия (ромбы). Сывороточные уровни и период полувыведения биотин-Cy5, который инъецировали животным с 24-часовой предварительной инъекцией антитела против биотина (без мутации Cys), были значительно увеличены. Это показывает то, что антитело захватывает его антиген (без груза) в системе кровообращения и продлевает период полувыведения антигена (и, подобным образом, конъюгированного груза) в сыворотке. Относительный уровень и период полувыведения в сыворотке биотин-Cys-Cy5, который инъецировали животным, которым за 24 часа была сделана предварительная инъекция антитела против биотина-Cys (т.е. антитела, содержащего мутацию Cys, как описано в данном документе, для ковалентного связывания груза), были еще больше увеличены. В данных примерах относительные уровни Cy5 были не только выше, чем уровни некомплексированного соединения, но также выше, чем уровни комплексированного (но не связанного дисульфидной связью) Cy5. Таким образом, комплектованные с гаптеном, связанные дисульфидом грузы (которые образуются при условиях преднацеливания in vivo) являются более стабильными в системе кровообращения и могут достигать более высоких уровней воздействия, чем нековалентно комплексированные грузы.
Пример 7
Полипептиды в конъюгатах и в комплексах с антителом против гаптена сохраняют функциональность
Авторы изобретения ранее показали, что полипептиды, которые являются частью нековалентных конъюгатов гаптен-полипептид и находятся в комплексах с антителами против гаптена, сохраняют функциональность (WO 2011/003557, WO 2011/003780 и РСТ/ЕР 2011/074273). Для демонстрации того, что связанные пептиды сохраняют функциональность также при ковалентном связывании дисульфидом, сравнивали биологическую активность полипептидов, комплексированных антителом против дигоксигенина, и их конъюгатов с антителом против дигоксигенина VH52bC, связанных дисульфидом.
Желательной с терапевтической точки зрения функциональностью пептидов, происходящих из PYY, является связывание с и препятствование сигнализации его когнатного рецептора NPY2. Сигнализация через рецептор NPY2 участвует в и/или регулирует метаболические процессы.
Для оценки того, влияет ли комплексообразование или SS-конъюгирование полипептида Dig-PYY с антителом против дигоксигенина или конъюгирование полипептида Dig-Cys-PYY с антителом против дигоксигенина VH52bC соответственно на его активность, авторы изобретения оценили его способность к ингибированию накопления цАМФ, стимулированного форсколином, в клетках HEK293, экспрессирующих рецептор NPY2 (анализ цАМФ).
В следующей Таблице 2 показаны результаты анализов цАМФ, которые проводили для оценки биологической активности PYY(3-36), его модифицированного аналога moPYY, специфичного в отношении рецептора Y2, его комплексированного с антителом Dig-варианта и его конъюгированного посредством дисульфида Dig-Cys-производного.
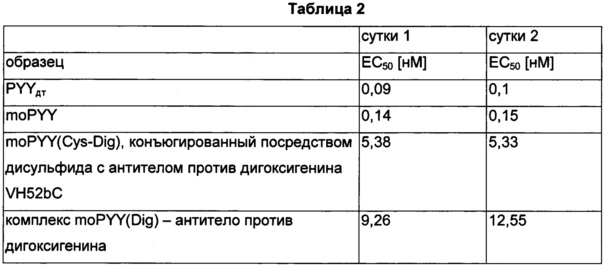
Для агонистического анализа цАМФ использовали следующие материалы: 384-луночный планшет; набор Tropix cAMP-Screen; систему ELISA для цАМФ (Applied Biosystems, кат. №Т1505; CS 20000); форсколин (кат. №344270 от Calbiochem); клетки: HEK293/hNPY2R; ростовая среда: среда Игла, модифицированная по Дульбекко (D-MEM, Gibco); 10% фетальная телячья сыворотка (FBS, Gibco), инактивированная нагреванием; 1% пенициллин/стрептомицин (Pen 10000 единиц/мл; Strep 10000 мг/мл, Gibco); 500 мкг/мл G418 (генетицин, кат. №11811-031 от Gibco) и среда для посева: DMEM/F12 без фенолового красного (Gibco); 10% FBS (Gibco, кат. №10082-147), инактивированная нагреванием; 1% пенициллин/стрептомицин (Gibco, кат. №15140-122); 500 мкг/мл G418 (генетицин, Gibco, кат. №11811-031).
Для проведения анализа в первые сутки среду отбрасывали, и монослой клеток промывали 10 мл PBS на колбу (Т225). После декантации с PBS использовали 5 мл VERSENE (Gibco, кат. №1504006) для перемещения клеток (5 мин при 37°С). Содержимое колбы аккуратно откачивали, и объединяли суспензию клеток. Каждую колбу промывали 10 мл среды для посева и центрифугировали при 1000 об./мин в течение 5 мин. Суспензию объединяли и осуществляли подсчет клеток. Суспендию ресуспендировали в среде для посева при плотности 2,0×105 клеток/мл для HEK293/hNPY2R. 50 микролитров клеток (HEK293/hNPY2R - 10000 клеток/лунку) переносили в 384-луночный планшет с использованием дозатора Multi-drop. Планшеты инкубировали при 37°С в течение ночи. На вторые сутки клетки проверяли на 75-85%-ную конфлюентность. Давали средам и реактивам достигнуть комнатной температуры. Перед приготовлением разведений давали маточному раствору стимулирующего соединения в диметилсульфоксиде (DMSO, Sigma, кат. №D2650) нагреться до 32°С в течение 5-10 мин. Разведения готовили в DMEM/F12 с 0,5 мМ 3-изобутил-1-метилксантином (IBMX, Calbiochem, кат. №410957) и 0,5 мг/мл BSA. Конечная концентрация DMSO в стимулирующей среде составляла 1,1% с концентрацией форсколина - 5 мкМ. Клеточную среду сливали аккуратным переворачиванием чашки с клетками на бумажное полотенце. Помещали 50 мкл стимулирующей среды на лунку (каждую концентрацию готовили в четырех повторностях). Планшеты инкубировали при комнатной температуре в течение 30 мин, и клетки проверяли под микроскопом на токсичность. После 30 мин обработки стимулирующие среды отбрасывали, и добавляли 50 мкл/лунку лизисного буфера для анализа (предоставленного в наборе Tropix). Планшеты инкубировали при 37°С в течение 45 мин. 20 мкл лизата переносили из стимулирующих планшетов в планшеты, предварительно покрытые антителом (384-луночные), из набора Tropix. Добавляли 10 мкл конъюгата АР и 20 мкл антитела против цАМФ. Планшеты инкубировали при комнатной температуре со встряхиванием в течение 1 часа. Затем планшеты 5 раз промывали промывочным буфером, по 70 мкл на лунку для каждой промывки. Осуществляли отсасывание из планшетов досуха. Добавляли 30 мкл/лунку раствора субстрата/усилителя CSPD/Sapphire-II RTU и инкубировали в течение 45 мин при RT (встряхивание). Измеряли сигнал в течение 1 с/лунку на люминометре (VICTOR-V).
Результаты данных анализов (Таблица 2) демонстрируют то, что модифицированное производное пептида moPYY имеет пренебрежимо меньшую активность, чем PYY дикого типа. Значение IC50 анализа на цАМФ составляло 0,09 нМ для PYY дикого типа и 0,14 нМ для модифицированного аналога. Ковалентное конъюгирование посредством дисульфида приводило к небольшому уменьшению биологической активности. Значение IC50 составляло 5-36 нМ для конъюгата. Неожиданно ковалентный дисульфидный конъюгат является в 2 раза более активным, чем нековалентный комплекс со значением IC50 10,91 нМ.
Пример 8
Стабильность в сыворотке комплексов биотинилированного Cy5 с гуманизированным антителом против биотина по сравнению с ковалентными конъюгатами биотинилированного Cy5 с гуманизированным антителом против биотина VH53C
Целью описанной технологии модификации пептида является улучшение терапевтической применимости пептидов. Главными препятствиями для терапевтического применения пептидов в настоящее время являются ограниченная стабильность in vivo и/или короткий период полувыведения в сыворотке и быстрый клиренс. PK параметры конъюгатов флуорофоров с антителом определяли in vivo и сравнивали с PK нековалентных комплексов антитело-флуорофор. В связи с этим, (i) антитело против биотина VH53C ковалентно конъюгировали с биотинилированным флуорофором Biot-Cys-Cy5, (ii) получали нековалентный комплекс антитела против биотина с биотинилированным флуорофором Biot-Cy5, (iii) вводили животным ковалентно конъюгированные и образующие нековалентный комплекс соединения, и (iv) у данных животных измеряли сывороточные концентрации соединений с течением времени посредством определения флуоресценции Cy5 (А650) и флуоресценции соответствующего антитела способом ELISA, в котором специфично выявляется гуманизированное антитело.
Экспериментальная методика
Для анализа влияния на PK параметры образования комплекса маленького флуоресцентного субстрата с антителом вводили 13 нмоль конъюгата Cy5-биотин/гуманизированное антитело против биотина VH53C или соединения, образующего нековалентный комплекс с соответствующим антителом, или одно флуоресцентное соединение в 20 мМ гистидине / 140 мМ NaCl, рН 6,0, шести самкам мышей (линия NRMI) для каждого вещества. Отбирали примерно 0,1 мл образцы крови в следующие моменты времени: 0,08 ч, 4 ч и 48 ч для мыши 1, 2 и 3 в первой группе, и 0,08 ч, 24 ч и 72 ч для мыши 1, 2 и 3 во второй группе. Образцы сыворотки - по меньшей мере 50 мкл получали через 1 ч при RT посредством центрифугирования (9300 g, 3 мин, 4°С). Образцы сыворотки хранили при -80°С.
Для определения количества соединения в сыворотке в данные моменты времени использовали флуоресцентные свойства Cy5: связанную с Cy5 флуоресценцию в образцах сыворотки измеряли в 120 мкл кварцевых кюветах при комнатной температуре с использованием флуоресцентного спектрофотометра Сагу Eclipse (Varian). Длина волны возбуждения составляла 640 нм, испускание измеряли при 667 нм. Образцы сыворотки разводили в 1× PBS до достижения подходящего диапазона интенсивности испускания. Сыворотку крови необработанной мыши в том же самом разведении в 1× PBS, что и в соответствующем образце, использовали в качестве пустой пробы, и она не демонстрировала какого-либо флуоресцентного сигнала.
На Фиг. 5 показаны результаты анализа с использованием ковалентных конъюгатов, нековалентных комплексов и некомплексированного гаптен-Cy5. Данные показаны как относительные (%) уровни флуоресценции, опосредованной Cy5, нормированные к (пиковым) сывороточным уровням через 5 мин после инъекции. Для соединения со скорее меньшей молекулярной массой некомплексированный биотин-Ser-Cy5 быстро исчезает из сыворотки. Через один час после инъекции только 6% флуоресценции, которая вводилась и выявлялась в сыворотке через 5 минут, все еще поддавалась выявлению. В более поздние моменты времени - 2 ч, 4 ч и 24 ч после инъекции сигналы, опосредованные Cy5, не выявлялись.
Из соединения, комплексированного антителом, через четыре часа после инъекции все еще приблизительно 50% флуоресценции, которая вводилась (уровни в 5 мин приняты за 100%), поддавалось выявлению в сыворотке. Уровни флуоресценции, опосредованной Cy5, также выявлялись в более поздние моменты времени, причем приблизительно 22% от значений в 5 мин выявлялось в 2 ч, и приблизительно 12% выявлялось через 48 ч после инъекции, и 8% все еще поддавалось выявлению через 72 ч. Конъюгированное с антителом соединение демонстрирует значительно более длительный период полувыведения in vivo, чем соединение, комплексированное антителом. Через четыре часа после инъекции 58% флуоресценции, которая вводилась (уровни в 5 мин приняты за 100%) все еще выявлялось в сыворотке (в 1,16 раза больше, чем для соединения, комплексированного антителом). Через 24 ч 35% (в 1,6 раза больше), через 48 ч 31% (в 2,6 раза больше) и через 72 ч 26% (в 3,3 раза больше) флуоресценции, опосредованной Cy5, выявлялось в сыворотке. Сопоставимое уменьшение флуоресценции для комплектованных и конъюгированных соединений в первые 24 ч экспериментов может быть объяснено ранним распределением, которое является аналогичным для комплексов и конъюгатов. Через 24 ч стабильность соединений, конъюгированных с антителом, in vivo отвечает за различие.
Для определения количества человеческого антитела IgG в сыворотке в данные моменты времени использовали следующий принцип анализа: человеческие антитела IgG1 в образцах сыворотки захватывали на твердой фазе (планшет для микротитрования Maxisorb®, NUNC-lmmuno™), покрытой моноклональным антителом IgG против человеческой цепи каппа. Образцы сыворотки разводили 1:105 и 1:106, и 100 мкл данных разведений добавляли в лунки. После инкубации каждую лунку 3 раза промывали 300 мкл PBS/0,05% Tween 20. Выявление человеческих антител IgG проводили, добавляя сначала 100 мкл антитела против СН1 домена человеческого IgG, которое является дигоксигенилированным на С-конце, в концентрации 0,25 мкг/мл. После промывки 3 раза, каждый раз 300 мкл 1× PBS/0,05% Tween 20, добавляли 100 мкл фрагмента Fab антитела против дигоксигенина, конъюгированного с пероксидазой хрена (HRP) в концентрации 25 mU/мл. Наконец, добавляли 100 мкл ABTS® на лунку. После 30 мин инкубации при температуре окружающей среды измеряли экстинкцию (ОП) при 405 нм и 492 нм [405/492] на имеющемся в продаже ридере планшетов ELISA для микротитрования (например, Tecan Sunrise).
На Фиг. 5 показаны сывороточные уровни Bio-Cy5, а также сывороточные уровни человеческого IgG у мышей, обработанных комплексами и конъюгатами антитело-биотин-Cy5. Данные показаны как относительные (%) уровни человеческого IgG, нормированные к (пиковым) сывороточным уровням через 5 мин после инъекции. Относительные сывороточные уровни человеческого IgG и комплексов, и конъюгатов антитело-гаптен согласуются с относительной флуоресценцией, измеренной для конъюгатов антитело-гаптен. Таким образом, соединение биотин-Cys-Cy5 демонстрирует аналогичную стабильность in vivo, что и антитело, с которым оно конъюгировано, что означает, что конъюгаты антитело-гаптен остаются интактными in vivo. Это очевидно не так для комплексов антитело-гаптен, для которых относительная опосредованная Cy5 флуоресценция уменьшается быстрее, чем относительные сывороточные уровни человеческого IgG. Это означает то, что комплексы высвобождают груз с течением времени in vivo.
В заключение, стабильность in vivo гаптенилированных соединений значительно увеличивается при связывании антителом против гаптена. Однако комплексы антитело-гаптен не являются полностью стабильными in vivo, так как уменьшение сывороточных уровней гаптен-Cy5 быстрее, чем уменьшение сывороточных уровней антитела. Это не так для конъюгатов антитело-гаптен-Cy5, которые демонстрируют характеристики in vivo, аналогичные нормальным антителам IgG.
Кинетика в сыворотке Dig-пептида (сравнение нековалентного комплекса и ковалентного конъюгата)
Для анализа влияния на PK параметры комплексообразования и конъюгирования дигоксигенилированного полипептида с антителом каждое вещество из 32,1 нмоль полипептида или нековалентного комплекса между полипептидом и соответствующим антителом в 20 мМ гистидине / 140 мМ NaCl, рН 6,0, вводили 2 самкам мышей (линия NMRI). Мыши имели массу 23 г и 25 г для MAK-DIG-PYY и 28 г и 26 г для DIG-PYY. Отбирали примерно 0,1 мл образцы крови в следующие моменты времени: 0,08 ч, 2 ч и 24 ч для мыши 1 и 0,08 ч, 4 ч и 24 ч для мыши 2. Образцы сыворотки - по меньшей мере 40 мкл получали через 1 ч при RT посредством центрифугирования (9300 g, 3 мин, 4°С). Образцы сыворотки хранили при -80°С.
Определение количества дигоксигенилированного пептида в сыворотке в данные моменты времени было затруднительным по сравнению с выявлением Dig-Cy5, так как прямые способы выявления полипептида в образцах сыворотки не были доступны. Следовательно, для выявления дигоксигенилированного пептида в сыворотке был налажен анализ, связанный с вестерн-блоттингом. На первом этапе образцы сыворотки разделяли на SDS-PAGE при восстанавливающих условиях. Поскольку приготовление образца включало воздействие на сыворотку высоких концентраций SDS и восстанавителей, комплексированные конъюгаты Dig-полипептид могут высвобождаться от (полностью денатурировавшего/развернутого) антитела против дигоксигенина, тогда как ковалентные конъюгаты оставались связанными. Для опосредования высвобождения полипептида из нековалентного комплекса с антителом и разделения индивидуальных компонентов посредством SDS-PAGE 2 мкл каждого образца сыворотки разводили в 18 мкл 20 мМ гистидина / 140 мМ NaCl, рН 6,0, смешивали с 6,7 мкл 4× буфера для образца LDS и 3 мкл 10× восстановителя для образца (NuPAGE, Invitrogen) в течение 5 мин при 95°С. В качестве контроля использовали 2 мкл сыворотки от необработанной мыши той же самой линии. Образцы наносили на 4-12% Bis-Tris гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 20 мин при 200 В/120 мА с использованием 1× MES (Invitrogen) в качестве подвижного буфера. Затем осуществляли блоттинг разделенных полипептидов на PVDF мембрану (размер пор 0,22 мкм, Invitrogen) с использованием системы миниячейки XCell Sure Lock® (Invitrogen) в течение 40 мин при 25В/130 мА. Мембраны блокировали в 1% обезжиренном молоке в 1× PBS плюс 0,1% Tween 20 (PBST) в течение 1 ч при RT. Дигоксигенилированные полипептиды затем выявляли на мембране с использованием антитела против дигоксигенина. Для этого антитело против дигоксигенина наносили на мембраны в концентрации 13 мкг/мл в 10 мл 1% обезжиренного молока/PBST на 2 ч при RT. Мембраны промывали 3 раза по 5 мин в 1× PBST. Фрагменты Fab против мышиного IgG, связанные с POD (пероксидаза), из набора для вестерн-блоттинга LumiLightPLUS (Roche) наносили в разведении 1:25 в 10 мл 1% обезжиренного молока/PBST на 1 ч при RT. Мембраны промывали 3 раза по 5 мин 1× PBST. Выявление проводили посредством инкубирования мембран в 4 мл субстрата для вестерн-блоттинга LumiLight в течение 5 мин при RT. Хемилюминисценцию выявляли с использованием Lumilmager F1 (Roche) со временем экспозиции 20 мин.
Результаты данных анализов показаны на Фиг. 6А и 6Б. Было определено присутствие/количество дигоксигенилированного полипептида в мышиной сыворотке в разные моменты времени. Мыши, которые получили пептиды в комплексе с антителом (Фиг. 6 слева), демонстрировали сильные сигналы в самый ранний момент времени (5 мин после введения). Данные сигналы были четко приписываемыми, что демонстрируется по размеру и расположению на блоте контролей. В сыворотках мышей, которые были обработаны пептидом в комплексе с антителом, сигналы, ассоциированные с полипептидом, были самыми сильными в ранние моменты времени и снижались с течением времени. Тем не менее, полипептид все еще выявлялся с хорошими сигналами во все моменты времени и даже через 24 ч после введения.
У мышей, которые получали некомплексированный полипептид, любой сигнал, ассоциируемый с маленьким полипептидом, был едва выявляемым даже в самый ранний момент времени. На Фиг. 6 справа показано, что при нормальных условиях экспозиции на блоте не виден свободный полипептид. Усиление контраста блота выявило присутствие некоторого полипептида через 5 мин после введения, однако, только в следовых количествах. В более поздние моменты времени не выявлялась определенная полипептидная полоса.
Можно видеть, что некомплексированный полипептид имеет очень короткий период полувыведения в сыворотке мышей. Мыши, которые получали такие же полипептиды, но в форме комплекса с антителом, демонстрируют присутствие данных полипептидов в сыворотке в течение увеличенного периода времени. Через двадцать четыре часа после инъекции полипептид все еще может быть определен в сыворотке данных мышей.
Пример 9
Период полувыведения в сыворотке ковалентно связанных комплексов дигоксигенин-антитело и IgG, связывающихся с дигоксигенином
Для анализа того, улучшает ли дополнительно ковалентное комплексообразование PK свойства, принимая во внимание нековалентно связанные комплексы гаптена, определяли in vivo PK параметры комплексов антитело против дигоксигенина-дигоксигенин-Cy5, а также ковалентно связанных конъюгатов [антитело против дигоксигенина-Cys]-[дигоксигенин-Cys-Cy5]. В связи с этим дигоксигенин-Cy5 определяли с использованием его флуоресценции (А650), и соответствующее антитело определяли способом ELISA, который специфично выявляет гуманизированное антитело. Дигоксигенин-Cy5 применяли как низкомолекулярную «имитацию» связанных с гаптеном пептидов, так как его флуоресцентные свойства обеспечивают легкое и точное выявление в сыворотке.
Таким же образом, как описано для биотин-Cy5 или биотин-Cys-Cy5 (см. Пример 8), дигоксигенин-Cy5 или дигоксигенин-Cy5, комплексированный с антителом или дополнительно связанный с антителом посредством Cys, внутривенно инъецировали самкам мышей NRMI, с последующим отбором крови в 0,08 ч, 2 ч, 4 ч и 24 ч. Значения опосредованной Cy5 флуоресценции, выявленные для/в обеих мышах через 5 мин после инъекции (t равно 0,08 ч), принимали за значение 100%, и значения флуоресценции, измеренные в последующие моменты времени, выражали относительно них.
Результаты данных экспериментов демонстрируют то, что для дигоксигенин-Cy5 через 2 часа после инъекции выявлялось менее чем 10% флуоресценции, которую вводили (значение через 5 мин). В более поздние моменты времени, 4 ч и 24 ч соответственно после инъекции, не выявлялись сигналы, опосредованные Cy5 (см. Фиг. 8). В отличие от некомплексированного соединения, соединение в комплексе с антителом выявлялось со значительно большими уровнями и в более поздние моменты времени (Фиг. 8). Это указывает на то, что комплексообразование с антителом значительно увеличивает период полувыведения в сыворотке маленького соединения дигоксигенин-Cy5. Кроме того, ковалентно связанные грузы демонстрируют большее пролонгирование PK по сравнению с нековалентно связанными комплексами. Прямое сравнение уровней дигоксигенин-Cy5 и уровней антитела указывает на потерю груза от антитела с течением времени, причем уровни Cy5 уменьшаются быстрее, чем уровни антитела. В отличие от этого, ковалентно связанные конъюгаты дигоксигенина демонстрировали почти идентичные Cy5 и IgG периоды полувыведения в сыворотке (Фиг. 8). Это указывает на то, что грузы, связанные дисульфидом, остаются стабильно присоединенными к антителам, тогда как нековалентные комплексы диссоциируют с течением времени.
Пример 10
Период полувыведения в сыворотке и уровни воздействия ковалентно связанных комплексов гаптен-антитело и комплексов, которые присоединяются только через сайт связывания гаптена
Для анализа того, улучшает ли ковалентное комплексообразование PK свойства комплексов гаптена, связанных нековалентно, определяли PK in vivo комплекса антитела против биотина с биотином-Cy5, а также PK ковалентно связанного конъюгата [антитело против биотина-Cys]-[биотин-Cys-Cy5]. Присутствие Cy5 определяли неинвазивно посредством оптической визуализации глаза животных, которая выявляла флуоресценцию Cy5 в капиллярах. Значения флуоресценции, опосредованной Cy5, которые выявляли в глазе мышей через 10 мин после инъекции, принимали за значение 100%, и значения флуоресценции, измеренные в последующие моменты времени, выражали относительно них. Результаты данных экспериментов показаны на Фиг. 9: некомплексированный биотин-Cy5 сам по себе имеет короткий период полувыведения в сыворотке и низкие уровени воздействия. Соединение в комплексе с антителом, которое не было ковалентно связано, выявлялось со значительно большими уровнями и с увеличенным периодом полувыведения. Кроме того, ковалентно связанные грузы демонстрировали большую пролонгацию PK и большие сывороточные уровни, по сравнению с комплексами, связанными нековалентно. Это показывает, что комплексированные с гаптеном, связанные дисульфидом грузы являются более стабильными в системе кровообращения и могут достигать более высоких уровней воздействия, чем нековалентно комплексированные грузы.
Пример 11
Комплексирование пептида и ковалентное конъюгирование с антителами, которые связываются с разными гаптенами
Применение гаптенсвязывающих модулей для связывания гаптенилированных соединений (грузов) с нацеливающими носителями представляет собой одну техническую возможность, посредством которой может осуществляться доставка, опосредованная гаптеном. Данную идею можно расширить на дополнительные гаптены или другие соединения, которые захватывают соединения и соединяют их с нацеливающим модулем. Например, для доставки или стабилизации полипептида можно применять моно- или биспецифичные антитела, которые связываются с дигоксигенином или другими гаптенами, для стабилизации и оптимизации PK терапевтических полипептидов.
Предпосылками для применения в качестве модулей захвата полипептида является то, что (i) связывание соединений с гаптеном не оказывает серьезного мешающего влияния на активность полипептида и (ii) возможность эффективного связывания/комплексообразования антитела с гаптенилированными соединениями.
Направляемое гаптеном связывание является предпосылкой для эффективного ковалентного связывания гаптенилированных красителей или полипептидов с цистеинилированным антителом против гаптена.
Для демонстрации того, что управляемое аффинностью комплексообразование гаптенилированных соединений с антителами против гаптена является предпосылкой для эффективного образования дисульфидной связи, биотин-Cys-Cy5 инкубировали с гуманизированным антителом против дигоксигенина и гуманизированным антителом против дигоксигенина VH53C. Инкубацию биотин-Cys-Cy5 с гуманизированным антителом против биотина и гуманизированным антителом против биотина VH53C проводили в качестве контрольной реакции.
0,13 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 0,7 мг каждого антитела использовали в концентрации 6,7 мг/мл (примерно 46 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитела смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся комплекс/конъюгат далее анализировали посредством SDS-PAGE и последующего выявления в полиакриламидном геле флуоресценции, относящейся к Cy5. 15 мкг комплекса/конъюгата смешивали с 4× буфером для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Относящуюся к Cy5 флуоресценцию записывали с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм.
Невосстановленные образцы демонстрируют ковалентное сайт-специфичное образование дисульфидной связи для гуманизированного антитела против биотина VH53C (Фиг. 36, полоса 4) с очень низким фоновым флуоресцентным сигналом при использовании гуманизированного антитела против биотина без цистеина в CDR2 (Фиг. 36, полоса 3). Биотин-Cys-Cy5 был также ковалентно связан с гуманизированным антителом против дигоксигенина VH52bC (Фиг. 36, полоса 2) с низким фоновым сигналом при использовании гуманизированного антитела против дигоксигенина (Фиг. 36, полоса 1), но со значительно меньшей эффективностью. Это может быть выведено из избытка биотин-Cys-Cy5, который выявляется внизу геля (стрелки). В случае гуманизированного антитела против дигоксигенина VH52bC можно выявить значительно больше несвязанного биотин-Cys-Cy5 (полоса 2), чем при использовании гуманизированного антитела против биотина VH53C (полоса 4). При восстановлении образцов относящаяся к Cy5 флуоресценция не выявляется около тяжелой и легкой цепей антитела, указывая на то, что ковалентная связь действительно образовалась посредством дисульфидного мостика. Окрашивания каждого геля кумасси показывают то, что общее количество белка в каждой полосе было равным.
Пример 12
Направляемое гаптеном связывание является предпосылкой для эффктивного ковалентного связывания гаптенилированных красителей или полипептидов с цистеинилированным антителом против гаптена
Для демонстрации того, что управляемое аффинностью комплексообразование гаптенилированных соединений с антителами против гаптенов является предпосылкой для эффективного образования дисульфидной связи негаптенилированный пептид Ac-PYY(PEG3-Cys-4Abu-NH2) (Biosynthan 1763.1, SEQ ID NO: 23) инкубировали с гуманизированным антителом против дигоксигенина VH52bC и гуманизированным антителом против дигоксигенина. 1,4 мг Ac-PYY(PEG3-Cys-4Abu-NH2) растворяли в 100% DMF до концентрации 10 мг/мл. 2 мг каждого антитела использовали в концентрации 11-13 мг/мл (примерно 75-89 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ас-PYY(PEG3-Cys-4Abu-NH2) и антитела смешивали в молярном отношении 2,1:1 (Ас-PYY(PEG3-Cys-4Abu-NH2) к антителу). Пептид добавляли 3 порциями при перемешивании раствора при 500 об./мин с использованием бруска для перемешивания. Между каждым добавлением образцы инкубировали в течение 5 мин при 200 об./мин. После добавления последней порции образцы инкубировали в течение 1 ч при RT и 200 об./мин.
Образующийся комплекс/конъюгат определяли посредством гель-фильтрации как 97% мономерной IgG-подобной молекулы и 3% димерных раствормых агрегатов для конъюгата Ac-PYY(PEG3-Cys-4Abu-NH2):гуманизированное антитело против дигоксигенина VH52C и как 100% мономера для комплекса Ac-PYY(PEG3-Cys-4Abu-NH2):гуманизированное антитело против дигоксигенина. Кроме того, образующийся комплекс/конъюгат анализировали посредством масс-спектрометрии. Для конъюгата Ac-PYY(PEG3-Cys-4Abu-NH2):гуманизированное антитело против дигоксигенина VH52C 17% выявленных соединений было идентифицировано как антитело, связанное с 2 молекулами пептида, 51% был идентифицирован как антитело, связанное с 1 молекулой пептида, и 32% было идентифицировано как антитело без связанного пептида. Для комплекса Ac-PYY(PEG3-Cys-4Abu-NH2):гуманизированное антитело против дигоксигенина 100% антитела не было связанным.
Пример 13
Картины дисульфидов, которые требуются для образования правильно свернутых функциональных гаптенсвязывающих антител с цистеиновой мутацией для ковалентного связывания груза
Гаптенсвязывающие модули для ковалентного связывания соединения/груза могут состоять из «стандартных» антител, таких как IgG, которые содержат дополнительные цистеины, которые обеспечивают ковалентное присоединение гаптенилированных соединений/грузов. В способе, описанном в данном документе, в пределах свернутых доменов, структура и последовательность которых обеспечивают основу для функциональности антитела, вводятся требующиеся функционалы (цистеины). Правильное образование определенных дисульфидных связей в пределах, а также между доменами антител является важным для образования и поддержания правильной структуры и функциональности. Для поддержания правильной картины дисульфидов дополнительный цистеин, который был введен в домен VH, не должен быть занят и не должен мешать или реагировать с соседними цистеинами. Факт того, что положение VH52bC/VH53C расположено в пределах домена VH (и довольно близко к другим цистеинам) усугубляет риск того, что во время биосинтеза тяжелой цепи могут образоваться неправильные дисульфиды. Другой потенциальной проблемой является то, что домены VH и VL собираются до одного фрагмента Fv в пределах секреторного пути. Секреторный путь включает перемену окислительно-восстановительных условий и ферметы образования и перетасовки дисульфидов. Следовательно, потенциал введения неправильных дисульфидов посредством добавления мутации VH52bC/VH53C также может «распространяться» на дисульфиды легкой цепи. Это, в самом деле, дополнительно увеличивает риск получения/генерации неправильно свернутых нефункциональных молекул. Следовательно, довольно неожиданно то, что, несмотря на эти риски, могли быть экспрессированы и получены хорошие количества гомогенных функциональных производных антитела, которые содержат мутацию VH52bC/VH53C, и которые способны ковалентно связываться с гаптенилированными соединениями/грузами.
Пример 14
Состав и получение одноцепочечных фрагментов Fv против гаптена, стабилизированных дисульфидом, с цистеиновой мутацией для ковалентного связывания
Гаптенсвязывающие модули для ковалентного связывания соединения/груза могут состоять из «стандартных» антител, таких как IgG. В качестве альтернативы, они могут представлять собой модифицированные соединения, такие как рекомбинантные фрагменты Fv или Fab, или их производные. Одноцепочечные фрагменты Fv часто применяют в качестве альтернативы полноразмерным антителам, особенно в применениях, когда требуется маленький размер модуля, или когда желательными являются дополнительные связывающие модули для получения би- или мультиспецифичных производных антител. Одним примером происходящих из Fv соединений против гаптена, которые были получены, является стабилизированный дисульфидом одноцепочечный Fv, который связывается с и ковалентно присоединяется к дигоксигенилированным соединениям/грузам. Стабилизированный дисульфидом одноцепочечный Fv со специфичностью связывания с Dig был получен посредством соединения друг с другом доменов VH и VL антитела против дигоксигенина через гибкий линкер, обогащенный Gly и Ser. Данные домены VH и VL дополнительно содержали цистеиновые мутации в положении 44 VH и в положении 100 VL (положения согласно Kabat et al.). Эти дополнительные цистеины образуют стабильную межмолекулярную дисульфидную связь между VH и VL. Это стабилизирует scFv, как было описано ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245).
Помимо этого, другой цистеин был введен в VH в положении 52b или 53 соответственно согласно нумерации по Kabat для того, чтобы добавить во фрагмент Fv функционал для образования ковалентной связи.
Однако введение такой мутации во фрагменты Fv, стабилизированные дисульфидом, является значительно большим вызовом, чем ее помещение в полноразмерные антитела. Одноцепочечные фрагменты Fv по своей природе менее стабильны, чем полноразмерные IgG или фрагменты Fab из-за того, что у них отсутствуют константные домены в качестве стабилизирующих и принуждающих к гетеродимеризации структурных единиц. Стабильность может придаваться помещением в Fv дополнительных цистеиновых мутаций, таких как мутации, приводящие к образованию дисульфида VH44-VL100. Однако данное стабилизирующее начало работает только при образовании дисульфида в правильных положениях между правильными цистеинами. Таким образом, помимо определенных внутридоменных дисульфидов (одного в VH и одного в VL), должен образоваться один определенный правильный междоменный дисульфид. Дисульфидные соединения между несоответствующими цистеинами будут генерировать неправильно свернутые, нестабильные и нефункциональные соединения. Учитывая то, что стабилизированный дисульфидом фрагмент Fv содержит 6 цистеинов, теоретически может образоваться 21 разное дисульфидное соединение, но только правильная комбинация из 3 определенных дисульфидов будет формировать функциональный стабилизированный dsscFv. Этот вызов усугубляется при добавлении в домен VH другого свободного цистеина. Стабилизированный dsscFv, который является желательным, содержит два определенных внутридоменных диульфида (один в VH и один в VL), один определенный междоменный дисульфид (между VH и VL) и, кроме того, один свободный цистеин для связывания гаптенилированного соединения/груза (в VH в положении 52b/53). Учитывая то, что стабилизированный дисульфидом фрагмент Fv с дополнительной цистеиновой мутацией для ковалентного связывания содержит 7 цистеинов, теоретически может образоваться много разных дисульфидных соединений, но только правильная комбинация из 3 определенных дисульфидов с точным положением свободного цистеина в VH52b/VH53 будет приводить к функциональному стабилизированному dsscFv, компетентному к ковалентному связыванию. Одним дополнительным вызовом является тот факт, что дополнительный свободный цистеин (VH52b/VH53) располагается в непосредственной близости к цистеину VH44, который не является встречающимся в природе цистеином, но мутацией, введенной для стабилизации дисульфидом. VH44C является необходимым для образования правильного междоменного дисульфида, и данный дисульфид, вероятнее всего, не будучи связанными этой теорией, образуется после независимого сворачивания и сборки VH и VL. Близость VH44C и VH52bC/VH53C усугубляет риск того, что внутридоменный дисульфид не образуется правильным образом. Но обнаружили, что могут быть получены функциональные стабилизированные дисульфидом одноцепочечные Fv модули, которые связываются с дигоксигенином, и которые одновременно способны ковалентно присоединяться к дигоксигенилированным грузам. Последовательности, которые кодируют вариабельные области легкой цепи и модифицированные вариабельные области тяжелой цепи данного связывающегося с Dig dsscFv с мутацией VH52bC производного Fv антитела, перечислены под SEQ ID NO: 25 (VH), и соответствующая VL - под SEQ ID NO: 24. Успешное получение таких dsscFv в виде модулей для получения производных биспецифичного антитела описано в Примере 15 (ниже).
Пример 15
Состав, экспрессия и очистка биспецифичных производных антитела против гаптена для целевой доставки ковалентно связанных соединений/грузов
Были получены биспецифичные антитела, которые содержат модули гаптенсвязывающего антитела для ковалентного связывания соединения/груза. Данные антитела дополнительно содержат связывающие модули, которые обеспечивают нацеливание на другие антигены. Применения таких биспецифичных антител включают специфичное нацеливание гаптенилированных соединений/грузов на клетки или ткани, которые несут нацеливающий антиген. Один пример таких молекул, которые были получены, представляет собой биспецифичное антитело со связывающими областями, которые распознают ассоциированный с опухолью углеводный антиген LeY, и одновременно с Fv, стабилизированными дисульфидом, которые связываются и ковалентно присоединяются к дигоксигенилированным соединениям/грузам. В связи с этим, стабилизированные дисульфидом одноцепочечные Fv присоединялись через гибкие, обогащенные Gly и Ser соединительные пептиды к С-концам доменов СН3 антитела против LeY, что приводило к четырехвалентным молекулам с двумя плечами, связывающимися с LeY, и дополнительно двумя дигоксигенинсвязывающими структурными единицами. Данные дигоксигенинсвязывающие структурные единицы содержали дисульфидную связь VH44-VL100, которая была описана ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245). Дигоксигенинсвязывающая структурная единица, кроме того, содержала мутацию VH52bC для ковалентного связывания. Последовательности, которые кодируют легкую цепь и модифицированную тяжелую цепь данного производного антитела против LeY-Dig, перечислены под SEQ ID NO: 17 и SEQ ID NO: 18.
Данные биспецифичные молекулы получали методиками молекулярной биологии, экспрессировали посредством секреции из культивируемых клеток, затем очищали из супернатантов культуры таким же образом, как описано выше. Таким образом, могут быть получены и очищены до гомогенности биспецифичные антитела, которые содержат нацеливающие модули, а также модули для ковалентного связывания гаптенилированных соединений/грузов.
Пример 16
Пептид YY, содержащий аминокислотную последовательность мотива хеликар
Пептид YY представляет собой короткий (36-аминокислотный) пептид, высвобождаемый клетками в подвздошной и толстой кишке в ответ на получение пищи. У людей он, по-видимому, уменьшает аппетит. Самой обычной формой находящегося в системе кровообращения PYY является PYY3-36, который связывается с рецептором Y2 (Y2R) семейства рецепторов Y. PYY находится в L клетках в слизистой желудочно-кишечного тракта, особенно в подвздошной и толстой кишке. Также маленькое количество PYY, примерно 1-10%, находится в пищеводе, желудке, двенадцатиперстной кишке и тощей кишке. В системе кровообращения концентрация PYY возрастает после приема пищи и снижается во время голодания. PYY оказывает его действие через рецепторы NPY; он ингибирует перистальтику желудка и увеличивает поглощение воды и электролитов в толстой кишке. PYY и миметики PYY использовали для воздействия на ожирение.
PYY модифицировали так, чтобы он содержал аминокислотную последоваельность мотива хеликар и комплексировался антителом против аминокислотной последовательности мотива хеликар для того, чтобы получить преимущество фармакокинетических свойств антитела и избежать собственной нестабильности PYY.
Образование нековалентного комплекса
Структурное исследование пептида PYY3-36 (Nygaard, R., et al., Biochem. 45 (2006) 8350-8357; SEQ ID NO: 26) выявляет спиральный мотив (аминокислотная последовательность хеликар-подобного мотива) для центральных аминокислот.Поскольку N-концевой изолейцин и модифицированный С-конец были описаны как важные для функциональной активности пептида, центральную спираль модифицировали для того, чтобы она отображала аминокислоты в аминокислотной последовательности мотива хеликар.

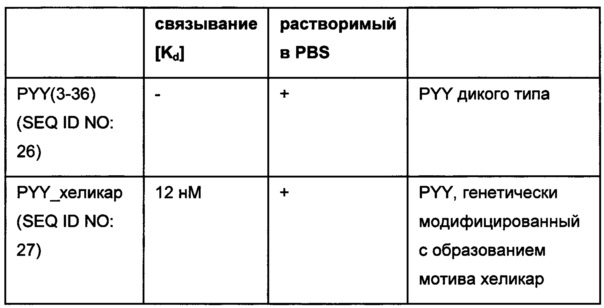
Полное антитело IgG1 против аминокислотной последовательности мотива хеликар продуцировали в клетках HEK293 путем трансфицирования двух плазмид, содержащих вариабельные области тяжелой и легкой цепи, вставленные в вектор, содержащий константную область тяжелой цепи человеческого IgG1 и константный человеческий домен лямбда соответственно. Антитело против аминокислотной последовательности мотива хеликар (0019) очищали стандартными методиками с использованием хроматографии на белке А. Эксперимент с использованием масс-спектрометрии подтвердил идентичность антитела 0019.
Комплекс между антителом 0019 и модифицированным пептидом PYY-PYY_хеликар был получен in vitro посредством введения небольшого избытка пептида в раствор антитела. Формировался комплекс 0052. Стехиометрия данного комплекса, определенная посредством аналитических экспериментов SEC-MALLS, составляет 1,6 пептидов, комплектованных на одном двухвалентном антителе.
Антитело 0019, PYY(3-36) дикого типа, PYY_хеликар и комплекс 0052 тестировали на их эффект на семейство рецептора Y2.
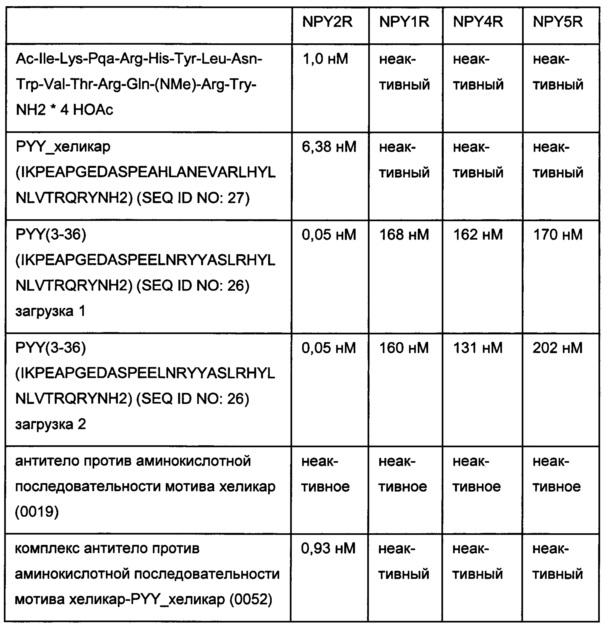
Как было продемонстрировано (Hoffmann, Е., et al., J. Cont. Rel. 171 (2013) 48-56.), пептиды, комплексированные антителом, имеют пролонгированный период полувыведения in vivo. Кроме того и неожиданно, данный комплекс демонстрирует немного лучшую аффинность в отношении рецептора NPY2R по сравнению с некомплексированным пептидом; антитело стабилизирует полипептид и презентирует пептид в его фиксированной биологически активной конформации.
Образование ковалентного комплекса (ковалентная дисульфидная связь)
Для того чтобы увеличить стабильность in vitro и in vivo комплекса между антителом против аминокислотной последовательности мотива хеликар и соединением, содержащим аминокислотную последовательность мотива хеликар, использовали образование дисульфидного мостика при связывании.
Первой стадией является стадия специфичного распознавания (высокоаффинное взаимодействие), т.е. образование комплекса соединение, содержащее аминокислотную последовательность мотива хеликар-антитело против аминокислотной последовательности мотива хеликар. После этого на второй стадии следует спонтанная перетасовка дисульфидного мостика с образованием ковалентного комплекса с улучшенной стабильностью.
Поскольку 12-мерный пептид (аминокислотная последовательность мотива хеликар) является относительно жестким соединением (по меньшей мере при комплексировании специфичным антителом против аминокислотной последовательности мотива хеликар), обнаружили, что необходимо использовать специфичную для структуры конструкцию дисульфидного мостика. Поскольку образование комплекса и осуществляемое позднее ковалентное связывание происходят между двумя соединениями, продуцированными рекомбинантно, искусственные остатки цистеина, введенные для образования ковалентной дисульфидной связи, не обязательно продуцируются в виде свободных остатков цистеина, но экспрессируются в восстановленной форме, т.е. конъюгированными со свободной аминокислотой цистеином или гомоцистеином.
Критически важным является положение в аминокислотной последовательности вариабельного домена антитела против аминокислотной последовательности мотива хеликар, куда вводится искусственный свободный остаток цистеина. Неэкспонированный цистеин в аминокислотной последовательности вариабельного домена антитела имеет большую вероятность экспрессии в форме свободного цистеина (не конъюгированного), тогда как экспонированный остаток цистеина, близкий к карману связывания, может отменить связывание 12-мерного пептида (аминокислотной последовательности мотива хеликар) из-за стерического препятствия, индуцированного конъюгированием цистеина с дополнительной группировкой, подобной свободному цистеину.
а) комплексы с аминокислотной последовательностью мотива хеликар, содержащей флуоресцентное соединение
Для того чтобы идентифицировать подходящее положение, которое создает минимальный риск стерического препятствия и сильного уменьшения аффинности, тестировали разные положения для введения искусственного остатка цистеина в аминокислотную последовательность мотива хеликар. Остаток цистеина был введен на С-конце 12 мера (аминокислотной последовательности мотива хеликар) для того, чтобы иметь главную часть паратопа неизменной. Пептиды синтезировали и сливали с флуоресцентным мотивом.

На антителе делали структурную конструкцию для обеспечения образования дисульфидного для обоих сконструированных пептидов, включающих каждый цистеин в отличном 3D (трехмерном) окружении.
12-мерный спиральный пептид AHLENEVARLKK (аминокислотная последовательность мотива хеликар) моделируется в VH и доменах VH. Остатки L10 и К11 идентифицируются как возможное положение на С-конце пептида, а в вариабельном домене легкой цепи идентифицируются положения N55 и G51 согласно нумерации легкой цепи по Kabat.
Вариабельный домен тяжелой цепи антитела против аминокислотной последовательности мотива хеликар (0019) имеет следующую аминокислотную последовательность:

(SEQ ID NO: 04).
Вариабельный домен легкой цепи антитела против аминокислотной последовательности мотива хеликар (0019) имеет следующую аминокислотную последовательность:

(SEQ ID NO: 05).
Вариабельный домен легкой цепи варианта N55C антитела против аминокислотной последовательности мотива хеликар (0155) имеет следующую аминокислотную последовательность:

(SEQ ID NO: 06).
Вариабельный домен легкой цепи варианта N51C антитела против аминокислотной последовательности мотива хеликар (0157) имеет следующую аминокислотную последовательность:

(SEQ ID NO: 07).
i) Ковалентный конъюгат соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом 0155
Двухвалентное антитело 0155 экспрессируется в клетках HEK293 аналогично его родительской молекуле Y2R(bck)-0019 без свободного цистеина. Модифицированное антитело очищают с использованием того же самого протокола, который используется для антитела 0019. Анализ масс-спектрометрией демонстрирует то, что экспериментально определенная масса дегликозилированного антитела составляет 142001 Да. Это превышает расчетную массу на 259 Да. Восстановленные цепи имеют экспериментально определенную массу 48167 Да (полная тяжелая цепь, расчетная - 48168 Да, Cys - SH, С-конец - - K) и 22720 Да (полная легкая цепь, N55C, расчетная - 22720 Да, Cys - SH). Последовательности данных цепей были подтверждены после восстановления.
Антитело 0155 связывали с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином, используя 2,5-молярный избыток соединения, содержащего аминокислотную последовательность мотива хеликар, в 100% DMF с образованием ковалентного комплекса 0156.
На геле SDS-PAGE (денатурирующие условия, см. Фиг. 12) флуоресценция видна только на антителе 0155; при восстанавливающих условиях виден только маленький пептид.
Результаты:
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против аминокислотной последовательности мотива хеликар было успешным. Всего примерно 43% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с двумя аминокислотными последовательностями мотива хеликар, примерно 40% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с одной аминокислотной последовательностью мотива хеликар, и примерно 17% антитела против аминокислотной последовательности мотива хеликар не было конъюгировано.
Примерно 50% конъюгата, содержащего две аминокислотные последовательности мотива хеликар, модифицируется. Это соединение не принимали во внимание для количественного измерения. Как уже было определено для исходного вещества, антитело без аминокислотной последовательности мотива хеликар содержит две модификации примерно по 128 Да. Антитело, конъюгированное с одной аминокислотной последовательностью мотива хеликар, имеет только одну примерно 128 Да модификацию.
ii) Ковалентный конъюгат соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом 0157
Аналогично антителу 0155, антитело 0157 экспрессируется, главным образом, как цистеинилированная форма. Анализ масс-спектрометрией демонстрирует то, что экспериментально определенная масса дегликозилированного антитела составляет 141863 Да. Это превышает расчетную массу на 3 Да. Антитело, главным образом, присутствует в виде одиночной или двойной гомоцистеинилированной формы. Восстановленные цепи имеют экспериментально определенную массу 48168 Да (полная тяжелая цепь, расчетная - 48168 Да, Cys - SH, С-конец - - K) и 22777 Да (полная легкая цепь, N51C, расчетная - 22777 Да, Cys - SH). Последовательности данных цепей были подтверждены после восстановления.
Связывание антитела 0157 с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином не приводило к ожидаемому ковалентному комплексу. Флуоресценция не видна в ожидаемой полосе, но видна на контроле, который должен быть негативным в данном эксперименте (см. Фиг. 13).
Антитело 0157 инкубировали с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином. В качестве контрольного антитела, с таким же вариантом 1 аминокислотной последовательности мотива хеликар с цистеином инкубировали 0019.
Результаты:
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против аминокислотной последовательности мотива хеликар не было успешным. Не будучи связанными данной теорией, предполагается, что в этом случае цистеинилирование антитела происходит слишком глубоко в кармане связывания для того, чтобы обеспечивать эффективное связывание флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, и доставлять нуклеофильную тиольную группу в подходящее положение для атаки С51.
б) комплексы с рекомбинантным полипептидом, содержащим аминокислотную последовательность мотива хеликар
Методология на основе хеликара становится особенно привлекательной при рассмотрении образования ковалентного комплекса с рекомбинантно продуцированным полипептидом, содержащим аминокислотную последовательность мотива хеликар.
Поскольку конъюгирование антитела 0155, содержащего мутацию VL-N55C, с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 02) работало значительно лучше по сравнению с альтернативой (G51C на VL с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARCKK; SEQ ID NO: 03)), дополнительно исследовали конъюгирование 0155 с полипептидом, содержащим вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Данный полипептид содержал вариант 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 02), слитой с N-концом.
Молекула экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина, содержащая вариант 1 аминокислотной последовательности мотива хеликар с цистеином (0236; SEQ ID NO: 28), была продуцирована в Е. coli и очищена с использованием комбинации анионообменной хроматографии и SEC (см., например, WO 2011/032022).
Антитело 0155 ковалентно конъюгируют с молекулой экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина SEQ ID NO: 28, содержащей вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Хроматограмма SEC показана на Фиг. 14. Эффективность конъюгирования анализируется посредством SDS-CE (капиллярный электрофорез с додецилсульфатом натрия), Caliper, для невосстановленных образцов (см. Фиг. 15).
Всего примерно 4% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с двумя полипептидами SEQ ID NO: 28, примерно 41% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с одним полипептидом SEQ ID NO: 28, и примерно 55% антитела против аминокислотной последовательности мотива хеликар не было конъюгировано.
В заключение, моноклональное антитело против аминокислотной последовательности мотива хеликар может быть использовано для комплексирования пептидов, маленьких молекул с пептидным линкером и рекомбинантных белков посредством высокоаффинного распознавания аминокислотной последовательности 12-мерного мотива хеликар. Пептиды с предрасположенностью к сворачиванию в виде спирали могут быть модифицированы для имитации исходной аминокислотной последовательности AHLENEVARLKK (SEQ ID NO: 01) 12-мерного мотива хеликар, и затем становятся способными к комплексообразованию с моноклональным антителом против аминокислотной последовательности мотива хеликар. Помимо высокоаффинного комплексообразования, создается возможность ковалентного конъюгирования с цистеиновым вариантом SEQ ID NO: 01, содержащим цистеин, и модифицированным антителом против аминокислотной последовательности мотива хеликар, содержащим цистеин в CDR, посредством образования стабильной дисульфидной связи. Рекомбинантные белки, экспрессируемые другой системой, могут быть конъюгированы in vitro позднее без участия конкретных условий реакции, но посредством спонтанной перетасовки дисульфидных мостиков.