ТВЁРДЫЕ ДИСПЕРСИИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] По настоящей заявке испрашивается приоритет на основании предварительной заявки на патент США №62/131060, поданной 10 марта 2015 года, содержание которой в полном объеме включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[002] Настоящая заявка в целом относится к твердым дисперсиям, содержащим активный фармацевтический ингредиент, такой как оспемифен, и гидрофильный носитель и необязательно одно или более вспомогательных веществ, включая, но не ограничиваясь им, поверхностно-активное вещество, а также способы их получения и применения.
УРОВЕНЬ ТЕХНИКИ
[003] В области фармацевтических препаратов по целому ряду причин пероральные лекарственные формы лекарственных средств являются предпочтительным способом доставки. В целом активные фармацевтические ингредиенты (АФИ), поставляемые в пероральной лекарственной форме, легче изготавливать, дозировать и вводить. Существование хорошо зарекомендовавших себя методов получения унифицированных доз в формах, которые могут быть химически очень стабильными, существенно упрощает производство и делает его в свою очередь более унифицированным. Можно проще осуществлять дозирование и введение, поскольку обычно пероральные дозы можно вводить самостоятельно, в отличие от других форм, таких как внутривенно вводимые лекарственные средства, которые вводить сложнее или для введения которых может потребоваться обученный специалист, который сможет осуществить правильное введение терапевтического средства нуждающемуся пациенту.
[004] В последнее время достижения в области химии и методологии разработки лекарственных средств привели к открытию ряда новых потенциальных лекарственных средств. Например, высокопроизводительный скрининг и комбинаторная химия очень эффективны при выборе потенциальных лекарственных средств на основании специфического связывания с представляющей интерес мишенью. Для терапевтических средств целевая специфичность является весьма желательной, с учетом того, что в целом она также коррелирует с увеличением терапевтического индекса, соотношением между LD50 для конкретного соединения и уровнями, требуемыми для достижения желаемого терапевтического эффекта. Однако одним из недостатков таких стратегий выбора лекарственных средств является то, что с их помощью часто выбирают соединения, которые не являются оптимальными с точки зрения свойств доставки лекарственного средства, что затрудняет переход потенциальных лекарственных средств на более поздние стадии разработки.
[005] Таким образом, одно из ограничений новых подходов к разработке новых фармацевтических препаратов заключается в том, что новые химические объекты могут не всегда обладать желаемыми свойствами, которые делали бы их подходящими для перорального введения, несмотря на то, что указанный активный ингредиент может обладать значительным терапевтическим потенциалом.
[006] Недавние исследования показали, что многие новые АФИ слабо растворяются в воде и плохо усваиваются после введения (см., например: Charman & Charman, 2003; van Drooge et al., 2006). Ограничения скорости солюбилизации и абсорбции будут иметь прямое влияние на биодоступность и фармакокинетические характеристики любого соединения. Таким образом, во многих случаях может быть желательным улучшить свойства растворимости АФИ, с тем, чтобы сократить время до достижения терапевтически эффективных уровней у пациента, а также улучшить общее поглощение фармацевтического препарата в системном кровообращении, или в какой-либо другой части организма, которого указанное лекарственное средство должно достичь для того, чтобы оказать там свой терапевтический эффект.
[007] Производство твердых дисперсий лекарственных средств является одним из способов, которые могут улучшить растворимость и растворение лекарственных средств, слабо растворимых в воде (Vasconcelos et at., 2007). Увеличение растворимости и растворения может привести к увеличению биодоступности лекарственных средств, слабо растворимых в воде, и/или могут позволить применять уменьшенную дозу такого лекарственного средства. Однако технологии твердой дисперсии имеют ограничения, среди которых трудоемкие и дорогостоящие методы получения, воспроизводимость физико-химических характеристик, трудности с включением в рецептуру лекарственных форм, расширение производственного процесса, стабильность лекарственного средства и носителя и другие.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[008] Настоящее изобретение относится к твердым дисперсиям и содержащим их композициям. Указанные твердые дисперсии содержат лекарственное средство, слабо растворимое в воде, такое как оспемифен, и гидрофильный носитель, включая, но не ограничиваясь, ими, следующие: по меньшей мере один из поливинилпирролидина (также известного как повидон или PVP) (например, PVP K30), сополимеров поливинилпирролидина/винилацетата (также известных как коповидон или PVPVA) (например, PVPVA64, также известного как Kollidon® VA64), гидроксилпропилметилцеллюлозы (НРМС), гипромеллозы ацетата сукцината (HPMCAS), соединений Eudragit® (сополимеров метакриловой кислоты, например, Eudragit® L100-55), гидроксипропилцеллюлозы (НРС) (например, HPC-SL), привитых сополимеров поливинилкапролактам/поливинилацетат/полиэтиленгликоль (например, Soluplus®) и фталата гидроксипропилметилцеллюлозы (НРМСР) (например, НР-55) или их смеси. В некоторых вариантах реализации настоящего изобретения массовое соотношение оспемифена к указанному гидрофильному носителю находится в диапазоне от примерно 1:1 до примерно 1:20. В некоторых вариантах реализации настоящего изобретения массовое соотношение оспемифена к указанному гидрофильному носителю составляет примерно 1:4.
[009] В дополнение к гидрофильному носителю указанная твердая дисперсия может дополнительно содержать одно или более поверхностно-активных веществ, включая, например, полисорбаты (например, Tween®20, Tween® 80, Span® 20, Span® 80), докузат натрия (например, АОТ) и полоксамеры (например, полоксамер 407).
[0010] Другой аспект относится к водному раствору, содержащему твердую дисперсию, растворенную в растворителе, выбранном из воды, 0,1 н. HCl или буферного раствора с рН в диапазоне от примерно 6,5 до примерно 7,5, при этом указанная твердая дисперсия содержит оспемифен и гидрофильный носитель, как описано в настоящем документе.
[0011] Еще один аспект относится к способам получения твердых дисперсий лекарственных средств, слабо растворимых в воде, таких как оспемифен, включая способы плавления и испарения растворителя. В одном варианте реализации настоящего изобретения предложен способ получения твердой дисперсии оспемифена, включающий: растворение оспемифена в первом растворителе с получением раствора оспемифена; растворение гидрофильного носителя во втором растворителе с получением раствора гидрофильного носителя; объединение указанного раствора оспемифена и указанного раствора гидрофильного носителя с получением смеси; сушка указанной смеси в условиях сушки с удалением из указанной смеси указанных первого растворителя и второго растворителя, так что оставшийся материал образует твердую дисперсию оспемифена и гидрофильного носителя.
[0012] В определенных вариантах реализации указанных методов указанный гидрофильный носитель выбран из группы, состоящей из коповидона, сукцината гипромеллозы ацетата, поливинилпирролидина, сополимера поливинилпирролидина и винилацетата, гидроксипропилметилцеллюлозы, соединения Eudragit® (сополимера метакриловой кислоты), гидроксипропилцеллюлозы, привитого сополимера поливинилкапролактам/поливинилацетат/полиэтиленгликоль, фталата гидроксипропилметилцеллюлозы и их смесей.
[0013] В определенных вариантах реализации указанных методов указанный первый растворитель содержит растворитель, выбранный из группы, состоящей из метанола или этанола. В определенных вариантах реализации указанных методов указанный второй растворитель содержит растворитель, выбранный из группы, состоящей из воды, метанола или этанола. В определенных вариантах реализации указанных методов указанные первый и второй растворители являются одинаковыми.
[0014] В определенных вариантах реализации указанных методов массовое соотношение оспемифена к указанному гидрофильному носителю в указанной смеси варьируется от 1:1 до 1:20. В определенных вариантах реализации указанных методов массовое соотношение оспемифена к указанному гидрофильному носителю в указанной смеси варьируется от 1:2 до 1: 4.
[0015] В определенных вариантах реализации настоящего изобретения указанный способ дополнительно включает стадию растворения поверхностно-активного вещества в третьем растворителе с получением раствора поверхностно-активного вещества и объединения указанного раствора поверхностно-активного вещества с указанными раствором оспемифена и раствором гидрофильного носителя с получением смеси. В определенных вариантах реализации настоящего изобретения указанный третий растворитель содержит растворитель, выбранный из группы, состоящей из воды, метанола или этанола.
[0016] В определенных вариантах реализации настоящего изобретения указанные условия сушки включают температуру окружающей среды и атмосферное давление в течение периода времени около 90 часов. В определенных вариантах реализации настоящего изобретения указанные условия сушки включают пониженное атмосферное давление и период времени менее 90 часов.
[0017] Другой аспект настоящего изобретения относится к фармацевтическим композициям, содержащим твердую дисперсию лекарственного средства, слабо растворимого в воде, такого как оспемифен, гидрофильного носителя, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit® (сополимеры метакриловой кислоты), привитых сополимеров поливинилкапролактам/поливинилацетат/полиэтиленгликоль (например, Soluplus®) и фталат гидроксипропилметилцеллюлозы (НРМСР), фармацевтически приемлемое вспомогательное вещество и необязательно поверхностно-активное вещество. В некоторых вариантах реализации настоящего изобретения указанная композиция предоставлена в лекарственной форме. В некоторых вариантах реализации настоящего изобретения указанное фармацевтически приемлемое вспомогательное вещество содержит по меньшей мере одно из скользящего вещества, диспергирующего агента, энтеросолюбильного покрытия, смазывающего вещества, связующего вещества или буферного агента. В некоторых вариантах реализации настоящего изобретения указанное фармацевтически приемлемое вспомогательное вещество выбрано из по меньшей мере одного из коллоидного диоксида кремния, моногидрата лактозы, стеарата магния, маннита, микрокристаллической целлюлозы, полиэтиленгликоля, прежелатинизированного крахмала, натрия крахмалгликолята, диоксида титана, триацетина и триоза и их смесей. В некоторых вариантах реализации настоящего изобретения соотношение указанных гидрофильного носителя и поверхностно-активного вещества составляет от 1:1 до 1:6. В некоторых вариантах реализации настоящего изобретения указанная фармацевтическая композиция предоставлена в лекарственной форме, выбранной из таблетки, капсулы или порошка. В некоторых вариантах реализации настоящего изобретения после однократного введения фармацевтической композиции субъекту, представляющему собой человека, наблюдается большая биодоступность оспемифена или нет существенной разницы в биодоступности оспемифена при введении указанной композиции субъекту натощак по сравнению с введением после приема пищи.
[0018] Кроме того, настоящее описание также относится к способу лечения симптома, связанного с менопаузой, включающему введение пациенту фармацевтической композиции, содержащей лекарственную форму твердой дисперсии оспемифена и гидрофильного носителя, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit® (сополимеры метакриловой кислоты), привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, и необязательно поверхностно-активного вещества, пациенту в количестве, достаточном для лечения симптома, связанного с менопаузой. В некоторых вариантах реализации настоящего изобретения указанный симптом, связанный с менопаузой, представляет собой вагинальную сухость или сексуальную дисфункцию.
[0019] Другой аспект связан со способами лечения, включая способ лечения симптома, связанного с менопаузой, включающий введение фармацевтической композиции, описанной в настоящем документе, пациенту в количестве, достаточном для лечения симптома, связанного с менопаузой. В некоторых вариантах реализации настоящего изобретения указанный симптом, связанный с менопаузой, представляет собой сексуальную дисфункцию. В некоторых вариантах реализации настоящего изобретения указанная сексуальная дисфункция выбрана из группы, состоящей из сниженного полового влечения, расстройства возбуждения, оргастического расстройства, вагинальной сухости и диспареунии. Другие варианты реализации настоящего изобретения направлены на способы лечения остеопороза, включающие введение фармацевтической композиции, описанной в настоящем документе, пациенту в количестве, достаточном для лечения остеопороза.
[0020] В некоторых вариантах реализации настоящего изобретения указанную фармацевтическую композицию вводят в дозе менее 60 мг оспемифена в сутки. В некоторых вариантах реализации настоящего изобретения указанную фармацевтическую композицию вводят без пищи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0021] Сопроводительные графические материалы, которые включены в настоящее описание и составляют его часть, иллюстрируют некоторые варианты реализации настоящего изобретения и вместе с описанием служат для объяснения некоторых принципов описанных здесь композиций и способов.
[0022] На фиг. 1 показана кинетика растворения оспемифена отдельно (целевая концентрация 0,24 мг/мл) в FeSSIF и FaSSIF.
[0023] На фиг. 2 показана кинетика растворения оспемифена из твердой дисперсии, содержащей коповидон (Kollidon® V64), в FeSSIF, FaSSIF и PBS, рН 6,8.
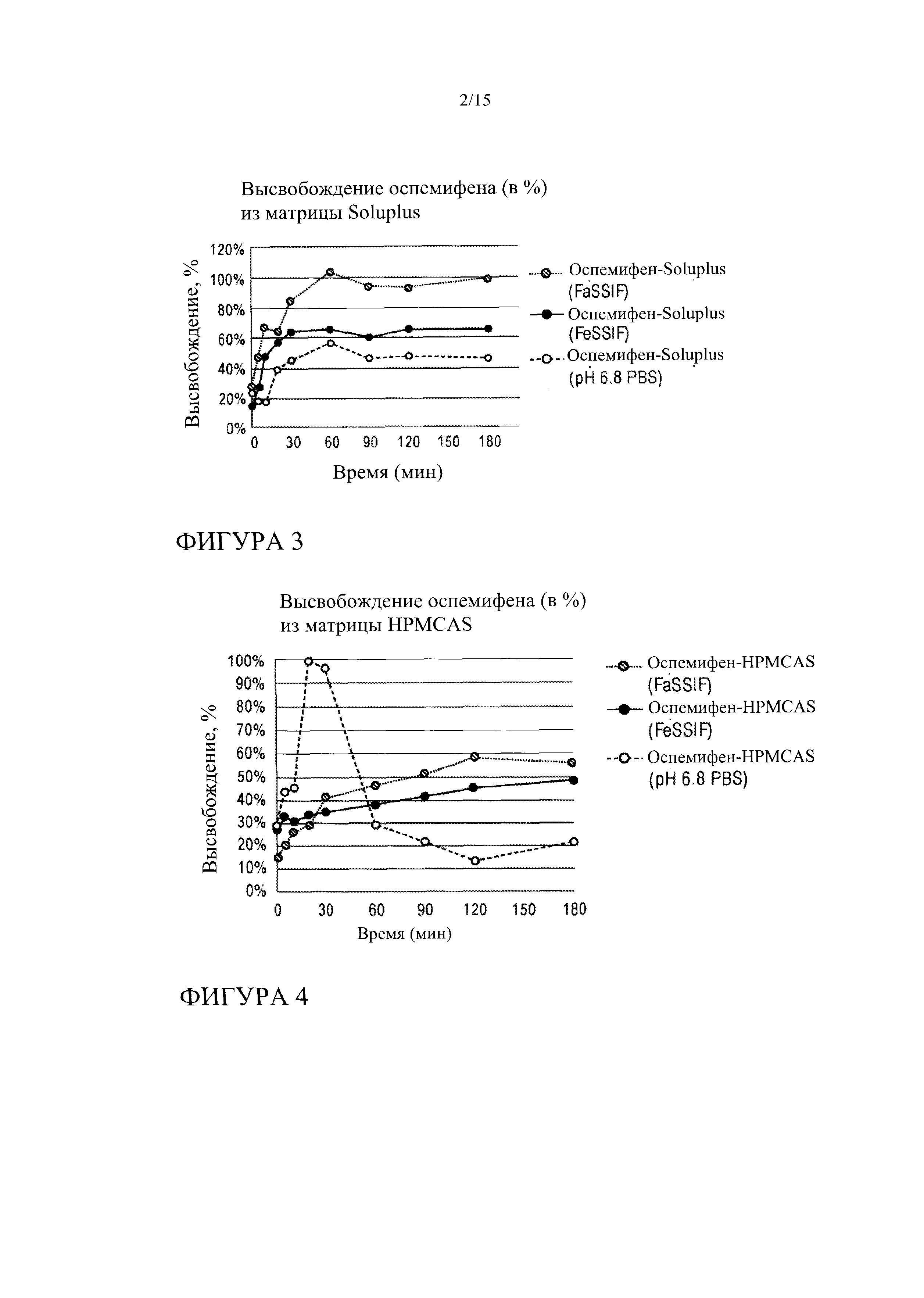
[0024] На фиг. 3 показана кинетика растворения оспемифена из твердой дисперсии, содержащей Soluplus®, в FeSSIF, FaSSIF и PBS, рН 6,8.
[0025] На фиг. 4 показана кинетика высвобождения оспемифена из твердой дисперсии, содержащей HPMCAS, в FeSSIF, FaSSIF и PBS, рН 6,8.
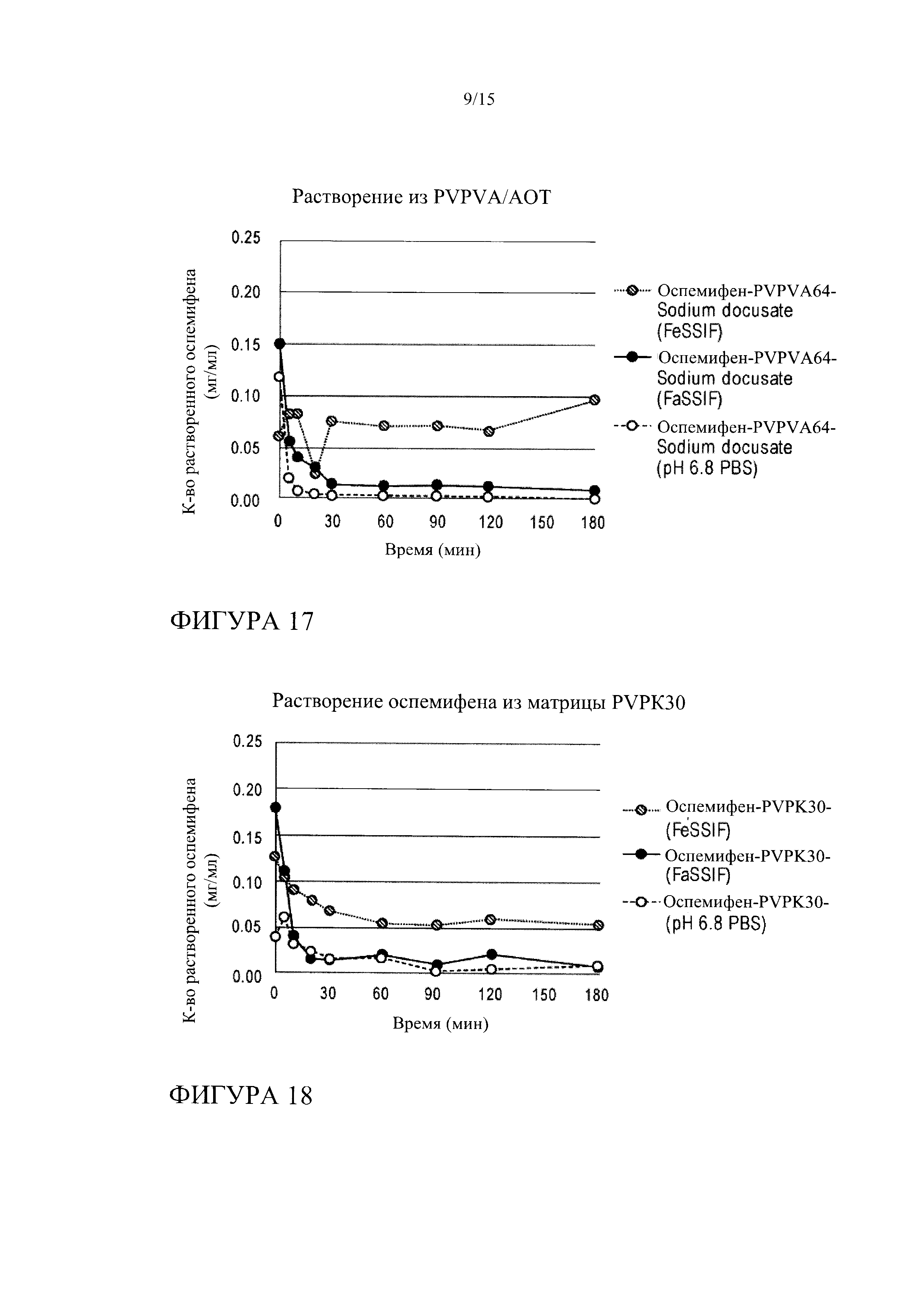
[0026] На фиг. 5 показана кинетика высвобождения оспемифена из твердой дисперсии, содержащей повидон (PVP K30), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0027] На фиг. 6 показана кинетика высвобождения оспемифена из твердой дисперсии, содержащей НРС, в FeSSIF, FaSSIF и PBS, рН 6,8.
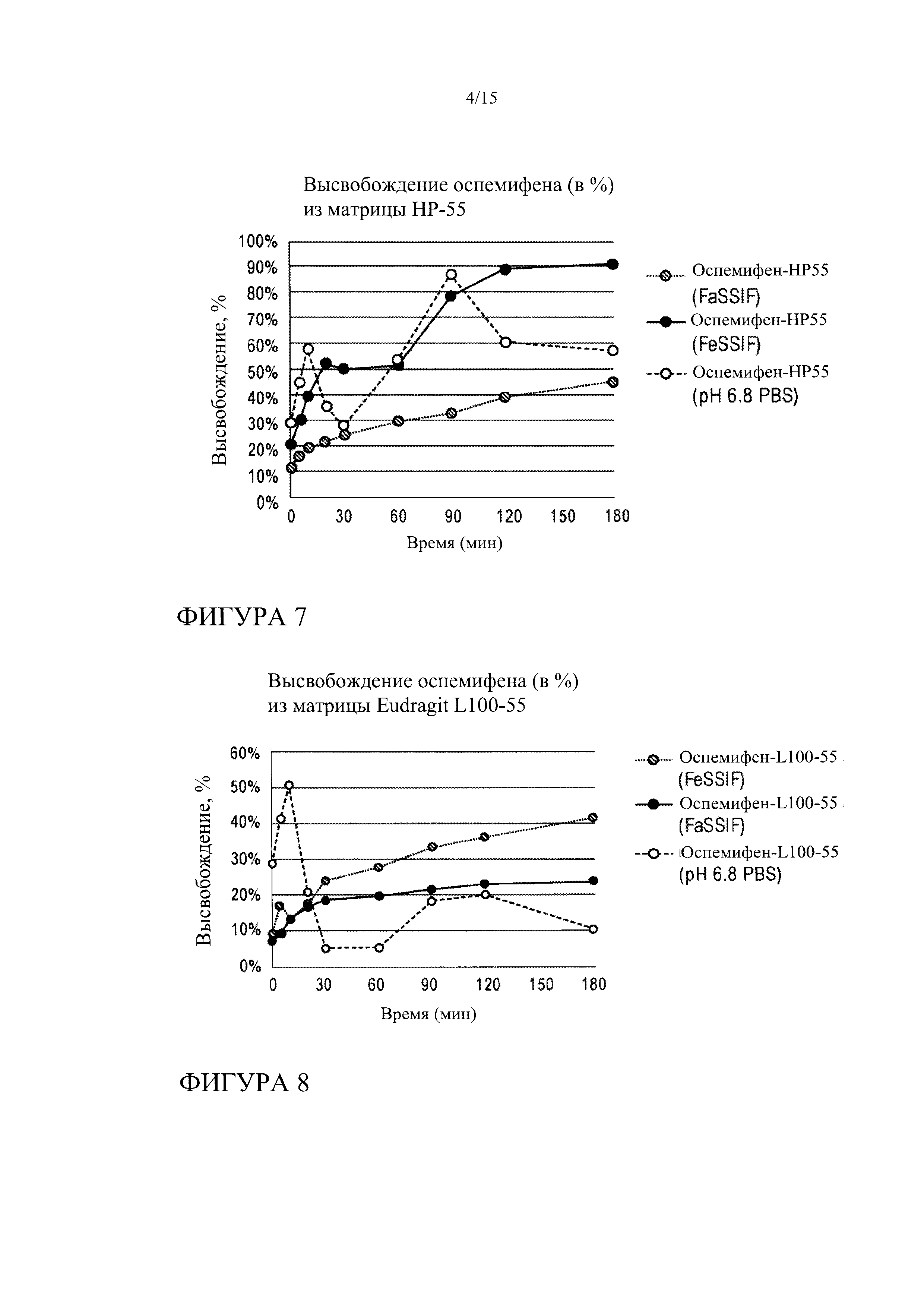
[0028] На фиг. 7 показана кинетика высвобождения оспемифена из твердой дисперсии, содержащей НР-55, в FeSSIF, FaSSIF и PBS, рН 6,8.
[0029] На фиг. 8 показана кинетика высвобождения оспемифена из твердой дисперсии, содержащей Eudragit® L100-55, в FeSSIF, FaSSIF и PBS, рН 6,8.
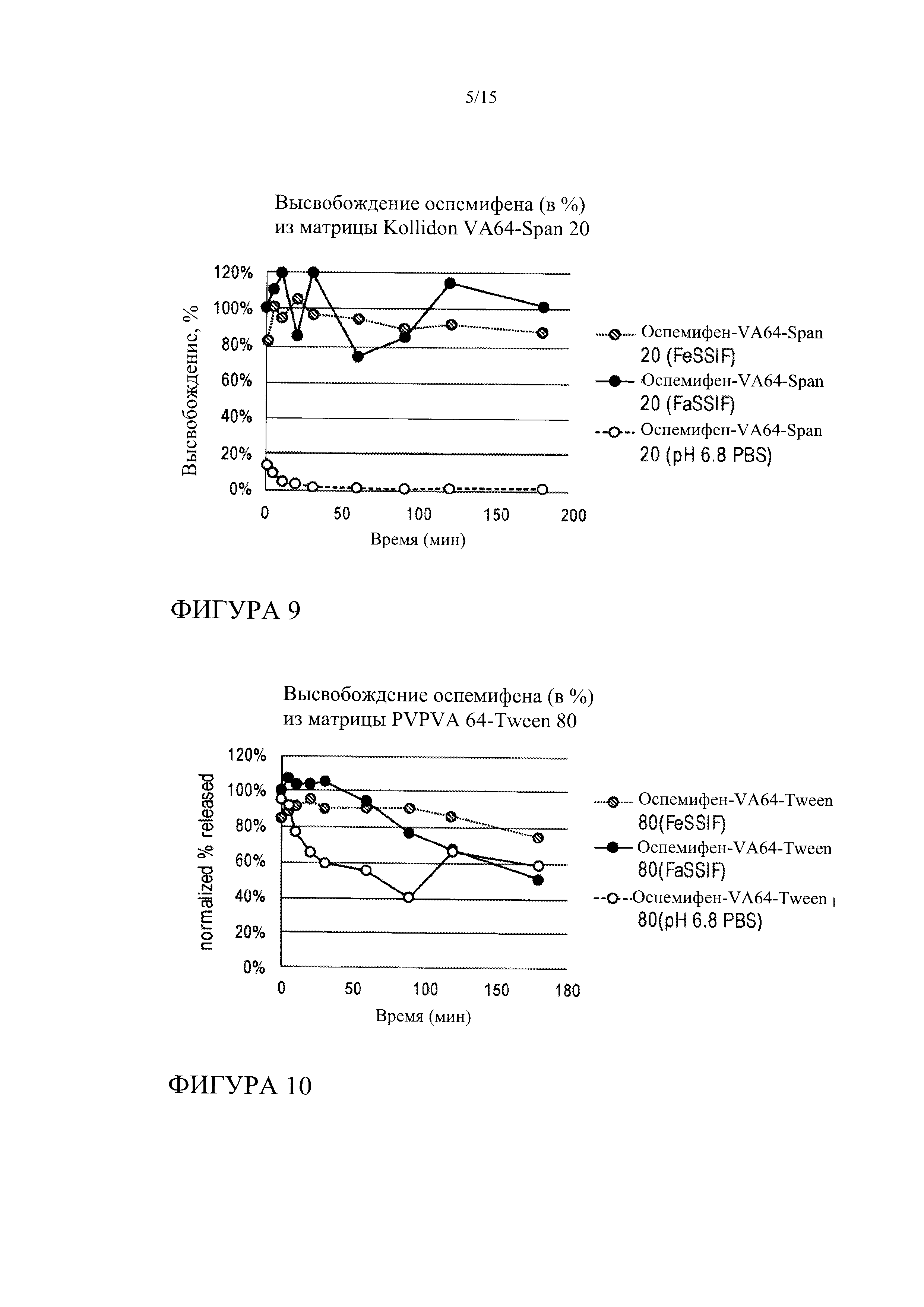
[0030] На фиг. 9 показана кинетика высвобождения оспемифена (целевая концентрация 0,024 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Span 20, в FeSSIF, FaSSIF и PBS, рН 6,8.
[0031] На фиг. 10 показана кинетика высвобождения оспемифена (целевая концентрация 0,024 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Tween 80, в FeSSIF, FaSSIF и PBS, рН 6,8.
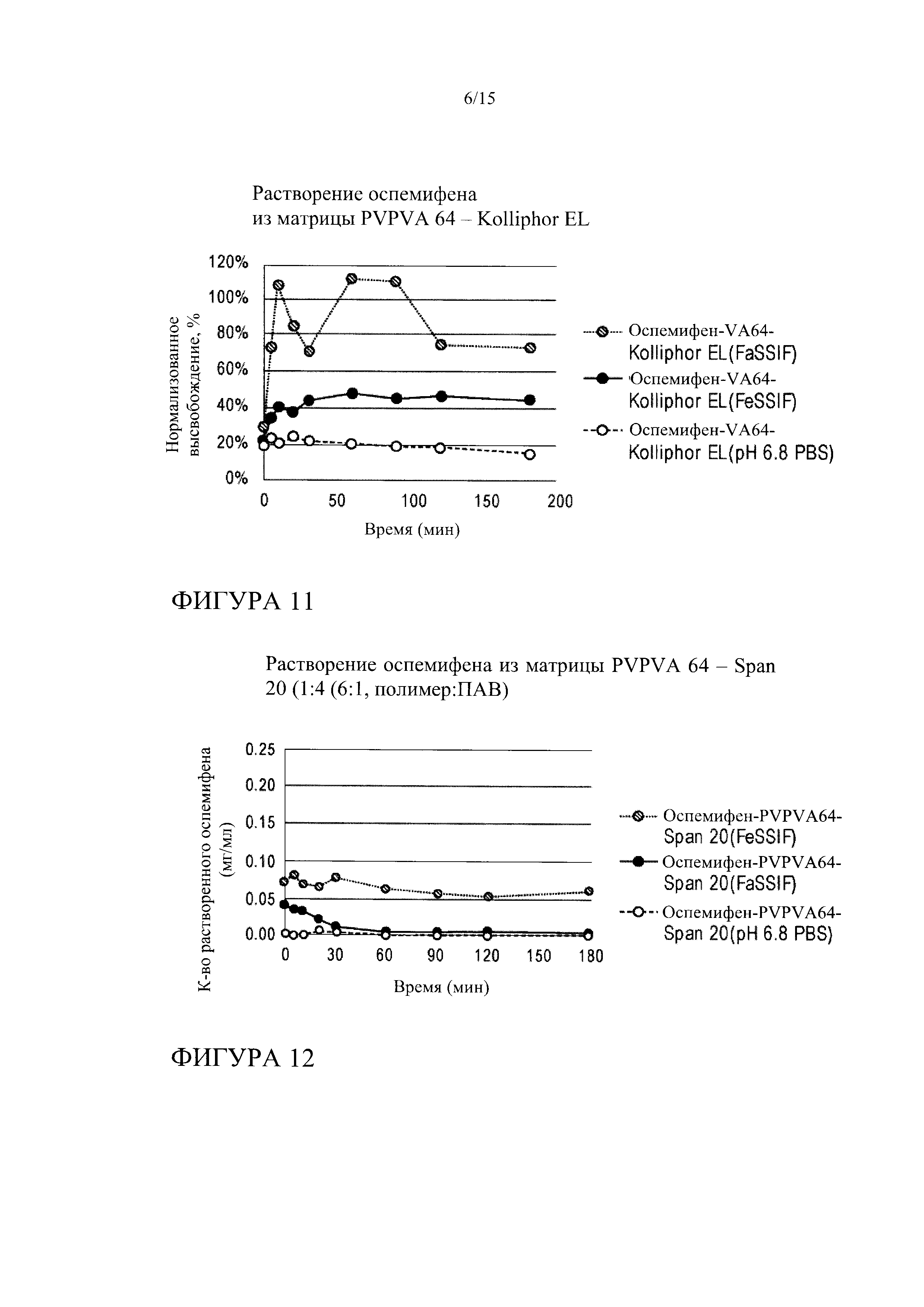
[0032] На фиг. 11 показана кинетика растворения оспемифена (целевая концентрация 0,024 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Kolliphor EL, в FeSSIF, FaSSIF и PBS, рН 6,8.
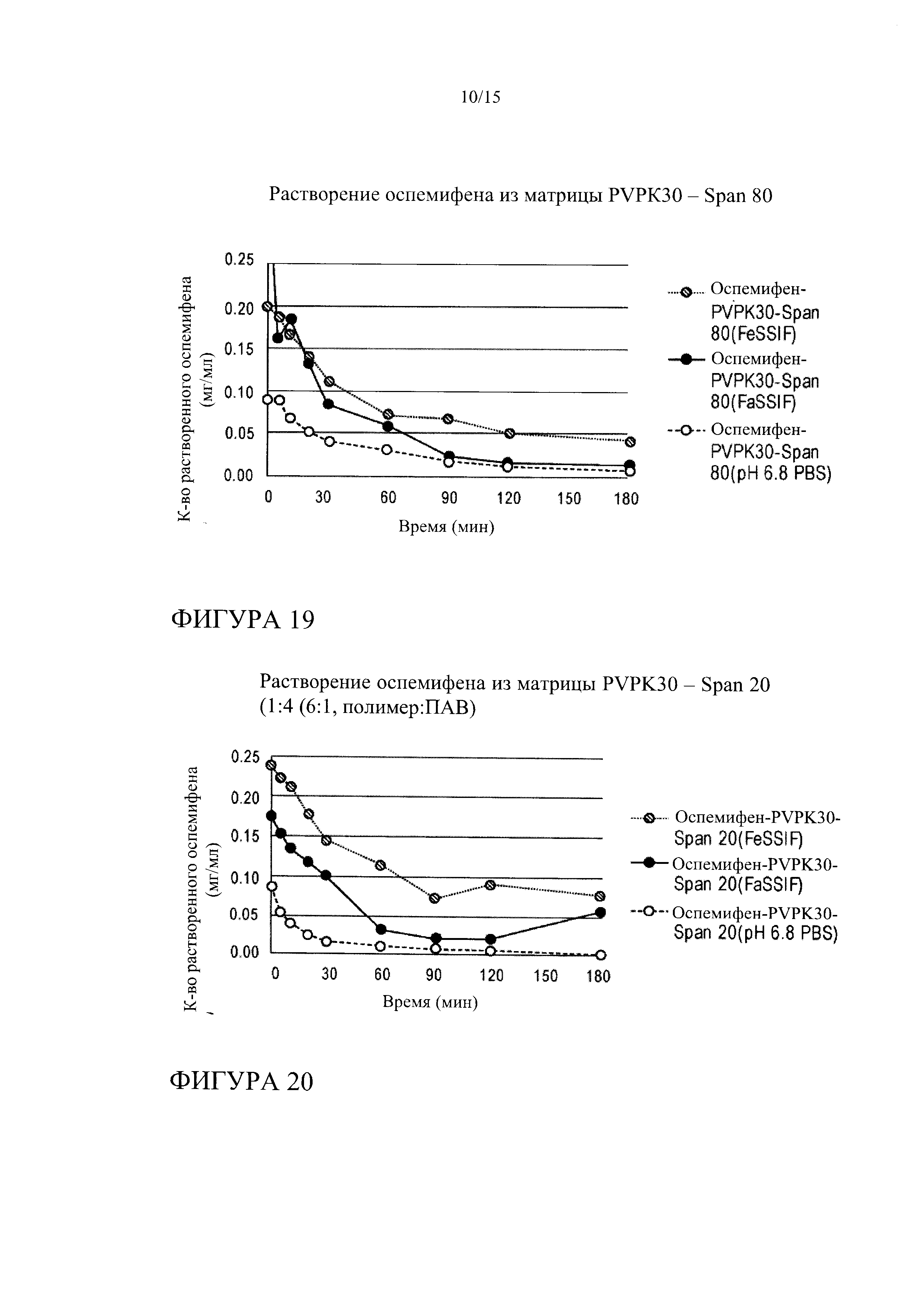
[0033] На фиг. 12 показана кинетика растворения оспемифена (целевая концентрация 0,24 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Span 20, в FeSSIF, FaSSIF и PBS, рН 6,8.
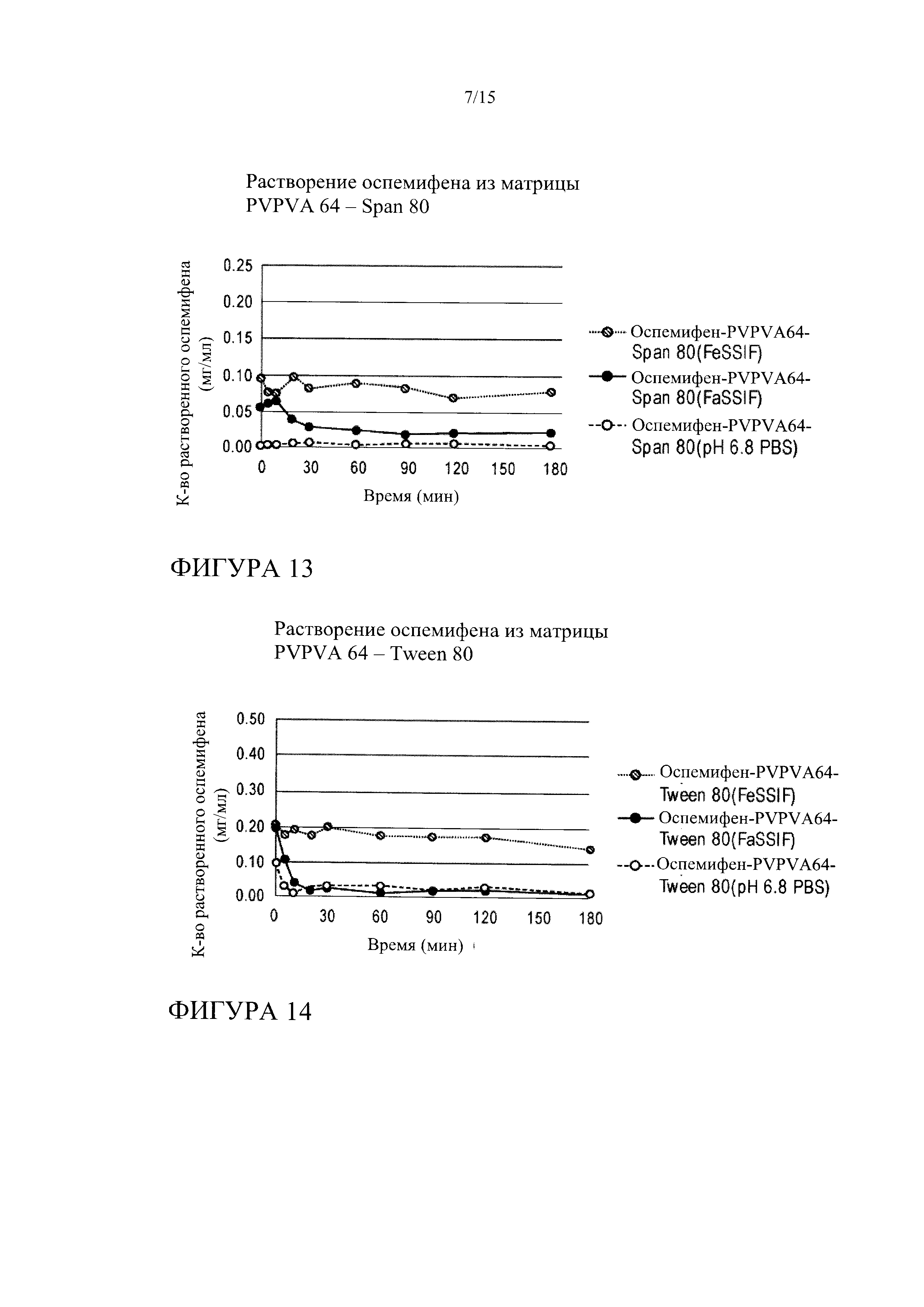
[0034] На фиг. 13 показана кинетика растворения оспемифена (целевая концентрация 0,24 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Span 80, в FeSSIF, FaSSIF и PBS, рН 6,8.
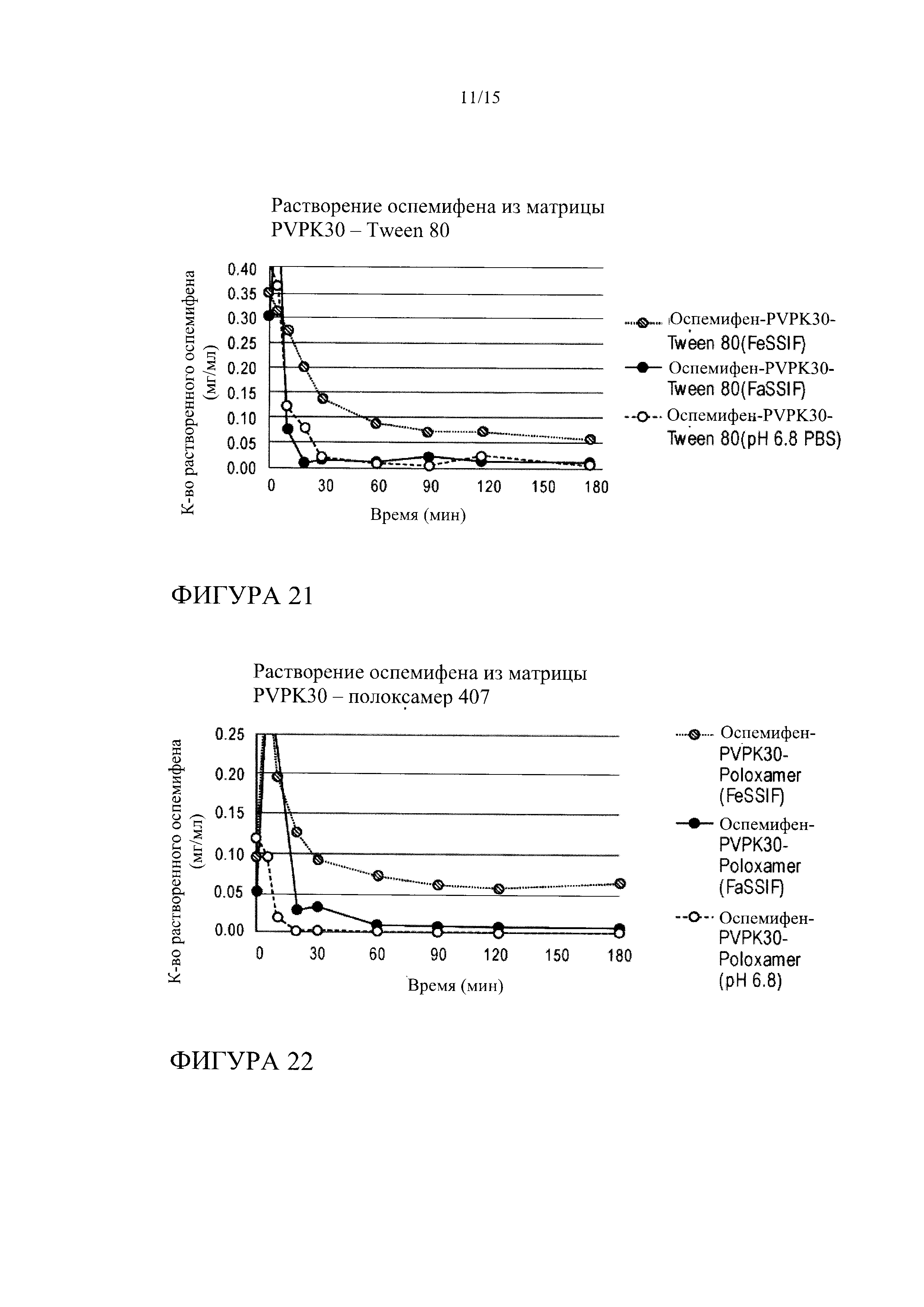
[0035] На фиг. 14 показана кинетика растворения оспемифена (целевая концентрация 0,24 мг/мл) из твердой дисперсии, содержащей коповидон (PVPVA 64) и Tween 80, в FeSSIF, FaSSIF и PBS, рН 6,8.
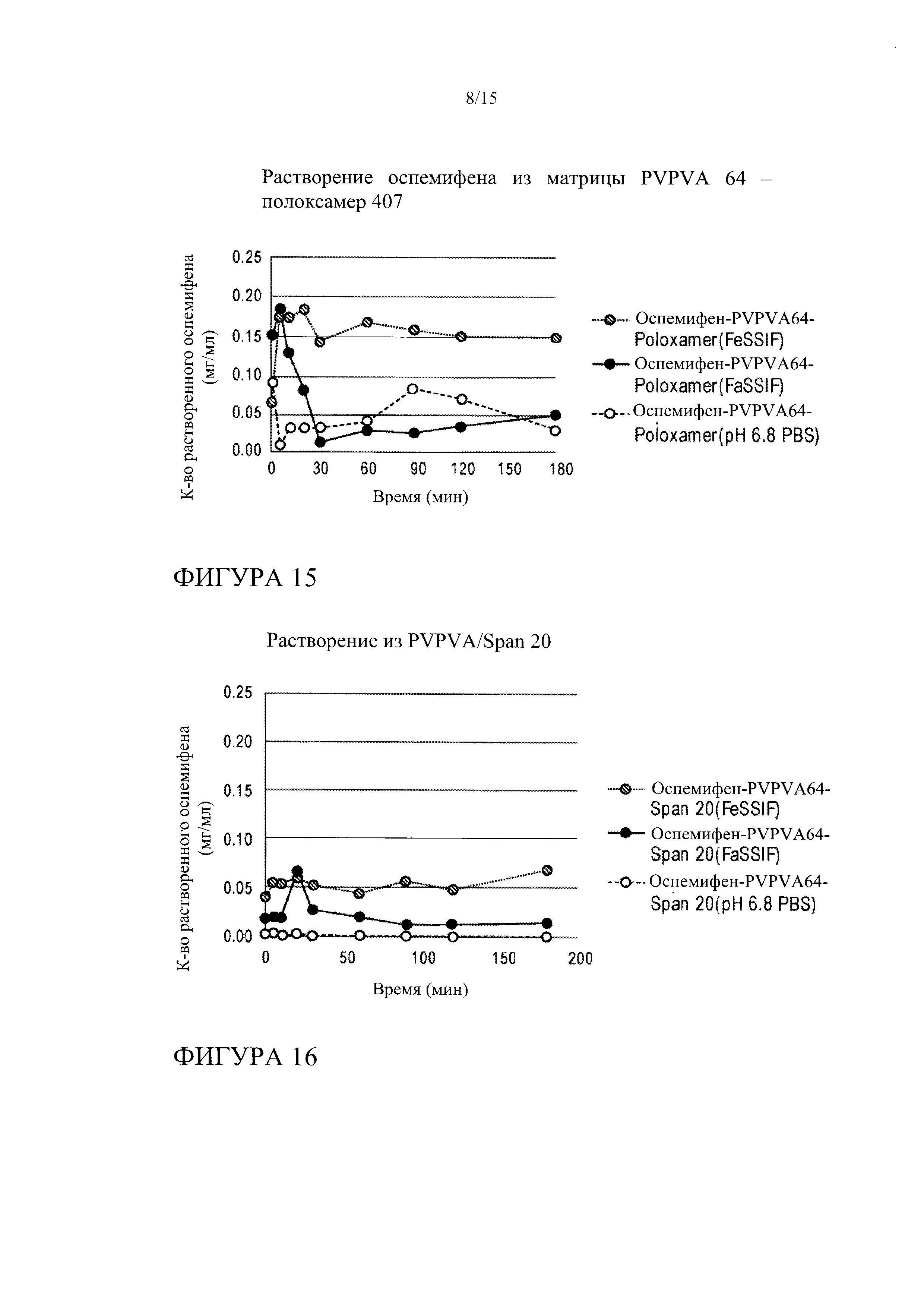
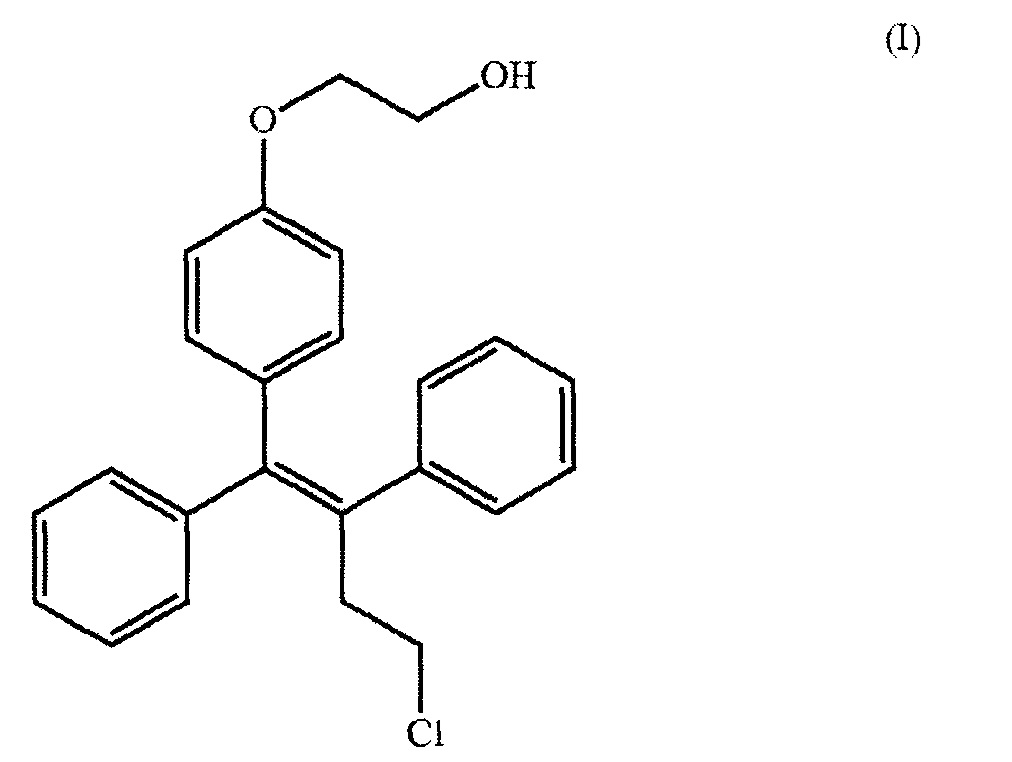
[0036] На фиг. 15 показана кинетика растворения оспемифена из твердой дисперсии, содержащей коповидон (PVPVA 64) 67 и полоксамер 407, в FeSSIF, FaSSIF и PBS, рН 6,8.
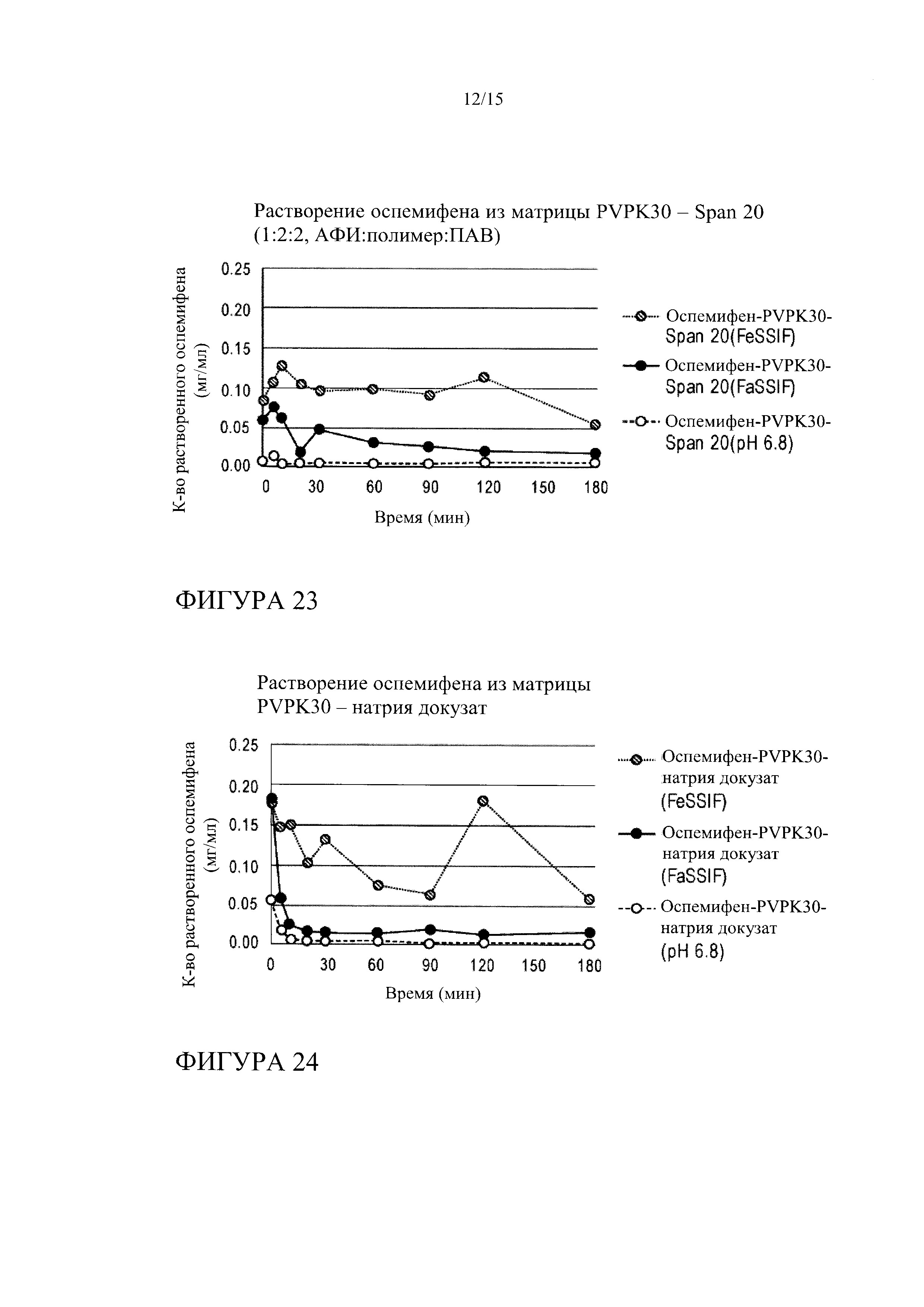
[0037] На фиг. 16 показана кинетика растворения оспемифена из твердой дисперсии, содержащей коповидон (PVPVA 64) и Span 20 (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0038] На фиг. 17 показана кинетика растворения оспемифена из твердой дисперсии, содержащей коповидон (PVPVA 64) и натрия докузат (АОТ), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0039] На фиг. 18 показана кинетика растворения оспемифена (целевая концентрация 0,24 мг/мл) из твердой дисперсии, содержащей повидон (PVP K30), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0040] На фиг. 19 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и Span 80 (лекарственное средство : носитель : поверхностно-активное вещество 1:3,4:0,6), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0041] На фиг. 20 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и Span 20 (лекарственное средство : носитель : поверхностно-активное вещество 1:3,4:0,6), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0042] На фиг. 21 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и Tween 80 (лекарственное средство : носитель : поверхностно-активное вещество 1:3,4:0,6), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0043] На фиг. 22 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и полоксамер 407 (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0044] На фиг. 23 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и Span 20 (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2), в FeSSIF, FaSSIF и PBS, рН 6,8.
[0045] На фиг. 24 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и натрия докузат (АОТ) (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2), в FeSSIF, FaSSIF и PBS, рН 6,8.
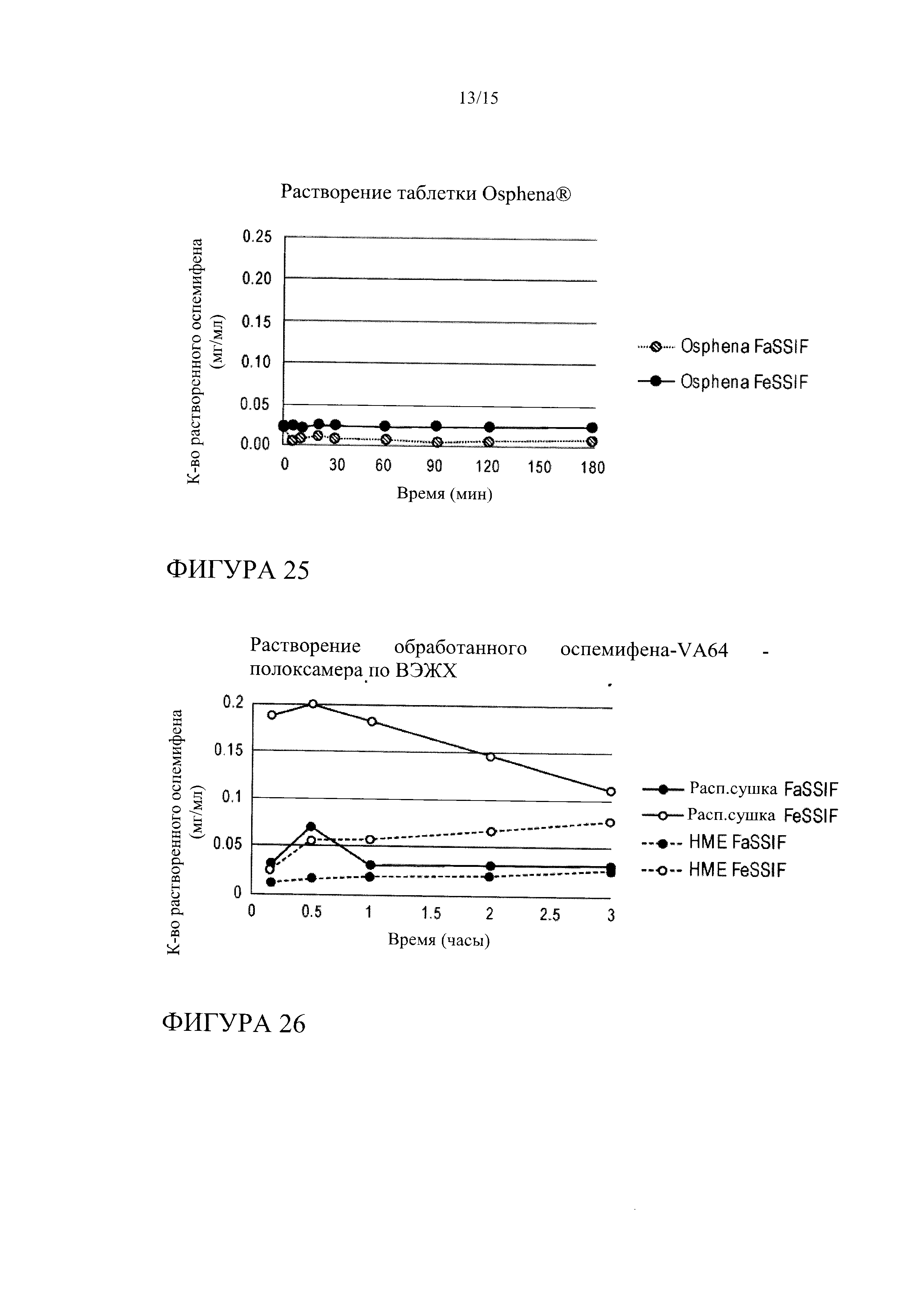
[0046] На фиг. 25 показана кинетика растворения гранул Osphena® в FeSSIF и FaSSIF.
[0047] На фиг. 26 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVPVA K30) и полоксамер 407, в FeSSIF и FaSSIF, при этом указанные твердые дисперсии получают методом распылительной сушки или методом экструзии горячего расплава.
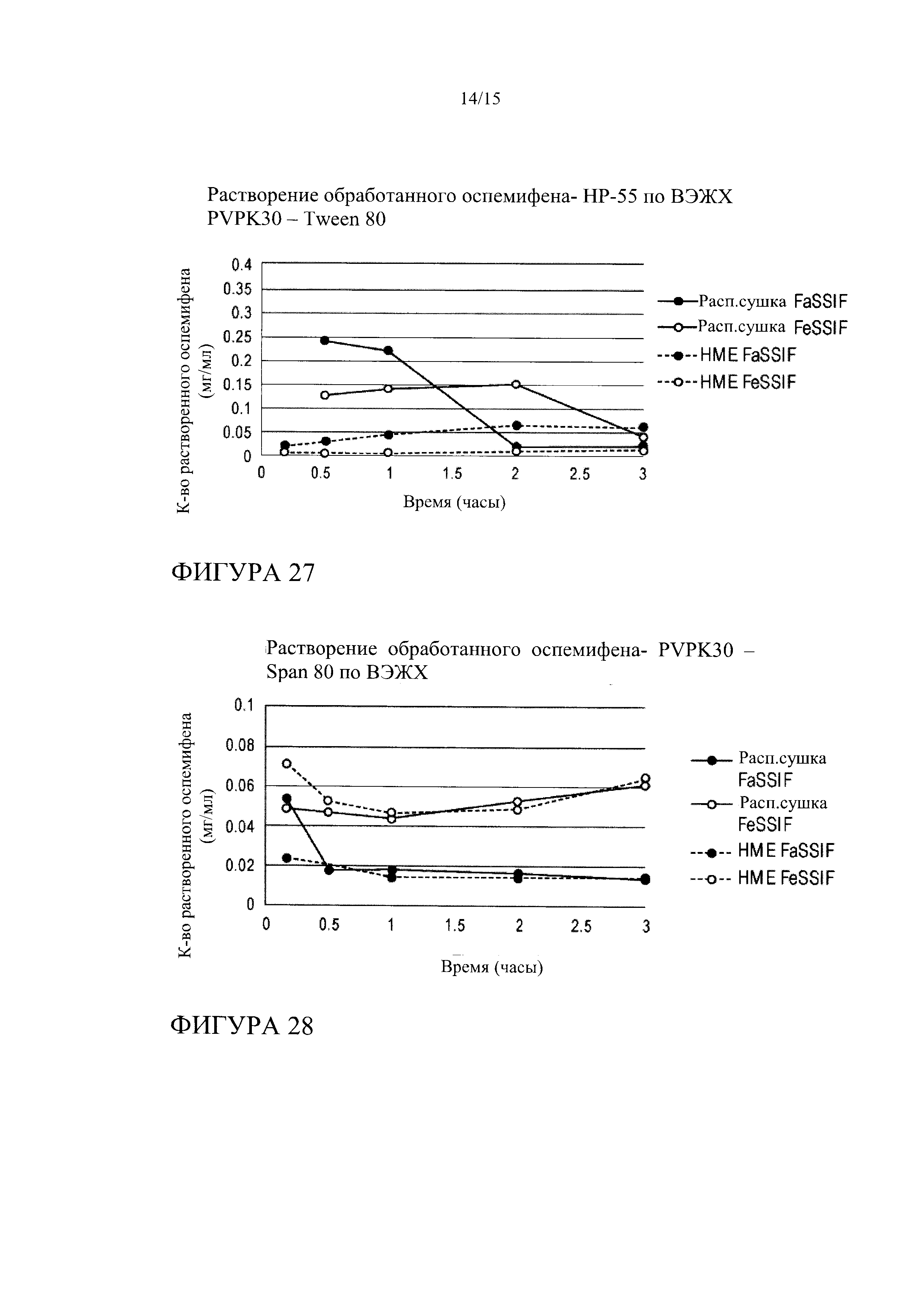
[0048] На фиг. 27 показана кинетика растворения оспемифена из твердой дисперсии, содержащей НР-55, в FeSSIF и FaSSIF, при этом указанные твердые дисперсии получают методом распылительной сушки или методом экструзии горячего расплава.
[0049] На фиг. 28 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVP K30) и Span 80, в FeSSIF и FaSSIF, при этом указанные твердые дисперсии получают методом распылительной сушки или методом экструзии горячего расплава.
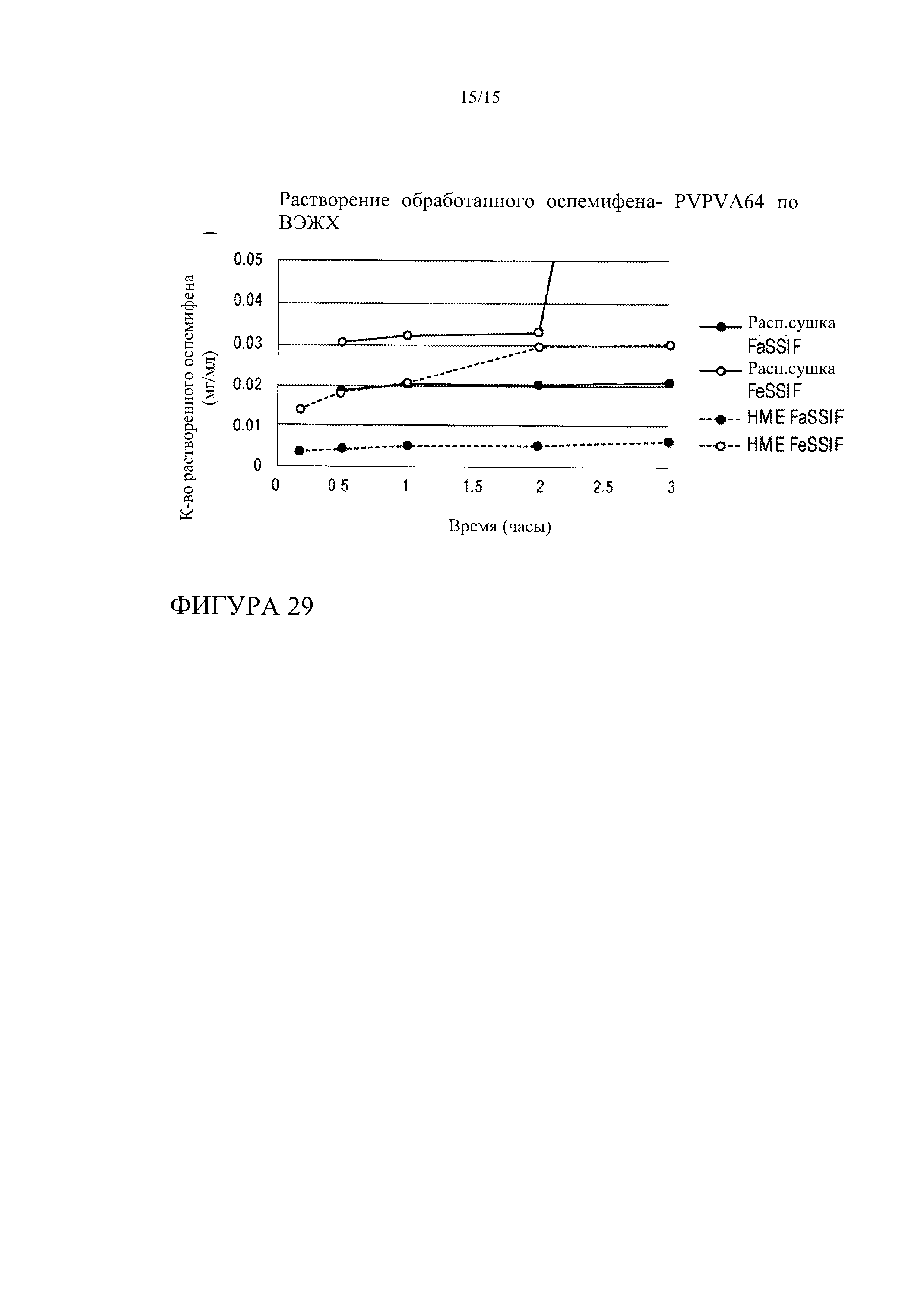
[0050] На фиг. 29 показана кинетика растворения оспемифена из твердой дисперсии, содержащей повидон (PVPVA K30), в FeSSIF и FaSSIF, при этом указанные твердые дисперсии получают методом распылительной сушки или методом экструзии горячего расплава.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0051] Ниже будет сделана ссылка на различные примерные варианты реализации настоящего изобретения, примеры которых проиллюстрированы на прилагаемых графических материалах и обсуждаются в нижеследующем подробном описании. Подразумевается, что подробное описание приведено для того, чтобы дать читателю более полное представление о некоторых вариантах реализации, особенностях и деталях аспектов настоящего изобретения и оно не должно интерпретироваться как ограничение объема изобретения.
1. Определения
[0052] Для того, чтобы настоящее изобретение было более понятным, сначала приведены определения некоторых терминов. Дополнительные определения приведены в подробном описании.
[0053] Термины «субъект», «хозяин», «пациент» и «индивид» используются в настоящем документе взаимозаменяемо для обозначения любого субъекта, представляющего собой млекопитающее, для которого требуется диагностирование или лечение, в частности, человека.
[0054] Термин «активный фармацевтический ингредиент» или «АФИ» относится к веществу, предназначенному для применения в качестве компонента лекарственного средства и для обеспечения фармакологической активности или другого прямого эффекта при диагностировании, излечении, смягчении, лечении или предотвращении заболевания, или для оказания воздействия на структуру или любую функцию организма, в который его вводят. Указанный термин включает любое вещество, предназначенное для окончательной кристаллизации, очистки или получения соли, или для любой комбинации этих действий, для того, чтобы становиться веществом или смесью, применяемыми для того, чтобы обеспечить фармакологическую активность или другое прямое воздействие при диагностировании, излечении, смягчении, лечении или предотвращении заболевания, или для оказания воздействия на структуру или любую функцию организма, в который его вводят.
[0055] Термин «соединение Eudragit®» относится к метакриловому сополимеру, такому как аминоалкил-метакриловый сополимер (немедленное высвобождение), сополимер метакриловой кислоты (замедленное высвобождение), сополимер сложного эфира метакриловой кислоты (контролируемое по времени высвобождение) или сополимер аминоалкил метакрилата (контролируемое по времени высвобождение), которые можно применять при составлении лекарственного средства в целях воздействия на профиль высвобождения лекарственного средства или АФИ. Eudragit® L100-55 представляет собой сополимер метакриловой кислоты и этилакрилата (1:1). Определенная методом гель-проникающей хроматографии (SEC, от англ. size-exclusion chromatography) средневзвешенная молярная масса (Mw) EUDRAGIT® L 100-55 составляет примерно 320000 г/моль. Eudragit® L100 представляет собой сополимер метакриловой кислоты и метилакрилата (1:1). Eudragit® S100 представляет собой сополимер метакриловой кислоты и метилакрилата (1:2). Eudragit® L30 D-55 представляет собой водную дисперсию (30% сухого продукта) сополимера метакриловой кислоты и этилакрилата (1:1). Eudragit® FS 30D представляет собой водную дисперсию (30% сухого продукта) сополимера метилакрилата, метилметакрилата и метакриловой кислоты.
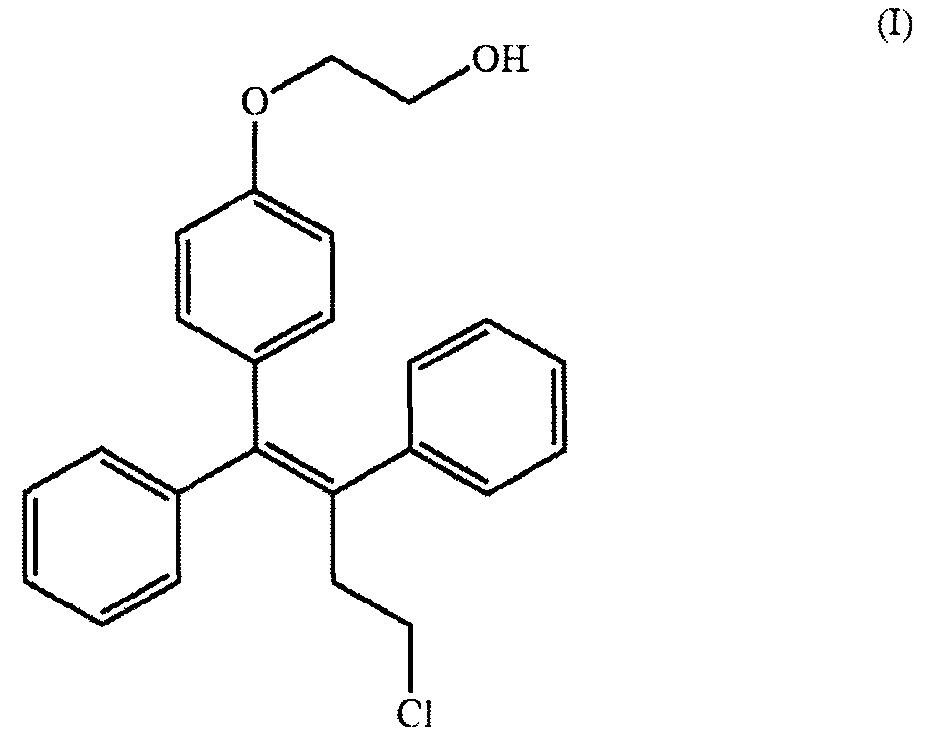
[0056] Термин «оспемифен» относится к Z-изомеру соединения формулы (I):
или его фармацевтически приемлемым солям.
[0057] Используемый в настоящем документе термин «аморфный» означает, например, в тех случаях, когда он относится к АФИ в твердой дисперсии, что кристаллические фракции АФИ составляют менее примерно 5 масс. % в расчете на общую массу твердой дисперсии.
[0058] Используемый в настоящем документе термин «твердая дисперсия» определяется как молекулярная смесь АФИ и одного или более гидрофильных носителей, при этом указанный гидрофильный носитель увеличивает растворимость АФИ. АФИ может быть диспергирован в матрице в виде аморфных кластеров или кристаллических частиц, или АФИ может быть молекулярно диспергирован по всей матрице. Твердую дисперсию получают путем преобразования комбинации жидкого лекарственного средства/носителя в твердое состояние, обычно при помощи процессов плавления или выпаривания растворителя, известных в данной области техники, или путем соосаждения при помощи антирастворителя. По расположению молекул можно различать различные типы твердых дисперсий. Указанные различные типы твердых дисперсий включают, но не ограничиваются ими, следующие: (1) эвтектические смеси; (2) аморфные преципитаты в кристаллической матрице; (3) твердые растворы, в том числе непрерывные твердые растворы, ограниченные твердые растворы, твердые растворы замещения и твердые растворы внедрения; (4) суспензия в стекле, где матрица находится в аморфном состоянии и АФИ диспергирован в указанной матрице в виде кристаллических частиц; (5) суспензия в стекле, где матрица находится в аморфном состоянии и АФИ диспергирован в матрице в виде аморфных кластеров; и (6) раствор в стекле, где матрица находится в аморфном состоянии и молекулы АФИ диспергированы по всей матрице. Это определение не охватывает дисперсию АФИ в гидрофильном носителе при помощи механического перемешивания.
2. Лекарственные средства со слабой растворимостью в воде
[0059] Наряду с проницаемостью растворимость и свойства лекарственного средства являются одним из факторов, определяющих биодоступность пероральной лекарственной формы. Ряд хорошо известных соединений обладает такими характеристиками растворимости, которые осложняют пероральное введение. К ним относятся такие соединения, как гризеофульвин, дигоксин, фенитоин и хлорамфеникол. Появившиеся в недавнее время высокопроизводительные способы скрининга, хотя и обеспечивают повышенную специфичность между соединениями-кандидатами и их прогнозируемыми мишенями, имеют недостатки, выражающиеся в том, что как правило, эти соединения слабо растворимы в воде. Одним из способов, который применяют для улучшения растворимости, является микронизация, в ходе которой уменьшают размер частиц, чтобы увеличить видимую площадь поверхности АФИ. Однако очень мелкие частицы создают другие проблемы, в том числе затрудняют обработку и обладают худшей смачиваемостью. Попытки преодолеть эти ограничения, например, применение органических растворителей или поверхностно-активных веществ, могут привести к снижению переносимости и другим проблемам, относящимся к механике получения лекарственного средства или экономике производства.
[0060] Одним из лекарственных средств, которые проявляют относительно низкую растворимость, является оспемифен, селективный модулятор рецепторов эстрогена (SERM, от англ. Selective Estrogen Receptor Modulator) (Kangas, 1990). Оспемифен представляет собой Z-изомер соединения формулы (I):
Он является одним из основных метаболитов торемифена, есть данные о его агонистической и антагонистической активностью по отношению к эстрогену (Kangas, 1990, и патент США №6245819, включенные во всей полноте посредством ссылки).
[0061] Было показано, что оспемифен обладает антиостеопоротической активностью и уменьшает общий холестерин и холестерин ЛПНП как в экспериментальных моделях, так у волонтеров, представляющих собой людей (патенты США №№5750576 и 6037379, включенные во всей полноте посредством ссылки). Также сообщалось, что указанное соединение обладает противоопухолевой активностью на ранней стадии развития рака молочной железы в экспериментальных моделях на животных.
[0062] Оспемифен также является первым селективным модулятором рецепторов эстрогена, для которого сообщалось, что он обладает благоприятными эффектами при лечении климактерических синдромов (менопаузы) у здоровых женщин. Во время менопаузы и после нее у женщин часто развиваются симптомы, которые обычно связаны с дефицитом эстрогена. Указанные симптомы могут включать приливы, потливость, бессонницу, депрессию, вагинальную сухость, недержание мочи, тошноту, боль, остеопороз, ишемическую болезнь сердца, болезненность молочных желез, отек, утомляемость, снижение сексуальной активности, а также более поздние психологические проблемы (Payer, 1990; Rekers, 1991). Традиционным лечением этих симптомов является введение эстрадиола, что эффективно смягчает последствия менопаузы. Однако, учитывая то, что нормальная функция эстрогена относится к агонисту рецепторов стероидных гормонов, его терапевтическое введение может приводить к нежелательным побочным эффектам, таким как увеличение риска развития рака эндометрия и молочной железы. В некоторых случаях эти риски можно смягчить за счет последовательного введения прогестина, но риск рака молочной железы не уменьшается даже с прогестином.
[0063] Предыдущие исследования оспемифена показали, что указанное соединение может быть полезным для лечения различных симптомов, включая, например, вагинальную сухость и сексуальную дисфункцию (международная патентная публикация WO 02/07718, патент США №6245819, содержание которых полностью включено в настоящее описание посредством ссылки). Испытания на людях показали, что ежедневная доза в диапазоне от примерно 25 мг до примерно 100 мг, в частности, примерно 60 мг, эффективна для облегчения вагинальной сухости и улучшения сексуальной активности. Было также показано, что оспемифен обладает превосходным профилем эстрогенного и антиэстрогенного действия по сравнению с другими антиэстрогенами или селективными модуляторами рецепторов эстрогена. Кроме того, ожидается, что оспемифен может быть эффективен при лечении остеопороза благодаря своей способности взаимодействовать с рецептором эстрогена.
[0064] Однако одно из ограничений, обнаруженных у оспемифена, заключается в том, что он является высоколипофильным и, как результат, обладает слабой растворимостью в воде. Слабая растворимость в воде означает, что для достижения терапевтически эффективных уровней пациенту необходимо вводить большее количество соединения. Подобным образом ожидается, что низкая растворимость снизит общую биодоступность, что будет способствовать задержке во времени от введения лекарственного средства до тех пор, пока оно достигнет целевых тканей. Следовательно, рекомендуемая в настоящее время суточная доза для доступных в настоящее время пероральных лекарственных форм составляет 60 мг. Даже при таких дозах фармакокинетические исследования показали, что большинство оспемифена выводится фекальным путем, что указывает на то, что только незначительная часть принятой внутрь дозы фактически становится биодоступной (Koskimies et al., 2013). Следовательно, было бы очень перспективно предложить форму оспемифена с улучшенными свойствами растворимости, с тем, чтобы улучшить его профиль биодоступности.
3. ТВЕРДЫЕ ДИСПЕРСИИ
[0065] Также хорошо известно, что липофильные соединения, такие как оспемифен, обычно проявляют низкую растворимость в водных растворах. Что касается применения липофильных соединений в качестве потенциальных терапевтических агентов, низкая растворимость в водных растворах может привести к низкой биодоступности. Часто один подход заключается в применении больших доз для достижения терапевтически эффективных уровней АФИ у пациента, при этом такой подход может привести к увеличению стоимости за счет применения большего количества АФИ, чем это может быть действительно необходимо для достижения желаемого терапевтического результата.
[0066] Одной из стратегий в области приготовления фармацевтических лекарственных средств для преодоления ограничений, связанных с соединениями, слабо растворимыми в воде, является синтез твердой дисперсионной формы лекарственного средства (см., например, Vasconcelos et al., 2007; Leuner & Dressman, 2000; Jansenns & Mooter, 2009, и Serajuddin, 1999).
[0067] В целом твердые дисперсии оказывают такое действие: они улучшают растворимость и растворение липофильных лекарственных средств. В свою очередь, ожидается, что при улучшении растворимости и растворения можно достичь улучшения биодоступности и/или снижения дозы для лекарственных средств, которые обычно слабо растворяются в воде. В дополнение к повышению растворимости присутствие гидрофильного носителя может улучшить смачиваемость, что также положительно сказывается на растворении. Обычно растворение лекарственных средств приводит к таким локальным условиям, при которых АФИ находится в пересыщенной концентрации, что способствует осаждению и/или кристаллизации, поэтому улучшенное растворение само по себе не может полностью решить задачу эффективной доставки липофильных соединений. Удобно, что гидрофильные носители, которые обычно применяют в твердых дисперсионных формах, также повышают кинетическую растворимость соединения за счет того, что поддерживают его в аморфном состоянии, тем самым предотвращая кристаллизацию лекарственного средства при растворении.
[0068] Гидрофильные носители, подходящие для получения фармацевтических твердых дисперсий оспемифена, включают, но не ограничиваются ими, полиэтиленгликоль (ПЭГ), предпочтительно с молярной массой примерно от 1,5 до 20 кДа; повидон, также известный как поливинилпирролидон (PVP), предпочтительно с молярной массой примерно от 2,5 до 3000 кДа; поливиниловый спирт (ПВС); кросповидон; сополимер поливинилпирролидона и поливинилацетата (коповидон); гидроксилпропилметилцеллюлозу (НРМС, гипромеллозу), предпочтительно с молярной массой примерно от 10 до 1500 кДа; метилцеллюлозу; сополимеры этиленоксида и пропиленоксида (РЕО/РРО); гидроксипропилцеллюлозу (НРС); карбоксиметилэтилцеллюлозу; гипромеллозы ацетата сукцината (HPMCAS); фталат гидроксипропилметилцеллюлозы (НРМСР); полиакрилаты и полиметакрилаты; соединения Eudragit®; Kollidon® VA64; циклодекстрины; поверхностно-активные вещества (например, инулин, инутек SP1, компритол 888, гелуцир 44/14, полоксамер 407); суперразрыхлители (например, эксплотаб (Explotab), натрий кроскармеллоза); полиолы; сахара; мочевину. См. также, например: Leuner & Dressman, 2000; патентная публикация США №2013/0123353, содержание которых полностью включено в настоящее описание посредством ссылки. Там, где это необходимо, молярную массу указанных гидрофильных носителей (например, ПЭГ, повидон) определяют с использованием методов, известных специалисту в данной области техники, таким образом, каким указанные методы обычно применяют к рассматриваемым молекулам.
[0069] В различных примерных вариантах реализации настоящего изобретения указанный гидрофильный носитель выбран из по меньшей мере одного из поливинилпирролидина (также известного как повидон или PVP) (например, PVP K30), сополимеров поливинилпирролидина/винилацетата (также известных как коповидон или PVPVA) (например, PVPVA64, Kollidon® VA64), гидроксилпропилметилцеллюлозы (НРМС), гипромеллозы ацетата сукцината (HPMCAS), соединений Eudragit® (например, Eudragit® L100-55, Eudragit® S100, Eudragit® L30 D-55, Eudragit® FS 30D), гидроксипропилцеллюлозы (НРС) (например, HPC-SL), привитых сополимеров поливинил капролактам/поливинилацетат/полиэтиленгликоль (например, Soluplus®) и фталата гидроксипропилметилцеллюлозы (НРМСР) (например, НР-55).
[0070] В некоторых случаях для того, чтобы оказывать оптимальное влияние на эффективность указанного лекарственного средства, будет выгодным варьировать соотношение лекарственного средства к гидрофильному носителю. Например, в случае оспемифена, оспемифен можно комбинировать с гидрофильными носителями, описанными в настоящем документе (например, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, Eudragit®, привитые сополимеры поливинил капролактам/поливинилацетат, и НРМСР или их смеси) в массовом соотношении от примерно 2:1 до примерно 1:50, от примерно 1:1 до примерно 1:20, от примерно 1:1 до примерно 1:15, от примерно 1:1 до примерно 1:10, от примерно 1:1 до примерно 1:5, от примерно 1:2 до примерно 1:5 или от примерно 1:2 до примерно 1:4. В одном варианте реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю составляет примерно 1:4.
[0071] В некоторых вариантах реализации настоящего изобретения указанная твердая дисперсия может дополнительно содержать одно или более поверхностно-активных веществ. Указанное поверхностно-активное вещество может быть неионным, анионным, катионным, амфотерным или цвиттерионным.
[0072] Примеры подходящих неионных поверхностно-активных веществ включают этоксилированные триглицериды; этоксилаты жирных спиртов; этоксилаты алкилфенолов; этоксилаты жирных кислот; этоксилаты жирных амидов; этоксилаты жирных аминов; алканоаты сорбитана; этилированные алканоаты сорбитана; алкилэтоксилаты; Pluronics™; алкилполиглюкозиды; стеарил этоксилаты; алкилполигликозиды.
[0073] Примеры подходящих анионных поверхностно-активных веществ включают алкилэфирсульфаты; алкилэфиркарбоксилаты; алкилбензолсульфонаты; алкилэфирфосфаты; диалкилсульфосукцинаты; саркозинаты; алкилсульфонаты; мыло; алкилсульфаты; алкилкарбоксилаты; алкилфосфаты; парафинсульфонаты; вторичные н-алкансульфонаты; альфа-олефинсульфонаты; изетионатсульфонаты.
[0074] Примеры подходящих катионных поверхностно-активных веществ включают соли жирных аминов; соли жирных диаминов; соединения четвертичного аммония; фосфониевые поверхностно-активные вещества; сульфониевые поверхностно-активные вещества; сульфоксониевые поверхностно-активные вещества.
[0075] Примеры подходящих цвиттерионных поверхностно-активных веществ включают N-алкильные производные аминокислот (таких как глицин, бетаин, аминопропионовая кислота); имидазолиновые поверхностно-активные вещества; аминоксиды; амидобетаины.
[0076] Неограничивающие примеры поверхностно-активного вещества, которое можно применять в твердых дисперсиях оспемифена, включают, например, Tween 20, Tween 80, Span 20, Span 80, докузат натрия (например, АОТ), лаурилсульфат натрия и полоксамеры (например, полоксамер 407, Kolliphor® EL, Pluronic F68). Полоксамеры также известны под коммерческими обозначениями Synperonics®, Pluronics® и Kolliphor®/Cremophor®.
[0077] В некоторых случаях для того, чтобы оказывать оптимальное влияние на эффективность лекарственного средства, будет выгодным варьировать соотношение гидрофильного носителя к поверхностно-активному веществу. Например, в случае твердых дисперсий оспемифена гидрофильные носители, описанные в настоящем документе, можно комбинировать с поверхностно-активными веществами, описанными в настоящем документе, в массовом соотношении от примерно 1:1 до примерно 10:1, от примерно 1:1 до примерно 6:1, от примерно 1:1 до примерно 5:1, от примерно 1:1 до примерно 4:1, от примерно 1:1 до примерно 3:1 или от примерно 1:1 до примерно 2:1. В одном варианте реализации настоящего изобретения массовое соотношение гидрофильного носителя к поверхностно-активному веществу составляет примерно 6:1. В другом варианте реализации настоящего изобретения массовое соотношение гидрофильного носителя к поверхностно-активному веществу составляет примерно 1:1.
[0078] В некоторых случаях для того, чтобы оказывать оптимальное влияние на эффективность лекарственного средства, будет выгодным варьировать соотношение лекарственного средства, гидрофильного носителя и поверхностно-активного вещества. Например, в случае твердых дисперсий оспемифена, оспемифен можно комбинировать с гидрофильными носителями, описанными в настоящем документе, и поверхностно-активными веществами, описанными в настоящем документе, в массовом соотношении, варьирующемся от примерно 1:2-4:0,5-4. В одном варианте реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю и к поверхностно-активному веществу составляет примерно 1:3,4:0,6. В другом варианте реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю и к поверхностно-активному веществу составляет примерно 1:2:2.
4. Фармацевтические композиции
[0079] Указанные твердые дисперсии оспемифена и гидрофильного носителя можно получать в виде фармацевтической композиции. Подходящие формы составов для описанных в настоящем документе фармацевтических композиций включают, например, таблетки, капсулы, мягкие капсулы, гранулы, порошки, суспензии, эмульсии, микроэмульсии, наноэмульсии, стандартные лекарственные формы, кольца, пленки, суппозитории, растворы, кремы, сиропы, трансдермальные пластыри, мази и гели.
[0080] В некоторых вариантах реализации настоящего изобретения фармацевтические композиции, описанные в настоящем документе, можно получить путем влажной или сухой грануляции. Грануляция представляет собой способ, в котором частицы первичного порошка изготавливают с возможностью сцепления с образованием более крупных объектов, состоящих из множества частиц и известных как гранулы. Фармацевтические гранулы обычно имеют размер от примерно 0,2 мм до примерно 4,0 мм в зависимости от их последующего применения. Например, при получении таблеток или капсул гранулы можно изготовить в виде промежуточного продукта, такие гранулы в определенных вариантах реализации настоящего изобретения имеют размер от примерно 0,2 до примерно 0,5 мм.
[0081] Способы грануляции можно разделить на два типа: влажная грануляция и сухая грануляция. В некоторые фармацевтические композиции, описанные в настоящем документе, можно добавлять по меньшей мере одно дополнительное вспомогательное вещество, такое как разбавители, с получением единичной дозы подходящего веса и размера, и дезинтегрирующих агентов, которые добавляют для облегчения расщепления указанной гранулы, когда она достигает жидкой среды, например, при проглатывании пациентом. Кроме того, можно также добавлять адгезивы, такие как сухие порошки, например, если применяют сухую грануляцию. Перед грануляцией можно смешать дополнительные вспомогательные вещества. В некоторых вариантах реализации настоящего изобретения по меньшей мере один из дополнительных вспомогательных веществ представляет собой не встречающийся в природе ингредиент.
[0082] В описанных в настоящем документе способах сухой грануляции частицы первичные порошка можно агрегировать под высоким давлением. Существует два основных процесса: либо крупногабаритную таблетку (известную как брикет) можно получать в высокопроизводительных прессах для таблетирования, либо указанный порошок можно под давлением пропустить между двумя роликами с получением листа материала (известного как роликовое уплотнение). Указанные промежуточные продукты можно раздробить любым подходящим способом измельчения. Способы сухого гранулирования можно использовать для лекарственных средств, чувствительных к влаге.
[0083] Способы влажной грануляции включают перемешивание смеси частиц сухого первичного порошка с применением гранулирующей жидкости. Указанная жидкость может содержать нетоксичный растворитель, который является летучим, чтобы его можно было удалить при помощи сушки. Типичные жидкости могут включать, например, по меньшей мере одну из следующих: вода, этанол и изопропанол. Указанную жидкость для гранулирования можно применять отдельно или в качестве растворителя, содержащего растворенный адгезив (связующее вещество), который можно применять для обеспечения адгезии частиц после высушивания гранул. Затем влажную массу пропускают через сито с получением влажных гранул, которые затем сушат. На последующей стадии скрининга разрушают агломераты и удаляют тонкий материал.
[0084] Тестирование на растворение in vitro может служить инструментом для характеристики биофармацевтического качества продукта на разных этапах его жизненного цикла. На ранней стадии разработки лекарственного средства на основании свойств растворения in vitro выбирают между различными композициями, которые являются альтернативными кандидатами на дальнейшую разработку, и производят оценку активных ингредиентов/лекарственных средств. Более того, данные о растворении in vitro могут иметь значение при оценке изменений на производственной площадке, производственного процесса или приготовления и оказать свое влияние при принятии решения относительно необходимости изучения биодоступности.
[0085] Абсорбирование лекарственного средства из твердой лекарственной формы после перорального введения зависит от высвобождения указанного лекарственного средства из лекарственного продукта, растворения или солюбилизации указанного лекарственного средства в физиологических условиях и проницаемости в желудочно-кишечном тракте. Растворение in vitro может иметь отношение к предсказанию эффективности in vivo. Исходя из приведенных общих соображений, испытания на растворение in vitro для твердых дисперсионных пероральных лекарственных форм, таких как таблетки и капсулы, можно применять для: а) оценки качества лекарственного продукта от партии к партии; b) определения направления разработки новых составов; и с) обеспечения постоянного качества и эффективности продукта после определенных изменений, таких как изменения в составе, производственном процессе, месте производства и при масштабировании производственного процесса.
[0086] В некоторых вариантах реализации указанных фармацевтических композиций после однократного введения субъекту, представляющему собой человека, лекарственной формы твердой дисперсии оспемифена наблюдается большая биодоступность оспемифена или нет существенной разницы в биодоступности оспемифена, при введении указанной композиции субъекту натощак по сравнению с введением после приема пищи. Другими словами, в некоторых вариантах реализации настоящего изобретения пища не увеличивает биологическую доступность лекарственной формы твердой дисперсии оспемифена, как это происходит с другими препаратами оспемифена, такими как Osphena®, где биодоступность значительно выше при введении после приема пищи.
[0087] В фармацевтической композиции согласно некоторым вариантам реализации настоящего изобретения, описанным в настоящем документе, внутригранулярное вспомогательное вещество может содержать по меньшей мере один ингредиент, который может принадлежать к той же или к различным категориям вспомогательных веществ. Например, внутригранулярное вспомогательное вещество может содержать по меньшей мере один разрыхлитель, по меньшей мере один разбавитель и/или по меньшей мере одно связующее вещество. Соответственно, внутригранулярное вспомогательное вещество может представлять собой комбинацию по меньшей мере одного разбавителя и по меньшей мере одного связующего вещества; комбинацию по меньшей мере одного разбавителя и по меньшей мере одного разрыхлителя; комбинацию по меньшей мере одного разрыхлителя и по меньшей мере одного связующего вещества; или комбинацию по меньшей мере одного разбавителя, по меньшей мере одного разрыхлителя и по меньшей мере одного связующего вещества.
[0088] В качестве типичных неограничивающих примеров указанного по меньшей мере одного разрыхлителя, который можно добавлять в фармацевтическую композицию согласно описанным в настоящем документе вариантами реализации настоящего изобретения, можно упомянуть повидон, кросповидон, карбоксиметилцеллюлозу, метилцеллюлозу, альгиновую кислоту, натрия кроскармеллозу, натрия крахмалгликолят, крахмал (например, кукурузный крахмал, картофельный крахмал), формальдегид-казеин, альгиновую кислоту, диоксид кремния, гуаровую камедь и их комбинации. В некоторых вариантах реализации настоящего изобретения по меньшей мере один разрыхлитель представляет собой не встречающийся в природе ингредиент.
[0089] В качестве типичных неограничивающих примеров указанного по меньшей мере одного разбавителя, который можно добавлять в фармацевтическую композицию в соответствии с описанными в настоящем документе вариантами реализации настоящего изобретения, можно назвать сахар (например, мальтозу, лактозу, фруктозу, сахарозу), целлюлозный материал (например, микрокристаллическую целлюлозу, силиконизированную микрокристаллическую целлюлозу, порошкообразную целлюлозу), крахмал (например, кукурузный крахмал, прежелатинизированный, мальтодекстрин, декстрин), сахарный спирт (например, маннитол, сорбитол), декстрат, фосфат кальция, смолу, акрилат (например, полиметилакрилат), карбонат кальция, оксид магния, тальк и их комбинации. В некоторых вариантах реализации настоящего изобретения по меньшей мере один разбавитель представляет собой не встречающийся в природе ингредиент.
[0090] В качестве типичных неограничивающих примеров указанного по меньшей мере одного связующего вещества, которое можно добавлять в фармацевтическую композицию согласно описанным в настоящем документе вариантам реализации настоящего изобретения, можно назвать аравийскую камедь, желатин, карбомер, декстрин, крахмал (например, кукурузный крахмал), повидон, коповидон, карбоксиметилцеллюлозу, гуаровую камедь, глюкозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этил целлюлозу, гипромеллозы ацетата сукцинат, полиметакрилаты, мальтодекстрин, гидроксиэтилцеллюлозу и их комбинации. В некоторых вариантах реализации настоящего изобретения по меньшей мере одно связующее вещество представляет собой не встречающийся в природе ингредиент.
[0091] Грануляты можно получить либо путем сухой грануляции, либо путем влажной грануляции в соответствии с известной технологией. Подходящие растворители при влажной грануляции могут содержать, например, воду или этанол.
[0092] Конечной фармацевтической композицией может быть любая подходящая композиция, такая как таблетки, капсулы, грануляты как таковые или грануляты, упакованные в виде подходящих лекарственных форм, капсуловидные таблетки, пастилки для рассасывания и тому подобное. Термин «таблетка» следует понимать как охватывающий любые типы таблеток, такие как таблетки без покрытия, таблетки с покрытием, таблетки с пленочным покрытием, шипучие таблетки, пероральные лиофилизаты, таблетки, диспергируемые в полости рта, таблетки, покрытые кишечнорастворимой оболочкой, таблетки с пролонгированным высвобождением, таблетки с модифицированным высвобождением, жевательные таблетки, жевательные резинки и пилюли. Под гранулятами также следует понимать шипучие грануляты, покрытые кишечнорастворимой оболочкой грануляты, грануляты с пролонгированным высвобождением и грануляты с модифицированным высвобождением. Под капсулами также следует понимать покрытые кишечнорастворимой оболочкой капсулы, капсулы с пролонгированным высвобождением и капсулы с модифицированным высвобождением.
[0093] Фармацевтическая композиция, описанная в настоящем документе, может представлять собой, например, капсулу, содержащую грануляты, инкапсулированные в оболочку из желатина, или тому подобное. Указанная фармацевтическая композиция может в дополнение к гранулятам содержать по меньшей мере одно внегранулярное смазывающее вещество. Указанное по меньшей мере одно смазывающее вещество можно выбрать, например, из полиэтиленгликоля, лаурилсульфата натрия, стеарата кальция, стеарата магния, стеариновой кислоты, талька, растительных масел, полоксамеров, минеральных масел, лаурилсульфата натрия, стеарилфумарата натрия и стеарата цинка. В некоторых вариантах реализации настоящего изобретения по меньшей мере одно смазывающее вещество представляет собой не встречающийся в природе ингредиент. Указанная фармацевтическая композиция может также содержать другие внегранулярные вспомогательные вещества, такие как разбавители.
[0094] Альтернативно, фармацевтическая композиция, описанная в настоящем документе, может представлять собой таблетку, содержащую грануляты в комбинации с по меньшей мере одним внегранулярным вспомогательным веществом. Указанное по меньшей мере одно внегранулярное вспомогательное вещество можно выбрать, например, из разрыхлителей, разбавителей, связующих и смазывающих веществ. Указанный по меньшей мере один внегранулярный разрыхлитель также может представлять собой один из разрыхлителей, упомянутых выше, или их комбинацию. Аналогично указанные внегранулярные разбавители, связующие и смазывающие вещества можно выбрать из указанных выше.
[0095] В некоторых вариантах реализации фармацевтических композиций, описанных в настоящем документе, указанные активные фармацевтические ингредиенты, такие как оспемифен, можно покрывать оболочкой для обеспечения лучшей химической стабильности, уменьшения несовместимости или способствования пролонгированному высвобождению. Например, описанные в настоящем документе фармацевтические композиции можно приготовить в виде лекарственной формы, представляющей собой таблетку с немедленным высвобождением, или в виде лекарственной формы, представляющей собой таблетку с контролируемым высвобождением. В таблетках для достижения пролонгированного высвобождения можно применять по меньшей мере один полимер с контролируемым высвобождением, такой как гипромеллоза, полиэтиленоксиды, этил целлюлоза, аммониевые метакрилатные сополимеры и тому подобное. В некоторых вариантах реализации настоящего изобретения указанный по меньшей мере один полимер с контролируемым высвобождением представляет собой не встречающийся в природе ингредиент.
[0096] В некоторых вариантах реализации настоящего изобретения, описанных в настоящем документе, указанная фармацевтическая композиция может также содержать другие внегранулярные ингредиенты, такие как ароматизаторы, красители, консерванты, суспендирующие добавки и наполнители. В некоторых вариантах реализации настоящего изобретения указанный внегранулярный ингредиент представляет собой не встречающийся в природе ингредиент.
[0097] В определенных вариантах реализации настоящего изобретения, описанных в настоящем документе, указанные грануляты могут необязательно содержать по меньшей мере один разрыхлитель в диапазоне от примерно 0,1% до примерно 10%, например, от примерно 0,1% до примерно 4% по массе гранулятов и/или по меньшей мере один разбавитель в диапазоне от примерно 20 масс. % до примерно 80% по массе гранулятов.
[0098] Если указанные грануляты перерабатывают в таблетки, то указанные таблетки могут содержать по меньшей мере один внегранулярный разрыхлитель в диапазоне от примерно 0,1% до примерно 25% по массе таблетки, по меньшей мере одно смазывающее вещество в диапазоне от примерно 0,1% до примерно 2% по массе таблетки и по меньшей мере один гранулят, содержащий лекарственное средство, в пределах от примерно 20% до примерно 80% по массе таблетки. Остальная часть может содержать разбавители, необязательно в комбинации с другими ингредиентами, такими как связующие вещества, ароматизаторы, красители, консерванты, суспендирующие добавки, наполнители и тому подобное.
[0099] Для того, чтобы добиться хорошего растворения, можно принять во внимание размер частиц оспемифена в гранулятах. Например, в некоторых вариантах реализации настоящего изобретения по меньшей мере примерно 90% лекарственного вещества оспемифена может иметь размер частиц менее примерно 250 мкм, например, менее 150 мкм или менее примерно 50 мкм. В некоторых вариантах реализации настоящего изобретения примерно 50% лекарственного вещества оспемифена может иметь размер частиц менее примерно 25 мкм, например, менее примерно 15 мкм. Используемый в настоящем документе термин «размер частиц» относится к диаметру частицы или, если частицы не являются сферическими, к самому большому размеру частицы в одном направлении.
[00100] Согласно некоторым примерным вариантам реализации настоящего изобретения, фармацевтические композиции, описанные в настоящем документе, могут быть в форме таблеток, содержащих ядро и по меньшей мере одно покрытие, при этом указанное ядро и необязательно указанное покрытие содержат оспемифен.
[00101] Согласно некоторым примерным вариантам реализации настоящего изобретения указанное покрытие таблетки может содержать (а) по меньшей мере один наполнитель, присутствующий в количестве от примерно 5% до примерно 30% по массе указанной фармацевтической композиции; (b) по меньшей мере одно связующее вещество, присутствующее в количестве от примерно 1% до примерно 10% по массе указанной фармацевтической композиции; (с) по меньшей мере один смачивающий агент, присутствующий в количестве от примерно 0,01% до примерно 2% по массе указанной фармацевтической композиции; (d) по меньшей мере один необязательный антиоксидант, присутствующий в количестве от примерно 0 до примерно 2% по массе указанной фармацевтической композиции; (е) оспемифен, присутствующий в количестве от примерно 0,1% до примерно 30%, например, от примерно 0,1% до примерно 20% по массе указанной фармацевтической композиции; и (f) по меньшей мере один необязательный хелатирующий агент, присутствующий в количестве от примерно 0% до примерно 0,1% по массе указанной фармацевтической композиции.
[00102] В некоторых вариантах реализации настоящего изобретения указанное покрытие может содержать по меньшей мере один наполнитель, такой как сахароза, по меньшей мере одно связующее вещество, такое как гидроксипропилметилцеллюлоза, по меньшей мере один смачивающий агент, такой как пальмитат сахарозы, необязательно по меньшей мере один антиоксидант, такой как аскорбиновая кислота или ее соль, и необязательно по меньшей мере один хелатирующий агент, такой как ЭДТА.
[00103] Необязательно фармацевтические композиции, описанные в настоящем документе, могут содержать цветное покрытие. В некоторых вариантах реализации настоящего изобретения цветное покрытие может содержать (а) необязательно по меньшей мере один наполнитель, присутствующий в количестве от 0,01 до примерно 8% по массе указанной фармацевтической композиции; (b) необязательно по меньшей мере одно связующее, присутствующее в количестве от примерно 0,01% до примерно 2% по массе указанной фармацевтической композиции; и (с) по меньшей мере один краситель, присутствующий в количестве от примерно 0,01% до примерно 6% по массе указанной фармацевтической композиции. В некоторых вариантах реализации настоящего изобретения указанный по меньшей мере один краситель представляет собой диоксид титана.
[00104] В некоторых вариантах реализации настоящего изобретения, описанных в настоящем документе, указанная фармацевтическая композиция может содержать прозрачное покрытие. Указанное прозрачное покрытие может, например, присутствовать в количестве от примерно 0,01% до примерно 2% по массе указанной фармацевтической композиции.
[00105] Как описано в настоящем документе, в некоторых вариантах реализации настоящего изобретения указанная фармацевтическая композиция может быть в форме пленки. Фармацевтическую пленку для введения оспемифена и по меньшей мере одного соединения для лечения приливов можно вводить, например, перорально, местно, трансдермально или интравагинально.
[00106] Фармацевтическая пленка может содержать (а) по меньшей мере одно пленкообразующее связующее вещество, содержащее гидрофильные полимеры; (b) по меньшей мере один растворимый полимерный материал; и (с) эффективное количество по меньшей мере одного активного фармацевтического ингредиента, такого как оспемифен, при этом указанное по меньшей мере одно пленкообразующее связующее и указанный по меньшей мере один растворимый полимерный материал способны эффективно облегчить растворение указанной пленки в течение примерно 30 минут после нанесения пленки на поверхность тела, такую как влажная поверхность тела. Кроме того, указанная фармацевтическая пленка может дополнительно содержать (а) по меньшей мере один пластификатор для улучшения механических свойств пленки, таких как прочность на разрыв и растяжение; (b) по меньшей мере одно поверхностно-активное вещество в качестве солюбилизирующих, смачивающих или диспергирующих агентов; (с) по меньшей мере один краситель; и/или (d) по меньшей мере один ароматизатор.
[00107] Согласно некоторым вариантам реализации настоящего изобретения, описанным в настоящем документе, указанная фармацевтическая композиция может быть в форме кольца. Указанное кольцо может представлять собой устройство сферической формы, выполненное из фармацевтически приемлемого ингредиента, например, содержащего оспемифен. Указанное кольцо может содержать силиконовые эластомеры, например, с добавлением диметилполисилоксана силанола, силикагеля и/или пропилортосиликата. Указанная кольцевая структура может быть многослойной и может содержать сердцевину, содержащую активный ингредиент (ингредиенты), а также внешний слой эластомера, окружающий сердцевину. Указанный активный ингредиент (ингредиенты) может присутствовать в указанном кольце в виде твердого раствора, в аморфной форме, в виде нанокристаллов, кристаллов или их комбинации. Профиль высвобождения можно контролировать диффузией и его можно адаптировать при помощи конструкции кольца, нагрузки лекарственного средства, формы активного ингредиента (ингредиентов) и распределения активного ингредиента (ингредиентов) в указанном кольце. В некоторых вариантах реализации настоящего изобретения указанные ингредиенты могут представлять собой фармацевтически приемлемые биоразлагаемые полимеры, такие как полилактид, полигликолевая кислота и полимолочная-когликолевая кислота. Указанный активный ингредиент (ингредиенты) может присутствовать в полимерной матрице, и высвобождение можно контролировать при помощи скорости растворения и деградации полимера. Указанная фармацевтическая композиция в форме вагинального кольца может быть изготовлена, например, путем экструзии из расплава. Указанное техническое решение, представляющее собой вагинальное кольцо, может обеспечить удобную доставку оспемифена при относительно постоянной скорости в течение длительного периода времени посредством одного введения, такого как один раз в месяц, например, вплоть до трех месяцев.
[00108] В дополнительных вариантах реализации настоящего изобретения, описанных в настоящем документе, указанная фармацевтическая композиция, содержащая оспемифен, может быть в форме геля для внутривагинальной доставки и может содержать воду и фармацевтически приемлемые ингредиенты. Примеры фармацевтически приемлемых ингредиентов, таких как мукоадгезивные полимеры, которые способны образовывать гидрогели, могут включать, например, синтетические полиакрилаты, поликарбофил, хитозан, производные целлюлозы (такие как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза), производные гиалуроновой кислоты, пектин, трагакант, каррагинан и альгинат натрия.
[00109] Гели можно легко изготовить, они удобны и обладают способностью распространяться на поверхности слизистой оболочки и обеспечивать тесный контакт со слизистой оболочкой влагалища. Кроме того, благодаря относительно высокому содержанию воды в гелях и реологическим свойствам гели могут обладать дополнительным преимуществом, которое выражается в гидратирующем и смазывающем действии, что может быть полезным в вызванных патологиями случаях, характеризующихся сухостью слизистой оболочки влагалища. Применение мукоадгезивных полимеров может улучшить время контакта со слизистой оболочкой влагалища, тем самым удерживая указанную композицию и продлевая желаемый эффект. Среди гелеобразующих агентов, которые можно применять для образования гелей, можно упомянуть, например, трагакант, аравийскую камедь, поликарбофил, Carbopol® 974Р; натрийкарбоксиметилцеллюлозу; гидроксиэтилцеллюлозу, коллоидный диоксид кремния и каррагинан PDR98-15.
[00110] Описанные в настоящем документе фармацевтические композиции могут быть полезны для лечения женщин во время менопаузы или после менопаузы. Однако применение описанных в настоящем документе способов и композиций не ограничивается женщинами указанной возрастной группы, но их можно применять у любого человека, нуждающегося в лечении.
[00111] Указанные фармацевтические композиции могут содержать другие фармацевтически приемлемые вспомогательные вещества, такие как буфер (например, трис-HCl, ацетат, фосфат) с различными значениями рН и ионной силы; добавку, такую как альбумин или желатин, для предотвращения абсорбции на поверхностях; ингибитор протеазы; усилитель проницаемости; солюбилизирующий агент (например, глицерин, полиэтиленглицерин); антиоксидант (например, аскорбиновая кислота, метабисульфит натрия, бутилированный гидроксианизол); стабилизатор (например, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза); агент для повышения вязкости (например, карбомер, коллоидный диоксид кремния, этил целлюлоза, гуаровая смола); подсластитель (например, аспартам, лимонная кислота); консервант (например, тимеросал, бензиловый спирт, парабены); агент для повышения текучести (например, коллоидный диоксид кремния), пластификатор (например, диэтилфталат, триэтилцитрат); эмульгатор (например, карбомер, гидроксипропилцеллюлоза, лаурилсульфат натрия); полимерное покрытие (например, полоксамеры или полоксамины, гипромеллозы ацетата сукцинат); агент для образования покрытия и пленки (например, этилцеллюлоза, акрилаты, полиметакрилаты, гипромеллозы ацетата сукцинат); адъювант; фармацевтически приемлемый носитель для жидких композиций, таких как водные растворы (вода, спиртовой/водный раствор, эмульсия или суспензия, включая физиологический раствор и буферные среды) или неводные растворы (например, пропиленгликоль, полиэтиленгликоль и инъецируемые органические сложные эфиры, такие как этил олеат), суспензию, эмульсию или масло; и парентеральный носитель (для подкожной, внутривенной, внутриартериальной или внутримышечной инъекции), включая, но не ограничиваясь ими, раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактированные растворы Рингера и фиксированные масла.
[00112] Внутривенные носители могут включать жидкие и питательные добавки (репленишеры), добавки электролитов, такие как добавки на основе декстрозы Рингера и тому подобное. Примерами являются стерильные жидкости, такие как вода и масла, с добавлением или без добавления поверхностно-активного вещества и других фармацевтически приемлемых адъювантов. В целом водные растворы, солевые растворы, водные растворы декстрозы и подобные растворы сахара, и гликоли, такие как пропиленгликоли или полиэтиленгликоль, являются предпочтительными жидкими носителями, особенно для инъекционных растворов. Примерами масел являются масла животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, оливковое масло, подсолнечное масло, жир из печени рыб, прочие рыбьи жиры или липид из молока или яиц.
[00113] В некоторых вариантах реализации настоящего изобретения указанное фармацевтически приемлемое вспомогательное вещество представляет собой не встречающееся в природе вспомогательное вещество.
[00114] В одном варианте реализации настоящего изобретения указанная твердая дисперсия, содержащая оспемифен и гидрофильный носитель, дополнительно содержит одно или более из следующих фармацевтически приемлемых вспомогательных веществ: коллоидный диоксид кремния, моногидрат лактозы, стеарат магния, маннит, микрокристаллическая целлюлоза, полиэтиленгликоль, прежелатинизированный крахмал, натрия крахмалгликолят, диоксид титана, триацетин и триозу. В другом варианте реализации настоящего изобретения указанная твердая дисперсия, содержащая оспемифен и гидрофильный носитель, дополнительно содержит следующие фармацевтически приемлемые вспомогательные вещества: коллоидный диоксид кремния, моногидрат лактозы, стеарат магния, маннит, микрокристаллическую целлюлозу, полиэтиленгликоль, прежелатинизированный крахмал, натрия крахмалгликолят, диоксид титана, триацетин и триозу.
[00115] Указанные вспомогательные вещества приведены в качестве примера, и специалистам в данной области техники будет известно, что существуют другие или различные вспомогательные вещества, обладающие теми же самыми химическими свойствами, что и перечисленные в настоящем документе.
5. Способы получения твердых дисперсий
[00116] Твердые дисперсии можно получить с применением любого подходящего способа. Двумя основными способами получения твердых дисперсий являются способы плавления и испарения растворителя. В способе плавления обычно один или более гидрофильных носителей, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль, а также НРМСР или их смеси, и АФИ, такой как оспемифен, объединяют без растворителя или с растворителем (например, одним или более из воды или низшего алкилового спирта) с получением смеси (например, жидкой смеси) или раствора. Необязательно указанный гидрофильный носитель и АФИ с дополнительными фармацевтически приемлемыми вспомогательными веществами или без них можно нагревать до температуры около или выше температуры стеклования Tg или температуры плавления Tm с получением жидкой смеси или раствора. Затем полученный раствор можно сушить путем распыления с получением твердой дисперсии. Альтернативно указанный способ включает процесс экструзии горячего расплава, где указанную смесь нагревают с получением гомогенной расплавленной массы, экструдируют и охлаждают с получением твердой дисперсии. Указанные экструдаты можно необязательно гранулировать или измельчать с получением твердой дисперсии, пригодной для дальнейшей переработки в подходящую стандартную лекарственную форму.
[00117] Другим распространенным способом получения твердой дисперсии является способ испарения растворителя, при котором указанный АФИ и носитель растворяют в обычном органическом растворителе (например, одном или более из воды или низшего алкилового спирта) с получением смеси (например, жидкой смеси) или раствора, откуда затем удаляют растворитель выпариванием при повышенной температуре и/или в вакууме.
[00118] При получении твердой дисперсии можно варьировать соотношение лекарственного средства к гидрофильному носителю, чтобы оказывать оптимальное влияние на эффективность лекарственного средства. Например, в случае оспемифена можно смешивать оспемифен с гидрофильным носителем, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, в массовом соотношении от примерно 2:1 до примерно 1:50, от примерно 1:1 до примерно 1:20, от примерно 1:1 до примерно 1:15, от примерно 1:1 до примерно 1:10, от примерно 1:1 до примерно 1:5, от примерно 1:2 до примерно 1:5 или от примерно 1:2 до примерно 1:4. В некоторых вариантах реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю составляет примерно 1:4. В некоторых вариантах реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю в указанной твердой дисперсии выбирают из группы, состоящей из примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9, примерно 1:10, примерно 1:11, примерно 1:12, примерно 1:13, примерно 1:14, примерно 1:15, примерно 1:16, примерно 1:17, примерно 1:18, примерно 1:19 и примерно 1:20. В некоторых вариантах реализации настоящего изобретения массовое соотношение оспемифена к гидрофильному носителю в указанной твердой дисперсии составляет примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9, примерно 1:10, примерно 1:11, примерно 1:12, примерно 1:13, примерно 1:14, примерно 1:15, примерно 1:16, примерно 1:17, примерно 1:18, примерно 1:19 или примерно 1:20.
[00119] В некоторых вариантах реализации получения указанной твердой дисперсии указанный гидрофильный носитель объединяют с АФИ, таким как оспемифен, и поверхностно-активным веществом, как описано в настоящем документе. В этих случаях количество поверхностно-активного вещества может составлять от примерно 1:1 до примерно 1:10 (поверхностно-активное вещество : гидрофильный носитель). В некоторых вариантах реализации настоящего изобретения соотношение поверхностно-активного вещества к гидрофильному носителю в указанной твердой дисперсии выбирают из группы, состоящей из примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9 и примерно 1:10.
[00120] В целом также будет выгодно измельчать АФИ, такой как оспемифен, посредством одного или более способов микронизации с получением частиц с размерами, подходящими для приготовления лекарственной формы твердой дисперсии. Способы, хорошо известные в данной области техники, пригодны для применения при обработке оспемифена с получением твердых дисперсий, включают, но не ограничиваются ими: испарение растворителя, такой как получение пленки наливом, ротационное испарение, распылительная сушка, нанесение покрытия методом распыления, сублимационная сушка, вакуумная сушка, осаждение из сверхкритического флюида, осаждение антирастворителем, контролируемая микрокристаллизация, экструзия горячего расплава, литьевое формование, способ плавления (сплавления), агломерация в расплаве и совместное измельчение.
[00121] Например, способ экструзии из расплава может включать стадии получения расплава, содержащего активный ингредиент (ингредиенты), носитель (носители) и необязательно дополнительные вспомогательные вещества, и охлаждение расплава до затвердевания. Во многих случаях гидрофильный носитель будет плавиться, а указанные другие компоненты, включая указанный АФИ, такой как оспемифен, и другие добавленные вспомогательные вещества будут растворяться в расплаве, тем самым образуя по существу гомогенную дисперсию. Получение расплава может происходить различными способами. Смешивание компонентов может происходить до, во время или после образования расплава. Например, указанные компоненты сначала можно смешать, а затем расплавить, или одновременно смешать и расплавить. Указанный расплав также можно гомогенизировать для того, чтобы эффективно диспергировать указанный АФИ, такой как оспемифен. Кроме того, может быть удобно сначала расплавить носитель (носители), а затем вмешать и гомогенизировать активный ингредиент (ингредиенты).
[00122] Распылительная сушка включает разбиение жидких смесей на небольшие капли и быстрое удаление растворителя из смеси в контейнере (аппарат распылительной сушки), который обеспечивает сильную движущую силу, вызывающую испарение растворителя из капель. Это часто обеспечивают за счет поддержания парциального давления растворителя в аппарате распылительной сушки значительно ниже давления паров растворителя при температурах высушивания капель и/или за счет обеспечения тепла. Этого можно достичь за счет (1) поддержания давления в аппарате распылительной сушки при частичном вакууме; (2) смешивания жидких капель с теплым газом для высушивания, например, с нагретым газообразным азотом; или (3) обоими способами. Аппарат распылительной сушки, подходящий для настоящего изобретения, может представлять собой любой из различных коммерчески доступных аппаратов. Неограничивающие примеры конкретных аппаратов распылительной сушки включают аппараты, произведенные Niro Inc., Buchi Labortechnik AG и Spray Drying Systems, Inc.
[00123] Кроме экструзии из расплава, распылительной сушки и других технологий твердых дисперсий, исходный материал для таблетирования также можно получать с применением других способов, таких как влажная грануляция, сухая грануляция или грануляция в псевдоожиженном слое. Все ингредиенты в исходном материале для таблетирования предпочтительно хорошо гранулируют и смешивают, так что таблетка, полученная из указанных материалов, имеет по существу равномерное распределение АФИ, например, оспемифена, и количество АФИ в каждой таблетке примерно одинаково.
[00124] В некоторых вариантах реализации настоящего изобретения твердую дисперсию оспемифена и гидрофильного носителя можно получить, первоначально растворяя оспемифен и указанный носитель отдельно в подходящих растворителях. В некоторых вариантах реализации настоящего изобретения оспемифен и носитель (и необязательно поверхностно-активное вещество) растворяют в одном и том же растворителе. В некоторых случаях указанный растворитель может представлять собой воду. В других случаях можно применять низший алкиловый спирт, например, метанол или этанол. Затем оспемифен и гидрофильный носитель (и необязательно поверхностно-активное вещество) можно смешать вместе с получением смеси лекарственного средства/носителя. Затем указанную смесь выливают в подходящий сосуд и дают растворителю (растворителям) испариться, такой способ обычно называют формованием окунанием в растворитель. Хотя желательно удалить как можно больше растворителя, в твердой дисперсии, полученной этими способами, обычно остаются некоторые небольшие количества остаточного растворителя. В некоторых случаях указанное испарение можно проводить в условиях окружающей среды при температуре окружающей среды и атмосферном давлении, например, под вытяжным колпаком. В других случаях может быть желательным ускорить испарение растворителя за счет нагрева, снижения атмосферного давления или комбинации нагрева и снижения давления.
[00125] Испарение растворителя оставляет твердую дисперсию, которая в некоторых случаях будет образовывать тонкую пленку в сосуде, в котором было проведено испарение. Затем указанную тонкую пленку можно дополнительно переработать, например, путем измельчения, с получением тонкодисперсной формы порошка твердой дисперсии. После этого указанный порошок подходит для дальнейшего фармакологического или химического тестирования или приготовления твердой лекарственной формы. В некоторых случаях твердая лекарственная форма может содержать дополнительные фармацевтически приемлемые вспомогательные вещества для улучшения физиологических характеристик оспемифена в лекарственной форме твердой дисперсии.
[00126] Указанную твердую дисперсию можно смешивать с одним или более фармацевтически приемлемыми вспомогательными веществами, как описано в настоящем документе, а затем измельчать, смешивать, гранулировать и/или уплотнять с получением конечной смеси для капсулирования или таблетирования. В определенных вариантах реализации настоящего изобретения одно или более фармацевтически приемлемых вспомогательных веществ содержат связующее вещество, поверхностно-активное вещество, наполнитель, разрыхлитель, смачивающий агент, скользящее вещество и смазывающее вещество.
6. Дозировка и введение
[00127] Фармацевтическую композицию, описанную в настоящем документе, составляют так, чтобы она была совместима с ее предполагаемым способом введения. Специалистам в данной области техники известны способы введения, которые включают, например, инъекции, парентеральными путями, такими как внутривенный, внутрисосудистый, внутриартериальный, подкожный, внутримышечный, внутрибрюшинный, внутрижелудочковый, внутриэпидуральный или другие, а также пероральный, назальный, офтальмологический, ректальный или местный путь введения. Особое внимание также уделяется введению с замедленным высвобождением с помощью таких средств, как депо-инъекции или разрушаемые имплантаты. Также отдельно рассматривается локализованная доставка такими способами, как доставка через катетер в одну или более артерий, таких как почечная артерия или сосуд, снабжающий место, представляющее интерес. В одном варианте реализации настоящего изобретения твердую дисперсную форму вводят перорально.
[00128] Рекомендуемая в настоящее время суточная доза оспемифена для лечения симптомов, связанных с менопаузой, составляет 60 мг в сутки при пероральном введении. В ходе фармакокинетических исследований было изучено распределение оспемифена в организме, а также пути выведения дозы 60 мг после перорального введения (Koskimies et al., 2013). Результаты этих исследований показали, что из общей вводимой дозы 75% удаляется с фекалиями. Это означает, что после перорального введения известных в данной области техники лекарственных форм оспемифена большая часть лекарственного средства не становится растворимой и/или абсорбированной и поэтому никогда не достигает своей биологической цели. Таким образом, с некоторыми пероральными формами оспемифена, известными в данной области техники, большая часть лекарственного средства просто выходит из организма, не оказывая какого-либо терапевтического эффекта.
[00129] За счет значительно улучшенной растворимости, обеспечиваемой твердыми дисперсиями, как описано, теперь станет возможным будет обеспечить более низкую суточную дозу оспемифена и при этом достигать фармацевтически эффективных уровней указанного лекарственного средства. Так, например, вместо того, чтобы составлять 60 мг в сутки, терапевтически эффективная доза может состоять из значительно меньшего количества оспемифена и при этом все же достигать сопоставимых уровней циркуляции лекарственного средства.
[00130] В некоторых вариантах реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет 60 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет 50 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 40 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 30 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 25 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 20 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 17,5 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 15 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 12,5 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 10 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 7,5 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 5 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 2,5 мг оспемифена в сутки. В другом варианте реализации настоящего изобретения эффективная дозировка твердой дисперсии оспемифена составляет менее 1 мг оспемифена в сутки.
[00131] В некоторых вариантах реализации настоящего изобретения эффективная дозировка оспемифена составляет около 5-50 мг в сутки, 5-45 мг в сутки, 5-40 мг в сутки, 5-35 мг в сутки, 5-30 мг в сутки, 5-25 мг в сутки, 5-20 мг в сутки, 5-15 мг в сутки, 5-10 мг в сутки, 10-50 мг в сутки, 10-45 мг в сутки, 10-40 мг в сутки, 10-35 мг в сутки, 10-30 мг в сутки, 10-25 мг в сутки, 10-20 мг в сутки, 10-15 мг в сутки, 15-50 мг в сутки, 15-45 мг в сутки, 15-40 мг в сутки, 15-35 мг в сутки, 15-30 мг в сутки, 15-25 мг в сутки, 15-20 мг в сутки, 20-50 мг в сутки, 20-45 мг в сутки, 20-40 мг в сутки, 20-35 мг в сутки, 20-30 мг в сутки, 20-25 мг в сутки, 25-50 мг в сутки, 25-45 мг в сутки, 25-40 мг в сутки, 25-35 мг в сутки, 25-30 мг в сутки, 30-50 мг в сутки, 30-45 мг в сутки, 30-40 мг в сутки, 30-35 мг в сутки, 35-50 мг в сутки, 35-45 мг в сутки, 35-40 мг в сутки, 40-50 мг в сутки, 45-50 мг в сутки или примерно 50 мг в сутки.
[00132] В другом варианте реализации настоящего изобретения эффективная дозировка оспемифена составляет около 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 25, примерно 30, примерно 35, примерно 40, примерно 45, примерно 50 или примерно 55 мг в сутки.
[00133] Оспемифен оказывает благотворное влияние на общий уровень холестерина, на уровни холестерина ЛПВП и ЛПНП, а также предотвращает остеопороз и рак молочной железы ранней стадии. Оспемифен также полезен при лечении сниженного полового влечения, расстройства возбуждения, оргастического расстройства и диспареунии у женщин в постменопаузе. Диспареуния - это состояние, характеризующееся болью во время полового акта, и обычно является симптомом вульварной и вагинальной атрофии, которая возникает одновременно с менопаузой. За счет твердой лекарственной формы со значительно улучшенной растворимостью становится возможным применять дозы, сравнимые с рекомендуемой в настоящее время суточной дозой или ниже, и при этом достичь аналогичных или лучших физиологических результатов у пациентов, для которых показан оспемифен.
7. Способ лечения
[00134] Оспемифен, как обсуждалось, оказывает ряд положительных эффектов, выражающихся в снятии симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, включая, но не ограничиваясь ими, сниженного полового влечения, расстройства возбуждения, оргастических расстройств, вагинальной сухости и болезненного полового акта (диспареунии). Большинство указанных симптомов являются результатом изменений гормонального статуса, которым сопровождается менопауза, особенно снижения уровней эстрогена и тестостерона. Таким образом, твердые дисперсионные формы оспемифена и гидрофильного носителя можно применять в способах лечения указанных симптомов.
[00135] В дополнение к различным нарушениям сексуальной функции, связанным с менопаузой, снижение уровня эстрогена у женщин связано с потерей костной массы, что приводит к остеопорозу. Почти 80% американцев с остеопорозом составляют женщины, и половина женщин старше 50 лет сталкиваются с переломом костей, связанным с остеопорозом. Остеопороз также распространен у пожилых мужчин. Оспемифен, являющийся селективным модулятором рецепторов эстрогенов (SERM), способен связывать рецептор эстрогена (ER) и придавать указанному ER агонистическое или антагонистическое действие в зависимости от ткани-мишени. Следовательно, учитывая его способность смягчать понижение выработки эстрогена после менопаузы, оспемифен можно применять для лечения остеопороза. Действительно, как сообщалось, оспемифен увеличивает плотность костной ткани у мужчин с раком предстательной железы, которые получали лечение агонистами, выделяющими гонадотропин. Smith, Matthew, Rev. Urol. 7 (Suppl 3):S30-S35 (2005). Таким образом, твердые дисперсионные формы оспемифена и гидрофильного носителя можно применять в способах лечения остеопороза.
[00136] Лекарственная форма твердой дисперсии будет обеспечивать оспемифен в количестве, эффективном для облегчения указанных симптомов и/или состояний. Кроме того, твердая дисперсионная лекарственная форма может обеспечивать циркулирующие уровни оспемифена, сравнимые с уровнями, полученными при помощи лекарственных форм, известных в уровне техники, содержащих 60 мг оспемифена, но при этом будет применяться меньшая доза оспемифена, чем рекомендуемая в настоящее время суточная доза 60 мг. Таким образом, в одном варианте реализации настоящего изобретения оспемифен вводят в дозе менее 60 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 50 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 40 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 30 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 25 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 20 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 17,5 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 15 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 12,5 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 10 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 7,5 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 5 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 2,5 мг в сутки. В другом варианте реализации настоящего изобретения оспемифен вводят в дозе менее 1 мг в сутки. В определенных вариантах реализации настоящего изобретения оспемифен вводят в дозе около 5-50 мг в сутки, 5-45 мг в сутки, 5-40 мг в сутки, 5-35 мг в сутки, 5-30 мг в сутки, 5-25 мг в сутки, 5-20 мг в сутки, 5-15 мг в сутки, 5-10 мг в сутки, 10-50 мг в сутки, 10-45 мг в сутки, 10-40 мг в сутки, 10-35 мг в сутки, 10-30 мг в сутки, 10-25 мг в сутки, 10-20 мг в сутки, 10-15 мг в сутки, 15-50 мг в сутки, 15-45 мг в сутки, 15-40 мг в сутки, 15-35 мг в сутки, 15-30 мг в сутки, 15-25 мг в сутки, 15-20 мг в сутки, 20-50 мг в сутки, 20-45 мг в сутки, 20-40 мг в сутки, 20-35 мг в сутки, 20-30 мг в сутки, 20-25 мг в сутки, 25-50 мг в сутки, 25-45 мг в сутки, 25-40 мг в сутки, 25-35 мг в сутки, 25-30 мг в сутки, 30-50 мг в сутки, 30-45 мг в сутки, 30-40 мг в сутки, 30-35 мг в сутки, 35-50 мг в сутки, 35-45 мг в сутки, 35-40 мг в сутки, 40-50 мг в сутки, 45-50 мг в сутки или примерно 50 мг в сутки.
[00137] Один из аспектов настоящего изобретения относится к способам лечения симптома, связанного с менопаузой, включающему введение лекарственной формы твердой дисперсии оспемифена и гидрофильного носителя, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, и необязательно поверхностно-активное вещество, пациенту в количестве, достаточном для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния).
[00138] Другой аспект настоящего изобретения относится к способу лечения остеопороза, включающему введение лекарственной формы твердой дисперсии оспемифена и гидрофильного носителя, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, и необязательно поверхностно-активного вещества пациенту в количестве, достаточном для лечения остеопороза.
[00139] Один из аспектов настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и гидрофильный носитель, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой аспект настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и гидрофильный носитель, включая, но не ограничиваясь ими, повидон, коповидон, НРМС, HPMCAS, соединения Eudragit®, привитые сополимеры поливинилкапролактам/поливинилацетат/полиэтиленгликоль и НРМСР или их смеси, и необязательно поверхностно-активное вещество, для применения для лечения остеопороза.
[00140] Один вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и HPMCAS и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и HPMCAS и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00141] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и НРМС и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и НРМС и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00142] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и коповидон и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и коповидон и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00143] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и повидон и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и повидон и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00144] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и привитый сополимер поливинилкапролактам/поливинилацетат/полиэтиленгликоль (например, Soluplus®) и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и привитый сополимер поливинилкапролактам/поливинилацетат/полиэтиленгликоль (например, Soluplus®) и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00145] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и гидроксипропилцеллюлозу (например, HPC-SSL) и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и гидроксипропилцеллюлозу (например, HPC-SSL), и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00146] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и фталат гидроксипропилметилцеллюлозы (НРМСР) (например, НР-55), и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и фталат гидроксипропилметилцеллюлозы (НРМСР) (например, НР-55), и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00147] Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и соединение Eudragit® (например, Eudragit® L100-55), и необязательно поверхностно-активное вещество, для применения для лечения симптомов, связанных с менопаузой, включая, но не ограничиваясь ими, различные симптомы женской сексуальной дисфункции, такие как сниженное половое влечение, расстройства возбуждения, оргастические расстройства, вагинальная сухость и болезненный половой акт (диспареуния). Другой вариант реализации настоящего изобретения относится к лекарственной форме твердой дисперсии, содержащей оспемифен и соединение Eudragit® (например, Eudragit® L100-55), и необязательно поверхностно-активное вещество для применения для лечения остеопороза.
[00148] В некоторых вариантах реализации настоящего изобретения лекарственные формы твердой дисперсии оспемифена вводят натощак или без приема пищи. В некоторых вариантах реализации после однократного введения субъекту, представляющему собой человека, лекарственной формы твердой дисперсии оспемифена наблюдается большая биодоступность оспемифена или нет существенной разницы в биодоступности оспемифена, при введении указанной композиции субъекту натощак по сравнению с введением после приема пищи. Другими словами, в некоторых вариантах реализации настоящего изобретения пища не увеличивает биологическую доступность лекарственной формы твердой дисперсии оспемифена, как это происходит с другими препаратами оспемифена, такими как Osphena®, где растворимость значительно выше при введении после приема пищи.
[00149] Учитывая улучшенную растворимость определенных твердых дисперсий, описанных в настоящем документе, ожидается, что одна лекарственная форма может содержать лекарственную форму, в которой порошок добавлен к буферному раствору, и индивид может затем употреблять ее, как обычный напиток. Учитывая улучшенную растворимость, теперь можно перорально доставлять оспемифен в терапевтически эффективных дозах в таком объеме, который можно вводить в одной порции. Это может стать дополнительным преимуществом для людей, которым трудно принимать пилюли, таблетки и другие обычные пероральные лекарственные формы лекарственных средств.
ПРИМЕРЫ
[00150] Приведенные примеры предназначены для иллюстративных целей. Специалисты в данной области техники смогут легко определить подходящие способы и оборудование для получения подходящих твердых дисперсионных форм, описанных в настоящем документе.
[00151] Пример 1: Изучение растворимости твердых дисперсий оспемифена с HMPCAS, НМРС, повидоном и коповидоном
[00152] Оспемифен является соединением II класса согласно биофармацевтической классификации лекарственных средств, и обладает слабой растворимостью в воде и высокой проницаемостью. Растворимость оспемифена составляет менее примерно 0,3 мкг/мл в воде или буферизованных растворах в диапазоне рН от примерно 1,2 до примерно 8,0. Оспемифен обычно получают в кристаллической форме с температурой плавления в диапазоне от примерно 115°С до примерно 127°С. Общепризнано, что аморфная форма остается в более высоком энергетическом состоянии, чем ее кристаллические аналоги и, в свою очередь, проявляет повышенную растворимость. Тем не менее, получение аморфного оспемифена затруднено.
[00153] В описанных в настоящем документе исследованиях получали твердые дисперсии оспемифена в сочетании с гидрофильными носителями, включая гидроксилпропилметилцеллюлозу (НРМС), повидон (PVP), коповидон и гипромеллозы ацетата сукцинат (HPMCAS), и определяли их относительную растворимость по сравнению с оспемифеном отдельно.
Материалы
[00154] Материалы, используемые в описанных в настоящем документе исследованиях, включая АФИ, гидрофильные носители и растворители, приведены в таблице I.

Способ приготовления твердых дисперсий, содержащих оспемифен
[00155] Твердые дисперсии оспемифена с гидрофильным носителем, включая PVP, коповидон, НРМС или HPMCAS, получали формованием окунанием в растворитель.
[00156] Для каждого состава 1 г оспемифена и гидрофильного носителя растворяли в общем растворителе в массовом соотношении от примерно 1:1 до примерно 1:20, в частности, в массовом соотношении примерно 1:4. Затем смеси раствора оспемифена и определенного гидрофильного носителя, оценку которого проводили, выливали в чашки Петри и сушили выпариванием под вытяжным колпаком в течение приблизительно 48 часов. Затем полученные твердые дисперсии в виде тонких пленок извлекали из чашек Петри и измельчали в ступке с помощью пестика.
[00157] При разработке методов оценки растворимости различных композиций, полученных в этих исследованиях, был выбран общий растворитель, способный растворять оспемифен и каждый из оцениваемых гидрофильных носителей. Из предыдущих исследований было известно, что оспемифен не растворим в воде, но растворим в этаноле, пропаноле и ацетонитриле. Таким образом, для оценки растворимости в смеси сорастворителей метанола и этанола использовали способ инкрементного добавления растворителя.
[00158] Растворимость оспемифена составляет примерно 67 мг/мл в метаноле и примерно 57 мг/мл в этаноле. Исходя из данных по растворимости оспемифена и гидрофильных носителей, для приготовления растворов АФИ с PVP или коповидоном, соответственно, был выбран этанол. Как показано в таблице II, смесь этанол/вода применяли для приготовления смесей АФИ и НРМС. В качестве растворителя для получения растворов АФИ и HPMCAS использовали только метанол. В некоторых случаях 0,2 г оспемифена и 0,8 г носителя растворяли отдельно в подходящем растворителе и затем смешивали с получением смешанного раствора. Для того, чтобы получить высушенную литую пленку каждой композиции оспемифен/носитель, указанный смешанный раствор выливали в чашку Петри и оставляли для сушки путем выпаривания под вытяжным колпаком при комнатной температуре в течение примерно 48 часов.
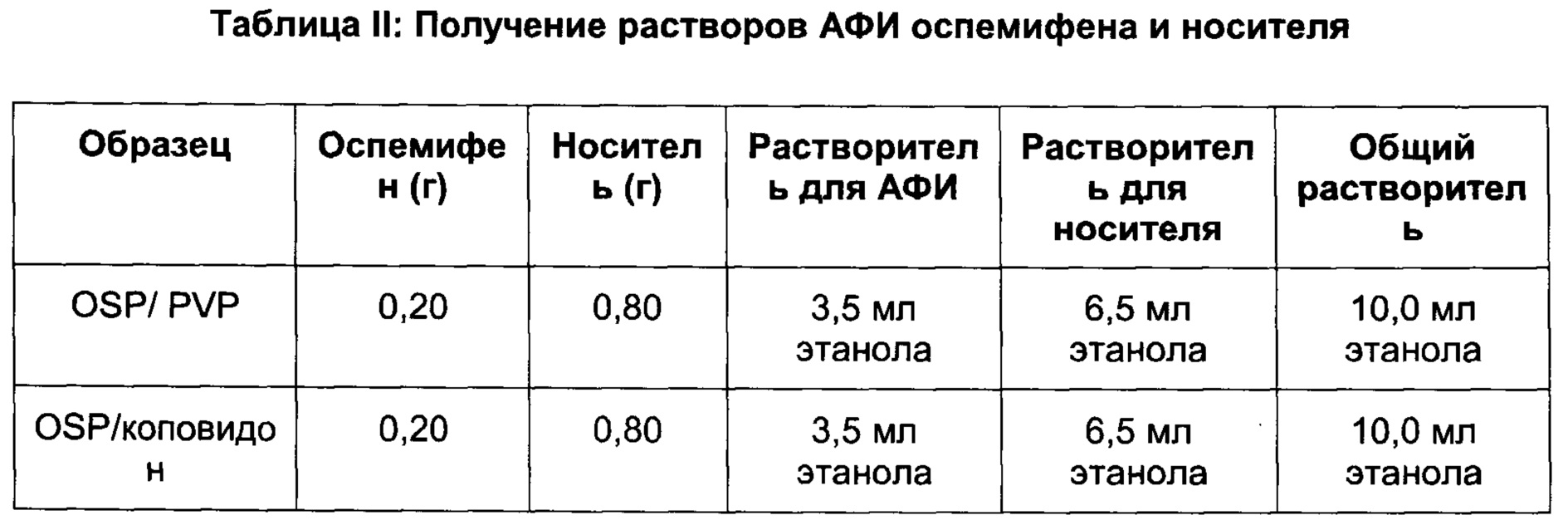
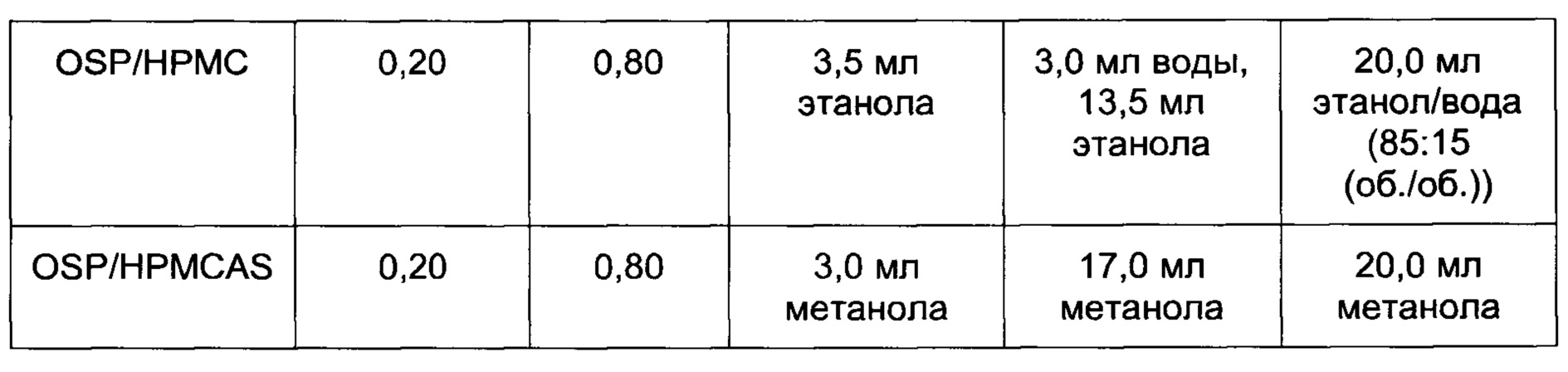
[00159] Также предполагается, что указанных способах можно производить изменения, и при этом все равно получить твердые дисперсионные формы оспемифена с повышенной растворимостью. Например, предполагается, что вместо пассивной сушки под вытяжным колпаком можно применять сушку при пониженном давлении, которая будет позволять быстрее удалять растворитель при получении тонких пленок для последующей переработки в порошки или другие формы. Аналогичным образом, способы получения достаточно мелких частиц, подходящих для приготовления конечной лекарственной формы, например, пероральной лекарственной формы, такой как таблетка, капсула или порошок, может включать в себя методы, отличные от измельчения твердых дисперсионных пленок при помощи ступки и пестика. Для переработки описанных в настоящем документе твердых дисперсионных форм применимы такие методы, как размол на струйной мельнице, размол на шаровой мельнице или другие методы микронизации.
[00160] После выпаривания каждую из тонких пленок извлекали с помощью шпателя и переносили в ступку для измельчения про помощи пестика. Было обнаружено, что твердые дисперсии, содержащие оспемифен и PVP, коповидон или НРМСАС, удобно можно измельчать в тонкий порошок. При этом было также обнаружено, что твердая дисперсия, содержащая НРМС, сильно прилипает к различным поверхностям и поэтому трудно поддается измельчению в тонкий порошок. В таблице III показаны выходы, полученные для каждой композиции.
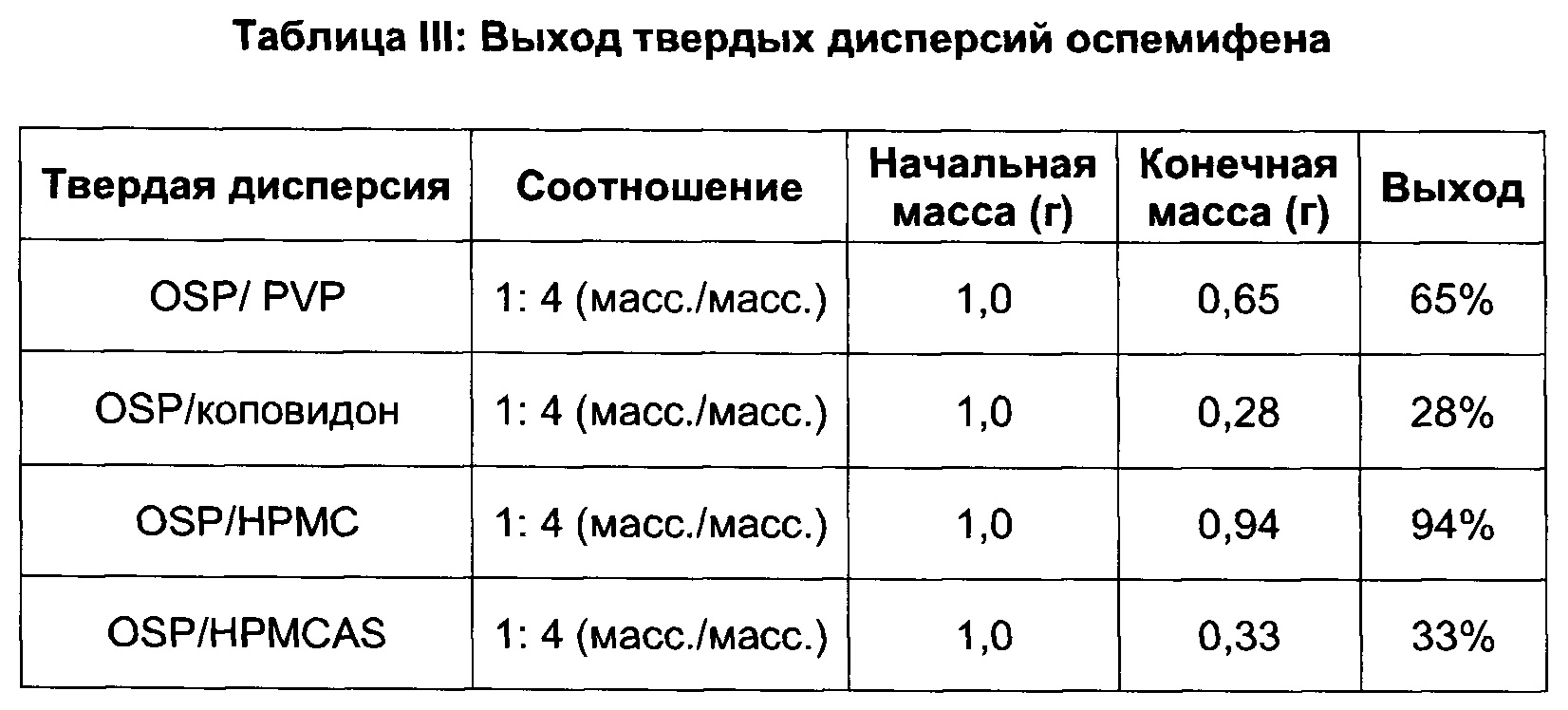
[00161] Вышеприведенный пример представляет собой пример одного из способов приготовления комбинации оспемифена с гидрофильным носителем в растворе, а затем получения высушенной твердой дисперсии оспемифена и указанного носителя. Специалисты в данной области техники поймут, что порядок шагов в некоторых случаях основан на личных предпочтениях и не является строго ограничивающим. Кроме того, в зависимости от личных предпочтений можно также варьировать масштаб, и не подразумевается, что указанные твердые дисперсии можно получать только в тех количествах, которые представлены в примере. Аналогично, с методом получения твердой дисперсии оспемифена могут быть совместимы другие растворители, отличные от тех, которые применяют в конкретном примере, приведенном в настоящем документе. Таким образом, приведенный в качестве примера способ получения указанных твердых дисперсий предназначен только для иллюстративных целей и не предназначен для того, чтобы ограничивать объем изобретения.
Способ приготовления механических смесей, содержащих оспемифен
[00162] В качестве контролей приготовили простые механические смеси оспемифена и гидрофильного носителя (PVP, коповидона, НРМС или HPMCAS) в диапазоне массовых соотношений от примерно 1:1 до примерно 1:20, в частности, в массовом соотношении примерно 1:4, которые готовили путем перемешивания вручную оспемифена с представляющим интерес гидрофильным носителем.
Измерения растворимости
[00163] Измерение растворимости твердых дисперсий и механических смесей проводили с применением метода встряхиваемой колбы. Отдельные образцы, содержащие примерно 5 мг оспемифена, 30 мг каждой механической смеси или 30 мг каждой твердой дисперсии, смешивали с 20 мл водной среды (только воды; 0,1 н. HCl; или буферного водного раствора, содержащего 50 мМ фосфат, рН 6,8). Образец перемешивали вручную в течение 3 часов. После смешивания 1,5 мл образца переносили в микроцентрифужную пробирку и центрифугировали при 12000 об/мин в течение 10 мин. Затем примерно 1 мл супернатанта переносили в пробирку для ВЭЖХ для анализа ВЭЖХ.
Анализ ВЭЖХ
[00164] В таблице IV приведены условия, используемые в способе ВЭЖХ.


Результаты
Растворимость твердых дисперсий оспемифена
[00165] Растворимость твердых дисперсий оспемифена, контрольных механических смесей и отдельно оспемифена определяли с помощью ВЭЖХ в воде, 0,1 н. HCI или 50 мМ рН 6,8 буфера при применении с применением метода встряхиваемой колбы, как описано выше. Данные по растворимости представлены в таблице V.
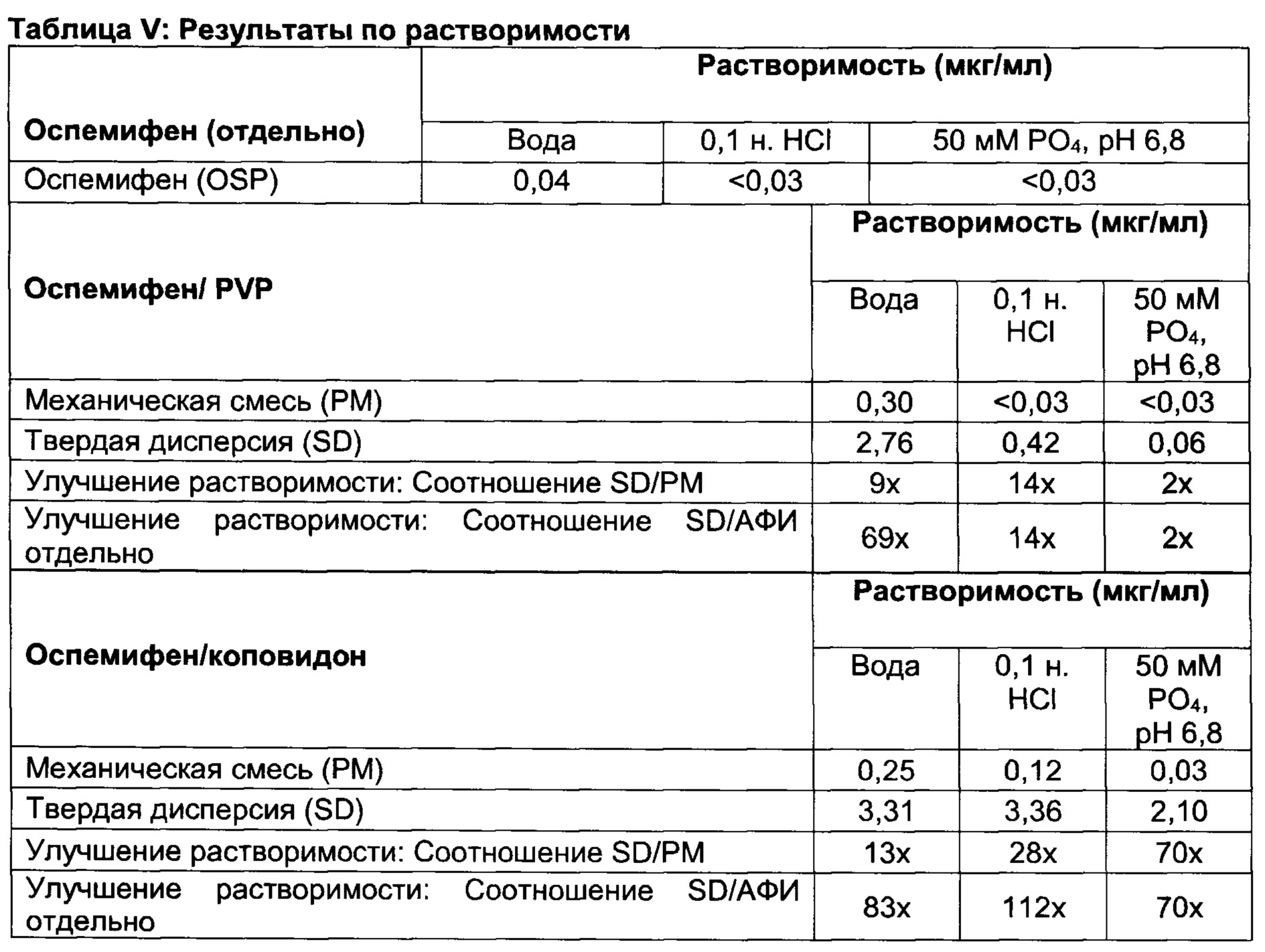

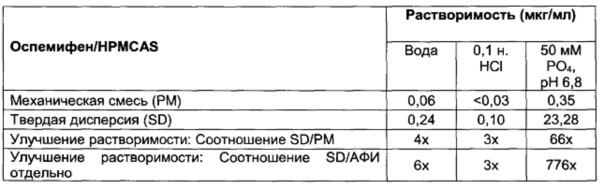
[00166] Наблюдалось усиление растворимости в твердых дисперсиях оспемифен/гидрофильный носитель с различной степенью в каждой из трех тестируемых водных сред. В целом, растворимость, наблюдаемая для твердых дисперсионных форм, по сравнению с растворимостью соответствующей механической смеси при испытаниях в той же водной среде, увеличивалась в от примерно 2 до примерно 70 раз. Твердая дисперсия оспемифена и HPMCAS, растворенная в 50 мМ PO4, рН 6,8, показала неожиданное 776-кратное увеличение растворимости по сравнению с соответствующей механической смесью. Значения растворимости, измеренные для механических смесей оспемифена и коповидона, были сопоставимы со значениями, полученными для оспемифена отдельно, что свидетельствует о хорошей физической стабильности.
[00167] Было обнаружено, что растворимость твердых дисперсий, содержащих оспемифен + HPMCAS, имеет зависимость от рН. Растворимость в воде и 0,1 н. HCl составляла 0,24 мкг/мл и 0,10 мкг/мл, соответственно, в то время как растворимость в фосфатном буферном растворе составляла 23,28 мкг/мл, что представляет собой неожиданное увеличение почти в 800 раз по сравнению с растворимостью оспемифена отдельно. Также неожиданно наблюдалось, что эти высокие пересыщенные уровни оспемифена поддерживались даже через 3 часа при комнатной температуре.
[00168] Кроме того, как показано в таблице V, твердые дисперсии, содержащие оспемифен и коповидон, неожиданно показали значительно повышенную растворимость во всех трех тестируемых растворителях. Более конкретно, для твердой дисперсии, содержащей оспемифен и коповидон, растворимость оказалась повышенной более чем в 80 раз в воде, в 70 раз в 50 мМ фосфате, рН 6,8 и более чем в 100 раз в 0,1 н. HCl.
[00169] Растворимость твердых дисперсий, содержащих оспемифен и повидон, неожиданно повышалась в 69 раз в воде, а растворимость твердых дисперсий, содержащих оспемифен и НРМС, неожиданно оказалась повышенной в 67 раз в воде и в 53 раза в 50 мМ РО4 буфере, рН 6,8.
[00170] Хотя ранее сообщалось, что присутствие гидрофильного носителя в твердой дисперсии может повысить растворимость лекарственного средства, трудно предсказать степень повышения растворимости, которая может быть достигнута, вероятно, поскольку его доля в каждой композиции будет уникальной в зависимости от конкретных АФИ и носителя, применяемых для получения какой-либо конкретной твердой дисперсной формы. Несмотря на это, ранее опубликованные данные свидетельствуют о том, что повышение растворимости в 10 раз является обычным, в то время как сообщения о повышении растворимости в 50-100 раз появляются редко.
[00171] Например, в патентной публикации США №2013/012335 (которая в полном объеме включена в настоящее описание в качестве ссылки) описаны твердые дисперсионные формы дронедарона, для которых в буферизованном растворе при рН 6,8 достигалось увеличение в 2-13 раз. Аналогичным образом, другие исследователи сообщили об оценке различных носителей в качестве носителей в твердых дисперсионных формах нифедипина (Tanno et at., 2012). Максимальное повышение растворимости, достигнутое в этих исследованиях, составляло повышение в 4 раза в буферном растворе при рН 6,8.
[00172] В других исследованиях было проведено сопоставление влияния различных носителей в твердых дисперсиях на повышение растворимости. Например, исследования, в ходе которых проводилось сравнение влияния HPMCAS или PVP на растворимость индометацина, показали, что HPMCAS оказывал большее влияние, чем PVP, хотя наблюдаемое максимальное повышение растворимости составляло всего в 9 раз (Sun et at., 2012). В других исследованиях, в ходе которых проводили изучение 41 соединения со слабой растворимостью, было установлено, что HPMCAS является наиболее эффективным для поддержания пересыщения лекарственного средства. Однако наилучшая эффективность в отношении повышения растворимости в лучшем случае составляла в 50-80 раз по сравнению с АФИ по отдельности, а для большинства соединений повышение растворимости составляло в от примерно 2 до 20 раз (Curatolo et at., 2009).
[00173] Таким образом, твердые дисперсии оспемифена, полученные с применением коповидона, HPMCAS, повидона или НРМС, демонстрируют удивительные свойства растворимости и стабильности и, таким образом, обеспечивают значительные преимущества по сравнению с лекарственными формами оспемифена, известными в настоящее время.
[00174] Пример 2: Исследования растворимости твердых дисперсий оспемифена с другими гидрофильными носителями
[00175] Твердые дисперсии, содержащие оспемифен и гидрофильный носитель, выбранный из Eudragit L100, гидроксипропилцеллюлозы (НРС), полоксамера 407, Soluplus® и фталата гидроксипропилметилцеллюлозы (НРМСР), получали при помощи способа выпаривания растворителя, как описано выше в примере 1. Растворимость указанных твердых дисперсий оспемифена анализировали в трех водных средах (вода, 0,1 н. HCl или буферный водный раствор, содержащий 50 мМ фосфат, рН 6,8), как описано выше в примере 1.
[00176] Результаты анализа растворимости приведены ниже в таблице VI. Твердые дисперсии оспемифена, полученные с указанными другими гидрофильными носителями, показали повышенную растворимость в каждой тестируемой водной среде. Растворимость твердых дисперсий, содержащих оспемифен и Eudragit® L100, неожиданно повышалась в 83 раз в 50 мМ РО4 буфере, рН 6,8, а растворимость твердых дисперсий, содержащих оспемифен и НРС, неожиданно оказалась повышенной в 160 раз в воде и в 240 раза в 0,1 н. HCl. Растворимость твердых дисперсий, содержащих оспемифен и полоксамер 407, оказалась заметно повышенной во всех трех водных растворах, включая значительное увеличение в 353 раза в 50 мМ буфере PO4, рН 6,8. Растворимость твердых дисперсий, содержащих оспемифен и Soluplus®, неожиданно оказалась повышенной в 110 раз в воде и в 367 раз в 50 мМ буфере РО4, рН 6,8. Для твердых дисперсий, содержащих оспемифен и НРМСР, растворимость оказалась повышенной в 450 раз в 50 мМ буфере PO4, рН 6,8.


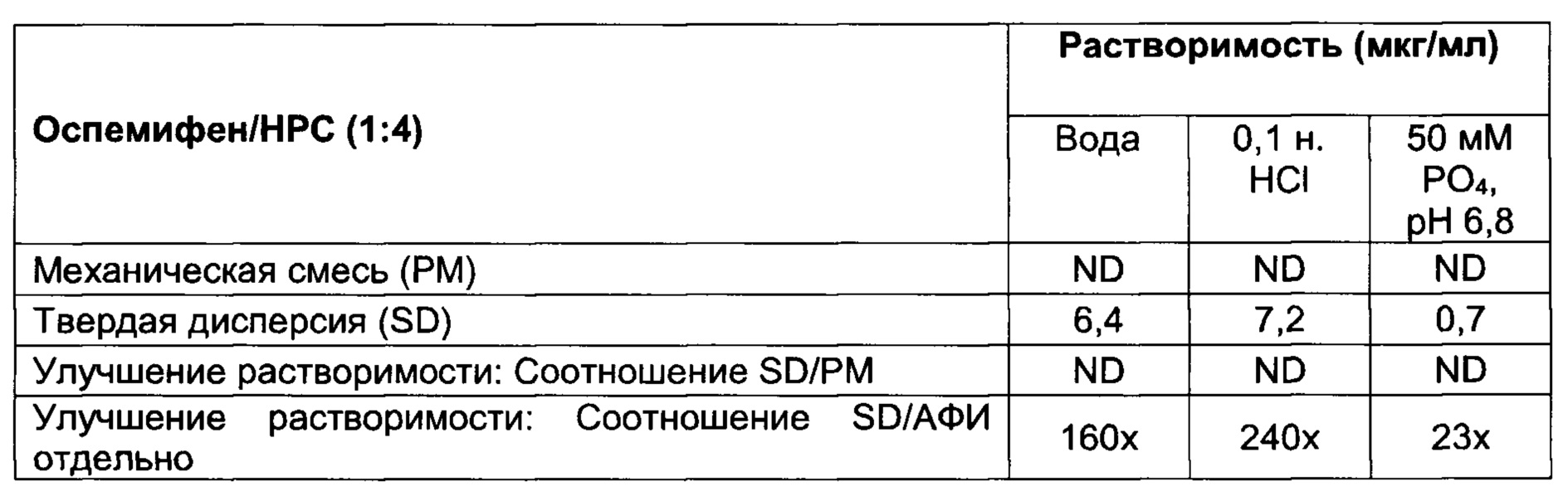
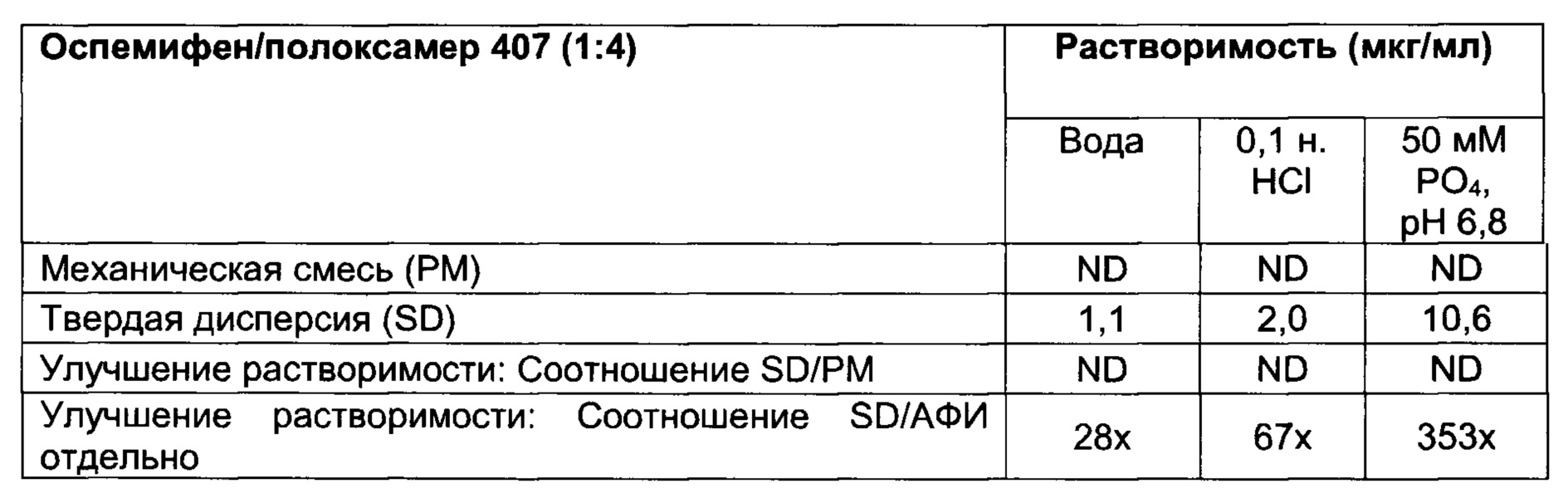
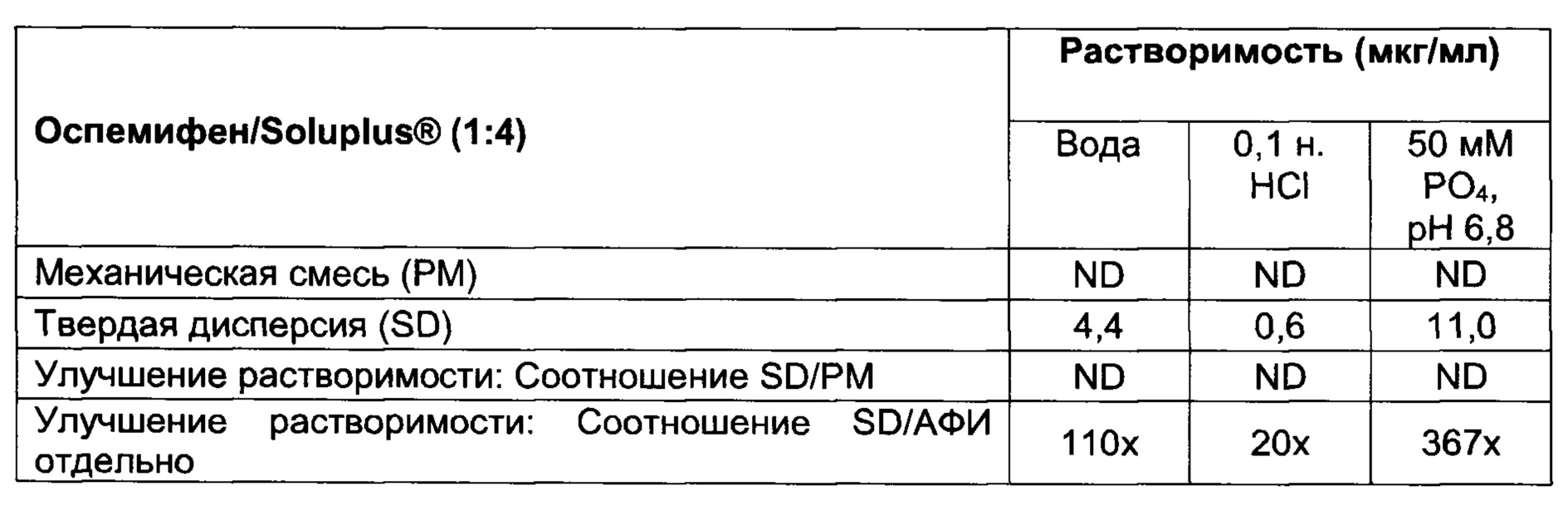
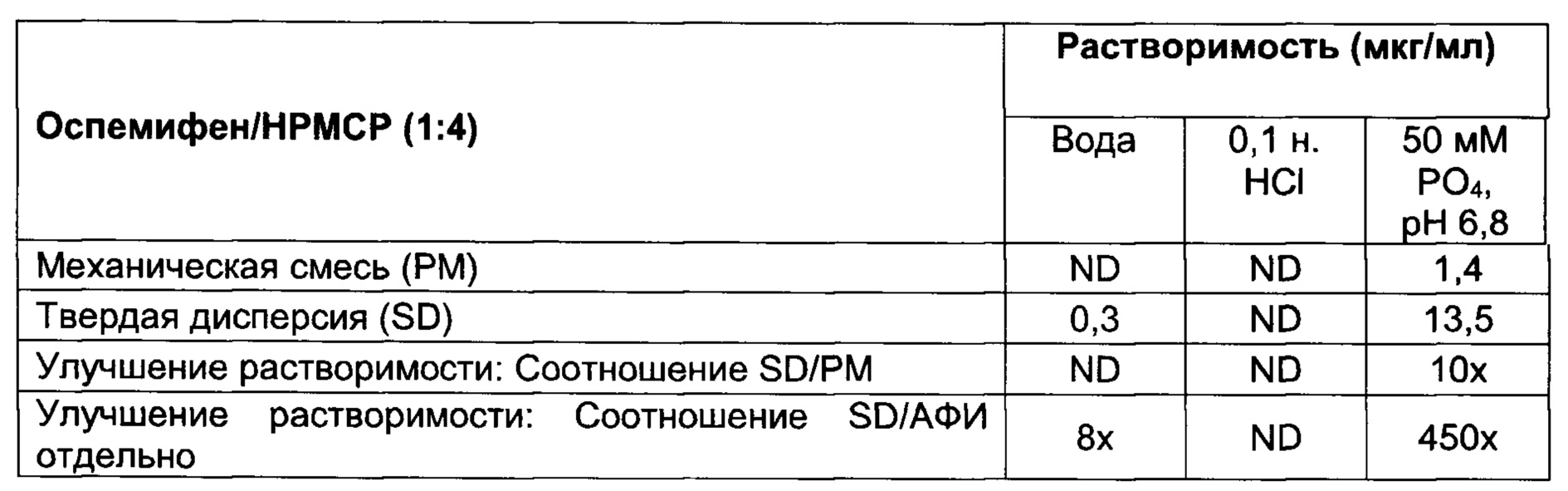
[00178] В таблице VI «ND» означает «не определено».
[00179] Таким образом, как и в случае с другими гидрофильными носителями, твердые дисперсии оспемифена, полученные с применением Soluplus®, Eudragit® L 100-55, полоксамера 407, НРМСР и НРС, демонстрируют удивительные свойства растворимости и стабильности и, таким образом, обеспечивают значительные преимущества по сравнению с лекарственными формами оспемифена, известными в настоящее время.
[00180] Пример 3: Исследования растворимости твердых дисперсий оспемифена с гидрофильным носителем и поверхностно-активным веществом
[00181] Чтобы исследовать, как поверхностно-активные вещества влияют на растворимость твердой дисперсии оспемифена, твердые дисперсии, содержащие оспемифен, гидрофильный носитель (коповидон или повидон) и поверхностно-активное вещество, синтезировали при помощи способа выпаривания растворителя, как описано выше в примере 1. Растворимость указанных твердых дисперсий оспемифена анализировали в трех водных средах (вода, 0,1 н. HCl или буферный водный раствор, содержащий 50 мМ фосфат, рН 6,8), как описано выше в примере 1.
[00182] Результаты анализа растворимости приведены ниже в таблице VII. Поверхностно-активные вещества, такие как полоксамер 407, натрия докузат, Span® 20, Span® 80, Tween® 80 и Cremophor® EL, в разной степени повышали растворимость оспемифена, а в ряде случаев увеличивали растворимость до нескольких сотен раз по сравнению с твердыми дисперсиями, не содержащими поверхностно-активное вещество. Например, растворимость твердой дисперсии, содержащей оспемифен, коповидон и Tween 80, оказалось повышенной в 773 раз, в 610 раз и в 460 раз в воде, 0,1 н. HCl и в 50 мМ PO4, рН 6,8, соответственно, в то время как твердая дисперсия, содержащая оспемифен, коповидон, и Cremophor® EL, обладала растворимостью, повышенной в 1995 раз, в 2077 раз и в 117 раз, в воде, 0,1 н. HCl и в 50 мМ РO4, рН 6,8, соответственно.
[00183]
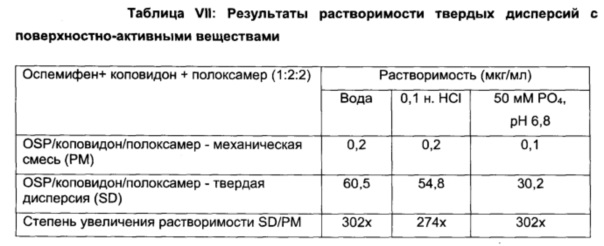

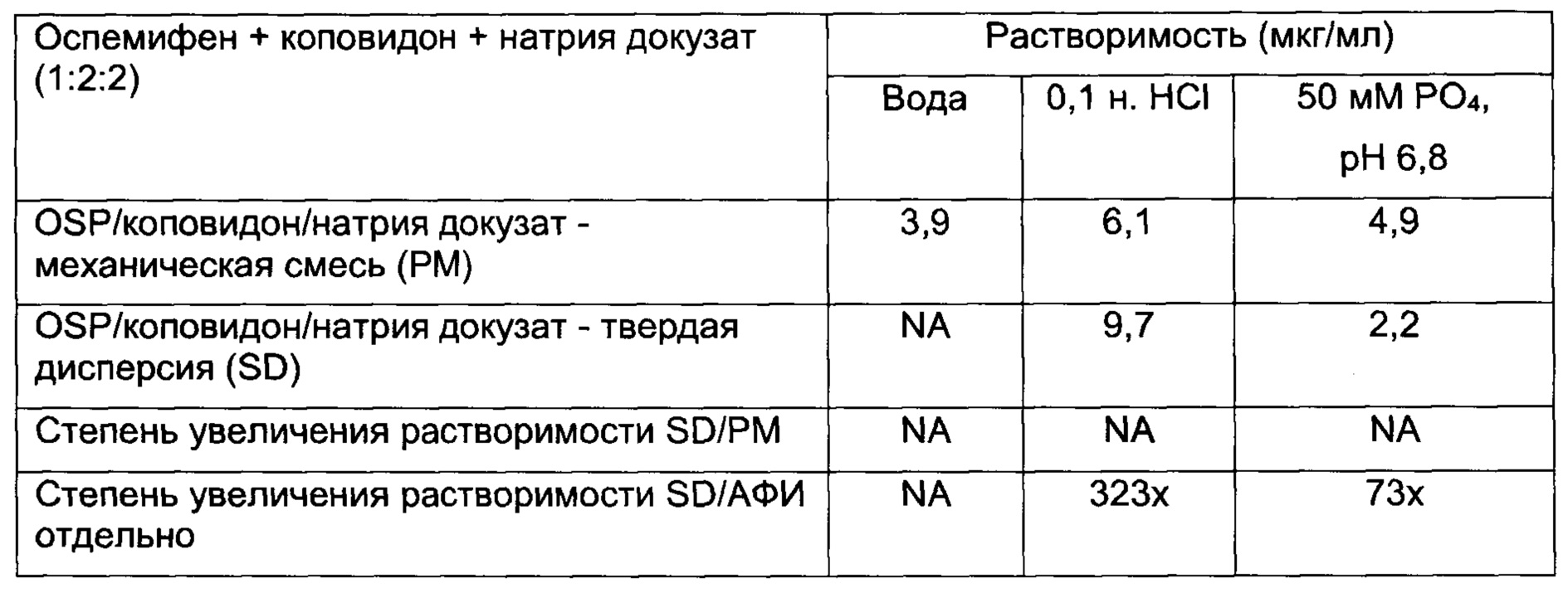
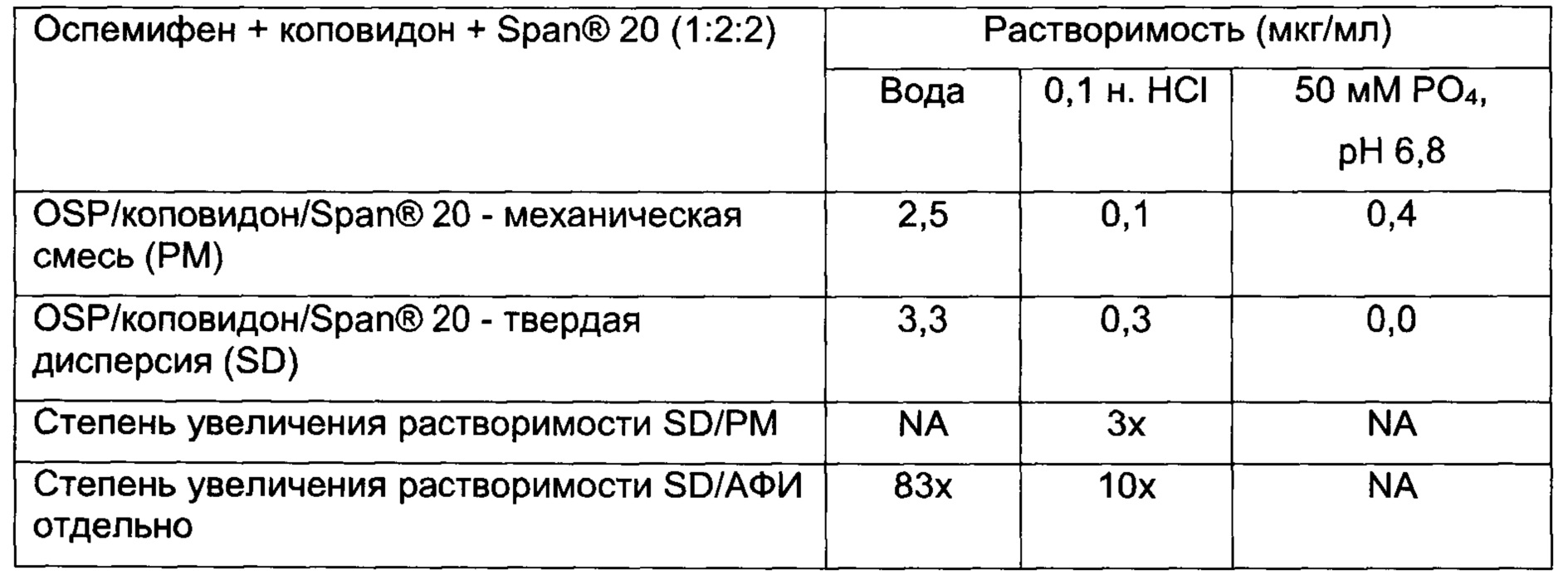
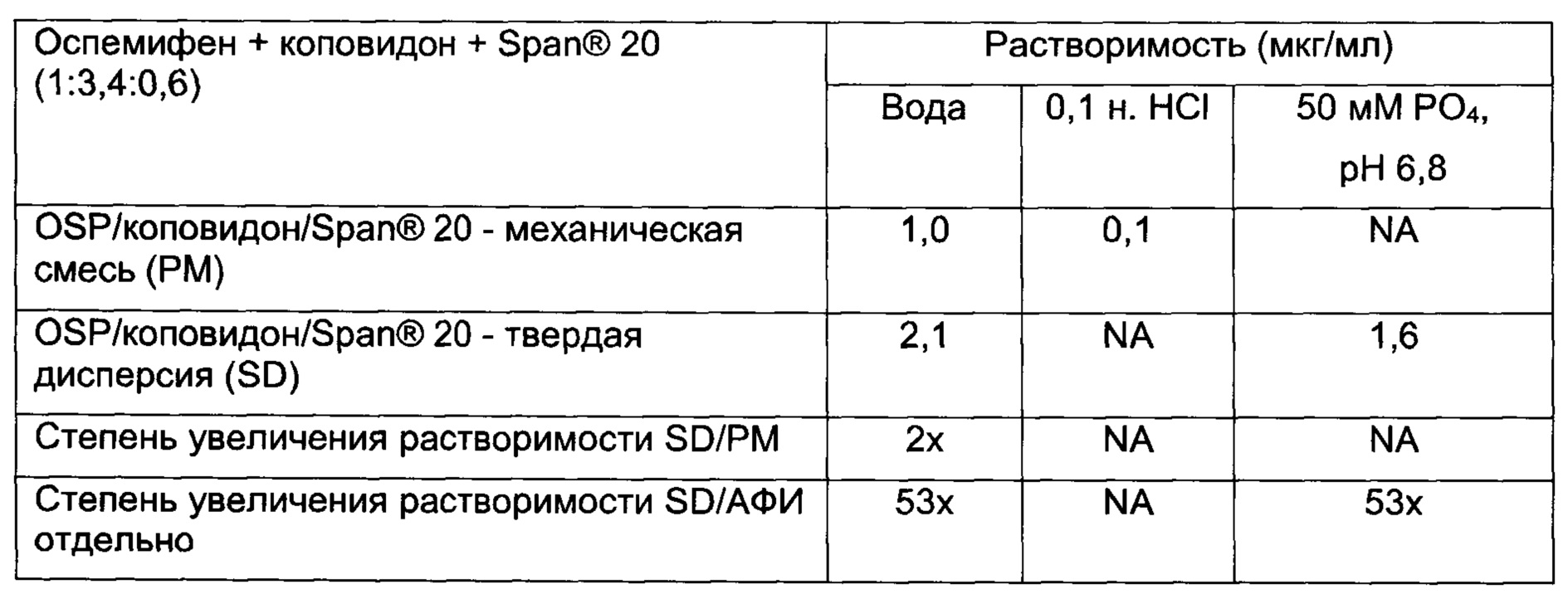

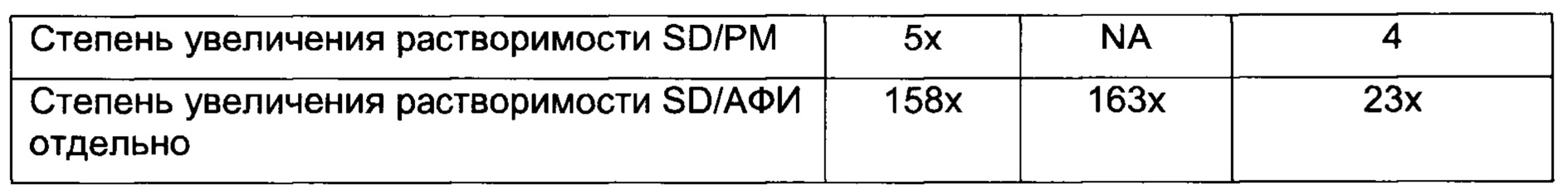
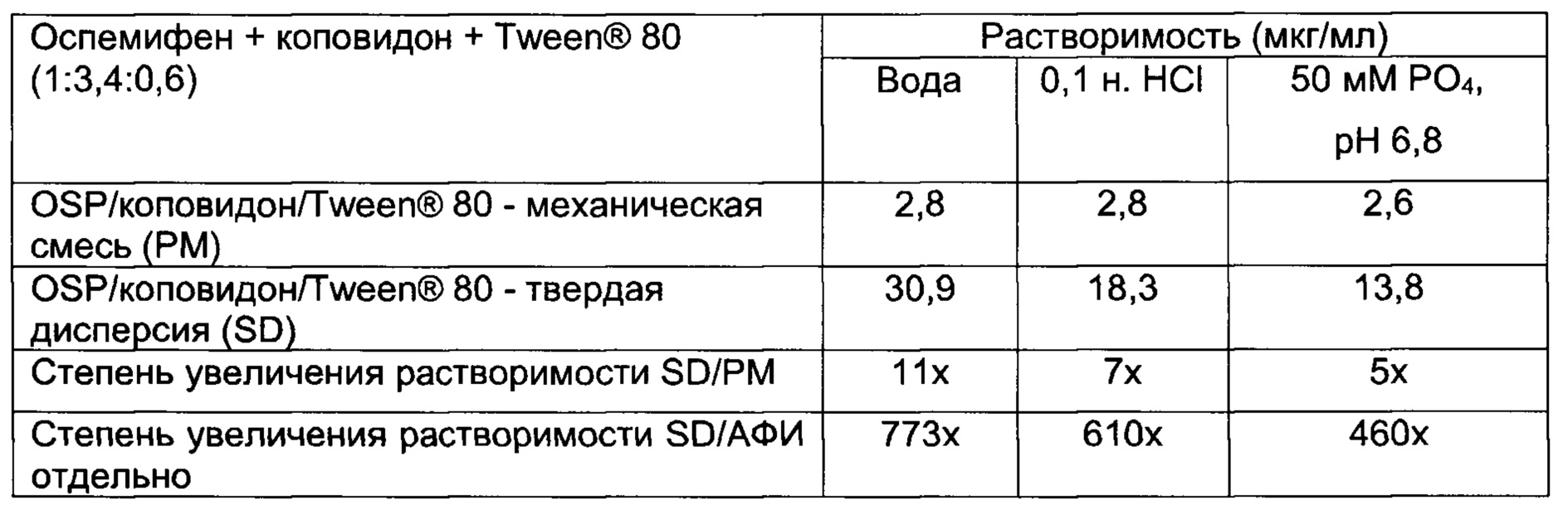
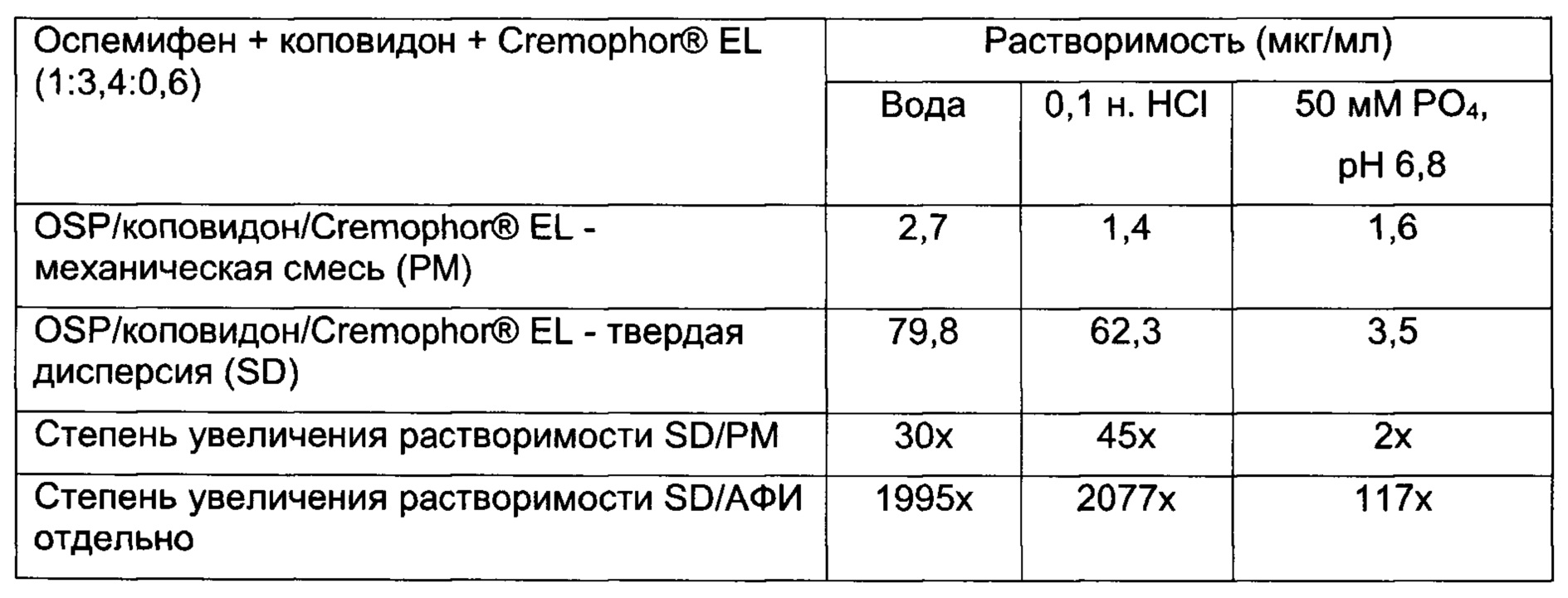
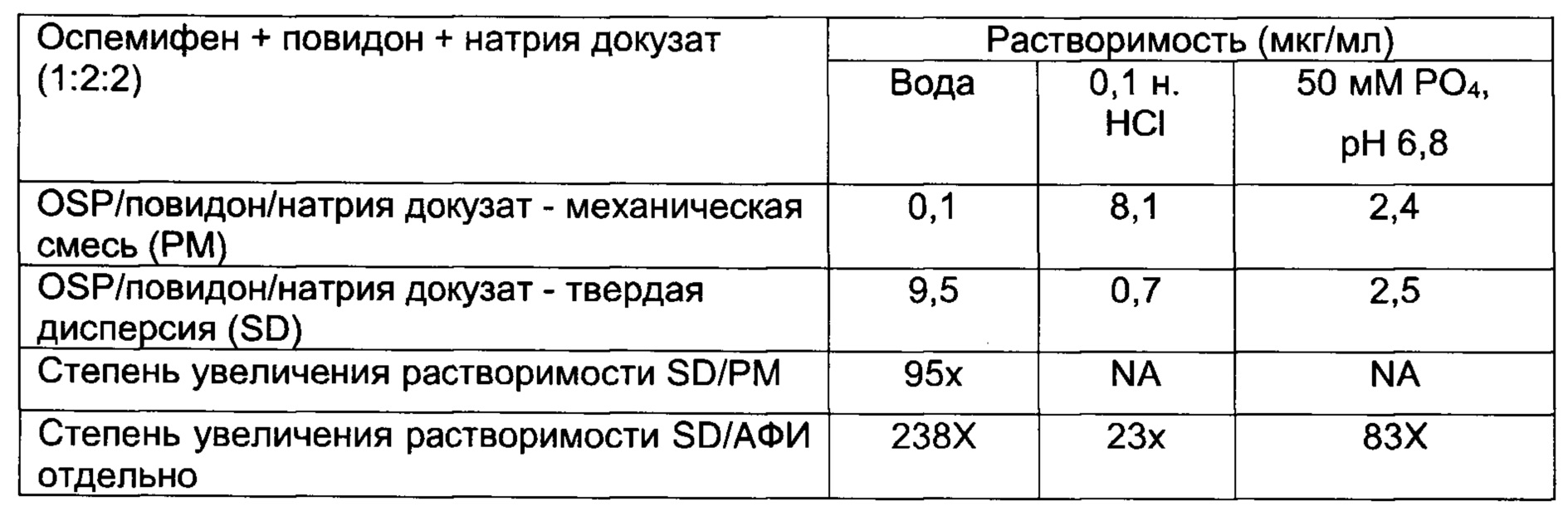



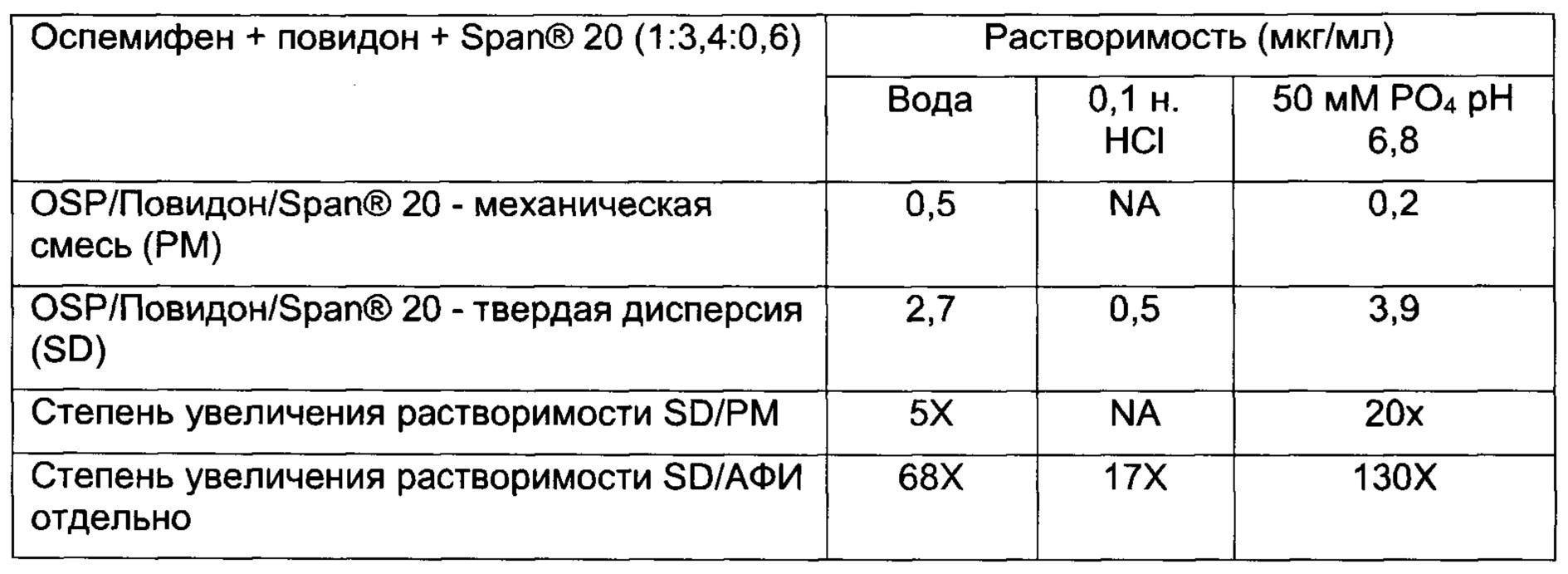

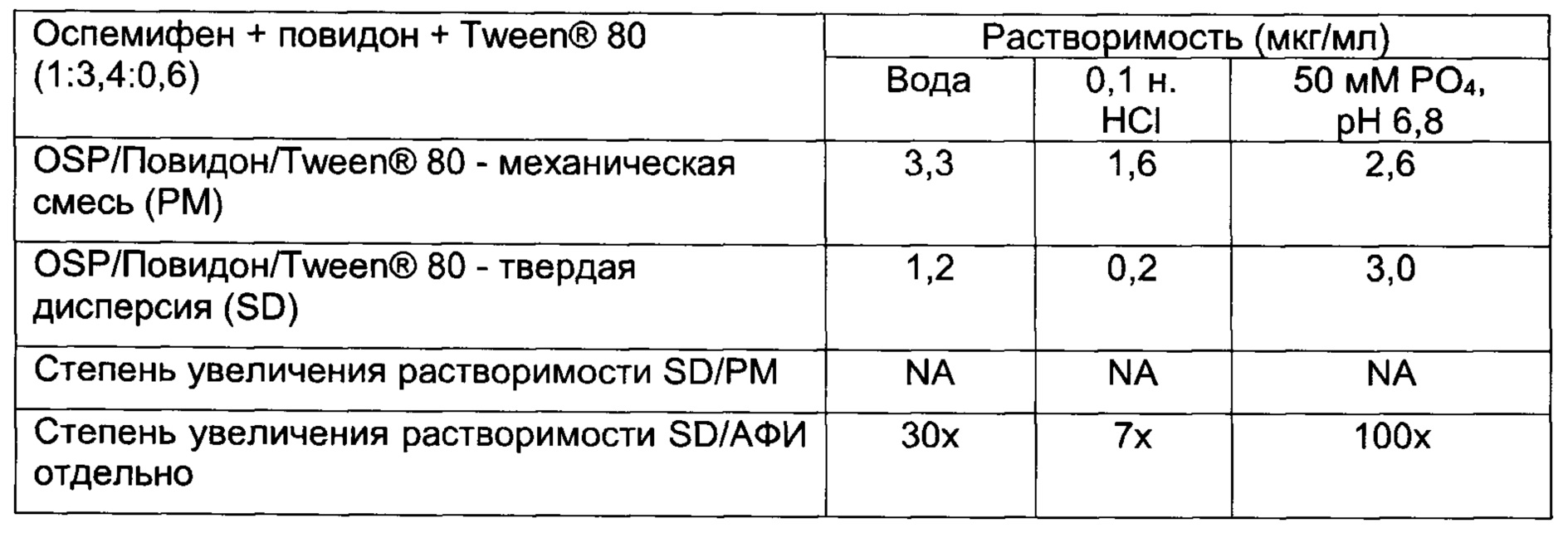
Пример 4: Фармакокинетическое поведение в моделируемых условиях после еды и натощак
[00184] Чтобы исследовать процесс абсорбции оспемифена in vivo в желудочно-кишечном тракте, был разработан метод растворения с использованием имитированных желудочно-кишечных жидкостей (FaSSIF и FeSSIF) для имитации растворения лекарственных веществ in vivo. Аббревиатура «FaSSIF» обозначает «искусственную кишечную жидкость состояния натощак», в то время как аббревиатура «FeSSIF» обозначает «искусственную кишечную жидкость сытого состояния». Растворимость микронизированного оспемифена в фосфатной буферной среде с рН 6,8 составляет <0,01 мг/мл. Среды FaSSIF и FeSSIF коммерчески доступны от компании Biorelevant; их применяли в соответствии с инструкциями производителя.
[00185] Микрорастворение проводили в центрифужной пробирке, содержащей 1,5 мл среды для растворения (FaSSIF или FeSSIF), при комнатной температуре. Целевая концентрация составляла 0,024 мг/мл для условий достаточного разбавления и 0,24 мг/мл для условий пересыщения, при этом вторая концентрация эквивалентна дозе 60 мг в 250 мл жидкости. См., например, Kostwicz et al., 2002. Пробирки центрифугировали после 30 мин, 1, 2 и 3 часов на 14000 об./мин. в течение одной минуты, затем 50 мкл супернатата переносили в пробирку ВЭЖХ, разбавляли 50 мкл ацетонитрила и анализировали с помощью ВЭЖХ.
[00186] Применяли колонну ВЭЖХ Agilent 1100, оборудованную Waters Symmetry Shield С18 150×4,6 мм, 3,5 мкм, уравновешенную при 30°С. Детектор был установлен на 235 нм. Применяли две подвижные фазы, подвижную фазу А и подвижную фазу В. Подвижная фаза А представляла собой 800/200/40 (об./об./об.) деионизированная вода/ацетонитрил/тетрагидрофуран, а подвижная фаза представляла собой 100% ацетонитрил.
[00187] Для анализа примесей скорость потока подвижных фаз составляла 0,85 мл/мин, вводимый объем составлял 10 мкл, со следующей программой градиента:
[00188] Для анализа содержания лекарственного средства применяли те же колонку ВЭЖХ и подвижные фазы, но скорость потока подвижных фаз составляла 1 мл/мин, вводимый объем составлял 7 мкл, со следующей программой градиента:
[00189] Для оспемифена отдельно растворимость в FeSSIF составляла примерно в 2-3 раза выше, чем в FaSSIF, и количество указанного лекарственного средства в растворе оставалось относительно стабильным в течение по меньшей мере 2-3 часов. Фигура 1. Для микронизированного оспемифена растворимость в FeSSIF (0,045 мг/мл) была примерно в 4 раза выше, чем в FaSSIF (0,01 мг/мл через 2 часа). Эти результаты согласуются с литературными данными (Koskimies et al.), а также с информацией на листовке-вкладыше для таблеток Osphena® (таблетки оспемифена для перорального применения), в которой указано, что пища увеличивает биодоступность оспемифена примерно в 2-3 раза.
[00190] А. Формование окунанием в растворитель
[00191] Проведено скрининг-исследование для оценки подходящих гидрофильных носителей для приготовления твердых дисперсий оспемифена. Первоначально получали твердую дисперсию оспемифена со следующими гидрофильными носителями: НРМС 603, PVP K30, PVPVA (PVPVA64), НРС SSL, Eudragit® L100-55, HPMCAS LF, полоксамер 407, НР-55 и Soluplus®, с применением методов распылительной сушки и экструзии горячего расплава.
[00192] Пленки отливали с применением этанольного раствора лекарственного средства/полимера (1:4 масс./масс. лекарственное средство : гидрофильный носитель) и сушили в условиях окружающей среды. Высушенные пленки помещали в камеру при 40°С и влажности окружающей среды или при 40°С и относительной влажности 75% (отн. вл.) в течение 90 часов для стабилизации пленки. После хранения пленки исследовали для определения визуальной прозрачности и кристалличности с использованием поляризованной микроскопии.
[00193] В. Распылительная сушка
[00194] На основе оценки полученных литых пленок были получены твердые дисперсии оспемифена и следующих гидрофильных носителей: Soluplus®, PVPVA, НРС SL, Eudragit® L100-55, HPMCAS LF, PVP K30 и НР-55 методом испарения растворителя. Для распылительной сушки оспемифен и гидрофильные носители в соотношении 2:8 масс/масс, растворяли в этаноле или смеси этанол/вода (8:2) (для целлюлозных носителей) при содержании твердого вещества 5% и сушили распылением с применением системы  В-290 при следующих условиях: температура на входе установлена на 50-80°С, аспиратор на 70-100%, скорость насоса на 10-30% и чистка распылительной головки на 4. Твердые вещества, полученные распылительной сушкой, переносили на широкую чашку Петри, покрытую алюминиевой фольгой, и сушили при 40°С в печи с принудительной подачей воздуха. Все образцы выдерживали в склянке темного стекла бутылке при комнатной температуре до дальнейшего использования. Размер партии составлял примерно 5-10 г.
В-290 при следующих условиях: температура на входе установлена на 50-80°С, аспиратор на 70-100%, скорость насоса на 10-30% и чистка распылительной головки на 4. Твердые вещества, полученные распылительной сушкой, переносили на широкую чашку Петри, покрытую алюминиевой фольгой, и сушили при 40°С в печи с принудительной подачей воздуха. Все образцы выдерживали в склянке темного стекла бутылке при комнатной температуре до дальнейшего использования. Размер партии составлял примерно 5-10 г.
[00195] С. Экструзия горячего расплава
[00196] Экструзию горячего расплава проводили с применением механических смесей лекарственного средства/гидрофильного носителя (2:8 (масс./масс.)) с использованием микроаппарата для интенсивного перемешивания Thermo Haake Minilab при следующих условиях: настройка температуры: 120-180°С, скорость мотора 100-200 л/мин. После затвердевания твердые частицы, полученные экструзией горячего расплава, измельчали в аппарате для измельчения. Все образцы выдерживали в склянке темного стекла бутылке при комнатной температуре до дальнейшего использования. Размер партии составлял примерно 10 г.
[00197] Образцы, полученные формованием окунанием в растворитель, распылительной сушкой и экструзией горячего расплава, хранили при 40°С и 75% относительной влажности (в открытом и закрытом виде) в течение 78 часов и анализировали с помощью ВЭЖХ. Результаты ВЭЖХ показали, что в целом оспемифен химически совместим со всеми протестированными вспомогательными веществами, за исключением НР-55, для которого наблюдали примеси, составляющие почти 5% от всего образца. Для всех других исследованных комбинаций примеси составляли 0,4% или менее.
[00198] D. Твердая дисперсия оспемифен/коповидон
[00199] Твердую дисперсию оспемифена и коповидона (PVPVA64) получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Указанное лекарственное средство как в FaSSIF, так и в FeSSIF высвобождалось с подобной скоростью и степенью, при этом примерно 60-70% дозы высвобождалось в течение 10 минут (при теоретической концентрации 0,024 мг/мл), и высвобождение было более быстрым, чем при суспендировании оспемифена в фосфатном буфере с рН 6,8. Фигура 2. В противоположность этому известно, что пища увеличивает биодоступность оспемифена в других препаратах (например, Osphena®) в 2-3 раза.
[00200] Е. Твердая дисперсия оспемифен/Soluplus®
[00201] Твердую дисперсию оспемифена и Soluplus® получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Для указанной твердой дисперсии почти 100% дозы высвобождалось в FeSSIF по сравнению с 60% высвобождением в FaSSIF и около 45% высвобождением в фосфатном буфере с рН 6,8. Фигура 3.
[00202] F. Твердая дисперсия оспемифен/HPMCAS
[00203] Твердую дисперсию оспемифена и HPMCAS получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. В твердой дисперсии оспемифена и HPMCAS кинетика высвобождения была значительно медленнее, при этом максимальное высвобождение в FaSSIF или FeSSIF достигалось почти за два часа. Фигура 4. Кроме того, было высвобождено только примерно 50-60% теоретической дозы, хотя неожиданно в FaSSIF наблюдалось большее высвобождение, чем в FeSSIF. Фигура 4. Эти данные отличаются от данных других исследований оспемифена, где, как правило, в FeSSIF наблюдается значительно лучшая растворимость.
[00204] G. Твердая дисперсия оспемифен/повидон
[00205] Твердую дисперсию оспемифена и повидона (PVP K30) получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Для указанной твердой дисперсии первоначально наблюдалась высокая скорость высвобождения лекарственного средства как в FaSSIF, так и в FeSSIF. Тем не менее, в условиях FASSIF наблюдалось небольшое снижение концентрации лекарственного средства во времени, вероятно, из-за осаждения лекарственного средства из среды растворения. Аналогично, лекарственное средство быстро высвобождался в буфере с рН 6,8 в течение примерно первых 30 минут. Тем не менее, через 30 минут скорость высвобождения замедлилась по сравнению с твердой дисперсией в FeSSIF и FaSSIF, возможно, по причине быстрого выпадения лекарственного средства в осадок с течением времени. Фигура 5.
[00206] Н. Твердая дисперсия оспемифен/гидроксипропилцеллюлоза
[00207] Твердую дисперсию оспемифена и гидроксипропилцеллюлозы (HPC-SSL) получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Для твердой дисперсии с гидроксипропилцеллюлозой скорость растворения оспемифена и степень его высвобождения значительно различались в условиях FaSSIF, FeSSIF и в буфере с рН 6,8. Порядок ранжирования степени высвобождения лекарственного средства такой: FeSSIF > FaSSIF > буфер с рН 6,8. Самая быстрая скорость растворения наблюдалась в FeSSIF, при этом плато достигалось в течение 30 минут, и самую медленную скорость высвобождения наблюдали в буфере с рН 6,8. Фигура 6.
[00208] I. Твердая дисперсия оспемифен/фталат гидроксипропилметилцеллюлозы
[00209] Твердую дисперсию оспемифена и фталата гидроксипропилметилцеллюлозы (НР-55) получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Подобно твердой дисперсии оспемифена, полученной с HPMCAS, растворение лекарственного средства из твердой дисперсии, полученной с НР-55, было относительно медленным как в условиях FeSSIF, так и в условиях FaSSIF, достигая примерно 90% целевой концентрации в течение 120 минут в FeSSIF. Высвобождение лекарственного средства в FaSSIF осуществлялось медленнее, чем в FeSSIF. Растворение лекарственного средства в буфере с рН 6,8 было умеренным и находилось между значениями растворения в FeSSIF и FaSSIF, и отличались от растворения для HPMCAS и Eudragit® L100-55 в буфере с рН 6,8. Фигура 7.
[00210] J. Твердая дисперсия оспемифен/Eudragit®
[00211] Твердую дисперсию оспемифена и Eudragit® L100-55 получали методом испарения растворителя, как описано в примере 1, и анализировали ее растворение в FaSSIF и FeSSIF. Подобно твердой дисперсии, полученной с HPMCAS, растворение лекарственного средства из твердой дисперсии, полученной с полимером Eudragit® L100-55, было медленным как в условиях FeSSIF, так и в условиях FaSSIF, достигая примерно 40% целевой концентрации в течение 180 минут в FeSSIF. Высвобождение лекарственного средства в FaSSIF осуществлялось медленнее, чем в FeSSIF. Растворение лекарственного средства в буфере с рН 6,8 было аналогично растворению лекарственного средства с HPMCAS, где в начале наблюдалось быстрое растворение, но пересыщенное состояние лекарственного средства не поддерживалось. В результате после того, как высвобождение лекарственного средства достигло 50% в течение 10 минут, концентрация лекарственного средства быстро упала ниже 20%. Фигура 8.
Пример 5: Влияние поверхностно-активных веществ на свойства растворения твердых дисперсий оспемифена
[00212] После проведения первоначального скрининга гидрофильных носителей к твердым дисперсиям оспемифена добавляли различные поверхностно-активные вещества, в том числе Span® 20, Span® 80, Tween® 80, Kolliphor® EL и полоксамер 407 для того, чтобы провести оценку их влияния на высвобождение оспемифена в FaSSIF или FeSSIF. В частности, оценивали влияние поверхностно-активных веществ различных типов и в различных количествах на свойства растворения твердых дисперсий оспемифена, содержащих коповидон (PVPVA) и повидон (PVP).
[00213] Кроме того, также оценивали получение твердых дисперсий комбинации оспемифена и поверхностно-активного вещества с коповидоном (PVPVA64), повидоном (PVP K30) и гидроксипропилцеллюлозой (HPC-SSL).
[00214] Твердые дисперсии, содержащие тройную смесь оспемифена, поверхностно-активного вещества и гидрофильного носителя, получали методом испарения растворителя, как описано в примере 1. Пленки получали с применением раствора твердая дисперсия/этанол (1:3,4:0,6 масс./масс/масс. лекарственное средство : гидрофильный носитель : поверхностно-активное вещество). При помощи поляризованной микроскопии не наблюдали кристаллизации после хранения при 40°С в течение 72 часов. После хранения в открытом виде в условиях 40°С / 75% отн. вл., PVPVA, по-видимому, обладал лучшей физической стабильностью по сравнению с пленкой с PVP и НРС, как показано в таблице VIII. Порядок ранжирования был следующий: PVPVA > НРС > PVP.
[00215]
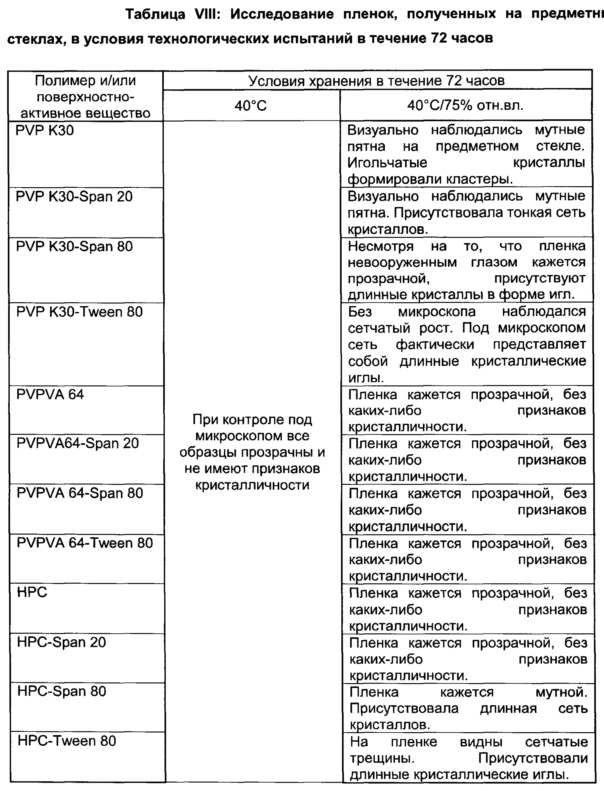
[00216] При целевой концентрации 0,024 мг/мл добавление поверхностно-активного вещества к твердой дисперсии, содержащей оспемифен и коповидон (PVPVA64) (лекарственное средство : носитель : поверхностно-активное вещество 1:3,4:0,6), значительно улучшило степень высвобождения лекарственного средства по сравнению с кристаллическим лекарственным средством во всех трех тестируемых средах (FeSSIF, FaSSIF и фосфатный буфер, рН 6,8), особенно с поверхностно-активными веществами Tween® 80 и Kolliphor® EL. Фигуры 9-11. Твердая дисперсия, содержащая оспемифен, коповидон (PVPVA64) и Span® 20 (и, в меньшей степени, Tween® 80), показала почти идентичную кинетику высвобождения как в FeSSIF, так и в FaSSIF. Фигуры 9-10. Это согласуется с эффектом, наблюдаемым для твердых дисперсий оспемифен/коповидон без поверхностно-активного вещества. См. фигуру 2. Подобные эффекты наблюдались в твердых дисперсиях, содержащих оспемифен, коповидон и Tween® 80, хотя присутствовали признаки потери оспемифена из среды растворения, возможно, из-за осаждения.
[00217] Для твердой дисперсия, содержащей оспемифен, PVPVA64 и Kolliphor® EL (неионный эмульгатор), также был неожиданно обнаружен больший выброс лекарственного средства в FaSSIF по сравнению с FeSSIF (80% против 50%).
[00218] Дополнительные исследования проводили при пересыщенной целевой концентрации, эквивалентной 60 мг оспемифена в 250 мл среды (0,24 мг/мл). По сравнению с растворением микронизированного оспемифена при той же пересыщенной концентрации (0,24 мг/мл) твердые дисперсии, содержащие оспемифен, коповидон (PVPVA64) и поверхностно-активное вещество (Span® 20, Span® 80 и Tween® 80) (коповидон : поверхностно-активное вещество = 6:1) (лекарственное средство : носитель : поверхностно-активное вещество = 1:3,4:0,6) демонстрируют значительное улучшение степени растворения лекарственного средства, особенно в среде FeSSIF. Однако степень высвобождения лекарственного средства в фосфатном буфере с рН 6,8 не улучшилась. Фигуры 12-14.
[00219] Исследования растворения in vitro проводили с твердыми дисперсиями оспемифена, полученными с другими поверхностно-активными веществами (лекарственное средство : носитель : поверхностно-активное вещество = 1:2:2), включая полоксамер 407 и натрия докузат. Значительное улучшение растворения во всех трех средах наблюдалось для твердой дисперсии, полученной с применением коповидона (РVРVА64)/полоксамера 407 в качестве матрицы. Фигура 15. Для твердых дисперсий, содержащих оспемифен, коповидон и натрия докузат, значительное улучшение растворения наблюдалось в среде FeSSIF, но не в фосфатном буфере с рН 6,8 и не в среде FaSSIF. Фигура 17. Для твердой дисперсии, содержащей оспемифен, коповидон и Span 20, где был увеличен уровень поверхностно-активного вещества (лекарственное средство : полимер : поверхностно-активное вещество = 1:2:2), значительное улучшение растворения наблюдалось в среде FeSSIF, но не в фосфатном буфере с рН 6,8 и не в среде FeSSIF по сравнению с твердой дисперсией, содержащей оспемифен, коповидон и Span® 20 в более низкой концентрации (лекарственное средство : полимер : поверхностно-активное вещество = 1:3,4:0,6). Фигура 16.
[00220] Аналогичные исследования проводили с твердыми дисперсиями, содержащими оспемифен, повидон (PVP K30) и поверхностно-активное вещество. При целевой концентрации 0,24 мг/мл твердая дисперсия, полученная с оспемифеном и повидоном, показала быструю начальную скорость растворения во всех трех растворяющих средах. Фигура 18. Однако наблюдалось быстрое снижение концентрации во времени. Фигура 18. Добавление поверхностно-активного вещества (Span® 20, Span® 80, Tween® 80) к твердой дисперсии (лекарственное средство : полимер : поверхностно-активное вещество = 1:3,4:0,6), значительно увеличивало во времени пересыщение лекарственного средства (в среде растворено больше лекарственного средства, чем термодинамическая растворимость кристаллического лекарственного средства), в частности, с поверхностно-активным веществом Span® 80 и Span® 20. Фигуры 19-21.
[00221] Для того, чтобы оценить влияние уровня поверхностно-активного вещества на профиль растворения твердых дисперсий оспемифена, получили и исследовали твердую дисперсию, содержащую оспемифен, повидон (PVP K30) и поверхностно-активное вещество (полоксамер 407, Span 20 и натрия докузат), в которой повышали уровень поверхностно-активного вещества (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2). При целевой концентрации 0,24 мг/мл не наблюдалось существенного улучшения степени растворения для твердых дисперсий, содержащих повидон и более высокие уровни поверхностно-активных веществ. Фигуры 22-24.
[00222] После того, как провели первоначальные скрининговые исследования твердых дисперсий оспемифена, содержащих гидрофильный носитель или гидрофильный носитель и поверхностно-активное вещество, для дальнейших исследований отобрали несколько композиций.
[00223] Определенные композиции, содержащие неионный гидрофильный носитель (например, оспемифен, повидон, Span® 80 (1:3,4:0,6), оспемифен, коповидон и полоксамер 407 (1:2:2)), показали превосходную кинетику растворения. Исследования растворения in vitro показали, что твердая дисперсия оспемифена с коповидоном и полоксамером 407 (лекарственное средство : носитель : поверхностно-активное вещество 1:2:2) обладала наибольшей степенью растворения (около 0,15 мг/мл в FeSSIF и > 0,03 мг/мл в FaSSIF и буфере с рН 6,8), что примерно в 2-6 раз выше, чем у микронизированного оспемифена в FeSSIF и FaSSIF. Твердая дисперсия оспемифена с повидоном и Span® 80 (6:1) значительно продлевала пересыщение лекарственного средства во всех трех средах, особенно в буфере с рН 6,8 (> 0,01 мг/мл в течение более 3 часов).
[00224] Другие составы, содержащие гидрофильный носитель на основе энтеросолюбильного полимера (например, оспемифен и НР-55 или оспемифен и HPMCAS), показали растворение > 0,01 мг/мл во всех трех тестируемых средах.
[00225] Твердые дисперсии оспемифена (загрузка лекарственным средством 20%) с коповидоном, НР-55, коповидоном/полоксамером 407 (1:1), повидоном/Span® 80 (6:1) получали экструзией горячего расплава и распылительной сушкой, как описано выше. Указанные твердые дисперсии анализировали при помощи ВЭЖХ, по стабильности, при помощи рентгеновской порошковой дифракции (XRPD), дифференциальной сканирующей калориметрии (ДСК) и инфракрасной спектроскопией с преобразованием Фурье (ИК-Фурье).
[00226] Спектры рентгеновской порошковой дифракции составов, полученных экструзией горячего расплава и распылительной сушкой (как свежих образцов, так и выдержанных в условия технологических испытаний (условия технологических испытаний = 40°С/75% отн. вл. в течение 5 дней в закрытом контейнере темного стекла) были получены на дифрактометре Panalytical X'pert PRO. Образцы готовили на держателях с нулевым фоном (zero background holder), спектры XRPD получали при комнатной температуре.
[00227] Для всех составов на спектрах рентгеновской дифракции наблюдали аморфное гало, за исключением состава, содержащего полоксамер 407. Пики, наблюдаемые для твердой дисперсии оспемифен/коповидон/полоксамер, по-видимому, обусловлены жидкокристаллической фазой полоксамера 407, что подтверждается наличием пика плавления в эксперименте ДСК (на приборе DSC Q1000 от ТА Instruments). Оспемифен во всех составах не показал кристалличности по рентгеновской порошковой дифракции, что указывает на то, что указанное лекарственное средство находится в аморфном состоянии. Дифрактограммы XRPD для всех трех составов не показали никаких изменений после хранения в течение 1 недели при 40°С/75% относительной влажности.
[00228] Температуру стеклования и/или температуру плавления твердых дисперсий оспемифена, полученных экструзией горячего расплава и распылительной сушкой, как в свежих образцах, так и выдержанных в условиях технологических испытаний (при 40°С/75% относительной влажности в течение 5 дней в закрытой бутылке темного стекла), оценивали при помощи прибора DSC Q1000 от ТА Instruments. Приблизительно 7-10 мг каждой композиции взвешивали и помещали в алюминиевый тигель с крышкой. Образец нагревали со скоростью 10°С/мин от 25 до 200°С. Для всех свежих образцов твердых дисперсий оспемифена, полученных экструзией горячего расплава и распылительной сушкой, наблюдали область стеклования, за исключением высушенного распылением образца твердой дисперсии оспемифен/коповидон/полоксамер 407.
Поскольку большая часть измеренных температур стеклования составляла примерно 50-60°С, пик плавления полоксамера 407 в составе, полученном распылительной сушкой, мог замаскировать стеклование. Для всех составов, полученных как методом экструзии горячего расплава, так и методом распылительной сушки, не было обнаружено пика эндотермы плавления лекарственного средства.
[00229] Было обнаружено, что температуры стеклования выдержанных в условиях технологических испытаний образцов составов, полученных распылительной сушкой, увеличиваются по сравнению с первоначально измеренными температурами. Возможно, состав, полученный распылительной сушкой, поглощает воду в течение периода хранения благодаря пористости. В этих случаях вода в камере для исследования стабильности могла действовать как антипластификатор.
[00230]

[00231] *Два значения указывают на существование двух аморфных фаз.
[00232] Спектры ИК-Фурье свежих образцов составов оспемифена и оспемифена и вспомогательных веществ, используемых в композициях, полученных экструзией из горячего расплава и распылительной сушкой, были получены с использованием Perkin Elmer Spectrum One с приспособлением для нарушенного полного внутреннего отражения (НПВО). Спектр ИК-Фурье получали на 4000-600 см-1, 4 сканирования на образец, при комнатной температуре.
[00233] Самый сильный пик на спектре ИК-Фурье оспемифена был связан с алкилгалогенидной связью хлорида и углерода на примерно 700 см-1. Чтобы определить, присутствует ли какое-либо взаимодействие между лекарственным средством и гидрофильным носителем и/или поверхностно-активным веществом, в качестве индикатора использовали сдвиг указанного алкилгалогенидного пика. Результаты показали, что указанный алкилгалогенидный пик полученного распылительной сушкой оспемифена с коповидоном смещался вверх до 705 см-1, что указывает на более слабое взаимодействие с хлоридом и водородом коповидона. С другой стороны, алкилгалогенидный пик обработанной методом экструзии горячего расплава (НМЕ) твердой дисперсии оспемифен-НР-55 показал сдвиг вниз до 701 см-1.
[00234]
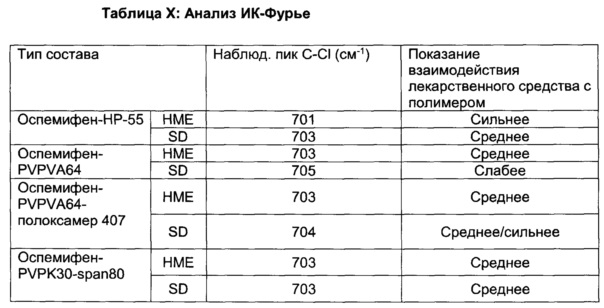
[00235] Следующие твердые дисперсии оспемифена были получены методами экструзии горячего расплава и распылительной сушки, как описано выше:
Оспемифен/коповидон (PVPVA64);
Оспемифен/коповидон (PVPVA64)/полоксамер 407;
Оспемифен/НР-55; и
Оспемифен/повидон (PVP K30)/Span 80.
[00236] Затем указанные составы хранили при 40°С и 75% относительной влажности (в открытом виде) в течение 78 часов и анализировали с помощью ВЭЖХ. Результаты ВЭЖХ показали, что в целом оспемифен химически совместим со всеми протестированными вспомогательными веществами, за исключением НР-55, который применяли в способе экструзии горячего расплава. Приготовление твердой дисперсии оспемифен/НР-55 путем экструзии горячего расплава приводило к наибольшему содержанию примесей (около 7%), однако при приготовлении такого же состава методом распылительной сушки было получено гораздо меньше примесей (около 1%), что указывает на то, что различные способы получения могут оказывать влияние на количество примесей, содержащихся в твердой дисперсии. Все другие исследуемые твердые дисперсии имели общее содержание примесей, составлявшее 0,34% или менее, при этом состав оспемифен/коповидон/полоксамер, полученный экструзией горячего расплава и распылительной сушкой, содержал наименьшее количество примесей (0,18% и 0,17%, соответственно).
[00237] Пример 6: Исследование растворения согласно Фармакопее США (USP) II
[00238] Крупномасштабное исследование растворения проводили при помощи лопастной мешалки (аппарат 2 согласно Фармакопее США) с 500 мл раствора FeSSIF или FaSSIF, температуру которого поддерживали при 37°С, при скорости лопасти, установленной на 50 об/мин. Твердые дисперсии оспемифена, содержащие 1) коповидон (PVPVA64) и полоксамер 407; 2) НР-55; 3) повидон и Tween 80; и 4) коповидон (PVPVA64) были получены методом экструзии горячего расплава и методом распылительной сушки, как описано выше. Также готовили образец порошка из истертых таблеток Osphena®. Образцы добавляли в виде порошка, при этом целевая концентрация составляла 0,24 мг/мл (120 мг в 500 мл). Образцы растворяющей среды отбирали через 30 минут, 1, 2 и 3 часа и центрифугировали при 14000 об/мин в течение одной минуты. Затем 50 мкл надосадочной жидкости переносили в ампулу ВЭЖХ, разбавляли 50 мкл ацетонитрила и анализировали с помощью ВЭЖХ, как описано выше.
[00239] Результаты растворения для истертых таблеток Osphena® показаны на фигуре 25. Состав твердой дисперсии, содержащей оспемифен, коповидон и полоксамер 407, полученный распылительной сушкой, показал большую степень растворения, чем состав, полученный экструзией горячего расплава. Фигура 26. Растворение состава, полученного распылительной сушкой, было примерно в 3 раза выше, чем растворение гранул таблеток Osphena® как в FaSSIF, так и в FeSSIF.
[00240] Состав твердой дисперсии, содержащей НР-55, полученный распылительной сушкой, показал большую степень растворения, чем состав, полученный экструзией горячего расплава. В FaSSIF твердая дисперсия НР-55, полученная распылительной сушкой, имела очень высокую скорость растворения и поддерживала пересыщенное состояние в течение по меньшей мере 1 часа, прежде чем вернуться к базовой линии 0,02 мг/мл, что примерно в 2 раза выше, чем растворение гранул таблеток Osphena® в FaSSIF. Фигура 27. В FaSSIF состав твердой дисперсии, содержащей НР-55, полученный распылительной сушкой, также показал большую степень растворения, чем состав, полученный экструзией горячего расплава.
[00241] Твердая дисперсия, содержащая оспемифен, повидон (PVP K30) и Span 80, как в виде состава, полученного распылительной сушкой, так ив виде состава, полученного экструзией горячего расплава, показала подобные профили растворения в FaSSIF и FeSSIF. Фигура 28. Растворение указанного состава было примерно в 2 раза выше, чем растворение гранул таблеток Osphena® как в FaSSIF, так и в FeSSIF.
[00242] Состав твердой дисперсии, содержащей оспемифен и коповидон, полученный распылительной сушкой, показал большую степень растворения, чем состав, полученный экструзией горячего расплава. Твердая дисперсия коповидона, полученная путем экструзии горячим расплавом, показала повышенное растворение в FeSSIF по сравнению с FaSSIF. Фигура 29.
[00243] Применяя указанные способы и композиции, теперь можно получить подходящие лекарственные формы оспемифена, которые обеспечивают улучшенные характеристики по сравнению с предыдущими составами, которые требуется вводить в дозе 60 мг в день. Например, можно достичь терапевтически эффективных уровней, используя лекарственные формы твердой дисперсии оспемифена в количествах менее 60 мг в день.
[00244] Хотя настоящее изобретение показано и описано со ссылками на предпочтительные варианты его реализации, специалистам в данной области техники будет понятно, что в него могут быть внесены различные изменения, касающиеся формы и деталей, без отхода от объема изобретения, охватываемого прилагаемой формулой изобретения.
БИБЛИОГРАФИЯ
Следующие ссылки включены в настоящий документ посредством ссылки в полном объеме:
Charman, S.A. & Charman, W.N. (2003). Oral modified-release delivery systems. In Modified-Release Drug Delivery Technology, Eds. Rathbone, M.J. et al. eds, Marcel Dekker, стр. 1-10.
Curatolo W, Nightingale JA, & Herbig SM. (2009). Utility of hydroxypropylmethylcellulsoe acetate succinate (HPMCAS) for initiation and maintenance of drug supersaturation in the GI milieu. Pharm Res. 26(6): 1419-1431.
Janssens, S. & Mooter, G.V.D. (2009). Review: physical chemistry of solid dispersions. J. Pharm. Pharmacol. 61: 1571-1586.
Kangas L. (1990). Biochemical and pharmacological effects of toremifene metabolites. Cancer Chemother. Pharmacol. 27: 8-12.
Koskimies, P. et al. (2013). Single-dose and steady-state pharmacokinetics of ospemifene, a selective estrogen modulator, in post-menopausal women. Int. J. Clin. Pharmacol. Ther. 51(11): 861-867.
Kostwicz, E.S., Brauns, U., Becker, R., and Dressman, J.B. (2002). Forecasting the oral absorption behavior of poorly soluble weak bases using solubility and dissolution studies in biorelevant media. Pharm. Res., 19(3): 345-349.
Leuner, C. & Dressman, L. (2000). Improving drug solubility for oral delivery using solid dispersions. Eur. J. Pharm. Biopharm. 50: 47-60.
Payer, L. (1991). The menopause in various cultures. In: A portrait of the menopause. Export reports on medical and therapeutic strategies for the 1990s, eds. Berger, H. and Boulet, M., Parthenon Publishing, Park Ridge N.J. USA, стр. 3-22.
Rekers, H. (1991). Matering the menopause. In: A portrait of the menopause. Export reports on medical and therapeutic strategies for the 1990s, eds. Berger, H. and Boulet, M., Parthenon Publishing, Park Ridge N.J. USA, стр. 23-43.
Serajuddin, A.T.M. (1999). Solid dispersion of poorly water-soluble drugs: early promise, subsequent problems, and recent breakthroughs. J. Pharm. Sci. 88(10): 1058-1066.
Sun DD, Ju TR, Lee PI. (2012). Enhanced kinetic solubility profiles of indomethacin amorphous solid dispersions in poly(2-hydroxylethyl methacrylate) hydrogels. Eu. J. Pharm. Biopharm. 81: 149-158.
Tanno F, Nishiyama Y, Kokubo H, Obara S. (2004). Evaluation of hypromellose acetate succinate (HPMCAS) as a carrier in solid dispersions. Drug Dev. Ind. Pharm. 30(1): 9-17.
Vasconcelos et al., (2007). Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs. Drug Discovery Today, 12: 1068-1075.
van Drooge, D.J. et al. (2006). Characterization of the molecular distribution of drugs in glassy solid dispersions at the nan-meter scale, using differential scanning calorimetry and gravimetric water vapour techniques. Int. J. Pharm. 310: 220-229.