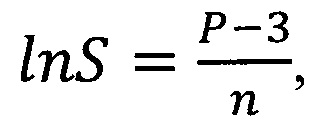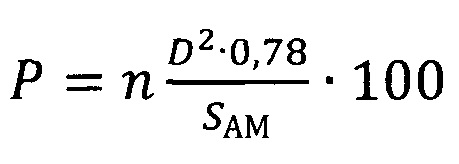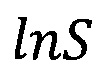Результат интеллектуальной деятельности: Способ расчета степени повреждения поверхности альвеолярного макрофага от воздействия частиц оксида алюминия
Вид РИД
Изобретение
Изобретение относится к медицине, в частности, к способам экспериментальной диагностики состояния клеточных структур in vivo, и предназначено для установления токсического воздействия оксида алюминия на величину степени повреждения альвеолярного макрофага.
Известно, что частицы оксидов металлов поражают дыхательные пути и обладают высокой цито- и генотоксичностью. Ключевым защитным механизмом при этом является реакция фагоцитоза на отложившиеся в дыхательных путях частицы, выражающиеся в изменении свободной клеточной популяции альвеолярных макрофагов глубоких дыхательных путей и в их повреждении.
В литературе имеются данные о способах определения повреждения клеток организма. Так из Патента РФ №2156460 известен способ определения степени повреждения клеток организма, который заключается в обработке лейкоцитов периферической крови гамма-излучением в присутствии препарата «Влаирин». Недостатком этого метода является потребность в дорогостоящем оборудовании, использование которого требует особых мер безопасности, кроме того, способ, описанный в указанном патенте, не позволяет провести оценку воздействия вещества, не обладающего выраженным мутагенным воздействием, и выявить признаки развития заболеваний дыхательной системы.
Из патента РФ №2635767 известен способ и средства для мониторинга нарушения тканевого гомеостаза в организме, который позволяет проводить раннюю диагностику и мониторинг заболевания у субъекта с использованием циркулирующих тканевых макрофагов по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR. Недостатком этого способа является потребность в дорогостоящих реактивах, отсутствие возможности локализации системы организма, пораженного заболеванием, отсутствие количественной оценки выявляемой патологии, а также отсутствие возможности определить характеристики окружающей среды, в частности, оксиды металлов, вызвавших патологию. Кроме того, данные, получаемые в рамках известного способа, являются конечными, то есть не могут быть использованы в моделировании или при разработке лечебных мероприятий.
Известен способ определения цитотоксичности малорастворимых пылей, в частности, пыли глинозема (Патент РФ №2019832), согласно которому определяют в суспензии пыли степень вызываемого ею подавления активности 5'-нуклеотидазы при кратковременной инкубации с культурой крысиных перитонеальных макрофагов.
Однако указанный известный способ имеет следующие недостатки.
Первый недостаток: пылевые частицы глинозема описаны только с позиции концентрации мг/мл, а потому известным способом невозможно определить, как влияет дисперсность частиц пыли на клеточный ответ. В предлагаемом же способе вводится параметр общей удельной поверхности частиц, который напрямую зависит от дисперсности этих частиц, и установлена взаимосвязь клеточного ответа с этим параметром.
Второй недостаток: показатель активности 5'-нуклеотидазы не связывают с параметрами самих частиц, а только с общей их концентрацией, что не позволяет по уровню 5'-нуклеотидазы определить, какой дозе частиц подвергся субъект экспозиции. В предлагаемом же способе предлагается математическая формула для выявления по клеточным показателям параметров воздействующих частиц, что является необходимым условием доказательства того, что вред нанесен именно специфической дисперсной группой частиц оксида алюминия и именно эти частицы обеспечили такое поражение дыхательной системы.
Из уровня техники (Привалова Л.И., Кацнельсон Б.А., Логинова Н.В., Гурвич В.Б., Шур В.Я., Бейкин Я.Б., Сутункова М.П., Минигалиева И.А., Шишкина Е.В., Пичугова С.В., Тулакина Л.Г., Беляева С.В., Рузаков В.О. Цитологические и биохимические особенности жидкости, получаемой при бронхоальвеолярном лаваже у крыс после интратрахеального введения наноразмерных меднооксидных частиц // Токсикол. вестник. 2014; 5(128):8-15) также известен способ, посредством которого изучались повреждения альвеолярных макрофагов после воздействия на дыхательные пути наночастицами и субмикронными частицами оксида меди. Для этого стабильные водные суспензии частиц оксида меди диаметром 20 нм и меднооксидных-медных частиц диаметром 340 нм были введены крысам интратрахеально в дозе 0,5 мг (1 мл), и через 24 часа был проведен бронхоальвеолярный лаваж, охарактеризованный с помощью оптической, просвечивающей электронной и полуконтактной атомно-силовой микроскопии и ряда биохимических показателей. Найдено, что обе фракции оказывают выраженное токсическое действие на легкие, однако наночастицы существенно токсичнее, чем субмикронные частицы крупнее 100 нм, но в то же время их отложение вызывает более выраженную защитную реакцию мобилизации альвеолярных макрофагов и особенно нейтрофильных лейкоцитов при более высокой фагоцитарной активности этих клеток. Полученные результаты в сопоставлении с литературными данными свидетельствуют о том, что причинами высокой цитотоксичности при действии меднооксидных частиц нанометровой размерности являются как внутриклеточный релиз ионов меди при их растворении, так и прямой контакт персистирующих частиц с клеточными органеллами (в первую очередь, митохондриями) и их повреждение.
Недостатком указанного известного способа является невозможность определения зависимости величины степени повреждения альвеолярных клеток макрофагов от параметров частиц оксида металла, вызвавших указанное повреждение, т.к. в нем в качестве параметров исследуются только размеры частиц оксида меди, в то время как на альвеолярные макрофаги отрицательно воздействуют оксиды металлов любых размеров. Т.е. в известном способе не указан универсальный параметр частиц оксидов металлов, который можно было бы использовать при выявлении параметров фагоцитарного ответа, и который может быть установлен для частиц любых размерных групп (в нашем случае это общая удельная площадь поверхности частиц).
Указанный известный способ, хотя и содержит ряд признаков, совпадающих с предлагаемым, но отличается от него назначением и по существу. Исходя из этого, он не может быть выбран в качестве прототипа.
При этом из уровня техники не были выявлены известные способы экспериментального определения зависимости количественной величины степени повреждения альвеолярных макрофагов от конкретного параметра частиц оксида алюминия, вызвавших указанное поражение, поэтому сделать выбор ближайшего аналога к заявляемому объекту не представляется возможным.
Технический результат, достигаемый предлагаемым изобретением, заключается в создании способа, позволяющего судить о повреждении альвеолярных макрофагов в зависимости от количественного параметра - общей удельной площади поверхности частиц оксида алюминия, вызвавшего это патологическое изменение именно в данной степени.
Указанный технический результат достигается предлагаемым способом расчета степени повреждения поверхности альвеолярного макрофага от воздействия частиц оксида алюминия, заключающимся в том, что подопытную особь подвергают однократной интратрахеальной экспозиции суспензией частиц оксида алюминия, затем через 24 часа после введения суспензии проводят однократное промывание дыхательных путей стерильным изотоническим физиологическим раствором, полученные промывные воды бронхоальвеолярного лаважа, извлеченные из легких при указанной промывке, центрифугируют в течение 4 мин при 1000 об/мин, и отделяют при этом клеточный осадок, из которого готовят по два мазка на каждую особь, далее мазки сушат, фиксируют метиловым спиртом в течение 1 мин и окрашивают азур-эозином в течение 20 мин, получая цитологические мазки, затем из клеток указанных мазков выделяют альвеолярные макрофаги и строят трехмерные модели поверхности альвеолярных макрофагов для каждого в отдельности, для этого проводят оптическую микроскопию полученных цитологических мазков с иммерсией при увеличении в диапазоне от 500-кратного до 1000-кратного увеличения и выявляют среди всех клеток в мазке альвеолярные макрофаги с визуально идентифицируемыми повреждениями в виде выступов и впадин, проводят цифровую фотографическую съемку каждой отдельной клетки при разных фокусных расстояниях; полученные снимки переводят в черно-белые восьмибитные изображения и вычитают фоновое изображение, из указанных изображений, полученных для каждой клетки, формируют последовательности по мере нарастания величины фокусного расстояния при съемке; полученные последовательности изображений, соответствующие истинному состоянию отдельного альвеолярного макрофага, интерпретируют, как послойные изображения единого трехмерного объекта, на основе которых и строят трехмерные модели поверхности альвеолярных макрофагов для каждого в отдельности; с использованием полученной трехмерной модели поверхности альвеолярного макрофага определяют следующие параметры: диаметр повреждений и число повреждений на одну клетку; затем определяют средние показатели для каждого из перечисленных параметров; определяют величину общей площади поверхности альвеолярного макрофага, рассчитывают степень повреждения поверхности каждой отдельной клетки альвеолярного макрофага, затем суммируют и устанавливают среднюю величину этой степени среди проанализированных клеток, в соответствии с уравнением:
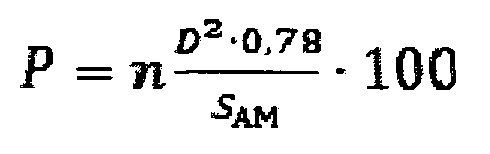
где, Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм2 поверхности клетки альвеолярного макрофага;
D - средний диаметр повреждения на поверхности клетки альвеолярного макрофага, мкм;
SAM - средняя величина площади поверхности клетки альвеолярного макрофага, мкм2;
0,78 - коэффициент, полученный экспериментальным путем;
затем на основе полученной величины Р производят расчет общей удельной площади поверхности частиц оксида алюминия, вызвавших такое повреждение клетки альвеолярного макрофага, определяемой по формуле:
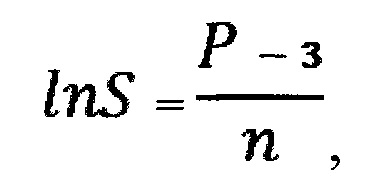
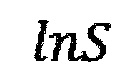 - десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
- десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм2 поверхности клетки альвеолярного макрофага;
S - общая удельная площадь поверхности частиц оксида алюминия, м2;
причем связь степени поражения альвеолярного макрофага от воздействия частиц оксида алюминия и общей удельной площади поверхности частиц этого оксида, вызвавших такое поражение, считают достоверной при величине общей удельной площади поверхности частиц оксида алюминия более 0,05 м2.
При цифровой фотографической съемки каждой отдельной клетки при разных фокусных расстояниях съемку ведут на не менее, чем на 3-х фокусных расстояниях.
Строят не менее 20 трехмерных моделей для каждой группы клеток.
Суспензию частиц оксида алюминия готовят путем введения частиц оксида алюминия в жидкую основу суспензии - стерильный физраствор, и последующего перемешивания.
Поставленный технический результат достигается за счет следующего.
Благодаря тому, что при реализации предлагаемого способа в качестве исследуемого материала использовали цитологические мазки, полученные из промывных вод бронхоальвеолярного лаважа подопытной особи, которая предварительно подвергалась однократной интратрахеальной экспозиции суспензии частиц оксида алюминия, обеспечивается точность определения, т.к. налицо присутствует взаимосвязь поражающего фактора (оксида алюминия) с возникающими при этом повреждениями альвеолярного макрофага.
Благодаря тому, что в дальнейшем проводят цифровую фотосъемку полученных цитологических мазков с иммерсией при увеличении в диапазоне от 500-кратного до 1000-кратного увеличения, обеспечивается визуальное выявление среди всех клеток в мазке повреждений альвеолярных макрофагов в виде выступов и впадин.
Выделение среди обнаруженных в мазках альвеолярных макрофагов не менее 30 отдельных клеток с повреждениями, обусловлено тем, что при использовании для последующего исследования менее 30 клеток не обеспечит необходимого количества данных, а также не обеспечит запас в количестве данных, если часть выбранных фото окажется непригодно для дальнейшей обработки по техническим причинам. Причем, если клеток с повреждениями менее 30, то выделяют общую сумму клеток, как с повреждениями, так и без них, и она должна составлять не менее 30 клеток.
Благодаря тому, что цифровую фотографическую съемку каждой отдельной клетки проводят при разных фокусных расстояниях при оптической микроскопии, появилась возможность на основе изображения (кстати, используют «истинное» изображение, т.к. перед этим вычитают фоновое изображение) реконструировать изображение клетки уже в объеме, получая трехмерную модель, а также обеспечивается возможность установления наличия «объемных» параметров повреждения.
Экспериментальным путем была установлена математическая формула, по которой рассчитывают количественно степень повреждения поверхности каждого отдельного альвеолярного макрофага, затем суммируют и устанавливают среднюю величину этой степени среди проанализированных клеток и по этой средней величине судят о величине степени повреждения альвеолярного макрофага от воздействия частиц оксида алюминия, в соответствии с уравнением:
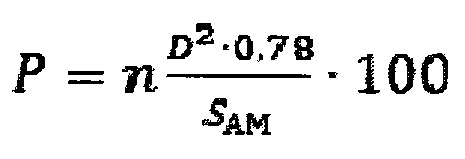
где, Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм поверхности клетки альвеолярного макрофага;
D - средний диаметр повреждения на поверхности клетки альвеолярного макрофага, мкм;
SAM - средняя величина площади поверхности клетки альвеолярного макрофага, мкм2;
0,78 - коэффициент, полученный экспериментальным путем;
А в качестве параметра частиц оксида алюминия, вызвавших такую степень повреждения клетки альвеолярного макрофага, принимают общую удельную площадь поверхности частиц указанного оксида, определяемую по формуле:
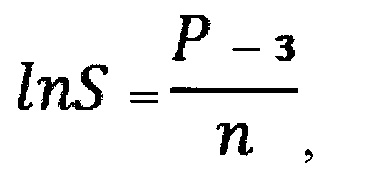
Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм поверхности клетки альвеолярного макрофага;
S - общая удельная площадь поверхности частиц оксида алюминия, м2;
3 - цифровое значение.
Причем было установлено, что взаимосвязь величины степени повреждения клетки альвеолярного макрофага от воздействия частиц оксида алюминия и общей удельной площади поверхности частиц этого оксида, вызвавших такую степень поражения, считают достоверной при величине общей удельной площади поверхности частиц оксида алюминия более 0,05 м2. Этот количественный показатель получен экспериментальным путем и обусловлен тем, что при величине общей удельной площади поверхности частиц оксида алюминия равном и менее 0,05 м2 достоверность связи со степенью повреждения не выявлена. Проверка статистических гипотез относительно полученных корреляционных зависимостей проводилась с использованием критерия Стьюдента. Различия считают статистически достоверным при заданном уровне значимости равном 0,05.
Исходя из вышеизложенного, в предлагаемом способе использован метод определения токсичности частиц оксида алюминия посредством цитологической оценки бронхоальвеолярного лаважа (БАЛЖ), проводимой in viro. Данный метод значительно расширен за счет использования количественного анализа параметров клеточных компонентов смывов, их форм, размеров и состояния поверхности. А наиболее полно оценить указанные параметры и визуализировать их стало возможно используемым методом анализа изображений мазков БАЛЖ, полученных при оптической микроскопии. Преимуществом анализа изображений является то, что, помимо высокой степени визуализации, с его помощью извлекаются массивы численных параметров клеточных компонентов, пригодных для обработки методами математической статистики, что позволяет расширить знания в области токсикологии. Это обеспечило достаточную точность предлагаемого способа.
Перечень операций предлагаемого способа и пример его конкретной реализации.
1. Подопытную особь подвергают однократной интратрахеальной экспозиции суспензией частиц оксида алюминия. Эксперимент проводили на половозрелых крысах-самцах линии Wistar массой 380-420 г в соответствии с требованиями Правил проведения работ с использованием экспериментальных животных (Приложение к Приказу Минздрава СССР от 12.08.1977 г. №755). Экспериментальные животные в количестве 27 особей были разделены на три группы по 9 особей: группа наблюдения 1, которым вводили суспензию с частицами оксида алюминия размером 13-20 нм; группа наблюдения 2, которым вводили суспензию с частицами оксида алюминия размером 10-20 мкм; и контрольная группа, которым вводили чистую основу суспензии - стерильный физиологический раствор. Введение суспензий животным проводили под эфирным наркозом. В качестве основы суспензии использовали стерильный физиологический раствор. Концентрация частиц оксида алюминия в суспензиях составляла 80±0,09 мг/мл. Для предотвращения агломерации частиц перед интратрахеальным введением суспензию подвергали диспергированию с помощью ультразвукового гомогенизатора марки Sonicator Q55 в течение 4 минут с частотой 20 кГц.
В качестве тестируемых материалов использовали оксид алюминия (Aluminumoxide, регистрационный №CAS 1344-28-1, № продукта 718475) производства Sigma-Aldrich (США) с размером частиц 13-20 нм и микродисперсный аналог (Aluminumoxide, регистрационный №CAS 1344-28-1, № продукта 265497) производства Sigma-Aldrich (США) с размером частиц 10-20 мкм.
Определение удельной площади поверхности частиц оксида алюминия проводили по методу Брюнера-Эммета-Теллера (БЭТ) (Грег С., Синг К. Адсорбция, удельная поверхность, пористость. 2-е изд. М.: Мир, 1984. 306 с.), в качестве адсорбата использовали азот (ГОСТ 9293-74). Образец перед измерением сушили на анализаторе влажности MS-70 (A&D) при температуре 110°С до постоянной массы. Далее образец взвешивали с точностью до 0,0001 г на аналитических весах марки OHAUS РА-64, помещали в стерильную пробирку (ИСО 1042-83) и проводили дегазацию в станции подготовки проб «SorbiPrep» при 110°С в течение 30 минут.
В ходе испытаний также проводили опыты с животными, которым вводили суспензию с частицами оксида алюминия размером 30-40 нм и 25-35 мкм. Полученные в процессе реализации предлагаемого способа результаты были аналогичными вышеуказанным испытаниям.
2. Для изучения реакции дыхательных путей через 24 часа после введения суспензии оксида алюминия у всех животных было проведено однократное промывание дыхательных путей 10 мл стерильного изотонического физиологического раствора. Промывные воды бронхоальвеолярного лаважа (БАЛЖ), извлеченные при этом из легких, центрифугировали в течение 4 минут при 1000 об/мин (центрифуга лабораторная ELMI СМ-6МТ, Латвия).
3. После центрифугирования жидкость физиологического раствора декантировали, отделяли при этом клеточный осадок, из которого готовили по два мазка на каждую особь (всего 54 мазка).
4. Мазки сушили на воздухе, затем фиксировали метиловым спиртом в течение 1 минуты и окрашивали азур-эозином по Романовскому (МиниМед) в течение 20 минут. Получение и исследование БАЛЖ выполнено в соответствии с Методикой изучения реакции альвеолярного фагоцитоза (РАФ) (Пневмокониозы: патогенез и биологическая профилактика / Б.А. Кацнельсон [и др.]. - Екатеринбург, 1995. 325 с.).
5. Для количественной характеристики клеточной реакции дыхательных путей использовали цифровые изображения оптической иммерсионной микроскопии мазков, полученные на поляризационном микроскопе (CarlZeiss, Германия Nikon Eclipse LV100NPOL). Анализ изображений проводили с использованием универсального программного обеспечения ImageJ-FiJi. При этом проводили оптическую микроскопию полученных цитологических мазков с иммерсией при увеличении в диапазоне от 500-кратного до 1000-кратного увеличения и выявляли среди всех клеток в мазке альвеолярные макрофаги с визуально идентифицируемыми повреждениями в виде выступов и впадин.
6. Среди обнаруженных в мазках клеток альвеолярных макрофагов выделяли не менее 30 отдельных клеток с повреждениями (при проводимых исследованиях в конкретном примере фактически выделяли 67 отдельных клеток с повреждениями) и проводили цифровую фотографическую съемку каждой отдельной клетки при разных фокусных расстояниях, а именно в примере, при фокусных расстояниях: 1-1,5 мм; 1,5-4 мм; 4-8 мм, получая таким образом по 3 изображения на каждую клетку. Но с целью повышения точности и достоверности можно делать и больше изображений при большем количестве фокусных расстояний, чтобы потом с их помощью создать наиболее реалистичную трехмерную модель.
7. Полученные снимки клетки переводили в черно-белые восьмибитные изображения и вычитали фоновое изображение, чтобы каждое изображение максимально соответствовало истинному состоянию отдельного альвеолярного макрофага. Указанную операцию проводили с помощью программного обеспечения, в данном примере image J Fiji.
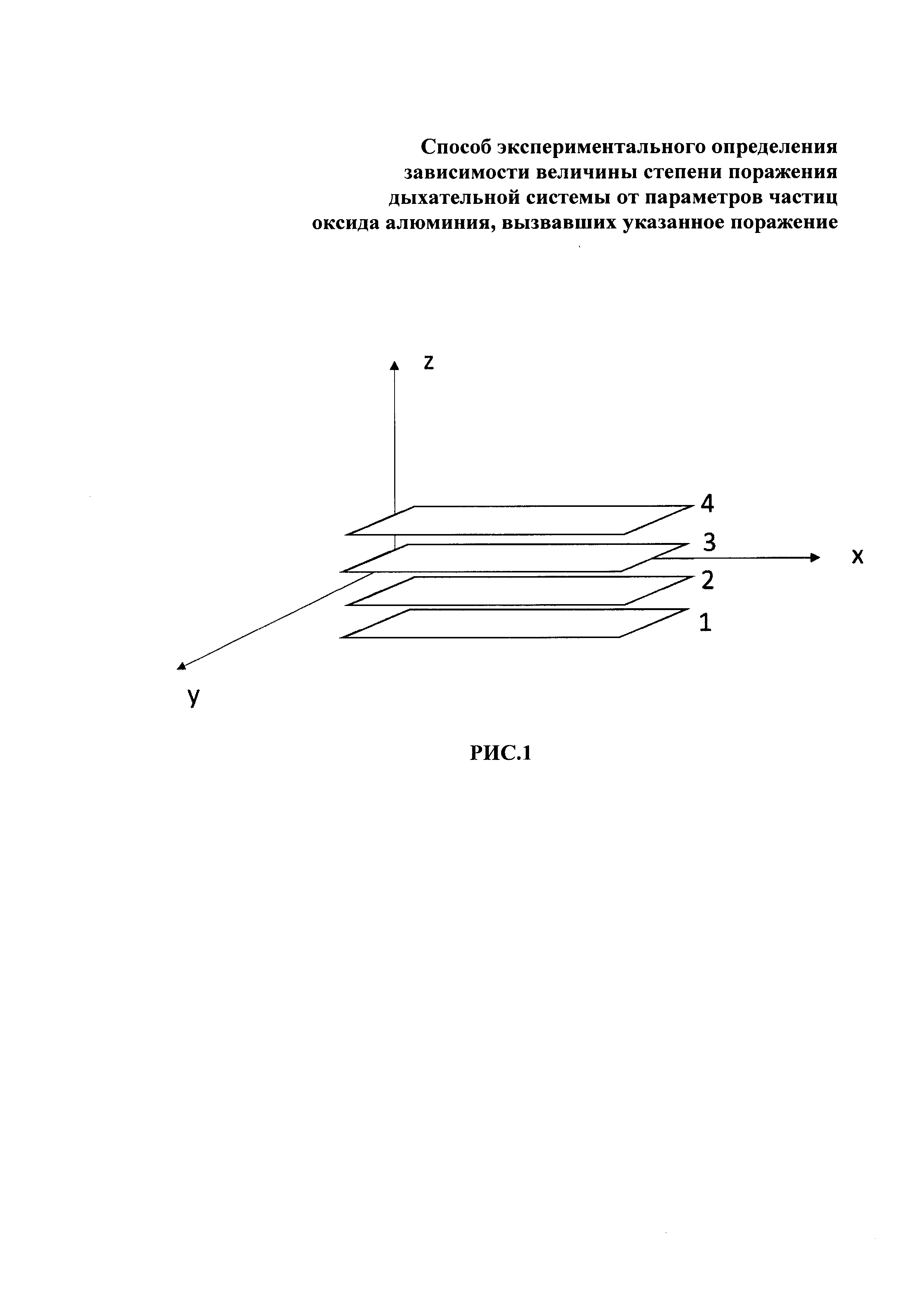
8. Все полученные изображения собирают последовательно для создания трехмерной модели (Рис. 1): для этого истинные изображения, полученные при съемке на разных фокусных расстояниях, размещают последовательно, начиная от меньшего фокусного расстояния (слой 1 Рис. 1) к большему (слой 2, слой 3, слой 4 Рис. 1) таким образом, чтобы они образовали слои, в этих слоях координаты х и у описывают каждое отдельное изображение, а ось Z - расположение этих изображений относительно друг друга, одновременно ось Z является мерилом высоты в трехмерной модели (http://imagei.net/Stack-slice_Manipulations).
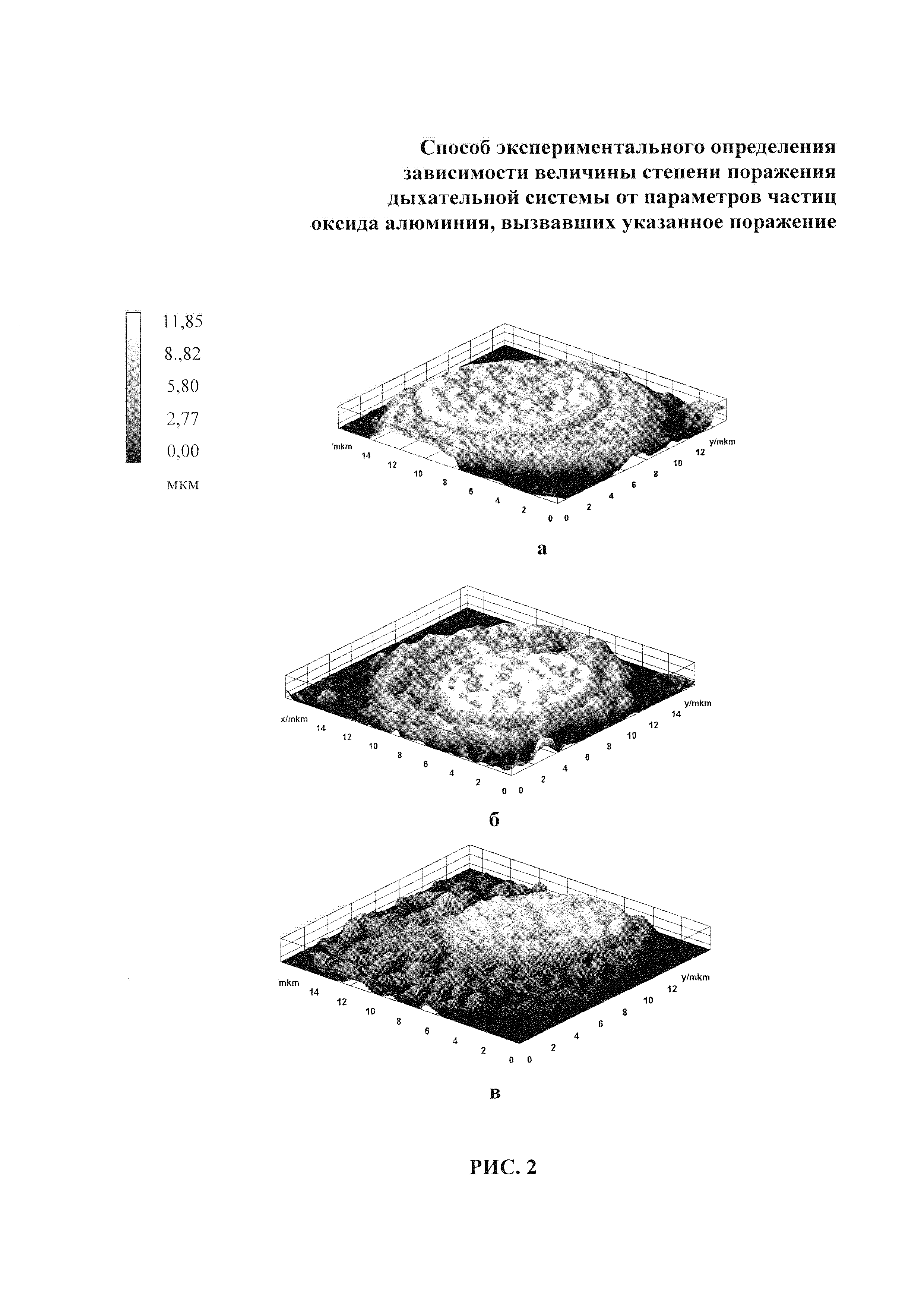
Например, для альвеолярного макрофага из БАЛЖ животного группы наблюдения 1, подвергшегося экспозиции суспензией с наночастицами оксида алюминия, были сделаны снимки при фокусных расстояниях 1,27; 2,86; 3,56 мм. Полученные последовательности истинных изображений интерпретировали как послойные изображения единого трехмерного объекта, на основе которых строили трехмерную модель каждой отдельной клетки поверхности альвеолярного макрофага.
Фотографии указанных моделей для каждой исследуемой группы особей представлены на Рис. 2, где «а» - трехмерная модель клетки особи контрольной группы; «б» - трехмерная модель клетки особи группы наблюдения 2 (микроразмерные частицы оксида алюминия); «в» - трехмерная модель клетки особи группы наблюдения 1 (наноразмерные частицы оксида алюминия). Эти рисунки показывают следующее.
Согласно статистической оценке количественных данных о состоянии поверхности альвеолярных макрофагов, полученных при анализе изображений, у крыс группы наблюдения 1 («в» Рис. 2) поверхность альвеолярных макрофагов повреждена максимально, среднее квадратичное отклонение в величине неровностей составляет 4,7±0,07 мкм, что в 13,36 превышает показатель группы контроля («а» рис. 3) (0,38±0,01 мкм) (различия являются достоверными, F=4,39; при Fкрит=3,79; р=0,015), и в 3,61 раза превышает показатель группы наблюдения 2 («б» Рис. 2) (1,3±0,09 мкм) (различия являются достоверными, F=16,53; при Fкрит=3,78; р=0,002).
Средний диаметр повреждений на поверхности макрофагов превышает размер частиц, вводимых животным. В группе наблюдения 1 (наноразмерные частицы) средний диаметр повреждений был равен 0,4±0,05 мкм, что в 2,25 раз меньше, чем в группе наблюдения 2 (микроразмерные частицы) (0,9±0,08 мкм), различия являются достоверными (F=7,71; при Fкрит=3,79; р=0,008).
Среднее число повреждений на 1 мкм2 поверхности в группе наблюдения 1 (наноразмерные частицы) составило 2,4±0,04 единиц, что в 8 раз больше, чем в группе наблюдения 2 (микроразмерные частицы) (0,3±0,06 единиц), различия являются достоверными (F=16,05; при Fкрит=5,20; р=0,005).
Общая поврежденность рассматривается как процент повреждений макрофагов от общей площади их поверхности, в группе наблюдения 1 (наноразмерные частицы) степень поврежденности составила 18%, что в 2,5 раза больше, чем в группе наблюдения 2 (микроразмерные частицы) (7,2%), различия являются достоверными (F=8,87; при Fкрит=5,05; р=0,011).
9. С использованием полученной трехмерной модели поверхности альвеолярного макрофага определяют следующие параметры: приведенный диаметр повреждений и число повреждений на одну клетку. Далее с учетом ранее полученных 3-4 и более изображений для клетки определяли средние показатели для каждого из перечисленных параметров.
10. С использованием полученной трехмерной модели определяли величину общей площади поверхности клетки альвеолярного макрофага. Также как и для повреждений, рассчитывали ее среднюю величину
11. Используя полученные данные, рассчитывали степень повреждения поверхности клетки альвеолярного макрофага по средней величине среди проанализированных клеток от воздействия частиц оксида алюминия:
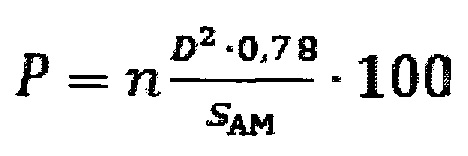
где, Р - степень повреждения поверхности клетки альвеолярного макрофага, %; n - среднее число повреждений на 1 мкм2 поверхности клетки альвеолярного макрофага; D - средний диаметр повреждения на поверхности клетки альвеолярного макрофага, мкм; SAM - средняя величина площади поверхности клетки альвеолярного макрофага, мкм; 0,78 - коэффициент, полученный экспериментальным путем.
12. В качестве параметра частиц оксида алюминия, вызвавших такую степень повреждения поверхности клетки альвеолярного макрофага, принимают общую удельную площадь поверхности частиц указанного оксида, определяемую по формуле:
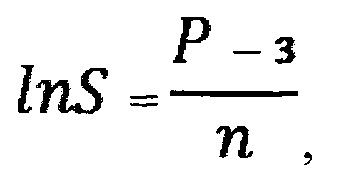
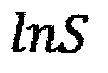 - десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
- десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм2 поверхности клетки альвеолярного макрофага;
S - общая удельная площадь поверхности частиц оксида алюминия, м2.
Причем связь степени повреждения поверхности клетки альвеолярного макрофага от воздействия частиц оксида алюминия и общей удельной площади поверхности частиц этого оксида, вызвавших такое поражение, считают достоверной при величине общей удельной площади поверхности частиц оксида алюминия более 0,05 м.
Ниже приведен пример расчета величины степени повреждения поверхности клетки альвеолярного макрофага от воздействия частиц оксида алюминия для животных из разных групп:
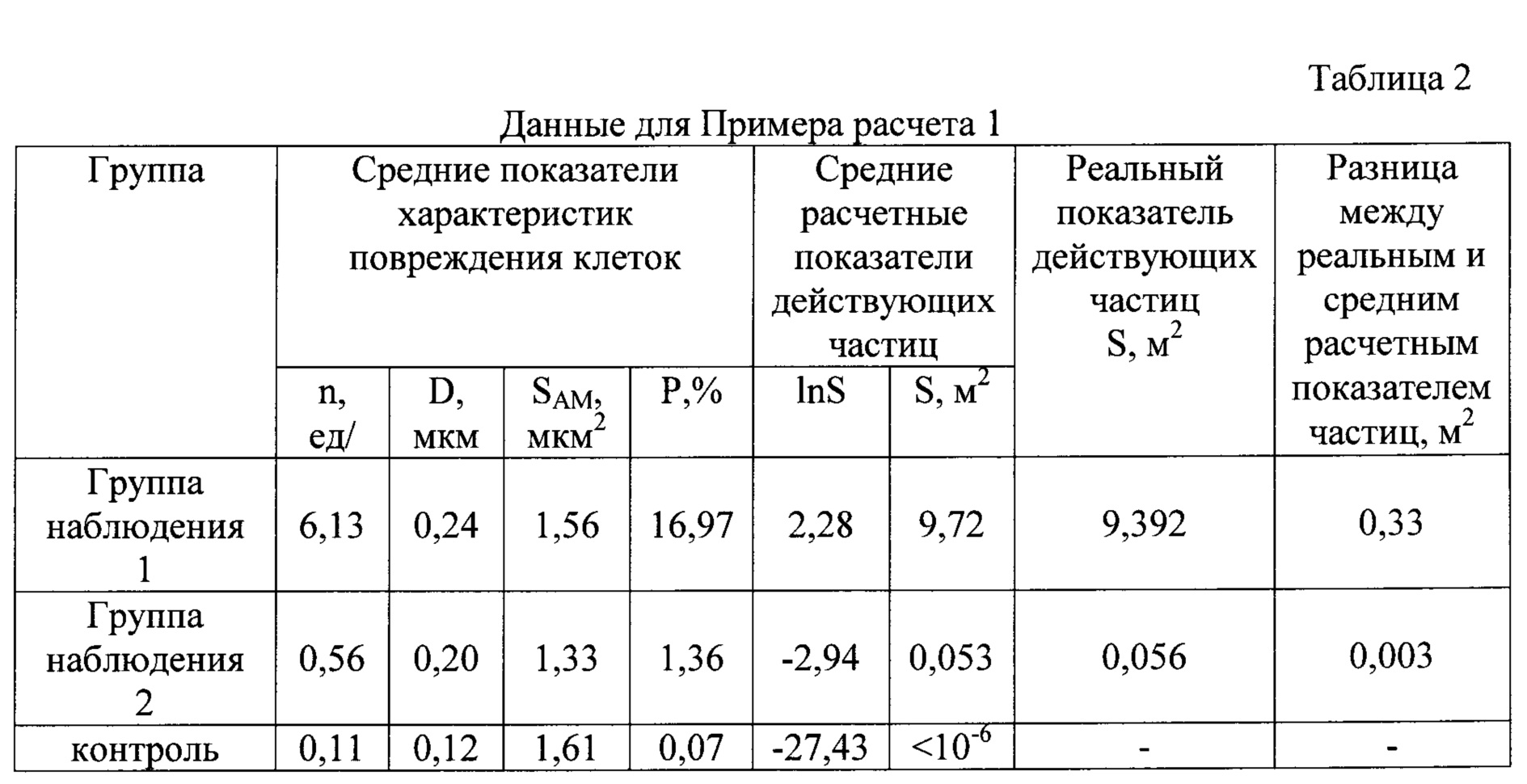
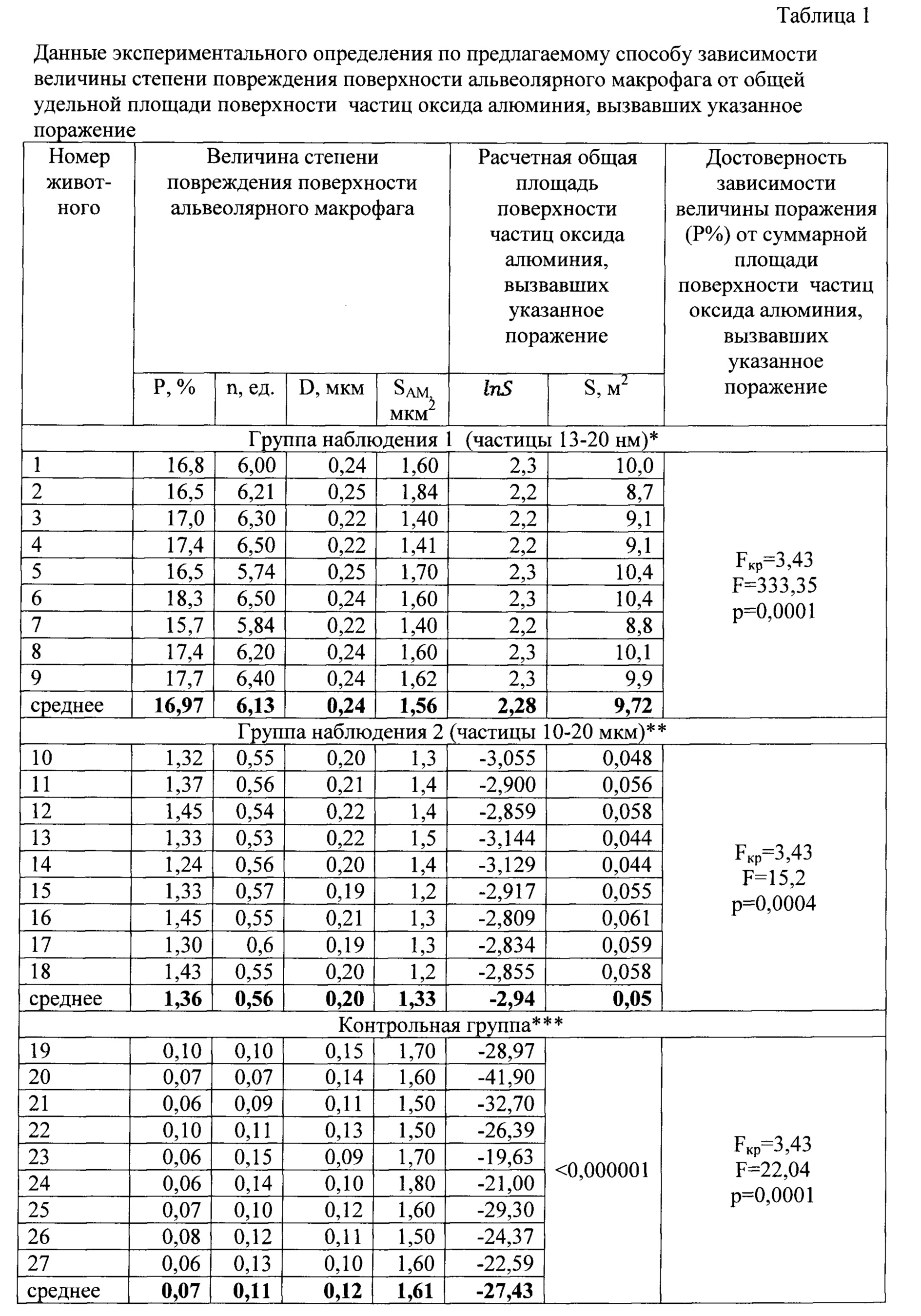
Пример 1. В результате анализа изображений получены данные о количестве и размере повреждений на поверхности каждой из клеток и донные площади поверхности каждой из клеток, которые приведены в таблице 1.
Для группы наблюдения 1 установлено, что среднее количество повреждений на 1 мкм поверхности клетки (n) составляет 6,13 единицы/1 мкм2 площади поверхности клетки, средний диаметр повреждений (D) 0,24 мкм, средняя величина площади поверхности клетки (SAM) составляет 1,56 мкм2.
Вводим значения в формулу:
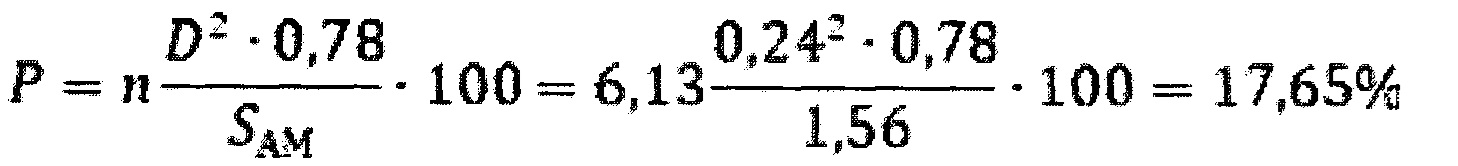
Для того чтобы вычислить, какова общая удельная площадь частиц, нанесших указанную степень поражения, используем полученные значения для формулы:
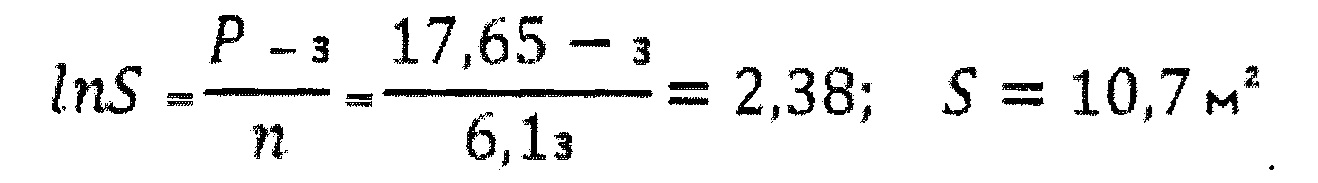
Таким образом, была установлена достоверная взаимосвязь степени повреждения поверхности клетки альвеолярного макрофага (17,65%) от воздействия частиц оксида алюминия, т.к. общая удельная площадь поверхности частиц этого оксида (10,7 м2) составляет величину более 0,05 м2.
Аналогичным образом проведены расчеты для двух других групп: группы наблюдения 2 и контрольной группы. Данные для расчетов приведены в таблице 2.
При проведении экспериментальных исследований было установлено, что величина средней степени повреждения поверхности альвеолярного макрофага у особей из группы наблюдения 2 составляет 6,7±0,45%, у которых установлена достоверная связь с общей удельной площадью поверхности частиц оксида алюминия; а у особей из контрольной группы - 0,51±0,09%.
Данные, приведенные в таблице 1, показывают достоверность данных о величине степени повреждения поверхности альвеолярного макрофага от воздействия частиц оксида алюминия для особей, подвергшихся воздействию частиц оксида алюминия с различной общей удельной площадью поверхности (а, следовательно, и разного размера).
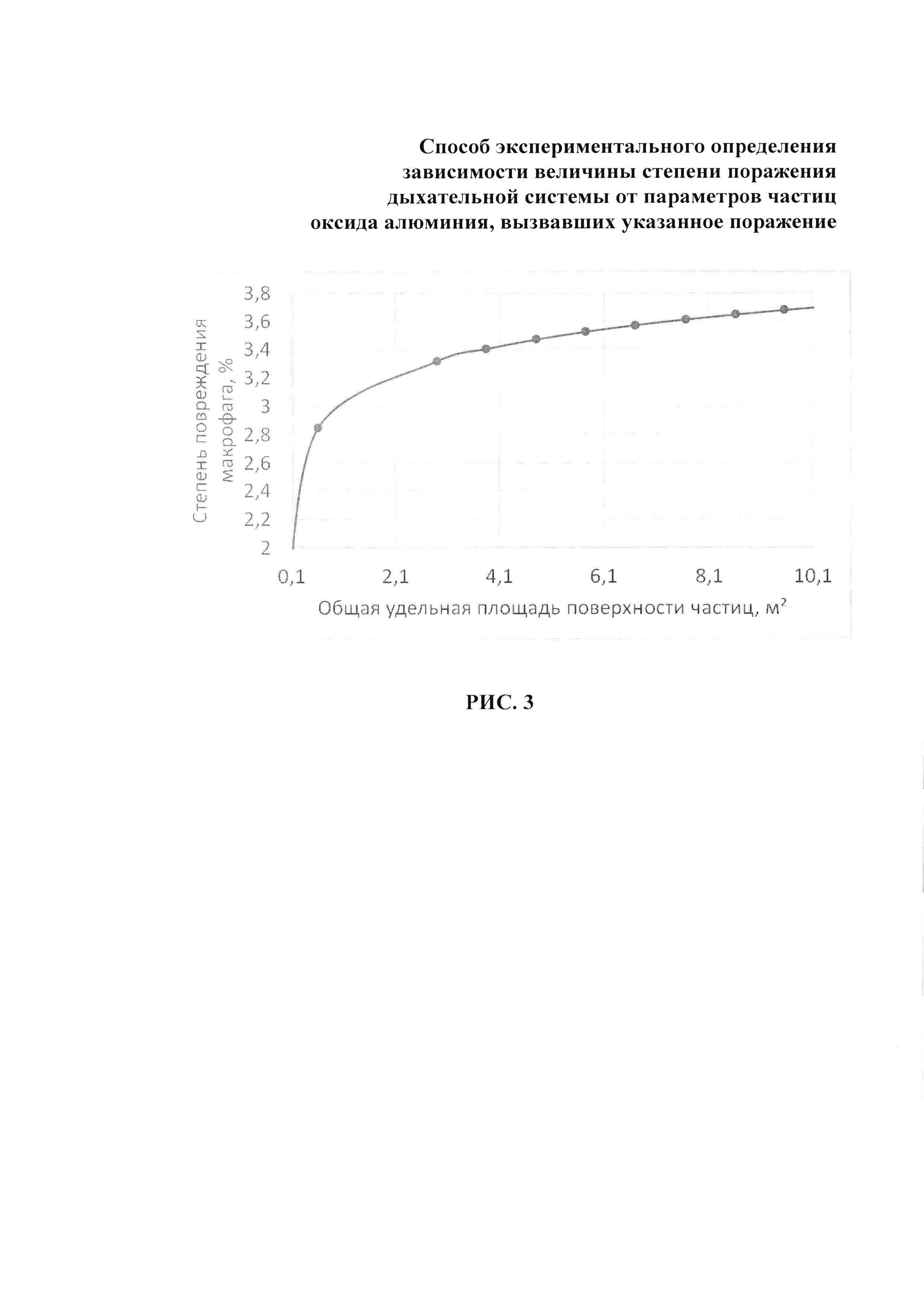
Данные о зависимости степени повреждения макрофагов от величины общей удельной площади поверхности частиц оксида алюминия приведены на рис. 3.
Таким образом, предлагаемый способ позволит определять степень повреждения поверхности альвеолярного макрофага по результатам БАЛЖ. Ценно, что используемый в предлагаемом способе показатель общей удельной площади поверхности частиц оксида алюминия является более универсальным, чем просто размер частиц.
Предложено рассматривать степень повреждения макрофагов как процент повреждений от общей площади их поверхности, вычисляемый по величине среднего размера единичного повреждения и частоты их расположения на поверхности.
Предложена зависимость, описывающая степень повреждения альвеолярных макрофагов от величины общей удельной площади поверхности частиц, воздействующей на дыхательные пути крыс. В исследованиях максимальная степень повреждения зафиксирована при воздействии наноразмерных частиц в группе наблюдения 1, которая составила около 18%, что в 2,4 раза выше, чем при воздействии микрочастиц (7,5%).
Доказано, что характеристика токсического действия вещества может быть расширена при использовании средств анализа цифровых изображений мазков БАЛЖ.
Предложена формула расчета, позволяющая определить какая удельная площадь поверхности частиц вызвала повреждения поверхности альвеолярного макрофага (с ограничением, достоверность результатов подтверждена экспериментально для величины только более 0,05 м2).
Примечание:
Р - степень повреждения поверхности клетки альвеолярного макрофага, %;
n - среднее число повреждений на 1 мкм2 поверхности клетки альвеолярного макрофага;
D - средний диаметр повреждения на поверхности клетки альвеолярного макрофага, мкм;
SAM - средняя величина площади поверхности клетки альвеолярного макрофага, мкм;
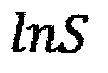 - десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
- десятичный логарифм общей удельной площади поверхности частиц оксида алюминия;
S - общая удельная площадь поверхности частиц оксида алюминия, м2.
* достоверно отличается от контрольной группы;
** достоверно отличается от показателей группы наблюдения 1;
*** достоверно отличается от показателей группы наблюдения 2.