ИНТРАНАЗАЛЬНЫЕ КОМПОЗИЦИИ ДЕКСМЕДЕТОМИДИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение частично направлено на интраназальные препаративные формы дексмедетомидина, или его фармацевтически приемлемой соли, которые представляют собой анальгетические средства, но без значительного седативного действия, а также к способам их применения.
Уровень техники
Дексмедетомидин, 5-[(1S)-1-(2,3-диметилфенил)этил]-1H-имидазол, представляет собой ненаркотический агонист α2-адренорецепторов с седативными и анальгетическими свойствами. В настоящее время дексмедетомидин имеется в продаже только в виде инъекционной препаративной формы, показанной для обеспечения седативного эффекта у первоначально интубированных и подвергающихся искусственной вентиляции легких пациентов во время лечения в отделении интенсивной терапии и для обеспечения седативного эффекта у не интубированных пациентов перед и/или во время хирургических и других процедур, и он должен вводиться внутривенно опытным и имеющим лицензию медицинским работником. Хотя дексмедетомидин обладает анальгетическими свойствами, в продаже, однако, нет интраназальной препаративной формы, которую можно применять в качестве анальгетика без седативного действия. Более того, по разнообразным причинам, имеющаяся в продаже инъекционная препаративная форма не пригодна для применения в качестве анальгетического средства, которое можно вводить самостоятельно. Существует сохраняющаяся и неудовлетворенная потребность в анальгетическом лекарственном препарате на основе дексмедетомидина, который, например, пациент может самостоятельно ввести интраназально для обеспечения обезболивания (или иного лечения или профилактики боли) без значительного седативного действия.
Краткое описание чертежей:
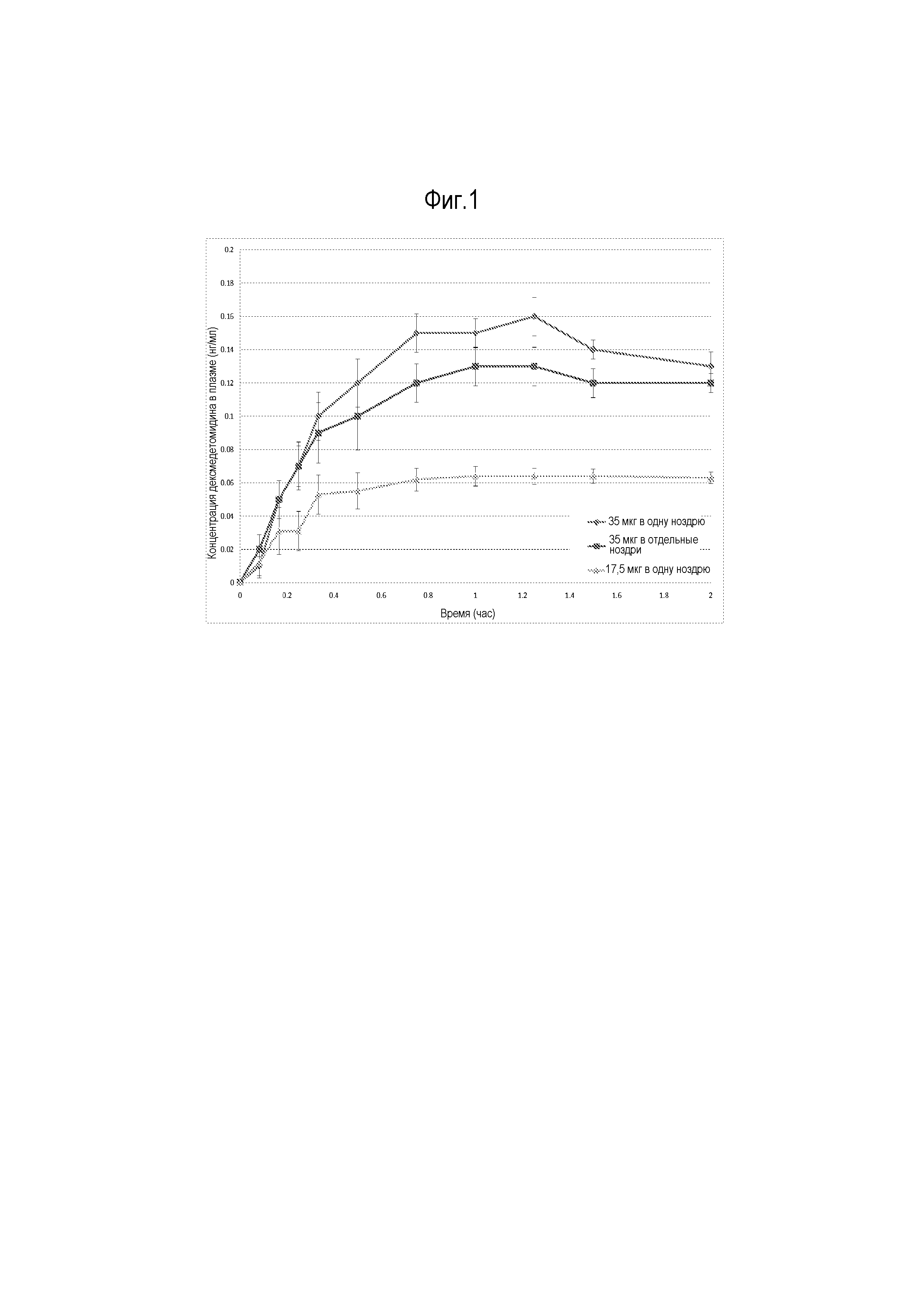
На фиг. 1 показана фармакокинетика интраназально введенного дексмедетомидина для некоторых вариантов осуществления.
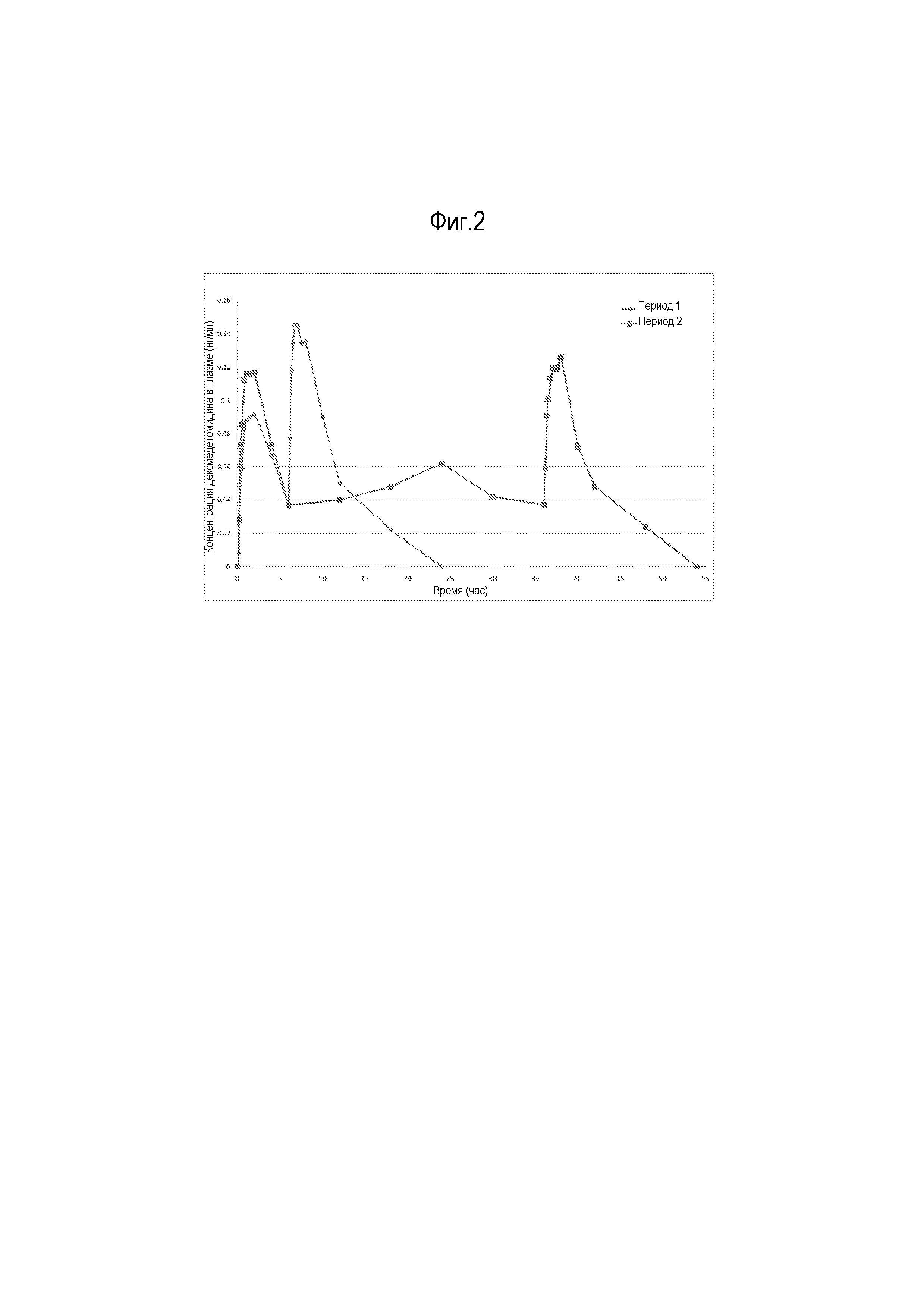
На фиг. 2 показаны средние величины концентрации дексмедетомидина в плазме (нг/мл) для некоторых вариантов осуществления.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли млекопитающему, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия.
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у взрослого человека, включающим интраназальное введение интраназально эффективного количества дексмедетомидина, или его фармацевтически приемлемой соли, взрослому человеку, посредством чего интраназально эффективное количество дексмедетомидина, или его фармацевтически приемлемой соли, не вызывает значительное седативное действие у взрослого в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени.
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение дексмедетомидина, или его фармацевтически приемлемой соли, в одну ноздрю млекопитающего, в частности, человека.
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное распыление у млекопитающего фармацевтической композиции, содержащей дексмедетомидин, или его фармацевтически приемлемую соль, причем аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 150 мкм.
Настоящее изобретение также относится к дозирующим устройствам, содержащим фармацевтическую композицию, включающую дексмедетомидин, или его фармацевтически приемлемую соль, причем дозирующее устройство подает отмеренную дозу фармацевтической композиции интраназально, которая обеспечивает обезболивание у млекопитающего без значительного седативного действия.
Описание вариантов осуществления
Пока нет иных определений, все технические и научные термины имеют значение, общепонятное обычному специалисту в данной области техники, для которого предназначены описанные варианты осуществления.
Используемые в настоящем описании термины в единственном числе обозначают «по меньшей мере один» или «один или несколько», пока контекст ясно не указывает иное.
Используемый в настоящем описании термин «примерно» значит, что числовая величина является приблизительной, и небольшие вариации не оказали бы значимого воздействия на реализацию описанных вариантов осуществления. При использовании числового ограничения, пока контекст ясно не указывает иначе, «примерно» значит, что числовая величина может варьироваться на ±10% и при этом оставаться в пределах объема описанных вариантов осуществления.
Используемый в настоящем описании термин «анальгезия» относится к облегчению (частичному или полному) или устранению ощущения боли.
Используемый в настоящем описании термин «носитель» означает разбавитель, адъювант или эксципиент, с которым вводится соединение. Фармацевтические носители могут представлять собой жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. Фармацевтические носители могут также представлять собой солевой раствор, смолу акации, желатин, крахмальную пасту, тальк, кератин, коллоидный диоксид кремния, мочевину и тому подобные. Кроме того, можно использовать вспомогательные, стабилизирующие агенты, загустители, смазывающие и красящие агенты.
Используемый в настоящем описании термин, «соединение» означает все стереоизомеры, таутомеры и изотопы соединений или их фармацевтически приемлемых солей, включая любые и все описанные здесь метаболиты.
Используемые в настоящем описании термины «содержащие» (и любая форма термина содержащие, такая как «содержат», «содержит» и «содержащийся»), «имеющие» (и любая форма термина «имеющие», такая как «имеют» и «имеет»), «включающие» (и любая форма термина «включающие», такая как «включает» и «включают»), или «содержащие» (и любая форма термина «содержащие», такая как «содержит» или «содержат») являются включающими или неограничивающими и не исключают дополнительных, не приведенных элементов или стадий способов.
Используемый в настоящем описании термин «контактирование» означает сближение вместе двух элементов в системе in vitro или в системе in vivo. Например, «контактирование» описанных здесь соединения или композиции с субъектом или пациентом или клеткой включает введение соединения субъекту или пациенту, такому как человек.
Используемый в настоящем описании термин «Dv90» означает величину, которая представляет размер частиц, ниже которого существует 90% объема множества капель (например, как это имеет место в распыленном тумане; в отличие от капли для носа, содержащей одну или две капли).
Используемый в настоящем описании термин «субъект» или «пациент», используемые взаимозаменяемо, означает любое животное, включая млекопитающих, таких как мыши, крысы, другие грызуны, кролики, собаки, кошки, свиньи, крупный рогатый скот, овцы, лошади или приматы, такие как люди.
Используемая в настоящем описании фраза «нуждающееся в нем» значит, что животное или млекопитающее было идентифицировано как нуждающееся в определенном способе лечения. В некоторых вариантах осуществления идентификация может проводиться любым средством диагностики. В любом из способов и методов лечения, описанных здесь, животное или млекопитающее может нуждаться в нем. В некоторых вариантах осуществления животное или млекопитающее находится в среде или попадет в среду, в которой распространено конкретное заболевание, расстройство или состояние. Например, млекопитающее или животное может нуждаться в лечении или профилактике боли без седативного действия или без значительного седативного действия.
Используемая в настоящем описании фраза «дозирующее устройство» относится к устройству, которое обеспечивает подачу определенной дозы.
Используемая в настоящем описании фраза «от X до Y» означает любое число между X и Y и включает конечные точки. Например, фраза «от 1 до 5» означает 1, 2, 3, 4 или 5.
Используемый в настоящем описании термин «боль» относится к широкому диапазону клинических проявлений, и он имеет широкое значение. Восприятие боли высоко субъективно и различные субъекты испытывают боль различным образом и с очень различной интенсивностью. Международная Ассоциация по исследованию боли определяет боль как «неприятное сенсорное и эмоциональное восприятие, связанное с действительным или возможным повреждением ткани, или описанное с точки зрения такого повреждения». Проще говоря, боль включает любое сенсорное восприятие, которое вызывает страдание, и связано с неприятным ощущением субъектом собственного тела. Неограничивающие типы и причины боли включают невралгию, миалгию, гипералгезию, гиперпатию, неврит и нейропатию. Боль часто является симптомом лежащей в основе физиологической патологии, такой как рак или артрит. Некоторые типы боли не имеют ясно установленных причин, такие как мигреневая головная боль. Боль может быть также вызвана физической травмой, такой как ожоги или хирургические вмешательства. Вирусные инфекции, такие как инфекция Herpes zoster (ветряная оспа и опоясывающий лишай), могут также вызвать боль. Отмена химической зависимости от алкоголя или наркотиков также часто связана с болевыми симптомами. Соответственно, здесь подразумевается, что термин «боль» имеет очень широкое значение.
Используемая в настоящем описании фраза «фармацевтически приемлемые» обозначает те соединения, материалы, композиции и/или лекарственные формы, которые, в пределах объема здравого медицинского суждения, пригодны для применения в контакте с тканями людей и животных. В некоторых вариантах осуществления «фармацевтически приемлемые» означает утвержденные регуляторным агентством Федерального правительства или правительства штата или включенные в перечень Фармакопеи США или другой общепризнанной фармакопеи для применения у животных, и конкретнее, у людей.
Используемая в настоящем описании фраза «фармацевтически приемлемая(ые) соль(и)» включает без ограничения соли кислотных или основных групп. Соединения, которые являются основными по природе, способны образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые можно использовать для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, представляют собой те, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, включающие без ограничения соли серной, тиосерной, лимонной, малеиновой, уксусной, щавелевой кислот, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, бисульфит, фосфат, кислый фосфат, изоникотинат, борат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, бикарбонат, малонат, месилат, эсилат, напсидисилат, тосилат, бесилат, ортофосфат, трифторацетат и памоат (т.е. 1,1ʹ-метилен-бис-(2-гидрокси-3-нафтоат)). Соединения, которые включают амино-составляющую, могут образовывать фармацевтически приемлемые соли с различными аминокислотами, в дополнение к кислотам, указанным выше. Соединения, которые являются кислотными по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают без ограничения соли щелочных металлов или щелочноземельных металлов, в частности, соли кальция, магния, аммония, натрия, лития, цинка, калия и железа. Настоящее изобретение может также включать соли четвертичного аммония соединений.
Используемые в настоящем описании термины «предотвращение» или «профилактика» означают снижение риска развития конкретного заболевания, состояния или расстройства.
Используемый в настоящем описании термин «пролекарство» означает производное известного лекарственного средства прямого действия, причем производное имеет улучшенные характеристики доставки и повышенную терапевтическую ценность по сравнению с лекарственным средством и трансформируется в активное лекарственное средство ферментным или химическим процессом.
Используемый в настоящем описании термин «седативное действие» означает угнетенное сознание, при котором пациент или субъект сохраняет способность независимо и непрерывно поддерживать проходимость дыхательных путей и регулярный тип дыхания и соответствующим образом и рационально реагировать на физическую стимуляцию и словесные команды.
Используемая в настоящем описании фраза «значительное седативное действие» согласуется с самооценкой пациента по Стэнфордской Шкале Сонливости, причем исследуемые пациенты проводят у себя рейтинговую оценку степени седативного действия как большую или равную уровню 3, причем: Уровень 1 = чувство активности, прилива жизненных сил, ясного сознания или полного бодрствования; Уровень 2 = Функционирование на высоком уровне, но не на максимуме; способность к концентрации внимания; Уровень 3 = Бодрствование, но расслабленное состояние; способность реагировать, но не полностью ясное сознание; Уровень 4 = Несколько затуманенное сознание, апатия; Уровень 5 = Затуманенное сознание; потеря интереса к сохранению бодрствования; замедленные реакции; Уровень 6 = Сонливость, одурманенность, борьба со сном; предпочтение пребывания в положении лежа; или Уровень 7 = Больше не борется со сном, вскоре засыпает; наличие мыслей, подобных снам. «Значительное седативное действие» также означает, что пациент или субъект испытывает седативное действие уровня 4 или более по Шкале седативного действия Рамсея, по которой: Уровень 1 = Пациент встревожен и возбужден или испытывает беспокойство, или проявляет оба чувства; Уровень 2 = Пациент готов к сотрудничеству, ориентирован и спокоен; Уровень 3 = Пациент только реагирует на команды; Уровень 4 = Пациент спит; бурная реакция на легкий вызов глабеллярного рефлекса или громкий слуховой раздражитель; Уровень 5 = Пациент спит; вялая реакция на легкий вызов глабеллярного рефлекса или громкий слуховой раздражитель; Уровень 6 = Пациент спит; отсутствие реакции на болезненный раздражитель. «Значительное седативное действие» также означает, что пациент или субъект испытывает седативное действие уровня 5 или менее по Модифицированной шкале оценки наблюдателем концентрации внимания/седативного действия, по которой: Уровень 6 = Пациент представляется встревоженным и бодрствующим, быстро реагирует на имя, произнесенное с нормальной интонацией; Уровень 5 = Пациент представляется спящим, но быстро реагирует на имя, произнесенное с нормальной интонацией; Уровень 4 = вялая реакция на имя, произнесенное с нормальной интонацией; Уровень 3 = пациент реагирует только после того как имя произносится громко или повторно; Уровень 2 = пациент реагирует только после легких толчков или встряхивания; Уровень 1 = пациент не реагирует на легкие толчки или встряхивание; и Уровень 0 = пациент не реагирует на болевой раздражитель.
Используемая в настоящем описании фраза «солюбилизирующий агент» означает агенты, которые приводят к образованию мицеллярного раствора или истинного раствора лекарственного средства.
Используемый в настоящем описании термин «раствор/суспензия» означает жидкую композицию, где первая порция активного средства присутствует в растворе, а вторая порция активного средства присутствует в форме частиц в суспензии в жидкой матрице.
Используемая в настоящем описании фраза «по существу изолированное» означает соединение, которое по меньшей мере частично или по существу отделено от среды, в которой оно образовано или выявлено.
Используемая в настоящем описании фраза «терапевтически эффективное количество» в целом означает количество активного соединения или фармацевтического средства, которое вызывает биологический или лечебный ответ в ткани, системе, у животного, субъекта или человека, желаемый исследователем, ветеринаром, врачом или другим клиницистом. Терапевтический эффект зависит от подвергаемого лечению расстройства или желаемого биологического эффекта. По существу, терапевтический эффект может представлять собой уменьшение тяжести симптомов, связанных с расстройством, и/или ингибирование (частичное или полное) прогрессирования расстройства, или улучшенное лечение, заживление, профилактику или устранение расстройства или побочных эффектов. Количество, требуемое для вызова терапевтического ответа, можно определить на основе возраста, состояния здоровья, размера и пола субъекта. Оптимальное количество можно также определить на основании мониторинга ответа субъекта на лечение. В некоторых вариантах осуществления терапевтически эффективное количество представляет собой определенное количество или описанный здесь диапазон.
Используемые в настоящем описании термины «лечить», «леченый» или «лечение» означают и терапевтическое лечение, и профилактические или превентивные меры, при которых целью является предотвращение или замедление (уменьшение) нежелательного физиологического состояния, расстройства или заболевания, или получение благоприятных или желательных клинических результатов. В целях настоящего изобретения, благоприятные или желательные клинические результаты включают без ограничения облегчение симптомов; уменьшение степени выраженности состояния, расстройства или заболевания; стабилизированную (т.е. не ухудшающуюся) клиническую картину состояния, расстройства или заболевания; задержку начала или замедление прогрессирования состояния, расстройства или заболевания; уменьшение интенсивности или ремиссию (частично или полностью) состояния, расстройства или патологического состояния, выявляемого или не выявляемого; улучшение по меньшей мере одного измеряемого физического параметра, необязательно ощущаемого пациентом; или повышение эффективности воздействие на течение или улучшение клинической картины течения состояния, расстройства или заболевания. Лечение включает вызов клинически значимого анальгетического ответа без избыточных уровней побочных эффектов, таких как без ограничения значительное седативное действие. Таким образом, «лечение боли» означает действия, которые предотвращают, облегчают или уменьшают интенсивность любых из первичных феноменов или вторичных симптомов, связанных с болью.
Используемая здесь фраза «без значительного седативного действия» означает, что пациент испытывает степень седативного действия, не больший, чем Уровень 3 по Шкале седативного действия Рамсея, не больший, чем Уровень 2 по Стэнфордской шкале сонливости и/или не меньше чем Уровень 6 по Модифицированной шкале оценки наблюдателем концентрации внимания/седативного действия.
Кроме того, понятно, что определенные описанные здесь признаки, которые для ясности описаны в контексте отдельных вариантов осуществления, могут быть также представлены в комбинации в одном варианте осуществления. Напротив, различные признаки, которые для краткости описаны в контексте одного варианта осуществления, могут быть также представлены отдельно или в любой подходящей подкомбинации.
Дексмедетомидин представляет собой специфический агонист альфа-2-адренергических рецепторов, который вызывает седативное действие, анестезию и анальгезию у млекопитающих. Для людей дексмедетомидин имеется в продаже для обеспечения седативного действия у первоначально интубированных и находящихся на искусственной вентиляции легких пациентов во время лечения в отделении интенсивной терапии, а также обеспечения седативного действия у не интубированных пациентов перед или во время хирургических и других процедур. См., например, патенты США №№ 6716867 и 6313311, каждый из которых полностью включен в настоящее описание путем ссылки.
Дексмедетомидин содержит основной атом азота, способный образовывать фармацевтически приемлемую соль с фармацевтически приемлемой кислотой. Фраза «фармацевтически приемлемые соли» в этом отношении относится к относительно нетоксичным, неорганическим и органическим кислотно-аддитивным солям дексмедетомидина. Эти соли могут быть получены in situ во время конечного выделения и очистки дексмедетомидина или отдельным взаимодействием очищенного дексмедетомидина в форме его свободного основания с подходящей органической или неорганической кислотой, и затем выделением образованной таким образом соли. Кроме того, соль может быть образована во время производственного процесса для получения аэрозольной препаративной формы. Репрезентативные фармацевтически приемлемые соли включают без ограничения галогеноводород (включая гидробромид и гидрохлорид), сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тосилат, цитрат, малеат, фумарат, сукцинат, тартрат, натилат, месилат, глюкогептонат, лактобионат, 2- гидроксиэтилсульфонат и лаурилсульфонат и тому подобные. См., например, "Pharmaceutical Salts," Berge et al., J. Pharm. Sci., 1977, 66, 1-19. Дексмедетомидин гидрохлорид является примером фармацевтически приемлемой соли. Дексмедетомидин гидрохлорид можно использовать частично потому, что в некоторых случаях гидрохлорид обладает большей растворимостью в воде и устойчивостью к окислению окружающим кислородом.
Производные дексмедетомидина включают ковалентные модификации, которые создают пролекарство. После введения пролекарственное производное подвергается химической модификации в организме млекопитающего, которая обеспечивает выход дексмедетомидина. Пролекарства можно применять для благоприятного изменения биораспределения или фармакокинетики дексмедетомидина или для получения других желаемых характеристик. Например, реактивный азот дексмедетомидина может быть дериватизирован функциональной группой, которая расщепляется, ферментативно или не ферментативно, восстановительно, окислительно или гидролитически, для выявления активного фармацевтического ингредиента. Виды применения определенных типов пролекарств известны (см., например, R. B. Silverman, 1992, "The Organic Chemistry of Drug Design and Drug Action," Academic Press, Chp. 8). Например, пролекарства могут быть получены in situ во время конечного выделения и очистки соединений, или отдельным взаимодействием очищенного соединения в форме его свободного основания с подходящим дериватизирующим агентом.
В настоящем описании представлены удивительные и неожиданные результат(ы), показывающие возможность разработки интраназальной препаративной формы дексмедетомидина или его фармацевтически приемлемой соли для лечения боли, которая обеспечивает уменьшенное время до начала облегчения боли, соответствующее Cplasma, Cmax и уменьшенному времени до Tmax, что может привести к облегчению или профилактике боли у млекопитающего без седативного действия или значительного седативного действия.
Настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение млекопитающему эффективного количества дексмедетомидина или его фармацевтически приемлемой соли. Дексмедетомидин или его фармацевтически приемлемая соль или композиции, содержащие их, можно вводить любым обычным образом, так что композиция вводится интраназально. То есть, композиция вступает в контакт с носовой полостью. Композиции можно также вводить, например, имплантацией композиции с тем, чтобы она всасывалась интраназально.
В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемая соль всасывается через слизистую оболочку носовой полости. В некоторых вариантах осуществления по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% композиции всасывается через слизистую оболочку носовой полости. В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемая соль не всасывается через слизистую оболочку ротовой полости.
В некоторых вариантах осуществления способ включает лечение или профилактику с облегчением боли без седативного действия или значительного седативного действия. В некоторых вариантах осуществления уровень седативного действия составляет не больше чем Уровень 1 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления уровень седативного действия составляет не больше чем Уровень 2 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления уровень седативного действия составляет не больше чем Уровень 3 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления уровень седативного действия составляет не больше чем Уровень 1 по Стэнфордской шкале сонливости. В некоторых вариантах осуществления уровень седативного действия составляет не больше чем Уровень 2 по Стэнфордской шкале сонливости. В некоторых вариантах осуществления уровень седативного действия не меньше чем Уровень 6 по Модифицированной шкале оценки наблюдателем концентрации внимания/седативного действия. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не больше чем Уровень 3 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не больше чем Уровень 2 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не больше чем Уровень 1 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не больше чем Уровень 2 по Стэнфордской шкале сонливости. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не больше чем Уровень 1 по Стэнфордской шкале сонливости. В некоторых вариантах осуществления в течение одного часа непосредственно после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку уровень седативного действия составляет не меньше чем Уровень 6 по Модифицированной шкале оценки наблюдателем концентрации внимания/седативного действия.
В некоторых вариантах осуществления боль представляет собой идиопатическую боль. В некоторых вариантах осуществления идиопатическая боль представляет собой невралгию, миалгию, гипералгезию, гиперпатию, неврит или нейропатию. В некоторых вариантах осуществления боль связана или вызвана раком, вирусной инфекцией, физической травмой, артритом, головной болью, мигренью или болью в поясничной области. В некоторых вариантах осуществления физическая травма связана или вызвана хирургическим вмешательством, ожогом, травмой тупым предметом или другой травмой, которая может вызвать боль, такой как травма в результате несчастного случая.
В некоторых вариантах осуществления средства и способы введения описанных здесь композиций известны. Средства и способы введения известны в данной области техники, и специалист может обратиться за руководством к различным фармакологическим ссылкам (см., например, руководства Modern Pharmaceutics, Banker & Rhodes, Marcel Dekker, Inc. (1979); и Goodman & Gilmanʹs The Pharmaceutical Basis of Therapeutics, 6th Edition, MacMillan Publishing Co., New York (1980)).
В некоторых вариантах осуществления подлежащее введению количество соединения представляет собой то количество, которое является терапевтически эффективным или эффективным при интраназальном введении. Подлежащая введению дозировка может зависеть от характеристик получающего лечение субъекта, например, конкретного получающего лечения животного, возраста, массы тела, состояния здоровья, типов современного лечения, если они имеются, и частоты лечебных воздействий, и их легко может определить специалист в данной области техники (например, клиницист). Клиницист может провести выбор, регулирование или титрование для подбора определенной схемы введения доз в соответствии со способами получения желательного клинического ответа, известными клиницисту, или как они описаны здесь. Кроме того, описанное здесь количество соединения, которое эффективно при лечении и/или профилактике конкретного заболевания, состояния или расстройства, зависит от природы и тяжести заболевания, состояния или расстройства, и его можно определить стандартными клиническими методиками. Кроме того, можно необязательно использовать анализы in vitro или in vivo для помощи в идентификации оптимальных диапазонов дозировки. Дозировки могут, например, представлять собой дозы, описанные здесь.
Соединения или композицию, содержащую их, можно вводить в различных лекарственных формах, пригодных для интраназального введения. Количество дозировки, присутствующее в лекарственной форме, может представлять собой фармацевтически или интраназально эффективное количество. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для лечения или профилактики боли. В некоторых вариантах осуществления эффективное количество представляет собой количество, которое не вызывает седативное действие. В некоторых вариантах осуществления эффективное количество не вызывает значительное седативное действие. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для лечения или профилактики боли, но при этом не вызывает седативное действие или значительное седативное действие.
Cplasma представляет собой концентрацию дексмедетомидина в плазме млекопитающего или человека в определенное время после введения. В некоторых вариантах осуществления интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия. Так, в некоторых вариантах осуществления в пределах от примерно 15 минут до примерно 20 минут после введения дексмедетомидина или его фармацевтически приемлемой соли млекопитающему или человеку Cplasma составит примерно 0,1 нг/мл. В некоторых вариантах осуществления Cplasma составляет от примерно 0,09 нг/мл до примерно 0,11 нг/мл, от примерно 0,08 нг/мл до примерно 0,12 нг/мл, от примерно 0,06 нг/мл до примерно 0,09 нг/мл, от примерно 0,07 нг/мл до примерно 0,09 нг/мл или от примерно 0,08 нг/мл до примерно 0,09 нг/мл. В некоторых вариантах осуществления целевая Cplasma достигается в пределах от примерно 8 минут до примерно 30 минут, в пределах от примерно 10 минут до примерно 30 минут, в пределах от примерно 12 минут до примерно 30 минут, в пределах от примерно 8 минут до примерно 20 минут, в пределах от примерно 10 минут до примерно 20 минут, в пределах от примерно 12 минут до примерно 20 минут, в пределах от примерно 8 минут до примерно 15 минут, в пределах от примерно 10 минут до примерно 15 минут, в пределах от примерно 12 минут до примерно 15 минут, в пределах от примерно 8 минут до примерно 10 минут, в пределах от примерно 8 минут до примерно 12 минут, в пределах от примерно 15 минут до примерно 20 минут, в пределах от примерно 15 минут до примерно 20 минут, в пределах от примерно 15 минут, в пределах от примерно 12 минут, в пределах от примерно 10 минут или в пределах от примерно 8 минут после введения и оказывает анальгетический эффект без значительного седативного действия. Эта точка времени может отражать начало облегчения боли (т.е. анальгетического эффекта).
В некоторых вариантах осуществления начало облегчения боли происходит меньше, чем примерно через 60 минут, меньше, чем примерно через 55 минут, меньше, чем примерно через 50 минут, меньше, чем примерно через 45 минут, меньше, чем примерно через 40 минут, меньше, чем примерно через 35 минут, меньше, чем примерно через 30 минут, меньше, чем примерно через 25 минут, меньше, чем примерно через 20 минут, меньше, чем примерно через 15 минут, меньше, чем примерно через 12 минут, меньше, чем примерно через 10 минут, примерно через 15 минут, примерно через 12 минут, примерно через 10 минут или примерно через 8 минут. Начало облегчения боли представляет собой время, когда млекопитающее ощущает, что боль стала меньше, чем перед введением описанного здесь соединения или композиции. В некоторых вариантах осуществления облегчение боли является полным, и млекопитающее больше не чувствует боли, облегчение которой осуществлялось.
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у взрослого человека, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли взрослому человеку, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не вызывает значительное седативное действие у взрослого в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени примерно 1,5 часа после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени примерно 1,0 часа после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени примерно 45 минут после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени от примерно 30 минут до примерно 1,5 часов после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени от примерно 40 минут до примерно 75 минут после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени от примерно 45 минут до примерно 70 минут после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени от примерно 50 минут до примерно 65 минут после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого субъекта не оказывается в пределах периода времени от примерно 55 минут до примерно 60 минут после введения, но при этом оказывает анальгетический эффект в пределах этого периода времени.
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю млекопитающего, в частности, человека. Введение в одну ноздрю означает, что вся стандартная доза вводится в одну ноздрю, в сравнении с порцией стандартной дозы, вводимой в обе ноздри. В некоторых вариантах осуществления стандартная доза вводится только в одну ноздрю. То есть, если дозировка вводится через каждые 4 часа, то дозировка вводится через каждые 4 часа только в одну ноздрю. Однако одна ноздря, в которую вводится композиция, может представлять собой одну из поочередно используемых для введения обеих ноздрей. В некоторых вариантах осуществления способы не включают введение описанного здесь дексмедетомидина или его фармацевтически приемлемой соли или композиции в еще одну ноздрю (например, в две ноздри).
Настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное распыление млекопитающему фармацевтической композиции, содержащей дексмедетомидин или его фармацевтически приемлемую соль, причем аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 150 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 125 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 100 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 от примерно 60 мкм до примерно 150 мкм, от примерно 60 мкм до примерно 125 мкм или от примерно 60 мкм до примерно 100 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 больше чем примерно 40 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 больше чем примерно 50 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 больше чем примерно 60 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 больше чем примерно 70 мкм.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли млекопитающему, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, и посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не оказывает значительное седативное действие в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю млекопитающего, в частности, человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли млекопитающему, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cpiasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, и причем аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у взрослого человека, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю взрослого человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не вызывает значительное седативное действие у взрослого в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени.
В некоторых вариантах осуществления настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у взрослого человека, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли взрослому человеку, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не вызывает значительное седативное действие у взрослого в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени, и причем аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное распыление дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю млекопитающего, в частности человека, причем аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у человека, включающим интраназальное введение интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не оказывает значительное седативное действие у человека в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у млекопитающего, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли млекопитающему, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не оказывает значительное седативное действие у млекопитающего в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени, и причем аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у человека, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, причем аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение также относится к способам лечения или профилактики боли без значительного седативного действия у человека, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не оказывает значительное седативное действие у человека в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени, причем аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 150 мкм.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения или профилактики боли без значительного седативного действия у человека, включающим интраназальное распыление интраназально эффективного количества дексмедетомидина или его фармацевтически приемлемой соли в одну ноздрю человека, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли создает Cplasma примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения и оказывает анальгетический эффект без значительного седативного действия, посредством чего интраназально эффективное количество дексмедетомидина или его фармацевтически приемлемой соли не оказывает значительное седативное действие у человека в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени, и причем аэрозоль содержит капли, которые имеют Dv90 менее чем примерно 150 мкм.
В любом из описанных здесь способов Cmax дексмедетомидина в плазме составляет от примерно 0,08 нг/мл до примерно 0,25 нг/мл, от примерно 0,08 нг/мл до примерно 0,2 нг/мл, от примерно 0,1 нг/мл до примерно 0,2 нг/мл, от примерно 0,08 нг/мл до примерно 0,15 нг/мл, от примерно 0,1 нг/мл до примерно 0,15 нг/мл или от примерно 0,15 нг/мл до примерно 0,2 нг/мл. В некоторых вариантах осуществления Cmax дексмедетомидина в плазме составляет от примерно 0,08 нг/мл до примерно 0,2 нг/мл. В некоторых вариантах осуществления Cmax дексмедетомидина в плазме составляет примерно 0,15 нг/мл. В некоторых вариантах осуществления Cmax дексмедетомидина в плазме составляет примерно 0,2 нг/мл. В некоторых вариантах осуществления Cmax дексмедетомидина в плазме составляет примерно 0,25 нг/мл.
В любом из описанных здесь способов Tmax составляет меньше чем примерно 60 минут, меньше чем примерно 50 минут, меньше чем примерно 40 минут, меньше чем примерно 35 минут или меньше чем примерно 30 минут. В некоторых вариантах осуществления Tmax составляет от примерно 20 минут до примерно 60 минут, от примерно 20 минут до примерно 50 минут, от примерно 20 минут до примерно 40 минут, от примерно 20 минут до примерно 30 минут, от примерно 30 минут до примерно 60 минут, от примерно 30 минут до примерно 50 минут, от примерно 30 минут до примерно 40 минут, от примерно 40 минут до примерно 60 минут, от примерно 40 минут до примерно 50 минут или от примерно 50 минут до примерно 60 минут. В некоторых вариантах осуществления Tmax дексмедетомидина составляет меньше чем примерно 1 час. В некоторых вариантах осуществления Tmax составляет меньше чем примерно 50 минут.
В любом из описанных здесь способов соединение или композицию можно вводить в соответствии с определенной схемой. В некоторых вариантах осуществления композицию вводят примерно через каждые 2 часа, примерно через каждые 4 часа, примерно через каждые 6 часов, примерно через каждые 8 часов, примерно через каждые 10 часов, примерно через каждые 12 часов или примерно через каждые 24 часа. Композицию можно также вводить по необходимости. В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемую соль или содержащую их композицию вводят примерно через каждые 6 часов.
В любом из описанных здесь способов дексмедетомидин или его фармацевтически приемлемую соль вводят в виде стандартной дозы от примерно 10 мкг до примерно 100 мкг, от примерно 10 мкг до примерно 90 мкг, от примерно 10 мкг до примерно 80 мкг, от примерно 10 мкг до примерно 70 мкг, от примерно 10 мкг до примерно 60 мкг, от примерно 10 мкг до примерно 50 мкг, от примерно 10 мкг до примерно 40 мкг, от примерно 10 мкг до примерно 30 мкг, от примерно 10 мкг до примерно 20 мкг, от примерно 25 мкг до примерно 100, от примерно 25 мкг до примерно 90 мкг, от примерно 25 мкг до примерно 80 мкг, от примерно 25 мкг до примерно 70 мкг, от примерно 25 мкг до примерно 60 мкг, от примерно 25 мкг до примерно 50 мкг, от примерно 25 мкг до примерно 40 мкг, от примерно 25 мкг до примерно 35 мкг, от примерно 25 мкг до примерно 30 мкг, от примерно 30 мкг до примерно 45 мкг, от примерно 35 мкг до примерно 45 мкг, от примерно 30 мкг до примерно 40 мкг, или от примерно 25 мкг до примерно 45 мкг. В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемую соль вводят в виде стандартной дозы примерно 10 мкг, примерно 15 мкг, примерно 20 мкг, примерно 25 мкг, примерно 30 мкг, примерно 35 мкг, примерно 40 мкг, примерно 45 мкг, примерно 50 мкг, примерно 55 мкг, примерно 60 мкг, примерно 70 мкг, примерно 75 мкг, примерно 80 мкг, примерно 85 мкг, примерно 90 мкг, примерно 95 мкг или примерно 100 мкг. В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемую соль вводят в виде стандартной дозы меньше чем примерно 100 мкг, меньше чем примерно 90 мкг, меньше чем примерно 80 мкг, меньше чем примерно 70 мкг, меньше чем примерно 60 мкг, меньше чем примерно 50 мкг, меньше чем примерно 40 мкг, меньше чем примерно 30 мкг, меньше чем примерно 20 мкг или меньше чем примерно 10 мкг. В некоторых вариантах осуществления дексмедетомидин или его фармацевтически приемлемую соль вводят в виде стандартной дозы примерно 10 мкг, примерно 25 мкг, примерно 30 мкг, примерно 35 мкг, примерно 40 мкг, примерно 50 мкг, примерно 75 мкг или примерно 100 мкг. Как обсуждается в настоящем описании, стандартную дозу можно вводить множеством различных путей. В некоторых вариантах осуществления стандартную дозу вводят однократным интраназальным распылением. В некоторых вариантах осуществления стандартную дозу вводят однократным интраназальным распылением с использованием однодозового распылительного устройства, не требующего первичного заполнения. Одну дозу можно вводить посредством одного приведения в действие интраназального распылительного устройства. Пример распылительного устройства, которое не требует первичного заполнения, включает без ограничения устройство Aptar Unitdose Intranasal Systems. Распылительное устройство может в некоторых вариантах осуществления подавать объем примерно 100 мкл. В некоторых вариантах осуществления объем составляет примерно 10, 20, 30, 40, 50, 60, 70, 80 или 90 мкл. В некоторых вариантах осуществления объем составляет примерно 10-100, примерно 20-100, примерно 30-100, примерно 40-100, примерно 50-100, примерно 60-100, примерно 70-100, примерно 80-100, примерно 90-100 мкл.
В любом из описанных здесь способов способ включает отсутствие воздействия или наличие минимального воздействия на артериальное давление после введения. В некоторых вариантах осуществления нет воздействия на артериальное давление в пределах часа непосредственно после введения описанного здесь соединения. В некоторых вариантах осуществления имеется лишь минимальное воздействие на артериальное давление в пределах часа непосредственно после введения описанного здесь соединения. В некоторых вариантах осуществления воздействие на среднее артериальное давление в покое у млекопитающего не превышает примерно 5 мм рт.ст., не превышает примерно 10 мм рт.ст., не превышает примерно 15 мм рт.ст., не превышает примерно 20 мм рт.ст., не превышает примерно 25 мм рт.ст. или не превышает примерно 30 мм рт.ст. Среднее артериальное давление можно измерить любым способом, известным специалисту в данной области техники. В некоторых вариантах осуществления нет воздействия или имеется лишь минимальное воздействие дексмедетомидина или его фармацевтически приемлемой соли на артериальное давление.
В любом из описанных здесь способов способ дополнительно включает введение человеку или млекопитающему в одновременной, чередующейся или последовательной комбинации одного или нескольких дополнительных терапевтических средств. Одно или несколько дополнительных терапевтических средств выбрано из анальгетика, такого как опиоидный анальгетик (например, морфин, оксикодон, гидроморфон и т.д.), синтетический опиоидноподобный анальгетик (например, меперидин, фентанил, пентазоцин, буторфанол и т.д.) или неопиоидный анальгетик (например NSAID, кетамин, салицилаты, стероиды и т.д.); витамин; сосудорасширяющее средство; бензодиазепин (например клоназепам, алпразолам, лоразепам и т.д.); триптан (и другие соединения для лечения мигреневых головных болей); противосудорожное средство (например, прегабалин, вальпроевая кислота, габапентин и т.д.); антидепрессант (например, трициклические антидепрессанты, такие как амитриптилин, нортриптилин и т.д.; ингибиторы обратного захвата серотонина и норэпинефрина, такие как дулоксетин, флуоксетин, венлафаксин и т.д.); лекарственный препарат против тошноты (например, метоклопрамид, прохлорперазин, ондансетрон, гранисетрон и т.д.); и антигипертензивное средство (например, бета-блокаторы, такие как пропранолол, и блокаторы кальциевых каналов, такие как верапамил и т.д.).
Настоящее изобретение также относится к любой одной или нескольким из описанных здесь композиций для лечения боли у млекопитающего без значительного седативного действия.
Настоящее изобретение также относится к любой одной или нескольким из описанных здесь композиций для применения при производстве лекарственного препарата для лечения боли у млекопитающего без значительного седативного действия.
В любом из описанных здесь способов дексмедетомидин или его фармацевтически приемлемую соль можно вводить интраназально устройством. В некоторых вариантах осуществления устройство представляет собой дозирующее устройство. В некоторых вариантах осуществления дозирующее устройство представляет собой многодозовое, стандартнодозовое или двухдозовое устройство.
В некоторых вариантах осуществления устройство пригодно для интраназального введения. Можно использовать любое устройство, которое пригодно для интраназального введения. В некоторых вариантах осуществления устройство представляет собой дозирующее устройство. Дозирующее устройство может подавать определенное дозируемое количество композиции. Дозирующее устройство может представлять собой стандартнодозовое, двухдозовое или многодозовое устройство. Фармацевтически эффективное количество, которое можно вводить, используя дозирующее устройство, может представлять собой стандартнодозовое устройство. Дозирующее устройство может в некоторых вариантах осуществления представлять собой устройство, которое может подавать фармацевтическую композицию интраназально. Примеры дозирующих устройств включают без ограничения устройства, которые представляют собой насосные устройства, механические устройства, устройства для аэрозольного распыления и/или электромеханические устройства. Примеры дозирующего устройства включают без ограничения пульверизатор, назальный пульверизатор с предварительным сжатием распыляемого потока, устройство с дозирующим клапаном, пусковой распылитель, распылитель с боковым пуском, шприцевой назальный распылитель (например, шприц, который имеет распылитель для подачи аэрозоля в носовую полость), распылительное устройство для трансмукозальной доставки, электромеханическое насосное устройство (со счетчиком или без него) и тому подобные. Примеры дозирующих устройств также включают без ограничения устройства, производимые компанией Aptar Pharma (Congers, NY), и имеются в продаже. Примеры дозирующих устройств также включают без ограничения UDS (Aptar Pharma), BDS (Aptar Pharma), eDevices (Aptar Pharma), Equadel (Aptar Pharma), Latitude (Aptar Pharma), DF30 (Aptar Pharma), VP7 (Aptar Pharma), Classic Nasal Device (Aptar Pharma), MAD Nasal Drug Device (Wolf Tory Medical, Inc.), BD Accuspray SCF™ (Becton Dickinson и тому подобные. Другой пример включает без ограничения Aptar Unitdose Intranasal System.
Анальгетические интраназальные препаративные формы дексмедетомидина или его фармацевтически приемлемой соли или производного можно вводить отмеренными дозами с тем, чтобы заданное количество активного фармацевтического ингредиента должным образом вводилось субъекту в фармацевтически эффективном количестве. Например, интраназальная препаративная форма может быть упакована в виде основного количества жидкости, содержащей множественные дозы, в пульверизатор, включающий герметично укупоренный контейнер, снабженный дозирующим насосом. В некоторых вариантах осуществления субъект лечится самостоятельно интраназально, например, одним или несколькими нажатиями, обеспечивающими подачу препаративной формы из пульверизатора. Преимуществом представленных здесь примеров интраназальной подачи является способность титрования доз для субъектов с использованием одиночных доз, подаваемых одиночными, дискретными нажатиями пускателя. Это преимущество обычно отсутствует при других формах подачи лекарственных средств (например, трансдермальных системах, пастилках, таблетках и суппозиториях), при которых универсальная стандартная дозировка вводится по стандартной схеме. Дополнительные преимущества интраназальных препаративных форм включают простоту их применения, в частности, при самостоятельном введении в отсутствие лечащего медицинского работника.
В некоторых вариантах осуществления дозирующее устройство представляет собой устройство для аэрозольной подачи, которое включает основной блок, привод выброса, отверстия для выхода препаративной формы из устройства и резервуар. Резервуар может быть заполнен дексмедетомидином или его фармацевтически приемлемой солью и, необязательно, другими эксципиентами, такими как те, которые описаны во всей настоящей заявке, перед подачей пациенту, например, на производственном участке. Резервуар может содержать отмеренное количество дексмедетомидина или его фармацевтически приемлемой соли или производного, подлежащее выбросу после нажатия пускателя. Корпус резервуара может быть выполнен из любого приемлемого материала, например, просто сформирован из отрезка полого цилиндра из пластикового, стального, такого как нержавеющая сталь, прозрачного материала или тому подобного, так что его производство не представляет трудности. Пускатель, который является подвижным относительно отверстия для активации выброса, может быть предоставлен на устройстве или с ним. В ходе пускового движения резервуар открывается, например, проколом, для введения одной дозировки через отверстие. Во время части хода пускателя после исходного положения создается повышенное давление. В следующем положении пускового движения, продолжающегося в том же направлении, давление на среду может стравливаться с одной из сторон и сообщаться с отверстием. Таким образом, среда выталкивается из резервуара и через отверстие под действием давления.
В некоторых вариантах осуществления по мере того как жидкая препаративная форма выходит из отверстия, капли жидкости следуют по траектории, на которую влияет форма отверстия, а также оказываемое давление. В некоторых вариантах осуществления размер капель, геометрия распыляемого аэрозоля и тип распыляемого аэрозоля зависят от конструкции насоса и/или свойств препаративной формы. В некоторых вариантах осуществления ориентация пускателя, конструкция насоса и свойства препаративной формы влияют на симметрию и форму распыляемого аэрозоля. Тип распыляемого аэрозоля можно также оптимизировать для диспергирования капель по более широкому каналу, посредством этого увеличивая площадь поверхности, через которую может всасываться соединение. Устройство может быть дополнительно сконструировано для облегчения использования и направления вводимого распыляемого аэрозоля в определенные области слизистой оболочки носовой полости.
Распыление аэрозоля под действием насоса может характеризоваться приложением внешнего давления для приведения в действие, например, внешнего ручного, механического или электрически инициированного давления. Это отличается от устройств, создающих избыточное давление, например, запускаемых пропеллентом аэрозольных или спреев со сжатым газом, где приведение в действие обычно достигается регулированием сброса давления, например, регулируемым отверстием клапана. В некоторых вариантах осуществления используются пульверизаторы. Использование пульверизатора с представленными здесь препаративными формами обеспечивает возможность введения капель или частиц, имеющих маленький средний диаметр, и регулируемого распределения размера капель. В некоторых вариантах осуществления создающие избыточное давление устройства, содержащие резервуар находящегося под избыточным давлением газа (например, диоксида углерода, азота, хлорфторуглеродов, гидрофторалканов и т.д.), могут продуцировать подходящие частицы или капли. Жидкие капли или частицы, имеющие диаметр, который слишком мал, могут поступить в легкие субъекта после введения. В некоторых вариантах осуществления размер капель подаваемых препаративных форм дополнительно обеспечивает увеличение площади поверхности, будучи распыленным интраназально, в отличие от размещения в ноздре, например, пипеткой. Размер аэрозольных частиц и форма типа аэрозоля также могут вносить вклад в то, всасывается ли активный ингредиент в системы организма (например, легкие) в дополнение к слизистой оболочке носовой полости.
Как описано здесь, пульверизатор может представлять собой устройство с предварительно отмеренной дозой или, альтернативно, устройство может представлять собой дозирующее устройство. Устройства с предварительно отмеренной дозой могут содержать предварительно отмеренные дозы или фракцию дозы при некотором типе единиц доз (например, одну стандартную дозу раствора, один или множество блистеров или других полостей), которые могут быть включены в устройство во время производства, или пациентом перед применением. Типичные дозирующие устройства имеют резервуар, содержащий препаративную форму в количестве, достаточном для множественных доз, которые подаются в виде дозированных спреев самим устройством при приведении в действие пациентом. Устройство может быть мерным и по количеству подаваемого лекарственного вещества (т.е. дозировки на одно нажатие для приведения в действие), а также по длительности промежутка времени между каждой дозировкой. Ограничение времени между каждой дозировкой может предотвратить передозировку путем ограничения частоты возможной подачи дозировки пациенту.
Представленные здесь варианты осуществления описанных устройств не предназначены для ограничения. В некоторых вариантах осуществления препаративные формы, содержащие дексмедетомидин, могут альтернативно или дополнительно представлены в виде других интраназальных лекарственных форм. Например, интраназальная композиция может быть представлена в виде жидкости, совместимой с введением по каплям пипеткой или подобным устройством. Интраназальная препаративная форма может быть также представлена в виде порошка, подлежащего введению в носовую полость. Препаративные формы могут быть, например, упакованы в фармацевтически приемлемые ампулы со стандартной дозой с отламываемыми верхушками для обеспечения возможности вставления в носовую полость пациента для подачи одной дозы препаративной формы.
В еще одном варианте осуществления соединения можно доставлять в системе контролируемого высвобождения. В одном варианте осуществления можно использовать насос (см. Langer, выше; Sefton, CRC Crit. Ref. Biomed. Eng., 1987, 14, 201; Buchwald et al., Surgery, 1980, 88, 507 Saudek et al., N. Engl. J. Med., 1989, 321, 574). В другом варианте осуществления можно использовать полимерные материалы (см. руководства Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger et al., J. Macromol. Sci. Rev. Macromol. Chem., 1983, 23, 61; см. также Levy et al., Science, 1985, 228, 190; During et al., Ann. Neurol., 1989, 25, 351; Howard et al., J. Neurosurg., 1989, 71, 105). Можно использовать другие системы контролируемого высвобождения, обсужденные в обзоре Langer, Science, 1990, 249, 1527-1533, и их можно приспособить для интраназального введения.
В некоторых вариантах осуществления водные интраназальные композиции дексмедетомидина можно вводить в виде капель или в виде мелкодисперсного тумана. Введение в виде мелкодисперсного тумана может улучшить воспроизводимость дозирования содействием равномерному осаждению композиции на слизистой оболочке носовой полости. В некоторых вариантах осуществления насосное устройство используют для генерирования мелкодисперсного тумана из основного объема раствора интраназальной композиции. Для интраназальных аэрозольных композиций дексмедетомидина можно использовать стандартнодозовые и двухдозовые устройства, поскольку эти устройства ограничивают общую дозу и/или число доз, которые можно подать из одного устройства, таким образом, снижая вероятность передозировки/злоупотребления. Кроме того, стандартнодозовые и/или двухдозовые устройства могут требовать меньшего упакованного объема для подачи объема аэрозоля путем уменьшения количества раствора, потерянного при первичном заполнении насоса. В некоторых вариантах осуществления используют многодозовые устройства ввиду более низких производственных затрат и меньших потерь при упаковке.
Настоящее изобретение также относится к дозирующим устройствам, содержащим фармацевтическую композицию, включающую дексмедетомидин или его фармацевтически приемлемую соль, причем дозирующее устройство интраназально подает отмеренную дозу фармацевтической композиции, которая обеспечивает обезболивание у млекопитающего без значительного седативного действия.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, включает капли, содержащие дексмедетомидин или его фармацевтически приемлемую соль, которые имеют Dv90 меньше чем примерно 150 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 125 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 меньше чем примерно 100 мкм. В некоторых вариантах осуществления аэрозоль содержит капли, которые имеют Dv90 от примерно 60 мкм до примерно 150 мкм, от примерно 60 мкм до примерно 125 мкм или от примерно 60 мкм до примерно 100 мкм.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит отмеренную дозу дексмедетомидина или его фармацевтически приемлемой соли от примерно 10 мкг до примерно 100 мкг, от примерно 10 мкг до примерно 90 мкг, от примерно 10 мкг до примерно 80 мкг, от примерно 10 мкг до примерно 70 мкг, от примерно 10 мкг до примерно 60 мкг, от примерно 10 мкг до примерно 50 мкг, от примерно 10 мкг до примерно 40 мкг, от примерно 10 мкг до примерно 30 мкг, от примерно 10 мкг до примерно 20 мкг, от примерно 25 мкг до примерно 100, от примерно 25 мкг до примерно 90 мкг, от примерно 25 мкг до примерно 80 мкг, от примерно 25 мкг до примерно 70 мкг, от примерно 25 мкг до примерно 60 мкг, от примерно 25 мкг до примерно 50 мкг, от примерно 25 мкг до примерно 40 мкг, от примерно 25 мкг до примерно 35 мкг, от примерно 25 мкг до примерно 30 мкг, или от примерно 25 мкг до примерно 45 мкг. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит отмеренную дозу аэрозоля, продуцируемую устройством, примерно 10 мкг, примерно 15 мкг, примерно 20 мкг, примерно 25 мкг, примерно 30 мкг, примерно 35 мкг, примерно 40 мкг, примерно 50 мкг, примерно 55 мкг, примерно 60 мкг, примерно 70 мкг, примерно 75 мкг, примерно 80 мкг, примерно 85 мкг, примерно 90 мкг, примерно 95 мкг, или примерно 100 мкг. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит отмеренную дозу меньше чем примерно 100 мкг, меньше чем примерно 90 мкг, меньше чем примерно 80 мкг, меньше чем примерно 70 мкг, меньше чем примерно 60 мкг, меньше чем примерно 50 мкг, меньше чем примерно 40 мкг, меньше чем примерно 30 мкг, меньше чем примерно 20 мкг или меньше чем примерно 10 мкг. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит отмеренную дозу примерно 10 мкг, примерно 25 мкг, примерно 35 мкг, примерно 50 мкг, примерно 75 мкг или примерно 100 мкг.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит объем меньше чем примерно 150 мкл, меньше чем примерно 140 мкл, меньше чем примерно 130 мкл, меньше чем примерно 120 мкл, меньше чем примерно 110 мкл, меньше чем примерно 100 мкл, меньше чем примерно 75 мкл или меньше чем примерно 50 мкл. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, содержит объем примерно 150 мкл, примерно 140 мкл, примерно 130 мкл, примерно 120 мкл, примерно 110 мкл, примерно 100 мкл, примерно 75 мкл или примерно 50 мкл.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cplasma у млекопитающего от примерно 0,09 нг/мл до примерно 0,11 нг/мл, от примерно 0,08 нг/мл до примерно 0,12 нг/мл или примерно 0,1 нг/мл в пределах от примерно 12 минут до примерно 30 минут, от примерно 12 минут до примерно 20 минут, от примерно 15 минут до примерно 20 минут, или в пределах от примерно 15 минут после введения и оказывает анальгетический эффект без значительного седативного действия. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cplasma у млекопитающего примерно 0,1 нг/мл в пределах от примерно 15 минут до примерно 20 минут после введения.
В некоторых вариантах осуществления отмеренная доза аэрозоля обеспечивает время до начала облегчения боли меньше чем примерно 60 минут, меньше чем примерно 55 минут, меньше чем примерно 50 минут, меньше чем примерно 45 минут, меньше чем примерно 40 минут, меньше чем примерно 35 минут, меньше чем примерно 30 минут, меньше чем примерно 25 минут, меньше чем примерно 20 минут или примерно 15 минут.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, не оказывает значительное седативное действие у взрослого в пределах периода времени примерно двух часов после введения и оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени примерно 1,5 часа после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени примерно 1,0 часа после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени примерно 45 минут после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени от примерно 30 минут до примерно 1,5 часа после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени от примерно 40 минут до примерно 75 минут после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени от примерно 45 минут до примерно 70 минут после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени от примерно 50 минут до примерно 65 минут после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени. В некоторых вариантах осуществления значительное седативное действие у взрослого не оказывается в пределах периода времени от примерно 55 минут до примерно 60 минут после введения, но тем не менее оказывает анальгетический эффект в пределах этого периода времени.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cmax в плазме млекопитающего от примерно 0,08 нг/мл до примерно 0,25 нг/мл, от примерно 0,08 нг/мл до примерно 0,2 нг/мл, от примерно 0,1 нг/мл до примерно 0,25 нг/мл, от примерно 0,1 нг/мл до примерно 0,2 нг/мл, от примерно 0,08 нг/мл до примерно 0,15 нг/мл, от примерно 0,1 нг/мл до примерно 0,15 нг/мл, от примерно 0,15 нг/мл до примерно 0,2 нг/мл или от примерно 0,15 нг/мл до примерно 0,25 нг/мл. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cmax в плазме млекопитающего от примерно 0,08 нг/мл до примерно 0,25 нг/мл. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cmax в плазме млекопитающего от примерно 0,08 нг/мл до примерно 0,2 нг/мл. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cmax в плазме млекопитающего примерно 0,15 нг/мл. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Cmax в плазме млекопитающего примерно 0,08 нг/мл, примерно 0,1 нг/мл, примерно 0,2 нг/мл или примерно 0,25 нг/мл.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Tmax у млекопитающего меньше чем примерно 60 минут, меньше чем примерно 50 минут, меньше чем примерно 40 минут, меньше чем примерно 35 минут или меньше чем примерно 30 минут. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Tmax у млекопитающего от примерно 20 минут до примерно 60 минут, от примерно 20 минут до примерно 50 минут, от примерно 20 минут до примерно 40 минут, от примерно 20 минут до примерно 30 минут, от примерно 30 минут до примерно 60 минут, от примерно 30 минут до примерно 50 минут, от примерно 30 минут до примерно 40 минут, от примерно 40 минут до примерно 60 минут, от примерно 40 минут до примерно 50 минут, или от примерно 50 минут до примерно 60 минут. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Tmax у млекопитающего меньше чем примерно 1 час. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, создает Tmax у млекопитающего меньше чем примерно 50 минут.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не больше чем Уровень 1, Уровень 2 или Уровень 3 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не больше чем Уровень 3 по Шкале седативного действия Рамсея. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не больше чем Уровень 2 по Шкале седативного действия Рамсея.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не больше чем Уровень 1 или Уровень 2 по Стэнфордской шкале сонливости. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не больше чем Уровень 2 по Стэнфордской шкале сонливости.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством в течение часа непосредственно после введения млекопитающему, вызывает уровень седативного действия не меньше чем Уровень 6 по Модифицированной шкале оценки наблюдателем концентрации внимания/седативного действия.
В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, не оказывает или оказывает минимальный эффект на артериальное давление млекопитающего после введения. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, не оказывает эффект на артериальное давление в пределах часа непосредственно после введения описанного здесь соединения. В некоторых вариантах осуществления отмеренная доза аэрозоля, продуцируемая устройством, оказывает лишь минимальный эффект на артериальное давление в пределах часа непосредственно после введения описанного здесь соединения. В некоторых вариантах осуществления под воздействием описанного здесь соединения среднее артериальное давление млекопитающего в покое повышается не больше чем примерно на 5 мм рт.ст., не больше чем примерно на 10 мм рт.ст., не больше чем примерно на 15 мм рт.ст., не больше чем примерно на 20 мм рт.ст., не больше чем примерно на 25 мм рт.ст. или не больше чем примерно на 30 мм рт.ст.
В некоторых вариантах осуществления любая из композиций, описанных здесь, может дополнительно содержать один или несколько других терапевтических средств. Одно или несколько дополнительных терапевтических средств выбрано из анальгетика, такого как опиоидный анальгетик (например, морфин, оксикодон, гидроморфон и т.д.), синтетический опиоидноподобный анальгетик (например, меперидин, фентанил, пентазоцин, буторфанол и т.д.) или неопиоидный анальгетик (например, NSAID, кетамин, салицилаты, стероиды и т.д.); витамин; сосудорасширяющее средство; бензодиазепин (например, клоназепам, алпразолам, лоразепам и т.д.); триптан (и другие соединения для лечения мигреневых головных болей); противосудорожное средство (например, прегабалин, вальпроевая кислота, габапентин и т.д.); антидепрессант (например, трициклические антидепрессанты, такие как амитриптилин, нортриптилин и т.д.; ингибиторы обратного захвата серотонина и норэпинефрина, такие как дулоксетин, флуоксетин, венлафаксин и т.д.); лекарственный препарат против тошноты (например, метоклопрамид, прохлорперазин, ондансетрон, гранисетрон и т.д.); и антигипертензивное средство (например, бета-блокаторы, такие как пропранолол, и блокаторы кальциевых каналов, такие как верапамил и т.д.).
Примеры других анальгетических средств включают без ограничения наркотические средства, NSAID, ингибиторы Cox-2, стероиды и тому подобные. Другие примеры включают без ограничения аспирин, кодеин, оксикодон, ибупрофен, буталбитал, ацетаминофен (APAP), кофеин, аспирин, гидрокодон, ацетоминофен, пропоксифен n-apap (N-ацетил-пара-аминофенол), пропоксифен HCl, буторфанол тартрат, пентазоцин-apap, пентазоцин-налоксон, трамадол, трамадол продолжительного высвобождения, фентанил, морфин, меперидин HC1, гидроморфон HC1, метадон, леворфанол тартрат, оксиморфон, бупренорфин, целекоксиб, рофекоксиб, налтрексон, напроксен, флурбипрофен, диклофенак, сулиндак, оксапрозин, пироксикам, индометацин, этодолак, меклофенамат, мелоксикам, фенопрофен, кетопрофен, набуметон, толметин, кеторолак трометамин, салсалат, дифлунизал, холин и салицилаты магния или любую их комбинацию. Описанные здесь соединения или их соли и композиции, содержащие их, можно вводить или отдельно, или в комбинации (одновременно или последовательно) с другими фармацевтическими средствами. В некоторых вариантах осуществления описанные здесь композиции можно вводить с одним или несколькими другими анальгетическими средствами.
В некоторых вариантах осуществления композиция дополнительно содержит носитель. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит фосфат натрия и/или цитрат натрия. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит цитрат натрия, лимонную кислоту и хлорид натрия. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит от примерно 0,2% до примерно 0,3% (масс./масс.) цитрата натрия и от примерно 0,005% до примерно 0,015% (масс./масс.) лимонной кислоты.
В некоторых вариантах осуществления композиция содержит соль, такую как фармацевтически приемлемая соль. В некоторых вариантах осуществления композиция содержит хлорид натрия, хлорид калия или любую их комбинацию. В некоторых вариантах осуществления композиция содержит лимонную кислоту. В некоторых вариантах осуществления композиция содержит цитрат натрия, лимонную кислоту и соль, включая без ограничения хлорид натрия. В некоторых вариантах осуществления композиция содержит от примерно 0,1% до примерно 0,5%, от примерно 0,1% до примерно 0,4%, от примерно 0,2% до примерно 0,5%, от примерно 0,2% до примерно 0,4%, от примерно 0,2% до примерно 0,3% (масс./масс.) цитрата натрия. В некоторых вариантах осуществления композиция содержит от примерно 0,005% до примерно 0,015%, от примерно 0,005% до примерно 0,05%, от примерно 0,005% до примерно 0,004%, от примерно 0,005% до примерно 0,03%, от примерно 0,005% до примерно 0,02% или от примерно 0,005% до примерно 0,0175% (масс./масс.) лимонной кислоты.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит хелатор или стабилизатор, который можно при необходимости использовать для повышения химической устойчивости. Подходящие стабилизаторы включают без ограничения хелатообразующие агенты или комплексообразующие агенты, такие как, например, комплексообразователь кальция этилендиаминтетрауксусная кислота (ЭДТА), соль ЭДТА, лимонная кислота, хитозан, сорбит и винная кислота. Например, соответствующее количество ЭДТА или ее соли, например, динатриевой соли, может быть включено в композицию для комплексообразования избытка ионов кальция и предотвращения образования геля во время хранения. ЭДТА или ее соль может соответственно быть включена в количестве от примерно 0,01% до примерно 0,5%. В тех вариантах осуществления, где композиция содержит консервант, отличный от ЭДТА, ЭДТА или ее соль, конкретнее, динатрий ЭДТА, может присутствовать в количестве от примерно 0,025% до примерно 0,1% масс. Без связи с какой-либо теорией, хелатообразующие агенты могут предотвратить разрушение многовалентными катионами дексмедетомидина или других компонентов в композиции.
В некоторых вариантах осуществления описанные здесь интраназальные композиции могут необязательно включать буферную систему, состоящую из пары кислота/основание, которая противодействует изменениям pH. pH композиций можно регулировать для ограничения раздражения, вызываемого интраназальным аэрозолем. В некоторых вариантах осуществления pH раствора от примерно 6,0 до примерно 6,5 можно использовать для совместимости с pH выделений носовой полости, в то же время сохраняя лекарственное средство в растворе. Фармацевтически приемлемые буферы, которые обеспечивают pH, совместимый со слизистой оболочкой носовой полости, включают цитрат, фосфат и тому подобные. В некоторых вариантах осуществления pH композиции составляет меньше чем 7, меньше чем 6,9, меньше чем 6,8, меньше чем 6,7, меньше чем 6,6, меньше чем 6,5, меньше чем 6,4, меньше чем 6,2 или меньше чем 6,1. В некоторых вариантах осуществления pH композиции составляет от примерно 6 до примерно 6,1, от примерно 6 до примерно 6,2, от примерно 6 до примерно 6,3, от примерно 6 до примерно 6,4, от примерно 6 до примерно 6,5, от примерно 6 до примерно 6,6, от примерно 6 до примерно 6,7, от примерно 6 до примерно 6,8, от примерно 6 до примерно 6,9 или от примерно 6 до примерно 7,0. В некоторых вариантах осуществления pH композиции таков, чтобы композиция не раздражала слизистую оболочку носовой полости.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит один или несколько противомикробных консервантов. Примеры консервантов включают без ограничения содержащие ртуть вещества, такие как фенилртутные соли (например, ацетат, борат и нитрат фенилртути) и тимеросал; стабилизированный хлордиоксид; соединения четвертичного аммония, такие как бензалконий хлорид, цетилтриметиламмоний бромид и цетилпиридиний хлорид; имидазолидинилмочевину; парабены, такие как метилпарабен, этилпарабен, пропилпарабен и бутилпарабен и их соли; фенокисэтанол; хлорфеноксиэтанол; феноксипропанол; хлорбутанол; хлоркрезол; фенилэтиловый спирт; динатрий ЭДТА и сорбиновую кислоту и ее соли. Консерванты могут осаждаться в присутствии других эксципиентов в композиции. Например, может осаждаться бензалконий хлорид. Таким образом, в некоторых вариантах осуществления, в которых присутствует консервант, консервант представляет собой тот, который не осаждается, но остается в растворе в композиции. Подходящим консервантом является фенилэтиловый спирт. Может быть включен один или несколько противомикробных консервантов, например, для подавления микробного и грибкового роста в конечных системах подачи.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит один или несколько антиоксидантов. Подходящие антиоксиданты могут быть необязательно включены в интраназальную композицию, например, для стабилизации препаративной формы против долгосрочных эффектов окисления. Примеры антиоксидантов включают без ограничения витамин E (и его производные), витамин C (и его производные), BHT, BHA, пропилгаллат, лимонную кислоту, эриторбовую кислоту, монотиоглицерин, метабисульфит (натрия или калия), пропионовую кислоту, сульфит натрия и тимол.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит один или несколько подтверждающих введение дозы эксципиентов, которые содействуют облегчению должного применения и/или исключению передозировки. Для медикаментозных средств, которые вводятся интраназально, субъект может испытывать трудности при определении, правильно ли было введено медикаментозное средство. Включение подтверждающего введение дозы эксципиента может обеспечить субъекту положительную обратную связь после введения, подтверждающую, что доза была введена интраназально. В некоторых вариантах осуществления подтверждающий введение дозы эксципиент имеет запах, который может позволить субъекту подтвердить, что доза была введена и поступила или отложена в носовую полость. Другие механизмы обратной связи можно использовать для подтверждения того, что доза была введена должным образом. Запах представляет собой один неограничивающий пример. В некоторых вариантах осуществления подтверждающий введение дозы эксципиент представляет собой фенилэтиловый спирт. Без связи с теорией, подтверждающие введение дозы эксципиенты обеспечивают сенсорную обратную связь пациенту для подтверждения того, что доза была доставлена, посредством этого увеличивая соблюдение пациентом назначенной схемы введения, и снижая вероятность передозировки. Фенилэтиловый спирт имеет отчетливый специфический запах и может служить в качестве и противомикробного средства, и подтверждающего введение дозы эксципиента в ранее описанных композициях.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит один или несколько увлажнителей. Примеры увлажнителей включают без ограничения глицерин, пропиленгликоль, полиэтиленгликоль и сахар/сахарный спирт или любую их комбинацию. Увлажнители могут обеспечить смачивающие воздействия и снижение раздражения слизистой оболочки носовой полости.
В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит один или несколько регулирующих осмоляльность агентов. Осмоляльность интраназальной композиции может быть также релевантной для интраназального захвата медикаментнозного средства. Подходящие регулирующие осмоляльность агенты включают без ограничения хлорид натрия, декстрозу, сахара или любую их комбинацию. Регулирующие осмоляльность агенты могут быть также включены в композицию для получения растворов, которые являются менее раздражающими для слизистой оболочки носовой полости за счет выравнивания осмоляльности вводимого раствора с осмоляльностью слизистой оболочки носовой полости.
В некоторых вариантах осуществления фармацевтическая композиция не содержит повышающий вязкость агент. Повышающие вязкость агенты, включая без ограничения метоцел E4M, можно необязательно добавлять для увеличения времени нахождения инстиллированного или распыленного раствора в слизистой оболочке носовой полости. Однако в случае дексмедетомидина использование повышающего вязкость агента может привести к сниженным уровням дексмедетомидина в плазме, и поэтому им можно пренебречь в определенных условиях, таких как когда композиция дексмедетомидина предназначена для быстрого всасывания. Поэтому, к удивлению было обнаружено, что вязкость интраназальной композиции может воздействовать на захват активного ингредиента. Таким образом, в некоторых вариантах осуществления увеличение вязкости может уменьшить захват дексмедетомидина. Соответственно, в некоторых вариантах осуществления композиция не содержит полимер, который увеличивает вязкость жидкого носителя или композиции. В некоторых вариантах осуществления полимер представляет собой растворимый в воде полимер. Примеры растворимого полимера включают без ограничения простой эфир целлюлозы (например, гидроксипропилметилцеллюлозу), другие полимеры на основе целлюлозы (метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу и т.д.), повидон, поливиниловый спирт, смолы (например, ксантановую смолу), полиэтиленгликоль (PEG), полиэтиленоксид (PEO), гиалуроновую кислоту (и ее производные и соли), каррагинан, декстран и полоксамер. В некоторых вариантах осуществления простой эфир целлюлозы представляет собой гидроксипропилметилцеллюлозу (HPMC). Таким образом, в некоторых вариантах осуществления композиция не содержит HPMC. В некоторых вариантах осуществления вязкость интраназальной композиции не больше чем вязкость воды.
В некоторых вариантах осуществления вязкость интраназальной композиции составляет не больше чем 110%, не больше чем 120%, не больше чем 130%, не больше чем 140%, не больше чем 150%, не больше чем 160%, не больше чем 170%, не больше чем 180%, не больше чем 190% или не больше чем 200% вязкости воды. В некоторых вариантах осуществления вязкость интраназальной композиции составляет примерно 1 мПа*с, 2 мПа*с, 3 мПа*с, 4 мПа*с или 5 мПа*с. В некоторых вариантах осуществления вязкость интраназальной композиции составляет меньше чем примерно 1 мПа*с, 2 мПа*с, 3 мПа*с, 4 мПа*с или 5 мПа*с. В некоторых вариантах осуществления вязкость интраназальной композиции составляет от примерно 1 мПа*с до примерно 2 мПа*с, от примерно 1 мПа*с до примерно 3 мПа*с, от примерно 1 мПа*с до примерно 4 мПа*с, от примерно 1 мПа*с до примерно 5 мПа*с, от примерно 1,5 мПа*с до примерно 2,5 мПа*с, от примерно 2 мПа*с до примерно 3 мПа*с, от примерно 2 мПа*с до примерно 4 мПа*с или от примерно 2 мПа*с до примерно 5 мПа*с.
Вязкость композиции можно рассчитать различными способами. Вязкость можно также непосредственно измерить, используя различные методики. Например, вязкость композиции можно рассчитать в соответствии со следующим уравнением. Уравнение, которое выражает иллюстрируемое аппроксимированное соотношение между вязкостью раствора и концентрацией полимера, представляет собой η1/8=(C*α)+1, где η обозначает вязкость раствора в миллипаскаль-секундах, C обозначает концентрацию полимера в растворе (выраженную в процентах), и α обозначает константу, специфичную для молекулярной массы. Например, величину α можно рассчитать замещением, и можно затем использовать для расчета аппроксимированной вязкости при желаемой концентрации.
В данной области техники также известно, что соединения и композиции, содержащие их, могут содержаться в препартивных формах с фармацевтически приемлемыми разбавителями, наполнителями, разрыхлителями, связывающими агентами, смазывающими веществами, поверхностно-активными веществами, гидрофобными носителями, растворимыми в воде носителями, эмульгаторами, буферами, увлажнителями, смачивающими веществами, консервантами и тому подобными веществами. В некоторых вариантах осуществления соединения и композиции, содержащие их, могут содержаться в препаративных формах, которые не содержат фармацевтически приемлемые разбавители, наполнители, разрыхлители, связывающие агенты, смазывающие вещества, поверхностно-активные вещества, гидрофобные носители, растворимые в воде носители, эмульгаторы, буферы, увлажнители, смачивающие вещества, консерванты и тому подобные вещества. В некоторых вариантах осуществления соединения и композиции, содержащие их, могут содержаться в препаративных формах, которые не содержат поверхностно-активное вещество. Фармацевтические композиции могут также содержать пригодные твердые или гелеобразные носители или эксципиенты. В дополнение к другим описанным здесь эксципиентам, примеры таких носителей или эксципиентов включают без ограничения карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли. В некоторых вариантах осуществления описанные здесь соединения можно использовать со средствами, включая без ограничения топические анальгетики (например, лидокаин), барьерные устройства (например, GelClair) или агентами для споласкивания (например, Caphosol).
В некоторых вариантах осуществления при введении человеку соединения могут быть стерильными. Вода может быть подходящим носителем, когда соединение вводится интраназально. В качестве жидких носителей можно также использовать солевые растворы и водные растворы декстрозы и глицерина. Пригодные фармацевтические носители также включают эксципиенты, такие как без ограничения крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарата натрия, глицерин моностеарат, тальк, хлорид натрия, сушеное снятое молоко, глицерин, пропиленгликоль, вода, этанол и тому подобные. Композиции по настоящему изобретению могут при желании также содержать небольшие количества смачивающих или эмульгирующих агентов или забуферивающих pH агентов.
Описанные здесь композиции могут принимать форму раствора, суспензии, эмульсии, порошка, препаративной формы длительного высвобождения, аэрозоля, спрея или любую другую форму, пригодную для описанного здесь применения. Примеры пригодных фармацевтических носителей описаны в руководстве Remingtonʹs Pharmaceutical Sciences, A.R. Gennaro (Editor) Mack Publishing Co.
В некоторых вариантах осуществления соединения включаются в состав композиции в соответствии с обычными процедурами в виде фармацевтической композиции, приспособленной для введения людям. В некоторых вариантах осуществления соединения представляют собой растворы в стерильном изотоническом водном буфере и, например, с другими описанными здесь компонентами. При необходимости, композиции могут также включать солюбилизирующий агент. Композиции могут необязательно включать местный анестетик, такой как лидокаин, для облечения боли в участке введения, которая может быть вызвана, например, раздражением от композиции.
В некоторых вариантах осуществления настоящее изобретение также относится к фармацевтическим упаковкам или наборам, включающим один или несколько контейнеров, содержащих одно или несколько описанных здесь соединений. Необязательно, к таким контейнер(ам) может быть прилагаться уведомление в форме, предписанной правительственным ведомством, регулирующим производство, применение или продажу фармацевтических или биологических продуктов, причем уведомление отражает утверждение ведомством производства, применения или продажи для введения людям с целью лечения описанного здесь состояния, заболевания или расстройства. В некоторых вариантах осуществления набор содержит несколько описанных здесь соединений. В некоторых вариантах осуществления набор содержит описанное здесь соединение в одной стандартной лекарственной форме, такой как одна доза внутри устройства для интраназального введения, такого как дозирующее устройство, которое обеспечивает введение аэрозоля или порошка в носовую полость.
В некоторых вариантах осуществления описанные здесь компоненты подаются или отдельно, или смешанные вместе в стандартной лекарственной форме, например, компоненты могут комбинироваться для создания интраназальной препаративной формы. Примеры получения препаративных форм описаны здесь и могут модифицироваться для выхода любой пригодной интраназальной препаративной формы.
Фармацевтические композиции могут быть представлены в стандартной лекарственной форме. В такой форме композиция может быть разделена на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, упаковку, содержащую дискретные количества препаратов. Лекарственная форма может представлять собой любую форму, включая без ограничения описанные здесь формы.
В некоторых вариантах осуществления композиция по настоящему изобретению представлена в форме жидкости, где активное средство присутствует в растворе, в суспензии, в виде эмульсии или в виде раствора/суспензии. В некоторых вариантах осуществления жидкая композиция представлена в форме геля. В других вариантах осуществления жидкая композиция является водной. В других вариантах осуществления композиция представлена в форме мази. Жидкая композиция может также представлять собой аэрозоль.
Жидкий носитель относится к жидкости, в которой суспендирован или растворен дексмедетомидин. Примеры жидких носителей включают без ограничения воду, солевой раствор, водный раствор, ДМСО и тому подобные.
В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,245% безводного цитрата натрия, примерно 0,01% безводной лимонной кислоты, примерно 0,7% хлорида натрия, примерно 99,045% очищенной воды при начальном pH 6,31, доведенным до конечного pH примерно 6,78 2н гидроксидом натрия. В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,245% безводного цитрата натрия, примерно 0,01% безводной лимонной кислоты, примерно 0,1% Methocel E4M, примерно 0,7% хлорида натрия, примерно 98,945% очищенной воды при начальном pH 6,36, доведенном до конечного pH примерно 6,83 2н гидроксидом натрия. В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,193% одноосновного фосфата натрия (моногидрата), примерно 0,162% двухосновного фосфата натрия (гептагидрата), примерно 0,7% хлорида натрия, примерно 98,946% очищенной воды при начальном pH 6,37, доведенном до конечного pH примерно 6,53 2н гидроксидом натрия. В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,193% одноосновного фосфата натрия (моногидрата), примерно 0,162% двухосновного фосфата натрия (гептагидрата), примерно 0,75% хлорида натрия, примерно 98,896% очищенной воды при начальном pH 6,37, доведенном до конечного pH примерно 6,53 2н гидроксидом натрия. В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,193% одноосновного фосфата натрия (моногидрата), примерно 0,162% двухосновного фосфата натрия (гептагидрата), примерно 0,25% фенилэтилового спирта, примерно 0,68% хлорида натрия, примерно 98,616% очищенной воды, при начальном pH 6,15, доведенным до конечного pH примерно 6,51 2н гидроксидом натрия. В некоторых вариантах осуществления фармацевтическая композиция в дополнение к дексмедетомидину содержит следующие компоненты (все на основании % масс./масс.): примерно 0,226% безводного цитрата натрия, примерно 0,024% безводной лимонной кислоты, примерно 0,25% фенилэтилового спирта, примерно 0,76% хлорида натрия, примерно 98,64% очищенной воды при начальном pH 5,68, доведенным до конечного pH примерно 6,04 2н гидроксидом натрия.
Описанные здесь композиции, содержащие дексмедетомидин, являются устойчивыми. Например, для препаративной формы в виде 0,035% интраназального аэрозоля дексмедетомидина гидрохлорида устойчивость составляет по меньшей мере 3 месяца, по меньшей мере 6 месяцев, по меньшей мере 9 месяцев или по меньшей мере один год, причем условиями хранения являются 25°C при относительной влажности 60%, и по меньшей мере 1 месяц, по меньшей мере 3 месяца, по меньшей мере 6 месяцев, причем условиями хранения являются 40°C при относительной влажности 75%.
Когда дексмедетомидин или его фармацевтически приемлемая соль применяется в любом описанном здесь способе или устройстве, понятно, что любые и все метаболиты дексмедетомидина или его фармацевтически приемлемой соли также могут применяться аналогичным образом.
Для более эффективного понимания описанного здесь изобретения ниже приведены примеры. Следует понимать, что эти примеры предназначены только для иллюстративных целей и их не следует рассматривать как ограничивающее изобретение любым образом.
Примеры
Пример 1: Получение интраназальных препаративных форм
В контейнер добавляли очищенную воду по Фармакопее США. К воде примешивали безводную лимонную кислоту, дигидроцитрат натрия, хлорид натрия, фенилэтиловый спирт и динатрий ЭДТА до их растворения. pH раствора при необходимости изменяли для доведения до диапазона от 6,0 до 6,5. При продолжающемся смешивании добавляли дексмедетомидин HCl до его растворения. Добавляли воду для регулирования конечной выбранной концентрации дексмедетомидина HCl.
Пример 2: Интраназальные препаративные формы дексмедетомидина
Назальную доставку дексмедетомидина HCl (DEX) оценивали в отношении водных аэрозолей для получения фармакокинетических профилей, которые обеспечивают анальгезию без значительного седативного действия. Назальный путь доставки часто желателен для пациентов, которые могут быть неспособны или не желают переносить лечение пероральным путем (например, буккальным, сублингвальным, проглатыванием), ректальным путем (например, пенами, суппозиториями и т.д.) или инъекционным путем. В дополнение к водным назальным аэрозолям, первоначально разработанным для оценки интраназально вводимого DEX, препаративные формы можно модифицировать для включения сухих порошков, суспензий и/или паров, что очевидно из содержащегося здесь описания.
Первоначальный скрининг водной назальной композиции DEX, вводимой в виде носовых капель, оценивали на модели у собак. Влияние вида и вязкости буфера оценивали в следующей базовой композиции.
|
DEX растворяли в базовой композиции плацебо для получения растворов препаративной формы, которые должны доставить 50 мкг DEX в объеме 100 мкл. Композиции DEX были представлены следующим образом.
|
Плотность композиции носовых капель DEX составила приблизительно 1 г/мл при комнатной температуре и позволяла взаимозаменяемо использовать массу и объем. Собакам вводили три композиции носовых капель DEX. К удивлению, композиции без простого эфира целлюлозы, который представляет собой агент, повышающий вязкость, такие как препаративная форма 1-Dex и препаративная форма 3-Dex, обеспечивали значительные уровни в плазме меньше чем через 15 минут после введения. Также к удивлению, препаративная форма 2-Dex, которая содержала 0,1% Methocel E4M и имела самую высокую вязкость раствора, привела к уровням DEX в плазме, которыми можно пренебречь, указывая на то, что увеличенная вязкость раствора уменьшала эффективность доставленного интраназально DEX. Этот результат был неожиданным.
Влияние дополнительных добавок препаративной формы дополнительно исследовали из водных растворов DEX, которые подавали в виде мелкодисперсных туманов из водных пульверизаторов многоразового использования. Получали следующие композиции на основе плацебо.
|
DEX растворяли во второй комплект базовых композиций плацебо для получения растворов для доставки 50 мкг DEX в объеме 100 мкл. Композиции DEX представлены следующим образом.
|
|
Плотность композиций носовых аэрозолей DEX составила приблизительно 1 г/мл при комнатной температуре и позволяла взаимозаменяемо использовать массу и объем. Собакам вводили три композиции назальных аэрозолей DEX, используя назальные пульверизаторы с ручным приводом. Результаты исследования на собаках указали на измеряемые уровни в плазме уже через 5 минут и снижающиеся уровни в плазме в соответствии с препаративной формой 4-Dex > препаративной формой 5-Dex > препаративной формой 6- Dex.
Дополнительную базовую композицию плацебо получали, как определено ниже.
|
|
DEX растворяли в третью базовую композицию плацебо для получения раствора для доставки 25 мкг DEX в объеме 100 мкл. Композиция DEX представлена следующим образом.
|
Плотность композиции назального аэрозоля DEX составила приблизительно 1 г/мл при комнатной температуре и позволяла взаимозаменяемо использовать массу и объем. Назальные композиции DEX были разработаны в виде водного раствора, которые можно было подавать в виде носовых капель или в виде мелкодисперсного тумана из назального аэрозольного распылителя. Назальные композиции DEX минимально содержали DEX, растворенный в очищенной воде, в подходящей концентрации для доставки предполагаемой дозы DEX в объеме от 25 мкл до 200 мкл. Объемы доз меньше чем 25 мкл могут привести к вариабельной доставке, тогда как объемы доз больше чем 200 мкл могут привести к избыточному вытеканию из носовой полости. Водные назальные композиции могут необязательно содержать дополнительные материалы для содействия интраназальной доставке DEX.
Пример 3: Определение размера частиц капель
Функциональные характеристики in vitro в пульверизаторе лекарственного продукта (интраназального аэрозоля DEX-IN.02 50 мкг API/100 мкл и интраназального аэрозоля DEX-TN.03 25 мкг API/50 мкл) и плацебо (интраназального аэрозоля DEX-TN.02P 100 мкл) основывались на распределении размера капель, по данным измерения лазерной дифракции с использованием измерителя Malvern Spraytec. Malvern Spraytec работает на основании принципа дифракции лазерного излучения и представляет собой обычно используемую методику для характеристики распределений размера капель из назальных аэрозолей. Распределение размера капель характеризовалось следующими показателями: распределение объема (Dv10, Dv50, Dv90), диапазон и процентная доля (%) меньше чем 10 мкм в соответствии с руководством FDA (Администрации пищевых продуктов и лекарственных средств США) CMC (по Химии, производству и контролям) по назальным аэрозолям (2002) и проектом Руководства FDA для промышленности: Исследования биодоступности и биоэквивалентности для назальных аэрозолей и назальных спреев для местного действия, апрель 2003 г.
Пример 4: Фармакокинетическое исследование препаративных форм дексмедетомидина после интраназального или сублингвального введения у собак
Одной целью настоящего исследования было сравнение фармакокинетики множества экспериментальных препаративных форм дексмедетомидина с фармакокинетикой имеющейся в продаже препаративной формы дексмедетомидина при интраназальном или сублингвальном введении у собак. При каждом введении пяти кобелям интраназально или сублингвально вводили 50 мкг свободного основания дексмедетомидина (эквивалентных 59 мкг дексмедетомидина HCl) в 100 мкл препаративной формы, за исключением препаративной формы 7-Dex, где собакам вводили 25 мкг свободного основания дексмедетомидина (эквивалентных 29,5 мкг дексмедетомидина HCl) в 100 мкл, и препаративной формы PRECEDEX®, которая содержала 50 мкг основания дексмедетомидина в 500 мкл раствора. Введение препаративных форм проводили в 10 циклов в трех сегментах с минимум 2-дневным интервалом между введениями, как показано ниже в таблице:
|
Средние фармакокинетические параметры для дексмедетомидина суммированы ниже.
|
|
Для интраназального введения (введения с 1 по 9) Tmax и период полувыведения для дексмедетомидина были сходными у препаративной формы PRECEDEX® и экспериментальных доз 1-3 и 5-9. Среднее Tmax для дексмедетомидина для препаративной формы PRECEDEX® составило 0,38 часа, а среднее Tmax для дексмедетомидина для экспериментальных препаративных форм, которые вводили интраназально (дозы 1-3, 5-9), находилось в диапазоне от 0,32 часа до 0,80 часа. Средний период полувыведения для дексмедетомидина для препаративной формы PRECEDEX® составил 0,52 часа, и средний период полувыведения для дексмедетомидина для экспериментальных препаративных форм, вводимых интраназально (дозы 1-3, 5-9), находился в диапазоне от 0,43 часа до 0,93 часа. Для сублингвального введения (введение 10, препаративная форма DEX-SL.01), среднее Tmax составило 0,60 часа, сходное с Tmax, полученным после интраназального введения PRECEDEX® и экспериментальных доз 1-9, в то время как средний период полувыведения для препаративной формы DEX-SL.01 составил 1,72 часа, дольше, чем период полувыведения, полученный после интраназального введения PRECEDEX® и экспериментальных доз 1-3 и 5-9.
На основании показателей Cmax и AUClast, воздействие дексмедетомидина после интраназального введения было самым высоким для препаративной формы 3-DEX. Средняя Cmax для препаративной формы 3-DEX составила приблизительно 140% средней Cmax для PRECEDEX®, тогда как AUClast для препаративной формы 3-DEX составила приблизительно 180% средней AUClast для PRECEDEX®. Средние величины AUClast для препаративной формы 6-Dex и препаративной формы 1-DEX были сходны со средней величиной для PRECEDEX®, тогда как средние величины Cmax для этих препаративных форм составляли приблизительно 70% средней Cmax для PRECEDEX®. Средние величины Cmax и AUClast для всех других экспериментальных препаративных форм, введенных интраназально, были ниже, чем средние величины для PRECEDEX®. Воздействие дексмедетомидина после интраназального введения было самым низким для препаративной формы 2-DEX и препаративной формы 7-DEX. К удивлению, воздействие дексмедетомидина после сублингвального введения препаративной формы DEX-SL.01 было существенно ниже, чем для интраназального введения PRECEDEX®; средняя Cmax для препаративной формы DEX-SL.01 составила 18% средней Cmax для PRECEDEX®, а средняя величина AUClast для препаративной формы DEX-SL.01 составила 34% средней величины AUClast для PRECEDEX®.
|
Для интраназального введения (введения с 1 по 9) Tmax в этой таблице было в целом сходным у препаративной формы PRECEDEX® и экспериментальных доз 1-3 и 5-9. Среднее Tmax для препаративной формы PRECEDEX® составило 1,55 часа, а среднее Tmax для экспериментальных препаративных форм, которые вводили интраназально (дозы 1-3, 5-9), находилось в диапазоне от 0,65 часа до 1,80 часа. Для большинства препаративных форм период полувыведения или не рассчитывали, или не представили ввиду недостаточного количества точек данных для фазы выведения или слабого критерия адекватности (R2<0,8) для фазы выведения. При возможности расчета, период полувыведения находился в диапазоне от 1,3 часа до 8,7 часа. Для сублингвального введения (введение 10, препаративная форма DEX-SL.01), среднее Tmax составило 1,80 часа, сходное с Tmax, полученным после интраназального введения PRECEDEX® и экспериментальных доз 1-3 и 5-9.
На основании показателей Cmax и AUClast воздействие после интраназального введения было самым высоким для препаративной формы 3-DEX. Средняя Cmax для препаративной формы 3-DEX составила приблизительно 117% средней Cmax для PRECEDEX®, тогда как средняя AUClast для препаративной формы 3-DEX составила приблизительно 108% средней AUClast для PRECEDEX®. Средние величины Cmax и AUClast для всех других экспериментальных препаративных форм, введенных интраназально, были сходны с величинами Cmax и AUClast для PRECEDEX®, за исключением препаративной формы 4-DEX и препаративной формы 7-DEX (количество дексмедетомидина, введенное с препаративной формой 7-DEX, составило половину количества дексмедетомидина в других препаративных формах). Воздействие после сублингвального введения препаративной формы DEX-SL.01 было ниже, чем для интраназального введения PRECEDEX®; средняя Cmax для препаративной формы DEX-SL.01 составила приблизительно 61% средней Cmax для PRECEDEX®, а средняя величина AUClast для препаративной формы DEX-SL.01 составила 57% средней величины AUClast для PRECEDEX®.
Представленные здесь результаты к удивлению показывают, что при сравнении с ранее исследованной сублингвально введенной препаративной формой DEX-SL.01, всасывание происходит быстрее через назальный путь введения. Поэтому интраназальное введение DEX может, к удивлению, обеспечить более быстрое облегчение боли и/или предотвращении боли у субъектов, по сравнению с сублингвальным способом или способами введения DEX через слизистую оболочку ротовой полости, без значительного седативного действия и с небольшим или отсутствующим воздействием на артериальное давление.
Дозированное введение
Дозы 1-3 вводили интраназально микропипеткой с головкой, перевернутой для дозированного введения. Дозировка составила 50 мкг свободного основания дексмедетомидина (эквивалентную 59 мкг дексмедетомидина HC1) в 100 мкл препаративной формы. Дозу 4 вводили, используя имеющийся в продаже аэрозольный флакон для интраназального распыления. Дозы аэрозольного препарата вводили при вертикально расположенной головке, чередуя ноздри для каждого распыления. Головку переворачивали на время от 30 секунд до 1 минуты после введения аэрозоля. Аэрозольный флакон вводит 100 мкл на одно распыление, и требовалось пять распылений для подачи дозы 50 мкг свободного основания дексмедетомидина (эквивалентной 59 мкг дексмедетомидина HC1). Аэрозольный флакон заполняли в зоне, отдаленной от места введения перед введением дозы, для предотвращения возможного перекрестной контаминации. Кроме того, дозированное введение выполняли в зоне, удаленной от места взятия крови, для предотвращения возможной контаминации образцов крови аэрозольным испытываемым изделием.
Дозы 5-7 вводили, используя имеющийся в продаже назальный аэрозольный флакончик. Дозы аэрозоля вводили при вертикальном расположении головки. Головку переворачивали на время от 30 секунд до 1 минуты после введения аэрозоля. Аэрозольный флакон вводит 100 мкл на одно распыление, и требовалось одно распыление для подачи дозы 50 мкг свободного основания дексмедетомидина (эквивалентной 59 мкг дексмедетомидина HC1). Аэрозольный флакон заполняли, используя пять пусковых распыляющих нажатий, в зоне, удаленной от дозированного введения, перед введением дозы для предотвращения возможной перекрестной контаминации. Кроме того, дозированное введение выполняли в зоне, удаленной от места взятия крови, для предотвращения возможной контаминации образцов крови аэрозольным испытываемым изделием.
Дозу 8 вводили, используя имеющийся в продаже назальный аэрозольный флакончик. Дозы аэрозоля вводили при вертикальном расположении головки. Головку переворачивали на время от 30 секунд до 1 минуты после введения аэрозоля. Аэрозольный флакон вводил 100 мкл на одно распыление, и требовалось одно распыление для подачи дозы 50 мкг свободного основания дексмедетомидина (эквивалентной 59 мкг дексмедетомидина HC1). Аэрозольный флакон заполняли, используя пять пусковых распыляющих нажатий, в зоне, удаленной от дозированного введения, перед введением дозы для предотвращения возможной перекрестной контаминации. Кроме того, дозированное введение выполняли в зоне, удаленной от места взятия крови, для предотвращения возможной контаминации образцов крови аэрозольным испытываемым изделием.
Дозу 9 вводили, используя имеющийся в продаже назальный аэрозольный флакончик. Дозы аэрозоля вводили при вертикальном расположении головки. Головку переворачивали на время от 30 секунд до 1 минуты после введения аэрозоля. Аэрозольный флакон вводит 100 мкл на одно распыление, и требовалось одно распыление для подачи дозы 25 мкг свободного основания дексмедетомидина (эквивалентной 29,5 мкг дексмедетомидина HC1). Аэрозольный флакон заполняли, используя пять пусковых распыляющих нажатий, в зоне, удаленной от дозированного введения, перед введением дозы для предотвращения возможной перекрестной контаминации. Кроме того, дозированное введение выполняли в зоне, удаленной от места взятия крови, для предотвращения возможной контаминации образцов крови аэрозольным испытываемым изделием.
Дозу 10 вводили сублингвально микропипеткой. Дозировка составила 50 мкг свободного основания дексмедетомидина (эквивалентную 59 мкг дексмедетомидина HC1) в 100 мкл препаративной формы.
Для интраназальных введений препаративные формы вводили интраназально. После введения ноздри собаки перекрывали, и голову переворачивали приблизительно на 1 минуту. Интервал между каждым введением составлял минимум 2 дня для обеспечения возможности соответствующего периода выведения препарата из организма.
После дозированного введения получали образцы крови и тестировали на содержание DEX в плазме.
Пример 5: Фармакокинетика интраназально введенного дексмедетомидина у людей
Применяли четыре различные препаративные формы DEX. PRECEDEX® (Лечение A) в доза 25 мкг, которую вводили внутривенно в течение 10 минут, и 3 различные интраназальные дозировки или препаративные формы. Препаративная форма B (35 мкг, вводимые в 100 мкл в одну ноздрю 1 аэрозольным распылением); Препаративная форма C (общее количество 35 мкг, вводимое через 2 ноздри) и Препаративная форма D (17,5 мкг, вводимые в 50 мкл в одну ноздрю посредством одного аэрозольного распыления).
|
Наблюдавшаяся фармакокинетика показала удивительный результат, что введение дозы одним распылением аэрозоля в одну ноздрю (Лечение B) обеспечивало лучшую Cmax и более короткое Tmax, по сравнению с такой же общей дозой, введенной в две ноздри двумя аэрозольными распылениями (половина дозы, введенной в каждую ноздрю). Этот результат невозможно было прогнозировать, и он противоположен тому, который мог бы ожидать специалист в данной области, частично, вследствие сравнения площади поверхности. Средние величины концентрации, создаваемой Лечением B, достигали минимальной целевой концентрации (0,1 нг/мл) в пределах 20 минут после дозированного введения. Этот удивительный результат введения в одну ноздрю может содействовать более быстрому началу активности (например, облегчению боли) у целевых популяций пациентов. Скорость всасывания, наблюдавшаяся при Лечении B, была более быстрой, чем ранее изученных не внутривенных препаративных форм или путей введения. Это неожиданное более быстрое всасывание может обеспечить возможность более быстрого начала обезболивающих воздействий. Действительно, анальгетические эффекты могут начаться меньше чем через 20 минут. Величины концентрации в плазме, достигнутые при интраназальном введении 17,5 и 35 мкг, представлены на фиг. 1.
Дозированное введение
Здоровым добровольцам вводили выбранную дозу интраназально или при показаниях другим путем введения. Каждый раз введение проводили в одну ноздрю при закрытии пальцем другой ноздри. Брали пробы крови и, как указано, измеряли величины концентрации DEX.
Пример 6: I фаза двухпериодной, открытой, многодозовой оценки безопасности, переносимости и фармакокинетики интраназально вводимого дексмедетомидина у здоровых добровольцев
Первичной целью настоящего исследования была оценка фармакокинетического профиля множественных доз интраназально вводимого дексмедетомидина у здоровых мужчин и женщин. Вторичными конечными точками этого исследования были оценки безопасности и переносимости интраназально вводимого дексмедетомидина у здоровых добровольцев.
Методология
Это была I фаза открытого, двухпериодного исследования с введением повторных доз у здоровых субъектов для исследования безопасности, переносимости и фармакокинетики интраназально вводимого дексмедетомидина. Как и планировалось, в исследование были включены в общей сложности 12 субъектов (6 мужчин и 6 женщин). В пределах 28 дней перед введением исследуемого лекарственного средства проводили скрининг здоровых субъектов в возрасте от 18 до 50 лет включительно в отношении участия в одном участке исследования в США. Во время посещения для скрининга регистрировали медицинский анамнез, проводили физикальное обследование, исходное лабораторное тестирование, запись электрокардиограммы (ЭКГ) в 12 отведениях, тестирование на беременность, измерение жизненно важных показателей и получали информированное согласие на участие в исследовании.
Все исследуемые дозы составляли дозу 35 мкг DEX IΝ.01, вводимую в виде однократного распыления 100 мкг аэрозоля в левую ноздрю. DEX-IN.01 содержал 35 мкг дексмедетомидина в каждых 100 мкл раствора, а также эксципиенты, включающие: лимонную кислоту, цитрат натрия, хлорида натрия, фенилэтиловый спирт, динатрий ЭДТА и очищенную воду. При введении доз DEX-IN.01 использовали сопло, распыляющее 100 мкл аэрозоля, для введения в ноздрю в соответствии с назначенным лечением.
В течение 1-го периода субъекты получали две дозы исследуемого медикаментозного средства с интервалом шесть часов. В течение 2-го периода участники исследования получали семь доз исследуемого медикаментозного средства, вводимого через 6-часовые интервалы. Периоды исследования разделялись не меньше чем 24-часовыми интервалами между последней дозой в 1-ом периоде и первой дозой во 2-ом периоде.
В течение 1-го периода субъектов изолировали с вечера перед дозированным введением (День -1) до приблизительно 18 часов после Дозы 2 (День 2). В течение 2-го периода субъектов изолировали с вечера перед дозированным введением (День -1) до приблизительно 24 часов после последней исследуемые дозы (День 3). Во время изоляции субъекты получали стандартизированный дневной рацион питания.
Серийные пробы крови брали через определенные интервалы во время каждого периода исследования для оценки фармакокинетических свойств интраназально введенного дексмедетомидина и его метаболита. Цельную кровь собирали в очищенные пробирки для забора крови емкостью 6 мл, обработанные К2ЭДТА.
Образцы плазмы следовало забирать в пределах от ±2 минут запланированного времени после введения до 60 минут после введения; образцы, взятые с интервалом от 75 минут до 6 часов после введения можно было взять в пределах ±5 минут, и образцы, взятые через 12 часов и более, можно было взять в пределах ±15 минут запланированного времени после введения. Действительные точки времени следовало регистрировать для всех случаев, и требовалось, чтобы любое отклонение за пределы определенных диапазонов ясно документировалось в материалах исследования субъекта.
Сразу после забора каждого образца пробирку для забора крови следовало осторожно перевернуть и затем поместить во влажный лед. В пределах 30 минут после забора крови пробирки центрифугировали примерно при 2000 g в течение 10-15 минут для отделения клеток от плазмы. Не следовало использовать вспомогательные средства для разделения. Две аликвоты (>0,5 мл каждый) плазмы переносили из каждого образца чистыми пипетками и помещали в 2 полипропиленовые пробирки для хранения в эквивалентных объемах. Пробирки для хранения маркировали следующей информацией: номер протокола, номер субъекта, день исследования и относительное время взятия образца (например, Период 1, Доза 1, 10 Минут после введения), и подлежащая анализу биологическая матрица (например, плазма). В пределах 60 минут после забора пробирки для хранения следовало поместить в морозильную камеру при -20°C или ниже; они оставались в морозильной камере до транспортировки для анализа.
Для фармакокинетических анализов в период 1, до 12 образцов крови брали у каждого субъекта перед и после введения каждой исследуемой дозы. Их забирали в период перед введением (время 0) и в следующие приблизительные точки времени после каждой дозы медикаментозного средства исследования: 10, 20, 30, 45, 60 и 90 минут и 2 и 4 часа; дополнительные образцы крови забирали через 6, 12 и 18 часов после дозы 2. В период 2 забирали до 13 образцов крови у каждого субъекта перед и после введения дозы 1 и дозы 7. Их забирали в период перед введением (время 0) и в следующие приблизительные точки времени после каждой дозы медикаментозного средства исследования: 10, 20, 30, 45, 60 и 90 минут и 2 и 4 часа; дополнительные образцы крови брали через 6, 12, 18 и 24 часа после дозы 7. Образцы крови для доз со 2 по 6 брали только перед введением (время 0).
Сводная таблица посещений в рамках исследования и назначенные точки времени представлены ниже в таблице для всего исследования, период 1, период 2 дозы 1 и 7 и период 2 дозы с 2 по 6.
|
Критерии включения:
Субъекты соответствовали следующим критериям для участия в исследовании: 1) мужчина или женщина в возрасте от 18 до 50 включительно; 2) женщины детородного возраста должны или быть подвергнуты ранее хирургической стерилизации, использовать метод двухбарьерной контрацепции, практиковать воздержание (должны согласиться на использование метода двухбарьерной контрацепции в случае сексуальной активности) или использовать вставляемые, инъецируемые, трансдермальные или комбинированные пероральные контрацептивные средства, утвержденные FDA, вплоть до завершения исследования и иметь отрицательные результаты сывороточного теста на беременность, проведенного перед введением исследуемого медикаментозного средства, и иметь отрицательные результаты последующих мочевых тестов на беременность (женщины после менопаузы [не имеющие менструации в течение по меньшей мере 2 лет] также подлежали участию в исследовании); 3) иметь индекс массы тела (BMI) <32 кг/м2 и массу тела от 50 до 95 кг включительно и 4) быть в состоянии понимать процедуры исследования, дать согласие на участие в программе исследования и добровольно представить письменное информированное согласие.
Проводимые виды лечения
Участвовавший в исследовании персонал вводил все дозы исследуемого медикаментозного средства в соответствии со схемой лечения. Дозы дексмедетомидина вводили, используя устройство для интраназальной доставки, в левую ноздрю. Дозы вводили в предназначенную ноздрю при закрытии другой ноздри пальцем. Голову субъекта удерживали в вертикальном положении при аэрозольном аппликаторе, вставленном приблизительно на ½ʺ (1,27 см) в обрабатываемую ноздрю. Субъект производил вдох через обрабатываемую ноздрю при сжатии насоса, и производилась подача дозы препарата.
После введения исследуемого медикаментозного средства участникам разрешали передвигаться по клинике, где проводилось исследование и выполнять не требующие усилий действия. Исследователь мог потребовать, чтобы субъекты оставались в положении сидя в течение некоторого периода времени, если передвижение субъекта по участку проведения исследования без сопровождения участвующего в исследовании персонала считали небезопасным.
Дозы в последующем оценивали в однодозовом исследовании у здоровых добровольцев, где DEX-IN оценивали, используя одиночное и парное введение аэрозоля в дозах 17,5 и 35 мкг. На основании наблюдавшейся фармакокинетики, определили, что уровень дозы 35 мкг, введенной в одну ноздрю, был бы наиболее целесообразным для дальнейшего исследования с целью достижения целевых концентраций в плазме. Концентрации в плазме, достигнутые при интраназальных дозах 17,5 и 35 мкг, представлены на фиг. 1.
Шкала седативного действия Рамсея
Исследователь или назначенный уполномоченный использовал шкалу седативного действия Рамсея для оценки степени седативного действия у каждого субъекта. Для каждого субъекта в каждую точку времени степень седативного действия оценивали в соответствии с категориями рейтинга по Рамсею. Оценку по шкале седативного действия Рамсея выполняли перед введением (время 0) и через 30, 60 и 90 минут после каждой исследуемой дозы. Все балльные оценки возвратились к их исходному уровню (балльной оценке 2) в пределах шести часов после введения. Хотя в ходе исследования двум субъектам была присвоена балльная оценка 5 по RSS, большинство субъектов не испытывали значимого седативного действия. Субъектам вводили исследуемые дозы через каждые шесть часов и для семи доз в течение периода 2 после каждой дозы круглые сутки проводили полный объем мероприятий мониторинга безопасности; искажающее действие данной схемы в этой оценке инструмента/результатов не проводили.
Критерии оценки:
Фармакокинетические параметры для различных концентраций дексмедетомидина и его основного метаболита (ORM-14305) в плазме рассчитывали для дозы 1 и 2 в течение периода 1 и для дозы 1 и 7 в течение периода 2. Рассчитанные параметры включали пиковую (максимальную) наблюдавшуюся концентрацию лекарственного средства (Cmax), время до достижения Cmax (Tmax), площадь под кривой концентрация-время (AUC) со времени 0 до времени взятия последней пробы (t) с количественно определяемой концентрацией лекарственного средства в плазме (AUC0-t), AUC от времени 0 до 6 часов после введения (AUC0-6), AUC от времени 0 до бесконечности (AUC0-∞ для периода 1 дозы 2 и периода 2 дозы 7) и период полувыведения для конечной фазы (t½, для периода 1 дозы 2 и периода 2 дозы 7).
Результаты:
Наблюдавшиеся фармакокинетические параметры Cmax, Tmax и AUC0-6 дексмедетомидина представлены ниже в таблице.
|
|
|
|
|
|
Это исследование подтвердило безопасность и переносимость повторных доз при интраназальном введении. При введении с интервалом шесть часов между дозами было мало свидетельств накопления дексмедетомидина, по сравнению с AUC для доз от 1 до 7. Было продемонстрировано, что DEX-IN.01 был хорошо переносимым после повторного введения до семи доз, введенных с интервалом шесть часов. Не было видимого увеличения побочных явлений, изменений жизненно важных признаков или тяжести раздражения слизистой носовой полости при повторном введении. При введении в виде начальной дозы 35 мкг DEX-IN.01 достигал пиковых концентраций в плазме через 1,01-1,26 часа (медиана) при средней Cmax 0,09-0,12 нг/мл. В различные точки времени в ходе исследования у субъектов не наблюдали значимое седативное действие.
Пример 7: Рандомизированная, двойная слепая, плацебо-контролируемая, трехпериодная перекрестная оценка эффективности, безопасности и фармакокинетики интраназально вводимого дексмедетомидина у субъектов с хронической болью в поясничной области
Исследование выполняли для оценки эффективности, безопасности и фармакокинетики двух уровней доз интраназально вводимого дексмедетомидина (DEX-IN.02 и DEX-IN.03), по сравнению с плацебо, у субъектов с хронической болью в поясничной области.
Методы: Участию в исследовании подлежали взрослые субъекты с симптомами хронической боли в поясничной области в течение более чем трех месяцев и исходной 24-часовой интенсивностью боли ≥4 (по шкале 0-10). Субъектов методом случайной выборки включали в группы лечения последовательным введением DEX-IN.02 (50 мкг; 50 мкг/100 мкл), DEX-IN.03 (25 мкг; 25 мкг/50 мкл) и подобранного плацебо. Исследуемые дозы вводили в виде интраназального аэрозоля с использованием однодозового распылительного устройства, не требовавшего заполнения. Дозы вводили в одну ноздрю. Дозирующие устройства заполняли соответствующим объемом раствора лекарственного средства для доставки предназначенной дозы 25 или 50 мкг дексмедетомидина. Исследуемые дозы вводили в последовательные дни с периодом очистки минимум 24 часа между дозами. Субъектам, получавшим исходную постоянную обезболивающую терапию, позволяли продолжать выполнение их схемы лечения в течение всего исследования, но дозы анальгетических средств не должны были вводиться в пределах 2 часов после исследуемого лечения (за исключением случаев, когда требовалась неотложная обезболивающая терапия). Неотложная анальгезия была доступна по требованию субъекта в соответствии с исходной схемой обезболивающей терапии субъекта.
Оценки эффективности включали показатели интенсивности боли (PI), облегчения боли (PR) и общей эффективности медикаментозного лечения (GMP). Показатели эффективности использовали для расчета различия интенсивности боли (PID), суммированного различия интенсивности боли (SPID) и общего облегчение боли (TOTPAR) в множественные точки времени после введения, и для определения числа субъектов с частичными или полными ответами на лечение. Оценки безопасности включали сбор данных о жизненно важных показателях, оценку симптомов, связанных с носовой полостью, седативного действия и побочных явлений. Образцы плазмы брали через определенные интервалы в течение первых 12 часов после введения для фармакокинетического анализа.
Результаты: 24 субъекта были включены в исследование и получали лечение DEX-IN.02, DEX-IN.03 и плацебо; все включенные в исследование субъекты получили полный набор всех предусмотренных схемой лечения доз. Субъекты представляли собой главным образом представителей белой расы (91,7%) и мужчин (58,3%) при среднем возрасте 33,7±10,19 лет. У субъектов была главным образом висцеральная боль (91,7%) при средней длительности болевых симптомов в анамнезе 6,75±6,85 лет. Одна треть субъектов применяла опиоидные анальгетики по поводу имеющихся у них болевых симптомов.
Среднее улучшение величин PID у субъектов было значимо бόльшим для дозы 50 мкг (DEX-IN.02), по сравнению с плацебо, начиная с 45 минут, и до 2 часов после введения (45 мин: 2,2 в сравнении с 1,2, p=0,0291; 1 ч: 2,2 в сравнении с 0,8, p=0,0082; 1,5 ч: 2,2 в сравнении с 0,7, p=0,0028; 2 ч: 2 в сравнении с 0,9, p=0,0126). Средняя величина SPID была значимо больше для дозы 50 мкг, чем для плацебо, через 60 минут после введения (7,1 в сравнении с 3,6; p=0,0352). Среднее TOTPAR было значимо выше для дозы 50 мкг, чем для плацебо и через 45, и через 60 минут после введения (4,3 в сравнении с 2,5; p=0,0298 и 6,2 в сравнении с 3,3; p=0,0097, соответственно). Результаты исследования показаны в следующих таблицах.
|
|
|
Средние балльные оценки GMP были сходны среди всех 3 групп лечения в течение и в 30-, и 60-минутную точки времени после дозированного введения. У группы, получавшей лечение 50 мкг дексмедетомидина, было больше субъектов с улучшением ≥33% и ≥50% во все точки времени через 15 минут после дозированного введения; 11 субъектов, получавших лечение DEX-IN.02, сообщили об улучшении ≥50% через 90 минут (95% CI, 1,02-7,44), и 10 субъектов через 2 часа (95% CI, 1,05-10,63), по сравнению с 4 субъектами через 90 минут и 3 субъектами через 2 часа в группе плацебо. Ни один субъект в любой из групп лечения не потребовал экстренных медикаментозных вмешательств.
Побочные реакции были в целом легкими у субъектов, получавших лечение DEX-IN, причем 5 явлений были определены как имевшие умеренную степень тяжести (2 случая снижения артериального давления, 1 случай головокружения, 1 случай сонливости и 1 случай гипотензии). Во время проведения исследования не возникали случаи SAE (тяжелых побочных явлений), смерти или отмены лечения вследствие побочных явлений. Изменения систолического и диастолического артериального давления (SBP и DBP, соответственно) были более выраженными у субъектов, получавших лечение DEX-IN.02, чем у субъектов, получавших лечение DEX-IN.03 и плацебо. Изменения частоты сердечных сокращений (HR) были сходны после введения DEX-IN.03 и плацебо, тогда как у субъектов, получавших лечение DEX-IN.02, было большее уменьшение частоты сердечных сокращений; самое большое изменение среднего процентного изменения частоты сердечных сокращений ниже исходного уровня составило -1% для плацебо и -9% для DEX-IN.02, тогда как величины средней частоты сердечных сокращений для DEX-IN.03 никогда не уменьшались ниже исходного уровня. Результаты оценки состояния носовой полости в отношении раздражения слизистой оболочки носовой полости были сходны среди всех групп лечения во все точки времени. Причем средняя балльная оценка не превышала 1 у субъектов, получавших лечение DEX-IN.02, через один час после дозированного введения (шкала 0-10). У субъектов в группе лечения DEX-IN.02 были самые высокие величины по Стэнфордской шкале сонливости через 60 минут после дозированного введения, причем 17 субъектов сообщили о балльной оценке ≥5.
Одна доза DEX-IN.03 (25 мкг) обеспечивала среднюю Cmax 0,11 нг/мл при медиане Tmax 0,75 часа, тогда как DEX-IN.02 (50 мкг) обеспечивала Cmax 0,25 нг/мл при медиане Tmax 0,51 часа. В следующих таблицах суммируются эти результаты.
|
|
Это исследование показывает, что интраназальный путь представляет собой жизнеспособное неинвазивное средство введения дексмедетомидина. Дозированное введение DEX-IN.02 и DEX-IN.03 давало более быстрое всасывание с более высокими пиковыми концентрациями дексмедетомидина в плазме, чем ранее исследованные препаративные формы. Анализ величин SPID и TOTPAR демонстрирует значимый обезболивающий эффект дозы 50 мкг интраназального дексмедетомидина, по сравнению с дозой 25 мкг или плацебо у субъектов с CLBP (хронической болью в поясничной области), начиная с 45 минут после дозированного введения. В целом, DEX-IN был хорошо переносим; отмеченные побочные явления были в целом легкими по степени тяжести, в то время как тяжелые побочные явления не были отмечены.