СПОСОБ ЧРЕСКОЖНОЙ ДОСТАВКИ ПРОНИКАЮЩИХ ВЕЩЕСТВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к чрескожной доставке лекарственных средств в организм или к чрескожному взятию аналита из организма. В частности, объектом настоящего изобретения является доставка лекарственного средства или взятие аналита через отверстие доставки в оболочке организма.
Уровень техники изобретения
Кожа представляет самую большую, самую доступную биологическую оболочку, через которую можно брать аналит или доставлять лекарственное средство. Слизистая и защечная оболочки представляют собой подходящие, но менее доступные области для отбора и доставки. К сожалению, кожа и, в несколько меньшей степени, слизистая и защечная оболочки высокоустойчивы к переносу веществ сквозь них. Кожа обычно состоит из двух основных частей: эпидермиса и дермы. Эпидермис образует наружную часть кожи и, сам по себе, состоит из нескольких различных слоев. Наружный слой эпидермиса, роговой слой, состоит из лишенных ядра ороговевших светлых мертвых клеток, и его толщина обычно составляет 10-30 микрон.
В основном, роговой слой отвечает за хорошо известные барьерные свойства кожи. Следовательно, именно этот слой представляет наиболее серьезный барьер для чрескожного потока лекарственных средств или других молекул в организм и аналитов из организма. Роговой слой, представляющий собой наружный ороговевший слой кожи, является сложной структурой из плотных ороговевших клеток, разделенных межклеточными липидными областями. По сравнению со слизистой оболочкой полости рта или желудка роговой слой значительно менее проницаем для молекул либо наружу, либо внутрь организма. Роговой слой образован из кератиноцитов, составляющих большую часть клеток эпидермиса, которые лишаются своих ядер и становятся корнеоцитами. Эти мертвые клетки затем образуют роговой слой, который представляет собой очень прочную водонепроницаемую оболочку, которая защищает организм от инвазии внешних веществ и от миграции снаружи жидкостей и растворенных молекул. Роговой слой непрерывно обновляется, отслаивая корнеоциты во время слущивания и образования новых корнеоцитов в процессе ороговения.
Формирование микропор или отверстий доставки в роговом слое для улучшения доставки лекарств было предметом различных исследований и, в результате, были выданы патенты на такие методики.
В работе Paranjape et al., “A PDMS dermal patch for non-intrusive transdermal glucose sensing” (Sensors and Actuators, May 2003, 195-204) описывается полидиметилсилоксановый (PDMS) аппликатор для осуществления контролируемого и неинвазивного мониторинга уровней глюкозы. PDMS-аппликатор применяется вместе с системой формирования микропор для раскрытия микропор в роговом слое пациента. Микропоры формируются разрушение ткани кожи с помощью микронагревателей, встроенных на стороне аппликатора, контактирующей с кожей. После этого контроль уровней глюкозы осуществляют с помощью аппликатора.
В патенте США № 5165418, Tankovich, описан способ получения образцов крови облучением кожи человека или животного одним или несколькими импульсами лазера достаточной энергии для испарения из ткани кожи и, тем самым, получения в коже отверстия, распространяющегося через эпидермис, и разрыва по меньшей мере одного кровеносного сосуда, вызывая вытеснение через отверстие такого количества крови, которое можно было бы собрать. Таким образом, патент № 5165418 Tankovich не отвечает требованиям неинвазивного или минимального инвазивного придания проницаемости роговому слою для доставки лекарственного средства в организм или для анализа аналита из организма.
В патенте США № 5423803 Tankovich описан способ лазерного удаления поверхностных эпидермальных кожных клеток на коже человека для косметических применений. Способ предусматривает нанесение светопоглощающих контаминантов на внешние слои эпидермиса и вдавливание некоторого количества этих контаминантов в межклеточные пространства рогового слоя и облучение инфильтрированной кожи импульсами лазерного света интенсивности, достаточной для того, чтобы количество энергии, поглощенной контаминантами, вызывало взрыв контаминантов с энергией, достаточной для отрыва некоторых эпидермальных кожных клеток. В патенте № 5423803 Tankovich, кроме того, сообщается, что необходим высокий коэффициент поглощения энергии контаминантами на длине волны лазерного излучения, что пучок лазерного излучения должен быть импульсным с продолжительностью импульса короче 1 микросекунды, что контаминант должен быть вдавлен в верхние слои эпидермиса, и что контаминант должен взрываться с энергией, достаточной для отрыва эпидермальных клеток после поглощения лазерной энергии. В этом изобретении не рассматривается и не предлагается способ доставки лекарственного средства или взятия аналита.
В публикации WO 92/00106, Raven et al., содержится описание способа селективного удаления нездоровой ткани из организма путем введения в выбранную ткань соединения, которое высокоэффективно поглощает инфракрасное излучение с длиной волны 750-860 нм, и облучением этой области соответствующим инфракрасным излучением с мощностью, достаточной для того, чтобы вызвать термическое испарение ткани, в которую введено соединение, но недостаточной для того, чтобы вызвать испарение ткани, в которую соединение не введено. Поглощающее вещество должно быть растворимым в воде или сыворотке, таким, как индоцианин зеленый, хлорофилл, порфирины, гемосодержащие соединения или соединения, содержащие полиеновую структуру, и уровни мощности которого должны быть в диапазоне 50-1000 Вт/см2 или еще выше.
Konig et al., в DD 259351 предлагает способ термической обработки опухолевой ткани, который предусматривает введение в опухолевую ткань среды, которая поглощает излучение в красном и/или ближнем инфракрасном спектральном диапазоне, и облучение инфильтрованной ткани лазерным излучением с соответствующей длиной волны. Поглощающие среды могут включать в себя метиленовый синий, восстановленный порфирин или его агрегаты и фталоцианиновый синий краситель. В качестве примера можно привести метиленовый синий, который высокоэффективно поглощает излучение при длине волны 600-700 нм, и криптоновый лазер, излучающий на 647 и 676 нм. Уровень мощности должен быть не меньше 200 мВт/см2.
Первые прототипы системы для формирования микропор показали прекрасные результаты для создания отверстий доставки в выбранных биологических оболочках, например, в коже, для обеспечения эффективной доставки проникающих веществ в организм индивидуума. Однако все еще остается потребность в количественном и более точном описании оптимальных отверстий доставки в биологической оболочке. В частности, существует потребность в разработке способа для единообразного измерения глубины и морфологии отверстия доставки для оптимизации применения системы формирования микропор при доставке терапевтически активных веществ и извлечении аналитов из организма для анализа.
Хотя многие из первых прототипов систем формирования микропор обеспечивают доставку проникающих соединений через биологическую оболочку, предпочтительный метод доставки многих этих соединений остается чрескожным, путем инъекции, с использованием полой иглы, присоединенной к шприцу. Другими словами, большой процент современных проникающих веществ вводят пациенту через кожу иглой для подкожных инъекций, которая прокалывает кожу и затем доставляет жидкую разовую дозу лекарственного препарата. Таким образом, существует также потребность в способе чрескожной доставки этих видов проникающих веществ пациенту, при этом профиль сывороточной концентрации проникающего вещества в организм, при доставке системой формирования микропор, должен воспроизводить профиль проникающего вещества, доставляемого через иглу для подкожных инъекций.
Сущность изобретения
Объектом настоящего изобретения является способ доставки проникающих веществ через биологическую оболочку животного, предусматривающий формирование по меньшей мере одного отверстия доставки в оболочке, где по меньшей мере одно отверстие доставки имеет среднюю глубину отверстия в диапазоне от приблизительно 40 до приблизительно 90 микрон.
Объектом настоящего изобретения также является способ доставки лекарственных средств через кожу в биологическую оболочку животного, где способ предусматривает формирование множества отверстий доставки сквозь оболочку, где указанные отверстия доставки характеризуются распределением, дающим в результате кривую нормального распределения Гаусса, и указанные отверстия доставки имеют среднюю глубину отверстия в диапазоне от приблизительно 40 до приблизительно 90 микрон.
Объектом настоящего изобретения также является способ оценки эффективности устройства для формирования микропор, предусматривающий следующие стадии: формирование по меньшей мере одного отверстия доставки в биологической оболочке млекопитающего, используя указанное устройство для формирования микропор, доставку проникающего вещества через область оболочки с указанным по меньшей мере одним отверстием доставки, измерение стационарной сывороточной концентрации для указанного проникающего вещества, измерение трансэпидермальной потери влаги через оболочку млекопитающего и сравнение результатов указанных измерений с известными значениями для каждого, обеспечивающего желаемые результаты.
Более того, объектом настоящего изобретения является способ оценки эффективности устройства формирования микропор, предусматривающий следующие стадии: формирование множества отверстий доставки в биологической оболочке млекопитающего, используя указанное устройство для формирования микропор, доставку проникающего вещества через область оболочки с указанным по меньшей мере одним отверстием доставки, измерение стационарной сывороточной концентрации для указанного проникающего вещества, измерение трансэпидермальной потери влаги через оболочку млекопитающего, и сравнение результатов указанных измерений с известными значениями для каждого, обеспечивающего желаемые результаты, где указанное множество отверстий имеет распределение, дающее в результате кривую распределения Гаусса, и указанное множество отверстий доставки характеризуется средней глубиной отверстия в диапазоне от приблизительно 40 до приблизительно 90 микрон.
Краткое описание чертежей
На фигуре 1 представлена ручная фокусировка глубины отверстий доставки, полученных плоскостной формирующей поры матрицей, и отверстий доставки, полученных пошаговым мультиплицированием с шагом 80 микрон.
На фигуре 2 показана глубина группы отверстий доставки, выполненных двумя разными операторами.
На фигуре 3 показано распределение глубин отверстий доставки, полученных системой формирования микропор с пошаговым мультиплицированием.
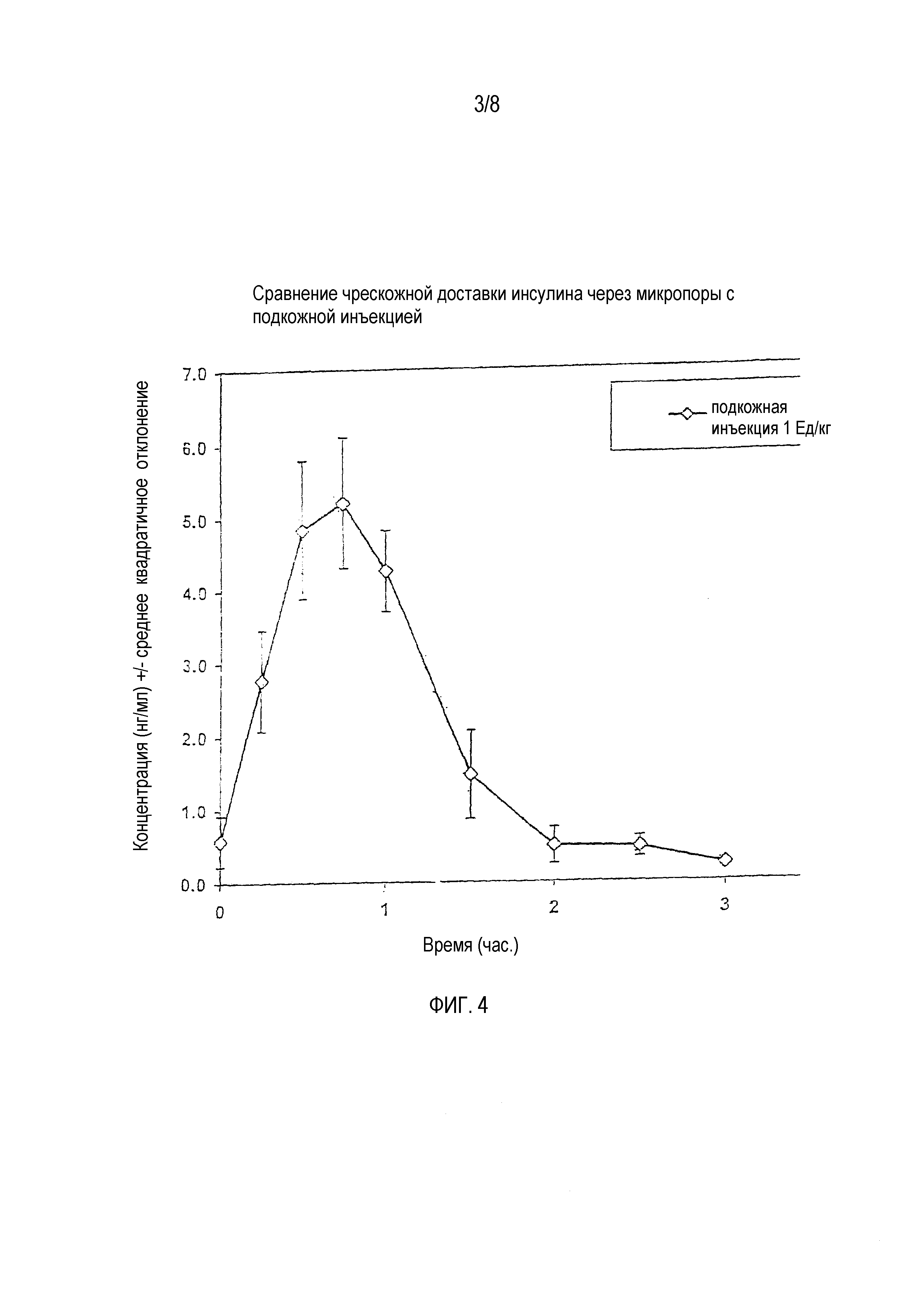
На фигуре 4 показан профиль сывороточной концентрации инсулина при подкожной доставке инсулина.
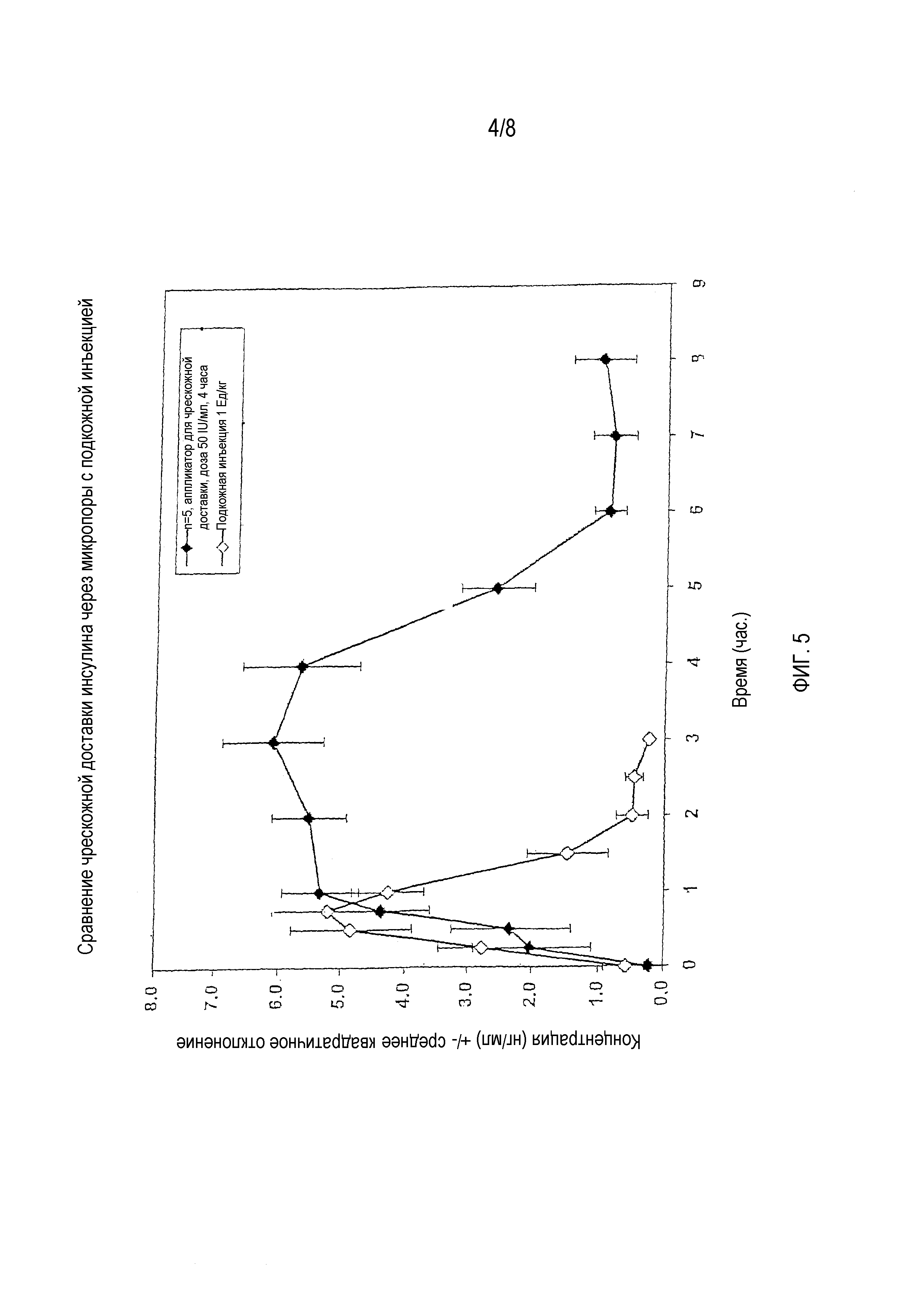
На фигуре 5 показан профиль сывороточной концентрации инсулина при чрескожной доставке дозы 50 IU/мл инсулина после формирования микропор в оболочке.
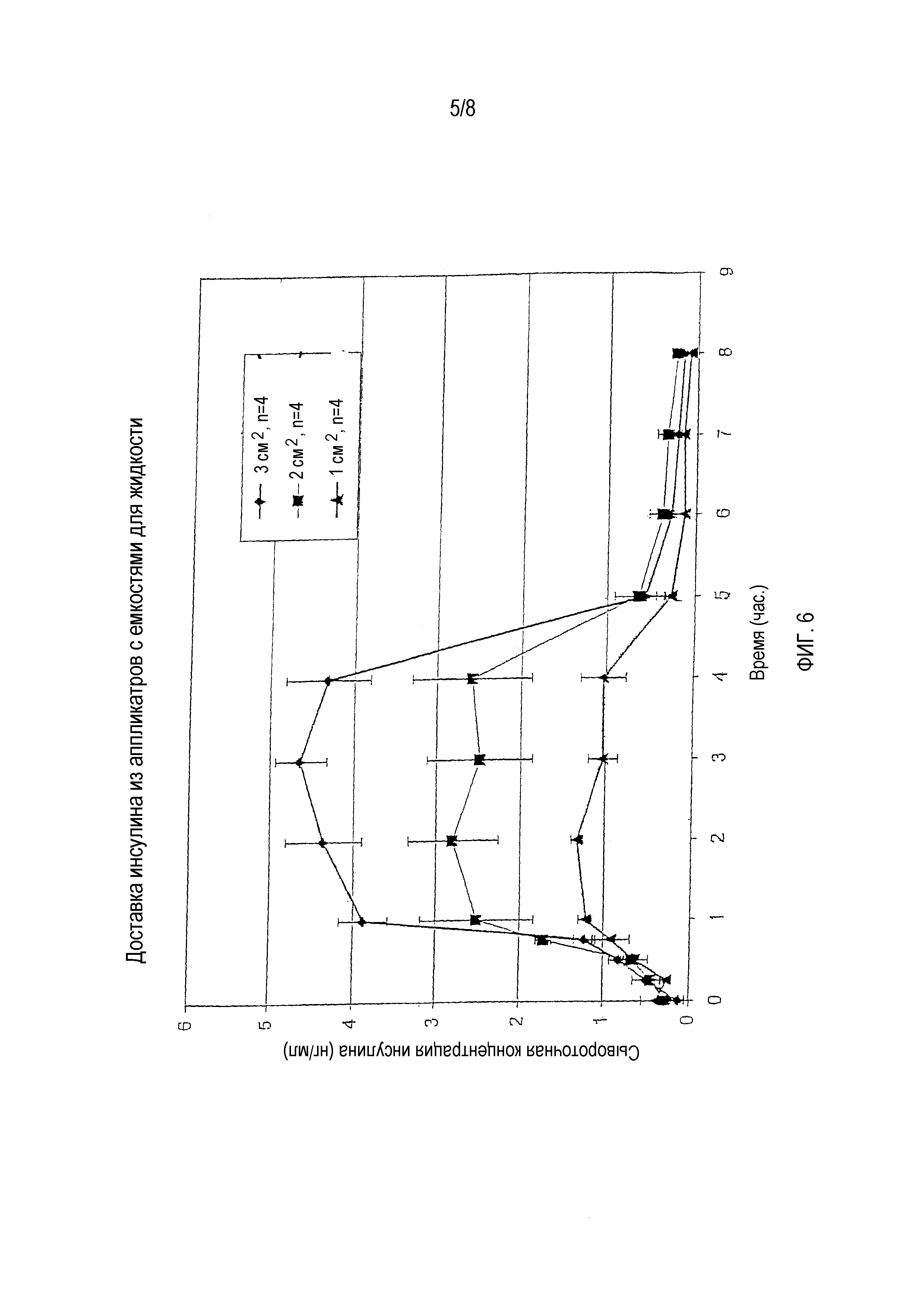
На фигуре 6 показан профиль сывороточной концентрации инсулина при чрескожной доставке доз 50 IU/мл с использованием аппликаторов для чрескожной доставки разных размеров.
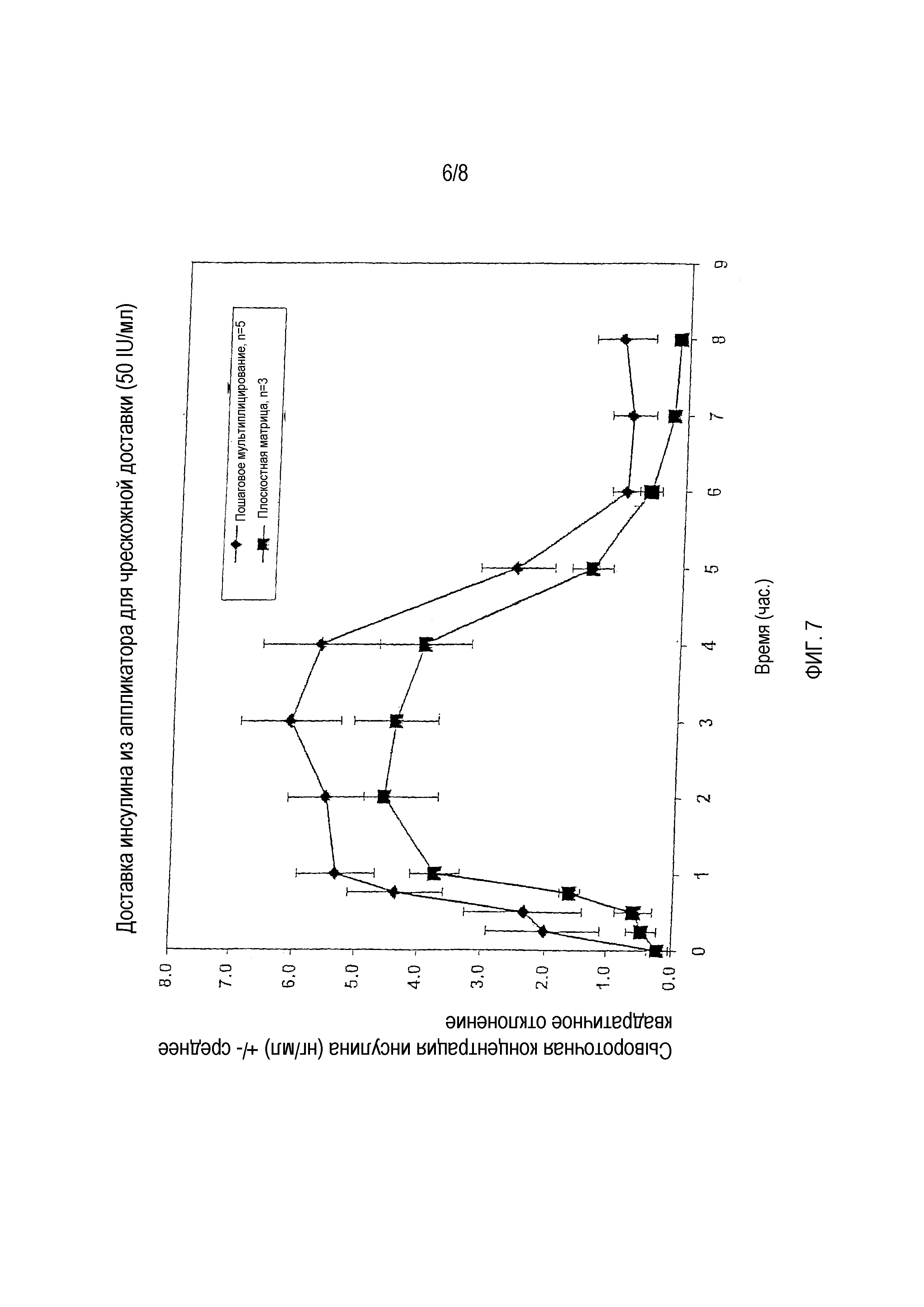
На фигуре 7 показан профиль сывороточной концентрации инсулина при чрескожной доставке дозы 50 IU/мл инсулина после формирования микропор с использованием первого опытного прототипа системы формирования микропор и системы формирования микропор второго поколения.
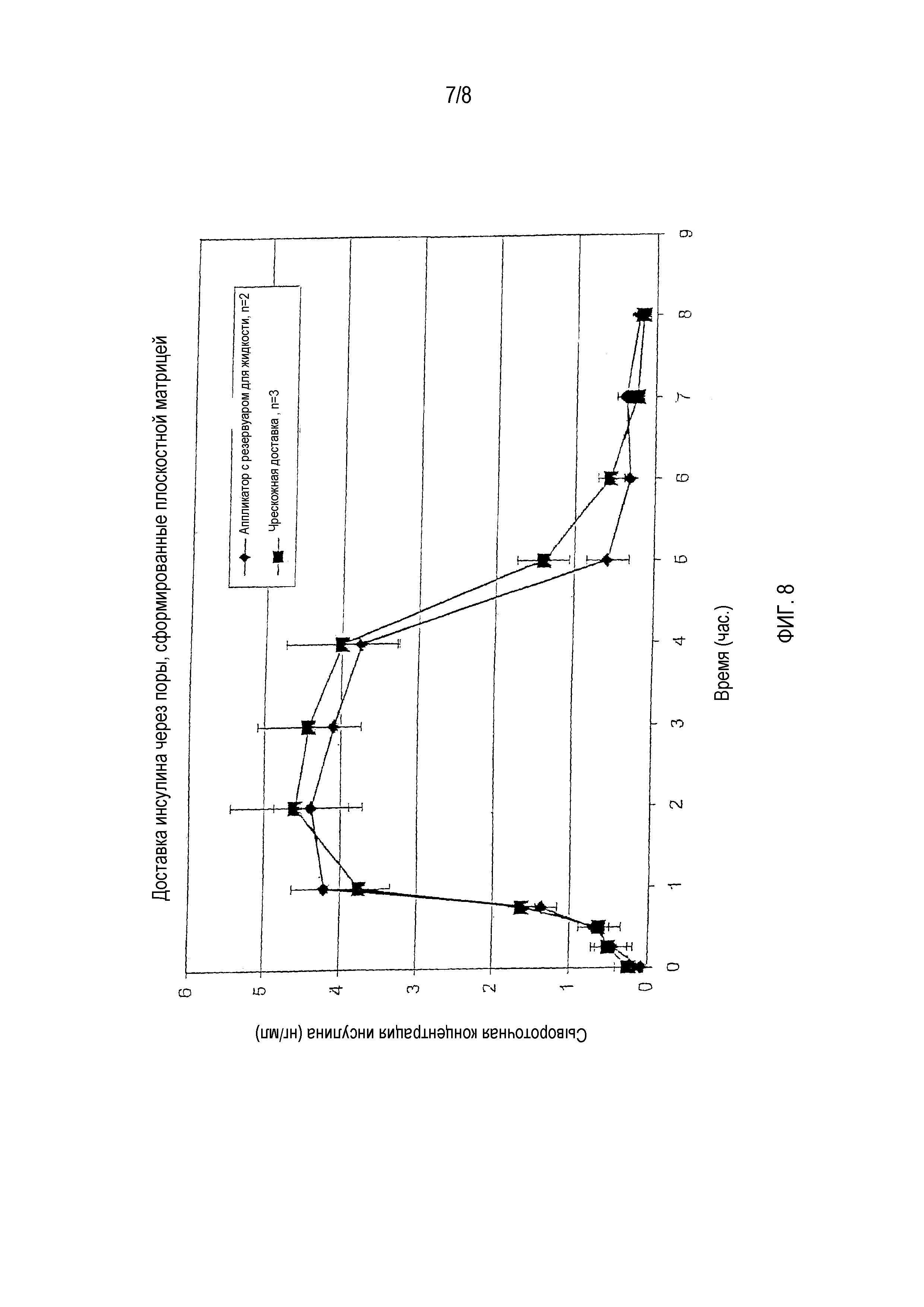
На фигуре 8 показан профиль сывороточной концентрации инсулина при доставке инсулина с использованием разных аппликаторов для чрескожной доставки.
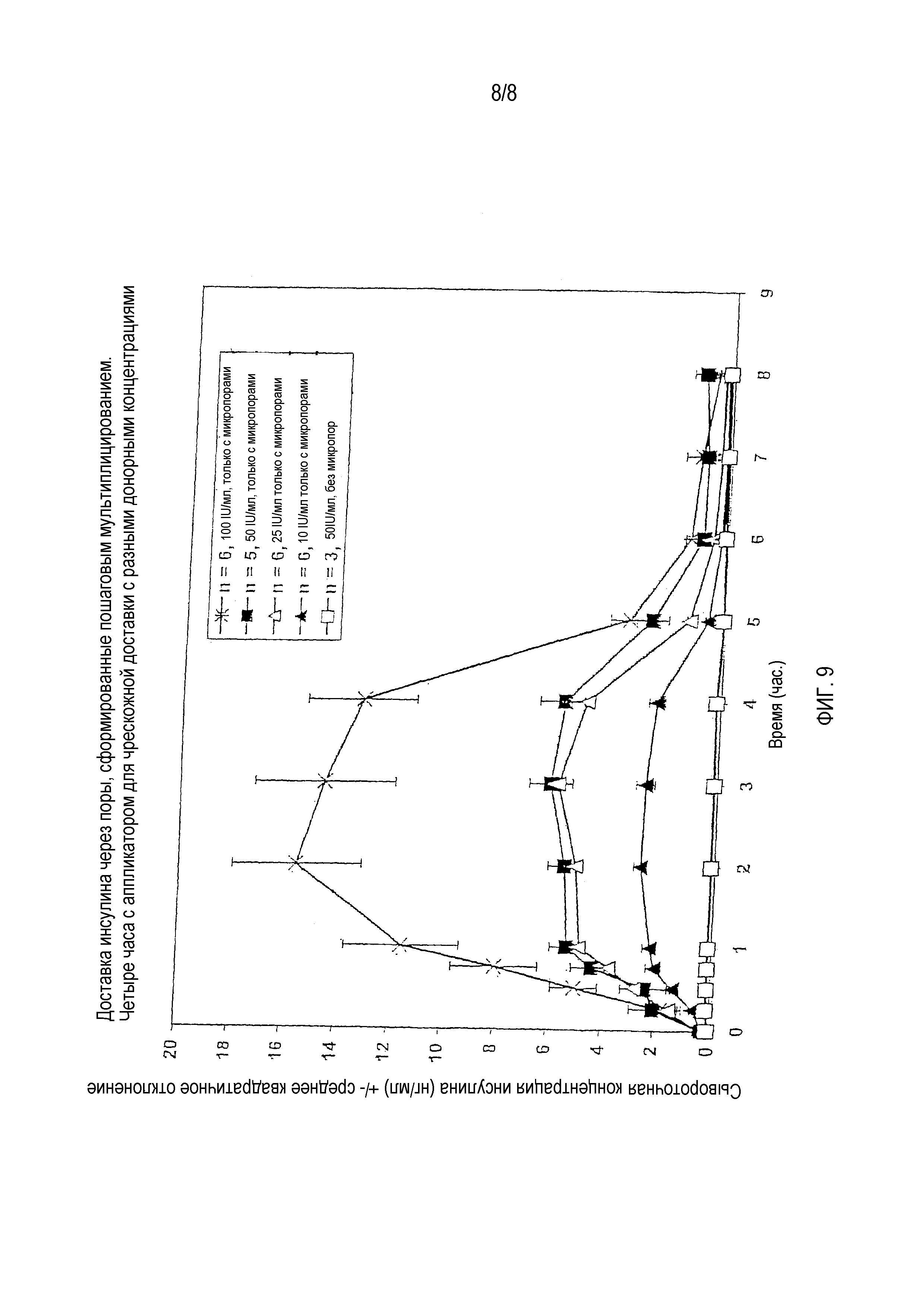
На фигуре 9 показан профиль сывороточной концентрации инсулина при доставке инсулина с использованием разных концентраций доз.
Подробное описание
Следует упомянуть, что, в целях настоящего описания и прилагаемой формулы изобретения упоминания в единственном числе подразумевают также и множественное число, если из контекста явно не следует иное. Поэтому, например, указание «лекарственное средство» включает в себя ссылку на смесь из двух или нескольких лекарственных средств, или ссылка «аналит» включает ссылку на смесь из двух или более аналитов. Эти примеры носят иллюстративный характер и не подразумевают никаких ограничений в отношении описания.
Как используется в настоящем описании, термин «чрескожный» или «чрескожно» обозначает прохождение проникающего вещества в и сквозь биологическую оболочку для обеспечения эффективного терапевтического уровня проникающего вещества в крови или локального уровня в ткани проникающего вещества, или выход молекул или жидкости организма («аналита») сквозь биологическую оболочку для сбора молекул аналита вне организма.
Как используется в настоящем описании, термин «кривая распределения Гаусса» или «кривая нормального распределения» обозначает функцию распределения вероятности, описывающую относительную частоту появления некоторой величины, например, средней глубины микропор или отверстия доставки. Это распределение не обязательно должно быть симметричным, Гауссовым, типа бета-распределения или любым конкретным, математически точно заданным распределением. Это распределение может быть описано гистограммой, показывающей ступенчатые скачки из одного диапазона в другой и, в зависимости от представления, может даже проявлять мультимодальный характер.
Термин «минимально инвазивный», как используется здесь, относится к методикам, согласно которым в биологическую оболочку или ткань внедряются посредством формирования небольших отверстий, пор или отверстий в поверхности ткани или оболочки, но с несущественным повреждением подлежащих не поверхностных участков ткани или оболочки.
Как используется здесь, термин «OPTO» относится к параметрической настройке системы управления, которая подает программируемые токовые импульсы в плоскостную формирующую поры матрицу. В частности, значение OPTO является численной величиной в диапазоне от 0 до 3000, при этом, чем больше число OPTO, тем выше максимальная температура, которую создают формирующие поры нити при конкретном импульсе. Число OPTO получают от кремниевого фотоприемника, который размещен в интерфейсе сопряжения блока управления с плоскостной матрицей, так что указанный фотоприемник отображает обратную сторону матрицы формирующих поры нитей. После включения, когда нити начинают нагреваться, в определенный момент нитями придается достаточная энергетическая светимость для детекции и количественного измерения излучаемой энергии кремниевым фотоприемником, который вырабатывает электрический выходной сигнал, пропорциональный температуре нитей в поле обзора этого фотоприемника. Величина сигнала служит входным сигналом для системы управления с замкнутой обратной связью, в которой, после достижения значения OPTO, заданного параметром настройки, цепь управления затем поддерживает это значение активным модулированием тока, подаваемого в матрицу, чем поддерживает постоянное значение максимальной температуры на протяжении программируемой продолжительности импульса. Другими словами, настройка OPTO на 100 приведет к повышению температуры формирующих поры нитей и поддерживанию на уровне выше настройки 25 значения OPTO, независимо от значения программируемой продолжительности импульса.
Как используется в описании изобретения, термин «неинвазивный» относится к методикам, не требующим ввода иглы, катетера или другого инвазивного инструмента в организм.
Термин «отверстие доставки» относится к удалению участка биологической оболочки животного для ослабления барьерных свойств биологической оболочки, что позволяет облегчить прохождение лекарств и/или аналитов сквозь биологическую оболочку. Если биологической оболочкой является кожа, то отверстие доставки создают удалением клеток в роговом слое в заданной оболочке кожи. Предпочтительно, отверстие доставки будет не более чем приблизительно 1 мм в диаметре и, еще более предпочтительно, не более, чем приблизительно 100 микрон в диаметре и будет проходить через роговой слой на достаточную глубину для нарушения барьерных свойств. В настоящем описании термин «отверстие доставки» является синонимом терминов «пора», «микропора», «отверстие» и «небольшое отверстие».
Термин «биологическая оболочка» обозначает оболочку, которая присутствует в живом организме, предпочтительно, в организме животного, более предпочтительно, в организме человека, и которая отделяют одну область организма от другой. Во многих случаях биологическая оболочка разделяет организм от его внешнего окружения или внешней среды. Не ограничивающими примерами биологических оболочек являются кожа и слизистые оболочки человека.
В настоящем описании термины «глубина отверстия» или «глубина отверстия доставки» обозначают глубину отверстия доставки, сформированного в биологической оболочке. Глубина отверстия определяется как расстояние от верхней поверхности биологической оболочки до нижней границы отверстия доставки. Ниже приведено определение дополнительного значения термина «глубина отверстия».
Термин «средняя глубина отверстия» относится к средней или усредненной глубине отверстия доставки, когда выполняют более одного измерения глубины отверстия доставки. Например, глубину отверстия могут измерять более одного человека, один человек может измерять глубину отверстия более одного раза, или измерение глубины может быть выполнено более чем одной области в пределах отверстия доставки. В приведенных случаях результаты разных измерений отверстия доставки будут усредняться с получением средней глубины отверстия.
Кроме того, термин «средняя глубина отверстия» относится к случаю, когда в биологической оболочке выполнено множество отверстий доставки. Глубину каждого отверстия доставки измеряют и затем рассчитывают среднее значение глубины, предоставляя специалисту в данной области информацию о средней глубине отверстия.
Как используется в настоящем описании, термин «разрушение» относится к процессу удаления ткани оболочки, предпочтительно, ткани кожи с применением нагревательного элемента, где температура нагревательного элемента испаряет ткань оболочки.
В настоящем описании термин «проникающее вещество» обозначает любой химический или биологический материал или соединение, подходящие для прохождения сквозь биологическую оболочку млекопитающего. В предпочтительном варианте термин «проникающее вещество» относится к лечебному агенту, вводимому млекопитающему. Не ограничивающими примерами таких проникающих веществ являются инсулин, гидроморфин, вакцины и тому подобное.
Объектом настоящего изобретения является способ чрескожной доставки лекарственных средств животному, предусматривающий формирование по меньшей мере одного отверстия доставки в оболочке животного, при этом по меньшей мере одно отверстие имеет среднюю глубину отверстия приблизительно 40-90 микрон. Предпочтительно, средняя глубина отверстия находится в диапазоне от приблизительно 50 до приблизительно 70 микрон. Более предпочтительно, средняя глубина отверстия находится в диапазоне от приблизительно 55 до приблизительно 65 микрон. Еще более предпочтительно, средняя глубина отверстия составляет приблизительно 60 микрон. Несмотря на вышеприведенные предпочтительные выбранные средние глубины отверстий, в каждом выбранном случае применения доставки конкретного проникающего вещества на более оптимальную выбранную среднюю глубину отверстия можно определить экспериментально измерением желаемой средней интенсивности потока проникающего вещества через каждое отверстие доставки в организм и затем сравнением полученных результатов с заданной желаемой интенсивностью потока и с результатами измерения средней глубины пор и трансэпидермальной потери влаги поверхностью кожи с полученными на ней порами.
Способ по настоящему изобретению предусматривает стадию формирования по меньшей мере одного отверстия доставки в оболочке животного. Предпочтительно, в коже животного формируют по меньшей мере одно отверстие доставки. В настоящем описании термин «животное» обозначает любое млекопитающее, и этот термин охватывает, без ограничения, любое млекопитающее, например, мышей, крыс, морских свинок, кошек, собак, коров, лошадей, овец или другой домашний скот, людей. Термины «животное» и «млекопитающее» используются в настоящем описании взаимозаменяемо. Термин «животное» предпочтительно относится к человеку.
Кроме того, в объеме настоящего изобретения предлагается способ доставки лекарственных средств животному, предусматривающий формирование множества отверстий доставки в оболочке животного, причем, большинство из отверстий доставки имеет среднюю глубину отверстия в диапазоне от приблизительно 40 до приблизительно 90 микрон. Предпочтительно, около 75% отверстий доставки имеет среднюю глубину отверстий в диапазоне от приблизительно 50 до приблизительно 70 микрон. Более предпочтительно, около 75% отверстий доставки имеет среднюю глубину отверстий в диапазоне от приблизительно 55 до приблизительно 65 микрон.
В настоящем описании термин «большинство» обозначает более половины отверстий доставки, сформированных в оболочке. Предпочтительно, большинство обозначает 60%-80% отверстий доставки, сформированных в оболочке. Более предпочтительно, термин «большинство» обозначает около 75% отверстий доставки, сформированных в оболочке.
Объектом настоящего изобретения также является способ измерения глубины отверстий доставки. Как было указано выше, формирование микропор в оболочке известно в данной области. Однако до сих пор не было попыток охарактеризовать глубину отверстия доставки, сформированного устройством для формирования микропор, и установить взаимосвязь между средней глубиной отверстия и потоком в организм через это отверстие.
Унифицированное получение характеристик отверстия доставки или группы отверстий доставки сопряжено с неустранимыми трудностями. Существует много переменных, которые могут влиять на результат измерения строения отверстия доставки. К таким переменным относятся, но ими не ограничиваются, форма оболочки, нормальные изменения поверхности биологических оболочек, временные изменения физиологических условий, например, находится ли субъект в состоянии потоотделения или нет, присутствуют ли на нем мурашки от озноба или сильный волосяной покров или нет, площадь поверхности контакта между устройством для формирования микропор и оболочкой, любое наблюдаемое и визуализируемое движение биологической оболочки, влага на поверхности, влияние сердцебиения и тому подобное.
Установлено, что размер отверстия доставки, в том числе его глубина, помогает определить интенсивность, с которой проникающее вещество вводится в организм через оболочку, или аналит отбирается из организма через оболочку. Другими словами, размер и глубина отверстия доставки являются важными переменными для определения интенсивности потока вещества через оболочку. В случае с проникающими веществами, которые характеризуются большими молекулами, например, в случае с инсулином, который обычно имеет формулу гексамера с молекулярной массой около 36000 дальтон, для того, чтобы обеспечить желаемый поток инсулина через оболочку, требуется более крупное и глубокое отверстие доставки, чем отверстие, необходимое для молекул меньшего размера, например, гидроморфина (с молекулярной массой около 300 дальтон).
Прототипы системы формирования микропор оказались эффективными для формирования отверстий в оболочках для доставки или отбора веществ через оболочку. Поскольку ранние прототипы системы формирования микропор оказались эффективными для доставки лекарственных средств, было разработано второе поколение систем формирования микропор для воспроизведения результатов (например, глубины микропор) первых прототипов. Для оценки прототипов системы формирования микропор как первого, так и второго поколений, в первую очередь, требуется определить характеристики размеров микропор, создаваемых каждой системой. Способ по настоящему изобретению позволяет специалисту в данной области осуществить указанное определение характеристик. Способ по настоящему изобретению позволяет унифицированно измерить глубину отверстия и среднюю глубину отверстия, независимо от применяемой системы формирования микропор.
Предпочтительно, методики по настоящему изобретению обеспечивают способ измерения характеристик размеров множества микропор, при этом статистический итог результатов этих измерений дает кривую нормального распределения глубин отверстий со средней глубиной отверстия на «максимуме» кривой. После формирования отверстий доставки глубину отверстия определяют способом по настоящему изобретению. Глубину отверстий измеряют, используя подходящее оборудование. Не ограничивающим примером устройства для определения глубины отверстия для множества отверстий является видеомикроскоп в сочетании с системой маркировки и измерений. Однако в рамках настоящего изобретения можно также применять другое подобное измерительное оборудование.
В предпочтительном варианте осуществления глубину отверстия измеряют с использованием микроскопа и цифрового индикатора глубины. Пружинный индикатор располагают так, чтобы наконечник индикаторного прибора опирался на плоскую поверхность столика микроскопа. Функцию установки на нуль индикатора используют для записи расстояния по направлению «Z» отверстия, а именно, глубины отверстия. Специалист в данной области фокусирует верхнюю поверхность оболочки, и в этой точке цифровой индикатор устанавливают на нуль. Затем столик двигают вниз с очень малыми перемещениями до фокусировки на нижней границе отверстия. Расстояние, на которое столик перемещается из положения установки на нуль до положения, в котором пора находится в фокусе, записывается как глубина отверстия. Объектив, применяемый в микроскопе, выбирают с достаточно короткой глубиной резкости, чтобы оператор мог четко отличить координату «Z», при которой центр поля зрения находится в фокусе.
Глубину отверстия можно измерять несколько раз в нескольких разных положениях в пределах отверстия и с привязкой к нескольким разным местоположениям по верхнему краю отверстия, и разными лицами для получения средней глубины отверстия для данного отверстия. Кроме того, глубину можно измерять до разных местоположений по нижней границе отверстия, чтобы обеспечить получение средней глубины отверстия для данного отверстия. В любом случае, среднюю глубину отверстия записывают как глубину отверстия для данного отверстия. Для конкретного отверстия часто удобно использовать среднюю глубину отверстия вследствие множества переменных, которые влияют на глубину отверстия. К переменным относятся неровность оболочки, наклон образца оболочки (образец оболочки может быть не совсем плоским), контактная поверхность устройства формирования микропор, давление и поглощенная вода в образце оболочки. Применение средней глубины отверстия помогает свести к минимуму влияние указанных переменных на результаты измерения разных отверстий.
Глубину отверстия можно также измерять введением индикаторного вещества, например, жидкости, имеющей флуоресцирующий состав, но предназначенной также для сведения к минимуму истечения данной жидкости из самого отверстия в окружающие тканевые структуры в течение времени, за которое будет выполнено измерение отверстия. В данном случае можно применить флуоресцентный микроскоп для визуализации отверстия и, путем калибровки интенсивности флуоресценции, созданной индикаторным веществом, можно вычислить точный профиль отверстия. В качестве альтернативы, при выборе флюорофора, который поглощает и флуоресцирует на длинах волн, на которых незначительно собственное влияние на данные фотоны со стороны мешающей и окружающей ткани, можно применить конфокальный флуоресцентный микроскоп для точного измерения отверстий, даже если самый наружный участок отверстия сходится и, тем самым, делает неясным оптическое изображение нижних зон отверстия. Конфокальная система может с легкостью просканировать сквозь данные ткани и отобразить полностью трехмерный профиль отверстия в биологической оболочке, например, коже. Подходящим флуорофором для данной цели был бы флуорофор, изготовленный из инертных полимерных микросфер в виде взвеси в воде и обладающий максимальным поглощением в диапазоне длин волн 600-800 нанометров и максимальным излучением в диапазоне 650-850 нанометров, например, FluoroSpheres Flurescent Color Kit F-10720 фирмы Micro Probes (Eugene, OR).
Кроме того, оценочное измерение глубины отдельных пор можно выполнить сканированием небольшим электродом по отверстиям и измерением полного комплексного сопротивления между электродом и вторым противоэлектродом, размещенным на некотором расстоянии на организме. Поскольку удельное электрическое сопротивление самых наружных слоев кожи млекопитающих обычно намного больше, чем более глубоких слоев эпидермиса и дермы, указанное измерение полного сопротивления можно связать с глубиной отдельных пор, измеренной другим средством. Аналогично, вышеописанные измерения трансэпидермальной потери влаги (TEWL) можно использовать для оценки средней глубины множество микропор.
По меньшей мере одну из указанных измерительных процедур повторяют для каждого отверстия, сформированного системой формирования микропор и, тем самым, обеспечивают совокупность данных для конкретной системы формирования микропор. С возрастанием количества отдельных отверстий, выполненных системой формирования микропор данной модификации, возрастает эффективность статистики для получения характеристических значений средней глубины. Предпочтительно, совокупность данных обеспечивает распределение глубин отверстий по нормальной кривой, при этом средняя глубина отверстия для отверстий, сформированных системой формирования микропор, представляет собой максимальное значение кривой и используется как характерная глубина для данной системы формирования микропор. Кроме того, желательно иметь узкую широту, охватываемую распределением, создаваемым конкретной системой формирования микропор. Сужение широты распределения обеспечит большую равномерность интенсивности потока проникающего вещества через оболочку при переходе от отверстия к отверстию. Следовательно, предпочтительно, средние глубины отверстий для отверстий доставки должны быть в диапазоне глубин, находящемся в пределах одного среднего квадратичного отклонения от приблизительно 50 до приблизительно 70 микрон. Более предпочтительно, средние глубины отверстий для отверстий доставки будут изменяться в пределах одного среднего квадратичного отклонения от приблизительно 60 микрон.
Желаемой средней глубиной отверстия для системы формирования микропор является такая глубина, при которой отверстия обеспечивают допустимый поток проникающего вещества через оболочку. Другими словами, если проникающее вещество, подлежащее доставке, состоит из молекул небольшого размера, как гидроморфин, то желаемая средняя глубина отверстия будет меньше, чем в случае, если проникающее вещество, подлежащее доставке, состоит из молекул большего размера или даже из таких частиц, как инсулин, или наночастиц. Например, если требуется доставлять гидроморфин, то подходящая средняя глубина отверстия может быть около 40-60 микрон. Однако если требуется доставлять инсулин, то подходящая средняя глубина отверстия может быть около 65-90 микрон. Объект настоящего изобретения охватывает также чрескожную доставку вакцин, частиц, которые могут изменять некоторое измеримое состояние в ответ на сдвиг уровня локального аналита и других проникающих веществ.
В еще одном предпочтительном варианте осуществления изобретения средняя глубина отверстия для системы формирования микропор составляет от приблизительно 40 до приблизительно 90 микрон. В более предпочтительном варианте средняя глубина отверстия для системы формирования микропор составляет от приблизительно 50 до приблизительно 70 микрон, и в еще более предпочтительном варианте осуществления составляет около 60 микрон.
В другом предпочтительном варианте осуществления изобретения около 75% отверстий, сформированных системой формирования микропор, имеют среднюю глубину отверстия от приблизительно 40 до приблизительно 90 микрон, в более предпочтительном варианте, от приблизительно 55 до приблизительно 65 микрон, и даже более предпочтительно, около 60 микрон.
В рамках настоящего изобретения предполагается, что, по мере совершенствования систем формирования микропор, распределение по кривой Гаусса средних глубин отверстий для конкретной системы формирования микропор будет сужаться, что обозначает сужение диапазона средних глубин отверстий. Вышеуказанное желательно потому, что отверстия, которые являются слишком мелкими, не будут обеспечивать надлежащего потока проникающего вещества через оболочку, а отверстия, которые являются слишком глубокими, часто вызывают эритематозный дерматит или дискомфорт у млекопитающего. В оптимальном варианте диапазон средних глубин отверстий для отверстий, формируемых конкретной системой формирования микропор, является достаточно узким для предотвращения формирования отверстий, которые являются слишком мелкими, или отверстий, которые являются слишком глубокими.
Преимущество настоящего изобретения состоит в том, что результат измерения глубины отверстия и средней глубины отверстия не зависит от типа примененной системы формирования микропор. Объект настоящего изобретения можно использовать для определения глубины отверстия любого отверстия, сформированного любой системой формирования микропор.
В предпочтительном варианте осуществления формирование отверстий доставки (микропор) через роговой слой с целью доставки белков и пептидов, некрупных гидрофильных молекул, частиц, вакцин и генов через кожу осуществляется с использованием плоскостной матричной системы формирования микропор. Технология основана на подводе энергии к небольшой, пространственно жестко ограниченной области на поверхности кожи. Один способ введения указанной энергии в кожу состоит в том, что кожу приводят в непосредственный контакт с миниатюрной электрически нагреваемой нитью, при этом температуру указанной нити можно быстро модулировать пропусканием заданных импульсов электрического тока через указанную нить, что вызывает ее нагревание и, тем самым, подведение к коже короткого импульса энергии в области, находящейся в непосредственной близости к зоне контакта. Когда энергия кратковременного импульса электрического тока подводится к коже, клетки кожи в указанной намеченной зоне моментально испаряются и оставляют в роговом слое сквозное отверстие, обеспечивающее доступ в нижележащие живые слои эпидермиса. В качестве альтернативы, данная плоскостная матричная система формирования микропор может использовать матрицу остроконечных микровыступов для формирования указанных разрывов в роговой оболочке. После того, как структура микропор сформирована, на микропоры налагают аппликатор, содержащий лекарственное средство или желаемое проникающее вещество. Профиль доставки определяют следующим образом: по концентрации проникающего вещества и препарату с другими наполнителями, например, поверхностно-активными веществами, модификаторами вязкости, органическими растворителями, интенсификаторами, предназначенными для усиления проницаемости подлежащих слоев кожи, площади аппликатора, плотности микропор и времени наложения аппликатора. Характеристики электрически нагреваемой нити (геометрия, материал и размеры) и параметры управления (длительность импульса электрического тока, максимальный уровень тока, форма импульса и т.д.) имеют определяющее значение для размера и глубины микропор, которые сформированы.
Размер отверстия доставки (длина, ширина и глубина) имеет важное значение для количества проникающего вещества, которое можно доставить за данное время (интенсивность потока). В литературе по обычно использующейся чрескожной доставке предполагается, что, для обеспечения значительного усиления потока любого проникающего вещества, глубина отверстия доставки должна лишь немного заходить за толщину рогового слоя (15-30 микрон толщиной). Однако, исходя из последних данных, которые устанавливают зависимость между данными размерного профиля отверстия доставки и полученными интенсивностями потоков проникающих веществ, очевидно, что для обеспечения надлежащего или, в некоторых случаях, даже измеримого потока некоторых молекул, требуются более крупные и глубокие отверстия. Поскольку значительная часть данных профиля отверстий получена на модели системы (коже с донорского человеческого трупа), размеры образованных пор и объем отслоенной кожной ткани коррелируются с экспериментальными данными по доставке лекарственных средств, полученными in vivo на моделях разных животных, а также на людях в клинических исследованиях (в основном, с инсулином и гидроморфином).
Критические размеры микропор, необходимые для доставки, можно описать несколькими способами: 1) критические глубина/размер, превышаемые для всех измеренных микропор; 2) критическое среднее +/- среднее квадратичное отклонение распределения всех микропор, измеренных для данной структуры; и 3) процент микропор с глубиной/размерами, превосходящими некоторый желаемый диапазон глубин/размеров. Каждый из указанных способов дополнительно рассмотрен ниже.
При определении важного размера формируемых отверстий доставки важно понять ограничения технологий, используемых для снятия профиля микропор. Количественные измерения размеров микропор непосредственно на живых объектах или людях являются очень сложной задачей из-за мелкого микроскопического масштаба (100 мкм) и наличия значительного искажения, обусловленного движением, а именно, непроизвольными движениями мускулов и пульсированием небольших кровеносных сосудов. Поэтому способы, устройства и технологии в соответствии с объектом настоящего изобретения, разработаны для исследования формирования микропор как в синтетических заменителях кожи, коже с человеческого трупа, вырезанной коже животного, так и в живой коже человека и животного.
Кроме того, доставка различных проникающих веществ требует различной интенсивности потока в зависимости от уровней проникающих веществ, необходимых для данного соединения. В прошлом глубину и размер микропор контролировали, ограничиваясь двумя характерными соединениями, инсулином и гидроморфином, однако, то же самое применимо также ко многим другим белкам, пептидам, небольшим молекулам, частицам, вакцинам и генам.
С учетом опыта нескольких доклинических и клинических исследований, установлены следующие диапазоны: 1) критические глубина/размер, которые следует превысить, чтобы обеспечить значимый поток через данные микропоры, составляет приблизительно 30 микрон; 2) желаемое распределение имеет приближенное среднее +/- среднее квадратичное отклонение в диапазоне 50-60±10-15 микрон; 3) процент микропор с глубиной в диапазоне 40-90 микрон составляет около 75%; и 4) процент микропор, которые имеют глубину, которая превосходит 30-микронную критическую глубину, составляет около 90%. Приведенные желаемые характеристики глубины отверстий доставки получены, в основном, в клинических исследованиях с плоскостной матрицей нитей.
В соответствии с задачей настоящего изобретения, система формирования микропор предпочтительно содержит плоскостное матричное устройство для формирования микропор. Примеры устройств для формирования микропор, которые можно применять по настоящему изобретению для количественного определения глубины сформированных отверстий, включают в себя, но ими не ограничиваются, нагревательный контактный элемент, способный гальванически подводить тепловую энергию через непосредственный контакт к биологической оболочке, чтобы вызывать отслоение некоторого участка оболочки на глубину, достаточную для формирования микропоры, при этом нагревательный контакт может содержать электрически нагреваемый резистивный элемент, способный иссекать биологическую оболочку или оптически нагреваемый верхний слой красителя/поглотителя, электромеханического привода, микроланцета, матрицы микроигл (сплошных или полых), микрошипов, микроструктур или ланцетов, ультразвукового устройства для отслойки, системы лазерного выжигания и жидкоструйного прокалывающего устройства высокого давления. В предпочтительном варианте устройство для формирования микропор содержит нагревательный элемент, который допускает быстрое модулирование температуры контактного нагревательного элемента.
В неограничительном примере системы формирования микропор, которая может использоваться в настоящем изобретении, для формирования отверстий доставки используют микроиглы. Это устройство для перфорирования кожи содержит множество круговых игольчатых дисков, содержащих микроиглы для перфорирования кожи, выполненных по окружности дисков. Устройство содержит также центральную ось, которая удерживает игольчатые диски торец к торцу один относительно другого и допускает поворот дисков. Микроиглы имеют трехгранную форму и боковые стороны в форме острой волны. Микроиглы в каждом из игольчатых дисков расположены с равным шагом, при этом отдельные игольчатые диски объединены так, что микроиглы в одном игольчатом диске расположены уступами от микроигл примыкающего игольчатого диска.
В этом не ограничивающем примере отверстия доставки выполняют приведением устройства в контакт с оболочкой. Таким образом, микроиглы приходят в контакт с оболочкой. Затем игольчатые диски устройства прокатывают по оболочке и при этом равномерно прижимают устройство к оболочке с постоянным давлением. При прокатывании устройства по оболочке с постоянным давлением игольчатые диски поворачиваются, и микроиглы на их окружности формируют отверстия доставки в оболочке. Таким образом, микроиглы формируют желаемое количество отверстий доставки заданной глубины в коже.
Применение микроигл дает один пример подходящей системы формирования микропор. В способах по настоящему изобретению применимы также другие подобные системы формирования микропор. В одной из других подобных систем возможно применение плоскостной матрицы отдельных электродов, посредством которой, при приложении электрического потенциала к каждому электроду, именуемому противоэлектродом, через ткань, находящуюся в контакте, можно пропустить локальный электрический ток, который подводит достаточно энергии для осуществления желаемой отслойки и формирования микропоры.
Другой переменной, которая влияет на среднюю глубину отверстия, является величина давления, прилагаемого устройством для формирования микропор системы формирования микропор к оболочке, в которой должны быть выполнены отверстия. Часто к устройству для формирования микропор желательно прилагать принудительное давление, чтобы между устройством для формирования микропор и оболочкой обеспечить контакт, достаточный для формирования отверстий с желаемыми свойствами. Необходимое механическое контактное давление, которое следует создать между нитями или электродами устройства для формирования микропор и тканевой оболочкой с целью облегчения переноса энергии, может быть обеспечено приложением вакуума к устройству для формирования микропор, что обеспечивает плотный контакт между образующими поры компонентами устройства для формирования микропор и оболочкой. В предпочтительном варианте величина вакуума, прилагаемого между устройством для формирования микропор и оболочкой, составляет от приблизительно 0,25 бар до приблизительно 0,80 бар. В более предпочтительном варианте величина вакуума, прилагаемого между устройством для формирования микропор и оболочкой, составляет приблизительно 0,50 бар.
Улучшенный контакт между устройством для формирования микропор и оболочкой помогает обеспечить сужение диапазона глубин отверстий доставки за счет обеспечения того, что больше устройств для формирования микропор в системе формирования микропор вводят в контакт с оболочкой. Кроме приложения вакуума между системой формирования микропор и оболочкой в описанном выше порядке, для улучшения контакта применяют изменение свойств подложки, на которой размещены устройства для формирования микропор системы формирования микропор. Вызывает удивление, что создание жесткой подложки обеспечивает улучшение контакта между устройствами для формирования микропор и оболочкой. К предпочтительным материалам для применения в жесткой оболочке относятся полиэтиленовая пленка и полиэтиленовая пленка с покрытием из акрилового клея.
Другой способ совершенствования контакта между устройствами для формирования микропор и оболочкой заключается в модификации поверхности плоскостной матрицы путем добавления выступов, которые способствуют установлению контакта между устройствами для формирования микропор и оболочкой. Выступы помогают стабилизировать плоскостную матрицу и, тем самым, способствуют контакту между устройствами для формирования микропор и оболочкой.
Объект настоящего изобретения охватывает также профиль доставки проникающего вещества после формирования отверстий в оболочке. Оптимальным профилем доставки для системы формирования микропор является воспроизведение такого профиля доставки, как если лекарственное средство доставлялось подкожно через оболочку иглой для подкожных инъекций. Посредством оптимизации средней глубины отверстий для отверстий, формируемых системой формирования микропор, обеспечивают профиль доставки, который воспроизводит профиль при подкожной доставке. Например, инсулин вводят млекопитающему через инфузионный насос и подкожную канюлю, имплантированную в объект, с заданной интенсивностью, и профиль инсулина в сыворотке крови млекопитающего контролируют для обеспечения профиля в сыворотке крови. Затем используют систему формирования микропор для формирования отверстий в коже млекопитающего. Затем инсулин доставляют млекопитающему через отверстия посредством размещения емкости с инсулином в области кожи, где сформированы отверстия, и контролируют уровни инсулина в сыворотке крови, и подготавливают профиль сыворотки крови. В соответствии с объектом настоящего изобретения, профиль сыворотки крови млекопитающего при доставке инсулина через отверстия воспроизводит профиль сыворотки крови млекопитающего после введения инсулина подкожно через инсулиновый насос. Оптимизация средней глубины отверстия для отверстий, сформированных системой формирования микропор, позволяет обеспечить вышеописанное условие.
Кроме того, млекопитающему можно вводить болюсную инъекцию инсулина подкожной инъекцией, и уровни в сыворотке крови контролируют, чтобы обеспечить профиль сыворотки крови. Затем используют систему формирования микропор для формирования отверстий в коже млекопитающего. Затем инсулин доставляют млекопитающему через отверстия посредством размещения емкости с инсулином над областью кожи, где сформированы отверстия, и добавлением активной системы усиления потока для форсирования движения инсулиновых молекул через отверстия млекопитающему с интенсивностью потока, большей, чем интенсивность, достигаемая, когда только пассивная диффузия обеспечивает доставку инсулина. Средством указанного активного усиления потока может быть давление, электрическое поле, обеспечивающее воздействие электродвижущей силы на инсулиновые молекулы с продвижением их в млекопитающее, или акустическая энергия, ускоряющая диффузию инсулина в млекопитающее. Еще раз контролируют уровни инсулина в сыворотке крови и подготавливают профиль сыворотки крови. В соответствии с объектом настоящего изобретения, профиль сыворотки крови млекопитающего с инсулином, доставляемым через отверстия, и активным усилением потока точно воспроизводит профиль инсулина в сыворотке крови млекопитающего после введения болюсной дозы инсулина посредством подкожной инъекции. Оптимизация средней глубины отверстия для отверстий, сформированных системой формирования микропор, позволяет обеспечить вышеописанное условие.
Дополнительным аспектом настоящего изобретения является применение для оценки эффективности системы формирования микропор и доставки лекарственного средства с использованием таковой посредством определения трансэпидермальной потери влаги (TEWL) через оболочку. При проведении измерения TEWL измеряют количество воды, пересекающей оболочку на единицу площади в единицу времени, после формирования микропор оболочки. Измерение TEWL может представлять собой количественное измерение средней глубины пор, выполненных в оболочке системой формирования микропор на измеряемой единице площади, так как более высокий результат измерения интенсивности потока воды через оболочку указывает, что микропоры, сформированные системой формирования микропор, имеют, в среднем, глубину, которая позволяет большему количеству жидкости пересекать оболочку. В конкретном случае человеческой кожи водосодержание различных слоев эпидермиса характеризуется достаточно хорошо, и изменения результатов измерения TEWL на единицу площади одной микропоры можно коррелировать с результатами независимых измерений средней глубины микропоры.
Между показаниями TEWL и средней глубиной микропор существует прямая зависимость, в соответствии с которой большое количество воды, проходящей через оболочку, указывает на бóльшую среднюю глубину пор при их формировании, тогда как меньшее показание TEWL свидетельствует о меньшей средней глубине пор. Если распространить вышеуказанное на ранее установленную зависимость между средней глубиной отверстий и интенсивностями потока проникающих веществ, то высокое показание TEWL коррелируется с более высокими интенсивностями потока проникающих веществ через оболочку, тогда как низкий результат измерения TEWL коррелируется с уменьшенными интенсивностями потока лекарственных веществ через оболочку. В соответствии с объектом настоящего изобретения, результат измерения TEWL, превосходящий 25, обеспечивает хорошие результаты при доставке гидроморфина. В предпочтительном варианте для введения гидроморфина результат измерения TEWL находится в диапазоне от приблизительно 25 до приблизительно 45. Результат измерения TEWL больше чем 50, обеспечивает хорошие результаты при введении инсулина. В предпочтительном варианте для введения инсулина результат измерения TEWL находится в диапазоне от приблизительно 50 до приблизительно 65.
При измерении TEWL у пациента требуется особое внимание. Если пациент потеет при измерении TEWL, то будет получено ошибочно высокое показание. Следовательно, важно измерять TEWL в условиях, в которых пациент чувствует себя комфортно и не потеет. Разработан стандартный способ с компьютерным управлением, со специально разработанными алгоритмами для минимизации посторонних переменных, могущих влиять на результаты измерения TEWL, для получения высококачественных показателей TEWL в клинике.
Одним из таких устройств для измерения TEWL, предложенное фирмой DermaLab, является модель № EN60601-1. С данным измерительным устройством доступны разнообразные контактные измерительные головки. Кроме того, программное обеспечение, прилагаемое к измерительному устройству, позволяет снимать результаты измерений TEWL в соответствии со следующим протоколом: 1) убедиться, что TEWL находится в режиме «Stop»; 2) выбрать «SET UP» из меню, предлагаемого программным обеспечением; 3) выбрать «ENVIRONMENT» и записать «RH» и «TEMP»; 4) выбрать «EXIT»; 5) запустить программу DasyLab 3.5 на компьютере, подключенном к устройству измерения TEWL; 6) щелкнуть мышью на «START»; 7) поместить зонд на желаемое место с крышкой в рабочем положении, с стороной кожи внизу; 6) щелкнуть «Collect» из доступных опций; 9) подождать окончания отработки 60-секундного таймера; 10) записать «20 sec. Mean» («20-сек среднее) и «20 Sec SD» («20-сек среднее квадратичное отклонение»). Вышеизложенное является всего лишь одним иллюстративным примером устройства измерения TEWL и прилагаемого программного обеспечения и не предполагает никакого ограничения объекта настоящего изобретения. Совместно с объектом настоящего изобретения можно использовать и другие подобные системы измерения TEWL.
Вышеописанные аспекты объекта настоящего изобретения относятся к доставке проникающего вещества через оболочку, однако, объект настоящего изобретения подразумевает также извлечение вещества из млекопитающего через отверстия доставки. Следовательно, настоящее изобретение также может использоваться как способ извлечения вещества из животного, при этом способ предусматривает формирование множества отверстий доставки в оболочке животного, причем большинство из множества отверстий доставки имеет среднюю глубину отверстия в диапазоне от приблизительно 40 до приблизительно 90 микрон, и извлечение вещества из животного через отверстия.
Другие аспекты различных и предпочтительных вариантов осуществления настоящего изобретения приведены в следующих примерах. Следующие примеры служат для иллюстрации предпочтительных вариантов изобретения и не предназначены для ограничения изобретения.
Пример 1
Этот пример демонстрирует способ измерения глубины отверстий, сформированных системой формирования микропор.
Кожа донорского человеческого трупа была получена по программе National Disease Research Interchange (NDRI) и Cooperative Human Tissue Network (CHTN)). Одна из полученных тканей представляла собой полнослойный образец размером 10 см на 10 см с большим количеством жировой ткани (NDRI № 0041785). Место снятия кожи было неизвестно. Образец был снят 10 ноября 2000 г. через 8 часов после смерти и немедленно заморожен. Образец был доставлен 16 января 2001 г. и хранился при -66°C на фирме Altea Therapeutics. Донором был белый мужчина, не страдавший диабетом, в возрасте 50 лет, без отметки о кожных заболеваниях в истории болезни. Причиной смерти по протоколу был, вероятно, инфаркт миокарда.
Кожу с трупа приготовили и разрезали на отдельные образцы размером приблизительно 2 см на 4 см. Каждый образец размораживали и разрезали для использования и измерения в тот же день. Во время разработки способа использовали два устройства для крепления образца: (1) акриловое предметное стекло с липучкой или (2) пенопласт с закрытыми порами со скобками для фиксации образца.
Каждое устройство для крепления образца закрепляли в рабочем положении на 3-координатном предметном столике зажимами. Объектив видеомикроскопа фиксировали в положении над предметным столиком жесткими лабораторными кольцевыми штативами и пружинными зажимами. Фокусировку (перемещение по оси «Z») и позиционирование образца (перемещение по осям «X» и «Y» для выбора отдельных пор для измерения) контролировал оператор путем ручной регулировки положения 3-координатного предметного столика. Выходной сигнал видеомикроскопа подавался на перезаписывающее устройство фирмы Sony. Выходной разделенный видеосигнал (S-video) с перезаписывающего устройства подавался в систему маркировки и измерений Imagex и затем отображался на 13-дюймовом телевизионном мониторе. Цифровой выходной сигнал перезаписывающего устройства подавался в персональный компьютер и фиксировался в виде отдельных неподвижных изображений с помощью программного обеспечения Ulead Video Studio. Система Imagex предназначалась для производства разнообразных вычислений по результатам измерений, например, длины по x и y, линейной длины пути или планарной области непосредственно с видеоэкрана. Система Imagex калибровалась в направлениях как x, так и y с использованием сетки со 100 делениями на миллиметр (Pyser-SGl Ltd Graticules, UK). Сетку помещали на 3-координатный предметный столик и ориентировали вручную так, чтобы шкала занимала горизонтальное положение на экране дисплея. Использовали функцию калибровки системы Imagex для калибровки устройства на отрезке длиной 100 мкм. Калибровку проверяли выполнением измерений той же самой сетки на отрезках разной длины, с разной ориентацией (вертикальной, горизонтальной и произвольной) и в разных положениях в поле зрения. Проверяли также пространственные характеристики измерением объектов известной ширины (вольфрамовые проволочки диаметром 50 и 80-мкм).
Для записи расстояния перемещения предметного столика в Z-направлении применяли цифровой индикатор фирмы Sony. Пружинный индикатор располагали так, чтобы конец индикаторного прибора упирался в плоскую поверхность предметного столика. Для записи расстояния между верхней границей поверхности кожи и нижней границей поверхности микропоры использовали функцию установки устройства на нуль.
При использовании оптической системы с постоянным фокусным расстоянием и малой глубиной резкости в поле зрения глубина пор равна расстоянию, на которое следует переместить образец, чтобы обеспечить четкую фокусировку на верхней границе поверхности кожи и на нижней границе микропоры. Использовали 100-кратный объектив на видеомикроскопе Scalar с разрешающей способностью +/- 5 мкм по глубине резкости.
В начале работы с этим образцом разморозили весь 10×10-см образец кожи. Подкожную жировую ткань удалили хирургически. Образец разделили и заморозили. В каждый день сбора данных размораживали достаточный по размеру образец и разрезали для использования в данный день. После размораживания и закрепления поверхность кожи протирали спиртом для воспроизведения процедуры, выполняемой in vivo. В каждом образце формировали матрицу микропор, используя желаемые экспериментальные параметры. После формирования пор небольшую каплю зеленого пищевого красителя натирали на область с порами. Через приблизительно 5-10 секунд пищевой краситель удаляли осторожным промоканием впитывающей тканью. Данный процесс обеспечивал выделение границ каждой микропоры, но не окрашивал ткань, подвергнутую формированию микропор.
С помощью программного обеспечения Ulead записывали цифровую неподвижную фотографию. Для измерения как длины, так и ширины поры использовали функции «расстояние» или «длина пути» системы Imagex. Функция «расстояние» выполняла измерение только по горизонтали или вертикали, поэтому каждый образец располагали как можно ближе к положению совмещения с осью измерения системы. Если совмещение было менее, чем оптимальное, то для измерения как длины, так и ширины микропоры использовали функцию «длина пути». Функция «площадь» системы Imagex позволяла пользователю определить периметр зоны произвольной формы и затем отобразить планарную область, определенную этой формой. Для каждого отверстия отслеживали наиболее заметный «верхний» край поры и записывали площадь.
В пределах, ограниченных небольшой глубиной резкости, оператор производил четкую фокусировку на верхнюю поверхность кожи около края измеряемой поры. После определения координаты верхней поверхности кожи цифровой индикатор устанавливали на нуль, и затем предметный столик пошагово перемещали в направлении «Z» до состояния четкой фокусировки на нижней границе микропоры. Расстояние, на которое перемещался предметный столик между точками фокусировки, записывали как глубину поры. В ряде случаев, когда структура края кожи по окружности поры характеризовалась существенным колебанием по высоте, выполняли несколько подобных измерений на одной поре, пока оператор не приходил к выводу, что для данной поры можно установить обоснованную величину «средней» глубины поры. Кроме того, чтобы обеспечить ничтожно малое значение «операторской составляющей» в данной измерительной системе, к измерению одних и тех же групп микропор привлекали несколько операторов и затем сравнивали результаты. При всех указанных сравнениях расхождения средней глубины микропор для группы образцов из 80 пор у разных операторов, измеряющих одни и те же группы микропор, оказались в пределах 9 микрон, и среднее квадратичное отклонение глубины по образцам с 80 порами было, практически, идентичным.
На фигуре 1 представлены результаты измерений глубины пор для планарных пор, сформированных с ограничением числа импульсов, и для первого прототипа системы, в которой применяли 80-микронные вольфрамовые проволочки в процессе пошагового мультиплицирования для формирования матрицы пор.
На фигуре 2 показана изменчивость результатов измерения глубины для одних и тех же 8 отверстий, выполненных в коже трупа по вышеописанной методике, при смене операторов. Расхождения в результатах измерения глубин были в диапазоне от 0 до 62%; но, при ограниченном размере образца, средняя глубина, измеренная обоими операторами, составляла 53±14 и 44±13 микрон.
Пример 2
Этот пример показывает применение системы формирования микропор второго поколения («плоскостного матричного» устройства для формирования микропор) для получения такой глубины микропор, как в первом прототипе системы формирования микропор (устройство для формирования микропор с «пошаговым мультиплицированием»).
Для формирования отверстий или матрицы микропор в донорской коже человека применили первый прототип системы формирования микропор. Глубину микропор измеряли с помощью способа, описанного в примере 1. Распределение глубин микропор представлено на фигуре 3. Средняя глубина составила 55±18 микрон. Данное значение использовали для оценки системы формирования микропор второго поколения, использующей плоскостное матричное устройство для формирования микропор с блоком управления.
Тест 1
Структуры из нескольких микропор, созданные с помощью плоскостной матрицы устройства для формирования микропор и блока управления, и настроек параметров клинического исследования (блок управления модели AACT-01, экранированные матрицы, импульсы 5 мсек × 4, 100 opto), изучали на коже от двух доноров.
|
Наблюдаемые глубины микропор не достигали заданного значения и были существенно мельче, чем ожидалось. Данные означали, что плохая доставка, наблюдавшаяся в клинике, была обусловлена мелкими образованными микропорами, и что повышение подводимой энергии позволило бы добиться цели и обеспечить улучшение доставки лекарственных средств.
Последующие сравнения показаний TEWL, снятых во время указанных клинических опытов, также подтвердили, что результаты измерений TEWL указывают на то, что поры мельче, чем ожидалось.
Тест 2
Для определения подходящих настроек подводимой энергии потребовалось охарактеризовать влияние изменения каждого параметра устройства на глубину микропоры.
Блок управления с более короткой длительностью фронта импульса вызвал бы ускорение улетучивания и лучшее удаление кожной ткани за счет создания более высокого максимального давления во время мгновенного испарения выжигаемой ткани и, тем самым, эффективнее формировал бы микропоры. Блок управления с более короткой длительностью фронта импульса (AACT-02) был собран и испытан параллельно с определением параметрических характеристик.
|
Не получено наблюдаемой тенденции, связанной с изменением числа импульсов или цветовой температуры.
После анализа данных результатов предложено несколько гипотез для объяснения данных наблюдений. Указанные гипотезы учитывали изменения от матрицы к матрице различия в донорской коже, различия между методами крепления/окраски/измерения и непостоянство переноса энергии от матрицы к коже для каждой пороформирующей нити (т.е. плохой контакт).
Тест 3
Данные для импульсов 5 мсек × 4 из теста 2 дают основание предположить, что блок управления с более короткой длительностью фронта импульса не повысил эффективность, с которой формировались микропоры. Так как данные получали с одной структуры, тест потребовалось повторить. Потребовалось также обратиться к некоторым гипотезам, которые составлены по данным теста 2. На одной донорской коже сформировали несколько структур с помощью блока управления с более короткой длительностью фронта импульса (модель AACT-02).
|
Повторные измерения не подтверждают данные из теста 2. Фактически, данные были очень похожи на данные, полученные с блоком управления с большей длительностью фронта импульса (AACT-01), что позволяет предположить, что длительность фронта импульса не может влиять на глубину микропоры. Для продолжения, те же самые настройки использовали для формирования 2 дополнительных структур для одного и того же донора и 2 структур для нового донора. Все четыре структуры сформировали с помощью одной и той же матрицы.
|
Как оказалось, разные образцы кожи не влияют на глубину микропор. Хотя совокупные данные измерений были очень схожими при использовании одной и той же плоскостной матрицы, корреляция между структурами для отдельных нитей была относительно слабой.
Тест 4
С учетом изменчивости и отсутствия наблюдаемых тенденций для данных, сделано заключение о наличии высокой вероятности того, что перенос энергии от каждой нити матрицы в кожу был нестабильным. Возможно, это обусловлено отгибанием матрицы от кожи или тем, что нити матрицы могут быть заглублены в адгезив и пластиковый экран. Для проверки данной гипотезы матрицы смонтировали на детали из твердого пластика с отверстием для вакуумирования. Пластиковая деталь служила опорой для штырей матрицы, чем предотвращала отгибание от кожи и допускала подачу вакуума к коже. Вакуум обеспечивал плотный контакт между матрицей и кожей путем подтягивания кожи вверх около нитей во время запуска. С блоком управления с более короткой длительностью фронта импульса (AACT-02) и комбинацией параметров импульсов 5 мсек × 4, 100 opto, с вакуумом и без него сформировали две структуры.
|
Данные указывают, что плотный контакт улучшает перенос энергии и обеспечивает формирование существенно более глубоких микропор. Данные также дают основание предположить, что при плотном контакте требуется подводить намного меньше энергии, чтобы достигнуть ранее установленного заданного уровня. Следующий этап заключается в быстром просмотре ряда комбинаций параметров, чтобы ограничиться параметрами настройки, которые обладают высоким потенциалом в отношении доставки.
|
Кроме того, проверили случайную группу комбинаций параметров для поддержки выявления подходящих комбинаций для клинического применения.
|
Тест 5
Вызывает удивление тот факт, что настройка импульсов 1 мсек × 5, 25 opto, без вакуума, представляется приближающейся к заданному строению микропоры. Пластиковая подкладка, поддерживающая штыри матрицы, предотвращала отгибание матрицы и улучшила контакт между матрицей и кожей. Добавление менее гибкой пластиковой подкладки в обычную структуру матрицы было сравнительно простой модификацией, но резко увеличило глубину и повысило возможность доставки лекарственных средств. Тесты повторили с несколькими структурами на нескольких донорских образцах.
|
Тест 6
Выработана исчерпывающая и надежная совокупность данных тестирования модифицированной матрицы, блока управления с короткой длительностью фронта импульса (AACT-02), и новых параметров устройства. Донорскую кожу человека брали из морозильника (-67°C) с помещением в нормальный солевой раствор при комнатной температуре. Образцы выдерживали в течение 75 минут для получения состояния равновесия, затем промокали досуха и закрепляли на устройстве для растягивания кожи. На каждом образце сформировали четыре структуры микропор, каждый раз с использованием новой матрицы, и выполнили окрашивание. К головке блока управления прикладывали усилие 3 фунта для всех структур. Длительность фронта импульса записывали для каждого импульса на каждой из структур.
|
Средние глубины постоянно находились в пределах заданного диапазона, и распределение глубин выглядело очень схожим с распределением, полученным первыми прототипами систем. Во всех конфигурациях с плоскостными матрицами, испытанных на человеческой донорской коже, отдельные микропоры маркировались как не поддающиеся измерению («n/m»). В прежних конфигурациях с плоскостными матрицами большинство n/m-микропор были просто слишком мелкими для измерения. Представлялось, что нить оставляла в коже вмятину, которая наполнялась красящим веществом, но не имела ощутимой глубины. В данном тесте, однако, большинство n/m-микропор имели количественные различия. Представлялось, что нить формировала микропору с заметной глубиной, но когда матрицу снимали, казалось, что края микропоры складывались один на другой. Под микроскопом данные n/m-микропоры выглядели как щели. Хотя n/m-микропоры, наблюдавшиеся во время данного теста, вероятнее всего, были микропорами, остается неясным, пригодны ли данные микропоры для доставки. Данные «сложенные» микропоры относятся к типу микропор, которые можно измерять с использованием флуоресцентных индикаторных веществ и/или вышеописанных методик с конфокальными микроскопами.
Пример 3
Данный пример демонстрирует возможность доставки лекарственного вещества с небольшими молекулами, гидроморфина, через биологическую оболочку с использованием системы формирования микропор.
Все химические вещества приобретали у фирмы Fisher Scientific, кроме гидроморфина (Sigma). Безволосые мыши (красящее вещество: SHK1) были получены из лаборатории Charles River Labs (Wilmington, MA). Обеспечили систему формирования микропор в соответствии с объектом настоящего изобретения и использовали для формирования микропор в роговом слое (75 микропор/см2). Образцы кожи закрепляли в ячейках Franz Cells, которые вмещают донорную фазу в верхней камере и рецепторную фазу в нижней камере, при этом образец кожи закрепляли между двумя камерами. Для анализа образца применяли систему HP/Agilent 1100 HPLC.
Донорный отсек содержал 10-мг/мл гидрохлорид гидроморфин, если не указано иное. Как донорный, так и рецепторный отсеки содержали 50-мМ фосфатный буфер с pH 7,5. Кожу безволосой мыши заготавливали непосредственно перед экспериментами. Кожу безволосой мыши вымачивали в 50-мМ фосфатном буфере для удаления остатков ферментов и крови.
Мышь из группы с микропорами содержала матрицу микропор, сформированных на коже мыши после ее заготовления и промывания. Контрольная группа (с нетронутой кожей) была без микропор. Затем кожу закрепляли на ячейках Franz Cells, наполненных рецепторной фазой. Объем пробы составлял 500 мкл для всех взятых проб, и для замены отобранного объема в рецепторе использовали свежий рецепторный раствор. Пробы в нулевой момент времени отбора брали немедленно после того, как донорную фазу вводили в донорный отсек. Пробы отбирали каждый час в течение 8 часов. Пробы анализировали методом ВЭЖХ с обратной фазой с использованием ультрафиолетового детектирования.
В пробах, взятых из рецепторного отсека, измеряли общее количество доставленного гидроморфина. В первом эксперименте доставку через кожу с микропорами сравнивали с доставкой через нетронутую кожу при концентрации гидроморфина 1 мг/мл. Количество гидроморфина, доставленного на 8 часу через кожу с микропорами, было в 18 раз больше, чем в случае нетронутой кожи при 1 мг/мл.
Затем влияние концентрации в донорном отсеке на доставленное количество оценивали путем испытаний при 0,1, 1,0, 5,0, 10,0 мг/мл. Количество гидроморфина, доставленного через кожу с микропорами на 8 часу при 10 мг/мл, было в 13 раз больше, чем количество, доставленное при 1 мг/мл.
Результаты показали, что формирование микропор является эффективным способом обеспечения доставки гидроморфина через свежую вырезанную кожу безволосой мыши. Поток гидроморфина через нетронутую кожу был минимальным. Интенсивность потока и доставленное количество пропорциональны концентрации раствора гидроморфина в донорном отсеке в течение 8-часового периода времени.
Пример 4
Данный пример демонстрирует способность системы формирования микропор воспроизводить доставку при подкожной инфузии инсулина. Приобрели безволосых крыс, и вводили им дозы инсулина в соответствии с нижеописанными режимами. Затем контролировали концентрацию инсулина в сыворотке крови крыс через заданные интервалы времени для обеспечения профиля концентрации инсулина в сыворотке крови.
Контрольный тест
Трем безволосым крысам дозировали 1 единица/кг (ЕД/кг) инсулина подкожным введением. Концентрацию инсулина в сыворотке крови крыс контролировали. Определяли среднюю концентрацию инсулина в сыворотке крови для трех крыс. Кривая средней концентрации инсулина в сыворотке крови (нг/мл) для трех крыс в зависимости от времени приведена на фигуре 4.
Тест 1
Пять безволосых крыс были получены от Charles River. Катетеризацию яремной вены выполняли за сутки до эксперимента, чтобы животные могли восстановиться от хирургического вмешательства.
Эксперимент проводили следующим образом. Крыс анестезировали непосредственно перед обработкой кожи, которая заключалась в очистке стороны брюшка кожи крысы тампоном со спиртом. Давали время для высыхания брюшка на воздухе.
После высыхания брюшка размещали продольно систему формирования микропор и размечали нижние уголки на очищенном месте кожи. Затем формировали микропоры на очищенном месте кожи с использованием системы формирования микропор. После формирования микропор снимали систему формирования микропор и размещали аппликатор с емкостью для жидкости в области с микропорами. Затем аппликатор наполняли дозой инсулина 50 IU/мл и сразу отбирали пробу в нулевой момент времени. Остальные пробы отбирали по заданному графику.
После взятия пробы на 4-м часу крыс анестезировали, чтобы извлечь донорный раствор из аппликатора с емкостью для жидкости. Отбор проб крови продолжали до 8-го часа.
Определяли среднюю концентрацию у пяти крыс и составляли профиль концентрации инсулина в сыворотке. На фигуре 5 приведена диаграмма, показывающая зависимость средней концентрации инсулина в сыворотке крови (нг/мл) от времени для вышеуказанных контрольных крыс и крыс в данном тесте. Как можно видеть на фигуре, у крыс, которым инсулин доставляли чрескожно через микропоры, наблюдалась более высокая средняя концентрация инсулина в сыворотке крови. Крысы в тесте 1 показали также большую продолжительность более высокой средней концентрации инсулина в сыворотке. Аппликатор накладывали на крыс в течение четырех часов, и профиль свидетельствует о высокой концентрации инсулина в продолжение данных четырех часов, причем концентрация снижается только после снятия аппликатора.
Следовательно, данный тест показывает, что результатом чрескожного введения инсулина крысам является более высокая средняя концентрация инсулина в сыворотке крови в течение более длительного периода времени по сравнению с концентрацией у крыс, которым инсулин вводили подкожно.
Тест 2
Четыре безволосые крысы были получены от Charles River. Катетеризацию яремной вены выполняли за сутки до эксперимента, чтобы животные могли восстановиться от хирургического вмешательства.
Эксперимент проводили следующим образом. Крыс анестезировали непосредственно перед обработкой кожи, которая заключалась в очистке стороны брюшка кожи каждой крысы тампоном со спиртом. Давали время для высыхания брюшка на воздухе.
После высыхания брюшка размещали продольно систему формирования микропор и размечали нижние уголки на очищенном месте кожи. Затем формировали микропоры на очищенном месте кожи с использованием системы формирования микропор. После формирования микропор снимали систему формирования микропор и размещали аппликатор с емкостью для жидкости на области с микропорами. Затем аппликатор наполняли дозой инсулина 50 IU/мл и сразу отбирали пробу в нулевой момент времени. Остальные пробы отбирали по заданному графику.
После взятия пробы на 4-м часу крыс анестезировали, чтобы извлечь донорный раствор из аппликатора с емкостью для жидкости. Отбор проб крови продолжали до 8-го часа.
В первой части данного теста аппликатор, накладываемый на крысиные брюшки с микропорами, имел площадь 1 см2. Впоследствии тест проводили снова, однако наложенный аппликатор имел площадь 2 см2. В заключение, тест выполняли в третий раз, с аппликатором площадью 3 см2.
Определяли среднюю концентрацию инсулина у четырех крыс для аппликатора каждого размера и составляли профиль концентрации инсулина в сыворотке крови. На фигуре 6 приведена диаграмма, показывающая зависимость средней концентрации инсулина в сыворотке от времени у крыс с аппликаторами разных размеров.
Как можно видеть на фигуре 6, средняя концентрация инсулина в сыворотке крови приблизительно удваивались, когда размер аппликатора увеличивали с 1 см2 до 2 см2. Кроме того, средняя концентрация инсулина также приблизительно удваивались, когда размер аппликатора увеличивали с 2 см2 до 3 см2.
Тест 3
Подготовили трех безволосых крыс и провели с ними испытание согласно процедуре, изложенной в вышеописанном тесте 1. Однако в данном тесте использовали плоскостную систему формирования микропор второго поколения для формирования микропор в брюшке каждой крысы. Кроме того, аппликатор для чрескожной доставки содержал дозу инсулина 50 IU/мл, при наложении на область с микропорами на коже каждой крысы.
Концентрацию инсулина в сыворотке крови контролировали у каждой из крыс через разные интервалы времени. Определяли среднюю концентрацию у трех крыс и составляли профиль концентрации инсулина в сыворотке крови.
На фигуре 7 приведена диаграмма, показывающая зависимость средней концентрации инсулина в сыворотке крови от времени для крыс в тесте 1 и крыс в данном тесте. Как можно видеть на фигуре, у крыс, которым инсулин доставляли чрескожно через микропоры в тесте 1, наблюдалась более высокая средняя концентрация инсулина в сыворотке крови, чем у крыс в данном тесте. Аппликатор накладывали на крыс в течение четырех часов в каждом тесте, и профиль свидетельствует о высокой концентрации инсулина в продолжение этих четырех часов, причем концентрация снижается только после снятия аппликатора.
Интересно отметить, что, хотя концентрация инсулина в сыворотке крови крыс в данном тесте (с плоскостной матричной системой формирования микропор) немного ниже, чем концентрация у крыс в тесте 1 (с системой формирования микропор с пошаговым мультиплицированием), форма профилей является согласованной. Это может быть обусловлено тем, что глубина микропор, сформированных системой формирования микропор с пошаговым мультиплицированием, больше, чем глубина микропор, сформированных плоскостной матричной системой формирования микропор.
Тест 4
Данный тест предназначался для определения любых различий между типами аппликаторов для чрескожной доставки, применяемых для доставки инсулина через микропоры. Подготовили пять безволосых крыс и провели с ними испытание согласно процедуре, изложенной в вышеописанном тесте 1. После формирования микропор у каждой крысы первый прототип аппликатора с емкостью для жидкости накладывали на двух крыс, тогда как аппликатор второго поколения для чрескожной доставки использовали для доставки инсулина трем остальным крысам. Каждый аппликатор содержал дозу инсулина 50 IU/мл при наложении на область с микропорами на коже каждой крысы.
Концентрацию инсулина в сыворотке крови контролировали у каждой из крыс через разные интервалы времени. Определяли средние концентрации у трех крыс и составляли профиль концентрации инсулина в сыворотке крови.
На фигуре 8 приведена диаграмма, показывающая зависимость средней концентрации инсулина в сыворотке крови от времени для крыс, с разделением по поколениям примененных аппликаторов. Как показывают данные, средняя концентрация инсулина была очень схожей для аппликаторов двух типов.
Тест 5
Данный тест был организован для определения влияния концентрации дозы на профиль сывороточного инсулина у безволосых крыс.
Несколько крыс подготовили согласно процедуре, изложенной в вышеописанном тесте 1. У тех крыс, которые имели отверстия доставки, выполненные на брюшке, отверстия доставки были выполнены с использованием первого прототипа системы формирования микропор. Инсулин доставляли крысам с использованием аппликатора доставки второго поколения, содержащего желаемую концентрацию инсулина.
В данном тесте, у трех крыс отсутствовали отверстия доставки. Аппликатор доставки накладывали на брюшки крыс без формирования микропор. Крысы в данной контрольной группе получали дозу инсулина с концентрацией 50 IU/мл.
На других крысах в данном тесте аппликатор доставки содержал инсулин в концентрациях 10 IU/мл (6 крыс), 25 IU/мл (6 крыс), 50 IU/мл (5 крыс) или 100 IU/мл (6 крыс). Концентрацию инсулина в сыворотке крови контролировали у каждой крысы через разные интервалы времени. Определяли среднюю концентрацию у крыс для данной конкретной концентрации инсулина (независимо от того, сформированы или нет отверстия доставки) и составляли профиль концентрации инсулина в сыворотке крови.
На фигуре 9 приведена диаграмма, показывающая зависимость средней концентрации инсулина в сыворотке крови от времени для крыс, с разделением по концентрациям инсулина, использованным в дозе, введенной крысам. Как показывают данные, средняя концентрация инсулина была очень низкой у тех крыс, у которых не были выполнены отверстия доставки. Кроме того, средняя концентрация инсулина в сыворотке крови у крыс, которым вводили дозу инсулина 100 IU/мл, была очень высокой по сравнению с крысами, получавшими другие дозы. Представляет интерес тот факт, что различие между крысами, получающими дозу 50 IU/мл, и крысами, получающими дозу 25 IU/мл, не слишком велико.
Пример 4
Данный пример демонстрирует корреляцию между результатами измерений трансэпидермальной потери влаги (TEWL) и эффективной доставкой гидроморфина.
У группы добровольцев, набранных через IND (Отдел исследования новых лекарств) и зарегистрированных в FDA (Управление по контролю за продуктами и лекарствами США) и соответствующей комиссии по контролю проверок (IRB) для выполнения специальной процедуры, приготовили пробу кожи для формирования микропор. После формирования микропор в коже выполнялось измерение TEWL, и в организм доставляли гидроморфин через аппликатор для чрескожной доставки. Определяли значение устойчивой сывороточной концентрации в период с 1-го до 4-го часа (Css(1-4 час)) для гидроморфина и выполняли измерение TEWL для кожи с микропорами. Измерения TEWL выполняли стандартным устройством для измерения TEWL (фирмы Cyberderm).
Результаты приведены ниже в таблице
|
Более высокое показание Css обычно коррелируется с более эффективной дозой лекарства или по меньшей мере с ощущением у пациента лучшего действия лекарства. В данном примере более высокие значения Css коррелировались с более высокими результатами измерения TEWL. Необходимо следить за тем, чтобы пациент чувствовал себя комфортно, и чтобы температура в помещении постоянно была 70-72°F, при этом можно быть уверенным в отсутствии потоотделения в области кожи с микропорами.
Выше приведено описание объектов изобретения, однако очевидна возможность внесения в них различных изменений. Такие изменения нельзя рассматривать как выход за пределы существа и объема изобретения, и предполагается, что все такие модификации должны охватываться нижеследующей формулой изобретения.