Результат интеллектуальной деятельности: СТАБИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ, ПРОТИВООПУХОЛЕВОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, АКТОПРОТЕКТОРНОЙ, АНТИМУТАГЕННОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к фармацевтической области и касается композиции, обладающей противовирусной, противоопухолевой, иммуномодулирующей, актопротекторной, антимутагенной и антиоксидантной активностью и может быть использовано для сопровождения методов противоопухолевой терапии: устранения послеоперационных осложнений, восстановления после химиотерапии, лучевой терапии, профилактики рецидивов опухолевого заболевания.
УРОВЕНЬ ТЕХНИКИ
Поиск эффективных и безопасных препаратов для лечения заболеваний, характеризующихся высокой летальностью или приводящих к тяжелой инвалидизации пациентов, является одной из важнейших задач медицинской науки. К числу таких заболеваний с неблагоприятным прогнозом относятся, прежде всего, онкологические заболевания, сепсис и ревматоидный артрит. В последние годы наметились определенные позитивные сдвиги в лечении больных с указанной патологией, которые обусловлены появлением более глубоких знаний о патогенезе заболеваний.
На сегодняшний день в клинической практике существует большое количество противоопухолевых препаратов, но эффективность большинства из них недостаточна и поэтому остается актуальным вопрос о разработке новых более активных препаратов, а также поиск веществ, эффективных при опухолях с первичной и приобретенной резистентностью к лекарственной терапии. В связи с этим решение о продвижении нового вещества с противоопухолевой активностью принимается на основании следующих критериев: новый механизм действия, высокая противоопухолевая активность, избирательная цитотоксичность в отношении определенных культур опухолевых клеток in vitro и ксенографтов опухолей человека, отсутствие перекрестной устойчивости с известными веществами.
Постоянно ведется поиск новых препаратов, которые могли бы повысить качество лечения пациентов с онкологической патологией
Всем хорошо известно, что онкологические заболевания лечатся химиотерапевтическими средствами, направленными на подавление роста опухоли и метастазных образований. Кроме того, сами химиотерапевтические средства обладают выраженными негативными свойствами в отношении здоровых клеток тканей организма человека. В частности, нарушается генетическая целостность хромосом, что выражается в резком увеличении регистрируемых хромосомных аберраций при применении химиотерапевтических средств. Другим негативным побочным эффектом является нарушение метаболизма полисахаридов и липидов, в результате которого как в клетке, так и в цитоплазматической жидкости накапливаются токсические продукты метаболизма.
Таким образом, для снижения негативных последствий противоопухолевой терапии требуется дополнительное комплексное оздоравливающее воздействие на организм человека.
В настоящее время значительное внимание для профилактики заболеваний и терапевтического применения уделяется цитокинам -биологически активным факторам пептидной природы, которые вырабатываются клетками иммунной системы и являются ее основными регуляторами. Первоначально интерферон использовался исключительно в качестве противовирусного агента и наиболее успешные клинические терапевтические применения, на сегодняшний день, были в лечении вирусных или связанных с вирусом болезненных состояний. Интерферон гамма также имеет значительные перспективы применения в онкологической практике, что определяется его функцией - стимуляцией и контролем активности цитотоксического противоопухолевого иммунитета. Механизмы противоопухолевой защиты интерферона гамма реализуются посредством активации макрофагов, цитотоксических лимфоцитов, индукции апоптоза раковых клеток, активации антиопухолевого иммунитета. Использование в онкологии связано с иммуномодулирующей активностью интерферона гамма. (О.И. Киселев, Ф.И. Ершов, Э.Г. Деева, "Интерферон гамма: новый цитокин в клинической практике", Ингарон", М-С-Пб, Дмитрейд График групп, 2007).
Так известен интерферон гамма, получаемый из штамма Escherichia coli, содержащего рекомбинантную плазмидную ДНК pGIF315 (RU, №2214832, 2002). Рекомбинантная плазмидная ДНК pGIF315 размером 3,15 тысяч пар нуклеотидов, кодирующая в клетках Escherichia coli рекомбинантный человеческий гамма-интерферон размером 144 аминокислотных остатка с молекулярной массой 16,9 кДа, характеризуется следующими свойствами: содержит между двумя сайтами рестриктазы EcoRI промотор А2 и между сайтами рестриктаз EcoRI и KpnI промотор A3 фага Т7, между сайтами рестриктаз KpnI и XbaI рибосомосвязывающий сайт, между сайтами рестриктаз Xbal и BgIII ген, кодирующий синтез рекомбинантного человеческого гамма-интерферона, между двумя сайтами рестриктазы Xbal терминатор транскрипции, имеет ген устойчивости к ампициллину. Плазмидой pGIF315 трансформирован штамм Е. coli, имеющий lon- и/или ompT-мутации по генам протеаз.
Фактор некроза опухолей - тимозин альфа 1 (далее ФНО-Т) представляет собой гибридный белок, состоящий из фактора некроза опухолей альфа и тимозина альфа 1. Из уровня техники известно получение нескольких гибридных белков (RU, 2077586, 2055896.)
Так же известен препарат, который выпускается под торговым наименованием РЕФНОТ ("Рекомбинантная плазмидная ДНК, кодирующая синтез; способ получения и препарат рекомбинантного гибридного белка α-фактор некроза опухолей-тимозин-альфа1", RU,2225443, 25.07.2002). Технология получения субстанции рекомбинантного гибридного белка α-фактор некроза опухолей-тимозин альфа 1 (далее - ФНО-Т) основана на его микробиологическом синтезе рекомбинантным штаммом Escherichia coli SG 200-50, трансформированным плазмидой pThy. Белок выделяют и очищают колоночной хроматографией. Препарат обладает прямым противоопухолевым действием in vivo и in vitro на различных линиях опухолевых клеток. По спектру цитотоксического и цитостатического действия на опухолевые клетки препарат соответствует фактору некроза опухолей альфа (ФНО) человека, однако, имеет в 100 раз меньшую общую токсичность, чем ФНО.
Сконструированный слитый белок - фактор некроза опухолей-тимозин альфа 1 (ФНО-Т) имеет удельную цитотоксичность на клетках фибросаркомы L-929 2000000 ЕД на мг белка и проявляет большое иммуностимулирующее действие. По спектру и активности цитотоксического и цитостатического действия на опухолевые клетки препарат ФНО-Т не уступает, а на некоторых опухолях превосходит ФНО человека. При этом ФНО-Т имеет в 100 раз меньшую общую токсичность, чем ФНО, что подтверждено клиническими испытаниями. Клинические исследования I фазы, проведенные в Российском онкологическом научном центре им. Н.Н. Блохина РАМН, г.Москва, «Изучение безопасности, переносимости и эффективности препарата РЕФНОТ у пациентов с плоскоклеточным раком головы и шеи» в отделении «Опухолей головы и шеи» (зав. отделением: д.м.н., проф. Любаев В. Л.), показали низкую токсичность Рефнота при интратуморальном введении в дозах до 800000 ЕД (400 мкг) на одну инъекцию онкологическим пациентам с опухолями головы.
Значимой эффективности для использования в онкологии можно достичь, комбинируя интерферон гамма и ФНО. Из доклинических исследований известен синергизм ФНО и ряда цитостатиков (Balkwill, 1987, Takahashi, 1995, Mareel, 1988, Rosen 1992). Однако вследствие выраженной системной токсичности ФНО эти синергичные комбинации мало изучены. В тех исследованиях, которые были проведены, наблюдались выраженные системные реакции, вызванные вазоплегией, что вело к плохой васкуляризации и ухудшению биодоступности препаратов, в первую очередь, ФНО (Mayer, 1995, DeBlasi, 2005). Неудивительно, что в 1986-1987 исследования рекомбинантного ФНО были приостановлены из-за выраженной системной токсичности и отсутствия удовлетворительной эффективности лечения.
Интерферон гамма, так же как и ФНО-Т выпускаются для внутривенного, внутримышечного или подкожного введения. Как правило, пероральный путь введения препаратов ИФНов не применяется, поскольку считается, что под действием протеолитических ферментов интерфероны разрушаются (инактивируются) и не всасываются в нативной форме. (Кантелл и  , JGen. Virol, 1973 20: 97-104; Gilson и др, J ИФН Res, 1985 5: 403-408)
, JGen. Virol, 1973 20: 97-104; Gilson и др, J ИФН Res, 1985 5: 403-408)
В зарубежных научных публикациях последних лет появился ряд сообщений о противовирусной, противоопухолевой эффективности перорального введения низких доз рекомбинантного ИФН (мышиного и человеческого) у мышей и положительных иммунологических и клинических сдвигах у больных СПИДом, рассеянным склерозом и диабетом I типа при длительном применении низких доз рекомбинантного человеческого интерферона (104-3⋅104 ME). (Satoh Y., Kasama К., Yimin et al. - Involvement of hypothalamic pituitary adrenal (HPA) axis in an induction of 2-5 OAS by low dose oral administration of interferon β in mice. - J. of Interferon & Cytokine Research. 1999, v. 19, p. 125.; Brod S.A., PhanT., Katz S. et al. - Ingest IFN a delays islet allograft rejecting. - J. of Interferon & Cytokine Research. 1999, v. l9, p. 124.; Brod S., Vriesendorp F.J., Ann C. et al. - Ingested IFNα decreases new MRI brain lesions in relapsing-remiting multiple sclerosis (RRMS). European Cytokine Network. 2000, v. 11, p. 154)
Лимитирующим фактором при использовании препаратов является развитие побочных эффектов в результате проводимой терапии. Большинство побочных эффектов являются дозозависимыми. Так, не рекомендуется вводить ИФН-гамма в дозах более 108 ME по причине развития высокой лихорадки, возникающей через 30-60 минут после внутривенного введения. Введение больших доз приводит также к метаболическим нарушениям (гиперкалиемии, повышению уровня мочевины, креатинина, аспарагиновой аминотрансферазы). У небольшого количества пациентов появляются ишемические проявления, аритмия.
Известно лечение низкими дозами интерферона иммунорезистентных болезней, гипераллергенности, аутоиммунных расстройств, вирусных инфекций. (WO 1988/003411, 19.05,1988; US 5019382 A, 28.05.1991; RU 2277932, С2, 24.09.2004; RU, 2191594 С1, 03.04.2001). Описано применение низких доз интерферона при терапии рака в сочетании с введением лучевой терапии или химиотерапии. ИФН-гамма может быть введен в ротовую полость, наиболее предпочтительно, сублингвально или трансбуккального, или их можно вводить парентерально. Интерферон также можно вводить путем перорального введения лекарственного средства, интраназально, например, путем ингаляции порошка или диспергированных капелек жидкости, или местно.
Из уровня техники так же известно использование низкодозовых средств, для лечения злокачественных новообразований. (RU, 2475865, 04.05.2010). Эффект сверхмалых доз изучали при использовании широкого спектра воздействующих факторов: противоопухолевых агентов, гормонов, иммуномодуляторов, антиоксидантов и др. (Бурлакова.Е.Б., Вести РАН 1994 т. 64. №5 с. 425).
Принято считать, что лечение заболеваний человека осуществляется путем введения дозы соединений, выбранной для тормозящего действия причин и/или симптомов указанного состояния. Тем не менее, этот принцип иногда неэффективен и часто появляются побочные эффекты, такие как непереносимость или аллергические реакции. Поэтому, в настоящее время, предпринимаются попытки по созданию новых препаратов обладающих лечебным эффектом и минимальным побочным действием.
Известно лечение иммунорезистентной болезни низкой дозой интерферона, когда опухолевые заболевания, гипераллергенность, аутоиммунные расстройства, вирусные инфекции лечат путем введения интерферона в дозе приблизительно от 0,1 до 5 ME/фунт в день путем контактирования интерферона со слизистой оболочкой глотки. Интерферон вводят в растворе или в новой твердой лекарственной форме, адаптированной для растворения в слюне при его попадании в рот (US 5019382, А, 28.05. 1991).
Использование низких доз интерферона известно при лечении опухолевых заболеваний (US 5019382, А, 06.11. 1986). Опухолевые заболевания, аутоиммунные расстройства, вирусные инфекции лечат путем введения интерферона в дозе от 0,2 до 12 МЕ/кг в день. Интерферон вводят в растворе или твердой лекарственной форме, адаптированной для растворения в слюне при его попадании в рот.
Известна таблетка для рассасывания, обладающая противовирусным действием содержащая ИФН в количестве 1/5-1/20 его разовой терапевтической дозы и один из рекомбинантных человеческих генно-инженерных интерферонов в количестве 500-1000 ME в соотношении 2:1-3:1 и вспомогательные вещества, при этом таблетка имеет массу 0,6-0,7 г, диаметр не менее 12 мм, высоту 2-3 мм (RU2277932, С2, 2004,А61К 38/21).
Известно средство, обладающее иммуномодулирующим, противомикробным, антиоксидантным и регенерирующим действием (RU, 2255760, опубл. 11.03.2003, А61К 38/21). В данном изобретении, предложено лекарственное средство и варианты выполнения его в виде различных лекарственных форм для перорального, парентерального и наружного применения (таблетки, спреи, растворы, гели), для введения на слизистые оболочки (суппозитории) на основе природного и рекомбинантного интерферонов (альфа, гамма, бета), лизоцима и эмоксипина. Эмоксипин в данном средстве выполняет функцию антиоксиданта. Однако данные свойства эмоксипина проявляются преимущественно в условиях гипоксии. В таблетированной форме этого средства для перорального применения содержится большое количество лактозы (0,3 г). Как известно, лактоза у многих пациентов вызывает нарушение пищеварения из-за сниженной активности или отсутствия соответствующего фермента - лактазы. При изготовлении препарата в форме таблетки возможна дестабилизация интерферона, поскольку при таблетировании под давлением происходит существенное повышение температуры.
Наиболее близким техническим решением является фармацевтическая композиция в форме капсулы, обладающая противовирусным и антимикробным действием, (патент RU №2292907 С1, 2007, А61К 38/19, А61К 9/20), которая представляет собой смесь для формирования содержимого капсулы, содержит рекомбинантный человеческий интерферон-α набухающее вещество и целевые добавки при следующем содержании компонентов в 1,0 г состава:

Препараты рекомбинантных и природных цитокинов традиционно используются в высоких дозах парентерально (в/м, п/к или в/в) в лечении гепатитов В и С, рассеянного склероза и различных онкологических заболеваний. Причем известно, что парентеральное применение препаратов в высоких дозах сопряжено, как правило, с развитием гриппоподобного синдрома: повышение температуры тела, ломота, артралгия, катаральные явления, головная боль. Пероральный путь введения препаратов ИФНов не применяется, поскольку считается, что под действием протеолитических ферментов ЖКГ интерфероны разрушаются (инактивируются) и не всасываются в нативной форме.
Задачей настоящего изобретения является создание стабилизированной композиции, обладающей противовирусной, противоопухолевой, иммуномодулирующей, актопротекторной, антимутагенной и антиоксидантной активностью, имеющей хорошую переносимость, минимальный побочный эффект и обладающей активностью для использования в комплексном лечении онкозаболеваний, а так же улучшающей качество жизни больного, при этом сама стабилизированная композиция сохраняет свои свойства при хранении в нормальных условиях и условиях заморозки, а также выдерживает кратковременные воздействия высокой температуры.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению, заявлена стабилизированная композиция, обладающая противовирусной, противоопухолевой, иммуномодулирующей, актопротекторной, антимутагенной и антиоксидантной активностью. Стабилизированная композиция помимо прямого терапевтического действия имеет хорошую переносимость, минимальный побочный эффект, а также улучшает качество жизни человека. При этом такие лекарства не требовательны к условиям хранения (хранятся при комнатной температуре).
При этом композиция имеет срок годности, приемлемый для использования в фармацевтическом производстве, а также технологична для такого производства.
Заявленная стабилизированная композиция, обладает противовирусной, противоопухолевой, иммуномодулирующей, актопротекторной, антимутагенной и антиоксидантной активностью, представляет собой кислотоустойчивую капсулу, содержащую стеарат кальция, аэросил, микрокристаллическую карбоксиметилцеллюлозу, крахмал, лактозу, порошек виноградных косточек, маннит и в низких дозах лиофилизаты человеческого рекомбинантного интерферона гамма и фактора некроза опухоли - тимозин альфа 1, при следующих соотношениях компонентов (масс%):
|
Лиофилизат человеческого рекомбинантного интерферона гамма может быть получен из субстанции интерферона гамма, выделенного из штамма продуцента Е. coli трансформированного плазмидой pGIF315
Лиофилизат рекомбинантного фактора некроза опухоли- тимозина альфа может быть получен из субстанции фактора некроза опухолей-тимозина альфа1, выделенного из штамма продуцента Escherichia coli, трансформированного плазмидой pThy316.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для получения заявляемого препарата использовали интерферон гамма «Ингарон» фирмы ООО «НЛП «Фармаклон» и Sigma, а рекомбинантный фактор некроза опухолей-тимозин альфа 1 «РЕФНОТ» фирмы ООО «Рефнот-Фарм».
Лекарственные формы, объединяющие в своем составе ФНО-Т и интерферон гамма, которые могут применяться при лечении заболеваний, в том числе в онкологии, обладающие минимальным побочным действием, не известны из уровня техники.
Средства на основе белка часто должны иметь высокую концентрацию для достижения эффекта, что создает много проблем, включающих изготовление, сохранение устойчивости, активности, что особенно характерно для белков.
Поэтому экспериментальным путем были определены границы количественного содержания белков, а также количественный и компонентный состав необходимый для их стабилизации в этих границах.
Нами было неожиданно обнаружено, что именно порошок виноградных косточек, лактоза, маннит, стеарат кальция, аэросил, микрокристаллическая карбоксиметилцеллюлоза в заявленном количестве по изобретению, могут уменьшить или предотвратить как воздействие внешних факторов, так и отрицательное взаимодействие/реакцию между биологически активными белками, содержащимися в лекарственном средстве, путем формирования стабильного комплекса.
Настоящее изобретение главным образом направлено на низкодозовые композиций цитокинов и их использование для профилактики и лечения, в т.ч. при терапии рака в сочетании с проведением лучевой терапии или химиотерапии.
Настоящее изобретение позволяет использовать низкие дозы ФНО-Т (от 4000 до 20000 ЕД на капсулу) и интерферона гамма (от 10000 до 50000МЕ на капсулу). Стабилизированная композиция по настоящему изобретению, в форме капсул может быть использована в комбинации с другими видами терапии, например, в случае лечения рака в сочетании с хирургическим удалением опухоли, терапии или лучевой терапии или химиотерапии, или в случае микробных заболеваний в комбинации с антибиотиками. Капсула выполнена кислотоустойчивой или с кислотоустойчивым покрытием. Дело в том, что инъекционная форма введения сопровождается локальными негативными явлениями: болезненное раздражение и воспаление в месте введения, уплотнение подкожных слоев, приводящее к снижению всасывания ЛС, требующие постоянной смены места инъекций; риск внесения инфекции. Предлагаемая пероральная форма лишена указанных недостатков, что позволяет вести прием лекарственного средства пациентом самостоятельно и улучшает качество жизни пациента. Применение кислотоустойчивых капсул позволяет лекарственным веществам миновать протеолитическое расщепление в желудке. Кроме того, капсула позволяет порошкам одновременно быть в компактной, но не спрессованной форме, таким образом сочетать преимущества таблеток (компактность) и порошков (быстрое растворение и всасывание лекарственного препарата), то есть капсула обеспечивает повышение биодоступности и стабильности компонентов.
В известных клинических схемах лечения используется раздельное инъекционное введение препаратов ФНО-Т и гамма-интерферона. При этом препараты используются последовательно, и их прием разнесен во времени.
В предлагаемой нами лекарственной форме оба биологически активных соединения поступают в организм одновременно, что усиливает синергизм их действия. В результате заявленная форма позволит снизить используемые дозировки основных действующих веществ, сохранив при этом общий цитокинетический эффект (показано увеличение экспрессии кластеров дифференциации на поверхности Т- и В-лимфоцитов, усиление экспрессии генов гистосовместимости I класса), а также снизить воспалительную интоксикацию.
За счет одновременного постепенного (пероральный способ введения) поступления в организм в малых дозах (максимум 50000 ME в капсуле и 20000 ЕД в капсуле) интерфероном гамма с ФНО-Т обладают мягким цитотоксическим эффектом и не проявляют токсичности, зарегистрированной при использовании монокомпонентных препаратов с инъекционным способом введения. ФНО-Т и интерферон гамма способствуют установлению и поддержанию достаточно высокого (терапевтического, но не токсического) уровня ФНО в крови человека, что обеспечивает функцию самокоррекции иммунных процессов в организме и активизирует разрушение опухолевой ткани на фоне отсутствия нежелательных реакций
При использовании простой смеси лиофилизированных порошков ФНО-Т и интерферона гамма при пероральном введении животным (в виде капсул №5) было отмечено, что количество фармацевтически активного компонента, поступающего в кровь и ткани животного, составляло не более 5% общего количества введенного материала. Исследования проводились методом ИФА. После использования кишечнорастворимых капсул со стабилизированной композицией, было установлено, что концентрация активных компонентов в тех же биологических объектах составила 20% введенного количества в среднем по выборке и до 35% в отдельных случаях. Таким образом, было показано, что введение в состав смеси шрота виноградной косточки повышает биодоступность основных компонентов.
Благодаря оптимально подобранному составу заявляемой композиции, удалось повысить биодоступность активных компонентов. А за счет совокупности всех заявляемых компонентов удалось получить технологически стабильный продукт.
Для получения стабилизированной композиции готовили навески лиофилизатов цитокинов, которые смешивали с порошком виноградных косточек, аэросилом, крахмалом, стеаратом кальция, микрокристаллической карбоксиметилцеллюлозой, лактозой, маннитом. Затем, полученную композицию загружали в кислотоустойчивые капсулы №1 по 0,2 г.
Количества человеческого рекомбинантных белков - интерферона гамма и ФНО-Т в соответствующих лиофилизатах определяли методом твердофазного иммуноферментного анализа с использованием коммерческих наборов реактивов фирмы Вектор-Бест (Новосибирск). В наборах использован "сэндвич" вариант твердофазного иммуноферментного анализа. Для реализации этого варианта для каждого компонента использованы два моноклональных антитела с различной эпитопной специфичностью. При подготовке проб для анализа содержимое капсулы помещали в пробирку и добавляли 2 мл натрий-фосфатного буфера, перемешивали, оставляли на 30 минут. Проводили стерилизующую фильтрацию полученной суспензии. Пробу передавали на испытание.
Биологическую активность интерферона гамма и ФНО-Т в капсуле и стабильность капсулы определяли, используя линию клеток Vero для интерферона гамма и линию L 929 для ФНО-Т.
Для оценки стабильности при хранении использовали методы контроля биологической активности заявляемой композиции при различных температурах хранения: противовирусной активности интерферона гамма и цитотоксической активности ФНО-Т. Для этого использовали 2 серии стабилизированной композиции, полученных по примерам 1, 2, 3. Каждую из композиций разделяли на три равные группы и помещали на хранение в различные температурные условия: при стандартных условиях (+25°С), при плюс 30°С, при плюс 35°С.
В течение первого месяца исследований пробы для контроля из разных групп отбирали еженедельно. В течение полугода - ежемесячно. В дальнейшем отбирали аналитические образцы один раз в три месяца.
Оценку противовирусной активности интерферона гамма при хранении проводили с использованием тест-системы in vitro на культуре клеток линии Vero. В качестве тестового вируса в нашем исследовании использовали вирус везикулярного стоматита (ВВС). Доза ВВС бралась в концентрации 10 ТЦД50. Пробоподготовку проводили, растворяя 200 мг композиции первой и второй серии соответственно в 1 мл воды для инъекций.
Для исследования противоопухолевой активности фактора некроза опухоли- тимозин альфа 1 использовали линию клеток L-929.
Концентрацию клеток в тест-системе в обоих случаях брали из расчета (2-2,5)×106. В случае оценки противоопухолевой активности использовали визуальный метод подсчета нарушений монослоя в результате губительного действия фактора некроза опухоли тимозин альфа 1 на клетки этого монослоя.
В качестве образцов сравнения использовались следующие специально приготовленные лиофилизированные смеси: субстанция гамма интерферона человеческого рекомбинантного в среде фосфатно-солевого буфера с активностью 100000 МЕ/мл; субстанция фактора некроза опухоли тимозин альфа 1 в среде фосфатно-солевого буфера с активностью 50000 ЕД/мл. Оценку активности простой смеси интерферона гамма и ФНО-Т в фосфатно-солевом буферном растворе провести вышеуказанными методами оказалось затруднительно. Вероятно, это связано с комплексным влиянием компонентов на клеточные линии, приводящему к сильному искажению результатов. Поэтому для количественной оценки активности компонентов был применен способ ингибирования компонента, контроль активности которого не проводился. Так при контроле активности гамма интерферона на линии клеток Vero, ФНО-Т предварительно ингибировался при помощи специфических моноклинальных антител. Аналогично при проверке активности ФНО-Т на линии клеток L969 ингибировалось действие интерферона гамма.
Специфическую активность цитокинов определяли по нижеприведенной методике.
Интерферон гамма определяли на культуре клеток Vero в присутствии специфических моноклональных антител к ФНО или ФНО-Т.
Для испытания объединяют содержимое 10 капсул. Из полученного объема порошка делают водное извлечение, которое фильтруют через ацетатцеллюлозный фильтр 0,22 мкм.
Готовят сначала последовательные десятикратные разведения 1:10, 1:100, 1:1000, после чего проводят двухкратные разведения: 1:2000, 1:4000, 1:8000, 1:16000, 1:32000, 1:64000, 1:128000 исследуемых образцов стабилизированной композиции и ОСО активности (активность которого выражена в международных единицах - МЕ-ОСО активности 42-28-90-67) в ростовой среде с добавлением моноклональных антител к ФНО (или ФНО-Т). Из планшета с монослоем клеток удаляют среду и вносят в лунки по 0,1 мл последовательных разведений образцов стабилизированной композиции. На каждое разведение образца стабилизированной композиции используют не менее 4 лунок с культурой клеток. 4 лунки с культурой оставляют в качестве контрольных. Кроме того, 16 лунок оставляют для контроля дозы индикаторного вируса. В эти лунки вносят по 0,1 мл поддерживающей среды. Инокулированные и контрольные культуры клеток инкубируют в течение 1 сут при (37±1,0)°С в атмосфере с (5,0±0,5)% СО2, под контролем дозы вируса.
Учет определения активности интерферона проводят, когда доза внесенного вируса соответствует 100 ТЦД50. Если доза вируса, соответствующая 100 ТЦД50, рассчитана на основании учета результатов через 24 ч после заражения, то учет титрования интерферона также можно проводить через 24 ч под микроскопом. Учет результатов опыта возможен, если нет признаков дегенерации в контрольной культуре. За титр интерферона принимают величину, обратную разведению образца стабилизированной композиции, при котором клеточная культура в 50% лунок оказалась полностью защищенной от цитопатического действия вируса. Пересчет активности ME осуществляется по известным формулам.
ФНО-Т определяли на культуре клеток L929 в присутствии специфических моноклональных антител к интерферону гамма.
Для испытания объединяют содержимое 10 капсул. Из полученного объема порошка делают водное извлечение, которое фильтруют через ацетатцеллюлозный фильтр 0,22 мкм.
Готовят сначала последовательные десятикратные разведения 1:10, 1:100, 1:1000, после чего делают двукратные разведения: 1:2000, 1:4000, 1:8000, 1:16000, 1:32000, 1:64000, 1:128000, исследуемых образцов стабилизированной композиции в ростовой среде с добавлением моноклональных антител к ИФН-гамма человека. Из планшета с монослоем клеток удаляют среду и вносят в лунки по 0,1 мл последовательных разведений образцов стабилизированной композиции и по 0,1 мл поддерживающей среды с актиномицином Д. На каждое разведение образца стабилизированной композиции используют не менее 4 лунок с культурой клеток. 4 лунки с культурой оставляют в качестве контрольных. Культуру клеток инкубируют в течение 1-2 сут при (37±1,0)°С в атмосфере с (5,0±0,5)% CO2.
Учет результатов проводят через 24 часа (предварительно) в том случае, если не наблюдается микроскопических признаков дегенерации монослоя в контрольных лунках. Окончательный учет результатов проводят через 48 часов.
Монослой отмывают от погибших клеток стерильным физиологическим раствором и окрашивают 0,2% раствором кристаллического фиолетового. Учет проводят визуально (под микроскопом) или аппаратно (спектрофотометрически, на планшетном спектрофотометре, при длине волны 540 нм).
За 1 ЕД принимают количество образца стабилизированной композиции, которое вызывает 50% повреждение клеток (или двукратное падение значение оптической плотности по отношению к оптической плотности контрольных лунок) в стандартных условиях.
Расчет активности проводят по известным формулам.
В результате проведенной оценки стабильности заявляемой композиции при хранении было установлено, что:
1. Исходная активность приготовленных растворов сравнения соответствует ожидаемой и равна по своей величине образцам сравнения, содержащим какое-либо одно активное вещество, находящееся в стандартных условиях.
2. При хранении в заданных условиях в течение первого месяца контрольные образцы, содержащие только человеческий рекомбинантный интерферон гамма независимо от состава буферной смеси теряли до 70% активности при хранении в комнатных условиях и полностью дезактивировались при температурах 30°С и 35°С.
3. При хранении в заданных условиях в течение первого месяца контрольные образцы, содержащие только фактор некроза опухоли тимозин альфа 1, теряли до 20% свой активности при хранении при комнатной температуре, до 40% при хранении при 30°С и дезактивировались до активности менее 50% от первоначальной при длительном воздействии высокой температуры. Таким образом, ФНО-Т оказался более стабильным, чем интерферон гамма, что вероятно связано с его структурой.
4. Стабилизированная композиция сохраняла начальную активность своих белковых компонентов в течение первого месяца на уровне первоначальной при всех температурных условиях хранения.
5. В течение трех лет стабилизированные композиции сохраняли свою термостабильность при хранении при плюс 25°С и при плюс 30°С. При хранении в течение более трех лет при 35°С была зафиксирована потеря до 10% активности.
Таким образом, было подтверждено, что заявляемая композиция является стабильной и сохраняет свои свойства при хранении при температуре окружающей среды до плюс 30°С в течение 3 лет.
Для подтверждения заявленных свойств стабилизированной композиции, а именно, противовирусной и противоопухолевой активности, были проведены эксперименты на моделях in vivo (крысы, мыши). В результате были дополнительно выявлены антимутагенные, иммуномодулирующие, антиоксидантные и актопротекторные свойства заявляемой стабильной композиции. Противовирусная активность стабильной композиции была показана на клеточных моделях in vitro.
Для определения противоопухолевой активности заявляемой стабильной композиции использовались мыши-самцы линии BDFI весом 19-22 г с перевитой эпидермальной карциномой легкого Льюис (LLC) объемом около 1,6 см3. В эксперименте использовали три группы животных по 20 особей в каждой. Контрольной группе (Г1) давали плацебо, помещенное в капсулы №5. Экспериментальной группе (Г2) давали заявляемую стабильную композицию per os. Экспериментальная группа Г3 получала терапию по схеме Рефнот+Ингарон в/м. Дозировку исследуемого состава предварительно корректировали с учетом объема капсул и количества единиц активности на массу тела животного. Оценивали рост транспонированных LLC во всех группах после однократного и многократного (ежесуточного) перорального (при помощи зонда) введения капсул.
Для оценки антиоксидантной активности заявляемой стабильной композиции исследовалась динамика накопления малонового диальдегида (МДА). Предварительно животные Г3 типировались по уровню фоновой активности природных антиоксидантов: глутатион, аскорбат, токоферол.
Для оценки состояния опухоли использовали уровень альфа фетопротеина(АФП).
При сравнении указанных показателей у животных, получавших комбинированную терапию ФНО-Т и интефероном гамма (Рефнот+Ингарон) внутримышечно и капсул №5, с заявляемой композицией перорально было показано устойчивое и длительное снижение уровней МДА и АФП у животных Г2. В это же время у животных Г1 уровень АФП снижался медленнее, а концентрация МДА оставалась на первоначальном уровне в течение всего срока терапии.
На основании приведенного исследования можно сделать вывод, что пероральное применение заявляемой стабильной композиции обладает антиоксидантной и противоопухолевой активностью, по всей видимости, обусловленной синергическим действием интерферона гамма, фактора некроза опухоли тимозин альфа 1 и порошком виноградной косточки.
При обработке полученных данных было установлено, что применение компонентов в виде лиофилизатов с более низким содержанием цитокинов приводит не к уменьшению, а к возрастанию их специфической активности и воздействия на организм мышей. Однако, как показали проведенные исследования, такая активность цитокинов, проявляется только в заявляемой стабилизированной композиции, которая помимо молекул интерферона гамма и фактора некроза опухоли - тимозин альфа 1 содержит также шрот виноградной косточки. В серии дополнительных исследований, когда оценивалось влияние только смеси активных белковых компонентов без присутствия виноградной косточки, эффекта увеличения активности не наблюдалось. Со снижением дозы активных веществ суммарный эффект в этом случае также снижался практически до уровней, демонстрируемых контрольными группами животных.
Как показали проведенные исследования, белки интерферон гамма и ФНО-Т обладают разными физико-химическими свойствами, и создание комбинированных лекарственных форм с этими белками вызывает трудности. Возможно, это обусловлено тем, что оптимальные условия проявления биологической активности интерферона гамма и ФНО-Т не идентичны. Например, человеческий рекомбинантный интерферон гамма стабилен и хранится при рН 6,0-6,5, тогда как ФНО-Т лучше работает в нейтральных и слабощелочных условиях (рН 7,0-7,5). То, что разные белки ведут себя по-разному, связано с их аминокислотным составом (первичной структурой) и физико-химическими свойствами.
Однако, при создании заявляемого изобретения, был проведен целый ряд экспериментов, позволивших преодолеть имеющиеся трудности. В процессе проведения исследований было неожиданно установлено, что введение в состав композиции, совместно с лиофилизатами интерферона гамма и ФНО-Т, шрота виноградной косточки существенно усиливает проникновение цитокинов через стенку кишечника, повышая, таким образом, биодоступность активных компонетов. Исследования показали, что в заявляемой композиции, виноградные косточки, рекомбинантный интерферон гамма и ФНО-Т, обладают выраженным синергическим эффектом, при этом специфическая активность каждого цитокина была равна теоретической величине.
Известно, что при введении цитокинов (интерферона гамма и ФНО-Т) возникает иммунный ответ, который сопровождается активацией свободно радикального окисления, что в свою очередь дезактивирует действие цитокинов. Однако, в заявляемой композиции при совместном действии цитокинов с виноградной косточкой данный дезактивирующий эффект отсутствует, что позволяет судить об антиоксидантном действии. По всей видимости, это обусловлено тем, что в данной композиции биологически активные вещества виноградной косточки выступают в качестве «ловушек свободных радикалов», т.к. в свою очередь эти свободные радикалы пагубно влияют на интерферон гамма и ФНО-Т. Поэтому удалось не только снять побочные эффекты, но и получить длительный синергетический эффект. Данное предположение было подтверждено ниже приведенными экспериментальными данными.
Для подтверждения противоопухолевого свойства заявляемой композиции (в форме капсулы) был проведен эксперимент, в котором использовались мыши-самцы линии BDFI весом 19-22 г с перевитой эпидермальной карциномой легкого Льюис (LLC) обьемом около 1,6 см3. В эксперименте использовалитри группы животных по 20 особей в каждой.
Дополнительно проводились исследования, направленные на выявление возможности применения заявляемой стабильной композиции для профилактики онкосостояний (антимутагенные свойства).
При исследовании антимутагенных свойств заявляемой стабильной композиции, в качестве метода контроля воздействия заявляемой композиции, был применен давно известный и широко применяемый метод учета хромосомных аберраций. В качестве положительного контроля использовался препарат циклофосфан, который, как известно, не только применяется в качестве химиотерапевтического средства при лечении онкологических заболеваний, но и в экспериментальных работах используется в качестве эталонного мутагена.
В этом эксперименте циклофосфан вводили мышам линии balb-c. Для введения использовали капсулы №5, приготовленные по примеру 1, предварительно смоченные водой для того, чтобы оболочка стала мягкой и легко проходила пищевод животного. По истечении контрольного времени животных усыпляли и собирали биологический материал для лабораторного исследования методом учета хромосомных аберраций. Всех животных делили на три равные группы. Первую группу никаким воздействиям не подвергали и использовали, как контрольную. Вторую группу обрабатывали только циклофосфаном, а животным из третьей группы дополнительно давали стабилизированную композицию, полученную по настоящему изобретению.
В результате проведения эксперимента было установлено, что у животных группы положительного контроля наблюдается резкое увеличение регистрируемого уровня хромосомных аберраций, тогда как в группе, получающей как мутаген, так и заявляемую стабильную композицию, этот уровень достоверно ниже, хотя и превышает контрольные значения.
Таким образом, было экспериментально подтверждено, что использование заявленной стабилизированной композиции снижает уровень хромосомных аберраций, возникающих в результате действия химиотерапевтического медикаментозного средства «циклофосфан». Тем самым заявляемая стабилизированная композиция демонстрирует антимутагенные и антиоксидантные свойства.
Условия эксперимента (острая фаза) не позволили в данном случае оценить общее воздействие заявляемой стабильной композиции на организм экспериментальных животных. Поэтому была предпринята попытка экспериментальной оценки такого комплексного воздействия.
Также были выявлены онкопротекторные свойства заявляемой стабилизированной композиции, что подтверждается исследованиями, в задачу которых входило определение экспрессии лейкоцитарных интегринов LFA-1 и Мас-1 на иммуноцитах и сывороточного уровня IL-6 и IL-10 на примере мышей высокораковой инбредной линии СВА, генетически предрасположенных к развитию спонтанных гепатокарцином, а также возможность коррекции этих показателей с помощью заявляемого средства. Работу проводили на мышах-самцах высокораковой инбредной линии СВА (сублиния СВ A/Lac Y). Эта линия является классической моделью генетической предрасположенности к опухолям печени с высоким риском их возникновения. Первые спонтанные гепатомы у мышей-самцов линии СВА возникают, начиная с 6-месячного возраста, и встречаются в 7 раз чаще, чем у самок. В позднем онтогенезе, в возрасте 18-22 мес, в 100% случаев у самцов выявляют гепатокарциномы. Известно, что у мышей-самцов высокораковой инбредной линии СВА в онтогенезе происходит снижение экспрессии лейкоцитарных интегринов LFA-1 и Мас-1 на эффекторах иммунитета параллельно с повышением уровня IL-6 и IL-10 в сыворотке крови.
Применение заявляемого средства в профилактическом режиме, в раннем онтогенезе, кратковременно, захватывая «критический» период развития ткани печени (7-10 дни), способствует долговременному увеличению числа CD11a+ и CD11b+ лимфоцитов, экспрессирующих, соответственно, молекулы LFA-1 и Мас-1, по сравнению с контрольными животными.
В эксперименте принимали участие мыши-самцы линии CBA/Lac-Y в возрасте 4-5 месяцев массой 18-22 г.Всех животных разделили на две группы, одна из которых использовалась в качестве контрольной, а вторая экспериментальной. Контрольной группе животных давали плацебо, помещенное в капсулы №5. Экспериментальной группе ежесуточно давали заявляемую стабилизированную композицию, также помещенную в капсулы №5. Для введения капсул использовали пероральный зонд. Капсулы с заявляемой стабилизированной композицией давали по схеме: один месяц приема - два месяца перерыва. Общая продолжительность эксперимента составила 12 месяцев, в течение которых через равные промежутки животных из обеих групп изымали в количестве не менее пяти особей для оценки регистрируемых в эксперименте показателей крови.
В результате проведенного эксперимента было установлено, что применение стабилизированной композиции в профилактическом режиме в т.ч. в раннем онтогенезе способствует долговременному увеличению числа CD11a+ и CD11b+ лимфоцитов, экспрессирующих соответственно молекулы LFA-1 и Мас-1, по сравнению с контрольными животными. Таким образом, установлено, что применение заявляемого состава в профилактических целях действительно снижает уровень образования гепатокарцином, т.е. заявляемый состав обладает онкопротекторным действием.
При исследовании общетерапевтических эффектов
стабилизированной композиции изготовленной по нижеприведенным примерам, нами был использован метод искусственного создания стрессовой ситуации в двух экспериментальных группах животных: группе, которой давали композицию вместе с кормом и группе, которой композицию не давали. Для оценки влияния предпринятых мер третья группа животных той же линии не подвергалась стрессовому воздействию и не получала заявляемую стабильную композицию. В качестве факторов стресса использовалось механическое вмешательство без причинения физических увечий животным. Резко менялся режим освещения, проводились механические воздействия на клетки с подопытными животными, животных внеурочно пересаживали из одной клетки в другую и т.д.
В результате проведенного исследования было установлено, что у животных, входящих в группу, не получающую стабилизированную композицию, но подвергающуюся стрессовому воздействию уровень выявленных хромосомных аберраций по отношению к контрольной группе повышался. Чем более интенсивным было стрессовое воздействие, тем больше отклонений в регистрируемом показателе наблюдалось. Правда с течением времени этот показатель стабилизировался и даже несколько снижался. Видимо, последнее связано с естественными механизмами адаптации организма животных к однотипному стрессовому воздействию.
В случае группы мышей, которым давали стабилизированную композицию и подвергали стрессовому воздействию, было замечено, что животные гораздо быстрее адаптируются к стрессовому воздействию и быстрее успокаиваются. Регистрируемый уровень хромосомных аберраций в этой группе хоть и превышал таковой уровень в контрольной группе животных, но был значительно ниже, чем в предыдущей группе.
Таким образом, было установлено, что стабилизированная композиция помимо снижения уровня спонтанных хромосомных аберраций у экспериментальной линии мышей, благоприятно сказывается на общем уровне их жизнедеятельности, что в свою очередь свидетельствует об улучшении качества жизни животных.
Заявленная стабилизированная композиция может использоваться в качестве профилактического средства, т.к. обладает антимутагенной и антиоксидантной активность.
На основании проведенных исследований и теоретических предпосылок были все основания считать, что заявляемая стабилизированная композиция будет обладать широким спектром противоопухолевой и противовирусной активности.
Данное предположение было проверенно в клинических испытаниях.
Для этого провели ряд рандомизированных клинических исследований с участием больных иммунодефицитными заболеваниями: диссеминированной меланомой кожи, раком молочной железы, шейки матки, толстого кишечника, головы и шеи и других локализаций, а также ВИЧ/СПИД в сочетании с туберкулезом легких.
Так, в контролируемом рандомизированном клиническом исследовании влияния стабилизированной композиции (капсулы для перорального применения) на иммунную систему человека в сравнении с инъекционными лекарственными препаратами Рефнот (фактор некроза опухоли - тимозин альфа 1 рекомбинантный) и Ингарон (интерферон гамма человеческий рекомбинантный) с участием 390 пациентов с онкологическими заболеваниями различных локализаций и стадий заболевания, показало, что у пациентов, принимавших заявленную стабилизирванную композицию, через 2 месяца лечения эффективность терапии статистически значимо не различалась (по критериям RECIST положительная динамика: полная или частичная ремиссия и стабилизация процесса, - наблюдалась в среднем у 56% vs. 53% в группе сравнения; полная или частичная ремиссия: 42% vs. 36%), однако по истечении 6 месяцев наблюдения достоверно большее число пациентов находилось в фазе клинической ремиссии (72% vs. 48%).
В исследованиях было показано, что стабилизированная композиция способствует:
1) уменьшению частоты развития токсических проявлений в ответ на лечение;
2) повышению эффективности противоопухолевой иммуномодулирующей терапии, проявляющейся в продления средней длительности срока ремиссии.
Контролируемое рандомизированное клиническое исследование влияния стабилизированной композиции (капсулы для перорального применения) на иммунную систему человека в сравнении с инъекционными лекарственными препаратами Рефнот (фактор некроза опухоли - тимозин альфа-1 рекомбинантный) и Ингарон (интерферон гамма человеческий рекомбинантный) проводили по следующим схемам.
В анализ были включены: 32 пациентов с раком молочной железы, 38 пациенток с раком яичников, 36 пациенток с раком шейки матки, 44 пациента с раком легкого, 36 пациентов с гепатоцеллюлярной карциномой, 34 пациента с раком желчевыводящих путей, 58 пациентов с колоректальным раком, 32 пациента с раком пищевода, 38 пациентов с раком желудка, 36 пациентов с раком поджедудочной железы.
Режим лечения: в группе 1 пациенты применяли стабилизированную композицию перорально по 2 капсулы 2 раза в день без перерывов; в группе 2 пациенты применяли препарат Рефнот по 200000 ME подкожно 1 раз в день через день и Ингарон по 500000 ME подкожно 1 раз в день через день поочередно в течение 10 дней (по 5 инъекций каждого препарата) перед и в перерывах между циклами химиотерапии. Обе группы были сравнимы по демографическим параметрам, распределению больных по локализациям и стадиям онкологического процесса, а также по другим значимым факторам (начальному уровню ФНО, сопутствующим патологиям, режимам противоопухолевой терапии и прочее).
Страта 1. Пациенты с нерезектабельным местно-распространенным или метастатическим раком молочной железы III-IV стадии в возрасте 37-71 лет (N=32) подвергались лечению комбинированным методом. Сначала лекарственная терапия+иммунотерапия (Стабилизированная композиция vs. Рефнот+Ингарон), после чего оценивалась клиническая эффективность терапии. В случае неэффективности пробовалась альтернативная лекарственная терапия+иммунотерапия, затем проводилась повторная оценка эффекта. В случае уменьшения размеров опухоли до резектабельного состояния проводилась операция. После первой линии терапии было прооперировано по 3 пациента в каждой подгруппе (19%), после второй -еще 4 пациента в исследуемой подгруппе и 5 пациентов в подгруппе контроля. Итоговая эффективность предоперационной терапии в обеих подгруппах достоверно не различалась (44% и 50% соответственно). После резекции проводилась иммунотерапия, затем послеоперационная лучевая терапия и лекарственная терапия по показаниям. Оценка отдаленных результатов лечения проводилась через 6 месяцев наблюдения после начала лечения и показала, что пациенты, получавшие стабилизированную композицию в 2 раза чаще оставались в фазе клинической ремиссии по истечению полугода (38% vs. 19%).
Страта 2. Пациенты с распространенным раком яичников, маточных труб или первичным перитониальным раком IIb-IV стадии в возрасте 46-68 лет (N=38), ранее не получавшие терапию по поводу опухолевого процесса, подвергались иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон), затем оперативному вмешательству и далее неоадъювантной полихимиотерапии с добавлением иммунотерапии в перерывах между циклами. Общий положительный эффект терапии (стабилизация, полная или частичная регрессия опухоли) через 6 месяцев наблюдения составил 97% в подгруппе исследования, тогда как в группе сравнения этот показатель был равен 69%.
Страта 3. Пациентки с плоскоклеточным раком шейки матки Ia1-Ib1 стадии в возрасте 36-67 лет (N=36) подвергались предоперационной иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон), затем выполнялась гистеректомия, вслед за которой также проводилась послеоперационная иммунотерапия с адъювантной химиотерапией с цисплатином по показаниям. По итогам наблюдения в течение 2 месяцев с момента начала терапии большая часть пациенток с незначительными межгрупповыми различиями (92% и 83%) показали высокую эффективность комплексной терапии, по итогам наблюдения в течение 6 месяцев - все пациентки, получавшие стабилизированную композицию, оставались в фазе клинической ремиссии (100% vs. 81%).
Страта 4. В исследование включались пациенты с немелкоклеточным раком легкого Ib-IIIa стадии в возрасте 34-73 лет (N=44), которым впоследствии проводилась комбинированная терапия: резекция+адъювантная химиотерапия на основе цисплатина с добавлением иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон) перед операцией и в перерывах между циклами химиотерапии. По истечении 6 месяцев наблюдения 20 пациентов из 22 (91%), принимавших стабилизирванную композицию, сохраняли состояние клинической ремиссии (vs. 81% в подгруппе сравнения).
Страта 5. Пациенты с нерезектабельной распространенной гепатоцеллюлярной карциномой стадии В или С в возрасте 52-71 лет (N=36) получали паллиативное медикаментозное лечение сорафенибом (800 мг/сут) с добавлением иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон) перед началом лечения и в перерывах между циклами химиотерапии. По итогам наблюдения пациентов в течение 6 месяцев отсутствие прогрессирования заболевания отмечено у большинства пациентов, получавших стабилизированную композицию (91% vs. 58%).
Страта 6. Пациенты с нерезектабельной аденокарциномой желчевыводящих путей 67-83 лет (N=34) получали комбинированную паллиативную химиотерапию (гемцитабин+5-фторурацил) с добавлением иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон) перед началом лечения и в перерывах между циклами химиотерапии. Обе подгруппы показали значимо не различимую эффективность терапии по итогам 2-месячного поддерживающего лечения (39% vs. 38%), по итогам дальнейшего наблюдения в течение 6 месяцев применение стабилизированной композиции оказалось более эффективным (78% vs. 38%).
Страта 7. Пациенты с метастатическом колоректальным раком (аденокарцинома) в возрасте 41-71 лет (N=58), ранее не получавшие терапию по поводу опухолевого процесса, подвергались иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон), затем химиотерапии по схеме FOLFOX6 с перерывом в 2 недели, в течение которых продолжалась иммунотерапия. Комбинированное лечение показало эффективность у более половины пациентов (55%) в обеих подгруппах терапии через 2 месяца. Через 6 месяцев эффективность терапии в подгруппе исследования достигла 68% (vs. 57% в подгруппе сравнения).
Страта 8. Пациенты с нерезектабельным плоскоклеточным раком пищевода без выраженной дисфагии в возрасте 49-74 лет (N=32), ранее не получавшие лечение по поводу опухолевого процесса, подвергались иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон), затем паллиативной химиотерапии (цисплатин+капецитабин в течение 2х недель) с 3-недельными перерывами, в течение которых продолжалась иммунотерапия. После 2х циклов химиотерапии частота объективного ответа составила 36% и 38%, после 6 циклов - 87% и 36% (Стабилизированная композиция vs. Рефнот+Ингарон соответственно).
Страта 9. Пациенты с нерезектабельным диссеминированным раком желудка в возрасте 36-69 лет (N=38), ранее не получавшие терапию по поводу опухолевого процесса, подвергались паллиативной химиотерапии (эпирубицин+оксалиплатин+капецитабин) с добавлением иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон) перед началом лечения и в перерывах между циклами химиотерапии. Отмечено достоверное улучшение отдаленных результатов: по итогам 6 месяцев наблюдения более выраженный положительный эффект терапии отмечен в подгруппе пациентов, принимавших стабилизированную композицию (51% vs. 34%).
Страта 10. Пациенты с нерезектабельным раком поджелудочной железы в возрасте 46-79 лет (N=36), ранее не получавшие терапию по поводу опухолевого процесса, имели погранично резектабельную и нерезектабельную формы. Проводилась индукционная химиотерапия FOLFIRINOX с добавлением иммунотерапии (Стабилизированная композиция vs. Рефнот+Ингарон) перед началом лечения и в перерывах между циклами химиотерапии (5-6 курсов каждые 2 недели), после чего оценивалась клиническая эффективность терапии и резектабельность опухоли. В результате, после индукционной терапии было прооперировано по 8 пациентов в каждой подгруппе (44%), по истечении 6 месяцев наблюдения половина пациентов, принимавших стабилизированную композицию сохранила состояние клинической ремиссии (22% vs. 6%).
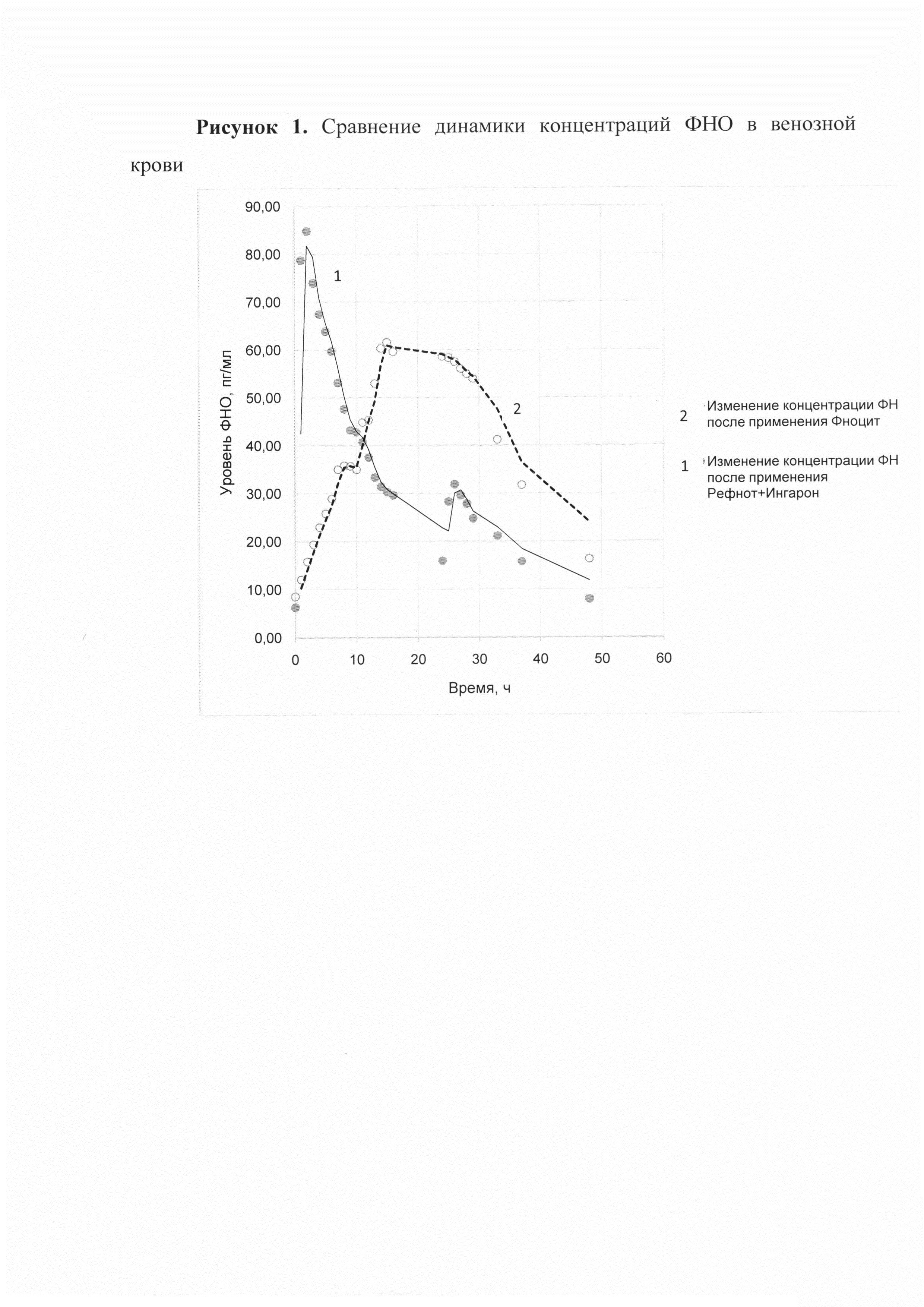
Биохимический анализ венозной крови пациентов (N=100) в течение двух суток применения препаратов продемонстрировал различную динамику изменений уровня фактора некроза опухоли (ФНО) в двух группах (см. Рис. 1).
У пациентов, принимающих стабилизированную композицию, наблюдалось постепенное нарастание уровня ФНО с момента первого приема разовой дозы, с мягким достижением пиковой концентрации ФНО (Cmax=61,56 пг/мл, Tmax=14 ч.) после повторного приема стабилизированной композиции и удержанием достаточно высокого уровня ФНО в течение более 15 часов. Тогда как, при подкожном введении препарата Рефнот 200 ООО ME наблюдалось быстрое нарастание концентрации ФНО в крови до максимальной (Cmax=84,76 пг/мл) в течение нескольких часов, затем падение уровня ФНО до 27,66 пг/мл в течение 5 часов и повторное незначительное повышение до среднего показателя (31,88 пг/мл) через 2 часа после подкожного введения лекарственного препарата Ингарон 500000 ME.
В контролируемом рандомизированном клиническом исследовании по изучению динамики уровня ФНО в венозной крови при применении стабилизированной композиции в сравнении с комбинированной схемой фармакотерапии с использованием лекарственных препаратов Рефнот и Ингарон (Рефнот по 200000 ME подкожно 1 раз в день через день и Ингарон по 500 ООО ME подкожно 1 раз в день через день поочередно) у пациентов с диссеминированной меланомой кожи (N=210) установлена связь развития нежелательных реакций с высоким уровнем ФНО при применении комбинированной схемы фармакотерапии (чаще нежелательные явления регистрировались в день введения лекарственного препарата Рефнот). В то время, как стабилизированная композиция демонстрировала отличную переносимость (частота развития нежелательных явлений: 7% vs. 31%) одновременно с лучшими отдаленными результатами.
Техническим результатом, заявленного изобретения является: -достижение стабилизирующего эффекта цитокинов, за счет оптимально подобранного состава компонентов и их количества, что позволяет обеспечить хранение интерферона гамма и ФНО-Т в нормальных условиях, без потери их активности
- получение на основе человеческого рекомбинантного интерферона гамма и ФНО-Т стабилизированной композиции, обладающей высокой противоопухолевой, противовирусной, антиоксидантной, иммуномодулирующей, актопротективной, антимутагенной активностью
- расширение диапазона температуры хранения интерферона гамма и ФНО-Т, без потери активности
- минимальный побочный эффект, в т.ч. отсутствие субфебрильных состояний и диспептических расстройств, входящих компонентов, что позволяет использовать его в комплексной терапии при лечении онкозаболеваний, в т.ч. противорецидивном лечении, для профилактики онкозаболеваний, и улучшающее качество жизни людей и животных.
Приведенные ниже примеры являются иллюстрацией изобретения и раскрывают различные аспекты возможного осуществления настоящего изобретения. Следующие примеры не должны быть истолкованы как ограничивающие изобретение, как оно заявлено.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1. Получение стабилизированной композиции с активностью 50000 МЕ/г по интерферону гамма и 20000 ЕД/г по ФНО-Т
Использовали лиофилизат интерферона гамма с активностью 10000000 МЕ/г, а также лиофилизат ФНО-Т обладающий активностью 10000000 ЕД/г.При использовании лиофилизатов с другой активностью необходимо произвести перерасчет добавляемого количества на 100 г порошка для капсул.
В перемешивающее устройство загружают 20 г порошка виноградных косточек, 0,6 г аэросила, 14,5 г крахмала, 1,2 г стеарата кальция, 6,0 г лактозы,6,0 г микрокристаллической карбоксиметилцеллюлозы. Добавляют 0,5 г лиофилизата интерферона гамма, 0,2 г лиофилизата фактора некроза опухоли тимозин-альфа 1. Доводят вес полученной смеси до 100 г маннитом, перемешивают. Полученный порошок (с активностью 50000МЕ/г по гамма интерферону и 20000 ЕД/г по ФНО-Т) загружают в кислотоустойчивые капсулы №5. Получают капсулы с активностью по интерферону гамма 2500 ME на капсулу, ФНО-Т - 1000 ЕД на капсулу.
Полученные капсулы №5 применяли при исследовании антимутагенных свойств. В качестве метода контроля воздействия заявляемой стабилизированной композиции был применен давно известный и широко применяемый метод учета хромосомных аберраций. Данное исследование изложено выше.
Таким образом, было экспериментально подтверждено, что использование разработанной стабилизированной композиции снижает уровень хромосомных аберраций, возникающих в результате действия химиотерапевтического медикаментозного средства «циклофосфан». Тем самым заявляемая стабилизированная композиция демонстрирует антимутагенные и антиоксидантные свойства.
Пример 2. Получение стабилизированной композиции с активностью 150000МЕ/Г по интерферону гамма и 60000 ЕД/г по ФНО-Т
Использовали лиофилизат интерферона гамма с активностью 10000000 МЕ/г, а также лиофилизат ФНО-Т обладающий активностью 10000000 ЕД/г.При использовании лиофилизатов с другой активностью необходимо произвести перерасчет добавляемого количества на 100 г порошка для капсул.
В перемешивающее устройство загружают 25 г порошка виноградных косточек, 1,2 г аэросила, 22 г крахмала, 2,5 г стеарата кальция, 10,05 г микрокристаллической карбоксиметилцеллюлозы, 10 г лактозы. Добавляют 1,5 г лиофилизата интерферона гамма, 0,6 г лиофилизата фактора некроза опухоли тимозин альфа 1. Доводят вес полученной смеси до 100 г маннитом, перемешивают.Полученный порошок с активностью 150000 МЕ/г по гамма интерферону и 60000 ЕД/г по ФНО-Т загружают в кислотоустойчивые капсулы №5. Получают капсулы с активностью по интерферону гамма 7500 ME на капсулу, ФНО-Т - 3000 ЕД на капсулу.
Полученные капсулы применяли для подтверждения онкопротекторных свойств заявляемой стабилизированной композиции. Данное исследование было изложено выше.
В эксперименте принимали участие мыши-самцы линии CBA/Lac-Y в возрасте 4-5 месяцев массой 18-22 г. Всех животных разделили на две группы, одна из которых использовалась в качестве контрольной, а вторая экспериментальной. Контрольной группе животных давали плацебо, также помещенное в капсулы №5. Экспериментальной группе ежесуточно давали полученную стабилизированную композицию, также помещенную в капсулы №5. Для введения капсул использовали пероральный зонд. Капсулы с заявляемой стабилизированной композицией давали по схеме: один месяц приема - два месяца перерыва. Общая продолжительность эксперимента составила 12 месяцев, в течение которых через равные промежутки животных из обеих групп изымали в количестве не менее пяти особей для оценки регистрируемых в эксперименте показателей крови.
В результате проведенного эксперимента было установлено, что применение стабилизированной композиции в профилактическом режиме в т.ч. в раннем онтогенезе способствует долговременному увеличению числа CD11a+ и CD11b+ лимфоцитов, экспрессирующих соответственно молекулы LFA-1 и Мас-1, по сравнению с контрольными животными. Таким образом, установлено, что применение заявляемого состава в профилактических целях действительно снижает уровень образования гепатокарцином, т.е. заявляемый состав обладает онкопротекторным действием.
Пример 3. Получение стабилизированной композиции с активностью 250000МЕ/г по интерферону гамма и 100000 ЕД/г по ФНО-Т
В перемешивающее устройство загружают 30 г порошка виноградных косточек, 1,8 г аэросила, 29,5 г крахмала, 3,7 г стеарата кальция, 14,1 г кристаллической карбоксиметилцеллюлозы, 14 г лактозы. Добавляют 2,5 г лиофилизата интерферона гамма с активностью 10000000 МЕ/г, 1 г лиофилизата фактора некроза опухоли тимозин альфа 1 обладающего активностью 10000000 ЕД/г.Доводят вес полученной смеси до 100 г маннитом. Перемешивают полученные 100 г смеси. Полученный порошок загружают в кислотоустойчивые капсулы №1 по 0,2 г.Получают 500 капсул с активностью по интерферону гамма 50000 ME на капсулу (250000 МЕ/г), ФНО-Т - 20000 ЕД на капсулу (100000 ЕД/г).
Полученную капсулу давали пациентам с метастатическим колоректальным раком (аденокарцинома) в возрасте 41-71 лет (N=58), ранее не получавшиим терапию по поводу опухолевого процесса. Затем проводилась химиотерапия по схеме FOLFOX6 с перерывом в 2 недели, в течение которых продолжалась иммунотерапия. Комбинированное лечение показало эффективность у более половины пациентов (55%) через 2 месяца.
Через 6 месяцев эффективность терапии в группе исследования получавшей капсулу со стабилизированной композицией достигла 68%, что свидетельствует об эффективности заявляемой стабильной композиции в отношении онкосостояний ассоциированных с вирусной этиологией. Таким образом, заявленная стабилизированная композиция обладает ярко выраженным противовирусным и противоопухолевым эффектом.