Результат интеллектуальной деятельности: Композиции для местного применения, содержащие кортикостероид
Вид РИД
Изобретение
Родственные заявки
[0001] Настоящая заявка претендует на приоритет по заявке на патент США №14/645,297, поданной 11 марта 2015 года, содержание которой в полном объеме включено в это описание посредством ссылки.
Область, к которой имеет отношение изобретение
[0002] Настоящее изобретение имеет отношение к композиции для местного применения, содержащей кортикостероид и по меньшей мере один интенсификатор проникновения, при этом упомянутая композиция по существу не содержит пропиленгликоля.
Предпосылки создания изобретения
[0003] Кортикостероиды для местного применения представляют собой лекарственные препараты, наиболее часто назначаемые дерматологами для лечения псориаза, облегчения воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, и сопутствующих заболеваний или расстройств. Кортикостероиды представляют собой класс соединений, содержащих стероиды (липиды, которые содержат гидрированную циклопентапергидрофенантреновую кольцевую систему), вырабатываемые корой надпочечников (кроме половых гормонов надпочечникового происхождения) в ответ на выделение гипофизом адренокортикотропина или адренокортикотропного гормона или на любой синтетический эквивалент или ангиотензин II. В фармакологических дозах кортикостероиды используют в основном для получения противовоспалительного и/или иммуносупрессивного эффектов.
[0004] Кортикостероиды для местного применения, такие как клобетазола пропионат, эффективны в лечении кортикостероид-зависимых дерматозов в основном благодаря их противовоспалительному, противозудному и сосудосуживающему действиям. Клобетазола пропионат используют для лечения различных других кожных заболеваний, включая экзему и псориаз. Он также весьма эффективен в случае контактного дерматита, вызванного действием ядовитого плюща/дуба.
[0005] Клобетазола пропионат известен как химическое соединение [17-(2'-хлорацетил)-9-фтор-11-гидрокси-10,13,16-триметил-3-оксо-6,7,8,11,12,14,15,16-октагидроциклопента[а]фенантрен-17-ил]пропаноат и представлен структурной формулой I:
[0006] Клобетазола пропионат присутствует на рынке в композициях для местного применения в виде аэрозольной пены, крема, мази, геля, раствора, лосьона, спрея или шампуня при массовой концентрации 0,05%. Крем TEMOVATE® представляет собой имеющийся в продаже препарат клобетазола, одобренный Управлением по контролю за пищевыми продуктами и медикаментами США (FDA) 27 декабря 1985 года, и в настоящее время поставляется на рынок Fougera Pharms. Крем TEMOVATE® содержит клобетазола пропионат (0,5 мг/г) в кремовой основе, содержащей пропиленгликоль, глицерилмоностеарат, цетостеариловый спирт, глицерилстеарат, стеарат ПЭГ 100, белый воск, хлоркрезол, цитрат натрия, моногидрат лимонной кислоты и очищенную воду. TEMOVATE® Е представляет собой еще один продукт, одобренный Управлением по контролю за пищевыми продуктами и медикаментами США (FDA), содержащий клобетазола пропионат (0,05% (мас.)) в кремовой основе, содержащей цетостеариловый спирт, изопропилмиристат, пропиленгликоль, цетет-20, диметикон 350, моногидрат лимонной кислоты, цитрат натрия, имидомочевину и очищенную воду.
[0007] Патент США №5,971,920 имеет отношение к композиции, характеризующейся соединением-носителем, образованным из комбинации двух компонентов с объемным соотношением приблизительно 50/50, при этом первый компонент носителя выбран из группы, состоящей по существу из этилового спирта и изопропилового спирта, а второй компонент носителя выбран из группы, состоящей по существу из изопропилмиристата, изопропилпальмитата, октилпальмитата, октилизононаноата и изоцетилстеарата. Эта композиция также содержит анионное поверхностно-активное вещество.
[0008] Публикация международной патентной заявки WO 2006/115987 имеет отношение к способу лечения псориаза распылением на кожу, пораженную псориазом, фармацевтической композиции, содержащей эффективное количество клобетазола пропионата, с осуществлением ежедневной обработки в течение по меньшей мере 4 недель. Предпочтительной композицией является композиция на основе клобетазола пропионата (0,05%) в виде аэрозоля, содержащая спирт, изопропилмиристат, анионное поверхностно-активное вещество, такое как лаурилсульфат натрия, и факультативно антимикробное соединение, такое как противогрибковое соединение, например, ундециленовая кислота.
[0009] Патенты США №6,419,913 и №6,284,234 имеют отношение к системам местной доставки активных веществ, содержащих мицеллярные композиции.
[0010] Публикация США №2006/0099173 имеет отношение к способу получения фармацевтической композиции для местного применения, упомянутая композиция представляет собой эмульсию, содержащую воду и по меньшей мере один активный ингредиент.
[0011] Публикация США №2007/0142343 имеет отношение к композиции, содержащей кортикостероиды, интенсификаторы проникновения, растворители и эмульгаторы. В носителе этой композиции использованы по меньшей мере два интенсификатора проникновения, включая диизопропиладипат, диметилизосорбид, пропиленгликоль, 1,2,6-гексантриол и бензиловый спирт.
[0012] Публикация США №2009/0104131 имеет отношение к фармацевтическим композициям для местного применения в виде эмульсий типа масло-в-воде (0/W), содержащим систему, способствующую проникновению, которая содержит по меньшей мере один гликоль и по меньшей мере одно дополнительное вещество, способствующее проникновению, приемлемую эмульгирующую систему и по меньшей мере одно активное вещество из семейства стероидных противовоспалительных веществ. Как вещество, способствующее проникновению, раскрыт пропиленгликоль.
[0013] Патент США №6,579,512 имеет отношение к композиции для местного применения в виде аэрозоля, содержащей клобетазола пропионат, этанол, пропеллент и изопропилмиристат.
[0014] Патенты США №7,700,081 и №7,316,810 имеют отношение к композициям на основе клобетазола пропионата (0,05% (мас.)) в виде шампуня, используемым для мытья волосистой части кожи головы и лечения ее заболеваний.
[0015] Применение дерматологических кортикостероидов, в частности, препаратов клобетазола пропионата для местного применения, сталкивается с множеством проблем, таких как эффективность доставки, стабильность и переносимость, в частности, в отношении наполнителей, которые не вызывали бы раздражения. Кроме того, кортикостероиды могут абсорбироваться через кожу и могут вызывать системные побочные эффекты, например, подавление системы гипоталамус-гипофиз-надпочечники (НРА). Поэтому, во избежание нежелательных побочных эффектов, кортикостероид используют в минимально возможной концентрации. Однако препараты для местного применения, содержащие низкие концентрации кортикостероидов, не могут обеспечить достаточный терапевтический эффект.
[0016] Публикация США №2010/0249060 имеет отношение к композиции с низкой дозой клобетазола пропионата в водном носителе на основе пропиленгликоля и гидроксистеарата макрогола или глицерина.
[0017] Несмотря на то, что некоторые из вышеупомянутых ссылок раскрывают композиции, содержащие клобетазола пропионат, большинство из них являются жирными и, следовательно, неприятными для применения на больших участках кожи. Кроме того, некоторые традиционные кремовые и мазевые основы, содержащие пропиленгликоль, раздражают кожу, особенно при длительном применении, которое часто требуется для эффективности. Текучесть лосьонов часто затрудняет контролирование их физического применения над желаемым участком. Кроме того, композиции, содержащие этанол или пропиленгликоль, могут быть связаны с повышенным риском сенсибилизации и имеют тенденцию вызывать раздражение, и, следовательно, такие композиции не способствуют соблюдению пациентом режима и схемы лечения. Как следует из характеристики, приведенной на этикетках крема TEMOVATE® и крема TEMOVATE® E, имеющиеся в продаже в настоящее время композиции для местного применения, содержащие клобетазол, оказывают неблагоприятное действие на эндокринную систему (подавление системы гипоталамус-гипофиз-надпочечники).
[0018] Соответственно, существует давно ощущаемая потребность в создании эффективной композиции для местного применения на основе клобетазола с пониженной концентрацией активного вещества, но с эффектом, сравнимым с эффектом, который можно получить с помощью традиционных композиций для местного применения на основе клобетазола пропионата. Кроме того, желательно иметь композицию на основе клобетазола пропионата с повышенным поглощением, которая не вызывает раздражения кожи.
Сущность изобретения
[0019] Соответственно, настоящее изобретение предлагает фармацевтическую композицию для местного применения, содержащую по меньшей мере один кортикостероид и по меньшей мере один интенсификатор проникновения. Эта композиция, соответствующая настоящему изобретению, по существу не содержит пропиленгликоля.
[0020] В некоторых вариантах осуществления настоящего изобретения предложена фармацевтическая композиция для местного применения, содержащая низкую дозу клобетазола; масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения и неполимерный загуститель; водную фазу; и факультативно по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров; причем упомянутая композиция для местного применения не оказывает существенного неблагоприятного действия на эндокринную систему.
[0021] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, содержащая низкую дозу клобетазола, причем эта композиция обеспечивает аналогичный или повышенный терапевтический эффект и пониженный побочный эффект по сравнению с таковыми в случае TEMOVATE®.
[0022] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, предусматривающий нанесение композиции для местного применения, содержащей низкую дозу клобетазола, на пораженный участок кожи субъекта, при этом лечение обеспечивает аналогичный или повышенный терапевтический эффект и по существу не имеет побочных эффектов по сравнению с таковыми в случае TEMOVATE®.
[0023] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, содержащая низкую дозу клобетазола, обеспечивающая более низкий процент снижения концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®.
[0024] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, предусматривающий применение композиции для местного применения, содержащей низкую дозу клобетазола, при этом упомянутое лечение обеспечивает более низкий процент снижения концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®.
Краткое описание фигур
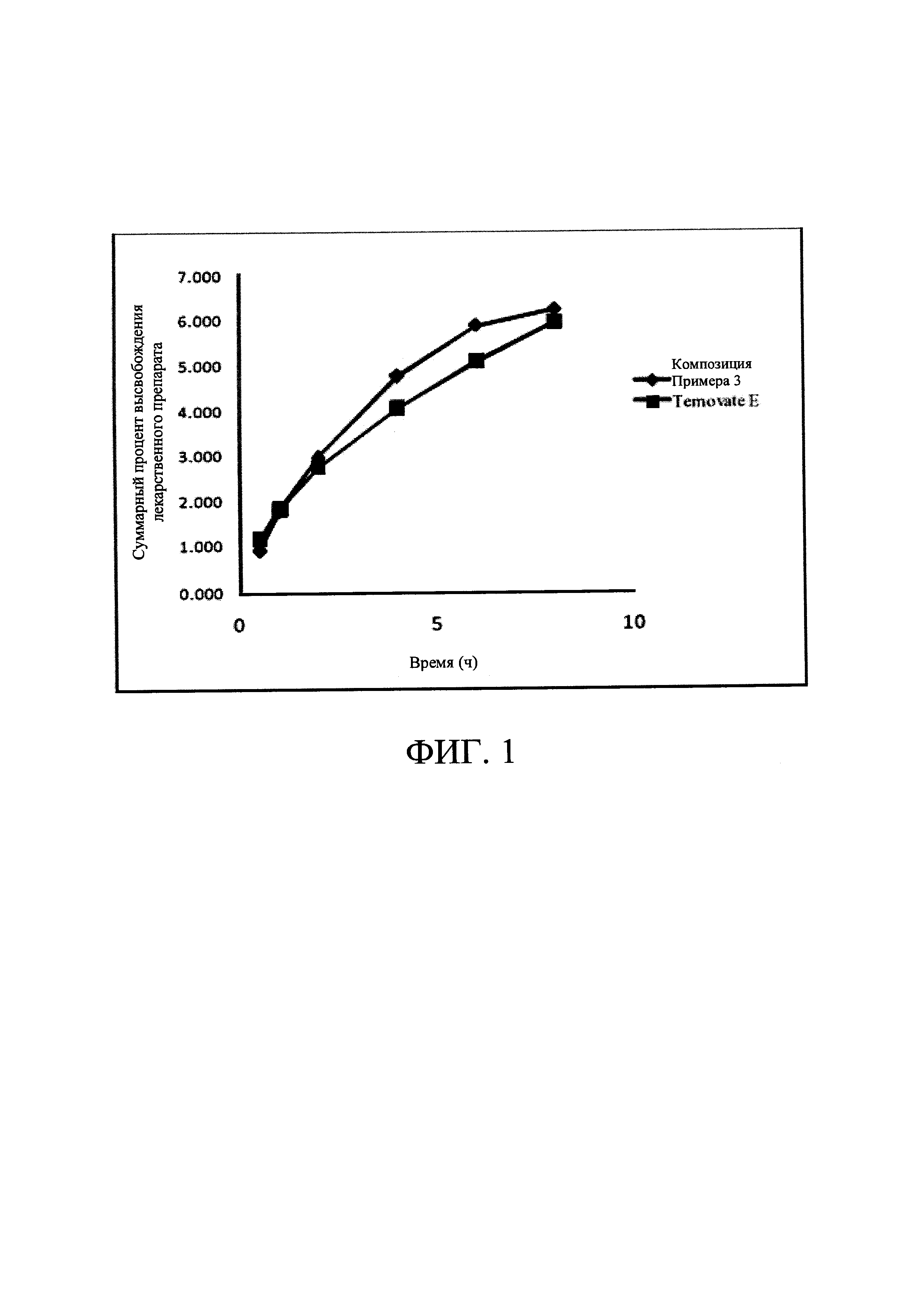
[0025] На Фиг. 1 показано высвобождение лекарственного средства для композиции, соответствующей настоящему изобретению, и имеющегося в продаже продукта.
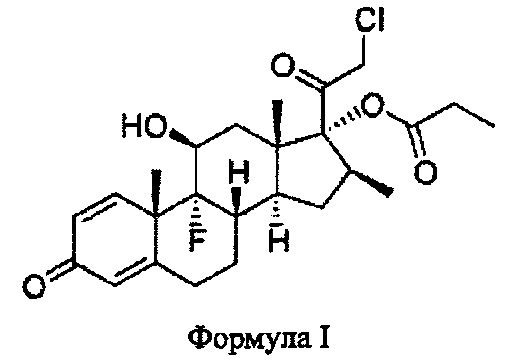
[0026] На Фиг. 2 показано высвобождение лекарственного средства для композиции, соответствующей настоящему изобретению, и имеющегося в продаже продукта.
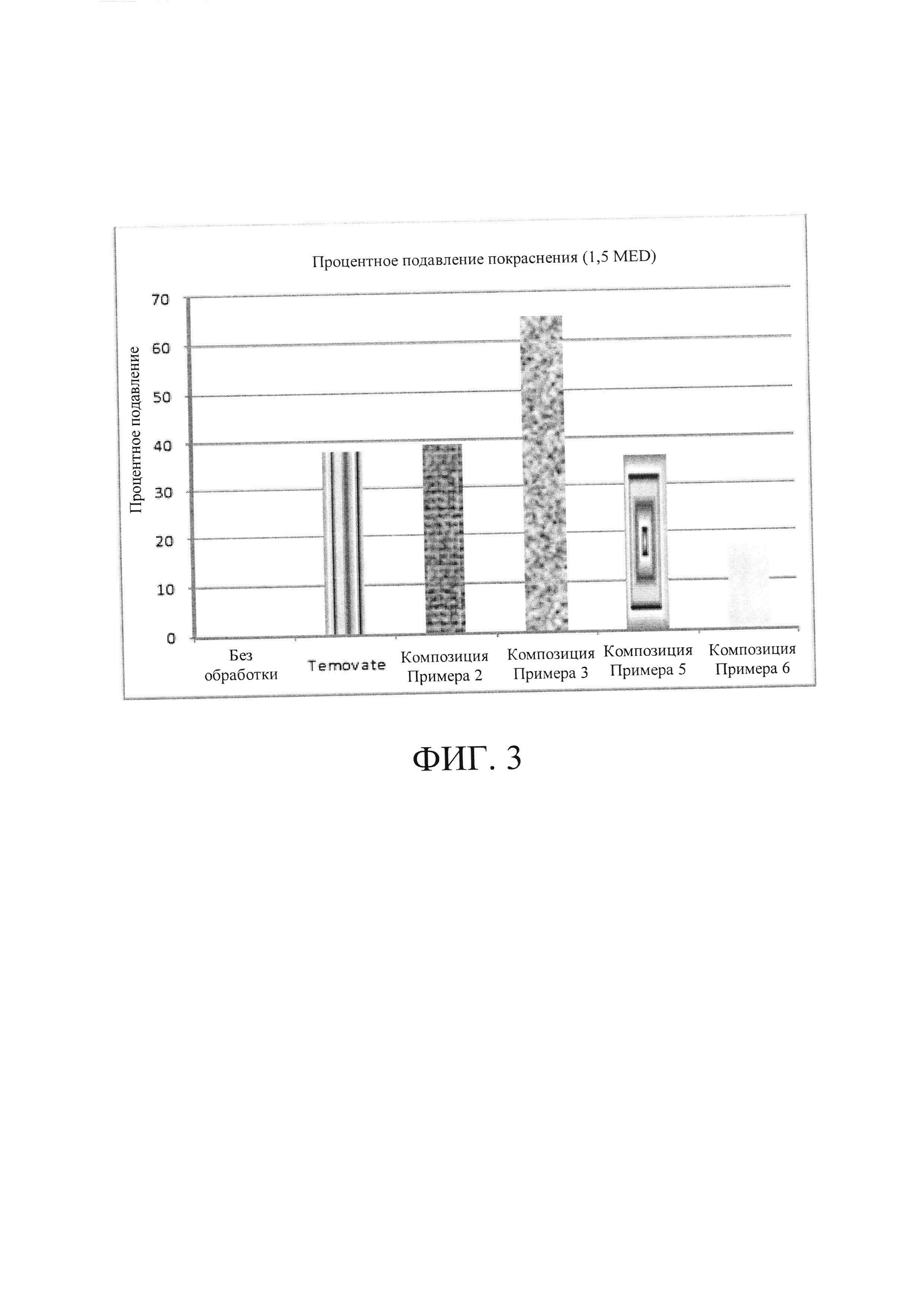
[0027] На Фиг. 3 показан процент уменьшения покраснения для необработанного контроля, композиций, соответствующих настоящему изобретению, и имеющегося в продаже продукта.
[0028] На Фиг. 4 показана площадь под кривой (AUC) покраснения кожи для необработанного контроля, композиций, соответствующих настоящему изобретению, и имеющегося в продаже продукта.
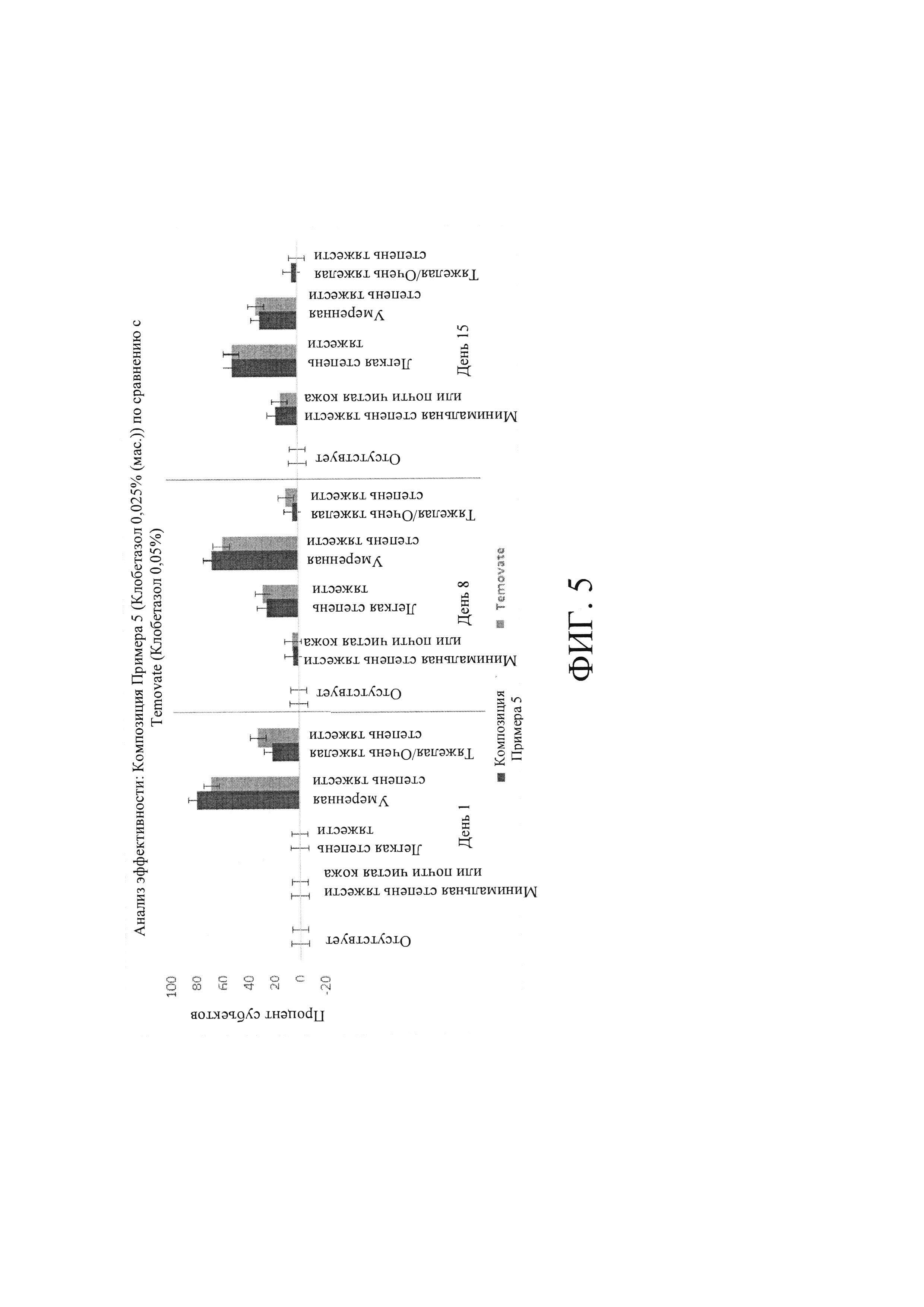
[0029] На Фиг. 5 показан анализ эффективности: оценка по шкале Глобальной оценки эффективности исследователем (Investigators Global Assessment, IGA) - композиция Примера 5 по сравнению с кремом TEMOVATE®.
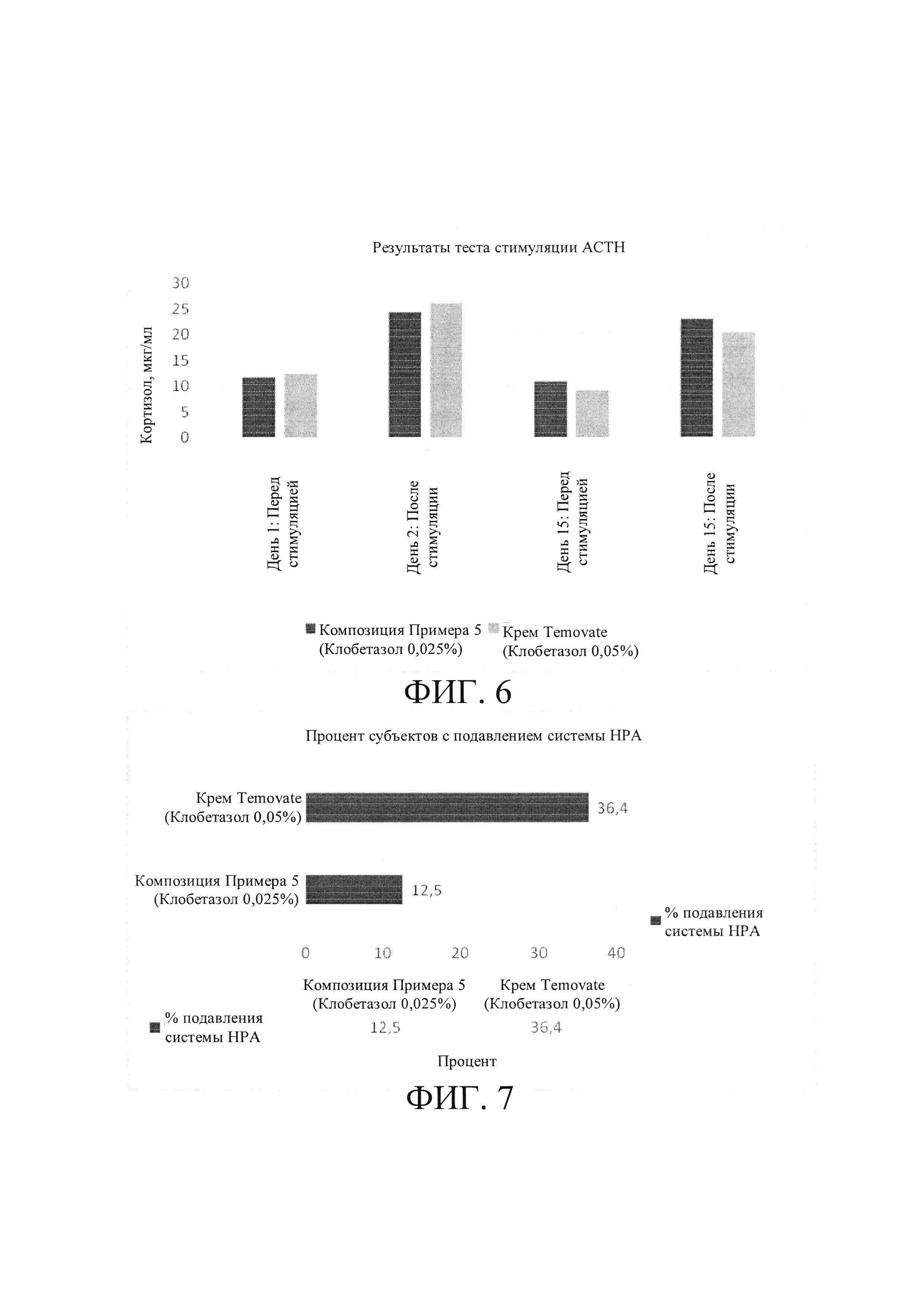
[0030] На Фиг. 6 показан результат теста стимуляции АСТН (уровни кортизола в сыворотке крови в нг/дл).
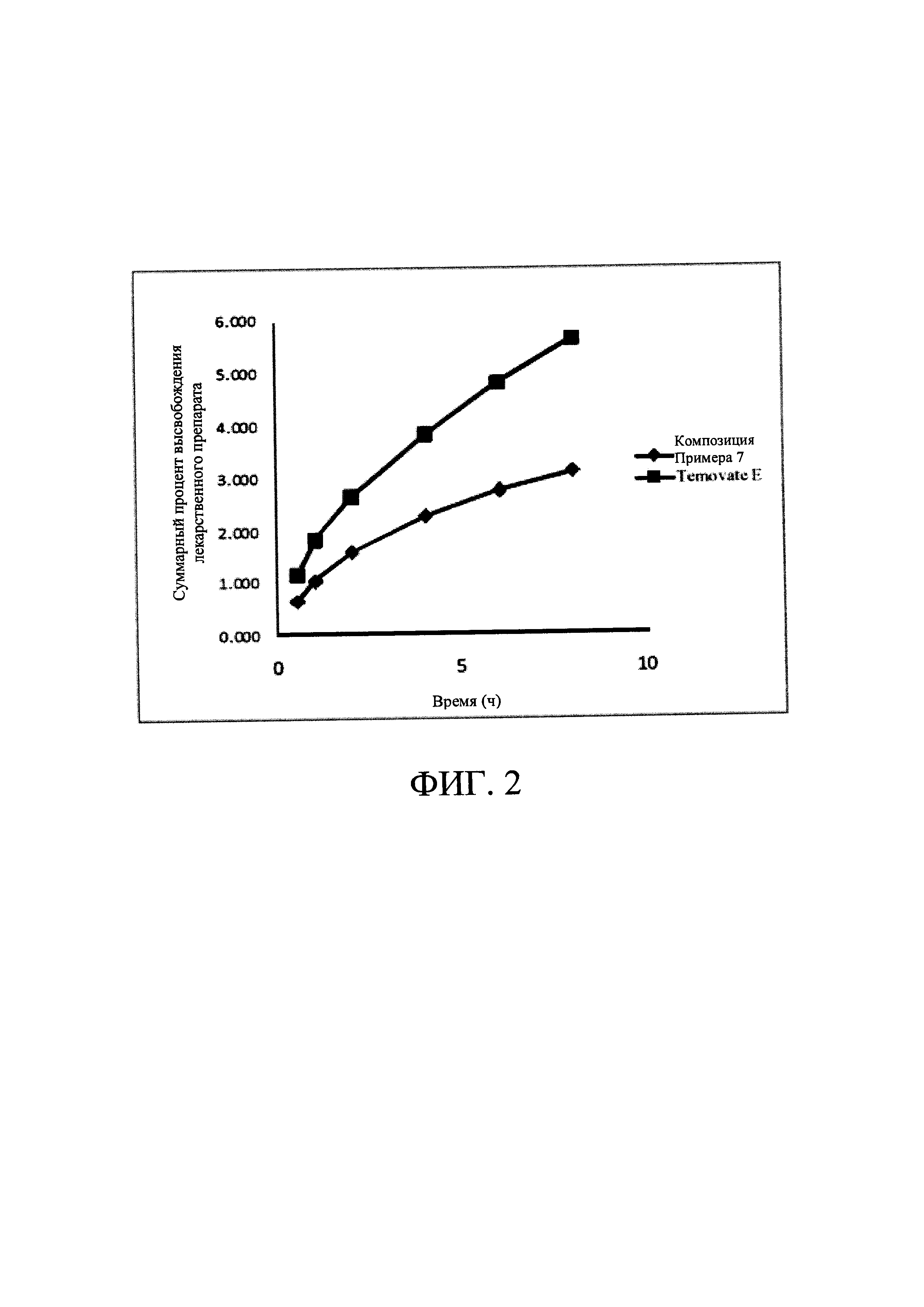
[0031] На Фиг. 7 показаны результаты подавления системы HPA (тест стимуляции АСТН).
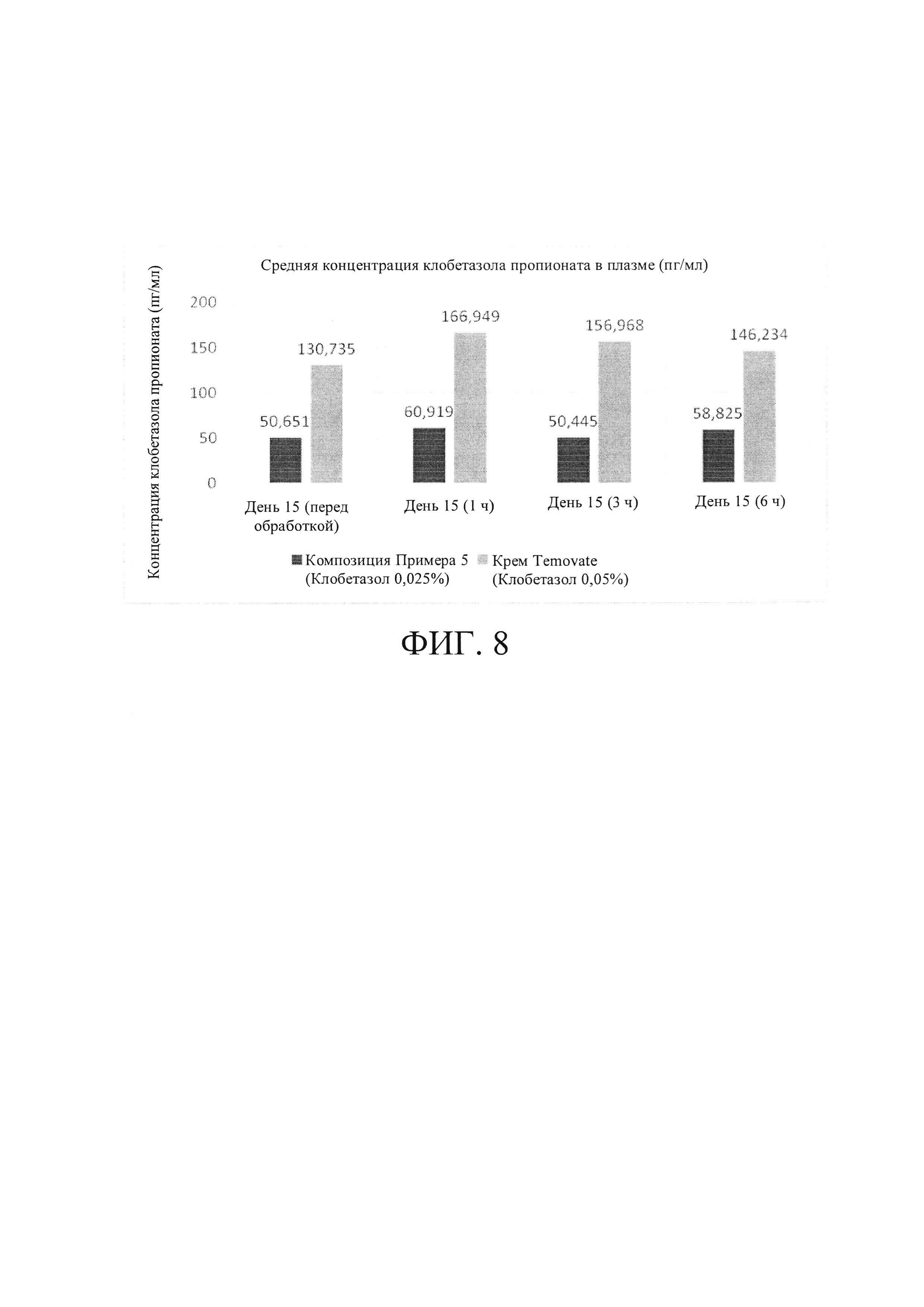
[0032] На Фиг. 8 показана средняя концентрация клобетазола пропионата в плазме: композиция Примера 5 по сравнению с кремом TEMOVATE®.
Подробное описание изобретения
[0033] В этом документе изложены подробности одного или нескольких d варианта(-ов) осуществления настоящего изобретения. Модификации вариантов осуществления настоящего изобретения, описанных в этом документе, и других вариантов осуществления настоящего изобретения будут понятны специалистам в данной области после изучения информации, представленной в этом документе. Информация, представленная в этом документе, и особенно конкретные подробности описанных вариантов осуществления настоящего изобретения, предоставлена в основном для ясности понимания, и из нее не следует делать выводы о каких-либо ограничениях. В случае возникновения конфликта описание настоящего изобретения, включая определения, имеет преимущественную силу.
[0034] Определения. Используемые в этом описании термины имеют нижеследующие значения.
[0035] Термин "клобетазол" в этом описании охватывает фармацевтически приемлемые фармакологически активные производные клобетазола, включая клобетазола пропионат, клобетазол в форме основания, его сложноэфирную форму, его изомерную форму, как отдельные энантиомеры клобетазола (правовращающие и левовращающие энантиомеры) в их по существу чистой форме, так и их фармацевтически приемлемые соли, смеси (в любом соотношении) энантиомеров клобетазола и их фармацевтически приемлемых солей, а также активные метаболиты клобетазола и их фармацевтически приемлемые соли, если не указано иное. Твердая форма клобетазола, используемая в композиции, соответствующей настоящему изобретению, не является критичной. Например, клобетазола пропионат может быть аморфным или кристаллическим. Как будет понятно специалисту в данной области при изучении этой заявки, клобетазол(-ы) является(-ются) кортикостероидом(-ами). В некоторых вариантах осуществления настоящего изобретения термины "активный", "активное вещество" или "соединение" в этом описании относятся к кортикостероидам, включая клобетазол, или к их фармацевтически приемлемым формам.
[0036] Термин "низкодозовый клобетазол низкая доза клобетазола" означает, что клобетазол присутствует в количестве от приблизительно 0,005% (мас.) до приблизительно 0,045% (мас.). В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола составляет от приблизительно 0,005% (мас.) до приблизительно 0,045% (мас.). В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола составляет от приблизительно 0,005% (мас.), 0,01% (мас.), 0,015% (мас.), 0,02% (мас.) или 0,025% (мас.) до приблизительно 0,03% (мас.), 0,035% (мас.) или 0,04% (мас.). В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола составляет от приблизительно 0,005% (мас.), 0,01% (мас.), 0,015% (мас.), 0,02% (мас.) или 0,025% (мас.) до приблизительно 0,03% (мас.), 0,035% (мас.), 0,04% (мас.) или 0,045% (мас.).
[0037] Термин "по существу не содержит" в этом описании означает, что конкретное вещество, на которое ссылаются, присутствует в количествах не более чем 10% (мас.) от общей массы композиции или в количествах не более чем приблизительно 9% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 8% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 7% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 6% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 5% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 4% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 3% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 2% (мас.) от общей массы композиции, или в количествах не более чем приблизительно 1%(мас.) от общей массы композиции, или в количестве приблизительно 0%(мас.) от общей массы композиции, или упомянутая композиция по существу не содержит конкретного вещества, т.е. 0%.
[0038] Термин "фармацевтически приемлемый" в этом описании означает, что инертные наполнители пригодны для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, несовместимости, нестабильности, раздражения, аллергической реакции и т.п., соизмеримо с разумным соотношением эффект/риск.
[0039] Термин "по существу без побочных эффектов" в этом описании означает, что по меньшей мере приблизительно 90% общего количества пациентов не имеют побочных эффектов, возникающих в результате применения композиций на основе клобетазола, или приблизительно 80% общего количества пациентов не имеют побочных эффектов, или по меньшей мере приблизительно 70% общего количества пациентов не имеют побочных эффектов, или по меньшей мере приблизительно 60% общего количества пациентов не имеют побочных эффектов. Например, приблизительно 90% общего количества пациентов не имеют подавления системы гипоталамус-гипофиз-надпочечники (HPA), или приблизительно 80% общего количества пациентов не имеют подавления системы HPA, или по меньшей мере приблизительно 70% общего количества пациентов не имеют подавления системы HPA, или по меньшей мере приблизительно 60% общего количества пациентов не имеют подавления системы НРА. В некоторых вариантах осуществления настоящего изобретения выражение "по существу не имеет подавления системы НРА" в этом описании означает, что по меньшей мере приблизительно 90% общего количества пациентов не имеют подавления системы гипоталамус-гипофиз-надпочечники (НРА), или приблизительно 80% общего количества пациентов не имеют подавления системы НРА, или по меньшей мере приблизительно 70% общего количества пациентов не имеют подавления системы НРА, или по меньшей мере приблизительно 60% общего количества пациентов не имеют подавления системы НРА. Другим побочным эффектом является снижение концентрации DHEAS в сыворотке крови, и процентное снижение концентрации DHEAS в сыворотке крови составляет менее чем приблизительно 18%, или процентное снижение концентрации DHEAS в сыворотке крови составляет менее чем приблизительно 15%, или процентное снижение концентрации DHEAS в сыворотке крови составляет менее чем приблизительно 12%.
[0040] Термин "побочный эффект" в этом описании означает побочные эффекты стероидов для местного применения высокой и средней степени активности, таких как клобетазол, и упомянутые побочные эффекты оказывают значительное влияние на эндокринную систему. Побочные эффекты, определенные в этой заявке, охватывают обратимое подавление системы гипоталамус-гипофиз-надпочечники (НРА), и/или снижение уровней дегидроэпиандростерона (DHEA), и/или дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови.
[0041] "Клинически значимое" означает изменение, которое будет оказывать неблагоприятное физиологическое действие.
[0042] Термин "наивысшая одобренная доза для местного применения клобетазола" в этом описании относится к наивысшей дозе для местного применения клобетазола пропионата, одобренной Управлением по контролю за пищевыми продуктами и медикаментами США (US FDA), для лечения одного или нескольких кожных заболеваний, и упомянутая наивысшая доза для местного применения клобетазола пропионата, одобренная US FDA, составляет 0,05% (мас.), т.е. TEMOVATE® или TEMOVATE® Е. Термин "TEMOVATE®" используется взаимозаменяемо для обозначения "наивысшей одобренной дозы для местного применения клобетазола пропионата", т.е. 0,05% (мас.), в виде крема, геля, мази или раствора; или его фармацевтических эквивалентов, или его терапевтических эквивалентов, или более поздних одобренных лекарственных средств, которые обозначены как АВ, определенных US FDA в соответствии с Approved Drug Products with Therapeutic Equivalence Evaluations (34th edition), или лекарственных препаратов, получивших одобрение на продажу со стороны US FDA через подачу Abbreviated New Drug Application (Заявка на сокращенную процедуру регистрации препарата) (ANDA) путем установления биоэквивалентности такого продукта. Например, крем TEMOVATE® содержит клобетазола пропионат (0,5 мг/г) в кремовой основе, содержащей пропиленгликоль, глицерилмоностеарат, цетостеариловый спирт, глицерилстеарат, стеарат ПЭГ 100, белый воск, хлоркрезол, цитрат натрия, моногидрат лимонной кислоты и очищенную воду. Мазь TEMOVATE® содержит клобетазола пропионат (0,5 мг/г) в кремовой основе, содержащей пропиленгликоль, сорбитансесквиолеат и белый вазелин. Дополнительные данные по другим композициям, таким как терапевтические эквиваленты/фармацевтические эквиваленты геля TEMOVATE®, геля TEMOVATE® или раствора TEMOVATE®, можно получить от US FDA или найти в любой другой общедоступной литературе. В некоторых вариантах осуществления настоящего изобретения TEMOVATE® охватывает его терапевтические или фармацевтические эквиваленты, одобренные US FDA. В некоторых вариантах осуществления настоящего изобретения крем TEMOVATE® охватывает его терапевтические или фармацевтические эквиваленты, одобренные US FDA. TEMOVATE® - это товарный знак, первоначально зарегистрированный Glaxo Group Limited Corporation, Great Britain, Clarges house, 6-12 Clarges Street, London, England W1Y8DH. Последним указанным в реестре владельцем этого товарного знака является Fougera Pharmaceuticals, Inc. Corporation New York 60 Baylis Road, Melville, New York 11747.
[0043J Термин "концентрация клобетазола в плазме" в этом описании означает концентрацию клобетазола в виде основания или его фармацевтически приемлемых солей или продуктов разложения в плазме до образования конкретной солевой формы; или же в некоторых вариантах осуществления настоящего изобретения термин "концентрация клобетазола в плазме" означает концентрацию клобетазола пропионата или клобетазола в виде основания в плазме.
[0044] Термин "послелечебный" в этом описании имеет отношение к периоду времени после приблизительно 2-недельного или 15-суточного курса местного лечения.
[0045] Термин "уровни клобетазола в плазме, недостаточные для снижения содержания кортизола в сыворотке крови до уровня, составляющего менее чем или равного 18 мкг/дл" используется в этом описании для обозначения любой концентрации клобетазола в плазме, которая не обеспечивает подавления системы гипоталамус-гипофиз-надпочечники (НРА) у субъекта, которого обрабатывали композицией для местного применения, соответствующей настоящему изобретению, и такие концентрации в плазме могут быть выбраны в пределах от примерно 1000 пг/мл до примерно 10 пг/мл или ниже предела, поддающегося количественному определению (<=10 пг/мл).
[0046] Некоторые термины, такие как "приблизительно", "до", "в целом", "по существу" и т.п., должны толковаться в качестве уточнения термина или значения таким образом, что упомянутый термин или значение не является абсолютным. Такие термины будут определяться обстоятельствами и терминами, которые они модифицируют, поскольку эти термины понятны специалистам в данной области. Они охватывают, по самой меньшей мере, уровень ожидаемой погрешности эксперимента, ошибки, обусловленной методом, и погрешности прибора для данного эксперимента, методики или инструмента, используемого для измерения значения.
[0047] Если не указано иное, все числа, выражающие количества ингредиентов, такие свойства, как условия реакции, и т.д., использованные в описании и формуле изобретения, следует понимать как модифицированные во всех случаях термином "приблизительно". Соответственно, если не указано обратное, числовые параметры, указанные в этом описании и формуле изобретения, являются приближенными параметрами, которые могут варьироваться в зависимости от желаемых свойств, которые должны быть получены в соответствии с настоящим изобретением.
[0048] В этом описании диапазоны могут быть выражены от "приблизительно" одного конкретного значения и/или до "приблизительно" другого конкретного значения. Следует также понимать, что существует ряд значений, раскрытых в этом описании, и что каждое значение также раскрыто в этом описании, как "приблизительно" это конкретное значение в дополнение к самому значению. Например, если раскрыто значение "10", в таком случае раскрыто также и значение "приблизительно 10". Следует также понимать, что раскрыта также каждая единица между двумя конкретными единицами. Например, если раскрыты 10 и 15, то раскрыты также 11, 12, 13 и 14.
[0049] Настоящее изобретение может содержать или состоять по существу из компонентов настоящего изобретения, а также других ингредиентов или элементов, описанных в данном документе. В этом описании термин "содержащий" означает приведенные элементы или их эквивалент по структуре или функции плюс любой другой элемент или элементы, который(-е) не указан(-ы). Термины "имеющий", "включающий" и "состоящий из" также должны толковаться как открытые, если контекст не предполагает иного. В этом описании термин "состоящий в основном из" означает, что изобретение может включать ингредиенты в дополнение к тем, которые указаны в формуле изобретения, но только в том случае, если дополнительные ингредиенты существенно не изменяют основные и новые характеристики заявленного изобретения.
[0050] В этом описании термин "факультативный" или "факультативно" означает, что описанное в последующем событие или обстоятельство происходит или существует и не происходит или не существует, и что описание включает случаи, когда упомянутое событие или обстоятельство происходит или существует, и случаи, когда это событие или обстоятельство не происходит или не существует.
[0051] В этом описании термин "повышенная эффективность" или "улучшающая эффективность" или "улучшающая терапевтическая эффективность" относится к терапевтически благоприятным эффектам активного вещества со снижением системных побочных эффектов, как описано в настоящем изобретении.
[0052] В этом описании термин "терапевтическая эффективность" означает превращение субъекта с "очень тяжелым или тяжелым" либо "умеренным" состоянием в субъекта со "слабыми" или "минимальными или почти отсутствующими" или "отсутствующими" поражениями в запланированный период лечения, и эти клинические определения осуществляются с использованием метода оценки по шкале Глобальной оценки эффективности исследователем (IGA) или метода сосудосуживающего анализа (VCA) (анализ побледнения кожи) для кортикостероидов или любого приемлемого метода оценки активности кортикостероидов в коже. В некоторых вариантах осуществления настоящего изобретения термин "субъект" имеет отношение к пациенту, страдающему кожными заболеваниями, такими как псориаз. В некоторых вариантах осуществления настоящего изобретения термин "субъект" имеет отношение к пациенту, страдающему псориазом, с поражением по меньшей мере приблизительно 5% площади поверхности тела, или пациенту, страдающему псориазом, с поражением по меньшей мере приблизительно 10% площади поверхности тела, или пациенту, страдающему псориазом, с поражением более чем приблизительно 10% площади поверхности тела.
[0053] Термин "усиленный перенос" в этом описании означает увеличение проникновения активного вещества в слои кожи субъекта до дермы с меньшим системным воздействием, т.е. усиленный перенос позволяет использовать более низкую дозу активного вещества для эффективного лечения заболевания.
[0054] Термин "интенсификатор(-ы) проникновения" в этом описании означает соединение(-я), которое(-ые) повышает(-ют) скорость проникновения кортикостероида через кожу или слизистую оболочку, например, временно уменьшая непроницаемость кожи или слизистой оболочки.
[0055] Обычно интенсификатор проникновения является компонентом, используемым для повышения скорости проникновения стероида через кожу или слизистую оболочку, например, путем временного уменьшения непроницаемости кожи или слизистой оболочки. Интенсификаторы проникновения также известны как "ускорители" и "промоторы абсорбции".
[0056] Примеры приемлемых интенсификаторов проникновения охватывают, но без ограничения ими, полиолы, гликоли (кроме пропиленгликоля), простые эфиры, гликолевые простые эфиры, сложные эфиры, сульфоксиды, жирные кислоты, сложные эфиры жирных кислот, жирные спирты, эфирные масла, терпены, терпеноиды, ПЭГилированные жирные кислоты, сложные эфиры ПЭГилированных жирных кислот, ПЭГилированные жирные спирты и их смеси, включая полиэтиленгликоль, монолаурат полиэтиленгликоля и бутандиол; сульфоксиды, включая диметилсульфоксид и децилметилсульфоксид; простые эфиры, включая моноэтиловый простой эфир диэтиленгликоля и монометиловый простой эфир диэтиленгликоля; жирные кислоты, включая лауриновую кислоту, олеиновую кислоту и валериановую кислоту; сложные эфиры жирных кислот, включая изопропилмиристат, изопропилпальмитат, метилпропионат и этилолеат; азотистые соединения, включая мочевину, диметилацетамид, диметилформамид-2-пирролидон, этаноламин, метил-2-пирролидон, диэтаноламин и триэтаноламин; терпены; терпеноиды; алканоны; органические кислоты, включая салициловую кислоту, лимонную кислоту и янтарную кислоту; и комбинации, содержащие один или более из вышеперечисленных материалов. В некоторых вариантах осуществления настоящего изобретения интенсификатор проникновения, использованный в фармацевтической композиции, соответствующей настоящему изобретению, представляет собой моноэтиловый простой эфир диэтиленгликоля. В некоторых вариантах осуществления настоящего изобретения интенсификатор проникновения не является полипропиленгликолем. Интенсификатор(-ы) проникновения может(-гут) быть взаимозаменяемо использован(-ы) в качестве растворителя.
[0057] Термин "локализованный участок" в этом описании означает дискретное местоположение на поверхности тела субъекта, такое как место, где наблюдается симптом состояния, подвергаемого лечению. В этом описании термин "субъект" охватывает как человека, так и животных. Таким образом, в соответствии с настоящим изобретением предложено как ветеринарное терапевтическое применение, так и применение в лечении человека.
[0058] В этом описании термин "терапия" или "лечение" относится к излечению или по существу излечению состояния, а также к улучшению по меньшей мере одного симптома этого состояния, и включает профилактическое лечение и терапевтическое лечение. Как будет понятно специалисту в данной области, лечение, проведенное до клинического проявления состояния, является профилактическим (т.е. оно защищает субъекта от развития состояния). Если лечение проводится после проявления состояния, то такое лечение является терапевтическим (т.е. оно предназначено для ослабления, уменьшения интенсивности симптомов, контроля или поддержания существующего состояния и/или побочных эффектов, связанных с упомянутым состоянием). Упомянутые термины имеют отношение к медицинскому лечению субъекта с намерением по существу вылечить, уменьшить интенсивность симптомов, стабилизировать или по существу предотвратить состояние, включая, но без ограничения им, профилактическое лечение, чтобы исключить, предотвратить, устранить, замедлить, остановить или помешать случиться чему-либо, или уменьшить тяжесть чего-либо происходящего, особенно путем упреждающего действия. Таким образом, термин "терапия" или "лечение" охватывает (но без ограничения ими) замедление прогрессирования состояния, представляющего интерес; остановку или предотвращение развития состояния, представляющего интерес; снижение тяжести состояния, представляющего интерес; уменьшение интенсивности или ослабление симптомов, связанных с состоянием, представляющим интерес; вызывание обратного развития состояния, представляющего интерес, или одного или нескольких симптомов, связанных с состоянием, представляющим интерес; и предотвращение состояния, представляющего интерес, или развития состояния, представляющего интерес.
[0059] Настоящее изобретение охватывает композицию для местного применения, содержащую кортикостероид. В некоторых вариантах осуществления настоящего изобретения предложена фармацевтическая композиция для местного применения, содержащая по меньшей мере один кортикостероид и по меньшей мере один интенсификатор проникновения. Композиция, соответствующая настоящему изобретению, по существу не содержит пропиленгликоля. В некоторых вариантах осуществления настоящего изобретения упомянутая композиция содержит не более чем 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% пропиленгликоля от общей массы композиции.
[0060] Таким образом, в некоторых вариантах осуществления настоящего изобретения упомянутая композиция по существу не содержит полипропиленгликоля, причем масса полипропиленгликоля составляет менее чем 1% (мас.) от общей массы композиции. В других вариантах осуществления настоящего изобретения композиция по существу не содержит полипропиленгликоля, причем масса полипропиленгликоля составляет менее чем 2% (мас.), 3% (мас.), 4% (мас.), 5% (мас.), 6% (мас.), 7% (мас.), 8% (мас.), 9% (мас.) или 10% (мас.) от общей массы композиции. В других вариантах осуществления настоящего изобретения композиция по существу не содержит полипропиленгликоля, причем масса полипропиленгликоля составляет менее чем приблизительно 0% (мас.) от общей массы композиции.
[0061] В некоторых вариантах осуществления настоящего изобретения предложена фармацевтическая композиция для местного применения, содержащая терапевтически эффективное количество клобетазола пропионата, по меньшей мере один интенсификатор проникновения и по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля. В некоторых вариантах осуществления настоящего изобретения предложен способ обеспечения усиленного переноса клобетазола пропионата через локализованный участок поверхности тела для достижения слоя дермы, предусматривающий применение индивидуумом эффективного количества фармацевтической композиции для местного применения, содержащей: (а) низкую дозу клобетазола пропионата, (b) масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения и неполимерный загуститель, (с) водную фазу; и (d) факультативно по меньшей мере один фармацевтически приемлемый наполнитель; при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров.
[0062] В некоторых вариантах осуществления настоящего изобретения предложенная композиция обеспечивает сопоставимую или повышенную эффективность по сравнению с имеющейся в продаже кремовой композицией клобетазола пропионата 0,05% (мас.) (крем TEMOVATE Е®) и не оказывает существенного неблагоприятного действия на эндокринную систему, как описано в этом документе и как известно специалистам в данной области.
[0063] Кортикостероиды для местного применения оказывают неблагоприятное действие на эндокринную систему человека. У сильнодействующих кортикостероидов, демонстрирующих высокий уровень системных побочных эффектов, таких как подавление системы гапоталамус-гипофиз-надпочечники (НРА), этот эффект является обратимым. Кортикостероиды для местного применения всасываются системно и демонстрируют подавление системы гипоталамус-гипофиз-надпочечники (НРА). Подавление системы НРА является критическим вопросом безопасности при терапии кортикостероидами для местного применения. Подавление системы НРА обычно оценивают по некоторым параметрам, таким как уровни кортизола и уровни дегидроэпиандростерона (DHEA) и дегидроэпиандростерона сульфата (DHEAS) в крови субъекта во время осуществления курса лечения. Уровни кортизола определяют методом стимуляции адренокортикотропного гормона - (АСТН, козинтропин). Методом стимуляции АСТН определяют, каким образом надпочечники реагируют на адренокортикотропный гормон (АСТН). АСТН представляет собой гормон, вырабатываемый в гипофизе, который стимулирует выделение надпочечниками гормона, называемого кортизолом. Антропогенная форма АСТН называется козинтропином. Нормальный уровень кортизола составляет менее чем 18 мкг/дл у нормального субъекта, а после инъекции АСТН субъекту уровень кортизола поднимается выше чем 18-20 микрограмм на децилитр (мкг/дл). Подобным же образом также изменяются уровни DHEA/DHEAS у субъекта, подвергаемого лечению кортикостероидами для местного применения; обычно стандартный контрольный диапазон DHEA составляет 280-640 мкг/дл у мужчин и 65-380 мкг/дл у женщин.
[0064] Клобетазола пропионат является высокоэффективным кортикостероидом для местного применения, который, как известно, оказывает влияние на эндокринную систему, и который подавляет систему НРА при дозах всего 2 г в сутки. Недостатки ранее описанной терапии включают необходимость периодической оценки степени подавления НРА и модификации дозирования и схемы применения лекарственного средства вследствие подавления системы НРА.
[0065] Не вызывает сомнений, что композиция для местного применения, соответствующая настоящему изобретению, не оказывает существенного отрицательного влияния на эндокринную систему при применении дважды в сутки в течение 15 суток (2 недель) у субъектов, имеющих по меньшей мере 20-50% пораженной площади поверхности тела, исключая лицо, волосистую часть кожи головы, паховую область, подмышечные впадины и другие участки с опрелостью.
[0066] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит терапевтически эффективное количество клобетазола; масляную фазу, содержащую по меньшей мере один интенсификатор проникновения; водную фазу и факультативно один фармацевтически приемлемый наполнитель.
[0067] В некоторых вариантах осуществления настоящего изобретения предложен способ профилактики, уменьшения интенсивности симптомов или лечения псориаза, облегчения воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакции контактной чувствительности и других сопутствующих заболеваний или расстройств путем применения индивидуумом эффективного количества композиции для местного применения, содержащей:
(a) низкую дозу клобетазола пропионата,
(b) масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения и неполимерный загуститель,
(c) водную фазу; а также
(d) факультативно по меньшей мере один фармацевтически приемлемый наполнитель; при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров.
[0068] В некоторых вариантах осуществления настоящего изобретения клобетазол содержится в композиции в количестве от приблизительно 0,005% до приблизительно 0,1% от общей массы композиции. В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве от приблизительно 0,005% до приблизительно 0,05% от общей массы композиции или в количестве до приблизительно 0,025% от общей массы композиции.
[0069] В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве до приблизительно 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,010%, 0,011%, 0,012%, 0,013%, 0,014%, 0,015%, 0,016%, 0,017%, 0,018%, 0,019%, 0,020%, 0,021%, 0,022%, 0,023%, 0,024%, 0,025%, 0,026%, 0,027%, 0,028%, 0,029%, 0,030%, 0,031%, 0,032%, 0,033%, 0,034%, 0,035%, 0,036%, 0,037%, 0,038%, 0,039%, 0,040%, 0,041%, 0,042%, 0,043%, 0,044% или 0,045% от общей массы композиции. В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве менее чем 0,050% от общей массы композиции. В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве от приблизительно 0,010% до приблизительно 0,040% от общей массы композиции. В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве от приблизительно 0,015% до приблизительно 0,035% от общей массы композиции. В некоторых вариантах осуществления настоящего изобретения клобетазола пропионат содержится в количестве от приблизительно 0,020% до приблизительно 0,030% от общей массы композиции.
[0070] В других вариантах осуществления настоящего изобретения композиция содержит по меньшей мере один интенсификатор проникновения в количестве от приблизительно 1% до приблизительно 30,0% от массы композиции или же в количестве от приблизительно 0,01% до приблизительно 10,0% от массы композиции. В некоторых вариантах осуществления настоящего изобретения по меньшей мере один интенсификатор проникновения содержится в количестве до приблизительно 0,05%, 0,10%, 0,15%, 0,20%, 0,25%, 0,30%, 0,35%, 0,40%, 0,45%, 0,50%, 0,55%, 0,60%, 0,65%, 0,70%, 0,75%, 0,80%, 0,85%, 0,90%, 0,95%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% или 10% от массы композиции.
[0071] В другом варианте осуществления настоящего изобретения предложена фармацевтическая композиция для местного применения, содержащая: низкую дозу клобетазола пропионата в количестве, выбранном в пределах от приблизительно 0,005% до приблизительно 0,1% от общей массы композиции; масляную фазу, содержащую по меньшей мере один интенсификатор проникновения в количестве от приблизительно 0,01% до приблизительно 15,0% от общей массы композиции и неполимерный загуститель, водную фазу и факультативно по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров.
[0072] В еще одном варианте осуществления настоящего изобретения предложен способ профилактики, уменьшения интенсивности симптомов или лечения кожных заболеваний или расстройств, таких как псориаз/псориатические бляшки, облегчения воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности, атонического дерматита, себорейного дерматита, экземы, бляшечного псориаза, эритродермического псориаза, псориаза волосистой части кожи головы и других сопутствующих заболеваний или расстройств, путем применения индивидуумом эффективного количества композиции для местного применения, содержащей: (а) клобетазола пропионат в количестве приблизительно 0,025% от общей массы композиции, (b) масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения и неполимерный загуститель, (с) водную фазу и (d) по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля, и упомянутая композиция имеет сопоставимую или повышенную эффективность по сравнению с имеющейся в продаже кремовой композицией клобетазола пропионата 0,05% (мас.) (крем TEMOVATE®). В некоторых вариантах осуществления настоящего изобретения упомянутую композицию для местного применения применяют дважды в сутки в течение 4 недель или композицию для местного применения применяют дважды в сутки в течение по меньшей мере 2 недель.
[0073] В другом варианте осуществления настоящего изобретения использован интенсификатор проникновения, выбранный из группы, которую составляют полиолы, гликоли (кроме пропиленгликоля), простые эфиры, простые гликолевые эфиры, сложные эфиры, сульфоксиды, жирные кислоты, сложные эфиры жирных кислот, жирные спирты, эфирные масла, терпены, терпеноиды, ПЭГилированные жирные кислоты, сложные эфиры ПЭГилированных жирных кислот, ПЭГилированные жирные спирты и их смеси.
[0074] В других вариантах осуществления настоящего изобретения упомянутый интенсификатор проникновения представляет собой моноэтиловый простой эфир диэтиленгликоля.
[0075] В некоторых вариантах осуществления настоящего изобретения композиция содержит один или несколько дополнительных активных веществ, которые полезны в лечении псориаза и сопутствующих патологических состояний, включая синтетические, полусинтетические или натуральные активные вещества.
[0076] Композиция, соответствующая настоящему изобретению, может быть использована для профилактики, уменьшения интенсивности симптомов или лечения кожных заболеваний или расстройств путем применения фармацевтически эффективного количества упомянутой композиции субъектом, нуждающимся в этом. Композиции, соответствующие настоящему изобретению, также применимы в сочетании с другими видами терапии, такими как фототерапия.
(0077] В других вариантах осуществления настоящего изобретения предложен способ получения фармацевтической композиции для местного применения, предусматривающий:
(i) приготовление масляной фазы путем плавления и перемешивания загустителя(-ей), эмульгатора(-ов), а затем консерванта(-ов) и смягчающего(-из) вещества(-ств);
(ii) приготовление водной фазы путем нагревания воды,
(iii) получение эмульсии путем добавления масляной фазы этапа (i) к водной фазе этапа (ii) или vice versa при постоянной гомогенизации,
(iv) растворение предварительно смешанного раствора клобетазола в растворителе с последующим добавлением антиоксиданта(-ов) и гомогенизацией для получения раствора клобетазола, и
(v) добавление раствора клобетазола, полученного на этапе (iv), к эмульсии, полученной на этапе (iii), с последующей гомогенизацией и охлаждением для получения кремовой композиции.
[0078] В других вариантах осуществления настоящего изобретения предложен способ получения фармацевтической композиции для местного применения, предусматривающий:
(i) приготовление масляной фазы путем плавления и перемешивания стеаринового спирта, цетилового спирта, белого воска, глицерилстеарата, стеарата ПЭГ 100 и смягчающего вещества, с последующим добавлением метилпарабена, пропилпарабена и оставшейся части минерального масла,
(ii) приготовление водной фазы путем добавления раствора сорбита в нагретую воду,
(iii) получение эмульсии путем добавления масляной фазы этапа (i) к водной фазе (ii) или vice versa при гомогенизации,
(iv) растворение предварительно смешанного раствора клобетазола пропионата в моноэтиловом простом эфире диэтиленгликоля и последующее добавление бутилированного гидрокситолуола (ВНТ) и гомогенизацию с получением раствора клобетазола пропионата, и
(v) добавление раствора стероида, полученного на этапе (iv), к эмульсии, полученной на этапе (iii), с последующей гомогенизацией для получения кремовой композиции.
[0079] В других вариантах осуществления настоящего изобретения композиции, содержащие один или несколько других кортикостероидов, могут быть получены с использованием способа, аналогичного описанному выше.
[0080] Фармацевтическая композиция для местного применения, соответствующая настоящему изобретению, может быть применена для профилактики, снижения интенсивности симптомов или лечения кожных заболеваний или расстройств, таких как псориаз/псориатические бляшки, облегчения воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности, атопического дерматита, себорейного дерматита, экземы, бляшечного псориаза, эритродермического псориаза, псориаза волосистой части кожи головы и других сопутствующих заболеваний или расстройств.
[0081] В некоторых вариантах осуществления настоящего изобретения было неожиданно установлено, что композиции для местного применения, соответствующие настоящему изобретению, содержащие масляную фазу, которая содержит по меньшей мере один интенсификатор проникновения, и водную фазу, обеспечивают усиленный перенос клобетазола через локализованный участок поверхности тела для достижения слоя дермы; это обеспечивает преимущество, заключающееся в использовании более низкой концентрации клобетазола, т.е. на приблизительно 50% меньше по сравнению с имеющейся в продаже лекарственной формой в виде крема TEMOVATE® (содержащего 0,05% (мас.) клобетазола пропионата), обеспечивая при этом аналогичную или повышенную эффективность и не оказывая существенного влияния на эндокринную систему, т.е. подавления системы НРА.
[0082] В других вариантах осуществления настоящего изобретения было обнаружено, что предложенная фармацевтическая композиция, содержащая 3% интенсификатора проникновения, обеспечивает аналогичную или повышенную эффективность по сравнению с кремом TEMOVATE® (который содержит 0,05% (мас.) клобетазола пропионата). В других вариантах осуществления настоящего изобретения предложенная фармацевтическая композиция содержит 10% интенсификатора проникновения.
[0083] Кроме того, следует отметить, что фармацевтическая композиция для местного применения, соответствующая настоящему изобретению, не содержит пропиленгликоля, не вызывает раздражения, нетоксична, хорошо переносится и не имеет каких-либо нежелательных свойств, обеспечивая тем самым возможность для точного выполнения пациентом терапевтических рекомендаций.
[0084] В других вариантах осуществления настоящего изобретения предложенные композиции являются физически и химически стабильными.
[0085] В других вариантах осуществления настоящего изобретения фармацевтические композиции для местного применения полезны для облегчения воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, и могут обеспечить увлажняющее и/или успокаивающее действие в месте нанесения на кожу. Упомянутая композиция, соответствующая настоящему изобретению, уменьшает сухость, которая сопровождает увеличение количества псориатических бляшек на коже.
[0086] В других вариантах осуществления настоящего изобретения предложенная композиция может быть нанесена непосредственно на псориатические поражения или дерматозы и может помочь уменьшить воспаление, удалить накопившиеся чешуйки, снизить кожный метаболизм и/или очистить пораженную кожу от бляшек.
[0087] В некоторых вариантах осуществления настоящего изобретения в предложенных композициях могут быть использованы любые кортикостероиды для местного применения, как отдельно, так и в комбинации с другими веществами. Примеры приемлемых кортикостероидов для местного применения охватывают, но без ограничения ими, клобетазола пропионат, алклометазона дипропионат, амцинонид, беклометазона дипропионат, бетаметазона бензоат, бетаметазона дипропионат, бетаметазона натрия фосфат, бетаметазона валерат, будесонид, клокортолона пивалат, десонид, дезоксиметазон, дексаметазон, дексаметазона ацетат, дексаметазона никотинат, дексаметазона пропионат, дексаметазона натрия фосфат, дексаметазона валерат, дифлоразона диацетат, дифлукторолона валерат, флуандренолид, флуметазона пивалат, флуоцинолона ацетонид, флуоцинонид, бутиловый сложный эфир флюкортина, флутиказона пропионат, галцинонид, галобетазола пропионат, моногидрат галометазона, гидрокортизон, гидрокортизона натрия фосфат, гидрокортизона натрия сукцинат, гидрокортизон-17-бутират-21-пропионат, гидрокортизона ацепонат, гидрокортизона ацетат, гидрокортизона валерат, гидрокортизона бутират, гидрокортизона пробутат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона ацепонат, мометазона фуроат, преднизолон, преднизолона натрия фосфат, преднизолона ацетат, преднизолон-17-валерат-21-ацетат, триамцинолона ацетонид, триамцинолона ацетат, триамцинолона диацетат и предникарбат. Приемлемы также другие лекарственные соединения, и эта заявка также конкретно предлагает использование любых комбинаций стероидных препаратов.
[0088] Композиции для местного применения, соответствующие настоящему изобретению, могут быть в форме раствора, суспензии, эмульсий, кремов, мазей, лосьонов, микроэмульсий, наноэмульсий, эмульгелей, липосом, мицелл, обратных мицелл, гелей, гидрогелей, спреев и т.п.
[0089] В одном из вариантов осуществления настоящего изобретения предложенная композиция для местного применения может быть в виде композиций, содержащих две фазы: масляную фазу и водную фазу, и композиции, соответствующие настоящему изобретению, могут быть в виде эмульсий, кремов, лосьонов, микроэмульсий, наноэмульсий, эмульгелей, липосом, мицелл, обратных мицелл, спреев и т.п. В некоторых вариантах осуществления настоящего изобретения композиции могут быть в виде эмульсии. Упомянутая эмульсия может быть в виде эмульсии типа масло-в-воде или эмульсии типа вода-в-масле. Эмульсия на водной основе, такая как эмульсия типа масло-в-воде, часто имеет более низкую вязкость, чем эмульсии других типов, и демонстрирует заметную стабильность при хранении и возможность для точного выполнения пациентом терапевтических рекомендаций. Обычно эмульсии типа масло-в-воде обладают лучшими свойствами в отношении ощущения при нанесении на кожу, поскольку вызываемое ими ощущение подобно ощущению, вызываемому водным материалом.
[0090] В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции получают в виде эмульсий, содержащих масляную, или гидрофобную, фазу, водную, или гидрофильную, фазу и эмульгатор. В том случае, когда масляная фаза диспергирована в виде капелек в водной дисперсионной фазе, это называется эмульсией типа "масло-в-воде". В том случае, когда водная фаза диспергирована в виде капелек в масляной дисперсионной фазе, это называется эмульсией типа "вода-в-масле".
[0091] В некоторых вариантах осуществления настоящего изобретения фармацевтическая композиция представляет собой эмульсию для местного применения на водной основе типа масло-в-воде. Термин "на водной основе" определяется как эмульсия, которая содержит высокий процент воды. В состав готовой эмульсионной композиции на водной основе типа масло-в-воде, соответствующей настоящему изобретению, входит по меньшей мере 60% воды или по меньшей мере 70% воды.
[0092] В некоторых вариантах осуществления настоящего изобретения эмульсионная композиция для местного применения на водной основе типа масло-в-воде содержит: терапевтически эффективное количество кортикостероида и по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров.
[0093] В некоторых вариантах осуществления настоящего изобретения эмульсионная композиция для местного применения на водной основе типа масло-в-воде содержит: (а) терапевтически приемлемое количество клобетазола (b) дисперсную масляную фазу, содержащую: растворитель и по меньшей мере один интенсификатор проникновения; (с) дисперсионную водную фазу; и (d) по меньшей мере один фармацевтически приемлемый наполнитель, при этом упомянутая композиция по существу не содержит пропиленгликоля и по существу не содержит полимеров. В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит: (а) терапевтически приемлемое количество клобетазола, составляющее приблизительно 0,025% (мас.); (b) масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения и неполимерный загуститель; (с) водную фазу; и (d) факультативно один фармацевтически приемлемый наполнитель; при этом упомянутая композиция для местного применения по существу не содержит пропиленгликоля и по существу не содержит полимеров; при этом упомянутая композиция для местного применения не оказывает существенного отрицательного влияния на эндокринную систему.
[0094] В других вариантах осуществления настоящего изобретения эмульсионная композиция для местного применения на водной основе типа масло-в-воде имеет вязкость в диапазоне от приблизительно 10 сП (0,01 Па⋅с) до приблизительно 100000 сП (100 Па⋅с). Вязкость эмульсионных композиций на водной основе, соответствующих настоящему изобретению, может составлять от приблизительно 0,01 Паскаль-секунда до 100 Паскаль-секунда, "Па⋅с" (10-100000 сП), или от приблизительно 0,1 Па⋅с до 100 Па⋅с (100-100000 сП), или приблизительно 1-50 Па⋅с (1000-50000 сП), или приблизительно 0,01-15 Па⋅с (10-15000 сантипуаз, "сП"), или приблизительно 0,02-1,5 Па⋅с (20-1500 сП), или приблизительно 0,05-1 Па⋅с (50-1000 сП).
[0095] Вязкость композиций для местного применения, соответствующих настоящему изобретению, составляет от приблизительно 0,1 сП (0,0001 Па⋅с) до приблизительно 500 сП (0,5 Па⋅с) при измерении с помощью вискозиметра Брукфилда Сар 2000+ со шпинделем №1 при 530 об/мин при 25°C.
[0096] В другом варианте осуществления настоящего изобретения фармацевтическая композиция содержит один или несколько фармацевтически приемлемых наполнителей, которые могут действовать как носитель(-и), эмульгатор(-ы), коэмульгирующий(-ие) растворитель(-и), корастворитель(-и), смягчающее(-ие) вещество(-а), антиоксидант(-ы), консервант(-ы), гелеобразователь(-и) или загуститель(-и), полимер(-ы), поверхностно-активное(-ые) вещество(-а), успокаивающее(-ие) средство(-а), модификатор(-ы) pH, солюбилизатор(-ы), увлажнитель(-и), увлажняющее(-ие) средство(-а), масляное(-ые) основание(-ия) и т.п.
[0097] Термин "носитель" или "основа" обозначает органические или неорганические ингредиенты, натуральные либо синтетические, с которыми активный ингредиент объединяют для облегчения нанесения композиции. Примеры носителей охватывают, но без ограничения ими, воду, ацетон, отдельно или в комбинации с такими материалами, как силиконовые жидкости. В некоторых вариантах осуществления настоящего изобретения носитель может содержать, помимо воды, несмешивающиеся с водой вещества, такие как любые фармацевтически приемлемые жирные сложные эфиры природных жирных кислот, триглицериды животного или растительного происхождения, среднецепочечные триглицериды, смеси моно-, ди- и/или триглицеридов, воски, гидрированные растительные масла и их смеси.
[0098] Примеры эмульгирующих веществ охватывают, но без ограничения ими, динатрийкокоамфодиацетат, оксиэтиленированный глицерилкокоат (7 ЕО), гексадеценилсукцинат ПЭГ-20, стеариловый простой эфир ПЭГ-15, моносульфосукцинатные соли моноэтаноламида рицинолевой кислоты, оксиэтиленированный гидрогенизированный триглицерид рицинолевой кислоты, содержащий 60 единиц этиленоксида, такой как продукты, поставляемые на рынок BASF под товарными знаками CREMOPHOR® RH 60 или CREMOPHOR® RH 40 (полиоксил 40 гидрогенизированное касторовое масло), полимеры, такие как полоксамеры, которые являются блок-сополимерами этиленоксида и пропиленоксида, и нетвердые при комнатной температуре (т.е. при температуре в пределах от приблизительно 20°C до 35°C) жирные вещества, такие как кунжутное масло, масло сладкого миндаля, масло косточек абрикоса, подсолнечное масло, октоксиглицерилпальмитат (или пальмитат 2-этилгексилглицерилового простого эфира), октоксиглицерилбегенат (или бегенат 2-этилгексилглицерилового простого эфира), диоктиладипат и тартраты разветвленных двухатомных спиртов. Сложные эфиры сорбитана и жирных кислот представляют собой ряд смесей неполных сложных эфиров сорбита и моно- и диангидридов сорбита с жирными кислотами. Сложные сорбитановые эфиры включают продукты, поставляемые на рынок как ARLACEL® 20, ARLACEL40, ARLACEL 60, ARLACEL 80, ARLACEL 83, ARLACEL 85, ARLACEL 987, ARLACEL С, стеарат ПЭГ-6 и стеарат гликоля, стеарат ПЭГ-32 (TEFOSE® 63), стеарат ПЭГ-6 и стеарат ПЭГ-32 (TEFOSE® 1500), глицерилстеарат и стеарат ПЭГ 100 (TEFOSE® 165) и любые их смеси. В другой группе эмульгаторов, которые могут быть использованы в эмульсиях, находятся полиэтиленгликолевые простые эфиры стеариновой кислоты. Примеры полиэтиленгликолевых простых эфиров стеариновой кислоты охватывают, но без ограничения ими, стеарет-2, стеарет-4, стеарет-6, стеарет-7, стеарет-10, стеарет-11, стеарет-13, стеарет-15, стеарет-20, полиэтиленгликолевые простые эфиры стеарилового спирта (стеарет-21) и любые их смеси. Другие эмульгаторы охватывают лаурилсульфат натрия, бромид цетилтриалкиламмония, сложные эфиры полиоксиэтиленсорбитана и жирных кислот и любые их смеси.
10099] Неионные эмульгирующие вещества включают те вещества, которые могут быть широко определены как продукты конденсации длинноцепочечных спиртов, например, С8-30 спиртов, с сахар- или крахмалсодержащими полимерами, т.е. с гликозидами. Различные сахара включают, но без ограничения ими, глюкозу, фруктозу, маннозу и галактозу, и различные длинноцепочечные спирты включают, но без ограничения ими, дециловый спирт, цетиловый спирт, стеариловый спирт, лауриловый спирт, миристиловый спирт, олеиловый спирт и любые их смеси.
[00100] Другие полезные неионогенные эмульгирующие вещества включают продукты конденсации алкиленоксидов с жирными кислотами, такие как алкиленоксидные сложные эфиры жирных кислот. Другими неионогенными поверхностно-активными веществами являются продукты конденсации алкиленоксидов с 2 молями жирных кислот, такие как алкиленоксидные сложные диэфиры жирных кислот.
[00101] Эмульгирующие вещества могут также включать любое из множества катионных, анионных, цвиттер-ионных и амфотерных поверхностно-активных веществ, которые известны в данной области. Примеры анионных эмульгирующих веществ охватывают, но без ограничения ими, алкилизетионаты, сульфаты алкила и алкилового простого эфира и их соли, фосфаты алкила и алкенилового простого эфира и их соли, алкилметилтаураты и мыла (например, соли щелочных металлов и натриевые или калиевые соли) жирных кислот.
[00102] Примеры амфотерных и цвиттер-ионных эмульгирующих веществ охватывают те из них, которые широко описаны как производные алифатических вторичных и третичных аминов, в которых алифатический радикал может быть неразветвленной или разветвленной цепью, при этом один из алифатических заместителей содержит от приблизительно 8 атомов до приблизительно 22 атомов углерода и один из алифатических заместителей содержит анионную водосолюбилизирующую группу, например, карбоксигруппу, сульфонат, сульфат, фосфат или фосфонат. Конкретные примеры охватывают, но без ограничения ими, алкилиминоацетаты, иминодиалканоаты и аминоалканоаты, производные имидазолиния и аммония. Другие приемлемые амфотерные и цвиттер-ионные эмульгирующие вещества включают бетаины, султаины, гидроксисултаины, алкилсаркозинаты и алканоилсаркозинаты.
[00103] Силиконовые эмульгаторы обычно представляют собой органически модифицированные органополисилоксаны, иногда называемые силиконовыми поверхностно-активными веществами. Приемлемые силиконовые эмульгаторы включают диметиконовые кополиолы. Эти материалы представляют собой полидиметилсилоксаны, которые были модифицированы с включением боковых полиэфирных цепей, таких как полиэтиленоксидные цепи, полипропиленоксидные цепи, смеси этих цепей и полиэфирные цепи, содержащие фрагменты, полученные как из этиленоксида, так и из пропиленоксида.
[00104] Коэмульгаторы или вторичные эмульгирующие вещества включают, но без ограничения ими, полиоксиглицериды, такие как олеоилмакроголглицериды (LABRAFIL® М 1944CS), линолеоилмакроголглицериды (LABRAFIL® М 2125CS), каприлокапроилмакроголглицериды (LABRASOL®), цетиловый спирт (и) цетет-20 (и) стеарет-20 (EMULCERE™ 61 WL 2659), глицерилстеарат (и) стеарат ПЭГ-75 (GELOT® 64), сукцинат d-альфа-токоферилполиэтиленгликоля 1000 (TPGS) и любые их смеси.
[00105] Термин "растворитель" относится к компонентам, которые помогают растворению лекарственного средства в композиции. Растворители предназначены для сохранения раствора лекарственного средства в композиции. Некоторые растворители могут также интенсифицировать чрескожное проникновение лекарственного средства и/или оказывать действие как увлажнители. Для кортикостероидов для местного применения растворители могут содержать несмешивающиеся с водой вещества, такие как жирные сложные эфиры натуральных жирных кислот, триглицериды животного или растительного происхождения, среднецепочечные триглицериды, смеси моно-, ди- и/или триглицеридов, воски, гидрогенизированные растительные масла, а также их смеси. Некоторые конкретные примеры охватывают, но без ограничения ими, касторовое масло, изопропилмиристат, диметилизосорбид, олеиловый спирт, лабрафил, лабразол, среднецепочечный триглицерид, диэтилсебацат, ланолиновое масло, триизоцетилцитрат триглицериды, содержащие 10-18 атомов углерода, каприловые/каприновые триглицериды, кокосовое масло, кукурузное масло, хлопковое масло, льняное масло, норковый жир, оливковое масло, пальмовое масло, подсолнечное масло, ореховое масло, насыщенные парафиновые масла, минеральные масла, растительные масла или глицериды и тому подобное. Растворитель также может быть выбран из группы, в состав которой входят моноалкиловый простой эфир диэтиленгликоля, такой как монометиловый простой эфир диэтиленгликоля, моноэтиловый простой эфир диэтиленгликоля или их смеси. В некоторых вариантах осуществления настоящего изобретения растворителем является моноэтиловый простой эфир диэтиленгликоля. Он поставляется на рынок Gattefosse под торговым названием TRANSCUTOL®, TRANSCUTOL-P®, TRANSCUTOL-CG® и TRANSCUTOL-HP®.
[00106] В одном из вариантов осуществления настоящего изобретения растворитель выбран из группы, которую составляют: минеральное масло, изопропилмиристат, диметилизосорбид, олеиловый спирт, лабрафил, лабразол, среднецепочечный триглицерид, диэтилсебацат, лаурилсульфат аммония, оксид лаурамина, лауретсульфат натрия, н-метил-2-пирролидинон, октановая кислота, кокобетаин, диметилсульфоксид, лаурет-2-сульфат натрия, бензиновый спирт, этилацетат, молочная кислота, олеиновая кислота, этилацетат, масло мяты кудрявой, изостеариновая кислота, этанол, диацетат пропиленгликоля, диметилизосорбид, 1-бутанол, метил глюцет-10, лауроилсаркозинат натрия, полисорбат 20, изопропиловый спирт, каприол 90, сорбитанмоноолеат, глицерилрицинолеат, полоксамер, полиэтиленгликоль 200, полисорбат 65, триацетин, бензиловый спирт, касторовое масло, арлацел 165, рицинолеат пропиленгликоля, глицерилизостеарат, пропиленгликоль, диэтилфталат, глицерил олеат, лаурат ПЭГ-8, сорбитансесквиолеат, олеат PPG-26, 1-октанол, лаурогликоль FCC, диизопропиладипат, лаурет 4 и диэтилсебацат для солюбилизации пропионата клобетазола. Композиции, соответствующие настоящему изобретению, содержат от приблизительно 1% (мас.) до 30% (мас.) растворителя от общей массы композиции.
[00107] Термин "смягчающие вещества" обозначает вещества, которые смягчают и обезболивают кожу. Они используются для предотвращения сухости и шелушения кожи. Примеры смягчающих веществ, которые могут быть использованы в настоящем изобретении, охватывают, но без ограничения ими, масла природного происхождения, такие как миндальное масло, кокосовое масло, оливковое масло, пальмовое масло, арахисовое масло и т.п., жирные кислоты, такие как лауриновая кислота, миристиновая кислота, пальмитиновая кислота и стеариновая кислота, сложные эфиры одноатомных спиртов и жирных кислот, такие как этилаурат, изопропилаурат, этилмиристат, н-пропилмиристат, изопропилмиристат, этилпальмитат, изопропилпальмитат, метилпальмитат, метилстеарат, этилстеарат, изопропилстеарат, бутилстеарат, изобутилстеарат, амилстеарат и изоамилстеарат, гликоли, такие как этиленгликоль, диэтиленгликоль, полиэтиленгликоль, разветвленные алифатические спирты, такие как лауриловый спирт, миристиловый спирт и стеариловый спирт, или их смеси. Примеры смягчающих веществ охватывают каприловые/каприновые триглицериды, касторовое масло, цетеарет-20, цетерет-30, цетеариловый спирт, цетет-20, цетостеариловый спирт, цетиловый спирт, цетилстеариловый спирт, масло какао, диизопропиладипат, глицерин, глицерилмоноолеат, глицерилмоностеарат, глицерилстеарат, изопропилмиристат, изопропилпальмитат, ланолин, ланолиновый спирт, гидрогенизированный ланолин, жидкие парафины, линолевую кислоту, минеральное масло, олеиновую кислоту, белый вазелин, полиэтиленгликоль, простые эфиры полиоксиэтиленгликолей и жирных спиртов, силиконы и их смеси.
[00108] Силиконы обычно представляют собой органически модифицированные органополисилоксаны, иногда называемые силиконовыми поверхностно-активными веществами. Приемлемые полисилоксановые или силиконовые смягчающие вещества охватывают, но без ограничения ими, полисилоксановый полимер, диметиконовые кополиолы, циклометиконы. Эти вещества представляют собой полидиметилсилоксаны, которые были модифицированы с включением боковых полиэфирных цепей, таких как полиэтиленоксидные цепи, полипропиленоксидные цепи, смеси этих цепей и полиэфирных цепей, содержащих фрагменты, полученные как из этиленоксида, так и из пропиленоксида.
[00109] Термин "антиоксиданты" обозначает вещества, которые ингибируют окисление или подавляют реакции, активированные кислородом или пероксидами. Антиоксиданты, особенно липидорастворимые антиоксиданты, могут абсорбироваться клеточной мембраной, чтобы нейтрализовать кислородные радикалы и тем самым защитить эту мембрану. Приемлемые антиоксиданты, которые могут быть использованы в настоящем изобретении, охватывают, но без ограничения ими, аскорбиновую кислоту (витамин С), глутатион, липоевую кислоту, мочевую кислоту, сорбиновую кислоту, каротины, α-токоферол (витамин Е), TPGS (D-альфа-токоферол полиэтиленгликоль 1000 сукцинат), убихинол, бутилированный гидроксианизол, бутилированный гидрокситолуол, бензоат натрия, пропилгаллат (PG, Е310) и третичный бутилгидрохинон.
[00110] Термин "консервант" означает природное или синтетическое химическое вещество, которое предотвращает разложение композиции вследствие микробного роста или нежелательных химических изменений. Консерванты, желательно, могут быть включены в композицию для защиты от роста потенциально вредных микроорганизмов. Несмотря на то, что микроорганизмы имеют тенденцию к росту в водной фазе, они могут также находиться в гидрофобной или масляной фазе. Примеры консервантов, которые могут быть использованы в настоящем изобретении, охватывают, но без ограничения ими, метилпарабен, пропилпарабен, бензиловый спирт, хлоркрезол, бензалкония хлорид, цетримония хлорид, эдетат натрия, борную кислоту, сорбиновую кислоту или любые их смеси.
[00111] Термины "загустители" или "гелеобразователи" используют для обозначения веществ, предназначенных для увеличения объема композиции. Примеры загустителей или гелеобразователей, которые могут быть использованы в настоящем изобретении, охватывают, но без ограничения ими, карбомеры, полиэтиленгликоли, акрилатные полимеры, метакрилатные полимеры, поливинилпирролидоны, сополимеры на основе бутилметакрилата и метилметакрилата, повидон, винилацетаты, поливинилацетаты, целлюлозы, камеди, альгинаты, ацетатфталаты целлюлозы, ацетатбутираты целлюлозы, фталаты гидроксипропилметилцеллюлозы и т.п. Примеры охватывают продукты CARBOPOL®, PEG 400, EUDRAGIT® 100, EUDRAGIT® RSPO, EUDRAGIT® RLPO, EUDRAGIT® ND40, PLASDONE®, сополимеры на основе бутилметакрилата и метилметакрилата (PLASTOID® В), алкилцеллюлозы, такие как этилцеллюлозы и метилцеллюлозы, гидроксиалкилцеллюлозы, такие как гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза, гидроксиалкилалкилцеллюлозы, такие как гидроксипропилметилцеллюлозы и гидроксибутилметилцеллюлозы, камеди, такие как ксантановая камедь, трагакант, гуаровая камедь, камедь рожкового дерева, аравийская камедь и т.п.
[00112] Согласно одному из вариантов осуществления настоящего изобретения загустители представляют собой неполимерные загустители; примеры неполимерного загустителя охватывают жирный спирт, выбранный из группы, в состав которой входят: цетиловый спирт, парафин, стеариловый спирт, белый воск, воскоподобные сложные эфиры цетилового спирта, микрокристаллический воск, анионный эмульгирующий воск, неионогенный эмульгирующий воск, желтый воск, касторовое масло, церезин, цетостеариловый спирт, циклометикон, глицерилбегенат, гекторит, миристиловый спирт, цетилстеариловый спирт, триолеин и ланолин. Жирные спирты, которые могут быть использованы в качестве неполимерного загустителя, охватывают, но без ограничения ими, стеариловый спирт, олеиловый спирт, цетиловый спирт, цетостеариловый спирт, представляющие собой длинноцепочечные жирные спирты. Стеариловый спирт представляет собой белое воскообразное твердое вещество со слабым запахом, тогда как олеиловый спирт и октилдодеканол представляют собой прозрачные бесцветные жидкости. Олеиловый спирт представляет собой ненасыщенный жирный спирт, подобный насыщенным жирным спиртам - стеариновому спирту и цетиловому спирту. Согласно одному из вариантов осуществления настоящего изобретения композиции для местного применения по существу не содержат полимеров.
[00113] Другие загустители или гелеобразователи, или полимеры, применимые в настоящем изобретении, охватывают, но без ограничения ими, полиамиды, поликарбонаты, полиалкилены, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, поливиниловые спирты, простые поливиниловые эфиры, сложные поливиниловые эфиры, поливинилгалогениды, полигликолиды, полисилоксаны, полиуретаны и их сополимеры, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, полимеры акриловых и метакриловых сложных эфиров, ацетаты целлюлозы, пропионаты целлюлозы, ацетатбутираты целлюлозы, ацетатфталаты целлюлозы, карбоксилэтилцеллюлозы, триацетаты целлюлозы, натриевые соли сульфатов целлюлозы, поли(метилетакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат), поли(октадецилакрилат), полиэтилены, полипропилены, поли(этиленгликоль), поли(этиленоксид), поли(этилентерефталат), поли(виниловый спирт), поли(винилацетат), поли(винилхлорид), полистиролы и т.п., включая их смеси.
[00114] Примеры других приемлемых полимеров, которые могут действовать как загустители или гелеобразователи, охватывают, но без ограничения ими, синтетические полимеры, такие как полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(ортоэфир), полиуретаны, поли(масляную кислоту), поли(валериановую кислоту), поли(капролактон), поли(гидроксибутират), поли(лактид-ко-гликолид), поли(лактид-ко-капролактон), и природные полимеры, такие как альгинат и другие полисахариды, которые охватывают, но без ограничения ими, арабинаны, фруктаны, фуканы, галактаны, галактуронаны, глюканы, маннаны, ксиланы (такие как, например, инулин), леван, фукоидан, каррагенин, галактокаролозу, пектиновую кислоту, пектин, амилозу, пуллулан, гликоген, амилопектин, целлюлозу, декстран, пустулан, хитин, агарозу, кератан, хондроитан, дерматан, гиалуроновую кислоту, альгиновую кислоту, ксантановую камедь, крахмалы и различные другие природные гомополимеры и гетерополимеры, такие как те из них, которые содержат одну или несколько альдоз, кетоз, кислот или аминов, эритрозу, треозу, рибозу, арабинозу, ксилозу, ликсозу, аллозу, альтрозу, глюкозу, маннозу, гулозу, идозу, галактозу, талозу, эритрулозу, рибулозу, ксилулозу, псикозу, фруктозу, сорбозу, тагатозу, маннит, сорбит, лактозу, сахарозу, трегалозу, мальтозу, целлобиозу, глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин, аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, гистидин, глюкуроновую кислоту, глюконовую кислоту, глюкаровую кислоту, галактуроновую кислоту, маннуроновую кислоту, глюкозамин, галактозамин и нейраминовую кислоту и их природные производные, включая декстран и целлюлозу, коллаген, альбумин и другие гидрофильные белки, зеин и другие проламины и гидрофобные белки, сополимеры и их смеси.
[00115] Термин "увлажнитель" означает гигроскопическое вещество, которое наиболее часто является молекулой с несколькими гидрофильными группами, чаще всего гидроксильными группами, но также могут встречаться амины и карбоксильные группы, иногда эстерифицированные; решающим моментом в данном случае является сродство к образованию водородных связей с молекулами воды. Примеры увлажнителей охватывают, но без ограничения ими, глицерин и глицерилтриацетат (Е1518). Другими примерами могут быть полиолы Сахаров, такие как сорбит (Е420), ксилит и мальтит (Е965), полимерные полиолы, такие как полидекстроза (Е1200), или природные экстракты, такие как квиллайа (Е999), молочная кислота или мочевина.
[00116] Некоторые из наполнителей, описанных выше, могут иметь более чем одну функцию в композиции. Например, наполнитель может быть как растворителем, так и интенсификатором проникновения, или же одновременно как растворителем, так и носителем. Категоризацию наполнителей, описанных выше, никоим образом не следует толковать как ограничение.
[00117] Композиция, соответствующая настоящей заявке, может быть нанесена непосредственно на пораженные участки кожи, такие как псориатические бляшки или пораженные дерматозом участки кожи. Кремовые композиции наносят в виде пленки на пораженные участки, и в некоторых вариантах осуществления они могут обеспечивать высвобождение активного вещества в течение длительного периода времени.
[00118] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит: (а) низкую дозу клобетазола; (b) масляную фазу, содержащую: по меньшей мере один интенсификатор проникновения, и неполимерный загуститель; (с) водную фазу; и (d) факультативно по меньшей мере один фармацевтически приемлемый наполнитель; при этом упомянутая композиция для местного применения, содержащая низкую дозу клобетазола, имеет скорость пропорционального высвобождения дозы, эквивалентную или превышающую скорость высвобождения крема TEMOVATE® 0,05%. Термин "скорость пропорционального высвобождения дозы" в этом описании означает, что композиция для местного применения, соответствующая настоящему изобретению, высвобождает клобетазол так, что концентрация клобетазола эквивалентна или превышает концентрацию, обеспечиваемую композициями для местного применения на основе клобетазола 0,05% (мас.), такими как крем TEMOVATE®. Скорость пропорционального высвобождения дозы является суммарным процентом высвобождения лекарственного средства, и составляет по меньшей мере приблизительно 6% от применяемой дозы клобетазола в течение приблизительно 9 часов.
[00119] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит: (а) низкую дозу клобетазола; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения, и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция для местного применения обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®.
[00120] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит: (а) низкую дозу клобетазола; (b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; при этом упомянутая композиция для местного применения обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.e. TEMOVATE®.
[00121] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит низкую дозу клобетазола; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект и пониженный побочный эффект по сравнению с таковыми в случае TEMOVATE®.
[00123] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая клобетазол, обеспечивает более низкий процент снижения концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®.
[00124] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит низкую дозу клобетазола; при этом упомянутая композиция обеспечивает более низкий процент снижения концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®.
[00125] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения представляет собой эмульсию типа масло-в-воде или эмульсию типа вода-в-масле. В некоторых вариантах осуществления настоящего изобретения упомянутая композиция для местного применения, содержащая клобетазол, представляет собой эмульсию типа масло-в-воде. В некоторых вариантах осуществления настоящего изобретения упомянутая композиция для местного применения представляет собой эмульсию типа масло-в-воде, содержащую (а) дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения, неполимерный загуститель и дисперсионную водную фазу; и (b) один или несколько фармацевтически приемлемых наполнителей.
[00126] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола составляет от приблизительно 0,005% до приблизительно 0,04% от общей массы композиции.
[00128] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 10% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,04% (мас.) от общей массы композиции.
[00129] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 20% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,04% (мас.) от общей массы композиции.
[00130] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 30% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,035% (мас.) от общей массы композиции.
[00131] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 40% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,03% (мас.) от общей массы композиции.
[00132] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 50% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,025% (мас.) от общей массы композиции.
[00133] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 60% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,02% (мас.) от общей массы композиции.
[00134] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 70% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,015% (мас.) от общей массы композиции.
[00135] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 80% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,01% (мас.) от общей массы композиции.
[00136] В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола на приблизительно 90% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,005% (мас.) от общей массы композиции.
[00137] В предпочтительном аспекте настоящего изобретения низкая доза клобетазола на приблизительно 50% меньше наивысшей одобренной дозы для местного применения клобетазола 0,05% (мас.), т.е. составляет приблизительно 0,025% (мас.) от общей массы композиции.
[00138] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая низкую дозу клобетазола, которая составляет приблизительно 0,025% (мас.), обеспечивает терапевтическую эффективность, эквивалентную терапевтической эффективности, обеспечиваемой наивысшей одобренной дозой для местного применения клобетазола 0,05% (мас.).
[00139] В некоторых аспектах настоящего изобретения клобетазол представляет собой клобетазола пропионат, т.е. клобетазол-17-пропионат.
[00140] В некоторых аспектах настоящего изобретения клобетазол представляет собой клобетазола пропионат, т.е. клобетазол-17-пропионат, и концентрация упомянутого клобетазола пропионата составляет приблизительно 0,025% (мас.).
[00141] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения обеспечивает аналогичную или повышенную терапевтическую эффективность и/или пониженный побочный эффект клобетазола. В некоторых вариантах осуществления настоящего изобретения композиция для местного применения обеспечивает аналогичную или повышенную терапевтическую эффективность и/или пониженный побочный эффект клобетазола пропионата.
{00142] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит: (а) приблизительно 0,025% (мас.) клобетазола; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®.
[00143] В некоторых вариантах осуществления настоящего изобретения кремовая композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола пропионата; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. крема TEMOVATE®.
[00144] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает среднюю концентрацию клобетазола в плазме, которая составляет меньше чем приблизительно 130пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00145] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола пропионата; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 130 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00146] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола в плазме, которая составляет меньше чем приблизительно 150 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00147] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола пропионата; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 150пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00148] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит (а) приблизительно 0,025% (мас.) клобетазола пропионата; (b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и (с) водную фазу; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет от приблизительно 130 пг/мл до приблизительно 10 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00149] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®.
[00150] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 130 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00151] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, и при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 150 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00152] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет от приблизительно 130 пг/мл до приблизительно 10 пг/мл. В другом варианте осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00153] В некоторых вариантах осуществления настоящего изобретения упомянутым побочным эффектом клобетазола является неблагоприятное действие на эндокринную систему. В некоторых вариантах осуществления настоящего изобретения упомянутым неблагоприятным действием на эндокринную систему является подавление системы гипоталамус-гипофиз-надпочечники (НРА).
[00154] В некоторых вариантах осуществления настоящего изобретения упомянутым побочным эффектом клобетазола является снижение концентрации дегидроэпиандростерона (DHEA) и/или дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови.
[00155] В некоторых вариантах осуществления настоящего изобретения TEMOVATE® представляет собой крем TEMOVATE®.
[00156] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие 0,025% (мас.) клобетазола, обеспечивают более низкое процентное снижение концентрации DHEAS в сыворотке крови. Процентное снижение концентрации DHEAS в сыворотке крови составляет менее чем приблизительно 18%, или составляет менее чем приблизительно 15%, или составляет менее чем приблизительно 10%, или составляет менее чем приблизительно 5%. В некоторых вариантах осуществления настоящего изобретения 0,025% (мас.) клобетазола обеспечивает процентное снижение концентрации DHEAS в сыворотке крови, составляющее приблизительно 18%, или 17%, или 16%, или 15%, или 14%, или 13%, или 12%, или 11%, или 10%, или 9%, или 8%, или 7%, или 6%, или 5%, или 4%, или 3%, или 2%, или 1%, причем процентное снижение концентрации DHEAS в сыворотке крови более низкое, чем у TEMOVATE®.
[00157] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие 0,025% (мас.) клобетазола, обеспечивают процентное снижение концентрации DHEAS в сыворотке крови, составляющее по меньшей мере приблизительно 20%, или составляющее по меньшей мере приблизительно 30%, или составляющее по меньшей мере приблизительно 40%, или составляющее по меньшей мере приблизительно 55% по сравнению с таковым в случае TEMOVATE®.
[00158] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие 0,025% (мас.) клобетазола пропионата, обеспечивают более низкое процентное снижение концентрации DHEAS в сыворотке крови. Процентное снижение концентрации DHEAS в сыворотке крови составляет менее чем приблизительно 18%, или составляет менее чем приблизительно 15%, или составляет менее чем приблизительно 10%, или составляет менее чем приблизительно 5%. В некоторых вариантах осуществления настоящего изобретения 0,025% (мас.) клобетазола пропионата обеспечивает процентное снижение концентрации DHEAS в сыворотке крови, составляющее приблизительно 18%, или 17%, или 16%, или 15%, или 14%, или 13%, или 12%, или 11%, или 10%, или 9%, или 8%, или 7%, или 6%, или 5%, или 4%, или 3%, или 2%, или 1%, причем процентное снижение концентрации DHEAS в сыворотке крови более низкое, чем у TEMOVATE®.
[00159] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие 0,025% (мас.) клобетазола пропионата, обеспечивают процентное снижение концентрации DHEAS в сыворотке крови, составляющее по меньшей мере приблизительно 20%, или составляющее по меньшей мере приблизительно 30%, или составляющее по меньшей мере приблизительно 40%, или составляющее по меньшей мере приблизительно 55% по сравнению с таковым в случае крема TEMOVATE®.
[00160] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие от приблизительно 0,005% (мас.) до приблизительно 0,04% (мас.) клобетазола, обеспечивают процентное снижение концентрации DHEAS в сыворотке крови, составляющее приблизительно 18%, или 17%, или 16%, или 15%, или 14%, или 13%, или 12%, или 11%, или 10%, или 9%, или 8%, или 7%, или 6%, или 5%, или 4%, или 3%, или 2%, или 1%, причем процентное снижение концентрации DHEAS в сыворотке крови более низкое, чем у TEMOVATE®.
[00161] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие приблизительно 0,025% (мас.) клобетазола, обеспечивают более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковым в случае TEMOVATE®.
[00162] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения, содержащие 0,025% (мас.) клобетазола, обеспечивают терапевтически благоприятные эффекты клобетазола, по существу не имеют побочного эффекта клобетазола, при этом упомянутым побочным эффектом является подавление системы HP А и/или снижение концентрации дегидроэпиандростерона (DHEA) и/или дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови.
[00163] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит низкую дозу клобетазола, при этом упомянутая композиция по существу не подавляет систему НРА у субъекта.
[00164] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола, при этом упомянутая композиция по существу не подавляет систему НРА у субъекта.
[00165] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола, при этом упомянутая композиция по существу не подавляет систему НРА у субъекта по сравнению с TEMOVATE®.
[00166] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция по существу не подавляет систему НРА у субъекта.
[00167] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция по существу не подавляет систему НРА у субъекта по сравнению с TEMOVATE®.
[00168] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет менее чем приблизительно 150 пг/мл, и по существу не подавляет систему НРА по сравнению с TEMOVATE®.
[00169] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит низкую дозу клобетазола, при этом упомянутая композиция обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковым в случае TEMOVATE®.
[00170] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит 0,025% (мас.) клобетазола, при этом упомянутая композиция обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковым в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения упомянутое процентное снижение составляет менее чем приблизительно 15%.
[00171] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковым в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения упомянутое процентное снижение составляет менее чем приблизительно 15%.
[00172] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола, при этом упомянутая композиция обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковым в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 150 пг/мл и обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови по сравнению с таковыми в случае TEMOVATE®.
[00173] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола в плазме, которая составляет меньше чем приблизительно 150пг/мл, обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови и также по существу не подавляет систему НРА по сравнению с таковыми в случае TEMOVATE®.
[00174] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме, которая составляет меньше чем приблизительно 150 пг/мл, обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови и также по существу не подавляет систему НРА по сравнению с таковыми в случае TEMOVATE®.
[00175] В некоторых вариантах осуществления настоящего изобретения процентное снижение уровней DHEA или DHEAS в сыворотке крови является параметром побочного эффекта стероидного лекарственного средства, такого как клобетазол. Композиции для местного применения, соответствующие настоящему изобретению, обеспечивают более низкое процентное снижение концентрации DHEA или DHEAS в сыворотке крови.
[00176] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) низкую дозу клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом является действие на эндокринную систему, такое как действие на надпочечник, которое, в свою очередь, производит подавление системы HPA.
[00177] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) низкую дозу клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу, и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом являются сниженные уровни дегидроэпиандростерона сульфата (DHEAS).
[00178] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом является действие на эндокринную систему, такое как действие на надпочечник, которое, в свою очередь, производит подавление системы НРА.
[00179] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом является сниженные уровни дегидроэпиандростерона сульфата (DHEAS).
[00180] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом является действие на эндокринную систему, такое как действие на надпочечник, которое, в свою очередь, производит подавление системы НРА.
[00181] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочного эффекта, при этом упомянутым побочным эффектом является сниженные уровни дегидроэпиандростерона сульфата (DHEAS).
[00182] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и которая по существу не имеет побочных эффектом, при этом упомянутыми побочными эффектами являются подавление системы НРА и сниженные уровни дегидроэпиандростерона сульфата (DHEAS).
[00183] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не имеет побочных эффектов, при этом упомянутыми побочными эффектами является подавление системы НРА и сниженные уровни дегидроэпиандростерона сульфата (DHEAS).
[00184] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит: а) низкую дозу клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с наивысшей одобренной дозой для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола в плазме, недостаточные для снижения уровней содержания кортизола в сыворотке крови, меньших чем или равных приблизительно 18 мкг/дл.
[00185] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит: а) приблизительно 0,025% (мас.) клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола в плазме, недостаточные для снижения уровней содержания кортизола в сыворотке крови, меньших чем или равных приблизительно 18 мкг/дл.
[00186] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит: а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола в плазме, недостаточные для снижения уровней содержания кортизола в сыворотке крови, меньших чем или равных приблизительно 18 мкг/дл.
[00187] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит приблизительно 0,025% (мас.) клобетазола, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола в плазме значительно более низкую, чем у TEMOVATE®, и средние концентрации в плазме измеряют после 2-недельного лечения.
[00188] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию клобетазола пропионата в плазме значительно более низкую, чем у TEMOVATE®, и средние концентрации в плазме измеряют после двухнедельного лечения.
[00189] В некоторых вариантах осуществления настоящего изобретения послелечебные концентрации в плазме измеряют после 8-недельного лечения.
[00190] В некоторых вариантах осуществления настоящего изобретения послелечебные концентрации в плазме измеряют после 4-недельного лечения.
[00191] В некоторых вариантах осуществления настоящего изобретения послелечебные концентрации в плазме измеряют после 15-суточного лечения.
[00192] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит приблизительно 0,025% (мас.) клобетазола пропионата, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию в плазме значительно более низкую, чем таковая в случае TEMOVATE®. Средние концентрации в плазме измеряют после 15-суточного или двухнедельного лечения. В некоторых вариантах осуществления настоящего изобретения послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 150 пг/мл. В некоторых вариантах осуществления настоящего изобретения послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 130 пг/мл, или послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 100 пг/мл, или послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 75 пг/мл, или послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 50 пг/мл, или послелечебные средние уровни клобетазола пропионата в плазме составляют менее чем приблизительно 25 пг/мл, или послелечебные средние уровни клобетазола пропионата в плазме находятся ниже уровня, поддающегося количественному определению. В некоторых вариантах осуществления настоящего изобретения композиция для местного применения содержит от приблизительно 0,005% (мас.) до приблизительно 0,04% (мас.) клобетазола, при этом упомянутая композиция обеспечивает послелечебную среднюю концентрацию в плазме значительно более низкую, чем таковая в случае TEMOVATE®, и средние концентрации в плазме измеряют после восьминедельного лечения, или после четырехнедельного лечения, или после двухнедельного лечения.
[00193] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола в плазме, которые составляют от приблизительно 130 пг/мл до 0 пг/мл.
[00194] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола в плазме, которые составляют от приблизительно 130 пг/мл до 0 пг/мл.
[00195] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель; и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола пропионата в плазме, которые составляют от приблизительно 130 пг/мл до 0 пг/мл.
[00196] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола пропионата в плазме, которые составляют от приблизительно 130 пг/мл до 0 пг/мл. В некоторых вариантах осуществления настоящего изобретения уровни клобетазола пропионата в плазме составляют от приблизительно 120 пг/мл до приблизительно 20 пг/мл или от 100 пг/мл до 20 пг/мл.
[00197] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит а) приблизительно 0,025% (мас.) клобетазола пропионата; b) эмульсию типа масло-в-воде, содержащую дисперсную масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и дисперсионную водную фазу; и с) один или несколько фармацевтически приемлемых наполнителей; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с TEMOVATE®, и обеспечивает послелечебные средние уровни клобетазола пропионата в плазме, которые составляют от приблизительно 150 пг/мл до 0 пг/мл. В некоторых вариантах осуществления настоящего изобретения уровни клобетазола пропионата в плазме составляют от приблизительно 130 пг/мл до приблизительно 0 пг/мл или от приблизительно 100 пг/мл до приблизительно 10 пг/мл.
[00198] В некоторых вариантах осуществления настоящего изобретения композиция обеспечивает среднюю концентрацию в плазме, которая является недостаточной для того, чтобы вызвать клинически значимое подавление системы НРА.
[00199] В некоторых вариантах осуществления настоящего изобретения композиция обеспечивает среднюю концентрацию в плазме, которая обеспечивает более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00200] В некоторых вариантах осуществления настоящего изобретения композиция обеспечивает средние концентрации в плазме, которые по существу не вызывают подавления системы НРА и которые обеспечивают более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00201] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая низкую дозу клобетазола, обеспечивает послелечебные средние концентрации клобетазола в плазме, которые по существу не вызывают подавления системы НРА и/или которые обеспечивают более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00202] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола, обеспечивает послелечебные средние концентрации клобетазола в плазме, которые по существу не вызывают подавления системы НРА и/или которые обеспечивают более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00203] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает послелечебные средние концентрации клобетазола в плазме, которые по существу не вызывают подавления системы НРА и/или которые обеспечивают более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00204] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает послелечебные средние концентрации клобетазола пропионата в плазме, которые по существу не вызывают подавления системы НРА или которые обеспечивают более низкое процентное снижение уровней DHEAS в сыворотке крови.
[00205] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает средние уровни клобетазола пропионата в плазме, которые меньше чем или равны приблизительно 130 пг/мл, или 129 пг/мл, или 128 пг/мл, или 127 пг/мл, или 126 пг/мл, или 125 пг/мл, или 124 пг/мл, или 123 пг/мл, или 122 пг/мл, или 121 пг/мл, или 120 пг/мл, или 119 пг/мл, или 118 пг/мл, или 117 пг/мл, или 116 пг/мл, или 115 пг/мл, или 114 пг/мл, или 113 пг/мл, или 112 пг/мл, или 111 пг/мл, или 110 пг/мл, или 109 пг/мл, или 108 пг/мл, или 107 пг/мл, или 106 пг/мл, или 105 пг/мл, или 104 пг/мл, или 103 пг/мл, или 102 пг/мл, или 101 пг/мл, или 100 пг/мл, или 99 пг/мл, или 98 пг/мл, или 97 пг/мл, или 96 пг/мл, или 95 пг/мл, или 94 пг/мл, или 93 пг/мл, или 92 пг/мл, или 91 пг/мл, или 90 пг/мл, или 89 пг/мл, или 88 пг/мл, или 87 пг/мл, или 86 пг/мл, или 85 пг/мл, или 84 пг/мл, или 83 пг/мл, или 82 пг/мл, или 81 пг/мл, или 80 пг/мл, или 79 пг/мл, или 78 пг/мл, или 77 пг/мл, или 76 пг/мл, или 75 пг/мл, или 74 пг/мл, или 73 пг/мл, или 72 пг/мл, или 71 пг/мл, или 70 пг/мл, или 69 пг/мл, или 68 пг/мл, или 67 пг/мл, или 66 пг/мл, или 65 пг/мл, или 64 пг/мл, или 63 пг/мл, или 62 пг/мл, или 61 пг/мл, или 60 пг/мл, или 59 пг/мл, или 58 пг/мл, или 57 пг/мл, или 56 пг/мл, или 55 пг/мл, или 54 пг/мл, или 53 пг/мл, или 52 пг/мл, или 51 пг/мл, или 50 пг/мл, или 49 пг/мл, или 48 пг/мл, или 47 пг/мл, или 46 пг/мл, или 45 пг/мл, или 44 пг/мл, или 43 пг/мл, или 42 пг/мл, или 41 пг/мл, или 40 пг/мл, или 39 пг/мл, или 38 пг/мл, или 37 пг/мл, или 36 пг/мл, или 35 пг/мл, или 34 пг/мл, или 33 пг/мл, или 32 пг/мл, или 31 пг/мл, или 30 пг/мл, или 29 пг/мл, или 28 пг/мл, или 27 пг/мл, или 26 пг/мл, или 25 пг/мл, или 24 пг/мл, или 23 пг/мл, или 22 пг/мл, или 21 пг/мл, или 20 пг/мл, или 19 пг/мл, или 18 пг/мл, или 17 пг/мл, или 16 пг/мл, или 15 пг/мл, или 14 пг/мл, или 13 пг/мл, или 12 пг/мл, или 11 пг/мл, или 10 пг/мл, или 9 пг/мл, или 8 пг/мл, или 7 пг/мл, или 6 пг/мл, или 5 пг/мл, или 4 пг/мл, или 3 пг/мл, или 2 пг/мл, или 1 пг/мл, или 0 пг/мл, у субъекта при применении в течение 15 суток, и по существу не вызывает подавления системы НРА.
[00206] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает средние уровни клобетазола пропионата в плазме, которые меньше чем или равны приблизительно 130 пг/мл, или 129 пг/мл, или 128 пг/мл, или 127 пг/мл, или 126 пг/мл, или 125 пг/мл, или 124 пг/мл, или 123 пг/мл, или 122 пг/мл, или 121 пг/мл, или 120 пг/мл, или 119 пг/мл, или 118 пг/мл, или 117 пг/мл, или 116 пг/мл, или 115 пг/мл, или 114 пг/мл, или 113 пг/мл, или 112 пг/мл, или 111 пг/мл, или 110 пг/мл, или 109 пг/мл, или 108 пг/мл, или 107 пг/мл, или 106 пг/мл, или 105 пг/мл, или 104 пг/мл, или 103 пг/мл, или 102 пг/мл, или 101 пг/мл, или 100 пг/мл, или 99 пг/мл, или 98 пг/мл, или 97 пг/мл, или 96 пг/мл, или 95 пг/мл, или 94 пг/мл, или 93 пг/мл, или 92 пг/мл, или 91 пг/мл, или 90 пг/мл, или 89 пг/мл, или 88 пг/мл, или 87 пг/мл, или 86 пг/мл, или 85 пг/мл, или 84 пг/мл, или 83 пг/мл, или 82 пг/мл, или 81 пг/мл, или 80 пг/мл, или 79 пг/мл, или 78 пг/мл, или 77 пг/мл, или 76 пг/мл, или 75 пг/мл, или 74 пг/мл, или 73 пг/мл, или 72 пг/мл, или 71 пг/мл, или 70 пг/мл, или 69 пг/мл, или 68 пг/мл, или 67 пг/мл, или 66 пг/мл, или 65 пг/мл, или 64 пг/мл, или 63 пг/мл, или 62 пг/мл, или 61 пг/мл, или 60 пг/мл, или 59 пг/мл, или 58 пг/мл, или 57 пг/мл, или 56 пг/мл, или 55 пг/мл, или 54 пг/мл, или 53 пг/мл, или 52 пг/мл, или 51 пг/мл, или 50 пг/мл, или 49 пг/мл, или 48 пг/мл, или 47 пг/мл, или 46 пг/мл, или 45 пг/мл, или 44 пг/мл, или 43 пг/мл, или 42 пг/мл, или 41 пг/мл, или 40 пг/мл, или 39 пг/мл, или 38 пг/мл, или 37 пг/мл, или 36 пг/мл, или 35 пг/мл, или 34 пг/мл, или 33 пг/мл, или 32 пг/мл, или 31 пг/мл, или 30 пг/мл, или 29 пг/мл, или 28 пг/мл, или 27 пг/мл, или 26 пг/мл, или 25 пг/мл, или 24 пг/мл, или 23 пг/мл, или 22 пг/мл, или 21 пг/мл, или 20 пг/мл, или 19 пг/мл, или 18 пг/мл, или 17 пг/мл, или 16 пг/мл, или 15 пг/мл, или 14 пг/мл, или 13 пг/мл, или 12 пг/мл, или 11 пг/мл, или 10 пг/мл, или 9 пг/мл, или 8 пг/мл, или 7 пг/мл, или 6 пг/мл, или 5 пг/мл, или 4 пг/мл, или 3 пг/мл, или 2 пг/мл, или 1 пг/мл, или 0 пг/мл, у субъекта при применении в течение 15 суток, и обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови.
[00207] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает послелечебные средние уровни клобетазола пропионата в плазме, которые меньше чем или равны приблизительно 150 пг/мл, или 149 пг/мл, или 148 пг/мл, или 147 пг/мл, или 146 пг/мл, или 145 пг/мл, или 144 пг/мл, или 143 пг/мл, или 142 пг/мл, или 141 пг/мл, или 140 пг/мл, или 139 пг/мл, или 138 пг/мл, или 137 пг/мл, или 136 пг/мл, или 135 пг/мл, или 134 пг/мл, или 133 пг/мл, или 132 пг/мл, или 131 пг/мл, или 130 пг/мл, или 129 пг/мл, или 128 пг/мл, или 127 пг/мл, или 126 пг/мл, или 125 пг/мл, или 124 пг/мл, или 123 пг/мл, или 122 пг/мл, или 121 пг/мл, или 120 пг/мл, или 119 пг/мл, или 118 пг/мл, или 117 пг/мл, или 116 пг/мл, или 115 пг/мл, или 114 пг/мл, или 113 пг/мл, или 112 пг/мл, или 111 пг/мл, или 110 пг/мл, или 109 пг/мл, или 108 пг/мл, или 107 пг/мл, или 106 пг/мл, или 105 пг/мл, или 104 пг/мл, или 103 пг/мл, или 102 пг/мл, или 101 пг/мл, или 100 пг/мл, или 99 пг/мл, или 98 пг/мл, или 97 пг/мл, или 96 пг/мл, или 95 пг/мл, или 94 пг/мл, или 93 пг/мл, или 92 пг/мл, или 91 пг/мл, или 90 пг/мл, или 89 пг/мл, или 88 пг/мл, или 87 пг/мл, или 86 пг/мл, или 85 пг/мл, или 84 пг/мл, или 83 пг/мл, или 82 пг/мл, или 81 пг/мл, или 80 пг/мл, или 79 пг/мл, или 78 пг/мл, или 77 пг/мл, или 76 пг/мл, или 75 пг/мл, или 74 пг/мл, или 73 пг/мл, или 72 пг/мл, или 71 пг/мл, или 70 пг/мл, или 69 пг/мл, или 68 пг/мл, или 67 пг/мл, или 66 пг/мл, или 65 пг/мл, или 64 пг/мл, или 63 пг/мл, или 62 пг/мл, или 61 пг/мл, или 60 пг/мл, или 59 пг/мл, или 58 пг/мл, или 57 пг/мл, или 56 пг/мл, или 55 пг/мл, или 54 пг/мл, или 53 пг/мл, или 52 пг/мл, или 51 пг/мл, или 50 пг/мл, или 49 пг/мл, или 48 пг/мл, или 47 пг/мл, или 46 пг/мл, или 45 пг/мл, или 44 пг/мл, или 43 пг/мл, или 42 пг/мл, или 41 пг/мл, или 40 пг/мл, или 39 пг/мл, или 38 пг/мл, или 37 пг/мл, или 36 пг/мл, или 35 пг/мл, или 34 пг/мл, или 33 пг/мл, или 32 пг/мл, или 31 пг/мл, или 30 пг/мл, или 29 пг/мл, или 28 пг/мл, или 27 пг/мл, или 26 пг/мл, или 25 пг/мл, или 24 пг/мл, или 23 пг/мл, или 22 пг/мл, или 21 пг/мл, или 20 пг/мл, или 19 пг/мл, или 18 пг/мл, или 17 пг/мл, или 16 пг/мл, или 15 пг/мл, или 14 пг/мл, или 13 пг/мл, или 12 пг/мл, или 11 пг/мл, или 10 пг/мл, или 9 пг/мл, или 8 пг/мл, или 7 пг/мл, или 6 пг/мл, или 5 пг/мл, или 4 пг/мл, или 3 пг/мл, или 2 пг/мл, или 1 пг/мл, или 0 пг/мл, у субъекта при применении в течение 15 суток, и по существу не вызывает подавления системы HPA.
[00208] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола пропионата, обеспечивает послелечебные средние уровни клобетазола пропионата в плазме, которые меньше чем или равны приблизительно 150 пг/мл, или 149 пг/мл, или 148 пг/мл, или 147 пг/мл, или 146 пг/мл, или 145 пг/мл, или 144 пг/мл, или 143 пг/мл, или 142 пг/мл, или 141 пг/мл, или 140 пг/мл, или 139 пг/мл, или 138 пг/мл, или 137 пг/мл, или 136 пг/мл, или 135 пг/мл, или 134 пг/мл, или 133 пг/мл, или 132 пг/мл, или 131 пг/мл, или 130 пг/мл, или 129 пг/мл, или 128 пг/мл, или 127 пг/мл, или 126 пг/мл, или 125 пг/мл, или 124 пг/мл, или 123 пг/мл, или 122 пг/мл, или 121 пг/мл, или 120 пг/мл, или 119 пг/мл, или 118 пг/мл, или 117 пг/мл, или 116 пг/мл, или 115 пг/мл, или 114 пг/мл, или 113 пг/мл, или 112 пг/мл, или 111 пг/мл, или 110 пг/мл, или 109 пг/мл, или 108 пг/мл, или 107 пг/мл, или 106 пг/мл, или 105 пг/мл, или 104 пг/мл, или 103 пг/мл, или 102 пг/мл, или 101 пг/мл, или 100 пг/мл, или 99 пг/мл, или 98 пг/мл, или 97 пг/мл, или 96 пг/мл, или 95 пг/мл, или 94 пг/мл, или 93 пг/мл, или 92 пг/мл, или 91 пг/мл, или 90 пг/мл, или 89 пг/мл, или 88 пг/мл, или 87 пг/мл, или 86 пг/мл, или 85 пг/мл, или 84 пг/мл, или 83 пг/мл, или 82 пг/мл, или 81 пг/мл, или 80 пг/мл, или 79 пг/мл, или 78 пг/мл, или 77 пг/мл, или 76 пг/мл, или 75 пг/мл, или 74 пг/мл, или 73 пг/мл, или 72 пг/мл, или 71 пг/мл, или 70 пг/мл, или 69 пг/мл, или 68 пг/мл, или 67 пг/мл, или 66 пг/мл, или 65 пг/мл, или 64 пг/мл, или 63 пг/мл, или 62 пг/мл, или 61 пг/мл, или 60 пг/мл, или 59 пг/мл, или 58 пг/мл, или 57 пг/мл, или 56 пг/мл, или 55 пг/мл, или 54 пг/мл, или 53 пг/мл, или 52 пг/мл, или 51 пг/мл, или 50 пг/мл, или 49 пг/мл, или 48 пг/мл, или 47 пг/мл, или 46 пг/мл, или 45 пг/мл, или 44 пг/мл, или 43 пг/мл, или 42 пг/мл, или 41 пг/мл, или 40 пг/мл, или 39 пг/мл, или 38 пг/мл, или 37 пг/мл, или 36 пг/мл, или 35 пг/мл, или 34 пг/мл, или 33 пг/мл, или 32 пг/мл, или 31 пг/мл, или 30 пг/мл, или 29 пг/мл, или 28 пг/мл, или 27 пг/мл, или 26 пг/мл, или 25 пг/мл, или 24 пг/мл, или 23 пг/мл, или 22 пг/мл, или 21 пг/мл, или 20 пг/мл, или 19 пг/мл, или 18 пг/мл, или 17 пг/мл, или 16 пг/мл, или 15 пг/мл, или 14 пг/мл, или 13 пг/мл, или 12 пг/мл, или 11 пг/мл, или 10 пг/мл, или 9 пг/мл, или 8 пг/мл, или 7 пг/мл, или 6 пг/мл, или 5 пг/мл, или 4 пг/мл, или 3 пг/мл, или 2 пг/мл, или 1 пг/мл, или 0 пг/мл, у субъекта при применении в течение 15 суток, и обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови.
[00209] В некоторых вариантах осуществления настоящего изобретения предложена композиция для местного применения, которая содержит: а) приблизительно 0,025% (мас.) клобетазола пропионата; b) масляную фазу, содержащую по меньшей мере один интенсификатор проникновения и неполимерный загуститель, и с) водную фазу; и которая обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает средние уровни клобетазола пропионата в плазме, недостаточные для снижения уровней содержания кортизола в сыворотке крови, меньших чем или равных приблизительно 18 мкг/дл.
[00210] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение по меньшей мере одних суток; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не вызывает подавления системы НРА. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00211] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение до приблизительно двух недель; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не вызывает подавления системы НРА. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00212] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия_воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение до приблизительно четырех недель; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и по существу не вызывает подавления системы НРА. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00213] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение по меньшей мере одних суток; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает более низкое процентное снижение DHEAS. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00214] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение до приблизительно двух недель; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает более низкое процентное снижение DHEAS. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00215] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу профилактики, уменьшения интенсивности симптомов или лечения псориаза, снятия воспалений и зуда, проявляющихся при стероид-зависимых дерматозах, эритемы, реакций контактной чувствительности и других сопутствующих заболеваний или расстройств, который предусматривает нанесение низкой дозы клобетазола в на пораженный участок кожи субъекта один раз или два раза в сутки в течение до приблизительно четырех недель; при этом упомянутая композиция обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и обеспечивает более низкое процентное снижение DHEAS. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00216] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей низкую дозу клобетазола, на пораженном участке кожи субъекта один раз или два раза в сутки в течение от по меньшей мере одних суток до приблизительно двух недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения низкая доза клобетазола содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00217] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола, на пораженном участке кожи субъекта; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®.
[00218] В некоторых вариантах осуществления настоящего изобретения упомянутый способ лечения псориаза предусматривает местное применение композиции, содержащей от приблизительно 0,005% (мас.) до приблизительно 0,04% (мас.) клобетазола, один раз в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью от приблизительно одних суток до двух недель, или два раза в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью от приблизительно одних суток до двух недель, или один раз в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью от приблизительно одних суток до приблизительно четырех недель, или дважды в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью от приблизительно одних суток до приблизительно четырех недель.
[00219] В некоторых вариантах осуществления настоящего изобретения упомянутый способ лечения псориаза предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола, один раз в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью приблизительно две недели, или два раза в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью приблизительно две недели, или один раз в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью приблизительно четыре недели, или дважды в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью приблизительно четыре недели. В некоторых вариантах осуществления настоящего изобретения упомянутая композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00220] В некоторых вариантах осуществления настоящего изобретения упомянутый способ лечения псориаза предусматривает местное применение субъектом композиции, содержащей приблизительно 0,025% (мас.) клобетазола, при этом упомянутый субъект имеет псориатические поражения, охватывающие по меньшей мере приблизительно 5% площади поверхности тела, или от приблизительно 5% до приблизительно 10% площади поверхности тела, или более чем приблизительно 10% площади поверхности тела. В некоторых вариантах осуществления настоящего изобретения упомянутая композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00221] В некоторых вариантах осуществления настоящего изобретения композицию применяют один раз или два раза в сутки.
[00222] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта от приблизительно двух недель до приблизительно четырех недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает средний уровень клобетазола пропионата в плазме, который составляет менее чем приблизительно 130 пг/мл.
[00223] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта в течение от приблизительно двух недель до приблизительно четырех недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебный средний уровень клобетазола пропионата в плазме, который составляет менее чем приблизительно 150 пг/мл.
[00224] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта в течение от приблизительно двух недель до приблизительно четырех недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебный средний уровень клобетазола пропионата в плазме, который составляет менее чем приблизительно 150 пг/мл.
[00225] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта в течение от приблизительно двух недель до приблизительно четырех недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебный средний уровень клобетазола пропионата в плазме, который составляет от 130 пг/мл до 0 пг/мл.
[00226] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью от приблизительно двух недель до приблизительно четырех недель; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебный средний уровень клобетазола пропионата в плазме, который составляет от 150 пг/мл до 0 пг/мл.
[00227] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает: местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, один раз или два раза в сутки на пораженном участке кожи субъекта в течение периода времени продолжительностью приблизительно две недели; при этом упомянутая композиция по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым в случае TEMOVATE®, и при этом упомянутая композиция обеспечивает послелечебный средний уровень клобетазола пропионата в плазме, который составляет от 150 пг/мл до 0 пг/мл.
[00228] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, имеющего псориатические поражения на более чем приблизительно 10% площади поверхности тела, при этом упомянутый способ предусматривает местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, на пораженном участке кожи субъекта два раза в сутки в течение периода лечения продолжительностью приблизительно четыре недели; при этом упомянутый способ по существу не имеет побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с композицией для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения местное применение композиции, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, осуществляют один раз или два раза в сутки в течение периода лечения продолжительностью четыре недели. В некоторых вариантах осуществления настоящего изобретения побочные эффекты представляют собой подавление системы HPA и/или снижение DHEAS.
[00229] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом композицию для местного применения, содержащую низкую дозу клобетазола, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает аналогичный или повышенный терапевтический эффект и по существу не имеет побочных эффектов по сравнению с TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00230] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и имеет аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00231] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и по существу не вызывает подавления системы НРА; и имеет аналогичный или повышенный терапевтический эффект по сравнению с таковыми в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00232] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, имеющего псориатические поражения на более чем приблизительно 10% площади поверхности тела, при этом упомянутую композицию для местного применения, содержащую низкую дозу клобетазола, применяют на участке кожи упомянутого субъекта, и такое лечение по существу не вызывает подавления системы гипоталамус-гипофиз-надпочечники (НРА), обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови с аналогичным или повышенным терапевтическим эффектом по сравнению с таковым в случае TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола. В некоторых вариантах осуществления настоящего изобретения композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00233] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую низкую дозу клобетазола, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую послелечебную среднюю концентрацию клобетазола в плазме субъектов без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00234] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола пропионата, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую послелечебную среднюю концентрацию клобетазола пропионата в плазме у субъектов без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00235] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую низкую дозу клобетазола, применяют местно на пораженном участке кожи субъекта, и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую послелечебную среднюю концентрацию клобетазола в плазме у субъектов по существу без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00236] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола, применяют местно на пораженном участке кожи субъекта один раз или два раза в сутки в течение периода времени продолжительностью от по меньшей мере одних суток до приблизительно четырех недель; и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую послелечебную среднюю концентрацию клобетазола в плазме у субъектов по существу без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00237] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола пропионата, применяют местно на пораженном участке кожи субъекта в течение периода времени продолжительностью от по меньшей мере одних суток до приблизительно четырех недель; и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую послелечебную среднюю концентрацию клобетазола пропионата в плазме у субъектов по существу без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00238] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола, применяют местно на пораженном участке кожи субъекта в течение периода времени продолжительностью от по меньшей мере одних суток до приблизительно двух недель; и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую среднюю послелечебную концентрацию клобетазола в плазме у субъектов по существу без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00239] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола пропионата, применяют местно на пораженном участке кожи субъекта в течение периода времени продолжительностью от по меньшей мере одних суток до приблизительно двух недель; и упомянутое лечение обеспечивает более низкое процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови и низкую среднюю послелечебную концентрацию клобетазола пропионата в плазме у субъектов по существу без подавления системы НРА по сравнению с таковыми у субъектов со значительным подавлением системы НРА.
[00240] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола пропионата, применяют местно на пораженном участке кожи субъекта, при этом упомянутый способ обеспечивает значительно более низкую послелечебную среднюю концентрацию клобетазола пропионата в плазме по сравнению с TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 150 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 130 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 100 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 75 пг/мл.
[00241] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, при этом упомянутую композицию для местного применения, содержащую приблизительно 0,025% (мас.) клобетазола пропионата, применяют местно на пораженном участке кожи субъекта, при этом упомянутый способ обеспечивает значительно более низкую послелечебную среднюю концентрацию клобетазола пропионата в плазме по сравнению с TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 150 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 130 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 100 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 75 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 50 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме составляют менее чем приблизительно 25 пг/мл, или средние послелечебные уровни клобетазола пропионата в плазме ниже уровня, поддающегося количественному определению.
[00242] В еще одном аспекте настоящего изобретения псориаз представляет собой бляшечный псориаз с тяжестью поражения от легкой до умеренной.
[00243] В еще одном аспекте настоящего изобретения псориаз представляет собой бляшечный псориаз с тяжестью поражения от умеренной до тяжелой.
[00244] В некоторых вариантах осуществления настоящее изобретение обеспечивает значительно более низкие средние послелечебные уровни клобетазола пропионата в плазме у субъектов, не имеющих подавления системы HPA, по сравнению с таковыми у пациентов с подавлением системы НРА.
[00245] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза у субъекта, имеющего псориатические поражения на по меньшей мере приблизительно 5% площади поверхности тела, или имеющего псориатические поражения на участке от приблизительно 5% до приблизительно 10% площади поверхности тела, или имеющего псориатические поражения на более чем приблизительно 10% площади поверхности тела.
[00246] Один из аспектов настоящего изобретения имеет отношение к способу применения композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, для лечения псориаза. Упомянутую композицию применяют два раза в сутки в течение периода времени продолжительностью приблизительно две недели, или композицию применяют один раз в сутки в течение периода времени продолжительностью приблизительно две недели, или композицию применяют один раз в сутки в течение периода времени продолжительностью приблизительно четыре недели, или композицию применяют два раза в сутки в течение периода времени продолжительностью приблизительно четыре недели.
[00247] Один из аспектов настоящего изобретения имеет отношение к способу применения композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола пропионата, для лечения псориаза. Упомянутую композицию применяют два раза в сутки в течение периода времени продолжительностью приблизительно две недели, или композицию применяют один раз в сутки в течение периода времени продолжительностью приблизительно две недели, или композицию применяют один раз в сутки в течение периода времени продолжительностью приблизительно четыре недели, или композицию применяют два раза в сутки в течение периода времени продолжительностью приблизительно четыре недели.
[00248] В некоторых вариантах осуществления настоящего изобретения композиция обеспечивает значительно большее процентное снижение концентрации DHEAS в сыворотке крови и значительно более высокую среднюю послелечебную концентрацию клобетазола пропионата в плазме у субъектов с подавлением системы НРА по сравнению с субъектами без подавления системы НРА.
[00249] В еще одном варианте осуществления настоящего изобретения композиция для местного применения, содержащая приблизительно 0,025% (мас.) клобетазола, обеспечивает значительно большее процентное снижение концентрации дегидроэпиандростерона сульфата (DHEAS) в сыворотке крови субъектов с подавлением системы НРА по сравнению с субъектами без подавления системы НРА.
[00250] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола, и ее можно применять в количестве больше чем приблизительно 2 г/сутки по существу без подавления системы НРА.
[00251] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола пропионата, и ее можно применять в количестве больше чем приблизительно 2 г/сутки по существу без подавления системы НРА.
[00252] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола, и ее можно применять в количестве больше чем приблизительно 2 г/сутки с более низким процентным снижением концентрации DHEAS в сыворотке крови.
[00253] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения псориаза, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола пропионата, и ее можно применять в количестве больше чем приблизительно 2 г/сутки с более низким процентным снижением концентрации DHEAS в сыворотке крови.
[00254] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения экземы, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола, и ее можно применять в количестве больше чем приблизительно 2 г/сутки с более низким процентным снижением концентрации DHEAS в сыворотке крови.
[00255] В некоторых вариантах осуществления настоящего изобретения предложен способ лечения экземы, при этом композиция для местного применения, соответствующая настоящему изобретению, содержит приблизительно 0,025% (мас.) клобетазола пропионата, и ее можно применять в количестве больше чем приблизительно 2 г/сутки с более низким процентным снижением концентрации DHEAS в сыворотке крови.
[00256] В некоторых вариантах осуществления настоящего изобретения упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один раз или два раза в сутки в дозе от приблизительно 1 г/сутки до приблизительно 12 г/сутки в течение периода времени продолжительностью от приблизительно одних суток до приблизительно двух недель. В другом аспекте настоящего изобретения упомянутая композиция содержит приблизительно 0,025% (мас.) клобетазола пропионата.
[00257] В некоторых вариантах осуществления настоящего изобретения упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один раз или два раза в сутки в дозе от приблизительно 0,1 мг/сутки до 3,15 мг/сутки клобетазола в течение периода времени продолжительностью приблизительно две недели. В другом аспекте настоящего изобретения клобетазол представляет собой клобетазола пропионат.
[00258] В некоторых вариантах осуществления настоящего изобретения упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один или два раза в сутки в дозе от приблизительно 0,25 мг/сутки до 2,5 мг/сутки клобетазола в течение периода времени продолжительностью приблизительно две недели. В другом аспекте настоящего изобретения клобетазол представляет собой клобетазола пропионат.
[00260] В некоторых вариантах осуществления настоящего изобретения композицию для местного применения субъект с экземой может применять в течение одной недели в дозе, превышающей приблизительно 2 г/сутки, но не превышающей приблизительно 12 г/сутки.
[00261] В некоторых вариантах осуществления настоящего изобретения композицию для местного применения можно применять в дозе больше чем приблизительно 60 г/неделя, не вызывая клинически значимого подавления системы НРА у субъекта.
[00262] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один раз или два раза в сутки в дозе от приблизительно 1 г/сутки до приблизительно 7 г/сутки упомянутой композиции для местного применения в течение периода времени продолжительностью приблизительно две недели; при этом упомянутый способ предусматривает применение клобетазола в дозе от приблизительно 0,25 мг/сутки до приблизительно 2,5 мг/сутки; и по существу не подавляет систему НРА, и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и упомянутая композиция обеспечивает средние уровни клобетазола в плазме, которые составляет менее чем приблизительно 130 пг/мл. В другом аспекте настоящего изобретения клобетазол представляет собой клобетазола пропионат.
[00263] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один раз или два раза в сутки в дозе от приблизительно 1 г/сутки до приблизительно 7 г/сутки упомянутой композиции для местного применения в течение периода времени продолжительностью приблизительно две недели; при этом упомянутый способ предусматривает применение клобетазола в дозе от приблизительно 0,25 мг/сутки до приблизительно 2,5 мг/сутки; и обеспечивает более низкое процентное снижение концентрации DHEAS в сыворотке крови, и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®, и упомянутая композиция обеспечивает средние уровни клобетазола в плазме, которые составляет менее чем приблизительно 130 пг/мл. В другом аспекте настоящего изобретения клобетазол представляет собой клобетазола пропионат.
[00264] В некоторых вариантах осуществления настоящее изобретение имеет отношение к способу лечения псориаза у субъекта, при этом упомянутый способ предусматривает применение композиции для местного применения, содержащей приблизительно 0,025% (мас.) клобетазола, один раз или два раза в сутки в дозе от приблизительно 1 г/сутки до приблизительно 7 г/сутки упомянутой композиции для местного применения в течение периода времени продолжительностью приблизительно две недели; при этом упомянутый способ предусматривает применение клобетазола в дозе от приблизительно 0,25 мг/сутки до приблизительно 2,25 мг/сутки; и упомянутый способ по существу не вызывает побочных эффектов и обеспечивает аналогичный или повышенный терапевтический эффект по сравнению с таковым композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения упомянутый способ представляет собой способ лечения псориаза у субъекта, имеющего псориатические поражения на по меньшей мере приблизительно 5% площади поверхности тела, или лечения псориаза у субъекта, имеющего псориатические поражения на участке от приблизительно 5% до приблизительно 10% площади поверхности тела, или лечения псориаза у субъекта, имеющего псориатические поражения на более чем приблизительно 10% площади поверхности тела. В другом аспекте настоящего изобретения клобетазол представляет собой клобетазола пропионат.
[00265] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения обеспечивает средние уровни клобетазола в плазме субъектов, которые в приблизительно 1 раз меньше, чем уровни композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. 0,05% (мас.), или в приблизительно 1,5 раза меньше, чем уровни композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. 0,05% (мас.), или в приблизительно 2,5 раза меньше, чем уровни композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. 0,05% (мас.), или в приблизительно 3 раза меньше, чем уровни композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. 0,05% (мас.), или в приблизительно 3,5 раза меньше, чем уровни композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. 0,05% (мас.), с аналогичной или повышенной терапевтической эффективностью.
[00266] В некоторых вариантах осуществления настоящего изобретения терапевтическая эффективность композиции для местного применения эквивалентна или повышена по сравнению с таковой композиции для местного применения, содержащей наивысшую одобренную дозу для местного применения клобетазола, т.е. TEMOVATE®. В некоторых вариантах осуществления настоящего изобретения у по меньшей мере 30% субъектов, обработанных композицией для местного применения, степень тяжести от тяжелой или очень тяжелой, от умеренной до тяжелой или от умеренной до легкой, перешла в стадию минимальной тяжести либо почти полного или полного очищения в течение 15 суток лечения.
[00267] В некоторых вариантах осуществления настоящего изобретения композиция для местного применения образует депо на коже с образованием окклюзионной пленки, тем самым продлевая продолжительность действия активного вещества, одновременно обеспечивая возможность "дыхания" коже.
[00268] В некоторых вариантах осуществления настоящего изобретения композиции для местного применения могут иметь значения рН в пределах от приблизительно 3,0 до приблизительно 7,0 или от приблизительно 3,5 до приблизительно 6,0.
[00269] Композиции, соответствующие настоящему изобретению, могут быть помещены в любое дозирующее устройство, такое как ламинированные тубы или лакированные алюминиевые тубы. Композиции для местного применения находятся в ламинированных тубах; при этом упомянутое устройство представляет собой ламинированную тубу, состоящую из 5 слоев белого полиэтилена, сополимера этилена/акриловой кислоты (ЕАА), алюминиевой фольги, ЕАА, полиэтилена высокой плотности, так что композицию можно равномерно выдавливать для нанесении. В одном из вариантов осуществления настоящего изобретения композиции помещены в лакированные алюминиевые тубы, которые являются очень практичными и очень эффективными для хранении крема.
[00270] Настоящее изобретение проиллюстрировано описанными ниже примерами. Однако специалист в данной области поймет, что конкретные обсуждаемые способы и результаты являются простой иллюстрацией настоящего изобретения, и их не следует рассматривать как ограничивающие применение. Приведенные ниже примеры могут включать компиляции данных, которые являются репрезентативными для данных, собранных в разное время в ходе разработки и экспериментов, связанных с настоящим изобретением.
ПРИМЕРЫ
[00271] Композиции Примеров 1-7 получали с использованием описанных ниже основных процессов обработки.
[00272] Процесс обработки I:
(i) приготовление масляной фазы плавлением и перемешиванием стеарилового спирта, цетилового спирта; глицерилстеарата, стеарата ПЭГ 100 и ланолина, с последующим добавлением метилпарабена, пропилпарабена и минерального масла,
(ii) приготовление водной фазы добавлением раствора сорбита в нагретую очищенную воду,
(iii) получение эмульсии добавлением масляной фазы этапа (i) к водной фазе этапа (ii) или vice versa при гомогенизации,
(iv) получение раствора клобетазола пропионата растворением предварительно перемешанного раствора клобетазола пропионата в моноэтиловом простом эфире диэтиленгликоля с последующим добавлением бутилированного гидрокситолуола (ВНТ) и гомогенизацией,
(v) добавление раствора клобетазола пропионата, полученного на этапе (iv), к эмульсии, полученной на этапе (iii), с последующей гомогенизацией для получения кремовой композиции.
[00273] Процесс обработки II:
(i) приготовление масляной фазы плавлением и перемешиванием цетостеарилового спирта; белого воска; глицерилстеарата, стеарата ПЭГ 100 и изопропилмиристата, с последующим добавлением метилпарабена, пропилпарабена и циклометикона,
(ii) приготовление водной фазы нагреванием очищенной воды,
(iii) получение эмульсии добавлением масляной фазы этапа (i) к водной фазе этапа (ii) или vice versa при гомогенизации,
(iv) получение раствора клобетазола пропионата растворением предварительно смешанного раствора клобетазола пропионата в моноэтиловом простом эфире диэтиленгликоля с последующим добавлением бутилированного гидрокситолуола (ВНТ) и гомогенизацией,
(v) добавление раствора клобетазола пропионата, полученного на этапе (iv), к эмульсии, полученной на этапе (iii), с последующей гомогенизацией для получения кремовой композиции.
[00274] Пример 1: Крем на основе клобетазола пропионата (0,05% (мас.)):
[00275] Композиция этого примера была получена согласно Процессу обработки I с использованием ингредиентов в следующих количествах:

[00276] Пример 2. Крем на основе клобетазола пропионата (0,025% (мас.)):
[00277] Композиция этого примера была получена согласно Процессу обработки I с использованием ингредиентов в следующих количествах:
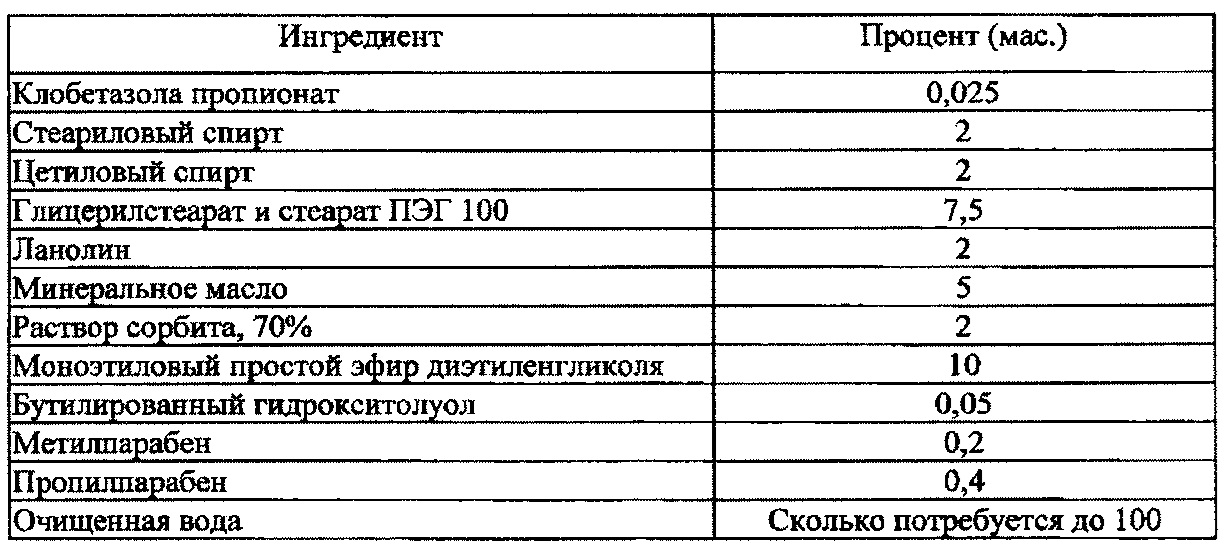
[00278] Пример 3. Крем на основе клобетазола пропионата (0,025% (мас.)):
[00279] Композиция этого примера была получена согласно Процессу обработки I с использованием ингредиентов в следующих количествах:

[00280] Пример 4. Крем на основе клобетазола пропионата (0,025% (мас.)):
[00281] Композиция этого примера была получена согласно Процессу обработки I с использованием ингредиентов в следующих количествах:
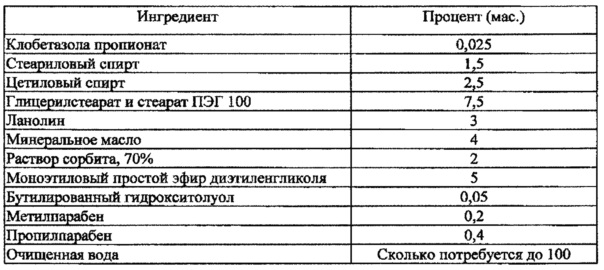
[00282] Пример 5: Крем на основе клобетазола пропионата (0,025% (мас.)):
[00283] Композиция этого примера была получена согласно Процессу обработки II с использованием ингредиентов в следующих количествах:


[00284] Пример 6: Крем на основе клобетазола пропионата (0,025% (мас.)):
[00285] Композиция этого примера была получена согласно Процессу обработки II с использованием ингредиентов в следующих количествах:

[00286] Пример 7: Крем на основе клобетазола пропионата (0,05% (мас.)):
[00287] Композиция этого примера была получена согласно Процессу обработки II с использованием ингредиентов в следующих количествах:

[00288] Пример 8: Оценка физической и химической стабильности композиций для местного применения, соответствующих настоящему изобретению. Во время исследований все композиции оценивали на физические изменения, такие как изменения цвета, и в ходе исследований цвет всех кремовых композиций оставался в пределах от не совсем белого до белого, и не наблюдалось каких-либо существенных изменений.
Полученной композицией примера 1, примера 2, примера 3 и примера 6 заполняли закрытый контейнер, и в течение двенадцати месяцев подвергали воздействию различных условий испытаний на стабильность, таких как температура 25°C и относительная влажность 60% (RH), температура 30°C и относительная влажность 65%, температура 40°C и относительная влажность 75%; результаты анализов в различные моменты времени при хранении показаны в Таблицах.
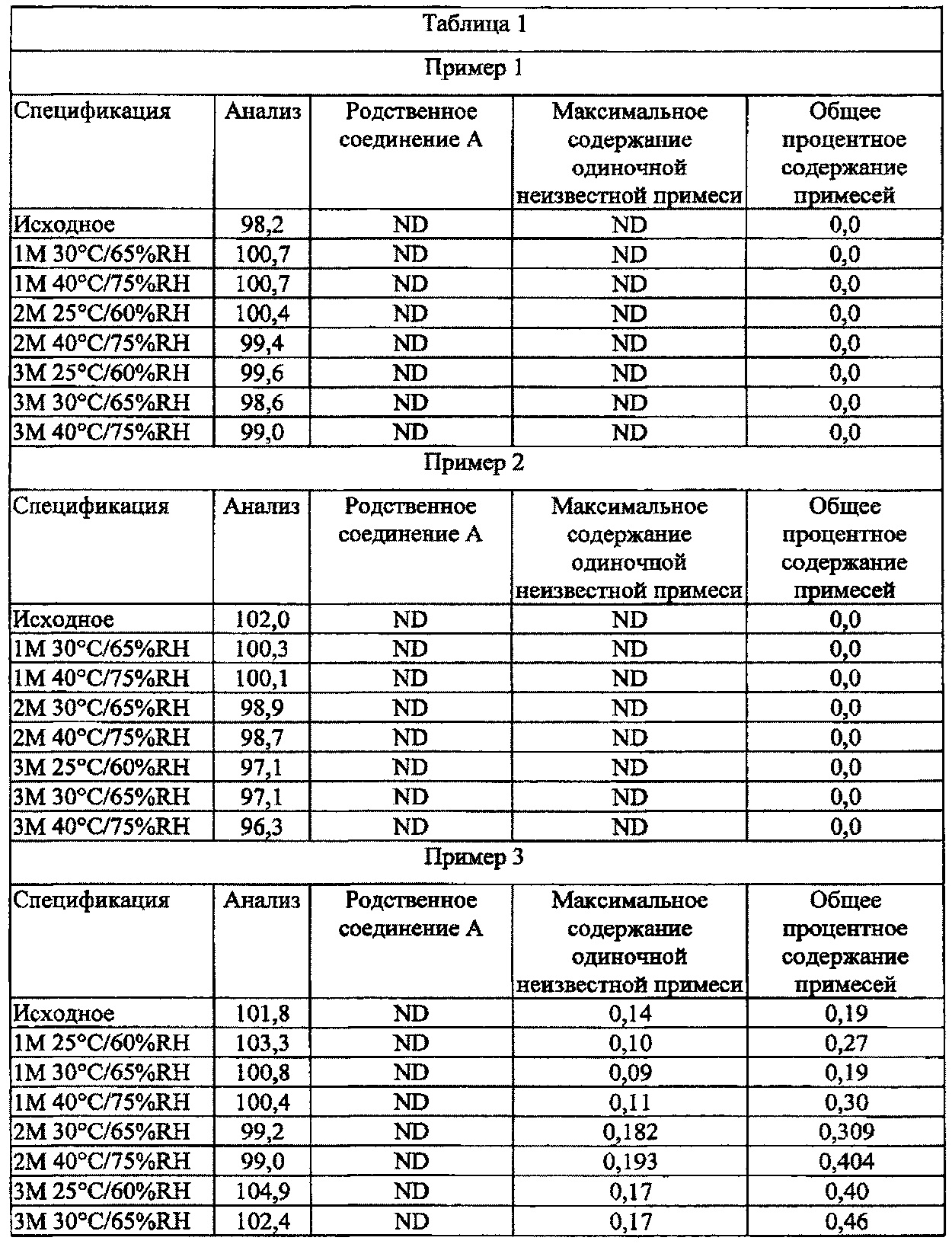
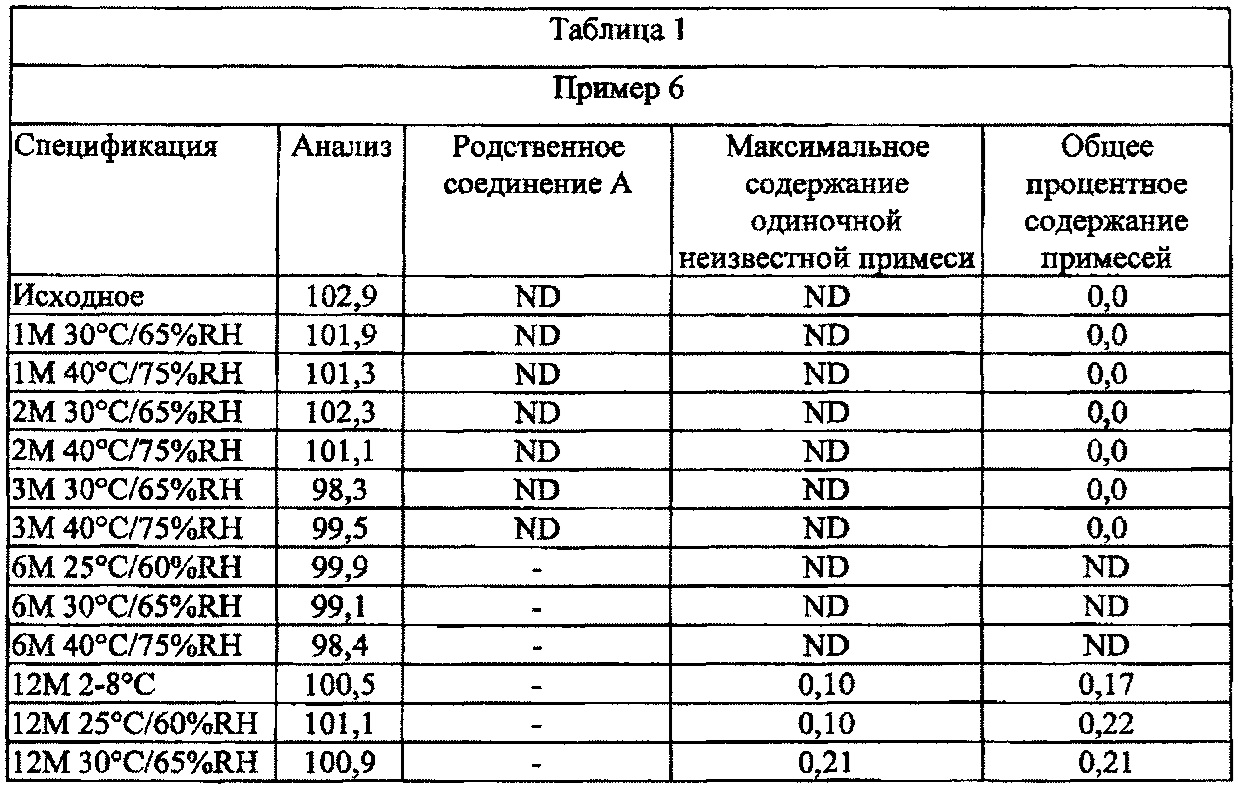
ND - не определяли
[00289] Пример 9: Исследование растворения in vitro
[00290] Провели сравнительное тестирование профиля растворения in vitro. показывающее высвобождение лекарственного средства Примера 3 и Примера 7 по сравнению с кремом TEMOVATE Е®. На Фиг. 1 и Фиг. 2 показан суммарный процент высвобожденного лекарственного средства по сравнению с кремом TEMOVATE Е®. Тестирование проводили, как описано ниже:
[00291] Диффузионную ячейку Франца снабжали 0,45 мкм нейлоновой мембраной, зажатой между камерой для образца и принимающей камерой. Рецепторный раствор получали смешиванием воды и ацетона (35:65 по объему) с объемом замещения 11,0 мл; пробу в объеме 2,0 мл отбирали через 30 мин, 1 ч, 2 ч, 4 ч, 6 ч и 8 ч, соответственно; температуру поддерживали на уровне 32±0,5°C. На мембрану равномерно наносили приблизительно 200 мг препарата. Камеру для образца покрывали, используя PARAFILM® (смесь углеводородного воска и полиолефина). Рецепторный раствор анализировали на наличие лекарственного средства, используя высокоэффективную жидкостную хроматографию (ВЭЖХ).
[00292] Пример 10: Исследование эффективности in vivo
[00293] Тест на УФ-эритему является приемлемой и принятой процедурой стандартизированного сравнения противовоспалительного действия лекарственных препаратов для местного применения. Чтобы обеспечить точное определение УФ-доз, определяли индивидуальную чувствительность к УФ, а затем получали световую шкалу для определения минимальной эритемной дозы (MED).
[00294] УФ-облучение проводили с использованием 1,5 MED с облучением поверхности кожи площадью менее чем 30 см2. Фармацевтические композиции, приведенные в примерах, и крем TEMOVATE Е® наносили в дозе приблизительно 10 мг/см2 на поверхность, подвергнутую воздействию УФ-облучения. Оценка подавления эритемы будет определена хромаметрическим измерением.
[00295] Процент уменьшения покраснения и площадь под кривой (AUC) по сравнению с кремом TEMOVATE Е®, показаны на Фиг. 3 и Фиг. 4, соответственно.
[00296] Несмотря на то, что было проиллюстрировано и описано несколько конкретных форм применения, следует иметь в виду, что могут быть выполнены различные модификации и комбинации форм применения, подробно описанных в тексте, без отклонения от сущности и объема этой заявки.
[00297] Пример 11: Влияние на эндокринную систему (исследование подавления системы гипоталамус-гипофиз-надпочечники)
[00298] Методы: это было 15-суточное рандомизированное мультицентровое многодозовое контролируемое блоком сравнения исследование с открытой этикеткой; испытуемые были в возрасте старше 18 лет с бляшечным псориазом от умеренной до тяжелой степени; они были произвольно распределены для лечения с кремом Примера 5, либо кремом TEMOVATE® в соотношении 1:1. Указанные исследуемые продукты наносили два раза в сутки на все пораженные участки тела, исключая лицо, волосистую часть кожи головы, паховую область, подмышечные впадины и другие интертригинозные участки. Для обеспечения максимальной экспозиции у пациентов обрабатывали от 20% до 50% площади поверхности тела. Пациентов посещали при проведении скрининга, в день начала проведения исследования (День 1), в День 8, День 15 и День 43 (при необходимости для подтверждения выздоровления). Клиническое определение тяжести заболевания проводили с использованием шкалы Глобальной оценки эффективности исследователем (IGA) для общей оценки тяжести при каждом посещении. Пациентов тестировали на функцию системы НРА, используя тест стимуляции АСТН (т.е. инъекцию козинтропина внутривенно или внутримышечно) при посещении в день проведения скрининга (по меньшей мере за 14 суток до и не более чем за 28 суток до дня начала проведения исследования) и на 15-й день. Кроме того, в качестве вторичного критерия подавления системы НРА, в сутки проведения скрининга, на 8 день и во время проведения теста стимуляции АСТН на 15-й день (предтестовая проба), отбирали пробы крови для определения уровня дегидроэпиандростерона сульфата (DHEAS) в сыворотке. При проведении скринингового теста стимуляции АСТН, отбирали PK (фармакокинетическую) пробу крови для определения исходного значения (PK скрининговая проба). На 15-й день пациентам наносили последнюю дозу исследуемого продукта в клинических условиях в пределах 60 мин после отбора PK пробы крови, предшествующего обработке (0 ч - День 15). Затем PK пробы крови отбирали через 1 ч, 3 ч и 6 ч (±5 мин) после нанесения исследуемого продукта.
[00299] Схема лечения: Пациентов обрабатывали исследуемым продуктом (Пример 5) два раза в сутки с приблизительно 12-часовым промежутком времени между нанесениями в течение 15 суток, начиная с 1-го дня во время посещения в ходе проведения исследования. Исследуемый продукт пациентам наносили на все пораженные участки тела, исключая лицо, волосистую часть кожи головы, паховую область, подмышечные впадины и другие интертригинозные участки. Целевая доза составляла от по меньшей мере 5 г до 7 г в сутки (1 чайная ложка крема, два раза в сутки, крем наносили из расчета приблизительно 1 мг/см2 на 20% площади поверхности тела - 3000 см2). Все начальные пораженные участки и недавно пораженные участки обрабатывали до конца исследования, даже если они очищались. Исследователь отмечал пораженные участки (в первичном документе), обновлял отметки при каждом посещении, и при каждом посещении, используя отметки, напоминал пациентам, на какие участки необходимо наносить продукт. Исследуемый продукт наносили непосредственно на пораженные участки и втирали мягко и полностью. Исследуемый продукт по возможности наносили после купания.
[00300] Изменения оценки по шкале IGA оценивали в День 1, День 8 и День 15. Изменение оценки по шкале IGA с 4 до 0-1 считали успешным результатом лечения, как показано ниже:

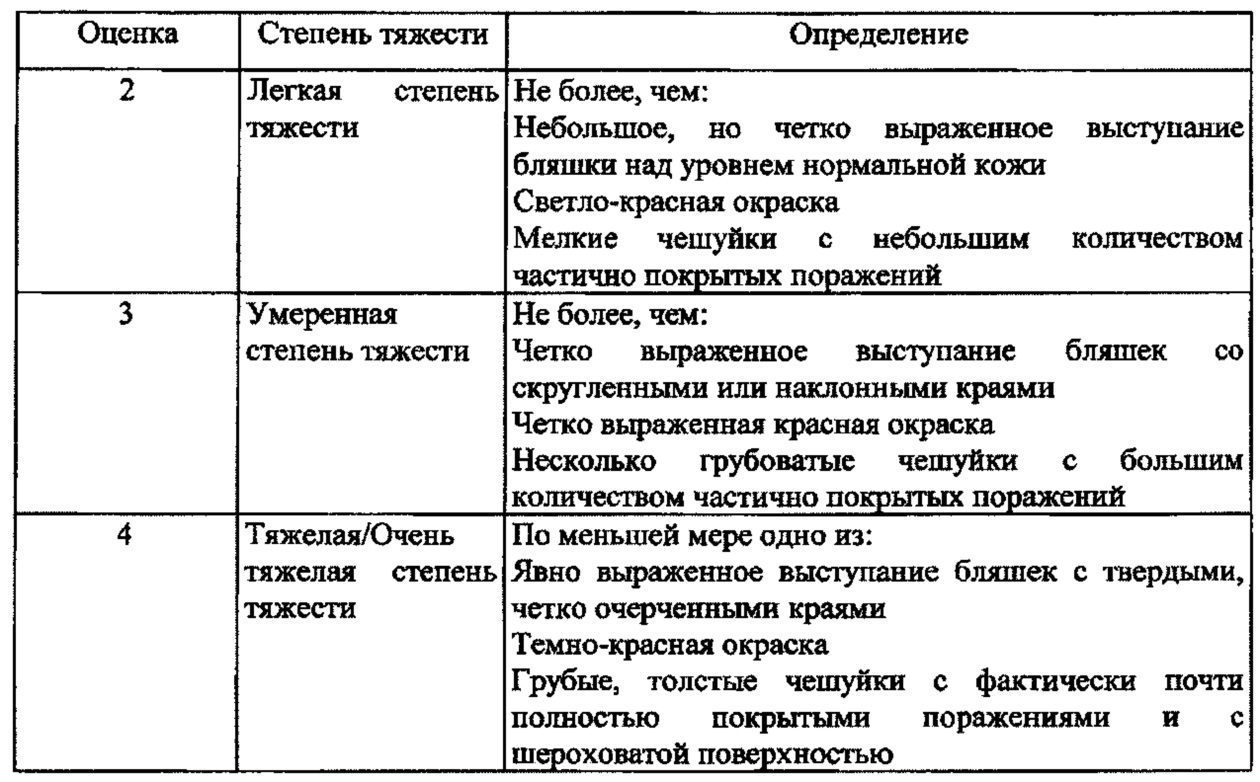
[00301] Тест стимуляции АСТН
[00302] Пациентов тестировали на функцию системы HPA, используя тест стимуляции АСТН (инъекция козинтропина внутривенно или внутримышечно) при посещении в день проведения скрининга и на 15-й день. Если во время посещения на 15-й день наблюдалось подавление системы HPA, еще один тест проводили через 28 дней (приблизительно на 43-й день) для подтверждения выздоровления. Тест стимуляции АСТН повторяли приблизительно каждые 28 дней до подтверждения выздоровления (или до выявления причины подавления). Тест должен проводиться между 7:00 и 9:30 утра. Результаты скринингового теста должны быть нормальными для того, чтобы пациент имел право на участие в исследовании (уровень кортизола >18 мкг/дл через 30 мин после стимуляции). Тест на 15-й день должен быть выполнен в пределах 1 ч с момента проведения скринингового теста.
[00303] Уровень DHEAS в сыворотке. Пробы крови на определение уровня DHEAS в сыворотке отбирали во время скринингового теста стимуляции АСТН на 8-й день и во время теста стимуляции АСТН на 15-й день (предтестовая проба) в качестве вторичного критерия подавления системы HPA.
[00304] Отмечается, что в случае композиции Примера 5 значительного подавления системы НРА не наблюдалось. Результаты исследования подавления системы НРА показали гораздо более низкий потенциал этого побочного эффекта по сравнению с кремом TEMOVATE® (клобетазола пропионат), 0,05% (мас.). Что касается терапевтической эффективности, эффективность композиции Примера 5 и TEMOVATE® была аналогичной или почти одинаковой (оценка по шкале IGA), а в отношении подавления системы НРА, композиция Примера 5 не демонстрировала клинически значимого подавления системы НРА по сравнению с таковым крема TEMOVATE®.
[00305] Заключение:
[00306] Таким образом, в конце 15-суточного лечения композицией Примера 5 у приблизительно 50% испытуемых степень тяжести изменилась на степень тяжести "легкая степень тяжести", и приблизительно 16,7% - на степень тяжести "минимальная степень тяжести или почти чистая кожа" из степени тяжести "умеренная, тяжелая/очень тяжелая степень тяжести", по сравнению с 15-дневным лечением кремом TEMOVATE®, при этом у приблизительно 50% пациентов степень тяжести изменилась на степень тяжести "легкая степень тяжести" и 13,6% - на степень тяжести "минимальная степень тяжести или почти чистая кожа" из степени тяжести "умеренная, тяжелая/очень тяжелая степень тяжести".
[00307] На основании оценки эффективности, как описано в Таблице 2 (Пример 5 - крем на основе клобетазола - 0,025% (мас.) и крем TEMOVATE® - 0,05% (мас.)), обе композиции показали сходную или почти идентичную терапевтическую эффективность.
[00308] В отношении результатов подавления системы НРА (Таблица 3 и Таблица 4), композиция, соответствующая настоящему изобретению (Пример 5), показала, что подавление системы НРА наблюдалось у приблизительно 12,5% от общего количества пациентов, то есть 3 пациента из 24 имели подавление системы НРА, тогда как крем TEMOVATE® показал, что подавление системы НРА наблюдалось у приблизительно 36,4% от общего количества пациентов, т.е. 8 пациентов из 22 имели подавление системы НРА. Средний уровень клобетазола в плазме в случае TEMOVATE® в приблизительно 2,5 раза превосходил соответствующий показатель композиции Примера 5, что подтвердило гораздо более низкое системное воздействие композиции Примера 5, а средний послелечебный уровень концентрации клобетазола в плазме в случае композиции Примера 5 (Таблица 7) был значительно ниже.
[00309] У пациентов с подавлением системы НРА средний уровень клобетазола в плазме более чем в 3 раза превосходил средний уровень клобетазола в плазме у пациентов с отсутствием подавления системы НРА, что подтвердило, что следствием более высокой экспозиции является большее подавление системы НРА (Таблица 8).
[00310] В Таблице 3 показан результат теста стимуляции АСТН, а в Таблице 5 и Таблице 6 показаны уровни DHEAS в сыворотке крови во время подавления системы HPA.
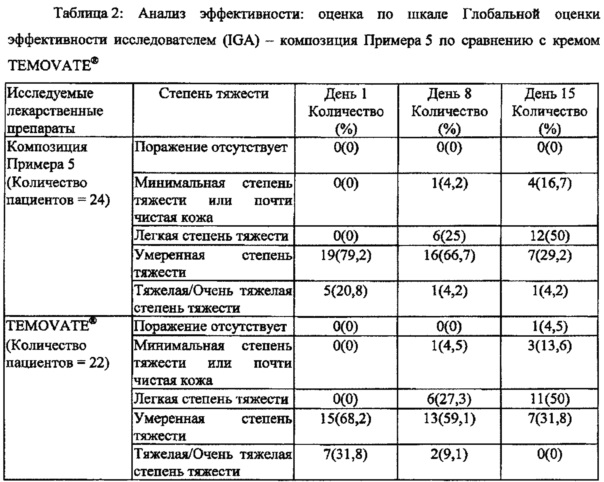
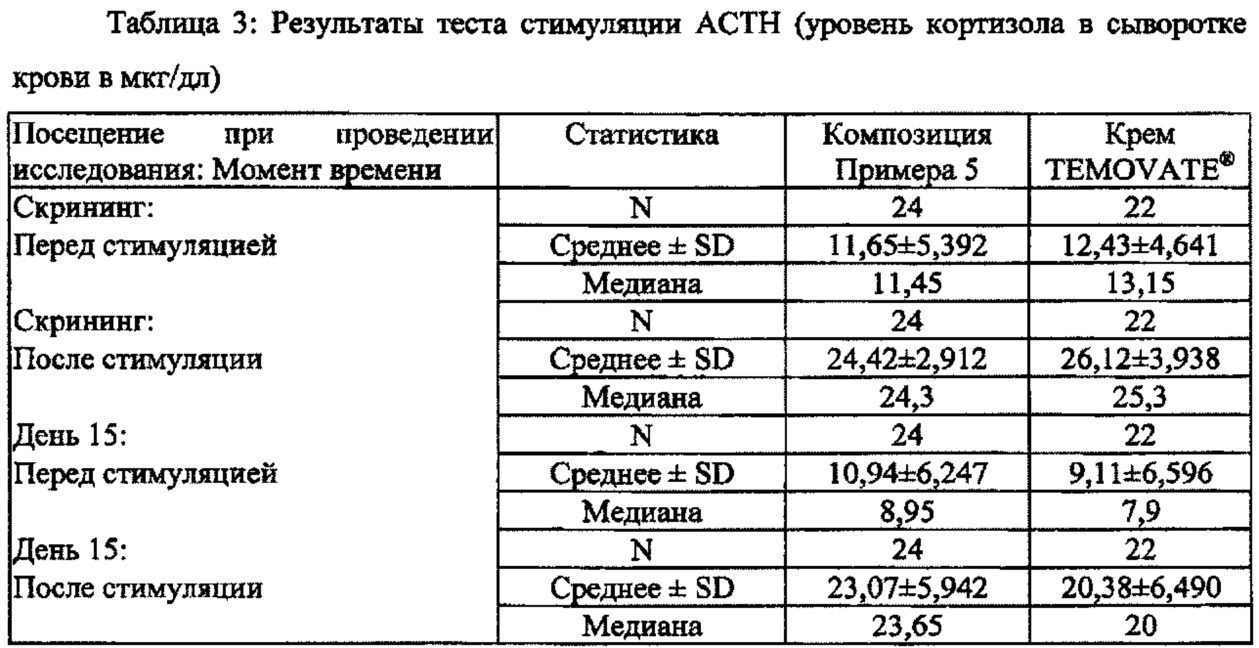
SD - среднее квадратическое отклонение

- полагают, что подавление системы НРА происходит при уровне кортизола <=18,00 мкг/дл через 30 мин после стимуляции
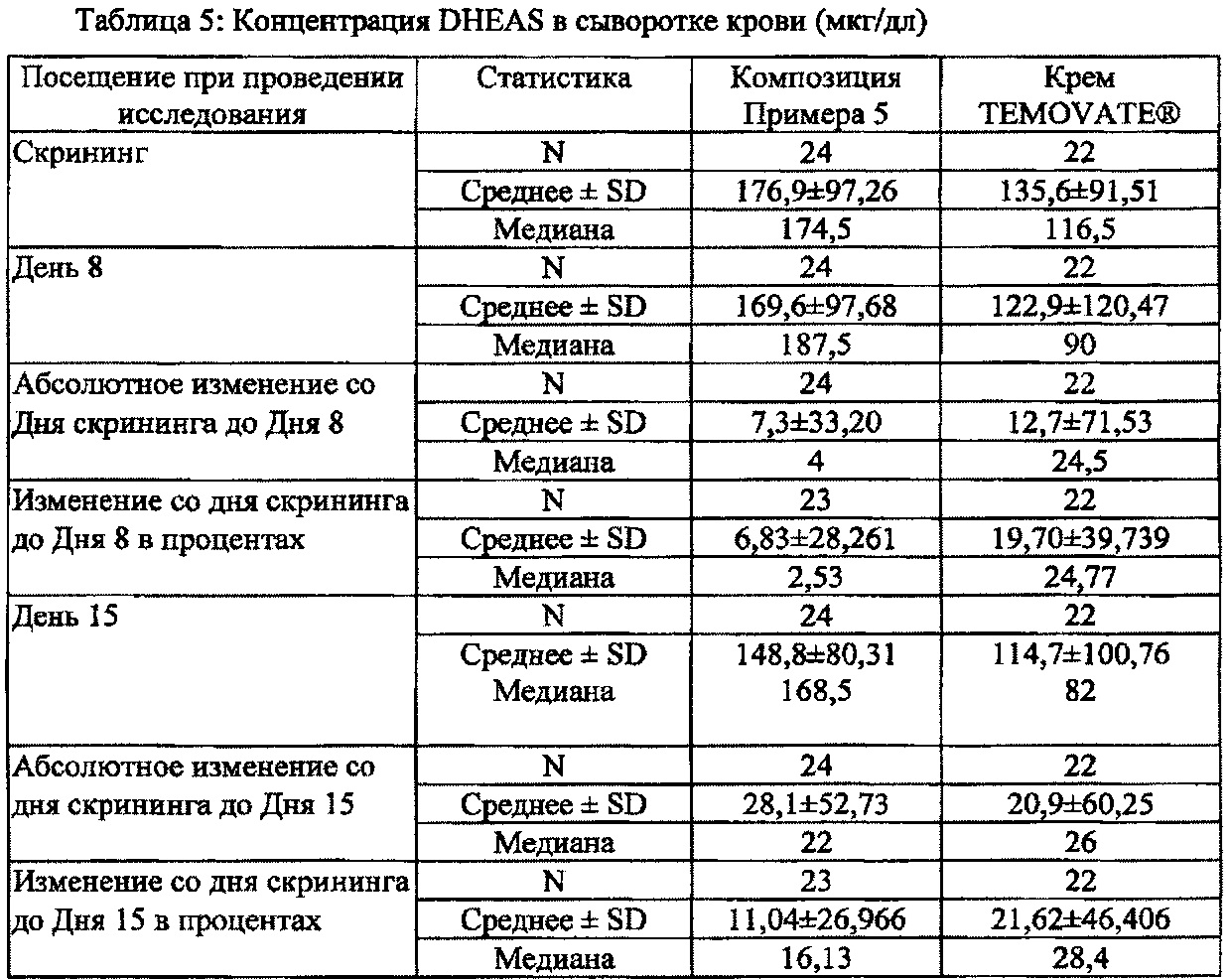
SD - среднее квадратическое отклонение
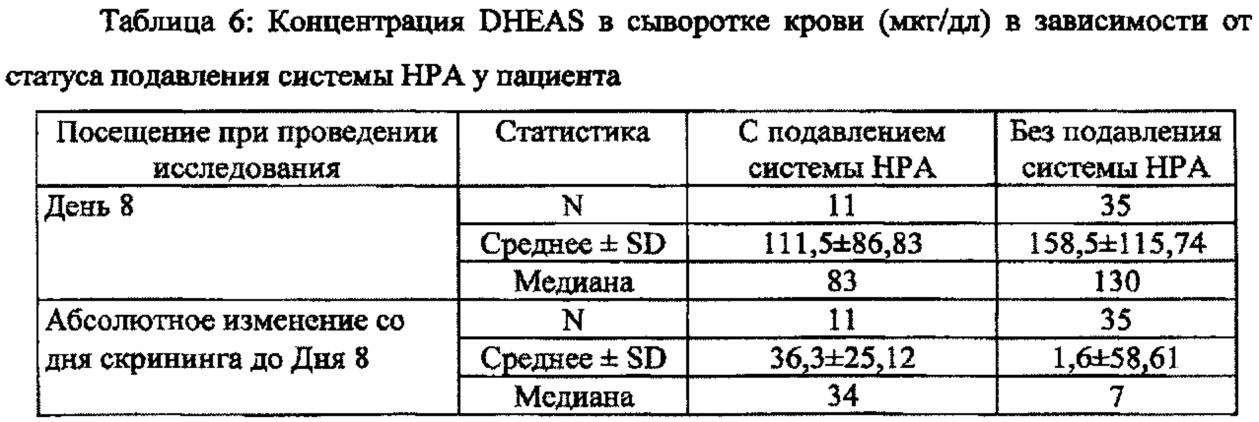
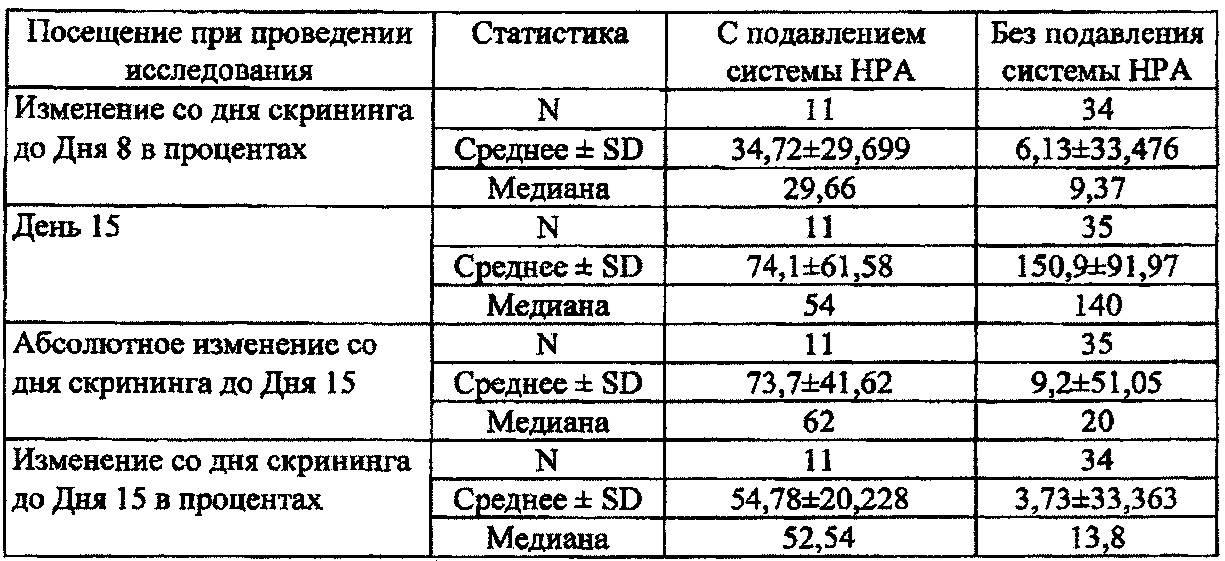
SD - среднее квадратическое отклонение
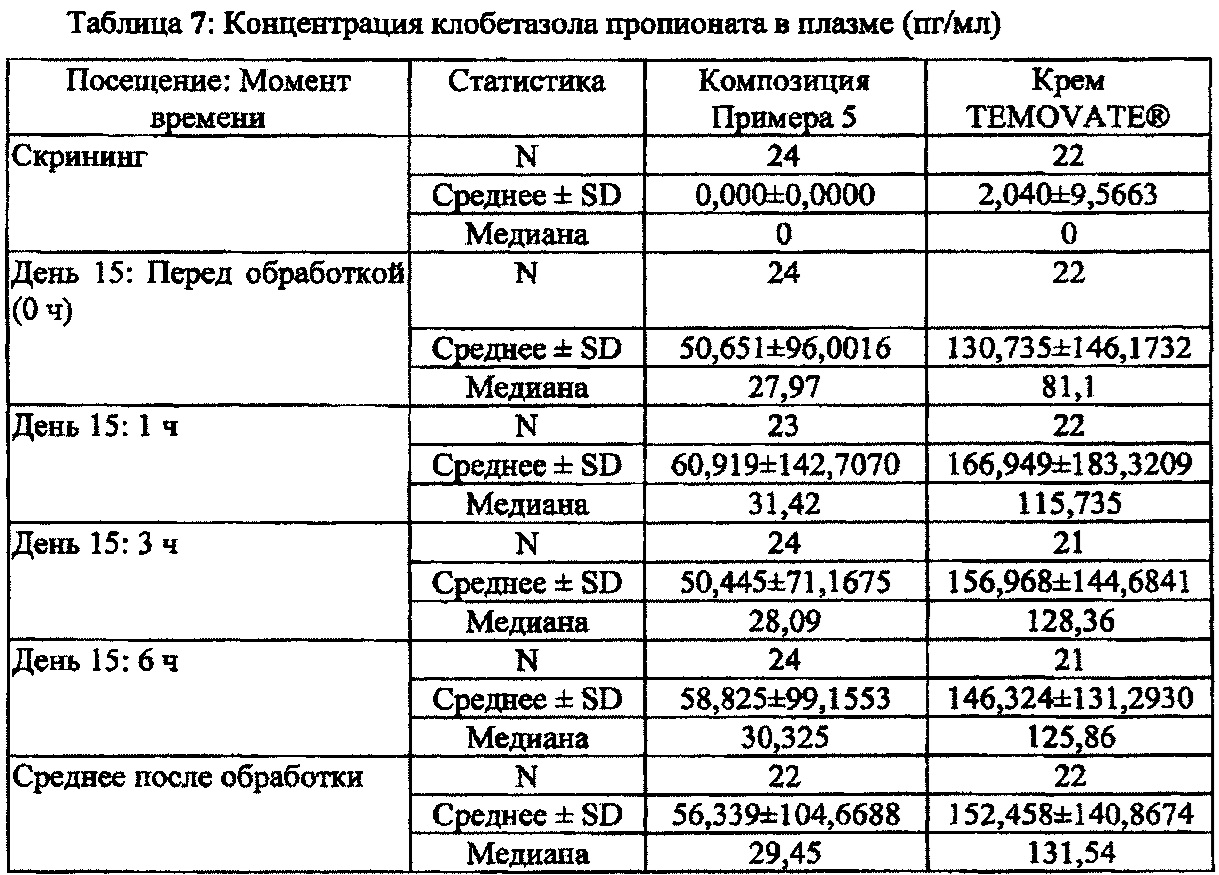
SD - среднее квадратическое отклонение
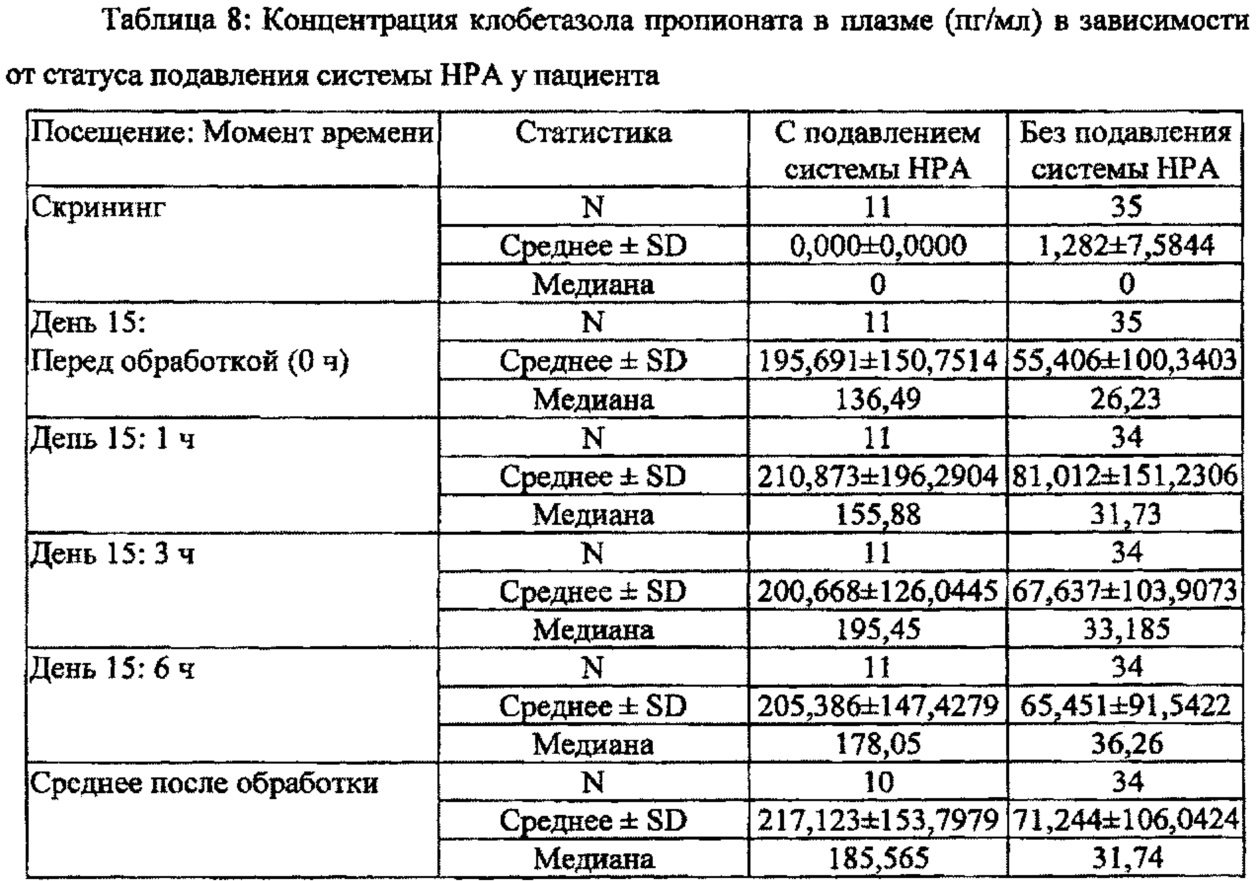
SD - среднее квадратическое отклонение
[00311] Несмотря на то, что было проиллюстрировано и описано несколько конкретных форм применения, следует иметь в виду, что могут быть выполнены различные модификации и комбинации форм применения, подробно описанных в тексте, без отклонения от сущности и объема данной заявки.
[00312] Все публикации, патенты и патентные заявки, упомянутые в настоящем описании, включены в данный документ посредством ссылок так, как если бы каждая отдельная публикация, патент или патентная заявка был(-а) конкретно и индивидуально указана для включения посредством ссылки.