Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ МОРФОЛИН-ПИРИДИНА
Вид РИД
Изобретение
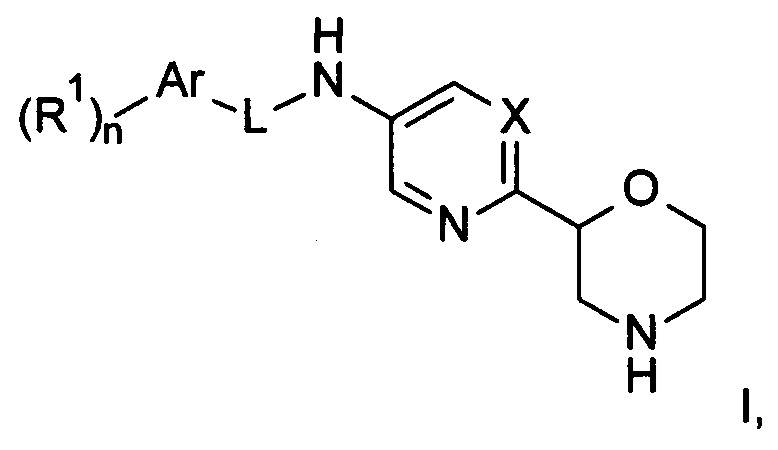
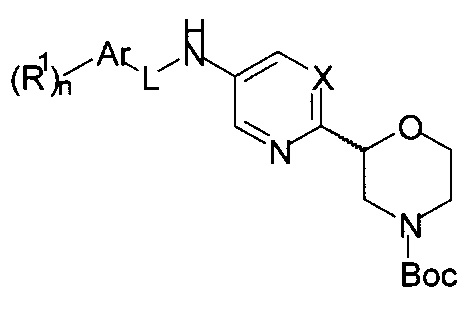
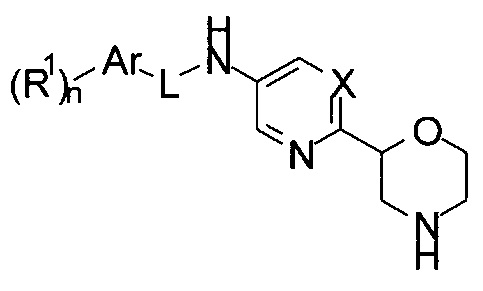
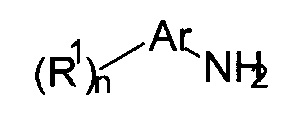
Настоящее изобретение относится к соединениям формулы
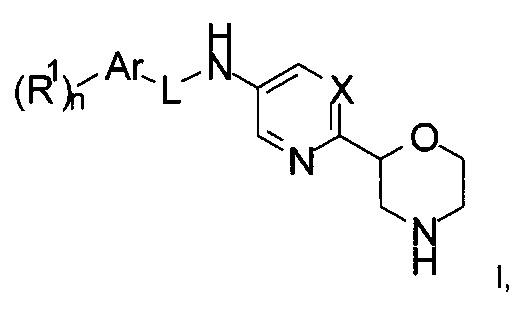
где
X представляет собой CR или N;
R представляет собой водород, галоген или низший алкил;
L представляет собой связь, -C(O)- или -C(O)NH-;
Ar представляет собой фенил или пяти- или шестичленную гетероарильную группу, содержащую один или более атомов N;
R1 представляет собой галоген, низший алкил, низший алкил, замещенный галогеном, низший алкокси, низший алкокси, замещенным галогеном, или представляет собой циклоалкил;
n представляет собой 0, 1, 2 или 3;
или к их фармацевтически приемлемым кислотно-аддитивным солям, ко всем рацемическим смесям, ко всем их соответствующим энантиомерам и/или оптическим изомерам.
В настоящее время было обнаружено, что соединения формулы I обладают хорошим сродством к рецепторам, ассоциированным со следовыми аминами (TAAR, от англ. - trace amine associated receptors), особенно к TAAR1.
Эти соединения могут быть использованы для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости и метаболических расстройств, таких как расстройства пищевого поведения, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства расхода и поглощения энергии, расстройства и нарушение гомеостаза температуры тела, расстройств сна и циркадного ритма, и сердечно-сосудистых расстройств.
Некоторые из физиологических эффектов (т.е. сердечно-сосудистые эффекты, гипотония, индукция седативного эффекта), о которых сообщалось в отношении соединений, которые могут быть связаны с адренергическими рецепторами (WO 02/076950, WO 97/12874 или EP 0717037), могут рассматриваться как нежелательные побочные эффекты в случае лекарств, нацеленных на лечение заболеваний центральной нервной системы, как описано выше. Следовательно, желательно получить лекарства, обладающие селективностью к рецептору TAAR1 по сравнению с адренергическими рецепторами. Объекты настоящего изобретения демонстрируют избирательность к рецептору TAAR1 относительно адренергических рецепторов, в частности хорошую селективность по сравнению с адренергическими рецепторами альфа1 и альфа2 человека и крысы.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, дофамин, гистамин) выполняют важные функции в качестве нейромедиаторов в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их разрушение и повторное поглощение после высвобождения строго регламентированы. Известно, что дисбаланс в уровнях биогенных аминов ответственен за измененную функцию головного мозга при многих патологических состояниях [2-5]. Второй класс эндогенных аминных соединений, так называемых следовых аминов (ТА, от англ. - trace amines), значительно совпадает с классическими биогенными аминами в отношении структуры, метаболизма и субклеточной локализации. ТА включают пара-тирамин, β-фенилэтиламин, триптамин и октопамин, и они присутствуют в нервной системе млекопитающих, как правило, на более низких уровнях, чем классические биогенные амины [6].
Их дисрегуляция связана с различными психиатрическими заболеваниями, подобными шизофрении и депрессии [7], и другими состояниями, подобными синдрому дефицита внимания с гиперактивностью, мигрени, болезни Паркинсона, наркотической зависимости и расстройств пищевого поведения [8, 9].
В течение длительного времени ТА-специфические рецепторы только предполагались, исходя из анатомически дискретных сайтов связывания с высоким сродством к ТА в ЦНС людей и других млекопитающих [10, 11]. Таким образом, считалось, что фармакологические эффекты ТА опосредованы широко известным механизмом классических биогенных аминов, либо инициированием их высвобождения, либо ингибированием их обратного захвата, либо «кросс-взаимодействием» с их системами рецепторов [9, 12, 13]. Данная точка зрения претерпела значительные изменения, связанные с определением нескольких членов нового семейства GPCR (рецепторов, сопряженных с G-белком, англ. G-protein-coupled receptors), а именно, рецепторов, ассоциированных со следовыми аминами (TAAR) [7, 14]. Существует 9 генов TAAR у человека (включая 3 псевдогена) и 16 генов у мыши (включая 1 псевдоген). Гены TAAR не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и располагаются рядом друг с другом на одном и том же участке хромосомы. Филогенетическая взаимосвязь генов рецепторов, согласующаяся с углубленным сравнением сходства фармакофоров GPCR, и фармакологические данные указывают на то, что эти рецепторы образуют три отдельных подсемейства [7, 14]. TAAR1 входит в первый подкласс четырех генов (TAAR1-4), высококонсервативных среди человека и грызунов. ТА активируют TAAR1 посредством Gas. Показано, что дисрегуляция ТА влияет на этиологию различных заболеваний, подобных депрессии, психозу, синдрому дефицита внимания с гиперактивностью, наркотической зависимости, болезни Паркинсона, мигрени, расстройствам пищевого поведения, метаболическим расстройствам и, следовательно, лиганды TAAR1 обладают высоким потенциалом в лечении этих заболеваний.
Следовательно, существует большой интерес к увеличению знаний о рецепторах, ассоциированных со следовыми аминами.
Используемые ссылки:
1 Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp.193-234, Academic Press;
2 Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351;
3 Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260;
4 Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson's disease. Expert Opin. Investig. Drugs 12, 1335-1352,
5 Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628;
6 Usdin, Earl; Sandler, Merton; Editors. Psychopharmacology Series, Vol. 1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976);
7 Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281;
8 Branchek, T.A. and Blackburn, TP. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97;
9 Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. U.S.A. 98, 9474-9475;
10 Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291;
11 McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101;
12 Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156;
13 Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210;
14 Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Предметами настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли, их применение для изготовления лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов, ассоциированных со следовыми аминами, их изготовление и лекарственные средства на основе соединения согласно изобретению для контроля или предотвращения заболеваний, таких как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания с гиперактивностью, расстройства, обусловленные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, наркотическая зависимость и метаболические расстройства, такие как расстройства пищевого поведения, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства расхода и поглощения энергии, расстройства и нарушение гомеостаза температуры тела, расстройства сна и циркадного ритма и сердечно-сосудистые расстройства.
Предпочтительными показаниями для применения соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, тревога и синдром дефицита внимания с гиперактивностью (СДВГ), и диабет.
Как используется здесь, термин «низший алкил» означает насыщенную неразветвленную или разветвленную группу, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.п. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Как используется здесь, термин «низший алкокси» означает группу, где алкильный остаток является таким, как определено выше, и который присоединен через атом кислорода.
Как используется здесь, термин «галоген» означает хлор, йод, фтор и бром. Предпочтительными галогеновыми группами являются фтор и хлор.
Как используется здесь, термин «низший алкил, замещенный галогеном» означает насыщенную неразветвленную или разветвленную группу, содержащую от 1 до 7 атомов углерода, как определено выше для термина «низший алкил», где по меньшей мере один атом водорода замещен атомом галогена. Предпочтительным атомом галогена является фтор. Примерами таких групп являются CF3, CHF2, CH2F, CH2CF3 или CH2CHF2.
Как используется здесь, термин «низший алкокси, замещенный галогеном» означает алкоксигруппу, как определено выше, где по меньшей мере один атом водорода замещен галогеном.
Термин «циклоалкил» означает насыщенное углеродное кольцо, содержащее от 3 до 6 кольцевых атомов углерода, например, циклопропил, циклопентил или циклогексил.
Термин "пяти- или шестичленная гетероарильная группа, содержащая один или более атомов N", означает циклическое ароматическое 5-ти или шестичленное кольцо, где по меньшей мере один атом углерода замещен атомом азота, например, группы пиридинил, пиримидинил или пиразолил.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п.
Одним вариантом осуществления изобретения являются соединения формулы I, где "L" представляет собой связь, например, следующие соединения: (RS)-N-(4-Хлорфенил)-6-морфолин-2-илпиридин-3-амин
(RS)-N-(4-Бромфенил)-6-морфолин-2-илпиридин-3-амин
(RS)-N-(4-Этоксифенил)-6-морфолин-2-илпиридин-3-амин
(RS)-N-(3-Хлорфенил)-6-морфолин-2-илпиридин-3-амин
(RS)-N-(4-Фторфенил)-6-морфолин-2-илпиридин-3-амин
(RS)-6-Морфолин-2-ил-N-[4-(трифторметил)фенил]пиридин-3-амин
(RS)-N-(6-Морфолин-2-ил-3-пиридил)-2-(трифторметил)пиримидин-4-амин
N-(4-Хлорфенил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
6-[(2S)-Морфолин-2-ил]-N-[4-(трифторметил)фенил]пиридин-3-амин
N-(5-Хлор-2-пиридил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
N-(5-Бром-2-пиридил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
6-[(2S)-Морфолин-2-ил]-N-[6-(трифторметил)-3-пиридил]пиридин-3-амин
6-[(2S)-Морфолин-2-ил]-N-[4-(трифторметил)-2-пиридил]пиридин-3-амин
N-(4-Хлорфенил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
6-[(2R)-Морфолин-2-ил]-N-[4-(трифторметил)фенил]пиридин-3-амин
N-(5-Хлор-2-пиридил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
6-[(2R)-Морфолин-2-ил]-N-[6-(трифторметил)-3-пиридил]пиридин-3-амин
6-[(2R)-Морфолин-2-ил]-N-[4-(трифторметил)-2-пиридил]пиридин-3-амин
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-5-(трифторметил)пиридин-2-амин
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-6-(трифторметил)пиридин-2-амин
N-(5-Бром-2-пиридил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-5-(трифторметил)пиридин-2-амин
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-6-(трифторметил)пиридин-2-амин
(RS)-N-(4-Хлорфенил)-2-морфолин-2-ил-пиримидин-5-амин
(RS)-2-Морфолин-2-ил-N-[4-(трифторметил)фенил]пиримидин-5-амин
(RS)-5-Хлор-N-(5-хлор-2-пиридил)-6-морфолин-2-илпиридин-3-амин
(RS)-5-Хлор-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
(RS)-5-Метил-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
(RS)-N-(5-Хлор-2-пиридил)-5-фтор-6-морфолин-2-илпиридин-3-амин или
(RS)-5-Фтор-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин.
Еще одним вариантом осуществления изобретения являются соединения формулы I, где "L" представляет собой -C(O)-, например следующие соединения
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)бензамид
(RS)-3-Хлор-N-(6-морфолин-2-ил-3-пиридил)бензамид
(RS)-4-Этокси-N-(6-морфолин-2-ил-3-пиридил)бензамид
(RS)-4-Фтор-N-(6-морфолин-2-ил-3-пиридил)бензамид
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
(RS)-N-(6-Морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]бензамид
3-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]бензамид
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-4-(трифторметил)бензамид
N-[6-[(25)-Морфолин-2-ил]-3-пиридил]-2-(трифторметил)пиридин-4-карбоксамид
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-3-(трифторметил)бензамид
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-6-(2,2,2-трифторэтокси)пиридин-3-карбоксамид
2-Этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]пиримидин-5-карбоксамид
3-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
4-Хлор-3-циклопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-(трифторметил)-1Н-пиразол-5-карбоксамид
4-Хлор-3-метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-1-метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-пропил-пиразол-3-карбоксамид
4-Хлор-1-метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-пропил-пиразол-3-карбоксамид
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]бензамид
3-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]бензамид
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-4-(трифторметил)бензамид
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-2-(трифторметил)пиридин-4-карбоксамид
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-3-(трифторметил)бензамид
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-6-(2,2,2-трифторэтокси)пиридин-3-карбоксамид
2-Этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]пиримидин-5-карбоксамид
3-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
4-Хлор-3-циклопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-(трифторметил)-1Н-пиразол-5-карбоксамид
4-Хлор-3-метил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Метил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
(R)-3-Этил-4-метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-1Н-пиразол-5-карбоксамид
(S)-3-Этил-4-метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-1Н-пиразол-5-карбоксамид
(R)-6-Метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-2-(трифторметил)пиримидин-4-карбоксамид
(S)-6-Метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-2-(трифторметил)пиримидин-4-карбоксамид
(RS)-4-Хлор-N-(2-морфолин-2-илпиримидин-5-ил)бензамид
(RS)-4-Хлор-3-этокси-N-(6-морфолин-2-ил-3-пиридил)-1Н-пиразол-5-карбоксамид
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
4-Хлор-3-этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Этил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Бром-3-этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
3-Циклопропил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Бром-3-циклопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-3-этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Этил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Бром-3-этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
3-Циклопропил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Бром-3-циклопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Изoбyтил-N-[6-[(2S)-мopфoлин-2-ил]-3-пиpидил]-1H-пиpaзoл-5-кapбoкcaмид
4-Фтор-3-изобутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Бутил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Бутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
5-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-2-(2,2,2-трифторэтил)пиразол-3-карбоксамид
2-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-(2,2,2-трифторэтокси)пиразол-3-карбоксамид
3-Изобутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Фтор-3-изобутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Бутил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
3-Бутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
5-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-2-(2,2,2-трифторэтил)пиразол-3-карбоксамид
2-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-5-(2,2,2-трифторэтокси)пиразол-3-карбоксамид
4-Хлор-3-этокси-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
4-Xлop-3-этoкcи-N-[6-[(2S)-мopфoлин-2-ил]-3-пиpидил]-1H-пиpaзoл-5-кapбoкcaмид
(RS)-N-(5-Хлор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
(RS)-4-Хлор-N-(5-хлор-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
(RS)-N-(5-Фтор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
(RS)-4-Хлор-N-(5-фтор-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
4-Хлор-3-изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
4-Фтор-3-изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
(RS)-N-(5-Метил-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
(RS)-4-Хлор-N-(5-метил-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
4-Хлор-3-изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид или
4-Фтор-3-изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид.
Еще одним вариантом осуществления изобретения являются соединения формулы I, где "L" представляет собой -C(O)NH-, например, следующие соединения:
(RS)-1-(3-Хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
(RS)-1-(4-Фторфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
(RS)-1-(6-Морфолин-2-ил-3-пиридил)-3-[4-(трифторметил)фенил]мочевина
(RS)-1-(4-Хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
1-(3-Хлорфенил)-3-[6-[(2S)-морфолин-2-ил]-3-пиридил]мочевина
1-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-3-[3-(трифторметил)фенил]мочевина
1-(3-Хлорфенил)-3-[6-[(2R)-морфолин-2-ил]-3-пиридил]мочевина
1-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-3-[3-(трифторметил)фенил]мочевина
(RS)-1-(3-Хлорфенил)-3-(2-морфолин-2-илпиримидин-5-ил)мочевина
(RS)-1-(5-Хлор-6-морфолин-2-ил-3-пиридил)-3-(3-хлорфенил)мочевина
(RS)-1-(3-Хлорфенил)-3-(5-фтор-6-морфолин-2-ил-3-пиридил)мочевина или
(RS)-1-(3-Хлорфенил)-3-(5-метил-6-морфолин-2-ил-3-пиридил)мочевина.
Получение соединений формулы I по настоящему изобретению может быть выполнено с помощью последовательных или сходящихся способов синтеза. Синтезы соединений по изобретению показаны на следующих схемах 1, 2 и 3, и в описании 121 конкретных примеров. Знания, необходимые для проведения реакций и очистки полученных в результате продуктов известны специалистам в данной области техники. Заместители и индексы, используемые в следующем описании способов, имеют приведенные выше значения, если не указано иное.
Более подробно соединения формулы I можно получить способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Соответствующие условия реакций для отдельных стадий реакций известны специалисту в данной области техники. Последовательность реакций не ограничивается изображенной на схемах 1, 2 и 3, однако в зависимости от исходных веществ и их соответствующей реакционной способности последовательность стадий реакций может быть свободно изменена. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, либо способами, описанными в ссылках, приведенных в описании или в примерах, либо способами, известными в данной области техники.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены известными в данной области техники способами, например способами, описанными ниже, в которых
а) осуществляют взаимодействие соединения формулы 14
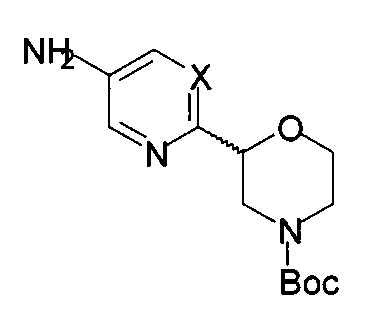
с соединением формулы 15-а
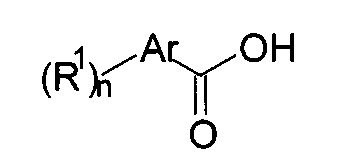
с получением соединения формулы 16-а
 ,
,
затем снимают защитную Вос-группу с получением соединения формулы I
 .
.
где L представляет собой -C(О)-, и другие заместители являются такими, как описано выше, или
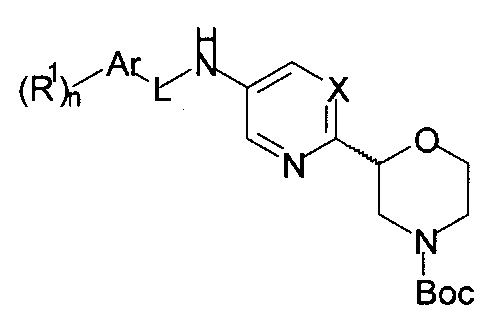
b) осуществляют взаимодействие соединения формулы 14
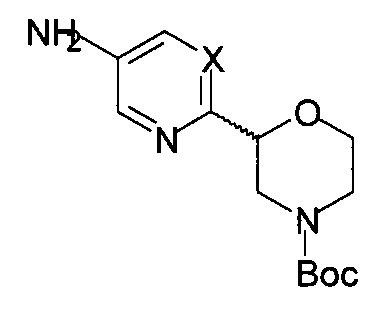
с соединением формулы 15-b
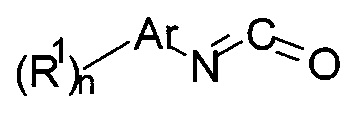
с получением соединения формулы 16-b
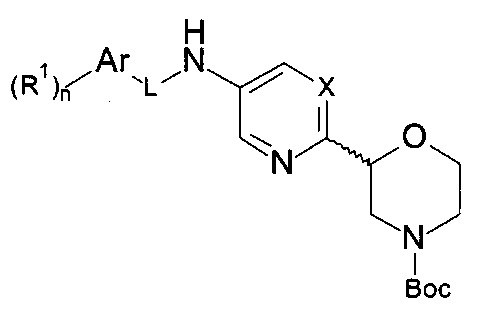 ,
,
затем снимают защитную Вос-группу с получением соединения формулы I
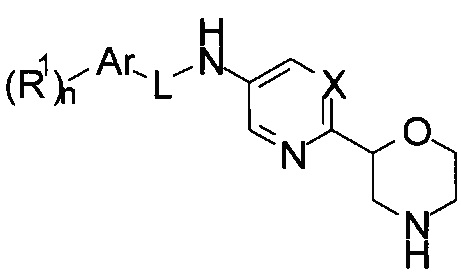 ,
,
где L представляет собой -NHC(O)-, и другие заместители являются такими, как описано выше, или
с) осуществляют взаимодействие соединения формулы 8, 9 или 10
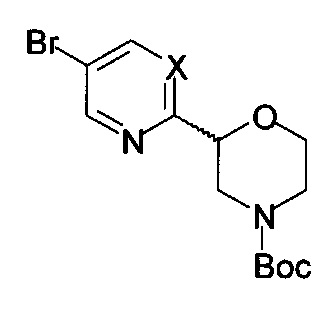
с соединением формулы 11
с получением соединения формулы 12
 ,
,
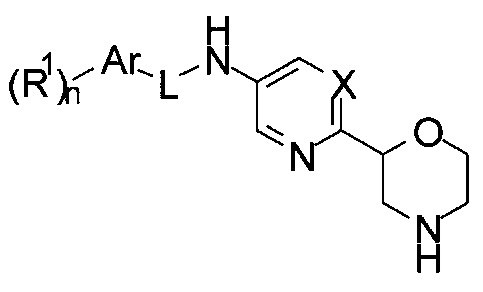
затем снимают защитную Вос-группу с получением соединения формулы I
 ,
,
где L представляет собой связь, и другие заместители являются такими, как описано выше, или
при желании, превращают полученные соединения в фармацевтически приемлемые кислотно-аддитивные соли.
ОБЩАЯ МЕТОДИКА
Схема 1
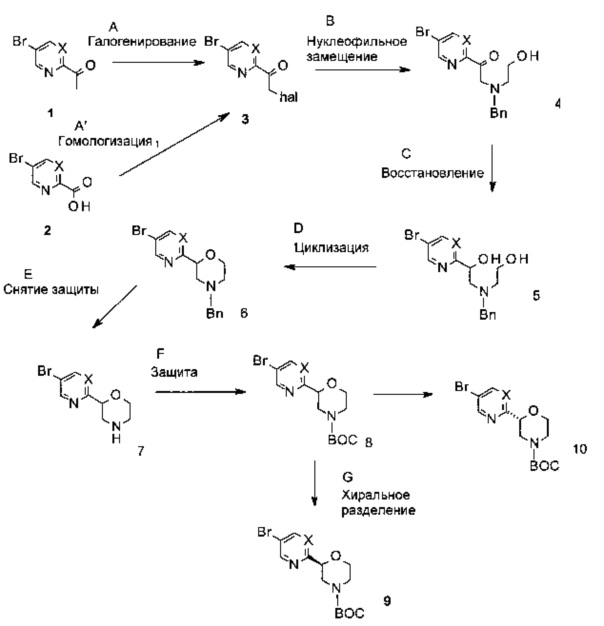
Заместители являются такими, как описано выше.
Стадия A: Превращение кетона 1 в альфа-галогенированный кетон 3 может быть выполнено путем обработки галогенирующими агентами, такими как хлор, бром, N-хлорсукцинимид (NCS), N-бромсукцинимид (NBS) или тетраэтиламмоний трихлорид, возможно кислотами, такими как HBr, HCl, НОАс, пара-толуолсульфокислота, в качестве добавок, в растворителях, таких как CH2Cl2, CHCl3, диоксан, ТГФ (тетрагидрофуран), ацетонитрил при температурах от комнатной до повышенных. Предпочтительными условиями являются бром в растворе HBr/HOAc при 70°C в течение 3 часов с образованием альфа-бромкетона 3 (hal представляет собой Br).
Стадия А': Альтернативно, альфа-галогенированный кетон 3 можно получить путем стадийного способа, включающего промежуточные соединения ацилгалогенидов. Карбоновую кислоту 2 можно превратить в соответствующие ацилгалогениды путем обработки галогенирующими агентами, такими как (COCl)2, SOCl2, PCl3, PBr3, или Ph3P⋅Br2, возможно в растворителях, таких как CH2Cl2, CHCl3, бензол или толуол, при температурах от 0°C до повышенных. На второй стадии промежуточное соединение ацилгалогенид можно отрабатывать (триметилсилил)диазометаном и затем концентрированной HCl или HBr. Реакцию можно проводить с использованием смеси ацетонитрила, ТГФ и диэтилового эфира в качестве растворителя при температуре между 0°C и комнатной температурой.
Предпочтительными условиями являются (COCl)2 в CH2Cl2 при температуре от 0°C до комнатной на первой стадии, и перемешивание реагентов при 0-5°C, затем их реагирование в течение 30 минут при комнатной температуре с образованием альфа-хлоркетона 3 (hal представляет собой Cl).
Стадия B: Образование связи C-N может быть выполнено путем нуклеофильного замещения c N-бензиламиноэтанолом с получением альфа-аминокетона 4. Реакцию можно проводить с основанием, таким как триэтиламин, диизопропилэтиламин, K2CO3, Na2CO3, Cs2CO3, KO'Bu, в апротонных растворителях, таких как ДМФА (диметилформамид), ацетонитрил, ДМСО (диметилсульфоксид), ТГФ, ДМЭ (диметоксиэтан) или диоксан, при температурах от комнатной до повышенных. Предпочтительными условиями являются K2CO3 в качестве основания в безводном ДМФА при комнатной температуре.
Стадия C: Превращение кетона 4 в диол 5 может быть выполнено путем обработки восстанавливающим агентом, таким как LiBH4, NaBH4, LiA1H4 или DIBAL-Н (диизобутилалюминий-гидрид), в растворителе, таком как МеОН, EtOH, ТГФ, диэтиловый эфир или толуол при температуре от -78°C до комнатной. Предпочтительными условиями являются NaBH4 в этаноле при комнатной температуре в течение 1 ч.
Стадия D: Циклизация диола 5 может быть выполнена путем катионной циклизации, опосредованной кислотой, или стадийным способом, включающим промежуточные соединения сульфонатные эфиры. При катионной циклизации, опосредованной кислотой, превращение может быть выполнено путем обработки неорганическими кислотами, такими как H2SO4 или H3PO4 при повышенных температурах.
При стадийном способе превращение может быть выполнено путем обработки диола 5 одним эквивалентом сульфонилирующего реагента, такого как 1-(пара-толуолсульфонил)имидазол, метансульфонилхлорид или толуолсульфонилхлорид, или в присутствии неорганического основания, такого как NaH и KO'Bu, или органического основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или МТБЭ (трет-бутилметиловый эфир), или с использованием органического основания в качестве растворителя, при температуре от 0°C до 50°C. Полученный сульфонатный эфир можно превратить в морфолин 6 путем обработки ненуклеофильным основанием, таким как гидрид натрия, трет-бутоксид калия или 2-метил-2-бутоксид калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или МТБЭ.
Предпочтительными условиями являются стадийный способ с использованием NaH в качестве основания и 1-(пара-толуолсульфонил)имидазола в качестве сульфонилирующего агента, в ТГФ при комнатной температуре в течение 16 часов.
Стадия E: Удаление бензильной защитной группы может быть выполнено либо путем реакции гидрирования, катализируемой Pd катализатором, либо путем обработки хлорформиатами, такими как ClCOOCH2CH2Cl, ClCOOCH(Cl)Me, ClCOOCH2Ph и СlСООСН2ССl3, и, возможно, основанием, таким как триэтиламин, диизопропилэтиламин и гидроксид натрия, в растворителях, таких как дихлорметан, 1,2-дихлорэтан, толуол, ТГФ, диэтиловый эфир, диоксан, МТБЭ, метанол и этанол, при температурах от комнатной до повышенных.
Предпочтительными условиями являются условия с использованием CICOOCH(Cl)Me в дихлорметане в течение 4 часов при комнатной температуре, затем в МеОН и толуоле при temperature кипения в течение 1 ч.
Стадия F: Защита морфолина 7 может быть выполнена путем обработки ди-трет-бутилкарбонатом, возможно, в присутствии органического или неорганического основания, такого как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, карбонат калия, карбонат натрия или карбонат цезия, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или МТБЭ.
Предпочтительными условиями являются ТГФ в присутствии карбоната калия в качестве основания при комнатной температуре в течение 2 часов.
Стадия G: Энантиомеры 8 можно разделить с использованием хиральной ВЭЖХ. Предпочтительными условиями являются условия с использованием СФХ (сверхкритической флюидной хроматографии) (Колонка: Chiralpak AD-3 100×4,6 мм I.D., 3 мкм) с этанолом (0.05% DEA) в CO2 от 5% до 40% в качестве мобильной фазы.
Схема 2
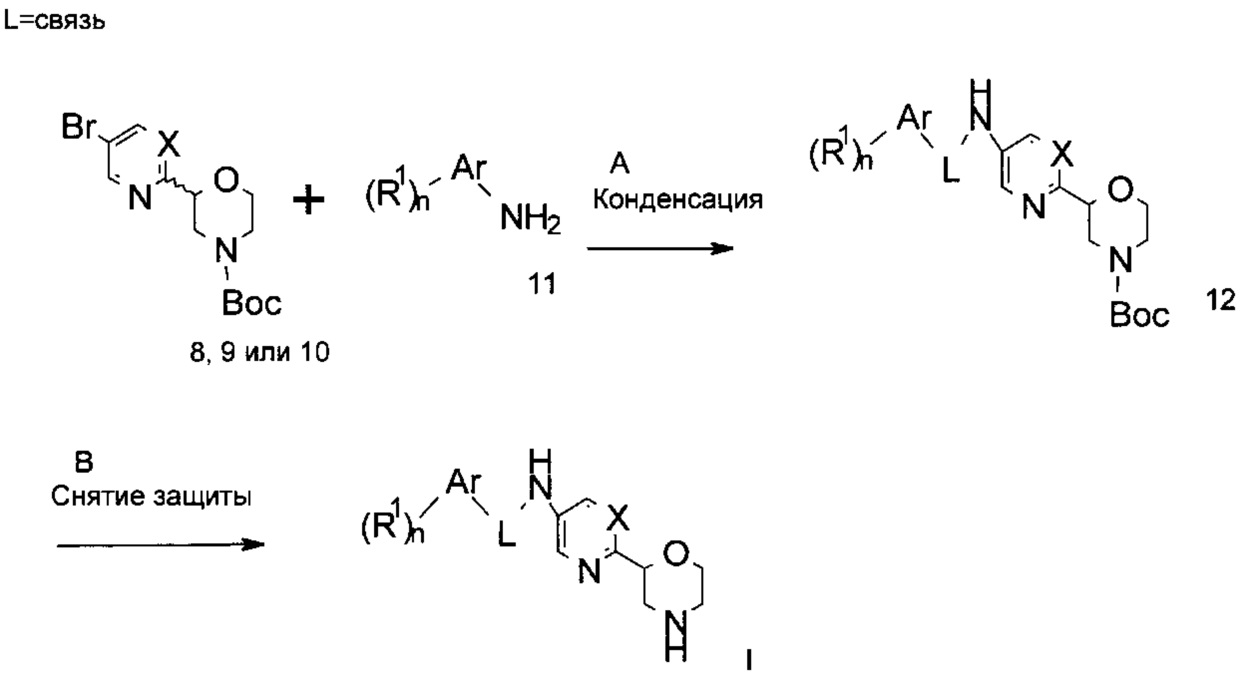
Стадия A: Конденсация арилбромида 8, 9 или 10 с ариламином 11 может быть выполнена путем обработки палладиевым катализатором или медным катализатором, лигандом и основанием в растворителях, таких как диоксан, ДМФА, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например, с использованием реакции Бухвальда-Хартвига, катализируемой палладием.
Предпочтительными условиями являются каталитический трис(дибензилидинацетон)дипалладий(0), каталитический 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos) и Cs2CO3, в диоксане при 90°C в течение 12 часов.
Стадия B: Удаление N-защитной группы Вое можно выполнить минеральными кислотами, такими как HCl, H2SO4 или Н3РО4, или органическими кислотами, такими как CF3COOH, CHCl2COOH, НОАс или пара-толуолсульфокислота в растворителях, таких как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при 0-80°C.
Предпочтительными условиями являются CF3COOH в качестве кислоты в CH2Cl2 при комнатной температуре в течение 1 ч.
Схема 3
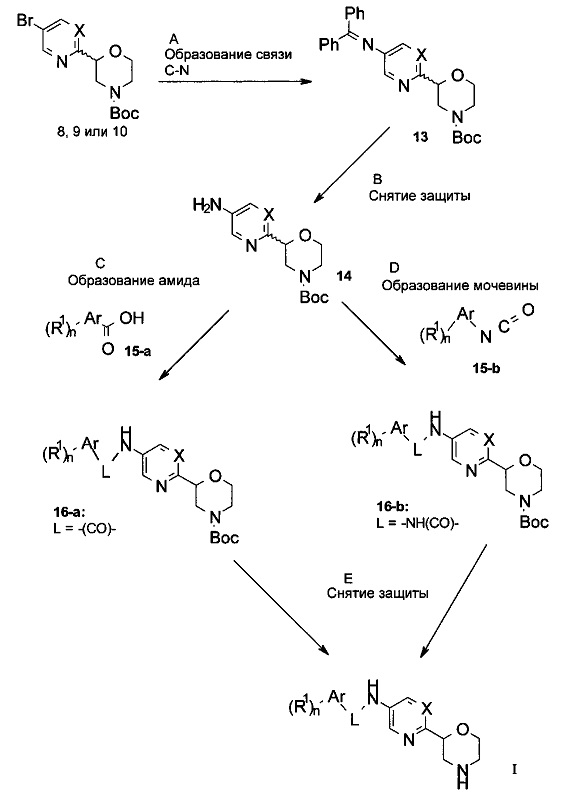
Стадия A: Образование связи C-N может быть выполнено путем обработки бромида 8, 9 или 10 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол и ДМСО при повышенных температурах, например, с использованием реакции Бухвальда-Хартвига, катализируемой палладием.
Предпочтительными условиями являются каталитический трис(дибензилидинацетон)дипалладий(0), каталитический 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos) и Cs2CO3 в диоксане при 90°C в течение 12 часов.
Стадия B: Удаление дифенилметиленовой N-защитной группы может быть выполнено путем гидрирования водородом при нормальном или повышенном давлении, или путем гидрирования с переносом водорода с использованием формиата аммония или циклогексадиена в качестве источника водорода с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как МеОН, EtOH, H2O, диоксан, ТГФ, EtOAc, дихлорметан, хлороформ, ДМФА или их смеси.
Это преобразование также можно выполнить путем обработки гидрохлоридом гидроксиламина вместе с основанием, таким как ацетат натрия, ацетат калия, карбонат натрия, карбонат калия, карбонат цезия, в растворителях, таких как МеОН, EtOH, диоксан, ТГФ, ДМФА или их смесь.
Предпочтительными условиями являются гидрохлорид гидроксиламина вместе с ацетатом натрия в МеОН при комнатной температуре в течение 1 ч.
Стадия С: Образование амида может быть выполнено путем обработки карбоновой кислотой 15-а и связывающим агентом, таким как DCC (дициклогексилкарбодиимид, англ. N,N'-Dicyclohexylcarbodiimide), EDC (1-Этил-3-(3-диметиламинопропил)карбодиимид, англ. 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide), TBTU (N,N,N',N''-Tetramethyl-O-(benzotriazol-1-yl)uronium tetrafluoroborate), HBTU (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) или HATU ((1-[Bis(dimethylamino)methylene]-1H-1,2,3-triazolo[4,5-b]pyridinium 3-oxid hexafluorophosphate) в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в растворителях, таких как дихлорметан, 1,2-дихлорэтан, ДМФА, ДМСО или эфирные растворители, такие как диэтиловый эфир, диоксан, ТГФ, ДМЭ или МТБЭ.
Предпочтительными условиями являются HATU с N,N-диизопропилэтиламином в ДМФА при комнатной температуре в течение 16 часов.
Стадия D: Образование мочевины может быть выполнено путем обработки изоцианатом 15-b в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан, 1,2-дихлорэтан или хлорбензол.
Предпочтительными условиями являются триэтиламин в качестве основания в дихлорметане при комнатной температуре.
Стадия E: Удаление N-защитной группы Boc можно выполнить минеральными кислотами, такими как HCl, H2SO4 или Н3РO4, или органическими кислотами, такими как CF3COOH, СНСl2СООН, НОАс или пара-толуолсульфокислота, в растворителях, таких как CH2Cl2, СНСl3, ТГФ, МеОН, EtOH или H2O при 0-80°C.
Предпочтительными условиями являются CF3COOH в качестве кислоты в CH2Cl2 при комнатной температуре в течение 1 ч.
Выделение и очистка соединений
Выделение и очистку соединений и промежуточных соединений, описанных здесь, можно выполнить, при необходимости, любым подходящим способом разделения или очистки, таким как, например фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография при низком или высоком давлении, или комбинация этих способов. Конкретные иллюстрации подходящих способов разделения и выделения могут быть выполнены в соответствии с получениями и примерами ниже. Однако, конечно, также можно использовать другие эквивалентные способы разделения или выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной ВЭЖХ. Рацемические смеси синтезированных хиральных промежуточных соединений также могут быть разделены с использованием хиральной ВЭЖХ.
Соли соединений Формулы I
Соединения формулы I являются основными и могут быть преобразованы в соответствующие кислотно-аддитивные соли. Превращение выполняют путем обработки по меньшей мере стехиометрическим количеством подходящей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол, и т.п., и добавляют кислоту в этом же растворителе. Температуру поддерживают между 0°C и 50°C. Полученная в результате соль осаждается самопроизвольно или может быть выделена из раствора менее полярным растворителем.
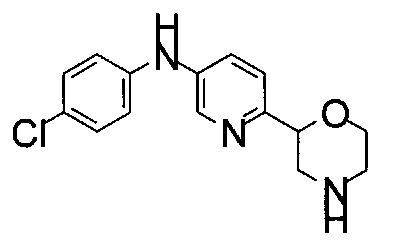
Пример 1
(RS)-N-(4-Хлорфенил)-6-морфолин-2-илпиридин-3-амин
а) 2-Бром-1-(5-бром-2-пиридил)этанон
2-Ацетил-5-бромпиридин (10,0 г, CAS: 214701-49-2) в растворе HBr/HOAc (35% ~ 39%, 80 мл) перемешивали при 70°C в течение 5 мин. Br2 (9,6 г) добавляли по каплям. Реакцию продолжали при 70°C в течение 3 ч, Анализ ТСХ показал полный расход исходного материала. Смесь охлаждали до комнатной температуры и фильтровали через фильтровальную бумагу. Летучие вещества удаляли при пониженном давлении и остаток сушили дополнительно в высоком вакууме с получением сырого 2-бром-1-(5-бром-2-пиридил)этанона (16,8 г, выход: 93,3%) в виде коричневого масла. Сырой продукт использовали на следующей стадии без очистки. МС (ИСП): 281,9 ([{81Br}М+Н]+), 277,9 ([{79Br}М+Н]+).
b) 2-[Бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанон
К раствору 2-бром-1-(5-бром-2-пиридил)этанона (16,8 г) в безводном ДМФА (150 мл) добавляли K2CO3 (19,5 г) порциями при комнатной температуре. После этого N-бензиламиноэтанол (10,2 г, CAS: 104-63-2) добавляли по каплям. Реакцию продолжали при комнатной температуре до завершения реакции, показанного анализом ТСХ. Смесь выливали в воду (1000 мл) и экстрагировали EtOAc (2×1000 мл). Органические слои объединяли и сушили с использованием Na2SO4. Летучие вещества удаляли при пониженном давлении. Остаток очищали флэш-хроматографией (силикагель, петролейный эфир/EtOAc составляет 10:1 по объему) с получением 2-[бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанона в виде светло-коричневого масла (9 г, выход: 55%).
с) (RS)-2-[Бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанол
При комнатной температуре к раствору 2-[бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанона (4,1 г) в EtOH (40 мл) добавляли NaBH4 (540 мг, 14 ммоль) порциями. После завершения реакции, как показано анализом ТСХ, реакцию осторожно гасили добавлением насыщенного раствора NH4Cl (200 мл). EtOH удаляли при пониженном давлении. Остаток экстрагировали EtOAc (2×100 мл). Объединенные органические экстракты сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток сушили дополнительно в высоком вакууме с получением сырого (RS)-2-[бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанола (3 г, 73%), который использовали на следующей стадии без очистки. МС (ИСП): 352,9 ([{81Br}М+Н]+), 350,9 ([{79Br}М+Н]+).
d) (RS)-4-Бензил-2-(5-бром-2-пиридил)морфолин
Гидрид натрия (60%, 2,7 г) добавляли порциями к раствору (RS)-2-[бензил(2-гидроксиэтил)амино]-1-(5-бром-2-пиридил)этанола (12 г) в ТГФ (100 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь охлаждали до 0°C и 1-(п-толуолсульфонил) имидазол (7 г, CAS: 2232-08-8) добавляли порциями. Через 30 минут смесь нагревали до комнатной температуры. Перемешивание продолжали в течение ночи. Реакцию гасили насыщенным водным хлоридом аммония. Смесь экстрагировали этилацетатом, промывали солевым раствором и сушили над Na2SO4. Очистка хроматографией (силикагель, петролейный эфир : этилацетат составляет 3:1 по объему) привела к получению (RS)-4-бензил-2-(5-бром-2-пиридил)морфолина (4 г, выход: 34,5%).
МС (ИСП): 335,0 ([{81Br}М+Н]+), 333,0 ([{79Br}М+Н]+).
1Н ЯМР (ДМСО-d6): 8,60 (1 Н), 8,05 (1Н), 7,42 (1Н), 7,30 (5Н), 4,51(1 Н), 3,97 (1Н), 3,82 (1Н), 3,59 (1Н), 3,47 (1Н), 3,07 (1Н), 2,75 (1Н), 2,19 (1Н), 1,91 (m, 1Н).
е) (RS)-2-(4-бромфенил)морфолин
Раствор (RS)-4-бензил-2-(5-бром-2-пиридил)морфолина (4,35 г) и 1-хлорэтилхлороформиата (2,5 г, CAS: 50893-53-3) в CH2Cl2 (50 мл) перемешивали при комнатной температуре в течение 4 ч. Анализ ТСХ показал, что исходный материал полностью израсходован. Летучие вещества удаляли при пониженном давлении и остаток сушили дополнительно в высоком вакууме. Остаток растворяли в МеОН (40 мл). Раствор перемешивали при температуре образования флегмы в течение часа. Анализ ТСХ показал завершение реакции. Летучие вещества удаляли при пониженном давлении и остаток сушили дополнительно в высоком вакууме с получением (RS)-2-(4-бромфенил)морфолина (4,35 г, 13 ммоль выход: 100%). Сырой продукт сразу использовали на следующей стадии.
МС (ИСП): 244,9 ([{81Br}М+Н]+), 242,9 ([{79Br}М+Н]+).
f) (RS)-трет-Бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилат
Раствор K2CO3 (5,38 г), ди-трет-бутилдикарбоната (3,4 г, СAS: 424-99-5) и (RS)-2-(4-бромфенил)морфолина (4,35 г, 13 ммоль) из вышеописанной реакции (стадия е) в ТГФ (50 мл) перемешивали при комнатной температуре в течение 2 часов. Анализ ТСХ показал завершение реакции. Добавляли воду (200 мл). Смесь экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой (200 мл). Органический слой концентрировали при пониженном давлении. Флэш-хроматография (силикагель, петролейный эфир/EtOAc составляет 3:1 по объему) привела к получению (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата (3,95 г, 89% выход)
МС (ИСП): 344,8 ([{81Br}М+Н]+), 342,8 ([{79Br}М+Н]+).
1Н ЯМР (ДМСО-d6): 8,69 (1Н), 8,09 (1Н), 7,46 (1Н), 4,45 (2Н), 4,00 (1Н), 3,82 (1Н), 3,63 (1Н), 2,89 (2Н), 1,43 (9H).
g) (RS)-трет-Бутил-2-[5-(4-хлоранилино)-2-пиридил]морфолин-4-карбоксилат
Смесь (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата (60 мг), 4-хлоранилина (25 мг, CAS: 106-47-8), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (Xantphos, 20 мг, CAS: 161265-03-8), трис(дибензилидинацетон)дипалладия(0) (16 мг, CAS: 51364-51-3) и Cs2CO3 (170 мг) в диоксане (3 мл) перемешивали при 90°C в течение 12 часов в атмосфере N2. ЖХМС показала завершение реакции. Смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой (100 мл). Органический слой концентрировали при пониженном давлении с получением сырого (RS)-трет-бутил-2-[5-(4-хлоранилино)-2-пиридил]морфолин-4-карбоксилата в виде коричневого масла. Сырой продукт использовали на следующей стадии без очистки.
h) (RS)-N-(4-Хлорфенил)-6-морфолин-2-илпиридин-3-амин
Сырой (RS)-трет-бутил-2-[5-(4-хлоранилино)-2-пиридил]морфолин-4-карбоксилат из вышеописанной реакции (стадия g) растворяли в CH2Cl2 (3 мл) при комнатной температуре. Добавляли трифторуксусную кислоту (TFA (трифторуксусная кислота), 1 мл, CAS: 76-05-1). Реакцию продолжали при комнатной температуре в течение часа. Летучие вещества удаляли при пониженном давлении. Очистка препаративной ВЭЖХ (мобильная фаза A: H2O, В: CH3CN с 0,1% TFA, С18 колонка) привела к получению (RS)-N-(4-хлорфенил)-6-морфолин-2-илпиридин-3-амина (25 мг) в виде светло-желтого воскообразного твердого вещества.
МС (ИСП): 292,1 ([{37Cl}M+H]+), 290,1 ([{35Cl}M+H]+).
Пример 2
(RS)-N-(4-Бромфенил)-6-морфолин-2-илпиридин-3-амин
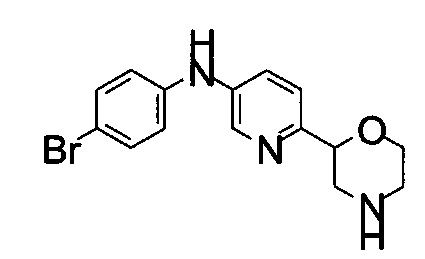
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 4-броманилина (CAS: 106-40-1) вместо 4-хлоранилина на стадии (g). Светло-желтое воскообразное твердое вещество. МС (ИСП): 336,0 ([{81Br}М+Н]+), 334,1 ([{79Br}М+Н]+).
Пример 3
(RS)-N-(4-Этоксифенил)-6-морфолин-2-илпиридин-3-амин
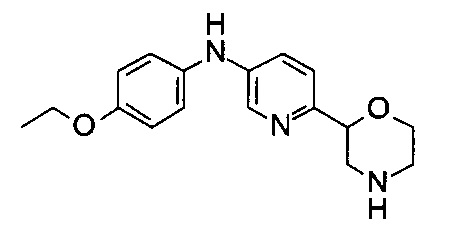
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 4-этоксианилина (CAS: 156-43-4) вместо 4-хлоранилина на стадии (g). Светло-желтое масло. МС (ИСП): 300,2 ([М+Н]+).
Пример 4
(RS)-N-(3-Хлорфенил)-6-морфолин-2-илпиридин-3-амин
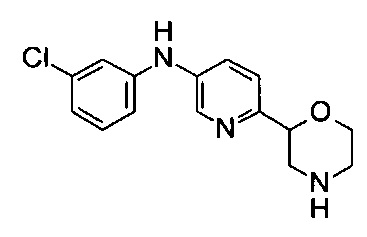
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 3-хлоранилина (CAS: 108-42-9) вместо 4-хлоранилина на стадии (g). Светло-желтое масло. МС (ИСП): 292,0 ([{37Cl}M+H]+), 290,0 ([{35Cl}M+H]+).
Пример 5
(RS)-N-(4-Фторфенил)-6-морфолин-2-илпиридин-3-амин
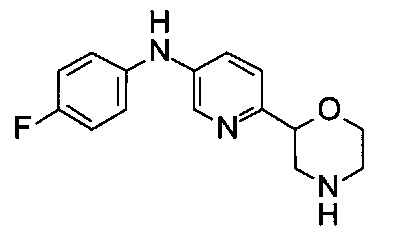
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 4-фторанилина (CAS: 371-40-4) вместо 4-хлоранилина на стадии (g). Светло-желтое масло. МС (ИСП): 274,1 ([М+Н]+).
Пример 6
(RS)-6-Морфолин-2-ил-N-[4-(трифторметил)фенил]пиридин-3-амин
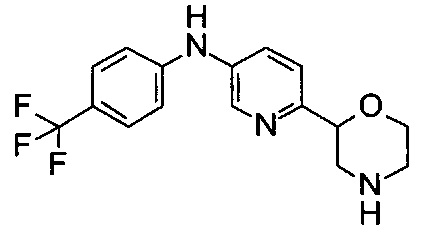
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 4-(трифторметил)анилина (CAS: 455-14-1) вместо 4-хлоранилина на стадии (g). Светло-желтое воскообразное твердое вещество. МС (ИСП): 324,1 ([М+Н]+).
Пример 7
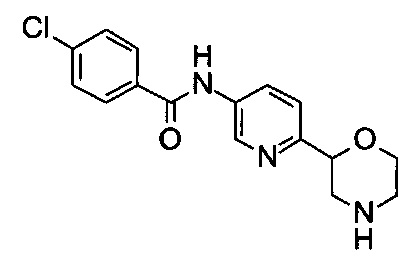
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)бензамид
а) (RS)-трет-Бутил-2-[5-(бензгидрилиденамино)-2-пиридил]морфолин-4-карбоксилат
Смесь (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата (1,0 г), Пример 1 (f), бензофенонимина (580 мг, CAS: 1013-88-3), 4,5-бис(дифенилфосфино) -9,9-диметилксантена (Xantphos, 500 мг, СAS: 161265-03-8), трис(дибензилидинацетон)дипалладия(0) (265 мг, CAS: 51364-51-3) и Cs2CO3 (2,8 г) в диоксане (40 мл) дегазировали путем продувания аргона через смесь в течение нескольких минут. Реакционную смесь перемешивали при 90°C в течение 12 часов в атмосфере аргона. Анализ ТСХ показал завершение реакции. Сырую реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали в вакууме и остаток разбавляли водой (100 мл). Смесь экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой (100 мл) и концентрировали досуха. Остаток очищали флэш-хроматографией (силикагель, CH2Cl2: МеОН составляет 30:1 по объему) с получением (RS)-трет-бутил-2-[5-(бензгидрилиденамино)-2-пиридил]морфолин-4-карбоксилата (1,28 г, выход: 99,9%) в виде желтого твердого вещества.
b) (RS)-трет-Бутил-2-(5-амино-2-пиридил)морфолин-4-карбоксилат
Смесь (RS)-трет-бутил-2-[5-(бензгидрилиденамино)-2-пиридил]морфолин-4-карбоксилата (1,28 г) из вышеописанной реакции (стадия а), гидроксиламина гидрохлорида (320 мг, СAS: 5470-11-1) и NaOAc (2,38 г, СAS: 127-09-3) в метаноле (50 мл) перемешивали при комнатной температуре в течение 3 часов. Анализ ТСХ показал завершение реакции. Смесь фильтровали и концентрировали. Очистка флэш-хроматографией (силикагель, CH2Cl2:MeOH составляет от 100:1 до 50:1 по объему) привела к получению (RS)-трет-бутил-2-(5-амино-2-пиридил)морфолин-4-карбоксилата (450 мг, выход: 55,4%) в виде белого твердого вещества.
МС (ИСП): 280,0 ([М+Н]+).
c) (RS)-трет-Бутил-2-[5-[(4-хлорбензоил)амино]-2-пиридил]морфолин-4-карбоксилат
(PS)-трет-Бутил-2-(5-амино-2-пиридил)морфолин-4-карбоксилат (35 мг), 4-хлорбензойную кислоту (23 мг, СAS: 74-11-3), HATU (57 мг, СAS: 148893-10-1) и N,N-диизопропилэтиламин (DIPEA, 49 мг, CAS: 7087-68-5) растворяли в ДМФА (1,5 мл). Раствор перемешивали при комнатной температуре, пока анализ ТСХ не показал завершения реакции. Реакционную смесь разбавляли водой (30 мл). Смесь экстрагировали этилацетатом (2×20 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Дополнительно сушили в высоком вакууме с получением сырого (RS)-трет-бутил-2-[5-[(4-хлорбензоил)амино]-2-пиридил]морфолин-4-карбоксилата в виде желтого твердого вещества, который использовали на следующей стадии без очистки.
d) (RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)бензамид
(RS)-трет-Бутил-2-[5-[(4-хлорбензоил)амино]-2-пиридил]морфолин-4-карбоксилат из вышеописанной реакции (стадия с) растворяли в смеси CH2Cl2 (2 мл) и трифторуксусной кислоты (1 мл). Раствор перемешивали при комнатной температуре в течение часа, пока анализ ЖХМС не показал завершения реакции. Раствор концентрировали при пониженном давлении. Очистка препаративной ВЭЖХ (мобильная фаза A: H2O, В: CH3CN с 0,1% TFA, С18 колонка) привела к получению (RS)-4-хлор-N-(6-морфолин-2-ил-3-пиридил)бензамида (32 мг) в виде белого твердого вещества.
МС (ИСП): 320,1 ([{37Cl}M+H]+), 318,1 ([{35Cl}M+H]+).
Пример 8
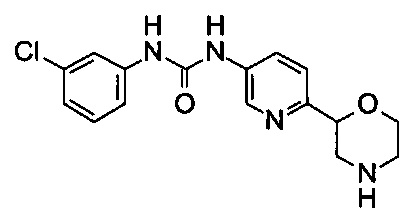
(RS)-1-(3-Хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
а) (RS)-трет-Бутил-2-[5-[(3-хлорфенил)карбамоиламино]-2-пиридил] морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(5-амино-2-пиридил)морфолин-4-карбоксилат (80 мг), Пример 7(b), 3-хлорфенилизоцианат (44 мг, CAS: 2909-38-8) и триэтиламин (90 мг, CAS: 121-44-8) растворяли в CH2Cl2 (1 мл). Раствор перемешивали при комнатной температуре, пока анализ ТСХ не показал завершения реакции. Добавляли воду (20 мл). Смесь экстрагировали этилацетатом (2×20 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Дополнительно сушили в высоком вакууме с получением сырого (RS)-трет-бутил-2-[5-[(3-хлорфенил)карбамоиламино]-2-пиридил]морфолин-4-карбоксилата в виде желтого масла, которое использовали на следующей стадии без очистки.
b) (RS)-1-(3-Хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
(RS)-трет-бутил-2-[5-[(3-хлорфенил)карбамоиламино]-2-пиридил]морфолин-4-карбоксилат из вышеописанной реакции (стадия а) растворяли в смеси трифторуксусной кислоты (0,5 мл) и CH2Cl2 (2 мл). Раствор перемешивали при комнатной температуре, пока анализ ТСХ не показал завершения реакции. Добавляли воду (20 мл). Смесь экстрагировали этилацетатом (2×20 мл). Водные слои нейтрализовали насыщенным водным раствором NaHCO3 до нейтрального pH и экстрагировали CH2Cl2/CH3OH (10:1 по объему, 20 мл). Объединенные органические слои концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (мобильная фаза A: H2O, В: CH3CN с 0,1% TFA, С18 колонка) с получением (RS)-1-(3-хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевины в виде белого твердого вещества (40 мг).
МС (ИСП): 335,1 ([{37Cl}M+H]+), 333,1 ([{35Cl}M+H]+).
1Н ЯМР (Метанол-d4): 8,75 (1Н), 8,10 (1Н), 7,68 (1Н), 7,59 (1Н), 7,30 (2Н), 7,16 (1Н), 4.91 (1Н), 4,15 (1Н), 4,37 (1Н), 3,67 (1Н), 3,36 (1Н), 3,29 (2Н).
Пример 9
(RS)-1-(4-Фторфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
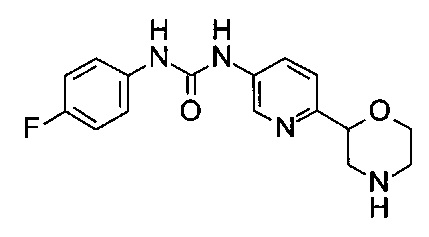
Указанное в заголовке соединение получали аналогично примеру 8 с использованием 4-фторфенилизоцианата (CAS: 1195-45-5) вместо 3-хлорфенилизоцианата на стадии (а). Светло-желтое масло. МС (ИСП): 317,1 ([М+Н]+).
Пример 10
(RS)-1-(6-Морфолин-2-ил-3-пиридил)-3-[4-(трифторметил)фенил]мочевина
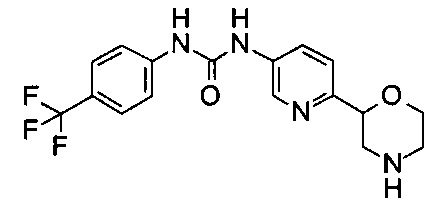
Указанное в заголовке соединение получали аналогично примеру 8 с использованием 4-(трифторметил)фенилизоцианата (CAS: 1548-13-6) вместо 3-хлорфенилизоцианата на стадии (а). Светло-желтое твердое вещество. МС (ИСП): 367,1 ([М+Н]+).
Пример 11
(RS)-1-(4-Хлорфенил)-3-(6-морфолин-2-ил-3-пиридил)мочевина
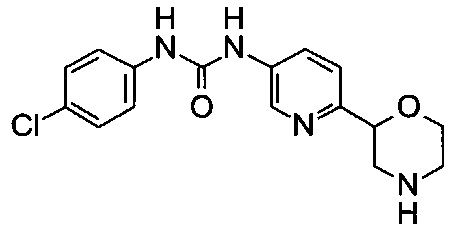
Указанное в заголовке соединение получали аналогично примеру 8 с использованием 4-хлорфенилизоцианата (CAS: 104-12-1) вместо 3-хлорфенилизоцианата на стадии (а). Не совсем белое твердое вещество. МС (ИСП): 335,1 ([{37Сl}М+Н]+), 333,1 ([{35Cl}М+Н]+).
Пример 12
(RS)-3-Хлор-N-(6-морфолин-2-ил-3-пиридил)бензамид
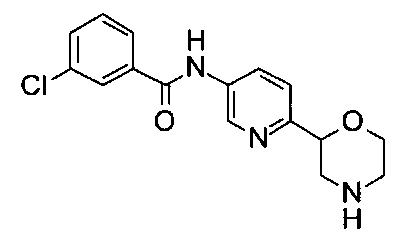
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 3-хлорбензойной кислоты (CAS: 535-80-8) вместо 4-хлорбензойной кислоты на стадии (с). Светло-желтое твердое вещество. МС (ИСП): 320,1 ([{37Cl}М+Н]+), 318,1 ([{35Cl}М+Н]+).
Пример 13
(RS)-4-Этокси-N-(6-морфолин-2-ил-3-пиридил)бензамид
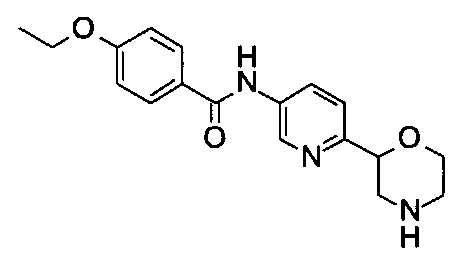
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 4-этоксибензойной кислоты (CAS: 619-86-3) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 328,2 ([М+Н]+).
Пример 14
(RS)-4-Фтор-N-(6-морфолин-2-ил-3-пиридил)бензамид
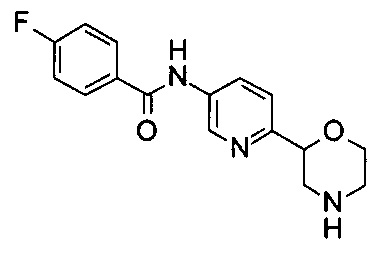
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 4-фторбензойной кислоты (CAS: 456-22-4) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 302,1 ([М+Н]+).
Пример 15
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
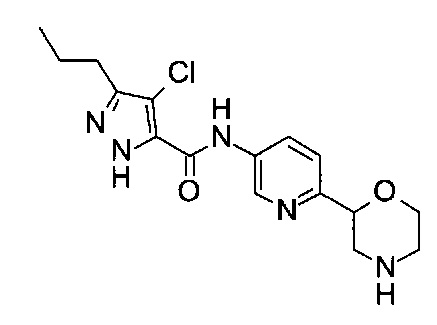
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 4-хлор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,1 ([{37Cl}M+H]+), 350,1 ([{35Cl}M+H]+).
Пример 16
(RS)-N-(6-Морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
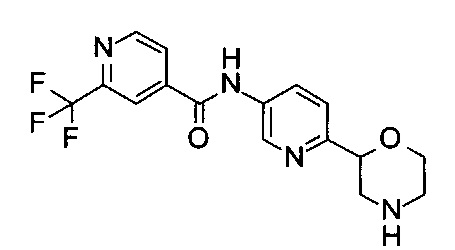
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 2-(трифторметил)пиридин-4-карбоновой кислоты (CAS: 131747-41-6) вместо 4-хлорбензойной кислоты на стадии (с). Светло-желтое твердое вещество. МС (ИСП): 353,0 ([М+Н]+).
Пример 17
(RS)-N-(6-Морфолин-2-ил-3-пиридил)-2-(трифторметил)пиримидин-4-амин
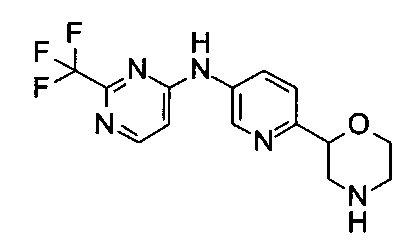
Указанное в заголовке соединение получали аналогично примеру 1 с использованием 2-(трифторметил)пиримидин-4-амина (CAS: 672-42-4) вместо 4-хлоранилина на стадии (g). Белое твердое вещество. МС (ИСП): 326,2 ([М+Н]+).
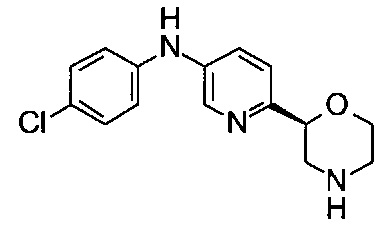
Пример 18
N-(4-Хлорфенил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
а) трет-Бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилат и трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилат
(RS)-трет-Бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилат разделяли путем СФХ с использованием следующих условий: колонка Chiralpak AD-3 (100×4,6 мм I.D.: 3 мкм); этанол (0,05% DEA) в CO2 от 5% до 40% в качестве мобильной фазы; скорость потока 3 мл/мин; длина волны: 220 нм. трет-Бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилат (1,6 г, время удерживания: 1,421 мин) получали в качестве первой фракции. трет-Бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилат (1,6 г, время удерживания: 1,571 мин) получали в качестве второй фракции.
b) N-(4-Хлорфенил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
N-(4-Хлорфенил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин получали аналогично примеру 1 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата для реакции с 4-хлоранилином (CAS: 106-47-8) на стадии (g). Воскообразное твердое вещество. МС (ИСП): 292,1 ([{37Cl}M+H]+), 290,2 ([{35Cl}M+H]+).
Пример 19
6-[(2S)-Морфолин-2-ил]-N-[4-(трифторметил)фенил]пиридин-3-амин
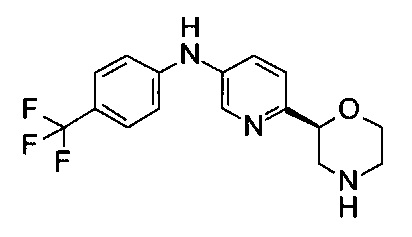
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 4-(трифторметил)анилина (CAS: 455-14-1) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 324,0 ([М+Н]+).
Пример 20
N-(5-Хлор-2-пиридил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
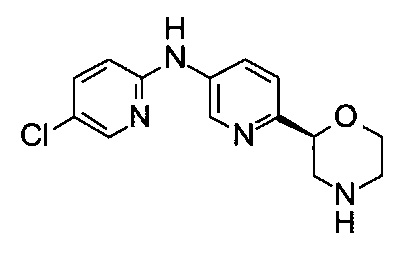
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 2-амино-5-хлорпиридина (CAS: 1072-98-6) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 293,0 ([{37Cl}M+H]+), 291,0 ([{35Cl}М+Н]+).
Пример 21
N-(5-Бром-2-пиридил)-6-[(2S)-морфолин-2-ил]пиридин-3-амин
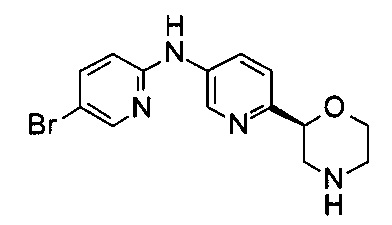
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 2-амино-5-бромпиридина (CAS: 1072-97-5) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 337,0 ([{81Br}М+Н]+), 335,0 ([{79Br}М+Н]+).
Пример 22
6-[(2S)-Морфолин-2-ил]-N-[6-(трифторметил)-3-пиридил]пиридин-3-амин
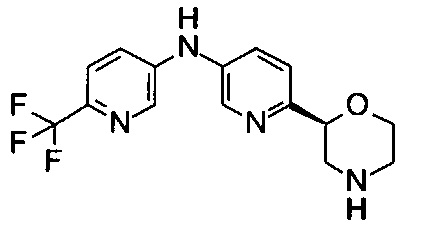
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 5-амино-2-(трифторметил)пиридина (CAS: 106877-33-2) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 325,1 ([М+Н]+).
Пример 23
6-[(2S)-Морфолин-2-ил]-N-[4-(трифторметил)-2-пиридил]пиридин-3-амин
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 2-амино-4-(трифторметил)пиридина (CAS: 106447-97-6) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 325,1 ([М+Н]+).
Пример 24
N-(4-Хлорфенил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
Указанное в заголовке соединение получали аналогично примеру 1 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата для реакции с 4-хлоранилином (CAS: 106-47-8) на стадии (g). Воскообразное твердое вещество. МС (ИСП): 292,1 ([{37Cl}M+H]+), 290,1 ([{35Cl}M+H]+).
Пример 25
6-[(2R)-Морфолин-2-ил]-N-[4-(трифторметил)фенил]пиридин-3-амин
Указанное в заголовке соединение получали аналогично примеру 24 с использованием 4-(трифторметил)анилина (CAS: 455-14-1) вместо 4-хлоранилина. Белое твердое вещество. МС (ИСП): 324,0 ([М+Н]+).
Пример 26
N-(5-Хлор-2-пиридил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
Указанное в заголовке соединение получали аналогично примеру 24 с использованием 2-амино-5-хлорпиридина (CAS: 1072-98-6) вместо 4-хлоранилина. Белое твердое вещество. МС (ИСП): 293,1 ([{37Cl}M+H]+), 291,1 ([{35Cl}M+H]+).
Пример 27
6-[(2R)-Морфолин-2-ил]-N-[6-(трифторметил)-3-пиридил]пиридин-3-амин
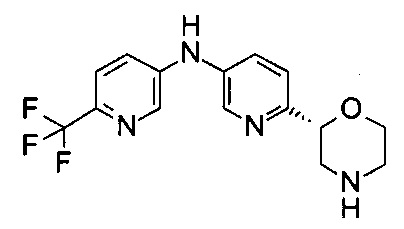
Указанное в заголовке соединение получали аналогично примеру 24 с использованием 5-амино-2-(трифторметил)пиридина (CAS: 106877-33-2) вместо 4-хлоранилина. Белое твердое вещество. МС (ИСП): 325,0 ([М+Н]+).
Пример 28
6-[(2R)-Морфолин-2-ил]-N-[4-(трифторметил)-2-пиридил]пиридин-3-амин
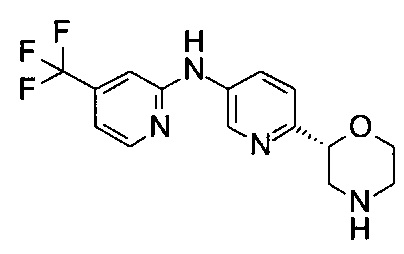
Указанное в заголовке соединение получали аналогично примеру 24 с использованием 2-амино-4-(трифторметил)пиридина (CAS: 106447-97-6) вместо 4-хлоранилина. Белое твердое вещество. МС (ИСП): 325,0 ([М+Н]+).
Пример 29
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-5-(трифторметил)пиридин-2-амин
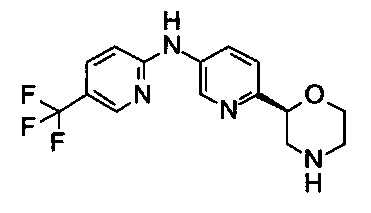
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 2-амино-5-(трифторметил)пиридина (CAS: 74784-70-6) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 325,1 ([М+Н]+).
Пример 30
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-6-(трифторметил)пиридин-2-амин
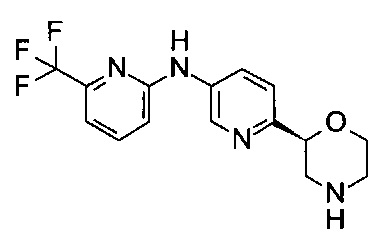
Указанное в заголовке соединение получали аналогично примеру 18 с использованием 2-амино-6-(трифторметил)пиридина (CAS: 34486-24-3) вместо 4-хлоранилина на стадии (b). Белое твердое вещество. МС (ИСП): 325,0 ([М+Н]+).
Пример 31
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]бензамид
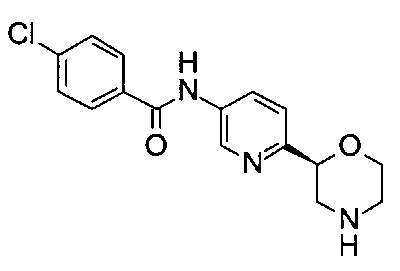
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а). Белое твердое вещество. МС (ИСП): 319,9 ([{37Cl}M+H]+), 317,9 ([{35Cl}M+H]+).
Пример 32
3-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]бензамид
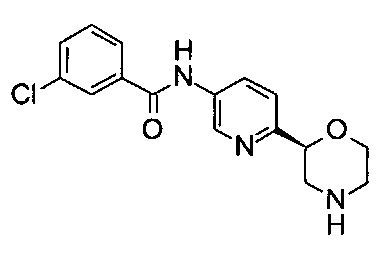
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-хлорбензойной кислоты (CAS: 535-80-8) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 319,9 ([{37Cl}M+H]+), 317,9 ([{35Cl}M+H]+).
Пример 33
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-4-(трифторметил)бензамид
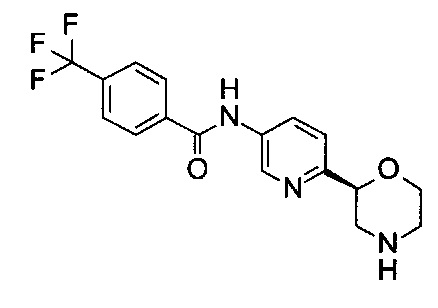
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-(трифторметил)бензойной кислоты (CAS: 455-24-3) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,0 ([М+Н]+).
Пример 34
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-2-(трифторметил)пиридин-4-карбоксамид
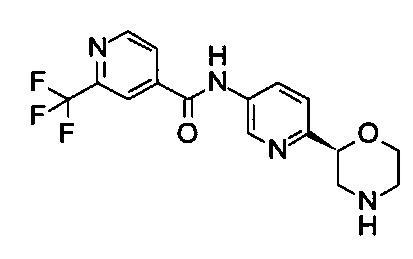
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 2-(трифторметил)пиридин-4-карбоновой кислоты (CAS: 131747-41-6) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,9 ([М+Н]+).
Пример 35
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-3-(трифторметил)бензамид
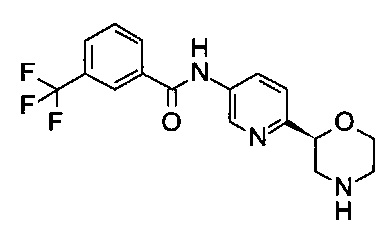
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-(трифторметил)бензойной кислоты (CAS: 454-92-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,0 ([М+Н]+).
Пример 36
N-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-6-(2,2,2-трифторэтокси)пиридин-3-карбоксамид
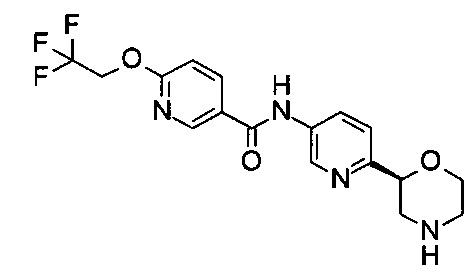
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 6-(2,2,2-трифторэтокси)никотиновой кислоты (CAS: 175204-90-7) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 382,9 ([М+Н]+).
Пример 37
2-Этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]пиримидин-5-карбоксамид
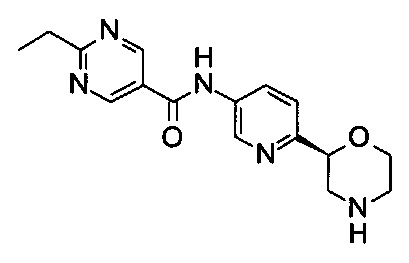
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 2-этилпиримидин-5-карбоновой кислоты (CAS: 72790-16-0) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 314,0 ([М+Н]+).
Пример 38
3-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
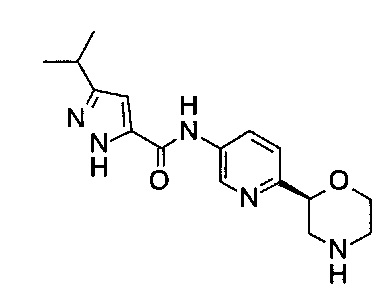
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-изопропилпиразол-5-карбоновой кислоты (CAS: 92933-47-6) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 316,0 ([М+Н]+).
Пример 39
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
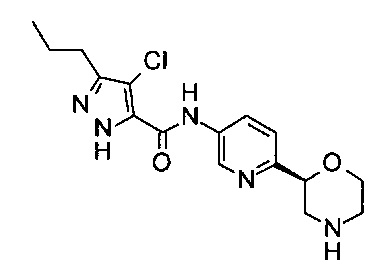
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,1 ([{37Cl}M+H]+), 350,1 ([{35Cl}М+Н]+).
Пример 40
4-Хлор-3-циклопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
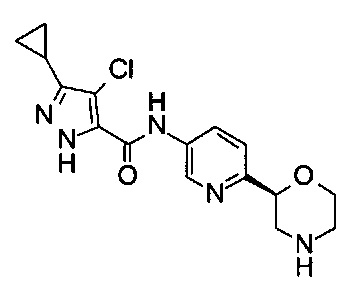
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-3-циклопропил-1Н-пиразол-5-карбоновой кислоты (CAS: 1291275-83-6) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 349,9 ([{37Cl}М+Н]+), 347,9 ([{35Cl}M+H]+).
Пример 41
1-(3-Хлорфенил)-3-[6-[(2S)-морфолин-2-ил]-3-пиридил]мочевина
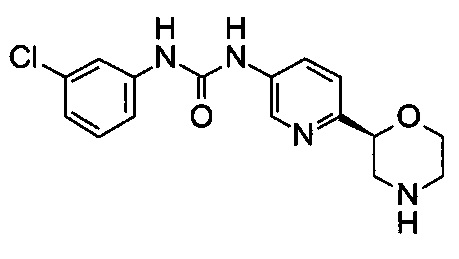
Указанное в заголовке соединение получали аналогично примеру 8 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а). Белое твердое вещество. МС (ИСП): 335,0 ([{37Cl}M+H]+), 333,0 ([{35Cl}M+H]+).
Пример 42
1-[6-[(2S)-Морфолин-2-ил]-3-пиридил]-3-[3-(трифторметил)фенил]мочевина
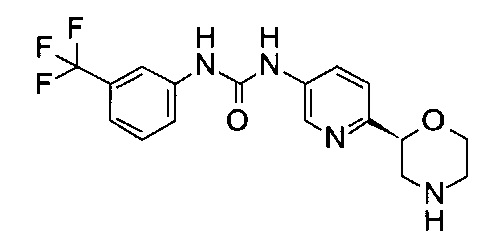
Указанное в заголовке соединение получали аналогично примеру 8 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата и 3-(трифторметил)фенилизоцианата (CAS: 329-01-1) вместо 3-хлорфенилизоцианата на стадии (а). Белое твердое вещество. МС (ИСП): 367,0 ([М+Н]+).
Пример 43
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-(трифторметил)-1Н-пиразол-5-карбоксамид
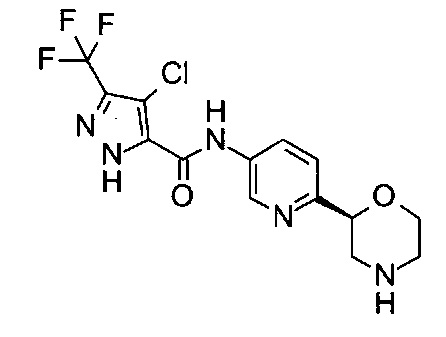
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-5-(трифторметил)-2Н-пиразол-3-карбоновой кислоты (CAS: 934758-95-9) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 377,9 ([{37Cl}М+Н]+), 375,9 ([{35Cl}М+Н]+).
Пример 44
4-Хлор-3-метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
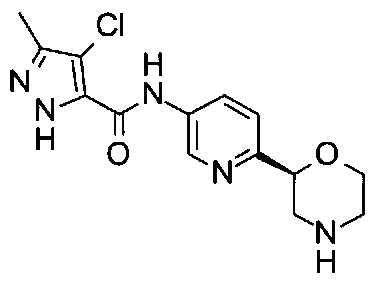
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-3-метил-1Н-пиразол-5-карбоновой кислоты (CAS: 29400-84-8) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 324,1 ([{37Cl}M+H]+), 322,2 ([{35Cl}М+Н]+).
Пример 45
4-Метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
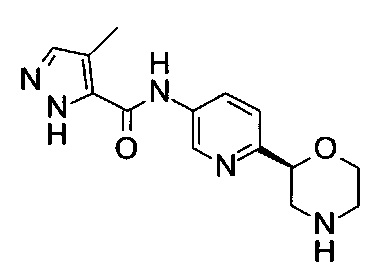
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-метил-1Н-пиразол-3-карбоновой кислоты (CAS: 82231-51-4) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 288,2 ([М+Н]+).
Пример 46
4-Хлор-1-метил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-пропил-пиразол-3-карбоксамид
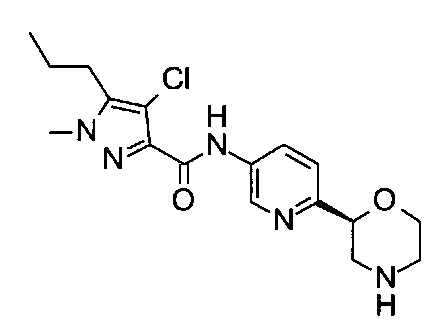
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-1-метил-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1248078-41-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 366,0 ([{37Cl}M+H]+), 364,0 ([{35Cl}M+H]+).
Пример 47
N-(5-Бром-2-пиридил)-6-[(2R)-морфолин-2-ил]пиридин-3-амин
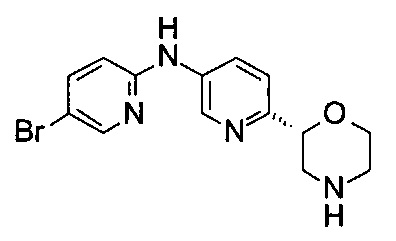
Указанное в заголовке соединение получали аналогично примеру 1 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата и 2-амино-5-бромпиридина (CAS: 1072-97-5) вместо 4-хлоранилина (CAS: 106-47-8) на стадии (g). Воскообразное твердое вещество. МС (ИСП): 337,0 ([{81Br}М+Н]+), 335,1 ([{79Br}М+Н]+).
Пример 48
4-Хлор-1-метил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-5-пропил-пиразол-3-карбоксамид
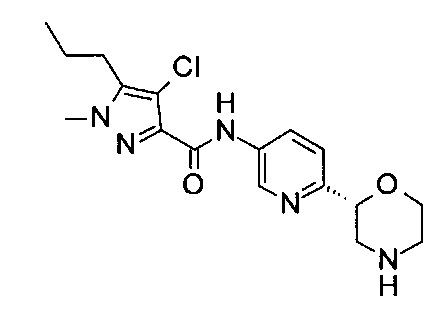
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-1-метил-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1248078-41-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 366,2 ([{37Cl}М+Н]+), 364,2 ([{35Cl}М+Н]+).
Пример 49
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-5-(трифторметил)пиридин-2-амин
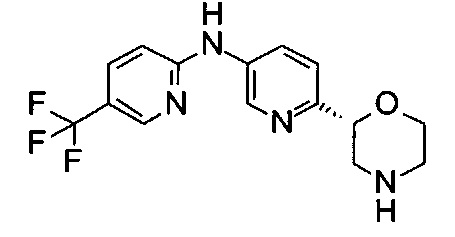
Указанное в заголовке соединение получали аналогично примеру 1 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата и 2-амино-5-(трифторметил)пиридина (CAS: 74784-70-6) вместо 4-хлоранилина (CAS: 106-47-8) на стадии (g). Белое твердое вещество. МС (ИСП): 325,2 ([М+Н]+).
Пример 50
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-6-(трифторметил)пиридин-2-амин
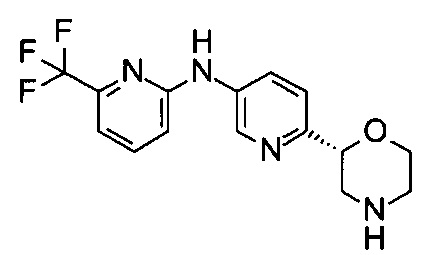
Указанное в заголовке соединение получали аналогично примеру 1 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата и 2-амино-6-(трифторметил)пиридина (CAS: 34486-24-3) вместо 4-хлоранилина (CAS: 106-47-8) на стадии (g). Белое твердое вещество. МС (ИСП): 325,2 ([М+Н]+).
Пример 51
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]бензамид
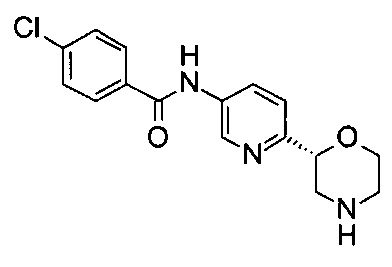
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а). Белое твердое вещество. МС (ИСП): 320,1 ([{37Cl}M+H]+), 318,1 ([{35Cl}M+H]+).
Пример 52
3-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]бензамид
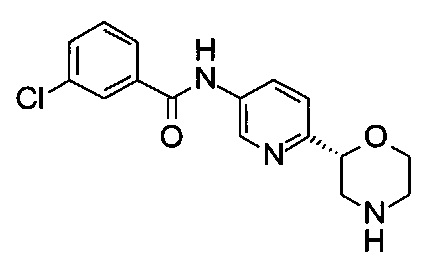
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-хлорбензойной кислоты (CAS: 535-80-8) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 320,1 ([{37Cl}M+H]+), 318,1 ([{35Cl}М+Н]+).
Пример 53
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-4-(трифторметил)бензамид
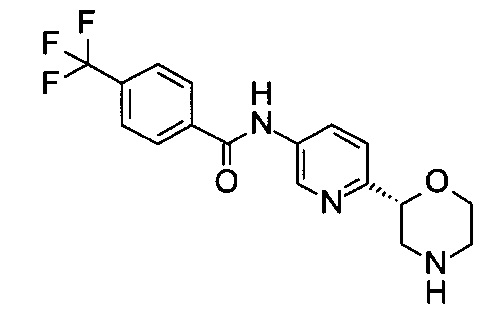
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-(трифторметил)бензойной кислоты (CAS: 455-24-3) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,2 ([М+Н]+).
Пример 54
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-2-(трифторметил)пиридин-4-карбоксамид
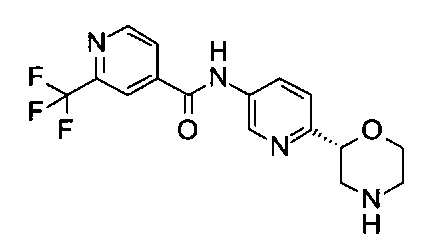
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 2-(трифторметил)пиридин-4-карбоновой кислоты (CAS: 131747-41-6) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 353,1 ([М+Н]+).
Пример 55
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-3-(трифторметил)бензамид
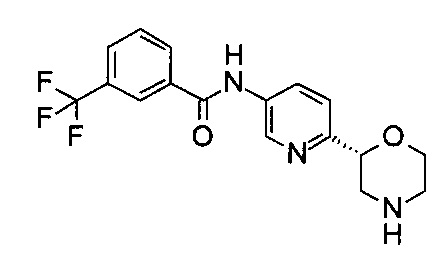
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-(трифторметил)бензойной кислоты (CAS: 454-92-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,1 ([М+Н]+).
Пример 56
N-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-6-(2,2,2-трифторэтокси)пиридин-3-карбоксамид
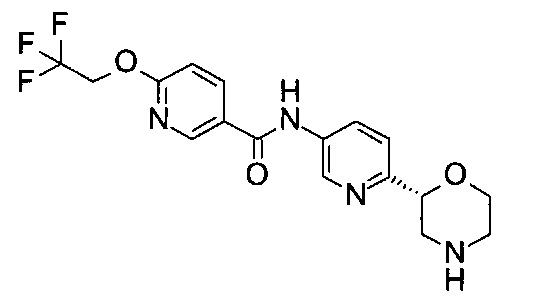
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 6-(2,2,2-трифторэтокси)никотиновой кислоты (CAS: 175204-90-7) вместо 4-хлорбензойной кислоты на стадии (с). Воскообразное твердое вещество. МС (ИСП): 383,2 ([М+Н]+).
Пример 57
2-Этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]пиримидин-5-карбоксамид
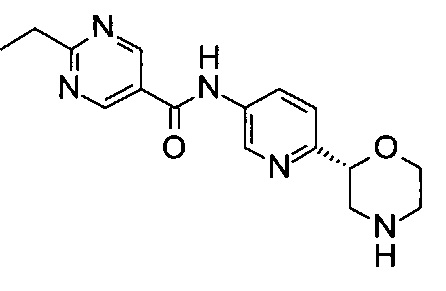
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 2-этилпиримидин-5-карбоновой кислоты (CAS: 72790-16-0) вместо 4-хлорбензойной кислоты на стадии (с). Воскообразное твердое вещество. МС (ИСП): 314,2 ([М+Н]+).
Пример 58
3-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
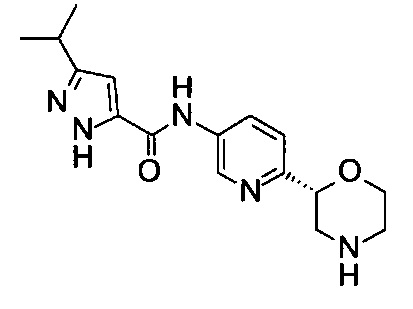
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-изопропилпиразол-5-карбоновой кислоты (CAS: 92933-47-6) вместо 4-хлорбензойной кислоты на стадии (с). Воскообразное твердое вещество. МС (ИСП): 316,2 ([М+Н]+).
Пример 59
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
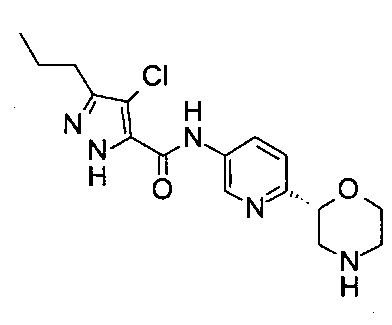
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 352,2 ([{37Cl}M+H]+), 350,2 ([{35Cl}M+H]+).
Пример 60
4-Хлор-3-циклопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
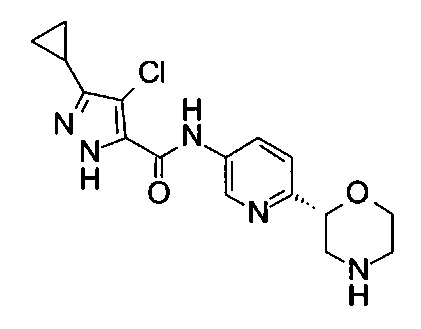
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-3-циклопропил-1Н-пиразол-5-карбоновой кислоты (CAS: 1291275-83-6) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 350,2 ([{37Cl}М+Н]+), 348,2 ([{35Cl}M+H]+).
Пример 61
1-(3-Хлорфенил)-3-[6-[(2R)-морфолин-2-ил]-3-пиридил]мочевина
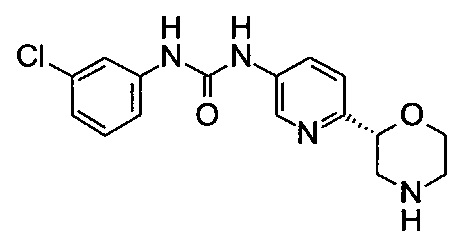
Указанное в заголовке соединение получали аналогично примеру 8 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а). Белое твердое вещество. МС (ИСП): 335,1 ([{37Cl}M+H]+), 333,2 ([{35Cl}M+H]+).
Пример 62
1-[6-[(2R)-Морфолин-2-ил]-3-пиридил]-3-[3-(трифторметил)фенил]мочевина
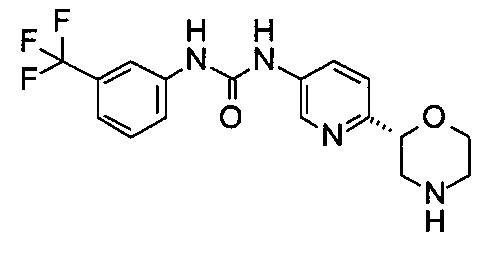
Указанное в заголовке соединение получали аналогично примеру 8 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата и 3-(трифторметил)фенилизоцианата (CAS: 329-01-1) вместо 3-хлорфенилизоцианата на стадии (а). Белое твердое вещество. МС (ИСП): 367,1 ([М+Н]+).
Пример 63
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-(трифторметил)-1Н-пиразол-5-карбоксамид
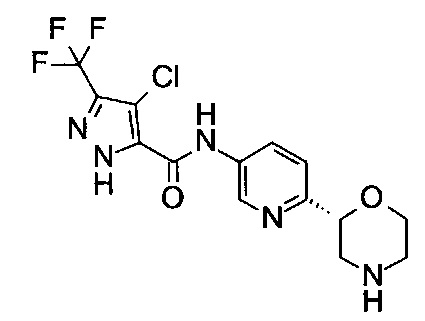
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-5-(трифторметил)-2Н-пиразол-3-карбоновой кислоты (CAS: 934758-95-9) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 378,1 ([{37Cl}M+H]+), 376,1 ([{35Cl}M+H]+).
Пример 64
4-Хлор-3-метил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
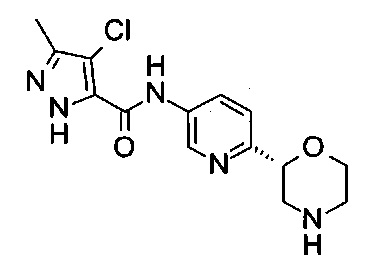
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-хлор-3-метил-1Н-пиразол-5-карбоновой кислоты (CAS: 29400-84-8) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 324,1 ([{37Cl}М+Н]+), 322,1 ([{35Cl}М+Н]+).
Пример 65
4-Метил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
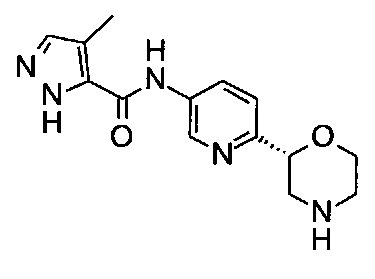
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 4-метил-1Н-пиразол-3-карбоновой кислоты (CAS: 82231-51-4) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 288,2 ([М+Н]+).
Пример 66
(R)-3-Этил-4-метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-1Н-пиразол-5-карбоксамид
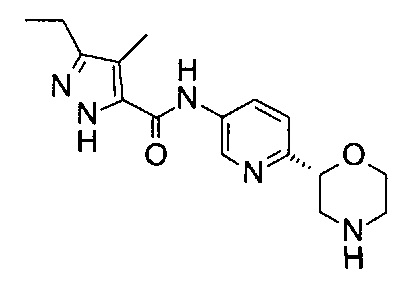
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты (CAS: 957129-38-3) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 316,2 ([М+Н]+).
Пример 67
(S)-3-Этил-4-метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-1Н-пиразол-5-карбоксамид
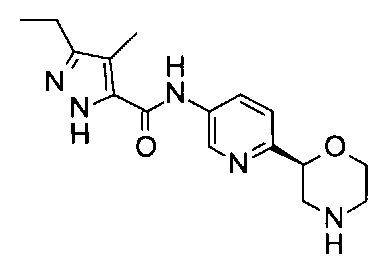
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты (CAS: 957129-38-3) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 316,2 ([М+Н]+).
Пример 68
(R)-6-Метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-2-(трифторметил)пиримидин-4-карбоксамид
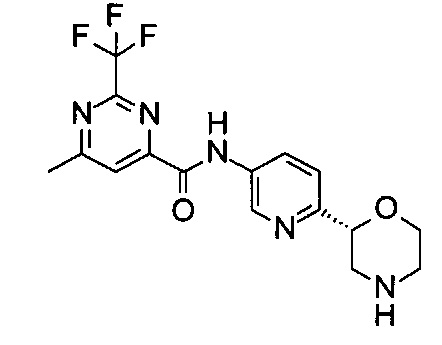
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2R)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 6-метил-2-(трифторметил)пиримидин-4-карбоновой кислоты (CAS: 945717-59-9) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 368,1 ([М+Н]+).
Пример 69
(S)-6-Метил-N-(6-(морфолин-2-ил)пиридин-3-ил)-2-(трифторметил)пиримидин-4-карбоксамид
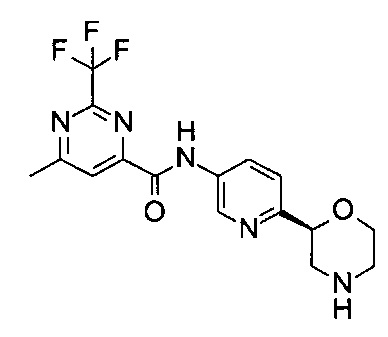
Указанное в заголовке соединение получали аналогично примеру 7 с использованием трет-бутил-(2S)-2-(5-бром-2-пиридил)морфолин-4-карбоксилата вместо (RS)-трет-бутил-2-(5-бром-2-пиридил)морфолин-4-карбоксилата на стадии (а) и 6-метил-2-(трифторметил)пиримидин-4-карбоновой кислоты (CAS: 945717-59-9) вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 368,1 ([М+Н]+).
Пример 70
(RS)-N-(4-Хлорфенил)-2-морфолин-2-ил-пиримидин-5-амин
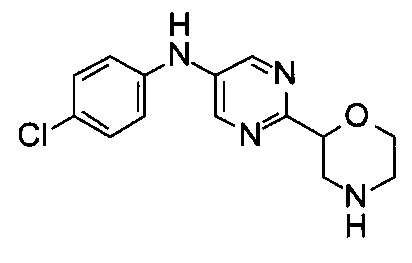
а) 5-Бромпиримидин-2-карбонилхлорид
К раствору 5-бромпиримидин-2-карбоновой кислоты (10,0 г, CAS: 37131-87-6) в CH2Cl2 (100 мл) добавляли оксалилхлорид (6,4 г) при комнатной температуре. Добавляли ДМФА (0,5 мл). Реакцию продолжали при комнатной температуре в течение 5 часов. Смесь фильтровали. Фильтрат концентрировали при пониженном давлении и сушили дополнительно в высоком вакууме с получением сырого 5-бромпиримидин-2-карбонилхлорида (10,9 г, выход: 100%) в виде серого твердого вещества, которое использовали на следующей стадии без очистки.
b) 2-Бром-1-(5-бромпиримидин-2-ил)этанон
К раствору 5-бромпиримидин-2-карбонилхлорида со стадии (а) (10,9 г, 49,5 ммоль) в CH3CN (200 мл) добавляли TMCCHN2 в гексане (2 М, 74,3 мл) по каплям при 0°C в атмосфере азота. Раствор перемешивали при комнатной температуре в течение 16 часов. Затем раствор HBr в АсОН (48%, 20 мл) добавляли при 0°C. Раствор перемешивали при комнатной температуре в течение 3 часов. EtOAc (500 мл) и добавляли воду (100 мл). Органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией (силикагель, петролейный эфир: EtOAc составляет 30/1~10/1 по объему) с получением 2-бром-1-(5-бромпиримидин-2-ил)этанона (13,8 г, выход: 100%) в виде желтого масла.
МС (ИСП): 282,8 ({81Br+81Br}М+Н)+, 280,8 ({79Br+81Br}М+Н)+, 278,8 ({79Br+79Br}М+Н)+.
c) 2-[Бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанон
К раствору 2-бром-1-(5-бромпиримидин-2-ил)этанона со стадии (b) (13,8 г, 49,5 ммоль) в CH3CN (200 мл) добавляли N-бензиламиноэтанол (7,5 г, CAS: 104-63-2) и K2CO3 (13,7 г). Смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор выливали в воду и экстрагировали CH2Cl2 (3×200 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией (силикагель, CH2Cl2:MeOH составляет 200/1~50/1 по объему) с получением 2-[бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанона (3,3 г, выход: 18,7% всего со стадии (а) за три стадии) в виде желтого масла.
МС (ИСП): 349,9 ({79Br}М+Н)+, 351,9 ({81Br}М+Н)+.
d) (RS)-2-[Бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанол
К раствору 2-[бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанона (3,3 г) в МеОН (70 мл) добавляли NaBH4 (394 мг) при 0°C. Раствор перемешивали при комнатной температуре в течение часа, пока анализ ТСХ не показал поглощения исходного материала. Реакционный раствор выливали в воду и экстрагировали CH2Cl2 (2×200 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении с получением сырого (RS)-2-[бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанола (3,5 г, выход: 100%), который использовали на следующей стадии без очистки.
е) (RS)-4-бензил-2-(5-бромпиримидин-2-ил)морфолин
К раствору (RS)-2-[бензил(2-гидроксиэтил)амино]-1-(5-бромпиримидин-2-ил)этанола (3,5 г, 9,93 ммоль, прямо со стадии d) в ТГФ (80 мл) добавляли Et3N (1,5 г) и метансульфонилхлорид (1,14 г) при 0°C.Смесь перемешивали при комнатной температуре в течение 2 часов и затем фильтровали. К фильтрату добавляли раствор трет-пентоксида калия (1,5 г) в ТГФ (20 мл) при 0°C. Смесь перемешивали при комнатной температуре в течение часа. Реакционный раствор выливали в EtOAc (500 мл), промывали солевым раствором (50 мл) и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией (силикагель, CH2Cl2/MeOH составляет 200/1~50/1 по объему) с получением (RS)-4-бензил-2-(5-бромпиримидин-2-ил)морфолина (0,5 г, 16% выход со стадии d за две стадии). МС (ИСП): 333,9 ({79Br}М+Н)+, 335,9 ({81Br}М+Н)+.
f) (RS)-2-(5-Бромпиримидин-2-ил)морфолин
К раствору (RS)-4-бензил-2-(5-бромпиримидин-2-ил)морфолина (0,5 г) в CH2Cl2 (10 мл) добавляли 2-хлорэтилхлороформиат (643 мг, CAS: 627-11-2). Затем раствор перемешивали при температуре образования флегмы в течение 4 часов, пока анализ ТСХ не показал поглощения исходного материала. Летучие вещества удаляли при пониженном давлении. Остаток растворяли в метаноле (10 мл) и перемешивали при температуре образования флегмы в течение часа. Реакционный раствор концентрировали при пониженном давлении. Дополнительная сушка в высоком вакууме привела к получению сырого (RS)-2-(5-бромпиримидин-2-ил)морфолина (365 мг, выход: 100%), который использовали на следующей стадии без очистки.
g) (RS)-трет-Бутил-2-(5-бромпиримидин-2-ил)морфолин-4-карбоксилат
К раствору (RS)-2-(5-бромпиримидин-2-ил)морфолина (365 мг, 1,5 ммоль) со стадии (f) и K2CO3 (414 мг) в смеси ТГФ (10 мл) и воды (5 мл) добавляли ди-трет-бутилдикарбонат (486 мг, CAS: 24424-99-5) при комнатной температуре. Реакцию продолжали в течение ночи. Смесь экстрагировали CH2Cl2 (2×50 мл). Объединенные органические слои промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка флэш-хроматографией (силикагель, CH2Cl2/MeOH составляет 200/1~50/1 по объему) привела к получению (RS)-трет-бутил-2-(5-бромпиримидин-2-ил)морфолин-4-карбоксилата (300 мг, 58% выход) в виде желтого масла.
МС (ИСП): 366,0 ({79Br}M+Na)+, 368,0 ({81Br}M+Na)+, 287,8 ({79Br}M-C4H8+H)+, 289,8 ({81Br}М-C4H8+Н)+.
h) (RS)-N-(4-Хлорфенил)-2-морфолин-2-ил-пиримидин-5-амин
К раствору (RS)-трет-бутил-2-(5-бромпиримидин-2-ил)морфолин-4-карбоксилата (30 мг) и 4-хлоранилина (11 мг, CAS: 106-47-8) в диоксане (1 мл) добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos, 15 мг, CAS: 161265-03-8), Cs2CO3 (85 мг, CAS: 534-17-8) и трис(дибензилидинацетон)дипалладий(0) (8 мг, CAS: 51364-51-3). Реакцию проводили при 90°C в атмосфере азота в течение ночи. Раствор разбавляли CH2Cl2 (10 мл), промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в смеси CH2Cl2 (1 мл) и TFA (1 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. Летучие вещества удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (мобильная фаза А: H2O, В: CH3CN с 0,1% TFA, С18 колонка) с получением (RS)-N-(4-хлорфенил)-2-морфолин-2-ил-пиримидин-5-амина (10 мг, 40% выход за две стадии) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,54 (2Н), 7,33 (2Н), 7,17 (2Н), 4,9 (1Н), 4,1 (1Н), 3,97 (1Н), 3,63 (1Н), 3,51 (1Н), 3,35-3,23 (2Н).
МС (ИСП): 290,9 ({35Cl}M+H)+, 292,9 ({37Cl}M+H)+.
Пример 71
(RS)-2-Морфолин-2-ил-N-[4-(трифторметил)фенил]пиримидин-5-амин
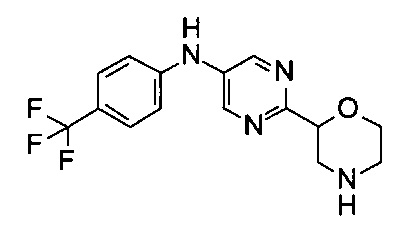
Указанное в заголовке соединение получали аналогично примеру 70 с использованием 4-(трифторметил)анилина (CAS: 455-14-1) вместо 4-хлоранилина на стадии (h). Белое твердое вещество. МС (ИСП): 325,0 ([М+Н]+).
Пример 72
(RS)-4-Хлор-N-(2-морфолин-2-илпиримидин-5-ил)бензамид
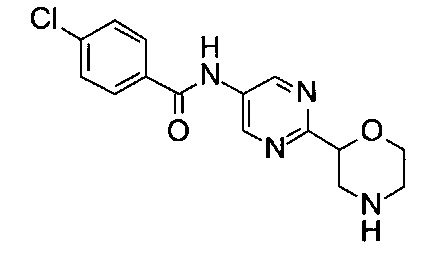
a) (RS)-трет-Бутил-2-[5-(бензгидрилиденамино)пиримидин-2-ил]морфолин-4-карбоксилат
К раствору (RS)-трет-бутил-2-(5-бромпиримидин-2-ил)морфолин-4-карбоксилата (230 мг) и бензофенонимина (127 мг, CAS: 1013-88-3) в диоксане (10 мл) добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos, 116 мг, CAS: 161265-03-8), трис(дибензилидинацетон)дипалладий(0) (61,3 мг, CAS: 51364-51-3) и Cs2CO3 (653 мг, CAS: 534-17-8). Реакцию проводили при 90°C в атмосфере азота в течение ночи. Раствор выливали в воду (100 мл) и экстрагировали CH2Cl2 (2×150 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении с получением сырого (RS)-трет-бутил-2-[5-(бензгидрилиденамино)пиримидин-2-ил]морфолин-4-карбоксилата (297 мг, выход: 100%), который использовали на следующей стадии без очистки.
b) (RS)-трет-Бутил-2-(5-аминопиримидин-2-ил)морфолин-4-карбоксилат
К раствору (RS)-трет-бутил-2-[5-(бензгидрилиденамино)пиримидин-2-ил]морфолин-4-карбоксилата (297 мг, 0,668 ммоль) в МеОН (10 мл) добавляли ацетат натрия (274 мг, CAS: 127-09-3) и гидрохлорид гидроксиламина (69,6 мг, CAS: 5470-11-1). Смесь перемешивали при комнатной температуре в течение 2 часов, пока анализ ТСХ не показал полного расхода исходного материала. Раствор выливали в воду (50 мл), экстрагировали CH2Cl2 (2×100 мл). Объединенные органические слои сушили над Na2SO4, концентрировали при пониженном давлении и очищали флэш-хроматографией (силикагель, CH2Cl2/MeOH составляет 100/1~50/1 по объему) с получением (RS)-трет-бутил-2-(5-аминопиримидин-2-ил)морфолин-4-карбоксилата (100 мг, выход: 55,6%) в виде желтого твердого вещества.
МС (ИСП): 281,2 (М+Н)+.
c) (RS)-4-Хлор-N-(2-морфолин-2-илпиримидин-5-ил)бензамид
К раствору 4-хлорбензойной кислоты (16,7 мг, CAS: 74-11-3) в ДМФА (1 мл) добавляли HATU (40,3 мг, СAS: CAS: 148893-10-1) и DIPEA (37,2 мг, СAS: 7087-68-5). Смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли (RS)-трет-Бутил-2-(5-аминопиримидин-2-ил)морфолин-4-карбоксилат (27 мг). Реакцию продолжали при комнатной температуре в течение ночи. Затем раствор разбавляли CH2Cl2 (10 мл), промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в смеси CH2Cl2 (1 мл) и трифторуксусной кислоты (TFA, 1 мл, CAS: 76-05-1). Раствор перемешивали при комнатной температуре в течение 2 часов. Летучие вещества удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (мобильная фаза A: H2O, В: CH3CN с 0,1% TFA, С18 колонка) с получением (RS)-4-хлор-N-(2-морфолин-2-илпиримидин-5-ил)бензамида (8 мг, 26% выход за две стадии) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 9,24 (2Н), 7,98 (2Н), 7,57 (2Н), 4,97 (1Н), 4,21 (1Н), 4,02 (1Н), 3,73 (1Н), 3,54 (1Н), 3,73-3,30 (2Н).
МС (ИСП): 319,0 ({35Cl}M+H)+, 321,0 ({37Cl}M+H)+.
Пример 73
(RS)-1-(3-Хлорфенил)-3-(2-морфолин-2-илпиримидин-5-ил)мочевина
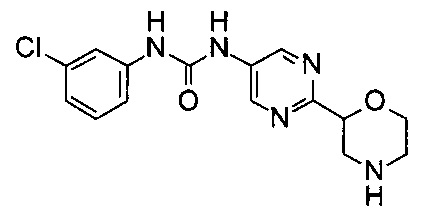
К раствору (RS)-трет-бутил-2-(5-аминопиримидин-2-ил)морфолин-4-карбоксилата (27 мг) в CH2Cl2 (1 мл) добавляли Et3N (19,4 мг, СAS: 121-44-8) и 3-хлорфенилизоцианат (14,7 мг, CAS: 2909-38-8). Реакцию проводили при комнатной температуре в течение ночи. Раствор разбавляли CH2Cl2 (10 мл), промывали водным раствором лимонной кислоты (2×20 мл) и солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в смеси CH2Cl2 (1 мл) и трифторуксусной кислоты (TFA, 1 мл, CAS: 76-05-1). Раствор перемешивали при комнатной температуре в течение 2 часов. Летучие вещества удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (мобильная фаза A: H2O, В: CH3CN с 0,1% TFA, С18 колонка) с получением указанного в заголовке соединения (7 мг, 22% выход за две стадии) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 9,00 (2Н), 7,67 (1Н), 7,32-7,26 (2Н), 7,05 (1Н), 4,95 (1Н), 4,18 (1Н), 4,01 (1Н), 3,67 (1Н), 3,53 (1Н), 3,36-3,30 (2Н).
МС (ИСП): 334,1 ({35Cl}M+H)+, 336,1 ({37Cl}M+H)+.
Пример 74
(RS)-4-Хлор-3-этокси-N-(6-морфолин-2-ил-3-пиридил)-1Н-пиразол-5-карбоксамид
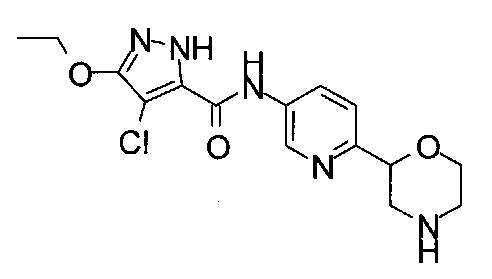
а) Метил-5-гидрокси-1Н-пиразол-3-карбоксилат
К раствору гидразина моногидрата (3,85 г, 0,077 моль, CAS: 7803-57-8) в толуоле (30 мл) добавляли уксусную кислоту (15 мл) и диметилацетилендикарбоксилат (10 г, 0,07 моль, CAS: 762-42-5). Раствор перемешивали при комнатной температуре в течение 3 часов. Затем смесь выливали в ледяную воду. Осадок собирали путем фильтрации и промывали холодной водой. Дополнительная сушка в высоком вакууме привела к получению метил-5-гидрокси-1Н-пиразол-3-карбоксилата (7,5 г, 75% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 12,81 (s, 1Н), 10,04 (br, 1Н), 5,96 (br, 1Н), 3,77 (s, 3Н).
b) Метил-5-этокси-1Н-пиразол-3-карбоксилат
К раствору метил-5-гидрокси-1Н-пиразол-3-карбоксилата (4 г, 28,17 ммоль) в ДМФА (25 мл) добавляли K2CO3 (5,83 г, 42,2 ммоль) и йодоэтан (4,8 г, 31 ммоль). Раствор перемешивали при комнатной температуре в течение 15 ч. Затем смесь выливали в ледяную воду. Смесь экстрагировали этилацетатом (100 мл). Органический слой промывали солевым раствором (30 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Перекристаллизация из дихлорметана (10 мл) привела к получению метил-5-этокси-1Н-пиразол-3-карбоксилата (2,2 г, 46% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,13 (s, 1Н), 6,23 (s, 1Н), 4,11 (d, 2Н), 3,81 (s, 3H), 1,28 (m, 3H).
с) Метил-4-хлор-5-этокси-1Н-пиразол-3-карбоксилат
К раствору метил-5-этокси-1Н-пиразол-3-карбоксилата (2,2 г, 12,94 ммоль) в ДМФА (40 мл) добавляли N-хлорсукцинимид (2,06 г, 15,53 ммоль, CAS: 128-09-6) при 0°C. Затем смесь нагревали до 50°C. Перемешивание продолжали в течение 15 часов. Реакционный раствор концентрировали при пониженном давлении для удаления примерно 50% ДМФА. Затем раствор выливали в ледяную воду. Осадок собирали путем фильтрации и промывали холодной водой. Дополнительная сушка в высоком вакууме привела к получению метил-4-хлор-5-этокси-1Н-пиразол-3-карбоксилата (1,65 г, 63% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,44 (br, 1Н), 4,24 (d, 2Н), 3,85 (s, 3H), 1,32 (t, 3H).
d) 4-Хлор-5-этокси-1Н-пиразол-3-карбоновой кислоты
К раствору метил-4-хлор-5-этокси-1Н-пиразол-3-карбоксилата (1,65 г, 8,06 ммоль) в ТГФ (30 мл) добавляли 1 М водный раствор NaOH (16,1 мл, 16,1 ммоль) при 0°C. Затем раствор кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в воду. pH доводили до ~1 концентрированной HCl. Осадок собирали путем фильтрации и промывали холодной водой. Дополнительная сушка в высоком вакууме привела к получению 4-хлор-5-этокси-1Н-пиразол-3-карбоновой кислоты (1,4 г, 91,5% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,25 (s, 1Н), 4,23 (d, 2Н), 1,32 (t, 3H).
e) (RS)-4-Хлор-3-этокси-N-(6-морфолин-2-ил-3-пиридил)-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 4-хлор-5-этокси-1Н-пиразол-3-карбоновой кислоты вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,91 (d, 1Н), 8,26 (dd, 1Н), 7,62 (d, 1Н), 4,90 (s, 1Н), 4,33 (m, 2Н), 4,25 (m, 1Н), 4,04 (m, 1Н), 3,70 (d, 1Н), 3,36 (d, 1Н), 3,29 (m, 2Н), 1,43 (t, 3H).
МС (ИСП): 352,1 ({35Cl}M+H)+, 354,1 ({37Cl}M+H)+.
Пример 75
(RS)-4-Хлор-N-(6-морфолин-2-ил-3-пиридил)-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
а) Метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилат
К раствору метил-5-гидрокси-1Н-пиразол-3-карбоксилата (10 г, 70,4 ммоль), Cs2CO3 (25 г, 77,5 ммоль) в ДМФА (100 мл) добавляли 57,2,2-трифторэтилтрифторметансульфонат (16,3 г, 70,4 ммоль, CAS: 6226-25-1) порциями. Раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 500 мл ледяной воды осторожно. Осадок собирали путем фильтрации и промывали холодной водой. Дополнительная сушка в высоком вакууме привела к получению метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (12 г, 76% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,41 (s, 1Н), 6,43 (s, 1Н), 4,86 (m, 2Н), 3,84 (s, 3H)
МС (ИСП): 225,1 ([М+Н]+).
b) Метил-4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилат
К раствору метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (1,9 г, 8,47 ммоль) в ДМФА (30 мл) добавляли N-хлорсукцинимид (1,35 г, 10,17 ммоль) при 0°C. Затем раствор перемешивали при 50°C в течение 15 часов. Реакционный раствор концентрировали в вакууме для удаления 50% ДМФА. Затем раствор выливали в воду. Осадок собирали путем фильтрации, промывали водой и сушили в высоком вакууме с получением метил-4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (1,9 г, 87% выход) в виде белого твердого вещества.
c) 4-Хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоновой кислоты
К раствору метил-4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (1,9 г, 7,35 ммоль) в смеси ТГФ (15 мл) и МеОН (15 мл) добавляли 1М водный раствор NaOH (14,7 мл, 14,7 ммоль) при 0°C. Затем раствор перемешивали при температуре образования флегмы в течение 3 часов. Реакционный раствор выливали в воду. pH доводили до примерно 1 раствором концентрированной HCl. Осадок собирали путем фильтрации, промывали водой и сушили в высоком вакууме с получением 4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоновой кислоты (1,5 г, 83% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,91 (br, 1Н), 13,56 (s, 1Н), 4,91 (m, 2Н).
МС (ИСП): 245,0 ({35Cl}M+H)+, 247,0 ({37Cl}M+H)+.
d) (RS)-4-хлор-N-(6-морфолин-2-ил-3-пиридил)-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 7 с использованием 4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоновой кислоты вместо 4-хлорбензойной кислоты на стадии (с). Белое твердое вещество.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,90 (d, 1Н), 8,26 (dd, 1Н), 7,63 (d, 1Н), 4,91 (s, 1Н), 4,81 (m, 2Н), 4,25 (d, 1Н), 4,03 (m, 1Н), 3,70 (d, 1Н), 3,36 (d, 1Н), 3,29 (m, 2Н).
МС (ИСП): 406,1 ({35Cl}M+H)+, 408,1 ({37Cl}M+H)+.
Пример 76
4-Хлор-3-этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-хлор-3-этил-1Н-пиразол-5-карбоновой кислоты (CAS: 158668-22-5) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 336,0 ({35Cl}M+H)+, 338,0 ({37Cl}M+H)+.
Пример 77
3-Этил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
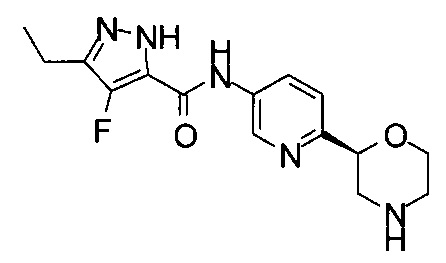
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 5-этил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-63-9) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 320,0 (М+Н)+.
Пример 78
4-Бром-3-этил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
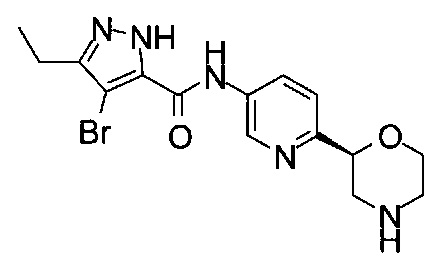
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 59-бром-5-этил-1Н-пиразол-3-карбоновой кислоты (CAS: 1291177-22-4) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 381,9 ([{81Br}М+Н]+), 379,9 ([{79Br}М+Н]+).
Пример 79
4-Фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
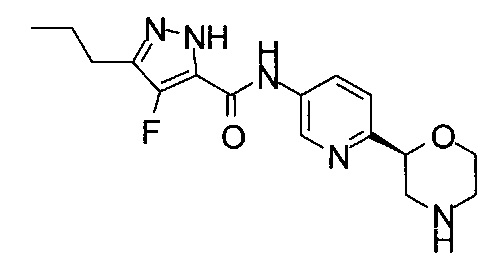
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-фтор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-64-0), вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 334,0 (М+Н)+.
Пример 80
3-Циклопропил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
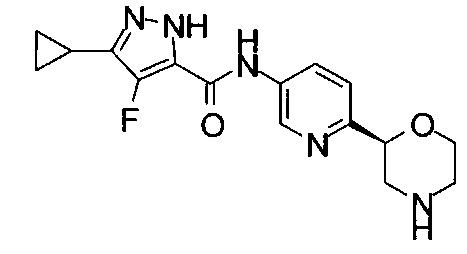
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 5-циклопропил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-74-2) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 332,0 (М+Н)+.
Пример 81
4-Бром-3-циклопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-60-карбоксамид
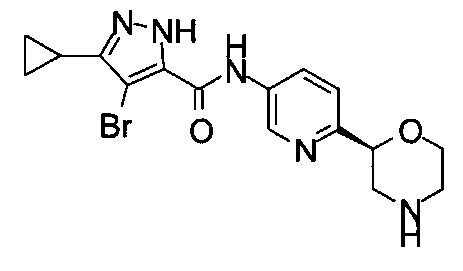
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-бром-5-циклопропил-2Н-пиразол-3-карбоновой кислоты (CAS: 1290764-98-5) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 394,0 ([{81Br}М+Н]+), 392,0 ([{79Br}М+Н]+).
Пример 82
4-Хлор-3-этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
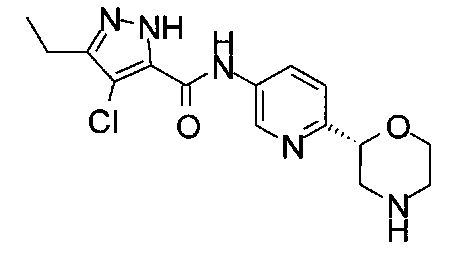
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-хлор-3-этил-1Н-пиразол-5-карбоновой кислоты (CAS: 158668-22-5) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 336,1 ({35Cl}M+H)+, 338,1 ({37Cl}M+H)+.
Пример 83
3-Этил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
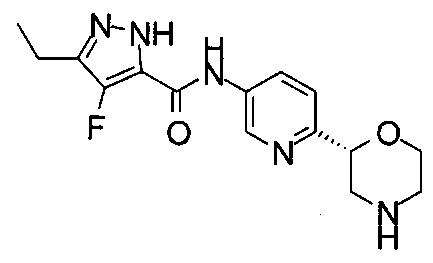
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 5-этил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-63-9) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 320,2 (М+Н)+.
Пример 84
4-Бром-3-этил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
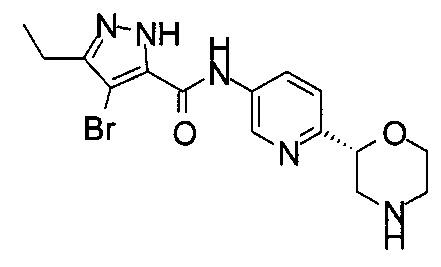
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-бром-5-этил-1Н-пиразол-3-карбоновой кислоты (CAS: 1291177-22-4) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 382,1 ([{81Br}М+Н]+), 380,1 ([{79Br}М+Н]+).
Пример 85
4-Фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-пропил-1Н-пиразол-5-карбоксамид
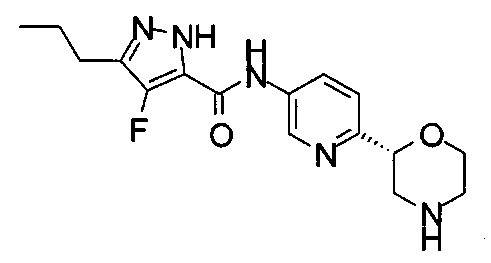
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-фтор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-64-0), вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 334,2 (М+Н)+.
Пример 86
3-Циклопропил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
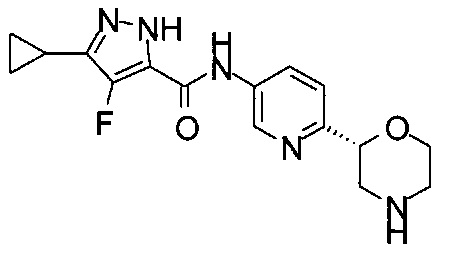
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 62-циклопропил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-74-2) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 332,2 (М+Н)+.
Пример 87
4-Бром-3-циклопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
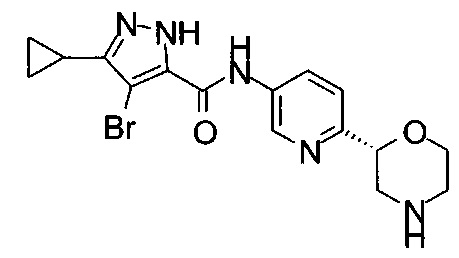
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-бром-5-циклопропил-2Н-пиразол-3-карбоновой кислоты (CAS: 1290764-98-5) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 394,0 ([{81Br}М+Н]+), 392,0 ([{79Br}М+Н]+).
Пример 88
3-Изобутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
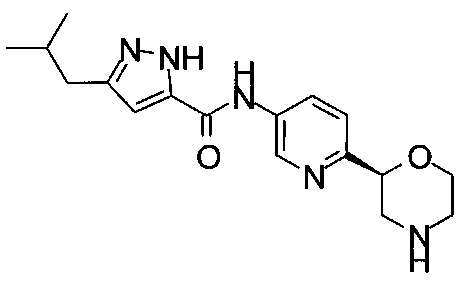
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 3-изобутил-1Н-пиразол-5-карбоновой кислоты (CAS: 92933-49-8) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 330,2 (М+Н)+.
Пример 89
4-Фтор-3-изобутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
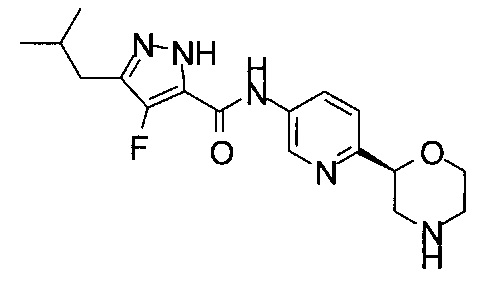
а) Этил-6-метил-2,4-диоксогептаноат
К раствору этоксида натрия (7 г, 0,1 моль) в безводном этаноле (150 мл) добавляли диэтилоксалат (15 г, 0,1 моль, CAS: 95-92-1) при 0°C. После этого добавляли 4-метил-2-пентанон (10 г, 0,1 моль, CAS: 108-10-1) порциями. Смесь перемешивали при 50°C в течение 20 часов. Раствор охлаждали до комнатной температуры и использовали прямо на следующей стадии.
b) Этил-5-изобутил-1Н-пиразол-3-карбоксилат
К раствору этил-6-метил-2,4-диоксогептаноата (0,1 моль) в этаноле (150 мл) со стадии (а) добавляли уксусную кислоту (9 г, 0,15 моль) и моногидрат гидразина (8,1 г, 0,15 моль, CAS: 7803-57-8). Реакционную смесь перемешивали в течение 12 часов. Затем реакционный раствор концентрировали при пониженном давлении, разбавляли водой и экстрагировали дважды с этилацетатом (2×300 мл). Объединенные органические слои промывали солевым раствором (50 мл), сушили над Na2SO4, фильтровали через тонкий слой силикагеля и концентрировали при пониженном давлении. Сырой продукт очищали хроматографией на силикагеле с получением этил-5-изобутил-1Н-пиразол-3-карбоксилата в виде белого твердого вещества (13 г, 68% выход).
МС (ИСП): 197,2 (М+Н)+.
с) Этил-4-фтор-5-изобутил-1Н-пиразол-3-карбоксилат
К раствору этил-5-изобутил-1Н-пиразол-3-карбоксилата (5,0 г, 25,5 ммоль) в CH3CN (300 мл) добавляли Selectfluor® (18,0 г, 51,0 ммоль, CAS: 140681-55-6) при 0°C. Затем раствор нагревали до 70°C. Перемешивание продолжали в течение 15 часов. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разбавляли водным раствором HCl (3N, 200 мл) и экстрагировали дихлорметаном (100 мл × 2). Объединенные органические слои промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка колоночной хроматографией на силикагеле (дихлорметан/МеОН составляет 200/1~100/1 по объему) привела к получению этил-4-фтор-5-изобутил-1Н-пиразол-3-карбоксилата (1,4 г, 26% выход) в виде желтого масла.
1Н ЯМР (400 МГц, ДМСО-d6): δ 4,42 (q, 2Н), 2,55 (d, 2Н), 2,00 (m, 1Н), 1,40 (t, 3H), 0,96 (d, 6Н).
МС (ИСП): 215,1 (М+Н)+.
d) 4-Фтор-5-изобутил-1Н-пиразол-3-карбоновой кислоты
К раствору 4-фтор-5-изобутил-1Н-пиразол-3-карбоновой кислоты (1,4 г, 6,54 ммоль) в ТГФ/МеОН (V/V составляет 1:1, 20 мл) добавляли 1 М водн. NaOH (13,1 мл, 13,1 ммоль) при 0°C. Затем раствор кипятили с обратным холодильником в течение 3 часов. Реакционный раствор выливали в воду. pH доводили до примерно 1 концентрированной HCl. Смесь экстрагировали этилацетатом (100 мл×2). Объединенные органические слои промывали солевым раствором (20 мл), концентрировали при пониженном давлении и перекристаллизовывали из этилацетата (30 мл) с получением 4-фтор-5-изобутил-1Н-пиразол-3-карбоновой кислоты (1,2 г, 99% выход) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 2,44 (d, 2Н), 1,90 (m, 1Н), 0,87 (d, 6Н).
МС (ИСП): 187,1 (М+Н)+.
e) 4-Фтор-3-изобутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил1-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-фтор-5-изобутил-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 348,2 (М+Н)+.
Пример 90
3-Бутил-4-фтор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
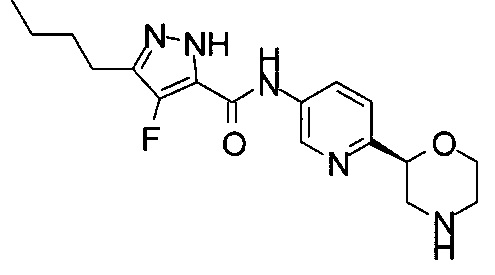
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 5-бутил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-65-1) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 348,2 (М+Н)+.
Пример 91
3-Бутил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
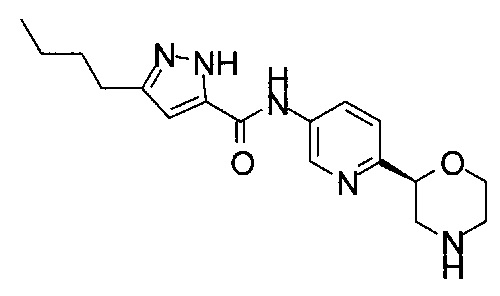
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 5-бутил-1Н-пиразол-3-карбоновой кислоты (CAS: 92933-48-7) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 330,2 (М+Н)+.
Пример 92
5-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-2-(2,2,2-трифторэтил)пиразол-3-карбоксамид
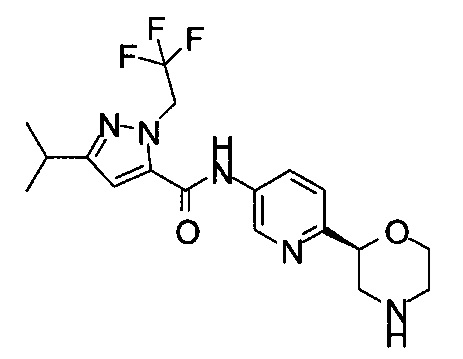
а) Этил-5-изопропил-1Н-пиразол-3-карбоксилат
К раствору этил-4-метил-3-оксопентаноата (4 г, 21,6 ммоль, CAS: 7152-15-0) в этаноле (100 мл) добавляли уксусную кислоту (1,9 г, 32,4 ммоль) и моногидрат гидразина (1,7 г, 0,032 моль, CAS: 7803-57-8). Реакционную смесь перемешивали в течение 12 часов, пока анализ ЖХМС не показал завершения реакции. Реакционный раствор концентрировали при пониженном давлении и разбавляли водой. Смесь экстрагировали дважды дихлорметаном (2×100 мл). Объединенные органические слои промывали солевым раствором (40 мл), сушили над Na2SO4, фильтровали через тонкий слой силикагеля и концентрировали в вакууме с получением этил-5-изопропил-1Н-пиразол-3-карбоксилата (2,1 г, 54% выход) в виде желтого масла.
МС (ИСП): 183,2 (М+Н)+.
b) Этил-5-изопропил-2-(2.2,2-трифторэтил)пиразол-3-карбоксилат
К раствору этил-5-изопропил-1Н-пиразол-3-карбоксилата (1 г, 5,5 ммоль) в ДМФА (10 мл), добавляли 2,2,2-трифторэтилйодид (1,7 г, 8,3 ммоль, CAS: 353-83-3) и Cs2CO3 (2,1 г, 11 ммоль). Реакционную смесь перемешивали при 50°C в течение 12 часов. Затем реакционный раствор концентрировали при пониженном давлении и разбавляли водой. Смесь экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали солевым раствором (50 мл), сушили над Na2SO4, фильтровали через тонкий слой силикагеля и концентрировали в вакууме. Сырой продукт очищали хроматографией на силикагеле с получением этил-5-изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоксилата (500 мг, 36% выход) в виде белого твердого вещества.
МС (ИСП): 265,2 (М+Н)+.
c) 5-Изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоновой кислоты
К раствору этил-5-изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоксилата (2 г, 7,6 ммоль) в МеОН/H2O (V/V составляет 3:1, 12 мл) добавляли NaOH (1,2 г, 30,3 ммоль). Реакционную смесь перемешивали при 30°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и разбавляли водой. Смесь подкисляли до примерно pH равен 2 с помощью 2Н HCl (30 мл). Смесь экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали через тонкий слой силикагеля и концентрировали при пониженном давлении. Дополнительная сушка в высоком вакууме привела к получению 5-изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоновой кислоты (1,6 г, 89% выход) в виде белого твердого вещества.
1Н ЯМР (CDCl3, 400 МГц): δ 6,91 (s, 1Н), 5,25 (q, 2Н), 3,04 (m, 1Н), 1,29 (d, 6Н).
МС (ИСП): 237,2 (М+Н)+.
d) 5-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-2-(2,2,2-трифторэтил)пиразол-3-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 5-изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 398,2 (М+Н)+.
Пример 93
2-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-(2,2,2-трифторэтокси)пиразол-3-карбоксамид
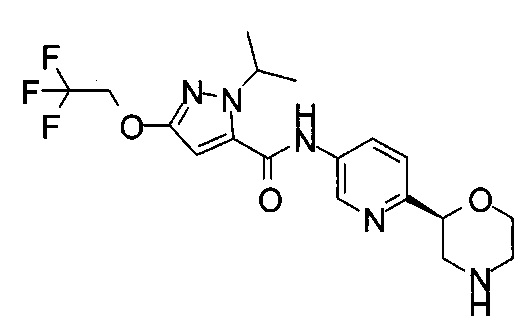
а) Метил-5-гидрокси-1Н-пиразол-3-карбоксилат
К раствору моногидрата гидразина (44,8 г, 0,894 моль, CAS: 7803-57-8) в толуоле (300 мл) добавляли уксусную кислоту (180 мл) и диметиловый эфир ацетилендикарбоновой кислоты (100 мл, 0,813 моль, CAS: 762-42-5). Раствор перемешивали при комнатной температуре в течение 3 часов. Смесь выливали в ледяную воду. Осадок собирали путем фильтрации, промывали холодной водой и сушили в высоком вакууме с получением метил-5-гидрокси-1Н-пиразол-3-карбоксилата (67,5 г, 59% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 12,81 (bra, 1Н), 10,03 (br, 1Н), 5,91 (s, 1Н), 3,78 (s, 3H).
b) Метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилат
К раствору метил-5-гидрокси-1Н-пиразол-3-карбоксилата (10 г, 70,4 ммоль), Cs2CO3 (25 г, 77,5 ммоль) в ДМФА (100 мл) добавляли 2,2,2-трифторэтилтрифторметансульфонат (16,3 г, 70,4 ммоль) порциями. Раствор перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь выливали в 500 мл ледяной воды. Осадок собирали путем фильтрации, промывали холодной водой и сушили в высоком вакууме с получением метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (12 г, 76% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 13,41 (s, 1Н), 6,43 (s, 1Н), 4,86 (m, 2Н), 3,84 (s, 3H)
МС (ИСП): 225,1 (М+Н)+.
с) Метил-2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоксилат
К раствору метил-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоксилата (12,0 г, 53,4 ммоль) и Cs2CO3 (52,0 г, 161 ммоль) в ДМФА (100,0 мл) добавляли 2-бромпропан (7,2 г, 56,0 ммоль) порциями. Раствор перемешивали при комнатной температуре в течение ночи. Затем реакционный раствор концентрировали в вакууме для удаления по меньшей мере 50% ДМФА. Оставшуюся смесь выливали в воду. Осадок собирали путем фильтрации, промывали холодной водой, сушили в высоком вакууме с получением метил-2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоксилата (10,3 г, 74% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 6,45 (s, 1Н), 5,35 (m, 1Н), 4,82 (q, 2Н), 3,83 (s, 3H), 1,371 (d, 6Н).
МС (ИСП): 267,0 (М+Н)+.
d) 2-Изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоновой кислоты
Раствор метил-2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоксилата (4,3 г, 16,2 ммоль) и NaOH (1,9 г, 48,5 ммоль) в МеОН/H2O (V/V составляет 3:1, 50,0 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь подкисляли до pH равен 4-5 путем добавления концентрированной HCl (about 5 мл) при 0°C. Раствор выливали в 500 мл ледяной воды. Осадок собирали путем фильтрации, промывали холодной водой и сушили в высоком вакууме с получением 2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоновой кислоты (3,86 г, 95% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 6,37 (s, 1Н), 5,38 (m, 1Н), 4,79 (q, 2Н), 1,34 (d, 6Н).
МС (ИСП): 252,9 (М+Н)+.
e) 2-Изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-5-(2,2,2-трифторэтокси)пиразол-3-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 414,2 (М+Н)+.
Пример 94
3-Изобутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
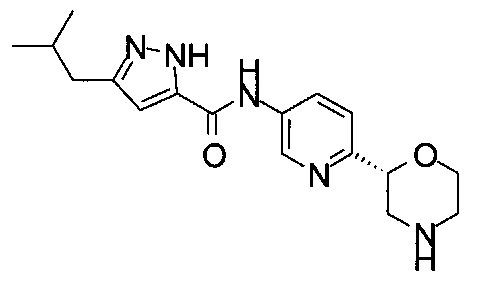
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 3-изобутил-1Н-пиразол-5-карбоновой кислоты (CAS: 92933-49-8) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество. МС (ИСП): 330,2 (М+Н)+.
Пример 95
4-Фтор-3-изобутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
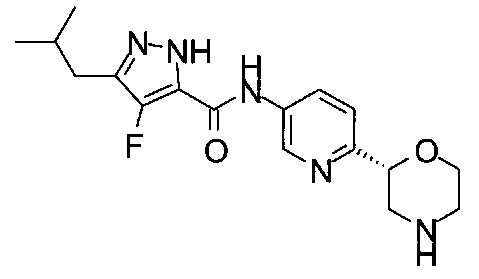
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-фтор-5-изобутил-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 348,2 (М+Н)+.
Пример 96
3-Бутил-4-фтор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
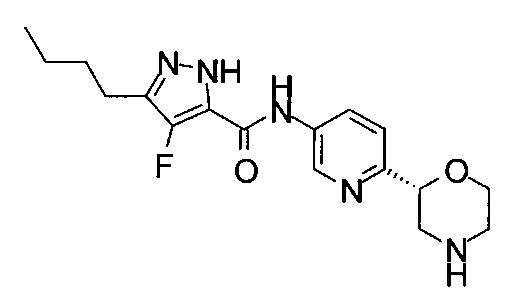
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 5-бутил-4-фтор-1Н-пиразол-3-карбоновой кислоты (CAS: 681034-65-1) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Воскообразное твердое вещество.
МС (ИСП): 348,2 (М+Н)+.
Пример 97
3-Бутил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
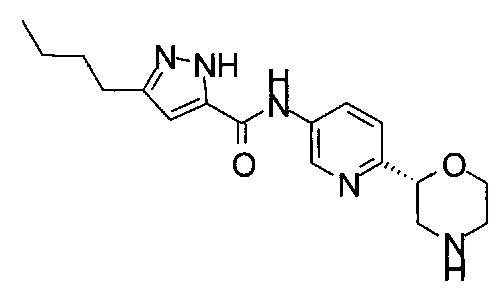
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 5-бутил-1Н-пиразол-3-карбоновой кислоты (CAS: 92933-48-7) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 330,2 (М+Н)+.
Пример 98
5-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-2-(2,2,2-трифторэтил)пиразол-3-карбоксамид
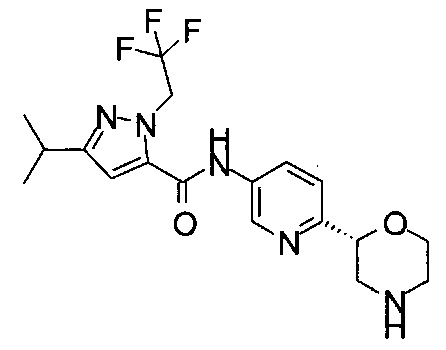
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 5-изопропил-2-(2,2,2-трифторэтил)пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 398,1 (М+Н)+.
Пример 99
2-Изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-5-(2,2,2-трифторэтокси)пиразол-3-карбоксамид
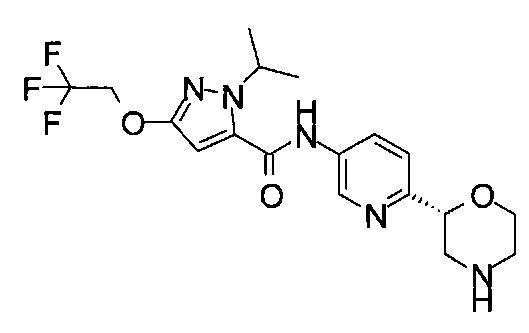
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 2-изопропил-5-(2,2,2-трифторэтокси)пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 414,2 (М+Н)+.
Пример 100
4-Хлор-3-этокси-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
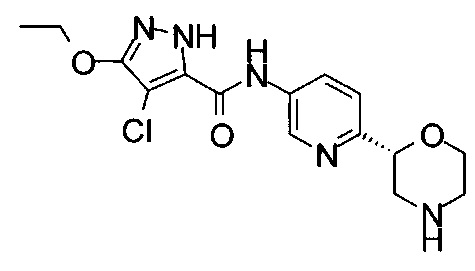
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-хлор-5-этокси-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 352,1 ({35Cl}M+H)+, 354,1 ({37Cl}M+H)+.
Пример 101
4-Хлор-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
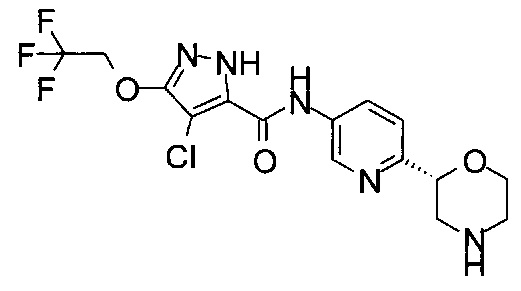
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 406,1 ({35Cl}M+H)+, 408,0 ({37Cl}M+H)+.
Пример 102
(RS)-5-Хлор-N-(5-хлор-2-пиридил)-6-морфолин-2-илпиридин-3-амин
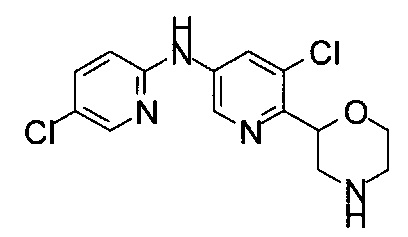
а) 5-Бром-3-хлорпиридин-2-карбонилхлорид
К суспензии 5-бром-3-хлорпиридин-2-карбоновой кислоты (5,0 г, 21,06 ммоль, CAS: 1189513-51-6) в дихлорметане (50 мл) добавляли оксалилхлорид (3,38 г, 31,6 ммоль, CAS: 79-37-8) и ДМФА (0,1 мл) при комнатной температуре. Реакцию продолжали в течение 5 часов. Раствор концентрировали при пониженном давлении и сушили в высоком вакууме с получением сырого 5-бром-3-хлорпиридин-2-карбонилхлорида (5,4 г, 100% выход) в виде желтого твердого вещества, который использовали прямо на следующей стадии.
b) 2-Бром-1-(5-бром-3-хлор-2-пиридил)этанон
К раствору сырого 5-бром-3-хлорпиридин-2-карбонилхлорида (5,4 г, 21,06 ммоль) в CH3CN (100 мл) добавляли раствор (триметилсилил)диазометана (2 M в гексане, 31,6 мл, 63,2 ммоль, CAS: 18107-18-1) по каплям при 0~5°C. Смесь перемешивали при комнатной температуре в течение ночи. HBr (48% в воде, 10 мл) добавляли при 0~5°C. Раствор перемешивали в течение часа. Реакционный раствор выливали в воду (200 мл). Смесь экстрагировали EtOAc (200 мл). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (Петролейный эфир/этилацетат составляет 100/1 по объему) с получением 5-бром-3-хлорпиридин-2-карбонилхлорида (5,17 г, 78,3% выход) в виде желтого твердого вещества.
МС (ИСП): 315,8 ([{81Br+81Br}М+Н]+), 313,8 ([{81Br+79Br}М+Н]+), 311,8 ([{79Br+79Br}М+Н]+).
c) 5-Бром-3-хлор-2-(оксиран-2-ил)пиридин
К раствору 5-бром-3-хлорпиридин-2-карбонилхлорида (5,17 г, 16,5 ммоль) в этаноле (100 мл) добавляли NaBH4 (752,4 мг, 19,8 ммоль) при 0-5°C.Раствор перемешивали при комнатной температуре в течение часа. Добавляли K2CO3 (2,3 г, 16,5 ммоль). Реакцию продолжали в течение ночи. Реакционную смесь выливали в воду (200 мл) и экстрагировали этилацетатом (200 мл). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Дополнительная сушка в высоком вакууме привела к получению 5-бром-3-хлор-2-(оксиран-2-ил)пиридина (3,86 г, 100% выход) в виде желтого масла, который использовали прямо на следующей стадии.
МС (ИСП): 235,9 ([{81Br}М+Н]+), 233,9 ([{79Br}М+Н]+).
d) 1-(Бром-3-хлор-2-пиридил)-2-(2-гидроксиэтиламино)этанол
К раствору 5-бром-3-хлор-2-(оксиран-2-ил)пиридина (3,86 г, 16,5 ммоль) в ТГФ (20 мл) добавляли этаноламин (10 мл, CAS: 141-43-5). Раствор перемешивали при комнатной температуре в течение ночи. Затем раствор разбавляли с этилацетатом (200 мл). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Дополнительная сушка в высоком вакууме привела к получению сырого 1-(5-бром-3-хлор-2-пиридил)-2-(2-гидроксиэтиламино)этанола (3,0 г, 61,6% выход) в виде желтого масла, которое использовали прямо на следующей стадии.
e) трет-Бутил-N-[2-(5-бром-3-хлор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамат
К раствору 1-(5-бром-3-хлор-2-пиридил)-2-(2-гидроксиэтиламино)этанола (3,0 г, 16,5 ммоль) в смеси ТГФ (30 мл) и воды (20 мл) добавляли ди-трет-бутилдикарбонат (3,29 г, 15,22 ммоль, СAS: 24424-99-5) и K2CO3 (2,8 г, 20,3 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли водой (50 мл). Смесь экстрагировали этилацетатом (200 мл). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (CH2Cl2/MeOH составляет 100/1~50/1 по объему) с получением трет-бутил-N-[2-(5-бром-3-хлор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (1,5 г, 37,5% выход) в виде желтого масла.
МС (ИСП): 295,0 ([{79Br}М-Вос+Н]+), 296,9 ([{81Br}М-Вос+Н]+), 338,9 ([{79Br}М-56+Н]+), 340,9([{81Br}М-56+Н]+),
f) трет-Бутил-2-(5-бром-3-хлор-2-пиридил)морфолин-4-карбоксилат
К раствору трет-бутил-N-[2-(5-бром-3-хлор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (1,5 г, 3,79 ммоль) в толуоле (20 мл) добавляли PPh3 (1,19 г, 4,55 ммоль) и Et3N (957 мг, 9,47 ммоль) при комнатной температуре. Затем добавляли раствор диизопропилазодикарбоксилата (0,92 г, 4,55 ммоль, CAS: 2446-83-5) в толуоле (10 мл) при 0~5°C. Раствор перемешивали при комнатной температуре в течение ночи. Затем реакционный раствор разбавляли с этилацетатом (200 мл). Смесь промывали водным раствором NaHCO3 (100 мл × 3) и солевым раствором (100 мл × 2), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (Петролейный эфир/этилацетат составляет 20/1~5/1 по объему) с получением трет-бутил-2-(5-бром-3-хлор-2-пиридил)морфолин-4-карбоксилата (1,0 г, 70% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,62 (d, J=2 Гц, 1Н), 7,89 (d, J=2 Гц, 1Н), 4,89 (d, J=10 Гц,1Н), 4,30-3,8 (m, 3H), 3,76 (m, 1Н), 3,13 (br, 2Н), 1,49 (s, 9Н).
q) (RS)-5-Хлор-N-(5-хлор-2-пиридил)-6-морфолин-2-илпиридин-3-амин
К раствору трет-бутил-2-(5-бром-3-хлор-2-пиридил)морфолин-4-карбоксилата (80 мг, 0,211 ммоль) и 2-амино-5-хлорпиридина (27 мг, 0,211 ммоль, CAS: 1072-98-6) в диоксане (1 мл) добавляли Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 36,7 мг, 0,063 ммоль, СAS: 161265-03-8), Cs2CO3 (206,2 мг, 0,633 ммоль) и трис(дибензилиденацетон)дипалладий(0) (19,3 мг, 0,021 ммоль, CAS: 51364-51-3) в атмосфере азота. Смесь перемешивали при 80°C в течение ночи. Затем раствор выливали в воду (100 мл). Смесь экстрагировали CH2Cl2 (150 мл × 2). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в CH2Cl2 (1 мл). Затем добавляли трифторуксусную кислоту (1 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-5-хлор-N-(5-хлор-2-пиридил)-6-морфолин-2-илпиридин-3-амина (50 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,62 (dd, 2Н), 8,21 (s, 1Н), 7,64 (dd, 1Н), 6,87 (d, 1Н), 5,23 (dd, 1Н), 4,11 (m, 1Н), 3,98 (m, 1Н), 3,67 (m, 1Н), 3,49 (m, 1Н), 3,35-3,30 (m, 2Н). МС (ИСП): 325,1 ({35Cl}M+H)+, 327,0 ({37Cl}M+H)+.
Пример 103
(RS)-5-Хлор-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
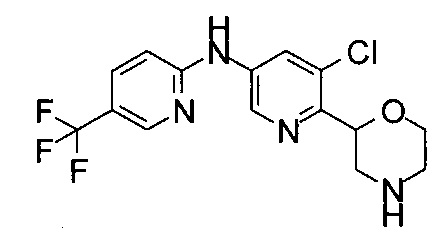
Указанное в заголовке соединение получали аналогично примеру 102 с использованием 2-амино-5-трифторметилпиридина (CAS: 74784-70-6) вместо 2-амино-5-хлорпиридина на стадии (g). Белое твердое вещество. МС (ИСП): 361,0 ([{37Сl}М+Н]+), 359,1 ([{35Сl}М+Н]+).
Пример 104
(RS)-5-Метил-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
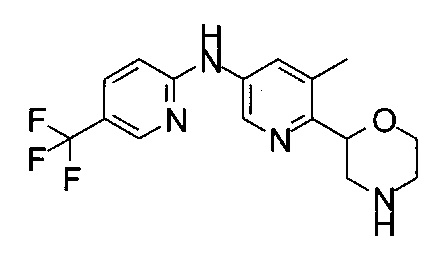
а) 2-Бром-1-(5-бром-3-метил-2-пиридил)этанон
Раствор 5-бром-3-метилпиридин-2-карбонилхлорида (4 г, 17 ммоль, CAS: 1114809-24-3) в CH3CN (60 мл) перемешивали при 0°C. Добавляли (триметилсилил)диазометан (2 М в гексане, 21 мл, 42 ммоль, CAS: 18107-18-1). Смесь перемешивали при комнатной температуре в течение ночи, пока анализ ТСХ не показал полный расход исходного материала. Добавляли HBr (12 мл, 48% водный раствор). Полученный раствор перемешивали при комнатной температуре в течение ночи. Смесь обрабатывали насыщенным водным NaHCO3 для доведения pH до примерно 7. Слои разделяли. Водный слой экстрагировали этилацетатом (200 мл × 2). Объединенные органические слои промывали солевым раствором (200 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток (4,5 г) использовали на следующей стадии без очистки.
b) 5-Бром-3-метил-2-(оксиран-2-ил)пиридин
Раствор 2-бром-1-(5-бром-3-метил-2-пиридил)этанона (4 г, 13,7 ммоль) в EtOH (80 мл) перемешивали при 0°C. Добавляли NaBH4 (623 мг, 16,4 ммоль). Смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли K2CO3 (945 мг, 6,9 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Смесь разбавляли водой (300 мл). Слои разделяли. Водный слой экстрагировали EtOAc (300 мл × 2). Объединенные органические слои промывали солевым раствором (300 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток использовали на следующей стадии без очистки.
с) 1-(5-Бром-3-метил-2-пиридил)-2-(2-гидроксиэтиламино)этанол
к перемешиваемому раствору 5-бром-3-метил-2-(оксиран-2-ил)пиридина (3,5 г, 16,4 ммоль) в ТГФ (15 мл) добавляли 2-аминоэтанол (15 мл, CAS: 41-43-5). Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем выливали в ТГФ/EtOAc (1:1, 200 мл) и промывали солевым раствором (100 мл). Органический слой сушили над Na2SO4 и концентрировали с получением сырого 1-(5-бром-3-метил-2-пиридил)-2-(2-гидроксиэтиламино)этанола (2,6 г, 58% выход) в виде масла, которое использовали на следующей стадии без очистки.
МС (ИСП): 277,0 ([{81Br}М+Н]+), 275,0 ([{79Br}М+Н]+).
d) трет-Бутил-N-[2-(5-бром-3-метил-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамат
Смесь 1-(5-бром-3-метил-2-пиридил)-2-(2-гидроксиэтиламино)этанола (2,6 г, 9,5 ммоль, сырого), K2CO3 (3,0 г, 22 ммоль) и (Вос)2O (1,9 г, 7,3 ммоль, CAS: 24424-99-5) в ТГФ (30 мл) перемешивали при комнатной температуре в течение 12 часов. Смесь затем разбавляли водой (200 мл) и экстрагировали этилацетатом (200 мл × 2). Объединенные органические слои промывали водой (100 мл) и солевым раствором (100 мл) и концентрировали при пониженном давлении. Очистка хроматографией на силикагеле привела к получению трет-бутил-N-[2-(5-бром-3-метил-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (1,31 г, 37% выход) в виде светло-желтого масла.
e) трет-Бутил-2-(5-бром-3-метил-2-пиридил)морфолин-4-карбоксилат
Смесь трет-бутил-N-[2-(5-бром-3-метил-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (1,3 g, 3,5 ммоль), PPh3 (1,02 г, 4,2 ммоль) и Et3N (900 мг, 9 ммоль) перемешивали при 0°C в течение 10 минут. Диизопропилазодикарбоксилат (848 мг, 4,2 ммоль, CAS: 2446-83-5) добавляли по каплям. Реакцию продолжали в течение ночи. Смесь концентрировали при пониженном давлении. Очистка флэш-хроматографией на силикагеле привела к получению трет-бутил-2-(5-бром-3-метил-2-пиридил)морфолин-4-карбоксилата (600 мг, 48% выход) в виде не совсем белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,46 (d, 1Н), 7,87 (d, 1Н), 4,65 (m, 1Н), 4,11 (m, 1Н), 3,98 (m, 2Н), 3,72 (t, 1Н), 3,32 (m, 2Н), 2,43 (s, 3H), 1,52 (s, 9Н).
МС (ИСП): 359,0 ([{81Br}М+Н]+), 357,0 ([{79Br}М+Н]+).
f) (RS)-5-Метил-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
Смесь трет-бутил-2-(5-бром-3-метил-2-пиридил)морфолин-4-карбоксилата (60 мг, 0,17 ммоль), 2-амино-5-трифторметилпиридина (26 мг, CAS: 74784-70-6), Xantphos (20 мг, 0,034 ммоль, СAS: 161265-03-8), Pd2(dba)3 (16 мг, 0,017 ммоль, CAS: 51364-51-3) и Cs2CO3 (166 мг, 0,51 ммоль) в диоксане (5 мл) перемешивали при 90°C в течение 12 часов в атмосфере азота. Затем смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали водой (100 мл) и концентрировали при пониженном давлении. Остаток сушили дополнительно в высоком вакууме. Затем остаток растворяли в дихлорметане (2 мл). Добавляли триэтиламин (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение часа. Летучие вещества удаляли при пониженном давлении. Очистка хроматографией на силикагеле привела к получению (RS)-5-метил-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амина (15 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 9,05 (d, 1Н), 8,54 (s, 1Н), 8,24 (d, 1Н), 7,89 (dd, 1Н), 7,01 (d, 1Н), 5,21 (dd, 1Н), 4,17 (m, 1Н), 4,04 (m, 1Н), 3,60 (m, 2Н), 3,41 (m, 1Н), 3,34 (m, 1Н), 2,50 (s, 3H).
МС (ИСП): 339,1 (М+Н)+.
Пример 105
4-Хлор-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-3-(2,2,2-трифторэтокси)-1Н-пиразол-5-карбоксамид
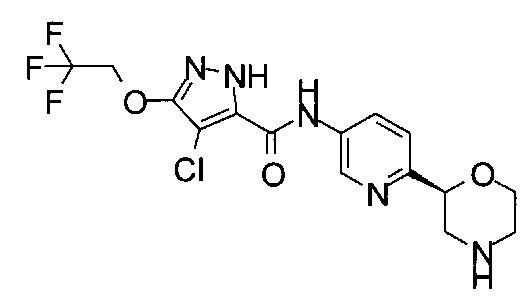
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-хлор-5-(2,2,2-трифторэтокси)-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 406,1 ({35Cl}M+H)+, 408,1 ({37Cl}M+H)+.
Пример 106
4-Хлор-3-этокси-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
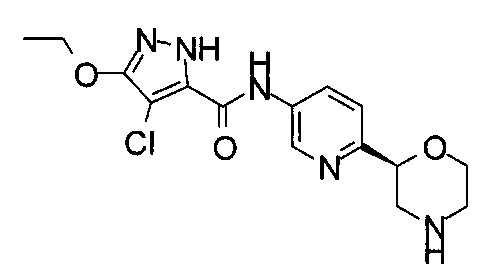
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-хлор-5-этокси-1Н-пиразол-3-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 352,1 ({35Cl}M+H)+, 354,1 ({37Cl}M+H)+.
Пример 107
(RS)-N-(5-Хлор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
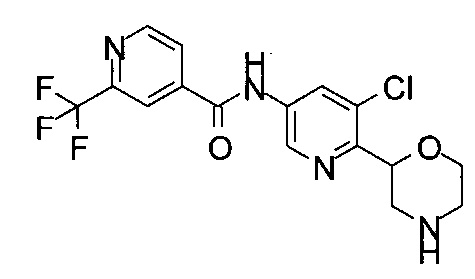
а) трет-Бутил-2-[5-(бензгидрилиденамино)-3-хлор-2-пиридил]морфолин-4-карбоксилат
К раствору трет-бутил-2-(5-бром-3-хлор-2-пиридил)морфолин-4-карбоксилата (0,4 г, 1,057 ммоль) и бензофенонимина (191,3 мг, 1,057 ммоль, CAS: 1013-88-3) в диоксане (15 мл) добавляли Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 183,5 мг, 0,317 ммоль, СAS: 161265-03-8), Cs2CO3 (1,03 г, 3,17 ммоль) и трис(дибензилиденацетон)дипалладий(0) (96,8 мг, 0,1 ммоль, CAS: 51364-51-3) в атмосфере азота. Смесь перемешивали при 85°C в течение ночи. Затем реакционную смесь фильтровали. Фильтрат концентрировали в вакууме с получением сырого трет-бутил-2-[5-(бензгидрилиденамино)-3-хлор-2-пиридил]морфолин-4-карбоксилата (505 мг, 100% выход) в виде желтого масла, которое использовали прямо на следующей стадии.
b) трет-Бутил-2-(5-амино-3-хлор-2-пиридил)морфолин-4-карбоксилат
К раствору трет-бутил-2-[5-(бензгидрилиденамино)-3-хлор-2-пиридил]морфолин-4-карбоксилата (505 мг, 1,057 ммоль) в метаноле (10 мл) добавляли ацетат натрия (433,4 мг, 5,28 ммоль) и гидрохлорид гидроксиламина (110,2 мг, 1,58 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Раствор выливали в воду (50 мл) и экстрагировали CH2Cl2 (100 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали в вакууме и очищали колоночной хроматографией (СН2Сl2/метанол составляет 100/1~50/1 по объему) с получением трет-бутил-2-(5-амино-3-хлор-2-пиридил)морфолин-4-карбоксилата (270 мг, 81% выход) в виде желтого твердого вещества.
МС (ИСП): 258,0 ([{35Cl}M-56+H]+), 314,0 ([{35Cl}M+H]+), 316,0 ([{37Cl}M+H]+), 336,0 ([{35Cl}M+Na]+).
с) (RS)-N-(5-Хлор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
К раствору 2-(трифторметил)пиридин-4-карбоновой кислоты (40 мг, 0,21 ммоль, CAS: 131747-41-6) в ДМФА (1 мл) добавляли HATU (79,7 мг, 0,21 ммоль, СAS: 148893-10-1), диизопропилэтиламин (73,7 мг, 0,57 ммоль) и трет-бутил-2-(5-амино-3-хлор-2-пиридил)морфолин-4-карбоксилат (60 мг, 0,19 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавляли с CH2Cl2 (50 мл). Раствор промывали солевым раствором (50 мл × 2), сушили над Na2SO4 и концентрировали в вакууме. Остаток растворяли в CH2Cl2 (1 мл) и трифторуксусной кислоте (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0,5% трифторуксусная кислота в CH3CN) с получением (RS)-N-(5-хлор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамида (11 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,95 (d, 1Н), 8,90 (d, 1Н), 8,50 (d, 1Н), 8,34 (s, 1Н), 8,15 (m, 1Н), 5,28 (dd, 1Н), 4,07 (m, 1Н), 4,01 (m, 1Н), 3,72 (m, 1Н), 3,56 (m, 1Н), 3,36-3,30 (m, 2Н).
МС (ИСП): 387,1 ([{35Cl}M+H]+), 389,1 ([{37Cl}M+H]+).
Пример 108
(RS)-4-Хлор-N-(5-хлор-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
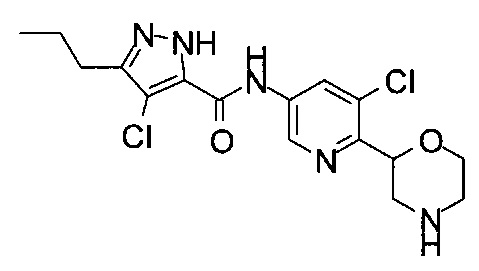
Указанное в заголовке соединение получали аналогично примеру 107 с использованием 4-хлор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 2-(трифторметил)пиридин-4-карбоновой кислоты на стадии (с). Белое твердое вещество. МС (ИСП): 386,1 ([{37Cl}M+H]+), 384,1 ([{35Cl}M+H]+).
Пример 109
(RS)-1-(5-Хлор-6-морфолин-2-ил-3-пиридил)-3-(3-хлорфенил)мочевина
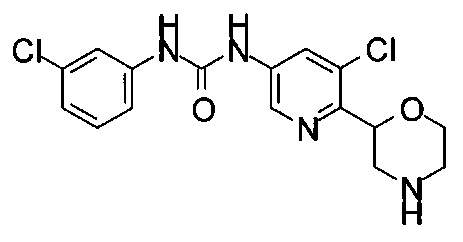
К раствору трет-бутил-2-(5-амино-3-хлор-2-пиридил)морфолин-4-карбоксилата (60 мг, 0,19 ммоль) в CH2Cl2 (1 мл) добавляли триэтиламин (38,4 мг, 0,38 ммоль) и 3-хлорфенилизоцианат (29,2 мг, 0,19 ммоль, CAS: 2909-38-8). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли с CH2Cl2 (50 мл), промывали солевым раствором (50 мл × 2), сушили над Na2SO4 и концентрировали в вакууме. Остаток растворяли в смеси CH2Cl2 (1 мл) и трифторуксусной кислоты (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Летучие вещества удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% трифторуксусной кислоты в CH3CN) с получением указанного в заголовке соединения (20 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,58 (s, 1Н), 8,25 (s, 1Н), 7,67 (s, 1Н), 7,31-7,27 (m, 2Н), 7,08-7,06 (m, 1Н), 5,27-5,24 (dd, J=12 Гц, 1Н), 4,10-4,00 (m, 1Н), 4,99-3,98 (m, 1Н), 3,71-3,68 (m, 1Н), 3,55-3,54 (m, 1Н), 3,36-3,30 (m, 2Н).
ЖХМС для соединения RW-04-035-05: МС (ИСП): 367,1 ({35Cl}M+H)+, 369,0 ({37Cl}M+H)+.
Пример 110
(RS)-N-(5-Хлор-2-пиридил)-5-фтор-6-морфолин-2-илпиридин-3-амин
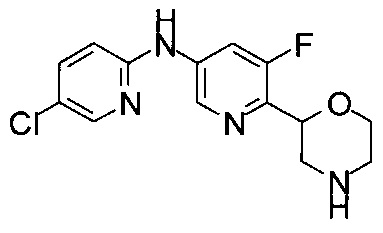
a) 2-Бром-1-(5-бром-3-фтор-2-пиридил)этанон
К раствору 1-(5-бром-3-фторпиридин-2-ил)этанона (5,5 г, 25,2 ммоль, CAS: 1160936-52-6) в уксусной кислоте (30 мл) добавляли раствор бромистоводородной кислоты (33 масс. % в уксусной кислоте, 30 мл) и пирролидона гидротрибромида (8,4 г, 26,4 ммоль, CAS: 22580-55-8) при комнатной температуре. Раствор перемешивали при комнатной температуре в течение ночи. Раствор концентрировали при пониженном давлении. Остаток разбавляли с этилацетатом (800 мл). Осадок собирали путем фильтрации и сушили в высоком вакууме с получением 2-бром-1-(5-бром-3-фтор-2-пиридил)этанона (7,52 г, 79% выход) в виде соли HBr.
b) 5-Бром-3-фтор-2-(оксиран-2-ил)пиридин
К раствору 2-бром-1-(5-бром-3-фтор-2-пиридил)этанона (7,52 г, 20 ммоль, HBr соль) в этаноле (140 мл) добавляли NaBH4 (910 мг, 81 ммоль) при 0~5°C. Затем раствор перемешивали при комнатной температуре в течение часа. Добавляли этоксид натрия (660 мг, 10 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл×3). Объединенные органические слои промывали солевым раствором (200 мл), сушили над Na2SO4 и концентрировали в вакууме с получением 5-бром-3-фтор-2-(оксиран-2-ил)пиридина (4,4 г, 100% выход) в виде желтого масла, которое использовали прямо на следующей стадии.
МС (ИСП): 219,9 ([{81Br}М+Н]+), 217,9 ([{79Br}М+Н]+).
c) 1-(5-Бром-3-фтор-2-пиридил)-2-(2-гидроксиэтиламино)этанол
К раствору 5-бром-3-фтор-2-(оксиран-2-ил)пиридина (4,8 г, 22,12 ммоль) в ТГФ (20 мл) добавляли 2-аминоэтанол (10 мл, CAS: 41-43-5). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли этилацетатом (200 мл). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали в вакууме с получением сырого 1-(5-бром-3-фтор-2-пиридил)-2-(2-гидроксиэтиламино)этанола (5,0 г, 81% выход) в виде желтого твердого вещества, которое использовали прямо на следующей стадии.
d) трет-Бутил-N-[2-(5-бром-3-фтор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамат
К раствору 1-(5-бром-3-фтор-2-пиридил)-2-(2-гидроксиэтиламино)этанола (5,0 г, 17,9 ммоль) в смеси ТГФ (50 мл) и H2O (30 мл) добавляли ди-трет-бутилдикарбонат (5,8 г, 26,9 ммоль, CAS: 24424-99-5) и K2CO3 (4,9 г, 36 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли водой (50 мл). Смесь экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CH2Cl2/MeOH составляет 100/1~50/1 по объему) с получением трет-бутил-N-[2-(5-бром-3-фтор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (5,2 г, 77% выход) в виде желтого масла.
МС (ИСП): 278,9 ([{79Br}М-Вос+Н]+), 280,9 ([{81Br}М-Вос+Н]+).
e) трет-Бутил-2-(5-бром-3-фтор-2-пиридил)морфолин-4-карбоксилат
К раствору трет-бутил-N-[2-(5-бром-3-фтор-2-пиридил)-2-гидрокси-этил]-N-(2-гидроксиэтил)карбамата (5,2 г, 13,7 ммоль) в толуоле (100 мл) добавляли PPh3 (4.3 г. 16,4 ммоль) и Et3N (3,46 г. 34,25 ммоль) при комнатной температуре. Затем добавляли раствор DIAD (3,32 г, 16,4 ммоль) в толуоле (30 мл) при 0~5°C. Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли водой (100 мл) и экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали водным раствором NaHCO3 (100 мл × 3) и солевым раствором (100 мл × 2), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (Петролейный эфир/этилацетат составляет 20/1~5/1 по объему) с получением трет-бутил-2-(5-бром-3-фтор-2-пиридил)морфолин-4-карбоксилата (3,2 г, 65% выход) в виде белого твердого вещества.
МС (ИСП): 361,0 ([{79Br}М+Н]+), 363,0 ([{81Br}М+Н]+).
f) (RS)-N-(5-Хлор-2-пиридил)-5-фтор-6-морфолин-2-илпиридин-3-амин
К раствору трет-бутил-2-(5-бром-3-фтор-2-пиридил)морфолин-4-карбоксилата (80 мг, 0,221 ммоль) и 2-амино-5-хлорпиридина (28,4 мг, 0,221 ммоль, CAS: 1072-98-6) в диоксане (1 мл) добавляли Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 38,4 мг, 0,066 ммоль, CAS: 161265-03-8), Cs2CO3 (216 мг, 0,663 ммоль) и трис(дибензилиденацетон)дипалладий(0) (20 мг, 0,022 ммоль, CAS: 51364-51-3) в атмосфере азота. Смесь перемешивали при 80°C в течение ночи. Затем раствор выливали в воду (100 мл). Смесь экстрагировали CH2Cl2 (150 мл × 2). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в CH2Cl2 (1 мл). Затем добавляли трифторуксусную кислоту (1 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-N-(5-Хлор-2-пиридил)-5-фтор-6-морфолин-2-илпиридин-3-амина (44 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,45 (m, 2Н), 8,22 (d, 1Н), 7,64 (dd, 1Н), 6,88 (d, 1Н), 5,12 (m, 1Н), 4,12 (m, 1Н), 3,98 (m, 1Н), 3,67 (m, 1Н), 3,48 (m, 1Н), 3,33 (m, 1Н), 3,31 (m, 1Н).
МС (ИСП): 308,9 ([{35Cl}M+H]+), 310,9 ([{37Cl}M+H]+).
Пример 111
(RS)-5-Фтор-6-морфолин-2-ил-N-[5-(трифторметил)-2-пиридил]пиридин-3-амин
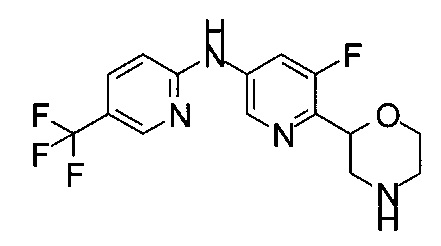
Указанное в заголовке соединение получали аналогично примеру 110 с использованием 2-амино-5-трифторметилпиридина (CAS: 74784-70-6) вместо 2-амино-5-хлорпиридина на стадии (f). Белое твердое вещество.
МС (ИСП): 343,0 (М+Н)+.
Пример 112
(RS)-1-(3-Хлорфенил)-3-(5-фтор-6-морфолин-2-ил-3-пиридил)мочевина
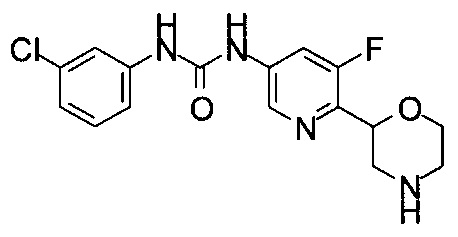
а) трет-Бутил-2-[5-(бензгидрилиденамино)-3-фтор-2-пиридил]морфолин-4-карбоксилат
К раствору трет-бутил-2-(5-бром-3-фтор-2-пиридил)морфолин-4-карбоксилата (0,6 г, 1,66 ммоль) и бензофенонимина (300 мг, 1,66 ммоль, CAS: 1013-88-3) в диоксане (30 мл) добавляли Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 288 мг, 0,5 ммоль, CAS: 161265-03-8), Cs2CO3 (1,62 г, 4,98 ммоль) и трис(дибензилиденацетон)дипалладий(0) (152 мг, 0,166 ммоль, CAS: 51364-51-3) в атмосфере азота. Смесь перемешивали при 85°C в течение ночи. Затем реакционную смесь фильтровали. Фильтрат концентрировали в вакууме с получением сырого трет-бутил-2-[5-(бензгидрилиденамино)-3-фтор-2-пиридил]морфолин-4-карбоксилата (766 мг, 100% выход) в виде желтого масла, который использовали прямо на следующей стадии.
b) трет-Бутил-2-(5-амино-3-фтор-2-пиридил)морфолин-4-карбоксилат
К раствору трет-бутил-2-[5-(бензгидрилиденамино)-3-фтор-2-пиридил]морфолин-4-карбоксилата (766 мг, 1,66 ммоль) в метаноле (20 мл) добавляли ацетат натрия (681 мг, 8,3 ммоль) и гидрохлорид гидроксиламина (173 мг, 2,5 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Раствор выливали в воду (50 мл) и экстрагировали CH2Cl2 (100 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали в вакууме и очищали колоночной хроматографией (СН2Сl2/метанол составляет 100/1~50/1 по объему) с получением трет-бутил-2-(5-амино-3-фтор-2-пиридил)морфолин-4-карбоксилата (350 мг, 71% выход) в виде желтого твердого вещества.
МС (ИСП): 242,0 (М-56+Н)+, 298,0 (М+Н)+.
с) (RS)-1-(3-Хлорфенил)-3-(5-фтор-6-морфолин-2-ил-3-пиридил)мочевина
К раствору трет-бутил-2-(5-амино-3-фтор-2-пиридил)морфолин-4-карбоксилата (70 мг, 0,235 ммоль) в дихлорметане (1 мл) добавляли Et3N (48 мг, 0,47 ммоль) и 3-хлорфенилизоцианат (36 мг, 0,24 ммоль, CAS: 2909-38-8). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли дихлорметаном (50 мл). Затем раствор промывали солевым раствором (50 мл × 2), сушили над Na2SO4, концентрировали при пониженном давлении и сушили в высоком вакууме. Остаток растворяли в дихлорметане (1 мл) и трифторуксусной кислоте (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-1-(3-Хлорфенил)-3-(5-фтор-6-морфолин-2-ил-3-пиридил)мочевины (52 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,41 (s, 1Н), 8,06 (dd, 1Н), 7,67 (s, 1Н), 7,29 (m, 2Н), 7,05 (m, 1Н), 5,13 (dd, 1Н), 4,12 (m, 1Н), 3,98 (m, 1Н), 3,69 (m, 1Н), 3,51 (dd, 1Н), 3,35-3,30 (m, 2Н).
МС (ИСП): 351,1 ([{35Cl}M+H]+), 353,1 ([{37Cl}M+H]+).
Пример 113
(RS)-N-(5-Фтор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
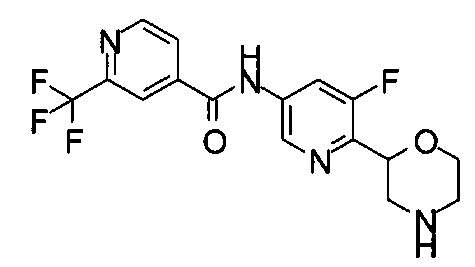
К раствору 2-(трифторметил)пиридин-4-карбоновой кислоты (57 мг, 0,30 ммоль, CAS: 131747-41-6) в ДМФА (1 мл) добавляли HATU (112,2 мг, 0,295 ммоль, СAS: 148893-10-1), N,N-диизопропилэтиламин (104 мг, 0,804 ммоль, CAS: 7087-68-5) и трет-бутил-2-(5-амино-3-фтор-2-пиридил)морфолин-4-карбоксилат (80 мг, 0,27 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном (50 мл). Раствор затем промывали водой (50 мл) и солевым раствором (50 мл), сушили над Na2SO4, концентрировали при пониженном давлении и сушили в высоком вакууме. Остаток растворяли в дихлорметане (1 мл) и трифторуксусной кислоте (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-N-(5-фтор-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамида (10 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,94 (d, 1Н), 8,77 (d, 1Н), 8,34-8,30 (m, 2Н), 8,15 (d, 1Н), 5,19 (dd, 1Н), 4,14 (m, 1Н), 4,06 (m, 1Н), 3,71 (m, 1Н), 3,55 (m, 1Н), 3,36-3,30 (m, 2Н).
МС (ИСП): 393,0 (M+Na)+, 371,0 (М+Н)+.
Пример 114
(RS)-4-Хлор-N-(5-фтор-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
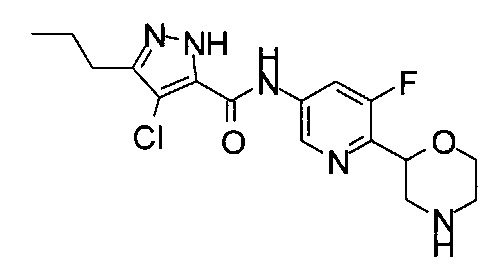
Указанное в заголовке соединение получали аналогично примеру 113 с использованием 4-хлор-5-пропил-1Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 2-(трифторметил)пиридин-4-карбоновой кислоты. Белое твердое вещество. МС (ИСП): 370,0 ([{37Cl}M+H]+), 368,0 ([{35Cl}M+H]+).
Пример 115
4-Хлор-3-изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
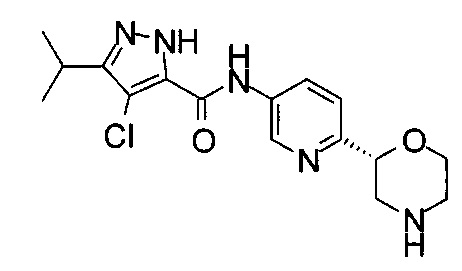
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-хлор-5-пропан-2-ил-2Н-пиразол-3-карбоновой кислоты (CAS: 1291271-55-0) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 350,0 ({35Cl}M+H)+, 352,0 ({37Cl}M+H)+.
Пример 116
4-Фтор-3-изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
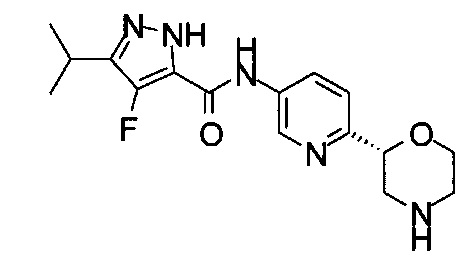
а) Этил-4-фтор-3-изопропил-1Н-пиразол-5-карбоксилат
К раствору этил-3-изопропил-1Н-пиразол-5-карбоксилата (5,0 г, 0,027 ммоль, CAS: 78208-72-7) в CH3CN (300 мл) добавляли Selectfluor® (12,7 г, 35,7 ммоль, CAS: 140681-55-6) при 0°C. Затем раствор нагревали до 70°C. Перемешивание продолжали в течение 15 часов. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разбавляли водным раствором HCl (3Н, 200 мл) и экстрагировали дихлорметаном (100 мл × 2). Объединенные органические слои промывали солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка колоночной хроматографией на силикагеле (дихлорметан/МеОН составляет 200/1~100/1 по объему) привела к получению этил-4-фтор-3-изопропил-1Н-пиразол-5-карбоксилата (900 мг, 17% выход) в виде желтого масла.
МС (ИСП): 223,1 (M+Na)+, 201,1 (М+Н)+.
b) 4-Фтор-3-изопропил-1Н-пиразол-5-карбоновая кислота
К раствору этил-4-фтор-3-изопропил-1Н-пиразол-5-карбоксилата (900 мг, 4,49 ммоль) в ТГФ/МеОН (10/10 мл) добавляли 1 М водн. NaOH (9 мл, 9 ммоль) при 0°C. Затем раствор кипятили с обратным холодильником в течение 3 часов. Реакционный раствор выливали в воду. pH доводили до 1 концентрированной HCl. Смесь экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали солевым раствором и концентрировали в вакууме. Остаток перекристаллизовывали из этилацетата (10 мл) с получением 4-фтор-3-изопропил-1Н-пиразол-5-карбоновой кислоты (450 мг, 58% выход) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 3,08 (m, 1Н), 1,32 (d, 6Н).
МС (ИСП): 173,1 (М+Н)+.
с) 4-Фтор-3-изопропил-N-[6-[(2R)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 66 с использованием 4-фтор-3-изопропил-1Н-пиразол-5-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,93 (d, 1Н), 8,27 (dd, 1Н), 7,59 (d, 1Н), 4,87 (m, 1Н), 4,24 (dd, 1Н), 4,01 (t, 1Н), 3,67 (d, 1Н), 3,34 (m, 1Н), 3,30 (m, 2Н), 3,11 (m, 1Н). 1,35 (d, 6Н).
МС (ИСП): 334,1 (М+Н)+.
Пример 117
(RS)-N-(5-Метил-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
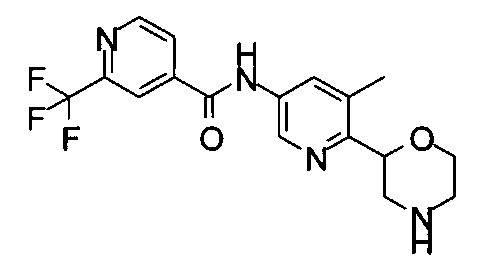
а) трет-Бутил-2-[5-(бензгидрилиденамино)-3-метил-2-пиридил]морфолин-4-карбоксилат
К раствору трет-бутил-2-(5-бром-3-метил-2-пиридил)морфолин-4-карбоксилата (0,28 г, 0,78 ммоль) и бензофенонимина (156 мг, 0,86 ммоль, CAS: 1013-88-3) в диоксане (20 мл) добавляли Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 90 мг, 0,156 ммоль, СAS: 161265-03-8), Cs2CO3 (0,77 г, 2,34 ммоль) и трис(дибензилиденацетон)дипалладий(0) (72 мг, 0,078 ммоль, CAS: 51364-51-3) в атмосфере азота. Смесь перемешивали при 90°C в течение 12 часов. Затем реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении. Дополнительная сушка в высоком вакууме привела к получению трет-бутил-2-[5-(бензгидрилиденамино)-3-метил-2-пиридил]морфолин-4-карбоксилата (360 мг) в виде желтого масла, который использовали прямо на следующей стадии.
b) трет-Бутил-2-(5-амино-3-метил-2-пиридил)морфолин-4-карбоксилат
К раствору трет-бутил-2-[5-(бензгидрилиденамино)-3-метил-2-пиридил]морфолин-4-карбоксилата (360 мг, 0,78 ммоль) в метаноле (10 мл) добавляли ацетат натрия (250 мг, 2,34 ммоль) и гидрохлорид гидроксиламина (82 мг, 1,17 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов. Раствор выливали в воду (50 мл) и экстрагировали СН2Сl2 (100 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали в вакууме и очищали колоночной хроматографией (СН2Сl2/метанол составляет 100/1~50/1 по объему) с получением трет-бутил-2-(5-амино-3-метил-2-пиридил)морфолин-4-карбоксилата (150 мг, 65% выход) в виде не совсем белого твердого вещества.
с) (RS)-N-(5-Метил-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамид
К раствору 2-(трифторметил)пиридин-4-карбоновой кислоты (29 мг, 0,15 ммоль, CAS: 131747-41-6) в ДМФА (1 мл) добавляли HATU (56 мг, 0,15 ммоль, СAS: 148893-10-1), N,N-диизопропилэтиламин (52 мг, 0,40 ммоль, CAS: 7087-68-5) и трет-бутил-2-(5-амино-3-метил-2-пиридил)морфолин-4-карбоксилат (40 мг, 0,14 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли дихлорметаном (50 мл). Раствор затем промывали водой (50 мл) и солевым раствором (50 мл), сушили над Na2SO4, концентрировали при пониженном давлении и сушили в высоком вакууме. Остаток растворяли в дихлорметане (1 мл) и трифторуксусной кислоте (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-N-(5-метил-6-морфолин-2-ил-3-пиридил)-2-(трифторметил)пиридин-4-карбоксамида (4 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, Метанол-d4): δ 8,95 (d, 1Н), 8,85 (d, 1Н), 8,34 (s, 1Н), 8,15 (dd, 1Н), 5,13 (dd, 1Н), 4,04 (m, 2Н), 3,77 (m, 1Н), 3,61 (dd, 1Н), 3,38-3,30 (m, 2Н), 2,49 (s, 3H). МС (ИСП): 367,1 (М+Н)+.
Пример 118
(RS)-4-Хлор-N-(5-метил-6-морфолин-2-ил-3-пиридил)-3-пропил-1Н-пиразол-5-карбоксамид
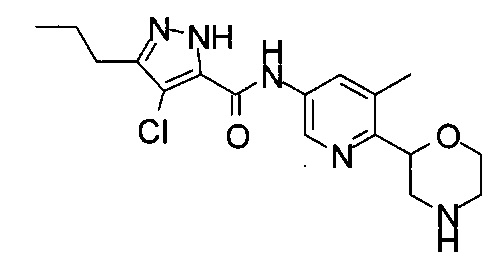
Указанное в заголовке соединение получали аналогично примеру 117 с использованием 4-хлор-5-пропил-89Н-пиразол-3-карбоновой кислоты (CAS: 1340578-20-2) вместо 2-(трифторметил)пиридин-4-карбоновой кислоты. Белое твердое вещество. МС (ИСП): 366,0 ([{37Cl}М+Н]+), 364,0 ([{35Cl}М+Н]+).
Пример 119
(RS)-1-(3-Хлорфенил)-3-(5-метил-6-морфолин-2-ил-3-пиридил)мочевина
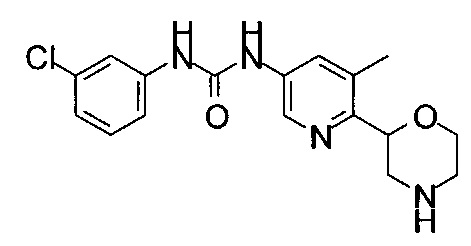
К раствору трет-бутил-2-(5-амино-3-метил-2-пиридил)морфолин-4-карбоксилата (30 мг, 0,1 ммоль) в дихлорметане (1 мл) добавляли Et3N (30 мг, 0,3 ммоль) и 3-хлорфенилизоцианат (16 мг, 0,1 ммоль, CAS: 2909-38-8). Раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли дихлорметаном (50 мл). Затем раствор промывали солевым раствором (50 мл × 2), сушили над Na2SO4, концентрировали при пониженном давлении и сушили в высоком вакууме. Остаток растворяли в дихлорметане (1 мл) и трифторуксусной кислоте (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ (0,5% TFA в CH3CN) с получением (RS)-1-(3-хлорфенил)-3-(5-метил-6-морфолин-2-ил-3-пиридил)мочевины (32 мг) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 9,36 (d, 2Н), 9,04 (m, 1Н), 8,47 (s, 1Н), 7,84 (d, 1Н), 7,73 (s, 1Н), 7,32 (m, 2Н), 7,05 (m, 1Н), 4,91 (dd, 1Н), 4,00 (m, 1Н), 3,89 (m, 1Н), 3,58 (m, 2Н), 3,27 (d, 1H), 3,15 (m, 1Н), 2,35 (s, 3H).
МС (ИСП): 347,0 ([{35Cl}M+H]+), 349,0 ([{37Cl}M+H]+).
Пример 120
4-Хлор-3-изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
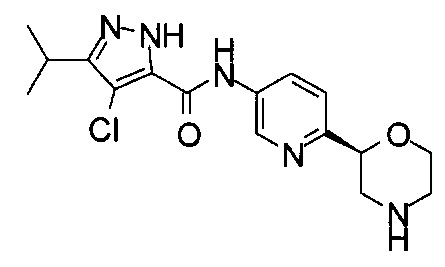
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-хлор-5-пропан-90-ил-2Н-пиразол-3-карбоновой кислоты (CAS: 1291271-55-0) вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 350,1 ({35Cl}M+H)+, 352,1 ({37Cl}M+H)+.
Пример 121
4-Фтор-3-изопропил-N-[6-[(2S)-морфолин-2-ил]-3-пиридил]-1Н-пиразол-5-карбоксамид
Указанное в заголовке соединение получали аналогично примеру 67 с использованием 4-фтор-3-изопропил-1Н-пиразол-5-карбоновой кислоты вместо 3-этил-4-метил-1Н-пиразол-5-карбоновой кислоты. Белое твердое вещество.
МС (ИСП): 334,2 (М+Н)+.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. В частности, было обнаружено, что соединения по настоящему изобретению обладают хорошим сродством к рецепторам, ассоциированным со следовыми аминами (TAAR), особенно к TAAR1.
Соединения исследовали в соответствии с приведенными ниже испытаниями.
Материалы и методы Конструкция плазмид экспрессии TAAR и стабильно трансфицированных клеточных линий
Для конструкции плазмид экспрессии кодирующие последовательности TAAR 1 человека, крысы и мыши амплифицировали из геномной ДНК, в основном как описано у Lindemann et al. [14]. Систему полимеразной цепной реакции с высокой точностью воспроизведения (Expand High Fidelity PCR System (Roche Diagnostics)) использовали с 1,5 мМ Mg2+ и очищенные продукты ПЦР клонировали в pCR2.1-ТОРО клонирующий вектор (Invitrogen), следуя инструкциям производителя. Продукты ПЦР субклонировали в plRESneo2 вектор (BD Clontech, Palo Alto, California) и последовательности векторов экспрессии проверяли перед введением в клеточные линии.
Клетки HEK293 (АТСС # CRL-1573) выращивали, в основном как описано у Lindemann et al. (2005). Для генерации стабильно трансфицированных клеточных линий клетки HEK293 трансфицировали с плазмидами экспрессии plRESneo2, содержащими кодирующие последовательности TAAR (описанные выше), с липофектамином 2000 (Invitrogen) согласно инструкциям производителя, и через 24 часа после трансфекции культуральную среду дополняли 1 мг/мл G418 (Sigma, Buchs, Швейцария). После культивирования приблизительно 10 d клонов выделяли, расширяли и исследовали на чувствительность к следовым аминам (все соединения приобретены у Sigma) с цАМФ системой иммуноферментного анализа Biotrak (EIA от Enzyme immunoassay) (Amersham), следуя EIA процедуре неацетилирования, предоставленной производителем. Моноклональные клеточные линии, которые показывали стабильную ЕС50 в течение периода культивирования 15 пассажей, использовали для всех последующих исследований.
Анализ радиолигандного связывания на TAAR1 крысы
Получение мембран и радиолигандное связывание.
Клетки HEK-293, стабильно экспрессирующие TAAR1 крысы, выдерживали при 37°C и 5% CO2 в среде DMEM (от англ. Dulbecco modified Eagle's medium - модифицированная по способу Дульбекко среда Игла) с высоким содержанием глюкозы, содержащей эмбриональную телячью сыворотку (10%, термоинактивированная в течение 30 минут при 56°C), пенициллин/стрептомицин (1%) и 375 мкг/мл генетицин (Gibco). Клетки выделяли из колб с культурами, используя трипсин/ЭДТА (этилендиаминтетрауксусная кислота), собирали, промывали дважды ледяным натрий-фосфатным буфером (англ. Phosphate buffered saline, PBS) (без Ca2+ и Mg2+), осаждали при 1'000 об/мин в течение 5 минут при 4°C, замораживали и хранили при -80°C. Замороженные осадки суспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7,4), содержащего 10 мМ ЭДТА, и гомогенизировали с помощью Polytron (РТ 6000, Kinematica) при 14'000 об/мин в течение 20 секунд. Гомогенат центрифугировали при 48'000 × g в течение 30 минут при 4°C. Затем надосадочную жидкость удаляли и отбрасывали, и осадок ресуспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7,4), содержащего 0,1 мМ ЭДТА, используя Polytron (20 секунд при 14'000 об/мин). Эту процедуру повторяли и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0,1 мМ ЭДТА, и гомогенизировали, используя Polytron. Обычно аликвоты по 2 мл мембранных частей хранили при -80°C. Для каждой новой партии мембран определяли константу диссоциации (Kd) с использованием кривой насыщения. Радиолиганд TAAR1 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) использовали при концентрации, равной рассчитанному значению Kd, которое обычно составляло около 2,3 нМ, полученному в результате связывания приблизительно 0,2% радиолиганда, и специфическое связывание составляло приблизительно 85% от общего связывания. Неспецифическое связывание определяли как количество 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связанного в присутствии 10 мкМ немеченого лиганда. Все соединения исследовали в широком диапазоне концентраций (10 пМ до 10 мкМ) в двух опытах. Исследуемые соединения (20□ мкл/лунка) трансфицировали в 96 луночных глубоких планшетах (TreffLab) и добавляли 180 мкл HEPES-NaOH (20 мМ, pH 7,4), содержащего MgCl2(10 мМ) и CaCl2 (2 мМ) (связывающий буфер), 300 мкл радиолиганда 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина при концентрации 3,3×Kd в нМ и 500 мкл мембран (ресуспендированных при 50 мкг белка на мл). 96 луночные глубокие планшеты инкубировали в течение 1 часа при 4°C. Инкубации завершали быстрой фильтрацией через Unifilter-96 для планшетов (Packard Instrument Company) и стеклянные фильтры GF/C (Perkin Elmer), предварительно замоченные в течение 1 часа в полиэтиленимине (0,3%), и промывали 3 раза 1 мл холодного связывающего буфера. После добавления 45 мкл Microscint 40 (PerkinElmer) Unifilter-96 для планшетов герметизировали и через 1 час радиоактивность считывали, используя сцинтилляционный счетчик для микропланшетов TopCount (Packard Instrument Company).
Анализ радиолигандного связывания на TAAR1 мыши
Получение мембран и радиолигандное связывание.
Клетки HEK-293, стабильно экспрессирующие TAAR1 мыши, выдерживали при 37°C и 5% СO2 в среде DMEM с высоким содержанием глюкозы, содержащей эмбриональную телячью сыворотку (10%, термоинактивированная в течение 30 минут при 56°C), пенициллин/стрептомицин (1%) и 375 мкг/мл генетицин (Gibco). Клетки выделяли из колб с культурами, используя трипсин/ЭДТА, собирали, промывали дважды ледяным PBS (без Са2+ и Mg2+), осаждали при 1'000 об/мин в течение 5 минут при 4°C, замораживали и хранили при -80°C. Замороженные осадки суспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7,4), содержащего 10 мМ ЭДТА, и гомогенизировали с помощью Polytron (РТ 6000, Kinematica) при 14'000 об/мин в течение 20 секунд. Гомогенат центрифугировали при 48'000 × g в течение 30 минут при 4°C. Затем надосадочную жидкость удаляли и отбрасывали, и осадок ресуспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7,4), содержащего 0,1 мМ ЭДТА, используя Polytron (20 секунд при 14'000 об/мин). Эту процедуру повторяли и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0,1 мМ ЭДТА, и гомогенизировали, используя Polytron. Обычно аликвоты по 2 мл мембранных частей хранили при -80°C. Для каждой новой партии мембран определяли константу диссоциации (Kd) с использованием кривой насыщения. Радиолиганд TAAR1 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) использовали при концентрации, равной рассчитанному значению Kd, которое обычно составляло около 0,7 нМ, полученному в результате связывания приблизительно 0,5% радиолиганда, и специфическое связывание составляло приблизительно 70% от общего связывания. Неспецифическое связывание определяли как количество 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связанного в присутствии 10 мкМ немеченого лиганда. Все соединения исследовали в широком диапазоне концентраций (10 пМ до 10 мкМ) в двух опытах. Исследуемые соединения (20□ мкл/лунка) трансфицировали в 96 луночных глубоких планшетах (TreffLab), и добавляли 180 мкл HEPES-NaOH (20 мМ, pH 7,4), содержащего MgCl2 (10 мМ) и CaCl2 (2 мМ) (связывающий буфер), 300 мкл радиолиганда 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина при концентрации 3,3×Кd в нМ и 500 мкл мембран (ресуспендированных при 60 мкг белка на мл). 96 луночные глубокие планшеты инкубировали в течение 1 часа при 4°C. Инкубации завершали быстрой фильтрацией через Unifilter-96 для планшетов (Packard Instrument Company) и стеклянные фильтры GF/C (Perkin Elmer), предварительно замоченные в течение 1 часа в полиэтиленимине (0,3%), и промывали 3 раза 1 мл холодного связывающего буфера. После добавления 45 мкл Microscint 40 (PerkinElmer) Unifilter-96 для планшетов герметизировали и через 1 час радиоактивность считывали, используя сцинтилляционный счетчик для микропланшетов TopCount (Packard Instrument Company).
Соединения показывают значение Ki (мкМ) у мыши или крысы на TAAR1 (в мкМ), как показано в таблице ниже
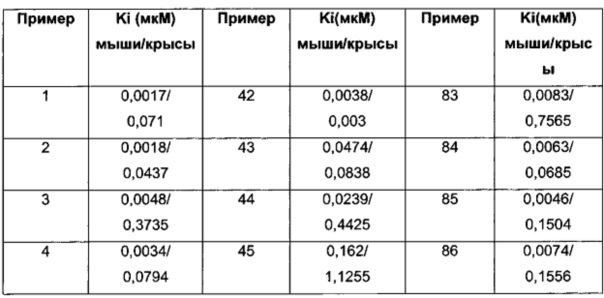
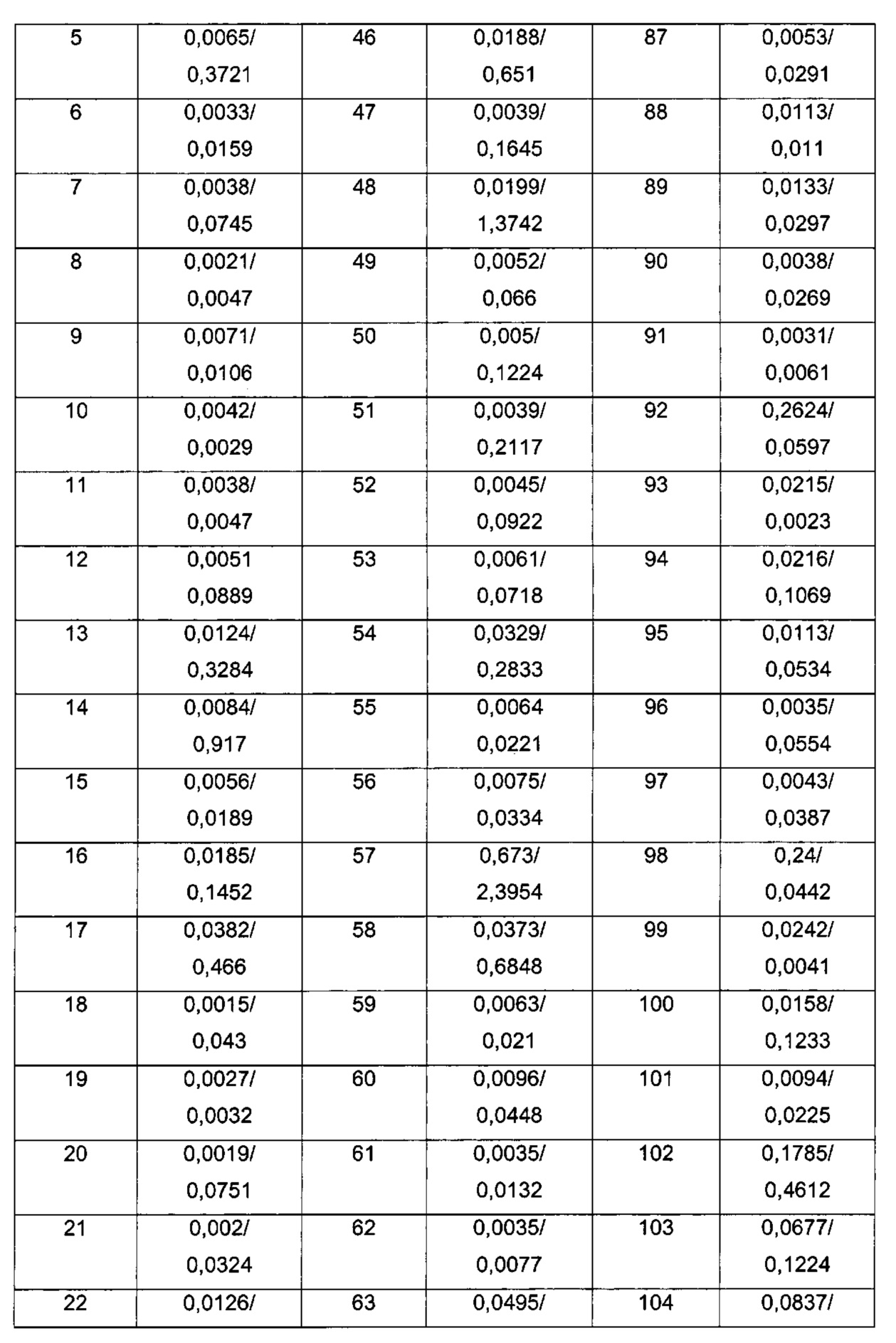
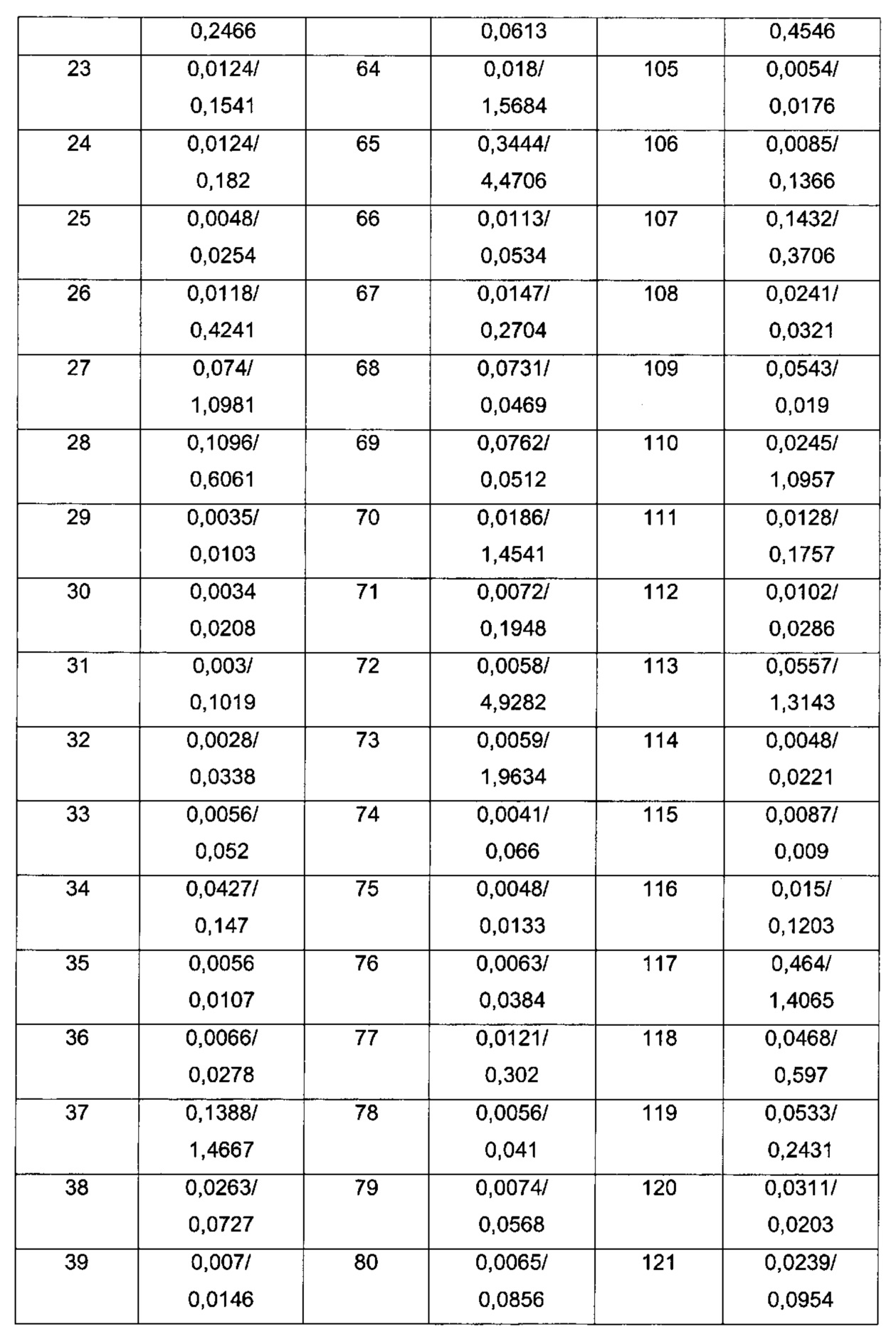
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть ректальное введение, например, в форме суппозиториев, или парентеральное, например, в форме растворов для инъекций.
Соединения формулы I могут быть объединены с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли, и тому подобное можно использовать, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы активного вещества для мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для производства растворов и сиропов являются, например вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для суппозиториев являются, например природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Также они могут содержать еще и другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются предметом настоящего изобретения, как и способ их получения, согласно которому одно или более соединений формулы I и/или фармацевтически приемлемых кислотно-аддитивных солей и, если требуется, одно или более других терапевтически ценных веществ объединяют в лекарственную форму введения вместе с одним или более терапевтически инертных носителей.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например лечение или предотвращение депрессии, психоза, болезни Паркинсона, тревоги, синдрома дефицита внимания с гиперактивнотью (СДВГ) и диабета.
Дозировка может изменяться в широких пределах и должна быть, конечно, подобрана в соответствии с индивидуальными потребностями в каждом конкретном случае. В случае перорального введения дозировка для взрослых может изменяться от приблизительно 0,01 мг до приблизительно 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточную дозу можно вводить в виде однократной дозы или дробными дозами и, кроме того, верхний предел также может быть превышен, когда для этого имеются показания.

Процесс изготовления
1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с очищенной водой.
2. Сушат гранулы при 50°C.
3. Пропускают гранулы через подходящее помольное оборудование.
4. Добавляют ингредиент 5 и смешивают в течение трех минут; прессуют на подходящем прессе.
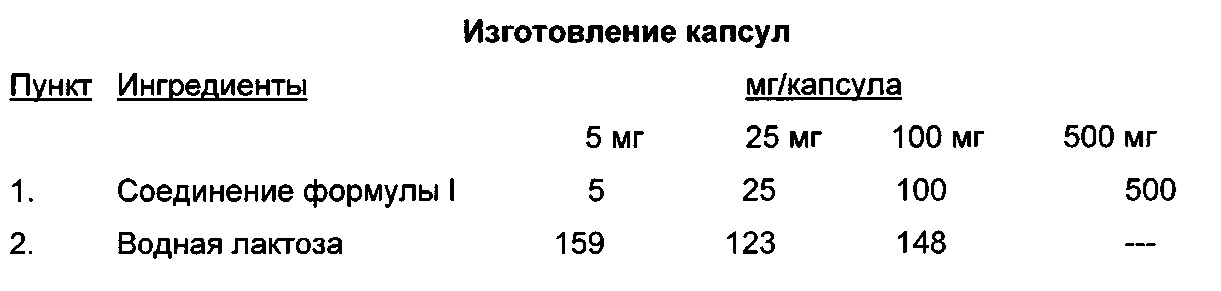
Процесс изготовления
1. Смешивают ингредиенты 1, 2 и 3 в подходящем смесительном аппарате в течение 30 минут.
2. Добавляют ингредиенты 4 и 5 и смешивают в течение 3 минут.
3. Заполняют подходящую капсулу.